Т‑клеточный иммунитет к COVID‑19
Тест предназначен для оценки Т-клеточного иммунитета к СOVID-19. Позволяет выявить в крови специфические Т-клетки (Т-лимфоциты), реагирующие на определенные антигены коронавируса SARS-CoV-2. Такие специфические Т-лимфоциты способны узнавать и уничтожать пораженные вирусом клетки и могут потенциально обеспечивать долгосрочную защиту от COVID-19, в том числе при отсутствии антител. Оценка Т-клеточного иммунитета наряду с гуморальным (определение антител) может использоваться как дополнительный маркер иммунной защиты от COVID-19.
Используется технология ELISPOT, которая является наиболее перспективной на сегодняшний день платформой для оценки Т-клеточного иммунитета.
Синонимы русские
Т-клети, Т-лимфоциты к коронавирусу.
Синонимы английские
T-cell immunity to COVID-19.
Метод исследования
Прямая оценка функции Т-клеток ELISPOT.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Общая информация об исследовании
Пандемия SARS-CoV-2 привела к гибели более 2 миллионов человек на сегодняшний день, и существует острая потребность в эффективной вакцине. Есть значительный интерес к пониманию того, насколько адаптивные иммунные реакции контролируют острую инфекцию и обеспечивают защиту от повторного заражения.
Антительные ответы против SARS-CoV-2 характеризуются реакцией против ряда вирусных белков, включая спайковые белки, нуклеопротеины и мембранные белки. Уровни антител снижаются после избавления от первичной инфекции, и в настоящее время актуален вопрос о поддержании гуморальных ответов в долгосрочной перспективе. Хотя первоначальные анализы показали потерю выявляемых вирус-специфических антител у части людей, высокочувствительный ИФА может определять обнаруживаемые антитела в течение как минимум 6-7 месяцев у большинства людей.
Величина и качество ответа иммунной памяти к SARS-CoV-2 будет иметь решающее значение для предотвращения повторного заражения.
Величина ответа Т-клеток является неоднородной и может отражать разнообразие профиля Т-клеточного иммунитета во время острого инфекционного заболевания. Важной особенностью является то, что величина клеточного иммунитета по данным ELISPOT на 50 % выше у доноров, перенесших симптомную инфекцию. Это демонстрирует, что первоначальная «контрольная точка» клеточного иммунитета, выработанная после острой инфекции, сохраняется не менее 6 месяцев.
Исследования показывают, что устойчивый клеточный иммунитет против SARS-CoV-2 может присутствовать в подавляющем большинстве случаев у взрослых через 6 месяцев после бессимптомной инфекции или легкой и средней степени тяжести инфекционного заболевания. Эти особенности обнадеживают в отношении длительности клеточного иммунитета против этого нового вируса и, вероятно, способствуют относительно низкому риску повторного заражения.
Анализ на Т-клеточный иммунитет проводится методом ELISPOT, который имеет ряд преимуществ:
-
проверенная технология обнаружения активных Т-клеток для измерения силы иммунного ответа на инфекцию;
-
технология ELISPOT в настоящее время является уникальной в мире;
-
ELISPOT широко используется исследователями разных стран при разработке вакцин от COVID-19;
-
ELISPOT является наиболее перспективной платформой среди методов оценки Т-клеточного иммунного ответа:
-
для теста берется кровь из вены, отделяются Т-лимфоциты, — они могут и уничтожить вирус, и активировать выработку антител другими лимфоцитами;
-
к определенным Т-лимфоцитам добавляют белки вируса;
-
если Т-лимфоциты и вирусы раньше встречались, то они выделяют цитокины;
-
если спотов больше 12 – это означает, что иммунитет есть.

-
Для чего используется исследование?
- Для оценки Т-клеточного иммунитета к СOVID-19. Позволяет выявить в крови специфические Т-клетки (Т-лимфоциты), реагирующие на определенные антигены коронавируса SARS-CoV-2.
Почему важно измерять клеточный ответ? Т-клетки реагируют на проникновение вируса в организм раньше, чем антитела. Клеточный ответ обеспечивает долгосрочную защиту от коронавирусной инфекции. Одного тестирования на антитела недостаточно для всесторонней оценки защиты от COVID-19. Комплексная проверка защиты от коронавируса — это: Определение уровня антител класса G — гуморальный иммунитет.Определение Т-клеток, специфически реагирующих на вирусные антигены — клеточного иммунитета.Как образуются Т-клетки?Вирус попадает в клетку, и она это запоминает.На клетке появляется рецептор, который активирует защиту при проникновении вируса.Начинают вырабатываться антитела.
Когда назначается исследование?
- Когда у человека, перенесшего COVID-19, у в крови не обнаружены антитела IgG.

- Когда у человека есть признаки коронавирусной инфекции с симптомами, но нет антител.
- После контакта с пациентом с COVID-19.
- Людям после иммунопрофилактики.
Что означают результаты?
Референсные значения
Панель антигенов 1 (пептиды белка S), SPOT:
— менее или равный 10 — отрицательный;
— от 11 до 12 — пограничный;
— более 12 — положительный.
Панель антигенов 2 (пептиды белков N, M, O3, O7), SPOT:
— менее или равный 10 — отрицательный;
— от 11 до 12 — пограничный;
— более 12 — положительный.
Положительный результат:
-
положительный результат может потенциально свидетельствовать о перенесенной или текущей инфекции COVID-19, в том числе бессимптомно, и о сформировавшемся Т-клеточном иммунном ответе к вирусу SARS-CoV-2.
Ученые оценили роль клеточного иммунитета в борьбе с COVID-19
https://ria. ru/20210727/immunitet-1743096767.html
ru/20210727/immunitet-1743096767.html
Ученые оценили роль клеточного иммунитета в борьбе с COVID-19
Ученые оценили роль клеточного иммунитета в борьбе с COVID-19 — РИА Новости, 27.07.2021
Ученые оценили роль клеточного иммунитета в борьбе с COVID-19
Новое исследование, проведенное на обезьянах, показало, что Т-клетки не имеют решающего значения для иммунной памяти на SARS-CoV-2 или выздоровления от острой… РИА Новости, 27.07.2021
2021-07-27T13:52
2021-07-27T13:52
2021-07-27T17:06
наука
сша
здоровье
биология
вакцины
коронавирус covid-19
антитела
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/155861/18/1558611872_0:413:1884:1473_1920x0_80_0_0_24c6b6d651f75bb76327d771544090c0.jpg
МОСКВА, 27 июл — РИА Новости. Новое исследование, проведенное на обезьянах, показало, что Т-клетки не имеют решающего значения для иммунной памяти на SARS-CoV-2 или выздоровления от острой инфекции COVID-19. У приматов даже с очень слабым клеточным иммунитетом антитела обеспечивали хороший уровень защиты при повторном заражении. Результаты исследования опубликованы в журнале Американского общества микробиологов mBio.Для того, чтобы проверить, насколько важен для защиты от коронавируса естественный Т-клеточный иммунитет, американские ученые под руководством Ким Хасенкруг (Kim Hasenkrug) из Национального института аллергии и инфекционных болезней взяли модельных макак-резусов и с помощью стандартных реагентов ослабили у них выработку Т-лимфоцитов класса CD4+ и CD8+.Клетки CD8+ напрямую атакуют инфицированные клетки и убивают их, а CD4+ запускают иммунный ответ, распознавая патогены и секретируя цитокины — небольшие белки, которые сигнализируют о необходимости действовать другим иммунным клеткам, включая CD8+ и продуцирующие антитела — В-клетки.В течение шести недель после заражения макак, исследователи брали у них мазки из носа и глотки и проводили бронхоскопию, чтобы измерить уровень вируса в носу, рту и легких, а также мазки из прямой кишки, чтобы определить, выделяется ли вирус из кишечника.
У приматов даже с очень слабым клеточным иммунитетом антитела обеспечивали хороший уровень защиты при повторном заражении. Результаты исследования опубликованы в журнале Американского общества микробиологов mBio.Для того, чтобы проверить, насколько важен для защиты от коронавируса естественный Т-клеточный иммунитет, американские ученые под руководством Ким Хасенкруг (Kim Hasenkrug) из Национального института аллергии и инфекционных болезней взяли модельных макак-резусов и с помощью стандартных реагентов ослабили у них выработку Т-лимфоцитов класса CD4+ и CD8+.Клетки CD8+ напрямую атакуют инфицированные клетки и убивают их, а CD4+ запускают иммунный ответ, распознавая патогены и секретируя цитокины — небольшие белки, которые сигнализируют о необходимости действовать другим иммунным клеткам, включая CD8+ и продуцирующие антитела — В-клетки.В течение шести недель после заражения макак, исследователи брали у них мазки из носа и глотки и проводили бронхоскопию, чтобы измерить уровень вируса в носу, рту и легких, а также мазки из прямой кишки, чтобы определить, выделяется ли вирус из кишечника. Через шесть недель исследователи повторно проверили обезьян на SARS-CoV-2 и провели анализ крови, что позволило оценить реакцию иммунной памяти.Результаты показали, что тяжесть заболевания COVID-19 не зависела от состояния Т-клеток, и у макак с сильным истощением Т-лимфоцитов развивались такие же мощные реакции иммунной памяти на вторую инфекцию. Организм обезьян создал хороший ответ иммунной памяти против коронавируса и в случае истощенных Т-клеток.»Мы обнаружили, что у нас действительно хорошие реакции памяти независимо от того, истощили мы Т-клетки или нет. В основном, мы обнаружили очень сильные вируснейтрализующие антитела — наиболее важные агенты в борьбе с инфекцией. Это было неожиданным для большинства иммунологов, вирусологов и разработчиков вакцин», — приводятся в пресс-релизе Американского общества микробиологов слова Ким Хасенкруг.»Если есть ответ памяти, вы получите гораздо более быстрый иммунный ответ и контроль над вирусом. Так работают прививки. Как только ваше тело обнаружит вирусный патоген, в следующий раз, когда оно увидит его, вы сможете получить гораздо более быстрый и сильный иммунный ответ.
Через шесть недель исследователи повторно проверили обезьян на SARS-CoV-2 и провели анализ крови, что позволило оценить реакцию иммунной памяти.Результаты показали, что тяжесть заболевания COVID-19 не зависела от состояния Т-клеток, и у макак с сильным истощением Т-лимфоцитов развивались такие же мощные реакции иммунной памяти на вторую инфекцию. Организм обезьян создал хороший ответ иммунной памяти против коронавируса и в случае истощенных Т-клеток.»Мы обнаружили, что у нас действительно хорошие реакции памяти независимо от того, истощили мы Т-клетки или нет. В основном, мы обнаружили очень сильные вируснейтрализующие антитела — наиболее важные агенты в борьбе с инфекцией. Это было неожиданным для большинства иммунологов, вирусологов и разработчиков вакцин», — приводятся в пресс-релизе Американского общества микробиологов слова Ким Хасенкруг.»Если есть ответ памяти, вы получите гораздо более быстрый иммунный ответ и контроль над вирусом. Так работают прививки. Как только ваше тело обнаружит вирусный патоген, в следующий раз, когда оно увидит его, вы сможете получить гораздо более быстрый и сильный иммунный ответ. Теперь мы знаем, что наиболее важными для защиты от коронавируса являются антитела, связанный с вакцинацией, а не ответ Т-клеток», — продолжает ученый.Еще один интересный эффект, который наблюдали авторы исследования — переключение классов Т-клеток, которое происходило по мере их истощения. Например, когда истощили CD8+ клетки, сильнее становились CD4+ клетки, или В-клетки. У отдельных животных с понижением функций Т-лимфоцитов сильнее становился антительный иммунный ответ.»У нас нет твердого объяснения того, почему это произошло, но мы думаем, что это связано с какой-то компенсаторной реакцией. Когда животным чего-то не хватает, они пытаются восполнить это, производя больше чего-то другого», — объясняет Хасенкруг.Авторы надеются, что полученные ими результаты сыграют важную роль при разработке вакцин и лекарств нового поколения.
Теперь мы знаем, что наиболее важными для защиты от коронавируса являются антитела, связанный с вакцинацией, а не ответ Т-клеток», — продолжает ученый.Еще один интересный эффект, который наблюдали авторы исследования — переключение классов Т-клеток, которое происходило по мере их истощения. Например, когда истощили CD8+ клетки, сильнее становились CD4+ клетки, или В-клетки. У отдельных животных с понижением функций Т-лимфоцитов сильнее становился антительный иммунный ответ.»У нас нет твердого объяснения того, почему это произошло, но мы думаем, что это связано с какой-то компенсаторной реакцией. Когда животным чего-то не хватает, они пытаются восполнить это, производя больше чего-то другого», — объясняет Хасенкруг.Авторы надеются, что полученные ими результаты сыграют важную роль при разработке вакцин и лекарств нового поколения.
https://ria.ru/20210727/glaza-1743064864.html
https://ria.ru/20210726/simptomy-1742926563.html
сша
РИА Новости
internet-group@rian. ru
ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2021
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/155861/18/1558611872_0:236:1884:1649_1920x0_80_0_0_53d3e290770576bc9aa5fef48913bab8.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
сша, здоровье, биология, вакцины, коронавирус covid-19, антитела
МОСКВА, 27 июл — РИА Новости. Новое исследование, проведенное на обезьянах, показало, что Т-клетки не имеют решающего значения для иммунной памяти на SARS-CoV-2 или выздоровления от острой инфекции COVID-19. У приматов даже с очень слабым клеточным иммунитетом антитела обеспечивали хороший уровень защиты при повторном заражении. Результаты исследования опубликованы в журнале Американского общества микробиологов mBio.Для того, чтобы проверить, насколько важен для защиты от коронавируса естественный Т-клеточный иммунитет, американские ученые под руководством Ким Хасенкруг (Kim Hasenkrug) из Национального института аллергии и инфекционных болезней взяли модельных макак-резусов и с помощью стандартных реагентов ослабили у них выработку Т-лимфоцитов класса CD4+ и CD8+.
Клетки CD8+ напрямую атакуют инфицированные клетки и убивают их, а CD4+ запускают иммунный ответ, распознавая патогены и секретируя цитокины — небольшие белки, которые сигнализируют о необходимости действовать другим иммунным клеткам, включая CD8+ и продуцирующие антитела — В-клетки.
В течение шести недель после заражения макак, исследователи брали у них мазки из носа и глотки и проводили бронхоскопию, чтобы измерить уровень вируса в носу, рту и легких, а также мазки из прямой кишки, чтобы определить, выделяется ли вирус из кишечника. Через шесть недель исследователи повторно проверили обезьян на SARS-CoV-2 и провели анализ крови, что позволило оценить реакцию иммунной памяти.
Результаты показали, что тяжесть заболевания COVID-19 не зависела от состояния Т-клеток, и у макак с сильным истощением Т-лимфоцитов развивались такие же мощные реакции иммунной памяти на вторую инфекцию. Организм обезьян создал хороший ответ иммунной памяти против коронавируса и в случае истощенных Т-клеток.
27 июля, 11:24НаукаОфтальмологи обнаружили еще одно последствие коронавируса«Мы обнаружили, что у нас действительно хорошие реакции памяти независимо от того, истощили мы Т-клетки или нет. В основном, мы обнаружили очень сильные вируснейтрализующие антитела — наиболее важные агенты в борьбе с инфекцией. Это было неожиданным для большинства иммунологов, вирусологов и разработчиков вакцин», — приводятся в пресс-релизе Американского общества микробиологов слова Ким Хасенкруг.
Это было неожиданным для большинства иммунологов, вирусологов и разработчиков вакцин», — приводятся в пресс-релизе Американского общества микробиологов слова Ким Хасенкруг.
Еще один интересный эффект, который наблюдали авторы исследования — переключение классов Т-клеток, которое происходило по мере их истощения. Например, когда истощили CD8+ клетки, сильнее становились CD4+ клетки, или В-клетки. У отдельных животных с понижением функций Т-лимфоцитов сильнее становился антительный иммунный ответ.
«У нас нет твердого объяснения того, почему это произошло, но мы думаем, что это связано с какой-то компенсаторной реакцией.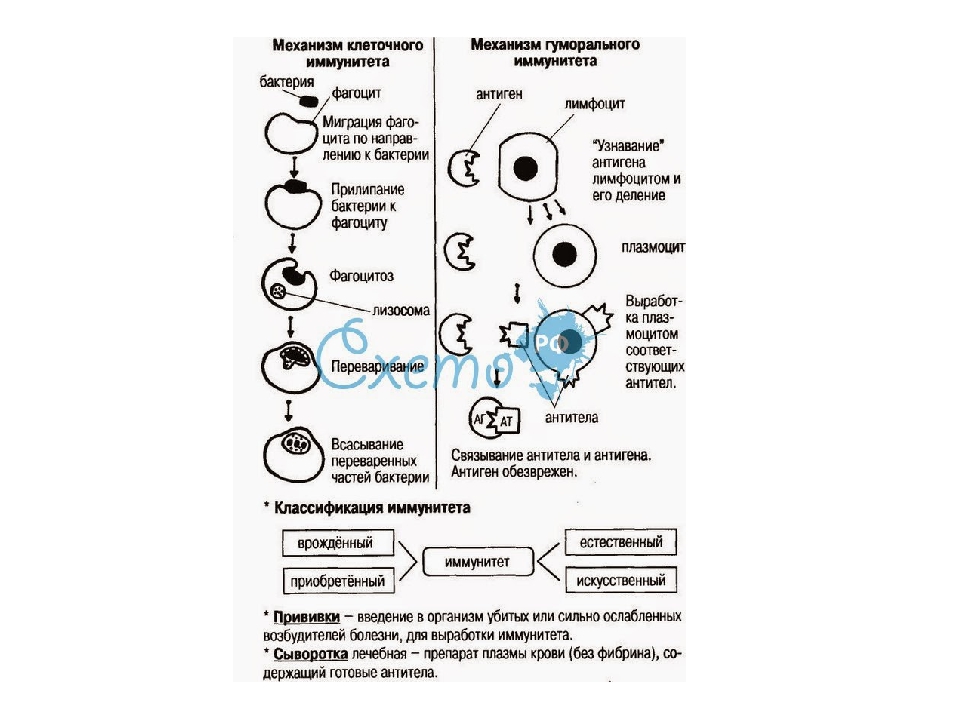 Когда животным чего-то не хватает, они пытаются восполнить это, производя больше чего-то другого», — объясняет Хасенкруг.
Когда животным чего-то не хватает, они пытаются восполнить это, производя больше чего-то другого», — объясняет Хасенкруг.
Авторы надеются, что полученные ими результаты сыграют важную роль при разработке вакцин и лекарств нового поколения.
26 июля, 14:33НаукаУченые объяснили, как отличить симптомы после прививки от раннего COVID-19Концентрация антител оказалась связана с Т-клеточным иммунитетом к коронавирусу — Наука
ТАСС, 23 августа. Российские медики проследили за развитием Т-клеточного иммунитета к коронавирусу примерно у 5 тыс. москвичей и пришли к выводу, что его активность в целом соответствует тому, насколько высока концентрация антител в организме пациентов. Свои выводы ученые опубликовали на medRxiv.
«Наши наблюдения показали, что люди с высокой концентрацией антител, как правило, обладали и сильной Т-клеточной реакцией на коронавирус. Они реже всего заражались коронавирусом. При этом пациенты, у которых наблюдалась только Т-клеточная реакция, были лишь незначительно лучше защищены от инфекции, чем никогда не болевшие москвичи», – пишут исследователи.
Медиков и биологов давно интересует то, как много антител и Т-клеток необходимо для полной защиты организма от коронавирусной инфекции и может ли каждый компонент иммунитета по отдельности подавлять COVID-19. Ответ на этот вопрос важен не только для лечения пациентов и оценки последствий вакцинации, но и для подсчета числа бывших носителей коронавируса.
Российские медики и биологи под руководством Павла Волчкова из МФТИ получили первые сведения такого рода во время наблюдений за здоровьем более 5 тыс. жителей Москвы в промежутке между октябрем прошлого года и началом апреля этого года.
Антитела и клетки
Все эти люди согласились сдать образцы их крови для оценки уровня антител, если они уже переболели коронавирусом, а также для изучения реакции Т-клеток на следы присутствия коронавируса в организме. Примерно 16% добровольцев переболели COVID-19 до начала исследования, а еще 300 заразились коронавирусом во время наблюдений.
Это позволило ученым детально проследить за тем, как формировались оба типа иммунитета и насколько хорошо они защищали организм добровольцев от повторного заражения коронавирусом.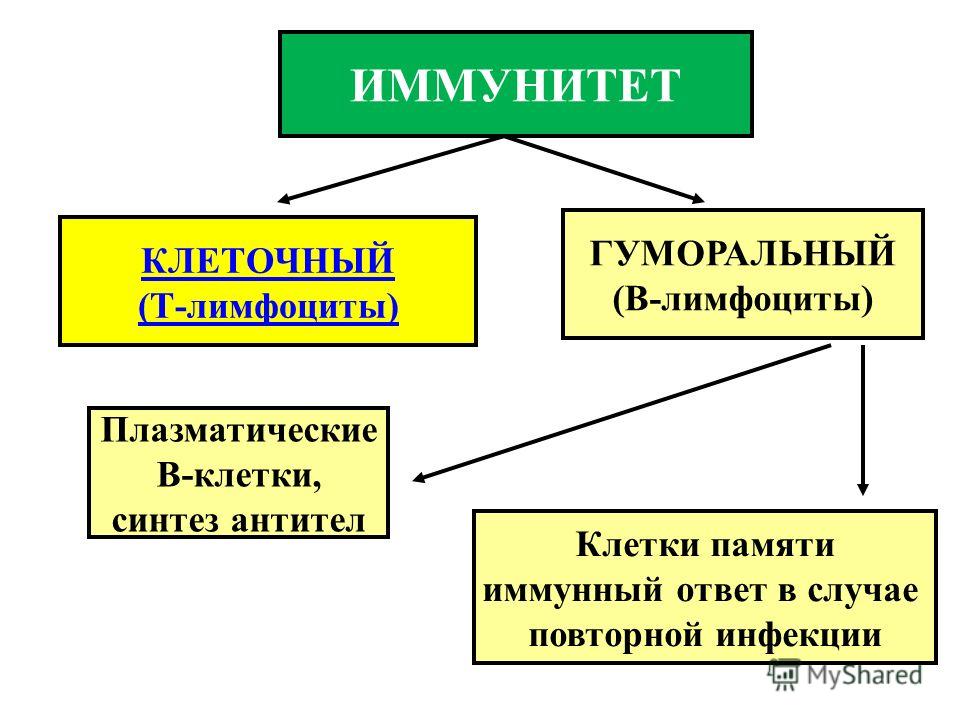 В дополнение биологи изучили, насколько активно культуры Т-клеток реагировали на SARS-CoV-2, а также проследили за тем, как антитела нейтрализовали его частицы.
В дополнение биологи изучили, насколько активно культуры Т-клеток реагировали на SARS-CoV-2, а также проследили за тем, как антитела нейтрализовали его частицы.
Эти наблюдения указали на отсутствие существенных различий в том, как инфекция повлияла на работу и того, и другого компонентов иммунитета. В частности, наличие большого числа антител у добровольцев почти всегда сопровождалось очень активной реакцией Т-клеток на следы вируса в организме. Аналогичным образом, отсутствие антител обычно сопровождалось крайне слабым или отсутствующим Т-клеточным иммунитетом.
Все это, по мнению Волчкова и его коллег, свидетельствует в пользу того, что число переболевших носителей коронавируса можно достаточно точно оценивать по концентрации антител в крови жителей отдельных городов и стран, не тратя дополнительные ресурсы на отдельное изучение Т-клеточного иммунитета. Кроме того, этот показатель можно использовать для оценки вероятности повторного заражения и выработке мер общественного здравоохранения, подытожили ученые.
Следует добавить, что статью ученых не рецензировали независимые эксперты и не проверяли редакторы научных журналов, как это обычно бывает в подобных случаях. Поэтому к выводам из нее и аналогичных статей нужно относиться осторожно.
Комитет по здравоохранению Санкт-Петербурга | Новости
В Городской больнице №40 начали проводить исследование клеточного иммунитета при COVID-19
20 мая 2021
У большинства людей, столкнувшихся с коронавирусной инфекцией SARS-CoV-2, спустя 14 суток от момента контакта обнаруживаются специфические антитела к данному вирусу. Такой ответ на инфекцию ученые называют гуморальным иммунным ответом.
Однако известно, что не менее важную роль в защите от вирусных инфекций играет клеточный иммунитет, опосредуемый клетками иммунной системы, прежде всего Т-лимфоцитами. В ряде случаев эти клетки способны элиминировать вирус без помощи антител. Предполагается, что такая ситуация может возникнуть, например, при контакте человека с низкой дозой возбудителя: Т-клетки уничтожают вирус без значимой активации антителообразования. В этом случае уровень выработавшихся антител может не определяться обычными тест-системами.
В этом случае уровень выработавшихся антител может не определяться обычными тест-системами.
Предполагается, что невосприимчивость некоторых людей к SARS-CoV-2 может быть обусловлена тем, что Т-лимфоциты данных пациентов перекрестно активированы предыдущими контактами с циркулирующими в популяции «простудными» коронавирусами, то есть у них имеется долговременная иммунная память.
Такая память Т-клеток при повторном воздействии вируса может остановить развитие тяжелого заболевания. По данным ряда исследований, у 93% людей, встречавшихся с вирусом SARS-CoV-2, формируется устойчивый Т-клеточный ответ. При этом антитела к коронарирусу были обнаружены только у 60% из них.
«Исследование только гуморального звена иммунитета не может дать полноценной картины иммунного статуса человека, — говорит Ольга Шнейдер, руководитель научно-исследовательского отдела инновационных и конверсионных программ Городской больницы №40. — С целью комплексной оценки иммунного ответа совместно с тестами на оценку уровня антител имеет смысл определять Т-клетки, специфично отвечающие на антигены вируса SARS-CoV-2. В нашем арсенале появилась тест-система, специально предназначенная для выявления в крови Т-лимфоцитов, которые реагируют на коронавирус. Она позволяет измерить силу иммунного ответа на инфекцию».
В нашем арсенале появилась тест-система, специально предназначенная для выявления в крови Т-лимфоцитов, которые реагируют на коронавирус. Она позволяет измерить силу иммунного ответа на инфекцию».
Внедрённая методика будет использована прежде всего в научных исследованиях. Первыми пациентами, сдавшими кровь для оценки Т-клеточного иммунитета, стали врачи Городской больницы №40, ранее переболевшие COVID-19.
Трекрезан. На всех стадиях ОРВИ
Всё о работе стражника организма и о том, как помочь ему держать оборону
Простудился — останься дома. Жаль, что это правило не работает: мы стойко переносим болезнь на ногах и в конце недели падаем на кровать без сил.
Но всегда можно обратиться к советам по укреплению иммунитета, чтобы избежать такого сценария.
Разберёмся, как можно поддержать здоровье и не обманывать себя бесполезными рекомендациями.
У каждого человека два иммунитета
Речь не о запасном иммунитете на случай, если что-то случится с первым. Дело в том, что у нас есть два вида иммунитета, где каждый играет свою роль: клеточный и гуморальный. Они взаимосвязаны и вместе обеспечивают стабильность всего организма.
Дело в том, что у нас есть два вида иммунитета, где каждый играет свою роль: клеточный и гуморальный. Они взаимосвязаны и вместе обеспечивают стабильность всего организма.
Клеточный иммунитет защищает человека от внутриклеточных бактерий и вирусов.
В работе клеточного иммунитета задействованы лимфоциты и фагоциты. Задача фагоцитов — прогуливаться по организму и подавать сигнал лимфоцитам, если клетка вызывает подозрения. Лимфоциты делятся на три группы:
- Т-киллеры. Уничтожают клетки, с которыми не всё в порядке.
- Т-хелперы. Активизируются, когда в человека попадают патогенные микроорганизмы.
- Т-супрессоры. Отвечают за борьбу с аутоиммунными заболеваниями.
Гуморальный иммунитет устроен сложнее. Гуморальный — значит «растворимый». В нём трудятся родственники клеточного иммунитета — В-лимфоциты. Они продуцируют антитела, которые окружают дефектные антигены и ждут прибытия Т-киллеров.
Есть и обратная сторона этого процесса. В первые дни болезни антитела вырабатываются медленно. И здесь вступает в игру иммунная память: она помогает запоминать враждебные антигены. Когда они попытаются снова навредить организму, то антитела начнут быстро вырабатываться в первые сутки. В результате мы либо не заболеем, либо легко перенесём болезнь.
В первые дни болезни антитела вырабатываются медленно. И здесь вступает в игру иммунная память: она помогает запоминать враждебные антигены. Когда они попытаются снова навредить организму, то антитела начнут быстро вырабатываться в первые сутки. В результате мы либо не заболеем, либо легко перенесём болезнь.
Как поддержать иммунитет
Можно начать с простых рекомендаций:
- Занимайтесь физкультурой
- Откажитесь от курения, алкоголя и перекусов на бегу
- Всегда высыпайтесь
- Сдайте анализы и пропейте курс недостающих витаминов
Эти советы помогут улучшить самочувствие и качество жизни. Для дополнительной поддержки иммунитета можно начать приём препаратов, обладающих иммуномодулирующим свойством. Один из таких — Трекрезан.
Его главные преимущества:
- стимуляция работы клеточного и гуморального иммунитета
- активизация выработки интерферонов, которые уничтожают вирусы
- повышение работоспособности организма
А ещё Трекрезан обладает адаптогенным действием: стабилизирует мембраны клеток, оказывает антиоксидантный эффект, стимулирует синтез внутриклеточных и иммунных белков. Всё это приводит к тому, что мы легче справляемся со стрессами и физическими нагрузками. Так один препарат одновременно укрепляет иммунитет и увеличивает работоспособность организма.
Всё это приводит к тому, что мы легче справляемся со стрессами и физическими нагрузками. Так один препарат одновременно укрепляет иммунитет и увеличивает работоспособность организма.
Когда можно принимать Трекрезан:
- осенью, зимой и ранней весной для профилактики сезонных инфекций
- как только почувствовали первые симптомы простуды
- после болезни, чтобы быстрее восстановиться
- во время акклиматизации
- в период высоких умственных и физических нагрузок
Не забывайте, что иммунитет — важная часть нашего организма. Поддерживайте его, не запускайте болезни, давайте себе время на восстановление после трудной работы. И тогда на смену затяжным больничным, на которых можно «отлежаться», придут яркие и активные дни, полные радостных встреч и позитивных эмоций.
Колоться или нет? Эксперты разделились во мнении о том, как проверить иммунитет к ковиду
Пандемия по-прежнему волнует людей, и медицина придумывает всё новые варианты, как проверить и обезопасить себя от мировой заразы. Так, лаборатории предлагают сдать анализ на Т-клетки. Его, согласно описанию на сайтах лабораторий, рекомендуют тем, кто перенёс ковид, но в чьих анализах крови при этом не обнаружены специфические иммуноглобулины. Или есть симптоматика заболевания, но экспресс-тест на антиген ничего не выявляет.
Так, лаборатории предлагают сдать анализ на Т-клетки. Его, согласно описанию на сайтах лабораторий, рекомендуют тем, кто перенёс ковид, но в чьих анализах крови при этом не обнаружены специфические иммуноглобулины. Или есть симптоматика заболевания, но экспресс-тест на антиген ничего не выявляет.
Что такое анализ на клеточный иммунитет?
Врач-терапевт, основатель приложения «Справочник врача» Константин Хоманов объяснил, что клеточный иммунитет — это тип иммунного ответа, в котором не участвуют ни антитела, ни система комплемента — веществ крови, активирующих процесс уничтожения вируса. Клеточный иммунитет обеспечивается особыми типами клеток — CD+ и NK-клетками, которые могут уничтожить вирус без антител и комплемента.
— То есть у вас может не быть антител, но может быть клеточный иммунитет. И это очень хорошо. В США, проанализировав образцы крови 30 человек, которые заболели CoViD-19, выяснили, что их клеточный иммунитет защищает от «британского», «южноафриканского» и «бразильского» штаммов коронавируса, — рассказал Константин Хоманов.
По словам врача-терапевта европейского медицинского центра «Терапевт», кандидата медицинских наук Петра Глазунова, оценка Т-клеточного иммунитета — относительно новое, но уже доказавшее свою эффективность исследование. С его помощью можно определить, перенёс ли пациент CoViD-19.
— С помощью этого исследования в крови пациента находят Т-лимфоциты — клетки, которые реагируют на проникновение в организм коронавирусной инфекции, — пояснил Пётр Глазунов.— Т-клетки отвечают на попадание вируса в организм раньше, чем антитела. В исследованиях показано, что у перенёсших CoViD-19 пациентов антитела появляются в 60%, а Т-клеточный иммунитет —в93% случаев. Ранняя диагностика CoViD-19, в том числе у людей без симптомов, и оценка иммунитета проводится в случае, если был контакт с заболевшим, есть симптомы ОРВИ, но ПЦР отрицательный, а на антитела сдавать ещё рано.
Сдать анализ на клеточный иммунитет после прививки от ковида стали рекомендовать для того, чтобы понять, была ли вакцина эффективна, появился ли у человека иммунитет к инфекции, пояснил Пётр Глазунов.
По его словам, существует два вида иммунитета, вырабатываемых организмом в ответ на коронавирусную инфекцию: гуморальный и клеточный. Анализ на антитела выявляет в крови человека белки IgG, то есть наличие гуморального иммунитета.
Но такое исследование неточно, так как антитела IgG не всегда находят у того, кто перенёс CoViD-19. Поэтому при отрицательном результате анализа на антитела специалисты рекомендуют провести исследование на Т-лимфоциты, которое покажет, есть ли у человека клеточный иммунитет к заболеванию, уточнил эксперт.
— Тест заключается в определении количества специфичных Т-клеток в поле зрения. Если их более 10, то Т-клеточный ответ есть, если их более 60 — значит, степень защиты высокая,— рассказал Пётр Глазунов.
Иное мнение
Ведущий эксперт Центра молекулярной диагностики CMD ЦНИИ эпидемиологии Роспотребнадзора Маргарита Провоторова отметила, что сейчас исследование Т-клеточного иммунитета не входит в перечень зарегистрированных медицинских услуг. Результаты анализа носят научно-исследовательский и аналитический характер и в рутинной медицинской практике пока неприменимы.
Результаты анализа носят научно-исследовательский и аналитический характер и в рутинной медицинской практике пока неприменимы.
Специалист по особо опасным инфекциям, врач-иммунолог Владислав Жемчугов считает, что пациентам не стоит делать анализ на клеточный иммунитет, выкладывая за него немалые деньги.
— Иммунитет един и одинаково реагирует на любую угрозу, будь она внутренняя, как онкология, или внешняя, как микробы, вирусы. Рекомендации сделать тест на клеточный иммунитет — чистое выколачивание денег за анализ, так как людям это ничего не даёт в плане решения вопроса о реальной защите, — пояснил Владислав Жемчугов.
Специалист считает, что анализы на клеточный иммунитет не имеют смысла в решении вопроса о том, есть ли защита у конкретного человека от заражения, так как достаточно анализа на антитела. Наличие антител говорит о том, что человек уже переболел коронавирусом или вакцинирован. По словамВладислава Жемчугова, это гарантия того, что у человека на полгода точно есть защита от заражения значительными дозами вируса.
Фото © Агентство городских новостей «Москва» / Сергей Киселёв
Эксперт подчеркнул, что никакие анализы, даже на антитела, не определяют уровень защиты, так как титр антител не связан с её уровнем. Спустя полгода вакцинированные не болеют или переносят вирус легко. Значит, вакцина работает, считает иммунолог.
— Не надо сдавать клеточный тест. Если есть иммунный ответ — человек переболел или вакцинирован. На полгода, а то и на год надо забыть, что вы подвержены заражению, — рекомендуетврач-иммунолог Владислав Жемчугов. — Через год читайте научную литературу, чтобы узнать, хватает иммунитета от вакцины на год или нужна ревакцинация. Значит, год нечего дёргаться, бежать и определять титры, клеточный иммунитет.
Подпишитесь на LIFE
В России создают тест на определение Т-клеточного иммунитета к коронавирусу
27.11.2020
Т-клетки (Т-лимфоциты) хранят информацию о ранее выявленных иммунной системой в организме антигенах и формируют долговременный иммунитет к перенесенным инфекционным заболеваниям. Т-клетки, специфичные к SARS-Cov-2, есть даже у людей, которые перенесли инфекцию бессимптомно и не выработали антитела. Ученые НМИЦ гематологии выяснили, что Т-клетки, которые «узнают» коронавирус, обнаруживаются даже в образцах крови, взятых еще до пандемии. Этот феномен исследователи объясняют перекрестным иммунитетом, вызванным ранее перенесенными коронавирусными инфекциями.
Т-клетки, специфичные к SARS-Cov-2, есть даже у людей, которые перенесли инфекцию бессимптомно и не выработали антитела. Ученые НМИЦ гематологии выяснили, что Т-клетки, которые «узнают» коронавирус, обнаруживаются даже в образцах крови, взятых еще до пандемии. Этот феномен исследователи объясняют перекрестным иммунитетом, вызванным ранее перенесенными коронавирусными инфекциями.
«Мы получаем все больше сведений, что Т-клетки, как минимум, не менее важный защитный механизм против COVID-19, чем антитела. Это подтверждается тем, что у многих, особенно легко и бессимптомно переболевших, не вырабатываются антитела, а Т-клетки присутствуют. Исследования показывают, что уже через полгода у значительной части переболевших количество антител сильно снижается, а у некоторых они и вовсе исчезают. Т-клеточный ответ потенциально сохраняется гораздо дольше»,— сообщил МедПорталу сотрудник лаборатории трансплантационной иммунологии НМИЦ гематологии Алексей Титов.
Массово протестировать людей на Т-клеточный иммунитет пока технически невозможно: такие исследования проводятся только в специализированных лабораториях практически вручную. Специалисты НМИЦ-гематологии работают над созданием тестов на Т-клетки, которые позволят выявлять переболевших на более длительной временной дистанции, чем антитела.
Специалисты НМИЦ-гематологии работают над созданием тестов на Т-клетки, которые позволят выявлять переболевших на более длительной временной дистанции, чем антитела.
«Технология основана на зарекомендовавшем себя методе выявления реагирующих на вирус Т-клеток, однако нашим ноу-хау является конкретный набор фрагментов коронавирусных белков, который мы тщательно отбираем, отсекая те, что могут дать ложно-позитивную реакцию Т-клеток»,— рассказал Алексей Титов,— «Эти тесты смогут в спорных случаях подтвердить факт прошлой коронавирусной инфекции, а также использоваться для оценки эффективности вакцинации».
«В перспективе мы сможем установить „границу“ Т-клеточного ответа, при пересечении которой человек, скорее всего, не заболеет. А для тех, кто ее не пересек, возможно, болезнь будет протекать легче. Но для того, чтобы провести такие исследования, требуется время»,— отметил Алексей Титов.
Ученые НМИЦ гематологии планируют завершить разработку теста уже зимой 2021 года. В ближайшее время он будет использоваться только в исследовательских целях. Однако на основе той же технологии работают некоторые тесты на латентный туберкулез (Т-спот), поэтому не исключено, что, как минимум, те же лаборатории, которые предоставляют такую услугу, смогут проводить тестирование.
В ближайшее время он будет использоваться только в исследовательских целях. Однако на основе той же технологии работают некоторые тесты на латентный туберкулез (Т-спот), поэтому не исключено, что, как минимум, те же лаборатории, которые предоставляют такую услугу, смогут проводить тестирование.
Читать подробнее.
Клеточный иммунитет — обзор
Клеточный иммунный ответ на вакцинацию
Клеточный иммунный ответ после вакцинации кажется аналогичным по масштабу и величине тем, которые измеряются после естественного инфицирования. Йокинен и его коллеги 192 обнаружили антиген-специфические лимфопролиферативные реакции паротита у 49 из 50 человек, оцененных через 21 год после получения второй дозы M-M-R II, у 28% из которых не было обнаруживаемых уровней антител паротита. В этом исследовании продукция IFN-γ, индуцированная антигеном эпидемического паротита, была обнаружена у 73% субъектов, а продукция интерлейкина-10 была обнаружена у 40%.Лимфопролиферативные ответы и уровни цитокинов были такими же высокими, как и в контрольной группе, состоящей из лиц с естественным иммунитетом.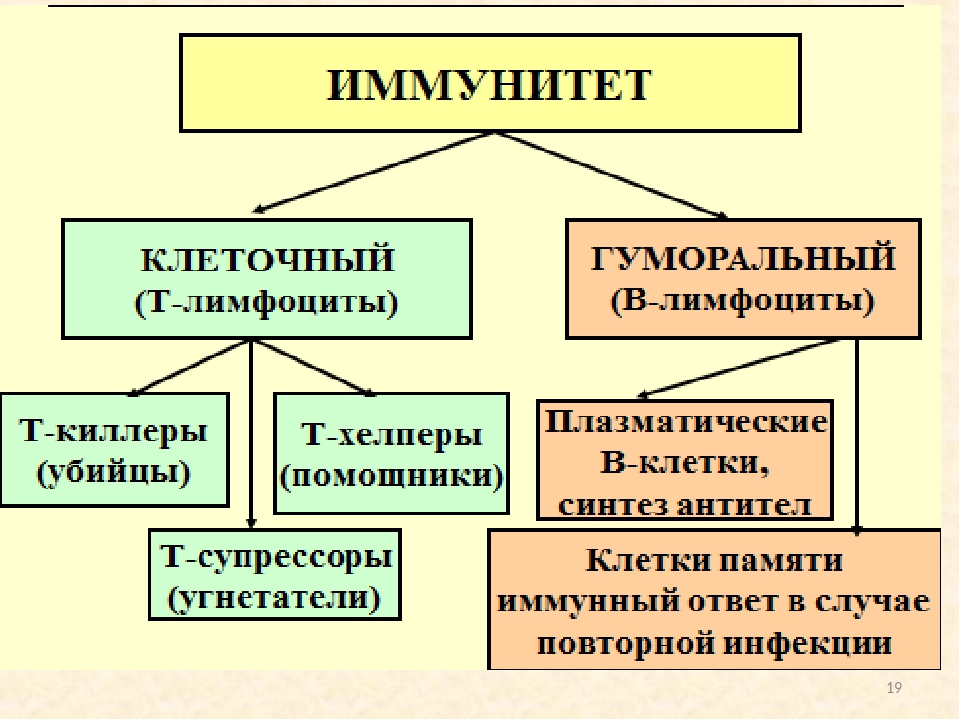 Это также было предложено в наблюдательном нерандомизированном когортном исследовании по оценке клеточно-опосредованного иммунитета к эпидемическому паротиту у 10 взрослых с естественным иммунитетом и 10 человек, вакцинированных второй дозой M-M-R II не менее 10 лет назад. В этом исследовании Т-клеточный иммунитет к эпидемическому паротиту был идентифицирован у 80% естественно иммунных и 70% вакцинированных лиц, 188 и аналогичное количество продуцирующих IFN-γ, специфичных для эпидемического паротита CD4 + Т-клеток было обнаружено в обеих группах. .Другие исследования обнаружили более низкие показатели клеточно-опосредованных иммунных ответов после вакцинации. В стратифицированном популяционном исследовании детей, иммунизированных M-M-R II, Диман и его коллеги 366 обнаружили специфические для вируса паротита лимфопролиферативные реакции в 67% проб крови, полученных через 4–6 лет после получения второй дозы вакцины. Vandermeulen и его коллеги 254 сообщили об идентичном результате, основанном на тестировании образцов крови, полученных через 16 лет после вакцинации.
Это также было предложено в наблюдательном нерандомизированном когортном исследовании по оценке клеточно-опосредованного иммунитета к эпидемическому паротиту у 10 взрослых с естественным иммунитетом и 10 человек, вакцинированных второй дозой M-M-R II не менее 10 лет назад. В этом исследовании Т-клеточный иммунитет к эпидемическому паротиту был идентифицирован у 80% естественно иммунных и 70% вакцинированных лиц, 188 и аналогичное количество продуцирующих IFN-γ, специфичных для эпидемического паротита CD4 + Т-клеток было обнаружено в обеих группах. .Другие исследования обнаружили более низкие показатели клеточно-опосредованных иммунных ответов после вакцинации. В стратифицированном популяционном исследовании детей, иммунизированных M-M-R II, Диман и его коллеги 366 обнаружили специфические для вируса паротита лимфопролиферативные реакции в 67% проб крови, полученных через 4–6 лет после получения второй дозы вакцины. Vandermeulen и его коллеги 254 сообщили об идентичном результате, основанном на тестировании образцов крови, полученных через 16 лет после вакцинации. В этом исследовании лимфопролиферация была продемонстрирована у 54% из 24 субъектов с низким титром антител по сравнению с 79% из 24 субъектов с высоким титром антител.Средний индекс стимуляции для субъектов с низкими титрами антител был примерно вдвое меньше, чем у субъектов с высокими титрами антител, что предполагает некоторую корреляцию между антителами и клеточно-опосредованными иммунными ответами на вакцинацию против эпидемического паротита.
В этом исследовании лимфопролиферация была продемонстрирована у 54% из 24 субъектов с низким титром антител по сравнению с 79% из 24 субъектов с высоким титром антител.Средний индекс стимуляции для субъектов с низкими титрами антител был примерно вдвое меньше, чем у субъектов с высокими титрами антител, что предполагает некоторую корреляцию между антителами и клеточно-опосредованными иммунными ответами на вакцинацию против эпидемического паротита.
В отличие от гуморальных иммунных ответов на вакцинацию, которые могут зависеть от возраста (см. «Факторы, влияющие на сероконверсию») и уменьшаться со временем (см. «Устойчивость антител»), величина клеточного иммунного ответа, по-видимому, не зависит от них. факторы. 192, 367
Как и в случае естественной инфекции, роль клеточно-опосредованных иммунных ответов в защите от повторного заражения или ослаблении течения заболевания не установлена (см. «Гуморальные и клеточно-опосредованные реакции на естественные инфекции»). инфекционное заболевание»). Интересно, что уровни лимфопролиферативных ответов, индуцированных после одной и двух доз M-M-R II, были аналогичны тем, которые индуцировались после одной и двух доз тривиратена. 368 Учитывая, что вакцина Тривиратен практически не обеспечивает защиты (см. «Эффективность при использовании в полевых условиях и продолжительность иммунитета»), величина специфического для вируса паротита, клеточно-опосредованного ответа после вакцинации, по-видимому, не позволяет предсказать эффективность вакцины, и , по большому счету, охрана.
инфекционное заболевание»). Интересно, что уровни лимфопролиферативных ответов, индуцированных после одной и двух доз M-M-R II, были аналогичны тем, которые индуцировались после одной и двух доз тривиратена. 368 Учитывая, что вакцина Тривиратен практически не обеспечивает защиты (см. «Эффективность при использовании в полевых условиях и продолжительность иммунитета»), величина специфического для вируса паротита, клеточно-опосредованного ответа после вакцинации, по-видимому, не позволяет предсказать эффективность вакцины, и , по большому счету, охрана.
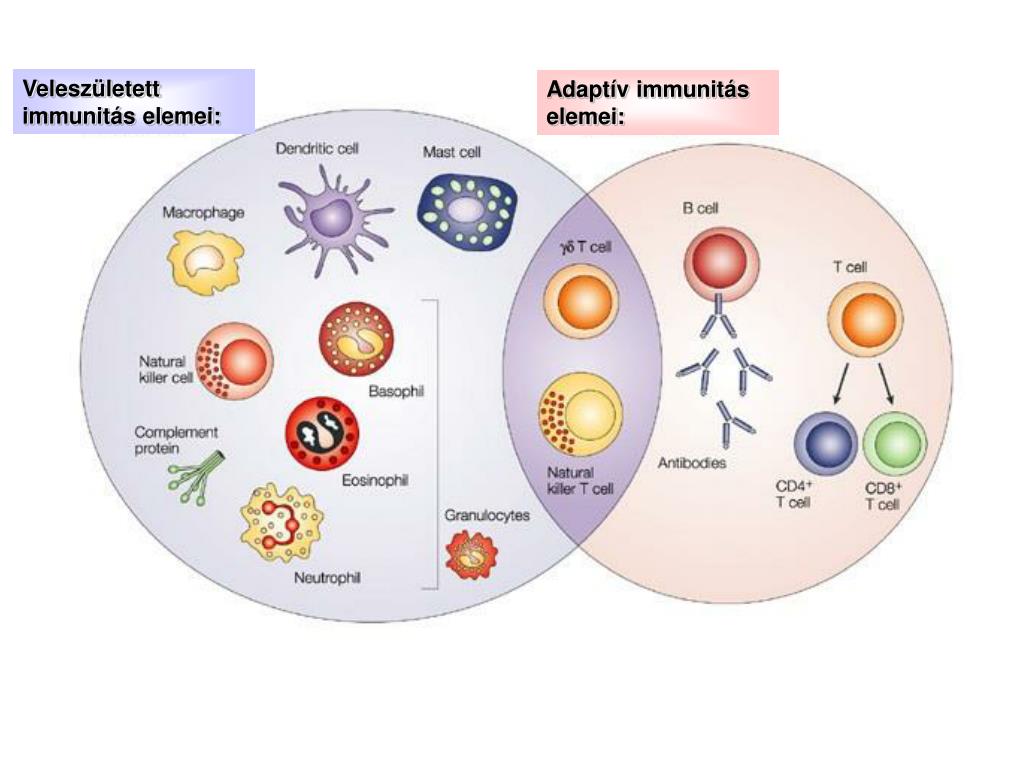
Адаптивная иммунная система — молекулярная биология клетки
Наша адаптивная иммунная система спасает нас от неминуемой смерти от инфекции. Младенец, рожденный с серьезно дефектной адаптивной иммунной системой, скоро умрет, если не будут приняты чрезвычайные меры для изоляции его от множества инфекционных агентов, включая бактерии, вирусы, грибки и паразиты. Действительно, всем многоклеточным организмам необходимо защищаться от заражения такими потенциально опасными захватчиками, которые вместе называются патогенами. Беспозвоночные используют относительно простые защитные стратегии, которые в основном полагаются на защитные барьеры, токсичные молекулы и фагоцитарные клетки, которые поглощают и уничтожают вторгшиеся микроорганизмы (микробы) и более крупных паразитов (таких как черви). Позвоночные животные тоже зависят от таких врожденных иммунных ответов в качестве первой линии защиты (обсуждается в главе 25), но они также могут создавать гораздо более сложные защиты, называемые адаптивными иммунными ответами. Врожденные реакции вызывают в игру адаптивные иммунные реакции, и оба работают вместе, чтобы устранить патогены ().В отличие от врожденных иммунных ответов, адаптивные ответы очень специфичны для конкретного патогена, который их вызвал. Они также могут обеспечить длительную защиту. Например, человек, выздоравливающий от кори, на всю жизнь защищен от кори адаптивной иммунной системой, но не от других распространенных вирусов, например, вызывающих паротит или ветряную оспу. В этой главе мы сосредотачиваемся в основном на адаптивных иммунных ответах, и, если мы не укажем иное, термин иммунные ответы относится к ним.
Беспозвоночные используют относительно простые защитные стратегии, которые в основном полагаются на защитные барьеры, токсичные молекулы и фагоцитарные клетки, которые поглощают и уничтожают вторгшиеся микроорганизмы (микробы) и более крупных паразитов (таких как черви). Позвоночные животные тоже зависят от таких врожденных иммунных ответов в качестве первой линии защиты (обсуждается в главе 25), но они также могут создавать гораздо более сложные защиты, называемые адаптивными иммунными ответами. Врожденные реакции вызывают в игру адаптивные иммунные реакции, и оба работают вместе, чтобы устранить патогены ().В отличие от врожденных иммунных ответов, адаптивные ответы очень специфичны для конкретного патогена, который их вызвал. Они также могут обеспечить длительную защиту. Например, человек, выздоравливающий от кори, на всю жизнь защищен от кори адаптивной иммунной системой, но не от других распространенных вирусов, например, вызывающих паротит или ветряную оспу. В этой главе мы сосредотачиваемся в основном на адаптивных иммунных ответах, и, если мы не укажем иное, термин иммунные ответы относится к ним. Мы подробно обсуждаем врожденные иммунные реакции в главе 25.
Мы подробно обсуждаем врожденные иммунные реакции в главе 25.
Рисунок 24-1
Врожденные и адаптивные иммунные ответы. Врожденные иммунные реакции активируются непосредственно патогенами и защищают все многоклеточные организмы от инфекции. У позвоночных патогены вместе с врожденными иммунными реакциями, которые они активируют, стимулируют адаптивные (подробнее …)
Функция адаптивных иммунных ответов заключается в уничтожении вторгающихся патогенов и любых токсичных молекул, которые они производят. Поскольку эти ответы деструктивны, крайне важно, чтобы они происходили только в ответ на молекулы, чуждые хозяину, а не молекулы самого хозяина.Таким образом, способность отличать чужеродный от собственного является фундаментальной особенностью адаптивной иммунной системы. Иногда система не может сделать это различие и деструктивно реагирует на собственные молекулы хозяина. таких аутоиммунных заболеваний могут привести к летальному исходу.
Конечно, многие чужеродные молекулы, попадающие в организм, безвредны, и было бы бессмысленно и потенциально опасно создавать против них адаптивные иммунные реакции.Аллергические состояния, такие как сенная лихорадка и астма, являются примерами пагубных адаптивных иммунных ответов против явно безвредных чужеродных молекул. Таких несоответствующих ответов обычно избегают, потому что врожденная иммунная система вызывает адаптивные иммунные ответы только тогда, когда она распознает молекулы, характерные для вторгающихся патогенов, называемые иммуностимуляторами, ассоциированными с патогенами, (обсуждается в главе 25). Более того, врожденная иммунная система может различать разные классы патогенов и задействовать наиболее эффективную форму адаптивного иммунного ответа для их устранения.
Любое вещество, способное вызывать адаптивный иммунный ответ, называется антигеном. (антикоррозийный корпус gen erator). Большая часть того, что мы знаем о таких реакциях, получено в результате исследований, в которых экспериментатор обманом заставляет адаптивную иммунную систему лабораторного животного (обычно мыши) реагировать на безвредную чужеродную молекулу, такую как чужеродный белок. Уловка заключается во введении безвредной молекулы вместе с иммуностимуляторами (обычно микробного происхождения), называемыми адъювантами , , которые активируют врожденную иммунную систему.Этот процесс называется иммунизацией . Если вводить таким образом, почти любая макромолекула, если она чужда реципиенту, может вызвать адаптивный иммунный ответ, специфичный для вводимой макромолекулы. Примечательно, что адаптивная иммунная система может различать антигены, которые очень похожи, например, между двумя белками, которые отличаются только одной аминокислотой, или между двумя оптическими изомерами одной и той же молекулы.
Уловка заключается во введении безвредной молекулы вместе с иммуностимуляторами (обычно микробного происхождения), называемыми адъювантами , , которые активируют врожденную иммунную систему.Этот процесс называется иммунизацией . Если вводить таким образом, почти любая макромолекула, если она чужда реципиенту, может вызвать адаптивный иммунный ответ, специфичный для вводимой макромолекулы. Примечательно, что адаптивная иммунная система может различать антигены, которые очень похожи, например, между двумя белками, которые отличаются только одной аминокислотой, или между двумя оптическими изомерами одной и той же молекулы.
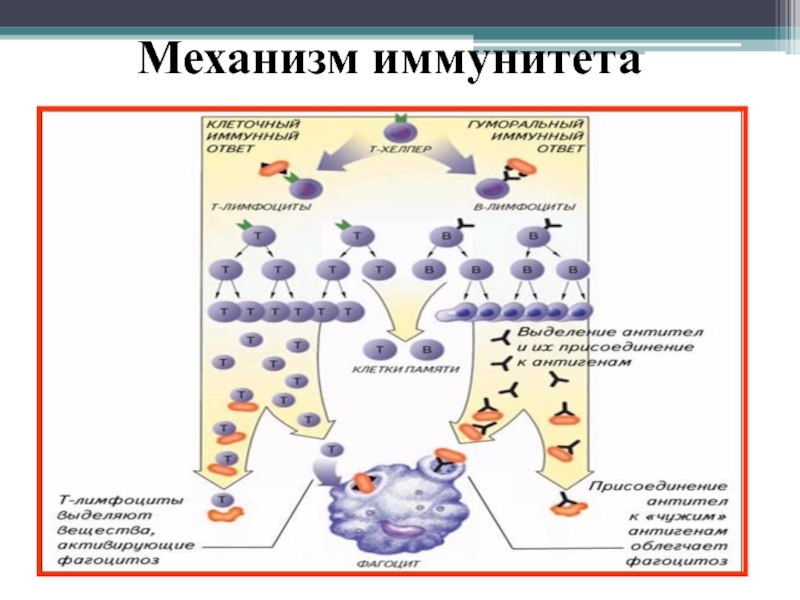
Адаптивный иммунный ответ осуществляется лейкоцитами, называемыми лимфоцитами.Существует два широких класса таких ответов — ответы антител и клеточно-опосредованные иммунные ответы , и они осуществляются разными классами лимфоцитов, называемыми В-клетками и Т-клетками, соответственно. В ответах антител В-клетки активируются, чтобы секретировать антитела, которые представляют собой белки, называемые иммуноглобулинами . Антитела циркулируют в кровотоке и проникают в другие жидкости организма, где они специфически связываются с чужеродным антигеном, который стимулировал их выработку ().Связывание антител инактивирует вирусы и микробные токсины (такие как токсин столбняка или токсин дифтерии), блокируя их способность связываться с рецепторами на клетках-хозяевах. Связывание антител также отмечает вторгшиеся патогены для разрушения, в основном за счет облегчения их поглощения фагоцитарными клетками врожденной иммунной системы.
Антитела циркулируют в кровотоке и проникают в другие жидкости организма, где они специфически связываются с чужеродным антигеном, который стимулировал их выработку ().Связывание антител инактивирует вирусы и микробные токсины (такие как токсин столбняка или токсин дифтерии), блокируя их способность связываться с рецепторами на клетках-хозяевах. Связывание антител также отмечает вторгшиеся патогены для разрушения, в основном за счет облегчения их поглощения фагоцитарными клетками врожденной иммунной системы.
Рисунок 24-2
Два основных класса адаптивных иммунных ответов. Лимфоциты выполняют оба класса ответов. Здесь лимфоциты реагируют на вирусную инфекцию.В одном классе ответов В-клетки секретируют антитела, которые нейтрализуют вирус. С другой стороны, (подробнее …)
В клеточно-опосредованных иммунных ответах, втором классе адаптивного иммунного ответа, активированные Т-клетки реагируют непосредственно против чужеродного антигена, который представлен им на поверхности клетки-хозяина. Т-клетка, например, может убить инфицированную вирусом клетку-хозяин, имеющую вирусные антигены на своей поверхности, тем самым уничтожая инфицированную клетку до того, как вирус сможет реплицироваться (см.).В других случаях Т-лимфоциты вырабатывают сигнальные молекулы, которые активируют макрофаги для уничтожения вторгшихся микробов, которых они фагоцитировали.
Т-клетка, например, может убить инфицированную вирусом клетку-хозяин, имеющую вирусные антигены на своей поверхности, тем самым уничтожая инфицированную клетку до того, как вирус сможет реплицироваться (см.).В других случаях Т-лимфоциты вырабатывают сигнальные молекулы, которые активируют макрофаги для уничтожения вторгшихся микробов, которых они фагоцитировали.
Мы начинаем эту главу с обсуждения общих свойств лимфоцитов. Затем мы рассматриваем функциональные и структурные особенности антител, которые позволяют им распознавать и нейтрализовать внеклеточные микробы и токсины, которые они вырабатывают. Затем мы обсудим, как В-клетки могут производить практически неограниченное количество различных молекул антител. Наконец, мы рассматриваем особенности Т-клеток и клеточно-опосредованные иммунные ответы, за которые они несут ответственность.Примечательно, что Т-клетки могут обнаруживать микробы, скрывающиеся внутри клеток-хозяев, и либо убивать инфицированные клетки, либо помогать другим клеткам уничтожить микробы.
Гуморальный против клеточно-опосредованного иммунитета | Технологические сети
Гуморальный иммунитет и клеточный иммунитет — это два типа адаптивного иммунного ответа, которые позволяют человеческому организму целенаправленно защищаться от вредных агентов, таких как бактерии, вирусы и токсины. Несмотря на то, что между этими ответвлениями иммунного ответа есть некоторое совпадение — оба они зависят от функций лимфоидных клеток — есть также некоторые важные различия.
Можно приобрести гуморальный иммунитет к конкретной инфекции или заболеванию, если вводить антитела от кого-то, кто ранее был подвержен той же инфекции, в обход гуморального ответа. Однако иммунитет, опосредованный антителами, включает набор молекулярных компонентов и процессов, которые отличаются от иммунитета, опосредованного клетками. В этой статье мы определяем гуморальный иммунитет и клеточный иммунитет, обсуждая различные иммунные процессы, цели и важные типы клеток.
Гуморальный иммунитет — это опосредованная антителами реакция, которая возникает, когда в организме обнаруживаются чужеродные вещества — антигены.
 Этот чужеродный материал обычно включает внеклеточных захватчиков, таких как бактерии. Этот механизм в первую очередь запускается лимфоцитами В-клеток, типом иммунных клеток, которые вырабатывают антитела после обнаружения специфического антигена.
Этот чужеродный материал обычно включает внеклеточных захватчиков, таких как бактерии. Этот механизм в первую очередь запускается лимфоцитами В-клеток, типом иммунных клеток, которые вырабатывают антитела после обнаружения специфического антигена.
Наивные В-клетки — это лимфоциты, которые циркулируют по всему телу в лимфатической системе. Эти лимфоциты экспрессируют множество антиген-специфических молекул, которые необходимы для обнаружения инфекционных агентов в организме человека. Когда наивные В-клетки сталкиваются с антигеном в лимфатической системе, они подвергаются процессу дифференцировки, который приводит к созданию В-клеток памяти и эффекторных В-клеток.
Во время этой дифференцировки В-клетки памяти и эффекторные В-клетки продуцируют те же антиген-специфические молекулы, что и их родительские наивные В-клетки. С помощью Т-клеточных лимфоцитов, в свою очередь активируемых рецепторами МНС класса II, которые распознают антигены, ассоциированные с микробами, активированные В-клетки памяти экспрессируют эти антигенспецифические молекулы на своей поверхности, в то время как эффекторные В-клетки секретируют эти молекулы в кровь для связывания интересующий антиген.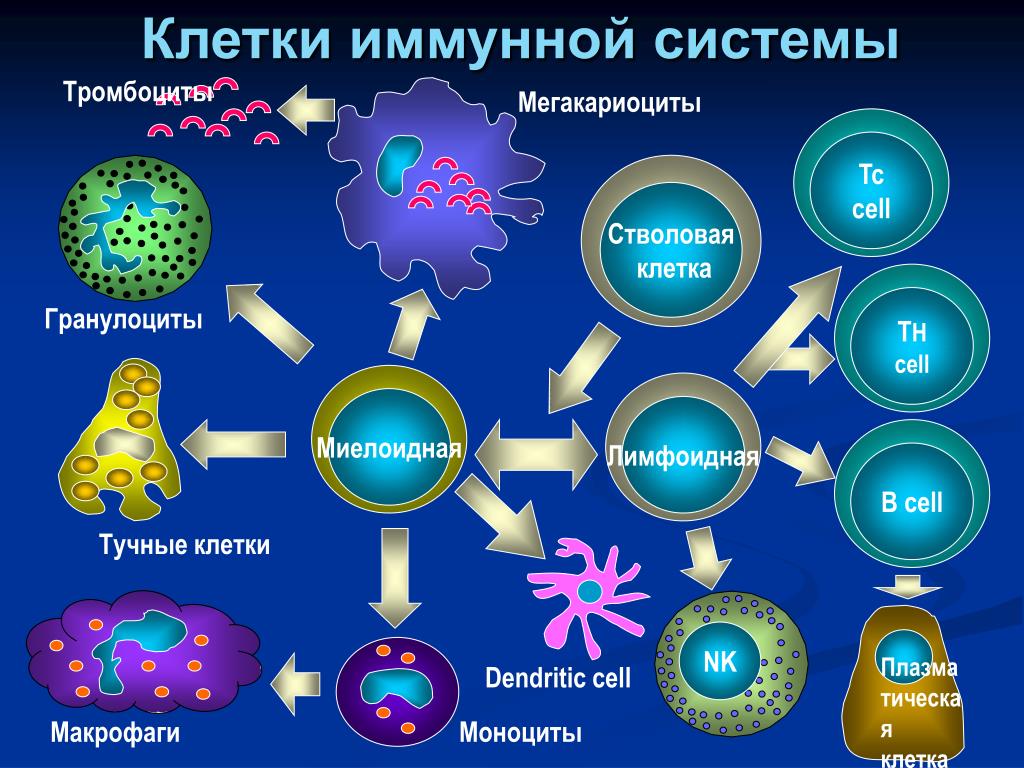
Что такое антитело?
Антитела — это тяжелые белки размером примерно 10 нанометров.Эти молекулы производятся В-клетками для выявления и нейтрализации вредных агентов, таких как инфекционные бактерии, грибы и вирусы. Эти Y-образные белки содержат антигенсвязывающие сайты, которые специфически связываются с их антигенами-мишенями. Как только антитела эффективно связываются со своим антигеном-мишенью, они могут либо нейтрализовать свой антиген-мишень напрямую, блокируя нормальное связывание антигена, либо могут вызвать рекрутирование других иммунных клеток. или молекулы, которые способствуют удалению или разрушению антигенов.У млекопитающих такие антитела имеют множество форм, обычно известных как изотипы.Как вырабатываются антитела?
Каждая В-клетка продуцирует собственный набор антител с уникальными антиген-специфическими сайтами связывания. Первоначально наивные В-клетки продуцируют антитела, которые остаются связанными с клеточной поверхностью, так что их открытые антигенсвязывающие сайты могут обнаруживать потенциальные патогены, токсины и чужеродный материал.
 Эта поверхностно-связанная форма антитела известна как иммуноглобулин.
Эта поверхностно-связанная форма антитела известна как иммуноглобулин. Когда антиген, соответствующий антигенсвязывающему сайту, связывается с наивной В-клеткой или В-клеткой памяти, он активирует В-клетку, чтобы производить и секретировать больше антиген-специфических антител. Когда В-клетка полностью созревает, она называется плазматической клеткой и будет продолжать вырабатывать и секретировать антиген-специфические антитела до конца своего жизненного цикла.
Как только антитела попадают в кровоток, эти свободно плавающие белки готовы действовать как защитные молекулы с прямыми и косвенными иммунными функциями.К этим функциям относятся:
- нейтрализация инфекционных агентов — посредством блокирования или антителозависимой клеточной цитотоксичности
- активация системы комплемента — комплемент-зависимая цитотоксичность
- связывание чужеродных веществ, подлежащих разрушению — опсонизация и фагоцитоз
Антитела нейтрализуют антигены прежде всего через механизмы прикрепления и накопления. Например, агрегация нейтрализующих антител на вирусных частицах, соответствующих антигену, блокирует способность этого вируса инфицировать другие клетки.
Например, агрегация нейтрализующих антител на вирусных частицах, соответствующих антигену, блокирует способность этого вируса инфицировать другие клетки.
Антитела также могут участвовать в процессах, которые приводят к лизису или уничтожению инфицированных или антигенпрезентирующих клеток посредством активации каскада комплемента или взаимодействия с эффекторными клетками и высвобождения цитокинов. Система комплемента является частью врожденного иммунитета, который увеличивает способность антител и лимфоцитов очищать организм от патогенов и инфицированных клеток. Наконец, антитела, которые покрывают патогены или инфицированные клетки, могут притягиваться (опсонизироваться) и интернализоваться макрофагами во время фагоцитоза.
Гуморальный иммунитет зависит от лимфоцитов, обеспечивающих защиту от инфекции посредством функций, опосредованных антителами, но это не единственная форма адаптивного иммунитета, в котором участвуют лимфоциты костного мозга.
В отличие от гуморального иммунитета , клеточный иммунитет не зависит от антител для его адаптивных иммунных функций.
 Клеточно-опосредованный иммунитет в первую очередь обеспечивается зрелыми Т-клетками, макрофагами и высвобождением цитокинов в ответ на антиген.
Клеточно-опосредованный иммунитет в первую очередь обеспечивается зрелыми Т-клетками, макрофагами и высвобождением цитокинов в ответ на антиген. Т-клетки, участвующие в клеточно-опосредованном иммунитете, полагаются на антигенпрезентирующие клетки, которые содержат мембраносвязанные белки MHC класса I, чтобы распознавать внутриклеточные антигены-мишени. Специфичность связывания между белками MHC и чужеродными антигенами важна для созревания и дифференцировки наивных Т-клеток в Т-хелперы или Т-клетки-киллеры.
Клеточный иммунитет обычно проявляется в тех участках тела, где клетки инфицированы вирусом, бактериями или грибами (внутриклеточные захватчики).С помощью белков MHC класса I Т-клетки также могут распознавать раковые клетки.
Основные типы лимфоцитов, участвующих в клеточном иммунитете, включают хелперные Т-клетки, Т-киллеры и макрофаги. Когда «вспомогательная» Т-клетка находит в организме антигенпрезентирующую клетку, она высвобождает набор сигнальных белков, называемых цитокинами.
 Эти цитокины активируют «киллерные» Т-клетки и макрофаги, чтобы перейти к интересующему участку, чтобы разрушить антигенпредставляющую клетку (ы).
Эти цитокины активируют «киллерные» Т-клетки и макрофаги, чтобы перейти к интересующему участку, чтобы разрушить антигенпредставляющую клетку (ы).Гуморальный и клеточный иммунитет: таблица
| | Гуморальный | Клеточно-опосредованный |
| Тип | Опосредованный антителами ответ | Т-клеточный ответ |
| Участок активности | Внеклеточные жидкости | Расположение антигенпрезентирующей ткани |
| Участвующие основные типы клеток | В-клетки | Т-клетки |
| Быстрый ответ при обнаружении | Медленный ответ | |
| Тип антигена | Внеклеточные патогены | Внутриклеточные патогены, раковые клетки |
| Метод удаления или нейтрализации 7 | 901 59 Лизис клеток и запрограммированная смерть | |
| Участвующие белки MHC | Белки MHC класса II | Белки MHC класса I |
Важность клеточного иммунитета в разработке вакцин и терапевтических средств от COVID-19 | Журнал инфекционных болезней
Для большинства вирусных инфекций восприимчивость основана на нескольких факторах, включая (1) наличие ранее существовавших антител к вирусу и / или способность человека быстро накапливать антитела de novo к агенту, (2) врожденный клеточный иммунитет. ответ, главным образом естественные клетки-киллеры (NK), и (3) фенотип чувствительных клеток-мишеней с точки зрения рецепторов для проникновения вируса. Тяжесть инфекции и вероятность повторного заражения могут зависеть от уровня, типа и сродства антител, выработанных к вирусу, но, что, возможно, более важно, от способности адаптивного клеточного иммунного ответа, в основном опосредованного Т-клетками. , работая совместно с другими типами клеток адаптивной и врожденной иммунной систем, уничтожая инфицированные вирусом клетки.Генерация Т-клеточного ответа на коронавирус 2 тяжелого острого респираторного синдрома (SARS-CoV-2) также может привести к менее тяжелому исходу в случаях вторичного воздействия вируса.
Большой прогресс был достигнут в терапии рака в последние годы благодаря открытиям и использованию моноклональных антител к ингибиторам контрольных точек для лечения ряда видов рака у человека. Это привело к огромным усилиям в академических кругах, правительстве и частном секторе по разработке других иммунотерапевтических средств и иммуномодуляторов для использования в иммуноонкологических платформах, что, в свою очередь, привело к гораздо большему пониманию человеческого иммунома и сложностей, связанных с взаимодействием между несколькими компоненты адаптивной и врожденной иммунной систем.
Это привело к огромным усилиям в академических кругах, правительстве и частном секторе по разработке других иммунотерапевтических средств и иммуномодуляторов для использования в иммуноонкологических платформах, что, в свою очередь, привело к гораздо большему пониманию человеческого иммунома и сложностей, связанных с взаимодействием между несколькими компоненты адаптивной и врожденной иммунной систем.
На сегодняшний день среди так называемых родительских типов клеток идентифицировано более 100 различных фенотипов иммунных клеток человека: NK-клетки, CD8 + , CD4 + и NK T-клетки, регуляторные CD4 + T клетки, обычные и плазмоцитоидные дендритные клетки, миелоидные супрессорные клетки, В-клетки и моноциты. Для каждого из этих типов родительских клеток было идентифицировано несколько подтипов, многие из которых обладают определенными активационными и / или подавляющими функциями.
Анализы для обнаружения антител к SARS-CoV-2 и для обнаружения цитокинов сыворотки или плазмы, таких как интерфероны, фактор некроза опухоли α и интерлейкин 6, 8 и 2, легко доступны для скрининга больших слоев населения. внешне здоровые, активно инфицированные SARS-CoV-2 или выздоравливающие.Однако в разработке вакцины наблюдается своего рода «парадигмальный паралич» с тенденцией концентрироваться на вакцинах, разработанных только для активации реакции антител на вирусные поверхностные белки (оболочки) и предотвращения вирусной инфекции клеток. Хотя это должно быть основным акцентом профилактической вакцины, мало внимания уделяется разработке вакцин, которые также будут индуцировать Т-клеточные ответы на внутренние компоненты вируса. Развитие Т-клеточных ответов, распознающих комплексы вирусный пептид — главный комплекс гистосовместимости (MHC) на поверхности инфицированных клеток, в свою очередь, лизирует эти клетки и ограничивает тяжесть инфекции.
внешне здоровые, активно инфицированные SARS-CoV-2 или выздоравливающие.Однако в разработке вакцины наблюдается своего рода «парадигмальный паралич» с тенденцией концентрироваться на вакцинах, разработанных только для активации реакции антител на вирусные поверхностные белки (оболочки) и предотвращения вирусной инфекции клеток. Хотя это должно быть основным акцентом профилактической вакцины, мало внимания уделяется разработке вакцин, которые также будут индуцировать Т-клеточные ответы на внутренние компоненты вируса. Развитие Т-клеточных ответов, распознающих комплексы вирусный пептид — главный комплекс гистосовместимости (MHC) на поверхности инфицированных клеток, в свою очередь, лизирует эти клетки и ограничивает тяжесть инфекции.
Описанные здесь стратегии и анализы предназначены для использования в клинических испытаниях, чтобы исследовать клеточный иммуном внешне здоровых людей, пациентов, активно инфицированных SARS-CoV-2, или пациентов на стадии выздоровления, чтобы определить, являются ли специфические клеточные иммунные субпопуляции или комбинации подгрупп определяют, какие люди с большей вероятностью будут иметь ограниченную, а не тяжелую инфекцию, и какие пациенты с большей вероятностью погибнут от вторичного воздействия вируса.
подгруппы периферических иммунных клеток (n = 138), проанализированные с помощью проточной цитометрии a
| 1. Общее количество CD4 + Т-клеток | ○ Tim-3 + CM CD8 — ингибирование | • Общее нетрадиционное ( CD16- CD56dim) NK — нелитическая, нецитокиновая продукция | |
| • PD-L1 + CD4 — активация / ингибирование | ○ Ki67 + CM CD8 — пролиферация | ○ PD- | ○ L1 + нетрадиционный NK — ингибирование |
| • PD-1 + CD4 — активация / ингибирование | • Общая эффекторная память (CCR7 — ○ CD45RA —5) CD8 | 1 + нетрадиционный NK — активация / ингибирование||
| • CTLA-4 + CD4 — ингибирование | ○ PD-L1 + EM CD8 — активация / ингибирование | ○ Tim-3 + нетрадиционный NK — активация / ингибирование | |
| • Tim-3 + CD4 — ингибирование | ○ PD-1 + EM CD8 — активация / ингибирование | 6. Всего NK-T Всего NK-T | |
| • 41bb + CD4 — костимуляция | ○ CTLA-4 + EM CD8 — ингибирование | • PD-L1 +99-T — ингибирование | |
| • Ki67 + CD4 — пролиферация | ○ Tim-3 + EM CD8 — ингибирование | • PD-1 + NK-T — активация / ингибирование | |
| • ICOS + CD4 — активация | ○ Ki67 + EM CD8 — распространение | • Tim-3 + NK-T — ингибирование | |
| • Всего EMRA (CCR7 — CD45RA + ) CD8 | 90○157 • Ki67 + NK-T — распространение IC○ PD-L1 + EMRA CD8 — активация / запрет | 7. Всего cDC Всего cDC | |
| • Всего наивных (CCR7 + CD45RA + ) CD4 | ○ PD-1 + EMRA CD8 — активация / ингибирование | • PD-L1 — + ингибирование | |
| ○ PD-L1 + наивный CD4 — активация / ингибирование | ○ CTLA-4 + EMRA CD8 — ингибирование | • PD-1 + 96 cDC активация — ингибирование | |
| ○ PD-1 + наивный CD4 — активация / ингибирование | ○ Tim-3 + EMRA CD8 — ингибирование | • Tim-3 + cDC — ингибирование | |
| ○ CTLA-4 + наивный CD4 — ингибирование | ○ Ki67 + EMRA CD8 — распространение | • Ki67 + cDC — распространение | ○ Tim-3 + наивный CD4 — ингибирование | 3. Общее количество Treg Общее количество Treg | 8. Общее количество pDC |
| • Общая центральная память (CCR7 + CD45RA — ) CD4 | • PD-L1 + Treg — активация / ингибирование PD7 • | -L1 + pDC — ингибирование||
| ○ PD-L1 + CM CD4 — активация / ингибирование | • PD-1 + Tregs — подавление | 9157 • PD-1 + pDC — активация / ингибирование||
| ○ PD-1 + CM CD4 — активация / ингибирование | • CTLA-4 + Tregs — подавление | • Tim-3 pDC — ингибирование | |
| ○ CTLA-4 + CM CD4 — ингибирование | • ICOS + Tregs — подавление | • Ki67 + 96 pifer — ation | |
| ○ Tim-3 + CM CD4 — ингибирование | • CD45RA + Tregs — сильно расширяемые in vitro | 9. Всего MDSC Всего MDSC | |
| ○ Ki67 + CM CD4 — пролиферация | • CD49d — Tregs — подавление | • PD-L1 + MDSC — | |
| • Ki67 + Tregs — пролиферация | • PD-1 + MDSC — активация / ингибирование | ||
| + EM CD4 — активация / ингибирование | • CD38 + Tregs — подавление | • CD16 + MDSC — незрелые / подавление | |
| ○ PD-1 96 9 CD4 — активация / ингибирование | • HLA-DR + Treg — подавление | • Тотальный моноцитарный (CD14 + CD15 — ) MDSC | |
| ○ CTLA-4 + EM CD4 — ингибирование | 4. Всего B-клеток Всего B-клеток | ○ PD-L1 + mMDSC — ингибирование | |
| ○ Tim-3 + EM CD4 — ингибирование | • PD-L1 + B-клеток — ингибирование | ○ PD-1 + mMDSC — активация / ингибирование | |
| ○ Ki67 + EM CD4 — пролиферация | • PD-1 + B-клеток — активация / ингибирование | ○ CD16 + mMDSC — незрелые / подавление | |
| • Всего EMRA (CCR7 — CD45RA + ) CD4 | 5.Всего NK | • Общий гранулоцитарный (CD14 — CD15 + ) MDSC | |
| ○ PD-L1 + EMRA CD4 — активация / ингибирование | • PD-L1 + ингибирование | ○ PD-L1 + gMDSC — ингибирование | |
| ○ PD-1 + EMRA CD4 — активация / ингибирование | • PD-1 + 9000 активация / ингибирование 6 NK — | ○ PD-1 + gMDSC — активация / ингибирование | |
| ○ CTLA-4 + EMRA CD4 — ингибирование | • Tim-3 + NK ингибирование — | ○ CD16 + gMDSC — незрелые / подавление | |
| ○ Tim-3 + EMRA CD4 — ингибирование | • Ki67 + NK — 99 | • Полное происхождение отрицательное (CD14 — CD15 — ) MDSC | |
| ○ Ki67 + EMRA CD4 — пролиферация | • NKp30 + NK — активация + lin neg MDSC — ингибирование | ||
2. Всего CD8 + Т-клетки Всего CD8 + Т-клетки | • NKp46 + NK — активация | ○ PD-1 + lin neg MDSC — активация / ингибирование | • NKG2D + NK — активация | ○ CD16 + lin neg MDSC — незрелая / подавление |
| • CD226 + NK — адгезия / активация | 10.Всего моноцитов | ||
| • CTLA-4 + CD8 — ингибирование | • Всего зрелых (CD16 + CD56 dim ) NK — литических | • Классических | 9 фагоцитов —|
| • Tim-3 + CD8 — ингибирование | ○ PD-L1 + зрелый NK — ингибирование | • Промежуточные моноциты — фагоцитарные / провоспалительные 000 | |
| ○ PD-1 + зрелый NK — активация / ингибирование | • Неклассические моноциты — провоспалительные | ||
| • Ki67 +57 CD8 — пролиферация ○ Tim-3 + зрелых NK — активация / ингибирование | • PD-L1 + моноцитов — ингибирование | 90 168||
| • Всего наивно (CCR7 + CD45RA + ) CD8 | • Общее функциональное промежуточное звено (CD16 + CD56 br ) NK — литическое, производство цитокинов | • PD-1 моноциты — активация / ингибирование | |
| ○ PD-L1 + наивный CD8 — активация / ингибирование | ○ PD-L1 + функциональный промежуточный продукт NK — ингибирование | ○ PD-1 + функциональный промежуточный продукт NK — активация / ингибирование | |
| ○ CTLA-4 + наивное подавление CD8 — | ○ Tim-3 + функциональный промежуточный продукт NK — активация / ингибирование | ||
| ○ Tim-3 + наивный CD8 — ингибирование ion | • Общая незрелая (CD16 — CD56 br ) NK — выработка цитокинов | ||
| • Общая центральная память (CCR7 + CD45RA — ) CD8 | + незрелый NK — ингибирование|||
| ○ PD-L1 + CM CD8 — активация / ингибирование | ○ PD-1 + незрелый NK — активация / ингибирование | ||
| ○ PD-1 + CM CD8 — активация / ингибирование | ○ Tim-3 + незрелый NK — активация / ингибирование | ||
| ○ CTLA-4 + + + — ингибирование |
1. Общее количество CD4 + Т-клеток Общее количество CD4 + Т-клеток | ○ Tim-3 + CM CD8 — ингибирование | • Общее количество нетрадиционных (CD16- CD56dim) NK — нелитическое, нецитокиновое производство |
| • PD-L1 + CD4 — активация / ингибирование | ○ Ki67 + CM CD8 — распространение | ○ PD-L1 + нетрадиционный NK — ингибирование |
| • PD-1 + CD4 ингибирование — | • Общая эффекторная память (CCR7 — CD45RA — ) CD8 | ○ PD-1 + нетрадиционный NK — активация / ингибирование |
| • CTLA-4 + ингибирование — CD4 | ○ PD-L1 + EM CD8 — активация / ингибирование | ○ Tim-3 + нетрадиционный NK — активация / ингибирование |
| • Tim-3 + CD4 — 9029 9 ингибирование | ○ PD-1 + EM CD8 — активация / ингибирование | 6. |
| • 41bb + CD4 — костимуляция | ○ CTLA-4 + EM CD8 — ингибирование | • PD-L1 +99-T — ингибирование |
| • Ki67 + CD4 — пролиферация | ○ Tim-3 + EM CD8 — ингибирование | • PD-1 + NK-T — активация / ингибирование |
| • ICOS + CD4 — активация | ○ Ki67 + EM CD8 — распространение | • Tim-3 + NK-T — ингибирование |
| • Всего EMRA (CCR7 — CD45RA + ) CD8 | 90○157 • Ki67 + NK-T — распространение IC○ PD-L1 + EMRA CD8 — активация / запрет | 7. Всего cDC Всего cDC |
| • Всего наивных (CCR7 + CD45RA + ) CD4 | ○ PD-1 + EMRA CD8 — активация / ингибирование | • PD-L1 — + ингибирование |
| ○ PD-L1 + наивный CD4 — активация / ингибирование | ○ CTLA-4 + EMRA CD8 — ингибирование | • PD-1 + 96 cDC активация — ингибирование |
| ○ PD-1 + наивный CD4 — активация / ингибирование | ○ Tim-3 + EMRA CD8 — ингибирование | • Tim-3 + cDC — ингибирование |
| ○ CTLA-4 + наивный CD4 — ингибирование | ○ Ki67 + EMRA CD8 — распространение | • Ki67 + cDC — распространение | ○ Tim-3 + наивный CD4 — ингибирование | 3.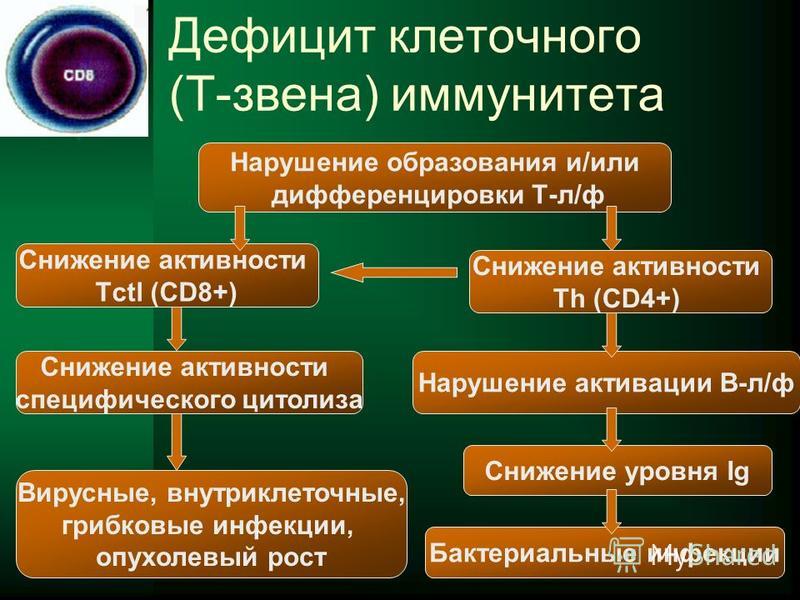 Общее количество Treg Общее количество Treg | 8. Общее количество pDC |
| • Общая центральная память (CCR7 + CD45RA — ) CD4 | • PD-L1 + Treg — активация / ингибирование PD7 • | -L1 + pDC — ингибирование|
| ○ PD-L1 + CM CD4 — активация / ингибирование | • PD-1 + Tregs — подавление | 9157 • PD-1 + pDC — активация / ингибирование|
| ○ PD-1 + CM CD4 — активация / ингибирование | • CTLA-4 + Tregs — подавление | • Tim-3 pDC — ингибирование |
| ○ CTLA-4 + CM CD4 — ингибирование | • ICOS + Tregs — подавление | • Ki67 + 96 pifer — ation |
| ○ Tim-3 + CM CD4 — ингибирование | • CD45RA + Tregs — сильно расширяемые in vitro | 9. Всего MDSC Всего MDSC |
| ○ Ki67 + CM CD4 — пролиферация | • CD49d — Tregs — подавление | • PD-L1 + MDSC — |
| • Ki67 + Tregs — пролиферация | • PD-1 + MDSC — активация / ингибирование | |
| + EM CD4 — активация / ингибирование | • CD38 + Tregs — подавление | • CD16 + MDSC — незрелые / подавление |
| ○ PD-1 96 9 CD4 — активация / ингибирование | • HLA-DR + Treg — подавление | • Тотальный моноцитарный (CD14 + CD15 — ) MDSC |
| ○ CTLA-4 + EM CD4 — ингибирование | 4. Всего B-клеток Всего B-клеток | ○ PD-L1 + mMDSC — ингибирование |
| ○ Tim-3 + EM CD4 — ингибирование | • PD-L1 + B-клеток — ингибирование | ○ PD-1 + mMDSC — активация / ингибирование |
| ○ Ki67 + EM CD4 — пролиферация | • PD-1 + B-клеток — активация / ингибирование | ○ CD16 + mMDSC — незрелые / подавление |
| • Всего EMRA (CCR7 — CD45RA + ) CD4 | 5.Всего NK | • Общий гранулоцитарный (CD14 — CD15 + ) MDSC |
| ○ PD-L1 + EMRA CD4 — активация / ингибирование | • PD-L1 + ингибирование | ○ PD-L1 + gMDSC — ингибирование |
| ○ PD-1 + EMRA CD4 — активация / ингибирование | • PD-1 + 9000 активация / ингибирование 6 NK — | ○ PD-1 + gMDSC — активация / ингибирование |
| ○ CTLA-4 + EMRA CD4 — ингибирование | • Tim-3 + NK ингибирование — | ○ CD16 + gMDSC — незрелые / подавление |
| ○ Tim-3 + EMRA CD4 — ингибирование | • Ki67 + NK — 99 | • Полное происхождение отрицательное (CD14 — CD15 — ) MDSC |
| ○ Ki67 + EMRA CD4 — пролиферация | • NKp30 + NK — активация + lin neg MDSC — ингибирование | |
2. Всего CD8 + Т-клетки Всего CD8 + Т-клетки | • NKp46 + NK — активация | ○ PD-1 + lin neg MDSC — активация / ингибирование | • NKG2D + NK — активация | ○ CD16 + lin neg MDSC — незрелая / подавление |
| • CD226 + NK — адгезия / активация | 10.Всего моноцитов | |
| • CTLA-4 + CD8 — ингибирование | • Всего зрелых (CD16 + CD56 dim ) NK — литических | • Классических | 9 фагоцитов —
| • Tim-3 + CD8 — ингибирование | ○ PD-L1 + зрелый NK — ингибирование | • Промежуточные моноциты — фагоцитарные / провоспалительные 000 |
| ○ PD-1 + зрелый NK — активация / ингибирование | • Неклассические моноциты — провоспалительные | |
| • Ki67 +57 CD8 — пролиферация ○ Tim-3 + зрелых NK — активация / ингибирование | • PD-L1 + моноцитов — ингибирование | 90 168|
| • Всего наивно (CCR7 + CD45RA + ) CD8 | • Общее функциональное промежуточное звено (CD16 + CD56 br ) NK — литическое, производство цитокинов | • PD-1 моноциты — активация / ингибирование |
| ○ PD-L1 + наивный CD8 — активация / ингибирование | ○ PD-L1 + функциональный промежуточный продукт NK — ингибирование | ○ PD-1 + функциональный промежуточный продукт NK — активация / ингибирование |
| ○ CTLA-4 + наивное подавление CD8 — | ○ Tim-3 + функциональный промежуточный продукт NK — активация / ингибирование | |
| ○ Tim-3 + наивный CD8 — ингибирование ion | • Общая незрелая (CD16 — CD56 br ) NK — выработка цитокинов | |
| • Общая центральная память (CCR7 + CD45RA — ) CD8 | + незрелый NK — ингибирование||
| ○ PD-L1 + CM CD8 — активация / ингибирование | ○ PD-1 + незрелый NK — активация / ингибирование | |
| ○ PD-1 + CM CD8 — активация / ингибирование | ○ Tim-3 + незрелый NK — активация / ингибирование | |
| ○ CTLA-4 + + + — ингибирование |

подгруппы периферических иммунных клеток (n = 138), проанализированные с помощью проточной цитометрии a
| 1. Общее количество CD4 + Т-клеток | ○ Tim-3 + CM CD8 — ингибирование | • Общее нетрадиционное (CD16- CD56dim) ) NK — нелитическая, не цитокиновая продукция |
| • PD-L1 + CD4 — активация / ингибирование | ○ Ki67 + CM CD8 — пролиферация | ○ PD-L1 нетрадиционный NK — ингибирование |
| • PD-1 + CD4 — активация / ингибирование | • Общая эффекторная память (CCR7 — CD45RA — ) CD8 | ○ + PD- нетрадиционный NK — активация / ингибирование |
| • CTLA-4 + CD4 — ингибирование | ○ PD-L1 + EM CD8 — активация / ингибирование | ○ Tim-3 0005 + нетрадиционный NK — активация / ингибирование |
| • Tim-3 + CD4 — ингибирование | ○ PD-1 + EM CD8 — активация / ингибирование | 6. Всего NK-T Всего NK-T |
| • 41bb + CD4 — костимуляция | ○ CTLA-4 + EM CD8 — ингибирование | • PD-L1 +99-T — ингибирование |
| • Ki67 + CD4 — пролиферация | ○ Tim-3 + EM CD8 — ингибирование | • PD-1 + NK-T — активация / ингибирование |
| • ICOS + CD4 — активация | ○ Ki67 + EM CD8 — распространение | • Tim-3 + NK-T — ингибирование |
| • Всего EMRA (CCR7 — CD45RA + ) CD8 | 90○157 • Ki67 + NK-T — распространение IC○ PD-L1 + EMRA CD8 — активация / запрет | 7. Всего cDC Всего cDC |
| • Всего наивных (CCR7 + CD45RA + ) CD4 | ○ PD-1 + EMRA CD8 — активация / ингибирование | • PD-L1 — + ингибирование |
| ○ PD-L1 + наивный CD4 — активация / ингибирование | ○ CTLA-4 + EMRA CD8 — ингибирование | • PD-1 + 96 cDC активация — ингибирование |
| ○ PD-1 + наивный CD4 — активация / ингибирование | ○ Tim-3 + EMRA CD8 — ингибирование | • Tim-3 + cDC — ингибирование |
| ○ CTLA-4 + наивный CD4 — ингибирование | ○ Ki67 + EMRA CD8 — распространение | • Ki67 + cDC — распространение | ○ Tim-3 + наивный CD4 — ингибирование | 3. Общее количество Treg Общее количество Treg | 8. Общее количество pDC |
| • Общая центральная память (CCR7 + CD45RA — ) CD4 | • PD-L1 + Treg — активация / ингибирование PD7 • | -L1 + pDC — ингибирование|
| ○ PD-L1 + CM CD4 — активация / ингибирование | • PD-1 + Tregs — подавление | 9157 • PD-1 + pDC — активация / ингибирование|
| ○ PD-1 + CM CD4 — активация / ингибирование | • CTLA-4 + Tregs — подавление | • Tim-3 pDC — ингибирование |
| ○ CTLA-4 + CM CD4 — ингибирование | • ICOS + Tregs — подавление | • Ki67 + 96 pifer — ation |
| ○ Tim-3 + CM CD4 — ингибирование | • CD45RA + Tregs — сильно расширяемые in vitro | 9.Всего MDSC |
| ○ Ki67 + CM CD4 — пролиферация | • CD49d — Tregs — подавление | • PD-L1 + MDSC — |
| • Ki67 + Tregs — пролиферация | • PD-1 + MDSC — активация / ингибирование | |
| + EM CD4 — активация / ингибирование | • CD38 + Tregs — подавление | • CD16 + MDSC — незрелые / подавление |
| ○ PD-1 96 9 CD4 — активация / ингибирование | • HLA-DR + Treg — подавление | • Тотальный моноцитарный (CD14 + CD15 — ) MDSC |
| ○ CTLA-4 + EM CD4 — ингибирование | 4.Всего B-клеток | ○ PD-L1 + mMDSC — ингибирование |
| ○ Tim-3 + EM CD4 — ингибирование | • PD-L1 + B-клеток — ингибирование | ○ PD-1 + mMDSC — активация / ингибирование |
| ○ Ki67 + EM CD4 — пролиферация | • PD-1 + B-клеток — активация / ингибирование | ○ CD16 + mMDSC — незрелые / подавление |
| • Всего EMRA (CCR7 — CD45RA + ) CD4 | 5.Всего NK | • Общий гранулоцитарный (CD14 — CD15 + ) MDSC |
| ○ PD-L1 + EMRA CD4 — активация / ингибирование | • PD-L1 + ингибирование | ○ PD-L1 + gMDSC — ингибирование |
| ○ PD-1 + EMRA CD4 — активация / ингибирование | • PD-1 + 9000 активация / ингибирование 6 NK — | ○ PD-1 + gMDSC — активация / ингибирование |
| ○ CTLA-4 + EMRA CD4 — ингибирование | • Tim-3 + NK ингибирование — | ○ CD16 + gMDSC — незрелые / подавление |
| ○ Tim-3 + EMRA CD4 — ингибирование | • Ki67 + NK — 99 | • Полное происхождение отрицательное (CD14 — CD15 — ) MDSC |
| ○ Ki67 + EMRA CD4 — пролиферация | • NKp30 + NK — активация + lin neg MDSC — ингибирование | |
| 2. Всего CD8 + Т-клетки | • NKp46 + NK — активация | ○ PD-1 + lin neg MDSC — активация / ингибирование | • NKG2D + NK — активация | ○ CD16 + lin neg MDSC — незрелая / подавление |
| • CD226 + NK — адгезия / активация | 10.Всего моноцитов | |
| • CTLA-4 + CD8 — ингибирование | • Всего зрелых (CD16 + CD56 dim ) NK — литических | • Классических | 9 фагоцитов —
| • Tim-3 + CD8 — ингибирование | ○ PD-L1 + зрелый NK — ингибирование | • Промежуточные моноциты — фагоцитарные / провоспалительные 000 |
| ○ PD-1 + зрелый NK — активация / ингибирование | • Неклассические моноциты — провоспалительные | |
| • Ki67 +57 CD8 — пролиферация ○ Tim-3 + зрелых NK — активация / ингибирование | • PD-L1 + моноцитов — ингибирование | 90 168|
| • Всего наивно (CCR7 + CD45RA + ) CD8 | • Общее функциональное промежуточное звено (CD16 + CD56 br ) NK — литическое, производство цитокинов | • PD-1 моноциты — активация / ингибирование |
| ○ PD-L1 + наивный CD8 — активация / ингибирование | ○ PD-L1 + функциональный промежуточный продукт NK — ингибирование | ○ PD-1 + функциональный промежуточный продукт NK — активация / ингибирование |
| ○ CTLA-4 + наивное подавление CD8 — | ○ Tim-3 + функциональный промежуточный продукт NK — активация / ингибирование | |
| ○ Tim-3 + наивный CD8 — ингибирование ion | • Общая незрелая (CD16 — CD56 br ) NK — выработка цитокинов | |
| • Общая центральная память (CCR7 + CD45RA — ) CD8 | + незрелый NK — ингибирование||
| ○ PD-L1 + CM CD8 — активация / ингибирование | ○ PD-1 + незрелый NK — активация / ингибирование | |
| ○ PD-1 + CM CD8 — активация / ингибирование | ○ Tim-3 + незрелый NK — активация / ингибирование | |
| ○ CTLA-4 + + + — ингибирование |
| 1.Общее количество CD4 + Т-клеток | ○ Tim-3 + CM CD8 — ингибирование | • Общее количество нетрадиционных (CD16- CD56dim) NK — нелитическое, нецитокиновое производство |
| • PD-L1 + CD4 — активация / ингибирование | ○ Ki67 + CM CD8 — распространение | ○ PD-L1 + нетрадиционный NK — ингибирование |
| • PD-1 + CD4 ингибирование — | • Общая эффекторная память (CCR7 — CD45RA — ) CD8 | ○ PD-1 + нетрадиционный NK — активация / ингибирование |
| • CTLA-4 + ингибирование — CD4 | ○ PD-L1 + EM CD8 — активация / ингибирование | ○ Tim-3 + нетрадиционный NK — активация / ингибирование |
| • Tim-3 + CD4 — 9029 9 ингибирование | ○ PD-1 + EM CD8 — активация / ингибирование | 6.Всего NK-T |
| • 41bb + CD4 — костимуляция | ○ CTLA-4 + EM CD8 — ингибирование | • PD-L1 +99-T — ингибирование |
| • Ki67 + CD4 — пролиферация | ○ Tim-3 + EM CD8 — ингибирование | • PD-1 + NK-T — активация / ингибирование |
| • ICOS + CD4 — активация | ○ Ki67 + EM CD8 — распространение | • Tim-3 + NK-T — ингибирование |
| • Всего EMRA (CCR7 — CD45RA + ) CD8 | 90○157 • Ki67 + NK-T — распространение IC○ PD-L1 + EMRA CD8 — активация / запрет | 7.Всего cDC |
| • Всего наивных (CCR7 + CD45RA + ) CD4 | ○ PD-1 + EMRA CD8 — активация / ингибирование | • PD-L1 — + ингибирование |
| ○ PD-L1 + наивный CD4 — активация / ингибирование | ○ CTLA-4 + EMRA CD8 — ингибирование | • PD-1 + 96 cDC активация — ингибирование |
| ○ PD-1 + наивный CD4 — активация / ингибирование | ○ Tim-3 + EMRA CD8 — ингибирование | • Tim-3 + cDC — ингибирование |
| ○ CTLA-4 + наивный CD4 — ингибирование | ○ Ki67 + EMRA CD8 — распространение | • Ki67 + cDC — распространение | ○ Tim-3 + наивный CD4 — ингибирование | 3.Общее количество Treg | 8. Общее количество pDC |
| • Общая центральная память (CCR7 + CD45RA — ) CD4 | • PD-L1 + Treg — активация / ингибирование PD7 • | -L1 + pDC — ингибирование|
| ○ PD-L1 + CM CD4 — активация / ингибирование | • PD-1 + Tregs — подавление | 9157 • PD-1 + pDC — активация / ингибирование|
| ○ PD-1 + CM CD4 — активация / ингибирование | • CTLA-4 + Tregs — подавление | • Tim-3 pDC — ингибирование |
| ○ CTLA-4 + CM CD4 — ингибирование | • ICOS + Tregs — подавление | • Ki67 + 96 pifer — ation |
| ○ Tim-3 + CM CD4 — ингибирование | • CD45RA + Tregs — сильно расширяемые in vitro | 9.Всего MDSC |
| ○ Ki67 + CM CD4 — пролиферация | • CD49d — Tregs — подавление | • PD-L1 + MDSC — |
| • Ki67 + Tregs — пролиферация | • PD-1 + MDSC — активация / ингибирование | |
| + EM CD4 — активация / ингибирование | • CD38 + Tregs — подавление | • CD16 + MDSC — незрелые / подавление |
| ○ PD-1 96 9 CD4 — активация / ингибирование | • HLA-DR + Treg — подавление | • Тотальный моноцитарный (CD14 + CD15 — ) MDSC |
| ○ CTLA-4 + EM CD4 — ингибирование | 4.Всего B-клеток | ○ PD-L1 + mMDSC — ингибирование |
| ○ Tim-3 + EM CD4 — ингибирование | • PD-L1 + B-клеток — ингибирование | ○ PD-1 + mMDSC — активация / ингибирование |
| ○ Ki67 + EM CD4 — пролиферация | • PD-1 + B-клеток — активация / ингибирование | ○ CD16 + mMDSC — незрелые / подавление |
| • Всего EMRA (CCR7 — CD45RA + ) CD4 | 5.Всего NK | • Общий гранулоцитарный (CD14 — CD15 + ) MDSC |
| ○ PD-L1 + EMRA CD4 — активация / ингибирование | • PD-L1 + ингибирование | ○ PD-L1 + gMDSC — ингибирование |
| ○ PD-1 + EMRA CD4 — активация / ингибирование | • PD-1 + 9000 активация / ингибирование 6 NK — | ○ PD-1 + gMDSC — активация / ингибирование |
| ○ CTLA-4 + EMRA CD4 — ингибирование | • Tim-3 + NK ингибирование — | ○ CD16 + gMDSC — незрелые / подавление |
| ○ Tim-3 + EMRA CD4 — ингибирование | • Ki67 + NK — 99 | • Полное происхождение отрицательное (CD14 — CD15 — ) MDSC |
| ○ Ki67 + EMRA CD4 — пролиферация | • NKp30 + NK — активация + lin neg MDSC — ингибирование | |
| 2. Всего CD8 + Т-клетки | • NKp46 + NK — активация | ○ PD-1 + lin neg MDSC — активация / ингибирование | • NKG2D + NK — активация | ○ CD16 + lin neg MDSC — незрелая / подавление |
| • CD226 + NK — адгезия / активация | 10.Всего моноцитов | |
| • CTLA-4 + CD8 — ингибирование | • Всего зрелых (CD16 + CD56 dim ) NK — литических | • Классических | 9 фагоцитов —
| • Tim-3 + CD8 — ингибирование | ○ PD-L1 + зрелый NK — ингибирование | • Промежуточные моноциты — фагоцитарные / провоспалительные 000 |
| ○ PD-1 + зрелый NK — активация / ингибирование | • Неклассические моноциты — провоспалительные | |
| • Ki67 +57 CD8 — пролиферация ○ Tim-3 + зрелых NK — активация / ингибирование | • PD-L1 + моноцитов — ингибирование | 90 168|
| • Всего наивно (CCR7 + CD45RA + ) CD8 | • Общее функциональное промежуточное звено (CD16 + CD56 br ) NK — литическое, производство цитокинов | • PD-1 моноциты — активация / ингибирование |
| ○ PD-L1 + наивный CD8 — активация / ингибирование | ○ PD-L1 + функциональный промежуточный продукт NK — ингибирование | ○ PD-1 + функциональный промежуточный продукт NK — активация / ингибирование |
| ○ CTLA-4 + наивное подавление CD8 — | ○ Tim-3 + функциональный промежуточный продукт NK — активация / ингибирование | |
| ○ Tim-3 + наивный CD8 — ингибирование ion | • Общая незрелая (CD16 — CD56 br ) NK — выработка цитокинов | |
| • Общая центральная память (CCR7 + CD45RA — ) CD8 | + незрелый NK — ингибирование||
| ○ PD-L1 + CM CD8 — активация / ингибирование | ○ PD-1 + незрелый NK — активация / ингибирование | |
| ○ PD-1 + CM CD8 — активация / ингибирование | ○ Tim-3 + незрелый NK — активация / ингибирование | |
| ○ CTLA-4 + + + — ингибирование |
Одно наблюдение, которое появилось в пандемии коронавирусной болезни 2019 (COVID-19), — это серьезность инфекции, наблюдаемая между разные возрастные группы.В предыдущем исследовании [2], в котором использовался этот анализ, изучали, есть ли какие-либо различия в иммуноме между внешне здоровыми людьми <40 и> 40 лет; это произвольное различие было сделано потому, что заболеваемость раком значительно возрастает после 40 лет. Результаты показали, что у лиц старше 40 лет уровни CD8 + Т-клеток значительно ниже, но, напротив, значительно более высокие уровни NK-клеток (у обоих P = 0,009). Также наблюдались явные различия во множестве других подмножеств иммунных клеток между двумя возрастными группами.У более молодого населения, например, были значительно более высокие уровни CD8 + цитотоксического Т-лимфоцитарного антигена 4 (CTLA-4) + , CD8 + лиганда запрограммированной клеточной смерти 1 (PD-L1 + ), наивных CD8 + и центральная память CD8 + Т-клеток, но значительно более низкие уровни Т-клеточного иммуноглобулина и муцинового домена 3 + В-клеток.
Эти исследования были расширены для поиска различий между внешне здоровыми людьми и пациентами того же возраста с рядом различных видов рака.Хотя не было разницы в абсолютном количестве лимфоцитов между двумя группами, пациенты с раком имели значительно более высокие уровни 2 фенотипов миелоидных супрессорных клеток, CTLA-4 + регуляторных Т-клеток и множественных фенотипов CD8 + T клетки (например, CTLA-4 + ), имея значительно более низкие уровни В-клеток, чем у практически здоровых людей. Этот анализ также использовался для изучения эффектов различных иммуномодуляторов и так называемых неиммунных терапевтических средств на иммунную систему.Таким образом, этот или аналогичный анализ можно использовать для определения эффектов различных противовирусных агентов на несколько компонентов клеточного иммунома и для дальнейшего определения того, оказывают ли они какое-либо влияние на вторичное воздействие SARS-CoV-2.
ОБНАРУЖЕНИЕ АНТИГЕН-СПЕЦИФИЧЕСКИХ ОТВЕТОВ Т-КЛЕТОК
Тяжесть инфекции SARS-CoV-2 у данного человека, скорее всего, определяется адаптивной Т-клеточной реакцией на комплексы вирусный пептид / MHC, включающие как цитолитические CD8 + , так и вспомогательные Т-клетки CD4 + .Таким образом, анализ, который одновременно определяет уровни и фенотипы как CD8 + , так и CD4 + Т-клеточных ответов, вполне может помочь в исследовании пациентов с COVID-19 путем (1) определения того, есть ли у практически здоровых людей « предсуществующие »Т-клеточные ответы на SARS-CoV-2 из-за предшествующего воздействия вируса SARS-CoV-2 или перекрестной реактивности Т-клеток, направленных против родственных коронавирусов, в результате предшествующего воздействия; (2) определение того, может ли данная профилактическая вакцина вызывать SARS-CoV-2 — специфические Т-клеточные ответы в дополнение к ответам антител; (3) помощь в разработке терапевтической вакцины против SARS-CoV-2, которую следует вводить сразу после контакта с вирусом; (4) более точное определение механизмов выведения вируса после инфицирования, поскольку они связаны с тяжестью заболевания; и (5) обеспечение возможности сравнения потенциальной эффективности различных вакцин против SARS-CoV-2 и / или противовирусных препаратов.
Описанный анализ основан на проточной цитометрии и использует перекрывающиеся 15-мерные вирусные пептиды и / или 9-мерные пептиды; он использовался в многочисленных клинических исследованиях иммунотерапии рака [4–6]. В нем используются ранее замороженные PBMC, поэтому образцы от одного и того же пациента, полученные с течением времени, можно анализировать одновременно. Этот анализ [5-7] одновременно определяет CD8 + и CD4 + Т-клеточные ответы с точки зрения их экспрессии интерферона γ, фактора некроза опухоли α, интерлейкина 2 и / или CD107a (маркера литического потенциала). , и, таким образом, он может одновременно определять уровень Т-клеточных ответов, а также их многофункциональность (т. е. эффективность).Этот анализ, который использовался для выявления Т-клеточных ответов, специфичных к вирусу папилломы человека, у пациентов с раком, также не ограничен ‒ MHC, и, таким образом, выявляет все генотипы аллелей MHC класса I и класса II.
РАСТВОРИМЫЕ ФАКТОРЫ
Основой анализа образцов сыворотки / плазмы от пациентов с COVID-19 будет обнаружение вируса SARS-CoV-2 или вирусной РНК, ответов противовирусных антител и уровней различных цитокинов. Однако существуют другие растворимые факторы, обнаруженные в сыворотке или плазме, которые образуются как следствие клеточных иммунных ответов, могут помочь определить реакцию пациента на SARS-CoV-2; к ним относятся растворимый CD27 (sCD27), CD40L (sCD40L), sPD-L1 и белок запрограммированной гибели клеток 1.sCD27 преимущественно происходит из активированных CD4 + Т-клеток, и более высокие уровни наблюдаются у практически здоровых людей, чем у пациентов с раком [8]. Некоторые исследования показали, что иммунотерапия может повышать уровень sCD27 в сыворотке [8]. sCD40L — это функциональный тример, который выделяется из активированных Т-лимфоцитов и, что более вероятно, из тромбоцитов. Доказано, что более высокие уровни sCD40L наблюдаются у некоторых больных раком и что они могут иметь иммунодепрессивный эффект [9].Исследования также показали, что соотношение sCD27 и sCD40L может указывать на терапевтический эффект [1].
ВЫВОДЫ
Множественные противовирусные и другие потенциальные терапевтические средства оценивались и продолжают оцениваться как способы борьбы с инфекциями SARS-CoV-2. Однако эти агенты могут также оказывать действие на различные компоненты врожденной и / или адаптивной иммунной системы и, таким образом, влиять на клинические исходы. Опыт применения различных терапевтических средств против рака, таких как низкомолекулярные нацеленные агенты, показал, что многие из этих так называемых неиммунных терапевтических средств могут оказывать глубокое воздействие на несколько компонентов иммунной системы человека.Некоторые предсказывают возможную вторую или множественные волны инфекции SARS-CoV-2. Воздействие противовирусных препаратов на иммунные подгруппы может иметь важные последствия для последующего контакта с SARS-CoV-2.
В настоящее время продолжаются многочисленные клинические исследования профилактических вакцин с целью индукции ответа антител против SARS-CoV-2. Эти вакцины будут в основном контролироваться на предмет уровня и типа индуцированных противовирусных антител. Предлагается, чтобы описанные здесь анализы также использовались в клинических исследованиях для определения того, какие вакцины также усиливают различные адаптивные и врожденные клеточные иммунные ответы.Эти анализы также могут помочь объяснить, почему определенные возрастные группы или другие демографические группы, такие как пациенты с ранее существовавшими заболеваниями (например, рак и диабет), различаются по реакции на инфекции SARS-CoV-2, что приводит к более тяжелой инфекции и / или осложнениям.
Таким образом, предлагается, чтобы — помимо поиска противовирусных препаратов, пассивного введения гипериммунного иммуноглобулина и разработки вакцин для индукции антител против SARS-CoV-2 — также были предприняты серьезные усилия по разработке вакцин, которые могут опосредуют адаптивный Т-клеточный ответ на компоненты агента SARS-CoV-2.Кроме того, предлагается использовать описанные здесь или аналогичные анализы в клинических испытаниях для мониторинга различных вмешательств COVID-19 и выяснения патогенеза как первичного, так и вторичного воздействия SARS-CoV-2.
Банкноты
Благодарности. Для получения подробных стандартных рабочих процедур для описанных здесь анализов свяжитесь с R. N. D. ([email protected]).
Финансовая поддержка. Эта работа была поддержана Программой внутренних исследований Центра исследований рака, Национальный институт рака, Национальные институты здравоохранения (внутренний номер.ZIA BC 010598).
Возможный конфликт интересов. Оба автора: о конфликтах не сообщалось. Оба автора подали форму ICMJE для раскрытия информации о потенциальных конфликтах интересов. Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.
Список литературы
1.Донахью
RN
,Лепоне
LM
,Гренга
I
и др.Анализ периферического иммунома после многократного введения авелумаба, человеческого моноклонального антитела против PD-L1 IgG1
.J Иммунный рак
2017
;5
:20
.2.Lepone
LM
,Donahue
RN
,Grenga
I
и др.Анализ 123 подмножеств периферических иммунных клеток человека: определение различий с возрастом и между здоровыми донорами и больными раком, не обнаруженными при анализе стандартных типов иммунных клеток
.J Circ Biomark
2016
;5
:5
.3.Fabian
KP
,Padget
MR
,Donahue
RN
и др.PD-L1, нацеленный на высокоаффинные NK (t-haNK) клетки, индуцирует прямые противоопухолевые эффекты и нацелен на супрессивные популяции MDSC
.J Другой иммунный рак
2020
;8
:e000450
.4.Gatti-Mays
ME
,Redman
JM
,Donahue
RN
и др.Испытание фазы I с использованием схемы иммунотерапевтической вакцины на основе многоцелевого рекомбинантного аденовируса 5 (CEA / MUC1 / brachyury) у пациентов с распространенным раком
.Онколог
2020
;24
:1
—6
.5.Gatti-Mays
ME
,Strauss
J
,Donahue
RN
и др.Испытание фазы I повышения дозы BN-CV301, рекомбинантной поксвирусной вакцины, нацеленной на MUC1 и CEA с костимулирующими молекулами
.Clin Cancer Res
2019
;25
:4933
—44
,6.Heery
CR
,Palena
C
,McMahon
S
и др.Фаза I исследования поксвирусной вакцины на основе TRICOM, направленной против транскрипционного фактора brachyury
.Clin Cancer Res
2017
;23
:6833
—45
,7.Strauss
J
,Gatti-Mays
ME
,Cho
B
и др.Оценка фазы I M7824, бифункционального слитого белка, нацеленного на TGF-β и PD-L1, у пациентов со злокачественными новообразованиями, ассоциированными с вирусом папилломы человека (ВПЧ) (аннотация)
.Cancer Res
2019
;79
(13 Supp): CT075.8.Хуанг
J
,Jochems
C
,Андерсон
AM
и др.Растворимый пул CD27 у человека может способствовать активации Т-клеток и опухолевому иммунитету
.J Immunol
2013
;190
:6250
—8
,9.Huang
J
,Jochems
C
,Talaie
T
и др.Повышенный уровень растворимого лиганда CD40 в сыворотке у онкологических больных может играть иммуносупрессивную роль
.Кровь
2012
;120
:3030
—8
.Опубликовано издательством Oxford University Press для Общества инфекционистов Америки, 2020 г.
Эта работа написана (а) государственным служащим (ами) США и находится в общественном достоянии США.
Грааль иммунолога: вакцины, генерирующие клеточный иммунитет
Многие из прошлых попыток разработки вакцин сосредоточены на генерации ответов антител. В ряде текущие усилия по разработке обеих новых вакцин против многих инфекционных болезней и эффективных иммунотерапевтических методов лечения рака, цель была выработка ответов цитотоксических Т-лимфоцитов (CTL).В отличие от B клетки (и антитела), которые могут распознавать химически разные антигены (например, белки, полисахариды) в различных контекстах (клеточный или ассоциированные с патогенами или растворимые), Т-клетки обычно распознают только бимолекулярный комплекс, состоящий из антигенного пептида, связанного с определенным гликопротеины клеточной мембраны, главный комплекс гистосовместимости (MHC) молекулы класса I и класса II. Эти молекулы MHC обеспечивают генетический идентичность для каждого человека, поскольку каждый родительский гаплотип кодоминантно выражен.
Таким образом, Т-клетки обладают двойной специфичностью, за исключением случаи трансплантации органов, когда Т-клетки одного человека распознают «чужие» молекулы MHC, их рецепторы специфичны как для их собственных молекул MHC, так и для соответствующих антигенный пептид, связанный с этими молекулами MHC. Награждение Нобелевской премии по физиологии и медицине 1996 г. Питеру Доэрти и Рольф Цинкернагель отмечает их важный вклад в их демонстрация этой двойной специфичности, которую CTL должен распознавать две детерминанты на инфицированной вирусом клетке: одна специфична для вируса и один, специфичный для MHC хоста.
Одна подгруппа Т-клеток, которые экспрессируют гликопротеин CD8 клеточной поверхности, распознают пептидные антигены, связанные с молекулами MHC класса I. Эти CD8 + Т-клетки также могут секретировать цитокины в ответ на вовлечению их рецепторов Т-клеток, но их название отражает их способность лизировать клетки, представляющие антиген. Потому что в отличие от к белкам MHC класса II, экспрессия которых в основном ограничена профессиональные антигенпрезентирующие клетки (APC), молекулы MHC класса I присутствуют на поверхности большинства ядерных клеток, CD8 + T клетки могут убивать различные типы клеток, тем самым устраняя клетки, которые инфицированы вирусом (и, следовательно, производят больше вируса) или опухолевыми клетками, и т.п.Пептиды, связанные с молекулами MHC класса I, обычно получают из белков, присутствующих в цитоплазме клеток, обычное явление с вирусной инфекцией или для любого другого белка эндогенно синтезируется клеткой-хозяином, но не экзогенными белками (такими как введенный белок, который обычно попадает в эндосомы для деградация эндолизосомным путем). Вызов для индукция этих так называемых «цитотоксических T-лимфоцитов, ограниченных классом I MHC. клетки »или CTL, как искусственно вводить антигены в Путь MHC класса I через цитоплазму.
С выяснением механизмов процессинга антигена и прибыла презентация по созданию ЦТЛ, ограниченного классом I MHC усилия по созданию таких ответов либо с помощью вирусных векторов кодирующие гетерологичные антигены или невирусные системы. Четыре статьи недавно опубликованные в Proceedings (1–4) описывают различные подходы к созданию CTL, ограниченных MHC класса I. Это из Интересно описать эти статьи для стратегий и наблюдений которые они представляют, а также для сравнения подходов друг с другом и с другими методами иммунизации, которые в настоящее время изучаются в лабораторные и ранние клинические испытания.
Исследование Saron et al. (1) использует способность токсина (из Bordatella pertussis ) для перемещения токсиновый домен молекулы в цитоплазму клетки. Вставив пептидный эпитоп, ограниченный MHC класса I, из вируса в этот ферментативный домен токсина, этот пептид, таким образом, был непосредственно перемещен в цитоплазму клеток в составе токсинового домена и эффективно иммунизированные мыши для защиты от смертельного заражения с вирусом.Исследование Bronte et al. (4) обеспечивает дополнительные сведения о стратегии, впервые разработанной в лаборатории Мосса, который вошел в клиническую оценку, а также широко использованный лабораторный инструмент: рекомбинантные вирусы вакцины, которые экспрессируют гетерологичные белковые антигены. Две статьи Buschle et al. al. (2) и Schmidt et al. (3) — новый взгляд на хорошо известный подход иммунизации пептидами путем доставки пептиды, смешанные с поликатионами, такими как полилизин и полиаргинин, Результатом является защита двух опухолевых систем.Каждое исследование важно для демонстрации не только потенциальной пользы для иммунной активация, способная опосредовать защиту in vivo против вирусная или опухолевая проба (или для иммунотерапии), но для дальнейшего разъяснение нашего понимания ключевых вопросов доставки антигена для оптимальная активация защитных / лечебных иммунитет.
В своих усилиях по доставке эпитопов в цитозоль APC для возможная ассоциация с возникающими молекулами MHC класса I, Saron et al. al. (1) сделал гибридный белок, вставив пептидный эпитоп интерес, полученный из нуклеопротеина лимфоцитарного хориоменингита (LCMV) в токсин аденилатциклазы B. pertussis . В токсин обладает способностью проникать в эукариотические клетки и доставлять N-концевой участок (каталитический домен) непосредственно через плазму мембрана в цитозоль. Пептиды можно вводить в определенные местоположения N-концевой каталитической области и, таким образом, транспортироваться непосредственно в цитоплазму, где они могут быть доступны для обработки и презентация о молекулах MHC класса I.В то время как другие, в том числе наши лаборатории, использовали другие гибридные белки для транспортировки пептидов или белков в цитоплазму клеток (5, 6). демонстрация эффективности in vivo такого подход для генерации CTL-ответов. Более того, ответы CTL были достаточно для защиты мышей от смертельного внутримозгового заражение LCMV. В качестве дополнительной и важной демонстрации авторы также показали, что гибридный белок, созданный с тем же самым LCMV эпитоп, вставленный в генетически детоксифицированный токсин, также индуцированный MHC CTL, ограниченные классом I, и защитный иммунитет.
Использование токсина коклюша, который непосредственно переносит ферментативные домен в цитоплазму может иметь решающее значение для способности этого определенный токсин-гибридный белок, чтобы направить эпитоп в правильный внутриклеточный компартмент для in vivo примирования CTL. Для Например, Pseudomonas aeruginosa экзотоксин A (PE-токсин) очевидно, использует более сложный ретроградный путь от эндосом к комплекс Гольджи и эндоплазматический ретикулум для транслокации в цитоплазма (7, 8).И хотя слитные белки сделаны со связыванием и транслоцирующие домены токсина PE и пептидов гриппа A матричный белок и нуклеопротеин были способны сенсибилизировать клетки-мишени для лизиса CTL (5) никогда не было показано, что они способны индуцировать CTL путем введения in vivo .
Различные молекулы MHC обычно связывают разные пептиды; таким образом вакцина, состоящая из одного эпитопа CTL, будет эффективна только для сегмент беспородного населения. Учитывая гаплотипическое разнообразие MHC человеческой популяции было бы предпочтительнее сделать синтез токсина белковая вакцина, которая обеспечила полный белковый антиген, а не гаплотип-специфические эпитопы, позволяющие детерминантному отбору обеспечить для увеличения охвата населения за счет предоставления количество различных пептидных эпитопов для любого данного антигена.Пастан и коллеги (9) продемонстрировали, что гибридный белок, состоящий из связывающие и перемещающие домены токсина PE и фермента барназы, смог доставить функциональный белок барназы в цитоплазму клетки. Их способность заменять токсин неповрежденным белком. фрагмента PE-токсина и демонстрация в статье Saron et al. al. (1) что каталазная активность токсина может быть инактивирована без нарушения способности токсина доставлять эпитопы, поднять вопрос о том, можно ли сделать токсин коклюша доставлять весь белок, а не только эпитоп, путем замены белок или вставка белка в N-конец токсин.Для слитых белков PE правильная рефолдинг рекомбинантных белки представляли проблему; неизвестно, было ли включение весь белок, а не пептид, попадет в токсин коклюша. ввести трудности для рефолдинга такого гибридного белка в функциональная молекула доставки. Интересно, что авторы возможность многократно иммунизировать животных из-за одного потенциального недостатка этого подхода может быть формирование иммунного ответа против сам токсиновый белок (который в этой статье не оценивался).
В статье Bronte et al. (4) использовали поксвирус (коровьей оспы) векторной стратегии, которая использовалась как вакцина / иммунотерапевтическая стратегия и как инструмент для изучения CTL ответы и механизмы. Они еще больше добавили понимания факторов, которые важны для оптимизации эффективности этого подход (и, возможно, другие технологии рекомбинантных вирусных векторов) путем демонстрации дополнительного механизма, посредством которого выражение антиген рекомбинантного вируса осповакцины более эффективен из с иммунологической точки зрения, если экспрессия управляется ранним промотором (я.е. промотор, который активен сразу после заражения вирусом клетки до репликации вирусной ДНК), а не поздним промотор (активен после репликации вирусной ДНК), несмотря на то, что последний считается более сильным промоутером. Хотя ряд типов клеток экспрессируют наибольшее количество антигена, когда рекомбинантный вирус осповакцины использует поздний промотор, дендритные клетки экспрессировали модельный опухолевый антиген и активировал антиген-специфический CTL только тогда, когда экспрессия антигена была контролируется одним из первых промоутеров.В статье исследовалась возможность что APC могут быть несколько непермиссивными по сравнению с другими ячейками для вирусная инфекция; следовательно, конструкция осповакцины, использующая поздний промотор приведет к меньшей экспрессии кодируемого антигена и, следовательно, низкая иммуногенность.
Однако, как указывают авторы, другие факторы могут различия в иммуногенности конструкций осповакцины с использованием ранних по сравнению с поздними промоутерами. Более ранние исследования Coupar et al. (10) продемонстрировали, что использование поздних промоторов для экспрессии коровьей оспы гемагглютинина (HA) гриппа приводит к ингибированию представление эпитопов НА для HA-специфических CTL.Townsend et al. al. (11) расширили эти наблюдения с использованием векторов осповакцины. кодирующие различные формы HA или нуклеопротеина гриппа (NP). Они продемонстрировали, что торможение также в меньшей степени происходило во время ранние стадии инфекции, и что торможение было эпитоп-зависимый и может быть преодолен, если антиген был сконструирован Быстрее деградировать. Они постулировали это как инфекцию осповакцины. продолжается, возникает дефект процессинга антигена, который может быть вызван производство ингибитора протеазы, кодируемой коровьей оспой; таким образом антиген который нацелен на более быструю деградацию, а не на более стабильный, эффективно спасет дефектный процессинг антигена в клетке, инфицированной коровьей оспой.Подавление клетки-хозяина синтез белка осповакциной может также снизить синтез MHC молекулы класса I, тем самым обеспечивая другую этиологию уменьшенного эффективность презентации антигена для конструкций с использованием позднего промоутер.
Тем не менее, результаты важны, потому что, если выражение белок APC по сравнению с экспрессией в других типах клеток определяет эффективность рекомбинантной вакцины как вакцины, векторы должны быть сконструирован специально для максимального увеличения экспрессии в этих клетках.Подчеркивая важность экспрессии белка (антигена, в случай вакцины), особенно в APC, демонстрирует необходимость оценить векторы экспрессии в интересующих клетках-мишенях. И все же потребность в экспрессии белка профессиональными APC, что является предположение, лежащее в основе этого подхода, возможно, не следует принимать предоставляется. Например, в некоторых системах перенос антигена (12) или «Перекрестное праймирование» (13) считается ответственным за доставку антиген из клетки, синтезирующей антиген, к APC, который затем представляет это CTL.Таким образом, демонстрация того, что использование раннего промоторы были более эффективны для создания желаемого иммунного ответы из-за их большей активности (по сравнению с поздними промоторов) в APC перефокусирует усилия на конструирование вектора на по крайней мере, для поксвирусов, особенно при экспрессии в APC, а не общие уровни экспрессии в широком диапазоне типов клеток.
Некоторые группы избегают усилий по доставке белковых антигенов цитозоль для входа в путь обработки MHC класса I в пользу пептиды, которые могут связываться с молекулами MHC в различных точки пути, в том числе внеклеточно.Группа Birnstiel (2) описывает способность поликатионов доставлять пептиды к APC. in vitro. Они показывают, что как отрицательно заряженные, так и нейтральные пептиды могут быть доставлены. Режим введения пептидов в клетки, по-видимому, различается для разных соединений, при этом полилизин, по-видимому, временно проницаемость клеточных мембран, тогда как полиаргинин действует через эндоцитарные механизмы. В их спутнике документ (3), процент мышей, иммунизированных пептидом, полученным из опухоль (мастоцитома P815), смешанная с полилизином, была защищена от опухоль.Используя систему меланомы, они показали, что подкожная иммунизация мышей комбинацией из четырех пептидов с некоторыми поликатионами обеспечивает определенную степень защиты при введении профилактически или терапевтически. В обеих системах защита обеспечивается облученными опухолевыми клетками (спроектированными так, чтобы секретировать цитокины) обеспечивает эквивалентную или лучшую защиту. Хотя частичный защита, замеченная в этих ранних исследованиях, интересна, механизм защита непонятна. Нет демонстрации CTL или T ответы вспомогательных клеток (т.д., производство цитокинов) после только иммунизация. (Спленоциты животных, которые были первыми инокулировали опухолевыми клетками, затем терапевтически получали один из пептидно-катионные смеси секретируют γ-интерферон в ответ на сокультивирование с клетками меланомы, но инокуляция опухолью будет иметь праймировали животных.) Поскольку ни один из экспериментов не содержал контроля группы, иммунизированные только поликатионами и не антиген-специфичные ответы были продемонстрированы только для животных, получавших вакцину, это неясно, была ли наблюдаемая защита специфической для опухолевых антигенов или был неспецифический эффект.Хотя у некоторых видов поли-L-лизин (PLL) может действовать как классический T-зависимый антиген представлен в контексте молекул MHC класса II, и фактически был использован для первоначальной демонстрации контроля гена Ir антитела. ответы у морских свинок (14, 15), у большинства линий мышей гаптены конъюгированные с PLL ведут себя как Т-независимые антигены. Действительно, чтобы породить защитные MHC класса I-ограниченные Т-клетки с помощью CTL, введение Только пептиды, ограниченные MHC класса I, в отсутствие T сотовая помощь, вероятно, будет неоптимальным.Таким образом, пока защита увидела может указывать на полезность этого подхода, было бы важно выяснить механизм защиты, чтобы определить, насколько специфичен иммунитет и насколько широко применим такой подход для другие антигены и системы.
Подходы к вакцинам, описанные Leclerc и соавторами (1) и группа Бирнстила (2, 3) основаны на предоставлении конкретных пептиды, а не белки в качестве антигена. В то время как исследования оба продемонстрировать защитную и / или терапевтическую эффективность у мышей в отношении их соответствующие модели инфекционных заболеваний и рака, пептидный подход вызывает три проблемы: ( i ) пептиды обеспечивают ограниченный, скорее, чем широкая база эпитопов CTL (или хелперов) для популяции, которая имеет гаплотипическое разнообразие людей; ( ii ) нет B-клетки представлены эпитопы, если необходимы ответы антител для полного иммунный набор как антител, так и клеточных ответов; а также ( iii ) хелперные Т-клеточные эпитопы, которые важны для оптимальной генерации CTL-ответов не предусмотрено.Хотя Первая проблема может быть решена путем предоставления смеси пептидов эпитопы для покрытия большинства гаплотипов, обеспечение всего белок или несколько белков, как упоминалось выше, могут дать более широкий охват. Такое положение может быть важным, чтобы избежать генерация моноспецифических CTL-ответов, которые могут привести к антигенным варианты ускользания вируса или опухолевого антигена. Действительно, администрация большого количества аутологичных CTL, моноспецифичных для одного эпитоп из белка nef ВИЧ индивидууму привел к развитие вирусного штамма, у которого отсутствует этот эпитоп (16).Касательно генерация помощи Т-клеток в случае слияния токсина и антигена белка, токсин предположительно отвечает за обеспечение эпитопы хелперных Т-клеток для генерации первичного ответа, хотя очевидно, что ответы помощников будут основаны на белке впоследствии не присутствовал во время инфекционного заражения. Для пептидно-поликатионный подход, неясно, являются ли специфические клеточные ответы хелперного или цитолитического фенотипа были вызваны сама иммунизация.
Таким образом, все эти три подхода представляют соблазнительную демонстрацию способность различных стратегий генерировать защитный иммунитет in vivo . Хотя поксвирус (4) и токсин-пептид слитый белок (1) оба ясно продемонстрировали способность генерировать CTL, механизм защиты пептидов-поликатионов (2, 3) менее ясен. Ряд других технологий, генерирующих CTL ответы (и в целом хорошие ответы антител) изучены доклинически и клинически, включая различные адъюванты, ДНК вакцины (17) и другие системы доставки векторов (например,г., другое рекомбинантные вирусы, ретровирусы и бактерии). Самый простой подход который позволяет избежать проблем с пептидами (ограничение эпитопов для популяции с различными гаплотипами MHC и необходимостью обеспечения разнообразных Помощь Т-лимфоцитов для генерации CTL) и потенциальное ограничение, вызванное иммунными реакциями, направленными против «носителя» доставки или вектор (например, фрагмент доставки токсина или вирусный вектор) представляет собой ДНК вакцинный подход (17), где бактериальная плазмида, кодирующая белок антиген под контролем вирусного промотора приводит к в situ поколения антигена с последующим развитием антитела и клеточные иммунные ответы.Этот подход был первым продемонстрировал свою эффективность для создания защитного класса MHC I-ограниченный CTL (18). Важно отметить, что защита была от перекрестной деформации. эффективный; то есть животные были защищены от смертельной опасности с другим штаммом вируса гриппа, чем тот, от которого ген, кодирующий антиген. Напротив, опосредованный антителами защита от вируса гриппа строго специфична для данного штамма вируса. Доказано, что эта технология обеспечивает защиту иммунитет против заражения рядом вирусных, бактериальных и других модели доклинических заболеваний (рак, аллергия и аутоиммунные заболевания) (17) путем генерации CTL и / или ответов антител.Это относительно универсальная технология, не способная вызывать инфекционные само заболевание (как это может происходить с вирусными или бактериальными переносчиками) и имеет способность предоставлять цельные белковые антигены или смеси антигенов (через их гены), тем самым обходя одно из основных ограничений подходы к вакцинам на основе пептидов (эпитопная рестрикция). Нет значительные иммунные ответы были замечены против самого вектора, тем самым позволяя повторно использовать вектор для бустерных доз или для разные вакцины; эта проблема может быть ограничением использования слитые белки или векторы осповакцины.Эти ДНК-вакцины можно легко манипулируют для нацеливания кодируемого белка на разные клеточные места, которые окажутся важными для улучшения конкретных стороны иммунного ответа (антитела, Т-клеточная помощь, CTL).
Эти различные технологии необходимо напрямую сравнивать для конкретных приложения для оценки соответствующих иммунных ответов в контексте специфической патофизиологии заболевания. Пока доклинические эффективность не может быть предиктором клинической полезности, каждый из подходы, описанные в этих статьях, расширили наш арсенал для разработки вакцин и иммунотерапевтических средств, и они обеспечивают дополнительные инструменты для дальнейшего изучения антигена обработка и механизмы защитного иммунитета.
Благодарности
Я хочу поблагодарить доктора. Герман Эйзен, Джон Доннелли, Джефф Улмер, Тонг Фу и Джону Шиверу за критическое прочтение этой рукописи.
Сноски
↵ * Кому запросы на перепечатку следует направлять по адресу: WP16-101, Merck Исследовательские лаборатории, Самнейтаун-Пайк, Вест-Пойнт, Пенсильвания, 19486. Электронная почта: margaret_liu {at} merck.com.
- Авторские права © 1997, Национальная академия наук США
Понимание клеточных иммунных ответов
Иммунная система человека использует как врожденные, так и адаптивные иммунные ответы для борьбы с патогенами, такими как вирусы и бактерии (см. VAX March 2004 Primer on Understanding the Immune System, Part II ).Врожденные иммунные реакции всегда находятся в режиме ожидания и могут действовать быстро, обычно в течение нескольких часов, чтобы либо подавить, либо помочь ограничить первоначальную инфекцию. Если требуется дополнительная помощь, срабатывают адаптивные иммунные ответы, которые включают как антитела, так и клеточные иммунные ответы. Их активация занимает больше времени, поскольку они предназначены для нацеливания на конкретный патоген. Иммунная система вырабатывает ВИЧ-специфические антитела и клеточные иммунные ответы против вируса, которые имеют решающее значение либо для предотвращения, либо для борьбы с инфекцией, и поэтому представляют большой интерес для исследователей вакцины против СПИДа.
Ответы антителпредставляют собой Y-образные молекулы, которые в первую очередь цепляются за вирусы и не позволяют им инфицировать клетки (см. VAX , февраль 2007 г., Primer на странице Understanding Neutralizing Antibodies ). Когда клетки уже инфицированы, в игру вступают клеточные иммунные реакции. Эти ответы включают подмножество иммунных клеток, известных как CD4 + Т-хелперы, которые регулируют активность активированных CD8 + Т-клеток, известных как цитотоксические Т-лимфоциты (CTL), которые могут убивать клетки, уже инфицированные вирусом.
Роль клеточного иммунного ответа в ВИЧ-инфекции сложна, потому что те самые клетки, которые играют роль в ограничении инфекции, подвергаются атаке — вирус преимущественно поражает CD4 + Т-клетки, серьезно ограничивая способность иммунной системы сопротивляться. Тем не менее, как CD4 +, так и CD8 + Т-клетки по-прежнему играют важную роль в борьбе с ВИЧ-инфекцией, а также, вероятно, будут важны для разработки вакцины против СПИДа. В настоящее время исследователи изучают идеальные типы антител и клеточные иммунные ответы, которые должна вызывать вакцина для наилучшего предотвращения или контроля ВИЧ-инфекции.
Вызвание Т-клеточного ответа
Разработка кандидатов для вакцины против СПИДа, способных вызывать нейтрализующие реакции антител против ВИЧ, является сложной задачей, и до сих пор испытанные стратегии не увенчались успехом. Однако было идентифицировано несколько кандидатов на вакцину против СПИДа, которые могут вызывать клеточные иммунные ответы, как CD4 +, так и CD8 + Т-клетки, против ВИЧ. Многие из них прошли клинические испытания, в том числе кандидат на вакцину MRKAd5 компании Merck, который недавно был протестирован в исследовании STEP (см. VAX , сентябрь 2007 г., специальный отчет ).
Обычно исследователи измеряют размер клеточных иммунных ответов, вызываемых различными кандидатами, а также способность этих клеток секретировать цитокины, которые представляют собой белки, вырабатываемые иммунными клетками в ответ на вирусы или бактерии (см. VAX August 2007 Primer on Understanding Immunogenicity ). Кандидат MRKAd5 компании Merck индуцировал Т-клетки, секретирующие цитокин, известный как интерферон-γ (IFN-γ), у большего количества людей, чем любой кандидат, протестированный в клинических испытаниях фазы I, до того, как он был переведен на испытание концепции фазы IIb.В испытаниях фазы I 80% реципиентов MRKAd5, у которых не было высокого уровня ранее существовавшего иммунитета к вирусу простуды, используемому в качестве вектора, развили Т-клетки, которые секретировали IFN-γ.
У большинства реципиентов вакцины в испытании STEP также развились Т-клеточные ответы CD4 + и CD8 + против ВИЧ после получения MRKAd5. Но этих иммунных ответов было недостаточно для защиты от инфекции. Исследователи до сих пор не наблюдали какой-либо корреляции между размером ВИЧ-специфических иммунных ответов у реципиентов вакцины и тем, заразились ли они впоследствии ВИЧ из-за рискованного поведения, такого как незащищенный секс с ВИЧ-инфицированным партнером или употребление инъекционных наркотиков.
Исследователи также обнаружили, что количество ответов Т-клеток, похоже, не коррелирует с контролем над вирусом у некоторых ВИЧ-инфицированных, известных как элитные контролеры. Элитные контролеры — это группа ВИЧ-инфицированных, не прогрессирующих в течение длительного времени, но имеющих очень низкий уровень вируса (вирусную нагрузку) и не прогрессирующих до СПИДа даже без помощи антиретровирусной терапии (см. VAX сентябрь 2006 г. Primer on Понимание долгосрочных непроцессоров ).Величина ВИЧ-специфических клеточных иммунных ответов у элитных контролеров на самом деле ниже, чем у людей с типичной вирусной нагрузкой, у которых заболевание протекает нормально.
Количество по сравнению с качеством
В совокупности эти результаты указывают на то, что размер Т-клеточного ответа не может быть ключевым фактором в предотвращении или контроле ВИЧ-инфекции. Вместо этого способность Т-клеток выполнять определенную функцию может быть более важной. Некоторые иммунологи предполагают, что значение имеет не размер первоначального Т-клеточного ответа на вакцинацию, а способность этих Т-клеток размножаться позже, когда человек сталкивается с патогеном, против которого он был вакцинирован, что является наиболее важным.
Другие исследователи изучают прямую способность Т-клеток, индуцированных кандидатом на вакцину против СПИДа, убивать инфицированные вирусом клетки. Исследователи могут извлекать Т-клетки из добровольцев в клинических испытаниях вакцины против СПИДа с помощью образцов крови и тестировать их в лаборатории на ВИЧ, чтобы увидеть, действительно ли они способны убивать инфицированные вирусом клетки. Этот метод сейчас используется некоторыми исследователями для определения приоритетности вакцин-кандидатов в клинических испытаниях фазы I.
Другой подход заключается в изучении различных вирусных и бактериальных векторов, которые могут быть использованы для кандидатов на вакцину против СПИДа, чтобы увидеть, вызывают ли они различные типы Т-клеточных ответов.Исследователи провели доклинические эксперименты на мышах, чтобы сравнить Т-клетки, индуцированные различными вирусными векторами. Результаты показывают, что выбор вектора действительно влияет на тип Т-клеток, которые индуцируются при вакцинации.
Исследователи также в настоящее время изучают характеристики эффективных Т-клеточных ответов при других вирусных инфекциях, при которых клеточные иммунные ответы хотя бы частично отвечают за защиту, чтобы определить, какие типы Т-клеток кандидат на вакцину против СПИДа должен в идеале индуцировать.Дополнительные исследования Т-клеточного ответа на ВИЧ, а также на другие патогены прольют свет на эти вопросы и помогут исследователям разработать более эффективные кандидаты для вакцины против СПИДа.
В клеточном иммунитете клетки играют наиболее важную роль в уничтожении чужеродных захватчиков. Вовлеченные клетки представляют собой макрофаги и различные подмножества Т-клеток: хелперные CD4 + клетки, супрессорные CD8 + клетки, цитотоксические Т-киллеры и естественные (NK) киллеры. Монокины и лимфокины , секретируемые макрофагами и CD4 + клетками-помощниками, соответственно, играют важную роль в управлении и усилении как клеточных, так и гуморальных иммунных ответов.
Сотовая связь
Макрофаги, клетки CD4 (хелперы), клетки CD8 (супрессоры), цитотоксические Т-киллеры (также CD8 +) и В-клетки — все они взаимодействуют, чтобы производить и регулировать иммунный ответ (рис. 2-4).
Обогатительная деятельность №2Посетите пункт «Клетки иммунной системы» и, основываясь на полученной информации, ответьте на следующие вопросы. Электронная почта ответы на Пат.
- В мазке крови, показанном внизу страницы, щелкните изображение моноцита .Под каким названием моноциты известны как
а) в печени?
(б) в мозгу?
(c) в почках?
(г) в кости?
(д) в других тканях и органах?
- Фагоцитоз включает несколько стадий. Кратко опишите своими словами
(а) хемотаксис
(б) приверженность
(в) образование псевдоподия
(г) образование фагосом
(e) образование фаголизосом
(f) презентация антигена
(g) опсонизация
- В разделе «Специфический иммунитет» прочтите следующие разделы:
- развитие иммунной системы
- клональный отбор
- текущая теория образования антител
- Т-клеточный иммунитет
- Также посетите сайт «Иммунная система», прокрутите вниз и прочтите A Selectionist Theory of Antibody Theory .

