— триацилглицеролы — Биохимия
Триацилглицеролы (ТАГ, триглицериды, триацилглицерины, нейтральные жиры) являются наиболее распространенными липидами в организме человека. В среднем их доля составляет 16-23% от массы тела взрослого.
Функции триацилглицеролов
- резервно-энергетическая – у среднего человека запасов подкожного жира хватает на поддержание жизнедеятельности в течение 40 дней полного голодания,
- в составе подкожной и брыжеечной жировой ткани механическая защита тела и внутренних органов.
- теплосберегающая – за счет толщины подкожного жира,
Триацилглицеролы плода и новорожденных отличаются бóльшим содержанием насыщенных жирных кислот. Они являются основным источником энергии и тепла для новорожденных, т.к. запасы гликогена у младенцев малы и зачастую имеется «незрелость» ферментативного окисления глюкозы. Недостаточное развитие жировой прослойки повышает требования к уходу за младенцами, особенно за недоношенными.
В состав ТАГ входит трехатомный спирт глицерол и три жирные кислоты. Жирные кислоты преобладают насыщенные (пальмитиновая, стеариновая) и мононенасыщенные (пальмитолеиновая, олеиновая). По строению можно выделить простые и смешанные ТАГ. В простых ТАГ все жирные кислоты одинаковые, например, трипальмитилглицерол, тристеарилглицерол. В смешанных ТАГ жирные кислоты отличаются, например, дипальмитилстеарилглицерол, пальмитилолеилстеарилглицерол..
Строение триацилглицеролов
Показателем числа двойных связей в жирнокислотных остатках ТАГ является йодное число. Для человека оно равно 64, у сливочного маргарина 63, в конопляном масле – 150.
Пищевые источники
Триацилглицеролы преобладают в практически любом жире, используемом в пищу – любые растительные масла, свиной, говяжий и другой животный жир, жир молочных продуктов и сливочное масло.
Суточная потребность в нейтральных жирах принята на уровне 80-100 г, растительных масел должно быть около 30% (но не менее 20 г) от общего количества жира. Однако в связи с изменением образа жизни в развитых странах (переедание, гиподинамия) в последние годы появилась тенденция к пересмотру рекомендуемых величин потребления ТАГ в сторону снижения – до 30-40 г/сут.
Прогоркание жиров
Прогоркание жиров – это бытовое определение широко распространенного в природе явления. Выделяют два типа прогоркания:
- биологическое – начинается с бактериального гидролиза ТАГ и накопления свободных жирных кислот. Их дальнейшее ферментативное окисление приводит к накоплению короткоцепочечных жирных кислот, β-кетокислот, гидроксикислот, эпоксидов, альдегидов и кетонов, которые и являются причиной изменения вкуса и запаха пищевого жира.
- химическое (перекисное окисление липидов, ПОЛ) – результат окисления жиров под действием О2 воздуха или под действием активных форм кислорода с образованием гидроперекисей (L-OOH), вторичных и третичных продуктов ПОЛ (малоновый диальдегид, диеновые конъюгаты).

В организме перекисному окислению противодействуют антиоксидантные системы, включающие витамины Е, А, С, трипептид глутатион, разнообразные белки и ферменты (каталаза, пероксидаза, супероксиддисмутаза).
Урок 2. Липиды, их структура и функции
Липиды – небольшие молекулы, их молекулярная масса составляет несколько сотен дальтон. Обычно в молекулах липидов имеются и гидрофильные, и гидрофобные группы, но в целом липиды имеют гидрофобные свойства. Липиды плохо растворимы в воде, зато хорошо растворяются в органических растворителях (спирте, ацетоне, хлороформе). Исторически липиды были выделены в отдельный класс веществ именно по этому признаку – как соединения, растворимые не в воде, а в менее полярных органических растворителях. К липидам относятся такие соединения, как фосфолипиды, нейтральные жиры, стероиды и воска. В живых организмах липиды выполняют несколько важных функций.
Структурная функция
Все клетки отграничены от окружающей среды наружной мембраной, которая примерно наполовину (по массе) состоит из липидов и наполовину – из белков. Способность липидов выполнять структурную функцию не ограничивается клеточным уровнем: медоносная пчела лепит свои соты из воска, из воскоподобных веществ состоит и кутикула наземных растений – тонкий слой на поверхности листьев и стеблей, уменьшающий испарение.
Способность липидов выполнять структурную функцию не ограничивается клеточным уровнем: медоносная пчела лепит свои соты из воска, из воскоподобных веществ состоит и кутикула наземных растений – тонкий слой на поверхности листьев и стеблей, уменьшающий испарение.
Энергетическая функция
Клетка может окислять липиды и использовать выделяющуюся энергию для своих нужд. При окислении нейтральных до углекислого газа и воды жиров выделяется много энергии – около 9,3 килокалорий на грамм. Жиры часто служат запасными питательными веществами. У высших позвоночных животных для этой цели используется особая ткань – жировая клетчатка. У растений запасы жиров нередко встречаются в семенах.
Регуляторная функция
Важнейшими регуляторами физиологических процессов в организме являются гормоны. Среди них встречаются соединения различной структуры. Особую группу составляют т. н. стероидные гормоны, которые относятся к классу липидов. Производными жирных кислот являются важные регуляторы клеточных функций простагландины (их иногда называют тканевыми гормонами).
Липиды могут выполнять и ряд других функций. Так, накопление липидов организмами планктона и нектона уменьшает их удельный вес и облегчает плавание в толще воды (такой механизм используют также акулы). Подкожная жировая клетчатка может служить механической защитой для внутренних органов, а у теплокровных животных она является теплоизолятором.
В молекулах фосфолипидов присутствуют различные по химическим свойствам составные части: «головка» и два «хвоста». В состав головки входят остатки глицерина, фосфорной кислоты и спирта. «Головка» гидрофильна и электрически заряжена, вода охотно с ней взаимодействует. «Хвосты» представляют собой остатки жирных кислот, содержащие множество СН2-групп. Поляризация связи С–Н очень слабая, так что «хвосты» вполне гидрофобны, и они «стремятся» избежать взаимодействия с водой.
|
Рис. |
В состав фосфолипидов входят как насыщенные жирные кислоты, не содержащие двойных связей, так и ненасыщенные. Очень распространенными жирными кислотами являются пальмитиновая CH3(CH2)14COOH, стеариновая CH3(CH2)16COOH, олеиновая CH3(CH2)7–СH=CH–(CH2)7COOH, пальмитоолеиновая CH3(CH2)5–СH=CH–(CH2)7COOH. В состав одной молекулы фосфолипида обычно входят остатки разных жирных кислот, причем ненасыщенная жирная кислота обычно располагается ближе к фосфату. Природные липиды содержат в основном цис-изомеры ненасыщенных жирных кислот. Транс-изомеры образуются при искусственной переработке растительных жиров – например, при получении маргарина. В последнее время выяснилось, что потребление транс-изомеров жирных кислот вредно для здоровья: оно увеличивает риск возникновения атеросклероза и онкологических заболеваний.
|
Рис. 2. Ионы пальмитиновой и олеиновой кислот |
Если молекулы фосфолипидов поместить на поверхность водного слоя, то, очевидно, что гидрофильные «головки» будут обращены в воду, а гидрофобные «хвосты» будут выталкиваться из воды. Образуется монослой – поверхностная пленка толщиной в одну молекулу. Если же «затолкать» молекулы фосфолипидов в воду целиком, то тогда «головки» будут обращены к воде (наружу), а «хвосты» – от воды (внутрь). Такие небольшие скопления молекул называются мицеллами.
|
Рис. 3. Структуры, образуемые фосфолипидами в воде |
К образованию мицелл более склонны не фосфолипиды, а жирные кислоты, имеющие только один гидрофобный «хвост» – мицеллы получаются, например, при растворении мыла в воде
Фосфолипиды чаще образуют другую структуру – липидный бислой. В составе бислоя молекулы фосфолипидов располагаются в два ряда: «головки» будут обращены к воде, а «хвосты» упрятаны внутрь. Липидный бислой составляет основу всех клеточных мембран – мембрана представляет собой «липидное озеро», в котором плавают белки.
В составе бислоя молекулы фосфолипидов располагаются в два ряда: «головки» будут обращены к воде, а «хвосты» упрятаны внутрь. Липидный бислой составляет основу всех клеточных мембран – мембрана представляет собой «липидное озеро», в котором плавают белки.
Липидный бислой непроницаем для заряженных ионов – они не могут проникнуть через его гидрофобную центральную зону. Для того чтобы транспортировать ионы через мембрану, в клетке имеются специальные белки-переносчики. Через бислой не могут пройти крупные молекулы – белки, полисахариды, нуклеиновые кислоты. Липидный бислой проницаем для небольших гидрофобных молекул, а также для совсем мелких полярных, но не заряженных – таких как Н 2О, СО2, а также О2.
Нейтральные жиры представляют собой эфиры глицерина и остатков трех жирных кислот. Они более гидрофобны, чем фосфолипиды, и располагаются внутри клетки в виде нерастворимых жировых включений.
|
Рис. |
В состав жиров также могут входить остатки насыщенных и ненасыщенных жирных кислот. Первые преобладают в животных жирах, а вторые – в растительных. Насыщенные жирные кислоты имеют более высокую температуру плавления, поэтому подсолнечное масло при комнатной температуре является жидкостью, а сливочное масло и говяжий жир – твердыми телами. В состав жиров сливочного масла входят насыщенные кислоты с меньшим числом углеродных атомов, чем у жиров говяжьего жира, поэтому сливочное масло плавится при меньшей температуре. Как и молекулы фосфолипидов, молекулы нейтральных жиров обычно содержат остатки разных жирных кислот.
Жирные кислоты могут синтезироваться из углеводов и аминокислот, из-за этого ожирение наступает при избыточном питании не только жирами, но и другими продуктами.
Еще один класс липидов – стероиды. Это небольшие гидрофобные молекулы, производные холестерина. Они содержат в своем составе систему связанных углеводородных колец – три шестиатомных и одно пятиатомное. Стероидами являются такие гормоны надпочечников, как глюкокортикоиды (например, кортизол), играющие важнейшую роль в развитии стресса, и минералокортикоиды (альдостерон), уменьшающие выведение почками воды и ионов натрия из организма. К стероидным относятся мужские и женские половые гормоны (тестостерон и эстрадиол), а также прогестины (прогестерон).
Они содержат в своем составе систему связанных углеводородных колец – три шестиатомных и одно пятиатомное. Стероидами являются такие гормоны надпочечников, как глюкокортикоиды (например, кортизол), играющие важнейшую роль в развитии стресса, и минералокортикоиды (альдостерон), уменьшающие выведение почками воды и ионов натрия из организма. К стероидным относятся мужские и женские половые гормоны (тестостерон и эстрадиол), а также прогестины (прогестерон).
|
Рис. 5. Холестерин и два стероидных гормона |
В печени из холестерина синтезируются желчные кислоты, которые затем поступают в желчь. Эти соединения содержат как гидрофильные, так и гидрофобные группы. В водной среде они легко образуют мицеллы. В просвете кишечника в эти мицеллы включаются молекулы жиров из съеденной пищи – сами по себе нейтральные жиры почти нерастворимы, а в составе мицелл образуют эмульсию и становятся доступными для действия пищеварительных ферментов.
Сам холестерин – не гормон, а необходимый компонент клеточных мембран у высших организмов; у бактерий он встречается редко.
Интересен механизм действия стероидных гормонов на клетки-мишени. Стероиды – это небольшие гидрофобные молекулы, они легко проникают через наружную мембрану клетки. Белки-рецепторы, связывающие эти гормоны, расположены в цитоплазме. После связывания со стероидом белок-рецептор активируется и идет из цитоплазмы в ядро. В ядре гормон-рецепторный комплекс связывается с ДНК и регулирует активность некоторых генов (ДНК и гены рассматриваются на уроке 8). Каждый класс стероидных гормонов имеет свои собственные рецепторы и регулирует только определенные гены.
|
Рис. 6. Механизм действия стероидных гормонов |
Так, глюкокортикоиды – гормоны стресса – активируют различные гены, отвечающие за обеспечения организма энергией, и угнетают гены, отвечающие за накопление запасных питательных веществ. Ведь стрессовая реакция служит для мобилизации организма на борьбу или бегство, а тут уж не до запасания. Минералокортикоиды активируют гены фермента Na+/K+–АТФазы, который возвращает в кровь из первичной мочи натрий, а вместе с ним и воду.
Ведь стрессовая реакция служит для мобилизации организма на борьбу или бегство, а тут уж не до запасания. Минералокортикоиды активируют гены фермента Na+/K+–АТФазы, который возвращает в кровь из первичной мочи натрий, а вместе с ним и воду.
Еще одна группа важнейших регуляторов жизнедеятельности организма – это простагландины. Они образуются из арахидоновой кислоты – одной из полиненасыщенных жирных кислот. Сперва простагландины были обнаружены в предстательной железе – простате – с чем и связано их название, однако вскоре они были найдены в самых разных клетках, тканях и органах.
Простагландины иногда называют тканевыми гормонами. Дело в том, что в организме у них довольно короткое время жизни, поэтому они действуют локально, в том же органе, в котором и вырабатываются.
|
Рис. 7. Слева – арахидоновая кислота, справа – простагландин Е2 |
Существует много разных классов простагландинов, они обладают различным, иногда прямо противоположным физиологическим действием.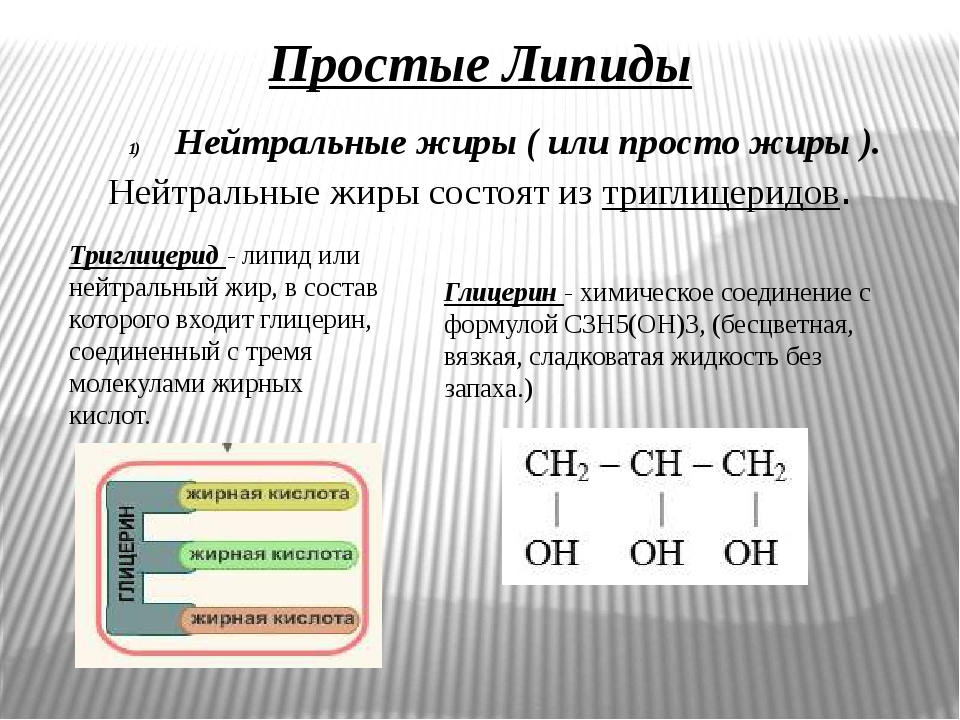 Так, простагландин Е2 расширяет стенки кровеносных сосудов, увеличивает их проницаемость, это вещество вырабатывается при воспалении и вызывает многие его симптомы. Простагландин F2 действует на сосуды противоположным образом – сужает и уменьшает проницаемость – он обладает противовоспалительным действием. Однако при беременности эти соединения действуют одинаково, усиливая сокращения гладкой мускулатуры матки.
Так, простагландин Е2 расширяет стенки кровеносных сосудов, увеличивает их проницаемость, это вещество вырабатывается при воспалении и вызывает многие его симптомы. Простагландин F2 действует на сосуды противоположным образом – сужает и уменьшает проницаемость – он обладает противовоспалительным действием. Однако при беременности эти соединения действуют одинаково, усиливая сокращения гладкой мускулатуры матки.
Простагландин I2 (простациклин) препятствует агрегации тромбоцитов и тормозит свертывание крови, тогда как тромбоксан А2 (очень похожее на простагландины вещество, тоже синтезируемое из арахидоновой кислоты) активирует эти два процесса.
Еще один класс производных арахидоновой кислоты – лейкотриены – играют ключевую роль в развитии такой тяжелой болезни как бронхиальная астма. Они вызывают сокращение гладких мышц дыхательных путей, что приводит к спазму бронхов и неукротимому кашлю, без специальной медицинской помощи больной может задохнуться и умереть.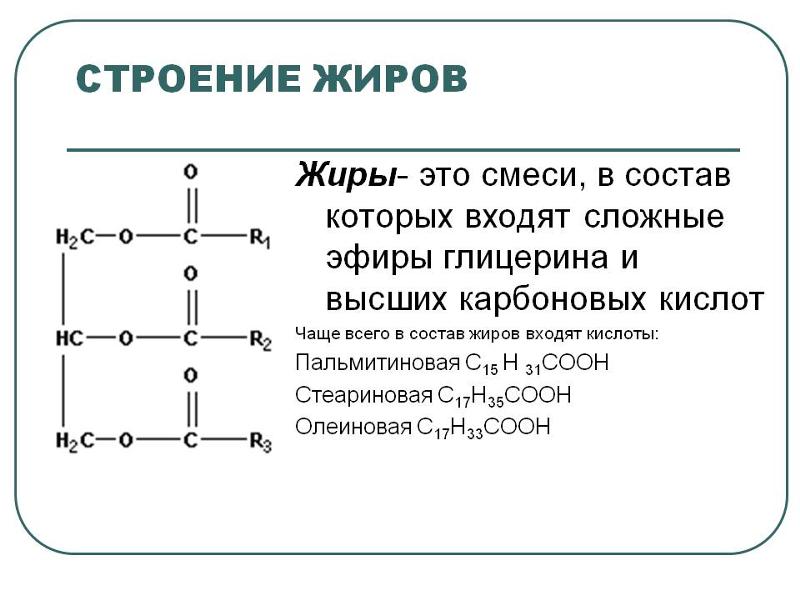
Широко распространенное лекарство аспирин угнетает синтез простагландинов. Оно обладает противовоспалительным и жаропонижающим действием.
В организме человека всасывание липидов происходит в тонком кишечнике. Жирные кислоты и глицерин поступают из просвета кишки в клетки эпителия кишечника. Там из них синтезируются нейтральные жиры, которые в комплексе со специальными белками и холестерином образуют особые частицы диаметром 0,1–1 мкм – хиломикроны. Хиломикроны поступают из клеток кишечника в лимфатическую систему, затем в кровоток и разносятся по всему организму.
Кроме хиломикронов, перенос жиров от одной ткани к другой осуществляют т. н. липопротеины очень низкой плотности (ЛПОНП). Они образуются в печени – там синтезируется и белковая, и жировая часть этих комплексов, а к другим тканям переносятся с кровотоком. ЛПОНП также содержат холестерин. После усвоения жиров различными тканями организма липопротеиновые частицы, содержащие холестерин, становятся т.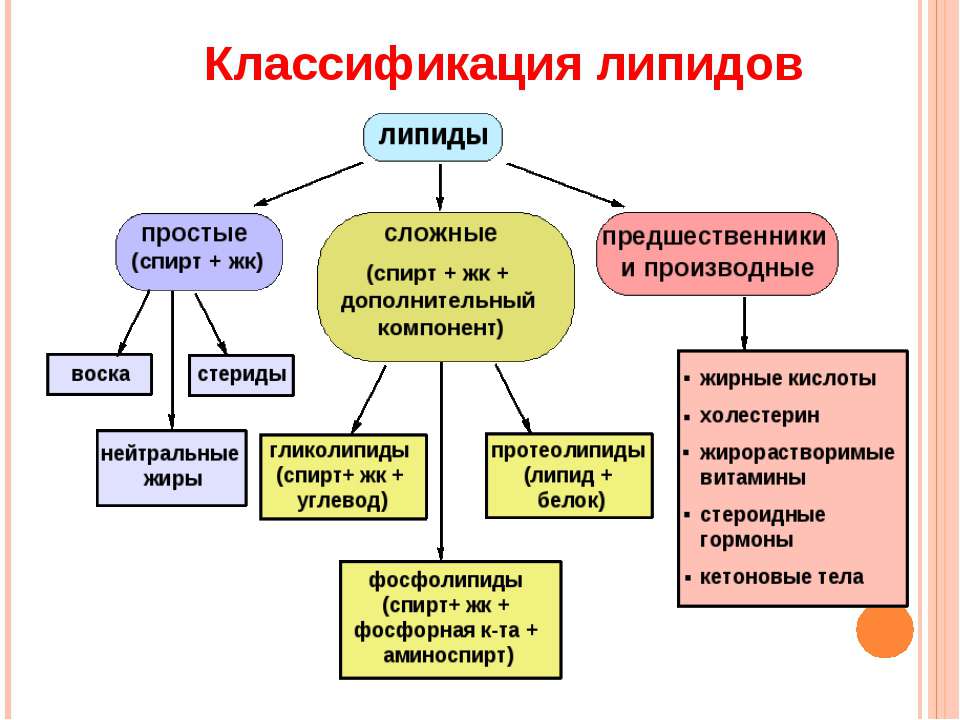 н. липопротеинами низкой плотности (ЛПНП). На поверхности почти всех клеток человеческого организма есть специальные белки–рецепторы ЛПНП. Когда ЛПНП связываются с этими рецепторами, клетка поглощает их, внутри клетки холестерин освобождается и используется для клеточных нужд.
н. липопротеинами низкой плотности (ЛПНП). На поверхности почти всех клеток человеческого организма есть специальные белки–рецепторы ЛПНП. Когда ЛПНП связываются с этими рецепторами, клетка поглощает их, внутри клетки холестерин освобождается и используется для клеточных нужд.
|
Рис. 8. Усвоение холестерина клеткой через ЛПНП |
При развитии опасного заболевания, атеросклероза, холестерин начинает откладываться на стенках кровеносных сосудов, образуя т. н. склеротические бляшки. Это может привести к закупорке и повреждению сосудов. Больным атеросклерозом часто назначают диету с пониженным содержанием холестерина, однако этот липид в значительных количествах вырабатывается в самом организме, так что такая диета не может предотвратить развитие заболевания.
Механизм развития атеросклероза изучен далеко не полностью. По-видимому, на первом этапе происходит самопроизвольное окисление жирных кислот, содержащихся в ЛПНП. Такие «испорченные» липопротеины откладываются на стенках кровеносных сосудов, что вызывает прикрепление к измененной сосудистой стенке защитных клеток – макрофагов. Макрофаги, прикрепленные к стенке сосуда, начинают активно поглощать из плазмы крови холестерин, причем не через рецепторы ЛПНП, а через совсем другие, т. н. рецепторы-мусорщики. Макрофаг оказывается напичканным холестерином, он и дает начало склеротической бляшке. Известно, что у людей с наследственными дефектами рецепторов ЛПНП атеросклероз развивается уже в детском возрасте.
Запасание триглицеридов происходит в специальной ткани – жировой клетчатке. При голодании в клетках этой ткани происходит распад триглицеридов, и свободные жирные кислоты переносятся к другим органам белком плазмы крови – сывороточным альбумином.
Краткое содержание урока
|
Нейтральные жиры триглицериды — Справочник химика 21
Жиры. В тканях живых организмов и растений содержатся нейтральные жиры и жироподобные соединения (общее название — липиды). Липиды построены по типу сложных эфиров. К нейтральным жирам относятся триглицериды — сложные эфиры трехатомного спирта глицерина (стр. 111) и высших жирных кислот пальмитиновой, стеариновой, олеиновой н др., например [c.441]Омыление нейтральных жиров. При омылении нейтральных жиров растворами едких щелочей одновременно протекают две химические реакции расщепление (гидролиз) триглицеридов и нейтрализация (связывание) щелочью выделяющихся в результате расщепления жирных кислот. [c.38]
Скорость нейтрализации и доомыления расщепленных жиров едкими щелочами. Расщепленные жиры состоят из 92—96% жирных кислот и 4—8% нейтральных жиров (триглицеридов). Омыление этой смеси раствором едкой щелочи происходит значительно быстрее, чем нейтрального жира. В этом случае процесс проходит в две стадии I стадия— моментальная нейтрализация жирных кислот при их соприкосновении с раствором едкой щелочи и сравнительно быстрое омыление основной массы нейтрального жира, находящегося в растворе мыла П стадия — замедленное доомыление небольшого количества оставшегося нейтрального жира и жирных кислот при незначительн-ом избытке свободной едкой щелочи (см. рис. 1 участок 3). [c.42]
Этот фермент занимает первое место на пути биосинтеза жирных кислот с длинной цепью. Другие процессы синтеза, в которых исходным соединением служит ацетил-СоА (синтез каротиноидов, стероидов, цитрата, малата и др.), не нуждаются в активирующем воздействии мало-нил-СоА. Ацетил-СоА-карбоксилаза активируется цитратом. Повышение содержания цитрата, способствуя образованию малонил-СоА, тем самым стимулирует синтез жирных кислот с длинной цепью и нейтральных жиров (триглицеридов). Роль отрицательных эффекторов играют при этом СоА-производные пальмитиновой и других жирных кислот. При накоплении СоА-производных происходит ингибирование конечным продуктом. [c.496]
Наиболее распространенными являются триглицериды, часто называемые нейтральными жирами или просто жирами. Нейтральные жиры находятся в организме либо в форме протоплазматического жира, являющегося структурным компонентом клеток, либо в форме запасного, резервного, жира. Роль этих двух форм жира в организме неодинакова. Протоплазматический жир имеет постоянный химический состав и содержится в тканях в определенном количестве, не изменяющемся даже при патологическом ожирении, в то время как количество резервного жира подвергается большим колебаниям. [c.193]
Молочный жир. Основную массу жировых веществ молока составляет нейтральный жир (триглицериды). Он [c.180]
Синтез нейтральных жиров (триглицеридов) [c.405]
Триглицериды или нейтральные жиры. [c.561]
Синтез нейтральных жиров (триглицеридов)……405 [c.429]
Синтезировавшиеся в эпителии кишок из глицерина и жирных кислот и из моноглицеридов и жирных кислот нейтральные жиры (триглицериды), а также капельки жиров, не подвергшиеся перевариванию, проходя через кишечную стенку, поступают в центральную лимфатическую полость ворсинки, а затем в сосуды лимфатической системы. При всасывании жиров лимфатические сосуды заполняются капельками жира и содержимое их становится мутным. Через грудной лимфатический проток содержимое лимфатических сосудов поступает в кровоток. [c.305]
Едкие щелочи. Эти щелочи отличаются высокой реакционной способностью. При взаимодействии с нейтральными жирами они легко и достаточно быстро омыляют триглицериды и связывают высвобождающиеся при этом жирные кислоты, образуя соответствующие мыла. При обработке едкими щелочами жирных кислот ОКИ нейтрализуют их и также образуют мыла. [c.28]
При омылении триглицеридов (нейтральных жиров) выход мыла находят из уравнения [c.39]
Скорость реакции омыления триглицеридов (нейтральных жиров) резко возрастает при наличии в массе 20% мыла и более. Это объясняется тем, что мыльный раствор такой концентрации довольно легко растворяет жиры. Благодаря этому увеличивается контакт между реагирующими веществами, что, как известно, ведет к ускорению реакции. Этот фактор имеет также существенное значение для организации непрерывного процесса варки мыла. [c.41]
Нейтральные жиры, или триглицериды, представляют собой сложные эфиры трехатомного спирта глицерина и высших жирных кислот. [c.91]
ТРИГЛИЦЕРИДЫ, ИЛИ НЕЙТРАЛЬНЫЕ ЖИРЫ [c.562]
Восстановление триглицеридов. Существуют два промышленных способа получения высших жирных спиртов из нейтральных жиров восстановление под высоким давлением и восстановление с помощью металлического натрия. [c.101]
К нейтральным жирам относится группа липидов, состоящих из трехатомного спирта — глицерина и трех остатков жирных кислот, поэтому они называются триглицеридами, например трипальмитин [c.187]
Нейтральные жиры накапливаются в жировых клетках (адипоцитах), под кожей, в молочных железах, жировых капсулах вокруг внутренних органов брюшной полости незначительное их количество находится в скелетных мышцах. Образование и накопление нейтральных жиров в жировых тканях называется депонированием. Триглицериды составляют основу резервных жиров, которые являются энергетическим запасом организма и используются при голодании, недостаточном употреблении жиров, длительных физических нагрузках. [c.188]
Промежуточный обмен липидов интенсивно протекает в печени и жировой ткани, где постоянно происходит синтез резервных и других липидов, а также их распад. Синтез резервных жиров, которые являются триглицеридами, приводит к накоплению их в тканях депонированию). Постоянно протекает и процесс распада резервных жиров до глицерина и жирных кислот, которые затем утилизируются тканями мобилизация жиров). Процесс распада нейтральных жиров в тканях осуществляется с участием тканевых липаз и называется липолизом. [c.196]
Использование отдельных типов жиров пищи. В состав жиров пищи входят триглицериды (нейтральные жиры), которые составляют около 98 % общего количества жиров, а также фосфолипиды и холестерин (2 %). Их химический состав рассмотрен в главе 10. [c.451]
Определение химических показателей жиров. По своему составу природные жиры весьма неоднородны. Они состоят из смеси триглицеридов рязличных предельных и непредельных жирных кислот. Кроме того, в их состав пходят также моно- и диглицериды, свободные жирные кислоты, пигменты, жирорастпоримые витамины, некоторая примесь белковых веществ. Нейтральным жирам обычно сопутствуют липоиды (фосфатиды, стери-Н1>1, стериды и т. д.). [c.163]
Триглицериды, или нейтральные жиры пищи поступают в организм человека с продуктами питания животного и растительного происхождения и [c.451]
Нейтральные жиры, или глицериды, представляют собой сложные эфиры высших жирных кислот tt трехатомного спирта глицерина. В жирах преобладают триглицериды, состоящие из трех или двух различных жирных кислот. Моно- и диглицериды встречаются только как промежуточные продукты обмена веществ. При гидролизе жиры распадаются на глицерин и жирные кислоты [c.101]
Существует несколько способов восстановления жирных кислот до жирных спиртов гидрогениза.ция бутиловых или метиловых Э1 .Ц )ов жирных кислот гидрогенизация нейтральных жиров (триглицеридов) гидрогенизация жирных кислот. [c.56]
В начале проведения этерификации в аппаратуру вводят стехиомет-рпческую смесь жирных кислот и глицерина с добавкой 0,1% окиси магния как катализатора. В первой зоне смесь, текущая слоем толщиной 5 см., нагревается до 170°, причем из сопел подают столько перегретого водяного пара, чтобы реакционная смесь длительное время находилась в движении. При этом происходит этерификация в основном до моно- и диглицеридов. Затем продукт попадает во вторую зону, где нагревается до 210°. Здёсь добавляют второй катализатор — отмученную глину, в результате чего происходит образование триглицеридов. Смесь попадает в третью зону, где для завершения образования триглицеридов нагревается до 240°. При помощи вводимого одновременно с этим влажного насыщенного водяного пара отгоняют остатки непрореагировавших кислот и глицерина и получают таким образом совершенно нейтральные жиры, которые в заключение обрабатывают отбеливающими глинами. Выход составляет около 95%. [c.475]
Нейтральные жиры (триглицериды), в особенно больших количествах откладывающиеся в вакуолях дрожжей и других грибов, сходны с жирами высших организмов. Дрожжи andida, Rhodotonda) могут накапливать до 80 % жиров по отношению к сухому веществу. [c.34]
Жировая эмульсия, всосавшаяся из кишечника в лимфатическую систему, в конце концов, попадает в кровяное русло, изливаясь в v. ava superior через грудной лимфатический проток. С током крови эта эмульсия разносится затем по всему организму, причем основная масса липидов откладывается в жировых депо — в подкожной клетчатке, в брыжейке и сальнике и т. д. — в форме запасного жира. Жир жировой ткани, как уже указывалось, имеет специфическую структуру для каждого вида животного. Опыт показывает, что если животному давать в пищу не жир, а отдельные моноглицериды или свободные жирные кислоты, или даже сложные эфиры высших жирных кислот и этилового или цетилового спирта, то тем не менее в лимфе, оттекающей от кишечника, появляются главным образом нейтральные жиры — триглицериды. Это подтверждает, что в эпителиальных клетках кишечных ворсинок происходит глубокая перестройка пищевых жиров с образованием специфичных для человека или данного вида животных липидов. При скармливании свободных жирных кислот жиры все же образуются, очевидно, вследствие того, что необходимый для их синтеза глицерин доставляется самими клетками слизистой оболочки кишечника, обладающими способностью синтезировать этот трехатомный спирт из углеводов или продуктов их распада (например, фосфотриоз). [c.286]
Нейтральные жиры (триглицериды) состоят из трех молекул жирных йслот, химически связанных с одной молекулой глицерина 1в виде сложного эфира. Свойства жиров определяются свойствами жирных 1кислот, вхо дящих в их состав. Молекула жира (глицерида) имеет следующее строение [c.7]
В процессе дистилляции нейтральный (недорасщепленный) жир, жирные кислоты, а также нежировые вещества при высокой температуре и низком вакууме претерпевают ряд химических изменений. Нейтральные жиры (триглицериды) при существующем вакууме и высокой температуре не испаряются. При длительном пребывании их в кубе они частично разлагаются. [c.88]
Косвенный метод варки мыла применяют, как правило, при переработке жирового сырья, содержащего различные примеси, при использовании соапстоков, фузы, темных сортов технических жиров и т. п. В процессе высолки, которую в зависимости от требований к качеству мыла и степени загрязненности сырья производят последовательно несколько раз, в подмыльный щелок и клей переходят загрязнения, содержащиеся в исходном сырье. Косвенный метод варки мыла применяют также в тех случаях, когда для производства мыла используют нейтральные жиры. Глицерин, выделяющийся при омылении триглицеридов, переходит в подмыльный щелок, который направляют для получения различных сортов глицерина. [c.88]
Простые и виниловые эфиры глицерина в природе встречаются в этери-фицированном виде, как алкоксидиглицериды и альдегидогенные триглицериды (нейтральные плазмалогены). Триглицериды кислот с длинными цепями являются основной составной частью жиров и масел — они являются жирами в узком смысле этого слова. [c.141]
Липиды молока представляют собой весьма сложную смесь. Главной составной частью липидов молока является нейтральный жир. Жир молока, так же как и белки молока, представляет очень большую пищевую ценность. По своему химическому составу сливочное масло, получающееся путем сбивания сливок, является смесью триглицеридов, содержащих главным образом олеиновую и пальмитиновую кислоты. В сливочном масле содержатся также триглицериды миристиновой, стеариновой, каприновой, лауриновой, масляной, арахидоновой и других кислот. Кроме того, фракция липидов молока содержит холестерин, кефалйн и лецитин. [c.486]
Углекислые щелочи КагСОз и К2СО3 нейтральные жиры не омыляют, но если их нагреть до 140—150° С, то триглицериды вступают в реакцию с углекислыми щелочами, образуя мыла. [c.254]
К простым липидам относятся нейтральные жиры и воски (схема 6). Нейтральные жиры (ацилглицерины, или глицериды) представляют собой эфиры глицерина и жирных кислот. Встречаются моноацилглицери-иы (если жирной кислотой этерифицирована одна гидроксильная группа глицерина), ди- и триацилглицерины (триглицериды) [c.315]
В состав нейтральных жиров могут входить одинаковые жирные кислоты, например пальмитиновая. В таком случае образуется триглицерид трипальмитин. Это простые жиры. Если жиры содержат разные жирные кислоты, то образуются смешанные жиры, название которых зависит от составляющих кислот. Так, например, триглицерид 1-пальми-то-2-олео-З-стеарин содержит пальмитиновую, олеиновую и стеариновую кислоты [c.188]
Жировая дистрофия печени характеризуется накоплением в ней триглицеридов (жиров) и приводит к дегенеративным изменениям клеток печени. В этом случае содержание жира в печени может достигать 40—50 % при норме 5 %. Возникает ожирение печени (жировая инфильтрация), нарушаются ее функции. В печени активно происходит синтез фосфолипидов из нейтральных жиров, фосфорной кислоты и, в большинстве случаев, азотистого основания — холина. Для образования холина необходимо поступление в организм с пищей достаточного количества аминокислоты метионина, являющейся донором метильных групп. При недостатке метильных групп нарушается синтез холина и последующее образование фосфолипидов, в результате чего в печени накапливается жир. Для синтеза фосфолипидов необходимы липотропные вещества, к которым относятся ненасыщенные жирнью кислоты, входящие в состав растительных масел. Растительные масла [c.207]
Тем 2.4. Органические вещества. Общая характеристика. Липиды.
1. Дайте определения понятий.
Органические вещества – сложные углеродсодержащие соединения.
Полимеры – молекулы, состоящие из повторяющихся частиц – мономеров.
Гомополимеры – полимеры, построенные из мономеров одного типа
Гетерополимеры – полимеры, в состав которых входят отличающиеся друг от друга мономеры.
Липиды – гидрофобные жироподобные соединения, не растворимые в воде.
2. Закончите схему «Органические вещества клетки».
3. Заполните кластер «Функции нейтральных жиров».
4. Прочитайте в § 2.4 раздел «Липиды» и укажите в таблице, какова роль восков и жироподобных веществ в жизни растений и животных.
ЗНАЧЕНИЕ ВОСКОВ И ЖИРОПОДОБНЫХ ВЕЩЕСТВ
5. Используя рисунок 10 учебника, объясните, почему, в отличие от хлорида натрия, нейтральный жир не растворяется в воде.
Нейтральный жир в составе молекулы имеет длинный «хвост» – гидрофобную часть, не растворимую в воде.
6. Объясните происхождение и общее значение слова (термина), опираясь на значение корней, его составляющих.
7. Выберите термин и объясните, насколько его современное значение соответствует первоначальному значению его корней.
Выбранный термин – гетерополимер.
Соответствие: термин соответствует своему значению. Он означает и означал, что в состав молекулы полимера входит много разных частиц-мономеров.
8. Сформулируйте и запишите основные идеи § 2.4
Органические вещества – сложные углеродсодержащие соединения. В клетке существуют в виде низкомолекулярных соединений и высокомолекулярных (полимеров) – молекул, состоящих из повторяющихся частиц – мономеров.
Есть гомополимеры (построенные из мономеров одного типа) и гетерополимеры (в состав их входят отличающиеся друг от друга мономеры). Один из низкомолекулярных видов соединений – липиды, представляющие собой гидрофобные жироподобные вещества, не растворимые в воде. Среди липидов выделяют нейтральные жиры, воски, витамины А, Д, Е и К, фосфолипиды и другие соединения.
Нейтральные жиры – важный компонент пищи и питательные вещества. Они выполняют в организме следующие функции:
Источник энергии.
Источник метаболической воды.
Теплоизоляционная.
Защитная.
Функция ненасыщенных жирных кислот в организме
Ненасыщенные жирные кислоты (НЖК) по числу двойных связей разделяются на моно-, ди-, три-, тетра-, пента-, гексаеновые. НЖК с одной или несколькими двойными связями являются структурными элементами фосфолипидов мембран и имеются в организме человека в значительных количествах (незаменимые жирные кислоты линолевая, линоленовая, арахидоновая поступают в организм с пищей). Самой распространенной из ненасыщенных жирных кислот является олеиновая (Е. А. Строев, 1986).
В фосфолипидах животных тканей очень мало содержится линолевой кислоты (0,05-0,4%), так как она превращается в линоленовую и арахидоновую. Линоленовая НЖК содержится в значительных количествах 4-24%, содержание арахидоновой кислоты в фосфолипидах тканей составляет 0,2-22% (табл. 1). Биологическое значение ненасыщенных жирных кислот в метаболизме окончательно не выяснено, механизмы катаболизма НЖК в клетках животных также досконально не изучены. В молекулах НЖК две двойные связи, расположенные следующим образом: -СН=СН-СН=СН–, называются сопряженными (конъюгированными) (Л. Уайт и соавт., 1981).
Двойные связи определяют существование двух разных жирных кислот с 18-20 углеродными атомами, имеющими различное положение в пространстве: трансизомер имеет прямую форму, а углеродная цепь цисизомера всегда изогнута в месте двойной связи. Ненасыщенные жирные кислоты являются только цисизомерами, т.е. они все изогнуты. Жирные кислоты в свободном состоянии редко встречаются в составе мембран. Они являются важным фактором регулирования проницаемости мембран (влияют на поверхностные свойства фосфолипидов, белок-липидные и липид-липидные взаимодействия), функционирования мембранно-связанных ферментов (П. Г. Богач и соавт., 1981). В мембранах располагаются ферменты, активность которых зависит от липидного окружения. В этом окружении ферменты имеют определенную конформацию. Изменение липидного окружения (делипидирование, использование липолитических ферментов, липидообменивающих белков) ведет к изменению конформации белков (ферментов), изменению их каталитической активности (Н. Е. Кучеренко, А. Н. Васильев, 1985). Активность ферментов в мембранах связана с вязкостью липидной фазы мембран, составом липидов (П. Г. Богач и соавт., 1981; Н. Е. Кучеренко, А. Н. Васильев, 1985). Метаболическая активность липидзависимых ферментов определяется изменениями в липидном микроокружении и в первую очередь это касается фосфолипидов: от их состава и метаболизма зависят ферментативные процессы. Это подтверждено для микросомальной монооксигеназной системы. Липидные молекулы являются матриксом, оптимальным для функционирования мембранно-связанных ферментов. НЖК в мембранах придают им такое качество, как жидкостность (текучесть). Увеличение в мембранах содержания холестерина, насыщенность жирнокислотных радикалов в фосфолипидах снижают жидкостность мембран. Подвижность липидов изменяет конформацию полярных головок. Регулирующее влияние на мембранно-связанные ферменты оказывают гликофосфолипиды (стабилизируя мембраны). При модификации липидного состава теряется чувствительность к гормонам, фосфолипиды влияют на функционирование рецепторов, могут регулировать их число (Н. Е. Кучеренко, А. В. Васильев, 1985), взаимодействовать с токсинами. Интенсивность обновления фосфолипидов зависит от скорости синтеза ДНК в клетке. Имеется связь синтеза ДНК с составом липидов, перераспределением фракций фосфолипидов, степенью ненасыщенности жирнокислотных радикалов (насыщенные жирные кислоты тормозят синтез ДНК). Такие фракции фосфолипидов, как фосфатидилэтаноламины, кардиолипины дестабилизируют молекулы ДНК путем усиления активности ДНК-полимеразы. Фосфолипиды влияют на прочность ДНК (стабилизацию структуры). Все эти данные (Н. Е. Кучеренко, А. Н. Васильев, 1985) свидетельствуют о важной регуляторной роли фосфолипидов мембран, составной частью которых являются ненасыщенные жирные кислоты.
Окисление ненасыщенных жирных кислот
Мембраны клетки являются неполярной средой, в которой кислород растворяется в 7-8 раз лучше, чем в полярной (А. Хорст, 1982). Поэтому, по мнению автора, именно в мембранах чаще наблюдается окислительное превращение полиненасыщенных жирных кислот. Реакции окисления протекают в тех местах, где имеются ненасыщенные липиды (фосфолипиды): в мембранах митохондрий, эндоплазматического ретикулума, лизосом, плазматических мембранах. Окисление ненасыщенных жирных кислот протекает по схеме: RH + O2 > ROOH.
К продуктам перекисного окисления ненасыщенных жирных кислот относят гидроперекиси липидов, альдегиды, малоновый диальдегид, другие диальдегиды, кетоны, спирты, эпоксиды. Физиологической функцией перекисного окисления является регуляция обновления, распада ненасыщенных структурных липидов, проницаемости липидов биологических мембран (Е. А. Строев, 1985). По мнению автора, активатором перекисного окисления липидов служат свободнорадикальные формы кислорода, образующиеся при одноэлектронном восстановлении его по схеме:
Кислородные радикалы (супероксидный, гидроксильный, пероксидный), обладая высокой реакционной способностью, ускоряют процесс перекисного окисления ненасыщенных жирных кислот. Активные атомы водорода ненасыщенных жирных кислот для вступления в реакцию, по мнению А. Хорста, нуждаются лишь в минимальных количествах энергии. Это окисление активирует радикальные формы кислорода, ионы металлов и, наоборот, тормозит витамин Е (токоферол), связывая пероксид и ОН-радикал. В присутствии оксидантов (даже небольшого количества) водород переходит к окислителю, что вызывает цепочку реакций, изменяющих структуру и функцию мембран. У насыщенных жирных кислот энергия разрыва С-Н-связи составляет около 381,3 кДж/моль, у ненасыщенных жирных кислот по месту двойной связи она равна 364,9 кДж/моль, т.е. значительно меньше (П. Г. Богач и соавт., 1981). Наименьшую энергию связи имеет водород, который находится в a-положении по отношению к двойной связи, 315,7 кДж/моль. Активные формы кислорода способны отнимать водород из групп СН2 ненасыщенной жирной кислоты, превращая их в свободнорадикальные группы НС– (А. Я. Николаев, 1989). Радикал жирной кислоты легко присоединяет молекулу кислорода и превращается в перекисный радикал жирной кислоты: HC•+O2 > HC–O–O–. Перекисный радикал может отнимать водород от другой молекулы жирной кислоты и восстанавливаться в гидроперекись (за счет окисления этой другой молекулы жирной кислоты в свободный радикал): HC–O-O•+CH2 > HC–O–OH+HC•.
Образовавшийся второй радикал аналогично вступает в реакцию и возникает цепная химическая реакция, которая продолжается уже без инициирующих веществ. Катализировать окислительный процесс может двухвалентное железо: Fe2+ + O2 + H+ > Fe3+ + HO2–. Затем радикал НО2– вступает в реакцию с жирной кислотой: RH + НО2– Н2О2 + R–, в дальнейшем образовавшийся радикал соединяется с молекулой кислорода О2 и образуется перекисный радикал RO2–. Он также может взаимодействовать с нейтральными молекулами жирных кислот и т.д. Перекиси (пероксиды) нестабильны и распадаются с образованием альдегидов в результате разрывов в жирной кислоте углерод-углеродной связи, которая соседствует с перекисной группой. Подобным образом могут окисляться не только ненасыщенные жирные кислоты в фосфолипидах мембран, но и свободные ненасыщенные жирные кислоты, остатки ненасыщенных жирных кислот. В тканях животных основное количество перекисей липидов составляют продукты, полученные из полиненасыщенных β-ацильных остатков эндогенных мембранных фосфатидилэтаноламинов и фосфатидилхолинов.
Однако имеются и иные взгляды на проблему окисления ненасыщенных жирных кислот. Л. С. Страйер (1984) считает, что образованный ковалентными связями скелет биомолекул стабилен в отсутствие ферментов или притока энергии. Для диссоциации углерод-углеродной связи (С-С) необходимо 83 ккал/моль, в то время как содержание энергии, запасенной в молекулах АТФ, составляет лишь 12 ккал/моль. Разрыв С-С связей под действием радикалов кислорода in vivo представляется маловероятным. А. Ленинджер считает, что самоокисление липидов в организме полностью заторможено благодаря наличию витамина Е, различных ферментов и аскорбиновой кислоты.
Ненасыщенные жирные кислоты, как и насыщенные, подвергаются β-окислению (А. Ленинджер,1985). Положение и число двойных связей в молекулах ненасыщенных жирных кислот определяют особенности их окисления. НЖК окисляются как насыщенные до места двойной связи. Если двойная связь имеет трансконфигурацию и расположение, как в еноил-КоА, образующемся при окислении насыщенных жирных кислот, то дальше окисление идет обычным путем (Е. А. Строев, 1986). При отсутствии этого условия вступает в действие дополнительный фермент, перемещающий двойную связь и меняющий цис- в трансконфигурацию. Двойная связь может восстанавливаться НАДФ•Н2 (Я. Кольман, К. Г. Рем, 2000). Е. А. Строев (1986) отмечает, что скорость окисления ненасыщенных жирных кислот очень высока: олеиновой кислоты в 11 раз, линолевой в 114, линоленовой в 170, арахидоновой в 200 раз выше, чем стеариновой. В исследованиях с олеиновой кислотой, меченной дейтерием, было установлено, что она может редуцироваться, превращаясь в стеариновую, а последняя подвергается β-окислению (И. В. Савицкий, 1973,1982). Такой путь допускали и для других ненасыщенных жирных кислот. Однако, по мнению И. В. Савицкого (1973, 1982), их окисление происходит иначе. На первом этапе под действием липоксигеназы происходит дегидрирование (отщепление) одного атома водорода и жирная кислота превращается на свободный радикал. Липоксигеназы широко представлены в тканях животных и обнаружены в микросомальной фракции гомогенатов клеток. Они катализируют реакции переокисления жирных кислот, которые различаются расположением окисляемого кислородом атома углерода. (В микросомальных мембранах образование перекисей катализирует диоксигеназа фосфолипидов, зависящая от НАДФ-Н2. Для образования перекисей липидов необходимо участие негеминового железа, которое в дальнейшем восстанавливается в микросомальной электронно-транспортной цепи). Образование под влиянием липоксигеназы свободного радикала обусловливает перестройку всей молекулы жирной кислоты. В результате этого превращения двойные связи из изолированных становятся сопряженными (приближаются одна к одной), а кислота с сопряженными двойными связями при наличии кислорода, по мнению автора, окисляется с образованием гидроперекиси и цикличной перекиси. Перекиси и гидроперекиси разлагаются до отдельных фрагментов жирного альдегида (к примеру, капронового), малонового диальдегида, полуальдегида дикарбоновой кислоты (И. В. Савицкий ). При этом имеется прямая зависимость количества образовавшегося малонового диальдегида от количества двойных связей в молекуле ненасыщенной жирной кислоты: линолевая образует одну молекулу малонового диальдегида, линоленовая две, арахидоновая три, клупанодоновая четыре. В качестве примера можно привести окисление линолевой кислоты: она последовательно превращается в свободный радикал линолевой кислоты, затем в ненасыщенную кислоту с двойными сопряженными связями, дальше в гидроперекись и циклическую перекись линолевой кислоты, которые разлагаются на капроновый альдегид, малоновый диальдегид и полуальдегид азелаиновой кислоты. Последние три продукта расщепления претерпевают дальнейшее окисление: образуются капроновая, азелаиновая и малоновая кислоты. Капроновая кислота после превращения в капронилкоэнзим А подвергается β-окислению. Азелаиновая кислота также включается в β-окисление, а малоновая после декарбоксилирования превращается в уксусную кислоту. Таким образом, линолевая кислота превращается в остатки уксусной кислоты, которые затем в цикле Кребса окисляются до СО2 и Н2О. Аналогичным образом (но с другими промежуточными продуктами) окисляются и другие ненасыщенные жирные кислоты: при окислении линоленовой кислоты образуется пропионовая, азелаиновая и две молекулы малоновой кислоты, при окислении арахидоновой капроновая, глютаровая и три молекулы малоновой кислоты. Путем многостадийного процесса линолевая кислота может сначала превратиться в арахидоновую, которая затем подвергается окислению. Таким образом, в данном случае ненасыщенные жирные кислоты подвергаются β-окислению, но это наступает на более поздних этапах после их предварительной фрагментации и образования альдегидов с короткой углеродной цепью. Однако следует напомнить, что приведенная выше в качестве примера окисления линолевая кислота используется для синтеза арахидоновой кислоты и в фосфолипидах тканей содержится лишь в следовых количествах. Продукты превращения линолевой и линоленовой кислот представлены в таблице 2.
Омега-3 жирные кислоты эйкозапентаеновая и докозагексаеновая оказывают выраженное антиатеросклеротическое, вазодилататорное, антитромботическое действие, улучшают реологию крови. Арахидоновая кислота (эйкозатетраеновая), входящая в состав фосфолипидов плазматических мембран, является предшественником эйкозаноидов медиаторов (локальных гормонов), сигнальных веществ, которые образуются почти во всех клетках организма и имеют небольшую дальность действия (Я. Кольман, К. Г. Рем, 2000). К эйкозаноидам относят первичные (классические) простагландины, простациклины, тромбоксаны, лейкотриены, метаболиты простагландинов, гидроперекиси (рис.). Наиболее изучены производные арахидоновой кислоты. В результате ее превращения образуются простагландины Е2, F22, простациклин I2, тромбоксан А2. Эйкозаноиды образуются и из других ненасыщенных жирных кислот эйкозатриеновой, эйкозапентаеновой (т.е. из С20 полиеновых жирных кислот). Продукты превращения различных жирных кислот отличаются своими свойствами. Биосинтез эйкозаноидов начинается с гидролиза фосфолипидов плазматической мембраны под действием фосфолипазы А2, активность которой контролируется гормонами, другими биорегуляторами, сопряженными с G-белками (активность фосфолипазы А2 повышается и под воздействием липоперекисей). Авторы отмечают два главных пути биосинтеза эйкозаноидов. Инициатором первого пути является простагландин-синтаза (имеет свойства циклооксигеназы и пероксидазы), катализирующая превращение арахидоновой кислоты в циклические эндоперекиси. В результате последующих реакций, катализируемых другими ферментами, образуются простагландины, простациклины и тромбоксаны. Этот путь (циклооксигеназный) блокируют ацетилсалициловая кислота и нестероидные противовоспалительные препараты (в настоящее время различают циклооксигеназы-1 и 2). Их антитромбогенный эффект обусловлен торможением образования тромбоксана и агрегации тромбоцитов. Инициатором второго пути биосинтеза эйкозаноидов является упоминавшаяся выше липоксигеназа (блокирующее действие оказывают витамин Е, рутин). При участии липоксигеназы все полиеновые (полиненасыщенные) жирные кислоты окисляются с образованием гидроперокси- и гидроксипроизводных жирных кислот. В дальнейшем за счет дегидратации, различных реакций переноса из них образуются лейкотриены. Детальные механизмы биосинтеза эйкозаноидов и пути их окисления до конечных продуктов не выяснены. Как отмечают Я. Кольман и К. Г. Рем (2000), эйкозаноиды служат вторичными мессенджерами гидрофильных гормонов, контролируют сокращение гладкомышечных тканей сосудов, бронхов, матки, принимают участие в высвобождении продуктов внутриклеточного синтеза (гормонов, соляной кислоты, мукоидов), влияют на метаболизм костной ткани, периферическую нервную систему, иммунную систему, передвижение и агрегацию лейкоцитов и тромбоцитов (свертывание крови), являются эффективными лигандами болевых рецепторов. Эйкозаноиды быстро разрушаются (инактивируются в течение нескольких секунд в результате восстановления двойных связей и окисления гидроксигрупп), поэтому действуют как локальные биорегуляторы путем связывания с близко расположенными мембранными рецепторами своей клетки (аутокринное действие) или соседних клеток (паракринное действие). Их действие может быть опосредовано через цАМФ и цГМФ. Особое внимание исследователи уделяют в настоящее время метаболизму арахидоновой кислоты в тромбоцитах и эндотелии. Под действием циклооксигеназы в тромбоцитах образуются циклические эндоперекиси, простагландины, которые под действием тромбоксансинтетазы (содержится в микросомальной фракции тромбоцитов) превращаются в тромбоксан А2 (ТхА2) с периодом полураспада 30 секунд (А. Хорст, 1982). Тромбоксан А2 вызывает агрегацию тромбоцитов, тромбообразование, сужение сосудов, боль, отек. Находящаяся в эндотелии сосудов простациклинсинтетаза превращает эндоперекиси в простациклин ПГI2, который обладает противоположными по отношению к тромбоксану А2 свойствами: подавляет агрегацию тромбоцитов, расширяет сосуды. При повреждении эндотелия выработка в нем простациклинсинтетазы нарушается и преимущественно образуется тромбоксан А2, вызывающий изменения, необходимые для восстановления эндотелия: агрегацию тромбоцитов, тромбоз, спазм сосудов. В данном случае выбор пути метаболизма, очевидно, связан с состоянием эндотелия сосудов. Как отмечает А. Хорст (1982), при метаболизме эндоперекисей образуются свободные радикалы. Освобождаемые при ферментном окислении арахидоновой кислоты свободные радикалы гидрокси-типа, по его мнению, могут быть дополнительными факторами воспаления. В частности, гидроперокси PGE2 образуют свободные радикалы с центральным атомом кислорода.
Имеется функциональная связь между обменом незаменимых полиненасыщенных жирных кислот (линолевой, линоленовой и арахидоновой) и функционированием костной ткани. При отсутствии незаменимых жирных кислот в пищевом рационе экспериментальных животных замедляется их рост, нарушается работа почек. Образующиеся из НЖК простагландины оказывают влияние на метаболизм костной ткани, воспаление, кровообращение, транспорт ионов через мембраны. Простагландины принимают участие в ремоделировании костной ткани. Так ПГЕ2 влияет на формирование и активность остеокластов, процессы резорбции костной ткани. В частности усиление костной резорбции при иммобилизации, воспалении, злокачественных процессах объясняют действием простагландинов. Влияние ПГЕ2 на костное формирование зависит от концентрации: в концентрации 10–9-10–7 ммоль/л он увеличивает синтез коллагена остеобластами, при концентрации 10–6 ммоль/л замедляет. ПГЕ1 ускоряет выход кальция из кости (А. Уайт и соавт., 1981). Как и паратгормон, ПГЕ1 стимулирует высвобождение из клеток костной ткани лизосомальных ферментов. Ацетилсалициловая кислота, ингибируя биосинтез простагландинов, снимает эти эффекты. Усилению костной резорбции способствуют, образующиеся в процессе окисления липидов, свободные радикалы: они участвуют в активации остеокластов.
Выделяют и третий путь метаболизма арахидоновой кислоты (В. Г. Денисюк и соавт., 1992). Под действием фосфолипазы А2 от молекулы арахидоновой кислоты отщепляется плазменилхолин и образуется предшественник фактора агрегации тромбоцитов (ФАТ) лизоплазменилхолин (лизо-ФАТ, лизофосфатидилхолин). Лизоплазменилхолин подвергается ацетилированию под влиянием ацетилтрансферазы и образуется ФАТ, вызывающий вазоконстрикцию, индуцирующий агрегацию тромбоцитов. Одновременно с увеличением содержания в крови ФАТ активизируется липоксигеназный путь метаболизма арахидоновой кислоты (увеличивается концентрация 5-НЕТЕ–5-гидроокись эйкозапентаеновой кислоты) и синтез лейкотриенов.
Продукты переокисления ненасыщенных жирных кислот легко обнаруживаются in vitro (Н. Е. Кучеренко, А. Н. Васильев, 1985). По мнению авторов in vivo их обнаружить сложно из-за незначительной концентрации, а также нейтрализации антиоксидантами. Кроме того, они включаются в β-окисление, цикл Кребса, а также из них образуются чрезвычайно не стабильные эйкозаноиды. Промежуточные гидроперекиси очень не стабильны и in vitro (Н. А. Тюкавкина, Ю. И. Бауков, 1991) и уже при комнатной температуре распадаются с образованием альдегидов, которые окисляются в конечные продукты реакции кислоты (образуется четыре моно- и дикарбоновые кислоты с короткими углеродными цепями).
Как отмечает А. Лабори (1970), на липидные молекулы окисление действует своеобразно: размещение в пространстве длинных молекул жирных кислот тесно связано с восстановленным или окисленным состоянием связей между различными атомами углерода, с изгибами по месту двойных связей. И окисление молекулы жирной кислоты не ограничивается потерей молекулы водорода, а сопровождается пространственной перестройкой молекулы. Так как молекула находится в мембране, изменяется ее проницаемость.
Резюмируя изложенную информацию, следует отметить, что имеется несколько путей окисления ненасыщенных жирных кислот. К ним относятся следующие.
- β-Окисление, при этом вклад ненасыщенных жирных кислот в энергетические процессы незначителен.
- Перекисное окисление, инициированное активными формами кислорода, (АФК) металлами с переменной валентностью, т.е. неферментативное. Параметры этого процесса не установлены. А. Ленинджер указывает на возможность повреждения молекул ненасыщенных жирных кислот активными формами кислорода, однако в его работах, как и монографиях других всемирно известных биохимиков, отсутствуют данные о перекисном окислении липидов, инициированном АФК, как системном биологическом явлении, о механизмах перекисного окисления липидов. С другой стороны, наличие нормального (фонового) уровня в организме продуктов окисления ненасыщенных жирных кислот (гидроперекисей, диеновых конъюгатов, малонового диальдегида) показывает, что перекисное окисление липидов не может быть случайным, цепным, хаотичным патологическим процессом (тогда он не может и не должен характеризоваться нормой). Если процесс представлен нормой, то возникает вопрос о его физиологической роли в организме. Следует отметить также, что показатель малонового диальдегида не может характеризовать выраженность перекисного окисления липидов, инициированного АФК, ионами металлов с переменной валентностью, так как он образуется и в результате ферментативного перекисного окисления липидов инициированного липоксигеназами (И. В. Савицкий, 1973, 1982).
Метаболический путь продуктов переокисления липидов не прослежен. Накопление продуктов переокисления липидов обнаруживается in vitro. In vivo продукты расщепления ненасыщенных жирных кислот включаются в конечном итоге в энергетические процессы, как это было показано И.В. Савицким, из них образуются «короткоживущие» эйкозаноиды.
- Ферментативное перекисное окисление липидов, осуществляемое с участием липооксигеназ (диоксигеназ в микросомальной сети) при наличии кислорода. Оно описано И.В Савицким (1973, 1982) и достаточно детально представлено выше.
- Окисление арахидоной (эйкозатетраеновой), дигомо-гамма-линолевой (эйкозатриеновой), эйкозапентаеновой кислот (т.е. С20-полиеновых жирных кислот) под влиянием циклооксигеназ, липооксигеназ с образованием эйкозаноидов. Линолевая, линоленовая, арахидоновые кислоты при участии липооксигеназ окисляются до гидроперекисей и гидроксипроизводных жирных кислот, из которых образуются лейкотриены.
Физиологическая роль перекисного окисления НЖК
Представленная выше информация позволяет сделать ряд важных выводов. Прежде всего, необходимо подчеркнуть, что переокисление ненасыщеных жирных кислот в мембранах, благодаря включению продуктов их распада в процесс β-окисления, сопряжено с окислительным фосфорилированием, энергетическими клеточными процессами: продукты распада НЖК в конечном итоге окисляются в цикле Кребса до СО2 и воды. Хотя в целом, как мы отметили выше, вклад ненасыщенных жирных кислот в энергетические процессы незначительный. Окисление ненасыщеных жирных кислот контролируется ферментами. Тот факт, что в организме имеется нормальный физиологический уровень (фоновый) малонового диальдегида (МДА), диеновых конъюгатов (ДК), других продуктов перекисного окисления липидов, свидетельствует о существовании строгого контроля за окислением липидов со стороны всей иерархической системы регуляции и в первую очередь ДНК. Последняя осуществляет контроль за метаболизмом посредством синтеза ферментов и клеточных белков, поэтому утверждение о существовании в клетках неконтролируемых свободнорадикальных реакций в больших масштабах не обосновано. Повреждение активными формами кислорода молекул ненасыщенных жирных кислот фосфолипидов мембран, по мнению А. Ленинджера и других исследователей, возможно, но имеет ограниченное место, т.к. АФК нейтрализуются ферментами, биоантиоксидантами (прежде всего витамином Е и С). Следует отметить, что лишь незначительная часть кислорода (1-3%) используется в свободнорадикальных реакциях, т.е. параметры этого процесса весьма ограничены. Образование перекисей липидов в различных тканях животных является нормальным процессом и осуществляется под контролем ферментов. Специфическое окисление ненасыщенных жирных кислот происходит в липоксигеназной реакции, в эндоплазматической сети его катализирует НАДФ•Н2-зависимая диоксигеназа. Образованные перекиси также подвергаются ферментативной деградации. При участии липоксигеназы все полиеновые кислоты (линолевая, линоленовая, арахидоновая) окисляются до гидроперекисей, гидроксипроизводных жирных кислот, из которых в результате последовательных реакций образуются лейкотриены. Арахидоновая кислота при участии простагландинсинтазы (циклооксигеназа + пероксидаза) превращается в ее метаболиты простагландины, простациклины, тромбоксаны, лейкотриены, т.е. локальные гормоны, обладающие чрезвычайно важной разносторонней физиологической активностью.
Ткани интактных животных имеют определенный, разный для каждого органа, физиологический уровень содержания перекисей липидов (Ю. П. Козлов, 1985; Н. Е. Кучеренко, А. Н. Васильев, 1985). При этом уровень содержания перекисей липидов выше в тканях с высокой метаболической активностью. При различных физиологических состояниях содержание перекисных продуктов в фосфолипидах изменяется. Приведенные П. Г. Богач и соавт. (1981) данные свидетельствуют об увеличении интенсивности переокисления липидов в различных органах животных при дыхании кислородом, физической нагрузке (плавании), раздражении нервов, сокращении мышц. Таким образом, процессы окисления липидов (с образованием перекисей) являются важными для нормального функционирования биологических мембран и организма в целом. Физиологическая роль этих реакций состоит в регуляции обновления и проницаемости липидов биологических мембран, образовании эйкозаноидов медиаторов (локальных гормонов) или сигнальных веществ, играющих важную биологическую роль в организме. Такие важнейшие мембранные процессы, как перенос электронов в дыхательной цепи, окислительное фосфорилирование, метилирование и гидроксилирование ряда субстратов эндогенного и экзогенного происхождения ферментными системами эндоплазматической сети и даже деление клеток, сопровождаются изменениями интенсивности течения процессов переокисления липидов (П. Г. Богач и соавт., 1981). Липоперекиси являются нормальными и необходимыми продуктами не только при биосинтезе простагландинов, простациклинов, тромбоксанов, но и прогестерона, они участвуют в гидроксилировании стирольного кольца холестерина. Свободные радикалы участвуют во многих биохимических процессах, без их образования в нейтрофилах и макрофагах организм погибает в результате нарушения обезвреживания микробов.
Регуляция процессов перекисного окисления НЖК
Выделяют (Н. Е. Кучеренко, А. Н. Васильев, 1985) целый ряд механизмов регуляции перекисного окисления липидов:
- Строгую структурную организацию липидных компонентов мембран: она влияет на количество промежуточных продуктов, скорость перекисного окисления липидов («разрыхление» мембран ведет к его усилению). Состав фосфолипидов мембран определяет количество, качество образующихся перекисей, перекисных радикалов.
- Нормальное функционирование ферментов, обеспечивающих инактивацию активных форм кислорода, свободных радикалов, и ферментов обмена фосфолипидов мембран. Процесс переокисления липидов зависит от степени ненасыщенности ацильных остатков жирных кислот: она оказывает определяющее влияние на количество гидроперекисей, их устойчивость к действию ферментов метаболизирующих гидроперекиси глутатионлипопероксидазы, пероксидазы, каталазы.
- Достаточное содержание биоантиоксидантов в клетке, организме.
Для уровня течения перекисного окисления НЖК большое значение имеют концентрация кислорода в тканях (при его низком уровне интенсивность переокисления снижается, как и других окислительных процессов, высоком усиливается), ферментные и неферментные системы, восстанавливающие перекиси (глутатионпероксидаза, глутатионредуктаза, супероксиддисмутаза, каталаза, пероксидаза, др.). Несколько механизмов регуляции действуют одновременно. С продуктами переокисления в клетке реагируют биоантиоксиданты: токоферолы, убихиноны, витамин К, аскорбиновая кислота. Они снижают активность перекисного окисления липидов. Антиоксидантными свойствами обладают восстановленные фенольные формы этих соединений: их свободные гидроксильные группы взаимодействуют с перекисными радикалами.
На наш взгляд, при анализе механизмов регуляции перекисного окисления ненасыщенных жирных кислот следует учитывать его взаимосвязь с энергетическими внутриклеточными процессами, а также функционированием пентозного цикла. Как это показал И.В. Савицкий, остатки (фрагменты) ненасыщенных жирных кислот, образующихся в процессе переокисления, включаются в конечном итоге в цикл Кребса и «сгорают» до СО2 и воды. Таким образом, их количество в клетке напрямую зависит от функционирования гликолиза, цикла Кребса, окислительно-восстановительной цепи. Имеется сопряженность между энергетическими процессами (окислительным фосфорилированием) в клетке и окислением ненасыщеных жирных кислот. Например, изменение концентрации свободных радикалов при злокачественном перерождении фибробластов в условиях воздействия аденовирусов коррелирует с активностью гликолитической цепи (Н. И. Кучеренко, А. Н. Васильев, 1985). В случае снижения интенсивности процессов окислительного фосфорилирования следует ожидать некоторое уменьшение активности процессов перекисного окисления липидов: уменьшение движения потока электронов по окислительно-восстановительной цепи митохондрий приведет к уменьшению образования активных форм кислорода, а затем к снижению интенсивности процесса переокисления. С другой стороны чрезвычайно важное регулирующее значение для уровня перекисного окисления липидов имеет функционирование пентозного цикла, в котором происходит восстановление НАДФ и окисленного глутатиона. Эти две молекулы, по мнению А. Лабори (1970), являются клеточным запасом водорода, необходимым для восстановления перекисей липидов, ликвидации свободных радикалов. Сульфгидрильные соединения (глутатион, цистеин, метионин, белки, содержащие сульфгидрильные группы), связывая радикалы и разлагая перекиси, снижают количество радикалов в организме. Защитное действие метиленового синего, цистамина, окисленного глутатиона при повышенном давлении О2, ионизирующем влиянии, по мнению А. Лабори, не связано с восстанавливающим действием. Наоборот, метиленовый синий, витамины Е, К могут окислять НАД•Н2, принимая электрон. Окисление, лимитированное НАДФ•Н2, направляет Г-6-Ф в сторону пентозного пути, а последний ведет к восстановлению НАДФ и вторично окисленного глутатиона. Физиологическим восстановителем НАДФ и окисленного глутатиона также является аскорбиновая кислота. Таким образом, в защите против агентов, образующих свободные радикалы и перекиси липидов, важнейшее значение имеет активность пентозного цикла. Ткани, в которых имеется активный пентозный цикл (слизистая оболочка, мышцы тонкого кишечника, яички), высокое содержание НАДФ, окисленного глутатиона, содержат очень мало перекисей.
И, наконец, перекисное окисление НЖК контролируется ДНК путем синтеза ферментов (липоксигеназы, диоксигеназы, глутатионпероксидазы, глутатионредуктазы, пероксидазы, каталазы, супероксиддисмутазы), клеточных белков (глутатиона). Таким образом, процесс перекисного окисления липидов (ненасыщенных жирных кислот) в организме не хаотичный, а контролируемый, имеющий исходный фоновый уровень.
Биологические эффекты продуктов переокисления НЖК
Переокисление ненасыщеных жирных кислот фосфолипидов мембран, значительное увеличение содержания продуктов этого окисления, по мнению П. Г. Богача и соавт. (1981), Н. Е. Кучеренко, А. Н. Васильева (1985), А. Лабори (1970), могут привести к целому ряду отрицательных эффектов, большинство из которых наблюдались in vitro. К этим эффектам относят конформацию липидов и белков, изменение структуры и функции мембран, повышение их проницаемости, нарушение активности мембранно-связанных ферментов. Сведения о свободнорадикальных процессах, полученные в эксперименте (in vitro), нельзя полностью экстраполировать на организм человека, хотя такие исследования помогают прояснить их сущность. Очевидно, что in vivo наиболее серьезные изменения в мембранах наступают в следующих случаях: при влиянии ионизирующей радиации, интенсивном ультрафиолетовом облучении, воздействии токсических веществ, обезвреживание которых совершается в эндоплазматической сети с участием специализированной ферментной системы переноса электронов цитохрома Р-450, НАДФ•Н2; гипербарической оксигенации (гипероксии), интоксикации озоном. При перечисленных воздействиях подтвержден подобный характер изменений и показана эффективность антиоксидантной терапии. Как показывают результаты наших исследований (В.К. Казимирко и соавт., 2004) и анализ литературы, абсолютное большинство заболеваний (прежде всего в острый период и в период обострения) сопровождается интенсификацией окисления НЖК и развитием выраженной в различной степени антиоксидантной недостаточности. Возникающий дефицит биоантиоксидантов требует проведения соответствующей коррекции.
Таким образом, важная роль НЖК в организме определяется, прежде всего, биологическими эффектами специфического для них перекисного окисления и высокой физиологической активностью образующихся эйкозаноидов.
Литература
- Богач П.Г., Курский МД., Кучеренко Н.Е., Рыбальченко В.К. Структура и функция биологических мембран. Вища шк., Киев, 1981, 336 с.
- Казимирко В.К., Мальцев В.И., Бутылин В.Ю., Горобец Н.И. Свободнорадикальное окисление и антиоксидантная терапия. Морион, Киев, 2004, 160 с.
- Козлов Ю.П. Свободнорадикальное окисление липидов в биомембранах в норме и патологии. Биоантиокислители. Наука, Москва, 1985, С.4-5.
- Кольман Я., Рем К.Г. Наглядная биохимия: Пер. с нем. Мир, Москва, 2000, 469 с.
- Кучеренко Н.Е., Васильев А.Н. Липиды. Вища шк., 1985, 247 с.
- Лабори А. Регуляция обменных процессов: Пер. с франц. Медицина, Москва, 1970, 384 с.
- Ленинджер А. Основы биохимии: В 3-х томах. Т.2. Мир, Москва, 1985, 368 с.
- Николаев А.Я. Биологическая химия. Высш.шк., Москва, 1989, 495 с.
- Савицкий И.В. Биологическая химия. Вища шк., Киев, 1982, 472 с.
- Страер Л.С. Биохимия: Пер. с англ. В 3-х томах. Т.1. Мир, Москва,1984, 1232 с.
- Строев Е.А. Биологическая химия. Высш.шк., Москва, 1986, 479 с.
- Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. 2-е изд. Медицина, Москва, 1991, 528 с.
- Уайт Л., Хендлер Ф., Смит Э., Хилл Р., Леман И. Основы биохимии: в 3-х томах. Т.2. Мир, Москва, 1981, 617 с.
- Хорст А. Молекулярные основы патогенеза болезней: Пер. с польск. Медицина, Москва, 1982, 456 с.
СТАТТІ ЗА ТЕМОЮ
30.07.2021 Ревматологія Такий різний остеопороз: як правильно підібрати лікування?Існує думка, що остеопороз є добре вивченим захворюванням, яке має чіткий характер і прогнозований перебіг. Та чи це дійсно так? Важливі питання діагностики й терапії остеопорозу були розглянуті цьогоріч навесні в межах визначних медичних заходів. Пропонуємо до вашої уваги огляд доповідей провідних вітчизняних фахівців….
30.07.2021 Кардіологія Відновлення ритму в пацієнта з фібриляцією передсердь в амбулаторних умовахЦьогоріч у травні відбулася ХІ Науково-практична конференція Всеукраїнської Асоціації аритмологів України в онлайн-форматі. У межах заходу були розглянуті проблеми порушень ритму та провідності серця на тлі коморбідних станів, які є надзвичайно актуальними у рутинній практиці кардіологів, електрофізіологів, лікарів суміжних спеціальностей тощо….
30.07.2021 Кардіологія Артеріальна гіпертензія: коморбідність і супутні захворюванняАртеріальна гіпертензія (АГ) останнім часом набула характеру епідемії та є найпоширенішим захворюванням серцево-судинної (СС) системи серед дорослого населення у світі. Це зумовило розробку програми профілактики й лікування цієї недуги в Україні. Нещодавно відбулася онлайн-конференція за темою «Артеріальна гіпертензія – коморбідність і супутні захворювання», на якій було розглянуто важливі моменти щодо факторів, які спричиняють підвищення артеріального тиску (АТ), та оптимальних підходів до терапії. …
30.07.2021 Кардіологія Консиліум при коморбідних станах: пацієнт із дилатаційною кардіоміопатієюДилатаційна кардіоміопатія (ДКМП) – захворювання серцевого м’яза, що характеризується збільшенням і розширенням одного чи обох шлуночків разом із порушенням скоротливої здатності міокарда, яка визначається як фракція викиду (ФВ) лівого шлуночка (ЛШ) ˂40%. Надалі можливими є порушення провідної системи, розвиток шлуночкових аритмій, тромбоемболії та серцевої недостатності (СН). Тому що раніше пацієнти будуть виявлені й розпочнуть терапію, тим кращим буде прогноз. …
§ 5. Триацилглицерины и жирные кислоты
§ 5. ТРИАЦИЛГЛИЦЕРИНЫ И ЖИРНЫЕ КИСЛОТЫ
Триацилглицерины – самые распространенные липиды в природе. Их принято делить на жиры и масла. Жиры при комнатной температуре находятся в твердом состоянии. При нагревании они плавятся и переходят в жидкое состояние. Масла же при комнатной температуре имеют жидкую консистенцию. Жиры и масла не растворяются в воде. При интенсивном перемешивании с водой они образуют эмульсии.
В современных развитых странах на долю жиров в рационе питания людей приходится до 45 % суммарного потребления энергии. Столь большая доля жиров при ограниченном движении нежелательна. Причиной многих все шире распространяющихся болезней, в первую очередь болезней сердечно-сосудистой системы, является избыточное содержание жиров в пище. В то же время во многих развивающихся странах, наоборот, жиров в пище недостаточно, в суммарном потреблении энергии на их долю приходится не более 10 %.
Триацилглицерины играют важную роль в организме животного или растения. Так, например, на долю триацилглицеринов в человеческом организме приходится около 10 % массы тела (рис 4).
Рис. 4. Химический состав человеческого тела.
Жиры являются наиболее эффективным средством запасания энергии, так как обладают особыми преимуществами перед другими соединениями. Они не растворяются в воде, поэтому не меняют существенно физико-химические свойства цитоплазмы; кроме того, они химически инертны. И самое главное, их энергоемкость значительно выше энергоемкости других веществ, например, углеводов и белков. Ограниченное количество энергии может запасаться и в виде углеводов (гликоген), но основная избыточная энергия, поступающая в организм, запасается главным образом в виде жиров. Практически все пищевые продукты содержат жиры, хотя их содержание колеблется в широких пределах (табл. 1).
Таблица 1
Среднее содержание жиров в некоторых пищевых продукта.
|
Пищевой продукт |
Масса жира в 100 гпищевого продукта, г |
Пищевой продукт |
Масса жира в 100 гпищевого продукта, г |
|
Молоко Сыр Яйца Цыплята Сливочное масло |
3,8 25 – 45 10,9 17,7 82,0 |
Подсолнечное масло Картофель Жареный арахис Белый хлеб |
99,9 0 49,0 1,7 |
Триацилглицерины
Триацилглицерины (жиры и жирные масла природного происхождения) представляют собой сложные эфиры, образованные глицерином и жирными кислотами. Жирные кислоты – это общее название одноосновных алифитических карбоновых кислот RCOOH. При гидролизе триацилглицеринов образуются глицерин и жирные кислоты:
В состав триацилглицерина могут входить остатки как одной и той же кислоты – такие жиры называются простыми, – так и разных (смешанные жиры). Жирные кислоты в зависимости от строения радикала можно подразделить на насыщенные, ненасыщенные, а также разветвленные и циклические.
Насыщенные жирные кислоты имеют общую формулу CH3(CH2)nCOOH, в которой n может изменяться от 2 до 20 и несколько выше. В качестве примера короткоцепочечной кислоты можно привести масляную кислоту CH3(CH2)2COOH, которая содержится в молочном жире и сливочном масле. Примерами длинноцепочечных кислот являются пальмитиновая CH3(CH2)14COOH и стеариновая CH3(CH2)16COOH. Они входят в состав триацилглицеринов почти всех жиров и масел животного и растительного происхождения.
Ненасыщенные жирные кислоты содержат одну или несколько двойных связей в алифитической цепи, которая тоже может быть короткой либо длинной. Одной из наиболее распространенных кислот в живой природе является олеиновая кислота. Она содержится в оливковом масле, от которого и произошло ее название, а также в свином жире CH3(CH2)7CH=CH(CH2)7COOH. Двойная связь в олеиновой кислоте имеет цис-конфигурацию. В природе встречаются жирные кислоты и с большим числом двойных связей, например, линолевая (две двойные связи), линоленовая (три двойные связи), арахидоновая (четыре двойные связи).
Триацилглицерины, в состав которых входят жирные кислоты с короткими цепями либо с высокой степенью ненасыщенности, как правило, имеют более низкие температуры плавления. Поэтому при комнатной температуре они находятся в виде масел. Это свойственно триацилглицеринам растительного происхождения, которые содержат большую долю ненасыщенных кислот. В отличие от этого животные жиры характеризуются высоким содержанием насыщенных жирных кислот и являются, как правило, твердыми. В этом можно убедиться, сравнивая состав оливкового масла (растительное масло) и сливочного масла (животный жир) (табл.2).
Таблица 2.
Распределение жирных кислот в оливковом и сливочном маслах
|
Тип жирной кислоты |
Число атомов углерода |
Содержание жирной кислоты, % |
|
|
в оливковом масле |
в сливочном масле |
||
|
Насыщенные |
4 6 – 10 12 14 16 18 |
— — — следы 10 2 |
4 5 5 12 27 10 |
|
Итого 12 61 |
|||
|
Ненасыщенные |
16 18 |
— 84 |
5 28 |
|
Итого 84 33 |
|||
Интересно знать! В клетках теплокровных животных содержание ненасыщенных жирных кислот ниже, чем в клетках хладнокровных животных.
Маргарин представляет собой заменитель сливочного масла. Получают его гидрированием растительных масел над никелевым катализатором. Двойные связи, находящиеся в остатках ненасыщенных кислот, присоединяют водород. В результате ненасыщенные жирные кислоты превращаются в насыщенные. Меняя степень гидрирования, можно получать твердые и мягкие маргарины. Дополнительно в маргарин добавляют жирорастворимые витамины, а также специальные вещества, придающие маргарину цвет, запах, устойчивость.
Разветвленные и циклические жирные кислоты встречаются в природе редко. Примером циклических жирных кислот является хаульмугровая кислота, а разветвленных – туберкулостеариновая кислота:
Мыла
Мыла представляют собой натриевые или калиевые соли длинноцепочечных жирных кислот. Они образуются при кипячении животного сала или растительного масла с гидроксидом натрия или калия.
Этот процесс получил название омыления. Калиевое мыло является более мягким, часто жидким, по сравнению с натриевым.
Очищающее действие мыла обусловлено тем, что анионы мыла обладают сродством, как к жирным загрязнителям, так и воде. Анионная карбоксильная группа обладает сродством к воде, с молекулами которой она образует водородные связи, т.е. она гидрофильна. Углеводородная цепь за счет гидрофобных взаимодействий обладает сродством к жирным загрязнителям. Гидрофобный хвост молекулы мыла растворяется в капле грязи, оставляя на поверхности гидрофильную головку. Поверхность капли грязи начинает активно взаимодействовать с водой и в конечном итоге отрывается от волокна и переходит в водную фазу (рис 5).
Рис.5. Моющее действие мыла: 1 – углеводородные цепи анионов мыла растворяются в жирной грязи, 2 – микрокапелька грязи (мицелла), взвешенная в воде
Взаимодействуя с ионами кальция, которые содержатся в жесткой воде, мыла образуют нерастворимые в воде кальциевые соли:
В результате мыло выпадает в виде хлопьев и расходуется бесполезно.
В последние десятилетия широкое распространение получили синтетические моющие средства. В их молекулах часто вместо карбоксильной группы находится сульфогруппа R-SO3Na. Кальциевые соли сульфокислот растворимы в воде.
Интересно знать! Природные жирные кислоты имеют, как правило, неразветвленную цепь с четным числом атомов углерода. Синтетические моющие средства содержат разветвленные цепи, которые с большим трудом расщепляются бактериями. Это приводит к значительным загрязнениям природных водоемов, куда в конечном итоге попадают бытовые стоки. Другой проблемой стиральных порошков являлось до недавнего времени большое содержание в них (до 30 %) неорганических фосфатов. Фосфаты являются хорошей питательной средой для определенных водорослей. Поэтому попадание большого количества фосфатов в водоемы вызывает бурный рост этих водорослей, интенсивно поглощающих кислород, растворенный в воде. При недостатке кислорода происходит массовая гибель водных растений и животных с последующим их разложением. В итоге водоем заболачивается.
Прогоркание жиров
Жиры при хранении под действием света и кислорода приобретают неприятный запах и вкус. Этот процесс называется прогорканием. В результате его происходит окисление жиров. Легче всего окисляются непредельные жирные кислоты:
Образующиеся продукты обладают неприятным запахом и вкусом. Для предотвращения прогоркания жиры следует хранить в темноте без доступа кислорода и при низкой температуре.
Распад и синтез жиров в организме
Переваривание жиров начинается в желудке и продолжается в кишечнике. Для этого процесса необходимы желчные кислоты, при их участии происходит эмульгирование жиров. Эмульгированные жиры расщепляются липазами. Гидролиз жиров протекает в несколько стадий:
1 стадия
2 стадия
3 стадия
Гидролиз триацилглицеринов в первой и второй стадиях протекает быстро, а гидролиз моноацилглицеринов идет медленнее. В результате гидролиза образуется смесь, содержащая жирные кислоты, моно-, ди-, триацилглицерины, которые и всасываются эпителиальными клетками кишечника. В этих клетках происходит ресинтез липидов, которые затем поступают в другие ткани, где они откладываются в запас или подвергаются окислению. В результате окисления жиров образуется вода и оксид углерода (IV), а освободившаяся энергия накапливается в виде АТФ. При окислении1 гжира выделяется 39 кДж энергии.
Метаболическая кардиомиопатия | Руководство по кардиологии
(Е.Г. Несукай)
Определение
Метаболическая кардиомиопатия (ранее ее определяли как дистрофию миокарда, миокардиодистрофию) — невоспалительное поражение миокарда различной этиологии, в основе которого лежит нарушение обмена веществ, процесса образования энергии и/или нарушение ее превращения в механическую работу, приводящее к дистрофии миокарда и недостаточности сократительной и других функций сердца.
Этиология
Метаболическая кардиомиопатия развивается в результате воздействия патогенных факторов при различных заболеваниях и состояниях (схема 8.1).
Среди физических факторов могут рассматриваться радиация, вибрация, перегревание, переохлаждение, гиперинсоляция.
К химическим факторам относятся лекарственные средства, токсическое воздействие бытовых и промышленных ядов.
Патогенез
В возникновении и развитии метаболических поражений миокарда при разных заболеваниях существенное значение имеет нарушение иннервации, транспорта и утилизации энергии в кардиомиоцитах, то есть их энергообеспечение.
Напряжение регулирующих систем, функции миокарда и метаболических процессов в кардиомиоцитах ограничивает резервные возможности сердца. Длительная гиперфункция сама по себе, а особенно в неблагоприятных условиях на фоне основного заболевания, может привести к возникновению энергетического дефицита и нарушению приспособительных изменений в миокарде.
Механизмы снижения продукции энергии в поврежденном сердце включают снижение плотности капилляров, увеличение межкапиллярного расстояния, а также больший диаметр гипертрофированных кардиомиоцитов, что ухудшает диффузию кислорода и обусловливает возникновение гипоксии миокарда. Один из механизмов связан также с нарушением функции митохондрий, которое вызвано редуцированным синтезом окислительных энзимов вследствие нарушения пролиферативной реакции, которая частично опосредована экспрессией рецепторов PPARα, играющих ключевую роль в биогенезе митохондрий. Эти рецепторы регулируют транскрипцию многих энзимов и переносчиков (транспортеров), которые участвуют в транспорте и окислении жирных кислот. Также снижается способность сердца восстанавливать запасы макроэргических фосфатов. Уменьшение окисления жирных кислот вызывает накопление липидов и вносит вклад в некроз поврежденных мембран, при этом высвобождение реактивных молекул (цитохромов, радикалов кислорода) приводит к апоптозу. Ускоренный гликолиз, вызванный нарушением окислительного фосфорилирования, приводит к ацидозу, который ингибирует многие процессы, включенные в процесс сокращения — расслабления. Из последних наиболее важным является повышение концентрации кальция в цитозоле, который инициирует множество порочных кругов, приводящих к некрозу миоцитов.
В прогрессировании метаболической кардиомиопатии ведущую роль играет усиление реакций свободнорадикального перекисного окисления липидов клеточных мембран. Повреждая мембраны, гидроперекиси и свободные радикалы снижают активность липидозависимых ферментативных реакций (к которым относятся основные жизненно важные ферменты ионного транспорта и дыхательной цепи митохондрий), изменяют мембранорецепторные системы клетки с развитием медиаторного дисбаланса, активируют протеолитические и лизосомальные ферменты.
Патологическая анатомия
Метаболические поражения миокарда охватывают все стадии нарушения обмена сердечной мышцы — от функциональных расстройств до грубых структурных изменений. Морфологические изменения происходят внутри клеток миокарда и не сопровождаются увеличением их количества. Наиболее чувствительны к патогенным воздействиям митохондрии и эндоплазматическая сеть. Для дегенеративных изменений миокарда характерно мозаичное нарушение структуры кардиомиоцитов: в одной и той же клетке среди набухших митохондрий с частично или полностью разрушенными внутренними перегородками могут быть митохондрии с нормальным строением.
Как правило, устранение патогенной причины приводит к постепенной нормализации ультраструктур кардиомиоцита, что обусловлено внутриклеточными регенераторными процессами. Поврежденные миофибриллы восстанавливаются в результате активной деятельности рибосом: постепенно устраняется внутриклеточный отек, появляются зерна гликогена, уменьшается количество жировых включений. При длительном и интенсивном воздействии повреждающих факторов на миокард дистрофические изменения могут приводить к глубоким морфологическим изменениям, заканчивающимся развитием миокардиофиброза.
Гибель части миокарда восполняется увеличением массы специфических структур в неповрежденных клетках, происходит гиперплазия митохондрий, саркоплазматического ретикулума, рибосом. В результате развивается гипертрофия миокарда, представляющая собой компенсаторную регенераторно-гиперпластическую реакцию, характерную для миокарда. Биохимические процессы чаще нарушаются в ЛЖ.
Клиническая картина
Клинические проявления многообразны и не являются специфичными. Начальные стадии могут протекать бессимптомно, со временем снижение сократительной способности миокарда может привести к тяжелой СН.
Нередко на фоне проявлений основного заболевания отмечают кардиалгию (чаще в области верхушки сердца (92%), реже за грудиной (15%)), расширение границ сердца, приглушенность тонов, небольшой систолический шум на верхушке сердца, нарушения ритма (в основном экстрасистолическую аритмию).
Диагностика
ЭКГ является ведущим методом в распознавании дистрофических изменений в миокарде, которые касаются в основном процесса реполяризации и проявляются чаще всего изменениями конечной части желудочкового комплекса: отмечается депрессия сегмента ST, которая имеет восходящий характер к положительному зубцу Т. Зубец Т также может быть деформированным, низкоамплитудным, сглаженным или отрицательным.
Также может определяться снижение вольтажа комплекса QRS, особенно выраженное при ожирении и микседеме, при тиреотоксикозе амплитуда зубцов чаще увеличена. В некоторых случаях могут возникать замедление внутрипредсердной проводимости, увеличение интервала Q–T, нарушения внутрижелудочковой проводимости. Из нарушений ритма наиболее часто отмечают синусовую тахикардию и экстрасистолическую аритмию.
При формулировке диагноза следует прежде всего указать основное заболевание или этиологический фактор, характер течения кардиомиопатии и основные клинические проявления (наличие нарушений ритма и проводимости, стадию СН).
В дифференциальной диагностике метаболической кардиомиопатии могут иметь значение нагрузочные и медикаментозные пробы, в случае необходимости — проведение коронарографии.
Лечение
Независимо от повреждающего фактора принципиальными для метаболической кардиомиопатии могут быть следующие положения:
- нарушения метаболизма миокарда при своевременном лечении обратимы;
- выраженная СН развивается сравнительно редко, в основном в конечной стадии заболевания, но возникшая СН резистентна к сердечным гликозидам и успех терапии целиком зависит от степени восстановления нарушенного обмена веществ в миокарде.
Помощь больным следует начинать с устранения причины развития дистрофии миокарда. Немаловажное значение имеет отказ от курения и злоупотребления алкоголем, исключение физического и психоэмоционального перенапряжения.
Наряду с лечением основного заболевания необходимо восстановление адекватного энергетического обмена. На первый план выступает применение комплекса лекарственных средств, направленных на улучшение транспорта кислорода в ткани и его утилизации.
На обмен веществ в клетке могут оказывать влияние две группы лекарственных средств: регуляторы экстрацеллюлярной природы (гормональные препараты, блокаторы и стимуляторы центральной и периферической нервной системы) и регуляторы метаболизма интрацеллюлярной природы (ферменты и антиферменты, витамины, кофакторы, разнообразные метаболиты), оказывающие действие на различные пути обмена веществ.
При нарушении процессов окислительного фосфорилирования применяют комплекс витаминов, включающий витамины В1, В2, пантотеновую и липоевую кислоты. Витамины группы В влияют на белковый, липидный, углеводно-энергетический обмен, синтез аминокислот, нуклеотидов.
Среди препаратов с антиоксидантными свойствами широко применяют токоферола ацетат, его сочетание с витамином РР (никотиновой кислотой) способствует улучшению энергетического обеспечения сократительной функции миокарда. Активным антиоксидантом, который участвует в окислительно-восстановительных процессах, является витамин С.
Большое значение для нормализации метаболизма миокарда имеет достаточное поступление в организм незаменимых аминокислот; в том числе метионина, лейцина, аланина, валина, лизина, трионина, триптофана, являющихся пластическим материалом для синтеза белка, ферментов, коферментов. Для улучшения их усвоения рекомендуется назначать их в комплексе с анаболическими стероидами (метандиенон, нандролон).
При прогрессировании дистрофического процесса показано применение внутрь калия хлорида, калия и магния аспарагината для устранения закономерного дефицита внутриклеточного калия, нарушения баланса кальция и магния, что приводит к восстановлению регуляции возбудимости и проводимости миокарда, его автоматизма и сократимости.
Для активации синтеза белков и нуклеиновых кислот применяют соли оротовой кислоты (оротат калия/магния).
Проводимая терапия должна быть направлена на повышение генерации энергии и повышение устойчивости миокарда к гипоксии. В последнее время большое внимание уделяют роли серотонинергической системы в регуляции стрессорной реакции. Специфической особенностью никотинамида является его способность стимулировать процессы аэробного окисления и обмен гликогена, тем самым повышая устойчивость кардиомиоцитов к гипоксии.
Прямое цито- и мембранопротекторное действие на кардиомиоциты в условиях гипоксических состояний оказывает триметазидин.
Продолжительность интенсивной метаболической терапии на ранних стадиях у больных с преимущественно функциональными нарушениями составляет 2–3 нед. При прогрессировании дистрофии миокарда и выявлении органического поражения сердца курс терапии следует повторять несколько раз в год.
ПОРАЖЕНИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ ПРИ ЭНДОКРИННЫХ НАРУШЕНИЯХ
Сердечно-сосудистая система часто вовлекается в патологический процесс при заболеваниях желез внутренней секреции. Функциональные изменения сердца могут превалировать в клинической картине, и пациент с эндокринным заболеванием становится фактически «кардиальным» больным. Поражение сердца при эндокринных заболеваниях в основном обусловлено обменными нарушениями, вызванными недостатком или избытком того или иного гормона в организме.
ПОРАЖЕНИЕ СЕРДЦА ПРИ САХАРНОМ ДИАБЕТЕ
Термин «диабетическая кардиомиопатия» впервые предложен в 1954 г. для обозначения кардиальных изменений, предшествующих ИБС.
Патогенез
Патогенез метаболической кардиомиопатии при сахарном диабете многофакторный, поражение сердечно-сосудистой системы обусловлено сложными обменными нарушениями, возникающими в связи с абсолютной или относительной недостаточностью инсулина и нарушением толерантности к глюкозе.
Патогенез миокардиальных нарушений включает несколько основных механизмов: повреждение кардиомиоцитов, микроциркуляторные и нейровегетативные нарушения. Первый механизм связан с нарушением метаболизма кардиомиоцитов, снижением эффективности энергетических, пластических процессов и изменением ионного метаболизма, в результате чего снижаются компенсаторные возможности сердечно-сосудистой системы, нарушается сократительная функция миокарда, уменьшается толерантность к физическим нагрузкам. Второй механизм основывается на микроциркуляторных нарушениях в мелких артериях миокарда как локального проявления генерализованной микроангиопатии. Третий механизм включает поражение вегетативной нервной системы в результате формирования нейровегетодистрофии.
Кардиомиопатия, не обусловленная нарушением коронарного кровообращения, возникает у больных молодого возраста с ювенильным сахарным диабетом, для которых нехарактерно развитие выраженного атеросклероза, или у пациентов старшего возраста без сопутствующей ИБС.
Инсулин оказывает на сердце прямое действие, которое заключается в увеличении поступления и стимуляции окисления глюкозы и лактата, увеличении образования гликогена в миокарде. Непрямой эффект инсулина состоит в снижении содержания жирных кислот в плазме крови, уменьшении их поступления в сердце.
Дефицит инсулина вызывает нарушение утилизации тканями глюкозы и усиливает расщепление липидов и белков, также приводит к выраженным изменениям состава внутренней среды организма — гипергликемии, гиперкетонемии, гиперлипидемии с накоплением в крови жирных кислот, диспротеинемии, метаболическому ацидозу, оксидантный стресс вызывает апоптоз миоцитов. Эти нарушения являются определяющими факторами изменения структуры и функции миокарда.
Патогенез и морфогенез диабетического поражения сердца обусловлены не только влиянием гиперинсулинемии на эндотелий сосудов, энергетические и метаболические процессы в миокарде, но и непосредственно связаны с токсико-метаболическим повреждением кардиомиоцитов.
Есть мнение, что причиной разрушения структур кардиомиоцитов, нарушения структуры сарколеммы и ее дериватов, изменения ионного равновесия и снижения активности актомиозинового комплекса кардиомиоцитов является прямая глюкозотоксичность.
В патогенезе кардиомиопатии важную роль играет тканевая гипоксия. Большое значение в развитии гипоксии имеет нарушение транспорта кислорода кровью, функции дыхательных ферментов под влиянием выраженного ацидоза. При сахарном диабете потребность тканей, в том числе миокарда, в кислороде повышена.
Важным фактором развития миокардиодистрофии является нарушение нейроэндокринной регуляции сердца, связанное с преобладанием эффектов контринсулярных гормонов. Доказано, что у пациентов происходит повышение продукции адренокортикотропного и соматотропного гормонов, а также глюкокортикоидов, катехоламинов и глюкагона, это приводит к инициации целой группы метаболических и ультраструктурных процессов, вызывающих развитие метаболической кардиомиопатии.
Патогенез увеличения жесткости миокарда связан с нарушением транспорта кальция, электромеханическим дисбалансом, сопровождающимся асинхронностью расслабления и механическими факторами.
Патологическая анатомия
Характерен фиброз миокарда, связанный с нарушением внутриклеточного метаболизма оксида азота и кальция, а также с пролиферативными процессами, обусловленными действием инсулина и ИФР. Морфологической основой дистрофии миокарда при сахарном диабете является микроангиопатия, характеризующаяся инфильтрацией тучными клетками и фибриноидным набуханием стенок мелких сосудов. При морфологическом исследовании выявляют развитие апоптозной дегенерации, потерю синаптических пузырьков, появление больших вакуолей в цитоплазме клеток симпатических ганглиев. При гистохимическом исследовании в стенках сосудов определяются отложения гликопротеинов. На ультраструктурном уровне определяется утолщение базальной мембраны сосудистой стенки. Важное значение придают дезорганизации мышечных волокон гипертрофированного миокарда.
Клиническая картина и диагностика
Больные с ювенильным сахарным диабетом изредка отмечают колющую боль в области сердца. Возникновение тахикардии покоя связано с поражением блуждающего нерва и относительным преобладанием тонуса симпатического отдела вегетативной нервной системы. Тахикардия сопровождается неэффективными сокращениями миокарда, что приводит к истощению энергоресурсов и в конечном счете к снижению сократительной функции миокарда и развитию СН.
Размеры сердца в пределах нормы. Некоторое приглушение тонов сердца и систолический шум на верхушке чаще отмечают у болеющих сахарным диабетом более 5 лет. В дальнейшем гипергликемия и инсулинорезистентность ассоциируются с увеличением массы ЛЖ и появлением симптомов СН.
На ЭКГ отмечаются синусовая тахикардия или брадикардия, желудочковая экстрасистолическая аритмия, нарушения процессов реполяризации: смещение сегмента ST, изменение амплитуды, инверсия, уплощение, сглаженность или двухфазность зубца Т, нарушение внутрижелудочковой проводимости.
При эхоКГ-исследовании наиболее ранним признаком поражения миокарда при сахарном диабете является нарушение диастолической функции, которое отмечают у 27–69% бессимптомных больных.
При анализе крови уровень гликемии в плазме крови натощак >7,0 ммоль/л.
Лечение
Одной из основных задач лечения больных диабетической кардиомиопатией является профилактика дальнейшего прогрессирования поражения миокарда и развития СН. Важным является борьба с факторами риска: курением, ожирением, малоподвижным образом жизни, несбалансированным питанием. Рекомендации по оптимизации образа жизни должны содержать обоснование соответствующей низкокалорийной диеты для уменьшения массы тела, отказ от курения, регулярные физические нагрузки.
Важной задачей является нормализация обмена веществ, что включает достижение целевых уровней глюкозы, аглюкозурии, нормализации уровня гликированного гемоглобина. Регулярные физические нагрузки позволяют снизить резистентность к инсулину, повысить толерантность к глюкозе, способствуют утилизации глюкозы крови и свободных жирных кислот в мышцах, оказывают благоприятное влияние на функционирование сердечно-сосудистой системы.
Фармакотерапия сахарного диабета II типа направлена на усиление секреции инсулина, снижение инсулинорезистентности и представлена препаратами с различными механизмами действия: бигуаниды, производные сульфонилмочевины, глитазоны, глиниды, ингибиторы α-глюкозидазы, инсулин. Применение метформина позволяет улучшить контроль глюкозы крови у больных сахарным диабетом и способствует снижению общей смертности на 36%.
Для восстановления метаболических нарушений в миокарде назначают препараты α-липоевой кислоты, которая активирует ферменты митохондрий, увеличивает окисление глюкозы, замедляет глюконеогенез и кетогенез, как антиоксидант защищает клетки от повреждающего действия свободных радикалов. Также применяют препараты, способствующие коррекции нарушений обмена в миокарде: триметазидин, триметилгидразиния пропионат.
ТИРЕОТОКСИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
Патогенез
Нарушение функции сердечно-сосудистой системы — появление «тиреотоксического сердца» является частым осложнением тиреотоксикоза. Изменения сердечно-сосудистой системы при тиреотоксикозе («тиреотоксическое сердце») обусловлены воздействием избыточного количества тиреоидных гормонов (L-тироксина и 3,5,3-трийод-L-тиронина) на обменные процессы в миокарде, гемодинамику и симпатическую нервную систему. Одним из важных эффектов тиреоидных гормонов является разобщение окислительного фосфорилирования, что приводит к снижению в сердечной мышце содержания АТФ и креатинфосфата. В результате происходит угнетение анаболических процессов: снижается синтез и усиливается распад гликогена и белка, снижается содержание калия в эритроцитах и других клетках. Потребление кислорода миокардом увеличивается, однако эффективность его утилизации в процессе биологического окисления снижается. При избытке тироксина нарушается проницаемость митохондриальных мембран.
Под влиянием тиреоидных гормонов происходит усиление сократительной функции миокарда, вероятно, вследствие активизации стимулирующего влияния на сердце и прямого действия тироксина на сердечную мышцу. Вследствие нарушений энергетических процессов и изменения калий-натриевого насоса происходит ускорение спонтанной деполяризации в клетках синусного узла, что обусловливает более частое образование в нем импульсов. Избыток тиреоидных гормонов изменяет симпатические и парасимпатические влияния на миокард. При высокой степени тиреотоксикоза в результате резкого снижения эффективности биологического окисления, преобладания распада белка над его синтезом снижается уровень энергетических ресурсов и пластических процессов, что приводит в конечном итоге к угнетению сократительной функции миокарда.
Гемодинамика
В основе гиперфункции сердца при тиреотоксикозе лежит повышение сократительной способности миокарда, что обусловлено как повышением активности симпатической нервной системы, так и непосредственным действием тиреоидных гормонов на миокард. При тиреотоксикозе происходят резкие изменения гемодинамики: увеличивается МОК (в основном за счет повышения ЧСС), скорость кровотока и ОЦК. Периферическое сосудистое сопротивление в большом круге кровообращения снижается, а в малом повышается. В результате повышается пульсовое давление. Сердце испытывает диастолическую перегрузку, а правые отделы сердца еще и систолическую перегрузку, увеличенная работа сердца происходит в крайне неблагоприятном для него режиме: вследствие изменений гемодинамики ЛЖ работает в условиях постоянной изотонической гиперфункции, а правый — в условиях смешанного типа гиперфункции (нагрузка объемом и сопротивлением), однако при этом отсутствуют условия для развития компенсаторной гипертрофии миокарда (усилен распад и снижен синтез белка, уменьшено количество АТФ и креатинфосфата). Все это достаточно быстро приводит к развитию СН.
Патологическая анатомия
Гистологические изменения миокарда при тиреотоксикозе характеризуются воспалением и дегенерацией вплоть до развития очагов некроза и фиброза. Гистологические изменения в миокарде непостоянны и неспецифичны. Факторы, обусловливающие поражение сердечно-сосудистой системы у больных с диффузным токсическим зобом, вначале вызывают дистрофические изменения, а в дальнейшем дегенеративно-склеротические. При тяжелом течении заболевания возникают дегенеративные изменения в митохондриях и их распад.
Клиническая картина и диагностика
Больные нередко жалуются на боль в области сердца, часто ноющего, колющего, нередко стенокардитического характера, а также на сердцебиение, которое возникает в состоянии покоя, но при физических нагрузках неадекватно усиливается. Больные отмечают повышенную возбудимость, потливость, мышечную слабость, тремор рук, похудение. Существенным симптомом является постоянная синусовая тахикардия, выраженность которой соответствует тяжести токсического зоба. У 10–20% больных диагностируется тахисистолическая форма фибрилляции предсердий. Характерно повышение САД, что обусловлено увеличением сердечного выброса. Одышка отмечается как при нагрузках, так и в покое. СН, в основном правожелудочковую, отмечают в 15–25% случаев. Признаки левожелудочковой недостаточности обычно выражены меньше, поскольку очень быстро возникает слабость ПЖ.
При осмотре отмечается прекардиальная пульсация и пульсация артерий. Аускультативно определяется повышение звучности сердечных тонов, особенно первого, почти всегда выслушивается систолический шум на верхушке сердца и ЛА.
На ЭКГ, кроме синусовой тахикардии или фибрилляции предсердий, отмечается повышение амплитуды зубца Р, иногда изменения комплекса QRS, снижение сегмента ST и вольтажа зубца Т.
При эхоКГ-исследовании на ранней стадии заболевания выявляют умеренную гипертрофию — утолщение задней стенки, межжелудочковой перегородки и увеличение сократительной функции ЛЖ. В дальнейшем развивается дилатация полостей сердца, увеличивается масса миокарда, уменьшается систолический и минутный объем крови, снижается сократительная функция миокарда.
В сыворотке крови определяется повышение уровней общего и свободного тироксина, трийодтиронина, снижение уровня тиреотропного гормона.
Лечение
Проводится по трем направлениям: нормализация функции щитовидной железы (достижение эутиреоидного состояния), устранение недостаточности кровообращения и восстановление синусового ритма (при фибрилляции предсердий).
Компенсация тиреотоксикоза достигается применением антитиреоидных препаратов или проведением хирургической операции или радиойодтерапии.
Для уменьшения синусовой тахикардии нецелесообразно применять сердечные гликозиды, широко назначают блокаторы β-адренорецепторов. При тахисистолической форме фибрилляции предсердий проводят комбинированное лечение антиаритмическими средствами (пропафенон) и блокаторами β-адренорецепторов, добиваясь восстановления синусового ритма или перевода фибрилляции предсердий в нормосистолическую форму.
Лечение СН не имеет специфических особенностей и обязательно должно проводиться на фоне антитиреоидной терапии. Следует учитывать, что чувствительность миокарда к гликозидам наперстянки может быть повышена.
КЛИМАКТЕРИЧЕСКАЯ (ДИСГОРМОНАЛЬНАЯ) КАРДИОМИОПАТИЯ
Эпидемиология
Изменение демографической структуры общества привело к увеличению в популяции доли женщин старшей возрастной группы (в настоящее время в мире около 500 млн женщин старше 50 лет, то есть в менопаузе).
О существовании связи между расстройством деятельности сердца и изменением функции женских половых органов известно давно. Заболевание может развиваться вследствие дефицита эстрогенов не только в климактерический период, но и у женщин молодого возраста с различными гинекологическими заболеваниями (миома матки, эндометриоз и др.), при посткастрационном и предменструальном синдромах. Климактерическая кардиомиопатия диагностируется иногда и у мужчин (климакс отмечают у 10–20% лиц мужского пола).
Патогенез
Менопауза, не являясь собственно заболеванием, приводит к нарушению эндокринного равновесия в организме и способствует развитию сердечно-сосудистых заболеваний.
В патогенезе обменных нарушений основное значение имеет нарушение активности эстрогенов, в норме благоприятно влияющих на белковый и электролитный обмен в миокарде и регулирующих симпатические влияния на сердце. При патологическом климаксе в миокарде происходят метаболические нарушения, приводящие к дистрофическим изменениям, в большинстве случаев носящим обратимый характер и лишь в некоторых случаях заканчивающимся развитием миокардиофиброза (кардиосклероза) (схема 8.2). Увеличение количества абдоминального жира и развитие абдоминального ожирения связано как с физиологическими изменениями, так и с изменениями образа жизни. Среди причин абдоминального ожирения после менопаузы можно выделить изменение баланса энергии — снижение скорости обменных процессов наряду с повышением аппетита и увеличением поступления энергии с пищей на фоне повышения тонуса симпатической нервной системы, усиления глюкокортикоидной стимуляции и падения уровня гормона роста. В основе патогенеза климактерической АГ лежит гипоэстрогения, которая сопровождается повышением возбудимости гипоталамо-гипофизарных структур, нарушением центральной и периферической регуляции сосудистого тонуса. Одним из механизмов является отсутствие в период менопаузы депрессорного эффекта фолликулярного гормона.
Клиническая картина
Наиболее распространенными являются жалобы на продолжительную, почти постоянную боль в области сердца разнообразного характера, локализующуюся слева от грудины, в области верхушки. Боль не провоцируется физическим напряжением. Кардиалгия не прекращается после приема нитроглицерина. Характерно сердцебиение при нормальном пульсе, не связанное с физической нагрузкой, нередко появляется в покое.
Больные часто жалуются на ощущение неудовлетворенности вдохом, невозможность вдохнуть полной грудью, которое не связано с физическими нагрузками и часто возникает в покое.
Типичны нарушения функции вегетативной нервной системы: гиперемия или побледнение кожи, потливость, приливы крови, сердцебиение, онемение конечностей, озноб, нарушение ритма дыхания, полиурия, головокружение, нарушение терморегуляции.
Большое количество жалоб обусловлено изменениями психического состояния: эмоциональная лабильность, раздражительность, плаксивость, повышенная возбудимость, нередко подавленное настроение, страхи, ухудшение памяти. Усугубление симптомов связано с нагрузками, особенно эмоциональными.
При патологическом климаксе нередко возникает симптоматическая АГ. Впоследствии, после исчезновения приливов крови и других проявлений климактерического синдрома, невротическое состояние может стать причиной развития гипертонической болезни.
У большинства мужчин с климактерической кардиомиопатией отмечают те или иные симптомы патологического климакса со стороны мочеполовой системы: отсутствие или снижение (редко повышение) либидо, снижение потенции. Больные часто жалуются на расстройства мочеиспускания, что обычно связано с доброкачественной гиперплазией предстательной железы.
Вазомоторный синдром проявляется в виде приливов крови, то есть внезапно возникающего ощущения жара в верхней половине туловища, коже лица, шеи, которое сменяется последовательно гиперемией и потоотделением. Наряду с приливами крови в отдельных областях тела периодически появляются парестезии: ощущение онемения, покалывания, ползания мурашек.
Климактерическая кардиомиопатия может возникнуть остро или развиваться постепенно. Характерно несоответствие между интенсивностью и длительностью болевого синдрома и удовлетворительным состоянием кровообращения.
При объективном обследовании характерно несоответствие между обилием жалоб и отсутствием клинических признаков коронарной или СН.
Диагностика
На ЭКГ самыми частыми изменениями являются снижение сегмента ST и/или инверсия зубца Т, которые в основном регистрируют в правых и средних грудных отведениях (V1–4). Зубец Т может длительное время быть отрицательным, затем положительным, а через несколько дней вновь отрицательным без какой-либо связи с клинической картиной болезни, на фоне удовлетворительного состояния больного. Изменения на ЭКГ не соответствуют клиническим проявлениям, физические нагрузки практически не влияют на конфигурацию зубцов. Часто возникают синусовая аритмия, предсердная и желудочковая экстрасистолия, пароксизмальная суправентрикулярная тахикардия. Изредка регистрируют нарушения предсердно-желудочковой и внутрижелудочковой проводимости.
На ранних стадиях климактерическая кардиомиопатия протекает чаще изолированно и характеризуется типичной клинической картиной заболевания. В более поздние периоды клиническая картина зависит от присоединения ИБС, воспалительных процессов в миокарде и других болезней, что несомненно отягощает течение кардиомиопатии и ухудшает прогноз.
Лечение
Должно быть направлено на устранение всех симптомов заболевания. Важное значение имеет модификация образа жизни, включающая повышение физической активности и соблюдение диеты с ограничением потребления насыщенных жиров и увеличением в рационе доли моно- и полиненасыщенных жиров и грубой клетчатки. Для нормализации деятельности нервной системы обычно назначают седативные препараты, транквилизаторы, иногда антидепрессанты.
Для лечения АГ в постменопаузе наиболее целесообразно назначение ингибиторов АПФ и диуретиков, которые должны быть нейтральными в отношении показателей углеводного и липидного обмена. Женщинам в постменопаузе должны назначаться только высокоселективные блокаторы β-адренорецепторов новой генерации, не оказывающие негативного воздействия на липидный и углеводный обмен.
Назначение заместительной гормонотерапии является патогенетически обоснованным в лечении больных с климактерической кардиомиопатией. Применяют препараты, содержащие эстрогены и гестагены. Половые гормоны подавляют повышенную активность гипоталамо-гипофизарных структур мозга и опосредованно влияют на сердце, нормализуя влияние вегетативной нервной системы. Не исключено, что половые гормоны ослабляют повышенную активность САС и тем самым нормализуют метаболические процессы в миокарде. Эстрогены оказывают непосредственное сосудорасширяющее действие на коронарные сосуды, а также нормализуют электролитный и белковый обмен в миокарде. Дозы и общая продолжительность лечения зависят от исходного гормонального фона и уровня эстрогенов, лечение следует проводить под наблюдением эндокринолога. Необходимо отметить, что климактерическая кардиомиопатия является самоизлечивающимся заболеванием, при котором гормоны оказывают лишь вспомогательное заместительное действие, гормональную терапию следует назначать на длительный срок. Лечение гормонами устраняет тягостные проявления климактерического синдрома и после окончания возрастной перестройки эндокринной системы заболевание исчезает.
Прогноз
Как правило, благоприятный. Снижение трудоспособности в большинстве случаев носит временный характер. Полное выключение больных из привычной трудовой обстановки, как правило, играет отрицательную роль, приводит к излишней концентрации внимания на тягостных ощущениях со стороны сердца.
ПОРАЖЕНИЯ СЕРДЦА ПРИ НАРУШЕНИИ ОБМЕНА ВЕЩЕСТВ
Нарушения обмена веществ в организме всегда отражаются на течении метаболических процессов в миокарде, нередко вызывая нарушение его функции и структуры. При различных заболеваниях первоначально могут нарушаться один или несколько путей метаболизма, что в дальнейшем обязательно отражается на энергообеспечении сердечной мышцы. При некоторых нарушениях обмена в межуточной ткани миокарда и в коронарных сосудах откладываются патологические продукты нарушенного метаболизма белков, углеводов, минералов или накапливаются избыточные компоненты нормального обмена. К таким заболеваниям относят амилоидоз, гликогеноз, гемохроматоз и др.
НАРУШЕНИЯ БЕЛКОВОГО ОБМЕНА. АМИЛОИДОЗ
Определение
Амилоидоз — системное заболевание неустановленной этиологии, характеризующееся внеклеточным отложением в органах и тканях (главным образом в медии артерий, периваскулярной соединительной и нервной ткани, в ретикулоэндотелиальной системе, а также миокарде, почках, печени, коже) особого белка β-фибриллярной структуры — амилоида.
Этиология и патогенез
Амилоидоз является следствием нарушения белкового обмена и может быть приобретенным или наследственным. Наследственный амилоидоз является аутосомным доминантным заболеванием. Ряд авторов связывают развитие заболевания с изменением свойств белков тканей вследствие аутоиммунных процессов под влиянием комплекса антиген — антитело. Диспротеинемия с накоплением в плазме крови грубодисперсных фракций белка и аномальных белков (парапротеинов) ведет к выходу последних из сосудов ткани с образованием амилоидных субстанций.
В последние годы стала возможной более точная биохимическая идентификация белков, входящих в состав амилоидных фибрилл, на основании чего выделены типы амилоида, определена связь отдельных типов с клиническими формами амилоидоза, изучены белки-предшественники, предположительно участвующие в синтезе белков.
Выделяют четыре типа амилоидоза: первичный (системный), вторичный, семейный (наследственный) и сенильный (старческий).
Наиболее распространен первичный тип (85%) с преимущественным поражением сердца, при котором амилоид образован легкими цепями молекул k и λ иммуноглобулина (AL-тип), часто ассоциирован с миеломной болезнью, более часто отмечают у мужчин и редко в возрасте младше 30 лет.
Вторичный амилоидоз возникает в результате образования неиммуноглобулиновых белков, миофибриллы содержат амилоидный протеин А, не относящийся к иммуноглобулинам (АА-тип), что часто происходит при хронических воспалительных заболеваниях — ревматоидном артрите, туберкулезе, болезни Крона и при семейной средиземноморской лихорадке.
Семейный или наследственный амилоидоз чаще всего является следствием образования мутантного белка преальбумина (транстиретина). Установлен аутосомно-доминантный тип наследования. Выявлены гены, ответственные за синтез этих белков, и идентифицирован характер генных мутаций.
Сенильный кардиальный амилоидоз, также известный как амилоид SSA, возникает вследствие образования патологического транстиретина у лиц старшего возраста. Выделяют две формы связанного с возрастом амилоидоза — амилоидоз предсердий, который охватывает только предсердия, и старческий аортальный амилоидоз, ограниченный аортой.
Патологическая анатомия
Миокард при амилоидозе сердца очень плотный на ощупь, утолщенный, мало поддается растяжению. Объем полостей сердца существенно не изменен или незначительно увеличен. Амилоид откладывается в разных отделах сердца, преимущественно в миокарде предсердий и желудочков, эндокарде, в клапанах, перикарде, нередко в синусном и AV-узлах, а также в мелких артериальных и венозных сосудах, включая vasa vasorum коронарных артерий, суживая их просвет вплоть до полной обтурации. В результате мышечные волокна сердца оказываются «замурованными» в массах амилоида, что приводит к атрофии сократительного миокарда.
Клиническая картина
Амилоидное поражение сердца не имеет специфических симптомов, развивается постепенно и может длительное время протекать бессимптомно, даже при выявлении отложений амилоида в миокарде при биопсии. Следует обратить внимание, что во время появления симптомов существует весьма значительная инфильтрация сердца амилоидом. У некоторых пациентов возникает боль в области сердца, иногда носящая стенокардический характер как следствие накопления депозитов амилоида в коронарных артериях.
В 10–15% случаев отмечается ортостатическая гипотензия, иногда с симптомами синкопальных состояний.
При аускультации на фоне глухих тонов сердца можно выслушать систолический шум митральной регургитации, при развитии СН — протодиастолический ритм галопа.
Часто определяют различные нарушения ритма, которые нередко могут быть причиной внезапной смерти. У некоторых больных отмечается выраженная брадикардия.
СН выявляют у 45–56% больных. Вначале доминирует правожелудочковая СН с повышенным давлением в яремных венах, гепатомегалией, периферическими отеками, асцитом. Затем возникает систолическая дисфункция и застойная СН.
Диагностика
Изменения на ЭКГ неспецифичны, наиболее типично наличие брадикардии, снижение амплитуды зубцов. Иногда наличие патологического зубца Q и отсутствие зубца R в отведениях V1–3 симулируют ИМ. Накопление депозитов амилоида в проводящей системе могут обусловливать различные расстройства образования импульса и проведения — возможны различные нарушения проводимости, включая полную блокаду сердца: часто выявляются предсердные и желудочковые нарушения ритма (синдром слабости синусного узла, фибрилляция предсердий (у 30% больных), желудочковая экстрасистолическая аритмия).
Двухмерная эхоКГ и допплерография являются основными методами неинвазивной диагностики. При обследовании выявляют нормальные или уменьшенные размеры полости ЛЖ со значительным утолщением миокарда и характерным нарушением его структуры с диффузным гранулярным блеском (рис. 8.1а, б). Отмечается также утолщение межпредсердной перегородки и створок клапанов, увеличение предсердий, наличие небольшого или умеренного перикардиального выпота. Нарушение диастолической функции ЛЖ и ПЖ происходит по рестриктивному типу нарушения их наполнения. В тяжелых случаях выявляются признаки различной степени нарушения систолической функции обоих желудочков.
При рентгеноскопии отмечают уменьшение пульсации контура сердца, размеры сердца увеличены (кардиомегалия) и обычно не соответствуют степени тяжести застойной СН.
К достижениям последних лет относится введение в клиническую практику метода сцинтиграфии с меченным 123I сывороточным Р-компонентом (SАР) для оценки распределения амилоида в организме. Р-компонент содержится в небольшом количестве (5–10%) в амилоиде всех типов; радиоактивный SАР, введенный больному амилоидозом, специфически связывается с амилоидными депозитами и может быть визуализирован и количественно оценен на серии сцинтиграмм. Метод особенно полезен для контроля за динамикой тканевых отложений амилоида в процессе лечения.
Для диагностики также используют сцинтиграфию с изотопом технеция 99mТс-пирофосфатом, способным связываться с амилоидом многих типов, однако эта проба оказывается положительной только при значительных отложениях амилоида в сердце, которые можно определить и с помощью эхоКГ.
МРТ используется для идентификации утолщения миокарда и небольшого размера полости ЛЖ при амилоидозе, что сопоставимо с данными эхоКГ.
Диагноз «амилоидоз» должен быть подтвержден эндомиокардиальной биопсией. При изучении биоптатов тканей важно не только выявить амилоид, но и провести иммуногистохимическое исследование для идентификации его типа.
Диагноз «амилоидоз сердца» чаще устанавливают при аутопсии, поскольку при жизни в ряде случаев не выявляют объективных причин, которыми можно было бы объяснить возникновение патологических признаков.
Лечение
Терапия при первичном амилоидозе включает клеточную антиплазменную терапию, которая останавливает продукцию легких цепей, а также применение алкилирующих средств (мелфалан) и преднизолона. Благоприятный эффект химиотерапии показан в двух рандомизированных испытаниях. Перспективна трансплантация стволовых клеток с органной ремиссией в 50% случаев. Другим подходом к лечению амилоидоза сердца может быть применение талидомида с дексаметазоном. Недавно показана эффективность леналидомида.
Для лечения пациентов с нарушениями ритма сердца назначают антиаритмические препараты. При явлениях полной поперечной блокады и слабости синусного узла эффективна имплантация искусственного водителя ритма. Кардиостимуляторы применяют для лечения пациентов с тяжелыми клинически выраженными нарушениями проводимости.
СН часто рефрактерна к медикаментозной терапии. Для уменьшения недостаточности кровообращения основными препаратами являются диуретики, которые применяют с осторожностью в низких дозах, и вазодилататоры — ингибиторы АПФ или блокаторы рецепторов ангиотензина II, хотя они плохо переносятся и могут вызвать значительную артериальную гипотензию или ортостатические симптомы, особенно у пациентов с амилоид-индуцированной дисфункцией автономной нервной системы. Не рекомендуется применять дигоксин из-за его токсичности и опасности развития аритмий, однако при тщательном ЭКГ-мониторировании его можно применять для контроля ритма у пациентов с фибрилляцией предсердий.
Блокаторы кальциевых каналов неэффективны в лечении при амилоидозе сердца. Больные могут быть гиперчувствительны к негативным инотропным эффектам блокаторов кальциевых каналов, их применение может привести к нарастанию симптомов декомпенсации.
Блокаторы β-адренорецепторов могут спровоцировать угрожающие жизни нарушения проводимости.
При резком снижении сократительной способности предсердий, свидетельствующем о массивной инфильтрации, даже при синусовом ритме показано применение антиагрегантов или антикоагулянтов, что обусловлено повышенным риском тромбообразования.
Трансплантация сердца обычно не проводится, поскольку возникают рецидивы амилоидоза в аллотрансплантате, а также неуклонное прогрессирование его в других органах, что сокращает продолжительность жизни больных.
Прогноз
Течение амилоидоза прогрессирующее, прогноз неблагоприятный, хотя зависит от формы, сроков диагностики и степени вовлечения жизненно важных органов. Каждый из четырех основных типов амилоидной болезни имеет различные степени вовлечения сердца, клинические симптомы и прогноз. Выживаемость больных со старческим амилоидозом намного выше, чем с первичным амилоидозом, — в среднем соответственно 60,0 и 5,5 мес со времени установления диагноза. Летальный исход (приблизительно через 1,5–2,5 года после появления первых признаков поражения сердца) обычно наступает вследствие нарушений ритма и проводимости, а также внесердечных осложнений (легочной или системной эмболии). У больных с вовлечением проводящей системы нередко возникает внезапная смерть. Самая низкая выживаемость отмечена у больных с рефрактерной к терапии застойной СН (в среднем 6 мес), особенностью которой является преимущественно правосердечный или тотальный ее тип с резким набуханием шейных вен и значительным повышением венозного давления, застойным увеличением печени и полостными отеками (гидроторакс, гидроперикард, асцит).
НАРУШЕНИЯ ПРЕИМУЩЕСТВЕННО ЛИПИДНОГО ОБМЕНА
ГОЛОДАНИЕ И КАХЕКСИЯ
Патогенез
Голодание, длительное неполноценное питание, кахексия приводят к нарушениям деятельности сердца, которые сопровождаются уменьшением массы миокарда, обычно пропорционально меньшим, чем уменьшение массы тела вследствие атрофии мышечных волокон, дегенеративным изменениям в миокарде и к СН.
Патологическая анатомия
При голодании микроскопически отмечают вакуолизацию миофибрилл, особенно вокруг ядер, изменения хроматина ядер и митохондрий. В далеко зашедших случаях выявляют бурую атрофию и дистрофические изменения миокарда.
Клиническая картина и диагностика
Основными проявлениями нарушения функции сердечно-сосудистой системы при голодании являются синусовая брадикардия, уменьшение МОК, снижение венозного давления и АД (преимущественно систолического), что нередко сопровождается головокружением, а при быстром перемещении из горизонтального положения в вертикальное — обмороком. Часто возникают отеки, обусловленные гипопротеинемией и увеличением ОЦК (но не СН).
На ЭКГ отмечаются отклонение оси сердца вправо, синусовая брадикардия, низкий вольтаж зубцов, иногда изменения зубца Т и комплекса QRS, которые, по-видимому, обусловлены нарушением обмена энергии и электролитов в миокарде.
Лечение заключается в восстановлении полноценного питания.
ОЖИРЕНИЕ
Эпидемиология
Эпидемиологические исследования свидетельствуют, что ожирение связано с сердечно-сосудистыми заболеваниями и преждевременной смертностью. Ожирение само по себе приводит к комплексному и прогностически неблагоприятному поражению сердца. Вероятность развития ГЛЖ у лиц с нормальной массой тела составляет 5,5%, а у лиц с ожирением — 30%. По данным Фремингемского исследования установлено наличие высокодостоверной связи между ИМТ, полостными размерами и толщиной стенок ЛЖ.
По современным представлениям ожирение представляет собой независимый фактор риска развития СН, являясь ее причиной у 11% мужчин и 14% женщин в США. По данным Фремингемского исследования увеличение ИМТ на каждый 1 кг/м2 повышает риск развития СН на 5% у мужчин и на 7% у женщин независимо от других факторов риска.
Этиология
Ожирение может быть самостоятельным заболеванием, возникающим вследствие избыточного потребления пищи с высокой калорийностью, или синдромом, сопровождающим различные заболевания, и развиваться вследствие ряда нейроэндокринных, социальных, поведенческих и генетических факторов. Генетические факторы играют важную роль в развитии ожирения. Результаты исследований свидетельствуют, что существует редко идентифицируемая группа генов, вызывающих значительное ожирение, однако чаще выявляют гены «восприимчивости», которые детерминируют склонность к ожирению и регулируют распределение жировой массы в организме, скорость обменных процессов и их реакцию на физическую активность и диету, контролируют пищевые привычки. Идентифицировано более 41 сайта в геноме, которые, возможно, связаны с развитием ожирения в популяции.
Патогенез
При ожирении происходит постепенное увеличение размеров клеток жировой ткани, ведущее к изменению их свойств. Гормонально-метаболические сдвиги, характерные для ожирения, могут напрямую воздействовать на структуру и массу миокарда. У пациентов с ожирением адипоциты жировой ткани высвобождают большое количество биологически активных субстанций, участвующих в регуляции сосудистого тонуса: ангиотензин II, интерлейкины, простагландины, эстрогены, ИФР, ФНО-α, ингибитор активатора плазминогена-1, лептин и другие, что повышает риск развития сердечно-сосудистых осложнений, при этом снижается уровень адипонектина, специфического циркулирующего белка жировой ткани, который вовлечен в регулирование метаболизма липидов и глюкозы (схема 8.3). Синтезируемый в жировой ткани лептин, важный маркер энергетического баланса, стимулирует гиперсимпатикотонию, способствует повышению уровня АКТГ, кортизола и альдостерона.
Ведущее значение в развитии различных форм ожирения имеют изменения функционирования гипоталамо-гипофизарной системы. Эндоканнабиноидная система, представленная в мозге (гипоталамусе) и периферически в жировой ткани (адипоцитах), печени, скелетных мышцах и пищеварительном тракте, посредством каннабиноидных рецепторов 1-го типа (СВ1) участвует в центральной и периферической регуляции энергетического баланса, а также метаболизме глюкозы и липидов, играет роль в контроле потребления пищи и массы тела. Гиперактивация этой системы ассоциирована с мотивацией к увеличенному потреблению пищи и ожирением и приводит к нарушению механизмов обратной связи, которые поддерживают устойчивый гомеостаз.
Присоединение АГ при ожирении происходит примерно у 60% больных, механизмы ее формирования связывают с развитием гормонально-метаболических отклонений, вызванных накоплением жировой ткани. Ключевую роль среди них играет развитие инсулинорезистентности и компенсаторной гиперинсулинемии, которая, усиливая задержку натрия почками, способствует дальнейшему росту ОЦК. Гипертензивное действие может оказывать и лептин, стимулирующий симпатическую нервную систему. Ожирение, АГ, дислипидемию и гипергликемию, в основе которых лежит инсулинорезистентность, объединяют в понятие «метаболический синдром».
При высокой степени ожирения нельзя исключить определенную роль гипоксии в изменении нейроэндокринной регуляции кровообращения и в развитии дистрофии миокарда. Включение гипоксического фактора в патогенез дистрофических поражений сердца может стать существенным механизмом не только их возникновения, но и развития СН.
Гемодинамика
Сердце у больных ожирением испытывает перегрузку объемом. ОЦК и объем плазмы крови увеличиваются пропорционально степени увеличения массы тела, что приводит к увеличению наполнения ЛЖ и ударного объема, дилатации и росту массы ЛЖ. Считается, что нарастание сердечного выброса при ожирении физиологически связано с удовлетворением метаболических потребностей возросшей тканевой массы тела. Развитие сердечно-сосудистых осложнений при ожирении связано с истощением компенсаторных механизмов миокарда, обусловленным увеличением величины ОЦК, которая формируется пропорционально объему сосудистой сети периферических тканей. Нарастающее содержание жировой ткани в организме десинхронизирует физиологические взаимосвязи между сердцем и кровотоком периферических метаболически активных тканей.
Сердечный выброс в состоянии покоя у больных с тяжелой степенью ожирения достигает 10 л/мин, причем на обеспечение кровотока в жировой ткани используется от ⅓ до ½ этого объема. Увеличенный объем крови в свою очередь увеличивает венозный возврат в ПЖ и ЛЖ, вызывая их дилатацию, увеличивая напряжение стенки. Это приводит к ГЛЖ, которая сопровождается снижением диастолической податливости камеры, приводя к повышению давления наполнения ЛЖ и его расширению.
Увеличение толщины миокарда снижает чрезмерное напряжение его волокон, что позволяет сохранить нормальную сократительную способность ЛЖ, одновременно создает предпосылки для диастолической дисфункции, в основе которой лежит относительное уменьшение количества капилляров на единицу объема мышечной ткани и ухудшение условий диффузии кислорода в гипертрофированных мышечных волокнах. По мере прогрессирования дилатации ЛЖ увеличение напряжения стенки приводит к систолической дисфункции.
Патологическая анатомия
При ожирении отмечают увеличенное отложение жировой ткани под эпикардом обоих желудочков и в поверхностных слоях миокарда, что со временем приводит к атрофии мышечных волокон, замещению их жировой тканью (cor adiposum). Миокард на разрезе имеет желтоватый оттенок. Выявляют наличие диффузной мышечной гипертрофии, которая является наиболее характерным проявлением ожирения со стороны сердечно-сосудистой системы.
Клиническая картина
У взрослого ожирение устанавливают при ИМТ >30,0 кг/м2. Клинически выраженные расстройства кровообращения развиваются у больных с ИМТ >40,0 кг/м2.
Жалобы на боль в сердце ноющего, колющего характера, сердцебиение и перебои в работе сердца при физических нагрузках. По мере накопления избыточной массы тела постепенно развивается прогрессирующая одышка при нагрузках, возникает ортопноэ и пароксизмальная ночная одышка, появляются отеки нижних конечностей, возможно увеличение живота в объеме.
Во многих проспективных исследованиях установлено, что увеличение массы тела приводит к повышению АД. У больных с ожирением высок риск присоединения ИБС, течение которой особенно агрессивно и тяжело.
Сердце принимает «поперечное» положение из-за высокого стояния диафрагмы, смещаясь влево и несколько кзади. Аускультативно определяется выраженная глухость тонов. Пульс имеет склонность к учащению.
При крайних степенях ожирения иногда отмечают клинический синдром, проявляющийся сочетанием сонливости, альвеолярной гиповентиляции и легочной гипертензии с гипертрофией ПЖ — синдром Пиквика.
Диагностика
На ЭКГ обычно синусовая тахикардия, отклонение электрической оси сердца влево, снижение сегмента ST в I–II и V5–6 отведениях, уплощенный и отрицательный зубец Т. У некоторых больных регистрируется низкоамплитудный зубец РІІІ и глубокий QІІІ. Отмечаются признаки ГЛЖ.
При эхоКГ-исследовании выявляют гипертрофию и дилатацию ЛЖ, увеличение левого предсердия, диаметра восходящей аорты. С помощью допплеровской эхоКГ выявляют признаки диастолической дисфункции, может определяться аортальная регургитация. В последующем происходит нарушение и систолической функции. Возможно расслоение листков перикарда за счет отложения жира. Проведение эхоКГ-исследования часто затруднено из-за большой толщины грудной клетки, сужения межреберных промежутков, смещения сердца кзади.
При изучении гемодинамических показателей у всех пациентов выявлено увеличение ОЦК, что сопровождается нарастанием ригидности миокарда ЛЖ, ростом давления его наполнения и УОК. С увеличением степени ожирения повышается конечное диастолическое давление в ПЖ, среднее давление в ЛА, давление заклинивания в легочных капиллярах и конечное диастолическое давление в ЛЖ. Эти изменения вызывают расширение полостей левого предсердия, ПЖ и правого предсердия. Давление крови в ПЖ, как правило, также повышено.
Рентгенологическая картина всегда изменена вследствие высокого стояния диафрагмы и скопления жира в области верхушки сердца, что создает картину его кажущегося увеличения. Пульсация вялая, тонус сердца понижен.
Лечение
Начальные дистрофические изменения миокарда при ожирении являются в значительной мере обратимыми при нормализации массы тела. Первоочередным этапом лечения является коррекция пищевых привычек и повышение физической активности. Специфические рекомендации включают 30 мин физической активности по крайней мере 5 раз в неделю, уменьшение калорийности пищи в среднем до 1500 ккал/сут, снижение потребления жиров до 30–35% дневной энергетической ценности (с оговоркой 10% для мононенасыщенных жирных кислот, например оливковое масло), отказ от трансгенных жиров, увеличение потребления продуктов, содержащих волокна, до 30 г/сут и отказ от жидких моно-и дисахаридов.
Для уменьшения массы тела применяют медикаментозные и хирургические методы лечения ожирения. Назначают ингибиторы липаз (средства периферического действия) и анорексигенные средства (центрального действия).
Лечение сердечно-сосудистых расстройств у больных с ожирением зависит от характера поражения сердца. Для лечения АГ наиболее целесообразно назначение ингибиторов АПФ и диуретиков, которые должны быть нейтральными в отношении показателей углеводного и липидного обмена. Должны назначаться только высокоселективные блокаторы β-адренорецепторов новой генерации, не оказывающие негативного воздействия на липидный и углеводный обмен.
При наличии признаков СН лечение проводят в соответствии с современными рекомендациями.
АЛКОГОЛЬНАЯ КАРДИОМИОПАТИЯ
Эпидемиология
Одна из форм алкогольного поражения сердца, отмечается у 50% лиц, на протяжении длительного времени злоупотребляющих алкоголем.
Алкогольную кардиомиопатию выявляют приблизительно у ⅓ всех больных с неишемической кардиомиопатией, 40–50% больных умирают в течение 3–6 лет.
Этиология
Этиологическим фактором является этанол и/или его метаболиты. Развитие алкогольной кардиомиопатии могут обусловить стрессовые состояния, недостаточность питания (дефицит белков, витаминов), наследственная предрасположенность, вирусная инфекция на фоне снижения иммунитета, изменения исходного состояния миокарда. Не всегда отмечается отчетливый параллелизм между количеством употребляемого этанола, длительностью интоксикации и выраженностью поражения сердца.
Патогенез
Основной из метаболитов этанола, ацетальдегид, оказывает прямое повреждающее воздействие на клеточные и субклеточные мембраны кардиомиоцитов, связанное с их способностью растворять липиды и увеличивать текучесть биологических мембран. На определенном этапе интоксикации это может вызывать нарушение обмена веществ в миокарде и ингибирование основных путей утилизации энергии в клетках сердца, в результате угнетения функции дыхательной цепи митохондрий возникает гипоксия миокарда. Опосредованное воздействие происходит в результате влияния алкоголя на различные отделы нервной системы и функцию надпочечников.
Патологическая анатомия
Длительное употребление алкоголя вызывает жировую инфильтрацию миокарда, дегенеративные изменения в стенках коронарных артерий и нейронах, расположенных в сердце. При микроскопическом исследовании отмечают исчезновение поперечной исчерченности миофибрилл, пикноз ядер, интерстициальный отек, вакуольную и жировую дистрофию, иногда единичные или множественные очаги некроза, мелкие участки фиброза.
Клиническая картина
Как правило, больные упорно отрицают злоупотребление алкоголем.
Развернутую клиническую картину с явлениями СН, стойкими нарушениями ритма и проводимости, тромбоэмболическими осложнениями, кардиомегалией выявляют редко.
Первым клиническим проявлением наиболее часто бывают нарушения ритма без признаков застойной СН. Развитие заболевания имеет несколько стадий — от функциональных расстройств, нарушений ритма сердца преходящего характера до стойкой гипертрофии миокарда с последующим развитием СН.
К наиболее частым и типичным клиническим симптомам относят:
- возбуждение, тремор рук, суетливость, многословность;
- ощущение нехватки воздуха, кардиалгию, тахикардию;
- похолодение конечностей;
- ощущение жара во всем теле, гиперемию кожи лица, инъецированность склер;
- потливость;
- повышение АД.
Начальными признаками заболевания принято считать сердцебиение и одышку при физической нагрузке. На более поздних стадиях заболевания состояние пациентов постепенно ухудшается.
Диагностика
На ЭКГ характерными изменениями являются укорочение интервала Р–Q, удлинение интервала Q–T в сочетании с небольшой элевацией сегмента ST и заостренным высоким с широким основанием зубцом Т, синусовая аритмия, бради- или тахикардия. Нередко нарушения ритма (предсердная и желудочковая экстрасистолическая аритмия, фибрилляция предсердий) и проводимости (атриовентрикулярная и внутрижелудочковая блокады) возникают после длительного и/или однократного употребления большого количества алкоголя (синдром «праздничного» сердца).
О наличии алкогольной кардиомиопатии может свидетельствовать отсутствие определенной причины фибрилляции предсердий (тиреотоксикоз, ревматический порок сердца) у мужчин молодого возраста.
Диагностику затрудняет и отсутствие маркеров алкогольного поражения сердца.
Диагностировать алкогольную кардиомиопатию легче в том случае, если в анамнезе имеются указания на длительное употребление алкоголя и определяются клинические признаки кардиомегалии, аритмии или застойной СН при отсутствии других причин, способных привести к аналогичным нарушениям сердечной деятельности.
При эхоКГ-исследовании отмечается дилатация полости ЛЖ, снижение его сократительной способности, возможна диффузная гипоксия. При допплеровском исследовании могут выявляться признаки митральной регургитации.
Лечение
При лечении обязательно исключают употребление алкоголя. Полная абстиненция может остановить прогрессирование поражения сердца на ранних этапах (обычно в первые 2–6 мес).
На ранних стадиях без проявлений СН и при наличии кардиалгии, тахикардии, АГ и аритмии рекомендованы блокаторы β-адренорецепторов. При выраженной кардиомегалии следует назначать сердечные гликозиды, однако строго контролировать их прием в целях предупреждения кардиотоксического эффекта. В комплексное лечение включают мочегонные средства, витамины, анаболические гормоны, соли калия и магния.
Прогноз
При полном отказе от употребления спиртных напитков и под влиянием лечения размеры сердца у больных с алкогольной кардиомиопатией нередко уменьшаются. Восстановление основных функций миокарда и улучшение общего состояния наступают очень медленно, сроки относительного выздоровления исчисляются месяцами и годами.
ЛИТЕРАТУРА
- Александров А.А., Кухаренко С.С. (2006) Миокардиальные проблемы ожирения. Рос. кардиол. журн., 2: 11-17.
- Артемчук А.Ф. (2000) Клинические особенности и терапия сердечно-сосудистых нарушений при алкоголизме. Укр. кардіол. журн., 4: 68-71.
- Ефимов А.С., Соколова Л.К., Рыбченко Ю.Б. (2005) Сахарный диабет и сердце. Мистецтво лікування, 34: 44-49.
- Зубкова С.Т., Тронько Н.Д. (2006) Сердце при эндокринных заболеваниях. Библиотечка практикующего врача, Киев, 200 с.
- Коваленко В.Н., Несукай Е.Г. (2001) Некоронарогенные болезни сердца. Практ. руководство. Морион, Киев, 480 с.
- Моисеев В.С., Сумароков А.В. (2001) Болезни сердца. Универсум паблишинг, Москва, с. 369-378.
- Alpert M.A. (2001) Obesity cardiomyopathy: pathophysiology and evolution of the clinical syndrome. Amer. J. Med. Sci., 321: 225-236.
- Bartnik M., Van der Berghe G., Betteridge J. et al. (2007) Guidelines on diabetes, pre-diabetes and cardiovascular diseases. Eur. Heart J., 28: 88-136.
- Cooper L.T., Baughman K.L., Feldman A.M. (2007) The role of endomyocardial biopsy in the management of cardiovascular disease. Eur. Heart J., 28: 3077-3093.
- Cote M., Matias I., Lemieux I. et al. (2007) Circulating endocannabinoid levels, abdominal adiposity and related cardiometabolic risk factors in obese men. Int. J. Obes. (Lond), 31: 692-699.
- Di Marzo V., Matias I. (2005) Endocannabinoid control of food intake and energy balance. Nature Neuroscience, 8: 585-589.
- Falk R.H. (2005) Diagnosis and management of the cardiac amyloidoses. Circulation, 112: 2047-2060.
- Fauchier L. (2003) Alcoholic cardiomyopathy and ventricular arrhythmias. Chest., 123: 1320-1325.
- Galinier M., Pathak K., Roncalli J. et al. (2005) Obesity and cardiac failure. Arch. Mal. Coeur. Vaiss., 98: 39-45.
- Gertz M.A., Blood E., Vesole D.H. et al. (2004) A multicenter phase 2 trial of stem cell transplantation for immunoglobulin light-chain amyloidosis (E4A97): An Eastern Cooperative Oncology Group Study. Bone Marrow Transplant., 34: 149-154.
- Hemery Y., Broustet H., Guiraude O. et al. (2000) Alcohol and rhythm disorders. Ann. Cardiol. Angeiol., 49: 473-479.
- Huss J.M., Kelly D.P. (2005) Mitochondrial energy metabolism in heart failure: a question of balance. J. Clin. Invest., 115: 547-555.
- Ingwall J.S., Weiss R.G. (2004) Is the failing heart energy starved? On using chemical energy to support cardiac function. Circ. Res., 95: 135-145.
- Katz A.M. (2006) Physiology of the heart. 4th ed. Williams&Wilkins, Lippincot, 644 p.
- Kholova I., Niessen H.W. (2005) Amyloid in the cardiovascular system: a review. J. Clin. Pathol., 58: 125-133.
- Maceira A.M., Joshi J., Prasad S.K. et al. (2005) Cardiovascular magnetic resonance in cardiac amyloidosis. Circulation, 111: 186-193.
- Matias I., Gonthier M.P., Orlando P. et al. (2006) Regulation, function, and dysregulation of endocannabinoids in models of adipose and beta-pancreatic cells and in obesity and hyperglycemia. J. Clin. Endocrinol. Metab., 91: 3171-3180.
- Miller S.R., SekijimaY., Kelly J.W. (2004) Native state stabilization by NSAIDs inhibits transthyretin amyloidogenesis from the most common familial disease variants. Lab. Invest., 84: 545-552.
- Murtagh B., Hammill S.C., Gertz M.A. et al. (2005) Electrocardiographic findings in primary systemic amyloidosis and biopsy-proven cardiac involvement. Amer. J. Cardiol., 95: 535-537.
- Poirier P., Giles T.D., Bray G.A. et al. (2006) Obesity and cardiovascular disease: pathophysiology, evaluation and effect of weight loss. Circulation,113: 898-918.
- Rajkumar S.V., Dispenzieri A., Kyle R.A. (2006) Monoclonal gammopathy of undetermined significance, Waldenstrom macroglobulinemia, AL amyloidosis, and related plasma cell disorders: Diagnosis and treatment. Mayo Clin. Proc., 81: 693-703.
- Rutter M.K., Parise H., Benjamin E.J. et al. (2003) Impact of glucose intolerance and insulin resistance on cardiac structure and function: sex-related differences in the Framingham Heart Study. Circulation, 107: 448-454.
- Topol E.J. (Ed.) (2007) Textbook of cardiovascular medicine. 3th ed. Williams& Wilkins, Lippincott, 1628 p.
- Torp-Pedersen C., Caterson I., Coutinho W. et al. (2007) Cardiovascular responses to weight management and sibutramine in high-risk subjects: an analysis from the SCOUT trial. Eur. Heart J., 28: 2915-2923.
- Trayhurn P., Wood I.S. (2004) Adipokines: inflammation and the pleiotropic role of white adipose tissue. Br. J. Nutr., 92: 347-355.
Генетика биосинтеза нейтральных липидов: эволюционная перспектива
Abstract
Хранение жирных кислот и жирных спиртов в форме нейтральных липидов, таких как триацилглицерин (TAG), сложный эфир холестерина (CE) и сложный эфир воска (WE), служит чтобы обеспечить резервуары для формирования и поддержания мембран, перемещения липопротеинов, детоксикации липидов, барьеров для испарения и топлива во время стресса или недостатка питательных веществ. Этот древний процесс, вероятно, возник у актиномицетов и сохранился у эукариот, хотя и за счет других молекулярных механизмов.Избыток нейтральных липидов сильно, возможно, причинно связан с некоторыми заболеваниями человека, такими как сахарный диабет, ожирение, атеросклероз и неалкогольная жировая болезнь печени. Следовательно, понимание метаболических путей синтеза нейтральных липидов и роли задействованных ферментов может облегчить разработку новых терапевтических вмешательств для этих синдромов.
Ключевые слова: ацилтрансфераза, триацилглицерин, восковой эфир, восковой диэфир, холестериловый эфир
Нейтральные липиды: что, почему, когда, где и как?
Хранение жирных кислот, жирных спиртов и стеролов в форме нейтральных липидов служит для распределения ресурсов для потенциального использования в жизненно важных функциях, таких как формирование мембран, целостность эпидермиса, синтез желчных кислот, перемещение липопротеинов и стероидогенез.Нейтральные липиды, такие как сложный эфир холестерина (CE), триацилглицерин (TAG) и эфир воска (WE), обеспечивают организм инертными формами энергии, используемыми в условиях недостатка питательных веществ и стресса окружающей среды. Они также обеспечивают отличную «раковину» для защиты от токсического воздействия жирных кислот и жирных спиртов. Во времена изобилия (например, типичная западная диета) энергия в виде жира эффективно сохраняется, но с последствиями. Повышенное отложение нейтральных липидов в цитоплазме (в первую очередь CE и TAG) является значительным фактором риска для ряда патологий заболеваний, включая диабет, ожирение, атеросклероз и неалкогольную жировую болезнь печени (41, 53, 101).Например, накопление CE в гладкомышечных клетках и макрофагах в стенке сосуда составляет самую раннюю распознаваемую стадию образования атеросклеротических бляшек (90). Кроме того, сывороточные уровни ТАГ и общего холестерина являются независимыми факторами риска атеросклероза. Точно так же загрузка ТАГ в цитоплазму адипоцитов представляет собой основную единицу ожирения и, таким образом, составляет накопление жира при всех синдромах ожирения.
ТАГ, производное глицерина на основе ацилового эфира жирной кислоты, представляет собой основное депо энергии всех эукариотических и некоторых бактериальных клеток (16) и образуется в основном в результате реакции ацил-КоА диацилглицеринацилтрансферазы (ДГАТ), хотя у некоторых организмов ацил-КоА -независимые реакции также вносят свой вклад в эти пулы.Энергия полного окисления алкильных цепей ТАГ (38 кДж / г) более чем в два раза превышает вес углевода или белка, и, в отличие от полисахарида, ТАГ не несет дополнительного веса, как сольватационная вода. Кроме того, ТАГ откладывается в липидных каплях цитоплазмы и, таким образом, не влияет на осмолярность цитозоля. Это разделение, общее для всех эукариотических клеток, но особенно распространенное в адипоцитах, является эффективным механизмом для безопасного и обратимого хранения жирных кислот и диацилглицерина (DAG), а также обеспечения важных молекулярных предшественников для мембранного синтеза (4, 73).TAG играет разнообразную роль в природе. У растений он играет важную роль в прорастании семян. У млекопитающих он участвует в метаболизме липопротеинов, хранении жира и производстве молока.
Точно так же образование CE является критическим гомеостатическим процессом, который обеспечивает хранение стеринов, важных молекул, участвующих в образовании мембран и стабильности, которые в избытке токсичны. У высших организмов стеролы также являются предшественниками стероидных гормонов и желчных кислот. Этерификация стеринов свободными жирными кислотами происходит двумя путями: 1 ) субклеточная ацил-КоА-зависимая реакция с участием ацил-КоА: холестерин-ацилтрансферазы (АСАТ) (15, 18, 76) или 2 ) внеклеточный лецитин. : реакция холестерина ацилтрансферазы, в которой фосфолипиды используются в качестве донора ацила (39).Во всех эукариотических клетках стериловые эфиры (SE) хранятся в липидных каплях цитоплазмы. В печени или кишечнике млекопитающих CE также может быть упакован в липопротеиновые частицы в эндоплазматическом ретикулуме для перераспределения по кровотоку. Таким образом, реакция этерификации представляет собой критическую, эволюционную, консервативную стадию гомеостаза стеролов. Однако увеличение CE в макрофагах или гладкомышечных клетках приводит к образованию пенистых клеток вдоль артериальной стенки и участвует в развитии атеросклеротических поражений.Это вызвало интерес к выяснению медиаторов и механизмов этих реакций с надеждой на лечение атеросклероза и / или гиперхолестеринемии.
WE представляют собой нейтральные липиды, состоящие из длинноцепочечных жирных спиртов, этерифицированных жирными кислотами посредством реакции ацил-КоА: парафиновый спирт-ацилтрансфераза (AWAT). WE в изобилии содержится в кутикуле растений, покрытии экзоскелета насекомых, спермацетах китов, кожном сале и мейбуме млекопитающих. Помимо того, что они действуют как другое средство предотвращения токсичности, опосредованной свободными жирными кислотами, WE также выполняют разнообразные биологические функции, такие как предотвращение высыхания, инфекции и повреждения растений ультрафиолетом, регулирование плавучести кашалотов и источник энергии в семена растения жожоба.Мы пользуемся уникальным рыночным спросом, потому что они являются важным компонентом косметики, полиролей, покрытий и смазок. Семена жожоба имеют особое значение как источник ЗЕ, учитывая ограниченную доступность масел от охоты на кашалотов в последнее время. WE также содержит значительную часть кожного сала млекопитающих, жирных секретов сальных желез внутри кожи. Хотя функция кожного сала в значительной степени неизвестна, он явно участвует в эпидермальном гомеостазе и развитии акне, поддержании гидратации шерсти и теплоизоляции у млекопитающих (33, 98).Первая ацилтрансфераза для синтеза WE была идентифицирована из жожоба (54). К настоящему времени описаны два AWAT млекопитающих (27, 104, 117), оба из которых высоко экспрессируются в сальных железах человека (104). Сложные диэфиры воска представляют собой производные жирных кислот и жирных спиртов. Помимо WE и других нейтральных липидов, они составляют критическую часть слезной пленки (68, 74). Мейбомиевые железы, состоящие из большого ряда голокринных желез, которые структурно и функционально подобны сальным железам, лежат внутри век у млекопитающих и секретируют мейбум, липидную часть слезной пленки человека.Этот липидный компонент обеспечивает гладкую глазную поверхность для роговицы и предотвращает испарение воды с глазной поверхности. Диэфиры воска также были обнаружены у различных бактерий (51). Они также синтезируются уропигиальной железой куликов высокой арктики и видов умеренного климата во время ухаживания до вылупления (85, 87). Предполагается, что переход на диэфирные парафины снижает запах птиц и, таким образом, снижает риск хищничества млекопитающих (86).
Нейтральные липиды представляют собой гетерогенный набор различных спиртов (стеринов, диацилглицеринов, длинноцепочечных спиртов), конъюгированных с жирными кислотами, причем степень насыщения и длина цепи, циклическая или линейная, разнообразна и, вероятно, налагает поразительные свойства и функции.Таким образом, неудивительно, что множественные реакции и генные продукты управляют их образованием. В этом обзоре мы описываем влияние и регуляцию этих реакций, уделяя особое внимание их сохранению на протяжении нескольких миллиардов лет эволюции.
Происхождение нейтральных липидов
Использование ТАГ как источника энергии и безопасного убежища для токсичных метаболитов, вероятно, послужило толчком для ранней эволюции ацилтрансфераз, которые конъюгируют спирты и жирные кислоты. Хронологически самая ранняя реакция ацил-нейтрализации спиртов, вероятно, возникла у бактерий (51), при которой длинноцепочечные спирты или DAG конъюгированы с жирными кислотами за счет действия многофункциональных WE-синтаз / ацил-CoA: диацилглицерин-ацилтрансфераз (WS / DGAT).Синтез ТАГ был также обнаружен у прокариот, таких как бактерии Actinomyctes (2, 108) и паразит Schistosoma Mansoni (7), где он в первую очередь служит источником энергии и углерода. Эти гены не обнаруживают какой-либо консервации последовательностей для ацилтрансфераз эукариот, участвующих в синтезе TAG или WE (46, 48–50, 100, 108). Однако недавно было идентифицировано новое растение WS / DGAT, которое обладает значительной идентичностью последовательности с аналогичным бифункциональным ферментом в A. calcoaceticus (52).
У эукариот идентифицировано по крайней мере три различных семейства генов ацилтрансфераз, молекулярная и биохимическая природа которых отличается от прокариот. Биохимически эти три семейства генов кодируют два типа ферментных реакций: 1 ) ацил-КоА-зависимые реакции, являющиеся неотъемлемой частью внутриклеточных мембран, и 2 ) ацил-КоА-независимые реакции, которые периферически связаны с липопротеинами сыворотки, в которых ацил-КоА-зависимые реакции донор — фосфолипид. Ацил-КоА-зависимые реакции осуществляются двумя неродственными семействами генов (ACAT и DGAT2), которые включают до 10 различных генов.Семейства генов ACAT и DGAT2 сохраняются в процессе эволюции, хотя и с меньшей внутренней избыточностью. Независимые от ацил-КоА реакции также сохраняются у дрожжей через все многоклеточные животные. Прототипом ацил-CoA-независимой ацилтрансферазы является лецитин-холестерин-ацилтрансфераза (LCAT), которая действует как фосфолипаза, отщепляя ацильные группы от фосфолипидов (особенно фосфатидилхолина, также известного как лецитин), а затем отдает их стеринам (103). У растений и грибов члены семейства генов LCAT кодируют внутриклеточные белки, способные синтезировать ТАГ, и были названы фосфолипидными: диацилглицерин ацилтрансферазами (PDAT) (32).
Эукариотические ацилтрансферазы
Два гена ACAT млекопитающих (ACAT1 и -2) были идентифицированы и охарактеризованы (обзор см. В ссылках 9, 25 и 79). ACAT1 широко экспрессируется с самыми высокими уровнями в макрофагах, стероидогенных тканях, сальных железах и атеросклеротических поражениях. С другой стороны, экспрессия ACAT2 ограничена печенью и тонкой кишкой (9, 79). Распределение ферментов ACAT в тканях предполагает, что ACAT1 участвует в первую очередь в отложении CE в цитоплазматических липидных каплях, тогда как ACAT2, вероятно, участвует в сборке липопротеинов.
ДАГ этерифицируется с образованием ТАГ по реакции ДГАТ (79). Известно по крайней мере два независимых фермента млекопитающих, катализирующих эту реакцию, DGAT1 и DGAT2 (34). DGAT1 структурно родственен ACAT, при этом расхождение в его аминокислотной последовательности придает его субстратную специфичность к DAG (16). Члены семейства DGAT2 не имеют гомологии последовательности с семейством ACAT, включая DGAT1. Три члена этого семейства являются аутосомно кодируемыми ацил-КоА: моноацилглицерин-ацилтрансферазами (MGAT1, -2 и -3; см.25), которые катализируют синтез DAG путем этерификации моноацилглицерина. Похоже, что реакция MGAT представляет собой важную альтернативу пути Кеннеди для синтеза DAG (и, следовательно, в конечном итоге триглицерида), который может быть особенно важен для всасывания пищевых жиров в кишечных энтероцитах.
Интересно, что три других члена семейства генов DGAT2 сгруппированы в довольно узкий Х-сцепленный локус размером ~ 200 т.п.н. два кодируют AWAT1 и -2 соответственно, которые синтезируют WE путем этерификации длинноцепочечных жирных спиртов (104).Реакция AWAT, по-видимому, особенно важна для себоцитов, потому что WE включает значительный компонент секреции сальных желез. Биохимическая функция последнего члена семейства генов DGAT2 (названного hDC3) еще предстоит определить. Выравнивание последовательностей показывает, что MGAT эволюционно тесно связаны друг с другом, тогда как AWAT1, AWAT2 и hDC3 сгруппированы вместе (). Члены семейства гена DGAT2, вероятно, произошли от предка, обладающего ацилтрансферазной активностью лизофосфатидовой кислоты, реакцией, которая требуется на последних стадиях биосинтеза фосфатидной кислоты.Эта гомология поддерживается во всем семействе генов DGAT2 человека и включает сохранение остатков в активных центрах бактериальных глицерин-3-фосфатацилтрансфераз. Семейства ферментов ACAT и DGAT2 консервативны для многих организмов, включая дрожжи и растения (79), как и семейство PDAT.
Эволюция семейств генов нейтральных липидов человека [ацил-КоА: холестерин-ацилтрансфераза (ACAT) и диацилглицерин-ацилтрансфераза 2 (DGAT2)] (дендрограммы, построенные с использованием ClustalW; круглые скобки и курсив указывают на ортологи дрожжей).Эволюционные отношения семейств генов ACAT и DGAT2 основаны на их соответствующих аминокислотных последовательностях. Не показана несвязанная 3-я реакция синтеза триацилглицерина, в которой в качестве донора ацила используются фосфолипиды, активность которых ограничена грибами и растениями. ARE , родственный ACAT фермент; MGAT, ацил-КоА: моноацилглицерин ацилтрансфераза; hDC3, последний член семейства генов DGAT2; AWAT, ацил-КоА: парафиноспиртовая ацилтрансфераза.
У человека DGAT1 высоко экспрессируется в тонкой кишке, толстой кишке, семенниках и скелетных мышцах человека с более низкими уровнями экспрессии в жировой ткани и печени (16, 76).DGAT2 также широко экспрессируется у людей, особенно в печени и жировой ткани (17). Было показано, что DGAT2 колокализируется и взаимодействует со стероил-КоА-десатуразой 1, ферментом, ответственным за образование мононенасыщенных жирных кислот (67). Это говорит о том, что DGAT2 играет важную роль в этерификации эндогенно образующихся мононенасыщенных жирных кислот. Характер экспрессии и взаимодействия белков DGAT указывает на то, что они могут выполнять разные функции в разных тканях.Разумно предположить, что DGAT1, вероятно, играет роль в переупаковке свободных жирных кислот в кишечнике с использованием пути моноацилглицерина после поглощения экзогенных жирных кислот или липолиза пищевых TAG в просвете кишечника, тогда как DGAT2 может функционировать в основном в синтезе и секреции TAG de novo. из печени в липопротеины и отложение в жировой ткани.
Учитывая критическую роль, которую нейтральные липиды играют во многих клеточных функциях, неудивительно, что существует множество путей биосинтеза.В чем же тогда причина генетической избыточности в семействе генов DGAT2? Хотя все его члены обладают активностью DGAT in vitro, было высказано предположение, что существование множества генов может быть связано с их специфическими паттернами тканевой экспрессии и альтернативными субстратными специфичностями. Например, мышиный MGAT1 экспрессируется в большинстве тканей, но не в кишечнике, что позволяет предположить, что он может играть важную роль в тканях, отличных от тонкой кишки (120). Напротив, MGAT2 и -3 экспрессируются в основном в кишечнике и, вероятно, являются ключевыми участниками переупаковки ТАГ внутри энтероцита (11, 13, 14, 26, 66, 118).Биохимически MGAT3 предпочитает 2-моноацилглицерин, преобладающий продукт липолиза TAG в кишечном тракте, но MGAT1 и -2 не обладают такой субстратной специфичностью и одинаково хорошо используют 1- и 3-моноацилглицерины. Интересно, что MGAT3 не обнаруживается у низших видов млекопитающих, и он наиболее широко экспрессируется в подвздошной кишке человека, которая находится дистальнее областей максимального поглощения липидов. Было также показано, что MGAT3 обладает довольно сильной активностью DGAT (12). Таким образом, точная роль MGAT3 в абсорбции липидов еще предстоит определить.
Х-связанная подгруппа семейства генов DGAT2 высоко экспрессируется в сальных железах человека и обладает значительной, но умеренной активностью DGAT. Однако два AWAT (AWAT1 и -2) опосредуют синтез WE (104), как и мышиный ортолог AWAT2 (27). Существование двух AWAT можно объяснить их разными профилями экспрессии и субстратной специфичностью. Экспрессия AWAT ограничена сальной железой специфическим для дифференцировки образом (104). AWAT2 ограничен недифференцированными периферическими себоцитами, тогда как AWAT1 экспрессируется в более зрелых, центрально расположенных клетках.AWAT1 отдает предпочтение жирным спиртам с более короткой цепью и насыщенным ацильным группам, тогда как AWAT2 предпочитает жирные спирты с более длинной цепью и ненасыщенные ацил-КоА. Этот профиль экспрессии и паттерн субстратной специфичности предполагает, что метаболизм WE отражает и может играть важную роль в дифференцировке себоцитов. Возможно, что по мере созревания себоцитов происходит цикл липолиза и повторной этерификации WE, так что WE модифицируются до их секреции на кожу. Это может служить для гомогенизации кожного сала с точки зрения насыщенности жирных кислот и спирта или длины цепи, так что достигается оптимальная гидрофобность и эффективность в качестве кожного барьера.
Модельные системы для изучения ацилтрансфераз
Дрожжевое генетическое расщепление DAG и стеролацилтрансфераз.
Дрожжи Saccharomyces cerevisiae предоставили чрезвычайно ценную эукариотическую систему для исследования метаболизма нейтральных липидов и анализа его роли во многих клеточных процессах. Помимо идентификации и характеристики членов различных членов семейства генов ацилтрансфераз человека (59, 76, 104), мы идентифицировали и удалили полный перечень генов синтеза ТАГ и СЭ в этой модели эукариот (78, 93, 115) ( ).В результате мы получили жизнеспособные штаммы дрожжей, в которых отсутствуют нейтральные липиды, и использовали эти штаммы для определения активности их человеческих аналогов (76, 104, 116).
Таблица 1.
Семейства генов нейтральных липидов сохраняются от человека до дрожжей
Семейство генов | |||||
|---|---|---|---|---|---|
| ACAT | DGAT2 | LCAT | |||
| Человек | ACAT1 | DGAT2 | LCAT | ||
| DGAT1 | |||||
| ACAT1 | |||||
| Дрожжи ( S.cerevisiae ) | ARE1 | DGA1 | LRO1 | ||
| ARE2 | |||||
В дрожжах ферменты 1 и 2, связанные с ACAT ( ARE1 и ARE2 ) являются ACAT млекопитающих. Клетки, в которых отсутствуют ARE1 и ARE2 , не способны этерифицировать стерины, но остаются жизнеспособными из-за адаптивного подавления синтеза эргостерина. В то время как ARE2 предпочитает эргостерин в качестве субстрата, ARE1 этерифицирует более широкий спектр стеролов и может служить как реакцией детоксикации, так и реакции накопления промежуточных продуктов биосинтеза стеролов (79).
В дрожжах три различных по структуре фермента определяют этерификацию DAG. Независимо от ацил-CoA, LRO1 , ортолог LCAT млекопитающих, опосредует синтез TAG, используя фосфолипиды в качестве доноров ацила в реакции PDAT (78). DGA1 , единственный дрожжевой ортолог человеческого DGAT2, который использует ацил-КоА в качестве донора ацила, отвечает за синтез оставшегося ТАГ в клетках, в которых отсутствует LRO1 (77). В то время как реакция LRO1 преобладает во время фазы экспоненциального роста дрожжей, реакция DGAT, опосредованная DGA1 , преобладает во время относительно спокойной стационарной фазы дрожжей.Удаление LRO1 снижает синтез ТАГ на ≤75% от нормального штамма, тогда как потеря DGA1 значительно снижает синтез ТАГ на ≤60%, в зависимости от условий культивирования. Дрожжевой ортолог DGAT1, ARE2 , играет второстепенную роль в синтезе ТАГ (76). Тройная делеция DGA1 , LRO1 и ARE2 в одном и том же штамме устраняет обнаруживаемые способности синтеза ТАГ у дрожжей. Кроме того, делеция ARE1 в таком штамме уничтожает способность таких клеток синтезировать SE и TAG.Впоследствии использование таких штаммов, лишенных нейтральных липидов, облегчило изучение ферментов млекопитающих, участвующих в синтезе нейтральных липидов (79).
Генетические модели плодовых мух и нематод при ожирении.
Распространенность ожирения среди западных популяций и его неприятие диетических вмешательств побудили к поиску модельных систем, с помощью которых можно было бы определить его генетическое происхождение (6). Большая часть понимания этой этиологии возникла в результате исследований инбредных или индуцированных мутантных систем грызунов (29, 30, 36–38, 43, 56–58, 89).В первую очередь, эти исследования изучали способ достижения или регулирования сытости и сосредоточились на нескольких аспектах эндокринологии и нейротрансмиссии. Некоторые подходы были сделаны на модельных организмах, таких как дрозофилы или нематоды, для дальнейшего понимания процессов, ведущих к ожирению. Например, adp , давно известная мутация, вызывающая ожирение у Drosophila , находится в эволюционно консервативном белке WD40 / тетратрикопептид-повторяющийся домен (42).Точно так же белки Drosophila , относящиеся к семейству факторов транскрипции мышей Tubby (88), и предполагаемая гидролаза a / b, CG3488 (110), консервативны и связаны с ожирением у мух. У дрозофилы было показано, что нарушение midway, белка, сходного по последовательности с DGAT1, приводит к гибели питательных клеток во время оогенеза. Фенотипическая характеристика и анализы DGAT in vitro демонстрируют, что промежуточные функции функционируют как DGAT и необходимы для образования нейтральных эфиров липидов в яичниках (10).Кроме того, полногеномное сканирование удаления генов, участвующих в накоплении жира у Caenorhabditis elegans , выявило многочисленные локусы, многие из которых имеют ортологи человека, которые либо способствуют, либо снижают накопление нейтральных липидов (3).
Обратные генетические модели ацилтрансфераз млекопитающих.
После молекулярной идентификации генов ферментов, участвующих в путях синтеза нейтральных липидов, с помощью трансгенных подходов были созданы многочисленные линии мышей. Фенотипическая характеристика этих штаммов значительно расширила наши знания о физиологических функциях этих ферментов.Удаление ACAT1 у мышей не влияет на уровень холестерина в сыворотке крови, но, что любопытно, способствует развитию атеросклероза (1, 35). ACAT1-нулевые мыши ( Acat1 — / — ) также страдают от сухости глаз из-за атрофических мейбомиевых желез и при скрещивании с рецептором липопротеинов низкой плотности (LDLR — / — ) или аполипопротеином E (апоЕ) Нокаут-мыши (ApoE — / — ) склонны к токсическому накоплению свободного холестерина в головном мозге и развитию обширных кожных ксантом из-за отложения холестерина в коже (112).Напротив, мыши, лишенные ACAT2 ( Acat2 — / — ), имеют нарушенное всасывание холестерина с пищей и устойчивы к индуцированной диетой гиперхолестеринемии и образованию желчных камней. В результате они защищены от развития атеросклероза на фоне апоЕ — / — (8, 109).
Влияние DGAT1 и DGAT2 на синтез ТАГ млекопитающих и энергетический гомеостаз также было подчеркнуто на мышиных моделях, дефицитных по этим генам. Хотя мыши, лишенные DGAT1 ( Dgat1 — / — ), демонстрируют на 50% меньше жира в организме и в остальном здоровы и плодовиты с нормальным уровнем ТАГ в сыворотке (95), у них наблюдается плохая выработка молока из-за недостаточного производства ТАГ в молочных железах, сухой шерсти. , атрофия сальных желез (95).Неожиданно фенотип сухого меха был связан с пониженным уровнем диэфиров воска, но не ТАГ, в коже. Это согласуется с исследованиями in vitro, предполагающими, что DGAT1 способен этерифицировать длинноцепочечные спирты и диалкоголы в WE и диэфиры, соответственно (119). Мыши Dgat1 — / — подтверждают, что DGAT1 играет важную роль в метаболизме ретинола благодаря своей активности ацил-КоА: ретинолацилтрансферазы. DGAT1 способен этерифицировать ретинол in vitro (75, 80, 119) и внутри энтероцита in vivo (111).Кроме того, у мышей Dgat1 — / — значительно снижена активность ацил-КоА: ретинол-ацилтрансферазы в печени, семенниках и почках (119) с повышенными уровнями неэтерифицированного ретинола в печени при употреблении диеты с высоким содержанием ретинола.
Несмотря на это, мыши Dgat1 — / — устойчивы к ожирению, вызванному диетой с высоким содержанием жиров и стеатозу печени, и имеют более низкие уровни глюкозы в плазме, связанные с повышенной чувствительностью к инсулину и лептину (95). Кроме того, трансплантация белой жировой ткани от мышей Dgat1 — / — мышам дикого типа сделала мышей дикого типа устойчивыми к ожирению с улучшенной чувствительностью к инсулину (21).Это предполагает, что факторы, происходящие из адипоцитов, ответственны за улучшение содержания жира в организме, утилизацию глюкозы и расход энергии в состоянии дефицита DGAT1.
Эти подходы были дополнены исследованиями, в которых DGAT1 сверхэкспрессировался либо в культуре клеток, либо в определенных тканях. Хотя мыши, которые сверхэкспрессируют DGAT1 в белой жировой ткани, становятся тучными из-за повышенного отложения ТАГ в адипоцитах, они чувствительны к инсулину и имеют нормальную утилизацию глюкозы (22). Сверхэкспрессия человеческого DGAT1 в клетках гепатомы крысы McA-RH7777 увеличивала синтез, клеточное накопление и секрецию ТАГ (59).Это связано со снижением внутриклеточной деградации и повышенной секрецией вновь синтезированного аполипопротеина B (апоВ). В соответствии с этими данными, мыши со сверхэкспрессией DGAT1 в печени обнаруживают повышенную секрецию ЛПОНП из печени (114). Эти исследования показывают, что печень способна адекватно компенсировать повышенную экспрессию DGAT1 в печени. Однако было показано, что кратковременная гиперэкспрессия DGAT1 в печени увеличивает содержание ТАГ в печени, но не продукцию ЛПОНП (71).
В отличие от здоровых физиологических изменений, связанных с дефицитом DGAT1, мыши Dgat2 — / — умирают в неонатальном периоде в результате серьезных дефектов проницаемости кожи и метаболической декомпенсации, связанной с заметным истощением ТАГ и свободных жирных кислот в организме. их ткани и плазма (99). DGAT1 не мог компенсировать потерю DGAT2, что подтверждает гипотезу о различных функциях двух ферментов. Таким образом, похоже, что DGAT2 является ферментом, ответственным за большую часть синтеза ТАГ у мышей.Хотя дефицит DGAT2, по-видимому, является дезадаптивным, когда экспрессия DGAT2 в печени подавляется введением DGAT2-специфических антисмысловых олигонуклеотидов у мышей дикого типа и мышей ob / ob с ожирением на диете с высоким содержанием жиров, наблюдается заметное снижение содержания ТАГ в печени. и стеатоз (121). Следует отметить, что когда антисмысловые олигонуклеотиды DGAT2 вводили мышам дикого типа и Dgat1 — / — , секреция VLDL снижалась дозозависимым образом, что подтверждает гипотезу о том, что DGAT2 отвечает за TAG, который предназначен для секреции в печени. (65).Таким образом, DGAT2 может быть законной мишенью для дислипидемических расстройств, таких как неалкогольная жировая болезнь печени.
Регуляция ацилтрансферазных реакций
Было показано, что ACAT регулируются трансляционными и посттрансляционными механизмами. МРНК ACAT1 увеличивается в печени и аорте после диеты, богатой холестерином (82, 105) или после того, как клетки HepG2 подвергаются воздействию свободных жирных кислот (93). Однако по большей части ACAT1 аллостерически активируется холестерином и оксистерином (24), но не жирными кислотами (19).Учитывая степень консервативности последовательности, кажется вероятным, что ACAT2 также аллостерически регулируется холестерином, хотя наблюдалась регуляция транскрипции этой изоформы (20, 61, 96, 107).
Реакция DGAT обеспечивает точку переключения для распределения ресурсов DAG ячейки, поскольку она находится в точке ветвления, где DAG используется для синтеза фосфолипида или TAG. В соответствии с этой гипотезой уровни мРНК DGAT1 увеличиваются в семь раз, когда клетки 3T3-L1 индуцируются инсулином и дексаметазоном для дифференцировки в адипоциты.Это дает примерно 90-кратное увеличение белка DGAT1 и активности DGAT (122). Однако, когда DGAT1 сверхэкспрессируется в недифференцированных клетках 3T3-L1, 20-40-кратное увеличение мРНК связано со умеренным 2-3-кратным увеличением активности DGAT, что позволяет предположить, что DGAT1 ограничивает скорость синтеза TAG. Экспрессия DGAT2 также увеличивается в 30 раз во время дифференцировки клеток 3T3-L1; его экспрессия еще больше увеличивается, когда клетки обрабатывают глюкозой и инсулином (70). По-видимому, глюкоза преимущественно увеличивает экспрессию мРНК DGAT1, тогда как инсулин увеличивает уровень мРНК DGAT2.Однако, когда голодных мышей давали пищу с высоким содержанием углеводов, DGAT2, но не DGAT1, мРНК увеличивалась в печени, жировой ткани и тонком кишечнике.
На сегодняшний день имеется небольшое количество данных, свидетельствующих о том, что DGAT1 и DGAT2 регулируются специфическими факторами транскрипции. Тиазолиндионы, которые активируют рецептор-γ, активируемый пролифератором пероксисом, увеличивают мРНК DGAT1 в жировых клетках и тканях (84). Было показано, что CCAAT / связывающие энхансер белки (C / EBPβ и C / EBPα) увеличивают экспрессию DGAT2 во время адипогенеза (83).В последнее время возрос интерес к развернутой реакции белка как следствие клеточного стресса и как индуктору липогенеза de novo. Х-бокс-связывающий белок-1 регулирует ответ развернутого белка и, как было показано, увеличивает экспрессию DGAT2 в печени, тогда как недостаток печеночного Х-бокс-связывающего белка-1 приводит к снижению содержания липидов в печени (55). DGAT1 и -2 также могут регулироваться сигнальным путем MEK / ERK (102).
Патофизиологические последствия ацилтрансферазных реакций
Неэтерифицированные спирты (холестерин и DAG) и свободные жирные кислоты в конечном итоге липотоксичны для всех эукариотических клеток, и это их отложение в виде нейтральных липидов [прежде всего в виде SE и триглицерида (TG)] в липоплазматических каплях цитоплазмы. который представляет собой безопасное убежище для этих биологически активных молекул.Как ни странно, отложение нейтральных липидов тесно связано с несколькими заболеваниями, такими как ожирение, диабет, атеросклероз и неалкогольная жировая болезнь печени. Таким образом, биосинтез нейтральных липидов представляет собой важный аспект липидного гомеостаза при избытке реакционных субстратов (то есть типичная диета в развитых странах). Хотя патофизиологические разветвления повышенного содержания нейтральных липидов ясны, важность этих молекул и цитоплазматических липидных капель, в которых они находятся в оптимальной липидно-сбалансированной клетке, неизвестна.
Исследования, в которых происходит сверхэкспрессия нейтральных липидсинтезирующих ферментов, подчеркивают последствия перегрузки нейтральными липидами. Когда человеческий ACAT1 сверхэкспрессируется в печени мышей LDLR, — / — , печеночный CE увеличивается с последующим увеличением плазменных VLDL, холестерина и TAG (97). В культивируемых клетках McA-RH7777 избыточная экспрессия человеческого ACAT1 или ACAT2 приводила к увеличению синтеза, клеточного накопления и секреции CE, а также к снижению деградации апоВ VLDL (59).Эти исследования показывают, что CE, образованные ACAT, играют важную роль в регуляции сборки и секреции апоВ-содержащих липопротеинов. Недавно также было показано, что индуцированная диабетом дислипидемия, наблюдаемая у крыс с диабетом, вызванным стрептозотоцином, частично связана с повышением активности ACAT2 в кишечнике (45).
Несколько исследований документально подтвердили роль DGAT печени в развитии стеатоза печени. Мыши, сверхэкспрессирующие DGAT1 в печени, демонстрируют повышенную секрецию печеночных VLDL и, что интересно, повышенное содержание гонадного, но не подкожного жира (114).В том же исследовании у мышей, которые сверхэкспрессируют DGAT2 в печени, накапливается значительное количество ТАГ. Это согласуется с гипотезой о том, что DGAT1 играет большую роль в сборке VLDL, тогда как DGAT2 способствует накоплению цитозольных TAG и развитию стеатоза. Кратковременная гиперэкспрессия DGAT1 и DGAT2 в печени увеличивает содержание ТАГ в печени, но не влияет на продукцию ЛПОНП (71). В обеих моделях сверхэкспрессии содержание цитозольных, но не микросомальных липидов значительно увеличивалось. Это предполагает, что при наличии адекватных запасов липидов в печени другие факторы, помимо синтеза ТАГ, могут ограничивать скорость продукции ЛПОНП.В другом исследовании сверхэкспрессия DGAT2 в печени мышей приводила к стеатозу без развития инсулинорезистентности, что указывает на то, что стеатоз печени может возникать независимо от инсулинорезистентности (72). Это говорит о том, что для развития инсулинорезистентности могут потребоваться другие факторы, помимо содержания ТАГ. Таким образом, точная роль DGAT в метаболизме ТГ в печени и развитии неалкогольной жировой болезни печени еще предстоит определить.
Несмотря на множество нарушений, связанных с накоплением нейтральных липидов, недавние данные свидетельствуют о том, что нейтральные липиды могут выполнять важные цитопротекторные функции (103).Свободные жирные кислоты, стерины и потенциально DAG являются токсичными, но важными компонентами всех эукариотических клеток. Таким образом, для каждой из этих молекул существуют сложные, часто перекрывающиеся механизмы, которые работают для оптимизации их уровней. Этот гомеостаз включает несколько уровней регуляции, включая контроль синтеза (транскрипционный и / или посттрансляционный), экспорт и, наконец, детоксикацию ацилтрансферазами, описанными здесь. Когда эти системы сдержек и противовесов нарушаются, возникает липотоксичность.Например, когда у делящихся дрожжей Schizosacharomyces pombe (123) отсутствуют ферменты, ответственные за синтез ТАГ, апоптоз возникает в результате накопления длинноцепочечных насыщенных жирных кислот, таких как пальмитат и стеарат. Денудация аппарата синтеза ТАГ и капель ТАГ делает эти клетки чувствительными ко всем жирным кислотам, включая мононенасыщенные свободные жирные кислоты, такие как олеат. Кроме того, штаммы Saccharomyces cerevisiae , лишенные всех нейтральных липидов, проявляют гиперчувствительность к ненасыщенным жирным кислотам (40).В этой модели гибель клеток включает активацию стрессовых путей, таких как ответ развернутого белка, кульминацией которого является апоптоз. Это заметно похоже на индукцию липоапоптоза во многих типах клеток млекопитающих, включая β-клетки поджелудочной железы и клетки гепатомы крысы (31, 81). В ходе этих исследований было продемонстрировано, что биосинтез нейтральных липидов является защитным шагом против липотоксичности (64, 91).
В соответствии с этой гипотезой избыточное накопление жирных кислот в фибробластах Dgat1 — / — приводит к липотоксичности и гибели клеток (62).Кроме того, трансгенные мыши, которые сверхэкспрессируют DGAT1 в белой жировой ткани, становятся тучными из-за отложения ТАГ в адипоцитах, но неожиданно оказываются чувствительными к инсулину при нормальном удалении глюкозы и неизменном содержании ТАГ в печени, несмотря на повышенное содержание свободных жирных кислот в плазме (22). Таким образом, специфическая для жировой ткани избыточная экспрессия DGAT1 может защищать печень, направляя липотоксичные свободные жирные кислоты в сторону синтеза ТГ в жировой ткани, а не в чувствительных к инсулину тканях, таких как печень. Защитная роль нейтральных липидов также была подчеркнута у лиц с липодистрофией, у которых отсутствуют жировые отложения для ТАГ и которые резистентны к инсулину, с диабетом типа II, дислипидемией и выраженным стеатозом печени (94).В соответствии с этим, когда DGAT1 сверхэкспрессируется в адипоцитах мышей FVB, устойчивых к ожирению, развивается выраженный стеатоз печени в сочетании с резистентностью к ожирению, повышенным содержанием свободных жирных кислот в плазме и резистентностью к инсулину (23). Таким образом, кажется, что инсулинорезистентность и стеатоз печени более тесно связаны с повышенным воздействием свободных жирных кислот и накоплением ТГ в чувствительных к инсулину тканях, таких как печень, а не в жировой ткани.
Недавно также было показано, что, хотя антисмысловой олиго-опосредованный нокдаун DGAT2 в печени снижает стеатоз, улучшает чувствительность к инсулину и снижает вес у мышей с ожирением, не подверженных алкогольному стеатогепатиту, он связан с заметно повышенным содержанием свободных жирных кислот в печени, повышенным содержанием сыворотки крови. трансаминазы, лобулярное некровоспаление и обострение фиброза (113).Маркеры перекисного окисления липидов и окислительного стресса, второго «удара» при неалкогольной жировой болезни печени, заметно увеличиваются в этой модели, несмотря на снижение экспрессии в печени фактора некроза опухоли-α. Таким образом, возможно, что гепатолипотоксичность и прогрессирование фиброза развиваются, когда способность клеток к отложению свободных жирных кислот нарушается или когда пулы ТГ гидролизуются, увеличивая воздействие токсичных свободных жирных кислот.
Липотоксичность также связана с кардиомиопатией, диабетом 1 и 2 типа, врожденными и приобретенными липодистрофиями и ожирением.Чрезмерные уровни свободных жирных кислот характеризуют эти синдромы, и способность хранить эти молекулы в виде ТАГ в жировой ткани, вероятно, представляет собой важный этап выживания. И наоборот, индукция липоапоптоза в не жировых тканях, таких как поджелудочная железа или сердце, в ответ на накопление свободных жирных кислот, может быть основным фактором заболеваний, связанных с перееданием и пожилым возрастом (106). Цитотоксичность насыщенных жирных кислот, таких как пальмитат, сопоставима с повышенными уровнями церамидов и / или активных форм кислорода (44, 63).С другой стороны, олеиновая кислота мононенасыщенных жирных кислот является наиболее распространенной жирной кислотой в жировой ткани (47) и, как сообщается, способствует апоптозу за счет активации серин / треониновых протеинфосфатаз, таких как PP2Ca / b (92). Следовательно, как насыщенные, так и ненасыщенные жирные кислоты являются проапоптотическими для нескольких типов клеток (69), но каждый может достигать своего эффекта с помощью разных механизмов. Кроме того, все больше данных указывает на то, что стресс эндоплазматического ретикулума и индукция ответа развернутого белка также могут быть вовлечены в липотоксический путь как для насыщенных, так и для ненасыщенных жирных кислот (5, 81).
Выводы
Устойчивость нейтральных липидов как в результате эволюции, так и в различных типах клеток, а также способ возникновения нескольких различных реакций ацилтрансферазы, несомненно, отражает их физиологическое значение. С нашей точки зрения, селективное преимущество, предоставляемое этими генами, представляет собой в первую очередь защиту от липотоксичности субстратов, которые сами по себе часто являются необходимыми. Продукты реакции впоследствии приобрели функции, которые не зависят от накопления липидов, часто в качестве барьеров проницаемости в коже, роговице и, возможно, других тканях у млекопитающих и кутикуле растений.Интересно, что обычным дефектом у животных, лишенных какой-либо из ацилтрансфераз, является потеря целостности эпидермиса. И это несмотря на очевидную избыточность этих семейств генов, что позволяет предположить, что состав этих масел так же важен, как и общие уровни.
Множественность задействованных генов (например, 3 гена ACAT и 7 DGAT2 у людей) отражает события дупликации генов, которые затем придали способность этерифицировать альтернативные спирты, возможно, с тканеспецифическими паттернами и в ответ на различные стимулы ().Хотя члены семейства генов DGAT2 являются классическим примером физиологической избыточности, точные механизмы, с помощью которых они регулируются и экспрессируются в конкретных тканях, еще предстоит определить. Если реакции продуктов семейства генов DGAT2 протекают аналогично другим ацилтрансферазам, можно предположить, что их механизмы регуляции схожи. Альтернативно, их изменяющаяся экспрессия и паттерны субстратной специфичности могут указывать на разные способы регуляции. Эти факторы еще предстоит определить.Столь же неясна природа активных центров, определяющих специфичность субстрата. Выяснение любого из этих аспектов биосинтеза нейтральных липидов представляет собой неиспользованный путь фармакологии, который может оказать значительное влияние на лечение нескольких синдромов болезней человека.
Таблица 2.
Первичная активность ацилтрансфераз нейтральных липидов человека
| Фермент | Предпочтительный субстрат | Продукт | |||
|---|---|---|---|---|---|
| ACAT1 и -2 | Свободный холестерин | Сложный эфир холестерина | G 1 и -2 | Диацилглицерин | Триглицерид |
| AWAT1 | Короткоцепочечные спирты | Сложный эфир воска | |||
| AWAT2 | Длинноцепочечные спирты | Сложный эфир воска | |||
| MGAT1 и -2 1- и 2-моноацилглицерин | Диацилглицерин | ||||
| MGAT3 | 2-Моноацилглицерин | Диацилглицерин |
Липиды | Биология для майоров I
Иллюстрирует различные типы липидов и связывает их структуру с их ролью в биологических системах
В результате мы обсудим липиды или жиры и их роль в нашем организме.
Цели обучения
- Различать разные виды липидов
- Определить несколько основных функций липидов
Рис. 1. Гидрофобные липиды в мехе водных млекопитающих, таких как речная выдра, защищают их от непогоды. (кредит: Кен Босма)
Липиды включают разнообразную группу соединений, которые в значительной степени неполярны по природе. Это потому, что они представляют собой углеводороды, которые включают в основном неполярные углерод-углеродные или углерод-водородные связи.Неполярные молекулы гидрофобны («водобоязнь») или нерастворимы в воде. Липиды выполняют в клетке множество различных функций. Клетки хранят энергию для длительного использования в виде жиров. Липиды также обеспечивают изоляцию растений и животных от окружающей среды (рис. 1). Например, они помогают водным птицам и млекопитающим оставаться сухими, образуя защитный слой над мехом или перьями из-за их водоотталкивающих гидрофобных свойств. Липиды также являются строительными блоками многих гормонов и являются важной составной частью всех клеточных мембран.Липиды включают жиры, масла, воски, фосфолипиды и стероиды.
Жиры и масла
Молекула жира состоит из двух основных компонентов — глицерина и жирных кислот. Глицерин — это органическое соединение (спирт) с тремя атомами углерода, пятью атомами водорода и тремя гидроксильными (ОН) группами. Жирные кислоты имеют длинную цепь углеводородов, к которой присоединена карбоксильная группа, отсюда и название «жирная кислота». Количество атомов углерода в жирной кислоте может составлять от 4 до 36; наиболее распространены те, которые содержат 12–18 атомов углерода.В молекуле жира жирные кислоты присоединены к каждому из трех атомов углерода молекулы глицерина сложноэфирной связью через атом кислорода (рис. 2).
Рис. 2. Триацилглицерин образуется в результате присоединения трех жирных кислот к основной цепи глицерина в реакции дегидратации. При этом выделяются три молекулы воды.
Во время образования сложноэфирной связи высвобождаются три молекулы воды. Три жирные кислоты в триацилглицерине могут быть одинаковыми или разными.Жиры также называют триацилглицеридами или триглицеридами из-за их химической структуры. Некоторые жирные кислоты имеют общие названия, указывающие на их происхождение. Например, пальмитиновая кислота, насыщенная жирная кислота , получена из пальмы. Арахидовая кислота получена из Arachis hypogea, — научного названия арахиса или арахиса.
Жирные кислоты могут быть насыщенными и ненасыщенными. В цепи жирной кислоты, если есть только одинарные связи между соседними атомами углерода в углеводородной цепи, жирная кислота называется насыщенной.Насыщенные жирные кислоты насыщены водородом; другими словами, максимальное количество атомов водорода, прикрепленных к углеродному скелету. Стеариновая кислота является примером насыщенной жирной кислоты (рис. 3)
Рис. 3. Стеариновая кислота — обычная насыщенная жирная кислота.
Когда углеводородная цепь содержит двойную связь, жирная кислота считается ненасыщенной. Олеиновая кислота является примером ненасыщенной жирной кислоты (рис. 4).
Рис. 4. Олеиновая кислота — обычная ненасыщенная жирная кислота.
Большинство ненасыщенных жиров являются жидкими при комнатной температуре и называются маслами. Если в молекуле есть одна двойная связь, то он известен как мононенасыщенный жир (например, оливковое масло), а если имеется более одной двойной связи, то он известен как полиненасыщенный жир (например, масло канолы).
Когда жирная кислота не имеет двойных связей, она известна как насыщенная жирная кислота, потому что к атомам углерода цепи больше нельзя добавлять водород. Жир может содержать похожие или разные жирные кислоты, присоединенные к глицерину.Длинные прямые жирные кислоты с одинарными связями имеют тенденцию плотно упаковываться и остаются твердыми при комнатной температуре. Примерами насыщенных жиров являются животные жиры со стеариновой кислотой и пальмитиновой кислотой (обычно в мясе) и жир с масляной кислотой (обычно в сливочном масле). Млекопитающие хранят жиры в специализированных клетках, называемых адипоцитами, где жировые шарики занимают большую часть объема клетки. В растениях жир или масло хранятся во многих семенах и используются в качестве источника энергии во время развития рассады. Ненасыщенные жиры или масла обычно растительного происхождения и содержат цис- ненасыщенных жирных кислот. цис и транс указывают конфигурацию молекулы вокруг двойной связи. Если водороды присутствуют в одной плоскости, это называется цис-жиром; если атомы водорода находятся в двух разных плоскостях, это называют трансжиром. Двойная связь цис вызывает изгиб или «перегиб», который препятствует плотной упаковке жирных кислот, сохраняя их в жидком состоянии при комнатной температуре (рис. 5). Оливковое масло, кукурузное масло, масло канолы и жир печени трески являются примерами ненасыщенных жиров.Ненасыщенные жиры помогают снизить уровень холестерина в крови, тогда как насыщенные жиры способствуют образованию бляшек в артериях.
Рис. 5. У насыщенных жирных кислот углеводородные цепи соединены только одинарными связями. Ненасыщенные жирные кислоты имеют одну или несколько двойных связей. Каждая двойная связь может иметь цис- или транс-конфигурацию. В цис-конфигурации оба атома водорода находятся на одной стороне углеводородной цепи. В транс-конфигурации атомы водорода находятся на противоположных сторонах. Цис-двойная связь вызывает перегиб в цепи.
Трансжиры
В пищевой промышленности масла искусственно гидрогенизируются для придания им полутвердого состояния и консистенции, необходимой для многих обработанных пищевых продуктов. Проще говоря, газообразный водород пропускают через масла, чтобы отвердить их. Во время этого процесса гидрирования двойные связи конформации цис — в углеводородной цепи могут быть преобразованы в двойные связи в конформации транс -.
Маргарин, некоторые виды арахисового масла и шортенинг являются примерами искусственно гидрогенизированных жиров транс .Недавние исследования показали, что увеличение транс жиров в рационе человека может привести к увеличению уровня липопротеинов низкой плотности (ЛПНП) или «плохого» холестерина, что, в свою очередь, может привести к отложению бляшек в артериях, что приводит к болезни сердца. Многие рестораны быстрого питания недавно запретили использование жиров trans , а на этикетках продуктов питания должно быть указано содержание жира trans .
Омега жирные кислоты
Рис. 6. Альфа-линоленовая кислота является примером жирной кислоты омега-3.Он имеет три двойные цис-связи и, как следствие, изогнутую форму. Для ясности атомы углерода не показаны. Каждый односвязанный углерод имеет два связанных с ним атома водорода, которые также не показаны.
Незаменимые жирные кислоты — это жирные кислоты, которые необходимы, но не синтезируются человеческим организмом. Следовательно, они должны приниматься через диету. Жирные кислоты омега-3 (подобные тем, которые показаны на рисунке 6) попадают в эту категорию и являются одной из двух, известных человеку (другая — жирная кислота омега-6).Это полиненасыщенные жирные кислоты, называемые омега-3, потому что третий углерод от конца углеводородной цепи соединен с соседним углеродом двойной связью.
Самый дальний углерод от карбоксильной группы нумеруется как углерод омега ( ω ), и если двойная связь находится между третьим и четвертым углеродом от этого конца, она известна как жирная кислота омега-3. К жирным кислотам омега-3, важным с точки зрения питания, поскольку они их не вырабатываются, относятся альфа-линолевая кислота (ALA), эйкозапентаеновая кислота (EPA) и докозагексаеновая кислота (DHA), все из которых являются полиненасыщенными.Лосось, форель и тунец — хорошие источники жирных кислот омега-3. Исследования показывают, что жирные кислоты омега-3 снижают риск внезапной смерти от сердечных приступов, снижают уровень триглицеридов в крови, снижают кровяное давление и предотвращают тромбоз, подавляя свертывание крови. Они также уменьшают воспаление и могут помочь снизить риск некоторых видов рака у животных.
Как и углеводы, жиры получили широкую огласку. Это правда, что чрезмерное употребление жареной и другой «жирной» пищи приводит к увеличению веса.Однако жиры выполняют важные функции. Многие витамины жирорастворимы, а жиры служат формой длительного хранения жирных кислот: источником энергии. Они также обеспечивают изоляцию тела. Поэтому «здоровые» жиры в умеренных количествах следует употреблять регулярно.
Воски
Рис. 7. Восковые покрытия некоторых листьев состоят из липидов. (кредит: Роджер Гриффит)
Воск покрывает перья некоторых водных птиц и поверхность листьев некоторых растений.Из-за гидрофобной природы восков они предотвращают прилипание воды к поверхности (рис. 7). Воски состоят из длинных цепей жирных кислот, этерифицированных до длинноцепочечных спиртов.
Фосфолипиды
Фосфолипиды являются основными составляющими плазматической мембраны, самого внешнего слоя клеток животных. Как и жиры, они состоят из цепей жирных кислот, прикрепленных к глицериновой или сфингозиновой основе. Однако вместо трех жирных кислот, связанных, как в триглицеридах, есть две жирные кислоты, образующие диацилглицерин, а третий углерод глицеринового остова занят модифицированной фосфатной группой (рис. 8).
Рис. 8. Фосфолипид — это молекула с двумя жирными кислотами и модифицированной фосфатной группой, присоединенными к глицериновой основной цепи. Фосфат можно модифицировать добавлением заряженных или полярных химических групп. Здесь показаны две химические группы, которые могут модифицировать фосфат, холин и серин. И холин, и серин присоединяются к фосфатной группе в положении, обозначенном R.
.Сама по себе фосфатная группа, присоединенная к диаглицерину, не квалифицируется как фосфолипид; это фосфатидат (диацилглицерин-3-фосфат), предшественник фосфолипидов.Фосфатная группа модифицируется спиртом. Фосфатидилхолин и фосфатидилсерин — два важных фосфолипида, которые содержатся в плазматических мембранах. Фосфолипид — это амфипатическая молекула, что означает, что он имеет гидрофобную и гидрофильную части. Цепи жирных кислот гидрофобны и не могут взаимодействовать с водой, тогда как фосфатсодержащая группа гидрофильна и взаимодействует с водой (рис. 9).
Рис. 9. Фосфолипидный бислой является основным компонентом всех клеточных мембран.Гидрофильные головные группы фосфолипидов обращены к водному раствору. Гидрофобные хвосты изолированы в середине бислоя.
Голова — это гидрофильная часть, а хвост содержит гидрофобные жирные кислоты. В мембране бислой фосфолипидов образует матрицу структуры, жирнокислотные хвосты фосфолипидов обращены внутрь, от воды, тогда как фосфатная группа обращена к внешней, водной стороне (рис. 9).
Фосфолипиды отвечают за динамический характер плазматической мембраны.Если капля фосфолипидов помещается в воду, она спонтанно образует структуру, известную как мицелла, где гидрофильные фосфатные головки обращены наружу, а жирные кислоты обращены внутрь этой структуры.
Стероиды
В отличие от фосфолипидов и жиров, рассмотренных ранее, стероиды имеют структуру конденсированного кольца. Хотя они не похожи на другие липиды, они сгруппированы с ними, поскольку они также гидрофобны и нерастворимы в воде. Все стероиды имеют четыре связанных углеродных кольца, и некоторые из них, как и холестерин, имеют короткий хвост (рис. 10).Многие стероиды также имеют функциональную группу –ОН, которая помещает их в классификацию алкоголя (стерины).
Рис. 10. Стероиды, такие как холестерин и кортизол, состоят из четырех конденсированных углеводородных колец.
Холестерин — самый распространенный стероид. Холестерин в основном синтезируется в печени и является предшественником многих стероидных гормонов, таких как тестостерон и эстрадиол, которые секретируются гонадами и железами внутренней секреции. Он также является предшественником витамина D. Холестерин также является предшественником солей желчных кислот, которые помогают в эмульгировании жиров и их последующем усвоении клетками.Хотя неспециалисты часто отзываются о холестерине отрицательно, он необходим для нормального функционирования организма. Он является компонентом плазматической мембраны клеток животных и находится внутри фосфолипидного бислоя. Будучи самой внешней структурой в клетках животных, плазматическая мембрана отвечает за транспорт материалов и распознавание клеток, а также участвует в межклеточной коммуникации.
Чтобы получить дополнительную информацию о липидах, изучите эту интерактивную анимацию.Вкратце: Липиды
Липиды — это класс макромолекул, неполярных и гидрофобных по природе.Основные типы включают жиры и масла, воски, фосфолипиды и стероиды. Жиры представляют собой запасенную форму энергии и также известны как триацилглицерины или триглицериды. Жиры состоят из жирных кислот и глицерина или сфингозина. Жирные кислоты могут быть ненасыщенными или насыщенными, в зависимости от наличия или отсутствия двойных связей в углеводородной цепи. Если присутствуют только одинарные связи, они известны как насыщенные жирные кислоты. Ненасыщенные жирные кислоты могут иметь одну или несколько двойных связей в углеводородной цепи.Фосфолипиды составляют матрицу мембран. Они имеют глицериновую или сфингозиновую основу, к которой присоединены две цепи жирных кислот и фосфатсодержащая группа. Стероиды — это еще один класс липидов. Их основная структура состоит из четырех сплавленных углеродных колец. Холестерин — это тип стероидов, важный компонент плазматической мембраны, где он помогает поддерживать жидкую природу мембраны. Он также является предшественником стероидных гормонов, таких как тестостерон.
Проверьте свое пониманиеОтветьте на вопросы ниже, чтобы увидеть, насколько хорошо вы понимаете темы, затронутые в предыдущем разделе.В этой короткой викторине , а не засчитываются в вашу оценку в классе, и вы можете пересдавать ее неограниченное количество раз.
Используйте этот тест, чтобы проверить свое понимание и решить, следует ли (1) изучить предыдущий раздел дальше или (2) перейти к следующему разделу.
3.6: Липиды — Biology LibreTexts
Ням!
Он блестит жиром, от сыра до стейка. Возможно, вы никогда не были в Филадельфии, но, вероятно, знаете о ее знаменитом гастрономическом изюминке — филадельфийском чизстейке, изображенном здесь.И сыр, и стейк — это, как правило, продукты с высоким содержанием жира, поэтому этот бутерброд определенно не рекомендуется, если вы соблюдаете диету с низким содержанием жиров. Для хорошего здоровья нам нужны жиры, но слишком много хорошего может нанести вред нашему здоровью, каким бы вкусным оно ни было. Какие жиры? И почему у нас с ними такие отношения любви-ненависти? Читай дальше что бы узнать.
Рисунок \ (\ PageIndex {1} \): Philly Cheesesteak SandwichЛипиды и жирные кислоты
На самом деле жиры представляют собой липиды. Липиды — это основной класс биохимических соединений, который включает масла, а также жиры. Организмы используют липиды для хранения энергии и для многих других целей.
Молекулы липидов состоят в основном из повторяющихся единиц, называемых жирными кислотами. Существует два типа жирных кислот: насыщенные жирные кислоты и ненасыщенные жирные кислоты. Оба типа состоят в основном из простых цепочек атомов углерода, связанных друг с другом и с атомами водорода. Эти два типа жирных кислот различаются количеством атомов водорода, которые они содержат.
Насыщенные жирные кислоты
В насыщенных жирных кислотах атомы углерода связаны с максимально возможным количеством атомов водорода. Все атомы углерода к углероду имеют между собой только одинарные связи. Это заставляет молекулы образовывать прямые цепочки, как показано на рисунке \ (\ PageIndex {2} \). Прямые цепи могут быть очень плотно упакованы, что позволяет им накапливать энергию в компактной форме. Насыщенные жирные кислоты имеют относительно высокие температуры плавления, что объясняет их твердость при комнатной температуре.Животные используют насыщенные жирные кислоты для хранения энергии.
Ненасыщенные жирные кислоты
В ненасыщенных жирных кислотах некоторые атомы углерода не связаны с максимально возможным количеством атомов водорода. Вместо этого они образуют двойные или даже тройные связи с другими атомами углерода. Это приводит к изгибу цепей (см. Рисунок \ (\ PageIndex {2} \)). Гнутые цепи нельзя уложить очень плотно. Ненасыщенные жирные кислоты имеют относительно низкие температуры плавления, что объясняет, почему они являются жидкими при комнатной температуре.Растения используют ненасыщенные жирные кислоты для хранения энергии.
Мононенасыщенные жирные кислоты содержат на один атом водорода меньше, чем цепь насыщенных жирных кислот такой же длины. Мононенасыщенные жирные кислоты являются жидкими при комнатной температуре, но начинают затвердевать при температуре холодильника. Хорошие пищевые источники мононенасыщенных жиров включают оливковое и арахисовое масла и авокадо.
Полиненасыщенные жирные кислоты содержат как минимум на два атома водорода меньше, чем цепь насыщенных жирных кислот такой же длины.Полиненасыщенные жирные кислоты являются жидкими при комнатной температуре и остаются в жидком состоянии в холодильнике. Хорошие пищевые источники полиненасыщенных жиров включают сафлоровое и соевое масла, а также многие орехи и семена.
Рисунок \ (\ PageIndex {2} \): модели жирных кислот. Синие шары, белые шары и красные шары представляют собой углерод, водород и кислород соответственно. Насыщенные жирные кислоты, такие как арахидовая, стеариновая и пальмитиновая, имеют прямые цепи. Ненасыщенные жирные кислоты имеют изогнутые цепи. Мононенасыщенные жирные кислоты, такие как эруковая и олеиновая, имеют одинарную двойную связь между атомами углерода, создающую единственный изгиб в цепи.Полиненасыщенные жирные кислоты, такие как арахидовая и линолевая, имеют несколько двойных углерод-углеродных связей, образующих несколько изгибов.Типы липидов
Липиды могут состоять только из жирных кислот, или они могут также содержать другие молекулы. Например, некоторые липиды содержат спиртовые или фосфатные группы. Типы липидов включают триглицериды, фосфолипиды и стероиды. У каждого типа есть разные функции в живых существах.
Триглицериды
Триглицериды образуются путем объединения молекулы глицерина с тремя молекулами жирных кислот.Глицерин (также называемый глицерином) — это простое соединение, известное как сахарный спирт. Это бесцветная жидкость без запаха, сладкая на вкус и нетоксичная. Триглицериды — основная составляющая жировых отложений человека и других животных. Они также содержатся в жирах, полученных из растений. Существует много различных типов триглицеридов, в основном те, которые содержат насыщенные жирные кислоты, и те, которые содержат ненасыщенные жирные кислоты.
В кровотоке человека триглицериды играют важную роль в обмене веществ в качестве источников энергии и переносчиков пищевых жиров.Они содержат в два раза больше энергии, чем углеводы — другой важный источник энергии в рационе. Когда вы едите, ваше тело превращает калории, которые ему не нужны сразу, в триглицериды, которые хранятся в ваших жировых клетках. Когда вам нужна энергия между приемами пищи, гормоны вызывают выброс некоторых из этих триглицеридов обратно в кровоток.
Рисунок \ (\ PageIndex {3} \): молекула триглицерида. Левая часть этой молекулы триглицерида представляет собой глицерин. Каждая из трех длинных цепей справа представляет собой разные жирные кислоты.Сверху вниз жирными кислотами являются пальмитиновая кислота, олеиновая кислота и альфа-линоленовая кислота. Эти жирные кислоты показаны на рисунке \ (\ PageIndex {2} \). Химическая формула этого триглицерида \ (\ ce {C55H98O6} \). КЛЮЧ: H = водород, C = углерод, O = кислород.Фосфолипиды
Фосфолипиды являются основным компонентом клеточных мембран всех живых существ. Каждая молекула фосфолипида имеет «хвост», состоящий из двух длинных жирных кислот, и «голову», состоящую из фосфатной группы и молекулы глицерина (см. Диаграмму ниже).Фосфатная группа представляет собой небольшую отрицательно заряженную молекулу. Головка фосфолипида , гидрофильная или притягивается к воде. Жирнокислотный хвост фосфолипида гидрофобен или отталкивается водой. Эти свойства позволяют фосфолипидам образовывать двухслойную или двухслойную клеточную мембрану.
Как показано на диаграмме ниже, фосфолипидный бислой образуется, когда многие молекулы фосфолипидов выстраиваются в линию от хвоста к хвосту, образуя внутреннюю и внешнюю поверхность гидрофильных головок. Гидрофильные головки указывают как на водянистое внеклеточное пространство, так и на водянистое внутриклеточное пространство (просвет) клетки.
Рисунок \ (\ PageIndex {4} \): бислой фосфолипидов состоит из двух соседних листов фосфолипидов, расположенных хвостом к хвосту. Гидрофобные хвосты соединяются друг с другом, образуя внутреннюю часть мембраны. Полярные головки контактируют с жидкостью внутри и снаружи ячейки.Стероиды
Стероиды — липиды с кольцевой структурой. Каждый стероид имеет ядро из семнадцати атомов углерода, расположенных в четыре кольца по пять или шесть атомов углерода в каждом (см. Модель, изображенную ниже).Стероиды различаются другими компонентами, прикрепленными к этому ядру с четырьмя кольцами. Сотни стероидов содержатся в растениях, животных и грибах, но большинство стероидов выполняют одну из двух основных биологических функций: некоторые стероиды, такие как холестерин, являются важными компонентами клеточных мембран; многие другие стероиды представляют собой гормоны, являющиеся молекулами-посредниками. У людей стероидные гормоны включают кортизон, гормон борьбы или бегства; и половые гормоны эстроген и тестостерон.
Рисунок \ (\ PageIndex {5} \): Каждая молекула стероида состоит из четырехкольцевого ядра из 17 атомов углерода (черные шары в модели).Красные шары представляют кислород, а белые шары представляют водород в модели. Компоненты молекулы могут варьироваться и определять функцию стероида.Характеристика: Мое человеческое тело
Во время планового осмотра у семейного врача у вас был взят анализ липидного профиля. Результаты вернулись, и ваш уровень триглицеридов составляет 180 мг / дл. Ваш врач говорит, что это немного завышено. Нормальным считается уровень триглицеридов в крови 150 мг / дл или ниже. Более высокий уровень триглицеридов в крови связан с повышенным риском атеросклероза, сердечных заболеваний и инсульта.
Если анализ крови показывает, что у вас высокий уровень триглицеридов, их можно снизить с помощью здорового образа жизни и / или приема лекарств, отпускаемых по рецепту. Выбор здорового образа жизни для контроля уровня триглицеридов включает:
- худеет. Если у вас избыточный вес, потеря даже 5 или 10 фунтов может помочь снизить уровень триглицеридов.
- сокращение калорий. Дополнительные калории преобразуются в триглицериды и откладываются в виде жира, поэтому сокращение калорий также должно снизить уровень триглицеридов.
- избегайте сладких и рафинированных продуктов. Простые углеводы, такие как сахар и продукты, приготовленные из белой муки, могут повышать уровень триглицеридов.
- выбирая более здоровые жиры. Обменяйте насыщенные жиры, содержащиеся в продуктах животного происхождения, на более здоровые ненасыщенные жиры, содержащиеся в растениях и жирной рыбе. Например, замените сливочное масло оливковым маслом, а красное мясо — лососем.
- ограничение употребления алкоголя. Алкоголь содержит много калорий и сахара и сильно влияет на уровень триглицеридов.
- тренируются регулярно. Чтобы снизить уровень триглицеридов, старайтесь заниматься физическими упражнениями не менее 30 минут большую часть или все дни недели.
Если изменения здорового образа жизни недостаточно для снижения высокого уровня триглицеридов, скорее всего, помогут лекарства, прописанные врачом.
Обзор
- Что такое липиды?
- Сравните и сопоставьте насыщенные и ненасыщенные жирные кислоты.
- Определите три основных типа липидов и опишите различия в их структурах.
- Как триглицериды играют важную роль в метаболизме человека?
- Объясните, как фосфолипиды образуют клеточные мембраны.
- Что такое холестерин и какова его основная функция?
- Приведите три примера стероидных гормонов у людей.
- Какой тип жирной кислоты, по вашему мнению, преобладает в стейке и сыре из чизстейка, показанного выше? Поясните свой ответ.
- Какой тип жира с наибольшей вероятностью останется жидким при более низких температурах — жир бекона, оливковое масло или соевое масло? Поясните свой ответ.
- Как вы думаете, почему форма различных типов молекул жирных кислот влияет на то, насколько легко они затвердевают?
- Высокий уровень холестерина в крови может вызвать негативные последствия для здоровья, но это объясняет, почему мы не хотим избавляться от всего холестерина в нашем организме.
- Назовите два типа липидов, входящих в состав клеточной мембраны.
- Верно или неверно. Жирные кислоты состоят из триглицеридов.
- Какой тип липидов часто действует как химические молекулы-посредники?
Узнать больше
Посмотрите видео ниже, чтобы узнать больше о триглицеридах и разнице между насыщенными и ненасыщенными жирными кислотами.
Simple Lipid — обзор
Waxes
Воски представляют собой сложные эфиры одноатомных спиртов с длинной цепью и жирных кислот с более длинной цепью, чем те, которые содержатся в простых липидах, то есть с углеродными цепями, содержащими более 20 атомов углерода.Воски также содержат алканы с нечетным числом атомов углерода, первичные спирты и свободные жирные кислоты с очень длинной цепью.
Существует два вида листовых восков: эпикутикулярный и внутрикутикулярный. Эпикутикулярные воски составляют внешнюю часть кутикулы; внутрикутикулярные воски заделаны в кутин (Stammitti et al ., 1995). Синтез воска происходит в клетках эпидермиса плодов яблони и нескольких видов листьев, и он должен происходить рядом с местом, где он откладывается, из-за сложности транспортировки такого нерастворимого материала.Воски, вероятно, обычно синтезируются в эпидермальных клетках в виде капель, проходят через клеточные стенки и образуют слои на внешних поверхностях. Некоторое количество воска выталкивается через кутинно-восковой слой, образуя отложение на кутикуле и вызывая цветение, характерное для поверхности некоторых листьев и плодов (см. Рис. 8.4). Воски также встречаются в коре, богатой суберином (Martin and Juniper, 1970). По-видимому, воск обычно накапливается на внешних поверхностях растений, в отличие от суберина, который накапливается в стенках клеток, и кутина, который иногда накапливается как на внутренних, так и на внешних поверхностях.Исключение составляет скопление жидкого воска в семенах жожоба.
РИСУНОК 8.4. Вариации воска листьев широколиственных деревьев: (A) вяз американский (× 2000), (B) белый ясень (× 2000), (C) сахарный клен (× 2000) и (D) восточный красный бутон (× 2000) .
Фото У. Дж. Дэвиса.Эпикутикулярные воски имеют физиологическое значение, поскольку они ограничивают транспирационную потерю воды, способствуют контролю газообмена, уменьшают вымывание питательных веществ, создают барьер для загрязнителей воздуха и влияют на попадание сельскохозяйственных химикатов в листья, плоды и стебли.Когда воск присутствует в виде неоднородных масс, он затрудняет смачивание поверхности листьев; следовательно, смачивающий агент или «распределитель», добавленный к распыляемым материалам, часто обеспечивает равномерное покрытие. Некоторые химические вещества в эпикутикулярном воске подавляют рост патогенных организмов (Martin and Juniper, 1970). Однако в некоторых случаях компоненты восков листьев стимулируют прорастание спор грибов и развитие зародышевых трубок, тем самым способствуя патогенезу (Schuck, 1972).
Отложение воска на листьях — важная адаптация к засухе.Скорость транспирации засухоустойчивых растений с закрытыми устьицами обычно колеблется от 2 до 20% от скорости транспирации при открытых устьицах. Для сравнения, мезофитные растения с более тонкими слоями восковых листьев обычно теряют от 20 до 50% воды при закрытых устьицах, чем при открытых (Levitt, 1980b). Коэффициент проницаемости для диффузии водяного пара через кутикулу увеличился в 300-500 раз после экстракции кутикулярного воска (Schönherr, 1976), что подчеркивает важность восков листьев в предотвращении высыхания растений.
У некоторых видов закупорка устьичных пор воском значительно снижает потерю воды и фотосинтез (главы 5 и 12). Воски листьев в порах устьиц также повышают устойчивость к проникновению некоторых грибковых патогенов (Patton and Johnson, 1970; Franich et al ., 1977).
Некоторые воски имеют большое коммерческое значение. Среди наиболее известных — карнаубский воск, полученный из листьев пальмы, Copernicia cerifera , обнаруженный в Бразилии. Он содержит около 80% сложных алкиловых эфиров длинноцепочечных жирных кислот и 10% свободных одноатомных спиртов.Пальмовый воск встречается на стволе восковой пальмы ( Ceroxylon andicola ) слоями до 2–3 см толщиной. Он состоит примерно на треть из настоящего воска, остальное — из смолы. Другие коммерческие пальмовые воски — это воск урикури, полученный из пальмы Attalea ( Attalea excelsa ), и воск рафии, полученный из сушеных листьев мадагаскарской пальмы рафия (Deuel, 1951). Эвкалипт gunnii var. acervula из Тасмании и листья белого сандалового дерева также дают воск.Листья Myrica carolinensis поставляют ароматный воск, используемый в брусничных свечах.
Листовой воск подразделяется на два основных типа: (1) плоские отложения (включая восковые гранулы, стержни и волокна, пластины и чешуйки) и (2) локальные отложения (включая слои и корки, а также жидкие или мягкие покрытия) . Количество и структура воска часто различаются на двух поверхностях одного листа и даже в разных местах на одной и той же поверхности листа. Например, в Eucalyptus polyanthemos воск имел пластинчатую форму на большей части листовой пластинки, но трубчатый на средней жилке (Hallam, 1967).Структура листового воска использовалась в качестве таксономического признака для разделения видов Eucalyptus и Cupressus (Hallam and Chambers, 1970; Dyson and Herbin, 1970).
Количество воска на листьях варьируется от следа до 15% от сухой массы листа и зависит от вида растений, генотипа, возраста листьев и условий окружающей среды. У белых ясеневых листьев был тонкий воск; На листьях сахарного клена не только были толстые отложения воска, но и многие устьичные поры были закрыты воском (Kozlowski et al ., 1974; Дэвис и Козловски, 1974b). Сообщалось о генетических вариациях отложения парафина у Eucalyptus и Hevea (Barber and Jackson, 1957; Rao et al ., 1988).
Количество образующегося листового воска зависит от высокой интенсивности света, низкой относительной влажности и засухи (Baker, 1974; Weete et al. ., 1978). У некоторых видов изменения воска листьев происходят в ответ на отбор по факторам окружающей среды. В Тасмании, например, небелые (зеленые) фенотипы Eucalyptus присутствовали в защищенных местах обитания, а серые фенотипы — на открытых участках.На высоте 2000 футов (610 м) листья эвкалипта Eucalyptus urnigera были блеклыми и имели преимущественно хлопьевидный воск; на высоте 2300 футов (700 м) восковые листья состояли из хлопьев и палочек; а на высоте 3 200 футов (975 м) листья были серо-голубыми, а их воск состоял из масс гребешков (Hall et al ., 1965).
Воск в основном производится на ранних стадиях распускания листьев. Полностью развернутые листья обычно теряют способность производить большое количество воска. Следовательно, старые листья с их тонкими слоями воска часто имеют высокую скорость транспирации, теряют большое количество минералов при вымывании и имеют низкую устойчивость к патогенам (Romberger et al ., 1993).
Структура эпикутикулярных восков изменяется в процессе развития листа. У пихты Дугласа сплавление кристаллических восковых стержней в аморфный (твердый) воск началось через несколько недель после распускания почек (Thijsse and Baas, 1990). Увеличение количества твердого воска происходило аналогичным образом, но медленнее в 1- и 2-летних иглах. Очень молодые иглы сосны обыкновенной имели больше аморфного воска, чем более старые. Это наблюдение, вместе с присутствием восковых стержней поверх аморфных восковых корок, указывает на то, что воск был перекристаллизован (Bacic et al ., 1994).
На структуру восков листьев влияет минеральное питание растений. Пихты Дугласа, удобренные азотом и калием, производили пропорционально больше трубчатого и менее чешуйчатого воска, чем неоплодотворенные деревья (Chiu et al ., 1992). Ухудшение влияния несбалансированного минерального питания на покрытие и структуру воска было очевидным в устьичных бороздах хвои сосны обыкновенной в течение года и в эпистоматических камерах годом позже (Ylimartino et al ., 1994). Дефицит Ca и Mg уменьшал восковое покрытие как в устьичных бороздах, так и в эпистоматических камерах. Охват эпистоматальных камер также уменьшался из-за дефицита K и избытка N (и, следовательно, отношения N: K). Воск как в устьичных бороздах, так и в эпистоматических камерах изменился с трубчатых на более слитые и сетчатые структуры в результате дефицита K, Mg и Ca (и, следовательно, увеличения соотношений N: K, N: Mg и N: Ca).
Жирные кислоты — обзор
Жирные кислоты для детского питания
Жирные кислоты обеспечивают энергию, потребляемую для роста клеток на определенных этапах жизни, особенно в младенчестве.Докозагексаеновая кислота (DHA) и арахидоновая кислота (ARA) были идентифицированы как важные структурные компоненты высокоспециализированных мембранных липидов центральной нервной системы человека с фосфолипидами серого вещества мозга, содержащими высокие пропорции DHA. Также было обнаружено, что DHA является основной длинноцепочечной полиненасыщенной жирной кислотой (LC PUFA) во внешних сегментах палочек и колбочек сетчатки глаза. DHA и ARA также содержатся в грудном молоке. Учитывая их роль в качестве незаменимых жирных кислот и их важность для развития центральной нервной системы (особенно мозга и глаз), они оба добавляются в детские смеси в Соединенных Штатах с 2002 года.Уровни ARA, обнаруженные в грудном молоке, довольно стабильны во всем мире; однако уровни DHA значительно изменчивы и, по-видимому, связаны с рационом питания матери. Детские смеси с добавками DHA и ARA теперь доступны в большинстве стран, включая Северную Америку, Южную Америку, Европу, Австралию, Новую Зеландию и Азию. Обоснование этого состоит в том, что смеси, обогащенные DHA и ARA, могут улучшить результаты зрительного и умственного развития у детей, вскармливаемых смесью, более похожую на таковую у их сверстников на грудном вскармливании.Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) заявило, что не возражает против добавления DHA и ARA в смеси для доношенных детей. Британский фонд питания, Продовольственная и сельскохозяйственная организация Объединенных Наций / Всемирная организация здравоохранения (ФАО / ВОЗ) и Международное общество по изучению жирных кислот и липидов — все рекомендуют добавлять в смеси для недоношенных детей как DHA, так и ARA. ФАО / ВОЗ проанализировали всю доступную научную литературу о добавках DHA и ARA и рекомендовали, чтобы все смеси для доношенных детей содержали 20 мг DHA / кг / день и 40 мг ARA / кг / день (0.3% DHA и 0,6% ARA при потреблении 6,5 г жира / кг / день).
Оптимальный профиль жирных кислот в детской смеси не определен. Эксперты сходятся во мнении, что детские смеси должны быть разработаны таким образом, чтобы соответствовать составу жирных кислот грудного молока и включать омега-3 жирные кислоты, такие как DHA. Младенцы могут иметь уникальную потребность в незаменимых жирных кислотах, особенно в DHA и ARA, которые являются важными жирными кислотами в материнском молоке. Во всем мире концентрация DHA в грудном молоке колеблется от 0,07% до более 1.0% от общего количества жирных кислот, в среднем около 0,34%. Концентрации ARA выше по величине и ниже по изменчивости, в среднем 0,53%. Учитывая важность всех омега-3 жирных кислот в рационе младенцев, Институт медицины установил адекватное потребление 0,5 г омега-3 жирных кислот в день в течение первых 12 месяцев жизни. Соотношение омега-6 и омега-3 в детской смеси может быть особенно важным, поскольку относительные количества этих жирных кислот влияют на количество DHA и ARA в тканях.
DHA является наиболее распространенной жирной кислотой омега-3 в головном мозге и сетчатке глаза, составляющей около 97% и 93% всех жирных кислот омега-3 в мозге и глазах, соответственно. DHA является ключом к развитию мозга, накапливаясь в огромных количествах во время развития ребенка и в течение первых нескольких лет младенчества. DHA является центральным компонентом нервной системы и способствует неврологическому развитию, особенно в отношении глаз и основных когнитивных функций. Мозг быстро растет в последние месяцы беременности и в первые годы жизни.Этот скачок роста — время быстрого накопления ДГК в головном мозге. Способность младенца вырабатывать DHA может быть непостоянной и неэффективной. Уровни DHA в крови младенцев значительно снижаются после рождения, если только младенец не получает DHA с грудным молоком или детскими смесями с добавками DHA.
Исследования изучали влияние диетической DHA и ARA на зрительную функцию младенцев. В ходе однолетнего исследования был измерен состав жирных кислот эритроцитов и зрительная функция 108 младенцев в возрасте 52 недель.Двадцать девять младенцев находились на грудном вскармливании, а остальные получали либо простую детскую смесь, либо смесь с добавлением DHA и / или ARA. Было обнаружено, что состав жирных кислот и зрительная функция были одинаковыми в группах, получавших грудное вскармливание и принимавших жирные кислоты, но были хуже в группе без добавок (Birch et al ., 1998). Исследования показывают, что ребенок, рожденный от матери с высоким уровнем ДГК в ее организме, с большей вероятностью будет иметь развитые когнитивные способности и повышенную концентрацию внимания (фундаментальный невербальный показатель интеллекта в очень раннем детстве).Эти эффекты были измерены в возрасте до 4 лет, что свидетельствует о долгосрочных преимуществах потребления DHA во время беременности и кормления грудью. В другом исследовании было протестировано более 70 матерей и их детей в возрасте от 4 до 8 месяцев. Исследование проверяло остроту зрения и способность к зрительно-когнитивному обучению путем демонстрации изображений младенцев и измерения реакций. Результаты показали, что дети, рожденные от матерей с повышенным уровнем DHA, обладали повышенными визуальными «навыками» и способностями. Младенцы, которые находились на грудном вскармливании, а затем отлучены от грудного вскармливания до смеси с добавлением DHA и ARA, демонстрировали более зрелую остроту зрения, чем дети на грудном вскармливании, отлученные от смеси без добавок.Младенцы, которых кормили смесью с добавлением ДГК, демонстрировали лучшую остроту зрения, чем у детей без добавок (что эквивалентно 1,5 строкам на диаграмме зрения), и схоже с остротой зрения детей, находящихся на грудном вскармливании. Одно исследование показало, что у младенцев, получавших смесь с добавкой DHA (0,36%) и ARA (0,72%), было меньше эпизодов бронхиолита и бронхита в возрасте 5, 7 и 9 месяцев по сравнению с младенцами, получавшими смесь без добавок. У младенцев, которых кормили смесью с добавкой DHA и ARA, было значительно более низкое кровяное давление по сравнению с младенцами, получавшими смесь без добавок, как и у младенцев, вскармливаемых грудью.Поскольку кровяное давление имеет тенденцию отслеживаться с детства до взрослой жизни, было высказано предположение, что раннее потребление DHA может снизить риск сердечно-сосудистых заболеваний в более позднем возрасте.
Было обнаружено, что грудное вскармливание по сравнению с обычным искусственным вскармливанием обеспечивает долгосрочное улучшение когнитивных способностей и успеваемости. Анализ данных показал, что содержание DHA и ARA в грудном молоке, по крайней мере, частично является причиной этой разницы. В одном исследовании было обнаружено преимущество IQ у недоношенных детей, которых кормили грудным молоком через зонд, по сравнению с группой, получавшей смесь без добавок, что указывает на эффект, выходящий за рамки фактического акта грудного вскармливания (Lucas et al ., 1992). Также было проведено несколько исследований, в которых сравнивали обычную детскую смесь со смесью с добавлением DHA и ARA, чтобы они влияли на умственное развитие. Эти исследования показали, что младенцы, получавшие смесь, обогащенную DHA и ARA, обладают более высокими когнитивными способностями, чем младенцы, получавшие смесь без добавок. Доношенные дети, получавшие смесь с добавкой DHA (0,36%) и ARA (0,72%), набрали на 7 пунктов выше по индексу умственного развития Бейли в 18 месяцев, чем дети, получавшие смесь без добавок (Birch et al ., 2000). В последующем исследовании тех же детей в возрасте 4 лет острота зрения и вербальный IQ были выше у тех детей, которые получали смесь с добавками, по сравнению с теми, кто получал смесь без DHA и ARA. Было оценено влияние DHA и ARA в детских смесях на решение проблем в возрасте 10 месяцев. В это исследование были включены 44 здоровых доношенных новорожденных. Сразу после рождения половина детей получала стандартную смесь для младенцев, а остальные получали такую же смесь с добавками DHA и ARA.Жировая добавка была получена из молочного жира, растительных масел и яичных липидов. При тестировании через 10 месяцев обе группы имели нормальное физическое развитие и в равной степени были способны решать простые умственные проблемы. Однако, столкнувшись с более сложной умственной проблемой, те, кто принимал формулу с добавлением ДГК, справились лучше, и их преимущество было статистически значимым.
Прирост DHA и ARA мозгом плода в течение последнего триместра беременности имеет важное значение; поэтому у недоношенных младенцев повышен риск снижения уровня этих двух жирных кислот.Исследования аутопсии доношенных детей, умерших в течение первого года жизни, также показали такие различия в ПНЖК в мозге и сетчатке грудных детей, получавших смеси без добавления ДГК. Исследования жирных кислот у вскармливаемых вскрытием детей с синдромом внезапной детской смерти (СВДС) показали снижение DHA примерно на 10% у тех, кто получал обычную смесь, по сравнению с теми, кто кормился грудным молоком. Все вышеперечисленные исследования подтверждают важность DHA и ARA для нормального нервного развития. В США с 1992 по 1999 год около 3600 смертей ежегодно приходилось на долю СВДС (Malby and Freeman, 2004).Тем не менее, не было сообщений об увеличении смертности, связанной с СВДС, в странах, где в течение нескольких лет использовались смеси, дополненные источником DHA и ARA.
Грудное молоко — оптимальное детское питание. Грудное молоко содержит длинноцепочечные полиненасыщенные жирные кислоты DHA и ARA. Несколько групп экспертов дали рекомендации по детским смесям, содержащим DHA и ARA. Многие исследования, как обсуждалось ранее, продемонстрировали улучшение умственного развития у младенцев, получавших смесь с добавками DHA и ARA, по сравнению с детьми, получавшими смесь без добавок.Эти преимущества выходят далеко за рамки периода приема добавок и сохраняются в детстве. Младенцы быстро накапливают ДГК от матери в последние месяцы (третий триместр) беременности. Младенцы, рожденные недоношенными, не успевают накапливать ДГК до того же уровня, что и их доношенные сверстники. При кормлении молочными смесями с добавлением DHA и ARA недоношенные дети достигли нормального роста с точки зрения веса, длины и окружности головы, а также показали улучшение зрительного и умственного развития по сравнению с младенцами, получавшими смесь без добавок DHA и ARA.Врачи во всем мире не сообщали о каких-либо проблемах, которые наблюдали за назначением смесей с добавлением DHA и ARA младенцам с низкой массой тела при рождении. Исследования стабильных изотопов показали, что недоношенные и доношенные дети могут превращать линолевую кислоту в ARA и ALA в DHA. Однако достаточный синтез, обеспечивающий рост тканей, ограничен при рождении из-за незрелости ферментных систем.
Поглощение липидов
Поглощение липидов
Основная часть пищевых липидов — это нейтральный жир или триглицерид, состоящий из глицериновой основы, каждый углерод которой связан с жирной кислотой.Пищевые продукты обычно также содержат фосфолипиды, стерины, такие как холестерин, и многие второстепенные липиды, включая жирорастворимые витамины. Наконец, содержимое тонкого кишечника содержит липиды из отшелушенных эпителиальных клеток и значительный холестерин, поступающий с желчью.
Для абсорбции триглицерида должны происходить два процесса:
- Большие агрегаты диетических триглицеридов, которые практически нерастворимы в водной среде, необходимо физически расщеплять и удерживать во взвешенном состоянии — процесс, называемый эмульгированием.
- Молекулы триглицеридов должны ферментативно перевариваться с образованием моноглицеридов и жирных кислот, которые могут эффективно диффундировать или транспортироваться в энтероцит
Ключевыми участниками этих двух преобразований являются желчные кислоты и липаза поджелудочной железы , обе из которых смешаны с химусом и действуют в просвете тонкой кишки. Желчные кислоты также необходимы для растворения других липидов, включая холестерин.
Эмульгирование, гидролиз и образование мицелл
Желчные кислоты играют свою первую важную роль в ассимиляции липидов, способствуя эмульгированию.Как производные холестерина, желчные кислоты имеют как гидрофильные, так и гидрофобные домены (т.е. они являются амфипатическими). При воздействии большого агрегата триглицерида гидрофобные части желчных кислот интеркалируются в липид, а гидрофильные домены остаются на поверхности. Такое покрытие желчными кислотами способствует разрушению крупных агрегатов или капель на более мелкие и мелкие капли. | |
Гидролиз триглицерида до моноглицерида и свободных жирных кислот осуществляется преимущественно липазой поджелудочной железы.Активность этого фермента заключается в урезании жирных кислот в положениях 1 и 3 триглицерида, в результате чего остаются две свободные жирные кислоты и 2-моноглицерид. Лекарство орлистат (ксеникал), которое продвигается для лечения ожирения, действует путем ингибирования липазы поджелудочной железы, тем самым уменьшая переваривание и всасывание жира в тонком кишечнике. Липаза — это водорастворимый фермент, и, проявив немного воображения, легко понять, почему эмульгирование является необходимой прелюдией к его эффективному действию.Вскоре после еды липаза присутствует в тонком кишечнике в довольно больших количествах, но может действовать только на поверхности капель триглиеридов. Для данного объема липида, чем меньше размер капель, тем больше площадь поверхности, а это означает, что большее количество молекул липазы может работать. | |
Поскольку моноглицериды и жирные кислоты высвобождаются под действием липазы, они сохраняют свою связь с желчными кислотами и образуют комплекс с другими липидами с образованием структур, называемых мицеллами .Мицеллы представляют собой по существу небольшие агрегаты (4-8 нм в диаметре) смешанных липидов и желчных кислот, взвешенных в пищеварительном тракте. При перемешивании пищи мицеллы сталкиваются с щеточной каймой энтероцитов тонкого кишечника, и липиды, включая моноглицериды и жирные кислоты, захватываются эпителиальными клетками. |
Поглощение и перенос в кровь
Основные продукты переваривания липидов — жирные кислоты и 2-моноглицериды — проникают в энтероцит путем простой диффузии через плазматическую мембрану.Значительная часть жирных кислот также попадает в энтероцит через специфический белок-переносчик жирных кислот в мембране.
Липиды транспортируются из энтероцитов в кровь по механизму, явно отличному от того, который мы наблюдали для моносахаридов и аминокислот.
Попав внутрь энтероцита, жирные кислоты и моноглицериды транспортируются в эндоплазматический ретикулум, где они используются для синтеза триглиеридов. Начиная с эндоплазматического ретикулума и заканчивая Гольджи, триглицерид упакован с холестерином, липопротеинами и другими липидами в частицы, называемые хиломикронами . Помните, где это происходит — в абсорбирующем энтероците тонкой кишки.
Хиломикроны вытесняются из Гольджи в экзоцитотические пузырьки, которые транспортируются в базолатеральную часть энтероцита. Везикулы сливаются с плазматической мембраной и подвергаются экзоцитозу, сбрасывая хиломикроны в пространство за пределами клеток.
Поскольку хиломикроны являются частицами, практически все шаги на этом пути можно визуализировать с помощью электронного микроскопа, как демонстрирует монтаж изображений ниже.
Транспортировка липидов в кровоток также отличается от того, что происходит с сахарами и аминокислотами. Вместо того, чтобы абсорбироваться непосредственно в капиллярную кровь, хиломикроны сначала транспортируются в лимфатический сосуд, который проникает в каждую ворсинку, называемую центральным млечным сосудом . До недавнего времени было непонятно, как большие хиломикроны попадают в млечные железы. Оказывается, есть участки молочной железы, в которых эндотелиальные клетки удерживаются вместе с помощью специализированных «кнопочных соединений», которые намного более проницаемы для хиломикронов, чем нормальные клеточные соединения.Лимфа, богатая хиломикронами, затем стекает в лимфатическую систему, которая быстро поступает в кровь. Хиломикроны, передающиеся с кровью, быстро разбираются, и составляющие их липиды используются по всему телу.
Когда абсорбируется большое количество хиломикронов, лимфа, оттекающая из тонкой кишки, кажется молочной, а лимфатические сосуды хорошо видны. На изображении ниже брюшного содержимого койота тонкие белые линии (стрелки) представляют собой лимфатические сосуды кишечника, заполненные хиломикронами.Эта лимфа проходит через брыжеечные лимфатические узлы (ЛУ), а затем в более крупные лимфатические узлы.
Другой важный липид, который всасывается в тонком кишечнике, — это холестерин. Гомеостатический холестерин является результатом баланса синтеза холестерина, абсорбции пищевого холестерина и выведения холестерина с желчью. Много лет назад было показано, что холестерин, но не растительные стерины, легко всасывается в кишечнике. Совсем недавно был идентифицирован специфический транспортный белок (NPC1L1), который переносит холестерин из просвета кишечника в энтероцит.Оттуда большая часть холестерина этерифицируется, включается в хиломикроны и перемещается в кровь с помощью механизмов, описанных выше.
Если вы хотите подтвердить для себя хотя бы некоторые из описанных выше процессов, вам следует провести следующий эксперимент:
- Съешьте чашку жирных сливок или мешок картофеля фри быстрого приготовления.
- Сделайте что-нибудь продуктивное, например, учебу в течение 30 минут.
- Возьмите образец крови у себя (достаточно капиллярной трубки) — используйте антикоагулянт, чтобы предотвратить свертывание.
- Центрифугируйте образец крови для разделения клеток и плазмы.
Когда вы исследуете свою плазму, она будет отчетливо выглядеть молочной из-за присутствия миллиардов светоотражающих хиломикронов (это состояние называется липемией ). Если вам нужен дополнительный балл, продолжайте забор крови каждые 15 минут, пока плазма не очистится, а затем нанесите результаты на миллиметровую бумагу. В качестве альтернативы вы можете просто изучить изображение справа, чтобы увидеть, как выглядит сыворотка собаки после нескольких часов голодания по сравнению с липемической сывороткой, собранной вскоре после приема корма для щенков.
Обновлено в мае 2019 г. Отправляйте комментарии по адресу [email protected]
Глава 4. Липиды и жирные кислоты
Глава 4. Липиды и жирные кислоты1. ВВЕДЕНИЕ
2. СОСТАВ ЖИРНЫХ КИСЛОТ РЫБЫ
3. ЛИПИДНЫЙ СОСТАВ ТЕЛА И ТРЕБОВАНИЯ К ПИЩЕВЫМ ЛИПИДАМ
4. ПОЛИНЕНАСЫЩЕННЫЕ ТРЕБОВАНИЯ РЫБЫ В ЖИРНЫХ КИСЛОТАХ
5. ВАЖНЕЙШИЕ ТРЕБОВАНИЯ РЫБЫ В ЖИРНЫХ КИСЛОТАХ
6.ОБМЕН ЖИРНЫХ КИСЛОТ В РЫБЕ
7. ОТРИЦАТЕЛЬНЫЙ АСПЕКТЫ ЛИПИДОВ В ПИТАНИИ РЫБ
8. ССЫЛКИ
Дж. Э. Халвер
Вашингтонский университет
Сиэтл, Вашингтон
Липиды — это общие названия, присвоенные группе жирорастворимых соединений, обнаруживаемых в тканях растений и животных: и широко классифицируются как: а) жиры, б) фосфолипиды, в) сфингомиелины, г) воски и д) стерины. .
Жиры представляют собой сложные эфиры жирных кислот глицерина и являются основными запасами энергии животных.Они используются для долгосрочной потребности в энергии в периоды интенсивных физических упражнений или в периоды недостаточного питания и потребления энергии. Рыбы обладают уникальной способностью легко метаболизировать эти соединения и, как следствие, могут существовать в течение длительных периодов времени в условиях отсутствия пищи. Типичный пример — это многонедельная миграция лососей, возвращающихся вверх по течению на нерест; накопленные липидные отложения сжигаются в качестве топлива, позволяя процессам организма продолжаться во время напряженного путешествия.
Фосфолипиды представляют собой сложные эфиры жирных кислот и фосфатидной кислоты. Это основные липиды, составляющие клеточные мембраны, позволяющие поверхностям мембран быть гидрофобными или гидрофильными в зависимости от ориентации липидных соединений во внутри- или внеклеточном пространстве.
Сфингомиелины представляют собой сложные эфиры жирных кислот сфингозина и присутствуют в соединениях головного мозга и нервной ткани.
Воски представляют собой сложные эфиры жирных кислот и длинноцепочечных спиртов.Эти соединения могут метаболизироваться для получения энергии и придания физических и химических характеристик за счет накопленных липидов некоторых растений и некоторых соединений животного происхождения.
Стерины представляют собой полициклические длинноцепочечные спирты и действуют как компоненты нескольких гормональных систем, особенно при половом созревании и физиологических функциях, связанных с полом.
Жирные кислоты могут существовать в виде компонентов с прямой или разветвленной цепью; многие рыбные жиры содержат многочисленные ненасыщенные двойные связи в структурах жирных кислот.Краткое обозначение облигации. жирные кислоты будут использоваться повсюду, где число w определяет положение первой двойной связи, считая от метильного конца. Линоленовая кислота будет написана 18: 3w 3. Первое число определяет количество атомов углерода; второе число — количество двойных связей; и последнее число, положение двойных связей.
Было опубликовано много обзоров по кормлению рыб, которые содержат информацию о потребностях в липидах. Большая часть исследований по потребностям рыб в липидах была проведена с лососевыми.Радужная форель имеет потребность в незаменимых жирных кислотах (EFA) для линоленовой кислоты серии w 3 1 , а не для линоленовой кислоты или w 6, как того требует большинство млекопитающих. Основной упор на потребности в липидах был сделан на EFA и энергетической ценности липидов.
2.1 Влияние окружающей среды
2.2 Влияние диеты
2.3 Сезонные колебания
2.1 Влияние окружающей среды
2.1.1 Соленость
На различие жирнокислотного состава морских и пресноводных рыб отмечали несколько авторов.Некоторые примеры структуры жирных кислот приведены в таблице 1. Хотя эти рыбные липиды содержат больше жирных кислот w 3, ясно, что пресноводная рыба имеет более высокие уровни жирных кислот w 6, чем морские виды. Среднее соотношение w 6 / w 3 составляет 0,37 и 0,16 для пресноводных и морских рыб соответственно. Рыба в целом содержит больше w 3, чем w 6 полиненасыщенных жирных кислот (ПНЖК) и должна иметь более высокие диетические потребности в w 3 ПНЖК; таким образом, диетическая потребность морской рыбы в w 3 ПНЖК в ОЖК может быть выше, чем у пресноводных рыб.
Таблица 1 — Сравнение содержания жирных кислот общего липида из цельной рыбы или мяса пресноводных и морских видов 1/
Такое же различие в соотношении w 6 / w 3 между пресной и морской водой наблюдается, когда некоторые виды рыб мигрируют из океанов в ручьи или наоборот. Соотношение ПНЖК сладкой корюшки ( Plecoglosus altivelis ) резко меняется всего за один месяц по мере их миграции из моря в пресноводные реки.Аналогичное, но обратное изменение происходит у лосося масу ( Oncorhynchus masu ), когда они мигрируют из пресной воды в морскую. Даже в пределах одного и того же вида рыб соленость воды, кажется, вызывает резкое изменение структуры жирных кислот.
Разница между морской и пресноводной рыбой может быть связана просто с различиями в содержании жирных кислот в рационе или может быть связана с особыми потребностями рыб, связанными с физиологической адаптацией к окружающей среде.Фосфолипиды обычно считаются структурными или функциональными липидами, которые в значительной степени включены в мембранную структуру клеточных и субклеточных частиц. Триглицериды чаще представляют собой запасные липиды и в большей степени отражают жирнокислотный состав рациона, чем фосфолипиды. В таблице 2 представлены составы жирных кислот триглицеридной и фосфолипидной фракций липидов рыб. Можно видеть, что влияние изменения окружающей среды на состав жирных кислот фосфолипида так же велико в случае лосося и значительно больше в случае сладкой корюшки, чем на состав триглицеридов.Радужная форель на рационах, содержащих кукурузное масло с высоким содержанием w 6 и низким содержанием w 6 ПНЖК, показала более высокую смертность и снижение роста в морской воде, чем в пресной воде, в течение двенадцатинедельного периода кормления.
2.1.2 Температура
Есть несколько других факторов, помимо солености воды, которые влияют на состав жирных кислот и особенно ПНЖК рыбы. В таблицах 1 и 2 можно увидеть, что лососевые, даже в пресной воде, имеют тенденцию иметь более высокое общее содержание ПНЖК с длиной углеродной цепи 20 и 22 и более низкое отношение w 6 / w 3, чем у других рыб.Лососевые в основном относятся к холодноводным рыбам. Жирные кислоты ряда морских животных из умеренных и арктических вод демонстрируют некоторые существенные различия в общей структуре; к сожалению, анализ включал жирные кислоты более 20: 1. Есть ряд других экспериментов, демонстрирующих влияние температуры окружающей среды на жирнокислотный состав водных животных. Общая тенденция к увеличению содержания длинноцепочечных ПНЖК при более низких температурах очевидна. Отношение w 6 / w 3 уменьшается с понижением температуры (таблица 3).Если тенденции в составе жирных кислот можно рассматривать как ключ к пониманию потребностей рыбы в ОДВ, то требование w 3 будет больше для рыбы, выращиваемой при более низких температурах. Рыбы, выращенные в более теплых водах, такие как карп, канальный сом и тилапия, могут лучше справиться со смесью жирных кислот w 6 и w 3.
2.2 Влияние диеты
Некоторые из составов жирных кислот, перечисленных в таблице 3, могут серьезно зависеть от пищевых липидов. Комаров и гуппи кормили гранулами форели, которые имели соотношение вес 6 / вес 3, равное 2.75. Сома кормили рационом с добавлением либо говяжьего жира, либо масла менхадена с соотношением w 6 / w 3 18,13 и 0,15 соответственно. Эти рыбы были способны изменять диетическое соотношение w 6 / w 3 в пользу включения жирных кислот w 3 в липиды мяса даже при самой высокой температуре. Коммерчески доступные гранулы форели часто содержат мало w 3 ПНЖК и много w 6 жирных кислот. Важно не игнорировать влияние липидного состава рациона на состав жирных кислот рыб, получающих искусственные корма.Из данных в таблице 3 ясно, что соотношение веса 6 / вес 3 липидов рыбы в значительной степени зависит от соотношения веса 6 / вес 3 пищевых липидов. Когда в рационе очень высокое содержание жирных кислот w 6, содержащихся в животном сале или растительных маслах, рыба имеет тенденцию изменять соотношение включенных ПНЖК в пользу жирных кислот w 3. Когда диетическое масло представляет собой рыбий жир с высоким содержанием жирных кислот до 3, соотношение липидов, включенных в рыбу, мало изменяется. Это еще одно свидетельство того, что рыба нуждается в w 3 ПНЖК в ОЖК.
Таблица 2 Изменения жирнокислотного состава липидов рыб по мере их миграции из морской воды в свежую и наоборот 1/
Таблица 3 Влияние температуры окружающей среды на жир Кислотный состав липидов рыб 1/
2.3 Сезонное изменение
Часто сообщается о сезонных колебаниях в составе жирных кислот у видов рыб.Наблюдаются сезонные изменения общего липидного и йодного числа масел сельди. Йодное число или степень ненасыщенности масла была минимальной в апреле и максимальной в июне. Сильное увеличение ненасыщенности соответствовало началу кормления весной. Отсутствие газожидкостного хроматографа (ГЖХ) в то время не позволяло идентифицировать изменения в отдельных жирных кислотах.
Содержание липидов плоти и внутренних органов сардины Sardinops melanosticta варьируется от 3.С 9 до 10,77 процента и с 10,9 до 38,3 процента соответственно. Жирные кислоты, представляющие основной интерес с точки зрения метаболизма EFA, — это 20: 4w 6, 20: 5w 3 и 22: 6w 3. Наблюдались значительные различия во всех этих жирных кислотах как в нейтральных, так и в полярных липидах обеих тканей. В мясе соотношение 20: 4 w 6 было постоянно выше в нейтральном липиде, чем в полярном липиде. Общее соотношение 20: 5w 3 плюс 22: 6w 3 было постоянно выше в полярном липиде, чем в нейтральном липиде. Таким образом, несмотря на значительные колебания содержания жирных кислот, вызванные изменениями в диете и температуре в течение сезона, наблюдалось последовательное предпочтительное включение ПНЖК серии w 3 в полярную или фосфолипидную фракцию липидов.
Один из лучших ключей к пониманию потребностей вида в ОДВ может быть получен из жирнокислотного состава липидов, включенных в потомство или яйцо. Акт воспроизводства или нереста также оказывает значительное влияние на сезонные колебания липидов у рыб. Состав жирных кислот липидов икры рыб, вероятно, различен для каждого вида и содержит повышенные уровни 16: 0, 20: 4 w 6, 20: 5 w 3 и 22: 6 w 3 по сравнению с липидами печени той же самки рыб (Ackman , 1967).
Повышенные уровни 16: 0, 20: 5w 3 и 22: 6 w 3 и пониженные 18: 1 в яичнике наблюдались по сравнению с мезентериальным жиром тихоокеанской сардины, получавшей естественную диету копепод. Жирные кислоты в крови сардин, получавших естественный рацион, были аналогичны жирным кислотам яичников. Когда сардины скармливали форелевым кормом, и кровь, и мезентериальный жир реагировали на диету повышением 18: 2w 6 и уменьшением 20: 5w 3 и 22: 6w 3. Влияние диеты на содержание жирных кислот в яичниках было значительно меньше. поскольку были сохранены относительно высокие уровни 20: 5w 3 и 22: 6w 3.
Липиды яичников сладкой корюшки показывают увеличение 16: 0 и снижение ПНЖК, особенно фосфолипидов, по сравнению с липидами из мяса рыбы, пойманной в то же время года. Соотношение w 6 / w 3 яичника было ниже, чем у липидов плоти, 0,21 и 0,17 для яичника по сравнению с 0,31 и 0,20 для триглицеридов и фосфолипидов мяса, соответственно.
Выводимость яиц карпа, получавшего несколько различных составов кормов, значительно снижается, когда 22: 6w 3 липидов яйца составляет менее 10 процентов.Кроме того, состав жирных кислот в мышцах, плазме и эритроцитах более подвержен влиянию пищевых липидов, чем составы яиц.
Потребности в ОДВ для ряда видов рыб были изучены в исследованиях питания. Сами рыбы дали убедительные доказательства предпочтения EFA по типам жирных кислот, которые они включают в свои липиды. Рыба, как правило, имеет тенденцию использовать w 3 по сравнению с w 6. Это особенно наблюдается, когда пищевые липиды с высоким содержанием w 6, поскольку рыба имеет тенденцию изменять соотношение w 6 / w 3 в сторону жирных кислот w 3 в ткани. липиды.Липиды яйца должны удовлетворять потребность эмбриона в EFA до тех пор, пока он не сможет питаться. Данные по составу жирных кислот показывают, что потребность в w 3 выше в морской воде, чем в пресной, и выше в холодной воде, чем в теплой.
По-прежнему отсутствует подробная информация о диетических потребностях в липидах многих видов рыб, но имеется большое количество информации о составе жирных кислот рыбьего жира. Информация о липидном составе рыбы может быть использована, чтобы сделать некоторые предположения о пищевых потребностях в липидах.Линоленовая кислота (18: 3w 3) приводила к некоторому щадящему действию и стимулированию роста у крыс, а жирные кислоты w 6 EFA предотвращали все симптомы дефицита EFA. Исследования на домашних животных, обитающих на суше, показали, что жирные кислоты серии w 6 являются «незаменимыми жирными кислотами», в то время как серия w 3 считается несущественной или оказывает лишь частичное сдерживающее действие на дефицит EFA. Было показано, что серия жирных кислот w 6 является незаменимой для достаточного количества видов животных, поэтому стало принято считать, что они являются незаменимыми жирными кислотами для всех животных.
Многие считали, что рыбе также требуется 6 жирных кислот. Многие исследователи начали с добавления в рацион рыб растительных масел, таких как кукурузное, арахисовое или подсолнечное масло, которые были богаты линолевой кислотой. Основным симптомом, наблюдаемым во время развития дефицита EFA у обезжиренных рационов чавычи, была выраженная депигментация, которую можно предотвратить добавлением 1% трилинолеина, но не 0,1% линоленовой кислоты.
Хотя жирные кислоты w 6 считаются незаменимыми, одной из общих характеристик рыбьего жира является низкий уровень жирных кислот серии w 6 и более высокий уровень жирных кислот типа w 3.Имеются данные о том, что полиненасыщенные жирные кислоты (PUPA) серии w 3, которые присутствуют в относительно больших концентрациях в рыбьем жире, играют роль незаменимых жирных кислот для рыбы.
Когда тестируемая диета, содержащая 13% кукурузного масла и 2% рыбьего жира, давалась радужной форели, последующее исключение рыбьего жира из рациона приводило к угнетению роста и некоторой дегенерации почек, что могло быть связано с отсутствием достаточного количества рыбьего жира. w 3 ПНЖК, присутствующие в значительных количествах в рыбьем жире (McLaren et al ., 1947). Пищевой рыбий жир превосходит кукурузное масло в стимулировании роста радужной форели (Salmo gairdneri) и желтохвоста ( Seriola guingueradiata ). Диетическая линоленовая кислота или этиллиноленат (18: 3 w 3) дает положительную реакцию роста радужной форели, что может быть связано с диетической потребностью в жирных кислотах w 3.
5.1 Радужная форель
5.2 Канальный сом
5.3 Карп
5.4 Угорь
5.5 Камбала
5.6 Турбот
5.7 Красноморский лещ
5.8 Другие виды
Одна из наиболее широко распространенных теорий, объясняющих присутствие таких высоких уровней жирных кислот 20: 5w 3 и 22: 6w 3 в рыбьем жире, связана с влиянием ненасыщенности на температуру плавления липидов. Большая степень ненасыщенности жирных кислот в фосфолипидах рыб обеспечивает гибкость клеточной мембраны при более низких температурах. Структура w 3 допускает большую степень ненасыщенности, чем w 6 или w 9.Эта теория согласуется с тем фактом, что холодноводная рыба имеет более высокую потребность в питательных веществах в жирных кислотах w 3, в то время как потребность в EFA некоторых теплокровных рыб может быть удовлетворена за счет смеси w 6 плюс w 3.
5.1 Радужная форель
Радужная форель, холодноводная рыба, требует в рационе w 3 жирных кислот в качестве НЖК. Требование ОДВ в рационе может составлять 1 процент 18: 3w 3. Включение 18: 2w 6 в рацион может привести к некоторому улучшению роста и конверсии корма по сравнению с рационами с дефицитом EFA; однако жирные кислоты w 6 не предотвращают некоторые симптомы дефицита EFA, такие как «синдром шока».Хотя очевидно, что радужная форель требует w 3 жирных кислот, еще предстоит окончательно доказать, является ли необходимый уровень содержания w 6 жирной кислоты в рационе.
Во всех вышеупомянутых исследованиях с радужной форелью диетические 18: 2w 6 или 18: 3w 3 были легко преобразованы в ПНЖК C-20 и C-22 той же серии, а 18: 3w 3 или 22: 6w 3 имели аналогичные Значение EFA для радужной форели. Либо 20: 5w 3, либо 22: 6 w 3 превосходит 18: 3w 3 по значению EFA для радужной форели, а первые две жирные кислоты в комбинации превосходят любую по отдельности.Это согласуется с данными для млекопитающих, где 20: 4w 6 имеет более высокое значение EFA, чем 18: 2w 6. Превосходная питательная ценность C-20 и C-22 углерода w 3-PUFA дополнительно подтверждается превосходным стимулирующим рост действием диетический рыбий жир, такой как масло печени минтая и масло лосося для радужной форели.
5.2 Канальный сом
Одной из самых важных теплопроводных рыб в Северной Америке является канальный сом (Ictalurus punctatus) . Количественная потребность сома в ОДВ еще не определена.Однако есть убедительные доказательства того, что потребность в w 3 не так высока, как у радужной форели. Анализ жирных кислот липидов сома, приобретенного на пяти перерабатывающих предприятиях, показал очень низкие уровни 20: 4w 6, 20: 5w 3 и 22: 6w 3; 0,8 — 5,5, 0,2 — 1,3 и 0,6 — 6,1 процента от общего количества жирных кислот соответственно. Было показано, что кукурузное масло, добавленное к полуочищенной диете на основе казеина, первоначально приводило к положительной реакции роста и экономии белка, но позже наблюдалось ингибирование роста.Явные репрессивные эффекты кукурузного масла могут быть связаны с его содержанием 18: 2 w 6, поскольку 20: 5 w 3 и 22: 6 w 3, присутствующие в масле менхадена, не оказывают видимого вредного воздействия. Эффект подавления роста 18: 2w 6 был также отмечен, когда 3 процента кукурузного масла было добавлено к 3 процентам говяжьего жира и 3 процентам масла менхадена. Подавление роста, вызванное ненасыщенными жирными кислотами, не ограничивается жирными кислотами. Льняное масло (с высоким содержанием 18: 3w 3) в рационе сома приводило к подавлению роста, аналогичному тому, которое вызывается кукурузным маслом, по сравнению с диетическим говяжьим жиром, оливковым маслом и маслом менхадена.
5.3 Обыкновенный карп
Картина для другой теплопроводной рыбы, обыкновенного карпа (Cyprinus carpio) , намного яснее, чем для канального сома. У этой рыбы есть потребность в EFA как в жирных кислотах w 3, так и в w 6. Наилучшая прибавка в весе и конверсия корма были получены у рыб, получавших рацион, содержащий как 1 процент 18: 2 w 6, так и 1 процент 18: 3 w 3. У карпа 20: 5 w 3 и 22: 6 w 3 составляли 0,5 процента рациона. превосходят 1 процент 18: 3u3.Карп, получавший обезжиренную диету или диету с дефицитом EFA, содержал высокие уровни липидов 20: 3w 9, особенно фосфолипидов.
5.4 Угорь
Угорь ( Anguilla japonica ), еще одна теплопроводная рыба, нуждается в жирных кислотах w 3 и w 6. Кукурузное масло (с высоким содержанием w 6) и жир печени трески (с высоким содержанием w 3) в смеси 2: 1 наиболее благоприятны для роста угрей. Угрю требуется w 6 и w 3 в той же пропорции, что и карпу, но в меньшем количестве в рационе; а именно 0.5 процентов каждого, а не 1,0 процента каждой ПНЖК.
5.5 Камбала
В камбалах истощаются как w 3, так и w 6 ПНЖК при обезжиренной диете. Добавление к рациону 12: 0 и 14: 0 приводит к синтезу насыщенных и моноеновых жирных кислот с длиной цепи до С18; однако о повышенных уровнях 20: 3w 9, отмеченных у форели и млекопитающих, у камбалы не сообщалось. Камбала, получавшая пищу 18: 2w 6 и 18: 3w 3, не будет производить значительных количеств 20: 4w 6, 20: 5w 3 или 22: 6w 3.
5.6 Турбот
Рост камбалы (Scophthalmus matimus) намного лучше с w 3 PUFA, чем с w 6 или насыщенным жиром (гидрогенизированное кокосовое масло) в рационе. Палтус также, по-видимому, не может преобразовать диетическое 18: 2w 6 в 20: 4w 6 при кормлении кукурузным маслом или преобразовать эндогенное 18: 1w 9 в 20: 3w 9 при кормлении рационом с дефицитом EFA. Хотя он, по-видимому, требует EFA для жирных кислот w 3, таких как присутствующие в масле печени трески, 18: 3w 3 этому требованию не удовлетворяет.Удлинение цепи и обесцвечивание 18: lw 9, 18: 2 w 6 или 18: 3w 3 оказалось очень ограниченным (3-15 процентов) у камбалы по сравнению с радужной форелью, у которой 70 процентов от 18: 3w. 3 был преобразован в 22: 6w 3. Требуемый уровень длинноцепочечных жирных кислот w 3 для палтуса составляет не менее 0,8% от рациона.
5.7 Красноморский лещ
Красный морской лещ (Chrysophyrys major) растет лучше, когда пищевые липиды имеют морское происхождение (остаточное масло минтая), а не растительное масло (например, кукурузное масло).Требование EFA красного морского леща не удовлетворяется ни линолевой кислотой кукурузного масла, ни добавками линолената. Смесь 20: 5w 3 и 22: 6w 3, добавленная к диете с кукурузным маслом, оказалась эффективной для улучшения роста и состояния этих рыб. Таким образом, даже в теплой воде морской рыбе, по-видимому, требуется не только w 3 жирных кислоты, но и 0) 3 жирные кислоты с длиной углеродной цепи от 20 до 22. Постулируется прямая корреляция между эффективностью корма и уровнем липидов красного морского леща 18: 1.
5,8 Прочие виды
Среди теплокровных морских рыб кефаль и глазное дно обладают способностью образовывать цепочки, удлиняться и обесцвечивать 18: 2w 6 или 18: 3w 3 ПНЖК. Однако этот процесс тормозится в глазном дне за счет высоких уровней (около 5 процентов) этих ПНЖК 18: 2 w 6 или 18: 3 w 3 в рационе.
Похоже, что высокие уровни 18-углеродных w 6 или w 3 жирных кислот ингибируют синтез и метаболизм 18: lw 9. Интересно отметить, что канальный сом, который также демонстрирует отрицательную реакцию роста на диетическое 18: 2w 6 или 18: 3w 3, содержит очень высокие уровни липидов тела 18: 1.Включение в рацион 18: 2w 6 или 18: 3w 3 снижает уровень 18: 1 жирных кислот в липидах организма. Подобное снижение также наблюдалось в фосфолипидах печени морского леща при добавлении в рацион любой из ПНЖК.
Конкурентное ингибирование удлинения цепи и десатурации членов одной серии жирных кислот для членов другой серии хорошо установлено, причем w 3> w 6> w 9 является обычным порядком эффективности для ингибирования.
Пути метаболизма жирных кислот были рассмотрены Мидом и Каямой (1967).Рыба способна синтезировать, de novo из ацетата, насыщенные жирные кислоты с четной цепью, как показано на рисунке 1. Исследования с использованием радиоизотопных индикаторов показали, что рыба может преобразовывать 16: 0 в моноен w 7 и 18: 0 к моноену w 9. Моноены w 5, w 11 и w 3 предложены на основе идентификации этих изомеров в моноенах сельдевого масла.
Рыба не может синтезировать какие-либо жирные кислоты ряда w 6 и u 3, если в рационе не присутствует предшественник с такой структурой w.Рыба способна обесцвечивать и удлинять жирные кислоты серий w 9, w 6 или w 3, как показано на рисунке 1. Существует конкурентное ингибирование десатурации жирных кислот одной серии за счет удлинения членами другой серии. Жирные кислоты w 3 являются наиболее сильными ингибиторами, а w 9 — наименее. Как отмечалось ранее, способность к удлинению и обесцвечиванию жирных кислот не одинакова у всех видов рыб. Палтус был способен обесцвечивать и удлинять только 3-15 процентов 18: 1w 9, 18: 2w 6 или 18: 3 w 3 при введении жирной кислоты, меченной C 14 ; у радужной форели 70 процентов метки из 18: 3w 3 (C 14 ) было найдено в 22: 6 w 3.
Незаменимые жирные кислоты не уникальны по своей способности поставлять энергию. Β-окисление жирных кислот у рыб в основном такое же, как у млекопитающих. EFA, насыщенные и моноеновые жирные кислоты в равной степени используются рыбой для производства энергии.
Рис. 1 Блок-схема механизмов синтеза жирных кислот в рыбе — Насыщенные и моноеновые жирные кислоты (адаптировано из Castell, 1979)
Рис. 1 Блок-схема механизмов синтеза жирных кислот в рыбе — Полиненасыщенные жирные кислоты (Адаптировано из Castell, 1979)
Повышенная скорость набухания митохондрий печени наблюдается в рационах питания радужной форели с дефицитом жирных кислот w 3.Возможно, что EFA играет важную роль в проницаемости, а также в пластичности мембран. Роль жирных кислот w 3 в проницаемости мембран может быть одним из факторов, объясняющих различия в содержании этого семейства жирных кислот у пресноводных и морских рыб.
Митохондрии рыб с высоким уровнем w 3 ПНЖК и очень низким уровнем w 6 жирных кислот очень похожи на митохондрии млекопитающих в отношении содержания цитохрома, b-окисления жирных кислот, функционирования цикла трикарбоновых кислот, транспорта электронов и т. Д. и окислительное фосфорилирование.W 3 ПНЖК может играть ту же роль в рыбе, что и жирные кислоты w 6 у крыс. EFA играют еще одну роль в митохондриях. Помимо их важности в структуре мембраны, EFA важны в некоторых ферментных системах.
Ненасыщенные жирные кислоты играют важную роль в транспортировке других липидов. Неоднократно было показано, что кормление ПНЖК снижает уровень холестерина у животных с уровнем липидов и холестерина в крови выше нормы. Рыбий жир более эффективен в снижении уровня холестерина, чем большинство пищевых липидов.Основная часть жирных кислот, всасываемых через слизистую оболочку кишечника, транспортируется в виде белково-липидных комплексов, стабилизированных фосфолипидами. Низкая температура тела у рыб, вероятно, имеет большее значение для ненасыщенности в транспорте липидов, чем у гомеотермных животных.
Потребность рыбы в ПНЖК серии w 3 создает проблемы с хранением кормов. Эти типы жирных кислот очень неустойчивы к окислению. Продукты окисления липидов могут вступать в реакцию с другими питательными веществами, такими как белки, витамины и т. Д., и снижение доступных диетических уровней или продуктов окисления может быть токсичным. Было продемонстрировано влияние окисленных липидов на пищевые белки, ферменты и аминокислоты.
Использование окисленного масла менхадена в рационе свиней и крыс вызывало снижение аппетита, замедление роста, желтовато-коричневую пигментацию жировых отложений и снижение уровней гемоглобина и гематокрита. Негативные эффекты окисленного рыбьего жира были устранены добавлением в рацион альфа-токоферола ацетата или этоксиохина.
Большая часть использования растительных масел в рационах рыб в 1950-х и 1960-х годах могла частично быть основана на их большей стабильности в приготовленных диетах. Было продемонстрировано, что прогорклая сельдь и мука хека в кормах для рыб вызывают темную окраску, анемию, летаргию, коричнево-желтую пигментированную печень, аномалии почек и мелкую жаберную булаву у чавычи. Симптомы можно облегчить, добавив альфа-токоферол к рациону, содержащему прогорклую рыбную муку. Добавление витамина Е предотвратит токсические или отрицательные эффекты добавления 5% сильно окисленного лососевого масла в рацион радужной форели.Такой же щадящий эффект альфа-токоферола можно применить и к прогорклому корму для карпа.
Положительная питательная ценность жирных кислот w 3 в липидах рыб для кормов для рыб может стать отрицательным фактором, если при приготовлении и хранении кормов не будут приняты соответствующие меры. В корма следует использовать только свежие масла с низким содержанием пероксидов. Ингредиенты рыбных кормов, такие как рыбная мука, должны быть защищены от окисления. Уровень витамина Е, добавляемого в рацион, следует увеличивать по мере увеличения уровня ПНЖК.Готовый корм, по возможности, следует хранить в герметичных контейнерах при пониженных температурах с минимальным воздействием УФ-излучения и других факторов, ускоряющих скорость окисления липидов. Нельзя игнорировать проблемы прогорклости или антиокисления липидов в кормах для рыб.
Акман Р.Г., 1967 Характеристики жирнокислотного состава и биохимии некоторых жиров и липидов пресноводных рыб в сравнении с жирами и липидами морских животных. Comp.Biochem.Physiol., 22: 907-22
Кастелл, Дж.Д., 1979 г. Обзор потребностей рыб в липидах. В Технология кормления и кормления рыб для рыб, под редакцией Дж. Э. Халвера и К. Труса. Труды Всемирного симпозиума, спонсируемого и поддержанного EIFAC / FAO / ICES / IUNS, Гамбург, 20-23 июня 1978 г. Schr.Bundesforschungsanst.Fisch., Hamb., (14/15) vol.1: 59-84
Коуи, С.Б. и Дж.Р. Сарджент, 1972 Кормление рыб. Adv.Mar.Biol ., 10: 383-492,
Коуи, С.Б. и Дж.Р. Сарджент, 1977 Липидное питание рыб. Comp.Biochem.Physiol. (B Comp.Biochem .) 57: 269-73
Макларен, Б.А. 1947 г., и др. , и др. . Кормление радужной форели. 1. Исследования витаминной потребности. Арх-Биохим . 19: 169-78
Мид, Дж. Ф. и М. Каяма, 1967 Липидный обмен у рыб. В Рыбий жир, под редакцией М.Э. Стэнсби. Вестпорт, Коннектикут, Avi Publ. Co., стр. 289-99.
Национальный исследовательский совет, Подкомитет 1973 года по питанию рыб, потребности в питательных веществах форели, лосося и сома.Вашингтон, округ Колумбия, Национальная академия наук, (Потребности домашних животных в питательных веществах), 11:57 стр.
Национальный исследовательский совет, Подкомитет по тепловодным рыбам 1977 года, Потребности теплопроводных рыб в питательных веществах. Вашингтон, округ Колумбия, Национальная академия наук, (Потребности домашних животных в питательных веществах), 78 стр.
Зиннхубер Р.О., 1969 Роль жиров. В Рыба в исследованиях, под редакцией О.В. Ньюхаус и Дж. Э. Халвер, Нью-Йорк, Academic Press, стр. 245-61.
.

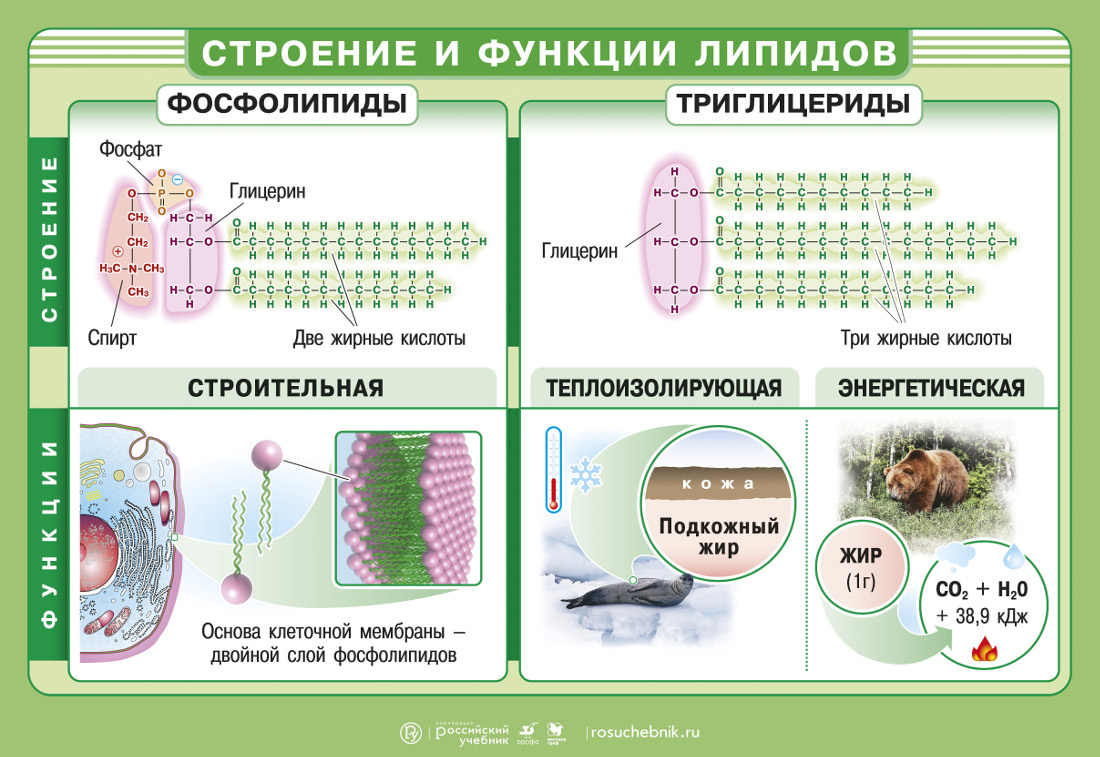
 4. Модель молекулы тристеарата
4. Модель молекулы тристеарата