Физические свойства воды
К основным физическим свойствам воды относят цвет, запах, вкус, прозрачность, температуру, плотность, сжимаемость, вязкость, радиоактивность и электропроводность.
Цвет подземных вод зависит от их химического состава и механических примесей. Обычно подземные воды бесцветны. Желтоватый цвет характерен для вод болотного происхождения, содержащих гуминовые вещества. Сероводородные воды вследствие окисления H2S и образования тонкой коллоидной мути, состоящей из частиц серы, имеют изумрудный оттенок. Цвет воды оценивается по стандартной платино-кобальтовой шкале в градусах.
Запах в подземных водах обычно отсутствует. Ощущение запаха свидетельствует или о наличии газов биохимического происхождения (сероводород и др.), или о присутствии гниющих органических веществ. Характер запаха выражают описательно: без запаха, сероводородный, болотный, гнилостный, плесневелый и т.
Вкус воды зависит от состава растворенных веществ. Соленый вкус вызывается хлористым натрием, горький — сульфатом магния, ржавый — солями железа. Сладковатый вкус имеют воды, богатые органическими веществами, наличие свободной углекислоты придает приятный освежающий вкус. Вкус воды оценивается по таблицам в баллах.
Прозрачность подземных вод зависит от количества растворенных в них минеральных веществ, содержания механических примесей, органических веществ и коллоидов. Для указания степени прозрачности подземных вод служит следующая номенклатура: прозрачная, слабопалесцирующая, опалесцирующая, слегка мутная, мутная, сильно мутная. Подземные воды обычно бывают прозрачными. Мутность воды оценивается в мг\л по стандартной шкале.
Температура подземных вод изменяется в очень широких пределах и зависит от геотермических особенностей района.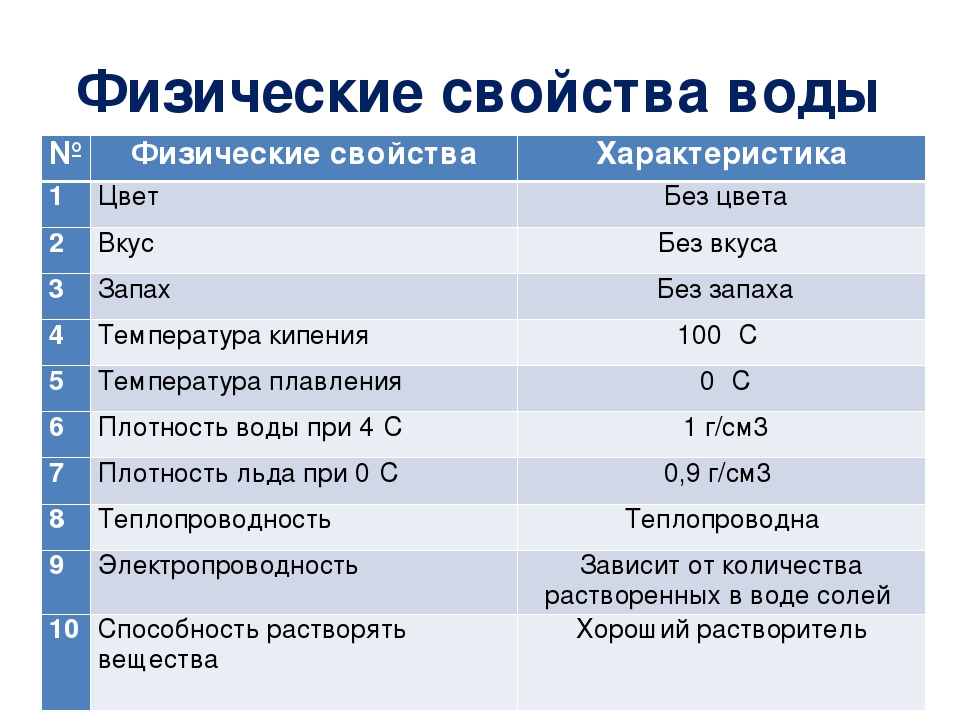 Она отражает возрастные, тектонические, литологические и гидродинамические особенности водовмещающих толщ. Температура вод влияет на их химический состав, на вязкость и на коэффициент фильтрации.
Она отражает возрастные, тектонические, литологические и гидродинамические особенности водовмещающих толщ. Температура вод влияет на их химический состав, на вязкость и на коэффициент фильтрации.
В естественных условиях подземные воды могут быть переохлажденными (ниже 0°С, распространены в районах многолетних не мерзлых пород), холодными (ниже 20°С, приурочены к верхней зоне земной коры до пояса постоянных годовых температур в средних широтах), термальными (20-100°С, вскрываются буровыми скважинами на различных глубинах) и перегретыми (100-375°С встречаются в районах современной вулканической деятельности).
Плотность воды определяется отношением ее массы к объему при определенной температуре. За единицу плотности воды принята плотность дистиллированной воды при температуре 4°С. Плотность воды зависит от температуры, количества растворенных в ней солей, газов и взвешенных частиц и изменяется от 1 до 1,4 г/см
Сжимаемость воды незначительна и характеризуется коэффициентом сжимаемости β = (2,7-5)10-5 Па. Вязкость воды характеризует внутреннее сопротивление частиц жидкости ее движению, количественно она выражается коэффициентами динамической и кинематической вязкости.
Электропроводность подземных вод зависит от количества растворенных в них солей. Пресные воды обладают незначительной электропроводностью. Дистиллированная вода является изолятором. Электропроводность воды оценивают по удельному электрическому сопротивлению
, которое выражается в Ом.м и изменяется от 0,02 до 1,0 Ом.м.Радиоактивность воды определяется содержанием в ней радона, эманации радия. За редким исключением подземные воды в той или иной степени радиоактивны.
Позвоните нам по телефону:
за более подробной информацией.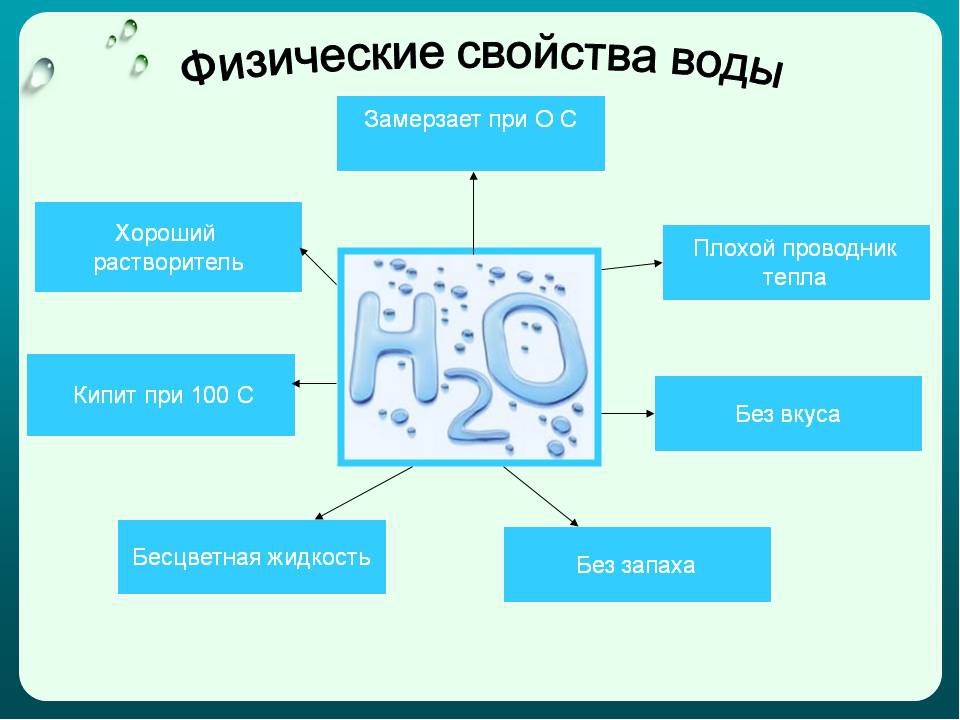
Физические свойства воды | Химия. Шпаргалка, шпора, формула, закон, презентация, ГДЗ, конспект, опыты, тесты, сообщение, реферат, кратко
При обычных условиях вода — жидкое прозрачное вещество без цвета, вкуса и запаха. Плотность жидкой воды имеет максимальное значение 1 г/см3 при 4 °C. При 0 °C вода переходит из жидкого состояния в твёрдое — лёд. При 100 °C кипит и переходит в газообразное состояние — водяной пар. Аналоги воды по строению и химическому составу — H2S, H2Se, H2Te — при комнатной температуре находятся в газообразном состоянии. Если бы свойства воды подчинялись общей закономерности, то она закипала бы при температуре -70 °C, а лёд образовывался бы при -90 °C, что вряд ли способствовало жизни на планете в её настоящем виде. Наличие водородной связи у низкомолекулярного вещества воды и объясняет аномально высокие значения её температур плавления и кипения.
Чистое вещество вода обладает и другими особенностями, которые делают это соединение поистине уникальным.
Вода способна расширяться при замерзании и иметь при +4 °C максимальную плотность. Поэтому при температуре меньше +4 °C лёд занимает верхнюю часть водоёма, укрывая, как шубой, его нижние слои и защищая водоём от промерзания. Это спасает нашу планету от обледенения. Не обладай вода таким загадочным свойством, все водоёмы и даже Мировой океан за определённый геологический период промёрзли бы до дна. Жизнь на Земле не только не получила бы своего эволюционного развития, она просто бы не возникла.
Вода обладает высокими значениями удельной теплоты плавления и удельной теплоты парообразования, которым академик В. И. Вернадский придавал планетарное значение, так как они определяют многие физико-химические и биологические процессы на Земле (рис. 157).
Высокая удельная теплота плавления льда, равная 332 • 103 Дж/кг, оберегает нашу планету от всемирных потопов. Таяние льда (рис. 158) и снега связано с огромными энергетическими затратами, поэтому процесс происходит постепенно, в большинстве случаев не причиняя вреда природе.
| Рис. 157. Облака — это миллиарды мельчайших капелек воды |
| Рис. 158. Таяние льда |
На испарение 1 кг воды при нормальном атмосферном давлении и температуре кипения расходуется 2257 • 103 Дж теплоты, т. е. приблизительно в 7 раз больше, чем на плавление 1 кг льда. В этом причина сохранения воды в жидком состоянии на нашей планете. Даже в самые жаркие дни вода испаряется крайне медленно. Поэтому и сезоны года меняются не резко, а плавно: лето — осень — зима — весна.
Вода имеет высокую удельную теплоёмкость. Эта величина показывает, какое количество теплоты надо затратить для нагревания 1 кг воды на 1 K (рис. 159). Оказывается, оно равно 4,1868 • 103 Дж.
Из-за высокой удельной теплоёмкости воды на континентах не бывает резкого перепада температур зимой и летом, ночью и днём, поскольку они окружены гигантским регулятором, своеобразным термостатом — водами Мирового океана.
При нагревании всех веществ удельная теплоёмкость их, как правило, возрастает, но вода — исключение. Изменение удельной теплоёмкости воды с повышением температуры аномально: от 0 до 30 °C она понижается и только от 50 до 100 °C повышается. Значит, удельная теплоёмкость воды достигает минимального значения при 36—37 °C, т. е. вблизи нормальной температуры тела человека и млекопитающих, благоприятной для биохимических реакций в их организме.
Ещё одна особенность воды — высокое поверхностное натяжение.
На каждую молекулу внутри жидкости действуют силы притяжения соседних молекул, окружающих её со всех сторон. На молекулы поверхностного слоя действуют как молекулы жидкости, так и молекулы газов воздуха. Взаимное притяжение молекул жидкости больше, чем молекул жидкости и газа, поэтому равнодействующая сил притяжения направлена внутрь жидкости и молекулы поверхностного слоя стремятся в неё втянуться. Под действием этой силы число молекул на поверхности уменьшается, её площадь сокращается.
| Рис. 159. Температурные шкалы Кельвина и Цельсия |
| Рис. 160. Капли росы стремятся принять форму шара |
| Рис. 161. Водомерка |
Поверхностным натяжением называется величина, равная работе, затраченной на увеличение поверхности жидкости на одну единицу.
Поверхностное натяжение собирает воду в капли (рис. 160) и позволяет водомерке (рис. 161) скользить по воде.
160) и позволяет водомерке (рис. 161) скользить по воде.
Ещё одна характеристика воды — вязкость. Обычно с повышением давления вязкость вещества увеличивается, а с ростом температуры уменьшается. Вода и здесь выделяется. Её вязкость с ростом давления при температуре ниже -30 °C значительно уменьшается. Поэтому активность организмов, живущих в низкотемпературных средах, не сильно зависит от этих температур: кровь, не потерявшая текучести, продолжает выполнять свои функции столь же интенсивно, как и при более высоких температурах.
На этой странице материал по темам:Аномальные свойства воды реферат по биологии кратко
Физ свойства воды аномалии-реферат
Опыты для реферата с водой
При обычных условиях вода это жидкое прозрачное вещество
Перечислите известные аномалии физических свойств
Какими физическими свойствами обладает вода?
Что такое поверхностное натяжение?
Как водородная связь определяет физические свойства воды?
Перечислите известные вам аномалии физических свойств воды.

Какую роль аномалии физических свойств воды играют в природе?
Урок по химии на тему «Физические и химические свойства воды. Применение воды». 8-й класс
Цель урока: сформировать у учащихся понятие о химических свойствах воды.
Предметная:
- создать условия для исследования и выявления химических свойств воды;
- способствовать осмыслению новых понятий “основания, гидроксильная группа”;
- способствовать развитию умения пользоваться опорными знаниями, закрепить умения и навыки химического эксперимента, умение работать с таблицами, учебником.
Метапредметная:
- способствовать формированию умения планировать свою деятельность для изучения различных сторон окружающей действительности, умения делать логические выводы из наблюдений по опыту;
- искать пути и средства осуществления целей.

Личностная:
- создание условий для формирования навыков сотрудничества, умения принимать мнения других;
- формирование навыков оценки и самооценки;
- сформировать понимание практической важности воды в жизни человека.
Задачи:
- Образовательные: Обобщить и расширить знания учащихся о воде, ее роли в живой и неживой природе, в жизни человека, о необходимости бережного отношения к воде.
- Развивающие: Продолжить формировать логическое мышление, умения наблюдать, анализировать и сравнивать, находить причинно-следственные связи, делать выводы, наблюдать за ходом эксперимента, осуществлять самоконтроль и взаимоконтроль.
- Воспитательные: Формировать научное мировоззрение учащихся; научить слушать учителя и своих одноклассников, быть внимательным к себе и окружающим, вести беседу.
Планируемые результаты: По окончанию урока учащиеся смогут:
Метапредметные: использовать свои знания и умения для изучения различных сторон окружающей действительности.
Предметные: иметь понятие о химических свойствах воды, писать их уравнения реакций, иметь понятия о гидроксидах, основаниях, щелочах, оксидах, кислотах, опыт проведения химического эксперимента.
Личностные: научаться управлять своей познавательной деятельностью, будут продолжать развивать в себе целеустремленность.
Формируемые химические знания, умения, навыки учащихся: систематизация знаний учащихся о распространенности воды в природе, физических и химических свойствах, областях применения воды, расширение знаний учащихся об экологических проблемах, связанных с очисткой воды.
Формируемые компетенции:
- учебно-познавательная компетенция: развитие умений сравнивать, анализировать, доказывать, составлять схемы на основе работы с текстом, быть способными решать следующие жизненно-практические задачи: умение давать оценку состояния окружающей среды, выдвижение своих идей по охране водных ресурсов родного края;
- информационная компетенция: развитие умения анализировать и отбирать необходимую информацию, умения готовить и делать сообщения, умения пользоваться Интернатом для поиска учебной информации;
- коммуникативная компетенция: развитие умений вести беседу, диалог, задавать вопросы.

Формы организации работы детей: групповая (просмотр презентации, видеоролика, решение задач), индивидуальная (беседа, работа с рабочей тетрадью, работа с книгой), проблемное обучение (решение проблемных вопросов), опережающее обучение.
Формы организации работы учителя: организует эмоциональный настрой учащихся, вводит детей в тему урока, активизация и обобщает ранее полученные знания, организует беседу по слайдам и опытам, анализирует и дополняет ответы детей, создает проблемные ситуации.
Основные виды деятельности учащихся.
1. Составлять уравнения реакций, характеризующих химические свойства воды.
2. Работа с книгой.
3. Анализ видеоролика.
4. Дидактические игры.
Используемые технологии обучения: проблемного обучение (решение проблемных вопросов), опережающее обучение, личностно-ориентированного обучения, критического мышления, здоровьесберегающая.
Используемое оборудование ИКТ: компьютер, экран, мультимедийный проектор, презентация к уроку, выполненная в программе PowerPoint, опорный конспект.
Ход урока
1. Организационный момент 1-2 мин.2. Актуализация знаний (фронтальная беседа)Здравствуйте. Хотите узнать, о чем мы сегодня с вами будем говорить? Тогда отгадайте загадку: слайд № 1.
Я и туча, и туман,
И ручей, и океан,
И летаю, и бегу,
И стеклянной быть могу!
Правильно, это вода.
Посмотрите ребята на экран. На экране слова аквариум, акватория, акваланг, акварель. Слайд № 2
Что общего в этих словах.
Ответы учащихся: слайд №2 корень аква.
Что означает слово аква?
Ответы учащихся: вода.
Сейчас мы продолжим говорить о воде, вспомним физические воды.
Слайд №3
«Вода… Ты не имеешь ни вкуса, ни цвета, ни запаха, тебя невозможно описать – тобой наслаждаешься, не ведая, что ты такое.
Ты не просто необходима для жизни, ты и есть сама жизнь. Ты божество, ты совершенство, ты самое большое богатство на свете» (Проблемный вопрос)
Ты божество, ты совершенство, ты самое большое богатство на свете» (Проблемный вопрос)
Такие слова написал о воде французский писатель Антуан де Сент-Экзюпери.
Слайд №4
- Без крыльев летят.
Без ног бегут, без паруса плывут. (Облака) - Приходил – стучал по крыше,
Ууходил – никто не слышал. (Дождь) - Растёт она вниз головою.
Не летом растет а зимою.
Но солнце её припечёт –
Заплачет она и умрет. (Сосулька)
Отгадав эти загадки мы назвали три агрегатных состояния воды.
(Газ, жидкость, лед)
А какими еще физическими свойствами обладает вода при нормальных условиях? Используя предыдущие высказывания, и свои знания обобщим физические свойства воды, работая с индивидуальной картой. Ответы проверим по слайду №5. 1-2 мин. (самопроверка)
| Характеристика вещества | Физические свойства воды |
Агрегатное состояние | Жидкое |
Вкус | Без вкуса |
Цвет | Без цвета |
Запах | Без запаха |
Температура кипения | 100° С |
Температура замерзания | 0° С |
Плотность воды при t+4°С | 1г/см3 |
 Фронтальный и индивидуальный опрос
Фронтальный и индивидуальный опрос Слайд №6
Вычислите массовые доли водорода и кислорода в воде в индивидуальной карте.
- Каков состав воды?
- Какими методами можно определить состав воды?
- Что такое анализ и синтез?
1. Вода в природе? Дополнить предыдущие ответы. Содержание воды в разных организмах.
2. Назовите способы очистки воды – отстаивание, фильтрование, обеззараживание (хлорирование, озонирование, ультрафиолетом), аэрация.
3. Чтобы очистить воду от примесей ее пропускают через решетки, направляют в отстойник, фильтруют. (Схема в учебнике)
4. Фильтром для очистки служит слой песка и гравия. Для обеззараживания питьевой воды применяют хлорирование (0,7 г хлора на 1т воды)
5. Метод хлорирования применяется и в нашем районе, хотя он устарел и экологически небезопасен для здоровья.
6. Хлорированная вода влияет, прежде всего, на органы пищеварения, печень, почки.
7. Причины загрязнения водоемов сточные воды, сбросы предприятий, с/х. Основная причина утечка нефти.
8. В чем заключается охрана природных ресурсов?
Охрана водных ресурсов. Сообщения учащихсяСообщение. «Берегите воду!»В конце ΧΙΧ в. горожанину хватало полтора ведра воды в сутки – и на мытье, и даже на тушение пожаров. Нынешняя норма – свыше 18 ведер, т.е. 220 л. На деле мы и в эту ному не укладываемся, расходуя 30-40 ведер на человека.
«Эталонное» 12-литровое ведро несильная струя воды заполняет за минуту. Вы простояли под душем 5 мин – 60 л. воды убежали в канализацию. Этого с лихвой хватит, чтобы аккуратно вымыть слона.
Струйкой толщиной со спичку литровая банка наполняется за 3 мин. Этот эксперимент позволяет установить, что за сутки из неисправного крана утекает минимум 500 л.
Существует мнение, что промышленность тратит львиную долю воды. На самом деле на выпуск 1 т стали уходит 150 м3, хлопчатобумажной ткани – 1000 м3, искусственного волокна – 3000 м3 водопроводной воды. Из воды, поступающей в Москву ежесуточно, заводы и фабрики забирают лишь четверть. Столько же идет в столовые, детские сады, больницы. Остальное – в жилые дома.
Из воды, поступающей в Москву ежесуточно, заводы и фабрики забирают лишь четверть. Столько же идет в столовые, детские сады, больницы. Остальное – в жилые дома.
А ведь экономить воду без всякого гигиенического ущерба совсем не сложно. Скажем, зубы после чистки можно прополоскать из стакана, закрыв кран. Экономия – 5 л. воды за одну человеко — чистку. Во время бритья можно, вместо того чтобы открыть кран с горячей водой, налить, как в старину, воду из чайника в стакан, на бритье уйдет не 5-10 л., а всего 0,2, а бреющихся миллионы…
Хозяйки считают, что полоскать белье после стирки надо в проточной воде. Конечно, так белье выполаскивается быстрее, поскольку градиент концентрации стирального порошка на поверхности белья и омывающей его воде больше, чем в непроточной, а значит, и скорость диффузии больше. Но зато расход воды велик. Современные моющие средства вымываются из чистого белья и после того, как оно полежит в непроточной воде 10-15 мин. Сменив воду, белье можно выполоскать дочиста. Кстати, в стиральных машинах белье полощется также в двух-трех водах, а не в проточной воде. Мыть посуду лучше всего в раковине с двумя отделениями и пробками для сливных отверстий. Так же можно мыть овощи. Не забывайте, что вода — это богатство, красота и жизнь нашей планеты, и её надо беречь.
Кстати, в стиральных машинах белье полощется также в двух-трех водах, а не в проточной воде. Мыть посуду лучше всего в раковине с двумя отделениями и пробками для сливных отверстий. Так же можно мыть овощи. Не забывайте, что вода — это богатство, красота и жизнь нашей планеты, и её надо беречь.
Учитель. Известны случаи пожаров причиной, которых являлся дождь?
Мы можете это объяснить?
Объяснить это явление, можно только изучив химические свойства воды.
Слайд №7. Химические свойства воды:
Разложение воды в индивидуальной карте записать уравнение реакции.
Проверка – прочитать уравнение, используя химический язык.
(вопросы на внимательность)
Как называется прибор — эвдиометр
- Условия прохождения реакции — пост. ток, 2000 гр.С
- Объемные отношения -1:2,
- Массовые -1:8
Взаимодействие с активными металлами
Как определить активность металла, чтобы правильно написать уравнение реакции. Металлы по своей активности делятся на три группы: активные, средней активности и неактивные. Работа с рядом активности.
Металлы по своей активности делятся на три группы: активные, средней активности и неактивные. Работа с рядом активности.
Н2О +
- Взаимодействие с менее активными металлами
- Взаимодействие с неметаллами
- Взаимодействие с оксидами металлов
- Взаимодействие с оксидами неметаллов
Запишите уравнения реакций по слайду, определите тип химической реакции (в индивидуальной карте).
Самопроверка химических свойств по слайду
Давайте просмотрим видеоролики взаимодействия воды.
Смотрите внимательно. Обратите внимание на определения. Условия течения реакций.
Что такое щелочь? (Растворимые основания)
Основания – это сложные вещества, состоящие из металлов и одной или несколько гидроксильных групп ОН.
Что за вещество фенолфталеин? (Индикатор – вещества, изменяющие свою окраску в зависимости от среды)
1) С активными металлами IA группы и IIA групп.
2Na + 2HOH = 2 Na OH + H2↑ +Q
Ca + 2HOH = Ca (OH)2 + H2↑
2) с менее активными металлами при нагревании
Zn+HOH=ZnO+H2↑
3) С неактивными металлами
Взаимодействие меди с водой — не реагирует с водой никогда.
Ребята, как вы думаете, будут ли с водой взаимодействовать серебро и золото.
Минута для релаксации (под шум прибоя)
Проведём физминутку.
Очень всем нужна вода
Делай – раз, делай – два.
Звери у ручья напились
Вправо влево наклонились.
Вместе на носочки встали,
Тучку лапками достали.
Дружно хлопнули в ладоши
До чего же день хороший.
Дождик вдруг полил с утра.
За работу нам пора!
Второй видеоролик
4. Взаимодействие с неметалламиС + НОН=СО+Н2↑
5. Взаимодействие со сложными веществами1) Взаимодействие с оксидами неметаллов.
СаО+НОН=Са (ОН)2+Q
2) Взаимодействие с оксидами неметаллов.
Просмотр видеоролик взаимодействие с кислотными оксидами.
P2O5 + 3H2O —>2 H3PO4
Применение воды.
Ни умыться, не напиться,
Без воды
Листику не распуститься
Без воды
Без воды прожить не могут
Птица, зверь и человек
И поэтому всегда
Всем везде нужна вода.
Что может быть привычнее для нас, чем вода? Это самое распространенное вещество на поверхности земли в природе. Жизнь человека во все времена самым тесным образом была связана с водой.
Работа с книгойИспользуя рис.44 стр. 109. Дайте характеристику применению воды. Беседа.
Применение водыЗемледелие. Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды, доходящих до 90 % в некоторых странах.
Питьё и приготовление пищиЖивое человеческое тело содержит от 50 % до 75 % воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т.д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
В зависимости от температуры и влажности окружающей среды, физической активности и т.д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
Питьевая вода представляет собой воду из какого-либо источника, очищенную от микроорганизмов и вредных примесей. Пригодность воды для питья при её обеззараживании перед подачей в водопровод оценивается по количеству кишечных палочек на литр воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других микробов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья.
РастворительВода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
ТеплоносительСреди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Замедлитель. Во многих ядерных реакторах вода используется не только в качестве теплоносителя, но и замедлителя нейтронов для эффективного протекания цепной ядерной реакции. Также существуют тяжеловодные реакторы, в которых в качестве замедлителя используется тяжёлая вода.
Пожаротушение. В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе пены.
Спорт. Многими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это подводное плавание, хоккей, лодочные виды спорта, биатлон и др.
Это подводное плавание, хоккей, лодочные виды спорта, биатлон и др.
Гидроабразивная резка. Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Смазка. Вода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках.
Слайды по бережному использованию воды.
Берегите эти земли, эти воды,
Даже малую былиночку любя.
Берегите всех зверей внутри природы.
Убивайте лишь зверей внутри себя!
Евгения Евтушенко
Приведите в систему все те знания, которые вы получили на уроке.
Закрепления знаний проведем дидактические игры. Учащиеся выполняют данный вид работы в индивидуальных листах.
Первая игра «Вставь пропущенное слово» (фронтальная работа)
1. Щелочи – это _(растворимые) основания
2. Вода взаимодействует с __(активными)_ металлами
3. С неактивными металлами вода _(не взаимодействует)_
4. Фенолфталеин меняет свою окраску в щелочах на (малиновую)
5. При взаимодействии воды с оксидами неметаллов образуются (кислоты)
6. Без воды человек может прожить __(три дня)__
7. Основания – это сложные вещества состоящие из металла и (гидроксильной группы ОН)
8. Вода распадается на (водород) _и (кислород)
Правильность выполнения задания осуществляется методом взаимопроверка, затем самопроверка. (слайд № 25)
Вторая игра «Удивительная цифра». На парте у вас индивидуальный лист — задание. В поле игры правильные ответы необходимо обвести кружком.
На парте у вас индивидуальный лист — задание. В поле игры правильные ответы необходимо обвести кружком.
Карточка-задание:
1. Формула воды – Н2О.
2. Мr (Н2О) = 18 а.е.м.
3. Щелочи хорошо растворяются в воде.
4. Вода не имеет вкуса и запаха.
5. Вода – хороший растворитель.
6. В воде растворяется железный гвоздь.
7. Вода имеет вкус и запах.
8. Вода – летучая жидкость.
9. Вода может существовать в трех агрегатных состояниях.
10. медь не взаимодействует с водой.
11. основание можно определить фенолфталеином.
12. Вода при температуре +4°С 1г/см3.
Заполненные индивидуальные листы сдайте на проверку учителю.
Итог урокаПочему воду называют самым уникальным веществом на земле?
Ты не просто необходима для жизни, ты и есть сама жизнь. Ты божество, ты совершенство, ты самое большое богатство на свете » (Проблемный вопрос)
Леонардо да Винчи назвал воду “Соком жизни на Земле”. Действительно, все живое в среднем состоит из этого вещества: человек – 60%, медуза – 95%, клетки мозга – 85%, кровь – 80%, клетки костной ткани – 20%. Потеря воды в количестве 1% от веса тела вызывает жажду. Если потеря воды в 10 раз больше (т.е. составляет 10% от веса тела, это может привести к смерти). Почти все химические реакции идут в водной среде. Кроме того, испаряясь, вода охлаждает организм обитателей суши. Если бы человек не испарял пот, то после часа напряженной работы или игры в футбол его температура тела подскочила бы до 460. Писатель Антуан де Сент-Экзюпери так сформулировал мысль о соотношении воды и жизни: “Вода! Ты не просто необходима для жизни, ты и есть сама жизнь!”
Действительно, все живое в среднем состоит из этого вещества: человек – 60%, медуза – 95%, клетки мозга – 85%, кровь – 80%, клетки костной ткани – 20%. Потеря воды в количестве 1% от веса тела вызывает жажду. Если потеря воды в 10 раз больше (т.е. составляет 10% от веса тела, это может привести к смерти). Почти все химические реакции идут в водной среде. Кроме того, испаряясь, вода охлаждает организм обитателей суши. Если бы человек не испарял пот, то после часа напряженной работы или игры в футбол его температура тела подскочила бы до 460. Писатель Антуан де Сент-Экзюпери так сформулировал мысль о соотношении воды и жизни: “Вода! Ты не просто необходима для жизни, ты и есть сама жизнь!”
При ответе да на данные вопросы поднимите руку.
- Урок мне был полезен, интересен (да, нет)
- Я успешно справился с большинством заданий на уроке.
- На уроке я себя чувствовал комфортно.

Домашнее задание. §32 стр.109 тест.
Творческое задание: составить синквейн по теме «Вода».
Приложение 1.
Химические свойства воды — Справочник химика 21
По химическим свойствам вода — достаточно активное вещество в подходящих условиях она реагирует со многими металлами и неметаллами, основными и кислотными оксидами, например [c.112] Химические свойства воды. Вода — весьма реакционноснособное вещество. Она взаимодействует с окислами металлов и неметаллов, образуя гидраты основного и кислотного характера. Вода обладает амфотерными свойствами. При взаимодействии со щелочами она ведет себя как кислота, а с кислотами как основание. Активные металлы взаимодействуют с водой с выделением водорода. Например, калий и натрий разлагают воду без нагревания, магний при нагревании, а железо при сильном нагревании. В результате наличия в молекуле воды отрицательно заряженных ветвей электронного облака она способна входить в состав координационных соединений в виде лигандов с образованием донорно-акцепторной связи (Си(Н20)4]804-Н20. [c.13]
[c.13]
Химические свойства воды [c.211]
Химические свойства воды. Молекулы воды отличаются [c.211]
ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ [c.101]
Ниже приводятся некоторые физико-химические свойства воды. [c.12]
Арланского месторо-з-химических свойств воды. [c.233]
Химические свойства воды. Молекулы воды отличаются большой устойчивостью к нагреванию. Однако при температурах выше 1000 °С водяной пар начинает разлагаться на водород и кислород [c.215]
Химические свойства воды Очистка воды на водоочистительных станциях [c.171]
Химические свойства. Вода — вещество устойчивое. Разложение ее на водород и кислород заметно идет лишь при температуре выше 1000° С. Вода относится к химически активным соединениям. При обычных условиях она реагирует с некоторыми (активными) металлами с выделением водорода [c. 166]
166]
Другие три главы посвящены более специальным темам. В главе I описываются особенности внутреннего строения и свойств жидкой воды и льда, различные формы состояния связанной воды, процессы образования и дегидратации кристаллогидратов и гидрогелей, лежащие в основе твердения вяжущих материалов, диаграммы состояния простейших водно-солевых систем и важнейшие химические свойства воды. Большое внимание в этой главе уделено процессам замерзания воды в различных ее состояниях, что в соответствии с климатическими условиями для значительной части нашей страны представляет существенный интерес для строителей. [c.3]
Специальная часть химии включает в себя химию конструкционных и электротехнических материалов, химию воды и топлива и специальные разделы электрохимии. Рассмотрены свойства металлов, особое внимание уделено -элементам и материалам ядерных реакторов. Освещено получение и свойства полимерных материалов. Приведены химические свойства воды, описаны методы очистки природных и сточных вод. Рассмотрено строение и химические свойства топлива, проблемы водородной энергетики. Описаны химические источники тока и электрохимические генераторы, электрохимические методы обработки и осаждения металлов. Особое внимание в учебнике уделяется проблеме охраны окружающей среды. [c.3]
Рассмотрено строение и химические свойства топлива, проблемы водородной энергетики. Описаны химические источники тока и электрохимические генераторы, электрохимические методы обработки и осаждения металлов. Особое внимание в учебнике уделяется проблеме охраны окружающей среды. [c.3]
В жидкой и твердой воде образуют водородные связи, которые обусловливают многие аномальные физико-химические свойства воды и льда. [c.215]
По химическим свойствам вода — достаточно активное вещество в подходящих условиях она реагирует со многими ме- [c.215]
Итак, в водных и неводных растворах одних и тех же исходных соединений взаимодействуют различные вещества, дающие продукты реакции с различными свойствами. Более того, исключительное своеобразие физико-химических свойств воды обусловливает и своеобразие химических свойств растворенных в ней соединений. Куда уж больше оказывается, что реакция между Ag + и С1 в воде приводит к образованию — подумать только — нерастворимого соединения АдС1. И что уж совсем удивительно хлористый натрий, поваренная соль, в воде превосходно растворима [c.82]
И что уж совсем удивительно хлористый натрий, поваренная соль, в воде превосходно растворима [c.82]
С химической точки зрения вода является весьма реакционноспособным веществом. Она соединяется со многими окислами металлов и металлоидов, энергично взаимодействует с наиболее активными металлами и вступает в различные другие реакции самого разнообразного характера. Поэтому с проявлениями химических свойств воды придется в дальнейшем встречаться довольно часто. При образовании рационализированных названий химических соединений (II 5) для молекулы НгО применяется термин акво или гидрат (в конце названия). [c.134]
Химические свойства. Вода — очень активный химический реагент, что объясняется следующими причинами 1) ориентационным взаимодействием с полярными молекулами других веществ 2) установлением Н-связей с полярными молекулами других веществ, электрический момент диполя которых близок к электрическому моменту диполя НгО 3) проявлением донорных свойств со стороны атома кислорода по отношению к частицам — акцепторам электронных пар 4) электролитической диссоциацией при обычных [c. 216]
216]
Другие химические свойства воды будут рассмотрены в дальнейшем. [c.283]
Химические свойства. Вода — весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основ- [c.164]
К важным химическим свойствам воды относится ее способность вступать в реакции гидролитического разложения (см. гидролиз солей, 6.5). [c.165]
С химической точки зрения вода является весьма реакционноспособным веществом. Она соединяется со многими оксидами металлов и металлоидов, взаимодействует с активными металлами и вступает в различные другие реакции самого разнообразного характера. Поэтому с проявлениями химических свойств воды придется в дальнейшем встречаться довольно часто. [c.113]
Вопросы электролитической диссоциации воды, гидратации ионов и реакции гидролиза уже рассмотрены выше. С химическими свойствами воды мы неоднократно будем сталкиваться при рассмотрении химии отдельных элементов. Здесь уместно отметить, что вода является весьма реакционноспособным веществом. В частности, это объясняется наличием в ее молекуле двух неподеленных электронных пар. [c.278]
Здесь уместно отметить, что вода является весьма реакционноспособным веществом. В частности, это объясняется наличием в ее молекуле двух неподеленных электронных пар. [c.278]
Химические свойства воды. Вода — весьма реакционноспособное вещество. Взаимодействует со [c.206]
В сточных водах имеются растворимые газы сероводород, углекислый газ, кислород, азот и др., общее содержание которых может достигать 0,09 mVm воды. Растворенные в воде газы влияют на физико-химические свойства воды. Кислые газы оказывают влияние на величину pH, которая может понижаться от 6,9 до 4,0. При транспортировке и хранении воды, которая содержит Нг5 и СОг, pH увеличивается вследствие выделения сероводорода и углекислого газа в железосодержащих водах pH уменьшается в результате окисления и гидролиза солей железа. [c.149]
Разрушение внутренней поверхности обсадных колонн в нефтяных скважинах при добыче слабоагрессивной продукции незначительно. Оно возрастает при эксплуатации залежей, в продукции которых содержится Нз8 и СО3. Большие разрушения наблюдаются в скважинах с высокими газовыми факторами и пластовым давлением, в продукции которых содержится значительное количество агрессивных компонентов. Отмечается, что при закачке сточных вод по колонне скорость коррозии зависит от физико-химических свойств воды и несколько меньше скорости коррозии наружной поверхности колонны. [c.374]
Оно возрастает при эксплуатации залежей, в продукции которых содержится Нз8 и СО3. Большие разрушения наблюдаются в скважинах с высокими газовыми факторами и пластовым давлением, в продукции которых содержится значительное количество агрессивных компонентов. Отмечается, что при закачке сточных вод по колонне скорость коррозии зависит от физико-химических свойств воды и несколько меньше скорости коррозии наружной поверхности колонны. [c.374]
Поскольку изменение толщины пленок влаги на поверхности твердых тел сильно влияет на физико-химические свойства воды в этих тонких слоях [47], целесообразно раздельно рассмотреть особенности процессов коррозии металлов во влажной атмосфере и при образовании фазовых слоев электролитов. [c.45]
Если к чистой воде добавить небольшое количество кислоты, то концентрация ионов водорода возрастает. При этом концентрация ионов гидроксила уменьшается, но не до нуля. Кислые растворы содержат ионы водорода в большой концентрации и ионы гидроксила в очень малой концентрации.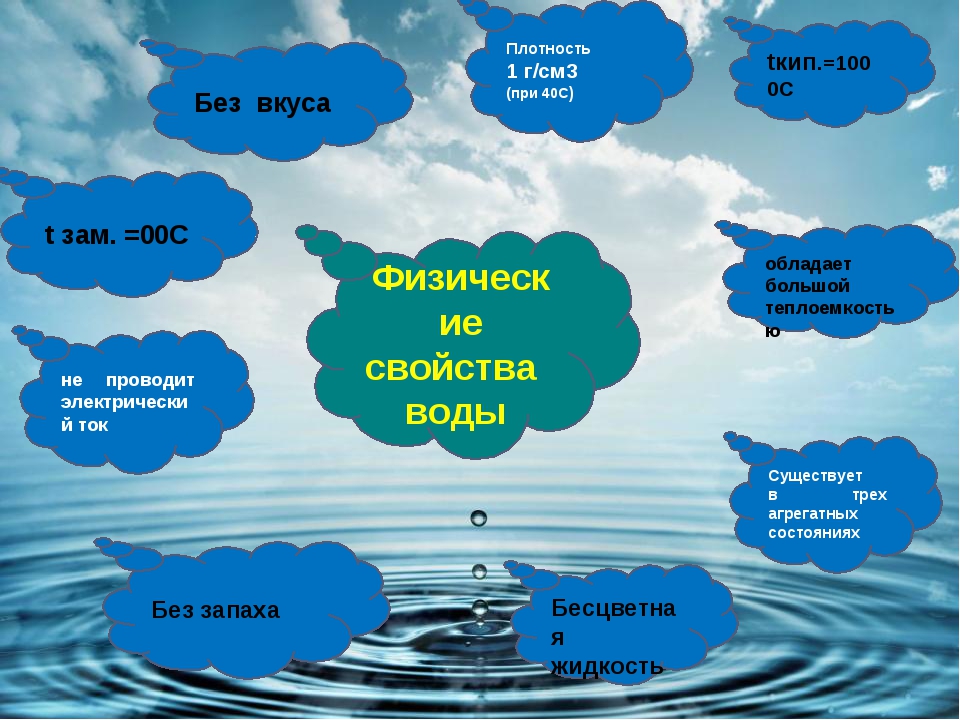 Многие химические свойства воды обусловлены тем, что для нее характерны как кислотные, так и основные функции. [c.245]
Многие химические свойства воды обусловлены тем, что для нее характерны как кислотные, так и основные функции. [c.245]
Весьма интересно в практическом и научном отношении выяснение состояния воды в нефтепродуктах. Кратко рассмотрим сначала структуру воды. Физические и химические свойства воды уникальны, что обусловлено электронной конфигурацией ее молекул, действием и направленностью водородных- связей между ними. [c.131]
Влияние физико-химических свойств воды. Высокая минерализация является существенным свойством сточных вод нефтепромыслов. Для изучения влияния минерализации воды на процесс дегазации готовилась модель пластовой сер1о-водородной воды с различным количеством хлористого натрия (до 250 г/л). [c.102]
Химические свойства воды также определяются ее составом и строением. Молекулу воды можно разрушить только энергичным внешним воздействием. Вода начинает заметно разлагаться только при 2000 °С (термическая диссоциация) или под действием ультрафиолетового излучения (фотохимическая диссоциация). На воду действует также радиоактивное излучение. При этом образуются водород, кислород и пероксид водорода Н2О2. Щелочные и щелочноземельные металлы разлагают воду с выделением водорода при обычной температуре, а магний и цинк — при кипячении. Железо реагирует с водяными парами при красном калении. Вода является одной из причин коррозии — ржавления металлов (с. 156). Благородные металлы с водой не реагируют. [c.101]
На воду действует также радиоактивное излучение. При этом образуются водород, кислород и пероксид водорода Н2О2. Щелочные и щелочноземельные металлы разлагают воду с выделением водорода при обычной температуре, а магний и цинк — при кипячении. Железо реагирует с водяными парами при красном калении. Вода является одной из причин коррозии — ржавления металлов (с. 156). Благородные металлы с водой не реагируют. [c.101]
Вода полностью разлг1таст гидриды, карбиды, фосфиды, силициды активных мс-таллоб. Соответствующие уравнения реакций приведены в Справочной части в разделе Химические свойства води , [c.140]
В периодической системе элементов Д. И. Менделеева водород занимает первое место. Особенности строения атома водорода позволяют формально рассматривать его как аналог галогенов. Для водорода характерны реакции, в которых он отдает электрон с образованием иона Н, а также присоединяет электрон с образованием гидрид-иона Н «. Самым распространенным соединением водорода является вода. Ее молекула гюстроена по кова-лентно-полярному типу связи, имеет угловую форму с валентным углом 104,5°. Молекулы воды образуют ассоциации благодаря водородным связям. Из химических свойств воды наибольшую практическую значимость имеют процессы гидратации и гидролиза. Активные металлы восстанавливают из воды водород, а галогены окисляют кислород. [c.164]
Ее молекула гюстроена по кова-лентно-полярному типу связи, имеет угловую форму с валентным углом 104,5°. Молекулы воды образуют ассоциации благодаря водородным связям. Из химических свойств воды наибольшую практическую значимость имеют процессы гидратации и гидролиза. Активные металлы восстанавливают из воды водород, а галогены окисляют кислород. [c.164]
Химические свойства воды во многом определяются ее химическим строением, в частности наличием двух неподеленных электронных пар и значительной полярностью молекулы. Вода является весьма реакционноспособным вещестаом. Она может быть окислителем, восстановителем, вступать в реакции без изменения степени окисления, функционировать в качестве лиганда в комплексных соединениях. Конкретно подобные реакции будут рассмотрены при описании химии отдельных элементов. [c.300]
Аномальные свойства воды
Аномальные свойства воды
Масалимова К. С. 1
С. 11МОУ СОШ № 1 г. Копейска Челябинской области
Лаврентьева В.Л. 11МОУ СОШ № 1 г. Копейска
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
ВВЕДЕНИЕ
Во 2 классе, на одном из занятий кружка «Необычное в обычном», учитель продемонстрировал нам как иголка не тонет на поверхности воды, налитой в небольшую емкость. Меня это удивило и заинтересовало. Как это может быть, ведь металлическая игла тяжелее? Я захотела подробнее узнать об этом удивительном свойстве воды, и выяснила, что она имеет еще и другие свойства. Я бы их назвала «волшебными», но ученые называют их «аномальными» свойствами воды.
Люди привыкли к воде, и считают ее обычным веществом. Многие не осознают, что структура воды и ее аномальные свойства обеспечивают существование жизни на Земле.
Наука до сих пор не смогла дать объяснение всем аномальным свойствам воды. Целый ряд свойств воды выпадает из общих закономерностей и правил, таких наук как физика и химия. Эти свойства не соответствуют законам «периодической системы», разработанной ученым-химиком Дмитрием Ивановичем Менделеевым. При этом, считается, что вся жизнь на Земле своим существованием во многом обязана аномальным свойствам воды, в частности — поверхностному натяжению. Так ли это на самом деле?
Целый ряд свойств воды выпадает из общих закономерностей и правил, таких наук как физика и химия. Эти свойства не соответствуют законам «периодической системы», разработанной ученым-химиком Дмитрием Ивановичем Менделеевым. При этом, считается, что вся жизнь на Земле своим существованием во многом обязана аномальным свойствам воды, в частности — поверхностному натяжению. Так ли это на самом деле?
Обоснование выбора темы: с водой мы сталкиваемся ежедневно, и она занимает важнейшее место в нашей жизни. С одной стороны — нет ничего более простого и доступного на планете, как вода, с другой – более загадочного и уникального.
Цель исследования: выяснить причины уникальности воды; при проведении физико-химических опытов, доказать, что вода необычное вещество.
Задачи:
~ изучить и проанализировать литературу и информацию в Интернете по данной теме;
~ провести наблюдения за основными состояниями воды, её физическими свойствами;
~ определить и выделить удивительные свойства воды;
~ провести эксперименты и опыты, доказывающие уникальность воды;
~ понаблюдать, как человек использует необычные свойства воды;
~ сделать выводы.
Объект исследования: вода.
Предмет исследования: свойства воды, присущие только ей и неочевидные в природе.
Гипотеза: мы предположили, что аномальные свойства воды можно доказать в домашних условиях.
Методы исследования:
~ анализ литературы и других источников;
~ экспериментальная работа;
~ наблюдение.
Актуальность заключается в практической значимости уникальности воды на современном этапе развития науки и техники. Проект реализуется в рамках химии и физики и может быть квалифицирован как экспериментально-информационный.
Вода является неотъемлемым компонентом существования всего живого. Это объясняет интерес к обнаружению воды в других частях Вселенной. Все известные биохимические процессы происходят в водной среде. Она обладает свойствами, известными с древних времен. Именно благодаря этим особенностям ее и называют «основой жизни». Так в чем же «чудесность» этих свойств? Давайте разбираться.
Все известные биохимические процессы происходят в водной среде. Она обладает свойствами, известными с древних времен. Именно благодаря этим особенностям ее и называют «основой жизни». Так в чем же «чудесность» этих свойств? Давайте разбираться.
Глава № 1. ВОДА В ПРИРОДЕ
Вода – самое значимое вещество для нашей планеты. Без нее на Земле жизнь невозможна, без нее не проходит ни один геологический процесс. Земная вода и поглощает, и возвращает очень много тепла и тем самым «выравнивает» климат. А от космического холода предохраняют Землю те молекулы воды, которые рассеяны в атмосфере – в облаках и в виде паров.
Вода входит в состав всех живых и растительных организмов. Вода присутствует не только в организме всех живых существ нашей планеты, но и во всех веществах на Земле – в минералах и горных породах.
Вода находится в постоянном и активном круговороте. Его движущей силой является Солнце, а основным источником воды — Мировой океан. Увлажняющая почву вода всасывается корнями растений. Вместе с водой растения получают растворенные питательные вещества. В растениях она поднимается по стеблям и возвращается в виде пара, в атмосферу через листья.
Его движущей силой является Солнце, а основным источником воды — Мировой океан. Увлажняющая почву вода всасывается корнями растений. Вместе с водой растения получают растворенные питательные вещества. В растениях она поднимается по стеблям и возвращается в виде пара, в атмосферу через листья.
Вода в естественных природных условиях может существовать в трех агрегатных состояниях: твёрдое – лёд; жидкое – вода; газообразное — водяной пар. Один из ранних греческих философов, Фалес Милетский (640-546 гг. до нашей эры), исследовал универсальный характер воды. Он считал ее основным элементом, из которого рождается все. Обилие воды было очевидным, но Фалес заметил, что она является единственным веществом, естественным образом, присутствующим на Земле одновременно в трех разных состояниях: твердом, жидком и газообразном. В холодный зимний день снег и лед покрывают поля, рядом течет река, а над головой плывут облака.
Глава № 2. УДИВИТЕЛЬНЫЕ СВОЙСТВА ВОДЫ
§ 1.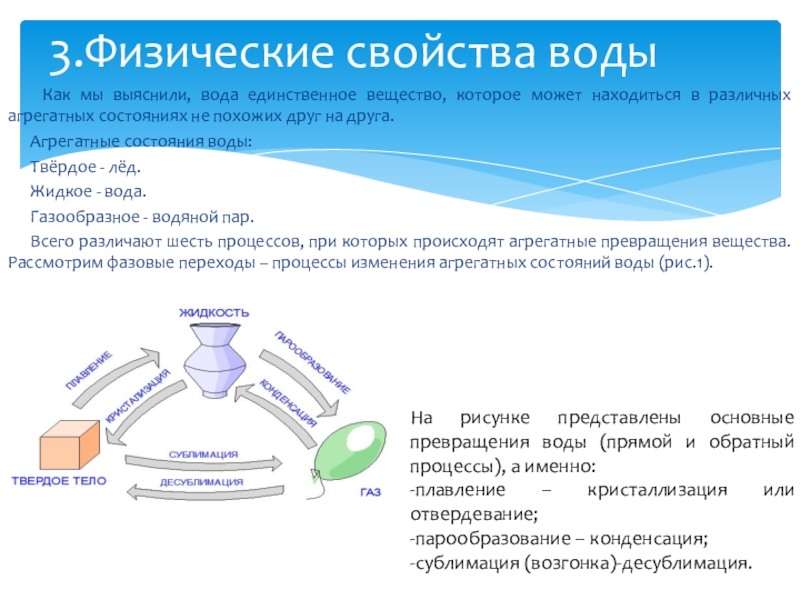 Химическая формула воды. Физические свойства воды
Химическая формула воды. Физические свойства воды
Вода — это простейшее химическое соединение двух атомов водорода и одного атома кислорода: h3O. Из химических свойств воды особенно важна способность воды растворять вещества разной химической природы. Она удивительно легко растворяет большое количество самых разнообразных веществ и газов и, что тоже весьма важно, так же легко их отдает.
Физические свойства воды – это свойства, которые проявляются вне химических реакций. Основными физическими свойствами воды являются – запах, цвет, прозрачность, вкус, плотность, температура, жесткость, вязкость, структура.
§ 2. АНОМАЛЬНЫЕ СВОЙСТВА ВОДЫ
Многие физические и химические свойства воды удивляют и выпадают из общих правил и закономерностей и являются аномальными. Отдельные свойства воды не соответствуют многим принципам физики и химии. Рассмотрим некоторые уникальные свойства воды.
Горячая вода застывает быстрее холодной
Удивительно, но факт – горячая вода замерзает быстрее холодной, что противоречит логике и общему восприятию вещей. Еще в древности Аристотель обращал внимание на это. В средние века ученые пытались объяснить данный феномен. Затем об этом неудобном факте забыли. И только в 1968 году «вспомнили» благодаря школьнику Эрасто Мпембе из далекой от всякой науки Танзании, который случайно заметил этот факт. Так его и назвали — эффект Мпембы – эффект горячей воды.
Высокая теплоемкость
Еще одним аномальным свойством воды является ее чрезвычайно высокая способность поглощать тепло без значительного повышения температуры. Пустой железный котелок, висящий над огнем, быстро раскалится докрасна, но если он заполнен водой, то его нагрев происходит постепенно. Теплоемкость воды в 10 раз превышает теплоемкость железа. Это значит, что для ее нагревания необходимо большое количество энергии, однако и при остывании энергии выделяется столько же. Это дает возможность в летнее время года накапливать тепло океанам и морям, а высвобождение тепла происходит в зимний период, Теплая вода легче холодной и всегда поднимается вверх. Благодаря этому явлению, называемому «конвекцией», большинство обитателей земных водоемов живут ближе к поверхности.
Это дает возможность в летнее время года накапливать тепло океанам и морям, а высвобождение тепла происходит в зимний период, Теплая вода легче холодной и всегда поднимается вверх. Благодаря этому явлению, называемому «конвекцией», большинство обитателей земных водоемов живут ближе к поверхности.
При замерзании вода увеличивается в объеме
В большинстве случаев при замерзании молекулы веществ располагаются ближе друг к другу, структура их становится компактнее и плотнее. Но с водой эта схема не работает. Плотность воды, при переходе ее из твердого состояния в жидкое, не уменьшается, как почти у всех других веществ, а возрастает. При замораживании объем воды увеличивается на 1%, но при этом становится не такой плотной, поэтому лед всегда легче воды, и находится на ее поверхности. Если бы озера замерзали снизу вверх, то водная жизнь вообще перестала бы существовать, а климатические и погодные условия резко изменились.
Температура закипания
Температура замерзания и кипения воды не соответствуют общим закономерностям и законам химии. Так, мы знаем, что вода в реальной жизни замерзает при 0°C, а кипит при 100°C, в то время как в соответствии с общими правилами химии эти процессы должны проходить при -90°C (минус девяносто) и -70°C (минус 70) соответственно. При -120 ° С с водой начинают происходить странные вещи: она становится тягучей, как патока, а при температуре ниже -135 ° С превращается в «стеклянную» воду — твердое вещество, в котором отсутствует кристаллическая структура.
Так, мы знаем, что вода в реальной жизни замерзает при 0°C, а кипит при 100°C, в то время как в соответствии с общими правилами химии эти процессы должны проходить при -90°C (минус девяносто) и -70°C (минус 70) соответственно. При -120 ° С с водой начинают происходить странные вещи: она становится тягучей, как патока, а при температуре ниже -135 ° С превращается в «стеклянную» воду — твердое вещество, в котором отсутствует кристаллическая структура.
Вода – уникальный растворитель
Еще одним аномальным свойством воды является ее способность растворять другие полярные соединения – соли, спирты, карбоксильные соединения. В ней можно найти более половины известных химических элементов, одни в высоких концентрациях, а другие – только в следовых количествах. Между ее подвижных молекул могут «затесаться» практически любые вещества – от жидкостей до металлов. Неполярные соединения, в том числе большинство углеводородов, растворяются в низких или следовых количествах. Например, масла, как правило, плавают на поверхности воды.
Например, масла, как правило, плавают на поверхности воды.
Поверхностное натяжение
К аномальным свойствам воды относят и ее самое высокое (после ртути) поверхностное натяжение по сравнению с любой другой жидкостью. Молекулы воды активно притягиваются друг к другу, в результате ее поверхность, стремится к минимуму. Именно поэтому естественной формой любой жидкости является шар. Объекты, более тяжелые, чем вода, могут удерживаться на ее поверхности. Насекомые способны ходить по ней, а лезвие бритвы или игла – плавать.
§ 3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Те аномальные свойства воды, которые мы описали выше, попробуем проверить в домашних условиях.
Опыт № 1. Проведем эксперимент и понаблюдаем за горячей и холодной водой в морозильной камере.
Условия: В ячейки для льда я налила теплую воду 35 ° С и поставила в морозильную камеру, засекла время превращения воды в лёд. Тоже самое проделала с холодной водой – 0,5 ° С.
Результат: тёплая вода превратилась в лед через 20 минут; холодная вода превратилась в лед через 25 минут. Для опыта необходима вода определенной температуры.
Вывод: горячая вода замерзает быстрее, чем холодная при определенных условиях.
Опыт № 2. В ходе работы над проектом я обратила внимание, что вода может перемещаться самостоятельно.
Условия: Я взяла 3 стакана, в два из них налила воду. Третий оставила пустым и к нему перекинула «мостики» из бумажных салфеток.
Результат: вода по «мостикам» «перешла» в пустой стакан, уровень воды в 3-х стаканах стал почти одинаковый.
Вывод: вода может подниматься вверх без посторонней помощи (приложение № 2) Это удивительное свойство помогает растениям получать влагу из почвы и перемещать от корней по стеблям к листьям.
Опыт № 3. Я задумалась, а какая вода быстрее будет подниматься вверх?
Условия: Я взяла 2 стакана: № 1 — с теплой водой и № 2 — с холодной водой; две полоски картона, один конец которых окрашен в разные цвета маркерами; опустила концы полосок картона в стаканы.
Результат: Краски маркера на полоске в тёплой воде поднялись вверх быстрее и выше, чем в холодной.
Вывод: теплая вода поднимается вверх быстрее холодной (приложение № 3). Теперь мне понятно, почему растения нужно поливать теплой водой, она доставит необходимые питательные вещества из почвы и живительную влагу быстрее.
Опыт № 4. Горку можно соорудить практически из чего угодно — и песка, соли, сахара. А можно ли сделать неподвижную горку из воды?
Условия: Я взяла хорошо вымытый сухой стакан, наполнила его водой до отказа, после чего аккуратно опускала в него по одной монете.
Результат: По мере опускания монет в стакан, вода из него не выливалась, а начала понемногу приподниматься, образуя горку. Это хорошо заметно, если посмотреть на стакан сбоку. По мере увеличения в стакане количества монет, горка становилась всё выше — поверхность воды надулась, словно воздушный шарик. Однако, в какой-то момент этот шарик лопнул, и вода струйками потекла по стенкам стакана. В этом опыте горка на поверхности воды образуется за счёт поверхностного натяжения.
Вывод: Взаимодействуя с твёрдой поверхностью, вода плохо к ней прилипает и плохо растекается. Именно поэтому она не стекает сразу же через край стакана при образовании горки (приложение № 4).
Опыт № 5. А можно ли управлять плавающими на поверхности предметами, при этом ничем их не касаясь.
Условия: В миску, наполненную водой, аккуратно положила 10-12 спичек. Расположила их в форме лучей звезды, по возможности равномерно. Взяла жидкое мыло и капнула в воду в центре спичечной звезды.
Результат: Спички тут же начали плыть от него к краям блюдца.
В другой миске вместо мыла опустила в центр спичечной звезды кончик кусочка сахара-рафинада.
Результат: Спички, наоборот, поплыли в обратном направлении и собрались возле погружённого в воду сахара.
Вывод: Такое поведение спичек обусловлено следующим: погружая в воду разные вещества (мыло и сахар), мы тем самым изменяем силу поверхностного натяжения. Когда капаешь мыло на поверхность жидкости, оно растворяется и смешивается с ней. Молекулы мыла проходят между молекулами воды и снижают их взаимное притяжение. Сахар действует противоположно мылу — он увеличивает поверхностное натяжение. (приложение № 5).
Опыт № 6. Следующий опыт показал, что поверхность воды может растягиваться. Как вы думаете, сколько капелек воды поместится на обычной монетке?
Условия: Я положила монетку на блюдце, а блюдце — на очень ровную поверхность. В пипетку набрала воды, капнула воду в центр монетки с очень близкого расстояния.
Результат: Опытным путем мной установлено, что на 2-х рублевой монетке помещается 20 капель воды, а на 5-ти рублевой — 28 капель. Вода на монете располагается не ровным тонким слоем, как это может показаться перед экспериментом, а образует горку. Поверхность воды растягивается и становится все более выпуклой с каждой новой каплей до тех пор, пока тонкая пленка, которую образует поверхность воды, не порвется. И тогда почти вся вода с монетки вытечет в блюдце
Вывод: Поверхность воды растягивается за счет поверхностного натяжения (приложение № 6).
Опыт № 7. В предыдущем опыте мы убедились, что поверхность воды похожа на тонкую пленку, которая может растягиваться. Теперь мы сможем рассмотреть эту пленку, и увидеть, что она может не только удерживать воду внутри, но и не дает утонуть относительно тяжелым предметам и прогибаться под их весом.
Условия: Я налила воду в стакан, взяла иголку и, держа ее горизонтально, поднесла максимально близко к поверхности воды и опустила.
Результат: Иголка плавает и можно будет рассмотреть, как поверхность воды прогибается под ее весом.
Вывод: Поверхностное натяжение воды позволяет удерживать на поверхности достаточно тяжелые предметы (приложение № 7).
Опыт № 8. В холодное время года наши квартиры теплые благодаря паровому отоплению. А почему в батареях именно вода?
Условия: Я поставила металлический ковш на плиту. Через 10 секунд его нельзя взять в руки — он раскален, так как металл нагрелся. В этот же ковш нальем стакан воды и поставим на плиту. Доводим до кипения, на это нужно уже больше времени. Переливаем горячую воду из ковша в стакан с ложкой.
Результат: Через десять минут металлический ковш остыл, а стакан стал очень горячим. Вода нагрела ложку и стенки стакана.
Вывод: У воды есть свойство долго удерживать тепло. Поэтому в батареях именно вода, ну и, конечно, вода самое доступное текучее вещество (приложение № 9).
Опыт № 9. Вода имеет свойство менять плотность при переходе в твердое состояние. Так ли это на самом деле?
Условия: Я взяла стеклянную бутылку, налила воду и поместила её в морозильную камеру холодильника.
Результат: вода замерзла и расширилась, её объём увеличился и бутылка растрескалась.
Вывод: Вода при низких температурах превращается в лед и при этом расширяется (приложение № 10).
Опыт № 10. Логично было бы предположить, что замерзая, вода, как и любое другое вещество становится тяжелее.
Условия: Кусочек льда я опустила в стакан с водой.
Результат: Лед плавает на поверхности и не тонет.
Вывод: Замерзая, вода увеличивается в объеме, но структура становится более рыхлой. Поэтому лед, легче самой воды, он плавает на поверхности и не тонет.
Опыт № 11. Приведем еще один интересный опыт, который продемонстрирует теплопроводность воды.
Условия: В воздушный шарик я налила холодную воду и немного надула. Поднесла шарик к горящей свече.
Результат: Воздушный шар не лопнул, так как в нем вода. Надуваем другой воздушный шарик и подносим к огню, он лопнул.
Вывод: Теплопроводность воды в 24 раза выше, чем у воздуха. Пока вода не испарится в шарике, он не лопнет (приложение № 12).
Опыт № 12. Жидкости, имеющие разную плотность – не смешиваются.
Условия: В стакан я поочерёдно налила жидкости разной плотности и цвета (растительное масло и воду).
Результат: они не смешиваются.
Вывод: Водородная связь определяет аномальное свойство воды смачивать большинство поверхностей. Такие вещества считаются гидрофильными. Другие вещества, такие как масла, жиры, воск и синтетика не намокают. Они являются гидрофобными. Разная плотность не дает смешиваться молекулам воды и масла (приложение № 13) .
4. ЗАКЛЮЧЕНИЕ
Объект моего исследования – вода — кажется будничным и естественным, только на первый взгляд. Исследование позволило мне сделать вывод, что многие свойства воды, присущи только ей, они обязательно встречаются в природе, но они совсем не так очевидно представляются глазам наблюдателя, как в наших опытах. На основе опытов, мы доказали уникальность воды, как химического вещества, а физические свойства воды действительно обусловлены особенностями ее строения. Гипотеза, что аномальные свойства воды можно доказать в домашних условиях – подтвердилась.
В данной работе были рассмотрены такие уникальные свойства воды, как высокая теплоёмкость, плотность, теплопроводность, конвекция или перемешивание, поверхностное натяжение.
Научная новизна:
~ опытным путём рассмотрены различные свойства воды, являющиеся уникальными, как физико-химического вещества;
~ экспериментально установлено, что физические свойства воды действительно обусловлены особенностями ее строения. На основе это, было доказана уникальность воды, как химического вещества.
Материалы исследования можно применять и использовать на уроках физики в 7-8 классах при изучении темы «Состав и физические свойства воды», а также на факультативных занятиях, внеклассных мероприятиях.
В ходе работы над проектом я научилась самостоятельности, у меня появился интерес к предметам физика и химия, которые мне еще только предстоит изучать, развились исследовательские умения и навыки, например, умение пользоваться дополнительной литературой, думать, рассуждать, делать выводы.
Список использованной литературы
1. Вода для жизни. Сбережем воду – сохраним жизнь. / авт.-сост. А. Н. Пахоменко и др. – Могилев: Могилев. обл. укруп. тип,
2. Врублевский А. И. Основы химии. Школьный курс. – 2-е изд. – Мн.: Юнипресс, 2010г. – 960 с.
3. Глинка Н. Л. Общая химия: учеб. пособие для вузов. – 23-е изд., испр. /Под ред. В. А. Рабиновича. – Л.: Химия, 1983г. – 704 с.
4. Энциклопедический словарь юного физика — М.: Педагогика, 1981
5. https://www.syl.ru/article/368647/anomalnyie-svoystva-vodyi-prichinyi znachenie
6. http://poznayka.org/s63232t1.html
7. https://vodamama.com/anomalnye-svojstva.html
9. http://sekretzdorovja.com/voda/maloizvestnoe-o-vode.html
Приложение № 1
Справа – стакан с водой +35 °C, слева – стакан с водой — 0, 5 °C
Горячая вода начала превращаться в лед через 20 минут, холодная через 25 минут
Приложение № 2
средний стакан пустой, в двух крайних стаканах – вода
вода по бумажным мостикам перешла в средний стакан
Приложение № 3
картонную полоску с отметкой черного цвета опускаем в стакан с холодной водой, с отметкой коричневого цвета – в стакан с теплой водой
теплая вода поднимается вверх быстрее, чем холодная
Приложение № 4
«горка» из воды
Приложение № 5
мыло уменьшает, а сахар увеличивает, а поверхностное натяжение воды
Приложение № 6
на двухрублевой монете помещается 20 капель воды
на пятирублевой монете помещается 28 капель воды
Приложение № 7
на поверхности воды спокойно плавают металлические игла, скрепка, лезвие
Приложение № 8
горячий металлический ковш остыл очень быстро, а стакан с водой – нет
Приложение № 9
при замерзании вода увеличилась в объеме
Приложение № 10
кусочек льда не тонет в воде
Приложение № 11
воздушный шар, наполненный водой, не лопается
воздушный шар, без воды лопнул сразу
Приложение № 12
растительное масло и вода не смешиваются
Просмотров работы: 4937
Физические и химические свойства веществ
Различные вещества отличаются друг от друга своими свойствами.
Свойства вещества — это признаки, по которым одно вещество отличается от других веществ или сходно с ними.
Пример. Сходства и отличия между водой и ацетоном на примере трёх свойств:
| Свойства | Вещества | |
|---|---|---|
| Вода | Ацетон | |
| Температура кипения | 100 °C | 56 °C |
| Цвет | нет | нет |
| Запах | нет | есть |
Свойства вещества делятся на физические и химические.
Физические свойства вещества — это свойства вещества, которые можно определить наблюдением, измерением или экспериментальным путём, без его превращения в другое вещество.
Пример. Вода не имеет цвета, вкуса, запаха, в зависимости от окружающих условий может находиться в одном из трёх агрегатных состояний — жидком, твёрдом или газообразном. Цвет, запах, вкус, агрегатное состояние при определённых температуре и давлении — физические свойства.
Физические свойства вещества зависят от его агрегатного состояния.
Пример. Плотность льда, воды и водяного пара различна. Газообразный кислород бесцветный, а жидкий — голубой.
Химические свойства вещества — это свойства вещества, которые проявляются в химических реакциях.
Пример. Вода при очень высокой температуре разлагается на водород и кислород. Вода вступает в химическую реакцию с натрием, при этом образуются гидроксид натрия и водород. Железо окисляется при нагревании на воздухе или в токе кислорода, или при высокой влажности воздуха. Способность окисляться, вступать в химическую реакцию с другими веществами и разлагаться — химические свойства.
Для установления свойств вещества необходимо брать его с минимально возможным количеством примесей. Иногда даже очень малое содержание примеси может привести к сильному изменению некоторых свойств вещества.
Пример. Содержание в цинке лишь сотых долей процента железа или меди ускоряет его взаимодействие с соляной кислотой в сотни раз.
Изучить вещество — это значит узнать его свойства, описать из чего и как оно построено.
Эмульсия — Что такое Эмульсия?
Нефтяные эмульсии — это механическая смесь нефти и пластовой воды, нерастворимых друг в друге и находящихся в мелкодисперсном состоянии.
Эмульсия — дисперсная система, состоящая из микроскопических капель жидкости (дисперсной фазы), распределенных в другой жидкости (дисперсионной среде).
Эмульсии могут быть образованы 2мя любыми несмешивающимися жидкостями.
В большинстве случаев одной из фаз эмульсий является вода, а другой — вещество, состоящее из слабополярных молекул (например, нефть или газ).
2 фазы нефтяных эмульсий:
- внутренняя — дисперсной фазой, и она разобщена;
- внешняя — дисперсионной средой (постоянная фаза), представляющей собой сплошную неразрывную фазу.
Эмульгированию нефти способствует:
- наличие нафтеновых кислот или сернистые соединений в смолистой нефти;
- интенсивное перемешивание ее с водой при добыче.
- нефть в воде — гидрофильная эмульсия, когда нефтяные капли образуют дисперсную фазу внутри водной среды. Содержание нефти: менее 1 %.
- вода в нефти — гидрофобная эмульсия, когда капли воды образуют дисперсную фазу в нефтяной среде. Содержание воды: 0,1 — 90 % и более.
Определение типа эмульсии путем определения свойств ее дисперсионной среды:
- в эмульсии нефть/вода дисперсионной средой является вода, и поэтому такая эмульсия смешивается с водой в любых соотношениях и обладают высокой электропроводностью,
- в эмульсии вода /нефть дисперсионной средой является нефть, и эмульсия смешиваются только с углеводородной жидкостью и не обладают достаточной электропроводностью.
- в процессах первичного и вторичного вскрытия продуктивных пластов,
- при глушении скважин,
- при обработках призабойной зоны пласта,
- процессах повышения нефтеотдачи.
Основные физико-химические свойства нефтяных эмульсий.
Дисперсность эмульсии — это степень раздробленности дисперсной фазы в дисперсионной среде.
Дисперсность — основная характеристика эмульсии, определяющей их свойства.
Размеры капелек дисперсной фазы в нефтяных эмульсиях 0,1 — 100 мкм.
Вязкость эмульсии — зависит от
— вязкости самой нефти,Вязкость нефтяных эмульсий не обладает аддитивным свойством, т. е. вязкость эмульсии не равна сумме вязкости нефти и воды.
— температуры, при которой получается эмульсия,
— количества воды, содержащейся в нефти,
— степени дисперсности,
— присутствия механических примесей (особенно сульфида железа FeS),
— рН воды.
При содержании воды в нефти свыше 20 % вязкость эмульсии резко возрастает.
Максимума вязкость достигает при критической концентрации воды, характерной для данного месторождения. При дальнейшем росте концентрации воды вязкость эмульсии резко уменьшается.
Эмульсия типа нефть /вода транспортируется при меньших энергетических затратах, чем эмульсия типа вода/нефть.
Электрические свойства эмульсий.
Нефть и вода в чистом виде — хорошие диэлектрики.
Электропроводимость нефти (удельная) 2∙10−10 — 0,3∙10−18 Ом−1∙см−1, а воды 10−7 — 10−8 Ом−1∙см−1.
Наличие в воде растворенных солей или кислот увеличивает электропроводимость в 10ки раз.
В нефтяных эмульсиях, помещенных в электрическом поле, капли воды располагаются вдоль его силовых линий, что приводит к резкому увеличению электропроводимости этих эмульсий. поскольку капли воды имеют в 40 раз большую диэлектрическую проницаемость, чем нефти.
Этот метод используется для разрушения нефтяных эмульсий.
Устойчивость нефтяных эмульсий и их старение (стабильность) — способность в течение определенного времени не разрушаться и не разделяться на нефть и воду.
В процессе перемешивания нефти с пластовой водой, вода дробится на мелкие капельки (глобулы), на поверхности которых адсорбируются частицы эмульгатора и образуют пленку, препятствующую слиянию глобул.
Устойчивость нефтяных эмульсий зависит:
- дисперсность системы,
- физико-химические свойства эмульгаторов, образующих на поверхности раздела фаз адсорбционные защитные оболочки;
- наличие на глобулах дисперсной фазы двойного электрического заряда;
- температура смешивающихся жидкостей;
- величина рН эмульгированной пластовой воды.
1.3 Физические и химические свойства — химия
Цели обучения
К концу этого раздела вы сможете:
- Определять свойства и изменения вещества как физические или химические
- Определять свойства материи как экстенсивные или интенсивные
Характеристики, позволяющие отличить одно вещество от другого, называются свойствами. Физическое свойство — это характеристика вещества, не связанная с изменением его химического состава.Знакомые примеры физических свойств включают плотность, цвет, твердость, точки плавления и кипения, а также электропроводность. Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения. Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения ее химического состава (идентичности веществ, содержащихся в материи).Мы наблюдаем физические изменения, когда воск тает, когда сахар растворяется в кофе и когда пар конденсируется в жидкую воду (рис. 1). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными противоугонными бирками) и измельчение твердых частиц в порошки (которые иногда могут приводить к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменяется его химический состав.
Рисунок 1. (a) Воск претерпевает физические изменения при нагревании твердого воска и образует жидкий воск. (б) Конденсация пара внутри кастрюли — это физическое изменение, поскольку водяной пар превращается в жидкую воду. (кредит а: модификация работы «95jb14» / Wikimedia Commons; кредит б: модификация работы «mjneuby» / Flickr)
Изменение одного типа вещества в другой (или невозможность изменения) — это химическое свойство . Примеры химических свойств включают воспламеняемость, токсичность, кислотность, реакционную способность (многие типы) и теплоту сгорания.Железо, например, соединяется с кислородом в присутствии воды с образованием ржавчины; хром не окисляется (рис. 2). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень инертен.
Рис. 2. (a) Одно из химических свойств железа — то, что оно ржавеет; (б) одно из химических свойств хрома состоит в том, что это не так. (кредит а: модификация работы Тони Хисгетта; кредит б: модификация работы «Атома» / Wikimedia Commons)
Чтобы определить химическое свойство, мы ищем химическое изменение.Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это другой тип вещества, чем железо, кислород и вода, присутствовавшие до образования ржавчины. Взрыв нитроглицерина — это химическое изменение, потому что образующиеся газы представляют собой вещества, очень отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, которые проводятся в лаборатории (например, взаимодействие меди с азотной кислотой), все формы горения (горения) и приготовление, переваривание или гниение пищи (рис. 3).
Рис. 3. (a) Медь и азотная кислота претерпевают химические изменения с образованием нитрата меди и коричневого газообразного диоксида азота. (b) Во время горения спички целлюлоза в спичке и кислород воздуха подвергаются химическому изменению с образованием диоксида углерода и водяного пара. (c) Приготовление красного мяса вызывает ряд химических изменений, включая окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (г) Банан становится коричневым — это химическое изменение, связанное с образованием новых, более темных (и менее вкусных) веществ.(кредит b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)
Свойства материи делятся на две категории. Если свойство зависит от количества присутствующего вещества, это обширное свойство . Масса и объем вещества являются примерами обширных свойств; например, галлон молока имеет большую массу и объем, чем чашка молока. Стоимость обширной собственности прямо пропорциональна количеству рассматриваемого вещества.Если свойство образца вещества не зависит от количества присутствующего вещества, это свойство интенсивного содержания . Температура — это пример интенсивного свойства. Если галлон и чашка молока имеют температуру 20 ° C (комнатная температура), при их объединении температура остается на уровне 20 ° C. В качестве другого примера рассмотрим различные, но взаимосвязанные свойства тепла и температуры. Брызги горячего кулинарного масла на руку вызывают кратковременный небольшой дискомфорт, а горшок с горячим маслом вызывает серьезные ожоги.И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Опасный алмаз
Вы могли видеть символ, показанный на Рисунке 4, на контейнерах с химическими веществами в лаборатории или на рабочем месте. Этот алмаз с химической опасностью, который иногда называют «огненным алмазом» или «опасным алмазом», дает ценную информацию, которая кратко описывает различные опасности, о которых следует помнить при работе с определенным веществом.
Рис. 4. Алмазный алмаз Национального агентства противопожарной защиты (NFPA) обобщает основные опасности химического вещества.
Национальное агентство противопожарной защиты (NFPA) 704 Система идентификации опасностей была разработана NFPA для предоставления информации о безопасности определенных веществ. Система детализирует воспламеняемость, реактивность, здоровье и другие опасности. Верхний (красный) ромб внутри общего символа ромба указывает уровень пожарной опасности (диапазон температур для точки вспышки).Синий (левый) ромб указывает на степень опасности для здоровья. Желтый (правый) ромб указывает на опасность реакционной способности, например, насколько легко вещество подвергнется детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особые опасности, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха / кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислотным, щелочным, биологическая опасность, радиоактивность и т. д. Каждая опасность оценивается по шкале от 0 до 4, где 0 означает отсутствие опасности, а 4 — чрезвычайно опасную.
Хотя многие элементы сильно различаются по своим химическим и физическим свойствам, некоторые элементы обладают схожими свойствами. Мы можем идентифицировать наборы элементов, которые демонстрируют общее поведение. Например, многие элементы хорошо проводят тепло и электричество, а другие плохо проводят. Эти свойства можно использовать для сортировки элементов по трем классам: металлы (элементы с хорошей проводимостью), неметаллы (элементы с плохой проводимостью) и металлоиды (элементы, обладающие свойствами как металлов, так и неметаллов).
Периодическая таблица — это таблица элементов, в которой элементы с похожими свойствами расположены близко друг к другу (рис. 4). Вы узнаете больше о таблице Менделеева, продолжая изучать химию.
Рис. 4. Периодическая таблица показывает, как элементы могут быть сгруппированы по определенным схожим свойствам. Обратите внимание, что цвет фона указывает, является ли элемент металлом, металлоидом или неметаллом, тогда как цвет символа элемента указывает, является ли элемент твердым, жидким или газообразным.
Все вещества обладают определенными физическими и химическими свойствами и могут претерпевать физические или химические изменения. Физические свойства, такие как твердость и температура кипения, и физические изменения, такие как плавление или замерзание, не влекут за собой изменение состава вещества. Химические свойства, такие как воспламеняемость и кислотность, а также химические изменения, такие как ржавление, приводят к образованию вещества, которое отличается от того, что было раньше.
Измеримые свойства делятся на две категории.Обширные свойства зависят от количества присутствующего вещества, например, от массы золота. Интенсивные свойства не зависят от количества присутствующего вещества, например, плотности золота. Тепло — это пример экстенсивного свойства, а температура — пример интенсивного свойства.
Химия: упражнения в конце главы
- Классифицируйте шесть подчеркнутых свойств в следующем абзаце как химические или физические:
Фтор — это бледно-желтый газ , который реагирует с большинством веществ .Свободный элемент плавится при −220 ° C и кипит при −188 ° C . Мелкодисперсные металлы горят во фторе ярким пламенем. Девятнадцать граммов фтора вступят в реакцию с 1,0 граммами водорода .
- Классифицируйте каждое из следующих изменений как физические или химические:
(а) конденсация пара
(б) сжигание бензина
(в) сквашивание молока
(г) растворение сахара в воде
(д) плавка золота
- Классифицируйте каждое из следующих изменений как физические или химические:
(а) сжигание угля
(б) таяние льда
(c) смешивание шоколадного сиропа с молоком
(г) взрыв петарды
(д) намагничивание отвертки
- Объем пробы газообразного кислорода изменился с 10 мл до 11 мл при изменении температуры.Это химическое или физическое изменение?
- 2,0-литровый объем газообразного водорода в сочетании с 1,0 литром газообразного кислорода для получения 2,0 литров водяного пара. Кислород претерпевает химические или физические изменения?
- Объясните разницу между экстенсивными и интенсивными свойствами.
- Укажите следующие свойства как обширные или интенсивные.
(а) том
(б) температура
(в) влажность
(г) тепло
(е) точка кипения
- Плотность (d) вещества — это интенсивное свойство, которое определяется как отношение его массы (m) к его объему (V).
Учитывая, что масса и объем являются экстенсивными свойствами, объясните, почему их соотношение, плотность, является интенсивным.
Характеристики воды — физические, химические и биологические
Вода имеет три характеристики: физические, химические и биологические. Неочищенную очищенную воду можно проверить и проанализировать путем изучения и тестирования этих характеристик, как описано ниже:
Физические характеристики воды 1.Мутность водыМутность измеряется стержнем мутности или измерителем мутности с оптическими наблюдениями и выражается как количество взвешенных веществ в мг / л или частях на миллион (ppm).
Для воды ppm и мг / л примерно равны.
Стандартная единица — это единица, которую получают из одного миллиграмма тонкоизмельченного кремнезема (фуллеровой земли) в одном литре дистиллированной воды.
Измерители мутностиШток для определения мутности:
Мутность можно легко измерить в полевых условиях с помощью стержня для измерения мутности.Он состоит из алюминиевого стержня, градуированного для определения мутности непосредственно в единицах диоксида кремния (мг / л)
Мутномер:
Мутность можно легко измерить в лаборатории с помощью прибора, называемого измерителем мутности. В общем, измеритель мутности работает по принципу измерения помех, создаваемых пробой воды прохождению световых лучей.
Свеча Джексона Мутномер:
Следовательно, для менее мутной воды высота водяного столба будет больше, и наоборот.Чем длиннее световой путь, тем меньше мутность. Такой турбидиметр не может измерять турбидиты ниже 25 JTU.
Может использоваться только для естественных источников и не может использоваться для измерения мутности очищенной воды, для чего используется мутномер Baylis или современные нефелометры .
Мутномеры Baylis
Одна из двух стеклянных пробирок заполнена пробой воды (мутность которой I необходимо измерить), а другая — стандартным водным раствором известной мутности.Электрическая лампочка горит, и синий цвет в обеих лампах наблюдается сверху прибора.
Современный нефелометр: для низкой мутности менее 1 единицы.
NTU — нефелометрические единицы измерения мутности
FTU — Единицы измерения мутности формазина
Коэффициент мутности: Речная вода имеет максимальную мутность.
2. ЦветНаличие цвета в воде не является нежелательным с точки зрения здоровья, но может испортить цвет стираемой одежды.Стандартная единица цвета — это единица, которая получается из одного миллиграмма платинового кобальта, растворенного в одном литре дистиллированной воды.
Для общественных принадлежностей число цветов по кобальтовой шкале не должно превышать 20, а желательно меньше 10.
Цвет, определяемый прибором, известен как тинтометр .
3. Вкус и запахСтепень вкуса или запаха, присутствующего в конкретном образце воды, измеряется термином, называемым запах интенсивность , который связан с пороговым значением запаха или пороговым числом запаха.
Тестируемая вода постепенно разбавляется водой без запаха и определяется смесь, при которой обнаружение запаха при наблюдении человеком только что теряется. Количество разбавлений образца представляет собой пороговое значение запаха.
Для коммунального водоснабжения вода, как правило, не должна иметь запаха, т.е. пороговое число должно быть 1 и никогда не должно превышать 3.
4. Температура водыДля питьевой воды желательна температура около
° C.Оно не должно быть больше C. 5. Удельная проводимостьОбщее количество растворенных солей, присутствующих в воде, можно легко оценить, измерив удельную проводимость воды.
Химические характеристики воды 1. Общее количество твердых и взвешенных веществОбщее количество твердых веществ (взвешенные твердые частицы + растворенные твердые частицы) можно получить, выпарив образец воды, взвесив оставшийся сухой остаток и взвесив остаток, оставшийся на фильтровальной бумаге.
Взвешенное твердое вещество может быть обнаружено путем фильтрации пробы воды. Общее допустимое количество твердых веществ в воде обычно ограничивается 500 ppm.
2. Значение pH водыЕсли концентрация
увеличивается, pH снижается, и тогда он будет кислым.Если концентрация
уменьшается, pH увеличивается, и тогда он будет щелочным.pH + pOH = 14
: если pH воды больше 7, она будет щелочной, а если меньше 7 — кислой.
Щелочность вызвана присутствием бикарбоната кальция и магния или карбонатов гидроксидов натрия, калия, кальция и магния.
Некоторые, но не все соединения, вызывающие щелочность, также вызывают твердость.
Измерение pH:
можно быстро и автоматически измерить значение pH воды с помощью потенциометра .
pH также можно измерить с помощью индикаторов, указанных ниже:
| Индикатор | Диапазон pH индикаторного красителя | Исходный цвет | Окончательный произведенный цвет |
| Метиловый оранжевый | 2.8 — 4,4 | Красный | Желтый |
| Метил красный | 4,4 — 6,2 | Красный | Желтый |
| Феноловый красный | 6,8 — 8,4 | Желтый | Красный |
| Фенолфталеин | 8,6 — 10,3 | Желтый | Красный |
Допустимое значение pH для общественного питания может находиться в диапазоне от 6,6 до 8.4.
Более низкое значение pH может вызвать образование отложений, отложений и затруднение хлорирования.
3. Жесткость водыЖесткая вода нежелательна, потому что она может привести к большему расходу мыла, образованию накипи в котлах, коррозии и образованию корки на трубах, потере вкуса пищи и т. Д.
Временная жесткость : Если в воде присутствуют бикарбонаты и карбонаты кальция и магния, вода временно становится жесткой, поскольку эту жесткость можно в некоторой степени снизить простым кипячением или полностью, добавив в воду известь.Такая твердость называется временной твердостью или карбонатной твердостью.
Постоянная жесткость: Если в воде присутствуют сульфаты, хлориды и нитраты кальция или магния, их невозможно удалить простым кипячением, поэтому такая вода требует специальной обработки для смягчения. Такая твердость известна как постоянная твердость или негарбонатная твердость.
Это вызвано сульфатами, хлоридами, нитратами Ca и Mg.
Карбонатная жесткость = Общая жесткость или щелочность (в зависимости от того, что меньше)
Негарбонатная жесткость = Общая жесткость — Щелочность
- Карбонатная жесткость равна общей жесткости или щелочности, которая всегда меньше
- Некарбонатная жесткость — это общая жесткость, превышающая щелочность.Если щелочность равна или превышает общую жесткость, негарбонатная жесткость отсутствует.
- Одна французская степень жесткости равна 10 мг / л CaCO3.
- Одна британская степень жесткости равна жесткости 14,25 мг / л.
- Вода с жесткостью до 75 частей на миллион считается мягкой, более 200 частей на миллион — жесткой, а промежуточная — умеренно жесткой.
- Подземные воды обычно жестче поверхностных.
- Предел жесткости, предписанный для общественных мест, составляет от 75 до 115 частей на миллион.
Содержание хлоридов в очищенной воде, поставляемой населению, не должно превышать значение около 250 ppm.
Содержание хлоридов в воде можно измерить титрованием воды стандартным раствором нитрата серебра с использованием хромата калия в качестве индикатора.
(5) Содержание азотаПрисутствие азота в воде может происходить по одной или нескольким из следующих причин:
- Свободный аммиак: Указывает на самую первую стадию разложения органических веществ.Она не должна превышать 0,15 мг / л
- Белковые или органические вещества: Указывает количество азота, присутствующего в воде до начала разложения органического расплава. Она не должна превышать 0,3 мг / л
- Нитриты: Не полностью окисленное органическое вещество в воде.
- Нитраты: Указывает на полностью окисленные органические вещества в воде (представляющие собой старые загрязнения).
- Нитриты очень опасны, поэтому допустимое количество нитритов в воде должно быть нулевым.
- Аммиачный азот + органический азот = азот Кьельдаля
- Нитраты в воде не вредны. Однако присутствие слишком большого количества нитратов в воде может отрицательно сказаться на здоровье младенцев, вызывая болезнь, называемую метгемоглобинемией , обычно называемой болезнью синего ребенка.
- Концентрация нитратов в бытовом водоснабжении ограничена 45 мг / л.
Железо — 0.3ppm, их избыток вызывает обесцвечивание одежды.
Марганец — 0,05 частей на миллион
Медь — 1,3 частей на миллион
Сульфат — 250 частей на миллион
Фторид — 1,5 промилле, в избытке действует на легкие человека и другие органы дыхания.
Концентрация фторида менее 0,8 — 1,0 ppm вызывает кариес (кариес). Если концентрация фтора превышает 1,5 ppm, это вызывает появление пятен и изменение цвета зубов (заболевание, называемое флюорозом).
7. Растворенные газыГазообразный кислород обычно поглощается водой из атмосферы, но он потребляется нестабильными органическими веществами для их окисления.Следовательно, если содержание кислорода в воде оказывается ниже уровня ее насыщения, это указывает на присутствие органических веществ и, следовательно, делает воду подозрительной.
Биологическая потребность в кислороде (БПК):Количество органических веществ, присутствующих в пробе воды, можно оценить, добавив в этот образец кислород и определив количество кислорода, потребляемого органическими веществами, присутствующими в воде. Эта потребность в кислороде известна как биологическая потребность в кислороде (БПК).
Практически невозможно определить предельную потребность в кислороде.Следовательно, БПК воды в течение первых пяти дней при температуре
° С обычно считается стандартной потребностью. = потеря кислорода в мг / л x коэффициент разбавления.БПК безопасной питьевой воды должен быть нулевым.
Бактериальные и микроскопические характеристики водыПять типов паразитических организмов (т. Е. Бактерии, простейшие, вирусы, черви и грибки) обычно известны как основные инфекционные и встречаются в воде.
1. БактерииЭто крошечные одноклеточные организмы, не имеющие определенного ядра и не имеющие зеленого материала, который помогал бы им производить собственную пищу.Они воспроизводятся двойным синтезом и могут иметь различные формы и размеры от 1 до 4 микрон, исследуемые под микроскопом.
a) Незаболевые бактерии — Непатогенные бактерии.
б) Бактерии, вызывающие болезни — Патогенные бактерии.
2. ПростейшиеЭто одноклеточные животные и представляют собой низшую и простейшую форму животной жизни. Они пожирают бактерии и таким образом уничтожают болезнетворные микроорганизмы. Их считают под микроскопом.
3.Вирусы 4. ЧервиЭто личинки мух.
5. ГрибыЭто те растения, которые растут без солнечного света и питаются другими растениями или животными, живыми или мертвыми.
Классификация бактерий по потребности в кислороде:- Аэробные бактерии: Те, которым для выживания требуется кислород.
- Анаэробные бактерии: Те, которые процветают в отсутствие свободного кислорода.
- Факультативные бактерии: Те, которые могут выжить как со свободным кислородом, так и без него.
Патогенные бактерии
Их можно проверить и пересчитать в лабораториях, но с большим трудом. Поэтому эти тесты, как правило, не проводятся в обычном порядке для проверки качества воды. Обычные рутинные тесты обычно проводятся для обнаружения и подсчета наличия колиформ, которые сами по себе безвредны, но их присутствие или отсутствие указывает на присутствие или отсутствие патогенных бактерий.
Методы измерения наличия колиформных бактерий:
- Мембранно-фильтровальная техника (современная техника)
- Смешивание различных разведений пробы воды с лактозной пеной и их инкубирование в пробирках в течение 48 часов при C. Наличие кислоты или углекислого газа в пробирках будет указывать на присутствие бактерий группы кишечной палочки.
Наиболее вероятное число (MPN) представляет плотность бактерий.
Колиформный индекс
Его можно определить как величину, обратную наименьшему количеству пробы, которое дает положительную долю.Колиформные бактерии, иногда называемые бактериями coli (B-coli) или Escherichia (E-coli), являются безвредными аэробными микроорганизмами.
Если на 100 мл воды присутствует не более 1 кишечной палочки, считается, что вода безопасна для питья.
Подробнее:
Испытания качества воды для бетонных конструкций и рекомендуемые пределы
5 Физические характеристики воды
Некоторые из основных физических характеристик воды следующие: 1.Взвешенные вещества 2. Мутность 3. Цвет 4. Вкус и запах 5. Температура!
Физические параметры определяют те характеристики воды, которые реагируют на зрение, осязание, вкус или запах. В эту категорию попадают взвешенные твердые вещества, мутность, цвет, вкус, запах и температура.
1. Взвешенные твердые частицы:Взвешенные твердые вещества в воде могут состоять из неорганических или органических частиц или из несмешивающихся жидкостей (масел или консистентных смазок). Неорганические твердые вещества, такие как глина, ил и другие компоненты почвы, часто встречаются в поверхностных водах.Органические материалы, такие как растительные волокна и твердые биологические вещества (бактерии, клетки водорослей и т. Д.), Также являются обычными составляющими поверхностных вод.
Эти материалы часто являются естественными загрязнителями, возникающими в результате эрозионного действия воды, текущей по поверхности. Взвешенная вода редко входит в состав грунтовых вод из-за фильтрующей способности почвы. Бытовые сточные воды обычно содержат большое количество взвешенных веществ, которые в основном являются органическими по своей природе. Широкое разнообразие взвешенных примесей органической или неорганической природы может быть результатом промышленного использования воды.
Взвешенная вода имеет следующие воздействия:
(a) Взвешенные вещества не вызывают эстетического удовлетворения, а биологическое разложение органического вещества может привести к образованию вредных побочных продуктов.
(b) Взвешенное вещество обеспечивает участки адсорбции для вредных химических или биологических организмов, которые могут отрицательно повлиять на флору и фауну реки.
(c) Оседая, взвешенные частицы задыхают организмы, населяющие дно водных местообитаний.
(d) Взвешенные вещества уменьшают свет, тем самым приводя к снижению фотосинтеза и соответствующей потере производства пищевых продуктов, что, в свою очередь, влияет на жизнь потребителей в зависимости от потребностей водной флоры в питании.
2. Мутность:Мутность — это мера того, насколько свет поглощается или рассеивается взвешенным материалом в воде. Поскольку на поглощение и рассеяние влияют как размер, так и характеристики поверхности взвешенного материала, мутность не является прямым количественным измерением взвешенных твердых частиц.
Например, один маленький камешек в стакане воды практически не помутнет. Но если этот маленький камешек раздробить на сотни частиц коллоидного размера, получится измеримая мутность, даже если масса твердых частиц не изменилась.
Большая часть мутности поверхностных вод возникает в результате эрозии коллоидных материалов, таких как глина, ил, обломки горных пород и оксиды металлов из почвы. Растительные волокна и микроорганизмы также способствуют помутнению.Бытовые и промышленные сточные воды могут содержать самые разные вещества, вызывающие мутность. Мыло, моющие средства и эмульгаторы производят стабильные коллоиды, которые приводят к мутности.
Мутность оказывает следующее отрицательное влияние на качество воды:
(a) Коллоидный материал, связанный с помутнением, обеспечивает места адсорбции для химических веществ, которые могут быть вредными или вызывать нежелательный вкус и запах, а также для биологических организмов, которые могут быть вредными.
(b) Мутность может придавать воде коричневый или другой цвет в естественных водоемах в зависимости от светопоглощающих свойств твердых веществ и может препятствовать проникновению света и фотосинтетическим реакциям в ручьях и озерах.
(c) Накопление частиц в пористых руслах ручья, вызывающих помутнение, приводит к образованию отложений, которые могут отрицательно повлиять на флору и фауну ручья.
3. Цвет:Чистая вода бесцветна, но в природе вода часто бывает окрашена посторонними веществами.Вода, цвет которой частично обусловлен взвешенными веществами, имеет видимый цвет. Цвет, создаваемый растворенными твердыми частицами, которые остаются после удаления взвешенных веществ, известен как истинный цвет.
Дубильные вещества, гуминовая кислота и т. Д., Присутствующие в органических остатках (листьях, древесине, сорняках и т. Д.), Придают воде желтовато-коричневый цвет при контакте с ними. Оксид железа вызывает красноватую воду, а оксиды марганца — коричневую или черноватую воду.
Промышленные отходы текстильных и красящих производств, пищевой, целлюлозно-бумажной, химической промышленности, а также горнодобывающей промышленности, рафинирования и убоя животных могут значительно окрашивать воду в принимающих потоках.
Цвет оказывает следующее влияние на количество воды:
(a) Цветная вода эстетически неприемлема для широкой публики.
(b) Сильно окрашенная вода непригодна для стирки, окрашивания, изготовления бумаги, производства напитков, производства молока и других пищевых продуктов, а также для производства текстиля и пластика.
Таким образом, цвет воды влияет на ее товарность как для бытового, так и для промышленного использования.
4.Вкус и запах:Многие вещества, с которыми вода вступает в контакт в природе или при использовании человеком, могут давать ощутимый вкус и запах. К ним относятся минералы, металлы и соли из почвы, а также продукты биологических реакций и компоненты сточных вод.
Вода имеет горький вкус при загрязнении щелочными примесями и соленую при загрязнении солями металлов. Биологическое разложение органических остатков придает характерный вкус и запах тухлых яиц, который в основном связан с сероводородом.Рост водорослей, микроорганизмов, сероводорода и аммиака придает воде неприятный запах, делая ее непригодной для использования.
Влияние вкуса и запаха на качество воды:
(a) Потребители считают вкус и запах неприятными с эстетической точки зрения по очевидным причинам. Поскольку вода считается безвкусной и без запаха, потребитель ассоциирует вкус и запах с загрязнением и может предпочесть использовать воду без вкуса и запаха, которая может представлять большую опасность для здоровья.
(b) Запахи, создаваемые органическими веществами, могут представлять собой нечто большее, чем просто эстетическую проблему, поскольку некоторые из этих веществ могут быть канцерогенными.
5. Температура:Это один из наиболее важных параметров в природных системах поверхностных вод. Температура поверхностных вод в значительной степени определяет наличие биологических видов и их скорость. Температура влияет на большинство химических разрушений, происходящих в природных водных системах.
Температура также оказывает большое влияние на растворимость газов в воде. Использование воды для отвода тепла отходов в промышленности и последующий сброс нагретой воды может привести к резкому временному изменению принимающих потоков.
Повышенная температура воды имеет следующие последствия:
(a) Более прохладные воды обычно характеризуются широким разнообразием биологических видов. При более низких температурах — уровень биологической активности, т. Е. Использование пищевых ресурсов, рост, воспроизводство и т. Д.медленнее. Биологическая активность увеличивается с повышением температуры (удваивается при повышении на 10 ° C).
(b) Некоторые водные организмы умирают из-за повышения температуры (например, холодноводные рыбы, такие как форель). На рыб сильно влияет температура и уровень растворенного кислорода, которые зависят от температуры.
(c) Процент насыщения кислородом уменьшается и. следовательно, уровень растворенного кислорода (уровень DO) снижается. Низкий уровень DO в сочетании с высокими температурами приводит к увеличению метаболической активности микроорганизмов, что приводит к снижению доступности кислорода, что приводит к анаэробным условиям.
(d) Токсичность химических загрязнителей возрастает с повышением температуры.
(e) Рост водорослей ускоряется и становится проблематичным, когда клетки водорослей объединяются в группы, образуя маты.
(f) Большинство химических реакций, связанных с растворением твердых веществ, ускоряются при повышении температуры. Однако растворимость газов снижается при повышенных температурах.
(г) Вязкость воды увеличивается с понижением температуры. Максимальная плотность воды достигается при 4 ° C, и плотность уменьшается по обе стороны от этой температуры.И температура, и плотность оказывают тонкое влияние на планктонические микроорганизмы в естественной водной системе.
Повышение температуры воды (и воздуха) до опасного уровня из-за тепла от электростанции, автомобилей, промышленных предприятий и т. Д. Называется тепловым загрязнением.
Термическое загрязнение можно контролировать с помощью сухих башен. Градирня пропускает холодный воздух по трубам с горячей водой (тепловые электростанции), передавая тепло воздуху.
Это называется непрямым охлаждением в отличие от прямого охлаждения, при котором вода перекачивается из реки и после однократного использования для охлаждения она сразу же возвращается в море или реку вместо того, чтобы использовать ту же воду снова и снова, прежде чем окончательно рассеивая его в водоемы, что приводит к значительному повышению температуры воды.
Плотность воды | Глава 3: Плотность
Тебе это нравится? Не любить это? Пожалуйста, уделите время и поделитесь с нами своим мнением. Спасибо!
Урок 3.3
Ключевые концепции
- Жидкости, как и твердые тела, обладают собственной характеристической плотностью.
- Объем жидкости можно измерить непосредственно с помощью градуированного цилиндра.
- Молекулы разных жидкостей имеют разный размер и массу.
- Масса и размер молекул в жидкости, а также то, насколько плотно они упакованы вместе, определяют плотность жидкости.
- Так же, как и твердое тело, плотность жидкости равна массе жидкости, деленной на ее объем; D = м / об.
- Плотность воды 1 грамм на кубический сантиметр.
- Плотность вещества одинакова независимо от размера образца.
Сводка
Учащиеся измеряют объем и массу воды, чтобы определить ее плотность. Затем они измеряют массу разных объемов воды и обнаруживают, что плотность всегда одинакова. Учащиеся составляют график зависимости между объемом и массой воды.
Цель
Студенты смогут измерять объем и массу воды и рассчитывать ее плотность. Студенты смогут объяснить, что, поскольку любой объем воды всегда имеет одинаковую плотность при данной температуре, эта плотность является характерным свойством воды.
Оценка
Загрузите лист активности учащегося и раздайте по одному каждому учащемуся, если это указано в упражнении. Лист упражнений будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и ваши ученики носите правильно подогнанные очки.
материалов для каждой группы
- Градуированный цилиндр, 100 мл
- Вода
- Весы с граммовой суммой (более 100 г)
- Капельница
Материалы для демонстрации
- Вода
- Два одинаковых ведра или большие емкости
Проведите демонстрацию, чтобы представить идею о плотности воды.
Материалы
- Вода
- Два одинаковых ведра или большие емкости
Подготовка учителей
Наполните одно ведро наполовину и добавьте примерно 1 стакан воды в другое.
Процедура
- Выберите ученика, который поднимет оба ведра с водой.
- Спросите студента-добровольца, какое ведро имеет большую массу.
Ожидаемые результаты
Ведро с большим количеством воды имеет большую массу.
Спросите студентов:
- В уроках 3.1 — Что такое плотность? и 3.2 — Метод вытеснения воды, вы определяете плотность твердых тел, измеряя их массу и объем. Как вы думаете, жидкость, такая как вода, может иметь плотность?
- Студенты должны понимать, что вода имеет объем и массу. Поскольку D = m / v, вода также должна иметь плотность.
- Как вы думаете, вы можете определить плотность жидкости, такой как вода?
- Ожидается, что на данный момент студенты не смогут полностью ответить на этот вопрос.Это сделано как начало расследования. Но студенты могут понять, что сначала им нужно каким-то образом определить массу и объем воды.
- Может ли и небольшое, и большое количество воды, которое поднял ваш одноклассник, иметь одинаковую плотность?
- Студенты могут указать, что ведро с большим количеством воды имеет большую массу, но больший объем. Ковш с меньшей массой имеет меньший объем. Таким образом, возможно, что разное количество воды может иметь одинаковую плотность.
Раздайте каждому учащемуся рабочий лист.
Студенты будут записывать свои наблюдения и отвечать на вопросы о деятельности в листе действий. «Объясни это с помощью атомов и молекул» и «Возьми это». Дальнейшие разделы рабочего листа будут заполнены либо в классе, либо в группах, либо индивидуально в зависимости от ваших инструкций. Посмотрите на версию листа деятельности для учителя, чтобы найти вопросы и ответы.
Обсудите со студентами, как найти объем и массу воды.
Скажите студентам, что они попытаются найти плотность воды.
Спросите студентов:
- Какие две вещи вам нужно знать, чтобы определить плотность воды?
- Студенты должны понимать, что им нужен как объем, так и масса пробы воды, чтобы определить ее плотность.
- Как можно измерить объем воды?
- Предложите учащимся использовать мерный цилиндр для измерения объема в миллилитрах.Напомните учащимся, что каждый миллилитр равен 1 см 3 .
- Как можно измерить массу воды?
- Предложите учащимся использовать весы для измерения массы в граммах. Скажите студентам, что они могут набрать массу, взвесив воду. Однако, поскольку вода — это жидкость, она должна быть в каком-то контейнере. Таким образом, чтобы взвесить воду, они должны взвесить и контейнер. Объясните учащимся, что им придется вычесть массу пустого градуированного цилиндра из массы цилиндра и воды, чтобы получить массу только воды.
Попросите учащихся найти массу различных объемов воды, чтобы показать, что плотность воды не зависит от размера образца.
Вопрос для расследования
Имеет ли разное количество воды одинаковую плотность?
Материалы для каждой группы
- Градуированный цилиндр, 100 мл
- Вода
- Весы с граммовой суммой (более 100 г)
- Капельница
Процедура
- Найдите массу пустого градуированного цилиндра.Запишите массу в граммах в таблице на листе активности.
Налейте 100 мл воды в мерный цилиндр. Постарайтесь быть максимально точными, убедившись, что мениск находится прямо на отметке 100 мл. Используйте пипетку, чтобы добавить или удалить небольшое количество воды.
- Взвесьте мерный цилиндр с водой. Запишите массу в граммах.
- Найдите массу только воды, вычтя массу пустого градуированного цилиндра.Запишите в таблицу массу 100 мл воды.
- Используйте массу и объем воды для вычисления плотности. Запишите в таблицу плотность в г / см 3 .
- Слейте воду, пока в мерный цилиндр не будет 50 мл воды. Если вы случайно вылили слишком много, добавляйте воды, пока не дойдете до 50 мл.
Найдите массу 50 мл воды. Запишите массу в листе деятельности. Рассчитайте и запишите плотность.
- Затем слейте воду, пока в мерный цилиндр не будет 25 мл воды. Найдите массу 25 мл воды и запишите ее в таблицу. Рассчитайте и запишите плотность.
Таблица 1. Определение плотности различных объемов воды. Объем воды 100 миллилитров 50 миллилитров 25 миллилитров Масса мерного цилиндра + вода (г) Масса пустого градуированного цилиндра (г) Масса воды (г) Плотность воды (г / см 3 ) Ожидаемые результаты
Плотность воды должна быть близка к 1 г / см 3 .Это верно для 100, 50 или 25 мл.
Спросите студентов:
- Посмотрите на свои значения плотности на диаграмме. Кажется ли, что плотность разных объемов воды примерно одинакова?
- Помогите учащимся увидеть, что большинство различных значений плотности составляют около 1 г / см 3 . Они могут задаться вопросом, почему их значения не равны 1 г / см 3 . Одной из причин могут быть неточности в измерениях. Другая причина в том, что плотность воды меняется в зависимости от температуры.Вода наиболее плотная при 4 ° C и при этой температуре имеет плотность 1 г / см 3 . При комнатной температуре около 20–25 ° C плотность составляет около 0,99 г / см 3 .
- Какова плотность воды в г / см3?
- Ответы учащихся могут быть разными, но обычно их значения должны составлять около 1 г / см. 3 .
Попросите учащихся построить график своих результатов.
Помогите учащимся составить график данных из их листа деятельности.Ось X должна быть объемом, а ось Y — массой.
Когда ученики наносят на график свои данные, должна быть прямая линия, показывающая, что по мере увеличения объема масса увеличивается на ту же величину.
Обсудите наблюдения, данные и графики учащихся.
Спросите студентов:
- Используйте свой график, чтобы найти массу 40 мл воды. Какова плотность этого объема воды?
- Масса 40 мл воды 40 грамм.Поскольку D = m / v и mL = cm 3 , плотность воды составляет 1 г / см 3 .
- Выберите объем от 1 до 100 мл. Используйте свой график, чтобы найти массу. Какова плотность этого объема воды?
- Вне зависимости от того, весят ли учащиеся 100, 50, 25 мл или любое другое количество, плотность воды всегда будет 1 г / см. 3 .
Скажите студентам, что плотность — это характерное свойство вещества. Это означает, что плотность вещества одинакова независимо от размера образца.
Спросите студентов:
- Является ли плотность характерным свойством воды? Откуда вы знаете?
- Плотность — это характерное свойство воды, потому что плотность любого образца воды (при той же температуре) всегда одинакова. Плотность 1 г / см 3 .
Объясните, почему плотность воды любого размера всегда одинакова.
Спроецировать изображение Плотность воды.
Все молекулы воды имеют одинаковую массу и размер. Молекулы воды также расположены довольно близко друг к другу. Они упакованы одинаково во всей пробе воды. Таким образом, если объем воды имеет определенную массу, удвоенный объем будет иметь удвоенную массу, трехкратный объем будет иметь трехкратную массу и т. Д. Независимо от того, какой размер образца воды вы измеряете, соотношение между массой и объемом всегда будет таким же. Поскольку D = m / v, плотность одинакова для любого количества воды.
Спроектируйте анимацию «Жидкая вода».
Молекулы воды всегда в движении. Но в среднем они все упакованы одинаково. Следовательно, соотношение между массой и объемом одинаково, а плотность одинакова. Это верно независимо от размера выборки или от того, где вы ее выбрали.
Попросите учащихся подумать, совпадает ли плотность большого куска твердого вещества с плотностью меньшего куска.
Дайте учащимся время вычислить плотность каждого из трех образцов, нарисованных на их листе с заданиями, и ответить на соответствующие вопросы.
Спросите студентов:
- Плотность жидкости одинакова независимо от размера образца. Может ли это быть верно и для твердых тел? Чтобы выяснить это, вычислите плотность каждого из трех образцов.
- Да. Плотность твердого вещества одинакова, независимо от размера образца.
- Образец А имеет массу 200 г. Какова плотность образца А?
- D = м / об
- D = 200 г / 100 см 3
- D = 2 г / см 3
- Если разрезать образец A пополам и посмотреть только на одну половину, получится образец B. Какова плотность образца B?
- Если учащиеся не знают, какова масса, скажите им, что это половина массы образца А.Поскольку образец A был 200 г, образец B составляет половину объема и, следовательно, половину массы (100 г).
- D = м / об
- D = 100 г / 50 см 3
- D = 2 г / см 3
- Если разрезать образец B пополам, вы получите образец C. Какова плотность образца C?
- D = м / об
- D = 50 г / 25 см 3
- D = 2 г / см 3
Свойства воды и ее значение для жизни
1.Вода обладает высокой адгезией и адгезией:
Из-за водородных связей между молекулами воды возникает сильное межмолекулярное притяжение. Это называется сплоченностью.
Когда вода образует водородные связи с другим веществом, притяжение называется адгезией. Благодаря сплоченности и адгезии семена набухают и прорастают; происходит подъем сока и капиллярное движение воды.
2. Вода имеет высокое напряжение:
Это происходит из-за сцепления молекул воды.Благодаря этому свойству маленькие организмы плавают или ходят по водной поверхности.
3. Вода имеет высокую удельную теплоемкость и высокую теплоту испарения:
Оба эти свойства обусловлены потребностью большего количества энергии для разрыва водородных связей. Удельная теплоемкость означает количество тепла, поглощаемого или теряемого на 1 грамм. вещества, чтобы изменить его температуру на 1 ° C. У воды высокая удельная теплоемкость (1 калория / г / ° C). Это свойство обеспечивает медленный нагрев воды; поддерживать постоянную температуру живых организмов и окружающей среды.
Вода имеет высокую теплоту испарения (540 кал. Г · м -1), то есть около 540 кал. Тепла требуется для превращения 1 г жидкой воды в газ. Таким образом, испарение воды с поверхности снимает избыточную тепловую энергию. Это вызывает охлаждающий эффект листьев, выводит тепло тела через потоотделение и защищает организм от теплового шока.
4. Вода имеет высокую температуру кипения и теплопроводность:
Благодаря этим свойствам вода накапливает и распространяет тепло, а также предотвращает перегрев
5.Вода имеет высокую теплоту плавления:
Вода требует большого количества тепла, чтобы замерзнуть. Это предотвращает замерзание и образование льда в протоплазме даже при очень низкой температуре.
6. Вода имеет меньшую плотность при замерзании:
Вода имеет максимальную плотность при 4 ° C. Но при температуре ниже 4 ° C вода становится менее плотной, потому что из-за этого они расположены отдельно, поэтому лед менее плотен, чем жидкая вода, и плавает на поверхности воды. Лед изолирует подводную пленку от замерзания и защищает водную жизнь.
7. Вода прозрачная:
Это позволяет свету проникать на глубину 200 метров в море и озера. Таким образом, растения продолжают фотосинтез в условиях затопления.
8. Вода имеет высокую диэлектрическую проницаемость:
Противостоит притяжению ионов противоположных зарядов. Из-за этого вода действует как мощный растворитель для солей и многих неионизируемых органических молекул.
9. Вода несжимаемая:
Помогает организмам переносить давление и сжатие.Благодаря этому вода у дождевых червей выполняет роль гидроскелета. Потеря или приток воды вызывает различные движения растений, такие как движение устьиц, сейсмонастение листьев мимозы и т. Д.
10. Вода может ионизироваться:
Небольшое количество воды самопроизвольно диссоциирует на ион водорода (H + ) и ион гидроксила (OH — ), что зависит от температуры. Это называется ионизацией.
H 2 O ⇋H + OH —
При 25 ° C из 550 миллионов молекул воды ионизируется только одна.В воде H + не существует стабильно и встречается в ассоциации с другой молекулой воды с образованием иона гидроксония (H 3 O + ).
H + H 2 O⇋ H 3 O +
В водных растворах концентрация H + и OH- становится основой для шкалы pH. При стандартных условиях температуры и давления всего 10 -7 моль. Это. молекул воды диссоциируют. Это означает, что в чистой воде [H + ] составляет 10 -7 моль / литр.
Таким образом, pH чистой воды:
pH = — log [H + ] = — log 10- 7 = 7,0
11. Вода — реагент:
Во многих биохимических реакциях вода является источником H + и OH ». Во время фотолиза вода отдает электрон (е-) хлорофиллу и сама окисляется до молекулярного кислорода.
Углерод (C) — химические свойства, воздействие на здоровье и окружающую среду
Его плотность колеблется от 2.25 г / см³ (1,30 унции / дюйм³) для графита и 3,51 г / см³ (2,03 унции / дюйм³) для алмаза. Температура плавления графита составляет 3500ºC (6332ºF), а экстраполированная точка кипения составляет 4830ºC (8726ºF). Элементарный углерод — инертное вещество, нерастворимое в воде, разбавленных кислотах и щелочах, а также в органических растворителях. При высоких температурах он связывается с кислородом с образованием окиси или двуокиси углерода. С помощью горячих окислителей, таких как азотная кислота и нитрат калия, получается метиловая кислота C 6 (CO 2 H) 6 .Из галогенов только фтор реагирует с элементарным углеродом. Большое количество металлов соединяется с элементом при высоких температурах с образованием карбидов.
Он образует три газообразных компонента с кислородом: монооксид углерода, CO, диоксид углерода, CO 2 и недокись углерода, C 3 O 2 . Два первых являются наиболее важными с промышленной точки зрения. Углерод образует соединения с галогенами с CX 4 в виде общей формулы, где X — фтор, хлор, бром или йод.При температуре окружающей среды тетрафторид углерода является газом, тетрахлорид — жидкостью, а два других соединения — твердыми веществами. Известны также смешанные тетрагалогениды углерода. Наиболее важным из всех может быть дихлордифторметан, CCl 2 F 2 , называемый фреоном.
Углерод в окружающей среде
Углерод и его компоненты широко распространены в природе. По оценкам, углерод составляет 0,032% земной коры. Свободный углерод находится в больших резервуарах, таких как каменный уголь, в аморфной форме элемента с другими сложными соединениями углерод-водород-азот.Чистый кристаллический углерод встречается в форме графита и алмаза.
Атмосфера Земли содержит постоянно увеличивающуюся концентрацию углекислого газа и окиси углерода, образующих сжигание ископаемого топлива, и метана (CH 4 ), образующих рисовые поля и коров.
Нет элемента более важного для жизни, чем углерод, потому что только углерод образует прочные одинарные связи с самим собой, которые достаточно стабильны, чтобы противостоять химическому воздействию в условиях окружающей среды. Это дает углероду способность образовывать длинные цепи и кольца из атомов, которые являются структурной основой многих соединений, составляющих живую клетку, наиболее важной из которых является ДНК.
В больших количествах углерод находится в виде соединений. Углерод присутствует в атмосфере в виде углекислого газа в количестве 0,03% по объему. Некоторые минералы, такие как известняк, доломит, гипс и мрамор, содержат карбонаты. Все растения и живые животные состоят из сложных органических соединений, в которых углерод сочетается с водородом, кислородом, азотом и другими элементами. Остатки живых растений и животных образуют месторождения: нефти, асфальта и битума. Залежи природного газа содержат соединения, образованные углеродом и водородом.
Заявка
Свободный элемент имеет множество применений, в том числе для украшения бриллиантов в ювелирных изделиях или черного дымового пигмента в автомобильных дисках и чернил для принтера. Другая форма углерода, графит, используется в высокотемпературных тиглях, сухих электродах и электродах легкой дуги, для наконечников карандашей и в качестве смазки. Растительный углерод, аморфная форма углерода, используется в качестве поглотителя газа и отбеливающего агента.
Углеродные соединения имеют множество применений. Двуокись углерода используется для газирования напитков, в огнетушителях и, в твердом состоянии, в качестве охладителя (сухой лед).Окись углерода используется в качестве восстановителя во многих металлургических процессах. Тетрахлорметан и сероуглерод являются важными промышленными растворителями. Фреон используется в системах охлаждения. Карбид кальция используется для получения ацетилена; он используется для сварки и резки металлов, а также для приготовления других органических соединений. Другие металлические карбиды находят важное применение в качестве жаропрочных материалов и фрез для резки металла.
Влияние углерода на здоровье
Элементарный углерод имеет очень низкую токсичность.Представленные здесь данные об опасностях для здоровья основаны на воздействии сажи, а не элементарного углерода. Хроническое вдыхание сажи может привести к временному или необратимому повреждению легких и сердца.
Пневмокониоз обнаружен у рабочих, занятых на производстве технического углерода. Также сообщалось о кожных заболеваниях, таких как воспаление волосяных фолликулов и поражения слизистой оболочки полости рта в результате воздействия на кожу.
Канцерогенность — Технический углерод был включен Международным агентством по изучению рака (IARC) в Группу 3 (агент не классифицируется по его канцерогенности для людей).
Некоторые простые соединения углерода могут быть очень токсичными, например, оксид углерода (CO) или цианид (CN-).
Углерод 14 является одним из радионуклидов, участвующих в атмосферных испытаниях ядерного оружия, которые начались в 1945 году с испытания в США и закончились в 1980 году с испытанием в Китае. Это один из долгоживущих радионуклидов, которые привели и будут вызывать повышенный риск рака в ближайшие десятилетия и столетия. Он также может проникать через плаценту, органически связываться с развивающимися клетками и, следовательно, представлять опасность для плода.
Большая часть того, что мы едим, состоит из соединений углерода, общее потребление углерода составляет 300 г / день. Пищеварение заключается в расщеплении этих соединений на молекулы, которые могут адсорбироваться на стенке желудка или кишечника. Там они переносятся кровью в места, где они используются или окисляются для высвобождения содержащейся в них энергии.
Воздействие углерода на окружающую средуО негативном воздействии на окружающую среду не сообщалось.
Графитовые бриллианты
Вернуться к периодической таблице элементов
Для получения дополнительной информации о месте углерода в окружающей среде перейдите к углеродному циклу.
Соображения качества почвы при выборе участков для аквакультуры
Соображения качества почвы при выборе участков для аквакультурыТекстура относится к относительным пропорциям частиц различные размеры, такие как песок, ил и глина в почве. Пропорции разделителей в классах, обычно используемых при описании почв, приведены в текстурный треугольник, показанный на рис.1.5. При использовании диаграммы точки соответствует процентному содержанию ила и глины, присутствующих в почве под рассмотрения расположены на иловой и глинистой линиях соответственно. Линии затем проецируются внутрь, в первом случае параллельно глиняной стороне треугольник, а во втором случае — параллельно песчаной стороне. Имя отсек, в котором пересекаются две линии, — это имя класса рассматриваемая почва. Например, почва, содержащая 15% глины, 20% ила и 65% песок — супесчаный суглинок и почва, содержащая равное количество песка, ила и глина — суглинок.
Можно определить процентное содержание песка, ила и глины в почве. в почвенной лаборатории двумя стандартными методами — ареометром и пипеткой метод (Black et al ., 1965a). Оба метода зависят от того, что на любом заданная глубина в осаждающейся суспензии концентрация частиц изменяется со временем, так как более крупные фракции оседают быстрее, чем мельче (рис. 1.6).
В полевых условиях текстуру почвы можно оценить следующими методами: (Рисунок.1.7).
(i) Метод на ощупь . В этом методе почва смачивается водой. и растереть между большим пальцем и пальцами. Как «расслаивается» влажная почва дает хорошее представление о содержании глины. Частицы песка песчаные, ил имеет мучнистый или тальк — порошок осыпался при высыхании и лишь умеренно пластичный и липкий во влажном состоянии. Точность этого метода во многом зависит от опыт.
Рис.1.3. Объемно-весовой состав почвы. (Процент воздуха и воды варьируется по влагонасыщенности почвы)
Рис. 1.4. Минералогический состав почвы (площадь внутри рисунка обозначает относительный обилие минералов)
Рис. 1.5. Текстурный треугольник почвы
Рис. 1.6. Оседание частиц в почве подвеска
Фиг.1.7. Полевые методы оценки текстуры почвы (Метод на ощупь и метод мяча и ленты)
(ii) Метод с шариком и лентой : Процедура этого метода, как описано Коче и Лафлина (1985) заключается в следующем: возьмите горсть почвы и смочите ее. чтобы он начал склеиваться, не прилипая к руке. Шар изготавливается и опускается диаметром около 3 см. Если он развалится, это песок . Если он слипается, скатайте шарик в форму сосиски длиной 6-7 см.Если он не остается в таком виде, это супеси . Если он останется в этом формы, продолжайте скатывать, пока не достигнет длины 15 — 16 см. Если это не так Остаться в таком виде это супесь . Если он останется в этой форме, попробуйте согните колбасу полукругом, если не получается, это суглинок . Если это Согните колбасу, чтобы сформировать полный круг, и если это не так, это тяжелый суглинок . Если есть небольшие трещинки в колбасе, это светлая глина .Если это так без трещин это глина .
(iii) Метод метания мяча : Текстура почвы может быть определена с помощью как шар земли действует, когда его бросают на твердую поверхность, например стену или дерево (рис. 1.8). Шаги, которые необходимо выполнить при использовании этого метода, описаны Коче и Лафлин (1985) пишет: Бросьте шар земли на дерево или стену на расстоянии 3 м. Если почва хороша только для брызг, когда она влажная или сухая, у нее есть крупнозернистый (супесчаный).Если при сушке и он держит свою форму против цели средней дальности во влажном состоянии, имеет умеренную крупнозернистый (супесчаный). Если мяч разобьется при ударе, когда он высохнет и держится вместе во влажном состоянии, но не прилипает к цели имеет среду по консистенции (суглинок, супесчаный суглинок, илистый суглинок). Если мяч держит форму для дальних выстрелов в мокром состоянии и прилипает к цели, но довольно легко для удаления имеет средне-мелкую консистенцию (суглинок).Если мяч застревает хорошо попадает в цель во влажном состоянии и становится очень твердой ракетой в сухом состоянии. имеет мелкую консистенцию (глина).
Обычный механический анализ грунта в лаборатории дает процентное содержание трех фракций: песка, ила и глины. Для особых использует те же методы лабораторных анализов (метод пипетки или ареометр метод) может предоставить гораздо более подробный анализ, дающий дальнейшую разбивку относительные количества почвенных частиц для более крупных классов в виде таблица или график.Данные в графическом виде представлены в виде размера частиц. частотная кривая (кривая PSF). Кривые PSF для выбранных грунтов показаны на Рис. 1.9. Вертикальная ось представляет совокупный процент встречаемости. различных размеров частиц, а горизонтальная ось представляет логарифмы размера частиц. Вертикальная ось в левой части относятся к процентному содержанию частиц, проходящих через сита определенного размер и вертикальная ось в правой части относятся к процентам частиц, не проходящих через сита определенного размера.
Чем вертикальнее кривая PSF или часть кривой, тем более равномерно размер частиц; вертикальная линия представляет частицы идеального однородного размера. Чем больше наклон кривая или ее часть, тем больше разница между размер частиц (т.е. меньшая пористость и более высокое уплотнение). В точка перегиба кривой показывает наиболее часто встречающийся размер частиц по массе. Мелкозернистые почвы имеют изгибы в правой части графика. и грубые почвы с левой стороны.Из кривых PSF, процентное содержание ила, песка и глины можно рассчитать и с помощью по текстурной треугольной диаграмме текстура может быть определена.
Текстура почвы — важный параметр почвы, определяющий пригодность участка для аквакультуры. Глинистая почва стабилизирует дно пруда помимо тот факт, что он адсорбирует большое количество питательных веществ и медленно их высвобождает в течение длительного периода к вышележащей воде. Глинистая почва обычно удерживает большее количество органического вещества, чем почвы с легкой текстурой, и тем самым увеличить продуктивность пруда.Следует отметить, что слишком глина почва (очень липкая глина) может быть не очень подходящей, так как она может вызвать фиксации фосфора и создают другие физико-химические биологические проблемы. Такие почвы могут вызвать трещины при осушении прудов, что приведет к увеличению фильтрационные потери.
Термин «текстура» используется для обозначения размеров отдельных частицы почвы, но когда расположение частиц считается используется терминологическая структура.Структура относится к агрегации первичной почвы. частицы (песок, ил и глина) в составные частицы или кластер первичных частицы, которые разделены соприкасающимися агрегатами поверхностями слабое место. Структура изменяет эффект текстуры относительно влаги и воздушные отношения, доступность питательных веществ, действие микроорганизмов и рост корней. Например. высокопластичная глина (60% глина) хороша для растениеводства если он имеет хорошо развитую зернистую структуру, которая облегчает аэрацию и движение воды.Точно так же почва, хотя и имеет тяжелую структуру, может иметь сильно развитая структура, что делает ее не очень подходящей для аквакультура, поскольку эта почва допускает высокие потери на просачивание.
Структура определяется по марке, классу и типу агрегатов.
Оценка : Степень структуры — это степень агрегации и выражает разницу между сцеплением внутри агрегатов и адгезией между агрегатами.Эти свойства меняются в зависимости от влажности почвы и ее следует определять при нормальной влажности — не когда необычно сухой или необычно влажный. Четыре основных уровня структуры с рейтингом от 0 до 3 перечислены ниже.
| 0 — Бесструктурный: | отсутствие наблюдаемой агрегации или определенного упорядоченного расположения естественных линий слабости. Массивно, если связно; одно зерно, если некогерентно. |
| 1 — Слабая: | Та степень агрегации, характеризующаяся плохо сформированными нечеткими агрегатами, которые едва заметны на месте.При нарушении почвенный материал с такой структурой распадается на смесь нескольких целых агрегатов, многих сломанных агрегатов и большого количества неагрегированного материала. |
| 2 — Умеренный: | Хорошо сформированные отчетливые агрегаты, умеренно стойкие и заметные, но не отчетливые в ненарушенной почве. При нарушении они распадаются на смесь множества отдельных целых агрегатов, некоторых сломанных агрегатов и небольшого количества неагрегированного материала. |
| 3 — Прочный: | Прочные агрегаты, которые хорошо видны в ненарушенной почве, которые слабо сцепляются друг с другом.При снятии с профиля материал sokl в значительной степени состоит из целых агрегатов и включает несколько сломанных и небольшое количество неагрегированного материала или его отсутствие. |
Рис. 1.8. Полевые методы оценки текстуры почвы (Метод метания мяча)
Диаметр частицы (мм)
| 1 Гравий и песок (старый аллювий) | A | Грунт, подходящий для дна пруда, если коэффициент проницаемости меньше 5 × 10 -6 м / с |
| 2 Песок | ||
| 3 Ил | B | Грунт, пригодный для строительства дамб без непроницаемого глиняного ядра |
| 4 Известняковый глинистый грунт (мергель) | C | Почва подходит для дна пруда или дамбы только после модификации почвы с использованием поправки. |
| 5 Глина тяжелая |
Рис. 1.9. Кривые частоты размера частиц (PSF) для избранные почвы
Класс : Структура Класс описывает средний размер отдельные агрегаты и Тип описывают их форму или форму (рис. 1. 10). Различают следующие классы: очень тонкий или очень тонкий, тонкий или тонкий, средний, грубый или толстый и очень крупный или очень толстый.
Движение воды и дренаж слабые на глыбовых, призматических, глыбовых почвах. столбчатые и пластинчатые конструкции. Эти структурированные почвы, особенно пластинчатые. типа наиболее подходят для аквакультуры.
— сопротивление грунта деформации или разрыву и определяется связующими и адгезионными свойствами грунтового массива. Этот термин используется для обозначения проявления сплоченности и адгезионные свойства грунта при различной влажности.Знание консистенция почвы важна при обработке почвы, движении и водоемы. Консистенция также указывает на структуру почвы.
Консистенция описана для трех уровней влажности:
— Влажная почва — нелипкая, слегка липкая, липкая, очень липкая; не пластик, немного пластичный, пластик и очень пластичный.
— Почва влажная — рыхлая, очень рыхлая, рыхлая, твердая, очень твердая, чрезвычайно твердая.
— Сухая почва — рыхлая, мягкая, слегка твердая, твердая, очень твердая, чрезвычайно трудно.
Описание вышеуказанных условий консистенции можно получить из «Руководства по описанию профиля почвы» ФАО (ФАО, 1974).
грунта — масса на единицу объема почвенных частиц. (твердая фаза почвы) — выражается в г / куб. Большинство почв имеют плотность частиц около 2,6 г / куб. Наличие органических веществ снижает плотность и железо составы увеличивают плотность.
грунта — масса грунта на единицу объема грунта. (объем включает как почву, так и поры) — выражается в г / куб.
Плотность частиц может быть определена с помощью метода определения плотности в бутылке. и объемная плотность путем отбора образцов керна грунта известного объема в полевых условиях и определение равномерного сухого веса (Black et al ., 1965a). Вода и воздух движение через почву зависит от порового пространства и гранулометрического состава пор (микропоры и макропоры).Уменьшите поровое пространство или увеличьте насыпная плотность грунта, тем выше пригодность грунта для аквакультура.
Из предыдущего раздела можно отметить, что консистенция почвы меняется в зависимости от количества влаги в почве. Пределы Аттерберга соответствуют влажности, при которой почва образец меняет свою консистенцию из одного состояния в другое. Жидкость предел (LL) и предел пластичности (PL) — два важных состояния консистенции.Предел жидкости — это процентное содержание влаги, при котором изменяется почва. с уменьшением влажности от жидкости до пластичной консистенции или с увеличением влажности от пластичной до жидкой консистенции, тогда как предел пластичности — это процентное содержание влаги, при котором почва изменяется по мере уменьшения влажности от пластичной до полутвердой консистенции или от полутвердой до пластичной консистенции. Пластический индекс (PI) = LL — PL — диапазон влажности, при котором почва остается пластичной.
Таблица III. Типичные лабораторные тесты показывают среднее LL, PL и PI (Коче и Лафлин, 1985)
| Тип грунта | LL | PL | PI | ||||||
| Пески | 20 | 0 | 0 | ||||||
| Глины | 100 | 45 | 45 | ||||||
| Коллоидные глины | 399 | 49 |
Фиг.1.10. Схематическое изображение различных типы конструкций (Buchman and Brady, 1964)
Таблица III. показывает, что чем тяжелее текстура почвы, тем выше LL, PL и PI. Грунт, имеющий высокое значение PI, имеет высокую сжимаемость.
Согласно Coche и Laughlin (1985) критическое значение LL почвы для сооружения дамбы пруда без глиняного стержня должно быть не менее 35% для наилучших результатов уплотнения и для создания непроницаемого глиняного сердечника грунтового материала дамбы пруда с LL менее 60%, PL менее 20% и PI более 30% следует использовать.
Цвет почвы указывает на различные процессы происходящее в почве, а также тип минералов в почве. Для Например, красный цвет почвы обусловлен обилием оксида железа. в окисленных условиях (колодезный дренаж) в почве; темный цвет обычно из-за скопления сильно разложившейся органики; желтый цвет из-за к гидратированным оксидам и гидроксиду железа; черные узелки возникают из-за марганца оксиды; крапчатость и оглеение связаны с плохим дренажом и / или большим количеством воды Таблица.Обилие бледно-желтых пятен в сочетании с очень низким pH являются показательными. возможных кислых сульфатных почв. Цвета почвенной матрицы и пятен указывает на водные и дренажные условия в почве и, следовательно, на пригодность почвы для аквакультуры.
Цвет почвы описывается параметрами, называемыми оттенком, значением и цветность. Оттенок представляет собой доминирующую длину волны или цвет света; значение относится к яркости цвета; цветность, относительная чистота или сила цвета.Цвет почвы с точки зрения вышеперечисленного параметры могут быть быстро определены путем сравнения образца с стандартный набор цветных фишек в блокноте MUNSELL SOIL ЦВЕТНЫЕ ДИАГРАММЫ (Таблица цветов почв Манселла, 1973). На этих диаграммах правый верхний угол представляет оттенок; вертикальная ось — значение; а также горизонтальная ось — цветность.
— это способность почвы пропускать воду и воздух. Непроницаемая почва хороша для аквакультуры, так как потеря воды из-за просачивания или инфильтрация низкая.Поскольку слои или горизонты почвы различаются по своему характеристики проницаемость также отличается от одного слоя к другому. Размер пор, текстура, структура и наличие непроницаемых слоев, таких как глиняный поддон определяет проницаемость почвы. Почвы глинистые с пластинчатым конструкции имеют очень низкую проницаемость.
Проницаемость измеряется с помощью коэффициента проницаемости или коэффициента проницаемости. проницаемости (см в час, см в сутки, см в секунду).



