Фазы сна. Быстрый и медленный сон
Сон – жизненно необходимое явление для каждого человека, именно во сне восстанавливается работоспособность организма. Сомнологи – специалисты в этой области – установили наличие двух фаз сна: медленный и быстрый, которые сменяют друг друга с определенной периодичностью. Здоровый, полноценный сон, как правило, состоит из 5 полных циклов. Каждый цикл, в свою очередь включает в себя несколько фаз медленного и быстрого сна. Причем по мере приближения к пробуждению продолжительность медленной фазы уменьшается, а доля быстрой – увеличивается. Что же такое быстрый и медленный сон, чем они отличаются?
Медленный сон
Медленный или ортодоксальный сон занимает примерно 80% от общей продолжительности отдыха, причем первый, наиболее длительный эпизод медленного сна составляет около полутора часов. Для этой фазы характерно уменьшение частоты дыхания, сердцебиения, замедленные движения глазных яблок.
На электроэнцефалограмме (ЭЭГ) заметно значительное снижение мозговой активности, уменьшается частота волн и увеличивается их амплитуда.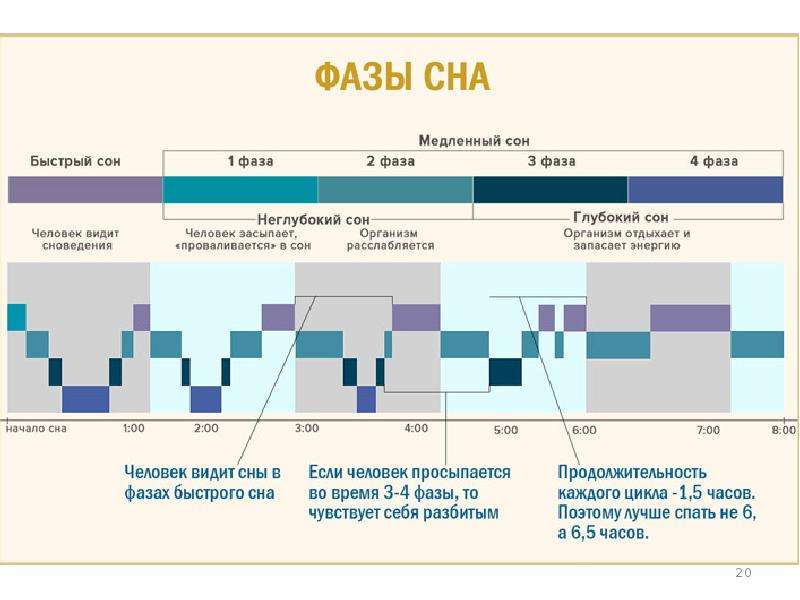
Быстрый сон
На этой фазе, постепенно сменяющей период медленного сна, ЭЭГ показывает волны, идентичные обычному состоянию бодрствования. В течение парадоксального сна, более глубокого по сравнению с ортодоксальным, глаза хаотично и быстро двигаются, мышцы лица и конечностей сокращаются. Кровяное давление характеризуется резкими перепадами, дыхание становится неровным. Именно на стадии быстрого сна человек видит сновидения, а если его разбудить – будет помнить увиденное.
Фазы быстрого сна удлиняются от цикла к циклу, а вот глубина снижается. Хотя быстрый сон ближе, чем медленный к порогу бодрствования, прервать эту фазу сна существенно труднее. Прерывание быстрого сна чревато более тяжелыми нарушениями психики, чем нарушение медленного сна.
Исследователи утверждают, что быстрый сон отвечает за обеспечение психологической защиты и обмен информацией между сознанием и подсознанием, а также за обработку информации.
Расстройства сна? Обратитесь в Центр медицины сна — мы поможем!
Возврат к списку
Во сне осьминогов выделили быструю и медленную фазы — Наука
ТАСС, 25 марта. Биологи из Бразилии обнаружили, что у осьминогов может быть две фазы сна – как и у людей, млекопитающих и птиц. Благодаря этому осьминогов можно будет использовать в исследованиях природы сна, пишут ученые в научном журнале iScience.
На эту тему
«Фазы сна у осьминогов очень похожи на человеческий быстрый и медленный сон, несмотря на то, что наши предки разошлись более 500 млн лет назад. Это может говорить о том, что быстрый сон становится необходимым для всех живых существ, если их нервная система достигает определенного уровня развития», – объяснила Сильвия Медейрос, один из авторов работы, научный сотрудник Федерального университета Рио-Гранде до Норте (Бразилия).
Ученые выделяют у человека два типа сна, которые постоянно сменяют друг друга. Сразу после погружения в сон наступает медленная фаза – состояние максимального покоя, при котором организм восстанавливает силы, а мозг упорядочивает воспоминания.
Через некоторое время человек переключается в фазу быстрого сна. В этом случае его глаза начинают быстро двигаться хаотическим образом, мышцы переходят в рабочий режим. Все тело при этом цепенеет, что предотвращает непроизвольные движения и другие действия, которые часто делает человек в состоянии медленного сна. Ученые предполагают, что во время быстрого сна люди видят самые яркие сны.
Долгое время считалось, что сны видят только люди. Однако наблюдения последних лет показывают, что схожие фазы сна и связанные с ними формы активности мозга характерны и для других организмов – как млекопитающих, так и птиц с рептилиями.
На эту тему
Медейрос и ее коллеги впервые обнаружили, что в этот список можно внести и беспозвоночных. В ходе исследования они наблюдали за движением щупалец и положением глаз осьминогов вида Octopus insularis. Также ученые отслеживали, как менялась окраска тела моллюсков, пока те спали.
В ходе исследования они наблюдали за движением щупалец и положением глаз осьминогов вида Octopus insularis. Также ученые отслеживали, как менялась окраска тела моллюсков, пока те спали.
Оказалось, что у осьминогов можно было выделить две разных фазы сна, которые очень похожи на медленный и быстрый сон человека. Во время медленного сна щупальца и другие части тела головоногих были расслаблены, зрачки максимально сужены, а их кожа не меняла цвет (по этому показателю ученые судят об изменении настроения животного).
Во время фазы быстрого сна глаза осьминогов начинали двигаться в разные стороны, щупальца начинали произвольным образом сокращаться, а окраска непрерывно менялась. Этот период активности обычно длился недолго, около шести минут. После его сменяла новая фаза медленного сна, которая длилась в несколько раз дольше.
«Конечно, осьминоги вряд ли видят какие-то сложные и долгие сны, так как эта фаза длится лишь несколько минут. Образно выражаясь, их сны, скорее всего, похожи на клипы или GIF-изображения», – подытожила Медейрос.
В ближайшее время ученые планируют проследить, как меняется рисунок активности мозга во время каждой из этих фаз. Они надеются, что это поможет выяснить, какие сны видят осьминоги и какую роль сон играет в работе нервных систем позвоночных и беспозвоночных живых существ.
Взаимосвязь сердечного ритма и сна. Структура и продолжительность, цикличность, влияние на качество жизни человека
Взаимосвязь сердечного ритма и сна. Структура и продолжительность, цикличность, влияние на качество жизни человека
1. Влияние сна на продолжительность и качество жизни человека
По статистике, в современном мире каждый третий человек неоднократно испытывает проблемы с засыпанием, и даже не задумывается о значении и ценности своего сна. Ежедневно наша жизнь расписана практически по минутам, заботы и цели выходят на первый план, и нет времени подумать о своем здоровье. Если человек каждый день сталкивается с огромным потоком информации, испытывает стрессы, с трудом просыпается по утрам, а проблемы с сердцем уже дают о себе знать, то пора задуматься о качестве своего сна.
Исходя из научных исследований, сон – это специфическое состояние организма, естественный процесс, который характеризуется пониженной реакцией на внешний мир. Сон влияет на продолжительность и качество жизни человека. Когда мы спим, уменьшается число сердечных сокращений, секреторная деятельность понижается, большинство реакций организма замедляется.
Для поддержания нормальной физиологии организму человека необходима правильная цикличность сна. Цикл сна включает две последовательно сменяющие друг друга фазы: медленный сон и быстрый сон. В медленном сне дополнительно различают фазы засыпания, легкого и глубокого сна. При здоровом сне эти стадии чередуются в определенной последовательности, чтобы обеспечить организм энергетическими ресурсами, привести в баланс гормональный фон, улучшить работу лимфоцитов иммунной системы. Человек обычно проходит через пять циклов сна за одну ночь.
2. Фазы сна, аритмия, связь со сном и ВСР
Обычно медленный сон начинается в тот момент, когда человек засыпает, и сердечно-сосудистая система работает в пониженном режиме. Быстрый сон длится сравнительно недолго, но в этой фазе наблюдаются изменения в работе сердечно-сосудистой, кровеносной и дыхательной систем. Также этот режим характеризуется тем, что число сердечных сокращений и артериальное давление максимальны, а, следовательно, есть риск осложнения сердечно-сосудистых заболеваний.
Аритмия – одно из самых известных расстройств работы сердца. Различные области сердца в фазу быстрого сна сбиваются с ритма, из-за этого, сокращения сердечных волокон происходят несогласованно, что негативно сказывается на тканях организма. Аномалии сердечного ритма чреваты инсультом или инфарктом в первые часы пробуждения. Одна из причин развития аритмии – беспокойный сон. А у людей, страдающих бессонницей, повышается шанс развития аритмии на 17–35%.
Сон, нарушаемый аритмией, влияет на эмоциональное состояние человека в течение дня, что может негативно сказаться не только на настроении и успеваемости, но и на вариабельности сердечного ритма. Степень активности автономной нервной системы часто определяется именно этим показателем. Считается, что вариабельность сердечного ритма отражает реакцию сердца на риск развития сердечных заболеваний. Недостаток сна увеличивает частоту сокращений сердца и системного артериального давления в дневное время суток, что может оказывать влияние на вариабельность сердечного ритма ночью. Диагностика ритма сердца во время сна существенно снижает риск неконтролируемого развития аритмии, гипертонии и апноэ. Используя носимые гаджеты, можно самостоятельно следить за данным параметром. Достаточно оставить трекер надетым на руку ночью, и на утро проверить свои показатели. Анализ вариабельности сердечного ритма во время сна позволит лучше понять закономерности развития болезней, определить нормативные значения вариабельности сердечного ритма, и оценить цикличность сна по изменениям ритма сердца.
Не только оценка вариабельности ритма сердца помогает поддерживать здоровое состояние организма. Также, человек должен соблюдать диету, следить за нормальным весом, выполнять физические упражнения, следить за полноценностью сна. Очень важно, чтобы пациенты с аритмией и гипертензией обследовались на наличие апноэ сна или других расстройств.
Стадии и фазы сна — Психологос
Самые яркие сновидения приходят к нам во время быстрого сна.
Во время сна у человека периодически чередуются две основные фазы: медленный и быстрый сон, причём в начале сна преобладает длительность медленной фазы, а перед пробуждением — растёт длительность быстрого сна. У здорового человека сон начинается с первой стадии медленного сна (Non-REM сон), которая длится 5-10 минут. Затем наступает 2-я стадия, которая продолжается около 20 минут. Ещё 30-45 минут приходится на период 3-4 стадий. После этого спящий снова возвращается во 2-ю стадию медленного сна, после которой возникает первый эпизод быстрого сна, который имеет короткую продолжительность — около 5 минут. Вся эта последовательность называется циклом. Первый цикл имеет длительность 90-100 минут. Затем циклы повторяются, при этом уменьшается доля медленного сна и постепенно нарастает доля быстрого сна (REM сон), последний эпизод которого в отдельных случаях может достигать 1 часа. В среднем, при полноценном здоровом сне, отмечается пять полных циклов.
Ещё 30-45 минут приходится на период 3-4 стадий. После этого спящий снова возвращается во 2-ю стадию медленного сна, после которой возникает первый эпизод быстрого сна, который имеет короткую продолжительность — около 5 минут. Вся эта последовательность называется циклом. Первый цикл имеет длительность 90-100 минут. Затем циклы повторяются, при этом уменьшается доля медленного сна и постепенно нарастает доля быстрого сна (REM сон), последний эпизод которого в отдельных случаях может достигать 1 часа. В среднем, при полноценном здоровом сне, отмечается пять полных циклов.
Медленный сон
Медленный сон также имеет свои стадии.
Первая стадия. Альфа-ритм уменьшается и появляются низкоамплитудные медленные тета- и дельта-волны. Поведение: дремота с полусонными мечтаниями и сноподобными галлюцинациями. В этой стадии могут интуитивно появляться идеи, способствующие успешному решению той или иной проблемы.
Вторая стадия. На этой стадии появляются так называемые «сонные веретёна» — сигма-ритм, который представляет собой учащённый альфа-ритм (12—14—20 Гц). С появлением «сонных веретён» происходит отключение сознания; в паузы между веретёнами (а они возникают примерно 2—5 раз в минуту) человека легко разбудить. Повышаются пороги восприятия. Самый чувствительный анализатор — слуховой (мать просыпается на крик ребёнка, каждый человек просыпается на называние своего имени).
На этой стадии появляются так называемые «сонные веретёна» — сигма-ритм, который представляет собой учащённый альфа-ритм (12—14—20 Гц). С появлением «сонных веретён» происходит отключение сознания; в паузы между веретёнами (а они возникают примерно 2—5 раз в минуту) человека легко разбудить. Повышаются пороги восприятия. Самый чувствительный анализатор — слуховой (мать просыпается на крик ребёнка, каждый человек просыпается на называние своего имени).
Третья стадия. Характеризуется всеми чертами второй стадии, в том числе наличием «сонных веретён», к которым добавляются медленные высокоамплитудные дельта-колебания (2 Гц).
4-я стадия медленного сна, глубокий сон. ЭЭГ выделена красной рамкой.
4-я стадия медленного сна, глубокий сон. Это самый глубокий сон. Преобладают дельта-колебания (2 Гц).
Третью и четвёртую стадии часто объединяют под названием дельта-сна. В это время человека разбудить очень сложно; возникают 80 % сновидений, и именно на этой стадии возможны приступы лунатизма и ночные кошмары, однако человек почти ничего из этого не помнит. Первые четыре медленноволновые стадии сна в норме занимают 75—80 % всего периода сна.
В это время человека разбудить очень сложно; возникают 80 % сновидений, и именно на этой стадии возможны приступы лунатизма и ночные кошмары, однако человек почти ничего из этого не помнит. Первые четыре медленноволновые стадии сна в норме занимают 75—80 % всего периода сна.
Предполагают, что медленный сон связан с восстановлением энергозатрат.
Быстрый сон
Быстрый сон. ЭЭГ выделена красной рамкой. Движения глаз подчёркнуты красным.
Быстрый сон (парадоксальный сон, стадия быстрых движений глаз, или сокращенно БДГ-сон, REM-сон) — это пятая стадия сна. ЭЭГ: быстрые колебания электрической активности, близкие по значению к бета-волнам. Это напоминает состояние бодрствования. Вместе с тем (и это парадоксально!) в эту стадию человек находится в полной неподвижности, вследствие резкого падения мышечного тонуса. Однако глазные яблоки очень часто и периодически совершают быстрые движения под сомкнутыми веками. Существует отчетливая связь между БДГ и сновидениями. Если в это время разбудить спящего, то в 90 % случаев можно услышать рассказ о ярком сновидении.
Существует отчетливая связь между БДГ и сновидениями. Если в это время разбудить спящего, то в 90 % случаев можно услышать рассказ о ярком сновидении.
Фаза быстрого сна от цикла к циклу удлиняется, а глубина сна снижается. Быстрый сон прервать труднее, чем медленный, хотя именно быстрый сон ближе к порогу бодрствования. Прерывание быстрого сна вызывает более тяжёлые нарушения психики по сравнению с нарушениями медленного сна. Часть прерванного быстрого сна должна восполняться в следующих циклах.
Предполагают, что быстрый сон обеспечивает функции психологической защиты, переработку информации, ее обмен между сознанием и подсознанием.
Слепым от рождения снятся звуки и ощущения, БДГ у них нет.
Pulmoradix » Апноэ
Несмотря на то, что одну треть нашей жизни мы спим, мы до недавнего времени мало что знали о нарушениях сна. К сожалению, остается много пациентов с недиагностированными расстройствами сна.
Распространенность нарушения дыхания во сне — 20%, из которых 4% очень важные. В Словении мы предполагаем, что нарушение дыхания во время сна примерно у 80.000 человек, преобладают мужчины в соотношении 4: 1.
Наиболее распространенным нарушением является обструктивного апноэ сна, СОАС акроним происходит от английского термина »obstructive sleep apnea«. Храп часто ассоциируется с обструктивным апноэ во сне, хотя правило большинство храпящих, это здоровые люди не имеющие существенного обструктивного апноэ сна.
На что необходимо обратить особое внимание: на храп, прекращение дыхания во время сна (апноэ), на беспокойный и плохой сон, а также сонливость в течение дня.
Авария на Чернобыльской АЭС, в Бхопале, на Три-Майл-Айленд, катастрофа шаттла «Челленджер» были официально отнесены к фатальной ошибки из-за усталости и плохого сна и возможно расстройства сна.
Хронически нарушенный сон, который является постоянным спутником обструктивного апноэ сна (СОАС) имеет разрушительные последствия для здоровья, потому что это приводит к сердечно-сосудистым заболеваниям, высокому кровяному давлению, диабету II типа, к возможному инсульту, психическим расстройствам, снижению полового влечения, понижению либидо, ожирению …
У пациентов с обструктивным апноэ во сне сильное раздражение, депрессия, рассеянность, их жизнь менее эффективна.
Сон является активным процессом. Протекает на различных этапах. Есть два типа сна: Фаза быстрого сна, одним из признаков этой фазы являются быстрые движения глазных яблок и медленный сон, когда нет движения глазных яблок. Фаза быстрого сна длится 20%, а медленный сон — 80% сна. Фаза быстрого сна происходит примерно один раз на каждые 90 минут.
Медленный сон восстанавливает истощенность тела, которое появилось в конце дня. Фаза быстрого сна расслабляет мозг, обдумывая воспоминания и мысли последних дней. Тогда мы видим сны. В эпизодах медленного сна более распространены центральные эпизоды апноэ в фазе быстрого сна более распространено обструктивное апноэ сна (СОАС).
У пациентов с обструктивным апноэ во время сна, как правило, говорят, что они не видят сны. Из-за нарушения сна, они сокращают фазу быстрого сна .
Взрослые в среднем спят 7,5 часов в сутки, в среднем 5-9 часов в сутки.
ДНЕВНАЯ СОНЛИВОСТЬ:
Если сонливость в дневное время длится более длительный период времени, существует вероятность того, что человек страдает расстройством сна. Но это может быть лишь симптомом сонливости в дневное время из-за того, что человек мало спал слишком мало спать или плохо спал. Недостаток сна накапливается кумулятивно.
Например, если ежедневно спим на один час меньше, чем требуется, столько, сколько оптимально нужно человеку, то к концу недели нам не хватает 7 часов сна и это означает, что одной полной ночи нам не хватает.
Причины сонливости в дневное время:
• Недостаток сна (поздно легли спать или общая сумма недостатка сна)
• Сменная работа: работа в ночное время или когда нужно вставать очень рано утром
• Плохие привычки сна (пренебрежение гигиеной сна)
• Разница во времени из-за смены часового пояса, как правило, на самолете (jet lag)
• Злоупотребление или зависимость от различных соединений (никотин, алкоголь, наркотики …)
• Болезни, такие как различные расстройства сна, среди наиболее распространенных обструктивного апноэ сна
Это является наиболее распространенными причинами усталости в течение дня с которыми мы сталкиваемся в современном обществе.
Здоровый сон | ГОБУЗ «Кольская ЦРБ»
Здоровый сон физиологически необходим человеку и является важным условием физического и душевного здоровья. Человек проводит во сне около трети жизни, поэтому этой части нашей жизни необходимо уделять пристальное внимание и заботиться о том, чтобы сон был здоровым и правильным. От качества сна зависит качество нашего бодрствования, то есть от того как наш организм отдохнет ночью зависит то, как он будет функционировать днем.
Правильный сон – источник прекрасного настроения, хорошего самочувствия и, конечно же, нашей красоты.
Стадии сна.
Сон человека состоит из нескольких стадий, несколько раз повторяющихся за ночь. Стадии сна характеризуются активностью различных структур головного мозга и несут в себе различные функции для организма. Сон делится на две стадии: медленный сон и быстрый сон.
Стадия медленного сна делится еще на четыре стадии.
- Первая стадия. Человек находится в полусонном состоянии, дремлет. У человека снижается мышечная активность, пульс и частота дыхания, понижается температура тела.
- Вторая стадия. Это стадия неглубокого сна. Продолжает снижаться мышечная активность, пульс и частота дыхания.
- Третья стадия. Стадия медленного сна. На этой стадии организм человека почти полностью расслаблен, клетки начинают восстановительную работу.
- Четвертая стадия. Стадия глубокого медленно сна. Тело человека полностью расслаблено, организм отдыхает и восстанавливается. Благодаря третьей и четвертой стадии при пробуждении мы чувствуем себя отдохнувшими.
Быстрый сон.
Стадию быстрого сна также называют парадоксальный сон или стадия БДГ (быстрого движения глаз). Эта стадия наступает примерно через 70-90 минут после начала сна. Парадокс этой стадии состоит в том, что в этот период активность мозга практически такая же, как и при бодрствовании, несмотря на то, что тело человека находится в полностью расслабленном состоянии. Помимо этого, повышается температура тела и артериальное давление, увеличивается частота дыхания и сердцебиения, а глаза под веками начинают быстро двигаться. Именно в этот период нам, как правило, сняться большинство снов.
Функции сна.
- Отдых организма.
- Защита и восстановление органов и систем организма для нормальной жизнедеятельности.
- Переработка, закрепление и хранение информации.
- Адаптация к изменению освещенности (день-ночь).
- Поддержание нормального психоэмоционального состояния человека.
- Восстановление иммунитета организма.
Правила здорового сна.
Существует ряд правил, соблюдение которых позволит сделать сон исключительно полезным для здоровья. Эти правила помогают организму правильно выполнять свои функции во время сна, что непременно благоприятно сказывается на самочувствии и настроении человека в период бодрствования.
- Старайтесь ложиться и просыпаться в одно и то же время вне зависимости от дня недели.
- Лучше всего ложиться спать до 23 часов. Именно в это время организмы большинства людей настроены на расслабление.
- Не стоит перед сном употреблять пищу. За пару часов до сна можно перекусить легкой пищей, например, овощами, фруктами или кисломолочными продуктами.
- Не стоит употреблять перед сном алкоголь и напитки, содержащие кофеин (какао, кофе, чай). Чай с ромашкой, мятой или теплое молоко с медом, выпитые перед сном, принесут пользу организму и помогут быстрее и легче заснуть.
- Быстро уснуть поможет прогулка перед сном на свежем воздухе.
- Перед сном не стоит думать о проблемах и переживаниях, о них вы успеете подумать днем. А вечером лучше всего расслабиться и помочь организму полноценно отдохнуть и восстановиться во время ночного сна. По возможности расслабьте мышцы и думайте о чем-то приятном.
- Не стоит принимать перед сном холодный душ, оставьте эту процедуру на утро. Вечером лучше всего принять теплую ванну или душ.
- Для быстрого и спокойного засыпания можно почитать спокойную литературу или включить негромко медленную музыку, звуки природы, колыбельные и т.п.
- Не забывайте проветривать перед сном спальное помещение.
- Выключайте в спальном помещении свет, в противном случае сон, скорее всего, будет поверхностным, что не даст вашему организму полноценно отдохнуть и восстановиться.
- Ученые рекомендуют спать головой на север или восток.
- Спать лучше всего более обнаженным, а в случае замерзания укрыться дополнительным одеялом, а не надевать на себя теплые вещи.
- Для отдыха организма достаточно спать четыре полных цикла сна, состоящих из медленного и быстрого сна и описанных выше.
- Спальное место должно быть ровным, не слишком мягким и не слишком жестким.
- Спать необходимо в горизонтальном положении, желательно попеременно — то на правом, то на левом боку. На животе спать специалисты не рекомендуют.
- Для того чтобы с самого утра дать старт хорошему настроению, не залеживайтесь долго в постели, сразу после пробуждения потянитесь, улыбнитесь и вставайте. Делайте это не спеша и с удовольствием.
5 правил для быстрого сна — Фазы сна
Во сне организм человека восстанавливается, набирается сил и энергии. Современная динамичная жизнь, стрессы на работе, бытовые проблемы часто способствуют расстройству сна. Во время отдыха не получается полностью расслабиться, быстрый сон преобладает над медленным, утром остается чувство усталости и недомогание.
Эксперты разработали несколько правил, которые помогут вернуть здоровый и полноценный сон. Нет необходимости принимать лекарства или обращаться к врачам – достаточно пересмотреть свое питание, обустроить удобное спальное место и психологически настроиться на отдых.
Быстрый и медленный сон: что нужно знать
Есть два периодических цикла — фаза быстрого сна и медленный сон. В период быстрого сна мозг активно работает, анализирует все происшедшее за день, сердце человека бьется чаще обычного, глазные яблоки быстро двигаются. После пробуждения в этот период в памяти сохраняются все сны и образы.
Фаза медленного сна предполагает старт регенерационных процессов. В процессе работы мозга формируются сигналы. Они указывают на слабое место, требующее восстановления. Средняя продолжительность медленного сна – два-три часа, после его сменяет фаза быстрого сна. Во время глубокого сна сердечный ритм, дыхание становится медленным, достигается максимальное расслабление мышц, тела. Ключевое влияние на самочувствие и общее состояние оказывает глубокий сон, как добиться увеличения его продолжительности, мы расскажем в статье.
Существует еще одна методика, помогающая максимально высыпаться за короткое время – полифазный сон. Человеку необходимо ложиться спать через определенные временные промежутки, при этом длительность отдыха – не более получаса. Методика спорная, но ее приверженцы утверждают, что для полноценного восстановления им хватает трех часов в сутки.
Важные фазы сна: как выспаться и набраться сил
Существует множество различных методов, как увеличить медленный сон, каждый человек подбирает для себя подходящий вариант. В науке выделяют три этапа сна:
- Этап засыпания. Организм готовится к отдыху, происходит снижение чувствительности, замедление биологических процессов. В это время нужно максимально расслабиться, отвлечься от мыслей и проблем, полностью предавшись чувству покоя;
- Медленный сон. Происходит восстановление организма. Первые 10-15 минут организм дремлет, после переходит в легкую стадию – сохраняется слух, но сознание отключается. Через 20-30 минут наступает глубокая стадия медленного сна;
- Быстрый сон. Характеризуется красочными снами. Мозг продолжает обрабатывать информацию, полученную за день. Постарайтесь думать о приятном, чтобы легко перейти в глубокую фазу.
5 советов: как вернуть глубокий сон и избавиться от бессонницы
Специалисты рекомендуют выбрать лучшее время для сна, опираясь на собственные ощущения. Некоторым людям намного проще заснуть рано, другие не хотят спать раньше полуночи. Это зависит от особенностей организма, биоритмов. Для восстановления сна рекомендуется:
- Соблюдать график. Оптимальное время для взрослого человека – 10-11 вечера, продолжительность сна должна составлять не менее 7-9 часов.
- Дышать свежим воздухом. Двадцатиминутная прогулка на воздухе перед сном действует аналогично легкому снотворному. Альтернатива – теплая ванная с успокаивающими травами.
- Удобное спальное место. Важно подобрать хороший матрас, подушку оптимальной высоты.
- Проветривание. В спальне должно быть не сильно жарко, не холодно. Температура, способствующая хорошему отдыху – 17-19 градусов тепла. Перед сном желательно открыть окно или балкон, проветрить помещение.
- Исключите кофе, алкогольные напитки в вечернее время.
Медленный сон: имеет ли это значение?
J Clin Sleep Med. 2009 Apr 15; 5 (2 доп.): S4 – S5.
Thomas Roth
Исследовательский центр нарушений сна, больница Генри Форда, Детройт, штат Мичиган
Центр исследований нарушений сна, больница Генри Форда, Детройт, штат Мичиган
Адресная корреспонденция: Thomas Roth PhD, Директор отдела исследований нарушений сна и исследовательского центра системы здравоохранения Генри Форда, Центр сна больницы Генри Форда, 2799 West Grand Blvd, Detroit, MI 48202 Телефон: (313) 876-2233, факс: (313) 916-5150, gro.shfh @ 1htorTCopyright © Американская академия медицины сна, 2010 г. Эта статья цитируется в других статьях в PMC.Сон — это поведение, наблюдаемое у всех живых организмов, и оно необходимо для выживания. У грызунов полное недосыпание приводит к значительному увеличению расхода энергии и, как следствие, потере веса, несмотря на повышенное потребление пищи, и, если не прекращается лишение сна, приводит к смерти, обычно через 2–3 недели. 1 Сообщалось также о смерти, связанной с хроническим недосыпанием, у других видов. 2 У людей редкое наследственное заболевание, фатальная семейная бессонница, которая связана с прогрессирующей бессонницей, неизменно приводит к смерти с течением времени от 8 до 72 месяцев. 3 , 4 При отсутствии расстройства полное лишение сна не происходит в течение продолжительных периодов времени. Это свидетельствует о гомеостатическом стремлении ко сну; По прошествии нескольких дней необходимо предпринять героические меры, чтобы не дать людям заснуть.
Хотя последствия нарушений сна менее драматичны, они могут иметь более практическое применение, помогая нам понять последствия обычно происходящих добровольных недосыпаний и недосыпаний, связанных с нарушениями сна.В недавнем крупном исследовании работающих взрослых американцев 16% респондентов сообщили, что в рабочие дни спят менее 6 часов в сутки. 5 Хроническое ограничение сна связано с увеличением склонности ко сну — даже в неудобных и опасных ситуациях — ухудшением дневной активности, включая память, и рядом физиологических последствий, включая неблагоприятное воздействие на эндокринные функции и иммунные ответы 6 и увеличение риска ожирения и диабета. 7
Чтобы понять последствия и эффекты нарушений сна и то, как они могут быть улучшены, важно уметь анализировать нейробиологию сна. Сегодня сон характеризуют с помощью полисомнографии. С помощью этой техники было показано, что сон состоит из двух отдельных компонентов: сна с быстрым движением глаз (REM) и сна без быстрого сна (NREM). Стандартизированные методы определения нормального сна были впервые опубликованы в 1968 году Алланом Реччаффеном и Энтони Кейлсом. 8 Быстрый сон характеризуется быстрыми движениями глаз и низкоамплитудной ЭЭГ смешанной частоты. 8 На его долю приходится примерно 18–22% от общего времени сна, при этом процент быстрого сна у взрослых немного снижается с возрастом. 9 NREM-сон характеризуется наличием K-комплексов, сонных веретен и медленной волновой активности (SWA) и условно разделен Рехтшаффеном и Калесом на четыре стадии сна, причем стадия 1 считается «легким сном», а стадия 3. и 4 считались «глубоким сном». 8
Сон 3-й стадии был определен как эпоха сна, содержащая более 20% SWA, а сон стадии 4 был определен как эпоха сна, содержащая более 50% SWA. 8 Вместе, стадии медленного сна 3 и 4 часто известны как медленный сон (SWS). Некоторые исследователи полагают, что SWS играет важную роль в восстановлении и восстановлении мозга у людей 10 , 11 и участвует в поддержании и укреплении сна. 12 Однако точная природа и роль SWS не совсем понятны, и еще многое предстоит узнать о генерации SWS и ее физиологических функциях. Вот некоторые из ключевых вопросов, на которые необходимо ответить: Какова взаимосвязь между SWS и другими параметрами сна, такими как непрерывность сна, продолжительность сна, склонность ко сну в дневное время и функционирование в дневное время? Различается ли SWS в зависимости от возраста, пола, расы или основной продолжительности сна? Каковы нейрофизиологические и нейроанатомические корни SWS? Есть ли у SWS уникальные функции? Можно ли воздействовать на SWS фармакологическими средствами и каковы последствия этого? Многие из этих важных вопросов рассматриваются в следующих статьях, которые впервые были представлены на сателлитном симпозиуме под названием «Медленный сон (SWS): имеет ли это значение?» состоялось на 22-м ежегодном собрании ассоциированных профессиональных обществ сна (APSS) в Балтиморе 10 июня 2008 г.В этих статьях авторы делают обзор того, что в настоящее время известно о SWS. В своей статье Дерк-Ян Дейк обсуждает природу SWA и SWS и то, как они регулируются, прежде чем перейти к оценке факторов, влияющих на SWS, и корреляции SWS с непрерывностью сна, склонностью ко сну и дневным функционированием. Затем Джулио Тонони углубляется в электрофизиологическую природу SWA, ее регуляцию и взаимосвязь между SWA и синаптической силой, прежде чем Мэтью Уокер изложит доказательства, подтверждающие роль SWS в обработке памяти.Наконец, Джеймс Уолш исследует влияние гипнотических агентов на SWS и последствия усиления SWS. На этом фоне будет рассмотрен вопрос о том, действительно ли SWS выполняет восстановительную и освежающую роль, вместе с предположением о том, что усиление SWS может быть полезным для пациентов, страдающих бессонницей во многих ее формах.
Заявление о раскрытии информации
Доктор Рот получил исследовательскую поддержку от Aventis, Cephalon, GlaxoSmithKline, Neurocrine Biosciences, Pfizer, Sanofi, Schering Plough, Sepracor, Somaxon, Syrex, Takeda, TransOral, Wyeth и Xenoport; был консультантом Abbott, Accadia, Acoglix, Actelion, Alchemers, Alza, Ancil, Arena, AstraZeneca, Aventis, AVER, Bristol-Myers Squibb, BTG, Cephalon, Cypress, Dove, Elan, Eli Lilly, Evotec, Forest, GlaxoSmithKline. , Hypnion, Impax, Intec, Intra-Cellular, Jazz, Johnson & Johnson, King, H.Lundbeck A / S, McNeil, MediciNova, Merck, Neurim, Neurocrine Biosciences, Neurogen, Novartis, Orexo, Organon, Prestwick Pharmaceuticals, Proctor & Gamble, Pfizer, Purdue Pharma LP, Restiva, Roche, Sanofi, SchoeringPlough, SepracvierPlough, , Somaxon, Syrex, Takeda, TransOral, Vanda, Vivometrics, Wyeth, Yamanuchi Pharma и Xenoport; и выступал в качестве спикера в Cephalon, Sanofi и Takeda.
СПИСОК ЛИТЕРАТУРЫ
1. Rechtschaffen A, Bergmann BM. Лишение сна у крысы: обновление статьи 1989 года.Спать. 2002; 25: 18–24. [PubMed] [Google Scholar] 2. Cirelli C, Tononi G. Важен ли сон? PLoS Biol. 2008. 6: 1605–11. [Google Scholar] 3. Montagna P, Lugaresi E. Agrypnia Excitata: синдром генерализованной гиперактивности и полезная концепция нейрофизиопатологии сна. Clin Neurophysiol. 2002; 113: 552–60. [PubMed] [Google Scholar] 4. Монтанья П. Смертельная семейная бессонница: модельное заболевание в физиопатологии сна. Sleep Med Rev.2005; 9: 339–53. [PubMed] [Google Scholar] 8. Рехтшаффен А., Калес А.Служба общественного здравоохранения. Вашингтон, округ Колумбия: Типография правительства США; 1968. Руководство по стандартизированной терминологии, методам и системе оценок для стадий сна людей. [PubMed] [Google Scholar] 9. Охайон М.М., Карскадон М.А., Гийемино С., Витьелло М.В. Метаанализ количественных параметров сна от детства до старости у здоровых людей: разработка нормативных значений сна на протяжении всей жизни человека. Спать. 2004. 27: 1255–73. [PubMed] [Google Scholar] 10. Бенингтон Дж. Х., Хеллер ХК. Восстановление энергетического обмена мозга как функция сна.Prog Neurobiol. 1995; 45: 347–60. [PubMed] [Google Scholar] 11. Хорн Дж. Медленноволновой сон человека: обзор и оценка недавних открытий, касающихся функций сна и психических заболеваний. Experientia. 1992; 48: 941–54. [PubMed] [Google Scholar] 12. Dijk DJ, Groeger J, Deacon S, Stanley N. Связь между индивидуальными различиями в медленном сне, медленноволновой активности и непрерывности сна у молодых, средних и пожилых мужчин и женщин. Eur Neuropsychopharmacol. 2006; 16: S538. [Google Scholar]Как лучше уснуть
Мы все слышали о глубоком сне (также известном как медленноволновой сон) и о том, как он нужен нашему телу для правильного функционирования, но что именно? Существует множество исследований глубокого сна, но у нас есть вся важная информация, которую вам нужно знать о том, что это такое, каковы его функции и как вы можете получить от них больше.
Что такое глубокий сон?
Глубокий сон — это стадия сна, связанная с самыми медленными мозговыми волнами во время сна. Поскольку активность ЭЭГ синхронизирована, этот период сна известен как медленноволновый сон: он производит медленные волны с относительно высокой амплитудой и частотой менее 1 Гц. Начальный участок волны обозначен состоянием вниз; период торможения, при котором нейроны неокортекса молчат. Именно в этот период нейроны неокортекса могут отдыхать.Следующий участок волны обозначен северной частью штата; период возбуждения, при котором нейроны кратковременно срабатывают с высокой скоростью. Это состояние является фазой деполяризации, тогда как первое состояние является фазой гиперполяризации. В отличие от сна с быстрым движением глаз (цикл быстрого сна), основными характеристиками медленного сна являются отсутствие или медленное движение глаз, умеренный мышечный тонус и отсутствие половой активности.
Исследование стадий сна и глубокого сна
Согласно Стандарту Rechtschaffen & Kales (R&K) 1968 года, глубокий сон можно описать как третий этап сна с медленными движениями глаз и часто обозначается как «сон с медленной волной ».Нет четкой разницы между третьим и четвертым этапами; однако на третьем этапе дельта-активность составляет от 20 до 50 процентов, а на четвертом этапе — более 50 процентов. С 2008 года Американская академия медицины сна больше не ссылается на четвертый этап, а третий и четвертый этапы объединились, чтобы создать третий этап. Таким образом, 30-секундный сон, состоящий из 20% или более медленноволнового сна, теперь считается третьей стадией. Медленноволновой сон (глубокий сон) — одна из стадий сна.
Особенности глубокого сна
- Электроэнцефалограф (ЭЭГ) демонстрирует дельта-волны (высокая амплитуда, низкая частота)
- Объединение воспоминаний
- Высокий порог возбуждения
- Предполагаемое восстановление тела и мозга
Почему так важен глубокий сон?
Глубокий сон важен для консолидации новых воспоминаний и часто упоминается как « зависимая от сна обработка памяти». »Таким образом, у людей с первичной бессонницей будет нарушена консолидация памяти, и они не будут работать так же эффективно, как нормальные пациенты, при выполнении задач на память после периода сна. Кроме того, при медленном сне улучшается декларативная память, которая включает как семантическую, так и эпизодическую память.
Центральная модель была создана в предположении, что долговременному хранению памяти способствует взаимодействие между гиппокампальной и неокортикальной сетями. Несколько исследований показали, что после того, как испытуемые были обучены изучению декларативной задачи на память, плотность веретен сна человека была значительно выше по сравнению с контрольной задачей, не связанной с обучением.Это происходит из-за бессознательных волновых колебаний, которые составляют внутриклеточные записи корковых и таламических нейронов.
Функция глубокого сна
Исследования депривации сна у людей, по-видимому, предполагают, что основная функция глубокого сна может заключаться в том, чтобы дать мозгу время для восстановления после его повседневной активности. Повышение метаболизма глюкозы в головном мозге происходит в результате выполнения задач, требующих умственной активности. Еще одна функция, на которую влияет медленный сон, — это секреция гормона роста, которая на этой стадии всегда максимальна.Кроме того, это также вызывает увеличение парасимпатической нейронной активности и снижение симпатической нейронной активности.
В глубоком сне наблюдаются самые высокие пороги возбуждения, например, трудность пробуждения от звука определенной громкости. Когда человек просыпается от медленного сна, он обычно чувствует себя довольно слабым. Когнитивные тесты после пробуждения действительно показывают, что умственные способности могут ухудшаться на периоды до 30 минут по сравнению с пробуждениями на других стадиях.Это явление известно как «инерция сна ». ”
После недосыпания всегда происходит резкий возврат к медленноволновому сну, а это означает, что следующий период сна будет включать не только более длительный медленноволновый сон, чем обычно, но и более глубокий медленноволновый сон. Предыдущая продолжительность этой стадии, в дополнение к продолжительности предшествующего бодрствования, будет определять продолжительность медленноволнового сна. При определении количества медленноволнового сна в любой данный период сна главным фактором, на который следует обратить внимание, является продолжительность предшествующего бодрствования, которое обычно связано с накоплением в мозге веществ, вызывающих сон.
Нарушения сна во время глубокого сна
Существует несколько нарушений сна и парасомнии, которые возникают преимущественно во время медленноволнового сна. Лунатизм (сомнамбулизм), ночные кошмары (страхи во сне), ночное недержание мочи (энурез), секссомния и сонливость — все это связано с медленноволновым сном. Люди с нарколепсией часто имеют фрагментированный глубокий сон.
Факторы, увеличивающие медленный глубокий сон
Факторы, которые, как было показано, увеличивают продолжительность медленного сна в периоде сна, который следует за ними, включают интенсивные продолжительные упражнения и нагревание тела, например, погружение в сауну или гидромассажную ванну.
Исследования показали, что медленный сон облегчается, когда температура мозга превышает определенный порог. Считается, что этот порог регулируется циркадным ритмом и гомеостатическими процессами. Необычно низкоуглеводная краткосрочная диета у здоровых спящих способствует увеличению процента медленного сна. Это включает производство в процентах сна во сне (REM-сон) по сравнению с контролем со смешанной диетой. Считается, что эти изменения сна вполне могут быть связаны с метаболизмом жиров, содержащихся в низкоуглеводной диете.Кроме того, прием антидепрессантов и некоторых СИОЗС может увеличить продолжительность периодов медленного сна; однако влияние ТГК на медленный сон остается спорным. Общее время сна в этих случаях часто не зависит от будильника человека, циркадных ритмов или обязательств по утрам.
Как лучше уснуть
Самое важное, что вы можете сделать для увеличения количества глубокого сна, — это обеспечить себе достаточное общее время сна.Часто люди лишают себя полноценного сна. В дополнение к сокращению глубокого сна, быстрый сон также укорачивается.
Есть некоторые данные, позволяющие предположить, что энергичные упражнения могут улучшить или укрепить глубокий сон. Некоторые специалисты по сну рекомендуют такие занятия аэробикой, как бег трусцой, бег и плавание. Тем, кто склонен к бессоннице, лучше заниматься спортом раньше днем, а не перед сном.
Вкратце
Третья стадия цикла сна, медленный сон (глубокий сон), является важной частью вашего когнитивного функционирования.Он играет важную роль в укреплении памяти и восстановлении мозга. Поскольку он важен для вашего здоровья в целом, вы должны увеличить количество глубокого сна, позволяя себе спать достаточно времени каждую ночь. Кроме того, упражнения и здоровое питание — это несколько различных методов, которые вы можете попробовать, чтобы улучшить медленный сон.
Сертифицированные советом доктора медицины сна, ученые, редакторы и писатели для ASA.
Последние сообщения авторов и рецензентов ASA (посмотреть все)Глоссарий: N-P | Здоровый сон
Самая легкая стадия медленного сна.Часто наблюдаются медленные движения глаз.
Вторая стадия медленного сна. На ЭЭГ во время сна N2 видны сонные веретена и К-комплексы на фоне относительно низковольтной, смешанно-частотной активности ЭЭГ.
Самая глубокая стадия медленного сна (NREM) сна, характеризующаяся большим количеством синхронизированных медленных волн ЭЭГ (активности мозговых волн), чем на других стадиях.Эти медленные волны называются дельта-активностью. Во время медленноволнового сна мозг становится менее отзывчивым на внешние раздражители; он считается самым глубоким сном, так как это самый трудный этап для пробуждения. Классификация комбинированных стадий сна 3 или 4 в 1968 году была реклассифицирована в 2007 году как стадия N3.
Расстройство сна, характеризующееся чрезмерной дневной сонливостью, иногда катаплексией и другими симптомами. Нарколепсией страдает примерно 1 человек из 2000.
Нервная клетка в головном мозге и других частях нервной системы, которая передает нервные сигналы через сложные сети, регулирующие сон, возбуждение, сознание, речь, ходьбу и многие другие виды поведения.
Химическое вещество (например, серотонин или норэпинефрин), которое позволяет нервным сигналам преодолевать разрыв или синапс между нервными клетками. Нейротрансмиттеры обычно возбуждают или подавляют активность нижележащих нейронов-мишеней.
Нарушение сна, возникающее во время сна без сновидений (как правило, глубокий медленноволновый сон). Человек, испытывающий ночной ужас, часто испытывает панику, но его нелегко разбудить из-за глубокого сна, в котором это явление происходит. В отличие от кошмаров, ночные кошмары обычно лишены визуальных образов и чаще всего не вспоминаются после пробуждения. См. Также кошмары.
Нарушение сна, возникающее во время быстрого сна (сновидения) и имеющее пугающее содержание.Кошмары часто приводят к частичному или полному пробуждению от сна, поскольку проснуться от быстрого сна относительно легко. См. Также ночной ужас.
Происходит или активен в ночное время, а не днем.
См. Процедурную память.
Состояние покоя, в котором человек мало осознает окружающую среду, имеет низкую активность коры головного мозга и почти не имеет внутренних мыслей.NREM-сон состоит из трех различных стадий: N1 (легкий сон), N2 и N3 (глубокий сон).
Состояние, при котором человек перестает дышать, по крайней мере, на 10 секунд, причем такие остановки происходят неоднократно во время сна. Обструктивное апноэ во сне похоже на крайнюю форму храпа. Апноэ во сне обычно возникает из-за полной или частичной обструкции дыхательных путей в задней части глотки. Апноэ во сне часто встречается у пожилых мужчин с ожирением, но также может возникать у детей и женщин.
Нейротрансмиттеры, которые обычно способствуют стабильному бодрствованию и помогают регулировать быстрый сон. У людей с нарколепсией с катаплексией происходит потеря нейронов, вырабатывающих орексины. Орексины также известны как гипокретины.
Термин, описывающий людей, которые предрасположены ложиться спать допоздна и быть в лучшем состоянии по вечерам. Также называется «вечерний». Контрасты с «жаворонком» (см. Запись). Такая предрасположенность совы и жаворонка может иметь генетический компонент.
Беспокойство или нежелательное поведение, которое вторгается во время сна, например, лунатизм. Они часто связаны с ненормальным или частичным возбуждением и обычно нарушают нормальный сон.
Одно из двух отделов вегетативной нервной системы. Ветвь парасимпатической нервной системы обычно участвует в восстановительных и поддерживающих функциях организма, таких как пищеварение.Эти два подразделения обычно работают в оппозиции (как тормоз и акселератор в автомобиле). Так, например, замедление работы сердца может быть достигнуто за счет одновременного снижения симпатической активности (уменьшение ускорения) и увеличения парасимпатической активности (усиление торможения).
Расстройство сна, характеризующееся движениями ног или подергиваниями, которые обычно происходят каждые 20-40 секунд во время сна, вызывая нарушение сна и вызывающее чрезмерную дневную сонливость.
Движения или подергивания ног, которые обычно происходят каждые 20-40 секунд во время сна. Термин «расстройство периодических движений конечностей» используется, если движения ног вызывают дневные симптомы (см. Запись).
Сдвиг, при котором обычное время сна или бодрствования перемещается на другую часть циркадного цикла.
Запись сна человека с использованием нескольких физиологических сигналов, таких как мозговые волны (электроэнцефалограмма), движения глаз (электроокулограмма) и мышечная активность (электромиограмма), а также модели дыхания, количество кислорода в кровотоке, частота сердечных сокращений, и положение тела.Полисомнограмма используется для оценки пациентов в лаборатории сна на предмет потенциальных нарушений сна.
Область мозга, которая играет решающую роль в формировании познания, направлении целенаправленных мыслей и исполнительной функции. ПФУ особенно уязвимы для последствий недосыпания.
Долговременная память навыков и процедур, или «практические» знания.Также называется неявной памятью.
границ | Медленный сон — многообещающая цель для лечения болезни Альцгеймера
Введение
Болезнь Альцгеймера (БА) — прогрессирующее нейродегенеративное заболевание и наиболее частая причина деменции у пожилых людей (Alzheimer’s Association, 2016). Патологическим признаком БА является наличие внеклеточных бляшек, состоящих из бета-амилоида (Aβ), и внутриклеточных нейрофибриллярных клубков, состоящих из связывающего микротрубочки белка тау в головном мозге (Bloom, 2014; Calderon-Garcidueñas and Duyckaerts, 2017).Согласно гипотезе амилоидного каскада, накопление Aβ приводит к отложению тау-белка, запускает нейрональную дисфункцию и приводит к гибели нейронов (Hardy and Higgins, 1992; Selkoe and Hardy, 2016). Хотя гипотеза амилоидного каскада широко обсуждается, было показано, что агрегации растворимого Aβ и тау-белка приводят к синаптической дисфункции и потере синаптической плотности (Spiers-Jones and Hyman, 2014), что приводит к нарушениям памяти и когнитивных функций у пациентов с БА (DeKosky и Scheff, 1990). Клинические признаки БА включают прогрессирующую потерю памяти, нарушение суждения и принятия решений (Förstl and Kurz, 1999).Современные методы лечения ограничиваются облегчением симптомов, а не обращением вспять или замедлением прогрессирования заболевания (Yiannopoulou and Papageorgiou, 2013; Cummings et al., 2019). Следовательно, существует острая необходимость в определении эффективных стратегий лечения для облегчения бремени болезни.
Помимо нарушений памяти и когнитивных функций, пациенты с болезнью Альцгеймера испытывают нарушения сна (Bliwise et al., 1995; McCurry et al., 1999; Moran et al., 2005), что приводит к снижению сна с медленным движением глаз (NREM). и медленная волновая активность (SWA), ритм мозга, преобладающий во время медленного сна (Prinz et al., 1982). Эти нарушения включают увеличение количества и частоты бодрствования в ночное время, а также дневного сна (Vitiello and Prinz, 1989; McCurry et al., 1999). Нарушения сна проявляются рано, поскольку люди с легкими когнитивными нарушениями (MCI), доклинической стадией БА, страдают от нарушений сна (Vitiello and Prinz, 1989; Westerberg et al., 2012). Точно так же люди с обнаруживаемым бета-амилоидом, но когнитивно здоровые, также страдают нарушениями сна, определяемыми как более низкое качество сна и увеличение количества дневных дремот (Ju et al., 2013). Таким образом, нарушения сна и памяти проявляются на ранней стадии прогрессирования заболевания, до появления симптомов.
Сон опосредует несколько форм консолидации памяти (Diekelmann, Born, 2010; Born and Wilhelm, 2012; Rasch and Born, 2013). Нарушения сна коррелируют с ухудшением функции памяти и когнитивным снижением у пациентов с БА и MCI (Moe et al., 1995; Brzecka et al., 2018). Повышенное бодрствование в ночное время и уменьшение медленного сна (SWS), в котором преобладает SWA, были связаны с нарушением памяти и когнитивных функций (Moe et al., 1995). NREM, в частности SWS, играет важную роль в декларативной консолидации памяти (Walker, 2009; Lu and Göder, 2012). Этот обзор предоставит обзор сбоев SWA в AD. Он также суммирует доказательства причинной связи между патологией AD, Aβ / tau и зависимыми от сна дефицитами консолидации памяти, которые вызваны нарушениями SWA у пациентов с AD и моделей AD на животных. Кроме того, мы предложим возможные механизмы, лежащие в основе сбоев SWA.Наконец, мы обсудим терапевтические стратегии нацеливания на SWS при БА, направленные на замедление прогрессирования заболевания и восстановление зависимой от сна консолидации памяти. Этот обзор сосредоточен на SWA, наиболее заметной неокортикальной активности с повышенной плотностью мощности в диапазоне частот 0,5–4,0 Гц, возникающей во время медленного сна. Он не будет охватывать другие ритмы, связанные с медленным сном, такие как таламо-кортикальные веретена сна или рябь гиппокампа, а также не будет обсуждать нарушения быстрого сна при БА, которые были рассмотрены или описаны в других источниках (Christos, 1993; Rauchs et al., 2008; Pase et al., 2017).
SWA и консолидация памяти, зависящая от сна
Сон состоит из быстрого движения глаз (REM) и NREM-сна. Быстрый сон характеризуется десинхронизированной активностью ЭЭГ с более быстрыми колебаниями и более низкими формами волн напряжения (Carskadon and Dement, 2011). NREM-сон человека подразделяется на стадии N1 – N3 (ранее стадии 1–4) и определяется активностью электроэнцефалограммы (ЭЭГ) в виде синхронных сигналов, включая сонные веретена (12–14 Гц), К-комплексы на стадии 2, а также медленная (<1 Гц) и дельта (1–4 Гц) активность на стадии 3 (Iber et al., 2007). Медленные и дельта-колебания или изолированные медленные волны обычно называют SWA (Тимофеев и др., 2020). Стадия N3, также называемая дельта-сном или SWS, характеризуется высоким уровнем SWA (Carskadon and Dement, 2011).
Медленные колебания — основной ритм глубокого сна. Во время медленных колебаний возбуждающие и тормозящие нейроны неокортекса всех слоев (неизвестны для слоя 1) у анестезированных (Steriade et al., 1993a, b, c) и спящих животных (Timofeev et al., 2000b, 2001; Steriade et al., 2001; Chauvette et al., 2010) колеблются между деполяризованным (активным или UP) и гиперполяризованным (молчащим или DOWN) состояниями. Несмотря на вовлечение всей таламокортикальной системы (Steriade et al., 1993a; Contreras, Steriade, 1995; Sheroziya, Timofeev, 2014), медленные колебания возникают в неокортексе, что может быть зарегистрировано в неокортикальных срезах (Sanchez-Vives and McCormick, 2000; Sanchez-Vives et al., 2010), культуры корковых клеток (Sun et al., 2010; Hinard et al., 2012) и изолированные кортикальные пластины поддерживали in vivo (Timofeev et al., 2000а; Lemieux et al., 2014). В таламусе декартифицированных животных медленные колебания отсутствуют (Тимофеев, Стериаде, 1996). Безмолвные (гиперполяризованные или ВНИЗ) состояния медленных колебаний — это периоды дисфункции, то есть отсутствия синаптической активности. Токи утечки в первую очередь опосредуют безмолвные состояния (Тимофеев и др., 1996, 2001). Активные (деполяризованные или открытые) состояния опосредуются шквалом возбуждающей и тормозной синаптической активности на уровне сомы (Steriade et al., 2001; Timofeev et al., 2001; Rudolph et al., 2007) и основные активности Ca 2+ в дендритах (Milojkovic et al., 2007; Seibt et al., 2017). Неокортекс генерирует медленные колебания, в то время как таламус способствует их поддержанию, поскольку инактивация таламуса временно изменяет корковый SWA (David et al., 2013; Lemieux et al., 2014).
Чтобы контролировать медленные колебания, важно понимать основные клеточные события, происходящие во время SWA. Возбуждение нейронов и, следовательно, синаптическая активность в локальных корковых сетях практически отсутствует в состоянии молчания.Предлагаются два основных механизма возникновения активного состояния. (i) Молчащее состояние частично опосредуется Ca 2+ — и Na + -зависимыми токами K + . Уменьшение этих токов приводит к наступлению нового активного состояния (Sanchez-Vives and McCormick, 2000). (ii) Безмолвные состояния характеризуются отсутствием синаптической активности, но спайк-независимый выброс нейротрансмиттера (миниатюрные постсинаптические потенциалы, minis) все еще присутствует. Совместное появление мини в крупных нейронах, которые обладают большим количеством постсинаптических сайтов, может привести к значительной деполяризации и инициированию спайков, которые приведут всю сеть в активное состояние (Тимофеев и др., 2000а; Баженов и др., 2002; Chauvette et al., 2010). Поскольку это случайный процесс, он может начаться в любой клетке, но чаще он начинается в более крупных нейронах, как правило, в больших пирамидных клетках коркового слоя 5 у экспериментальных животных (Chauvette et al., 2010; Fiáth et al., 2016). Однако у человека медленные активные состояния чаще начинаются в слое 3 (Cash et al., 2009; Csercsa et al., 2010). Это различие может быть вызвано двумя причинами: (а) пирамидные клетки человека из слоя 3 очень большие (Mohan et al., 2015), и, следовательно, они хорошо подходят для суммирования миниатюр и запуска активных состояний; и (b) усиленная электрическая компартментализация в пирамидных нейронах слоя 5 у людей не позволяет дендритным деполяризующим событиям достигать сомы даже при наличии дендритных шипов (Beaulieu-Laroche et al., 2018), тем самым снижая общее влияние клеток слоя 5. в работе сети. Локальное происхождение активных состояний и плотные синаптические взаимодействия в коре головного мозга запускают распространение медленных волн через корковую мантию (Massimini et al., 2004; Волгушев и др., 2006; Шерозия, Тимофеев, 2014). Активные состояния опосредуются взаимодействием возбуждающей и тормозной проводимости (Haider et al., 2006; Haider, McCormick, 2009; Chen et al., 2012) с общим более сильным торможением на уровне сомы (Rudolph et al., 2007; Haider и др., 2013). Прекращение активных состояний и переход в молчащие состояния происходит за счет нескольких факторов: (i) активации Na + — и Ca 2+ -зависимых калиевых токов (Sanchez-Vives and McCormick, 2000), (ii) синаптических депрессия (Тимофеев и др., 2000b) и (iii) синхронное активное тормозное влечение (Steriade et al., 1993b; Lemieux et al., 2015). Поскольку активные состояния завершаются почти одновременно на больших корковых территориях (Волгушев и др., 2006; Шерозия, Тимофеев, 2014), внутренняя активация тока или синаптическая депрессия, вероятно, не играют ведущей роли, поскольку они специфичны для клеток. Таким образом, мы предполагаем, что активные тормозные механизмы завершают активные состояния и обеспечивают синхронное начало молчания в масштабах всей сети.Во-первых, соматостатин-положительные ГАМКергические интернейроны повышают активность до наступления молчащих состояний (Funk et al., 2017; Niethard et al., 2018). Большинство этих интернейронов имеют короткие аксоны, поэтому внешний триггер, возможно, из таламуса, синхронизирует их. Действительно, инактивация таламуса отменяет синхронное начало молчаливых состояний (Lemieux et al., 2015). Кроме того, некоторые таламокортикальные нейроны активируются во время молчания, управляя парвальбумин-положительными интернейронами (Zucca et al., 2019). Другим потенциальным источником является клауструм, структура, которая имеет широко распространенные корковые проекции и, если активирована оптогенетически, вызывает состояния коркового опускания (Narikiyo et al., 2018). Похоже, что клауструм хорошо расположен, чтобы одновременно управлять корковыми интернейронами в разных областях непосредственно перед началом молчания.
Медленные колебания сна играют важную роль в пластичности коры. Однако направление этих пластических изменений все еще обсуждается. Подгруппа исследований, основанная в основном на косвенных измерениях, предполагает, что корковые синаптические связи усиливаются во время бодрствования и ослабляются во время сна (Tononi and Cirelli, 2003, 2014).Другие исследования демонстрируют, что медленные колебания и общий сон усиливают эффективность корковых синапсов (Aton et al., 2009; Chauvette et al., 2012; Seibt et al., 2012; Yang et al., 2014; Jasinska et al., 2015; Тимофеев, Шоветт, 2017). Наконец, в этой дискуссии делается попытка прийти к соглашению, в котором предполагается, что одни синапсы активируются, а другие подавляются во сне (Seibt and Frank, 2019).
Независимо от синаптических механизмов, медленные колебания играют важную роль в зависящей от сна декларативной консолидации памяти (Steriade, Timofeev, 2003; Marshall et al., 2006; Уокер, 2009; Лу и Гёдер, 2012). Борн и его коллеги предложили модель декларативной консолидации памяти, связанной с гиппокампом, во время SWS. Корковые медленные колебания вызывают реактивацию кратковременных воспоминаний гиппокампа, синхронизируя резкую волновую рябь гиппокампа с активностью веретена в таламусе во время медленных колебаний UP состояний. Таким образом, этот механизм способствует долгосрочным изменениям синаптической пластичности в неокортикальных сетях и поддерживает консолидацию долговременной памяти в неокортексе (Diekelmann and Born, 2010; Rasch and Born, 2013).SWS снижается с возрастом, особенно после 30 лет (Van Cauter et al., 2000). Связанное с возрастом снижение SWS коррелировало с нарушением консолидации памяти, связанной со сном (Backhaus et al., 2007). Кроме того, у пациентов с бессонницей с меньшим SWS наблюдалось снижение декларативной консолидации памяти за ночь по сравнению с контрольной группой того же возраста (Backhaus et al., 2006). Повышение SWA способствовало зависимой от сна консолидации памяти (Marshall et al., 2006). Таким образом, SWA, в частности медленные колебания, необходим и достаточен для консолидации памяти во время сна, и мы предполагаем, что сбои SWA могут способствовать ухудшению памяти при AD.
Нарушения SWA у пациентов с БА
Считается, что токсичный Aβинициирует патологические события и стимулирует образование патологических агрегатов тау-белка, которые в конечном итоге приводят к потере синапсов и гибели клеток (Hardy and Higgins, 1992; Selkoe and Hardy, 2016; Henstridge et al., 2019), что, в свою очередь, нарушает нейронную схему. Уровни Aβ коррелируют с нарушениями сна у когнитивно нормальных людей с доклинической БА (Ju et al., 2013; Spira et al., 2013). Сообщалось о нарушениях нейрональной активности, включая сбои медленных колебаний, у пожилых людей (Mander et al., 2013, 2015; Lucey et al., 2019). Отложения Aβ и тау были связаны со снижением NREM SWA у когнитивно нормальных пожилых людей и на ранних стадиях БА (Mander et al., 2015; Lucey et al., 2019). Снижение медленных колебаний NREM (0,6–1 Гц) было связано с повышенным накоплением Aβ в медиальной префронтальной коре (Mander et al., 2015). Кроме того, более высокое осаждение тау коррелировало со снижением дельта-мощности (1–4 Гц) (Lucey et al., 2019). Эти данные убедительно подтверждают связь между нарушениями SWA и патологией AD (Рисунок 1).Помимо нарушений SWA у бессимптомных когнитивно нормальных взрослых, SWA снижалась у лиц с MCI (Westerberg et al., 2012). Нарушения сна у когнитивно нормальных пожилых людей могут предсказывать бремя Aβ и накопление тау в более позднем возрасте (Winer et al., 2019). Принимая во внимание все вышесказанное, мы предполагаем, что нарушения цикла сна-бодрствования, особенно снижение NREM SWA, могут служить потенциальным ранним биомаркером БА.
Рис. 1. Схематическое изображение причинно-следственной связи между NREM SWS, консолидацией памяти и патологией AD.Низкий NREM SWS приводит к снижению SWA и периваскулярному клиренсу растворимого Aβ и связан с нарушением консолидации памяти. Кроме того, низкий SWA связан с повышенной агрегацией Aβ / тау у пациентов с БА. Способы восстановления NREM SWA предлагаются для животных моделей и пациентов с болезнью Альцгеймера, где они могут привести к многообещающей терапевтической стратегии для AD. Сокращения: NREM SWS, медленный сон с медленными движениями глаз; SWA, медленноволновая активность; Aβ, бета-амилоид; AD, болезнь Альцгеймера; tDCS, транскраниальная стимуляция постоянным током; ТМС, транскраниальная магнитная стимуляция.
Аберрации SWA коррелировали с нарушенной консолидацией памяти у пациентов с MCI (Westerberg et al., 2012) и пожилых людей (Mander et al., 2015). Следовательно, естественно, что нарушения медленных колебаний у людей с ранним БА могут способствовать и ускорять прогрессирующее ухудшение памяти и когнитивных функций. В свою очередь, патология AD может еще больше нарушить зависимую от сна активность ритма мозга, что еще больше усугубит AD (Рисунок 1).
Гипотеза глифатической системы, хотя до сих пор обсуждается (Abbott et al., 2018), говорится, что растворимый Aβ выводится по периваскулярным путям, в том числе через глимфатическую систему (Iliff et al., 2012). SWS увеличивает клиренс Aβ по сравнению с состоянием бодрствования (Xie et al., 2013). Интересно, что у людей уровни растворимого Aβ колеблются в зависимости от цикла сна и бодрствования. Уровни Aβ повышались во время бодрствования и снижались во время сна (Kang et al., 2009; Lucey et al., 2017), что позволяет предположить, что сон облегчает клиренс Aβ. Таким образом, накапливаются доказательства взаимосвязи между Aβ, сном и нарушениями активности нейронов (Рисунок 1).
SWA Нарушения в моделях мышей AD
Мышиные модели AD предоставляют мощные средства для изучения сбоев SWA. Модели амилоидоза повторяют продукцию Aβ, отложение амилоидных бляшек и связанную с ними невропатологию, наблюдаемую у пациентов с болезнью Альцгеймера. Модели тауопатии имитируют продукцию тау, внутриклеточные клубки тау и связанную с ними невропатологию. Более того, медленные нарушения колебаний воспроизводились в мышиных моделях амилоидоза и таупатии (Holth et al., 2017; Kastanenka et al., 2017; Castano-Prat et al., 2019). Визуализация в широком поле с использованием красителей, чувствительных к напряжению (VSD) и генетически кодированных репортеров, в дополнение к традиционным методам, таким как электрофизиология, позволила контролировать SWA у мышей. Подобно таковым у людей (Massimini et al., 2004), медленные колебания распространяются по коре головного мозга мышей в виде бегущих волн между двумя полушариями (Mohajerani et al., 2010). Мы использовали модель амилоидоза у трансгенных мышей (мыши APPswe / PS1dE9; мыши APP), чтобы показать, что мощность медленных волн коры головного мозга, но не частота, снижалась у молодых (Kastanenka et al., 2017) и старых мышей (Кастаненка и др., 2019). Мыши APP проводили меньше времени в NREM-сне (Roh et al., 2012). У мышей Tg2576 наблюдалось снижение SWA; а их спектральная плотность мощности была смещена в сторону более высоких частот (Kent et al., 2018). Что касается моделей таупатии, трансгенные мыши P301S человека с тау-белком демонстрировали нарушения цикла сна-бодрствования, снижение NREM-сна и повышенное бодрствование. Более того, их SWA значительно снижалась во время медленного сна (Holth et al., 2017). Кроме того, модель трансгенных мышей 3xTg-AD, у которой развиваются патологии бляшек и клубков, демонстрирует медленные волны с более низкой частотой и пониженную частоту возбуждения (Castano-Prat et al., 2019). Таким образом, эти модели на животных воспроизводили нарушения SWA, наблюдаемые у пациентов с болезнью Альцгеймера (Lucey et al., 2019). Следует отметить, что модели на животных не отражают все аспекты состояния человека. У мышей более примитивная кора головного мозга, и поэтому медленные колебания, присутствующие у мышей, не так сложны, как у людей. Во время старения сон мышей претерпевает изменения, иногда не похожие на таковые у людей. Например, у старых мышей SWS меньше, чем у молодых мышей. Мощность медленных волн у стареющих мышей увеличивается при измерении в лобной коре, в то время как мощность медленных волн у стареющих взрослых людей снижается.С другой стороны, стареющие мыши также имеют сходство со стареющими людьми. Например, у старых мышей наблюдается увеличение фрагментации сна, увеличение продолжительности сна во время активной фазы цикла сна-бодрствования (светлый для людей, темный для мышей) и уменьшение быстрого сна в конце спокойной фазы цикла сна-бодрствования (Soltani и др., 2019). Таким образом, при моделировании условий жизни человека следует с осторожностью использовать модели мышей. Несмотря на эти ограничения, мышиные модели успешно использовались для мониторинга и модуляции активности определенных нейрональных и ненейрональных популяций, которые вносят вклад в нарушения медленных волн (см. Ниже).Выявление механизмов нейронных цепей, лежащих в основе нарушений SWA, может привести к открытию новых терапевтических стратегий.
Механизмы, лежащие в основе нарушений SWA в
нашей эрыНаблюдения в ходе исследований на людях показали, что нарушенная SWA способствовала нарушению консолидации памяти у пациентов с БА. Однако механизмы, лежащие в основе сбоев SWA, остаются в значительной степени неизвестными. Пептиды Aβ нацелены на синапсы и нарушают возбуждающую и тормозную нейротрансмиссию, что приводит к дисфункции нейронной сети (Selkoe, 2019).Это указывает на то, что аномалии SWA у пациентов с aMCI и AD могут быть связаны с дисфункцией нейронной сети, возникающей в результате гипер- и гипоактивности нейронов. Исследования на животных с использованием многофотонной микроскопии выявили дефицит тормозного тонуса как один из возможных механизмов нарушения SWA (Busche et al., 2008; Kastanenka et al., 2017). Дефицит синаптического торможения приводит к гиперактивности нейронов (Busche et al., 2008) и вызывает десинхронизацию активности цепи в возбуждающих нейронах коры (Kastanenka et al., 2017). Более 20% нейронов коркового слоя 2/3 проявляли гиперактивность вокруг бляшек Aβ. Эта гиперактивность снижалась, когда гиперактивные нейроны обрабатывались диазепамом, агонистом гамма-аминомасляной кислоты A (GABA A ) (Busche et al., 2008), в то время как медленные колебания устранялись путем местного нанесения ГАМК непосредственно на соматосенсорную кору (Кастаненка). и др., 2017). В дополнение к низким уровням ГАМК, экспрессия рецепторов GABA A и GABA B была подавлена у мышей APP (Kastanenka et al., 2017). Интересно, что применение ингибиторов GABA A или GABA B нарушало медленные колебания у здоровых животных дикого типа, имитируя медленные колебания у мышей APP (Kastanenka et al., 2017). Как мы указывали ранее, ГАМКергические нейроны играют критическую роль в возникновении молчания коры головного мозга, основного элемента SWA. Местное применение агониста рецептора GABA A спасало медленные волны и зависимую от сна консолидацию памяти у трансгенных мышей (Busche et al., 2015). Таким образом, мыши APP проявляют гипер- и гипоактивность коры из-за дефицита ингибирующих элементов цепи, в частности рецепторов GABA, GABA A и GABA B , активность которых необходима и достаточна для нормального SWA.
Болезнь Альцгеймера — действительно прогрессирующее заболевание. Дефицит тормозных элементов цепи сменялся дефицитом возбуждающих (Кастаненко и др., 2019). Уровни белка глутамата возбуждающего нейротрансмиттера коры головного мозга исследовали на мышах APP.Уровни глутамата были сопоставимы у APP и однопометников дикого типа в возрасте 7 месяцев (Kastanenka et al., 2017). Однако к 9 месяцам у мышей APP начался дефицит глутамата (Kastanenka et al., 2019). Эти данные показывают, что нарушения синаптического торможения с последующим дефицитом синаптического возбуждения в нейрональных цепях могут быть связаны с нарушениями медленных колебаний при AD. Кроме того, введение антагонистов рецептора глутамата уменьшало гиперактивность у мышей APP (Busche et al., 2008). Взятые вместе, дефицит торможения с последующим дефицитом возбуждения в цепях медленных волн, скорее всего, способствовал нарушению медленных колебаний на ранней стадии прогрессирования заболевания и нарушению формирования памяти, зависящей от сна.
Помимо тормозных и возбуждающих нейронов, кортико-таламические цепи полагаются на астроциты для поддержания их нормальной функции (Araque et al., 1999; Poskanzer and Yuste, 2011, 2016). Астроциты — это глиальные клетки, которые поддерживают рециркуляцию глутамата и ГАМК посредством циклов глутамата / ГАМК-глутамина.Астроциты образуют трехчастные синапсы с пре- и постсинаптическими нейрональными компартментами, чтобы регулировать синаптическую передачу посредством передачи сигналов кальция астроцитам (Araque et al., 1999; Newman, 2003). До недавнего времени вклад астроцитов в нормальную функцию контура недооценивался (Clarke and Barres, 2013; Kastanenka et al., 2020). Отложения амилоида нарушили топологию астроцитов (Galea et al., 2015), и динамика кальция астроцитов была изменена у мышей APP (Kuchibhotla et al., 2009). Кроме того, сообщалось о повышении концентрации кальция в состоянии покоя в астроцитах мышей APP (Kuchibhotla et al., 2009). Таким образом, аберрантная астроцитарная активность может способствовать нарушению SWA при AD. Более того, уровни экспрессии белков переносчиков глутамата GLAST и GLT-1, которые локализуются специфически на плазматической мембране астроцитов, были снижены в коре и гиппокампе в мышиной модели AD (Schallier et al., 2011). Об изменениях астроцитарных элементов цепи также сообщалось в мозговой ткани пациентов с БА. Экспрессия астроцитарной глутамин синтетазы снижалась в непосредственной близости от бляшек Aβ в головном мозге при БА (Robinson, 2000).Интересно, что аберрантная экспрессия глутамин синтетазы была обнаружена в субпопуляции пирамидных нейронов у индивидуумов с БА (Робинсон, 2000), что позволяет предположить, что цикл глутамат-глутамин был нарушен. Нарушения астроцитарной активности могут способствовать аберрантному возбуждению нейронов и приводить к нарушению нейронных сетей, нарушая таким образом SWA. Действительно, астроциты участвовали в запуске медленных колебаний UP состояний in vitro (Poskanzer and Yuste, 2011) и in vivo (Poskanzer and Yuste, 2016; Szabó et al., 2017). Посканцер и Юсте (2016) визуализировали переходные процессы внутриклеточного кальция и продемонстрировали, что астроциты модулируют внеклеточный глутамат, тем самым запуская SWA в мозге мышей. Кроме того, Szabó et al. (2017) показали, что блокирование транзиентов кальция в астроцитах приводит к уменьшению количества астроцитов и нейронов, участвующих в SWA. Эта серия исследований поддерживает идею о том, что астроциты необходимы и играют критическую роль в индукции медленных колебаний UP состояний в корковых цепях.Следовательно, исследования астроцитарной сети с использованием моделей на животных важны для понимания роли астроцитов в дисфункции медленных волн при БА. Наконец, понимание роли астроцитов в нарушениях SWA может указать на новую терапевтическую стратегию для пациентов с болезнью Альцгеймера.
Оптогенетический контроль медленных колебаний в мышиных моделях AD
Оптогенетика — это передовой исследовательский инструмент, который можно использовать для получения ценного понимания причинно-следственной связи между динамикой контуров и прогрессированием болезни Альцгеймера с использованием моделей на животных (Boyden et al., 2005; Ли и др., 2005). Эта методология обеспечивает высокую пространственно-временную точность со специфичностью клеточного типа. Определенные типы клеток могут быть нацелены на in vivo на с использованием промоторов, специфичных для клеточного типа, со светоактивируемыми каналами или протонными насосами (Fenno et al., 2011). Световая активация клеток, экспрессирующих каналы или насосы, может использоваться для управления активностью в интересующих нейронных цепях. Оптогенетика была успешно адаптирована для изучения БА с использованием моделей мышей.
Optogenetics использовали для хронического увеличения нейрональной активности в перфорантном пути гиппокампа у мышей AD.Это усилило гиперактивность в контуре и увеличило уровни Aβ42 в интерстициальной жидкости, а также отложение Aβ в областях проекции (Yamamoto et al., 2015). Оптогенетически опосредованное увеличение нейрональной активности также увеличивает высвобождение и распространение тау у мышей htau (Wu et al., 2016). Эти данные дополнительно подтверждают тот факт, что аберрантная синаптическая активность способствует прогрессированию AD (Cirrito et al., 2005, 2008). Оптогенетика также использовалась, чтобы пролить свет на состояние ритмов мозга при БА.Оптогенетический захват интернейронов в диапазоне гамма-частот восстанавливает гамма-осцилляции и снижает отложение Aβ в модели БА у мышей (Iaccarino et al., 2016). Наша лаборатория сообщила, что световая активация возбуждающих нейронов, экспрессирующих канал родопсин-2 (ChR2) на эндогенной частоте медленных волн, у мышей APP в течение 4 недель устраняла аберрантные медленные колебания за счет восстановления мощности медленных волн. Он также восстанавливал уровни рецепторов ГАМК, а также ГАМК А и ГАМК В (Kastanenka et al., 2017). Кроме того, хроническое восстановление SWA останавливает отложение бляшек Aβ и предотвращает повышение внутринейронального уровня кальция (определяемое как перегрузка кальцием) (Kastanenka et al., 2017). В качестве альтернативы, возбуждение медленных волн с вдвое большей эндогенной частотой с использованием оптогенетики увеличивало производство Aβ, увеличивало перегрузку нейронов кальцием и уменьшало плотность синаптического шипа (Kastanenka et al., 2019). Оптогенетическое восстановление активности контура замедляло прогрессирование патологии в мышиных моделях БА, в то время как оптогенетическое увеличение частоты медленных волн ускоряло прогрессирующую патофизиологию и приводило к отказу нейронной сети.
Точно так же модуляция волновой активности мозга восстанавливала дефицит памяти в экспериментальных моделях с использованием оптогенетики. Синхронизация SWA в соматосенсорной и моторной коре головного мозга с помощью оптогенетики смогла восстановить нарушение перцепционной памяти и продлить сохранение памяти у лишенных сна мышей (Miyamoto et al., 2016). Кроме того, восстановление колебаний гиппокампа с помощью оптогенетики привело к улучшению памяти распознавания у мышей APP (Giovannetti et al., 2018). Кроме того, оптогенетическая активация клеток энграммы памяти в гиппокампе увеличивала плотность шипов в клетках энграммы и восстанавливала долговременную память (Roy et al., 2016). Кроме того, спасение гамма-колебаний с использованием оптогенетики улучшило пространственную память в модели мыши с AD (Etter et al., 2019). Восстановление колебаний мозга с помощью оптогенетических подходов на моделях мышей дает представление о новых терапевтических подходах к лечению и / или профилактике БА в целом. Исследования на животных показывают, что восстановление колебательной активности мозга, включая SWA, может быть эффективной терапевтической стратегией для уменьшения дефицита памяти у пациентов с БА.
Восстановление медленного сна — многообещающий метод лечения
нашей эрыВ настоящее время не существует эффективных методов лечения, способных замедлить прогрессирование AD и облегчить когнитивные нарушения и нарушения памяти у пациентов.Большинство клинических терапевтических подходов сосредоточено на очистке от Aβ и тау-белка моноклональными антителами с использованием пассивной иммунотерапии (van Dyck, 2018). Световая терапия в клинике дала неоднозначные результаты (Dowling et al., 2005, 2008; Riemersma-van der Lek et al., 2008). Однако большое количество неудач клинических испытаний подчеркивает необходимость определения новых терапевтических стратегий для лечения БА.
Восстановление SWA во время NREM-сна у пациентов с болезнью Альцгеймера может замедлить прогрессирование болезни и спасти зависимую от сна консолидацию памяти.Транскраниальная стимуляция постоянным током (tDCS) и транскраниальная магнитная стимуляция (TMS) — это два неинвазивных метода стимуляции мозга, которые потенциально могут быть использованы для этого. Недавно tDCS была применена к людям с MCI во время дневного сна для исследования паттернов SWA и консолидации памяти в зависимости от сна. Как мощность медленных колебаний, так и производительность памяти были улучшены после стимуляции мозга на частоте медленных колебаний с помощью tDCS (Ladenbauer et al., 2017). Кроме того, повторные применения tDCS вызывали медленные колебания во время SWS и приводили к усиленному сохранению декларативной памяти на следующий день у пожилых людей (Westerberg et al., 2015) и у молодых здоровых взрослых (Marshall et al., 2004, 2006). В аналогичном исследовании TMS использовалась для вызова медленных волн во время медленного сна. TMS увеличивал мощность SWA у здоровых молодых людей (Massimini et al., 2007). В дополнение к методикам tDCS и TMS, медленные колебания можно усилить с помощью слуховой стимуляции (Ngo et al., 2013; Leminen et al., 2017; Papalambros et al., 2017; Ong et al., 2018). Применяемые слуховые тоны, которые были синхронизированы по фазе с состояниями медленных колебаний во время сна, способствовали консолидации декларативной памяти у здоровых молодых людей (Ngo et al., 2013; Leminen et al., 2017) и у пожилых людей (Papalambros et al., 2017). Кроме того, акустическая стимуляция с синхронизацией по фазе также улучшает кодирование памяти во время сна у здоровых молодых людей (Ong et al., 2018). Другая стратегия сенсорной стимуляции — визуальная стимуляция — может быть использована для индукции SWA (Riedner et al., 2011). Используя записи ЭЭГ с высокой плотностью записи у здоровых молодых людей во время медленного сна, SWA была успешно вызвана визуальными стимулами (Riedner et al., 2011). Таким образом, tDCS, TMS, акустическая и визуальная стимуляция потенциально могут быть использованы для усиления зависимой от сна консолидации памяти у здоровых субъектов и пациентов с БА на ранних стадиях заболевания.
Нацеливание на определенные элементы нейронной цепи ГАМК может быть особенно привлекательным при разработке новых методов лечения БА. В то время как восстановление активности интернейронов парвальбумина резко восстанавливает гамма-осцилляции (Iaccarino et al., 2016) и предотвращает потерю памяти, а также повышенную возбудимость сети (Hijazi et al., 2019), активация нейрональной синтазы оксида азота (nNOS) или нейронов соматостатина может пригодится для восстановления SWA. Недавнее исследование, касающееся хемогенетической активации SST-положительных клеток в коре головного мозга, показало увеличение SWA, повышенный наклон отдельных медленных волн и увеличенную продолжительность NREM-сна по сравнению с контрольными условиями.С другой стороны, хемогенетическое ингибирование этих клеток уменьшало SWA и частоту медленных волн без изменения времени, проведенного в NREM-сне (Funk et al., 2017). Ранее мы продемонстрировали, что нейроны nNOS активируются во время эпизодов NREM-сна, связанных с увеличением SWA (Геращенко и др., 2008). Мы также показали, что оптогенетически вызванные ответы в nNOS-положительных клетках коры головного мозга согласуются с их ролью в физиологии медленноволнового сна (Геращенко и др., 2018). Кроме того, у мышей, лишенных экспрессии nNOS в SST-положительных нейронах, наблюдались значительные нарушения как гомеостатической продукции SWA в низком частотном диапазоне дельта, так и задачи распознавания памяти, которая зависит от кортикального входа (Zielinski et al., 2019). Дальнейшие исследования позволят определить, является ли активация нейронов nNOS / соматостатин в коре головного мозга эффективной для снижения патологии БА и опосредуется ли этот эффект усилением SWA. Наконец, вместо активации эндогенных интернейронов было бы многообещающим исследовать терапевтические стратегии на основе клеток, такие как трансплантация интернейронов, полученных из стволовых клеток человека, для повышения тормозящего тонуса и восстановления SWA.
Обсуждение
Помимо нарушений памяти, пациенты с болезнью Альцгеймера испытывают нарушения в циклах сна и бодрствования из-за увеличения бодрствования в ночное время и снижения NREM SWS.Патология AD коррелирует с нарушениями SWA на ранних стадиях AD. Снижение SWA было обнаружено у бессимптомных когнитивно нормальных взрослых и пациентов с ОМКН. Поскольку нарушение медленных колебаний является ранним событием, оно может быть использовано в качестве раннего биомаркера БА. Следует отметить, что многие обсуждаемые здесь исследования на людях были основаны на небольшом размере выборки с повышенным риском ложноположительных результатов из-за случайных вариаций в небольшом количестве точек данных. Таким образом, необходимы повторения для подтверждения результатов.Тем не менее, нарушения медленных колебаний могут лежать в основе нарушений памяти как части прогрессирования БА, поскольку SWA играет ключевую роль в декларативной консолидации памяти во время сна. Более того, модели БА на животных воспроизводят медленные разрушения и могут быть использованы для механистических исследований. Использование передовых технологий, включая оптогенетику, широкополосную визуализацию и многофотонную микроскопию, в дополнение к традиционным технологиям, включая электрофизиологию, позволило понять механизмы медленных волн при БА.Лучшее понимание взаимосвязи между нарушениями SWA и снижением памяти может пролить свет на механистические пути, лежащие в основе нарушения памяти, связанного с AD. Восстановление SWA представляет собой новую многообещающую терапевтическую мишень для лечения AD. Использование неинвазивных технологий стимуляции мозга и лекарств, которые активируют ингибирующие элементы кортико-таламических цепей, может оказаться эффективными терапевтическими стратегиями. Разработка новых терапевтических вмешательств, направленных на SWA во время NREM-сна на ранней стадии прогрессирования заболевания, может замедлить снижение памяти у пожилых людей и отсрочить начало AD у MCI или у здоровых людей с риском развития AD.
Авторские взносы
YL и KK написали первоначальный черновик рукописи. YL и KK подготовили рисунок. YL, DG, IT, BB и KK просмотрели и отредактировали окончательную рукопись. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Эта работа была поддержана грантом Ассоциации Альцгеймера AARG-18-529336 и NIH RF1AG061774.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим спонсоров программы «Исследования болезни Альцгеймера» фонда BrightFocus.
Ссылки
Эбботт, Н. Дж., Пиццо, М. Э., Престон, Дж. Э., Джанигро, Д., и Торн, Р. Г. (2018). Роль мозговых барьеров в движении жидкости в ЦНС: существует ли «глимфатическая» система? Acta Neuropathol. 135, 387–407. DOI: 10.1007 / s00401-018-1812-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Араке, А., Парпура, В., Санзгири, Р. П., и Хейдон, П. Г. (1999). Трехсторонние синапсы: глия, непризнанный партнер. Trends Neurosci. 22, 208–215. DOI: 10.1016 / S0166-2236 (98) 01349-6
CrossRef Полный текст | Google Scholar
Атон, С. Дж., Зейбт, Дж., Дюмулин, М., Джа, С. К., Стейнмец, Н., Коулман, Т. и др. (2009). Механизмы зависимой от сна консолидации корковой пластичности. Нейрон 61, 454–466. DOI: 10.1016 / j.neuron.2009.01.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Backhaus, J., Борн, Дж., Хокесфельд, Р., Фокул, С., Хохаген, Ф., и Юнгханс, К. (2007). Снижение декларативной консолидации памяти в среднем возрасте коррелирует с уменьшением медленного сна. ЖЖ. Mem. 14, 336–341. DOI: 10.1101 / лм. 470507
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Backhaus, J., Junghanns, K., Born, J., Hohaus, K., Faasch, F., and Hohagen, F. (2006). Нарушение декларативной консолидации памяти во время сна у пациентов с первичной бессонницей: влияние архитектуры сна и ночного выброса кортизола. Biol. Психиатрия 60, 1324–1330. DOI: 10.1016 / j.biopsych.2006.03.051
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баженов М., Тимофеев И., Стериаде М. и Сейновски Т. Дж. (2002). Модель таламокортикальных медленных колебаний сна и переходов в активированные состояния. J. Neurosci. Выключенный. J. Soc. Neurosci. 22, 8691–8704. DOI: 10.1523 / jneurosci.22-19-08691.2002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Больё-Ларош, Л., Толоза, Э. Х. С., Ван дер Гус, М.-С., Лафуркад, М., Барнаджан, Д., Уильямс, З. М. и др. (2018). Повышенная дендритная компартментализация в корковых нейронах человека. Ячейка 175, 643–651. DOI: 10.1016 / j.cell.2018.08.045
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бливайз, Д. Л., Хьюз, М., МакМахон, П. М., и Катнер, Н. (1995). Наблюдение за сном / бодрствованием и степенью деменции в отделении особого ухода за больными болезнью Альцгеймера. J. Gerontol.A. Biol. Sci. Med. Sci. 50, M303 – M306. DOI: 10.1093 / gerona / 50a.6.m303
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бойден, Э.С., Чжан, Ф., Бамберг, Э., Нагель, Г., и Дейссерот, К. (2005). Генетически направленный оптический контроль нейронной активности в миллисекундной шкале времени. Нат. Neurosci. 8, 1263–1268. DOI: 10.1038 / nn1525
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Brzecka, A., Leszek, J., Ashraf, G.М., Эйма, М., Авила-Родригес, М. Ф., Ярла, Н. С. и др. (2018). Расстройства сна, связанные с болезнью Альцгеймера: перспектива. Фронт. Neurosci. 12: 330. DOI: 10.3389 / fnins.2018.00330
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Busche, M.A., Eichhoff, G., Adelsberger, H., Abramowski, D., Wiederhold, K.-H., Haass, C., et al. (2008). Кластеры гиперактивных нейронов возле амилоидных бляшек на мышиной модели болезни Альцгеймера. Science 321, 1686–1689.DOI: 10.1126 / science.1162844
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Busche, M. A., Kekuš, M., Adelsberger, H., Noda, T., Förstl, H., Nelken, I., et al. (2015). Спасение дисфункции дальнего контура в моделях болезни Альцгеймера. Нат. Neurosci. 18, 1623–1630. DOI: 10.1038 / nn.4137
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кэш, С. С., Халгрен, Э., Дехгани, Н., Россетти, А. О., Тесен, Т., Ван, К., и другие. (2009). К-комплекс человека представляет собой изолированное корковое пониженное состояние. Наука 324, 1084–1087. DOI: 10.1126 / science.1169626
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кастано-Прат, П., Перес-Мендес, Л., Перес-Забальса, М., Санфелиу, К., Хименес-Ллорт, Л., и Санчес-Вивес, М. В. (2019). Изменены медленные (<1 Гц) и быстрые (бета и гамма) неокортикальные колебания в мышиной модели болезни Альцгеймера 3xTg-AD под анестезией. Neurobiol.Старение 79, 142–151. DOI: 10.1016 / j.neurobiolaging.2019.02.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шоветт, С., Сеньор, Дж., Тимофеев, И. (2012). Колебания сна в таламокортикальной системе вызывают долговременную пластичность нейронов. Нейрон 75: 1105. DOI: 10.1016 / j.neuron.2012.08.034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шоветт, С., Волгушев, М., Тимофеев, И. (2010). Возникновение активных состояний в локальных неокортикальных сетях при медленных колебаниях сна. Cereb. Cortex 20, 2660–2674. DOI: 10.1093 / cercor / bhq009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, Ж.-Й., Шоветт, С., Скорхейм, С., Тимофеев, И., Баженов, М. (2012). Ингибирование, опосредованное интернейроном, синхронизирует активность нейронов во время медленных колебаний. J. Physiol. 590, 3987–4010. DOI: 10.1113 / jphysiol.2012.227462
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Христос, Г. А. (1993).Связана ли болезнь Альцгеймера с дефицитом или нарушением режима быстрого сна? Med. Гипотезы 41, 435–439. DOI: 10.1016 / 0306-9877 (93)
-6CrossRef Полный текст | Google Scholar
Чиррито, Дж. Р., Кан, Дж. Э., Ли, Дж., Стюарт, Ф. Р., Верджес, Д. К., Сильверио, Л. М. и др. (2008). Эндоцитоз необходим для высвобождения бета-амилоида in vivo, зависящего от синаптической активности. Нейрон 58, 42–51. DOI: 10.1016 / j.neuron.2008.02.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чиррито, Дж.Р., Ямада, К. А., Финн, М. Б., Словитер, Р. С., Бейлс, К. Р., Мэй, П. С. и др. (2005). Синаптическая активность регулирует уровни бета-амилоида в интерстициальной жидкости in vivo. Нейрон 48, 913–922. DOI: 10.1016 / j.neuron.2005.10.028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Контрерас Д. и Стериаде М. (1995). Клеточная основа медленных ритмов ЭЭГ: исследование динамических кортикоталамических отношений. J. Neurosci. 15, 604–622. DOI: 10.1523 / jneurosci.15-01-00604.1995
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Csercsa, R., Dombovári, B., Fabó, D., Wittner, L., Eross, L., Entz, L., et al. (2010). Ламинарный анализ медленноволновой активности человека. Brain J. Neurol. 133, 2814–2829. DOI: 10.1093 / мозг / awq169
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каммингс, Дж. Л., Тонг, Г., и Баллард, К. (2019). Комбинации лечения болезни Альцгеймера: текущие и будущие варианты фармакотерапии. J. Alzheimers Dis. 67, 779–794. DOI: 10.3233 / JAD-180766
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дэвид Ф., Шмидт Дж. Т., Тейлор Х. Л., Орбан Г., Ди Джованни Г., Убеле В. Н. и др. (2013). Существенный вклад таламуса в медленные волны естественного сна. J. Neurosci. Выключенный. J. Soc. Neurosci. 33, 19599–196 10. DOI: 10.1523 / JNEUROSCI.3169-13.2013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ДеКоски, С.Т. и Шефф С. В. (1990). Потеря синапсов при биопсии лобной коры при болезни Альцгеймера: корреляция с когнитивной тяжестью. Ann. Neurol. 27, 457–464. DOI: 10.1002 / ana.410270502
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Доулинг, Г. А., Берр, Р. Л., Ван Сомерен, Э. Дж. У., Хаббард, Э. М., Люксенберг, Дж. С., Мастик, Дж. И др. (2008). Мелатонин и лечение ярким светом при нарушении покоя и активности у госпитализированных пациентов с болезнью Альцгеймера. J. Am. Гериатр. Soc. 56, 239–246. DOI: 10.1111 / j.1532-5415.2007.01543.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Доулинг, Г. А., Хаббард, Э. М., Мастик, Дж., Люксенберг, Дж. С., Берр, Р. Л. и Ван Сомерен, Э. Дж. У. (2005). Эффект лечения ярким утренним светом на нарушение покоя и активности у госпитализированных пациентов с тяжелой болезнью Альцгеймера. Внутр. Психогериатр. 17, 221–236. DOI: 10,1017 / s1041610205001584
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эттер, Г., Вельдт, С., ван дер Мансо, Ф., Зарринкуб, И., Трило-Доппиа, Э., и Уильямс, С. (2019). Оптогенетическая гамма-стимуляция устраняет нарушения памяти на мышиной модели с болезнью Альцгеймера. Нат. Commun. 10, 1–11. DOI: 10.1038 / s41467-019-13260-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фиат Р., Керекес Б. П., Виттнер Л., Тот, К., Берегсаси П., Хорват Д. и др. (2016). Ламинарный анализ медленноволновой активности в соматосенсорной коре анестезированных крыс. Eur. J. Neurosci. 44, 1935–1951. DOI: 10.1111 / ejn.13274
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Функ, К. М., Пилман, К., Беллези, М., Маршалл, В., Сирелли, К., и Тонони, Г. (2017). Роль соматостатин-положительных корковых интернейронов в генерации медленных волн сна. J. Neurosci. Выключенный. J. Soc. Neurosci. 37, 9132–9148. DOI: 10.1523 / JNEUROSCI.1303-17.2017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Галеа, Э., Моррисон, В., Худри, Э., Арбель-Орнат, М., Бакскаи, Б. Дж., Гомес-Исла, Т. и др. (2015). Топологический анализ мышей APP / PS1 показывает, что астроциты не мигрируют в бляшки амилоида-β. Proc. Natl. Акад. Sci. США 112, 15556–15561. DOI: 10.1073 / pnas.1516779112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Геращенко Д., Шмидт М. А., Зелински М. Р., Мур М. Э., Висор Дж. П. (2018). Зависимость от состояния сна оптогенетически вызванных ответов в нейрональных синтазе оксида азота клетках коры головного мозга. Неврология 379, 189–201. DOI: 10.1016 / j.neuroscience.2018.02.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Геращенко Д., Висор, Дж. П., Бернс, Д., Рех, Р. К., Широмани, П. Дж., Сакураи, Т. и др. (2008). Идентификация популяции спящих нейронов коры головного мозга. Proc. Natl. Акад. Sci. США 105, 10227–10232. DOI: 10.1073 / pnas.0803125105
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джованнетти, Э.A., Poll, S., Justus, D., Kaneko, H., Fuhrmann, F., Steffen, J., et al. (2018). Восстановление памяти путем оптогенетической синхронизации колебаний гиппокампа на мышиной модели с болезнью Альцгеймера. bioRxiv [Препринт], DOI: 10.1101 / 363820
CrossRef Полный текст | Google Scholar
Хайдер Б., Дуке А., Хазенстауб А. Р. и Маккормик Д. А. (2006). Активность неокортикальной сети in vivo создается за счет динамического баланса возбуждения и торможения. Дж.Neurosci. Выключенный. J. Soc. Neurosci. 26, 4535–4545. DOI: 10.1523 / JNEUROSCI.5297-05.2006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хенстридж, К. М., Хайман, Б. Т., и Спирс-Джонс, Т. Л. (2019). Помимо нейронно-клеточных взаимодействий на ранних этапах патогенеза болезни Альцгеймера. Нат. Rev. Neurosci. 20, 94–108. DOI: 10.1038 / s41583-018-0113-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хиджази, С., Хейстек, Т.S., Scheltens, P., Neumann, U., Shimshek, D.R., Mansvelder, H.D., et al. (2019). Раннее восстановление активности интернейронов парвальбумина предотвращает потерю памяти и гипервозбудимость сети на мышиной модели болезни Альцгеймера. Мол. Психиатрия DOI: 10.1038 / s41380-019-0483-4 [Epub перед печатью].
CrossRef Полный текст | PubMed Аннотация | Google Scholar
Hinard, V., Mikhail, C., Pradervand, S., Curie, T., Houtkooper, R.H., Auwerx, J., et al. (2012). Ключевые электрофизиологические, молекулярные и метаболические признаки сна и бодрствования, выявленные в первичных корковых культурах. J. Neurosci. Выключенный. J. Soc. Neurosci. 32, 12506–12517. DOI: 10.1523 / JNEUROSCI.2306-12.2012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Холт, Дж. К., Махан, Т. Э., Робинсон, Г. О., Роча, А., и Хольцман, Д. М. (2017). Изменен сон и мощность ЭЭГ в модели трансгенных мышей P301S Tau. Ann. Clin. Пер. Neurol. 4, 180–190. DOI: 10.1002 / acn3.390
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Яккарино, Х.Ф., Сингер А. С., Марторелл А. Дж., Руденко А., Гао Ф., Гиллингем Т. З. и др. (2016). Гамма-частота ослабляет амилоидную нагрузку и изменяет микроглию. Природа 540, 230–235. DOI: 10.1038 / природа20587
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ибер К., Анколи-Исраэль С., Чессон А. Л. и Куан С. Ф. (2007). Руководство AASM по оценке сна и связанных с ним событий: правила, терминология и технические спецификации. Вестчестер, Иллинойс: Американская академия медицины сна.
Google Scholar
Илифф, Дж. Дж., Ван, М., Ляо, Ю., Плог, Б. А., Пэн, В., Гундерсен, Г. А., и др. (2012). Параваскулярный путь способствует прохождению спинномозговой жидкости через паренхиму головного мозга и удалению интерстициальных растворенных веществ, включая амилоид β. Sci. Пер. Med. 4: 147ra111. DOI: 10.1126 / scitranslmed.3003748
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ясинская, М., Grzegorczyk, A., Woznicka, O., Jasek, E., Kossut, M., Barbacka-Surowiak, G., et al. (2015). Циркадная ритмичность синапсов соматосенсорной коры мышей. Eur. J. Neurosci. 42, 2585–2594. DOI: 10.1111 / ejn.13045
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ju, Y.-E. S., McLeland, J.S., Toedebusch, C.D., Xiong, C., Fagan, A.M., Duntley, S.P., et al. (2013). Качество сна и доклиническая болезнь Альцгеймера. JAMA Neurol. 70, 587–593.DOI: 10.1001 / jamaneurol.2013.2334
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Канг, Дж. Э., Лим, М. М., Бейтман, Р. Дж., Ли, Дж. Дж., Смит, Л. П., Чиррито, Дж. Р. и др. (2009). Динамика бета-амилоида регулируется орексином и циклом сна-бодрствования. Наука 326, 1005–1007. DOI: 10.1126 / science.1180962
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кастаненка, К.В., Кальво-Родригес, М., Хоу, С.С., Чжоу, Х., Такеда, С., Arbel-Ornath, M., et al. (2019). Частотно-зависимое обострение нейропатофизиологии болезни Альцгеймера. Sci. Реп. 9: 8964. DOI: 10.1038 / s41598-019-44964-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кастаненко, К. В., Хоу, С. С., Шакердж, Н., Логан, Р., Вегманн, С., Чопра, В., и др. (2017). Оптогенетическое восстановление нарушенных медленных колебаний останавливает отложение амилоида и восстанавливает гомеостаз кальция в животной модели болезни Альцгеймера. PLoS One 12: e0170275. DOI: 10.1371 / journal.pone.0170275
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кастаненка, К. В., Морено-Ботэ, Р., Питта, М. Д., Переа, Г., Эрасо-Пичот, А., Масграу, Р. и др. (2020). Дорожная карта по интеграции астроцитов в нейробиологические системы. Glia 68, 5–26. DOI: 10.1002 / glia.23632
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кент, Б.А., Стритматтер, С.М., и Найгаард, Х.Б. (2018). Спектральный анализ сна и мощности ЭЭГ на трех моделях трансгенных мышей с болезнью Альцгеймера: APP / PS1, 3xTgAD и Tg2576. J. Alzheimers Dis. JAD 64, 1325–1336. DOI: 10.3233 / JAD-180260
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кучибхотла, К. В., Латтаруло, К. Р., Хайман, Б. Т., и Бакскаи, Б. Дж. (2009). Синхронная гиперактивность и межклеточные волны кальция в астроцитах мышей с болезнью Альцгеймера. Наука 323, 1211–1215.DOI: 10.1126 / science.1169096
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ladenbauer, J., Ladenbauer, J., Külzow, N., Boor, R., de Avramova, E., Grittner, U., et al. (2017). Содействие колебаниям сна и их функциональной связи с помощью транскраниальной стимуляции улучшает консолидацию памяти при легких когнитивных нарушениях. J. Neurosci. 37, 7111–7124. DOI: 10.1523 / JNEUROSCI.0260-17.2017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лемье, М., Шоветт, С., Тимофеев, И. (2015). Неокортикальная тормозная активность и дальнодействующие афференты способствуют синхронному наступлению молчаливых состояний неокортикальных медленных колебаний. J. Neurophysiol. 113, 768–779. DOI: 10.1152 / jn.00858.2013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лемье, М., Чен, Ж.-Й., Лонжерс, П., Баженов, М., Тимофеев, И. (2014). Влияние корковой деафферентации на медленные колебания неокортекса. Дж.Neurosci. Выключенный. J. Soc. Neurosci. 34, 5689–5703. DOI: 10.1523 / JNEUROSCI.1156-13.2014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Leminen, M. M., Virkkala, J., Saure, E., Paajanen, T., Zee, P. C., Santostasi, G., et al. (2017). Улучшенная консолидация памяти за счет автоматической звуковой стимуляции во время медленного сна. Сон 40: zsx003. DOI: 10.1093 / сон / zsx003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Х., Gutierrez, D. V., Hanson, M. G., Han, J., Mark, M. D., Chiel, H., et al. (2005). Быстрая неинвазивная активация и ингибирование нейронной и сетевой активности родопсином позвоночных и каналом родопсина зеленых водорослей. Proc. Natl. Акад. Sci. США 102, 17816–17821. DOI: 10.1073 / pnas.050
02PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лу В. и Гёдер Р. (2012). Нарушает ли сон с аномальными небыстрыми движениями глаз декларативную консолидацию памяти? Нарушение таламических функций во сне и обработке памяти. Sleep Med. Rev. 16, 389–394. DOI: 10.1016 / j.smrv.2011.08.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Люси, Б. П., Мавуеньега, К. Г., Паттерсон, Б. В., Эльберт, Д. Л., Овод, В., Кастен, Т. и др. (2017). Связь между кинетикой β-амилоида и суточным режимом β-амилоида в центральной нервной системе. JAMA Neurol. 74, 207–215. DOI: 10.1001 / jamaneurol.2016.4202
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Люси, Б.П., Маккалоу, А., Ландснесс, Э. К., Тёдебуш, К. Д., МакЛеланд, Дж. С., Заза, А. М. и др. (2019). Уменьшение сна с медленным движением глаз связано с патологией тау-белка на ранних стадиях болезни Альцгеймера. Sci. Пер. Med. 11: aau6550. DOI: 10.1126 / scitranslmed.aau6550
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мандер, Б.А., Маркс, С.М., Фогель, Дж. У., Рао, В., Лу, Б., Салетин, Дж. М. и др. (2015). β-амилоид нарушает медленные волны NREM человека и связанную с этим гиппокамп-зависимую консолидацию памяти. Нат. Neurosci. 18, 1051–1057. DOI: 10.1038 / nn.4035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мандер, Б.А., Рао, В., Лу, Б., Салетин, Дж. М., Линдквист, Дж. Р., Анколи-Исраэль, С. и др. (2013). Префронтальная атрофия, нарушение медленных волн NREM и нарушение гиппокампальной памяти при старении. Нат. Neurosci. 16, 357–364. DOI: 10.1038 / nn.3324
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маршалл, Л., Мёлле, М., Хальшмид, М., и Борн, Дж. (2004). Транскраниальная стимуляция постоянным током во время сна улучшает декларативную память. J. Neurosci. 24, 9985–9992. DOI: 10.1523 / JNEUROSCI.2725-04.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Массимини М., Феррарелли Ф., Эссер С. К., Риднер Б. А., Хубер Р., Мерфи М. и др. (2007). Запуск медленных волн сна с помощью транскраниальной магнитной стимуляции. Proc. Natl. Акад. Sci. США 104, 8496–8501.DOI: 10.1073 / pnas.07024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Массимини М., Хубер Р., Феррарелли Ф., Хилл С. и Тонони Г. (2004). Медленное колебание сна в виде бегущей волны. J. Neurosci. Выключенный. J. Soc. Neurosci. 24, 6862–6870. DOI: 10.1523 / JNEUROSCI.1318-04.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маккарри, С. М., Логсдон, Р. Г., Тери, Л., Гиббонс, Л. Е., Кукулл, В. А., Боуэн, Дж.D., et al. (1999). Характеристики нарушения сна у пациентов с болезнью Альцгеймера, проживающих в сообществе. J. Geriatr. Psychiatry Neurol. 12, 53–59. DOI: 10.1177 / 0879
0203
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Милойкович Б.А., Чжоу В.-Л. и Антич С.Д. (2007). Напряжение и кальциевые переходные процессы в базальных дендритах префронтальной коры крыс. J. Physiol. 585: 447. DOI: 10.1113 / jphysiol.2007.142315
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миямото, Д., Hirai, D., Fung, C. C. A., Inutsuka, A., Odagawa, M., Suzuki, T., et al. (2016). Кортикальный ввод сверху вниз во время медленного сна консолидирует перцептивную память. Наука 352, 1315–1318. DOI: 10.1126 / science.aaf0902
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мо, К. Э., Витиелло, М. В., Ларсен, Л. Х. и Принц, П. Н. (1995). Модели сна / бодрствования при болезни Альцгеймера: взаимосвязь с познанием и функцией. J. Sleep Res. 4, 15–20.DOI: 10.1111 / j.1365-2869.1995.tb00145.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мохаджерани М. Х., МакВи Д. А., Фингас М. и Мерфи Т. Х. (2010). Зеркально отраженная двусторонняя медленноволновая корковая активность в локальных цепях, выявленная с помощью быстрой биополушарной визуализации чувствительного к напряжению красителя у анестезированных и бодрствующих мышей. J. Neurosci. 30, 3745–3751. DOI: 10.1523 / JNEUROSCI.6437-09.2010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мохан, Х., Verhoog, M. B., Doreswamy, K. K., Eyal, G., Aardse, R., Lodder, B. N., et al. (2015). Дендритная и аксональная архитектура отдельных пирамидных нейронов в слоях неокортекса взрослого человека. Cereb. Cortex 25, 4839–4853. DOI: 10.1093 / cercor / bhv188
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моран М., Линч К. А., Уолш К., Коэн Р., Коукли Д. и Лоулор Б. А. (2005). Нарушение сна при болезни Альцгеймера легкой и средней степени тяжести. Sleep Med. 6, 347–352. DOI: 10.1016 / j.sleep.2004.12.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нарикио К., Мидзугути Р., Адзима А., Мицуи С., Сиодзаки М., Хаманака Х. и др. (2018). Клауструм координирует корковую медленноволновую активность. Нат. Neurosci. doi: 10.1101 / 286773 [Epub перед печатью],
CrossRef Полный текст | Google Scholar
Ньюман, Э. А. (2003). Новые роли астроцитов: регуляция синаптической передачи. Trends Neurosci. 26, 536–542. DOI: 10.1016 / S0166-2236 (03) 00237-6
CrossRef Полный текст | Google Scholar
Ngo, H.-V. В., Мартинец, Т., Борн, Дж., И Мёлле, М. (2013). Звуковая стимуляция с обратной связью медленных колебаний сна улучшает память. Нейрон 78, 545–553. DOI: 10.1016 / j.neuron.2013.03.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Niethard, N., Ngo, H.-V. В., Эрлих И., Борн Дж. (2018).Активность коркового контура, лежащая в основе сна, замедляет колебания и веретена. Proc. Natl. Акад. Sci. США 115, E9220 – E9229. DOI: 10.1073 / pnas.1805517115
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Онг, Дж. Л., Патанаик, А., Чи, Н. И. Й. Н., Ли, Х. К., По, Дж .- Х., и Чи, М. В. Л. (2018). Звуковая стимуляция медленных колебаний сна модулирует последующее кодирование памяти через измененную функцию гиппокампа. Сон 41: zsy031. DOI: 10.1093 / сон / zsy031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Папаламброс, Н. А., Сантостази, Г., Малкани, Р. Г., Браун, Р., Вайнтрауб, С., Паллер, К. А., и др. (2017). Акустическое усиление медленных колебаний сна и сопутствующее улучшение памяти у пожилых людей. Фронт. Гм. Neurosci. 11: 109. DOI: 10.3389 / fnhum.2017.00109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Pase, M. P., Himali, J. J., Grima, N.A., Beiser, A. S., Satizabal, C. L., Aparicio, H.J. и др. (2017). Архитектура сна и риск развития слабоумия в обществе. Неврология 89, 1244–1250. DOI: 10.1212 / WNL.0000000000004373
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Принц П. Н., Пескинд Э. Р., Виталиано П. П., Раскинд М. А., Эйсдорфер К., Земкузников Х. Н. и др. (1982). Изменения ЭЭГ сна и бодрствования у пожилых людей без деменции и слабоумия. Дж.Являюсь. Гериатр. Soc. 30, 86–92. DOI: 10.1111 / j.1532-5415.1982.tb01279.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Rauchs, G., Schabus, M., Parapatics, S., Bertran, F., Clochon, P., Hot, P., et al. (2008). Есть ли связь между изменениями сна и памятью при болезни Альцгеймера? Нейроотчет 19, 1159–1162. DOI: 10.1097 / WNR.0b013e32830867c4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Риднер, Б.А., Халс, Б.К., Мерфи М. Дж., Феррарелли Ф. и Тонони Г. (2011). Временная динамика корковых источников, лежащих в основе спонтанных и периферически вызванных медленных волн. Прог. Brain Res. 193, 201–218. DOI: 10.1016 / B978-0-444-53839-0.00013-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Римерсма-ван дер Лек, Р. Ф., Свааб, Д. Ф., Твиск, Дж., Хол, Э. М., Хугендейк, В. Дж. Г., и Ван Сомерен, Э. Дж. У. (2008). Влияние яркого света и мелатонина на когнитивные и некогнитивные функции у пожилых жителей учреждений группового ухода: рандомизированное контролируемое исследование. JAMA 299, 2642–2655. DOI: 10.1001 / jama.299.22.2642
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Робинсон, С. Р. (2000). Экспрессия глутамин синтетазы в нейронах при болезни Альцгеймера указывает на глубокое нарушение метаболических взаимодействий с астроцитами. Neurochem. Int. 36, 471–482. DOI: 10.1016 / S0197-0186 (99) 00150-3
CrossRef Полный текст | Google Scholar
Ро, Дж. Х., Хуанг, Ю., Беро, А. В., Кастен, Т., Стюарт, Ф. Р., Бейтман, Р. Дж. И др. (2012). Цикл сон-бодрствование и суточные колебания амилоида-β как биомаркеры амилоидной патологии головного мозга. Sci. Пер. Med. 4: 150ra122. DOI: 10.1126 / scitranslmed.3004291
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рой Д. С., Аронс А., Митчелл Т. И., Пигнателли М., Райан Т. Дж. И Тонегава С. (2016). Восстановление памяти путем активации инграммных клеток в мышиных моделях ранней болезни Альцгеймера. Природа 531, 508–512.DOI: 10.1038 / природа17172
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рудольф М., Поспишил М., Тимофеев И. и Дестекс А. (2007). Ингибирование определяет динамику мембранного потенциала и контролирует генерацию потенциала действия в коре головного мозга бодрствующей и спящей кошки. J. Neurosci. Выключенный. J. Soc. Neurosci. 27, 5280–5290. DOI: 10.1523 / JNEUROSCI.4652-06.2007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Санчес-Вивес, М.В., Маттиа, М., Компте, А., Перес-Забальца, М., Виноград, М., Дескальцо, В. Ф. и др. (2010). Тормозная модуляция корковых состояний вверх. J. Neurophysiol. 104, 1314–1324. DOI: 10.1152 / jn.00178.2010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Schallier, A., Smolders, I., Van Dam, D., Loyens, E., De Deyn, P.P, Michotte, A., et al. (2011). Региональные и возрастные изменения транспорта глутамата в мышиной модели AβPP23 при болезни Альцгеймера. J. Alzheimers Dis. JAD 24, 287–300. DOI: 10.3233 / JAD-2011-101005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зейбт, Дж., Думулин, М. К., Атон, С. Дж., Коулман, Т., Уотсон, А., Найду, Н. и др. (2012). Синтез белка во время сна укрепляет пластичность коры in vivo. Curr. Биол. CB 22, 676–682. DOI: 10.1016 / j.cub.2012.02.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зайбт, Дж., Ричард, К.J., Sigl-Glöckner, J., Takahashi, N., Kaplan, D. I., Doron, G., et al. (2017). Кортикальная дендритная активность коррелирует с богатыми веретеном колебаниями во время сна у грызунов. Нат. Commun. 8, 1–13. DOI: 10.1038 / s41467-017-00735-w
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шерозия М., Тимофеев И. (2014). Глобальная внутриклеточная медленноволновая динамика таламокортикальной системы. J. Neurosci. Выключенный. J. Soc. Neurosci. 34, 8875–8893.DOI: 10.1523 / JNEUROSCI.4460-13.2014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Солтани С., Шоветт С., Бухтиярова О., Лина Ж.-М., Дубе Дж., Сеньор Дж. И др. (2019). Цикл сон-бодрствование у молодых и старых мышей. Фронт. Syst. Neurosci. 13:51. DOI: 10.3389 / fnsys.2019.00051
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Спира, А. П., Гамальдо, А. А., Ан, Ю., Ву, М. Н., Симонсик, Э. М., Билгель, М. и др.(2013). Самостоятельно сообщаемый сон и отложение β-амилоида у пожилых людей, проживающих в сообществе. JAMA Neurol. 70, 1537–1543. DOI: 10.1001 / jamaneurol.2013.4258
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стериаде М., Контрерас Д., Курро Досси Р. и Нуньес А. (1993a). Медленные (<1 Гц) колебания в ретикулярных таламических и таламокортикальных нейронах: сценарий генерации ритма сна во взаимодействующих таламических и неокортикальных сетях. J. Neurosci.Выключенный. J. Soc. Neurosci. 13, 3284–3299. DOI: 10.1523 / jneurosci.13-08-03284.1993
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стериаде М., Нуньес А. и Амзика Ф. (1993b). Новое медленное (<1 Гц) колебание нейронов неокортекса in vivo: деполяризующие и гиперполяризующие компоненты. J. Neurosci. 13, 3252–3265. DOI: 10.1523 / JNEUROSCI.13-08-03252.1993
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стериаде, М., Нуньес А. и Амзика Ф. (1993c). Внутриклеточный анализ связи между медленными (<1 Гц) неокортикальными колебаниями и другими ритмами сна на электроэнцефалограмме. J. Neurosci. Выключенный. J. Soc. Neurosci. 13, 3266–3283. DOI: 10.1523 / jneurosci.13-08-03266.1993
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стериаде М., Тимофеев И. (2003). Нейрональная пластичность в таламокортикальных сетях при колебаниях сна и бодрствования. Нейрон 37, 563–576.DOI: 10.1016 / S0896-6273 (03) 00065-5
CrossRef Полный текст | Google Scholar
Стериаде М., Тимофеев И. и Гренье Ф. (2001). Естественные состояния бодрствования и сна: взгляд изнутри нейронов неокортекса. J. Neurophysiol. 85, 1969–1985. DOI: 10.1152 / jn.2001.85.5.1969
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сан, Дж .-Дж., Килб, В., Луман, Х. Дж. (2010). Самоорганизация повторяющихся паттернов спайков в развивающихся нейронных сетях in vitro. Eur. J. Neurosci. 32, 1289–1299. DOI: 10.1111 / j.1460-9568.2010.07383.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Szabó, Z., Héja, L., Szalay, G., Kékesi, O., Füredi, A., Szebényi, K., et al. (2017). Обширная синхронизация астроцитов способствует взаимодействию нейронов в медленноволновой активности in vivo. Sci. Отчет 7: 6018. DOI: 10.1038 / s41598-017-06073-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тимофеев, И., Контрерас Д. и Стериаде М. (1996). Синаптическая реакция кортикальных и таламических нейронов во время различных фаз медленных колебаний сна у кошек. J. Physiol. 494, 265–278. DOI: 10.1113 / jphysiol.1996.sp021489
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тимофеев И., Гренье Ф., Баженов М., Сейновски Т. Дж. И Стериаде М. (2000a). Происхождение медленных корковых колебаний в глухих корковых пластинах. Cereb. Cortex 10, 1185–1199.DOI: 10.1093 / cercor / 10.12.1185
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тимофеев И., Гренье Ф. и Стериад М. (2000b). Влияние внутренних свойств и синаптических факторов на активность неокортикальных сетей in vivo. J. Physiol. Париж 94, 343–355. DOI: 10.1016 / s0928-4257 (00) 01097-4
CrossRef Полный текст | Google Scholar
Тимофеев И., Гренье Ф. и Стериад М. (2001). Дисфункция и активное торможение в неокортексе во время естественного цикла сна-бодрствования: внутриклеточное исследование. Proc. Natl. Акад. Sci. США 98, 1924–1929. DOI: 10.1073 / pnas.98.4.1924
CrossRef Полный текст | Google Scholar
Тимофеев И., Шох С.Ф., ЛеБуржуа М.К., Хубер Р., Риднер Б.А. и Курт С. (2020). Пространственно-временные свойства медленных волн сна и их значение для развития. Curr. Opin. Physiol. 15, 172–182. DOI: 10.1016 / j.cophys.2020.01.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тимофеев, И., и Steriade, M. (1996). Низкочастотные ритмы в таламусе интактной коры и декортикации кошек. J. Neurophysiol. 76, 4152–4168. DOI: 10.1152 / jn.1996.76.6.4152
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тонони Г. и Чирелли К. (2014). Сон и цена пластичности: от синаптического и клеточного гомеостаза до консолидации и интеграции памяти. Нейрон 81:12. DOI: 10.1016 / j.neuron.2013.12.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Каутер, Э., Лепроулт Р. и Плат Л. (2000). Возрастные изменения медленного и быстрого сна, а также взаимосвязь с уровнем гормона роста и кортизола у здоровых мужчин. JAMA 284, 861–868. DOI: 10.1001 / jama.284.7.861
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Витиелло, М. В., и Принц, П. Н. (1989). Болезнь Альцгеймера. Режимы сна и сна / бодрствования. Clin. Гериатр. Med. 5, 289–299.
Google Scholar
Волгушев, М., Шоветт, С., Муковски, М., Тимофеев, И. (2006). Точная долгая синхронизация активности и молчания нейронов неокортекса во время медленных колебаний [исправлено]. J. Neurosci. Выключенный. J. Soc. Neurosci. 26, 5665–5672. DOI: 10.1523 / JNEUROSCI.0279-06.2006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уокер, М. П. (2009). Роль медленного сна в обработке памяти. J. Clin. Sleep Med. JCSM Выкл. Publ. Являюсь. Акад. Sleep Med. 5, S20 – S26.
Google Scholar
Вестерберг, К. Э., Флорчак, С. М., Вайнтрауб, С., Месулам, М.-М., Маршалл, Л., Зи, П. С. и др. (2015). Улучшение памяти за счет медленной колебательной стимуляции во время сна у пожилых людей. Neurobiol. Старение 36, 2577–2586. DOI: 10.1016 / j.neurobiolaging.2015.05.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вестерберг, К. Э., Мандер, Б. А., Флорчак, С. М., Вайнтрауб, С., Месулам, М.-M., Zee, P.C., et al. (2012). Сопутствующие нарушения сна и памяти при амнестических умеренных когнитивных нарушениях. J. Int. Neuropsychol. Soc. ДЖИНС 18, 490–500. DOI: 10.1017 / S135561771200001X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Винер, Дж. Р., Мандер, Б. А., Хелфрич, Р. Ф., Маасс, А., Харрисон, Т. М., Бейкер, С. Л. и др. (2019). Сон как потенциальный биомаркер тау- и β-амилоидной нагрузки в человеческом мозге. J. Neurosci. Выключенный. J. Soc.Neurosci. 39, 6315–6324. DOI: 10.1523 / JNEUROSCI.0503-19.2019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wu, J. W., Hussaini, S. A., Bastille, I. M., Rodriguez, G.A., Mrejeru, A., Rilett, K., et al. (2016). Активность нейронов усиливает распространение тау-белка и патологию тау-белка in vivo. Нат. Neurosci. 19, 1085–1092. DOI: 10.1038 / nn.4328
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Се, Л., Кан, Х., Сюй, К., Чен, М.J., Liao, Y., Thiyagarajan, M., et al. (2013). Сон стимулирует выведение метаболитов из мозга взрослого человека. Наука 342, 373–377. DOI: 10.1126 / science.1241224
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ямамото К., Таней З., Хашимото Т., Вакабаяси Т., Окуно Х., Нака Ю. и др. (2015). Хроническая оптогенетическая активация увеличивает патологию Aβ на мышиной модели болезни Альцгеймера. Cell Rep. 11, 859–865. DOI: 10.1016 / j.celrep.2015.04.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янг, Г., Лай, К. С. У., Цишон, Дж., Ма, Л., Ли, В., и Ган, В.-Б. (2014). Сон способствует формированию ветвей дендритных шипов после обучения. Наука 344, 1173–1178. DOI: 10.1126 / science.1249098
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zielinski, M. R., Atochin, D. N., McNally, J. M., McKenna, J. T., Huang, P.L., Strecker, R.E., et al. (2019).Соматостатин + / nNOS + нейроны участвуют в дельта-электроэнцефалограмме и кортикально-зависимой памяти распознавания. Спящий режим 42: zsz143. DOI: 10.1093 / сон / zsz143
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зукка, С., Паскуале, В., Лагомарсино де Леон Ройг, П., Панцери, С., и Феллин, Т. (2019). Таламический привод кортикальных парвальбумин-положительных интернейронов во время депрессивных состояний у анестезированных мышей. Curr. Биол. CB 29, 1481–1490.DOI: 10.1016 / j.cub.2019.04.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Понимание циклов сна и стадий сна
Советы для хорошего сна и улучшения циклов сна
Хотя не существует простой формулы для увеличения количества времени, которое вы проводите на любом из этапов сна, есть поведение, которое вы можете принять, чтобы дать себе наилучшие шансы на эффективный сон. Вот несколько передовых методов, которые мы извлекли из ведущих исследований в области науки о сне:
Чем темнее ваша комната , , тем лучше вы спите .Свет влияет на этап бодрствования, поэтому чем темнее будет ваша комната, тем больше времени вы проведете на этапах восстановления.
Установите температуру в помещении около 68 градусов . Вы быстрее заснете, когда в спальне немного прохладно.
Ваша кровать не является универсальным помещением . Чем больше вы сможете тренировать свое тело, чтобы ассоциировать кровать со сном, тем более искусно вы будете засыпать в этом пространстве. Поэтому избегайте работы и отдыха в постели.
Экраны стимулируют и не дают уснуть . Не пользуйтесь телефоном или компьютером в постели, экранное время затрудняет засыпание.
Установите время окончания приема кофеина . Кофеин сохраняется в течение многих часов после употребления. Для большей эффективности сна сознательно воздержитесь от употребления кофеина по крайней мере за 4 часа до сна.
Планируйте употребление алкоголя заранее . Так же, как потребление кофеина влияет на организм через несколько часов после употребления, алкоголь тоже.Помните об этом во время прогулки, чтобы не ухудшить качество сна.
Засыпать и просыпаться каждый день в одно и то же время . Мы называем это постоянством сна, и исследования показали, что это может улучшить качество и эффективность вашего времени в постели (см. The Circadian Rhythm Sleep Hack ).
Слушайте приложение WHOOP Sleep Coach . Основываясь на ваших физиологических данных и естественном циркадном ритме, Sleep Coach дает ежедневные рекомендации относительно вашего оптимального времени, когда ложиться спать ночью и вставать на следующее утро.
Подробнее : Советы по сну от 100 лучших спящих на WHOOP
Медленноволновый гомеостаз сна и когнитивные функции у детей с эпилептическим электрическим статусом во сне | СОН
Аннотация
Цели исследования
Энцефалопатия с эпилептическим электрическим статусом во сне (ESES) характеризуется эпилептиформной активностью, вызванной небыстрым движением глаз (non-REM), и приобретенными когнитивными нарушениями.Гипотеза синаптического гомеостаза описывает процесс дневной синаптической потенциации, уравновешенной синаптическим даунскейлингом в не-REM-сне, и считается критически важным для сохранения эффективной корковой сети. Мы стремились изучить ночной спад медленных волн, косвенный маркер синаптического даунскейлинга, у пациентов с ESES и выяснить, связано ли измененное даунскейлинг с проблемами развития нервной системы и поведением.
Методы
Ретроспективное исследование пациентов с ЭСЭС по крайней мере с одной ночной электроэнцефалограммой (ЭЭГ) и нейропсихологическим обследованием (НПА) в течение 4 месяцев.Были проанализированы медленные волны в первый и последний час медленного сна. Были проанализированы различия в наклоне медленной волны (SWS) и наклоне в ночное время между эпилептическими фокусирующими и нефокусированными электродами, а также их взаимосвязь с развитием нервной системы и поведением.
Результаты
Всего было включено 29 пациентов с 44 комбинациями ЭЭГ ~ NPA. Среднее значение SWS снизилось с 357 до 327 мкВ / с (-8%, p <0,001) в течение ночи, и ночное уменьшение было менее выражено в эпилептическом очаге, чем в нефокусных электродах (-5.6% против -8,7%, р = 0,003). Мы не обнаружили связи между SWS и результатами тестов на развитие нервной системы в поперечном и продольном анализах. Пациенты с поведенческими проблемами показали меньшее снижение SWS, чем пациенты без него, и разница была наиболее заметной в эпилептическом очаге (-0,9% против -8,8%, p = 0,006).
Выводы
Медленноволновый гомеостаз — маркер синаптического гомеостаза — нарушается эпилептиформной активностью при ESES. Проблемы с поведением, но не результаты тестов на развитие нервной системы, были связаны с серьезностью этого нарушения.
Заявление о значимости
Отличительной чертой энцефалопатии с эпилептическим электрическим статусом во сне (ЭСЭС) является почти непрерывная эпилептиформная активность в медленноволновом сне, сопровождающаяся нейропсихологическими нарушениями. Медленноволновой сон имеет важное значение для когнитивного функционирования. Гипотеза синаптического гомеостаза предлагает основу для роли медленноволнового сна в когнитивном функционировании. В этом исследовании мы проанализировали, связаны ли медленные волны с развитием нервной системы и поведенческими функциями у детей с ЭСЭ.Мы обнаружили, что нарушение спада медленной волны за ночь связано с поведенческими проблемами. Нарушение медленноволнового гомеостаза может связывать эпилептиформную активность в не-REM-сне с нейропсихологическими проблемами. Раскрытие механизмов, лежащих в основе нейропсихологического дефицита, может привести к лучшему пониманию этой эпилептической энцефалопатии и того, как нарушения физиологии сна влияют на познание.
Введение
Эпилептическая энцефалопатия с эпилептическим электрическим статусом во сне (ЭСЭС) — это редкий детский эпилептический синдром, характеризующийся почти непрерывной эпилептиформной активностью во время небыстрых движений глаз (БДГ), связанной с нейропсихологическим дефицитом.Пациенты обычно обращаются с глобальной когнитивной, речевой или поведенческой регрессией в возрасте от 2 до 12 лет. У большинства пациентов случаются (эпизодические) судороги, часто начинающиеся до появления нарушений развития [1–3]. ESES можно диагностировать в контексте структурных (особенно при вовлечении таламуса или перисильвиевой области) или генетических аномалий (например, мутации GRIN2A ), но примерно в одной трети случаев этиология неизвестна [4–8]. Приступы обычно хорошо поддаются лечению противоэпилептическими препаратами (AED), в то время как лечение когнитивных симптомов является сложной задачей.То, что ESES приводит к снижению когнитивных функций, принято, но не совсем понятно, как это сделать. Индекс спайк-волны (SWI), отражающий долю не-REM-сна, затронутого эпилептиформными разрядами, часто используется в качестве электроэнцефалограммы (ЭЭГ) маркера тяжести ESES [9], при этом аномалии EEG при типичном ESES часто определяются как двусторонние. и с SWI выше 85%, в то время как атипичные случаи с SWI от 50% до 85% также считаются частью спектра. SWI также используется для оценки эффективности лечения.Однако предыдущие исследования показали, что это не всегда коррелирует с серьезностью нарушений развития нервной системы и что у значительной части пациентов наблюдается несоответствие между SWI и когнитивным ответом на лечение [10–13].
Решающая роль сна — в особенности медленного сна — для когнитивного функционирования хорошо известна и проиллюстрирована гипотезой синаптического гомеостаза [14]. Эта гипотеза утверждает, что во время бодрствования люди учатся благодаря активному мышлению и новым впечатлениям и сенсорным стимулам.На клеточном уровне это отражается в синаптической потенциации: — в увеличении количества и силы связей между нейронами. Во время сна мозг функционально отделен от внешних раздражителей, и предполагается, что имеет место восстановительный процесс, названный синаптическим даунскейлингом . (Частично избирательное) уменьшение количества и силы синаптических связей во время сна важно, потому что оно восстанавливает чистую синаптическую силу до эффективного базового уровня. Ночное сокращение синаптических связей, таким образом, обеспечивает пространство и экономит энергию для следующего увеличения синаптических связей на следующий день [15-17].Процесс синаптического гомеостаза, основанный на исследованиях как на животных, так и на людях, считается, что он отражается и, возможно, индуцируется медленноволновой активностью (SWA) [17-19]. Медленные волны — это дельта-волны (0,5–4 Гц), наблюдаемые на ЭЭГ во время не-REM-сна, вызванные на клеточном уровне почти синхронными колебаниями больших групп нейронов [20, 21]. Амплитуда и наклон медленной волны тесно связаны с синхронностью возбуждения или эффективностью взаимодействия нейронов и, таким образом, обеспечивают маркеры синаптической силы [18, 19, 22, 23].У здоровых людей SWA уменьшается во время сна; в то время как медленные волны в медленном сне имеют относительно высокую амплитуду и наклон в начале сна, они намного ниже к концу ночи [19].
Гипотеза о том, что медленные волны связаны с когнитивным функционированием, изучалась в нескольких исследованиях. У здоровых субъектов выполнение определенной задачи на двигательное обучение непосредственно перед сном было связано с локальным увеличением SWA в области, используемой для этой задачи, в следующий период сна и последующим улучшением выполнения задачи после сна [24].Кроме того, усиление медленных волн за счет звуковой стимуляции с замкнутым контуром улучшало производительность при выполнении ночной задачи на память [25]. В исследовании с участием пациентов с эпилепсией судороги и интериктальные спайки увеличивали SWA в эпилептическом очаге и снижали гомеостатический ночной медленный спад, а также способность к визуальному обучению во время бодрствования [26].
В нескольких исследованиях было высказано предположение, что почти непрерывная эпилептиформная активность во время не-REM-сна у пациентов с ESES мешает обучению и консолидации памяти, нарушая физиологический SWA [27–29].Доказательства нарушения медленноволнового гомеостаза были обнаружены в исследовании, сравнивающем ночной курс медленноволновых характеристик между девятью пациентами ESES и девятью здоровыми людьми из контрольной группы. В то время как в контрольной группе наблюдалось значительное снижение амплитуды и крутизны медленных волн в течение ночи, этого не наблюдалось у пациентов с ESES [30]. В последующем исследовании было обнаружено, что изменение наклона медленной волны (SWS) в течение ночи коррелирует с SWI [31]. Кроме того, SWS в конце ночи на электродах в эпилептическом очаге был более крутым, чем на «нефокальных» электродах.После ремиссии медленноволнового гомеостаза медленноволновый гомеостаз нормализовался, и при исследовательском анализе когнитивные последствия казались более значительными у детей с наиболее нарушенным медленноволновым гомеостазом во время их активной фазы ESES [32].
Насколько нам известно, возможная связь между параметрами медленной волны и нейропсихологическим функционированием не оценивалась в популяции пациентов с ESES.
В текущем исследовании мы изучали: (1) есть ли разница в ночном медленноволновом течении (медленноволновом гомеостазе) между электродами в эпилептическом очаге и нефокусированными электродами.Основываясь на предыдущих исследованиях [31, 32], мы предположили, что уменьшение SWS в эпилептическом очаге будет менее выраженным или отсутствовать по сравнению с электродами без фокуса; (2) связь между медленноволновым гомеостазом и развитием нервной системы и поведением пациентов с ЭСЭС. Мы предположили, что пациенты с (более выраженным) снижением SWS в течение ночи относительно сохраняют нейропсихологическое функционирование и нормальное поведение по сравнению с пациентами с тяжелым нарушением медленноволнового гомеостаза; и (3) связь между изменением медленноволнового гомеостаза и изменением нейропсихологического функционирования в поисковом продольном сравнении у пациентов с ESES.Мы ожидали, что улучшение медленного спада в ночное время со временем будет связано с улучшением когнитивных функций и поведения.
Методы
Выбор пациентов
Мы ретроспективно включили всех пациентов, у которых была хотя бы одна ЭЭГ сна на всю ночь и нейропсихологическое обследование (NPA), проведенное в период с января 2009 года по июль 2017 года в Университетском медицинском центре Утрехта, если они соответствовали следующим критериям:
- •
хотя бы один ЭЭГ сна в течение всей ночи, показывающая паттерн ESES, определяемый как SWI во сне не менее 50% и не менее 25% ухудшения по сравнению с бодрствованием.
- •
приобретенные когнитивные или поведенческие нарушения; либо новые дефициты, либо изменение ожидаемых траекторий развития.
- •
по крайней мере одна комбинация ЭЭГ / NPA, удовлетворяющая критериям выбора, приведенным ниже.
Комбинации ЭЭГ и НПА были включены, если:
- •
интервал между ЭЭГ и НПА <4 месяцев.
- •
возраст младше 12 лет на момент исследования.
- •
не более одного приступа (клинического или электрофизиологического) в течение всей ночи регистрации.
Исследование было одобрено комитетом по медицинской этике, который постановил, что Закон Нидерландов о медицинских исследованиях с участием людей не применяется.
Характеристики пациента
Были собраны исходные характеристики пациентов (пол; возраст на момент постановки диагноза ESES; этиология, классифицированная как структурная, генетическая / синдромальная, постинфекционная или неизвестная; результаты МРТ; частота приступов; и развитие до постановки диагноза ESES). Для непрерывных переменных, которые следуют нормальному распределению, сообщаются средние значения и стандартные отклонения, тогда как для переменных с ненормальным распределением указываются медиана и диапазон.
Нейропсихологические исследования
Для каждого NPA были собраны тип теста и результаты теста. Был выбран тип теста, адаптированный к возрасту и способностям ребенка. В зависимости от выполненных тестов мы извлекали общий коэффициент интеллекта (TIQ), коэффициент развития (DQ), вербальный IQ (VIQ), IQ производительности (PIQ), скорость обработки, тест визуально-моторной интеграции (VMI) Бири, диапазон цифр (память). , и тест Peabody Picture Vocabulary Test из отчетов и форм тестирования.Для пациентов с тяжелыми когнитивными нарушениями, у которых полное тестирование интеллекта было невозможно, рассчитывали умственный возраст и DQ. Развитие до начала ESES и поведенческие проблемы (например, проблемы регуляции настроения и тревога) были классифицированы как отсутствующие, легкие, умеренные и тяжелые в соответствии с критериями, используемыми Massa et al. [33]. Пациенты с ранее существовавшей задержкой развития могли быть включены только в том случае, если у них был явный регресс или остановка развития в дополнение к этому. Это отклонение от ожидаемых траекторий развития предпочтительно демонстрировалось повторным NPA (если у них уже была NPA ранее) или иным образом на основании истории родителей, взятых детским неврологом и нейропсихологом.Поведение оценивалось нейропсихологом с помощью структурированного родительского интервью, часто дополняемого поведенческим опросником (Контрольный список поведения ребенка). Поведенческие аномалии сначала были классифицированы как отсутствующие, легкие, умеренные и тяжелые в соответствии с критериями, используемыми Massa et al . Принимая во внимание относительно небольшое количество измерений, мы впоследствии классифицировали это как нормальное / ненормальное (таким образом, легкие, умеренные или тяжелые поведенческие отклонения были закодированы как отклонения от нормы).Это позволило статистически сравнить курс SWS между двумя группами разумного размера.
Регистрация и предварительная обработка ЭЭГ
РегистрировалиЭЭГ кожи головы с 21 электродом по международной системе 10–20 / 10–10 и электроокулограммы. В большинстве случаев также была доступна электромиография подбородка, а в некоторых случаях — измерение дыхательного усилия. Для каждой включенной ЭЭГ рассчитывался SWI в эпоху продолжительностью 10 минут (600 с), начинающуюся через 5 минут после альфа-затухания или, при отсутствии альфа-ритма, после начала сна на основе видео и характеристик ЭЭГ, указывающих на начало сна.Количество секунд, содержащих эпилептиформные разряды на любом из электродов, было разделено на общее количество секунд в эпоху (600) и умножено на 100, чтобы отразить SWI в процентах. Кроме того, оценивали фоновый рисунок, наличие или отсутствие физиологических явлений сна и локализацию (очаг) эпилептиформных аномалий. Эпохи ЭЭГ оценивались как бодрствование, не-REM, REM или движение / артефакты в соответствии с Руководством Американской академии медицины сна (AASM) по оценке сна и связанных с ним событий , версия 2.3 (2016), если возможно. Если это было невозможно из-за отсутствия узнаваемой архитектуры сна, использовались модифицированные критерии, использованные в предыдущих исследованиях с пациентами с ESES [30–32]. Каналы ЭЭГ, для которых сигнал состоял в основном из артефактов (например, каналы, которые были потеряны в течение ночи), были исключены из анализа.
Расчет замедляющих характеристик
Мы использовали алгоритмы обработки данных для обнаружения медленных волн сна (0,5–2 Гц), всплесков и артефактов, основанные на ранее опубликованных методах [19, 30].Во-первых, медленные волны сна первого часа (FH) и последнего часа (LH) без артефактов не-REM-сна были автоматически обнаружены в каждом электроде. Впоследствии были обнаружены всплески. Затем медленные волны, возникшие в пределах временного окна 0,5 с после всплеска, считались частью комплекса всплеск-волна и, таким образом, исключались из анализа. Были оценены амплитуды включенных медленных волн. Абсолютные наклоны включенных медленных волн были вычислены как амплитуда отрицательного пика, деленная на временной интервал между отрицательным пиком и следующим переходом через нуль, то есть наклоном роста.Чтобы учесть изменчивость амплитуды отдельных медленных волн (также зависящую от возраста и технических аспектов), которая по своей сути будет влиять на расчетный наклон, наклон также был рассчитан при заданной амплитуде 75 мкВ, как и в предыдущих исследованиях [30–32]. . Приведены только характеристики амплитуды и абсолютного наклона, в то время как нормализованный наклон используется в качестве первичной медленной характеристики при анализе и далее обозначается как наклон . Он был рассчитан для каждого электрода для FH и LH не-REM-сна (наклон FH и наклон LH).Относительное изменение наклона (наклон FH, вычитаемый из наклона LH, деленный на наклон FH) рассчитывалось для каждого электрода ЭЭГ, чтобы отразить ночной ход наклона.
Мы заранее определили области интереса для анализа характеристик медленных волн: были выполнены анализы для средних характеристик медленных волн , все электроды , фокусирующие электроды , несфокусированные электроды , и по умолчанию -режимные сетевые (DMN) электроды. Фокус был определен как до четырех электродов с эпилептиформной активностью, и если более четырех электродов демонстрировали эпилептиформную активность, выбирались четыре с наивысшими пиками амплитуды.Остальные электроды были обозначены как нефокусные. Основываясь на предыдущих исследованиях, DMN была выбрана в качестве области интереса для связи характеристик медленных волн с нейропсихологическим функционированием [34, 35]. Согласно недавнему исследованию, DMN включала электроды, регистрирующие префронтальную кору (электроды Fp1 и Fp2), предклинье (электрод Pz) и двусторонние теменные области (электроды P7 / P8) [36].
Определение результата
В первом анализе, сравнивая характеристики SWS фокусирующего и нефокусного электродов, результат был определен как относительное изменение SWS в течение ночи (нормализованное на 75 мкВ).Для поперечного и лонгитюдного анализа возможных взаимосвязей между характеристиками SWS и нейропсихологическим функционированием мы использовали результаты теста NPA (TIQ, VIQ, PIQ, PS, VMI и размах цифр) в качестве количественных показателей результатов. Поведение было включено в качестве качественного показателя результата (нормальный / ненормальный) во время записи ЭЭГ / NPA. Мы также проанализировали, было ли лечение обычными противоэпилептическими препаратами, бензодиазепинами или стероидами во время ЭЭГ / НПА связано с поведением, поскольку это могло быть мешающим фактором при оценке взаимосвязи между ночным курсом SWS и поведением.Наконец, для лонгитюдного анализа мы также использовали улучшение SWI (снижение SWI по крайней мере на 25%) и субъективное улучшение (улучшение / не улучшение) в повседневном функционировании, о котором сообщили родители и лечащий врач, в качестве качественных результатов.
Статистический анализ
Для всех пациентов мы описали курс SWS в заранее определенных регионах и проанализировали возможную корреляцию относительной разницы SWS в этих регионах с нейропсихологическими показателями исхода в их первой комбинации ЭЭГ ~ NPA.Таким образом, для пациентов с несколькими комбинациями ЭЭГ ~ NPA для этого анализа использовалась только первая комбинация. Для оценки различий в FH и LH SWS и для сравнения ночного наклона между фокусирующими и нефокусирующими электродами были опубликованы парные образцы t -тесты. Для непрерывных результатов был проведен линейный регрессионный анализ; для корреляции характеристик медленных волн и SWI (нераспределенного нормально) оценивался Rho Спирмена, а для дихотомического исхода (поведенческие аномалии) использовались независимые выборки t -тест или U-критерий Манна-Уитни (в зависимости от распределения данных).Точный тест Фишера использовался для оценки наличия связи между наличием или отсутствием лечения противоэпилептическими препаратами, бензодиазепинами и стероидами и поведенческими отклонениями.
Для пациентов с множественными комбинациями ЭЭГ ~ NPA, мы оценили, было ли улучшение SWI (снижение как минимум на 25%) и субъективное улучшение повседневного функционирования связано с изменением курса SWS при 75 мкВ. Впоследствии была подобрана линейная смешанная модель, включающая все повторные измерения у пациентов с несколькими комбинациями ЭЭГ ~ NPA.С помощью этой смешанной модели мы проанализировали возможную корреляцию ночного курса SWS при 75 мкВ с TIQ, VIQ, PIQ, скоростью обработки, тестом Бири визуально-моторной интеграции и размахом цифр. Измерения нейропсихологического результата были определены как зависимая переменная, использовался случайный интервал для каждого пациента, а относительная средняя разница SWS для предварительно определенных областей была включена как фиксированная переменная.
Для получения статистически значимых результатов анализа линейной регрессии / анализа линейной смешанной модели мы рассчитали коэффициент Коэна f 2 как меру величины эффекта, как определено с помощью формулы Коэна f 2 = R 2 / (1 — R 2 ).Коэффициент Коэна f 2 ≥ 0,02 считается малым эффектом, ≥ 0,15 — средним эффектом и ≥ 0,35 — большим эффектом.
Анализы проводились с использованием MATLAB версии 2018a и SPSS версии 25. p — Значения <0,05 считались значимыми. GraphPad Prism 8 использовался для графической иллюстрации.
Результаты
Характеристики пациентов и результаты ЭЭГ / нейропсихологии
Мы включили 29 пациентов.Всего было выполнено 44 комбинации ЭЭГ ~ НПА; У 12 пациентов было 2 и 3 пациента имели 3 комбинации ЭЭГ ~ NPA, которые соответствовали критериям отбора. Характеристики пациентов представлены в таблице 1. Среднее время (± SD ) между ЭЭГ и NPA составило 1,1 ± 1,2 месяца для первого, 0,5 ± 1,3 месяца для второго и 0,0 ± 0,0 месяца для третьего EEG ~ NPA. комбинации соответственно. Медиана SWI составила 90% для первой ЭЭГ, 91% для второй и 70% для третьей ЭЭГ. Одновременное лечение обычными ПЭП и кортикостероидами было гораздо более распространенным во время второй и третьей ЭЭГ, чем во время первой ЭЭГ.ЭЭГ и нейропсихологические данные представлены в таблице 2.
Таблица 1.Характеристики пациента ( n = 29)
| Мужчины (%) | 16 (55%) | ||
| Возраст на момент постановки диагноза ESES: средний (± SD ) | 75 ± 26 мес. / 6,3 ± 2,2 года | ||
| Предполагаемая (основная) этиология | |||
| Структурная | 10 (35%) | ||
| Генетическая / синдромальная | 4 (14%) | 9-13 43 Пост-инфекционная | 1 (3%) |
| Неизвестно | 14 (48%) | ||
| Нарушения МРТ (вкл.неэпилептогенный) | 19 (66%) | ||
| Латерализация аномалий МРТ | |||
| Левый | 3 (10%) | ||
| Правый | 44 | 13 (45%) | |
| Нет | 10 (35%) | ||
| Частота приступов на момент постановки диагноза | |||
| Ежедневно | 4 (14%) | ||
| 10 (35%) | |||
| Ежегодно | 5 (17%) | ||
| Спорадически | 8 (28%) | ||
| Нет | 2 (7%) | ||
| Начало разработки | |||
| Нормальный | 10 (35%) | ||
| Небольшая задержка | 11 (38%) | ||
| Средняя задержка | 4 (14%) | 91 347||
| Тяжелая задержка | 4 (14%) |
| Мужской (%) | 16 (55%) | ||
| Возраст при диагнозе ESES: средний (± SD ) | 75 ± 26 месяцев / 6.3 ± 2,2 года | ||
| Предполагаемая (основная) этиология | |||
| Структурная | 10 (35%) | ||
| Генетическая / синдромальная | 4 (14%) | ||
| Неизвестно | 14 (48%) | ||
| Нарушения МРТ (в т.ч. неэпилептогенные) | 19 (66%) | ||
| Латерализация аномалий МРТ | |||
| Левый | 3 (10%) | ||
| Правый | 3 (10%) | ||
| Двусторонний | 13 (45%) | ||
| Нет | 10 (35%) | ||
| судорог на момент постановки диагноза | |||
| Ежедневно | 4 (14%) | ||
| Ежемесячно | 10 (35%) | ||
| Ежегодно | 5 (17%) | ||
| Спорадически | 8 (28%) | ||
| Нет | 2 (7%) | ||
| Развитие до начала ESES | |||
| 101344 | Нормальное | Нормальное | |
| Небольшая задержка | 11 (38%) | ||
| Средняя задержка | 4 (14%) | ||
| Серьезная задержка | 4 (14%) |
Характеристики пациента ( n = 29)
| Мужчины (%) | 16 (55%) | |
| Возраст на момент постановки диагноза ESES: средний (± SD ) | 75 ± 26 месяцев / 6,3 ± 2,2 года | |
| Предполагаемая (основная) этиология | ||
| Структурная | 10 (35%) | |
| Генетическая / синдромальная | 4 (14%) | |
| Неизвестно | 14 (48%) | |
| Нарушения МРТ (вкл.неэпилептогенный) | 19 (66%) | |
| Латерализация аномалий МРТ | ||
| Левый | 3 (10%) | |
| Правый | 44 | 13 (45%) |
| Нет | 10 (35%) | |
| Частота приступов на момент постановки диагноза | ||
| Ежедневно | 4 (14%) | |
| 10 (35%) | ||
| Ежегодно | 5 (17%) | |
| Спорадически | 8 (28%) | |
| Нет | 2 (7%) | |
| Начало разработки | ||
| Нормальный | 10 (35%) | |
| Небольшая задержка | 11 (38%) | |
| Средняя задержка | 4 (14%) | 91 347|
| Тяжелая задержка | 4 (14%) |
| Мужской (%) | 16 (55%) | ||
| Возраст при диагнозе ESES: средний (± SD ) | 75 ± 26 месяцев / 6.3 ± 2,2 года | ||
| Предполагаемая (основная) этиология | |||
| Структурная | 10 (35%) | ||
| Генетическая / синдромальная | 4 (14%) | ||
| Неизвестно | 14 (48%) | ||
| Нарушения МРТ (в т.ч. неэпилептогенные) | 19 (66%) | ||
| Латерализация аномалий МРТ | |||
| Левый | 3 (10%) | ||
| Правый | 3 (10%) | ||
| Двусторонний | 13 (45%) | ||
| Нет | 10 (35%) | ||
| судорог на момент постановки диагноза | |||
| Ежедневно | 4 (14%) | ||
| Ежемесячно | 10 (35%) | ||
| Ежегодно | 5 (17%) | ||
| Спорадически | 8 (28%) | ||
| Нет | 2 (7%) | ||
| Развитие до начала ESES | |||
| 101344 | Нормальное | Нормальное | |
| Небольшая задержка | 11 (38%) | ||
| Средняя задержка | 4 (14%) | ||
| Серьезная задержка | 4 (14%) |
Результаты ЭЭГ и NPA ( n = 44)
| Комбинация EEG ~ NPA . | Первый ( n = 29) . | Вторая ( n = 12) . | Третий ( n = 3) . | ||
|---|---|---|---|---|---|
| Время между ЭЭГ и НПА (месяцы): среднее ± SD | 1,1 ± 1,2 | 0,5 ± 1,3 | 0,0 ± 0,0 | ||
| Результаты ЭЭГ за всю ночь ЭЭГ | 913 | ||||
| Возраст на момент записи ЭЭГ (лет): среднее ± SD | 6.7 ± 2,2 | 7,5 ± 1,7 | 8,9 ± 1,4 | ||
| Время между постановкой диагноза и ЭЭГ (мес.): Среднее ± СО | 6 ± 11 | 12 ± 12 | 20 ± 0,6 | ||
| SWI (%): медиана (диапазон) | 90 (62–100) | 91 (0–100) | 70 (46–95) | ||
| Нормальный фоновый узор (%) | 22 (76) | 10 (83) | 3 (100) | ||
| Наличие явлений сна (%) | 24 (83) | 11 (92) | 3 (100) | ||
| Распределение эпилептиформной активности во сне | |||||
| Обобщенный | 9 (31%) | 4 (33%) | 1 (33%) | ||
| Мультифокальный двусторонний | 8 (28%) 913 171343 2 ) | 1 (33%) | |||
| Мультифокальный односторонний | 5 (17%) | 0 (0%) | 0 (0%) | ||
| Очаговое одностороннее | 7 (24%) | 4 (33%) | 1 (33%) | ||
| Эпилептиформных аномалий нет | 0 (0%) | 2 (17%) | 0 (0%) | ||
| Параллельное лечение AED | 19 (66%) | 10 (83%) | 2 (67 %) | ||
| Одновременное лечение бензодиазепинами | 5 (17%) | 6 (50%) | 1 (33%) | ||
| Параллельное лечение кортикостероидами | 5 (17%) 7 (17%) | 913% )0 (0%) | |||
| Нейропсихологические данные | |||||
| Общий IQ: среднее ± SD | 78 ± 17 ( n = 22) 84 ± 171343 n = 9) | 84 ± 5 ( n = 3) | |||
| Вербальный IQ : среднее ± стандартное отклонение | 84 ± 15 ( n = 18) | 87 ± 15 ( n = 8) | 88 ± 8 ( n = 3) | ||
| IQ эффективности: среднее ± SD | 84 ± 18 ( n = 19) | 84 ± 19 ( n = 9) | 83 ± 5 ( n = 3) | ||
| DQ (при отсутствии IQ ): среднее ± SD | 43 ± 37 ( n = 4) | 29 ± 10 ( n = 2) | |||
| Скорость обработки: среднее ± SD | 75 ± 15 ( n = 13) | 80 ± 21 ( n = 9) | 90 ± 6 ( n = 2) | ||
| Beery VMI: среднее ± SD | 89 ± 11 ( n = 19) | 85 ± 10 ( n = 9) | 87 ± 6 ( n = 3) | ||
| Память: диапазон цифр (WISC III): м ean ± SD | 7 ± 3 ( n = 12) | 8 ± 4 ( n = 8) | 8 ± 2 ( n = 3) | ||
| Словарный тест Peabody Picture: среднее ± SD | 105 ± 18 ( n = 10) | 95 ± 22 ( n = 7) | 91 ± 6 ( n = 3) | ||
| Наличие поведенческих проблем ( %) | 12 (41) | 6 (50) | 0 (0) |
| Комбинация ЭЭГ ~ NPA . | Первый ( n = 29) . | Вторая ( n = 12) . | Третий ( n = 3) . | ||
|---|---|---|---|---|---|
| Время между ЭЭГ и НПА (месяцы): среднее ± SD | 1,1 ± 1,2 | 0,5 ± 1,3 | 0,0 ± 0,0 | ||
| Результаты ЭЭГ за всю ночь ЭЭГ | 913 | ||||
| Возраст на момент записи ЭЭГ (лет): среднее ± SD | 6.7 ± 2,2 | 7,5 ± 1,7 | 8,9 ± 1,4 | ||
| Время между постановкой диагноза и ЭЭГ (мес.): Среднее ± СО | 6 ± 11 | 12 ± 12 | 20 ± 0,6 | ||
| SWI (%): медиана (диапазон) | 90 (62–100) | 91 (0–100) | 70 (46–95) | ||
| Нормальный фоновый узор (%) | 22 (76) | 10 (83) | 3 (100) | ||
| Наличие явлений сна (%) | 24 (83) | 11 (92) | 3 (100) | ||
| Распределение эпилептиформной активности во сне | |||||
| Обобщенный | 9 (31%) | 4 (33%) | 1 (33%) | ||
| Мультифокальный двусторонний | 8 (28%) 913 171343 2 ) | 1 (33%) | |||
| Мультифокальный односторонний | 5 (17%) | 0 (0%) | 0 (0%) | ||
| Очаговое одностороннее | 7 (24%) | 4 (33%) | 1 (33%) | ||
| Эпилептиформных аномалий нет | 0 (0%) | 2 (17%) | 0 (0%) | ||
| Параллельное лечение AED | 19 (66%) | 10 (83%) | 2 (67 %) | ||
| Одновременное лечение бензодиазепинами | 5 (17%) | 6 (50%) | 1 (33%) | ||
| Параллельное лечение кортикостероидами | 5 (17%) 7 (17%) | 913% )0 (0%) | |||
| Нейропсихологические данные | |||||
| Общий IQ: среднее ± SD | 78 ± 17 ( n = 22) 84 ± 171343 n = 9) | 84 ± 5 ( n = 3) | |||
| Вербальный IQ : среднее ± стандартное отклонение | 84 ± 15 ( n = 18) | 87 ± 15 ( n = 8) | 88 ± 8 ( n = 3) | ||
| IQ эффективности: среднее ± SD | 84 ± 18 ( n = 19) | 84 ± 19 ( n = 9) | 83 ± 5 ( n = 3) | ||
| DQ (при отсутствии IQ ): среднее ± SD | 43 ± 37 ( n = 4) | 29 ± 10 ( n = 2) | |||
| Скорость обработки: среднее ± SD | 75 ± 15 ( n = 13) | 80 ± 21 ( n = 9) | 90 ± 6 ( n = 2) | ||
| Beery VMI: среднее ± SD | 89 ± 11 ( n = 19) | 85 ± 10 ( n = 9) | 87 ± 6 ( n = 3) | ||
| Память: диапазон цифр (WISC III): м ean ± SD | 7 ± 3 ( n = 12) | 8 ± 4 ( n = 8) | 8 ± 2 ( n = 3) | ||
| Словарный тест Peabody Picture: среднее ± SD | 105 ± 18 ( n = 10) | 95 ± 22 ( n = 7) | 91 ± 6 ( n = 3) | ||
| Наличие поведенческих проблем ( %) | 12 (41) | 6 (50) | 0 (0) |
Результаты ЭЭГ и NPA ( n = 44)
| Комбинация EEG ~ NPA . | Первый ( n = 29) . | Вторая ( n = 12) . | Третий ( n = 3) . | ||
|---|---|---|---|---|---|
| Время между ЭЭГ и НПА (месяцы): среднее ± SD | 1,1 ± 1,2 | 0,5 ± 1,3 | 0,0 ± 0,0 | ||
| Результаты ЭЭГ за всю ночь ЭЭГ | 913 | ||||
| Возраст на момент записи ЭЭГ (лет): среднее ± SD | 6.7 ± 2,2 | 7,5 ± 1,7 | 8,9 ± 1,4 | ||
| Время между постановкой диагноза и ЭЭГ (мес.): Среднее ± СО | 6 ± 11 | 12 ± 12 | 20 ± 0,6 | ||
| SWI (%): медиана (диапазон) | 90 (62–100) | 91 (0–100) | 70 (46–95) | ||
| Нормальный фоновый узор (%) | 22 (76) | 10 (83) | 3 (100) | ||
| Наличие явлений сна (%) | 24 (83) | 11 (92) | 3 (100) | ||
| Распределение эпилептиформной активности во сне | |||||
| Обобщенный | 9 (31%) | 4 (33%) | 1 (33%) | ||
| Мультифокальный двусторонний | 8 (28%) 913 171343 2 ) | 1 (33%) | |||
| Мультифокальный односторонний | 5 (17%) | 0 (0%) | 0 (0%) | ||
| Очаговое одностороннее | 7 (24%) | 4 (33%) | 1 (33%) | ||
| Эпилептиформных аномалий нет | 0 (0%) | 2 (17%) | 0 (0%) | ||
| Параллельное лечение AED | 19 (66%) | 10 (83%) | 2 (67 %) | ||
| Одновременное лечение бензодиазепинами | 5 (17%) | 6 (50%) | 1 (33%) | ||
| Параллельное лечение кортикостероидами | 5 (17%) 7 (17%) | 913% )0 (0%) | |||
| Нейропсихологические данные | |||||
| Общий IQ: среднее ± SD | 78 ± 17 ( n = 22) 84 ± 171343 n = 9) | 84 ± 5 ( n = 3) | |||
| Вербальный IQ : среднее ± стандартное отклонение | 84 ± 15 ( n = 18) | 87 ± 15 ( n = 8) | 88 ± 8 ( n = 3) | ||
| IQ эффективности: среднее ± SD | 84 ± 18 ( n = 19) | 84 ± 19 ( n = 9) | 83 ± 5 ( n = 3) | ||
| DQ (при отсутствии IQ ): среднее ± SD | 43 ± 37 ( n = 4) | 29 ± 10 ( n = 2) | |||
| Скорость обработки: среднее ± SD | 75 ± 15 ( n = 13) | 80 ± 21 ( n = 9) | 90 ± 6 ( n = 2) | ||
| Beery VMI: среднее ± SD | 89 ± 11 ( n = 19) | 85 ± 10 ( n = 9) | 87 ± 6 ( n = 3) | ||
| Память: диапазон цифр (WISC III): м ean ± SD | 7 ± 3 ( n = 12) | 8 ± 4 ( n = 8) | 8 ± 2 ( n = 3) | ||
| Словарный тест Peabody Picture: среднее ± SD | 105 ± 18 ( n = 10) | 95 ± 22 ( n = 7) | 91 ± 6 ( n = 3) | ||
| Наличие поведенческих проблем ( %) | 12 (41) | 6 (50) | 0 (0) |
| Комбинация ЭЭГ ~ NPA . | Первый ( n = 29) . | Вторая ( n = 12) . | Третий ( n = 3) . | ||
|---|---|---|---|---|---|
| Время между ЭЭГ и НПА (месяцы): среднее ± SD | 1,1 ± 1,2 | 0,5 ± 1,3 | 0,0 ± 0,0 | ||
| Результаты ЭЭГ за всю ночь ЭЭГ | 913 | ||||
| Возраст на момент записи ЭЭГ (лет): среднее ± SD | 6.7 ± 2,2 | 7,5 ± 1,7 | 8,9 ± 1,4 | ||
| Время между постановкой диагноза и ЭЭГ (мес.): Среднее ± СО | 6 ± 11 | 12 ± 12 | 20 ± 0,6 | ||
| SWI (%): медиана (диапазон) | 90 (62–100) | 91 (0–100) | 70 (46–95) | ||
| Нормальный фоновый узор (%) | 22 (76) | 10 (83) | 3 (100) | ||
| Наличие явлений сна (%) | 24 (83) | 11 (92) | 3 (100) | ||
| Распределение эпилептиформной активности во сне | |||||
| Обобщенный | 9 (31%) | 4 (33%) | 1 (33%) | ||
| Мультифокальный двусторонний | 8 (28%) 913 171343 2 ) | 1 (33%) | |||
| Мультифокальный односторонний | 5 (17%) | 0 (0%) | 0 (0%) | ||
| Очаговое одностороннее | 7 (24%) | 4 (33%) | 1 (33%) | ||
| Эпилептиформных аномалий нет | 0 (0%) | 2 (17%) | 0 (0%) | ||
| Параллельное лечение AED | 19 (66%) | 10 (83%) | 2 (67 %) | ||
| Одновременное лечение бензодиазепинами | 5 (17%) | 6 (50%) | 1 (33%) | ||
| Параллельное лечение кортикостероидами | 5 (17%) 7 (17%) | 913% )0 (0%) | |||
| Нейропсихологические данные | |||||
| Общий IQ: среднее ± SD | 78 ± 17 ( n = 22) 84 ± 171343 n = 9) | 84 ± 5 ( n = 3) | |||
| Вербальный IQ : среднее ± стандартное отклонение | 84 ± 15 ( n = 18) | 87 ± 15 ( n = 8) | 88 ± 8 ( n = 3) | ||
| IQ эффективности: среднее ± SD | 84 ± 18 ( n = 19) | 84 ± 19 ( n = 9) | 83 ± 5 ( n = 3) | ||
| DQ (при отсутствии IQ ): среднее ± SD | 43 ± 37 ( n = 4) | 29 ± 10 ( n = 2) | |||
| Скорость обработки: среднее ± SD | 75 ± 15 ( n = 13) | 80 ± 21 ( n = 9) | 90 ± 6 ( n = 2) | ||
| Beery VMI: среднее ± SD | 89 ± 11 ( n = 19) | 85 ± 10 ( n = 9) | 87 ± 6 ( n = 3) | ||
| Память: диапазон цифр (WISC III): м ean ± SD | 7 ± 3 ( n = 12) | 8 ± 4 ( n = 8) | 8 ± 2 ( n = 3) | ||
| Словарный тест Peabody Picture: среднее ± SD | 105 ± 18 ( n = 10) | 95 ± 22 ( n = 7) | 91 ± 6 ( n = 3) | ||
| Наличие поведенческих проблем ( %) | 12 (41) | 6 (50) | 0 (0) |
Медленноволновые характеристики, ночной курс и региональные различия
Средняя (± SD ) амплитуда медленных волн на всех электродах составляла 67 ± 19 мкВ в FH и снижалась до 41 ± 14 мкВ в LH не-REM-сна (-38%).Среднее значение абсолютного наклона медленных волн снизилось с 322 ± 94 в FH до 187 ± 67 мкВ / с в LH (-41%). Средняя нормализованная крутизна (при 75 мкВ, обозначаемая как SWS в следующих анализах) по всем электродам снизилась с 357 ± 19 до 327 ± 22 мкВ / с (-8%, p <0,001). SWS в LH не-REM-сна была значительно ниже, чем во время FH не-REM-сна для всех электродных областей ( p <0,001 для всех электродов, фокусирующих электродов, нефокусированных электродов, а также электродов DMN).SWS была выше в фокусе, чем в нефокусных электродах, как в FH, так и в LH (оба p <0,001). Относительное изменение SWS от FH к LH не-REM-сна было различным между фокусирующими и нефокусирующими электродами (-5,6% для фокусирующих электродов и -8,7% для нефокусных электродов; p = 0,003). Ночной курс SWS показан на Рисунке 1. Подробный обзор ночного медленного курса для всех интересующих регионов представлен в Таблице S1.
Рисунок 1.
Ночной курс SWS. Различия проверялись зависимыми тестами t ; ** p <0,01, *** p <0,001.
Рисунок 1.
Ночной курс SWS. Различия проверены с помощью зависимых t -тестов; ** p <0,01, *** p <0,001.
Связь между SWS и SWI
Среднее значение SWS при 75 мкВ на всех электродах в ЛГ не-REM-сна значимо коррелировало с SWI (rho 0.37; p = 0,049), тогда как SWS в изменении FH и SWS не были достоверно коррелированы с SWI (rho 0,26; p = 0,17 и rho 0,12; p = 0,53). SWS LH в фокусных электродах продемонстрировал незначительную тенденцию к положительной корреляции с SWI (rho 0,36; p = 0,054), в то время как другие характеристики медленных волн для фокусирующего и нефокусного электродов не были достоверно коррелированы с SWI. (Таблица S2).
Поперечное сечение между изменением наклона за ночь, исходными характеристиками пациента, результатами ЭЭГ и нейропсихологическим функционированием при первом комбинированном исследовании.
Среди клинических переменных тяжесть аномалий развития до начала ESES была тесно связана с TIQ и VIQ ( β = −15,7, p = 0,001, коэффициент Коэна f 2 = 0,71 и β = — 12,7, p = 0,01, Cohen f 2 = 0,47) на протяжении болезни (таблица 3). Процент времени, занятого эпилептиформными разрядами, также коррелировал с нейропсихологическим функционированием: чем выше SWI, тем ниже TIQ и PIQ ( β = -0.7, p = 0,04, Коэна f 2 = 0,24 и β = -0,8, p = 0,01, Коэна f 2 = 0,44). Среднее изменение относительного наклона (при 75 мкВ) для всех электродов, фокусных, нефокусных и DMN-электродов не было связано с нейропсихологическими результатами в этом анализе (Таблица 3).
Таблица 3. Одномерный линейный регрессионный анализклинических данных, результатов ЭЭГ и NPA для первой комбинации WN EEG ~ NPA
| . | TIQ β ( P -значение) . | VIQ β ( P -значение) . | PIQ β ( P -значение) . | PS β ( P -значение) . | VMI β ( P -значение) . | DS β ( P -значение) . |
|---|---|---|---|---|---|---|
| Нарушения МРТ | 1.8 (0,81) | −9,0 (0,22) | 1,4 (0,87) | 7,3 (0,41) | −7,9 (0,11) | −3,8 (0,04), f 2 = 0,55 |
| Частота припадков | -0,5 (0,88) | -0,1 (0,97) | -1,0 (0,77) | 1,8 (0,63) | -1,4 (0,51) | 1,0 (0,21347) |
| Наличие / степень нарушения развития до ESES | −15.7 (0,001), f 2 = 0,71 | −12,7 (0,01), f 2 = 0,47 | −11,1 (0,07) | — 11,6 (0,18) | −5,5 (0,19) | −1,4 (0,39) |
| SWI | −0,7 (0,04), f 2 = 0,24 | −0,5 ( 0,12) | -0,8 (0.01), f 2 = 0,44 | -0,34 (0,39) | -0,37 (0,09) | 0,06 (0,57) |
| Явления сна | 7,0 (0,5143) | 5,1 (0,60)18,7 (0,09) | 10,4 (0,40) | 10,1 (0,14) | 1,18 (0,75) | |
| Изменение относительного наклона всех электродов (при 75 мкВ) | −14,1 (0,84) | 51,4 (0,81) | −21.5 (0,76) | 0,3 (1,00) | 52,6 (0,21) | -0,02 (0,99) |
| Изменение относительного наклона фокуса (при 75 мкВ) | 10,5 (0,83) | 30,4 (0,51) | -29,2 (0,55) | -33,8 (0,50) | 33,8 (0,25) | -0,01 (0,99) |
| Изменение относительного наклона вне фокуса (при 75 мкВ) | -19,3 (0,78) | 55,0 (0,42) | −3,4 (0,96) | 29,5 (0,71) | 55.1 (0,20) | 0,4 (0,98) |
| Изменение относительного наклона DMN (при 75 мкВ) | −19,1 (0,80) | 48,9 (0,52) | −18,7 (0,81) | 0,9 (0,99) | 45,1 (0,33) | 2,0 (0,91) |
| . | TIQ β ( P -значение) . | VIQ β ( P -значение) . | PIQ β ( P -значение) . | PS β ( P -значение) . | VMI β ( P -значение) . | DS β ( P -значение) . |
|---|---|---|---|---|---|---|
| Нарушения МРТ | 1,8 (0,81) | -9,0 (0,22) | 1,4 (0,87) | 7,3 (0,41) | -7,9 (0,11) | 9004) -3,871 (0,071) f 2 = 0.55 |
| Частота приступов | -0,5 (0,88) | -0,1 (0,97) | -1,0 (0,77) | 1,8 (0,63) | -1,4 (0,51) | 1,0 (0,21347) |
| Наличие / степень нарушения развития до ESES | −15,7 (0,001), f 2 = 0,71 | −12,7 (0,01), f 2 = 0.47 | −11,1 (0,07) | −11,6 (0,18) | −5,5 (0,19) | −1,4 (0,39) |
| SWI | −0,7 (0,04), f 2 = 0,24 | −0,5 (0,12) | −0,8 (0,01), f 2 = 0,44 | −0,34 (0,39) | −0,37 (0,09) | 0,06 (0,57) |
| Явления сна | 7.0 (0,51) | 5,1 (0,60) | 18,7 (0,09) | 10,4 (0,40) | 10,1 (0,14) | 1,18 (0,75) |
| Изменение относительного наклона всех электродов (при 75 мкВ) | -14,1 (0,84) | 51,4 (0,81) | -21,5 (0,76) | 0,3 (1,00) | 52,6 (0,21) | -0,02 (0,99) |
| Изменение относительного наклона фокуса (при 75 мкВ) | 10,5 (0,83) | 30,4 (0,51) | −29.2 (0,55) | -33,8 (0,50) | 33,8 (0,25) | -0,01 (0,99) |
| Нефокусное относительное изменение наклона (при 75 мкВ) | -19,3 (0,78) | 55,0 ( 0,42) | -3,4 (0,96) | 29,5 (0,71) | 55,1 (0,20) | 0,4 (0,98) |
| Изменение относительного наклона DMN (при 75 мкВ) | -19,1 (0,80) | 48,9 (0,52) | −18,7 (0,81) | 0,9 (0,99) | 45.1 (0,33) | 2,0 (0,91) |
Одномерный линейный регрессионный анализ клинических данных, результатов ЭЭГ и NPA первой комбинации WN EEG ~ NPA
| . | TIQ β ( P -значение) . | VIQ β ( P -значение) . | PIQ β ( P -значение) . | PS β ( P -значение) . | VMI β ( P -значение) . | DS β ( P -значение) . | |
|---|---|---|---|---|---|---|---|
| Нарушения МРТ | 1,8 (0,81) | -9,0 (0,22) | 1,4 (0,87) | 7,3 (0,41) | -7,9 (0,11) | 9004) -3,871 (0,071) f 2 = 0,55 | |
| Частота припадков | −0.5 (0,88) | -0,1 (0,97) | -1,0 (0,77) | 1,8 (0,63) | -1,4 (0,51) | 1,0 (0,22) | |
| Наличие / серьезность дефицита развития до ESES | −15,7 (0,001), f 2 = 0,71 | −12,7 (0,01), f 2 = 0,47 | −11,1 (0,07) | −11,6 (0,18) | −5.5 (0,19) | -1,4 (0,39) | |
| SWI | -0,7 (0,04), f 2 = 0,24 | -0,5 (0,12) | -0,8 (0,01), f 2 = 0,44 | -0,34 (0,39) | -0,37 (0,09) | 0,06 (0,57) | |
| Явления сна | 7,0 (0,51) | 7,0 (0,51) | 5,1 (0,60) | 18.7 (0,09) | 10,4 (0,40) | 10,1 (0,14) | 1,18 (0,75) |
| Изменение относительного наклона всех электродов (при 75 мкВ) | −14,1 (0,84) | 51,4 (0,81) | −21,5 (0,76) | 0,3 (1,00) | 52,6 (0,21) | −0,02 (0,99) | |
| Изменение относительного наклона фокуса (при 75 мкВ) | 10,5 (0,83) | 30,4 (0,51) | -29,2 (0,55) | -33,8 (0,50) | 33.8 (0,25) | -0,01 (0,99) | |
| Несфокусированное изменение относительного наклона (при 75 мкВ) | -19,3 (0,78) | 55,0 (0,42) | -3,4 (0,96) | 29,5 ( 0,71) | 55,1 (0,20) | 0,4 (0,98) | |
| Изменение относительного наклона DMN (при 75 мкВ) | −19,1 (0,80) | 48,9 (0,52) | −18,7 (0,81) | 0,9 (0,99) | 45,1 (0,33) | 2,0 (0,91) |
| . | TIQ β ( P -значение) . | VIQ β ( P -значение) . | PIQ β ( P -значение) . | PS β ( P -значение) . | VMI β ( P -значение) . | DS β ( P -значение) . |
|---|---|---|---|---|---|---|
| Нарушения МРТ | 1.8 (0,81) | −9,0 (0,22) | 1,4 (0,87) | 7,3 (0,41) | −7,9 (0,11) | −3,8 (0,04), f 2 = 0,55 |
| Частота припадков | -0,5 (0,88) | -0,1 (0,97) | -1,0 (0,77) | 1,8 (0,63) | -1,4 (0,51) | 1,0 (0,21347) |
| Наличие / степень нарушения развития до ESES | −15.7 (0,001), f 2 = 0,71 | −12,7 (0,01), f 2 = 0,47 | −11,1 (0,07) | — 11,6 (0,18) | −5,5 (0,19) | −1,4 (0,39) |
| SWI | −0,7 (0,04), f 2 = 0,24 | −0,5 ( 0,12) | -0,8 (0.01), f 2 = 0,44 | -0,34 (0,39) | -0,37 (0,09) | 0,06 (0,57) |
| Явления сна | 7,0 (0,5143) | 5,1 (0,60)18,7 (0,09) | 10,4 (0,40) | 10,1 (0,14) | 1,18 (0,75) | |
| Изменение относительного наклона всех электродов (при 75 мкВ) | −14,1 (0,84) | 51,4 (0,81) | −21.5 (0,76) | 0,3 (1,00) | 52,6 (0,21) | -0,02 (0,99) |
| Изменение относительного наклона фокуса (при 75 мкВ) | 10,5 (0,83) | 30,4 (0,51) | -29,2 (0,55) | -33,8 (0,50) | 33,8 (0,25) | -0,01 (0,99) |
| Изменение относительного наклона вне фокуса (при 75 мкВ) | -19,3 (0,78) | 55,0 (0,42) | −3,4 (0,96) | 29,5 (0,71) | 55.1 (0,20) | 0,4 (0,98) |
| Изменение относительного наклона DMN (при 75 мкВ) | −19,1 (0,80) | 48,9 (0,52) | −18,7 (0,81) | 0,9 (0,99) | 45,1 (0,33) | 2,0 (0,91) |
Поперечная взаимосвязь между характеристиками медленных волн, SWI, результатами нейропсихологических тестов и лечением с поведением при первом исследовании.
Пациенты с поведенческими проблемами показали меньшее снижение SWS (при 75 мкВ), чем у пациентов без него, на всех электродах (−5.2% против −10,2%; p = 0,02), фокусирующие электроды (-0,9% против -8,8%; p = 0,006, рисунок 2), нефокусные электроды (-6,1% против -10,6%, p = 0,04), и электроды DMN (-5,9% против -11,3%; p = 0,02) (Таблица 4). SWI составил 84% для пациентов с и 90% для пациентов без поведенческих аномалий, и эта разница не была значимой ( p = 0,20). Результаты нейропсихологических тестов существенно не различались между пациентами с поведенческими проблемами и пациентами без них (Таблица S3).Наличие или отсутствие лечения AED, бензодиазепинами или стероидами на момент исследования не было связано с наличием или отсутствием поведенческих проблем (Таблица S4).
Таблица 4. Медленно-волновые характеристикидля пациентов с поведенческими проблемами и без них (первая комбинация ЭЭГ ~ NPA)
| . | Поведенческие проблемы ( n = 17) . | Нет проблем с поведением ( n = 12) . | P -значение . |
|---|---|---|---|
| Изменение относительного наклона всех электродов (при 75 мкВ) | −5,2% | −10,2% | 0,02 |
| Изменение относительного наклона фокуса (при 75 мкВ) | −0,943% — | −0,943% 913 8,8% | 0,006 |
| Нефокусное изменение относительного наклона (при 75 мкВ) | −6,1% | −10,6% | 0,04 |
| Изменение относительного наклона DMN (при 75 мкВ) − | .9% | −11,3% | 0,02 |
| . | Поведенческие проблемы ( n = 17) . | Нет проблем с поведением ( n = 12) . | P -значение . |
|---|---|---|---|
| Изменение относительного наклона всех электродов (при 75 мкВ) | −5,2% | −10,2% | 0,02 |
| Изменение относительного наклона фокуса (при 75 мкВ) | −0.9% | -8,8% | 0,006 |
| Несфокусированное изменение относительного наклона (при 75 мкВ) | −6,1% | −10,6% | 0,04 |
| Изменение относительного наклона DMN (при 75 мкВ) ) | −5,9% | −11,3% | 0,02 |
Медленно-волновые характеристики пациентов с поведенческими проблемами и без них (первая комбинация ЭЭГ ~ NPA)
| . | Поведенческие проблемы ( n = 17) . | Нет проблем с поведением ( n = 12) . | P -значение . |
|---|---|---|---|
| Изменение относительного наклона всех электродов (при 75 мкВ) | −5,2% | −10,2% | 0,02 |
| Изменение относительного наклона фокуса (при 75 мкВ) | −0,943% | −0,943% 913 8,8% | 0,006 |
| Изменение относительного наклона без фокуса (при 75 мкВ) | −6.1% | −10,6% | 0,04 |
| Изменение относительного наклона DMN (при 75 мкВ) | −5,9% | −11,3% | 0,02 |
| Поведенческие проблемы ( n = 17) . | Нет проблем с поведением ( n = 12) . | P -значение . | |
|---|---|---|---|
| Изменение относительного наклона всех электродов (при 75 мкВ) | −5.2% | −10,2% | 0,02 |
| Изменение относительного наклона фокуса (при 75 мкВ) | −0,9% | −8,8% | 0,006 |
| Изменение относительного наклона вне фокуса (при 75 мкВ) ) | −6,1% | −10,6% | 0,04 |
| Изменение относительного наклона DMN (при 75 мкВ) | −5,9% | −11,3% | 0,02 |
Рисунок 2.
Курс SWS в ночное время для пациентов с поведенческими аномалиями и без них.
Рис. 2.
Курс SWS в ночное время для пациентов с поведенческими аномалиями и без них.
Продольные изменения характеристик SWS по сравнению с изменениями SWI и субъективного повседневного функционирования
Из 12 пациентов с по крайней мере двумя комбинациями ЭЭГ ~ NPA, 3 показали улучшение SWI, а 9 показали субъективное улучшение повседневного функционирования между первой и второй временной точкой. Разница в ночном курсе SWS (при 75 мкВ) между их первой и второй комбинацией ЭЭГ ~ NPA не отличалась значимо для пациентов с улучшением SWI по сравнению с пациентами без улучшения SWI; также не было субъективного когнитивного улучшения, связанного с разницей в ночном курсе SWS (при 75 мкВ; Таблица 5).
Таблица 5. Медленно-волновые характеристикидля пациентов с улучшением SWI и без него, а также с ежедневным функционированием между первой и второй комбинацией ЭЭГ ~ NPA *
| . | Улучшение SWI . | . | . | Улучшение повседневного функционирования . | . | . |
|---|---|---|---|---|---|---|
| . | Да ( n = 3) † . | Нет ( n = 9) . | P -значение . | Да ( n = 9) . | Нет ( n = 3) . | P -значение . |
| Изменение относительного наклона всех электродов (при 75 мкВ) ~ разность | -1,2% | + 0,4% | 0.22 | + 2,2% | + 0,7% | 0,70 |
| Изменение относительного наклона фокуса (при 75 мкВ) ~ разница | + 0,7% | + 1,9% | 0,79 | + 1,8% | + 1,0% | 0,86 |
| Несфокусированное изменение относительного наклона (при 75 мкВ) ~ разница | -2,6% | + 3,5% | 0,11 | + 2,0% | + 0,7% | 0,67 | 913
| Изменение относительного наклона DMN (при 75 мкВ) ~ разность | -1.4% | + 3,5% | 0,29 | + 2,2% | + 2,5% | 0,95 |
| . | Улучшение SWI . | . | . | Улучшение повседневного функционирования . | . | . |
|---|---|---|---|---|---|---|
| . | Да ( n = 3) † . | Нет ( n = 9) . | P -значение . | Да ( n = 9) . | Нет ( n = 3) . | P -значение . |
| Изменение относительного наклона всех электродов (при 75 мкВ) ~ разность | -1,2% | + 0,4% | 0,22 | + 2,2% | + 0,7% | 0.70 |
| Изменение относительного наклона фокуса (при 75 мкВ) ~ разница | + 0,7% | + 1,9% | 0,79 | + 1,8% | + 1,0% | 0,86 |
| Относительный несфокусированный изменение наклона (при 75 мкВ) ~ разница | -2,6% | + 3,5% | 0,11 | + 2,0% | + 0,7% | 0,67 |
| DMN относительное изменение наклона (при 75 мкВ) ~ разница | -1,4% | +3.5% | 0,29 | + 2,2% | + 2,5% | 0,95 |
Медленно-волновые характеристики пациентов с и без улучшения SWI и ежедневного функционирования между первой и второй комбинацией ЭЭГ ~ NPA *
| . | Улучшение SWI . | . | . | Улучшение повседневного функционирования . | . | . |
|---|---|---|---|---|---|---|
| . | Да ( n = 3) † . | Нет ( n = 9) . | P -значение . | Да ( n = 9) . | Нет ( n = 3) . | P -значение . |
| Изменение относительного наклона всех электродов (при 75 мкВ) ~ разность | -1.2% | + 0,4% | 0,22 | + 2,2% | + 0,7% | 0,70 |
| Изменение относительного наклона фокуса (при 75 мкВ) ~ разница | + 0,7% | + 1,9% | 0,79 | + 1,8% | + 1,0% | 0,86 |
| Несфокусированное изменение относительного наклона (при 75 мкВ) ~ разница | -2,6% | + 3,5% | 0,11 | + 2,0% | + 0,7% | 0,67 |
| Изменение относительного наклона DMN (при 75 мкВ) ~ разность | -1.4% | + 3,5% | 0,29 | + 2,2% | + 2,5% | 0,95 |
| . | Улучшение SWI . | . | . | Улучшение повседневного функционирования . | . | . |
|---|---|---|---|---|---|---|
| . | Да ( n = 3) † . | Нет ( n = 9) . | P -значение . | Да ( n = 9) . | Нет ( n = 3) . | P -значение . |
| Изменение относительного наклона всех электродов (при 75 мкВ) ~ разность | -1,2% | + 0,4% | 0,22 | + 2,2% | + 0,7% | 0.70 |
| Изменение относительного наклона фокуса (при 75 мкВ) ~ разница | + 0,7% | + 1,9% | 0,79 | + 1,8% | + 1,0% | 0,86 |
| Относительный несфокусированный изменение наклона (при 75 мкВ) ~ разница | -2,6% | + 3,5% | 0,11 | + 2,0% | + 0,7% | 0,67 |
| DMN относительное изменение наклона (при 75 мкВ) ~ разница | -1,4% | +3.5% | 0,29 | + 2,2% | + 2,5% | 0,95 |
Анализ смешанной модели пациентов с множественными комбинациями ЭЭГ ~ NPA не показал значимой корреляции ночного курса SWS (при 75 мкВ) с TIQ , VIQ, PIQ, PS, VMI или диапазон цифр (Таблица S5).
Обсуждение
В этом исследовании пациентов с эпилептической энцефалопатией с ЭСЭС мы обнаружили, что: (1) снижение SWS в ночное время менее выражено в электродах, представляющих эпилептический очаг, по сравнению с электродами без фокуса, следовательно, медленноволновой гомеостаз в большей степени изменен в эпилептический очаг; (2) при поперечном сравнении между пациентами, нервное развитие, измеренное с помощью NPA, не связано с ночным курсом SWS у пациентов.Пациенты с поведенческими проблемами имеют более нарушенное снижение SWS по сравнению с пациентами, у которых нет заявленных или диагностированных поведенческих проблем, при этом наибольшая разница наблюдается в фокусирующих электродах. (3) Продольные изменения в течении SWS в течение ночи не были связаны с продольными изменениями SWI и результатов нейропсихологических тестов или субъективным улучшением повседневного функционирования.
Обнаруженная нами разница в ночном ходе SWS между фокусирующими и нефокусирующими электродами соответствует предыдущим наблюдениям.В исследовании с участием 14 пациентов с ESES SWS существенно не различалась между фокусирующими и нефокусирующими электродами в FH сна, в то время как в LH нефокусированные электроды показали меньшую SWS. Авторы обнаружили, что относительное снижение SWS просто незначительно различается между фокусирующим и нефокусным электродами [31]. В нашем исследовании эти параметры дополнительно оценивались на более широкой когорте из 29 пациентов и было обнаружено, что как FH, так и LH SWS выше в фокусирующих электродах по сравнению с нефокусированными электродами, и что снижение SWS на фокусирующих электродах менее заметно по сравнению с не-фокусирующими электродами. фокусирующие электроды.Эти данные предоставляют дополнительные доказательства того, что уменьшение масштаба медленных волн локально нарушается эпилептиформной активностью у детей с эпилептической энцефалопатией с ЭЭС, и предполагают, что на локальный синаптический гомеостаз могут влиять спайковые волны.
В отличие от наших ожиданий, мы не обнаружили связи между ночным курсом SWS и результатами нейропсихологических тестов. Предыдущие исследования связывали медленноволновый сон с обучением, показывая, что SWA увеличивается локально в начале сна после задачи визуального обучения [24] и что снижение гомеостатического снижения SWS коррелирует с плохим дневным зрительно-моторным обучением [26].Другое исследование показало, что нормальное улучшение производительности в течение ночи при выполнении задания на память отсутствовало у пациентов с преобладающей эпилептической активностью во время сна и, по крайней мере, в одном задании, связанном с плотностью всплесков волн, и предположило, что это может отражать нарушение консолидации памяти, связанной со сном [37 ]. То, что мы не обнаружили связи между ночным курсом SWS и результатами нейропсихологических тестов в нашем перекрестном (между пациентами) анализе, можно отнести к нескольким аспектам:
контексту огромной изменчивости характеристик пациентов.Наличие структурных поражений, ранее существовавшие нарушения развития, локализация аномалий тройничного нерва и лечение могут объяснить большую часть вариабельности результатов тестов у детей с эпилептической энцефалопатией с ESES [11, 38-40]. Это возможное объяснение подтверждается наблюдением, что в нашем линейном регрессионном анализе аномалии развития до ESES являются сильнейшим определяющим фактором TIQ и VIQ в течение ESES. Предыдущие исследования показали, что возраст на момент постановки диагноза ESES и продолжительность ESES являются важными детерминантами когнитивного функционирования; более раннее начало и более длительная продолжительность ESES связаны с худшим когнитивным исходом [39, 40].Кроме того, предыдущие исследования показали, что SWA демонстрирует возрастную эволюцию [41, 42]. Вариабельность этих факторов могла усложнить оценку связи ночного медленноволнового течения и результатов нейропсихологических тестов.
Мы предполагаем, что нейропсихологические тесты, которые мы использовали, были относительно нечувствительны к колебаниям, возникающим в контексте ESES. У значительной части включенных пациентов были ЭЭГ с очаговым ЭЭЭС (24% первых ЭЭГ, 33% второй и третьей ЭЭГ).Предыдущие публикации предполагали, что стандартный NPA может быть относительно нечувствительным к специфическим когнитивным нарушениям у детей с очаговым ЭСЭС [43, 44]. Следовательно, обычные нейропсихологические показатели результатов, которые мы проанализировали, могли быть нечувствительны к дефициту в контексте этих пациентов. Нечувствительность NPA к колебаниям в контексте ESES также была предложена в предыдущем исследовании. В этом исследовании мы обнаружили, что субъективное улучшение когнитивного функционирования после лечения не было существенно связано с улучшением TIQ и что снижение SWI было связано с субъективным улучшением когнитивных функций, в то время как оно не было связано с изменением TIQ [13].В наше текущее исследование мы также включили субъективное улучшение когнитивных функций, по оценке детского невролога во время амбулаторных посещений клиники. Их оценка была основана на информации, предоставленной родителями / опекунами ребенка. Часто информацию учителей сообщали родители во время визитов. Хотя это субъективный показатель результата, мы подумали, что он может представлять интерес, потому что субъективное улучшение может принимать любую форму и, следовательно, может быть более чувствительным к изменениям, касающимся конкретных недостатков у отдельного ребенка, по сравнению с NPA.Кроме того, субъективное улучшение может иметь большое клиническое значение. Однако в нашем текущем анализе ночного курса SWS по сравнению с субъективным улучшением функционирования в подгруппе пациентов с несколькими комбинациями ЭЭГ ~ NPA мы также не обнаружили взаимосвязи. Однако этот анализ был основан на относительно небольшом количестве пациентов ( n = 12).
Большинство из вышеупомянутых факторов, влияющих на развитие нервной системы, должны иметь меньшее влияние при анализе смешанной линейной модели (тем самым корректируя корреляцию между измерениями одного и того же пациента).Однако и в этом анализе мы не обнаружили связи между курсом SWS и результатами нейропсихологических тестов и субъективным когнитивным функционированием. Мы предполагаем, что относительно небольшой размер выборки пациентов с несколькими комбинациями ЭЭГ ~ NPA ( n = 12), возможно, был недостаточным для выявления связи или того, что изменение лечения (например, бензодиазепин и кортикостероиды) между временными точками размыло возможное соотношение. . Кроме того, в группе с комбинированной продольной оценкой ЭЭГ и NPA у большинства пациентов по-прежнему был высокий SWI во время второго и третьего периода наблюдения (9 из 12 пациентов и 2 из 3 пациентов, соответственно).Это говорит о том, что эти пациенты все еще находились в активной фазе ESES и что явные нейропсихологические нарушения могли появиться позже.
Интересно, что мы обнаружили связь между поведенческими проблемами и курсом SWS в течение ночи. Для всех комбинаций электродов (среднее значение для всех электродов, электродов для фокусировки, без фокусировки и электродов DMN) SWS показал меньшее снижение для пациентов с поведенческими проблемами по сравнению с пациентами без зарегистрированных или диагностированных поведенческих проблем, и эта разница была наиболее выраженной для пациентов с поведенческими проблемами. фокусирующие электроды.Мы предполагаем, что поведение пациентов с ЭСЭС, как было предложено в предыдущем исследовании [45], легко колеблется и, следовательно, более тесно связано с медленноволновым гомеостазом в определенный момент времени. Можно предположить значительный вклад лечения в эти колебания, однако мы не обнаружили никакой связи между терапией противоэпилептическими препаратами, бензодиазепинами или кортикостероидами с наличием или отсутствием поведенческих проблем. Насколько нам известно, эта концепция не исследовалась в предыдущих исследованиях.
Наши результаты нужно интерпретировать осторожно. Во-первых, неоднородность исследуемой популяции, включая пациентов с впервые установленным диагнозом, а также с давним ЭСЭС, со структурной этиологией и без нее, с лечением и без него, увеличивает вариабельность и, следовательно, мешающие факторы ограничивают обобщаемость наших результатов. Однако неоднородность нашей когорты характерна для широкого спектра пациентов с ESES [1, 11]. Во-вторых, хотя мы использовали разные подходы, которые не дали четкой связи между характеристиками медленных волн и результатами нейропсихологических тестов, наше исследование не было разработано (и недостаточно мощным) для доказательства отсутствия связи.Более того, дизайн нашего исследования, связывающий ночной курс SWS с результатами нейропсихологических тестов одной тестовой сессии, мог быть недостаточным для анализа влияния ESES на синаптический гомеостаз. Тестирование за ночь Улучшение производительности (т. Е. Сравнение результатов теста до и после ночного сна) может быть лучшим методом для ответа на этот вопрос исследования.
В заключение, мы добавляем доказательства того, что у детей с ЭСЭС медленноволновый гомеостаз сна нарушается эпилептической активностью, поскольку больше всего на него влияет эпилептический очаг.Наличие поведенческих проблем связано с уменьшением масштабирования медленных волн, в то время как мы не обнаружили связи между ночным снижением SWS и результатами нейропсихологических тестов. Основываясь на ранее сообщенной взаимосвязи между медленными волнами и синхронизацией сети и косвенно синаптической силой, мы можем заключить, что синаптический гомеостаз нарушается эпилептиформной активностью у детей с ЭСЭС, самое большее в эпилептическом очаге; будущие исследования с ночной записью ЭЭГ и ночным нейропсихологическим тестированием с соответствующими тестами (т.е. тестирование перед сном и повторное тестирование после), может выяснить, объясняет ли это нарушение синаптического гомеостаза возникновение когнитивных нарушений.
Финансирование
Это исследование финансировалось Голландским фондом эпилепсии (Epilepsiefonds, грант 13–17) и Исследовательским фондом детской больницы Вильгельмина (грант R2634). Источники финансирования не принимали непосредственного участия в проведении исследования.
Заявление о конфликте интересов .Ничего не объявлено.
Благодарности
Мы благодарим детского нейропсихолога Моник ван Шоневельд за советы относительно дизайна исследования и интерпретации нейропсихологических результатов. Мы благодарим Eltje Bloemen, медсестру-исследователя, за ее участие в планировании ночных ЭЭГ, NPA, а также за ее общую поддержку и доступность для пациентов с ESES.
Список литературы
1.Санчес Фернандес
Я
, и другие.Электрический эпилептический статус во сне: клиника и патофизиология
.Pediatr Neurol.
2012
;47
(6
):390
—410
. 2.Никели
К
, и другие.Электрический эпилептический статус во сне
.Semin Pediatr Neurol.
2008
;15
(2
):50
—60
.3.Патри
G
, и другие.Субклинический «эпилептический электрический статус» у детей, вызванный сном. Клиническое и электроэнцефалографическое исследование шести пациентов
.Arch Neurol.
1971
;24
(3
):242
—252
. 4.Леска
G
, и другие.Мутации GRIN2A при приобретенной эпилептической афазии и родственных детских фокальных эпилепсиях и энцефалопатиях с речевой и языковой дисфункцией
.Nat Genet.
2013
;45
(9
):1061
—1066
. 5.Carvill
GL
, и другие.Мутации GRIN2A вызывают расстройства спектра эпилепсии-афазии
.Nat Genet.
2013
;45
(9
):1073
—1076
.6.Керсберген
кДж
, и другие.Неонатальное таламическое кровотечение тесно связано с эпилептическим электрическим статусом в медленноволновом сне
.Эпилепсия.
2013
;54
(4
):733
—740
. 7.Guzzetta
Ф
, и другие.Раннее повреждение таламуса, связанное с эпилепсией, и непрерывные спайк-волны во время медленного сна
.Эпилепсия.
2005
;46
(6
):889
—900
. 8.Лемке
JR
, и другие.Мутации в GRIN2A вызывают идиопатическую фокальную эпилепсию с роландическими шипами
.Nat Genet.
2013
;45
(9
):1067
—1072
.9.Scheltens-De Boer
м
.Рекомендации по ЭЭГ при энцефалопатии, связанной с ESES / CSWS у детей
.Эпилепсия
.2009
;50
:13
—17
.10.Ниссенкорн
А
, и другие.Влияние эпилептической активности во время сна на когнитивные способности при доброкачественной детской эпилепсии с центрально-височными спайками
.евро J Paediatr Neurol
.2017
;21
:858
—863
.11.Ван Хиртум-Дас
м
, и другие.Дети с ЭСЭС: вариабельность синдрома
.Epilepsy Res
.2006
;70
(Доп.1
):248
—258
. 12.ван ден Мункхоф
В
, и другие.Лечение эпилептического электрического статуса во сне: объединенный анализ 575 случаев
.Эпилепсия.
2015
;56
(11
):1738
—1746
. 13.ван ден Мункхоф
В
, и другие.Лечение эпилептического электрического статуса во сне: клинические характеристики, характеристики ЭЭГ и ответ на 147 процедур у 47 пациентов
.евро J Paediatr Neurol.
2018
;22
(1
):64
—71
. 14.Тонони
G
, и другие.Сон и синаптический гомеостаз: гипотеза
.Brain Res Bull.
2003
;62
(2
):143
—150
.15.Тонони
G
, и другие.Функция сна и синаптический гомеостаз
.Sleep Med Rev.
2006
;10
(1
):49
—62
. 16.Тонони
G
, и другие.Сон и цена пластичности: от синаптического и клеточного гомеостаза до консолидации и интеграции памяти
.Нейрон.
2014
;81
(1
):12
—34
. 17.de Vivo
л
, и другие.Ультраструктурные доказательства масштабирования синапсов в цикле бодрствования / сна
.Наука.
2017
;355
(6324
):507
—510
. 18.Вязовский
VV
, и другие.Гомеостаз сна и корковая синхронизация: II.Исследование потенциала локального поля медленных волн сна у крысы
.Сон.
2007
;30
(12
):1631
—1642
. 19.Риднер
BA
, и другие.Гомеостаз сна и корковая синхронизация: III. Исследование медленных волн сна у людей с помощью ЭЭГ высокой плотности
.Сон.
2007
;30
(12
):1643
—1657
.20.Массимини
м
, и другие.Медленное колебание сна в виде бегущей волны
.J Neurosci.
2004
;24
(31
):6862
—6870
. 21.Steriade
м
, и другие.Естественные состояния бодрствования и сна: вид изнутри нейронов неокортекса
.J Neurophysiol.
2001
;85
(5
):1969
—1985
.22.Вязовский
VV
, и другие.Корковое возбуждение и гомеостаз сна
.Нейрон.
2009
;63
(6
):865
—878
. 23.Эссер
СК
, и другие.Гомеостаз сна и корковая синхронизация: I. Моделирование влияния синаптической силы на медленные волны сна
.Сон.
2007
;30
(12
):1617
—1630
. 24.Хубер
R
, и другие.Локальный сон и обучение
.Природа
.2004
;430
(6995
):78
—81
. 25.Ngo
HV
, и другие.Звуковая стимуляция медленных колебаний сна с обратной связью улучшает память
.Нейрон.
2013
;78
(3
):545
—553
. 26.Болы
м
, и другие.Нарушение гомеостаза сна коррелирует с когнитивными нарушениями у пациентов с фокальной эпилепсией
.Мозг.
2017
;140
(4
):1026
—1040
. 27.Холмс
GL
, и другие.Роль интериктальных эпилептиформных аномалий в когнитивных нарушениях
.Epilepsy Behav.
2006
;8
(3
):504
—515
. 28.Тассинари
CA
, и другие.Познавательная и пароксизмальная активность на ЭЭГ: от одиночного всплеска до электрического эпилептического статуса во время сна
.Эпилепсия.
2006
;47
(Дополнение 2
):40
—43
.29.Рубболи
G
, и другие.Связь эпилепсии, нарушения сна и когнитивных нарушений при энцефалопатии, связанных с эпилептическим статусом во время медленного сна (ESES)
.Эпилептическое расстройство.
2019
;21
(S1
):1
—2
.30.Bölsterli
BK
, и другие.Нарушение медленного сна при энцефалопатии с эпилептическим статусом во время сна (ESES)
.Clin Neurophysiol.
2011
;122
(9
):1779
—1787
. 31.Bölsterli Heinzle
BK
, и другие.Местоположение и плотность спайковых волн нарушают сон медленными волнами у пациентов с CSWS (непрерывные спайковые волны во время сна)
.Эпилепсия.
2014
;55
(4
):584
—591
. 32.Bölsterli
BK
, и другие.Ремиссия энцефалопатии с эпилептическим статусом (ESES) во время сна перенормирует регуляцию медленного сна
.Эпилепсия.
2017
;58
(11
):1892
—1901
.33.Масса
R
, и другие.Критерии ЭЭГ для прогнозирования осложненного развития при идиопатической роландической эпилепсии
.Неврология.
2001
;57
(6
):1071
—1079
.34.Синячкин
м
, и другие.Нейронные сети у детей с непрерывными спайками и волнами во время медленного сна
.Мозг.
2010
;133
(9
):2798
—2813
.35.Джапаридзе
N
, и другие.Нейронные сети при эпилептических энцефалопатиях с CSWS
.Эпилепсия.
2016
;57
(8
):1245
—1255
.36.Ван де Стин
Ф
, и другие.Динамическое каузальное моделирование флуктуирующей связности в ЭЭГ в состоянии покоя
.Нейроизображение
.2019
;189
:476
—484
0,37.Галер
S
, и другие.Нарушение консолидации декларативных воспоминаний во сне при идиопатических фокальных эпилепсиях детского возраста
.Epilepsy Behav.
2015
;43
:16
—23
,38.Карабальо
правая
, и другие.Энцефалопатия с эпилептическим статусом во сне: необычные паттерны ЭЭГ
.Изъятие.
2015
;25
:117
—125
.39.Мальтони
л
, и другие.Долгосрочное наблюдение когнитивных функций у пациентов с непрерывными спайк-волнами во время сна (CSWS)
.Epilepsy Behav.
2016
;60
:211
—217
.40.Пера
MC
, и другие.Долгосрочная эволюция нейропсихологических компетенций при энцефалопатии с эпилептическим статусом во время сна: переменный прогноз
.Эпилепсия
.2013
;54
(Доп.7
):77
—85
. 41.Кэмпбелл
IG
, и другие.Продольные траектории небыстрых движений глаз дельта и тета ЭЭГ как индикаторы созревания мозга подростков
.Proc Natl Acad Sci USA.
2009
;106
(13
):5177
—5180
.42.Файнберг
Я
, и другие.Изменения в созревании амплитуды, частоты и цикличности электроэнцефалограммы сна человека с частотой от 0 до 3 Гц (дельта)
.Нарушение функции мозга
.1990
;3
:183
—192
.43.Куки
Я
, и другие.Эпилептическая энцефалопатия с непрерывными спайками и волнами в затылочно-височной области во время медленноволнового сна у двух пациентов с приобретенной дисграфией кандзи
.Эпилептическое расстройство.
2014
;16
(4
):540
—545
. 44.Тассинари
CA
, и другие.Фокальная ЭСЭС как селективная фокальная дисфункция головного мозга: проблема для клиницистов, возможность для когнитивных нейробиологов
.Эпилептическое расстройство.
2015
;17
(3
):345
—347
. 45.Зегмюллер
С
, и другие.Отдаленный исход когнитивной и поведенческой регрессии при нелолевой эпилепсии с непрерывными спайк-волнами во время медленноволнового сна
.Эпилепсия.
2012
;53
(6
):1067
—1076
.Заметки автора
© Общество исследования сна, 2020 г. Опубликовано Oxford University Press от имени Общества исследования сна.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-NonCommercial-NoDerivs (http://creativecommons.org/licenses/by-nc-nd/4.0/), которая разрешает некоммерческое воспроизведение и распространение. произведения на любом носителе при условии, что оригинальное произведение никоим образом не было изменено или преобразовано, и что произведение правильно процитировано.По вопросам коммерческого повторного использования обращайтесь по адресу [email protected].ESES Электрический эпилептический статус во время медленного сна
Это редкий эпилептический синдром. Чаще всего он развивается в среднем возрасте от 5 до 10 лет. Это также называется «непрерывная волна медленного сна» (CSWSS). Причина этого синдрома неизвестна. Обычно это случается у детей, у которых уже есть эпилепсия или другой эпилептический синдром. Эпилепсии и синдромы эпилепсии, при которых может возникать ЭСЭ, включают синдром Леннокса-Гасто, фокальные эпилепсии и, реже, самоограничивающуюся эпилепсию детства с центро-височными спайками (то, что раньше называлось «доброкачественной роландической эпилепсией детства» [BREC] или «доброкачественная эпилепсия детства с центро-височными спайками» [BECTS]).
ESES может возникать у детей с эпилептическим синдромом, причина которого не установлена. Но это также может случиться у детей, у которых причина известна. Эти причины включают повреждение головного мозга в результате нехватки кислорода при рождении, менингита, энцефалита или травмы головы. Это также может произойти, если мозг сформировался ненормально. Это называется корковой дисплазией и может затрагивать часть или весь мозг. ЭСЭС, которая возникает у ребенка с предыдущим повреждением головного мозга или аномально сформированным мозгом, обычно труднее лечить.
Существует еще более редкий синдром, называемый синдромом Ландау-Клеффнера, который также проявляет некоторые особенности ESES.
Симптомы
Первым признаком любой проблемы обычно является то, что скорость обучения ребенка значительно замедляется. У многих детей возникают проблемы либо с пониманием речи и языка (это называется рецептивной дисфазией), либо с выражением собственных мыслей (экспрессивная дисфазия) в форме разговорной речи. Также могут быть проблемы с чтением и кратковременной памятью.Некоторые дети могут усвоить новую информацию и задачи в течение нескольких дней или недель, но затем они, кажется, теряют то, чему они научились.
Развивается эпилепсия и могут возникать различные приступы как в течение дня, так и во сне. У многих детей будут атипичные абсансы (пустые), у некоторых — миоклонические (судорожные) приступы. У других будут очаговые двигательные припадки (припадки, включающие подергивания только одной стороны тела). Эти очаговые приступы возникают особенно ночью.Однако у некоторых детей с ЭСЭН не бывает припадков в ночное время.
Несмотря на то, что характер сна часто сильно нарушается из-за припадков, дети с ЭСЭС обычно просыпаются на следующее утро отдохнувшими.
Диагностика
Для постановки диагноза необходимо провести ЭЭГ. Он показывает непрерывные всплески и медленные волны эпилептической активности во время сна, особенно во время сна, называемого «медленноволновым» сном. Это часто бывает непрерывным и длится несколько минут, даже все время, пока ребенок находится в медленном сне.Вот почему ESES также называют «непрерывной спайк-волной медленного сна» (CSWSS). Медленный сон возникает при более глубоком сне после того, как ребенок проспал примерно 20-30 минут.
Из-за этого было бы необычно записывать медленный сон во время обычного амбулаторного приема ЭЭГ. Это связано с тем, что обычный прием длится всего 25-30 минут, и ребенку не хватает времени, чтобы достичь медленного сна, даже если он засыпает! Если есть подозрение на ESES, то ребенку потребуется гораздо более длительный амбулаторный прием, по крайней мере, от одного до двух часов.Как вариант, ЭЭГ нужно будет записывать в течение всей ночи. Обычно это можно сделать дома или, при необходимости, в больнице.
ЭЭГ часто бывает ненормальной, когда ребенок бодрствует, но в некоторых случаях она может быть нормальной. Название синдрома дало именно результаты ЭЭГ во время более глубокого сна ребенка (медленного сна).
Метаболические тесты (кровь), с помощью которых изучается, как работает организм, обычно дают нормальные результаты. Сканирование мозга с помощью магнитно-резонансной томографии (МРТ) может быть нормальным или показывать предыдущие повреждения, как указано выше.
Лечение
Важно, чтобы всех детей с ЭСЭС осматривал консультант по детской неврологии. Если судороги являются проблемой для ребенка, можно предложить лекарства от эпилепсии для контроля приступов. К ним относятся вальпроат натрия (Эпилим), леветирацетам (Кеппра), этосуксимид (Заронтин) и клобазам (Фризиум). Эти лекарства также могут лечить ESES, но это менее вероятно, чем лекарства, уменьшающие количество или полностью останавливающие приступы.
Иногда преднизолон (стероидный препарат) может быть эффективным при лечении ESES, но это лекарство требует тщательного контроля.Есть еще одно лекарство, называемое сультиамом (Осполот), которое также может быть полезным. Назначить эти лекарства может только специалист по детской эпилепсии.
Для некоторых детей CSWSS на их ЭЭГ не реагирует на какие-либо лекарства.
Если у вашего ребенка этот синдром, у него могут быть продолжительные или повторяющиеся приступы. Врач вашего ребенка обсудит с вами план «спасения» или неотложной помощи для лечения любых продолжительных или повторяющихся приступов.
Возможно, будут открыты исследования, относящиеся к этому синдрому эпилепсии.Лечащий врач вашего ребенка сможет обсудить это с вами.
Информацию о лечении детей можно найти на веб-сайте «Лекарства для детей».
Перспективы
Для большинства молодых людей улучшение ESES наблюдается в раннем подростковом возрасте. ЭЭГ может вернуться в норму во время медленного сна. Припадки становятся реже и могут даже полностью пройти. Примерно в это же время также наблюдается улучшение речи и языковых навыков и обучения. Однако это улучшение не всегда означает, что они будут нормально учиться.У некоторых останутся проблемы с обучением или поведением, либо и то, и другое. Редко ESES может продолжаться в детстве и во взрослой жизни. Если это произойдет, то перспективы обучения ухудшатся.
Поддержка
Контакты
Благотворительность для семей с детьми-инвалидами.
Бесплатный телефон доверия: 0808 808 3555
Веб-сайт : contact.org.uk
Электронная почта: [email protected]
Что такое синдром?
Синдром — это группа признаков и симптомов, которые в совокупности указывают на определенное заболевание.При эпилепсии примерами этих признаков и симптомов могут быть такие вещи, как возраст, в котором начинаются припадки, тип припадков, независимо от того, является ли ребенок мальчиком или девочкой, и есть ли у него физические недостатки или нарушения обучаемости, или и то, и другое. Результаты ЭЭГ также используются для выявления синдромов эпилепсии.
Если вы хотите узнать больше об эпилептическом синдроме, обратитесь к своему врачу.