особенности строения соединительной костной ткани и какую она выполняет функцию в организме
Клеточный состав костной ткани представлен остеоцитами, остеокластами и остеобластами. Они располагаются в межклеточном матриксе, на 70% состоящем из неорганических соединений (преимущественно кристаллов фосфатов кальция — гидроксиапатита) и на 30% — из органических веществ (коллагеновых волокон, межклеточного матрикса). Костная ткань выполняет в организме 2 основных функции — скелетная (опорная) и защитная (грудная клетка, череп), а также участвует в процессах кроветворения.
Под влиянием возрастных изменений, системных заболеваний и неблагоприятных факторов, кости способны разрушаться, что может приводить к необратимым последствиям для организма.
Почему важна профилактика заболеваний опорно-двигательной системы
Костная и хрящевая ткани выполняют важную функцию в организме. Вместе с мышцами и связками они формируют опорно-двигательный аппарат, который испытывает огромную нагрузку в течение всей жизни человека. Чтобы предупредить заболевания опорно-двигательного аппарата, врачи рекомендуют проводить ежедневную профилактику и придерживаться принципов здорового образа жизни.
Чтобы предупредить заболевания опорно-двигательного аппарата, врачи рекомендуют проводить ежедневную профилактику и придерживаться принципов здорового образа жизни.
Человек должен давать организму адекватную физическую нагрузку, правильно питаться, отказаться от вредных привычек и исключить факторы, негативно влияющие на состояние костно-хрящевой системы (подъём тяжестей, перепады температур, недостаток витаминов и минералов и т.д.). Основой профилактики является лечебная физическая культура (ЛФК).
Существуют специальные комплексы упражнений, направленные на укрепление костной, хрящевой и мышечной ткани, разработку суставов и увеличение их мобильности, лечение определённых патологий (остеохондроз, артроз, плоскостопие и другие). Любой гимнастический комплекс содержит в себе разминку (7-10 минут) и основную часть. Тренировки проводятся 2-3 раза в неделю во второй половине дня. В одно занятие обычно включается 5-10 упражнений, которые повторяются по кругу. Каждый подход состоит из 20-30 повторений.
При наличии конкретного заболевания гимнастический комплекс подбирается индивидуально врачом ЛФК. Также назначаются медикаментозные средства, направленные на уменьшение симптомов болезни и восстановление хрящевой ткани. Одним из таких препаратов является Терафлекс. Он стимулирует регенерацию хрящевых структур, замедляет процессы разрушения хрящевой ткани. После приёма Терафлекса в течение 3-6 мес снижается интенсивность боли в суставах, улучшается функция сустава[3]. (раздел фармакологическое действие)
Урок-презентация «Основные отделы скелета человека»
Добро пожаловать на урок!
Давайте вспомним! Положение человека в системе органического мира. Отличительные признаки животных. Какая система органов обеспечивает движение? Какие вы знаете скелеты, приведите примеры.
Внимание!
Исходя из сказанного, подумайте и попробуйте сформулировать тему урока.
Открытый урок: тема: Основные отделы скелета человека Учитель биологии КГУ лицей Токсанова Асемгуль Сериковна 2017 год Биология 8 класс
Цель урока: Цель урока: Изучить отделы скелета человека, сравнить со скелетом млекопитающих, сделать выводы.
Вспомним строение скелета у млекопитающих
? Типы соединительных тканей
Функции скелета Механическая: опора, движение защита. Метаболическая: участие костей в процессе обмена веществ. Кроветворная: осуществляется в костях, в губчатом веществе.
Отделы скелета: Отделы скелета: 1.Скелет головы- череп. 2.Скелет туловища: позвоночник, грудная клетка. 3.Скелет конечностей: а) Пояс верхних конечностей. б) Скелет верхних конечностей. в) Пояс нижних конечностей. г) Скелет нижних конечностей.
Задание в группах
1 группа
Изучить строение скелета головы ( лицевой и мозговой части) Заполнить таблицу и показать расположение костей на скелете. 2 группа
Изучить строение скелета туловища (позвоночника и грудной клетки) Заполнить таблицу и показать расположение костей на скелете.
3 группа
Изучить скелет конечностей (пояса конечностей, свободную верхнюю и нижнюю конечность) Заполнить таблицу и показать расположение костей на скелете.
2 группа
Изучить строение скелета туловища (позвоночника и грудной клетки) Заполнить таблицу и показать расположение костей на скелете.
3 группа
Изучить скелет конечностей (пояса конечностей, свободную верхнюю и нижнюю конечность) Заполнить таблицу и показать расположение костей на скелете.
Сводная таблица: «Строение скелета человека»
Отделы скелета
Чем образованы
Название костей
Соединение костей
Скелет головы
1.Лицевой отдел
2.Мозговой отдел
Скелет туловища
1.Грудная клетка
2.Позвоночник отделы:
— шейный
— грудной
— поясничный
-крестцовый
— копчиковый
Скелет конечностей
1.
Сравнение скелета человека и животного: 1. На основе изученного, перечислите сходства в скелетах и сделайте вывод! 2. Подумайте и назовите отличия в отделах скелета человека, с чем они связаны? Сделайте вывод!
Отличительные признаки в скелете человека (Антропоморфозы)
связаны
С прямохождением:
Позвоночник имеет четыре изгиба.
Грудная клетка расширена
в стороны.
Подвижное соединение костей
предплечья.
Широкий, в форме чаши тазовый
пояс.
Массивные нижние конечности.
Сводчатая форма стопы.
С трудовой
деятельностью:
Преобладает мозговой отдел
черепа.
Меньше развиты челюсти.
Подвижность пальцев.
Противопоставление большого
пальца остальным.
Выполните задание « Четвертый лишний», зачеркнув в каждом ряду лишнее понятие. 1. Скуловая кость, височная, верхнечелюстная, нижнечелюстная. 2. Лопатка, плечевая кость, локтевая, лучевая. 3. Грудина, ребра. Грудной отдел позвоночника, ключица. 4. Поясничный отдел, крестцовый, копчиковый, тазовые кости.
Выполни тест
1. Из каких отделов состоит скелет человека:
А) из 2-х
Б) из 3-х
В) из 4-х
2. Наиболее крупные кости лицевого отдела черепа:
А) скуловая;
Б) носовая;
В) лобная.
3. Крестцовый отдел позвоночника состоит из:
А) 12 позвонков;
Б) 5 позвонков;
В) 7позвонков.
4. Какие кости черепа подвижны:
А) носовая;
Б) нижняя челюсть;
В) скуловая;
5. Пояс нижних конечностей образуют:
А) тазовые кости;
Б) бедренная и берцовые кости;
В) крестец;
6. Скелет свободной верхней конечности образуют:
А) плечевая кость, лучевая и локтевая кости, кости кисти;
Б) лопатка и ключица;
В) ребра и грудина.
Ученые нашли кости в сердцах шимпанзе
В сердце шимпанзе могут образовываться кости, выяснили британские ученые. Это связано с фиброзными изменениями миокарда, однако пока неясно, опасна сама кость или, наоборот, имеет защитную функцию.
В сердце шимпанзе с возрастом могут образовываться кости, выяснили специалисты из Ноттингемского университета. «Газета.Ru» разобралась в выводах исследования, опубликованного в журнале Scientific reports.
Сердечная кость — os cordis — известна у нескольких видов животных, включая коз, волов, оленей и даже выдр.
Считается, что os cordis выполняет механическую функцию, поддерживая сокращения сердца и повышая выносливость, но точные ее функции неизвестны.
До этого образование сердечной кости не наблюдалось ни у шимпанзе, ни у других высших приматов, отмечают исследователи. Эта находка заставляет задуматься, насколько такие изменения возможны у человека.
«Открытие новой кости — редкое событие, особенно у шимпанзе, которые имеют анатомию, схожую с человеческой. В связи с этим возникает вопрос, может ли сердечная кость формироваться и у людей», — говорит анатом Катрин Рутланд.
В связи с этим возникает вопрос, может ли сердечная кость формироваться и у людей», — говорит анатом Катрин Рутланд.
Исследователи изучали с помощью компьютерной томографии структуру сердечного скелета — плотной соединительной ткани, которая поддерживает сердце — у высших приматов. Причиной смерти шимпанзе, в том числе и в дикой природе, часто становятся сердечные заболевания, и ученые собирались выяснить особенности этих болезней. Во время работы они обратили внимание на кальцификаты в сердцах некоторых шимпанзе. Это были пожилые животные, самой старой самке было 59 лет.
Проанализировав новообразования на микроскопическом уровне, исследователи установили, что эти структуры состояли местами из хрящевой ткани, местами — из костной, а иногда и из промежуточного типа ткани.
close
100%
Изменения наблюдались лишь у нескольких животных, поэтому можно предположить, что это лишь случайные индивидуальные анатомические особенности.
У человека минерализация сердечного скелета, как правило, обусловлена возрастом и связана с сердечно-сосудистыми заболеваниями. Хотя шимпанзе, по-видимому, не так склонны к проблемам с коронарными артериями, как люди, от болезней сердца рано или поздно страдают почти 70% взрослых шимпанзе, находящихся в неволе.
Наиболее распространенное сердечное заболевание у шимпанзе — идиопатический фиброз миокарда, который характеризуется накоплением фиброзной соединительной ткани. Это приводит к аритмии и внезапной остановке сердца.
Из 16 сердец шимпанзе, которые изучили исследователи, лишь в трех случаях не наблюдалось никаких признаков фиброза миокарда или каких-либо уплотнений. При этом в сердцах, пораженных фиброзом, наблюдались образования хрящей и костей, а также разрастание соединительной ткани.
«В семи сердцах мы обнаружили гиперплотные участки, к которым прилегали участки минерализации или костного образования, — пишут авторы работы.
«Значительная связь между присутствием os cordis и высоким уровнем фиброза позволяет предположить, что присутствие os cordis у шимпанзе может быть маркером заболевания, а не анатомической особенностью», — заключают ученые.
Фиброз миокарда у человекообразных обезьян изучен плохо, но если авторы правы и эта кость каким-то образом связана с заболеванием, это важное открытие — шимпанзе находятся под угрозой исчезновения, и своевременная борьба с сердечно-сосудистыми заболеваниями могла бы помочь сохранить им жизнь хотя бы в неволе.
Остается неясным, опасна ли сердечная кость для шимпанзе сама по себе. Возможно, она, наоборот, защищает сердечные клапаны.
«Клинические и функциональные последствия присутствия хряща и костной ткани в сердечном скелете шимпанзе еще предстоит выяснить», — пишут исследователи.
Ранее новую кость обнаружили и у людей — вернее, хорошо забытую старую. Фабелла — небольшая кость в составе человеческого скелета, когда-то считавшаяся утраченной в ходе эволюции, вновь стала часто встречаться по истечении довольно короткого периода времени. Фабелла коленного сустава, согласно анатомическому строению, представляет собой сесамовидную кость, которая расположена во внутренней поверхности икроножной мышцы и присоединяется к заднему мыщелку бедра.
Фабелла — небольшая кость в составе человеческого скелета, когда-то считавшаяся утраченной в ходе эволюции, вновь стала часто встречаться по истечении довольно короткого периода времени. Фабелла коленного сустава, согласно анатомическому строению, представляет собой сесамовидную кость, которая расположена во внутренней поверхности икроножной мышцы и присоединяется к заднему мыщелку бедра.
Если в 1918 году фабелла встречалась в среднем лишь у 11,2% популяции, то спустя век этот показатель вырос в 3,5 раза и достиг 39%.
Причины, по которым она стала встречаться чаще, пока неизвестны.
Механическая нагрузка на кости — Physiopedia
Костная масса регулируется как механическими, так и биохимическими раздражителями. Как и мышцы, кости добавляют массу, когда они нагружены (физическая активность), и теряют массу, если они не работают (иммобилизация или время, проведенное в условиях низкой или невесомости) [1]
Smart Material : Кость — замечательная жизнь материал, который бывает двух форм с разной пористостью и разной макроструктурой, но с одинаковой высокоорганизованной микроструктурой и наноструктурой. По мере накопления повреждений кость удаляется и заменяется. Когда механические требования к кости увеличиваются, масса кости увеличивается, в то время как уменьшение нагрузки приводит к удалению кости, таким образом, кость можно рассматривать как «умный материал».
По мере накопления повреждений кость удаляется и заменяется. Когда механические требования к кости увеличиваются, масса кости увеличивается, в то время как уменьшение нагрузки приводит к удалению кости, таким образом, кость можно рассматривать как «умный материал».
Ремоделирование : Постоянное замещение старой костной ткани новой костной тканью называется ремоделированием. Формирование, восстановление и ремоделирование костей контролируется и производится четырьмя типами клеток, а именно остеобластами, остеокластами, остеоцитами и клетками выстилки кости.Ремоделирование костей регулируется сигналами к этим клеткам, генерируемыми механической нагрузкой. Как именно нагрузка передается в кость, как костные клетки воспринимают эту нагрузку и как сигналы переводятся в формирование или удаление кости, неизвестно [2] .
Основным датчиком механических сил является сеть остеоцитов, которая передает приказы эффекторным клеткам, то есть остеокластам и остеобластам, путем секреции нескольких цитокинов, которые модулируют концентрацию костного микроокружения.
Остеоциты:
- Наибольшее количество клеток в костях (90-95% всех костных клеток) с длинными дендритными отростками для связи с окружающими клетками.
- Обнаруживает изменение деформации под действием нагрузки и посылает сигналы остеобластам и остеокластам для восстановления и укрепления кости.
- Биохимическая реакция, запускаемая этими механочувствительными остеоцитами, приводит к остеогенезу (образованию новой кости).
Ключевые молекулы в восприятии и преобразовании:
- Кальциевые каналы (ионный канал, который показывает избирательную проницаемость для ионов кальция)
- MAP-киназы (участвуют в клеточных ответах на различные стимулы и регулируют рост, цикл, дифференцировку, митоз и апоптоз клеток).
Реакция кости на механические призывы будет зависеть от качества этих призывов, как с точки зрения интенсивности, так и частоты. Из-за снижения чувствительности системы при непрерывной нагрузке ожидается прерывистая активность, которая, как было показано, более эффективна.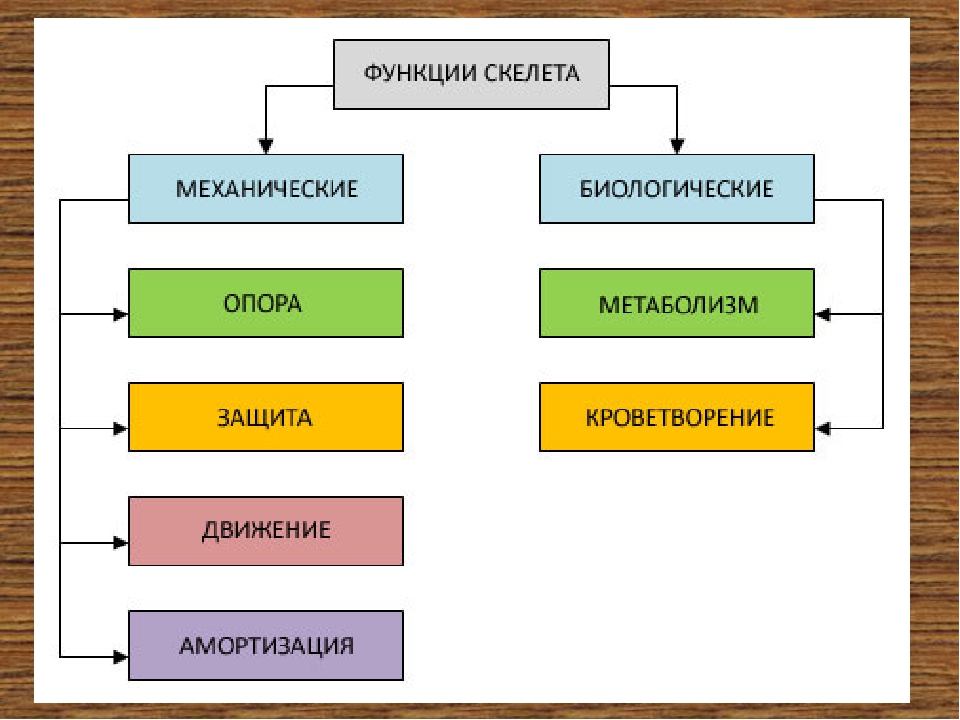 Ответ также будет зависеть от чувствительности сенсора, которая снижается с возрастом и регулируется гормональной средой, особенно эстрогенами. [3] Исследование, проведенное в 2002 году Robling et. al.обнаружили, что участники набирали больше костной массы, разбивая сеансы нагрузки на несколько более мелких сеансов, разделенных периодами восстановления, по сравнению с участниками, завершившими всю нагрузку за один непрерывный сеанс [4] .
Ответ также будет зависеть от чувствительности сенсора, которая снижается с возрастом и регулируется гормональной средой, особенно эстрогенами. [3] Исследование, проведенное в 2002 году Robling et. al.обнаружили, что участники набирали больше костной массы, разбивая сеансы нагрузки на несколько более мелких сеансов, разделенных периодами восстановления, по сравнению с участниками, завершившими всю нагрузку за один непрерывный сеанс [4] .
Когда мы просто стоим прямо, простое действие сопротивления гравитации создает нагрузку на кости, но наше тело хорошо приспособлено к этой нагрузке. Чтобы укрепить кости, необходима гораздо более высокая нагрузка, то есть большее сжатие и изгиб, чтобы наши тела тратили необходимую энергию и ресурсы.
Нагрузку на кость можно измерить, кратную массе тела. Чем выше нагрузка, тем лучше активность стимулирует рост костей. Большинство физических нагрузок в определенной степени нагружают кости, но для сильной остеогенной стимуляции нагрузка должна примерно в 4 раза превышать массу тела. Расчеты, кратные массе тела, для обычных физических нагрузок выглядят следующим образом:
Расчеты, кратные массе тела, для обычных физических нагрузок выглядят следующим образом:
- Плавание: 0 (Ваша нагрузка фактически уменьшается в воде.)
- Стоянка: 1
- Быстрая ходьба: 1-2
- Бег / бег трусцой: 3–4
- Силовые прыжки: 4+
- Сопротивление, силовая тренировка: от 4 до 10 (в зависимости от удара.) [5]
Что это значит для физиотерапевта? [Править | править источник]
Большинство физических нагрузок в определенной степени нагружают кости, но для сильной остеогенной стимуляции нагрузка должна примерно в 4 раза превышать массу тела.- Однако при таком увеличении массы тела безопасность становится проблемой. Любая кость поддастся перелому при нагрузках, превышающих ее возможности. При тренировках с высокой кратной массой тела требуется профессиональное руководство.
- Было доказано, что многие программы безопасных тренировок с ударом способствуют наращиванию костей
- Помимо воздействия физической активности на кости, она также влияет на мышечную массу и силу, что способствует предотвращению падений и переломов. [3] [5]
- ↑ Gusmão CVB de, Belangero WD. КАК КОСТНЫЕ КЛЕТКИ ЧУВСТВУЮТ МЕХАНИЧЕСКОЙ НАГРУЗКЕ? Revista Brasileira de Ortopedia . 2009; 44 (4): 299-305. DOI: 10.1016 / S2255-4971 (15) 30157-9.
- ↑ Mellon SJ, Tanner KE. Кость и ее адаптация к механической нагрузке: обзор. Международные обзоры материалов. 2012 сентябрь 1; 57 (5): 235-55 Доступно: https://www.tandfonline.com/doi/full/10.1179/1743280412Y.0000000008 (дата обращения 17.6.2021)
- ↑ 3.0 3,1 Бергманн П., Боди Дж. Дж., Боонен С., Бутсен Й., Девогелаер Дж. П., Гоэмэре С., Кауфман Дж., Регинстер Дж. Ю., Розенберг С. Нагрузка, развитие и обслуживание скелета. Журнал остеопороза. 2011 г., 1 января 2011 г. Доступно: https://www.hindawi.com/journals/jos/2011/786752/#summary-and-conclusion (дата обращения 17.6.2021)
- ↑ Klein-Nulend J, Bacabec RG, Bakker AD. Механическая нагрузка и ее влияние на костные клетки: роль цитоскелета остеоцитов в поддержании нашего скелета. Eur Cell Mater.2012; 24 (24): 278-91.
- ↑ 5,0 5,1 Лучшие кости OL Доступно: https://www.betterbones.com/exercise/osteogenic-loading/ (дата обращения 17.6.2021)
Измерения глобального и локального напряжения в биомиметических тканях скелетных мышц выявляют ранний механический гомеостаз
Возрастающая важность механобиологии продемонстрировала, что механическое взаимодействие между клетками, а также силы жесткости и растяжения обеспечивают важные сигнальные элементы для клеточной биологии и судьбы клеток.Мышечная ткань по своей природе подвержена большим силам и быстрым изменениям напряжения и жесткости. Следовательно, следует ожидать, что механические свойства окружающей среды имеют особое значение для гомеостаза мышечной ткани. Для изучения этих взаимодействий требуется не только точное наблюдение за самоорганизованной трехмерной тканью, но также важно неинвазивное считывание глобальных и локальных сил.
Кроме того, системы моделирования ткани скелетных мышц in vitro обладают огромным потенциалом, позволяющим по-новому взглянуть на формирование, деградацию, восстановление и динамику мышц.Однако возможность использования этих новых систем была ограничена несколькими ключевыми недостатками используемых в настоящее время методов культивирования. В то время как эластомеры на основе PDMS, используемые в таких камерах на основе штифтов, хорошо изучены и находятся под контролем, их оптические свойства не позволяют использовать объективы с высокой числовой апертурой и, следовательно, флуоресцентную микроскопию высокого и сверхвысокого разрешения. Кроме того, PDMS действует как белковая губка, которая поглощает большое количество белков из среды, что предотвращает использование специальных бессывороточных сред, которые требуются в современных подходах со стволовыми клетками.Здесь мы решаем обе проблемы, используя камеру с обратной геометрией, изготовленную из ПММА. Материал предотвращает эффект белковой губки, а геометрия позволяет располагать покровное стекло в непосредственной близости от самоорганизующейся мышечной ткани, что обеспечивает микроскопию с высоким и даже сверхвысоким разрешением.
Изменение материала и адаптация геометрии, чтобы по-прежнему можно было измерять глобальные силы, с одновременным получением высококачественного оптического доступа, является ключевым достижением. Теперь он позволяет измерять с высоким разрешением с разрешением по времени формирование мышечной ткани in vitro, слияние миобластов и созревание миотрубок без необходимости фиксации и удаления ткани, как это было необходимо в предыдущих разработках.Используя флуоресцентную метку белков, можно было напрямую получить трехмерные изображения актиновых сетей с высоким разрешением по времени. Такие флуоресцентные белковые пятна жизни в сочетании с этим подходом помогут понять динамические взаимодействия между мышечными клетками во время дифференцировки, слияния, образования мышечной трубки и созревания. Таким образом, мы впервые обеспечиваем получение изображений с высоким разрешением в реальном времени во время культивирования мышечных тканей in vitro, что является большим преимуществом для решения различных будущих исследовательских задач, таких как слияние миобластов или созревание миотрубок.Предыдущий подход к культивированию миотрубок 2.5D действительно позволял отслеживать созревание первой миотрубки и движение ядер к периферии скелетных миотрубок с помощью динамической визуализации с высоким разрешением (Roman et al., 2017). Однако этот подход не позволяет делать выводы в рамках трехмерной системы, не позволяет проводить функциональные исследования или исследования сокращения и, кроме того, не может количественно оценить создание силы тканью, и все это можно объединить с использованием нашего нового подхода.
На представленных здесь трехмерных мышечных тканях in vitro, приподнятых близко к покровному стеклу, были обнаружены структуры мышечных трубок, характерные для прогрессирующего созревания, например полоски сакомера и многоядерность (рис. 1), и действительно показаны функциональные ответы на сократительные стимулы (рис. 2, видео 2).Хотя измерение силы с помощью пост-отклонения является широко используемым методом (Legant et al., 2009), теперь мы предлагаем расширенный и надежный способ считывания данных для генерации глобальной силы, который является еще более точным из-за резко отфрезерованных краев штифта и более высокого качества изображения. через стекло. Поэтому мы прокладываем путь для будущих исследований сокращения пораженных или отдельных тканей, связанных с пациентом. Например, за счет уменьшения высоты стоек из ПММА мы можем резко изменить жесткость пружины штифтов и, таким образом, сделать возможным первые исследования изометрического сокращения тканей скелетных мышц in vitro, что невозможно при использовании очень гибкого ПДМС.
Чтобы изучить потенциальные корреляции сократительных сил и натяжения между клетками, мы используем пост-деформации для определения общей сократимости ткани, в то время как деформируемые шарики используются для измерения местного натяжения между отдельными клетками и трубками. Ранее сообщалось, что шарики из ПАК действуют как сенсоры натяжения в раковых сфероидах in vitro, во время фагоцитоза, а также в эмбрионах рыбок данио in vivo (Dolega et al., 2017; Lee et al., 2019; Träber et al., 2019; Vorselen et al., 2020). Сочетание локального и глобального анализа возможно только с новым дизайном камеры, так как анализ деформации шарика основан на изображениях с высоким разрешением. Кроме того, в отличие от ранее опубликованных программ анализа натяжения, здесь представленный подход фокусируется на основных компонентах натяжения и направленности тканей, что в значительной степени упрощает анализ и сравнение между различными видами лечения, типами клеток и подходами к триггерам сокращения. Доступ к глобальному и локальному напряжению также позволяет независимо проверять значения.Используя измеренную общую силу натяжения, определенную по последующему прогибу f t = 0,3 ± 0,1 мН (Рисунок 2), а также площади поперечного сечения A = 0,17 ± 0,03 мм 2 (Рисунок 1) скелетной мышечной ткани in vitro, мы используем t = ft / A для прогнозирования местного среднего напряжения t = 1,8 ± 0,67 кПа, что отлично согласуется со средним значением 2,4 ± 0,9 кПа. полученные с помощью анализа упругих валиков (рисунок 4, подробности см. в разделе «Материалы и методы»).Поскольку гранулометрический анализ чувствительно зависит от хорошего знания коэффициента Пуассона, этот тест обеспечивает важное подтверждение того, что введенные измерения являются надежными. Кроме того, эта перекрестная проверка предполагает, что измерений после отклонения уже достаточно для определения среднего натяжения в ткани, но локальное измерение можно использовать для последующего тестирования натяжения как функции положения в ткани. Опять же, этот вывод напрямую подтверждается картами сил, выведенными из распределения шариков в ткани, которые не показали никаких очевидных пространственных схем сил, действующих в ткани (рис. 4G).
Создавая впервые комбинированный подход к формированию трехмерных тканей скелетных мышц in vitro, мы наблюдаем значительное увеличение локального напряжения между мышечными трубками в клетках C2C12 через 1 неделю дифференцировки, которое больше не увеличивается на следующей неделе (рис. 4C, D. ). Интересно, что мы не наблюдаем увеличения общего предварительного натяжения тканей на второй неделе дифференцировки (рис. 2). Однако мы действительно наблюдаем за значительным увеличением диаметра миотрубки с 1 по 2 неделю дифференцировки, как сообщалось ранее (Madden et al., 2015; Афшар Бакушли и др., 2019; Афшар и др., 2020). Кроме того, Afshar et al. показали небольшое ремоделирование мышечной ткани in vitro в период с 1 по 2 неделю дифференцировки. Следовательно, ни диаметр миотрубки, ни прогрессирующее ремоделирование ткани не оказывают значительного влияния на локальное клеточное напряжение в трехмерных мышечных тканях на второй неделе дифференцировки. Следовательно, механический гомеостаз может быть достигнут на клеточном уровне среди слияния миобластов, гибели миотрубок и прогрессирующего созревания миотрубок после 1 недели дифференцировки мышечной ткани in vitro.Кроме того, мы можем предположить, что миотрубки могут быть защищены механическим буферным слоем, состоящим, например, из крупных биополимеров гликокаликса, которые, как известно, выполняют важные механические функции для клеток и клеточных агрегатов (Gandhi et al., 2019). Наши результаты предполагают, что клеточное напряжение в мышечных тканях in vitro больше связано с предварительным натяжением ткани, хотя направление силовых диполей предполагает, что ремоделирование ткани и формирование мышечной трубки способствует деформации бусинок.
Эти результаты могут быть интегрированы в простую модель самоорганизации миобластов и миотрубок, которая зависит от напряжения (рис. 4H). Поскольку клетки и ECM изначально засеваются однородно и с изотропной ориентацией, мы наблюдаем нарушение механической и структурной симметрии вдоль направлений штифта. Поскольку граничные условия стенки камеры не являются адгезивными, единственной механической опорой является закрепление ткани вокруг стоек. Хорошо известно, что клетки в целом и миобласты в частности создают сократительные силы в окружающей их среде.Из-за наличия свободной границы на стенке камеры это приводит к анизотропной деформации ткани, которая подвергается резкому сокращению в направлении, перпендикулярном оси штифта, в то время как усадка минимальна в направлении штифтов. Следовательно, любой продольный объект (клетки и волокна ECM) начнет вращаться из-за сжатия, таким образом выравниваясь вдоль оси столба. Это уже приводит к наблюдаемому выравниванию опорных сил, направлению, измеренному анализом деформации шариков и выравниванию ячеек (рис. 4).Кроме того, механическое напряжение в ткани приводит к систематическому натяжению клеток. С точки зрения простого вязкоупругого материала эти силы приводят к удлинению ячеек вдоль оси штифта. В такой простой модели результат, следовательно, связан с начальным нарушением симметрии, вызванным граничными условиями, которое позже дополнительно усиливается механическим напряжением, которое поддерживает удлинение в пост-направлении и сжатие в перпендикулярном направлении. Дальнейшие активные вклады в клетки также могут быть вызваны или не вызваны механикой.Такая активная клеточная реакция на силы является очень актуальной областью исследований, которой теперь можно заниматься с помощью нашей системы камер.
Новая форма для культивирования фрезерована с использованием ПММА, поэтому ее легко и надежно изготовить. Конструкция камеры также позволяет масштабировать большое количество параллельных экспериментов, что является ключевым элементом для отбора подходов. Он был разработан для достаточного газообмена, легкого обмена среды, а также для доставки лекарств через отверстия в крышке формы. Используя ПММА и стекло для микроскопии для наших форм, мы преодолеваем проблемы огромного химического поглощения материала и плохих оптических свойств, которыми обладали предыдущие подходы (Madden et al., 2015; Афшар Бакушли и др., 2019; Афшар и др., 2020). Таким образом, мы можем дополнительно предложить бессывороточное культивирование тканей скелетных мышц in vitro и точные исследования реакции на дозу лекарства.
В заключение, мы предлагаем новую технику для функционального трехмерного культивирования ткани скелетных мышц in vitro, которая впервые дает возможность микроскопии с высоким разрешением в реальном времени живой трехмерной биомиметической мышечной ткани. Мы используем новый подход для первых глобальных, а также локальных исследований клеточной силы в развивающихся мышечных тканях in vitro.Мы наблюдаем, что клеточное напряжение в мышечных тканях C2C12 in vitro тесно связано с глобальным предварительным натяжением ткани и достигает механической гомеостатической фазы через 1 неделю дифференцировки. Однако, что интересно, созревание ткани скелетных мышц in vitro все еще прогрессирует на второй неделе дифференцировки. Кроме того, культивирование мышечной ткани непосредственно на стекле открывает совершенно новые возможности для изучения очень сложных и динамических проблем миогенеза в 3D in vitro. Кроме того, простое и надежное считывание сократительных сил позволяет использовать новую культуральную форму для индивидуального скрининга лекарств, а также для диагностики.
Скелетно-мышечная система — обзор
Введение
Скелетно-мышечная система представляет собой очень сложную единицу, в которой есть пять основных элементов: кости, мышцы, сухожилия, соединяющие два первых элемента, хрящи и мениски, которые функционируют вместе для достижения локомоции. . Хотя эти элементы одинаково важны, кости исторически считались центральным компонентом опорно-двигательного аппарата. Кости имеют прочную и жесткую структуру благодаря минерализованной матрице, но они стремительно растут в раннем возрасте и сохраняют свою прочность на протяжении всей жизни.Вопреки своему инертному виду, кости поразительно многофункциональны. Основные функции костей — защищать жизненно важные органы и действовать как рычаги, посредством которых сокращение мышц приводит к движению тела. Кроме того, костные клетки поддерживают кроветворение в прилегающем костном мозге и выделяют гормоны, регулирующие метаболизм углеводов и минеральных ионов, а также фертильность и функцию мозга.
В силу своих основных функций кости, мышцы и сухожилия на сегодняшний день являются наиболее часто повреждаемыми тканями тела.Эти ткани обладают удивительной способностью восстанавливать повреждения различной степени, от микроскопических до значительных повреждений, нарушающих целостность ткани. Тканевая инженерия открыла большие перспективы для регенерации скелетно-мышечной ткани. Современные подходы предназначены для усиления врожденных регенеративных способностей путем добавления соответствующих клеток, сигналов и каркасов. Несмотря на некоторый успех во многих ситуациях, существующие подходы имеют определенные ограничения в их применимости к регенерации опорно-двигательного аппарата.Вообще говоря, тканевые инженеры могут восстановить утраченный компонент только при наличии достаточного количества уже существующих структур. Другими словами, они по-прежнему не могут построить скелетные компоненты из ничего. Таким образом, способность тканевых инженеров к регенерации сейчас находится на начальной стадии. Был достигнут большой прогресс в разработке протезов, но они не выполняют тех же биологических функций, что и живые кости, и им критически не хватает многих важных аспектов, таких как рост и регенерация. Поскольку многие молодые и старые пациенты страдают от значительной потери важных опорно-двигательных тканей, таких как пальцы, конечности, лицо, череп или зубные структуры, весьма желательны более эффективные способы функциональной регенерации.В частности, тканевым инженерам необходимо будет разработать более комплексный подход, чтобы резюмировать процесс разработки. Таким образом, важно узнать, как стволовые клетки и сигналы используются для управления развитием опорно-двигательного аппарата. В этой главе мы рассмотрим фундаментальный процесс развития опорно-двигательного аппарата, который может иметь важное значение для тканевой инженерии.
Механический показатель биомеханики скелета, полученный на основе спектрального анализа матрицы жесткости
Шлехт, С. Х., Бигелоу, Э. М. и Джепсен, К. Дж. Картирование естественных вариаций жесткости и прочности всей кости по участкам скелета. Кость 67 , 15–22 (2014).
PubMed PubMed Central Статья Google ученый
Войде, Р., Ван Ленте, Г. Х. и Мюллер, Р. Морфометрия костей достоверно предсказывает жесткость и прочность кортикальной кости, но не прочность, в моделях инбредных мышей с высокой и низкой костной массой. J. Bone Miner. Res. 23 , 1194–1203 (2008).
PubMed Статья PubMed Central Google ученый
Bowman, L., Ellerbrock, E. R., Hausfeld, G.C, Neumeyer, J. M. & Loucks, A. B. Новый неинвазивный тест на механический изгиб точно предсказывает прочность локтевой кости на изгиб в руках трупа человека. Кость 120 , 336–346 (2019).
PubMed Статья PubMed Central Google ученый
Fyhrie, D. P. & Vashishth, D. Жесткость кости предсказывает прочность аналогично губчатой кости позвоночника человека при сжатии и кортикальной кости при растяжении. Кость 26 , 169–173 (2000).
CAS PubMed Статья PubMed Central Google ученый
Zhu, T. Y. et al. Значение измерения микроархитектуры кости в распознавании переломов у пожилых женщин с недавним переломом бедра: исследование случай-контроль с помощью HR-pQCT. Sci. Отчет 6 , 34185 (2016).
ADS CAS PubMed PubMed Central Статья Google ученый
Маттеи, Л., Лонго, А., Ди Пуччио, Ф., Чиулли, Э. и Маркетти, С. Процедуры вибрационных испытаний для оценки жесткости костей при переломах, леченных с помощью внешней фиксации. Ann. Биомед. Англ. 45 , 1111–1121 (2017).
PubMed Статья Google ученый
Kumasaka, S. et al. Взаимосвязь между минеральной плотностью кости и жесткостью кости при переломе кости. Oral Radiol. 21 , 38–40 (2005).
Артикул Google ученый
Луо, Й. и Янг, Х. Сравнение жесткости бедренной кости, измеренной с помощью DXA и QCT, для оценки риска перелома бедра. J. Bone Miner. Метаб. 37 , 342–350 (2019).
PubMed Статья Google ученый
Heyer, F. et al. Отдаленный функциональный результат переломов дистального отдела лучевой кости связан с ранней пост переломной жесткостью кости в области перелома: поисковое исследование HR-pQCT. Кость 127 , 510–516 (2019).
CAS PubMed Статья Google ученый
Шлехт, С. Х. и Джепсен, К. Дж. Функциональная интеграция скелетных черт: внутрискелетная оценка размера кости, минерализации и ковариации объема. Кость 56 , 127–138 (2013).
PubMed PubMed Central Статья Google ученый
Laing, A.C. & Robinovitch, S. N. Характеристика эффективной жесткости таза при боковом падении на бедро. J. Biomech. 43 , 1898–1904 (2010).
PubMed Статья Google ученый
Резаи, А. et al. Чувствительны ли оценки жесткости и прочности DXA / aBMD и QCT / FEA к полу и возрасту ?. Ann. Биомед. Англ. 45 , 2847–2856 (2017).
MathSciNet PubMed PubMed Central Статья Google ученый
Patton, D. M. et al. Взаимосвязь между жесткостью и прочностью всей кости зависит от возраста и пола. J. Biomech. 83 , 125–133 (2019).
PubMed Статья Google ученый
Левин И. К., Бхан С. и Лэйнг А. С. Влияние индекса массы тела и пола на силу удара и эффективную жесткость таза во время имитации бокового падения. Clin. Биомех. 28 , 1026–1033 (2013).
Артикул Google ученый
Уорд, Дж., Вуд, К., Руш, К., Пенковски, Д.И Маллуче, Х. Жесткость и прочность костей у пациентов с остеопорозом, получавших пероральные бисфосфонаты различной продолжительности. Остеопорос. Int. 27 , 2681–2688 (2016).
CAS PubMed Статья Google ученый
Барак М. и Блэк М. А. Новое использование модели 3D-печати демонстрирует влияние ухудшения структуры губчатой кости на жесткость и прочность кости. Дж.Мех. Behav. Биомед. Матер. 78 , 455–464 (2018).
PubMed Статья Google ученый
Коллинз, К. Дж., Бойер, М., Креншоу, Т. Д. и Плоег, Х.-Л. Дизайн суррогата для оценки методов прогнозирования жесткости кости при изгибе. J. Mech. Behav. Биомед. Матер. 88 , 346–351 (2018).
PubMed Статья Google ученый
Arjmand, H. et al. Механические показатели проксимального отдела большеберцовой кости являются точными и позволяют дифференцировать остеоартрит и нормальные колени: исследование методом конечных элементов. Sci. Отчет 8 , 11478 (2018).
ADS PubMed PubMed Central Статья CAS Google ученый
Liu, X. S. et al. Плотность, геометрия, микроструктура и жесткость костей: взаимосвязь между периферическими и центральными участками скелета, оцененная с помощью DXA, HR-pQCT и cQCT у женщин в пременопаузе. J. Bone Miner. Res. 25 , 2229–2238 (2010).
PubMed PubMed Central Статья Google ученый
Ноулз, Н. К., Кусинс, Дж., Коламбус, М. П., Атвал, Г. С. и Феррейра, Л. М. Морфологические и видимые различия жесткости между нормальной и остеоартрозной костью в головке плечевой кости. J. Orthopaed. Res. 38 , 503–509 (2019).
Артикул Google ученый
Хениш, П., Сутула, Д., Копал, Й., Кухарж, М. и Чапек, Л. Локализация наименьшей жесткости и ее направления в однородной структуре с помощью спектрального и оптимизационного подходов. Eng. Struct. 232 , 111842 (2021).
Артикул Google ученый
Рейтер М., Вольтер Ф.-Э., Шентон М. и Нитхаммер М. Собственные значения Лапласа – Бельтрами и топологические особенности собственных функций для статистического анализа формы. Comput. Помощь Дес. 41 , 739–755 (2009).
PubMed PubMed Central Статья Google ученый
Chaudhari, A. J. et al. Сигнатура глобальной точки для анализа формы костей запястья. Phys. Med. Биол. 59 , 961 (2014).
PubMed PubMed Central Статья Google ученый
Venkadesan, M. et al. Жесткость стопы человека и эволюция поперечного свода. Природа 579 , 97–100 (2020).
ADS CAS PubMed Статья PubMed Central Google ученый
Hong, A. L. et al. Индекс пористости кости, полученный на основе МРТ, коррелирует с составом кости и механической жесткостью. Костяной Реп. 11 , 100213 (2019).
PubMed PubMed Central Статья Google ученый
Cosman, M. N., Britz, H. M. и Rolian, C. Выбор более длинных конечностей у мышей увеличивает жесткость и хрупкость костей, но не влияет на прочность на изгиб. J. Exp. Биол. 222 , jeb203125 (2019).
PubMed Статья PubMed Central Google ученый
Барри, Дж. Дж., Синг, Д. К., Вейл, Т. П. и Хансен, Е. Н. Ранние результаты первичной тотальной артропластики тазобедренного сустава после предшествующего спондилодеза поясничного отдела позвоночника. J. Артропластика 32 , 470–474 (2017).
PubMed Статья PubMed Central Google ученый
Стайбано П., Винодел М., Петруччелли Д. и де Бир Дж. Тотальная артропластика сустава и предоперационная боль в пояснице. J. Артропластика 29 , 867–871 (2014).
PubMed Статья PubMed Central Google ученый
Вайнберг, Д., Гебхарт, Дж. И Лю, Р. Синдром тазобедренного сустава: трупный анализ остеоартроза поясничного отдела позвоночника и тазобедренных суставов. Ортопед. Traumatol. Surg. Res. 103 , 651–656 (2017).
CAS Статья Google ученый
Девин, К. Дж., Маккалоу, К.А., Моррис, Б. Дж., Йейтс, А. Дж. И Канг, Дж. Д. Синдром тазобедренного сустава. JAAOS J. Am. Акад. Ортопед. Surg. 20 , 434–442 (2012).
Артикул Google ученый
Kuchař, M., Henyš, P., Rejtar, P. & Hájek, P. Техника морфинга формы позволяет точно предсказать ориентиры тазовых костей. Int. J. Legal Med. 135 , 1–10 (2021 г.).
Артикул Google ученый
Вахюни, Э. и Джи, Т. Дж. Т. Взаимосвязь между статической жесткостью и модальной жесткостью конструкций. IPTEK J. Technol. Sci. 21, 1-5 (2010).
Хениш, П. и Чапек, Л. Модель материала тазовой кости на основе модального анализа: исследование композитной кости. Biomech. Модель. Механобиол. 16 , 363–373 (2017).
PubMed Статья PubMed Central Google ученый
Neugebauer, R. et al. Экспериментальный модальный анализ свежезамороженных гемипельвических костей человека с использованием трехмерного лазерного виброметра с целью определения модальных параметров. J. Biomech. 44 , 1610–1613 (2011).
CAS PubMed Статья PubMed Central Google ученый
Конза, Н., Риксен, Д. и Пломп, С. Вибрационные испытания свежезамороженного таза человека: роль тазовых связок. J. Biomech. 40 , 1599–1605 (2007).
CAS PubMed Статья PubMed Central Google ученый
Scholz, R. et al. Подтверждение соотношений плотности и эластичности для конечно-элементного моделирования тазовой кости человека с помощью модального анализа. J. Biomech. 46 , 2667–2673 (2013).
PubMed Статья PubMed Central Google ученый
Аллеманг, Р. Дж. Модальный критерий гарантии — Двадцать лет использования и злоупотребления. Sound Vib. 37 , 14–23 (2003).
Google ученый
Михальски, А.С., Беслер, Б.А., Михалак, Дж. Дж. И Бойд, С. К. Калибровка внутренней плотности на основе КТ для оценки условно-патогенного состояния скелета с использованием компьютерной томографии брюшной полости. Med. Англ. Phys. 78 , 55–63 (2020).
PubMed Статья PubMed Central Google ученый
Blanchard, R., Dejaco, A., Bongaers, E. & Hellmich, C. Интравоксельная микромеханика кости для моделирования методом конечных элементов на основе микроКТ. J. Biomech. 46 , 2710–2721 (2013).
PubMed Статья Google ученый
Hellmich, C., Kober, C. & Erdmann, B. Преобразование данных компьютерной томографии в анизотропные тензоры упругости на основе микромеханики, применяемое для моделирования нижней челюсти методом КЭ. Ann.Биомед. Англ. 36 , 108 (2008).
PubMed Статья Google ученый
Blanchard, R. et al. Оценка риска перелома позвонков для конкретного пациента: многомасштабный подход, сочетающий физику рентгеновских лучей и микромеханику континуума. Int. J. Numer. Методы Биомед. Англ. 32 , e02760 (2016).
MathSciNet Статья Google ученый
Schneider, R., Faust, G., Hindenlang, U. & Helwig, P. Модель неоднородного ортотропного материала для кортикальной структуры длинных костей, смоделированная на основе клинической компьютерной томографии или данных плотности. Comput. Методы Прил. Мех. Англ. 198 , 2167–2174 (2009).
ADS МАТЕМАТИКА Статья Google ученый
Vukicevic, A. M. et al. Openmandible: среда с открытым исходным кодом для высокореалистичного численного моделирования физиологии нижней челюсти. Dental Mater. 37 , 612–624 (2021).
Артикул Google ученый
Kober, C., Erdmann, B., Hellmich, C., Sader, R. & Zeilhofer, H.-F. Учет анизотропной эластичности сводит к минимуму объемную, а не сдвигающую деформацию нижней челюсти человека. Comput. Методы Биомех. Биомед. Англ. 9 , 91–101 (2006).
CAS Статья Google ученый
Pauchard, Y. et al. Интерактивная сегментация в виде графика для быстрого создания моделей конечных элементов на основе клинических данных компьютерной томографии для прогнозирования перелома бедра. Comput. Методы Биомех. Биомед. Англ. 19 , 1693–1703 (2016).
Артикул Google ученый
Helgason, B. et al. Влияние зависимости модуля упругости и плотности и метода картирования материала на моделируемую механическую реакцию проксимального отдела бедренной кости в конфигурации нагрузки при боковом падении. Med. Англ. Phys. 38 , 679–689 (2016).
CAS PubMed Статья Google ученый
Шредер, В. Дж., Лоренсен, Б. и Мартин, К. Набор инструментов визуализации: объектно-ориентированный подход к трехмерной графике (Kitware, 2004).
Google ученый
Hu, Y. et al. Тетраэдральная сетка в дикой природе. ACM Trans. График. 37 , 60–1 (2018).
Google ученый
Taylor, W. et al. Определение ортотропных упругих постоянных костной ткани с помощью МКЭ и модального анализа. J. Biomech. 35 , 767–773 (2002).
CAS PubMed Статья Google ученый
Келлер, Т. С. Прогнозирование механического поведения кости при сжатии. J. Biomech. 27 , 1159–1168 (1994).
CAS PubMed Статья PubMed Central Google ученый
Киак, Дж., Ли, И. и Скиннер, Х. Корреляции между ортогональными механическими свойствами и плотностью губчатой кости: использование различных денситометрических измерений. J. Biomed. Матер. Res. 28 , 1329–1336 (1994).
CAS PubMed Статья PubMed Central Google ученый
Дахан Г., Трабелси Н., Сафран О. и Йосибаш З. Анализ методом конечных элементов для прогнозирования анатомических переломов шейки проксимального отдела плечевой кости. Clin. Биомех. 68 , 114–121 (2019).
Артикул Google ученый
Уотсон, П. Дж., Достанпор, А., Фаган, М. Дж. И Добсон, К. А. Влияние граничных ограничений на моделирование конечных элементов таза человека. Med. Англ. Phys. 43 , 48–57 (2017).
CAS PubMed Статья Google ученый
Логг, А., Мардал, К.-А. & Wells, G. Автоматическое решение дифференциальных уравнений методом конечных элементов: Книга FEniCS Vol. 84 (Springer, 2012).
MATH Книга Google ученый
Зенкевич О.С., Тейлор Р. Л. и Чжу Дж. З. Метод конечных элементов: его основы и основы (Elsevier, 2005).
MATH Google ученый
Эрнандес, В., Роман, Дж. Э. и Видаль, В. Слепц: масштабируемый и гибкий набор инструментов для решения задач на собственные значения. ACM Trans. Математика. Софтв. (ТОМС) 31 , 351–362 (2005).
MathSciNet МАТЕМАТИКА Статья Google ученый
Bržek, J., Santos, F., Dutailly, B., Murail, P. & Cunha, E.Подтверждение и надежность оценки пола os coxae человека с использованием свободно доступного программного обеспечения DSP2 для биоархеологии и судебной антропологии. Am. J. Phys. Антрополь. 164 , 440–449 (2017).
Артикул Google ученый
Чандран, В., Рейес, М. и Зиссет, П. Новая основанная на регистрации методология прогнозирования трабекулярной костной ткани на основе клинической ККТ: всесторонний анализ. PLoS ONE 12 , e0187874 (2017).
PubMed PubMed Central Статья CAS Google ученый
Avants, B. B. et al. Воспроизводимая оценка метрики сходства муравьев при регистрации изображений мозга. Neuroimage 54 , 2033–2044 (2011).
PubMed Статья Google ученый
Pedregosa, F. et al. Scikit-learn: Машинное обучение на Python. J. Mach. Учиться. Res. 12 , 2825–2830 (2011).
MathSciNet МАТЕМАТИКА Google ученый
Анатомия и физиология нормальной кости
Резюме
В этом обзоре описываются анатомия и физиология нормальной кости в качестве введения к последующим статьям этого раздела, в которых обсуждаются клинические применения биопсии гребня подвздошной кости.Сначала рассматриваются нормальная анатомия и функции скелета, после чего дается общее описание процессов моделирования и ремоделирования костей. Процесс ремоделирования кости регулирует увеличение и уменьшение минеральной плотности костной ткани в скелете взрослого человека и напрямую влияет на прочность кости. Тщательное понимание процесса ремоделирования кости имеет решающее значение для оценки ценности и интерпретации результатов гистоморфометрии гребня подвздошной кости. Рекрутирование, активация и резорбция остеокластов обсуждается довольно подробно с последующим обзором рекрутирования остеобластов и процесса образования новой кости.Затем суммируются коллагеновые и неколлагеновые белковые компоненты и функция внеклеточного матрикса кости, после чего дается описание процесса минерализации вновь образованного костного матрикса. Воздействие биомеханических сил на кость воспринимается синцитием остеоцитов в кости через канальцевую сеть и межклеточные щелевые соединения. Наконец, концепции, касающиеся ремоделирования кости, функции остеокластов и остеобластов, внеклеточного матрикса, минерализации матрикса и функции остеоцитов, синтезируются в кратком изложении понятных в настоящее время функциональных детерминант прочности кости.Эта информация закладывает основу для понимания полезности и клинического применения биопсии гребня подвздошной кости.
Скелет
Скелет взрослого человека состоит всего из 213 костей, не считая сесамовидных костей (1). Аппендикулярный скелет состоит из 126 костей, осевого скелета — 74, а слуховых косточек — 6 костей. Каждая кость постоянно подвергается моделированию в течение жизни, чтобы помочь ей адаптироваться к изменяющимся биомеханическим силам, а также ремоделированию для удаления старой, микроповрежденной кости и замены ее новой, механически более прочной костью, чтобы помочь сохранить прочность кости.
Четыре основные категории костей: длинные, короткие, плоские и неправильные кости. Длинные кости включают ключицы, плечевые кости, радиусы, локтевые кости, пястные кости, бедренные кости, голени, малоберцовые кости, плюсневые кости и фаланги. Короткие кости включают запястные и предплюсневые кости, надколенники и сесамовидные кости. Плоские кости включают череп, нижнюю челюсть, лопатки, грудину и ребра. Кости неправильной формы включают позвонки, крестец, копчик и подъязычную кость. Плоские кости образуются за счет образования перепончатой кости, тогда как длинные кости образуются путем сочетания эндохондрального и перепончатого образования кости.
Каркас выполняет множество функций. Кости скелета обеспечивают структурную поддержку для остального тела, позволяют движение и передвижение, обеспечивая рычаги для мышц, защищают жизненно важные внутренние органы и структуры, обеспечивают поддержание минерального гомеостаза и кислотно-щелочного баланса, служат резервуаром для роста. факторов и цитокинов, а также обеспечивают среду для кроветворения в костном мозге (2).
Длинные кости состоят из полого стержня или диафиза; расширяющиеся конусообразные метафизы под пластинками роста; и округлые эпифизы над пластинками роста.Диафиз состоит в основном из плотной кортикальной кости, тогда как метафиз и эпифиз состоят из кости трабекулярной сети, окруженной относительно тонкой оболочкой из плотной кортикальной кости.
Скелет взрослого человека состоит из 80% кортикальной кости и 20% губчатой кости в целом (3). Различные кости и участки скелета внутри костей имеют разное соотношение кортикальной и губчатой кости. Позвонок состоит из кортикальной и губчатой кости в соотношении 25:75. Это соотношение составляет 50:50 в головке бедренной кости и 95: 5 в лучевом диафизе.
Кортикальная кость плотная и твердая и окружает костный мозг, тогда как губчатая кость состоит из сотовой сети трабекулярных пластин и стержней, вкрапленных в компартменте костного мозга. И кортикальная, и губчатая кость состоят из остеонов.
Кортикальные остеоны называются гаверсовыми системами. Гаверсовы системы имеют цилиндрическую форму, примерно 400 мм в длину и 200 мм в ширину в основании и образуют разветвленную сеть внутри кортикальной кости (3). Стены гаверсовских систем образованы концентрическими пластинками.Кортикальная кость обычно менее метаболически активна, чем губчатая кость, но это зависит от вида. У здоровых взрослых людей имеется приблизительно 21 × 10 6 кортикальных остеонов с общей площадью ремоделирования по Гаверсу примерно 3,5 м 2 . Пористость кортикальной кости обычно составляет <5%, но это зависит от соотношения активно ремоделирующих гаверсовских систем и неактивных кортикальных остеонов. Увеличение кортикального ремоделирования вызывает увеличение кортикальной пористости и уменьшение корковой костной массы.Здоровые стареющие взрослые обычно испытывают истончение коры и увеличение пористости коры.
Кортикальная кость имеет внешнюю периостальную поверхность и внутреннюю эндостальную поверхность. Поверхностная активность надкостницы важна для аппозиционного роста и заживления переломов. Костеобразование обычно превышает резорбцию кости на периостальной поверхности, поэтому кости обычно увеличиваются в диаметре с возрастом. Поверхность эндоста имеет общую площадь приблизительно 0,5 м 2 , с более высокой активностью ремоделирования, чем поверхность надкостницы, вероятно, в результате большего биомеханического напряжения или большего воздействия цитокинов из соседнего компартмента костного мозга.Резорбция костной ткани обычно превышает костное образование на эндостальной поверхности, поэтому костный мозг обычно расширяется с возрастом.
Трабекулярные остеоны называются пакетами. Трабекулярная кость состоит из пластин и стержней толщиной от 50 до 400 мм (3). Трабекулярные остеоны имеют полулунную форму, обычно примерно 35 мм толщиной, и состоят из концентрических пластинок. Подсчитано, что у здоровых взрослых людей имеется 14 × 10 6 трабекулярных остеонов с общей площадью трабекул примерно 7 м 2 .
Кортикальная кость и губчатая кость обычно имеют пластинчатый узор, в котором коллагеновые фибриллы располагаются в чередующейся ориентации (3). Пластинчатая кость лучше всего видна при микроскопическом исследовании в поляризованном свете, во время которого виден пластинчатый узор в результате двойного лучепреломления. Механизм, с помощью которого остеобласты откладывают фибриллы коллагена в виде пластин, неизвестен, но пластинчатая кость имеет значительную прочность в результате чередования ориентаций фибрилл коллагена, как у фанеры.В тканой кости отсутствует нормальный пластинчатый узор, в котором коллагеновые фибриллы располагаются неорганизованным образом. Плетеная кость слабее пластинчатой. Плетеная кость обычно образуется во время образования первичной кости, а также может наблюдаться при состояниях с высоким метаболизмом костной ткани, таких как кистозно-фиброзный остит, в результате гиперпаратиреоза и болезни Педжета или во время высокого костеобразования во время раннего лечения фтором.
Надкостница — это волокнистая соединительнотканная оболочка, которая окружает внешнюю кортикальную поверхность кости, за исключением суставов, где кость выстлана суставным хрящом, который содержит кровеносные сосуды, нервные волокна, остеобласты и остеокласты.Надкостница плотно прикреплена к внешней кортикальной поверхности кости толстыми коллагеновыми волокнами, называемыми волокнами Шарпейса, которые проникают в подлежащую костную ткань. Эндост представляет собой мембранную структуру, покрывающую внутреннюю поверхность кортикальной кости, губчатой кости и каналы кровеносных сосудов (каналы Фолькмана), присутствующие в кости. Эндост находится в контакте с пространством костного мозга, губчатой костью и каналами кровеносных сосудов и содержит кровеносные сосуды, остеобласты и остеокласты.
Рост, моделирование и ремоделирование костей
Кость подвергается продольному и радиальному росту, моделированию и ремоделированию в течение жизни.Продольный и радиальный рост во время роста и развития происходит в детском и подростковом возрасте. Продольный рост происходит в пластинах роста, где хрящ разрастается в эпифизарной и метафизарной областях длинных костей, прежде чем впоследствии подвергнется минерализации с образованием первичной новой кости.
Моделирование — это процесс, с помощью которого кости изменяют свою общую форму в ответ на физиологические воздействия или механические силы, что приводит к постепенной адаптации скелета к силам, с которыми он сталкивается.Кости могут расширяться или изменять ось за счет удаления или добавления кости к соответствующим поверхностям за счет независимого действия остеобластов и остеокластов в ответ на биомеханические силы. Кости обычно расширяются с возрастом в ответ на надкостницу новой кости и эндостальную резорбцию старой кости. Закон Вольфа описывает наблюдение, что длинные кости меняют форму, чтобы приспособиться к действующим на них нагрузкам. Во время моделирования кости формирование и резорбция кости не взаимосвязаны. Моделирование кости у взрослых встречается реже, чем ремоделирование (4).Моделирование может быть усилено при гипопаратиреозе (5), почечной остеодистрофии (6) или лечении анаболическими средствами (7).
Ремоделирование кости — это процесс обновления кости для поддержания прочности кости и минерального гомеостаза. Ремоделирование включает в себя непрерывное удаление отдельных пакетов старой кости, замену этих пакетов вновь синтезированным белковым матриксом и последующую минерализацию матрицы с образованием новой кости. Процесс ремоделирования резорбирует старую кость и формирует новую кость, чтобы предотвратить накопление микроповреждений кости.Ремоделирование начинается до рождения и продолжается до смерти. Блок ремоделирования кости состоит из тесно связанной группы остеокластов и остеобластов, которые последовательно выполняют резорбцию старой кости и образование новой кости. Ремоделирование костей увеличивается у женщин в перименопаузе и в раннем постменопаузе, а затем замедляется с дальнейшим старением, но продолжается более быстрыми темпами, чем у женщин в пременопаузе. Считается, что ремоделирование костей у стареющих мужчин происходит умеренно.
Цикл ремоделирования состоит из четырех последовательных фаз.Активация предшествует резорбции, предшествующей обращению, предшествующей формированию. Сайты ремоделирования могут развиваться случайным образом, но также нацелены на участки, требующие ремонта (8,9). Считается, что сайты ремоделирования развиваются в основном случайным образом.
Активация включает привлечение и активацию мононуклеарных моноцитов-макрофагов-предшественников остеокластов из кровотока (10), отрыв эндоста, который содержит выстилающие клетки от поверхности кости, и слияние нескольких мононуклеарных клеток с образованием многоядерных преостеокластов.Преостеокласты связываются с костным матриксом посредством взаимодействий между рецепторами интегрина в их клеточных мембранах и RGD (аргинин, глицин и аспарагин) пептидами в матричных белках с образованием кольцевых герметизирующих зон вокруг резорбируемых костью компартментов под многоядерными остеокластами.
Опосредованная остеокластами резорбция кости занимает всего около 2–4 недель в течение каждого цикла ремоделирования. Образование, активация и резорбция остеокластов регулируются соотношением активатора рецептора лиганда NF-κB (RANKL) к остеопротегерину (OPG; Рисунок 1), IL-1 и IL-6, колониестимулирующему фактору (CSF), паратиреоидному гормону. , 1,25-дигидроксивитамин D и кальцитонин (11,12).Резорбирующиеся остеокласты секретируют ионы водорода через протонные насосы H + -АТФазы и хлоридные каналы в своих клеточных мембранах в резорбирующий отсек, чтобы снизить pH внутри резорбирующего кость компартмента до 4,5, что помогает мобилизовать костные минералы (13 ). Резорбирующиеся остеокласты выделяют устойчивую к тартрату кислую фосфатазу, катепсин К, матриксную металлопротеиназу 9 и желатиназу из цитоплазматических лизосом (14) для переваривания органического матрикса, что приводит к образованию лакуны Ховшипа в форме блюдца на поверхности губчатой кости (рис. 2) и Гаверсовы каналы в кортикальном слое кости.Фаза резорбции завершается мононуклеарными клетками после того, как многоядерные остеокласты подвергаются апоптозу (15,16).
Рисунок 1.Регулирование остеокластогенеза с помощью активатора рецептора лиганда NF-κB (RANKL) и остеопротегерина (OPG): колониестимулирующий фактор 1 (CSF-1) обычно стимулирует рекрутирование остеокластов. Две формы RANKL продуцируются остеобластами и предшественниками остеобластов для стимуляции рекрутирования и активации остеокластов. Мембраносвязанная форма напрямую взаимодействует с мембраносвязанными молекулами RANK на соседних предшественниках остеокластов.Растворимая форма высвобождается из остеобластов или предшественников остеобластов, чтобы диффундировать через межклеточное пространство и взаимодействовать с мембраносвязанными молекулами RANK на соседних предшественниках остеокластов. OPG действует как ловушка-рецептор, предотвращая взаимодействие RANKL или sRANKL с RANK. Соотношение между RANKL и OPG, продуцируемыми остеобластами и предшественниками остеобластов, контролирует стимулированный RANKL остеокластогенез.
Рис. 2.Многоядерные остеокласты резорбируют кость с образованием резорбционных ямок, известных как лакуны Ховшипа.
Во время фазы обращения резорбция кости переходит в формирование кости. По завершении резорбции кости резорбционные полости содержат множество мононуклеарных клеток, включая моноциты, остеоциты, высвобождаемые из костного матрикса, и преостеобласты, привлекаемые для начала образования новой кости. Связанные сигналы, связывающие конец резорбции кости с началом образования кости, пока неизвестны. Предлагаемые кандидаты в сигнал связывания включают факторы, производные от костного матрикса, такие как TGF-β, IGF-1, IGF-2, костные морфогенетические белки, PDGF или фактор роста фибробластов (17-19).Концентрация TGF-β в костном матриксе коррелирует с гистоморфометрическими показателями метаболизма костной ткани, а также с остеокальцином в сыворотке крови и костной специфической щелочной фосфатазой. TGF-β, высвобождаемый из костного матрикса, снижает резорбцию остеокластов за счет ингибирования продукции RANKL остеобластами. Было высказано предположение, что фаза обращения опосредуется градиентом деформации в лакунах (20,21). Поскольку остеокласты резорбируют кортикальный слой кости в режущем конусе, деформация уменьшается спереди и увеличивается сзади, а в лакунах Ховшипа деформация наиболее высока в основании и меньше — в окружающей кости по краям лакунов.Градиент штамма может привести к последовательной активации остеокластов и остеобластов, при этом остеокласты активируются уменьшенным напряжением, а остеобласты — повышенным напряжением. Было высказано предположение, что сам остеокласт играет роль во время обращения (22).
Формирование кости занимает от 4 до 6 месяцев. Остеобласты синтезируют новый коллагеновый органический матрикс (рис. 3) и регулируют минерализацию матрикса путем высвобождения небольших мембраносвязанных матричных везикул, которые концентрируют кальций и фосфат и ферментативно разрушают ингибиторы минерализации, такие как пирофосфат или протеогликаны (23).Остеобласты, окруженные матриксом и погребенные в нем, становятся остеоцитами с обширной канальцевой сетью, соединяющей их с клетками выстилки поверхности кости, остеобластами и другими остеоцитами, поддерживаемыми щелевыми соединениями между цитоплазматическими процессами, отходящими от остеоцитов (24). Сеть остеоцитов в кости служит функциональным синцитием. По завершении формирования кости примерно от 50 до 70% остеобластов подвергаются апоптозу, а остальная часть становится остеоцитами или клетками выстилки кости.Клетки, выстилающие костную ткань, могут регулировать приток и отток минеральных ионов в костную внеклеточную жидкость и из нее, тем самым выступая в качестве гемато-костного барьера, но сохраняя способность повторно дифференцироваться в остеобласты при воздействии паратиреоидного гормона или механических сил (25). Клетки, выстилающие костную ткань эндоста, отрываются от поверхности кости перед резорбцией кости, чтобы сформировать дискретные компартменты ремоделирования кости со специализированным микроокружением (26). У пациентов с множественной миеломой клетки выстилки могут быть индуцированы экспрессией устойчивой к тартрату кислой фосфатазы и других классических маркеров остеокластов.
Рис. 3.Остеобласты синтезируют белковый матрикс, состоящий в основном из коллагена I типа, для заполнения ямок резорбции. Белковая матрица постепенно минерализуется, образуя новую кость.
Конечным результатом каждого цикла ремоделирования кости является производство нового остеона. Процесс ремоделирования в кортикальной и губчатой кости по существу одинаков, при этом единицы ремоделирования кости в губчатой кости эквивалентны единицам ремоделирования кортикальной кости, разделенным пополам в продольном направлении (27).Костный баланс — это разница между резорбированной старой костью и новой сформированной костью. Баланс надкостницы умеренно положительный, тогда как балансы эндостальной и губчатой кости умеренно отрицательны, что приводит к истончению кортикального и трабекулярного слоев с возрастом. Эти относительные изменения происходят при эндостальной резорбции, опережающей периостальное образование.
Основные признанные функции ремоделирования кости включают сохранение механической прочности кости путем замены старой, микроповрежденной кости на более новую, более здоровую кость, а также гомеостаз кальция и фосфата.Относительно низкая скорость обновления кортикального слоя кости у взрослых, составляющая 2–3% в год, достаточна для поддержания биомеханической прочности кости. Скорость обновления губчатой кости выше, чем требуется для поддержания механической прочности, что указывает на то, что обновление губчатой кости более важно для метаболизма минералов. Повышенная потребность в кальции или фосфоре может потребовать увеличения единиц ремоделирования кости, но во многих случаях эта потребность может быть удовлетворена за счет увеличения активности существующих остеокластов. Повышенная потребность в кальции и фосфоре скелета частично удовлетворяется за счет резорбции остеокластов и частично за счет притока и оттока неостеокластического кальция.Постоянная деятельность по ремоделированию кости обеспечивает непрерывное поступление вновь сформированной кости, которая имеет относительно низкое содержание минералов и способна легче обмениваться ионами с внеклеточной жидкостью. Единицы ремоделирования кости, по-видимому, в основном случайным образом распределены по скелету, но могут быть вызваны образованием микротрещин или апоптозом остеоцитов. Пространство ремоделирования кости представляет собой сумму всех активных единиц ремоделирования кости в скелете в данный момент времени.
Остеокласты
Остеокласты — единственные клетки, которые, как известно, способны резорбировать кость (рис. 2).Активированные многоядерные остеокласты происходят из одноядерных клеток-предшественников моноцитарно-макрофагальной линии (11). Мононуклеарные клетки-предшественники моноцитов-макрофагов были идентифицированы в различных тканях, но считается, что клетки-предшественники моноцитов-макрофагов костного мозга дают начало большинству остеокластов.
RANKL и макрофагальный CSF (M-CSF) — два цитокина, которые имеют решающее значение для образования остеокластов. И RANKL, и M-CSF продуцируются в основном стромальными клетками костного мозга и остеобластами в мембраносвязанных и растворимых формах, а для остеокластогенеза необходимо присутствие стромальных клеток и остеобластов в костном мозге (28).RANKL принадлежит к суперсемейству TNF и имеет решающее значение для образования остеокластов. M-CSF необходим для пролиферации, выживания и дифференцировки предшественников остеокластов, а также для выживания остеокластов и перестройки цитоскелета, необходимых для резорбции кости. OPG — это мембраносвязанный и секретируемый белок, который связывает RANKL с высоким сродством, чтобы ингибировать его действие на рецептор RANK (29).
Резорбция кости зависит от секреции остеокластами ионов водорода и фермента катепсина К. Ионы H + подкисляют отсек резорбции под остеокластами, растворяя минеральный компонент костного матрикса, тогда как катепсин К переваривает белковый матрикс, который в основном состоит из коллагена I типа (11).
Остеокласты связываются с костным матриксом через рецепторы интегрина в мембране остеокластов, связываясь с пептидами костного матрикса. Семейство рецепторов интегрина β1 в остеокластах связывается с коллагеном, фибронектином и ламинином, но основным рецептором интегрина, способствующим резорбции кости, является интегрин α v β 3 , который связывается с остеопонтином и костным сиалопротеином (30).
Связывание остеокластов с костным матриксом приводит к тому, что они становятся поляризованными, при этом резорбирующая кость поверхность образует волнистую границу, которая образуется, когда подкисленные везикулы, содержащие металлопротеиназы матрикса и катепсин К, транспортируются через микротрубочки для слияния с мембраной.Рифленая граница секретирует ионы H + через H + -ATPase и хлоридные каналы и вызывает экзоцитоз катепсина K и других ферментов в подкисленных везикулах (31).
При контакте с костным матриксом фибриллярный актиновый цитоскелет остеокласта организуется в актиновое кольцо, которое способствует образованию зоны уплотнения по периферии прикрепления остеокласта к матрице. Зона уплотнения окружает и изолирует подкисленный отсек резорбции от окружающей поверхности кости (32).Нарушение взъерошенной границы или актинового кольца блокирует резорбцию кости. Активно резорбирующиеся остеокласты образуют подосомы, которые прикрепляются к костному матриксу, а не к фокальным спайкам, которые образуются большинством клеток. Подосомы состоят из актинового ядра, окруженного интегринами α v β 3 и ассоциированными белками цитоскелета.
Остеобласты
Остеопрогениторные клетки образуют и поддерживают остеобласты, которые синтезируют новый костный матрикс на костеобразующих поверхностях (Рисунок 3), остеоциты в костном матриксе, поддерживающие структуру кости, и клетки защитной оболочки, покрывающие поверхность покоящегося кость.Внутри линии остеобластов субпопуляции клеток по-разному реагируют на различные гормональные, механические или цитокиновые сигналы. Остеобласты осевой и аппендикулярной кости по-разному реагируют на эти сигналы.
Самообновляющиеся плюрипотентные стволовые клетки дают начало клеткам-остеопрогениторам в различных тканях при правильных условиях окружающей среды. Костный мозг содержит небольшую популяцию мезенхимальных стволовых клеток, которые способны давать начало костной, хрящевой, жировой или волокнистой соединительной ткани, в отличие от популяции гемопоэтических стволовых клеток, дающих начало клонам клеток крови (33).Клетки со свойствами, характерными для мезенхимальных стволовых клеток костного мозга взрослых, были выделены из периферической крови, пульпы зуба и пуповинной крови плода, печени, крови и костного мозга. Также были идентифицированы мультипотенциальные миогенные клетки, которые способны дифференцироваться в кости, мышцы или адипоциты. Мезенхимные клетки, принадлежащие к одному фенотипу, могут дедифференцироваться во время пролиферации и развить другой фенотип, в зависимости от местной тканевой среды. Перициты кровеносных сосудов могут развить остеобластический фенотип во время дедифференцировки при определенных обстоятельствах (34).
Приверженность мезенхимальных стволовых клеток к клону остеобластов требует канонического пути Wnt / β-catenin и ассоциированных белков (35). Идентификация фенотипа с высокой костной массой, связанного с активирующими мутациями белка, связанного с рецепторами LDL 5, подчеркнула важность канонического пути Wnt / β-catenin в формировании паттерна эмбрионального скелета, развитии скелета плода и ремоделировании скелета взрослых (36,37). Система Wnt также важна в хондрогенезе и гематопоэзе и может быть стимулирующей или ингибирующей на разных стадиях дифференцировки остеобластов.
Уплощенные клетки выстилки кости считаются покоящимися остеобластами, которые образуют эндост на трабекулярной и эндостальной поверхностях и лежат в основе надкостницы на минерализованной поверхности. Остеобласты и клетки выстилки находятся в непосредственной близости и соединяются сращениями. Кадгерины — это кальций-зависимые трансмембранные белки, которые являются неотъемлемой частью адгезивных соединений и вместе с плотными контактами и десмосомами соединяют клетки вместе, связывая их цитоскелеты (38).
Предшественники остеобластов изменяют форму от веретеновидных остеопрогениторов до больших кубовидных дифференцированных остеобластов на поверхности костного матрикса после того, как преостеобласты перестают пролиферировать.Преостеобласты, которые находятся рядом с функционирующими остеобластами в модуле ремоделирования кости, обычно распознаются из-за экспрессии в них щелочной фосфатазы. Активные зрелые остеобласты, которые синтезируют костный матрикс, имеют большие ядра, увеличенные структуры Гольджи и обширный эндоплазматический ретикулум. Эти остеобласты секретируют коллаген I типа и другие матричные белки векторно по направлению к поверхности образования кости.
Популяции остеобластов неоднородны, разные остеобласты экспрессируют разные репертуары генов, что может объяснять гетерогенность трабекулярной микроархитектуры в разных участках скелета, анатомические сайт-специфические различия в болезненных состояниях и региональные различия в способности остеобластов реагировать на используемые агенты. для лечения заболеваний костей.
Костный внеклеточный матрикс
Костный белок на 85–90% состоит из коллагеновых белков (таблица 1). Костный матрикс в основном состоит из коллагена I типа (39) со следовыми количествами коллагенов типов III и V и FACIT на определенных стадиях формирования кости, что может помочь определить диаметр коллагеновых фибрилл. Коллагены FACIT являются членами семейства ассоциированных с фибриллами коллагенов с прерывистой тройной спиралью, группы нефибриллярных коллагенов, которые служат в качестве молекулярных мостиков, которые важны для организации и стабильности внеклеточных матриксов.Члены этого семейства включают коллагены IX, XII, XIV, XIX, XX и XXI. Неколлагеновые белки составляют от 10 до 15% от общего костного белка. Примерно 25% неколлагенового белка происходит экзогенно, включая сывороточный альбумин и α2-HS-гликопротеин, которые связываются с гидроксиапатитом из-за своих кислотных свойств. Неколлагеновые белки сыворотки могут помочь регулировать минерализацию матрикса, а α2-HS-гликопротеин, который является человеческим аналогом фетуина, может регулировать пролиферацию костных клеток. Остальные неколлагеновые белки, полученные экзогенно, состоят из факторов роста и большого количества других молекул в следовых количествах, которые могут влиять на активность костных клеток.
Таблица 1.Белки внеклеточного матрикса a
Остеобласты синтезируют и секретируют столько же неколлагенового белка, сколько коллаген на молярной основе. Неколлагеновые белки в целом делятся на несколько категорий, включая протеогликаны, гликозилированные белки, гликозилированные белки с потенциальной активностью прикрепления клеток и γ-карбоксилированные (gla) белки. Роли каждого из костных белков в настоящее время четко не определены, и многие из них, по-видимому, выполняют несколько функций, включая регуляцию отложения и обмена костных минералов, а также регуляцию активности костных клеток.Ранее считалось, что остеокальцин в сыворотке, синтезируемый остеобластами, действует как промотор или инициатор отложения кальция в очаге между концами коллагеновых фибрилл и, следовательно, рассматривается как маркер образования кости. Наблюдение, что мышь с нокаутом остеокальцина имеет фенотип с высокой костной массой, предполагает, что остеокальцин обычно ингибирует образование кости. Поскольку остеокальцин в сыворотке крови образуется как в результате высвобождения матрикса за счет активности остеокластов, так и в результате синтеза остеобластов, в настоящее время он рассматривается как маркер обновления костной ткани, а не как специфический маркер образования кости.
Основным гликозилированным белком, присутствующим в кости, является щелочная фосфатаза. Щелочная фосфатаза в кости связана с поверхностями клеток остеобластов через фосфоинозитоловую связь, а также находится в свободном состоянии в минерализованном матриксе. Щелочная фосфатаза играет пока еще неопределенную роль в минерализации костей (40). Наиболее распространенным неколлагеновым белком в кости является остеонектин, составляющий примерно 2% от общего белка в развивающейся кости. Считается, что остеонектин влияет на рост и / или пролиферацию остеобластов и минерализацию матрикса.
Минерализация костного матрикса
Кость состоит из 50–70% минералов, 20–40% органического матрикса, 5–10% воды и <3% липидов. Минеральный состав кости состоит в основном из гидроксиапатита [Ca 10 (PO 4 ) 6 (OH) 2 ] с небольшими количествами карбоната, магния и кислого фосфата с отсутствующими гидроксильными группами, которые обычно присутствуют. . По сравнению с геологическими кристаллами гидроксиапатита, костные кристаллы гидроксиапатита очень малы, их наибольший размер составляет всего около 200 Å.Эти маленькие, малокристаллические, карбонат-замещенные кристаллы более растворимы, чем геологические кристаллы гидроксиапатита, что позволяет им поддерживать минеральный метаболизм.
Созревание матрикса связано с экспрессией щелочной фосфатазы и нескольких неколлагеновых белков, включая остеокальцин, остеопонтин и костный сиалопротеин. Считается, что эти связывающие кальций и фосфат белки помогают регулировать упорядоченное отложение минералов, регулируя количество и размер образующихся кристаллов гидроксиапатита.
Костный минерал обеспечивает механическую жесткость и прочность костей, а органический матрикс обеспечивает эластичность и гибкость. Костный минерал изначально откладывается в зонах «дырок» между концами коллагеновых фибрилл (41). Этому процессу могут способствовать везикулы внеклеточного матрикса в кости, такие как кальцификация хряща и минерализация сухожилий индейки (23). Внеклеточные везикулы матрикса синтезируются хондроцитами и остеобластами и служат защищенным микроокружением, в котором концентрации кальция и фосфата могут увеличиваться в достаточной степени, чтобы ускорить образование кристаллов.Внеклеточная жидкость обычно не перенасыщена гидроксиапатитом, поэтому гидроксиапатит не осаждается самопроизвольно. Внеклеточные везикулы матрицы содержат ядро ядра, которое состоит из белков и комплекса кислых фосфолипидов, кальция и неорганического фосфата, которого достаточно для осаждения кристаллов гидроксиапатита. Пока неясно, как внеклеточные везикулы матрикса вносят вклад в минерализацию в определенных местах на концах фибрилл коллагена, потому что везикулы, по-видимому, не нацелены непосредственно на концы фибрилл (23).
Нет никаких доказательств того, что кластеры некристаллического фосфата кальция (аморфный фосфат кальция) образуются в кости до того, как он превращается в гидроксиапатит (42). По мере созревания костей кристаллы гидроксиапатита увеличиваются в размерах и снижают уровень примесей. Увеличение кристаллов происходит как за счет роста кристаллов, так и за счет агрегации. Макромолекулы костного матрикса могут способствовать начальному зарождению кристаллов, секвестрировать ионы минералов для увеличения локальной концентрации кальция и / или фосфора или способствовать гетерогенному зарождению.Макромолекулы также связываются с поверхностями растущих кристаллов, чтобы определить размер, форму и количество образующихся кристаллов.
Подтвержденные промоторы минерализации (нуклеаторы) включают белок 1 матрикса дентина и сиалопротеин кости. Коллаген I типа не способствует минерализации костей. Фосфопротеинкиназы и щелочная фосфатаза регулируют процесс минерализации. Костная щелочная фосфатаза может увеличивать локальную концентрацию фосфора, удалять фосфатсодержащие ингибиторы роста кристаллов гидроксиапатита или изменять фосфопротеины, чтобы контролировать их способность действовать как нуклеаторы.
Витамин D играет косвенную роль в стимуляции минерализации неминерализованного костного матрикса. После абсорбции или выработки кожей витамина D печень синтезирует 25-гидроксивитамин D, а почки впоследствии производят биологически активный 1,25-дигидроксивитамин D [1,25- (OH) 2 D]. Сыворотка 1,25- (OH) 2 D отвечает за поддержание сывороточного кальция и фосфора в адекватных концентрациях, позволяющих пассивную минерализацию неминерализованного костного матрикса. Сыворотка 1,25- (OH) 2 D делает это в первую очередь за счет стимуляции кишечного всасывания кальция и фосфора.Сыворотка 1,25- (OH) 2 D также способствует дифференцировке остеобластов и стимулирует экспрессию остеобластами специфической для кости щелочной фосфатазы, остеокальцина, остеонектина, OPG и ряда других цитокинов. Сыворотка 1,25- (OH) 2 D также влияет на пролиферацию и апоптоз других скелетных клеток, включая гипертрофические хондроциты.
Остеоциты
Остеоциты представляют собой терминально дифференцированные остеобласты и функционируют в синцитиальных сетях, поддерживая структуру кости и метаболизм.Остеоциты лежат в лакунах в минерализованной кости (Рис. 3) и имеют обширные филиподиальные отростки, которые лежат внутри канальцев в минерализованной кости (43). Остеоциты обычно не экспрессируют щелочную фосфатазу, но экспрессируют остеокальцин, галектин 3 и CD44, рецептор клеточной адгезии для гиалуроната, а также несколько других белков костного матрикса. Остеоциты экспрессируют несколько матричных белков, которые поддерживают межклеточную адгезию и регулируют обмен минералов в костной жидкости в лакунах и канальцевой сети.Остеоциты активны во время остеолиза и могут функционировать как фагоцитарные клетки, поскольку содержат лизосомы.
Остеоциты поддерживают связь друг с другом и с поверхностью кости посредством своих множественных филиподиальных клеточных отростков. Коннексины — это интегральные клеточные белки, которые поддерживают щелевые контакты между клетками, чтобы обеспечить прямую связь через межклеточные каналы. Остеоциты метаболически и электрически связаны через щелевые соединения, состоящие в основном из коннексина 43 (44).Щелевые соединения необходимы для созревания, активности и выживания остеоцитов.
Основная функция синцития остеоцитов-остеобластов / выстилающих клеток — механочувствительность (45). Остеоциты преобразуют сигналы напряжения от изгиба или растяжения кости в биологическую активность. Поток канальцевой жидкости в ответ на внешние силы вызывает множество реакций внутри остеоцитов. Считается, что быстрые потоки костного кальция через щелевые соединения филиподий стимулируют передачу информации между остеобластами на поверхности кости и остеоцитами внутри кости (46).Сигнальные механизмы, участвующие в механотрансдукции, включают простагландин E2, циклооксигеназу 2, различные киназы, Runx2 и закись азота.
Остеоциты могут десятилетиями жить в человеческих костях, которые не перевернуты. Присутствие пустых лакун в стареющей кости указывает на то, что остеоциты могут подвергаться апоптозу, вероятно, вызванному нарушением их межклеточных щелевых контактов или взаимодействий клетка-матрица (47). Апоптоз остеоцитов в ответ на дефицит эстрогена или лечение глюкокортикоидами вредит структуре кости.Терапия эстрогенами и бисфосфонатами, а также физиологическая нагрузка на кость могут помочь предотвратить апоптоз остеобластов и остеоцитов (48).
Детерминанты прочности кости
Костная масса составляет от 50 до 70% прочности кости (49). Однако геометрия и состав костей важны, потому что более крупные кости прочнее, чем более мелкие кости, даже при эквивалентной минеральной плотности костей. По мере того как диаметр кости увеличивается в радиальном направлении, прочность кости увеличивается на радиус пораженной кости, увеличенный до четвертой степени.Количество и пропорция трабекулярной и кортикальной кости в данном участке скелета независимо влияет на прочность кости. Свойства костного материала важны для прочности кости. У некоторых пациентов с остеопорозом аномальный костный матрикс. Мутации в некоторых белках могут вызывать слабость костей (, например, , дефекты коллагена вызывают снижение прочности костей при несовершенном остеогенезе, нарушение γ-карбоксилирования белков Gla). На прочность костей могут влиять остеомаляция, терапия фтором или состояния гиперминерализации.Микроструктура костей также влияет на прочность костей. Низкий костный обмен приводит к накоплению микротрещин. Высокий метаболизм кости, при которой резорбция кости выше, чем образование кости, является основной причиной ухудшения микроархитектуры.
Выводы
Каркас выполняет несколько функций. Моделирование и ремоделирование костей сохраняют функцию скелета на протяжении всей жизни. Блок ремоделирования кости обычно сочетает резорбцию и формирование кости. Костный матрикс регулирует минерализацию костей. Прочность костей зависит от костной массы, геометрии и состава, свойств материала и микроструктуры.
- Авторские права © 2008 Американского общества нефрологов
Ссылки
- ↵
Скелетно-мышечная система. В: Анатомия Грея, 39-е изд., Под редакцией Standring S, New York, Elsevier, 2004. , pp83– 135
- ↵
Тайчман Р.С.: Кровь и кость: две ткани, судьбы которых переплетаются, образуя нишу гемопоэтических стволовых клеток. Кровь105 : 2631– 2639,2005
- ↵
Eriksen EF, Axelrod DW, Melsen F.Костная гистоморфометрия, Нью-Йорк, Raven Press, 1994 , pp1– 12
- ↵
Кобаяси С., Такахаши Х.Э., Ито А, Сайто Н., Навата М., Хориучи Х, Охта Х, Ито А, Иорио Р., Ямамото Н., Такаока К.: Трабекулярное минимальное моделирование в подвздошной кости человека. Кость32 : 163– 169,2003
- ↵
Ubara Y, Tagami T, Nakanishi S, Sawa N, Hoshino J, Suwabe T., Kaitori H, Takemoto F, Hara S, Takaichi K: Значение минимоделирования у диализных пациентов с адинамической болезнью костей .Почки Int68 : 833– 839,2005
- ↵
Ubara Y, Fushimi T, Tagami T, Sawa N, Hoshino J, Yokota M, Kaitori H, Takemoto F, Hara S: гистоморфометрические особенности кости у пациентов с первичным и вторичным гиперпаратиреозом. Почки Int63 : 1809– 1816,2003
- ↵
Lindsay R, Cosman F, Zhou H, Bostrom M, Shen V, Cruz J, Nieves JW, Dempster DW: новый график маркировки тетрациклинов для продольной оценки краткосрочных эффектов анаболических препаратов. терапия с помощью биопсии одиночного гребня подвздошной кости: ранние действия терипаратида.J Bone Miner Res21 : 366– 373,2006
- ↵
Burr DB: Целевое и нецелевое ремоделирование. Кость30 : 2– 4,2002
- ↵
Parfitt AM: Целевое и нецелевое ремоделирование кости: взаимосвязь с возникновением и развитием основных многоклеточных единиц. Кость30 : 5– 7,2002
- ↵
Рудман GD: Клеточная биология остеокластов. Опыт Гематол27 : 1229– 1241,1999
- ↵
Boyle WJ, Simonet WS, Lacey DL: Дифференциация и активация остеокластов.Природа423 : 337– 342,2003
- ↵
Blair HC, Athanasou NA: Последние достижения в биологии остеокластов и патологической резорбции кости. Гистол Гистопатол 19 : 189– 199,2004
- ↵
Silver IA, Murrills RJ, Etherington DJ: Микроэлектродные исследования кислой микросреды под прилипшими макрофагами и остеокластами. Exp Cell Res175 : 266– 276,1988
- ↵
Delaisse JM, Andersen TL, Engsig MT, Henriksen K, Troen T., Blavier L: матриксные металлопротеиназы (MMP) и катепсин K по-разному способствуют активности остеокластов.Microsc Res Tech61 : 504– 513,2003
- ↵
Эриксен Э.Ф .: Нормальное и патологическое ремоделирование трабекулярной кости человека: Трехмерная реконструкция последовательности ремоделирования у нормальных и метаболических костных заболеваний. Endocr Rev7 : 379– 408,1986
- ↵
Reddy SV: Регуляторные механизмы, действующие в остеокластах. Crit Rev Eukaryot Gene Expr14 : 255– 270,2004
- ↵
Bonewald L, Mundy GR: Роль трансформирующего фактора роста бета в ремоделировании костей.Clin Orthop Rel Res2S : 35– 40,1990
Hock JM, Centrella M, Canalis E: инсулиноподобный фактор роста I (IGF-I) оказывает независимое влияние на формирование костного матрикса и репликацию клеток. Эндокринология122 : 254– 260,2004
- ↵
Locklin RM, Oreffo RO, Triffitt JT: Эффекты TGFbeta и bFGF на дифференцировку стромальных фибробластов костного мозга человека. Cell Biol Int23 : 185– 194,1999
- ↵
Smit TH, Burger EH, Huyghe JM: Является ли BMU-сцепление явлением, регулируемым деформацией? Анализ методом конечных элементов.J Bone Miner Res15 : 301– 307,2002
- ↵
Smit TH, Burger EH, Huyghe JM: случай для индуцированного деформацией потока жидкости в качестве регулятора соединения BMU и выравнивания костной ткани. J Bone Miner Res17 : 2021– 2029,2002
- ↵
Мартин Т.Дж., Симс Н.А.: Активность остеокластов в сочетании образования кости с резорбцией. Тенденции Mol Med11 : 76– 81,2005
- ↵
Андерсон ХК: матричные везикулы и кальцификация. Curr Rheumatol Rep5 : 222– 226,2003
- ↵
Burger EH, Klein-Nuland J, Smit TH: Поток канальцевой жидкости, полученный деформацией, регулирует активность остеокластов в ремоделирующем остеоне: предложение.Дж Биомех46 : 1452– 1459,2003
- ↵
Добниг Х., Тернер RT: Доказательства того, что периодическое лечение паратиреоидным гормоном увеличивает образование костной ткани у взрослых крыс за счет активации клеток выстилки костей. Эндокринология136 : 3632– 3638,1995
- ↵
Hauge EM, Qvesel D, Eriksen EF, Mosekilde L, Melsen F. Ремоделирование злокачественной кости происходит в специализированных отделениях, выстланных клетками, экспрессирующими маркеры остеобластов. J Bone Miner Res16 : 1575– 1582,2001
- ↵
Parfitt AM: Костное и гемиостеональное ремоделирование: пространственная и временная основа для передачи сигналов в кости взрослого человека.J Cell Biochem55 : 273– 276,1994
- ↵
Teitelbaum SL, Ross FP: Генетическая регуляция развития и функции остеокластов. Нат Рев Генет4 : 638– 649,2003
- ↵
Коэн М.М. младший: Новая биология кости: патологические, молекулярные, клинические корреляты. Am J Med Genet A140 : 2646– 2706,2006
- ↵
Ross FP, Teitelbaum SL: α v β 3 и фактор, стимулирующий колонии макрофагов: партнеры в биологии остеокластов.Иммунол Рев208 : 88– 105,2005
- ↵
Тейтельбаум С.Л., Абу-Амер Й., Росс Ф.П.: Молекулярные механизмы резорбции кости. J Cell Biochem59 : 1– 10,1995
- ↵
Vaananen HK, Zhao H, Mulari M, Halleen JM: Клеточная биология функции остеокластов. J Cell Sci113 : 377– 381,2000
- ↵
Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simonetti DW, Craig S, Marshak DR: Многолинейный потенциал мезенхимальных стволовых клеток взрослого человека.Наука284 : 143– 147,1990
- ↵
Доэрти MJ, Ashton BA, Walsh S, Beresford JN, Grant ME, Canfield AE: Сосудистые перициты выражают остеогенный потенциал in vitro и in vivo. J Bone Miner Res13 : 828– 838,1998
- ↵
Logan CY, Nusse R: Путь передачи сигналов Wnt в развитии и заболевании. Анну Rev Cell Dev Biol20 : 781– 810,2004
- ↵
Boyden LM, Mao J, Belsky J, Mitzner L, Farhi A, Mitnick MA, Wu D, Insogna K, Lifton RP: Высокая плотность костей из-за мутации в белке, связанном с рецептором ЛПНП 5.N Engl J Med346 : 1513– 1521,2002
- ↵
Little RD, Recker RR, Johnson ML: Высокая плотность костной ткани из-за мутации белка 5, связанного с рецептором ЛПНП. N Engl J Med347 : 943– 944,2002
- ↵
Shin CS, Lecanda F, Sheikh S, Weitzmann L, Cheng SL, Civitelli R: Относительное количество различных кадгеринов определяет дифференциацию мезенхимальных предшественников в остеогенные, миогенные или адипогенные пути. J Cell Biochem78 : 566– 577,2000
- ↵
Бродский Б., Персиков А.В.: Молекулярная структура тройной спирали коллагена.Adv Protein Chem70 : 301– 339,2005
- ↵
Уайт М.П .: Гипофосфатазия и роль щелочной фосфатазы в минерализации скелета. Endocr Rev15 : 439– 461,1994
- ↵
Landis WJ: Прочность кальцинированной ткани частично зависит от молекулярной структуры и организации составляющих ее минеральных кристаллов в их органической матрице. Кость16 : 533– 544,1995
- ↵
Вайнер С., Саги И., Аддади Л.: Структурная биология: выбор менее пройденного пути кристаллизации.Наука309 : 1027– 1028
- ↵
Bonewald LF: Создание и характеристика остеоцитоподобной клеточной линии MLO-Y4. J Bone Miner Metab17 : 61– 65,1999
- ↵
Plotkin LI, Manolagas SC, Bellido T: Трансдукция сигналов выживания клеток с помощью полуканалов коннексина-43. J Biol Chem277 : 8648– 8657,2002
- ↵
Rubin CT, Lanyon LE: Остеорегуляторная природа механических стимулов: функция как детерминант адаптивного ремоделирования кости.J Orthop Res5 : 300– 310,1987
- ↵
Jorgensen NR, Teilmann SC, Henriksen Z, Civitelli R, Sorensen OH, Steinberg TH: Активация кальциевых каналов L-типа необходима для опосредованной щелевым соединением межклеточной передачи сигналов кальция в остеобластных клетках. J Biol Chem278 : 4082– 4086,2003
- ↵
Xing L, Boyce BF: Регулирование апоптоза в остеокластах и остеобластных клетках. Биохимия Биофиз Рес Коммуна 328 : 709– 720,2005
- ↵
Plotkin LI, Aguirre JI, Kousteni S, Manolagas SC, Bellido T: Бисфосфонаты и эстрогены ингибируют апоптоз остеоцитов через различные молекулярные механизмы, расположенные ниже по течению от активации киназы, регулируемой внеклеточными сигналами.J Biol Chem280 : 7317– 7325,2005
- ↵
Покок Н.А., Эйсман Дж. А., Хоппер Дж. Л., Йейтс М.Г., Сэмбрук П.Х., Эберл С. Генетические детерминанты костной массы у взрослых: исследование близнецов. J Clin Invest80 : 706– 710,1987
Механическая неоднородность в костном микроокружении по данным атомно-силовой микроскопии
ВВЕДЕНИЕ
Становится все более очевидным, что механические свойства и силы играют важную роль в управлении многими аспектами клеточной биологии тканей и органов, включая рост, миграция, дифференциация, гомеостаз и коммуникация (1–3).Как такие силы влияют на эти фундаментальные клеточные процессы, требует понимания механических свойств на субклеточном уровне, но в контексте ткани, органа или даже всего организма. Получение этой информации особенно сложно, поскольку большинство традиционных методов обработки тканей (, например, . Секционирование) или фиксации радикально изменяют механические свойства по крайней мере части структуры (, например, . Путем замораживания и оттаивания). Точно так же получение соответствующего пространственного и временного разрешения с достаточной чувствительностью к силе для систематического определения соответствующих механических изменений в различных масштабах клеток и тканей требует новых специализированных подходов.Здесь мы представляем подход на основе атомно-силовой микроскопии (АСМ) для решения этих проблем, позволяющий изучать кости, уникальный и сложный с механической точки зрения орган.
Костная ткань состоит преимущественно из двух типов костной ткани: кортикальной и трабекулярной. Кортикальная кость (также известная как плотная кость) структурно компактна и несет нагрузку веса тела. Трабекулярная кость (также известная как губчатая кость или губчатая кость) имеет более слабо организованную структуру и высокую метаболическую активность (4).Оба типа костей содержат неорганические (костный минерал и вода) и органические компоненты (костные клетки и матрикс), которые образуют сложные взаимосвязанные структуры (5). Помимо того, что кость играет центральную роль в механической поддержке, кость содержит костный мозг, который играет важную роль в физиологии млекопитающих через кроветворение и регулирование переноса иммунных и стромальных клеток (6). Костные ткани подвергаются непрерывному динамическому ремоделированию в ответ на изменения механической нагрузки и во время гомеостатического восстановления микроповреждений, возникающих в результате нормального «износа».Баланс между отложением и резорбцией кости регулируется костными клетками, называемыми остеобластами и остеокластами соответственно (4, 5). Остеобласты происходят из мезенхимальных стволовых клеток (МСК), а остеокласты происходят из гемопоэтических стволовых клеток (ГСК), оба из которых находятся в костном мозге (6). Кроме того, существует множество клеток-предшественников, иммунных клеток, стромальных клеток и адипоцитов, участвующих в поддержании гомеостаза кости.
Механические свойства кости имеют фундаментальное значение для функции скелета (7), и изменения в нагрузке на костную ткань могут влиять на метаболизм кости, процесс, при котором формирование и абсорбция кости находятся в физиологическом равновесии, тем самым предотвращая чистый прирост или потерю костной ткани. (8).Исследования механики костей необходимы для полного понимания того, как механические свойства костного микроокружения (BMev) влияют на биологические функции, такие как обмен костной ткани, и были хорошо развиты в последние десятилетия. In-vitro модели , имитирующие BMev, обычно используются для изучения роли механических свойств в функции костей и связанных с ними заболеваний, таких как метастазы в кости, вызванные раком (9, 10). Однако эти модели in vitro не полностью повторяют сложность модели in vivo BMev и, следовательно, не имеют фундаментальных компонентов лежащей в основе биологии (10).
В многочисленных исследованиях с использованием различных методов были охарактеризованы механические свойства кости в различных масштабах длины. Исследования эластичности и вязкоупругости как кортикальных, так и трабекулярных костей обычно дают модули Юнга / сдвига в диапазоне ГПа, хотя результаты различаются из-за различных экспериментальных условий (11–22). Модуль Юнга / сдвига губчатой кости немного ниже, чем у кортикальной кости, и иногда составляет всего 10–100 МПа (23, 24). Пластинка роста более податлива, чем кортикальная и губчатая костные ткани, с модулем Юнга от 300 кПа до 50 МПа (25–28).Напротив, большинство исследований костного мозга рассматривают его как чисто вязкую ткань (29), сообщая о значениях вязкости в диапазоне от менее 1 Па⋅с до 100 Па⋅с (29–31).
Структурная сложность образцов кости может препятствовать точному механическому мониторингу. Для решения этой проблемы был принят ряд подходов, включая замораживание кости (32, 33), обезвоживание (34), струйную промывку (35), полировку (12, 19, 36) и гомогенизацию (37, 38) в дополнение. к секционированию или разрыву. Хотя различия в механических свойствах BMev могут быть извлечены из образцов, полученных с помощью этих методов, такая обработка существенно изменяет структуру поверхности (35) и, как следствие, вызывает сдвиг в измеренных механических свойствах (14, 19).Однако возможность количественной оценки механических свойств тканей в различных масштабах длины имеет решающее значение при построении моделей для теоретического моделирования или в тканевой инженерии для воспроизведения ключевых характеристик таких тканей. Недавнее исследование интактного костного мозга продемонстрировало как возможность, так и преимущества механических измерений с использованием минимально деконструированных образцов (39). В отличие от других исследований, эта работа определила, что костный мозг преимущественно эластичен, и предположила, что вклад внеклеточного матрикса в механические свойства свежих образцов важен для объяснения наблюдаемой неоднородности.Доступного масштаба в этом исследовании было недостаточно, чтобы выявить механическую неоднородность кости, и предполагалось, что необходимы методы, подходящие для более мелкомасштабной характеристики.
За последнее десятилетие появилось несколько методов оценки локальных (, т.е. клеточных или субклеточных) механических свойств биологических тканей, включая оптические (40, 41) и акустические (42) методы. Однако структурная и механическая неоднородность BMev делает применение этих подходов особенно сложным.АСМ позволяет характеризовать в масштабе длины от нм до десятков мкм (25, 43–45), что особенно важно для понимания биологических механизмов, возникающих на молекулярном и клеточном уровне.
Здесь мы сосредоточились на измерении субклеточных механических свойств ненесущих компонентов необработанной кости на внутренних поверхностях (за исключением продольного расщепления, которое необходимо для доступа к ткани). Механические измерения были выполнены с использованием коллоидного зонда AFM, в отличие от наноиндентирования (19, 34) или AFM с помощью обычных острых зондов (13, 14, 17, 25) из-за чрезвычайной мягкости неминерализованных компонентов в BMev.Точечные измерения проводились случайным образом на макромасштабе (> 100 мкм) поверхностей кости. Как упругие, так и вязкоупругие свойства различных областей BMev были определены количественно путем подгонки данных, полученных из кривых сила-расстояние и ползучести (, т.е. релаксации деформации), полученных с помощью АСМ с соответствующими механическими моделями. Кости молодых (6-8 недель) и зрелых (11-13 недель) мышей сравнивали, чтобы определить любые механические изменения, вызванные возрастным созреванием скелета. Наконец, для получения изображений использовалось силовое картирование АСМ (макс.размер 100 × 100 мкм 2 ), что отражает неоднородность морфологии и механики BMev в надклеточном масштабе (от 5 мкм до 100 мкм). Также обсуждаются последствия наших выводов для потенциальной корреляции с биологическими функциями костей.
МАТЕРИАЛЫ И МЕТОДЫ
Животные
Все эксперименты с животными были одобрены Комитетом по приложениям и поправкам (этике) Университета Шеффилда и проводились в соответствии с Положениями Министерства внутренних дел Великобритании под номером лицензии на проект 70/8964 (NJB).Мышей содержали в контролируемой среде с 12-часовым циклом свет / темнота при 22 ° C. Мыши имели доступ к пище и воде ad libitum , Teklad Diet 2918 (Envigo, UK). В этих исследованиях использовалась 21 мышь.
Подготовка образцов костей
Бедренные кости как молодых (от 6 до 8 недель, 9 костей от 8 мышей), так и зрелых (от 11 до 13 недель, 24 кости от 13 мышей) использовали в этом исследовании, если не указано иное. Мышей забивали путем смещения шейных позвонков и отделения задних конечностей от таза у головки бедренной кости.Мышечная ткань, соединенная с костью, была удалена, а бедренная кость отделена от большеберцовой кости в коленном суставе. Рассеченные бедренные кости помещали в фосфатно-солевой буфер (PBS) (Lonza, США) при 4 ° C и разделяли перед измерением, которое было в пределах 36 часов после выбраковки. Специально разработанный инструмент с лезвием бритвы (рис. S1a) использовался для продольного перелома кости, которая была иммобилизована на платформе с помощью двухкомпонентной замазки для снятия слепков (Provil Novo Light, Kulzer, UK). Затем расщепленную кость погружали в PBS и иммобилизовали в чашке Петри (TPP, Швейцария) с тем же материалом для снятия слепков.Были приняты меры для поддержания гидратации обнаженной поверхности кости в течение всего процесса.
Подготовка кантилевера коллоидного зонда
Прямоугольные Si 3 N 4 кантилевера с номинальной жесткостью пружины 0,02 Н / м (кантилевер B MLCT, Bruker, США) использовались для всех измерений АСМ. Микросферы из полистирола диаметром 25 мкм (Sigma Aldrich, США) были прикреплены к кантилеверу с помощью УФ-отверждаемого клея (NOA 81, Norland Inc., США) с использованием AFM (Nanowizard III, JPK, Германия) и в сочетании с инвертированный оптический микроскоп (Eclipse Ti, Nikon, Япония) в качестве микроманипулятора.Перед установкой коллоидного зонда жесткость пружины каждой кантилевера определялась на воздухе методом теплового шума (46). Чтобы предотвратить сильное неспецифическое связывание между зондом и поверхностью образца, кантилевер с прикрепленным коллоидным зондом и держатель кантилевера пассивировали 20-минутным погружением в 10 мг / мл бычьего сывороточного альбумина (BSA) (Sigma Aldrich, США). Избыток БСА удаляли промыванием 5 × 1 мл PBS.
Силовая спектроскопия и картирование в АСМ
Все измерения АСМ были выполнены на системе Nanowizard III (JPK, Германия) с использованием нагретого предметного столика (от 35 до 37 ° C).Чувствительность к отклонению кантилевера была откалибрована перед каждым измерением из режима жесткого контакта кривых сила-расстояние (среднее значение из 10 повторяющихся кривых), полученных из чистой чашки Петри, содержащей PBS. Подготовленные образцы костей в PBS (рис. 1а) затем помещали на предметный столик и исследовали после того, как температура жидкости стабилизировалась. Кривые сила-расстояние (рис. 1b) были получены в случайно выбранных положениях из разных областей интереса по направлению к дистальному концу каждой бедренной кости, как показано на рис.1а. Для большинства образцов от каждой бедренной кости измеряли от 5 до 10 положений в каждой области BMev, но иногда их количество выходило за пределы этого диапазона в зависимости от качества образца (, например, шероховатость поверхности). Скорость подхода составляла 1 мкм / с, если не указано иное. Впоследствии кривые с 3-секундной выдержкой при постоянной силе (0,5 нН), , т.е. кривые ползучести, были также получены из того же положения (рис. 1d). Как для кривых «сила-расстояние», так и для кривых ползучести, в каждом месте было проведено минимум 3 измерения.
Рисунок 1.Методы измерения механических свойств внутренних поверхностей кости (цветная версия доступна в Интернете). (а) Изображение подготовленной поверхности кости в светлом поле для АСМ-характеристики Четыре области интереса обозначены цветными пунктирными линиями: (1) кортикальная кость ( красный ), (2) пластина роста ( синий ), (3 ) метафиз ( зеленый ) и (4) костный мозг в диафизе ( пурпурный ). (b) Представительские силы ( F ) vs.кривая вдавливания ( δ ), полученная при приближении зонда АСМ ( красный ) и ретракции ( синий ) на поверхности кости. Положение контакта (δ = 0) определялось по кривой подхода с использованием метода определения порога треугольника, описанного в вспомогательном материале. (c) Примеры модели Герца-Снеддона (HS) подходят для участка подвода кривой сила-вдавливание ( красный ) HS-подходят либо с использованием фиксированной точки контакта ( синяя пунктирная линия ), определенной с использованием порогового значения треугольника. метод (описанный в Поддерживающем материале), или с точкой контакта в качестве параметра свободной подгонки ( черная пунктирная линия ).Звездочка (★) показывает положение точки контакта, определяемое посадкой. (d) Репрезентативная кривая ползучести (Δδ по сравнению с t ), полученная из участка выдержки кривой силы, снятой на поверхности кости. Приложенная сила ( синий ) поддерживалась постоянной в течение 3 с, в то время как глубина вдавливания увеличивалась ( красный ) из-за того, что материал был скорее вязкоупругим, чем чисто эластичным. (e) Пример подгонки вязкоупругой модели ( черная пунктирная линия ) на кривой ползучести ( красная линия ).
Затем был получен двумерный массив кривых сила-расстояние (, т.е. карта АСМ, одна кривая силы на пиксель) в случайно выбранных областях в различных областях кости со скоростью приближения 30 мкм / с. Была выбрана более высокая скорость приближения для карт сил, чтобы минимизировать время сбора данных и последующее ухудшение качества образца. Перед получением карт для анализа (обычно 1–1,6 мкм на пиксель) были собраны «обзорные» карты низкого разрешения (от 10 до 15 мкм на пиксель), чтобы гарантировать, что основные элементы в выбранной области могут быть отображены, не превышая 15 мкм Z диапазон АСМ.
Все измерения АСМ (кривые «сила-расстояние», кривые ползучести и карты сил) на одном образце кости обычно можно собрать за 2-6 часов. Измеренные костные поверхности были стабильными в течение этого времени (, то есть , не наблюдалось значительной диссоциации или значительных отличий в кривых силы). Кривые эталонной силы-расстояния были получены на чашке Петри в конце измерений для проверки загрязнения коллоидного зонда, при этом не было обнаружено никаких значительных загрязняющих веществ (ожидается, что они проявятся в виде сильных адгезионных свойств в отводном сегменте кривых).
Необработанные данные были экспортированы в формате .txt с использованием обработки данных JPK и импортированы в настраиваемые алгоритмы в MATLAB (сгенерированные собственными силами XC) для всех последующих анализов. Скрипты обработки данных доступны по запросу.
Обработка и анализ кривых «сила-расстояние»
Необработанные кривые «сила-расстояние» сначала были преобразованы в кривые «сила ( F ) — вдавливание ( δ )» (рис. 1b) путем применения коррекции базовой линии, определения точки контакта и вычитая прогиб кантилевера из смещения по оси Z в режиме контакта (см.Методы поддержки и рис.S1b-e). Кривые были подогнаны к модели Герца-Снеддона (47) с использованием специальной процедуры Matlab с модулем Юнга ( E H-S ) и виртуальной точкой контакта в качестве параметров произвольной подгонки (см. Вспомогательные методы). E H-S в любом измеренном положении определяли по среднему значению, полученному в результате подгонки ко всем повторяющимся кривым F — δ в одном и том же положении, если не указано иное. Качество F — δ кривых ( i.е. наклон базовых линий), а изменение качества подгонки лишь незначительно повлияло на результаты, как описано в Вспомогательных методах. Важно отметить, что анализ, описанный в этом разделе, неявно предполагает, что механический отклик BMev является чисто упругим.
Обработка и анализ кривых ползучести
Необработанные кривые силы ( F ) — времени ( t ) из сегмента выдержки кривых сила-расстояние были проверены и отброшены, если сила не могла поддерживаться постоянной с помощью контура обратной связи .Значение смещения по оси Z в начале периода выдержки было вычтено из кривой смещения-времени, чтобы получить кривую изменения вдавливания ( Δδ ) — время ( t ) (кривая ползучести). Это соответствовало как стандартной модели линейного твердого тела (SLS) (рис. S1f), так и модели Кельвина-Фойгта (K-V) (рис. S1g), основанной на теории, разработанной Cheng et. al. (48) (см. Поддерживающие методы). Мгновенный модуль упругости ( E 1 ), запаздывающий модуль упругости ( E 2 ) и вязкость ( η ) были параметрами произвольной подгонки с использованием модели SLS, а модуль Юнга ( E KV ) и вязкости ( η ) с использованием модели KV.Результаты были получены из среднего значения повторных измерений в каждой позиции, а результаты с низким качеством подгонки ( R 2 <0,9) были отброшены, если не указаны.
Обработка данных карты АСМ
Из карт АСМ были созданы карты трех типов, которые графически представляли топографию и механические свойства отсканированных областей. Во-первых, карта точки запуска была построена из вертикального положения, в котором сила взаимодействия между зондом и образцом достигла значения запуска.Это представляет собой топографию поверхности, включая врезание зонда в образец. Во-вторых, карта точки контакта была построена из вертикального положения, в котором считалось, что зонд вошел в первоначальный контакт с поверхностью образца, определяемого из точки контакта, найденной для каждой кривой силы на карте с использованием метода определения порогового значения треугольника, как показано на рис. .S1b. Это представляет собой приближение к топографии при нулевой нагрузке и вдавливании. В-третьих, карта упругости была построена на основе модуля Юнга E H-S , извлеченного из всех силовых кривых на карте с использованием модели Герца-Снеддона с подобранной точкой контакта.Как для карты точек контакта, так и для механической карты пиксели с кривыми, которые не могли быть правильно подогнаны из-за отсутствия четкой бесконтактной базовой линии, точки контакта и монотонного режима контакта, считались «недостающими данными» и окрашивались в черный цвет на рисунках. .
Статистический анализ
Статистический анализ проводился с использованием программного обеспечения OriginPro. Перед дальнейшим анализом ко всем распределениям применялся тест на нормальность. Затем данные были проанализированы с помощью теста Краскела-Уоллиса для сравнения между различными группами.Статистически значимая разница была определена как p <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Четыре представляющие интерес области (рис. 1а) внутри BMev были выбраны на поверхности расщепленных костей для АСМ-характеристики из-за их разнообразного состава и функций: (i) кортикальная кость, (ii) пластинка роста , (iii) метафиз и (iv) костный мозг в диафизе. Четыре области интереса показаны цветными контурами на светлопольном изображении (рис. 1а). В длинных костях, таких как бедренная кость, пластинка роста (также известная как эпифизарная пластинка или физиз) находится на каждом конце.Здесь происходит продольный рост кости, состоящей из большого количества хондроцитов и белкового матрикса. Узкая часть, расположенная чуть ниже ростовой пластинки, метафиз (4), также была исследована. Предыдущие доклинические исследования in vivo из нашей группы определили, что это преобладающая область, где циркулирующие метастатические раковые клетки являются домом и колонизируют в кости (49, 50). В метафизе измерения проводились либо на губчатой костной ткани, либо на прилегающих мягких тканях в окружающем костном мозге.В диафизе мы измерили как кортикальную часть кости, которая включает внешний стержень длинной кости, так и центральную полость костного мозга.
Для измерений АСМ использовались только кости с достаточно гладкой топографией поверхности после расщепления. Однако даже на этих образцах диапазон высоты профиля поверхности мог по-прежнему варьироваться на несколько сотен микрометров по всей кости. Наклон или кривизна разделенной поверхности иногда приводили к засорению кантилевера или держателя кантилевера на частях кости, которые были выше интересующей области.В этих случаях невозможно было измерить все интересующие области на одном и том же образце.
Измерения точечной силы и вдавливания выявляют механическую неоднородность, охватывающую несколько порядков величины в каждой из различных областей микросреды кости, причем все области содержат очень мягкие (1-10 Па) области
Для исследования общего механического профиля для каждой области кости , мы сначала применили измерения точечной силы ( F ) -индентирования ( δ ) в случайно выбранных положениях в указанной области.Типичная кривая F — δ , полученная на поверхности расщепленной кости, показана на рис. 1b (см. Вспомогательный материал и рис. S1b-e для получения подробной информации о преобразовании исходных кривых отклонения-расстояния в F —. δ кривые). На большинстве кривых не наблюдались особенности, связанные с пластической деформацией (пределы текучести, плато и т. Д.), Что указывает на целесообразность анализа упругости или вязкоупругости. Для простоты модуль Юнга E H-S вместе с виртуальной точкой контакта был получен из модели Герца-Снеддона, которая соответствует кривым F — δ (рис.1в) в предположении чисто упругого отклика. Данные включают кости как молодых, так и взрослых мышей.
Гистограммы E H-S для каждой области кости показаны на рис. 2 (обратите внимание на логарифмический масштаб горизонтальных осей) и не подчиняются ни нормальному, ни лог-нормальному распределению. Медиана E HS составляет: (i) кортикальный слой кости: 0,29 кПа, (ii) пластина роста: 91 Па, (iii) метафиз: 17 Па и (iv) костный мозг: 6,7 Па. Среднее значение E HS — это (i) кортикальная кость: 2.7 кПа, (ii) пластина роста: 0,19 кПа, (iii) метафиз: 0,42 кПа и (iv) костный мозг: 0,14 кПа. Эти данные говорят о том, что BMev очень мягкий.
Рис. 2.Эластичные свойства различных участков кости (цветная версия доступна в Интернете). (а) Модуль Юнга ( E H-S ) различных областей в BMev, рассчитанный с использованием модели Герца-Снеддона с подобранной точкой контакта. Центральное поле охватывает нижний квартиль и верхний квартиль данных. Сплошная линия внутри прямоугольника показывает срединное значение, а усы — нижний и верхний крайние значения.Средние значения обозначены черными пунктирными линиями. Данные были получены в случайно выбранных позициях в интересующих областях на костях как молодых, так и зрелых мышей. Модуль Юнга, представленный в каждой позиции, представляет собой среднее значение индивидуальных аппроксимаций для всех кривых сила-вдавливание, взятых в этом месте. Кривые с сильно наклоненными базовыми линиями (, т.е. , d b > d c /4, как на рис. S1c) были отброшены. Следствие некачественной фурнитуры ( i.е . R 2 <0,9) также были выброшены. (b) Гистограммы E H-S различных областей кости, как на (a). Соответствующие гистограммы в линейном масштабе представлены на рис. S2.
Распределения E HS очень широки во всех областях, представляющих интерес, охватывая несколько порядков величины (данные в линейном масштабе см. На рис. S2), выявляя крайнюю механическую неоднородность в каждой области, которая согласуется с известной неоднородной структурой кости (12, 26, 33).
Механическое распределение значительно различается между различными областями кости ( p <10 -4 по критерию Краскела-Уоллиса). Гистограммы E HS , измеренные для кортикальной кости, показывают широкое распределение, в котором отсутствует резкий пик с большой частью данных на относительно высоком уровне E HS (, т.е. E HS > 10 3 Па) по сравнению с механическим распределением других измеренных участков кости.Это согласуется с высоким уровнем минерализации кортикального слоя кости (5). Механическое распределение как пластинки роста, так и костного мозга более узкое, что отражает более однородный состав и / или структуру по сравнению с другими областями кости (51). Измеренный модуль метафиза охватывает самый широкий диапазон из-за присутствия в этой области как костной ткани, так и костного мозга, что усиливает структурную и, следовательно, механическую неоднородность.
Наш подход ограничивает получение данных за пределами диапазона, показанного на гистограммах.На конце распределения с низкой жесткостью (Па) ошибки преобладают из-за неточностей в определении точки контакта и имеют тенденцию приводить к завышению извлеченных модулей, поэтому распределения могут расширяться до еще более низких модулей. На конце с высокой жесткостью (100 с кПа) имеется недостаточное вдавливание при максимальных используемых (спусковых) усилиях, что может привести к занижению извлеченных модулей. В качестве контроля, E HS , извлеченные из твердой стены F — кривые δ , из чашки Петри из полистирола (ожидается E HS ~ 3 ГПа) под тем же экспериментальным условиях, не превышает 10–100 кПа, что является верхним пределом E HS при использовании текущей настройки АСМ (которая ориентирована на измерение мягких компонентов).Экспериментальная установка не чувствительна к модулям ГПа кальцифицированной кортикальной и губчатой кости, описанным ранее (11-15), так как это выходит за рамки данного исследования.
Однако наш подход имеет важное преимущество, заключающееся в возможности измерения субклеточных свойств мягких тканей, то есть клеточного микроокружения. Модули Юнга, найденные в текущем исследовании, на порядки ниже, чем значения, указанные в большинстве предыдущих исследований (11–28, 34). Прямое сравнение затруднено, но возможность измерения в масштабе длины клеточных компонентов, вероятно, будет способствовать различию.Предыдущие эксперименты, выполненные с использованием методов индентирования без АСМ (19, 34), обычно усредняются на больших площадях (сотни мкм 2 ) и, таким образом, не могут определить свойства меньшего масштаба. Между тем, кантилевер с низкой жесткостью пружины и датчик с относительно большим радиусом контакта были выбраны для использования в текущем исследовании после обширных предварительных экспериментов и обеспечивают достаточную чувствительность к силе для оценки механики субклеточного отложения в мягких тканях. Это контрастирует с использованием обычных острых зондов AFM и позволяет точные измерения мягких компонентов в BMev, а не просто возможность получить измерения из кальцифицированных областей (11-15).
В предыдущих исследованиях сообщалось, что механические характеристики костного мозга отличаются от других областей внутри BMev. Область костного мозга традиционно считается вязкой жидкостью (29), и существует лишь несколько исследований, описывающих эластические свойства. Однако недавнее исследование показало, что костный мозг преимущественно эластичен, и сообщил об эффективном модуле Юнга в диапазоне от 0,1 до 10,9 кПа при физиологической температуре (39). Это значение, полученное для кости свиньи, аналогично значению, полученному в текущем исследовании для кости мыши, разница в результирующих модулях, скорее всего, связана с использованием реологических измерений вместо вдавливания.Важно отметить, что костный мозг, использованный как в предыдущем (36), так и в настоящем исследовании, практически не поврежден, без обработки (например, фиксации) до измерения механических свойств.
Модель H-S с установленной точкой контакта не идеально подходит для всей кривой F — δ (рис. 1c). Вероятно, это связано с тем, что модель H-S предполагает, что исследуемый материал является однородным и линейно упругим, тогда как BMev, как известно, структурно неоднороден (5) (дополнительные ошибки в модели обсуждаются в материалах поддержки).Упругие модели, описывающие прерывистые материалы (, например, модель ячеисто-полимерной кисти (52)), могут быть полезны для более точного определения эластичности BMev. Кроме того, во многих исследованиях предполагается, что BMev является вязкоупругим материалом (18, 21, 34, 53). Чтобы исследовать это дальше, мы охарактеризовали вязкоупругие свойства путем измерения ползучести при вдавливании.
Точечные измерения вдавливания и ползучести демонстрируют, что микросреда кости может быть описана как неоднородное вязкоупругое твердое тело Кельвина-Фойгта
Для определения вязкоупругих свойств BMev используется уравнение, основанное на трехэлементной модели Standard Linear Solid (SLS) (Рис.S1f), разработанный Cheng et. al . (48) был впервые использован для соответствия изменению отступа ( Δδ ) по сравнению с . Кривые времени ползучести ( t ) (рис. 1d-e). Кривые Δδ — t для 90% из всех 779 измеренных положений во всех областях BMev костей как молодых, так и зрелых мышей могут быть хорошо подогнаны с помощью этой простой вязкоупругой модели ( R 2 > 0,9). Это подтверждает предположение о том, что BMev является скорее вязкоупругим, чем чисто эластичным.
Модули, представляющие как мгновенное упругое поведение ( E 1 ), так и запаздывающее упругое поведение ( E 2 ), могут быть получены из модели SLS (рис. S3). Примечательно, что в большинстве случаев E 1 был значительно выше, чем E 2 . Для всех позиций, которые хорошо соответствовали модели SLS, 93% имеют E 1 > 10 E 2 и 84% имеют E 1 > 100 E 2 (рис.S3d). Это указывало на то, что любая деформация, вызванная мгновенной эластичностью, была незначительной. Таким образом, полная модель SLS в значительной степени не нужна и может быть дополнительно упрощена до двухэлементной модели Кельвина-Фойгта (K-V) (рис. S1g). Δδ против . Затем кривые t были подогнаны к упрощенному уравнению (для разработки и проверки см. Вспомогательный материал) на основе модели K-V. По сравнению с использованием модели SLS, можно было бы хорошо подогнать такое же количество измеренных положений ( R 2 > 0.9). Это предполагает, что модели K-V достаточно для описания вязкоупругости, а большая часть BMev по своей природе действует как твердое тело Кельвина-Фойгта. Твердое тело типа K-V представляет собой преимущественно вязкую жидкость на коротких временных масштабах и преимущественно упругое твердое тело на больших временных масштабах. Это имеет биологическое значение в контексте BMev. Являясь твердым телом типа K-V, обеспечивает быстрое демпфирование энергии через BMev в ответ на любую резкую механическую нагрузку, а также поддерживает стабильную форму в течение длительного времени как часть каркаса тела.
Модуль Юнга, определенный с помощью модели KV E KV и вязкость η для различных областей кости, показаны на рис. 3. Медиана E KV для различных областей Интерес к BMev, представленный на фиг. 3a, представляет (i) кортикальный слой кости: 0,86 кПа, (ii) пластинка роста: 1,5 кПа, (iii) метафиз: 0,40 кПа и (iv) костный мозг: 0,14 кПа. Среднее значение E K-V для различных областей, представляющих интерес в BMev: (i) кортикальная кость: 4.2 кПа, (ii) пластина роста: 2,9 кПа, (iii) метафиз: 1,7 кПа и (iv) костный мозг: 0,52 кПа. Эти значения значительно выше, чем значения E HS , полученные из чистой эластичной посадки (как на рис. 2a, кортикальная кость: p <0,01, пластина роста: p <10 -33 , метафиз: p <10 −18 , костный мозг: p <10 −22 ), что неудивительно, поскольку последний не учитывает наличие вязкого эффекта.Распределения E K-V всех областей BMev (рис. 3c) охватывают несколько порядков величины со значительными различиями ( p <0,05) между областями кости.
Рис. 3.Вязкоупругие свойства различных участков кости (цветная версия доступна в Интернете). (a) Модуль Юнга E K-V и (b) вязкость η различных участков кости, рассчитанная на основе кривых ползучести с использованием вязкоупругой модели Кельвина-Фойгта.Центральное поле охватывает нижний квартиль и верхний квартиль данных. Сплошная линия внутри рамки показывает медианное значение, а усы — нижнюю и верхнюю крайние значения. Средние значения обозначены черными пунктирными линиями. Данные были получены в тех же местах, что и измерения эластичности (рис. 2) от всех костей мышей. Результаты основаны на среднем значении всех повторных измерений в каждой позиции. Результаты для фитингов низкого качества ( т.е. . R 2 <0,9) были отброшены.Также показаны гистограммы (c) E K-V и (d) η различных областей кости.
Средняя результирующая вязкость η различных областей BMev представлена на рис. 3b следующим образом: (i) кортикальный слой кости: 1,3 кПа · с, (ii) пластина роста: 0,68 кПа · с, (iii) метафиз: 0,29 кПа. ⋅s и (iv) костный мозг: 0,21 кПа⋅с. Средняя результирующая вязкость η различных областей BMev составляет (i) кортикальный слой кости: 4,4 кПа · с, (ii) пластинка роста: 1,3 кПа · с, (iii) метафиз: 1.3 кПа⋅с и (iv) костный мозг: 0,31 кПа⋅с. Ширина распределения η (рис. 3г) меньше, чем у E K-V , но все же охватывает несколько порядков. Значительные различия между различными областями кости ( p <0,01) также обнаружены в отношении данных эластичности. Время ползучести τ , определяемое как время спада деформации до 1/ e от ее полного изменения, может быть вычислено из значений E KV и η каждого измеренного положения. на τ = 3 η / E K − V .Среднее время ползучести τ различных областей BMev: (i) кортикальная кость: 2,2 с, (ii) пластинка роста: 1,3 с, (iii) метафиз: 2,1 с и (iv) костный мозг: 4,1 с. Среднее время ползучести τ различных областей BMev: (i) кортикальный слой кости: 140 с, (ii) пластинка роста: 16 с, (iii) метафиз: 34 с и (iv) костный мозг: 36 с. Среднее время ползучести для всех областей аналогично времени вдавливания при измерениях упругости, поэтому релаксация ползучести и вдавливание, скорее всего, происходят одновременно в экспериментах по силе-расстоянию.Таким образом, сила вязкого сопротивления, вероятно, будет иметь сильное влияние на кривую F — δ , особенно в более мягких областях и вокруг точки контакта, где скорость нагружения наиболее высока. Это, скорее всего, основная причина расхождения между аппроксимацией Герца-Снеддона и модулем, полученным из данных о ползучести.
Трудно проводить сравнения с предыдущими опубликованными исследованиями по количественной оценке вязкоупругих свойств твердых областей кости, поскольку в этих исследованиях измерялась механика потенциальной нагрузки (т.е.е. минерализованные области) (18–20), в то время как текущее исследование было сосредоточено на получении измерений из клеточного микросреда. Исследования метафиза измеряли губчатую кость (23, 34), тогда как в наших измерениях преобладает компонент, более похожий на костный мозг, который составляет большую часть площади поверхности в области, количественно определяемой в наших образцах.
В отличие от твердых участков кости, состав костного мозга в предыдущих исследованиях более сопоставим со значениями, указанными здесь. Модуль Юнга из упругих ( E H-S ) и вязкоупругих ( E K-V ) характеристик в нашем исследовании хорошо согласуется с эффективным модулем Юнга, полученным в (39).Вязкость η по реологическим измерениям (29–31) находится в диапазоне от намного ниже 1 Па⋅с до примерно 100 Па⋅с. Однако в нашем исследовании результирующие медиана и среднее значение вязкости костного мозга значительно больше (0,2 кПа⋅с и 0,3 кПа⋅с). Это можно объяснить как подготовкой образца, так и ограничениями инструмента. Было показано, что подготовка и последующая обработка образца влияют на вязкость костного мозга. Например, вязкость образцов, прошедших цикл замораживания-оттаивания перед тестированием, была на порядок ниже по сравнению со свежими образцами (31).Также в наших исследованиях костный мозг не извлекался из костномозговой полости. Таким образом, связи костного мозга и костной ткани, а следовательно, и жесткость структуры костного мозга, были сохранены и относительно неповреждены.
Примечательно, что вязкость часто зависит от скорости и, следовательно, меняется в зависимости от частоты измерений, используемых в различных исследованиях. Было показано, что вязкость костного мозга уменьшается с увеличением скорости сдвига по степенному закону (31, 39).В отличие от динамических измерений, квазистатический метод, использованный в нашем исследовании, не охватывает широкий диапазон частот. Этот квазистатический метод требует, чтобы время ползучести τ образца было значительно больше, чем время, необходимое для преодоления инерции системы во время перехода от вдавливания к выдержке (примерно 0,05 с). Поскольку τ коррелирует как с E KV , так и с η , нижний предел обнаруживаемого τ указывает на то, что результирующая вязкость η с использованием такого квазистатического метода не может быть очень большой. ниже самых низких значений, которые мы измерили (или E KV намного выше, чем текущие самые высокие измеренные нами значения).
Старение влияет на субклеточные механические свойства в макромасштабе костного мозга, но лишь незначительно влияет на другие области костного микроокружения
Обмен костной ткани при здоровье и таких заболеваниях, как остеопороз и потеря костной массы, вызванная раком, демонстрирует особенности, зависящие от возраста ( 26, 49, 54–57). Следовательно, сравнение механических свойств BMev у мышей разного возраста позволит выяснить изменения, происходящие в механике BMev во время созревания скелета. Модуль Юнга из упругой модели E HS вместе с параметрами вязкоупругости E KV и η делятся на две группы: данные, полученные от молодых мышей (возраст от 6 до 8 лет). недельного возраста, синие ) и зрелых мышей (возраст от 11 до 13 недель, красных ) (рис.4). Две группы данных в каждом регионе сравнивались методом Краскала Уоллиса (KW).
Рисунок 4.Сравнение механических свойств костей молодых ( синий ) и зрелых ( красный ) мышей (цветная версия доступна в Интернете). (а) Модуль Юнга E H-S , полученный из модели H-S. Данные идентичны данным на рис. 2. (b) Модуль Юнга E K-V и (c) вязкость η , полученная из модели K-V.Данные идентичны данным на рис. 3. Центральное поле охватывает нижний квартиль и верхний квартиль данных. Сплошная линия внутри рамки показывает медианное значение, а заглавные буквы под и над рамкой представляют нижнюю и верхнюю крайние значения. Средние значения обозначены черными пунктирными линиями. Точки представляют собой отдельные точки данных, наложенные поверх прямоугольных диаграмм. Данные включают результаты как молодых, так и взрослых мышей. Значимость статистических сравнений с использованием метода Краскала Уоллиса была указана над каждой группой диаграмм (n.с .: не имеет значения; *: p <0,05; ***: р <0,001).
Тест KW, сравнивающий E H-S (рис. 4a), показывает незначительную, но статистически значимую разницу (0,05> p > 0,03) в кортикальном слое кости и метафизе. Тогда как E H-S пластинки роста и костного мозга не менялись с возрастом. Для E K-V и η (рис.4b-c), тест KW демонстрирует высокий уровень значимости ( p <0,001) в костном мозге, но не для любой другой области BMev. Существуют различия в статистическом сравнении результатов чистой эластичной посадки (, т.е. E H-S ) и результатов вязкоупругой посадки (, то есть E K-V и η ). Основная причина, скорее всего, заключается в том, что модель Герца-Снеддона неадекватно описывает свойства BMev из-за того, что не учитывается сила вязкости, особенно в мягких областях, таких как костный мозг.
Было проведено очень мало исследований по количественной оценке механических свойств BMev в зависимости от возраста. Испытания на растяжение целых костей, опубликованные в 1976 году, показали лишь умеренные различия между костями людей разного возраста (54). Недавно тесты с микро- / нано-вдавливанием показали, что механические свойства кортикальных (55) и трабекулярных (56) костей человека были удивительно постоянными в зависимости от возраста. Сообщается, что модуль упругости пластинки роста мышей значительно различается между эмбриональной стадией и постнатальной стадией, в возрасте 2 недель, но существенно не менялся на следующих стадиях роста до взрослого возраста (до возраста 4 месяцев) (25).Эти результаты согласуются с нашими выводами. Динамическая жесткость стромальных клеток костного мозга была значительно выше у взрослых лошадей по сравнению с жеребятами (58), что согласуется с возрастной тенденцией механики костного мозга, наблюдаемой в нашем исследовании.
Такое статистическое сравнение отражает влияние старения на субклеточные механические свойства различных областей BMev только на макроуровне. Было бы полезно объединить влияние старения и различных масштабов длины в будущих исследованиях.
Картирование сил в надклеточном масштабе выявляет высокую локальную механическую неоднородность в различных областях микросреды кости
Данные, обсуждаемые в предыдущих разделах, были получены на основе точечных измерений, которые не дают информации о пространственном распределении механической неоднородности в клеточном масштабе . Чтобы исследовать это дальше, мы выполнили силовое картирование АСМ. Максимальная площадь для картирования силы АСМ в нашей установке составляет 100 × 100 мкм 2 с размером каждого пикселя на карте до 1 мкм 2 .Это гарантирует, что картирования АСМ достаточно для разрешения субклеточного механического профиля в надклеточном масштабе, учитывая размеры большинства клеток в кости (средний диаметр от 0,5 до приблизительно 100 мкм) (59–61).
На рис. 5a-c показаны репрезентативные карты, полученные для кортикальной кости. Карта триггерных точек (рис. 5а) показывает топографию поверхности BMev при срабатывании триггерного усилия. Видны плотно упакованные структуры (обозначенные пунктирным кругом), размер и форма которых соответствуют размерам и форме, ожидаемым для отдельных ячеек.Приближение к топографии поверхности BMev при нулевой нагрузке дается картой точек контакта (рис. 5b). Это выглядит значительно более гладким, чем карта триггерных точек, из-за минимального вдавливания в точке контакта и указывает на то, что поверхность кости после расщепления является относительно гладкой в надклеточном масштабе. Поперечное разрешение обеих карт ограничено коллоидным зондом и его сверткой с топографией поверхности. Черные пиксели на рис. 5b представляют собой недостающие данные из-за того, что кривые силы и расстояния в этих пикселях не подходят для подгонки (см. Методы).К ним относятся большие черные области, обозначенные стрелками, где топография превышает нижний и верхний пределы диапазона вертикального сканирования АСМ. Соответствующая карта E H-S показана на рис. 5c. R 2 больше 0,9 для 54% и 0,5 для 95% всех кривых на этой карте и не зависит от значений E H-S .
Рис. 5.Механическая неоднородность различных участков кости в надклеточном масштабе (цветная версия доступна в Интернете).(a-c) Пример карт AFM, полученных из случайно выбранной позиции на кортикальной кости. (а) Топографическая карта, показывающая высоту, на которой было достигнуто усилие спуска. Пунктирным кружком выделена наблюдаемая сферическая структура. (b) Топографическая карта, показывающая высоту, на которой зонд впервые соприкасается с поверхностью. Положение точки контакта определялось методом определения порога треугольника, как показано на рис. S1b. (c) Карта измеренного модуля Юнга E H-S по всем кривым силы на карте.Кривые с сильно наклоненными базовыми линиями (, т.е. , d b > d c /4, как на рис. S1c) были отброшены. (d-f) Примеры карт E H-S , полученных из (d) пластины роста, (e) метафиза и (f) костного мозга. Данные включают значения из кривых с сильно наклоненными базовыми линиями (, т.е. , d b > d c ).Для всех карт в (a-f) недостающие данные (, т.е. . Не удалось подобрать надлежащие кривые силы-вдавливания) обозначены черными пикселями (белыми стрелками). Масштаб размеров карт указан внизу каждой карты. (g) Гистограммы распределения E H-S , составленные из карт в (c-f). (h) Гистограммы распределения E H-S для различных областей кости, составленные из всех карт AFM. Для каждого региона было записано не менее 5 карт, и каждая карта была собрана с разных мышей.
Интересно, что механическая неоднородность коррелирует с топографическими структурами на рисунках 5a и 5b и, таким образом, помогает различать клеточные и бесклеточные компоненты (первый обычно более жесткий из-за ядерных, цитоскелетных и мембранных компонентов) и статус минерализации (минерализованные компоненты. ожидается, что они будут намного жестче). Эти карты ясно показывают механическую сложность BMev в надклеточном масштабе, которая, вероятно, важна для таких процессов, как миграция и пролиферация клеток, которые опосредуются механическими свойствами как клеток, так и окружающего внеклеточного матрикса (2, 62).
Коррелированная со структурой механическая неоднородность обнаружена во всех областях, представляющих интерес в этом исследовании (рис. 5d-f и S4), со значениями E H-S , охватывающими несколько порядков величины. Структуры и механические свойства, отраженные на картах АСМ, варьируются от региона к региону, и их трудно точно определить количественно, поскольку некоторые области труднее нанести на карту из-за их большой топографии. Полуколичественное сравнение механических свойств различных участков кости возможно путем сравнения гистограмм E H-S , рассчитанных по картам.
Гистограммы E H-S , соответствующие картам модуля Юнга на рис. 5c-f, показаны на рис. 5g. Гистограммы, представляющие E H-S , полученные из всех карт каждой области кости (минимум 5 карт на область), показаны на фиг. 5h. Эти гистограммы включают данные всех кривых F — δ без критериев выбора кривой или качества подгонки. Как обсуждалось во вспомогательном материале, удаление плохих кривых мало влияет на распределения, поэтому данные карты можно сравнивать напрямую с отдельными кривыми из точечных измерений (рис.2б). Для всех областей, кроме кортикальной кости, форма распределения E HS , полученная с одной карты (рис. 5g), всех карт (рис. 5h) и отдельных кривых, охватывающих всю область (рис. 2б) сопоставимы. Главный пик на каждой гистограмме сдвигается менее чем на один порядок между различными гистограммами для каждой области кости. Это показывает, что степень эластической неоднородности в надклеточном масштабе сравнима с неоднородностью в макроскопическом масштабе.Напротив, гистограммы кортикальных костей значительно отличаются друг от друга. По сравнению с профилем всей кортикальной области кости (рис. 2b), пик распределения E H-S выбранной карты сил сдвигается более чем на один порядок величины. Кроме того, форма гистограммы для всех карт, полученных на кортикальной кости, сильно отличается от формы гистограмм либо выбранной карты, либо отдельных кривых по всей области кортикальной кости.Это указывает на то, что общая неоднородность субклеточных механических свойств кортикальной кости является результатом не только неоднородности в надклеточном масштабе, но также вариаций в макроскопическом масштабе по региону.
Следует отметить, что скорость подхода, используемая при картировании сил, была значительно увеличена (30 мкм / с по сравнению с 1 мкм / с при точечных измерениях). Соответственно, время индентирования большинства кривых F — δ на картах обычно не превышает 0.3 с. Это значительно короче, чем среднее / медианное время ползучести τ каждой из областей BMev, как описано в вязкоупругом разделе. В течение таких коротких периодов времени BMev будет преимущественно вязким, как твердое тело типа K-V (см. Вспомогательный материал). Следовательно, мы должны рассматривать значения модуля, полученные при вдавливании, как эффективный модуль, зависящий от скорости деформации и включающий как упругие, так и вязкие вклады.
Кортикальная или губчатая кость: в чем разница? — FullText — Американский журнал нефрологии 2018, Vol.47, № 6
Кость — прекрасный пример принципа, согласно которому форма следует за функцией. Кость обеспечивает структурную поддержку при передвижении и вентиляции; резервуар для кальция, фосфата, аминокислот и бикарбоната; защита внутренних органов; передача звуковых волн; и выращивание гемопоэтических стволовых клеток. Метаболические функции включают секрецию гормонов, регулирующих как минеральный, так и энергетический обмен. Для выполнения этих функций кость имеет кортикальный и трабекулярный отделы.
Примерно 80% костной массы находится в кортикальном отделе. Сосудистые каналы занимают около 30% объема. Отношение поверхности к объему в кортикальной кости намного ниже, чем в губчатой кости. С возрастом или болезнью кора головного мозга становится более пористой, увеличивая площадь поверхности, но теряя прочность. В длинных костях увеличенная пористость около периостальной поверхности вызывает большую потерю прочности, чем повышенная пористость около эндокортикальной поверхности. Медленное расширение надкостницы на протяжении всей жизни частично компенсирует эту потерю прочности, поскольку сила изгиба пропорциональна радиусу в четвертой степени.
В трабекулярном отделе 20% объема составляет кость, а оставшееся пространство заполнено костным мозгом и жиром. Трабекулярная кость передает механические нагрузки с суставной поверхности на кортикальную кость. Гидравлические свойства поглощают удары. Свойства материала костных компартментов различаются: губчатая кость имеет более низкое содержание кальция и больше воды по сравнению с кортикальной костью. Трабекулярная кость имеет большую поверхность, открытую для костного мозга и кровотока, а обмен веществ выше, чем в кортикальной кости [1].Резорбция происходит вдоль поверхности кости в губчатой кости, тогда как в кортикальной кости туннели резорбции проходят через саму кость. Эндокортикальная поверхность, открытая для костного мозга, а также твердая кость, часто имеет более высокий метаболизм, чем другие трабекулярные или кортикальные поверхности.
Некоторые считали, что слишком много внимания уделяется потере губчатой кости, тогда как другие подчеркивали вклад губчатой кости. Фактически, и кортикальная, и губчатая кость важны для прочности кости, и отношения между ними сложны.Тело позвонка является классическим участком губчатой кости, а компрессионные переломы позвонков являются признаком остеопороза. Однако тонкая корковая оболочка играет существенную роль.
Бедро считается участком кортикальной кости, но кортикальная и губчатая кость вносят вклад в прочность бедренной кости, причем вклад кортикальной кости выше в бедрах с более низкой плотностью губчатой кости [2]. Кроме того, кортикальная кость поддерживает изгиб в дистальной области шейки бедренной кости, а губчатая кость поддерживает проксимальную нагрузку.
Сигналы к кости, механические или химические, могут по-разному влиять на костные компартменты. Последствия осложняются полом, возрастом или заболеванием. Например, исследования постельного режима у здоровых мужчин показывают, что при неиспользовании кость больше теряется из трабекулярного компартмента, чем из коры большеберцовой кости [3].
Низкоинтенсивная вибрация у пациентов с хронической болезнью почек увеличивает прочностные параметры большеберцовой кости из-за изменений трабекулярного компартмента, но не коры [4].
Гормоны гонад по-разному влияют на костные компартменты в зависимости от пола. И у мужчин, и у женщин тестостерон поддерживает расширение надкостницы, а эстроген предотвращает потерю кортикальной кости. Потеря трабекулярной кости предотвращается эстрогеном у женщин и тестостероном у мужчин.
Потеря костной массы после менопаузы в губчатой кости происходит быстрее, но поскольку кортикальная кость составляет 80% скелета, абсолютная величина потери костной массы в каждом отделе в течение первых 10 лет одинакова.Позже происходит большая потеря кортикального слоя кости. Гаверсовы каналы расширяются, увеличивая отношение поверхности к объему кости и еще больше увеличивая потерю кости, которая раньше была кортикальной, но стала трабекуляризованной [5]. У женщин большие каналы, вызывающие корковую пористость, присутствуют по всей коре головного мозга, тогда как у мужчин они ближе к эндокортексу. В целом женщины теряют больше кортикальной кости, чем мужчины, но потеря трабекулярной кости аналогична. С возрастом диаметр длинных костей у мужчин увеличивается больше, чем у женщин, что увеличивает прочность на изгиб.
Гормоны и лекарства могут по-разному влиять на трабекулярную и кортикальную кость. Ежедневные инъекции паратиреоидного гормона (ПТГ) уменьшают массу кортикальной кости и увеличивают массу губчатой кости. Значительное увеличение прочности связано с увеличением губчатой кости.
При первичном гиперпаратиреозе кость теряется из кортикального компартмента с уменьшенной толщиной кортикального слоя и повышенной пористостью. Трабекулярный отдел, особенно в осевом скелете, имеет нормальную плотность кости.У пациентов с хроническим заболеванием почек более высокие уровни ПТГ связаны с быстрой потерей кортикальной кости на лучевой кости, но трабекулярная плотность и микроархитектура сохраняются [6].
Новое исследование, опубликованное в этом выпуске, еще раз подчеркивает важность кортикальной кости при почечной остеодистрофии. Sharma et al. [7] провели биопсию гребня подвздошной кости у 14 пациентов и измерили структурные параметры, используя как стандартную гистоморфометрию (на 2-мерных срезах), так и микро-КТ на образце керна (3-мерный).Они обнаружили нормальные трабекулярные параметры, но уменьшили толщину коркового слоя и увеличили кортикальную пористость.
Sharma et al. [7] предположили, что кортикальный компонент объема кости относительно игнорировался в костных гистоморфометрических исследованиях почечной остеодистрофии. Однако на консенсусной конференции «Болезнь почек: улучшение глобальных результатов» по этой теме кортикальная кость была включена в аспект объема кости, а несколько важных исследований биопсии включили толщину коры в качестве одного из представленных измерений.Отсутствие внимания к этой коре может быть связано с ограниченным размером образца биопсии и сомнительной корреляцией с общей массой кортикальной кости в скелете.
Биопсия кости выполняется на гребне подвздошной кости, поскольку это безопасное и удобное анатомическое место. Однако он может не соответствовать скелету. Гребень подвздошной кости не несет нагрузки, а губчатая кость имеет более высокий метаболизм, чем метафиз длинных костей. Кора более тонкая, чем у длинных костей, и здесь не так много нагрузки, как в осевом скелете.
Периферическая количественная КТ с высоким разрешением (HR-pQCT) — это неинвазивный метод, позволяющий отделить кортикальные от трабекулярных компонентов лучевой кости или большеберцовой кости, а также измерить некоторые аспекты трабекулярной микроархитектуры. В исследовании с участием 54 женщин измеряли толщину кортикального слоя и пористость на биоптатах кости с помощью гистоморфометрии и трабекулярные параметры при основной биопсии с помощью микро-КТ, а также выполняли HR-pQCT на лучевой кости и большеберцовой кости. Корреляция между измерениями биопсий гребня подвздошной кости и периферических костей была весьма незначительной [8].
HR-pQCT использовался у диализных пациентов, продемонстрировав, что толщина и площадь кортикального слоя были параметрами, наиболее сниженными и были связаны с ПТГ. У женщин снижение трабекулярных параметров лучевой кости было хуже, чем у мужчин [9].
Таким образом, хотя инвазивная биопсия кости остается золотым стандартом для определения минерализации и обновления костной ткани, это, вероятно, не лучший способ измерения объема кости. Очевидно, кора головного мозга играет важную роль в укреплении костей.Использование микро-КТ у диализных пациентов является новым, и это позволяет более точно определять структуру кости, чем двухмерная гистология. Однако оба метода ограничены небольшим размером образца кости и местом проведения биопсии. Биопсия кости является инвазивной, и как микро-КТ, так и HR-pQCT требуют дорогостоящего оборудования, недоступного для клинического использования. Хотя и не столь точные, двухэнергетические рентгенографические денситометрические измерения лучевой кости позволяют измерить потерю кортикальной кости, что является практичным и широко доступным, но у нас отсутствуют проспективные исследования у диализных пациентов, которые имели бы достаточные возможности для определения связи с переломами скелета.
Заявление о раскрытии информации / источник финансирования
Нет.
Ссылки
- Парфитт AM: Заблуждения (2): оборот всегда выше в губчатом веществе, чем в кортикальном слое кости. Bone 2002; 30: 807–809.
- Johannesdottir F, Thrall E, Muller J, Keaveny TM, Kopperdahl DL, Bouxsein ML: Сравнение неинвазивных оценок прочности проксимального отдела бедренной кости.Bone 2017; 105: 93–102.
- Cervinka T, Sievanen H, Hyttinen J, Rittweger J: Модели потери костной массы в корковых, подкорковых и трабекулярных компартментах во время симуляции микрогравитации. J Appl Physiol 2014; 117: 80–88.
- Раджапакс К.С., Леонард МБ, Кобе Е.А., Слингер М.А., Борхес К.А., Биллиг Э. и др.: Эффективность низкоинтенсивной вибрации для улучшения здоровья костей у пациентов с терминальной стадией почечной недостаточности во многом зависит от комплаентности и мышечной реакции.Акад. Радиол 2017; 24: 1332–1342.
- Seeman E: Потеря костной массы, связанная с возрастом и менопаузой, нарушает кортикальную и трабекулярную микроструктуру. J Gerontol A Biol Sci Med Sci 2013; 68: 1218–1225.
- Николас Т.Л., Штейн Э.М., Двораковски Э., Нишияма К.К., Команда-Косе М., Чжан К.А. и др.: Быстрая потеря кортикальной кости у пациентов с хроническим заболеванием почек.J Bone Miner Res 2013; 28: 1811–1820.
- Шарма А.К., Туссент Н.Д., Мастерсон Р. и др.: Ухудшение микроархитектуры кортикальной кости: критический компонент оценки почечной остеодистрофии. Am J Nephrol 2018; 47: 376–384.
- Коэн А., Демпстер Д.В., Мюллер Р., Гуо XE, Николас Т.Л., Лю XS и др.: Оценка трабекулярной и кортикальной архитектуры и механической компетентности кости с помощью периферической компьютерной томографии высокого разрешения: сравнение с транс-подвздошной биопсией кости.Osteoporos Int 2010; 21: 263–273.
- Negri AL, Del Valle EE, Zanchetta MB, Nobaru M, Silveira F, Puddu M, et al: Оценка микроархитектуры кости с помощью периферической количественной компьютерной томографии высокого разрешения (HR-pQCT) у пациентов, находящихся на гемодиализе. Osteoporos Int 2012; 23: 2543–2550.
Автор Контакты
Susan M. Ott
Медицинский факультет
Вашингтонский университет
Сиэтл, Вашингтон 98195 (США)
E-Mai [email protected]
Подробности статьи / публикации
Поступила: 26 апреля 2018 г.
Дата принятия: 27 апреля 2018 г.
Опубликована онлайн: 22 мая 2018 г.
Дата выпуска: июль 2018 г.
Количество страниц для печати: 3
Количество рисунков: 0
Количество столов: 0
ISSN: 0250-8095 (печатный)
eISSN: 1421-9670 (онлайн)
Для дополнительной информации: https: // www.karger.com/AJN
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме или любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарства: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарства, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Однако ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности.