| 1. |
Содержание органических веществ в продуктах питания
Сложность: лёгкое |
1 |
| 2. |
Витамины
Сложность: лёгкое |
1 |
3.
|
Витамины и ферменты
Сложность: среднее |
1 |
| 4. |
Питательные вещества в продуктах питания
Сложность: среднее |
3 |
5. |
Энергоёмкость и взаимопревращение органических веществ
Сложность: среднее |
2 |
| 6. |
Нехватка витаминов
Сложность: среднее |
2 |
7.
|
Содержание азота в продуктах обмена
Сложность: среднее |
2 |
| 8. |
Обмен веществ. Расщепление питательных веществ в организме
Сложность: среднее |
4 |
9.
|
Нарушения обмена веществ Сложность: сложное | 2 |
| 10. |
Расщепление органических веществ
Сложность: сложное |
3 |
Недосып нарушает обмен веществ — исследование
By Reuters Staff, Рейтер
Сотрудник BMW во время отдыха в специальной комнате, 16 февраля 2011 года.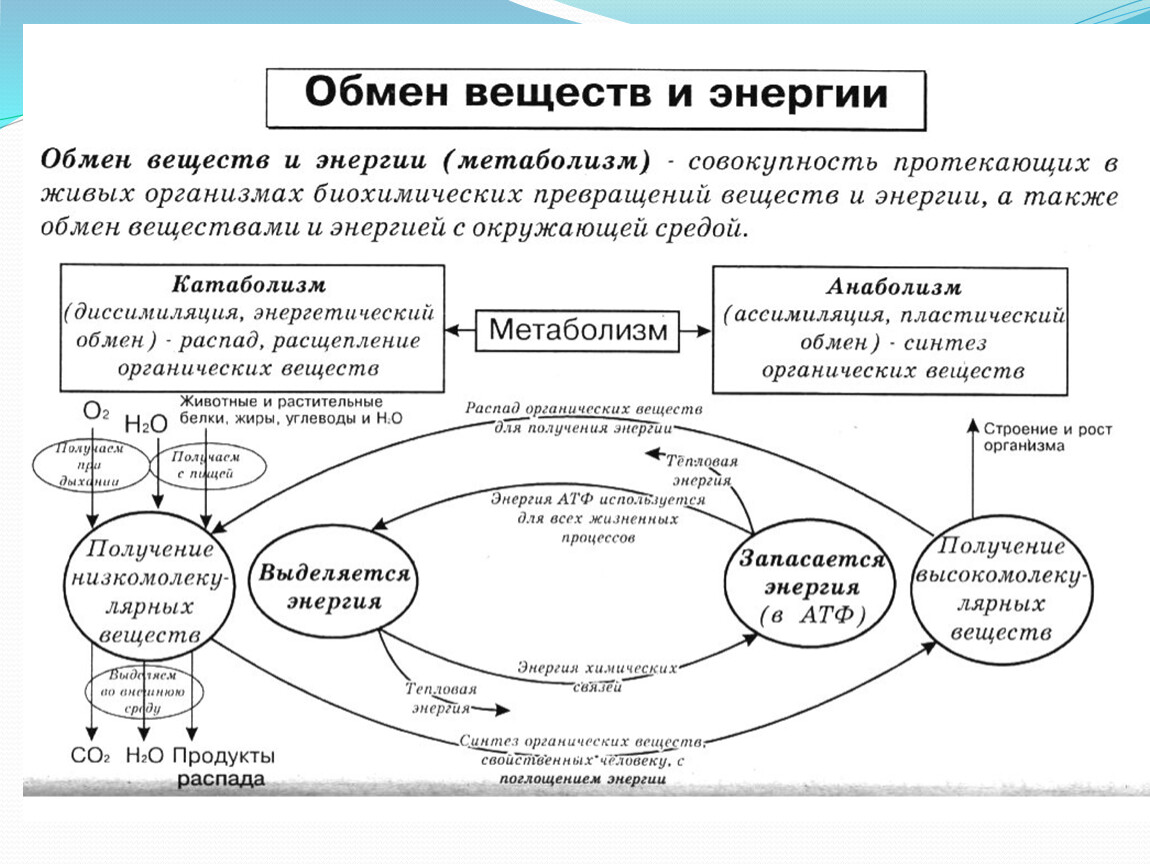 Недосыпание — это не только испорченный день, но и нарушение обмена веществ в человеческом организме, что может привести к набору лишнего веса, показало исследование. REUTERS/Michaela Rehle
Недосыпание — это не только испорченный день, но и нарушение обмена веществ в человеческом организме, что может привести к набору лишнего веса, показало исследование. REUTERS/Michaela Rehle
НЬЮ-ЙОРК (Рейтер) — Недосыпание — это не только испорченный день, но и нарушение обмена веществ в человеческом организме, что может привести к набору лишнего веса, показало исследование.
Полученные результаты, опубликованные в American Journal of Clinical Nutrition, стали лишним доказательством того, что недостаток сна может способствовать увеличению веса — не только за счет усиления чувства голода, но также из-за замедления скорости сжигания калорий.
Следовательно увеличение времени сна, по мнению ученых, может предотвратить набор веса.
“Наши изыскания показывают, что одна бессонная ночь резко снижает расход энергии у здоровых мужчин; это свидетельствует, что сон способствует регуляции дневного расхода энергии в организме людей”, — написал руководитель эксперимента Кристиан Бенедикт из Уппсальского университета в Швеции.
Чтобы определить точные механизмы воздействия сна на организм, Бенедикт и его коллеги в течение нескольких дней следили за состоянием 14 студентов мужского пола в разных условиях: при нормальном сне, ограниченном и его полном отсутствии. Затем ученые оценили изменения в количестве потребления пищи, уровне сахара в крови, гормонов и показателей метаболизма.
В ходе исследования обнаружилось, что даже одна ночь, проведенная без сна, замедляет обмен веществ на следующее утро, сокращая расход энергии на выполнение таких задач, как дыхание и пищеварение на 5-20 процентов по сравнению с показателями, полученными наутро после хорошего ночного сна.
При этом уменьшение сна, как выяснилось, не увеличило количество пищи, потребляемой мужчиной в течение дня.
Эксперты из специализированной независимой американской организации National Sleep Foundation рекомендуют взрослым людям спать примерно семь-девять часов каждую ночь.
Наташа Аллен, перевела Яна Соболева
Урок 44.
 1. Обмен веществ и превращение энергии
1. Обмен веществ и превращение энергииМетодическое пособие разработки уроков с видеоматериалами биологии 7класс
Тип урока — комбинированный
Методы: частично-поисковый, проблемного изложения, репродуктивный, объяснительно-иллюстративный.
Цель: овладение умениями применять биологические знания в практической деятельности, использовать информацию о современных достижениях в области биологии; работать с биологическими приборами, инструментами, справочниками; проводить наблюдения за биологическими объектами;
Задачи:
Образовательные: формирование познавательной культуры, осваиваемой в процессе учебной деятельности, и эстетической культуры как способности к эмоционально-ценностному отношению к объектам живой природы.
Развивающие: развитие познавательных мотивов, направленных на получение нового знания о живой природе; познавательных качеств личности, связанных с усвоением основ научных знаний, овладением методами исследования природы, формированием интеллектуальных умений;
Воспитательные: ориентация в системе моральных норм и ценностей: признание высокой ценности жизни во всех ее проявлениях, здоровья своего и других людей; экологическое сознание; воспитание любви к природе;
УУД
Личностные: понимание ответственности за качество приобретенных знаний; понимание ценности адекватной оценки собственных достижений и возможностей;
Познавательные: умение анализировать и оценивать воздействие факторов окружающей среды, факторов риска на здоровье, последствий деятельности человека в экосистемах, влияние собственных поступков на живые организмы и экосистемы; ориентация на постоянное развитие и саморазвитие; умение работать с различными источниками информации, преобразовывать её из одной формы в другую, сравнивать и анализировать информацию, делать выводы, готовить сообщения и презентации.
Регулятивные: умение организовать самостоятельно выполнение заданий, оценивать правильность выполнения работы, рефлексию своей деятельности.
Коммуникативные: формирование коммуникативной компетентности в общении и сотрудничестве со сверстниками, понимание особенностей гендерной социализации в подростковом возрасте, общественно полезной, учебно-исследовательской, творческой и других видов деятельности.
Технологии: Здоровьесбережения, проблемного, развивающего обучения, групповой деятельности
Виды деятельности (элементы содержания, контроль)
Формирование у учащихся деятельностных способностей и способностей к структурированию и систематизации изучаемого предметного содержания: коллективная работа — изучение текста и иллюстративного материала составление таблицы «Систематические группы многоклеточных » при консультативной помощи учеников- экспертов с последующей самопроверкой; парное или групповое выполнение лабораторной работы при консультативной помощи учителя с последующей взаимопроверкой; самостоятельная работа по изученному материалу.
Планируемые результаты
Предметные
понимать смысл биологических терминов;
описывать особенности строения и основные процессы жизнедеятельности животных разных систематических групп; сравнивать особенности строения простейших и многоклеточных животных;
распознавать органы и системы органов животных разных систематических групп; сравнивать и объяснять причины сходства и различий;
устанавливать взаимосвязь между особенностями строения органов и функциями, которые они выполняют;
приводить примеры животных разных систематических групп;
различать на рисунках, таблицах и натуральных объектах основные систематические группы простейших и многоклеточных животных;
характеризовать направления эволюции животного мира; приводить доказательства эволюции животного мира;
Метапредметные УУД
Познавательные:
работать с разными источниками информации, анализировать и оценивать информацию, преобразовывать ее из одной формы в другую;
составлять тезисы, различные виды планов (простых, сложных и т. п.), структурировать учебный материал, давать определения понятий;
п.), структурировать учебный материал, давать определения понятий;
проводить наблюдения, ставить элементарные эксперименты и объяснять полученные результаты;
сравнивать и классифицировать, самостоятельно выбирая критерии для указанных логических операций;
строить логические рассуждения, включающие установление причинно-следственных связей;
создавать схематические модели с выделением существенных характеристик объектов;
определять возможные источники необходимых сведений, производить поиск информации, анализировать и оценивать ее достоверность;
Регулятивные:
организовывать и планировать свою учебную деятельность — определять цель работы, последовательность действий, ставить задачи, прогнозировать результаты работы;
самостоятельно выдвигать варианты решения поставленных задач, предвидеть конечные результаты работы, выбирать средства достижения цели;
работать по плану, сверять свои действия с целью и, при необходимости, исправлять ошибки самостоятельно;
владеть основами самоконтроля и самооценки для принятия решений и осуществления осознанного выбора в учебно-познавательной и учебно-практической деятельности;
Коммуникативные:
слушать и вступать в диалог, участвовать в коллективном обсуждении проблем;
интегрироваться и строить продуктивное взаимодействие со сверстниками и взрослыми;
адекватно использовать речевые средства для дискуссии и аргументации своей позиции, сравнивать разные точки зрения, аргументировать свою точку зрения, отстаивать свою позицию.
Личностные УУД
Формирование и развитие познавательного интереса к изучению биологии и истории развития знаний о природе
Приемы: анализ, синтез, умозаключение, перевод информации с одного вида в другой, обобщение.
Основные понятия
Понятия: питание, пищеварение, ферменты, обмен веществ, превращение энергии; особенности питания у животных, формы пищеварения; эволюция органов пищеварения у животных; особенности обмена веществ и превращения энергии в организме животных; понятия: холоднокровность, теплокровность.
Ход урока
Актуализация знаний
Выберите правильный на ваш взгляд вариант ответа.
1. Чем дышат простейшие организмы?
Всей поверхностью тела
Жабрами
Легкими
2. Органы дыхания членистоногих
Жабры
Вся поверхность тела
Легкие
3. Как кровь рыб насыщается кислородом?
Как кровь рыб насыщается кислородом?
Кровь омывает жабры и забирает из воды кислород
Через легкие
Из воды, попавшей через жабры, в желудке выделяется кислород
4. Органы дыхания наземных позвоночных
Жабры
Все поверхность тела
Легкие
5. При помощи чего дышат земноводные?
При помощи кожи
При помощи легких
При помощи легких и кожи
6. У каких животных газообмен протекает наиболее сложно?
У птиц
У рыб
У пресмыкающихся
7. Что представляет из себя двойное дыхание?
Дыхание при помощи кислорода и углекислого газа
Дыхание птиц при полете
Дыхание двумя легкими
8. Как называются легочные пузырьки?
Воздушные пузыри
Альвеолы
Дыхательные пузыри
9. Назначение диафрагмы
Фиксация легких
Отделение грудной полости от брюшной
Удержание кислорода
10. Что обеспечивает вентиляцию легких?
Что обеспечивает вентиляцию легких?
Сокращение и расслабление легких
Сокращение и расслабление пресса
Сокращение и расслабление межреберных мышц
Изучение нового материала (рассказ учителя с элементами беседа)
Обмен веществ у животных
1.Что такое обмен веществ?
Обмен веществ, или метаболизм, – это совокупность химических превращений в организмах, обеспечивающих их жизнедеятельность. Животные способны к росту, размножению, взаимодействия с окружающей средой именно благодаря обмену веществ. Обмен веществ состоит из двух противоположно направленных процессов – расщепление и построения органических веществ. Они проходят одновременно во всех живых организмах в течение всей жизни. Химические реакции в организмах происходят достаточно быстро. В химической промышленности, чтобы ускорить
реакции, повышают температуру и давление, а также используют катализаторы. В «живых реакторах» – клетках – и давление, и температура являются невысокими, а реакции ускоряют специальные белки-катализаторы – ферменты.
В «живых реакторах» – клетках – и давление, и температура являются невысокими, а реакции ускоряют специальные белки-катализаторы – ферменты.
2. Особенности обмена веществ у животных. Вы уже знаете , что животные являются гетеротрофами и должны получать органические вещества из окружающей среды. Органические вещества – это сложно построенные молекулы, основой которых является цепочки из сочетающихся атомов углерода. они образуют автотрофы, прежде всего растения. На это расходуется энергия, которую растения получают из солнечного света. Часть этой энергии накопленная в органических веществах, как в аккумуляторах.
Гетеротрофы потребляют органические вещества, которые выработали автотрофы. Животные получают из этих веществ, во-первых, энергию для жизнедеятельности, во-вторых, материал для построения собственного тела. Во время образования органических веществ из неорганических растения выделяют в окружающую среду кислород. Большинству животных этот кислород нужен для того, чтобы высвободить энергию, накопленную в органических веществах. Это – аэробные животного. Некоторые группы, например, внутренние паразиты, обитающие в условиях отсутствия кислорода. Это – анаэробные организмы. Взрослые аскариды является анаэробами, а их яйца – аэробы. Именно поэтому, чтобы яйцо аскариды могло заражать нового хозяина, оно имеет определенное время находиться на открытом воздухе. Для анаэробов кислород даже может быть ядом. Поэтому с аскаридами иногда борются, закачивая кислород в кишечник.
Это – аэробные животного. Некоторые группы, например, внутренние паразиты, обитающие в условиях отсутствия кислорода. Это – анаэробные организмы. Взрослые аскариды является анаэробами, а их яйца – аэробы. Именно поэтому, чтобы яйцо аскариды могло заражать нового хозяина, оно имеет определенное время находиться на открытом воздухе. Для анаэробов кислород даже может быть ядом. Поэтому с аскаридами иногда борются, закачивая кислород в кишечник.
3. Куда расходуется энергия, полученная из среды?
Энергия, полученная с пищей, расходуется на жизнедеятельность организма: движение, работу всех его систем и тому подобное. Кроме того, за счет этой энергии животное строит собственные вещества. В качестве материала применяемого органические вещества пищи, расщепленные не полностью. Однако использовать для нужд организма всю полученную с пищей энергию невозможно. Ее часть неизбежно потеряется. Более того, любое
преобразования энергии сопровождается ее потерями. Потоки энергии, которая теряется для организма, изображены красными стрелками.
Потоки энергии, которая теряется для организма, изображены красными стрелками.
4.Поддержание температуры тела.
Любой организм разогревается в результате обмена веществ и процессов жизнедеятельности. Количество тепла возрастает, когда животное активно движется: вспомните, вам становится жарко во время интенсивных движений. Всех животных разделяют на две группы. Теплокровные животные (птицы и млекопитающие) поддерживают постоянную температуру своего тела. Холоднокровные животные не тратят энергию на поддержание температуры тела. Отличие теплокровных животных от холоднокровных заключается не в температуре крови, а в возможности обеспечивать ее устойчивость. Что делает воробей, когда ему холодно? Он топорщит перья, пытается втянуть в себя голову, лапы и дрожит. Таким образом уменьшается теплоотдача, а работа мышц (дрожь) способствует дополнительному выработке тепла. А что делаете вы, когда замерзли? А собака, которой жарко?
Холоднокровные животные также могут разогреваться благодаря движениям. Впрочем, они делают это только тогда, когда возникает необходимость, например питоны, что при необходимости разогревают кладку яиц
Впрочем, они делают это только тогда, когда возникает необходимость, например питоны, что при необходимости разогревают кладку яиц
5. «Узел», что связывает всю жизнедеятельность. Обмен веществ объединяет все процессы, происходящие в живых организмах, в том числе и животных. Поглощение питательных веществ происходит в процессе питания, а их переработка – во время пищеварения. Получение кислорода происходит при газообмена между телом и средой через покровы или благодаря дыхательной системе. При обмене веществ могут образовываться вещества, от которых организму необходимо освободиться. Они выводятся благодаря выделительной и некоторым другим системам организма. Перемещение веществ по телу осуществляет транспортная система. То есть движения, поведение, все внутренние и внешние проявления активности организма животного – последствия обмена веществ!
Благодаря обмену веществ животные получают органические вещества, которые используют для построения собственного тела и как источник энергии для жизнедеятельности, роста, развития и тому подобное. По способности к поддержанию постоянной температуры тела все животные делятся на теплокровных и холоднокровных.
По способности к поддержанию постоянной температуры тела все животные делятся на теплокровных и холоднокровных.
Обмен веществ аэробные и анаэробы; теплокровные и холоднокровные животные.
1.Какими именно веществами животные обмениваются со средой?
2.Назовите основные пути преобразования энергии в организме животных.
3. Объясните основные различия животных как гетеротрофных организмов от автотрофов и других гетеротрофов.
4. Назовите способы, благодаря которым организм теплокровных животных может разогреться или охладиться.
6. Теплокровные, которые снижают температуру тела. В природе существуют теплокровные животные (большинство из них – мелкие), которые при неблагоприятных условиях впадают в спячку. К таким животным относятся, например, летучие мыши. Эти животные впадают в зимнюю спячку, а в летнее время днем снижают температуру тела, чтобы дождаться ночи, когда они питаются . Во время зимнего оцепенения температура их тела снижается до температуры окружающей среды, все проявления жизни существенно замедляются: сердце делает лишь несколько ударов в минуту, дыхание почти отсутствует и тому подобное. В отличие от летучих мышей, колибри питаются днем. Поэтому они находятся в оцепеневшему состоянии с понижением температуры тела ночью
В отличие от летучих мышей, колибри питаются днем. Поэтому они находятся в оцепеневшему состоянии с понижением температуры тела ночью
ОБМЕН ВЕЩЕСТВ И ЭНЕРГИИ У ЖИВОТНЫХ
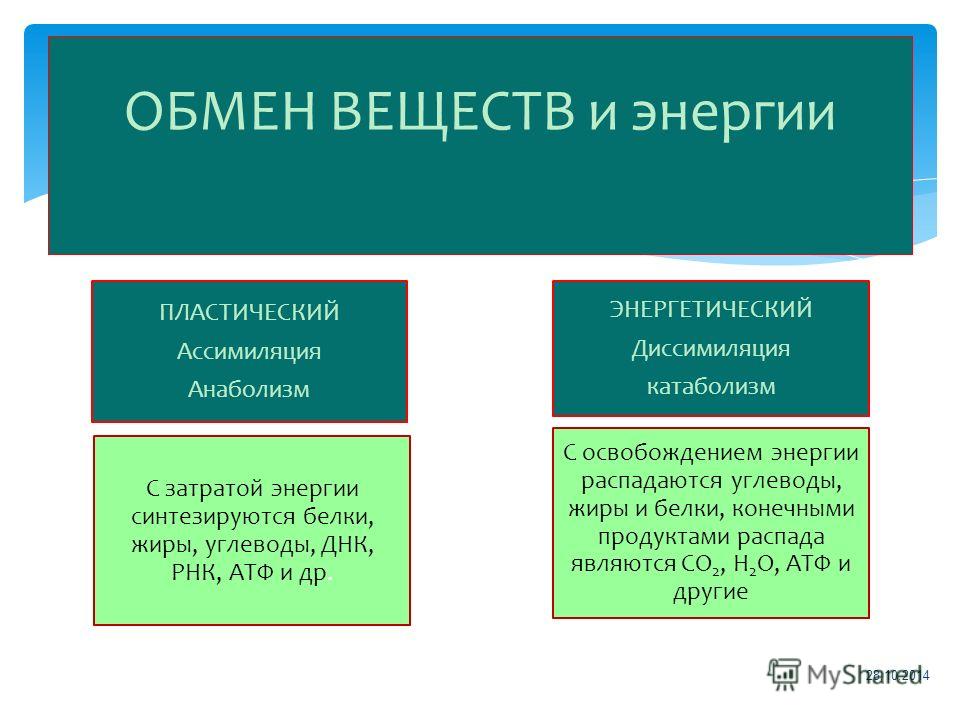
Обмен веществ и энергии – совокупность химических и физических превращений веществ, происходящих в живом организме и обеспечивающих его жизнедеятельность во взаимосвязи с внешней средой. Обмен веществ и энергии отличает живой организм от мертвого. Сущность заключается в поступлении веществ в организм, их усвоении, использовании и выделении продуктов обмена. Одновременно происходит превращение одних видов энергии в другие (потенциальная энергия химических связей, механическая, тепловая, электрическая). Ассимиляция – усвоение питательных веществ корма, превращение их в собственные белки, жиры и углеводы организма, накопление энергии. Диссимиляция – распад сложных веществ организма, освобождение энергии, образование конечных продуктов метаболизма.
Обмен веществ и энергии включает три этапа:
1. превращение веществ в пищеварительном тракте, всасывание в кровь и лимфу;
превращение веществ в пищеварительном тракте, всасывание в кровь и лимфу;
2.превращение веществ в органах и тканях;
3.выделение конечных продуктов обмена.
Различают общий, основной и промежуточный обмен.
Общий обмен – обмен между организмом и средой в обычных условиях жизни.
Общий обмен зависит от вида животных, породы, возраста, пола, массы тела, физиологического состояния (беременность, лактация), продуктивности, а также от внешних факторов – климатических условий, метеорологических факторов, кормления, содержания и др.
Основной обмен – минимальный уровень обмена, необходимый для поддержания жизненно важных функций организма.
Определяют при следующих условиях:
1.комфортная температура помещения (сбалансированы теплопродукция и теплоотдача), состояние физиологического покоя, натощак.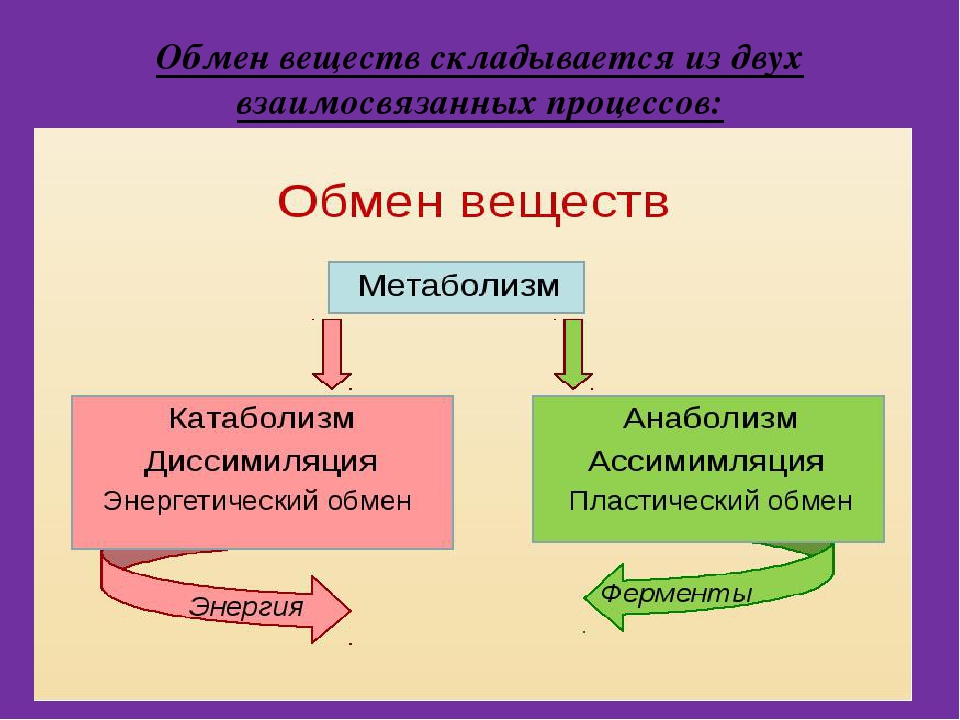 Млекопитающие самых разных размеров — от мыши (масса тела 20 г) до человека (70 кг) и борова (130 кг) — обладают примерно одинаковым основным обменом, если рассчитывать его на единицу площади поверхности тела. Причина сходства значений состоит в том, что тепло рассеивается в окружающую среду каждым квадратным сантиметром поверхности тела, следовательно, для сохранения температуры тела на постоянном уровне образование энергии должно соответствовать площади поверхности тела животного.
Млекопитающие самых разных размеров — от мыши (масса тела 20 г) до человека (70 кг) и борова (130 кг) — обладают примерно одинаковым основным обменом, если рассчитывать его на единицу площади поверхности тела. Причина сходства значений состоит в том, что тепло рассеивается в окружающую среду каждым квадратным сантиметром поверхности тела, следовательно, для сохранения температуры тела на постоянном уровне образование энергии должно соответствовать площади поверхности тела животного.
2. Площадь поверхности тела пропорциональна квадрату его линейных размеров, масса — кубу линейных размеров, поэтому, чем больше тело животного, тем выше у него соотношение «масса/поверхность». Это означает, что каждый грамм массы тела мелкого теплокровного должен вырабатывать значительно больше энергии, чем такая же масса в организме крупного животного. Величина основного обмена зависит, прежде всего, от площади поверхности тела, которую легко можно определить по специальным номограммам или формулам. Для этого достаточно знать массу тела и его длину (рост). Кроме площади поверхности тела основной обмен зависит от пола и возраста.
Для этого достаточно знать массу тела и его длину (рост). Кроме площади поверхности тела основной обмен зависит от пола и возраста.
Принципиально важно, что в обычных условиях существования величина основного обмена не может быть уменьшена. Снижение основного обмена происходит только при длительном голодании. Усиление же метаболизма могут вызвать многочисленные факторы. Самым сильным из них является специфическое динамическое действие пищи, прием смешанной пищи увеличивает основной обмен примерно на 5—20%, белковой — больше.
Промежуточный обмен – это превращение веществ после всасывания из пищеварительного канала; происходит в клетках и тканях.
Общие принципы регуляции обмена веществ и энергии и значение регуляции – приспособить уровень обмена веществ и энергии к потребностям организма.
Регуляция обменных процессов происходит на трех уровнях:
1) клеточном – автоматическая регуляция на уровне клетки;
2) гуморальном – главным образом при помощи гормонов.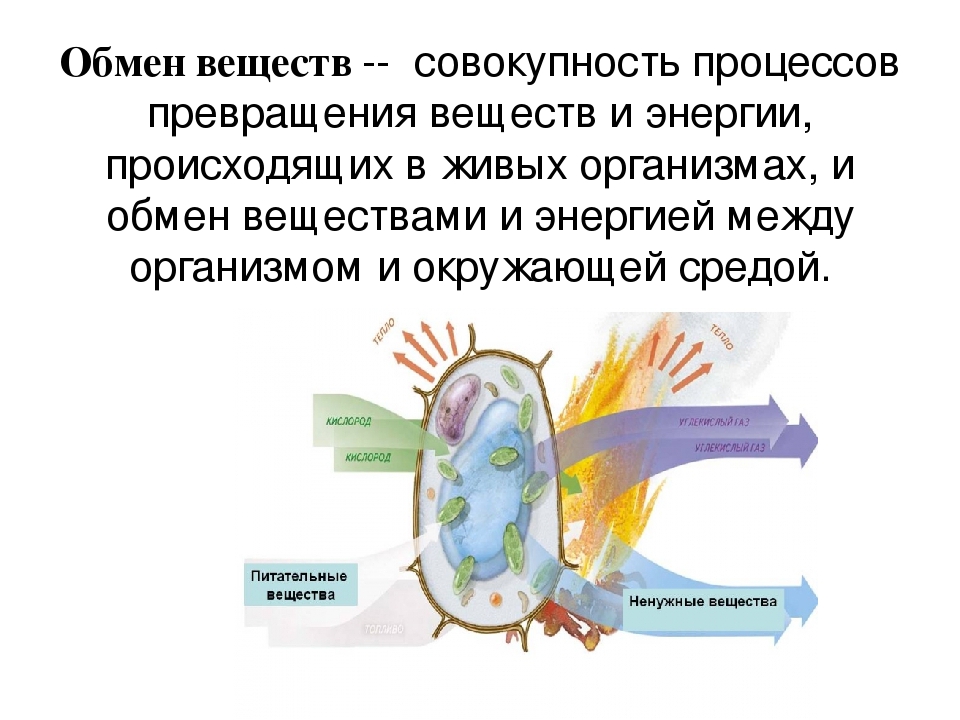 Гормоны влияют на синтез и активность ферментов, проницаемость мембран;
Гормоны влияют на синтез и активность ферментов, проницаемость мембран;
3) нервном – нервная система воздействует на обменные процессы (трофическое влияние) в тканях, на деятельность эндокринных органов, на поступление крови в органы и ткани. Центр всех видов обмена – в гипоталамусе.
Регуляция обмена энергии тесно связана с регуляцией обмена веществ. Участвуют кора больших полушарий, гипоталамус, вегетативная нервная система, из желез внутренней секреции – гипофиз, щитовидная и поджелудочная железы, надпочечники, половые железы.
Обмен веществ и энергии в клетке
Органы пищеварения. Обмен веществ
youtube.com/embed/Trpo69GVIFM»>
Обмен веществ и энергии
Ресурсы
Биология. Животные. 7 класс учебник для общеобразоват. учреждений/ В. В. Латюшин, В. А. Шапкин.
Активные формы и методы обучения биологии: Животные. Кп. для учителя: Из опыта работы, —М.:, Просвещение. Молис С. С.. Молис С. А
Рабочая программа по биологии 7класс к УМК В.В. Латюшина, В.А. Шапкина (М.: Дрофа).
В.В. Латюшин, Е. А. Ламехова. Биология. 7 класс. Рабочая тетрадь к учебнику В.В. Латюшина, В.А. Шапкина «Биология. Животные. 7 класс». – М.: Дрофа.
Захарова Н. Ю. Контрольные и проверочные работы по биологии: к учебнику В. В. Латюшина и В. А. Шапкина «Биология. Животные. 7 класс»/ Н. Ю. Захарова. 2-изд. – М.: Издательство «Экзамен»
Ю. Контрольные и проверочные работы по биологии: к учебнику В. В. Латюшина и В. А. Шапкина «Биология. Животные. 7 класс»/ Н. Ю. Захарова. 2-изд. – М.: Издательство «Экзамен»
Природа Мира https://natworld.info/zhivotnye/rakoobraznye
Викторины по учебнику В. В. Латюшина «Биология. 7 класс»
http://kupidonia.ru/viktoriny/viktorina-klass-kolchetsov-maloschetinkovye-ili-oligohety
Биоуроки http://biouroki.ru/material/lab/2.html
Сайт YouTube: https://www.youtube.com /
Хостинг презентаций
Обмен веществ и энергии реферат по биологии
ОБМЕН ВЕЩЕСТВ И ЭНЕРГИИ Обмен веществ и энергии (метаболизм) — это совокупность химических реакций, протекающих в клетках или в целостном организме и заключающихся в синтезе сложных молекул и новой протоплазмы (анаболизм) и в распаде молекул с освобождением энергии (катаболизм). Энергия необходима для биосинтеза (образования нового вещества), осмотической работы (поглощения и секреции клетками разных веществ), механической работы (при движении) и других реакций. Обмен веществ и энергии — это важнейшее свойство живого, проявляющееся на разных уровнях организации живого. Благодаря обмену веществ и энергии происходят рост и размножение, формируются другие важнейшие свойства клеток и организмов. Характерная особенность метаболических функций животных и растительных клеток заключается в том, что они являются ферментативными и сходны между собой, поскольку клетки всех орга низмов обладают всеми молекулами, играющими центральную роль в метаболизме и обеспечивающими переход энергии одного вида в энергию другого вида. Кроме того в основе регуляции метаболических путей лежат общие механизмы. Благодаря этому энергетические процессы у всех живых существ сходны. Жизнь существует и продолжается лишь благодаря энергии Анаболизм и катаболизм Основными метаболическими процессами являются анаболизм (ассимиляция) и катаболизм (диссимиляция).
Энергия необходима для биосинтеза (образования нового вещества), осмотической работы (поглощения и секреции клетками разных веществ), механической работы (при движении) и других реакций. Обмен веществ и энергии — это важнейшее свойство живого, проявляющееся на разных уровнях организации живого. Благодаря обмену веществ и энергии происходят рост и размножение, формируются другие важнейшие свойства клеток и организмов. Характерная особенность метаболических функций животных и растительных клеток заключается в том, что они являются ферментативными и сходны между собой, поскольку клетки всех орга низмов обладают всеми молекулами, играющими центральную роль в метаболизме и обеспечивающими переход энергии одного вида в энергию другого вида. Кроме того в основе регуляции метаболических путей лежат общие механизмы. Благодаря этому энергетические процессы у всех живых существ сходны. Жизнь существует и продолжается лишь благодаря энергии Анаболизм и катаболизм Основными метаболическими процессами являются анаболизм (ассимиляция) и катаболизм (диссимиляция). Анаболизм, или ассимиляция (от лат. assimilatio — уподобление), представляет собой эндотермический процесс уподобления поступающих в клетку веществ веществам самой клетки. Она является «созидательным» метаболизмом. Важнейшим моментом ассимиляции является синтез белков и нуклеиновых кислот. Частным случаем анаболизма является фотосинтез, который представляет собой биологический процесс, при котором органическое вещество синтезируется из воды, двуокиси углерода и неорганических солей под влиянием лучистой энергии Солнца. Фотосинтез в зеленых растениях является автотрофным типом обмена. Катаболизм, или диссимиляция (от лат. dissimilis — расподобление), является экзотермическим процессом, при котором происходит распад веществ с освобождением энергии. Этот распад происходит в результате переваривания и дыхания. Переваривание представляет собой процесс распада крупных молекул на более мелкие молекулы, тогда как дыхание является процессом окислительного катаболизма простых Сахаров, глицерина, жирных кислот и дезаминированных аминокислот, в результате которого происходит освобождение жизненно необходимой химической энергии.
Анаболизм, или ассимиляция (от лат. assimilatio — уподобление), представляет собой эндотермический процесс уподобления поступающих в клетку веществ веществам самой клетки. Она является «созидательным» метаболизмом. Важнейшим моментом ассимиляции является синтез белков и нуклеиновых кислот. Частным случаем анаболизма является фотосинтез, который представляет собой биологический процесс, при котором органическое вещество синтезируется из воды, двуокиси углерода и неорганических солей под влиянием лучистой энергии Солнца. Фотосинтез в зеленых растениях является автотрофным типом обмена. Катаболизм, или диссимиляция (от лат. dissimilis — расподобление), является экзотермическим процессом, при котором происходит распад веществ с освобождением энергии. Этот распад происходит в результате переваривания и дыхания. Переваривание представляет собой процесс распада крупных молекул на более мелкие молекулы, тогда как дыхание является процессом окислительного катаболизма простых Сахаров, глицерина, жирных кислот и дезаминированных аминокислот, в результате которого происходит освобождение жизненно необходимой химической энергии.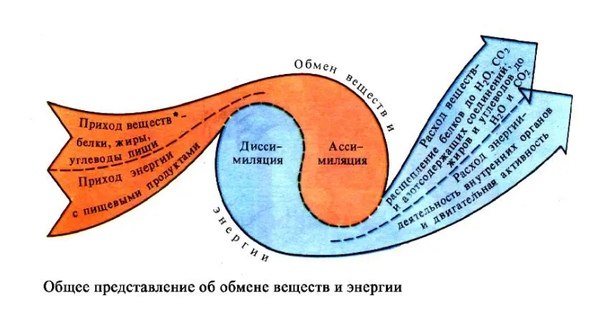 Эта энергия используется для пополнения запасов аденозинтри- фосфата (АТФ), который является непосредственным донором (источником) клеточной энергии, универсальной энергетической «валютой» в биологических системах. Пополнение запасов АТФ обеспечивается реакцией фосфата (Ф) с аденозиндифосфатом (АДФ), а именно: АДФ + Ф + энергия F 0A E АТФ Когда АТФ разлагается на АДФ и фосфат, энергия клетки освобождается и используется для работы в клетке. АТФ представляет собой нуклеотид, состоящий из остатков аденина, рибозы и трифосфата (трифосфатных групп), тогда как аденозиндифосфат (АДФ) имеет лишь две фосфатные группы. Богатство АТФ энергией определяется тем, что его трифосфатный компонент содержит две фос-фоангидридные связи. Энергия АТФ превышает энергию АДФ на 7000 ккал/моль. Этой энергией обеспечиваются все биосинтетические реакции в клетке в результате гидролиза АТФ до АДФ и неорганического фосфата. Итак, цикл АТФ-АДФ является основным механизмом обмена энергии в живых системах. К живым системам применимы два закона термодинамики.
Эта энергия используется для пополнения запасов аденозинтри- фосфата (АТФ), который является непосредственным донором (источником) клеточной энергии, универсальной энергетической «валютой» в биологических системах. Пополнение запасов АТФ обеспечивается реакцией фосфата (Ф) с аденозиндифосфатом (АДФ), а именно: АДФ + Ф + энергия F 0A E АТФ Когда АТФ разлагается на АДФ и фосфат, энергия клетки освобождается и используется для работы в клетке. АТФ представляет собой нуклеотид, состоящий из остатков аденина, рибозы и трифосфата (трифосфатных групп), тогда как аденозиндифосфат (АДФ) имеет лишь две фосфатные группы. Богатство АТФ энергией определяется тем, что его трифосфатный компонент содержит две фос-фоангидридные связи. Энергия АТФ превышает энергию АДФ на 7000 ккал/моль. Этой энергией обеспечиваются все биосинтетические реакции в клетке в результате гидролиза АТФ до АДФ и неорганического фосфата. Итак, цикл АТФ-АДФ является основным механизмом обмена энергии в живых системах. К живым системам применимы два закона термодинамики. В соответствии с первым законом термодинамики (законом сохранения энергии) энергия на протяжении химических и физических процессов не солнечного света. В результате этого клетки зеленых растении обладают высоким содержанием свободной энергии. Получение энергии в результате окисления неорганических веществ происходит при хемосинтезе. Животные организмы получают энергию, уже запасенную в углеводах, через пищу. Следовательно, они способствуют увеличению энтропии среды. В митохондриях клеток этих организмов энергия, запасенная в углеводах, переводится в форму свободной энергии, подходящей для синтеза молекул других веществ, а также для обеспечения механической, электрической и осмотической работы клеток. Освобождение энергии, запасенной в углеводах, осуществляется в результате дыхания — аэробного и анаэробного. При аэробном дыхании расщепление молекул, содержащих запасенную энергию, происходит путем гликолиза и в цикле Кребса. При анаэробном дыхании действует только гликолиз. Таким образом, жизнедеятельность клеток животных организмов обеспечивается в основном энергией, источником которой служат реакции окисления-восстановления «топлива» (глюкозы и жирных кислот), в процессе которых происходит перенос электронов от одного соединения (окисление) к другому (восстановление).
В соответствии с первым законом термодинамики (законом сохранения энергии) энергия на протяжении химических и физических процессов не солнечного света. В результате этого клетки зеленых растении обладают высоким содержанием свободной энергии. Получение энергии в результате окисления неорганических веществ происходит при хемосинтезе. Животные организмы получают энергию, уже запасенную в углеводах, через пищу. Следовательно, они способствуют увеличению энтропии среды. В митохондриях клеток этих организмов энергия, запасенная в углеводах, переводится в форму свободной энергии, подходящей для синтеза молекул других веществ, а также для обеспечения механической, электрической и осмотической работы клеток. Освобождение энергии, запасенной в углеводах, осуществляется в результате дыхания — аэробного и анаэробного. При аэробном дыхании расщепление молекул, содержащих запасенную энергию, происходит путем гликолиза и в цикле Кребса. При анаэробном дыхании действует только гликолиз. Таким образом, жизнедеятельность клеток животных организмов обеспечивается в основном энергией, источником которой служат реакции окисления-восстановления «топлива» (глюкозы и жирных кислот), в процессе которых происходит перенос электронов от одного соединения (окисление) к другому (восстановление). С окислительно-восстановительными реакциями сопряжено фосфорилирование. Эти реакции протекают как при фотосинтезе, так и дыхании. Организм — открытая саморегулирующая система, она поддерживает и реплицирует себя посредством использования энергии, заключенной в пище, либо генерируемой Солнцем. Непрерывно поглощая энергию и вещества, жизнь не «стремится» к равновесию между упорядоченностью и неупорядоченностью, между высокой молекулярной оранизацией и дезорганизацией. Напротив, для живых существ характерна упорядоченность как в их структуре и функциях, так и в превращении и использовании энергии. Таким образом, сохраняя внутреннюю упорядоченность, но получая свободную энергию с солнечным светом или пищей, живые оранизмы возвращают в среду эквивалентное количество энергии, но в менее полезной форме, в основном в виде тепла, которое, рассеиваясь, уходит во Вселенную. Процессы обмена веществ и энергии подвержены регуляции, причем существует множество регулирующих механизмов. Главнейшим механизмом регуляции метаболизма является контроль количества ферментов.
С окислительно-восстановительными реакциями сопряжено фосфорилирование. Эти реакции протекают как при фотосинтезе, так и дыхании. Организм — открытая саморегулирующая система, она поддерживает и реплицирует себя посредством использования энергии, заключенной в пище, либо генерируемой Солнцем. Непрерывно поглощая энергию и вещества, жизнь не «стремится» к равновесию между упорядоченностью и неупорядоченностью, между высокой молекулярной оранизацией и дезорганизацией. Напротив, для живых существ характерна упорядоченность как в их структуре и функциях, так и в превращении и использовании энергии. Таким образом, сохраняя внутреннюю упорядоченность, но получая свободную энергию с солнечным светом или пищей, живые оранизмы возвращают в среду эквивалентное количество энергии, но в менее полезной форме, в основном в виде тепла, которое, рассеиваясь, уходит во Вселенную. Процессы обмена веществ и энергии подвержены регуляции, причем существует множество регулирующих механизмов. Главнейшим механизмом регуляции метаболизма является контроль количества ферментов.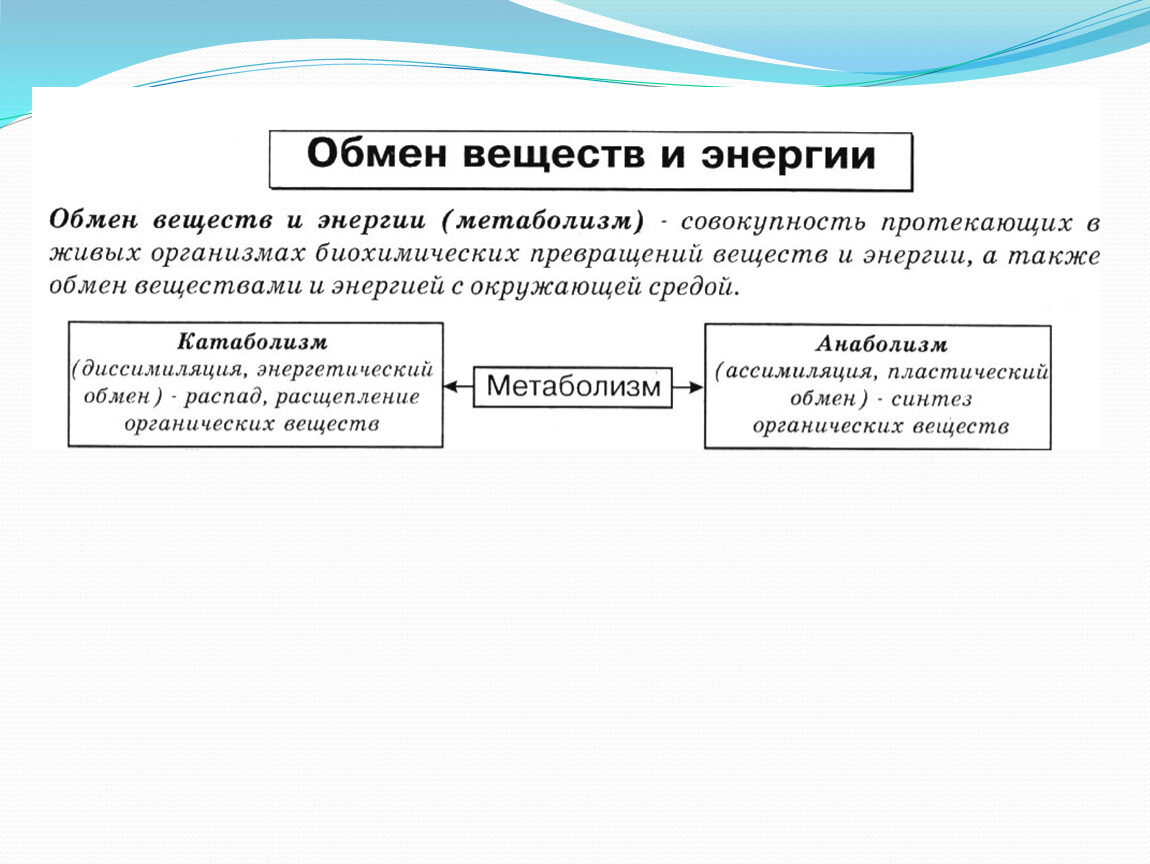 К числу регулирующих механизмов относят также контроль скорости расщепления субстрата ферментами, а также контроль каталитической активности ферментов. Метаболизм подвержен так называемому обратному аллостерическому контролю, заключающемуся в том, что во многих биосинтетических путях первая реакция может быть ингибирована (подавлена) конечным продуктом. Можно сказать, что такое ингибирование происходит по принципу обратной связи. В регуляции обмена веществ и энергии имеет значение и то, что метаболические пути синтеза и распада почти всегда разобщены, причем у эукариотов это разобщение усиливается компартментализацией клеток. Например, местом окисления жирных кислот в клетках являются митохондрии, тогда как их синтез происходит в цитозоле. Многие реакции метаболизма подвержены некоторой регуляции со стороны так называемого энергетического статуса клетки, показателем которого является энергетический заряд, определяемый суммой молярных фракций АТФ и АДФ. Энергетический заряд в клетке всегда постоянен.
К числу регулирующих механизмов относят также контроль скорости расщепления субстрата ферментами, а также контроль каталитической активности ферментов. Метаболизм подвержен так называемому обратному аллостерическому контролю, заключающемуся в том, что во многих биосинтетических путях первая реакция может быть ингибирована (подавлена) конечным продуктом. Можно сказать, что такое ингибирование происходит по принципу обратной связи. В регуляции обмена веществ и энергии имеет значение и то, что метаболические пути синтеза и распада почти всегда разобщены, причем у эукариотов это разобщение усиливается компартментализацией клеток. Например, местом окисления жирных кислот в клетках являются митохондрии, тогда как их синтез происходит в цитозоле. Многие реакции метаболизма подвержены некоторой регуляции со стороны так называемого энергетического статуса клетки, показателем которого является энергетический заряд, определяемый суммой молярных фракций АТФ и АДФ. Энергетический заряд в клетке всегда постоянен. Синтез АТФ ингибируется высоким зарядом, тогда как использование АТФ стимулируется таким же зарядом. Поступление вещества в клетки Благодаря содержанию растворов солей, Сахаров и других осмотически активных веществ, клетки характеризуются наличием в них определенного осмотического давления. Например, давление в клетках животных (морских и океанических форм) достигает 30 атм и более. В клетках растений осмотическое давление является еще большим. Разность концентрации веществ внутри и снаружи клетки называют градиентом концентрации. Поступление веществ в клетки животных, равно как и удаление их из клеток, связано с проницаемостью клеточной мембраны для молекул или ионов, а также со свойствами веществ. Клеточная мембрана регулирует обмен различными веществами между клеткой и средой. Поддержание мембраны и ее проницаемость обеспечиваются клеточной энергией. Известно несколько путей поступления веществ в клетки. В частности, различают пассивный, катализируемый и активный транспорт веществ в клетки, а также проникновение веществ в клетки путем эндоцитоза в виде фагоцитоза и пиноцитоза.
Синтез АТФ ингибируется высоким зарядом, тогда как использование АТФ стимулируется таким же зарядом. Поступление вещества в клетки Благодаря содержанию растворов солей, Сахаров и других осмотически активных веществ, клетки характеризуются наличием в них определенного осмотического давления. Например, давление в клетках животных (морских и океанических форм) достигает 30 атм и более. В клетках растений осмотическое давление является еще большим. Разность концентрации веществ внутри и снаружи клетки называют градиентом концентрации. Поступление веществ в клетки животных, равно как и удаление их из клеток, связано с проницаемостью клеточной мембраны для молекул или ионов, а также со свойствами веществ. Клеточная мембрана регулирует обмен различными веществами между клеткой и средой. Поддержание мембраны и ее проницаемость обеспечиваются клеточной энергией. Известно несколько путей поступления веществ в клетки. В частности, различают пассивный, катализируемый и активный транспорт веществ в клетки, а также проникновение веществ в клетки путем эндоцитоза в виде фагоцитоза и пиноцитоза.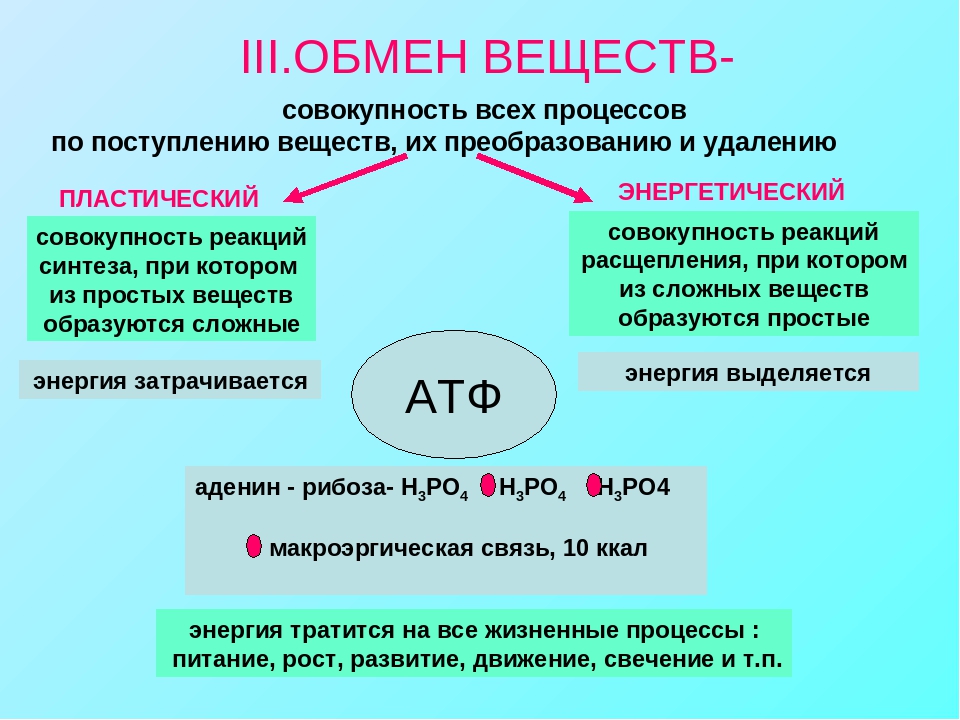 Пассивный, катализируемый и активный транспорт обеспечивают проникновение в клетки лишь малых молекул, тогда как эндоцитоз ответственен за поступление в клетки макромолекул (белков, по- линуклеотидов, полисахаридов) и разных твердых частиц, включая бактерии. В то же время клетки способны секретировать различные вещества в окружающую их среду. Этот процесс называют экзоцитозом. Пассивный транспорт веществ в клетки обеспечивается диффузией через мембрану по градиенту концентрации. Молекулы обычно переходят из области высокой концентрации в область более низкой концентрации. Количество работы, затрачиваемой на обеспечение транспорта молекул в клетку против градиента концентрации, можно определить, исходя из допущенияпростой реакции, в которой Ац есть концентрация молекул за пределами клетки, a Ai есть концентрация молекул внутри клетки. Эту реакцию можно описать константой равновесия в виде уравнения: активного транспорта веществ является транспорт ионов натрия и калия, который определяет клеточный мембранный потенциал.
Пассивный, катализируемый и активный транспорт обеспечивают проникновение в клетки лишь малых молекул, тогда как эндоцитоз ответственен за поступление в клетки макромолекул (белков, по- линуклеотидов, полисахаридов) и разных твердых частиц, включая бактерии. В то же время клетки способны секретировать различные вещества в окружающую их среду. Этот процесс называют экзоцитозом. Пассивный транспорт веществ в клетки обеспечивается диффузией через мембрану по градиенту концентрации. Молекулы обычно переходят из области высокой концентрации в область более низкой концентрации. Количество работы, затрачиваемой на обеспечение транспорта молекул в клетку против градиента концентрации, можно определить, исходя из допущенияпростой реакции, в которой Ац есть концентрация молекул за пределами клетки, a Ai есть концентрация молекул внутри клетки. Эту реакцию можно описать константой равновесия в виде уравнения: активного транспорта веществ является транспорт ионов натрия и калия, который определяет клеточный мембранный потенциал.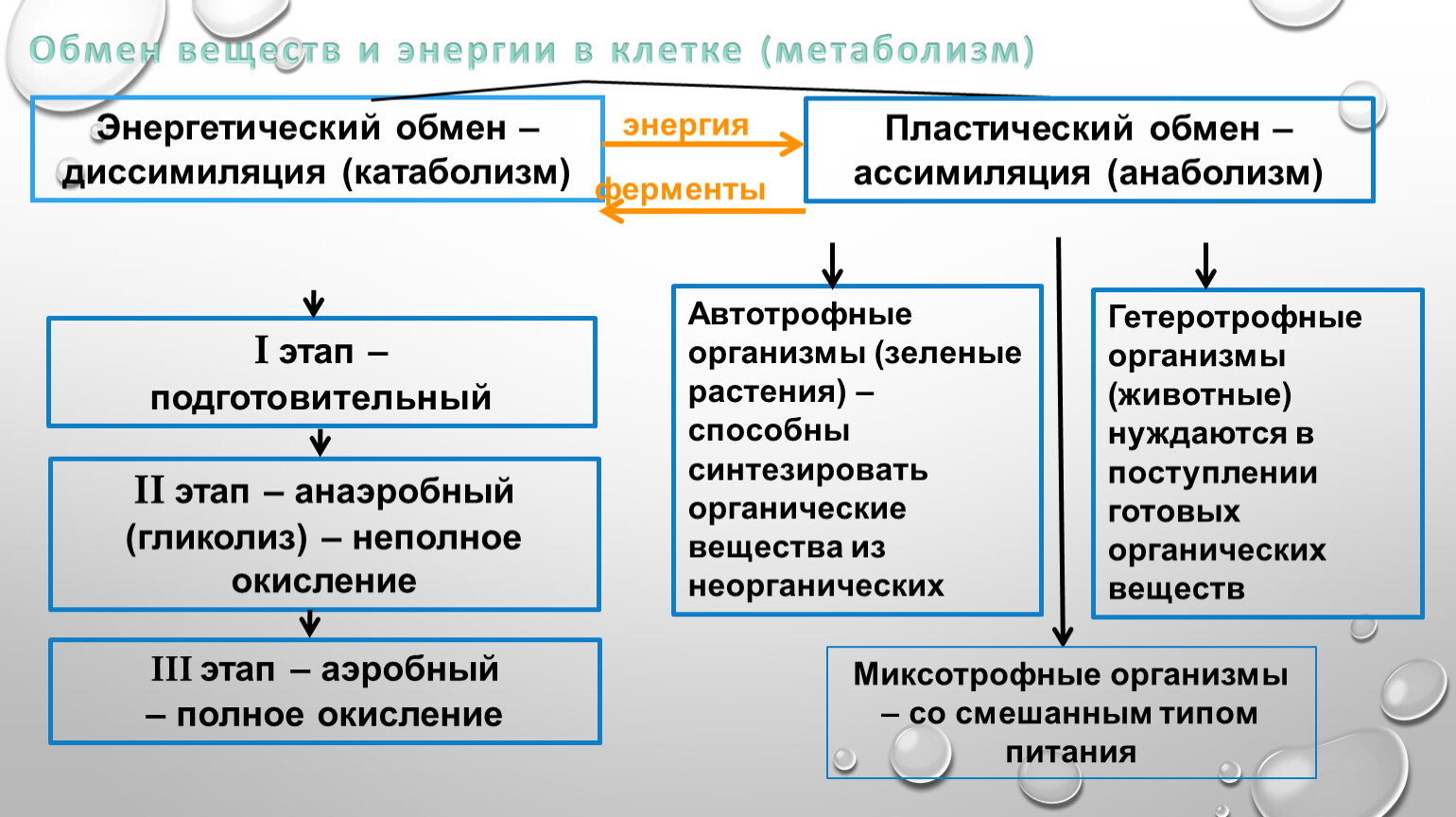 Концентрация ионов натрия (Na+) внутри большинства клеток является меньшей, чем в среде, тогда как концентрация ионов калия (К+) внутри клеток является в 10—20 раз большей, чем в среде. В результате этого ионы Nа+ стремятся проникнуть из среды в клетку, а ионы К+, наоборот, выйти из клетки в среду. Поддержание концентрации этих ионов в клетке и в окружающей среде обеспечивается благодаря наличию в клеточной мембране системы, которая является ионным «насосом» и которая откачивает ионы Na+ из клетки в среду и накачивает ионы К+ в клетку из среды. Работа этой системы, т.е. движение ионов против электрохимического градиента, обеспечивается энергией, которая генерируется гидролизом АТФ, причем фермент АТФ-аза, катализирующий эту реакцию, содержится в самой мембране и, как считают, выполняет роль натриево-калиевого «насоса», генерирующего мембранный потенциал. Энергия, освобождаемая при гидролизе одной молекулы АТФ, обеспечивает транспорт за пределы клетки трех ионов Na+ и внутрь клетки двух ионов К+.
Концентрация ионов натрия (Na+) внутри большинства клеток является меньшей, чем в среде, тогда как концентрация ионов калия (К+) внутри клеток является в 10—20 раз большей, чем в среде. В результате этого ионы Nа+ стремятся проникнуть из среды в клетку, а ионы К+, наоборот, выйти из клетки в среду. Поддержание концентрации этих ионов в клетке и в окружающей среде обеспечивается благодаря наличию в клеточной мембране системы, которая является ионным «насосом» и которая откачивает ионы Na+ из клетки в среду и накачивает ионы К+ в клетку из среды. Работа этой системы, т.е. движение ионов против электрохимического градиента, обеспечивается энергией, которая генерируется гидролизом АТФ, причем фермент АТФ-аза, катализирующий эту реакцию, содержится в самой мембране и, как считают, выполняет роль натриево-калиевого «насоса», генерирующего мембранный потенциал. Энергия, освобождаемая при гидролизе одной молекулы АТФ, обеспечивает транспорт за пределы клетки трех ионов Na+ и внутрь клетки двух ионов К+. Система Na+ + К+ —АТФ-аза помогает поддерживать ассиметрическое распределение ионов калия при высокой концентрации последнего в клетках. Ионы калия участвуют в регуляции многих клеточных функций, включая поток солей и воды из почечных клеток, освобождение инсулина из панкреатических клеток, частоту сердцебиений. Установлено, что энергетически выгодный транспорт ионов Na+ внутрь клеток оказывает также влияние на транспорт сахаров и аминокислот в клетки. В частности, с транспортом ионов Na+ сопряжен транспорт глюкозы. Чтобы создать градиент концентрации ионов Na+, благоприятный для транспорта ионов К+ и глюкозы внутрь клеток, ионная «насосная» система благодаря энергии активно откачивает ионы Na+ из клетки за ее пределы. Определенная роль в транспорте веществ принадлежит белоксвязывающим системам, представляющим четвертый способ транспорта. Речь идет о белках, локализованных в периплазматическом пространстве. Эти белки специфически связывают сахара, аминокислоты и ионы, перенося их затем к специфическим молекулам-носителям, локализованным в клеточной мембране.
Система Na+ + К+ —АТФ-аза помогает поддерживать ассиметрическое распределение ионов калия при высокой концентрации последнего в клетках. Ионы калия участвуют в регуляции многих клеточных функций, включая поток солей и воды из почечных клеток, освобождение инсулина из панкреатических клеток, частоту сердцебиений. Установлено, что энергетически выгодный транспорт ионов Na+ внутрь клеток оказывает также влияние на транспорт сахаров и аминокислот в клетки. В частности, с транспортом ионов Na+ сопряжен транспорт глюкозы. Чтобы создать градиент концентрации ионов Na+, благоприятный для транспорта ионов К+ и глюкозы внутрь клеток, ионная «насосная» система благодаря энергии активно откачивает ионы Na+ из клетки за ее пределы. Определенная роль в транспорте веществ принадлежит белоксвязывающим системам, представляющим четвертый способ транспорта. Речь идет о белках, локализованных в периплазматическом пространстве. Эти белки специфически связывают сахара, аминокислоты и ионы, перенося их затем к специфическим молекулам-носителям, локализованным в клеточной мембране.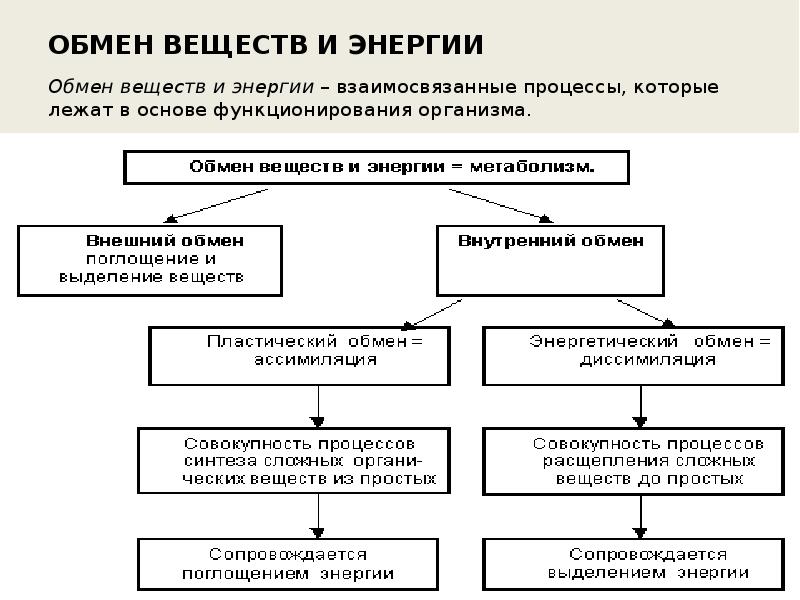 Источником энергии для этих систем является АТФ. Эндоцитоз, как отмечено выше, обеспечивает перенос в клетки крупных частиц и молекул. В рамках эндоцитоза различают фагоцитоз и пиноцитоз. Фагоцитоз (от греч. phagos — пожирающий и cytos — клетка) представляет собой процесс, заключающийся в том, что клетки-лейкоциты (макрофаги и нейтрофилы) захватывают (обволакивают) твердые частицы (фрагменты клеток, бактерии) путем выпячиваний своей клеточной мембраны и образования пузырьков, сливающихся затем с плазматической мембраной и открывающихся внутрь клетки. Вошедшие внутрь клеток частицы поступают в лизосомы, где с помощью клеточных (лизосомных) ферментов разрушаются и усваиваются затем клетками. Фагоцитоз широко распространен среди одноклеточных организмов. У многоклеточных (млекопитающих) он выполняется специализированными клетками (лейкоцитами). У простейших фагоцитоз является формой питания, в результате которого твердые частицы проникают в лизосомы, где и перевариваются, образуя продукты, служащие пищей.
Источником энергии для этих систем является АТФ. Эндоцитоз, как отмечено выше, обеспечивает перенос в клетки крупных частиц и молекул. В рамках эндоцитоза различают фагоцитоз и пиноцитоз. Фагоцитоз (от греч. phagos — пожирающий и cytos — клетка) представляет собой процесс, заключающийся в том, что клетки-лейкоциты (макрофаги и нейтрофилы) захватывают (обволакивают) твердые частицы (фрагменты клеток, бактерии) путем выпячиваний своей клеточной мембраны и образования пузырьков, сливающихся затем с плазматической мембраной и открывающихся внутрь клетки. Вошедшие внутрь клеток частицы поступают в лизосомы, где с помощью клеточных (лизосомных) ферментов разрушаются и усваиваются затем клетками. Фагоцитоз широко распространен среди одноклеточных организмов. У многоклеточных (млекопитающих) он выполняется специализированными клетками (лейкоцитами). У простейших фагоцитоз является формой питания, в результате которого твердые частицы проникают в лизосомы, где и перевариваются, образуя продукты, служащие пищей.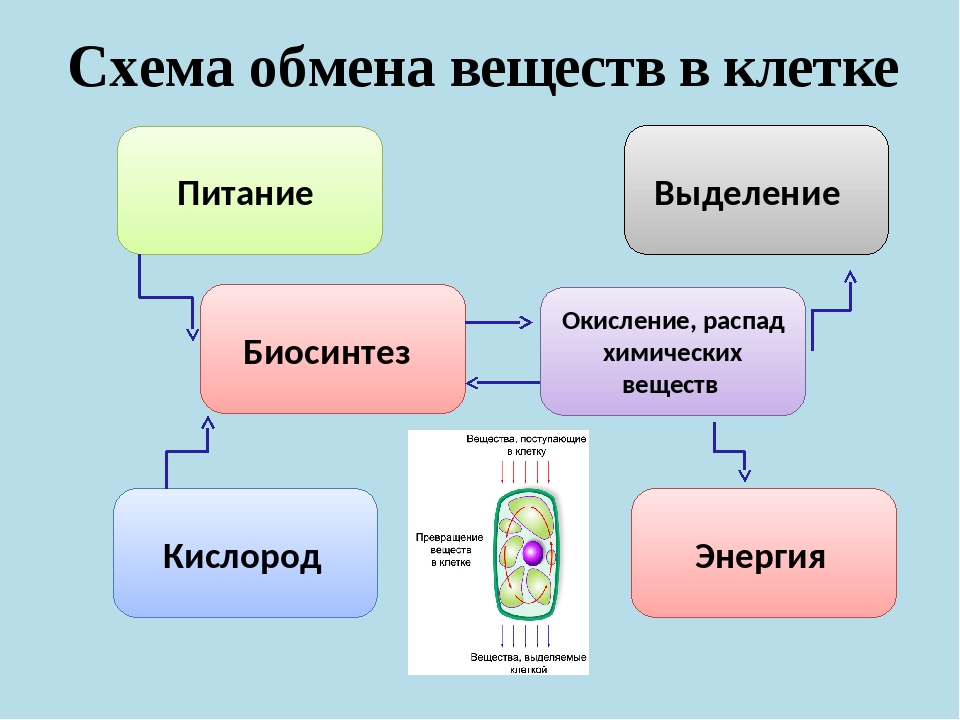 Биологическое значение фагоцитоза у млекопитающих заключается в том, что он обеспечивает иммунную (фагоцитарную) защиту организма Пиноцитоз (от греч. pino — пить и cytos — клетка) представляет собой процесс, при котором клетки поглощают жидкости и находящиеся в них высокомолекулярные вещества путем впячиваний плазматической мембраны и образования пузырьков (канальцев), куда поступает жидкость. Канальцы после заполнения жидкостью отшнуровываются, поступают в цитоплазму и доходят до лизосом, где их стенки перевариваются, в результате чего содержимое (жидкость) канальцев освобождается и подвергается дальнейшей обработке лизосомными ферментами. Пиноцитоз часто встречается у одноклеточных животных, у многоклеточных он наблюдается в клетках кровеносной и лимфатической систем, в клетках злокачественных опухолей, а также в клетках тканей, для которых характерен повышенный уровень обмена веществ. Экзоцитоз — это процесс секретирования клетками различных веществ, причем известны регулируемый и конститутивный пути экзоцитоза.
Биологическое значение фагоцитоза у млекопитающих заключается в том, что он обеспечивает иммунную (фагоцитарную) защиту организма Пиноцитоз (от греч. pino — пить и cytos — клетка) представляет собой процесс, при котором клетки поглощают жидкости и находящиеся в них высокомолекулярные вещества путем впячиваний плазматической мембраны и образования пузырьков (канальцев), куда поступает жидкость. Канальцы после заполнения жидкостью отшнуровываются, поступают в цитоплазму и доходят до лизосом, где их стенки перевариваются, в результате чего содержимое (жидкость) канальцев освобождается и подвергается дальнейшей обработке лизосомными ферментами. Пиноцитоз часто встречается у одноклеточных животных, у многоклеточных он наблюдается в клетках кровеносной и лимфатической систем, в клетках злокачественных опухолей, а также в клетках тканей, для которых характерен повышенный уровень обмена веществ. Экзоцитоз — это процесс секретирования клетками различных веществ, причем известны регулируемый и конститутивный пути экзоцитоза.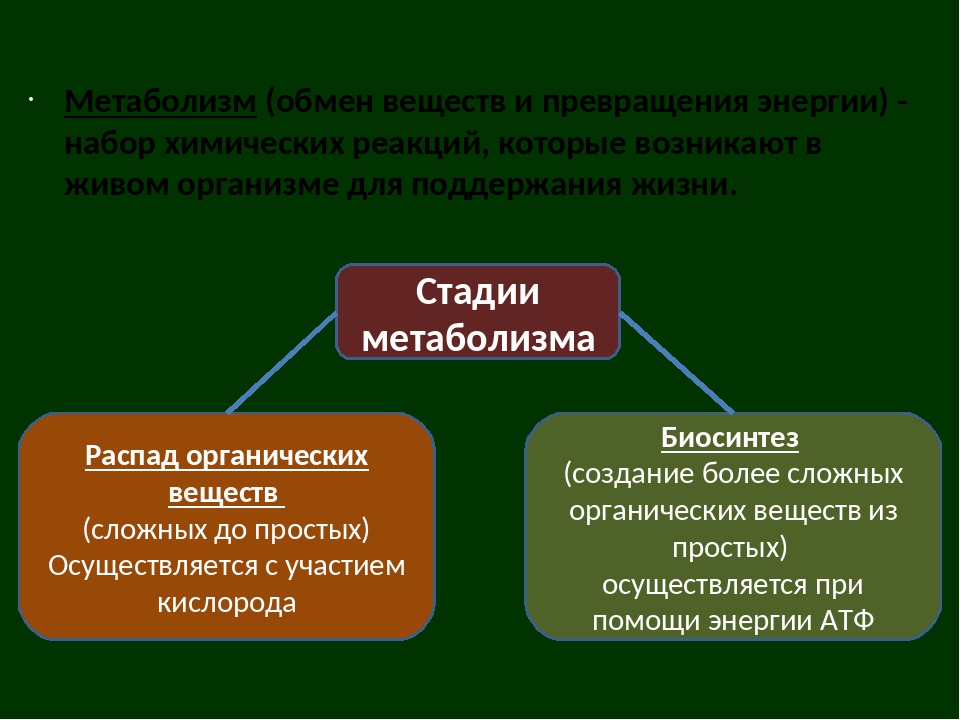 Примером регулируемого экзоцитоза является экзоцитоз инсулина. Клетки поджелудочной железы, продуцирующие инсулин, упаковывают его вначале в так называемые секреторные пузырьки, которые после внеклеточного сигнала сливаются с плазматической мембраной, а затем открываются в межклеточное пространство, освобождая гормон. Подобным образом происходит экзоцитоз других гормонов, нейротрансмиттеров и многих ферментов. Напротив, конститутивный путь экзоцитоза присущ многим белкам, непрерывно синтезируемым клетками и упаковываемым в эк- зоцитозные пузырьки в комплексе Гольджи, после чего эти пузырьки перемещаются к плазматической мембране, где и открываются в межклеточное пространство, освобождаясь от белкового содержимого. С помощью экзоцитоза из клетки удаляются также частицы, оказавшиеся непереваренными путем фагоцитоза. У большинства клеток циклы эндоцитоз-экзоцитоз непрерывны. Фотосинтез. Хемосинтез Фотосинтез — это синтез органических соединений в листьях зеленых растений из воды и углекислого газа атмосферы с использованием солнечной (световой) энергии, адсорбируемой хлорофиллом в хлоропластах.
Примером регулируемого экзоцитоза является экзоцитоз инсулина. Клетки поджелудочной железы, продуцирующие инсулин, упаковывают его вначале в так называемые секреторные пузырьки, которые после внеклеточного сигнала сливаются с плазматической мембраной, а затем открываются в межклеточное пространство, освобождая гормон. Подобным образом происходит экзоцитоз других гормонов, нейротрансмиттеров и многих ферментов. Напротив, конститутивный путь экзоцитоза присущ многим белкам, непрерывно синтезируемым клетками и упаковываемым в эк- зоцитозные пузырьки в комплексе Гольджи, после чего эти пузырьки перемещаются к плазматической мембране, где и открываются в межклеточное пространство, освобождаясь от белкового содержимого. С помощью экзоцитоза из клетки удаляются также частицы, оказавшиеся непереваренными путем фагоцитоза. У большинства клеток циклы эндоцитоз-экзоцитоз непрерывны. Фотосинтез. Хемосинтез Фотосинтез — это синтез органических соединений в листьях зеленых растений из воды и углекислого газа атмосферы с использованием солнечной (световой) энергии, адсорбируемой хлорофиллом в хлоропластах. Благодаря фотосинтезу происходит улавливание энергии видимого света и превращение ее в химическую энергию, сохраняемую (запасаемую) в органических веществах, образуемых при фотосинтезе Значение фотосинтеза гигантское. Отметим лишь, что он поставляет топливо (энергию) и атмосферный кислород, необходимые для существовария всего живого. Следовательно, энергией последующие, так называемые темновые реакции, протекающие без света и приводящие, в конце концов, к восстановлению атмосфертной COg до Сахаров. Источником энергии здесь является АТФ, а восстанавливающим агентом — НАДФ-Н, синтезируемые в реакциях фотосинтетического переноса электронов. Процесс восстановления COg начинается с катализируемой рибулозобисфосфаткарбоксилазой фиксации молекул этого соединения молекулами акцептора и сопровождается вступлением атомов углерода в ряд последовательных реакций, что приводит к образованию на каждые шесть фиксированных молекул COg одной молекулы глюкозы, причем связывание одной молекулы COg обеспечивается затратой трех молекул АТФ и двух молекул НАДФ-Н.
Благодаря фотосинтезу происходит улавливание энергии видимого света и превращение ее в химическую энергию, сохраняемую (запасаемую) в органических веществах, образуемых при фотосинтезе Значение фотосинтеза гигантское. Отметим лишь, что он поставляет топливо (энергию) и атмосферный кислород, необходимые для существовария всего живого. Следовательно, энергией последующие, так называемые темновые реакции, протекающие без света и приводящие, в конце концов, к восстановлению атмосфертной COg до Сахаров. Источником энергии здесь является АТФ, а восстанавливающим агентом — НАДФ-Н, синтезируемые в реакциях фотосинтетического переноса электронов. Процесс восстановления COg начинается с катализируемой рибулозобисфосфаткарбоксилазой фиксации молекул этого соединения молекулами акцептора и сопровождается вступлением атомов углерода в ряд последовательных реакций, что приводит к образованию на каждые шесть фиксированных молекул COg одной молекулы глюкозы, причем связывание одной молекулы COg обеспечивается затратой трех молекул АТФ и двух молекул НАДФ-Н. Как отмечено выше, энергия и электроны, необходимые для темновых реакций, поставляются АТФ и восстановленным НАДФ, образованными в световых реакциях. Таким образом, химическая энергия, генерированная световыми реакциями, стабилизируется в молекулах глюкозы в процессе темновых реакций. В конечном итоге из глюкозы образуется крахмал, который является ее высокомолекулярным полимером, в котором оказываются запасенными по существу как атомы углерода, так и энергия. Полимеризуясь, глюкоза образует также целлюлозу. Подсчитано, что в листьях зеленых растений Земли и в фитопланктоне водоемов ежегодно синтезируется около 150 млрд. тонн органических веществ и выделяется в атомсферу около 200 млрд. тонн кислорода. Фотосинтез имеет большую древность. Предполагают, что круговорот углерода, т. е. фотосинтез, существовал уже 3,5 х 109 лет назад. Хемосинтез — это синтез органических веществ с помощью энергии, генерируемой окислением неорганических соединений, например, аммиака, оксида железа, сероводорода.
Как отмечено выше, энергия и электроны, необходимые для темновых реакций, поставляются АТФ и восстановленным НАДФ, образованными в световых реакциях. Таким образом, химическая энергия, генерированная световыми реакциями, стабилизируется в молекулах глюкозы в процессе темновых реакций. В конечном итоге из глюкозы образуется крахмал, который является ее высокомолекулярным полимером, в котором оказываются запасенными по существу как атомы углерода, так и энергия. Полимеризуясь, глюкоза образует также целлюлозу. Подсчитано, что в листьях зеленых растений Земли и в фитопланктоне водоемов ежегодно синтезируется около 150 млрд. тонн органических веществ и выделяется в атомсферу около 200 млрд. тонн кислорода. Фотосинтез имеет большую древность. Предполагают, что круговорот углерода, т. е. фотосинтез, существовал уже 3,5 х 109 лет назад. Хемосинтез — это синтез органических веществ с помощью энергии, генерируемой окислением неорганических соединений, например, аммиака, оксида железа, сероводорода. Хемосинтез был открыт С. Н. Виноградским в 1889-1890 гг. Его осуществляют бактерии разных видов. Рассмотрим некоторые из наиболее известных примеров, начав с нитрифицирующих бактерий, роль которых была показана С. Н. Виноградским. Нитрифицирующие бактерии являются обитателями почвы. Они получают энергию окислением аммиака, образующегося в почве в результате разложения белков (остатков животных и растений). Реакция окисления аммиака может быть описана следующим уравнением: В этой реакции выделяется энергия в количестве бй2 кДж. Образующаяся в ходе этой реакции азотистая кислота окисляется нитрифицирующими бактериями другого вида до азотной кислоты с выделением энергии в количестве 101 кДж. Эта реакция описывается следующим уравнением: Энергия, освобождаемая в этих реакциях, используется для синтеза органических веществ. Серобактерии получают энергию, окисляя сероводород. Этот процесс можно описать следующим уравнением: энергия Образующаяся в результате этой реакции свободная сера накапливается в цитоплазме серобактерий.
Хемосинтез был открыт С. Н. Виноградским в 1889-1890 гг. Его осуществляют бактерии разных видов. Рассмотрим некоторые из наиболее известных примеров, начав с нитрифицирующих бактерий, роль которых была показана С. Н. Виноградским. Нитрифицирующие бактерии являются обитателями почвы. Они получают энергию окислением аммиака, образующегося в почве в результате разложения белков (остатков животных и растений). Реакция окисления аммиака может быть описана следующим уравнением: В этой реакции выделяется энергия в количестве бй2 кДж. Образующаяся в ходе этой реакции азотистая кислота окисляется нитрифицирующими бактериями другого вида до азотной кислоты с выделением энергии в количестве 101 кДж. Эта реакция описывается следующим уравнением: Энергия, освобождаемая в этих реакциях, используется для синтеза органических веществ. Серобактерии получают энергию, окисляя сероводород. Этот процесс можно описать следующим уравнением: энергия Образующаяся в результате этой реакции свободная сера накапливается в цитоплазме серобактерий. Если недостает далее сероводорода, то происходит окисление свободной серы в бактериальной цитоплазме с дальнейшим освобождением энергии: энергия Эта энергия используется для синтеза органических веществ из углекислого газа. Хемосинтезирующие бактерии окисляют также соединения железа и марганца. Считают, что образование залежей железных и марганцевых руд является результатом деятельности микроорганизмов в прошлые геологические эпохи (В. И. Вернадский). Подготовка энергии к использованию (дыхание) У растений источником энергии является солнечный свет, причем ответственными за производство АТФ являются хлоропласты. Энергия, которая оказывается запасенной в основном в углеводах, используется в дальнейшем клетками растений для обеспечения различных биологических реакций. Что же касается клеток животных, то энергия поступает к ним с пищей (сахарами и жирными кислотами). Чтобы эта энергия могла использоваться в процессе жизнедеятельности клеток, она должна быть подготовлена для использования.
Если недостает далее сероводорода, то происходит окисление свободной серы в бактериальной цитоплазме с дальнейшим освобождением энергии: энергия Эта энергия используется для синтеза органических веществ из углекислого газа. Хемосинтезирующие бактерии окисляют также соединения железа и марганца. Считают, что образование залежей железных и марганцевых руд является результатом деятельности микроорганизмов в прошлые геологические эпохи (В. И. Вернадский). Подготовка энергии к использованию (дыхание) У растений источником энергии является солнечный свет, причем ответственными за производство АТФ являются хлоропласты. Энергия, которая оказывается запасенной в основном в углеводах, используется в дальнейшем клетками растений для обеспечения различных биологических реакций. Что же касается клеток животных, то энергия поступает к ним с пищей (сахарами и жирными кислотами). Чтобы эта энергия могла использоваться в процессе жизнедеятельности клеток, она должна быть подготовлена для использования. Подготовка энергии к использованию, т. е. генерирование (извлечение) энергии из пищевых веществ осуществляется в процессе дыхания, под которым понимают окисление (расщепление) молекул-энергоносителей, т. е. «топливных» молекул, при котором роль конечного акцептора электронов выполняет О у а донором электронов является органическое или неорганическое соединение. Процесс подготовки энергии к использованию протекает в три последовательные стадии На первой стадии поступающие в клетки крупные молекулы полисахаридов гидролизуются до простых Сахаров. На этой стадии происходит разложение и других энергоносителей. В частности, жиры разлагаются на глицерол и жирные кислоты, белки гидро-лизуются до аминокислот. Однако на этой стадии высвобождение запасенной в пищевых веществах энергии все еще не происходит. На второй стадии происходит распад малых молекул до еще более простых структур, играющих уже ключевую роль в метаболизме. Глюкоза превращается в ацетильную часть ацетил-КоА, являющегося производным кофермента А.
Подготовка энергии к использованию, т. е. генерирование (извлечение) энергии из пищевых веществ осуществляется в процессе дыхания, под которым понимают окисление (расщепление) молекул-энергоносителей, т. е. «топливных» молекул, при котором роль конечного акцептора электронов выполняет О у а донором электронов является органическое или неорганическое соединение. Процесс подготовки энергии к использованию протекает в три последовательные стадии На первой стадии поступающие в клетки крупные молекулы полисахаридов гидролизуются до простых Сахаров. На этой стадии происходит разложение и других энергоносителей. В частности, жиры разлагаются на глицерол и жирные кислоты, белки гидро-лизуются до аминокислот. Однако на этой стадии высвобождение запасенной в пищевых веществах энергии все еще не происходит. На второй стадии происходит распад малых молекул до еще более простых структур, играющих уже ключевую роль в метаболизме. Глюкоза превращается в ацетильную часть ацетил-КоА, являющегося производным кофермента А. В результате этих реакций образуются молекулы АТФ, но их еще мало. На уровне ацетил-КоА в метаболический путь могут вступать также жирные кислоты и аминокислоты. НАД F 0D 7Н образуется в результате окисления глицеральдегид-3-фосфата, который используется при восстановлении пирувата. В процессе превращения пировиноградной кислоты в лактат происходит регенерирование НАД+, что поддерживает непрерывность гликолиза в анаэробных условиях. Этиловый спирт образуется из пирувата при метаболизме дрожжей и некоторых других микроорганизмов спиртового брожения. Суммарная реакция превращения глюкозы в этанол имеет следующий вид: Глюкоза + 2Pi + 2АДФ + 2Н+ F 0A E 2 этанол + 2СО2 + 2АТФ + 2Н20. Восстановление ацетальдегида в этиловый спирт сопровождается регенерированием НАД+. Анаэробное дыхание с точки зрения производительности не является эффективным процессом, т. к. при анаэробном превращении глюкозы в этанол или лактат освобождается лишь небольшое количество энергии. Большая часть энергии, запасенная в глюкозе, продолжает затем оставаться запасенной уже в молекулах этанола.
В результате этих реакций образуются молекулы АТФ, но их еще мало. На уровне ацетил-КоА в метаболический путь могут вступать также жирные кислоты и аминокислоты. НАД F 0D 7Н образуется в результате окисления глицеральдегид-3-фосфата, который используется при восстановлении пирувата. В процессе превращения пировиноградной кислоты в лактат происходит регенерирование НАД+, что поддерживает непрерывность гликолиза в анаэробных условиях. Этиловый спирт образуется из пирувата при метаболизме дрожжей и некоторых других микроорганизмов спиртового брожения. Суммарная реакция превращения глюкозы в этанол имеет следующий вид: Глюкоза + 2Pi + 2АДФ + 2Н+ F 0A E 2 этанол + 2СО2 + 2АТФ + 2Н20. Восстановление ацетальдегида в этиловый спирт сопровождается регенерированием НАД+. Анаэробное дыхание с точки зрения производительности не является эффективным процессом, т. к. при анаэробном превращении глюкозы в этанол или лактат освобождается лишь небольшое количество энергии. Большая часть энергии, запасенная в глюкозе, продолжает затем оставаться запасенной уже в молекулах этанола. Как видно, последовательность реакций, в процессе которых глюкоза превращается в пируват, сходна в клетках всех видов у всех организмов. Биологическое значение гликолиза заключается в том, что он генерирует молекулы АТФ. В результате распада глюкозы образуются строительные блоки, используемые для синтеза клеточных структур. Оба эти процесса регулируются скоростью превращения глюкозы в пируват. Однако роль пирувата в генерировании энергии обмена веществ различна в разных клетках и разных организмах. У аэробных организмов гликолиз, осуществляемый в цитозоле выполняет роль своего рода процесса-прелюдии к дальнейшему окислению, ибо при аэробном дыхании (в присутствии кислорода) окисление идет дальше и осуществляется уже в митохондриях в так называемом цикле Кребса (цикле трикарбоновых кислот или цикле лимонной кислоты) и в цепи переноса электронов, цикл Кребса является конечным путем окисления топливных молекул, причем не только глюкозы и других углеводов, но и жирных кислот и аминокислот.
Как видно, последовательность реакций, в процессе которых глюкоза превращается в пируват, сходна в клетках всех видов у всех организмов. Биологическое значение гликолиза заключается в том, что он генерирует молекулы АТФ. В результате распада глюкозы образуются строительные блоки, используемые для синтеза клеточных структур. Оба эти процесса регулируются скоростью превращения глюкозы в пируват. Однако роль пирувата в генерировании энергии обмена веществ различна в разных клетках и разных организмах. У аэробных организмов гликолиз, осуществляемый в цитозоле выполняет роль своего рода процесса-прелюдии к дальнейшему окислению, ибо при аэробном дыхании (в присутствии кислорода) окисление идет дальше и осуществляется уже в митохондриях в так называемом цикле Кребса (цикле трикарбоновых кислот или цикле лимонной кислоты) и в цепи переноса электронов, цикл Кребса является конечным путем окисления топливных молекул, причем не только глюкозы и других углеводов, но и жирных кислот и аминокислот. Следовательно, «топливом» для окисления в митохондриях являются пируват и жирные кислоты. Включение в этот окислительный путь осуществляется на уровне кофермента (ацетил-КоА), т. е. происходит с образования ацетил-КоА в митохондриальном матриксе, в результате окислительного декарбоксилирования пирувата или распада жирных кислот до двухуглеродных групп. Ацетил-КоА обладает высоким потенциалом переноса ацетильных групп. Следовательно, топливные молекулы вступают в цикл Кребса в виде ацетил-КоА. Непрерывность же снабжения окислительных процессов «топливом» обеспечивается запасанием животными клетками липидов, являющихся главным ресурсом жирных кислот, а также гликогена, являющегося источником глюкозы. Цикл Кребса действует только в аэробных условиях и начинается с конденсации ацетил-КоА (C2) и оксалоацетата (C4 с образованием цитрата (С6), изомеризация которого приводит к изоцитрату (C6). Затем следует окислительное декарбоксилирование изоцитрата и образование F 06 1- оксоглутарата (С5), после чего последний подвергается окислительному декарбоксилированию (выделяется вторая молекула CO2 в сукцинил-КоА (С4).
Следовательно, «топливом» для окисления в митохондриях являются пируват и жирные кислоты. Включение в этот окислительный путь осуществляется на уровне кофермента (ацетил-КоА), т. е. происходит с образования ацетил-КоА в митохондриальном матриксе, в результате окислительного декарбоксилирования пирувата или распада жирных кислот до двухуглеродных групп. Ацетил-КоА обладает высоким потенциалом переноса ацетильных групп. Следовательно, топливные молекулы вступают в цикл Кребса в виде ацетил-КоА. Непрерывность же снабжения окислительных процессов «топливом» обеспечивается запасанием животными клетками липидов, являющихся главным ресурсом жирных кислот, а также гликогена, являющегося источником глюкозы. Цикл Кребса действует только в аэробных условиях и начинается с конденсации ацетил-КоА (C2) и оксалоацетата (C4 с образованием цитрата (С6), изомеризация которого приводит к изоцитрату (C6). Затем следует окислительное декарбоксилирование изоцитрата и образование F 06 1- оксоглутарата (С5), после чего последний подвергается окислительному декарбоксилированию (выделяется вторая молекула CO2 в сукцинил-КоА (С4). В следующей реакции происходит расщепление тиоэфирной связи сукцинил-КоА в присутствии пирофосфата (Pi), в результате чего образуется сукцинат и генерируется высокоэнергетические фосфатные связи в форме ГТФ и АТФ. Сукцинат потом окисляется в фумарат (С4), а последний гидратируется в малат. В последующей реакции происходит окисление малата, что приводит к регенерированию оксалоацетата (C4). Следовательно, в цикл Кребса вступают два атома углерода в виде ацетил-КоА и такое же количество атомов углерода покидают этот цикл уже в виде CO2 в последовательных реакциях декарбоксилирования, которые катализируются дегидрогеназами. В результате четырех окислительно-восстановительных реакций цикла Кребса происходит перенос трех пар электронов над НАД и одной пары электронов на ФАД. Восстановленные этим путем переносчики электронов НАД и ФАД подвергаются затем окислению уже в цепи переноса электронов, в результате которого генерируется одиннадцать молекул АТФ. Одна высокоэнергетическая связь генерируется непосредственно в цикле Кребса.
В следующей реакции происходит расщепление тиоэфирной связи сукцинил-КоА в присутствии пирофосфата (Pi), в результате чего образуется сукцинат и генерируется высокоэнергетические фосфатные связи в форме ГТФ и АТФ. Сукцинат потом окисляется в фумарат (С4), а последний гидратируется в малат. В последующей реакции происходит окисление малата, что приводит к регенерированию оксалоацетата (C4). Следовательно, в цикл Кребса вступают два атома углерода в виде ацетил-КоА и такое же количество атомов углерода покидают этот цикл уже в виде CO2 в последовательных реакциях декарбоксилирования, которые катализируются дегидрогеназами. В результате четырех окислительно-восстановительных реакций цикла Кребса происходит перенос трех пар электронов над НАД и одной пары электронов на ФАД. Восстановленные этим путем переносчики электронов НАД и ФАД подвергаются затем окислению уже в цепи переноса электронов, в результате которого генерируется одиннадцать молекул АТФ. Одна высокоэнергетическая связь генерируется непосредственно в цикле Кребса.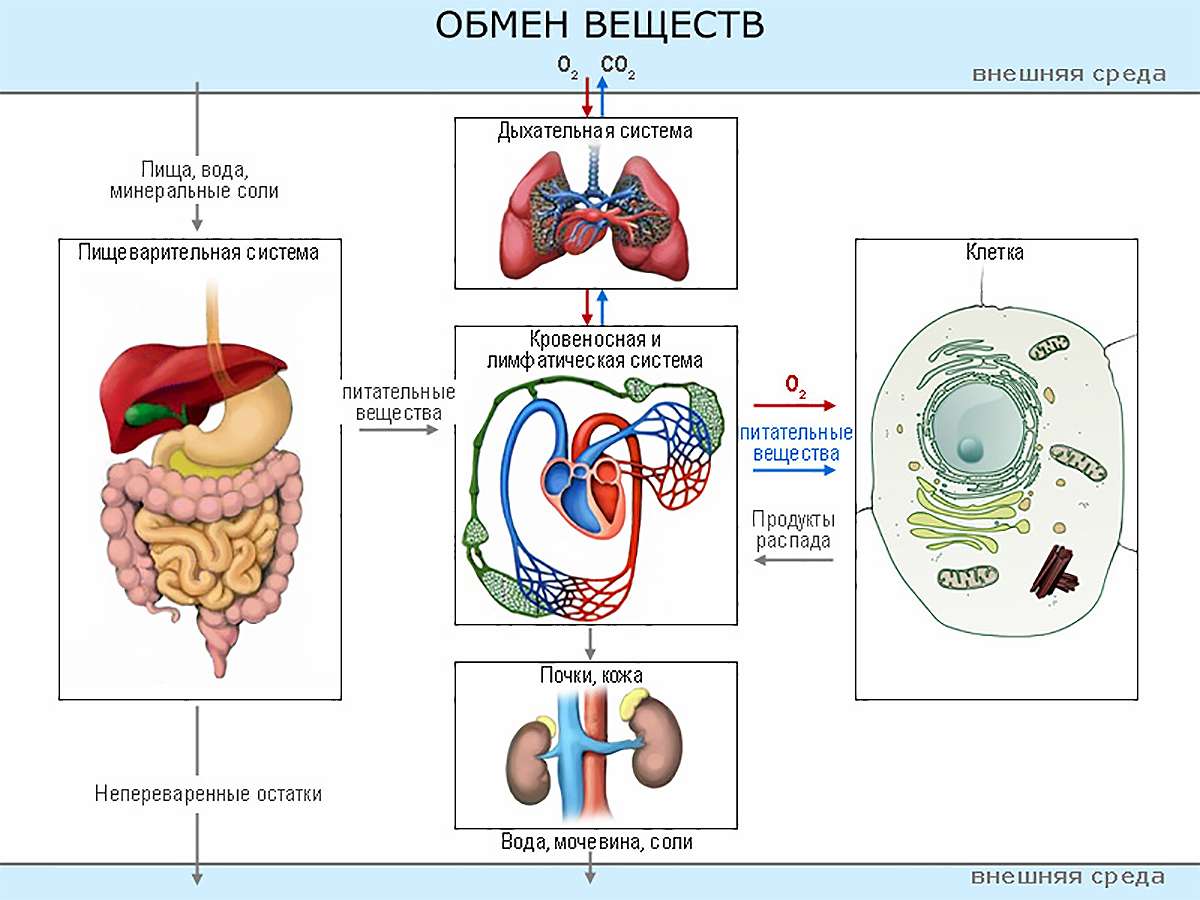 Таким образом, на каждый двухуглеродный фрагмент, полностью окисляемый до Н2О и СО2, генерируется двенадцать высокоэнергетических фосфатных связей. Цикл Кребса подвержен регуляции; его скорость зависит от потребности в АТФ других метаболических реакций. Важное значение имеет регуляция синтеза цитратсинтазы, изоцитратдегидроге-назы и оксоглутаратдегидрогеназы. Биологическое значение цикла Кребса заключается не только в том, что он является завершающим этапом в генерировании энергии, но и в том, что он «поставляет» промежуточные продукты для биосинтеза. Цикл Кребса действует только в аэробных условиях по той причине, что для него необходимы НАД и ФАД, регенерирование которых происходит при переносе электронов НАД F 0D 7Н и ФАД F 0 D 7h3 на О2 по цепи транспорта электронов, сопровождаемом одновременным образованием АТФ Поскольку у аэробных организмов единственным акцептором электронов является О2, а электроны не переносятся от топливных молекул и продуктов их реакций прямо на O2, топливные молекулы и продукты их распада переносят электроны к пиримидиннуклеотидам или флавинам, являющимся переносчиками.
Таким образом, на каждый двухуглеродный фрагмент, полностью окисляемый до Н2О и СО2, генерируется двенадцать высокоэнергетических фосфатных связей. Цикл Кребса подвержен регуляции; его скорость зависит от потребности в АТФ других метаболических реакций. Важное значение имеет регуляция синтеза цитратсинтазы, изоцитратдегидроге-назы и оксоглутаратдегидрогеназы. Биологическое значение цикла Кребса заключается не только в том, что он является завершающим этапом в генерировании энергии, но и в том, что он «поставляет» промежуточные продукты для биосинтеза. Цикл Кребса действует только в аэробных условиях по той причине, что для него необходимы НАД и ФАД, регенерирование которых происходит при переносе электронов НАД F 0D 7Н и ФАД F 0 D 7h3 на О2 по цепи транспорта электронов, сопровождаемом одновременным образованием АТФ Поскольку у аэробных организмов единственным акцептором электронов является О2, а электроны не переносятся от топливных молекул и продуктов их реакций прямо на O2, топливные молекулы и продукты их распада переносят электроны к пиримидиннуклеотидам или флавинам, являющимся переносчиками. Главным акцептором электронов при окислении топливных молекул является никотинамидадениндинуклеотид (НАД+, реакционноспособной частью которого является никотинамидное кольцо. Последнее присоединяет Больше того, между биосинтезом и деградацией химических соединений наблюдается взаимодействие, причем это взаимодействие обеспечивается АТФ Одним из обычных примеров механической работы является мышечное сокращение, в котором существенную роль играет АТФ. Метаболизм на уровне организмов По характеру ассимиляции различают автотрофные, гетеротрофные и миксотрофные организмы. Автотрофные (от греч. autos — сам, trophe — пища), или самопитающиеся организмы, — это организмы, способные синтезировать органические соединения из неорганических (углекислого газа, воды и неорганических соединений азота и серы). В зависимости от источника потребляемой энергии автотрофы классифицируют на фотосинтезирующие и хемосинтезирующие организмы. Первые используют световую энергию, тогда как вторые — энергию экзотермических химических реакций (в ходе превращения неорганических соединении), т.
Главным акцептором электронов при окислении топливных молекул является никотинамидадениндинуклеотид (НАД+, реакционноспособной частью которого является никотинамидное кольцо. Последнее присоединяет Больше того, между биосинтезом и деградацией химических соединений наблюдается взаимодействие, причем это взаимодействие обеспечивается АТФ Одним из обычных примеров механической работы является мышечное сокращение, в котором существенную роль играет АТФ. Метаболизм на уровне организмов По характеру ассимиляции различают автотрофные, гетеротрофные и миксотрофные организмы. Автотрофные (от греч. autos — сам, trophe — пища), или самопитающиеся организмы, — это организмы, способные синтезировать органические соединения из неорганических (углекислого газа, воды и неорганических соединений азота и серы). В зависимости от источника потребляемой энергии автотрофы классифицируют на фотосинтезирующие и хемосинтезирующие организмы. Первые используют световую энергию, тогда как вторые — энергию экзотермических химических реакций (в ходе превращения неорганических соединении), т. е. энергию, образующуюся при окислении различных неорганических соединений (водорода, сероводорода, аммиака и др.). Фотосинтезирующими организмами являются растения, в листьях которых осуществляется фотосинтез. Зеленые растения образуют углеводы, которые передвигаются из листьев в корни, где вступают в реакции с аммиаком и образуют аминокислоты. Хемосинтезирующими организмами являются микроорганизмы — нитрифицирующие, серобактерии, водородные бактерии и железобактерии. Свободный азот усваивают азотфиксирующие бактерии. Гетеротрофные (от греч. heteros — другой, trophe — пища) организмы — это организмы, которые нуждаются в готовых органических соединениях. Ими являются животные, а также микроорганизмы. Гетеротрофные организмы получают энергию путем окисления органических соединений Для животных характерен голозойный способ гетеротрофного питания, заключающийся в потреблении пищи в виде твердых частиц с последующей ее механической и химической переработкой. Напротив, для микроорганизмов характерен осмотическим способ гетеротрофного питания.
е. энергию, образующуюся при окислении различных неорганических соединений (водорода, сероводорода, аммиака и др.). Фотосинтезирующими организмами являются растения, в листьях которых осуществляется фотосинтез. Зеленые растения образуют углеводы, которые передвигаются из листьев в корни, где вступают в реакции с аммиаком и образуют аминокислоты. Хемосинтезирующими организмами являются микроорганизмы — нитрифицирующие, серобактерии, водородные бактерии и железобактерии. Свободный азот усваивают азотфиксирующие бактерии. Гетеротрофные (от греч. heteros — другой, trophe — пища) организмы — это организмы, которые нуждаются в готовых органических соединениях. Ими являются животные, а также микроорганизмы. Гетеротрофные организмы получают энергию путем окисления органических соединений Для животных характерен голозойный способ гетеротрофного питания, заключающийся в потреблении пищи в виде твердых частиц с последующей ее механической и химической переработкой. Напротив, для микроорганизмов характерен осмотическим способ гетеротрофного питания.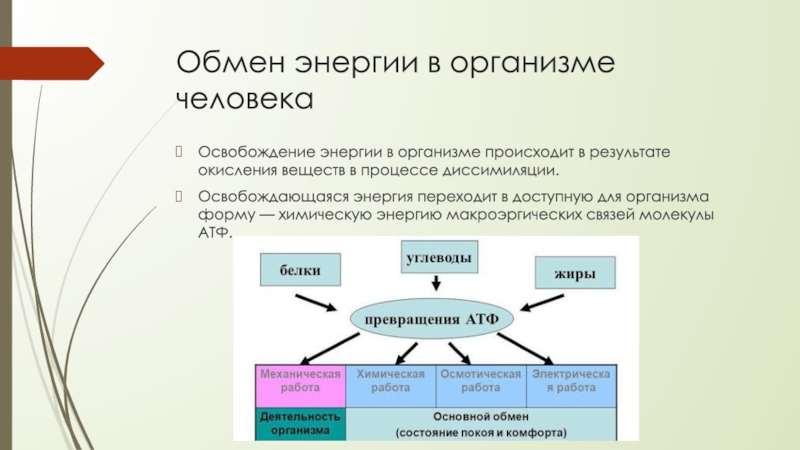 При этом способе питание происходит растворенными питательными веществами путем поглощения их всей поверхностью тела. Миксотрофные (от лат. mixtus — смешанный) организмы — это организмы, способные как к синтезу органических веществ, так и к использованию их в готовом виде. Например, эвглена зеленая на свету является автотрофом, в темноте — гетеротрофом. По характеру диссимиляции различают аэробные и анаэробные организмы. Аэробные (от греч. aer — воздух) организмы для дыхания (окисления) используют свободный кислород. Аэробами является большинство ныне живущих организмов. Напротив, анаэробы окисляют субстраты, например, сахара в отсутствие кислорода, следовательно, для них дыханием является брожение. Анаэробами являются многие микроорганизмы, гельминты. Например, динитри-фицирующие анаэробные бактерии окисляют органические соединения, используя нитриты, являющиеся неорганическим окислителем. Автотрофы и гетеротрофы связаны между собой питанием (пищевыми цепями) и энергетически, в результате чего существование одних из них зависит от других и наоборот.
При этом способе питание происходит растворенными питательными веществами путем поглощения их всей поверхностью тела. Миксотрофные (от лат. mixtus — смешанный) организмы — это организмы, способные как к синтезу органических веществ, так и к использованию их в готовом виде. Например, эвглена зеленая на свету является автотрофом, в темноте — гетеротрофом. По характеру диссимиляции различают аэробные и анаэробные организмы. Аэробные (от греч. aer — воздух) организмы для дыхания (окисления) используют свободный кислород. Аэробами является большинство ныне живущих организмов. Напротив, анаэробы окисляют субстраты, например, сахара в отсутствие кислорода, следовательно, для них дыханием является брожение. Анаэробами являются многие микроорганизмы, гельминты. Например, динитри-фицирующие анаэробные бактерии окисляют органические соединения, используя нитриты, являющиеся неорганическим окислителем. Автотрофы и гетеротрофы связаны между собой питанием (пищевыми цепями) и энергетически, в результате чего существование одних из них зависит от других и наоборот. Например, кислородные потребности аэробоз полностью зависят от автотрофов (зеленых растений). Последние используют СОу поставляемый в окружающую среду гетеротрофами. Все живые существа обладают системами, обеспечивающими превращение энергии и способны понижать энтропию. Жизнедеятельность организмов с различными типами питания создает круговороты веществ в природе Происхождение типов обмена Обсуждение вопросов, касающихся происхождения типов обмена, очень осложнено незнанием первых этапов в развитии жизни. Поэтому формулируемые гипотезы не доступны экспериментальной проверке. Тем не менее предполагают, что когда возникла жизнь и когда ресурсы «первичного бульона» были исчерпаны, то у первых клеток возникла необходимость синтезировать ферменты, катализирующие образование органических молекул. Следовательно, селективные преимущества далее приобрели клетки, способные к биосинтезу. Со временем у клеток возникли различные метаболические пути. Предполагают, что центральным был метаболизм в виде гликолиза, ведущего к синтезу АТФ.
Например, кислородные потребности аэробоз полностью зависят от автотрофов (зеленых растений). Последние используют СОу поставляемый в окружающую среду гетеротрофами. Все живые существа обладают системами, обеспечивающими превращение энергии и способны понижать энтропию. Жизнедеятельность организмов с различными типами питания создает круговороты веществ в природе Происхождение типов обмена Обсуждение вопросов, касающихся происхождения типов обмена, очень осложнено незнанием первых этапов в развитии жизни. Поэтому формулируемые гипотезы не доступны экспериментальной проверке. Тем не менее предполагают, что когда возникла жизнь и когда ресурсы «первичного бульона» были исчерпаны, то у первых клеток возникла необходимость синтезировать ферменты, катализирующие образование органических молекул. Следовательно, селективные преимущества далее приобрели клетки, способные к биосинтезу. Со временем у клеток возникли различные метаболические пути. Предполагают, что центральным был метаболизм в виде гликолиза, ведущего к синтезу АТФ. Считают, что первыми организмами, сходными, вероятно, с бактериями, были гетеротрофные анаэробы, способные использовать органические вещества абиогенного происхождения. Формирование цепи транспорта электронов позволило анаэробным бактериям использовать в качестве источника энергии те органические соединения, которые не подвергаются сбраживанию. Первые гетеротрофы дали начало автотрофам, которые тоже были анаэробами. Позднее среди автотрофов появились организмы, способные осуществлять фотосинтез, что повело около 3,5—2 млрд. лет назад к превращению СО2 в органическое соединение и к накоплению в атмосфере кислорода. Предполагают, что первой стадией в возникновении фотосинтеза у примитивных организмов явился простейший синтез АТФ. Более поздние организмы возможно использовали водород для синтеза углеводов, после чего появились организмы, которые оказались способными использовать воду в качестве источника водорода и продуцировать кислород, т. е. уже быть фотосинтезирующими. Предполагают, что первые автотрофы использовали ферментные системы, развитые гетеротрофами.
Считают, что первыми организмами, сходными, вероятно, с бактериями, были гетеротрофные анаэробы, способные использовать органические вещества абиогенного происхождения. Формирование цепи транспорта электронов позволило анаэробным бактериям использовать в качестве источника энергии те органические соединения, которые не подвергаются сбраживанию. Первые гетеротрофы дали начало автотрофам, которые тоже были анаэробами. Позднее среди автотрофов появились организмы, способные осуществлять фотосинтез, что повело около 3,5—2 млрд. лет назад к превращению СО2 в органическое соединение и к накоплению в атмосфере кислорода. Предполагают, что первой стадией в возникновении фотосинтеза у примитивных организмов явился простейший синтез АТФ. Более поздние организмы возможно использовали водород для синтеза углеводов, после чего появились организмы, которые оказались способными использовать воду в качестве источника водорода и продуцировать кислород, т. е. уже быть фотосинтезирующими. Предполагают, что первые автотрофы использовали ферментные системы, развитые гетеротрофами.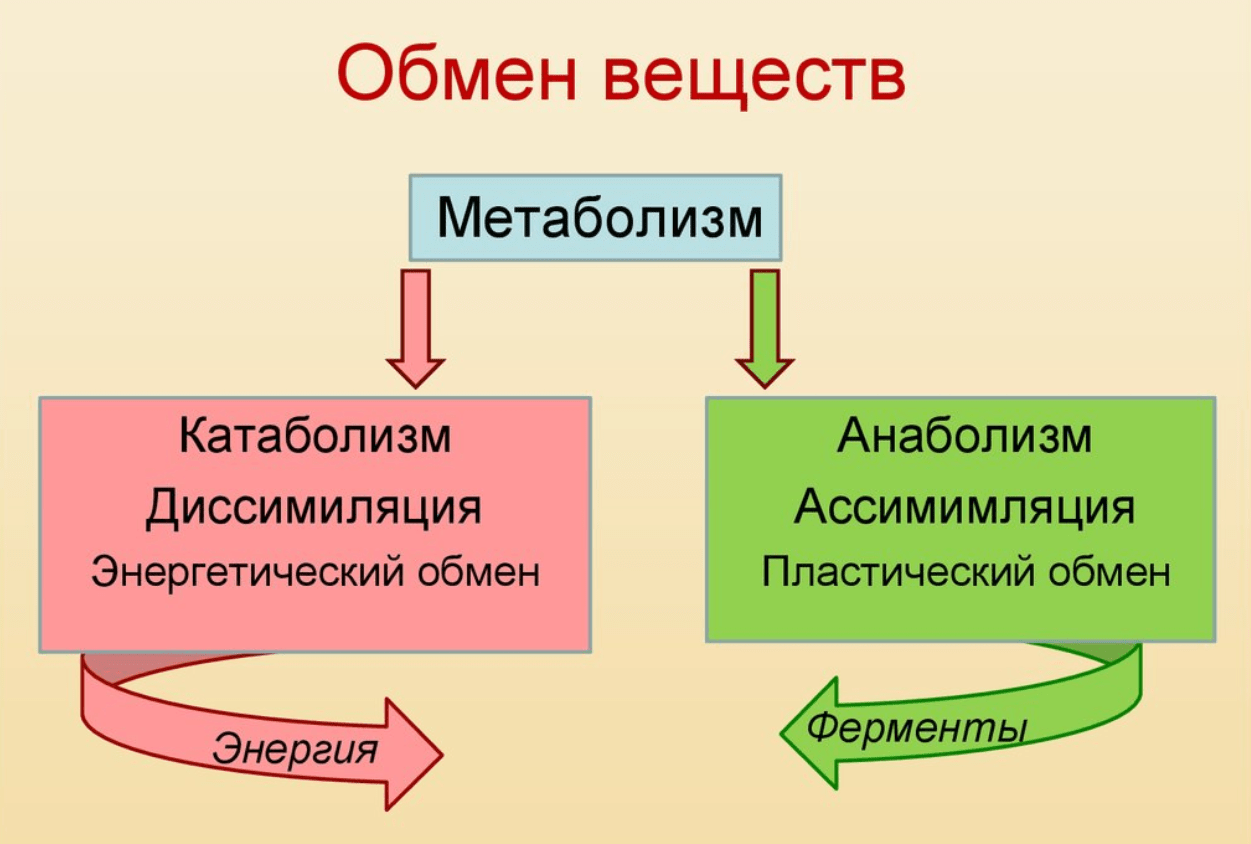 Поэтому на фотосинтез
Поэтому на фотосинтез
Обмен веществ и энергии в живых организмах
В здоровом организме взрослого человека наблюдается состояние водного равновесия или водного баланса. Оно заключается в том, что количество воды, потребляемое человеком, равно количеству воды, выводимой из организма. Водный обмен является важной составной частью общего обмена веществ живых организмов, в том числе и человека. Водный обмен включает процессы всасывания воды, которая поступает в желудок при питье и с пищевыми продуктами, распределение ее в организме, выделения через почки, мочевыводящие пути, легкие, кожу и кишечник. Следует отметить, что вода также образуется в организме вследствие окисления жиров, углеводов и белков, принятых с пищей. Такую воду называют метаболической. Слово метаболизм происходит от греческого, что означает перемена, превращение. В медицине и биологической науке метаболизмом называют процессы превращения веществ и энергии, лежащие в основе жизнедеятельности организмов.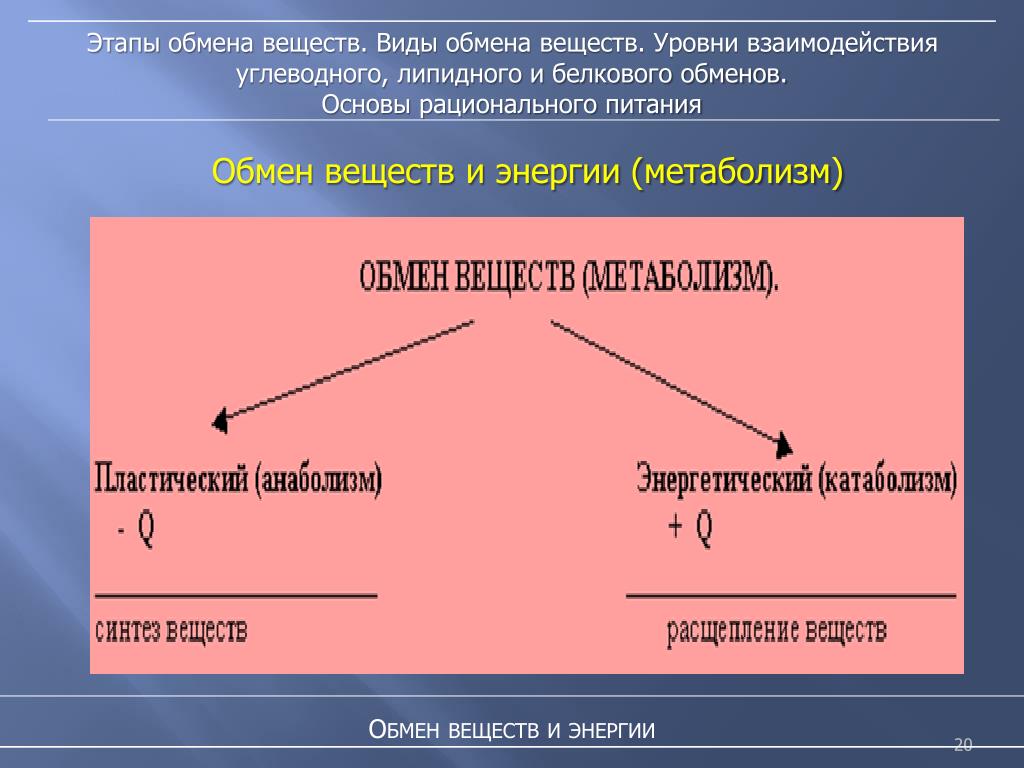 Белки, жиры и углеводы окисляются в организме с образованием воды НгО и углекислого газа (диоксида углерода) СОг. При окислении 100 г жиров образуется 107 г воды, а при окислении 100 г углеводов — 55,5 г воды. Некоторые организмы обходятся лишь метаболической водой и не потребляют ее извне. Примером является ковровая моль. Не нуждаются в воде в природных условиях тушканчики, которые водятся в Европе и Азии, и американская кенгуровая крыса. Многие знают, что в условиях исключительно жаркого и сухого климата верблюд обладает феноменальной способностью долгое время обходиться без пищи и воды. Например, при массе 450 кг за восьмидневный переход по пустыне верблюд может потерять 100 кг в массе, а потом восстановить их без последствий для организма. Установлено, что его организм использует воду, содержащуюся в жидкостях тканей и связок, а не крови, как это происхо-
Белки, жиры и углеводы окисляются в организме с образованием воды НгО и углекислого газа (диоксида углерода) СОг. При окислении 100 г жиров образуется 107 г воды, а при окислении 100 г углеводов — 55,5 г воды. Некоторые организмы обходятся лишь метаболической водой и не потребляют ее извне. Примером является ковровая моль. Не нуждаются в воде в природных условиях тушканчики, которые водятся в Европе и Азии, и американская кенгуровая крыса. Многие знают, что в условиях исключительно жаркого и сухого климата верблюд обладает феноменальной способностью долгое время обходиться без пищи и воды. Например, при массе 450 кг за восьмидневный переход по пустыне верблюд может потерять 100 кг в массе, а потом восстановить их без последствий для организма. Установлено, что его организм использует воду, содержащуюся в жидкостях тканей и связок, а не крови, как это происхо- Если исключен обмен теплотой между системой и окружающей средой, то система называется адиабатически изолированной.
 Система называется закрытой (замкнутой), если между ней и окружающей средой возможны все виды взаимодействия, кроме обмена веществом. Примером закрытой системы является закрытый сосуд с веществом, баллон с газом и т. п. Открытой называется система, которая может обмениваться с окружающей средой и веществом и энергией. Примером открытой системы является живой организм. [c.19]
Система называется закрытой (замкнутой), если между ней и окружающей средой возможны все виды взаимодействия, кроме обмена веществом. Примером закрытой системы является закрытый сосуд с веществом, баллон с газом и т. п. Открытой называется система, которая может обмениваться с окружающей средой и веществом и энергией. Примером открытой системы является живой организм. [c.19] ОБМЕН ВЕЩЕСТВ. Совокупность биохимических реакций, лежащих в основе жизнедеятельности организмов. Биологический обмен веществ представляет собой процессы превращения веществ внешней среды в вещества живого организма и обратные превращения веществ организма в вещества внешней среды. С другой стороны, это процессы, происходящие внутри организма, в отдельных частях, органах и тканях, и, наконец, процессы превращения веществ в клетке и в отдельных клеточных структурах. Без непрерывного взаимодействия организма с внешней средой, без обмена веществ не может быть жизни. Обмен веществ неразрывно связан с обменом энергии.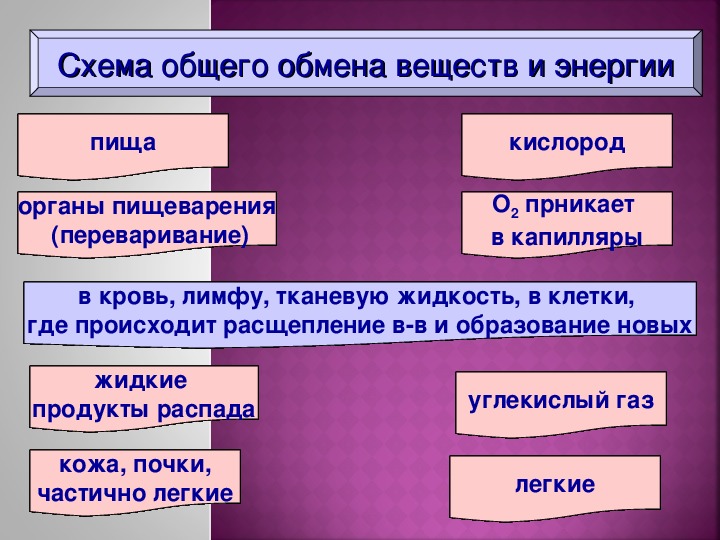 Важнейшую сторону обмена веществ составляют биохимические процессы, и выяснение химизма отдельных звеньев обмена веществ является одним из путей познания жизни. Благодаря крупным успехам биохимии к настоящему времени в основном раскрыт химизм таких кардинальных звеньев обмена веществ, как дыхание и брожение, фотосинтез, обмен азотистых соединений, жиров, углеводов и органических кислот и многие другие процессы. Выяснено также влияние многих внешних и внутренних факторов на интенсивность и направленность отдельных звеньев обмена веществ, что позволяет путем изменения внешних условий изменять обмен веществ микроорганизмов, растений и животных в желаемом для человека направлении. Процессы обмена веществ делятся на две группы — катаболизм и анаболизм. Катаболизм — это процессы, при которых происходит распад, расщепление сложных органических соединений до белее простых (например, распад белков до аминокислот, крахмала до глюкозы, сахаров до углекислоты и воды т. д.). Анаболизм — это синтетические процессы, при которых образуются более сложные соединения из более простых.
Важнейшую сторону обмена веществ составляют биохимические процессы, и выяснение химизма отдельных звеньев обмена веществ является одним из путей познания жизни. Благодаря крупным успехам биохимии к настоящему времени в основном раскрыт химизм таких кардинальных звеньев обмена веществ, как дыхание и брожение, фотосинтез, обмен азотистых соединений, жиров, углеводов и органических кислот и многие другие процессы. Выяснено также влияние многих внешних и внутренних факторов на интенсивность и направленность отдельных звеньев обмена веществ, что позволяет путем изменения внешних условий изменять обмен веществ микроорганизмов, растений и животных в желаемом для человека направлении. Процессы обмена веществ делятся на две группы — катаболизм и анаболизм. Катаболизм — это процессы, при которых происходит распад, расщепление сложных органических соединений до белее простых (например, распад белков до аминокислот, крахмала до глюкозы, сахаров до углекислоты и воды т. д.). Анаболизм — это синтетические процессы, при которых образуются более сложные соединения из более простых. При катаболизме происходит выделение энергии, а при анаболизме ее поглощение. Всякое усиление синтетических процессов в организме неизбежно сопровождается усилением процессов распада веществ. [c.204]
При катаболизме происходит выделение энергии, а при анаболизме ее поглощение. Всякое усиление синтетических процессов в организме неизбежно сопровождается усилением процессов распада веществ. [c.204]
Окислительно-восстановительные реакции самые распространенные и играют большую роль в природе и технике. Они являются основой жизни на Земле, так как с ними связаны дыхание и обмен веществ в живых организмах, гниение и брожение, фотосинтез в зеленых частях растений и нервная деятельность человека и животных. Их можно наблюдать при сгорании топлива, в процессах коррозии металлов и при электролизе. Они лежат в основе металлургических процессов и круговорота элементов в природе. С их помощью получают аммиак, щелочи, азотную, соляную и серную кислоты и многие другие ценные продукты. Благодаря окислительно-восстановительным реакциям происходит превращение химической энергии в электрическую в гальванических элементах и аккумуляторах.
 Они широко используются в мероприятиях по охране природы. [c.226]
Они широко используются в мероприятиях по охране природы. [c.226]Обмен веществ и энергии в живых организмах > [c.16]
В зависимости от объекта исследования биохимию условно подразделяют на биохимию человека и животных, биохимию растений и биохимию микроорганизмов. Несмотря на биохимическое единство всего живого, существуют и коренные различия как химического состава, так и обмена веществ в животных и растительных организмах. Обмен веществ, или метаболизм,—это совокупность всех химических реакций, протекающих в организме и направленных на сохранение и самовоспроизведение живых систем. Известно, что растения строят сложные органические вещества (углеводы, жиры, белки) из таких простых, как вода, углекислый газ и минеральные вещества, причем энергия, необходимая для этой синтетической деятельности, образуется за счет поглощения солнечных лучей в процессе фотосинтеза. Животные организмы, напротив, нуждаются в пище, состоящей не только из воды и минеральных компонентов, но содержащей сложные вещества органической природы белки, жиры, углеводы.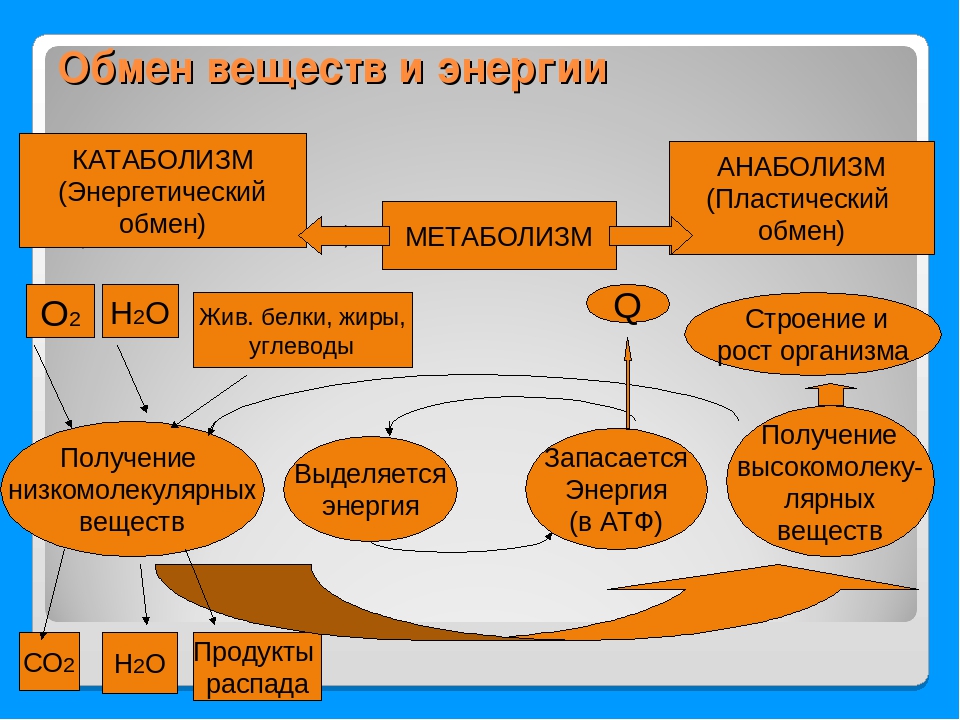 У животных проявления жизнедеятельности и синтез веществ, входящих в состав тела, обеспечиваются за счет химической энергии, освобождающейся при распаде (окислении) сложных органических соединений. [c.15]
У животных проявления жизнедеятельности и синтез веществ, входящих в состав тела, обеспечиваются за счет химической энергии, освобождающейся при распаде (окислении) сложных органических соединений. [c.15]
Различные клетки многоклеточных организмов отличаются друг от друга, однако каждая растительная клетка имеет общие черты строения и в каждой находятся общие внутриклеточные структуры, выполняющие аналогичные функции. Каждая растительная клетка состоит из цитоплазмы и ядра. Цитоплазма окружена клеточной оболочкой, а ядро — ядерной оболочкой. Цитоплазма — это очень сложная коллоидная система. Дисперсной средой ее служит вода, в которой растворены минеральные соли, сахара, аминокислоты, органические кислоты и многие другие вещества. Во взвешенном состоянии в цитоплазме находятся различные включения и большое число органелл, или структур, разного состава и размера. В последнее время с помощью дифференциального центрифугирования, электронной микроскопии, и других методов исследования удалось установить огромную роль этих структур в обмене веществ и энергии в живых организмах. [c.27]
[c.27]
Азот. В среднем растительная масса содержит около 1,5% азота от своего веса в сухом состоянии, но содержание его в отдельных частях и органах растения различно. Происходит это потому, что не все органические вещества растения содержат азот. Его, например, нет в клетчатке, которая является главной составной частью древесины и волокнистых веществ. Не содержат азота и крахмал, сахар, жир. Но без азота не может существовать и развиваться ни одно растение, так как он входит в состав белка, нуклеиновых кислот и хлорофилла. Без белка же не может возникнуть в растении ни одной живой клетки, а без хлорофилла растения не в состоянии поглощать и использовать энергию солнечных лучей. Нуклеиновые кислоты имеют важное значение в передаче наследственных признаков потомству и в обмене веществ в живом организме. [c.22]
Обязательным условием жизни является обмен веществ между живым организмом и окружающей средой. Из внешней среды в организм поступают источники энергии, строительный материал для различных синтезов, витамины, минеральные вещества, вода и кислород. Из организма вовне удаляются конечные продукты химических процессов, протекающих в организме углекислый газ, вода и аммиак (в форме мочевины). [c.20]
Из организма вовне удаляются конечные продукты химических процессов, протекающих в организме углекислый газ, вода и аммиак (в форме мочевины). [c.20]
Исключительно важна роль тиамина в обмене веществ всех живых организмов. Тиамин функционирует в живых организмах как необходимый кофермент в метаболизме белков, углеводов и жиров при выработке энергии. Он входит в состав двух групп ферментов — карбоксилаз и дегидрогеназ — цикла трикарбоновых кислот. В составе фермента транскетолазы пентозофосфатного пути участвует в переносе активных альдегидных групп, окисляя глюкозу. Образующиеся только в этих биохимических реакциях, пентозы идут на синтез ДНК [c.99]
Живой организм — система принципиально открытая. Жизнь существует благодаря метаболизму — обмену веществ с окружающей средой. Живое существо дышит и питается, выделяет ряд веществ, получает н отдает тепловую энергию. [c.
 58]
58]Что касается способа существования живой материи, то, наряду со всеобщим признанием процесса самообновления всех ее химических составных частей, установлены важные особенности обменных процессов в живых организмах. Наиболее существенной является энергетическая направленность этих процессов. Жизнь может поддерживаться лишь при постоянном потреблении энергии, освобождающейся за счет превращения веществ окружающей среды. Эта энергия необходима для поддержания высокой степени организации биологических структур. Последний процесс находится в диалектическом противоречии с более общим процессом нарастания энтропии системы. Можно сказать, что жизнь — это борьба с энтропией. [c.7]
По учению В. И. Вернадского, биосфера — это единая термодинамическая оболочка Земли, в которой сосредоточена жизнь и постоянно осуществляется взаимодействие живого с неорганическим миром, где живые организмы являются огромной геологической силой, происходят улавливание, накопление и перенос энергии путем обмена веществ между живыми организмами и окружающей их средой. Взаимодействие микроорганизмов, растений, животных обеспечивает непрерывный поток элементов в биогенном обмене вещества на планете, включая элемент жизни — кислород. [c.13]
Взаимодействие микроорганизмов, растений, животных обеспечивает непрерывный поток элементов в биогенном обмене вещества на планете, включая элемент жизни — кислород. [c.13]
Любую часть окружающего нас мира, которую мы хотим исследовать и описать с позиций термодинамики, называют системой. В качестве примера интересующих нас термодинамических систем можно назвать клетку, митохондрию, сердце, организм, биосферу. Следует, однако, отметить, что методы термодинамики приложимы только к макроскопическим системам, состоящим из большого числа ча-стиц. Система, которая не может обмениваться со средой ни энергией, ни веществом, называется изолированной если происходит обмен только энергией, то система называется замкнутой, а если и энергией и веществом — открытой. Живой организм в целом система открытая. И лишь в отдельных частях клетки могут существовать условия, характерные для замкнутой и даже изолированной системы. [c.8]
При формулировке первого закона термодинамики предполагается, что энергия может преобразовываться только в теплоту или работу. Однако принципиально энергия системы можег меняться также при изменении количества вещества при удалении вещества из системы оно уносит часть внутренней энергии этой системы, а при поступлении вещества в систему последняя получает дополнительное количество энергии. Системы, в которых возможно изменение количества вещества за счет его притока или выноса из системы, называют открытыми. Если такой процесс невозможен, систему называют замкнутой. Следует отличать еще изолированную систему, в которой невозможен обмен с внещней средой не только веществом, яо и энергией. В изолированных системах энергия всегда остается постоянной. Термодинамическое исследование открытых систем приобрело важное значение при переходе к живым организмам, которые находятся в обмене веществом с внешней средой. Эти системы также широко используются при моделировании непрерывных процессов в химической промышленности, где в химический реактор (систему реакторов) непрерывно поступают исходные вещества, а на выходе— конечные продукты.
Однако принципиально энергия системы можег меняться также при изменении количества вещества при удалении вещества из системы оно уносит часть внутренней энергии этой системы, а при поступлении вещества в систему последняя получает дополнительное количество энергии. Системы, в которых возможно изменение количества вещества за счет его притока или выноса из системы, называют открытыми. Если такой процесс невозможен, систему называют замкнутой. Следует отличать еще изолированную систему, в которой невозможен обмен с внещней средой не только веществом, яо и энергией. В изолированных системах энергия всегда остается постоянной. Термодинамическое исследование открытых систем приобрело важное значение при переходе к живым организмам, которые находятся в обмене веществом с внешней средой. Эти системы также широко используются при моделировании непрерывных процессов в химической промышленности, где в химический реактор (систему реакторов) непрерывно поступают исходные вещества, а на выходе— конечные продукты. Теория открытых процессов (систем) достаточно хорошо разработана, поскольку исторически она возникла одновременно с термодинамикой необратимых процессов, однако при дальнейшем изложении теория открытых процессов не будет рассматриваться более глубоко. [c.220]
Теория открытых процессов (систем) достаточно хорошо разработана, поскольку исторически она возникла одновременно с термодинамикой необратимых процессов, однако при дальнейшем изложении теория открытых процессов не будет рассматриваться более глубоко. [c.220]
Обмен веществ включает как синтез, так и распад многих химических соединений в клетках. У животных расщепление компонентов пищи до более простых веществ обеспечивает организм не только энергией, но и химическими соединениями, которые используются затем при синтезе молекул, необходимых для роста. Подобным же образом каждая отдельная клетка любого живого организма синтезирует или поглощает из окружающей среды низкомолекулярные вещества и из них, как из кирпичиков, строит крупные молекулы. В то же время в клетках имеются ферменты, расщепляющие любые синтезированные организмом соединения. В итоге устанавливается стационарное состояние, при котором сложные соединения непрерывно синтезируются в ходе одних процессов и распадаются в ходе других. На этом основана замечательная система самообновления наших тканей. [c.11]
На этом основана замечательная система самообновления наших тканей. [c.11]
Обмен белков занимает особое место в многообразных превращениях веществ, характерных для всех живых организмов. Выполняя ряд уникальных функций, свойственных живой материи, белки определяют не только микро- и макроструктуру отдельных субклеточных образований, специфику организации клеток, органов и целостного организма (пластическая функция), но и в значительной степени динамическое состояние между организмом и окружающей его средой. Белковый обмен строго специфичен, направлен и настроен, обеспечивая непрерывность воспроизводства и обновления белков организма. В течение всей жизнедеятельности в организме постоянно и с высокой скоростью совершаются два противоположных процесса распад, расщепление органических макромолекул и надмолекулярных структур и синтез этих соединений. Эти процессы обеспечивают катаболические реакции и создание сложной структурной организации живого из хаоса веществ окружающей среды, причем ведущую роль в последнем случае играют именно белки. Все остальные виды обмена подчинены этой глобальной задаче живого—самовоспроизведению себе подобных путем программированного синтеза специфических белков. Для осуществления этого используются энергия обмена углеводов и липидов, строительный материал в виде углеродных остатков аминокислот, промежуточных продуктов метаболизма углеводов и др. [c.409]
Все остальные виды обмена подчинены этой глобальной задаче живого—самовоспроизведению себе подобных путем программированного синтеза специфических белков. Для осуществления этого используются энергия обмена углеводов и липидов, строительный материал в виде углеродных остатков аминокислот, промежуточных продуктов метаболизма углеводов и др. [c.409]
Между живым организмом и окружающей его средой происходит постоянный обмен веществ. Закон сохранения вещества и энергии, открытый М. В. Ломоносовым, позволил установить неразрывную связь между обменом веществ и обменом энергии. [c.116]
Обмен веществ ъ растениях неразрывно связан с обменом энергии. Изучением процессов обмена энергии в живых организмах занимается раздел биохимии, который называют биоэнергетикой. [c.15]
В основе процессов жизнедеятельности лежат различные сложные, сопряженные между собой, химические реакции, характеризующиеся строгой закономерностью сочетания и чередования. Эти реакции базируются на законах физики и химии, однако проявление их действия в живом организме имеет характерные отличия. С точки Зрения термодинамики живые организмы представляют с( й открытые системы, которые постоянно обмениваются с внеишей средой как веществом, так и энергией. В закрытых системах обмен ограничен энергией, а обмен веществом отсутсгаует. В изолированных системах обмен со внешней средой ни вэдеством, ни энергией ие происходит. Такие типы систем названы замкнутыми. [c.207]
Эти реакции базируются на законах физики и химии, однако проявление их действия в живом организме имеет характерные отличия. С точки Зрения термодинамики живые организмы представляют с( й открытые системы, которые постоянно обмениваются с внеишей средой как веществом, так и энергией. В закрытых системах обмен ограничен энергией, а обмен веществом отсутсгаует. В изолированных системах обмен со внешней средой ни вэдеством, ни энергией ие происходит. Такие типы систем названы замкнутыми. [c.207]
По-видимому, ключом к объяснению возникновения жизни на Земле является понимание явления, известного под названием естественный отбор . Естественный отбор должен был лежать в основе перехода к метаболизму от набора случайных химических реакций. Метаболизм (обмен веществ) присущ только жИвым организмам, он представляет собой ряд молекулярных превращений, в результате которых организм получает энергию для жизни, роста и воспроизводства. [c.30]
БИОХИМИЯ (биологическая химия).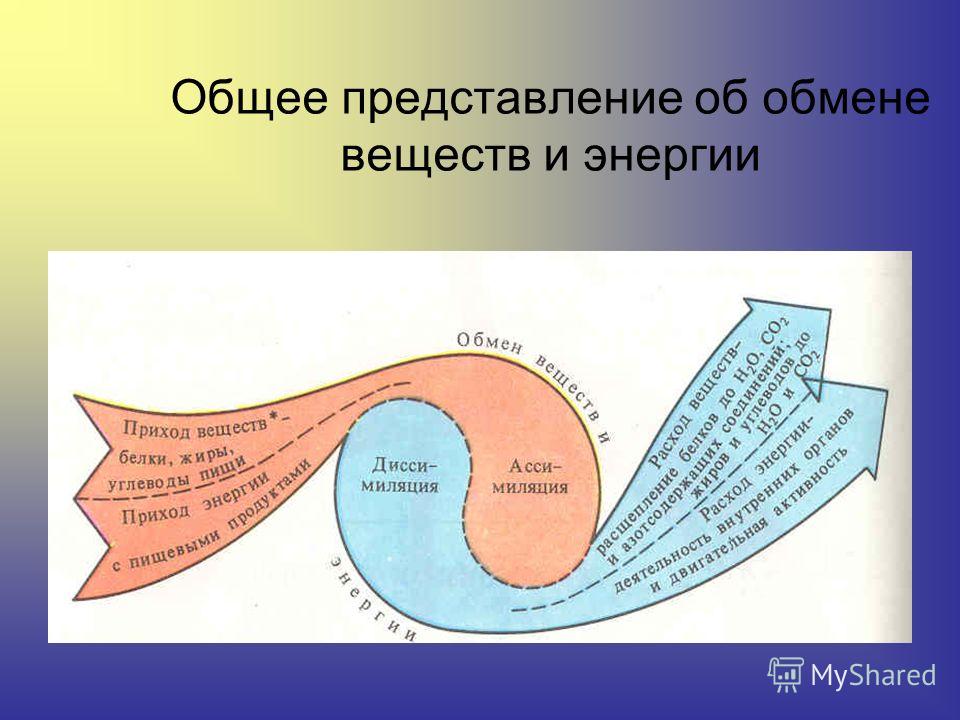 Наука о химическом составе живых организмов (статическая Б.) и химических превращениях веществ и энергии, которые лежат в основе жизнедеятельности организмов, об обмене веществ в них (динамическая В.). Но объектам исследования Б. разделяют обычно па Б. растений, Б. животных и Б. микроорганизмов. [c.45]
Наука о химическом составе живых организмов (статическая Б.) и химических превращениях веществ и энергии, которые лежат в основе жизнедеятельности организмов, об обмене веществ в них (динамическая В.). Но объектам исследования Б. разделяют обычно па Б. растений, Б. животных и Б. микроорганизмов. [c.45]
Однако объяснять причину старения живого организма только старением его коллоидов нельзя. Как известно, в организме происходит непрерывный обмен веществ, процесс ассимиляции и диссимиляции, разрушение органической субстанции и образование ее. И хотя протоплазма всех организмов находится в коллоидном состоянии, причины старения их кроются не в физико-химических, а более сложных, биологических процессах. В самом деле, в любом растворе того или иного коллоида не наблюдается специфического, присущего именно живым организмам обмена веществ и энергии, явлений ассимиляции и диссимиляции. Если у коллоидов протоплазмы в процессе ее жизнедеятельности и наблюдается постепенное понижение водосвязывающей способности, уменьшение стойкости и изменение других свойств, сходных с изменениями коллоидных растворов, то они происходят в результате направленного изменения химического состава коллоидов организма, определяемых процессами обмена веществ.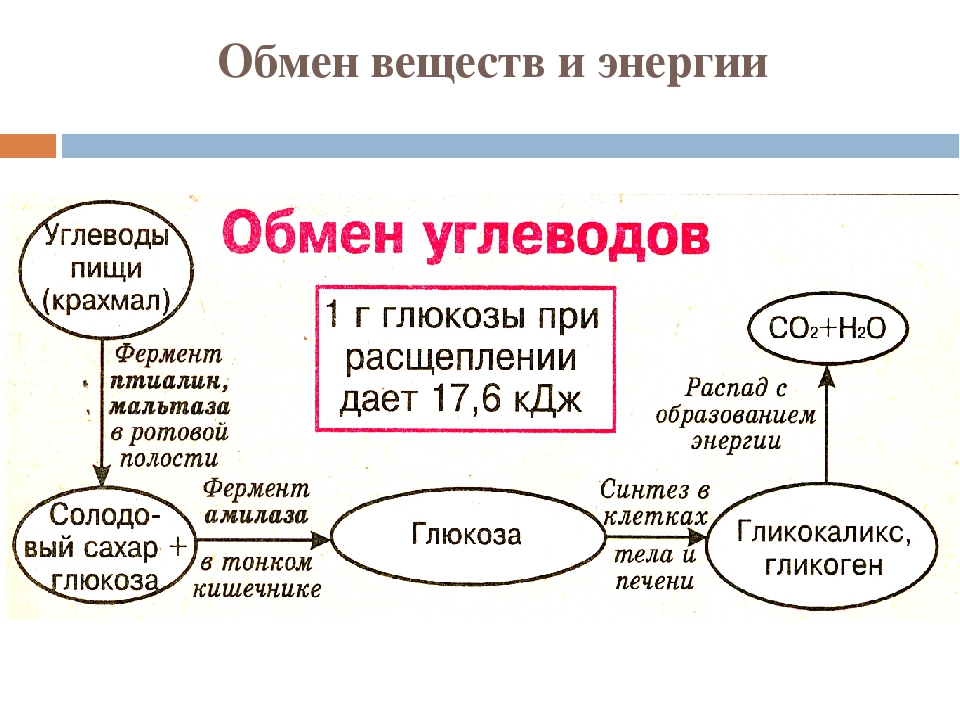 [c.489]
[c.489]
Изменения температуры приводят к биохимическим эффектам всего лишь двух основных типов. Во-первых, изменение средней кинетической энергии атомов и молекул в живом организме будет сказываться на скорости химических реакций, составляющих в совокупности обмен веществ. Несколько позже мы рассмотрим физическую основу этой довольно значительной зависимости скорости реакций от температуры. [c.206]
Однако объяснять причину старения лсивого организма только старением его коллоидов нельзя. Как известно, в организме происходит непрерывный обмен веществ, процесс ассимиляции и диссимиляции, разрушение органической субстанции и образование ее, И хотя протоплазма всех организмов на.ходится в коллоидном состоянии, причины старения их кроются не в физико-химических, а более сложных, биологических, процессах. В самом деле, в любом растворе того или иного коллоида не наблюдается специфического, присущего именно живым организмам обмена веществ и энергии, явлений ассимиляции и диссимиляции. Если у коллоидов прото- [c.398]
Если у коллоидов прото- [c.398]
На этой схеме основные питательные вещества для высокоорганизованных живых организмов представлены углеводами, липидами и белками они превращаются через многие другие более простые соединения в углекислый газ, воду и соединения азота. Эти превращения осуществляются посредством реакций, катализируемых ферментами. Основная роль ферментов — катализ реакций обмена, за счет которых осуществляется сохранение, рост и репродукция живых организмов. Обмен (метаболизм) включает два точно сбалансированных процесса, а именно анаболизм, или использование энергии и материалов для химических синтезов, и катаболизм, или расщепление субстратов с освобождением энергии. Каждая ступень в сложной [c.112]
В связи с указанным, многие радиоактивные изотопы нашли широкое применение в качестве радиоактивных индикаторов, или меченых атомов. С использованием последних изучаются вопросы биологии (в частности, обмен веществ в живых организмах).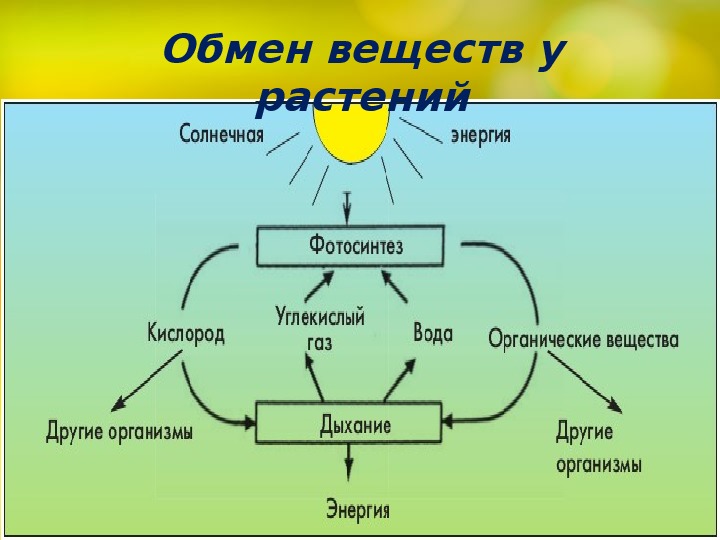 Метод нашел разностороннее использование в сельском хозяйстве. Например, изотопные индикаторы позволяют наблюдать за ростом корней растений непосредственно в почве, успешно изучаются усвояемость удобрений растениями, кормов — животными и т. д. (о меченом атоме С-14 см. гл. 23, 5). Изотопные индикаторы играют важную роль в исследованиях трения, износа деталей машин, системы рациональной смазки действующих механизмов. Они позволяют дистанционно (на расстоянии) контролировать влажность зерна в потоке, плотность и толщину проката и вообще листового материала самого разнообразного характера. Для этих целей широко используется изотоп Ат (америций, моноэнер-гетический у-излучатель). В космонавтике эффективны автономные генераторы тепловой энергии, построенные на основе изотопов Ри-238, Ст-232 и Ст-244. Эти изотопы находят также применение в медицине. Радиация используется в поисках полезных ископаемых (у-каротаж). В последнее время для аналогичных целей начинают широко применять нейтроны. В качестве источника таковых для обнаружения и оценки газовых и нефтяных месторождений заслужил внимание изотоп калифорния СГ.
Метод нашел разностороннее использование в сельском хозяйстве. Например, изотопные индикаторы позволяют наблюдать за ростом корней растений непосредственно в почве, успешно изучаются усвояемость удобрений растениями, кормов — животными и т. д. (о меченом атоме С-14 см. гл. 23, 5). Изотопные индикаторы играют важную роль в исследованиях трения, износа деталей машин, системы рациональной смазки действующих механизмов. Они позволяют дистанционно (на расстоянии) контролировать влажность зерна в потоке, плотность и толщину проката и вообще листового материала самого разнообразного характера. Для этих целей широко используется изотоп Ат (америций, моноэнер-гетический у-излучатель). В космонавтике эффективны автономные генераторы тепловой энергии, построенные на основе изотопов Ри-238, Ст-232 и Ст-244. Эти изотопы находят также применение в медицине. Радиация используется в поисках полезных ископаемых (у-каротаж). В последнее время для аналогичных целей начинают широко применять нейтроны. В качестве источника таковых для обнаружения и оценки газовых и нефтяных месторождений заслужил внимание изотоп калифорния СГ. Область практического применения радиоактивных индикаторов непрерывно расширяется. [c.23]
Область практического применения радиоактивных индикаторов непрерывно расширяется. [c.23]
Обмен веществ, или метаболизм,—это закономерный порядок превращения веществ и энергии в живых системах. Обмен веществ, происходящий в организме, и организма с ок-ружаюн ей внешней средой—совокупность всех химических реакций, направленных на самоорганизацию и самовоспроизведение это важнейшее свойство жизни и непременный ее приз-как. [c.353]
Процессы, протекающие в биологических объектах, принадлежат к так называемым открытым системам, в которых происходит постоянный обмен веществ и энергии с внешней средой. Обмен веществ в открытых системах обеспечивает непрерывное поступление и удаление различных метаболитов. В результате этого в живом организме многие реакции не достигают стадии динамического равновесия, как это происходит в замкнутых системах, например in vitro , а протекают непрерывно, находясь в состоянии стабильного превалирования прямых реакций. [c.115]
[c.115]
Экосистема — единый природный комплекс, образованный живыми организмами и средой их обитания, в котором живые и косные компоненты связаны обменом веществ и энергии. Экосистема является саморазвивающейся термодинамически открытой системой. В отечественной литературе используется эквивалентное понятие «биогеоценоз». [c.295]
АДЕНОЗИНТРИФОСФОРНАЯ КИСЛОТА (АТФ). Основное соединение, в котором запасается и переносится энергия, необходимая для осуществления синтетических процессов в обмене веществ, а также для выполнения работы нивыми организмами. В состав АТФ входят остатки аденина, углевода рибозы и три остатка фосфорной кислоты. Энергия, высвобождаемая АТФ, может переноситься почти без потерь на другие соединения или использоваться для синтеза белков, нуклеиновых кислот, углеводов, жиров, витаминов и многих других соединений. Энергия АТФ потребляется также при мышечном сокращении, в нервных клетках и при других видах работы в живых организмах.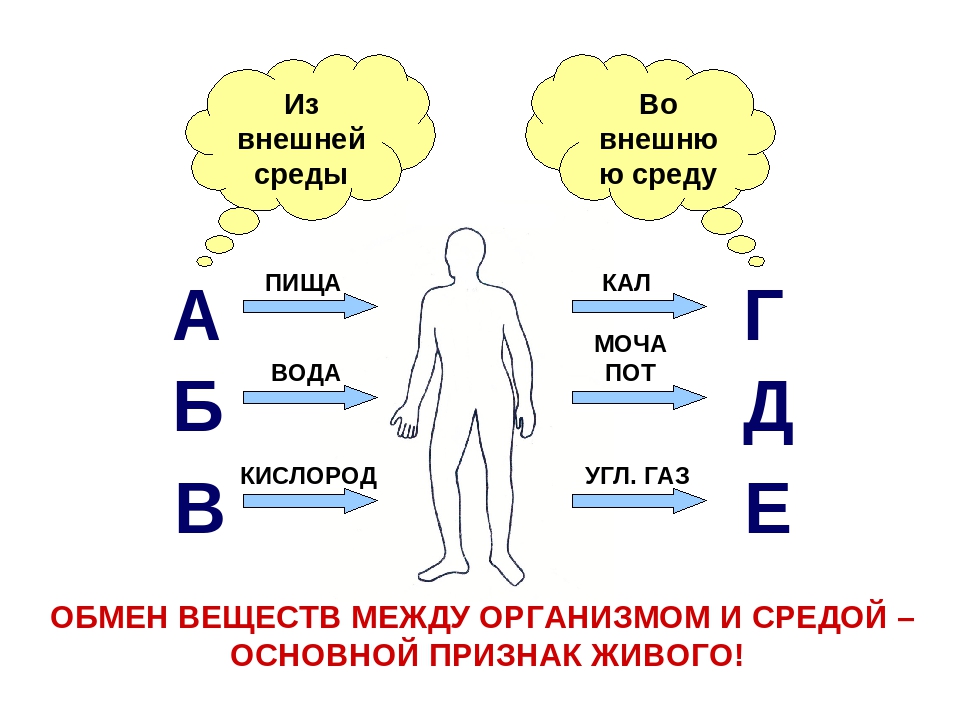 АТФ в организме образуется из адепозиндифосфорной кислоты (АДФ) и минеральной фосфорной кислоты за счет энергпп, которая выделяется при окислении различных органических веществ в живых клетках или при фотосинтезе за счет световой энергии. Во всех этих процессах энергия, как правило, не теряется, а переходит в особый вид химической энергии, заключенной в фосфатных связях АТФ. При окислении в процессе дыхания грамм-молекулы глюкозы, например, может образоваться до 30 молекул АТФ. [c.14]
АТФ в организме образуется из адепозиндифосфорной кислоты (АДФ) и минеральной фосфорной кислоты за счет энергпп, которая выделяется при окислении различных органических веществ в живых клетках или при фотосинтезе за счет световой энергии. Во всех этих процессах энергия, как правило, не теряется, а переходит в особый вид химической энергии, заключенной в фосфатных связях АТФ. При окислении в процессе дыхания грамм-молекулы глюкозы, например, может образоваться до 30 молекул АТФ. [c.14]
Одна из особенностей живых организмов состоит в том, что все они представляют собой открытые системы, которые способны извлекать, преобразовывать и использовать энергию окружающей среды либо в форме органических питательных веществ (хемотрофы), либо в форме энергии солнечного излучения (фототрофы). Обмен энергией в организме тесно связан с обменом веществ (метаболизмом). Метаболизм можно определить как совокупность ферментативных химических реакций, которые могут протекать в клетке.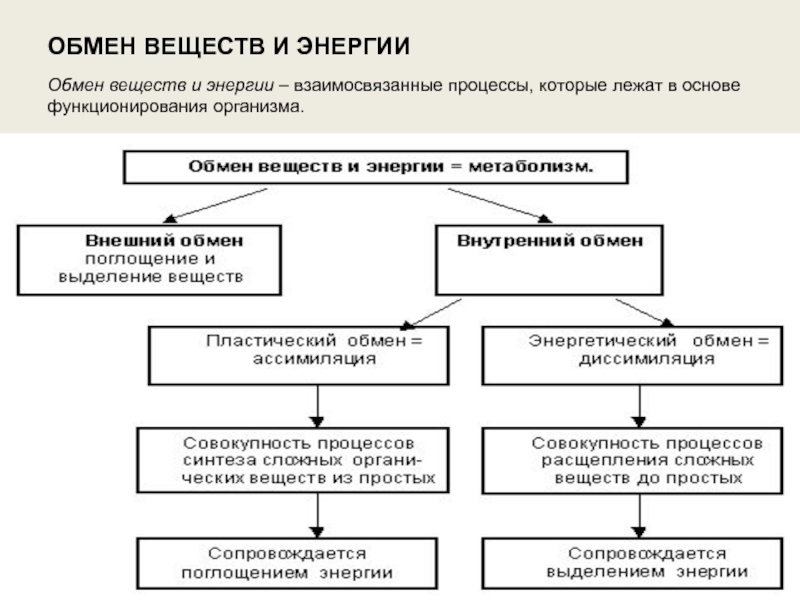 Активность ферментов, катализирующих эти реакции, регулируется с помощью чувствительной системы взаимосвязанных механизмов, поэтому метаболизм представляет собой высококоординированную, целенаправленную клеточную активность. Он выполняет следующие функции [c.189]
Активность ферментов, катализирующих эти реакции, регулируется с помощью чувствительной системы взаимосвязанных механизмов, поэтому метаболизм представляет собой высококоординированную, целенаправленную клеточную активность. Он выполняет следующие функции [c.189]
Установление химического состава растений, открытие ферментов и выяснение их роли в обмене веществ, открытие витаминов и гормонов, развитие химии аминокислот и белков, жиров и углеводов создали возможность формирования динамической биохимии, с развитием которой стали создаваться единые представления об общих закономерностях процессов обмена зе> щестз и превращений энергии в живых организмах. [c.6]
Конструктивный и энергетический обмен. Физиология изучает процессы, протекающие в живом организме, и их закономерности. Современная материалистическая физиология основана на принципе единства организма с окружающей средой. Взаимодействие организма со средой проявляется в обмене веществ и энергии (метаболизм). Он включает в себя два процесса конструктивный обмен (ассимиляция, или анаболизм) и энергетический (диссимиляция, или катаболизм). В основе конструктивного обмена лежат биохимические реакции, в процессе которых усваиваются вещества, поступающие из окружающей среды, и идет создание биомассы клетки. Сущность энергетического обмена заключается в разрушении веществ, содержащихся в организме, преимущественно в результате гидролитических и окислительных процессов, сопровождающихся выделением энергии, необходимой для биосинтеза. Оба процесса в клетке идут одновременно и сочетаются друг с другом. Энергия, полученная клеткой в процессе обмена веществ, акку.мулируется в соединениях, содержащих химические связи, при разрыве которых выделяется большое количество энергии (макроэргические). Часто это соединения с фосфатными связями, например аденозинтрифос-фат (АТФ). По мере надобности эти вещества подвергаются гидролитическому распаду, сопровождающемуся выделением энергии. [c.210]
Он включает в себя два процесса конструктивный обмен (ассимиляция, или анаболизм) и энергетический (диссимиляция, или катаболизм). В основе конструктивного обмена лежат биохимические реакции, в процессе которых усваиваются вещества, поступающие из окружающей среды, и идет создание биомассы клетки. Сущность энергетического обмена заключается в разрушении веществ, содержащихся в организме, преимущественно в результате гидролитических и окислительных процессов, сопровождающихся выделением энергии, необходимой для биосинтеза. Оба процесса в клетке идут одновременно и сочетаются друг с другом. Энергия, полученная клеткой в процессе обмена веществ, акку.мулируется в соединениях, содержащих химические связи, при разрыве которых выделяется большое количество энергии (макроэргические). Часто это соединения с фосфатными связями, например аденозинтрифос-фат (АТФ). По мере надобности эти вещества подвергаются гидролитическому распаду, сопровождающемуся выделением энергии. [c.210]
Совокупность химических реакций, протекающих в живом организме, называется обменом веществ, или метаболизмом (от греческого слова т 1аЪо1е — изменение). Это реакции самых различных типов. Рассмотрим, например, что происходит с пищей, потребляемой человеком. Пища может содержать сложные углеводы, в частности крахмал которые расщепляются в процессе пищеварения на простые сахара и затем через стенки желудочно-кишечного тракта попадают в ток крови. Далее эти простые сахара в печени превращаются в гликоген (животный крахмал), имеющий ту же формулу, что и обычный растительный крахмал (СдНюОб) , где X — большое число. Гликоген и другие полисахариды — важные источники энергии в организмах животных. При окислении кислородом они образуют двуокись углерода и воду одна часть освобождаемой при этом энергии идет на производство работы, а другая — на согревание тела живого организма. [c.690]
Это реакции самых различных типов. Рассмотрим, например, что происходит с пищей, потребляемой человеком. Пища может содержать сложные углеводы, в частности крахмал которые расщепляются в процессе пищеварения на простые сахара и затем через стенки желудочно-кишечного тракта попадают в ток крови. Далее эти простые сахара в печени превращаются в гликоген (животный крахмал), имеющий ту же формулу, что и обычный растительный крахмал (СдНюОб) , где X — большое число. Гликоген и другие полисахариды — важные источники энергии в организмах животных. При окислении кислородом они образуют двуокись углерода и воду одна часть освобождаемой при этом энергии идет на производство работы, а другая — на согревание тела живого организма. [c.690]
Итак, любой живой организм является таким телом, в основе существования которого лежит специфический обмен веществ. Этот обмен веществ является наиболее общим, определяющИхМ фактором для всех других элементарных свойств живого организма — питания, роста, размножения, раздражимости, движения и проч. Любой организм, чтобы осуществлять всю совокупность жизненных проявлений, вынужден непрерывно расходовать определенное количество энергии. Эта энергия освобождается в результате распада органических веществ, входящих в состав протоплазмы. Следовательно, организмы непрерывно разрушают свою собственную протоплазму. Эти процессы распада органических веществ, входящих в состав протоплазмы, называются процессами диссимиляции. [c.9]
Любой организм, чтобы осуществлять всю совокупность жизненных проявлений, вынужден непрерывно расходовать определенное количество энергии. Эта энергия освобождается в результате распада органических веществ, входящих в состав протоплазмы. Следовательно, организмы непрерывно разрушают свою собственную протоплазму. Эти процессы распада органических веществ, входящих в состав протоплазмы, называются процессами диссимиляции. [c.9]
Читать «Обмен веществ и энергии в клетках организма» — Петросова Рената Арменаковна — Страница 1
Рената Арменаковна Петросова
Обмен веществ и энергии
в клетках организма
Предисловие
Предлагаемое пособие представляет собой достаточно подробное и полное изложение одной из наиболее сложных тем курса общей биологии — обмена веществ на клеточном уровне. Пособие написано в соответствии с программой углубленного курса общей биологии и программой для поступающих в вузы. Оно адресовано учащимся 10–11 классов, изучающим общую биологию, абитуриентам, поступающим на факультеты биологического и медицинского профиля, а также школьным учителям биологии.
Книга будет полезна тем учащимся, которые хотели бы разобраться в биохимических процессах, протекающих в клетке. Она не подменяет учебник, а дополняет его и систематизирует имеющиеся знания. С его помощью вы разберетесь в том, что осталось неясным после изучения темы по учебнику или объяснения учителя. В нем полно и в доступной форме описаны и объяснены сложные процессы обмена веществ, протекающие на клеточном уровне у автотрофных и гетеротрофных организмов. Это фотосинтез, энергетический обмен, реакции матричного синтеза (репликация ДНК, биосинтез РНК и белка). Понимание именно этих вопросов вызывает наибольшие трудности у старшеклассников. Поэтому параллельно с описанием каждого процесса предлагаются схемы и рисунки, которые значительно облегчают процесс усвоения сложного материала.
После каждой темы даны вопросы для самопроверки и задания различного уровня сложности. Любой ученик, ознакомившись с приведенным в пособии теоретическим материалом и ответив на предлагаемые вопросы, может считать, что он вполне освоил данную тему.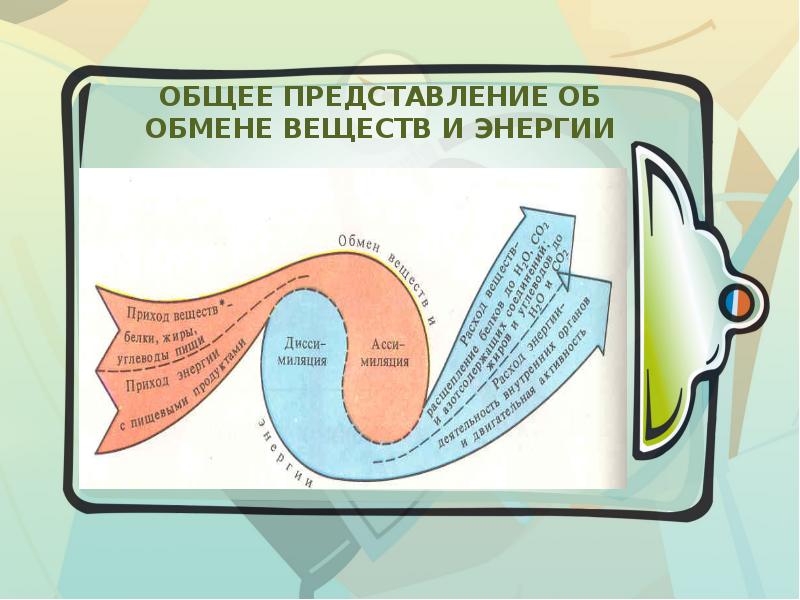
Пособие понадобится тем учащимся, которые хотели бы хорошо подготовиться к выпускным и вступительным экзаменам по биологии, единому государственному экзамену. Старшеклассники и абитуриенты смогут воспользоваться этим пособием для повышения уровня подготовки и систематизации учебного материала. Предлагаемые схемы легко запоминаются и позволяют уточнить и систематизировать сложный материал. Работа с пособием поможет приобрести прочные знания по наиболее сложным вопросам курса общей биологии.
Пособие интересно и учителям биологии, работающим в общеобразовательной и профильной биологической школе. Оно поможет восстановить в памяти сложные процессы обмена веществ, подготовиться к урокам. Приведенные в пособии вопросы и задания могут использоваться для контроля знаний учащихся.
Желаем всем успешной работы с предлагаемым учебным пособием и надеемся, что книга окажет помощь в овладении биологическими знаниями.
1. Обмен веществ и превращение энергии как основное свойство живого
Понятие об обмене веществ и превращении энергии
Одним из характерных признаков живого является обмен веществ и превращение энергии. Обмен веществ, или метаболизм (от греч. metabol — превращение), — это совокупность всех реакций синтеза и распада, протекающих в живых системах, связанная с выделением или поглощением энергии. Для существования организмов необходимы питательные вещества и энергия, которые они получают из внешней среды. В процессе питания и дыхания в организм поступают определенные вещества, которые в результате жизнедеятельности преобразуются, частично накапливаются, а частично выделяются в окружающую среду. Энергия и питательные вещества необходимы для осуществления всех процессов жизнедеятельности организма: роста, развития, движения, размножения и т. д. Основой этих процессов является обмен веществ и превращение энергии.
Живая система, которой является любой организм, находится в сложных взаимоотношениях с окружающей средой. Из окружающей среды он получает пищу, воду, кислород, свет, тепло. Из поступающих веществ и энергии организмы строят свое тело, образуя массу живого вещества планеты. В результате своей жизнедеятельности организмы сами воздействуют на окружающую среду и изменяют ее. Основой взаимосвязи живых систем и среды является обмен веществ и превращение энергии.
Для неживой природы также характерен обмен веществ. Например, при разрушении и выветривании горной породы происходит обмен веществ. Под действием воды, углекислого газа и других веществ крупные сложные породы разрушаются и превращаются в песок и глину. Химические вещества окисляются, например железо ржавеет. При их горении образуются газообразные продукты и вода, которые выделяются в атмосферу.
Основное отличие между обменом веществ в неживой и живой природе заключается в том, что обмен веществ в неживой природе приводит к уничтожению, разрушению вещества, породы. Живые же организмы, благодаря метаболизму, создают новые вещества, живут и воспроизводят себе подобных.
Обмен веществ и энергии состоит из двух взаимосвязанных и противоположных процессов — ассимиляции и диссимиляции. Ассимиляция, анаболизм, или пластический обмен, — это совокупность реакций синтеза высокомолекулярных органических веществ, сопровождающихся поглощением энергии за счет распада молекул АТФ. Диссимиляция, катаболизм, или энергетический обмен, — это совокупность реакций распада и окисления органических веществ, сопровождающихся выделением энергии и запасанием ее в синтезируемых молекулах АТФ. Эти процессы характерны для живых систем почти всех уровней организации, начиная от клетки и заканчивая биосферой (рис. 1).
Рис. 1. Общая схема обмена веществ и превращения энергии
Ассимиляция и диссимиляция — противоположные и взаимосвязанные процессы, составляющие единство обмена веществ. В живой природе это замкнутый процесс, так как химические элементы, из которых синтезируются органические вещества, переходят от одного организма к другому или выделяются в окружающую среду и вновь поступают в организмы. Происходит круговорот веществ и химических элементов.
Значение АТФ в обмене веществ
В отличие от круговорота веществ, круговорота энергии в живых системах не происходит. Организмам для жизнедеятельности постоянно необходима энергия. Единственным ее источником на Земле является солнце. Солнечная энергия аккумулируется растениями в процессе фотосинтеза, в результате чего она превращается в энергию химических связей молекул органических веществ.
Все остальные организмы используют готовые органические вещества. В процессе жизнедеятельности они расщепляют эти вещества, и энергия высвобождается. Она частично преобразуется, накапливается и в дальнейшем используется вновь в процессе пластического обмена на синтез органических веществ, специфичных для каждого организма. При этом клетка или организм постоянно теряет часть энергии, которая выделяется в виде тепла. Поэтому для существования жизни на Земле необходим постоянный приток энергии.
Одним из ключевых веществ, которое способно преобразовывать энергию солнечного света в энергию химических связей органических веществ, а далее вновь накапливать и передавать для синтеза новых веществ, является АТФ (рис. 2). В двух макроэргических связях ее молекул накапливается в 2,5 раза больше энергии, чем в обычных связях. Клетка использует эту запасенную энергию на различные процессы: биосинтез собственных органических веществ, движение, деление, передачу нервных импульсов и т. д. АТФ — основное вещество, которое обеспечивает функционирование клетки, запасает энергию в процессе энергетического обмена и выделяет в процессе пластического обмена. Ее синтез происходит на кристах митохондрий. Молекулы этого вещества легко и быстро способны доставлять энергию в любую часть клетки. АТФ является ключевым веществом обменных процессов и универсальным источником энергии в клетках, тканях и организмах.
Обмен веществ
Обмен веществ и энергии — основное свойство живого. В цитоплазме клеток органов и тканей постоянно идет процесс синтеза сложных высокомолекулярных соединений и одновременно с этим — их распад с выделением энергии и образованием простых низкомолекулярных веществ — диоксида углерода, воды, аммиака и др. Процесс синтеза органических веществ называется ассимиляцией или пластическим обменом. В ходе ассимиляции обновляются органоиды клетки и накапливается запас энергии. Распад структурных элементов клетки сопровождается выделением заключенной в химических связях энергии, а конечные продукты распада, вредные для организма, выводятся за пределы клетки и затем из организма.
Процесс распада органических веществ противоположен процессу ассимиляции и называется диссимиляцией. Подобного типа реакции идут с поглощением кислорода, поэтому расщепление органических веществ связано с окислением, а освобождающаяся при этом энергия идет на синтез АТФ, необходимой для ассимиляции.
Таким образом, ассимиляция и диссимиляция — это две противоположные, но взаимно связанные стороны единого процесса — обмена веществ. При нарушении ассимиляции и диссимиляции расстраивается весь обмен веществ. Непрерывный распад и окисление органических соединений возможны лишь тогда, когда количество
этих веществ в клетках постоянно пополняется. Поэтому при разработке пищевых норм учитываются калорийность пищевых продуктов: белков, жиров, углеводов с тем расчетом, чтобы расход энергии не превышал потребления.
Наряду с обменом органических веществ в организме человека осуществляется водный и солевой обмен. Эти вещества не являются источниками энергии и питательными веществами, но их значение для организма очень велико. Вода входит в состав клеток, межклеточной и тканевой жидкости, плазмы и лимфы. Общее ее количество в организме человека составляет 70%. В клетках вода химически связана с белками, углеводами и другими соединениями. Она растворяет органические и неорганические соединения. Всасывание питательных веществ в кишечнике, их поглощение клетками из тканевой жидкости и выведение из клеток конечных продуктов обмена может осуществляться только в растворенном состоянии и при участии воды. Вода — непосредственный участник всех реакций гидролиза.
Суточная потребность в воде взрослого человека 2,5-3 л. Эта потребность зависит от условий и температуры среды. Поступает вода в организм при питье и в составе пищи. В тонком и толстом отделах кишечника вода всасывается в кровь, откуда она поступает в ткани, а из них вместе с продуктами распада проникает в кровь и лимфу. Из организма вода выводится в основном через почки, а также кожу, легкие (в виде пара) и с калом. Обмен воды в организме тесна связан с обменом солей.
Минеральные вещества поступают в организм человека с пищей, откладываются в виде солей и входят в состав различных органических соединений. Так, железо включено в молекулу гемоглобина и участвует в транспортировке кислорода и диоксида углерода, йод — в состав гормона щитовидной железы, сера и цинк содержатся в гормонах поджелудочной железы. Для кроветворения необходимы железо, кобальт, медь; соли кальция и фосфора входят в состав костей; калий и натрий создают определенную концентрацию ионов в клеточной мембране и по обе стороны от нее и т. д. Общее количество минеральных веществ в теле человека составляет около 4,5%. Все эти элементы поступают в организм с пищей и водой. Железа много в яблоках, иода — в морской капусте, кальция — в молоке, сыре, брынзе, в яйцах и т. д. Человек нуждается в постоянном поступлении натрия и хлора. Натрий создает определенную концентрацию ионов в плазме, тканевой жидкости, хлор (составная часть соляной кислоты) — компонент желудочного сока. Эти важнейшие элементы организм получает с поваренной солью.
Обмен белков. Белковые пищевые продукты — творог, нежирное мясо, рыба, яйцо и другие, попав в пищеварительный тракт, подвергаются механической и химической обработке. В желудке белок расщепляется до пептидов, а в двенадцатиперстной кишке — до аминокислот. В тонком кишечнике аминокислоты всасываются в кровь и разносятся ко всем органам и тканям. В клетке из аминокислот синтезируются специфические для данной ткани белки. Так, в клетках мышц идет синтез белка миозина, в молочной железе’- казеина и т. д. Часть белков, входящих в состав клеток органов и тканей, а также аминокислоты, поступившие в организм, но не использованные в синтезе белка, подвергаются распаду с освобождением 17,6 кДж энергии на 1 г вещества и образованием продуктов распада белка: воды, диоксида углерода, аммиака, мочевины и др. Все продукты диссимиляции белка выделяются из организма в составе мочи, пота и частично с выдыхаемым воздухом. В запас белки не откладываются. У взрослого человека их синтезируется столько, сколько необходимо для компенсации распавшихся белков. При избытке белковой пищи она преобразуется в жиры и гликоген. Потребность белков в сутки составляет 100-118 г. В детском организме синтез белков превышает их распад, что учитывается при составлении рационов питания.
Обмен углеводов. Углеводы, входящие в состав продуктов растительного происхождения, в организме человека расщепляются до глюкозы, которая поступает в кровь и разносится по всему телу. Содержание глюкозы в крови относительно постоянно и не превышает 0,08-0,12%. Если глюкоза поступает в кровь в большем количестве, то этот избыток в печени превращается в животный крахмал — гликоген, который накапливается, а затем при необходимости снова распадается до глюкозы. При расщеплении 1 г углеводов освобождается 17,6 кДж энергии. Ее потребление увеличивается с возрастанием нагрузки при физической работе. Часть энергии используется для механической работы и служит источником тепла, другая часть идет на синтез молекул АТФ. При избытке углеводов в организме они превращаются в жиры. Суточная потребность углеводов составляет 450-500 г. —
Обмен жиров. Жиры входят в состав растительной и животной пищи. Часть синтезированного в организме жира откладывается в запас, другая часть поступает в клетку, где вместе с жироподобными веществами (липоидами) служит пластическим материалом, из которого строятся мембраны клеток и органоидов. Жиры- важный источник энергии. При их окислении выделяются диоксид углерода, вода и освобождается энергия. Расщепление 1 г жиров сопровождается выделением 38,9 кДж энергии. Жиры могут синтезироваться в организме человека из углеводов и белков. Суточная потребность в них для взрослого человека 100 г.
Обмен жиров, белков и углеводов взаимосвязан. Отклонение от нормы обмена одного из этих веществ влечет за собой нарушение обмена других веществ. Например, при расстройстве обмена углеводов продукты их неполного распада нарушают обмен белков и жиров, расщепление которых тоже идет не до конца, с образованием ядовитых веществ, отравляющих организм.
Витамины (от лат. «вита» — жизнь) — органические соединения разнообразной химической природы, необходимые для нормального роста и развития организма. Они способствуют нормальному протеканию всех жизненных процессов в организме. Значение витаминов было доказано работами русского врача Н. И. Лунина в опытах над животными. Заболевания, развивающиеся при недостатке витаминов в организме, называются авитаминозами. Здоровому взрослому человеку требуется в сутки всего несколько миллиграммов различных витаминов. Экспериментально было доказано, что витамины входят в состав ферментов, которые, являясь биологическими катализаторами, ускоряют обмен веществ. При недостатке витаминов ферменты оказываются неполноценными, что приводит к нарушению обмена веществ. Витамины образуются в растительных организмах, но имеются и в продуктах животного происхождения. Обозначаются они заглавными буквами латинского алфавита: А, В, С, D, Е, К, РР, Н. Некоторые буквы, например В, охватывают целые группы: от B1 до B15. Одни из них растворимы в жирах (А, D, Е), другие — в воде (В, С).
Важнейший из витаминов — витамин А. Его называют витамином роста, он участвует в окислительно-восстановительных реакциях обмена. При нехватке в организме витамина А наблюдается сухость кожи, сухость роговицы глаза и ее помутнение. С недостатком витамина А связано нарушение сумеречного зрения («куриная слепота»). Наиболее богаты витамином А печень рыб, сливочное масло, молоко, морковь, абрикосы и др.
Витамин С, или аскорбиновая кислота, синтезируется в растениях и накапливается в шиповнике, лимоне, черной смородине, зеленом луке, плодах клюквы и др. В настоящее время разработан промышленный синтез витамина С. При его недостатке развивается цинга. Особенно чувствуется нехватка витамина С к весне (у человека появляется сонливость, усталость, апатия).
Витамин D играет важную роль в обмене кальция, фосфора и в целом — в процессе образования костей. При отсутствии витамина D соли кальция и фосфора не откладываются в костях, а выводятся из организма и поэтому кости, особенно у детей, размягчаются. Под тяжестью тела ноги искривляются, на ребрах образуются утолщения — четки, задерживается развитие зубов. Наиболее богаты витамином D печень рыб, сливочное масло, икра, желток яйца. Растения содержат вещество, близкое к витамину D, — эргостерин, который под влиянием солнечных и ультрафиолетовых лучей переходит в витамин D. Эргостерин находится в коже человека, поэтому для детей необходимо пребывание на солнце.
Витамины группы В (B1, В2, В6, B12 и др.) регулируют многие ферментативные реакции обмена веществ, особенно обмена белков, аминокислот, нуклеиновых кислот. При их недостатке нарушаются функции нервной системы (например, болезнь бери-бери), желудочно-кишечного тракта (поносы), кроветворных органов (злокачественное малокровие) и др. Эти витамины содержатся в печени млекопитающих и некоторых рыб, в почках, петрушке и др.
Авитаминозы, возникающие от недостатка витаминов, могут развиться как в случае нехватки одного из витаминов, так и нескольких из них. Расстройства здоровья человека возможны и при избытке витаминов.
Макро- и микроэлементы (По материалам сайта Корпорация «Центр Семейной Медицины»)
Как известно, макро- и микроэлементы, или минералы, как их теперь называют на западный манер, играют очень важную и существенную роль в человеческом организме. Ввиду этой важности некоторые несложные и практически применимые факты о них должен знать не только специалист, но и любой человек, желающий сам заботиться о своем здоровье.
Макроэлементы: K, Na, Ca, Mg, P
Калий К
Суточная потребность: 2-3г
Вместе с натрием участвует в поддержании обмена веществ, стимулирует почки к выведению метаболических ядов, нормализует сердечный ритм и предупреждает токсическое влияние на сердце сердечных гликозидов (дитоксин, коргликон, строфантин К). Кроме того, участвует в регуляции кислотно-щелочного равновесия, способствует здоровой коже. Всего в организме человека содержится 170-240 г К (из них более 95% внутри клеток).
Дефицит К: нарушения в нервной (депрессия), нервно-мышечной (дискоординация движений, мышечная гипотония, гипорефлексия, разрушение мышц) и сердечно-сосудистой (артериальная гипотония, брадикардия) систем; повышается токсичность сердечных гликозидов.
Избыток К: параличи, парестезии, боли в икрах ног, диспепсические расстройства, нарушения работы сердца вплоть до остановки, нарушения функции почек.
Натрий Na
Суточная потребность: ок. 4г.
Вместе с калием участвует в поддержании кислотно-щелочного равновесия посредством буферных систем. Один из главных регуляторов обмена веществ в почках и осмотического давления плазмы крови. Необходим для поддержания мембранного потенциала всех клеток и генерации возбуждения в нервных и мышечных клетках. В организме содержится в биологических жидкостях, в клетках, а также в хрящах и костях.
Дефицит Na: слабость, апатия, головные боли, расстройства сознания, тошнота, рвота, гипотония, мышечные подергивания.
Избыток Na: возбуждение, гипертермия, жажда, возможны судороги, нарушения сознания.
Кальций Са
Суточная потребность: 1-1.5г
Строит и укрепляет кости и зубы, участвует в регуляции сердечного ритма, помогает питательным веществам проникать через клеточную мембрану, участвует в свертывающей системе крови,в функционировании нервной и мышечной систем, важен для нормальной работы почек, снижает уровень холестерина в крови. Обычно потребление человеком Са недостаточно, особенно это ощутимо у беременных и уже имеющих детей. Поэтому во время беременности и после нее потребление Са необходимо увеличить.
Дефицит Са: спазмы мыщц рук и ног, судороги (тетания) мышц ног и спины, размягчение костей, остеопороз, разрушение зубов, депрессия.
Избыток Са: снижение аппетита, запоры, жажда, повышенный диурез, гипотония мыщц, снижение рефлексов, повышение давления. Длительно существующая гиперкальциемия приводит к задержкам роста, отложениям кальция в стенках сосудов, поражениям почек.
Магний Mg
Суточная потребность: 0.3г
Играет важную роль в регуляции нервномышечной активности сердца, укрепляет нормальный сердечный ритм, необходим для метаболизма кальция и витамина С, участвует в превращении углеводов в энергию. Всего в организме содержится около 20 г Mg, в основном в костях и внутри клеток.
Дефицит Mg: снижение концентрации Са и отложение Са в тканях, тремор, мышечная слабость, сердечные спазмы, нервозность, трофические язвы, камни в почках.
Избыток Mg: седативный эффект, может быть угнетение дыхательного центра.
Фосфор Р
Суточная потребность: 1.5-3г
В виде фосфата занимает одно из центральных мест в процессах обмена веществ и энергии, входит в состав костей и зубов, является частью многих биологических веществ.
Дефицит Р: заторможенность, нарушения системы крови (гемолитическая анемия, тромбоцитопения и другие), мышечные нарушения вплоть до параличей, нарушения костной ткани и сердечной деятельности.
Избыток Р: гипотония, снижение концентрации Са в крови.
Микроэлементы: Fe, Cu, I, Zn, Mn
Микроэлементами называются такие химические элементы, содержание которых в организме человека менее 0.001%. Около двадцати из них являются жизненно необходимыми.
Железо Fe
Суточная потребность: 15 мг
В организме у железа три важнейшие функции: обуславливает транспорт и депонирование кислорода (входит в состав гемоглобина и миоглобина), входит в состав ферментов энергетического обмена и формирует активные центры многих других ферментов. Также предупреждает ожирение и защищает хороший цвет кожи. Всего в организме содержится 3-5 г Fe.
Дефицит Fe: слабость, бледность, запоры, анемии, гастрит, воспаления органов рото- и носоглотки.
Избыток Fe: поражения сердца и печени, легких и поджелудочной железы, нарушение зрения.
Медь Cu
Суточная потребность: 2-5 мг
Необходима для абсорбции и утилизации железа, участвует в формировании эритроцитов, синтезе соединительной ткани, формировании и укреплении костей, передаче нервных импульсов. Обладает противовоспалительными свойствами. Требуется для регуляции гормональных механизмов. Всего в организме содержится до 80 г Cu.
Дефицит Cu: общая слабость, угнетение дыхания, кожные язвы, нарушения сердечно-сосудистой системы, скелета, соединительной ткани, поражение центральной нервной системы, возможна гиперхолестеринемия.
Избыток Cu: возможны медная лихорадка, заболевания легких.
Иод I
Суточная потребность: около 0.2 мг
Важен для развития и функционирования щитовидной железы, входит в состав секретируемых ей гормонов, через эти гормоны стимулирует метаболизм всего организма в сторону распада жиров и углеводов и продукции энергии; необходим для нормального развития головного мозга, кожи, волос и зубов.
Дефицит I: увеличение щитовидной железы (эндемический зоб), заторможенные реакции человека, кретинизм (при дефиците I в детском возрасте), замедление обменных процессов и снижение температуры тела, сухая кожа, снижение физических и умственных возможностей.
Избыток I: возможны аллергические реакции.
Цинк Zn
Суточная потребность: 100 мг
Антиоксидант, необходим для синтеза белка, стабилизации ДНК и РНК, роста и деления клеток, способствует заживлению ран, участвует в процессах развития репродуктивных органов, управляет сократимостью мышц, важен для стабилизации системы крови (гомеостаза), участвует во всасывании и метаболизме фосфора, входит в состав многих ферментов. Неорганический цинк может вызвать нарушения в желудочно-кишечном тракте, поэтому лучше принимать хелатный цинк. Всего в организме содержится до 2 г Zn.
Дефицит Zn: задержка роста и полового созревания, замедление заживления ран, белые пятнышки на ногтях, полнота, возприимчивость к инфекциям.
Избыток Zn: быстро выводится из организма, но возможен небольшой токсический эффект.
Марганец Mn
Суточная потребность: 3-5 мг
Антиоксидант, важен для распада аминокислот и продукции энергии, для метаболизма витаминов B1 и E. Активирует различные ферменты для переваривания и утилизации питательных веществ, катализирует распад жиров и холестерина. Участвует в нормальном развитии скелета, поддерживает продукцию половых гормонов. Всего в организме 10-20 г Mn.
Дефицит Mn: параличи, конвульсии, головокружение, ослабление слуха, глухота и слепота у детей, нарушения пищеварения, снижение уровня холестерина, может приводить к развитию неинсулинзависимого диабета.
Избыток Mn: двигательные и психические нарушения
Метаболическая энергия — клетка
Многие задачи, которые клетка должна выполнять, такие как движение и синтез макромолекул, требуют энергии. Таким образом, большая часть деятельности клетки направляется на получение энергии из окружающей среды и использование этой энергии для запуска энергозатратных реакций. Хотя ферменты контролируют скорость практически всех химических реакций в клетках, на равновесное положение химических реакций ферментативный катализ не влияет. Законы термодинамики управляют химическим равновесием и определяют энергетически выгодное направление всех химических реакций.Многие реакции, которые должны происходить внутри клеток, являются энергетически невыгодными, и поэтому могут протекать только за счет дополнительных затрат энергии. Следовательно, клетки должны постоянно расходовать энергию, полученную из окружающей среды. Таким образом, производство и использование метаболической энергии является фундаментальным для всей клеточной биологии.
Свободная энергия и АТФ
Энергетика биохимических реакций лучше всего описывается в терминах термодинамической функции, называемой свободной энергией Гиббса ( G ) , названной в честь Джозайи Уилларда Гиббса.Изменение свободной энергии (Δ G ) реакции объединяет эффекты изменений энтальпии (тепла, которое выделяется или поглощается во время химической реакции) и энтропии (степени беспорядка, возникающего в результате реакции), чтобы предсказать, будет ли или не реакция энергетически выгодна. Все химические реакции самопроизвольно протекают в энергетически выгодном направлении с уменьшением свободной энергии (Δ G <0). Например, рассмотрим гипотетическую реакцию, в которой A превращается в B:
Если Δ G <0, эта реакция будет идти в прямом направлении, как написано.Однако, если Δ G > 0, реакция будет протекать в обратном направлении, и B будет преобразован в A.
Δ G реакции определяется не только собственными свойствами реагентов и продуктов, но и также их концентрацией и другими условиями реакции (например, температурой). Таким образом, полезно определить изменение свободной энергии реакции при стандартных условиях. (Стандартными условиями считаются концентрация всех реагентов и продуктов 1- M и давление 1 атм).Стандартное изменение свободной энергии (Δ G °) реакции напрямую связано с ее положением равновесия, поскольку фактическое Δ G является функцией как Δ G ° , так и концентраций реагентов и продуктов. Например, рассмотрим реакцию
Изменение свободной энергии можно записать следующим образом:
, где R — газовая постоянная, а T — абсолютная температура.
В состоянии равновесия Δ G = 0, и реакция не идет ни в одном направлении.Константа равновесия для реакции ( K = [B] / [A] в равновесии), таким образом, напрямую связана с Δ G ° с помощью приведенного выше уравнения, которое может быть выражено следующим образом:
или
. фактическое отношение [B] / [A] больше, чем равновесное соотношение ( K ), Δ G > 0, и реакция протекает в обратном направлении (превращение B в A). С другой стороны, если отношение [B] / [A] меньше равновесного отношения, Δ G <0 и A конвертируется в B.
Стандартное изменение свободной энергии (Δ G °) реакции, таким образом, определяет ее химическое равновесие и предсказывает, в каком направлении реакция будет протекать при любом заданном наборе условий. Для биохимических реакций стандартное изменение свободной энергии обычно выражается как Δ G ° ′, что является стандартным изменением свободной энергии реакции в водном растворе при pH = 7, примерно в условиях внутри клетки.
Многие биологические реакции (например, синтез макромолекул) термодинамически невыгодны (Δ G > 0) в клеточных условиях.Для протекания таких реакций требуется дополнительный источник энергии. Например, рассмотрим реакцию
Превращение A в B энергетически невыгодно, поэтому реакция протекает в обратном, а не в прямом направлении. Однако реакцию можно направить в прямом направлении, сочетая превращение A в B с энергетически выгодной реакцией, такой как:
Если эти две реакции объединить, связанную реакцию можно записать следующим образом:
Δ G комбинированной реакции представляет собой сумму изменений свободной энергии ее отдельных компонентов, поэтому сопряженная реакция является энергетически выгодной и будет протекать, как написано.Таким образом, энергетически невыгодное превращение A в B происходит за счет его связывания со второй реакцией, связанной с большим уменьшением свободной энергии. Ферменты несут ответственность за скоординированное проведение таких сопряженных реакций.
Клетка использует этот основной механизм для запуска множества энергетически неблагоприятных реакций, которые должны иметь место в биологических системах. Аденозин-5′-трифосфат (АТФ) играет центральную роль в этом процессе, действуя как накопитель свободной энергии внутри клетки ().Связи между фосфатами в АТФ известны как высокоэнергетические связи, потому что их гидролиз сопровождается относительно большим уменьшением свободной энергии. В самих химических связях нет ничего особенного; они называются высокоэнергетическими связями только потому, что при их гидролизе внутри клетки высвобождается большое количество свободной энергии. При гидролизе АТФ до АДФ плюс фосфат (P i ) Δ G ° ‘= -7,3 ккал / моль. Напомним, однако, что Δ G ° ‘относится к «стандартным условиям», в которых концентрации всех продуктов и реагентов составляют 1 M .Фактические внутриклеточные концентрации P i составляют приблизительно 10 -2 M, , а внутриклеточные концентрации АТФ выше, чем концентрации АДФ. Эти различия между внутриклеточными концентрациями и концентрациями в стандартном состоянии способствуют гидролизу АТФ, поэтому для гидролиза АТФ внутри клетки Δ G составляет приблизительно -12 ккал / моль.
Рис. 2.31
АТФ как запас свободной энергии. Связи между фосфатными группами АТФ называются высокоэнергетическими связями, потому что их гидролиз приводит к значительному снижению свободной энергии.АТФ может быть гидролизован либо до АДФ плюс фосфатная группа (HPO 4 2-), либо до АМФ (подробнее …)
В качестве альтернативы АТФ может быть гидролизован до АМФ плюс пирофосфат (PP i ) . Эта реакция дает примерно такое же количество свободной энергии, что и гидролиз АТФ до АДФ. Однако пирофосфат, полученный в результате этой реакции, затем сам быстро гидролизуется с Δ G , аналогичным таковому при гидролизе АТФ. Таким образом, общее изменение свободной энергии в результате гидролиза АТФ до АМФ примерно вдвое больше, чем при гидролизе АТФ до АДФ.Для сравнения, связь между сахаром и фосфатной группой АМФ, вместо того, чтобы иметь высокую энергию, типична для ковалентных связей; для гидролиза АМФ Δ G ° ′ = -3,3 ккал / моль.
Из-за сопутствующего уменьшения свободной энергии гидролиз АТФ может использоваться для запуска других энергозатратных реакций внутри клетки. Например, первая реакция гликолиза (обсуждается в следующем разделе) — это превращение глюкозы в глюкозо-6-фосфат. Реакцию можно записать следующим образом:
Поскольку эта реакция энергетически невыгодна, как написано (Δ G ° ′ = +3.3 ккал / моль), он должен двигаться в прямом направлении, будучи связан с гидролизом АТФ (Δ G ° ′ = -7,3 ккал / моль):
Комбинированная реакция может быть записана следующим образом:
Свободный -Изменение энергии для этой реакции представляет собой сумму изменений свободной энергии для отдельных реакций, поэтому для связанной реакции Δ G ° ‘= -4,0 ккал / моль, что способствует образованию глюкозо-6-фосфата.
Другие молекулы, в том числе другие нуклеозидтрифосфаты (например, GTP), также имеют высокоэнергетические связи и могут использоваться в качестве АТФ для управления реакциями, требующими энергии.Однако для большинства реакций АТФ обеспечивает свободную энергию. Таким образом, энергетические реакции внутри клетки связаны с синтезом АТФ, в то время как требующие энергии реакции связаны с гидролизом АТФ. Таким образом, высокоэнергетические связи АТФ играют центральную роль в метаболизме клеток, выступая в качестве полезной формы хранения свободной энергии.
Производство АТФ из глюкозы
Расщепление углеводов, особенно глюкозы, является основным источником клеточной энергии. Полный окислительный распад глюкозы до CO 2 и H 2 O можно записать следующим образом:
Реакция дает большое количество свободной энергии: Δ G ° ′ = -686 ккал / моль.Чтобы использовать эту свободную энергию в пригодной для использования форме, глюкоза окисляется в клетках в несколько этапов, связанных с синтезом АТФ.
Гликолиз, начальная стадия распада глюкозы, характерна практически для всех клеток. Гликолиз происходит в отсутствие кислорода и может обеспечить всю метаболическую энергию анаэробных организмов. Однако в аэробных клетках гликолиз — это только первая стадия разложения глюкозы.
Реакции гликолиза приводят к распаду глюкозы на пируват с общим увеличением двух молекул АТФ ().Начальные реакции в этом пути фактически потребляют энергию, используя АТФ для фосфорилирования глюкозы до глюкозо-6-фосфата, а затем фруктозо-6-фосфат до фруктозо-1,6-бисфосфата. Ферменты, которые катализируют эти две реакции — гексокиназа и фосфофруктокиназа, соответственно — являются важными регуляторными точками гликолитического пути. Ключевым элементом контроля является фосфофруктокиназа, которая ингибируется высоким уровнем АТФ. Ингибирование фосфофруктокиназы приводит к накоплению глюкозо-6-фосфата, который, в свою очередь, ингибирует гексокиназу.Таким образом, когда клетка имеет достаточный запас метаболической энергии, доступной в форме АТФ, распад глюкозы подавляется.
Рисунок 2.32
Реакции гликолиза. Глюкоза расщепляется на пируват с образованием двух молекул АТФ и НАДН каждая. В анаэробных условиях НАДН повторно окисляется путем превращения пирувата в этанол или лактат. В аэробных условиях (подробнее …)
Реакции, следующие за образованием фруктозо-1,6-бисфосфата, составляют энергопроизводящую часть гликолитического пути.Расщепление фруктозо-1,6-бисфосфата дает две молекулы трехуглеродного сахарного глицеральдегид-3-фосфата, который окисляется до 1,3-бисфосфоглицерата. Фосфатная группа этого соединения имеет очень высокую свободную энергию гидролиза (Δ G ° ‘= -11,5 ккал / моль), поэтому она используется в следующей реакции гликолиза для управления синтезом АТФ из АДФ. Продукт этой реакции, 3-фосфоглицерат, затем превращается в фосфоенолпируват, второе высокоэнергетическое промежуточное соединение при гликолизе.При гидролизе высокоэнергетического фосфата фосфоенолпирувата Δ G ° ‘= -14,6 ккал / моль его превращение в пируват сопровождается синтезом АТФ. Таким образом, каждая молекула глицеральдегид-3-фосфата, превращенная в пируват, связана с образованием двух молекул АТФ; Всего из каждой исходной молекулы глюкозы синтезируется четыре АТФ. Поскольку для инициации начальных реакций требовалось два АТФ, чистый выигрыш от гликолиза составляет две молекулы АТФ.
Помимо производства АТФ, гликолиз превращает две молекулы кофермента NAD + в NADH.В этой реакции NAD + действует как окислитель, который принимает электроны от глицеральдегид-3-фосфата. NADH, образующийся в виде продукта, должен быть переработан, поскольку он служит донором электронов для других окислительно-восстановительных реакций внутри элемента. В анаэробных условиях НАДН, образующийся во время гликолиза, повторно окисляется до НАД + путем превращения пирувата в лактат или этанол. Однако у аэробных организмов НАДН служит дополнительным источником энергии, отдавая свои электроны в цепь переноса электронов, где они в конечном итоге используются для восстановления O 2 до H 2 O, связанного с генерацией дополнительного АТФ. .
В эукариотических клетках гликолиз происходит в цитозоле. Затем пируват транспортируется в митохондрии, где его полное окисление до CO 2 и H 2 O дает большую часть АТФ, полученного при расщеплении глюкозы. Следующим этапом метаболизма пирувата является его окислительное декарбоксилирование в присутствии кофермента А (КоА) , который служит переносчиком ацильных групп в различных метаболических реакциях (). Один углерод пирувата выделяется как CO 2 , а оставшиеся два атома углерода добавляются к CoA с образованием ацетил-CoA.При этом одна молекула NAD + восстанавливается до NADH.
Рисунок 2.33
Окислительное декарбоксилирование пирувата. Пируват превращается в CO 2 и ацетил-КоА, и в процессе образуется одна молекула НАДН. Коэнзим A (CoA-SH) является основным носителем активированных ацильных групп в различных реакциях.
Ацетил-КоА, образованный в результате этой реакции, входит в цикл лимонной кислоты или цикл Кребса (), который является центральным путем в окислительном метаболизме.Двухуглеродная ацетильная группа соединяется с оксалоацетатом (четыре атома углерода) с образованием цитрата (шесть атомов углерода). В ходе следующих восьми реакций два атома углерода цитрата полностью окисляются до CO 2 и регенерируется оксалоацетат. Во время цикла в ГТФ образуется одна высокоэнергетическая фосфатная связь, которая используется непосредственно для управления синтезом одной молекулы АТФ. Кроме того, каждый виток цикла дает три молекулы НАДН и одну молекулу восстановленного флавинадениндинуклеотида ( FADH 2 ), который является еще одним переносчиком электронов в окислительно-восстановительных реакциях.
Рисунок 2.34
Цикл лимонной кислоты. Двухуглеродная ацетильная группа переносится с ацетил-КоА на оксалоацетат с образованием цитрата. Затем два атома углерода цитрата окисляются до CO 2 и регенерируется оксалоацетат. Каждый оборот цикла дает одну молекулу GTP, три (подробнее …)
Цикл лимонной кислоты завершает окисление глюкозы до шести молекул CO 2 . Четыре молекулы АТФ получают непосредственно из каждой молекулы глюкозы — две из гликолиза и две из цикла лимонной кислоты (по одной на каждую молекулу пирувата).Кроме того, образуются десять молекул НАДН (две из гликолиза, две из превращения пирувата в ацетил-КоА и шесть из цикла лимонной кислоты) и две молекулы FADH 2 . Оставшаяся энергия, полученная при расщеплении глюкозы, поступает в результате повторного окисления NADH и FADH 2 , при этом их электроны переносятся по цепи переноса электронов, чтобы (в конечном итоге) восстановить O 2 до H 2 O.
Во время При окислительном фосфорилировании электроны НАДН и ФАДН 2 соединяются с О 2 , и энергия, высвобождаемая в процессе, стимулирует синтез АТФ из АДФ.Перенос электронов от НАДН к О 2 высвобождает большое количество свободной энергии: Δ G ° ′ = -52,5 ккал / моль для каждой перенесенной пары электронов. Так что эта энергия может быть собрана в пригодной для использования форме, процесс происходит постепенно за счет прохождения электронов через ряд носителей, которые составляют цепь переноса электронов (). Компоненты цепи переноса электронов расположены во внутренней митохондриальной мембране эукариотических клеток, и окислительное фосфорилирование рассматривается более подробно при обсуждении митохондрий в главе 10.У аэробных бактерий, которые используют сопоставимую систему, компоненты цепи переноса электронов расположены в плазматической мембране. В любом случае перенос электронов от НАДН к О 2 дает энергию, достаточную для запуска синтеза примерно трех молекул АТФ. Электроны из FADH 2 входят в цепь переноса электронов на более низком уровне энергии, поэтому их перенос на O 2 дает меньше полезной свободной энергии, только две молекулы АТФ.
Рисунок 2.35
Цепь переноса электронов. Электроны от NADH и FADH 2 переносятся на O 2 через ряд переносчиков, организованных в четыре белковых комплекса в митохондриальной мембране. Свободная энергия, полученная в результате реакций переноса электронов в комплексах (подробнее …)
Теперь можно рассчитать общий выход АТФ от окисления глюкозы. Чистая прибыль от гликолиза — две молекулы АТФ и две молекулы НАДН. Превращение пирувата в ацетил-КоА и его метаболизм через цикл лимонной кислоты дает две дополнительные молекулы АТФ, восемь молекул НАДН и две молекулы ФАДН 2 .Предполагая, что три молекулы АТФ являются производными от окисления каждого НАДН и по две — от каждого FADH 2 , общий выход составляет 38 молекул АТФ на молекулу глюкозы. Однако в некоторых клетках этот выход ниже, поскольку две молекулы НАДН, образующиеся при гликолизе в цитозоле, не могут напрямую проникать в митохондрии. Вместо этого их электроны должны быть перенесены в митохондрии через систему челнока. В зависимости от используемой системы этот перенос может привести к тому, что эти электроны войдут в цепь переноса электронов на уровне FADH 2 .В таких случаях две молекулы НАДН, полученные в результате гликолиза, дают две, а не три молекулы АТФ, снижая общий выход до 36, а не до 38 АТФ на молекулу глюкозы.
Получение энергии из других органических молекул
Энергия в форме АТФ может быть получена в результате распада других органических молекул, при этом пути, участвующие в деградации глюкозы, снова играют центральную роль. Нуклеотиды, например, могут быть расщеплены на сахара, которые затем вступают в гликолитический путь, а аминокислоты разлагаются через цикл лимонной кислоты.Две основные формы хранения энергии в клетках, полисахариды и липиды, также могут расщепляться с образованием АТФ. Полисахариды расщепляются на свободные сахара, которые затем метаболизируются, как обсуждалось в предыдущем разделе. Липиды, однако, представляют собой еще более эффективную молекулу хранения энергии. Поскольку липиды более восстановлены, чем углеводы, состоящие в основном из углеводородных цепей, их окисление дает значительно больше энергии на вес исходного материала.
Жиры (триацилглицерины) являются основной формой хранения липидов.Первым шагом в их использовании является их расщепление на глицерин и свободные жирные кислоты. Каждая жирная кислота присоединяется к коферменту А, образуя жирный ацил-КоА за счет одной молекулы АТФ (). Затем жирные кислоты разлагаются в ступенчатом окислительном процессе, два атома углерода за раз, с образованием ацетил-КоА плюс жирный ацил-КоА, более короткий на одну двухуглеродную единицу. Каждый цикл окисления также дает одну молекулу НАДН и одну молекулу ФАДН 2 . Затем ацетил-КоА входит в цикл лимонной кислоты, и разложение остатка жирной кислоты продолжается таким же образом.
Рисунок 2.36
Окисление жирных кислот. Жирная кислота (например, пальмитат насыщенной жирной кислоты с 16 атомами углерода) первоначально присоединяется к коферменту А за счет одной молекулы АТФ. Окисление жирной кислоты затем происходит путем поэтапного удаления двухуглеродных звеньев в виде ацетила (подробнее …)
Таким образом, распад 16-углеродной жирной кислоты дает семь молекул НАДН, семь молекул ФАДН 2 и восемь молекул. ацетил-КоА. С точки зрения генерации АТФ этот выход соответствует 21 молекуле АТФ, полученной из НАДН (3 × 7), 14 АТФ из FADH 2 (2 × 7) и 96 из ацетил-КоА (8 × 12).Поскольку для запуска процесса использовался один АТФ, чистый выигрыш составляет 130 АТФ на молекулу 16-углеродной жирной кислоты. Сравните этот выход с чистым приростом 38 АТФ на молекулу глюкозы. Поскольку молекулярная масса насыщенной 16-углеродной жирной кислоты составляет 256, а глюкозы — 180, выход АТФ примерно в 2,5 раза больше на грамм жирной кислоты — отсюда преимущество липидов перед полисахаридами в качестве молекул-аккумуляторов.
Фотосинтез
Производство энергии в результате окисления углеводов и липидов зависит от разложения предварительно образованных органических соединений.Энергия, необходимая для синтеза этих соединений, в конечном итоге получается из солнечного света, который собирают и используют растения и фотосинтезирующие бактерии для управления синтезом углеводов. Преобразуя энергию солнечного света в пригодную для использования форму химической энергии, фотосинтез является источником практически всей метаболической энергии в биологических системах.
Общее уравнение фотосинтеза можно записать следующим образом:
Однако этот процесс намного сложнее и проходит в две отдельные стадии.В первой, называемой световыми реакциями, энергия, поглощенная солнечным светом, стимулирует синтез АТФ и НАДФН (кофермент, подобный НАДН), связанный с окислением H 2 O до O 2 . АТФ и НАДФН, образующиеся в световых реакциях, управляют синтезом углеводов из CO 2 и H 2 O во втором наборе реакций, названном темными реакциями , потому что они не требуют солнечного света. В эукариотических клетках в хлоропластах протекают как световые, так и темные реакции.
Фотосинтетические пигменты улавливают энергию солнечного света путем поглощения фотонов. Поглощение света этими пигментами заставляет электрон перемещаться со своей нормальной молекулярной орбитали на орбиталь с более высокой энергией, таким образом преобразуя энергию солнечного света в химическую энергию. В растениях наиболее распространенными фотосинтетическими пигментами являются хлорофиллы (), которые вместе поглощают видимый свет всех длин волн, кроме зеленого. Дополнительные пигменты поглощают свет с другими длинами волн, поэтому практически весь спектр видимого света может быть захвачен и использован для фотосинтеза.
Рисунок 2.37
Строение хлорофилла. Хлорофиллы состоят из порфириновых кольцевых структур, связанных с углеводородными хвостами. Хлорофиллы a и b отличаются одной функциональной группой в порфириновом кольце.
Энергия, захваченная при поглощении света, используется для преобразования H 2 O в O 2 (). Полученные в результате этого процесса высокоэнергетические электроны затем попадают в цепь переноса электронов, в которой их перенос через ряд носителей связан с синтезом АТФ.Кроме того, эти электроны с высокой энергией восстанавливают NADP + до NADPH.
Рисунок 2.38
Световые реакции фотосинтеза. Энергия солнечного света используется для расщепления H 2 O на O 2 . Полученные в результате этого процесса высокоэнергетические электроны переносятся через ряд носителей и используются для преобразования NADP + в NADPH. Энергия, полученная от электрона (подробнее …)
В темных реакциях АТФ и НАДФН, полученные в световых реакциях, управляют синтезом углеводов из CO 2 и H 2 O.Одна молекула CO 2 за один раз добавляется в цикл реакций, известный как цикл Кальвина в честь его первооткрывателя, Мелвина Кальвина, который приводит к образованию углеводов (). В целом цикл Кальвина потребляет 18 молекул АТФ и 12 молекул НАДФН на каждую синтезируемую молекулу глюкозы. Два электрона необходимы для преобразования каждой молекулы НАДФ + в НАДФН, поэтому 24 электрона должны пройти через цепь переноса электронов, чтобы произвести достаточно НАДФН для синтеза одной молекулы глюкозы.Эти электроны получают преобразованием 12 молекул H 2 O в шесть молекул O 2 , что соответствует образованию шести молекул O 2 для каждой молекулы глюкозы. Однако неясно, достаточно ли прохождения тех же 24 электронов через цепь переноса электронов для генерации 18 АТФ, необходимых для цикла Кальвина. Вместо этого некоторые из этих молекул АТФ могут генерироваться альтернативными цепями переноса электронов, которые используют энергию солнечного света для синтеза АТФ без синтеза НАДФН (см. Главу 10).
Рисунок 2.39
Цикл Кальвина. Здесь показан синтез одной молекулы глюкозы из шести молекул CO 2 . Каждую молекулу CO 2 добавляют к рибулозо-1,5-бисфосфату, чтобы получить две молекулы 3-фосфоглицерата. Таким образом, шесть молекул CO 2 приводят к образованию (подробнее …)
6.1A: Роль энергии и метаболизма
- Последнее обновление
- Сохранить как PDF
- Ключевые моменты
- Ключевые термины
- Энергия и метаболизм
- Биоэнергетика и химические реакции
- Клеточный метаболизм
Всем организмам требуется энергия для выполнения задач; метаболизм — это набор химических реакций, которые высвобождают энергию для клеточных процессов.
Задачи обучения
- Объяснить важность метаболизма
Ключевые моменты
- Все живые организмы нуждаются в энергии для роста и воспроизводства, поддержания своих структур и реагирования на окружающую среду; метаболизм — это набор процессов, делающих энергию доступной для клеточных процессов.
- Метаболизм — это комбинация химических реакций, которые являются спонтанными и высвобождают энергию, и химических реакций, которые не являются спонтанными и требуют энергии для протекания.
- Живые организмы должны получать энергию через пищу, питательные вещества или солнечный свет, чтобы выполнять клеточные процессы.
- Транспортировка, синтез и расщепление питательных веществ и молекул в клетке требует использования энергии.
Ключевые термины
- метаболизм : полный набор химических реакций, которые происходят в живых клетках
- биоэнергетика : изучение преобразований энергии, происходящих в живых организмах
- энергия : работоспособность
Энергия и обмен веществ
Все живые организмы нуждаются в энергии для роста и воспроизводства, поддержания своей структуры и реагирования на окружающую среду.Метаболизм — это набор поддерживающих жизнь химических процессов, которые позволяют организмам преобразовывать химическую энергию, хранящуюся в молекулах, в энергию, которая может использоваться для клеточных процессов. Животные потребляют пищу, чтобы восполнить энергию; их метаболизм расщепляет углеводы, липиды, белки и нуклеиновые кислоты, чтобы обеспечить химическую энергию для этих процессов. В процессе фотосинтеза растения преобразуют световую энергию солнца в химическую энергию, хранящуюся в молекулах.
Биоэнергетика и химические реакции
Ученые используют термин биоэнергетика для обсуждения концепции потока энергии через живые системы, такие как клетки.Клеточные процессы, такие как построение и разрушение сложных молекул, происходят в результате пошаговых химических реакций. Некоторые из этих химических реакций являются спонтанными и высвобождают энергию, тогда как другие требуют энергии для протекания. Все химические реакции, происходящие внутри клеток, включая те, которые используют энергию, и те, которые высвобождают энергию, являются метаболизмом клетки.
Рисунок \ (\ PageIndex {1} \): Большая часть энергии прямо или косвенно исходит от Солнца. : Большинство форм жизни на Земле получают энергию от Солнца.Растения используют фотосинтез для улавливания солнечного света, а травоядные животные поедают эти растения для получения энергии. Плотоядные животные поедают травоядных, а разлагатели переваривают растительную и животную материю.Клеточный метаболизм
Каждое задание, выполняемое живыми организмами, требует энергии. Энергия необходима для выполнения тяжелой работы и упражнений, но люди также расходуют много энергии во время размышлений и даже во время сна. Для каждого действия, требующего энергии, происходит множество химических реакций, обеспечивающих химическую энергию системам тела, включая мышцы, нервы, сердце, легкие и мозг.
Живые клетки каждого организма постоянно используют энергию для выживания и роста. Клетки расщепляют сложные углеводы на простые сахара, которые клетка может использовать для получения энергии. Мышечные клетки могут потреблять энергию для построения длинных мышечных белков из небольших молекул аминокислот. Молекулы могут быть изменены и транспортироваться по клетке или могут быть распределены по всему организму. Так же, как энергия требуется как для строительства, так и для сноса здания, энергия требуется как для синтеза, так и для разрушения молекул.
Многие клеточные процессы требуют постоянного снабжения энергией, обеспечиваемой клеточным метаболизмом. Сигнальные молекулы, такие как гормоны и нейротрансмиттеры, должны быть синтезированы и затем транспортированы между клетками. Патогенные бактерии и вирусы попадают в организм и разрушаются клетками. Клетки также должны экспортировать отходы и токсины, чтобы оставаться здоровыми, и многие клетки должны плавать или перемещать окружающие материалы посредством биения клеточных придатков, таких как реснички и жгутики.
Рисунок \ (\ PageIndex {1} \): Прием пищи дает энергию для таких действий, как полет. : Колибри нужна энергия, чтобы поддерживать длительные периоды полета.Колибри получает энергию от приема пищи и преобразования питательных веществ в энергию посредством ряда биохимических реакций. Летные мышцы птиц чрезвычайно эффективны в производстве энергии.границ | Энергия мозга и кислородный метаболизм: новая роль в нормальном функционировании и заболеваниях
Введение
Регулирование тканевых метаболитов и клеточного энергетического метаболизма имеет важное значение для поддержания здоровой клеточной и системной функции.Это регулирование особенно важно для центральной нервной системы (ЦНС), где потребление энергии очень динамично. В головном мозге повышенная активность нейронов приводит к увеличению потребления энергии, а компенсаторные метаболические и сосудистые изменения, в свою очередь, улучшают функцию нейронов (Roy and Sherrington, 1890). Поэтому нормальная функция мозга требует, чтобы метаболизм жестко регулировался как во времени, так и в пространстве от регионального уровня до уровня отдельного синапса. В настоящее время наши знания о взаимосвязи между активностью нейронов и метаболизмом кислорода плохо изучены, и, вероятно, еще предстоит раскрыть многочисленные механизмы и сложные регуляторные пути.
Хотя мозг составляет лишь небольшую часть от общей массы нашего тела, он представляет собой самый большой источник потребления энергии — на его долю приходится более 20% общего кислородного обмена. Из этого количества нейроны потребляют 75–80% энергии, производимой в головном мозге (Hyder et al., 2013). Эта энергия в основном используется в синапсе, большая часть тратится на восстановление мембранных потенциалов нейронов после деполяризации (Harris et al., 2012). Другие нейронные функции, такие как рециклинг везикул, синтез нейротрансмиттеров и аксоплазматический транспорт, также способствуют истощению синаптической энергии и необходимости повышения скорости метаболизма в нейронах (Attwell and Laughlin, 2001; Rangaraju et al., 2014; Pathak et al., 2015). Поэтому потребности в энергии неодинаковы по всему мозгу, а вместо этого увеличиваются в локализованных областях в зависимости от активности нейронов. Хотя были выявлены механизмы изменения подачи кислорода к областям мозга в ответ на активность, по-видимому, гипоксия играет роль в модулировании функции и поведения нейронов. Нарушение кислородного обмена и функции митохондрий также являются последовательными патологическими особенностями различных возрастных нейродегенеративных заболеваний, связанных со снижением когнитивных функций (Tabrizi et al., 2000; Сильверман и др., 2001; Чжоу и др., 2008). Несмотря на это, основные молекулярные механизмы, предшествующие нейродегенерации, остаются относительно неизвестными. В последние годы в ряде исследований были выявлены связи между метаболически регулируемыми генами и поведением, что может дать понимание роли окислительного метаболизма нейронов как для здоровья, так и для болезни.
Нейроваскулярная и нейрометаболическая связь
Чтобы компенсировать изменяющиеся потребности мозга в энергии и повысить эффективность доставки метаболитов, были разработаны нейрососудистые и нейрометаболические механизмы сцепления для улучшения кровотока и утилизации метаболитов в областях нервной активности.
Нейроваскулярное соединение
Церебральный кровоток (CBF), объем крови, потребление глюкозы и метаболизм кислорода увеличиваются в локализованных областях активности после нейрональной стимуляции. Нейроваскулярная связь, впервые постулированная Роем и Шеррингтоном (1890), составляет основу многих технологий функциональной нейровизуализации, в которых области нейрональной активности выявляются с помощью связанного с активностью увеличения локального CBF. Несмотря на то, что после этого открытия было проведено существенное исследование нейроваскулярного взаимодействия, детали молекулярных механизмов все еще не раскрываются.
Значительные данные свидетельствуют о том, что нервно-сосудистое соединение опосредуется свободным радикалом, оксидом азота (• NO), продуцируемым в нейронах. Вазодилатация сильно стимулируется • NO посредством активации ферментативного • рецептора NO, растворимой гуанилатциклазы (sGC), продуцирующей цГМФ и ведущей к вазодилатации за счет передачи сигналов цГМФ-зависимой киназой (Miki et al., 1977; Archer et al., 1994) . Продукция • NO нейрональной синтазой оксида азота (nNOS) тесно связана с глутаматергическим возбуждением, а активация nNOS связана со стимуляцией ионотрофных рецепторов глутамата.Это в основном происходит через рецепторы NMDA (NMDA-R) из-за сильного связывания между кластерным белком NMDA-R, белком постсинаптической плотности 95 (PSD-95) и nNOS (Garthwaite et al., 1988; Brenman et al., 1996). Имеющиеся данные также свидетельствуют о том, что • NO способен быстро распространяться за пределы области непосредственно активированных нейронов и, вероятно, саморегулируется, поскольку усиленный кровоток инактивирует • передачу сигналов NO через усиленное опосредованное эритроцитами удаление • NO (Steinert et al., 2008 ; Сантос и др., 2011). Астроциты также играют роль в опосредовании регуляции CBF во время активации нейронов, запуская высвобождение Ca 2+ в концевых ножках астроцитов и индуцируя различные нижестоящие сигнальные пути Ca 2+ , которые, как известно, контролируют вазодилатацию (Mulligan and MacVicar, 2004; Takano et al. , 2006). Недавно стало ясно, что передача сигналов астроцитов Ca 2+ действует на сократительные периктиды, окружающие капилляры, а не на артериолы (Mishra et al., 2016). Таким образом, современный взгляд на нервно-сосудистое сопряжение состоит в том, что повышение CBF запускается астроцитарной передачей сигналов Ca 2+ в капиллярном ложе и нейронами • NO, генерируемыми посредством активации NMDA-R на артериолярном уровне (Рисунки 1a, b; Peppiatt et al. al., 2006; Мишра и др., 2016).
Рисунок 1 . Нейроваскулярные и нейрометаболические механизмы связи. Схема, иллюстрирующая нейрональные и астроцитарные механизмы, ответственные за связанный с активностью кровоток и метаболические изменения. (a) рецепторов NMDA (NMDA-R) связаны с нейрональной синтазой оксида азота (nNOS) через белок постсинаптической плотности 95 (PSD-95), и считается, что нервно-сосудистое соединение во время активности запускается через продуцируемый нейронами вазодилататор. • NO, который может быстро и свободно диффундировать через мембраны, воздействуя на артериолы. (b) Также считается, что расширение сосудов контролируется на уровне капилляров посредством передачи сигналов астроцитов Ca + , воздействующих на сократительные перикты. (c) В цикле глутамин-глутамат глутамат (Glu), высвобождаемый в синаптическую щель, очищается от Na + -зависимого поглощения астроцитами, в первую очередь через GLT-1. Глутамат превращается в глутамин (Gln) и возвращается в нейроны для пополнения запасов нейромедиаторов. (d, e) Гипотеза лактатного челнока астроцитов-нейронов (ANLS) предполагает, что связанное с этим повышение концентрации астроцитов Na + запускает активацию насосов АТФазы Na + / K + , способствуя захвату глюкозы и гликолизу.Генерируемый гликолитами лактат высвобождается и используется в качестве субстрата для окислительного фосфорилирования в нейронах во время периодов активности. ЛДГ, лактатдегидрогеназа; МСТ, переносчик монокарбоксилата. Сплошные линии указывают на ферментативную активность, пунктирные линии указывают на движение растворенного вещества.
Нейрометаболическая связь
Эта синергетическая функция астроцитов и нейронов в регуляции CBF отражается в их обратных, но комплементарных метаболических профилях: астроциты преимущественно метаболизируют глюкозу посредством гликолиза, в то время как нейроны полагаются на окислительный метаболизм (Kasischke et al., 2004). Астроциты плотно прилегают как к стенкам капилляров, так и к синаптическим щелям и являются решающими регуляторами нейрометаболического взаимодействия во время нейрональной активности. Одна из наиболее хорошо охарактеризованных ролей астроцитов в активации нейронов — поддержание запасов нейротрансмиттеров через глутамин-глутаматный цикл. Глутамат, высвобождаемый в синаптическую щель во время возбуждения, быстро очищается астроцитарным захватом, в первую очередь через Na + -зависимый переносчик глутамата GLT-1 (EAAT2), вызывая ослабление постсинаптической активации (Рисунок 1c; Danbolt et al., 1992; Берглес и Яр, 1997). Очищенный глутамат в первую очередь превращается астроцитами в глутамин, который затем высвобождается обратно во внеклеточное пространство для повторного захвата нейронами и обратного преобразования в глутамат (Hertz et al., 1978; Kvamme, 1998). В гипотезе лактатного челнока астроцитов и нейронов (ANLS), предложенной Пеллерином и Магистретти (1994), вторичный эффект поглощения астроцитами глутамата вызывает переключение с окислительного метаболизма на аэробный гликолиз в астроцитах, вызывая отклонение метаболизма глюкозы от трикабоксциловой кислоты ( TCA) к гликолитическому пути и производству лактата.Считается, что это переключение запускается связанным внутриклеточным увеличением концентрации Na + , которое активирует насосы Na + / K + -АТФазы, стимулирующие захват глюкозы и гликолиз (рис. 1d; Pellerin and Magistretti, 1997). Эта адаптация, по-видимому, поддерживает повышенную метаболическую нагрузку нейронов, при этом лактат, образующийся в результате астроцитарного гликолиза, используется в качестве субстрата для окислительного метаболизма в нейронах. Эта гипотеза подтверждается многочисленными исследованиями, обнаруживающими повышенный уровень лактата в областях активности мозга, а также доказательствами того, что лактат имеет решающее значение для синаптической передачи в срезах гиппокампа крыс и достаточен для поддержания синаптической активности в отсутствие глюкозы (рис. 1e; Schurr et al., 1988, 1999; Frahm et al., 1996; Мэддок и др., 2009; Suzuki et al., 2011; Schaller et al., 2014; Махлер и др., 2016).
Этот сегрегированный метаболизм поддерживается различными паттернами экспрессии генов, наблюдаемыми в нейронах и астроцитах. Дифференциальная экспрессия белков-транспортеров лактата, транспортеров монокарбоксилатов (MCT), поддерживает транспортировку лактата от астроцитов к нейронам. Транспортер оттока лактата MCT4 экспрессируется в основном в астроцитах, в то время как MCT2, изоформа, которая обеспечивает быстрое поглощение лактата субстратом, в первую очередь экспрессируется в нейронах (Debernardi et al., 2003; Рафики и др., 2003). Кроме того, изофермент лактатдегидрогеназы (ЛДГ), ЛДГ-5, который способствует превращению пирувата в лактат, высоко экспрессируется в астроцитах, но не в нейронах, в то время как ЛДГ-1, который способствует выработке пирувата, обнаружен как в нейронах, так и в астроцитах (Bittar et al. ., 1996; Bröer et al., 1997). В поддержку индукции гликолиза в астроцитах киназа-4 пируватдегидрогеназы (PDK4) экспрессируется на высоких уровнях в астроцитах, заставляя ее мишень, пируватдегидрогеназу (PDH), оставаться в неактивном, фосфорилированном состоянии, тем самым уменьшая вход пирувата в цикл TCA. (Халим и др., 2010; Zhang et al., 2014). Соответственно, астроциты экспрессируют более высокие уровни ферментов глиоксалазы Glo-1 и Glo-2, которые детоксифицируют метигликоксаль, метаболический побочный продукт гликолиза (Belanger et al., 2011). Ферментативный промотор гликолиза, 6-фосфофрукто-2-киназа / фруктозо-2,6-бисфосфат 3 (Pfkfb3), также функционирует в астроцитах, но подвержен постоянной деградации в нейронах, что способствует отвлечению нейрональной глюкозы от гликолиза. к пентозофосфатному пути (PPP; Herrero-Mendez et al., 2009; Belanger et al., 2011; Zhang et al., 2014). В то время как есть существенные доказательства в поддержку ANLS, действующего как механизм связи нейрональной активности с нейрональным метаболизмом, противоречивые доказательства продолжают обсуждение этой гипотезы. Было показано, что поглощение и фосфорилирование глюкозы происходит преимущественно в нейронах, а не в астроцитах. Кроме того, нейроны метаболизируют значительное количество глюкозы и увеличивают метаболизм глюкозы в ответ на активность (Patel et al., 2014; Lundgaard et al., 2015). Это противоречивое свидетельство может быть связано с тем, что метаболизм по-разному регулируется в разных нейронных сетях или областях мозга. Однако все эти наблюдения способствуют накоплению доказательств того, что нейроны могут поддерживать и улучшать окислительный метаболизм для удовлетворения энергетических потребностей в периоды активности.
Окислительный метаболизм и гипоксия
Концентрация кислорода в головном мозге
Несмотря на наличие значительных доказательств в поддержку усиленного окислительного метаболизма нейронов во время активности, остается неясным, что происходит с концентрацией кислорода в клетках после активации.Частично это связано с трудностями при регистрации концентрации кислорода, а также с трудностями при интерпретации сигналов изображения потребления кислорода. ФМРТ, зависящая от уровня кислорода в крови (BOLD), которая основана на нейрососудистом взаимодействии для измерения областей мозговой активности на основе измерений оксигемеоглобина и дезоксигемеоглобина, постоянно генерирует сигналы с недостаточным уровнем постстимулятора (van Zijl et al., 2012). Физиологическая основа ЖИВОГО недобора активно обсуждается и, вероятно, зависит от стимула, однако одна теория предполагает, что ЖИРНЫЙ недобор отражает разъединение CBF и энергетического метаболизма.Это подтверждается данными о том, что окислительный метаболизм остается повышенным после активации после того, как кровоток и объем крови вернулись к исходному уровню (Lu et al., 2004). В соответствии с этим, в многочисленных исследованиях сообщалось об аналогичном увеличении окислительного метаболизма, указывающем на то, что устойчивая локальная активация повышает скорость окислительного метаболизма до нового устойчивого уровня (Hoge et al., 2005; Mangia et al., 2007; Frahm et al., 2008; Донахью и др., 2009; Лин и др., 2010). При динамических изменениях метаболизма кислорода, происходящих во время активности нейронов, динамические изменения, вероятно, будут отражаться в уровнях концентрации кислорода, потенциально оказывая вторичное влияние на функцию белков и экспрессию генов.
Нейроны и нейронные функции обычно считаются высокочувствительными к гипоксии с нарушением подачи кислорода в мозг, вызывающим пагубные повреждения в течение нескольких минут. Хотя не существует четко определенного «критического» давления кислорода (PtO 2 ), при котором гипоксическое повреждение будет происходить в нейронах, в коре головного мозга крысы значение PtO 2 между 6,8 мм рт. Ст. И 8,8 мм рт. 2 , где окислительный метаболизм будет нарушен (Rolett et al., 2000).В физиологических условиях измерения PtO 2 у крыс колеблются от 6 мм рт. Ст. До 40 мм рт. Ст. В коре головного мозга (6–16 мм рт. Ст. В белом веществе и 19–40 мм рт. Hg во всех областях мозга с проксимальными структурами, показывающими большие вариации в напряжении кислорода (Erecińska and Silver, 2001). Во время эмбрионального развития напряжение кислорода в мозге плода низкое (0,076–7,6 мм рт. Ст.), И гипоксия необходима для правильного морфологического развития эмбриона. В развивающемся головном мозге напряжение кислорода действует как регулятор нейрогенеза с низким содержанием кислорода, способствующим расширению предшественников в корковых нейрогенных областях и уменьшению дофаминергического нейрогенеза в среднем мозге (Wagenführ et al., 2015, 2016). Кроме того, в мозге взрослого человека гипоксическое повреждение, вызванное ишемическим инсультом, вызывает усиление пролиферации нейрональных стволовых клеток и нейрогенез (Arvidsson et al., 2002; Macas et al., 2006; Martí-Fàbregas et al., 2010). Эти данные подтверждают роль гипоксии как регулирующего механизма нейрональной функции и указывают на то, что физиологическая гипоксия, возникающая во взрослом мозге, может играть функциональную роль.
Факторы транскрипции, индуцируемые гипоксией
Долговременные изменения клеточного ответа на гипоксию опосредуются изменениями в экспрессии генов, при этом предполагается, что гипоксия регулируется примерно на 1% -1.5% генома, в основном за счет факторов, индуцируемых гипоксией (HIF; Koong et al., 2000; Denko et al., 2003). HIF представляет собой гетеродимерный комплекс, состоящий из конститутивно экспрессируемой субъединицы β, разделяемой семейством из трех чувствительных к кислороду субъединиц α. Среди них наиболее широко изучается субъединица HIF-1α. Белок HIFα конститутивно экспрессируется, но сразу же подвергается деградации пролилгидроксилазами HIF (PHD), которые связывают и гидроксилируют два консервативных остатка пролина HIFα кислородозависимым образом (Bruick and McKnight, 2001).Комплекс убиквитин-лигазы-супрессора фон Хиппеля-Линдау (pVHL) впоследствии распознает HIFα, вызывая убиквитинирование HIFα и деградацию белка (Ivan et al., 2001; Jaakkola et al., 2001). Во время гипоксии, несмотря на ограниченную кислородом инактивацию активности HIF PHD, HIFα больше не нацелен на pVHL и способен накапливаться в цитоплазме перед перемещением в ядро и действием, способствующим транскрипции (Рисунок 2). В нервной системе HIF-1α и гены-мишени HIF-1 широко экспрессируются в условиях гипоксии, но регуляция HIF-1α может различаться для разных подтипов нейронов (Bergeron et al., 1999; Строка и др., 2001). Было показано, что после гипоксии HIF-1α как in vitro, и in vivo, значительно усиливается в интернейронах, но не в пирамидных нейронах, а в нейрональных и ненейрональных клетках было установлено, что окислительно-восстановительное состояние клетки способствует регуляции HIF-1α (Welsh et al., 2002; Ramamoorthy and Shi, 2014). Кроме того, во время развития C. elegans в было показано, что гипоксия вызывает дефекты миграции аксонов, которые возникают специфическим для нейрональных клеток образом и зависят от стабилизации Hif-1 либо гипоксией, либо повышением активности активных форм кислорода (ROS ; Покок, Хоберт, 2008).Будучи основным источником восстановителей, глюкоза вносит основной вклад в окислительно-восстановительное состояние клетки, и было показано, что экспрессия HIF-1α в нейронах зависит от глюкозы во время гипоксии (Shi and Liu, 2006; Guo et al. ., 2008). Существует также отрицательная взаимосвязь между уровнями HIF-1α и ROS, что указывает на то, что ROS способствует деградации HIF-1α, в то время как восстанавливающая среда стабилизирует HIF-1α (Schafer and Buettner, 2001; Niecknig et al., 2012).
Рисунок 2 .Регулирование фактора транскрипции, индуцируемого гипоксией. В нормальных кислородных условиях индуцируемый гипоксией фактор-1α (HIF-1α) гидроксилируется ферментами пролилгидроксилазы (PHD) и нацелен на убиквитинирование комплексом убиквитин-лигазы, подавляющим опухоль фон Хиппеля-Линдау (pVHL). Во время гипоксии или условий с низким содержанием кислорода HIF-1α стабилизируется, перемещается в ядро и связывается с HIF-β, чтобы способствовать экспрессии генов, нацеливаясь на гены, содержащие элемент ответа на гипоксию (HRE). HIF-1α действует как усилитель гликолита за счет активации транскрипции метаболических генов, включая 6-фосфофрукто-2-киназу / фруктозо-2,6-бисфосфат 3 (PFKFB3) и киназу пируватдегидрогеназы-1 (PDK1), оба положительных регулятора гликолиза и транспортер монокарбоксилата 4 (MCT4), переносчик оттока лактата.Уб, убиквитин; ОН, гидроксильная группа.
АФК — это высокоактивные молекулы свободных радикалов, которые могут вызывать повреждение клеток из-за окисления липидов, белков и ДНК. Производство ROS в основном происходит за счет утечки электронов в комплексах I или III электронно-транспортной цепи (ETC) во время нормального окислительного дыхания. Это вызывает превращение 1-2% кислорода в супероксид-анион, предшественник перекиси водорода и свободных радикалов гидроксила. В головном мозге высокая скорость окисления нейронов увеличивает потенциал производства АФК, а нейроны особенно уязвимы к окислительному повреждению из-за низкого уровня антиоксидантных ферментов, таких как глутатион (GSH; Dringen et al., 1999). Таким образом, нейрональное отклонение катаболизма глюкозы от гликолиза к PPP через деградацию Pfkfb3 не только поддерживает окислительный метаболизм лактата, но также увеличивает антиоксидантную способность нейронов за счет продукции восстанавливающего агента, НАДН. HIF-1α также участвует в этом процессе и действует как усилитель гликолита за счет активации транскрипции метаболических генов, включая Pfkfb3 и киназу пируватдегидрогеназы-1 (PDK1), оба положительных регулятора гликолиза и переносчик оттока лактата, MCT4 (Рисунок 2; Минченко и другие., 2002; Ким и др., 2006; Ullah et al., 2006).
Как чувствительная к кислороду молекула, которая сильно интегрирована в метаболические процессы, HIF-1α, вероятно, играет важную роль в пластичности мозга, а нарушение регуляции экспрессии HIF-1α уже было связано с активацией нейронов, обучением и памятью. В исследовании с использованием микроматриц на крысах судороги, вызванные инъекцией каината, мощного агониста глутаматных рецепторов, вызывающего чрезмерную стимуляцию нейронов, привели к увеличению HIF-1α в 2,2 раза через 24 часа (Hunsberger et al., 2005). В другом исследовании микроматрицы было обнаружено, что HIF-1α увеличивается в 7 раз у мышей после обогащения окружающей среды, когда мышей подвергают повышенной сенсорной стимуляции, которая, как известно, способствует нейрогенезу и улучшает производительность при выполнении задач на память (Rampon et al., 2000). Повышенные уровни HIF-1α также наблюдались у крыс после обучения в водном лабиринте Морриса, а анализ генов, активируемых в ранние моменты времени после тестов в водном лабиринте Морриса, обнаружил чрезмерную представленность сайтов связывания HIF, элементов ответа на гипоксию (HREs). ), в их промоторах (O’Sullivan et al., 2007). Эти данные подтверждают значительную роль гипоксии в активности нейронов, потенциально через нервно-сосудистое разобщение и усиленный окислительный метаболизм нейронов, истощающий уровни кислорода в нейронах.
Нарушение метаболизма при нейродегенеративных заболеваниях
Болезнь Альцгеймера
Нейродегенеративные расстройства включают ряд состояний, характеризующихся прогрессирующим повреждением и дегенерацией нейронов, а также гибелью нервных клеток. Хотя нейродегенеративные расстройства различаются в зависимости от популяций нейронов и затрагиваются когнитивные или моторные функции, метаболическая дисфункция является объединяющей патологией, лежащей в основе многих из этих расстройств.Наиболее распространенным и наиболее широко изученным из них является болезнь Альцгеймера (БА), встречающаяся примерно у 1:10 людей в возрасте старше 65 лет. БА в основном влияет на кратковременную рабочую память и классифицируется по наличию двух характерных невропатологий; внеклеточные амилоидные бляшки, образованные в результате агрегации амилоидного (Aβ) пептида, и внутринейрональные нейрофибриллярные клубки, образованные в результате агрегации гиперфосфорилированного тау-белка. У пациентов с БА регионарный гипометаболизм в головном мозге является предиктором прогрессирующего когнитивного снижения, а снижение церебрального метаболизма связано с носителями аллеля риска БА гена APOE-4 (Small et al., 1995; Silverman et al., 2001). На клеточном уровне митохондрии (MC), изолированные от пациентов с AD, демонстрируют пониженную ферментативную активность комплекса ETC IV (цитохром С оксидазы; Parker et al., 1990; Parker and Parks, 1995). Точно так же в моделях БА на мышах окислительное дыхание снижается, и обнаруживается, что Aβ локализуется и прогрессивно накапливается в нейрональных MC (Mucke et al., 2000; Manczak et al., 2006; Rhein et al., 2009; Yao et al. , 2009). Это прогрессирующее накопление Aβ в MC связано со снижением окислительного дыхания и сниженной активностью ограничивающего скорость фермента цикла TCA, комплекса α-кетоглутаратдегидрогеназы (KGDHC) и комплекса пируватдегидрогеназы (PDHC), который генерирует ацетил-CoA для входа. в цикл TCA (Casley et al., 2002). Как метаболическая дисфункция, так и накопление митохондриального Aβ, по-видимому, происходят на ранней стадии прогрессирования заболевания, до начала образования внеклеточных бляшек (Wirths et al., 2001; Du et al., 2010). Это указывает на то, что ранняя метаболическая дисфункция является ключевым процессом в прогрессировании БА и потенциальной целью терапевтического вмешательства.
Также предшествующее образование внеклеточных бляшек в головном мозге с БА значительно увеличивало продукцию АФК и окислительный стресс. Существенно повышенная активность АФК и окислительное повреждение постоянно выявляются у пациентов с БА различными методами (Hensley et al., 1995; Габбита и др., 1998; Praticò et al., 1998; Калингасан и др., 1999; Greilberger et al., 2008). Повышенный окислительный стресс возникает на ранней стадии прогрессирования заболевания, наблюдая у пациентов с легкой степенью БА, а также в случаях легких когнитивных нарушений с высоким риском развития БА (Baldeiras et al., 2008). Также известно, что патологический Aβ является источником продукции ROS и причиной окислительного повреждения нейронов при БА (Behl et al., 1994; Harris et al., 1995; Bianca et al., 1999).
Связанный с окислительным стрессом, а также связанный с патологией БА, нарушение регуляции гомеостаза окислительно-восстановительных ионов переходных металлов, включая цинк, медь и железо (Schrag et al., 2011; Ventriglia et al., 2012; Ayton et al., 2015). Как повышение, так и дефицит цинка связаны с БА, и данные свидетельствуют о том, что измененная компартментализация цинка, а не измененные уровни цинка, могут быть причиной патологии цинка при БА (Suh et al., 2000; Schrag et al., 2011). Это подтверждается нарушением регуляции многочисленных переносчиков цинка в головном мозге пациентов с БА (Lovell et al., 2005, 2006; Beyer et al., 2009). Цинк играет важную роль в нормальном функционировании нейронов и вместе с глутаматом высвобождается в синапсах (Vogt et al., 2000). Основная роль цинка заключается в его значительной антиоксидантной способности, так что дефицит цинка связан с окислительным стрессом нейронов (Aimo et al., 2010). Как и цинк, повышение содержания меди и дефицит меди связаны с БА, а также с локализацией меди с бляшками Aβ (Miller et al., 2006; Schrag et al., 2011; Ventriglia et al., 2012). Медь также модулируется синаптической активацией в нейронах, и цинк и медь способны связывать Aβ (Schlief et al., 2005; Tõugu et al., 2008). При патологии БА медь усиливает токсичность Аβ, а комплексы медь: Аβ являются источником продукции АФК и окислительного повреждения нейронов (Дикалов и др., 2004; Лю и др., 2008; Эллис и др., 2010).
Редокс-активное железо, хотя и жизненно важно для клеточной функции, также является прооксидантом и способствует образованию высокореактивных гидроксильных радикалов из перекиси водорода. Повышенные уровни железа в головном мозге при БА, а также связь железа с бляшками Aβ и нейрофибриллярными клубками были обнаружены в различных исследованиях (Smith et al., 1997; Барцокис и др., 2000; Raven et al., 2013). Недавно было показано, что повышенное содержание железа предсказывает прогрессирование БА, а повышенное содержание железа связано с аллелем риска АПОЕ-4, что позволяет предположить, что он может иметь патологическую роль в БА (Ayton et al., 2015).
Другой общий признак БА, который способствует патологии БА, — сосудистая дисфункция. Цереброваскулярное заболевание, характеризующееся нарушением кровотока в головном мозге, значительно увеличивает риск БА и возникает до накопления Aβ и когнитивного снижения (Arvanitakis et al., 2016). В моделях на животных гипоперфузия также приводит к симптомам, сходным с симптомами БА, и усугубляет существующую патологию БА (Walsh et al., 2002; Wang et al., 2010b). Дисфункция сосудов вносит свой вклад в патологию AD из-за более низкой плотности капилляров, что означает сужение кровеносных сосудов и снижение CBF (Hamel et al., 2008). Уменьшение кровотока снижает поступление метаболитов и кислорода в мозг и потенциально способствует накоплению Aβ за счет нарушения клиренса нейротоксических молекул (Shibata et al., 2000; Кумар-Сингх и др., 2005). Считается, что сам по себе Aβ усиливает дефицит CBF и утилизации глюкозы при AD за счет нарушения вазодилатации и цереброваскулярных механизмов ауторегуляции (Niwa et al., 2002). Цереброваскулярная дисфункция может привести к нарушению метаболизма кислорода из-за гипоперфузии-гипоксии, а гипоксия, в свою очередь, может усилить патологию БА, способствуя фосфорилированию тау-белка, а также транскрипционно активируя мишень HIF-1, фермент 1 расщепления белка-предшественника β-амилоида β-сайта (BACE1). который расщепляет белок-предшественник амилоида (APP) с образованием Aβ (Рисунок 3; Sun et al., 2006).
Рисунок 3 . Нарушенные метаболические пути при нейродегенеративных заболеваниях. Гипоксия, связанная с болезнью Альцгеймера (БА), приводит к увеличению активности HIF-1α-мишени, фермента 1 расщепления белка-предшественника β-амилоида в β-сайте (BACE1), который расщепляет белок-предшественник амилоида (APP) с образованием Aβ. Aβ накапливается в митохондриях нейронов (MC) на ранних стадиях прогрессирования заболевания и нарушает окислительный метаболизм. Продукция ацетил-КоА и вход в цикл триабоксициловой кислоты (ТСА) снижается при БА за счет снижения активности комплекса пируватдегидрогеназы (ПДГК).При всех трех заболеваниях активность комплекса α-кетоглутаратдегидрогеназы (KGDHC) снижается, активные формы кислорода (ROS) увеличиваются, а активность трансглутаминазы (TG) повышается. ТГ увеличивает агрегацию α-синуклеина и снижает окислительное дыхание.
Болезнь Паркинсона и Хантингтона
Помимо редких случаев генетических мутаций при семейном БА, основным фактором риска развития БА является старение. Соответственно, AD имеет ряд общих черт с другими нейродегенеративными расстройствами с поздним началом, включая болезнь Паркинсона (PD) и болезнь Хантингтона (HD).Считается, что БП вызывается как генетическими факторами, так и факторами окружающей среды и в первую очередь влияет на двигательную функцию пациента. БП включает образование белковых агрегатов, состоящих в основном из α-синуклеина, и влияет на дофаминергические нейроны черной субстанции среднего мозга. HD — это наследственное нейродегенеративное заболевание, вызванное расширенными повторами CAG в гене Хантингтина (HTT), вызывающее прогрессирующую дегенерацию нейронов и гибель клеток во всем мозге, влияя на настроение, познавательные способности и двигательные навыки. Включения также обнаруживаются в головном мозге HD в результате агрегации мутантного белка HTT (mHTT).Как и БА, как БП, так и БД связаны с повышенным окислительным стрессом, а также снижением активности фермента KGDHC (Tabrizi et al., 2000; Gibson et al., 2003; Klivenyi et al., 2004; Zhou et al., 2008). ). Кроме того, общим для всех трех заболеваний является повышенная активность трансглутаминазы (TG; Johnson et al., 1997; Junn et al., 2003; Jeitner et al., 2008). TG катализирует посттрансляционные модификации белков при полиаминировании, известно, что он усиливается ROS, а также ослабляет передачу сигналов HIF-1 (Campisi et al., 2004; Филиано и др., 2008). TG может снижать окислительный метаболизм посредством модификации гликолитических ферментов и, как известно, вызывает окислительный стресс при HD и агрегацию α-синуклеина при PD (Cooper et al., 1997; Junn et al., 2003; Kim et al., 2005).
Мутации в митохондриальных генах также были идентифицированы в случаях семейной болезни Паркинсона и воздействия нейротоксина MPP +, который ингибирует комплекс I ETC и, следовательно, окислительное дыхание вызывает стойкий паркинсонизм (Langston et al., 1983; Parker and Parks, 2005; Plun- Favreau et al., 2007). Измененный гомеостаз ионов металлов может играть роль в патологии БП, а также нарушенные уровни цинка и меди, наблюдаемые у пациентов с БП (Brewer et al., 2010; Davies et al., 2014). Подобно Aβ, медь также участвует в агрегации α-синуклеина и может способствовать окислительному стрессу за счет образования реактивных комплексов медь: α-синуклеин (Wang et al., 2010a; Dell’Acqua et al., 2015). Известно также, что α-синуклеин усугубляет дисфункцию митохондрий в присутствии токсичных окислителей, при этом потеря α-синуклеина в моделях на животных приводит к устойчивости к митохондриальным токсинам (Klivenyi et al., 2006; Норрис и др., 2007). Кроме того, уровни α-синуклеина повышаются, когда окислительный метаболизм ингибируется, а модели на животных, экспрессирующие мутантные формы α-синуклеина, демонстрируют дегенерацию митохондрий нейронов и гибель клеток (Lee et al., 2002; Martin et al., 2006). При HD наблюдается повышенное окислительное повреждение митохондриальной ДНК, а также более высокая частота делеций в митохондриальном геноме и дефицит функции ETC со снижением экспрессии комплекса II в полосатом теле и снижением активности комплекса IV в полосатом теле и кортикальных областях (Horton et al. al., 1995; Polidori et al., 1999). Проницаемость митохондрий нейронов также нарушается белком mHTT из-за увеличения чувствительности поры перехода проницаемости к концентрации Ca 2+ , что приводит к дисфункции митохондрий и снижению продукции АТФ (Brustovetsky et al., 2003; Milakovic et al., 2006). Сосудистый дефицит и нарушение кровотока являются основной патологией HD, а также изменением плотности и размера кровеносных сосудов, обнаруживаемых в сером веществе коры, скорлупе и полосатом теле мозга.У пациентов с HD включения mHTT также обнаруживаются в базальной мембране и эпителии кортикальных кровеносных сосудов, а на мышиных моделях болезни перицитарный охват кортикальных и полосатых кровеносных сосудов снижен (Drouin-Ouellet et al., 2015; Hsiao et al. ., 2015).
Старение
Ряд метаболических патологий, наблюдаемых при нейродегенеративных расстройствах, связан с нормальным старением и может объяснять возрастные проявления фенотипов нейродегенеративных заболеваний.Хотя свободные радикалы и окислительный стресс больше не считаются прямой причиной старения, они накапливаются в стареющем мозге, как при нейродегенерации (Smith et al., 1992). Функция митохондрий также связана со старением из-за ассоциации гаплотипов митохондриальной ДНК (мтДНК) с долголетием и образования мышей-мутаторов мтДНК, которые имеют фенотип преждевременного старения (Trifunovic et al., 2004; Alexe et al., 2007; Bilal et al., 2007; Bilal et al. др., 2008). Также было показано, что существует повышенная частота повреждающих мутаций в мтДНК постмитотических стареющих клеток по сравнению со стареющими митотическими клетками (Greaves et al., 2012). Хотя было высказано предположение, что соматическая скорость мутации мтДНК вряд ли будет иметь патологический эффект из-за избыточности числа митохондрий клеток, в постмитотических нейронах частота мутаций мтДНК значительно выше, чем в среднем, а в пределах коры — MC с большим количеством мтДНК. делеции обладают репликативным преимуществом во время экспансии митохондрий (Song et al., 2005; Bender et al., 2006; Kraytsberg et al., 2006; Fukui and Moraes, 2009). Помимо болезни Альцгеймера и болезни Паркинсона, дефицит цинка также связан со старением, который уменьшается у пожилых людей в целом (Pepersack et al., 2001). Снижение CBF происходит при нормальном старении, а также при корковой перфузии, которая, как было установлено, снижается с возрастом у здоровых взрослых (Chen et al., 2011). Зависимое от возраста снижение периктиев также происходит у мышей и связано с микрососудистыми изменениями и нейродегенерацией (Bell et al., 2010). Таким образом, существуют существенные доказательства, подтверждающие, что нарушение снабжения нейронов кислородом и окислительного метаболизма является основным патологическим компонентом возрастной нейродегенерации.
Кислородный метаболизм как фактор пластичности нейронов
Хотя было хорошо установлено, что метаболическая регуляция имеет решающее значение для функции нейронов и что метаболическая дисфункция является основной патологией при заболеваниях, влияющих на поведение и познание, мало что известно о том, как регуляторы метаболизма могут участвовать в пластичности нейронов.Однако ряд исследований подтверждает прямую роль метаболической регуляции и метаболически связанных генов во влиянии на обучение и память. Один из лучших примеров этого — разоблачение гипоксии как модулятора когнитивных функций. В C. elegans гипоксия действует как усилитель вкусового сенсорного восприятия посредством Hif-1-зависимой индукции нейромедиатора серотонина в определенных сенсорных нейронах (Pocock and Hobert, 2010). В моделях на грызунах воздействие гипобарической гипоксии у взрослых крыс в течение периодов 7–21 дней вызывает снижение пространственного обучения, подобное старению, и связано со старением отложения липофусцина и ультраструктурных изменений в MC.Увеличение продолжительности воздействия гипобарической гипоксии также положительно коррелирует с увеличением экспрессии маркеров старения (Biswal et al., 2016). Кратковременное гипоксическое воздействие (100 с) у крыс также вызывает синаптическую остановку пирамидных нейронов гиппокампа CA1 и дефицит пространственной памяти, которые устраняются блокадой рецепторов аденозина, тормозящего нейромедиатора (Sun et al., 2002). Прерывистая гипоксия (интервалы 90–120 с 6–10% O 2 в течение 10 часов в день) также вызывает дефицит пространственной памяти у взрослых крыс, который можно предотвратить введением антиоксиданта (Row et al., 2003; Ward et al., 2009). Напротив, долгосрочное облегчение двигательной активности у взрослых крыс усиливается перемежающейся гипоксией (интервалы 3 × 3 мин, разделенные гипероксией 5 мин), увеличивая как диафрагмальную амплитуду, так и частоту всплесков, чего не наблюдалось при постоянной гипоксии того же типа. совокупная продолжительность (Baker and Mitchell, 2000). Различные эффекты гипоксии на пластичность мозга, вероятно, связаны с разными воздействиями, а также с измерением разных результатов. Интересно отметить, что предварительное кондиционирование легкой гипоксии обеспечивает защиту когнитивных способностей во время последующего воздействия тяжелой гипоксии, в которой участвуют HIF и транскрипционные изменения, вызванные легкой гипоксией (Рыбникова и др., 2005). В самом деле, нокаут нейронов HIF-1α у мышей нарушает пространственную память, а стабилизация HIF улучшает память гиппокампа при формировании условий страха (Tomita et al., 2003; Adamcio et al., 2010). Подобные нарушения обучения и возрастные изменения также наблюдаются в модели старения, вызванной D-галактозой, где окислительное повреждение было основным стимулом для старения (Li et al., 2016).
В исследованиях обучения и памяти с использованием парадигмы ингибиторного избегания изменения в экспрессии метаболических генов наблюдались через 24 часа с повышенной экспрессией Na + / K + АТФазы, Glut1, Glut3 и, что наиболее заметно, переносчиков лактата MCT1 и Обнаружен MCT4, что указывает на то, что транскрипционная модуляция нейрометаболической связи происходит после обучения (Yao et al., 2009; Тади и др., 2015). Измененная экспрессия метаболических ферментов и транспортеров лактата также связана с индуцированным стрессом улучшением когнитивной функции. Психологический стресс, хотя и вреден при хронических состояниях, эволюционировал для улучшения когнитивных функций и улучшения реакции на стрессовые ситуации за счет активации адренорецепторов гипоталамусом и выработки глюкокортикоидов в системе гипоталамус-гипофиз-надпочечники (Dong et al., 2017). В мышиной модели стресса, вызванного активацией β2-адренергического рецептора (β2AR), когнитивные функции улучшались при кратковременной (3-5 дней) активации, в то время как более длительная активация (> 6 дней) была вредной.Улучшение когнитивной функции после кратковременной индукции стресса соответствует зависимому от β2AR увеличению экспрессии LDH A, MCT1 и MCT4, экспрессия которой модулируется активацией β-аррестином-1 HIF-1α, ниже β2AR (Dong et al. , 2017).
Измененная экспрессия генов окислительного фосфорилирования ETC также связана с измененным поведением медоносной пчелы. В исследовании, посвященном изучению молекулярных профилей агрессивного поведения медоносных пчел, окислительное фосфорилирование было наиболее значительно обогащено в связи с повышенной агрессивностью.Было обнаружено, что это верно в отношении старых пчел, которые проявляют повышенное агрессивное поведение, а также проявляют повышенную агрессивность окружающей среды в результате воздействия феромонов тревоги и генетической агрессии, происходящей в популяции африканизированных медоносных пчел (Alaux et al., 2009). В соответствии с этим ингибирование окислительного фосфорилирования путем лечения лекарствами, нацеленными на цикл TCA, увеличивало агрессивность медоносных пчел, измеренную с помощью анализа вторжения (Li-Byarlay et al., 2014). В том же исследовании, специфичный для клеточного типа нокдаун комплексных генов ETC с использованием драйверов GAL4 в Drosophila показал, что нейрон-специфический, но не специфичный для глии нокдаун гена комплекса I, подобного ND20, значительно усиливает агрессивное поведение мух при выпаде. (Ли-Бьярлай и др., 2014).
Также участвуют в обучении и памяти некодирующие гены miRNA, которые регулируются во время нейрональной активности с помощью различных механизмов и способны регулировать трансляцию различных нижестоящих генов-мишеней. Ряд miRNAs были связаны с пластичностью, включая регулируемую гипоксией мишень HIF-1, miR-210, которая, как известно, участвует в регуляции метаболизма. miR-210 значительно активируется через 24 часа после формирования долговременной памяти у медоносной пчелы с использованием парадигмы обонятельного кондиционирования.Повышающая регуляция miR-210 коррелировала с понижающей регуляцией ряда метаболически связанных генов, кодирующих белок, включая Gapdh3, глюкозодегидрогеназу, Laccase2 и подобную альдозоредуктазе. Ингибирование miR-210 обработкой пчел miR-210 antogmiR также привело к снижению сохранения памяти в тесте обонятельного кондиционирования, что указывает на функциональную роль в обучении и памяти (Cristino et al., 2014). Учитывая чувствительность нейронов и нервных структур к гипоксии, Cristino et al.(2014) предполагают, что небольшие изменения уровня кислорода в нейронах метаболической активности могут вызывать экспрессию miR-210, которая, в свою очередь, нацелена на ключевые молекулы, включая молекулы пластичности, аспарагинсинтетазу (участвующую в биосинтезе глутамата) и актин. Последующее исследование показало, что в нейрональной клеточной линии человеческого происхождения miR-210 нацелена на гены, связанные с нейродегенерацией, а также на другие гены, связанные с пластичностью, в человеческом транскриптоме. Это включало ряд генов окислительного метаболизма, ген риска БА APOE , а также NMDA-R, GRINA и гомолог актина человека ACTB (Watts et al., 2018). Другая регулируемая гипоксией miRNA, miR-181c, также связана с модулированием когнитивной функции у крыс. В модели хронической церебральной гипоперфузии miR-181c постоянно ингибировалась, что коррелировало с активацией его гена-мишени, связанного с пластичностью, TRIM2. Гипоперфузия в этой модели была связана с дефицитом пространственного обучения, который улучшался гиперэкспрессией miR-181c в гиппокампе (Fang et al., 2017). Все эти исследования подтверждают гипотезу о том, что метаболически регулируемые гены непосредственно участвуют в регуляции пластичности нейронов.
Заключение
В то время как механизмы нервно-сосудистого взаимодействия, по-видимому, поддерживают стабильные уровни кислорода в головном мозге, становится очевидным, что нервно-сосудистое разобщение на самом деле может иметь физиологическую роль в регулировании пластичности посредством кислородного истощения и индукции последующих путей ответа на гипоксию. Нарушения гипоксии и окислительного метаболизма также широко приписываются патологии нейродегенерации, хотя отсутствует понимание того, как эти нарушения запускаются и как они могут быть терапевтически нацелены, чтобы остановить прогрессирование заболевания и улучшить когнитивные и двигательные функции.Изменение поведения, включая обучение и память, связанное с нарушением регуляции метаболических генов, подчеркивает важность понимания роли метаболизма кислорода в пластичности нейронов. Дальнейшее выяснение того, как путь ответа на гипоксию и другие метаболические гены участвуют в функции нейронов, будет иметь решающее значение для определения молекулярных связей между когнитивной функцией и окислительным метаболизмом. Это, в свою очередь, поможет выяснить, как нарушение обмена веществ может привести к когнитивным нарушениям и нейродегенеративным заболеваниям.
Авторские взносы
Рукопись написанаМВт. РП и СС редактировали рукопись.
Финансирование
МВт было поддержано стипендией в рамках программы стипендий правительства Австралии. RP был поддержан старшим научным сотрудником Национального совета по здравоохранению и медицинским исследованиям (GNT1137645). CC был поддержан Future Fellowship Австралийского исследовательского совета (FT110100292).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
Adamcio, B., Sperling, S., Hagemeyer, N., Walkinshaw, G., and Ehrenreich, H. (2010). Стабилизация индуцируемого гипоксией фактора приводит к стойкому улучшению памяти гиппокампа у здоровых мышей. Behav. Brain Res. 208, 80–84. DOI: 10.1016 / j.bbr.2009.11.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аймо, Л., Черр, Г. Н., Отейза, П. И. (2010). Низкое содержание внеклеточного цинка увеличивает выработку оксиданта нейронами за счет активации надфоксидазы и синтазы оксида азота. Free Radic. Биол. Med. 48, 1577–1587. DOI: 10.1016 / j.freeradbiomed.2010.02.040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Alaux, C., Sinha, S., Hasadsri, L., Hunt, G.J., Guzmán-Novoa, E., DeGrandi-Hoffman, G., et al. (2009). Агрессия медоносных пчел поддерживает связь между регуляцией генов и эволюцией поведения. Proc. Natl. Акад. Sci. U S A 106, 15400–15405. DOI: 10.1073 / pnas.0
3106PubMed Аннотация | CrossRef Полный текст | Google Scholar
Алексей, Г., Fuku, N., Bilal, E., Ueno, H., Nishigaki, Y., Fujita, Y., et al. (2007). Обогащение фенотипа долголетия гаплогруппами мтДНК D4b2b, D4a и D5 в популяции Японии. Hum. Genet. 121, 347–356. DOI: 10.1007 / s00439-007-0330-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Арчер, С. Л., Хуанг, Дж. М., Хэмпл, В., Нельсон, Д. П., Шульц, П. Дж., И Вейр, Э. К. (1994). Оксид азота и цГМФ вызывают вазорелаксацию за счет активации харибдотоксин-чувствительного К-канала цГМФ-зависимой протеинкиназой. Proc. Natl. Акад. Sci. U S A 91, 7583–7587. DOI: 10.1073 / pnas.91.16.7583
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Арванитакис, З., Капуано, А. В., Леурганс, С. Э., Беннет, Д. А., и Шнайдер, Дж. А. (2016). Связь заболевания сосудов головного мозга с деменцией при болезни Альцгеймера и когнитивными функциями у пожилых людей: перекрестное исследование. Lancet Neurol. 15, 934–943. DOI: 10.1016 / s1474-4422 (16) 30029-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Арвидссон, А., Коллин, Т., Кирик, Д., Кокая, З., и Линдвалл, О. (2002). Замена нейронов из эндогенных предшественников в мозге взрослого человека после инсульта. Nat. Med. 8, 963–970. DOI: 10,1038 / нм747
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аттуэлл, Д., и Лафлин, С. Б. (2001). Энергетический баланс для передачи сигналов в сером веществе мозга. J. Cereb. Blood Flow Metab. 21, 1133–1145. DOI: 10.1097 / 00004647-200110000-00001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эйтон, С., Фокс, Н. Г., Буш, А. И., и Инициатива по нейровизуализации болезни Альцгеймера (2015). Уровни ферритина в спинномозговой жидкости предсказывают исходы болезни Альцгеймера и регулируются APOE. Nat. Commun. 6: 6760. DOI: 10.1038 / ncomms7760
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бейкер Т. Л. и Митчелл Г. С. (2000). Эпизодическая, но не непрерывная гипоксия вызывает долгосрочное облегчение диафрагмальной моторной активности у крыс. J. Physiol. 529, 215–219.DOI: 10.1111 / j.1469-7793.2000.00215.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Baldeiras, I., Santana, I., Proenca, M. T., Garrucho, M. H., Pascoal, R., Rodrigues, A., et al. (2008). Периферическое окислительное повреждение при легких когнитивных нарушениях и легкой форме болезни Альцгеймера. J. Alzheimers Dis. 15, 117–128. DOI: 10.3233 / jad-2008-15110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Барцокис, Г., Сульцер, Д., Каммингс, Дж., Холт, Л. Е., Ханс, Д. Б., Хендерсон, В. В. и др. (2000). in vivo оценка железа в головном мозге при болезни Альцгеймера с использованием магнитно-резонансной томографии. Arch. Gen. Psychiatry 57, 47–53. DOI: 10.1001 / archpsyc.57.1.47
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Беланже, М., Янг, Дж., Пети, Дж. М., Ларош, Т., Магистретти, П. Дж., И Алламан, И. (2011). Роль глиоксалазной системы в опосредованной астроцитами нейрозащите. J. Neurosci. 31, 18338–18352. DOI: 10.1523 / JNEUROSCI.1249-11.2011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Белл Р. Д., Винклер Э. А., Сагаре А. П., Сингх И., Ла Рю Б., Дин Р. и др. (2010). Перициты контролируют ключевые нервно-сосудистые функции и нейрональный фенотип в мозге взрослого человека и во время старения мозга. Нейрон 68, 409–427. DOI: 10.1016 / j.neuron.2010.09.043
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бендер, А., Кришнан, К. Дж., Моррис, К. М., Тейлор, Г. А., Рив, А. К., Перри, Р. Х. и др. (2006). Высокий уровень делеций митохондриальной ДНК в нейронах черного вещества при старении и болезни Паркинсона. Nat. Genet. 38, 515–517. DOI: 10.1038 / ng1769
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бержерон М., Ю. А. Ю., Солуэй, К. Э., Семенца, Г. Л., и Шарп, Ф. Р. (1999). Индукция индуцируемого гипоксией фактора-1 (HIF-1) и его генов-мишеней после очаговой ишемии в головном мозге крыс. евро. J. Neurosci. 11, 4159–4170. DOI: 10.1046 / j.1460-9568.1999.00845.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бейер Н., Колсон Д. Т., Хеггарти С., Рэвид Р., Ирвин Г. Б., Хеллеманс Дж. И др. (2009). Уровни мРНК ZnT3 снижены в посмертном мозге при болезни Альцгеймера. Мол. Neurodegener. 4:53. DOI: 10.1186 / 1750-1326-4-53
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бьянка, В. Д., Дуси, С., Бьянкини, Э., Даль Пра, И., и Росси, Ф. (1999). β-амилоид активирует O-2-образующую НАДФН-оксидазу в микроглии, моноцитах и нейтрофилах. Возможный воспалительный механизм повреждения нейронов при болезни Альцгеймера. J. Biol. Chem. 274, 15493–15499. DOI: 10.1074 / jbc.274.22.15493
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Билал, Э., Рабадан, Р., Алексей, Г., Фуку, Н., Уэно, Х., Нишигаки, Ю. и др. (2008). Гаплогруппа D4a митохондриальной ДНК является маркером экстремального долголетия в Японии. PLoS One 3: e2421. DOI: 10.1371 / journal.pone.0002421
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бисвал, С., Шарма, Д., Кумар, К., Наг, Т. К., Бархвал, К., Хота, С. К. и др. (2016). Нарушение обучения и пространственной памяти, вызванное глобальной гипоксией, связано с преждевременным старением гиппокампа. Neurob. Учиться. Mem. 133, 157–170. DOI: 10.1016 / j.nlm.2016.05.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Биттар, П.Г., Чарне, Ю., Пеллерин, Л., Бурас, К., и Маджистретти, П. Дж. (1996). Селективное распределение изоферментов лактатдегидрогеназы в нейронах и астроцитах головного мозга человека. J. Cereb. Blood Flow Metab. 16, 1079–1089. DOI: 10.1097 / 00004647-199611000-00001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бренман, Дж. Э., Чао, Д. С., Джи, С. Х., МакГи, А. В., Крейвен, С. Е., Сантильяно, Д. Р., и др. (1996). Взаимодействие синтазы оксида азота с белком постсинаптической плотности PSD-95 и α1-синтрофином, опосредованное доменами PDZ. Cell 84, 757–767. DOI: 10.1016 / s0092-8674 (00) 81053-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брюер, Г. Дж., Канзер, С. Х., Циммерман, Э. А., Молхо, Э. С., Целминс, Д. Ф., Хекман, С. М. и др. (2010). Субклинический дефицит цинка при болезни Альцгеймера и Паркинсона. г. J. Alzheimers. Дис. Другой Демен. 25, 572–575. DOI: 10.1177 / 1533317510382283
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bröer, S., Rahman, B., Pellegri, G., Pellerin, L., Martin, J.L., Verleysdonk, S., et al. (1997). Сравнение транспорта лактата в астроглиальных клетках и транспортере монокарбоксилата 1 (MCT 1), экспрессирующем ооцитов Xenopus laevis . Экспрессия двух разных транспортеров монокарбоксилата в астроглиальных клетках и нейронах. J. Biol. Chem. 272, 30096–30102. DOI: 10.1074 / jbc.272.48.30096
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бустовецкий, Н., Брустовецкий, Т., Перл, К. Дж., Капано, М., Кромптон, М., и Дубинский, Дж. М. (2003). Повышенная восприимчивость митохондрий полосатого тела к изменению проницаемости, вызванному кальцием. J. Neurosci. 23, 4858–4867. DOI: 10.1523 / JNEUROSCI.23-12-04858.2003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Калингасан, Н. Ю., Учида, К., Гибсон, Г. Э. (1999). Связанный с белком акролеин: новый маркер окислительного стресса при болезни Альцгеймера. J. Neurochem. 72, 751–756.DOI: 10.1046 / j.1471-4159.1999.0720751.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Campisi, A., Caccamo, D., Li Volti, G., Currò, M., Parisi, G., Avola, R., et al. (2004). Вызванные глутаматом изменения окислительно-восстановительного состояния участвуют в активации тканевой трансглутаминазы в первичных культурах астроцитов. FEBS Lett. 578, 80–84. DOI: 10.1016 / j.febslet.2004.10.074
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кэсли, К.С., Каневари, Л., Лэнд, Дж. М., Кларк, Дж. Б. и Шарп, М. А. (2002). β-амилоид подавляет комплексное митохондриальное дыхание и активность ключевых ферментов. J. Neurochem. 80, 91–100. DOI: 10.1046 / j.0022-3042.2001.00681.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен Дж. Дж., Росас Х. Д. и Салат Д. Х. (2011). Возрастное снижение церебрального кровотока не зависит от региональной атрофии. Нейроизображение 55, 468–478. DOI: 10.1016 / j.neuroimage.2010.12.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Купер, А. Дж., Шеу, К. Р., Берк, Дж. Р., Онодера, О., Стритматтер, В. Дж., Розес, А. Д., и др. (1997). Катализируемая трансглутаминазой инактивация глицеральдегид-3-фосфатдегидрогеназы и комплекса α-кетоглутаратдегидрогеназы полиглутаминовыми доменами патологической длины. Proc. Natl. Акад. Sci. U S A 94, 12604–12609. DOI: 10.1073 / pnas.94.23.12604
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кристино, А.С., Барчук, А. Р., Фрейтас, Ф. К., Нараянан, Р. К., Бирганс, С. Д., Чжао, З. и др. (2014). Связанная с нейролигином микроРНК-932 нацелена на актин и регулирует память у пчел. Nat. Commun. 5: 5529. DOI: 10.1038 / ncomms6529
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Данболт, Н.С., Сторм-Матисен, Дж., И Каннер, Б.И. (1992). [Na + + K +] связанный переносчик L-глутамата, очищенный из мозга крысы, находится в отростках глиальных клеток. Неврология 51, 295–310.DOI: 10.1016 / 0306-4522 (92) -т
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дэвис, К. М., Бохик, С., Кармона, А., Ортега, Р., Коттам, В., Хейр, Д. Дж. И др. (2014). Патология меди в уязвимых областях мозга при болезни Паркинсона. Neurobiol. Старение 35, 858–866. DOI: 10.1016 / j.neurobiolaging.2013.09.034
PubMed Аннотация | CrossRef Полный текст
Дебернарди, Р., Пьер, К., Ленгахер, С., Магистретти, П. Дж., И Пеллерин, Л.(2003). Клеточно-специфический паттерн экспрессии транспортеров монокарбоксилата в астроцитах и нейронах, наблюдаемый в различных культурах кортикальных клеток головного мозга мышей. J. Neurosci. Res. 73, 141–155. DOI: 10.1002 / jnr.10660
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Dell’Acqua, S., Pirota, V., Anzani, C., Rocco, M.M., Nicolis, S., Valensin, D., et al. (2015). Реакционная способность комплексов медь-α-синуклеиновый пептид, относящаяся к болезни Паркинсона. Металломика 7, 1091–1102.DOI: 10.1039 / c4mt00345d
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Денко, Н. К., Фонтана, Л. А., Хадсон, К. М., Сатфин, П. Д., Райчаудхури, С., Альтман, Р. и др. (2003). Изучение физиологии гипоксических опухолей с помощью паттернов экспрессии генов. Онкоген 22, 5907–5914. DOI: 10.1038 / sj.onc.1206703
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дикалов С. И., Витек М. П., Мейсон Р. П. (2004). Пептидный комплекс медь-амилоид β стимулирует окисление аскорбата и образование гидроксильного радикала. Free Radic. Биол. Med. 36, 340–347. DOI: 10.1016 / j.freeradbiomed.2003.11.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Донахью, М. Дж., Стивенс, Р. Д., де Бордер, М., Пекар, Дж. Дж., Хендрикс, Дж., И ван Зейл, П. К. (2009). Гемодинамические изменения после визуальной стимуляции и задержки дыхания свидетельствуют о том, что мозговой кровоток и объем не связаны с метаболизмом кислорода. J. Cereb. Blood Flow Metab. 29, 176–185. DOI: 10.1038 / jcbfm.2008.109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Dong, J.H., Wang, Y.J., Cui, M., Wang, X.J., Zheng, W. S., Ma, M. L., et al. (2017). Адаптивная активация пути стрессовой реакции улучшает обучение и память за счет метаболизма лактата, регулируемого Gs и β-аррестин-1. Biol. Психиатрия 81, 654–670. DOI: 10.1016 / j.biopsych.2016.09.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дринген, Р., Куссмаул, Л., Гуттерер, Дж. М., Хиррлингер, Дж., И Хампрехт, Б. (1999). Система детоксикации перекисью глутатиона в нейронах менее эффективна, чем в астроглиальных клетках. J. Neurochem. 72, 2523–2530. DOI: 10.1046 / j.1471-4159.1999.0722523.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Друэн-Уэлле, Дж., Савяк, С. Дж., Сисбани, Г., Лагасе, М., Куан, В. Л., Сен-Пьер, М., и др. (2015). Нарушения цереброваскулярного и гематоэнцефалического барьера при болезни Хантингтона: потенциальные последствия для ее патофизиологии. Ann. Neurol. 78, 160–177. DOI: 10.1002 / ana.24406
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ду, Х., Го, Л., Ян, С., Сосунов, А. А., Маккханн, Г. М., и Ян, С. С. (2010). Ранние дефициты синаптических митохондрий на мышиной модели болезни Альцгеймера. Proc. Natl. Акад. Sci. U S A 107, 18670–18675. DOI: 10.1073 / pnas.1006586107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эллис, Г., Фанг, Э., Maheshwari, M., Roltsch, E., Holcomb, L., Zimmer, D., et al. (2010). Окисление липидов и модификация амилоида-β (Aβ) in vitro и in vivo . J. Alzheimers Dis. 22, 593–607. DOI: 10.3233 / JAD-2010-100960
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фанг, К., Ли, К., Мин, Г., Лю, М., Цуй, Дж., Сан, Дж. И др. (2017). MicroRNA-181c улучшает когнитивные нарушения, вызванные хронической гипоперфузией головного мозга у крыс. Мол.Neurobiol. 54, 8370–8385. DOI: 10.1007 / s12035-016-0268-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Филиано А. Дж., Бейли К. Д., Тухольски Дж., Гундемир С. и Джонсон Г. В. (2008). Трансглутаминаза 2 защищает от ишемического инсульта, взаимодействует с HIF1β и ослабляет передачу сигналов HIF1. FASEB J. 22, 2662–2675. DOI: 10.1096 / fj.07-097709
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фрам Дж., Бодевиг Дж., Калленберг, К., Каструп, А., Мербольдт, К. Д., и Дечент, П. (2008). Недостаточный импульс после стимуляции в BOLD фМРТ головного мозга человека не вызван повышенным объемом церебральной крови. Нейроизображение 40, 473–481. DOI: 10.1016 / j.neuroimage.2007.12.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фрам Дж., Крюгер Г., Мербольдт К. Д. и Кляйншмидт А. (1996). Динамическое разъединение и восстановление перфузионного и окислительного метаболизма во время фокальной активации мозга у человека. Magn. Резон. Med. 35, 143–148. DOI: 10.1002 / mrm.1
0202
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фукуи, Х., Мораес, К. Т. (2009). Механизмы образования и накопления делеций митохондриальной ДНК в стареющих нейронах. Hum. Мол. Genet. 18, 1028–1036. DOI: 10.1093 / hmg / ddn437
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Габбита, С. П., Ловелл, М. А., и Маркесбери, В. Р. (1998). Повышенное окисление ядерной ДНК в головном мозге при болезни Альцгеймера. J. Neurochem. 71, 2034–2040. DOI: 10.1046 / j.1471-4159.1998.71052034.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гартуэйт Дж., Чарльз С. Л. и Чесс-Уильямс Р. (1988). Высвобождение производного эндотелия релаксирующего фактора при активации рецепторов NMDA предполагает их роль в качестве межклеточного посредника в головном мозге. Природа 336, 385–388. DOI: 10.1038 / 336385a0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гибсон, Г.E., Kingsbury, A.E., Xu, H., Lindsay, J.G., Daniel, S., Foster, O.J., et al. (2003). Дефицит фермента цикла трикарбоновых кислот в головном мозге пациентов с болезнью Паркинсона. Neurochem. Int. 43, 129–135. DOI: 10.1016 / s0197-0186 (02) 00225-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гривз, Л. К., Элсон, Дж. Л., Нутебум, М., Грейди, Дж. П., Тейлор, Г. А., Тейлор, Р. В. и др. (2012). Сравнение спектров митохондриальных мутаций в стареющем эпителии толстой кишки человека и заболевании: отсутствие доказательств очищающего отбора точечных мутаций соматической митохондриальной ДНК. PLoS Genet. 8: e1003082. DOI: 10.1371 / journal.pgen.1003082
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Greilberger, J., Koidl, C., Greilberger, M., Lamprecht, M., Schroecksnadel, K., Leblhuber, F., et al. (2008). Малоновый диальдегид, карбонильные белки и дисульфид альбумина в качестве полезных маркеров окисления при легких когнитивных нарушениях и болезни Альцгеймера. Free Radic. Res. 42, 633–638. DOI: 10.1080 / 10715760802255764
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Го, С., Брагина, О., Сюй, Ю., Цао, З., Чен, Х., Чжоу, Б. и др. (2008). Глюкоза регулирует экспрессию HIF-1α в первичных корковых нейронах в ответ на гипоксию за счет поддержания клеточного окислительно-восстановительного статуса. J. Neurochem. 105, 1849–1860. DOI: 10.1111 / j.1471-4159.2008.05287.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Халим, Н. Д., МакФейт, Т., Мохиелдин, А., Окагаки, П., Короткина, Л. Г., Патель, М. С. и др. (2010). Статус фосфорилирования пируватдегидрогеназы различает метаболические фенотипы культивируемых астроцитов и нейронов головного мозга крыс. Glia 58, 1168–1176. DOI: 10.1002 / glia.20996
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хамель Э., Николакакис Н., Абулкасим Т., Онгали Б. и Тонг X. К. (2008). Окислительный стресс и цереброваскулярная дисфункция на мышиных моделях болезни Альцгеймера. Exp. Physiol. 93, 116–120. DOI: 10.1113 / expphysiol.2007.038729
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Харрис, М. Э., Хенсли, К., Баттерфилд, Д.А., Лидл, Р. А., и Карни, Дж. М. (1995). Прямое свидетельство окислительного повреждения, вызываемого β-амилоидным пептидом Альцгеймера (1–40) в культивируемых нейронах гиппокампа. Exp. Neurol. 131, 193–202. DOI: 10.1016 / 0014-4886 (95) -1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хенсли К., Холл Н., Субраманиам Р., Коул П., Харрис М., Аксенов М. и др. (1995). Региональное соответствие мозга между гистопатологией болезни Альцгеймера и биомаркерами окисления белков. J. Neurochem. 65, 2146–2156. DOI: 10.1046 / j.1471-4159.1995.65052146.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эрреро-Мендес, А., Алмейда, А., Фернандес, Э., Маэстре, К., Монкада, С., и Боланос, Дж. П. (2009). Биоэнергетический и антиоксидантный статус нейронов контролируется непрерывной деградацией ключевого гликолитического фермента под действием APC / C-Cdh2. Nat. Cell Biol. 11, 747–752. DOI: 10.1038 / ncb1881
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Герц, Л., Schousboe, A., Boechler, N., Mukerji, S., and Fedoroff, S. (1978). Кинетические характеристики поглощения глутамата нормальными астроцитами в культурах. Neurochem. Res. 3, 1–14. DOI: 10.1007 / bf00964356
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хоге, Р. Д., Франческини, М. А., Коволан, Р. Дж., Хупперт, Т., Мандевиль, Дж. Б., и Боас, Д. А. (2005). Одновременная запись вызванных заданием изменений в оксигенации, объеме и потоке крови с использованием диффузной оптической визуализации и МРТ с меткой спина артерий. Нейроизображение 25, 701–707. DOI: 10.1016 / j.neuroimage.2004.12.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хортон, Т. М., Грэм, Б. Х., Коррал-Дебрински, М., Шоффнер, Дж. М., Кауфман, А. Е., Бил, М. Ф. и др. (1995). Заметное увеличение уровней делеций митохондриальной ДНК в коре головного мозга у пациентов с болезнью Хантингтона. Неврология 45, 1879–1883. DOI: 10.1212 / wnl.45.10.1879
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сяо, Х.Y., Chen, Y.C., Huang, C.H., Chen, C.C., Hsu, Y.H., Chen, H.M. и др. (2015). Аберрантные астроциты ухудшают реактивность сосудов при болезни Гентингтона. Ann. Neurol. 78, 178–192. DOI: 10.1002 / ana.24428
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хансбергер, Дж. Г., Беннет, А. Х., Сельванаягам, Э., Думан, Р. С., и Ньютон, С. С. (2005). Генетическое профилирование реакции на судороги, вызванные каиновой кислотой. Мол. Brain Res. 141, 95–112. DOI: 10.1016 / j.molbrainres.2005.08.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хайдер Ф., Ротман Д. Л. и Беннетт М. Р. (2013). Потребность корковой энергии в сигнальных и несигнальных компонентах мозга сохраняется у всех видов млекопитающих и на разных уровнях активности. Proc. Natl. Акад. Sci. U S A 110, 3549–3554. DOI: 10.1073 / pnas.1214
0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Иван М., Кондо К., Ян Х., Kim, W., Valiando, J., Ohh, M., et al. (2001). HIFα направлен на VHL-опосредованное разрушение путем гидроксилирования пролина: последствия для восприятия O 2 . Наука 292, 464–468. DOI: 10.1126 / science.1059817
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Яаккола П., Моль Д. Р., Тиан Ю. М., Уилсон М. И., Гилберт Дж., Гаскелл С. Дж. И др. (2001). Нацеливание HIF-α на комплекс убиквитилирования фон Хиппеля-Линдау посредством O2-регулируемого гидроксилирования пролила. Наука 292, 468–472. DOI: 10.1126 / science.1059796
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джейтнер, Т. М., Матсон, В. Р., Фолк, Дж. Э., Бласс, Дж. П., и Купер, А. Дж. (2008). Повышенные уровни γ-глутамиламинов в спинномозговой жидкости при болезни Гентингтона. J. Neurochem. 106, 37–44. DOI: 10.1111 / j.1471-4159.2008.05350.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонсон, Г. В., Кокс, Т. М., Локхарт, Дж. П., Зиннерман, М. Д., Миллер, М. Л., и Пауэрс, Р. Э. (1997). Активность трансглутаминазы увеличивается в мозге при болезни Альцгеймера. Brain Res. 751, 323–329. DOI: 10.1016 / s0006-8993 (96) 01431-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джунн, Э., Ронкетти, Р. Д., Кесадо, М. М., Ким, С. Ю., и Мурадян, М. М. (2003). Тканевая трансглутаминаза-индуцированная агрегация α-синуклеина: значение для образования телец Леви при болезни Паркинсона и деменции с тельцами Леви. Proc. Natl. Акад. Sci. США 100, 2047–2052. DOI: 10.1073 / pnas.0438021100
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Касишке К. А., Вишвасрао Х. Д., Фишер П. Дж., Зипфель В. Р. и Уэбб В. В. (2004). Нервная активность запускает окислительный метаболизм нейронов, за которым следует астроцитарный гликолиз. Наука 305, 99–103. DOI: 10.1126 / science.1096485
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким, С.Ю., Мареков, Л., Буббер, П., Браун, С. Е., Ставровская, И., Ли, Дж. И др. (2005). Митохондриальная аконитаза является субстратом трансглутаминазы 2: трансглютаминация является вероятным механизмом, способствующим образованию высокомолекулярных агрегатов аконитазы и потере активности аконитазы в головном мозге при болезни Гентингтона. Neurochem. Res. 30, 1245–1255. DOI: 10.1007 / s11064-005-8796-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким Дж. У., Чернышёв И., Семенза Г.Л. и Данг, К. В. (2006). HIF-1-опосредованная экспрессия киназы пируватдегидрогеназы: метаболический переключатель, необходимый для клеточной адаптации к гипоксии. Cell Metab. 3, 177–185. DOI: 10.1016 / j.cmet.2006.02.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кливени П., Сивек Д., Гардиан Г., Янг Л., Старков А., Клерен К. и др. (2006). Мыши, лишенные α-синуклеина, устойчивы к митохондриальным токсинам. Neurobiol. Дис. 21, 541–548.DOI: 10.1016 / j.nbd.2005.08.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кливеньи П., Старков А.А., Калингасан Н.Ю., Гардиан Г., Браун С.Э., Янг Л. и др. (2004). Мыши с дефицитом дигидролипоамиддегидрогеназы проявляют повышенную уязвимость к нейротоксичности МФТП, малоната и 3-нитропропионовой кислоты. J. Neurochem. 88, 1352–1360. DOI: 10.1046 / j.1471-4159.2003.02263.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кунг, А.К., Денко, Н. С., Хадсон, К. М., Шиндлер, К., Свирз, Л., Кох, С. и др. (2000). Гены-кандидаты фенотипа гипоксической опухоли. Cancer Res. 60, 883–887. Доступно в Интернете по адресу: http://cancerres.aacrjournals.org/content/60/4/883.long
Google Scholar
Крайцберг, Ю., Кудрявцева, Э., Макки, А. К., Геула, К., Ковалл, Н. В., Храпко, К. (2006). Делеции митохондриальной ДНК многочисленны и вызывают функциональные нарушения у пожилых нейронов черной субстанции человека. Nat. Genet. 38, 518–520. DOI: 10.1038 / ng1778
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кумар-Сингх, С., Пиричи, Д., Макгоуэн, Э., Сернелс, С., Сеутерик, К., Харди, Дж. И др. (2005). Бляшки с плотным ядром в моделях болезни Альцгеймера на мышах Tg2576 и PSAPP сосредоточены на стенках сосудов. г. J. Pathol. 167, 527–543. DOI: 10,1016 / s0002-9440 (10) 62995-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лэнгстон, Дж.У., Баллард П., Тетруд Дж. У. и Ирвин И. (1983). Хронический паркинсонизм у человека, вызванный продуктом синтеза аналога меперидина. Наука 219, 979–980. DOI: 10.1126 / science.6823561
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Х. Дж., Шин, С. Ю., Чой, К., Ли, Ю. Х., и Ли, С. Дж. (2002). Образование и удаление агрегатов α-синуклеина в клетках, подвергшихся действию митохондриальных ингибиторов. J. Biol. Chem. 277, 5411–5417. DOI: 10.1074 / jbc.M105326200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, X., Chen, Y., Shao, S., Tang, Q., Chen, W., Chen, Y., et al. (2016). Окислительный стресс вызывает снижение экспрессии ЭПО в головном мозге стареющих крыс. Exp. Геронтол. 83, 89–93. DOI: 10.1016 / j.exger.2016.07.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли-Бьярлей, Х., Ритчоф, К. К., Мэсси, Дж. Х., Питтендрай, Б. Р., и Робинсон, Г. Э. (2014).Социально-ответные эффекты окислительного метаболизма мозга на агрессию. Proc. Natl. Акад. Sci. U S A 111, 12533–12537. DOI: 10.1073 / pnas.1412306111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лин А. Л., Фокс П. Т., Харди Дж., Дуонг Т. К. и Гао Дж. Х. (2010). Нелинейная связь между мозговым кровотоком, потреблением кислорода и производством АТФ в зрительной коре головного мозга человека. Proc. Natl. Акад. Sci. U S A 107, 8446–8451. DOI: 10,1073 / PNAS.01107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю Л., Комацу Х., Мюррей И. В. и Аксельсен П. Х. (2008). Содействие неправильной укладке амилоидного β-белка и фибриллогенезу продуктом окисления липидов. J. Mol. Биол. 377, 1236–1250. DOI: 10.1016 / j.jmb.2008.01.057
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ловелл, М.А., Смит, Дж. Л., и Маркесбери, В. Р. (2006). Повышенный переносчик цинка-6 при легких когнитивных нарушениях, болезни Альцгеймера и болезни Пика. J. Neuropathol. Exp. Neurol. 65, 489–498. DOI: 10.1097 / 01.jnen.0000229237.98124.91
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ловелл, М.А., Смит, Дж. Л., Сюн, С., и Маркесбери, В. Р. (2005). Изменения белка-переносчика цинка-1 (ZnT-1) в мозге субъектов с легкими когнитивными нарушениями, ранней и поздней стадиями болезни Альцгеймера. Neurotox. Res. 7, 265–271. DOI: 10.1007 / bf03033884
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лу, Х., Голей, X., Пекар, Дж. Дж., И Ван Зейл, П. С. (2004). Устойчивое постстимульное повышение утилизации кислорода в мозге после восстановления сосудов. J. Cereb. Blood Flow Metab. 24, 764–770. DOI: 10.1097 / 01.wcb.0000124322.60992.5c
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lundgaard, I., Li, B., Xie, L., Kang, H., Sanggaard, S., Haswell, J. D., et al. (2015). Прямое нейрональное поглощение глюкозы предвещает зависящее от активности увеличение церебрального метаболизма. Nat. Commun. 6: 6807. DOI: 10.1038 / ncomms7807
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Macas, J., Nern, C., Plate, K. H., and Momma, S. (2006). Повышенное образование нейронов-предшественников после ишемического повреждения переднего мозга пожилого человека. J. Neurosci. 26, 13114–13119. DOI: 10.1523 / JNEUROSCI.4667-06.2006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Махлер, П., Висс, М. Т., Эльсайед, М., Stobart, J., Gutierrez, R., von Faber-Castell, A., et al. (2016). In vivo свидетельствует о градиенте лактата от астроцитов к нейронам. Cell Metab. 23, 94–102. DOI: 10.1016 / j.cmet.2015.10.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мэддок Р. Дж., Буонокор М. Х., Коупленд Л. Э. и Ричардс А. Л. (2009). Повышенный лактатный ответ мозга на нервную активацию при паническом расстройстве: динамическое исследование 1H-MRS. Мол. Психиатрия 14, 537–545.DOI: 10.1038 / sj.mp.4002137
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Манчак М., Анеконда Т. С., Хенсон Э., Парк Б. С., Куинн Дж. И Редди П. Х. (2006). Митохондрии являются прямым местом накопления Aβ в нейронах болезни Альцгеймера: последствия для образования свободных радикалов и окислительного повреждения в прогрессировании заболевания. Hum. Мол. Genet. 15, 1437–1449. DOI: 10.1093 / hmg / ddl066
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мангиа, С., Ткац, И., Грюеттер, Р., Ван де Муртеле, П. Ф., Маравилья, Б., и Угурбил, К. (2007). Устойчивая активация нейронов поднимает окислительный метаболизм на новый стабильный уровень: данные спектроскопии ЯМР 1Н в зрительной коре головного мозга человека. J. Cereb. Blood Flow Metab. 27, 1055–1063. DOI: 10.1038 / sj.jcbfm.9600401
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Марти-Фабрегас, Х., Ромагера-Рос, М., Гомес-Пинедо, У., Мартинес-Рамирес, С., Хименес-Ксарри, Э., Марин Р. и др. (2010). Распространение в ипсилатеральной субвентрикулярной зоне человека после ишемического инсульта. Неврология 74, 357–365. DOI: 10.1212 / WNL.0b013e3181cbccec
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мартин, Л. Дж., Пэн, Ю., Прайс, А. К., Стерлинг, В., Коупленд, Н. Г., Дженкинс, Н. А. и др. (2006). У трансгенных мышей с α-синуклеином при болезни Паркинсона развивается нейрональная дегенерация митохондрий и гибель клеток. J. Neurosci. 26, 41–50.DOI: 10.1523 / JNEUROSCI.4308-05.2006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мики Н., Кавабе Ю. и Курияма К. (1977). Активация церебральной гуанилатциклазы оксидом азота. Biochem. Биофиз. Res. Commun. 75, 851–856. DOI: 10.1016 / 0006-291x (77)
-7PubMed Аннотация | CrossRef Полный текст | Google Scholar
Милакович Т., Кинтанилья Р. А. и Джонсон Г. В. (2006). Экспрессия мутантного хантингтина вызывает дефекты митохондриальной обработки кальция в клональных клетках полосатого тела: функциональные последствия. J. Biol. Chem. 281, 34785–34795. DOI: 10.1074 / jbc.M603845200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миллер, Л. М., Ван, К., Теливала, Т. П., Смит, Р. Дж., Ланциротти, А., и Миклосси, Дж. (2006). Инфракрасное и рентгеновское изображения на основе синхротрона показывают очаговое накопление Cu и Zn, локализованных вместе с β-амилоидными отложениями при болезни Альцгеймера. J. Struct. Биол. 155, 30–37. DOI: 10.1016 / j.jsb.2005.09.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Минченко, А., Лещинский И., Опентанова И., Санг Н., Сринивас В., Армстед В. и др. (2002). Опосредованная гипоксией фактором-1 экспрессия гена 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы-3 (PFKFB3). Его возможная роль в эффекте Варбурга. J. Biol. Chem. 277, 6183–6187. DOI: 10.1074 / jbc.M110978200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мишра, А., Рейнольдс, Дж. П., Чен, Ю., Гурин, А. В., Русаков, Д. А., Атвелл, Д. (2016).Астроциты передают нервно-сосудистые сигналы перицитам капилляров, но не артериолам. Nat. Neurosci. 19, 1619–1627. DOI: 10.1038 / nn.4428
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mucke, L., Masliah, E., Yu, G.Q., Mallory, M., Rockenstein, E.M, Tatsuno, G., et al. (2000). Высокий уровень нейрональной экспрессии aβ 1-b42 у трансгенных мышей-предшественников амилоидного белка человека дикого типа: синаптотоксичность без образования бляшек. J. Neurosci. 20, 4050–4058. DOI: 10.1523 / JNEUROSCI.20-11-04050.2000
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Никниг, Х., Таг, С., Рейес, Б. Д., Кирш, М., Фандри, Дж., И Берхнер-Пфанншмидт, У. (2012). Роль активных форм кислорода в регуляции HIF-1 с помощью пролилгидроксилазы 2 в условиях легкой гипоксии. Free Radic. Res. 46, 705–717. DOI: 10.3109 / 10715762.2012.669041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нива, К., Казама, К., Юнкин, Л., Юнкин, С. Г., Карлсон, Г. А., Иадекола, К. (2002). Цереброваскулярная ауторегуляция сильно нарушена у мышей со сверхэкспрессией белка-предшественника амилоида. г. J. Physiol. Heart Circ. Physiol. 283, h415 – h423. DOI: 10.1152 / ajpheart.00022.2002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Норрис, Э. Х., Урю, К., Ли, С., Гиассон, Б. И., Трояновски, Дж. К., и Ли, В. М. (2007). Воздействие пестицидов усугубляет α-синуклеинопатию на модели трансгенных мышей A53T. г. J. Pathol. 170, 658–666. DOI: 10.2353 / ajpath.2007.060359
PubMed Аннотация | CrossRef Полный текст | Google Scholar
О’Салливан, Н.С., МакГеттиган, П.А., Шеридан, Г.К., Пикеринг, М., Конбой, Л., О’Коннор, Дж. Дж. И др. (2007). Временное изменение экспрессии генов в зубчатой извилине крыс после обучения пассивному избеганию. J. Neurochem. 101, 1085–1098. DOI: 10.1111 / j.1471-4159.2006.04418.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паркер, В.Д. мл. И Паркс Дж. К. (1995). Цитохром С оксидаза в мозге при болезни Альцгеймера: очистка и характеристика. Неврология 45, 482–486. DOI: 10.1212 / wnl.45.3.482
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паркер, У. Д. мл., И Паркс, Дж. К. (2005). Митохондриальные мутации ND5 при идиопатической болезни Паркинсона. Biochem. Биофиз. Res. Commun. 326, 667–669. DOI: 10.1016 / j.bbrc.2004.11.093
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Патель, А.Б., Лай, Дж. К., Чоудхури, Г. М., Хайдер, Ф., Ротман, Д. Л., Шульман, Р. Г. и др. (2014). Прямые доказательства зависимого от активности фосфорилирования глюкозы в нейронах с последствиями для лактатного челнока от астроцита к нейрону. Proc. Natl. Акад. Sci. U S A 111, 5385–5390. DOI: 10.1073 / pnas.1403576111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Патак Д., Шилдс Л. Ю., Мендельсон Б. А., Хаддад Д., Лин В., Геренсер А. А. и др. (2015).Роль митохондриального АТФ в рециклинге синаптических пузырьков. J. Biol. Chem. 290, 22325–22336. DOI: 10.1074 / jbc.M115.656405
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пеллерин, Л., Маджистретти, П. Дж. (1994). Поглощение глутамата астроцитами стимулирует аэробный гликолиз: механизм, связывающий активность нейронов с утилизацией глюкозы. Proc. Natl. Акад. Sci. U S A 91, 10625–10629. DOI: 10.1073 / pnas.91.22.10625
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пеллерин, Л.и Магистретти П. Дж. (1997). Поглощение глутамата стимулирует активность Na +, K + -АТФазы в астроцитах за счет активации отдельной субъединицы, очень чувствительной к уабаину. J. Neurochem. 69, 2132–2137. DOI: 10.1046 / j.1471-4159.1997.632.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Pepersack, T., Rotsaert, P., Benoit, F., Willems, D., Fuss, M., Bourdoux, P., et al. (2001). Распространенность дефицита цинка и его клиническое значение среди госпитализированных пожилых людей. Arch. Геронтол. Гериатр. 33, 243–253. DOI: 10.1016 / s0167-4943 (01) 00186-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Plun-Favreau, H., Klupsch, K., Moisoi, N., Gandhi, S., Kjaer, S., Frith, D., et al. (2007). Митохондриальная протеаза HtrA2 регулируется киназой PINK1, связанной с болезнью Паркинсона. Nat. Cell Biol. 9, 1243–1252. DOI: 10.1038 / ncb1644
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Полидори, М.К., Мекоччи П., Браун С. Е., Сенин У. и Бил М. Ф. (1999). Окислительное повреждение митохондриальной ДНК в париетальной коре при болезни Гентингтона. Neurosci. Lett. 272, 53–56. DOI: 10.1016 / s0304-3940 (99) 00578-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пратико Д., Ли, В. М.-Й., Трояновски, Дж. К., Рокач, Д., Фицджеральд, Г. А. (1998). Повышенное содержание F2-изопростанов при болезни Альцгеймера: данные об усилении перекисного окисления липидов in vivo . FASEB J. 12, 1777–1783. DOI: 10.1096 / fasebj.12.15.1777
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рафики, А., Булланд, Дж. Л., Халестрап, А. П., Оттерсен, О. П., и Бергерсен, Л. (2003). Высокодифференциальная экспрессия транспортеров монокарбоксилата MCT2 и MCT4 в развивающемся мозге крысы. Неврология 122, 677–688. DOI: 10.1016 / j.neuroscience.2003.08.040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рамамурти, П., и Ши, Х. (2014). Ишемия индуцирует различные уровни экспрессии белка фактора-1α, индуцируемого гипоксией, в интернейронах и пирамидных нейронах. Acta Neuropathol. Commun. 2:51. DOI: 10.1186 / 2051-5960-2-51
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рэмпон, К., Цзян, К. Х., Донг, Х., Тан, Ю. П., Локхарт, Д. Дж., Шульц, П. Г. и др. (2000). Влияние обогащения окружающей среды на экспрессию генов в головном мозге. Proc. Natl. Акад. Sci. U S A 97, 12880–12884.DOI: 10.1073 / pnas.97.23.12880
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ворон, Э. П., Лу, П. Х., Тишлер, Т. А., Хейдари, П., и Барцокис, Г. (2013). Повышенный уровень железа и снижение целостности тканей в гиппокампе при болезни Альцгеймера обнаружено in vivo с помощью магнитно-резонансной томографии. J. Alzheimers Dis. 37, 127–136. DOI: 10.3233 / JAD-130209
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Райн, В., Song, X., Wiesner, A., Ittner, L.M., Baysang, G., Meier, F., et al. (2009). Амилоид-β и тау синергетически нарушают систему окислительного фосфорилирования у мышей с тройной трансгенной болезнью Альцгеймера. Proc. Natl. Акад. Sci. США 106, 20057–20062. DOI: 10.1073 / pnas.0
9106PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ролетт, Э. Л., Аззави, А., Лю, К. Дж., Юнби, М. Н., Шварц, Х. М., и Данн, Дж. Ф. (2000). Критическое напряжение кислорода в головном мозге крысы: комбинированное исследование 31P-ЯМР и ЭПР-оксиметрии. г. J. Physiol. Regul. Интегр. Комп. Physiol. 279, R9 – R16. DOI: 10.1152 / ajpregu.2000.279.1.r9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Row, B. W., Liu, R., Xu, W., Kheirandish, L., and Gozal, D. (2003). Периодическая гипоксия связана с окислительным стрессом и дефицитом пространственного обучения у крыс. г. J. Respir. Крит. Care Med. 167, 1548–1553. DOI: 10.1164 / rccm.200209-1050oc
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рыбникова, Е., Ватаева, Л., Тюлькова, Е., Глущенко, Т., Отеллин, В., Пелто-Хуйкко, М., и др. (2005). Предварительная подготовка к умеренной гипоксии предотвращает нарушение обучения пассивному избеганию и подавление экспрессии NGFI-A в головном мозге, вызванное тяжелой гипоксией. Behav. Brain Res. 160, 107–114. DOI: 10.1016 / j.bbr.2004.11.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сантос, Р. М., Лоренко, К. Ф., Померло, Ф., Хюттль, П., Герхард, Г. А., Ларанжинья, Дж. И др. (2011).Инактивация оксида азота в мозге регулируется сосудистой сетью. Антиоксид. Редокс-сигнал. 14, 1011–1021. DOI: 10.1089 / ars.2010.3297
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шафер, Ф. К., и Бюттнер, Г. Р. (2001). Редокс-среда клетки с точки зрения окислительно-восстановительного состояния пары дисульфид / глутатион глутатиона. Free Radic. Биол. Med. 30, 1191–1212. DOI: 10.1016 / s0891-5849 (01) 00480-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шаллер, Б., Xin, L., O’Brien, K., Magill, A. W., and Gruetter, R. (2014). Повсеместно ли повышение глутамата и лактата приводит к физиологической активации? Исследование функциональной МР-спектроскопии 1H во время моторной активации в мозге человека на 7Tesla. Нейроизображение 93, 138–145. DOI: 10.1016 / j.neuroimage.2014.02.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шлиф М. Л., Крейг А. М. и Гитлин Дж. Д. (2005). Активация рецептора NMDA опосредует гомеостаз меди в нейронах гиппокампа. J. Neurosci. 25, 239–246. DOI: 10.1523 / JNEUROSCI.3699-04.2005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шраг М., Мюллер К., Ойойо У., Смит М. А. и Кирш В. М. (2011). Железо, цинк и медь в мозге при болезни Альцгеймера: количественный метаанализ. Некоторое представление о влиянии систематической ошибки цитирования на научное мнение. Прог. Neurobiol. 94, 296–306. DOI: 10.1016 / j.pneurobio.2011.05.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шурр, А., Миллер, Дж. Дж., Пейн, Р. С. и Ригор, Б. М. (1999). Увеличение выработки лактата тканями мозга служит для удовлетворения энергетических потребностей нейронов, активируемых глутаматом. J. Neurosci. 19, 34–39. DOI: 10.1523 / JNEUROSCI.19-01-00034.1999
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шурр А., Уэст К. А. и Ригор Б. М. (1988). Поддерживаемая лактатом синаптическая функция в препарате среза гиппокампа крысы. Наука 240, 1326–1328. DOI: 10.1126 / science.3375817
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ши Х. и Лю К. Дж. (2006). Влияние концентрации глюкозы на окислительно-восстановительный статус в первичных корковых нейронах крыс в условиях гипоксии. Neurosci. Lett. 410, 57–61. DOI: 10.1016 / j.neulet.2006.09.066
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шибата М., Ямада С., Кумар С. Р., Калеро М., Бадинг Дж., Франджоне Б. и др. (2000). Удаление пептида амилоида-ss (1-40) Альцгеймера из мозга с помощью белка-1, связанного с рецептором ЛПНП, через гематоэнцефалический барьер. J. Clin. Инвестировать. 106, 1489–1499. DOI: 10.1172 / jci10498
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сильверман, Д. Х., Смолл, Г. В., Чанг, К. Ю., Лу, С. С., Кунг Де Абурто, М. А., Чен, В. и др. (2001). Позитронно-эмиссионная томография в оценке деменции: региональный метаболизм головного мозга и отдаленные результаты. JAMA 286, 2120–2127. DOI: 10.1001 / jama.286.17.2120
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Малый, Г.W., Mazziotta, J.C., Collins, M.T., Baxter, L.R., Phelps, M.E., Mandelkern, M.A., et al. (1995). Аллель аполипопротеина E типа 4 и церебральный метаболизм глюкозы у родственников с риском семейной болезни Альцгеймера. JAMA 273, 942–947. DOI: 10.1001 / jama.1995.03520360056039
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смит, К. Д., Карни, Дж. М., Тацумо, Т., Штадтман, Е. Р., Флойд, Р. А., и Марксбери, В. Р. (1992). Окисление белков при старении мозга. Ann. N Y Acad. Sci. 663, 110–119. DOI: 10.1111 / j.1749-6632.1992.tb38654.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смит, М. А., Харрис, П. Л., Сэйр, Л. М., и Перри, Г. (1997). Накопление железа при болезни Альцгеймера является источником свободных радикалов, образующихся в результате окислительно-восстановительного потенциала. Proc. Natl. Акад. Sci. U S A 94, 9866–9868. DOI: 10.1073 / pnas.94.18.9866
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сонг, X., Дэн, Дж. Х., Лю, К. Дж., И Бай, Ю. (2005). Конкретные точечные мутации могут не накапливаться с возрастом в контрольной области митохондриальной ДНК мыши. Ген 350, 193–199. DOI: 10.1016 / j.gene.2005.02.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Steinert, J. R., Kopp-Scheinpflug, C., Baker, C., Challiss, R.A., Mistry, R., Haustein, M. D., et al. (2008). Оксид азота является передатчиком объема, регулирующим постсинаптическую возбудимость глутаматергического синапса. Нейрон 60, 642–656. DOI: 10.1016 / j.neuron.2008.08.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Строка Д. М., Буркхардт Т., Дебайе И., Венгер Р. Х., Нил Д. А., Бауэр К. и др. (2001). HIF-1 экспрессируется в нормоксической ткани и проявляет органоспецифическую регуляцию при системной гипоксии. FASEB J. 15, 2445–2453. DOI: 10.1096 / fj.01-0125com
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сух, С.W., Jensen, K. B., Jensen, M. S., Silva, D. S., Kesslak, P.J., Danscher, G., et al. (2000). Гистохимически активный цинк в амилоидных бляшках, ангиопатиях и дегенерирующих нейронах головного мозга, пораженного болезнью Альцгеймера. Brain Res. 852, 274–278. DOI: 10.1016 / s0006-8993 (99) 02096-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sun, X., He, G., Qing, H., Zhou, W., Dobie, F., Cai, F., et al. (2006). Гипоксия способствует патогенезу болезни Альцгеймера за счет активации экспрессии гена BACE1. Proc. Natl. Акад. Sci. U S A 103, 18727–18732. DOI: 10.1073 / pnas.0606298103
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сан, М. К., Сюй, Х., и Алкон, Д. Л. (2002). Фармакологическая защита синаптической функции, пространственного обучения и памяти от преходящей гипоксии у крыс. J. Pharmacol. Exp. Ther. 300, 408–416. DOI: 10.1124 / jpet.300.2.408
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сузуки, А., Стерн, С. А., Боздаги, О., Хантли, Г. У., Уокер, Р. Х., Магистретти, П. Дж. И др. (2011). Транспорт лактата астроцитов и нейронов необходим для формирования долговременной памяти. Ячейка 144, 810–823. DOI: 10.1016 / j.cell.2011.02.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тебризи, С. Дж., Уоркман, Дж., Харт, П. Э., Манджиарини, Л., Махал, А., Бейтс, Г. и др. (2000). Дисфункция митохондрий и повреждение свободных радикалов у трансгенных мышей Huntington R6 / 2. Ann. Neurol. 47, 80–86. DOI: 10.1002 / 1531-8249 (200001) 47: 1 <80 :: aid-ana13> 3.3.co; 2-b
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тади, М., Алламан, И., Ленгахер, С., Греннингло, Г., и Магистретти, П. Дж. (2015). Экспрессия генов в гиппокампе, индуцированная обучением, показывает роль метаболического взаимодействия нейрон-астроцит в долговременной памяти. PLoS One 10: e0141568. DOI: 10.1371 / journal.pone.0141568
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Такано Т., Tian, G.F., Peng, W., Lou, N., Libionka, W., Han, X., et al. (2006). Астроцит-опосредованный контроль мозгового кровотока. Nat. Neurosci. 9, 260–267. DOI: 10.1038 / nn1623
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Томита С., Уэно М., Сакамото М., Китахама Ю., Уэки М., Маэкава Н. и др. (2003). Нарушение развития мозга у мышей, лишенных гена Hif-1α в нервных клетках. Мол. Клетка. Биол. 23, 6739–6749. DOI: 10.1128 / mcb.23.19.6739-6749.2003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тыугу В., Карафин А. и Палумаа П. (2008). Связывание цинка (II) и меди (II) с полноразмерным пептидом амилоид-β Альцгеймера. J. Neurochem. 104, 1249–1259. DOI: 10.1111 / j.1471-4159.2007.05061.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Трифунович, А., Вреденберг, А., Фалькенберг, М., Спелбринк, Дж. Н., Ровио, А. Т., Брудер, К. Э. и др. (2004).Преждевременное старение мышей, экспрессирующих дефектную митохондриальную ДНК-полимеразу. Природа 429, 417–423. DOI: 10.1038 / nature02517
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уллах, М. С., Дэвис, А. Дж., И Халестрап, А. П. (2006). Переносчик лактата плазматической мембраны MCT4, но не MCT1, активируется гипоксией посредством HIF-1α-зависимого механизма. J. Biol. Chem. 281, 9030–9037. DOI: 10.1074 / jbc.M511397200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ван Зейл, П.К., Хуа Дж. И Лу Х. (2012). ЖИВОЕ недооценка постстимулирующего воздействия — одна из наиболее обсуждаемых проблем фМРТ. Нейроизображение 62, 1092–1102. DOI: 10.1016 / j.neuroimage.2012.01.029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вентрилья, М., Букосси, С., Панетта, В., и Сквитти, Р. (2012). Медь при болезни Альцгеймера: метаанализ исследований сыворотки, плазмы и спинномозговой жидкости. J. Alzheimers Dis. 30, 981–984. DOI: 10.3233 / JAD-2012-120244
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фогт, К., Меллор Дж., Тонг Дж. И Николл Р. (2000). Воздействие синаптически высвобожденного цинка на синапсы мшистых волокон гиппокампа. Нейрон 26, 187–196. DOI: 10.1016 / s0896-6273 (00) 81149-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вагенфюр, Л., Мейер, А. К., Брауншвейг, Л., Маррон, Л., и Шторх, А. (2015). Напряжение кислорода в головном мозге контролирует расширение базальных предшественников, подобных внешней субвентрикулярной зоне, в развивающемся мозге мыши. Развитие 142, 2904–2915.DOI: 10.1242 / dev.121939
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вагенфюр, Л., Мейер, А. К., Маррон, Л., и Сторч, А. (2016). Напряжение кислорода в нейрогенной нише регулирует дофаминергический нейрогенез в развивающемся среднем мозге. Stem Cells Dev. 25, 227–238. DOI: 10.1089 / scd.2015.0214
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уолш, Д. М., Клюбин, И., Фадеева, Дж. В., Каллен, В. К., Анвил, Р., Wolfe, M. S., et al. (2002). Природно секретируемые олигомеры амилоидного β-белка сильно ингибируют долгосрочную потенциацию гиппокампа in vivo . Природа 416, 535–539. DOI: 10.1038 / 416535a
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Х., Муалла Д., Райт Дж. А. и Браун Д. Р. (2010a). Связывание меди регулирует внутриклеточную локализацию, агрегацию и токсичность α-синуклеина. J. Neurochem. 113, 704–714. DOI: 10.1111 / j.1471-4159.2010.06638.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, X., Син, А., Сюй, К., Цай, К., Лю, Х., и Ли, Л. (2010b). Гипоперфузия сосудов головного мозга вызывает нарушение пространственной памяти, синаптические изменения и олигомеризацию β-амилоида у крыс. J. Alzheimers Dis. 21, 813–822. DOI: 10.3233 / jad-2010-100216
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уорд, К. П., Маккой, Дж. Г., Маккенна, Дж. Т., Коннолли, Н. П., Маккарли, Р. У., и Стрекер, Р. Э. (2009). Дефицит пространственного обучения и памяти после воздействия 24-часовой фрагментации сна или перемежающейся гипоксии на крысиной модели обструктивного апноэ во сне. Brain Res. 1294, 128–137. DOI: 10.1016 / j.brainres.2009.07.064
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уоттс, М. Э., Уильямс, С. М., Нитианантараджа, Дж. И Клаудианос, К. (2018). Вызванная гипоксией MicroRNA-210 нацелена на нейродегенеративные пути. Некодирующая РНК 4: E10. DOI: 10.3390 / ncrna4020010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уэлш, С. Дж., Беллами, В. Т., Бриль, М. М., и Поуис, Г. (2002). Редокс-белок тиоредоксин-1 (Trx-1) увеличивает экспрессию белка фактора 1α, индуцируемого гипоксией: сверхэкспрессия Trx-1 приводит к увеличению продукции фактора роста эндотелия сосудов и усилению ангиогенеза опухоли. Cancer Res. 62, 5089–5095. Доступно в Интернете по адресу: http: // Canceres.aacrjournals.org/content/62/17/5089
Google Scholar
Виртс, О., Мультхауп, Г., Чех, К., Бланшар, В., Муссауи, С., Тремп, Г., и др. (2001). Накопление внутриуронального Aβ предшествует образованию бляшек у мышей-предшественников β-амилоида и двойных трансгенных мышей пресенилина-1. Neurosci. Lett. 306, 116–120. DOI: 10.1016 / s0304-3940 (01) 01876-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Яо, Дж., Ирвин, Р. В., Чжао, Л., Нильсен, Дж., Гамильтон, Р. Т., и Бринтон, Р. Д. (2009). Митохондриальный биоэнергетический дефицит предшествует патологии Альцгеймера в модели самок мышей с болезнью Альцгеймера. Proc. Natl. Акад. Sci. U S A 106, 14670–14675. DOI: 10.1073 / pnas.03106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан Б., Инь К. П., Чжао К. и Юэ С. В. (2014). Повышающая регуляция HIF-1α посредством гипоксии защищает клетки нейробластомы от апоптоза, способствуя экспрессии сурвивина. Asian Pac.J. Cancer Prev. 15, 8251–8257. DOI: 10.7314 / apjcp.2014.15.19.8251
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжоу К., Хуанг Ю. и Прзедборски С. (2008). Окислительный стресс при болезни Паркинсона: механизм патогенетического и терапевтического значения. Ann. N Y Acad. Sci. 1147, 93–104. DOI: 10.1196 / анналы.1427.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Энергия и обмен веществ
Энергия требуется и преобразуется в биологических системах
Студенты должны уметь объяснять и применять основные концепции преобразования материи и энергии, включая термодинамику, катализ, связь экзергонических и эндергонических процессов, а также природу биологической энергии.
Цели обучения, указанные ниже, делятся на следующие категории: вводный A, средний B и верхний C.
1. Природа биологической энергии
В биологических процессах участвуют многие формы энергии: световая, химическая, конформационная, механическая и градиентная. Эти формы можно понять с точки зрения принципов термодинамики. Энергия используется для различных целей, таких как работа, необходимая для синтеза биомолекул, создания электрических и химических градиентов, выполнения механической работы или хранения внутри биомолекул.
Связанные цели обучения
- Учащиеся должны уметь сравнивать и противопоставлять биологически значимые формы энергии (например, кинетическая энергия по сравнению с потенциальной энергией, энергия, хранящаяся в связях, по сравнению с потенциальной энергией градиентов концентрации). A
- Учащиеся должны уметь идентифицировать и объяснять случаи, когда энергия преобразуется из одной формы в другую. A
- Учащиеся должны уметь написать общую химическую реакцию и соответствующее математическое выражение, которое приближает ее константу равновесия (Keq).A
- Учащиеся должны уметь объяснять взаимосвязь между константами равновесия и константами скорости реакции. B
- Студенты должны уметь применять свои знания по основам химической термодинамики к биологически катализированным системам. B
- Учащиеся должны уметь учитывать изменения энергии на промежуточных этапах, которые определяют биологический процесс и предсказывают спонтанность всего процесса или промежуточного этапа. C
- Студенты должны уметь объяснять свойства биомолекул с высоким потенциалом передачи энергии, которые делают их пригодными в качестве энергетической валюты.C
2. Катализ
Ферменты, которые могут быть белками или РНК, представляют собой макромолекулы с каталитическими функциями. Они не изменяют реакционное равновесие; вместо этого они снижают энергетический барьер активации конкретной реакции, позволяя ей протекать быстрее. Ключевые концепции кинетики ферментов обычно определяются в терминах начальной скорости образования продукта, Vo и различных каталитических кинетических параметров, таких как Vmax или Kcat и Km, которые либо математически определены для ферментов, которые следуют кинетике Михаэлиса-Ментен, либо определены эмпирически. для более сложных моделей ферментов.
Связанные цели обучения
- Учащиеся должны уметь определять факторы, влияющие на энергию активации реакции. A
- Учащиеся должны уметь объяснить стабилизацию переходного состояния. A
- Учащиеся должны уметь рассчитывать увеличение скорости реакции, катализируемой ферментами. A
- Учащиеся должны уметь объяснять, что такое субстрат с точки зрения реагента. A
- Студенты должны различать энергию активации, свободную энергию и стандартную свободную энергию реакции.B
- Учащиеся должны уметь использовать кинетические параметры для сравнения ферментов. B
- Учащиеся должны уметь различать различные формы каталитического торможения и объяснять, чем и почему они различаются. B
- Студенты должны уметь количественно моделировать, как происходят каталитические реакции, и рассчитывать кинетические параметры ферментов на основе экспериментальных данных. C
- Студенты должны уметь объяснять, как меняются каталитические параметры при изменении концентрации субстрата или фермента.C
- Учащиеся должны уметь интерпретировать физический смысл различных кинетических параметров и описывать лежащие в основе допущения и условия (такие как установившееся состояние или равновесие), от которых зависят различные параметры. C
3. Энергетическая связь химических процессов в метаболических путях
Биохимические системы сочетают энергетически неблагоприятные реакции с энергетически благоприятными реакциями. Эти реакции могут быть частью катаболических путей, когда сложные вещества разбиваются на более простые с высвобождением энергии, или анаболических путей, где сложные молекулы синтезируются с подводом энергии.
Связанные цели обучения
- Студенты должны быть в состоянии обсудить концепцию свободной энергии Гиббса и ее применение к химическим превращениям. A
- Учащиеся должны уметь объяснять, как можно сочетать эндергонические и экзэргонические пути и как это применимо к метаболизму. A
- Учащиеся должны уметь рассчитать общий ΔG для сопряженной реакции с учетом значений ΔG для компонентных реакций. A
- Студенты должны уметь объяснять упрощающие допущения, сделанные в биохимии, которые согласуются с физиологическими условиями и делают «биохимические стандартные условия» (устойчивое состояние) отличными от стандартных условий (условий равновесия), обычно упоминаемых в химии.B
- Учащиеся должны уметь предсказать, как возмущение системы влияет на фактическую свободную энергию (как математически, так и концептуально). B
- Студенты должны уметь объяснить эволюционное сохранение основных метаболических путей. C
- Учащиеся должны уметь объяснять различия в использовании и производстве энергии в разных клетках и разных биологических системах. C
- Студенты должны уметь объяснять роль дупликации генов в эволюции производства и использования энергии различными организмами.C
Энергетический метаболизм
Клетки должны выполнять балансирующее действие по поддержанию уровней энергии, биосинтезу нового материала и контролю активных форм кислорода, создаваемых генерацией энергии. Портфель анализов энергетического метаболизма Promega помогает исследователям понять этот балансирующий акт, выполняемый клетками, наряду с изменениями метаболических путей в результате терапевтического лечения.
Мониторинг метаболитов в среде для культивирования клеток может предоставить информацию о путях клеточного метаболизма.Потребление глюкозы и секреция лактата могут служить индикаторами гликолиза, в то время как потребление глутамина и секреция глутамата предоставляют информацию о глутаминолизе. Также можно оценить скорость поглощения глюкозы, связанную с диабетом, раком и активацией иммунных клеток.
Никотинамидадениндинуклеотиды представляют собой многочисленные растворимые кофакторы, которые подвергаются обратимому окислению и восстановлению в основных метаболических путях. Они могут связывать метаболические пути с контролем транскрипции, эпигенетикой и передачей клеточных сигналов, когда клетки переключаются с нормального метаболизма на метаболизм раковых клеток (пролиферативный).Эти динуклеотиды работают парами, либо фосфорилированные НАДФ и НАДФН, либо нефосфорилированные НАД и НАДН. У каждой пары разные функции. Наборы для анализа можно использовать для измерения общих, окисленных и восстановленных версий нуклеотидов. АТФ, обильное количество нуклеотидов, используемых для внутриклеточной передачи энергии, можно измерить с помощью тестов CellTiter-Glo®.
Уровень окислительного стресса как клеточный ответ связан с клеточным метаболизмом. Клетки генерируют реактивные формы кислорода (АФК) в результате повышенного метаболизма или в результате стрессовой реакции.Глутатион (GSH), антиоксидант, используется для уменьшения повреждения ROS. Анализы окислительного стресса, которые измеряют уровни ROS или GSH (общего и пониженного), связаны с метаболическим состоянием клетки.
Биолюминесцентные анализы на основе планшет-ридеров для мониторинга этих процессов дают исследователям возможность измерять множество образцов с простыми требованиями к их обработке. В чувствительных анализах сохраняются исходные образцы, которые могут быть клетками, выращенными в однослойной культуре, или трехмерными моделями, тканями или другими биологическими образцами.
Энергии для сжигания: скорость метаболизма у подростков аналогична показателям взрослых, говорится в исследовании | Медицинское исследование
Можно сказать, что подростки едят своих родителей вне дома, но исследования показывают, что их ежедневные затраты энергии не намного больше, чем у взрослых.
Международная группа исследователей проследила общий дневной расход энергии более чем 6000 человек в возрасте от восьми дней до 95 лет, перевернув многие стереотипы о метаболизме с ног на голову.
«Это исследование показывает, что существует множество неправильных представлений о том, как скорость метаболизма изменяется с возрастом», — сказал профессор Джон Спикман, соавтор исследования из Университета Абердина.
В статье в журнале Science Спикман и его коллеги сообщают, как они использовали данные так называемых исследований воды с двойной маркировкой для расчета энергозатрат 6421 человека в 29 странах, а также данные дополнительных исследований с участием беременных или недавно родивших женщин. родила.
Исследования воды с двойной маркировкой включают в себя предоставление участникам воды, содержащей тяжелые формы или изотопы водорода и кислорода, а затем отслеживание их присутствия в моче участников с течением времени.Тяжелый кислород вымывается быстрее, чем водород: эта разница связана со скоростью производимого углекислого газа и, следовательно, дает оценку расхода энергии.
Команда обнаружила, что общий дневной расход энергии и «базальный расход», энергия, необходимая для выполнения основных метаболических функций, таких как дыхание, увеличиваются с размером тела. Приняв это во внимание, они обнаружили, что младенцы в возрасте до одного месяца потребляют примерно такое же общее количество энергии в день, как и взрослые, и что в возрасте одного года это значение быстро выросло примерно на 50% по сравнению со взрослыми значениями.
Исследователи добавили, что по прошествии этого времени общий дневной расход энергии медленно снижается в детстве и подростковом возрасте примерно на –2,8% в год, чтобы достичь уровня взрослого примерно к 20 годам. Затем он находится на плато примерно до 60 лет, после чего снова начинает снижаться. Общий расход энергии у взрослых остается стабильным даже во время беременности.
Сходные — хотя и не идентичные — тенденции наблюдались для базальных затрат энергии, в то время как моделирование добавило дополнительных идей, «указывая на то, что вариации физической активности и тканевого метаболизма вносят вклад в общие расходы и их компоненты на протяжении всей жизни», — пишут исследователи. .
Спикмен сказал, что результаты показывают, что рост — не единственная причина, по которой дети потребляют больше энергии, чем взрослые. «Кажется, это комбинация роста, большей физической активности и более высокого уровня клеточного метаболизма. Просто кажется, что они делают намного больше всего », — сказал он.
Исследование также предполагает, что, вопреки распространенному мнению, подросткам может не требоваться постоянный доступ к холодильнику. «Их расходы немного выше, чем у взрослых, но не намного», — сказал Спикмен.«Если им нужно есть больше — это незначительно».
Спикмен сказал, что огромный рост энергозатрат у младенцев и постоянство скорости метаболизма в зрелом возрасте от 20 до 60 лет стали неожиданностью.
«Ранее высказывалось предположение, что метаболизм может замедляться к 30 годам, и тогда считалось, что это [вызывает] предрасположенность к распространению в среднем возрасте», — сказал он. «Мы не нашли никаких доказательств, подтверждающих это. Так что если вы набираете вес и ваша талия расширяется в течение 30-40 лет, это, вероятно, связано с тем, что вы едите больше еды, а затем тратите меньше энергии.
Гарет Лавери, профессор молекулярного метаболизма Университета Бирмингема, не принимавший участия в работе, назвал это исследование уникальным и всеобъемлющим.
«Эти интригующие результаты предполагают, что нам, возможно, потребуется больше внимания, чтобы адаптировать рекомендации по вопросам здоровья и лечение заболеваний в контексте возраста человека и скорости метаболизма», — сказал он.
«Следующим шагом в использовании этой информации является применение того, что мы теперь знаем о метаболических вариациях и расходах энергии у людей, для формирования стратегий питания и общественного здравоохранения, которые сохранят качество наших более поздних лет.”
2. Энергетический метаболизм — обзор • Функции клеток и человеческого тела
Содержание:
1. Основные термины энергетического обмена
2. Энергетический обмен
3. Роль органов в энергетическом обмене
_
Основные термины энергетического обмена
Метаболизм (от греч. метаболе — изменение) — набор всех химических реакций, происходящих в организме .Они включают преобразование питательных веществ, в большинстве случаев катализируемое и регулируемое.
Метаболические реакции часто соединяются вместе, образуя метаболических путей , где одно вещество преобразуется посредством серии реакций в другое. Этот процесс производит различные промежуточных продуктов , которые могут действовать как начальный субстрат для других метаболических путей.
Например, пируват может быть преобразован в лактат, или он может образовывать аминокислоту аланин, участвовать в образовании глюкозы в процессе глюконеогенеза или превращаться в ацетил-КоА и действовать как источник энергии.
Мы называем это взаимопревращение питательных веществ с различными промежуточными продуктами промежуточное звено (или промежуточное звено ) метаболизм .
Метаболические реакции в целом можно разделить на анаболических и катаболических .
1) Анаболические реакции (гр.
aná — вверх)Анаболические реакции являются синтетическими; они конструируют более сложные вещества из более простых. Им требуется энергия, которая расходуется в ходе реакции, поэтому они относятся к группе эндергонических реакций.
Анаболические реакции в организме человека представлены глюконеогенезом, синтезом гликогена, жирных кислот, ТАГ (так называемый липогенез), аминокислот, белков, кетоновых тел, мочевины или других веществ.
2) Катаболические реакции (гр.
кат. — вниз)Катаболические реакции включают расщепление, разложение или разложение сложных веществ на более простые. Энергия высвобождается во время этого процесса и может быть использована для образования макроэргических молекул.
Среди наиболее важных катаболических реакций, происходящих в нашем организме, — гликолиз, гликогенолиз, липолиз, бета-окисление, разложение кетоновых тел, белков или аминокислот.
Некоторые метаболические пути имеют характер как анаболических, так и катаболических реакций и называются амфиболическими (группа amfi- обе).
Хорошим примером является цикл лимонной кислоты, который завершает окисление углеродного скелета всех питательных веществ (катаболический путь), но его промежуточные соединения служат субстратами для анаболических путей (альфа-кетоглутарат превращается в глутамат; сукцинил-КоА в гем или цитрат используется в синтезе жирных кислот).
Группа реакций, которые служат дополнением промежуточных продуктов к другим метаболическим путям, называются анаплеротическими реакциями (гр. aná — вверх и plerotikos — для заполнения). Эти реакции, например, дополняют цикл лимонной кислоты, в основном оксалацетатом (с использованием глюкозы, лактата или глюкогенных аминокислот) и альфа-кетоглутаратом (из глутамата).
_
Энергетический обмен
A непрерывный регенерация из макроэргических соединений , служащий источником свободной энергии для эндергонических реакций, жизненно важен для поддержания жизни.Их производство начинается с катаболизма высокомолекулярных веществ. Фрагменты, созданные в результате этого процесса, превращаются в основные промежуточные продукты (например, ацетил-КоА), которые дополнительно (в случае аэробного метаболизма) окисляются в цикле лимонной кислоты, и образующиеся коферменты (NADH + H + a FADH 2 ) используются в цепи переноса электронов для производства АТФ.
ATP
АТФ — важнейшее и универсальное макроэргическое соединение. Частично он служит накопителем энергии, но в основном обеспечивает передачу свободной энергии (G) в клетках.Несмотря на то, что существуют макроэргические соединения, способные выделять большее количество энергии, чем АТФ, они не так широко используются. Причина — относительная стабильность ангидридной связи, которая устойчива к самопроизвольному гидролизу (в отличие от других ангидридов) и расщепляется только в присутствии ферментов.
Вещества с более отрицательными значениями G (например, фосфоенолпируват, фосфокреатин, 1,3-бисфосфоглицерат,…) могут использоваться в процессе регенерации АТФ.
Существует два пути синтеза АТФ в клетках животных:
1) Фосфорилирование на уровне субстрата
2) Аэробное фосфорилирование и дыхательная цепь
1) Фосфорилирование на уровне субстрата
Это процесс энергетического сочетания экзергонической реакции с синтезом АТФ из АДФ и Pi (неорганический фосфат).Наиболее распространены три реакции: две происходят во время гликолиза (превращение фосфоенолпирувата в пируват и 1,3-бисфосфоглицерата в 3-фосфоглицерат) и одна является частью цикла лимонной кислоты (превращение сукцинил-КоА в сукцинат).
2) Аэробное фосфорилирование и дыхательная цепь
Чтобы узнать подробнее об этом типе синтеза АТФ, см. Подглаву 2/7.
Высвобождение энергии из ATP (гидролиз ATP ) происходит в несколько этапов.
АТФ → АДФ + Pi (ΔG = — 30,5 кДж / моль)
ADP все еще содержит одну макроэргическую связь, которая может служить источником энергии. Однако использование АДФ вместо АТФ создает проблемы из-за субстратной специфичности ферментов. Вот почему большая часть АДФ подвергается реакции превращения, катализируемой аденилат киназой : 2 АДФ → АТФ + АМФ, и клетка использует полученный АТФ.
АТФ → АМФ + PPi (ΔG = — 45,6 кДж / моль)
Можно расщепить PPi ферментом дифосфатазой (также называемой пирофосфатазой) и дополнительно высвободить энергию.
Другие макроэргические соединения
1) Другие нуклеозидтрифосфаты
Другие нуклеозидтрифосфаты менее универсальны, чем АТФ, и обычно используются для определенных целей. UTP, например, обеспечивает активацию сахаридов и, таким образом, позволяет им войти в метаболические пути.
2) Энол фосфаты
Энол фосфаты содержат ОН-группу, связанную сложноэфирной связью с фосфатной группой.Наиболее важным представителем является фосфоенолпируват ( PEP ), макроэргическое соединение с самым высоким потенциалом ΔG (до -61,9 кДж выделяемой энергии на моль). Экзотермическая степень этого превращения объясняет, почему реакция ПЭП и пирувата, протекающая при гликолизе, необратима.
3) Ацилфосфаты
Ацилфосфаты имеют ангидридную связь между COOH- и фосфатной группой. Они включают карбамоилфосфат (используется в синтезе мочевины) или 1,3-бисфосфоглицерат (промежуточный продукт гликолиза).
4) Другие макроэргические соединения
Другими группами макроэргических соединений являются гуанидинфосфатов ( креатинфосфат ) или тиоэфиров и тиоэфиров (производные HS-CoA или SAM )
Иногда встречается термин низкоэнергетические фосфаты . Согласно классическому определению, макроэргическое вещество — это вещество, способное выделять не менее 25 кДж энергии на моль.Низкоэнергетический фосфат (например, глюкозо-6-фосфат ) выделяет меньше энергии, примерно от 9 до 20 кДж / моль.
Основные промежуточные продукты энергетического обмена
В клеточном метаболизме есть несколько общих метаболических путей, которые действуют как пересечение в преобразовании питательных веществ. Наиболее важными являются пируват дегидрогеназа реакция ( PDH ), Кребса цикл ( KC ) и дыхательная цепь ( RC ).Три промежуточных продукта: ацетил-КоА , пируват и НАДН занимают видное место в энергетическом метаболизме.
1) Ацетил-КоА
Синтез:
a) PHD (реакция пируватдегидрогеназы) — необратимость этой реакции является причиной того, что жирные кислоты в большинстве случаев не могут быть преобразованы в глюкозу
б) Разложение аминокислот — только лизин и лейцин разлагаются непосредственно до ацетил-КоА, другие аминокислоты превращаются в него через пируват
c) Бета-окисление жирных кислот и разложение кетоновых тел
Использование:
а) Цикл Кребса и последующая дыхательная цепь (синтез АТФ)
б) Синтез жирных кислот и кетоновых тел (при избытке ацетил-КоА)
c) Синтез холестерина
2) Пируват
Синтез:
а) Аэробный гликолиз
б) Окисление лактата (катализируемое лактатдегидрогеназой)
c) Разложение некоторых аминокислот
Использование:
a) Синтез ацетил-КоА (PDH)
б) Синтез лактата — происходит во время анаэробного гликолиза для регенерации коферментов NADH + H + обратно в NAD +
c) Синтез аланина (катализируемый аланинаминотрансферазой)
d) Синтез оксалоацетата (катализируемый пируваткарбоксилазой)
д) Глюконеогенез
3) НАДН
Синтез:
а) Аэробный гликолиз
б) Реакция пируватдегидрогеназы
в) Бета-окисление жирных кислот
г) Цикл Кребса
д) Окисление этанола
Использование:
а) Дыхательная цепь и синтез АТФ
б) Превращение пирувата в лактат
_
Роль органов в энергетическом обмене
Печень
Клетки печени (гепатоциты) играют уникальную роль в промежуточном метаболизме.Они играют жизненно важную роль в обеспечении гомеостаза, синтеза различных молекул, промежуточного метаболизма и регуляции накопления и высвобождения энергии. Печень принимает участие в метаболизме всех питательных веществ.
1) Печень и метаболизм сахаридов
Печень играет важную роль в краткосрочной (в течение нескольких часов) и долгосрочной (в диапазоне от дней до недель) гликемической регуляции (так называемая глюкостатическая функция печени).Когда уровень глюкозы в vena portae повышается после еды, печень запускает процесс синтеза гликогена, который использует глюкозу из крови. Противоположный процесс происходит во время голодания, когда уровень глюкозы в крови падает. Глюкоза добавляется в кровоток через гликогенолиз (расщепление накопленного гликогена) или глюконеогенез (когда запасы гликогена истощаются). Разложение фруктозы и галактозы также происходит в печени.
2) Печень и метаболизм липидов
Некоторые пути метаболизма липидов уникальны для печени (например, синтез кетоновых тел), но большинство из них происходит и в других тканях (хотя печень часто является самым важным органом в количественном отношении). Здесь происходит окисление жирных кислот, которое ускоряется во время голодания до такой степени, что вырабатывается больше энергии, чем нужно печени. Из избыточного ацетил-КоА синтезируются кетоновые тела. Печень не может утилизировать кетоновые тела и выпускает их в кровоток, где они служат альтернативным источником энергии .
Печень также играет решающую роль в метаболизме липопротеинов . Он синтезирует частицы ЛПОНП, некоторое количество ЛПВП, конвертирует ЛПОНП в ЛПНП и разрушает остатки хиломикронов, ЛПВП и часть ЛПНП. Здесь также происходит синтез из холестерина .
3) Печень и метаболизм белков и аминокислот
Некоторые реакции метаболизма белков и аминокислот происходят только в печени ( мочевина синтез ), тогда как другие могут осуществляться и другими тканями (дезаминирование и трансаминирование аминокислот, синтез несущественных АК,…).
Печень синтезирует, за исключением иммуноглобулинов, все плазматических белков (например, альбумин или факторы свертывания крови).
Другие органы
Почки
Процессы концентрации мочи и транспортировка веществ, происходящие в почках, требуют большого количества энергии. Вот почему потребление АТФ, особенно в коре почек, велико. АТФ производится в результате окислительного метаболизма глюкозы, лактата, жирных кислот и аминокислот.
Почки после печени являются вторым по важности участком глюконеогенеза (в основном во время голодания). Его основной субстрат — углеродный скелет из аминокислот (особенно глутамина). Аммиак, продукт этих реакций, выделяется непосредственно с мочой, где он действует как буфер.
Скелетные мышцы
Активные скелетные мышцы потребляют огромное количество энергии. Регенерация АТФ происходит за счет аэробного и анаэробного гликолиза, разложения жирных кислот, а также креатинфосфата.
Скелетные мышцы играют важную роль в метаболизме аминокислот, прежде всего разветвленных аминокислот (валин, лейцин, изолейцин). Углеродные скелеты, полученные в этом процессе, используются для синтеза энергии, а аминогруппы служат субстратом для синтеза аланина, глутамина и глутамата. Эти аминокислоты впоследствии в относительно больших количествах попадают в кровоток. Печень может использовать аланин, продуцируемый скелетными мышцами, для регенерации глюкозы (цикл аланина ).
Жировая ткань
После еды (после еды, когда преобладает инсулин) жировая ткань служит местом хранения ТАГ. Он хранит липиды, полученные с пищей, а также синтезированные в печени. Во время голодания (из-за действия глюкагона) происходит липолиз — расщепление липидов на жирные кислоты и глицерин.
Мозг
Глюкоза — основной энергетический субстрат для мозга. Ежедневное потребление составляет около 120 г , но во время адаптированного голодания (которое происходит примерно через 3 недели без достаточного запаса энергии) мозг может покрыть до 50% своей потребности в энергии за счет окисления кетоновых тел .
На следующем рисунке показано взаимодействие наших органов во время физической активности:
Автор подраздела: Петра Лаврикова и Йозеф Фонтана
.