2.Строение костей,их рост и развитие.Роль спорта в процессе роста костей.
1.Содержание и методы исследования анатомии.
Анатомия человека — это наука о происхождении и развитии, формах и строении человеческого организма. Анатомия изучает внешние формы и пропорции тела человека и его частей, отдельные органы, их конструкцию, микроскопическое строение. В задачи анатомии входит исследование основных этапов развития человека в процессе эволюции, особенностей строения тела и отдельных органов в различные возрастные периоды, формирования человеческого организма в условиях внешней среды.
Методы исследований
Для
изучения строения тела человека и его
функций пользуются различными методами
исследований. Для изучения морфологических
особенностей человека выделяют две
группы методов. Первая группа применяется
для изучения строения организма человека
на трупном материале, а вторая — на
живом человеке.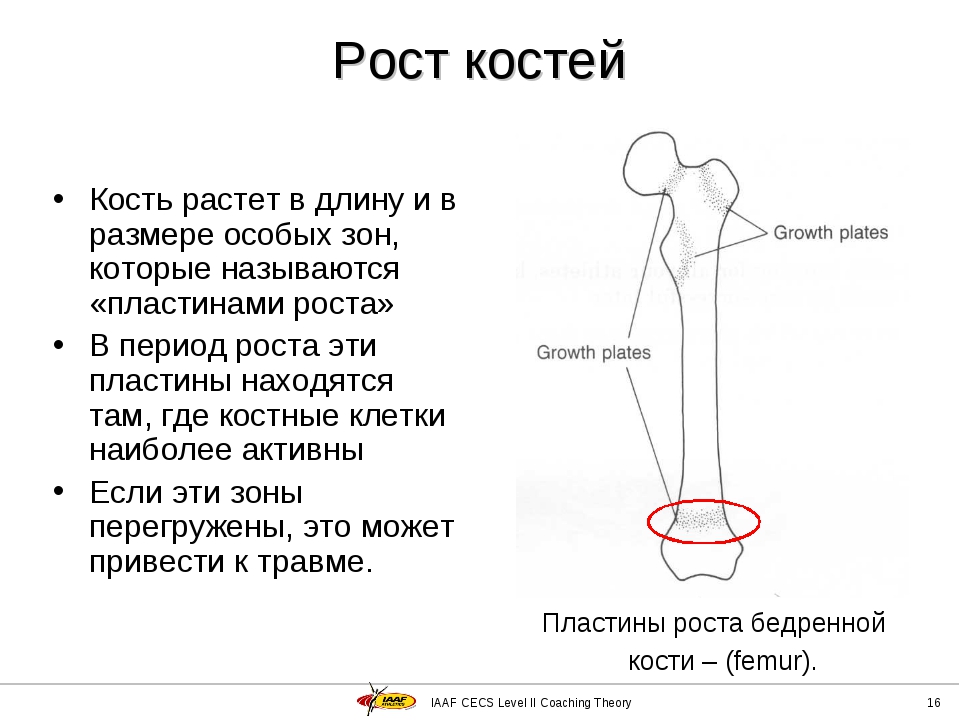
В первую группу входят:
1) метод рассечения с помощью простых инструментов (скальпель, пинцет, пила и др.) — позволяет изучать. строение и топографию органов;
2) метод вымачивания трупов в воде или в специальной жидкости продолжительное время для выделения скелета, отдельных костей для изучения их строения;
3) метод распиливания замороженных трупов — разработан Н. И. Пироговым, позволяет изучать взаимоотношения органов в отдельно взятой части тела;
4) метод коррозии — применяется для изучения кровеносных сосудов и других трубчатых образований во внутренних органах путем заполнения их полостей затвердевающими веществами (жидкий металл, пластмассы), а затем разрушением тканей органов при помощи сильных кислот и щелочей, после чего остается слепок от налитых образований;
5)
инъекционный метод — заключается в
введении в органы, имеющие полости,
красящих веществ с последующим осветлением
паренхимы органов глицерином, метиловым
спиртом и др. Широко применяется для
исследования кровеносной и лимфатической
систем, бронхов, легких и др.
6) микроскопический метод — используют для изучения структуры органов при помощи приборов, дающих увеличенное изображение. Ко второй группе относятся:
1) рентгенологический метод и его модификации (рентгеноскопия, рентгенография, ангиография, лимфография, рентгенокимография и др.) — позволяет изучать структуру органов, их топографию на живом человеке в разные периоды его жизни;
2) соматоскопический (визуальный осмотр) метод изучения тела человека и его частей — используют для определения формы грудной клетки, степени развития отдельных групп мышц, искривления позвоночника, конституции тела и др.;
3) антропометрический метод — изучает тело человека и его части путем измерения, определения пропорции тела, соотношение мышечной, костной и жировой тканей, степень подвижности суставов и др.;
4)
эндоскопический метод — дает возможность
исследовать на живом человеке с помощью
световодной техники внутреннюю
поверхность пищеварительной и дыхательной
систем, полости сердца и сосудов,
мочеполовой аппарат.
В современной анатомии используются новые методы исследования, такие как компьютерная томография, ультразвуковая эхолокация, стереофотограмметрия, ядерно-магнитный резонанс и др.
В свою очередь из анатомии выделились гистология — учение о тканях и цитология — наука о строении и функции клетки.
Для исследования физиологических процессов обычно использовали экспериментальные методы.
На ранних этапах развития физиологии применялся метод экстирпации (удаления) органа или его части с последующим наблюдением и регистрацией полученных показателей.
Фистульный метод основан на введении в полый орган (желудок, желчный пузырь, кишечник) металлической или пластмассовой трубки и закреплении ее на коже. При помощи этого метода определяют секреторную функцию органов.
Метод
катетеризации применяется для изучения
и регистрации процессов, которые
происходят в протоках экзокринных
желез, в кровеносных сосудах, сердце.
При помощи тонких синтетических трубок
— катетеров — вводят различные
лекарственные средства.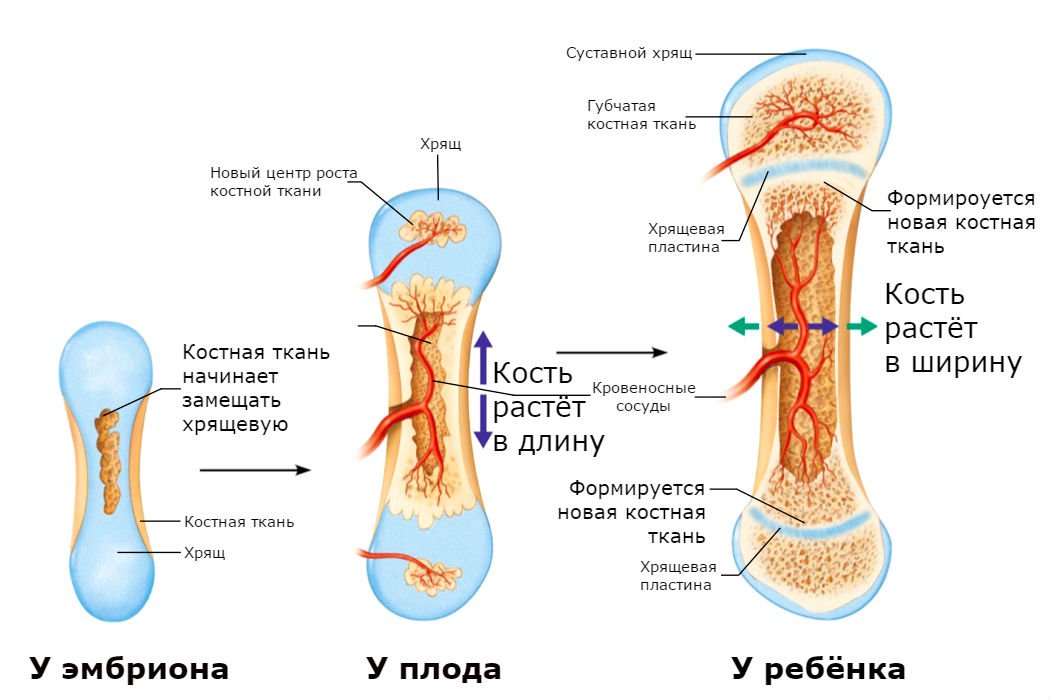
Метод денервации основан на перерезании нервных волокон, иннервирующих орган, с целью установить зависимость функции органа от воздействия нервной системы. Для возбуждения деятельности органа используют электрический или химический вид раздражения.
В последние десятилетия широкое применение в физиологических исследованиях нашли инструментальные методы (электрокардиография, электроэнцефалография, регистрация активности нервной системы путем вживления макро- и микроэлементов и др.).
В зависимости от формы проведения физиологический эксперимент делится на острый, хронический и в условиях изолированного органа.
Острый эксперимент предназначен для проведения искусственной изоляции органов и тканей, стимуляции различных нервов, регистрации электрических потенциалов, введения лекарств и др.
Хронический
эксперимент применяется в виде
целенаправленных хирургических операций
(наложение фистул, нервнососудистых
анастомозов, пересадка разных органов,
вживление электродов и др. ).
).
Функцию органа можно изучать не только в целом организме, но и изолировано от него. В таком случае органу создают все необходимые условия для его жизнедеятельности, в том числе подачу питательных растворов в сосуды изолированного органа (метод перфузии).
Применение компьютерной техники в проведении физиологического эксперимента значительно изменило его технику, способы регистрации процессов и обработку полученных результатов.
Кость, как орган живого организма, состоит из нескольких тканей, важнейшей из которых является костная. Кость выполняет опорно-механическую и защитную функции, является составной частью эндоскелета позвоночных.
В
скелете человека различают по форме
длинные, короткие, плоские и смешанные
кости, также есть кости пневматические
и сесамовидные. Расположение костей в
скелете связано с выполняемой ими
функцией: «Кости построены так, что при
наименьшей затрате материала обладают
наибольшей крепостью, легкостью, по
возможности уменьшая влияние толчков
и сотрясений» (П. Ф. Лесгафт).
Ф. Лесгафт).
Длинные кости, ossa longa, имеют вытянутую, трубчатую среднюю часть, называемую диафизом, diaphysis, состоящую из компактного вещества. Внутри диафиза имеется костномозговая полость, cavitas medullaris, с жёлтым костным мозгом. На каждом конце длинной кости находится эпифиз, epiphysis, заполненный губчатым веществом с красным костным мозгом. Между диафизом и эпифизом располагается метафиз, metaphysis. В период роста кости здесь находится хрящ, который позже замещается костью. Длинные трубчатые кости составляют в основном скелет конечностей. Костные выступы на эпифизах, которые являются местом прикрепления мышц и связок, называются апофизами, apophysis].
Плоские кости, ossa plana, состоят из тонкого слоя губчатого вещества, покрытого снаружи компактным веществом. Они различны по происхождению: лопатка и тазовая кость развиваются из хряща, а плоские кости крыши черепа — из соединительной ткани.
Короткие
кости, ossa brevia, состоят из губчатого
вещества, покрытого снаружи тонким
слоем компактного вещества.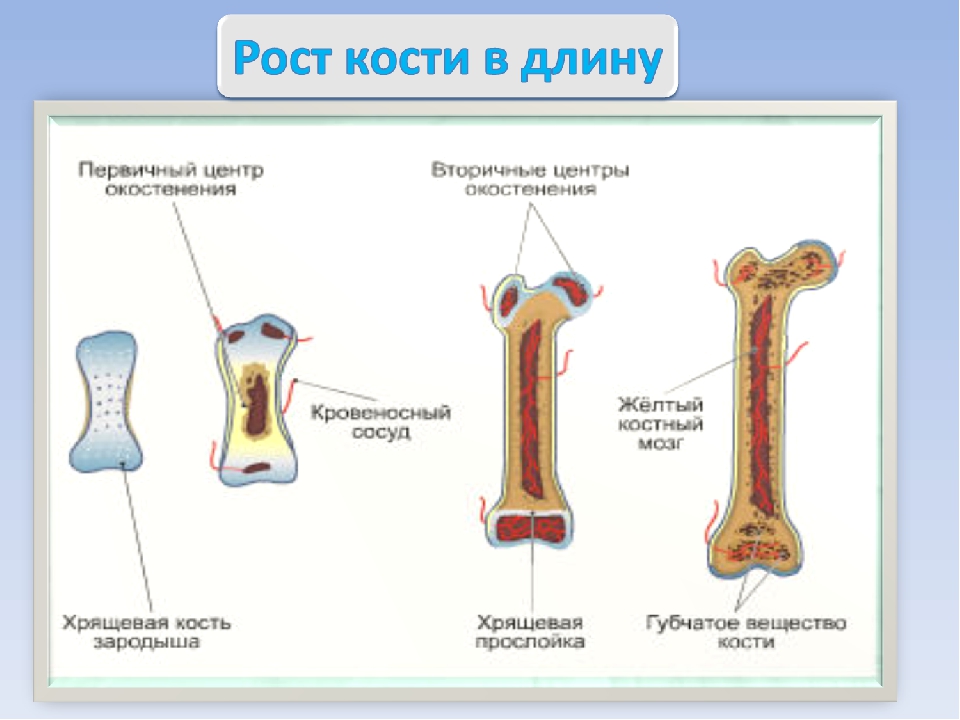
Смешанные кости, ossa irregularia, находятся в различных отделах скелета (позвоночник, череп). В них сочетаются элементы коротких и плоских костей (основная часть и чешуя затылочной кости, тело позвонка и его отростки, каменистая часть и чешуя височной кости). Такие особенности обусловлены различием происхождения и функции частей этих костей.
Пневматические кости, или воздухоносные, – кости, которые имеют внутри полость, выстланную слизистой оболочкой и заполненную воздухом, что облегчает вес кости, не уменьшая ее прочности.
Сесамовидные кости – это кости, вставленные в сухожилия мышц и поэтому увеличивающие плечо силы мышц, способствующие усилению их действия.
Поверхность
кости может иметь различные углубления
(бороздки, ямки и т.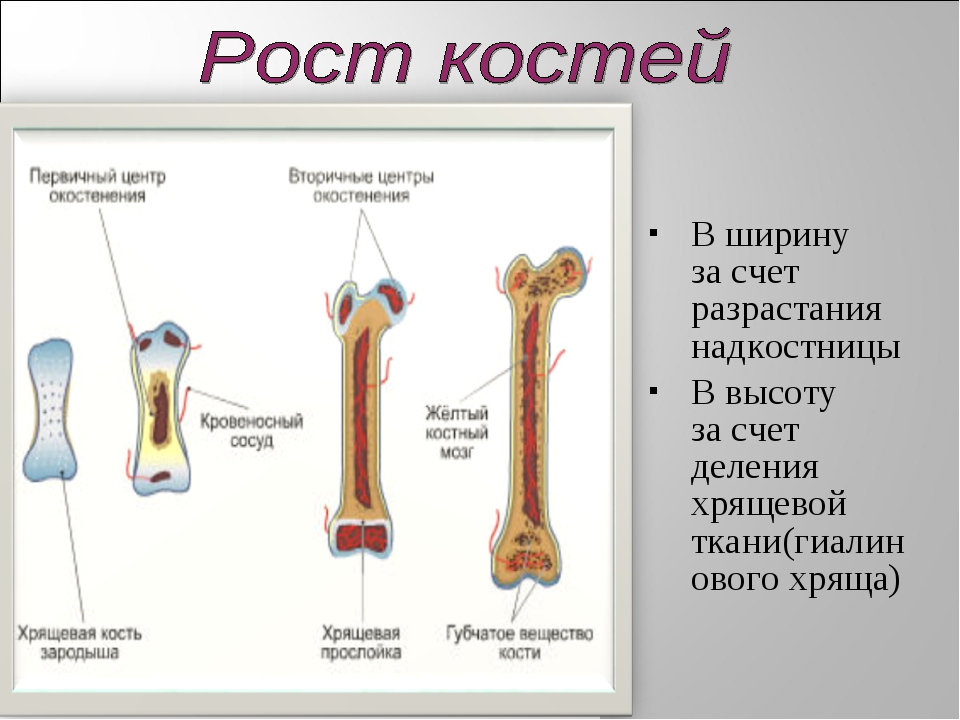 д.) и возвышения
(углы, края, ребра, гребни, бугорки и т.
п.). Неровности служат для соединения
костей между собой или для прикрепления
мускулов и бывают тем сильнее развиты,
чем более развита мускулатура. На
поверхности находятся так называемые
«питательные отверстия» (Foramina nutritiva),
через которые входят внутрь кости нервы
и кровеносные сосуды.
д.) и возвышения
(углы, края, ребра, гребни, бугорки и т.
п.). Неровности служат для соединения
костей между собой или для прикрепления
мускулов и бывают тем сильнее развиты,
чем более развита мускулатура. На
поверхности находятся так называемые
«питательные отверстия» (Foramina nutritiva),
через которые входят внутрь кости нервы
и кровеносные сосуды.
В костях различают компактное и губчатое костное вещество. Первое отличается однородностью, твёрдостью и составляет наружный слой кости; оно особенно развито в средней части трубчатых костей и утончается к концам; в широких костях оно составляет 2 пластинки, разделённые слоем губчатого вещества; в коротких оно в виде тонкой плёнки одевает кость снаружи. Губчатое вещество состоит из пластинок, пересекающихся в различных направлениях, образуя систему полостей и отверстий, которые в середине длинных костей сливаются в большую полость.
Наружная
поверхность кости одета так называемой
надкостницей (Periosteum), оболочкой из
соединительной ткани, содержащей
кровеносные сосуды и особые клеточные
элементы, служащие для питания, роста
и восстановления кости.
Развитие кости происходит двумя способами:
из соединительной ткани;
на месте хряща.
Из
соединительной ткани развиваются кости
свода и боковых отделов черепа, нижняя
челюсть и, по мнению некоторых, ключица
(а у низших позвоночных и некоторые
другие) — это так называемые покровные
или облегающие кости. Они развиваются
прямо из соединительной ткани; волокна
её несколько сгущаются, между ними
появляются костные клетки и в промежутках
между последними отлагаются известковые
соли; образуются сначала островки
костной ткани, которые затем сливаются
между собой. Большинство костей скелета
развивается из хрящевой основы, имеющей
такую же форму, как будущая кость.
Хрящевая ткань подвергается процессу
разрушения, всасывания и вместо неё
образуется, при деятельном участии
особого слоя образовательных клеток
(остеобластов), костная ткань; процесс
этот может идти как с поверхности хряща,
от одевающей его оболочки, перихондрия,
превращающегося затем в надкостницу,
так и внутри его.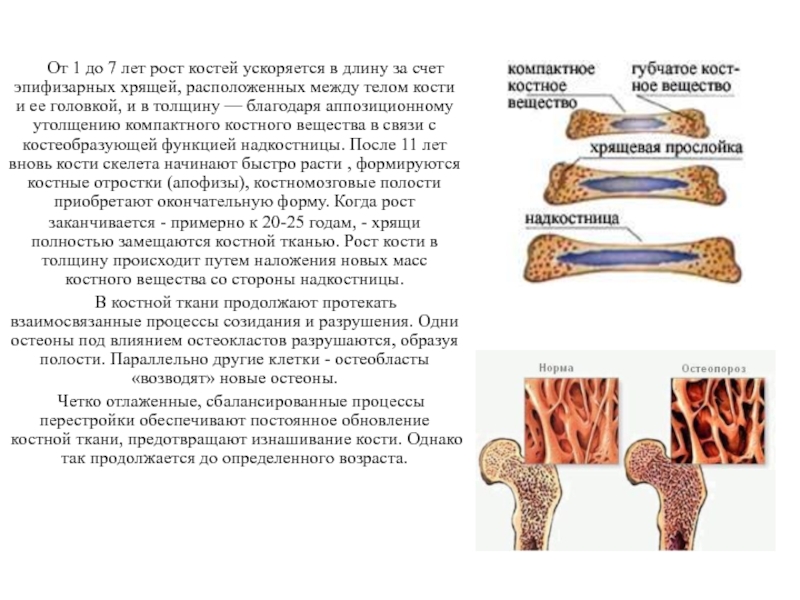
Рост кости в длину происходит главным образом в частях ещё не окостеневших (в трубчатых костях между эпифизами и диафизом), но отчасти и путём отложения новых частиц ткани между существующими («интуссусцепция»), что доказывают повторные измерения расстояний между вбитыми в кость остриями, питательными отверстиями и т. п.; утолщение костей происходит путём отложения на поверхности кости новых слоев («аппозиция»), благодаря деятельности остеобластов надкостницы. Эта последняя обладает в высокой степени способностью воспроизводить разрушенные и удалённые части кости. Деятельностью её обусловливается и срастание переломов. Параллельно с ростом кости идёт разрушение, всасывание (резорбция) некоторых участков костной ткани, причём деятельную роль играют так называемые остеокласты («клетки, разрушающие кость»).
3.Виды
соединения костей,их возрастные
изменения.
Соединения костей
Синдесмология — учение о соединениях костей.
Синартрозы — непрерывные соединения костей, более ранние по развитию, неподвижные или малоподвижные по функции.
Синдесмоз — кости соединены посредством соединительной ткани.
межкостные перепонки (между костями предплечья или голени)
связки (во всех суставах)
роднички
швы
зубчатые (большинство костей свода черепа)
чешуйчатые (между краями височной и теменной костей)
гладкие (между костями лицевого черепа)
Синхондроз — кости соединены посредством хрящевой ткани.
по свойству хрящевой ткани:
гиалиновый (между рёбрами и грудиной)
волокнистые (между позвонками)
по длительности своего существования различают синхондрозы:
временные
постоянные
Синостоз — кости соединены посредством костной ткани.
Диартрозы — прерывные соединения, более поздние по развитию и более подвижные по функции.
классификации суставов:
по числу суставных поверхностей
по форме и по функции
Гемиартроз
— переходная форма от непрерывных к
прерывным или обратно.
Возрастные изменения костей скелета
В своем развитии большинство костей скелета проходит три ста-дии: перепончатую, хрящевую, костную. На ранних стадиях развития скелет зародыша представлен хордой. С середины первого месяца внутриутробной жизни вокруг хорды появляется сгущение мезенхи-мы и развивается перепончатый скелет. Примерно в середине второго месяца развития мезенхима превращается в гиалиновый хрящ, а ске-лет получает название хрящевого. С конца второго — начала третьего месяца развития хрящевой скелет начинает окостеневать. Полное за-мещение хрящей костной тканью происходит к 20—25-летнему воз-расту. С этого времени рост костей в длину прекращается. Кости свода черепа, лицевого черепа и части ключицы, в отличие от других костей скелета, в своем развитии проходят только две стадии — перепонча-тую и костную.
В
течение первого года жизни человека
кости растут медленно. До 7 лет рост
увеличивается и становится максимальным
после 11 лет. В это время формируется
окончательный рельеф кости и костномоз-говые
полости.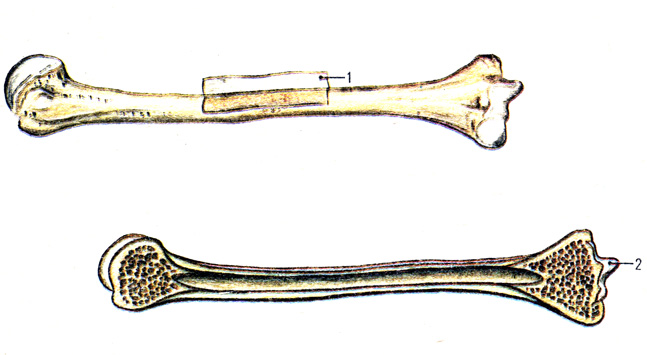 В пожилом возрасте наблюдаются
значительные из-менения в строении
кости. В губчатом веществе уменьшается
число костных перекладин, происходит
их истончение. Уменьшается тол-щина
слоя компактного вещества на диафизах
трубчатых костей.
В пожилом возрасте наблюдаются
значительные из-менения в строении
кости. В губчатом веществе уменьшается
число костных перекладин, происходит
их истончение. Уменьшается тол-щина
слоя компактного вещества на диафизах
трубчатых костей.
ВСЕМУ — СВОЁ ВРЕМЯ или как определиться с занятиями спортом
В настоящее время проблема гиподинамии привлекает внимание большого числа специалистов: врачей, физиологов, психологов, педагогов. Это связано с многогранностью влияния движения на человеческий организм. Вечная истина заключена в словах древнегреческого философа Аристотеля: «Движение – это жизнь. Ничто так не ослабляет и не истощает человека как продолжительное физическое бездействие».
И конечно родители стремятся решить эту проблему, когда приводят своих чад в спортивную секцию. Чем же они руководствуются при выборе того или иного вида спорта? Наверное, одни восхищаются выступлениями мастеров спорта по телевидению, поражаясь легкостью исполнения тяжёлых элементов. Другие – стремятся повторить свой путь спортивных достижений в юные годы. Третьи – слушают советы друзей и знакомых. Давайте попробуем вместе разобраться в этом вопросе и решить что, когда и кому можно.
Другие – стремятся повторить свой путь спортивных достижений в юные годы. Третьи – слушают советы друзей и знакомых. Давайте попробуем вместе разобраться в этом вопросе и решить что, когда и кому можно.
Необходимо помнить, что правильное использование средств и форм физического воспитания возможно лишь при условии учёта анатомо-физиологических особенностей детского организма в различные периоды развития. А оно происходит неравномерно, волнообразно. Периоды усиленного роста, сочетающиеся со значительным повышением энергетических и обменных процессов, сменяются замедленным ростом, сопровождающимся накоплением массы тела и преобладанием процессов дифференцировки.
Во врачебном контроле существует разделение школьников на следующие возрастные группы:
- младшая – 7-11 лет;
- средняя — 12-15 лет;
- старшая – 16-18 лет.
Младшая возрастная группа или «второе детство» — является наиболее спокойным периодом в развитии детей. Однако, несмотря на замедление темпов роста, на плавность изменений структур и функций, рост в длину до 12 лет протекает интенсивнее, чем увеличение массы тела: на 4-5см роста приходится 3-4кг прибавки веса. Изменяются пропорции тела: заметно удлиняются ноги, уменьшается грудной показатель, т.е. происходит как бы вытягивание тела.
Однако, несмотря на замедление темпов роста, на плавность изменений структур и функций, рост в длину до 12 лет протекает интенсивнее, чем увеличение массы тела: на 4-5см роста приходится 3-4кг прибавки веса. Изменяются пропорции тела: заметно удлиняются ноги, уменьшается грудной показатель, т.е. происходит как бы вытягивание тела.
Продолжается окостенение скелета, которое происходит неравномерно: к 9-11 годам окостеневают фаланги пальцев рук и ног, остальное — гораздо позже и заканчивается даже у взрослых.
И эти особенности формирования скелета необходимо принимать во внимание при выборе вида спорта. Следует помнить, что резкие толчки во время приземления при прыжках, неравномерная нагрузка на правую или левую ногу могут вызвать смещение костей таза и неправильное их срастание. Чрезмерные нагрузки на нижние конечности при незавершённом процессе окостенения могут привести к появлению плоскостопия. Скелет детей содержит значительное количество хрящевой ткани, суставы очень подвижны, связочный аппарат легко растягивается. У детей 8-9 лет позвоночник обладает наибольшей подвижностью, в это время формируются основные физиологические изгибы. Отсюда у младших школьников нередки случаи разнообразных нарушений осанки и деформаций позвоночника.
У детей 8-9 лет позвоночник обладает наибольшей подвижностью, в это время формируются основные физиологические изгибы. Отсюда у младших школьников нередки случаи разнообразных нарушений осанки и деформаций позвоночника.
В этот период значительно наращивается сухожильный компонент мышц, что улучшает прикрепление мышц к костям и вследствие этого повышается коэффициент полезного действия. Поэтому можно широко использовать упражнения, связанных с преодолением массы тела (лазание) в наклонном и вертикальном положении, для воспитания силы. Следует избегать больших по объёму и интенсивных нагрузок, т.к. они очень энергозатратны и могут привести к задержкам роста.
В младший возрастной период у детей отмечается высокая пластичность нервной системы, что способствует лучшему и более быстрому усвоению двигательных навыков, а двигательные условные рефлексы закрепляются сразу же и на всю жизнь. Вспомните, что один раз научившись ездить на велосипеде или кататься на коньках в детстве, мы всегда смело садимся за руль или встаём на коньки, приговаривая: «да я ещё ребёнком это умел!».
Таким образом, в младший возрастной период можно рекомендовать занятия такими видами спорта, как акробатика с 8-10 лет, спортивная гимнастика для мальчиков с 8-10 лет, для девочек с 7-10 лет. Художественная гимнастика с 7-10 лет. Фигурное катание с 7-10 лет, плавание с 7-10 лет, теннис с 7-10 лет.
Чуть позже, с 9 лет можно начинать занятия лыжами, парусным спортом, на батате, биатлоном.
Конечно, вы можете привести своего ребёнка в секцию, посоветоваться с тренером и начать заниматься и за год-два до официально разрешённого срока, но это должны быть подготовительные занятия. Подобные «тренировки» содержат упражнения общеразвивающие, так называемые общей физической подготовки и не подразумевают чрезмерных специфических нагрузок.
Средняя возрастная группа (12-15 лет).
Подростковый возраст характеризуется максимальным темпом роста всего организма и отдельных его частей. Годичный прирост длины тела уже 4-7,5см, причём главным образом за счёт ног.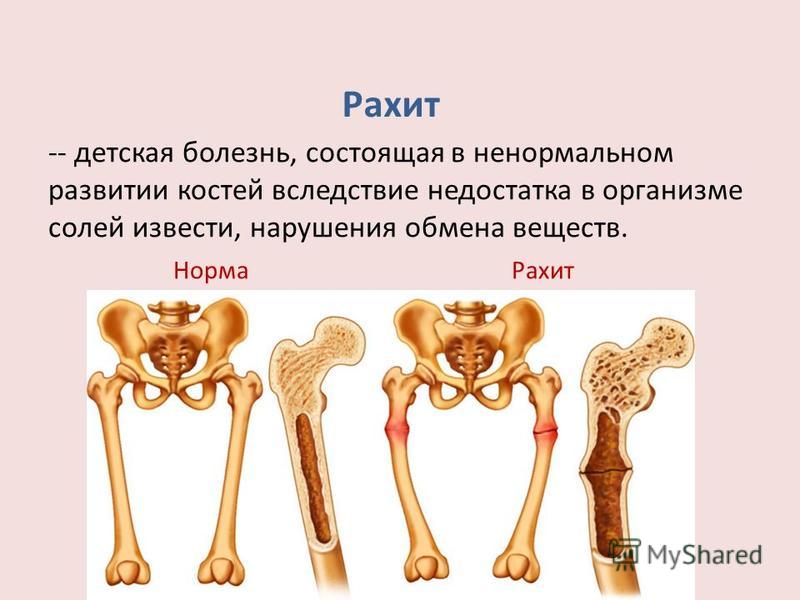 Масса тела увеличивается ежегодно на 3-6кг.
Масса тела увеличивается ежегодно на 3-6кг.
Продолжается процесс окостенения скелета, позвоночник по-прежнему очень подвижен и податлив. Поэтому, в связи с отставанием развития мышечной ткани при неблагоприятных условиях (в том числе при недостатке движений) могут возникнуть различные нарушения осанки или деформации позвоночника. А чрезмерные мышечные нагрузки, ускоряя процесс окостенения, могут замедлять в этом возрасте рост костей в длину.
К 14-15 годам развитие суставно-связочного аппарата, мышц и сухожилий достигают высокого уровня. Одновременно увеличивается сила мышц.
У подростков нередко возникают нарушения пропорциональности в развитии отдельных систем и органов организма.
В период полового созревания увеличивается как интенсивность выполняемых кратковременных нагрузок, так и способность выполнять длительную работу большой интенсивности.
Организм подростков по ряду параметров приближается к уровню взрослых, однако своеобразие этого возраста, заключающееся в относительном несовершенстве нервной и гуморальной регуляции, дисгармонии в темпах роста, обуславливают повышенную чувствительность их организма к различным воздействиям, в том числе и к физическим нагрузкам.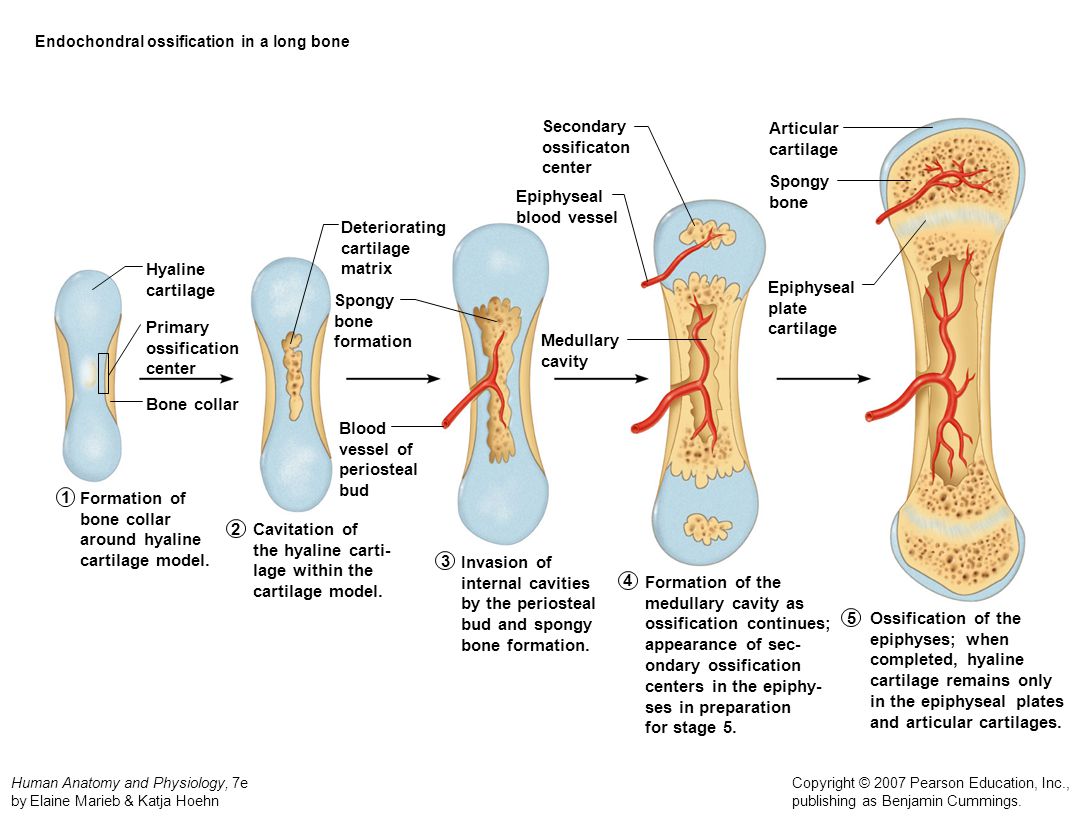
Необходимо помнить, что рационально построенная тренировка способствует преодолению временных противоречий и затруднений подросткового возраста, а гипокинезия углубляет и расширяет их.
С 10-13 лет можно серьёзно заниматься такими видами спорта, как волейбол, баскетбол, бадминтон, всеми видами борьбы, ручным мячом, футболом, хоккеем, академической греблей, коньками. С 11-13 лет – конным спортом, лёгкой атлетикой, байдаркой каноэ, стрелковым спортом. С 12-13 лет разрешаются занятия боксом, велоспортом. С 13-14 лет можно приступать к занятиям тяжёлой атлетикой.
Старшая возрастная группа (16-18 лет).
Продолжается рост и развитие, причём в ширину. Кости становятся наиболее толстыми и прочными, но процесс окостенения их ещё полностью не закончен. Позвоночник становится более прочным, усиленно развивается грудная клетка. В целом опорно-двигательный аппарат может уже выдерживать значительные статические напряжения и способен к довольно длительной работе. Складываются основные черты личности, формируется характер, более объективной становится самооценка, изменяется мотивация тех или иных поступков. Для этого возраста характерна тяга к творчеству, соревнованиям, подвигам.
Складываются основные черты личности, формируется характер, более объективной становится самооценка, изменяется мотивация тех или иных поступков. Для этого возраста характерна тяга к творчеству, соревнованиям, подвигам.
Повышается работоспособность, способность к выполнению длительной работы, возрастает мощность выполняемой работы.
В свете освещённой здесь темы необходимо обратить внимание на следующее. Темпы роста организма не совпадают с возрастными изменениями сердечно-сосудистой системы, увеличение массы тела опережает прирост массы сердца. Это может проявляться в относительной недостаточности сердечной деятельности, которая связана с физиологической невозможностью обеспечить большую массу тела достаточным количеством крови. Появляются жалобы в виде слабости, лёгкой утомляемости, склонности к обмороку при нагрузках и резких изменениях тела. Эти симптомы требуют консультации врача. И, если не обнаруживаются серьёзные поражения сердца, ребёнка ни в коем случае нельзя переводить на щадящий двигательный режим. Только достаточные и систематические занятия физкультурой, полноценный двигательный режим могут обеспечить синхронизацию функции сердца и возрастных требований организма. Ограниченная двигательная активность на фоне продолжительной учебной работы, необходимость длительное время находится в вынужденном положении (сидя) приводит к нарушению тонуса кровеносных сосудов и расстройствам его регуляции со стороны нервной системы, что может выражаться в гипо- и гипертонических состояниях.
Только достаточные и систематические занятия физкультурой, полноценный двигательный режим могут обеспечить синхронизацию функции сердца и возрастных требований организма. Ограниченная двигательная активность на фоне продолжительной учебной работы, необходимость длительное время находится в вынужденном положении (сидя) приводит к нарушению тонуса кровеносных сосудов и расстройствам его регуляции со стороны нервной системы, что может выражаться в гипо- и гипертонических состояниях.
Как видите, Аристотель всё-таки был прав в своих высказываниях. Поэтому не следует откладывать решение вопроса, когда и каким спортом заняться вашему ребёнку на «потом». Время не ждёт. Только не забывайте, что всему свое время.
Главный врач ГУЗ«ОВФД» Николаева И.В.
Эмбриональное развитие и строение зоны роста Текст научной статьи по специальности «Биотехнологии в медицине»
ЛЕКЦИИ
УДК 611-013. 7/8 DOI: 10.17816/PTORS3261-65
7/8 DOI: 10.17816/PTORS3261-65
ЭМБРИОНАЛЬНОЕ РАЗВИТИЕ И СТРОЕНИЕ ЗОНЫ РОСТА
© Заварухин В. И., Моренко Е. С., Свиридов М. К., Говоров А. В.
ФГБУ «НИДОИ им. Г. И. Турнера» Минздрава России, Санкт-Петербург
В статье представлены современные данные об эмбриональном развитии и зональном строении метаэпифизарной пластинки роста, нарушения функции которой играют важнейшую роль в формировании деформаций скелета у детей.
Ключевые слова: эпифизарная пластинка роста, зона роста, хондроциты, хрящ.
Из многочисленных аспектов биологии, вопрос о том, как происходит рост кости в длину, вызвал, пожалуй, наибольшее количество интересов. Экспериментальные исследования на данную тему начались более двух веков назад, когда Hales (1727) заметил, что отверстия, просверленные в диафизе растущей кости, всегда остаются на том же расстоянии друг от друга.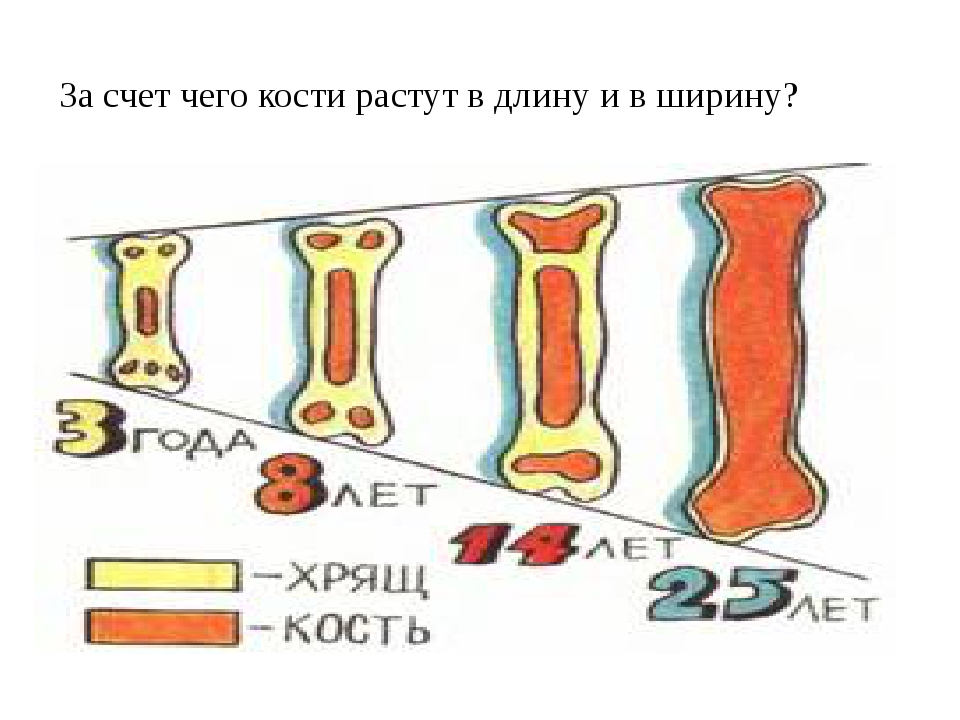 Это привело к выводу, что рост длинных трубчатых костей осуществляется на концах кости. Последующие исследования, выполненные с фиксированными маркерами, позволили идентифицировать метаэпифизарный хрящ как точное место роста трубчатых костей в длину (du Hamel, 1745; Hunter, 1772)[1].
Это привело к выводу, что рост длинных трубчатых костей осуществляется на концах кости. Последующие исследования, выполненные с фиксированными маркерами, позволили идентифицировать метаэпифизарный хрящ как точное место роста трубчатых костей в длину (du Hamel, 1745; Hunter, 1772)[1].
Эпифизарная пластинка роста, которая также называется «метаэпифизарный хрящ или физис» [2, 3], представляет собой тонкую прослойку гиалинового хряща, расположенного между эпифизом и метафизом длинных трубчатых костей [4]. Продольный рост трубчатых костей осуществляется в зоне роста благодаря процессам энхон-дрального окостенения, предполагающим постепенное замещение хрящевой ткани костной.
Развитие энхондрального окостенения у человека начинается сразу после формирования среднего зародышевого листка (мезодермы) [5]. Клетки данного зародышевого листка представляют собой малодифференцированные пролифири-рующие клетки с округлым или овальным ядром, богатым рыхло расположенным хроматином. В дальнейшем в клетках одной из субпопуляций мезодермы выявляется тенденция к конденсации: образуются плотные скопления, агрегаты клеток. Затем основное вещество, окружающее клетки в агрегатах, приобретает тинкториальные свойства, присущие хрящевой ткани. Данные клетки
В дальнейшем в клетках одной из субпопуляций мезодермы выявляется тенденция к конденсации: образуются плотные скопления, агрегаты клеток. Затем основное вещество, окружающее клетки в агрегатах, приобретает тинкториальные свойства, присущие хрящевой ткани. Данные клетки
начинают продуцировать специфические для хряща коллаген II типа и сульфатированные протео-гликаны, начинается хондрогенная дифференци-ровка, формируется хрящевая бластема [2].
Дальнейшая дифференцировка бластемы и моделирование хрящевых закладок будущих трубчатых костей связаны с процессами пролиферации клеток, активной секрецией ими межклеточного вещества, образованием перехондра (надхрящницы) и фрагментацией на сегменты.
В бластеме содержатся клетки, находящиеся в аутосинтетической интерфазе, в процессе подготовки к митотическому делению и пролиферации. Совокупность процессов пролиферации и секреции обеспечивает увеличение массы образующейся хрящевой ткани. В результате этого клетки бластемы, располагающиеся на ранних стадиях дифференцировки более тесно, разъединяются, отодвигаются друг от друга накапливающимся основным веществом и погружаются в матрикс. Таким образом, ткань хрящевого зачатка конечности приобретает строение, характерное для гиалинового хряща. Образование надхрящницы же осуществляется за счет клеток парахондральной мезенхимы, непосредственно окружающих хрящевую закладку [2]. Так происходит образование хрящевой модели будущей кости (рис. 1).
В результате этого клетки бластемы, располагающиеся на ранних стадиях дифференцировки более тесно, разъединяются, отодвигаются друг от друга накапливающимся основным веществом и погружаются в матрикс. Таким образом, ткань хрящевого зачатка конечности приобретает строение, характерное для гиалинового хряща. Образование надхрящницы же осуществляется за счет клеток парахондральной мезенхимы, непосредственно окружающих хрящевую закладку [2]. Так происходит образование хрящевой модели будущей кости (рис. 1).
В последующем хондроциты в центре образовавшейся хрящевой модели перестают активно делиться и происходит их гипертрофия. В результате действия фактора роста эндотелия сосудов (VEGF), который продуцируют клетки гипертрофической зоны, происходит инвазия кровеносных сосудов, остеобластов и других мезенхимальных клеток в хрящевую ткань, что приводит к возникновению первичного ядра (очага) оссификации
Рис. 1
1
и формированию кости [6]. По мере роста кости данное ядро окостенения распространяется в сторону эпифизарных пластинок [5].
Энхондральное окостенение осуществляется из двух очагов оссификации: диафизарного (первичный) и эпифизарного (вторичный). В результате распространения очагов энхондральной оссификации навстречу друг другу между ними отграничивается новая структура кости, называемая эпифизарной зоной роста.
При наступлении скелетной зрелости у большинства млекопитающих, в результате синосто-зирования эпифиза и метафиза, происходит замещение эпифизарной зоны роста эпифизарной линией, хотя у некоторых млекопитающих, таких как крысы, эпифизарная пластинка сохраняется и после наступления скелетной зрелости, однако уже в неактивном состоянии [7].
Также следует отметить, что эпифизарная пластинка роста «открыта» для резорбции и за-
Рис. 2
2
мещения костной тканью со стороны диафиза и в то же время относительно «закрыта» для данных процессов со стороны эпифиза. Со стороны эпифиза менее выражена гибель хондроцитов, их кальцификация, а также сосудистая инвазия. Кроме этого, присутствуют пограничные пластинки, преграждающие путь сосудам, которые располагаются в основном параллельно границе кости и хряща [2]. Данные особенности обеспечивают длительную сохранность метафизарного хряща как пластинки роста в трубчатых костях.
Метафизарному хрящу свойственны такие понятия, как зональность и полярность [2]. Пластинку роста разделяют на зоны в зависимости от скорости пролиферации хондроцитов, от степени их дифференцировки и от особенностей клеточного состава [8].
Так, раньше в эпифизарном хряще выделяли (по направлению от эпифиза к диафизу) поверхностную зону, или зону покоящегося хряща, зону столбчатого хряща и зону пузырчатого хряща [2].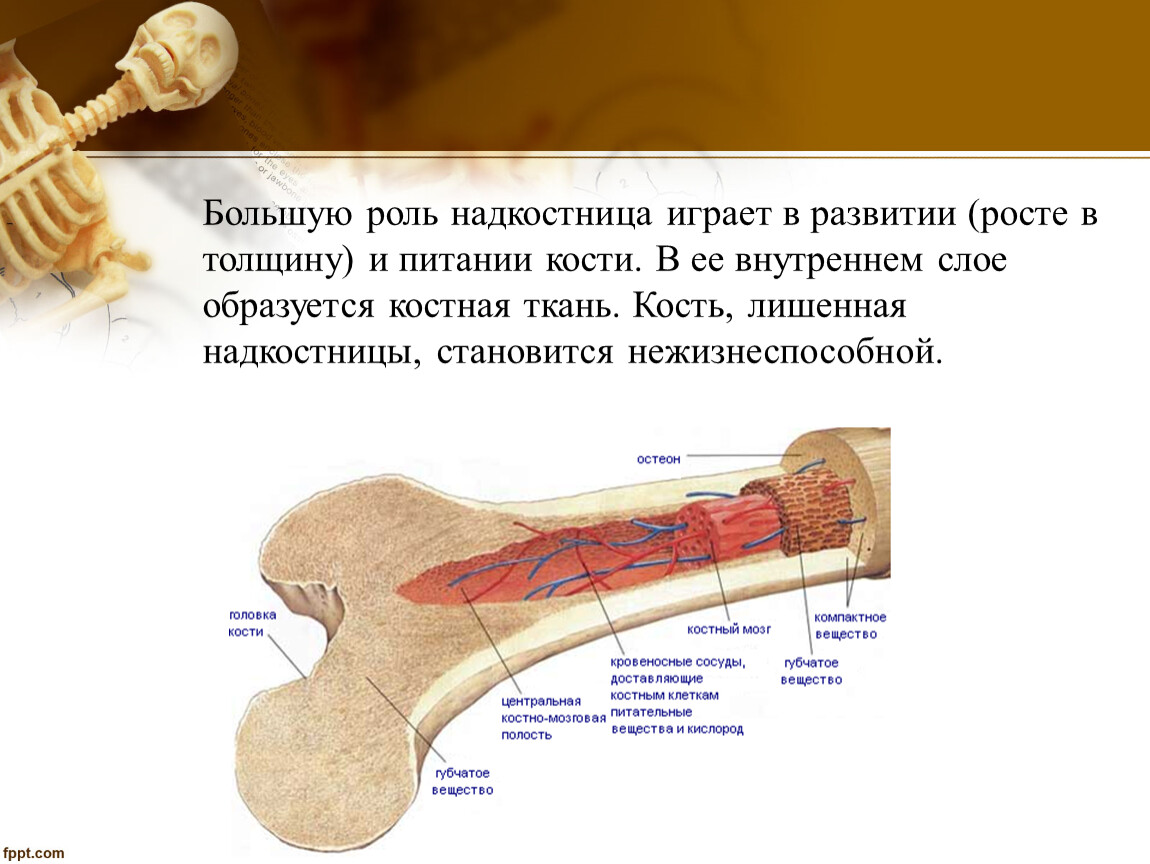 В дальнейшем было предложено выделять следующие три зоны: пограничную, промежуточную и внутреннюю.
В дальнейшем было предложено выделять следующие три зоны: пограничную, промежуточную и внутреннюю.
В 1971 г. Е. Gardner предложил использовать для классификации следующие четыре зоны эпи-физарного хряща: зона покоящегося хряща, зона пролиферирующего хряща, зона зрелого хряща, зону гибнущего и кальцифицирующего хряща.
В 1980 г. В. Г. Ковешников описал пять зон метафизарного хряща, включая в качестве пятой зоны область активного остеогенеза.
На сегодняшний день мнения различных авторов также расходятся в отношении классификации зон метаэпифизарного хряща.
Так, T. Ballock, I. Villemure et al. в зависимости от морфологических и биохимических особенностей в процессе дифференцировки хондроци-тов выделяют следующие анатомические зоны пластинки роста: зону покоя, зону пролиферации и гипертрофическую зону [9, 10].
C. Anenisia и O. Nilsson предлагают выделить, помимо вышеуказанных зон, еще одну — пре-гипертрофическую зону, которая располагается между зоной пролиферации и гипертрофической. В данной зоне, как и в зоне пролиферации, хон-дроциты имеют то же расположение, однако клетки увеличиваются в размере, а во внеклеточном матриксе увеличивается концентрация коллагена X типа. В гипертрофической же зоне происходят сосудистая инвазия и замещение вновь образовавшегося хряща на костную ткань [8].
Как следует из названий, в характеристике зон главное внимание уделялось и уделяется до сих пор клеточному составу. По мнению В. М. Павло-
вой и др., это справедливо в плане функциональной оценки зон [2]. В последующем описании характеристика основных зон метаэпифизарного хряща дана с учетом противоречий между мнениями отдельных исследователей (рис. 2).
2).
Что же касается полярности, пластинка роста считается монополярной, так как рост данной структуры осуществляется за счет только хон-дроцитов пролиферативной зоны, в то время как другие хрящи, например апофизы, биполярны. Их рост осуществляется как за счет резервных хон-дроцитов средней зоны, так и за счет хондроци-тов пролиферативной и гипертрофической зон с обеих сторон. Таким образом, рост хряща происходит в двух направлениях [10].
Процентное соотношение зон в пластинке роста относительно друг друга различно для каждого вида млекопитающих. Так, для пластинки роста новорожденного поросенка характерно следующее процентное соотношение: 70 % составляет резервная зона, 17 % — зона пролифе-ративных хондроцитов и 13 % — зона гипертрофированных хондроцитов. В то же время у крыс в возрасте 21 дня на резервную зону приходится 6 %, 35 % составляет зона пролиферативных хондроцитов и 59 % — зона гипертрофированных хондроцитов [10].
Резервная зона непосредственно контактирует с эпифизом и является в свою очередь местом фиксации эпифизарной пластинки к костным балкам эпифизарной кости [2]. В данной зоне высоко соотношение внеклеточного матрикса к объему клеток, хондроциты находятся в относительно неподвижном состоянии, представляя собой небольшие сферической формы клетки, которые располагаются или по отдельности, или парами [8, 9].
Отсутствие признаков пролиферации в клетках позволило данную зону обозначить как зону покоящегося хряща. В 1973 г. было предложено называть покоящуюся зону резервной по отношению к нижележащим зонам. Однако в результате проведенных исследований признаков пролиферации хондроцитов так и не было выявлено. На основании полученных данных было сделано предположение, что клетки данной зоны не являются резервом для подлежащих зон [2].
Однако позднее, в 2001 г. , после проведенных исследований на кроликах in vivo, было выявлено, что удаление пролиферативной и гипертрофической зон с сохранением только резервной зоны в пластинке роста приводит к полному восстановлению структуры эпифизарной пластинки в течение одной недели. Это позволяет предположить, что хондроциты резервной зоны выступают
, после проведенных исследований на кроликах in vivo, было выявлено, что удаление пролиферативной и гипертрофической зон с сохранением только резервной зоны в пластинке роста приводит к полному восстановлению структуры эпифизарной пластинки в течение одной недели. Это позволяет предположить, что хондроциты резервной зоны выступают
в роли стволовых клеток, которые постоянно пополняют запасы пролиферативной зоны [11].
Пролиферативная зона отличается способностью к активной пролиферации, чем обусловлено ее название [2]. Большинство клеток данной зоны имеют уплощенную и клиновидную форму, находятся в аутосинтетической интерфазе, и во многих из них обнаруживаются митотические фигуры. Клетки расположены в основном в плоскости продольной оси самой эпифизарной пластинки роста, это связано с особенностями расположения коллагеновых волокон внеклеточного матрикса данной зоны. Их расположение организует делящиеся клетки в столбики. Рост мета-эпифизарного хряща осуществляется как за счет увеличения числа самих клеток данной зоны, так и за счет увеличения объема внеклеточного мат-рикса, а именно за счет образования коллагена II и IX типов и протеогликанов [2].
Рост мета-эпифизарного хряща осуществляется как за счет увеличения числа самих клеток данной зоны, так и за счет увеличения объема внеклеточного мат-рикса, а именно за счет образования коллагена II и IX типов и протеогликанов [2].
Хондроциты же гипертрофической зоны теряют способность к делению, происходит 10-кратное увеличение их внутриклеточного объема за счет увеличения числа органелл, эндоплазма-тической сети, увеличения щелочной фосфа-тазы, а также синтеза и секреции коллагена X типа. Хотя точная функция коллагена X типа в пластинке роста до сих пор остается неясной, мутации, возникающие в его гене, вызывают метафизарную хондродисплазию Шмидта. Кроме этого, хондроциты этой зоны принимают участие в метаболической функции, они подготавливают внеклеточный матрикс к кальци-фикации, формированию кальцинированного хрящевого матрикса, который в дальнейшем подвергается резорбции и замещению пластинчатой костью [9, 12].
Что же касается хрящевого внеклеточного ма-трикса, его функция в эпифизарной пластинке роста также важна.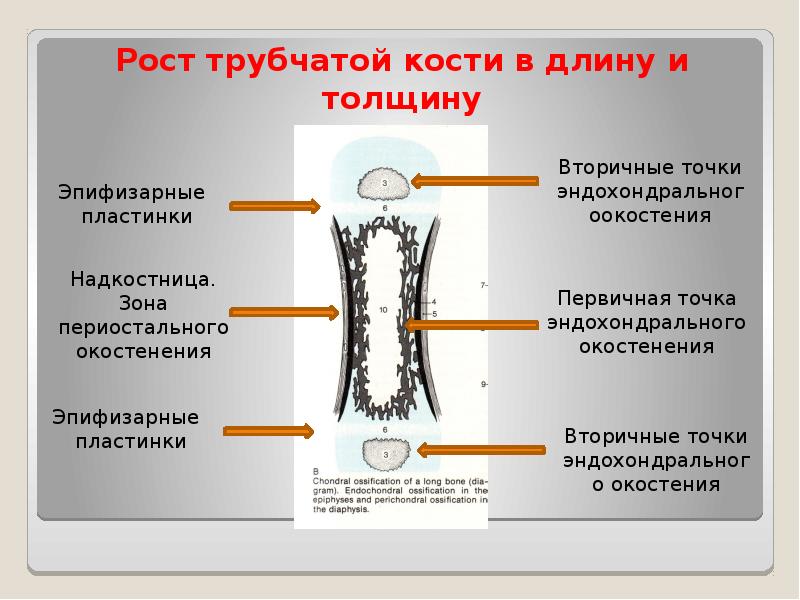 Он принимает активное участие в кальцификации хрящевой ткани, которая и служит шаблоном для образования костной ткани остеобластами [9].
Он принимает активное участие в кальцификации хрящевой ткани, которая и служит шаблоном для образования костной ткани остеобластами [9].
В пластинке роста внеклеточный матрикс представлен определенными типами коллагена и протеогликанов. Основным видом коллагена в пластинке роста является коллаген II типа, он состоит из трех идентичных а1-цепей и кодируется геном COL2А1. При возникновении мутаций в этом гене возникают хондродисплазии различной степени тяжести: ахондрогенез II типа, синдром Стиклера [13].
В пластинке роста представлены и коллагены других типов, такие как XI, IX и X типы, они также выполняют важную роль в нормальном функционировании пластинки роста.
Коллаген XI типа является гетеродимером и представлен коллагеновыми цепями а1(Х1)а2(Х1)а3(Х1), цепи а1(Х1)а2(Х1) кодируются геном COL11А1, в то время как а3(Х1) — геном COL11А2.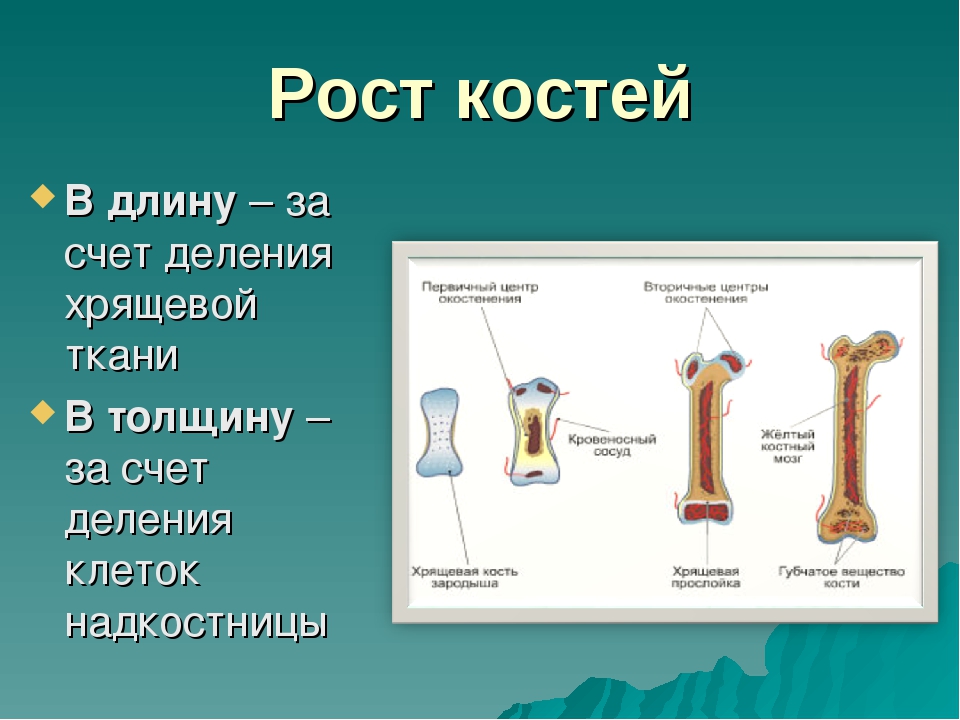 Коллаген данного типа находится только в тонких фибриллах коллагена II типа и регулирует их диаметр. Мутации, возникающие в генах COL11А1 и COL11А2, приводят к возникновению различных скелетных дисплазий, таких как синдром Стикле-ра или синдром Маршала. В результате проведенных исследований установлено, что при возникновении мутаций в данных генах у гомозиготных мышей возникают нарушения в структуре пластинки роста, развивается тяжелая степень хон-дродисплазии и животные погибают сразу после рождения [13].
Коллаген данного типа находится только в тонких фибриллах коллагена II типа и регулирует их диаметр. Мутации, возникающие в генах COL11А1 и COL11А2, приводят к возникновению различных скелетных дисплазий, таких как синдром Стикле-ра или синдром Маршала. В результате проведенных исследований установлено, что при возникновении мутаций в данных генах у гомозиготных мышей возникают нарушения в структуре пластинки роста, развивается тяжелая степень хон-дродисплазии и животные погибают сразу после рождения [13].
Коллаген IX также является гетеродимером и состоит из трех отдельных коллагеновых цепей: а1(ГХ)а2(ГХ)а3(ГХ), которые кодируются генами COL9А1, COL9А2, COL9А3 соответственно. При возникновении мутаций в данных генах возникают различные эпифизарные дисплазии с аутосом-но-доминантным типом наследования.
Что же касается коллагена X типа, он также состоит из трех цепей а1(Х), за образование данного коллагена отвечает ген COL10А1, различные сбои в данном гене вызывают дисплазию Шмидта.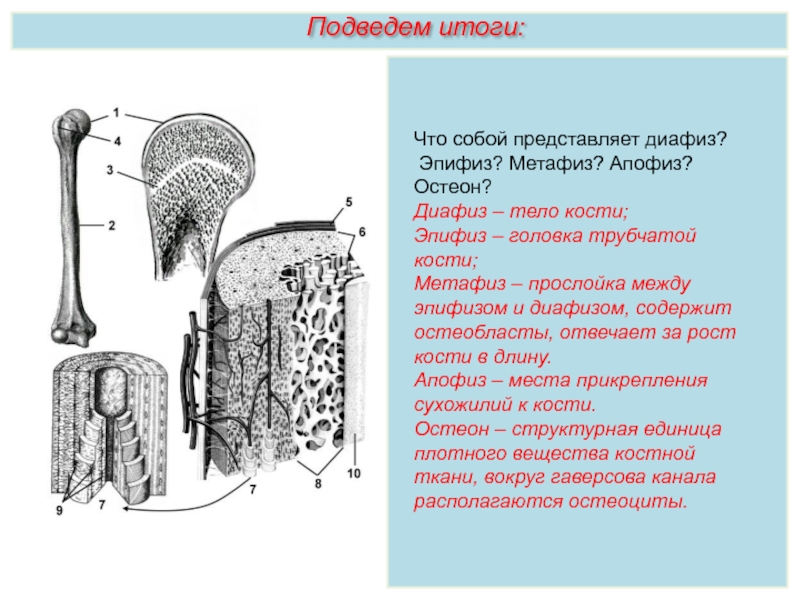
Протеогликаны в эпифизарной пластинке представлены агреканом, как основным компонентом, перлеканом, декорином, фибромодулином и люмиканом. Кроме этого, в пластинке роста содержатся непротеиновые белки — матрилин, те-насцин С, олигомерный матричный белок хряща.
Агрекан относится к крупным протеоглика-нам, так как он имеет большую молекулярную массу и содержит свыше 100 цепей гликозами-ногликанов. Он придает прочность эпифизарной пластинке роста. Матрилин рассматривается как адаптер белка при формировании внеклеточного матрикса. Перлекан является основным гепаран-сульфатсодержащим протеогликаном базальных мембран, он обеспечивает связь между клетками и компонентами межклеточного матрикса.
Кроме вышеупомянутых хондродисплазий, в результате действия различных факторов на ме-таэпифизарный хрящ могут возникать и другие патологии опорно-двигательного аппарата, такие как вальгусная или варусная деформация на уровне коленных суставов, идиопатический сколиоз, брахиметакарпия [14], брахиметатарзия и многие другие.
Представленные и систематизированные в статье современные данные о строении и функциональном значении структур зон роста позволяют
по-новому взглянуть на механизмы развития деформаций скелета у детей.
Список литературы
1. Scott B, Pease D. Electron microscopy of the epiphyseal apparatus. The Anatomical record. 2005;126(4):465-95. doi: 10.1002/ar.1091260405.
2. Павлова В.Н., Копьева Т.Н., Слуцкий Л.И., Павлов Г.Г. Хрящ. — М.: Медицина, 1988. — 320 с. [Pavlova VN, Kop,eva TN, Slutskiy LI, Pavlov GG. Khryashch. Moscow, 1988. 320 p.]
3. Piszczatowski S. Material aspects of growth plane modeling using Carters and Stoke,s approaches. Acta of Bioengineering and Biomechanics. 2011;13(3):3-14.
2011;13(3):3-14.
4. Emons J, Chagin A, Malmlof T, et al. Expression of vascular endothelial growth factor in the growth plate is stimulated by estradiol and increases during pubertal development. Journal of Endocrinology. 2010;205:61-68. doi: 10.1677/J0E09-03-37.
5. Ornitz D, Marie P. FGF signaling pathways in endo-chondral and intramembranous bone development and human genetic disease. Genes and Development. 2002;16:1446-1465. doi: 10.1101/gad.990702.
6. Zelzer E, Olsen B. Multi roles of vascular endothelial growth factor (VEGF) in skeletal development, growth, and repair. Current Topics in Developmental Biology. 2004;65;169-87. doi: 10.10.16/s0070-2153(04)65006-x.
7. Horton J, Bariteau J, et al. Ontogeny of skeletal maturation in the juvenile rat. Anat. Rec (Hoboken). 2008;291(3):283-292.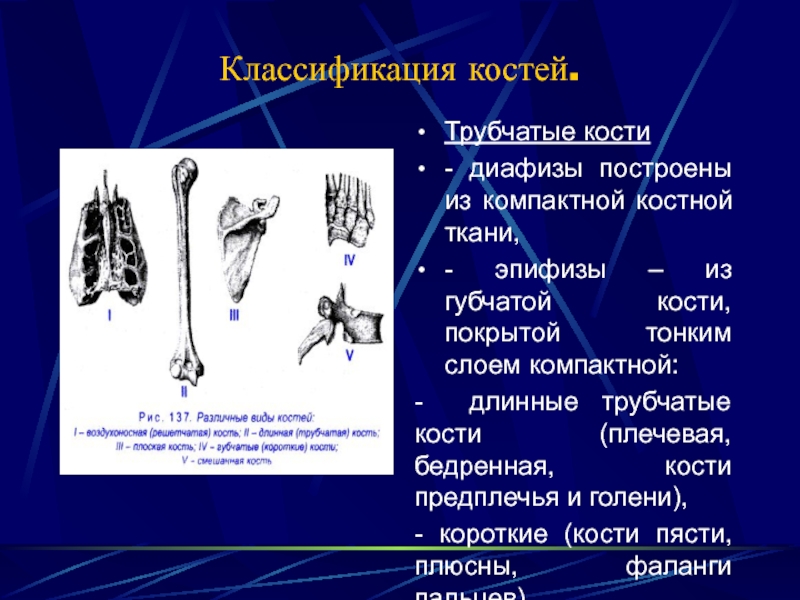 doi: 10.1002/ar.20650.
doi: 10.1002/ar.20650.
8. Anenisia Coelho de Andrade. Local regulation of growth plane chondrocytes: molecular mechanisms and implications for longitudinal bone growth. Thesis for doctor degree (Ph. D). 2010.
9. Ballock R, Regis J. The biology of the growth plane. JBJS. ORG. 2003;85(4):715-726.
10. Villemure I, Stokes A. Growth plane mechanics and mechanobiology. A survey of present understanding. The Journal of biomechanics. 2009;42:1793-1803. doi: 10.1016/j.biomech.2009.05.021.
11. Abad V, Meyers J, Weise M, et al. The role of resting zone in growth plane chondrogenesis. Endocrinology. 2002;43(5):1851-1857. doi: 10.1210/en.1435.1851.
12. Nowlan N, Sharpe J, Prendergast P, et al. Mechanobiol-ogy of embryonic skeletal development: insights from animal models.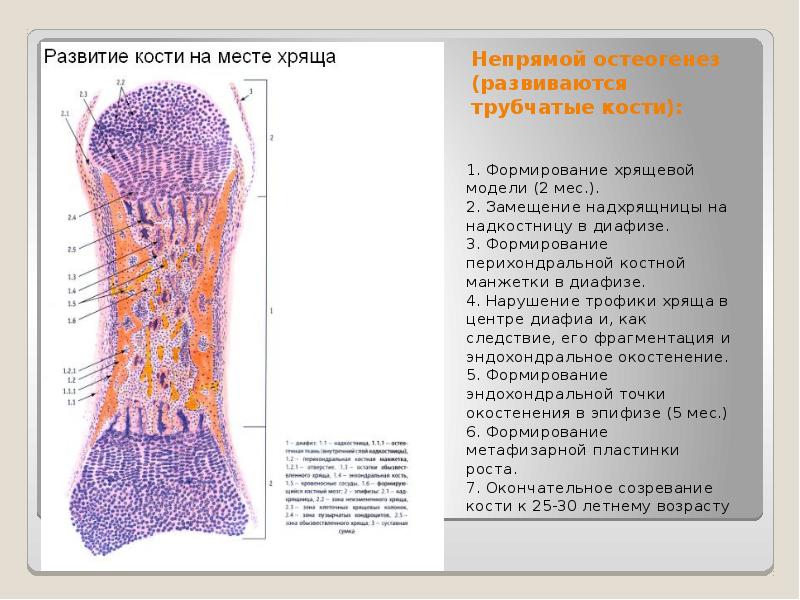 Birth defects Rec C Embryo Today. 2010;90(3):203-213. doi: 10.1002/bdrc.20184.
Birth defects Rec C Embryo Today. 2010;90(3):203-213. doi: 10.1002/bdrc.20184.
13. Myllyharju J. Extracellular matrix and developing growth plane. Curr osteoporos rep. 2014;12:439-445. doi: 10.1007/s11914-014-0232-1.
14. Заварухин В.И., Баиндурашвили А.Г., Говоров А.В. Брахиметакарпия: особенности патологии и ее оперативного лечения. // Травматология и ортопедия России. 2013;4(70):33-41. [Zavarukhin VI, Baindurash-vili AG, Govorov AV. Brakhimetakarpiya: osobennosti patologii I ee operativnogo lecheniya. Travmatologiya I ortopediy Rossii. 2013;4(70):33-41.]
EMBRYONIC DEVELOPMENT AND THE STRUCTURE OF THE GROWTH PLATE
Zavarukhin V.I., Morenko E.S., Sviridov M.K., Govorov A.V.
The Turner Institute for Children’s Orthopedics, Saint-Petersburg, Russian Federation
The article presents modern data on embryonic Keywords: epiphyseal plate, growth plate, chondro-development and zonal structure of the metaepiphyseal cytes, cartilage. growth plate, which dysfunction plays an important role in the formation of skeletal deformities in children.
growth plate, which dysfunction plays an important role in the formation of skeletal deformities in children.
Сведения об авторах:
Заварухин Владимир Иванович — научный сотрудник отделения реконструктивной микрохирургии и хирургии кисти ФГБУ «НИДОИ им. Г. И. Турнера» Минздрава России. E-mail: [email protected].
Моренко Екатерина Сергеевна — ординатор ФГБУ «НИДОИ им. Г. И. Турнера» Минздрава России. E-mail: [email protected].
Свиридов Максим Константинович — аспирант отделения реконструктивной микрохирургии и хирургии кисти ФГБУ «НИДОИ им. Г. И. Турнера» Минздрава России. E-mail: [email protected].
Говоров Антон Владимирович — к. м. н., научный сотрудник отделения реконструктивной микрохирургии и хирургии кисти ФГБУ «НИДОИ им. Г. И. Турнера» Минздрава России. E-mail: [email protected].
Г. И. Турнера» Минздрава России. E-mail: [email protected].
Zavarukhin Vladimir Ivanovich — MD, research associate of the department of reconstructive microsurgery and hand surgery. The Turner Scientific and Research Institute for Children’s Orthopedics. E-mail: [email protected].
Morenko Ekaterina Sergeevna — resident The Turner Scientific and Research Institute for Children’s Orthopedics. E-mail: [email protected].
Sviridov Maxim Konstantinovich — MD, PhD student of the department of reconstructive microsurgery and hand surgery. The Turner Scientific and Research Institute for Children’s Orthopedics. E-mail: [email protected].
Govorov Anton Vladimirovich — MD, PhD, research associate of the department of reconstructive microsurgery and hand surgery. The Turner Scientific and Research Institute for Children’s Orthopedics. E-mail: [email protected].
E-mail: [email protected].
Физическое развитие ребёнка — Детский сад №119 г. Калининград
Физическое развитие ребенкаДошкольный возраст имеет особо важное значение, так как в этом возрасте закладывается основа для физического развития, здоровья и характера человека в будущем.
Строго фиксированную границу между отдельными периодами детства провести трудно, но среди других возрастов дошкольный возраст имеет особо важное значение. В этом возрасте закладывается основа для физического развития, здоровья и характера человека в будущем. В дошкольном возрасте отчетливо намечаются генетические особенности детей. Этот период детства характеризуется постепенным совершенствованием всех функций детского организма. Ребенок этого возраста отличается чрезвычайной пластичностью. Влияние мышечной деятельности организма приобретает еще более важное значение, ибо движение является биологической потребностью растущего организма.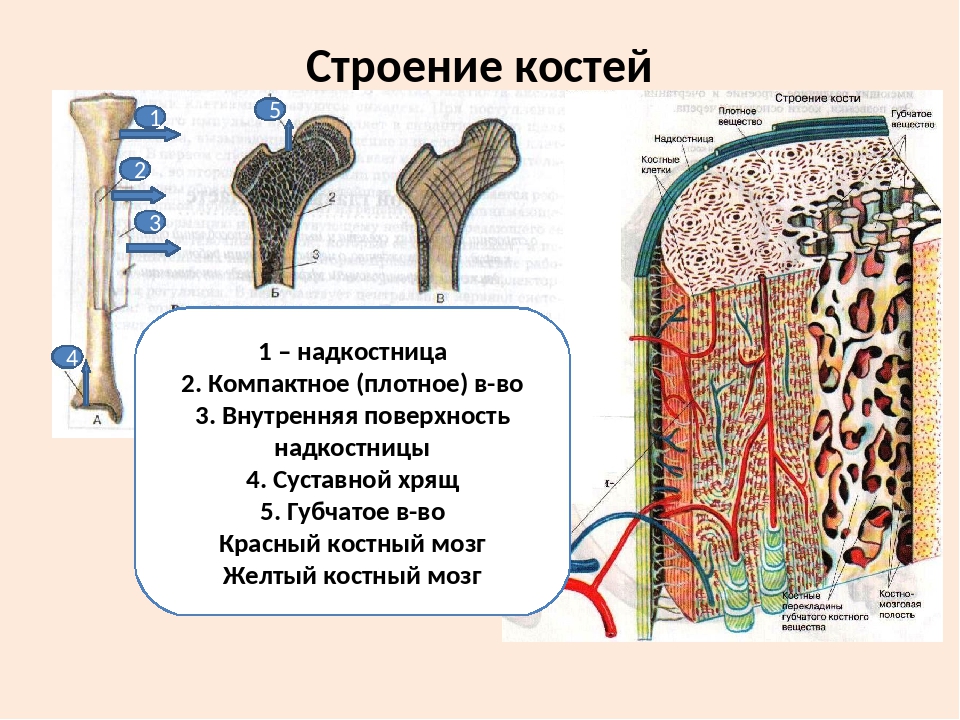
Физическое развитие детей дошкольного возраста идет менее интенсивно, чем в раннем детстве. Масса тела годовалого ребенка удваивается к 6-7 годам. Если в течение 1-го года жизни рост увеличивается на 20-25 см, то в 4-5 лет он увеличивается только на 4-6 см. К 5 годам рост новорожденного удваивается. В 5-7 лет интенсивность роста вновь нарастает. Этот период именуется периодом «первого вытяжения».
Одним из важных показателей, определяющих физическое развитие детей, является отношение окружности головы к окружности груди. Чем старше ребенок, тем большое становится разница между этими показателями (окружность груди должна быть большое). На первом году жизни окружность груди превышает полурост ребенка на 7-10 см, а у 7-летнего ребенка она равна полуросту.
В дошкольном возрасте происходит быстрый рост скелета. Сращение черепных швов заканчивается к 4 годам. Форма грудной клетки несколько изменяется, хотя у детей 3-7 лет она еще остается конусообразной, ребра приподняты и не могут опускаться так низко, как у взрослых, что ограничивает амплитуду их движения.
Сроки начала и окончания окостенения различны для различных костей. Так, сращение подвздошной, седалищной и лобковых костей начинается только с 5-6 лет. По мере роста и развития ребенка с переходом его в вертикальное положение формируются физиологические кривизны позвоночника в шейном и поясничном отделах с изгибом вперед, а в грудном и крестцовом — назад. К 6-7 годам они отчетливо намечаются, но только к 14-15 годам становятся постоянными. Конфигурация позвоночника, положение головы, плечевого пояса, наклон таза определяют осанку ребенка. Формирование осанки зависит от многих условий внешней среды (питание, режим для, организация сна), но в основном — от двигательной активности ребенка. Большое значение для воспитания правильной осанки имеет симметричное развитие мышц и равномерность опоры на нижние конечности.
До 4 лет свод стопы несколько уплощен — это физиологическое явление. Но при чрезмерной статической нагрузке можно вызвать тяжелое, необратимое плоскостопие, несмотря на высокую эластичность мышц и связочного аппарата голени и стопы. При правильной дозировке нагрузки свод стопы формируется правильно. Это же положение относится к росту и развитию все костной системы у детей. Физически оптимальные нагрузки способствуют нормальному формированию скелета, чрезмерные же отражаются на форме и структуре костей. Это подтверждается исследованиями, выявившими значительную гипертрофию костной ткани при чрезмерной нагрузке на руки при длительной тренировке в метании и на толчковой ноге при тренировке прыжков в высоту.
При правильной дозировке нагрузки свод стопы формируется правильно. Это же положение относится к росту и развитию все костной системы у детей. Физически оптимальные нагрузки способствуют нормальному формированию скелета, чрезмерные же отражаются на форме и структуре костей. Это подтверждается исследованиями, выявившими значительную гипертрофию костной ткани при чрезмерной нагрузке на руки при длительной тренировке в метании и на толчковой ноге при тренировке прыжков в высоту.
Интенсивное развитие скелета детей взаимосвязано с ростом, формированием мышц и связочно-суставного аппарата. Чем младше ребенок, тем более эластичен связочно-суставной аппарат. Масса мышечной ткани мала по отношению к общей массе тела, но с возрастом мышечная ткань изменяется. Масса мышц в ходе развития увеличивается больше, чем масса многих других органов. Если масса мышц у новорожденных составляет 23,3% массы всего тела, то у 7-8-летних детей она увеличивается до 27,2%.
Одновременно с увеличением массы мышц совершенствуются их функциональные свойства. Если у грудного ребенка скелетная мускулатура является одним из стимуляторов бурного роста и развития, то в дошкольном возрасте, по мере снижения интенсивности роста, развитие скелетной мускулатуры связано с увеличением ее двигательной активности. Чем выше деятельность скелетных мышц в оптимальных условиях для данного возраста, тем полноценней обмен, функции внутренних органов и систем.
Если у грудного ребенка скелетная мускулатура является одним из стимуляторов бурного роста и развития, то в дошкольном возрасте, по мере снижения интенсивности роста, развитие скелетной мускулатуры связано с увеличением ее двигательной активности. Чем выше деятельность скелетных мышц в оптимальных условиях для данного возраста, тем полноценней обмен, функции внутренних органов и систем.
Развитие и улучшение функции опорно-двигательного аппарата в старшем дошкольном возрасте тесно связано с совершенствованием функции внутренних органов и систем.
При интенсивной мышечной нагрузке ребенок обладает малыми возможностями, по сравнению со взрослыми, за счет недостаточного регулирования кислородного режима. Задержка, а также затруднение дыхания у детей во время мышечной деятельности вызывает быстрое уменьшение насыщения крови кислородом.
Большую роль в развитии и регуляции дыхания играет двигательная активность ребенка. Тренировка дыхательных мышц приводит к увеличению экскурсий грудной клетки, мощности дыхательного аппарата.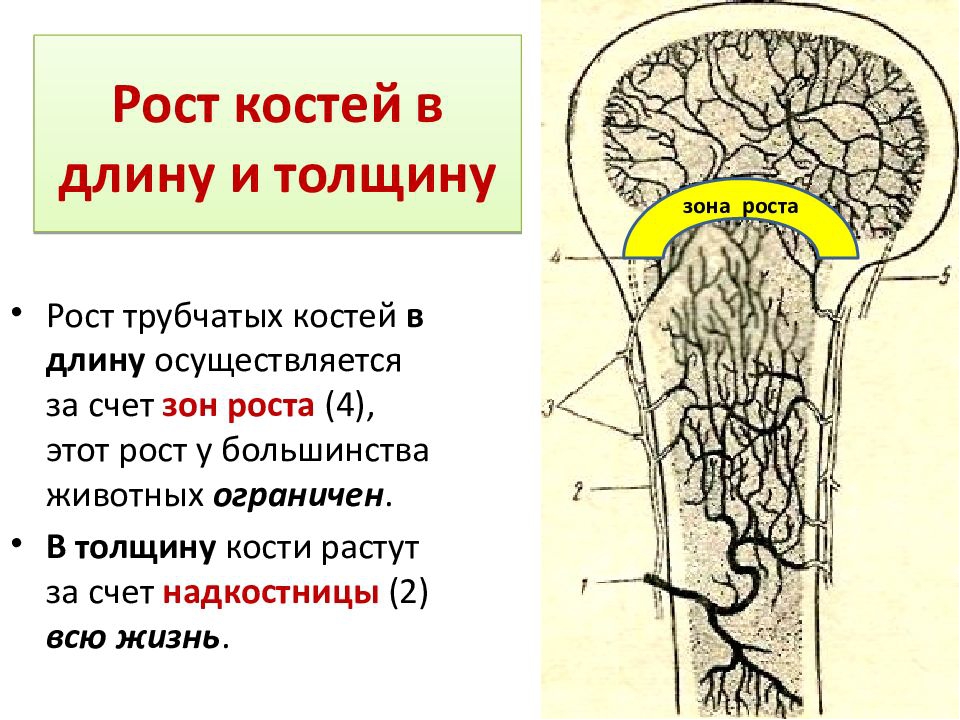 С возрастом дыхание становится все более управляемым. Необходимо приучать детей дышать через нос, спокойно. Вдыхаемый через нос воздух раздражает рецепторы верхних дыхательных путей, что рефлекторно приводит к расширению бронхиол (носолегочный рефлекс). Улучшению управления дыханием способствует пребывание и активная двигательная деятельность детей на воздухе (подвижные игры, лыжи, санки и др.).
С возрастом дыхание становится все более управляемым. Необходимо приучать детей дышать через нос, спокойно. Вдыхаемый через нос воздух раздражает рецепторы верхних дыхательных путей, что рефлекторно приводит к расширению бронхиол (носолегочный рефлекс). Улучшению управления дыханием способствует пребывание и активная двигательная деятельность детей на воздухе (подвижные игры, лыжи, санки и др.).
Как указывалось ранее, функцию сердечно-сосудистой системы нельзя рассматривать изолированно от функций других систем организма. Работоспособность детского сердца высокая. Масса сердца к 5 годам увеличивается в 4 раза. Развитие мышечной ткани сердца заканчивается к 10-12 годам, а иннервационный аппарат сердца совершенствуется примерно к 7-8 годам. Частота пульса продолжает уменьшаться (в 3-5 лет — 72-110 ударов в 1 мин, в 6-7 лет — 70-80 ударов в 1 мин). Артериальное давление увеличивается, особенно в период с 6-7 до 10 лет.
Считается, что хорошее развитие скелетной мускулатуры, соответствующее возрасту, во многом способствует развитию здорового сердца, а физические упражнения увеличивают возможности организма и удлиняют жизнь человека. Рекомендуется начинать занятия физическими упражнениями как можно раньше для профилактики сердечно-сосудистых заболеваний.
Рекомендуется начинать занятия физическими упражнениями как можно раньше для профилактики сердечно-сосудистых заболеваний.
В последнее время в связи с явлениями акселерации отмечается и более ранее изменение некоторых функциональных показателей сердечно-сосудистой системы. Так, раньше у детей в 5 лет средняя частота пульса составляла 98-100 ударов в минуту, а сейчас 97 ударов в 1 минуту.
Напряженность обмена веществ продолжает оставаться особенностью растущего организма: чем младше ребенок, тем интенсивнее обмен. Энергетические затраты на 1 кг массы тела с возрастом постепенно снижаются.
Высокая пластичность нервной системы в данном возрасте способствует лучшему и быстрому освоению новых движений, иногда даже сложных.
Дети в процессе свободной игровой деятельности и при занятиях физическими упражнениями овладевают сохранением равновесия, плаванием, ходьбой на лыжах, катанием на коньках и пр. Улучшается ориентировка. Освоение двигательных навыков, особенно в возрасте от 3 до 5 лет, происходит с широкой иррадиацией процесса возбуждения, что затрудняет обучение. У детей этого возраста сила нервных процессов, особенно внутреннего торможения, невелика. Поэтому внимание детей неустойчиво; они быстро отвлекаются, в связи с чем в этом возрасте рекомендуется максимально использовать показ упражнений и упражнения подражательно-игрового характера, сочетая их со словом. При слишком трудных заданиях у детей может наступить утомление. Вопрос об оптимальных нагрузках должен обязательно учитываться при усвоении некоторыми детьми сложных спортивных навыков (коньки, некоторые виды гимнастики, плавание). В этом возрасте может быть нанесен вред растущему организму, неподготовленному по своим возрастным особенностям к чрезмерным нагрузкам. В этом периоде к перегрузкам не готовы ни центральная нервная система, ни дыхательная и сердечно-сосудистая системы. Отсутствуют также сила и выносливость. Осторожность в подходе к тренировке детей дошкольного возраста диктуется еще и тем обстоятельством, что усталость как субъективное проявление утомления выражается у них неярко.
У детей этого возраста сила нервных процессов, особенно внутреннего торможения, невелика. Поэтому внимание детей неустойчиво; они быстро отвлекаются, в связи с чем в этом возрасте рекомендуется максимально использовать показ упражнений и упражнения подражательно-игрового характера, сочетая их со словом. При слишком трудных заданиях у детей может наступить утомление. Вопрос об оптимальных нагрузках должен обязательно учитываться при усвоении некоторыми детьми сложных спортивных навыков (коньки, некоторые виды гимнастики, плавание). В этом возрасте может быть нанесен вред растущему организму, неподготовленному по своим возрастным особенностям к чрезмерным нагрузкам. В этом периоде к перегрузкам не готовы ни центральная нервная система, ни дыхательная и сердечно-сосудистая системы. Отсутствуют также сила и выносливость. Осторожность в подходе к тренировке детей дошкольного возраста диктуется еще и тем обстоятельством, что усталость как субъективное проявление утомления выражается у них неярко.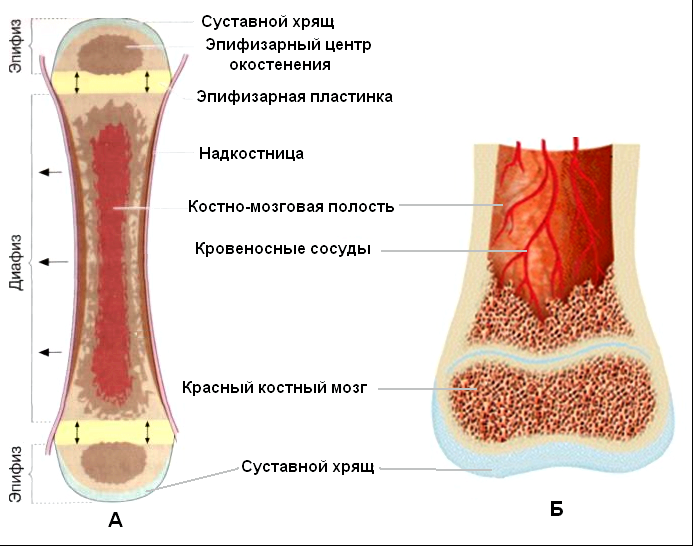 Это особенно характерно в тех случаях, когда занятия проводятся эмоционально. Повышенные требования, ведущие к перегрузке, являются вредными для здоровья ребенка, т.е.е могут вызвать серьезные изменения как в центральной нервной системе, так и во внутренних органах, нарушить правильный ритм роста и развития.
Это особенно характерно в тех случаях, когда занятия проводятся эмоционально. Повышенные требования, ведущие к перегрузке, являются вредными для здоровья ребенка, т.е.е могут вызвать серьезные изменения как в центральной нервной системе, так и во внутренних органах, нарушить правильный ритм роста и развития.
Развитие ловкости, быстроты, силы и выносливости происходит постепенно и связано с развитием функций центральной нервной системы, с подвижностью, силой и уравновешенностью процессов возбуждения и торможения. Совершенствуется анализаторная деятельность коры головного мозга, становятся более понятными явления окружающей среды, усиливается роль тормозных процессов. Значительно усиливается роль тормозных процессов. Значительно проявляются типологические черты характера. Речь делается связной, ребенок может хорошо передать свои мысли, впечатления. Легко образуются условно-рефлекторные связи, чтение, письмо, проявляется относительный приоритет над эмоциями.
Двигательные качества детей характеризуются генетическими свойствами нервно-мышечного аппарата, одновременно они отражают условия воспитания, влияния окружающей среды.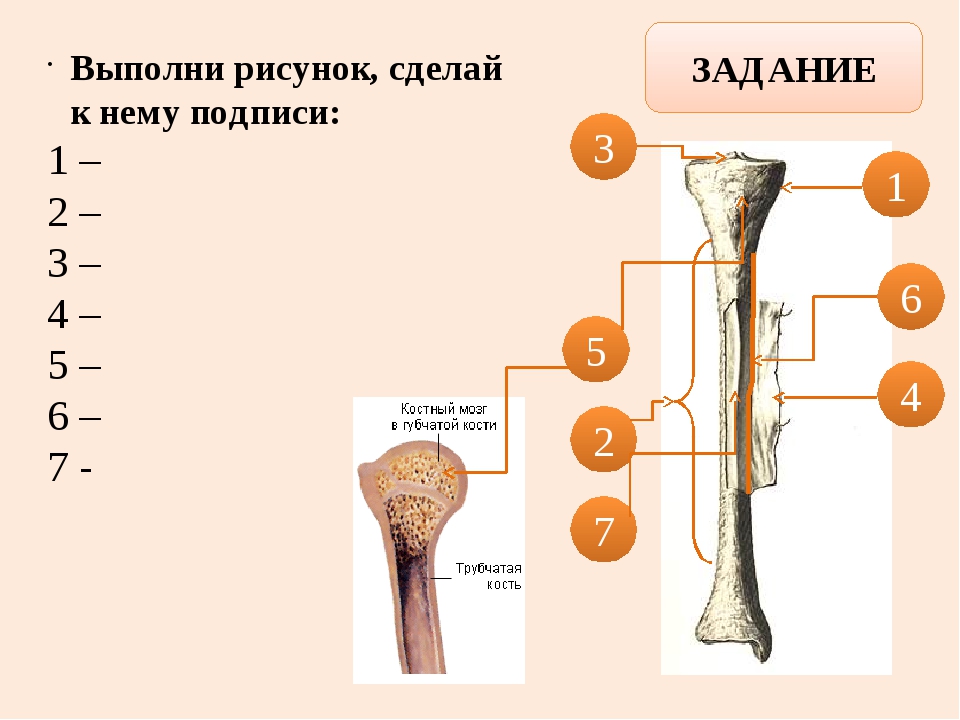 Такой подход к оценке двигательных качеств позволяет понять причины неравномерного формирования двигательных возможностей у детей и обязательное обеспечение соответствующих условий для их всестороннего физического развития.
Такой подход к оценке двигательных качеств позволяет понять причины неравномерного формирования двигательных возможностей у детей и обязательное обеспечение соответствующих условий для их всестороннего физического развития.
Необходимо поощрять двигательную активность ребенка, так как большие энергозатраты способствуют не только восстановлению, но и накоплению, что является основным фактором для обеспечения роста и развития организма.
Поделиться с друзьями:ПЕРСПЕКТИВЫ ИСПОЛЬЗОВАНИЯ ФАКТОРОВ РОСТА В ВОССТАНОВЛЕНИИ КОСТНОЙ ТКАНИ. ОБЗОР ЛИТЕРАТУРЫ
Введение. В практике хирургической стоматологии и челюстно-лицевой хирургии, для заполнения дефектов, возникающих после удаление зубов, опухолей и опухолевидных образований, с целью предотвращения возможных осложнений, а также для ускорения регенерации костной ткани используется большое количество биогенных и синтетических препаратов. В настоящее время ведется поиск новых фармакологических средств, добавление которых в имплантируемый остеопластический материал, будет способствовать улучшению микроциркуляции в зоне оперативного вмешательства, ускоренному прорастанию сосудов и регенерации костной ткани в месте дефекта.
Поиск препаратов, способствующих восстановлению микроциркуляции и ускоряющих регенерацию костной ткани, как в эксперименте, так и в клинике, после операций на челюстных костях, является актуальной темой хирургической стоматологии и челюстно-лицевой хирургии. Костная ткань – одна из разновидностей соединительной ткани, состоит в основном из гидроксиапатита (65%) и коллагена (25%). Кроме того, в кости присутствуют специализированные клетки, способствующие функционированию костной ткани. Учёные создают для имплантата специальное покрытие, максимально близкое по параметрам к параметрам человеческой кости. Оно включает в себя не только гидроксиапатит и коллаген, но и факторы роста, дифференциации и адгезии (сцепление поверхностей разнородных твёрдых и/или жидких тел) клеток, привлекающие к месту имплантации клетки организма, которые способствуют заживлению области введения имплантата и восстановлению костной ткани [1].
В поддержании жизни высших организмов ключевую роль играет контроль пролиферации, дифференцировки и направленного движения клеток.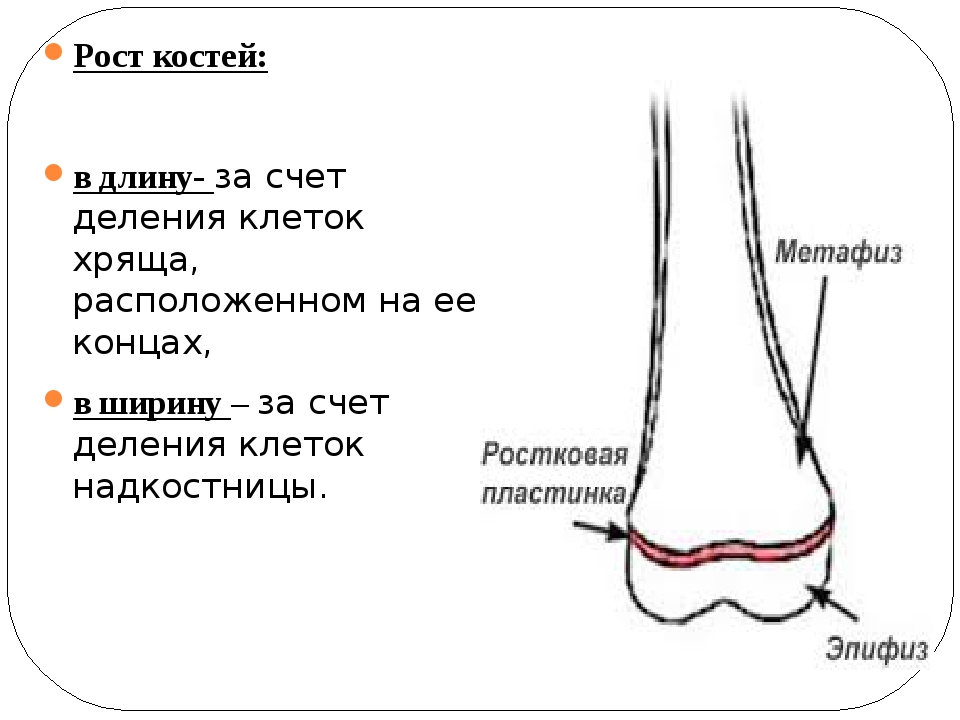 Нормальное протекание этих процессов обеспечивает правильные развитие и защитные реакции организма. Постоянно регенерирующие ткани также требуют строгой регуляции пролиферации стволовых клеток. Необходимая регуляция клеточной пролиферации, дифференцировки и клеточной подвижности осуществляется с помощью различных механизмов. Одним из них является взаимодействие клетки с ростовыми факторами.
Нормальное протекание этих процессов обеспечивает правильные развитие и защитные реакции организма. Постоянно регенерирующие ткани также требуют строгой регуляции пролиферации стволовых клеток. Необходимая регуляция клеточной пролиферации, дифференцировки и клеточной подвижности осуществляется с помощью различных механизмов. Одним из них является взаимодействие клетки с ростовыми факторами.
Факторы роста — это белковые молекулы, регулирующие деление и выживание клеток. Их можно получать с помощью генной инженерии в лаборатории и использовать в терапии. Часто исследователи используют термин «факторы роста» как синоним цитокинов.
Подобно гормонам, эти факторы обладают широким спектром биологического воздействия на многие клетки стимулируют или ингибируют митогенез, хемотаксис и дифференцировку. В отличие от гормонов, факторы роста, как правило, продуцируются неспециализированными клетками, находящимися во всех тканях, и обладают эндокринным, паракринным и аутокринным действием. Эндокринные факторы вырабатываются и транспортируются к удаленным клеткам-мишеням через кровоток. Достигая своей «цели», они взаимодействуют со специализированными высокоаффинными рецепторами. Паракринные факторы отличаются тем, что распространяются путем диффузии. Клетки-мишени для этих факторов обычно расположены вблизи клеток-продуцентов. Аутокринные факторы оказывают воздействие на клетки, являющиеся их непосредственным источником. Большинство полипептидных факторов роста действует по паракринному или аутокринному типу. Однако отдельные факторы, такие как инсулиноподобный фактор роста, способны оказывать эндокринное действие [2, 3].
Эндокринные факторы вырабатываются и транспортируются к удаленным клеткам-мишеням через кровоток. Достигая своей «цели», они взаимодействуют со специализированными высокоаффинными рецепторами. Паракринные факторы отличаются тем, что распространяются путем диффузии. Клетки-мишени для этих факторов обычно расположены вблизи клеток-продуцентов. Аутокринные факторы оказывают воздействие на клетки, являющиеся их непосредственным источником. Большинство полипептидных факторов роста действует по паракринному или аутокринному типу. Однако отдельные факторы, такие как инсулиноподобный фактор роста, способны оказывать эндокринное действие [2, 3].
Первые публикации о возможности поддержания в живом состоянии фрагментов биологической ткани in vitro появились 90 лет назад, но рутинное культивирование отдельных клеток стало возможным менее 50 лет назад. Успешное поддержание процесса деления клеток млекопитающих зависит от компонентов среды культивирования. Традиционно среда для культивирования состоит из питательных веществ и витаминов в забуференном солевом растворе.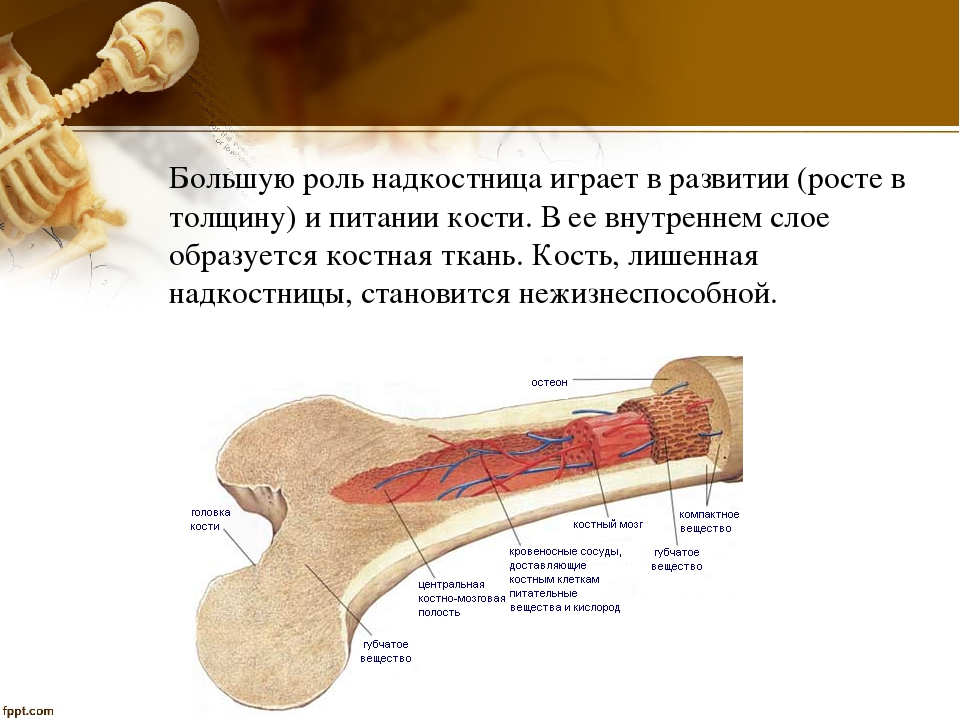 Ключевым компонентом является сыворотка животных, например, эмбриональная бычья сыворотка. Без такой добавки наибольшая часть культивируемых клеток не будут воспроизводить собственную ДНК и, следовательно, не будут пролиферировать. Позже был изолирован полипептид с молекулярной массой 30 кД, секретируемый тромбоцитами, обладающий митогенными свойствами. Он был назван PDGF (или ФРТ — тромбоцитарный фактор роста).
Ключевым компонентом является сыворотка животных, например, эмбриональная бычья сыворотка. Без такой добавки наибольшая часть культивируемых клеток не будут воспроизводить собственную ДНК и, следовательно, не будут пролиферировать. Позже был изолирован полипептид с молекулярной массой 30 кД, секретируемый тромбоцитами, обладающий митогенными свойствами. Он был назван PDGF (или ФРТ — тромбоцитарный фактор роста).
Как и в случае с гормонами, факторы роста взаимодействуют с соответствующими рецепторами факторов роста с высокой степенью аффинности и могут инициировать множественные эффекты: от процессов регуляции роста, дифференцировки и экспрессии генов до инициирования апоптоза. Эффекты факторов роста, в отличие от гормонов, могут продолжаться в течение нескольких дней.
Факторы роста обычно представляют собой небольшие полипептиды, которые стимулируют или ингибируют пролиферацию определенных типов клеток. Как правило, они секретируются одними клетками и действуют на другие клетки, хотя иногда бывает так, что они действуют на те же клетки, которые их секретируют.
Факторы роста действуют на свои клетки-мишени, которые отличаются от других клеток рецепторами, экспонированными на поверхности клеточных мембран и характерными именно для данного типа клеток.
В конечном счете, клетка выходит из фазы отдыха G0 и начинает делиться. Интегральная картина взаимодействий множества факторов с множеством клеток сложна, тем более, что часто даже отдельно взятый ростовый фактор обладает несколькими функциями. Удаление ростовых факторов из среды не всегда приводит просто к остановке клеточного деления, но часто вызывает программируемую клеточную смерть.
Факторы роста не только промотируют клеточное деление, но и наоборот, некоторые из них ингибируют этот процесс. Роль ингибитора, в частности, выполняют члены большого семейства ростовых факторов — TGF-бета (группа ростовых факторов).
Несмотря на огромное разнообразие охарактеризованных факторов роста и колоссальную разницу клеточных ответов, можно сформулировать общие правила регуляции:
1. Для поддержания жизни нормальных клеток высших организмов абсолютно необходимо их взаимодействие с уникальной комбинацией специфических ростовых факторов.
Для поддержания жизни нормальных клеток высших организмов абсолютно необходимо их взаимодействие с уникальной комбинацией специфических ростовых факторов.
2. Одна и та же клетка может взаимодействовать с несколькими факторами роста; один и тот же фактор роста может оказывать влияние на разные типы клеток.
3. Уровень экспрессии данного ростового фактора, а также восприимчивость и характер ответа являются специфичными для каждого данного типа клеток [4, 5].
С момента повреждения кости до образования морфологически зрелой костной ткани, заполняющей костный дефект, и полноценного восстановления функции кости, проходит достаточно много времени. Обширные костные дефекты, ослабление организма, связанное с перенесенными заболеваниями, и тому подобное снижают способность организма к остеогенезу. Восстановление поврежденных костей в этих случаях может оказаться неполноценным или замедленным. Факторы, влияющие на кровоснабжение можно разделить на две группы: стимуляторы ангиогенеза и стимуляторы кровотока. Стимуляторы ангиогенеза и остеогенеза — это факторы роста.
Стимуляторы ангиогенеза и остеогенеза — это факторы роста.
В настоящее время выделяют следующие факторы, стимулирующие новообразование кости: 1 IGF1; PDGF; TGF-ß; ЭФР; ФРФ (1 IGF1 или ИФР — инсулиноподобный фактор роста, TGF-ß или ТФР-β — трансформирующий фактор роста бета, EGF или ЭФР — эпидермальный фактор роста, ФРФ — фактор роста фибробластов).
* * *
ИФР-1 и ИФР-2 циркулируют в плазме человека в концентрации 20–80 нл. Они сходны по структуре с инсулином. Продуцируются не только в клетках печени, но и клетками других тканей, включая кость. Главная функция этих белков заключается в воздействии на процессы роста и развития. Они играют ключевую роль в регенерации, оказывая митогенный эффект. ИФР действуют через аутокринные или паракринные механизмы. Они связываются со специфическими клеточными рецепторами. ИФР-1 и ИФР-2 влияют на формирование костной ткани в регенерате путем стимуляции пролиферации клеток остеобластического дифферона и повышения метаболической активности остеобластов.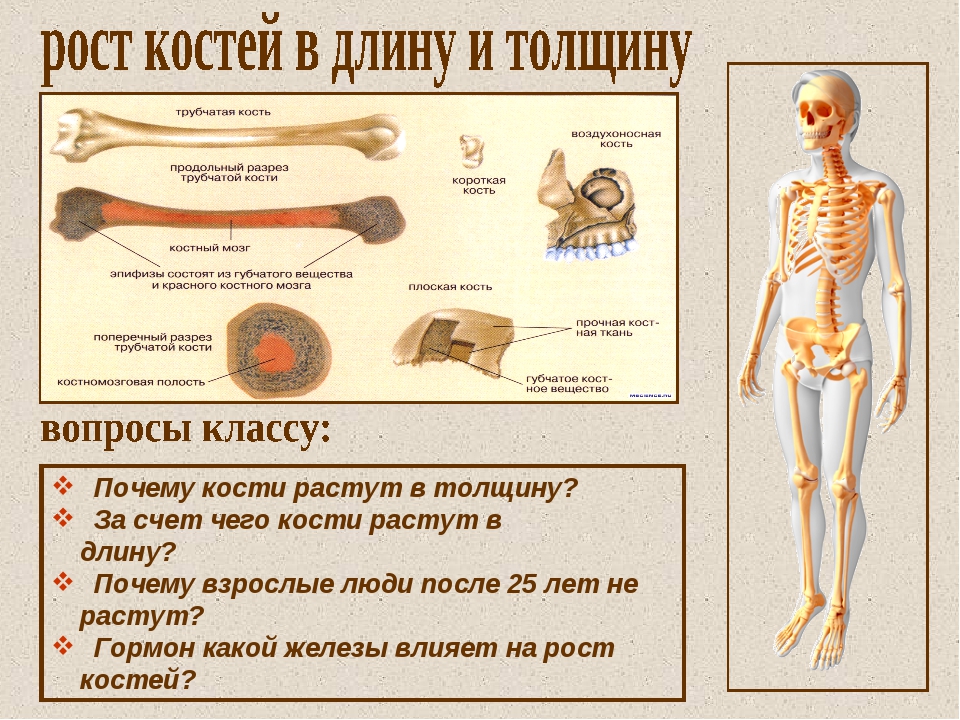 Из двух факторов превалирующим в зоне сращения перелома является ИФР-1. Установлено, что под его действием в зоне повреждения на ранних стадиях регенерации в клетках снижается генная экспрессия маркеров воспаления, а также повышается пролиферативная активность остеогенных и хондрогенных клеток-предшественников [6]. Под действием ИФР-1 отмечается активизация костеобразования и снижение костной резорбции [7]. Имеются экспериментальные исследования воздействия 100 мкг ИФР-1 нанесенного на биодеградируемые полилактид-гликолидные матрицы, которые помещали в метафизарные и диафизарные дефекты большеберцовых костей овец. В дефектах размером от 8 до 10 мм отмечается активация костеобразования и снижение костной резорбции. Инсулиноподобные факторы роста выступают как посредники в рост-стимулирующем воздействии гормона роста.
Из двух факторов превалирующим в зоне сращения перелома является ИФР-1. Установлено, что под его действием в зоне повреждения на ранних стадиях регенерации в клетках снижается генная экспрессия маркеров воспаления, а также повышается пролиферативная активность остеогенных и хондрогенных клеток-предшественников [6]. Под действием ИФР-1 отмечается активизация костеобразования и снижение костной резорбции [7]. Имеются экспериментальные исследования воздействия 100 мкг ИФР-1 нанесенного на биодеградируемые полилактид-гликолидные матрицы, которые помещали в метафизарные и диафизарные дефекты большеберцовых костей овец. В дефектах размером от 8 до 10 мм отмечается активация костеобразования и снижение костной резорбции. Инсулиноподобные факторы роста выступают как посредники в рост-стимулирующем воздействии гормона роста.
* * *
Наиболее хорошо изученным представителем группы белковых факторов роста (мито- и мотогенов) является ФРТ (Platelet- Derived Growth Factor, PDGF). Несмотря на огромное количество данных, накопленных с момента открытия PDGF, теории, объясняющей большинство его эффектов в живом организме, не существует — поэтому новые и новые исследования приносят новые и новые результаты. ФРТ секретируется тромбоцитами на ранней стадии заживления костной ткани и идентифицирован как у мышей, так и у приматов [8, 9]. ФРТ обладает митогенной активностью для остеобластов и клеток-предшественников [10]. Кроме того, установлено, что ФРТ принимает участие в ангиогенезе (процесс образования новых кровеносных сосудов в органе или ткани). При исследовании течения репаративного остеогенеза в эксперименте на кроликах доказано, что ФРТ в концентрации 80 мкг на коллагеновой губке-матрице стимулировал остеогенную дифференцировку в области периоста и эндоста [11]. В последние годы ФРТ нашли свое применение в стоматологии для оптимизации регенерации костных дефектов. Рандомизированные плацебо-контролируемые исследования были проведены в 7 научных центрах. В исследование были вовлечены 180 пациентов. Наблюдение в течение 3 месяцев показало заполнение дефектов зрелой костной тканью.
ФРТ секретируется тромбоцитами на ранней стадии заживления костной ткани и идентифицирован как у мышей, так и у приматов [8, 9]. ФРТ обладает митогенной активностью для остеобластов и клеток-предшественников [10]. Кроме того, установлено, что ФРТ принимает участие в ангиогенезе (процесс образования новых кровеносных сосудов в органе или ткани). При исследовании течения репаративного остеогенеза в эксперименте на кроликах доказано, что ФРТ в концентрации 80 мкг на коллагеновой губке-матрице стимулировал остеогенную дифференцировку в области периоста и эндоста [11]. В последние годы ФРТ нашли свое применение в стоматологии для оптимизации регенерации костных дефектов. Рандомизированные плацебо-контролируемые исследования были проведены в 7 научных центрах. В исследование были вовлечены 180 пациентов. Наблюдение в течение 3 месяцев показало заполнение дефектов зрелой костной тканью.
Одним из последних достижений является использование аутогенного тромбоцитарного геля для улучшения заживления и созревания мягких и твердых тканей после проведения хирургических вмешательств. Кроме того, доставка факторов роста непосредственно в область использования костных материалов в значительной степени улучшает восстановление тканей [12].
Кроме того, доставка факторов роста непосредственно в область использования костных материалов в значительной степени улучшает восстановление тканей [12].
ТФР-β относится к суперсемейству, включающему 5 белков (ТФР-β1 — ТФР-β5), которые оказывают плейотропный эффект на целый ряд процессов, обеспечивая метаболическую активность клеток, включая рост, дифференцировку и биосинтез макромолекул межклеточного вещества. Присутствие рецепторов к ТФР на поверхности остеобластов и хондроцитов дает возможность предположить участие этих факторов на всех этапах регенерации кости [13, 14, 15].
Большинство исследователей склоняются к мысли, что дозы, стимулирующие репаративный остеогенез, должны быть высокими [16, 17].
К факторам, которые первыми запускают каскад процессов регенерации кости, относятся полученные из PDGF и TGF-β. Эти факторы инициируют процесс регенерации кости. Оба фактора высвобождаются из дегранулирующих тромбоцитов в области раны. За этим следует увеличение числа тромбоцитов в области раны или травмы, что еще больше увеличивает количество данных факторов роста, необходимых для регенерации кости.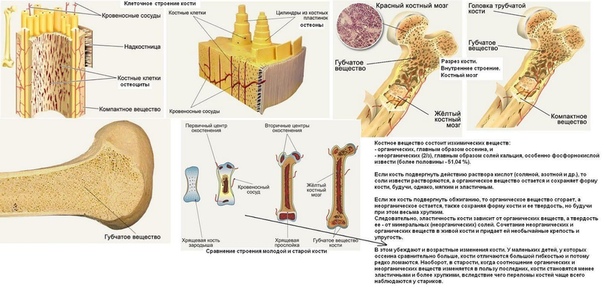 БоТП (богатая тромбоцитами плазма) представляет собой среду, содержащую высокую концентрацию аутогенных тромбоцитов. Данный материал легко приготовить, забирая небольшое количество крови пациента и используя центрифугу для отделения тромбоцитов. В исследовании с участием 88 пациентов, подготовка БоТП (БоТП) позволяет увеличить концентрацию тромбоцитов в 3–10 раз по сравнению с исходной [18]. Это в свою очередь приводит к увеличению концентрации PDGF и TGF-β, которые запускают процессы заживления.
БоТП (богатая тромбоцитами плазма) представляет собой среду, содержащую высокую концентрацию аутогенных тромбоцитов. Данный материал легко приготовить, забирая небольшое количество крови пациента и используя центрифугу для отделения тромбоцитов. В исследовании с участием 88 пациентов, подготовка БоТП (БоТП) позволяет увеличить концентрацию тромбоцитов в 3–10 раз по сравнению с исходной [18]. Это в свою очередь приводит к увеличению концентрации PDGF и TGF-β, которые запускают процессы заживления.
* * *
EGF – глобулярный белок с м.м. 6,4 кДа, состоящий из 53 аминокислотных остатков, который действует как сильный митоген на различные клетки эндодермального, эктодермального и мезодермального происхождения. EGF найден в крови, цереброспинальной жидкости, молоке, слюне, желудочном и панкреатическом соках. Фактор роста в моче, известный как урогастрон, также идентичен EGF. Основным местом синтеза EGF являются слюнные железы. EGF контролирует и стимулирует пролиферацию эпидермальных и эпителиальных клеток, включая фибробласты. EGF также стимулирует пролиферацию эмбриональных клеток и увеличение высвобождения кальция из костной ткани. Он способствует резорбции кости и является сильным хемоаттрактантом для фибробластов и эпителиальных клеток. EGF сам и в комбинации с другими цитокинами является важнейшим фактором, опосредующим процессы заживления ран и ангиогенеза [4].
EGF также стимулирует пролиферацию эмбриональных клеток и увеличение высвобождения кальция из костной ткани. Он способствует резорбции кости и является сильным хемоаттрактантом для фибробластов и эпителиальных клеток. EGF сам и в комбинации с другими цитокинами является важнейшим фактором, опосредующим процессы заживления ран и ангиогенеза [4].
* * *
Фибробласты — основные клетки соединительной ткани. Фибробласты синтезируют тропоколлаген, предшественник коллагена, межклеточный матрикс и основное вещество соединительной ткани, аморфное желе подобное вещество, заполняющее пространство между клетками и волокнами соединительной ткани. Участвуют в заживлении ран. В результате дифференцирования фибробласты превращаются в менее активные зрелые клетки — фиброциты. Основной bFGF (фактор роста фибробластов) положительно влияет на рост всех типов клеток кожи, стимулирует продукцию компонентов внеклеточного матрикса фибробластами (фибронектина и коллагена), стимулирует хемотаксис фибробластов и выработку ими новых волокон коллагена, эластина и фибронектина. В настоящее время существует следующая модель взаимодействия основного фактора роста фибробластов с клетками и матриксом.
В настоящее время существует следующая модель взаимодействия основного фактора роста фибробластов с клетками и матриксом.
bFGF связывается с протеогликанами, содержащими гепарин-сульфат, последующий может диффундировать через строму к клеткам-мишеням и связываться со специфическими рецепторами клеток. В отличие от других факторов роста, таких как тромбоцитарный фактор роста, эпидермальный фактор роста, bFGF может стимулировать in vitro и in vivo пролиферацию всех типов клеточных элементов, вовлеченных в процесс заживления [19, 20].
На ранних стадиях репаративного остеогенеза повышается экспрессия клетками ФРФ-1 и ФРФ-2. С этими факторами связаны ангиогенез, пролиферация и дифференцировка хондроцитов и остеобластов. В экспериментальных исследованиях на кроликах и собаках доказано, что локальные инъекции рФРФ-2 стимулируют заживление переломов и сегментарных дефектов кости [21, 22]. Наиболее исследовано действие рекомбинантного ФРФ-2. Было доказано, что одноразовые инъекции рчФРФ-2 (рекомбинантный ФРФ-2 человека) в концентрации 100, 200, 400 мкг в область перелома стимулируют костеобразование и приводят к повышению минеральной плотности костной ткани в зоне повреждения по сравнению с контролем. В последние 7 лет проводится разработка систем, состоящих из биосовместимых матриц — носителей и факторов роста фибробластов.
В последние 7 лет проводится разработка систем, состоящих из биосовместимых матриц — носителей и факторов роста фибробластов.
* * *
Таким образом, использование факторов роста в восстановление костной ткани — одно из актуальных экспериментальных и клинических направлений в стоматологии и ортопедии.
Остеопороз — «молчаливая эпидемия»
Остеопороз — это системное заболевание скелета, которое характеризуется потерей общей костной массы. Кости становятся хрупкими и ломаются даже при небольших нагрузках. Чаще всего встречаются переломы шейки бедра или позвоночника, однако бывают переломы и других частей скелета. Ранняя стадия остеопороза – остеопения, для нее характерна меньшая потеря плотности костных тканей. От остеопороза страдает весь организм – выпадают зубы, проседают челюстно-лицевые кости, уменьшается рост и, конечно же, ломаются руки, ноги, позвонки, шейки бедра. Мировая медицинская статистика регистрирует около полутора миллионов переломов в год. Поэтому 20 октября медицинская общественность отмечает Всемирный день борьбы с остеопорозом.
Поэтому 20 октября медицинская общественность отмечает Всемирный день борьбы с остеопорозом.
С рождения и примерно до 30 лет кости пропитываются солями и приобретают прочность, в преклонном возрасте из-за уменьшения кровообращения и воздействия других факторов человек теряет костную массу. Костная ткань, на первый взгляд, не подвергающаяся никаким изменениям, на самом деле постоянно обновляется, и каждые 10 лет старая костная ткань рассасывается (это называется резорбцией) и заменяется новой. У детей и подростков образование новой костной ткани происходит быстрее, чем резорбция, и ее плотность увеличивается, достигая максимума к 18 годам. Затем наступает равновесие — оба процесса идут с одинаковой скоростью. Примерно к 40 годам начинается возрастное истончение костей, и резорбция постепенно берет верх.
В норме в организме постоянно идет обновление костной ткани — удаление старой кости и образование новой. Скорость обновления с возрастом замедляется: если у детей она составляет 50% в год, то у взрослых всего 5%.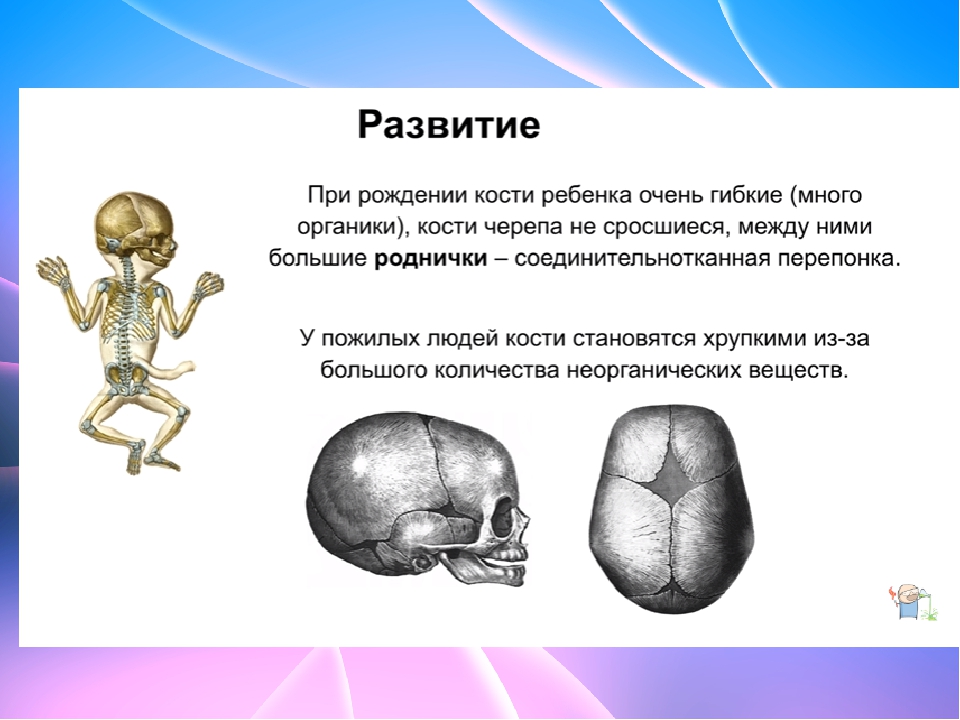 После 30 лет разрушение костей происходит быстрее, чем их замена новой костной тканью. Кроме того, примерно после 35 лет вымывание из костей кальция идёт более интенсивно, нежели его отложение в костной ткани. Кости с возрастом истончаются, становятся менее прочными и упругими.
После 30 лет разрушение костей происходит быстрее, чем их замена новой костной тканью. Кроме того, примерно после 35 лет вымывание из костей кальция идёт более интенсивно, нежели его отложение в костной ткани. Кости с возрастом истончаются, становятся менее прочными и упругими.
Если запасы кальция в костях недостаточны, когда процесс старения уже начался, то возрастает вероятность развития остеопороза. Кроме кальция для профилактики остеопороза необходимы магний и витамин D. Не менее важно соотношение в пищевом рационе кальция и фосфора. Поэтому профилактикой этого заболевания является правильное питание и физическая нагрузка.
Достаточно распространенный миф, что остеопороз развивается только у людей, которые получают мало кальция с пищей. Сбалансированное питание – важная составляющая профилактики, но не единственная. На самом деле можно есть кальций день и ночь и не добиться ничего, кроме нарушения солевого обмена и возможного образования камней в почках. Остеопороз — это болезнь, при которой кальций плохо усваивается костями или «вымывается» из них, даже если в еде его с избытком. Это может быть вызвано несколькими важными причинами.
Остеопороз — это болезнь, при которой кальций плохо усваивается костями или «вымывается» из них, даже если в еде его с избытком. Это может быть вызвано несколькими важными причинами.
1. Плотность костей зависит от количества определенных гормонов в организме, в первую очередь – от половых. В организме мужчины количество тестостерона больше, нежели в женском, поэтому у мужчин кости изначально толще и прочнее женских. Именно поэтому мужчины гораздо меньше страдают от последствий остеопороза. Комплекция человека во многом зависит от гормонального фона и уровня обмена веществ. Высокие и худые, «тонкокостные» люди в большей степени подвержены остеопорозу, чем люди плотного телосложения и невысокого роста.
Вероятность развития остеопороза у женщин гораздо больше, чем у мужчин: на их долю приходится 80% случаев этого заболевания. После 60 лет остеопорозом страдает каждая четвёртая женщина. У мужчин он возникает вчетверо реже. С возрастом женщины лишаются одного из важных «протекторов» костной ткани — эстрогенов, и с наступлением менопаузы скорость резорбции у них резко возрастает.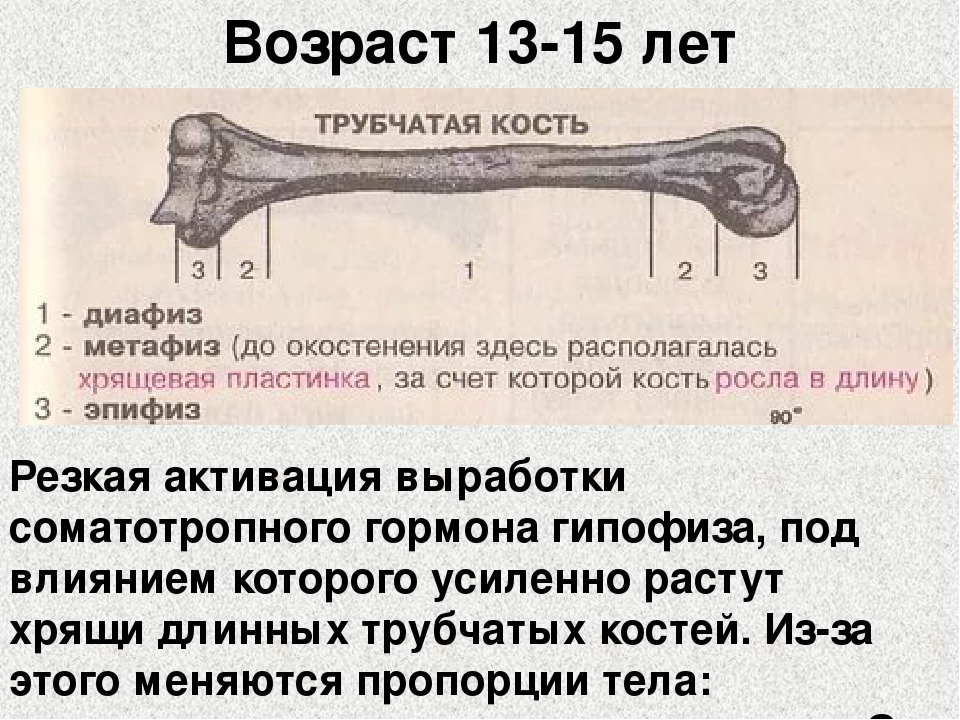
У женщин в климактерическом периоде ускоряется потеря костной ткани и тормозится усвоение кальция и образование новой кости. После наступления менопаузы примерно у половины женщин происходит потеря 1-2% костной массы в год. Точно так же влияет на плотность костей и «искусственный климакс», вызванный операциями по двухстороннему удалению яичников.
2. Если человека на год лишить подвижности, за это время скелет потеряет 50%(!) своей прочности. Движение — фактор, который определяет крепость костей. Именно из-за нехватки физических нагрузок в наш век признаки остеопороза можно обнаружить у все большего числа людей. В природе все рационально: если какой-то орган или система длительное время не используются, значит они не нужны – в организме включается программа их самоуничтожения. Если кости или скелет в целом не подвергается физическим нагрузкам, костная ткань постепенно теряет присущие ей свойства.
3. Заболевания, который способствуют развитию остеопороза, можно перечислять долго – это и сахарный диабет, болезни щитовидной и околощитовидной желез, хроническая почечная или печёночная недостаточность, синдром нарушенного всасывания в кишечнике. .. Также высокий риск развития остеопороза возникает у больных, страдающих бронхиальной астмой и ревматоидным артритом (на фоне приема глюкокортикоидов), а также у людей, длительно принимающих противосудорожные, мочегонные препараты и антикоагулянты.
.. Также высокий риск развития остеопороза возникает у больных, страдающих бронхиальной астмой и ревматоидным артритом (на фоне приема глюкокортикоидов), а также у людей, длительно принимающих противосудорожные, мочегонные препараты и антикоагулянты.
4. Витамин D синтезируется в организме человека самостоятельно, под влиянием солнечного света, или поступает в организм с такими продуктами, как рыбий жир, масло, яйца, печень и молоко. Витамин D участвует в процессе регуляции всасывания кальция в кишечнике и механизме образования костной ткани. Соответственно, недостаток солнечного света или нехватка в питании вышеперечисленных продуктов увеличивают риск развития остеопороза.
5. Проведенные в последние годы исследования однозначно установили тенденцию к снижению костной массы у людей, систематически употребляющих алкоголь, по сравнению с непьющими людьми, причем в равной степени, как у женщин, так и у мужчин. В отличие от алкоголя, курение в большей степени влияет на женщин — курящие женщины имеют более низкую концентрацию половых гормонов в крови и у них раньше наступает менопауза. Всё это приводит к более быстрому разрежению костей.
Всё это приводит к более быстрому разрежению костей.
Частота заболеваемости остеопорозом с каждым годом стремительно увеличивается. Остеопороз — это «эпидемия без симптомов». Для него характерно бессимптомное течение в первые 10-15 лет. Возможны жалобы на боли в костях (особенно в поясничном и грудном отделах позвоночника, могут напоминать радикулит), медленное уменьшение роста, изменение осанки, ограничение двигательной активности, потерю массы тела.
Чаще всего остеопороз проявляется незначительными симптомами с почти полным отсутствием жалоб, очень часто заболевание выявляется только при наличии переломов. Такая особенность болезни дала ученым повод назвать остеопороз «молчаливой эпидемией». Конечно, и при остеопорозе бывают боли в спине, но это ноющие боли «усталости», возникающие только после относительно длительного (больше 30 минут) нахождения в одной статической позе. К другим косвенным признакам болезни относятся старческая сутулость (горб), ночные судороги ног, повышенная утомляемость, пародонтоз, хрупкость ногтей и преждевременное поседение. И хотя наличие этих симптомов не является стопроцентным подтверждением диагноза, оно всё-таки позволяет определить круг исследований, необходимых для его уточнения. С этим заболеванием связаны практически все случаи переломов у людей старше 65 лет. Специалисты советуют: для предупреждения переломов при остеопорозе соблюдайте минимальную технику безопасности: уберите скользящие коврики дома, провода электрических приборов с проходов. Откажитесь от высоких каблуков, носите удобную обувь. Пользуйтесь палкой или приспособлением для ходьбы, если ваша походка потеряла устойчивость. Оборудуйте ванную специальными поручнями. Сделайте свою жизнь более удобной и безопасной.
И хотя наличие этих симптомов не является стопроцентным подтверждением диагноза, оно всё-таки позволяет определить круг исследований, необходимых для его уточнения. С этим заболеванием связаны практически все случаи переломов у людей старше 65 лет. Специалисты советуют: для предупреждения переломов при остеопорозе соблюдайте минимальную технику безопасности: уберите скользящие коврики дома, провода электрических приборов с проходов. Откажитесь от высоких каблуков, носите удобную обувь. Пользуйтесь палкой или приспособлением для ходьбы, если ваша походка потеряла устойчивость. Оборудуйте ванную специальными поручнями. Сделайте свою жизнь более удобной и безопасной.
Распространенность остеопороза в Красноярском крае отражает мировую статистику. Большую часть пациентов составляют женщины в постменопаузном периоде. Сегодня в поликлинике на базе Краевой клинический больницы создан Центр остепороза, в котором пациенты могут пройти необходимое обследование и определить степень выраженности заболевания. После этого специалистами определяется индивидуальная тактика лечения. Для этого нужно в установленном порядке получить направление от хирурга по месту жительства.
После этого специалистами определяется индивидуальная тактика лечения. Для этого нужно в установленном порядке получить направление от хирурга по месту жительства.
Следует отметить, что за последние годы ученым удалось проникнуть в суть процессов образования и рассасывания костной ткани, что, по мнению специалистов, поможет в разработке новых методов профилактики и лечения этого заболевания.
В подборке использованы статистические данные ВОЗ, материалы специалистов Краевой клинической больницы, Интернет-ресурсы.
Факторы, влияющие на состояние костной ткани
1. Генетические факторы
Как правило, белые и азиатские женщины, подвержены большему риску остеопороза, особенно имеющие небольшой рост и/или недостаточный для своего роста вес. Существует ряд свидетельств, указывающих на роль наследственных факторов в развитии костной массы, которые не зависит от моделей потребления кальция и других питательных веществ.
Есть предположение, что приблизительно 75% наследственного влияния на вероятность развития остеопороза у человека обусловлено определенным вариантом в гене, который отвечает за кодирование рецептора 1,25-дигидроксивитамина D.
2. Пол
Женщины более подвержены остеопорозу, чем мужчины. Дефицит женского гормона эстрогена, вызванный менопаузой или удалением яичников, приводит к ускоренной потере костной массы. Дефицит эстрогена при менопаузе также снижает усвоение кальция. Как следствие, костная масса уменьшается. В период менопаузы у женщин наблюдается ускоренная потеря костной массы (2–3% в год).
Также роль эстрогена в поддержании здоровья костей обусловена его способностью ингибировать действие паратиреоидного гормона (ПТГ), который увеличивает резорбцию кости.
3. Кальций
Эпидемиологические данные подтверждают, что увеличение потребления кальция в детском и подростковом возрасте приводит к более высокой пиковой плотности кости.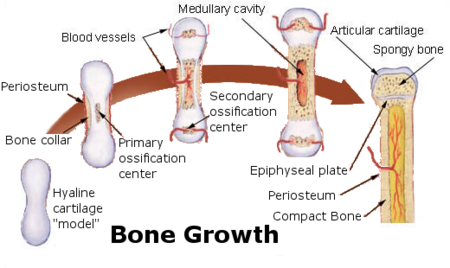 Кальций в сочетании с витамином D необходим для укрепления костей, увеличения костной массы и снижения частоты переломов. Рекомендуется принимать 1000 мг элементарного кальция в день для молодых женщин. Лица старше 51 года должны потреблять не менее 1200 мг кальция в день. Кальций лучше всего употреблять с пищей, но если в рационе мало кальция, можно использовать биологически активные добавки.
Кальций в сочетании с витамином D необходим для укрепления костей, увеличения костной массы и снижения частоты переломов. Рекомендуется принимать 1000 мг элементарного кальция в день для молодых женщин. Лица старше 51 года должны потреблять не менее 1200 мг кальция в день. Кальций лучше всего употреблять с пищей, но если в рационе мало кальция, можно использовать биологически активные добавки.
4. Фосфор
Фосфор присутствует в большинстве пищевых продуктов. Некоторые исследования показали неблагоприятное влияние избытка фосфора в рационе или низкого соотношения кальций/фосфор на здоровье костей. Обычно рекомендуется, чтобы соотношение кальций/фосфор в рационе было между 1:2 и 2:1.
5. Лактоза
Ряд исследований на людях продемонстрировали, что лактоза из молочного сахара оказывает благотворное влияние на усвоение кальция. Лактозная
непереносимость, по-видимому, мало влияет на усвоение кальция из молочных продуктов, потребляемых умеренно, и из немолочных продуктов. 6. Белок
6. Белок
6. Белок
Известно, что высокое потребление белка увеличивает экскрецию кальция с мочой. Адекватное потребление белка необходимо для снижения потери минеральной плотности кости и риска переломов, особенно у пожилых женщин.
7. Витамин Д
Адекватный статус витамина Д имеет важное значение для эффективного использования кальция, поступающего с пищей. И печень, и почки участвуют в гидроксилировании витамина и превращении его в метаболически активную форму, которая необходима для облегчения всасывания кальция в кишечнике. Состояние витамина Д у человека зависит от потребления этого витамина с пищей и/или воздействия солнечного света (ультрафиолетовых лучей). Пожилые люди могут не получать достаточного количества витамина в рационе и/или не получать достаточного воздействия солнечного света. Также превращение витамина в активную форму почками с возрастом происходит менее эффективно.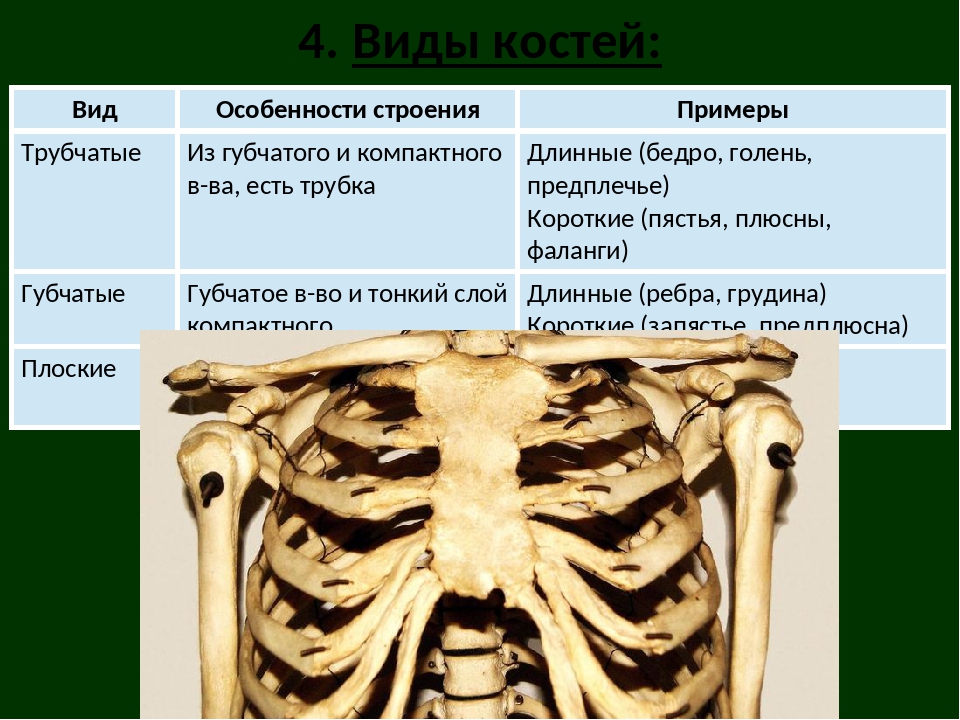 Для пожилых людей, которые имеют ограниченное воздействие солнечного света, например, потому что они живут в районах, где зима длинная, может потребоваться дополнительный витамин Д. Кроме того, людям с заболеваниями почек или печени может потребоваться добавление соответствующего метаболита витамина Д.
Для пожилых людей, которые имеют ограниченное воздействие солнечного света, например, потому что они живут в районах, где зима длинная, может потребоваться дополнительный витамин Д. Кроме того, людям с заболеваниями почек или печени может потребоваться добавление соответствующего метаболита витамина Д.
8. Витамин С
Нарушение синтеза коллагена может быть причиной остеопороза, потому что этот процесс совмещен с отложением минералов во время формирования кости. При дефиците витамина С способность образовывать зрелые коллагеновые волокна значительно снижается. В пожилом возрасте, а также у курильщиков, уровень витамина С снижен, что может повысить риск развития остеопороза.
9. Витамин К
Остеокальцин, витамин К-зависимый белок, составляет 15–20% неколлагенового белка в кости. Он вырабатывается остеобластами во время формирования костного матрикса и появляется в костях с началом отложения гидроксиапатита.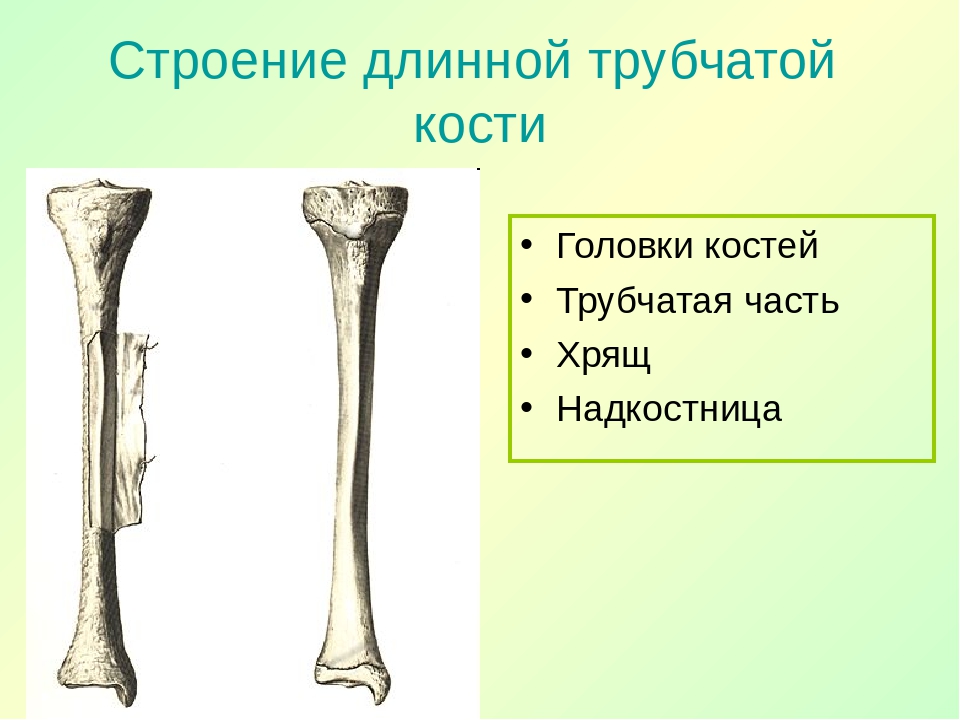 Синтез остеокальцина усиливается витамином Д, а его концентрация в кости прямо пропорциональна количеству кальция в кости. Таким образом, дефицит витамина К может быть связан с повышенной ломкостью скелета.
Синтез остеокальцина усиливается витамином Д, а его концентрация в кости прямо пропорциональна количеству кальция в кости. Таким образом, дефицит витамина К может быть связан с повышенной ломкостью скелета.
10. Магний
Около двух третей магния в организме присутствует в скелете. Нормальные уровни магния в сыворотке необходимы для правильного метаболизма кальция, поскольку гипомагниемия приводит к гипокальциемии. Таким образом, адекватное потребление кальция может не обеспечить надлежащее здоровье костей, если состояние магния является ненормальным. В ряде исследовании среди пожилых мужчин и женщин было обнаружено, что употребление магния улучшает минеральную плотность костей.
11. Кремний
Кремний участвует в кальцификации костей. Кремний присутствует в высоких концентрациях в коллагене, а при дефиците кремния концентрация коллагена в костях снижается, то есть кремний играет роль в биосинтезе костного коллагена.
12. Пищевые волокна
Пищевые волокна
Пищевые волокна могут оказывать хелатообразующее действие на кальций, что препятствует его всасыванию в кишечнике. В результате, у людей, получающих большое количество клетчатки, таких как целлюлоза, цельная пшеница, фрукты и овощи, может наблюдаться отрицательный баланс кальция, несмотря на достаточное его потребление. Подсчитано, что потребление 26 г белка увеличивает потребность в кальции примерно на 150 мг/день. Употребление большого количества оксалата и фитиновой кислоты в пищевых продуктах могут снизить эффективность усвоения кальция, однако в количествах, присутствующих в обычном рационе, они не влияют на его усвоение.
13. Вегетарианская диета
Вегетарианцы теряют меньше костной массы, чем люди с обычным рационом. Это объясняется меньшим процентным содержанием серосодержащих аминокислот в белках продуктов растительного происхождения, чем в мясе. Включение в рацион соевых продуктов снижает экскрецию кальция с мочой и благоприятно влияет на минеральную плотность костей. Фрукты и овощи являются важными источниками калия и магния. Калий способствует удержанию кальция в почках, а магний необходим для баланса кальция.
Фрукты и овощи являются важными источниками калия и магния. Калий способствует удержанию кальция в почках, а магний необходим для баланса кальция.
14. Кофеин
Кофеин и напитки, содержащие кофеин, такие как кофе, увеличивают экскрецию кальция с мочой. Чрезмерное потребление кофеина может увеличить риск остеопороза из-за увеличения выведения кальция.
15. Алкоголь
Потеря костной массы и остеопороз наблюдались у относительно молодых мужчин и мужчин среднего возраста, страдающих хроническим алкоголизмом.
Причиной остеопороза у хронических алкоголиков может быть прямое токсическое воздействие алкоголя на кости и/или недостаточное потребление некоторых питательных веществ, включая кальций, фосфор, витамин D и белок, с пищей. Также при хроническом алкоголизме наблюдаются нарушение всасывания кальция из-за недостаточности поджелудочной железы, стеаторея, повышенние потери кальция с мочой, гиперкортицизм, стимуляция паращитовидных желез, что также может влиять на изменение метаболизма костей.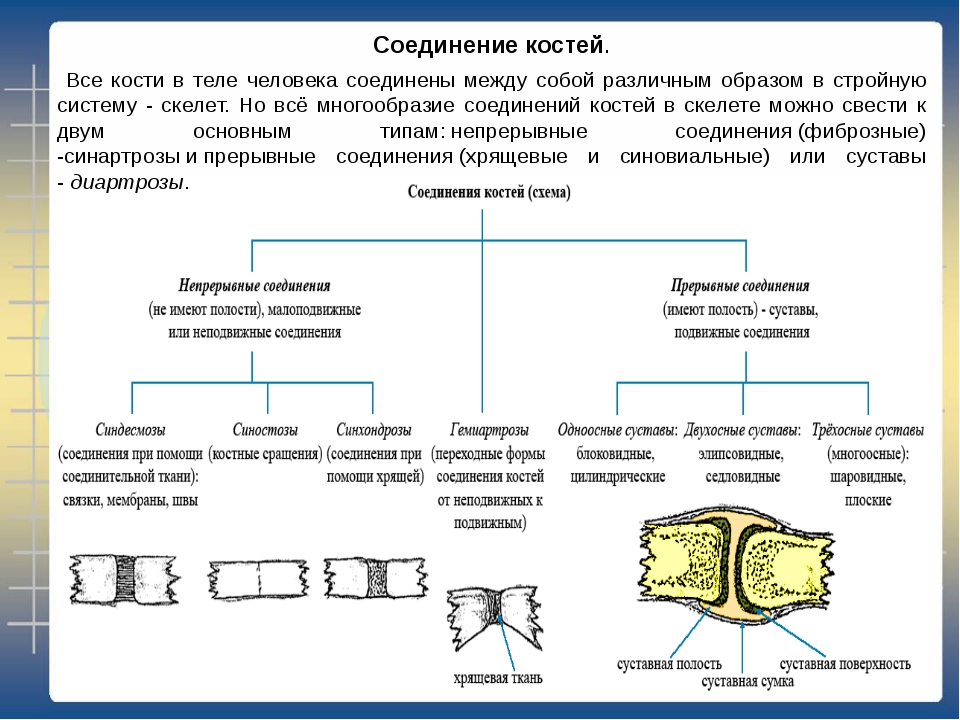 Алкоголики также могут подвергаться повышенному риску падений.
Алкоголики также могут подвергаться повышенному риску падений.
16. Курение
Курение сигарет может вызвать потерю кальция. Курящие женщины, особенно худые, подвержены повышенному риску переломов по сравнению с некурящими. Кроме того, курящие в пременопаузе имеют более низкие концентрации эстрогена в сыворотке и менопауза у них наступает раньше, чем у некурящих.
17. Прием лекарственных средств
Известно, что такие лекарства, как гепарин, кортикостероиды, диуретики и некоторые противотуберкулезные препараты, вызывают потерю кальция. Алюминийсодержащие антациды также вызывают потерю кальция и интенсивную деминерализацию костей.
18. Физическая активность
Известно, что физические упражнения приводят к увеличению костной массы, а отсутствие физической активности, связанное со старением или иммобилизацией, способствует ее потере. Масса костей у спортсменов превышает таковую у людей, ведущих сидячий образ жизни, а физические упражнения снижают потерю костной массы, связанную с возрастом. Оптимальный тип и объем физической активности, которая может предотвратить остеопороз, не установлены. Упражнения с нагрузкой, такие как ходьба, бег трусцой более полезны, чем занятия, не связанные с весом, такие как плавание и езда на велосипеде. Доказательства в пользу полезного эффекта упражнений достаточно убедительны, чтобы рекомендовать его в любой программе профилактики или лечения остеопороза
Оптимальный тип и объем физической активности, которая может предотвратить остеопороз, не установлены. Упражнения с нагрузкой, такие как ходьба, бег трусцой более полезны, чем занятия, не связанные с весом, такие как плавание и езда на велосипеде. Доказательства в пользу полезного эффекта упражнений достаточно убедительны, чтобы рекомендовать его в любой программе профилактики или лечения остеопороза
19. Токсическое действие некоторых минералов
Есть несколько минералов, которые могут вызывать токсические эффекты. К ним относятся кадмий, литий и свинец. Кадмий присутствует в табачном дыме и также может попасть в организм в результате промышленного загрязнения. Некоторые виды кишечных паразитов усиливают абсорбцию кадмия. Почки являются целевой тканью для его накопления, поэтому кадмий может оказывать неблагоприятное воздействие на организм и, в частности, состояние костей, вызывая повреждение почек и измененяя метаболизм витамина Д. Свинец неблагоприятно влияет на формирование активной формы витамина Д. Литий легко удерживается в костях благодаря своему физико-химическому сходству с кальцием и магнием и может препятствовать действию гормона околощитовидной железы. Хроническая литиевая терапия может вызвать остеопороз, особенно у женщин.
Литий легко удерживается в костях благодаря своему физико-химическому сходству с кальцием и магнием и может препятствовать действию гормона околощитовидной железы. Хроническая литиевая терапия может вызвать остеопороз, особенно у женщин.
Развитие и рост костей | SEER Обучение
Термины остеогенез и оссификация часто используются как синонимы для обозначения процесса формирования кости. Части скелета формируются в течение первых нескольких недель после зачатия. К концу восьмой недели после зачатия в хрящевой и соединительнотканной мембранах формируется скелетный узор и начинается окостенение.
Развитие костей продолжается в течение всей взрослой жизни.Даже после достижения взрослого роста развитие костей продолжается для восстановления переломов и ремоделирования в соответствии с изменяющимся образом жизни. Остеобласты, остеоциты и остеокласты — это три типа клеток, участвующих в развитии, росте и ремоделировании костей. Остеобласты — это костеобразующие клетки, остеоциты — зрелые костные клетки, а остеокласты разрушаются и реабсорбируют кость.
Остеобласты — это костеобразующие клетки, остеоциты — зрелые костные клетки, а остеокласты разрушаются и реабсорбируют кость.
Существует два типа окостенения: внутримембранозное и эндохондральное.
внутримембранозный
Внутрирамембранозная оссификация включает замену пластинчатых соединительнотканных мембран костной тканью.Образованные таким образом кости называются внутримембранозными костями. Они включают в себя определенные плоские кости черепа и некоторые кости неправильной формы. Будущие кости сначала образуются как соединительнотканные оболочки. Остеобласты мигрируют к мембранам и откладывают костный матрикс вокруг себя. Когда остеобласты окружены матриксом, они называются остеоцитами.
Эндохондральная оссификация
Эндохондральная оссификация включает замену гиалинового хряща костной тканью.Таким образом сформировано большинство костей скелета. Эти кости называются эндохондральными костями. В этом процессе будущие кости сначала формируются как модели гиалинового хряща. В течение третьего месяца после зачатия перихондрий, окружающий «модели» гиалинового хряща, инфильтрируется кровеносными сосудами и остеобластами и превращается в надкостницу. Остеобласты образуют вокруг диафиза воротник из компактной кости. При этом начинает распадаться хрящ в центре диафиза.Остеобласты проникают в разрушающийся хрящ и заменяют его губчатой костью. Это образует первичный центр окостенения. Оссификация продолжается от этого центра к концам костей. После образования губчатой кости в диафизе остеокласты разрушают новообразованную кость, открывая костномозговую полость.
В течение третьего месяца после зачатия перихондрий, окружающий «модели» гиалинового хряща, инфильтрируется кровеносными сосудами и остеобластами и превращается в надкостницу. Остеобласты образуют вокруг диафиза воротник из компактной кости. При этом начинает распадаться хрящ в центре диафиза.Остеобласты проникают в разрушающийся хрящ и заменяют его губчатой костью. Это образует первичный центр окостенения. Оссификация продолжается от этого центра к концам костей. После образования губчатой кости в диафизе остеокласты разрушают новообразованную кость, открывая костномозговую полость.
Хрящ в эпифизах продолжает расти, поэтому длина развивающейся кости увеличивается. Позже, обычно после рождения, в эпифизах образуются вторичные центры окостенения.Оссификация эпифизов аналогична окостенению диафиза, за исключением того, что губчатая кость сохраняется, а не разрушается с образованием медуллярной полости. Когда вторичное окостенение завершено, гиалиновый хрящ полностью замещается костью, за исключением двух областей. Область гиалинового хряща остается над поверхностью эпифиза, тогда как суставной хрящ и другая область хряща остаются между эпифизом и диафизом. Это эпифизарная пластинка или область роста.
Область гиалинового хряща остается над поверхностью эпифиза, тогда как суставной хрящ и другая область хряща остаются между эпифизом и диафизом. Это эпифизарная пластинка или область роста.
Рост костей
Кости растут в длине эпифизарной пластинки за счет процесса, который похож на эндохондральную оссификацию.Хрящ в области эпифизарной пластинки рядом с эпифизом продолжает расти путем митоза. Хондроциты в области рядом с диафизом стареют и дегенерируют. Остеобласты проникают внутрь и окостеняют матрикс, образуя кость. Этот процесс продолжается в детстве и подростковом возрасте, пока рост хряща не замедлится и не остановится. Когда рост хряща прекращается, обычно в начале двадцатых годов, эпифизарная пластинка полностью окостеняет, так что остается только тонкая эпифизарная линия, и кости больше не могут расти в длину.Рост костей происходит под влиянием гормона роста из передней доли гипофиза и половых гормонов из яичников и яичек.
Даже несмотря на то, что кости перестают расти в длину в раннем взрослом возрасте, они могут продолжать увеличиваться в толщине или диаметре на протяжении всей жизни в ответ на стресс, вызванный повышенной мышечной активностью или весом. Увеличение диаметра называется аппозиционным ростом. Остеобласты в надкостнице образуют компактную кость вокруг внешней поверхности кости. В то же время остеокласты в эндосте разрушают кость на внутренней поверхности кости, вокруг костномозговой полости.Эти два процесса вместе увеличивают диаметр кости и, в то же время, не дают кости стать чрезмерно тяжелой и громоздкой.
Увеличение диаметра называется аппозиционным ростом. Остеобласты в надкостнице образуют компактную кость вокруг внешней поверхности кости. В то же время остеокласты в эндосте разрушают кость на внутренней поверхности кости, вокруг костномозговой полости.Эти два процесса вместе увеличивают диаметр кости и, в то же время, не дают кости стать чрезмерно тяжелой и громоздкой.
6.4 Формирование и развитие костей — анатомия и физиология
Цели обучения
К концу этого раздела вы сможете:
Обсудите процесс формирования и развития костей.
- Перечислить этапы внутримембранного окостенения
- Объясните роль хряща в формировании кости
- Перечислить этапы эндохондральной оссификации
- Объясните ростовую активность эпифизарной пластинки
- Объясните, как кости реконструируются сверхурочно
- Сравнить и сопоставить процессы образования внутримембранной и эндохондральной кости
- Сравните и сопоставьте промежуточный и аппозиционный рост
На ранних стадиях эмбрионального развития скелет эмбриона состоит из фиброзных оболочек и гиалинового хряща. К шестой или седьмой неделе эмбриональной жизни начинается собственно процесс развития костей, окостенение , (остеогенез). Существует два остеогенных пути — внутримембранозная оссификация и эндохондральная оссификация, — но, в конце концов, зрелая кость одинакова, независимо от того, каким путем она образуется.
К шестой или седьмой неделе эмбриональной жизни начинается собственно процесс развития костей, окостенение , (остеогенез). Существует два остеогенных пути — внутримембранозная оссификация и эндохондральная оссификация, — но, в конце концов, зрелая кость одинакова, независимо от того, каким путем она образуется.
Во время внутримембранозная оссификация , компактная и губчатая кость развивается непосредственно из слоев мезенхимальной (недифференцированной) соединительной ткани. Плоские кости лица, большинство костей черепа и ключицы (ключицы) образуются путем внутримембранозной оссификации.
Процесс начинается, когда мезенхимные клетки в эмбриональном скелете собираются вместе и начинают дифференцироваться в специализированные клетки (рис. 6.4.1 a ). Некоторые из этих клеток будут дифференцироваться в капилляры, в то время как другие станут остеогенными клетками, а затем и остеобластами. Хотя в конечном итоге они будут распространяться за счет образования костной ткани, ранние остеобласты появляются в кластере, который называется центром окостенения .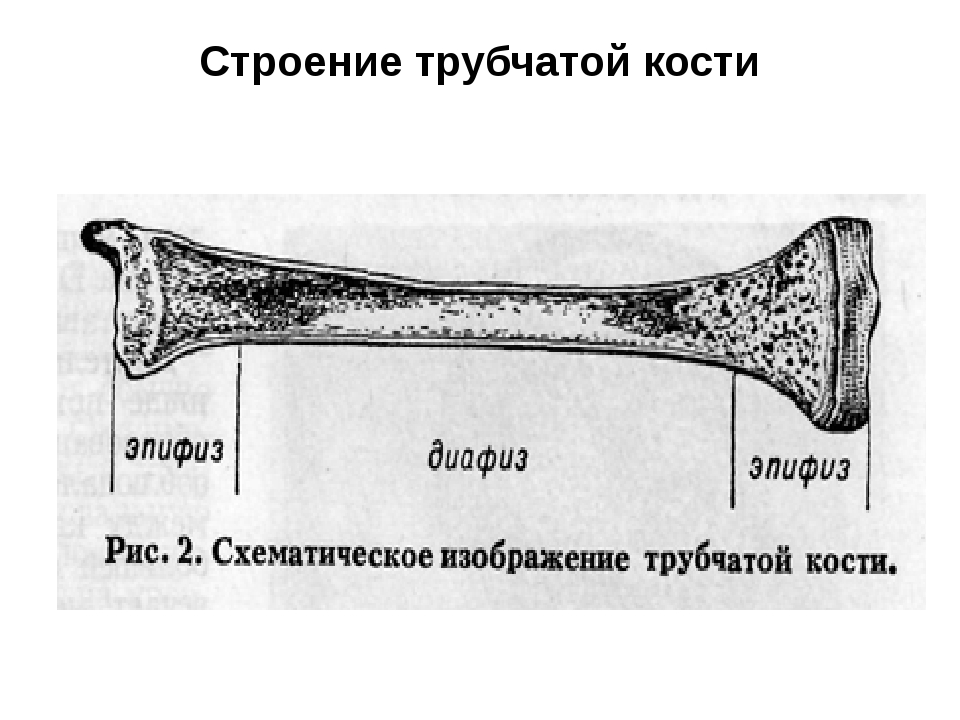
Остеобласты секретируют остеоид , некальцинированный матрикс, состоящий из предшественников коллагена и других органических белков, который кальцинируется (затвердевает) в течение нескольких дней по мере того, как на нем откладываются минеральные соли, тем самым захватывая остеобласты внутри.После захвата остеобласты становятся остеоцитами (рис. 6.4.1 b ). По мере того как остеобласты трансформируются в остеоциты, остеогенные клетки окружающей соединительной ткани дифференцируются в новые остеобласты по краям растущей кости.
Несколько скоплений остеоидов объединяются вокруг капилляров, образуя трабекулярный матрикс, в то время как остеобласты на поверхности вновь образованной губчатой кости становятся клеточным слоем надкостницы (рис. 6.4.1 c ). Затем надкостница выделяет компактную кость, расположенную на поверхности губчатой кости.Губчатая кость скапливается рядом с кровеносными сосудами, которые в конечном итоге конденсируются в красный костный мозг (рис. 6.4.1 d ). Новая кость также постоянно ремоделируется под действием остеокластов (не показано).
6.4.1 d ). Новая кость также постоянно ремоделируется под действием остеокластов (не показано).
Внутримембранозная оссификация начинается с внутриутробно, во время внутриутробного развития плода и продолжается в подростковом возрасте. При рождении череп и ключицы не окостенели полностью, а соединения между костью черепа (швы) не закрыты. Это позволяет черепу и плечам деформироваться во время прохождения через родовые пути. Последними костями, окостеневшими в результате внутримембранного окостенения, являются плоские кости лица, которые достигают своего взрослого размера в конце подросткового скачка роста.
При эндохондральной оссификации кость развивается на , замещая гиалиновый хрящ. Хрящ не становится костью. Вместо этого хрящ служит шаблоном, который полностью заменяется новой костью. Эндохондральная оссификация длится намного дольше, чем внутримембранозная оссификация. Кости у основания черепа и длинные кости образуются посредством эндохондральной оссификации.
В длинной кости, например, примерно через 6-8 недель после зачатия некоторые из мезенхимальных клеток дифференцируются в хондробласты (хрящевые клетки), которые образуют гиалиновый хрящевой скелетный предшественник костей (Рисунок 6.4.2 a ). Этот хрящ представляет собой гибкую полутвердую матрицу, продуцируемую хондробластами, и состоит из гиалуроновой кислоты, хондроитинсульфата, волокон коллагена и воды. Поскольку матрица окружает и изолирует хондробласты, они называются хондроцитами. В отличие от большинства соединительных тканей, хрящ не имеет сосудов, что означает, что в нем нет кровеносных сосудов, снабжающих питательными веществами и удаляющих метаболические отходы. Все эти функции выполняются за счет диффузии через матрикс из сосудов в окружающем надхрящнике (), мембране, покрывающей хрящ ( a ).
Все эти функции выполняются за счет диффузии через матрикс из сосудов в окружающем надхрящнике (), мембране, покрывающей хрящ ( a ).
По мере того, как производится все больше и больше матрикса, хрящевая модель увеличивается в размерах. Кровеносные сосуды в надхрящнице доставляют остеобласты к краям структуры, и эти прибывающие остеобласты откладывают кость в кольце вокруг диафиза — это называется костным воротником (рис. 6.4.2b). Костные края развивающейся структуры препятствуют проникновению питательных веществ в центр гиалинового хряща.Это приводит к гибели хондроцитов и распаду в центре структуры. Без хряща, препятствующего инвазии кровеносных сосудов, кровеносные сосуды проникают в образовавшиеся пространства, не только увеличивая полости, но и неся с собой остеогенные клетки, многие из которых станут остеобластами. Эти увеличивающиеся пространства в конечном итоге объединяются, образуя мозговую полость. Кость теперь откладывается в структуре, создающей первичный центр окостенения ( Рис. 6.4.2, c).
Кровеносные сосуды в надхрящнице доставляют остеобласты к краям структуры, и эти прибывающие остеобласты откладывают кость в кольце вокруг диафиза — это называется костным воротником (рис. 6.4.2b). Костные края развивающейся структуры препятствуют проникновению питательных веществ в центр гиалинового хряща.Это приводит к гибели хондроцитов и распаду в центре структуры. Без хряща, препятствующего инвазии кровеносных сосудов, кровеносные сосуды проникают в образовавшиеся пространства, не только увеличивая полости, но и неся с собой остеогенные клетки, многие из которых станут остеобластами. Эти увеличивающиеся пространства в конечном итоге объединяются, образуя мозговую полость. Кость теперь откладывается в структуре, создающей первичный центр окостенения ( Рис. 6.4.2, c).
Пока происходят эти глубокие изменения, хондроциты и хрящ продолжают расти на концах структуры (будущие эпифизы), что увеличивает длину структуры в то же время, когда кость замещает хрящ в диафизах.Этот продолжающийся рост сопровождается ремоделированием внутри костномозговой полости (остеокласты также были перенесены с проникновением в кровеносные сосуды) и общим удлинением структуры (рис. 6.4.2d). К тому времени, когда скелет плода полностью сформирован, хрящ остается на эпифизах и на поверхности сустава в виде суставного хряща.
После рождения такая же последовательность событий (минерализация матрикса, гибель хондроцитов, инвазия кровеносных сосудов из надкостницы и засевание остеогенными клетками, которые становятся остеобластами) происходит в эпифизарных областях, и каждый из этих центров активности рассматривается как как вторичный центр окостенения (рис.4.2 и ). В детстве и подростковом возрасте между диафизом и эпифизом остается тонкая пластинка гиалинового хряща, известная как рост или эпифизарная пластинка (рис. 6.4.2 f ). В конце концов, этот гиалиновый хрящ будет удален и заменен костью, чтобы стать эпифизарной линией .
Эпифизарная пластинка — это область удлинения длинной кости. Он включает в себя слой гиалинового хряща, где оссификация может продолжаться в незрелых костях.Мы можем разделить эпифизарную пластинку на диафизарную сторону (ближе к диафизу) и эпифизарную сторону (ближе к эпифизу). На эпифизарной стороне эпифизарной пластинки гиалиновые хрящевые клетки являются активными, делятся и производят гиалиновый хрящевой матрикс. (рисунок 6.43, резервная и пролиферативная зоны). На диафизарной стороне пластинки роста хрящ кальцифицируется и умирает, затем замещается костью (рис. 6.43, зоны гипертрофии и созревания, кальцификации и окостенения).По мере роста хряща вся структура увеличивается в длину, а затем превращается в кость. Как только хрящ не может расти дальше, структура не может больше удлиняться.
Эпифизарная пластинка состоит из пяти зон клеток и активности (рис. 6.4.3). Резервная зона — это область, ближайшая к эпифизарному концу пластины и содержащая небольшие хондроциты внутри матрикса. Эти хондроциты не участвуют в росте кости, но прикрепляют эпифизарную пластинку к вышележащей костной ткани эпифиза.
Рисунок 6.4.3 — Продольный рост кости: Эпифизарная пластинка отвечает за продольный рост кости.Зона пролиферации является следующим слоем по направлению к диафизу и содержит стопки немного более крупных хондроцитов. Он производит новые хондроциты (через митоз), чтобы заменить те, которые умирают на диафизарном конце пластины. Хондроциты в следующем слое, в зоне созревания и гипертрофии , старше и крупнее, чем хондроциты в пролиферативной зоне.Более зрелые клетки расположены ближе к диафизарному концу пластинки. Продольный рост кости является результатом деления клеток в зоне пролиферации и созревания клеток в зоне созревания и гипертрофии. Этот рост в ткани называется интерстициальным ростом .
Большинство хондроцитов в зоне кальцинированного матрикса , зоне, ближайшей к диафизу, мертвы, потому что матрица вокруг них кальцинирована, что ограничивает диффузию питательных веществ.Капилляры и остеобласты из диафиза проникают в эту зону, а остеобласты секретируют костную ткань на оставшемся кальцинированном хряще. Таким образом, зона кальцинированного матрикса соединяет эпифизарную пластинку с диафизом. Кость увеличивается в длину, когда к диафизу добавляется костная ткань.
Кости продолжают расти в длину до раннего взросления. Скорость роста контролируется гормонами, о которых мы поговорим позже. Когда хондроциты в эпифизарной пластинке прекращают свою пролиферацию и кость заменяет весь хрящ, продольный рост прекращается.Все, что осталось от эпифизарной пластинки, — это окостеневшая эпифизарная линия (рис. 6.4.4).
Рисунок 6.4.4 — Переход от эпифизарной пластинки к эпифизарной линии: По мере созревания костей эпифизарная пластинка переходит в эпифизарную линию. (а) Эпифизарные пластинки видны в растущей кости. (b) Эпифизарные линии — это остатки эпифизарных пластинок в зрелой кости. ПРИМЕЧАНИЕ РЕДАКТОРА: вы должны добавить рентгеновский снимок эпифизарной пластинки против линии.Хотя кости увеличиваются в длину, они также увеличиваются в диаметре; рост в диаметре может продолжаться даже после прекращения продольного роста.Этот рост за счет добавления к свободной поверхности кости называется аппозиционным ростом . Аппозиционный рост может происходить в эндосте или перистеуме, где остеокласты рассасывают старую кость, выстилающую мозговую полость, а остеобласты производят новую костную ткань. Эрозия старой кости вдоль костномозговой полости и отложение новой кости под надкостницей не только увеличивают диаметр диафиза, но и увеличивают диаметр костномозговой полости. Это ремоделирование кости в основном происходит во время роста кости.Однако во взрослой жизни кость подвергается постоянному ремоделированию, при котором резорбция старой или поврежденной кости происходит на той же поверхности, где остеобласты закладывают новую кость, чтобы заменить ту, которая резорбируется. Травмы, упражнения и другие действия приводят к ремоделированию. Эти влияния обсуждаются позже в этой главе, но даже без травм или упражнений от 5 до 10 процентов скелета ежегодно реконструируется, просто разрушая старую кость и заменяя ее свежей.
Заболевания… скелетной системы
Несовершенный остеогенез (НО) — это генетическое заболевание, при котором кости не формируются должным образом, поэтому они хрупкие и легко ломаются.Его еще называют болезнью хрупкости костей. Заболевание присутствует с рождения и поражает человека на протяжении всей жизни.
Генетическая мутация, вызывающая ОИ, влияет на выработку организмом коллагена, одного из важнейших компонентов костного матрикса. Степень тяжести заболевания может варьироваться от легкой до тяжелой. У людей с наиболее тяжелыми формами болезни гораздо больше переломов, чем у пациентов с легкой формой. Частые и множественные переломы обычно приводят к деформации костей и низкому росту.Искривление длинных костей и искривление позвоночника также часто встречаются у людей, страдающих ОИ. Искривление позвоночника затрудняет дыхание, потому что легкие сжаты.
Поскольку коллаген является важным структурным белком во многих частях тела, люди с НО могут также испытывать хрупкую кожу, слабые мышцы, расшатанные суставы, легкие синяки, частые кровотечения из носа, ломкие зубы, посинение склеры и потерю слуха. Лекарства от ОИ не существует. Лечение направлено на то, чтобы помочь человеку сохранить как можно большую независимость, сводя к минимуму переломы и увеличивая подвижность.С этой целью рекомендуются безопасные упражнения, такие как плавание, при которых тело менее подвержено столкновениям или усилиям сжатия. При необходимости используются скобы для поддержки ног, лодыжек, колен и запястий. Трости, ходунки или инвалидные коляски также могут помочь компенсировать слабые места.
Когда кости действительно ломаются, используются гипсовые повязки, шины или бинты. В некоторых случаях металлические стержни могут быть имплантированы хирургическим путем в длинные кости рук и ног. В настоящее время проводятся исследования использования бисфосфонатов для лечения ОИ.Курение и избыточный вес особенно опасны для людей с ОИ, поскольку известно, что курение ослабляет кости, а лишний вес создает дополнительную нагрузку на кости.
Обзор разделаВсе костеобразование — это процесс замещения. В процессе развития ткани замещаются костью в процессе окостенения. При внутримембранозной оссификации кость развивается непосредственно из слоев мезенхимальной соединительной ткани. При эндохондральной оссификации кость развивается за счет замены гиалинового хряща.Активность эпифизарной пластинки позволяет костям увеличиваться в длину (это интерстициальный рост). Аппозиционный рост позволяет костям увеличиваться в диаметре. Ремоделирование происходит по мере того, как кость рассасывается и заменяется новой костью.
Контрольные вопросыВопросы о критическом мышлении
1. Чем различаются внутримембранная и эндохондральная оссификация?
2.Учитывая, как развивается длинная кость, каковы сходства и различия между первичным и вторичным очагами окостенения?
3. Сравните и сопоставьте интерстициальный и аппозиционный рост.
Глоссарий
- аппозиционный рост
- Рост за счет добавления на свободную поверхность кости, может происходить в эндосте или надкостнице
- эндохондральная оссификация
- процесс, при котором кость формируется путем замещения гиалинового хряща
- эпифизарная линия
- полностью окостеневший остаток эпифизарной пластинки
- эпифизарная пластина
- соединение между эпифизом и диафизом растущей длинной кости, содержит гиалиновый хрящ, заменяемый костью, место удлинения длинной кости
- межстраничный рост
- Рост за счет добавления внутрь структуры, происходит за счет гиалинового хряща на эпифизарной пластине
- внутримембранное окостенение
- процесс, при котором кость образуется непосредственно из мезенхимальной ткани
- окостенение
- (также остеогенез) образование кости
- центр окостенения
- кластер остеобластов, обнаруженный на ранних стадиях внутримембранозной оссификации
- остеоид
- некальцинированный костный матрикс, секретируемый остеобластами, содержит коллаген и предшественники коллагена
- надхрящница
- мембрана, покрывающая хрящ
- центр первичной оссификации
- область, глубоко в диафизе, где начинается развитие кости при эндохондральной оссификации
- зона пролиферации
- область эпифизарной пластинки, которая производит новые хондроциты взамен тех, которые умирают на диафизарном конце пластинки и способствует продольному росту эпифизарной пластинки
- реконструкция
- процесс, с помощью которого остеокласты рассасывают старую или поврежденную кость одновременно с той же поверхностью, где остеобласты образуют новую кость, чтобы заменить ту, которая рассасывается
- резервная зона
- Область эпифизарной пластинки, которая прикрепляет пластину к костной ткани эпифиза
- центр вторичной оссификации
- область развития эндохондральной кости в эпифизах
- зона кальцинированного матрикса
- область эпифизарной пластинки, ближайшая к диафизарному концу; функции для соединения эпифизарной пластинки с диафизом
- зона созревания и гипертрофии
- область эпифизарной пластинки, где хондроциты из пролиферативной зоны растут и созревают и вносят вклад в продольный рост эпифизарной пластинки
Решения
Ответы на вопросы о критическом мышлении
- При внутримембранозной оссификации кость развивается непосредственно из слоев мезенхимальной соединительной ткани, но при эндохондральной оссификации кость развивается за счет замены гиалинового хряща.Внутримембранозная оссификация завершается к концу подросткового всплеска роста, в то время как эндохондральная оссификация продолжается в молодом возрасте. Плоские кости лица, большинство костей черепа и значительная часть ключиц (ключиц) образуются за счет внутримембранозной оссификации, в то время как кости у основания черепа и длинные кости образуются за счет эндохондрального окостенения.
- При эндохондральной оссификации присутствует единственный первичный центр окостенения глубоко в диафизе. Как и первичный центр окостенения, вторичные центры окостенения присутствуют во время эндохондрального окостенения, но формируются позже, и их по крайней мере два, по одному в каждом эпифизе.
- Происходит интерстициальный рост в гиалиновом хряще эпифизарной пластинки, увеличивает длину растущей кости. Аппозиционный рост происходит на эндостальной и надкостничной поверхностях, увеличивает ширину растущих костей. Интерстициальный рост происходит только до тех пор, пока присутствует гиалин, он не может происходить после закрытия эпифизарной пластинки. Аппозиционный рост может продолжаться в течение всей жизни.
6.4 Формирование и развитие костей — анатомия и физиология
Цели обучения
К концу этого раздела вы сможете:
- Объясните функцию хряща
- Перечислить этапы внутримембранного окостенения
- Перечислить этапы эндохондральной оссификации
- Объясните ростовую активность эпифизарной пластинки
- Сравните и сопоставьте процессы моделирования и ремоделирования
На ранних стадиях эмбрионального развития скелет эмбриона состоит из фиброзных оболочек и гиалинового хряща.К шестой или седьмой неделе эмбриональной жизни начинается собственно процесс развития костей, окостенения (остеогенеза). Есть два остеогенных пути — внутримембранозная оссификация и эндохондральная оссификация, — но кость одна и та же, независимо от пути, который ее производит.
Шаблоны для хрящей
Кость — замещающая ткань; то есть он использует модельную ткань, на которую закладывается минеральная матрица. Для развития скелета наиболее распространенным шаблоном является хрящ. Во время внутриутробного развития закладывается основа, определяющая, где будут формироваться кости.Этот каркас представляет собой гибкую полутвердую матрицу, производимую хондробластами, и состоит из гиалуроновой кислоты, хондроитинсульфата, волокон коллагена и воды. Поскольку матрица окружает и изолирует хондробласты, они называются хондроцитами. В отличие от большинства соединительных тканей, хрящ не имеет сосудов, что означает, что в нем нет кровеносных сосудов, снабжающих питательными веществами и удаляющих метаболические отходы. Все эти функции выполняются за счет диффузии через матрицу. Вот почему поврежденный хрящ не восстанавливается так быстро, как большинство тканей.
На протяжении всего внутриутробного развития и роста и развития в детстве на хрящевой матрице формируются кости. К моменту рождения плода большая часть хряща заменяется костью. Некоторый дополнительный хрящ будет заменен в детстве, а часть хряща останется в скелете взрослого.
Внутримембранозное окостенение
При внутримембранозной оссификации компактная и губчатая кость развивается непосредственно из слоев мезенхимальной (недифференцированной) соединительной ткани.Плоские кости лица, большинство костей черепа и ключицы (ключицы) образуются путем внутримембранозной оссификации.
Процесс начинается, когда мезенхимные клетки в эмбриональном скелете собираются вместе и начинают дифференцироваться в специализированные клетки (рис. 6.16 a ). Некоторые из этих клеток будут дифференцироваться в капилляры, в то время как другие станут остеогенными клетками, а затем и остеобластами. Хотя в конечном итоге они будут распространяться за счет образования костной ткани, ранние остеобласты появляются в кластере, который называется центром окостенения.
Остеобласты выделяют остеоид, некальцинированный матрикс, который кальцинируется (затвердевает) в течение нескольких дней, поскольку на нем откладываются минеральные соли, тем самым захватывая остеобласты внутри. После захвата остеобласты становятся остеоцитами (рис. 6.16 b ). По мере того как остеобласты трансформируются в остеоциты, остеогенные клетки окружающей соединительной ткани дифференцируются в новые остеобласты.
Остеоид (неминерализованный костный матрикс), секретируемый вокруг капилляров, приводит к образованию трабекулярного матрикса, в то время как остеобласты на поверхности губчатой кости становятся надкостницей (Рисунок 6.16 c ). Затем надкостница создает защитный слой компактной кости, находящейся на поверхности губчатой кости. Трабекулярная кость скапливается рядом с кровеносными сосудами, которые в конечном итоге конденсируются в красный костный мозг (рис. 6.16 d ).
Рис. 6.16. Внутримембранозная оссификация. Внутримембранозная оссификация происходит в четыре этапа. (а) Мезенхимные клетки группируются в кластеры и образуются центры окостенения. (б) Секретированный остеоид захватывает остеобласты, которые затем становятся остеоцитами. (c) Трабекулярный матрикс и форма надкостницы.(d) Компактная кость развивается на поверхности губчатой кости, и переполненные кровеносные сосуды конденсируются в красный костный мозг.
Внутримембранозная оссификация начинается в утробе матери во время внутриутробного развития и продолжается в подростковом возрасте. При рождении череп и ключицы не окостенели полностью, а швы черепа не закрыты. Это позволяет черепу и плечам деформироваться во время прохождения через родовые пути. Последними костями, окостеневшими в результате внутримембранного окостенения, являются плоские кости лица, которые достигают своего взрослого размера в конце подросткового скачка роста.
Эндохондральная оссификация
При эндохондральной оссификации кость развивается посредством , заменяя гиалиновым хрящом. Хрящ не становится костью. Вместо этого хрящ служит шаблоном, который полностью заменяется новой костью. Эндохондральная оссификация длится намного дольше, чем внутримембранозная оссификация. Кости у основания черепа и длинные кости образуются посредством эндохондральной оссификации.
В длинной кости, например, примерно через 6-8 недель после зачатия некоторые из мезенхимальных клеток дифференцируются в хондроциты (хрящевые клетки), которые образуют хрящевой скелетный предшественник костей (Рисунок 6.17 а ). Вскоре после этого появляется перихондрий, мембрана, покрывающая хрящ (рис. 6.17 ( b )).
Рис. 6.17. Эндохондральная оссификация. Эндохондральная оссификация выполняется в пять этапов. (а) Мезенхимные клетки дифференцируются в хондроциты. (б) Модель хряща будущего костного скелета и перихондриальная форма. (c) Капилляры проникают в хрящ. Надхрящница переходит в надкостницу. Развивается периостальный воротник. Развивается первичный очаг окостенения.(d) Хрящ и хондроциты продолжают расти на концах кости. д) развиваются центры вторичной оссификации. (f) Хрящ остается на эпифизарной пластине (ростовой) и на поверхности сустава в виде суставного хряща.
По мере производства большего количества матрикса хондроциты в центре хрящевой модели увеличиваются в размере. Поскольку матрикс кальцинируется, питательные вещества больше не могут достигать хондроцитов. Это приводит к их гибели и разрушению окружающего хряща. Кровеносные сосуды проникают в образовавшиеся пространства, не только увеличивая полости, но и неся с собой остеогенные клетки, многие из которых станут остеобластами.Эти увеличивающиеся пространства в конечном итоге объединяются, образуя мозговую полость.
По мере роста хряща в него проникают капилляры. Это проникновение инициирует преобразование надхрящницы в надкостницу, продуцирующую кость. Здесь остеобласты образуют надкостничный воротник из компактной кости вокруг хряща диафиза. Ко второму или третьему месяцу жизни плода развитие костных клеток и окостенение усиливается и образует первичный центр окостенения — область в глубине надкостничного воротника, где начинается окостенение (рис.17 c ).
Пока происходят эти глубокие изменения, хондроциты и хрящ продолжают расти на концах кости (будущие эпифизы), что увеличивает длину кости, в то время как кость замещает хрящ в диафизах. К тому времени, когда скелет плода полностью сформирован, хрящ остается только на суставной поверхности в виде суставного хряща и между диафизом и эпифизом в качестве эпифизарной пластинки, последняя из которых отвечает за продольный рост костей.После рождения такая же последовательность событий (минерализация матрикса, гибель хондроцитов, инвазия кровеносных сосудов из надкостницы и засевание остеогенными клетками, которые становятся остеобластами) происходит в эпифизарных областях, и каждый из этих центров активности называется вторичный центр окостенения (рис. 6.17 e ).
Как растут кости
Эпифизарная пластинка — это область роста длинной кости. Это слой гиалинового хряща, в котором окостенение происходит в незрелых костях.На эпифизарной стороне эпифизарной пластинки образуется хрящ. Со стороны диафиза хрящ окостенел, а диафиз увеличивается в длину. Эпифизарная пластинка состоит из четырех зон клеток и активности (рис. 6.18). Резервная зона — это область, ближайшая к эпифизарному концу пластины и содержащая небольшие хондроциты внутри матрикса. Эти хондроциты не участвуют в росте кости, но прикрепляют эпифизарную пластинку к костной ткани эпифиза.
Рисунок 6.18 Продольный рост кости Эпифизарная пластинка отвечает за продольный рост кости.
Зона пролиферации является следующим слоем по направлению к диафизу и содержит стопки немного более крупных хондроцитов. Он производит новые хондроциты (через митоз), чтобы заменить те, которые умирают на диафизарном конце пластины. Хондроциты в следующем слое, зоне созревания и гипертрофии, старше и крупнее, чем хондроциты в зоне пролиферации. Более зрелые клетки расположены ближе к диафизарному концу пластинки.Продольный рост кости является результатом деления клеток в зоне пролиферации и созревания клеток в зоне созревания и гипертрофии.
Большинство хондроцитов в зоне кальцинированного матрикса, зоне, ближайшей к диафизу, мертвы, потому что матрица вокруг них кальцинировалась. Капилляры и остеобласты из диафиза проникают в эту зону, а остеобласты секретируют костную ткань на оставшемся кальцинированном хряще. Таким образом, зона кальцинированного матрикса соединяет эпифизарную пластинку с диафизом.Кость увеличивается в длину, когда к диафизу добавляется костная ткань.
Кости продолжают расти в длину до раннего взросления. Скорость роста контролируется гормонами, о которых мы поговорим позже. Когда хондроциты в эпифизарной пластинке прекращают свою пролиферацию и кость замещает хрящ, продольный рост прекращается. Все, что осталось от эпифизарной пластинки, — это эпифизарная линия (рис. 6.19).
Рис. 6.19. Переход от эпифизарной пластинки к эпифизарной линии По мере созревания кости эпифизарная пластинка переходит в эпифизарную линию.(а) Эпифизарные пластинки видны в растущей кости. (б) Эпифизарные линии — это остатки эпифизарных пластинок в зрелой кости.
Как кости растут в диаметре
Хотя кости увеличиваются в длину, они также увеличиваются в диаметре; рост в диаметре может продолжаться даже после прекращения продольного роста. Это называется аппозиционным ростом. Остеокласты резорбируют старую кость, выстилающую костномозговую полость, в то время как остеобласты посредством внутримембранозного окостенения производят новую костную ткань под надкостницей.Эрозия старой кости вдоль костномозговой полости и отложение новой кости под надкостницей не только увеличивают диаметр диафиза, но и увеличивают диаметр костномозговой полости. Этот процесс называется моделированием.
Ремоделирование костей
Процесс, при котором матрица резорбируется на одной поверхности кости и откладывается на другой, известен как моделирование кости. Моделирование в основном происходит во время роста кости. Однако во взрослой жизни кость претерпевает ремоделирование, при котором резорбция старой или поврежденной кости происходит на той же поверхности, где остеобласты откладывают новую кость, чтобы заменить ту, которая резорбируется.Травмы, упражнения и другие действия приводят к ремоделированию. Эти влияния обсуждаются позже в этой главе, но даже без травм или упражнений от 5 до 10 процентов скелета ежегодно реконструируется, просто разрушая старую кость и обновляя ее свежей.
Болезни …
Скелетная система
Несовершенный остеогенез (НО) — это генетическое заболевание, при котором кости не формируются должным образом, поэтому они хрупкие и легко ломаются. Его еще называют болезнью хрупкости костей.Заболевание присутствует с рождения и поражает человека на протяжении всей жизни.
Генетическая мутация, вызывающая ОИ, влияет на выработку организмом коллагена, одного из важнейших компонентов костного матрикса. Степень тяжести заболевания может варьироваться от легкой до тяжелой. У людей с наиболее тяжелыми формами болезни гораздо больше переломов, чем у пациентов с легкой формой. Частые и множественные переломы обычно приводят к деформации костей и низкому росту. Искривление длинных костей и искривление позвоночника также часто встречаются у людей, страдающих ОИ.Искривление позвоночника затрудняет дыхание, потому что легкие сжаты.
Поскольку коллаген является важным структурным белком во многих частях тела, люди с НО могут также испытывать хрупкую кожу, слабые мышцы, расшатанные суставы, легкие синяки, частые кровотечения из носа, ломкие зубы, посинение склеры и потерю слуха. Лекарства от ОИ не существует. Лечение направлено на то, чтобы помочь человеку сохранить как можно большую независимость, сводя к минимуму переломы и увеличивая подвижность.С этой целью рекомендуются безопасные упражнения, такие как плавание, при которых тело менее подвержено столкновениям или усилиям сжатия. При необходимости используются скобы для поддержки ног, лодыжек, колен и запястий. Трости, ходунки или инвалидные коляски также могут помочь компенсировать слабые места.
Когда кости действительно ломаются, используются гипсовые повязки, шины или бинты. В некоторых случаях металлические стержни могут быть имплантированы хирургическим путем в длинные кости рук и ног. В настоящее время проводятся исследования использования бисфосфонатов для лечения ОИ.Курение и избыточный вес особенно опасны для людей с ОИ, поскольку известно, что курение ослабляет кости, а лишний вес создает дополнительную нагрузку на кости.
Интерактивная ссылка
Посмотрите это видео, чтобы увидеть, как растет кость.
Формирование и развитие костей — анатомия и физиология
OpenStaxCollege
Цели обучения
К концу этого раздела вы сможете:
- Объясните функцию хряща
- Перечислить этапы внутримембранного окостенения
- Перечислить этапы эндохондральной оссификации
- Объясните ростовую активность эпифизарной пластинки
- Сравните и сопоставьте процессы моделирования и ремоделирования
На ранних стадиях эмбрионального развития скелет эмбриона состоит из фиброзных оболочек и гиалинового хряща.К шестой или седьмой неделе эмбриональной жизни начинается собственно процесс развития костей, окостенения (остеогенеза). Есть два остеогенных пути — внутримембранозная оссификация и эндохондральная оссификация, — но кость одна и та же, независимо от пути, который ее производит.
Кость — замещающая ткань; то есть он использует модельную ткань, на которую закладывается минеральная матрица. Для развития скелета наиболее распространенным шаблоном является хрящ. Во время внутриутробного развития закладывается основа, определяющая, где будут формироваться кости.Этот каркас представляет собой гибкую полутвердую матрицу, производимую хондробластами, и состоит из гиалуроновой кислоты, хондроитинсульфата, волокон коллагена и воды. Поскольку матрица окружает и изолирует хондробласты, они называются хондроцитами. В отличие от большинства соединительных тканей, хрящ не имеет сосудов, что означает, что в нем нет кровеносных сосудов, снабжающих питательными веществами и удаляющих метаболические отходы. Все эти функции выполняются за счет диффузии через матрицу. Вот почему поврежденный хрящ не восстанавливается так быстро, как большинство тканей.
На протяжении всего внутриутробного развития и роста и развития в детстве на хрящевой матрице формируются кости. К моменту рождения плода большая часть хряща заменяется костью. Некоторый дополнительный хрящ будет заменен в детстве, а часть хряща останется в скелете взрослого.
При внутримембранозной оссификации компактная и губчатая кость развивается непосредственно из слоев мезенхимальной (недифференцированной) соединительной ткани. Плоские кости лица, большинство костей черепа и ключицы (ключицы) образуются путем внутримембранозной оссификации.
Процесс начинается, когда мезенхимные клетки в эмбриональном скелете собираются вместе и начинают дифференцироваться в специализированные клетки ([link] a ). Некоторые из этих клеток будут дифференцироваться в капилляры, в то время как другие станут остеогенными клетками, а затем и остеобластами. Хотя в конечном итоге они будут распространяться за счет образования костной ткани, ранние остеобласты появляются в кластере, который называется центром окостенения.
Остеобласты выделяют остеоид, некальцинированный матрикс, который кальцинируется (затвердевает) в течение нескольких дней, поскольку на нем откладываются минеральные соли, тем самым захватывая остеобласты внутри.После захвата остеобласты становятся остеоцитами ([ссылка] b ). По мере того как остеобласты трансформируются в остеоциты, остеогенные клетки окружающей соединительной ткани дифференцируются в новые остеобласты.
Остеоид (неминерализованный костный матрикс), секретируемый вокруг капилляров, приводит к образованию трабекулярного матрикса, в то время как остеобласты на поверхности губчатой кости становятся надкостницей ([link] c ). Затем надкостница создает защитный слой компактной кости, находящейся на поверхности губчатой кости.Трабекулярная кость переполняет близлежащие кровеносные сосуды, которые в конечном итоге конденсируются в красный костный мозг ([ссылка] d ).
Внутримембранозная оссификация
Внутримембранозная оссификация происходит в четыре этапа. (а) Мезенхимные клетки группируются в кластеры и образуются центры окостенения. (б) Секретированный остеоид захватывает остеобласты, которые затем становятся остеоцитами. (c) Трабекулярный матрикс и форма надкостницы. (d) Компактная кость развивается на поверхности губчатой кости, и переполненные кровеносные сосуды конденсируются в красный костный мозг.
Интрамембранозное окостенение начинается в утробе матери во время внутриутробного развития и продолжается в подростковом возрасте. При рождении череп и ключицы не окостенели полностью, а швы черепа не закрыты. Это позволяет черепу и плечам деформироваться во время прохождения через родовые пути. Последними костями, окостеневшими в результате внутримембранного окостенения, являются плоские кости лица, которые достигают своего взрослого размера в конце подросткового скачка роста.
При эндохондральной оссификации кость развивается посредством , заменяя гиалиновым хрящом. Хрящ не становится костью. Вместо этого хрящ служит шаблоном, который полностью заменяется новой костью. Эндохондральная оссификация длится намного дольше, чем внутримембранозная оссификация. Кости у основания черепа и длинные кости образуются посредством эндохондральной оссификации.
В длинной кости, например, примерно через 6-8 недель после зачатия некоторые из мезенхимальных клеток дифференцируются в хондроциты (хрящевые клетки), которые образуют хрящевой скелетный предшественник костей ([link] a ).Вскоре после этого появляется надхрящница, оболочка, покрывающая хрящ [ссылка] b ).
Эндохондральная оссификация
Эндохондральная оссификация проходит в пять этапов. (а) Мезенхимные клетки дифференцируются в хондроциты. (б) Модель хряща будущего костного скелета и перихондриальная форма. (c) Капилляры проникают в хрящ. Надхрящница переходит в надкостницу. Развивается периостальный воротник. Развивается первичный очаг окостенения. (d) Хрящ и хондроциты продолжают расти на концах кости.д) развиваются центры вторичной оссификации. (f) Хрящ остается на эпифизарной пластине (ростовой) и на поверхности сустава в виде суставного хряща.
По мере производства большего количества матрикса хондроциты в центре хрящевой модели увеличиваются в размере. Поскольку матрикс кальцинируется, питательные вещества больше не могут достигать хондроцитов. Это приводит к их гибели и разрушению окружающего хряща. Кровеносные сосуды проникают в образовавшиеся пространства, не только увеличивая полости, но и неся с собой остеогенные клетки, многие из которых станут остеобластами.Эти увеличивающиеся пространства в конечном итоге объединяются, образуя мозговую полость.
По мере роста хряща в него проникают капилляры. Это проникновение инициирует преобразование надхрящницы в надкостницу, продуцирующую кость. Здесь остеобласты образуют надкостничный воротник из компактной кости вокруг хряща диафиза. Ко второму или третьему месяцу жизни плода развитие костных клеток и окостенение усиливается и создает первичный центр окостенения, область в глубине периостального воротника, где начинается окостенение ([ссылка] c ).
Пока происходят эти глубокие изменения, хондроциты и хрящ продолжают расти на концах кости (будущие эпифизы), что увеличивает длину кости, в то время как кость замещает хрящ в диафизах. К тому времени, когда скелет плода полностью сформирован, хрящ остается только на суставной поверхности в виде суставного хряща и между диафизом и эпифизом в качестве эпифизарной пластинки, последняя из которых отвечает за продольный рост костей. После рождения такая же последовательность событий (минерализация матрикса, гибель хондроцитов, инвазия кровеносных сосудов из надкостницы и засевание остеогенными клетками, которые становятся остеобластами) происходит в эпифизарных областях, и каждый из этих центров активности называется вторичный центр окостенения ([ссылка] e ).
Эпифизарная пластинка — это область роста длинной кости. Это слой гиалинового хряща, в котором окостенение происходит в незрелых костях. На эпифизарной стороне эпифизарной пластинки образуется хрящ. Со стороны диафиза хрящ окостенел, а диафиз увеличивается в длину. Эпифизарная пластинка состоит из четырех зон клеток и активности ([ссылка]). Резервная зона — это область, ближайшая к эпифизарному концу пластины и содержащая небольшие хондроциты внутри матрикса.Эти хондроциты не участвуют в росте кости, но прикрепляют эпифизарную пластинку к костной ткани эпифиза.
Продольный рост кости
Эпифизарная пластинка отвечает за продольный рост кости.
Зона пролиферации является следующим слоем по направлению к диафизу и содержит стопки немного более крупных хондроцитов. Он производит новые хондроциты (через митоз), чтобы заменить те, которые умирают на диафизарном конце пластины. Хондроциты в следующем слое, зоне созревания и гипертрофии, старше и крупнее, чем хондроциты в зоне пролиферации.Более зрелые клетки расположены ближе к диафизарному концу пластинки. Продольный рост кости является результатом деления клеток в зоне пролиферации и созревания клеток в зоне созревания и гипертрофии.
Большинство хондроцитов в зоне кальцинированного матрикса, зоне, ближайшей к диафизу, мертвы, потому что матрица вокруг них кальцинировалась. Капилляры и остеобласты из диафиза проникают в эту зону, а остеобласты секретируют костную ткань на оставшемся кальцинированном хряще.Таким образом, зона кальцинированного матрикса соединяет эпифизарную пластинку с диафизом. Кость увеличивается в длину, когда к диафизу добавляется костная ткань.
Кости продолжают расти в длину до раннего взросления. Скорость роста контролируется гормонами, о которых мы поговорим позже. Когда хондроциты в эпифизарной пластинке прекращают свою пролиферацию и кость замещает хрящ, продольный рост прекращается. Все, что осталось от эпифизарной пластинки, — это эпифизарная линия ([ссылка]).
Переход от эпифизарной пластины к эпифизарной линии
По мере созревания кости эпифизарная пластинка прогрессирует до эпифизарной линии. (а) Эпифизарные пластинки видны в растущей кости. (б) Эпифизарные линии — это остатки эпифизарных пластинок в зрелой кости.
Хотя кости увеличиваются в длину, они также увеличиваются в диаметре; рост в диаметре может продолжаться даже после прекращения продольного роста. Это называется аппозиционным ростом.Остеокласты резорбируют старую кость, выстилающую костномозговую полость, в то время как остеобласты посредством внутримембранозного окостенения производят новую костную ткань под надкостницей. Эрозия старой кости вдоль костномозговой полости и отложение новой кости под надкостницей не только увеличивают диаметр диафиза, но и увеличивают диаметр костномозговой полости. Этот процесс называется моделированием.
Процесс, при котором матрица резорбируется на одной поверхности кости и откладывается на другой, известен как моделирование кости.Моделирование в основном происходит во время роста кости. Однако во взрослой жизни кость претерпевает ремоделирование, при котором резорбция старой или поврежденной кости происходит на той же поверхности, где остеобласты откладывают новую кость, чтобы заменить ту, которая резорбируется. Травмы, упражнения и другие действия приводят к ремоделированию. Эти влияния обсуждаются позже в этой главе, но даже без травм или упражнений от 5 до 10 процентов скелета ежегодно реконструируется, просто разрушая старую кость и обновляя ее свежей.
Болезни…
Скелетная система
Несовершенный остеогенез (НО) — это генетическое заболевание, при котором кости не формируются должным образом, поэтому они хрупкие и легко ломаются. Его еще называют болезнью хрупкости костей. Заболевание присутствует с рождения и поражает человека на протяжении всей жизни.
Генетическая мутация, вызывающая ОИ, влияет на выработку организмом коллагена, одного из важнейших компонентов костного матрикса. Степень тяжести заболевания может варьироваться от легкой до тяжелой.У людей с наиболее тяжелыми формами болезни гораздо больше переломов, чем у пациентов с легкой формой. Частые и множественные переломы обычно приводят к деформации костей и низкому росту. Искривление длинных костей и искривление позвоночника также часто встречаются у людей, страдающих ОИ. Искривление позвоночника затрудняет дыхание, потому что легкие сжаты.
Поскольку коллаген является важным структурным белком во многих частях тела, люди с НО могут также испытывать хрупкую кожу, слабые мышцы, расшатанные суставы, легкие синяки, частые кровотечения из носа, ломкие зубы, посинение склеры и потерю слуха.Лекарства от ОИ не существует. Лечение направлено на то, чтобы помочь человеку сохранить как можно большую независимость, сводя к минимуму переломы и увеличивая подвижность. С этой целью рекомендуются безопасные упражнения, такие как плавание, при которых тело менее подвержено столкновениям или усилиям сжатия. При необходимости используются скобы для поддержки ног, лодыжек, колен и запястий. Трости, ходунки или инвалидные коляски также могут помочь компенсировать слабые места.
Когда кости действительно ломаются, используются гипсовые повязки, шины или бинты.В некоторых случаях металлические стержни могут быть имплантированы хирургическим путем в длинные кости рук и ног. В настоящее время проводятся исследования использования бисфосфонатов для лечения ОИ. Курение и избыточный вес особенно опасны для людей с ОИ, поскольку известно, что курение ослабляет кости, а лишний вес создает дополнительную нагрузку на кости.
Посмотрите это видео, чтобы увидеть, как растет кость.
Все костеобразование — это процесс замещения. У эмбрионов развивается хрящевой скелет и различные оболочки.В процессе развития они замещаются костью в процессе окостенения. При внутримембранозной оссификации кость развивается непосредственно из слоев мезенхимальной соединительной ткани. При эндохондральной оссификации кость развивается за счет замены гиалинового хряща. Активность эпифизарной пластинки позволяет костям увеличиваться в длину. Моделирование позволяет костям увеличиваться в диаметре. Ремоделирование происходит по мере того, как кость рассасывается и заменяется новой костью. Несовершенный остеогенез — это генетическое заболевание, при котором нарушается выработка коллагена, что приводит к хрупкости и хрупкости костей.
Почему заживает хрящ медленно?
- , потому что со временем разовьется в кость
- , потому что он полутвердый и гибкий
- , потому что в нем нет кровоснабжения
- , потому что эндохондральная оссификация заменяет весь хрящ на кость
Почему остеоциты распространены в костной ткани?
- Они развиваются из мезенхимальных клеток.
- Они окружены остеоидом.
- Они проходят через капилляры.
- Формирование остеоида распространяет остеобласты, которые сформировали центры окостенения.
Что происходит с хондроцитами при эндохондральной оссификации?
- Они развиваются в остеоциты.
- Они умирают в кальцинированном матриксе, который их окружает, и образуют мозговую полость.
- Они разрастаются и образуют надкостницу.
- Они группируются вместе, образуя первичный центр окостенения.
Какая из следующих костей образована (образуются) в результате внутримембранозной оссификации?
- плюсневые кости
- бедренная кость
- ребра
- плоские кости черепа
Кости увеличиваются в длину из-за активности в ________.
- эпифизарная пластина
- надхрящница
- надкостница
- Медуллярная полость
Кости увеличиваются в диаметре за счет образования кости ________.
- в костномозговой полости
- под надкостницей
- в эпифизарной пластинке
- в метафизе
Что из следующего представляет правильную последовательность зон в эпифизарной пластинке?
- пролиферация, резерв, созревание, обызвествление
- созревание, разрастание, резерв, обызвествление
- кальцификация, созревание, разрастание, зарезервировано
- обызвествление, отложенное, разрастание, созревание
Чем различаются внутримембранная и эндохондральная оссификация?
При внутримембранозной оссификации кость развивается непосредственно из слоев мезенхимальной соединительной ткани, но при эндохондральной оссификации кость развивается за счет замены гиалинового хряща.Внутримембранозная оссификация завершается к концу подросткового всплеска роста, в то время как эндохондральная оссификация продолжается в молодом возрасте. Плоские кости лица, большинство костей черепа и значительная часть ключиц (ключиц) образуются за счет внутримембранозной оссификации, в то время как кости у основания черепа и длинные кости образуются за счет эндохондрального окостенения.
Учитывая, как развивается длинная кость, каковы сходства и различия между первичным и вторичным центрами окостенения?
Один первичный центр окостенения присутствует во время эндохондрального окостенения глубоко в надкостничном воротничке.Как и первичный центр окостенения, вторичные центры окостенения присутствуют во время эндохондрального окостенения, но формируются позже, и их два, по одному в каждом эпифизе.
Глоссарий
- эндохондральная оссификация
- процесс, при котором кость формируется путем замещения гиалинового хряща
- эпифизарная линия
- полностью окостеневший остаток эпифизарной пластинки
- внутримембранное окостенение
- процесс, при котором кость образуется непосредственно из мезенхимальной ткани
- моделирование
- процесс во время роста кости, при котором кость резорбируется на одной поверхности кости и откладывается на другой.
- окостенение
- (также остеогенез) образование кости
- центр окостенения
- кластер остеобластов, обнаруженный на ранних стадиях внутримембранозной оссификации
- остеоид
- некальцинированный костный матрикс, секретируемый остеобластами
- надхрящница
- мембрана, покрывающая хрящ
- центр первичной оссификации
- область, глубоко в воротничке надкостницы, где начинается развитие кости во время эндохондральной оссификации
- зона пролиферации
- область эпифизарной пластинки, которая производит новые хондроциты взамен тех, которые умирают на диафизарном конце пластинки и способствует продольному росту эпифизарной пластинки
- реконструкция
- процесс, с помощью которого остеокласты рассасывают старую или поврежденную кость одновременно с той же поверхностью, где остеобласты образуют новую кость, чтобы заменить ту, которая рассасывается
- резервная зона
- Область эпифизарной пластинки, которая прикрепляет пластину к костной ткани эпифиза
- центр вторичной оссификации
- область развития кости в эпифизах
- зона кальцинированного матрикса
- область эпифизарной пластинки, ближайшая к диафизарному концу; функции для соединения эпифизарной пластинки с диафизом
- зона созревания и гипертрофии
- область эпифизарной пластинки, где хондроциты из пролиферативной зоны растут и созревают и вносят вклад в продольный рост эпифизарной пластинки
Развитие костей — обзор
Несовершенный остеогенез
Несовершенный остеогенез (НО) происходит каждые 10 000–20 000 живорождений.Это генетическое заболевание, которое в основном влияет на качество костей, хотя могут поражаться и другие ткани, богатые коллагеном I типа, например, сухожилия, связки и зубы. Многие идентифицированные типы НО показали значительную клиническую изменчивость. Большинство типов OI являются аутосомно-доминантными, либо с гаплонедостаточностью, либо с доминантно-отрицательными мутациями в коллагене I типа. Рецессивные формы OI вызываются генетическими мутациями в посттрансляционном механизме модификации коллагена I типа. Применяется мультидисциплинарный подход, чтобы максимизировать функцию и минимизировать вероятность переломов у пациентов.Фармакологически бисфосфонаты обычно используются для подавления активности остеокластов. Другие оцениваемые агенты, включая кальций, фторид, кальцитонин, анаболические стероиды и магний, не достигли большого успеха. Хирургическая коррекция может потребоваться при тяжелых деформациях, влияющих на жизнь пациента. Однако ни один из этих подходов не устраняет основную причину ОИ — мутацию коллагена. 106
Поскольку дефектный коллаген либо разрушается, либо откладывается во внеклеточном матриксе, целью генной терапии является либо замалчивание дефектного гена, либо замена существующих остеобластов здоровыми остеобластами.Было продемонстрировано, что рибозимы, которые специфически воздействуют на мутировавший коллаген, являются эффективными in vitro посредством ретровирусной трансдукции. 107 Однако никаких многообещающих результатов in vivo не поступало. Трансплантация МСК может обеспечить как замену остеобластов, так и поддержание их за счет самообновления. Трансплантированные клетки могут также получить преимущество в выживаемости по сравнению с эндогенными клетками, поскольку они синтезируют нормальный матрикс. 108 Чтобы проверить эту гипотезу, МСК были выделены от мышей и инфицированы аденовирусными векторами, кодирующими человеческий Col1a2.Исправленный ген был обнаружен в клетках различных тканей, включая кости. 109 Исследования на овцах и бабуинах показали аналогичные результаты. 110,111
Хорвиц и др. Провели клиническое исследование у пациентов с тяжелой формой НО. Шесть детей с тяжелым несовершенным остеогенезом получили две инфузии HLA-согласованных аллогенных МСК. У пяти детей было обнаружено, что МСК попадают в один или несколько участков, включая кость, кожу и костный мозг. 112 Сообщалось, что у одного ребенка, у которого через 6 месяцев после инфузии костного мозга произошло приживление остеобластов, увеличилась длина тела и увеличилось содержание минералов в костях, хотя результаты трудно оценить из-за отсутствия контролируемых исследований.
Развитие скелета — обзор
Остеопения
Развитие скелета максимально у здоровых людей в возрасте 25 лет у женщин и в возрасте 30–35 лет у мужчин. Костные изменения происходят при нормальном старении как у мужчин, так и у женщин. Эти изменения включают изменения в динамике популяций костных клеток, разобщение образования и резорбции кости, изменения архитектуры кости, накопление микротрещин и изменения минерализации и белкового матрикса. Старение также вызывает уменьшение массы скелета.Остеопения определяется как клинически значимая потеря костной массы. Помимо потери костной массы, остеопороз сопровождается болью в костях, деформацией позвоночника, потерей роста и увеличением частоты переломов. У здоровых мужчин содержание минералов в лучевой кости (BMC) уменьшается на 1% в год в возрасте от 30 до 87 лет, тогда как BMC позвонков уменьшается на 2,3% в год. Лечение карбонатом кальция и холекальциферолом в течение 3 лет не предотвращает снижения у пациентов с высоким базальным потреблением кальция с пищей (> 1100 мг / день).Кроме того, в возрасте от 35 до 70 лет прочность кортикальной кости при изгибе снижается на 15–20%, а прочность губчатого вещества кости при сжатии снижается примерно на 50%. Кость становится все более хрупкой и ломается с меньшим количеством энергии.
Восприимчивость к клинически значимой остеопении зависит от многих переменных, включая генетику, статус питания, массу тела, физические упражнения и максимальную костную массу. Гормональный дефицит, такой как гормон роста, может способствовать снижению пиковой массы костной ткани по сравнению с нормой. Диабет может быть дополнительным фактором риска развития остеопении.У крыс как старение, так и диабет 1-го типа приводят к повышенной коллаген-связанной флуоресценции в кости, показателю неферментативных поперечных связей, что коррелирует со снижением плотности костей, снижением остеокальцина в сыворотке и повышенной хрупкостью костей. Частично можно предотвратить прогрессирование остеопении в остеопороз, поддерживая хороший пищевой статус (белок, кальций, витамин D) и адекватную физическую активность.
Воздействие гонадных стероидов на кости может зависеть от пола. Во время развития метаболическая реакция костей на гормоны гонад становится зависимой от пола от андрогенов у мужчин и от эстрогенов у женщин.Дефицит андрогенов вызывает остеопению у стареющих самцов крыс. Это можно исправить обработкой T, 5 α -дигидротестостероном или E 2 .
У старых крыс с удаленными яичниками обработка E 2 предотвращает потерю минерального содержания костной ткани позвоночника. Кальцитонин менее эффективен. Однако N-концевой человеческий ПТГ отдельно или в комбинации с E 2 или кальцитонином увеличивает BMC до фиктивных уровней и увеличивает механическую прочность. Это представляет особый интерес, поскольку лечение E 2 у женщин с овариэктомией увеличивает всасывание кальция в кишечнике независимо от 1,25-дигидроксивитамина D, предотвращает потерю BMC и повышает уровень кальцитонина в сыворотке.По крайней мере, одно крупное исследование показало, что минеральная плотность костной ткани у женщин в постменопаузе может поддерживаться заместительной терапией эстрогенами до девятого десятилетия жизни.
Также эффективно лечение пероральным приемом кальция и витамина D. Лечение 800 МЕ / день витамина D снизило частоту переломов в группе пациентов французского дома престарелых. Другие исследования с использованием 1,25-дигидроксивитамина D показали улучшение всасывания кальция и BMC со значительным снижением частоты переломов.
Лекарства первой линии для мужчин и женщин с первичным остеопорозом — это добавки кальция и витамина D и терапия алендролатом.Другие одобренные методы лечения включают гонадные стероиды, если их дефицит, и рекомбинантный ПТГ или кальцитонин.
(PDF) Развитие и рост костей
Развитие и рост костей
DOI: http://dx.doi.org/10.5772/intechopen.82452
Ссылки
[] Vanputte CL, Regan JL, Руссо А.Ф.
Скелетная система: кости и суставы.
In: Seeley’s Essentials of Anatomy &
Physiology. -е изд. США: Мак Гроу Хилл;
.pp.-
[] Muscolino JE.Kinesiology the
Skelatal System and Muscle Function.
изд. Нью-Йорк: Elsevier Inc .;
[] Кэшман К.Д., Джинти Ф.Боун.
Нью-Йорк: Эльзевир; . pp.-
[] OpenStax College. Анатомия и
Физиология. Техас: Университет Райса; .
стр. -
[] Florencia-Silva R, Rodrigues G, Sasso-
Cerri E, Simoes MJ, Cerri PS. Биология
костной ткани: структура, функция и
факторов, влияющих на костные клетки.Биолмед
Research International. : -
[] Тим А. Структура костей и кости
Ремоделирование. Лондон: Университет
Лондонский колледж;
[] Mohamed AM.Review article
обзор костных клеток и их регулирование
. Малазийский медицинский журнал
наук. ; (): -
[] Актер Ф, Ибанез Дж. Кости и хрящ
тканевая инженерия. В: Актер Ф,
редактор. Легкая тканевая инженерия
[Интернет].st ed. Нью-Йорк: Elsevier
Inc .; . стр.-. DOI: . /
B----.-
[] Guus van der Bie MD, редактор .
Морфологическая анатомия с феноменологической точки зрения
. Рим:
Институт Луи Болка;
[] Войнар Р. Кость и хрящ — его структура и физические свойства
.
Weinheim: Wiley-VCH Verlag GmbH &
Co .;
[] Караплис AC.Эмбриональное
развитие кости и регуляция
внутримембранозного и эндохондрального
образования кости. В: Bilezikian J, Raisz
L, Martin TJ, редакторы. Принципы костей
Биология. rd ed. Нью-Йорк: Academic
Press; . pp.-
[] Dennis SC, Berkland CJ, Bonewald
LF, Determore MS. Эндохондральное окостенение
для улучшения костной ткани
регенерация: Конвергенция нативных
биоматериалов ECM и развивающих
инженерное дело invivo.Ткань
Инжиниринг. Часть B, Обзоры.
; (): -
[] Кларк Б. Нормальная анатомия кости
и физиология. Клинический журнал
Американского общества нефрологов.
; : -
[] Provot S, Schipani E, Wu JY,
Kronenberg H. Разработка
скелета. В: Marcus R,
Dempster D, Cauley J, Feldman D,
editors. Остеопороз [Интернет].
изд.Нью-Йорк: Эльзевир;
. стр.-. DOI: . /
B----.-
[] Schindeler A, Mcdonald MM, Бокко
П, Литтл ДГ. Ремоделирование кости при восстановлении перелома
: Клеточная картина.
Семинары по клетке и развитию
Биология. ; : -. DOI.
. / j.semcdb...
[] Ozasa R, Matsugaki A, Isobe
Y, Saku T, Yun HS, Nakano
Т.Создание индуцированной человеком
плюрипотентных стволовых клеток на основе
ориентированной микроструктуры костного матрикса
с использованием модели анизотропной культуры
, разработанной invitro. Журнал
Исследования биомедицинских материалов, часть A.
; : -
[] Су П, Тянь И, Ян Ц, Ма Х, Ван
X . Миграция мезенхимальных стволовых клеток
при формировании кости и лечении заболеваний костей
. Международный журнал
молекулярных наук.