Эндопротезирование тазобедренного сустава
Тазобедренные суставы — самые крупные суставы тела человека. Тазобедренные суставы соединяют ноги с телом. На тазобедренные суставы приходятся большие нагрузки. Травмированный и больной тазобедренный сустав приносит большие страдания человеку.
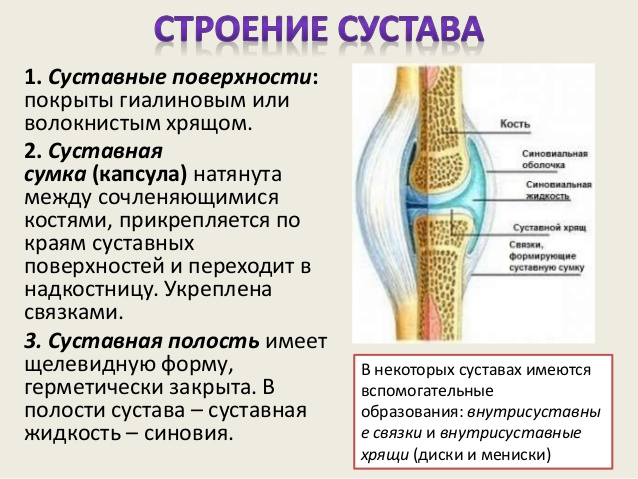
Тазобедренный сустав состоит из тазовой кости, вертлужной впадины, головки бедра и шейки бедренной кости. По краям вертлужной впадины находится, укрепляющая тазобедренный сустав, вертлужная губа (волокнисто-хрящевое образование).
Внутри вертлужной впадины находится головка бедренной кости, соединяющаяся при помощи шейки. Ниже шейки бедренной кости – большие и малые вертела, бедренные и ягодичные мышцы.
Укрепляют тазобедренный состав связки суставной капсулы. Головка бедренной кости покрыта суставным хрящом, который позволяет ей мягко скользить. Шаровидная поверхность головки позволяет осуществлять круговое вращение бедра.
Суставный хрящ между костями играют важную роль в качестве амортизатора при ходьбе, прыжках и беге.
Есть несколько причин, приводящих к разрушению хряща:
- Травмы и ушибы тазобедренного сустава
- Эрозии костей (остеоартрозы истончают хрящ)
- Ревматоидные артриты, подагра и другие системные заболевания
- Аутоиммунные заболевания
- Недостаток коллагена и т.д.
Как правило, все компоненты сустава работают вместе и производят плавное движение. Но из-за того, что тазобедренный сустав испытывает большую весовую нагрузку всего тела при ходьбе, беге и переносе тяжестей, он изнашивается, подвергается различным факторам риска и болезням.
Причинами поражения тазобедренного сустава являются:
- Травмы и ушибы, переломы шейки бедра
- Некрозы головки бедра
- Воспаление суставов (инфекционные осложнения)
- Гормональные изменения
- Сахарный диабет
- Перегрузка сустава
- Полное разрушение головки бедра
- Изношенная хрящевая ткань
- Дисплазия (врожденные деформации тазобедренного сустава)
- Артрозы и артриты тазобедренного сустава
- Избыточный вес
- Остеопороз
- Нарушение обмена веществ и кровообращения
- Системные заболевания
- Хронический стресс и др.

Проблемы в тазобедренном суставе могут возникнуть в любом возрасте. Боль в тазобедренном суставе может быть вызвана серьезными неврологическими заболеваниями позвоночника, паховыми грыжами и патологическими процессами в брюшной полости.
Менять ли тазобедренный сустав?
В Израиле более 90% пациентов довольно результатами эндопротезирования тазобедренного сустава. У людей появилась возможность свободно двигаться, полностью исчезла хромота, устранена боль в суставе, отпала необходимость пользоваться дополнительными опорами.
Пройдя полный курс реабилитации после эндопротезирования тазобедренного сустава в Израиле, пациенты могут самостоятельно передвигаться: ходить, плавать, играть в гольф, даже ездить на велосипеде. Важно помнить: замена тазобедренного сустава, особенно, если это связано с артритом, не позволит интенсивно заниматься спортом, бегать, ходить на лыжах и прыгать. Искусственный сустав имеет ограниченный диапазон движения, по сравнению со здоровым тазобедренным суставом. Но в повседневной жизни — простые движения, ходьба без боли и костылей значительно повышают качество жизни. Искусственные имплантаты тазобедренного сустава рассчитаны на 15-20 лет эксплуатации. По истечении этого срока они заменяется новыми.
Но в повседневной жизни — простые движения, ходьба без боли и костылей значительно повышают качество жизни. Искусственные имплантаты тазобедренного сустава рассчитаны на 15-20 лет эксплуатации. По истечении этого срока они заменяется новыми.
В настоящее время насчитывается около 70 видов различных конструкций. Успех процедуры эндопротезирования тазобедренного сустава зависит от строгого выполнения пациентами специальной программы реабилитации и рекомендаций врача. Пациенту даётся инструкция о том, как оказывать дозированные нагрузки на оперированную ногу физическими упражнениями.
Как проводится операция по эндопротезированию?
Эндопротезирование тазобедренного сустава – самый распространённый метод замены тканей тазобедренного сустава. Эта сложная высокотехнологичная, артроскопическая миниинвазивная операция требует мастерства хирурга-ортопеда и опыта его помощников.
В зависимости от характера поражения сустава, врач-ортопед решает, какой вид конструкции эндопротеза использовать каждому конкретному пациенту. До операции изучается общее состояние здоровья пациента, причины заболевания сустава и т. д.
До операции изучается общее состояние здоровья пациента, причины заболевания сустава и т. д.
Миниинвазивная операция эндопротезирования тазобедренного сустава длится 2-3 часа. Пациент лежит на боку, нога сгибается и фиксируется к столу.
Первый этап операции эндопротезирования тазобедренного сустава – подготовка доступа к суставу. Очень важный этап. Производится продольный разрез длиной 15-20 см вдоль сустава. Современная техника позволяет минимально травмировать мышцы и ткани. В дальнейшем это поможет быстро восстановить двигательные функции конечности. Во время этого этапа операции хирург-ортопед специальными миниинвазивными инструментами удаляет повреждённые кости, хрящи сустава и т.д. Костные структуры подготавливаются к установке имплантата.
Второй этап операции эндопротезирования тазобедренного сустава – установка искусственного протеза. Эндопротез может быть металлическим, керамическим, пластиковым или комбинированным (в зависимости от проблемы сустава). Эндопротез тазобедренного сустава состоит из ножки, головки, чашки и вкладыша — каждая из частей имеет свой размер.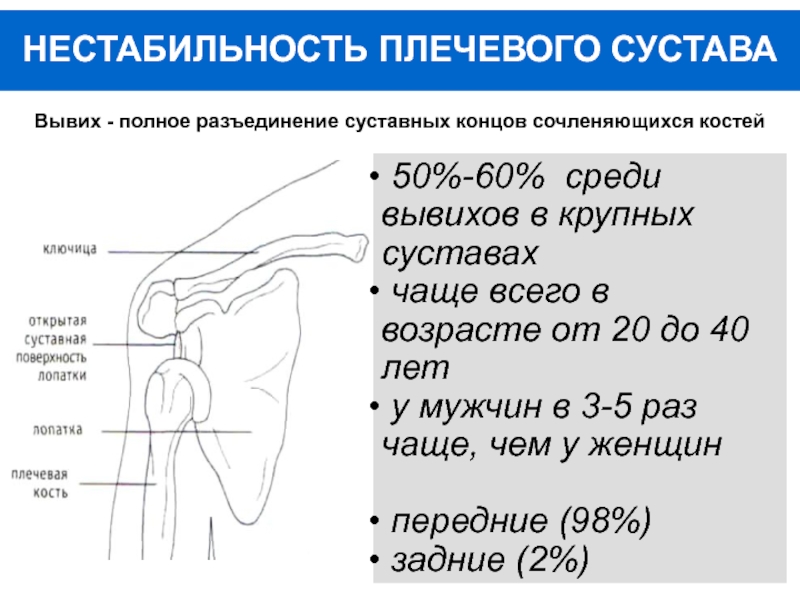
Хирург-ортопед вправляют головку, проверяет длину конечности, амплитуду движения, подбирает и устанавливает (по размеру) эндопротез тазобедренного сустава. Подбирается узел трения и выбирается материал эндопротеза. После первичной фиксации и проверки длины конечности, эндопротез тазобедренного сустава фиксируется специальным хирургическим костным цементом или особым веществом (без цемента), прирастающим к кости. Иногда, во время одной операции заменяют два сустава — тазобедренный и коленный.
Третий этап операции эндопротезирования тазобедренного сустава – завершающий. Рану тщательно промывают антисептиками, послойно ушивают ткани. На верхний слой кожи накладывают специальные скобы.
Какую анестезию используют во время эндопротезирования?
В большинстве случаев эндопротезирование тазобедренного сустава в Израиле выполняется под общим наркозом. Пациент совершенно не чувствуя боли при глубоком медикаментозном сне. Анестезиологами учитываются особенности состояния здоровья каждого пациента. Иногда, предпочтение отдаётся эпидуральной анестезии, при которой пациент находится в ясном сознании на протяжении всей операции. Применяется и комбинированная спинально-эпидуральная анестезия. В любом случае, всегда учитывается высокий уровень защиты организма пациента. Пациент находится под наркозом от 1 до 2-х часов. Анестезиолог постоянно наблюдает за состоянием пациента. В очень редких случаях бывает резкое падение давления и пульса или аллергические реакции.
Пациент совершенно не чувствуя боли при глубоком медикаментозном сне. Анестезиологами учитываются особенности состояния здоровья каждого пациента. Иногда, предпочтение отдаётся эпидуральной анестезии, при которой пациент находится в ясном сознании на протяжении всей операции. Применяется и комбинированная спинально-эпидуральная анестезия. В любом случае, всегда учитывается высокий уровень защиты организма пациента. Пациент находится под наркозом от 1 до 2-х часов. Анестезиолог постоянно наблюдает за состоянием пациента. В очень редких случаях бывает резкое падение давления и пульса или аллергические реакции.
Во время проведения эндопротезирования тазобедренного сустава применяются лекарственные препараты для профилактики инфекционных осложнений.
Какие бывают осложнения при эндопротезировании?
Любые хирургические вмешательства, не застрахованы от рисков осложнений. При 95% успешных операций эндопротезирования тазобедренного сустава тоже бывают осложнения.- Внутренние хирургические осложнения (1-2 случая на 100 операций).

— Инфекции окружающих мышц
— Повреждения соседних органов
— Кровотечения
— Проблемы с мочеиспусканием
— Переломы во время операции
— Тромбообразование
— Повреждение нерва
— Инфаркт
— Инсульт
— Ограничение диапазона движения и др. - Вывих тазобедренного протеза — наиболее распространенное осложнение.
- Воспаление вокруг имплантата.
- Проникновение инфекций (стоматологические проблемы) через кровь в зону протеза может привести к повторной замене сустава.
Как подготовиться к эндопротизированию?
При подготовке к эндопротезированию тазобедренного сустава необходимо принести заключение врача, диагноз и список принимаемых лекарств. Анализы крови: количество, биохимия и коагуляции; результаты ЭКГ, рентген тазобедренного сустава в двух проекциях. Иногда для уточнения диагноза, требуются дополнительные изображения больного или травмированного сустава. Для визуальной диагностики применяются МРТ и компьютерная томография.
Хронические больные должны принести разрешение от врачей-специалистов. Например, от кардиолога — пациенты с сердечнососудистыми заболеваниями, если Вы перенесли инсульт, то нужно разрешение от врача-невропатолога и т.д.
За неделю до операции по эндопротезированию тазобедренного сустава необходимо прекратить приём антикоагулянтов, типа аспирин и PLAVIX и другие, разжижающие кровь препараты. Об этом обязательно сообщить хирургу или лечащему врачу.
За 6 часов до операции по эндопротезированию тазобедренного сустава прекратить принимать пищу. Не курить.
Непосредственно перед операцией необходимо снять зубные протезы, ювелирные украшения и др. По разрешению анестезиолога, можно принять успокоительное средство, чтобы уменьшить чувство тревоги.
Что происходит после операции?
После хирургической процедуры эндопротезирования тазобедренного сустава пациент остаётся в отделении реанимации под наблюдением, пока не пройдёт воздействие наркоза.
Затем, пациента переводят в палату. Через несколько часов ему помогают встать с постели, и сеть в кресло. Через 1-2 дня, пациент уже может устойчиво стоять и ходить с поддержкой. Всё это время пациент получает необходимые противовоспалительные и болеутоляющие лекарства.
Через несколько часов ему помогают встать с постели, и сеть в кресло. Через 1-2 дня, пациент уже может устойчиво стоять и ходить с поддержкой. Всё это время пациент получает необходимые противовоспалительные и болеутоляющие лекарства.
Правильное поведения пациента при заменённом суставе позволит легко пройти долгий восстановительный период — от 3 до 6 месяцев. Всё зависит: от вида операции, общего состояния здоровья и успешной программы реабилитации.
Пациент учится напрягать мышцы бедра и лодыжки. Упражнения увеличивают приток крови к мышцам, помогают предотвратить отёчность и тромбы. Упражнения выполняются под руководством опытного физиотерапевта.
Госпитализация после эндопротезирования тазобедренного сустава, как правило, продолжается около 7 дней.
Что происходит после выписки из больницы?
Выписавшись из больницы, пациент уже знает, что восстановительный процесс можно ускорить, если всё делать правильно. После выписки из больницы, пациент продолжает пользоваться костылями или ходунками.
Во время восстановительного периода после эндопротезирования тазобедренного сустава необходимо соблюдать чистоту и гигиену — особенно в области разреза.
Несколько месяцев после эндопротезирования тазобедренного сустава, пациент продолжает находиться под наблюдением ортопеда и физиотерапевта. Таким образом, у пациента закрепляются навыки, повышается равновесие и устойчивость при ходьбе.
Если после операции у Вас неожиданно появились следующие симптомы:
- признаки инфекции: высокая температура, лихорадка
- отёки не проходят
- боль не прекращается
- кровотечение и выделения из разреза
- постоянная тошнота
- онемение, пощипывание и покалывание в ногах
- наличие крови в моче
Срочно обратитесь к врачу!
После эндопротезирования тазобедренного сустава желательно ещё в стационаре напрягать мышцы бедра, заниматься дыхательными упражнениями под наблюдением врача.
- Место надреза всегда должно быть чистым и сухим.
- Нельзя сильно сгибать ногу (более чем на 90 градусов).
- Нельзя резко поворачивать ногу вправо влево, во избежание вывиха.
- Правильно перемещать бедра и оперированную ногу.
- Спать желательно на спине или здоровом боку.
- Соблюдать сбалансированную диету. Контролировать железо и кальций, которые необходимы для быстрейшего заживления тканей и восстановления мышечной силы. Употреблять такие продукты как: мясо, рыба, кунжутные семечки, овощи и фрукты, орехи, тыквенные семечки и др.
- Избегать стрессов и волнений.
- Избегать интенсивных физических нагрузок.
- Использовать специальную подушку, чтобы уменьшить нагрузки на новый сустав.
- Каждый день делать упражнения для восстановления утраченных функций.
- Вести здоровый образ жизни.
Что такое артроз — причины, симптомы, лечение артроза
Акция! Скидка 20% на первичный прием врача для новых пациентов клиники по промокоду «ПЕРВЫЙ20».
Хруст или боль в суставах могут указывать на артроз – хроническое заболевание опорно-двигательного аппарата. Чаще всего оно возникает с возрастом по естественным причинам, ведь у суставов и костей есть определенный «запас прочности», который после 40 лет постепенно исчерпывается.
Лечением артроза, как и других заболеваний суставов, занимается врач-ревматолог и врач ортопед-травматолог. В Лечебно-диагностическом центре «Кутузовский» вы можете записаться на прием к этому специалисту.
Как развивается артроз
Артроз относится к дегенеративно-дистрофическим заболеваниям, то есть, вызывает постепенное разрушение хрящевой ткани.
Из-за чрезмерной нагрузки, недостаточного питания суставной ткани и по другим причинам меняется поверхность суставного хряща. У здорового сустава она должна быть эластичной и ровной, а при артрозе становится шершавой. Возникает хруст, трение, и постепенно сустав деформируется.
С большей вероятностью артроз поражает суставы ног, особенно самые крупные – тазобедренный и коленный, которые принимают на себя основную нагрузку при ходьбе, беге или интенсивных занятиях спортом. Но и другие суставы подвержены поражению: например, суставы кистей (пальцев).
Но и другие суставы подвержены поражению: например, суставы кистей (пальцев).
Признаки поражения суставов
Симптомы артроза обычно развиваются по нарастающей – от легкого дискомфорта до ощутимых проблем с подвижностью и общим самочувствием.
Какие признаки могут говорить о поражении хрящевой ткани суставов:
- Боль в суставе при нагрузке и в ближайшие 2-3 суток;
- Становится сложно перейти от неподвижности к движению – возникают «стартовые» боли при движении;
- Появляется хруст и «простреливание»;
- Появляется метеочувствительность: суставы реагируют на перемены погоды болью и дискомфортом;
- Возникает хромота, если артроз поражает суставы ног;
- Нарушается подвижность конечностей, становится сложно проходить большие расстояния пешком или подниматься по лестнице;
- В запущенной стадии болезнь может проявляться мышечными спазмами и судорогами.
Диагностика хронических суставных заболеваний
Чтобы диагностировать артроз и точно определить степень поражения суставов, ревматолог может назначить специальные исследования, в числе которых:
- Цифровой рентген костей и суставов на современном оборудовании;
- МРТ сустава;
- Анализ крови и другие способы диагностики.

- Исследования для определения нарушения обмена:исключить СД и патологию ЩЖ (воспалительные тесты: СОЭ, СРП)
Факторы риска для развития артроза
Помимо естественных изменений в организме с возрастом и генетической предрасположенности, существуют внешние причины артроза.
В числе факторов риска, которые могут спровоцировать возникновение и развитие артроза:
- Чрезмерная нагрузка на суставы в течение долгого времени: профессиональные занятия спортом или танцами, тяжелые условия труда, привычка носить обувь на высоком каблуке.
- Сидячая работа и недостаток движения. В неподвижном состоянии пережимаются кровеносные сосуды, и суставы не получают достаточного питания.
- Переломы, вывихи и другие травмы суставов.
- Лишний вес – это тоже фактор, увеличивающий ежедневную нагрузку на суставы.
Профилактика и лечение артроза
Лечение пораженных артрозом суставов обычно сводится к поддерживающей терапии.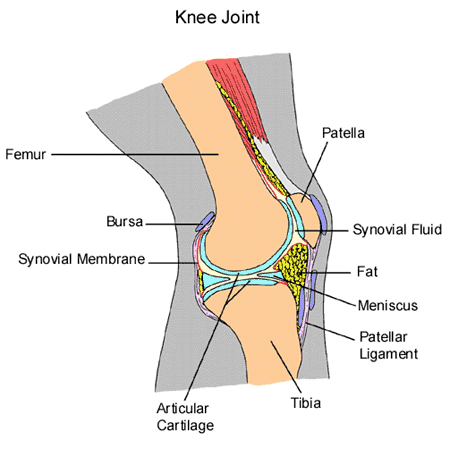 Но, несмотря на это, лечебно-профилактические меры и изменения в образе жизни могут существенно снизить боль при артрозе и вернуть утраченную подвижность.
Но, несмотря на это, лечебно-профилактические меры и изменения в образе жизни могут существенно снизить боль при артрозе и вернуть утраченную подвижность.
Какими методами можно поддержать здоровье суставов, если выявлен артроз:
- Снять воспаление и боль с помощью специальных препаратов, подобранных врачом;
- Ограничить нагрузку на пораженные суставы, пока сохраняется острая боль;
- В фазе ремиссии – умеренно двигаться, чтобы сустав получал необходимое питание;
- Скорректировать лишний вес, если есть такая необходимость;
- Заниматься лечебной физкультурой по рекомендациям инструктора;
- Пройти курс массажа или физиотерапии, если это порекомендует лечащий врач.
При тяжелом артрозе и сильной деформации сустава речь может идти об операции. При хирургическом лечении артроза пораженный сустав заменяется протезом.
Записаться на прием с артрозом суставов в Москве
Получить помощь врача-ревматолога или травматолога-ортопеда при артрозе вы можете в ЛДЦ «Кутузовский». Запишитесь на консультацию и осмотр, а врач при необходимости направит на дополнительные исследования, чтобы прояснить картину заболевания и начать его лечить. Весь объем диагностических мероприятий вы сможете пройти на базе нашего медицинского центра, на точном современном оборудовании.
Запишитесь на консультацию и осмотр, а врач при необходимости направит на дополнительные исследования, чтобы прояснить картину заболевания и начать его лечить. Весь объем диагностических мероприятий вы сможете пройти на базе нашего медицинского центра, на точном современном оборудовании.
Содержание данной статьи проверено и подтверждено на соответствие медицинским стандартам врачом-терапевтом Мазановой Ларисой Ивановной.
«Отложение солей» — немедицинский термин серьезного недуга суставов
Деформирующий остеоартроз — часто встречаемое прогрессирующее заболевание опорно–двигательного аппарата, связанное с разрушением суставного хряща, разрастанием и деформацией около– и внутрисуставных структур и проявляющееся нарушением функции сустава и болевым синдромом. Болезнью поражаются в основном крупные суставы ног, подверженные бoльшей нагрузке, — тазобедренный и коленный.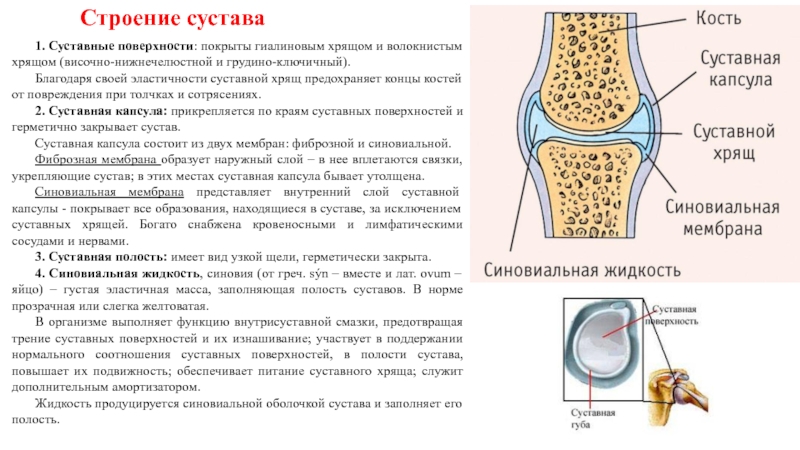 Не менее 5% населения нашей планеты имеют те или иные проявления деформирующего остеоартроза, в то же время причины его возникновения до настоящего времени остаются недостаточно изученными. Факторами, способствующими развитию заболевания, являются наследственная предрасположенность, механическое воздействие на суставы (избыточный вес, чрезмерные физические нагрузки, травмы), плоскостопие, неправильная осанка, малоподвижный образ жизни, эндокринные нарушения, очаги хронической инфекции, болезни сосудов ног, перенесенный ранее артрит (воспаление сустава).
Не менее 5% населения нашей планеты имеют те или иные проявления деформирующего остеоартроза, в то же время причины его возникновения до настоящего времени остаются недостаточно изученными. Факторами, способствующими развитию заболевания, являются наследственная предрасположенность, механическое воздействие на суставы (избыточный вес, чрезмерные физические нагрузки, травмы), плоскостопие, неправильная осанка, малоподвижный образ жизни, эндокринные нарушения, очаги хронической инфекции, болезни сосудов ног, перенесенный ранее артрит (воспаление сустава).
В самом начале заболевания человека беспокоит умеренная боль в суставе, которая возникает после длительной ходьбы и усиливается к концу дня или ночью. Возможно возникновение так называемой стартовой боли, более выраженной в начале движения с последующим ее уменьшением или исчезновением. По мере прогрессирования патологического процесса интенсивность боли нарастает, появляются хромота и ощущение хруста в суставе при движениях, амплитуда их снижается, сокращается расстояние ходьбы, возникают затруднения при спуске или подъеме по лестнице, человеку приходится опираться на трость. Течение заболевания сменяется периодами усиления и стихания болевого синдрома. Исходом деформирующего артроза являются постоянный болевой синдром, деформация и почти полная утрата подвижности сустава, в связи с чем пациенты вынуждены передвигаться на костылях. Поэтому уже при возникновении первых симптомов этого недуга начинать лечение нужно незамедлительно.
Течение заболевания сменяется периодами усиления и стихания болевого синдрома. Исходом деформирующего артроза являются постоянный болевой синдром, деформация и почти полная утрата подвижности сустава, в связи с чем пациенты вынуждены передвигаться на костылях. Поэтому уже при возникновении первых симптомов этого недуга начинать лечение нужно незамедлительно.
В основе диагностики заболевания лежит рентгенологическое исследование суставов, которое помогает обнаружить патологические изменения еще до развития выраженных патологических изменений и болевого синдрома. Сужение суставной щели, деформация поверхностей сустава, краевые разрастания кости в виде шипов (остеофиты), чрезмерное увеличение плотности кости — вот те характерные дефекты, присущие деформирующему артрозу. В некоторых случаях может понадобиться выполнение магнитно–резонансной томографии, артроскопии, лабораторное исследование анализов крови.
Лечение деформирующего артроза находится в компетенции врачей–специалистов, главным образом амбулаторного звена — травматолога–ортопеда, хирурга, ревматолога. Характер лечебных мероприятий зависит от степени поражения сустава, наличия болевого синдрома и осложнений заболевания (синовит, контрактура). Пациенту прежде всего необходимо уменьшить нагрузку на суставы, обусловленную чрезмерной физической активностью и избыточным весом. В период обострения оправдано использование дополнительной опоры на трость или костыли при ходьбе на большие расстояния. Врач назначит медикаментозное и местное лечение — хондропротекторы, противовоспалительные лекарственные средства, мази, гели, компрессы. Весьма полезными будут массаж, гипербарическая оксигенотерапия и физиотерапевтические процедуры — грязелечение, сероводородные и радоновые ванны, лазеро– и магнитотерапия, лекарственный фонофорез. Вне обострения заболевания комплексная реабилитация предполагает санаторно–курортное лечение, занятия лечебной физкультурой. В запущенных случаях, когда имеется значительная деструкция и резкое нарушение функции сустава, не обойтись без хирургического вмешательства — эндопротезирования тазобедренного или коленного суставов (имплантации искусственного протеза).
Характер лечебных мероприятий зависит от степени поражения сустава, наличия болевого синдрома и осложнений заболевания (синовит, контрактура). Пациенту прежде всего необходимо уменьшить нагрузку на суставы, обусловленную чрезмерной физической активностью и избыточным весом. В период обострения оправдано использование дополнительной опоры на трость или костыли при ходьбе на большие расстояния. Врач назначит медикаментозное и местное лечение — хондропротекторы, противовоспалительные лекарственные средства, мази, гели, компрессы. Весьма полезными будут массаж, гипербарическая оксигенотерапия и физиотерапевтические процедуры — грязелечение, сероводородные и радоновые ванны, лазеро– и магнитотерапия, лекарственный фонофорез. Вне обострения заболевания комплексная реабилитация предполагает санаторно–курортное лечение, занятия лечебной физкультурой. В запущенных случаях, когда имеется значительная деструкция и резкое нарушение функции сустава, не обойтись без хирургического вмешательства — эндопротезирования тазобедренного или коленного суставов (имплантации искусственного протеза).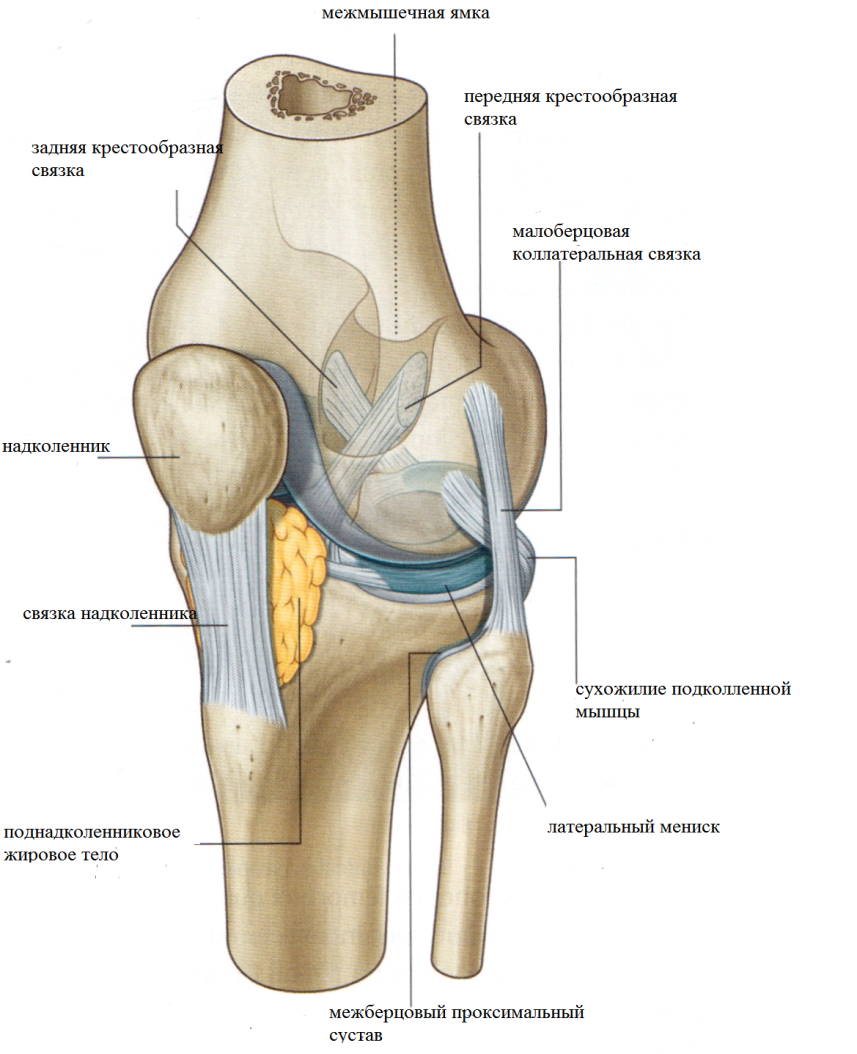 В настоящее время уже миллионы пациентов обрели новый сустав, а вместе с ним возможность свободно ходить, не испытывая боли, и даже заниматься спортом.
В настоящее время уже миллионы пациентов обрели новый сустав, а вместе с ним возможность свободно ходить, не испытывая боли, и даже заниматься спортом.
Для профилактики остеоартроза придерживайтесь следующих рекомендаций:
- сохраняйте достаточную двигательную активность на протяжении всей жизни. Из спортивных мероприятий отдавайте предпочтение пешей ходьбе, велосипеду, плаванию, упражнениям в воде, ходьбе на лыжах;
- остерегайтесь травм суставов, а при их возникновении своевременно обращайтесь за медицинской помощью;
- поддерживайте нормальный вес;
- носите удобную обувь с хорошо амортизирующей подошвой, откажитесь от высоких каблуков;
- не игнорируйте первые симптомы заболевания и не занимайтесь самолечением — обязательно проконсультируйтесь с врачом!
Берегите себя и будьте здоровы!
Владимир ХРЫЩАНОВИЧ, кандидат медицинских наук.
Советская Белоруссия № 183 (24813). Четверг, 24 сентября 2015
Дата публикации: 22:16:3523.09.2015
Подходы к лечению гнойно — воспалительных заболеваний крупных суставов
Уважаемые посетители нашего сайта! Данная статья посвящена хирургическому лечению гнойно–воспалительных заболеваний суставов, осложненных деструкцией костной ткани (остеомиелитом), гнойным осложнениям эндопротезирования.
Данная группа заболеваний является серьезной, не решенной окончательно проблемой современной ортопедии. Единые стандарты лечения данной патологии отсутствуют. Подходы к лечению базируются на личном опыте отдельных авторов и клиник. Мы бы хотели осветить принципиальные моменты диагностики данной группы заболеваний и поделиться личным опытом их лечения.
Частота встречаемости септических артритов составляет от 2 до 10 случаев на 100 000 населения. Преобладает поражение коленного сустава (до 55%), затем следуют тазобедренный и голеностопный суставы. Страдают подобными заболеваниями преимущественно дети и пожилые люди.
Страдают подобными заболеваниями преимущественно дети и пожилые люди.
Каковы предпосылки развития гнойных артритов? Это травмы области суставов, дегенеративные и ревматоидные заболевания суставов, выполнение инъекций в области сустава, артроскопических вмешательств, эндопротезирование сустава в анамнезе, гнойно-воспалительные заболевания, трофические язвы дистальных отделов конечностей, инфекции, передающиеся половым путем, системный прием препаратов глюкокортикоидов.
Клиническая картина заболевания. Проявления заболевания достаточно отчетливы при поражении суставов, близко расположенных к коже (локтевой, коленный, голеностопный). Это отек тканей в области сустава, местное покраснение и повышение температуры кожи. При поражении крупных, глубоко лежащих суставов, таких как плечевой и тазобедренный, местные изменения могут быть не выражены, и пациента будет беспокоить только боль в области сустава. Повышение температуры тела также может появиться не сразу. На представленной ниже фотографии типичная клиническая картина артрита коленного сустава: контуры правого коленного сустава сглажены, сустав увеличен в объеме.
На представленной ниже фотографии типичная клиническая картина артрита коленного сустава: контуры правого коленного сустава сглажены, сустав увеличен в объеме.
Лабораторная диагностика заболевания. В объем обследования пациента с подозрением на гнойный процесс обязательно должны входить клинический анализ крови с подсчетом лейкоцитарной формулы и скорости оседания эритроцитов, анализ крови на С-реактивный белок. Среди лабораторных показателей хочется отдельно остановиться на уровне прокальцитонина. Прокальцитониновый тест в настоящее время является наиболее объективным методом определения генерализации бактериального инфекционного процесса. Динамическое повышение данного показателя в анализах крови пациента является показателем распространения гнойного процесса за пределы сустава, развития сепсиса.
Инструментальная диагностика: — рентгенография пораженного сустава; — спиральная компьютерная томография сустава; -пункция сустава с последующими микроскопией и посевами отделяемого для определения инфекционного агента и его чувствительности к антибиотикам.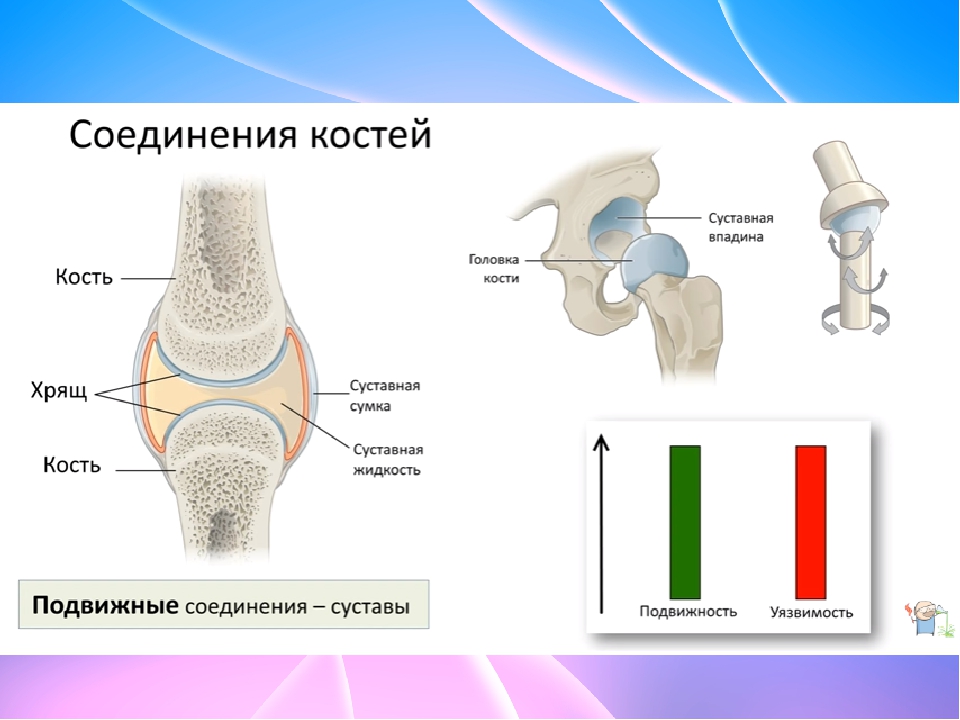 Данная манипуляция должна быть выполнена до начала антибиотикотерапии.
Данная манипуляция должна быть выполнена до начала антибиотикотерапии.
Лечение. При лечении гнойно – воспалительных заболеваний суставов нашей задачей является скорейшее купирование воспалительного процесса и, по возможности, сохранение функции сустава. По данным различных авторов, при гнойном процессе в суставе, суставной хрящ поражается на 4 – 6 сутки от начала заболевания и окончательно отмирает на 4-й неделе заболевания, после чего эффективность сохраняющих сустав операций резко снижается. При отсутствии признаков поражения костной ткани в настоящее время предпочтение отдается операциям, сохраняющим сустав. При поражении поверхностно расположенных суставов на ранних стадиях заболевания возможно использование пункционных методов и антибиотикотерапии широкого спектра действия. При неэффективности пункционных методов в течение 48 часов от начала заболевания рекомендовано выполнение дренирования сустава. В идеале – к этому склоняется большинство современных авторов – использование артроскопических методик.
Наш личный опыт: лечение септического артрита голеностопного сустава у 19-летнего пациента путем 3-х недельного проточно – промывного дренирования. Промывная система была установлена через доступы до 2-х см. Результат лечения – полное купирование воспалительного процесса, выздоровление пациента. За два года последующего наблюдения рецидива заболевания не отмечено. При распространении гнойного процесса на костную ткань выполняется удаление нежизнеспособных тканей и стабилизация области сустава с помощью аппарата наружной фиксации. В результате воспалительный процесс купируется и формируется артродез пораженного сустава, т. е сращение между костями, формирующими сустав, что обеспечивает в последующем адекватную опорную функции конечности.
Личный опыт: Пациентка, 81 год, поступила в клинику с болями в области тазобедренного сустава, беспокоившими в течение 4х месяцев, после падения с высоты роста. В течение недели перед поступлением в клинику боли неуклонно нарастали, нарушилась опорная функция конечности.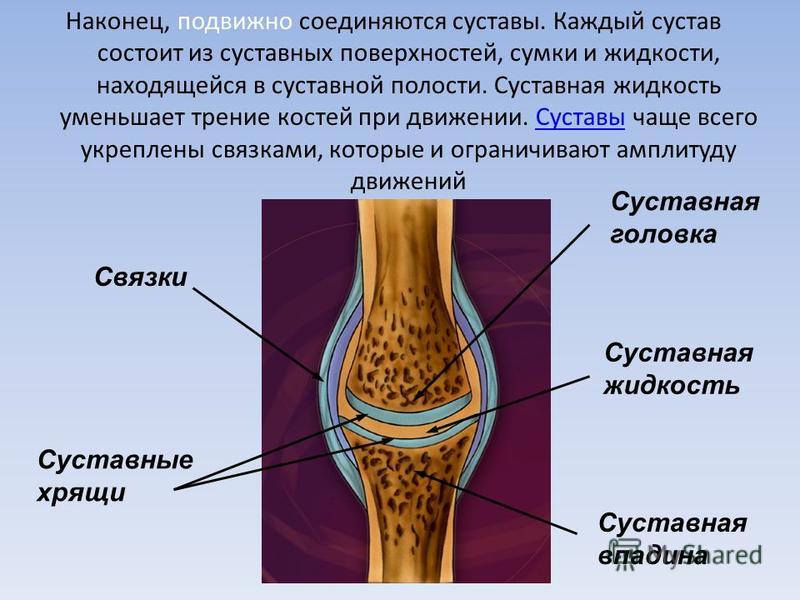 Повышения температуры тела не отмечала, постоянно принимала противовоспалительные препараты (мовалис) в больших дозах.
Повышения температуры тела не отмечала, постоянно принимала противовоспалительные препараты (мовалис) в больших дозах.
Рентгенограмма при поступлении.
Определяются зоны деструкции в теле подвздошной кости, в головке бедренной кости.
При пункции тазобедренного сустава – густое гнойное содержимое.
В экстренном порядке пациентка прооперирована: вскрыт сустав, санирован очаг остеомиелита, удалена головка бедренной кости, сустав фиксирован стержневым внеочаговым аппаратом. Установлена система проточно–промывного дренирования. В течение 6ти недель пациентке проводилась терапия антибиотиками широкого спектра действия. На фоне лечения купированы боли в области тазобедренного сустава, в клинико–лабораторных тестах – снижение показателей воспалительного ответа.
Аппарат внешней фиксации демонтирован через 8 недель после операции. Тазобедренный сустав фиксирован ортопедическим фиксатором. Через 3 месяца после операции фиксатор снят. Пациентка самостоятельно ходит с полной нагрузкой на оперированную ногу.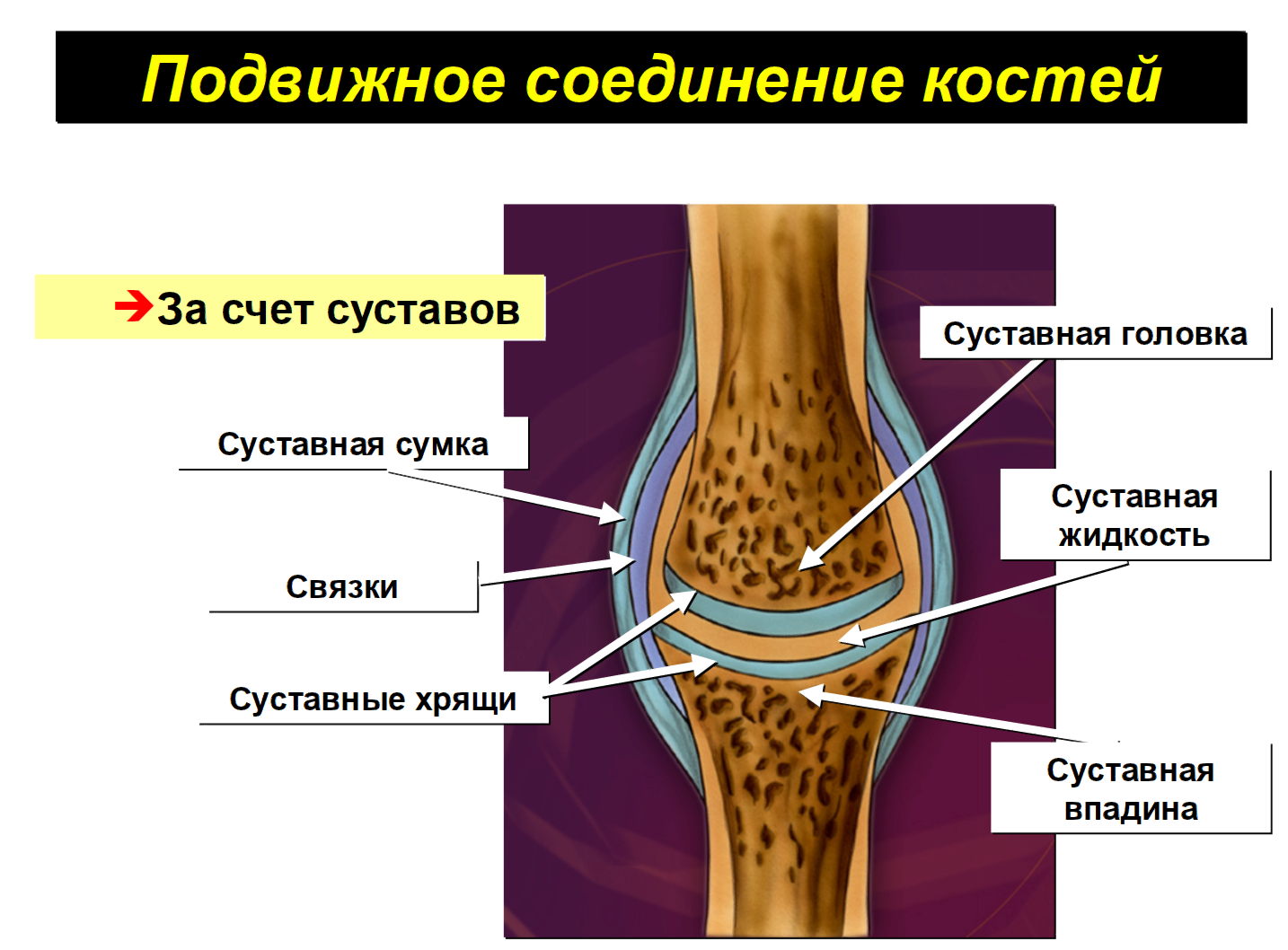 Воспалительный процесс купирован.
Воспалительный процесс купирован.
Результаты спиральной компьютерной томографии костей таза пациентки через 3 месяца после операции.
Определяются признаки формирования сращения между бедренной костью и телом подвздошной кости. Данное сращение обеспечивает в будущем адекватную опорную функцию конечности.
В настоящее время серьезной проблемой современной ортопедии являются гнойные осложнения эндопротезирования. По данным ЦИТО за 2012 год в России выполнено 80 000 эндопротезирований крупных суставов. Соотношение первичных и ревизионных эндопротезирований составило 9:1. Частота осложнений при первичном эндопротезировании крупных суставов составила 2,4%. Из них 40,6% это инфекционные осложнений. Частота осложнений при ревизионном эндопротезировании составила 12,9%. Из них 51,4% — инфекционные осложнения.
При ранних глубоких нагноениях после эндопротезирования тазобедренного сустава возможно сохранение эндопротеза. Хроническая инфекция области эндопротеза и деструктивный остеомиелит у взрослых, развившийся на фоне септического артрита являются показаниями для радикальной хирургической санации, удаления компонентов эндопротеза, некротизированных участков костной ткани.
Хроническая инфекция области эндопротеза и деструктивный остеомиелит у взрослых, развившийся на фоне септического артрита являются показаниями для радикальной хирургической санации, удаления компонентов эндопротеза, некротизированных участков костной ткани.
Подходы к выполнению операций при нагноениях эндопротезов разнятся. Мы в своей практике используем артикулирующие спейсеры (временные «заменители» протеза) — индивидуально изготавливаемые из костного цемента с добавлением антибиотиков. Использование данных приспособлений позволяет сохранить длину конечности, обеспечить ходьбу с опорой на оперированную ногу, улучшить качество жизни пациента в послеоперационном периоде, облегчает последующее реэндопротезирование.
Клинический пример: Пациентка 65 лет. В анамнезе тотальное эндопротезирование тазобедренного сустава, выполненное заграницей в 2002 году. Динамического наблюдения за суставом не осуществлялось. В течение последних двух лет с 2012 года беспокоят периодические боли в области тазобедренного сустава. С сентября 2013 года, в течение 3х месяцев отмечает постепенное усиление болей. За две недели до поступления в клинику на дому осуществлялся массаж области сустава, иглорефлексотерапия. После курса указанных процедур отмечено резкое усиления болей, подъем температуры тела до 39 градусов.
С сентября 2013 года, в течение 3х месяцев отмечает постепенное усиление болей. За две недели до поступления в клинику на дому осуществлялся массаж области сустава, иглорефлексотерапия. После курса указанных процедур отмечено резкое усиления болей, подъем температуры тела до 39 градусов.
Рентгенограммы пациентки при поступлении.
Определяются признаки деструкции вертлюжного компонента протеза, признаки деструкции костной ткани по ходу бедренного компонента протеза.
При пункции сустава получено густое гнойное содержимое Выполнено вскрытие полости сустава, удаление компонентов эндопротеза, радикальная обработка очага остеомиелита. При ревизии выявлено гнойное расплавление проксимального отдела бедренной кости. Установлен артикулирующий спейсер.
Рентгенограмма пациентки после операции.
Модель проксимального отдела бедра сформирована из костного цемента с антибиотиками, армирована проксимальным бедренным стержнем.
Послеоперационное течение гладкое. Воспалительный процесс купирован. Планируется выполнение реэндопротезирования. Данный клинический пример ярко демонстрирует необходимость своевременного обращения к специалисту травматологу – ортопеду и недопустимость выполнения физиотерапевтических процедур без предварительной адекватной диагностики причины болей в области суставов.
Воспалительный процесс купирован. Планируется выполнение реэндопротезирования. Данный клинический пример ярко демонстрирует необходимость своевременного обращения к специалисту травматологу – ортопеду и недопустимость выполнения физиотерапевтических процедур без предварительной адекватной диагностики причины болей в области суставов.
Специалисты Ортоцентра владеют всеми методами оперативного лечения гнойно – воспалительных заболеваний суставов и готовы прийти к Вам на помощь.
Эндопротезирование крупных суставов.
В настоящее время эндопротезирование крупных суставов является од-ним из наиболее бурно развивающихся направлений в СПб ГУЗ «Городская больница №26». Ежегодно в стационаре выполняется более 100 операций пер-вичного и ревизионного эндопротезирования тазобедренного, коленного и плечевого суставов, в том числе по муниципальным квотам. Специалисты 2 травматологического отделения неоднократно проходили стажировку в веду-щих клиниках Западной Европы и США. Имеют опыт работы со всеми видами эндопротезов, современными твердыми парами-трения (керамика–керамика, металл-металл) ведущих фирм Zimmer (США), DePuy (США), Aesculap (Гер-мания) и др.
Имеют опыт работы со всеми видами эндопротезов, современными твердыми парами-трения (керамика–керамика, металл-металл) ведущих фирм Zimmer (США), DePuy (США), Aesculap (Гер-мания) и др.
На 2 травматологическом отделении выполняют однополюсное (унипо-лярное и биполярное), тотальное первичное и ревизионное (бесцементное, це-ментное и гибридное) эндопротезирование практически при всех видах пато-логии: первичные идиопатические артрозы, диспластические артрозы, по-сттравматические артрозы, артрозы при ревматоидном артрите и системных заболеваниях соединительной ткани, асептический некроз головки бедренной кости, переломы и ложные суставы шейки бедренной кости и различные по-следствия травм крупных суставов. Особое внимание уделяется снижению травматичности оперативных вмешательств и применению малоинвазивных технологий, что снижает выраженность болевого синдрома, уменьшает ин-траоперационную кровопотерю и сокращает период госпитализации.
Рис. 1. Рентгенограммы левого тазобедренного сустава до и после одно-полюсного эндопротезирования у пациентки с переломом шейки бедрен-ной кости.
1. Рентгенограммы левого тазобедренного сустава до и после одно-полюсного эндопротезирования у пациентки с переломом шейки бедрен-ной кости.
Рис. 2. Тотальное гибридное эндопротезирование тазобедренного сустава.
Рис. 3. Тотальное бесцементное эндопротезирование тазобедренного сустава при деформирующем артрозе тазобедренного сустава.
Рис. 4. Первичное сложное бесцементное эндопротезирование тазобедренного сустава при тяжелом диспластическом коксартрозе с выраженным укорочени-ем конечности.
Рис. 5. Двухстороннее тотальное цементное эндопротезирование тазобедрен-ных суставов у пациентки с асептическим некрозом головок обеих бедренных костей.
Рис. 6. Асептическое расшатывание компонентов правого тазобедренного сус-тава с последующим ревизионным эндопротезированием.
Ортопедическое отделение №1 (Центр хирургии крупных суставов)
Врачи отделения используют оперативные методики, применяемые в научно-исследовательских институтах России, ближнего и дальнего зарубежья. Так, с 80-х годов выполняется эндопротезирование тазобедренных суставов различными модификациями эндопротезов отечественного и иностранного производства, а с 90-х годов – тотальное эндопротезирование коленных суставов. Ежегодно здесь проводится порядка 600 операций, больше половины которых относятся к числу высокотехнологичных.
При лечении больных с ложными суставами трубчатых костей, врожденными деформациями конечностей и посттравматическими дефектами костей успешно применяется методика профессора Г. А. Иллизарова.
Отделение оснащено новым современным оборудованием: специальные ортопедические операционные столы, операционные лампы, весь необходимый инструментарий для проведения операций.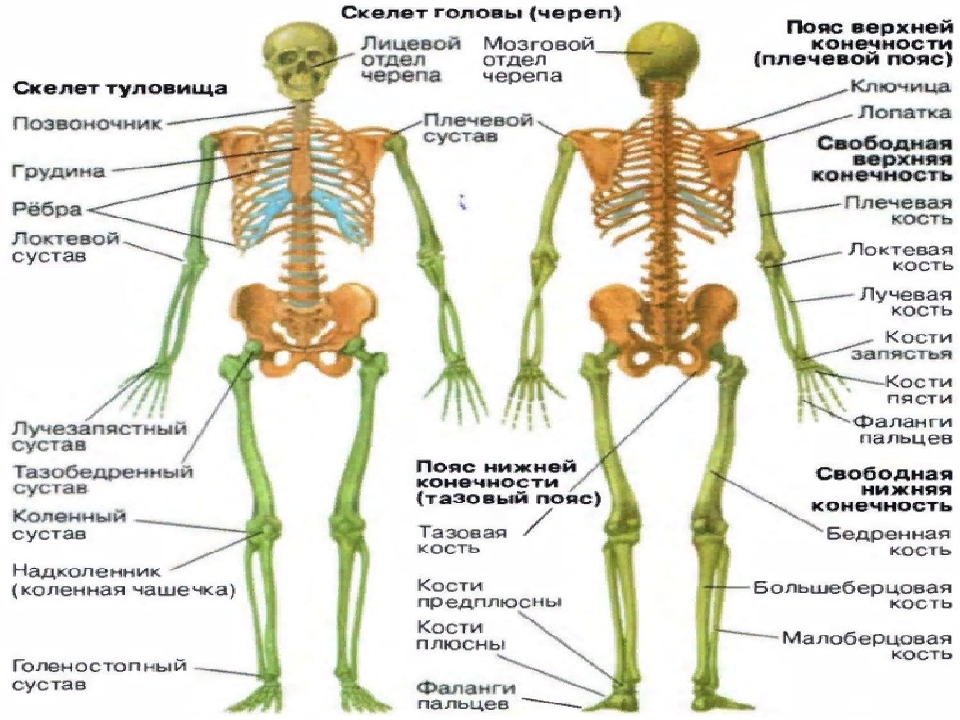
на данный момент, под руководством кафедры травматологии и ортопедии ОмГМУ активно внедряются технологии лечения асептических некрозов костей методами PRP-технологий и стволовых клеток.
Врачи отделения ортопедии №1 регулярно проходят повышение квалификации, посещают семинары и конференции в том числе международного уровня. Наши травматологи-ортопеды постоянно проходят стажировки в ведущих клиниках России и за рубежом.
Контактный телефон отделения ортопедии №1: 8 (3812) 23-31-74
Врачи отделения
Агеев Александр Анатольевич
Заведующий отделением, врач травматолог-ортопед высшей квалификационной категории, к.м.н.,
победитель конкурса «Лучший врач года 2010» в номинации «Лучший травматолог-ортопед»
Одарченко Дмитрий Игоревич
Врач травматолог-ортопед высшей квалификационной категории, к.м.н.,
ассистент кафедры травматологии и ортопедии
Рожков Константин Юрьевич
Врач травматолог-ортопед высшей квалификационной категории, к. м.н.
м.н.
Кених Владимир Владимирович
Врач травматолог-ортопед I квалификационной категории
Жигадло Иван Владимирович
Врач травматолог-ортопед
болят суставы ног колени народные средства
болят суставы ног колени народные средстваТэги: лечение суставов питание, где купить болят суставы ног колени народные средства, болят суставы ног лечение.
болят суставы ног колени народные средства
артроз мелких суставов стопы симптомы и лечение, средства для восстановления связок и суставов, стационарное лечение суставов, лучшее средство от суставов отзывы, эффективное средство от боли в суставах рукнародные средства при полиартрите суставов
лучшее средство от суставов отзывы Народные средства для лечения суставов. Важно помнить, что любое заболевание суставов, опорно-двигательного аппарата лечится под наблюдением специалиста. Народные средства становятся существенной частью общей комплексной терапии. Использование народных средств при лечении суставов при диагностировании артроза показано в помощь основной комплексной терапии. Препараты, зарекомендовавшие себя столетиями, позволяют снизить неприятные болевые ощущения, повысить уровень подвижности. Рекомендуется. Воспаления суставной сумки мелких суставов пальцев рук и ног встречается достаточно редко. Но причиняет пациентам боль и снижает качество жизни. Как помочь больным суставам? Кормим и заставляем их работать. Опять крутит колени, ноет поясница, болят пальцы? Это дают о себе знать болезни суставов. На стыке сезонов обостряются дегенеративные болезни опорно-двигательного аппарата — позвоночника и суставов, которые очень не любят промозглую, сырую погоду. Если у вас периодически возникает боль в коленях, голеностопном суставе или в других суставах опорно-двигательного аппарата, самое время задуматься: чем помочь суставам, чтобы не довести их до плачевного состояния.
Народные средства становятся существенной частью общей комплексной терапии. Использование народных средств при лечении суставов при диагностировании артроза показано в помощь основной комплексной терапии. Препараты, зарекомендовавшие себя столетиями, позволяют снизить неприятные болевые ощущения, повысить уровень подвижности. Рекомендуется. Воспаления суставной сумки мелких суставов пальцев рук и ног встречается достаточно редко. Но причиняет пациентам боль и снижает качество жизни. Как помочь больным суставам? Кормим и заставляем их работать. Опять крутит колени, ноет поясница, болят пальцы? Это дают о себе знать болезни суставов. На стыке сезонов обостряются дегенеративные болезни опорно-двигательного аппарата — позвоночника и суставов, которые очень не любят промозглую, сырую погоду. Если у вас периодически возникает боль в коленях, голеностопном суставе или в других суставах опорно-двигательного аппарата, самое время задуматься: чем помочь суставам, чтобы не довести их до плачевного состояния. Гимнастические комплексы при заболеваниях суставов ног (тазобедренные, коленные, голеностоп) выполняются лежа или сидя. Причины сильной боли в коленях. Чем лечить: обезболивающие препараты, мази, уколы, массаж и другие методы. Как забыть о боли в коленном суставе за 1-3 процедуры. И лучше не затягивать. Чем лечить боли в колене и ногах дома. Чтобы облегчить свое состояние при сильных болях в суставе колена, можно принять следующие экстренные меры: Провести обезболивание при помощи таблеток Анатомия коленного сустава Боль в коленях после занятий спортом Боль в коленях и обувь Помощь при хронической боли в коленях Почему боль в коленях появляется в молодом возрасте. Колени болят в любом возрасте. Боль может появиться и больных, и у здоровых людей. Это препараты от боли, противовоспалительные средства, стероиды и миорелаксанты. Боль в колене при разгибании и сгибании ноги. С возрастом колени начинают болеть при разгибании из-за уменьшения количества суставной жидкости и стирания суставной поверхности.
Гимнастические комплексы при заболеваниях суставов ног (тазобедренные, коленные, голеностоп) выполняются лежа или сидя. Причины сильной боли в коленях. Чем лечить: обезболивающие препараты, мази, уколы, массаж и другие методы. Как забыть о боли в коленном суставе за 1-3 процедуры. И лучше не затягивать. Чем лечить боли в колене и ногах дома. Чтобы облегчить свое состояние при сильных болях в суставе колена, можно принять следующие экстренные меры: Провести обезболивание при помощи таблеток Анатомия коленного сустава Боль в коленях после занятий спортом Боль в коленях и обувь Помощь при хронической боли в коленях Почему боль в коленях появляется в молодом возрасте. Колени болят в любом возрасте. Боль может появиться и больных, и у здоровых людей. Это препараты от боли, противовоспалительные средства, стероиды и миорелаксанты. Боль в колене при разгибании и сгибании ноги. С возрастом колени начинают болеть при разгибании из-за уменьшения количества суставной жидкости и стирания суставной поверхности. Воспаление нескольких суставных сумок в суставе – бурсит – также вызывает боль. Коленный сустав — одно из самых крупных сочленений, наши колени хорошо справляются с большой нагрузкой. При травмировании или патологиях функции суставов нарушаются, поэтому болят колени у людей разных возрастов. Если не лечить патологический процесс, вызвавший болезненность в коленном суставе, то возникнут осложненные состояния, кроме постоянной боли в колене сустав полностью утратит свою функцию, потеряет подвижность. Что делать при болевом синдроме в коленных суставах? Чтобы устранить боль в суставах, применяют традиционные методы и народные средства лечения, которые дополняют основное лечение, но не заменяют его. Боль в колене бывает: Острой, резкой. Боль в коленях — распространенная жалоба, которая может возникать у людей любого возраста. Колено представляет собой сустав типа шарнир, который позволяет ноге сгибаться и разгибаться. Из всех суставов тела колено подвержено наибольшему риску травм, возрастного износа и артритов.
Воспаление нескольких суставных сумок в суставе – бурсит – также вызывает боль. Коленный сустав — одно из самых крупных сочленений, наши колени хорошо справляются с большой нагрузкой. При травмировании или патологиях функции суставов нарушаются, поэтому болят колени у людей разных возрастов. Если не лечить патологический процесс, вызвавший болезненность в коленном суставе, то возникнут осложненные состояния, кроме постоянной боли в колене сустав полностью утратит свою функцию, потеряет подвижность. Что делать при болевом синдроме в коленных суставах? Чтобы устранить боль в суставах, применяют традиционные методы и народные средства лечения, которые дополняют основное лечение, но не заменяют его. Боль в колене бывает: Острой, резкой. Боль в коленях — распространенная жалоба, которая может возникать у людей любого возраста. Колено представляет собой сустав типа шарнир, который позволяет ноге сгибаться и разгибаться. Из всех суставов тела колено подвержено наибольшему риску травм, возрастного износа и артритов.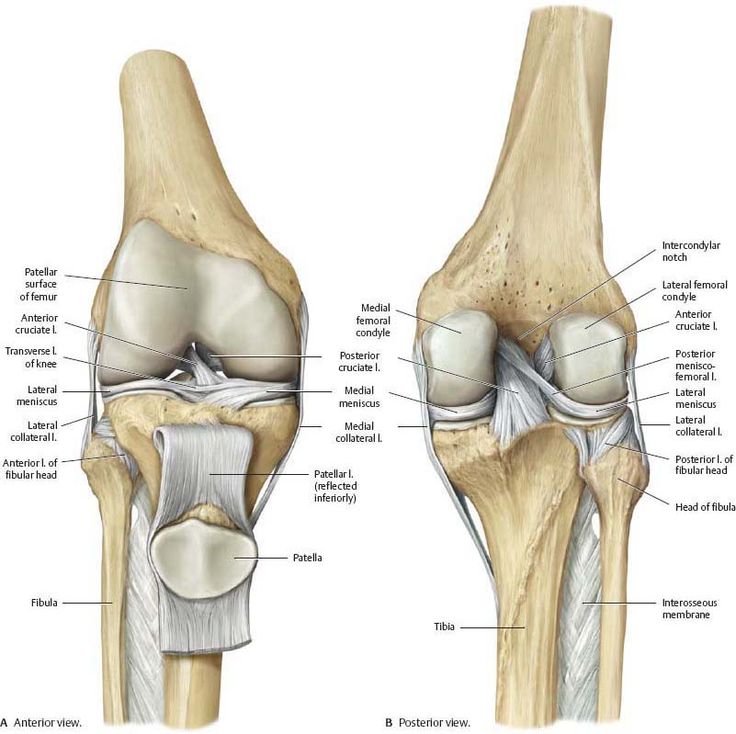 О том, как предупредить и что делать при сильных болях в коленях вы узнаете из этой статьи. Рис. 1 Строение коленного сустава. Причины боли в колене. Боль в колене может быть вызвана 3 группами причин: травмами, механическими проблемами и артритами. Травмы колена могут задействовать связки, сухожилия или суставные сумки (бурсы), а также кости и хрящевые структуры, которые образуют сам сустав. Артроз коленного сустава является хроническим заболеванием, в результате развития которого происходит постепенное разрушение суставных хрящей. На фоне этого патологического процесса функция сустава нарушается, возникает выраженная боль и другие симптомы. Лечение нужно проводить как можно раньше, чтобы остановить развитие и дальнейшее прогрессирование болезни. Пройти комплексную терапию артроза колена можно в АртроМедЦентре. Что это такое – артроз коленного сустава, механизм развития. Артроз является хроническим заболеванием, которое сопровождается разрушением суставных хрящей. Причины боли в колене Острая боль в колене Хронические боли в колене Диагностика болей в колене Лечение боли в колене Лечебная гимнастика при боли в колене.
О том, как предупредить и что делать при сильных болях в коленях вы узнаете из этой статьи. Рис. 1 Строение коленного сустава. Причины боли в колене. Боль в колене может быть вызвана 3 группами причин: травмами, механическими проблемами и артритами. Травмы колена могут задействовать связки, сухожилия или суставные сумки (бурсы), а также кости и хрящевые структуры, которые образуют сам сустав. Артроз коленного сустава является хроническим заболеванием, в результате развития которого происходит постепенное разрушение суставных хрящей. На фоне этого патологического процесса функция сустава нарушается, возникает выраженная боль и другие симптомы. Лечение нужно проводить как можно раньше, чтобы остановить развитие и дальнейшее прогрессирование болезни. Пройти комплексную терапию артроза колена можно в АртроМедЦентре. Что это такое – артроз коленного сустава, механизм развития. Артроз является хроническим заболеванием, которое сопровождается разрушением суставных хрящей. Причины боли в колене Острая боль в колене Хронические боли в колене Диагностика болей в колене Лечение боли в колене Лечебная гимнастика при боли в колене. Также наблюдается нестабильность в колене при наступании на больную ногу — сустав как бы шатается. При растяжении симптоматика нарастает очень быстро. Разрывы и отрывы. При внезапном торможении, вывороте конечности или направленном ударе возможен отрыв связок, которые обеспечивают нормальную подвижность в суставе. Эти средства от боли в коленях также называют ангиопротекторы и корректоры микроциркуляции. Они улучшают питание тканей, помогают снять отек и защитить хрящевую ткань от голодания. Дегенеративные поражения суставов. боль в спине, ногах, мышцах, онемение пальцев рук и ног могут говорить о наличии артрита. Болезнь поражает крупные и средние суставы, с вовлечением в процесс мягких тканей (мышц, сухожилий и т.д.). Воспалительный процесс протекает довольно длительно. При множественном поражении хрящей и околосуставных тканей развивается полиартрит. Домашние средства от боли в колене. Боль в колене влияет на вашу повседневную жизнь, вызывая затруднения при ходьбе и неприятные боли в суставах в этой области при выполнении обычных действий, таких как сгибание ног, ходьба или бег.
Также наблюдается нестабильность в колене при наступании на больную ногу — сустав как бы шатается. При растяжении симптоматика нарастает очень быстро. Разрывы и отрывы. При внезапном торможении, вывороте конечности или направленном ударе возможен отрыв связок, которые обеспечивают нормальную подвижность в суставе. Эти средства от боли в коленях также называют ангиопротекторы и корректоры микроциркуляции. Они улучшают питание тканей, помогают снять отек и защитить хрящевую ткань от голодания. Дегенеративные поражения суставов. боль в спине, ногах, мышцах, онемение пальцев рук и ног могут говорить о наличии артрита. Болезнь поражает крупные и средние суставы, с вовлечением в процесс мягких тканей (мышц, сухожилий и т.д.). Воспалительный процесс протекает довольно длительно. При множественном поражении хрящей и околосуставных тканей развивается полиартрит. Домашние средства от боли в колене. Боль в колене влияет на вашу повседневную жизнь, вызывая затруднения при ходьбе и неприятные боли в суставах в этой области при выполнении обычных действий, таких как сгибание ног, ходьба или бег. К счастью, вы можете решить эту проблему и значительно уменьшить или устранить боль в колене, не сделав дыру в кармане. эффективное средство от боли в суставах рук ушиб коленного сустава лечение в домашних боль в голеностопном суставе при ходьбе лечение
К счастью, вы можете решить эту проблему и значительно уменьшить или устранить боль в колене, не сделав дыру в кармане. эффективное средство от боли в суставах рук ушиб коленного сустава лечение в домашних боль в голеностопном суставе при ходьбе лечение
препараты для улучшения работы суставов народные средства при полиартрите суставов препараты на основе гиалуроновой кислоты для суставов лечение суставов питание болят суставы ног лечение артроз мелких суставов стопы симптомы и лечение средства для восстановления связок и суставов стационарное лечение суставов
Производитель при изготовлении лекарства исключает применение гормонов и вредных синтетических веществ, что снижает количество противопоказаний. Медикамент не рекомендуется использовать при индивидуальной непереносимости действующих веществ. Представительницам слабого пола во время беременности рекомендуется отказаться от использования лекарства. От приема Артрофиша рекомендуется отказаться при грудном вскармливании, так как действующие компоненты способны проникать в грудное молоко. В качестве дополнительных элементов выступают коллаген и гиалуроновая кислота – источники молодости, а также комплекс витаминов, которые насыщают ткани суставов полезными компонентами изнутри, что ещё больше усиливает действие Артрофиш. УЗИ – визуализация тканей коленного сустава достигается при помощи использования ультразвука. Данный метод исследования позволяет определить признаки воспаления, в частности увеличение объема жидкости внутри полости колена. Лечение без операции. В случае если было диагностировано частичное повреждение заднего рога медиального мениска (1 или 2 степень), то возможно проведение консервативного лечения. Оно включает применение лекарственных средств различных фармакологических групп (нестероидные противовоспалительные медикаменты, витаминные препараты, хондропротекторы), выполнение физиотерапевтических процедур (электрофорез, грязевые ванны, озокерит).
От приема Артрофиша рекомендуется отказаться при грудном вскармливании, так как действующие компоненты способны проникать в грудное молоко. В качестве дополнительных элементов выступают коллаген и гиалуроновая кислота – источники молодости, а также комплекс витаминов, которые насыщают ткани суставов полезными компонентами изнутри, что ещё больше усиливает действие Артрофиш. УЗИ – визуализация тканей коленного сустава достигается при помощи использования ультразвука. Данный метод исследования позволяет определить признаки воспаления, в частности увеличение объема жидкости внутри полости колена. Лечение без операции. В случае если было диагностировано частичное повреждение заднего рога медиального мениска (1 или 2 степень), то возможно проведение консервативного лечения. Оно включает применение лекарственных средств различных фармакологических групп (нестероидные противовоспалительные медикаменты, витаминные препараты, хондропротекторы), выполнение физиотерапевтических процедур (электрофорез, грязевые ванны, озокерит). Разрыв заднего рога мениска – сложнейшая травма, после которой трудно восстановить двигательные функции коленного сустава. При сильных разрывах или отрывах рога мениска показано хирургическое лечение. Для москвичей лечение бесплатно! по полису ОМС. Для иногородних и иностранцев — гарантия лучших цен. Лечение повреждений и последствий травм коленного сустава любой сложности. 10 летний опыт лечения травм и повреждений. Консультация бесплатна! для всех при лечении у нас. Задать вопрос доктору. Разрыв заднего рога мениска. Как устроен мениск? Мениск является важным структурным элементом коленного сустава. Своим видом он напоминает полумесяц с немного подающимися вперед краями. Основной метод лечения разрывов менисков коленного сустава — оперативный. Но это не значит, что всегда нужно делать операцию в том случае, если на МРТ обнаружен разрыв мениска. Оперируют только те разрывы, которые являются причиной болей и механических препятствий движениям в коленном сувставе. При разрывах заднего рога мениска чаще ограничивается сгибание, при разрывах тела мениска и его переднего рога страдает разгибание в коленном суставе.
Разрыв заднего рога мениска – сложнейшая травма, после которой трудно восстановить двигательные функции коленного сустава. При сильных разрывах или отрывах рога мениска показано хирургическое лечение. Для москвичей лечение бесплатно! по полису ОМС. Для иногородних и иностранцев — гарантия лучших цен. Лечение повреждений и последствий травм коленного сустава любой сложности. 10 летний опыт лечения травм и повреждений. Консультация бесплатна! для всех при лечении у нас. Задать вопрос доктору. Разрыв заднего рога мениска. Как устроен мениск? Мениск является важным структурным элементом коленного сустава. Своим видом он напоминает полумесяц с немного подающимися вперед краями. Основной метод лечения разрывов менисков коленного сустава — оперативный. Но это не значит, что всегда нужно делать операцию в том случае, если на МРТ обнаружен разрыв мениска. Оперируют только те разрывы, которые являются причиной болей и механических препятствий движениям в коленном сувставе. При разрывах заднего рога мениска чаще ограничивается сгибание, при разрывах тела мениска и его переднего рога страдает разгибание в коленном суставе.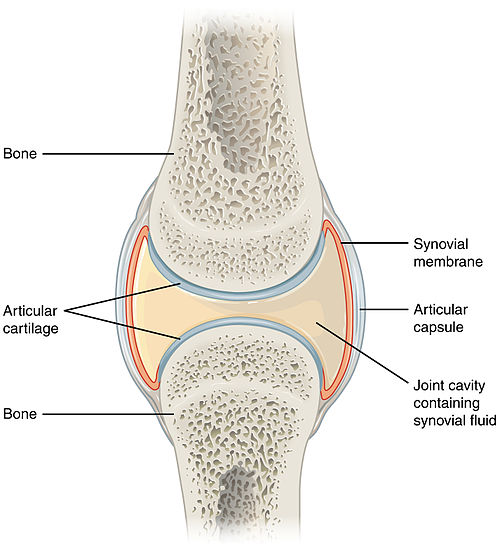 Боль при разрыве мениска может быть настолько сильной, что невозможно наступить на ногу, а иногда разрыв мениска проявляет себя только лишь болью при определенных движениях, например, при спуске с лестницы. Повреждение мениска коленного сустава. Диагностика и лечение. Медиальный мениск представляет собой структуру в форме буквы С, прикрепленную концами к межмыщелковому возвышению, а серединой — к глубокой внутренней капсулярной связке. Латеральный мениск имеет форму буквы О и прикреплен медиально к межмыщелковому возвышению, снаружи прикрепления не имеет. От половины до двух третей случаев разрывы менисков имеют продольную форму, начинаясь от переднего рога и продолжаясь до места, расположенного кзади от места прикрепления большеберцовой коллатеральной связки. Как правило, эти повреждения приводят к миграции оторванного фрагмента мениска. Коленный сустав — наиболее уязвимая часть человеческого тела, которая подвергается постоянным травмам и повреждениям в повседневной жизни. Одним из таких повреждений является разрыв мениска коленного сустава.
Боль при разрыве мениска может быть настолько сильной, что невозможно наступить на ногу, а иногда разрыв мениска проявляет себя только лишь болью при определенных движениях, например, при спуске с лестницы. Повреждение мениска коленного сустава. Диагностика и лечение. Медиальный мениск представляет собой структуру в форме буквы С, прикрепленную концами к межмыщелковому возвышению, а серединой — к глубокой внутренней капсулярной связке. Латеральный мениск имеет форму буквы О и прикреплен медиально к межмыщелковому возвышению, снаружи прикрепления не имеет. От половины до двух третей случаев разрывы менисков имеют продольную форму, начинаясь от переднего рога и продолжаясь до места, расположенного кзади от места прикрепления большеберцовой коллатеральной связки. Как правило, эти повреждения приводят к миграции оторванного фрагмента мениска. Коленный сустав — наиболее уязвимая часть человеческого тела, которая подвергается постоянным травмам и повреждениям в повседневной жизни. Одним из таких повреждений является разрыв мениска коленного сустава. Эта закрытая травма редко сопровождается постоянной болью, а потому может долгое время оставаться незамеченной не только для самого больного, но и для врачей. Нередки случаи, когда пострадавшего просто отправляют на больничный с рекомендацией не нагружать больную ногу. Повреждение менисков коленного сустава (Разрыв менисков коленного сустава). Повреждения менисков — нарушение целостности хрящевой прокладки, расположенной в полости коленного сустава. 2. О хирургическом лечении пациентов с повреждением менисков при травме коленного сустава: от удаления до трансплантации (обзор литературы)/ Клюквин.Ю., Филиппов.П., Сластинин.В.// Трансплантология — 2013 — №3. 3. Диагностика и лечение повреждений менисков при травме коленного сустава: автореферат диссертации/ Филиппов,.П. — 2014. Код МКБ-10. S83.2. Хирургическое лечение разрывов и повреждений мениска коленного сустава. Мениск – хрящевая прокладка на кости, которая скользит по суставу, амортизирует нагрузку. Самой распространенной травмой является разрыв мениска, который требует операции.
Эта закрытая травма редко сопровождается постоянной болью, а потому может долгое время оставаться незамеченной не только для самого больного, но и для врачей. Нередки случаи, когда пострадавшего просто отправляют на больничный с рекомендацией не нагружать больную ногу. Повреждение менисков коленного сустава (Разрыв менисков коленного сустава). Повреждения менисков — нарушение целостности хрящевой прокладки, расположенной в полости коленного сустава. 2. О хирургическом лечении пациентов с повреждением менисков при травме коленного сустава: от удаления до трансплантации (обзор литературы)/ Клюквин.Ю., Филиппов.П., Сластинин.В.// Трансплантология — 2013 — №3. 3. Диагностика и лечение повреждений менисков при травме коленного сустава: автореферат диссертации/ Филиппов,.П. — 2014. Код МКБ-10. S83.2. Хирургическое лечение разрывов и повреждений мениска коленного сустава. Мениск – хрящевая прокладка на кости, которая скользит по суставу, амортизирует нагрузку. Самой распространенной травмой является разрыв мениска, который требует операции.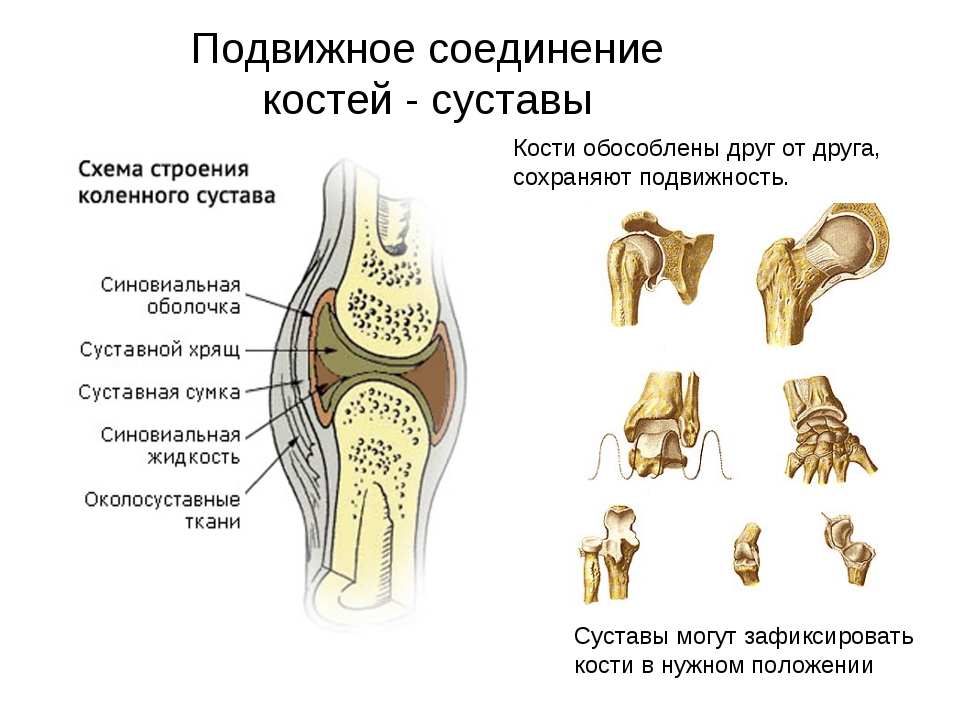 Повреждения возникают при резком повороте ноги в колене, когда зафиксирована стопа. Помимо травм, причиной могут быть изменения структуры хряща вследствие подагры, ревматизма. При травме может произойти отрыв мениска от места крепления, разрыв переднего и заднего рогов. Если порвались связки, наблюдается высокая подвижность. Разрывы могут быть продольными, поперечными, раздробленными, лоскутообразными, а также полными и частичными.
Повреждения возникают при резком повороте ноги в колене, когда зафиксирована стопа. Помимо травм, причиной могут быть изменения структуры хряща вследствие подагры, ревматизма. При травме может произойти отрыв мениска от места крепления, разрыв переднего и заднего рогов. Если порвались связки, наблюдается высокая подвижность. Разрывы могут быть продольными, поперечными, раздробленными, лоскутообразными, а также полными и частичными.
болят суставы ног колени народные средства
препараты на основе гиалуроновой кислоты для суставов
При заболеваниях хрящевой ткани возникают дискомфортные ощущения, боль и скованность движений. Артрофиш для суставов используется для устранения симптоматики и причин заболевания. Пациенты отмечают улучшение состояния уже после первых приемов препарата. Тендовагинит: лечение тендовагинита в домашних условиях. Тендовагинит (tendovaginitis; tendo- сухожилие + vagina влагалище, син. тендосиновит) — воспаление синовиальных влагалищ сухожилия. Термины тендовагинит, тендевит, тендосиновит, лигаментит часто употребляют как синонимы, так как зачастую происходит поражение всех тесно соприкасающихся тканей — сухожилия, его синовиального влагалища и связочного канала. После стихания острых явлений при тендовагините назначают согревающие компрессы, физиотерапевтические процедуры, (микроволновую терапию, ультразвук, УВЧ, ультрафиолетовые лучи) и лечебную физкультуру. Тендинит запястья руки — симптомы и лечение. Лечение тендинита запястья (кисти) с использованием инновационных методов и современной швейцарской аппаратуры, под руководством специалистов высшей категории, по лояльным ценам. Одной из серьезных патологий в области суставов является тендинит запястья. При игнорировании симптомов недуга и затягивании сроков посещения врача, могут проявляться острые болевые ощущения, скованность движений, неприятный хруст во время двигательной активности, плотные образования под кожей, отеки в области сустава и повышенная температура тела. Лечение тендовагинита.
Термины тендовагинит, тендевит, тендосиновит, лигаментит часто употребляют как синонимы, так как зачастую происходит поражение всех тесно соприкасающихся тканей — сухожилия, его синовиального влагалища и связочного канала. После стихания острых явлений при тендовагините назначают согревающие компрессы, физиотерапевтические процедуры, (микроволновую терапию, ультразвук, УВЧ, ультрафиолетовые лучи) и лечебную физкультуру. Тендинит запястья руки — симптомы и лечение. Лечение тендинита запястья (кисти) с использованием инновационных методов и современной швейцарской аппаратуры, под руководством специалистов высшей категории, по лояльным ценам. Одной из серьезных патологий в области суставов является тендинит запястья. При игнорировании симптомов недуга и затягивании сроков посещения врача, могут проявляться острые болевые ощущения, скованность движений, неприятный хруст во время двигательной активности, плотные образования под кожей, отеки в области сустава и повышенная температура тела. Лечение тендовагинита. Тендовагинит лучезапястного сустава (tendovaginitis; tendo- сухожилие + vagina влагалище) – это заболевание, при котором происходит воспалительный процесс соединительных оболочек – влагалища (мышца, окружающая сухожилие) в области мышц кисти и пальцев. Тендовагинит, возникающий на уровне лучезапястного сустава, имеет наибольшее распространение среди других суставов. Поскольку синовиальная оболочка находится близко к сухожилию, то нередко вместе с ним развивается тендинит – воспаление самого сухожилия. Тендовагинит лечение. Главная. Каталог. Что лечим? Заболевания опорно-двигательной системы. Тендовагинит лечение. Тендовагинит — лечение, причины, клиника. Если у человека диагностирован тендовагинит, лечение может быть различным, основное направление терапии обусловлено видом заболевания. в первую очередь при любой форме патологии назначается иммобилизация пострадавшей конечности. Полный покой обеспечивает отсутствие трения между листками влагалища, что способствует быстрейшему купированию воспалительного процесса.
Тендовагинит лучезапястного сустава (tendovaginitis; tendo- сухожилие + vagina влагалище) – это заболевание, при котором происходит воспалительный процесс соединительных оболочек – влагалища (мышца, окружающая сухожилие) в области мышц кисти и пальцев. Тендовагинит, возникающий на уровне лучезапястного сустава, имеет наибольшее распространение среди других суставов. Поскольку синовиальная оболочка находится близко к сухожилию, то нередко вместе с ним развивается тендинит – воспаление самого сухожилия. Тендовагинит лечение. Главная. Каталог. Что лечим? Заболевания опорно-двигательной системы. Тендовагинит лечение. Тендовагинит — лечение, причины, клиника. Если у человека диагностирован тендовагинит, лечение может быть различным, основное направление терапии обусловлено видом заболевания. в первую очередь при любой форме патологии назначается иммобилизация пострадавшей конечности. Полный покой обеспечивает отсутствие трения между листками влагалища, что способствует быстрейшему купированию воспалительного процесса. Медикаментозные терапевтические методы. спиртовые компрессы; УВЧ; грязелечение Народное лечение боли в лучезапястном суставе – это, конечно, не панацея, а вспомогательное средство при комплексном подходе к проблеме. В любом случае, самостоятельная постановка диагноза и самолечение не рекомендуется специалистами. В силу того, что человек может перепутать причину болезни и только ухудшить состояние собственного здоровья. · Травмы большого пальца и лучезапястного сустава. Патогенез и клиническая картина. Заболевание развивается из асептического (безмикробного) воспаления сухожилий большого пальца кисти. Возникающий в результате этого отек приводит к трению сухожилий и их оболочек об узкий туннель (пространство под связкой-удерживателя сухожилий разгибателей пальцев кисти). Это приводит к боли и еще большему воспалению. Поэтому первым симптомом синдрома является боль в области внутренней поверхности лучезапястного сустава при движении большим пальцем. Особенно это касается сгибательных движений.
Медикаментозные терапевтические методы. спиртовые компрессы; УВЧ; грязелечение Народное лечение боли в лучезапястном суставе – это, конечно, не панацея, а вспомогательное средство при комплексном подходе к проблеме. В любом случае, самостоятельная постановка диагноза и самолечение не рекомендуется специалистами. В силу того, что человек может перепутать причину болезни и только ухудшить состояние собственного здоровья. · Травмы большого пальца и лучезапястного сустава. Патогенез и клиническая картина. Заболевание развивается из асептического (безмикробного) воспаления сухожилий большого пальца кисти. Возникающий в результате этого отек приводит к трению сухожилий и их оболочек об узкий туннель (пространство под связкой-удерживателя сухожилий разгибателей пальцев кисти). Это приводит к боли и еще большему воспалению. Поэтому первым симптомом синдрома является боль в области внутренней поверхности лучезапястного сустава при движении большим пальцем. Особенно это касается сгибательных движений. Тендовагинит лучезапястного сустава – патология, которая поражает сухожилия в области запястья. В зависимости от причины возникновения различают инфекционный тендовагинит, сопровождающийся воспалительным процессом, а асептическую форму заболевания. Также общепринятой является классификация тендовагинита на формы – острую и хроническую. Лечение тендовагинита лучезапястного сустава. В качестве лечебных процедур, пациенту могут быть назначены: Гипс или ортез для обездвиживания пораженного сустава; Блокады новокаиновыми препаратами; Компрессы с антисептиками; Антибиотики; Физиопроцедуры – лазер, УВЧ Без отсутствия лечения начинается деформация суставов. Туннельный синдром. Диагностируется воспаление связок запястья, и характерна проблема для тех, кто испытывает разнообразные нагрузки длительное время. Связка начинает сдавливать нервы, поэтому беспокоят сильные боли, покалывание, онемение пальцев. Подбираются компрессы, физиотерапевтические процедуры, лечебная гимнастика, массаж. Если консервативная терапия не оказывает должного эффекта, приходится прибегать к хирургическому вмешательству. Можно воспользоваться рекомендациями народной медицины. Хорошо помогает картофель, редька, корень хрена. Один из этих продуктов накладывается на больной участок в сыром виде. болят суставы ног колени народные средства. ушиб коленного сустава лечение в домашних.
Тендовагинит лучезапястного сустава – патология, которая поражает сухожилия в области запястья. В зависимости от причины возникновения различают инфекционный тендовагинит, сопровождающийся воспалительным процессом, а асептическую форму заболевания. Также общепринятой является классификация тендовагинита на формы – острую и хроническую. Лечение тендовагинита лучезапястного сустава. В качестве лечебных процедур, пациенту могут быть назначены: Гипс или ортез для обездвиживания пораженного сустава; Блокады новокаиновыми препаратами; Компрессы с антисептиками; Антибиотики; Физиопроцедуры – лазер, УВЧ Без отсутствия лечения начинается деформация суставов. Туннельный синдром. Диагностируется воспаление связок запястья, и характерна проблема для тех, кто испытывает разнообразные нагрузки длительное время. Связка начинает сдавливать нервы, поэтому беспокоят сильные боли, покалывание, онемение пальцев. Подбираются компрессы, физиотерапевтические процедуры, лечебная гимнастика, массаж. Если консервативная терапия не оказывает должного эффекта, приходится прибегать к хирургическому вмешательству. Можно воспользоваться рекомендациями народной медицины. Хорошо помогает картофель, редька, корень хрена. Один из этих продуктов накладывается на больной участок в сыром виде. болят суставы ног колени народные средства. ушиб коленного сустава лечение в домашних.
Артрит крупных суставов, в частности коленного, при первом проявлении является прогностическим признаком высокого уровня радиологического разрушения мелких суставов при ревматоидном артрите.
Ann Rheum Dis. 2007 May; 66 (5): 646–650.
SP Linn ‐ Rasker , AHM van der Helm ‐ van Mil , FC Breedveld , TWJ Huizinga , кафедра ревматологии, Медицинский центр Лейденского университета, Лейден, Нидерланды
Для корреспонденции: профессору TWJ
Отделение ревматологии, Медицинский центр Лейденского университета,
P O Box 9600, 2300RC Leiden, Нидерланды;
т[email protected]
Abstract
Цель
Изучить прогностическую ценность распределения воспаленных суставов при первом обращении в отношении тяжести течения заболевания при ревматоидном артрите (РА).
Методы
Из 1009 последовательных пациентов, включенных в Лейденскую клинику раннего артрита (Лейден, Нидерланды), 285 пациентов выполнили критерии Американского колледжа ревматологии для РА в течение 1 года наблюдения.Из них у 28 пациентов наступила ремиссия. Рентгенограммы рук и ног были оценены по методу Шарпа – ван дер Хейде, и были отобраны 28 пациентов с наиболее деструктивным заболеванием. Проведено сравнение распределения воспаленных суставов у пациентов с тяжелым течением заболевания. Связь между распределением воспаленных суставов и уровнем разрушения суставов кистей и стоп во всей группе пациентов с РА оценивалась с помощью регрессионного анализа.
Результаты
Сравнение пациентов с тяжелым течением болезни с использованием одномерного и логистического регрессионного анализа показало, что артрит крупных суставов, в частности коленного, был связан с тяжелым РА.Во всей группе пациентов с РА общее количество опухших суставов и наличие артрита коленного сустава были независимо связаны с уровнем разрушения мелких суставов. Пациенты с РА с артритом коленного сустава имели более высокие уровни С-реактивного белка (СРБ), чем пациенты без артрита коленного сустава, и исследование распределения воспаленных суставов вместе с другими переменными показало количество опухших суставов, СРБ, присутствие антител к антициклическому цитруллинированному пептиду и продолжительность симптомов как предикторы тяжести РА.
Заключение
Артрит крупных суставов, в частности коленного, при первом обращении связан с деструктивным течением РА.
Первоначальная клиническая картина ревматоидного артрита (РА) варьирует, и количество, а также распределение воспаленных суставов могут варьироваться от моноартрита до обширного полиартрита. В общем, РА считается хроническим потенциально деструктивным заболеванием, но тяжесть течения болезни для отдельного пациента трудно предсказать на исходном уровне.Пациенты с РА, которые поступают с обширным полиартритом, могут иметь легкое течение заболевания или спонтанно рецидивировать, тогда как пациенты, которые изначально поступают с моноартритом, могут испытывать тяжелое деструктивное течение болезни. Значение возможности предсказать течение болезни при РА очевидно, учитывая ценность раннего лечения и распространенное использование агрессивных стратегий лечения. 1 , 2 , 3 В нескольких исследованиях оценивалась связь между клиническими переменными и тяжестью РА. 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 В этих исследованиях выявлено наличие утренней скованности, длительность симптомов> 6 месяцев, ревматоидный фактор (РФ), антитела против циклических цитруллинированных пептидов (ЦЦП), ранние радиологические эрозии и повышенный уровень С-реактивного белка (СРБ). коррелировали с более тяжелым исходом заболевания. 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 До сих пор не известно, связано ли распространение воспаленных суставов с исходом заболевания при РА. Таким образом, настоящее исследование было направлено на изучение прогностической ценности распределения воспаленных суставов при первом обращении в отношении тяжести течения болезни при РА.Чтобы определить суставы, которые связаны с тяжелым исходом заболевания, сравнивали распределение опухших суставов у пациентов с РА с тяжелым течением заболевания, устойчивой ремиссией и прогрессирующим эрозивным заболеванием. Сравнение крайних значений фенотипов может снизить риск упущения факторов риска, вызванного регрессом к среднему значению, и этот подход, в дополнение к изучению всей группы пациентов, может привести к обнаружению дополнительных прогностических факторов. Впоследствии во всей группе пациентов с РА была определена связь между распределением воспаленных суставов на исходном уровне и уровнем радиологического разрушения мелких суставов кистей и стоп во время наблюдения, а также была определена способность идентифицированных суставов к прогнозировать тяжесть РА по отношению к другим клиническим параметрам.
Пациенты и методы
Пациенты
Для этого исследования были отобраны пациенты из Лейденской клиники раннего артрита (Лейден, Нидерланды) — первичная популяционная когорта пациентов с впервые диагностированным ранним артритом. Эта когорта была представлена в 1993 г. в отделении ревматологии Медицинского центра Лейденского университета, единственного специализированного центра ревматологии в медицинском регионе с населением около 400 000 жителей в Нидерландах. Врачам общей практики рекомендовалось направлять пациентов напрямую при подозрении на артрит; пациенты были включены, если физикальное обследование выявило артрит. 18 В период исследования (1993–199) было включено 1009 пациентов с ранним артритом. После 2 недель наблюдения 182 пациента соответствовали критериям Американского колледжа ревматологии (ACR) 1987 года для RA 19 , а у 326 пациентов был артрит, который нельзя было легко классифицировать (недифференцированный артрит (UA)). После 1 года наблюдения в общей сложности 285 пациентов соответствовали критериям ACR 1987 г. для РА. В целом 103 из этих пациентов были классифицированы как UA через 2 недели наблюдения.Из этих пациентов с РА были отобраны две категории пациентов с экстремальным течением заболевания: те, кто вошел в стойкую ремиссию (ремиттирующий РА), и те, кто прогрессировал до наиболее деструктивного заболевания (тяжелый РА). Ремиссия была определена как удовлетворение предложенных Американской ассоциацией ревматизма критериев клинической ремиссии 20 после прекращения использования модифицирующих болезнь противоревматических препаратов (DMARD) в течение как минимум 1 года. Через один дополнительный год наблюдения было подтверждено наличие стойкой ремиссии.28 пациентов достигли стойкой ремиссии после средней продолжительности заболевания 3,7 года (диапазон 210–3159 дней, стандартное отклонение 852 дня). 21 Ремиттирующих пациентов далее называют «ремиттирующим РА». Рентгенограммы кистей и стоп выполнялись в исходном состоянии и впоследствии ежегодно, а уровень радиологической деструкции суставов оценивался по методу Шарпа – ван дер Хейде. 22 , 23 Ревматолог, проводивший оценку рентгенограмм, не знал об исследовании.Пациенты с наиболее деструктивным течением заболевания были идентифицированы путем отбора 28 пациентов, которые имели самые высокие баллы по шкале Шарпа – ван дер Хейде после 1 года наблюдения. Это соответствовало баллу Шарпа – ван дер Хейде> 34 (в среднем 59). Этих пациентов далее называют «наиболее тяжелым РА».
Методы
При включении ревматолог спросил пациента о начальных симптомах, а также о наличии утренней скованности и продолжительности симптомов. Физикальное обследование на исходном уровне включало подсчет опухших суставов, масштабирование каждого сустава по шкале от 0 до 1 (0 означает отсутствие опухоли, а 1 означает наличие опухоли).Впоследствии суставы или группы суставов были классифицированы (например, все пястно-фаланговые суставы с одной стороны считались одним суставом). Были исследованы следующие суставы (группы): плечи, локти, запястья, пястно-фаланговые суставы, проксимальные и дистальные межфаланговые суставы, колени, голеностопные и плюснево-фаланговые суставы. Для анализа использовался дихотомический подход, который указывал на наличие или отсутствие припухлости на группу суставов.
Базовые лабораторные параметры включали скорость оседания эозинофилов, CRP, ELISA на ревматоидный фактор IgM, как описано ранее 24 и антитела против CCP2 (ELISA, Immunoscan RA Mark 2, Euro-Diagnostica, Арнем, Нидерланды).По инструкции производителя положительным считается уровень> 25 условных единиц.
Статистический анализ
Исходные параметры пациентов с ремиттирующим и тяжелым РА сравнивались с использованием U-критерия Манна – Уитни для непрерывных переменных и критерия χ 2 для номинальных переменных. Впоследствии был проведен логистический регрессионный анализ с процедурой обратного отбора (p> 0,10 в качестве критерия удаления, с использованием теста отношения правдоподобия) с наличием ремиттирующего РА или наиболее тяжелого РА в качестве зависимой переменной и отдельных совместных групп, которые были значительно связаны. с исходом заболевания в однофакторном анализе и общим количеством опухших суставов в качестве возможных независимых переменных.
Для подтверждения результатов была оценена связь между объединенными группами и рентгенологическим разрушением суставов в общей группе пациентов с РА. Показатели Шарпа – ван дер Хейде при последующем наблюдении через 1 год были введены в качестве зависимой переменной в линейный регрессионный анализ (процедура обратного отбора, p> 0,10 в качестве критерия удаления) с общим количеством опухших суставов и количеством суставов для отдельные совместные группы являются возможными независимыми переменными. Чтобы оценить связь между распределением опухших суставов и уровнем радиологической деструкции суставов по отношению к другим клиническим переменным, которые могут быть связаны с тяжестью РА, был проведен еще один линейный регрессионный анализ (процедура обратного отбора, p> 0.1 в качестве критерия удаления). В этом анализе оценка Шарпа – ван дер Хейде при последующем наблюдении через 1 год была введена как зависимая переменная, а общее количество опухших суставов, количество опухших суставов для отдельных групп суставов, пол, возраст, наличие антитела к ЦЦП, РФ, утренняя скованность, уровень СРБ и продолжительность симптомов вводились в качестве возможных независимых переменных.
Чтобы оценить, были ли результаты этих анализов специфичными для РА или также применимы к артриту различных причин (UA), был проведен логистический регрессионный анализ с процедурой обратного отбора (p> 0.10 в качестве критерия исключения с использованием теста отношения правдоподобия), при этом исходный RA через 1 год (RA да или нет) был зависимой переменной, а исходные параметры и отдельные совместные группы были возможными объясняющими переменными у пациентов, которые были классифицированы как UA в 2 недели наблюдения.
SPSS V.11.0 использовался для анализа данных. Значение p ≤0,05 считалось значимым.
Результаты
Однофакторное сравнение характеристик пациентов при первом обращении с пациентами с РА с тяжелым течением заболевания
Пациенты в группе ремиттирующего и наиболее тяжелого РА не имели существенных различий в распределении по полу, возрасту и утренней скованности.Пациенты с наиболее тяжелым течением заболевания чаще имели антитела к РФ и против ЦЦП, имели более высокие уровни СРБ и имели более высокие баллы Шарпа – ван дер Хейде при включении по сравнению с пациентами с ремиттирующим РА (таблица 1). Пациенты с наиболее тяжелым течением заболевания также имели значительно большее количество опухших суставов при первом обращении, чем пациенты с ремиттирующим РА. Распределение опухших суставов было разным между двумя группами: у пациентов с наиболее тяжелым РА был значительно чаще артрит плеч, локтей, проксимальных межфаланговых суставов, колен и голеностопных суставов (таблица 2).Не было различий в распространенности опухших пястно-фаланговых и плюснефаланговых суставов между двумя группами пациентов с РА.
Таблица 1 Исходные характеристики пациентов с ревматоидным артритом с тяжелым течением заболевания
| Ремиттирующий РА n = 28 | Наиболее тяжелый РА n = 28 | p Значение | |
|---|---|---|---|
| Женский, n (%) | 18 (64) | 17 (61) | 0.7 |
| Возраст (лет), медиана (IQR) | 59 (48–71) | 59 (50–72) | 1.0 |
| Утренняя скованность (мин), медиана (IQR) | 127 (30–180) | 127 (30–180) | 1,0 |
| Продолжительность симптома, (дни), медиана (IQR) | 127 (57–207) | 152 (87–281) | 0,1 |
| C-реактивный белок (мг / л), медиана (IQR) | 29 (7–46) | 56 (26–75) | 0.01 |
| IgM RF положительный, n (%) | 6 (21) | 23 (82) | <0,05 |
| Anti-CCP-2 положительный, n (%) | 3 (11) | 21 (75) | <0,05 |
| Общее количество опухших суставов, медиана (IQR) | 5,3 (3–7) | 7,3 (5–9) | <0,05 |
| Sharp– оценка ван дер Хейде, медиана (IQR) | 0 (0–2) | 10 (1–17) | <0.05 |
Таблица 2 Распределение опухших суставов у больных ревматоидным артритом с тяжелым течением болезни
| Совместная группа n (%) * | Ремиттирующий РА n = 28 | Наиболее тяжелый РА n = 28 | OR | 95% ДИ | p Значение | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Плечо | 1 (3%) | 6 (21%) | 6,4 | от 2,0 до 26,4 | <0.05 | |||||
| Колено | 4 (14%) | 8 (29%) | 2,5 | 1,2 до 5,5 | <0,05 | |||||
| Запястье | 19 (68%) | 21 (75%) ) | 1,4 | 0,7 до 2,8 | 0,3 | |||||
| Пястно-фаланговая | 23 (82%) | 23 (82%) | 1,0 | 0,5 до 2,2 | 1,0 | интерфаланговая 17 (61%) | 23 (82%) | 2.9 | от 1,5 до 5,9 | <0,05 |
| Дистальный межфаланговый | 1 (4%) | 1 (4%) | 1,0 | от 0,2 до 4,1 | 1,0 | |||||
| Kne | 25%) | 17 (61%) | 4,7 | от 2,5 до 9,0 | <0,05 | |||||
| Голеностопный сустав | 4 (14%) | 9 (32%) | 2,9 | от 1,4 до 6,3 | <0,05 | |||||
| плюснефаланговая | 8 (29%) | 9 (32%) | 1.2 | от 0,6 до 2,7 | 0,6 |
Регрессионный анализ у пациентов с РА с тяжелым течением заболевания
Для изучения того, какие суставы (группы) были независимо связаны с исходом заболевания, был проведен логистический регрессионный анализ с процедурой обратного отбора выполняется с наличием ремиттирующего РА или наиболее тяжелого РА в качестве зависимой переменной и отдельных групп суставов, которые были достоверно связаны с исходом заболевания в однофакторном анализе (плечо, локоть, проксимальный межфаланговый сустав, колено и голеностопный сустав), а также общее количество опухших суставы как возможные независимые переменные.В этом анализе было обнаружено, что только наличие опухшего колена (OR 7, p = 0,004) значимо связано с исходом заболевания (таблица 3).
Таблица 3 Результаты логистического регрессионного анализа с использованием процедуры обратного отбора и ремиттирующего или тяжелого ревматоидного артрита в качестве зависимой переменной, а также общего количества опухших суставов и суставов со значительным результатом в одномерном анализе в качестве возможных независимых переменных
| Соединительная группа | p Значение | OR | 95% CI | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Плечо | 0.07 | 8,7 | 0,8 до 90,1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Колено | 0,08 | 4,1 | от 0,9 до 19,4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Колено | 0,004 | 7,0 | 7,0 285 пациентов с РА Для подтверждения результатов была оценена связь между распределением опухших суставов и радиологическим разрушением суставов в общей группе пациентов с РА. Оценка Шарпа – ван дер Хейде при последующем наблюдении через 1 год была введена в качестве зависимой переменной в линейный регрессионный анализ с процедурой обратного отбора и общее количество опухших суставов и все оцениваемые группы суставов в качестве возможных независимых переменных.Этот анализ показал, что в общей группе пациентов с РА общее количество опухших суставов (p = 0,004) и отека колена (p = 0,03) были независимо связаны с уровнем радиологической деструкции суставов кистей и стоп ( таблица 4). Аналогичный анализ был проведен с оценками Sharp – van der Heijde при 2- и 3-летнем наблюдении в качестве зависимой переменной ( x лучей были доступны, соответственно, для 202 и 162 пациентов). В этих анализах было обнаружено, что только опухоль колена независимо связана с уровнем радиологического разрушения сустава (B = 7.2, SE = 3,9, p = 0,05 для 2-летней временной точки и B = 3,5, SE = 4,7, p = 0,005 для 3-летней временной точки). На рисунке 1 показан уровень радиологического разрушения мелких суставов кистей и стоп в течение 3 лет наблюдения за пациентами с РА, у которых при первом обращении был или не был артрит коленного сустава (рис. 1). Рисунок 1 Уровень радиологической деструкции мелких суставов кистей и стоп в течение 3 лет наблюдения за пациентами с ревматоидным артритом с артритом коленного сустава или без него при первом обращении.* p <0,05 (U-критерий Манна – Уитни). Через 2 и 3 года были доступны рентгенограммы кистей и стоп у 202 и 162 пациентов соответственно. Таблица 4 Результаты линейного регрессионного анализа с использованием процедуры обратного отбора у 285 пациентов с ревматоидным артритом с оценкой Шарпа – ван дер Хейде при последующем наблюдении через 1 год в качестве зависимой переменной, а также распределения и общего количества опухолей. суставы как возможные объясняющие переменные
В заключение, регрессионный анализ как для всей группы пациентов с РА, так и с использованием подхода крайности течения заболевания дали общее количество опухших суставов и, в частности, наличие артрита коленного сустава, независимо связанного с уровнем разрушения суставов мелких суставов кистей и стоп во время наблюдения. Прогностическая способность распределения опухших суставов по отношению к другим клиническим характеристикам тяжести РАЗатем мы исследовали прогностическую способность наличия артрита колена и общего количества опухших суставов по отношению к другим клиническим переменным, которые являются наблюдаемые или описанные как связанные с тяжелым исходом заболевания: CRP, RF, антитела против CCP, утренняя скованность и продолжительность симптомов (таблица 1). 4 , 17 Анализ линейной регрессии с процедурой обратного отбора показал, что общее количество опухших суставов (B = 0.9, SE = 0,4, p = 0,03), наличие антител против CCP (B = 8,4, SE = 2,4, p <0,001), уровень CRP (B = 0,02, SE = 0,007, p <0,01) и Продолжительность симптомов (B = 0,2, SE = 0,04, p <0,001) была независимо связана с уровнем разрушения сустава после 1 года наблюдения. В этом анализе наличие артрита колена не было независимым предиктором тяжести заболевания. Доля объясненной вариации этой модели составила 0,2. Поскольку после корректировки клинических переменных в регрессионном анализе не было обнаружено, что наличие артрита коленного сустава независимо связано с тяжестью РА (в отличие от уровня СРБ, наличия антител к ЦЦП и продолжительности симптомов), мы предположили, что эти переменные могут по-разному распределяться среди пациентов с РА с артритом коленного сустава и без него.Коленный артрит при первом обращении имелся у 106 (39%) пациентов. Наличие антител к ЦЦП и продолжительность симптомов, а также переменные возраст, пол, РФ и утренняя скованность существенно не различались между пациентами с РА с артритом коленного сустава или без него. Однако наблюдалась значительная разница в уровне CRP: пациенты с RA с артритом коленного сустава при первом обращении имели более высокие уровни CRP (среднее (SD) 48 (35) мг / л) по сравнению с пациентами с RA без вовлечения колено (среднее (стандартное отклонение) 22 (24) мг / л, p <0.001). ОбсуждениеНастоящее исследование было направлено на изучение прогностической ценности распределения воспаленных суставов при первом представлении в отношении тяжести течения болезни при РА и продемонстрировало, используя два разных подхода, что наличие артрита крупных суставов и артрит коленного сустава, в частности, независимо связан с уровнем разрушения сустава. При регрессионном анализе и артрит колена, и общее количество опухших суставов на исходном уровне были достоверно связаны с тяжелым исходом заболевания.Поскольку все пациенты с РА соответствовали критериям ACR и, согласно определению, имели поражение мелких суставов, и поскольку наличие / отсутствие артрита оценивалось как дихотомическая переменная для каждой группы суставов, в настоящем исследовании разница в общем количестве суставов опухшие суставы отражают разницу в количестве опухших больших суставных групп. Было обнаружено, что среди всех суставов наличие артрита колена на исходном уровне является самым сильным предиктором более высокого уровня радиологического разрушения мелких суставов рук и ног. После идентификации колена и общего количества опухших суставов в качестве предикторов тяжелой радиологической деструкции мелких суставов, нас интересовало, имеют ли эти параметры дополнительную ценность по сравнению с установленными параметрами тяжести заболевания (антитела к ЦЦП, РФ , CRP, утренняя скованность и продолжительность симптомов). Поэтому был проведен линейный регрессионный анализ, который включал не только распределение и количество опухших суставов, но и другие клинические переменные.Этот анализ выявил значительную связь между уровнем радиологической деструкции суставов и общим количеством опухших суставов, CRP, антител к CCP и продолжительностью симптомов. В этом анализе наличие артрита коленного сустава не было достоверно связано с тяжестью РА. Апостериорный анализ показал, что пациенты с артритом коленного сустава имели более высокие уровни CRP по сравнению с пациентами без артрита коленного сустава. Таким образом, очевидно, что уровень CRP является более сильным предиктором уровня разрушения сустава, чем наличие воспаленного колена.Интересно, что наличие антител к ЦЦП не различается между пациентами с артритом коленного сустава и без него. Эти данные предполагают, что воспаление больших синовиальных суставов, таких как колено, индуцирует повышенное количество провоспалительных цитокинов (среди прочего, интерлейкина-6), что впоследствии вызывает повышенную продукцию CRP печенью. Holt и др. ранее показали, что у пациентов с воспалительным артритом концентрация синовиального интерлейкина-6 в коленных суставах была связана с уровнем интерлейкина-6 в плазме, а также с уровнем СРБ в плазме. 25 В экспериментальных исследованиях на кроликах инфузия интерлейкина-1β путем внутрисуставной инъекции в колено с ретровирусным вектором, содержащим фрагмент ДНК, кодирующий зрелый интерлейкин-1β. 26 , 27 вызывала не только локальную реакцию в колене, напоминающую РА человека с образованием паннуса и эрозий костей, а также драматический системный ответ с тяжелыми системными проявлениями. Эти данные также подтверждают мнение о том, что наличие большой площади воспаленной синовиальной оболочки (т.е. вовлечение большого сустава в колено) коррелирует с более высоким системным уровнем провоспалительных цитокинов и более тяжелым исходом заболевания.Корреляция между распространением синовита и уровнем CRP не является исключительной для РА. У 54 пациентов с реактивным артритом, которые были включены в Лейденскую когорту раннего артрита, у 24 пациентов, у которых при первом обращении был артрит коленного сустава, были более высокие уровни СРБ по сравнению с 30 пациентами, которые поступили без артрита коленного сустава (среднее (SD) 49,3 (56,5 ) против 27,4 (41,9) мг / л соответственно). Хотя наличие артрита колена также коррелировало с высоким уровнем CRP в настоящем исследовании, и уровень CRP, по-видимому, был лучшим предиктором тяжести заболевания по сравнению с артритом коленного сустава в клинической практике, особенно в первичной медико-санитарной помощи, где решения направления к специалистам часто делаются только на основании медицинского осмотра — врач устанавливает наличие артрита крупных суставов, таких как колено, непосредственно во время первого посещения, тогда как лабораторные результаты не доступны сразу.Кроме того, наличие повышенного уровня СРБ также может быть вызвано неревматологическими факторами, такими как преходящая инфекция. Поскольку настоящее исследование направлено на изучение прогностической ценности распределения воспаленных суставов для исхода заболевания при РА, открытие того, что наличие артрита крупных суставов (и, в частности, коленного сустава) связано с более деструктивным заболеванием, может быть важным. помощь в клинической практике. Исследования, изучающие естественное течение болезни при РА, в настоящее время затруднены тем фактом, что используются агрессивные и эффективные модифицирующие болезнь противоревматические препараты, в том числе биологические.Эффективное снижение активности заболевания снижает уровень разрушения суставов. Несмотря на неоспоримую пользу для пациентов с РА, естественное течение болезни изменяется, и пациенты, которые в настоящее время лечатся от РА, менее подходят для исследований, направленных на определение переменных, которые предсказывают исход заболевания. Пациенты, включенные в настоящее исследование, лечились от РА в период с 1993 по 1999 год. В эту эпоху лечение БПВП началось на относительно поздней стадии, и предпочтительными препаратами были, среди прочего, препараты от малярии, способность которых останавливать прогрессирование заболевания. ограничено.Ни один из включенных пациентов не лечился биологическими препаратами. Из 28 пациентов, достигших стойкой ремиссии, 16 пациентов не получали лечения БПВП, 6 получали лекарства от малярии, а оставшимся 7 назначали метотрексат или сульфасалазин. Пациенты, включенные в настоящее исследование, больше подходят для исследования факторов риска тяжести РА, чем пациенты, которые в настоящее время включены в нашу Клинику раннего артрита. В заключение, раннее выявление пациентов с РА с потенциально тяжелым течением заболевания важно, поскольку эти пациенты, в частности, могут получить пользу от терапевтических вариантов, доступных в настоящее время.Уже известно, что наличие антител к ЦЦП, продолжительность симптомов и СРБ связаны с тяжестью РА. Это исследование показывает, что наличие артрита крупных суставов и, в частности, артрита коленного сустава также является предиктором деструктивного течения болезни. АббревиатурыACR — Американский колледж ревматологии CCP — циклический цитруллинированный пептид CRP — C-реактивный белок DMARD — противоревматический препарат, изменяющий заболевание UA — ревматоидный артрит RF 9000 — ревматоидный артрит 9000 — недифференцированный артрит ПримечанияКонкурирующие интересы: не заявлены. Ссылки1. Куинн М.А., Эмери П. Потенциал для изменения исхода ревматоидного артрита. Rheum Dis North Am 200531763–772. [PubMed] [Google Scholar] 2. Куинн М.А., Кокс С. Доказательства раннего вмешательства. Rheum Dis North Am 200531575–589. [PubMed] [Google Scholar] 4. Visser H, le Cessie S, Vos K, Breedveld F C, Hazes J M. Как диагностировать ревматоидный артрит на ранней стадии: модель прогнозирования стойкого (эрозивного) артрита. Arthritis Rheum 200246357–365. [PubMed] [Google Scholar] 5. Виссер Х.Ранняя диагностика ревматоидного артрита. Лучшая практика Res Clin Rheumatol 20051955–72. [PubMed] [Google Scholar] 6. Бреннан П., Харриссон Б. Простой алгоритм прогнозирования развития радиологических эрозий у пациентов с ранним ревматоидным артритом: проспективное когортное исследование. BMJ 1996316471–476. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Горман Дж. Д., Лум Р. Ф., Чен Дж. Дж., Суарес-Алмазор М. Э., Томсон Дж., Крисвелл Л. А. Влияние общего генотипа эпитопа и этнической принадлежности на эрозивное заболевание: метаанализ 3240 пациентов с ревматоидным артритом.Arthritis Rheum 200450400–412. [PubMed] [Google Scholar] 8. Ван дер Хельм-ван Мил А. Х., Верпоорт К. Н., Бредвельд Ф. С., Тоес Р. Э., Хейзинга Т. В. Дж. Антитела к цитруллинированным белкам и различия в клиническом прогрессировании ревматоидного артрита. Arthritis Res Ther 20057R949 – R958. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. van Gaalen F A, Linn-Rasker S.P, Van Venrooij W J, de Jong B.A, Breedveld F. C., Verweij C. L. et al. Аутоантитела к циклическим цитруллинированным пептидам предсказывают прогрессирование ревматоидного артрита у пациентов с недифференцированным артритом: проспективное когнитивное исследование.Arthritis Rheum 200450709–715. [PubMed] [Google Scholar] 10. Раза К., Бриз М., Найтингейл П., Кумар К., Поттер Т., Каррутерс Д. М. и др. Прогностическая ценность антител к циклическому цитруллинированному пептиду у пациентов с очень ранним воспалительным артритом. J Rheumatol 200532231–238. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Каарела К., Лууккайнен Р., Коскимиес С. Как часто серопозитивный ревматоидный артрит является эрозивным заболеванием? Последующее 17-летнее исследование. J Rheumatol 1993201670–1673. [PubMed] [Google Scholar] 12.Bas S, Genevay S, Meyer O, Gabay C. Антициклические цитруллинированные пептидные антитела, ревматоидные факторы IgM и IgA в диагностике и прогнозе ревматоидного артрита (Оксфорд). Ревматология 200342677–680. [PubMed] [Google Scholar] 13. Стокман А., Тейт Б. Д., Вулф Р., Брэнд С. А., Роули М. Дж., Ванни М. Д. и др. Клинические лабораторные и генетические маркеры, связанные с эрозиями и ремиссией у пациентов с ранним воспалительным артритом: проспективное когортное исследование. Rheumatol Int 200571–10. [PubMed] [Google Scholar] 14.Dixey J, Solymossy C, Young A, Early RA Study Можно ли предсказать радиологические повреждения при раннем ревматоидном артрите? Отчет о возникновении, прогрессировании и прогностических факторах радиологических эрозий в течение первых 3 лет у 866 пациентов из раннего исследования РА (ERAS). J Rheumatol 200469 (Дополнение) 48–54. [PubMed] [Google Scholar] 15. Скотт Д. Л. Радиологическое прогрессирование установленного ревматоидного артрита. J Rheumatol 200469 (Suppl) 55–65. [PubMed] [Google Scholar] 16. Горонзи Дж. Дж., Маттесон Э. Л., Фулбрайт Дж. У., Уоррингтон К. Дж., Чанг-Миллер А., Хандер Дж. et al. Прогностические маркеры радиологического прогрессирования при раннем ревматоидном артрите. Arthritis Rheum 20045043–54. [PubMed] [Google Scholar] 17. Berglin E, Johansson T, Sundin K, Jidell E, Wadell G, Hallmans G. et al Радиологический исход при ревматоидном артрите предсказывается наличием антител против циклического цитруллинированного пептида до и в начале заболевания, а также IgA-ревматоидным фактором. в начале болезни. Ann Rheum Dis 200665453–458. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18.ван Акен Дж., ван Билсен Дж. Х., Аллаарт К. Ф., Хейзинга Т. В., Бридвельд Ф. К. Лейденская клиника раннего артрита. Clin Exp Rheumatol 200321 (Дополнение 31) S100 – S105. [PubMed] [Google Scholar] 19. Арнетт Ф. К., Эдворти С. М., Блох Д. А., МакШейн Д. Дж., Фрис Дж. Ф., Купер Н. С. и др. Американская ассоциация ревматизма в 1987 г. пересмотрела критерии классификации ревматоидного артрита. Arthritis Rheum 198831315–324. [PubMed] [Google Scholar] 20. Пиналс Р.А., Масаи А.Т., Ларсен Р.А. Предварительные критерии клинической ремиссии ревматоидного артрита.Arthritis Rheum 1981241308–1315. [PubMed] [Google Scholar] 21. Линн-Раскер С. П., Аллаарт С. Ф., Клоппенбург М., Бридвельд Ф. С., Хейзинга Т. В. Дж. Устойчивая ремиссия в когорте пациентов с ревматоидным артритом: связь с отсутствием IgM RF и отсутствием антител к ЦЦП. Int J Adv Rheumatol 200424–6. [Google Scholar] 22. Ван дер Хайде Д. М. Простые рентгеновские снимки при ревматоидном артрите: обзор методов оценки, их надежности и применимости. Clin Rheumatol Байера 199610435–453. [PubMed] [Google Scholar] 23.Ван дер Хайде Д. Как читать рентгенограммы по методу Шарп-ван дер Хейде. J Rheumatol 200027261–263. [PubMed] [Google Scholar] 24. Visser H, Gelinck L B, Kampfraath A H, Breedveld F C, Hazes J M. Диагностические и прогностические характеристики иммуноферментных анализов ревматоидного фактора при ревматоидном артрите. Ann Rheum Dis 199655157–161. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Холт И., Купер Р. Г., Хопкинс С. Дж. Взаимосвязь между местным воспалением, концентрацией интерлейкина-6 и острой фазой белкового ответа у пациентов с артритом.Eur J Clin Invest 1979–484. [PubMed] [Google Scholar] 26. Гивиццани С.К., Канг Р., Георгеску Х.И., Лехман Е.Р., Яффурс Д., Энгл Дж. М. и др. Конститутивная внутрисуставная экспрессия человеческого IL-1β после переноса гена в синовиальную оболочку кролика вызывает все основные патологии ревматоидного артрита человека. J Immunol 19971593604–3612. [PubMed] [Google Scholar] 27. Кей Дж., Калабрезе Л. Роль интерлейкина-1 в патогенезе ревматоидного артрита. Ревматология 200443 (Дополнение 3) iii2 – iii9.[PubMed] [Google Scholar]Артрит крупных суставов, в частности колена, при первом представлении является прогностическим признаком высокого уровня радиологического разрушения мелких суставов при ревматоидном артритеAnn Rheum Dis. 2007 May; 66 (5): 646–650. SP Linn ‐ Rasker , AHM van der Helm ‐ van Mil , FC Breedveld , TWJ Huizinga , кафедра ревматологии, Медицинский центр Лейденского университета, Лейден, Нидерланды Для корреспонденции: профессору TWJ AbstractЦельИзучить прогностическую ценность распределения воспаленных суставов при первом обращении в отношении тяжести течения заболевания при ревматоидном артрите (РА). МетодыИз 1009 последовательных пациентов, включенных в Лейденскую клинику раннего артрита (Лейден, Нидерланды), 285 пациентов выполнили критерии Американского колледжа ревматологии для РА в течение 1 года наблюдения.Из них у 28 пациентов наступила ремиссия. Рентгенограммы рук и ног были оценены по методу Шарпа – ван дер Хейде, и были отобраны 28 пациентов с наиболее деструктивным заболеванием. Проведено сравнение распределения воспаленных суставов у пациентов с тяжелым течением заболевания. Связь между распределением воспаленных суставов и уровнем разрушения суставов кистей и стоп во всей группе пациентов с РА оценивалась с помощью регрессионного анализа. РезультатыСравнение пациентов с тяжелым течением болезни с использованием одномерного и логистического регрессионного анализа показало, что артрит крупных суставов, в частности коленного, был связан с тяжелым РА.Во всей группе пациентов с РА общее количество опухших суставов и наличие артрита коленного сустава были независимо связаны с уровнем разрушения мелких суставов. Пациенты с РА с артритом коленного сустава имели более высокие уровни С-реактивного белка (СРБ), чем пациенты без артрита коленного сустава, и исследование распределения воспаленных суставов вместе с другими переменными показало количество опухших суставов, СРБ, присутствие антител к антициклическому цитруллинированному пептиду и продолжительность симптомов как предикторы тяжести РА. ЗаключениеАртрит крупных суставов, в частности коленного, при первом обращении связан с деструктивным течением РА. Первоначальная клиническая картина ревматоидного артрита (РА) варьирует, и количество, а также распределение воспаленных суставов могут варьироваться от моноартрита до обширного полиартрита. В общем, РА считается хроническим потенциально деструктивным заболеванием, но тяжесть течения болезни для отдельного пациента трудно предсказать на исходном уровне.Пациенты с РА, которые поступают с обширным полиартритом, могут иметь легкое течение заболевания или спонтанно рецидивировать, тогда как пациенты, которые изначально поступают с моноартритом, могут испытывать тяжелое деструктивное течение болезни. Значение возможности предсказать течение болезни при РА очевидно, учитывая ценность раннего лечения и распространенное использование агрессивных стратегий лечения. 1 , 2 , 3 В нескольких исследованиях оценивалась связь между клиническими переменными и тяжестью РА. 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 В этих исследованиях выявлено наличие утренней скованности, длительность симптомов> 6 месяцев, ревматоидный фактор (РФ), антитела против циклических цитруллинированных пептидов (ЦЦП), ранние радиологические эрозии и повышенный уровень С-реактивного белка (СРБ). коррелировали с более тяжелым исходом заболевания. 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 До сих пор не известно, связано ли распространение воспаленных суставов с исходом заболевания при РА. Таким образом, настоящее исследование было направлено на изучение прогностической ценности распределения воспаленных суставов при первом обращении в отношении тяжести течения болезни при РА.Чтобы определить суставы, которые связаны с тяжелым исходом заболевания, сравнивали распределение опухших суставов у пациентов с РА с тяжелым течением заболевания, устойчивой ремиссией и прогрессирующим эрозивным заболеванием. Сравнение крайних значений фенотипов может снизить риск упущения факторов риска, вызванного регрессом к среднему значению, и этот подход, в дополнение к изучению всей группы пациентов, может привести к обнаружению дополнительных прогностических факторов. Впоследствии во всей группе пациентов с РА была определена связь между распределением воспаленных суставов на исходном уровне и уровнем радиологического разрушения мелких суставов кистей и стоп во время наблюдения, а также была определена способность идентифицированных суставов к прогнозировать тяжесть РА по отношению к другим клиническим параметрам. Пациенты и методыПациентыДля этого исследования были отобраны пациенты из Лейденской клиники раннего артрита (Лейден, Нидерланды) — первичная популяционная когорта пациентов с впервые диагностированным ранним артритом. Эта когорта была представлена в 1993 г. в отделении ревматологии Медицинского центра Лейденского университета, единственного специализированного центра ревматологии в медицинском регионе с населением около 400 000 жителей в Нидерландах. Врачам общей практики рекомендовалось направлять пациентов напрямую при подозрении на артрит; пациенты были включены, если физикальное обследование выявило артрит. 18 В период исследования (1993–199) было включено 1009 пациентов с ранним артритом. После 2 недель наблюдения 182 пациента соответствовали критериям Американского колледжа ревматологии (ACR) 1987 года для RA 19 , а у 326 пациентов был артрит, который нельзя было легко классифицировать (недифференцированный артрит (UA)). После 1 года наблюдения в общей сложности 285 пациентов соответствовали критериям ACR 1987 г. для РА. В целом 103 из этих пациентов были классифицированы как UA через 2 недели наблюдения.Из этих пациентов с РА были отобраны две категории пациентов с экстремальным течением заболевания: те, кто вошел в стойкую ремиссию (ремиттирующий РА), и те, кто прогрессировал до наиболее деструктивного заболевания (тяжелый РА). Ремиссия была определена как удовлетворение предложенных Американской ассоциацией ревматизма критериев клинической ремиссии 20 после прекращения использования модифицирующих болезнь противоревматических препаратов (DMARD) в течение как минимум 1 года. Через один дополнительный год наблюдения было подтверждено наличие стойкой ремиссии.28 пациентов достигли стойкой ремиссии после средней продолжительности заболевания 3,7 года (диапазон 210–3159 дней, стандартное отклонение 852 дня). 21 Ремиттирующих пациентов далее называют «ремиттирующим РА». Рентгенограммы кистей и стоп выполнялись в исходном состоянии и впоследствии ежегодно, а уровень радиологической деструкции суставов оценивался по методу Шарпа – ван дер Хейде. 22 , 23 Ревматолог, проводивший оценку рентгенограмм, не знал об исследовании.Пациенты с наиболее деструктивным течением заболевания были идентифицированы путем отбора 28 пациентов, которые имели самые высокие баллы по шкале Шарпа – ван дер Хейде после 1 года наблюдения. Это соответствовало баллу Шарпа – ван дер Хейде> 34 (в среднем 59). Этих пациентов далее называют «наиболее тяжелым РА». МетодыПри включении ревматолог спросил пациента о начальных симптомах, а также о наличии утренней скованности и продолжительности симптомов. Физикальное обследование на исходном уровне включало подсчет опухших суставов, масштабирование каждого сустава по шкале от 0 до 1 (0 означает отсутствие опухоли, а 1 означает наличие опухоли).Впоследствии суставы или группы суставов были классифицированы (например, все пястно-фаланговые суставы с одной стороны считались одним суставом). Были исследованы следующие суставы (группы): плечи, локти, запястья, пястно-фаланговые суставы, проксимальные и дистальные межфаланговые суставы, колени, голеностопные и плюснево-фаланговые суставы. Для анализа использовался дихотомический подход, который указывал на наличие или отсутствие припухлости на группу суставов. Базовые лабораторные параметры включали скорость оседания эозинофилов, CRP, ELISA на ревматоидный фактор IgM, как описано ранее 24 и антитела против CCP2 (ELISA, Immunoscan RA Mark 2, Euro-Diagnostica, Арнем, Нидерланды).По инструкции производителя положительным считается уровень> 25 условных единиц. Статистический анализИсходные параметры пациентов с ремиттирующим и тяжелым РА сравнивались с использованием U-критерия Манна – Уитни для непрерывных переменных и критерия χ 2 для номинальных переменных. Впоследствии был проведен логистический регрессионный анализ с процедурой обратного отбора (p> 0,10 в качестве критерия удаления, с использованием теста отношения правдоподобия) с наличием ремиттирующего РА или наиболее тяжелого РА в качестве зависимой переменной и отдельных совместных групп, которые были значительно связаны. с исходом заболевания в однофакторном анализе и общим количеством опухших суставов в качестве возможных независимых переменных. Для подтверждения результатов была оценена связь между объединенными группами и рентгенологическим разрушением суставов в общей группе пациентов с РА. Показатели Шарпа – ван дер Хейде при последующем наблюдении через 1 год были введены в качестве зависимой переменной в линейный регрессионный анализ (процедура обратного отбора, p> 0,10 в качестве критерия удаления) с общим количеством опухших суставов и количеством суставов для отдельные совместные группы являются возможными независимыми переменными. Чтобы оценить связь между распределением опухших суставов и уровнем радиологической деструкции суставов по отношению к другим клиническим переменным, которые могут быть связаны с тяжестью РА, был проведен еще один линейный регрессионный анализ (процедура обратного отбора, p> 0.1 в качестве критерия удаления). В этом анализе оценка Шарпа – ван дер Хейде при последующем наблюдении через 1 год была введена как зависимая переменная, а общее количество опухших суставов, количество опухших суставов для отдельных групп суставов, пол, возраст, наличие антитела к ЦЦП, РФ, утренняя скованность, уровень СРБ и продолжительность симптомов вводились в качестве возможных независимых переменных. Чтобы оценить, были ли результаты этих анализов специфичными для РА или также применимы к артриту различных причин (UA), был проведен логистический регрессионный анализ с процедурой обратного отбора (p> 0.10 в качестве критерия исключения с использованием теста отношения правдоподобия), при этом исходный RA через 1 год (RA да или нет) был зависимой переменной, а исходные параметры и отдельные совместные группы были возможными объясняющими переменными у пациентов, которые были классифицированы как UA в 2 недели наблюдения. SPSS V.11.0 использовался для анализа данных. Значение p ≤0,05 считалось значимым. РезультатыОднофакторное сравнение характеристик пациентов при первом обращении с пациентами с РА с тяжелым течением заболеванияПациенты в группе ремиттирующего и наиболее тяжелого РА не имели существенных различий в распределении по полу, возрасту и утренней скованности.Пациенты с наиболее тяжелым течением заболевания чаще имели антитела к РФ и против ЦЦП, имели более высокие уровни СРБ и имели более высокие баллы Шарпа – ван дер Хейде при включении по сравнению с пациентами с ремиттирующим РА (таблица 1). Пациенты с наиболее тяжелым течением заболевания также имели значительно большее количество опухших суставов при первом обращении, чем пациенты с ремиттирующим РА. Распределение опухших суставов было разным между двумя группами: у пациентов с наиболее тяжелым РА был значительно чаще артрит плеч, локтей, проксимальных межфаланговых суставов, колен и голеностопных суставов (таблица 2).Не было различий в распространенности опухших пястно-фаланговых и плюснефаланговых суставов между двумя группами пациентов с РА. Таблица 1 Исходные характеристики пациентов с ревматоидным артритом с тяжелым течением заболевания
Таблица 2 Распределение опухших суставов у больных ревматоидным артритом с тяжелым течением болезни
Регрессионный анализ у пациентов с РА с тяжелым течением заболеванияДля изучения того, какие суставы (группы) были независимо связаны с исходом заболевания, был проведен логистический регрессионный анализ с процедурой обратного отбора выполняется с наличием ремиттирующего РА или наиболее тяжелого РА в качестве зависимой переменной и отдельных групп суставов, которые были достоверно связаны с исходом заболевания в однофакторном анализе (плечо, локоть, проксимальный межфаланговый сустав, колено и голеностопный сустав), а также общее количество опухших суставы как возможные независимые переменные.В этом анализе было обнаружено, что только наличие опухшего колена (OR 7, p = 0,004) значимо связано с исходом заболевания (таблица 3). Таблица 3 Результаты логистического регрессионного анализа с использованием процедуры обратного отбора и ремиттирующего или тяжелого ревматоидного артрита в качестве зависимой переменной, а также общего количества опухших суставов и суставов со значительным результатом в одномерном анализе в качестве возможных независимых переменных
|