Основные функции белков в организме, их свойства и роль
Поможем понять и полюбить химию
Начать учиться
Генетическая информация о структуре и функциях всех белков в организме передается нам от родителей с помощью специальных белков. К тому же эти вещества определяют структуру и форму клетки, обеспечивают узнавание и связывание различных молекул, а также катализ и регуляцию химических реакций, протекающих в наших телах. И это все еще неполный список функций белков в организме человека!
Что такое белки
Белки — это высокомолекулярные органические соединения, которые состоят из аминокислотных остатков, соединенных между собой пептидной связью.
Этот класс органических веществ можно рассматривать с точки зрения двух наук: биологии и химии. Начнем с биологической роли белков.
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Биологические функции белков
Строительная, или пластическая
Белки являются основой структурного материала всех клеточных мембран, так как образуют основу протоплазмы любой живой клетки. Наверняка вам известны такие белки, как коллаген, кератин и эластин. Именно они составляют основу соединительной ткани организма и обеспечивают ее прочность.
Транспортная
Эта функция заключается в присоединении химических элементов или биологически активных веществ, то есть гормонов, и в перемещении их к различным тканям и органам тела. Например, гемоглобин является переносчиком кислорода в крови, а также принимает участие в транспорте углекислого газа. Перенос насыщенных жирных кислот в крови по организму происходит при участии альбумина. Трансферрин переносит ионы железа, а особые белки участвуют в переносе ионов натрия и калия через мембрану клетки.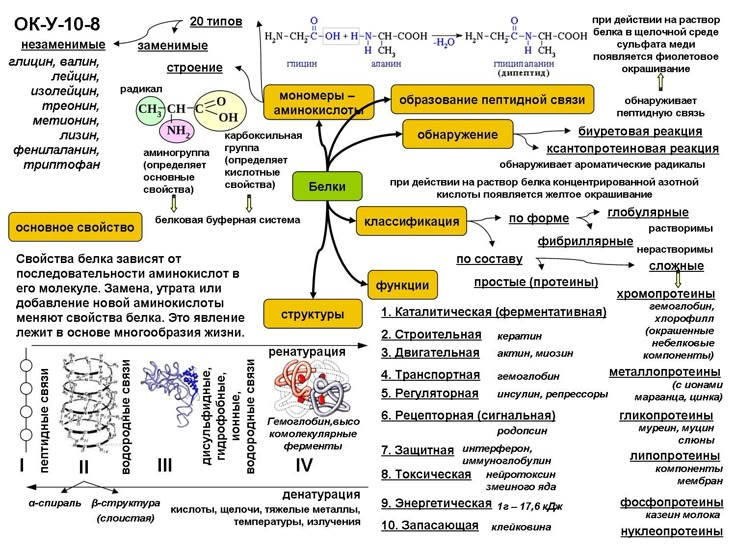
Регуляторная
Белки играют роль в регуляции и согласовании обмена веществ в различных клетках организма. Например, инсулин регулирует уровень глюкозы в крови, а также увеличивает образование жиров из углеводов.
Защитная
При попадании в организм чужеродного белка или микроорганизма образуются особые белки — антитела. Защитой организма от чрезмерной кровопотери является превращение белка фибриногена. Конечно, в этом процессе участвуют и другие белки, например тромбин, а также множество других факторов свертывания. Защиту нашего желудка от воздействия сильнокислой среды обеспечивает белок муцин, основу кожи составляет коллаген, а кератин является белком защитного волосяного покрова.
Двигательная
Двигательную функцию обеспечивают специальные сократительные белки, например актин и миозин, которые участвуют в сокращении скелетных мышц.
Сигнальная
В поверхность мембраны клетки встроены рецепторы (молекулы белков), которые в ответ на воздействие внешней среды способны изменять свою структуру, передавая команды в клетку.
Запасающая
Белки способны образовывать запасные отложения — правда, в организме животных белки, как правило, не запасаются. Но на каждое правило всегда найдется исключение — это альбумин, который содержится в яйцах, и казеин молока. Благодаря белкам в организме могут откладываться, например, ионы железа, которые впоследствии образуют комплекс с белком ферритином.
Энергетическая
Белки могут распадаться в клетке до составляющих, то есть до аминокислот. Часть этих аминокислот подвергается расщеплению, в ходе которого высвобождается энергия. При расщеплении 1 грамма белка выделяется 17,6 кДж, или 4,2 ккал, энергии. Но в этой роли белки используются крайне редко.
Каталитическая
Белки, которые называются ферментами, способны ускорять биохимические реакции, происходящие в клетке, — в этом заключается каталитическая функция белков.
Питательная, или резервная
Эту функцию выполняют резервные белки, которые являются источником питания для плода.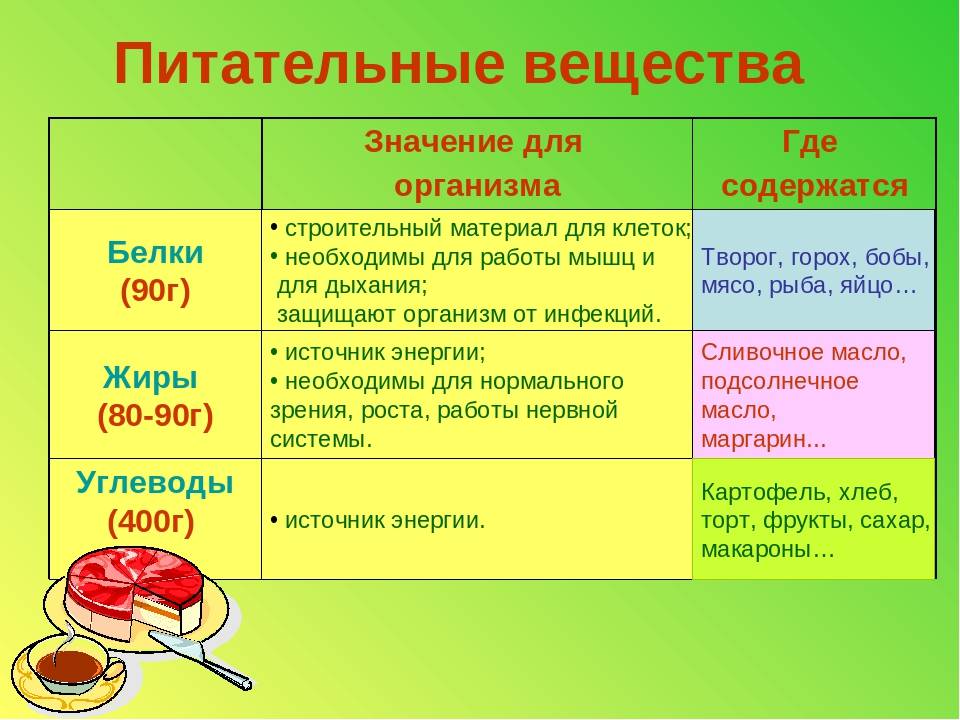 Такими белками могут быть казеин — белок молока, овальбумины — белки яйца, проламины и глютелины — белки растений.
Такими белками могут быть казеин — белок молока, овальбумины — белки яйца, проламины и глютелины — белки растений.
Функция антифриза
Антифризные белки способны понижать температуру замерзания раствора в клетках, чтобы предупредить замерзание в условиях низких температур.
Белки как класс органических соединений
А теперь рассмотрим белки с точки зрения химии. В состав белков живых организмов входит только 20 типов аминокислот. Все они являются альфа-аминокислотами, а состав белка и порядок соединения аминокислот друг с другом определяется индивидуальным генетическим кодом.
Перед нами пример альфа-аминокислоты, которая называется альфа-аминопропановой. В строении аминокислоты можно выделить две функциональные группы: карбоксильную (—СООН), которая отвечает за кислотные свойства, и аминогруппу (—NH2), которая, в свою очередь, отвечает за основные свойства.
Отсюда можно сделать вывод, что все аминокислоты являются амфотерными соединениями и способны реагировать друг с другом по разным функциональным группам с образованием пептидной связи:
Химические свойства белков очень ограниченны. Давайте их рассмотрим.
Гидролиз
Все белки способны вступать в реакцию гидролиза. В общем виде данная реакция выглядит следующим образом:
Белок + nH2O = смесь из α-аминокислот.
Денатурация
Денатурация — это разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры.
Напомним виды структур белка:
The image is a derivative of «Protein structure vector illustration» by VectorMine on Shutterstock.
Денатурация может быть обратимой, а может быть необратимой:
обратимая денатурация:
необратимая денатурация:
Как видно из условий, обратимость зависит от условий протекания реакций.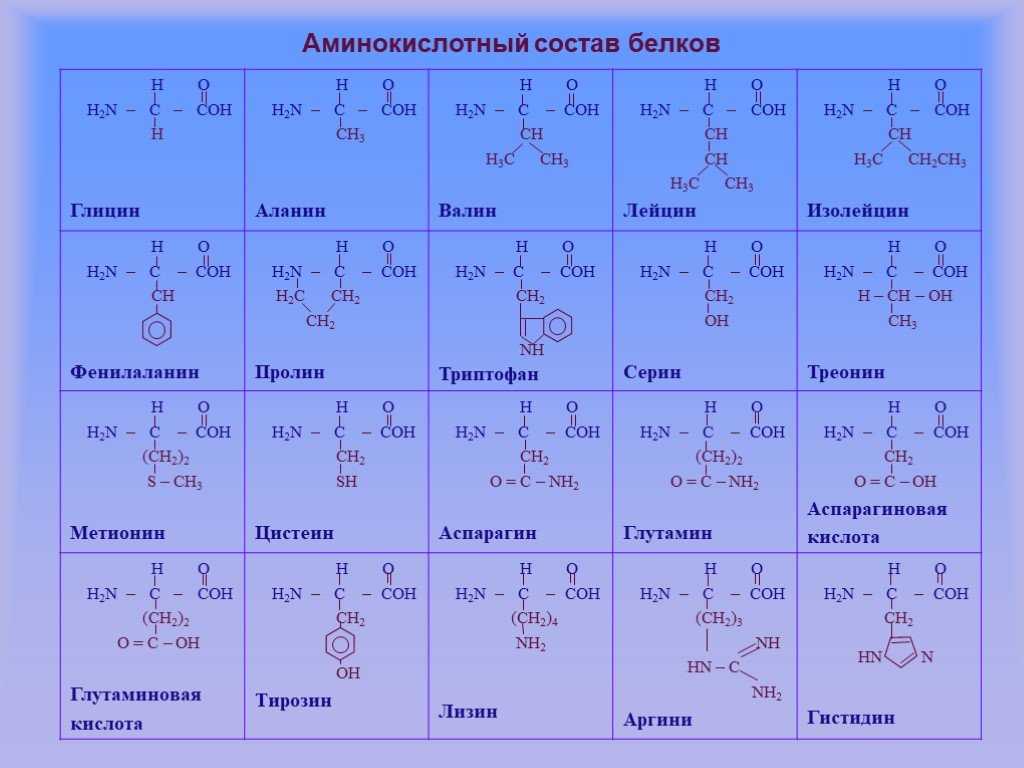 Чем они жестче, тем меньше вероятность обратимости реакции.
Чем они жестче, тем меньше вероятность обратимости реакции.
Биуретовая реакция (качественная реакция на белок)
Раствор белка + NaOH(10%-й р-р) + CuSO4 = фиолетовое окрашивание.
Ксантопротеиновая реакция (качественная реакция на белок)
Растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
Раствор белка + HNO3 (конц) = желтое окрашивание.
Реакция Фоля (цистеиновая проба)
Эта реакция является качественной для аминокислот, содержащих серу:
Белок + (CH3COO)2Pb + NaOH = PbS + черное окрашивание.
Вопросы для самопроверки
Какая из структур белка является самой прочной?
Первичная
Вторичная
-
Третичная
Четвертичная
Какую из перечисленных функций способен выполнять белок?
Результативную
Регуляторную
Регулятивную
Растворную
За счет какой связи образуется первичная структура белка?
Ионной
Водородной
Пептидной
При гидролизе белка получается (получаются).
 ..
..Аминокислоты, образующие этот белок
Углекислый газ
Аминокислота и вода
Белок гидролизу не подвергается
Какая реакция с белком дает фиолетовое окрашивание?
Ксантопротеиновая
Цистеиновая
- Биуретовая
Денатурация
Еще больше наглядных примеров функций белков в клетках живых организмов — на онлайн-курсах химии в Skysmart. Мы поможем полюбить предмет, разобраться в непонятных темах, улучшить оценки в школе и подготовиться к государственным экзаменам. Выберите подходящий курс и начните учиться с удовольствием!
Мы поможем полюбить предмет, разобраться в непонятных темах, улучшить оценки в школе и подготовиться к государственным экзаменам. Выберите подходящий курс и начните учиться с удовольствием!
Ответы на вопросы
a
b
c
a
c
Ксения Боброва
К предыдущей статье
К следующей статье
Реакции обмена и химические уравнения для них
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Белки — химический состав, структура, общая формула
Поможем понять и полюбить химию
Начать учиться
Белки — основной строительный материал клеток, они составляют 15–20% общей массы человека. Так что разобраться в значении белков для организма человека важно не только ради экзамена по химии, но и для того, чтобы лучше понимать, как мы устроены, правильно питаться и быть здоровым.
Так что разобраться в значении белков для организма человека важно не только ради экзамена по химии, но и для того, чтобы лучше понимать, как мы устроены, правильно питаться и быть здоровым.
Что такое белок. Химический состав и образование белков
Белки — это высокомолекулярные органические соединения, которые состоят из аминокислотных остатков, соединенных между собой пептидной связью. Важно уточнить, что в состав белков входит только 20 альфа-аминокислот, тогда как всего ученым известно около 500 аминокислот. Общая формула белков выглядит следующим образом:
Греческая приставка «альфа-» в названиях альфа-аминокислот взялась из систематической номенклатуры. По ее правилам, следующий после карбоксильной группы углерод получает название первой буквы греческого алфавита — альфа, затем идет буква бета и так далее. В названии аминокислоты указывается греческая буква того углерода, у которого есть заместитель, в данном случае — аминогруппа.
Рассмотрим пример образования молекулы белка. Для этого познакомимся сначала с представителем альфа-аминокислот — альфа-аминопропановой кислотой.
Рассматривая строение молекулы, можно увидеть две конкурирующие по свойствам группы: карбоксильную, которая отвечает за кислотные свойства, и аминогруппу, которая отвечает за оснóвные свойства. Две молекулы аминокислот и более могут вступать в реакцию между собой, реагируя по разным функциональным группам. Именно таким образом получается пептид:
Соединение, которое образуется в результате взаимодействия двух аминокислот, называется дипептидом. Благодаря наличию двух свободных функциональных групп (карбоксильной и аминогруппы) дипептид может взаимодействовать с другими аминокислотами, увеличивая свое строение и превращаясь в полипептид.
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Аминокислоты и их значение для человеческого организма
Говоря об аминокислотах, важно рассмотреть понятие незаменимости. Основной критерий определения биологической ценности аминокислоты — это способность поддерживать рост человека, что, в свою очередь, связано с синтезом белка в живом организме.
Незаменимые аминокислоты — это такие кислоты, которые либо не синтезируются в организме, либо синтезируются со скоростью, недостаточной для обмена веществ и образования новых клеток и тканей.
Если исключить из рациона хотя бы одну из незаменимых аминокислот, это повлечет за собой задержку роста и снижение массы тела растущего организма.
К незаменимым аминокислотам относятся валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
Заменимые аминокислоты
— это те, которые организм может синтезировать самостоятельно или получить с продуктами питания. К ним относятся:
К ним относятся:| аланин | глицин | серин |
| аргинин | глютамин | таурин |
| аспарагин | инозитол | тирозин |
| аспартат | орнитин | цистеин |
| гистидин | пролин | цитруллин |
Давайте рассмотрим основные функции некоторых аминокислот в организме человека, чтобы лучше понять их значение:
- аспартат используется для процессов регенерации;
гистидин необходим маленьким детям, у которых недостаточен эндогенный синтез;
глютамин нужен для регенерационных процессов, важный энергетический субстрат в критических состояниях;
таурин нужен новорожденным, у которых недостаточен эндогенный синтез, а также больным в критических состояниях.
 Дефицит таурина возникает при недостатке метионина и цистеина;
Дефицит таурина возникает при недостатке метионина и цистеина;тирозин необходим маленьким детям, у которых недостаточен эндогенный синтез. При нарушении функции почек снижено образование тирозина из фенилаланина;
цистеин необходим маленьким детям, у которых недостаточен эндогенный синтез. Дефицит цистеина возникает при недостаточном содержании метионина в питании. Необходим при нарушениях функции печени, а также больным в критических состояниях.
Пептиды
Вернемся к продукту синтеза двух аминокислот — пептиду — и дадим ему определение.
Пептид — это продукт конденсации двух аминокислот или более, соединенных пептидной связью.
Пептид и белок — это одно и то же? Между ними действительно есть сходство, но есть и различия:
Основные различия — это структура и размер.
 Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.
Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.Пептиды менее строго определены в структуре, в то время как белки могут принимать сложные конформации.
Пептиды делятся на олигопептиды и полипептиды, а белок состоит из нескольких полипептидов.
Какие бывают белки
По строению
По строению белки делятся на простые (протеины) и сложные (протеиды):
составными частями простых белков являются в большинстве 20 различных остатков α–аминокислот;
сложные белки могут содержать ионы металлов или образовывать комплексные соединения с углеводами, липидами и др.
По форме молекулы
По форме молекулы белки подразделяются на глобулярные и фибриллярные:
форма молекулы глобулярных белков — глобула (сфера или эллипс).
 Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;
Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;форма молекулы фибриллярных белков — фибрилла (нити или волокна). Например, кератин (волосы, ногти, перья), коллаген (мускулы, сухожилия). Эти белки в воде не растворяются.
По аминокислотному составу
Как мы уже знаем, существуют незаменимые аминокислоты. Так вот, исходя из их наличия, белки бывают либо полноценные, либо неполноценные:
к полноценным относятся белки животного происхождения, также полноценные белки содержат некоторые растения: картофель, бобовые и другие;
к неполноценным относятся желатин и белки преимущественно растительного происхождения.
По растворимости
Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры и определяется природой тех групп, которые находятся на поверхности белковой молекулы.
Так, существуют белки (глобулины), которые растворяются только в растворах солей и не растворяются в чистой воде, а противоположные им альбумины хорошо растворимы в чистой воде.
К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген (сухожилия), фиброин (шелк, паутина).
Чтобы запомнить классификацию белков было проще, показали ее на картинке:
Структура белков
После того как мы рассмотрели все производные белков, пора переходить к структуре белков.
Как видно из рисунка, белки имеют 4 структуры: первичную, вторичную, третичную и четвертичную. Рассмотрим каждую чуть более подробно.
Первичная структура белка — это простейший вид белковой структуры. Представляет собой последовательность аминокислот в полипептидной цепи. Последовательность аминокислот в белке определяется ДНК, а именно геном, кодирующим этот белок.
 Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.
Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.Вторичная структура — пространственная структура, которая образуется в результате взаимодействия функциональных групп пептидного остова (полипептидная цепь без атомов R-групп). Самые распространенные формы вторичной структуры — это α-спираль и β-лист. Обе структуры удерживают форму благодаря водородным связям между кислородом карбонильной группы одной аминокислоты и водородом аминогруппы другой аминокислоты.
Третичная структура — это пространственное строение всей молекулы белка, состоящей из единственной цепи.
 Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.
Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.Четвертичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Подробнее об основных функциях белков и их химических свойствах можно узнать из другой нашей статьи. А чтобы убедиться, что вы запомнили характеристику белков, их строение, структуру и функции, приходите на онлайн-курсы химии в школу Skysmart. Здесь вас ждут интересные факты из мира химии, интерактивные задания и опытные преподаватели, которые всегда помогут и поддержат.
Ксения Боброва
К предыдущей статье
Тепловой эффект
К следующей статье
Моносахариды
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Руководство по форматированию названий генов и белков
Дата выпуска: 30 января 2014 г.
Категория: Научная работа
Автор: Кэтрин А., доктор философии.
В статьях, описывающих генетические исследования, читателям часто трудно определить, имеют ли в виду авторы ген или соответствующий ему белок. Это может быть проблематично, когда читатели пытаются понять детали сложных молекулярных систем и методологию, используемую авторами для исследования этих систем. Чтобы уменьшить этот потенциальный источник путаницы как для рецензентов, так и для более широкой аудитории вашей опубликованной статьи, важно последовательно использовать принятые правила форматирования для символов генов и белков во всей вашей рукописи.
Общие рекомендации по форматированию и написанию
Когда это возможно, чтобы уменьшить распространение повторяющихся названий генов, всегда используйте стандартные названия генов и символы, которые можно найти в базах данных сообщества, специфичных для конкретных организмов (например, человек: www.genenames.org; крыса: rgd.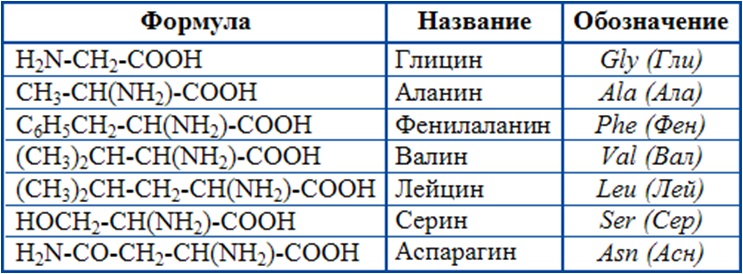 mcw. образование; мыши: www.informatics.jax.org; рыбки данио: zfin.org; мухи: flybase.org; черви: www.wormbase.org).
Использование стандартных названий генов и символов часто специально требуется научными и медицинскими журналами.
Если у гена еще нет утвержденного названия или символа, можно предложить новое название или обозначение символа в соответствующую базу данных или ее профессиональную ассоциацию.
mcw. образование; мыши: www.informatics.jax.org; рыбки данио: zfin.org; мухи: flybase.org; черви: www.wormbase.org).
Использование стандартных названий генов и символов часто специально требуется научными и медицинскими журналами.
Если у гена еще нет утвержденного названия или символа, можно предложить новое название или обозначение символа в соответствующую базу данных или ее профессиональную ассоциацию.
Как правило, символы генов выделены курсивом (например, IGF1 ), тогда как символы белков курсивом не выделены (например, IGF1).
Форматирование символов для РНК и комплементарной ДНК (кДНК) обычно следует тем же соглашениям, что и для символов генов.
Если несколько генов перечислены вместе в таблице, обычно на усмотрение авторов (или журнала) следует ли выделять их курсивом.
Названия генов, написанные полностью, курсивом не выделяются (например, инсулиноподобный фактор роста 1). Обозначения генотипа должны быть выделены курсивом, тогда как обозначения фенотипа не должны быть выделены курсивом.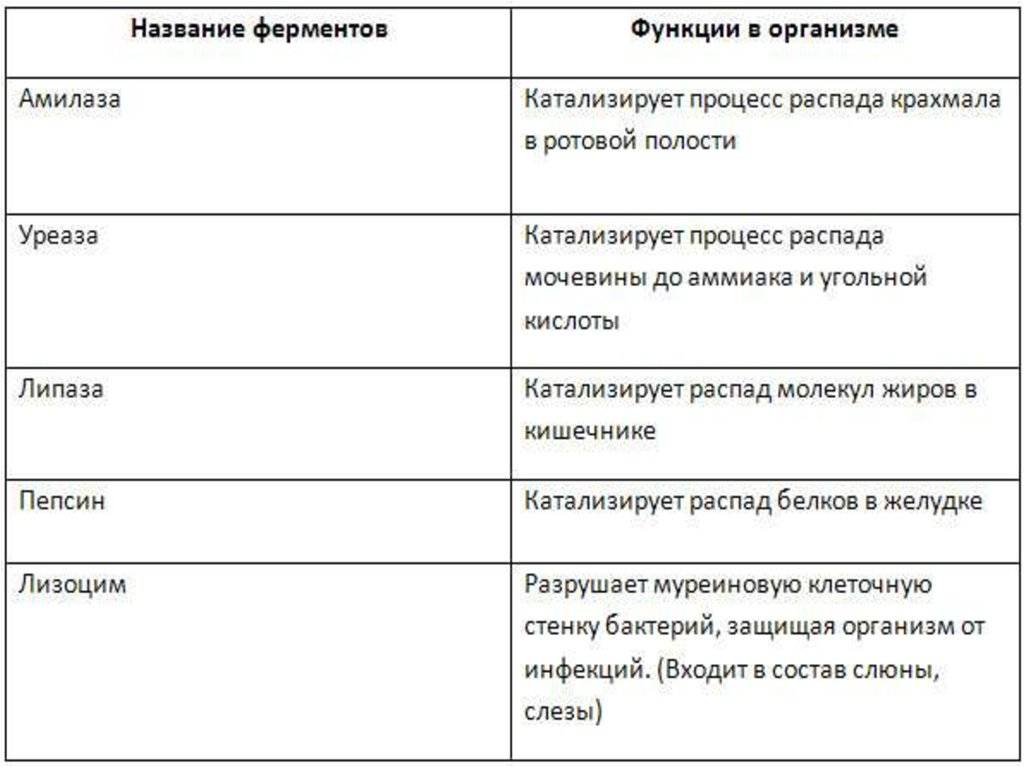 Несколько правил форматирования также зависят от типа организма, и они более подробно обсуждаются ниже.
Несколько правил форматирования также зависят от типа организма, и они более подробно обсуждаются ниже.
Хотя опытные читатели могут быть знакомы с символами генов и белков, неспециалисты могут не быть уверены в том, какие конкретные гены или белки представлены. Таким образом, рекомендуется указывать полное название гена или белка с последующим его символом в скобках при первом использовании (например, ген хантингтина ( HTT )), особенно если ваша статья будет опубликована в журнале с широкой читательской аудиторией.
В дополнение к форматированию символов генов и белков существуют также способы подчеркнуть разницу между генами и белками путем тщательного выбора слов в письме.
Например, может быть полезно четко указать, имеете ли вы в виду ген или белок, особенно в предложениях, в которых упоминаются и ген, и его продукт (например, «Мы количественно оценили Экспрессия гена АРОЕ и уровни белка АРОЕ. . . “).
Кроме того, вы можете выборочно использовать термин «экспрессия», когда речь идет о генах, и термин «уровни», когда речь идет о РНК или белках.
Рекомендации по форматированию для конкретных организмов
Хотя общее правило, согласно которому символы генов выделены курсивом, а символы белков не выделены курсивом, остается верным независимо от типа организма, между организмами существует несколько вариаций в составе и написании буквенно-цифровых символов в символах генов и белков.
Люди, нечеловеческие приматы, куры и домашние виды: Генные символы содержат от трех до шести выделенных курсивом символов, которые все написаны прописными буквами (например, AFP ). Генные символы могут быть комбинацией букв и арабских цифр (например, 1, 2, 3), но всегда должны начинаться с буквы; обычно они не содержат римских цифр (например, I, II, III), греческих букв (например, α, β, γ) или знаков препинания. Символы белков идентичны соответствующим символам генов, за исключением того, что они не выделены курсивом (например, AFP).
Мыши и крысы: Генные символы выделены курсивом, только первая буква в верхнем регистре (например, Gfap ).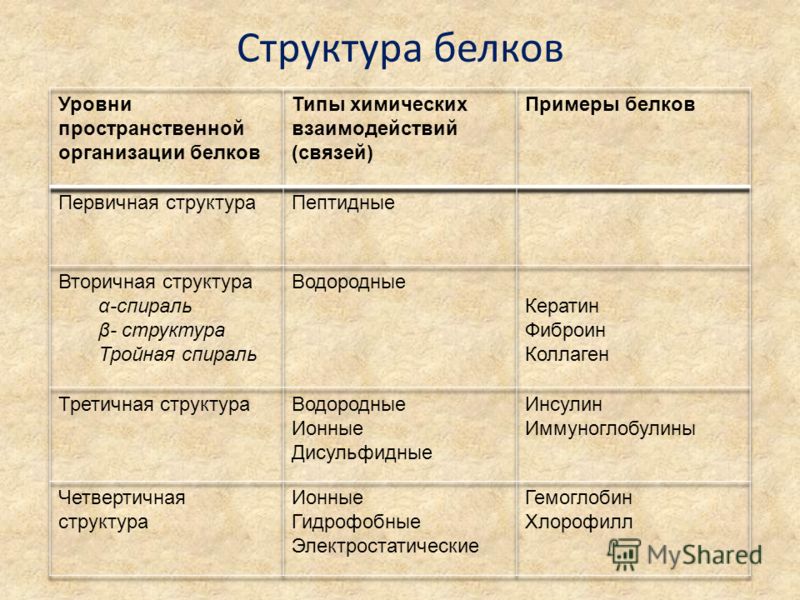 Символы белка не выделены курсивом, и все буквы в верхнем регистре (например, GFAP).
Символы белка не выделены курсивом, и все буквы в верхнем регистре (например, GFAP).
Рыба: В отличие от общего правила полные названия генов выделены курсивом (например, латунь ). Генные символы также выделены курсивом, все буквы в нижнем регистре (например, brs ). Символы белка не выделены курсивом, а первая буква заглавная (например, Brs).
Мухи: Названия и символы генов начинаются с заглавной буквы, если: (1) ген назван в честь белка или (2) ген был впервые назван в честь мутантного фенотипа, который доминирует над фенотипом дикого типа ( например, Rpp30 ).
Имена и символы генов начинаются со строчной буквы, если ген был впервые назван в честь мутантного фенотипа, рецессивного по отношению к фенотипу дикого типа (например, kis ).
Символы генов выделены курсивом.
Символы для белков, названных в честь генов, начинаются с прописной буквы, но общепринятых правил форматирования для белков, названных не в честь генов, не существует. Символы белков курсивом не выделены.
Символы белков курсивом не выделены.
Черви: Генные символы выделены курсивом и обычно состоят из трех-четырех букв, дефиса и арабского числа (например, abu-1 ). Символы белка не выделены курсивом, а все буквы в верхнем регистре (например, ABU-1).
Бактерии: Генные символы обычно состоят из трех строчных букв, выделенных курсивом, которые служат аббревиатурой процесса или пути, в который вовлечен продукт гена (например, 9гены 0013 rpo кодируют R NA po лимеразу). Чтобы различать разные аллели, за аббревиатурой следует заглавная буква (например, ген rpoB кодирует β-субъединицу РНК-полимеразы). Символы белка не выделены курсивом, а первая буква прописная (например, RpoB).
Руководство по форматированию журнала
Несмотря на то, что следование этим общим рекомендациям повысит точность вашего научного письма и предотвратит путаницу среди ваших читателей, важно помнить, что в разных журналах иногда действуют разные правила в отношении того, как генетические термины (например, гены, РНК, кДНК, белки, генотипы, фенотипы, обозначение мутантных аллелей) должны быть оформлены.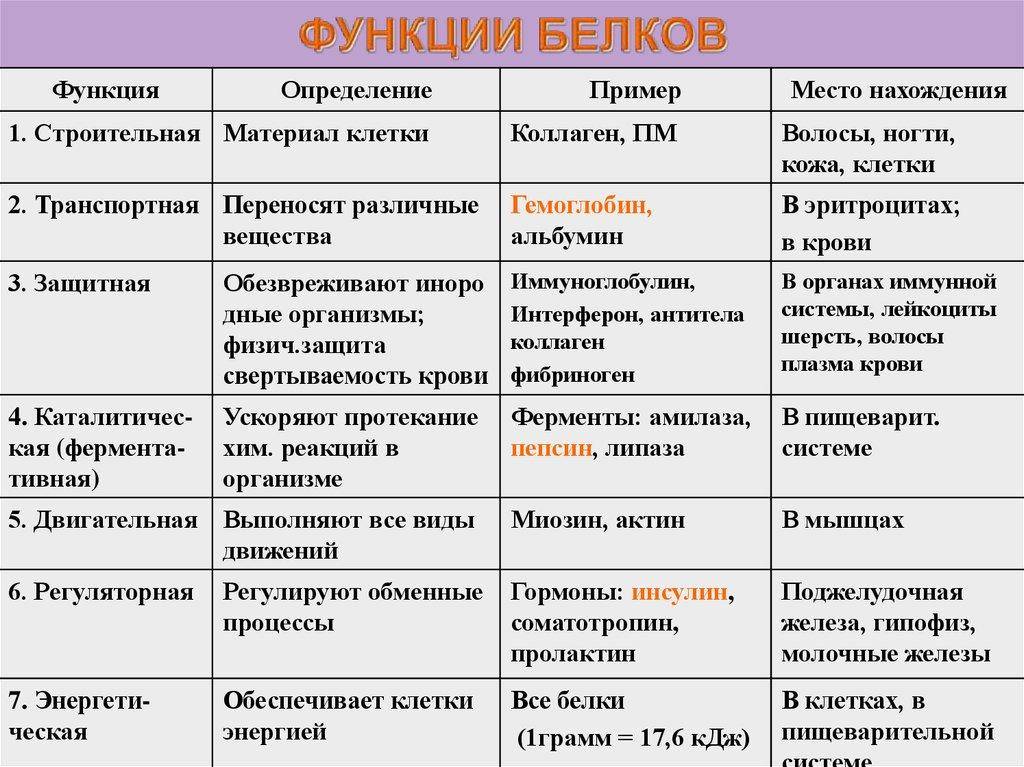 Поэтому, прежде чем отправлять рукопись в журнал, мы рекомендуем проверить, соответствует ли ваше форматирование конкретным правилам журнала, которые могут быть представлены в «Инструкциях для авторов» на веб-сайте журнала.
Поэтому, прежде чем отправлять рукопись в журнал, мы рекомендуем проверить, соответствует ли ваше форматирование конкретным правилам журнала, которые могут быть представлены в «Инструкциях для авторов» на веб-сайте журнала.
Дополнительные ресурсы
- Страница Википедии по номенклатуре генов:
https://en.wikipedia.org - Руководство по стилю Национального центра биотехнологии:
https://www.ncbi.nlm.nih.gov - Руководство по номенклатуре генов человека:
https://www.genenames.org - Руководство по номенклатуре генов, генетических маркеров, аллелей и мутаций у мышей и крыс:
https://www.informatics.jax.org - Генетическая номенклатура Drosophila melanogaster:
https://flybase.org - Генетическая номенклатура Caenorhabditis elegans:
https://www.wormbase.org
Семинары по научному письму
Если вам нравятся наши статьи, попробуйте наши мастер-классы!
Наши статьи основаны на материалах наших семинаров по написанию научных статей, которые более подробно освещают эти и многие другие темы, содержат больше примеров и обсуждений.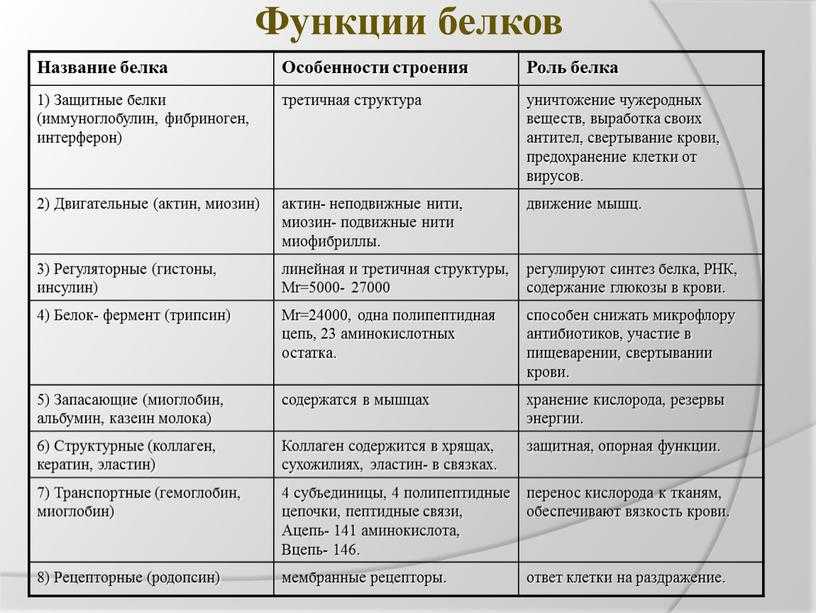
Мы предлагаем семинары на месте для вашего мероприятия или организации, а также проводим семинары, которые могут посетить отдельные участники. Наши выездные семинары по научному письму могут длиться от 1-2 часов до нескольких дней. Мы можем адаптировать продолжительность в соответствии с вашими потребностями, и мы можем провести письменный семинар как отдельное мероприятие или как часть запланированных встреч.
Наши семинары по написанию научных работ неизменно получают высокую оценку участников, включая аспирантов, докторантов и преподавателей в различных областях. Подробности смотрите на странице семинара по научному письму.
Если вы нашли эту статью полезной или если есть тема, которую вы хотите, чтобы мы рассмотрели в будущей статье, пожалуйста,
используйте наш
онлайн-форма отправки комментариев,
или
свяжитесь с нами напрямую. Ваши комментарии и предложения ценны!
Нажмите здесь, чтобы вернуться в нашу библиотеку научных статей для редактирования.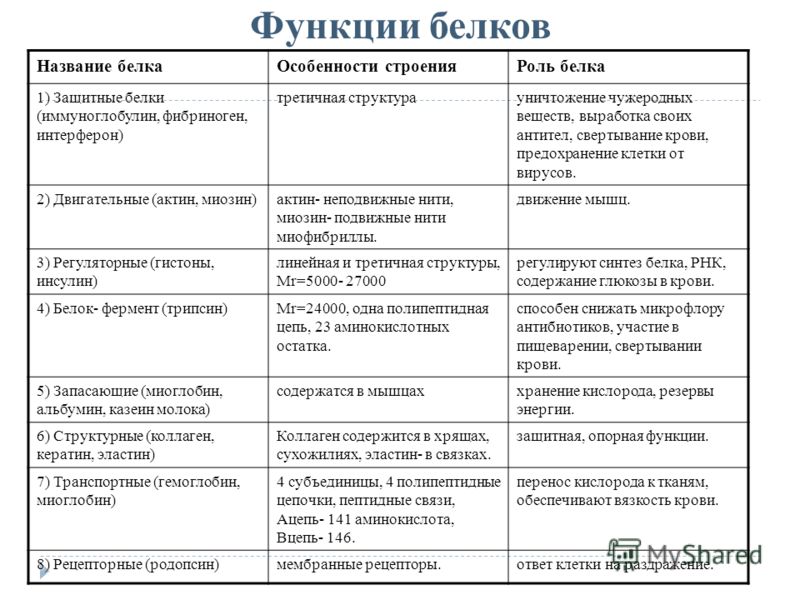
Коды, используемые в описании последовательности
Аннотированные/собранные последовательности DDBJ
Нуклеотид
Базовые коды нуклеотидов
Коды оснований нуклеотидов, которые используются с Международным
База данных нуклеотидных последовательностей выглядит следующим образом.
Данные последовательности выражаются только строчными буквами. Заглавная буква будет
быть автоматически преобразованы в строчные буквы.
| Символ | Значение | Пояснение |
|---|---|---|
| и | и | аденин |
| с | в | цитозин |
| г | г | гуанин |
| т | т | тимин в ДНК; урацил в РНК |
| м | а или с | амино |
| р | а или г | пурин |
| ш | а или т | |
| с | с или г | |
| у | с или т | пиримидин |
| к | г или т | кето |
| против | а или в или г | не т |
| ч | а или с или т | не г |
| д | а или г или т | не c |
| б | с или г или т | не |
| п | а или в или г или т | любой |
[Ссылки]
- Cornish-Bowden, A.
 Nucl Acid Res 13, 3021-3030 (1985)
Nucl Acid Res 13, 3021-3030 (1985) - Определение таблицы характеристик: 7.4.1 Коды оснований нуклеотидов (IUPAC)
Модифицированные базовые сокращения
Пример описания модифицированной базы в строке FEATURES.
Пример
ОСОБЕННОСТИ Место/Квалификаторы
модифицированная_база 15
/mod_base="m2g"
| Сокращение | Модифицированное базовое описание |
|---|---|
| ак4с | 4-ацетилцитидин |
| чм5у | 5-(карбоксигидроксиметил)уридин |
| см | 2’-O-метилцитидин |
| смнм5с2у | 5-карбоксиметиламинометил-2-тиуридин |
| смнм5у | 5-карбоксиметиламинометилуридин |
| зху | дигидроуридин |
| FM | 2’-O-метилпсевдоуридин |
| галлона | бета, D-галактозилкевозин |
| г | 2’-O-метилгуанозин |
| и | инозин |
| и6а | N6-изопентениладенозина |
| м1а | 1-метиладенозин |
| м1ф | 1-метилпсевдоуридин |
| м1г | 1-метилгуанозин |
| м1и | 1-метилинозин |
| м22г | 2,2-диметилгуанозин |
| м2а | 2-метиладенозин |
| м2г | 2-метилгуанозин |
| м3с | 3-метилцитидин |
| м4с | N4-метилцитозин |
| м5с | 5-метилцитидин |
| м6а | N6-метиладенозин |
| м7г | 7-метилгуанозин |
| мам5у | 5-метиламинометилуридин |
| мам5с2у | 5-метоксиаминометил-2-тиуридин |
| человек q | бета, D-маннозилкевозин |
| мкм5с2у | 5-метоксикарбонилметил-2-тиуридин |
| мкм5у | 5-метоксикарбонилметилуридин |
| мо5у | 5-метоксиуридин |
| мс2и6а | 2-метилтио-N6-изопентениладенозина |
| мс2т6а | N-((9-бета-D-рибофуранозил-2-метилтиопурин-6-ил)карбамоил)треонин |
| мт6а | N-((9-бета-D-рибофуранозилпурин-6-ил)N-метилкарбамоил)треонин |
| мв | метиловый эфир уридин-5-оксиуксусной кислоты |
| о5у | уридин-5-оксиуксусная кислота (v) |
| osyw | вибутоксозин |
| р | псевдоуридин |
| к | кеуозин |
| с2к | 2-тиоцитидин |
| с2т | 5-метил-2-тиуридин |
| с2у | 2-тиуридин |
| с4у | 4-тиуридин |
| м5у | 5-метилуридин |
| т6а | N-((9-бета-D-рибофуранозилпурин-6-ил)карбамоил)треонин |
| тм | 2’-О-метил-5-метилуридин |
| мм | 2’-O-метилуридин |
| гв | вибутозин |
| х | 3-(3-амино-3-карбоксипропил)уридин, (acp3)u |
| ДРУГОЕ | Другое (/примечание квалификатор に修飾塩基を記載します) |
[Ссылки]
- Sprinzl, M.
 and Gauss, D.H. Nucl Acid Res 10, r1 (1982) (обратите внимание, что
в Cornish_Bowden, A. Nucl Acid Res 13, 3021-3030 (1985)
IUPAC-IUB отказался рекомендовать набор сокращений для модифицированных
нуклеотиды)
and Gauss, D.H. Nucl Acid Res 10, r1 (1982) (обратите внимание, что
в Cornish_Bowden, A. Nucl Acid Res 13, 3021-3030 (1985)
IUPAC-IUB отказался рекомендовать набор сокращений для модифицированных
нуклеотиды) - Определение таблицы характеристик: 7.4.2 Изменено базовые сокращения
Аминокислота
Коды аминокислот
Код аминокислоты, который используется с Международным кодом нуклеотидов.
База данных последовательностей выглядит следующим образом.
Эти аминокислоты обозначаются однобуквенной аббревиатурой в
/translation квалификатор CDS
особенность.
Перечисленные аббревиатуры аминокислот являются допустимыми значениями для квалификаторов
/transl_кроме и
/антикодон.
Те, которые не включены в «Коды аминокислот», см.
Модифицированные и необычные аминокислоты.
| Сокращение | 1 буквенное сокращение | Название аминокислоты |
|---|---|---|
| Аля | А | Аланин |
| Арг | Р | Аргинин |
| Асн | Н | Аспарагин |
| Асп | Д | Кислота аспарагиновая |
| Цис | С | Цистеин |
| Глн | В | Глютамин |
| Клей | Э | Глутаминовая кислота |
| Гли | Г | Глицин |
| Его | Х | Гистидин |
| Иль | я | Изолейцин |
| Лев | л | Лейцин |
| Лис | К | Лизин |
| Мет | М | Метионин |
| Фе | Ф | Фенилаланин |
| Про | Р | Пролин |
| Пыл | О | Пирролизин |
| Серия | С | Серин |
| сек | У | Селеноцистеин |
| Тр | Т | Треонин |
| Трп | Вт | Триптофан |
| Тыр | Д | Тирозин |
| Вал | В | Валин |
| Асх | Б | Аспарагиновая кислота или аспарагин |
| Глюкс | З | Глутаминовая кислота или глутамин |
| Хаа | Х | Любая аминокислота |
| Шле | Дж | Лейцин или изолейцин |
| СРОК | терминирующий кодон |
[Ссылки]
- Совместная комиссия IUPAC-IUB по биохимической номенклатуре.
 Номенклатура
и символизм аминокислот и пептидов. Евро. Дж. Биохим. 138:
9–37 (1984).
Номенклатура
и символизм аминокислот и пептидов. Евро. Дж. Биохим. 138:
9–37 (1984). - Определение таблицы функций: 7.4.3 Amino кислотные сокращения
Модифицированные и необычные аминокислоты
Для других аминокислот, не входящих в состав Amino Acid Коды, используются приведенные ниже аббревиатуры. Все эти амино кислоты обозначаются однобуквенной аббревиатурой «Х» в /translation квалификатор CDS особенность.
| Сокращение | Название аминокислоты |
|---|---|
| Аад | 2-аминоадипиновая кислота |
| БАД | 3-аминоадипиновая кислота |
| бала | бета-аланин, бета-аминопропионовая кислота |
| Абу | 2-аминомасляная кислота |
| 4Абу | 4-Аминомасляная кислота, пиперидиновая кислота |
| Акп | 6-аминокапроновая кислота |
| Ахэ | 2-Аминогептановая кислота |
| Аиб | 2-аминоизомасляная кислота |
| бАиб | 3-аминоизомасляная кислота |
| Вечер | 2-аминопимелиновая кислота |
| Дбу | 2,4-диаминомасляная кислота |
| Des | Десмозин |
| ДПМ | 2,2’-диаминопимелиновая кислота |
| Дпр | 2,3-Диаминопропионовая кислота |
| ЭтГли | N-этилглицин |
| ЭтАсн | N-этиласпарагин |
| Хил | Гидроксилизин |
| ахил | алло-гидроксилизин |
| 3Hyp | 3-гидроксипролин |
| 4Hyp | 4-гидроксипролин |
| Иде | Изодесмозин |
| али | алло-изолейцин |
| МеГли | N-метилглицин, саркозин |
| Меле | N-метилизолейцин |
| Мелис | 6-N-метиллизин |
| МеВал | N-метилвалин |
| Нва | Норвалин |
| Нле | Норлейцин |
| Орн | Орнитин |
| ДРУГОЕ | Другое ( (Аминокислота, не указанная в этом списке, должна быть описана в квалификаторе /примечание) |
[Ссылки]
- Определение таблицы характеристик: 7.

 ..
.. Дефицит таурина возникает при недостатке метионина и цистеина;
Дефицит таурина возникает при недостатке метионина и цистеина; Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.
Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот. Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;
Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде; Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.
Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа. Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.
Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы. Nucl Acid Res 13, 3021-3030 (1985)
Nucl Acid Res 13, 3021-3030 (1985) and Gauss, D.H. Nucl Acid Res 10, r1 (1982) (обратите внимание, что
в Cornish_Bowden, A. Nucl Acid Res 13, 3021-3030 (1985)
IUPAC-IUB отказался рекомендовать набор сокращений для модифицированных
нуклеотиды)
and Gauss, D.H. Nucl Acid Res 10, r1 (1982) (обратите внимание, что
в Cornish_Bowden, A. Nucl Acid Res 13, 3021-3030 (1985)
IUPAC-IUB отказался рекомендовать набор сокращений для модифицированных
нуклеотиды) Номенклатура
и символизм аминокислот и пептидов. Евро. Дж. Биохим. 138:
9–37 (1984).
Номенклатура
и символизм аминокислот и пептидов. Евро. Дж. Биохим. 138:
9–37 (1984).