| 1. |
Какие свойства у воды?
Сложность: лёгкое |
1 |
| 2. |
Какие вещества растворяются в воде?
Сложность: лёгкое |
1 |
3.
|
Фильтрование
Сложность: лёгкое |
1 |
| 4. |
Дополни предложение
Сложность: среднее |
1 |
5. |
Вопросы о свойствах воды
Сложность: среднее |
2 |
| 6. |
Значение воды для живых организмов
Сложность: среднее |
2 |
7.
|
Найди массу воды
Сложность: среднее |
2 |
| 8. |
Соответствие
Сложность: сложное |
4 |
9.
|
Воздух и вода Сложность: сложное | 4 |
Свойства воды
Вода в природе существует в твердом, жидком и парообразном состоянии. Это единственное вещество, которое мы можем наблюдать в трех агрегатных состояниях.
При переходе из жидкого состояния в твердое другие вещества сжимаются, так как уменьшается расстояние между молекулами; вода же ведет себя совсем наоборот.
Она при замерзании теряет плотность и поднимается на поверхность вместо того, чтобы идти на дно.
Значение поверхностного натяжения воды больше, чем у любой другой жидкости. Именно это свойство влияет на процесс образования дождевых капель, а, стало быть, и на круговорот воды в природе. В противном случае пары воды, поднявшись в небо и обратившись в облака, не смогли бы так легко и просто превратиться в капли, чтобы затем пролиться дождем на землю.
Наибольшая температура кипения среди всех веществ, встречающихся в природе в жидком виде — опять у воды: около ста градусов по Цельсию. Это обстоятельство способствует замедлению процессов испарения и помогает избежать больших потерь воды.
Молекула воды не может возникнуть так, чтобы к атому кислорода прицепилось с двух противоположных сторон по атому водорода. Напротив, атом кислорода присоединяется к двум атомам водорода, в результате чего последние составляют положительно заряженный полюс молекулы, а атом кислорода, находясь на противоположной стороне, составляет отрицательно заряженный полюс. Образуются двухполюсные молекулы воды, которые начинают группироваться друг с другом, притягиваясь разными полюсами.
Напротив, атом кислорода присоединяется к двум атомам водорода, в результате чего последние составляют положительно заряженный полюс молекулы, а атом кислорода, находясь на противоположной стороне, составляет отрицательно заряженный полюс. Образуются двухполюсные молекулы воды, которые начинают группироваться друг с другом, притягиваясь разными полюсами.
Еще одно удивительное свойство воды заключается в следующем. В одной группе с кислородом в периодической системе химических элементов находятся сера (S), селен (Se) и теллурий (Te). Тем не менее, соединения этих элементов с водородом даже близко не напоминают воду. Например, сероводород — H2S — это газ с неприятным запахом тухлых яиц. Да и другие соединения в нормальных условиях находятся в газообразном состоянии. Их молекулы тяжелее молекулы воды: у H
По сравнению с другими жидкостями вода обладает наивысшим показателем электрического сопротивления. В водной среде сила притяжения наэлектризованных частиц друг к другу достаточно слаба, поэтому ионизированные частицы солей прекрасно растворяются в воде, хотя большинство этих солей имеет слабую растворимость в органических жидкостях.
Образовавшиеся в атмосфере дождевые капли, начав свое движение, приходят в соприкосновение с кислородом, азотом и углекислым газом, которые растворяются в них. Мельчайшие твердые частички, находящиеся в атмосфере, также оказываются в плену у дождевых капель.
В воде повышается кислотность при смешивании с углекислым газом: она становится более сильным растворителем. А когда в атмосфере становится много оксида серы и азота (эти соединения образуются в результате сжигания топлива), кислотность воды растет еще больше. В итоге месте с дождевыми каплями на землю попадают растворы кислот. В такой среде растворяются и те вредные вещества, которые раньше не могли смешаться с дождевыми каплями. А значит, возникает опасность отравления и растений, и животных, и человека.
А значит, возникает опасность отравления и растений, и животных, и человека.
Кислотные дожди опасны и для водоемов. От них гибнут обитатели рек и озер, а вода становится непригодной для питья. В местах с очень плохой экологической обстановкой уничтожаются целые леса. Так, например, произошло в Карабаше, городе на Урале, который по праву считают самым грязным населенным пунктом планеты.
Самые главные свойства воды в картинках
Свойства питьевой воды | Доставка питьевой воды Аквалайн
Физиологически полноценная питьевая вода (47;78) с уровнем минерализации 150-350 мг/л по праву может считаться эталоном качества питьевой воды для Санкт-Петербурга и Ленинградской области. Именно такую воду добывает и доставляет потребителям наша компания.
Немного истории
В конце 90-х годов прошлого столетия в Санкт Петербурге начинал формироваться рынок бутилированной питьевой воды, переработанной из водопровода по западной технологии – очистка воды обратным осмосом. Этот метод вызывал большие сомнения в целесообразности его применения, так как вода при очистке делается близкой к дистиллированной, которая не содержит солей и при длительном использовании способна разбалансировать работу организма человека.
Этот метод вызывал большие сомнения в целесообразности его применения, так как вода при очистке делается близкой к дистиллированной, которая не содержит солей и при длительном использовании способна разбалансировать работу организма человека.
 Ю., Воронюк Г.Ю. «Гидрогеологичес
Ю., Воронюк Г.Ю. «Гидрогеологичесдля регионов № 47 (Ленинградская область) и 78 (Санкт-Петербург).
ФППВ(47; 78;) по своим химическим, микробиологическим и физическим параметрам полностью соответствует основным научным критериям действительно полезной питьевой воды. Именно такая вода может нести полноценную, здоровую жизнь, в том случае, если она местная, энергетически и информационно чиста, биологически активна и с оптимальным для организма составом.
Несмотря на то, что в регионе воды много, по-настоящему полезной питьевой воды мало. Это подтверждается продолжительными исследованиями и многочисленными комплексными анализами подземных вод. Только в четырёх районах Ленинградской области есть физиологически полноценные подземные питьевые воды и их дебит позволяет производить розлив для питьевых целей. Это уникальные подземные воды — химический состав и энергоинформацио
Это подтверждается продолжительными исследованиями и многочисленными комплексными анализами подземных вод. Только в четырёх районах Ленинградской области есть физиологически полноценные подземные питьевые воды и их дебит позволяет производить розлив для питьевых целей. Это уникальные подземные воды — химический состав и энергоинформацио
В естественной природной среде подземные воды структурируются путем длительной фильтрации с поверхности земли до места коптажа в подземной толще водоносного горизонта, пронизываясь энергетическими потоками земли и космическими излучениями, что обеспечивает природную чистоту и первозданность воды.
Места расположения водоисточников отличаются особыми природными свойствами – это районы чистых озер, родников и больших лесных массивов.

Информационное насыщение питьевой воды происходит под воздействием уникального ландшафта местности – это озерная гладь, капелька росы на веточке сосны, листочках, журчанье ручья, свежесть и умиротворение. В таких водах сохранена энергия жизни. Энерго-информаци
Русский врач-терапевт М. Мудров в XVIII веке писал: «Зная взаимные действия друг на друга души и тела, долгом считаю заметить, что есть и душевные лекарства, кои врачуют тело». Таким лекарством обладает слово (энергоинформаци Например, если воспроизводить классическую музыку, кристаллы приобретают правильную симметричную форму, а после «прослушивания» рока — располагаются в хаотичном порядке. Точно так же вода по-разному реагирует на различные слова, звуки и даже мысли. Известны также случаи, когда подопытные животные погибали, выпив воды, которая некоторое время стояла в абсолютно герметичном сосуде рядом с ядом. Иными словами, вода — это не просто вещество, а живая материя, способная «напитываться» окружающей информацией и потом «транслировать» ее окружающему миру.
Например, если воспроизводить классическую музыку, кристаллы приобретают правильную симметричную форму, а после «прослушивания» рока — располагаются в хаотичном порядке. Точно так же вода по-разному реагирует на различные слова, звуки и даже мысли. Известны также случаи, когда подопытные животные погибали, выпив воды, которая некоторое время стояла в абсолютно герметичном сосуде рядом с ядом. Иными словами, вода — это не просто вещество, а живая материя, способная «напитываться» окружающей информацией и потом «транслировать» ее окружающему миру.
В настоящее время факт существования энергоинформацио
По минеральному составу и микро и макроэлементам ФППВ ( 47: 87) идеально подходит для организма человека. Питьевая вода мягкая. Очень жесткая или очень мягкая вода одинаково не подходят для нормального функционирования клеток организма. Диаметр молекул воды ФППВ (47;78) позволяет легко проходить сквозь мембрану клеток организма, поэтому химические реакции в организме протекают быстрее и обмен веществ активизируется.
Очень жесткая или очень мягкая вода одинаково не подходят для нормального функционирования клеток организма. Диаметр молекул воды ФППВ (47;78) позволяет легко проходить сквозь мембрану клеток организма, поэтому химические реакции в организме протекают быстрее и обмен веществ активизируется.
ФППВ (47; 78) биологически доступна, легкоусваиваема, имеет максимальную проникающую способность через мембраны клеток организма, основные физические и физиологические характеристики сравнимые с внутриклеточной средой.
Содержание основных жизненно важных биогенных элементов ФППВ (47; 78): кальций — 15 мг/л, магний — 10 мг/л, калий — 5 мг/л, бикарбонаты — 100-300 мг/л, фторид-ионы — 0,5-1,0 мг/л, йодид-ионы — 5-100 мкг/л, Ph — 7,4–8,3, общая жесткость — 1,5-2,5 мг-экв/л. Вода мягкая, в ней хорошо заваривается чай, кофе. Жёсткой считается вода, в которой содержатся в больших концентрациях соли кальция и магния. Мягкая вода – это вода, которая содержит мало солей. Жесткую воду не рекомендуется использовать в питьевых целях, т.к. содержащиеся в них в избыточном количестве минеральные соли плохо усваиваются организмом и они откладываются в суставах, хрящах, на стенках сосудов. В отличие от жесткой, мягкая вода, в основном выступает в роли оздоровительного фактора.
Жесткую воду не рекомендуется использовать в питьевых целях, т.к. содержащиеся в них в избыточном количестве минеральные соли плохо усваиваются организмом и они откладываются в суставах, хрящах, на стенках сосудов. В отличие от жесткой, мягкая вода, в основном выступает в роли оздоровительного фактора.
ФППВ (47; 78) благодаря стерильности, свежести, естественной минерализации, биологической активности, обусловленными кругооборотом воды в природе, несёт жизненную энергию и является главным профилактическим средством заболеваний и средством немедикаментозного оздоровления населения. Вода имеет собственную биоэнергетику, задаваемую её природным свойством — это фрактальная, диссиметричная питьевая вода.
Употребление ФППВ(47; 78) снижает опасность возникновения артрита, атеросклероза. Эта вода полезна для людей, предрасположенны Питьевая вода ФППВ(47; 78) не содержит никакой отрицательной, негативной для организма человека информации. Полезные свойства воды раскрываются полностью при правильном её использовании. Воду необходимо пить сырой в необходимом количестве, тогда эта вода будет способствовать оздоровлению всего организма. Ежедневная норма питьевой воды при весе человека 70 кг — 1,5-2,5 литра. При физических нагрузках и жаре количество употребляемой воды увеличивается. ФППВ(47;78 ) восстанавливает весь организм, возвращает естественное состояние здоровья. Водный фактор обеспечивает по всем направлениям физиологии человека правильное энергообеспечени
Питьевая вода ФППВ(47; 78) не содержит никакой отрицательной, негативной для организма человека информации. Полезные свойства воды раскрываются полностью при правильном её использовании. Воду необходимо пить сырой в необходимом количестве, тогда эта вода будет способствовать оздоровлению всего организма. Ежедневная норма питьевой воды при весе человека 70 кг — 1,5-2,5 литра. При физических нагрузках и жаре количество употребляемой воды увеличивается. ФППВ(47;78 ) восстанавливает весь организм, возвращает естественное состояние здоровья. Водный фактор обеспечивает по всем направлениям физиологии человека правильное энергообеспечени
Утверждение о том, что энергию организму поставляет пища за счет образования аденозинтрифосфа Вода приводит в действие натриево-калиевы
Вода приводит в действие натриево-калиевы
ФППВ (47; 78) способствует поддержанию в организме условий, которые препятствуют развитию патологий в организме. Вода безопасна в бактериологическом отношении и отличается великолепными органолептическими свойствами.
Эталоном питьевой воды в Санкт-Петербурге по праву может считать физиологически полноценная питьевая вода Аквалайн Природная Премиум, которую можно заказать на нашем сайте!
Факты о воде
Вода сама по себе не имеет питательной ценности, но она – непременная составляющая часть всего живого. Ни один из живых организмов нашей планеты не может существовать без воды.
Из воды состоят все живые растительные и животные существа:
рыбы – на 75%; медузы – на 99%; картофель — на 76%; яблоки — на 85%; помидоры — на 90%; огурцы — на 95%; арбузы — на 96%.
В целом организм человека состоит по весу на 50-86% из воды (86% у новорожденного и до 50% у пожилых людей). Содержание воды в различных частях тела составляет: кости – 20-30%; печень — до 69%; мышцы – до 70%; мозг – до 75%; почки — до 82%; кровь – до 85%.
Это обстоятельство позволило фантасту В. Савченко заявить о том, что у человека “гораздо больше оснований считать себя жидкостью, чем, скажем, у сорокапроцентного раствора едкого натрия”.
На протяжении всей своей жизни человек ежедневно имеет дело с водой. Он использует ее для питья и пищи, для умывания, летом – для отдыха, зимой – для отопления.
Для человека вода является более ценным природным богатством, чем уголь, нефть, газ, железо, потому что она незаменима.
Без пищи человек может прожить около 50-ти дней, если во время голодовки он будет пить пресную воду, без воды он не проживет и неделю — смерть наступит через 5 дней. По данным медицинских экспериментов при потере влаги в размере 6-8% от веса тела человек впадает в полуобморочное состояние, при потере 10% — начинаются галлюцинации, при 12% человек не может восстановиться без специальной медицинской помощи, а при потере 20% наступает неизбежная смерть.
В организме человека вода:
- увлажняет кислород для дыхания;
- регулирует температуру тела;
- помогает организму усваивать питательные вещества;
- защищает жизненно важные органы;
- смазывает суставы;
- помогает преобразовать пищу в энергию;
- участвует в обмене веществ;
- выводит различные отходы из организма.
Человек начинает испытывать жажду, когда количество воды в его теле уменьшается на 1-2% (0,5- 1,0л). Потеря 10% влаги от веса тела может привести к необратимым изменениям в организме, а потеря 20% (7 — 8л) уже смертельна.
Обычный человек теряет в день 2-3 литра воды. В жаркую погоду, при высокой влажности, во время занятий спортом расход воды возрастает. Даже благодаря дыханию человек теряет почти пол-литра воды ежедневно.
Правильный питьевой режим подразумевает сохранение физиологического водного баланса — это уравновешивание поступления и образования воды с ее выделением.
Суточная потребность взрослого человека в воде – 30-40 грамм на 1 кг веса тела. Приблизительно 40% ежедневной потребности организма в воде удовлетворяется с пищей, остальное мы должны принимать в виде различных напитков. Летом ежедневно нужно употреблять 2 — 2,5 литра воды. В жарких районах планеты — 3,5 — 5,0л в сутки, а при температуре воздуха 38–40С и низкой влажности работающим на открытом воздухе потребуется в сутки 6,0 — 6,5л воды. При этом нельзя ориентироваться на то, испытываете вы жажду или нет, поскольку этот рефлекс возникает уже поздно и не является адекватным показателем того, сколько воды нужно вашему организму.
Небезынтересно узнать, что в кашах содержится до 80% воды, в хлебе – около 50%, в мясе – 58-67%, в овощах и фруктах – до 90% воды, т.е. “сухая” еда состоит на 50-60% из воды.
А около 3% (0,3л) воды образуется в результата биохимических процессов в самом организме.
По некоторым оценкам за 60 лет жизни человек выпивает около 50т воды – целую цистерну!
Участвуя в обмене веществ, вода позволяет уменьшить жировые накопления и снизить вес. Многие из тех, кто хочет похудеть, считают, что их организм удерживает воду и стараются меньше ее пить. Однако вода является естественным мочегонным средством и, если вы ее пьете, то теряете в весе.
Многие из тех, кто хочет похудеть, считают, что их организм удерживает воду и стараются меньше ее пить. Однако вода является естественным мочегонным средством и, если вы ее пьете, то теряете в весе.
Если организм получает достаточное количество воды, то человек становится более энергичным и выносливым. Ему проще контролировать свой вес, поскольку улучшается пищеварение, а когда вас тянет перекусить, часто достаточно бывает просто попить воды, чтобы снизить аппетит. Симптомами обезвоживания организма являются сухая кожа (может сопровождаться зудом), усталость, плохая концентрация внимания, головные боли, повышение давления, плохая работа почек, сухой кашель, боли в спине и суставах.
Исследованиями ученых уже доказано, что употребление достаточного количества воды может свести к минимуму боли в спине, мигрени, ревматические боли, а также понижение уровня холестерина в крови и кровяного давления, уменьшая тем самым вероятность сердечного приступа. Потребление достаточного количества воды — это один из лучших способов предотвратить образование камней в почках. Так как вода не содержит солей, жира, холестерина и кофеина, то, соответственно, она по-другому выводится из организма.
Так как вода не содержит солей, жира, холестерина и кофеина, то, соответственно, она по-другому выводится из организма.
Немецкие ученые, проведя испытания на студентах-добровольцах, пришли к выводу, что те, которые пьют воды и напитков больше, проявляют и больше выдержки и склонности к творчеству, чем пьющие меньше.
Регулярное потребление воды улучшает мышление и координационные действия мозга. Головной мозг и весь организм будут достаточно заряжены нужными веществами, если вода, которую мы пьем, будет высокого качества, то есть, будет богата минеральными веществами. Здоровый человек не должен ограничивать себя в питье, но гораздо полезнее пить часто и понемногу. Вредно выпивать сразу много жидкости, так как вся жидкость всасывается в кровь, и, пока ее излишек не будет выведен из организма почками, сердце получает излишнюю нагрузку.
Таким образом, можно сделать вывод о том, что роль воды для человека огромна. Сегодня каждый человек может создать для себя условия сохранения бесценного водного баланса путем правильной организации питьевого режима.
Биологическое значение воды | Статьи
Вода известна как хороший растворитель — она растворяет многие вещества. Помимо этого, вода является той физико-химической средой, благодаря которой возможно осуществление большинства реакций обмена веществ, обеспечивающих непрерывный процесс разрушения и восстановления живых тканей.
Таким образом, вода является главной биологической жидкостью. Она не только инертная среда, она может также вступать в реакцию с другими элементами живой материи. Нужно особо подчеркнуть ее значение в биологическом круговороте. Одновременно вода играет роль в регулировании температуры организма и нужна для орошения его тканей.
Взрослому организму необходимо выпивать около 2,5 л воды в сутки. За шестьдесят лет жизни человек выпивает полную цистерну пресной воды (50 т). Пить очень пресные воды вредно, так как это вызывает выщелачивание кальция из организма, особенно детского.
Жажда является естественной потребностью, ее провоцирует рост осмотического давления внутри организма. Это так называемая » тканевая жажда «, которую нельзя утолить, смазывая слизистую оболочку ротовой полости, данную потребность можно удовлетворить только введением жидкости в организм. В течение суток в пищеварительный канал поступает до 10 литров жидкости, которая впитывается слизистой оболочкой. Из этого объема жидкости извне поступает только 2,5 л, а остальное количество жидкости распределяется в следующих пропорциях: 1,5 л слюны, столько же желудочного сока, три литра кишечного сока, 0,7 л сока поджелудочной железы и поллитра желчи. В ухе у человека есть так называемый лабиринт, заполненный жидкостью, при движении он регулирует равновесие всего организма. Питьевой центр в организме — это командный пункт, ведающий водным балансом человеческого организма. Он контролирует и регулирует беспрерывный обмен воды между отдельными органами. В среднем в сутки из организма человека выделяется до 2,5 л воды. Чтобы поддержать водный баланс в теле нужно вводить в него такое же количество воды.
Это так называемая » тканевая жажда «, которую нельзя утолить, смазывая слизистую оболочку ротовой полости, данную потребность можно удовлетворить только введением жидкости в организм. В течение суток в пищеварительный канал поступает до 10 литров жидкости, которая впитывается слизистой оболочкой. Из этого объема жидкости извне поступает только 2,5 л, а остальное количество жидкости распределяется в следующих пропорциях: 1,5 л слюны, столько же желудочного сока, три литра кишечного сока, 0,7 л сока поджелудочной железы и поллитра желчи. В ухе у человека есть так называемый лабиринт, заполненный жидкостью, при движении он регулирует равновесие всего организма. Питьевой центр в организме — это командный пункт, ведающий водным балансом человеческого организма. Он контролирует и регулирует беспрерывный обмен воды между отдельными органами. В среднем в сутки из организма человека выделяется до 2,5 л воды. Чтобы поддержать водный баланс в теле нужно вводить в него такое же количество воды.
Отсюда, очевидно, то огромное значение, которое имеет вода для всех живых существ.
Значение воды в нашем мире и её свойства.
Вода является важнейшим компонентом окружающей природной среды,
возобновляемым ограниченным и уязвимым природным ресурсом,
используются и охраняются в Российской Федерации как основа жизни и
деятельности народов, проживающих на ее территории.
Водный кодекс РФ
В. И. Вернадский писал о воде так: «Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы сравниться с ней по влиянию на ход основных, самых грандиозных, геологических процессов. Нет земного вещества –
минерала, горной породы, живого тела, которое ее бы не заключало. Все земное вещество ею проникнуто и охвачено».
В почве и верхнем слое земной коры находятся подпочвенные воды и скрытые подземные водоемы. Наконец, животные и растения большей частью состоят из воды, в том числе и человек: вода составляет 70% массы нашего тела. Пожалуй, в распространенности воды, в том, что водой все «проникнуто и охвачено», и заключается ее главнейшее уникальное свойство.
Вторым по значению свойством является способность воды растворять вещества. Вода — универсальный растворитель. Благодаря этому ее состав не исчерпывается формулой Н2О. В воде содержатся практически все элементы Периодической таблицы, а также газы, основания, кислоты, соли и органические вещества. Все прочие жидкости, которые мы пьем, или употребляем с пищей, или используем в быту и технике, — все, начиная от спирта, вина, духов, микстур и кончая электролитами, жидкими маслами и бензином, — являются водными растворами той или иной концентрации. При этом множество веществ, которые в газообразной или твердой фазе состоят из нейтральных молекул, в воде диссоциируют, то есть распадаются на ионы, а это ведет как к изменению их свойств, так и свойств самого раствора. Говоря простейшим языком, диссоциация резко увеличивает способность веществ, вступать в химические и биохимические реакции. Огромное количество этих реакций, включая явление, называемое жизнью, протекает именно в водной среде.
Третье уникальное свойство воды заключается в том, что на Земле она присутствует одновременно в трех состояниях или, употребляя физическую терминологию, в трех фазах – газообразной, жидкой и твердой, то есть в виде водяного пара, собственно жидкой воды и льда. Не пытайтесь отыскать другое вещество, которое обладало бы таким же свойством! Возьмем, например, газ кислород он превращается в жидкость при температуре – 183 градуса по Цельсию, а в твердую фазу при – 218 градусах. Железо, твердый металл, становится жидкостью (расплавом) при + 1539 градусах С, а в парообразное состояние переходит при огромной температуре + 3200 градусов С. Примерно таким же образом ведут себя другие вещества, газообразные или твердые при том давлении и диапазоне температур, которые выдерживаются на Земле: давление – около 760 мм рт. ст., температура – от 50 до + 50 градусов С. Немногие из нас помнят точки плавления железа и твердого кислорода и точки их кипения, но эти характеристики для воды мы затвердили наизусть, ибо на них основана температурная шкала Цельсия:
0 градусов С – точка плавления льда, 100 градусов С – точка кипения воды. Но вода с легкостью переходит в пар и при более низких температурах, о чем известно всякому: выстиранная ткань быстро высыхает, как и вымытая посуда. И мы, конечно, знаем о необычном свойстве воды расширяться при замерзании, о том, что лед легче воды, тогда как у остальных веществ все происходит наоборот: при охлаждении и переходе в твердую фазу их объем уменьшается.
Но вода с легкостью переходит в пар и при более низких температурах, о чем известно всякому: выстиранная ткань быстро высыхает, как и вымытая посуда. И мы, конечно, знаем о необычном свойстве воды расширяться при замерзании, о том, что лед легче воды, тогда как у остальных веществ все происходит наоборот: при охлаждении и переходе в твердую фазу их объем уменьшается.
Как видим, вода – уникальная субстанция!
Наша страна обладает огромным запасом подземных вод, которые интенсивно используются для промышленно – питьевых целей. В настоящее время в восточных районах в связи с развитием народного хозяйства расходуется более 10 % прогнозных ресурсов подземных вод. Развитие промышленности ведет к росту водопотребления и более интенсивному использованию поземных вод. В современном городе на каждого жителя приходится от 100 до 1000 л/сут воды. Так, водопотребление на 1 т различных видов продукции составляет, м3: стали – 150-200, меди-500, бумаги-450, химического волокна-2000-6000, пшеницы-1800, хлопка-7500, мяса-20000. Поэтому суммарное водопотребление на душу населения достигает 6500 л/сут.
Поэтому суммарное водопотребление на душу населения достигает 6500 л/сут.
Серьезная проблема в использовании поверхностных вод для питьевого и хозяйственно-бытового водоснабжения населения связана с их загрязнением. В настоящее время большая часть поверхностных водных объектов, используемых для питьевого водоснабжения, соответствуют показателям 3 класса, что требует дорогостоящей очистки и подготовки питьевой воды.
По качеству подземные воды значительно превосходят поверхностные благодаря своей лучшей защищенности от загрязнения. Подземными водами обеспечивается 36% нужд жилищно-коммунального хозяйства и 20% — промышленного производства.
Предусматривается расширение использования подземных вод, что диктуется необходимостью повышения качества воды и обеспечения резервного водоснабжения населенных пунктов на случай чрезвычайных ситуаций.
Сооружение водозаборных скважин, относится к специальным строительно –монтажным работам (СМР), которые включают гидрогеологическое бурение, сооружение водоприемной части скважины, освоение водоносного пласта, крепление ствола, а также СМР, связанные с оборудованием устья скважины, монтажом водоподъемного оборудования, и др.
Кроме того, бурение водозаборных скважин связано с добычей полезного ископаемого-воды, что обуславливает специфические особенности в организации производства и экономике этого вида работ.
Таким образом, бурение скважин на воду совмещает характерные черты геологоразведочных, горнодобывающих и строительно-монтажных работ, что усложняет структуру управления, подготовку, организацию производства и экономику буровых работ на воду.
Рациональное использование воды – государственная проблема. По ориентировочным подсчетам общий объем гидросферы превышает 1,4 млрд. км3, из которых 94% приходится на соленые воды морей и океанов. Из оставшихся 6% большую часть ( чуть более 4% гидросферы ) составляют подземные воды.
Запасы подземных вод достаточно большие. Например, Западно-Сибирский артезианский бассейн занимает площадь 3,5 млн. км.2, что эквивалентно объему Каспийского моря.
Однако большая часть подземных вод минерализована и составляет только 14% мировых запасов пресных вод, остальные 85% пресных вод аккумулированы в ледниках, а 1% приходится на реки, озера, почвенные воды и атмосферные осадки.
По оценке известного советского гидрогеолога М. И. Львовича доступные человеку объем пресной воды равен всего 4,2 млн. км.3 (0,3% гидросферы).
Нерациональное использование подземных вод в современных условиях недопустимо. ПО данным ВОЗ (Всемирной организации здравоохранения) при ООН, 1/3 населения нашей планеты испытывает недостаток в питьевой воде или потребляет недоброкачественную воду, из-за чего почти 500 млн. человек ежегодно болеют, при этом 10 млн., главным образом дети, погибают.
В наш век интенсивного развития промышленности и сельского хозяйства каждый случай использования подземных вод для производства должен иметь серьезное технико-экономическое обоснование.
Недопустимо возведение предприятий и комплексов на территориях, имеющих залежи подземных вод, без специальных работ по их охране.
Подземные воды относятся к труднодоступным источникам водоснабжения. В настоящее время наиболее распространенный способ их добычи — бурение водозаборных скважин. Этот вид работ достаточно трудоемкий и требует значительных капиталовложений, сроки окупаемости которых сокращаются пропорционально увеличению дебита скважин.
Этот вид работ достаточно трудоемкий и требует значительных капиталовложений, сроки окупаемости которых сокращаются пропорционально увеличению дебита скважин.
Вода и её полезные свойства
«Жизнь – это одушевленная вода»
Леонардо да Винчи, XVв.
Вода (оксид водорода) — бинарное неорганическое соединение с химической формулой Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью.
При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях). Составляет приблизительно около 0,05 % массы Земли.
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) — 361,13 млн км2. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % — ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды).
Большая часть земной воды — солёная, непригодная для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах. Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Вода является важнейшим веществом для всех живых существ на Земле.
Вода и ее полезные свойства для живых существ:
Сложно переоценить то значение, которое имеет оксид водорода для всего живого. Ведь вода и есть сам источник жизни. Известно, что без нее человек не смог бы прожить и недели. Вода, ее свойства и значение просто колоссальны.
- Это универсальный, то есть способный растворять и органические, и неорганические соединения, растворитель, действующий в живых системах. Именно поэтому вода — источник и среда для протекания всех каталитических биохимических преобразований, с формированием сложных жизненно важных комплексных соединений.
- Способность образовывать водородные связи делает данное вещество универсальным в выдерживании температур без изменения агрегатного состояния. Если бы это было не так, то при малейшем снижении градусов она превращалась бы в лед внутри живых существ, вызывая гибель клеток.

- Для человека вода — источник всех основных бытовых благ и нужд: приготовление пищи, стирка, уборка, принятие ванны, купание и плавание и прочее.
- Промышленные заводы (химические, текстильные, машиностроительные, пищевые, нефтеперерабатывающие и другие) не сумели бы осуществлять свою работу без участия оксида водорода.
- Издревле считалось, что вода — это источник здоровья. Она применялась и применяется сегодня как лечебное вещество.
- Растения используют ее как основной источник питания, за счет чего они продуцируют кислород — газ, благодаря которому существует жизнь на нашей планете.
Питьевая вода — это вода, которая предназначена для ежедневного неограниченного и безопасного потребления человеком и другими живыми существами. Главным отличием от столовых и минеральных вод является пониженное содержание солей (сухого остатка), а также наличие действующих стандартов на общий состав и свойства (СанПиН 2. 1.4.1074-01 — для централизованных систем водоснабжения и СанПиН 2.1.4.1116-02 — для вод, расфасованных в ёмкости).
1.4.1074-01 — для централизованных систем водоснабжения и СанПиН 2.1.4.1116-02 — для вод, расфасованных в ёмкости).
Вода многих источников пресной воды непригодна для питья людьми, так как может служить источником распространения болезней или вызывать долгосрочные проблемы со здоровьем, если она не отвечает определённым стандартам качества воды.
Вода, которая не вредит здоровью человека, и отвечает требованиям действующих стандартов качества, называется питьевой водой. В случае необходимости, чтобы вода соответствовала санитарно-эпидемиологическим нормам, её очищают или, официально говоря, «подготавливают» с помощью установок водоподготовки.
Водопроводная вода (проточная вода, вода из городского водопровода, городского водоснабжения) — вода, поступающая для потребления из крана, доставляется в дома коммунальным предприятием по водоснабжению. Стала доступна в городах развитого мира на протяжении последней четверти XIX века, и в общем в середине XX века. Как правило, это вода из речных водозаборов.
Как правило, это вода из речных водозаборов.
Сточные воды — любые воды и атмосферные осадки, отводимые в водоёмы с территорий промышленных предприятий и населённых мест через систему канализации или самотёком, свойства которых оказались ухудшенными в результате деятельности человека.
Вода – это важный источник энергоресурсов.
Смотрите так же:
Вода — теплофизические свойства
Термодинамические свойства воды:
- Температура кипения (при 101,325 кПа): 99,974 ° C = 211,953 ° F
- Объемный модуль упругости: 2,15 x 10 9 Па или Н / м 2
- Критическая температура: 373,946 ° C = 705,103 ° F
- Критическое давление: 217,7 атм = 220,6 бар = 22,06 МПа (МН / м 2 ) = 3200 фунтов на кв. Дюйм (= фунтов на / дюйм 2 )
- Критическая плотность: 0.322 г / см 3 = 0,62478 снаряда / фут 3 = 20,1018 фунта м / фут 3
- Константа ионизации, pKw (при 25 ° C): 13,995
- Скрытая теплота плавления: 334 кДж / кг = 144 БТЕ (IT) / фунт
- Скрытая теплота испарения (при 100 ° C): 40,657 кДж / моль = 2256 кДж / кг = 970 БТЕ (IT) / фунт
- Максимальная плотность (при 4 o C ): 999,975 кг / м 3 = 1,9403 снаряда / фут 3 = 8.
 34519 фунтов м / галлон (США)
34519 фунтов м / галлон (США) - Температура плавления (при 101,325 кПа): 0 ° C = 32 ° F
- Молярная масса: 18,01527 г / моль
- pH (при 25 ° C): 6,9976
- Удельная теплоемкость (C p ) вода (при 15 ° C / 60 ° F): 4,187 кДж / кг · K = 1,001 Btu (IT) / (фунт м ° F) или ккал / (кг · K)
- лед: 2,108 кДж / кг · K = 0,5035 Btu (IT) / (фунт м · ° F) или ккал / (кг · K)
- Удельная теплоемкость водяного пара: 1.996 кДж / кг · K = 0,4767 британских тепловых единиц (IT) / (фунт м · ° F) или ккал / (кг · K)
- Удельный вес (при температуре 4 o C): 9,806 кН / м 3 = 62,43 фунта f / фут 3
- Температурное расширение от 4 o C до 100 o C: 4,2×10 -2 (Примечание! — объемное температурное расширение воды не зависит от температуры)
- Давление тройной точки: 0,00604 атм = 0.
 00612 бар = 611,657 Па = 0,08871 фунт / кв. Дюйм (= фунт / дюйм / дюйм 2 )
00612 бар = 611,657 Па = 0,08871 фунт / кв. Дюйм (= фунт / дюйм / дюйм 2 ) - Температура тройной точки: 0,01 ° C = 32,02 ° F
Перейдите по ссылкам ниже, чтобы получить значения для перечисленных свойств жидкости вода при переменном давлении и температуре :
Для каждой темы есть рисунки и таблицы, показывающие изменения свойств в зависимости от температуры. Также доступны калькуляторы, определяющие свойства при заданных температурах.Все свойства даны как в системе СИ, так и в британской системе мер.
См. Также дополнительные сведения об атмосферном давлении и STP — Стандартная температура и давление и NTP — Нормальные температура и давление,
и Теплофизические свойства следующих компонентов: Ацетон, Ацетилен, Воздух, Аммиак, Аргон, Бензол, Бутан, Двуокись углерода , Окись углерода, этан, этанол, этилен, гелий, водород, сероводород, метан, метанол, азот, кислород, пентан, пропан, толуол и тяжелая вода, D 2 O.
Структура и свойства воды
Цель обучения
- Опишите структуру и свойства воды.
Ключевые моменты
- Вода — это жидкость при стандартной температуре и давлении (25 градусов Цельсия и 1 атм для жидкостей).
- Вода без вкуса и запаха.
- Вода прозрачна в видимой части электромагнитного спектра.
- Вода может действовать как кислота или щелочь.
- Вода — универсальный растворитель, растворяющий многие вещества, встречающиеся в природе.
Условия
- фазовая диаграмма График, показывающий фазу, которую имеет образец вещества при различных условиях температуры и давления.
- равновесие Состояние реакции, при котором скорости прямой и обратной реакций равны.
- диполь: Любая молекула или радикал, имеющий делокализованный положительный и отрицательный заряды.
- амфотерный — молекула, которая может действовать как кислота или основание в зависимости от своего химического окружения.
 Например, вода (H 2 O) амфотерная.
Например, вода (H 2 O) амфотерная.
Свойства воды
Вода — это самый распространенный компонент на поверхности Земли. В природе вода существует в жидком, твердом и газообразном состояниях. Он находится в динамическом равновесии между жидкостью и газом при 0 градусах Цельсия и давлении 1 атм. При комнатной температуре (примерно 25 градусов по Цельсию) это жидкость без вкуса, запаха и цвета. Многие вещества растворяются в воде, и его обычно называют универсальным растворителем.
Свойства воды Таблица некоторых химических и физических свойств воды.Фазы воды
Как и многие другие вещества, вода может принимать различные формы. Его жидкая фаза, самая распространенная фаза воды на Земле, обычно обозначается словом «вода».
Твердая фаза (лед)
Твердая фаза воды известна как лед и обычно имеет структуру твердых, амальгамированных кристаллов, таких как кубики льда, или рыхлых зернистых кристаллов, таких как снег. В отличие от большинства других веществ, твердая форма воды (лед) на меньше, чем ее жидкая форма, на густота в результате характера ее гексагональной упаковки в ее кристаллической структуре. Эта решетка содержит больше места, чем когда молекулы находятся в жидком состоянии.
В отличие от большинства других веществ, твердая форма воды (лед) на меньше, чем ее жидкая форма, на густота в результате характера ее гексагональной упаковки в ее кристаллической структуре. Эта решетка содержит больше места, чем когда молекулы находятся в жидком состоянии.
Тот факт, что плотность льда меньше плотности жидкой воды, имеет важное последствие — лед плавает.
Плотность льда и воды как функция температуры Твердая форма большинства веществ более плотная, чем жидкая фаза; поэтому блок данного твердого вещества обычно тонет в соответствующей жидкости. Однако ледяная глыба плавает в жидкой воде, потому что лед менее плотен, чем жидкая вода. На вставке более подробно показана кривая в диапазоне 0-10 градусов Цельсия.Жидкая вода наиболее плотная при 4 градусах Цельсия.
На вставке более подробно показана кривая в диапазоне 0-10 градусов Цельсия.Жидкая вода наиболее плотная при 4 градусах Цельсия.Жидкая фаза (вода)
Вода — это в основном жидкость при стандартных условиях (25 градусов Цельсия и давление 1 атм). Эту характеристику нельзя было предсказать по ее взаимосвязи с другими газообразными гидридами семейства кислорода в периодической таблице, такими как сероводород. Элементы, окружающие кислород в периодической таблице, — азот, фтор, фосфор, сера и хлор — все соединяются с водородом с образованием газов в стандартных условиях.Вода образует жидкость вместо газа, потому что кислород более электроотрицателен, чем окружающие элементы, за исключением фтора. Кислород притягивает электроны намного сильнее, чем водород, что приводит к частичному положительному заряду на атомах водорода и частичному отрицательному заряду на атоме кислорода. Наличие такого заряда на каждом из этих атомов дает молекуле воды чистый дипольный момент.
Электрическое притяжение между молекулами воды, вызванное этим диполем, сближает отдельные молекулы, затрудняя разделение молекул и, следовательно, повышая температуру кипения. Этот тип притяжения известен как водородная связь. Молекулы воды постоянно движутся относительно друг друга, а водородные связи непрерывно разрываются и преобразовываются с интервалами короче 200 фемтосекунд (200 x 10 -15 секунд).
Этот тип притяжения известен как водородная связь. Молекулы воды постоянно движутся относительно друг друга, а водородные связи непрерывно разрываются и преобразовываются с интервалами короче 200 фемтосекунд (200 x 10 -15 секунд).
Многие физические и химические свойства воды (в том числе ее способность к растворителю) частично связаны с кислотно-основными реакциями, в которых она может участвовать.- (водн.) [/ латекс]
Газовая фаза (водяной пар)
Газовая фаза воды, известная как водяной пар (или пар), характеризуется прозрачным облаком. Вода также существует в редком четвертом состоянии, называемом сверхкритической жидкостью, которое встречается только в крайне непригодных для жизни условиях. Когда вода достигает определенной критической температуры и определенного критического давления (647 K и 22,064 МПа), жидкая и газовая фазы сливаются в одну гомогенную жидкую фазу, которая имеет общие свойства как газа, так и жидкости.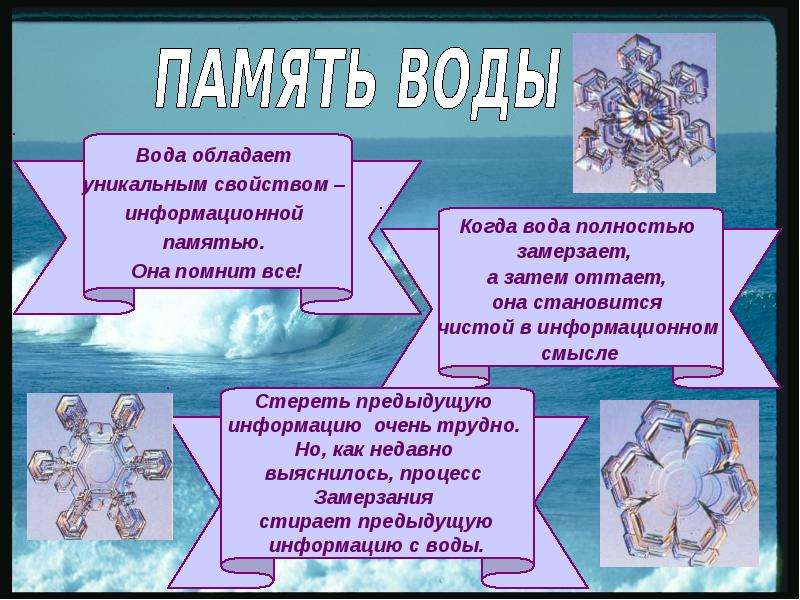
Фазовая диаграмма воды
Вода замерзает, образуя лед, лед тает, образуя жидкую воду, и вода и лед могут переходить в парообразное состояние. Фазовые диаграммы помогают описать, как вода меняет состояние в зависимости от давления и температуры.
Фазовая диаграмма воды Три фазы воды — жидкая, твердая и паровая — показаны в пространстве температура-давление.Обратите внимание на следующие ключевые моменты на фазовой диаграмме:
- Критическая точка (CP), выше которой существуют только сверхкритические жидкости.
- Тройная точка (TP), четко определенная координата в месте пересечения кривых, в которой три состояния вещества (твердое, жидкое, газообразное) находятся в равновесии друг с другом.
- Четко определенные границы между твердым телом и жидкостью, твердым телом и газом, жидкостью и газом. Во время фазового перехода между двумя фазами (то есть вдоль этих границ) фазы находятся в равновесии друг с другом.
Полярность воды
Полярная природа воды — особенно важная особенность, которая способствует уникальности этого вещества. Молекула воды образует угол с атомом кислорода на вершине и атомами водорода на концах. Поскольку кислород имеет более высокую электроотрицательность, чем водород, сторона молекулы с атомом кислорода имеет частичный отрицательный заряд. Объект с такой разностью зарядов называется диполем (что означает «два полюса»). Кислородный конец частично отрицательный, а водородный частично положительный; из-за этого направление дипольного момента указывает от кислорода к центральному положению между двумя атомами водорода.Эта разница зарядов заставляет молекулы воды притягиваться друг к другу (относительно положительные области притягиваются к относительно отрицательным областям), а также к другим полярным молекулам. Это притяжение способствует образованию водородных связей и объясняет многие свойства воды (включая ее способность действовать как растворитель для многих веществ).
Молекула воды образует угол с атомом кислорода на вершине и атомами водорода на концах. Поскольку кислород имеет более высокую электроотрицательность, чем водород, сторона молекулы с атомом кислорода имеет частичный отрицательный заряд. Объект с такой разностью зарядов называется диполем (что означает «два полюса»). Кислородный конец частично отрицательный, а водородный частично положительный; из-за этого направление дипольного момента указывает от кислорода к центральному положению между двумя атомами водорода.Эта разница зарядов заставляет молекулы воды притягиваться друг к другу (относительно положительные области притягиваются к относительно отрицательным областям), а также к другим полярным молекулам. Это притяжение способствует образованию водородных связей и объясняет многие свойства воды (включая ее способность действовать как растворитель для многих веществ).
 Цифра указывает частичные заряды, которыми обладают атомы.
Цифра указывает частичные заряды, которыми обладают атомы.Молекула воды может образовывать максимум четыре водородные связи, принимая два атома водорода и отдавая два атома водорода. Хотя водородная связь является относительно слабым притяжением по сравнению с ковалентными связями внутри самой молекулы воды (внутримолекулярные связи), она отвечает за ряд физических свойств воды. Одно из таких свойств — относительно высокие температуры плавления и кипения; больше энергии требуется для разрыва водородных связей между молекулами, чтобы перейти в фазу с более высокой энергией.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
2.2 Вода — Концепции биологии — 1-е канадское издание
К концу этого раздела вы сможете:
- Опишите свойства воды, которые имеют решающее значение для поддержания жизни
youtube.com/embed/VzvN0On_rE0?list=PLi8sJ5jarQsyUiIn4rUA71ecODy3o9Md5″ allowfullscreen=»allowfullscreen»/>
Посмотреть видео о Oxygen
Вы когда-нибудь задумывались, почему ученые проводят время в поисках воды на других планетах? Это потому, что вода необходима для жизни; даже мельчайшие следы ее на другой планете могут указывать на то, что жизнь могла или существовала на этой планете.Вода — одна из наиболее распространенных молекул в живых клетках и наиболее важная для жизни, какой мы ее знаем. Примерно 60–70 процентов вашего тела состоит из воды. Без него жизни просто не было бы.
Атомы водорода и кислорода в молекулах воды образуют полярные ковалентные связи. Общие электроны проводят больше времени, связанного с атомом кислорода, чем с атомами водорода. У молекулы воды нет общего заряда, но есть небольшой положительный заряд на каждом атоме водорода и небольшой отрицательный заряд на атоме кислорода.Из-за этих зарядов слегка положительные атомы водорода отталкиваются друг от друга и образуют уникальную форму. Каждая молекула воды притягивает другие молекулы воды из-за положительных и отрицательных зарядов в разных частях молекулы. Вода также притягивает другие полярные молекулы (например, сахара), образуя водородные связи. Когда вещество легко образует водородные связи с водой, оно может растворяться в воде и обозначается как гидрофильный («любящий воду»). Водородные связи не образуются легко с неполярными веществами, такими как масла и жиры.Эти неполярные соединения являются гидрофобными («водобоязненными») и не растворяются в воде.
Каждая молекула воды притягивает другие молекулы воды из-за положительных и отрицательных зарядов в разных частях молекулы. Вода также притягивает другие полярные молекулы (например, сахара), образуя водородные связи. Когда вещество легко образует водородные связи с водой, оно может растворяться в воде и обозначается как гидрофильный («любящий воду»). Водородные связи не образуются легко с неполярными веществами, такими как масла и жиры.Эти неполярные соединения являются гидрофобными («водобоязненными») и не растворяются в воде.
Водородные связи в воде позволяют ей поглощать и отдавать тепловую энергию медленнее, чем многие другие вещества. Температура — это мера движения (кинетической энергии) молекул. По мере увеличения движения увеличивается энергия и, следовательно, выше температура. Вода поглощает много энергии, прежде чем ее температура повышается. Повышенная энергия разрушает водородные связи между молекулами воды. Поскольку эти связи могут создаваться и быстро разрушаться, вода поглощает увеличение энергии, и температура изменяется лишь минимально. Это означает, что вода смягчает изменения температуры внутри организмов и в окружающей их среде. По мере того как подвод энергии продолжается, баланс между образованием и разрушением водородных связей смещается в сторону разрушения. Связей разорвано больше, чем образовано.Этот процесс приводит к высвобождению отдельных молекул воды на поверхности жидкости (например, в водоеме, листьях растений или на коже организма) в процессе, называемом испарением . Испарение пота, который на 90% состоит из воды, позволяет охладить организм, поскольку разрыв водородных связей требует затрат энергии и отводит тепло от тела.
Вода поглощает много энергии, прежде чем ее температура повышается. Повышенная энергия разрушает водородные связи между молекулами воды. Поскольку эти связи могут создаваться и быстро разрушаться, вода поглощает увеличение энергии, и температура изменяется лишь минимально. Это означает, что вода смягчает изменения температуры внутри организмов и в окружающей их среде. По мере того как подвод энергии продолжается, баланс между образованием и разрушением водородных связей смещается в сторону разрушения. Связей разорвано больше, чем образовано.Этот процесс приводит к высвобождению отдельных молекул воды на поверхности жидкости (например, в водоеме, листьях растений или на коже организма) в процессе, называемом испарением . Испарение пота, который на 90% состоит из воды, позволяет охладить организм, поскольку разрыв водородных связей требует затрат энергии и отводит тепло от тела.
И наоборот, по мере того, как движение молекул уменьшается и температура падает, требуется меньше энергии для разрыва водородных связей между молекулами воды. Эти связи остаются неповрежденными и начинают образовывать жесткую решетчатую структуру (например, лед) (рис. 2.8 a ). В замороженном состоянии лед менее плотен, чем жидкая вода (молекулы находятся дальше друг от друга). Это означает, что лед плавает на поверхности водоема (рис. 2.8 b ). В озерах, прудах и океанах на поверхности воды образуется лед, создавая изолирующий барьер для защиты находящихся под ними животных и растений от замерзания в воде. Если бы этого не произошло, растения и животные, живущие в воде, замерзли бы в глыбе льда и не могли бы свободно передвигаться, что сделало бы жизнь при низких температурах трудной или невозможной.
Эти связи остаются неповрежденными и начинают образовывать жесткую решетчатую структуру (например, лед) (рис. 2.8 a ). В замороженном состоянии лед менее плотен, чем жидкая вода (молекулы находятся дальше друг от друга). Это означает, что лед плавает на поверхности водоема (рис. 2.8 b ). В озерах, прудах и океанах на поверхности воды образуется лед, создавая изолирующий барьер для защиты находящихся под ними животных и растений от замерзания в воде. Если бы этого не произошло, растения и животные, живущие в воде, замерзли бы в глыбе льда и не могли бы свободно передвигаться, что сделало бы жизнь при низких температурах трудной или невозможной.
Поскольку вода полярная, с небольшими положительными и отрицательными зарядами, ионные соединения и полярные молекулы могут легко растворяться в ней. Следовательно, вода — это то, что называется растворителем — веществом, способным растворять другое вещество.Заряженные частицы образуют водородные связи с окружающим слоем молекул воды. Это называется сферой гидратации и служит для отделения или диспергирования частиц в воде. В случае поваренной соли (NaCl), смешанной с водой, ионы натрия и хлора разделяются или диссоциируют в воде, и вокруг ионов образуются сферы гидратации. Положительно заряженный ион натрия окружен частично отрицательными зарядами атомов кислорода в молекулах воды. Отрицательно заряженный хлорид-ион окружен частично положительными зарядами атомов водорода в молекулах воды.Эти сферы гидратации также называют гидратными оболочками. Полярность молекулы воды делает ее эффективным растворителем и играет важную роль в ее многочисленных функциях в живых системах.
Следовательно, вода — это то, что называется растворителем — веществом, способным растворять другое вещество.Заряженные частицы образуют водородные связи с окружающим слоем молекул воды. Это называется сферой гидратации и служит для отделения или диспергирования частиц в воде. В случае поваренной соли (NaCl), смешанной с водой, ионы натрия и хлора разделяются или диссоциируют в воде, и вокруг ионов образуются сферы гидратации. Положительно заряженный ион натрия окружен частично отрицательными зарядами атомов кислорода в молекулах воды. Отрицательно заряженный хлорид-ион окружен частично положительными зарядами атомов водорода в молекулах воды.Эти сферы гидратации также называют гидратными оболочками. Полярность молекулы воды делает ее эффективным растворителем и играет важную роль в ее многочисленных функциях в живых системах.
Вы когда-нибудь наполняли стакан воды до самого верха, а затем медленно добавляли еще несколько капель? Прежде чем переливаться через край, вода фактически приобретает куполообразную форму над краем стакана. Эта вода может оставаться над стеклом благодаря свойству когезии .В процессе когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-воздух (газ), хотя в стекле больше нет места. Когезия дает поверхностное натяжение , способность вещества выдерживать разрыв при воздействии на него напряжения или напряжения. Когда вы роняете небольшой клочок бумаги на каплю воды, бумага плавает поверх капли, хотя объект более плотный (тяжелый), чем вода.Это происходит из-за поверхностного натяжения, создаваемого молекулами воды. Сплоченность и поверхностное натяжение сохраняют молекулы воды нетронутыми, а предмет плавным. Можно даже «поплавать» стальную иглу над стаканом с водой, если аккуратно поставить ее, не нарушая поверхностного натяжения.
Эта вода может оставаться над стеклом благодаря свойству когезии .В процессе когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-воздух (газ), хотя в стекле больше нет места. Когезия дает поверхностное натяжение , способность вещества выдерживать разрыв при воздействии на него напряжения или напряжения. Когда вы роняете небольшой клочок бумаги на каплю воды, бумага плавает поверх капли, хотя объект более плотный (тяжелый), чем вода.Это происходит из-за поверхностного натяжения, создаваемого молекулами воды. Сплоченность и поверхностное натяжение сохраняют молекулы воды нетронутыми, а предмет плавным. Можно даже «поплавать» стальную иглу над стаканом с водой, если аккуратно поставить ее, не нарушая поверхностного натяжения.
 Обратите внимание на углубление в воде вокруг иглы.
Обратите внимание на углубление в воде вокруг иглы.Эти силы сцепления также связаны со свойством воды адгезия или притяжением между молекулами воды и другими молекулами. Это наблюдается, когда вода «поднимается» по соломке, помещенной в стакан с водой. Вы заметите, что вода кажется выше по бокам соломинки, чем в середине. Это связано с тем, что молекулы воды притягиваются к соломке и, следовательно, прилипают к ней.
Силы сцепления и сцепления важны для поддержания жизни.Например, из-за этих сил вода может течь вверх от корней к верхушкам растений, чтобы кормить растение.
Концепция в действии
Чтобы узнать больше о воде, посетите сайт Геологической службы США «Наука о воде для школ: все о воде!» интернет сайт.
pH раствора является мерой его кислотности или щелочности. Вы, вероятно, использовали лакмусовую бумагу , бумагу, обработанную натуральным водорастворимым красителем, чтобы ее можно было использовать в качестве индикатора pH, чтобы проверить, сколько кислоты или основания (щелочности) существует в растворе. Возможно, вы даже использовали их, чтобы убедиться, что вода в открытом бассейне очищена должным образом. В обоих случаях этот тест pH измеряет количество ионов водорода, которое существует в данном растворе. Высокие концентрации ионов водорода приводят к низкому pH, тогда как низкие уровни ионов водорода приводят к высокому pH. Общая концентрация ионов водорода обратно пропорциональна его pH и может быть измерена по шкале pH (рис. 2.11). Следовательно, чем больше присутствует ионов водорода, тем ниже pH; и наоборот, чем меньше ионов водорода, тем выше pH.
Возможно, вы даже использовали их, чтобы убедиться, что вода в открытом бассейне очищена должным образом. В обоих случаях этот тест pH измеряет количество ионов водорода, которое существует в данном растворе. Высокие концентрации ионов водорода приводят к низкому pH, тогда как низкие уровни ионов водорода приводят к высокому pH. Общая концентрация ионов водорода обратно пропорциональна его pH и может быть измерена по шкале pH (рис. 2.11). Следовательно, чем больше присутствует ионов водорода, тем ниже pH; и наоборот, чем меньше ионов водорода, тем выше pH.
Шкала pH находится в диапазоне от 0 до 14. Изменение на одну единицу шкалы pH представляет изменение концентрации ионов водорода в 10 раз, изменение на две единицы представляет собой изменение концентрации ионов водорода на величину коэффициент 100. Таким образом, небольшие изменения pH представляют собой большие изменения концентрации ионов водорода. Чистая вода нейтральна. Он не является ни кислым, ни основным, и его pH составляет 7,0. Все, что ниже 7,0 (от 0,0 до 6,9), является кислотным, а все, что выше 7.0 (от 7,1 до 14,0) — щелочной. Кровь в ваших венах слегка щелочная (pH = 7,4). Среда в желудке очень кислая (pH от 1 до 2). Апельсиновый сок имеет умеренную кислотность (pH = приблизительно 3,5), тогда как пищевая сода является щелочной (pH = 9,0).
Все, что ниже 7,0 (от 0,0 до 6,9), является кислотным, а все, что выше 7.0 (от 7,1 до 14,0) — щелочной. Кровь в ваших венах слегка щелочная (pH = 7,4). Среда в желудке очень кислая (pH от 1 до 2). Апельсиновый сок имеет умеренную кислотность (pH = приблизительно 3,5), тогда как пищевая сода является щелочной (pH = 9,0).
Кислоты — это вещества, которые выделяют ионы водорода (H + ) и понижают pH, тогда как основания обеспечивают ионы гидроксида (OH — ) и повышают pH.Чем сильнее кислота, тем легче она отдает H + . Например, соляная кислота и лимонный сок очень кислые и при добавлении в воду легко выделяют H + . И наоборот, основания — это те вещества, которые легко отдают OH —. Ионы OH — соединяются с H + с образованием воды, которая повышает pH вещества. Гидроксид натрия и многие бытовые чистящие средства очень щелочные и быстро выделяют OH — при помещении в воду, тем самым повышая pH.
Большинство клеток нашего тела работают в очень узком диапазоне шкалы pH, обычно в пределах от 7,2 до 7,6. Если pH тела выходит за пределы этого диапазона, дыхательная система не работает, как и другие органы тела. Клетки больше не функционируют должным образом, и белки будут разрушаться. Отклонение от диапазона pH может вызвать кому или даже смерть.
Так как же мы можем проглотить или вдохнуть кислые или основные вещества и не умереть? Буферы — это ключ. Буферы легко абсорбируют избыток H + или OH –, тщательно поддерживая pH тела в вышеупомянутом узком диапазоне. Двуокись углерода является частью заметной буферной системы в организме человека; он поддерживает pH в нужном диапазоне. Эта буферная система включает анион угольной кислоты (H 2 CO 3 ) и бикарбонат (HCO 3 —). Если слишком много H + попадает в организм, бикарбонат объединяется с H + , образуя угольную кислоту и ограничивая снижение pH. Аналогичным образом, если в систему вводится слишком много OH — , угольная кислота быстро диссоциирует на бикарбонат и ионы H + . Ионы H + могут объединяться с ионами OH — , ограничивая повышение pH. Хотя угольная кислота является важным продуктом этой реакции, ее присутствие мимолетно, потому что углекислота выделяется из организма в виде углекислого газа каждый раз, когда мы дышим. Без этой буферной системы pH в нашем организме будет слишком сильно колебаться, и мы не сможем выжить.
Аналогичным образом, если в систему вводится слишком много OH — , угольная кислота быстро диссоциирует на бикарбонат и ионы H + . Ионы H + могут объединяться с ионами OH — , ограничивая повышение pH. Хотя угольная кислота является важным продуктом этой реакции, ее присутствие мимолетно, потому что углекислота выделяется из организма в виде углекислого газа каждый раз, когда мы дышим. Без этой буферной системы pH в нашем организме будет слишком сильно колебаться, и мы не сможем выжить.
Вода имеет множество свойств, критически важных для поддержания жизни. Он полярный, что позволяет образовывать водородные связи, которые позволяют ионам и другим полярным молекулам растворяться в воде. Поэтому вода — отличный растворитель. Водородные связи между молекулами воды дают воде способность удерживать тепло лучше, чем многие другие вещества. При повышении температуры водородные связи между водой непрерывно разрываются и преобразуются, позволяя общей температуре оставаться стабильной, хотя в систему добавляется повышенная энергия. Силы сцепления воды учитывают свойство поверхностного натяжения. Все эти уникальные свойства воды важны для химии живых организмов.
Силы сцепления воды учитывают свойство поверхностного натяжения. Все эти уникальные свойства воды важны для химии живых организмов.
pH раствора является мерой концентрации ионов водорода в растворе. Раствор с большим количеством ионов водорода кислый и имеет низкое значение pH. Раствор с большим количеством гидроксид-ионов является основным и имеет высокое значение pH. Шкала pH находится в диапазоне от 0 до 14, при этом pH 7 является нейтральным. Буферы — это растворы, которые замедляют изменение pH при добавлении кислоты или основания в буферную систему.Буферы важны в биологических системах из-за их способности поддерживать постоянный уровень pH.
- Какое из следующих утверждений неверно?
- Вода полярная.
- Вода стабилизирует температуру.
- Вода необходима для жизни.
- Вода — самый распространенный атом в атмосфере Земли.
- Используя pH-метр, вы обнаружите, что pH неизвестного раствора составляет 8,0.
 Как бы вы описали это решение?
Как бы вы описали это решение?- слабокислый
- сильнокислый
- слабоосновная
- сильно простой
- pH лимонного сока составляет около 2.0, тогда как pH томатного сока составляет около 4,0. Насколько приблизительно увеличивается концентрация ионов водорода между томатным и лимонным соками?
- 2 раза
- 10 раз
- 100 раз
- 1000 раз
- Почему некоторые насекомые могут ходить по воде?
- Объясните, почему вода является отличным растворителем.
Ответы
- Д
- С
- С
- Некоторые насекомые могут ходить по воде, хотя они тяжелее (плотнее) воды из-за поверхностного натяжения воды.Поверхностное натяжение возникает в результате сцепления или притяжения между молекулами воды на поверхности водного тела [граница раздела жидкость-воздух (газ)].
- Молекулы воды полярны, то есть у них разделены частичные положительный и отрицательный заряды.
 Благодаря этим зарядам молекулы воды могут окружать заряженные частицы, возникающие при диссоциации вещества. Окружающий слой молекул воды стабилизирует ион и не дает ионам с разным зарядом повторно связываться, поэтому вещество остается растворенным.
Благодаря этим зарядам молекулы воды могут окружать заряженные частицы, возникающие при диссоциации вещества. Окружающий слой молекул воды стабилизирует ион и не дает ионам с разным зарядом повторно связываться, поэтому вещество остается растворенным.
кислота: вещество, которое отдает ионы водорода и, следовательно, снижает pH
адгезия: притяжение между молекулами воды и молекулами другого вещества
основание: вещество, поглощающее ионы водорода и, следовательно, повышающее pH
буфер: раствор, который сопротивляется изменению pH за счет поглощения или высвобождения ионов водорода или гидроксида
когезия: межмолекулярные силы между молекулами воды, вызванные полярной природой воды; создает поверхностное натяжение
испарение: высвобождение молекул воды из жидкой воды с образованием водяного пара
гидрофильный: описывает вещество, растворяющееся в воде; водолюбивый
гидрофобный: описывает вещество, не растворяющееся в воде; водобоязненный
Лакмусовая бумага : фильтровальная бумага , обработанная натуральным водорастворимым красителем, поэтому ее можно использовать в качестве индикатора pH
Шкала pH: шкала от 0 до 14, которая измеряет приблизительную концентрацию ионов водорода в веществе
растворитель: вещество, способное растворять другое вещество
поверхностное натяжение: сила сцепления на поверхности жидкого тела, которая препятствует разделению молекул
температура: мера молекулярного движения
Список литературы
Хамфри, W. , Далке, А. и Шультен, К., «VMD — визуальная молекулярная динамика», J. Molec. Графика , 1996, т. 14. С. 33-38. http://www.ks.uiuc.edu/Research/vmd/
, Далке, А. и Шультен, К., «VMD — визуальная молекулярная динамика», J. Molec. Графика , 1996, т. 14. С. 33-38. http://www.ks.uiuc.edu/Research/vmd/
Атрибуция в СМИ
- Рисунок 2.7, Гаутам Догра
- Рисунок 2.8
- ледяная решетка от Джейн Уитни
- (b) Карлос Понте
- Рисунок 2.10 Кори Занкер
- Рисунок 2.11. Автор Эдвард Стивенс
5.1 Свойства воды — Введение в океанографию
Наиболее очевидной особенностью океанов является то, что они содержат воду.Вода настолько распространена, что может показаться не очень интересным веществом, но она обладает множеством уникальных свойств, влияющих на глобальные океанографические и климатологические процессы. Многие из этих процессов связаны с образованием водородных связей между молекулами воды.
Рисунок 5.1.1 Водородные связи (пунктирные линии) между молекулами воды. Атомы кислорода показаны красным, атомы водорода — белым (общественное достояние, через Wikimedia Commons).
Молекула воды состоит из двух атомов водорода и одного атома кислорода.Электроны, ответственные за связи между атомами, неравномерно распределены по всей молекуле, так что водородные концы молекул воды имеют небольшой положительный заряд, а кислородные концы имеют небольшой отрицательный заряд, что делает воду полярной молекулой . Отрицательная кислородная сторона молекулы притягивает положительный водородный конец соседней молекулы. Эта довольно слабая сила притяжения называется водородной связью (рис. 5.1.1). Если бы не водородные связи, вода испарялась бы при температуре -68 o C, а это означает, что жидкая вода (и, следовательно, жизнь) не могла бы существовать на Земле.Эти водородные связи отвечают за некоторые уникальные свойства воды:
1. Вода — единственное вещество, которое в природе существует в твердой, жидкой и газообразной форме в нормальном диапазоне температур и давлений, существующих на Земле. Это связано с относительно высокими температурами замерзания и испарения воды (см. Ниже).
Ниже).
2. Вода имеет высокую теплоемкость , то есть количество тепла, которое необходимо добавить для повышения ее температуры. Удельная теплоемкость — это количество тепла, необходимое для повышения температуры 1 г вещества на 1 o C.Вода имеет самую высокую удельную теплоемкость из всех жидкостей, кроме аммиака (таблица 5.1.1).
Таблица 5.1.1 Значения удельной теплоемкости для ряда обычных веществ
| Удельная теплоемкость (калорий / г / градус o ) | |
|---|---|
| Аммиак | 1,13 |
| Вода | 1,00 |
| ацетон | 0,51 |
| Зерновой спирт | 0,23 |
| Алюминий | 0.22 |
| Медь | 0,09 |
| Серебро | 0,06 |
Таким образом, вода — одна из самых сложных жидкостей для нагрева или охлаждения; он может поглощать большое количество тепла без повышения температуры. Помните, что температура отражает среднюю кинетическую энергию молекул внутри вещества; чем сильнее движение, тем выше температура. В воде молекулы удерживаются вместе водородными связями, и эти связи необходимо преодолеть, чтобы молекулы могли свободно перемещаться.Когда к воде добавляется тепло, энергия сначала должна идти на разрыв водородных связей, прежде чем температура сможет начать повышаться. Следовательно, большая часть добавленного тепла поглощается за счет разрыва Н-связей, а не за счет повышения температуры, что придает воде высокую теплоемкость.
Помните, что температура отражает среднюю кинетическую энергию молекул внутри вещества; чем сильнее движение, тем выше температура. В воде молекулы удерживаются вместе водородными связями, и эти связи необходимо преодолеть, чтобы молекулы могли свободно перемещаться.Когда к воде добавляется тепло, энергия сначала должна идти на разрыв водородных связей, прежде чем температура сможет начать повышаться. Следовательно, большая часть добавленного тепла поглощается за счет разрыва Н-связей, а не за счет повышения температуры, что придает воде высокую теплоемкость.
Водородные связи также отдают воде большое скрытое тепло; тепло, необходимое для фазового перехода из твердого в жидкое или из жидкого в газообразное. Скрытая теплота плавления — это теплота, необходимая для перехода от твердого тела к жидкости; 80 кал / г в случае плавления льда до воды.Лед является твердым телом, потому что водородные связи удерживают молекулы воды в твердую кристаллическую решетку (см. Ниже). Когда лед нагревается, температура повышается до 0 o C. В этот момент любое дополнительное тепло идет на плавление льда за счет разрыва водородных связей, а не на повышение температуры. Поэтому, пока присутствует лед, температура воды не повышается. Вот почему ваш напиток будет оставаться холодным, пока в нем есть лед; поглощенное тепло идет на таяние льда, а не на нагревание напитка.
Ниже). Когда лед нагревается, температура повышается до 0 o C. В этот момент любое дополнительное тепло идет на плавление льда за счет разрыва водородных связей, а не на повышение температуры. Поэтому, пока присутствует лед, температура воды не повышается. Вот почему ваш напиток будет оставаться холодным, пока в нем есть лед; поглощенное тепло идет на таяние льда, а не на нагревание напитка.
Когда весь лед растает, дополнительное тепло повысит температуру воды на 1 o C на каждую добавленную калорию, пока не достигнет 100 o C. В этот момент любое дополнительное тепло идет на преодоление водородные связи и превращение жидкой воды в водяной пар, а не повышение температуры воды. Тепло, необходимое для испарения жидкой воды в водяной пар, составляет скрытая теплота парообразования , которая имеет значение 540 кал / г (Рисунок 5.1.2).
Рисунок 5.1.2 Скрытое тепло, необходимое для фазовых превращений в воде. Скрытая теплота плавления — это теплота, необходимая для плавления льда (80 кал / г), а скрытая теплота испарения — это теплота, необходимая для превращения жидкой воды в водяной пар (540 кал / г) (PW).
Скрытая теплота плавления — это теплота, необходимая для плавления льда (80 кал / г), а скрытая теплота испарения — это теплота, необходимая для превращения жидкой воды в водяной пар (540 кал / г) (PW).Высокая теплоемкость воды помогает регулировать глобальный климат, поскольку океаны медленно поглощают и выделяют тепло, предотвращая резкие колебания температуры (см. Раздел 8.1). Это также означает, что водные организмы не так подвержены таким быстрым перепадам температуры, как земные.Глубоководный организм может испытывать изменение температуры не более чем на 0,5 o C за всю свою жизнь, в то время как наземные виды могут столкнуться с изменениями температуры более чем на 20 o C за один день!
3. Вода растворяет больше веществ, чем любая другая жидкость; это «универсальный растворитель» , поэтому так много веществ растворено в океане. Вода особенно хорошо растворяет ионные соли; молекулы, состоящие из противоположно заряженных ионов, таких как NaCl (Na + и Cl — ). В воде заряженные ионы притягивают полярные молекулы воды. Ионы окружены слоем молекул воды, что ослабляет связь между ионами до 80 раз. При ослаблении связей между ионами вещество растворяется (рис. 5.1.3).
В воде заряженные ионы притягивают полярные молекулы воды. Ионы окружены слоем молекул воды, что ослабляет связь между ионами до 80 раз. При ослаблении связей между ионами вещество растворяется (рис. 5.1.3).
4. Твердая фаза менее плотная, чем жидкая фаза .Другими словами, лед плавает. Большинство веществ более плотно в твердой форме, чем в жидкой форме, поскольку их молекулы более плотно упакованы вместе как твердое тело. Вода является исключением: плотность пресной воды составляет 1,0 г / см 3 , а плотность льда составляет 0,92 г / см 3 , и опять же, это связано с действием водородных связей.
По мере того, как температура воды понижается, молекулы замедляются, в конечном итоге замедляясь настолько, что водородные связи могут образовывать и удерживать молекулы воды в кристаллической решетке. Молекулы в решетке расположены дальше друг от друга, чем молекулы в жидкой воде, что делает лед менее плотным, чем жидкая вода (рис. 5.1.4). Это знакомо любому, кто когда-либо оставлял полную бутылку с водой в морозильной камере, только чтобы она лопнула, когда вода замерзла и расширилась.
Молекулы в решетке расположены дальше друг от друга, чем молекулы в жидкой воде, что делает лед менее плотным, чем жидкая вода (рис. 5.1.4). Это знакомо любому, кто когда-либо оставлял полную бутылку с водой в морозильной камере, только чтобы она лопнула, когда вода замерзла и расширилась.
Но зависимость между температурой и плотностью воды не является простой линейной.Когда вода охлаждается, ее плотность увеличивается, как и ожидалось, поскольку молекулы воды замедляются и сближаются. Однако пресная вода достигает максимальной плотности при температуре 4 o ° C, и по мере охлаждения выше этой точки ее плотность уменьшается, поскольку начинают формироваться водородные связи и увеличивается межмолекулярное расстояние (вставка на рис. 5.1.5). Плотность продолжает снижаться до тех пор, пока температура не достигнет 0 o ° C и не образуются кристаллы льда, резко снижающие плотность (Рисунок 5.1.5).
Плотность продолжает снижаться до тех пор, пока температура не достигнет 0 o ° C и не образуются кристаллы льда, резко снижающие плотность (Рисунок 5.1.5).
То, что лед менее плотный, чем вода, имеет ряд важных последствий. Лед, плавающий на поверхности океана, помогает регулировать температуру океана и, следовательно, глобальный климат, влияя на количество отраженного, а не поглощаемого солнечного света (см. Раздел 8.1). В меньшем масштабе поверхностный лед может предотвратить замерзание озер и прудов зимой. По мере охлаждения пресной поверхностной воды вода становится более плотной и опускается на дно. Затем новая поверхностная вода охлаждается и опускается, и процесс повторяется в так называемом опрокидывании , при этом более плотная вода опускается, а менее плотная вода перемещается к поверхности только для того, чтобы охладиться и опустить сама себя. Таким образом, вся вода охлаждается равномерно. Этот процесс продолжается до тех пор, пока поверхностная вода не остынет ниже 4 o C.При температуре ниже 4 o C вода становится на менее плотной, чем на , по мере охлаждения, поэтому она больше не тонет. Вместо этого он остается как поверхность, становясь все холоднее и менее плотной, пока не замерзнет при температуре 0 o C. Когда пресная вода замерзает, лед всплывает и изолирует остальную воду под собой, уменьшая дальнейшее охлаждение. Самая плотная придонная вода по-прежнему имеет температуру 4 o C, поэтому она не замерзает, позволяя дну озера или пруда оставаться незамерзшим (что является хорошей новостью для живущих там животных) независимо от того, насколько холодно на улице.
Таким образом, вся вода охлаждается равномерно. Этот процесс продолжается до тех пор, пока поверхностная вода не остынет ниже 4 o C.При температуре ниже 4 o C вода становится на менее плотной, чем на , по мере охлаждения, поэтому она больше не тонет. Вместо этого он остается как поверхность, становясь все холоднее и менее плотной, пока не замерзнет при температуре 0 o C. Когда пресная вода замерзает, лед всплывает и изолирует остальную воду под собой, уменьшая дальнейшее охлаждение. Самая плотная придонная вода по-прежнему имеет температуру 4 o C, поэтому она не замерзает, позволяя дну озера или пруда оставаться незамерзшим (что является хорошей новостью для живущих там животных) независимо от того, насколько холодно на улице.
Растворенные соли в морской воде препятствуют образованию кристаллической решетки и, следовательно, затрудняют образование льда. Таким образом, морская вода имеет точку замерзания около -2 o C (в зависимости от солености) и замерзает до того, как будет достигнута температура максимальной плотности. Таким образом, морская вода будет продолжать тонуть по мере того, как становится холоднее, пока, наконец, не замерзнет.
Таким образом, морская вода будет продолжать тонуть по мере того, как становится холоднее, пока, наконец, не замерзнет.
5. Вода имеет очень высокое поверхностное натяжение , самое высокое из всех жидкостей, кроме ртути (таблица 5.1.2). Молекулы воды притягиваются друг к другу водородными связями.Если молекулы не находятся на поверхности воды, они окружены другими молекулами воды во всех направлениях, поэтому силы притяжения равномерно распределены во всех направлениях. Но для молекул на поверхности есть несколько соседних молекул над ними, только под ними, поэтому все силы притяжения направлены внутрь, от поверхности (рис. 5.1.6). Эта сила, направленная внутрь, заставляет капли воды принимать сферическую форму, а воду разбрызгивать на поверхность, поскольку сферическая форма обеспечивает минимально возможную площадь поверхности.Эти силы притяжения также заставляют поверхность воды действовать как эластичная «кожа», которая позволяет таким вещам, как насекомые, сидеть на поверхности воды, не тоня.
Таблица 5.1.2 Поверхностное натяжение различных жидкостей
| Жидкость | Поверхностное натяжение (миллиньютон на метр) | Температура o C |
|---|---|---|
| Меркурий | 487.00 | 15 |
| Вода | 71,97 | 25 |
| Глицерин | 63,00 | 20 |
| ацетон | 23,70 | 20 |
| этанол | 22,27 | 20 |
Необычные свойства воды — Химия LibreTexts
Поскольку 70% нашей Земли — это вода океана, а 65% наших тел — вода, трудно не осознавать, насколько это важно в нашей жизни.Существует 3 различных формы воды, или H 2 O: твердая (лед), жидкость (вода) и газ (пар). Поскольку вода кажется такой повсеместной, многие люди не знают о необычных и уникальных свойствах воды, в том числе:
Поскольку вода кажется такой повсеместной, многие люди не знают о необычных и уникальных свойствах воды, в том числе:
- Температура кипения и замерзания
- Поверхностное натяжение, теплота испарения и давление пара
- Вязкость и когезия
- Твердотельный
- Жидкое состояние
- Состояние газа
Температура кипения и замерзания
Если вы посмотрите в периодическую таблицу и найдите теллур (атомный номер: 52), вы обнаружите, что точки кипения гидридов уменьшаются по мере уменьшения размера молекулы.Таким образом, гидрид теллура: H 2 Te (теллурид водорода) имеет температуру кипения -4 ° C . Двигаясь вверх, следующим гидридом будет H 2 Se (селенид водорода) с температурой кипения -42 ° C . Еще раз, и вы обнаружите, что H 2 S (сероводород) имеет точку кипения -62 ° C . Следующим гидридом будет H 2 O (ВОДА!) . И все мы знаем, что температура кипения воды составляет 100 ° C .Таким образом, несмотря на свою малую молекулярную массу , вода имеет невероятно высокую точку кипения . Это связано с тем, что воде требуется больше энергии, чтобы разорвать водородные связи, прежде чем она сможет закипеть. То же самое применимо и к точке замерзания, как показано в таблице ниже. Точки кипения и замерзания воды позволяют молекулам очень медленно закипать или замерзать, это важно для экосистем, живущих в воде. Если бы воду было очень легко заморозить или вскипятить, резкие изменения в окружающей среде, а также в океанах или озерах привели бы к смерти всех организмов, живущих в воде.Вот почему пот может охлаждать наше тело.
Следующим гидридом будет H 2 O (ВОДА!) . И все мы знаем, что температура кипения воды составляет 100 ° C .Таким образом, несмотря на свою малую молекулярную массу , вода имеет невероятно высокую точку кипения . Это связано с тем, что воде требуется больше энергии, чтобы разорвать водородные связи, прежде чем она сможет закипеть. То же самое применимо и к точке замерзания, как показано в таблице ниже. Точки кипения и замерзания воды позволяют молекулам очень медленно закипать или замерзать, это важно для экосистем, живущих в воде. Если бы воду было очень легко заморозить или вскипятить, резкие изменения в окружающей среде, а также в океанах или озерах привели бы к смерти всех организмов, живущих в воде.Вот почему пот может охлаждать наше тело.
| СОЕДИНЕНИЕ | ТОЧКА КИПЕНИЯ | ТОЧКА ЗАМЕРЗАНИЯ |
|---|---|---|
| Теллурид водорода | -4 ° С | -49 ° С |
| Селенид водорода | -42 ° С | -64 ° С |
| Сероводород | -62 ° С | -84 ° С |
| Вода | 100 ° С | 0 ° С |
Поверхностное натяжение, теплота испарения и давление пара
Помимо ртути, вода имеет самое высокое поверхностное натяжение для всех жидкостей. Высокое поверхностное натяжение воды связано с водородными связями в молекулах воды. Вода также имеет исключительно высокую теплоту испарения (). Испарение происходит, когда жидкость превращается в газ, что вызывает эндотермическую реакцию. Теплота испарения воды составляет 41 кДж / моль. Давление пара. обратно пропорционально межмолекулярным силам, поэтому те, у кого более сильные межмолекулярные силы, имеют более низкое давление пара. Вода имеет очень сильные межмолекулярные силы, отсюда и низкое давление пара, но оно даже ниже по сравнению с более крупными молекулами с низким давлением пара.
Высокое поверхностное натяжение воды связано с водородными связями в молекулах воды. Вода также имеет исключительно высокую теплоту испарения (). Испарение происходит, когда жидкость превращается в газ, что вызывает эндотермическую реакцию. Теплота испарения воды составляет 41 кДж / моль. Давление пара. обратно пропорционально межмолекулярным силам, поэтому те, у кого более сильные межмолекулярные силы, имеют более низкое давление пара. Вода имеет очень сильные межмолекулярные силы, отсюда и низкое давление пара, но оно даже ниже по сравнению с более крупными молекулами с низким давлением пара.
- Вязкость — это свойство жидкости, имеющей высокое сопротивление течению. Обычно мы думаем, что жидкости, такие как мед или моторное масло, вязкие, но по сравнению с другими веществами с аналогичной структурой вода вязкая. Жидкости с более сильным межмолекулярным взаимодействием обычно более вязкие, чем жидкости со слабым межмолекулярным взаимодействием.

- Когезия — это межмолекулярные силы между подобными молекулами; вот почему молекулы воды могут удерживаться вместе в капле.Молекулы воды очень сплочены из-за полярности молекулы. Вот почему вы можете наполнить стакан водой чуть выше края, не пролив ее.
Твердотельный (лед)
Все вещества, включая воду, становятся менее плотными при нагревании и более плотными при охлаждении. Таким образом, если вода охлаждается, она становится более плотной и образует лед. Вода — одно из немногих веществ, твердое состояние которого может плавать в жидком состоянии! Зачем? Вода продолжает становиться более плотной, пока не достигнет 4 ° C.После достижения 4 ° C он становится на МЕНЬШЕ плотностью. При замерзании молекулы в воде начинают двигаться медленнее, что облегчает им образование водородных связей и, в конечном итоге, превращается в открытую кристаллическую гексагональную структуру. Из-за этой открытой структуры, когда молекулы воды удерживаются дальше друг от друга, объем воды увеличивается на примерно на 9%. Таким образом, в жидком состоянии молекулы более плотно упакованы, чем в твердом состоянии. Вот почему банка газировки может взорваться в морозильной камере.
Таким образом, в жидком состоянии молекулы более плотно упакованы, чем в твердом состоянии. Вот почему банка газировки может взорваться в морозильной камере.
Жидкое состояние (Жидкая вода)
Очень редко можно найти соединение, в котором отсутствует углерод, чтобы быть жидким при стандартных температурах и давлениях. Поэтому вода при комнатной температуре не является жидкостью! Вода при комнатной температуре жидкая, поэтому она может двигаться быстрее, чем твердая, что позволяет молекулам образовывать меньше водородных связей, в результате чего молекулы упаковываются более плотно. Каждая молекула воды соединяется с четырьмя другими, образуя тетраэдрическое расположение, однако они могут свободно перемещаться и скользить друг мимо друга, в то время как лед образует твердую, более крупную гексагональную структуру.
Состояние газа (пар)
Когда вода закипает, ее водородные связи разрываются. Частицы пара движутся очень далеко друг от друга и быстро, поэтому водородные связи едва ли успевают сформироваться. Таким образом, по мере того, как частицы достигают критической точки над паром, присутствует все меньше и меньше водородных связей. Отсутствие водородных связей объясняет, почему пар вызывает гораздо большие ожоги, чем вода. Пар содержит всю энергию, используемую для разрыва водородных связей в воде, поэтому, когда пар попадает вам в лицо, вы сначала поглощаете энергию, полученную паром от разрыва водородных связей в его жидком состоянии.Затем в результате экзотермической реакции пар превращается в жидкую воду и выделяется тепло. Это тепло добавляется к теплу кипящей воды, поскольку пар конденсируется на вашей коже.
Таким образом, по мере того, как частицы достигают критической точки над паром, присутствует все меньше и меньше водородных связей. Отсутствие водородных связей объясняет, почему пар вызывает гораздо большие ожоги, чем вода. Пар содержит всю энергию, используемую для разрыва водородных связей в воде, поэтому, когда пар попадает вам в лицо, вы сначала поглощаете энергию, полученную паром от разрыва водородных связей в его жидком состоянии.Затем в результате экзотермической реакции пар превращается в жидкую воду и выделяется тепло. Это тепло добавляется к теплу кипящей воды, поскольку пар конденсируется на вашей коже.
Вода как «универсальный растворитель»
Благодаря полярности воды она способна растворять или диссоциировать многие частицы. Кислород имеет слегка отрицательный заряд, тогда как два атома водорода имеют слегка положительный заряд. Слегка отрицательные частицы соединения будут притягиваться к атомам водорода воды, а слегка положительные частицы будут притягиваться к молекуле кислорода воды; это вызывает диссоциацию соединения. Помимо приведенных выше объяснений, мы можем взглянуть на некоторые атрибуты молекулы воды, чтобы выявить еще несколько причин уникальности воды:
Помимо приведенных выше объяснений, мы можем взглянуть на некоторые атрибуты молекулы воды, чтобы выявить еще несколько причин уникальности воды:
- Если забыть о фторе, то кислород является наиболее электроотрицательным элементом, не являющимся благородным газом, поэтому при образовании связи электроны тянутся к атому кислорода, а не к водороду. Это создает 2 полярные связи, которые делают молекулу воды более полярной, чем связи в других гидридах в группе.
- Валентный угол 104,5 ° создает очень сильный диполь.
- Вода имеет водородные связи, что, вероятно, является важным аспектом сильного межмолекулярного взаимодействия в воде.
Почему это важно для реального мира?
Свойства воды делают ее пригодной для выживания организмов в различных погодных условиях. Лед замерзает при расширении, что объясняет, почему лед может плавать в жидкой воде. Зимой, когда озера начинают замерзать, поверхность воды замерзает, а затем опускается к более глубокой воде; это объясняет, почему люди могут кататься на коньках или падать в замерзшем озере. Если бы лед не мог плавать, озеро замерзло бы снизу вверх, убив все экосистемы, обитающие в озере. Однако лед плавает, поэтому рыба может выжить зимой под поверхностью льда. Поверхность льда над озером также защищает озера от холодной температуры снаружи и изолирует воду под ним, позволяя озеру под замерзшим льдом оставаться жидким и поддерживать температуру, достаточную для выживания экосистем, живущих в озере.
Если бы лед не мог плавать, озеро замерзло бы снизу вверх, убив все экосистемы, обитающие в озере. Однако лед плавает, поэтому рыба может выжить зимой под поверхностью льда. Поверхность льда над озером также защищает озера от холодной температуры снаружи и изолирует воду под ним, позволяя озеру под замерзшим льдом оставаться жидким и поддерживать температуру, достаточную для выживания экосистем, живущих в озере.
ресурсов
- Cracolice, Марк С.и Эдвард Петерс I. Основы вводной химии . Томпсон, издательство Brooks / Cole Publishing Company. 2006
- Петруччи и др. Общая химия: принципы и современные приложения: AIE (твердый переплет). Река Аппер Сэдл: Пирсон / Прентис Холл, 2007.
Авторы и указание авторства
- Корин Йи (UCD), Дезире Роззи (UCD)
8 (а) Физические свойства воды
Мы живем на планете, где доминируют
воды. Покрыто более 70% поверхности Земли.
с этой простой молекулой. По оценкам ученых, гидросфера содержит около
1,36 миллиарда кубических километров этого вещества в основном
в виде жидкости (воды), занимающей топографические
впадины на Земле. Вторая по распространенности форма
молекулы воды на нашей планете — это лед.
Если бы весь лед на нашей планете растаял, уровень моря
подняться примерно на 70 метров.
Покрыто более 70% поверхности Земли.
с этой простой молекулой. По оценкам ученых, гидросфера содержит около
1,36 миллиарда кубических километров этого вещества в основном
в виде жидкости (воды), занимающей топографические
впадины на Земле. Вторая по распространенности форма
молекулы воды на нашей планете — это лед.
Если бы весь лед на нашей планете растаял, уровень моря
подняться примерно на 70 метров.
Вода также необходима для жизни. вода является основной составляющей почти всех форм жизни. Наиболее животные и растения содержат более 60% воды по объему. Без воды жизнь, наверное, никогда бы не развивалась на нашей планете.
Вода имеет очень простую атомную структуру. Эта структура состоит из двух атомов водорода, связанных
к одному атому кислорода ( Рисунок 8a-1 ).Природа атомной структуры воды обуславливает ее
молекулы обладают уникальными электрохимическими свойствами.
Водородная сторона молекулы воды имеет небольшой
положительный заряд (см. рис. ).
8а-1 ). На
На другой стороне молекулы существует отрицательный заряд.
Эта молекулярная полярность делает воду мощным
растворитель и отвечает за его прочную поверхность напряжение (для получения дополнительной информации об этих двух свойствах
см. обсуждение ниже).
Эта структура состоит из двух атомов водорода, связанных
к одному атому кислорода ( Рисунок 8a-1 ).Природа атомной структуры воды обуславливает ее
молекулы обладают уникальными электрохимическими свойствами.
Водородная сторона молекулы воды имеет небольшой
положительный заряд (см. рис. ).
8а-1 ). На
На другой стороне молекулы существует отрицательный заряд.
Эта молекулярная полярность делает воду мощным
растворитель и отвечает за его прочную поверхность напряжение (для получения дополнительной информации об этих двух свойствах
см. обсуждение ниже).
Рисунок
8a-1 :
Атомная структура воды (или дигидрогена
монооксида) молекула состоит из двух водородных
( H )
атомы соединены в один кислород ( O )
атом. Уникальный способ, которым атомы водорода
прикреплены к атому кислорода, вызывает одну сторону
молекулы иметь отрицательный заряд и
область в противоположном направлении, чтобы иметь положительный
плата.Результирующая полярность заряда вызывает
молекулы воды притягиваются друг к другу
образуя прочные молекулярные связи. Уникальный способ, которым атомы водорода
прикреплены к атому кислорода, вызывает одну сторону
молекулы иметь отрицательный заряд и
область в противоположном направлении, чтобы иметь положительный
плата.Результирующая полярность заряда вызывает
молекулы воды притягиваются друг к другу
образуя прочные молекулярные связи. |
Когда молекула воды образует физическую фазу изменить его молекулы располагаются в
отчетливо разные узоры ( Рисунок 8a-2 ).Молекулярное устройство льда (твердое тело
форма молекулы воды) приводит к увеличению
в объеме и уменьшении плотности.
Расширение молекулы воды при замерзании позволяет
лед, чтобы плавать поверх жидкой воды.
Рисунок
8a-2 :
Три диаграммы выше иллюстрируют различные
схемы расположения молекул воды как
они меняют свое физическое состояние с льда на воду
к газу.Молекулы замороженной воды расставляют
себя в особо высокоорганизованной жесткой
геометрический узор, вызывающий массу воды
расширяться и уменьшаться в плотности. Диаграмма
наверху показан срез массы льда,
шириной в одну молекулу. В жидкой фазе вода
молекулы объединяются в небольшие группы
объединенных частиц. Тот факт, что эти договоренности
маленькие позволяет жидкой воде двигаться и течь.
Молекулы воды в виде газа очень
заряжен энергией. Это состояние высокой энергии
заставляет молекулы всегда двигаться, уменьшая
вероятность связей между отдельными
молекулы от формирования. Тот факт, что эти договоренности
маленькие позволяет жидкой воде двигаться и течь.
Молекулы воды в виде газа очень
заряжен энергией. Это состояние высокой энергии
заставляет молекулы всегда двигаться, уменьшая
вероятность связей между отдельными
молекулы от формирования. |
У воды есть несколько других уникальных физических свойств. свойства.Эти свойства:
- Вода имеет высокую удельную тепло . Удельная теплоемкость — это количество
энергия, необходимая для изменения температуры
вещество. Поскольку вода имеет высокую удельную
тепло, он может поглощать большое количество тепловой энергии
прежде, чем он начнет нагреваться.
 Это также означает, что
вода медленно выделяет тепловую энергию, когда ситуации
заставьте его остыть.Высокая удельная теплоемкость воды
позволяет смягчить климат Земли
и помогает организмам регулировать температуру тела
более эффективно.
Это также означает, что
вода медленно выделяет тепловую энергию, когда ситуации
заставьте его остыть.Высокая удельная теплоемкость воды
позволяет смягчить климат Земли
и помогает организмам регулировать температуру тела
более эффективно. - Вода в чистом виде имеет нейтральный pH . В результате чистая вода не является ни кислой , ни основной . Вода меняет свой pH при растворении веществ в этом.Дождь имеет естественно кислый pH около 5,6. потому что он содержит диоксид углерода природного происхождения и диоксид серы.
- Вода проводит тепло
легче любой жидкости, кроме ртути.
 Эта
факт вызывает большие объемы жидкой воды, такие как озера
и океаны должны иметь по существу однородную вертикальную
температурный профиль.
Эта
факт вызывает большие объемы жидкой воды, такие как озера
и океаны должны иметь по существу однородную вертикальную
температурный профиль. - Молекулы воды существуют в жидкой форме над важным диапазон температур от 0 до 100 ° Цельсия. Эта диапазон позволяет молекулам воды существовать в виде жидкости в большинстве мест на нашей планете.
- Вода — универсальный растворитель . Способен растворять большое количество разных химические соединения.Эта функция также включает воду для переноса питательных веществ-растворителей в сток , инфильтрация , подземные воды поток , и живые организмы.
- Вода имеет высокую поверхность натяжение ( рисунки 8a-3 и 8a-4 ).
 Другими словами, вода липкая и эластичная,
и имеет тенденцию собираться каплями, а не растекаться
на поверхность в виде тонкой пленки.Этот феномен
также заставляет воду прилипать к сторонам вертикального
структуры, несмотря на нисходящее притяжение гравитации. Воды
высокое поверхностное натяжение позволяет образовывать
капель воды и волн, позволяет растениям
удалить воду (и растворенные питательные вещества) из их
корни к их листьям, и движение крови
через крошечные сосуды в теле некоторых животных.
Другими словами, вода липкая и эластичная,
и имеет тенденцию собираться каплями, а не растекаться
на поверхность в виде тонкой пленки.Этот феномен
также заставляет воду прилипать к сторонам вертикального
структуры, несмотря на нисходящее притяжение гравитации. Воды
высокое поверхностное натяжение позволяет образовывать
капель воды и волн, позволяет растениям
удалить воду (и растворенные питательные вещества) из их
корни к их листьям, и движение крови
через крошечные сосуды в теле некоторых животных.
Рисунок 8a-3 :
На следующем рисунке показано, как вода
молекулы притягиваются друг к другу, чтобы создать
высокое поверхностное натяжение. Это свойство может вызвать воду
существовать в виде обширной тонкой пленки на твердых поверхностях.
В приведенном выше примере пленка состоит из двух слоев
молекулы воды толщиной. Это свойство может вызвать воду
существовать в виде обширной тонкой пленки на твердых поверхностях.
В приведенном выше примере пленка состоит из двух слоев
молекулы воды толщиной. |
| Рисунок 8a-4 : Адгезионные свойства. молекул воды позволяет образовывать капель воды (Фото © 2004 Эдвард Цанг). |
- Молекулы воды — единственное вещество на Земле
которые существуют во всех трех физических
состояния вещества : твердое , жидкое и газ .
 Включены в изменения состояния огромны
количества теплообмена. Эта функция играет важную
роль в перераспределении тепловой энергии в
Атмосфера Земли. По теплопередаче
в атмосферу, примерно 3/4 этого
процесс осуществляется за счет испарения и конденсации
воды.
Включены в изменения состояния огромны
количества теплообмена. Эта функция играет важную
роль в перераспределении тепловой энергии в
Атмосфера Земли. По теплопередаче
в атмосферу, примерно 3/4 этого
процесс осуществляется за счет испарения и конденсации
воды. - Замерзание молекул воды вызывает их массу
занимать больший объем. Когда вода замерзает
быстро расширяется, добавляя около 9% по объему. Свежий
вода имеет максимальную плотность около 4 ° по Цельсию.
(см. таблицу 8а-1 ).
Вода — единственное вещество на этой планете, где
максимальная плотность его массы не возникает при
он затвердевает.

Таблица 8a-1: Плотность молекул воды при различных температурах.
Температура (градусы Цельсия) | Плотность (граммов на куб. сантиметр) |
0 (цельный) | 0.9150 |
0 (жидкость) | 0,9999 |
4 | 1. |
20 | 0.9982 |
40 | 0,9922 |
60 | 0,9832 |
80 | 0.9718 |
100 (газ) | 0,0006 |
Физические и химические свойства воды
Эксперты Element оценивают физические и химические свойства качества воды, чтобы помочь консультантам по экологии убедиться, что вода соответствует нормативным требованиям, а также безопасна для людей и окружающей среды.
Физические характеристики воды зависят от температуры, цвета, вкуса и запаха пробы воды. Химические свойства воды включают такие параметры, как pH и растворенный кислород. Мониторинг этих характеристик помогает определить, соответствует ли вода государственным постановлениям и является ли она безопасной для потребления человеком и окружающей среды.
Физические характеристики качества воды
Очень важно отслеживать физические аспекты качества воды, чтобы определить, загрязнена ли вода.Физические характеристики можно определить по:
- Цвет — чистая вода бесцветна; цветная вода может указывать на загрязнение. Цвет также может отображать органические вещества. Максимально допустимый уровень цвета питьевой воды — 15 TCU (единица истинного цвета).
- Мутность — чистая вода прозрачная и не поглощает свет. Если в воде появляется помутнение, это может указывать на загрязнение воды.
- Вкус и запах — чистая вода всегда без вкуса и запаха.
 Если присутствует какой-либо вкус и запах, это может указывать на загрязнение воды.
Если присутствует какой-либо вкус и запах, это может указывать на загрязнение воды. - Температура — температура не используется напрямую для оценки пригодности воды для питья. Однако в природных водных системах, таких как озера и реки, температура является важным физическим фактором, определяющим качество воды.
- Твердые вещества — если вода фильтруется для удаления взвешенных твердых частиц, оставшееся твердое вещество в воде указывает общее количество растворенных твердых веществ. Если содержание растворенных твердых веществ в воде превышает 300 мг / л, это отрицательно сказывается на живых организмах, а также на промышленных продуктах.
Химические свойства воды
Химические свойства воды включают оценку таких параметров, как pH и растворенный кислород:
- pH — pH воды измеряется в диапазоне от 0 до 14, чтобы определить, насколько она кислая или щелочная. Измерение проводится по логарифмической шкале.
- Растворенный кислород — это уровень свободного, несоставного кислорода, присутствующего в воде или других жидкостях.
 Это важный параметр при оценке качества воды из-за его влияния на организмы, живущие в водоеме.
Это важный параметр при оценке качества воды из-за его влияния на организмы, живущие в водоеме.
Услуги экспертов по испытанию и анализу воды
Привлеченные экспертыElement могут оценить как физические, так и химические свойства качества воды, чтобы определить, является ли вода безопасной и пригодной для использования.
В море нормативных требований эксперты Element готовы помочь вам пройти путь к соблюдению, а также обсудить и разработать индивидуальные программы мониторинга и анализа воды, которые точно соответствуют вашим потребностям. Мы активно помогаем со сбором и анализом данных, отбираем пробы и предоставляем экологическую отчетность.
Наши ученые обладают опытом в различных аналитических лабораторных услугах. Они умеют применять передовые технологии для получения точных и надежных результатов, которые помогут вам соблюдать все соответствующие нормативы для вашей отрасли.
Чтобы узнать больше о наших услугах по анализу воды или поговорить с одним из наших экспертов, свяжитесь с нами сегодня.


 34519 фунтов м / галлон (США)
34519 фунтов м / галлон (США) 00612 бар = 611,657 Па = 0,08871 фунт / кв. Дюйм (= фунт / дюйм / дюйм 2 )
00612 бар = 611,657 Па = 0,08871 фунт / кв. Дюйм (= фунт / дюйм / дюйм 2 ) Например, вода (H 2 O) амфотерная.
Например, вода (H 2 O) амфотерная. Как бы вы описали это решение?
Как бы вы описали это решение? Благодаря этим зарядам молекулы воды могут окружать заряженные частицы, возникающие при диссоциации вещества. Окружающий слой молекул воды стабилизирует ион и не дает ионам с разным зарядом повторно связываться, поэтому вещество остается растворенным.
Благодаря этим зарядам молекулы воды могут окружать заряженные частицы, возникающие при диссоциации вещества. Окружающий слой молекул воды стабилизирует ион и не дает ионам с разным зарядом повторно связываться, поэтому вещество остается растворенным.
 Это также означает, что
вода медленно выделяет тепловую энергию, когда ситуации
заставьте его остыть.Высокая удельная теплоемкость воды
позволяет смягчить климат Земли
и помогает организмам регулировать температуру тела
более эффективно.
Это также означает, что
вода медленно выделяет тепловую энергию, когда ситуации
заставьте его остыть.Высокая удельная теплоемкость воды
позволяет смягчить климат Земли
и помогает организмам регулировать температуру тела
более эффективно. Эта
факт вызывает большие объемы жидкой воды, такие как озера
и океаны должны иметь по существу однородную вертикальную
температурный профиль.
Эта
факт вызывает большие объемы жидкой воды, такие как озера
и океаны должны иметь по существу однородную вертикальную
температурный профиль. Другими словами, вода липкая и эластичная,
и имеет тенденцию собираться каплями, а не растекаться
на поверхность в виде тонкой пленки.Этот феномен
также заставляет воду прилипать к сторонам вертикального
структуры, несмотря на нисходящее притяжение гравитации. Воды
высокое поверхностное натяжение позволяет образовывать
капель воды и волн, позволяет растениям
удалить воду (и растворенные питательные вещества) из их
корни к их листьям, и движение крови
через крошечные сосуды в теле некоторых животных.
Другими словами, вода липкая и эластичная,
и имеет тенденцию собираться каплями, а не растекаться
на поверхность в виде тонкой пленки.Этот феномен
также заставляет воду прилипать к сторонам вертикального
структуры, несмотря на нисходящее притяжение гравитации. Воды
высокое поверхностное натяжение позволяет образовывать
капель воды и волн, позволяет растениям
удалить воду (и растворенные питательные вещества) из их
корни к их листьям, и движение крови
через крошечные сосуды в теле некоторых животных. Включены в изменения состояния огромны
количества теплообмена. Эта функция играет важную
роль в перераспределении тепловой энергии в
Атмосфера Земли. По теплопередаче
в атмосферу, примерно 3/4 этого
процесс осуществляется за счет испарения и конденсации
воды.
Включены в изменения состояния огромны
количества теплообмена. Эта функция играет важную
роль в перераспределении тепловой энергии в
Атмосфера Земли. По теплопередаче
в атмосферу, примерно 3/4 этого
процесс осуществляется за счет испарения и конденсации
воды.
 0000
0000 Если присутствует какой-либо вкус и запах, это может указывать на загрязнение воды.
Если присутствует какой-либо вкус и запах, это может указывать на загрязнение воды. Это важный параметр при оценке качества воды из-за его влияния на организмы, живущие в водоеме.
Это важный параметр при оценке качества воды из-за его влияния на организмы, живущие в водоеме.