4 свойства воды определяющих нашу жизнь
4 свойства воды определяющих нашу жизнь
Вода – главный источник всей жизни на Земле
Все живые организмы на планете состоят на определенный процент из жидкости. Человек в среднем на 60-70% состоит из воды, это соотношение уменьшается по мере старения. Чтобы поддерживать хорошее состояние здоровья, необходимо ежедневно выпивать определенное количество жидкости, но ведь не каждая вода пригодна к употреблению.
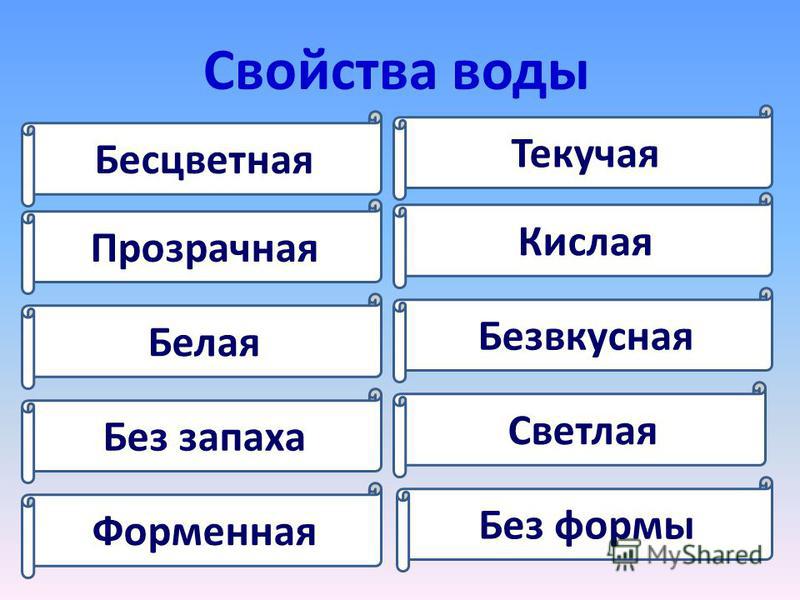
Несмотря на свою простоту на первый взгляд, вода – сложная система взаимосвязей с десятками различных свойств и характеристик. Человек способен определить только поверхностные признаки, такие как:
• Вкус
• Цвет
• Запах
• Чистота
• Прозрачность
Если по этим критериям вода выглядит нормальной, значит, считается, что она пригодна к употреблению, но это ошибочное мнение.
4 ключевые свойства, влияющие на здоровье
Не считая основных физических характеристик, жидкость имеет 4 свойства, значение которых влияет на наше самочувствие:
• Окислительно-восстановительный потенциал. В зависимости от показателей ОВП в организме активно развиваются процессы старения или омоложения. Разная жидкость имеет разные значения этого свойства.
В зависимости от показателей ОВП в организме активно развиваются процессы старения или омоложения. Разная жидкость имеет разные значения этого свойства.
• Кислотно-щелочной баланс. PH в организме человека в среднем составляет 6-9 единиц. Для поддержания здоровья, вода должна быть на уровне 7 единиц и не превышать допустимые показатели. В другом случае, такая вода не только будет бесполезной, но и нанесет вред организму, что в дальнейшем приведет к серьезным проблемам со здоровьем.
• Минерализация. Показатель концентрации в воде различных веществ определяется в единицах мг/л (миллиграмм на литр). Хорошая вода содержит 0,1-0,3 мг/л, превышение допустимого значения вызывает ряд негативных последствий из-за содержания в жидкости токсичных веществ, солей и металлов.
• Поверхностное натяжение. Жидкость способствует выведению из организма токсинов и шлаков. Поверхностное натяжение напрямую влияет, насколько эффективно будут выводиться продукты обмена. При высоком натяжении, вода будет плохо всасываться в клетки и естественно менее эффективно выводить вредные вещества. Для поддержания хорошего самочувствия необходимо употреблять жидкость с низким показателем поверхностного натяжения.
При высоком натяжении, вода будет плохо всасываться в клетки и естественно менее эффективно выводить вредные вещества. Для поддержания хорошего самочувствия необходимо употреблять жидкость с низким показателем поверхностного натяжения.
Внешне определить характер этих свойств вы не сможете. Эффект будет заметен только спустя несколько месяцев приема некачественной питьевой воды, когда начнет проявляться усталость, заболевания и другие проблемы со здоровьем.
Любая вода может быть идеальной
Не важно, покупаете вы воду в магазинах или пьете ее из-под крана, показатели свойств в любом случае будут далеки от идеала. Ведь все что продается на прилавках, это более очищенная жидкость из водопровода, тем не менее, ее оздоровительный эффект весьма сомнительный.
Любую воду можно довести до идеального состояния и сделать из нее «живую» просто добавив один пакетик Coral Mine.
Коралловый песок:
• Нормализует кислотно-щелочной баланс.
• Приравнивает ОВП к необходимым показателям.
• Удаляет лишние вещества, выставляя минерализацию на необходимый уровень.
• Снимает поверхностное натяжение, улучшая всасывание жидкости в клетки.
Все что от вас требуется – опустить один пакетик в 1,5 литра воды. Этого достаточно, чтобы создать целебную коралловую воду, которая позволит вам избежать проблем со здоровьем и стать одним из немногих долгожителей нашей планеты.
Вода свойства воды
Свойства воды (4 класс, окружающий мир, доклад)
Свойства воды (4 класс, окружающий мир, доклад)
Опубликовано: 22 января 2016 года
Предмет:
окружающий мир
Класс:
4 класс
Вода – это вещество образованное двумя химическими элементами из таблицы периодической системы Д.И. Менделеева – кислородом и водородом (Н2О).
Воду можно с уверенностью назвать главным жизнеобразующим веществом на Земле.
Подавляющее большинство живых организмов не могут жить без воды. Именно поэтому, когда ученые ведут поиски жизни на других планетах, они, в первую очередь, ищут воду. И если вдруг вода где-нибудь обнаруживается, такая планета автоматически причисляется к планетам «земного» типа, на которых с большой вероятностью может быть найдена жизнь.
И если вдруг вода где-нибудь обнаруживается, такая планета автоматически причисляется к планетам «земного» типа, на которых с большой вероятностью может быть найдена жизнь.
Обычным состоянием для воды является жидкое. Среди прочих жидкостей, воду принято считать нейтральным веществом. Именно жидкая вода (пресная) взята за исходную точку определения параметров жидкостей, таких как: плотность, текучесть, прозрачность и других.
Вода прекрасно проводит электричество, именно поэтому в грозу можно услышать раскаты грома и увидеть молнию. От дождя воздух увлажняется, что создает идеальные условия для возникновения электрического разряда, которым и является молния. После удара молнии, накопившееся в верхних слоях атмосферы электричество уходит в землю.
Вода также может принимать твердое состояние. Это происходит при ее замерзании. Если температура воды опускается ниже нуля градусов по цельсию, вода становится льдом. При этом объем воды немного возрастает, и если вода замерзла в стеклянной бутылке заполненной доверху, бутылка может расколоться.
В северных странах зимой водой заливают катки, а изо льда замерзших рек и озер делают ледяные скульптуры. Еще лед принято класть в различные напитки, для придания им мягкости и особого вкуса холодной свежести.
Кстати, считается, что талая вода – самая чистая и полезная. Потому что при замерзании с воды стирается вся впитавшаяся в нее энергоинформация, а вся грязь и другие примеси замерзают в верхних или нижних слоях льда которые визуально отличаются от кристально чистого среднего слоя. Соленая морская вода, превратившись в лед , становится пресной.
Вода способна впитывать, накапливать и передавать различную энергоинформацию. Научные опыты доказали, что вода, с которой обращались с любовью – впитав эту хорошую энергетику, может исцелять людей от болезней, стимулировать рост и развитие растений, влиять на окружающую среду. И напротив – вода, заряженная плохой энергетикой, может убить.
Люди, как и большинство других живых существ на Земле, более чем на 90% состоят из воды.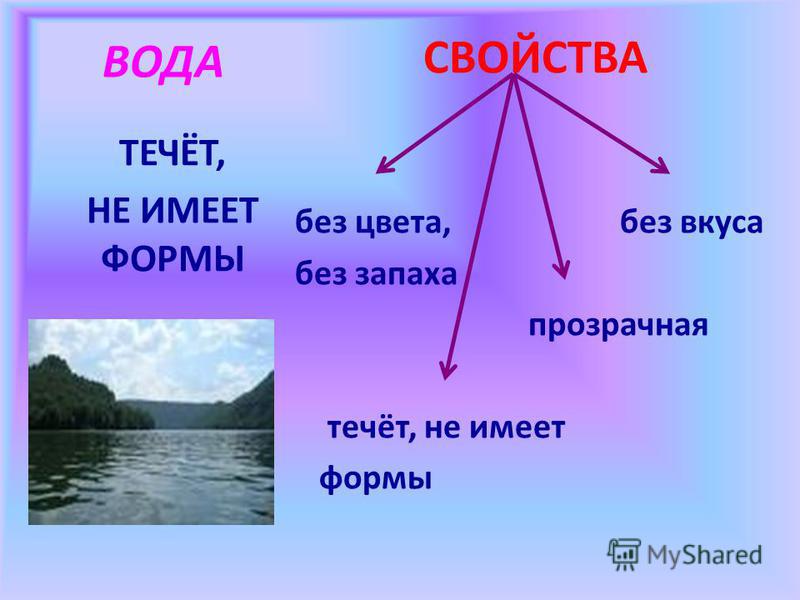 Из чего можно сделать вывод — все, что, так или иначе, влияет на нас, таким же самым образом влияет и на воду. Проще говоря – вода, которая лежит в нашей физической основе, подвержена внешним влияниям , что незамедлительно отражается на нашем душевном и физическом состоянии. Без еды человек способен прожить несколько недель, без воды – несколько дней.
Из чего можно сделать вывод — все, что, так или иначе, влияет на нас, таким же самым образом влияет и на воду. Проще говоря – вода, которая лежит в нашей физической основе, подвержена внешним влияниям , что незамедлительно отражается на нашем душевном и физическом состоянии. Без еды человек способен прожить несколько недель, без воды – несколько дней.
Другим удивительным состоянием воды является – пар. Вода превращается в пар при нагревании. Как правило, пар поднимается вверх, потому что теплый воздух легче холодного. Пар нагревает воздух и все, что встречает на своем пути. На этом принципе функционируют некоторые летательные аппараты типа дирижаблей и воздушных шаров. Также, на тепловой энергии пара работают некоторые устаревшие теперь механизмы. Например, в начале 20 века на пару работали двигатели поездов и кораблей. Такие поезда называются паровозы, а корабли – пароходы. В настоящее время энергия пара используется для обогрева жилых домов.
Если пар мгновенно охладить и заморозить – получится снег.
Вода – это чудо. В любом состоянии она необходима и полезна.
Еще материалы по теме:
Оцените доклад:
Почему нельзя загрязнять воду? (доклад для 3 класса) | Cвойства льда, 3 класс (доклад по Окружающему миру) | Почему надо беречь водоемы и реки (3 класс, доклад) |
Свойства воды: объяснение, когезия и сцепление
Знаете ли вы, что вода — единственное вещество на Земле, которое в природе встречается во всех трех агрегатных состояниях? Несмотря на то, что вода не имеет запаха, вкуса и не имеет калорийности, она необходима для жизни, и мы не можем жить без нее. Он играет роль в фотосинтезе и дыхании, растворяет многие растворенные вещества в организме, обеспечивает сотни химических реакций и необходим для метаболизма и функции ферментов.
Он играет роль в фотосинтезе и дыхании, растворяет многие растворенные вещества в организме, обеспечивает сотни химических реакций и необходим для метаболизма и функции ферментов.
Однако это тоже необычная молекула. Несмотря на свой небольшой размер, он имеет странно высокие температуры плавления и кипения и образует прочные связи со многими другими молекулами, включая саму себя. В этой статье мы рассмотрим, почему это так, наряду с некоторыми из других свойства воды .
- Эта статья представляет собой сфокусированный на химии обзор свойств воды .
- Начнем со структуры воды.
- Затем мы увидим, как это соотносится с его физическими свойствами, включая сцепление , адгезию и поверхностное натяжение .
- Мы также исследуем воду с высокой удельной теплоемкостью и температурами плавления и кипения .
- После этого мы рассмотрим почему лед менее плотный, чем вода и почему воду часто называют универсальным растворителем .

- Наконец, мы исследуем некоторые химические свойства воды: то, как она самоионизируется , и ее амфотерная природа .
Структура воды
Официальное название воды: дигидрогенмоноксид . Более внимательное изучение этого имени дает нам представление о его структуре. -водород говорит нам, что он содержит атомы водорода, а ди- указывает на то, что их два. -оксид относится к атомам кислорода, а моно- говорит нам, что он имеет только один. Соедините все вместе, и у нас останется вода: H 2 O. Вот она, показанная ниже:
Рис. 1 – Молекула воды
Вода состоит из двух атомов водорода, соединенных с центральным атомом кислорода одинарные ковалентные связи . Атом кислорода имеет две неподеленных пар электронов . Они плотно сжимают две ковалентные связи, уменьшая валентный угол до 104,5° и превращая воду в молекулу v-образной формы .
Рис. 2. Валентный угол в воде
Для получения дополнительной информации о различных формах молекул и влиянии неподеленных пар электронов на валентные углы см. Формы молекул .
Связь в воде
Давайте теперь посмотрим, как структура воды влияет на ее связь.
Водородные связи относятся к типу межмолекулярная сила . Они возникают из-за разницы в электроотрицательности между водородом и чрезвычайно электроотрицательным атомом, таким как кислород.
Электроотрицательность — это способность атома притягивать связанную пару электронов. Это приводит к тому, что связывающие электроны находятся ближе к одному атому в ковалентной связи, чем к другому.
Если вы еще этого не сделали, рекомендуем прочитать Межмолекулярные силы . Он объяснит некоторые концепции, которые мы упоминаем здесь, более подробно.
Как мы знаем, вода содержит два атома водорода, связанные с центральным атомом кислорода ковалентными связями . Благодаря этому вы обнаружите водородных связей между соседними молекулами воды.
Благодаря этому вы обнаружите водородных связей между соседними молекулами воды.
В случае воды кислород намного более электроотрицательный, чем водород. Это означает, что кислород притягивает связанную пару электронов, обнаруженную в каждой из связей кислород-водород, к себе и от водорода. Водород становится электрон-дефицитным , и мы говорим, что в целом молекула равна полярный .
Поскольку электроны имеют отрицательный заряд, кислород теперь заряжен слегка отрицательно, а водород — слегка положительно. Мы представляем эти частичные заряды дельта-символом , δ .
Рис. 3 – Полярность воды
Но как это приводит к образованию водородных связей? Ну, водород — это маленький атом. Фактически, это самый маленький атом во всей таблице Менделеева! Это означает, что его частичный положительный заряд плотно упакован в одно крошечное пространство. Мы говорим, что он имеет высокая плотность заряда . Поскольку он настолько положительно заряжен, его особенно притягивают отрицательно заряженные частицы, такие как другие электроны.
Поскольку он настолько положительно заряжен, его особенно притягивают отрицательно заряженные частицы, такие как другие электроны.
Что мы знаем об атоме кислорода в воде? Он содержит две неподеленные пары электронов! Это означает, что атомы водорода в молекулах воды притягиваются к неподеленным парам электронов в атомах кислорода в других молекулах воды.
Притяжение между плотно заряженным атомом водорода и неподеленной парой электронов кислорода известно как водородная связь .
Рис. 4 – Водородная связь между молекулами воды
Подводя итог, мы обнаруживаем водородную связь, когда имеем атомов водорода, ковалентно связанных с крайне электроотрицательным атомом с неподеленной парой электронов . Атом водорода становится электронодефицитным и притягивается к неподеленной паре электронов другого атома. Это водородная связь .
Только некоторые элементы обладают достаточной электроотрицательностью для образования водородных связей. Этими элементами являются кислород, азот и фтор. Хлор также теоретически достаточно электроотрицателен, но не образует водородных связей. Это потому, что это более крупный атом, и отрицательный заряд его неподеленных пар электронов распределен по большей площади. Плотность заряда недостаточно велика, чтобы должным образом притянуть частично заряженный атом водорода, поэтому он не образует водородных связей. Однако хлор испытывает постоянные диполь-дипольные силы.
Этими элементами являются кислород, азот и фтор. Хлор также теоретически достаточно электроотрицателен, но не образует водородных связей. Это потому, что это более крупный атом, и отрицательный заряд его неподеленных пар электронов распределен по большей площади. Плотность заряда недостаточно велика, чтобы должным образом притянуть частично заряженный атом водорода, поэтому он не образует водородных связей. Однако хлор испытывает постоянные диполь-дипольные силы.
Еще одно напоминание — мы более подробно рассмотрим эту тему в Межмолекулярные силы .
Физические свойства воды
Теперь, когда мы рассмотрели структуру и связь воды, мы можем исследовать, как это влияет на ее физические свойства. В следующем разделе мы рассмотрим следующие свойства:
- Когезия
- Адгезия
- Поверхностное натяжение
- Удельная теплоемкость
- Температура плавления и кипения
- Плотность
- Способность растворять
Когезионные свойства воды
Когезия — это способность частиц вещества прилипать друг к другу.
Если вы плеснете небольшое количество воды на поверхность, вы заметите, что она образует капли. Это пример сплоченности . Вместо того, чтобы распространяться равномерно, молекулы воды прилипают друг к другу в виде кластеров. Это связано с водородными связями между соседними молекулами воды.
Адгезионные свойства воды
Адгезия — это способность частиц одного вещества прилипать к другому веществу.
Когда вы наливаете воду в пробирку, вы заметите, что вода поднимается по краям сосуда. Он образует так называемый мениск . Когда вы измеряете объем воды, вы должны измерять от нижней части мениска, чтобы ваши измерения были полностью точными. это пример адгезия . Это происходит, когда вода образует водородные связи с другим веществом, например со стенками пробирки в данном случае.
Рис. 5 — Мениск
Не путайте когезию и адгезию. Когезия — это способность вещества прилипать к самому себе, тогда как адгезия — это способность вещества прилипать к другому веществу.
Поверхностное натяжение воды
Вы когда-нибудь задумывались, как насекомые могут ходить по поверхности луж и озер? Это из-за поверхностное натяжение .
Поверхностное натяжение описывает то, как молекулы на поверхности жидкости действуют как эластичный лист и пытаются занять наименьшую возможную площадь поверхности.
Это место, где частицы на поверхности жидкости сильно притягиваются к другим частицам в жидкости. Эти внешние частицы втягиваются в объем жидкости, заставляя жидкость принимать форму с наименьшей возможной площадью поверхности. Благодаря этому притяжению поверхность жидкости способна противостоять внешним силам, например весу насекомого. Вода имеет особенно высокое поверхностное натяжение из-за водородных связей между его молекулами. Это еще один пример связной природы воды.
Удельная теплоемкость воды
Удельная теплоемкость – это энергия, необходимая для повышения температуры одного грамма вещества на один градус Кельвина или один градус Цельсия.
Помните, что изменение на один градус Кельвина равносильно изменению на один градус Цельсия.
Изменение температуры вещества связано с разрывом некоторых связей внутри него. Водородные связи между молекулами воды очень прочны, поэтому для их разрыва требуется много энергии. Это означает, что вода имеет высокая удельная теплоемкость .
Высокая удельная теплоемкость воды означает, что она дает много преимуществ живым организмам, поскольку вода сопротивляется резким колебаниям температуры. Это помогает им поддерживать постоянную внутреннюю температуру, оптимизируя активность ферментов.
Температура плавления и кипения воды
Вода имеет высокие температуры плавления и кипения из-за сильных водородных связей между ее молекулами, для преодоления которых требуется много энергии. Это становится очевидным, когда вы сравниваете воду с молекулами аналогичного размера, которые не имеют водородных связей. Например, метан (СН 4 ) имеет молекулярную массу 16 и температуру кипения -161,5 ℃, тогда как вода имеет аналогичную молекулярную массу 18, но гораздо более высокую температуру кипения — ровно 100,0 ℃!
Плотность воды
Возможно, вы знаете, что большинство твердых тел более плотные, чем жидкости. А вот с водой немного необычно — все наоборот. Твердый лед намного менее плотный, чем жидкая вода , поэтому айсберги плавают на поверхности моря, а не тонут на дне океана. Чтобы понять почему, нам нужно более внимательно изучить структуру воды в двух состояниях.
А вот с водой немного необычно — все наоборот. Твердый лед намного менее плотный, чем жидкая вода , поэтому айсберги плавают на поверхности моря, а не тонут на дне океана. Чтобы понять почему, нам нужно более внимательно изучить структуру воды в двух состояниях.
Жидкая вода
В жидкости молекулы воды постоянно движутся . Это означает, что водородные связи между молекулами постоянно разрываются и снова восстанавливаются. Некоторые молекулы воды расположены очень близко друг к другу, а другие далеко друг от друга.
Твердый лед
В твердом состоянии молекулы воды зафиксированы в положении . Каждая молекула воды связана с четырьмя соседними молекулами воды водородными связями, удерживая ее в решетчатой структуре. Четыре водородные связи означают, что молекулы воды удерживаются на фиксированном расстоянии друг от друга. На самом деле, в этом твердом состоянии они находятся дальше друг от друга, чем в жидкой форме. Это делает твердый лед менее плотным, чем жидкая вода.
Это делает твердый лед менее плотным, чем жидкая вода.
Рис. 6. Ледяная решетка
Вода как растворитель
Последнее физическое свойство, которое мы рассмотрим сегодня, — это способность воды как растворителя .
Растворитель — это вещество, которое растворяет второе вещество, называемое растворенным веществом , с образованием раствора .
Воду часто называют универсальным растворителем . Это потому, что он может растворять широкий спектр различных веществ. На самом деле почти все полярные вещества растворяются в воде . Это потому, что молекулы воды также полярны. Вещества растворяются, когда притяжение между ними и растворителем сильнее, чем притяжение между молекулой растворителя и молекулой растворителя, молекулой растворенного вещества и молекулой растворенного вещества.
В случае воды отрицательный атом кислорода притягивается к любым положительно заряженным молекулам растворенного вещества, а положительные атомы водорода притягиваются к любым отрицательно заряженным молекулам растворенного вещества. Это притяжение сильнее, чем силы, удерживающие растворенное вещество вместе, поэтому растворенное вещество растворяется.
Это притяжение сильнее, чем силы, удерживающие растворенное вещество вместе, поэтому растворенное вещество растворяется.
Химические свойства воды
Все идеи, которые мы исследовали выше, были примерами физических свойств . Это свойства, которые можно наблюдать и измерять без изменения химического состава вещества. Например, молекулы воды в паре имеют точно такую же химическую идентичность, что и молекулы воды во льду, с той лишь разницей, что они состоят из вещества. Однако химических свойств — это свойства, которые мы наблюдаем, когда вещество подвергается химической реакции. В частности, мы собираемся сосредоточиться на двух химических свойствах воды.
- Способность к самоионизации
- Амфотерность
Самоионизация воды
Как жидкость вода существует в равновесии . Большинство его молекул находятся в виде нейтральных молекул H 2 O, но некоторые ионизируются в ионы гидроксония, H 3 O + , и ионы гидроксида, OH — . Молекулы постоянно переключаются между этими двумя состояниями вперед и назад, как показано в приведенном ниже уравнении:
Молекулы постоянно переключаются между этими двумя состояниями вперед и назад, как показано в приведенном ниже уравнении:
2H 2 O ⇋ H 3 O + + OH —
Это известно как самоионизация . Вода делает это сама по себе — ей не нужно другое вещество для реакции.
Амфотерная природа воды
Поскольку вода самоионизируется, как мы видели выше, она может действовать амфотерно .
Амфотерное вещество может действовать как кислота и как основание.
Помните, что кислота является донором протонов, тогда как основание является акцептором протонов. Протон — это просто ион водорода, H + .
Как это делает вода? Что ж, посмотрите на ионы, которые он образует при самоионизации: H 3 O + и OH — . Ион гидроксония, H 3 O + , может действовать как кислота, теряя протон с образованием H 2 O и H + . Ион гидроксида, OH — , может действовать как основание, принимая протон, снова образуя H 2 O.
Ион гидроксида, OH — , может действовать как основание, принимая протон, снова образуя H 2 O.
H 3 o + → H 2 O + H +
OH — + H + → H 2 O
IT AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS AS 2 O. кислоты, отдавая протон. Если он реагирует с другими кислотами, он действует как основание, принимая протон. Можно сказать, что вода не привередлива — она просто хочет со всеми реагировать!Свойства воды. Ключевые выводы
- Вода , H 2 O, состоит из одного атома кислорода, связанного с двумя атомами водорода с помощью ковалентных связей .
- Вода испытывает водородных связей между молекулами. Это влияет на его свойства.
- Вода когезивная , клейкая и имеет высокое поверхностное натяжение .

- Вода имеет высокую удельную теплоемкость и высокие температуры плавления и кипения .
- Твердый лед на менее плотный, чем жидкая вода .
- Воду часто называют универсальным растворителем .
- Вода самоионизируется в ионы гидроксония , H 3 O + , и ионы гидроксида 6 8 0 9 0 9 0 0 0 0 0 0 0 6 , OH
- Вода является амфотерным веществом.
Биологическое значение воды | A-Level (A2/AS) Biology Revision Notes
Присоединяйся сейчас
Если вы готовы сдать экзамены по биологии уровня A, станьте участником прямо сейчас, чтобы получить полный доступ ко всей нашей библиотеке материалов для повторения.
Присоединяйтесь к более чем 22 000 учащихся, сдавших экзамены благодаря нам!
Зарегистрируйтесь ниже, чтобы получить мгновенный доступ!
Присоединиться →
Или попробуйте пример.
 ..
..Еще не готовы приобрести комплект для доработки? Без проблем. Если вы хотите ознакомиться с тем, что мы предлагаем, перед покупкой, у нас есть бесплатная подписка с образцами материалов для пересмотра.
Зарегистрируйтесь в качестве бесплатного члена ниже, и вы вернетесь на эту страницу, чтобы попробовать образцы материалов перед покупкой.
Скачать образцы →
Quick Navigation
[скрыть]
Введение- Вода — основа жизни на нашей планете. Он существует в различных физических состояниях – твердом, жидком и газообразном – и составляет 70 % поверхности Земли, плюс 65 – 90 % веса всех живых организмов. Вода также играет важную роль во всех процессах жизнедеятельности живых организмов.
- Молекула воды H 2 O состоит из одного атома кислорода и двух атомов водорода. Эти атомы связаны ковалентно (ковалентной связью). В молекуле воды водород несет положительный молекулярный заряд, а кислород несет отрицательный молекулярный заряд.
 Таким образом, молекула воды является «полярной» молекулой, поскольку она имеет как положительные, так и отрицательные полюса.
Таким образом, молекула воды является «полярной» молекулой, поскольку она имеет как положительные, так и отрицательные полюса. - Близкие молекулы воды притягиваются друг к другу за счет относительно слабого электрического притяжения (отрицательные атомы водорода притягивают положительные атомы кислорода в других молекулах). Эта связь называется «водородной связью». Вода обладает уникальными свойствами благодаря своей полярности и водородным связям между ее молекулами.
- Вода считается «общим растворителем» или «универсальным растворителем» из-за полярности ее молекул.
Для примера , когда хлорид натрия (NaCl) растворяется в воде, образуются положительные ионы натрия и отрицательные ионы хлора. Положительные атомы кислорода в воде притягивают отрицательные ионы хлора, а отрицательные атомы водорода притягивают положительные ионы натрия. Все полярные вещества (вещества, содержащие ионы) могут растворяться в полярных растворителях, например в воде.
- Все необходимые для живых организмов вещества (витамины, соли, аминокислоты, газы, глюкоза) транспортируются в организме в виде растворенных в воде растворенных веществ. Эти вещества принимают участие в метаболических реакциях внутри клеток.
- Это означает, что вода обладает способностью диссоциировать молекулы, необходимые для жизни, на положительные и отрицательные ионы (вода может делать это из-за полярности своих молекул).
Например, , поджелудочная железа секретирует бикарбонат натрия (NaHCO 3). Это соединение ионизируется в воде на положительные ионы водорода и отрицательные ионы бикарбоната, что делает среду щелочной и, таким образом, пригодной для работы ферментов.
- Удельная теплоемкость – это количество теплоты, необходимое для повышения температуры одного грамма вещества на 1 градус Цельсия.

- Вода имеет самую высокую удельную теплоемкость на Земле из-за водородных связей между ее молекулами.
- В результате высокой удельной теплоемкости воде требуется большое количество энергии для повышения ее температуры, и она теряет большое количество энергии при понижении температуры. Это помогает живым организмам иметь постоянную температуру, которая необходима для жизненных процессов, происходящих в их телах. Клетки содержат много воды, чтобы поддерживать постоянную температуру.
- Животные и растения теряют воду в процессе потоотделения и транспирации, что снижает их температуру.
- Высокая удельная теплоемкость воды обеспечивает живые организмы температурами, подходящими для жизни на Земле.
- Вода составляет почти 70% поверхности Земли. Если бы воды не было в таком большом количестве, температура Земли резко понизилась бы, так как вещества, образующие земную кору, имеют низкую удельную теплоемкость.
- Вода, из которой состоят океаны, поглощает большое количество солнечных лучей утром и распространяет их в атмосферу ночью, чтобы поддерживать температуру Земли, подходящую для живых организмов.

- Поверхностное натяжение – это сцепление молекул на поверхности жидкости с целью занять наименьший возможный объем. Вязкость – это сопротивление жидкости течению.
- Вода имеет низкую вязкость и высокое поверхностное натяжение благодаря водородным связям между ее молекулами; эти условия подходят для жизни.
1- Работают над сцеплением клеточных веществ.
2- Замедляет потерю воды листьями растений через поры.
3- Некоторые насекомые могут ходить по воде из-за сцепления молекул на ее поверхности.
5- Плотность воды уменьшается ниже 4 ◦ C.
- Вода расширяется, когда ее температура становится ниже 4 ◦ C (вместо сжатия). Это уменьшает его плотность и делает его плавающим. В замерзших озерах мы находим лед на поверхности, а под ним — жидкую воду.

- Это свойство обусловлено наличием водородных связей между молекулами воды.
- Это свойство важно, потому что оно позволяет живым организмам жить в океанах и морях. Без этого свойства в лед превратятся все океаны и моря, а не только поверхность. Поверхностное замерзание действует как изолятор, предотвращая замерзание остальной воды.
6- Температура замерзания воды снижается, если в ней растворены вещества.
- Это свойство очень важно для живых организмов, так как предотвращает замерзание воды в клетках при воздействии температуры ниже 0◦C.
7- Вода может превращаться в пар при температуре ниже точки кипения (100°C).
- Водяной пар, образующийся на поверхности океанов, переносится конвекционными течениями в холодные слои атмосферы. Это превращается в облака, которые обеспечивают живые организмы дождем и водой.
8- Подъем воды в капиллярах.
- Вода способна подниматься по капиллярам без перекачки и в противовес внешним силам, таким как гравитация.


 Таким образом, молекула воды является «полярной» молекулой, поскольку она имеет как положительные, так и отрицательные полюса.
Таким образом, молекула воды является «полярной» молекулой, поскольку она имеет как положительные, так и отрицательные полюса. 



