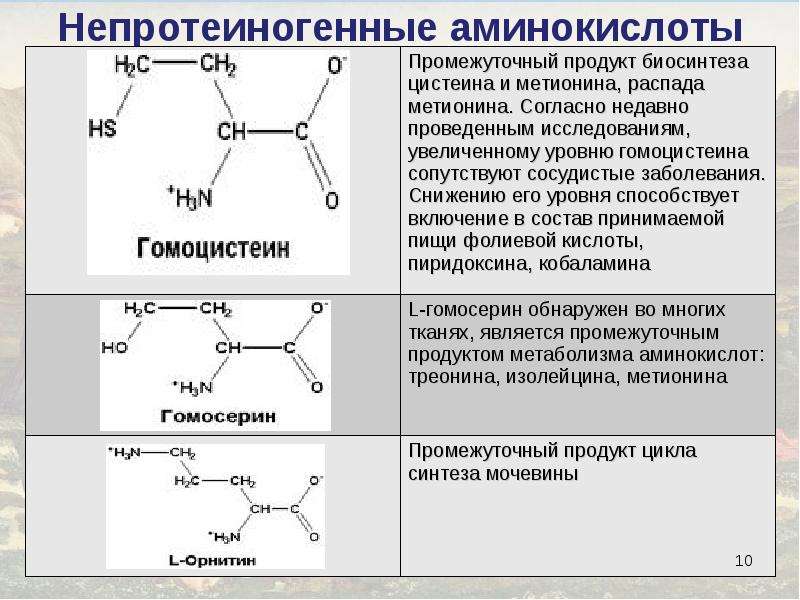
Аминокислоты — это анаболики
От чего зависит рост мускулатуры? Прежде всего, конечно, от работы гормонов – инсулина и тестостерона. Кроме того, в процессе участвует инсулиноподобный фактор роста (IGF-1). Кстати, не некоторые предполагают, что в создании анаболического эффекта IGF-1 выполняет даже более важные функции, чем сам инсулин.
Впрочем, все это давно известно. Но недавно ученые сделали новое открытие: оказывается, аминокислоты тоже могут вызывать анаболический и антикатаболический эффект!
Этот вопрос исследовался группой экспертов Гетеборгском университете Швеции. В качестве “подопытных” выступали восемь здоровых атлетов. Для начала ученые измерли у них синтез (рост) и деградацию (распад) микрофибриллярных (задействованных в сокращении мускулатуры) и глобулярных протеинов (которые прямо не участвуют в мышечных сокращениях). А затем начали вводить внутривенно аминокислотные смеси разных концентраций. И что же показали тесты? В крови испытуемых постоянно повышалось содержание аминокислот.
Что же из этого следует? А вот что: как выяснилось, анаболическое действие аминокислот может проходить независимо от инсулина и IGF-1! Иными словами, для того, чтобы аминокислоты попали в мышцы, на не нужен инсулин. Инсулин, который, который многие специалисты считают едва ли не самым важным анаболическим гормоном, на самом деле скорее действует как антикатаболик. Что же касается IGF-1, то он же не так принцепеально важен, как полагают некоторые исследователи.
Теперь мы знаем, что стимулировать рост мышц можно без внешней помощи – без “вливания” инсулина, тестостерона и гормона роста. Аминокислоты сами по себе – отличные анаболики! И гормональная помощь им не нужна. А ведь совсем недавно мнение спортивных специалистов было противоположным. Аминокислоты считали лишь сырьем анаболизма, которое идет в дело только после инъекций стероидов, ГР и инсулина. Оказалось, что аминокислоты – это самостоятельный анаболический фактор, а это значит, что у тех, кто не хочет принимать “химию” есть равноценный выход.
Источник: «Сила и красота». Ноябрь 2000
17.11.2008 11007 0как принимать, виды и типы аминокислот, полезные свойства

Виды аминокислот и их предназначение
По своей сути аминокислоты являются белками, расщепленными на частицы. Когда белок распадается (например, в процессе пищеварения), он образовывает эти питательные вещества.
Все аминокислоты можно разделить на три вида:
- заменимые (которые могут вырабатываться в организме человека) – это аланин, аспаргин, глицин, пролин, глютамин, серин;
- условно заменимые (вырабатываются только в благоприятных условиях или только у взрослых людей) – аргинин, цистеин, тирозин;
- все остальные аминокислоты относятся к категории незаменимых (они не вырабатываются самостоятельно и поступают в организм только с продуктами рациона).
В организме эти нутриенты выполняют множество функций:
- отвечают за создание новых клеток, а также регенерацию мышечных волокон;
- обеспечивают организм дополнительной энергией;
- способствуют нормальному обмену веществ, поддержанию здорового гормонального фона;
- улучшают память, повышают концентрацию внимания, влияют на состояние нервной системы;
- поддерживают иммунную систему;
- подавляют аппетит и способствуют избавлению от лишнего веса;
- играют важную роль при формировании мышечного рельефа;
- улучшают состояние волос, ногтей и кожи.

Если вы занимаетесь спортом, отдельное внимание следует обратить на комплекс ВСАА. Он состоит из трех незаменимых аминокислот – лейцина, изолейцина и валина, препятствующих распаду мышечных волокон (катаболизму). Принимайте этот вид спортпита, чтобы защитить мышцы во время интенсивной тренировки или сразу после нее.
Аминокислоты одинаково важны и для мужчин, и для женщин. Но если представители сильного пола используют их для прироста мышечной массы, то женщины таким образом избавляются от избытков жировой ткани. Таким образом, аминокислотные комплексы практически не требуют времени для усвоения организмом, и быстрее проникают в мышечные клетки, питая и восстанавливая их.
Типы аминокислотных комплексов
- Свободная форма – это такие аминокислоты, которые моментально всасываются в кровеносные сосуды и не требуют дополнительное переваривание пищеварительной системой. За счет этого они способны очень быстро проникнуть в мышцы и предвидеть мышечный катаболизм.

- Гидролизованная форма – самые быстрые в усвоении организмом, активно питают мышечную ткань и являются основной всех анаболических реакцией.
- BCAA, которые еще называют «мышечными аминокислотами», ведь именно они наиболее положительно влияют на рост мышечной ткани.
- Ди- и трипептидные аминокислоты питают мышцы и активируют анаболические реакции.
Любые аминокислоты отлично комбинируются с другими продуктами спортпита, но далеко не все можно вместе употреблять и тем более смешивать. Для дополнительной консультации лучше обратиться к специалистам нашего магазина спортивного питания Bcaa.
Польза аминокислот
- они отлично повышают силы и выносливость на тренировке, что ускоряет набор мышечной массы;
- быстро восстанавливают организм, устраняют боли после тренировки;
- отлично обогащают рацион питания полезными компонентами;
- активно устраняют чувство голода;
- сжигают лишнюю жировую прослойку, ускоряя метаболизм.

Как принимать аминокислотные комплексы?
Правильный прием зависит от вашей цели. Если вы хотите нарастать мышечную массу и выглядеть лучше, идеальное время для употребления аминокислот – это до и после тренировки, после пробуждения утром. Если вам нужно быстро похудеть, продукт стоить принимать чаще. Универсальная дозировка – не менее 5 грамм.
Самые популярные продукты
Ассортимент аминокислот на рынке спортивного питания поражает, но вот процесс выбора качественного и полезного комплекса часто оказывается большой проблемой. Какие же продукты считаются самыми популярными и завоевали доверие профессионалов? Это такие аминокислоты, как Whey Amino Tabs 2000 и Amino Max Hydrolysate от Maxler, Mega Amino 3200 от бренда BioTech и таблетки Amino 5600 от известного производителя Scitec Nutrition.
Другие полезные статьи:
Гормон роста | Dopinglinkki
С поправками от 22.07.2019
Влияние на функции организмаГормон роста (соматропин, соматотропин, гормон роста) представляет собой пептидный гормон из 191 аминокислоты, выделяемый гипофизом. Передняя часть гипофиза вырабатывает гормон роста в зависимости от частоты пульса, и концентрации сильно варьируются в течение дня. Большая часть ежедневного гормона роста вырабатывается через 1–2 часа после засыпания. На уровень естественных гормонов роста влияют многие факторы, такие как возраст, пол, композиция тела, физические упражнения, питание и сон [1, 2].
Передняя часть гипофиза вырабатывает гормон роста в зависимости от частоты пульса, и концентрации сильно варьируются в течение дня. Большая часть ежедневного гормона роста вырабатывается через 1–2 часа после засыпания. На уровень естественных гормонов роста влияют многие факторы, такие как возраст, пол, композиция тела, физические упражнения, питание и сон [1, 2].
Гормон роста регулирует множество функций в организме, включая рост. Гормон роста действует посредством ростовых факторов (IGF-1), которые образуются главным образом в печени. Гормон роста также имеет независимые от IGF эффекты. Некоторые эффекты даже противоположны эффектам IGF, например, влияние на уровень глюкозы в крови. Самостоятельное анаболическое влияние гормона роста не совсем ясно, для эффективного действия ему требуется IGF-1 [3, 4].
Гормон роста обладает многоплановым влиянием на обмен углеводов и жиров. Гормон роста — это анаболический гормон (то есть гормон, стимулирующий рост тканей), который повышает транспорт определенных аминокислот в клетки, ускоряет синтез белков и влияет на обмен жиров и баланс жидкости в организме. Гормоны роста усиливают эффекты тестостерона и анаболических стероидов, направленные на рост мышц [5].
Гормоны роста усиливают эффекты тестостерона и анаболических стероидов, направленные на рост мышц [5].
Все препараты гормона роста, которые зарегистрированы в Финляндии, производятся при помощи технологии рекомбинантных ДНК. Продажа человеческого гормона роста, который производят из трупных гипофизов, в Финляндии запрещена с 1988 года из-за риска развития смертельного заболевания — болезни Крейтцфельдта-Якоба. На черном рынке человеческий гормон роста продается, часто в замаскированном под рекомбинантный гормон роста виде.
Дозирование при применении в медицинеДоза гормона роста в медицине варьирует в зависимости от заболевания и его тяжести. При лечении недостаточности гормона роста у взрослых начальная доза составляет 0,15–0,3 миллиграммов (примерно 0,5–1 МЕ). Для длительного лечения рекомендованная доза составляет не более 1–1,3 миллиграммов в сутки (3–4 МЕ).
Средняя доза гормона роста, применяемая для лечения взрослых, составляет 0,67 миллиграммов в сутки (2 МЕ).
Гормон роста является допинговым препаратом, согласно Приказу 705/2002, определяющему список допинговых препаратов, в соответствии с разделом 44, §16, подразделом 1 Уголовного кодекса. Гормон роста является рецептурным препаратом, который может быть выписан только врачами, которые специализируются в эндокринологии, детской эндокринологии или детской нефрологии.
В медицине гормон роста используется для лечения детей с нарушениями роста, вызванными недостаточной секрецией гормона роста. В ряде случаев гормон роста используется для лечения взрослых с выраженной недостаточностью гормона роста.
Диагноз должен быть подтвержден при помощи точного использования различных типов проб с нагрузкой, посредством которых измеряется секреция гормона роста до начала его применения. Врач может быть обвинен в терапевтической ошибке, если он назначает гормоны роста пациенту, не видя его или не проводя тщательную диагностику.
Состояние пациентов, которые получают гормон роста, необходимо тщательно контролировать, в частности определять показатели функции щитовидной железы и проводить обследование для исключения возможного нарушения толерантности к глюкозе (нарушение обмена сахара). Рекомендуется оценивать адекватность дозы гормона роста каждые 6 месяцев.
Рекомендуется оценивать адекватность дозы гормона роста каждые 6 месяцев.
Гормоны роста применяются для развития анаболических эффектов [6, 7]. Считается, что он повышает мышечную массу и силу, улучшает переносимость значительных физических нагрузок и ускоряет восстановление после травм. Гормон роста редко используют как единственный препарат. Обычно его применяют вместе с анаболическими стероидами, инсулином и IGF-1. Гормон роста также может применяться с намерением уменьшить признаки старения и улучшить качество кожи. В дополнение к своему анаболическому действию гормон роста обладает жиросжигающим эффектом, так как увеличивает расщепление триглицеридов в жировых клетках и уменьшает накопление жира [1]. Профессиональные велосипедисты также используют гормон роста из-за его липолитического действия, чтобы уменьшить жировые отложения [8].
Гормон роста — популярный допинговый препарат, но его повышающее производительность воздействие не было полностью доказано клинически [3]. Основным результатом систематического обзора и метаанализа, опубликованного в 2017 году, было то, что гормон роста умеренно увеличивает мышечную массу и уменьшает жир, но не увеличивает мышечную силу и не улучшает аэробные возможности у здоровых молодых людей. Увеличение безжировой массы может быть в значительной степени связано с накоплением жидкости. Наибольшая польза от гормона роста, по-видимому, заключается в ускорении восстановления и предотвращении травм в результате усиления синтеза коллагена [9]. В данном исследовании использовались умеренные дозы только гормона роста. При злоупотреблении дозы обычно выше, и гормон роста зачастую используется с другими анаболическими веществами. В этих случаях могут возникать различные побочные эффекты. Однако гормон роста очень эффективен для людей, которые испытывают его дефицит [8].
Основным результатом систематического обзора и метаанализа, опубликованного в 2017 году, было то, что гормон роста умеренно увеличивает мышечную массу и уменьшает жир, но не увеличивает мышечную силу и не улучшает аэробные возможности у здоровых молодых людей. Увеличение безжировой массы может быть в значительной степени связано с накоплением жидкости. Наибольшая польза от гормона роста, по-видимому, заключается в ускорении восстановления и предотвращении травм в результате усиления синтеза коллагена [9]. В данном исследовании использовались умеренные дозы только гормона роста. При злоупотреблении дозы обычно выше, и гормон роста зачастую используется с другими анаболическими веществами. В этих случаях могут возникать различные побочные эффекты. Однако гормон роста очень эффективен для людей, которые испытывают его дефицит [8].
Использование гормона роста, вероятно, увеличилось из-за его низкой стоимости и удобства заказа онлайн. Гормон роста больше не может рассматриваться в качестве допинг-агента только спортсменов высшей лиги [10].
При использовании гормона роста в адекватных терапевтических дозах наиболее частыми побочными эффектами являются боли в суставах и мышцах и различные типы отеков из-за задержки жидкости. Отек может привести к повышению внутричерепного давления или отеку глазного дна. Также он может привести к развитию синдрома запястного канала.
Острая передозировка может привести вначале к развитию гипогликемии (снижению уровня сахара крови) и впоследствии даже привести к развитию комы. В дальнейшем последствием терапии может быть гипергликемия (повышение уровня сахара). Длительная терапия может приводить к повышению кровяного давления, дегенерации сердечной мышцы, сахарному диабету, акромегалии (избыточному росту хрящей, пальцев и подбородка), огрубению и утолщению кожи. Возрастает также риск определенных видов рака (в т. ч. рака щитовидной железы, молочной железы, предстательной железы). Однако точных данных по данному вопросу не имеется [5, 6, 7, 11, 12, 13].
Наиболее распространенные торговые наименования (9/2014): Омнитроп, Генотропин.
Timo Seppälä (Тимо Сеппяля)
Руководитель медицинского учреждения
Финский антидопинговый комитет FINADA (ныне SUEK ry)
Поправки внесены: Dopinglinkki
АНАБОЛИЧЕСКАЯ ТЕРАПИЯ ОСТЕОПОРОЗА.ТЕРИПАПАРАТИД: ЭФФЕКТИВНОСТЬ, БЕЗОПАСНОСТЬ И ОБЛАСТЬ ПРИМЕНЕНИЯ | БЕЛАЯ
1. Recklinghausen FD.: Die fibrose oder deformierende ositis, die osteomalazie und die osteoplastische carzinose in ihren gegenseitigen beziehungen.// Festchrift Rudolf Virchow. George Reimer, Berlin, 1891.
2. Bauer E, Aub J, Albright JF: Studies of calcium and phosphorus metabolism: study of bone trabeculae as readily available reserve supply of calcium. J. Experimental Medicine 1929 Vol. 49 pp. 145—162.
49 pp. 145—162.
3. Selye H.: On the stimulation of new bone formation with parathyroid extract and irradiated ergosterol. J. Endocrinology 1932 Vol. 16, p. 547.
4. Белая Ж.Е., Рожинская Л.Я. «Возможности применения паратирео-идного гормона для лечения остеопороза» Ж. Остеопороз и остеопатии, 2004, №3 стр 26—33.
5. Habener JF, Potts JT : Biosynthesis of parathyroid hormone (Part 1). New England J. Medicine 1978 Vol. 299 pp. 580—585.
6. Habener JF, Potts JT: Biosynthesis of parathyroid hormone (Part 2). New England J. Medicine 1978 Vol. 299 pp. 635—644.
7. Potts JT, Bringhurst FR, Gardella T.: Parathyroid hormone: physiology, chemistry, biosynthesis, secretion, metabolism and mode of action. In: DeGroot LJ, Ed. Endocrinology 3rd edn. Philadelphia: WB Saunders 1995 Vol. 2 pp. 920—966.
Potts JT, Bringhurst FR, Gardella T.: Parathyroid hormone: physiology, chemistry, biosynthesis, secretion, metabolism and mode of action. In: DeGroot LJ, Ed. Endocrinology 3rd edn. Philadelphia: WB Saunders 1995 Vol. 2 pp. 920—966.
8. Sato M, Zeng GQ, Turner CH.: Biosynthetic human parathyroid hormone (1-34) effects on bone quality in aged ovariectomized rats. J. Endocrinology 1997 Vol. 138, pp. 4330—4337.
9. Potts JT Jr, Murray TM, Peacock M. Niall HD., Tregear GW, Keutmann HT, Powell D., Deftos LJ.: Parathyroid hormone: sequence, synthesis, immunoassay studies. American J. Medicine 1971 Vol. 50 pp. 639—649.
10. Potts JT Jr.: The non-traditional actions of parathyroid hormone: status 1991, an overview. J. Endocrinology Investigation 1992 Vol. 15 pp. 3—9.
15 pp. 3—9.
11. Jilka RL. Molecular and cellular mechanisms of the anabolic effect of intermittent PTH.// Bone, 2007, Vol. 40, pp. 1434—1446.
12. Bellido T, Ali AA, Gubrij I, Plotkin Li, Fu Q, O’Brien CA, et.al.: Chronic elevation of parathyroid hormone in mice reduces expression of sclerostin by osteocytes: a novel mechanism for hormonal control of osteoblastogenesis. Endocrinology, 2005, Vol. 146, pp. 4577—4583.
13. Keller H, Kneissel M.: SOST is a target gene for PTH in bone.// Bone, 2005, Vol. 37, pp. 148—158.
14. Guo J, Liu M, Yang D, Bouxsein ML, Saito H, Galvin RJ, et.al.: Suppression of Wnt signaling by Dkk1 attenuates PTH-mediated stromal cell response and new bone formation. Cell Metab, 2010, Vol. 11, pp. 161—171.
Cell Metab, 2010, Vol. 11, pp. 161—171.
15. Robling AG, Kedlaya R, Ellis SN, Childress PJ, Bidwell JP, Bellido T, et.al. Anabolic and catabolic regimens of human parathyroid hormone 1-34 elicit bone- and envelop-specific attenuation of skeletal effects in SOST-deficient mice. Endocrinology, 2011, Vol. 152, pp. 2963—2975.
16. Rhee Y, Allen MR, Condon K, Lezkano V, Ronda AC, Galli C, et.al.: PTH receptor signaling in osteocytes governs periosteal bone formation and intracortical remodeling. J. Bone Mineral Res, 2011, Vol. 26, pp. 1035—1046.
17. Bedi B, Li JY, Tawfeek H, Baek KH, Adams J, Vangara SS, et.al.: Silencing of parathyroid hormone (PTH) receptor 1 in T cells blunts the bone anabolic activity of PTH. Proc Natl Acad Sci USA, 2012, Vol. 109, E725—733.
109, E725—733.
18. Wan M, Yang C, Li J, Wu X, Yuan H, Ma H, et.al.: Parathyroid hormone signaling through low-density lipoprotein-related ptrotein-6.// Genes Dev, 2008, Vol. 22, pp. 2968—2979.
19. Taurin S, Sandbo N, Qin Y, Browning D, Dulin NO.: Phosphorilation of beta-catenin by cyclic AMP-dependent protein kinase. J. Biol Chem, 2006, Vol. 281, pp. 9971—9976.
20. Jilka RL, Almeida M, Ambrogini E, Han L, Roberson PK, Weinstein RS, et.al.: Decreased oxidative stress and greater bone anabolism in the aged, when compared to the young , murine skeleton with parathyroid hormone administration. Aging Cell, 2010, Vol. 9, pp. 851—867.
21. Fei Y, Hurley MM. : Role of fibroblast growth factor 2 and Wnt signaling in anabolic effects of parathyroid on bone formation.// J. Cell Physiol, 2012, Vol. 227, pp. 3539—3545.
: Role of fibroblast growth factor 2 and Wnt signaling in anabolic effects of parathyroid on bone formation.// J. Cell Physiol, 2012, Vol. 227, pp. 3539—3545.
22. Marie PJ.: Signaling Pathways affecting skeletal health.// Curr Osteoporos Rep, 2012, Vol. 10, pp. 190—198.
23. McClung MR, Martin JS, Miller PD, Civitelli R, Bandeira F, Omizzo M, Donley DW, Dalsky GP, Eriksen EF.: Opposite bone remodeling effects of teriparatide and alendronate in increasing bone mass.//Arch Intern Med, 2005, Vol. 165, pp. 1762—1768.
24. Lindsay R, Cosman F, Zhou H, Bostrom MP, Shen VW, Cruz JD, Nieves JW, Dempster DW.: A novel tetracycline labeling schedule for longitudinal evaluation of the short-term effects of anabolic therapy with a single iliac crest bone biopsy: early actions of teriparatide. // J. Bone and Mineral Research, 2006, Vol. 21, pp. 366—373.
// J. Bone and Mineral Research, 2006, Vol. 21, pp. 366—373.
25. Белая Ж.Е., Рожинская Л.Я.: «Бисфосфонаты: мифы и реальность».// Ж. Эффективная фармакотерапия в эндокринологии, 2010, сентябрь, стр. 52—58.
26. Белая Ж.Е., Рожинская Л.Я.: «Бисфосфонаты в терапии постменопаузального остеопороза» Ж. Доктор Ру, 2010, Т.58 (№7), стр. 29—38.
27. Белая Ж.Е., Рожинская Л.Я. Новые направления в терапии остеопороза — применение моноклональных человеческих антител к RANKL (Деносумаб) // Ж. Остеопороз и Остеопатии, 2011, № 2, стр. 19—22.
28. Balena R, Toolan BC, Shea M, Markatos A, Myers ER, Lee SC, Opas EE , Seedor JG , Klein H, Frankenfield D : The effects of 2-year treatment with the aminobisphosphonate alendronate on bone metabolism, bone hystomorphometry and bone strength in ovariectomized nonhuman primates. J. Clinical Investigation 1993 Vol. 92 pp. 2577—2586.
J. Clinical Investigation 1993 Vol. 92 pp. 2577—2586.
29. Draper MW, Flowers DE, Huster WJ, Neild JA, Harper KD, Arnaud C.: A controlled trial of raloxifene (LY139481) HCl: impact on bone turnover and serum lipid profile in healthy postmenopausal women. J. Bone Mineral Research 1996 Vol. 11, pp. 835—842.
30. Дедов ИИ, Рожинская ЛЯ, Белая ЖЕ «Роль и место бисфосфонатов в профилактике и лечении остеопороза 10-летний опыт применения алендроната, Ж. Остеопороз и остеопатии, 2005, № 1, стр. 20—30.
31. Торопцова НВ, Беневоленская ЛИ.: Результаты применения золедроновой кислоты в лечении остеопороза. Ж. Остеопороз и остеопатии, 2008, № 2, стр. 25—28.
32. Скрипникова ИА, Рожинская ЛЯ.: Применение дженериков — способ повышения приверженности лечению остеопороза. Ж.Остеопороз и остеопатии, 2010, №3, стр. 36—40.
Скрипникова ИА, Рожинская ЛЯ.: Применение дженериков — способ повышения приверженности лечению остеопороза. Ж.Остеопороз и остеопатии, 2010, №3, стр. 36—40.
33. Arlot M, Meunier PJ, Boivin G, Haddock L, Tamayo J, Correa-Rotter R, Jasqui S, Donley DW, Dalsky GP, San Martin J, Eriksen EF.: Differential effects of teriparatide and alendronate on bone remodeling in postmenopausal women assessed by histomorphometric parameters.// JBMR, 2005, Vol. 20, pp. 1244—1253.
34. McClung MR, Martin JS, Miller PD, Civitelli R, Bandeira F, Omizzo M, Donley DW, Dalsky GP, Eriksen EF.: Opposite bone remodeling effects of teriparatide and alendronate in increasing bone mass.//Arch Intern Med, 2005, Vol. 165, pp. 1762—1768.
35. Dempster DW, Zhou H, Recker RR, Brown JP, Bolognese MA, Recknor CP, Kendler DL, Lewiecki EM, Hanley DA, Rao DS, Miller PD, Woodson GC, Lindsay R, Binkley N, Wan X, Ruff VA, Janos B, Taylor KA. : Skeletal histomorphometry in subjects on teriparatide or zoledronic acid therapy (SHOTZ) study: a randomized controlled trial.//J. Clin Endocrinol Metabolism, 2012, Vol. 97, pp. 2799—2808.
: Skeletal histomorphometry in subjects on teriparatide or zoledronic acid therapy (SHOTZ) study: a randomized controlled trial.//J. Clin Endocrinol Metabolism, 2012, Vol. 97, pp. 2799—2808.
36. Canalis E, Hott M, Deloffre P, Tsouderos Y, Marie PJ.: The divalent strontium salt S12911 enhances bone cell replication and bone formation in vitro. Bone, 1996, Vol. 18, pp. 517—523.
37. Takahashi N, Sasaki T, Tsuoderos Y, Suda TS.: 12911-2 inhibits osteoclastic bone resorption in vitro. // J. Bone Mineral Research, 2003, Vol. 18, pp. 1082—1087.
38. Rogers MJ.: New insights into the molecular mechanisms of action of bisphosphonates. // Curr Pharm Des, 2003, Vol. 12, pp. 2643—2658.
39. Meunier PJ, Slosman DO, Delmas PD, Sebert JL, Brandi ML, Albanese C, Lorenc R, Pors-Nielsen S, Roges VA, Reginster JY.: Strontium ranelate: dose-dependent effects in established postmenopausal vertebral osteoporosis — a 2-year randomized placebo controlled trial.// JCEM, 2002, Vol. 87, pp. 2060—2066.
Meunier PJ, Slosman DO, Delmas PD, Sebert JL, Brandi ML, Albanese C, Lorenc R, Pors-Nielsen S, Roges VA, Reginster JY.: Strontium ranelate: dose-dependent effects in established postmenopausal vertebral osteoporosis — a 2-year randomized placebo controlled trial.// JCEM, 2002, Vol. 87, pp. 2060—2066.
40. Meunier PJ, Roux C, Seeman E, Ortolani S, Badurski JE, Spector TD, Cannata J, Balogh A, Lemmel EM, Pors-Nielsen S, Rizzoli R, Genant HK, Reginster JY.: The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis.// N. Engl J. Med, 2004, Vol. 350, pp. 459—468.
41. Recker RR, Marin F, Ish-Shalom S, Moricke R, Hawkins F, Kapetanos G, Pena MP, Kekow J, Farrerons J, Sanz B, Oertel H, Stepan J.: Comparative effects of teriparatide and strontium ranelate on bone biopsies and biochemical markers of bone turnover in postmenopausal women with osteoporosis. // JBMR, 2009, Vol. 24, pp. 1358—1368.
// JBMR, 2009, Vol. 24, pp. 1358—1368.
42. Kanis J.A, McCloskey EV, Johansson H, Cooper C, Rizolli R, Reginster R, on behalf of the Scientific Advisory Board of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) and the Committee of Scientific Advisors of the International Osteoporosis Foundation (IOF).: European guidance for the diagnosis and management of osteoporosis in postmenopausal women.// Osteoporosis International, 2013, Vol. 24, pp. 23—57.
43. Blake GM, Fogelman I.: Effect of bone strontium on BMD measurements.// J. Clinical Densitometry, 2007, Vol. 10, pp. 34—38.
44. Blake GM, Lewiecki EM, Kendler DL, Fogelman I.: A review of strontium ranelate and its effect on DXA scans. // J. Clinical Densitometry, 2007, Vol. 10, pp. 113—119.
// J. Clinical Densitometry, 2007, Vol. 10, pp. 113—119.
45. Nielsen SP, Slosman D, Sorensen OH, Basse-Cathalinat B, De Cassin P, Roux C, Meunier PJ.: Influence of strontium on bone mineral density and bone mineral content measurements by dual X-ray absorptiometry.// J. Clinical Densitometry, 1999, Vol. 2, pp. 371—379.
46. Blake GM, Compston JE, Fogelman I.: Could strontium ranelate have a synergistic role in the treatment of osteoporosis?// JBMR, 2009, Vol. 24, pp. 1354—1357.
47. Stepan JJ.: Strontium ranelate: in search for the mechanism of action.// J. Bone Miner Metab, punlished online 09 August 2013.
48. Рожинская Л.Я. «Системный остеопороз» Москва, изд. Мокеев, 2000 195стр.
Мокеев, 2000 195стр.
49. Белая ЖЕ, Рожинская ЛЯ, Ильин АВ, Сазонова НИ, Алексеева ТМ, Дорофеева ОК, Попова ВГ: Эффективность профилактики остеопении препаратами кальция и витамина Д (Кальций Д3 Никомед форте) у женщин в постменопаузе с субклиническим тиреотоксикозом.// Ж. Остеопороз и остеопатии, 2007, № 2, стр. 13—18.
50. European Medicines Agency.: Recommendation to restrict the use of Protelos/Osseor (strontium ranelate) 25 April 2013 EMA/258269/2013.
51. European Medicines Agency: Questions and answers on the review of Protelos and Osseor (strontium ranelate) 15 March 2012 EMA/18304/2012.
52. Jonville-Bera AP, Autrer-Leca E.: Adverse drug reactions of strontium ranelate (Protelos in France). : Presse Med., 2011, Vol. 40, pp. E 453—462.
: Presse Med., 2011, Vol. 40, pp. E 453—462.
53. Watts NB, Bilezikian JP, Camacho PM, Greenspan SL, Harris ST, Hodgson SF, Kleerekoper M, Luckey MM, McClung MR, Pollack RP, Petak SM.: American Association of clinical endocrinologists medical guidelines for clinical practice for the diagnosis and treatment of postmenopausal osteoporosis.// Endocrine Practice, 2010, Vol. 16, suppl 3, pp. 1—37.
54. Compston J, Bowring C, Cooper A, Cooper C, Davies C, Francis R, Kanis JA, Marsh D, McCloskey EV, Reid DM, Selby P.: Diagnosis and management of osteoporosis in postmenopaual women and older men in the UK: National Osteoporosis Guideline Group (NOGG) update 2013.// Maturitas, 2013, epub ached of print.
55. Papaioannou A, Morin S, Cheung AM, Atkinson S, Brown JP, Feldman S, Hanley DA, Hodsman A, Jamal SA, Kaiser SM, Kvern B, Siminoski K, Leslie WD for the Scientific Advisory Council of Osteoporosis Canada. : 2010 clinical practice guidelines for the diagnosis and management of osteoporosis in Canada: summary.// CMAJ, 2010, Vol. 182, pp. 1864—1873.
: 2010 clinical practice guidelines for the diagnosis and management of osteoporosis in Canada: summary.// CMAJ, 2010, Vol. 182, pp. 1864—1873.
56. Kanis JA, on behalf of the World Health Organization Scientific Group. Assessment of osteoporosis at the primary health care level. Technical report. University of Sheffield, UK, WHO Collaborating Centre, 2008.
57. Kanis JA.: Diagnosis of osteoporosis and assessment of fracture risk. Lancet, 2002, Vol. 359, pp. 1929-—1936.
58. Lindsay R, Silverman SL, Cooper C, Hanley DA, Barton I, Broy SB, Licata A, Benhamou L, Geusens P, Flowers K, Stracke H, Seeman E.: Risk of new vertebral fracture in the year following a fracture.//JAMA. 2001, Vol. 285, pp.320—323.
59. Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster JY, Hodsman AB, Eriksen EF, Ish-Shalom S, Genant HK, Wang O, Mitlak BH.: Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis./ England J. Medicine 2001 Vol.35 pp. 1434—1441.
Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster JY, Hodsman AB, Eriksen EF, Ish-Shalom S, Genant HK, Wang O, Mitlak BH.: Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis./ England J. Medicine 2001 Vol.35 pp. 1434—1441.
60. Gallagher JC, Genant HK, Crans GG, Vargas SJ, Krege JH.: Teriparatide reduces the fracture risk associated with increasing number and severity of osteoporotic fractures.// J. Clinical Endocrinology Metabolism, 2005, Vol. 90, pp. 1583—1587.
61. Marcus R, Wang O, Satterwhite J, Mitlak B.: The skeletal response to teriparatide is largely independent of age, initial bone mineral density, and prevalent vertebral fractures in postmenopausal women with osteoporosis./ J. Bone Mineral Research. 2003 Vol.18 pp.18—23.
62. Prevrhal S, Krege JH, Chen P, Genant H, Black DM.: Teriparatide vertebral fracture risk reduction determined by quantitative and qualitative radiographic assessment.// Current Medical Research Opinion, 2009, Vol. 25, pp. 921—928.
Prevrhal S, Krege JH, Chen P, Genant H, Black DM.: Teriparatide vertebral fracture risk reduction determined by quantitative and qualitative radiographic assessment.// Current Medical Research Opinion, 2009, Vol. 25, pp. 921—928.
63. Gallagher JC, Rosen CJ, Chen P, Misurski DA, Marcus A.: Response rate of bone density to teriparatide in postmenopausal women.// J. Bone, 2006, Vol. 39, pp. 1268.
64. Delmas PD, Licata AA, Reginster JY, Crans GG, Chen P, Misurski DA, Wagman RB, Mitlak BH.: Fracture risk reduction during treatment with teriparatide is independent of pretreatment bone turnover.// J. Bone, 2006, Vol. 39, pp. 237—243.
65. Eastell R, Krege JH, Chen P, Glass EV, Reginster JY. : Development of an algorithm for using PINP to monitor treatment of patients with teriparatide. // Curr Med Res Opin, 2006, Vol. 22, pp. 61—66.
// Curr Med Res Opin, 2006, Vol. 22, pp. 61—66.
66. Dobnig H, Sipos A, Jiang Y, Fahrleitner-Pammer A, Ste-Marie LG, Gallagher JC, Pavo I, Wang J, Eriksen EF.: Early changes in biochemical markers of bone formation correlate with improvements in bone structure during teriparatide therapy.// J. Clinical Endocrinology Metabolism, 2005, Vol. 90, pp. 3970—3977.
67. Chen P, Miller PD, Delmas PD, Misurski DA, Krege JH.: Change in lumbar spine BMD and vertebral fracture risk reduction in teriparatide-treated postmenopausal women with osteoporosis.// J. Bone Mineral Research, 2006, Vol. 21, pp. 1785—1790.
68. Zanchetta JR, Bogardo CE, Ferretti JL, Wang O, Wilson MG, Sato M, Gaich GA, Dalsky GP, Myers SL.: Effects of Teriparatide [Recombinant Human Parathyroid Hormone (1-34)] on cortical bone in postmenopausal women with osteoporosis. J. Bone and Mineral Research 2003 Vol. 18 pp.539—543.
J. Bone and Mineral Research 2003 Vol. 18 pp.539—543.
69. Graeff C, Timm W, Nickelsen TN, Farrerons J, Marin F, Barker C, Gluer CC.: Monitoring teriparatid-associated changes in vertebral microstructure by high-resolution CT in vivo: results from the EUROFORS study.// J. Bone Mineral Research, 2007, Vol. 22, pp. 1426—1433.
70. Uusi-Rasi K, Semanick LM, Zanchetta JR, Bogado CE, Eriksen EF, Sato M, Beck TJ.: Effects of teriparatide [rhPTH (1-34)] on structural geometry of the proximal femur in elderly osteoporotic women.// J. Bone, 2005, Vol. 36, pp. 948—958.
71. Jiang Y, Zhao JJ, Mitlak BH, Wang O, Genant HK, Eriksen EF.: Recombinant human Parathyroid hormone (1-34) [Teriparatide] improves both cortical and cancellous bone structure. / J. Bone and Mineral Research 2003 Vol. 18 pp. 1932—1941.
/ J. Bone and Mineral Research 2003 Vol. 18 pp. 1932—1941.
72. Graeff C, Chevalier Y, Charlebois M, Varga P, Pahr D, Nickelsen TN, Morlock MM, Gluer CC, Zysset PK.: Improvement in vertebral body strength under teriparatide treatment assessed in vivo by finite element analysis: results from the EUROFORS study.// JBMR, 2009, Vol. 24, pp. 1672—1680.
73. Ma YL, Zeng Q, Donley DW, Ste-Marie LG, Gallagher JC, Dalsky GP, Marcus R, Eriksen EF. : Teriparatide increases bone formation in modeling and remodeling osteons and enhances IGF-II immunoreactivity in postmenopausal women with osteoporosis.// J. Bone Mineral Research, 2006, Vol. 21, pp. 855—864.
74. Peschalis EP, Glass EV, Donley DW, Eriksen EF.: Bone mineral and collagen quality in iliac crest biopsies of patients given teriparatide: new results from the fracture prevention trial. // J. Clinical Endocrinology and Metabolism, 2005, Vol. 90, pp. 4644—4649.
// J. Clinical Endocrinology and Metabolism, 2005, Vol. 90, pp. 4644—4649.
75. Genant HK, Halse J, Briney WG, Xie L, Glass EV, Krege JH.: The effects of teriparatide on the incidence of back pain in postmenopausal women with osteoporosis.// J. Curr Med Res Opin, 2005, Vol. 21, pp. 1027—1034.
76. Nevitt MC, Chen P, Kiel DP, Reginster JY, Dore RK, Zanchetta JR, Glass EV, Krege JH.: Reduction in the risk of developing back pain persists at least 30 months after discontinuation of teriparatide treatment: a meta-analysis.// J. Osteoporosis International, 2006, Vol. 17, pp. 1630—1637
77. Prince R, Sipos A, Hossain A, Syversen U, Ish-Shalom S, Marcinowska E, Halse J, Lindsay R, Dalsky GP, Mitlak BH.: Sustained nonvertebral fragility fracture risk reduction after discontinuation of teriparatide treatment. // J. Bone Mineral Research, 2005, Vol. 20, pp. 1507—1413.
// J. Bone Mineral Research, 2005, Vol. 20, pp. 1507—1413.
78. Fahrleitner-Pammer A, Langdahl BL, Marin F, Jakob F, Karras D, Barret A, Ljunggren O, Walsh JB, Rajzbaum G, Barker C, Lems WF.: Fracture rate and back pain during and after discontinuation of teriparatide: 36 month data from the European Forsteo Observational Study (EFOS).// Osteoporosis International, 2011, Vol. 22, pp. 2709—2719.
79. Lindsay R, Miller P, Pohl G, Glass EV, Chen P, Krege JH. Relationship between duration of teriparatide therapy and clinical outcomes in postmenopausal women with osteoporosis // Osteoporosis Int, 2009, Vol. 20, pp. 943—948.
80. Рожинская Л.Я., Арапова СД, Дзеранова ЛК, Молитвословова Н.Н., Ильин А.В., Сазонова Н.И., Чернова ТО., Шишкина А. А., Дедов И.И., Беневоленская Л.И., Никитинская О.А., Короткова ТА., Торопцова Н.В., Смирнов А.В., Дёмин Н.В., Николенко В.К., Брижань Л.К., Цибина Л.В.: Исследование эффективности и безопасности терапии терипаратидом (Форстео) в течение 1 года при постменопаузальном остеопорозею.// Ж. Остеопороз и остеопатии, 2006, Том 2, стр. 6—12.
А., Дедов И.И., Беневоленская Л.И., Никитинская О.А., Короткова ТА., Торопцова Н.В., Смирнов А.В., Дёмин Н.В., Николенко В.К., Брижань Л.К., Цибина Л.В.: Исследование эффективности и безопасности терапии терипаратидом (Форстео) в течение 1 года при постменопаузальном остеопорозею.// Ж. Остеопороз и остеопатии, 2006, Том 2, стр. 6—12.
81. Orwoll ES, Scheele WH, Paul S, Adami S, Syversen U, Diez-Perez A, Kaufman JM, Clancy AD, Gaich GA.: The effect of teriparatide [human parathyroid hormone (1-34)] therapy on bone density in men with osteoporosis./ J. Bone Mineral Research 2003 Vol.18 pp. 9.
82. Saag KG, Shane E, Boonen S, Marin F, Donley DW, Taylor KA, Dalsky GP, Marcus R.: Teriparatide or alendronate in glucocorticoid-induced osteoporosis.// New England J. Medicine, 2007, Vol. 357, pp. 2028—2039.
83. Saag KG, Zanchetta JR, Devogelaer JP, Adler RA, Eastell R, See K, Krege JH, Krohn K, Warner MR.: Effects of teriparatide versus alendronate for treating glucocorticoid-induced osteoporosis: thirty-six-month results of randomized, double-blind, controlled trial. Arthritis Rheum, 2009, Vol. 60, pp. 3346—3355.
Saag KG, Zanchetta JR, Devogelaer JP, Adler RA, Eastell R, See K, Krege JH, Krohn K, Warner MR.: Effects of teriparatide versus alendronate for treating glucocorticoid-induced osteoporosis: thirty-six-month results of randomized, double-blind, controlled trial. Arthritis Rheum, 2009, Vol. 60, pp. 3346—3355.
84. Lane NE, Sanchez S, Modin GW, Genant HK, Pierini E, Arnaud CD.: Parathyroid hormone treatment can reverse corticosteroid-induced osteoporosis. Results of a randomized controlled clinical trial. /J. Clinical Investigation 1998 Vol.102 pp.1627—33.
85. Rehman Q, Lang TF, Arnaud CD, Modin GW, Lane NE.: Daily treatment with parathyroid hormone is associated with an increase in vertebral cross-sectional area in postmenopausal women with glucocorticoid-induced osteoporosis./ J. Osteoporosis Internal 2003 Vol. 14 pp. 77—81.
14 pp. 77—81.
86. Belaya ZE Should we really compare absolute risk reduction in different trials on osteoporosis: comment on the article by Ringe JD and Doherty JG.// J. Rheumatology International 2011 Dec;31(12) pp.1669—1671.
87. Black DM, Thompson DE, Bauer DC, Ensrud K, Musliner T, et.al.: Fracture risk reduction with alendronate in women with osteoporosis: the Fracture Interventional Trial. J. Clin Endocrinol Metab, 2000, Vol. 85, pp. 4118—4124.
88. Black DM, Delmas PD, Eastell R, Reid IR, Boonen S, Cauley JA, Cosman F, Lakatos P, Leung PC, et.al: Once-Yearly Zoledronic acid for treatment of postmenopausal osteoporosis.// New England J. Medicine, 2007, Vol. 356, pp. 1809—1822.
89. Chesnut CH, Skag A, Christiansen C, Recker R, Stakkestad JA, Hoiseth A, Felsenberg D, Huss H, Gilbride J, Schimmer RC, Delmas PD.: Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis.// J. Bone Miner Res, 2004, Vol. 19, pp. 1241—1249.
Chesnut CH, Skag A, Christiansen C, Recker R, Stakkestad JA, Hoiseth A, Felsenberg D, Huss H, Gilbride J, Schimmer RC, Delmas PD.: Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis.// J. Bone Miner Res, 2004, Vol. 19, pp. 1241—1249.
90. Cummings SR, Martin JS, McClung MR, Siris ES, Eastell R, Reid IR, Delmas P, Zoog HB, Austin M, Wang A, Kutilek S, Adami S, Zanchetta J, Libanati C, Siddhanti S, Christiansen C, for the FREEDOM Trial: Denosumab for Prevention of Fractures in Postmenopausal Women with Osteoporosis.// New England J. Medicine, 2009, Vol.361, pp. 756—765.
91. European Medicines Agency Press Office. EMEA recommends changes in the product Information for Protelos/Osseor due to the risk of severe hypersensitivity reactions. EMEA/417458/2007.
92. Cacoub P, Descamps V, Meyer O, Speirs C, Belissa-Mathiot P, Musette P: Drug rash with eosinophilia and systemic symptoms (DRESS) in patients receiving strontium ranelate.// Osteoporosis International, 2013, Vol. 24, pp. 1751—1757.
93. Body JJ, Gaich GA, Scheele WH, Kulkarni PM, Miller PD, Peretz A, Dore RK, Correa-Rotter R, Papaioannou A, Cumming DC, Hodsman AB.: A randomized double-blind trial to compare the efficacy of teriparatide [recombinant human parathyroid hormone (1-34)] with alendronate in postmenopausal women with osteoporosis./ J Clinical Endocrinology and Metabolism 2002 Vol. 87 pp. 4528.
94. Hadji P, Zanchetta JR, Russo L, Recknor CP, Saag KG, McKiernan FE, Silverman SL, Alam J, Burge RT, Krege JH, Lakshmanan MC, Masica DN, Mitlak BH, Stock JL. : The effect of teriparatide compared with risedronate on reduction of back pain in postmenopausal women with osteoporotic vertebral fracture. Osteoporosis Int, 2012, Vol.23, pp. 2141—2150.
: The effect of teriparatide compared with risedronate on reduction of back pain in postmenopausal women with osteoporotic vertebral fracture. Osteoporosis Int, 2012, Vol.23, pp. 2141—2150.
95. Keaveny TM, McClung MR, Wan X, Kopperdahl DL, Mitlak BH, Krohn K.: Femoral strength in osteoporotic women treated with teriparatide or alendronate.// Bone, 2012, Vol. 50, pp. 165—170.
96. Diez-Perez A, Adachi JD, Agnusdei D, Bilezikian JP, Compston JE, Cummings SR, Eastell R, Eriksen EF, Gonzales-Macies J, Liberman UA, Wahl DA, Seeman E, Kanis JA, Cooper C.: Treatment failure in osteoporosis.// Osteoporosis Int, 2012, Vol. 23, pp. 2769—2774.
97. Jakob F, Oertel H, Langdahl B, Ljunggren O, Barrett A, Karras D, Walsh JB, Fahrleintner-Pammer A, Rajzbaum G, Barker C, Lems WF, Marin F. : Effects of teriparatide in postmenopausal women with osteoporosis pre-treated with bisphosphonates: 36-month results from the European Forsteo Obsrevational Study.// European J. Endocrinology, 2012, Vol. 166, pp. 87—97.
: Effects of teriparatide in postmenopausal women with osteoporosis pre-treated with bisphosphonates: 36-month results from the European Forsteo Obsrevational Study.// European J. Endocrinology, 2012, Vol. 166, pp. 87—97.
98. Boonen S, Marin F, Obermayer-Pietsch B, Simoes ME, Barker C, Glass EV, Hadji P, Lyritis G, Oertel H, Nickelsen T, McCloskey EV.: Effects of previous antiresorbtive therapy on the bone mineral density response to two years of teriparatide treatment in postmenopausal women with osteoporosis.// J. Clin Endocrinol Metab, 2008, Vol. 93, pp. 852—860.
99. Obermayer-Pietsch BM, Marin F, McCloskey EV, Hadji P, Farrerons J, Boonen S, Aurdan M, Barker C, Anastasilakis AD, Fraser WD, Nickelsen T.: Effects of two years of daily teriparatide treatment on BMD in postmenopausal women with severe osteoporosis with and without prior antiresorbtive treatment.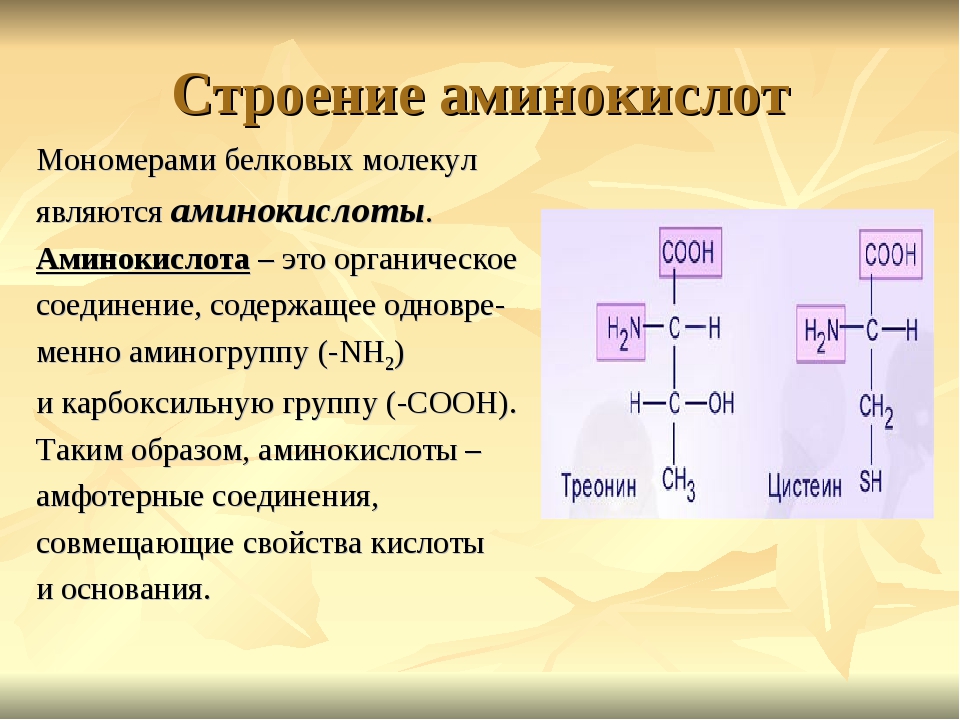 // JBMR, 2008, Vol. 23, pp. 1591—1600.
// JBMR, 2008, Vol. 23, pp. 1591—1600.
100. Ettinger B, Martin JS, Crans G, Pavo I.: Differential effects of Teriparatide on BMD after treatment with Raloxifene or Alendronate. / J. Bone and Mineral Research 2004 Vol. 19 pp. 745—751.
101. Rittmaster rS, Bolognese M, Ettinger MP, Hanley DA, Hodsman AB, Kendler DL, Rosen CJ.: Enhancement of bone mass in osteoporotic women with parathyroid hormone followed by alendronate. J Clin Endocrinol Metab. 2000 Vol. 85 pp.2129—34.
102. Eastell R, Nickelsen T, Marin F, Barker C, Hadji P, Farrerons J, Audran M, Boonen S, Brixen K, Comes JM, Obermayer-Pietsch B, Avramidis A, Sigurdsson G, Gluer CC.: Sequential treatment of severe postemenopausal osteoporosis after teriparatide: final results of the randomized, controlled European study of Forteo (EUROPORS).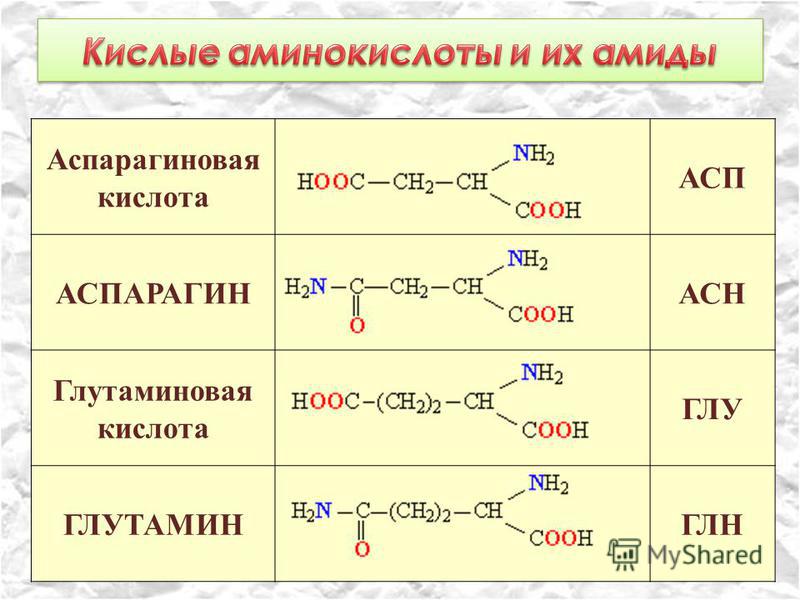 // JBMR, 2009, Vol. 24, pp. 726—736.
// JBMR, 2009, Vol. 24, pp. 726—736.
103. Black DM, Greenspan S.L., Ensrud K.I., Palermo L., McGowan JA, Lang TF., Garnero P, Bouxsein M.L., Bilezikian JP, Rosen CJ.: The effects of Parathyroid hormone and Alendronate alone or in combination in postmenopausal osteoporosis./ The New England J Medicine 2003 Vol.349 pp. 1207—1215.
104. Finkelstein JS, Hayes A, Hunzelman JL, Wyland JJ, Lee H, Neer RM.: The effects of parathyroid hormone, alendronate, or both in men with osteoporosis./ The New England J Medicine 2003 Vol.349 pp. 1216—26.
105. Cosman F, Ericksen EF, Recknor C, Miller PD, Guanabens C, Kasperk C, Papanastasiou P, Readie A, Rao H, Gasser JA, Bucci-Rechtweg C, Boonen S.: Effects of intravenous zoledronic acid plus subcutaneous teriparatide [rhPTH(1-34) in postmenopausal osteoporosis. // JBMR, 2011, Vol. 26, pp. 503—511.
// JBMR, 2011, Vol. 26, pp. 503—511.
106. Tsai JN, Uihlein AV, Lee H, Kumbhani R, Siwila-Sackman E, McKay EA, Burnett-Bowie SA, Neer RM, Leder BZ. Teriparatide and denosumab, alone or combined, in women with postmenopausal osteoporosis: the DATA study randomised trial.//Lancet. 2013 Vol. 382(9886):pp,50—56.
107. Tashjian AH, Chabner BA.: Commentary on clinical safety of recombinant human parathyroid hormone 1-34 in the treatment of osteoporosis in men and postmenopausal women. / J. Bone and Mineral Research 2002 Vol. 17 pp. 1151—1161.
108. Vahle J.L., Sato M., Long GG, Young J.K., Francis PC, Engelhardt JA, Westmore MS, Ma YL, Nold JM.: Skeletal Changes in rats given daily subcutaneous injections of recombinant human parathyroid hormone (1-34) for 2 years and relevance to human safety. / J. Toxicologic Pathology 2002 Vol. 30 pp. 312—321.
/ J. Toxicologic Pathology 2002 Vol. 30 pp. 312—321.
109. Miller PD, Schwartz EN, Chen P, Misurski DA, Krege JH.: Teriparatide in postmenopausal women with osteoporosis and mild or moderate renal impairment.// Osteoporosis International, 2007, Vol. 18, pp. 59—68.
110. Burr DB, Hirano T, Turner CH, Hotchkiss C, Brommage R, Hock JM: Intermittently administered human parathyroid hormone (1-34) treatment increases intracortical bone turnover and porosity without reducing bone strength in the humerus of ovariectomized cynomolgus monkeys./ J. Bone Mineral research 2001 Vol. 16 pp. 157—165.
111. Smeland S, Muller C, Alvegard TA et al. Scandinavian Sarcoma Group Osteosarcoma Study SSG VIII: prognostic factors for outcome and the role of replacement salvage chemotherapy for poor histological responders. / European J. Cancer 2003 Vol.39 pp. 488-94.
/ European J. Cancer 2003 Vol.39 pp. 488-94.
NOW ZMA 1082 mg 90 caps
ZMA – продукт спортивного питания, состоящий из 3-х микроэлементов: цинка, магния и витамина В6.
ZMA – это запатентованная пищевая добавка нестероидного происхождения, которая, как было клинически доказано, поднимает уровень свободного тестостерона и увеличивает силу у тренирующихся атлетов.
Особенностью данного препарата является органически связанное состояние этих микроэлементов, в котором они проявляют синергичные (взаимодополняющие) свойства. Эта формула является активным стимулятором синтеза в организме тестостерона и инсулина, мышечного протеина.
По силе воздействия на рост мышц и силы ZMA лишь незначительно уступает креатину, ВСАА и глютамину и стоит на одном уровне с НМВ, таурином и прогормонами. При достаточно сбалансированном белками и жирными кислотами питании ZMA дает значительный анаболический эффект.
Цинк и магний играют огромную роль в функционировании самых различных систем организма.
Магний – микроэлемент номер один для “силовиков”. Магний участвует в накоплении энергии и синтезе белка. В связи с тем, что его потери (с потом, например) велики, спортсменам нужно постоянно потреблять продукты, богатые магнием.
Именно значимость этого элемента в биохимии мышц объясняет увлечение многих спортсменов и тренеров препаратами, содержащими магний. По данным исследований, его дефицит (менее 2/3 оптимального уровня в плазме крови) в разных видах спорта наблюдался у 23-39% спортсменов. Рекомендуемое ежедневное потребление: мужчины – 350 мг, женщины – 280 мг.
Цинк участвует практически во всех стадиях роста клеток. Он необходим для работы более чем 300 различных ферментов. В организме взрослого человека содержится достаточно большое количество (2-3 г) цинка. Основная часть его сосредоточена в костях и коже. Уровень цинка наиболее высок в сперме и предстательной железе.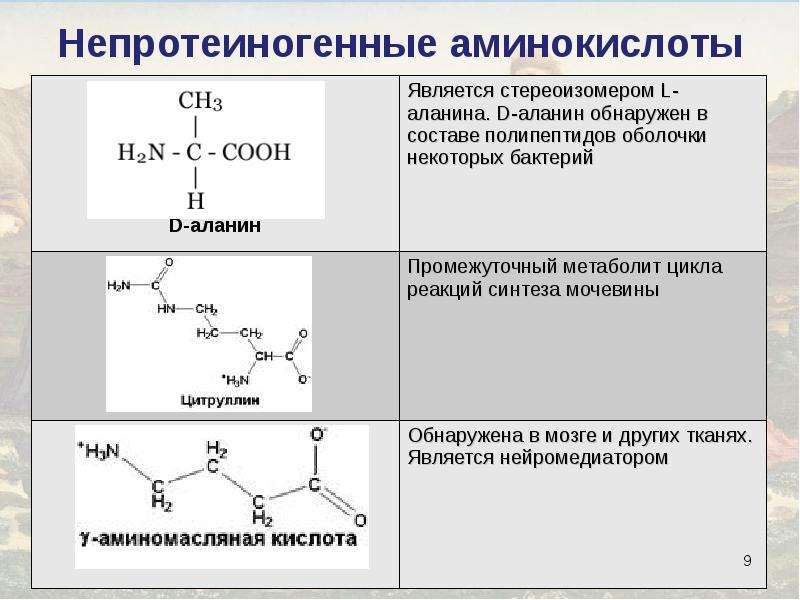 Достаточно высока его концентрация в костях и волосах, во внутренних органах она значительно меньше.
Достаточно высока его концентрация в костях и волосах, во внутренних органах она значительно меньше.
Цинк находится в органах и тканях преимущественно в органически связанной форме в виде легко диссоциирующих соединений с белком. Велика биологическая роль цинка в росте, развитии и половом созревании человека, поддержании репродуктивной функции, для кроветворения, вкусовосприятия и обоняния, нормального течения процессов заживления ран и др. Он необходим для нормальной работы гипофиза, щитовидной, поджелудочной и предстательной желез. Под влиянием его соединений усиливается активность гонадотропных гормонов гипофиза. Установлено, что гипогликемическое действие инсулина также зависит от цинка, который постоянно присутствует в гормоне. Цинк нормализует жировой обмен, повышая интенсивность распада жиров в организме и предотвращая ожирение печени.
К тому же интенсивные тренировки способствуют ускоренной потере микроэлемента. Поэтому необходимо соблюдать правильный баланс питания. Из-за его недостатка может прекратиться ваш рост. По некоторым данным, цинковый дефицит в различных видах спорта наблюдается у 24-60% занимающихся.
Из-за его недостатка может прекратиться ваш рост. По некоторым данным, цинковый дефицит в различных видах спорта наблюдается у 24-60% занимающихся.
Аспарагиновая кислота способствует усвоению углеводов, накоплению гликогена в мышцах, повышает активность иммунной системы, увеличивает сопротивляемость утомлению и выносливость. Она вовлечена в формирование РНК и ДНК, действует как гепатопротектор, участвует в реакциях цикла мочевины и переаминирования. Известно ее положительное воздействие на уровень гормона роста, проявляющееся при больших дозах.
Функциональные действия:- Поддерживая необходимые уровни магния и цинка в организме, ZMA оказывает мягкое анаболизирующее действие – в основном за счет аспарагиновой кислоты и витамина В6. Он несколько повышает уровень гормона роста во время сна, что доказано научными экспериментами.
- Добавки магния улучшают качество сна, удлиняя долю “медленной” фазы, во время которой и происходит основной выброс гормона роста.
 Аспартаты усиливают этот процесс.
Аспартаты усиливают этот процесс. - ZMA влияет на гормональный профиль сразу двумя механизмами. К тому же улучшение работы поджелудочной железы также активирует анаболические процессы. Положительно воздействуя на уровень тестостерона, препарат в конечном итоге приводит к повышению силовых показателей.
- Путем безопасного стимулирования естественной выработки тестостерона и IGF-1, ZMA может серьезно подстегнуть анаболизм, что в свою очередь ведет к убыстрению мышечного роста и лучшему восстановлению.
- Занятия спортом.
- Низкий уровень тестостерона.
- Низкий рост у подростков.
- Слабая мышечная масса тела.
Не содержит сахар, соль, дрожжи, пшеницу, глютен, кукурузу, сою, молоко, яйца, моллюски и консерванты.
Инструкция по применению ZMA
В качестве пищевой добавки, мужчиная принимать 3 капсулы (женщинам принимать по 2 капсулы) в день, желательно на пустой желудок, за 30 – 60 минут перед сном.
Аминокислоты анаболизм — Справочник химика 21
Стабильность белкового состава организма — следствие устойчивого динамического равновесия, при котором количество постоянно распадающихся белков практически равно синтезируемому их количеству. Поддержание этого равновесия между анаболизмом и катаболизмом — явление тонкое, так как организм располагает лишь очень малым резервом аминокислот. В организме человека соотношение свободных аминокислот и возобновимых белков составляет приблизительно 1 5000 [65]. [c.568]В организме синтез и распад белков тесно взаимосвязаны. Постоянство массы и белкового состава взрослого организма является результатом тонко настроенного равновесия между анаболизмом и катаболизмом. Аминокислоты белков пищи и аминокислоты, возникающие в результате распада белков тканей в процессе самообновления, составляют общий фонд аминокислот организма, равный приблизительно 500 г.
 [c.167]
[c.167]Основная часть аминокислот используется в процессах биосинтеза белка и других азотсодержащих веществ. Те аминокислоты, которые не были использованы в реакциях анаболизма (около 100 г в сутки), распадаются в организме до конечных продуктов. Примерно такое же количество аминокислот должно попадать ежедневно в организм с пищей для сохранения азотистого равновесия. [c.167]
Основное различие в реакциях путей катаболизма и анаболизма заключается в том, что они редко повторяют друг друга. Продукт катаболизма не идентичен тому источнику углерода, который используется в процессе анаболизма. Так происходит при синтезе многих аминокислот, например, при распаде ароматических аминокислот образуются ацетил-КоА и фумаровая или янтарная кислоты, тогда как для синтеза тех же аминокислот исходными продуктами служат фосфоенолпировиноградная кислота и эритро-зо-4-фосфат (см. подробнее тему 5 Пути биосинтеза протеиногенных аминокислот ). [c. 451]
451]
АНАБОЛИЗМ м. Ферментативный синтез биополимеров из простых предшественников (напр., белков, аминокислот и т.п.). [c.28]
ОБМЕН ВЕЩЕСТВ. Совокупность биохимических реакций, лежащих в основе жизнедеятельности организмов. Биологический обмен веществ представляет собой процессы превращения веществ внешней среды в вещества живого организма и обратные превращения веществ организма в вещества внешней среды. С другой стороны, это процессы, происходящие внутри организма, в отдельных частях, органах и тканях, и, наконец, процессы превращения веществ в клетке и в отдельных клеточных структурах. Без непрерывного взаимодействия организма с внешней средой, без обмена веществ не может быть жизни. Обмен веществ неразрывно связан с обменом энергии. Важнейшую сторону обмена веществ составляют биохимические процессы, и выяснение химизма отдельных звеньев обмена веществ является одним из путей познания жизни. Благодаря крупным успехам биохимии к настоящему времени в основном раскрыт химизм таких кардинальных звеньев обмена веществ, как дыхание и брожение, фотосинтез, обмен азотистых соединений, жиров, углеводов и органических кислот и многие другие процессы. Выяснено также влияние многих внешних и внутренних факторов на интенсивность и направленность отдельных звеньев обмена веществ, что позволяет путем изменения внешних условий изменять обмен веществ микроорганизмов, растений и животных в желаемом для человека направлении. Процессы обмена веществ делятся на две группы — катаболизм и анаболизм. Катаболизм — это процессы, при которых происходит распад, расщепление сложных органических соединений до белее простых (например, распад белков до аминокислот, крахмала до глюкозы, сахаров до углекислоты и воды т. д.). Анаболизм — это синтетические процессы, при которых образуются более сложные соединения из более простых. При катаболизме происходит выделение энергии, а при анаболизме ее поглощение. Всякое усиление синтетических процессов в организме неизбежно сопровождается усилением процессов распада веществ. [c.204]
Выяснено также влияние многих внешних и внутренних факторов на интенсивность и направленность отдельных звеньев обмена веществ, что позволяет путем изменения внешних условий изменять обмен веществ микроорганизмов, растений и животных в желаемом для человека направлении. Процессы обмена веществ делятся на две группы — катаболизм и анаболизм. Катаболизм — это процессы, при которых происходит распад, расщепление сложных органических соединений до белее простых (например, распад белков до аминокислот, крахмала до глюкозы, сахаров до углекислоты и воды т. д.). Анаболизм — это синтетические процессы, при которых образуются более сложные соединения из более простых. При катаболизме происходит выделение энергии, а при анаболизме ее поглощение. Всякое усиление синтетических процессов в организме неизбежно сопровождается усилением процессов распада веществ. [c.204]
Процесс анаболизма, как и катаболизма, включает три стадии.
 Исходными веществами для него служат соединения, поставляемые третьей стадией катаболизма, т. е. третья стадия катаболизма — первая, исходная, стадия анаболизма. Так, например, синтез белка начинается с а-кетокислот, являющихся предшественниками а-аминокислот. На второй стадии анаболизма а-кетокислоты аминируются аминогруппой доноров с образованием а-аминокислот, а на третьей, заключительной, стадии аминокислоты объединяются в пептидные цепи. [c.96]
Исходными веществами для него служат соединения, поставляемые третьей стадией катаболизма, т. е. третья стадия катаболизма — первая, исходная, стадия анаболизма. Так, например, синтез белка начинается с а-кетокислот, являющихся предшественниками а-аминокислот. На второй стадии анаболизма а-кетокислоты аминируются аминогруппой доноров с образованием а-аминокислот, а на третьей, заключительной, стадии аминокислоты объединяются в пептидные цепи. [c.96]В целом все химические процессы, происходящие при построении и деятельности тканей живого организма, называются метаболизмом или обменом веществ. Анаболизм — это процесс синтеза сложных молекул из простых, например образование белков клеток из аминокислот крови [c.325]
Анаболизм тоже состоит из трех стадий, причем соединения, образовавшиеся на третьей стадии катаболизма, являются исходными веществами в процессе анаболизма. Например, биосинтез белков начинается с а-кетокислот, получающихся на третьей стадии катаболизма на второй стадии а-кетокислоты превращаются в а-аминокислоты на третьей стадии анаболизма из а-аминокислот создаются пептидные цепи. Пути катаболизма и анаболизма в большинстве случаев неидентичны. [c.393]
Пути катаболизма и анаболизма в большинстве случаев неидентичны. [c.393]
Белковый обмен характеризуется катаболизмом и анаболизмом. В процессе катаболизма бактерии разлагают белки под действием протеаз с образованием пептидов. Под действием пептидаз из пептидов образуются аминокислоты. [c.17]
Аминокислоты незаменимые — кислоты, которые не синтезируются в тканях организма валин, гистидин, лейцин, изолейцин, лизин, метионин, треонин, фенилаланин. Анаболизм — см, ассимиляция. [c.486]
Последовательное рассмотрение анаболических и катаболических путей белков и аминокислот целесообразно начать с первичного пути анаболизма данных соединений — процесса фиксации атмосферного азота. [c.361]
Катехоламины — представители биогенных аминов, lie. аминов, образующихся в организме в результате процессов Анаболизма. Принципиальный путь биосинтеза катехоламинов, одя из незаменимой а-аминокислоты фенилаланина (см. 11.1), веден на рис. 9.1. К каФехоламинам относятся три последних представленных на рисунке соединений — дофамин, норадре-Яин и адреналин, выполняющие, как и ацетилхолии, роль ней- иедиаторов. Адреналин является гормоном мозгового ве-Й тва надпочечников, а норадреналин и дофамин — () предщественниками. [c.255]
11.1), веден на рис. 9.1. К каФехоламинам относятся три последних представленных на рисунке соединений — дофамин, норадре-Яин и адреналин, выполняющие, как и ацетилхолии, роль ней- иедиаторов. Адреналин является гормоном мозгового ве-Й тва надпочечников, а норадреналин и дофамин — () предщественниками. [c.255]
Это совершенно очевидно, когда продукт катаболизма не идентичен тому источнику углерода, который используется в процессе анаболизма. Так, при синтезе многих аминокислот, например при распаде ароматических аминокислот, образуются ацетил-КоА и фумаровая или янтарная кислоты, тогда как для синтеза тех же аминокислот исходными продуктами служат фосфоенолпи-ровиноградная кислота и альдотетрозофосфат. [c.446]
Превращения веществ в клетке (обмен веществ, или метаболизм), в результате которых из сравнительно простых предшественников, например глюкозы, жирных кислот с длинной цепью или ароматических соединений, образуется новое клеточное вещество, можно ради простоты подразделить на три основные группы. Сначала питательные вещества расщепляются на небольшие фрагменты (распад, или катаболизм), а затем в ходе реакций промежуточного обмена, или амфиболизма, они превращаются в ряд органических кислот и фосфорных эфиров. Эти два пути переходят незаметно один в другой. Многообразные низкомолекулярные соединения-это тот субстрат, из которого синтезируются основные строительные блоки клетки. Строительными блоками мы называем аминокислоты, пуриновые и пиримидиновые основания, фос-форилированные сахара, органические кислоты и другие метаболиты — конечные продукты цепей биосинтеза, иногда длинных. Из них строятся полимерные макромолекулы (нуклеиновые кислоты, белки, резервные вещества, компоненты клеточной стенки и т.п.), из которых состоит клетка. Эти два этапа биосинтеза клеточных веществ-синтез строительных блоков и синтез полимеров-составляют синтетическую ветвь метаболизма, или анаболизм (рис. 7.1). [c.214]
Сначала питательные вещества расщепляются на небольшие фрагменты (распад, или катаболизм), а затем в ходе реакций промежуточного обмена, или амфиболизма, они превращаются в ряд органических кислот и фосфорных эфиров. Эти два пути переходят незаметно один в другой. Многообразные низкомолекулярные соединения-это тот субстрат, из которого синтезируются основные строительные блоки клетки. Строительными блоками мы называем аминокислоты, пуриновые и пиримидиновые основания, фос-форилированные сахара, органические кислоты и другие метаболиты — конечные продукты цепей биосинтеза, иногда длинных. Из них строятся полимерные макромолекулы (нуклеиновые кислоты, белки, резервные вещества, компоненты клеточной стенки и т.п.), из которых состоит клетка. Эти два этапа биосинтеза клеточных веществ-синтез строительных блоков и синтез полимеров-составляют синтетическую ветвь метаболизма, или анаболизм (рис. 7.1). [c.214]
Образование ферментов, участвующих в процессах анаболизма, например в биосинтезе пиримидинов, пуринов и 20 аминокислот, регулируется путем репрессии. В большинстве случаев сигнал к остановке биосинтеза белков исходит от конечных продуктов этого процесса (репрессия конечным продуктом). Если в среде имеются одновременно два субстрата, то бактерия обычно предпочитает тот субстрат, который обеспечивает более быстрый рост. Синтез ферментов, расще-пляюпщх второй субстрат, репрессируется в этом случае говорят о катаболитной репрессии. [c.474]
В большинстве случаев сигнал к остановке биосинтеза белков исходит от конечных продуктов этого процесса (репрессия конечным продуктом). Если в среде имеются одновременно два субстрата, то бактерия обычно предпочитает тот субстрат, который обеспечивает более быстрый рост. Синтез ферментов, расще-пляюпщх второй субстрат, репрессируется в этом случае говорят о катаболитной репрессии. [c.474]
Очевидно, что обновление белков отражает совокупность процессов синтеза и распада до сих пор исследования процессов обновления не дали однозначного ответа на вопрос о том, могут ли аминокислоты включаться в белки при отсутствии реального синтеза de novo. Эти исследования мало чем обогатили наши познания о механизме процессов анаболизма и катаболизма белков. [c.275]
Есть и еще одно важное различие оно заключается в том, что анаболиче-ские и катаболические пути очень редко повторяют друг друга в деталях.
 Это совершенно очевидно, когда продукт катаболизма не идентичен тому источнику углерода, который используется в процессе анаболизма. Так, в частности, обстоит дело при синтезе многих аминокислот. При распаде [c.273]
Это совершенно очевидно, когда продукт катаболизма не идентичен тому источнику углерода, который используется в процессе анаболизма. Так, в частности, обстоит дело при синтезе многих аминокислот. При распаде [c.273]Цикл лимонной кислоты (синоним цикл трикарбоновых кислот), часто связываемый с именем Кребса это, образно говоря, та главная ось, вокруг которой вертится метаболизм почти всех суш еству1ощих клеток. Естественно поэтому, что он займет центральное место и в нашем обсуждении. Значение этого цикла, первоначально постулированного для объяснения полного сгорания пирувата (и, таким образом, углеводов), а также дву- и трехуглеродных конечных продуктов окисления жирных кислот, вышло далеко за рамки этих и им подобных чисто катаболических функций, связанных с выработкой энергии. Цикл Кребса является фокусом , в котором сходятся все метаболические пути (см. гл. XI). Поэтому его реакции и субстраты играют решаюш,ую роль в биосинтезе (анаболизме) множества важных соединений, начиная от аминокислот, пуринов и пиримидинов и кончая жирными кислотами с длинной цепью и порфиринами. [c.348]
Репрессия под действием конечных продуктов характерна для процессов биосинтеза (анаболизма) аминокислот, витаминов, пуринов и пиримидинов индукция же, как правило, имеет место при распаде (катаболизме) источников углерода и энергии Совершенно очевидно, что регуляция необходима для обеспечения экономичности работы белоксинтезирующей системы. Синтез ферментов любого метаболического пути включается или выключается в зависимости от того, сколь велика в данный момент потребность клетки в этом пути. Зачем синтезировать белки, если они не нужны Особенно ярким примером того, как с помощью индукции и репрессии обеспечивается строгий контроль над синтезом определенной группы белков, может служить регуляция образования ферментов, катализирующих распад миндальной кислоты (точнее ее солей — манделатов) у Pseudomonas. Ниже приведена предполагаемая последовательность реакций распада. [c.536]
Совокупность всех химических реакций, протекающих в клетке, составляет то, что мы называем метаболизмом. Метаболизм подразделяется на анаболизм и катаболизм — два разных типа реакций, которые нередко протекают и в разных частях клетки. Катаболические реакции, или реакции распада, обьгано сопровождаются высвобождение энергии. По большей части это окисление и гидролиз. Анаболические реакции, или реакции синтеза, наоборот, требуют затрат энергии. Часто это реакции конденсации. Все эти реакции протекают с участием ферментов. Примером фермента, участвующего в анаболизме, может служить глутаминсинтетаза, катализирующая синтез аминокислоты глутамина из глутаминовой кислоты и аммиака [c.152]
В обмене белков участвуют чрезвычайно сложные молекулы их сложность заключается не только в том, что они построены приблизительно из двадцати разных аминокислот, но также и в том, что содержание этих аминокислот, а также последовательность их расположения в молекулах различны. Это приводит к образованию самых разнообразных белков. Все тканевые белки животных, принадлежащих к разным видам, а также белки разных органов и желез имеют специфическое строение и состав. Белки иного типа — это белки ферментов и гормонов, плазменные белки, белок гемоглобина, а также белки различных нуклеонротеидов. Проблема анаболизма, т. е. синтеза белков, необходимых для роста и развития организма, еще далека от разрешения. Процесс катаболизма, или расщепления белков, при котором осво- [c.378]
Изучение молекулярных процессов, лежаш их в основе переноса наследственной информации, сопряжено со многими методологическими проблемами, которые обусловлены особенностями биосинтеза нуклеиновых кислот, протекающего только на готовой матрице матричный биосинтез). Кроме того, учитывая огромное биологическое значение процессов, протекающих с участием нуклеиновых кислот, многие авторы предпочитают рассматривать их в отдельных разделах курса биохимии. В рамках настоящего пособия процессы переноса генетической информации в живых организмах рассматриваются, исходя из следующих соображений. Прежде всего учитывается, что биосинтезы нуклеиновых кислот представляют собой анаболические процессы, которые целесообразно рассматривать наряду с процессами анаболизма и катаболизма биосоединений данного и других классов. Кроме того, в настоящей главе обсуждается метаболизм нуклеотидов как строительных блоков нуклеиновых кислот. Таким образом, исследование путей биосинтеза нуклеиновых кислот, начиная с нуклеотидов и заканчивая полинуклеотидными цепями, включая их трансформацию, позволяет уяснить взаимосвязь между разными биомолекулами, что, по сути, составляет материальную основу биологической эволюции. Информация, касающаяся общих вопросов биоэнергетики и метаболизма, необходимая для усвоения материала по метаболизму нуклеиновых кислот, дана в предыдущей главе. В следующей главе Обмен белков и аминокислот изложен биосинтез белков трансляция), который протекает на матрице РНК и отражает биологический принцип передачи наследственной информации по цепочке ДНК РНК белок. [c.343]
Кажущееся постоянство химического состава живого организма поддерживается за счет равновесия между процессами синтеза и разрушения составляющих его компонентов, т. е. равновесия между катаболизмом и анаболизмом. В растущем организме такое равновесие смещено в сторону синтеза белков, т. е. анаболическая функция преобладает над катабо-лической. В организме взрослого человека в результате биосинтеза ежесуточно обновляется до 400 г белка. Разные белки обновляются с различной скоростью — от нескольких минут до 10 и более суток, атакой белок, как коллаген, практически не обновляется за все время жизни организма. В целом период полураспада всех белков в организме человека составляет около 80 сут. Из них необратимо распадается примерно четвертая часть протеиногенных аминокислот (около 100 г), которая должна возобнов- [c.360]
Полезная информация об аминокислотах. Советы доктора
В нашем Центре осуществляется анализ на 15 важнейших аминокислот.
Аланин | Alanine | ALA | Валин | Valine | VAL | Метионин | Methionine | MET |
Альфа-амино-масляная к-та | Alfa-Aminobutyric Acid | AAB | Гидроксипролин | Hydroxyproline | HYPRO | Серин | Serine | SER |
Аргинин | Arginine | ARG | Гистидин | Histidine | HIS | Таурин | Taurine | TAU |
Аспарагин | Asparagine | ASN | Глицин | Glycine | GLY | Тирозин | Tyrosine | TYR |
Аспарагиновая к-та | Aspartic Acid | ASP | Глутамовая к-та | Glutamic Acid | GLU | Треонин | Threonine | THR |
Альфа-аминомасляная кислота повышает синтез белка, что способствует его восполнению при интенсивных занятиях спортом. Промежуточный метаболит окислительного распада треонина и метионина. Низкие уровни этой аминокислоты, фиксируемые в результатах анализа крови на аминокислоты, свидетельствуют о недостаточном приеме треонина или метионина, также это может быть связано с недостаточным поступлением в организм витамина В6.
Аланин играет главную роль в цикле преобразования аминокислот в глюкозу. Обладает иммуномодулирующим действием. Считается, что аланин можно эффективно использовать для увеличения концентрации глюкозы в крови перед стартом или после тренировки, когда это особенно необходимо атлету. Анализ крови на эту аминокислоту важен для спортсменов.
Аргинин является условно заменимой аминокислотой, т.е. он может быть синтезирован организмом из других аминокислот. Аргинин стимулирует процессы высвобождения в кровоток инсулина, глюкагона и гормона роста, обладает выраженным анаболическим эффектом, помогая залечивать раны и участвуя в образовании коллагена. Известна способность аргинина повышать иммунореактивность организма. Это свойство обусловлено влиянием на Т-лимфоциты иммунной системы. Помимо всего аргинин является предшественником креатина.
Аспарагин — амид аспарагиновой кислоты, заменимая аминокислота. В живых клетках присутствует в свободном виде и в составе белков (богаты аспарагином белки семян). Наряду с глутамином аспарагин — растворимое Nh3-содержащее резервное соединение для биосинтеза белков у многих растений. Путем образования аспарагина из аспарагиновой кислоты в организме связывается токсический аммиак.
Аспарагиновая кислота — заменимая аминокислота. Входит в состав белков (кроме протаминов), играет важную роль в реакциях цикла мочевины и переаминирования, участвует в биосинтезе пуринов и пиримидинов, предшественник в биосинтезе незаменимых аминокислот метионина, треонина и лизина у растений и микроорганизмов. Декарбоксилированием аспарагиновой кислоты могут получаться альфа- и бета-аланины. Аспарагиновая кислота служит предшественником и первой ступенью распада аспарагина в обмене веществ.
Глутаминовая кислота не только может быть синтезирована в организме из других аминокислот, но и сама является главным предшественником для синтеза ряда важнейших аминокислот и обеспечивает обменные процессы. Путем химических преобразований из глутаминовой кислоты образуются глутамин, пролин, аргинин и глутатион. Является потенциальным источником энергии в организме. Глутаминовая кислота способствует концентрации внимания и может приниматься через некоторые промежутки времени по 1-3 г.
Глицин способствует синтезу других аминокислот и входит в состав структуры гемоглобина и цитохромов. В энергетическом плане является ключевым звеном в синтезе глюкагона – одного из основных факторов, влияющих на использование запасов гликогена мышц и печени.
Гистидин участвует в производстве красных и белых кровяных телец и применяется при анемии, лечении аллергических заболеваний, язв желудка и кишечника. Гистидин — исходное вещество при биосинтезе гистамина и биологически активных пептидов мышц (карнозина и анзерина).
Гидроксипролин образуется из пролина в результате посттрансляционного гидроксилирования пептидной цепи. Свободный гидроксипролин, освобождающийся во время деградации коллагена, не может повторно использоваться для синтеза этого белка. Поэтому большая часть эндогенного гидроксипролина, находящегося в биологических жидкостях, является продуктом распада различных форм коллагена.
Метионин является незаменимой аминокислотой – предшественником цистина и креатина. Метионин участвует в восстановлении тканей печени и почек и способствует выведению токсинов из организма. Эта аминокислота стимулирует повышение уровня антиоксидантов и участвует в жировом обмене, снижая содержание холестерина. Анализ крови на уровень этой аминокислоты может потребоваться пациентам с проблемами сердечно-сосудистой системы.
Серин – одна из важнейших аминокислот, необходимых для производства клеточной энергии. Как и многие другие аминокислоты, стимулирует систему иммунитета организма. Некоторые исследователи считают, что серин необходимо принимать между приемами пищи, так как эта аминокислота способна увеличить уровень глюкозы в крови. Это особенно важно перед соревнованиями или после физической нагрузки в качестве компонента углеводной загрузки. На рынке спортивного питания появился весьма эффективный препарат фосфатидилсерин. Это вещество относится к классу так называемых фосфоацилглицеролов. Основное действие фосфатидилсерина связано с передачей нервных импульсов в головной мозг и, в частности, в гипоталамус. С возрастом продукция этого фактора снижается. Поэтому фосфатидилсерин часто используют для улучшения умственной работоспособности. Препарат фосфатидилсерин снижает уровень кортизола и поднимает таким образом анаболические процессы на новый уровень. Анализ крови на содержание этой аминокислоты важен для широкого круга пациентов.
Таурин (ß-аминоэтансульфоновая кислота) — природная аминосульфоновая кислота. У позвоночных животных и человека встречается в головном и спинном мозге, периферических нервах, мышцах, печени, почках, крови, молоке. Амиды, образованные таурином и желчными кислотами (например, таурохолевая кислота), входят в состав желчи млекопитающих и обеспечивают эмульгирование и всасывание жиров. Таурин выводится из организма с мочой в свободном состоянии, а также в виде производных с гуанидином или карбаминовой кислотой. При попадании в кишечник таурин под действием микрофлоры распадается до неорганических сульфидов.
Треонин — незаменимая аминокислота, входит в состав всех природных белков, за исключением протаминов. Суточная потребность в ней у взрослого человека составляет 0,5 г, у детей до 7 лет — около 3 г. Треонин участвует в обезвреживании токсинов, предотвращает накопление жира в печени и является важным компонентом коллагена.
Анализ на аминокислоты и оценка их результатов — область интересов не только врачей и аналитиков, но и исследователей, см. например, здесьАнализ на заменимые и незаменимые аминокислоты в рационе питания школьников Беларуси Speciation-анализ на аминокислоты и микроэлементыАминокислоты с разветвленной цепью и синтез мышечного белка у человека: миф или реальность? | Журнал Международного общества спортивного питания
В общей сложности мышечный белок состоит из двадцати аминокислот. Девять из двадцати считаются незаменимыми аминокислотами (EAA), что означает, что они не могут вырабатываться организмом в физиологически значимых количествах и, следовательно, являются важными компонентами сбалансированной диеты. Мышечный белок находится в постоянном состоянии обмена, что означает, что синтез белка происходит непрерывно, чтобы заменить белок, потерянный в результате распада белка.Для синтеза нового мышечного белка все EAA вместе с одиннадцатью незаменимыми аминокислотами (NEAA), которые могут вырабатываться в организме, должны присутствовать в адекватных количествах. Аминокислоты с разветвленной цепью лейцин, изолейцин и валин являются тремя из девяти EAA. Лейцин является не только предшественником синтеза мышечного белка, но также может играть роль регулятора внутриклеточных сигнальных путей, которые участвуют в процессе синтеза белка (например, [1]).
Идея о том, что BCAA могут обладать уникальной способностью стимулировать синтез мышечного белка, выдвигалась более 35 лет.Данные, подтверждающие эту гипотезу, были получены при изучении ответов крыс. В 1981 г. Бузе [2] сообщил, что у крыс BCAA могут ограничивать скорость синтеза мышечного белка. Дополнительные исследования подтвердили концепцию уникального эффекта BCAA на синтез мышечного белка у крыс, хотя немногие изучали реакцию на пероральное употребление только BCAA. Гарлик и Грант показали, что введение смеси BCAA крысам увеличивает скорость синтеза мышечного белка в ответ на инсулин [3], но они не измеряли эффекты только BCAA.Введение крысам только BCAA Kobayashi et al. [4], как было показано, вызывает увеличение синтеза мышечного белка, но ответ был временным. Предположительно скорость синтеза быстро стала ограничиваться доступностью других EAA.
Исследования синтеза мышечного белка у крыс имеют ограниченное отношение к реакции человека. Скелетные мышцы составляют гораздо меньший процент от общей массы тела у крыс по сравнению с людьми, и регулирование синтеза мышечного белка во многих отношениях отличается.Так, в своей знаменательной книге по метаболизму белков Уотерлоу и его коллеги на основании имеющихся данных пришли к выводу, что пищевые аминокислоты не стимулируют синтез мышечного белка у крыс [5]. В то время как недавняя работа ставит под сомнение это утверждение, ограниченный стимулирующий эффект пищевых аминокислот на синтез белка у крыс отражает тот факт, что в нормальных постабсорбтивных условиях имеются избыточные эндогенные аминокислоты, позволяющие увеличить синтез белка, если активность внутриклеточных факторы, участвующие в инициации синтеза белка, стимулируются.Выражаясь по-другому, синтез мышечного белка у крысы, по-видимому, ограничивается скорее процессом инициации, чем процессом трансляции. Напротив, как будет описано ниже, у людей этого не происходит. Еще одно важное различие между исследованиями, изучающими влияние аминокислот на синтез мышечного белка у людей и крыс, связано с обычно используемыми методологиями. В исследованиях на крысах обычно используется метод «затопляющей дозы» [6]. Эта процедура включает измерение включения индикатора аминокислот в мышечный белок в течение очень короткого промежутка времени, часто всего 10 минут.Этот подход не делает различий между кратковременной и устойчивой стимуляцией синтеза белка. С физиологической точки зрения важна только длительная стимуляция синтеза. Потребление несбалансированной смеси аминокислот, такой как BCAA, может временно стимулировать синтез белка за счет использования эндогенных запасов других предшественников синтеза белка. Однако эндогенные запасы аминокислот, например, в плазме и свободных внутриклеточных пулах, весьма ограничены и могут быстро истощиться.Если стимуляция синтеза белка не может быть продолжена, это не имеет большого физиологического значения. Следовательно, метод дозирования наводнения, обычно используемый для измерения синтеза мышечного белка у крыс, дает результаты, не имеющие отношения к питанию человека. Поскольку пищевые добавки BCAA предназначены для употребления в пищу человеком, в центре внимания этого краткого обзора будут исследования на людях.
Продажа BCAA в качестве пищевых добавок превратилась в многомиллионный бизнес.В основе маркетинга этих продуктов лежит широко распространенное мнение о том, что потребление BCAA стимулирует синтез мышечного белка и, как следствие, вызывает анаболический ответ. BCAA также можно употреблять с целью улучшения «умственной сосредоточенности», но мы не будем рассматривать это применение. Основная цель данной статьи — оценить утверждение о том, что только BCAA являются анаболическими, — адекватно подтверждена теоретически или эмпирически исследованиями на людях. Неявным в нашей оценке будет исследование того, играет ли состояние фосфорилирования эукариотических факторов инициации роль регулятора скорости в регуляции синтеза мышечного белка у людей.
Оборот мышечного белка и потребление белка с пищей
Мышечный белок находится в постоянном состоянии оборота, что означает, что новый белок постоянно вырабатывается, в то время как старые белки расщепляются. Анаболическое состояние не имеет конкретного определения, но обычно относится к обстоятельствам, при которых скорость синтеза мышечного белка превышает скорость распада мышечного белка. Результат — набор мышечной массы. Обычно считается, что анаболическое состояние вызывается стимуляцией синтеза мышечного белка, но теоретически оно также может быть результатом ингибирования распада мышечного белка.
Основная метаболическая цель приема добавок BCAA — максимизировать анаболическое состояние. Широко распространено мнение, что BCAA вызывают анаболическое состояние, стимулируя синтез мышечного белка. Обильная доступность всех EAA является необходимым условием для значительной стимуляции синтеза мышечного белка [7]. Синтез мышечного белка будет ограничен из-за отсутствия каких-либо EAA, тогда как нехватка NEAA может быть компенсирована увеличением de novo продукции дефицитных NEAA [7].В постпрандиальном состоянии после приема пищи, содержащей белок, все предшественники EAA, необходимые для синтеза нового мышечного белка, могут быть получены либо из повышенных концентраций в плазме, возникающих в результате переваривания потребленного белка, либо в результате его рециркуляции в результате распада белка. В этом случае обильной доступности EAA скорость синтеза мышечного белка превышает скорость распада, что приводит к анаболическому состоянию. В постабсорбционном состоянии уровни EAA в плазме падают ниже постпрандиальных значений, потому что аминокислоты больше не всасываются.В результате EAA больше не поглощаются мышцами, а высвобождаются мышцами в плазму [8]. Это катаболическое состояние мышечного белка в постабсорбционном состоянии обеспечивает постоянную доступность EAA для других тканей для поддержания скорости синтеза белка за счет мышечного белка, который можно рассматривать как резервуар EAA для остальных. тела, чтобы опираться.
Так как EAA не могут продуцироваться в организме и есть чистое высвобождение EAA из мышц, в постабсорбтивном состоянии единственным источником предшественников EAA для синтеза мышечного белка являются внутриклеточные EAA, полученные в результате распада мышечного белка [8].Помимо того, что они повторно включаются в мышечный белок посредством синтеза, некоторые EAA, высвобождаемые в результате распада мышечного белка, могут частично окисляться в мышцах, что делает их недоступными для повторного включения в мышечный белок. EAA, высвобождаемые в результате распада мышечного белка, которые не включаются в мышечный белок или не окисляются в мышечной ткани, высвобождаются в плазму, после чего они могут либо поглощаться другими тканями в качестве предшественников для синтеза белка, либо необратимо окисляться [9].Таким образом, скорость синтеза мышечного белка всегда будет ниже, чем скорость распада мышечного белка в состоянии после абсорбции, из-за чистого потока EAA от распада белка в плазму и окислительных путей. Другими словами, синтез мышечного белка не может превысить скорость распада мышечного белка, когда предшественники полностью получены из распада белка, и, таким образом, анаболическое состояние не может возникнуть в отсутствие потребления экзогенных аминокислот.
Являются ли BCAA анаболическими в состоянии после абсорбции?
Теоретические соображения
Все предшественники EAA для синтеза мышечного белка в постабсорбирующем состоянии являются производными от распада мышечного белка.Постоянно сообщалось, что у нормальных людей после абсорбции скорость распада мышечного белка превышает скорость синтеза мышечного белка примерно на 30% [10]. Потребление только BCAA (то есть без других EAA) может только увеличить синтез мышечного белка в постабсорбтивном состоянии за счет повышения эффективности рециркуляции EAA из расщепления белка обратно в синтез белка, в отличие от их высвобождения в плазму или окисленный. Это связано с тем, что все 9 EAA (а также 11 NEAA) необходимы для производства мышечного белка, а EAA не могут производиться в организме.Если потребляются только 3 EAA, как в случае с BCAA, то распад белка является единственным источником оставшихся EAA, необходимых в качестве предшественников для синтеза мышечного белка. Следовательно, потребление только BCAA теоретически невозможно для создания анаболического состояния, при котором синтез мышечного белка превышает распад мышечного белка. Если сделать щедрое предположение, что потребление BCAA повышает эффективность рециркуляции EAA от распада мышечного белка до синтеза мышечного белка на 50%, то это приведет к увеличению скорости синтеза мышечного белка на 15% (30% рециркулируется в базовом режиме). состояние X 50% улучшение рециркуляции = 15% увеличение синтеза).Кроме того, снижение на 50% высвобождения ЕАА в плазму из мышц также уменьшило бы плазменный и внутриклеточный пулы свободных ЕАА. Рисунок Рис. 1 схематично иллюстрирует эти принципы. Поскольку повышение эффективности рециркуляции на 50% будет примерно разумным максимальным пределом, это означает, что максимальная стимуляция синтеза мышечного белка не может превышать 15%. Это соответствовало бы увеличению фракционной скорости синтеза мышцы от базального значения около 0,050% / ч в базовом состоянии до 0.057% / час, и эту разницу во фракционной скорости синтеза (FSR) белка трудно точно измерить [11].
Рис. 1Схематическое изображение рециркуляции незаменимых аминокислот (EAA) из распада мышечного белка в синтез мышечного белка в постабсорбтивном состоянии. Произвольные единицы используются для простоты и основаны на измеренных скоростях каждого пути у людей после абсорбции [10]. a Нормальное состояние после абсорбции.Примерно 70% EAA, образующихся при распаде мышечного белка, повторно используется в синтезе белка [10]. В результате распада белка происходит чистый отток примерно 85% EAA, которые могут либо поглощаться и включаться в белок в других тканях, либо окисляться. Около 15% EAA от распада белка частично окисляются в мышцах и недоступны для синтеза белка. Показатели внешнего потока и внутриклеточного окисления ЕАА являются средними, поскольку некоторые ЕАА, такие как фенилаланин, совсем не окисляются в мышцах. b Представление о 50% -ном увеличении эффективности рециркуляции EAA из распада мышечного белка в синтез белка. В этом примере синтез увеличится с 70 до 80 единиц, или на 20%. Синтез белка никогда не может превышать распад белка в состоянии после абсорбции, поскольку расщепление белка является единственным источником EAA
.Эмпирические результаты
BCAA вводили внутривенно в единственных исследованиях, определяющих реакцию метаболизма мышечных белков у людей только на BCAA.Хотя вливание BCAA не является общепринятым способом употребления пищевой добавки, было показано, что вводимые внутривенно и перорально аминокислоты вызывают сопоставимые эффекты на синтез мышечного белка в других случаях [12]. Следовательно, есть смысл оценить статьи, в которых описывается ответ синтеза мышечного белка на внутривенное вливание BCAA у людей.
Louard et al. [13] использовали метод баланса предплечий для количественной оценки реакции на внутривенное вливание смеси BCAA в течение 3 часов у 10 субъектов после абсорбции.Метод баланса предплечья включает измерение поглощения и высвобождения индивидуальных EAA (в данном случае лейцина и фенилаланина) и их изотопно-меченых аналогов. Рассчитаны скорости исчезновения (Rd) и появления (Ra) фенилаланина и лейцина. Исходя из предположения, что баланс лейцина и фенилаланина в мышцах является репрезентативным для всех EAA, Rd. Считается, что фенилаланин отражает синтез мышечного белка, поскольку синтез белка — единственная судьба фенилаланина, поглощаемого мышцами из плазмы.Rd. лейцина нельзя интерпретировать с точки зрения синтеза белка, поскольку лейцин, поглощаемый мышцами, может окисляться, а также включаться в белок. Трехчасовая инфузия BCAA увеличила плазменные концентрации всех 3 BCAA в четыре раза, в то время как концентрации других EAA снизились [13]. Синтез мышечного белка снизился с 37 +/- 3 до 21 +/- 2 нмоль / мин / 100 мл ноги (статистически значимо, p <0,05) [13], вместо того, чтобы стимулироваться инфузией BCAA. Не было значительных изменений в чистом балансе фенилаланина, что указывает на то, что распад мышечного белка также уменьшился на величину, аналогичную сокращению синтеза мышечного белка.Баланс между синтезом и распадом мышечного белка оставался отрицательным, что означало, что катаболическое состояние сохранялось, а анаболическое состояние не возникало. Одновременное снижение синтеза и распада мышечного белка во время инфузии BCAA можно охарактеризовать как снижение оборота мышечного белка.
Аналогичные результаты были получены теми же исследователями, когда они увеличили продолжительность инфузии BCAA до 16 часов у 8 нормальных добровольцев и определили, стимулирует ли хроническое повышение BCAA синтез мышечного белка [14].Для расчета синтеза и распада мышечного белка использовалась та же методика баланса предплечий, что и в предыдущем исследовании. 16-часовая инфузия увеличивает концентрацию BCAA от 5 до 8 раз [14], что почти вдвое превышает уровни, достигаемые при пероральном приеме нормальной дозы BCAA [15]. Как и в предыдущем исследовании, синтез мышечного белка (отраженный фенилаланином Rd) был снижен у субъектов, получавших BCAA, по сравнению с инфузией физиологического раствора с 36 +/- 5 до 27 +/- 2 нмоль / мин / 100 мл. был также снижен, что означает, что оборот мышечного белка также был снижен, и катаболическое состояние сохранялось.
Из этих двух исследований мы можем сделать вывод, что инфузия BCAA не только не увеличивает скорость синтеза мышечного белка у людей, но фактически снижает скорость синтеза мышечного белка и скорость обмена мышечного белка. Катаболическое состояние не было обращено в анаболическое ни в одном исследовании. Кроме того, можно ожидать, что устойчивое снижение скорости оборота мышечного белка будет иметь пагубный эффект на мышечную силу, даже если мышечная масса сохраняется. Оборот мышечного белка обновляет мышечные волокна и приводит к увеличению эффективности сокращения на уровне отдельных волокон [16], что отражается в увеличении силы in vivo, независимо от мышечной массы [17, 18].
Неспособность синтеза мышечного белка значительно увеличиться в ответ на инфузию только BCAA, как и ожидалось в соответствии с теоретическими соображениями, обсужденными выше и проиллюстрированными на рис. 1, в отношении требования для всех EAA поддерживать увеличение. Вместо этого, поскольку распад мышечного белка уменьшился, доступность EAA также упала, что, в свою очередь, фактически снизило скорость синтеза мышечного белка.
Ограничивают ли анаболические сигнальные факторы скорость в постабсорбционном состоянии?
Утверждение о том, что синтез мышечного белка стимулируется BCAA, по крайней мере частично, связано с наблюдением усиления внутриклеточной анаболической передачи сигналов, включая состояние активации ключевых факторов, участвующих в инициации синтеза белка [1].Теория о том, что активация внутриклеточных анаболических сигнальных факторов вызывает повышенную скорость синтеза мышечного белка, прочно вошла в современные концепции регуляции синтеза мышечного белка. Повышенная анаболическая передача сигналов в ответ на BCAA была приведена в качестве доказательства стимуляции синтеза мышечного белка даже в отсутствие измерения синтеза мышечного белка (например, [1]). Однако активация анаболических сигнальных путей может совпадать с повышенным синтезом мышечного белка только при наличии достаточного количества EAA, обеспечивающего необходимые предшественники для производства полноценного белка.
Диссоциация состояния фосфорилирования сигнальных факторов и синтеза мышечного белка у людей была показана в различных обстоятельствах, когда доступность всех EAA ограничена. Например, повышение концентрации инсулина (например, в результате приема глюкозы) является мощным активатором анаболических сигнальных путей, но это не может увеличить мышечный FSR из-за дефицита EAA [19]. И наоборот, потребление небольшого количества (3 г) EAA стимулирует синтез мышечного белка, не влияя на активность фактора инициации e.g., Akt, киназа S6 и 4E – BP1 [20]. Небольшое увеличение концентрации ЕАА в плазме не имело бы никакого эффекта, если бы синтез белка ограничивался состоянием активации факторов инициации. В упомянутых выше исследованиях, в которых BCAA вводили внутривенно, разумно предположить, что такое большое увеличение концентрации BCAA могло активировать сигнальные факторы, но синтез мышечного белка фактически снизился из-за отсутствия EAA в результате снижения расщепление белков.Таким образом, у людей введение ЕАА может увеличить синтез мышечного белка при отсутствии каких-либо изменений в активации факторов инициации, а активация факторов инициации при отсутствии потребления всех ЕАА не влияет на синтез мышечного белка. Эти результаты можно интерпретировать только как демонстрацию того, что ограничивающий скорость контроль синтеза базальных мышечных белков у людей — это доступность всех EAA, а не активность анаболического сигнального фактора. Этот вывод ставит под сомнение роль пищевых добавок, содержащих только BCAA, как стимуляторов синтеза мышечного белка.
Когда все доказательства и теории рассматриваются вместе, можно сделать вывод об отсутствии достоверных доказательств того, что прием одной пищевой добавки с BCAA приводит к физиологически значимой стимуляции мышечного белка. Фактически, имеющиеся данные указывают на то, что BCAA действительно снижают синтез мышечного белка. Все EAA должны быть доступны в изобилии, чтобы усиление анаболической передачи сигналов приводило к ускоренному синтезу мышечного белка.
Одновременное употребление BCAA с другими питательными веществами
В центре внимания этого обзора была реакция только на BCAA, поскольку это логическая цель пищевых добавок BCAA.Как и в случае потребления только BCAA, существует ограниченное количество исследований совместного приема BCAA с другими питательными веществами. Когда BCAA или изоазотная смесь треонина, метионина и гистидина вводились людям вместе с углеводами, скорость синтеза мышечного белка снижалась одинаково в обеих группах, что указывает на отсутствие уникальной роли BCAA [21]. Точно так же потребление смеси BCAA с углеводами после упражнений с отягощениями не увеличивало анаболические сигнальные факторы в большей степени, чем одни углеводы [22].Таким образом, имеющиеся данные не поддерживают идею об особом анаболическом эффекте BCAA при приеме с углеводами.
В отличие от отсутствия взаимодействия между BCAA и углеводами, BCAA могут усиливать анаболический эффект белковой пищи. Например, добавление 5 г BCAA к напитку, содержащему 6,25 г сывороточного протеина, увеличивало синтез мышечного протеина до уровня, сопоставимого с уровнем, вызываемым 25 г сывороточного протеина [23]. Этот результат предполагает, что один или несколько BCAA могут ограничивать скорость стимуляции синтеза мышечного белка сывороточным белком или что дополнительные BCAA индуцируют больший потенциал анаболического ответа мышц на сывороточный белок за счет активации факторов инициации.В любом случае реакция BCAA в сочетании с интактным белком — это другая проблема, чем эффект только BCAA, поскольку интактный белок обеспечивает все EAA, необходимые для производства интактного белка.
Индивидуальные эффекты лейцина, валина и изолейцина
В этой статье мы рассмотрели только реакцию на смеси BCAA. Ответы на отдельные BCAA (например, лейцин, валин или изолейцин) могут отличаться от комбинации этих трех по нескольким причинам.Доказательства указывают на то, что лейцин сам по себе может вызывать анаболический ответ (например, [24]), в то время как таких данных не существует для изолейцина или валина. Таким образом, можно было ожидать, что один лейцин будет более эффективным, чем комбинация всех BCAA. Однако есть два существенных ограничения пищевой добавки, содержащей только лейцин. Во-первых, те же проблемы, которые ограничивают степень стимуляции синтеза мышечного белка одними только BCAA в отношении доступности других EAA, необходимых для производства неповрежденного мышечного белка, также ограничивают ответ на один лейцин.Во-вторых, повышение концентрации лейцина в плазме активирует метаболический путь, который окисляет все BCAA. В результате прием одного лейцина приводит к снижению плазменных концентраций валина и изолейцина. Таким образом, доступность валина и изолейцина может стать ограничивающей для синтеза мышечного белка, когда потребляется только лейцин. Возможно, поэтому долгосрочные исследования результатов с добавлением лейцина в рацион не дали положительных результатов [25].Основное обоснование для диетической добавки, содержащей все BCAA, а не только лейцина, состоит в том, чтобы преодолеть снижение концентраций валина и изолейцина в плазме, которое могло бы произойти при приеме только лейцина.
В то время как пищевая добавка со всеми BCAA преодолевает снижение концентрации, вызванное потреблением только лейцина, добавление валина и изолейцина, тем не менее, может ограничивать эффективность одного лейцина из-за конкуренции за перенос в мышечные клетки.Все BCAA активно транспортируются в клетки, включая мышечные, с помощью одной и той же транспортной системы. Следовательно, при совместном использовании BCAA конкурируют друг с другом за транспортировку в клетки. Если один из BCAA (например, лейцин) ограничивает скорость синтеза белка, добавление двух других BCAA может ограничить стимуляцию синтеза белка из-за снижения проникновения лейцина в клетку. BCAA также конкурируют за транспорт с другими аминокислотами, включая фенилаланин, и эта конкуренция может повлиять на внутримышечную доступность других EAA.В результате конкуренции за переносчики, возможно, что один лейцин, например, может оказывать временное стимулирующее действие на синтез мышечного белка (например, [21]), когда BCAA не вызывают такой реакции [13, 14].
Анаболическая реакция на состав незаменимых аминокислот и сывороточного протеина выше, чем на только сывороточный протеин у молодых здоровых взрослых | Журнал Международного общества спортивного питания
Volpi E, Kobayashi H, Sheffield-Moore M, Mittendorfer B, Wolfe RR.Незаменимые аминокислоты в первую очередь отвечают за аминокислотную стимуляцию анаболизма мышечного белка у здоровых пожилых людей. Am J Clin Nutr. 2003. 78 (2): 250–8.
CAS Статья Google ученый
Типтон К.Д., Гуркин Б.Е., Матин С., Вулф Р.Р. Заменимые аминокислоты не нужны для стимуляции синтеза чистого мышечного белка у здоровых добровольцев. J Nutr Biochem. 1999. 10 (2): 89–95.
CAS Статья Google ученый
Като Х, Вольтерман К.А., Западный DWD, Сузуки К., Мур ДР. Незаменимые с пищей аминокислоты незаменимы для синтеза белка в организме после тренировки у выносливых спортсменов с адекватным потреблением незаменимых аминокислот. Аминокислоты. 2018; 50 (12): 1679–84.
CAS Статья Google ученый
Дэвис Р. У., Басс Дж. Дж., Карсон Б. П., Нортон С., Козойр М., Амиго-Бенавент М., Уилкерсон Д. Д., Брук М. С., Атертон П. Дж., Смит К., Джейкман П. М..Дифференциальная стимуляция послетренировочного синтеза миофибулярного белка у людей после изонитрогенного изокалорийного кормления перед тренировкой. Питательные вещества. 2019; 11 (7). https://doi.org/10.3390/nu11071657.
CAS Статья Google ученый
Паддон-Джонс Д., Шеффилд-Мур М., Катсанос К.С., Чжан XJ, Вулф Р.Р. Дифференциальная стимуляция синтеза мышечного протеина у пожилых людей после изокалорийного приема аминокислот или сывороточного протеина.Exp Gerontol. 2006. 41 (2): 215–9.
CAS Статья Google ученый
Katsanos CS, Kobayashi H, Sheffield-Moore M, Aarsland A, Wolfe RR. Для оптимальной стимуляции скорости синтеза мышечного белка незаменимыми аминокислотами у пожилых людей требуется высокая доля лейцина. Am J Physiol Endocrinol Metab. 2006; 291 (2): E381–7.
CAS Статья Google ученый
Черчворд-Венне Т.А., Бурд Н.А., Митчелл С.Дж., Вест Д.В., Филп А., Маркотт Г.Р., Бейкер С.К., Баар К., Филлипс С.М. Дополнение субоптимальной дозы белка лейцином или незаменимыми аминокислотами: влияние на синтез миофибриллярного белка в состоянии покоя и после упражнений с отягощениями у мужчин. J Physiol. 2012. 590 (11): 2751–65.
CAS Статья Google ученый
Цуцуми Р., Цуцуми Ю.М. Пептиды и белки в сыворотке и их польза для здоровья человека.Остин Дж. Nutri Food Sci. 2014; 1 (1): 1002.
Google ученый
Gaudel C, Nongonierma AB, Maher S, Flynn S, Krause M, Murray BA, Kelly PM, Baird AW, FitzGerald RJ, Newsholme P. Гидролизат сывороточного протеина способствует инсулинотропной активности в клональных β-клетках поджелудочной железы линии и усиливает гликемическую функцию у мышей Ob / Ob. J Nutr. 2013. 143 (7): 1109–14.
CAS Статья Google ученый
Сайто Т. Антигипертензивные пептиды, полученные из бычьего мустеина и сывороточных белков. Adv Exp Med Biol. 2008; 606: 295–317.
CAS Статья Google ученый
Athira S, Mann B, Sharma R, Kumar R. Улучшающий потенциал гидролизата сывороточного протеина против оксидативного стресса, вызванного парацетамолом. J Dairy Sci. 2013; 96 (3): 1431–7.
CAS Статья Google ученый
Типтон К.Д., Эллиотт Т.А., Феррандо А.А., Арсланд А.А., Вулф Р.Р. Стимуляция мышечного анаболизма упражнениями с отягощениями и приемом лейцина и протеина. Appl Physiol Nutr Metab. 2009. 34 (2): 151–61.
CAS Статья Google ученый
Черчвард-Венне Т.А., Брин Л., Ди Донато Д.М., Гектор А.Дж., Митчелл С.Дж., Мур Д.Р., Стеллингверфф Т., Брейл Д., Оффорд Е.А., Бейкер С.К., Филлипс С.М. Добавка лейцина к напитку с низким содержанием белка и смешанным макроэлементам усиливает синтез миофибриллярного белка у молодых мужчин: двойное слепое рандомизированное исследование.Am J Clin Nutr. 2014. 99 (2): 276–86.
CAS Статья Google ученый
Ким И.Ю., Шутцлер С., Шредер А., Спенсер Х.Дж., Азхар Г., Феррандо А.А., Вулф Р.Р. Анаболический ответ на еду, содержащую разное количество белка, не ограничивается максимальной стимуляцией синтеза белка у здоровых молодых людей. Am J Physiol Endocrinol Metab. 2016; 310 (1): E73–80.
Артикул Google ученый
Ким И.Ю., Шин Ю.А., Шутцлер С.Е., Азхар Г., Вулф Р.Р., Феррандо А.А. Качество пищевого белка определяет анаболический ответ у пожилых людей. Clin Nutr. 2018; 37 (6 Pt A): 2076–83.
CAS Статья Google ученый
Ким И.Ю., Шутцлер С., Шрадер А.М., Спенсер Х.Дж., Азхар Дж., Вулф Р.Р., Феррандо А.А. Схема распределения потребления белка не влияет на анаболический ответ, безжировую массу тела, мышечную силу или функцию в течение 8 недель у пожилых людей: рандомизированное контролируемое исследование.Clin Nutr. 2018; 37 (2): 488–93.
CAS Статья Google ученый
Резерферд С.М., Фаннинг А.С., Миллер Б.Дж., Моуган П.Дж. Показатели аминокислот с поправкой на перевариваемость белка и показатели перевариваемых незаменимых аминокислот по-разному описывают качество белка у растущих самцов крыс. J Nutr. 2015; 145 (2): 372–9.
CAS Статья Google ученый
Мэтьюз Д.Е., Марано Массачусетс, Кэмпбелл Р.Г.Утилизация лейцина и фенилаланина в спланхническом ложе у человека. Am J Phys. 1993; 264 (1 Pt 1): E109–18.
CAS Google ученый
Ридс П.Дж., Хачи Д.Л., Паттерсон Б.В., Мотил К.Дж., Кляйн П.Д. Аполипопротеин В-100 ЛПОНП, потенциальный индикатор изотопного мечения пула синтетических предшественников печеночного белка у людей: исследования с множеством стабильных изотопно меченых аминокислот. J Nutr. 1992. 122 (3): 457–66.
CAS Статья Google ученый
Wolfe RR, Chinkes DL. Изотопные индикаторы в метаболических исследованиях: принципы и практика кинетического анализа. 2-е изд. Хобокен: Вили-Лисс; 2004.
Devries MC, Phillips SM. Дополнительный белок для поддержки мышечной массы и здоровья: преимущество сыворотки. J Food Sci. 2015; 80 (Приложение 1): A8 – A15.
CAS Статья Google ученый
Ким И.Ю., Парк С., Смитс ЕТГК, Шутцлер С., Азхар Г., Вей Дж.Й., Феррандо А.А., Вулф Р.Р.Потребление специально разработанной смеси незаменимых аминокислот способствует увеличению общего количества белка в организме в большей степени, чем полноценная замена еды у пожилых женщин с сердечной недостаточностью. Питательные вещества. 2019; 11 (6): 1360.
CAS Статья Google ученый
Borsheim E, Bui QU, Tissier S, Kobayashi H, Ferrando AA, Wolfe RR. Влияние добавок аминокислот на мышечную массу, силу и физические функции у пожилых людей.Clin Nutr. 2008. 27 (2): 189–95.
CAS Статья Google ученый
Бухари С.С., Филлипс Б.Э., Уилкинсон Д.Д., Лимб М.С., Рэнкин Д., Митчелл В.К., Кобаяши Н., Гринхафф П.Л., Смит К., Атертон П.Дж. Прием низких доз незаменимых аминокислот, богатых лейцином, стимулирует мышечный анаболизм аналогично болюсному сывороточному белку у пожилых женщин в состоянии покоя и после тренировки. Am J Physiol Endocrinol Metab. 2015; 308 (12): E1056–65.
Артикул Google ученый
Norton LE, Обычный специалист DK, Бунпо П., Энтони Т.Г., Брана Д.В., Гарлик П.Дж. Содержание лейцина в полноценной пище определяет пиковую активацию, но не продолжительность синтеза белка скелетных мышц и цель млекопитающих передачи сигналов рапамицина у крыс. J Nutr. 2009. 139 (6): 1103–9.
CAS Статья Google ученый
Деврис М.С., МакГлори К., Больстер Д.Р., Камил А., Ран М., Харкнесс Л., Бейкер С.К., Филлипс С.М. Лейцин, а не общий белок, содержание в добавке является основным фактором, определяющим анаболические реакции мышечного белка у здоровых пожилых женщин.J Nutr. 2018; 148 (7): 1088–95.
PubMed Google ученый
Deutz NE, Safar A, Schutzler S, Memelink R, Ferrando A, Spencer H, van Hevoort A, Wolfe RR. Синтез мышечного белка у онкологических больных можно стимулировать с помощью специальной лечебной пищи. Clin Nutr. 2011. 30 (6): 759–68.
CAS Статья Google ученый
van Loon LJ. Лейцин как фармаконутриент для здоровья и болезней.Curr Opin Clin Nutr Metab Care. 2012; 15 (1): 71–7.
Артикул Google ученый
Katsanos CS, Kobayashi H, Sheffield-Moore M, Aarsland A, Wolfe RR. Старение связано с уменьшением накопления мышечных белков после приема небольшого количества незаменимых аминокислот. Am J Clin Nutr. 2005. 82 (5): 1065–73.
CAS Статья Google ученый
Sa A, Gray SJ, Menden E. Кинетика абсорбции аминокислот и изменение состава плазмы свободных аминокислот после кишечной перфузии смесей аминокислот. Am J Clin Nutr. 1967. 20 (1): 24–33.
Артикул Google ученый
West DW, Burd NA, Coffey VG, Baker SK, Burke LM, Hawley JA, Moore DR, Stellingwerff T, Phillips SM. Быстрая аминоацидемия усиливает синтез миофибриллярного белка и анаболические внутримышечные сигнальные реакции после упражнений с отягощениями.Am J Clin Nutr. 2011; 94 (3): 795–803.
CAS Статья Google ученый
Heger J. Соотношения незаменимых и заменимых аминокислот. JPF D’Mello, редактор. Аминокислоты в питании животных, 2-е изд. Pt 1, pp 103–124. CABI Publishing; 2003.
Borsheim E, Tipton KD, Wolf SE, Wolfe RR. Восстановление незаменимых аминокислот и мышечного белка после упражнений с отягощениями. Am J Physiol Endocrinol Metab. 2002. 283 (4): E648–57.
CAS Статья Google ученый
Hegsted DM. Оценка потребности в азоте. Am J Clin Nutr. 1978. 31 (9): 1669–77.
CAS Статья Google ученый
Ferrando AA, Williams BD, Stuart CA, Lane HW, Wolfe RR. Оральные аминокислоты с разветвленной цепью уменьшают протеолиз всего тела. J Parenter Enter Nutr. 1995. 19 (1): 47–54.
CAS Статья Google ученый
Louard RJ, Barrett EJ, Гельфанд RA. Влияние введенных аминокислот с разветвленной цепью на метаболизм аминокислот в мышцах и в организме человека. Clin Sci (Лондон). 1990. 79 (5): 457–66.
CAS Статья Google ученый
Луар Р.Дж., Барретт Э.Дж., Гельфанд Р.А. Ночная инфузия аминокислот с разветвленной цепью вызывает стойкое подавление протеолиза мышц. Обмен веществ. 1995. 44 (4): 424–9.
CAS Статья Google ученый
Ким И.Ю., Deutz NEP, Wolfe RR. Обновленная информация о максимальном анаболическом ответе на диетический белок [обзор]. Clin Nutr. 2018; 37 (2): 411–8.
CAS Статья Google ученый
Вулф Р.Р., Парк С., Ким И.Ю., Моуган П.Дж., Феррандо А.А. Достижения в методологии индикаторов стабильных изотопов, часть 2: новые мысли о «старом» методе измерения синтеза и распада белка всего тела в сытом состоянии. J Investig Med. 2019. https://doi.org/10.1136 / jin-2019-001108 (EPUB перед печатью).
Amazon.com: Healthy ‘n Fit Anabolic Amino 10000 180t, Бутылка: Health & Household
Часто задаваемые вопросы (FAQ)
В: В чем разница между белком из пищевых продуктов, протеиновыми порошками и ANABOLIC AMINO 10,000?
A: Давайте подумаем о белке как о заборе из цепных звеньев, а звенья в заборе представляют собой аминокислоты.Ваше тело не может использовать сетчатый забор (или белок) в его нынешнем виде; он должен разбить этот забор из звеньев цепи или белок на отдельные звенья, звенья из двух и трех, а некоторые из них — с множеством звеньев (но намного меньше, чем забор из звеньев цепи в целом). Организму нужен не весь забор (целая молекула белка), а отдельные звенья ограждения (аминокислоты). Эти единичные связи (аминокислоты в свободной форме), связи из двух и трех (аминокислоты с ди- и трипептидными связями) и более крупные множественные связи (полипептидные аминокислоты) теперь находятся в той форме, которую ваше тело может использовать для поддержания, восстановления и рост мышц, и для многих различных частей вашего тела, кожи, волос, органов и так далее.
В: Как другие продукты с аминокислотами сравниваются с ANABOLIC AMINO 10,000?
О: Многие другие «амино» продукты на самом деле представляют собой протеиновые таблетки с небольшим содержанием аминокислот или без них. Некоторые даже содержат желатин или соевый белок низкого качества. Просто посмотрите на этикетку большинства других продуктов. Вот список некоторых ингредиентов, которые вы можете увидеть в ДРУГИХ «амино» продуктах, которые могут указывать на то, что продукт не идеален:
Гидролизованный желатин — расщепляется на аминокислоты, но желатин не содержит достаточного количества всех незаменимых аминокислот, необходимых организму, и поэтому является неполным.
Сывороточный протеин (концентрат или изолят) — не расщеплен из белка на аминокислоты и представляет собой просто порошок сывороточного протеина, спрессованный в таблетки.
Соевый белок (или гидролизованный соевый белок) — может расщепляться или не расщепляться на аминокислоты, но его аминокислотный профиль не так благоприятен, как сыворотка или яйца, которые используются для производства Anabolic Amino 10,000.
Компании, которые производят эти продукты, больше сосредотачиваются на маркетинге для продажи своей продукции и своей прибыли, а не на наиболее эффективных рецептурах.Ни один другой продукт не имеет более высоких оценок во всех тестах качества белков / аминокислот, а именно NPU, Chemical Score, PER, BV и PCDAAS, чем ANABOLIC AMINO 10,000, являющийся самым качественным и наиболее эффективным аминокислотным продуктом из существующих.
В: Что вы можете рассказать мне о компании, производящей Anabolic Amino 10,000, потому что история компании и эффективность продукта могут идти рука об руку?
О: То, чего достигла компания, является синонимом качества рецептур ее продуктов и их эффективности.Посмотрите на компанию, у которой вы покупаете или думаете о покупке, и посмотрите, какие настоящие технологии (а не маркетинговая шумиха или фасад платной поддержки бодибилдеров) они привнесли в индустрию.
ПЯТЬ ДЕСЯТИЛЕТИЙ. . . HEALTHY ‘N FIT — признанный лидер в области действительно эффективных передовых технологий питания. Некоторые из крупнейших компаний индустрии пищевых добавок, врачи, химики и министерства здравоохранения консультировались и использовали услуги HEALTHY ‘N FIT.В HEALTHY ‘N FIT вы не найдете никакой маркетинговой шумихи, псевдонауки или псевдонауки, а также фасадов оплачиваемых одурманиваемых бодибилдеров, которые можно найти в других брендах. Вы найдете команду исследований и разработок HEALTHY ‘N FIT, которая объединяет почти 100 лет знаний и опыта в области диетологии, физиологии, фармакокинетики и физиологии упражнений, разрабатывает революционные инновации и действительно эффективные передовые технологии питания, что приравнивается к созданию рецептур продуктов. ЭФФЕКТИВНЕЕ, ЧЕМ ЛЮБОЙ ДРУГОЙ БРЕНД, дающий МАКСИМАЛЬНЫЕ РЕЗУЛЬТАТЫ.Anabolic Amino 10,000 отражает эту историю достижений и успеха. HEALTHY ‘N FIT разработала и внедрила более эффективные передовые технологии питания, чем любой другой бренд, в более чем дюжине категорий продуктов. Изучая нашу историю достижений и успехов и становясь свидетелем МАКСИМАЛЬНЫХ РЕЗУЛЬТАТОВ наших формул продуктов, вы обнаружите, как HEALTHY ‘N FIT изменил курс индустрии спортивного питания. СПАСИБО за наш успех.
Аминокислоты наращивают мышцы?
Начнем с основ.Самую распространенную добавку для наращивания мышечной массы можно найти прямо в холодильнике. Это называется протеином.
Когда вы едите белок, ваше тело расщепляет белок на аминокислоты. Затем эти аминокислоты используются для восстановления и роста новых мышечных волокон. Когда вы потребляете достаточное количество белка, ваше тело будет испытывать то, что называется положительным балансом азота.
Баланс азота — это показатель метаболизма белков. Это может показаться сложным, но это просто означает, что если потребление азота в ваше тело больше, чем потеря азота из вашего тела, общий запас белка в организме увеличивается.Этот положительный баланс сигнализирует вашему телу о переходе в анаболическое состояние, или состояние наращивания мышц.
Есть одна интересная деталь: периоды роста у детей, гипотиреоз, восстановление тканей и беременность также связаны с положительным балансом азота.
Люди, у которых нет доступа к достаточному количеству белка, могут испытывать атрофию мышц и истощение мышц. Рекомендуемая в США суточная норма белка составляет 0,36 грамма на фунт. Вы, наверное, слышали сообщения о том, что американцы едят намного больше белка, чем требуется.Но, как отметила в статье моя коллега по быстрому и грязному разбору, дива по питанию, это не совсем так.
Большинство американцев не тренируют мышцы под штангой регулярно. Но для активного человека, который тренируется, достаточно примерно 0,45 грамма белка на фунт массы тела.
Но прежде чем большее число, которое я только что назвал, заставит вас подумать, что чем больше белка, тем лучше, имейте в виду, что многие исследования показали, что потребление белка выше единицы.2 грамма на фунт веса тела не дали никаких дополнительных преимуществ для наращивания мышечной массы. Фактически, в крайних случаях избыточное потребление белка может увеличить риск обезвоживания и повреждения почек.
Итак, да, нам нужно потреблять достаточное количество белка для наращивания мышечной массы, но не переусердствуйте. Исследователи недавно измерили влияние белка на синтез мышц, скармливая людей стейками, а затем измерили скорость, с которой их тела наращивали новую мышечную ткань после еды. Они обнаружили, что после употребления говядины синтез мышц увеличился на 50%.Но 4 унции говядины работали так же хорошо, как 12 унций.
»Продолжить чтение« Увеличивают ли мышцы мышцы с помощью аминокислот? » на QuickAndDirtyTips.com
Recovery Charge — Anabolic Amino Acid Complex
by Dr. Jason Barker 22 января 2021 г.
Recovery Charge — одна из наших захватывающих новых формул, которая обеспечивает полный спектр аминокислот, которые специфичны для синтеза мышечного белка (роста мышц).
Способность улучшать здоровье мышц зависит от нескольких выбранных аминокислот. В то время как диетический белок должен играть ведущую роль в обеспечении этими аминокислотами, добавки с ними в научно исследованных соотношениях помогут в этом вопросе, значительно улучшив способность вашего тела восстанавливать, наращивать и поддерживать драгоценную мышечную массу.
Идеально подходит для поддержки функции и силы мышц или для помощи в поддержании мышечной массы, Recovery Charge был создан как простая в использовании добавка, разработанная для периода после тренировки, когда процесс восстановления мышц достигает пика.
Лучшее применение для восстановления:
- Поддерживает восстановление мышц после упражнений
- Поддерживает рост и развитие мышц
- Поддерживает наращивание мышечной массы у спортсменов всех возрастов.
Как работает Recovery Charge:
В этом продукте используется особый набор аминокислот для синтеза мышечного белка.
Проще говоря, аминокислоты — это строительные блоки белков. Более 20 исследований, проведенных на людях, продемонстрировали, что данная запатентованная (1) комбинация оказывает мощный анаболический (ростовой) эффект на мышцы, предоставляя определенные аминокислоты в определенной комбинации.
Другими словами, такое расположение аминокислот обеспечивает их идеальное соотношение, чтобы поддерживать здоровую мышечную массу.
Если ваша цель — предотвратить потерю мышечной массы, связанную с бездействием или старением, или вы хотите поддержать существующую мышечную силу и функцию, Recovery Charge предоставит вам правильные аминокислоты в наиболее эффективной синергетической комбинации, чтобы вы могли достичь своих целей в отношении здоровья. .
Диета всегда является основой здоровья и работоспособности.Но если нужные питательные вещества недоступны для вас немедленно (неполная диета, недоступность из-за поездок и т. Д.), Заряд восстановления может помочь вам не сбиться с пути.
И, если вы хорошо питаетесь и имеете все необходимые источники белка, эта добавка обеспечит страховку питания, чтобы вы могли сохранить эту с трудом заработанную мышечную массу!
Закажите сегодня и ощутите преимущества этого полностью натурального порошка для восстановления мышц.
1. Защищено патентом США 9,364,463
Комментарии будут одобрены перед появлением.
Лейцин — самая большая анаболическая аминокислота, необходимая для набора мышечной массы
Мы все слышали о том, что нашему организму необходимы 9 незаменимых аминокислот для оптимального выполнения функций восстановления и восстановления. Однако возникает вопрос, какая из этих 9 аминокислот наиболее важна для развития мышц и почему?
© Thinkstock / Getty Images
Что касается развития мышц, лейцин, изолейцин и валин являются 3 ключевыми незаменимыми аминокислотами, широко известными как разветвленные аминокислоты, также известные как BCAA.Как следует из названия, эти аминокислоты находятся в виде структур с разветвленной цепью и являются неотъемлемой частью пула аминокислот в организме. Однако лейцин — самая анаболическая аминокислота из трех.
Что делает лейцин таким сильнодействующим?
© Thinkstock / Getty Images
Согласно нескольким исследованиям, лейцин — самая эффективная и мощная аминокислота, которая запускает синтез белка (когда клетки начинают производить свои соответствующие белки) для скелетных мышц.Именно благодаря концентрации лейцина мишень рапамицина у млекопитающих или mTOR (датчик аминокислот и регулятор синтеза белка, присутствующий в организме) активируется и дополнительно поддерживает анаболизм, который приводит к росту мышц.
Десять интересных фактов о лейцине:
© Thinkstock / Getty Images
1. Чтобы включить синтез белка, нам необходимо как минимум 3 г лейцина в нашем рационе.
2. Доказано, что прием 3 г лейцина перед тренировкой, после тренировки и перед сном обеспечивает оптимальную гипертрофию мышц.
3. Людям, соблюдающим диету с дефицитом калорий, лейцин может помочь предотвратить эффект катаболизма (разрушение мышц).
4. Лейцин также известен тем, что регулирует уровень сахара в крови, обеспечивает энергией мышечные клетки и поддерживает функцию мозга.
5. Лейцин играет важнейшую роль в создании анаболической среды в организме, поэтому он является любимой добавкой атлетов.
6. Согласно исследованию, концентрация лейцина также поддерживает функцию инсулина, другого жизненно важного анаболического гормона человеческого организма.
7. Поскольку лейцин поддерживает развитие мышц, он одновременно увеличивает базальную скорость метаболизма в организме, поэтому мы можем сказать, что он также способствует потере жира
8. При диете с высоким содержанием белка нам потребуются добавки лейцина для создания идеальной анаболической среды в организме.
9. В качестве добавки в свободной форме лейцин всасывается в кровоток намного быстрее, чем любая другая форма аминокислот.
10. В добавках BCAA содержание лейцина должно быть как минимум в соотношении 2: 1: 1. Любое соотношение выше, чем это, на самом деле бесполезно.
Неудивительно, что лейцин является самой анаболической аминокислотой из всех и поэтому может считаться королем аминокислот.
Рахит Дуа — продвинутый тренер по фитнесу с сертификатом K11 для общего и особого населения (люди с проблемами здоровья, пожилые люди, беременные женщины и дети) и сертифицированный спортивный диетолог.Вы можете связаться с ним здесь.
Опасности для здоровья BCAA в протеиновых добавках
Добавки с аминокислотами с разветвленной цепью (BCAA) часто используются фанатиками легкой атлетики и фитнеса для увеличения мышечной массы и повышения производительности.
Изображение предоставлено: Ник Старченко / Shutterstock.com
Однако исследования показывают, что чрезмерное потребление добавок может представлять опасность для здоровья.
Что такое BCAA?
Белки пищевого происхождения расщепляются во время пищеварения, высвобождая аминокислоты, которые затем используются организмом для создания белков, необходимых органам, тканям и клеткам организма.
Организм может кодировать 20 различных типов аминокислот. Однако некоторые аминокислоты считаются незаменимыми, поэтому они не могут быть синтезированы организмом в достаточно больших количествах. Поэтому их необходимо употреблять в рамках сбалансированной диеты. Незаменимые аминокислоты вырабатываются организмом.
Существует девять типов незаменимых аминокислот: фенилаланин, гистидин, треонин, изолейцин, лейцин, триптофан, лизин, валин и метионин.
Из девяти незаменимых аминокислот лейцин, валин и изолейцин относятся к аминокислотам с разветвленной цепью.Как правило, все три BCAA действуют как субстрат для производства белка и энергии.
Лейцин играет дополнительную роль в качестве регулятора межклеточной передачи сигналов для механизмов производства белка. Обычно BCAA содержатся в продуктах, богатых белками, таких как яйца, рыба, красное мясо, молочные продукты и курица, а также в соевых белках, орехах и чечевице.
Исследования показали, что, поскольку производство белка является непрерывным, необходимо восполнить потерянный белок. Эта потребность в постоянном потреблении белка увеличила популярность добавок BCAA.
Например, включение добавок BCAA в диеты бодибилдеров, спортсменов и посетителей тренажерного зала увеличилось благодаря их предполагаемым преимуществам для наращивания мышечной массы и способности повышать производительность.
Опасности для здоровья протеиновых добавок BCAA
Несмотря на предполагаемую пользу для роста мышц, исследования показали, что протеиновые добавки BCAA могут вызывать неблагоприятные последствия для здоровья, если их принимать в избытке.
Исследователи использовали модель на мышах, чтобы исследовать эффекты потребления BCAA, а также других незаменимых аминокислот.
Мышей разделили на четыре основных условия: те, кто должен был потреблять стандартное количество BCAA; те, которые потребляют вдвое больше рекомендуемого количества; те, которые потребляют половину стандартной суммы; и тем, кто потребляет 20% от рекомендованного количества в течение своей жизни.
Исследователи обнаружили, что в целом потребление добавок BCAA привело к увеличению уровня аминокислот с разветвленной цепью в крови. Это привело к тому, что BCAA конкурировали с триптофаном за транспортировку мозга.Когда обе аминокислоты попадают в мозг, они вызывают разные эффекты. Триптофан считается одним из немногих предшественников серотонина, гормона, который, помимо прочего, улучшает настроение и помогает спать.
В случаях повышения уровня BCAA в крови, BCAA занимает положение триптофана в головном мозге, что приводит к снижению синтеза серотонина и ухудшению настроения.
Помимо роли серотонина в улучшении настроения, он также играет роль в регуляции аппетита.В ходе исследования из-за более низкого уровня серотонина и избытка BCAA исследователи отметили, что мыши, потреблявшие вдвое большую дозу BCAA, переедали и страдали ожирением, сокращая продолжительность их жизни.
BCAA и сердечно-сосудистые заболевания
Помимо воздействия на настроение, избыточное потребление добавок BCAA может быть связано с повышенной восприимчивостью к сердечно-сосудистым заболеваниям.
Исследования показали, что метаболизм аминокислот потенциально участвует в развитии сердечных заболеваний.Например, было обнаружено, что у людей с проблемами сердца повышена концентрация BCAA.
BCAA и диабет
Аналогично сердечно-сосудистым заболеваниям высокий уровень BCAA коррелирует с началом диабета 2 типа. В настоящее время неясно, являются ли повышенные уровни BCAA чисто маркерами заболевания, или их увеличение является следствием потери инсулина, или повышенные уровни BCAA ответственны за инсулинорезистентность.
Добавки BCAA увеличивают мышечную массу?
Существуют противоречивые данные об эффективности добавок BCAA для увеличения мышечной массы у тех, кто их употребляет.
Исследования, изучающие такие эффекты между теми, кто принимал добавки BCAA и плацебо, показали, что те, кто принимал добавку, сообщили об увеличении энергетического обмена и снижении уровней веществ, связанных с повреждением мышц.
Однако другие исследователи предположили, что нет единого мнения относительно эффектов BCAA в качестве пищевой добавки.
Несмотря на разногласия в научной литературе, указывается, что потенциальное чрезмерное потребление BCAA может представлять опасность для здоровья.Однако необходимы дополнительные исследования для дальнейшего изучения влияния как типичного, так и чрезмерного потребления.
Источники
- Вулф Р. Р. (2017). Аминокислоты с разветвленной цепью и синтез мышечного белка у человека: миф или реальность? Журнал Международного общества спортивного питания. DOI: 10.1186 / s12970-017-0184-9
- Солон-Биет, С. М., Коггер, В. К.,… Симпсон, С. Дж. (2019). Аминокислоты с разветвленной цепью косвенно влияют на здоровье и продолжительность жизни через аминокислотный баланс и контроль аппетита. Природа метаболизма. DOI: https://doi.org/10.1038/s42255-019-0059-2
- Холечек, М. (2018). Аминокислоты с разветвленной цепью для здоровья и болезней: метаболизм, изменения в плазме крови и в качестве пищевых добавок. DOI: https://doi.org/10.1186/s12986-018-0271-1
- Бифари Ф.



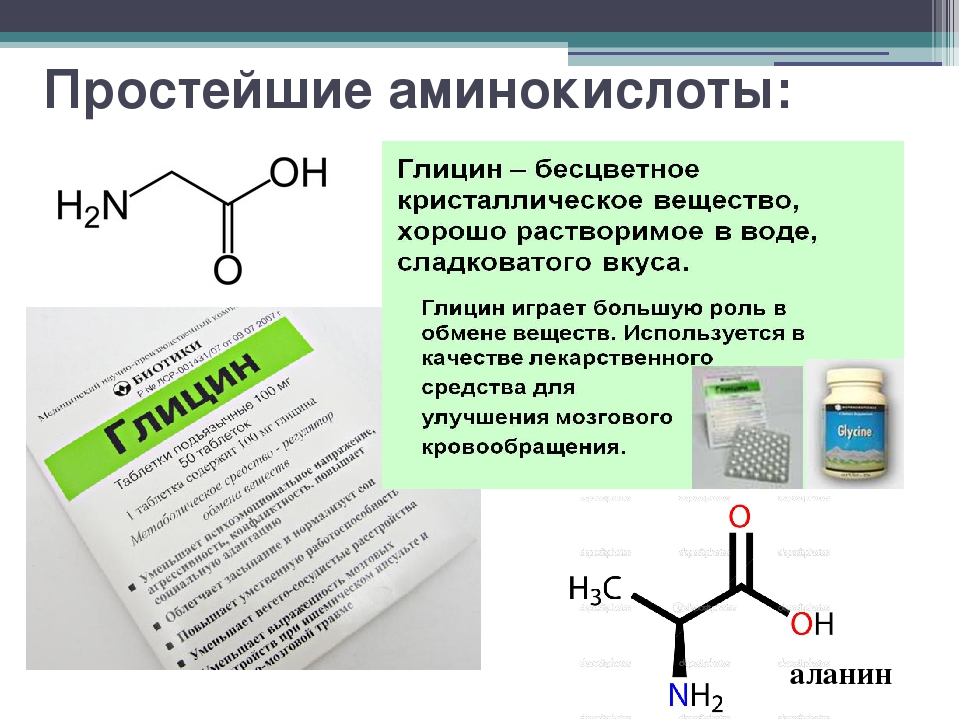 Аспартаты усиливают этот процесс.
Аспартаты усиливают этот процесс.