Чем нас лечат: Мексидол и другие антиоксиданты
Всего PubMed выдает восемь статей по названию вещества и упоминанию плацебо-контролируемого исследования. В абстракте этих статей даже не указано количество пациентов, а их полный текст недоступен.
Indicator.Ru выяснил: доказательств мало, и они невысокого качества
Как бы нам этого ни хотелось, никто не смог доказать, что ежедневные передозировки антиоксидантов спасают от рака, старения и болезней. Витамины A, C, E, зеленый чай, ликопин, антоцианы, селен и прочие популярные вещества поодиночке и в разных сочетаниях, которые относят к этой группе, полезны и нужны только в разумных количествах. Ударные дозы вовсе не приносят здоровья и вечной молодости, напротив, они могут лишь повысить риск расстроить некоторые химические реакции, происходящие в каждой клеточке вашего тела, так что энтузиазм ученых по поводу антиоксидантов сильно преувеличен (что выгодно их многочисленным производителям).
Общая судьба антиоксидантов постигла и Мексидол, который оказался очередным препаратом, продаваемым практически только в России. Исследование его эффективности при лечении ишемического инсульта, которое соответствовало бы международным критериям и снижало бы риск предубеждений должно было быть завершено 31 мая 2016 года, но найти публикацию нельзя до сих пор. Да и проводилось исследование на выборке всего лишь в 200 человек. Это вряд ли можно назвать лучшей стратегией позиционирования для препарата, который в прошлом году отметил 20-летие применения в клинической практике, о чем гордо сообщается на сайте.
Сказать что-либо определенное о его действии против инфаркта, инсульта, глаукомы и других болезней без более четких и достоверных результатов нельзя. Если есть альтернативный препарат с лучшей доказательной базой, лучше воспользоваться им.
Наши рекомендации нельзя приравнивать к назначению врача. Перед тем, как начать принимать тот или иной препарат, обязательно посоветуйтесь со специалистом.
Подписывайтесь на Indicator.Ru в соцсетях: Facebook, ВКонтакте, Twitter, Telegram.
Антиоксидантный препарат Гистохром в офтальмологической практике
Реферативный обзор.
Куренков Вячеслав Владимирович, Жемчугова Алена Владиславна
Antioxidant Histochrom in the treatment of ophthalmic diseases.
Review
Kurenkov Vyacheslav Vladimirovich, Zhemchugova Alena Vladislavna
Отечественный препарат Гистохром, разработанный в Тихоокеанском институте биоорганической химии РАН, относится к группе антиоксидантов. Антиоксиданты – большая группа биологически активных соединений, широко распространенных в природе. Спектр биологического защитного действия антиоксидантов весьма разнообразен и обусловлен, в основном, их способностью нейтрализовать негативное действие свободных радикалов. К числу наиболее известных антиоксидантов относятся токоферолы (витамин Е), каротиноиды (витамин А), аскорбиновая кислота (витамин С). Мощным антиоксидантным действием обладают также природные соединения растительного происхождения, объединенные под общим названием флавоноиды.
Основные представления о свободнорадикальных процессах в организме были сформулированы академиком Н.М. Эмануэлем в 70-80 годах прошлого столетия. Перекисное окисление липидов представляет собой цепь реакций, включающих инициирование, распространение и обрыв цепи окисления с образованием свободных радикалов токсичных интермедиатов – альдегидов, кетонов и других. Большое значение в этом процессе придается ион-радикалу кислорода и ионам железа, инициирующим перекисное окисление липидов. Интенсивность реакций перекисного окисления липидов в организме регулируется антиоксидантами.
При взаимодействии свободных радикалов (супероксид, перекись водорода, синглетный кислород) с липидами образуются липоперекиси, которые вызывают окислительное повреждение клеточных мембран. Антиоксиданты защищают организм от негативного действия свободных радикалов и продуктов перекисного окисления липидов. Установлено, что снижение количества антиоксидантов в организме человека ускоряет старение, способствует воспалению, ухудшает метаболические процессы, увеличивает ишемические проявления. Обоснованность применения и патогенетическая направленность антиоксидантов определена только в последние годы. Перекисная концепция патогенеза и антиоксидантная терапия различных заболеваний представлена в многочисленных публикациях. Поиск новых, биологически активных антиоксидантов, изучение их структуры и механизма действия на сегодняшний день очень актуален.
Антиоксиданты защищают организм от негативного действия свободных радикалов и продуктов перекисного окисления липидов. Установлено, что снижение количества антиоксидантов в организме человека ускоряет старение, способствует воспалению, ухудшает метаболические процессы, увеличивает ишемические проявления. Обоснованность применения и патогенетическая направленность антиоксидантов определена только в последние годы. Перекисная концепция патогенеза и антиоксидантная терапия различных заболеваний представлена в многочисленных публикациях. Поиск новых, биологически активных антиоксидантов, изучение их структуры и механизма действия на сегодняшний день очень актуален.
В основе многих патологических процессов в глазу также лежит увеличение числа свободных радикалов и появление продуктов перекисного окисления липидов. В офтальмологии в качестве ингибиторов свободнорадикальных процессов широко применяются такие антиоксиданты, как эмоксипин, токоферола ацетат, витамин С, А, дицинон и другие. Однако эффективность их при некоторых состояниях недостаточна.
Тихоокеанским институтом биоорганической химии Дальневосточного отделения РАН был разработан новый природный антиоксидант из группы полигидроксинафтахинонов — Гистохром (регистрационный номер 002363/02-2003).
Гистохром — водорастворимый препарат эхинохрома. Эхинохром (2, 3, 5, 6, 8-пентагидрокси-7-этил-1,4-нафтохинон) — это хиноидный пигмент морских беспозвоночных, относящихся к типу иглокожих, выделенный из их панцирей и игл. Установлена высокая антиоксидантная активность эхинохрома. В отличие от других антиоксидантов он уменьшает накопление в ишемизированной мышечной ткани токсических пероксидов, стабилизирует мембраны эритроцитов, обладает антиагрегантными свойствами, снижает уровень холестерина в крови и проявляет антимикробное и противовирусное действие.
По данным биохимических исследований, Гистохром выполняет роль перехватчика свободных радикалов, возникающих при перекисном окислении мембранных липидов и повреждающих ткани, а также роль хелатора свободных катионов железа.
Анализ опубликованных клинических данных по применению Гистохрома при офтальмологических заболеваниях показал его высокую эффективность и практически отсутствие аллергических и системных побочных реакций. Локальное побочное действие препарата может проявиться в виде легкой гиперемии в зоне инъекции и светло-коричневом окрашивании конъюнктивы, которые исчезают через 2-3 дня. Некоторые пациенты отмечали легкую, быстропроходящую болезненность в глазу.
Клинические исследования препарата Гистохром, проведенные на кафедре глазных болезней лечебного факультета РГМУ им. Н.И. Пирогова под руководством профессора Е.А. Егорова, выявили зависимость клинического эффекта препарата от локализации, давности и массивности кровоизлияний. Под наблюдением находились 92 человека (98 глаз) в возрасте от 16 до 85 лет с различными нозологическими формами: гемофтальмами, тромбозами центральной вены сетчатки и ее ветвей, преретинальными кровоизлияниями, центральной дегенерацией сетчатки, гифемами и дистрофиями роговицы. Повышение остроты зрения при рассасывании небольших кровоизлияний в передних отделах стекловидного тела отмечалось в 73,6% случаев. Кровоизлияния давностью несколько дней рассасывались полностью или частично с повышением остроты зрения в 64,7% случаев, при этом процесс резорбции и повышение остроты зрения отмечались к концу курса лечения. При кровоизлиянии в сетчатку давностью 5-7 дней на фоне тромбоза центральной вены сетчатки, а также гипертонической ангиоретинопатии отмечалось повышение остроты зрения до 1,0 в 27,8% (5 глаз) случаев, на 0,5 в 38,9% (7 глаз).
При лечении гифем препаратом Гистохром практически у всех больных отмечалась положительная динамика: быстрое уменьшение имбибирования кровью ткани радужки, задней поверхности роговицы. В 2 (15,3%) случаях наблюдалось полное рассасывание тотальной гифемы после двух инъекций, в 10 (77%) — после 3-5 инъекций. В одном случае отмечалась организация сгустка крови. По данным электроретинографии, Гистохром обладает выраженными ретинопротекторными свойствами. Препарат улучшает показатели электрофизиологических исследований при дегенеративных процессах сетчатки и зрительного нерва. У большинства больных с центральной дегенерацией сетчатки отмечалось разной степени повышение остроты зрения. Все больные с дистрофическими заболеваниями роговицы субъективно отмечали субъективное улучшение, уменьшение болевого синдрома. Объективно наблюдалось уменьшение отека, эпителизация дефектов, в 60% случаев — повышение остроты зрения.
Положительное действие Гистохрома отмечено в целом в 92,8% случаев. Препарат был эффективен при пролиферативных процессах, дегенерациях и гемофтальмах различного генеза. Обнаруженное геморезорбционное, ретинопротекторное и антиоксидантное действие позволило авторам рекомендовать препарат Гистохром к широкому использованию в офтальмологической практике при заболеваниях, связанных с нарушением обменных процессов сетчатки, сосудистой оболочки и роговицы, для улучшения трофики тканей глаза, уменьшения отека и ускорения эпителизации.
Исследования препарата Гистохром, проведенные в НИИ глазных болезней РАМН под руководством профессора Г.С. Полунин на 75 пациентах с гипертонической и диабетической ангиоретинопатией, осложненной кровоизлиянием в стекловидное тело и сетчатую оболочку глаза, показали наибольшую терапевтическую эффективность Гистохрома при небольших кровоизлияниях (общий индекс 1-2) в передних отделах стекловидного тела. Острота зрения с коррекцией в этих случаях повысилась в среднем с 0,10±0,03 до 0,64±0,02 (р < 0,001) уже через один месяц после начала лечения. При ультразвуковом исследовании отмечалось уменьшение помутнений вплоть до полной акустической прозрачности стекловидного тела. В контрольной группе резорбция гемофтальма в течение первого месяца практически не наблюдалась. При более массивном кровоизлиянии (субтотальном гемофтальме) с общим индексом от 3 до 6 баллов рассасывание гемофтальма и повышение остроты зрения наблюдалось только у 43,3% пациентов в сроки от 1 до 3 месяцев. У больных повторными кровоизлияниями в стекловидное тело и сетчатку при гипертонической болезни и тромбозе центральной вены сетчатки рассасывание гемофтальма и повышение остроты зрения отмечалось только в 21,5% случаев. При этом резорбция кровоизлияний в стекловидном теле протекала более активно чем при ретинальных геморрагиях. Низкая острота зрения отчасти объяснялась экссудативными и пролиферативными изменениями сетчатой оболочки при сахарном диабете, посттромботической ретинопатией при гипертонической болезни и сахарном диабете. Терапевтический эффект Гистохрома еще в большей степени зависел от давности кровоизлияний и наличия пролиферативных процессов в стекловидном теле. Кровоизлияния сроком в несколько дней рассасывались полностью или частично с повышением остроты зрения в 51,3% случаев, при этом процесс резорбции и повышение остроты зрения отмечались через 3-5 дней или к концу курса лечения. Однако среди больных с повторными кровоизлияниями на фоне пролиферативной диабетической ретинопатии при наличии швартообразования в стекловидном теле или тракционной отслойки сетчатки резорбция кровоизлияний отмечалась лишь в 12,7% случаев, а лизиса или уменьшения швартообразования не наблюдалось ни в одном случае.
Острота зрения с коррекцией в этих случаях повысилась в среднем с 0,10±0,03 до 0,64±0,02 (р < 0,001) уже через один месяц после начала лечения. При ультразвуковом исследовании отмечалось уменьшение помутнений вплоть до полной акустической прозрачности стекловидного тела. В контрольной группе резорбция гемофтальма в течение первого месяца практически не наблюдалась. При более массивном кровоизлиянии (субтотальном гемофтальме) с общим индексом от 3 до 6 баллов рассасывание гемофтальма и повышение остроты зрения наблюдалось только у 43,3% пациентов в сроки от 1 до 3 месяцев. У больных повторными кровоизлияниями в стекловидное тело и сетчатку при гипертонической болезни и тромбозе центральной вены сетчатки рассасывание гемофтальма и повышение остроты зрения отмечалось только в 21,5% случаев. При этом резорбция кровоизлияний в стекловидном теле протекала более активно чем при ретинальных геморрагиях. Низкая острота зрения отчасти объяснялась экссудативными и пролиферативными изменениями сетчатой оболочки при сахарном диабете, посттромботической ретинопатией при гипертонической болезни и сахарном диабете. Терапевтический эффект Гистохрома еще в большей степени зависел от давности кровоизлияний и наличия пролиферативных процессов в стекловидном теле. Кровоизлияния сроком в несколько дней рассасывались полностью или частично с повышением остроты зрения в 51,3% случаев, при этом процесс резорбции и повышение остроты зрения отмечались через 3-5 дней или к концу курса лечения. Однако среди больных с повторными кровоизлияниями на фоне пролиферативной диабетической ретинопатии при наличии швартообразования в стекловидном теле или тракционной отслойки сетчатки резорбция кровоизлияний отмечалась лишь в 12,7% случаев, а лизиса или уменьшения швартообразования не наблюдалось ни в одном случае.
Антиоксидантные свойства препарата способствовали улучшению функций зрительного нерва и сетчатки у больных с непролиферативной формой диабетической ретинопатии, у которых после лечения Гистохромом отмечалось повышение остроты зрения на 0,05-0,25 (в среднем 0,09±0,03). Авторы делают вывод, что Гистохром является эффективным средством для резорбции гемофтальмов, особенно при свежих кровоизлияниях. При наличии пролиферативных процессов в стекловидном теле и сетчатке Гистохром можно использовать в качестве вспомогательного средства. Препарат позволяет расширить возможности медикаментозного лечения диабетической и гипертонической ангиопатии, дистрофических процессов сетчатки.
Авторы делают вывод, что Гистохром является эффективным средством для резорбции гемофтальмов, особенно при свежих кровоизлияниях. При наличии пролиферативных процессов в стекловидном теле и сетчатке Гистохром можно использовать в качестве вспомогательного средства. Препарат позволяет расширить возможности медикаментозного лечения диабетической и гипертонической ангиопатии, дистрофических процессов сетчатки.
Терапевтическая эффективность Гистохрома была изучена в Отделении инфекционных и аллергических заболеваний глаз МНИИ глазных болезней им. Гельмгольца (руководитель профессор Ю.Ф. Майчук). Сравнительный анализ результатов лечения 226 больных с воспалительными и дистрофическими поражениями роговицы показал, что применение Гистохрома (96 больных) повышало эффективность лечения во всех клинических группах: герпесвирусные кератиты и кератоувеиты, бактериальные кератиты (язва роговицы), передние увеиты, послеоперационный отек роговицы, первичная стромальная дистрофия роговицы (решетчатая, макулярная), вторичная буллезная дистрофия, возникшая после роговичной, катарактальной, антиглаукомной и комбинированной хирургии. Авторы заключают, что применение Гистохрома как антиоксидантного препарата патогенетически обосновано при дистрофических поражениях роговицы и при воспалительных заболеваниях глаз, хорошо сочетается со средствами метаболической терапии и препаратами специфического противовирусного и антибактериального лечения.
На кафедре офтальмологии Пензенского института усовершенствования врачей под руководством профессора М.И. Алешаева проведены исследования эффективности Гистохрома на 213 больных с различной глазной патологией: гемофтальм и ретинальные кровоизлияния различной этиологии (44 человека), послеоперационная гифема (12 человек), диабетическая ретинопатия (96 человек), кератиты (28 человек), эндотелиально-эпителиальная дистрофия роговицы (3 человека), послеоперационный отек роговицы (15 человек), тромбоз центральной вены сетчатки (5 человек), дистрофии сетчатки (10 человек). Гистохром применяли в виде парабульбарных или подконъюнктивальных инъекций по 0,5 мл ежедневно или через день, на курс 5-10 инъекций. Кроме этого, у больных с кератитами и дистрофиями роговицы Гистохром использовали в виде капель 0,02% раствора по 1 капле до 4-6 раз в сутки.
Гистохром применяли в виде парабульбарных или подконъюнктивальных инъекций по 0,5 мл ежедневно или через день, на курс 5-10 инъекций. Кроме этого, у больных с кератитами и дистрофиями роговицы Гистохром использовали в виде капель 0,02% раствора по 1 капле до 4-6 раз в сутки.
Наиболее убедительный лечебный эффект Гистохрома был установлен при послеоперационных гифемах. Они полностью рассасывались после 3-4 инъекций. При гемофтальме и ретинальных кровоизлияниях различного происхождения (посттравматические, послеоперационные, послевоспалительные, при миопии, отслойке сетчатки, гипертонической ангиоретинопатии) также отмечался хороший эффект. Более всего он был выражен при посттравматических и послеоперационных, менее при других кровоизлияниях. Недавний и не сочетанный с глубокой патологией глаза гемофтальм рассасывался быстрее и нередко окончательно. Однако во всех случаях гемофтальма отмечалась положительная динамика, иногда значимо видимая после окончания курса лечения Гистохромом. Самая большая группа пролеченных больных была с диабетической ретинопатией (ДР). В нее вошли пациенты с непролиферативной, препролиферативной и пролиферативной ДР. Всего было 96 человек. Все они получали Гистохром под конъюнктиву или парабульбарно в количестве не менее 10 инъекций. Авторами установлено, что при выраженном липоидозе сетчатки отмечалось уменьшение твердых экссудатов и исчезновение мягких. При кровоизлияниях в сетчатку и стекловидное тело наибольшему рассасыванию подвергалась кровь в передних слоях стекловидного тела, меньше в задних и сетчатке. В определенной степени такое влияние на кровоизлияния при ДР может быть связано с парабульбарным способом введения Гистохрома, когда он практически достигает только переднего отрезка глаза. Кроме рассасывающего влияния при ДР, отмечено улучшение некоторых биохимических показателей крови у больных сахарным диабетом (нормализация уровня общего холестерина, триглицеридов и холестерина липопротеидов низкой плотности). Это очень важный аспект, обнаруженный при лечении Гистохромом, который, видимо, объясняет улучшение в состоянии глазного дна у больных с ДР, когда исчезают экссудаты и уменьшаются кровоизлияния на сетчатке. Это свойство нормализовать липидный обмен установлено и другими авторами, которые применили Гистохром при лечении ишемической болезни сердца [Г.Б. Еляков с соавт.].
Это свойство нормализовать липидный обмен установлено и другими авторами, которые применили Гистохром при лечении ишемической болезни сердца [Г.Б. Еляков с соавт.].
Положительные результаты при лечении Гистохромом были также получены при лечении кератитов и ЭЭД роговицы. В этих случаях больные получали Гистохром в виде сочетания капель и подконъюнктивальных инъекций. Менее значимые результаты были получены при лечении дистрофических заболеваний сетчатки. Однако при наблюдении за этой группой больных удавалось отметить определенную стабилизацию процесса. Зрительные функции сохранялись на прежнем уровне, хотя физикально данные глазного дна не имели положительной динамики. Нами отмечен клинический эффект при использовании Гистохрома у больных тромбозом центральной вены сетчатки.
Авторы определили группы заболеваний глаза, при которых показано лечение антиоксидантом Гистохром. Это гифема и гемофтальм различной этиологии; диабетическая ретинопатия; кератиты воспалительного происхождения, после травм и операций; эпителиально-эндотелиальные дистрофии роговицы; дистрофии сетчатки и, особенно, обусловленные атеросклерозом с нарушениями липидного обмена. Гистохром может быть использован локально во многих случаях при лечении как монопрепарат. Полученные результаты свидетельствуют, что антиоксидант Гистохром является достаточно эффективным препаратом, оказывает геморезорбционное действие и улучшает метаболические процессы в сетчатке, сосудистой оболочке и роговице, имеет липотропное свойство. Препарат не имеет побочных действий при своем применении и может быть рекомендован в широкую офтальмологическую практику.
В Центре лазерной офтальмохирургии поликлиники АО “Газпром” Гистохром (В.Д. Антонюк и др.) применяли в комплексном лечении при наиболее серьезных осложнениях операций при катаракте у 9 пациентов с критической исходной плотностью эндотелиальных клеток роговицы, отеком стромы роговицы с переходом в тяжелых случаях в эпителиально-эндотелиальную дистрофию. Показано, что применение природного антиоксиданта Гистохром в комплексе с гемодезом после удаления катаракты значительно сокращает время отека стромы роговицы, уменьшает сроки послеоперационного лечения пациентов.
Показано, что применение природного антиоксиданта Гистохром в комплексе с гемодезом после удаления катаракты значительно сокращает время отека стромы роговицы, уменьшает сроки послеоперационного лечения пациентов.
Эффективность и безопасность применения Гистохрома в педиатрической практике была изучена на большой группе детей профессором Гусевой М.Р. и ее коллегами. В глазных отделениях Морозовской детской клинической больницы и Российской детской клинической больницы Гистохром применяли у 407 детей (449 глаз) в возрасте от одного месяца до 14 лет с травматическими гифемами II–III степени, гемофтальмами, кровоизлияниями на глазном дне, геморрагическими ретиноваскулита-ми, диабетической ретинопатией, увеитами с выраженным экссудативным компонентом и отеком сетчатки, реактивным папиллитом и оптическим невритом, с кровоизлияниями в переднюю камеру после реконструктивных операций с экстракцией катаракты и кровоизлияниями и экссудативными изменениями в заднем отрезке глаза при ретинопатиях недоношенных. Показано, что применение Гистохрома при гемо¬фтальмах различной степени является эффективным методом лечения, особенно через ирригационную систему, значительно сокращает сроки лечения, не оставляет грубой деструкции стекловидного тела и сохраняет функцию сетчатки. Менее выраженный эффект был получен у больных с патологией сетчатки в сочетании с патологией общего и местного характера, что связано с давностью процесса, швартообразованием, деструктивными изменениями в сетчатке. Но и при таких грубых изменениях в структурах глазного яблока с треть¬его дня лечения Гистохромом начинается активное рассасывание кровоизлияний. Особенно хорошие результаты получены при свежих кровоизлияниях в сетчатку. На основании полученных результатов авторами сделаны следующие выводы: 1). 0,02% раствор Гистохрома способствует более активной резорбции крови в структурах глазного яблока при травмах, заболеваниях внутренних оболочек глаза, протекающих с геморрагическим компонентом, у детей разного возраста. 2). Эффективность лечения зависит от сроков начала применения препарата и более высока при его раннем применении и при введении в ретробульбарное пространство через ирригационную систему. 3). Гистохром можно использовать при лечении ретинопатии с выраженным отеком сетчатки и диска зрительного нерва. 4). Применение Гистохрома в комплексном лечении гемофтальмов и кровоизлияний в сетчатку позволяет улучшить функциональные исходы в связи с его ретинопротекторным действием. 5). Применение препарата не вызвало ни в одном случае каких-¬либо осложнений как со стороны глазного яблока, так и со стороны организма пациента в целом. 6). Гистохром рекомендуется к применению в офтальмологической практике для лечения внутриглазных заболеваний различного генеза, ретинопатии с выраженным экссудативным компонентом и увеитов.
2). Эффективность лечения зависит от сроков начала применения препарата и более высока при его раннем применении и при введении в ретробульбарное пространство через ирригационную систему. 3). Гистохром можно использовать при лечении ретинопатии с выраженным отеком сетчатки и диска зрительного нерва. 4). Применение Гистохрома в комплексном лечении гемофтальмов и кровоизлияний в сетчатку позволяет улучшить функциональные исходы в связи с его ретинопротекторным действием. 5). Применение препарата не вызвало ни в одном случае каких-¬либо осложнений как со стороны глазного яблока, так и со стороны организма пациента в целом. 6). Гистохром рекомендуется к применению в офтальмологической практике для лечения внутриглазных заболеваний различного генеза, ретинопатии с выраженным экссудативным компонентом и увеитов.
Информация для врачей
Гистохром выпускается в двух лекарственных формах:
1. «Раствор Гистохрома 1% для инъекций» (для кардиологии) непрозрачная коричнево-черная жидкость, рН от 7,2 до 8,0, легко окисляется кислородом воздуха. Выпускается в ампулах объемом 5 мл.
2. «Раствор Гистохрома 0,02% для инъекций» (для офтальмологии) прозрачная жидкость желто-коричневого цвета, рН от 6,5 до 7,5, легко окисляется кислородом воздуха. Выпускается в ампулах объемом 1 мл.
Фармакологические свойства. Через 12 часов после внутривенного введения Гистохрома его концентрация в плазме крови снижается почти вдвое, а затем длительно держится на одном уровне. Возможно, более быстрая элиминация происходит из крови и хорошо перфузируемых органов, а медленная — из тканей «периферической камеры».
Показания к применению, способ введения и дозы препарата. В офтальмологической практике Гистохром применяют при заболеваниях роговицы для ускорения эпителизации, при заболеваниях сетчатки как ретинопротектор, при пролиферативных процессах, дегенерациях и гемофтальмах различного генеза, а также при контузиях и проникающих ранениях глаза. Применяется 0,02% раствор Гистохрома в виде субконъюктивальных или парабульбарных инъекций в объеме 0,3-0,5 мл. Инъекции проводят ежедневно или через день в зависимости от показаний и клинического течения заболеваний. На курс лечения до 10 инъекций. Повторные курсы в зависимости от показаний. Побочное действие. В зоне инъекции Гистохрома отмечается легкая гиперемия и светло коричневое окрашивание конъюнктивы, которые исчезают через 2-3 дня после окончания инъекций без дополнительного лечения. У отдельных пациентов после инъекции может быть легкая болезненность в области глаза.
Применяется 0,02% раствор Гистохрома в виде субконъюктивальных или парабульбарных инъекций в объеме 0,3-0,5 мл. Инъекции проводят ежедневно или через день в зависимости от показаний и клинического течения заболеваний. На курс лечения до 10 инъекций. Повторные курсы в зависимости от показаний. Побочное действие. В зоне инъекции Гистохрома отмечается легкая гиперемия и светло коричневое окрашивание конъюнктивы, которые исчезают через 2-3 дня после окончания инъекций без дополнительного лечения. У отдельных пациентов после инъекции может быть легкая болезненность в области глаза.
Заключительная фаза клинических испытаний Гистохрома в офтальмологии была проведена в трех ведущих глазных клиниках страны:
1. Российский государственный медицинский университет (кафедра глазных болезней), Москва.
2. НИИ глазных болезней РАМН, Москва.
3. МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова, Москва.
Клинические исследования подтвердили эффективность препарата Гистохром при лечении:
1) гемофтальмов различного генеза
2) химических ожогов роговицы
3) диабетических ретинопатий
4) дистрофических поражений сетчатой оболочки глаз
5) увеитов, кератитов
6) катаракты.
Взаимодействие с другими лекарственными веществами. Неустановлены.
Условия хранения и отпуска препарата. В защищенном от света месте, при температуре не выше 25С. Срок годности 2 года. Список Б.
Потенциальный контингент больных, у которых может быть использован препарат. Диабетические ретинопатии, гемофтальмы различного генеза, химические ожоги роговицы, дистрофические поражения сетчатой оболочки глаз, увеиты, кератиты, катаракта. Ишемическая болезнь сердца, острый инфаркт миокарда.
Административные документы (регистрационные документы, фармакопейная статья и т. д.).
д.).
«Раствор гистохрома 1% для инъекций» рекомендован Фармакологическим государственным комитетом к медицинскому применению в качестве антиишемического средства и к промышленному выпуску (Протокол №3 от 20 марта 1997 г.)
«Раствор гистохрома 0,02% для инъекций» рекомендован Фармакологическим государственным комитетом к медицинскому применению в качестве антиоксидантного средства при воспалительных заболеваниях сетчатки и роговицы и к промышленному выпуску (Протокол №8 от 26 июня 1997 г.)
Почему витаминные добавки не приносят пользы и могут быть смертельно опасны
- Алекс Райли
- BBC Future
Автор фото, Thinkstock
Мы глотаем антиоксиданты так, словно это волшебный эликсир, способный продлить нам жизнь. Однако в лучшем случае они просто неэффективны, а в худшем — могут сократить наш земной путь. Обозреватель BBC Future рассказывает, почему.
Лайнус Полинг совершил серьезную ошибку, когда решил кое-что изменить в своем традиционном завтраке.
В 1964 году, в возрасте 65 лет, он начал добавлять витамин C в апельсиновый сок, который пил по утрам.
Это все равно, что добавлять сахар в кока-колу, но он искренне и даже слишком рьяно верил в то, что это полезно.
До этого его завтраки вряд ли можно было назвать необычными. Особого упоминания заслуживает лишь то, что завтракал он рано утром перед тем, как отправиться на работу в Калифорнийский технологический университет, даже по выходным.
Он был неутомим, а его работа отличалась исключительной плодотворностью.
В возрасте 30 лет, например, он предложил третий фундаментальный закон взаимодействия атомов в молекулах, основанный на принципах химии и квантовой механики.
Двадцать лет спустя его работа о структуре белков (строительного материала для всего живого) помогла Фрэнсису Крику и Джеймсу Уотсону в 1953 году расшифровать структуру ДНК (кодирующей этот материал).
В следующем году Полинг был удостоен Нобелевской премии в области химии за свои исследования природы химических связей.
Ник Лэйн, биохимик из Университетского колледжа Лондона, в 2001 году написал о нем в своей книге «Кислород»: «Полинг …был колоссом науки XX века, чьи труды заложили основы современной химии».
Автор фото, Getty Images
Подпись к фото,Лайнус Полинг был одним из влиятельнейших ученых, однако его вера в силу антиоксидантов, возможно, подвергает наши жизни опасности
Но затем началась «эпоха витамина C». В своем бестселлере 1970 года под названием «Как прожить дольше и чувствовать себя лучше» Полинг заявлял, что дополнительный прием этого витамина помогает справиться с простудой.
Он принимал 18 000 мг (18 г) этого вещества в день, а это, между прочим, в 50 раз выше рекомендованной дневной нормы.
Во втором издании этой книги в список болезней, с которыми эффективно борется витамин C, был добавлен и грипп.
В 1980-х годах, когда в США начал распространяться ВИЧ, Полинг заявил, что витамин C может вылечить и от этого вируса.
В 1992 году о его идеях написал журнал Time, на обложке которого красовался заголовок: «Реальная сила витаминов». Их преподносили как лекарство от сердечно-сосудистых заболеваний, катаракты и даже рака.
«Еще более заманчивы предположения о том, что витамины способны замедлить процесс старения», — говорилось в статье.
Продажи мультивитаминов и других пищевых добавок взлетели вверх, равно как и слава Полинга.
Однако его научная репутация, наоборот, пострадала. Научные исследования, проведенные в течение нескольких следующих лет, практически не подтвердили пользу витамина C и многих других пищевых добавок.
На самом деле, каждая ложка витамина, которую Полинг добавлял в свой апельсиновый сок, скорее вредила, а не помогала его организму.
Наука не только опровергла его суждения, но и нашла их довольно опасными.
Автор фото, Getty Images
Подпись к фото,Считалось, что антиоксиданты замедляют старение, но доказательств реальной пользы пищевых добавок явно недостаточно
Теории Полинга основывались на том, что витамин C относится к антиоксидантам — особой категории природных соединений, к которой также принадлежат витамин E, бета-каротин и фолиевая кислота.
Они нейтрализуют чрезвычайно активные молекулы, известные как свободные радикалы, и поэтому считаются полезными.
В 1954 году Ребекка Гершман, в то время работавшая в Рочестерском университете, штат Нью-Йорк, впервые выявила связанную с этими молекулами опасность.
В 1956 году ее гипотезу развил Денхам Харман из Лаборатории медицинской физики при Калифорнийском университете в Беркли, заявивший, что свободные радикалы — это причина разрушения клеток, различных болезней и, в конечном итоге, старения.
На протяжении всего XX века ученые продолжали исследовать эту тему, и вскоре идеи Хармана получили всеобщее признание.
Вот как это работает. Процесс начинается с митохондрий, микроскопических двигателей внутри наших клеток.
Внутри их мембран питательные вещества и кислород перерабатываются в воду, углекислый газ и энергию.
Так происходит клеточное дыхание — механизм, служащий источником энергии для всех сложных форм жизни.
«Протекающие водяные мельницы»
Но все не так просто. Помимо питательных веществ и кислорода, для этого процесса необходим постоянный поток отрицательно заряженных частиц — электронов.
Поток электронов проходит через четыре белка, находящиеся в мембранах митохондрии, которые можно сравнить с водяными мельницами. Так он участвует в производстве конечного продукта — энергии.
Эта реакция лежит в основе всей нашей деятельности, однако она не совершенна.
Электроны могут «утекать» из трех клеточных мельниц и вступать в реакции с находящимися поблизости молекулами кислорода.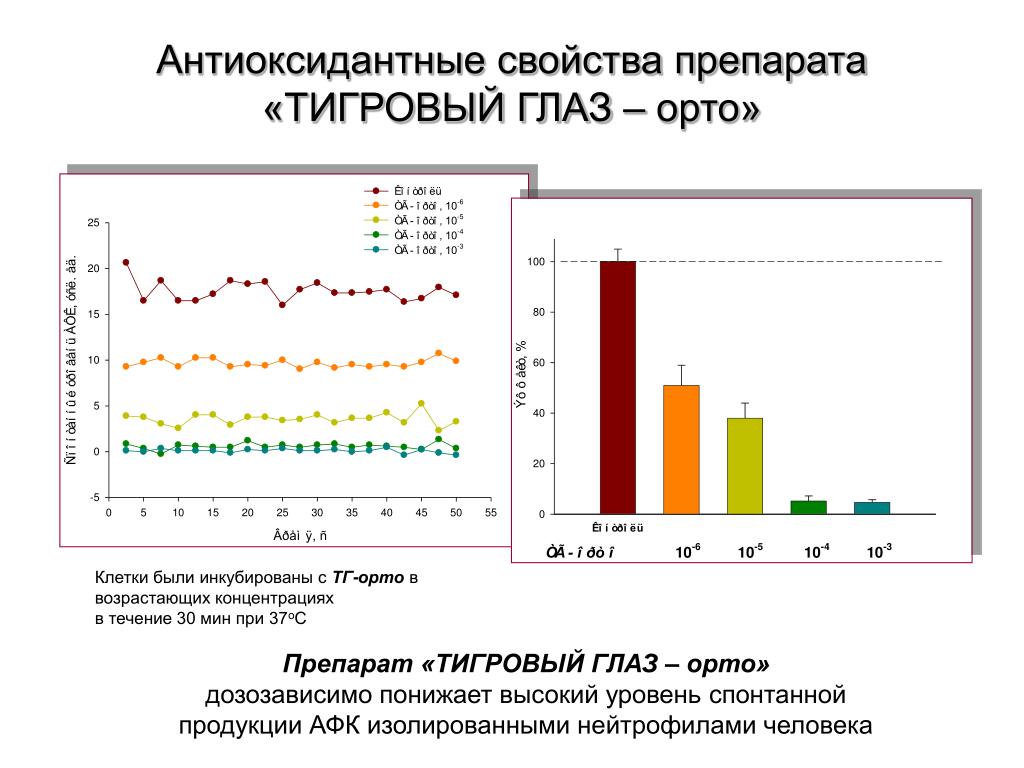
В результате образуются свободные радикалы — очень активные молекулы со свободным электроном.
Чтобы вернуть стабильность, свободные радикалы наносят серьезный ущерб окружающим их системам, забирая электроны у жизненно важных молекул, таких как ДНК и белки, — для поддержания собственного заряда.
Харман и многие другие утверждали, что, несмотря на свой малый масштаб, образование свободных радикалов постепенно наносит вред всему организму, вызывая мутации, приводящие к старению и таким связанным с ним болезням, как рак.
Коротко говоря, кислород — это источник жизни, но он также может быть фактором старения, заболеваний и, наконец, смерти.
Автор фото, Thinkstock
Подпись к фото,Клиническое испытание — это единственный способ проверить то, как действует лекарственный препарат, и в случае с антиоксидантами получены шокирующие результаты
Как только свободные радикалы связали со старением и болезнями, их стали рассматривать как врагов, которых необходимо изгнать из нашего организма.
В 1972 году, к примеру, Харман написал: «Снижение количества [свободных радикалов] в организме, как ожидается, позволит снизить темпы биологического распада, тем самым дав человеку дополнительные годы здоровой жизни. Надеемся, что [эта теория] приведет к плодотворным экспериментам, направленным на повышение продолжительности здоровой жизни человека».
Он говорил об антиоксидантах — молекулах, принимающих электроны у свободных радикалов и снижающих уровень исходящей от них угрозы.
А эксперименты, на которые он надеялся, тщательно проводились и многократно повторялись в течение нескольких десятков лет. Однако их результаты были не очень убедительны.
Так, например, в 1970-х и 80-х годах различные добавки, содержащие антиоксиданты, давали мышам — самым распространенным лабораторным животным — с кормом или посредством инъекции.
Некоторые из них даже подверглись генетической модификации, чтобы гены, отвечающие за определенные антиоксиданты, были более активными, чем у обычных лабораторных мышей.
Ученые применяли различные методы, однако получали очень похожие результаты: избыток антиоксидантов не замедлял старение и не предотвращал заболевания.
«Никому не удалось достоверно доказать, что они (антиоксиданты — Ред.) способны продлить жизнь или улучшить здоровье, — говорит Антонио Энрикес из Национального центра исследований сердечно-сосудистых заболеваний в Мадриде, Испания. — На добавки мыши почти не реагировали».
Автор фото, Thinkstock
Подпись к фото,Одно из исследований показало, что витаминные добавки не только не защищают от болезней, но и повышают уровень заболеваемости раком среди курильщиков
А как насчет людей? В отличие от братьев наших меньших, членов нашего общества ученые не могут поместить в лаборатории, чтобы отслеживать состояние их здоровья на протяжении всей жизни, а также исключить все внешние факторы, которые могут повлиять на итоговый результат.
Единственное, что они могут сделать, — это организовать долгосрочное клиническое исследование.
Его принцип очень прост. Сначала нужно найти группу людей примерно одинакового возраста, живущих в одной местности и ведущих схожий образ жизни. Затем нужно разделить их на две подгруппы.
Первая из них получает добавку, которую необходимо протестировать, в то время как вторая — таблетку-пустышку, или плацебо.
Для обеспечения чистоты эксперимента до завершения исследования никто не должен знать, что именно получают участники — даже те, кто выдает таблетки.
Этот метод, известный как двойное слепое исследование, считается эталоном фармацевтических исследований.
Начиная с 1970-х годов ученые провели немало подобных экспериментов, пытаясь выяснить, каким образом антиоксидантные добавки влияют на наше здоровье и продолжительность жизни. Результаты оказались неутешительными.
Так, например, в 1994 году в Финляндии было организовано исследование с участием 29 133 курильщиков в возрасте от 50 до 60 лет.
В группе, принимавшей пищевые добавки с бета-каротином, заболеваемость раком легких увеличилась на 16%.
Схожие результаты дало американское исследование с участием женщин, вступивших в период постменопаузы.
Они принимали фолиевую кислоту (разновидность витамина B) каждый день на протяжении 10 лет, и после этого риск рака груди у них увеличился на 20% по сравнению с теми, кто не принимал эту добавку.
Дальше все было только хуже. Исследование с участием более 1000 заядлых курильщиков, опубликованное в 1996 году, пришлось прекратить примерно на два года раньше назначенного срока.
По прошествии всего четырех лет приема добавок с бета-каротином и витамином A число случаев рака легких увеличилось на 28%, а число смертей — на 17%.
И это не просто цифры. В группе, принимавшей добавки, каждый год умирало на 20 человек больше, чем в группе, принимавшей плацебо.
Это значит, что за четыре года исследования умерло на 80 человек больше.
Его авторы отметили: «Результаты исследования дают веские основания для отказа от приема добавок с бета-каротином, а также бета-каротина в сочетании с витамином A».
Фатальные идеи
Само собой, эти достойные внимания исследования не дают нам полной картины. Некоторые испытания все же доказывали пользу антиоксидантов, особенно в случаях, когда их участники не имели возможности питаться правильно.
Тем не менее выводы научного обзора 2012 года, составленного на основе 27 клинических испытаний эффективности различных антиоксидантов, свидетельствуют не в пользу последних.
Лишь в семи исследованиях прием добавок был в какой-то степени полезен для здоровья: снизился риск заболеваний сердечно-сосудистой системы и рака поджелудочной железы.
Десять исследований не показали никакой пользы антиоксидантов — результаты были такими, как будто все пациенты получали плацебо (хотя на самом деле это, конечно, было не так).
Итоги оставшихся 10 исследований свидетельствовали о том, что многие пациенты находились в заметно более худшем состоянии, чем до приема антиоксидантов. Кроме того, среди них увеличилась заболеваемость раком легких и раком груди.
«Предположение о том, что добавки с антиоксидантами — это волшебное лекарство, не имеет под собой совершенно никаких оснований», — утверждает Энрикес.
Лайнус Полинг даже не подозревал, что его собственные идеи могут быть смертельно опасными.
В 1994 году, еще до опубликования результатов многочисленных крупномасштабных клинических исследований, он умер от рака простаты.
Витамин C вовсе не был панацеей, хотя Полинг до самого последнего вздоха упорно настаивал на этом. Но связано ли его повышенное потребление с дополнительными рисками?
Вряд ли мы когда-нибудь узнаем это наверняка. Тем не менее, учитывая то, что многие испытания связывают прием антиоксидантов с раком, это не исключено.
К примеру, исследование специалистов Национального института онкологии США, опубликованное в 2007 году, показало, что у мужчин, принимавших мультивитамины, риск умереть от рака простаты был в два раза выше, чем у тех, кто этого не делал.
Автор фото, Thinkstock
Подпись к фото,Прием дополнительных доз витамина C не защитит даже от обычной простуды
А в 2011 году похожее исследование с участием 35 533 здоровых мужчин выявило, что прием добавок с витамином E и селеном увеличивал риск рака простаты на 17%.
С тех пор как Харман предложил свою знаменитую теорию о свободных радикалах и старении, ученые стали постепенно отказываться от четкого разделения антиоксидантов и свободных радикалов (оксидантов). Сейчас оно считается устаревшим.
Антиоксидант — это всего лишь название, которое не отражает природу того или иного вещества в полной мере.
Возьмем, например, столь любимый Полингом витамин C. При правильной дозировке он нейтрализует высокоактивные свободные радикалы, забирая у них свободный электрон.
Он становится «молекулярным мучеником», принимая удар на себя и защищая окружающие его клетки.
Однако, приняв электрон, он сам становится свободным радикалом, способным повредить клеточные мембраны, белки и ДНК.
Как в 1993 году написал химик пищевой промышленности Уильям Портер, «[витамин C] — это настоящий двуликий Янус, доктор Джекил и мистер Хайд, оксюморон антиоксидантов».
К счастью, в нормальных обстоятельствах фермент редуктаза способен вернуть витамину C его антиоксидантный облик.
Но что, если витамина C так много, что фермент просто не успевает справляться с ним?
Несмотря на то, что такое упрощение сложных биохимических процессов не способно отразить всю суть проблемы, результаты вышеуказанных клинических исследований свидетельствуют о том, к чему это может привести.
Разделяй и властвуй
У антиоксидантов есть своя темная сторона. Кроме того, даже их светлая сторона не всегда действует нам во благо — в свете появления все большего количества доказательств того, что свободные радикалы также важны для нашего здоровья.
Сейчас мы знаем, что свободные радикалы часто выполняют функцию молекулярных передатчиков, отправляющих сигналы из одной части клетки в другую. Так они регулируют процессы роста, деления и гибели клетки.
На каждом этапе существования клетки свободные радикалы играют очень важную роль. Без них клетки продолжали бы расти и делиться бесконтрольно — это процесс и называют раком.
Без свободных радикалов мы также чаще заражались бы инфекциями. В условиях стресса, вызванного проникновением в организм человека нежелательных бактерий или вирусов, свободные радикалы начинают вырабатываться более активно, действуя как бесшумный сигнал для иммунной системы.
В результате клетки, стоящие в авангарде нашей иммунной защиты — макрофаги и лимфоциты — начинают делиться и бороться с возникшей проблемой. Если это бактерия, они проглотят ее, как Пакман синее привидение в популярной компьютерной игре.
Бактерия окажется в ловушке, но будет еще жива. Чтобы исправить это, свободные радикалы вновь вступают в дело.
Внутри иммунной клетки они используются как раз для того, из-за чего получили плохую репутацию: для убийства и разрушения. Незваного гостя разрывают на кусочки.
С самого начала и до конца здоровая иммунная реакция зависит от наличия в организме свободных радикалов.
Генетики Жуан Педру Магальяйнш и Джордж Черч написали в 2006 году: «Огонь опасен, однако люди научились использовать его себе во благо. Точно так же и клетки, по-видимому, смогли развить механизмы контроля и использования [свободных радикалов]».
Другими словами, избавляться от свободных радикалов при помощи антиоксидантов не стоит.
«В таком случае мы будем беззащитны перед некоторыми инфекциями», — подчеркивает Энрикес.
Автор фото, Getty Images
Подпись к фото,Мало кто сомневается в том, что для поддержания хорошего здоровья необходимо сбалансированное питание, но большинству из нас для удовлетворения пищевых потребностей не нужны добавки
К счастью, в организме человека есть системы, отвечающие за поддержание стабильности биохимических процессов.
В случае с антиоксидантами их излишек удаляется из кровотока в мочу. «Они просто выводятся из организма естественным путем», — говорит Клева Виллануэва из Национального политехнического института Мехико.
«Человеческий организм обладает невероятной способностью приводить все в равновесие, поэтому последствия [приема добавок] в любом случае будут умеренными, и мы должны быть благодарны за это», — отмечает Лэйн.
К рискам, связанным с кислородом, мы начали приспосабливаться еще тогда, когда первые микроорганизмы начали дышать этим токсичным газом, и изменить то, что создавалось за миллиарды лет эволюции, простая пилюля не в силах.
Никто не станет отрицать, что витамин C — это неотъемлемая часть здорового образа жизни, равно как и все антиоксиданты.
Но, за исключением случаев, когда эти добавки прописаны врачом, здоровое питание все же является лучшим способом продлить себе жизнь.
«Прием антиоксидантов оправдан только тогда, когда в организме наблюдается реальный дефицит конкретного вещества, — говорит Виллануэва. — Лучше всего получать антиоксиданты из продуктов питания, которые содержат определенный набор антиоксидантов, действующих в комплексе».
«Рацион, богатый фруктами и овощами, как правило, очень полезен, — говорит Лэйн. — Не всегда, но в большинстве случаев это так».
Несмотря на то, что преимущества такого питания часто приписывают антиоксидантам, свою роль здесь играет здоровый баланс прооксидантов и других веществ, чье значение пока достоверно не известно.
Десятки лет ученые старались понять сложную биохимию свободных радикалов и антиоксидантов, привлекли к своим исследованиям сотни тысяч добровольцев и потратили на клинические испытания миллионы, однако современная наука пока не может предложить нам ничего лучшего, чем совет, известный нам со школьной скамьи: ешьте по пять овощей или фруктов каждый день.
Антиоксидантный препарат в комплексном лечении язвенно-некротических процессов полости рта
К. Г. Караков
профессор, заведующий кафедрой терапевтической стоматологии СтГМА
Т. Н. Власова
к. м. н., доцент кафедры терапевтической стоматологии СтГМА
А. В. Оганян
ассистент кафедры терапевтической стоматологии СтГМА
О. М. Губжокова
клинический ординатор кафедры терапевтической стоматологии СтГМА
В настоящее время многочисленные исследования посвящены изучению повышения эффективности лечения воспалительных заболеваний пародонта — объясняется это высокой частотой их распространения, различной тяжестью течения, появлением в организме очагов хронической инфекции, преждевременной потерей зубов.
Многие авторы указывают на необходимость комплексного лечения язвенно-некротических процессов полости рта.
Согласно современным представлениям, бактериальная агрессия, являясь одним из инициирующих факторов возникновения заболеваний пародонта, обусловливает развитие различных форм поражения пародонтального комплекса в зависимости от характера и интенсивности вызванной ею ответной реакции организма. Даже если микрофлора в определенной степени подавляется антимикробной терапией, это не является полной гарантией прекращения деструктивного процесса: он может поддерживаться механизмами воспалительных, микроциркуляторных, дегенеративных цепных реакций в зонах поражения пародонта.
Особый интерес в тканевой деструкции представляют кислородосодержащие свободные радикалы. Влияние свободных радикалов на клетки и ткани очень разнообразно, включая нарушение белковой составляющей клеток, нуклеиновых кислот и липидов мембран. Результатом описанных процессов является деструкция и в конечном итоге потеря мягких и твердых тканей, окружающих зуб.
Эффективными средствами защиты пародонта от патогенных воздействий являются антиоксидантные комплексы, пресекающие разрушительную атаку свободных радикалов и восстанавливающие нормальное функционирование околозубных тканей.
Антиоксиданты широко используются в качестве компонента комплексной терапии язвенно-некротических процессов полости рта. В качестве антиоксидантов, применяющихся в комплексной терапии, используются природные вещества: витамины (ретинол, токоферол), растительные экстракты, микроэлементы (цинк, селен), входящие в состав антиоксидантных ферментов.
Из современных антиоксидантов мы отдали предпочтение отечественному препарату «Мексидол», который зарекомендовал себя как эффективное средство патогенетической терапии в лечении общесоматических заболеваний.
Этот препарат, легко растворимый в воде и способный быстро проникать в клеточные структуры, способствует ликвидации очагов воспаления и стимулирует процессы регенерации в тканях пародонта. Он уменьшает интоксикацию, улучшает реологические свойства крови, восстанавливает микроциркуляцию крови в пародонте, снимает отек, а также улучшает местный иммунитет. Механизм действия обусловлен антиоксидантным, антигипоксическим, липидрегулирующим и мембранопротекторным его действием.
Применение других антиоксидантов в стоматологии затруднено в силу определенных фармакологических свойств: плохая растворимость в воде, неустойчивость к ферментам слюны.
Согласно схеме комплексного лечения язвенно-некротических процессов полости рта лечение проводилось индивидуально, включало общие и местные факторы.
К нам на кафедру обратились 10 пациентов с язвенно-некротическим процессом в полости рта. Возраст больных — от 23 до 50 лет. Все больные были разделены на две группы. В первую группу включили 6 пациентов с острым язвенно-некротическим гингивитом, вторую составили 4 человека с язвенным гингивитом.
Пациенты предъявляли жалобы на интенсивные боли в деснах, гнилостный запах изо рта, кровоточивость десен. У большинства было нарушено общее состояние: повышенная температура тела, отмечали слабость, головную боль. При осмотре полости рта было обнаружено, что десневой край покрыт серым зловонным налетом, после удаления которого обнажалась кровоточащая резко болезненная поверхность. Вершины десневых сосочков как бы срезаны, контуры десневого края нарушены. Определились обильные неминерализованные зубные отложения, зубной камень. Регионарные лимфатические узлы увеличены, болезненны при пальпации.
В первый день обращения пациентов было проведено активное лечение. Сначала обезболивание пораженных участков путем аппликаций 0,5–2%-ным раствором новокаина. Затем были удалены некротизированные ткани десны. Эту манипуляцию выполняют острыми экскаваторами или ватными тампонами. Нужно стремиться удалить весь некротический налет в первое же посещение. Одновременно устраняют зубные отложения, сошлифовывают острые края зубов, травмирующие слизистую оболочку. После этого местно применяют антимикробные препараты: 0,06%-ный раствор хлоргексидина, 1%-ный раствор перекиси водорода и аппликации на слизистую оболочку полости рта 5%-ным раствором мексидола на 15 минут.
Пациентам были назначены мероприятия для выполнения в домашних условиях:
- Антиоксидантный препарат внутрь в таблетированной форме по 0,125 г три раза в день, курс — 14 дней.
- Метронидазол — по 0,5 г 2 раза в день.
- Димедрол — по 0,05 г утром и вечером.
- Ацетилсалициловая кислота — по 0,5 г 3 раза в день.
- Ротовые ванночки с растворами антисептиков (перекиси водорода, фурацилина), отварами трав (ромашки, шалфея).
- Обильное питье.
- Щадящая, полноценная диета.
Во второе посещение, при улучшении общего состояния и местного статуса, применялись аппликации средств, улучшающих эпителизацию изъязвленных поверхностей: масла шиповника, солкосерила, каротолина.
Курс лечения — 8–10 процедур.
Результаты лечения язвенно-некротических процессов полости рта после завершения курса, когда дополнительно применялась антиоксидантная терапия: положительные результаты после трех-четырех процедур наблюдались в 90 % случаев.
Нейрокс инструкция по применению: показания, противопоказания, побочное действие – описание Neurox р-р д/в/в и в/м введения 250 мг/5 мл: амп. 5, 10 или 20 шт. (22271)
Ингибитор свободнорадикальных процессов — мембранопротектор, обладающий также антигипоксическим, стресспротекторным, ноотропным, противоэпилептическим и анксиолитическим действием. Относится к классу 3-оксипиридинов.
Механизм действия обусловлен антиоксидантным и мембранопротекторным свойствами. Подавляет ПОЛ, повышает активность супероксидоксидазы, повышает соотношение липид-белок, улучшает структуру и функцию мембраны клеток. Модулирует активность мембраносвязанных ферментов (Ca2+-независимой ФДЭ, аденилатциклазы, ацетилхолинэстеразы), рецепторных комплексов (бензодиазепинового, ГАМК, ацетилхолинового), что способствует их связыванию с лигандами, сохранению структурно-функциональной организации биомембран, транспорта нейромедиаторов и улучшению синаптической передачи. Повышает концентрацию в головном мозге дофамина.
Усиливает компенсаторную активацию аэробного гликолиза и снижает степень угнетения окислительных процессов в цикле Кребса в условиях гипоксии с увеличением АТФ и креатинфосфата, активирует энергосинтезирующую функцию митохондрий.
Повышает резистентность организма к воздействию различных повреждающих факторов при патологических состояниях (шок, гипоксия и ишемия, нарушения мозгового кровообращения, интоксикация этанолом и антипсихотическими лекарственными средствами).
Улучшает метаболизм и кровоснабжение головного мозга, микроциркуляцию и реологические свойства крови, уменьшает агрегацию тромбоцитов. Стабилизирует мембраны клеток крови (эритроцитов и тромбоцитов), снижая вероятность развития гемолиза.
Обладает гиполипидемическим действием, уменьшает содержание общего холестерина и ЛПНП.
Улучшает функциональное состояние ишемизированного миокарда при инфаркте миокарда, сократительную функцию сердца, а также уменьшает проявления систолической и диастолической дисфункции левого желудочка.
В условиях критического снижения коронарного кровотока способствует сохранению структурно-функциональной организации мембран кардиомиоцитов, стимулирует активность мембранных ферментов — ФДЭ, аденилатциклазы, ацетилхолинэстеразы. Поддерживает развивающуюся при острой ишемии активацию аэробного гликолиза и способствует в условиях гипоксии восстановлению митохондриальных окислительно-восстановительных процессов, увеличивает синтез АТФ и креатинфосфата. Обеспечивает целостность морфологических структур и физиологических функций ишемизированного миокарда.
Улучшает клиническое течение инфаркта миокарда, повышает эффективность проводимой терапии, ускоряет восстановление функциональной активности миокарда левого желудочка, снижает частоту возникновения аритмий и нарушений внутрисердечной проводимости. Нормализует метаболические процессы в ишемизированном миокарде, уменьшает зону некроза, восстанавливает и/или улучшает электрическую активность и сократимость миокарда, а также увеличивает коронарный кровоток в зоне ишемии, повышает антиангинальную активность нитропрепаратов, улучшает реологические свойства крови, уменьшает последствия реперфузионного синдрома при острой коронарной недостаточности.
Уменьшает ферментативную токсемию и эндогенную интоксикацию при остром панкреатите.
Антиоксидантная защита кожи на клеточном уровне с помощью ампул Muse
Сегодня все большую актуальность приобретают такие понятия, как оксидативный стресс, свободные радикалы, антиоксидантная защита. Тем не менее, у большинства людей нет четкого представления, что это такое, чем опасны свободные радикалы, а главное – как уберечь клетки организма от их негативного воздействия. Рассказать всю правду о свободных радикалах сегодня попытаемся мы, Christina же дает новый инструмент для борьбы с ними — Ампулы с препаратом для восстановления защитного барьера кожи Muse Cell Shield Ampoules.Что такое оксидативный стрeсс и как с ним бороться
Оксидативным (или окислительным) стрессом называют процесс повреждения клетки в результате процессов окисления. В живом организме окислителями могут быть разные молекулы. Наиболее активной из них является молекула кислорода. Свободный радикал образуется в тот момент, когда кислород, участвующий в процессе метаболизма, теряет электрон, что делает его химически активным. Пытаясь возместить потерю электрона, свободные радикалы отбирают электроны, у молекул, входящих в состав клеток, превращая их в новые свободные радикалы. Эта цепная реакция нарушает целостность клеток и открывает дорогу многим заболеваниям.
В каждой клетке живого организма существует целая система антиоксидантов (антиокислителей), задача которых прервать эту реакцию: молекулы антиоксидантов взаимодействуют с активными свободными радикалами, образуя малоактивные соединения.
Однако иногда в работе антиоксидантных систем могут происходить сбои, и тогда процесс связывания свободных радикалов начинает замедляться. В результате развиваются заболевания, организм начинает преждевременно стареть.
Еще в 1956 году Денхам Харман представил миру свободнорадикальную теорию старения организма. В соответствии с ней гибель клеток и старение организма напрямую связаны с процессами окисления и повреждения молекул свободными радикалами. На сегодняшний день в той или иной степени доказано, что воздействие свободных радикалов способствует развитию более 100 различных заболеваний.
В современном мире риск развития оксидативного стресса у каждого из нас очень велик, так как ежедневно нам приходится сталкиваться с огромным количеством агрессивных стрессовых факторов. Плохая экология, посещение солярия, несбалансированное питание, постоянные стрессы, нездоровый образ жизни, частый прием различных лекарственных препаратов, в том числе антибиотиков, гормональные нарушения, психоэмоциональное напряжение и прочие стрессовые факторы ежедневно испытывают наш организм на прочность. В таких условиях даже здоровый и крепкий организм рано или поздно даст сбой.
Одним из барьеров, которые защищают внутреннюю среду организма от воздействия внешних стрессовых факторов, является кожа. Она, словно стены крепости, не позволяет «агрессорам» проникнуть внутрь. Вот почему поддержание здоровья кожи является одним из важнейших этапов в борьбе за здоровье.
Максимальный результат в короткие сроки
В основе препаратов линии Muse — экстракты самых жизнестойких сортов розы и комплекс инновационных компонентов, действие которых направлено на укрепление собственных защитных систем кожи и повышение ее устойчивости к внешнему воздействию, стимуляцию ее естественного обновления и замедление процессов старения.В домашнюю линию входят:
- Очищающее молочко Milky Cleanser;
- Отшелушивающий гоммаж для сияния кожи Muse Illuminating Gommage;
- Сыворотка «Абсолютная защита кожи» Muse Absolute Defense;
- Маска красоты с экстрактом розы Muse Beauty Mask;
- Питательный крем Muse Nourishing Cream;
- Дневной защитный крем SPF 30 Muse Protective Day Cream SPF 30;
- Восстанавливающий крем для кожи вокруг глаз Muse Muse Restoring Eye Cream;
- Ночной восстанавливающий крем Revitalizing Night Cream;
- Детокс-сыворотка «Суприм» Muse Serum Supreme.
А сейчас линия дополнилась новым средством — Ампулами с препаратом для восстановления защитного барьера кожи Muse Cell Shield Ampoules, способствующими интенсивному увлажнению и эффективному омоложению кожи, наполняющими ее энергией и важными питательными веществами и ускоряющими естественные процессы обновления.
Активные ингредиенты ампул Muse
Дневной ампульный препарат Muse —
это интенсивный уход за кожей,
который обеспечивает ей надежную защиту в течение дня, предотвращая пагубное действие свободных радикалов,
УФ-излучения и экстремальных температур. В его составе —
уже известные специалистам
и поклонникам программы Muse инновационные комплексы и растительные экстракты.
Комплекс ActiRose — вытяжка биоактивных веществ из лепестков роз наиболее стойких сортов, в состав которой в большом количестве входят полисахариды, оказывающие увлажняющее действие, ценные липиды, восстанавливающие естественную гидролипидную мантию кожи, и антиоксидантные вещества (биофлавоноиды), снимающие раздражение и успокаивающие кожу.
Detoxiquin — биоактивный детокс-пептидный комплекс, обладающий выраженными антиоксидантными свойствами и помогающий собственной антиоксидантной системе кожи противостоять окислительному стрессу.
Экстракт стволовых клеток альпийской розы из сверхстойкого сорта роз Rhododendron ferrugineum, произрастающего на горных склонах швейцарских Альп. Данный сорт розы отличается устойчивостью к экстремальным климатическим условиям благодаря особым веществам — полифенолам с антиоксидантной активностью и дегидрину, защищающему клетки от холода и перепадов температуры.
Экстракт льна — способствует восстановлению кожи, защищает ее, улучшает текстуру, повышает уровень увлажненности и эластичность.
Ночной ампульный препарат Muse оказывает мощное детоксицирующее действие, успокаивает кожу, насыщает ее ценными питательными веществами и запускает природные механизмы восстановления и обновления клеток. Он также содержит ряд уникальных комплексов и экстрактов.
Telosense Active — инновационный комплекс, способный защищать теломеры ДНК от укорачивания в процессе клеточного деления. Теломеры — это концевые участки хромосом, препятствующие соединению разных хромосом друг с другом в процессе деления клеток. Во время каждого деления теломеры укорачиваются, в конце концов они становятся настолько короткими, что клетка гибнет. Однако существует защитный механизм, препятствующий быстрому укорачиванию теломер ДНК путем обратного «наращивания» их длины. За открытие данного механизма группа американских ученых получила в 2009 году Нобелевскую премию. Компания Christina использовала эти знания для создания уникального комплекса Telosense Active, который предотвращает укорачивание теломер ДНК, оказывает омолаживающее действие, продлевая красоту и здоровье кожи.
Активный комплекс водорослей повышает сопротивляемость кожи к воздействию УФ-лучей, высоких температур, укрепляет собственные защитные системы клеток, улучшает потребление ими кислорода.
Экстракт цветов хлопчатника уменьшает воспаление и раздражение кожи, повышает уровень ее увлажненности. Содержит вещества, стимулирующие собственный иммунитет кожи и повышающие ее сопротивляемость.
Ампулы с препаратом для восстановления защитного барьера кожи Muse Cell Shield Ampoules для домашнего применения поддержат и усилят эффект салонной программы Muse. Дневной препарат наносится на очищенную кожу утром, массажными движениями он распределяется на коже лица, шеи, декольте. Вечером аналогичным способом применяется Ночной препарат. Оставшийся после применения на основных зонах препарат можно нанести на тыльную поверхность рук. Интенсивный курс, расчитанный на 5 дней, рекомендуется повторять 1 раз в 3 месяца.
Фармакология антиоксидантов на основе 3-оксипиридина Текст научной статьи по специальности «Фундаментальная медицина»
Вестник Смоленской медицинской академии, 2004, № 3
ОБЗОРЫ
УДК 615.72:616-001.8
ФАРМАКОЛОГИЯ АНТИОКСИДАНТОВ НА ОСНОВЕ 3-ОКСИПИРИДИНА В. Е. Новиков, Л. А. Ковалева, С. О. Лосенкова, Е. И. Климкина
Смоленская государственная медицинская академия
В живом организме в результате естественного метаболизма кислорода, а также в процессах окислительно-восстановительных превращений различных эндогенных субстратов, лекарств, ксенобиотиков, постоянно образуются свободные радикалы. Первичные радикалы специально вырабатываются организмом и выполняют важнейшие функции переноса электрона в дыхательной цепи (убихинон), защиты от микроорганизмов (супероксид) и регуляции кровяного давления (окись азота), тогда как вторичные радикалы оказывают цито-токсическое действие и, как правило, наносят организму большой вред [20, 136].
Действие свободных радикалов в организме контролируется эндогенными и экзогенными антиоксидантами, а также ферментными антиоксидантными системами. Эндогенная антиоксидантная система организма противостоит повреждающему действию свободных радикалов [16]. Нарушение систем регуляции свободно-радикальных процессов может приводить к развитию различных патологических состояний (лучевое поражение, злокачественный рост, гипоксия, ишемия, атеросклероз, стресс и другие). В связи с этим актуальное значение приобретает проблема фармакологической коррекции свободно-радикальных процессов с помощью экзогенных препаратов, оказывающих антиоксидантное и антигипоксантное действие [1, 35, 38, 71, 72, 87, 88, 107].
В последние годы пристальное внимание фармакологов и клиницистов в качестве перспективных лекарственных средств, эффективно регулирующих процессы окисления и перооксидации, привлекли соединения гетероароматических фенолов, в частности производные 3-оксипиридина. Производные 3-оксипиридина (3-ОП) относятся к простейшим гетероциклическим аналогам ароматических фенолов и в этой связи проявляют антиоксидантные и антирадикальные свойства. Они являются структурными аналогами соединений группы витамина В6 (пиридоксол, пиридоксаль и пиридоксамин), играющих важную роль в жизнедеятельности организма. Синтез и анализ физико-химических свойств ряда оригинальных производных 3-ОП осуществлен Л. Д. Смирновым, К.М. Дюмаевым, В.И. Кузьминым, а их фармакологическое изучение проведено в лаборатории психофармакологии НИИ фармакологии РАМН под руководством заслуженного деятеля науки профессора Т.А. Ворониной [17, 38].
Фармакодинамика. Производные 3-ОП обладают широким спектром биологического действия. Известно, что в формировании любого фармакологического эффекта химических соединений значительную роль играют особенности их строения. Основная роль принадлежит так называемым фармакофорам. Находясь в различном положении, либо будучи связанными с различными структурами, они способны изменять спектр проявляемой активности соединений [100, 104].
Алкил- и арилзамещенные 3-ОП и их 2- и 6-алкокси (окси) производные обладают выраженной антиокси-дантной активностью [38]. Эксперименты по оценке антирадикальной активности показали, что в ряду изученных производных 3-ОП увеличение констант скоростей ингибирования наблюдается при введении в цикл алкильных заместителей, обладающих электронодонорными свойствами [79]. Сравнительная оценка антиок-сидантной активности некоторых производных 3-ОП осуществлялась на модели черепно-мозговой травмы (ЧМТ). Показано, что соединения под шифрами ИБХФ-1 и ИБХФ-2 в дозе 10 мг/кг через 24 часа после ЧМТ полностью восстанавливали выявленные изменения ПОЛ в сыворотке крови. В гомогенате ткани мозга ИБХФ-1 и ИБХФ-2 также показали высокую антиокислительную активность, причем активность ИБХФ-1 преобладала через 24 часа, ИБХФ-2 — через 4 суток после ЧМТ [64]. Алкилзамещенные 3-ОП оказались эффективными мембранопротекторами при механической травме, арилзамещенные и аминометильные производные 3-ОП проявляли меньшую эффективность. Замена ОН-группы на №И2-группу или на атом водорода приводила к значительной потере биологической активности, что указывает на определяющую роль ОН-группы, как носителя стабилизирующих свойств [38].
Среди производных 3-ОП выявлены соединения с выраженной антигипоксической активностью. По спектру эффективных доз и степени выраженности антигипоксического действия на разных моделях гипоксии предпочтительнее других оказалось производное 3-ОП под шифром ИБХФ-2. Это соединение в эксперименте снижает потребление кислорода и ректальную температуру животных, не изменяет функциональные показатели крови, обладает низкой токсичностью [50, 87]. При изучении противоопухолевой активности отмечено, что наибольшей активностью обладали 2-третбутил-6-метил- и 2-этил-6-метил-3-оксипиридины, которые тормозили развитие саркомы на 74 и 58% соответственно [38].
Профессором Н.Н. Самойловым с соавторами [100] на моделях физической работоспособности в обычных и осложненных условиях было изучено 69 новых производных пиридина и 3-оксипиридина под шифрами СК-и ВК- и соответствующими лабораторными номерами, имеющих неодинаковые радикалы в различных положениях пиридинового кольца: метилбензилзамещенные производные 3-ОП, фенилэтилзамещенные, изо-тиурониевые замещенные 3-ОП, адамантильные производные пиридина, аминофенильные 3-ОП, другие прозводные пиридина и 3-оксипиридина. Результаты опытов показали, что в обычных условиях актопротек-торная активность проявляется у соединений, в структуре которых присутствуют метоксифенильный, диме-токсифенильный и фенилэтильный радикалы. Максимальный эффект оказывало соединение, в структуре которого присутствуют диметоксифенильный, метильный и диметиламинометильный радикалы (физическая работоспособность повышалась на 38-110% в сравнении с контролем). Можно предполагать, что актопро-текторные свойства производных 3-ОП определяются наличием в их структуре диметоксифенильного и ме-
тильного радикалов. Наличие других групп атомов в их структуре не оказывает столь существенного влияния на физическую работоспособность [104].
При гипертермии более выраженное положительное актопротекторное действие оказывало фенилэтилзаме-щенное производное 3-ОП под шифром СК-115, особенно при введении его с профилактической целью. При гипотермии в качестве фригопротектора эффект проявляло соединение под шифром СК-119 [100]. На основе 3-ОП разработаны и внедрены в клиническую практику лекарственные препараты эмоксипин и мексидол (мексикор). Их синтез осуществлен на основе производных гидроксипиридина и эстрогенов путем придания структуре витамина В6 (пиридоксол) антиоксидантных свойств за счет экранирования алкильными группами фенольного гидроксила [79]. Препараты мексидол и эмоксипин широко применяются в медицинской практике. Эффекты мексидола и эмоксипина определяются их механизмом действия [107, 109].
Мексидол ингибирует свободнорадикальное окисление липидов биомембран, сохраняя их упорядоченность. Активно реагирует с перекисными радикалами липидов, первичными и гидроксильными радикалами пептидов, повышает активность супероксиддисмутазы (СОД) и других антиоксидантных ферментов [16, 31, 37]. Эмоксипин снижает интенсивность ПОЛ в легких, крови, суставах, предотвращает снижение концентрации общих липидов, фосфолипидов, жирных кислот и холестерина, активирует естественную антиоксидантную систему организма, ингибирует образование глюкокортикоидрецепторных комплексов путем неконкурентного связывания с рецептором [87].
Производные 3-ОП способны оказывать влияние на активность мембраносвязанных ферментов (фосфодиэ-стеразу, аденилатциклазу), ингибировать свободнорадикальные стадии синтеза простагландинов, катализируемых циклооксигеназой и липооксигеназой, изменять соотношение простациклин/тромбоксан А2 и тормозит образование лейкотриенов (ЛТ В4) [38]. Мексидол оказывает выраженное гиполипидемическое действие: снижает уровень общего холестерина и липопротеинов низкой плотности и повышает уровень липопро-теинов высокой плотности [16, 17]. Мексидол сочетает антиоксидантные свойства основания (производное 3-ОП) с антигипоксической активностью сукцината [134, 138]. Антиоксидант эмоксипин, входящий в состав мексидола, обладает слабой антигипоксической активностью, но он облегчает транспорт сукцината через мембраны [50]. Сукцинатоксидазное звено — это ФАД-зависимое звено цикла Кребса [89]. Механизм проти-вогипоксического действия мексидола связан с его специфическим влиянием на энергетический обмен [71]. Антиоксидантная и антигипоксическая активность мексидола способствует одновременному включению нескольких защитных механизмов в организме при гипоксии и, тем самым, повышает эффективность его действия. Мексидол по своей антиоксидантной активности превосходит как эмоксипин, так и проксипин [57, 87].
Производные 3-ОП ингибируют свободнорадикальные процессы в микросомах печени. Связываясь с цито-хромом Р-450, они образуют комплексы, способные снижать активность микросомальных реакций, которые имеют преимущественное значение в метаболизме полициклических ароматических углеводородов, и, тем самым, уменьшать эндотоксикоз на уровне отдельного органа и организма в целом [87]. Всесторонние исследования биологических свойств производных 3-ОП позволили установить, что данные вещества могут выступать в качестве потенциальных защитных агентов при действии на организм различных повреждающих факторов и проявляют высокую эффективность в качестве радио-, фото-, гепато- и геропротекторов и в этой связи могут быть использованы в качестве универсальных средств антиоксидантной фармакотерапии [107, 108].
Фармакокинетика. При введении мексидола внутрь в дозе 100 мг/кг было установлено, что препарат определяется в плазме крови с двойным пиком максимальной концентрации. Появление пиковой концентрации препарата в плазме крови через 0,5 часа можно объяснить изначальным всасыванием вещества из ЖКТ. Что касается второй максимальной концентрации, которая определяется через 1,5-2 часа, можно предположить возможность экскреции мексидола с желчью и последующую его реабсорбцию из ЖКТ. Этот факт позволяет допустить наличие энтерогепатической рециркуляции, характерной для мексидола после его введения внутрь. После внутривенного введения мексидола в дозе 50 мг/кг вещество элиминирует из плазмы биоэкспоненциально и может определяться в высоких концентрациях на протяжении 6-12 часов.
Установлено, что мексидол связывается с белками плазмы крови в среднем на 42%. Результаты исследований позволяют сделать вывод о возможности образования в организме тканевого и кровяного депо мекси-дола [38]. При изучении особенностей биотрансформации мексидола было выделено и идентифицировано 5 метаболитов, представленных деалкилированными и конъюгированными продуктами превращения: 1) 2,6-диметил-3-оксипиридин; 2) 6-метил-3-оксипиридин; 3) фосфатный конъюгат 2-этил,6-метил-3-оксипиридин; 4) глюкуроноконъюгат 2-этил-6-метил-3-оксипиридин; 5) фосфатно-глюкуроновый конъюгат 2-этил-6-метил-3-оксипиридин [38, 62]. Первый метаболит обладает такой же анксиолитической активностью, как неизменный препарат, а по антигипоксическому и седативному действию даже превосходит его. Третий метаболит играет важную роль в проявлении мембранотропного действия и фармакологической активности мексидола, так как является аккумулятором фосфата, участвующего в энергетическом обмене клетки, и пролонгирует действие исходного препарата за счет образования печеночного депо.
Существуют четкие межвидовые различия в биотрансформации мексидола у животных и человека. В организме человека биотрансформация протекает в печени путем интенсивной конъюгации препарата с глюку-роновой кислотой. Показатели экскреции мексидола и его конъюгированного метаболита имеют выраженную вариабельность у отдельных пациентов [101].
Применение. Лекарственные препараты мексидол (мексикор) и эмоксипин нашли эффективное применение в различных областях клинической медицины: неврологии, психиатрии, кардиологии, офтальмологии, хирургии, стоматологии, эндокринологии и др. Препараты могут быть использованы как с целью быстрого достижения терапевтического эффекта, так и с целью снижения частоты побочных реакций и сокращения сроков пребывания в стационаре [1, 107].
Неврология и психиатрия. Мексидол и эмоксипин широко используются в неврологии и психиатрии. Это обусловлено оригинальным спектром нейротропного действия препаратов на нейрональном уровне (анксио-литические, противосудорожные, антистрессорные, церебропротекторные, противопаркинсонические, антиамнестические и противоалкогольные свойства) [17, 19, 56, 107]. На сосудистом уровне мексидол улучшает мозговое кровообращение, ингибирует агрегацию тромбоцитов, повышает антитромбогенный
потенциал крови [14], снижает общий уровень холестерина, оказывает кардиопротекторное и антиатеро-склеротическое действие [17, 76]. Мексидол и эмоксипин успешно применяют для лечения неврологических, неврозоподобных состояний (мексидол ускоряет регресс неврологических симптомов и боли), а также для купирования абстинентного синдрома при алкоголизме и наркомании [18, 50, 107, 138].
Препараты эффективны при острых нарушениях мозгового кровообращения, дисциркуляторной энцефалопатии, вегетососудистой дистонии, атеросклеротических нарушениях функций мозга и при других состояниях, сопровождающихся гипоксией тканей [89]. Показано как профилактическое, так и лечебное действие мексидола и эмоксипина при данных заболеваниях [107]. Так, курсовое применение мексидола у больных с дисциркуляторной энцефалопатией на фоне артериальной гипертонии и атеросклероза в дозе 300-400 мг/сутки парентерально оказывало выраженное положительное влияние, меньшая доза 200 мг/сутки оказалась недостаточной (дозозависимый эффект препарата) [117, 118].
Исследовано влияние мексидола на реологические свойства крови у больных цереброваскулярными заболеваниями. Препарат проявляет модулирующий эффект в отношении антитромбогенных свойств эндотелия сосудистой стенки при нарушениях в системе гемореологии. Данное свойство мексидола позволяет устранить негативное действие кавинтона, стугерона, сермиона, используемых для лечения инсультов [107, 117]. При изучении мексидола у больных с острыми нарушениями мозгового кровообращения выявлен максимальный клинический эффект при его применении в первые часы от момента развития нарушения мозгового кровообращения (инсульта). Мексидол способствует восстановлению нарушенного после ишемии потребления кислорода и глюкозы мозгом, снижает в крови уровень молочной кислоты и соотношение лак-тат/пируват [93, 94]. Эмоксипин тоже благоприятно влияет на мозговой кровоток. Терапевтическое введение его в дозе 20 мг/кг купировало постишемические цереброваскулярные расстройства. Это может быть связано с влиянием эмоксипина на показатели гемостаза. Он тормозит свертывание крови, что объясняется его способностью усиливать активность гепарина, задерживать образование тромбина и фибрина. Эмоксипин оказывает антиглюкокортикоидное действие, увеличивает выброс серотонина [52, 94].
Анксиолитический и антистрессорный эффекты производных 3-ОП проявляются в условиях различных моделей конфликтных, экстремальных ситуаций в дозах 25-100 мг/кг и по глубине действия сходны с эффектом диазепама. Их можно отнести к группе дневных транквилизаторов. Анксиолитический эффект мексидола не сопровождается седативным, миорелаксантным действием, нарушением памяти в отличие от бензодиазепи-новых транквилизаторов. Однако он может потенцировать действие бензодиазепинов. Установлено, что в реализации угнетающего влияния мексидола на корковые нейроны в более чем 50% случаев участвует ГАМКа-бензодиазепин-рецепторный комплекс. Производные 3-ОП предотвращают стрессорные повреждения желудка, стрессорную ферментемию, оказывая стресспротекторное действие [38, 44].
Ноотропные свойства мексидола, по-видимому, связаны с его мембранопротекторным действием. Мексидол обладает выраженной способностью улучшать процессы обучения и памяти и оказывает отчетливое антиам-нестическое действие, устраняя нарушения памяти, вызванные различными воздействиями [16, 18, 97]. В механизме антиамнестического действия мексидола имеют место его антиоксидантные свойства, причем это действие мексидола проявлялось более отчетливо в условиях патологии позднего возраста [38, 97].
В ходе исследования противосудорожного действия мексидола было выявлено, что препарат в дозах 50, 100 и 300 мг/кг обладал отчетливой способностью увеличивать латентное время наступления судорог (в 1,5-2,2 раза) по сравнению с контролем. Мексидол предупреждает тонический компонент судорог и гибель животных, но не способен оказывать влияния на клонический компонент судорожного припадка. Мексидол имеет сходную противосудорожную активность с фенитоином и меньшую, чем бензодиазепины и фенобарбитал, но превосходит по активности триметадион [38]. Возможность применения мексидола для предупреждения приступов эпилепсии изучалась в ходе нескольких научно-исследовательских работ. Н. Н. Маслова, В. Е. Новиков [78, 88] успешно применяли мексидол в лечении больных посттравматической эпилепсией. Ими было показано, что в/в введение мексидола в течение 10-15 дней в суточной дозе 0,1 г вызывало снижение в плазме крови больных провоспалительного цитокина ИЛ-1р и повышение противовоспалительного цитоки-на ИЛ-4 до уровня здоровых, что свидетельствует о позитивном влиянии препарата на иммунологическую реактивность. Некоторые авторы предлагают комбинированное применение мексидола и депакина, отмечая при этом потенцирование эффекта антиконвульсанта [114]. Мексидол применяли в комплексном лечении больных шизофренией, при этом наблюдалась положительная динамика показателей ПОЛ: снижение уровня малонового диальдегида, уменьшение выраженности перекисного гемолиза эритроцитов, снижение уровня диеновых конъюгатов [65].
Показано, что применение мексидола внутрь при экспериментальном паркинсоническом синдроме ослабляет активацию процесса ПОЛ, снижает проявление олигокинезии и ригидности. Применение мексидола в комбинации с Ь-ДОФА, пролонгирующего его антипаркинсонический эффект, позволило снизить терапевтическую дозу последнего в 5 раз. Мексидол в дозе 100 мг/кг, обладая антиоксидантными свойствами, защищает нигростриатные дофаминергические нейроны от повреждения и гибели при паркинсонизме [66], причем применение мексидола эффективнее для лечения паркинсонизма, протекающего в мягкой форме и в начальных стадиях заболевания. Мексидол обладает способностью потенцировать действие противопаркин-сонических и анксиолитических веществ, уменьшает их побочные эффекты [17]. В медицинскую практику внедрена методика применения мексидола в сочетании с галоперидолом и финлепсином при синдроме Жиль де ля Туретта у детей [34].
Мексидол в дозе 200-300 мг успешно применялся в комплексном лечении тяжелых неврологических заболеваний совместно с нейротрансплантацией фетальных клеток головного мозга человека для улучшения приживаемости в мозг реципиента [131]. Совместное применение мексидола 50 мг/кг и киоторфина 0,05 мг/кг (пептида, выделенного из мозга зимоспящих животных) способствует улучшению постреанимационного восстановления функций ЦНС [85]. Наблюдается взаимное потенцирование нейропротекторной и антистрес-сорной активности препаратов.
Кардиология и кардиохирургия. Ряд научных работ подтверждают кардиопротекторные свойства эмоксипина и мексидола [24, 43, 76, 82]. Мексидол может использоваться в комплексной терапии различных форм ишемической болезни сердца (ИБС). Отмечено, что мексидол ускоряет стабилизацию стенокардии, улучшает клиническое течение инфаркта миокарда, уменьшает содержание в крови липопротеидов, повышает анти-ангинальную эффективность нитратов, но не влияет на эффективность антагонистов кальция и р-блокаторов
[30, 81, 82,]. Выявлено позитивное влияние мексидола на параметры диастолической функции левого желудочка у больных ИБС [24].
Для изучения влияния мексидола, как антиишемического препарата, на эффективность комплексной терапии стабильной и нестабильной стенокардии, было проведено рандомизированное плацебоконтролируемое исследование [82]. Двухнедельная комплексная терапия больных нестабильной стенокардией с включением капсулированной формы мексидола и ампулированного раствора способствовала ускорению стабилизации стенокардии, сокращению периодов нестабильной стенокардии, снижению частоты эпизодов нарушения ритма, улучшению клинического течения болезни. Для лечения больных стабильной стенокардией была вы-орана длительная (6 мес) терапия пролонгированными нитратами и двухнедельный прием мексидола в капсулах (0,3 г в сутки). Мексидол повышал антиангинальную эффективность нитратов: при их неизменной дозе наблюдалось увеличение пороговой мощности, сокращение частоты периодов ишемии. Терапия мексидолом способствует улучшению внутрисердечной гемодинамики уже через 1 месяц лечения и позволяет повысить физическую толерантность больных ИБС [82].
Для лечения больных ИБС с мультифокальным атеросклерозом предложено дополнительно к коронаролити-ческой терапии добавлять 5% раствор мексидола 4 мл внутривенно в сочетании с лазеротерапией в течение 10 дней. Такая тактика приводила к уменьшению частоты и продолжительности периодов ишемии миокарда, уменьшению частоты аритмических осложнений, уменьшению потребности больных в приеме нитропрепа-ратов [29]. Рекомендуется назначать эмоксипин и мексидол больным пожилого и старческого возраста при сочетании ИБС с различными проявлениями деменции (сосудистого или другого генеза) [87].
В литературе приводятся клинические и экспериментальные данные, свидетельствующие о потенцировании мексидолом и эмоксипином противоаритмической активности ряда антиаритмиков. Исследованы некоторые аспекты механизма противоаритмического действия препаратов. Так, мексидол предупреждает опосредованное ишемией высвобождение норадреналина из симпатических терминалей, чем уменьшает повреждающее адренергическое воздействие на кардиомиоциты. Механизм противоаритмического действия эмоксипи-на опосредован уменьшением энергодефицита и степени метаболического ацидоза. Препарат на 15-20% повышает эффективность 10-дневного традиционного нейрометаболического лечения экстрасистолии, непаро-ксизмальной тахикардии и положительно влияет на параметры гемодинамики [12, 60].
Отмечено, что мексидол и эмоксипин уменьшают выраженность некоторых побочных эффектов верапамила, нибентана и амиодарона и в связи с этим они могут быть рекомендованы как компоненты противоаритми-ческой терапии в сочетании с классическими антиаритмиками для увеличения их эффективности и снижения побочных эффектов [55].
Мексидол — это перспективное средство повышения эффективности и безопасности лечения аритмий в детском возрасте (дети от 3 до 6 лет). Комплексная терапия нарушений ритма у детей антиаритмиками в половинных дозах и мексидолом (10 мг/кг/сут в/в 10 дней) была на 15% эффективнее, чем при монотерапии полными дозами противоаритмических средств (финоптин). При этом частота развития побочных эффектов уменьшилась на 30%. Использование повторных курсов мексидола (1 раз в 2-3 месяца) повышает эффективность лечения нарушений ритма и проводимости у детей на 20% [4, 5, 6]. Показана перспективность применения мексидола в комплексном лечении и профилактике кризов у больных гипертонической болезнью [25], а также в кардиохирургической практике для противоишемической защиты миокарда и головного мозга после операций по поводу врожденных и приобретенных пороков сердца.
Эмоксипин (50 мг/кг) и мексидол (50 мг/кг) оказывают кардиопротекторное действие при острой ишемии головного мозга, сопоставимое с эффектом пропранолола (0,1 мг/кг). Однако преимуществом препаратов антиоксидантного типа действия, по сравнению с пропранололом, является отсутствие у них отрицательного хронотропного эффекта [115]. Доказана возможность увеличения латентного периода развития острого це-реброкардиального синдрома на фоне профилактического введения эмоксипина [11].
Эндокринология. При сахарном диабете и в развитии его осложнений одним из важных патогенетических механизмов является окислительный стресс, проявляющийся в ускорении процессов перекисного окисления липидов и снижении активности антиоксидантной системы. Это послужило предпосылкой к изучению эффективности антиоксидантов при этой патологии. В серии опытов по инкубации крови с мексидолом (0,005 мг/мл и 0,025 мг/мл) и эмоксипином (0,0125 мг/мл) зафиксировано достоверное снижение уровня глюкозы в крови больных сахарным диабетом средней степени на 17 и 36% в группах мексидола соответственно, отмечено снижение содержания МДА по сравнению с контролем на фоне резкого роста каталазной активности. Степень выраженности корригирующего эффекта мексидола у больных с тяжелым сахарным диабетом была выше. Приведенные данные свидетельствуют о том, что мексидол эффективно модифицирует функциональную активность эритроцитов, повышая их способность к утилизации глюкозы и достоверно корригирует процессы липопероксидации. Эмоксипин по эффективности значительно уступал мексидолу [15].
Установлено, что мексидол повышает чувствительность тканей к действию инсулина путем стимулирования прямого окисления глюкозы в пентозофосфатном шунте, снижая тем самым глюкозотоксичность в отношении к транспортерам глюкозы, инсулиновым рецепторам и ферментам. Применение мексидола и эмоксипина при экспериментальном аллоксановом сахарном диабете на фоне гиперхолестеринемии способствовало нивелированию нарушений липидного обмена. Наиболее эффективно восстанавливал уровень триглицеридов и p-липопротеидов эмоксипин. Мексидол оказывал более выраженный корригирующий эффект в отношении холестерина ЛПВП, превосходя эффект а-токоферола [23, 53, 76]. При остром панкреатите мексидол уменьшает расстройства обмена липидов в поджелудочной железе, что свидетельствует о мембранопротек-торной способности препарата при этой патологии [21]. В экспериментах на крысах показано, что интрадук-тальное введение мексидола существенно снижает летальность при остром панкреатите, при внутрибрю-шинном введении препарата летальность крыс возрастает [45, 46].
Акушерство и гинекология. Мексидол повышает резистентность организма к воздействию экстремальных факторов и кислородзависимым патологическим состояниям. Поэтому его применяют при гипоксических состояниях в акушерстве. При хронической гипоксии плода показаны умеренные защитные свойства мекси-дола при длительном введении. Применение препарата у новорожденных с 5-7 дня жизни (0,1- 0,2 мл/кг массы внутривенно капельно на 10% растворе глюкозы) не выявило каких-либо побочных реакций. У детей, получавших мексидол, повышался уровень глюкозо-6-фосфодиэстеразы [70, 123]. В гинекологии мексидол
применяли при лапароскопических операциях, после операции кесарева сечения. Доказано, что местное ин-траоперационное введение мексидола нормализует ПОЛ, снижает частоту возникновения и рецидива образования послеоперационных спаек за счет уменьшения воспалительных реакций и улучшения репарации тканей. Разработан метод эндохирургического лечения бесплодия с применением мексидола [8, 76].
Гастроэнтерология. Имеются данные о том, что активация свободнорадикального окисления в покровно-эпителиальном пласте может стать одним из факторов, угнетающих резистентность слизистой оболочки га-стродуоденальной зоны [120]. С целью профилактики ульцерогенного действия НПВС мексидол вводили внутримышечно или внутрижелудочно в дозе 25 мг/кг. Это приводило к уменьшению количества и общей площади язвенных поражений, снижению общей площади глубоких язв и перфорации язв. При сформированной индометациновой язве мексидол достоверно снижал количество и площадь глубоких дефектов в 3 раза и 4,5 раза соответственно [132]. В последние годы в медицинской практике возникло новое направление в лечении эрозивно-язвенных поражений гастродуоденальной зоны природными и синтетическими антиок-сидантами, биологическая эффективность которых определяется наличием в первую очередь гидрокси- или ароматических группировок, что обуславливает их участие в регуляции ПОЛ. Имеются сообщения о применении электрофореза с эмоксипином в комплексном лечении больных язвенной болезнью обоих локализаций язв, что является экономически выгодным способом репарации язвенных дефектов [95, 96]. Учитывая сложность и многофакторность патогенеза язвенной болезни, обосновывается включение антиоксидантов в комплексную терапию как при обострении, так и в качестве противорецидивной терапии [80].
Данные литературы свидетельствуют о благотворном действии мексидола на кишечник при перитоните за счет восстановления микроциркуляции. Восстановление морфофункционального состояния кишечника сопровождается снижением активности фосфолипазы А2 и торможением процесса ПОЛ. Показана высокая эффективность совместного применения цитохрома С, гипоксена, эмоксипина, витамина С, мафусола при разлитом перитоните [31, 67]. Эмоксипин применяли для лечения паралитической кишечной непроходимости [74].
Гепатопротекторные свойства мексидола и эмоксипина изучены в ряде экспериментальных работ [38, 111, 116, 128]. Производные 3-оксипиридина обладают выраженным защитным эффектом при токсическом поражении печени, эффективно предотвращают угнетение ферментной функции, снижают тяжесть деструктивных изменений паренхимы, активируют дезинтоксикационную функцию печени. При токсическом гепатите, вызванном четыреххлористым углеродом, гепатопротекторный эффект отмечен после длительного введения мексидола в дозе 10 мг/кг. Использование мексидола в дозе 100 мг/кг, напротив, способствовало возникновению более выраженных нарушений [128]. Возможна коррекция мексидолом гепатотоксичности, индуцируемой туберкулостатиками (побочное действие противотуберкулезных препаратов). При этом гепа-топротекторная активность мексидола в дозе 25 мг/кг при подкожном введении через день сопоставима с активностью гептрала (8-аденозил-Ь-метионин), а в дозе 50 мг/кг препарат по всем показателям оказался эффективнее гептрала [49].
Мексидол оказывает протективное действие при повреждениях печени в условиях острого иммобилизацион-ного стресса у крыс (нормализует содержание билирубина, дезинтоксикационную функцию печени), улучшает состояние печени в условиях гипоксии и эндотоксемии, при ишемическом поражении гепатоцитов [36, 51, 73]. Препарат можно использовать в качестве неспецифической терапии при прогрессировании патологического процесса в печени [128]. Применение мексидола при печеночной недостаточности больных острым панкреатитом показало, что гепатопротекторное действие препарата выраженнее, чем семакса (в эксперименте) и эссенциале (в клинике), особенно на ранних стадиях заболевания [110]. Однако неконтролируемое профилактическое и лечебное применение мексидола может привести как к прогрессированию атеросклероза, так и к жировой дистрофии печени [69].
Хирургия и травматология. Для местного лечения гнойных ран используются перевязочные материалы с иммобилизованным мексидолом [40]. Системное введение мексидола в дозах 5 мг/кг и 25мг/кг применяли для коррекции активности ПОЛ при ожогах, в комплексной терапии больных с ингаляционной травмой [26, 130]. В работе Р.Ч. Муршудли [83] выявлено, что мексидол и комплексированные ионы меди эффективно ингибируют ПОЛ мембран липосом, обладают выраженной антимикробной активностью по отношению к большинству штаммов микроорганизмов. Парентеральное применение мексидола и местное использование биологически активных раневых покрытий (мексидол с трипсином и ионами меди) ограничивают расширение вторичного некроза, способствуют очищению огнестрельных ран. Поликомпонентность действия, отсутствие побочных эффектов определяют мексидол, как один из наиболее перспективных антиоксидантов для применения в госпиталях при различных травмах, шоке, болевом синдроме, острой интоксикации и гнойно-воспалительных процессах [17, 19].
Офтальмология. Эмоксипин обладает выраженным ретинопротективным действием. Препарат используют при лечении ряда офтальмологических заболеваний [50, 138]. Это субконъюктивальные и внутриглазные кровоизлияния, ангиоретинопатии различной этиологии, включая диабетическую, для защиты и лечения роговицы и сетчатки при воздействии света высокой интенсивности, при экспериментальной глаукоме [38, 59].
Стоматология. Способность мексидола влиять на течение хронического генерализованного пародонтита используется в стоматологической практике. При хроническом парадонтите апликация 1% водного раствора на десны, а так же ультрафонофорез 1% раствора мексидола способствуют прекращению кровоточивости десен после лечебных мероприятий, улучшению общего самочувствия. За счет своего транквилизирующего эффекта возможно использование мексидола для премедикации стоматологических больных с патологией сердечно-сосудистой системы. Препарат в виде 5% раствора 2 мл внутримышечно за 10 минут до начала лечения устраняет чувство тревоги, страха, напряжения. [68, 119, 124].
Другие области медицины. Введение эмоксипина и мексидола в дозе 5 мг/кг в/м в течение 10 дней позволяет ограничить степень выраженности нарушений функционального состояния почек после моделирования со-четанной индометациново-гентамициновой нефропатии [127]. Получены свидетельства благоприятного влияния эмоксипина на эффективность лечения больных дифтерией [3]. Применяют эмоксипин в клинике кожных болезней для лечения экзем, контактных дерматитов. Доказана его эффективность в комплексной терапии бронхиальной астмы и атопического дерматита у детей в период обострения [38, 58]. Среди биологических свойств производных 3-оксипиридина выделяют противоопухолевую активность и геропротек-торные свойства. Предположено, что в основе геропротекторного действия препаратов лежит их способ-
ность уменьшать скорость возрастного расходования природных антиоксидантов. Применение эмоксипина, начиная с 8-месячного возраста животных, приводило к замедлению старения в 1,8 раза, что может служить обоснованием для клинического применения препарата у лиц с наследственными заболеваниями, для которых характерны симптомы преждевременного старения и высокая частота злокачественных заболеваний. Мексидол оказывает выраженное миелопротекторное действие при применении противоопухолевых средств, установлен дозозависимый характер цитопротекторного действия мексидола при введении цикло-фосфана и доксорубицина. Мексидол уменьшает выраженность и частоту развития побочных эффектов проводимого химиотерапевтического лечения противоопухолевыми средствами у больных раком молочной железы, снижая частоту и выраженность лейкопении и нейтропении [38, 109]. Производные 3-оксипиридина представляют перспективный класс радиопротекторов, которые обеспечивают защиту от облучения на клеточном и организменном уровне. Мексидол усиливает регенераторную способность костного мозга, ускоряя процессы восстановления клеточного состава периферической крови при воздействии ионизирующего облучения [38, 125].
Таким образом, разработанные на основе 3-оксипиридина лекарственные препараты мексидол (мексикор) и эмоксипин, обладают уникальными фармакологическими свойствами, обусловленными, прежде всего, их выраженной антиоксидантной и антигипоксантной активностью. Препараты имеют широкий спектр фармакологических эффектов, достаточно большую широту терапевтического действия, малотоксичны и заслуженно нашли эффективное применение в клинической практике в различных областях медицины. Новые производные 3-оксипиридина заслуживают дальнейшего экспериментального изучения в качестве потенциальных лекарственных веществ. Вместе с тем, необходимо с большой осторожностью применять лекарственные вещества, механизм действия которых основан на антиоксидантных свойствах, поскольку известно, что антиоксиданты способны становиться прооксидантами в зависимости от условий реакций. На фоне генетической гетерогенности антиоксидантных систем такие препараты у одних больных могут вызывать ожидаемый защитный эффект, в то время как у других — прооксидантное действие [102].
Литература
1. Абрамченко В.В. Антиоксиданты и антигипоксанты в акушерстве (оксидативный стресс в акушерстве и его терапия антиоксидан-тами и антигипоксантами).- С-Пб., 2001.-400с.
2. Авакян А.Р., Лазарев А.И., Прокопенко Л.Г. и соавт. Иммуномодулирующее действие активаторов обмена углеводов при остром холодовом стрессе // Эксперим. и клин. фармакология.-2002.- №3.-с.50-53.
3. Амбалов Ю.М. Влияние эмоксипина на некоторые клинические и биохимические показатели у больных дифтерией. // Справочник НИР-1999.- №4.
4. Балыкова Л.А. Экспериментально-клиническое исследование эффективности метаболической терапии нарушений ритма сердца: Автореф. дис…. докт. мед. наук.- Казань.- 1999.
5. Балыкова Л.А., Балашов В.П., Смирнов Л.Д. и соавт. Опыт применения мексидола для лечения нарушений ритма и проводимости у детей // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека».- Смоленск, 2001.- с.264-266.
6. Балыкова Л.А. Влияние мексидола на эффективность традиционной терапии синдрома слабости синусового узла у подростков // Эксперим. и клин. фармакол.-2003.-№5.-с.25-27.
7. Батищев С.А. Фармакологическая коррекция острого гнойного пиелонефрита у больных мочекаменной болезнью с метаболическим Х-синдромом в послеоперационном периоде: Автореф. дисс… канд.мед. наук.-Смоленск, 2003.
8. Бейлин В.С. Применение мексидола при эндоскопических операциях в гинекологии: Автореф. дисс… канд. мед. наук.- М.-2002.
9. Белостоцкий Н.И., Амиров Н.Ш. Язвообразование в слизистой оболочке желудка и лизосомный аппарат // Современные аспекты патогенеза, перспективы диагностики и лечения в гастроэнтерологии: Труды 30-й конференции гастроэнтерологов.- Смоленск, 2002.- с.3-12.
10. Васильев Ю.В. Язвенная болезнь двенадцатиперстной кишки и возможности альтернативной медикаментозной терапии // Медицинский консилиум.-М., 2003.-№1.-с.7-10.
11. Ведяшкина И. А. Влияние эмоксипина, мексидола и цитохрома на биоэлектрическую активность миокарда при острой ишемии головного мозга: Автореф. дисс…. канд. мед. наук.- Саранск,1999.
12. Верещагина В.С. Исследование некоторых аспектов механизма противоаритмического действия димефосфона и мексидола: Автореф. дисс… канд. мед. наук.- М., 2002.
13. Виноградов В.М., Криворучко Б.И. Фармакологическая защита мозга от гипоксии // Психофармакология и биол. наркология.-2001.-№1.- с.27-37.
14. Винтин Н.А. Влияние димефосфона, мексидола и вамина на гемостаз и перекисное окисление липидов при длительном иммобили-зационном стрессе: Автореф. дис…. канд. мед. наук.- Саранск,1999.
15. Волкова Н.А. Влияние некоторых антиоксидантов на функциональную активность эритроцитов больных сахарным диабетом //Сбор. тезисов 2-го Съезда Росс. науч. Общ. фармакологов.- М., 2003.- с.102.
16. Воронина Т.А. Антиоксидант мексидол. Основные нейропсихотропные эффекты и механизм действия// Психофармакология и биологическая наркология.- 2001.-№1.- с.2-12.
17. Воронина Т.А., Смирнов Л.Д., Дюмаев К.М. Актуальные направления применения антиоксиданта мексидола // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека».- Смоленск, 2001.- с.191-193.
18. Воронина Т. А., Смирнов Л. Д., Горейнова И.И. Механизм действия и обоснование применения препарата мексидол в неврологии. // Мат. научно-практич. конф. по неврологии.- М., 2000.- с.18.
19. Воронина Т.А., Смирнов Л.Д., Дюмаев К.М. Возможности применения мексидола в экстремальных ситуациях. // Человек и лекарство: Тез.докл.7 Росс. нац. конгр.- М., 2000.- с.483.
20. Владимиров Ю.А. Свободные радикалы и антиоксиданты // Вестник РАМН.- М., 1998.- №7.- с.43-51.
21. Власов А.П., Трофимов В.А., Березин В.А. и соавт. Модификация обмена липидов при панкреатите под влиянием мексидола // Эксперим. и клин. фармакология.- 2003.-№1.- с.40-45.
22. Выборнова И.А. Ранняя диагностика, профилактика и лечение эндометрита после кесарева сечения: Дисс… канд. мед. наук.- Смоленск, 2000.-133с.
23. Гаврилова Л.В. Влияние некоторых антиоксидантов на гемостаз при экспериментальной дислипидемии, артериальной гипертонии и сахарном диабете второго типа: Автореф. дисс… канд. мед. наук.- Саранск, 2001.
24. Гарькин Г.Г. Сравнительная оценка кардиопротекторного эффекта обзидана, мексидола, эмоксипина, димефосфона и предуктала при ишемии миокарда: Автореф. дисс… канд. мед. наук.- Саранск, 2001.
25. Голиков А.П., Лукьянов М.М., Рябинин В.А. и соавт. Мексикор в комплексном лечении и профилактике кризов у больных гипертонической болезнью // Клинические исследования лекарственных средств в России. — 2003.-№3-4.- с. 56-59.
26. Голиков П.П., Матвеев С.Б., Логинов Л.П. и соавт. Применение антиоксиданта мексидола в коррекции процессов ПОЛ у больных с ингаляционной травмой // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека».- Смоленск, 2001.- с.209-210.
27. Горенкова Н.А., Назаренко И.В., Смирнов Л.Д. и соавт. Влияние мексидола на процессы восстановления функций ЦНС после 12-минутной остановки сердца //Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека».- Смоленск, 2001.- с.210-212.
28. Григорьев П.Я. Фармакотерапия болезней органов системы пищеварения // Труды 7 Рос. Нац. конгресса «Человек и лекарство».-М., 2000. — с.407-421.
29. Горяйнова И.И., Ойноткинова О.Ш., Дронова Т.Е.и соавт. Использование мексидола и гелий-неонового лазерного излучения в комплексном лечении больных ИБС с мультифокальным атеросклерозом // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека».- Смоленск, 2001.- с.114-116.
30. Горячева Т.В. Исследование противоаритмической активности препарата мексикор в эксперименте: Автореф. дис…. канд. мед. наук.- Саранск, 2003.- 16 с.
31. Гусев В.А. Влияние мексидола на морфофункциональное состояние тканей кишечника при перитоните: Автореф. дис… канд. мед. наук.-Саранск, 2000.
32. Густоварова Т.А., Крюковский С.Б., Иванян А.А. и соавт. Экспериментальные данные эффективности применения мексидола в процессе заживления асептических ран // Сборник науч. трудов «Вестник Смоленской мед. академии».-1998.-с.113-114.
33. Густоварова Т.А. Применение мексидола в профилактике и лечении нагноений ран промежности в акушерстве: Автореф. дис… канд. мед. наук.- Смоленск, 1999.
34. Дахаева Л.Н. Компьютерное нейрокартирование головного мозга при синдроме Жиль де ля Туретта у детей: Автореф. дис… канд. мед. наук.-М.,1998.
35. Девяткина Т.А., Бречко В.В., Тарасенко Л.М. и соавт. Антиоксиданты как средства коррекции адаптации // Тезисы докладов 6 Всесоюзного съезда фармакологов.- Ташкент, 1988.- с.111-112.
36. Девяткина Т.А., Луценко Р.В., Важничая Е.М. Фармакологическая активность мексидола при стрессорных повреждениях печени. //Эксперим. и клин. фармакология.-2003.- №3.-с.56-58.
37. Девяткина Т.А., Луценко Р.В., Важничая Е.М. и соавт. Влияние мексидола и его структурных компонентов на содержание углеводов и ПОЛ при остром стрессе // Вопросы мед. химии.-1999, т.45-№3.-с.246-249.
38. Дюмаев К.М., Воронина Т.А.,Смирнов Л.Д. Антиоксиданты в профилактике и терапии патологий ЦНС.- М., 1995.-272 с.
39. Ефимов Е.В., Блувштейн Г.А., Степанов С.А. Современные представления об острых послеоперационных язвах пищеварительного тракта //Труды 30-й конф. гастроэнтерологов «Современные аспекты патогенеза, перспективы диагностики и лечения в гастроэн-терологии».-Смоленск, 2002.-с.23-26.
40. Жинко Ю.Н. Применение перевязочных материалов с мексидолом, иммобилизованным методом текстильной печати, для лечения гнойных ран: Автореф. дисс. …канд. мед. наук. — М., 1999.
41. Зайцев В.Г., Островский О.В., Закревский В.И. Антиоксидантное и прооксидантное действие химических соединений в модельной системе в условиях длительно протекающего процесса ПОЛ // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека». — Смоленск, 2001.- с.30-32.
42. Зайцев В.Г., Островский О.В., Закревский В.И. Связь между химическим строением и мишенью действия как основа классификации антиоксидантов прямого действия // Эксперим. и клин. фармакология.-2003.- №4.- с.66-70.
43. Зорькина А.В. Экспериментальное исследование кардиопротекторного действия некоторых отечественных антиоксидантов в условиях миокардиодистрофии. // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека».- Смоленск, 2001.- c.118-119.
44. Зорькина А.В., Костин Я.В., Инчина В.И. и соавт. Антиокислительные и гиполипидемические свойства мексидола и эмоксипина при длительном иммобилизационном стрессе // Химико-фармацевтическ. журнал-1998.-№5.-с.3-5.
45. Иванов Ю.В., Яснецов В.В., Матюшин И.А. Поиск в эксперименте новых средств фармакотерапии острого панкреатита // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека».- Смоленск, 2001.-с. 225226.
46. Иванов И.В., Яснецов В.В. Влияние семакса и мексидола на течение острого панкреатита у крыс // Эксперим. и клин. фармакол.-2000.-т.63.-№1.-с.41-44.
47. Капелько В.И. Активные формы кислорода, антиоксиданты и профилактика заболеваний сердца //Русский медицинский журнал.-2003.- т.11, №21.-с.1185-1188.
48. Карпова Е.Л. Сравнительная стресс-протекторная эффективность растительных адаптогенов и синтетических пептидов: Автореф. дисс. … канд. мед. наук.- Смоленск, 2002. -24с.
49. Катикова О.Ю., Смирнов Л.Д. Коррекция мексидолом гепатотоксичности, индуцируемой туберкулостатиками у крыс. // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека».- Смоленск, 2001.-с.148-150.
50. Катунина Н.П. Изучение антигипоксической активности новых производных 3-оксипиридина, бензимидазола, оксиникотиновой кислоты и меркаптобензимидазола: Автореф. дисс. …канд. биол. наук.- Смоленск, 2002.
51. Кечемайкин В.Н. Эффективность внутрипортальных инфузий эмоксипина в комплексе с озонированным физиологическим раствором при лечении комбинированной травмы: Автореф. дисс… канд. мед. наук.- Саранск, 2002.
52. Кильдюшова Л.Н. Влияние эмоксипина и цитохрома С на некоторые показатели гемостаза при остром нарушении мозгового кровообращения: Автореф. дисс…канд. мед. наук.-Саранск, 2000.
53. Кокорева Е.В., Инчина В.И., Цыганова Е.Ю. и соавт. Влияние мексидола и димефосфона на углеводный обмен и состояние пере-кисного окисления липидов у крыс с аллоксановым диабетом // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека».- Смоленск, 2001.-с.181-182.
54. Косолапов В.А., Степанов А.В., Спасов А.А. Антиоксиданты: современное состояние, проблемы. Создание на их основе церебро-протекторных средств. // Сбор тезисов 2-го Съезда Росс. Науч. Общ. фармакологов.-М.,2003.-с.263.
55. Котляров А.А., Куркина Н.В., Смирнова Л.Э. и соавт. Исследование влияния мексидола, эмоксипина и димефосфона на электрофизиологические эффекты нибентана // Эксперим. и клин. фармакология.- 2002.-№2.-с.27-30.
56. Кошелев В.В. Обоснование психофармакотерапии психических расстройств у ликвидаторов последствий катастрофы на Чернобыльской АЭС (клинико-фармакологическое исследование): Автореф. дисс…. канд. мед. наук.- М., 1999.
57. Клебанов Г.И., Любицкий О.Б., Васильева О.В. и соавт. Антиоксидантные свойства производных 3-оксипиридина: мексидола, эмоксипина и проксипина // Вопросы медицинской химии.-2001.-№3.-с.25-27.
58. Климова Н.В. Применение антиоксиданта эмоксипина в комплексной терапии бронхиальной астмы и атопического дерматита у детей. //Справочник НИР.- 2003.-№4.
59. Корелина В.Е. Изучение коррекции перекисного окисления липидов антиоксидантами при экспериментальной глаукоме (экспериментальное исследование): Автореф. дисс….канд. мед. наук.- С-Пб., 1999.
60. Корнилова Т.И. Экспериментально-клиническое исследование противоаритмической активности эмоксипина: Автореф. дис… канд. мед. наук.- Саранск, 2002.
61. Косолапов В.А., Островский О.В., Спасов А.А. Влияние антиоксидантных средств на процесс хемилюминесценции // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека».- Смоленск, 2001.- с.40-41.
62. Кравцова О.Ю., Сариев А.К., Жердев В.П. Биотрансформация мексидола (экспериментальные и клинические данные) // Сбор.тезисов 2-го Съезда Росс. науч. общ. фармакологов.-М., 2003.-с.271.
63. Крюковский С.Б., Выборнова И.А., Густоварова Т.А. и соавт. Местное применение мексидола в профилактике гнойно-септических осложнений после кесарева сечения // Сбор. науч. трудов «Вестник Смоленской мед. академии».- 1998.-с.175-176.
64. Кулагин К.Н., Новиков В.Е., Смирнов Л.Д. Сравнительная оценка антиоксидантной активности некоторых производных 3-ОП на модели черепно-мозговой травмы. // Сбор.тезисов 2-го Съезда Росс. науч. общ. фармакологов.-М., 2003.-c.285.
65. Кутько И.И., Фролов В.М., Пустовой Ю.Г. и соавт. Антиоксиданты в лечении шизофрении (коррекция процессов ПОЛ) // Журнал неврологии и психиатрии им С.С.Корсакова.- 1996.- т.96, №6.- с.32-35.
66. Кучеряну В.Г. Мексидол усиливает противопаркинсоническое действие L-Дофа на модели МФТП-индуцированного паркинсонизма // Эксперим. и клин. фармакол.- 2001.- т.64, №1.-с.22-25.
67. Лапшихин А.П. Многокомпонентная антиоксидантная терапия при разлитом перитоните как профилактика полиорганной недостаточности: Автореф. дис… канд. мед. наук.- М., 2001.
68. Ларенцова Л.И., Воронина Т.А., Максимовский Ю.М. и соавт. Антиоксидант мексидол для премедикации стоматологических больных с патологией сердечно-сосудистой системы // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиосиданты и болезни человека».- Смоленск, 2001.- с.228-230.
69. Лебкова Н.П. Влияние мексидола на ультраструктуру гепатоцитов в норме и при экспериментальном атеросклерозе // Материалы 3 Всерос. конф. «Гипоксия, механизмы, адаптация, коррекция».- М., 2002.-с.74-75. .
70. Левитина Е.В. Влияние мексидола на клинико-биохимические проявления перинатальной гипоксии у новорожденных детей. // Эксперим. и клин. фармакология.-2001.-т.64, №5.- с.34-36.
71. Лукьянова Л.Д. Современные проблемы гипоксии // Вестник РАМН.-2000.-№9.-с.3-12.
72. Лукьянчук В.Д., Савченкова Л.В. Антигипоксанты: состояние и перспективы // Эксперим. и клин. фармакол.-1998.-№4.-с.72-79.
73. Лунева Н.В. Иммуномодулирующее, антиоксидантное и гепатопротекторное действие мексидола и персульфата натрия в условиях ишемии печени: Автореф. дисс… канд. мед. наук.- Курск, 1998.
74. Магомедов М.А. Местное применение антиоксидантов в комплексном лечении больных с паралитической кишечной непроходимостью: Автореф. дисс…. канд. мед. наук.- М.,1998.
75. Маев И.В., Вьючнова Е.С., Грищенко Е.Б. Современные принципы лечения кислотозависимых заболеваний // Клиническая меди-цина.-2003.-№1.-с.56-62.
76. Макарова М.Ю. Оценка кардиопротекторного действия некоторых препаратов с антиоксидантной активностью при сочетании экспериментального диабета с физической нагрузкой: Автореф.дисс….канд.мед.наук.- Саранск, 2003.
77. Марышева В.В., Шабанов П.Д. Исследование биологической активности соединений имидазо(4,5-Ь)индола // Сбор. тез. 2-го Съезда Рос. науч. общ. фармакологов, ч.2.-2003.-с.17.
78. Маслова Н. Н. Патогенез и лечение симптоматической посттравматической эпилепсии: Автореф. дис… д-ра мед. наук. — М., 2003.46 с.
79. Матюшин И.А., Балабаньян В.Ю., Кудрин В.С. и соавт. Антирадикальная и антиоксидантная активность ряда нейротропных и антигипоксических средств // Труды нац. научно-практ. конф. с меж-дун. участием «Свободные радикалы, антиоксиданты и болезни человека».- Смоленск, 2001.- с.46-48.
80. Махакова Г.Ч., Сыбденова Л.П., Панасенко О.М. Изучение перекисного окисления липидов, антиоксидантной активности у больных ЯБЖ и двенадцатиперстной кишки // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека».- Смоленск, 2001.- с.152-153.
81. Михин В.П., Михайлова Т.Ю., Харченко А.В. и соавт. Эффективность пролонгированных нитратов у больных стабильной стенокардией напряжения на фоне сочетанного применения мексикора // Клинические исследования лекарственных средств в России.-2003.-№2.-с.23-26.
82. Михин В.П., Смирнов Л.Д., Васильева Н.В. и соавт. Влияние антиишемического препарата мексидол на эффективность комплексной терапии стабильной и нестабильной стенокардии // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека».- Смоленск, 2001.-с.127-129.
83. Муршудли Р.Ч. Новые подходы к лечению экспериментальных огнестрельных ран мягких тканей (экспериментальное исследование): Автореф. дисс… канд. мед. наук. — М., 2002.
84. Мышкин В.А., Кривоногов В.П., Гуляева И.Л. и соавт. Фармакологическая коррекция ПОЛ при экспериментальных интоксикациях химическими веществами // Сбор. Тез. 2-го Съезда Рос. науч. общ. фармакологов.- М.,2003.- ч.2.- с.40.
85. Назаренко И.В., Горенкова Н.А., Смирнов Л.Д. Улучшение постреанимационного восстановления функций ЦНС с помощью совместного применения мексидола и киоторфина // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, ан-тиоксиданты и болезни человека».- Смоленск, 2001.- с.214-216.
86. Новиков В.Е., Маслова Н.Н., Тургенева Л.Б. и соавт. Клиническая фармакодинамика мексидола // Сбор.тезисов 2 Съезда Рос. науч. общ. фармакологов.- М., 2003.-с.57.
87. Новиков В.Е., Катунина Н.П. Фармакология и биохимия гипоксии //Обзоры по клинической фармакологии и лекарственной терапии.- 2002.- т.1.-с.73-87.
88. Новиков В.Е., Маслова Н.Н. Влияние мексидола на течение посттравматической эпилепсии // Эксперим. и клин. фармакология.-2003.-№4.-с.9-11.
89. Оковитый С.В., Смирнов А.В. Антигипоксанты // Эксперим. и клин. фармакология.- 2001.-т.64, №3.- с.76-80.
90. Окуневич И.В., Сапронов Н.С., Рыженков В.Е. и соавт. Гиполипидемическая и антиоксидантная активность бисанионов, содержащих серу // Химико-фармацевтический журнал.-1999.-№11.-с.14-16.
91. Парфенов Э.А., Смирнов Л.Д. Основные направления разработки антиоксидантов медицинского назначения // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека».- Смоленск, 2001. — с.51-52.
92. Поварова О.В., Каленикова Е.И. и соавт. Антиоксиданты как нейропротекторы при ишемическом инсульте // Эксперим. и клин. фармакология.-2003.-№3.-с.69-73.
93. Погорелый В.Е., Арльт А.В., Гаевый М.Д. и соавт. Противоишемические эффекты производных 3-ОП при цереброваскулярной патологии // Эксперим. и клин. фармакология.-1999.-№5.-с.15-17.
94. Погорелый В.Е., Гаевый М.Д. Изучение действия эмоксипина, лития оксибутирата и пикамилона на кровообращение ишемизиро-ванного мозга // Эксперим. и клин. фармакология.- 1999.-№6.-с.26-28.
95. Подопригорова В.Г., Хибин Л.С., Козлов Н.Б. и соавт. Изучение эффективности синтетических антиоксидантов в лечении больных язвенной болезнью (открытое контролированное рандомизированное исследование) // Клиническая медицина.- 1999.-№3. -с.32-35.
96. Подопригорова В.Г. Роль свободнорадикального окисления липидов и антиоксидантных систем в патогенезе и саногенезе язвенной болезни желудка и двенадцатиперстной кишки, возможности коррекции антиоксидантами: Автореф. дисс… докт. мед. наук.-М., 1998.
97. Проворнова Н.А. Коррекция ноотропами мнестических расстройств, вызванных некоторыми экстремальными воздействиями: Автореф. дисс…. канд. биол. наук.- М.,1999.
98. Радынова С.Б. Влияние эмоксипина и гелий-неонового лазерного излучения на некоторые показатели гомеостаза у женщин при индуцированном позднем аборте: Автореф. дисс…. канд. мед. наук.- 2003, Саранск. — 16 с.
99. Рууге Э.К. Коэнзим Q: электронный переносчик, антиоксидант и прооксидант // Нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека». Смоленск, 2001.-с.56-57.
100.Самойлов Н.Н. Фармакологическая коррекция физической работоспособности.- М., 2002. -120 с.
101.Сариев А.К., Давыдова И.А., Незнамов Г.Г. и соавт. Взаимосвязь глюкуронконъюгации мексидола и особенностей его терапевтического действия у больных с органическими поражениями ЦНС // Эксперим. и клин. фармакология.- 2001.- т.64, №3. -с.17-21.
102.Середенин С.Б. Проблема индивидуальной чувствительности в фармакологии // Труды 7 Рос. Нац. конгресса «Человек и лекарство».- М., 2000.- с.96-124.
103.Сергеева С.А., Гуляева И.Л., Красных Л.М. Экспериментальная фармакокинетика актопротекторов — производных бензимидазола и адамантана в жировой ткани при однократном и курсовом введении // Сбор.тезисов 2 Съезда Рос. науч. общ. фармакологов. -М., 2003.- с.155.
104.Сизаева В.Э. Зависимость актопротекторной активности некоторых производных 3-оксипиридина от их химической структуры // Сбор.тезисов 2-го Съезда Рос. науч. общ. фармакологов. -М., 2003.- с.167.
105.Смирнов А.В., Криворучко Б.И. Антигипоксанты в неотложной медицине // Анестезиология и реаниматология.-1998. — № 2.-с.50-55.
106.Смирнов В.С., Кузьмич М.К. Фармакология гипоксена // Сбор. тезисов 2-го Съезда Рос. науч. общ. фармакологов. — М., 2003.- ч.2.-с.173.
107.Смирнов Л.Д. Антиоксиданты гетероароматического ряда. Структура, активность, медицинское применение // Сбор. тезисов 2-го Съезда Росс. науч. общ. фармакологов. -М., 2003.- с.171.
108.Смирнов Л.Д., Инчина В.И., Волкова Н.А. Фармакологическая коррекция антиоксидантами показателей углеводного и липидного обменов при экспериментальном сахарном диабете на фоне гиперхолестеринэмии // Сбор. тезисов 2-го Съезда Росс. науч. общ. фармакологов. -М., 2003.-с.172.
109.Смирнов О.Н. Влияние мексидола на некоторые побочные эффекты циклофосфана и доксорубицина (экспериментально-клиническое исследование): Автореф. дис….канд. мед. наук.- Саранск, 2000.
110.Соловьев Н.А. Применение мексидола при печеночной недостаточности больных острым панкреатитом (экспериментально-клиническое исследование): Автореф. дис… канд. мед. наук.- М., 2002.
111.Солонина Н.В. Изучение гепатопротекторной активности некоторых антиоксидантов при экспериментальной свинцовой интоксикации // Сбор. тезисов 2-го Съезда Рос. науч. общ. фармакологов.- 2003.- с.183.
112.Спасов А.А., Иежица И.Н., Бугаева Л.И. и соавт. Спектр фармакологической активности и токсикологические свойства производных бензимидазола // Химико-фармацевтический журнал.- 1999.-№5.-с.6-17.
113.Спрыгин В.Г., Кушнерова Н.Ф., Гордейчук Т.Н. и соавт. Стресс-протективное действие диприма // Эксперим. и клин. фармакология.- 2002.- №4.-с.56-58.
114.Стойко М.И., Воронина Т.А., Неробкова Л.Н. и соавт. Возможность применения вальпроата натрия, мексидола и их комбинации для лечения и профилактики вторично-генерализованных припадков при эпилепсии // Сбор. тезисов 2-го Съезда Рос. науч. общ. фармакологов. — М., 2003.-с.197.
115.Столярова В.В. Исследование кардиопротекторного действия препаратов с антиоксидантной активностью при острой ишемии головного мозга // Эксперим. и клин. фармакология.- 2001.-т.64, №6.- с.3-6.
116.Сударева С.Ю. Экспериментальное обоснование эффективности эмоксипина, димефосфона, мексидола, а-токоферола на динамику некоторых функциональных показателей печени при остром отравлении уксусной кислотой. // Сбор. тезисов 2-го Съезда Рос. Науч. Общ. фармакологов. -М., 2003.-с.202.
117.Суслина З.А., Смирнова И.Н., Танашян М.М. и соавт. Мексидол: возможности влияния на реологические свойства крови и мозговую перфузию у больных с цереброваскулярными заболеваниями // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека».- Смоленск, 2001.- с.203-205.
118.Суслина З.А., Смирнова И.Н., Федорова Т.Н. и соавт. Оценка фармакологических эффектов антиоксиданта мексидола у больных с сосудистыми заболеваниями головного мозга // Сбор. тезисов 2-го Съезда Рос. науч. общ. фармакологов. — М., 2003.- с.209.
119.Сухова Т.В. Особенности свободнорадикального окисления, антиоксидантной защиты и состояния нервной системы у больных хроническим генерализованным пародонтитом: Автореф. дис…. канд. биол. наук.- М.,2000.
120.Сухомлин А.К. Применение антиоксидантов и антигипоксантов для комплексной терапии острых язв желудка и двенадцатиперстной кишки: Автореф. дисс…. канд. мед. наук.- С-Пб.,-1998.- 25с.
121.Толстенок Н.В. Влияние некоторых производных 3-оксипиридина на гистохимические показатели печени мышей при подостром отравлении нитритом натрия // Сбор. тезисов 2-го Съезда Рос. науч. общ. фармакологов. — М., 2003.- с.225.
122.Томчин А.Б., Вележева В.С., Шустов Е.Б. Производные тиомочевины и тиосемикарбазида. Строение, превращения и фармакологическая активность. Антигипоксическое и актопротекторное действие производных имидазо-(4,5-в) индола // Химико-фармацевтический журнал.-1998.- №2.- с.7-10.
123.Трегубова И.А. Действие антиоксидантных веществ на систему мать-плод при гипоксических состояниях (экспериментальное исследование): Автореф. дисс… канд. мед. наук.- Волгоград, 2000.
124.Тургенева Л.Б., Новиков В.Е., Смирнов Л.Д. Влияние мексидола на течение хронического генерализованного пародонтита // Мат. 3 Всерос. конф. «Гипоксия, механизмы, адаптация, коррекция».- М., 2002.- с.126-127.
125.Уварова Н.В., Инчина В.И., Кашина Т.П. Фармакологическая коррекция пострадиационного цитопенического синдрома мексидо-лом и димефосфоном //Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека».- Смоленск, 2001.- с.281-282.
126. Федорова Т.Н. Применение хемилюминесцентного анализа для сравнительной оценки антиоксидантной активности некоторых фармакологических веществ // Эксперим. и клин. фармакология.- 2003.-т.66, №5.- с.56-58.
127.Цыганова С.Ю., Инчина В.И., Балыкова Л.А. Фармакологическая коррекция месидолом, эмоксипином и димефосфоном нарушений функционального состояния почек при индометациново-гентамициновой нефропатии // Сбор. тезисов 2-го Съезда Рос. науч. общ. фармакологов. — М., 2003,- ч.2.- с.269.
128.Цыганкова Г.М. Влияние мекисидола на развитие токсического гепатита // Автореф. дисс… канд. мед. наук.- Смоленск, 2003.- 21с.
129.Чукаев С.А. Оптимизация режимов коррекции антиоксидантного статуса организма при гипоксии с помощью мексидола и пробу-
кола: Дис… канд. мед. наук.- 1993.- 133с.
130.Шабалина Н.В., Смирнов Л.Д., Инчина В.И. Изменение активности процессов липопероксидации на фоне применения препаратов антиоксидантного типа действия при ожоге // Сбор. тезисов 2-го Съезда Рос. науч. общ. фармакологов. — М., 2003.- с.284.
131.Шмырев В.И., Миронов Н.В., Горяйнова И.И. и соавт. Роль антиоксидантов в биологической клеточной трансплантологии // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека».- Смоленск, 2001.-с.205-207.
132.Ямашкина Е.И. Экспериментальное исследование антиульцерогенного действия мексидола, отрицательных аэроионов кислорода и их комбинаций: Автореф. дис…. канд. мед. наук.- Саранск, 2002.
133.Яременко К.В., Пашинский В.Г., Удинцев С.Н. и соавт. Фармакологическая регуляция стресса как путь к профилактике заболевания // Тезисы докладов 6 Всесоюз. съезда фармакологов. — Ташкент, 1988.- с.442-443.
134.Bergeron M., Ferriero D.M., Vreman H.J. Hypoxia-ischemia, but not hypoxia alone, induces the expression of heme oxygenase-1(HSP32) in new born rat brain.// Cerebral blood flow and metabolism.-1997.-Vol.17.-№36.-Р.647-658.
135.Digivesi V., Lenuzza M., Digivesi G. Prospects for use of antioxidants therapy in hypertension. Ann Ital Med Int.- 2001.- Apr-Jun, 16(2).-Р. 93-100.
136.Freeman B.A., Grapo J.D. Lab. Invest.- 1982.- Vol. 47.- P. 412.
137.Landman R., Burgisser F., Wesp M. Beta- adrenergic receptors are different in subpopulations of human circulating lymphocytes // J. Recept. Res. — 1984.- №1-6.- Р. 37-50.
138.Voronina T., Smirnov L. Antioxidants in profilactic and treatment of CNS athology.// Pharmacol. and Toxicol.-1997. -Vol.80.- P.215-219.
новых антиоксидантных препаратов | SpringerLink
- Джузеппе Буонокоре
- Серафина Перроне
- Мария Луиза Татаранно
Первый онлайн:
Часть Окислительный стресс в прикладных фундаментальных исследованиях и клинической практике серия книг (OXISTRESS)Abstract
Окислительный стресс является результатом комбинированного воздействия энергетической недостаточности клеток, ацидоза, гипоксии, гипероксии и воспаления, которые приводят к увеличению образования свободных радикалов (FR).Чрезмерное окисленное состояние и, в частности, продукция ОН могут нарушать функцию клеток плода и новорожденного, вызывая апоптоз в быстрорастущих структурах. Повышенный окислительный стресс (ОС) плода и новорожденного объясняется дефицитом антиоксидантных факторов. Антиоксидантные стратегии могут быть использованы в качестве дополнительной нейропротективной терапии после перинатальной ОС.
Длинный список антиоксидантных препаратов (витамины, ингибиторы бескислородных радикалов и поглотители) использовался в клинических и экспериментальных подходах к снижению ОС при неонатальных заболеваниях, связанных со свободными радикалами, но результаты пока не ясны.Из этих антиоксидантных веществ только добавка витамина А, вводимая новорожденным в течение нескольких дней после рождения, оказалась полезной для снижения смертности и потребности в кислороде в 36-недельном постменструальном возрасте. В настоящее время некоторые новые препараты, уже испытанные в экспериментальных исследованиях, такие как аллопуринол и эритропоэтин, готовы к крупным клиническим испытаниям.
Предварительные результаты показывают, что лечение аллопуринолом ослабляет вызванное гипоксией ремоделирование сосудов, не влияя на нормальный рост и пролиферацию.Показано, что мелатонин, другая молекула антиоксиданта, защищает от повреждения головного мозга OS при экспериментальном гипоксическом повреждении головного мозга у крыс. Иминобиотин, ингибитор медиаторов воспаления, защищает после церебральной ишемии у новорожденных крыс. Неонатальное лечение лютеином снижает ОС в плазме и увеличивает антиоксидантный потенциал в первые дни жизни новорожденных. В настоящее время лечение антиоксидантами все еще имеет несколько ограничений: (а) длительный интервал для проникновения через гематоэнцефалический барьер, (б) узкий диапазон терапевтических дозировок и (в) короткое окно для защитного вмешательства.Снижение FR и восстановление оксидативного дисбаланса, безусловно, оказываются полезными в ответ на гипоксию, реперфузию и воспаление, но на сегодняшний день исследования недостаточно изучили последствия изменения оксидативного или иммунного баланса. Введение антиоксидантов при подозрении на ОС еще не готово к внедрению в клиническую практику, например, после реанимации новорожденных с асфиксией. Наша задача на будущее — лучше прояснить преимущества и риски антиоксидантных вмешательств и проверить их влияние на здоровье младенцев.
Ключевые слова
Ксантиноксидаза, сульфат магния, свободные радикалы, бескислородные радикалы, окислительный стресс, травмаЭти ключевые слова были добавлены машиной, а не авторами. Это экспериментальный процесс, и ключевые слова могут обновляться по мере улучшения алгоритма обучения.
Это предварительный просмотр содержимого подписки,
войдите в, чтобы проверить доступ.
Список литературы
1.
Холливелл Б. Свободные радикалы, антиоксиданты и болезни человека: любопытство, причина или следствие? Ланцет.1994; 344: 721–4.
PubMedGoogle Scholar2.
Тибо Д. Слабая антиоксидантная защита недоношенного ребенка. Am J Perinatol. 2000; 17: 167–81.
PubMedGoogle Scholar3.
Kowaltowski AJ, Vercesi AE. Повреждение митохондрий, вызванное окислительным стрессом. Free Rad Biol Med. 1999; 26: 463–71.
PubMedGoogle Scholar4.
McCord JM. Кислородные свободные радикалы при постишемическом повреждении тканей.New Engl J Med. 1985; 312: 159–63.
PubMedGoogle Scholar5.
Эванс П.Дж., Эванс Р., Ковар И.З., Холтон А.Ф., Холливелл Б. Железо, определяемое блеомицином, в плазме недоношенных и доношенных новорожденных. FEBS Lett. 1992; 303: 210–2.
PubMedGoogle Scholar6.
Aruoma OI. Характеристика лекарств как антиоксидантных профилактических средств. Free Rad Biol Med. 1996; 20: 675–705.
PubMedGoogle Scholar7.
Shadid M, Buonocore G, Groenendaal F, et al.Влияние дефероксамина и аллопуринола на концентрации железа, не связанного с белками, в плазме и корковой ткани мозга новорожденных ягнят после гипоксической ишемии. Neurosci Lett. 1998; 22: 5–8.
Google Scholar8.
Shadid M, Moison R, Steendijk P, Hiltermann L, Berger HM, van Bel F. Влияние комбинированной антиоксидантной терапии на постгипоксически-ишемическую перфузию, метаболизм и электрическую активность новорожденного мозг. Pediatr Res. 1998. 44 (1): 119–24.
PubMedGoogle Scholar9.
Livrea MA, Tesoriere L, Bongiorno A, Pintaudi AM, Ciaccio M, Riccio A. Вклад витамина A в устойчивость к окислению липопротеинов низкой плотности человека. Free Radic Biol Med. 1995. 18 (3): 401–409.
PubMedGoogle Scholar10.
Пакер Л., Вебер С.У., Римбах Г. Молекулярные аспекты антиоксидантного действия альфа-токотриенола и клеточной передачи сигналов. J Nutr. 2001; 131: 369С – 73.
PubMedGoogle Scholar11.
Шин С.М., Раздан Б., Мишра О.П., Джонсон Л., Деливория-Пападопулос М.Защитное действие альфа-токоферола на функцию мембран клеток головного мозга при гипоксии коры головного мозга у новорожденных поросят. Brain Res. 1994. 653 (1-2): 45-50.
PubMedGoogle Scholar12.
Осакада Ф., Хашино А., Куме Т., Кацуки Х., Канеко С., Акаике А. Нейропротекторные эффекты альфа-токоферола на окислительный стресс в культурах полосатого тела крыс. Eur J Pharmacol. 2003; 465: 15–22.
PubMedGoogle Scholar13.
Iwasa H, Aono T, Fukuzawa K. Защитный эффект витамина E на дистресс плода, вызванный ишемией маточно-плацентарной системы у беременных крыс.Free Radic Biol Med. 1990. 8 (4): 393–400.
PubMedGoogle Scholar14.
Raju TN, Langenberg P, Bhutani V, Quinn GE. Профилактика витамином Е для уменьшения ретинопатии недоношенных: переоценка опубликованных исследований. J Pediatr. 1997. 131 (6): 844–50.
PubMedGoogle Scholar15.
Shichiri M, Yoshida Y, Ishida N, Hagihara Y, Iwahashi H, Tamai H, Niki E. α-токоферол подавляет перекисное окисление липидов и поведенческие и когнитивные нарушения в мышиной модели синдрома Дауна Ts65Dn. .Free Radic Biol Med. 2011; 50 (12): 1801–111.
PubMedGoogle Scholar16.
ван Титс Л.Дж., Демакер П.Н., де Грааф Дж., Хак-Леммерс Х.Л., Сталенхёф А.Ф. Добавка альфа-токоферола снижает выработку супероксида и цитокинов лейкоцитами ex vivo как у нормолипидемических, так и у гипертриглицеридемических лиц. Am J Clin Nutr. 2000; 71: 458–64.
PubMedGoogle Scholar17.
Darlow BA, Graham PJ. Добавки витамина А для предотвращения смертности, а также краткосрочных и долгосрочных заболеваний у младенцев с очень низкой массой тела при рождении.Кокрановская база данных Syst Rev.2011; 10: CD000501.
PubMedGoogle Scholar18.
Кирквуд Б., Хамфри Дж., Моултон Л., Мартинес Дж. Неонатальные добавки витамина А и выживаемость младенцев. Ланцет. 2010. 376 (9753): 1643–4.
PubMedGoogle Scholar19.
West Jr KP, Christian P, Labrique AB, Rashid M, Shamim AA, Klemm RD, et al. Влияние добавок витамина А или бета-каротина на смертность, связанную с беременностью, и младенческую смертность в сельских районах Бангладеш: кластерное рандомизированное исследование.ДЖАМА. 2011. 305 (19): 1986–95.
PubMedGoogle Scholar20.
Chen YC, Tain YL, Sheen JM, Huang LT. Полезность мелатонина у новорожденных и детей. J Formos Med Assoc. 2012. 111 (2): 57–66.
PubMedGoogle Scholar21.
Beyer RE. Роль аскорбата в антиоксидантной защите биомембран: взаимодействие с витамином Е и коферментом Q. J Bioenerg Biomembr. 1994; 26: 349–58.
PubMedGoogle Scholar22.
Nakai A, Shibazaki Y, Taniuchi Y, Oya A, Asakura H, Koshino T., Araki T.Витамины улучшают вторичную митохондриальную недостаточность в мозге новорожденных крыс. Pediatr Neurol. 2002; 27: 30–5.
PubMedGoogle Scholar23.
Bass WT, Malati N, Castle MC, White LE. Доказательства безопасности введения аскорбиновой кислоты недоношенным детям. Am J Perinatol. 1998. 15 (2): 133–40.
PubMedGoogle Scholar24.
Tan S, Parks DA. Сохранение функции мозга при неонатальной асфиксии. Clin Perinatol. 1999. 26 (3): 733–47.
PubMedGoogle Scholar25.
Hisanaga K, Sagar SM, Sharp FR. Нейротоксичность аскорбата в культуре корковых клеток. Энн Нейрол. 1992. 31 (5): 562–5.
PubMedGoogle Scholar26.
Затем С.М., Мазлан М., Мат Топ G, Ван Нга WZ. Витамин Е токсичен для нейронных клеток? Cell Mol Neurobiol. 2009. 29: 485–96.
PubMedGoogle Scholar27.
Richter HG, Camm EJ, Modi BN, Naeem F, Cross CM, Cindrova-Davies T, et al. Аскорбат предотвращает оксидативный стресс плаценты и увеличивает массу тела при рождении у крыс при гипоксической беременности.J Physiol. 2012; 590: 1377–87.
PubMedCentralPubMedGoogle Scholar28.
Chappell LC, Seed PT, Kelly FJ, Briley A, Hunt BJ, Charnock-Jones DS, et al. Прием витаминов С и Е у женщин с риском преэклампсии связан с изменением показателей оксидативного стресса и функции плаценты. Am J Obstet Gynecol. 2002; 187: 777–84.
PubMedGoogle Scholar29.
Roberts JM, Myatt L, Spong CY, et al. Витамины C и E для предотвращения осложнений гипертонии, связанной с беременностью.N Engl J Med. 2010; 362: 1282–91.
PubMedCentralPubMedGoogle Scholar30.
Conde-Agudelo A, Romero R, Kusanovic JP, Hassan SS. Добавки витаминов C и E во время беременности для профилактики преэклампсии и других неблагоприятных исходов для матери и перинатального периода: систематический обзор и метаанализ. Am J Obstet Gynecol. 2011; 204: 503.
PubMedCentralPubMedGoogle Scholar31.
Solaroglu I, Solaroglu A, Kaptanoglu E, Dede S, Haberal A, Beskonakli E, Kilinc K.Эритропоэтин предотвращает индукцию ишемии-реперфузии окислительного повреждения в мозге эмбриона крысы. Childs Nerv Syst. 2003. 19 (1): 19–22.
PubMedGoogle Scholar32.
Kumral A, Baskin H, Gokmen N, Yilmaz O, Genc K, Genc S, et al. Селективное ингибирование оксида азота на модели гипоксически-ишемического мозга у новорожденных крыс: объяснение защитной роли эритропоэтина? Biol Neonate. 2004. 85 (1): 51–4.
PubMedGoogle Scholar33.
Sun Y, Calvert JW, Zhang JH.Гипоксия / ишемия новорожденных связана со снижением медиаторов воспаления после введения эритропоэтина. Инсульт. 2005. 36 (8): 1672–8.
PubMedGoogle Scholar34.
Bierer R, Peceny MC, Hartenberger CH, Ohls RK. Концентрации эритропоэтина и исходы нервного развития у недоношенных детей. Педиатрия. 2006; 118 (3): e635–40.
PubMedGoogle Scholar35.
Maiese K, Li F, Chong ZZ. Новые направления исследований эритропоэтина.J Am Med Assoc. 2005; 293: 90–5.
Google Scholar36.
Kellert BA, McPherson RJ, Juul SE. Сравнение схем лечения высокими дозами рекомбинантного эритропоэтина у новорожденных крыс с повреждением головного мозга. Pediatr Res. 2007; 61: 451–5.
PubMedGoogle Scholar37.
Gonzalez FF, McQuillen P, Mu D, et al. Эритропоэтин усиливает долгосрочную нейрозащиту и нейрогенез при неонатальном инсульте. Dev Neurosci. 2007; 29: 321–30.
PubMedGoogle Scholar38.
van der Kooij MA, Groenendaal F, Kavelaars A, Heijnen CJ, van Bel F. Комбинация дефероксамина и эритропоэтина: терапия вызванного гипоксией-ишемией повреждения головного мозга у новорожденных крыс? Neurosci Lett. 2009; 451: 109–13.
PubMedGoogle Scholar39.
Zhu C, Kang W, Xy F, et al. Эритропоэтин улучшил неврологические исходы у новорожденных с гипоксически-ишемической энцефалопатией. Педиатрия. 2009; 124: e218–26.
PubMedGoogle Scholar40.
Cariou A, Claessens Y-E, Pène F, et al. Ранняя терапия высокими дозами эритропоэтина и гипотермия после остановки сердца вне больницы: согласованное контрольное исследование. Реанимация. 2008. 76: 397–404.
PubMedGoogle Scholar41.
Ehrenreich H, Weissenborn K, Prange H, et al. Для группы ЕПВ по исследованию инсульта. Рекомбинантный эритропоэтин человека в лечении острого ишемического инсульта. Инсульт. 2009; 40 (12): e647–56.
PubMedGoogle Scholar42.
Samdani AF, Dawson TM, Dawson VL. Синтаза оксида азота в моделях очаговой ишемии. Инсульт. 1997. 28 (6): 1283–8.
PubMedGoogle Scholar43.
Beckman JS, Koppenol WH. Оксид азота, супероксид и пероксинитрит: хорошее, плохое и уродливое. Am J Physiol. 1996; 271: C1424–37.
PubMedGoogle Scholar44.
Sup SJ, Green BG, Grant SK. 2-Иминобиотин — ингибитор синтаз оксида азота. Biochem Biophys Res Commun. 1994. 204 (2): 962–8.
PubMedGoogle Scholar45.
Nijboer CH, Heijnen CJ, Groenendaal F, May MJ, van Bel F, Kavelaars A. Сильная нейрозащита путем ингибирования NF-kappaB после гипоксии-ишемии новорожденных включает механизмы апоптоза, но не зависит от цитокинов. . Инсульт. 2008. 39 (7): 2129–37.
PubMedGoogle Scholar46.
Марро П.Дж., Мишра О.П., Деливория-Пападопулос М. Влияние аллопуринола на уровни аденозина в головном мозге во время гипоксии у новорожденных поросят.Brain Res. 2006; 1073–1074: 444–50.
PubMedGoogle Scholar47.
Gunes T, Ozturk MA, Koklu E, Kose K, Gunes I. Влияние добавок аллопуринола на уровни оксида азота у новорожденных, страдающих асфиксией. Pediatr Neurol. 2007. 36 (1): 17–24.
PubMedGoogle Scholar48.
Kaandorp JJ, van Bel F, Veen S, Derks JB, Groenendaal F, Rijken M, Roze E, Venema MM, Rademaker CM, Bos AF, Benders MJ. Долгосрочные нейропротективные эффекты аллопуринола после умеренной перинатальной асфиксии: результаты двух рандомизированных контролируемых исследований.Arch Dis Child Fetal Neonatal Ed. 2012; 97: 162–6.
Google Scholar49.
Torrance HL, Benders MJ, Derks JB, Rademaker CM, Bos AF, Van Den Berg P, Longini M, Buonocore G, et al. Материнский аллопуринол во время гипоксии плода снижает уровень маркера повреждения головного мозга S-100B в пуповинной крови. Педиатрия. 2009. 124 (1): 350–7.
PubMedGoogle Scholar50.
Kelen D, Robertson NJ. Экспериментальные методы лечения гипоксической ишемической энцефалопатии. Early Hum Dev.2010. 86 (6): 369–77.
PubMedGoogle Scholar51.
Chaudhari T, McGuire W. Аллопуринол для предотвращения смертности и заболеваемости новорожденных с гипоксически-ишемической энцефалопатией. Кокрановская база данных Syst Rev.2012. Doi:
10.1002 / 14651858.CD006817.
PubMedGoogle Scholar52.
Marzocchi B, Perrone S, Paffetti P, Magi B, Bini L, Tani C, Longini M, Buonocore G. Окислительный стресс железа и белков плазмы, не связанный с белками, при рождении.Pediatr Res. 2005. 58 (6): 1295–9.
PubMedGoogle Scholar53.
Wayenberg JL, Ransy V, Vermeylen D, Damis E, Bottari SP. Нитрированный альбумин плазмы как маркер нитратного стресса и неонатальной энцефалопатии при перинатальной асфиксии. Free Radic Biol Med. 2009. 47 (7): 975–82.
PubMedGoogle Scholar54.
Liu Y, Belayev L, Zhao W, Busto R, Belayev A, Ginsberg MD. Нейропротективный эффект лечения альбумином человека при перманентной очаговой ишемии головного мозга: гистопатология и исследования корковой перфузии.Eur J Pharmacol. 2001. 428 (2): 193–201.
PubMedGoogle Scholar55.
Ginsberg MD, Hill MD, Palesch YY, Ryckborst KJ, Tamariz D. Пилотное испытание ALIAS: исследование повышения дозы и безопасности альбуминовой терапии при остром ишемическом инсульте-I: физиологические реакции и результаты безопасности. Инсульт. 2006. 37 (8): 2100–6.
PubMedGoogle Scholar56.
Berman DR, Mozurkewich E, Liu Y, Barks J. Предварительная обработка докозагексаеновой кислотой обеспечивает нейрозащиту на модели перинатальной церебральной гипоксии-ишемии на крысах.Am J Obstet Gynecol. 2009; 200: 305.e1-6.
PubMedGoogle Scholar57.
Berman DR, Liu YQ, Barks J, Mozurkewich E. Докозагексаеновая кислота обеспечивает нейрозащиту на крысиной модели перинатальной гипоксии-ишемии, усиленной воспалением, вызванным липополисахаридной системой Escherichia coli. Am J Obstet Gynecol. 2010; 202 (5): 469.e1-6.
PubMedGoogle Scholar58.
Peeters-Scholte C, Braun K, Koster J, Kops N, Blomgren K, Buonocore G, et al.Влияние аллопуринола и дефероксамина на реперфузионное повреждение головного мозга у новорожденных поросят после неонатальной гипоксии-ишемии. Pediatr Res. 2003. 54 (4): 516–22.
PubMedGoogle Scholar59.
deLemos RA, Roberts RJ, Coalson JJ, deLemos JA, Null Jr DM, Gerstmann DR. Токсические эффекты, связанные с применением дефероксамина у недоношенных бабуинов с заболеванием гиалиновых мембран. Am J Dis Child. 1990; 144: 915–9.
PubMedGoogle Scholar60.
Marret S, Doyle LW, Crowther CA, Middleton P.Антенатальная нейропротекция сульфатом магния у недоношенных детей. Semin Fetal Neonatal Med. 2007. 12 (4): 311–7.
PubMedGoogle Scholar61.
Shogi T, Miyamoto A, Ishiguro S, Nishio A. Повышенное высвобождение IL-1beta и TNF-alpha после провокации эндотоксином из альвеолярных макрофагов крысы, культивированных в среде с низким содержанием мг (2+). Magnes Res. 2003. 16 (2): 111–9.
PubMedGoogle Scholar62.
Ovbiagele B, Kidwell CS, Starkman S, Saver JL. Возможная роль нейропротекторов в лечении пациентов с острым ишемическим инсультом.Варианты лечения Curr Cardiovasc Med. 2003; 6: 441–9.
Google Scholar63.
Kim CR, Oh W, Stonestreet BS. Магний является церебровазодилататором у новорожденных поросят. Am J Physiol. 1997; 272 (1 Pt 2): H511–6.
PubMedGoogle Scholar64.
Costantine MM, Weiner SJ, Eunice Kennedy Shriver Национальный институт детского здоровья и развития человеческого потенциала Сеть отделений медицины плода и матери. Влияние антенатального воздействия сульфата магния на нейрозащиту и смертность недоношенных детей: метаанализ.Obstet Gynecol. 2009. 114 (2 Pt 1): 354–64.
PubMedCentralPubMedGoogle Scholar65.
Doyle LW, Crowther CA, Middleton P, Marret S, Rouse D. Сульфат магния для женщин с риском преждевременных родов для нейрозащиты плода. Кокрановская база данных Syst Rev.2009; 1: CD004661.
PubMedGoogle Scholar66.
Конде-Агудело А., Ромеро Р. Антенатальный прием сульфата магния для профилактики церебрального паралича у недоношенных детей менее 34 недель беременности: систематический обзор и метаанализ.Am J Obstet Gynecol. 2009. 200 (6): 595–609.
PubMedCentralPubMedGoogle Scholar67.
Zhu H, Meloni BP, Bojarski C, Knuckey MW, Knuckey NW. Постишемическая умеренная гипотермия (35 ° C) в сочетании с внутривенным введением магния более эффективна для снижения гибели нейронов CA1, чем любое лечение, используемое отдельно, после глобальной церебральной ишемии у крыс. Exp Neurol. 2005. 193 (2): 361–8.
PubMedGoogle Scholar68.
Zhu H, Meloni BP, Moore SR, Majda BT, Knuckey NW.Внутривенное введение магния оказывает нейропротекторное действие только при временной глобальной ишемии, если присутствует при постишемической легкой гипотермии. Brain Res. 2004. 1014 (1–2): 53–60.
PubMedGoogle Scholar69.
Ramsey PS, Rouse DJ. Сульфат магния как токолитическое средство. Семин Перинатол. 2001. 25 (4): 236–47.
PubMedGoogle Scholar70.
Azria E, Tsatsaris V, Goffinet F, Kayem G, Mignon A, Cabrol D. Сульфат магния в акушерстве: текущие данные.J Gynecol Obstet Biol Reprod. 2004. 33 (6 Pt 1): 510–7.
Google Scholar71.
Хан М., Сехон Б., Джатана М. и др. Введение N-ацетилцистеина после очаговой церебральной ишемии защищает мозг и снижает воспаление на крысиной модели экспериментального инсульта. J Neurosci Res. 2004. 76: 519–27.
PubMedGoogle Scholar72.
Джатана М., Сингх И., Сингх А.К., Дженкинс Д. Комбинация системной гипотермии и N-ацетилцистеина ослабляет гипоксически-ишемическое повреждение головного мозга у новорожденных крыс.Pediatr Res. 2006; 59: 684–9.
PubMedGoogle Scholar73.
Cakir O, Erdem K, Oruc A, Kilinc N, Eren N. Нейропротекторный эффект N-ацетилцистеина и гипотермия на ишемию-реперфузионное повреждение спинного мозга. Cardiovasc Surg. 2003; 11: 375–9.
PubMedGoogle Scholar74.
Paintlia MK, Paintlia AS, Barbosa E, Singh I, Singh AK. N-ацетилцистеин предотвращает вызванную эндотоксином дегенерацию предшественников олигодендроцитов и гипомиелинизацию в развивающемся мозге крысы.J Neurosci Res. 2004. 78: 347–61.
PubMedGoogle Scholar75.
Ахола Т., Лапатто Р., Райвио К.О. и др. N-ацетилцистеин не предотвращает бронхолегочную дисплазию у недоношенных детей: рандомизированное контролируемое исследование. J Pediatr. 2003. 143: 713–9.
PubMedGoogle Scholar76.
Велин А.К., Сведин П., Лапатто Р., Султан Б., Хагберг Н., Грессенс П. и др. Мелатонин снижает воспаление и гибель клеток в белом веществе у плодов овцы в середине беременности после окклюзии пуповины.Pediatr Res. 2007. 61 (2): 153–8.
PubMedGoogle Scholar77.
Tütüncüler F, Eskiocak S, Başaran UN, Ekuklu G, Ayvaz S, Vatansever U. Защитная роль мелатонина при экспериментальном гипоксическом повреждении мозга. Pediatr Int. 2005; 47 (4): 434–9.
PubMedGoogle Scholar78.
Vijayalaxmi Jr TCR, Reiter RJ, Herman TS. Мелатонин: от фундаментальных исследований до клиник по лечению рака. J Clin Oncol. 2002. 20 (10): 2575–601.
PubMedGoogle Scholar79.
Руссо А., Петрен С., Плантин Дж., Эклунд Т., Нордин С. Концентрация мелатонина в сыворотке и спинномозговой жидкости: пилотное исследование на здоровых добровольцах-мужчинах. J Neural Transm. 1999. 106 (9–10): 883–8.
PubMedGoogle Scholar80.
Vakkuri O, Leppäluoto J, Kauppila A. Пероральное введение и распределение мелатонина в сыворотке, слюне и моче человека. Life Sci. 1985. 37 (5): 489–95.
PubMedGoogle Scholar81.
Bornman MS, Schulenburg GW, Reif S, Oosthuizen JM, De Wet EH, Luus HG.Семенной мелатонин плазмы и параметры спермы. S Afr Med J. 1992. 81 (9): 485–6.
PubMedGoogle Scholar82.
Kivelä A, Kauppila A, Leppäluoto J, Vakkuri O. Мелатонин сыворотки и околоплодных вод во время родов у человека. J Clin Endocrinol Metab. 1989. 69 (5): 1065–8.
PubMedGoogle Scholar83.
Agez L, Laurent V, Guerrero HY, Pévet P, Masson-Pévet M, Gauer F. Эндогенный мелатонин обеспечивает эффективное циркадное сообщение как супрахиазматическим ядрам, так и туберализму крысы.J Pineal Res. 2009. 46 (1): 95–105.
PubMedGoogle Scholar84.
Shanahan TL, Cheisler CA. Физиологические эффекты света на циркадный кардиостимулятор человека. Семин Перинатол. 2000. 24 (4): 299–320.
PubMedGoogle Scholar85.
Paradies G, Petrosillo G, Paradies V, Reiter RJ, Ruggiero FM. Мелатонин, кардиолипин и митохондриальная биоэнергетика в здоровье и болезнях. J Pineal Res. 2010. 48 (4): 297–310.
PubMedGoogle Scholar86.
Tan DX, Manchester LC, Terron MP, Flores LJ, Tamura H, Reiter RJ. Мелатонин как встречающийся в природе со-субстрат хинонредуктазы-2, предполагаемого мембранного рецептора мелатонина МТ3: гипотеза и значение. J Pineal Res. 2007. 43 (4): 317–20.
PubMedGoogle Scholar87.
Ceraulo L, Ferrugia M, Tesoriere L, Segreto S, Livrea MA, Turco Liveri V. Взаимодействие мелатонина с моделями мембран: разделение мелатонина на AOT и мицеллы, обращенные лецитином.J Pineal Res. 1999. 26 (2): 108–12.
PubMedGoogle Scholar88.
Reiter RJ, Tan DX, Burkhardt S. Активные формы кислорода и азота, а также снижение уровня клеток и организма: улучшение с помощью мелатонина. Mech Aging Dev. 2002. 123 (8): 1007–19.
PubMedGoogle Scholar89.
Acuña-Castroviejo D, Martín M, Macías M, Escames G, León J, Khaldy H, et al. Мелатонин, митохондрии и клеточная биоэнергетика. J Pineal Res. 2001; 30: 65–74.
PubMedGoogle Scholar90.
Тамура Х, Такасаки А., Такетани Т., Танабе М., Кизука Ф., Ли Л. и др. Мелатонин как поглотитель свободных радикалов в фолликуле яичника. Endocr J. 2013; 60 (1): 1–13.
PubMedGoogle Scholar91.
Reiter RJ, Tan DX, Manchester LC, Qi W. Биохимическая реакционная способность мелатонина с реактивными формами кислорода и азота: обзор доказательств. Cell Biochem Biophys. 2001. 34 (2): 237–56.
PubMedGoogle Scholar92.
Mishra OP, Delivoria-Papadopoulos M.Перекисное окисление липидов в развивающемся мозге плода морской свинки при нормоксии и гипоксии. Brain Res Dev Brain Res. 1989. 45 (1): 129–35.
PubMedGoogle Scholar93.
Esposito E, Cuzzocrea S. Противовоспалительная активность мелатонина в центральной нервной системе. Curr Neuropharmacol. 2010. 8 (3): 228–42.
PubMedCentralPubMedGoogle Scholar94.
Carrillo-Vico A, García-Mauriño S, Calvo JR, Guerrero JM. Мелатонин противодействует ингибирующему эффекту PGE2 на продукцию IL-2 в лимфоцитах человека через свой мембранный рецептор mt1.FASEB J. 2003; 17 (6): 755–77.
PubMedGoogle Scholar95.
Briceño-Pérez C, Briceño-Sanabria L, Vigil-De Gracia P. Прогнозирование и профилактика преэклампсии. Гипертоническая болезнь при беременности. 2009. 28 (2): 138–55.
PubMedGoogle Scholar96.
Гупта П., Наранг М., Банерджи Б.Д., Басу С. Окислительный стресс у доношенных новорожденных, рожденных от недоедающих матерей, с малой степенью гестации: исследование случай-контроль. BMC Pediatr. 2004; 4: 14.
PubMedCentralPubMedGoogle Scholar97.
Longini M, Perrone S, Kenanidis A, Vezzosi P, Petraglia F, Buonocore G и др. Изопростаны в околоплодных водах: прогностический маркер ограничения роста плода во время беременности. Free Radic Biol Med. 2005. 38 (11): 1537–41.
PubMedGoogle Scholar98.
Okatani Y, Wakatsuki A, Shinohara K, Kaneda C, Fukaya T. Мелатонин стимулирует активность глутатионпероксидазы в хорионе человека. J Pineal Res. 2001. 30 (4): 199–205.
PubMedGoogle Scholar99.
Richter HG, Hansell JA, Raut S, Giussani DA. Мелатонин улучшает эффективность плаценты и массу тела при рождении, а также увеличивает экспрессию антиоксидантных ферментов в плаценте при беременности с недостаточным питанием. J Pineal Res. 2009. 46 (4): 357–64.
PubMedGoogle Scholar100.
Gitto E, Reiter RJ. Ранние индикаторы хронического заболевания легких у недоношенных детей с респираторным дистресс-синдромом и их угнетение мелатонином. J Pineal Res. 2004; 36: 250e5.
Google Scholar101.
Gitto E, Reiter RJ, Cordaro SP, La Rosa M, Chiurazzi P, Trimarchi G и др. Окислительные и воспалительные параметры при респираторном дистресс-синдроме недоношенных новорожденных: благотворное влияние мелатонина. Am J Perinatol. 2004; 21: 209e16.
Google Scholar102.
Gitto E, Reiter RJ, Sabatino G, Buonocore G, Romeo C, Gitto P, et al. Корреляция между цитокинами, бронхолегочной дисплазией и модальностью вентиляции у недоношенных новорожденных: улучшение при лечении мелатонином.J Pineal Res. 2005; 39: 287e93.
Google Scholar103.
Carloni S, Perrone S, Buonocore G, Longini M, Proietti F, Balduini W. Мелатонин защищает от долгосрочных последствий гипоксически-ишемического повреждения головного мозга у новорожденных крыс. J Pineal Res. 2008. 44 (2): 157–64.
PubMedGoogle Scholar104.
Buonocore G, Perrone S, Bracci R. Свободные радикалы и повреждение мозга у новорожденных. Biol Neonate. 2001. 79 (3–4): 180–6.
PubMedGoogle Scholar105.
Kijlstra A, Tian Y, Kelly ER, Berendschot TT. Лютеин: больше, чем просто фильтр для синего света. Prog Retin Eye Res. 2012. 31 (4): 303–15.
PubMedGoogle Scholar106.
Vijayapadma V, Ramyaa P, Pavithra D, Krishnaswamy R. Защитный эффект лютеина против вызванного бензо (а) пиреном окислительного стресса в эритроцитах человека. Toxicol Ind Health. 2014; 30 (3): 284–93.
PubMedGoogle Scholar107.
Li SY, Fung FK, Fu ZJ, Wong D, Chan HH, Lo AC.Противовоспалительные эффекты лютеина при ишемическом / гипоксическом поражении сетчатки: исследования in vivo и in vitro. Инвестируйте Ophthalmol Vis Sci. 2012. 53 (10): 5976–84.
PubMedGoogle Scholar108.
Moukarzel AA, Bejjani RA, Fares FN. Ксантофиллы и здоровье глаз младенцев и взрослых. J Med Liban. 2009; 57: 261–7.
PubMedGoogle Scholar109.
Perrone S, Longini M, Marzocchi B, Picardi A, Bellieni CV, Proietti F, et al. Влияние лютеина на окислительный стресс у доношенных новорожденных: пилотное исследование.Неонатология. 2010. 97 (1): 36–40.
PubMedGoogle Scholar110.
Bettler J, Zimmer JP, Neuringer M, DeRusso PA. Концентрация лютеина в сыворотке крови здоровых доношенных детей, которых кормили грудным молоком или детской смесью с лютеином. Eur J Nutr. 2010. 49 (1): 45–51.
PubMedCentralPubMedGoogle Scholar111.
Manzoni P, Guardione R, Bonetti P, Priolo C, Maestri A, Mansoldo C, et al. Добавки лютеина и зеаксантина у недоношенных новорожденных с очень низкой массой тела при рождении в отделениях интенсивной терапии новорожденных: многоцентровое рандомизированное контролируемое исследование.Am J Perinatol. 2013; 30 (1): 25–32.
PubMedGoogle Scholar112.
Rubin LP, Chan GM, Barrett-Reis BM, Fulton AB, Hansen RM, Ashmeade TL, et al. Влияние добавок каротиноидов на каротиноиды плазмы, воспаление и зрительное развитие у недоношенных детей. J Perinatol. 2012; 32 (6): 418–24.
PubMedGoogle Scholar
Информация об авторских правах
© Springer Science + Business Media New York 2014
Авторы и аффилированные лица
- Джузеппе БуонокореЭлектронная почта автору
- Серафина Перроне
- Мария Луиза Татаранно
- .Кафедра молекулярной медицины и медицины развития Сиенского университета Сиена Италия
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Взаимодействие с антиоксидантами и лекарствами — Drugs.com
- Процедуры
- Витаминно-минеральные добавки и дефицит
- Антиоксидантная формула
Всего известно, что 91 лекарство взаимодействуют с препаратом. Формула антиоксиданта (поливитамины с минералами).
- 4 основных лекарственные взаимодействия
- 82 умеренные лекарственные взаимодействия
- 5 незначительных лекарственные взаимодействия
Просмотреть все лекарства, которые могут взаимодействовать с формулой антиоксиданта (поливитамины с минералами).
Взаимодействует ли Antioxidant Formula с другими моими препаратами?
Введите другие лекарства, чтобы просмотреть подробный отчет.
Наиболее часто проверяемые взаимодействия
Просмотр отчетов о взаимодействии Антиоксидантная формула (поливитамины с минералами) и лекарств, перечисленных ниже.
Подробнее об антиоксидантной формуле (поливитамины с минералами)
Сопутствующие лечебные руководства
Классификация лекарственного взаимодействия
| Майор | Очень клинически значимо. Избегайте комбинаций; риск взаимодействия перевешивает пользу. |
|---|---|
| Умеренная | Умеренно клинически значимо. Обычно избегают комбинаций; используйте его только в особых случаях. |
| Незначительное | Минимально клинически значимое. Минимизировать риск; оценить риск и рассмотреть альтернативный препарат, предпринять шаги, чтобы избежать риска взаимодействия и / или разработать план мониторинга. |
| Неизвестно | Информация о взаимодействии отсутствует. |
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об отказе от ответственности
Антиоксиданты | Бесплатный полнотекстовый | Антиоксидантный потенциал психотропных препаратов: от клинических данных к оценке in vitro и in vivo и к новой проблеме для молекулярного дизайна in Silico
1. Введение
Принято считать, что некоторые клинические состояния вызваны или облегчены окислительным стрессом или хотя бы то, что это способствует их прогрессу. С другой стороны, окислительный стресс часто является следствием самого заболевания [1].Более того, воспаление и окислительный стресс, по-видимому, связаны как с физиологическими, так и с патологическими состояниями. Следовательно, они были определены как «важные партнеры» при определенных заболеваниях [2]. Даже если мозг составляет лишь небольшую часть массы тела человека, нейроны центральной нервной системы (ЦНС) используют почти 80% всей энергии. Метаболическая активность мозга высока, и последующая потребность в кислороде, обогащение ненасыщенных липидов и метаболизм нейротрансмиттеров определяют, что ЦНС сильно подвержена воздействию окислительно-восстановительного дисбаланса, в основном с участием реактивного кислорода (АФК) и азотных форм ( RNS) [3,4].В этом контексте Холливелл четко заявил, что антиоксиданты, которые могут быть многообещающими вариантами или добавками для лечения нескольких заболеваний человека, можно разделить на три основные группы, состоящие из: (1) эндогенных антиоксидантов, т.е. естественным образом встречающихся в организме человека. , (2) синтетические антиоксиданты, такие как хелатирующие агенты, противодействующие ионно-зависимым свободнорадикальным реакциям, и (3) лекарства, которые были разработаны для вмешательства в другие биохимические пути, но могут иметь дополнительное физиологическое действие благодаря своим антиоксидантным свойствам [1].В этом обзоре мы сосредоточим внимание на третьей группе. Фактически, было продемонстрировано, что несколько лекарств или классов лекарств, уже используемых в клинической практике, обладают антиоксидантной активностью. Несколько классов одобренных лекарств изучались на протяжении многих лет на предмет их антиоксидантных свойств [1,5,6]. Ингибиторы протонной помпы [7], противодиабетические средства [8], лекарственные средства, действующие на сердечно-сосудистую систему [9], противоэпилептические средства [10] и противовоспалительные средства [11], представляют собой некоторые из исследованных классов, которые также объединены с природными антиоксидантами и антиоксидантами. полусинтетические соединения с биологической активностью [12,13,14,15,16,17,18,19].Кроме того, помимо терапевтических агентов, необходимо подчеркнуть, что биоактивные компоненты из диеты были признаны среди факторов риска или, с другой стороны, защитными агентами, которые могут влиять на окислительный стресс и патогенез связанных заболеваний [20,21]. В частности, повышенные маркеры периферического воспаления, повышенная продукция АФК, пониженная активность антиоксидантных систем и пониженная эффективность механизмов восстановления связаны с психическими заболеваниями, такими как серьезные депрессивные расстройства и шизофрения, что предполагает прямое участие окислительного стресса в их патофизиологии.Начиная с этого момента, мы изучили литературу за последние 30 лет, чтобы проверить, сколько вкладов было внесено в эту область исследования, используя некоторые точные комбинации ключевых слов (рис. 1). Результаты подтверждают, что, хотя корреляция окислительного стресса и депрессии или шизофрении широко изучена, антиоксидантное действие активных нейролептиков и антидепрессантов изучено гораздо меньше.В этом обзоре мы представляем целенаправленный взгляд на роль антипсихотических и антидепрессантов в противодействии окислительному стрессу при шизофрении и депрессии, поскольку, насколько нам известно, на сегодняшний день не сообщалось об обзоре этих классов.
Окислительный стресс при шизофрении и депрессии
Окислительный стресс состоит из измененного баланса между прооксидантными и антиоксидантными эффектами. Это может привести к окислительному повреждению компонентов клетки, таких как липиды, белки (включая ферменты), углеводы и ДНК [22]. Что наиболее важно, оксидативный стресс — это состояние, которое, как считается, участвует в патогенезе и прогрессировании нескольких психических расстройств [23] и, в частности, связано с началом первого эпизода психоза [24,25].Следует также учитывать, что частое употребление сигарет и чрезмерное потребление алкоголя также очень распространены у пациентов с большой депрессией и шизофренией. Было высказано предположение, что лучший контроль окислительного стресса может предотвратить начало и ухудшение течения психического заболевания. В этом контексте хорошо задокументировано, что типичная американская диета, в основном основанная на обработанных пищевых продуктах, страдает серьезным дефицитом антиоксидантных соединений и что высококалорийная диета и высокое потребление красного мяса увеличивают окислительный стресс.В качестве примера следует отметить, что пергидроксильный радикал может диффундировать в липидах и может образовывать углерод-центрированный радикал полиненасыщенных липидов [6]. С другой стороны, было продемонстрировано, что пациенты с шизофренией имеют низкий уровень антиоксидантных и противовоспалительных питательных веществ, таких как омега-3 ПНЖК, витамин D, витамины группы B, витамин E и каротиноиды, а их дополнительное лечение, по-видимому, снижает окислительный стресс. и психотические симптомы [26]. ЦНС особенно подвержена повреждениям, вызванным прооксидантно-реактивными формами, и уязвима для них.Высокая окислительная метаболическая активность и потребление кислорода, уровни антиоксидантных ферментов от умеренных до низких, наличие большой площади поверхности мембраны и уязвимой анатомической структуры нейронов способствуют этой восприимчивости [22,27]. Более того, мозг богат полиненасыщенными жирными кислотами и не имеет клеточного обмена, поэтому он особенно уязвим для окислительного повреждения [6]. Также необходимо учитывать, что метаболизм нейротрансмиттеров сам по себе угрожает окислительно-восстановительному балансу ЦНС: распад дофамина, адреналина и норэпинефрина может вызывать продукцию H 2 O 2 , а митохондрии нейронов генерируют супероксидный радикал .Более того, присутствие токсичных аминокислот может способствовать протеолизу клеток [28]. С другой стороны, система антиоксидантной защиты человека играет физиологическую роль в противопоставлении этих повреждений. Супероксиддисмутаза (SOD), глутатионпероксидаза (GPx) и каталаза (CAT) составляют ферментативный пул, который играет роль блокирования побочных цепных реакций. Более того, неферментативные компоненты включают небольшие молекулы, такие как глутатион (GSH), витамин E, витамин C, N-ацетилцистеин и β-каротин. В принципе, патологические изменения, вызванные активностью АФК, можно улучшить с помощью двух механизмов: инактивации оксирадикалов с помощью антиоксидантов, вводимых с пищей (витамин С, Е, β-каротин и убихиноны), и / или добавлением этерифицированных жирных кислот [ 29,30,31].Как и ожидалось, окислительный стресс проявляется, когда окислительные воздействия преодолевают эти защитные механизмы, что приводит к изменению прооксидантного / антиоксидантного баланса, например, в «расстроенных» инь и ян (рис. 2), где пищевые добавки и антиоксидантные препараты также могут сыграть свою роль. роль. Дефицит одного из этих компонентов может сделать клеточные мембраны уязвимыми для повреждения ROS, вызывая перекисное окисление липидных мембран, изменение сигналов трансдукции, которые вызывают повреждение рецепторов, ядерной и митохондриальной ДНК и, в конечном итоге, гибель нейронных клеток.В этом контексте появляется все больше данных, подтверждающих участие окислительного стресса, нитрозативного стресса и митохондриальной дисфункции в патогенетическом процессе и снижении течения шизофрении [25,32,33,34]. Что касается доступных биохимических маркеров, окислительное повреждение ЦНС может быть обнаружено с помощью измерение продуктов перекисного окисления липидов в спинномозговой жидкости и плазме и оценка восстановления мембранных полиненасыщенных жирных кислот (ПНЖК) в мозге и мембранах красных кровяных телец [22,35]. Перекисное окисление ПНЖК — возможный индикатор прогрессирования заболевания — может быть обнаружено путем количественного определения перекисей липидов, изопростанов, альдегидных продуктов и летучих углеводородов.Вещества, родственные тиобарбитуровой кислоте (TBARS), считаются маркерами перекисного окисления липидов при шизофрении, хотя этот параметр характеризуется низкой специфичностью [36]. Более того, обнаруживаемая окислительная модификация белков также может быть принята во внимание для отслеживания прогрессирования заболевания. На клеточном уровне такие повреждения влияют на ферментативный катализ, связывание лиганда, передачу сигнала и могут способствовать вторичному повреждению других белков. В этом контексте связанные альдегиды, гликозилированные белки и гомоцистеины обычно измеряются как маркеры [37].Окислительное повреждение также может отражаться на статусе нуклеиновых кислот: Nishioka et al. сообщили, что повышенные уровни 8-гидрокси-2-дезоксигуанозина были обнаружены у пациентов с шизофренией. Тем не менее, надежность этого параметра также обсуждается [22,38]. Помимо маркеров, описанных выше, антиоксидантные ферменты (SOD, GPx и CAT), уровни витамина E и витамина C также могут быть количественно определены для оценки статуса защитной системы при шизофрении [39], хотя значимость положительных или отрицательных вариаций их концентрации ( в частности, о ферментных компонентах) не совсем ясно.Фактически, хотя, согласно большинству исследований, снижение уровня антиоксидантной системы может быть связано с прогрессированием заболевания, некоторые другие отчеты показали противоположные результаты. В частности, одна из гипотез состоит в том, что уровни антиоксидантных ферментов должны быть ниже на ранних стадиях психотических расстройств [22,40]. В контексте психических расстройств оксидативный стресс также играет роль в возникновении депрессии [41]. Кроме того, в этом случае не очень ясна причинно-следственная связь. Более того, полезная роль антидепрессантов в отношении окислительного стресса сама по себе обсуждается, поскольку некоторые терапевтические агенты действуют, вмешиваясь в ферменты, которые участвуют в окислительном метаболизме.В частности, активность моноаминоксидазы A и B (MAO-A и MAO-B) приводит к образованию пероксида водорода как побочного продукта реакции между ферментами и их моноаминовым субстратом. Депрессию обычно лечат лекарствами, которые увеличивают концентрацию биогенных аминов, которые являются субстратами для МАО, и это может вызвать образование нейротоксических альдегидов и увеличить окислительный стресс [42,43,44]. Таким образом, метаболизм биогенных аминов может сам по себе играть роль в окислительном равновесии в ЦНС, и это особенно касается дофамина (DA), который имеет основополагающее значение для поощрения и регуляции движений в головном мозге, а также является предшественником в биосинтезе. других катехоламинов, таких как норадреналин и адреналин.Его метаболическая трансформация осуществляется ферментами МАО и катехол-О-метилтрансферазы (СОМТ). Однако дисфункция митохондрий и окислительный стресс способствуют образованию 6-гидроксидофамина (6-OHDA), который сам является медиатором окислительного стресса и может способствовать гибели клеток [45]. С другой стороны, маркеры окислительного стресса (уровни витаминов и малонового диальдегида, TBARS) оказались выше у пациентов с депрессией [46]. 8-гидрокси-2′-дезоксигуанозин (8-OHdG), окисленное производное дезоксигуанозина, и F2-изопростаны — еще два специфических маркера, указывающих на окислительное повреждение ДНК и липидов, соответственно, и были рассмотрены в метаанализе Блэка. и коллеги [47, 48].Авторы подчеркнули, что 8-OHdG и F2-изопростаны повышены у субъектов с депрессией (большое депрессивное расстройство, биполярное расстройство и депрессивные симптомы). Эти результаты указывают на связь между депрессией и повышенным окислительным повреждением, но лежащие в основе механизмы все же необходимо прояснить, особенно в свете взаимной корреляции депрессии с другими поведенческими факторами, которые связаны с повышенным воздействием АФК (курение, употребление алкоголя, состояние избыточной массы тела) [49,50,51].2. Антипсихотические препараты.
Антипсихотические препараты — это фармакологические препараты, которые были внедрены более 4 десятилетий назад [52,53]. В настоящее время варианты лечения включают использование одной молекулы или комбинации нейролептиков. Эти агенты классифицируются как первого поколения или типичные, и второго поколения или атипичные. Более того, совсем недавно было введено третье поколение лекарств [54]. Механизм действия типичных нейролептиков (галоперидол, 1 , схема 1) заключается в блокировании дофаминовых рецепторов 2 типа.Атипичные нейролептики (клозапин, рисперидон, оланзапин, кветиапин и зипразидон, 2 — 6 , Схема 1), с другой стороны, имеют более низкое сродство к дофаминергическим рецепторам, но также блокируют серотонинергические рецепторы 5-HT 2A [54] . Для получения более подробной информации о молекулярных механизмах, лежащих в основе активности антипсихотических препаратов, и о фармакологических аспектах, читателю предлагается обратиться к недавним статьям Арингири и его коллег и Мардера и его коллег [55,56].Хотя значительные улучшения в лечении шизофрении были достигнуты после введения атипичных антипсихотических препаратов в начале 1990-х годов, следует также отметить, что их использование связано с некоторыми серьезными побочными эффектами. Клозапин может вызывать агранулоцитоз, в то время как использование оланзапина связано с гепатотоксичностью [57]. В дополнение к вышеизложенным соображениям необходимо уточнить влияние на окислительный статус ЦНС препаратов, используемых для лечения шизофрении, поскольку противоречивые сообщения присутствует в литературе [58,59].Фактически, все больше данных подчеркивает, что на статус окислительного стресса ЦНС можно повлиять с помощью нейролептиков, хотя различное поведение атипичных и типичных агентов является спорным вопросом [60].2.1. Нейролептики первого поколения (типичные)
Влияние типичных антипсихотиков на уровень окислительного стресса, вероятно, является наиболее обсуждаемым. Фактически, данные свидетельствуют о том, что повышенное перекисное окисление липидов, по-видимому, связано с использованием этих молекул в терапии [61]. Более того, согласно имеющимся в литературе сообщениям, лечение типичным антипсихотическим препаратом галоперидолом вызывает заметное повышение митохондриальной активности по образованию токсичных реактивных видов.В частности, считается, что образование метаболита пиридиния отвечает за цитотоксичность, экстрапирамидные побочные эффекты и сердечные функциональные нарушения [61,62,63]. Антиоксидантная роль галоперидола также была исследована в более позднем исследовании Brinholi et al. (обсуждается ниже). В антиоксидантных тестах in vitro было обнаружено, что это соединение не очень эффективно [53]. Было также описано, что галоперидол вызывает перекисное окисление липидов у больных шизофренией [64]. Тот факт, что лечение такими нейролептиками не приведет к однозначным результатам, дополнительно подтверждается клиническими данными.Kriisa et al. сообщили о результатах исследования, проведенного с учетом нескольких показателей окислительного стресса у пациентов с первым эпизодом психоза. Пациентам давали типичные, атипичные или смешанные препараты, а маркеры окислительного стресса (общая антиоксидантная способность, перекисное окисление липидов и окисление белков) измеряли в крови. Во-первых, авторы подчеркнули отсутствие значимых различий в таких уровнях между пациентами с первым эпизодом психоза и контрольной группой. Так или иначе, лечение антипсихотиками вызвало два положительных эффекта: снижение окислительного статуса и уменьшение воспаления.Тем не менее, авторы указали, что эти эффекты не наблюдались у пациентов с длительной хронической шизофренией, которые демонстрировали значительный окислительный стресс высокой степени [25].2.2. Антипсихотические препараты второго поколения (атипичные)
Роль атипичных антипсихотиков во влиянии на оксидативный стресс также является предметом обсуждения [64]. Некоторые авторы сообщают, что изменения концентрации и активности антиоксидантных ферментов вместе с другими биомаркерами окислительного повреждения могут не зависеть от лечения антипсихотиками и в противном случае могут отражать результаты патофизиологического процесса заболевания у пациентов [22,65].В дополнение к этому и перед любыми другими соображениями необходимо отметить, что окислительно-восстановительное поведение и характеристики любого органического соединения зависят от нескольких параметров, поэтому прямое сравнение не всегда возможно. В частности, результаты тестов in vitro и in vivo могут различаться из-за ряда условий реакции. Более того, как указали Янашевска и Бартош, даже в контексте простого и предварительного теста in vitro антиоксидантная активность данного соединения может отличаться при оценке с помощью различных тестов из-за специфических индикаторов или кинетики реакции [57,66 ].Также необходимо подчеркнуть, что такой антиоксидантный эффект может быть прямым или косвенным (опосредованным ферментами или другими биохимическими путями). Таким образом, антиоксидантная активность должна быть проверена на нескольких моделях, чтобы лучше оценить различные возможные механизмы и пути [53]. В нескольких сообщениях было высказано предположение, что атипичные нейролептики могут улучшать окислительный статус, уменьшая маркеры повреждения [67,68]. Хотя механизм действия не совсем ясен, этот эффект может быть проявлен путем вмешательства в антиоксидантные ферменты или путем противопоставления O 2 • — и образования гидроксильных радикалов [67].Другие сообщения показали, что атипичные нейролептики действуют косвенно, увеличивая концентрацию серотонинергического метаболита 5-гидроксииндолуксусной кислоты, эффективного акцептора гидроксильных и супероксидных радикалов, который также противостоит перекисному окислению липидов [69]. Более того, Садовска-Бартош и др. подчеркнули важность «местного антиоксидантного действия» атипичных нейролептиков из-за их более высокой локальной концентрации вблизи рецепторов дофамина и серотонина. Такое поведение привело бы к защитному эффекту против окисления, нитрования и хлорирования самих рецепторов, что позволило бы правильному функционированию рецептора и передаче сигналов [57].В моделях на грызунах, за исключением оланзапина, лечение атипичными нейролептиками не вызывало значительных изменений уровней перекисного окисления липидов, которые также были обнаружены через 90 дней лечения. Более того, предыдущие исследования показали, что оланзапин и другие нейролептики могут стимулировать выработку АФК, истощение глутатиона и перекисное окисление липидов [70,71]. Есть также данные, показывающие, что оланзапин может проявлять антиоксидантную активность, повышая регуляцию СОД [72,73]. Что касается эффектов in vivo, общее повышение общего антиоксидантного статуса сыворотки наблюдалось через 2 месяца лечения оланзапином, параллельно со снижением уровней малонового диальдегида в сыворотке [74].Совсем недавно Садовска-Бартош и др. представили исследование, посвященное оценке антиоксидантных свойств атипичных нейролептиков в бесклеточных и клеточных системах. Оланзапин и клозапин были идентифицированы как наиболее эффективные антиоксиданты на основе ряда тестов, изучающих эффекты таких препаратов на молекулярном уровне (окисление DHR123, ABTS, DPPH, FRAP, отбеливание флуоресцеином), что согласуется с предыдущими наблюдениями [53] . Авторы рационализировали эти результаты, обсудив структурные особенности двух соединений.Фактически, молекулы несут аналогичные функциональные группы, состоящие из азотсодержащего фрагмента, который ведет себя как основания Льюиса, способные отдавать электроны, таким образом стабилизируя радикальные частицы [57]. Клозапин также оказался эффективным в тесте по улавливанию радикалов DPPH и в качестве инактиватора H 2 O 2 в предыдущем исследовании [75,76]. Эти результаты дополнительно подтверждаются клиническими данными, такими как наблюдение эффектов оланзапина и клозапина у пациентов, у которых после введения наблюдалось уменьшение вызванного радикалами повреждения и неврологических симптомов [77].Более того, считается, что оланзапин улучшает функционирование СОД [68]. С другой стороны, следует учитывать, что предыдущее исследование пациентов с шизофренией выявило, что клозапин может вызывать окислительный стресс и экспрессию проапоптотических генов в нейтрофилах [78]. Brinholi et al. исследовали антиоксидантные свойства атипичных нейролептиков in vitro по сравнению с галоперидолом. В частности, измерялась продукция активных форм кислорода нейтрофилами, и этот эксперимент проводился параллельно с анализами улавливания свободных радикалов (DPPH, ABTS) [53].Согласно результатам этого исследования, клозапин, оланзапин и рисперидон снижали продукцию активных форм кислорода. Клозапин, оланзапин и, в некоторой степени, также зипразидон, также были описаны как хорошие поглотители супероксид-аниона [53]. В согласии с Sadowska-Bartosz et al., [57] Brinholi et al. обсудили результаты исследования, сопоставив антиоксидантную активность и химическую структуру, заявив, что «структура и химическая реактивность оцениваемых антипсихотических препаратов могут объяснить их антиоксидантную активность».В частности, авторы акцентировали внимание на роли аминогруппы, которая является общей чертой таких молекул. Благодаря наличию такого фрагмента эти молекулы ведут себя как основания Льюиса с электронодонорным эффектом. Кроме того, клозапин и оланзапин, в частности, несут алкильные группы, которые способствуют передаче электронов. Эта функция может объяснить результаты теста ABTS. Точно так же, как наблюдалось в анализе DPPH, кислородные частицы могут поглощаться водородом, выделенным из аминогруппы, чему способствует резонанс ароматического кольца.В зипразидоне и рисперидоне, с другой стороны, атом азота связан через линкер с гетероциклическими кольцами, конкурируя за электронные эффекты. Более того, стерические эффекты ограничивают доступность пары электронов азота. Аналогичным образом, атом азота в кветиапине нелегко делится своими электронами из-за присутствия атомов кислорода в простых эфирных и гидроксильных группах [53,79]. Эти наблюдения в некоторой степени подтверждаются предыдущим экспериментом Dietrich-Muszalska et al., при котором инкубация с зипразидоном вызывала в образцах плазмы от здоровых людей больший окислительный стресс и перекисное окисление липидов, чем другие антипсихотические препараты [71]. Совсем недавно Cai et al. представили исследование метаболического профилирования, направленное на выявление метаболических путей, на которые влияет оксидативный стресс и которые реагируют на атипичные антипсихотические препараты. Авторы рассмотрели несколько биомаркеров (креатин, холин, инозин, гипоксантин, мочевая кислота, аллантовая кислота, лизофосфатидилхолины, фосфатидилэтаноламины, кортикостерон и прогестерон), которые были количественно определены с помощью UPLC-MS / MS в различных областях мозга крыс.Исследование показало, что окислительное повреждение может влиять на креатин-фосфокреатиновый цикл и пуриновый путь, что приводит к усилению перекисного окисления мембранных липидов. Лечение атипичными нейролептиками (в частности, клозапином и рисперидоном) частично восстановило такие нарушения за счет повышения концентрации креатина, прогестерона и фосфатидилэтаноламинов [33]. Наконец, Dietrich-Muszalska et al. сообщили, что атипичные нейролептики могут вызывать различные эффекты на уровни TBARS в плазме (индикатор перекисного окисления липидов) в зависимости от дозы препарата.В целом зипразидон индуцировал прооксидантные эффекты в этом тесте, тогда как оланзапин и кветиапин снижали уровни TBARS [71].2.3. Арипипразол
В контексте лечения нейролептиками арипипразол ( 7 , схема 2) проявляет другой механизм действия и, следовательно, упоминается как средство третьего поколения. Этот препарат действует как частичный агонист рецепторов D 2 , D 3 и 5-HT 1A , а также является антагонистом рецепторов 5-HT 2A .Арипипразол — первый частичный агонист дофамина, продаваемый как антипсихотический препарат, и он также определяется как стабилизатор дофамин-серотониновой системы [52,71]. Он очень эффективен при лечении аффективных, когнитивных и негативных симптомов шизофрении [80]. Park et al. сообщили, что арипипразол, а также оланзапин и зипразидон могут обеспечивать защиту от окислительного стресса в модели грызунов, индуцированной ионом N-метил-4-фенилпиридиния (MPP + ), путем модуляции уровней ROS и активности SOD) и BCL2-ассоциированного X экспрессия белка (Bax) [81].Като и др. сообщили, что арипипразол может также контрастировать с образованием микроглии O 2 • — , вмешиваясь в каскад активации протеинкиназы C (PKC), внутриклеточную передачу сигналов Ca 2+ и активацию NADPH-оксидазы [82]. Cai et al. в исследовании терапевтической эффективности антипсихотических средств в отношении метаболических путей, связанных со стрессом, упомянутых выше. Этот препарат, а также клозапин и рисперидон, оказались эффективными в регулировании уровня креатина в префронтальной коре и гиппокампе [33].Dietrich-Muszalska et al. сравнили антиоксидантный эффект арипипразола in vitro с действием других антипсихотических препаратов (галоперидола, клозапина, рисперидона, оланзапина, кветиапина и зипразидона) в концентрациях, соответствующих их клинически эффективным дозам в плазме пациентов. Эффект от такого лечения оценивали путем измерения уровня TBARS, который является индикатором перекисного окисления липидов в плазме. По данным этих авторов, арипипразол индуцировал незначительное перекисное окисление липидов в плазме, тогда как при более высоких дозах он проявлял антиоксидантное действие на уровень TBARS в плазме [71].2.4. Другие агенты против окислительного стресса: природные и диетические соединения
Сообщалось, что помимо синтетических нейролептиков, другие природные и диетические небольшие молекулы играют антиоксидантную роль и инактивируют вредные реактивные виды в контексте шизофрении. Введение ПНЖК крысам представляет собой иллюстративный пример, поскольку наблюдалось повышение активности СОД [35,83]. Также был исследован потенциал витамина C (водорастворимого) и витамина E (жирорастворимого) в качестве антиоксидантной добавки у пациентов с шизофренией.Однако использование витаминов C и E не представляется целесообразной стратегией, так как высокое потребление с пищей, скорее всего, приведет к прооксидантному действию [84]. Бошкович и др. проанализировал вклад, сообщающий об исследованиях, выполненных с использованием других добавок, таких как N-ацетилцистеин ( 8 ), рутин ( 9 ), гинкго билоба, мелатонин ( 10 ), гидрокситирозол ( 11 ), фенэтиловый эфир кофейной кислоты ( 12 ), ресвератрол ( 13 ), кверцетин ( 14 ) и ликопин ( 15 , схема 3) [22].Различные доклинические и клинические исследования показали положительное влияние гинкго билоба на улучшение когнитивных способностей у лиц с нарушениями и снижение тревожности при патологических состояниях [85]. К сожалению, из-за неоднородности данных и неопределенных механизмов действия правильная интерпретация таких эффектов не является тривиальной. Скьявоне и Трабас недавно проанализировали научный вклад за период 2007–2017 годов, исследуя влияние антиоксидантных соединений на нейропатологические изменения на моделях психотических грызунов. [86].N-ацетилцистеин является одной из наиболее изученных добавок и показал положительный эффект в предотвращении или облегчении невропатологических и поведенческих изменений в перинатальной модели психоза кетамином и в нескольких других доклинических исследованиях. В частности, это соединение вызывает нормализацию невропатологических изменений у мышей GCLM-KO и предотвращает негативные эффекты окислительного стресса в постнатальном развитии ЦНС [87,88,89]. Аналогичное благоприятное поведение наблюдалось и для апоцинина, природного соединения, также известного как ацетованиллон.В более ограниченном количестве работ также исследовалась роль витамина С, омега-3 жирных кислот и эбселена [86]. В частности, Cabungcal et al. изучили эффекты лечения подростков последним соединением, хорошо известным имитатором GPX, на крысах с неонатальным поражением вентральной части гиппокампа, модели шизофрении на грызунах. Авторы наблюдали реверсию поведенческих дефицитов на этой животной модели, предполагая, что пре-симптоматический оксидативный стресс может представлять собой потенциальную цель для раннего вмешательства [90].4. Подходы In Silico
Обзор, представленный на данный момент, дает довольно хорошее представление о том, как уже существующие соединения могут иметь тандемный положительный эффект при лечении основных психических расстройств и снижении уровней окислительного стресса. Использование алгоритмов машинного обучения, разработанных в последние несколько лет для возможного использования антипсихотических или антидепрессантов в качестве эффективных антиоксидантов, также стало решающим вкладом многих исследователей [118,119,120,121,122,123,124,125]. Однако во многих исследованиях, выполненных до сих пор, использовались статистические или основанные на классической механике методологии (такие как QSAR, молекулярный докинг и молекулярная динамика) [126,127,128].Эти подходы, будучи очень полезными при работе с большим количеством пробных молекул, не способны объяснить внутренний молекулярный механизм, лежащий в основе эффективности конкретной структуры. Для решения этой задачи необходимо прибегнуть к методам, основанным на квантово-механических (КМ) расчетах.Теория функционала плотности (DFT) в настоящее время является одним из наиболее применяемых методов QM, поскольку его можно использовать на довольно больших структурах без множества компромиссов по сравнению с другими более точными методами, которые требуют гораздо больших вычислительных затрат.Хотя при рассмотрении механизма действия лекарств мы сталкиваемся с очень сложной структурой физиологии человека, способность знать на молекулярном уровне внутренние механизмы, приводящие к созданию эффективного соединения, является мощным инструментом. Например, это открывает путь к использованию рационального дизайна для улучшения уже существующих структур или предложения новых с потенциально более высокой активностью.
Хотя DFT-исследования антипсихотических препаратов [129,130,131,132] и антидепрессантов [133,134,135] обычно встречаются в литературе, работ по антиоксидантной активности таких соединений все еще мало.В недавнем исследовании, проведенном некоторыми из нас [123], активность флуоксетина (20) и серотонина ( 18 , схема 4) по улавливанию свободных радикалов была исследована с использованием метагибридного функционала (M06-2X [136]) в в газовой фазе и в растворителе. Исследование подтвердило мнение о том, что, хотя флуоксетин сам по себе обладает некоторой способностью улавливать радикалы, он менее активен, чем сам серотонин. Таким образом, эффект, который он оказывает в качестве балансира окислительного стресса, скорее всего, связан с более высокой концентрацией свободного серотонина, обнаруживаемой при приеме препарата.Кроме того, использование вычислений DFT позволило авторам проанализировать антиоксидантную активность каждого доступного сайта для ряда различных механизмов, что дает полную картину общего механизма антиоксидантной активности флуоксетина и серотонина. В другой работе некоторых авторов этого обзора вместо этого рассматривалось другое соединение, а именно золпидем ( 28 , схема 6), препарат, обычно применяемый для борьбы с бессонницей [124]. Антиоксидантная способность этой молекулы по механизму переноса атома водорода (HAT) исследована на уровне теории SMD-M06-2X / 6-311 + G (d, p) // M06-2X / 6-31G (d). и было обнаружено, что он сопоставим с мелатонином ( 10 , схема 3) или Trolox ( 29 , схема 6) (аналог витамина E).Кроме того, в этом случае были протестированы все сайты, способные проявлять какую-либо активность по отношению к свободным радикалам, а наиболее реактивные были выделены и проанализированы на основе их химической природы. В частности, выяснилось, что флуоксетин, золпидем и серотонин, по аналогии с мелатонином, обладают реактивным сайтом CH 2 , из которого HAT эффективен в отношении алкоксильных, а также пероксильных радикалов. Эти два исследования открывают многообещающие пути в качестве специфических мотивов, придающих флуоксетину, серотонину и золпидему их антиоксидантную активность, и могут рассматриваться как прогностический фактор антиоксидантной активности, и это может быть распространено также на другие препараты для оценки их антиоксидантной способности.Напротив, антиоксидантные свойства диетических и природных соединений, которые могут оказывать положительное воздействие при лечении психологических или поведенческих расстройств, были тщательно изучены. В частности, модель для оценки общей антиоксидантной способности раствора была недавно предложена и успешно применена к таким молекулам, как мелатонин и тролокс, Галано и др. [137]. Кроме того, та же группа глубоко изучила антиоксидантные свойства мелатонина и амида N-ацетилцистеина [138, 139].Мелатонин был исследован с метагибридным функционалом (M05-2X [140]) в бензоле и воде с использованием подхода непрерывной сольватации (IEFPCM [141, 142, 143]), и его возможные механизмы реакции были оценены и ранжированы. Было обнаружено, что он является отличным поглотителем • OH и очень хорошим гасителем реактивных пероксильных радикалов (таких как • OOCCl 3 ), которые в водном растворе реагируют в основном по механизму последовательного переноса электронов и протонов (SEPT). Более того, в более поздней работе возможные производные мелатонина были исследованы с помощью вычислений на предмет улучшения антиоксидантных возможностей [144].Результаты, полученные снова с функционалом M05-2X, предсказывают, что пять из исследованных производных будут иметь более высокую антиоксидантную активность, чем мелатонин. Амид N-ацетилцистеина ( 8 , схема 3) также был темой компьютерного исследования DFT. с использованием функционала M05-2X [139]. Результаты показывают контролируемую диффузией реакцию как в водной, так и в неполярной среде для реакции с • OH с одним и тем же механизмом для двух сред. Однако в полярном растворе атом S оказался наиболее реакционноспособным центром, тогда как в бензоле атом S и атом C, непосредственно связанные с ним, в равной степени способствовали антиоксидантной активности.Эти результаты были подтверждены другим последовательным исследованием, которое подчеркнуло предпочтение механизма HAT для сульфгидрильной группы, присутствующей в пяти исследуемых препаратах, среди которых N-ацетилцистеин [145]. Примечательным аспектом этой работы является то, что N-ацетилцистеин занял самое низкое место среди пяти протестированных молекул. Полезные свойства нарингенина ( 25 , схема 5) в ограничении окислительного стресса также были рассмотрены в недавнем вычислительном исследовании [146]. Расчеты, проведенные на уровне теории M06-2X / 6-311 + G **, дали хорошее представление о влиянии электроноакцепторных и электронодонорных групп на антиоксидантную активность этого соединения в газовой фазе в бензоле. и в воде.Кроме того, были проанализированы различные механизмы поглощения, и выяснилось, что в газовой фазе и в бензоле HAT является наиболее предпочтительным механизмом, тогда как в воде происходит последовательная передача электронов с потерей протонов (SPLET), что подтверждает результаты, полученные в предыдущей вычислительной работе. [147]. Лютеолин ( 27 , схема 5) и апигенин ( 30 , схема 6) были проверены в комбинированном экспериментальном и вычислительном исследовании для оценки эффекта комплексообразования Cu (II) с двумя очень похожими флавоноидами [ 148].Авторы обнаружили противоположный эффект на антиоксидантную способность при внедрении катиона меди. В случае лютеолина была выявлена повышенная активность, а у апигенина — пониженная антиоксидантная способность. Было обнаружено, что роль меди в повышенной реакционной способности лютеолина напрямую связана с более низкими потенциалами ионизации комплексов Cu-лютеолин по отношению к единственной молекуле лютеолина. Литература по антиоксидантным свойствам флавоноидов в природных соединениях обширна.В этом разделе был представлен краткий обзор, ограниченный результатами, полученными для соединений, которые показали возможное применение при лечении шизофрении или депрессии. Для более исчерпывающего и общего изучения этого вопроса был опубликован ряд недавних обзоров [149, 150, 151, 152]. Этот анализ показывает, как очень богатая литература, касающаяся общей антиоксидантной активности флавоноидов, сочетается с очень скудным собранием работ, посвященных исследованию антиоксидантные свойства антидепрессантов и нейролептиков на молекулярном уровне.Один из немногих недавних достижений в этой области, о котором сообщили некоторые из авторов этой работы, был основан на идее объединить антиоксидантные свойства флуоксетина и селена [153]. Хотя селен является олигоэлементом в организме человека, он содержится в некоторых основных антиоксидантных ферментах, таких как глутатионпероксидаза, йодтиронин дейодиназа (DIO), тиоредоксинредуктазы (TrxR) и метионинсульфоксидредуктазы (Msr) [154]. Среди них GPx играет центральную роль в балансировании клеточного окислительного стресса, и его механизм действия [155, 156, 157, 158] вдохновил на разработку и тестирование многих биомиметических соединений, направленных на предотвращение окислительного повреждения [159, 160, 161].Многие возможные различные структуры и модельные химические мотивы были оценены с помощью вычислений, чтобы стать исходным каркасом для создания эффективного и действенного антиоксидантного препарата [162, 163, 164, 165]. Хорошие результаты, полученные в этих исследованиях, открывают некоторые очень многообещающие перспективы для комбинации внутренних антиоксидантных свойств селена с специально разработанными молекулами, которые обладают множественными целевыми способностями в одном соединении.FDA одобряет антиоксидантный препарат для лечения БАС
FDA одобрило эдаравон (Radicava) для лечения бокового амиотрофического склероза (БАС), первое новое лечение, одобренное для этого состояния за несколько лет, сообщило агентство.
По словам производителя лекарств Mitsubishi Tanabe, препарат является антиоксидантом, который снимает последствия окислительного стресса при БАС, нейтрализуя липидные пероксильные радикалы и пероксинитрит, предотвращая повреждение кровеносных сосудов и нейронов.
Edaravone был одобрен для лечения БАС в Японии в июне 2015 года, но был одобрен в этой стране с 2002 года для облегчения повреждения мозга после инсульта.
FDA заявило, что эффективность препарата была продемонстрирована в ходе шестимесячного испытания в Японии, в котором приняли участие 137 пациентов, которые были рандомизированы в группы эдаравона или плацебо.На 24 неделе у тех, кто принимал препарат, клиническая оценка повседневного функционирования была меньше, чем у тех, кто принимал плацебо.
Alzforum сообщил, что в Японии было проведено два испытания препарата III фазы; в первом не было обнаружено никакого эффекта от лечения, но во втором, в который были включены пациенты, у которых изначально было лучше функционирование, было обнаружено, что препарат работает для этих пациентов с умеренными симптомами.
FDA сообщило, что побочные эффекты между группами были схожими, и наиболее частыми побочными реакциями были синяки и нарушение походки.
Агентство также отметило, что препарат связан с рисками, требующими медицинской помощи, такими как крапивница, отек, одышка и аллергические реакции на бисульфит натрия — ингредиент, который может вызывать анафилактические симптомы, которые могут быть опасными для жизни у людей с сульфитом. чувствительность.
Эдаравон вводится в виде внутривенной инфузии с начальным циклом лечения, состоящим из ежедневного приема в течение 14 дней, с последующим 14-дневным периодом отсутствия лекарств. Последующие циклы лечения состоят из приема лекарств в течение 10 из 14 дней с последующим двухнедельным периодом отсутствия лекарств.
Эрик Бастингс, доктор медицины, заместитель директора отдела неврологических продуктов в Центре оценки и исследований лекарственных средств FDA, заявил в заявлении, что после того, как FDA узнало об использовании препарата для лечения БАС в Японии, агентство «быстро занялось с разработчиком препарата о подаче заявки на маркетинг в США «.
В США этому препарату был присвоен статус орфанного препарата, что вызывает вопросы о потенциально высокой цене, несмотря на то, что генерические версии препарата доступны в Китае и Индии, согласно Alzforum.
По оценкам CDC, от 12 000 до 15 000 американцев страдают БАС.
Как избежать взаимодействия антиоксидантов с лекарственными средствами во время лечения рака
Авторы: Дэн Лабриола, Северная Дакота, и Роберт Б. Ливингстон, Мэриленд,
, 25 июля 2014 г.
Дэн Лабриола, Северная Дакота
Роберт Б. Ливингстон, Мэриленд
Рекомендуется, чтобы дополнительное лечение пациентов ограничивалось теми, действия и взаимодействия которых понятны; когда есть сомнения, следует проявлять осторожность.Потенциальные преимущества уменьшения побочных эффектов часто не перевешивают потенциальный риск неблагоприятного исхода.— Дэн Лабриола, Северная Дакота, и Роберт Б. Ливингстон, Мэриленд
Многие потенциальные взаимодействия между лекарственными средствами и питательными веществами могут повлиять на лечение рака. Важно учитывать эти взаимодействия, учитывая значительное использование добавок и других вариантов самолечения во время лечения рака. На антиоксиданты приходится значительная часть продаж индустрии пищевых добавок в размере 32 миллиардов долларов, 1 , и поэтому у пациентов часто возникают вопросы о них.Перед онкологами стоит задача определить, какие сочетания добавок и лечения рака безопасны, и объяснить пациентам риски.
Решение состоит в том, чтобы не полагаться на ссылки на взаимодействие между лекарственными средствами и питательными веществами, поскольку они не являются столь зрелыми и надежными, как научные отчеты о взаимодействии лекарств и лекарственных веществ для получения неизменно точных ответов. Более того, сказать пациенту, чтобы он прекратил принимать все добавки или даже просто прекратить прием антиоксидантов, проблематично, поскольку пациенты не хотят отказываться от препаратов, которые, по их мнению, приведут к лучшим результатам и уменьшат побочные эффекты, как обычно упоминается в агрессивном маркетинге.
Понимание противоречия
Множество противоречивых сообщений об антиоксидантах при лечении рака можно понять и легче объяснить пациентам, если мы вернемся к фармакологии этих агентов. Мы сосредоточены здесь исключительно на взаимодействии между антиоксидантами и теми методами лечения рака, которые используют активные формы кислорода для их цитотоксического действия. Характеризуясь неспаренным набором электронов на внешнем орбитальном кольце, активные формы кислорода представляют собой хорошо известный механизм, с помощью которого лучевая терапия и некоторые химиотерапевтические агенты предпочтительно вызывают апоптоз в раковых клетках.
Антиоксиданты получили известность у онкологических больных благодаря их способности подавлять активные формы кислорода, свободные радикалы, которые могут вызывать некоторые виды рака. Также хорошо известно, что они могут подавлять активные формы кислорода, создаваемые лечением рака. 2 Эти взаимодействия, однако, происходят только тогда, когда антиоксидант и химиотерапия согласованы. Если молекулы не совпадают, антиоксидант не будет взаимодействовать и, следовательно, не повлияет на лечение.
В различных методах лечения рака используются различные уникальные реактивные формы кислорода из-за их цитотоксичности, хотя их часто называют так, как если бы все виды химиотерапии или лечения рака были одинаковыми.Антиоксиданты из диетических, растительных и других доступных источников также бывают во многих различных формах. Некоторые комбинации антиоксидантов и лечения рака будут взаимодействовать, некоторые — нет, и на сегодняшний день мы не можем точно предсказать, какие из них взаимодействуют, а какие нет.
Когда происходит взаимодействие, это имеет чистый эффект снижения дозировки за счет уменьшения количества активных форм кислорода, доставляемых лечением. Поскольку большинство из этих методов лечения имеют узкий терапевтический индекс и эффективность, пропорциональную дозе, даже незначительное уменьшение количества активных форм кислорода может иметь значительное влияние на исход, включая снижение выживаемости без болезней, 3 , особенно в случае долгосрочного исхода. это клиническая цель.
В опубликованной литературе, касающейся одновременной химиотерапии или облучения с антиоксидантами, делается широкий спектр выводов, некоторые из которых показывают улучшение выживаемости и статуса, а другие — снижение выживаемости. Удобный список был опубликован Ladas et al. 4 Однако, если рассматривать их в свете основной фармакологии, эти явно противоречивые результаты понятны. Некоторые комбинации взаимодействовали, а другие нет.
К сожалению, обобщения обо всех взаимодействиях антиоксидантов и активных форм кислорода, основанные на этих проверенных комбинациях, вводят в заблуждение.Фактически, может быть даже неточно предсказать взаимодействие конкретной комбинации, которая была протестирована при применении к другому пациенту или состоянию, до тех пор, пока мы не получим более глубокие знания о независимых переменных, которые могут повлиять на результат.
Объяснение пациентам потенциальных рисков
Когда пациент приходит с рекомендациями по антиоксидантам, основанными на данных, которые кажутся слишком хорошими, чтобы быть правдой, учтите, что здесь могут быть другие факторы. Наиболее очевидное объяснение состоит в том, что непреднамеренное снижение дозы в результате взаимодействия антиоксидант-активные формы кислорода, вероятно, уменьшит побочные эффекты, ничем не отличаясь от введения уменьшенной дозы.Кроме того, добавки с противовоспалительной активностью могут улучшить состояние пациента и вызвать появление опухолевой реакции в краткосрочной перспективе даже при снижении эффективной дозировки.
Данные испытаний краткосрочной или спасительной терапии, когда снижение реакции опухоли в результате взаимодействия может быть незаметным, следует рассматривать с осторожностью. Это особенно важно для пациентов, для которых долгосрочная выживаемость без заболевания является клинической целью, поскольку такое же вмешательство может существенно повлиять на выживаемость, если чистый эффект лечения падает ниже терапевтического индекса.
В единственном долгосрочном рандомизированном плацебо-контролируемом проспективном исследовании, посвященном этой теме, Байрати и др. Назначали антиоксиданты с лучевой терапией 540 пациентам с плоскоклеточными клетками головы и шеи I и II стадии и обнаружили значительное увеличение частоты рецидивов у этих пациентов. антиоксидантная рука. 5 Те же авторы снова опубликовали, на этот раз с поправкой на пациентов, которые продолжали курить после лечения, 6 и предположили, что различия могут быть устранены путем исключения курильщиков из рандомизации.Тем не менее, эта корректировка была спорной, и авторы признают, что антиоксиданты, в действительности, взаимодействует с лучевой терапией.
Минимизация взаимодействий и управление ими
Что касается ведения пациентов и безопасности, очевидны доказательства того, что химиотерапевтические агенты, которые зависят от механизмов реактивных форм кислорода для их цитотоксичности, в том числе алкилирующие, противоопухолевые антибиотики и другие, должны считаться потенциально уязвимыми для вмешательства со стороны антиоксидантных добавок, превышающих диетические уровни .Если антиоксиданты должны использоваться с этими пациентами, взаимодействие можно минимизировать, разделив дозировку по крайней мере на 4 периода полураспада для лекарства и вернув антиоксидант к нормальным диетическим уровням в сыворотке. Следует учитывать многокомпонентную фармакокинетику как антиоксиданта, так и лекарственного средства. Те же принципы применимы к лучевой терапии.
Фармакокинетика уязвимых химиотерапевтических препаратов и антиоксидантов, включая стратегии управления этими взаимодействиями, была рассмотрена более подробно и может быть полезной. 7 При поиске дополнительной информации, к сожалению, не все Интернет-сайты и службы баз данных являются точными, но одним надежным источником является научно обоснованный веб-сайт интегративной медицины Мемориального онкологического центра им. Слоуна Кеттеринга. 8 Также доступны более широкие и понятные для пациента объяснения многих взаимодействий онкологических и питательных веществ, включая антиоксиданты. 9,10
Часто задаваемые вопросы
Химиотерапия и лучевая терапия — мощные методы лечения.Как получается, что некоторые витамины или другие относительно безвредные вещества могут мешать?
Цитотоксические методы лечения действительно эффективны, но их эффективность определяется относительно узким терапевтическим индексом, что означает, что дозировка уже близка к верхнему или нижнему пределу. В исследовании Bairati et al. 5 использовались скромные 400 МЕ витамина Е и 30 мг бета-каротина. Пациенты часто занимаются самолечением, применяя гораздо более высокие дозировки.
Можно ли избежать риска нежелательного взаимодействия, посоветовав пациенту избегать приема антиоксидантов в течение 24 часов после химиотерапии или облучения?
Ответ зависит от лечения и пациента.Эмпирическое правило состоит в том, чтобы разделить взаимодействующие агенты по крайней мере на 4 конечных периода полураспада лечения рака и, для дополнительного антиоксиданта, вернуться к нормальным уровням в сыворотке. Например, маловероятно, что цитотоксичность бусульфана (Busulfex, Myleran) с конечным периодом полураспада примерно 3 часа будет иметь значимое взаимодействие через 24 часа, тогда как оксалиплатин, конечный период полувыведения которого составляет более 50 часов , будет уязвима для помех на следующий день и дольше.
Когда путь введения отличается от внутривенного, фармакокинетика соответствующего компартмента также важна.При интратекальном введении метотрексата нельзя использовать кинетику первого отсека.
Фармакокинетика антиоксиданта также важна. Например, период полувыведения витамина Е составляет примерно 48 часов, что значительно превышает 24 часа даже для умеренных дозировок.
Каковы наиболее распространенные источники антиоксидантов?
Витамины A (включая бета-каротин), B6, C и E — мощные антиоксиданты. Минералы цинк и селен также обладают значительной антиоксидантной активностью.Поскольку это питательные вещества для поддержания жизни, которые не могут быть произведены организмом, они должны быть доступны в разумных количествах в рационе питания и / или с добавками.
Существует также множество источников антиоксидантов на растительной основе, включая некоторые фрукты, овощи и лекарственные травы.
Безопасно ли для пациентов принимать несколько витаминов во время лечения?
Не все мультивитаминные продукты подходят. Многие из них содержат 2000% или более дневной нормы некоторых ингредиентов.Лучше всего найти несколько витаминов, которые имеют примерно 100% дневной нормы для всех ингредиентов.
Являются ли лекарственные травы потенциальным источником антиоксидантного воздействия?
Некоторые растения содержат более 50 фармакологически активных алкалоидов, многие из которых обладают антиоксидантной активностью. Те, которые были научно протестированы, стандартизированы по своим активным ингредиентам и произведены с хорошим контролем качества, будут вести себя предсказуемо.Для других у нас просто еще недостаточно данных, чтобы знать все их действия. Если вы не уверены, самый безопасный курс — предположить, что средство обладает антиоксидантной активностью, и отделить его от лечения.
Может ли диета быть потенциальным источником помех?
Нормальное разнообразное питание не должно быть проблемой. Однако полезно предостеречь пациентов от практики, которая может концентрировать антиоксиданты, таких как суровые «монодиеты» и приготовление сока из овощей. Кроме того, некоторые спортивные напитки и протеиновые добавки обогащены питательными веществами, которые могут помешать лечению.Проконсультируйтесь с этикеткой.
Многие другие продукты дополнительной и альтернативной медицины, такие как гомеопатические препараты и травы традиционной китайской медицины, продвигаются для использования при лечении рака. Являются ли они потенциальным источником антиоксидантного вмешательства?
Традиционные гомеопатические препараты очень слабые и вряд ли будут взаимодействовать друг с другом. Однако некоторые продукты, помеченные как гомеопатические, содержат другие ингредиенты, которые не являются разбавленными и могут представлять опасность.
Растения, связанные с традиционной китайской медициной и другими азиатскими целительскими искусствами, сталкиваются с теми же проблемами, что и западные травы, а именно: мы не всегда знаем, сколько антиоксидантной активности они содержат.Рекомендуются такие же меры предосторожности.
Есть ли какие-либо другие проблемы при сочетании добавок с лекарствами от рака, которые уязвимы для антиоксидантного вмешательства?
Существует множество научно обоснованных методов лечения дополнительной и альтернативной медицины с продемонстрированной пользой 11 при применении в дисциплинированных комплексных условиях лечения, но также существуют риски снижения эффективности лечения, усиления побочных эффектов и создания новых проблем при неправильном назначении. .Провайдеры этих методов лечения часто не понимают технологии современной онкологической помощи и, как следствие, не распознают потенциально негативные взаимодействия.
Пациенты также сбиты с толку, когда взаимодействия дают не интуитивные результаты. В случаях, когда дополнительное лечение снижает побочные эффекты, пациенту может быть трудно понять, что это не может быть полностью положительным событием в отношении результата. Пациенты, которые стремятся сделать что-то самостоятельно, чтобы улучшить путь к раку, часто сбиваются с толку, когда обычно здоровые стратегии, такие как приготовление сока из овощей и фруктов, описываются как рискованные.
Сводка
Рекомендуется, чтобы лечение пациентов добавлялось только к тем, действия и взаимодействия которых понятны; когда есть сомнения, следует проявлять осторожность. Потенциальные преимущества уменьшения побочных эффектов часто не перевешивают потенциальный риск неблагоприятного исхода. Важно отметить, что антиоксиданты представляют собой лишь одно из многих дополнительных и альтернативных методов лечения, которые могут взаимодействовать с лечением онкологии.
Приверженность и удовлетворенность пациентов повышаются, если эти взаимодействия можно объяснить, а не просто сказать «нет». Соблюдение правил будет еще лучше, если вместо опасной добавки можно будет прописать безопасный заменитель, особенно для пациентов, которые серьезно настроены использовать эти продукты во время лечения. Пациенты ценят получение компетентных рекомендаций от своей онкологической бригады, особенно когда они получают противоречивую информацию.
Первоначальный скрининг пациента на предмет возможных взаимодействий может быть проведен провайдером среднего звена, прошедшим соответствующее обучение.Пациентам, которым нужен план лечения с использованием дополнительных и альтернативных методов лечения, настоятельно рекомендуется компетентная интегративная онкологическая служба.
В будущем, по мере того, как мы расширяем наши знания с помощью новых исследований, возможно, диетические и растительные антиоксиданты найдут свое место в традиционной онкологической помощи. ■
Доктор Лабриола — директор специализированной клиники Northwest Natural Health и медицинский директор Натуропатической службы Шведского института рака Шведского медицинского центра, Сиэтл.Доктор Ливингстон — профессор медицины и гематологии онкологического центра Университета Аризоны, Тусон.
Раскрытие информации: Drs. Ливингстон и Лабриола не сообщили о потенциальных конфликтах интересов.
Список литературы
1. Ларивьер Д: Пищевые добавки, разгибающие мускулы, как растущая индустрия. Forbes, апрель 2013 г. Доступно на сайте www.forbes.com. По состоянию на 30 июня 2014 г.
2. Эрхола М., Келлокумпу-Лехтинен П., Метса-Кетела Т. и др.: Влияние химиотерапии на основе антрациклинов на общую антиоксидантную способность плазмы у пациентов с мелкоклеточным раком легкого.Free Radic Biol Med 21: 383-390, 1996.
.3. Budman DR, Berry DA, Cirrincione CT и др.: Доза и интенсивность дозы как детерминанты результата адъювантного лечения рака груди. J Natl Cancer Inst 90: 1205-1211, 1998.
4. Ladas EJ, Jacobson JS, Kennedy DD, et al: Антиоксиданты и терапия рака: систематический обзор. J Clin Oncol 22: 517-528, 2004.
5. Байрати И., Мейер Ф, Гелинас М. и др.: Рандомизированное испытание витаминов-антиоксидантов для предотвращения острых побочных эффектов лучевой терапии у пациентов с раком головы и шеи.J Clin Oncol 23: 5805-5813, 2005.
6. Мейер Ф, Байрати И., Фортин А. и др.: Взаимодействие между добавлением антиоксидантных витаминов и курением сигарет во время лучевой терапии в связи с долгосрочным воздействием на рецидивы и смертность: рандомизированное исследование среди пациентов с раком головы и шеи. Int J Cancer 122: 1679-1683, 2008.
.7. Лабриола Д., Ливингстон Р.: Возможные взаимодействия между диетическими антиоксидантами и химиотерапией. Онкология (Уиллистон-Парк) 13: 1003-1008, 1999.
8.Мемориальный онкологический центр им. Слоуна Кеттеринга: интегративная медицина. Доступно на www.mskcc.org/cancer-care/integrative-medicine. По состоянию на 30 июня 2014 г.
9. Кассилет Б: Выживание: хорошая жизнь во время и после рака. Анн-Арбор, Мичиган, Spry Publishing, 2014.
10. Лабриола D: Дополнительные методы лечения рака. Нью-Йорк, Three Rivers Press, 2000.
11. Объединение традиционной и натуропатической медицины. Новости Шведского медицинского центра, март 2011 г. Доступно на www.nwnaturalhealth.com/holmstrom-article.pdf. По состоянию на 30 июня 2014 г.
Интегративная онкология — приглашенный редактор Барри Р. Кассилет, магистр медицины, доктор философии , руководитель службы интегративной медицины и Лоренс С. Рокфеллер, заведующий кафедрой интегративной медицины в Мемориальном онкологическом центре им. Слоана Кеттеринга, Нью-Йорк.
Служба интегративной медицины при Мемориальном онкологическом центре им. Слоана Кеттеринга разработала и поддерживает бесплатный веб-сайт About Herbs (www.mskcc.org/aboutherbs), который предоставляет объективную и непредвзятую информацию о травах, витаминах, минералах и других пищевых добавках, а также недоказанные противоопухолевые методы лечения.Каждая из 269 и постоянно растущего числа записей предлагает версии для медицинских работников и пациентов, и записи регулярно обновляются с учетом последних результатов исследований.
Кроме того, приложение About Herbs, первое мобильное приложение онкологического центра Memorial Sloan Kettering, совместимо с устройствами iPad, iPhone и iPod Touch, и его можно загрузить по адресу http://itunes.apple.com/us/app / о-травах / id554267162? mt = 8.
Что такое антиоксиданты? Польза для здоровья, лучшие источники, побочные эффекты и многое другое
Согласно U.S. Рекомендации MyPlate Министерства сельского хозяйства, существуют различные типы антиоксидантов, каждый из которых может играть важную роль для вашего здоровья.