Продукты, содержащие белок: таблица
Белок, как известно, является важнейшим строительным материалом для нашего организма. Без него невозможна регенерация тканей, набор мышечной массы и даже эффективное похудение. В последнее время особой популярностью стали пользоваться пищевые добавки — протеиновые коктейли. А, между тем, мы забываем, что пополнять запасы белка в организме можно с помощью продуктов питания.
Какую роль играют белки в организме
Белок, протеин и полипептиды – это один и тот же элемент, имеющий одну химическую формулу. Основа молекулы белка — цепочка из аминокислот, без которых организм просто не может жить. Белки содержатся в каждой клетке и участвуют во всех обменных процессах. Кроме того, белки служат незаменимым источником сил. После употребления белковой пищи мы чувствуем прилив энергии и сил, а также сытость на протяжении нескольких часов. Без белков печень превращает протеины в жир, формируя запас быстродоступного источника энергии.
Молекула белка отображается химической формулой: h3N–CH(R)–COOH
Белки в организме человека — это основной материал для развития и роста всех без исключения клеток. Аминокислоты, содержащиеся в белке, ничем не заменимы, но все же, самой важной их функцией является участие в репликации молекул ДНК и РНК. Также без аминокислот невозможно образование многих гормонов, производство гемоглобина и ферментов, построения новых клеток и восстановления поврежденных. Вся жизнедеятельность нашего организма построена на белково-углеводных процессах. Кроме того, белковая пища незаменима при восстановлении организма после долгой болезни.
Аминокислоты, содержащиеся в белке, ничем не заменимы, но все же, самой важной их функцией является участие в репликации молекул ДНК и РНК. Также без аминокислот невозможно образование многих гормонов, производство гемоглобина и ферментов, построения новых клеток и восстановления поврежденных. Вся жизнедеятельность нашего организма построена на белково-углеводных процессах. Кроме того, белковая пища незаменима при восстановлении организма после долгой болезни.
Белок относится к тем веществам, которые не накапливаются и не производятся нашим организмом — его необходимо получать извне. Самым доступным способом являются продукты с содержанием протеинов (белка).
Однако, бывают ситуации и заболевания, когда нужно ограничивать употребление белков. К таким относят почечную недостаточность, при которой количество белка не должно превышать 20-40 г в сутки.
Регулярное употребление белковой пищи гарантирует регенерацию всех тканей и быстрое наращивание мышечной массы (заметьте — именно мышечной, а не жировой). Протеины могут содержаться как в продуктах животного происхождения, так и в растительной пище. Но при необходимости набора мышечной массы спортсменами приходится пить протеиновые коктейли, так как белковых продуктов для этого не хватает.
Протеины могут содержаться как в продуктах животного происхождения, так и в растительной пище. Но при необходимости набора мышечной массы спортсменами приходится пить протеиновые коктейли, так как белковых продуктов для этого не хватает.
Для чего нужны протеины спортсменам? Во время спортивных тренировок тратится достаточно много энергии, которую нужно восстанавливать. Кроме того, при занятиях определенными видами спорта нужно употреблять нужное количество протеинов. Так, доза белка при занятиях бодибилдингом составляет 2-3 г на 1 кг веса спортсмена.
Также протеиновые коктейли используют и для похудения. Как можно похудеть с помощью протеинов?
Как похудеть с помощью протеинов
Дело в том, что без достаточного количество белка и физической активности, наш организм мышечную ткать превращает в жировую. А вот похудеть потом оказывается сложнее. Поэтому, чтобы похудение проходило быстрее и легче, нужно обеспечить организм достаточным количеством белковой пищи, а не сидеть на долгих изнуряющих диетах.
Однако, нужно сочетать продукты, содержащие белок, и протеиновые добавки с физическими нагрузками. Чем больше мышечной массы — тем легче организму худеть. К тому же, с помощью белков и спорта можно получить аппетитные рельефные формы тела.
Дополнительный прием аминокислот позволяет сжигать только жировую ткань, наращивая при этом мышечную. А значит, вместе с приемом протеиновых коктейлей придется и попотеть в спортзале.
Чтобы обеспечить усваиваемость протеина, рацион должен содержать и углеводы
Чтобы похудеть с помощью протеинов, нужно соблюдать следующие рекомендации по питанию: свести к минимуму вредных углеводов, а калорий потреблять на 15% меньше, чем тратится за день.
Продукты, богатые протеинами
Чтобы знать, какими продуктами можно заменить протеиновый коктейль, нужно запомнить продукты, богатые белком — таблица в этом поможет. Мы употребляем белковые продукты ежедневно, даже не задумываясь об этом. Но существует список продуктов, в которых содержание протеинов самое высокое. В совокупности с углеводами белки из этих продуктов легко усваиваются и надолго вызывают чувство сытости.
В совокупности с углеводами белки из этих продуктов легко усваиваются и надолго вызывают чувство сытости.
Итак, таблица продуктов, содержащих белок.
Молочные и кисло-молочные продукты. Являются чемпионом по содержанию белка. Кроме того, молоко и его производные известны как самый главный источник кальция, способствующий укреплению костной ткани. Содержание белка в молочных продуктах таблица:
| Продукт | Содержание белка в 100 г |
| Молоко | 2,8 г |
| Молоко сухое цельное | 25,6 г |
| Йогурт натуральный (1,5% жирности) | 5 г |
| Кефир нежирный | 3 г |
| Творог нежирный | 18 г |
| Брынза из коровьего молока | 17,9 г |
| Сыр голландский | 26,8 г |
| Сыр пошехонский | 26 г |
Яичные белки. Содержание белка на 100 г продукта составляет 3,6 г.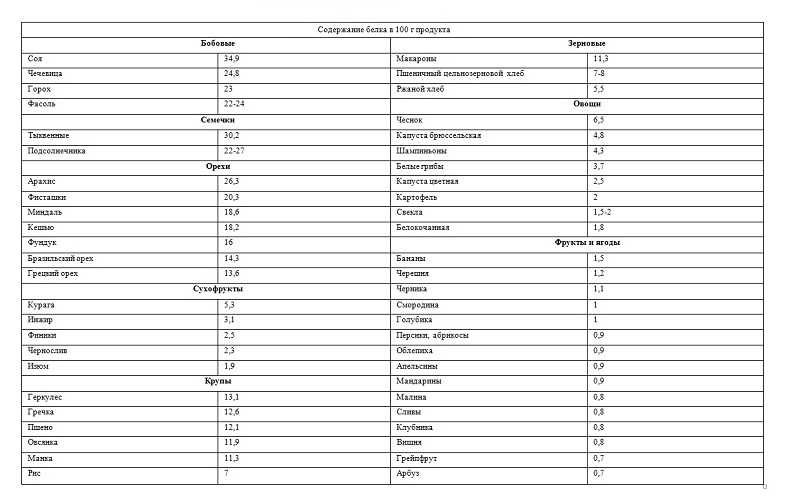
Рыба и морепродукты. Креветки, лосось, треска, окунь, палтус — любая рыба является известнейшим источником легкоусваиваемого белка. К тому же, только в рыбе содержатся незаменимые омега-кислоты, влияющие на нашу красоту и молодость. А йод помогает работу головного мозга и улучшает память, что актуально для школьников. Разная рыба содержит разное количество белка:
| Продукт | Содержание белка в 100 г |
| Креветка дальневосточная | 28,7 г |
| Тунец | 22,7 г |
| Кета | 22 г |
| Горбуша | 21 г |
| Семга | 20,8 г |
| Сайра | 20,4 г |
| Палтус | 18,9 г |
| Кальмар | 18 г |
| Сельдь | 17,7 г |
| Скумбрия | 18 г |
| Минтай | 15,9 г |
| Икра осетровая зернистая | 28,9 г |
Мясо: курица, говядина, индейка, телятина. Что касается мяса, то оно также является известнейшим источником белка, причем более бюджетным, чем некоторые сорта рыбы. Но не только мякоть мяса содержит белок, его также много в субпродуктах, например. в печени. Содержание белка в мясе таблица:
Что касается мяса, то оно также является известнейшим источником белка, причем более бюджетным, чем некоторые сорта рыбы. Но не только мякоть мяса содержит белок, его также много в субпродуктах, например. в печени. Содержание белка в мясе таблица:
| Продукт | Содержание белка в 100 г |
| Говьяжья печень | 18,4 г |
| Баранья печень | 18,7 г |
| Свиная печень | 18,8 г |
| Индейка | 21,6 г |
| Сердце | 15 г |
| Кирица | 20,8 г |
| Цыплята | 18,7 г |
| Кролик | 20,7 г |
| Говядина | 18,9 г |
| Свинина нежирная | 18,4 г |
| Свинина жирная | 11 г |
| Телятина | 19,7 г |
Соя. Содержание растительного белка в сое составляет 34,9 г на 100 г продукта, в соевом мясе белков еще больше — 54 г на 100 г продукта (при этом содержание жира всего 1 г).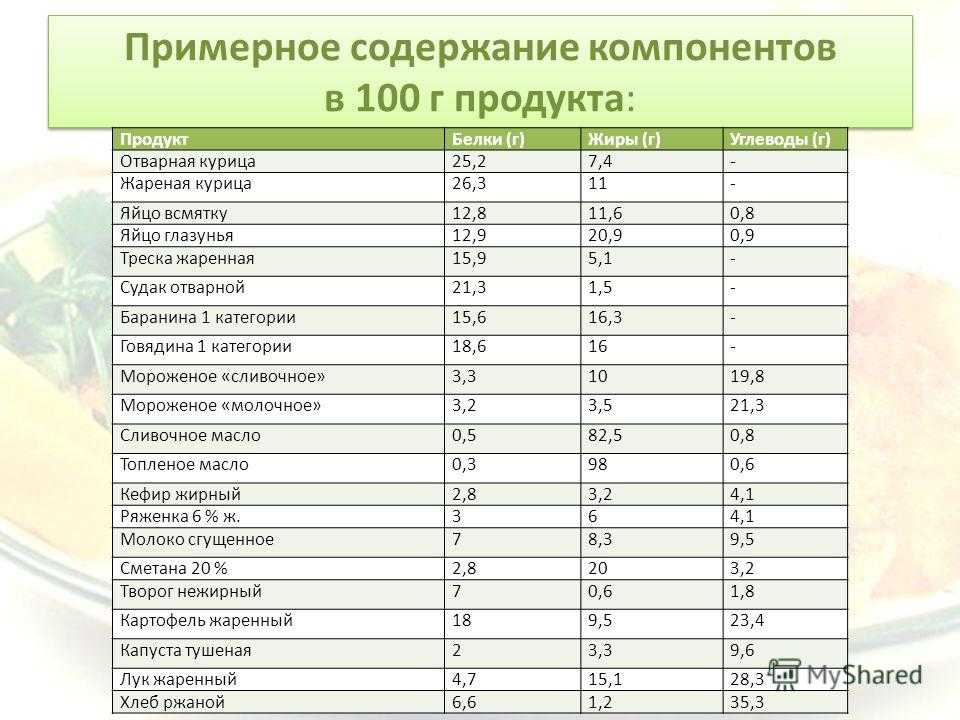 Кроме того, что соя — чемпион среди белковых растительных продуктов, она оказывает также другое положительное влияние на наш организм: нормализует уровень сахара в крови, ускоряет обмен веществ, очищает желчные протоки, защищает от образования раковых клеток, замедляет процессы старения.
Кроме того, что соя — чемпион среди белковых растительных продуктов, она оказывает также другое положительное влияние на наш организм: нормализует уровень сахара в крови, ускоряет обмен веществ, очищает желчные протоки, защищает от образования раковых клеток, замедляет процессы старения.
Орехи, семена и бобовые. В этих продуктах содержится достаточное количество растительного белка, а также витаминов и других микроэлементов. Итак, растительные продукты содержащие белок в количестве таблица:
| Продукт | Содержание белка в 100 г |
| Арахис | 26,3 г |
| Семена подсолнечника | 20,7 г |
| Миндаль | 18,6 г |
| Фундук | 16,1 г |
| Грецкий орех | 13,8 г |
| Горох | 20,3 г |
| Нут | 20,1 г |
| Красная чечевица | 24,2 |
| Красная фасоль | 22,3 г |
| Белая фасоль | 25,1 г |
Хлеб и крупы. Так как в основе хлебо-булочных изделий лежит мука, яйца и дрожжи, то, конечно же, в готовых изделиях также содержится белок. Однако, его все же меньше, чем в мясе и рыбе. Ну и, конечно, не обделила природа белком и крупы.
Так как в основе хлебо-булочных изделий лежит мука, яйца и дрожжи, то, конечно же, в готовых изделиях также содержится белок. Однако, его все же меньше, чем в мясе и рыбе. Ну и, конечно, не обделила природа белком и крупы.
| Продукт | Содержание белка в 100 г |
| Хлеб ржаной | 4,7 г |
| Хлеб из пшеничной муки 1 сорта | 7,7 г |
| Выпечка сдобная | 7,6 г |
| Гречневая ядрица | 12,6 г |
| Грецкий орех | 13,8 г |
| Пшено | 12 г |
| Рис | 7 г |
| Овсянка | 11,9 |
| Крупа манная | 11,3 г |
| Крупа перловая | 9,3 г |
| Пшеница цельная | 9 г |
А что насчет овощей? Содержится ли белок в овощах или фруктах?
Многие уверенны, что в растительной пище, кроме бобовых, белка нет и в помине.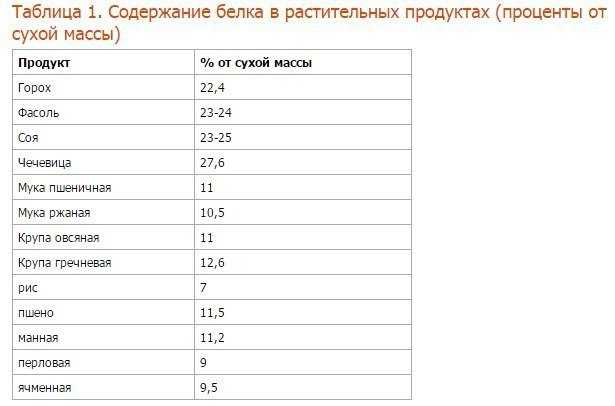 Но есть такие продукты, у которых белка гораздо больше, чем в хлебе. В каких фруктах и овощах содержится протеин:
Но есть такие продукты, у которых белка гораздо больше, чем в хлебе. В каких фруктах и овощах содержится протеин:
| Продукт | Содержание белка в 100 г |
| Дыня | 11 г |
| Клубника | 7,5 г |
| Арбузы | 6,1 г |
| Бананы | 5,1 г |
| Оливки | 5,2 г |
| Чеснок | 6,5 г |
Итак, мы разобрали, в каких продуктах содержится белок. Таблица содержания белка поможет выбрать наиболее протеиносодержащие продукты для правильного питания.
Таблица содержания в яйцах витаминов, минералов, белков, углеводов, жиров*
ЯЙЦА КУРИНЫЕ СЫРЫЕ
100 грамм сырых куриных яиц (белок и желток) содержит 12,56 грамма белка, 0,72 грамма углеводов, 9,51 грамма жира,
калорийность = 143 ккал.
| Витамин А — 540 IU | Калий — 138 мг | |
| Витамин В1 — 0,040 мг | Кальций — 56 мг | |
| Витамин В2 — 0,457 мг | Железо — 1,75 мг | |
| Витамин PP — 0,075 мг | Натрий — 142 мг | |
| Содержание нутриентов: | Витамин В5 — 1,533 мг | Магний — 12 мг |
| Витамин В6 — 0,170 мг | Марганец — 0,028 мг | |
| Витамин В9 — 47 мкг | Медь — 0,072 мг | |
| Витамин В12 — 0,89 мкг | Селен — 30,7 мкг | |
| Витамин D — 82 IU | Фосфор — 198 мг | |
| Витамин Е — 1,05 мг | Фтор — 1,1 мкг | |
| Витамин К — 0,3 мкг | Цинк — 1,29 мг | |
| И другие витамины в сырых куриных яйцах, но с меньшим содержанием. | И другие макро- микроэлементы в сырых куриных яйцах, но с меньшим содержанием. 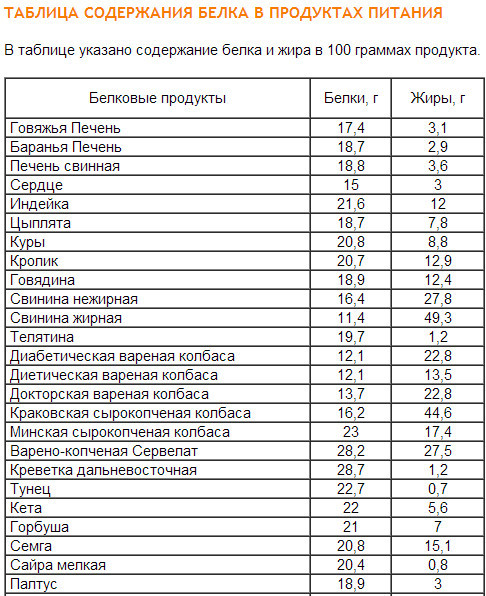 |
ЯЙЦА КУРИНЫЕ СЫРЫЕ (БЕЛОК)
100 грамм белка сырых куриных яиц содержит 10,90 грамма белка, 0,73 грамма углеводов, 0,17 грамма жира,
калорийность = 52 ккал.
| Витамин В1 — 0,004 мг | Калий — 163 мг | |
| Витамин В2 — 0,439 мг | Кальций — 7 мг | |
| Витамин PP — 0,105 мг | Железо — 0,08 мг | |
| Витамин В5 — 0,190 мг | Натрий — 166 мг | |
| Содержание нутриентов: | Витамин В6 — 0,005 мг | Магний — 11 мг |
| Витамин В9 — 4 мкг | Марганец — 0,011 мг | |
| Витамин В12 — 0,09 мкг | Медь — 0,023 мг | |
| Селен — 20,0 мкг | |
| Фосфор — 15 мг | ||
| Цинк — 0,03 мг | ||
| И другие витамины в сырых куриных яйцах, но с меньшим содержанием.  | И другие макро- микроэлементы в сырых куриных яйцах, но с меньшим содержанием. |
ЯЙЦА КУРИНЫЕ СЫРЫЕ (ЖЕЛТОК)
100 грамм желтка сырых куриных яиц содержит 15,86 грамма белка, 3,59 грамма углеводов, 26,54 грамма жира,
| Витамин А — 1442 IU | Калий — 109 мг | |
| Витамин В1 — 0,176 мг | Кальций — 129 мг | |
| Витамин В2 — 0,528 мг | Железо — 2,73 мг | |
| Витамин PP — 0,024 мг | Натрий — 48 мг | |
| Содержание нутриентов: | Витамин В5 — 2,990 мг | Магний — 5 мг |
| Витамин В6 — 0,350 мг | Марганец — 0,055 мг | |
| Витамин В9 — 149 мкг | Медь — 0,077 мг | |
| Витамин В12 — 1,95 мкг | Селен — 56,0 мкг | |
| Витамин D — 218 IU | Фосфор — 390 мг | |
| Витамин Е — 2,58 мг | Цинк — 2,30 мг | |
| Витамин К — 0,7 мкг | ||
| И другие витамины в сырых куриных яйцах, но с меньшим содержанием. 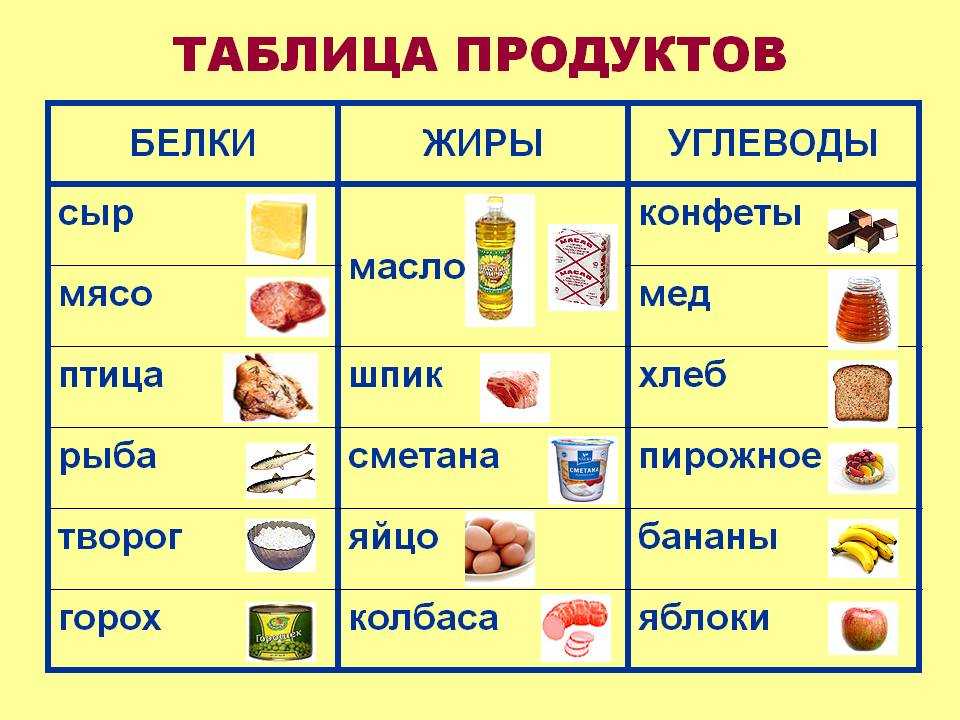 | И другие макро- микроэлементы в сырых куриных яйцах, но с меньшим содержанием. |
ЯЙЦА КУРИНЫЕ, СВАРЕННЫЕ ВКРУТУЮ
100 грамм яиц (или 2 яйца по 50 грамм), сваренных вкрутую, содержат 12,58 грамма белка, 1,12 грамма углеводов, 10,61 грамма жира,
калорийность = 155 ккал.
| Витамин А — 520 IU | Калий — 126 мг | |
| Витамин В1 — 0,066 мг | Кальций — 50 мг | |
| Витамин В2 — 0,513 мг | Железо — 1,19 мг | |
| Витамин PP — 0,064 мг | Натрий — 124 мг | |
| Содержание нутриентов: | Витамин В5 — 1,398 мг | Магний — 10 мг |
| Витамин В6 — 0,121 мг | Марганец — 0,026 мг | |
| Витамин В9 — 44 мкг | Медь — 0,013 мг | |
| Витамин В12 — 1,11 мкг | Селен — 30,8 мкг | |
| Витамин D — 87 IU | Фосфор — 172 мг | |
| Витамин Е — 1,03 мг | Фтор — 4,8 мкг | |
| Витамин К — 0,3 мкг | Цинк — 1,05 мг | |
| И другие витамины в сырых куриных яйцах, но с меньшим содержанием. 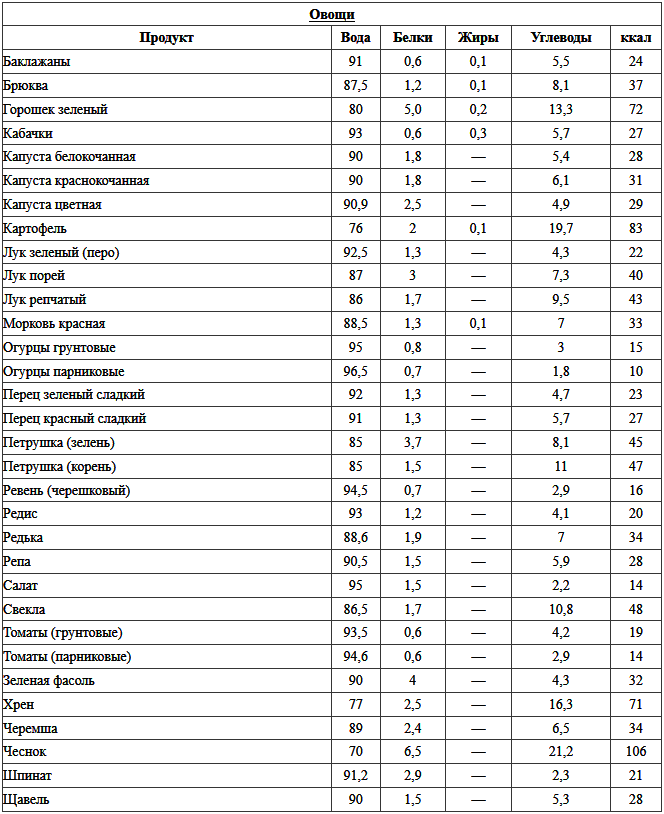 | И другие макро- микроэлементы в сырых куриных яйцах, но с меньшим содержанием. |
ЯИЧНИЦА (ЯЙЦА ЖАРЕНЫЕ)
100 грамм жаренных яиц, содержат 13,61 грамма белка, 0,83 грамма углеводов, 14,84 грамма жира,
калорийность = 196 ккал.
| Витамин А — 787 IU | Калий — 152 мг | |
| Витамин В1 — 0,044 мг | Кальций — 62 мг | |
| Витамин В2 — 0,495 мг | Железо — 1,89 мг | |
| Витамин PP — 0,082 мг | Натрий — 207 мг | |
| Содержание нутриентов: | Витамин В5 — 1,660 мг | Магний — 13 мг |
| Витамин В6 — 0,184 мг | Марганец — 0,030 мг | |
| Витамин В9 — 51 мкг | Медь — 0,078 мг | |
| Витамин В12 — 0,97 мкг | Селен — 33,1 мкг | |
| Витамин D — 88 IU | Фосфор — 215 мг | |
| Витамин Е — 1,31 мг | Фтор — 1,2 мкг | |
| Витамин К — 5,6 мкг | Цинк — 1,39 мг | |
| И другие витамины в сырых куриных яйцах, но с меньшим содержанием.  | И другие макро- микроэлементы в сырых куриных яйцах, но с меньшим содержанием. |
ОМЛЕТ
100 грамм омлета, содержат 10,57 грамма белка, 0,64 грамма углеводов, 11,66 грамма жира,
калорийность = 154 ккал.
| Витамин А — 617 IU | Калий — 117 мг | |
| Витамин В1 — 0,034 мг | Кальций — 48 мг | |
| Витамин В2 — 0,386 мг | Железо — 1,48 мг | |
| Витамин PP — 0,064 мг | Натрий — 155 мг | |
| Содержание нутриентов: | Витамин В5 — 1,289 мг | Магний — 11 мг |
| Витамин В6 — 0,143 мг | Марганец — 0,024 мг | |
| Витамин В9 — 39 мкг | Медь — 0,063 мг | |
| Витамин В12 — 0,76 мкг | Селен — 25,8 мкг | |
| Витамин D — 69 IU | Фосфор — 167 мг | |
| Витамин Е — 1,29 мг | Фтор — 21,2 мкг | |
| Витамин К — 4,5 мкг | Цинк — 1,09 мг | |
| И другие витамины в сырых куриных яйцах, но с меньшим содержанием.  | И другие макро- микроэлементы в сырых куриных яйцах, но с меньшим содержанием. |
ЯИЧНЫЙ ПОРОШОК
100 грамм яичного порошка (белок и желток) содержит 48,37 грамма белка, 1,53 грамма углеводов, 43,04 грамма жира,
калорийность = 605 ккал.
| Витамин А — 500 IU | Калий — 540 мг | |
| Витамин В1 — 0,183 мг | Кальций — 236 мг | |
| Витамин В2 — 1,977 мг | Железо — 4,33 мг | |
| Витамин PP — 0,340 мг | Натрий — 480 мг | |
| Содержание нутриентов: | Витамин В5 — 5,550 мг | Магний — 34 мг |
| Витамин В6 — 0,494 мг | Марганец — 0,058 мг | |
| Витамин В9 — 119 мкг | Медь — 0,203 мг | |
| Витамин В12 — 3,39 мкг | Селен — 164,7 мкг | |
| Витамин D — 125 IU | Фосфор — 629 мг | |
| Витамин Е — 2,17 мг | Цинк — 3,15 мг | |
| Витамин К — 1,2 мкг | ||
| И другие витамины в сырых куриных яйцах, но с меньшим содержанием.  | И другие макро- микроэлементы в сырых куриных яйцах, но с меньшим содержанием. |
* информация о содержании микроэлементов носит справочный характер и может незначительно отличаться в зависимости от размера яиц и породы кур-несушек
Определение белка – питание человека
Белок составляет примерно 20 процентов человеческого тела и присутствует в каждой отдельной клетке. Слово «белок» — греческое слово, означающее «крайне важное значение». Белки называют рабочими лошадками жизни, поскольку они обеспечивают структуру тела и выполняют широкий спектр функций. Вы можете стоять, ходить, бегать, кататься на коньках, плавать и многое другое благодаря своим богатым белком мышцам. Белок необходим для правильной работы иммунной системы, пищеварения, роста волос и ногтей, а также участвует во многих других функциях организма. На самом деле, по оценкам, в организме человека существует более ста тысяч различных белков.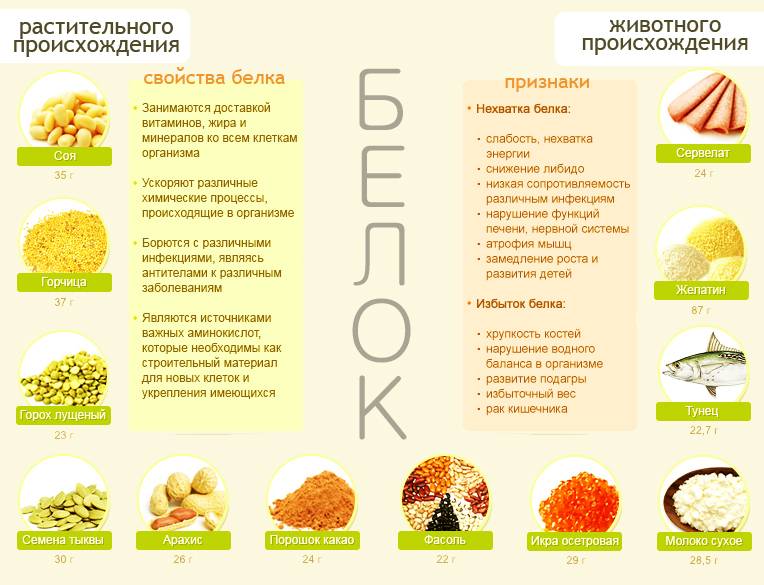
Что такое белок?

Рисунок 6.1 Структура аминокислот
Изображение Allison Calabrese / CC BY 4.0Аминокислоты содержат четыре элемента. Расположение элементов вокруг углеродного центра одинаково для всех аминокислот. Отличается только боковая цепь (R).
Все дело в боковой цепи
Боковая цепь аминокислоты, иногда называемая группой «R», может быть простой, состоящей из одной водородной связи с углеродным центром, или сложной, состоящей из шестиуглеродного кольца, связанного с углеродным центром. Хотя каждая боковая цепь из двадцати аминокислот уникальна, среди них есть некоторое химическое сходство. Таким образом, их можно разделить на четыре различные группы. Это неполярные, полярные, кислотные и основные.
Рисунок 6.2 Различные группы аминокислот
Аминокислоты делятся на четыре группы. Это неполярные, полярные, кислотные и основные.Заменимые и незаменимые аминокислоты
Аминокислоты дополнительно классифицируются на основе пищевых аспектов. Вспомните, что существует двадцать различных аминокислот, и все они нужны нам для производства множества различных белков, содержащихся в организме. Одиннадцать из них называются заменимыми аминокислотами, потому что организм может их синтезировать. Однако девять аминокислот называются незаменимыми, потому что мы не можем синтезировать их вообще или в достаточных количествах. Они должны быть получены из рациона. Иногда в младенчестве, росте и в болезненных состояниях организм не может синтезировать достаточное количество некоторых заменимых аминокислот, и их требуется в рационе в большем количестве. Эти типы аминокислот называются условно незаменимыми аминокислотами. Пищевая ценность белка зависит от того, какие аминокислоты он содержит и в каких количествах.
Вспомните, что существует двадцать различных аминокислот, и все они нужны нам для производства множества различных белков, содержащихся в организме. Одиннадцать из них называются заменимыми аминокислотами, потому что организм может их синтезировать. Однако девять аминокислот называются незаменимыми, потому что мы не можем синтезировать их вообще или в достаточных количествах. Они должны быть получены из рациона. Иногда в младенчестве, росте и в болезненных состояниях организм не может синтезировать достаточное количество некоторых заменимых аминокислот, и их требуется в рационе в большем количестве. Эти типы аминокислот называются условно незаменимыми аминокислотами. Пищевая ценность белка зависит от того, какие аминокислоты он содержит и в каких количествах.
Таблица 6.1 Заменимые и незаменимые аминокислоты
| Основной | Необязательно |
| Гистидин | Аланин |
| Изолейцин | Аргинин* |
| Лейцин | Аспарагин |
| Лизин | Кислота аспарагиновая |
| Метионин | Цистеин* |
| Фенилаланин | Глутаминовая кислота |
| Треонин | Глютамин* |
| Триптофан | Глицин* |
| Валин | Пролин* |
| Серин | |
| Тирозин* | |
| *Условно обязательный |
Множество различных типов белков
Как уже говорилось, в организме человека насчитывается более ста тысяч различных белков. Различные белки производятся потому, что существует двадцать типов встречающихся в природе аминокислот, которые объединяются в уникальные последовательности для образования полипептидов. Затем эти полипептидные цепи складываются в трехмерную форму, образуя белок (см. рис. 6.3 «Формирование полипептидов»). Кроме того, белки бывают разных размеров. Гормон инсулин, регулирующий уровень глюкозы в крови, состоит всего из пятидесяти одной аминокислоты; тогда как коллаген, белок, который действует как клей между клетками, состоит из более чем тысячи аминокислот. Титин является самым крупным известным белком. Он отвечает за эластичность мышц и состоит из более чем двадцати пяти тысяч аминокислот! Обильные вариации белков обусловлены бесконечным числом аминокислотных последовательностей, которые могут быть образованы. Чтобы сравнить, сколько различных белков может быть создано всего из двадцати аминокислот, подумайте о музыке. Вся музыка, которая существует в мире, была получена из основного набора из семи нот C, D, E, F, G, A, B и их вариаций.
Различные белки производятся потому, что существует двадцать типов встречающихся в природе аминокислот, которые объединяются в уникальные последовательности для образования полипептидов. Затем эти полипептидные цепи складываются в трехмерную форму, образуя белок (см. рис. 6.3 «Формирование полипептидов»). Кроме того, белки бывают разных размеров. Гормон инсулин, регулирующий уровень глюкозы в крови, состоит всего из пятидесяти одной аминокислоты; тогда как коллаген, белок, который действует как клей между клетками, состоит из более чем тысячи аминокислот. Титин является самым крупным известным белком. Он отвечает за эластичность мышц и состоит из более чем двадцати пяти тысяч аминокислот! Обильные вариации белков обусловлены бесконечным числом аминокислотных последовательностей, которые могут быть образованы. Чтобы сравнить, сколько различных белков может быть создано всего из двадцати аминокислот, подумайте о музыке. Вся музыка, которая существует в мире, была получена из основного набора из семи нот C, D, E, F, G, A, B и их вариаций. В результате существует огромное количество музыки и песен, состоящих из определенных последовательностей этих основных музыкальных нот. Точно так же двадцать аминокислот могут быть связаны друг с другом в необычайном количестве последовательностей, гораздо больше, чем возможно для семи музыкальных нот для создания песен. В результате могут быть созданы огромные вариации и потенциальные аминокислотные последовательности. Например, если аминокислотная последовательность белка состоит из 104 аминокислот, возможные комбинации аминокислотных последовательностей равны 20104, то есть 2, за которыми следуют 135 нулей!
В результате существует огромное количество музыки и песен, состоящих из определенных последовательностей этих основных музыкальных нот. Точно так же двадцать аминокислот могут быть связаны друг с другом в необычайном количестве последовательностей, гораздо больше, чем возможно для семи музыкальных нот для создания песен. В результате могут быть созданы огромные вариации и потенциальные аминокислотные последовательности. Например, если аминокислотная последовательность белка состоит из 104 аминокислот, возможные комбинации аминокислотных последовательностей равны 20104, то есть 2, за которыми следуют 135 нулей!
Рисунок 6.3. Образование полипептидов
Изображение Allison Calabrese / CC BY 4.0Строительные белки с аминокислотами
Создание белка состоит из сложной серии химических реакций, которые можно свести к трем основным этапам: транскрипция, трансляция и сворачивание белка. Первым шагом в конструировании белка является транскрипция (копирование) генетической информации из двухцепочечной дезоксирибонуклеиновой кислоты (ДНК) в одноцепочечную информационную макромолекулу рибонуклеиновой кислоты (РНК).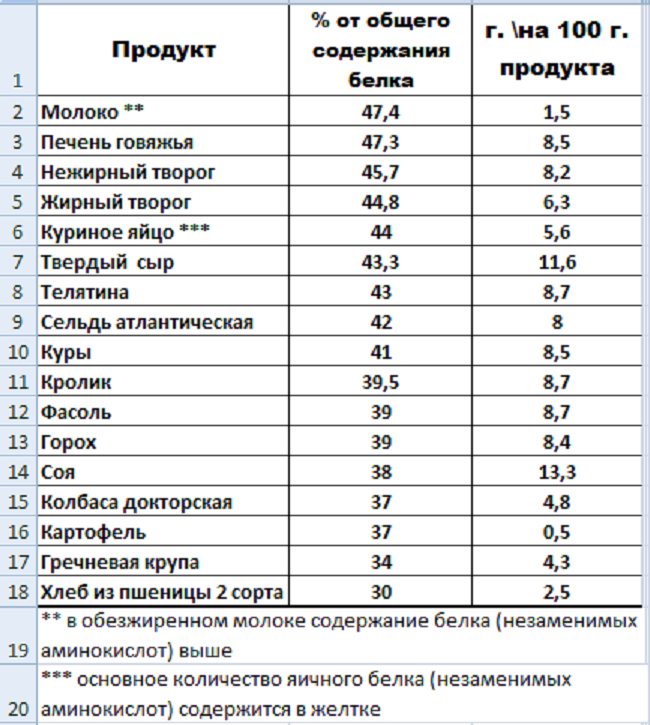 РНК химически похожа на ДНК, но имеет два отличия; во-первых, в его основе используется сахарная рибоза, а не дезоксирибоза; и во-вторых, он содержит нуклеотидное основание урацил, а не тимидин. РНК, которая транскрибируется с данного фрагмента ДНК, содержит ту же информацию, что и эта ДНК, но теперь она находится в форме, которую может прочитать производитель клеточного белка, известный как рибосома. Затем РНК инструктирует клетки собрать все необходимые аминокислоты и добавить их в растущую белковую цепь в строго определенном порядке. Этот процесс называется переводом. Расшифровка генетической информации для синтеза белка является центральной основой современной биологии.
РНК химически похожа на ДНК, но имеет два отличия; во-первых, в его основе используется сахарная рибоза, а не дезоксирибоза; и во-вторых, он содержит нуклеотидное основание урацил, а не тимидин. РНК, которая транскрибируется с данного фрагмента ДНК, содержит ту же информацию, что и эта ДНК, но теперь она находится в форме, которую может прочитать производитель клеточного белка, известный как рибосома. Затем РНК инструктирует клетки собрать все необходимые аминокислоты и добавить их в растущую белковую цепь в строго определенном порядке. Этот процесс называется переводом. Расшифровка генетической информации для синтеза белка является центральной основой современной биологии.
Рисунок 6.4 Этапы построения белка
Создание белка включает три этапа: транскрипцию, трансляцию и укладку. Во время трансляции каждая аминокислота соединяется со следующей аминокислотой специальной химической связью, называемой пептидной связью. Пептидная связь образуется между карбоксильной группой одной аминокислоты и аминогруппой другой, высвобождая молекулу воды.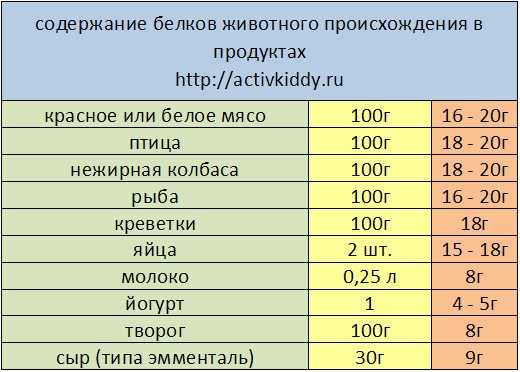 Третий шаг в производстве белка включает в себя складывание его в правильную форму. Конкретные аминокислотные последовательности содержат всю информацию, необходимую для самопроизвольного складывания в определенную форму. Изменение аминокислотной последовательности вызовет изменение формы белка. Каждый белок в организме человека отличается своей аминокислотной последовательностью и, следовательно, своей формой. Вновь синтезированный белок структурирован для выполнения определенной функции в клетке. Белок, полученный с неправильно расположенной аминокислотой, может не функционировать должным образом, что иногда может вызвать заболевание.
Третий шаг в производстве белка включает в себя складывание его в правильную форму. Конкретные аминокислотные последовательности содержат всю информацию, необходимую для самопроизвольного складывания в определенную форму. Изменение аминокислотной последовательности вызовет изменение формы белка. Каждый белок в организме человека отличается своей аминокислотной последовательностью и, следовательно, своей формой. Вновь синтезированный белок структурирован для выполнения определенной функции в клетке. Белок, полученный с неправильно расположенной аминокислотой, может не функционировать должным образом, что иногда может вызвать заболевание.
Белковая организация
Структура белка позволяет ему выполнять множество функций. Белки похожи на углеводы и липиды в том, что они представляют собой полимеры простых повторяющихся звеньев; однако белки имеют гораздо более сложную структуру. В отличие от углеводов, которые имеют одинаковые повторяющиеся звенья, белки состоят из различных аминокислот. Кроме того, белок организован на четырех различных структурных уровнях.
Кроме того, белок организован на четырех различных структурных уровнях.
Первичный : Первый уровень представляет собой одномерную последовательность аминокислот, которые удерживаются вместе пептидными связями. Углеводы и липиды также представляют собой одномерные последовательности соответствующих им мономеров, которые могут быть разветвленными, спиральными, волокнистыми или глобулярными, но их конформация гораздо более случайна и не организована последовательностью их мономеров.
Вторичный : Второй уровень структуры белка зависит от химических взаимодействий между аминокислотами, которые заставляют белок сворачиваться в определенную форму, такую как спираль (как спиральная пружина) или лист.
Третичный : Третий уровень структуры белка является трехмерным. Поскольку различные боковые цепи аминокислот химически взаимодействуют, они либо отталкиваются, либо притягиваются друг к другу, в результате чего образуется складчатая структура. Таким образом, определенная последовательность аминокислот в белке направляет белок к свертыванию в определенную, организованную форму.
Таким образом, определенная последовательность аминокислот в белке направляет белок к свертыванию в определенную, организованную форму.
Четвертичный : Четвертый уровень структуры достигается, когда белковые фрагменты, называемые пептидами, объединяются в один более крупный функциональный белок. Белок гемоглобин является примером белка с четвертичной структурой. Он состоит из четырех пептидов, которые соединяются вместе, образуя функциональный переносчик кислорода.
Структура белка также влияет на его пищевую ценность. Крупные волокнистые белковые структуры перевариваются труднее, чем более мелкие белки, а некоторые, такие как кератин, не перевариваются. Поскольку переваривание некоторых волокнистых белков неполное, не все аминокислоты усваиваются и доступны для использования организмом, что снижает их питательную ценность.
Рисунок 6.5. Четыре структурных уровня белков
Изображение OpenStax / CC BY 4.0Незаменимые аминокислоты: таблица, сокращения и структура
Аминокислоты являются строительными блоками, из которых формируются полипептиды и, в конечном счете, белки. Следовательно, они являются основными компонентами нашего тела и жизненно важны для физиологических функций, таких как синтез белка, восстановление тканей и усвоение питательных веществ. Здесь мы более подробно рассмотрим свойства аминокислот, то, как они используются в организме и откуда берутся.
Следовательно, они являются основными компонентами нашего тела и жизненно важны для физиологических функций, таких как синтез белка, восстановление тканей и усвоение питательных веществ. Здесь мы более подробно рассмотрим свойства аминокислот, то, как они используются в организме и откуда берутся.
Таблица аминокислот
Белки состоят из 20 аминокислот, и все они имеют одинаковую базовую структуру, отличаясь только R-группой или боковой цепью.
Аминокислоты находятся в равновесии между двумя кислотами, при этом протон (H+) перемещается между аминогруппой и карбоксильной группой, как показано ниже.
В таком равновесии всегда преобладает более слабая кислота. Так как аммиак является более слабой кислотой, чем карбоновая кислота, равновесие будет лежать влево (в сторону «цвиттер-иона»). Хотя аминокислоты часто изображаются в учебниках как правосторонние, на самом деле они в основном существуют как левосторонние.
Простейшей и самой маленькой аминокислотой является глицин, у которого R-группа представляет собой водород (H).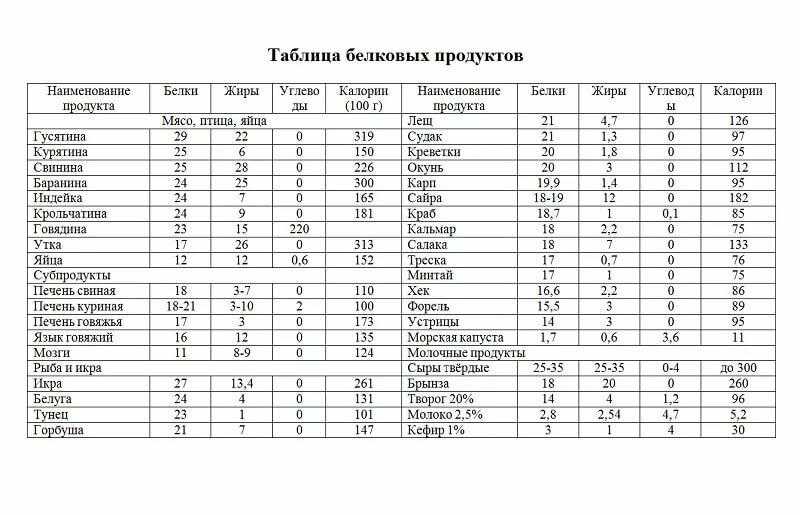 Их можно подразделить в соответствии с их свойствами, определяемыми функциональными группами, которыми они обладают. В широком смысле они делятся по заряду, гидрофобности и полярности. Эти свойства влияют на то, как они взаимодействуют с окружающими аминокислотами в полипептидах и белках, и, следовательно, влияют на трехмерную структуру и свойства белков.
Их можно подразделить в соответствии с их свойствами, определяемыми функциональными группами, которыми они обладают. В широком смысле они делятся по заряду, гидрофобности и полярности. Эти свойства влияют на то, как они взаимодействуют с окружающими аминокислотами в полипептидах и белках, и, следовательно, влияют на трехмерную структуру и свойства белков.
На этой диаграмме показаны химические структуры 20 аминокислот, из которых состоят белки.
Сокращения аминокислот
В этой таблице показаны сокращения и однобуквенные коды, используемые для 20 аминокислот, содержащихся в белках. Кроме того, синим цветом отмечены пирролизин, используемый в биосинтезе белков у некоторых архей и бактерий, но не присутствующий у людей, и селеноцистеин, аналог цистеина, обнаруженный только в некоторых линиях. Наконец, аббревиатуры, используемые для аминокислотных остатков с более чем одной потенциальной идентичностью, и терминирующий кодон показаны красным, чтобы завершить алфавит однобуквенных аббревиатур.
Какова структура аминокислот?
Структура аминокислоты состоит из центрального атома углерода, присоединенного к водороду, кислой карбоксильной группы (-COOH), аминогруппы (-Nh3) и органической боковой цепи (также называемой R-группой). Боковая цепь уникальна для каждой из 20 аминокислот.
Аминокислота | Аббревиатура | 80150 |
Alanine | Ala | A |
Arginine | Arg | Р |
Аспарагин | Asn | N |
Aspartic acid | Asp | D |
Цистеин | Цис | C |
Glutamine | Gln | Q |
Glutamic acid | Glu | E |
Глицин | Gly | G |
Histidine | His | H |
Изолейцин | Иль | I |
Leucine | Leu | L |
Lysine | Lys | К |
Метионин | Met | M |
Phenylalanine | Phe | F |
Proline | Pro | P |
Serine | Ser | S |
Threonine | Thr | Т |
Триптофан | Trp | W |
Tyrosine | Tyr | Y |
Valine | Вал | В |
Pyrrolysine | Pyl | O |
Selenocysteine | Sec | U |
Кислота аспарагиновая или аспарагин | Asx | B |
Glutamic acid or Glutamine | Glx | Z |
Any amino acid | Xaa | X |
Лейцин или изолейцин | Xle | J |
Termination codon | TERM |
Ala amino acid
Discovered in белка в 1875 г. аланин составляет 30% остатков в шелке. Его низкая реакционная способность способствует простой, удлиненной структуре шелка с небольшим количеством поперечных связей, что придает волокнам прочность, устойчивость к растяжению и гибкость. В биосинтезе белков участвует только l-стереоизомер.
аланин составляет 30% остатков в шелке. Его низкая реакционная способность способствует простой, удлиненной структуре шелка с небольшим количеством поперечных связей, что придает волокнам прочность, устойчивость к растяжению и гибкость. В биосинтезе белков участвует только l-стереоизомер.
В организме человека аргинин вырабатывается при переваривании белков. Затем он может быть преобразован в оксид азота в организме человека, химическое вещество, которое, как известно, расслабляет кровеносные сосуды.
Из-за его сосудорасширяющего действия аргинин был предложен для лечения людей с хронической сердечной недостаточностью, высоким уровнем холестерина, нарушением кровообращения и высоким кровяным давлением, хотя исследования в этих областях все еще продолжаются. Аргинин также может быть получен синтетическим путем, а соединения, родственные аргинину, могут использоваться для лечения людей с дисфункцией печени из-за его роли в стимулировании регенерации печени. Хотя аргинин необходим для роста, а не поддержания тела, исследования показали, что аргинин имеет решающее значение для процесса заживления ран, особенно у людей с плохим кровообращением.
Хотя аргинин необходим для роста, а не поддержания тела, исследования показали, что аргинин имеет решающее значение для процесса заживления ран, особенно у людей с плохим кровообращением.
В 1806 году аспарагин был выделен из сока спаржи, что сделало его первой аминокислотой, выделенной из природного источника. Однако только в 1932 году ученым удалось доказать, что аспарагин присутствует в белках. В биосинтезе белков млекопитающих участвует только l-стереоизомер. Аспарагин играет важную роль в удалении токсичного аммиака из организма.
Аминокислота AspОбнаруженная в белках в 1868 году, аспарагиновая кислота обычно встречается в животных белках, однако в биосинтезе белков участвует только L-стереоизомер. Растворимость этой аминокислоты в воде способствует присутствию рядом с активными центрами ферментов, таких как пепсин.
Аминокислота Cys Цистеин особенно богат белками волос, копыт и кератином кожи, он был выделен из мочевого конкремента в 1810 году и из рога в 1899 году. и структура решена в 1903–1904 гг.
и структура решена в 1903–1904 гг.
Серосодержащая тиоловая группа в боковой цепи цистеина играет ключевую роль в его свойствах, обеспечивая образование дисульфидных мостиков между двумя пептидными цепями (как в случае с инсулином) или образование петель внутри одной цепи, что влияет на конечную структуру белка. Две молекулы цистеина, связанные вместе дисульфидной связью, составляют аминокислоту цистин, которая иногда указывается отдельно в общих списках аминокислот. Цистеин вырабатывается в организме из серина и метионина и присутствует только в L-стереоизомере белков млекопитающих.
Люди с генетическим заболеванием цистинурия неспособны эффективно реабсорбировать цистин в кровь. Следовательно, высокий уровень цистина накапливается в их моче, где он кристаллизуется и образует камни, блокирующие почки и мочевой пузырь.
Аминокислота Gln Глютамин был впервые выделен из свекольного сока в 1883 г., выделен из белка в 1932 г. и впоследствии синтезирован химически в следующем году. Глютамин является наиболее распространенной аминокислотой в нашем организме и выполняет несколько важных функций. В организме человека глютамин синтезируется из глютаминовой кислоты, и этот этап превращения жизненно важен для регулирования уровня токсичного аммиака в организме с образованием мочевины и пуринов.
Глютамин является наиболее распространенной аминокислотой в нашем организме и выполняет несколько важных функций. В организме человека глютамин синтезируется из глютаминовой кислоты, и этот этап превращения жизненно важен для регулирования уровня токсичного аммиака в организме с образованием мочевины и пуринов.
Глутаминовая кислота была выделена из пшеничного глютена в 1866 г. и химически синтезирована в 1890 г. Обычно встречается в животных белках, только L-стереоизомер встречается в белках млекопитающих, которые люди могут синтезировать из общего промежуточного соединения α-кетоглутаровая кислота. Мононатриевая соль l-глутаминовой кислоты, глутамат натрия (MSG), обычно используется в качестве приправы и усилителя вкуса. Карбоксильная боковая цепь глутаминовой кислоты способна действовать как донор и акцептор аммиака, который токсичен для организма, обеспечивая безопасную транспортировку аммиака в печень, где он превращается в мочевину и выводится почками. Свободная глутаминовая кислота также может разлагаться до углекислого газа и воды или превращаться в сахара.
Свободная глутаминовая кислота также может разлагаться до углекислого газа и воды или превращаться в сахара.
Аминокислота Gly
Глицин был первой аминокислотой, выделенной из белка, в данном случае желатина, и единственной, которая не является оптически активной (нет d- или l-стереоизомеров). ). Структурно самая простая из α-аминокислот, она практически не реагирует при включении в белки. Тем не менее, глицин играет важную роль в биосинтезе аминокислоты серина, кофермента глутатиона, пуринов и гема, жизненно важной части гемоглобина.
Его аминокислота
Гистидин был выделен в 1896 году, а его структура подтверждена химическим синтезом в 1911 году. Гистидин является прямым предшественником гистамина, а также важным источником углерода в синтезе пуринов. При включении в белки боковая цепь гистидина может действовать как акцептор и донор протонов, передавая важные свойства при объединении с ферментами, такими как химотрипсин, и теми, которые участвуют в метаболизме углеводов, белков и нуклеиновых кислот.
Для младенцев гистидин считается незаменимой аминокислотой, взрослые могут в течение короткого времени обходиться без приема пищи, но все же считается незаменимой аминокислотой.
Ile аминокислота
Изолейцин был выделен из свекловичной патоки в 1904 году. Гидрофобная природа боковой цепи изолейцина важна для определения третичной структуры белков, в которые он входит.
Те, кто страдает от редкого наследственного заболевания, называемого болезнью мочи кленового сиропа, имеют неисправный фермент в пути деградации, общем для изолейцина, лейцина и валина. Без лечения метаболиты накапливаются в моче пациента, вызывая характерный запах, который и дал название этому заболеванию.
Leu аминокислота
Лейцин был выделен из сыра в 1819 году и из мышц и шерсти в кристаллическом состоянии в 1820 году. В 1891 году он был синтезирован в лаборатории.
В белке млекопитающих присутствует только L-стереоизомер, который может расщепляться ферментами организма до более простых соединений. Некоторые ДНК-связывающие белки содержат области, в которых лейцины расположены в конфигурациях, называемых лейциновыми застежками-молниями.
Некоторые ДНК-связывающие белки содержат области, в которых лейцины расположены в конфигурациях, называемых лейциновыми застежками-молниями.
Аминокислота Lys
Лизин был впервые выделен из казеина молочного белка в 1889 г., а его структура была установлена в 1902 г. Лизин играет важную роль в связывании ферментов с коферментами и играет важную роль в образовании гистонов. функция.
Многие зерновые культуры содержат очень мало лизина, что привело к дефициту лизина у некоторых групп населения, которые в значительной степени полагаются на него в пищу, а также у вегетарианцев и людей, придерживающихся диеты с низким содержанием жиров. Следовательно, были предприняты усилия по созданию штаммов кукурузы, богатых лизином.
Метионин аминокислота
Метионин был выделен из казеина молочного белка в 1922 году, а его структура была определена путем лабораторного синтеза в 1928 году. Метионин является важным источником серы для многих соединений в организме, включая цистеин и таурин. Благодаря содержанию серы метионин помогает предотвратить накопление жира в печени и способствует детоксикации метаболических отходов и токсинов.
Благодаря содержанию серы метионин помогает предотвратить накопление жира в печени и способствует детоксикации метаболических отходов и токсинов.
Метионин является единственной незаменимой аминокислотой, которая не содержится в значительных количествах соевых бобов и поэтому производится в промышленных масштабах и добавляется во многие продукты из соевой муки.
Аминокислота Phe
Фенилаланин был впервые выделен из природного источника (ростки люпина) в 1879 году, а затем химически синтезирован в 1882 году. у людей с наследственной фенилкетонурией (ФКУ) фермент, который выполняет это преобразование, неактивен. Если не лечить, фенилаланин накапливается в крови, вызывая задержку умственного развития у детей. На 10 000 детей, родившихся с этим заболеванием, переход на диету с низким содержанием фенилаланина в раннем возрасте может облегчить последствия.
Про аминокислота
В 1900 году был химически синтезирован пролин. В следующем году он был выделен из молочного белка казеина, и было показано, что его структура осталась прежней. Люди могут синтезировать пролин из глутаминовой кислоты, которая присутствует только в виде l-стереоизомера в белках млекопитающих. Когда пролин включается в белки, его особая структура приводит к резким изгибам или изгибам в пептидной цепи, что в значительной степени влияет на окончательную структуру белка. Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
В следующем году он был выделен из молочного белка казеина, и было показано, что его структура осталась прежней. Люди могут синтезировать пролин из глутаминовой кислоты, которая присутствует только в виде l-стереоизомера в белках млекопитающих. Когда пролин включается в белки, его особая структура приводит к резким изгибам или изгибам в пептидной цепи, что в значительной степени влияет на окончательную структуру белка. Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
Ser аминокислота
Серин был впервые выделен из белка шелка в 1865 г., но его структура не была установлена до 1902 г. Люди могут синтезировать серин из других метаболитов, включая глицин, хотя только L-стереоизомер появляется в белках млекопитающих. Серин важен для биосинтеза многих метаболитов и часто важен для каталитической функции ферментов, в которые он включен, включая химотрипсин и трипсин.
Нервно-паралитические газы и некоторые инсектициды действуют путем соединения с остатком серина в активном центре ацетилхолинэстеразы, полностью ингибируя фермент. Активность эстеразы необходима для разрушения нейротрансмиттера ацетилхолина, в противном случае накапливается опасно высокий уровень, быстро приводящий к судорогам и смерти.
Thr аминокислота
Треонин был выделен из фибрина в 1935 году и синтезирован в том же году. Только L-стереоизомер появляется в белках млекопитающих, где он относительно нереактивен. Хотя он важен во многих реакциях у бактерий, его метаболическая роль у высших животных, включая человека, остается неясной.
Trp аминокислота
Выделенный из казеина (молочный белок) в 1901 году, структура триптофана была установлена в 1907 году, но в белках млекопитающих присутствует только L-стереоизомер. В кишечнике человека бактерии расщепляют пищевой триптофан, высвобождая такие соединения, как скатол и индол, которые придают фекалиям неприятный запах. Триптофан превращается в витамин B3 (также называемый никотиновой кислотой или ниацином), но с недостаточной скоростью, чтобы поддерживать наше здоровье. Следовательно, мы также должны потреблять витамин B3, а невыполнение этого требования приводит к дефициту, называемому пеллагра.
Триптофан превращается в витамин B3 (также называемый никотиновой кислотой или ниацином), но с недостаточной скоростью, чтобы поддерживать наше здоровье. Следовательно, мы также должны потреблять витамин B3, а невыполнение этого требования приводит к дефициту, называемому пеллагра.
Tyr аминокислота
В 1846 году тирозин был выделен в результате разложения казеина (белка из сыра), после чего он был синтезирован в лаборатории, а его структура определена в 1883 году. L-стереоизомера белков млекопитающих люди могут синтезировать тирозин из фенилаланина. Тирозин является важным предшественником гормонов надпочечников адреналина и норадреналина, гормонов щитовидной железы, включая тироксин, а также пигмента меланина для волос и кожи. В ферментах остатки тирозина часто связаны с активными центрами, изменение которых может изменить специфичность фермента или полностью уничтожить активность.
Страдающие серьезным генетическим заболеванием фенилкетонурия (ФКУ) неспособны преобразовывать фенилаланин в тирозин, в то время как у пациентов с алкаптонурией нарушен метаболизм тирозина, из-за чего выделяется моча, которая темнеет на воздухе.
Val аминокислота
Структура валина была установлена в 1906 году после того, как он впервые был выделен из альбумина в 1879 году. В белке млекопитающих присутствует только L-стереоизомер. Валин может расщепляться в организме на более простые соединения, но у людей с редким генетическим заболеванием, называемым болезнью мочи кленового сиропа, дефектный фермент прерывает этот процесс и может привести к летальному исходу, если его не лечить.
Свойства карбоксильной группы
- Все аминокислоты имеют карбоксильную группу и аминогруппу.
- В процессе полимеризации аминокислот карбоксильная группа одной аминокислоты соединяется с аминогруппой следующей аминокислоты посредством пептидной связи с потерей молекулы воды.
- Аминокислоты, подпадающие под классификацию гидрофобных, включают аланин, валин, изолейцин, лейцин, метионин, фенилаланин, триптофан и тирозин.

- Как следует из их классификации, боковые цепи имеют тенденцию отталкиваться от воды, поэтому это влияет на расположение этих аминокислот в третичной структуре белка.
- Остатки полярных аминокислот обычно находятся снаружи белка после полимеризации из-за гидрофильных свойств боковой цепи.
- Четыре аминокислоты классифицируются как полярные, но не заряженные (аспарагин, глутамин, серин и треонин).
- Ароматические аминокислоты (фенилаланин, тирозин и триптофан), хотя и подпадают под другие классификации, имеют ароматические боковые цепи.
- Следовательно, все они в разной степени поглощают ультрафиолетовый свет, причем больше всего поглощает тирозин, а меньше всего фенилаланин.
Для образования белка аминокислоты полимеризуются с образованием пептидной связи, начиная с N-конца и заканчивая С-концом.
- Информационная РНК (мРНК), скопированная с ДНК, содержит инструкции о том, какую аминокислоту следует включить в какое положение для синтеза определенного белка.
- На рибосоме транспортная РНК (тРНК) присоединяется к одному концу мРНК, а к другому концу переносит необходимые аминокислоты.
- Дополнительные белковые факторы способствуют инициации, удлинению и прекращению синтеза белка.
- Генетическая информация, необходимая для определения того, какая аминокислота должна быть включена в какое положение, закодирована как серия из трех оснований или триплетов в мРНК, также называемая триплетным кодом. 64 возможных триплета и определяемые ими аминокислоты называются генетическим кодом или аминокислотным кодом.
- Многие аминокислоты кодируются более чем одним триплетным кодом, например аргинин, который добавляется, когда встречается CGU, CGC, CGA или CGG. У большинства организмов три (а иногда и два) триплета сигнализируют об окончании цепи.

Организм человека способен синтезировать 11 из 20 аминокислот, а остальные девять мы не можем. Вероятно, это происходит в результате потери или мутации генов с течением времени в ответ на меняющееся селективное давление, такое как обилие определенных продуктов, содержащих определенные аминокислоты. Поэтому они называются незаменимыми аминокислотами и должны поступать с пищей.
Отдельные виды животных способны синтезировать разные аминокислоты и, соответственно, их пищевые потребности различаются. Например, люди способны синтезировать аргинин, а собаки и кошки не могут — они должны получать его с пищей. В отличие от людей и собак, кошки не способны синтезировать таурин. Это одна из причин, по которой коммерческие корма для собак не подходят для кошек. Для человека девять аминокислот, которые должны быть получены с пищей, — это гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.
Продукты, содержащие все девять незаменимых аминокислот, называются «полноценными белками» и включают мясо, морепродукты, яйца, молочные продукты, сою, лебеду и гречку. Другие источники белка, такие как орехи, семена, злаки и бобы, содержат некоторые, но не все незаменимые аминокислоты, и поэтому называются неполными.
В этой таблице указаны рекомендуемые в США суточные нормы девяти незаменимых аминокислот на 1 кг массы тела.
Amino acid | Recommended daily allowances (mg/kg body weight) |
Histidine | 14 |
Isoleucine | 19 |
Лейцин | 42 |
Lysine | 38 |
Methionine | 19 |
Phenylalanine | 33 |
Threonine | 20 |
Триптофан | 5 |
Вален | 24 |
Существуют также рекомендации для невозмутимого аминокинса (19 мг. .
.
Поговорим о добавках. Все потребности организма в незаменимых аминокислотах могут быть удовлетворены за счет здоровой сбалансированной диеты. Тем не менее, есть некоторые сторонники приема добавок с высокой концентрацией для улучшения таких факторов, как настроение, сон, физическая работоспособность, потеря веса и предотвращение потери мышечной массы. Посмотрите на многие страницы о здоровье и благополучии, и вы увидите, что люди рекламируют преимущества добавок с аминокислотами, но есть ли веские доказательства, подтверждающие это?
Незаменимая аминокислота триптофан необходима для производства серотонина, нейротрансмиттера, играющего важную роль во сне, настроении и поведении. Следовательно, в ряде исследований изучалось влияние манипулирования уровнями триптофана на сон и настроение. Хотя есть доказательства того, что снижение уровня триптофана может негативно повлиять на сон и настроение, многие исследования страдают от небольших размеров выборки, отсутствия достаточного контроля или других недостатков.