Физические свойства воды
К основным физическим свойствам воды относят цвет, запах, вкус, прозрачность, температуру, плотность, сжимаемость, вязкость, радиоактивность и электропроводность.
Цвет подземных вод зависит от их химического состава и механических примесей. Обычно подземные воды бесцветны. Желтоватый цвет характерен для вод болотного происхождения, содержащих гуминовые вещества. Сероводородные воды вследствие окисления H2S и образования тонкой коллоидной мути, состоящей из частиц серы, имеют изумрудный оттенок. Цвет воды оценивается по стандартной платино-кобальтовой шкале в градусах.
Запах в подземных водах обычно отсутствует. Ощущение запаха свидетельствует или о наличии газов биохимического происхождения (сероводород и др.), или о присутствии гниющих органических веществ. Характер запаха выражают описательно: без запаха, сероводородный, болотный, гнилостный, плесневелый и т.
Вкус воды зависит от состава растворенных веществ. Соленый вкус вызывается хлористым натрием, горький — сульфатом магния, ржавый — солями железа. Сладковатый вкус имеют воды, богатые органическими веществами, наличие свободной углекислоты придает приятный освежающий вкус. Вкус воды оценивается по таблицам в баллах.
Прозрачность подземных вод зависит от количества растворенных в них минеральных веществ, содержания механических примесей, органических веществ и коллоидов. Для указания степени прозрачности подземных вод служит следующая номенклатура: прозрачная, слабопалесцирующая, опалесцирующая, слегка мутная, мутная, сильно мутная. Подземные воды обычно бывают прозрачными. Мутность воды оценивается в мг\л по стандартной шкале.
Температура подземных вод изменяется в очень широких пределах и зависит от геотермических особенностей района. Она отражает возрастные, тектонические, литологические и гидродинамические особенности водовмещающих толщ. Температура вод влияет на их химический состав, на вязкость и на коэффициент фильтрации.
Она отражает возрастные, тектонические, литологические и гидродинамические особенности водовмещающих толщ. Температура вод влияет на их химический состав, на вязкость и на коэффициент фильтрации.
В естественных условиях подземные воды могут быть переохлажденными (ниже 0°С, распространены в районах многолетних не мерзлых пород), холодными (ниже 20°С, приурочены к верхней зоне земной коры до пояса постоянных годовых температур в средних широтах), термальными (20-100°С, вскрываются буровыми скважинами на различных глубинах) и перегретыми (100-375°С встречаются в районах современной вулканической деятельности).
Плотность воды

Сжимаемость воды незначительна и характеризуется коэффициентом сжимаемости β = (2,7-5)10-5 Па. Вязкость воды характеризует внутреннее сопротивление частиц жидкости ее движению, количественно она выражается коэффициентами динамической и кинематической вязкости.
Электропроводность подземных вод зависит от количества растворенных в них солей. Пресные воды обладают незначительной электропроводностью. Дистиллированная вода является изолятором. Электропроводность воды оценивают по удельному электрическому сопротивлению, которое выражается в Ом.м и изменяется от 0,02 до 1,0 Ом.м.
Радиоактивность воды определяется содержанием в ней радона, эманации радия. За редким исключением подземные воды в той или иной степени радиоактивны.
Позвоните нам по телефону:
за более подробной информацией.
Особенности физических свойств воды — урок. Химия, 8–9 класс.
При обычных условиях вода — прозрачная жидкость без вкуса и запаха. В тонком слое она бесцветна, а при толщине более \(2\) м имеет голубой оттенок.
Плотность жидкой воды максимальна при \(4\) °С и равна \(1\) г/см³ (\(1000\) г/дм³). В отличие от других веществ твёрдая вода (лёд) легче жидкой. Плотность льда при \(0\) °С составляет \(0,92\) г/см³. Поэтому айсберги плавают по поверхности океанов, а пресноводные водоёмы зимой не промерзают до дна, и обитающие в них организмы выживают во время сильных морозов.
Рис. \(1\). Айсберг
Температура плавления воды равна \(0\) °С, а температура кипения — \(100\) °С. Это аномально высокие значения для вещества с такой низкой молекулярной массой.
Эта и другие особенности свойств воды обусловлены образованием агрегатов из полярных молекул воды за счёт межмолекулярных водородных связей.
Водородная связь — это взаимодействие между положительно заряженными атомами водорода одной молекулы и отрицательно заряженными атомами кислорода, фтора или азота другой молекулы.
Эта связь слабее ковалентной. Но благодаря ей значительно повышаются температуры плавления и кипения веществ.Рис. \(2\). Водородная связь
Водородными связями объясняется также способность воды образовывать при замерзании снежинки разной формы.
Рис. \(3\). Снежинка
Из всех жидких и твёрдых веществ у воды самая высокая теплоёмкость. Она медленно нагревается и так же медленно остывает. Благодаря такому свойству вода влияет на климат Земли, сглаживая колебания температуры. Моря и океаны накапливают тепло в тёплое время, а в холодное — его освобождают.
У воды высокие значения теплоты плавления и теплоты парообразования. Поэтому процессы таяния льда и снега, испарения воды происходят постепенно и приводят к медленной смене сезонов года: зима — весна — лето — осень.
Ещё одна особенность воды — высокое поверхностное натяжение. Поверхностное натяжение обуславливает капиллярные явления, собирает воду в капли, создаёт поверхностную плёнку и позволяет некоторым насекомым перемещаться по ней.
Рис. \(4\). Роса
Рис. \(5\). Водомерка
Высокая полярность молекул обуславливает способность воды растворять вещества с ионной или ковалентной полярной связью. Такие вещества часто называют гидрофильными. К ним относятся соли, щёлочи, некоторые кислоты и другие. Неполярные вещества в воде не растворяются. Их называют гидрофобными.
Источники:
Рис. 1. Айсберг https://cdn.pixabay.com/photo/2014/07/30/02/00/iceberg-404966_960_720.jpg
Рис. 2. Водородная связь © ЯКласс
Рис. 3. Снежинка https://cdn.pixabay.com/photo/2016/03/09/09/21/snowflake-1245748_960_720.jpg
Рис. 4. Роса https://cdn. pixabay.com/photo/2011/08/16/14/04/plant-8701_960_720.jpg
pixabay.com/photo/2011/08/16/14/04/plant-8701_960_720.jpg
Рис. 5. Водомерка https://cdn.pixabay.com/photo/2016/05/25/17/01/gerridae-1415382_960_720.jpg
Физические свойства воды. Статьи компании «ООО МЕД-ПРОМ РЕСУРС Лабораторное Оборудование»
- Состояние (ст.усл.): жидкость
- Плотность: 0,9982 г/куб.см
- Динамическая вязкость (ст.усл.): 0,00101 Па•с (при 20°C)
- Кинематическая вязкость (ст.усл.): 0,01012 кв.см/с (при 20°C)
Термические свойства воды:
- Температура плавления: 0°C
- Температура кипения: 99,974°C
- Тройная точка: 0,01 °C, 611,73 Па
- Критическая точка: 374°C, 22,064 MПа
- Молярная теплоёмкость(ст.усл.): 75,37 Дж/(моль•К)
- Теплопроводность(ст.усл.): 0,56 Вт/(м•K)
Агрегатные состояния воды:
- Твёрдое ― лёд.
- Жидкое ― вода.

- Газообразное ― водяной пар.
1. При атмосферном давлении вода замерзает (превращается в лёд) при температуре в 0°C и кипит (превращается в водяной пар) при температуре 100°C.
2. При снижении давления температура плавления воды медленно растёт, а температура кипения ― падает.
3. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01°C. Такое давление и температура называются тройной точкой воды.
4. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки льда падает со снижением давления.
5. При росте давления температура кипения воды растёт, плотность водяного пара в точке кипения тоже растёт, а жидкой воды ― падает.
6. При температуре 374°C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают.
7. При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения.
8. Так же возможны метастабильные состояния ― пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, нетрудно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0°C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Вода обладает рядом необычных особенностей:
- При таянии льда, его плотность увеличивается (с 0,9 до 1 г/куб.см). Почти у всех остальных веществ при плавлении плотность уменьшается.
- При нагревании от 0°C до 4°C (точнее 3,98°C), вода сжимается. Благодаря этому могут жить рыбы в замерзающих водоёмах: когда температура падает ниже 4°C, более холодная вода, как менее плотная остаётся на поверхности и замерзает, а под льдом сохраняется положительная температура.

- Высокая температура и удельная теплота плавления (0°C и 333,55 кДж/кг), температура кипения (100°C) и удельная теплота парообразования (2250 КДж/кг), по сравнению с соединениями водорода с похожим молекулярным весом.
- Высокая теплоёмкость жидкой воды.
- Высокая вязкость.
- Высокое поверхностное натяжение.
- Отрицательный электрический потенциал поверхности воды.
Все эти особенности связаны с наличием водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а также того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода ― каждый в одной, а атом кислорода ― в двух; в таком состоянии молекулы находятся в кристалле льда. При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4°С этот эффект становится слабее, чем тепловое расширение. При испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4°С этот эффект становится слабее, чем тепловое расширение. При испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
По сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные ― атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Чистая (не содержащая примесей) вода ― хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония H3O+) и гидроксильных ионов HO ― составляет 0,1 мкмоль/л. Но поскольку вода ― хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60% парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Физические свойства воды | Химия. Шпаргалка, шпора, формула, закон, презентация, ГДЗ, конспект, опыты, тесты, сообщение, реферат, кратко
При обычных условиях вода — жидкое прозрачное вещество без цвета, вкуса и запаха. Плотность жидкой воды имеет максимальное значение 1 г/см3 при 4 °C. При 0 °C вода переходит из жидкого состояния в твёрдое — лёд. При 100 °C кипит и переходит в газообразное состояние — водяной пар. Аналоги воды по строению и химическому составу — H2
Чистое вещество вода обладает и другими особенностями, которые делают это соединение поистине уникальным.
Вода способна расширяться при замерзании и иметь при +4 °C максимальную плотность. Поэтому при температуре меньше +4 °C лёд занимает верхнюю часть водоёма, укрывая, как шубой, его нижние слои и защищая водоём от промерзания. Это спасает нашу планету от обледенения. Не обладай вода таким загадочным свойством, все водоёмы и даже Мировой океан за определённый геологический период промёрзли бы до дна. Жизнь на Земле не только не получила бы своего эволюционного развития, она просто бы не возникла.
Вода обладает высокими значениями удельной теплоты плавления и удельной теплоты парообразования, которым академик В. И. Вернадский придавал планетарное значение, так как они определяют многие физико-химические и биологические процессы на Земле (рис. 157).
Высокая удельная теплота плавления льда, равная 332 • 103 Дж/кг, оберегает нашу планету от всемирных потопов. Таяние льда (рис. 158) и снега связано с огромными энергетическими затратами, поэтому процесс происходит постепенно, в большинстве случаев не причиняя вреда природе.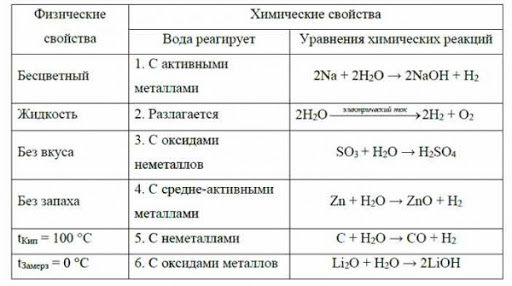
| Рис. 157. Облака — это миллиарды мельчайших капелек воды |
| Рис. 158. Таяние льда |
На испарение 1 кг воды при нормальном атмосферном давлении и температуре кипения расходуется 2257 • 103 Дж теплоты, т. е. приблизительно в 7 раз больше, чем на плавление 1 кг льда. В этом причина сохранения воды в жидком состоянии на нашей планете. Даже в самые жаркие дни вода испаряется крайне медленно. Поэтому и сезоны года меняются не резко, а плавно: лето — осень — зима — весна.
Вода имеет высокую удельную теплоёмкость. Эта величина показывает, какое количество теплоты надо затратить для нагревания 1 кг воды на 1 K (рис. 159). Оказывается, оно равно 4,1868 • 103 Дж.
Из-за высокой удельной теплоёмкости воды на континентах не бывает резкого перепада температур зимой и летом, ночью и днём, поскольку они окружены гигантским регулятором, своеобразным термостатом — водами Мирового океана.
При нагревании всех веществ удельная теплоёмкость их, как правило, возрастает, но вода — исключение. Изменение удельной теплоёмкости воды с повышением температуры аномально: от 0 до 30 °C она понижается и только от 50 до 100 °C повышается. Значит, удельная теплоёмкость воды достигает минимального значения при 36—37 °C, т. е. вблизи нормальной температуры тела человека и млекопитающих, благоприятной для биохимических реакций в их организме.
Ещё одна особенность воды — высокое поверхностное натяжение.
На каждую молекулу внутри жидкости действуют силы притяжения соседних молекул, окружающих её со всех сторон. На молекулы поверхностного слоя действуют как молекулы жидкости, так и молекулы газов воздуха. Взаимное притяжение молекул жидкости больше, чем молекул жидкости и газа, поэтому равнодействующая сил притяжения направлена внутрь жидкости и молекулы поверхностного слоя стремятся в неё втянуться. Под действием этой силы число молекул на поверхности уменьшается, её площадь сокращается.
| Рис. 159. Температурные шкалы Кельвина и Цельсия |
| Рис. 160. Капли росы стремятся принять форму шара |
| Рис. 161. Водомерка |
Поверхностным натяжением называется величина, равная работе, затраченной на увеличение поверхности жидкости на одну единицу.
Поверхностное натяжение собирает воду в капли (рис. 160) и позволяет водомерке (рис. 161) скользить по воде.
160) и позволяет водомерке (рис. 161) скользить по воде.
Ещё одна характеристика воды — вязкость. Обычно с повышением давления вязкость вещества увеличивается, а с ростом температуры уменьшается. Вода и здесь выделяется. Её вязкость с ростом давления при температуре ниже -30 °C значительно уменьшается. Поэтому активность организмов, живущих в низкотемпературных средах, не сильно зависит от этих температур: кровь, не потерявшая текучести, продолжает выполнять свои функции столь же интенсивно, как и при более высоких температурах.
На этой странице материал по темам:При обычных условиях вода это жидкое прозрачное вещество
Опыты для реферата с водой
Физ свойства воды аномалии-реферат
Перечислите известные аномалии физических свойств
Аномальные свойства воды реферат по биологии кратко
Какими физическими свойствами обладает вода?
Что такое поверхностное натяжение?
Как водородная связь определяет физические свойства воды?
Перечислите известные вам аномалии физических свойств воды.

Какую роль аномалии физических свойств воды играют в природе?
Физические свойства воды :: HighExpert.RU
Вода (обычная) — вещество, описываемое химической формулой H2O, самое распространенное соединение на земле, состоящее из двух атомов водорода и одного атома кислорода, растворитель минеральных солей.
Плотность воды при различной температуре
| Температура воды | Плотность воды |
| оС | кг/м3 |
| 0 | 999,9 |
| 5 | 1000 |
| 10 | 999,7 |
| 20 | 998,2 |
| 30 | 995,7 |
| 40 | 992,2 |
| 50 | 988,1 |
| 60 | 983,2 |
| 70 | 977,8 |
| 80 | 971,8 |
| 90 | 965,3 |
| 100 | 958,4 |
Динамическая и кинематическая вязкость воды при различной температуре
| Температура | Динамическая вязкость, μ | Кинематическая вязкость, ν |
| оС | (Н • c/м 2) • 103 — [сПуаз] | м2/с • 106 — [сСтокс] |
| 0 | 1,787 | 1,787 |
| 5 | 1,519 | 1,519 |
| 10 | 1,307 | 1,307 |
| 20 | 1,002 | 1,004 |
| 30 | 0,798 | 0,801 |
| 40 | 0,653 | 0,658 |
| 50 | 0,547 | 0,658 |
| 60 | 0,467 | 0,475 |
| 70 | 0,404 | 0,413 |
| 80 | 0,355 | 0,365 |
| 90 | 0,315 | 0,326 |
| 100 | 0,282 | 0,294 |
Основные физические свойства воды при различной температуре
| Температура | Плотность, ρ | Удельная теплоёмкость, Cp | Коэффициент температурного линейного расширения, α | Число Прандтля, Pr |
| оС | кг/м3 | кДж / (кг • К) | (1 / K) x 103 | — |
| 0 | 999,9 | 4,217 | -0,07 | 13,67 |
| 20 | 998,2 | 4,182 | 0,207 | 7,01 |
| 40 | 992,1 | 4,179 | 0,385 | 4,34 |
| 60 | 983,2 | 4,185 | 0,523 | 2,99 |
| 80 | 971,8 | 4,197 | 0,643 | 2,23 |
| 100 | 958,4 | 4,216 | 0,752 | 1,75 |
Температура кипения воды в зависимости от давления
1,013 бар
1,379 бар
2,068 бар
2,758 бар
3,585 бар
4,826 бар
6,205 бар
7,929 бар
10,34 бар
15,51 бар
Формулы физических свойств воды
При проведении инженерных расчетов удобнее использовать приближённые формулы для определения физических свойств воды⋆.
Плотность воды
⋆ [ кг/м3 ]Теплоёмкость воды
⋆ [ Дж/(кг • К) ]Теплопроводность воды
⋆ [ Вт/(м • K) ]Динамическая вязкость воды
[ Па • c ]Кинематическая вязкость воды
⋆ [ м2/с ]Температуропроводность воды
⋆ [ м2/с ]Число Прандтля воды
[ — ]⋆ Приближённые формулы физических свойств воды получены авторами настоящего сайта.
Размерность величин: температура — К (Кельвин).
Приближённые формулы действительны в диапазоне температур воды от 283 К до 373 К.
ее состав, строение молекулы, физические свойства. Химические свойства воды
Билет № 15
1. Вода: ее состав, строение молекулы, физические свойства.
 Химические свойства воды: разложение, отношение к натрию, оксиду кальция, оксиду серы (IV). Основные загрязнители природной воды
Химические свойства воды: разложение, отношение к натрию, оксиду кальция, оксиду серы (IV). Основные загрязнители природной водыСостав воды можно выяснить с помощью реакции разложения электрическим током. Образуется два объема водорода на один объем кислорода (объем газа пропорционален количеству вещества):
2H2O = 2H2↑ + O2↑
Вода состоит из молекул. Каждая молекула содержит два атома водорода, соединенные ковалентными связями с одним атомом кислорода. Угол между связями около 105°:
O — H
|
H
Поскольку кислород является более электроотрицательным элементом (сильным окислителем), общая электронная пара ковалентной связи смещается к атому кислорода, на нем образуется частичный отрицательный заряд δ−, на атомах водорода — частичный положительный δ+. Соседние молекулы притягиваются друг к другу противоположными зарядами — это обуславливает сравнительно высокую температуру кипения воды.
Вода при комнатной температуре — бесцветная прозрачная жидкость. Температура плавления 0º C, температура кипения при атмосферном давлении — 100° С. Чистая вода не проводит электрический ток.
Температура плавления 0º C, температура кипения при атмосферном давлении — 100° С. Чистая вода не проводит электрический ток.
Интересной особенностью воды является то, что она имеет наибольшую плотность 1 г/см3 при температуре около 4° С. При дальнейшем понижении температуры плотность воды снижается. Поэтому с наступлением зимы верхние замерзающие слои воды становятся легче и не погружаются вниз. Лед образуется на поверхности. Промерзания водоема до дна обычно не происходит (к тому же лед тоже имеет плотность меньше воды и плавает на поверхности).
Химические свойства:
- Вода разлагается при пропускании электрического тока* на водород и кислород:
2H2O = 2H2↑ + O2↑ - Вода взаимодействует с натрием и некоторыми другими активными металлами, которые вытесняют из нее водород, образуется щелочь (гидроксид натрия):
2Na + 2HOH = 2NaOH + H2↑ - Оксид кальция (негашеная известь) бурно взаимодействует с водой (гасится) с выделением большого количества тепла, что может быть
даже причиной пожара.
 Образуется гидроксид кальция (гашеная известь):
Образуется гидроксид кальция (гашеная известь):
CaO + H2O = Ca(OH)2 + Q - Большинство оксидов неметаллов реагируют с водой с образованием кислот. Оксид серы (IV) взаимодействует с водой с образованием серни́стой кислоты:
SO2 + H2O = H2SO3
К основным загрязнителям природной воды относятся сточные воды промышленных предприятий, содержащие соединения ртути, мышьяка и других токсичных элементов. Стоки животноводческих комплексов, городов могут содержать отходы, вызывающие бурное развитие бактерий. Большую опасность для природных водоемов представляет неправильное хранение (не обеспечивающее защиту от атмосферных осадков) или применение удобрений и ядохимикатов, смываемых в водоемы. Транспорт, особенно водный, загрязняет водоемы нефтепродуктами и бытовым мусором, выбрасываемым недобросовестными людьми прямо в воду.
Для охраны вод необходимо вводить замкнутое водоснабжение промышленных предприятий, комплексную переработку сырья и отходов, строительство очистных сооружений, экологическое воспитание населения.
* Для электролиза воды используются растворы солей
2. Опыт. Распознавание соли угольной кислоты среди трех предложенных солей.
Качественной реакцией на карбонаты служит взаимодействие с кислотами, сопровождающееся бурным выделением углекислого газа:
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
или, в ионном виде:
CO32− + 2H+ = H2O + CO2↑
Доказать, что выделяется именно оксид углерода (IV), можно, пропуская его через раствор известковой воды, что вызывает её помутнение:
CO2 + Ca(OH)2 = CaCO3↓ + H2O
Чтобы распознать соль угольной кислоты, добавляем во все три пробирки немного кислоты (чтобы не вылилась через край при «вскипании»). Где будет выделяться бесцветный газ без запаха, там находится карбонат.
автор: Владимир Соколов
состав, таблица, основные свойства природных вод, строение молекулы, изменение подземных вод
Вода – второе по значимости, после воздуха, вещество для человеческого организма. Прожить без нее человек может не более, чем 8 суток. Все химико-биологические реакции проходят с участием данного вещества. В природе вода пребывает с трех агрегатных состояниях – в твердом, жидком и газообразном. Таким разнообразием обладает только она. Многие физические и химические свойства воды удивляют и поражают. Еще великий ученый Вернадский писал о том, что нет на Земле такого компонента, который мог бы сравниться с ней по влиянию на основные процессы, происходящие в природе.
Прожить без нее человек может не более, чем 8 суток. Все химико-биологические реакции проходят с участием данного вещества. В природе вода пребывает с трех агрегатных состояниях – в твердом, жидком и газообразном. Таким разнообразием обладает только она. Многие физические и химические свойства воды удивляют и поражают. Еще великий ученый Вернадский писал о том, что нет на Земле такого компонента, который мог бы сравниться с ней по влиянию на основные процессы, происходящие в природе.
Изучение
Благодаря своим уникальным физическим и химическим свойствам, вода сделала возможным зарождение и развитие жизни на планете. Многие ученые посвятили свою жизнь изучению данной жидкости. На протяжении нескольких столетий проводились эксперименты с целью узнать все химические и физические свойства воды. Даже сейчас интерес к этому веществу не угасает.
Формула воды известна каждому школьнику. Это три простых знака, но содержатся они в 75% от общей массы всего на планете.
Н2О – это два атома водорода и один — кислорода. Структура молекулы имеет эмпирическую форму, поэтому свойства жидкости такие многообразные, несмотря на простой состав. Каждая из молекул находится в окружении соседей. Они связаны одной кристаллической решеткой.
Структура молекулы имеет эмпирическую форму, поэтому свойства жидкости такие многообразные, несмотря на простой состав. Каждая из молекул находится в окружении соседей. Они связаны одной кристаллической решеткой.
Простота строения позволяет жидкости существовать в нескольких агрегатных состояниях. Ни одно вещество на планете не может этим похвастаться. Н2О очень подвижна, она уступает в этом свойстве лишь воздуху. Каждый осведомлен о круговороте воды, о том, что после испарения ее с поверхности земли, где-то далеко проходит дождь или снег. Климат регулируется именно благодаря свойствам жидкости, которая может отдавать тепло, а сама при этом практически не изменяет свою температуру.
Физические свойства
Н2О и физические ее свойства зависят от многих ключевых факторов. Основные из них:
- Кристаллическая решетка. Строение воды, а точнее ее кристаллической решетки, обусловлено агрегатным состоянием. Она имеет рыхлое, но очень прочное строение. Снежинки показывают решетку в твердом состоянии, а вот в привычном – жидком, у воды нет четкости в строении кристаллов, они подвижны и изменчивы.
- Строение молекулы – шар. Но влияние земного притяжения заставляет воду принимать форму сосуда, в котором находится. Это интересное ее физическое свойство. Если притяжение есть, она будет подстраивать форму под сосуд, а в космосе будет геометрически правильной формы.
- Следующее физическое свойство — реагирует вода с другими веществами, в том числе с теми, кто обладает неразделенными электронными парами, среди них спирт и аммиак.
- Обладает высокой теплоемкостью и теплопроводностью, быстро нагревается и долго не остывает.
- Еще со школы известно и такое физическое свойство воды — температура ее кипения — 100 градусов Цельсия. В жидкости появляются кристаллы при понижении до +4 градусов, а вот лед образуется при еще большем снижении. Температура кипения зависит от давления, в которое поместить Н2О. Чтобы определить физические свойства воды при нагревании был проведен эксперимент, при котором температура химического соединения достигает 300 градусов, при этом жидкость не кипит, а плавит свинец.
- Еще одним важным физическим свойством является поверхностное натяжение. Формула воды позволяет ему быть очень прочным. Ученые выяснили, чтобы разорвать его потребуется сила с массой больше 100 тонн.
Особое биологическое значение имеет такое физическое свойство воды как поверхностное напряжение. Объяснить это просто. Если налить немного жидкости на гладкую поверхность, то она не растечется по ней, а образует сферические капли. Это физическое свойство объясняет высокую биологическую активность воды. Поверхностное напряжение дает возможность всем растениям на планете поглощать жидкость, находящуюся в почве, своей корневой системой. Это же физическое свойство помогает крови человека проникать через все ткани организма.
[warning] Интересное физическое свойство — Н2О, очищенная от примесей (дистиллированная), не может проводить ток. Это свойство оксида водорода появляется лишь при наличии растворенных в нем солей.[/warning]
Другие особенности и физические свойства
Лед – это состояние, которое свойственно оксиду водорода. Он образует рыхлые связи, которые легко деформируются. Кроме того, расстояние между частицами увеличивается, делая плотность льда намного ниже жидкости. Это позволяет водоемам не промерзать полностью в зимний период, сохраняя жизнь под слоем льда. Ледники – большой запас пресной воды.
[warning]У воды есть уникальное физическое свойство, которое называется явлением тройной точки. Это когда она находится сразу в трех своих состояниях. Возможно это условие, лишь при температуре 0,01 градус и давлении 610 Па.[/warning]
Химические свойства
Химические свойства воды:
- Разделяют воду по жесткости, от мягкой и средней — до жесткой. Этот показатель зависит от содержания солей магния и калия в растворе. Есть также такие металлы, которые находятся в жидкости постоянно, а от некоторых можно избавиться кипячением.
- Следующие важные химические свойства воды — окисление и восстановление. Вода влияет на процессы, изучаемые в химии, происходящие с другими веществами: одни она растворяет, с другими вступает в реакцию. Исход любого эксперимента зависит от правильного выбора условий, при которых он проходит.
- Влияние на биохимические процессы. Вода основная часть любой клетки, в ней как в среде, происходят все реакции в организме.
- Интересное химическое свойство воды — жидком состоянии впитывает в себя газы, которые неактивны. Их молекулы располагаются между молекулами Н2О внутри полостей. Так образуются клатраты.
- При помощи оксида водорода образуются новые вещества, которые не связаны с окислительно-восстановительным процессом. Речь идет о щелочах, кислотах и основаниях.
- Еще одно химическое свойство воды — это способность образовывать кристаллогидраты. Оксид водорода при этом остается в неизменном виде. Среди обычных гидратов можно выделить медный купорос.
- Если через соединение пропустить электрический ток, то можно разложить молекулу на газы.
Важность физических и химических свойств воды для человека
Давно люди поняли значение жидкости для всего живого и планеты. Без нее человек не может прожить и недели. Вода — вещество, обладающее уникальными физическими и химическими свойствами. Она участвует во всех процессах внутри человеческого организма. Положительное воздействие жидкости:
- Главное применение — это наличие в организме, в клетках, где проходят все реакции.
- Образование водородных связей благоприятно сказывается на живых существах, ведь при изменении температуры жидкость в теле не замерзает.
- Человек давно применяет воду в бытовых нуждах, кроме приготовления пищи, это: стирка, уборка, купание.
- Ни один промышленный завод не может работать без жидкости.
- Н2О – источник жизни и здоровья, она является лекарством.
- Растения используют ее на всех этапах развития и жизни. С ее помощью они производят кислород, такой необходимый для жизни живых существ, газ.
Важность воды для человека
Критическая температура
У Н2О, как и у всех веществ, есть температура, которая называется критической. Критическая температура воды определяется методом нагрева. До 374 градусов по Цельсию жидкость называют паром, она еще может превратиться обратно в привычное жидкое состояние, при определенном давлении. Когда температура вышей этой критической отметки, то вода как химический элемент, превращается в газ безвозвратно (химическое свойство жидкости).
Применение в химии
Интерес у химиков вода вызывает благодаря своему умению растворять (одно из химических свойств). Часто ученые ею очищают вещества, чем создают благоприятные условия для проведения экспериментов. Она является средой, в которой можно провести опытные испытания. Кроме того, Н2О сама участвует в химических процессах, влияя на тот или иной химический эксперимент. Она соединяется с неметаллическими и металлическими веществами.
Три состояния
Вода предстает перед людьми в трех состояниях, называемых агрегатными. Это жидкость, лед и газ. Вещество одно и то же по составу, но разное по физическим и химическим особенностям. Умение перевоплощаться – важная характеристика воды для планеты, таким образом, происходит ее круговорот.Сравнивая три состояния, человек чаще видит химическое соединение все же в жидком виде. Вода не имеет вкуса и запаха, а то, что ощущается в ней, это из-за наличия примесей, растворенных веществ.
Физические и химические свойства воды в жидком состоянии — это: сила, позволяющая точить камни и рушить скалы, а также возможность принимать любую форму.
Мелкие частицы при замерзании сокращают скорость сдвижения и увеличивают дистанцию, поэтому структура льда пористая и по плотности ниже жидкости. Лед применяется в холодильных установках, для бытовых и промышленных целей. В природе лед несет разрушения, выпадая в виде града или лавины.
Газ – еще одно состояние, который образуется, когда не достигается критическая температура воды. Обычно при температуре больше 100 градусов, или испаряясь с поверхности (физическая особенность). В природе это облака, туманы и испарения. Большую роль искусственное газообразование сыграло в техническом прогрессе в 19 веке, когда были изобретены паровые двигатели.
Количество вещества в природе
75% — такая цифра покажется огромной, но это вся вода на планете, даже та, которая находится в разных агрегатных состояниях, в живых существах и органических соединениях. Если же учесть лишь жидкое, то есть воду, находящуюся в морях и океанах, а также в твердую – в ледниках, то процент становится 70,8%.
Распределение процентного содержания такое:
- моря и океаны – 74,8%
- Н2О пресных источников, распределенная неравномерно по планете, в ледниках составляет — 3,4%, а в озерах, болотах и реках 1,1%.
- На подземные источники приходится 20,7% от всего количества.
Характеристика тяжелой воды
Природное вещество – водород встречается в виде трех изотопов, в таком же количестве форм есть и кислород. Это позволяет выделять кроме обычной питьевой воды еще дейтериевую и тритиевую.
Дейтериевая имеет самую устойчивую форму, она встречается во всех природных источниках, но в малом количестве. Жидкость с такой формулой обладает рядом отличий от легкой, и иными физическими и химическими свойствами. Так, образование кристаллов начинается уже при температуре 3,82 градуса. А вот температура кипения (физическое свойство) выше — 101,42 градуса Цельсия. У нее больше плотность и способность к растворению веществ снижена (химическое свойство). Кроме того, ее обозначают другой формулой (D2O).
Живые системы реагируют на такое химическое соединение плохо. Лишь некоторые виды бактерий смогли в нем приспособиться к жизни. Рыбы и вовсе не выдержали такого эксперимента. В организме человека, дейтерий может находиться несколько недель, а после выводится, не причиняя вреда.
[stop]Пить дейтериевую воду – нельзя![/stop]
Свойства воды:
Химические свойства воды:
За счет иных физических и химических свойств применение тяжелая вода нашла в ядерной и атомной промышленности, а обычная — в повсеместном.
8 (а) Физические свойства воды
Мы живем на планете, где доминируют вода. Более 70% поверхности Земли покрыто с этой простой молекулой. По оценкам ученых, гидросфера содержит около 1,36 миллиарда кубических километров этого вещества в основном в виде жидкости (воды), занимающей топографические впадины на Земле.Вторая по распространенности форма молекулы воды на нашей планете — лед. Если бы весь лед на нашей планете растаял, уровень моря подняться примерно на 70 метров.
Вода также необходима для жизни. Вода является основной составляющей почти всех форм жизни. Наиболее животные и растения содержат более 60% воды по объему. Без воды жизнь, наверное, никогда бы не развивалась на нашей планете.
Вода имеет очень простую атомную структуру. Эта структура состоит из двух атомов водорода, связанных к одному атому кислорода ( Рисунок 8a-1 ). Природа атомной структуры воды обуславливает ее молекулы обладают уникальными электрохимическими свойствами. Водородная сторона молекулы воды имеет небольшой положительный заряд (см. рисунок ). 8а-1 ).На На другой стороне молекулы существует отрицательный заряд. Эта молекулярная полярность делает воду мощным растворитель и отвечает за его прочную поверхность напряжение (для получения дополнительной информации об этих двух свойствах см. обсуждение ниже).
| Рисунок 8a-1 : Атомная структура воды (или дигидрогена монооксида) молекула состоит из двух водородных ( H ) атомы соединены в один кислород ( O ) атом.Уникальный способ, которым атомы водорода прикреплены к атому кислорода, вызывает одну сторону молекулы иметь отрицательный заряд и область в противоположном направлении, чтобы иметь положительный заряжать. Результирующая полярность заряда вызывает молекулы воды притягиваются друг к другу образуя прочные молекулярные связи. |
Когда молекула воды образует физическую фазу изменить , его молекулы располагаются в отчетливо разные узоры ( Рисунок 8a-2 ).Молекулярное устройство льда (твердое тело форма молекулы воды) приводит к увеличению в объеме и уменьшении плотности. Расширение молекулы воды при замерзании позволяет лед, чтобы плавать поверх жидкой воды.
| Рисунок 8a-2 : Три диаграммы выше иллюстрируют различные схемы расположения молекул воды как они меняют свое физическое состояние с льда на воду к газу.Молекулы замороженной воды расставляют себя в особо высокоорганизованной жесткой геометрический узор, вызывающий массу воды расширяться и уменьшаться в плотности. Диаграмма выше показан срез массы льда, который шириной в одну молекулу. В жидкой фазе вода молекулы объединяются в небольшие группы объединенных частиц.Тот факт, что эти договоренности маленькие позволяет жидкой воде двигаться и течь. Молекулы воды в виде газа очень высоки. заряжен энергией. Это состояние высокой энергии заставляет молекулы всегда двигаться, уменьшая вероятность связей между отдельными молекулы от формирования. |
Вода имеет несколько других уникальных физических свойств. характеристики.Вот эти объекты недвижимости:
- Вода имеет высокий удельный тепло . Удельная теплоемкость — это количество энергия, необходимая для изменения температуры вещество. Поскольку вода имеет высокую удельную тепло, он может поглощать большое количество тепловой энергии прежде, чем он начнет нагреваться. Это также означает, что вода медленно выделяет тепловую энергию в ситуациях, когда заставьте его остыть.Высокая удельная теплоемкость воды позволяет смягчить климат Земли и помогает организмам регулировать температуру своего тела более эффективно.
- Вода в чистом виде имеет нейтральный pH . В результате чистая вода не является ни кислой , ни основной . Вода меняет свой pH при растворении веществ. в этом.Дождь имеет естественно кислый pH около 5,6. потому что он содержит диоксид углерода природного происхождения и диоксид серы.
- Вода проводит тепла легче любой жидкости, кроме ртути. Этот факт вызывает большие объемы жидкой воды, такие как озера и океаны должны иметь по существу однородную вертикальную температурный профиль.
- Молекулы воды существуют в жидкой форме над важным диапазон температур от 0 до 100 ° по Цельсию. Этот диапазон позволяет молекулам воды существовать в виде жидкости в большинстве мест на нашей планете.
- Вода — универсальный растворитель . Способен растворять большое количество разных химические соединения.Эта функция также включает воду для переноса питательных веществ-растворителей в стоке , инфильтрация , подземные воды поток , и живые организмы.
- Вода имеет высокую поверхность напряжение ( рисунки 8a-3 и 8a-4 ). Другими словами, вода липкая и эластичная, и имеет тенденцию собираться каплями, а не растекаться по поверхности в виде тонкой пленки.Этот феномен также заставляет воду прилипать к сторонам вертикального структуры, несмотря на нисходящее притяжение силы тяжести. Воды высокое поверхностное натяжение позволяет образовывать капель воды и волн, позволяет растениям перемещать воду (и растворенные питательные вещества) из их корни к их листьям, и движение крови через крошечные сосуды в теле некоторых животных.
| Рисунок 8a-3 : На следующем рисунке показано, как вода молекулы притягиваются друг к другу, чтобы создать высокое поверхностное натяжение. Это свойство может вызвать попадание воды существовать как обширная тонкая пленка на твердых поверхностях. В приведенном выше примере пленка состоит из двух слоев молекулы воды толщиной. |
| Рисунок 8a-4 : Адгезионные свойства. молекул воды позволяет образовывать капель воды (Фото © 2004 Эдвард Цанг). |
- Молекулы воды — единственное вещество на Земле которые существуют во всех трех физических состояния вещества : твердое , жидкое и газовое .Включены в изменения состояния огромны количества теплообмена. Эта функция играет важную роль в перераспределении тепловой энергии в Атмосфера Земли. По теплопередаче в атмосферу, примерно 3/4 этого процесс осуществляется за счет испарения и конденсации воды.
- Замерзание молекул воды вызывает их массу. занимать больший объем. Когда вода замерзает быстро расширяется, добавляя около 9% по объему. Свежий вода имеет максимальную плотность около 4 ° по Цельсию. (см. таблицу 8а-1 ). Вода — единственное вещество на этой планете, где максимальная плотность его массы не возникает при он затвердевает.
Таблица 8a-1: Плотность молекул воды при различных температурах.
Температура (градусы Цельсия) | Плотность (граммов на куб. сантиметр) |
0 (сплошной) | 0.9150 |
0 (жидкость) | 0,9999 |
4 | 1,0000 |
20 | 0.9982 |
40 | 0,9922 |
60 | 0,9832 |
80 | 0.9718 |
100 (газ) | 0,0006 |
Водные ресурсы 1. Введение Люди живут на планете, где преобладает вода.Более 70% поверхности Земли покрыта им. Ученые подсчитали, что гидросфера содержит около 1,36 миллиарда кубических километров этого вещества в основном в форма жидкости, занимающая топографические впадины на Земле. Пресная вода является основным ресурсом для всей земной жизни на этой планете. Вода важно для облегчения большинства биотик и абиотический экологические процессы. Люди используют воду для базового выживания и нуждаются в воде для использования в промышленности, сельском хозяйстве, на транспорте и в электроэнергетике поколение.Поскольку человеческое население и промышленная активность в мире увеличиваются, так же потребность в воде. В 1990 году каждый человек использовал примерно 710 куб. метров воды в год, что составляет около 2600 кубических километров в год. К 2000 году рост населения и экономической активности будет увеличить общее использование примерно до 6000 кубических километров в год. Источники воды для использования в описанных выше процессах:
становится все больше загрязненный из множества контролируемых человеком процессов.Многие люди не могут
получить доступ к чистой воде для потребления. Загрязненная вода вызывает
вспышки заболеваний среди людей, которые вызывают чрезмерную нагрузку на естественные
экосистемы. Будущее повышение продуктивности сельского хозяйства, чтобы прокормить растущий
человеческому населению потребуется вода для орошения. Однако новые источники
воду трудно найти. 1.1 Химическая и физическая Свойства воды Вода имеет очень простую атомную структуру.Эта структура состоит двух атомов водорода, связанных с одним атомом кислорода ( Рисунок 4.1 ). Природа атомной структуры воды делает ее молекулы уникальными. электрохимические свойства. Водородная сторона молекулы воды имеет небольшой положительный заряд (см. Рисунок 4.1 ). На другой стороне у молекулы отрицательный заряд. Эта молекулярная полярность заставляет воду быть сильным растворителем и отвечает за его прочную поверхность напряжение (для получения дополнительной информации об этих двух свойствах см. обсуждение ниже).
Когда вода образует физическую фазу change его молекулы располагаются в совершенно разных шаблоны ( Рисунок 4.2 ). Образец воды, когда она замороженный, заставляет его объем расширяться, а его плотность уменьшаться. Расширение вода при замерзании позволяет льду плавать поверх жидкой воды.
Вода обладает рядом других уникальных физических свойств. Вот эти объекты недвижимости:
1.2 Доступность воды и распространение Осадки являются основным источником пресной воды для реки, озера, грунтовые воды и ледники на земной поверхности Земли.Среднее годовое количество осадков в мире оценивается в 1050 миллиметра в год или 2,9 миллиметра в день. Рисунок 4.4 ниже иллюстрирует структуру годового количества осадков во всем мире. В Диаграмма показывает, что распределение осадков на нашей планете не однородный. Районы с большим количеством осадков находятся недалеко от экватора, на западном побережье. Северной Америки между широтами от 35 до 60 градусов северной широты, юго-восток США, побережье Юго-Восточной Азии и восточная Австралия.Недостаток участков осадков включают континентальные пустыни в субтропических высоких поясах, Центральная Евразия и Северная Америка, а также полярные регионы выше 60-й широты. градусов. Среднее годовое количество осадков в мире составляет оценивается в 1050 миллиметров в год или 2,9 миллиметра в день. Однако, Рисунок 4.4 показывает, что фактические значения отличаются от минимум 0 миллиметров в день или максимум 10 миллиметров в день в зависимости от местоположения.Причины появления этих шаблонов следующие:
В таблице 4.1 ниже описаны основные резервуары вода, найденная на Земле.В таблице указано, что большая часть воды, обнаруженной на эта планета находится в океанах. Использование этой раковины для воды людьми ограничен из-за содержащихся в нем растворенных солей. Ледниковые шапки и ледники содержат около 2% всей воды в мире и около 60% пресной воды поставлять. Использование этой воды людьми очень ограничено из-за ее формы. и расположение. Люди в основном используют пресную воду, содержащуюся в грунтовых водах, озерах, реки, почва и атмосфера.Эта вода составляет менее 1% Запасы Земли. Таблица 4.1: Учет воды на поверхность Земли.
(1) 750-4000 м ниже поверхности; (2) 0-749 м ниже поверхность. Таблица Содержание След. |
Физические свойства воды | Химия для неосновных
Цели обучения
- Определите поверхностное натяжение.
- Определите давление пара.
- Объясните физические свойства воды с точки зрения водородных связей.
Для чего используется эта сковорода?
Чаша испарителя. Предоставлено NOAA.
Потери воды в атмосферу — серьезная проблема во многих частях мира. Когда запасы воды низки, все, что можно сделать, чтобы уменьшить потери воды, важно для фермеров. Испарительный поддон (см. Выше) можно использовать для измерения скорости испарения воды в данном месте.Эта информация может использоваться в рамках проектов по разработке способов сокращения испарения и увеличения количества используемой воды в регионе.
Свойства воды
По сравнению с другими молекулярными соединениями с относительно низкой молярной массой, лед тает при очень высокой температуре. Требуется много энергии, чтобы разорвать ледяную сеть с водородными связями и вернуть ее в жидкое состояние. Точно так же температура кипения воды очень высока. Большинство молекулярных соединений с аналогичной молярной массой при комнатной температуре являются газами.
Поверхностное натяжение
Вода имеет высокое поверхностное натяжение (притяжение между молекулами на поверхности жидкости) из-за своей водородной связи. Жидкости, которые не могут связывать водород, не обладают таким большим поверхностным натяжением. Поверхностное натяжение можно увидеть по изогнутому мениску, который образуется, когда вода находится в тонком столбике, таком как градуированный цилиндр или бюретка.
Рис. 1. Мениск воды в градуированном цилиндре образуется из-за водородных связей воды.Изображение Питера Виткопа, 2014 г. http://www.shutterstock.com.
Давление пара
Пар Давление жидкости — это давление пара, образующегося при испарении жидкости или твердого вещества над жидкостью или твердым телом в закрытом контейнере. Водородная связь между жидкими молекулами воды объясняет, почему вода имеет необычно низкое давление пара. Относительно небольшое количество молекул воды способно покинуть поверхность жидкости и перейти в паровую фазу.Испарение происходит медленно, поэтому пар оказывает низкое давление в закрытом контейнере. Низкое давление пара является важным физическим свойством воды, поскольку в противном случае озера, океаны и другие крупные водоемы испарялись бы гораздо быстрее.
Давление пара зависит от температуры. По мере повышения температуры с поверхности жидкости высвобождается больше молекул. Это увеличивает движение над поверхностью жидкости, увеличивая давление в паровой стадии.На изображении ниже показано влияние температуры на давление пара.
Рисунок 2. Из Garnix / Wikipedia. http://commons.wikimedia.org/wiki/File:Dampfdruck05.png.
Резюме
- Вода имеет высокое поверхностное натяжение из-за обширных водородных связей.
- Давление пара воды низкое из-за водородных связей.
- Давление пара увеличивается с увеличением температуры.
Практика
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http: // science.howstuffworks.com/environmental/earth/geophysics/h3o7.htm
- Почему вода скапливается на восковых поверхностях?
- Объясните капиллярное действие.
- Дайте определение сплоченности.
- Определите адгезию.
Обзор
- Что такое поверхностное натяжение?
- Что такое давление пара?
- Как температура влияет на давление пара?
Глоссарий
- поверхностное натяжение: Притяжение между молекулами на поверхности жидкости.
- давление пара: Давление пара, возникающее при испарении жидкости или твердого вещества над жидкостью или твердым телом в закрытом контейнере.
Физические свойства воды | SpringerLink
Раздел
- 1 Цитаты
- Бег 3,4 км Загрузки
Abstract
В этой главе обсуждаются физические свойства воды, но, по необходимости, она содержит объяснение как атмосферного, так и гидростатического давления.Молекула воды диполярна — на противоположных сторонах молекулы есть отрицательно и положительно заряженные участки. В результате молекулы воды образуют водородные связи с другими молекулами воды. Водородные связи сильнее ван-дер-ваальсовых притяжений, возникающих между молекулами, и придают воде уникальные физические свойства. Диполярная молекула и водородная связь сильно влияют на плотность, давление пара, точку замерзания, точку кипения, поверхностное натяжение, фазовые изменения, удельную теплоемкость, диэлектрическую постоянную, вязкость, когезию, адгезию и капиллярность воды.Вода имеет максимальную плотность около 4 ° C; это приводит к плаванию льда и потенциальной термической стратификации естественных водоемов. Физические свойства воды представляют внутренний интерес, но некоторые из этих свойств влияют на качество воды, как будет показано в других главах.
Ключевые слова
Молекула воды Атмосферное давление Физические характеристики Альбедо воды Термическая стратификацияЭто предварительный просмотр содержания подписки,
войдите в, чтобы проверить доступ.
Ссылки
Когли Дж. Г. (1979) Альбедо воды как функция широты. Monthly Weather Rev 107: 775–781
CrossRefGoogle ScholarColt J (2012) Концентрация растворенного газа в воде. Эльзевир, Амстердам
Google Scholar
Информация об авторских правах
© Springer International Publishing Switzerland 2015
Авторы и аффилированные лица
- 1. Школа рыболовства, аквакультуры и водных наук Обернский университет Оберн США
Ключевые физические переменные температуры в океане Соленость и плотность
Соленость — это мера «солености» морской воды, или, точнее, количество растворенного вещества в морской воде.В рабочем состоянии растворенное вещество — это то, что остается после прохождения морской воды через очень тонкий фильтр для удаления твердых частиц. Исторически использовался стекловолоконный фильтр с номинальным размером пор 0,45 мкм. Совсем недавно фильтры с размером пор 0,2 мкм стали стандартом, поскольку фильтры с таким размером пор улавливают мельчайшие бактерии.Однако история концепции солености и ее различных определений (которые со временем менялись) — длинная и сложная история, восходящая к концу 19 века.История сложна по двум причинам. Во-первых, любое полезное определение солености содержит какие-то приближения. Эти приближения необходимы, потому что растворенные вещества в морской воде представляют собой сложную смесь практически всех известных элементов, и невозможно измерить полный состав каждой пробы воды. Во-вторых, тонкие технические детали этих приближений, которые претерпели изменения по мере того, как стало больше узнаваться о морской воде, очень важны на практике. Эти детали важны, потому что требуемая точность измерения солености, необходимая для понимания общей циркуляции океана, чрезвычайно высока (около ± 0.006%, см. Таблицу 1), так что даже небольшие изменения числовых значений могут иметь значительные последствия при неправильной интерпретации.
Наиболее полезные определения солености основаны на хорошо известном факте, что относительные соотношения большинства важных составляющих морской воды в океане примерно постоянны (Принцип постоянных пропорций). Следовательно, практические, но приблизительные измерения общего растворенного содержания могут быть найдены путем масштабирования измерений одного свойства.
Первоначально наиболее удобным для измерения свойством была концентрация хлоридов или галогенид-иона (в основном Cl — и Br — ). Хлорность измеряли с помощью прямого химического титрования, а затем преобразовывали в меру солености с помощью простой линейной функции. Такие солености часто можно определить по прилагаемой единице ppt или символу.
Однако почти все современные оценки солености основаны на измерениях электропроводности (или, с высокой точностью, на измерениях отношения проводимости образца морской воды к проводимости специального эталонного материала, называемого IAPSO Standard Seawater).Поскольку электропроводность морской воды также сильно зависит от температуры и, в некоторой степени, от давления, при этом подходе также необходимо измерять температуру и давление. Преобразование измеренных температуры, давления и проводимости в соленость является сложным и нелинейным. С начала 1980-х годов океанографы использовали расчетное значение, формально называемое практической соленостью (обозначенное S P ) в качестве прокси для истинной солености. Практическая соленость определяется как функция температуры, давления и проводимости другим стандартом, Практической шкалой солености 1978 года (или PSS-78).Когда океанологи используют слово соленость , они часто имеют в виду практическую соленость, хотя лучше использовать полное название, чтобы избежать двусмысленности.
Важно подчеркнуть, что у практических соленостей нет единиц. Этот факт, вводящий в заблуждение неспециалистов, связан с техническими проблемами, которые не позволяли дать точное определение при создании PSS-78. Иногда этот недостаток единиц неловко устраняется путем добавления аббревиатуры PSU (практические единицы солености) к числовому значению, хотя это формально неверно и настоятельно не рекомендуется.Практическая соленость численно меньше примерно на 0,5%, чем массовая доля растворенного вещества, когда эта массовая доля выражается в граммах растворенного вещества на килограмм морской воды. Тем не менее, практическая соленость была определена как достаточно сопоставимая с численными значениями солености на основе хлорирования, чтобы сохранить историческую преемственность.
Специальный эталонный материал, используемый для калибровки приборов для измерения солености, IAPSO Standard Seawater, производится одной компанией (Ocean Scientific International Ltd., Великобритания) и создается с использованием морской воды, полученной из определенного региона Северной Атлантики. Хотя использование стандартной морской воды для определения практической солености было обычным делом на протяжении многих лет, зависимость измерений практической солености от физического артефакта, который, как известно, деградирует с возрастом, приводит к ряду технических проблем, особенно с точки зрения долгосрочной стабильности и взаимосопоставимость высокоточных измерений океана.
Новый стандарт морской воды TEOS-10 определяет лучший показатель солености, называемый абсолютной соленостью (обозначается S A ).Это новое определение включает в себя несколько характеристик, разработанных для решения технических трудностей, описанных выше, и обеспечивает наилучшую имеющуюся оценку массовой доли растворенного вещества. Обычно это связано с прилагаемой единицей г / кг.
Во-первых, определение солености больше не основывается на свойствах стандартной морской воды IAPSO. Вместо этого лучшие оценки концентраций важных неорганических компонентов стандартной морской воды используются в TEOS-10 для точного определения искусственной морской воды с эталонным составом (таблица 2).По практическим и историческим причинам определение эталонного состава игнорирует растворенные органические вещества, а также большинство газов, хотя в остальном оно включает наиболее важные составляющие реальной морской воды с низким содержанием питательных веществ.| Справочная композиция | ммоль / кг | мг / кг |
| Na + | 468.9675 | 10781.45 |
| Мг 2+ | 52,8170 | 1283,72 |
| Ca 2+ | 10,2820 | 412,08 |
| К + | 10.2077 | 399,10 |
| Ср 2+ | 0,0907 | 7.94 |
| Класс — | 545,8695 | 19352,71 |
| СО 4 2- | 28.2353 | 2712,35 |
| Br — | 0,8421 | 67,29 |
| Ф — | 0,0683 | 1.30 |
| HCO 3 — | 1,7178 | 104,81 |
| CO 3 2- | 0,2389 | 14,34 |
| В (ОН) 3 | 0,3143 | 19,43 |
| В (ОН) 4 — | 0.1008 | 7,94 |
| CO 2 | 0,0097 | 0,43 |
| ОН — | 0,0080 | 0,14 |
| Наблюдаемые вариации, наблюдаемые в реальной морской воде | ||
| О 2 | 0 — 0.3 | 0-10 |
| № 2 | 0,4 | 14 |
| Si (OH) 4 | 0 — 0,17 | 0–16 |
| НЕТ 3 — | 0 — 0,04 | 0-2 |
| А / я 4 — | 0 — 0.003 | 0 — 0,2 |
| ΔCa + | 0 — 0,1 | 0-4 |
| ΔHCO 3 — | 0 — 0,3 | 0-20 |
| Растворенные органические вещества (РОВ) | — | 0-2 |
| Таблица 2. Ссылка Состав морской воды с S P ≡ 35,000 и S R ≡ 35,16504 г / кг. Концентрации в морской воде с более высокой или низкой соленостью могут быть найдены приблизительно путем масштабирования всех значений в большую или меньшую сторону на один и тот же коэффициент. Единицы концентрации даны на килограмм морской воды. Настоящая морская вода содержит дополнительные компоненты, которые не включены в контрольную композицию, но концентрации (и их вариации) могут превышать 1 мг / кг.Концентрации этих компонентов не увеличиваются и не уменьшаются с увеличением солености, но в значительной степени контролируются биогеохимическими процессами. | ||
Затем определяется числовая эталонная соленость (обозначенная S R ), представляющая массовую долю растворенного вещества в морской воде этого эталонного состава. Эталонная соленость выражается в граммах растворенного вещества на килограмм морской воды и определяется численно путем умножения концентраций различных компонентов эталонной композиции на их атомные веса и последующего суммирования.Считается, что определенная таким образом соленость находится на шкале солености эталонного состава. Обратите внимание, что погрешность самих атомных весов вносит в это определение погрешность около 1 мг / кг.
Стандартная морская вода теперь рассматривается как физический артефакт, который приблизительно соответствует эталонному составу морской воды. Затем конкретному образцу стандартной морской воды присваивается эталонная соленость по шкале эталонной солености состава. Эта эталонная соленость численно отличается от практической солености образца (рис. 1b), но ее можно получить из практической солености на основе проводимости с помощью простого масштабирования.Однако эталонная соленость также может быть оценена с использованием других подходов (например, путем прямых измерений плотности и инверсии уравнения состояния TEOS-10).
Хотя определение эталонного состава обеспечивает стандарт для определения солености стандартной морской воды, при рассмотрении реальных морских вод возникает дополнительная проблема. Это связано с тем, что относительный химический состав морской воды на самом деле немного отличается в разных географических точках. Наиболее важные изменения, которые происходят в реальном океане, возникают из-за изменений в углеродной системе, а также в концентрациях кальция (Ca 2+ ) и нитрата макроэлементов (NO 3 —) и кремниевой кислоты (Si ( OH) 4 ) (Таблица 2).На эти составляющие влияют биогеохимические процессы в океане. Они удаляются при образовании биологического материала и возвращаются при его растворении.
При использовании PSS-78 эти изменения относительного состава игнорируются. Однако это означает, что воды одной и той же практической солености из разных частей океана могут содержать разные массовые доли растворенного вещества. В открытом океане разница может достигать 0,025 г / кг (рис. 1b). В прибрежных водах, где присутствие речных солей является дополнительным фактором, разница может достигать 0.1 г / кг. Различия такого размера более чем на порядок превышают точность, с которой сообщается соленость (Таблица 1).
Согласно TEOS-10 эти изменения относительного состава явно учитываются в определении абсолютной солености. Абсолютную соленость TEOS-10 можно определить, как и прежде, путем измерения электропроводности, температуры и давления водяного пучка. Затем рассчитывается эталонная соленость, как если бы вода имела эталонный состав.Наконец, добавляется небольшой поправочный коэффициент для учета вариаций состава. Эта поправка, также известная как аномалия солености, обозначается Δ S A . Это примерно коррелирует с концентрацией макроэлементов в морской воде и является наибольшим в глубинах северной части Тихого океана, где эти концентрации являются наибольшими.Физические свойства воды
Физические свойства водыФизические свойства Вода
Какое значение имеет форма воды?
Краткое описание некоторых физических свойств воды представлено ниже (ссылка 2). Ссылки на фигуры: 1. http://hercules.gcsu.edu/~sdatta/home/teaching/hydro/slides/de density_t.gif 2. http://hercules.gcsu.edu/~sdatta/home/teaching/hydro/slides/prop_h3o.gif |
Физические свойства воды
Физические свойства воды
Вода имеет высокую удельную теплоемкость, т.е. ей нужно много тепла для нагрева, и требуется много времени, чтобы потерять накопленное тепло и остыть.Вот почему он используется в системах охлаждения (например, в радиаторах автомобилей или для охлаждения промышленного оборудования). И именно поэтому в прибрежных (или озерных) регионах температура воздуха ниже: в этих районах при смене времен года температура воды «смягчает» температуру воздуха, поскольку она понижается или повышается медленнее, чем что из воздуха. Вода имеет высокое поверхностное натяжение: это означает, что после того, как она вылита на гладкую поверхность, она имеет тенденцию образовывать сферические капли, а не расширяться в тонкую пленку.Без силы тяжести капля воды была бы идеально сферической. Поверхностное натяжение позволяет растениям поглощать воду, содержащуюся в почве, через свои корни. И снова именно поверхностное натяжение заставляет кровь, которая в основном состоит из молекул воды, течь через кровеносную систему нашего тела.
Только жидкая вода?
Кроме того, воду обычно можно найти в жидком состоянии, но она легко может стать твердой или газообразной. Чистая вода переходит из жидкой в твердую, т.е.е. замерзает при 0 градусах Цельсия, а на уровне моря закипает при 100 ° C (чем выше уровень, тем ниже температура, при которой вода начинает кипеть). Значения кипения и замерзания воды берутся за точку отсчета для калибровки термометров: по шкале Цельсия 0 ° по шкале Цельсия — это точка замерзания, а 100 ° — точка кипения.
При замерзании вода расширяется, то есть ее плотность уменьшается, а объем остается прежним: поэтому лед плавает на воде или бутылка, наполненная водой и помещенная в морозильную камеру, распадается.



 Образуется гидроксид кальция (гашеная известь):
Образуется гидроксид кальция (гашеная известь):