Пять физических состояний воды — Александр Леснянский
Со школы мы знаем, что вода может существовать в жидком, твердом и газообразном видах. Это ошибка. Ученые заблуждаются. Я сам лично три дня назад наблюдал воду в пяти различных субстанциях, причем все в одном месте. Это было на Уакитском горячем источнике. Как это стало возможным? — Я приехал туда с Упорным и Бешеным и с тремя аналитиками — специалистами по жидкостям на основе Н2О. С вечера мы просто накупались в горячем озерце, затем посидели за столом в избе, да и пошли спать. А рано утром я, как вышел на босу ногу и с фотоаппаратом в руках, так и застрял на улице часа на два, потому что красота неописуемая. Вода с цветными водорослями, клубы пара гуляют, как привидения, изморозь на траве, снег, лед… И все это одновременно! Вот тут меня и осенило, я обнаружил четыре состояния Н2О:
— Вода – жидкое состояние;
— Пар – газообразное состояние;
— Лед – твердое состояние
— Снег – рыхлое (или мягкое) состояние.
Ну а пятое состояние – это «плазма» – огненная вода. В природном виде на источнике такой жидкости нет, но обычно ее много в избе, – всегда привозят с собой.
Огненную воду я не фотографировал, а все остальное – смотрите.
Это — водоросли, я думаю, они сине-зеленые, несмотря на то, что желто-оранжевые
Мы еще раз дружно приняли сероводородные ванны…
А это – наша компания в интерьере избы – гостиницы.
9 апреля
Горячий – Багдарин – Чита.
Вездеход – хорошо, Cruiser – хорошо, а УАЗик лучше
… А потом собрались и в 11 часов отправились в обратную дорогу, предварительно сделав коллективный снимок у самой горячей лужи, в которой легко можно сварить яйца.
Штатив пригодился
Одно место – маленький брод через ручей стало небольшим препятствием, впрочем легко преодолимым.
Ну а дальше по «дороге» уже знакомая качка, тряска и дымящиеся обочины…
Пиромания защитников леса достигла апогея. Едем, дышим свежим дымом, любуемся реальной плазмой…
С не реальной (жидкой) «плазмой» будем иметь дело скоро, когда доедем до зимовий Шуринды. Не выяснил точно откуда название, наверное так зовется ручей – приток Ципы, где проходит лесная дорога для тяжелых «Уралов», перевозящих грузы старателям. Но это не сильно интересно. А любопытно то, что на ручье есть талик с теплой водой (примерно +40 градусов), где тоже можно купаться, только ямку для ванны копать придется.
Шуринда. Здесь тоже можно купаться
На Шуринде мы тормознулись, чтобы пообедать. Получилось весело! Время 13 часов.
Как видите, для веселья все идет в ход: и чай, и горчица в банке, и лапша «Ролтон», и 40-градусная вода. Результат налицо – лица у всех веселые:
Лёша «Бешеный»
Михалыч «Упорный»
Максим
Коля
Егор
А это я
Через полтора часа поехали дальше. До дома еще очень далеко.
До дома еще очень далеко.
17:15. Между Ципиканом и Багдарино, немного не доехав до перевального бурхана на Лешином Круизере оторвался второй амортизатор. Теперь нужно искать СТО в Багдарине. Зато УАЗик прет как танк.
Проезжая бурхан, я каждый раз его фотографирую.
Характер и состав подношений местным духам между прочим, с временами меняется. Теперь в цене нефрит. Не знаю, как ценят его местные духи, но в Китае этот камень очень дорог, и ради экспорта в Поднебесную в Забайкалье и Бурятии последние лет 10-20 делаются очень серьезные деньги очень серьезными людьми с очень солидной техникой, охраной, вооруженной автоматами Калашникова. Один речной валун весом 3-4 кг может стоить 10- 20 тыс. долларов и даже больше. А другой образец может не стоить и ни копейки – все зависит от качества камня. Ясно, что хороший нефрит не положат на бурхан, такого подарка не достоин ни один бог на свете.
Много нефрита по Ципе. Из-за этого некогда очень популярная у туристов-сплавщиков река превратилась в пристанище для всяких личностей, заполонивших все косы и берега. Эти личности зачастую можно назвать «подозрительными» или даже попросту «сбродом». Поэтому туристы стали опасаться ехать на сплав по Ципе.
Из-за этого некогда очень популярная у туристов-сплавщиков река превратилась в пристанище для всяких личностей, заполонивших все косы и берега. Эти личности зачастую можно назвать «подозрительными» или даже попросту «сбродом». Поэтому туристы стали опасаться ехать на сплав по Ципе.
Но я отвлекся. Мы едем дальше, в Багдарин, и нам нужна сварка.
На поиски СТО и на ремонт ушло часа два или больше. Автомастерская была закрыта, но Михалыч знаком с хозяином, и нас пустили чиниться.
Когда все закончили с ремонтом, на дворе уже наступила темень.
Около полуночи устроили себе ужин в Романовке, в столовой, которая к моему удивлению работала.
А до Читы добрались только к 5 утра (уже по нашему местному времени). … И я сразу свалился спать, и думал, что мне понадобится три дня… Ну да, я с этого и начал свой рассказ, можно уже не повторяться.
Что важного я забыл сказать, чем закончить?… Ну, можно так: «Домой мы привезли много впечатлений, усталости и некоторое количество неиспользованной «огненной жидкости» – воды в пятом физическом состоянии.
p.s. Просьба к участникам рейда и ко всем читателям: Если вы заметили орфографические, географические, технические, политические, морально-этические или другие ошибки, прошу прямо и честно мне на них указать.
у воды есть два жидких состояния
Вода может существовать в виде двух разных жидкостей, которые при определённых условиях даже не смешиваются друг с другом. Такой удивительный результат получили физики, проведя тончайшие эксперименты.
Достижение описано в научной статье, опубликованной в журнале Science.
Каждому из нас со школьной скамьи известно, что вещество может находиться в трёх состояниях: твёрдом (как лёд), жидком (как вода при комнатной температуре) или газообразном (как водяной пар).
Но не всё так просто. У одного и того же вещества бывает много твёрдых состояний. Они отличаются тем, как атомы расположены друг относительно друга. А уж отсюда могут проистекать различия в самых разных свойствах: плотности, прочности, прозрачности и… рыночной стоимости. Например, графит и алмаз – два разных твёрдых состояния углерода, а между тем их очень трудно спутать, и ещё труднее превратить первое во второе.
Например, графит и алмаз – два разных твёрдых состояния углерода, а между тем их очень трудно спутать, и ещё труднее превратить первое во второе.
У воды тоже есть несколько твёрдых состояний. Этих разновидностей льда больше десятка. Но лишь одна модификация образуется на поверхности Земли естественным образом. Остальные получаются либо в лаборатории, либо в экзотических уголках вроде земных недр.
Но несколько десятилетий назад теоретики выдвинули гипотезу, что и жидких состояний у этого привычного нам вещества больше одного.
«Гипотеза, что вода может существовать в двух различных жидких состояниях, была предложена примерно 30 лет назад на основе результатов компьютерного моделирования», – рассказывает соавтор статьи Николас Джовамбаттиста (Nicolas Giovambattista) из Городского университета Нью-Йорка.
Специалисты рассчитали, что «вторая вода» возникает при температуре около -70 °C и давлении в тысячи атмосфер. Она на 20% плотнее обычной воды из-за того, что молекулы располагаются теснее друг к другу.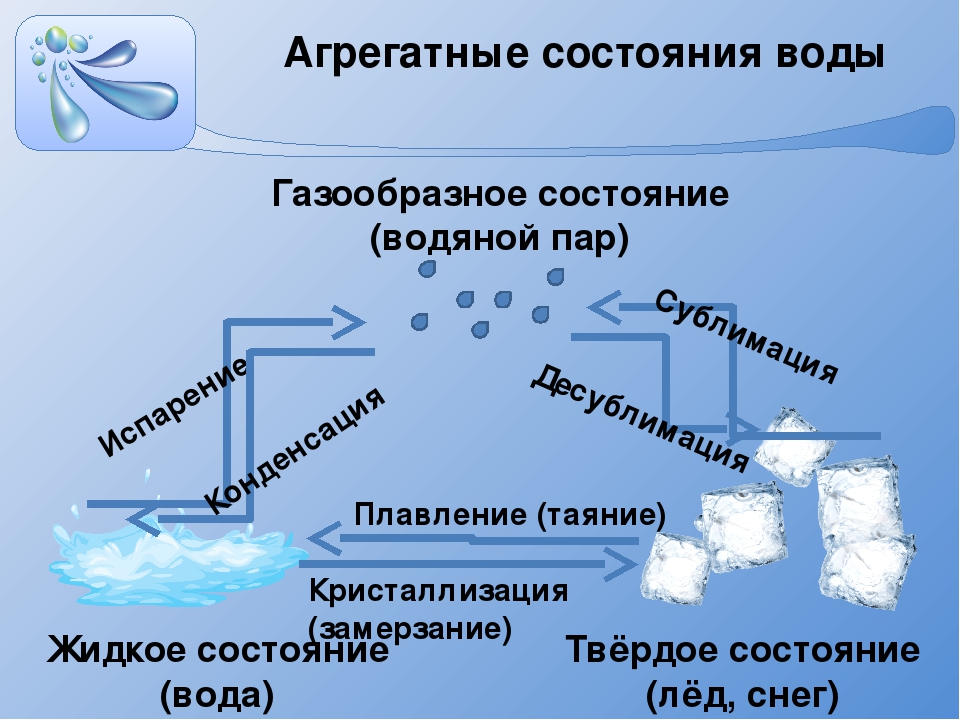
Привычная вода таит ещё много загадок.
Однако проверить это предположение в эксперименте оказалось чрезвычайно сложно. Ведь в описанных условиях вода (как обычная, так и «аномальная») за доли секунды превращается в лёд. До недавнего времени физики просто не успевали обнаружить это неуловимое жидкое состояние до того, как оно перейдёт в твёрдое.
Авторы новой работы взяли этот барьер, применив два фемтосекундных лазера. Один из них, инфракрасный, они использовали для моментального нагрева льда и превращения его в жидкую воду. Другой, рентгеновский, зондировал образец, чтобы учёные могли узнать, в каком состоянии тот находится.
Исследователи зафиксировали появление своеобразных пузырей жидкости, содержащих «вторую» воду. Они существовали недолго: от 20 наносекунд до 3 микросекунд. При этом уже через несколько микросекунд вещество превращалось в лёд.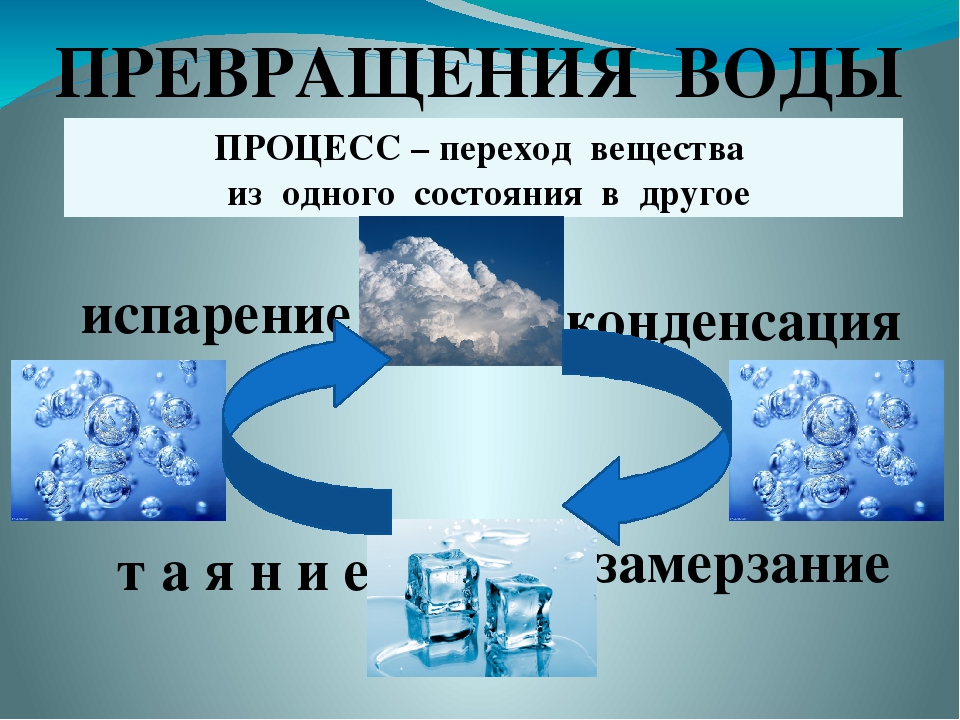
Итак, экспериментаторы блестяще подтвердили теоретический прогноз тридцатилетней давности. Кому и чем может быть полезно это достижение?
Отметим, что вода вообще очень необычное вещество с точки зрения физики и химии. Например, вода – поразительно хороший растворитель. И это её свойство лежит в основе физиологии всех живых существ. Напомним, что и человек на 60–70% состоит из воды и в каком-то смысле является большой вертикальной лужей.
У воды есть и ещё одно необычное качество. Почти все вещества в твёрдом состоянии плотнее, чем в жидком, а вода – наоборот. Поэтому лёд плавает в воде, и это большая удача для жителей водоёмов. Если бы лёд тонул, холодной зимой все реки и озёра промерзали бы до дна. Более того, в полярных широтах не образовывались бы плавучие морские льды – важнейший фактор климата. Вся жизнь на Земле выглядела бы иначе, не будь у привычной нам жидкости такого удивительного свойства.
Изучая свойства воды, учёные проникают в основы множества самых важных процессов, от биохимических до климатических.
Конечно, в человеческом организме или полярных шапках не встретить «воду II», только что открытую экспериментаторами. Ведь для её существования (и то мимолётного) требуются давления в тысячи атмосфер. Но этот феномен возникает благодаря неким свойствам воды, которые могут проявляться и в менее экзотических условиях, а значит, влиять на нашу жизнь.
К слову, ранее Вести.Ru рассказывали о том, как физики охладили жидкую воду до рекордной температуры. Писали мы и о том, как воду заморозили при температуре кипения.
Физические состояния воды
THE áвода, драгоценный элемент для человечества, подарки
• жидкость;
• твердый;
• газообразный.
В каждом из физических состояний воды составляющие частицы вещества агрегированы по-разному.
Читайте тоже: Насколько важна вода для нашего тела?
Каковы физические состояния воды?В жидком состоянии вода принимает форму емкости, в которой хранится, будь то в природе, как в случае озера, будь то в повседневной жизни людей, как в бутылках, которые мы покупаем в супермаркете.
В газообразном состоянии вода не имеет формы. На этом этапе она проходит процесс испарения, когда он выходит из жидкого состояния, чтобы перейти в газообразное состояние. Это происходит, когда вода нагревается до кипения и начинает испаряться. Когда вода нагревается естественным путем от тепла, она испаряется в атмосфера и образует капли, которые вызывают облакоа такженас.
В твердом состоянии вода имеет обычный способ
. Что происходит при контакте с более низкой температурой и так он затвердевает. Мы находим это состояние воды во льду, айсберге, снеге и град.Смотрите также: Почему морская вода соленая?
Как меняется состояние воды?Как мы уже видели, вода претерпевает изменения в различных ситуациях. Но знаете ли вы, как происходит каждое изменение? Давайте узнаем прямо сейчас!
- Затвердевание
И переход из жидкого в твердое состояние. Это возможно только при температуре воды 0 ° C. Это происходит, когда мы наливаем воду в морозилку, и она превращается в лед.
Это возможно только при температуре воды 0 ° C. Это происходит, когда мы наливаем воду в морозилку, и она превращается в лед.
И переход из газового в жидкое состояние. Мы можем заметить это изменение при приготовлении пищи. Вода в кастрюле закипает, и на крышке кастрюли образуются маленькие капли воды.
И переход из твердого в жидкое состояние. Это происходит, например, когда мы достаем лед из морозильника и ставим его на комнатную температуру. Помните, что для того, чтобы вода превратилась в лед, она должна достичь температуры 0 ° C. При температуре выше 0 ° C лед начинает таять.
Наконец, у нас есть сублимация, которая происходит когда вода переходит прямо из газообразного состояния в твердое состояние, без необходимости проходить через жидкое состояние. Это явление редко встречается в природе, поскольку вода обычно следует естественному порядку, от жидкости к твердому или от жидкости к газу.
Схема изменения физического состояния воды.
Смотрите также: Почему кожа на ногах и руках морщится от воды?
Мероприятия1) Сопоставьте изображения с их соответствующими описаниями.
Отвечать:
Физические и химические свойства воды. Показатели качества воды : Farmf
Физические и химические свойства воды. Показатели качества воды
- 1.1. Состав воды и ее строение
- 1.2. Особенности физико-химических свойств воды
- 1.3. Диаграмма состояния воды
- 1.4. Структура и свойства льда
- 1.5. Физические свойства воды
- 1.6. Химические свойства воды
- 1.7. Вода в связанном состоянии
- 1.8. Замерзание воды и водных растворов в различных условиях
- 1.9. Показатели качества воды
Одним из важнейших химических соединений для человечества является вода. Вода, занимая почти 75 % поверхности Земли, является самым обильным и ценным ресурсом. Мировые запасы воды огромны – около 1389 млн. км 3 . Если распределить их поровну, то на каждого жителя планеты пришлось бы по 280 млрд. литров. Однако 97 % водных ресурсов приходится на долю океанов и морей, в которых вода слишком соленая. Оставшиеся 3% – пресные воды. Вода составляет от 50-97 % веса всех растений и животных и около 70 % веса человеческого тела. Все химические реакции в организме протекают только в водной среде.
Мировые запасы воды огромны – около 1389 млн. км 3 . Если распределить их поровну, то на каждого жителя планеты пришлось бы по 280 млрд. литров. Однако 97 % водных ресурсов приходится на долю океанов и морей, в которых вода слишком соленая. Оставшиеся 3% – пресные воды. Вода составляет от 50-97 % веса всех растений и животных и около 70 % веса человеческого тела. Все химические реакции в организме протекают только в водной среде.
Из всей пресной воды человечество может использовать лишь 0,003%, так как она либо сильно загрязнена, либо залегает на больших глубинах и ее нельзя извлечь по приемлемым ценам, либо содержится в айсбергах, полярных льдах, в атмосфере и в почве.
Вода находится в постоянном круговороте (рис.1). Этот естественный процесс рециркуляции происходит до тех пор, пока потребление воды не становится интенсивнее, чем восполняются ее запасы и пока не превышен объем отходов, делающий воду непригодной. Существует два источника пресной воды поверхностные воды и грунтовые воды.
Рис. 1. Круговорот воды в биосфере
Критериями использования воды служат показатели водозабора и водопотребления. Почти три четверти добываемой в мире воды идет на орошение, остальная вода используется в промышленности и коммунальном хозяйстве, для охлаждения оборудования на электростанциях и т.д.
На выращивание одной тонны пшеницы необходимо 1500 тонн воды, одной тонны риса – более 7000 тонн, одной тонны хлопка – 10000 тонн. Огромное количество воды требуется для производства продовольствия и различной промышленной продукции. Прежде чем в магазине появится литровая банка консервов из фруктов или овощей, на нее будет истрачено 40 литров воды. Для производства суточной нормы пищевых продуктов на одного человека требуется около 6 м 3 воды.
Различают природную, сточную и денатурированную воду.
- Природная вода – это вода, которая качественно и количественно формируется под влиянием естественных процессов при отсутствии антропогенного воздействия и качественные показатели которой находятся на естественном среднемноголетнем уровне.

- Сточная вода – это вода, бывшая в бытовом, производственном или сельскохозяйственном употреблении, а также прошедшая через какую-либо загрязненную территорию, в том числе населенного пункта.
- Денатурированная или природно-антропогенная вода – природная вода, подвергаемая антропогенному загрязнению, например, путем смешивания со сточной водой.
Человек может существовать без пищи несколько недель, а без воды лишь несколько дней. От поступления воды в живой организм зависит переваривание пищи, циркуляция крови, удаление распадающихся клеток, регуляция кислотно-основного баланса и температура тела. Несмотря на активное участие в процессах обмена вода инертна в физиологическом отношении. Вода участвует в таких процессах, как перестройка молекул и ионов, образование сложных органических молекул, выполняющих биохимические функции, диссоциация молекул, гидролиз соединений, окислительно-восстановительные реакции и т.д. Для инженеров-строителей представляют интерес свойства жидкой воды и льда и особенности их внутреннего строения, формы связанной воды, образование кристаллогидратов и гидрогелей, составляющих основу при твердении вяжущих материалов.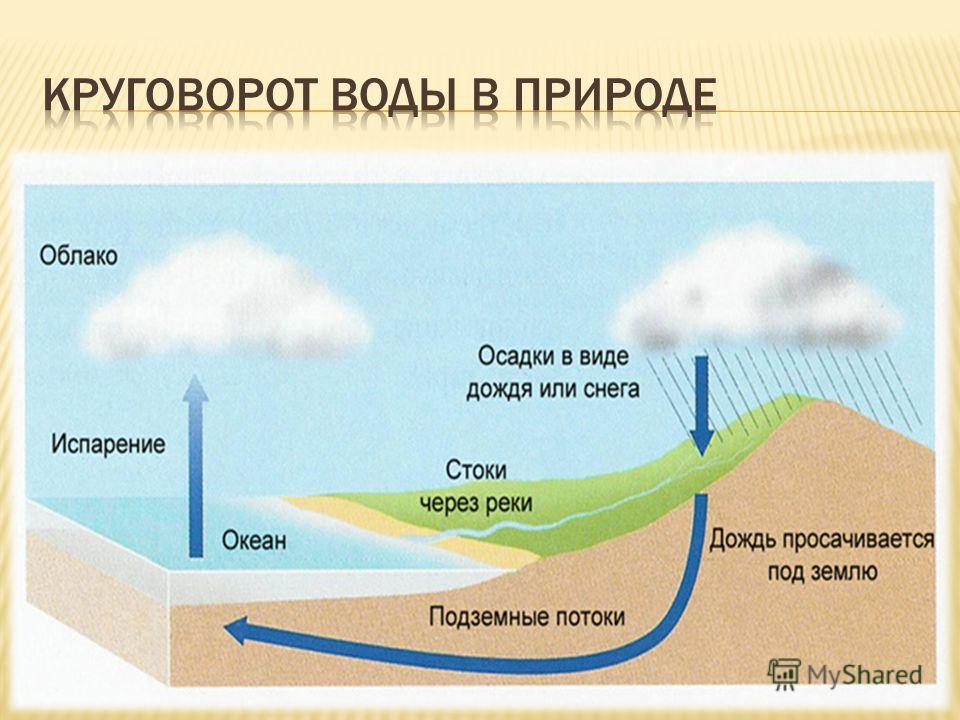
В современном строительстве широко применяются различные вяжущие материалы (цемент, гипс, известь и др.). Вяжущие необходимы для изготовления бетона, строительных деталей и конструкций, скрепления отдельных элементов сооружений, камней, кирпичей. Строительные растворы готовят смешивая с водой вяжущие материалы, пластичность растворов которых обеспечивает их применение для различных строительных работ. Пластичная масса со временем загустевает и превращается в твердое камневидное тело. При замешивании порошкового гипса (СаSО 4 * 0,5Н2О) получают тесто, затвердевающее за счет присоединения воды и образования двухводного гипса:
2(СаSО 4 * 0,5Н2О) + 3 Н2О) =2(СаSО 4 * 2Н2О)
Этот процесс используется для получения перегородочных плит, панелей, слепков с различных предметов и получения известковогипсовых растворов для штукатурных работ. Известковый раствор – смесь гашеной извести с песком и водой, также используют в качестве вяжущего материала. Но в отличие от гипса он затвердевает в результате отщепления воды и образования кристаллического карбоната кальция по схеме:
Са(ОН)2+ СО2= СаСО 3 + Н2О
Сложные процессы гидратации и поликонденсации составных частей цементного клинкера происходят только при его смешивании с водой и способствуют постепенному затвердеванию и образованию высокомолекулярных силикатов и алюминатов кальция.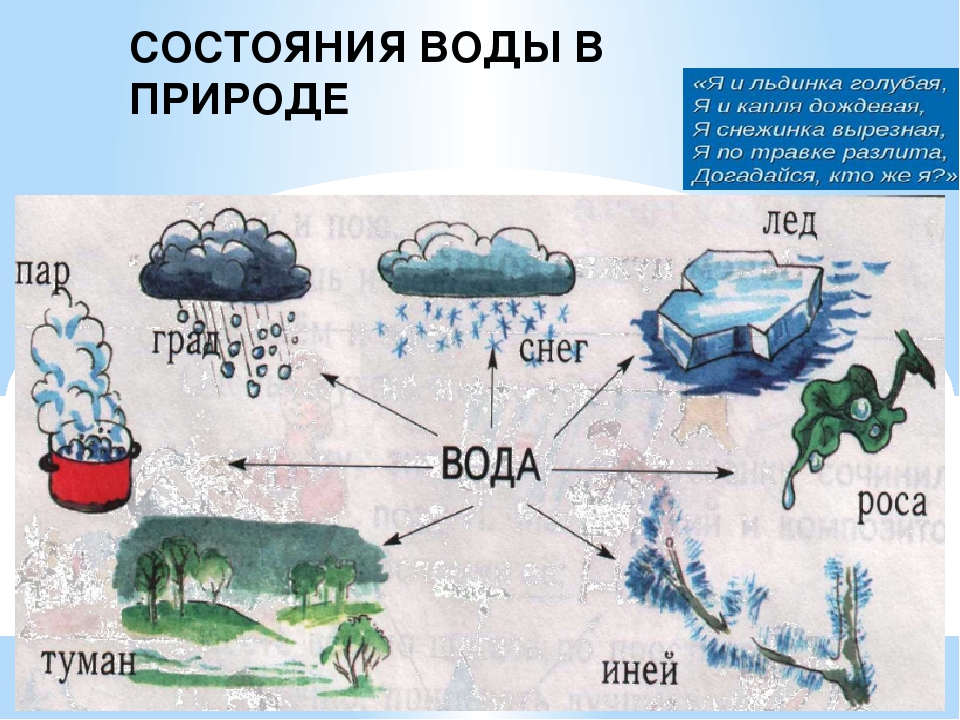 Например, однокальциевый алюминат сначала гидратируется:
Например, однокальциевый алюминат сначала гидратируется:
СаО * А12О 3 + 10 Н2О = СаО * А12О 3 *10Н2О
Образовавшийся гидроалюминат кальция переходит в более устойчивый кристаллический двухкальциевый гидроалюминат с выделением гидроксида алюминия:2(СаО * А12О 3 *10Н2О) + Н2О =2СаО * А12О 3 * 8Н2О +2А1(ОН) 3
Прочность цементного камня нарастает с большой скоростью.
Свойства воды
1.1. Состав воды и ее строение
Н2О (оксид водорода) – устойчивое соединение, с массовой долей водорода 11,10 % и кислорода – 88,91 %. Известно до 36 разновидностей молекул воды, состоящих из сочетаний изотопов водорода (протия – 1 1 Н; дейтерия – 21 D и трития – 3 1 Т) и кислорода с массовыми числами от 14 до 19. На долю стабильного изотопа Н2О (где кислород с массовым числом 16) приходится 99,73 % от массы воды. Тяжелая вода D2О получается в результате многократного электролиза обычной воды и отличается по свойствам от обычной воды.
Таблица 1. Свойства обычной и тяжелой воды
Свойства обычной и тяжелой воды
Реакции с тяжелой водой происходят значительно медленнее, чем с обычной водой. Тяжелая вода оказывает сильное биологическое воздействие на живые организмы и непригодна для жизненных процессов, так как более прочные связи О – Д изменяют скорости биологических процессов и приводят к смещению равновесия этих процессов. Тяжелую воду применяют в качестве замедлителя нейтронов в ядерных реакторах, а также как источник дейтронов Д + для ядерных и термоядерных реакций, для получения искусственных радиоактивных изотопов, используемых при исследовании механизмов протекания реакций.
Между атомами водорода (1s1) и кислорода (1s2 2s2 2р4) в молекуле воды образуются две ковалентные полярные связи по обменному механизму.
По методу ВС (валентных связей) атом кислорода в молекуле воы находится в состоянии sр 3 -гибридизации. Две гибридные орбитали атома кислорода перекрываются с s-орбиталями двух атомов водорода, а на двух других гибридных орбиталях кислорода располагаются две несвязывающие электронные пары (рис. 2а). В результате отталкивания связывающих и несвязывающих электронных пар валентный угол в молекуле жидкой воды равен 105о.
2а). В результате отталкивания связывающих и несвязывающих электронных пар валентный угол в молекуле жидкой воды равен 105о.
Неподеленные пары электронов кислорода влияют на строение молекулы воды, придавая ей тетраэдрическую структуру (рис. 2б). Орбитали, с неподеленными электронными парами, направлены к противоположным от протонов вершинам тетраэдра. Поэтому около протонов создается пониженная электронная плотность (+), а вокруг орбиталей с неподеленной парой электронов – повышенная электронная плотность (-). а) б)
Рис. 2. Схема структуры молекулы воды
В молекуле воды ядерные центры атомов водорода и кислорода образуют равнобедренный треугольник (рис.3)
Рис. 3. Расстояние между ядрами и угол связи в молекуле жидкой воды
Параметры молекул воды зависят от ее агрегатного состояния (табл. 2).
Таблица 2. Параметры молекул воды
1.2. Особенности физико-химических свойств воды
1. Полярность. Высокая полярность молекул воды объясняется несовпадением центров тяжести ее положительных и отрицательных зарядов. Благодаря необычно большому дипольному моменту (μ (Н2О) = 1,85 Д) вода является химически активным соединением, обусловливающим электролитическую диссоциацию солей кислот, оснований и имеет аномально большую диэлектрическую постоянную, равную 79,5 при 25 о С, т.е. в воде два электрических заряда притягиваются или отталкиваются с силой приблизительно в 80 раз меньшей, чем в вакууме.
Полярность. Высокая полярность молекул воды объясняется несовпадением центров тяжести ее положительных и отрицательных зарядов. Благодаря необычно большому дипольному моменту (μ (Н2О) = 1,85 Д) вода является химически активным соединением, обусловливающим электролитическую диссоциацию солей кислот, оснований и имеет аномально большую диэлектрическую постоянную, равную 79,5 при 25 о С, т.е. в воде два электрических заряда притягиваются или отталкиваются с силой приблизительно в 80 раз меньшей, чем в вакууме.
2. Наличие водородных связей. Молекулы воды связаны между собой водородными связями. По прочности они занимают промежуточное положение между ковалентными и межмолекулярными связями. Причиной образования водородной связи является смещение единственного электрона водорода к сильно электроотрицательному атому кислорода. При этом водород превращается в частицу с уникальными свойствами:
а) не имеет электрона, а поэтому не отталкивается, а притягивается электронными оболочками других частиц;
б) обладает ничтожно малым размером и, следовательно, большим поляризующим действием. Энергия водородной связи в воде равна 29 кДж/моль. Водородные связи объединяют молекулы воды в ассоциаты (рис.4.)
Энергия водородной связи в воде равна 29 кДж/моль. Водородные связи объединяют молекулы воды в ассоциаты (рис.4.)
Ассоциация молекул воды является причиной аномально высоких температур ее кипения, плавления, теплоты парообразования. Известно, что в ряду аналогичных соединений с увеличением молярной массы возрастают температуры плавления и кипения. Однако в случае воды при сопоставлении ее с аналогами эта закономерность нарушается (рис. 5).
Рис. 5. Зависимость температур кипения (I) и замерзания (II) от величины молярной массы вещества для водородных соединений р-элементов (VI) группы
Молекулы воды не образуют ассоциатов в парообразном состоянии. В жидкой воде ассоциированные молекулы могут находиться в равновесии с неассоциированными молекулами. Среднее координационное число молекул в жидкой фазе близко к четырем. В 1932 году Бернал и Фаулер (Англия), основываясь на данных рентгеноструктурного анализа, установили, что связь между молекулами и относительное расположение их в жидкой воде подобно расположению молекул воды в структуре льда.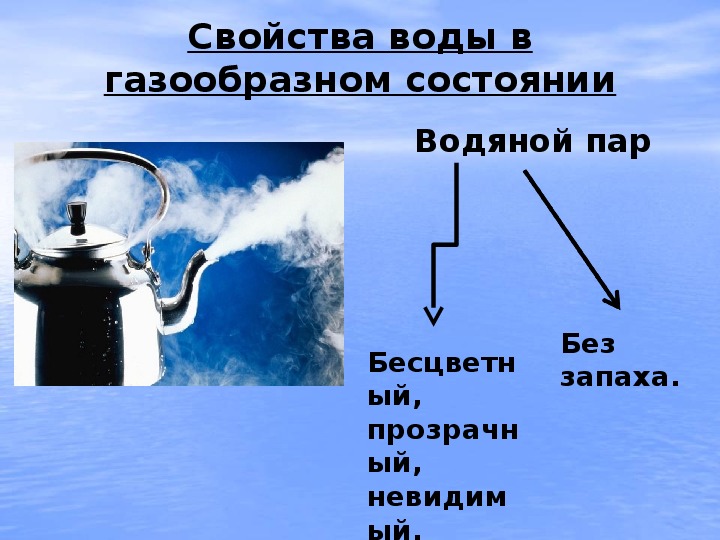 Определить процентное содержание свободных молекул не удалось. Очевидно, что с повышением температуры усиливается тепловое движение и уменьшается степень связанности молекул.
Определить процентное содержание свободных молекул не удалось. Очевидно, что с повышением температуры усиливается тепловое движение и уменьшается степень связанности молекул.
Притяжение молекул воды друг к другу обусловливает большую величину поверхностного натяжения 72,7 мДж/м2. Это значит, что для разрыва водяного столбика диаметром 2,5 см потребуется усилие в 90 тонн. Схема возникновения поверхностного натяжения такова:
молекула А, расположенная внутри жидкости, притягивается соседними частицами с одинаковой силой, т.е. межмолекулярные силы, действующие на молекулу воды, расположенную в объеме фазы, распределены равномерно со стороны соседних молекул;
молекула Б, расположенная на поверхности жидкости, испытывает действие межмолекулярных сил в большей степени со стороны жидкой фазы и почти не взаимодействует с молекулами газообразной фазы. Поэтому каждая отдельная молекула на поверхности жидкости обладает большей энергией по сравнению с энергией молекулы в объеме фазы. Она находится в неравновесном состоянии и стремится втянуться в объем жидкости (рис. 6).
Она находится в неравновесном состоянии и стремится втянуться в объем жидкости (рис. 6).
Поэтому небольшие количества воды принимают шарообразную форму, так как из всех геометрических тел одинакового объема шар имеет наименьшую поверхность.
Рис. 6. Схема возникновения поверхностного натяжения на границе раздела двух фаз
Водородные связи влияют на растворимость веществ. В воде хорошо растворяются вещества, имеющие в составе полярные группы или ионную связь, например, спирты, амины, сахара, соли, кислоты, основания, а также некоторые газы NН 3 , СО2, SО2и другие. Структура льда и его свойства также обусловлены водородными связями.
3. Способность к донорно-акцепторному взаимодействию. Вода проявляет свойства донора за счет неподеленной пары электронов атома кислорода. Этим объясняется высокая химическая активность воды и способность ее к комплексообразованию в качестве лигандов. Вода относится к слабым электролитам и поэтому ионизирует в небольшой степени по следующей схеме:
В одной тонне чистой воды содержится 0,1 мг-иона водорода и 1,7 мг-иона гидроксила.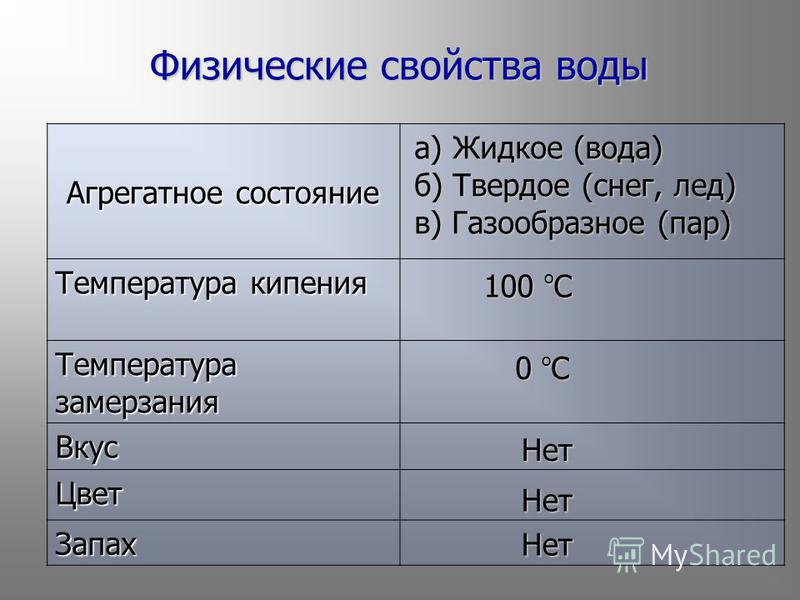 Время пребывания водорода в одной из молекул не превышает 10 -8 сек, что указывает на большую скорость диссоциации.
Время пребывания водорода в одной из молекул не превышает 10 -8 сек, что указывает на большую скорость диссоциации.
1.3. Диаграмма состояния воды
Вода при 0оС и давлении насыщенного пара 600,5 Па образует три фазы в состоянии равновесия (рис. 7):
ПАР <=> ЛЕД <=> ВОДА
С повышением температуры исчезает твердая фаза – лед, с понижением температуры – жидкая фаза – вода. Система из трехфазной системы становится двухфазной. Тройная точка (0) – место пересечения трех кривых 1, 2, 3 – соответствует нонвариантной системе, т.е. число ее степеней свободы равно нулю. Изобара с давлением 1,013 * 105 Па пересекает кривую I при температуре кипения воды. Точки кривой I соответствуют таким значениям температуры и давления, при которых жидкая вода и водяной пар находятся в равновесии (кривая кипения). Аналогично кривая II – кривая плавления, III – кривая сублимации. Отклонение кривой II к оси ординат с повышением давления указывает на снижение температуры плавления, что обусловлено меньшей плотностью льда по сравнению с водой.
Рис. 7. Схема фазовой диаграммы воды
1.4. Структура и свойства льда
Кристаллы льда имеют гексагональную структуру (рис. 8,а)
Как видно из рисунка 8а в структуре льда есть пустоты, которые могут заполняться другими соединениями, например, одноатомными молекулами газов с образованием соединений включения или клатратов. Каждый атом кислорода тетраэдрически связан с четырьмя другими атомами кислорода (рис. 8б). Между ними располагаются атомы водорода. Два атома водорода соединены с атомом кислорода ковалентной полярной связью (длина связи – 0,099 нм), а два других – соединены водородной связью (длина связи – 0,176 нм), т.е. принадлежат двум другим молекулам воды. В результате образуется рыхлая структура с небольшой плотностью. При плавлении льда водородные связи частично разрушаются (примерно на 10 %), молекулы воды сближаются и плотность воды немного возрастает. При нагревании воды происходит ее расширение, увеличивается расстояние между молекулами и одновременно разрушаются водородные связи, что приводит к уменьшению объема.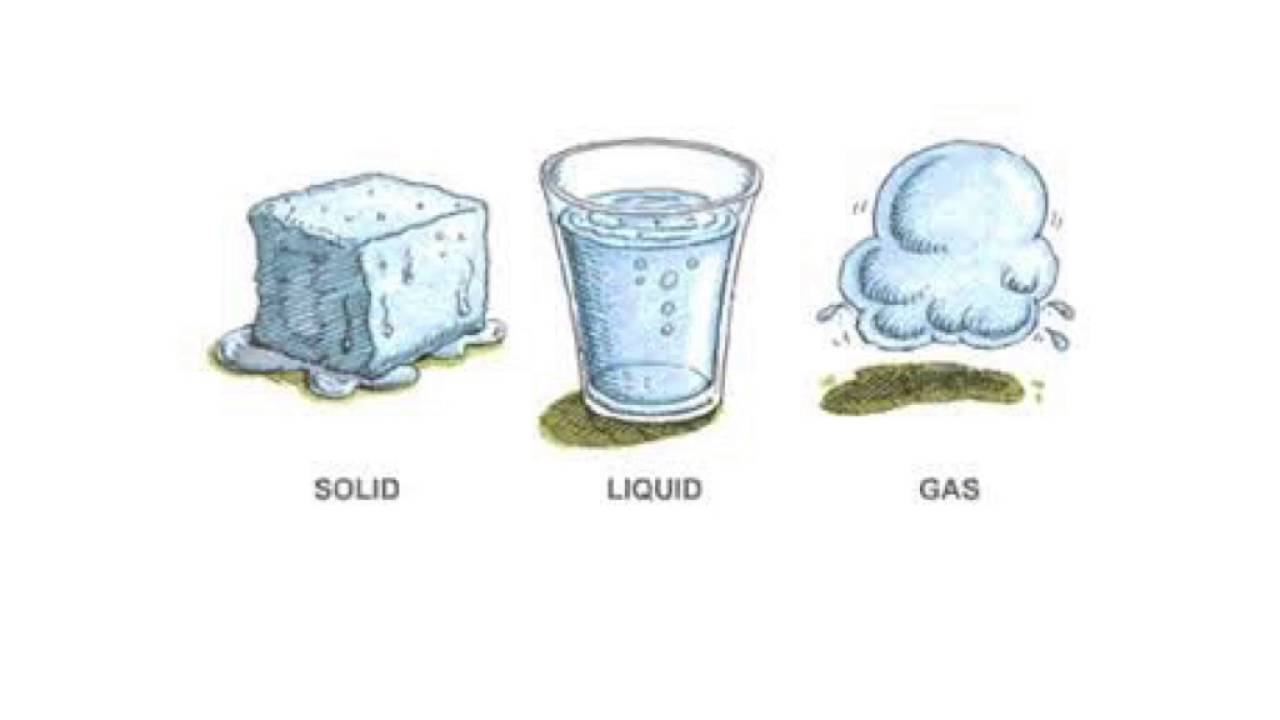 Поэтому плотность воды проходит через максимум при температуре 3,98оС (рис. 9).
Поэтому плотность воды проходит через максимум при температуре 3,98оС (рис. 9).
Рис. 9. Изменение плотности воды с температурой (dv/dt – изменение объема данного количества воды с температурой)
Благодаря аномалии в плотности лед плавает на воде. При замерзании на глубине водоемов сохраняется относительно теплая вода (не ниже 4оС), что позволяет существовать живым организмам.
По мере замерзания воды происходит увеличение ее объема (~10 %). Это может привести к нежелательным последствиям, например, к разрыву стальных труб, развитию трещин в скальных породах, разрушению стройматериалов. Наибольший вред приносит периодическое замораживание и оттаивание воды. Учитывая свойства воды, строительные материалы и сооружения из них защищают различными способами.
Необычным свойством льда является его пластичность. Примером проявления пластичности может служить течение горных ледников. Это свойство льда объясняется наличием в его структуре таких сечений, вдоль которых снежные слои кристалла оказываются слабее связанными водородными связями.
1.5. Физические свойства воды
Вода – прозрачная текучая жидкость, не имеющая в чистом виде вкуса, запаха, цвета. Синий цвет морей, озер обусловлен присутствием в воде тонко измельченных твердых веществ. Некоторые свойства воды используются для определения единиц измерения фундаментальных физических величин. Например, в основу стоградусной термометрической шкалы положен интервал между точками замерзания (0оС) и кипения (100оС) воды при давлении 101,3 кПа.
Плотность веществ сравнивают с плотностью воды, выбранной в качестве стандартной. Плотность чистой воды равна 1 г/см 3 при 3,98оС. Благодаря высокой теплоемкости воды 4,18 кДж/(г . град), она выполняет функции регулятора температуры на земном шаре. Вода медленно нагревается и медленно остывает. Поэтому, например, отсутствие воды в пустыне приводит к резким суточным колебаниям температуры (жара днем и холод ночью).
1.6. Химические свойства воды
Наличие неподеленных пар электронов и высокий дипольный момент воды придают ей химическую активность. Вода взаимодействует с большим количеством разнообразных веществ:
Вода взаимодействует с большим количеством разнообразных веществ:
1. С инертными газами. При пропускании инертных газов над переохлажденной водой под давлением 150 атм. образуются клатраты или соединения включения типа Ar * 6Н2О, Xе *6Н2О, Кr *6Н2О, устойчивые при низких температурах.
2. С галогенами. Реакции галогенов с водой зависят от окислительной активности галогенов. В ряду F2 – С12– Вr2– I2окислительные свойства уменьшаются, поэтому реакции взаимодействия с водой протекают следующим образом:
Н2О + F2=2НF + О (реакция протекает при обычной температуре)
Н2О + С12<=> НС1 + НС1О (система находится в равновесии)
Н2О + Вr2(I2) <=> НВr + НвrО (равновесие смещено в сторону исходных веществ)
2 Н2О + С12= 4 НС1 + О2(при нагревании)
3. С атомарным кислородом. Н2О + О = Н2О2
4. С фосфором. 6 Н2О +2Р =2НРО 3 + 5 Н2(давление, катализатор)
5. С углеродом и его соединениями. В промышленности эти реакции используются для получения водорода. Н2О (пар) + С (раскаленный) = СО + Н2(смесь СО + Н2– водяной газ) Н2О + СО = СО2+ Н2(катализатор – Fе, 450оС) Н2О + СН4 = СО + 3 Н2(1200 – 1400оС)
В промышленности эти реакции используются для получения водорода. Н2О (пар) + С (раскаленный) = СО + Н2(смесь СО + Н2– водяной газ) Н2О + СО = СО2+ Н2(катализатор – Fе, 450оС) Н2О + СН4 = СО + 3 Н2(1200 – 1400оС)
6. С металлами.
а) С s-элементами. Реакция протекает при обычных условиях (кроме магния, с которым реакция протекает при 100оС, и бериллия, покрытого прочной оксидной пленкой)2Н2О +2Nа =2NаОН + Н2
б) С металлами средней активности (Fе, Сd, Со, Ni т.д.) Н2О + Fе = FеО + 3Н2(при температуре красного каления)
в)С благородными металлами (Аg, Аu, Рt) и ртутью вода не взаимодействует.
7. С гидридами s-элементов. Н2О + NаН = NаОН + Н2
8. С основными и кислотными оксидами. Н2О + СаО = Са(ОН)2Н2О + SO 3 = Н2SО 4
9. С солями (гидролиз солей) СuС12+ Н2О <=> СuОНС1 + НС1 Сu 2+ + Н2О <=> СuОН + + Н +
10. С различными веществами с образованием гидратов Nа2СО 3 + 10 Н2О = Nа2СО 3 . 10 Н2О
10 Н2О
11. С органическими веществами (реакции гидратирования) С2Н 4 + Н2О = С2Н 5 ОН
Термическая устойчивость воды. Вода устойчива к нагреванию, но свыше 1000оС происходит ее термическая диссоциация.
2Н2О <=>2Н2+ О2
Каталитические свойства воды. Некоторые металлы не реагируют с сухим хлором, натрий не окисляется в атмосфере воздуха без следов влаги. Фтороводород в отсутствии влаги не разъедает стекло и т. д.
1.7. Вода в связанном состоянии
Формы состояния связанной воды довольно многообразны. Для строительных специальностей интерес представляют следующие формы: химически связанная вода, вода в кристаллогидратах, вода в гидрогелях, вода, адсорбированная на поверхности твердых тел и капиллярная вода. Рассмотрим более подробно состояния связанной воды без учета переходных форм.
1. Химически связанная вода. В такой форме вода не существует самостоятельно, но может выделиться в свободном виде Например, при нагревании гидроксида кальция происходит диссоциация по следующей схеме:
Са(ОН)2<=> СаО + Н2О
Это гетерогенная реакция с участием твердых веществ – Са(ОН)2, СаО и паров воды. Поэтому константа равновесия определяется концентрацией паров воды или их давлением К = С(Н2О) или К = Р(Н2О)
Поэтому константа равновесия определяется концентрацией паров воды или их давлением К = С(Н2О) или К = Р(Н2О)
Иными словами при любой температуре равновесное давление водяного пара является постоянной величиной и не зависит от количеств Са(ОН)2и СаО. Согласно принципу Ле-Шателье равновесие смещается в сторону прямой реакции как при повышении температуры (прямая реакция – эндотермическая), так и при уменьшении влажности воздуха. Зависимость давления диссоциации Са(ОН)2от температуры смещена в сторону высоких температур, что свидетельствует о больших затратах энергии для выделения водяного пара из Са(ОН)2, чем из свободной воды (рис. 10)
Рис. 10. Влияние температуры на давление диссоциации Са(ОН)2
Химически связанная вода содержится в большинстве вяжущих строительных материалов, во многих горных породах, а также в кислородсодержащих кислотах, основных и кислых солях.
2. Вода в кристаллогидратах. Вода, содержащаяся в кристаллогидратах называется кристаллизационной. Количество кристаллизационной воды влияет на устойчивость соединения. Кристаллогидрат с большим содержанием воды устойчив при низких температурах и разлагается при ее повышении, образуя менее гидратированные соединения. Например, при дегидратации гексагидрата хлорида кальция происходят следующие процессы:
Количество кристаллизационной воды влияет на устойчивость соединения. Кристаллогидрат с большим содержанием воды устойчив при низких температурах и разлагается при ее повышении, образуя менее гидратированные соединения. Например, при дегидратации гексагидрата хлорида кальция происходят следующие процессы:
В кристаллической решетке молекулы воды связаны и с анионами, и с катионами, кроме того они могут располагаться между слоями, одновременно взаимодействуя с двумя-тремя ионами. Так, слоистая структура двухводного гипса СаSО4 *2Н2О состоит из небольших по размеру катионов Са2+ и крупных анионов SО42-. Молекулы воды располагаются в этом «шахматном поле» через два слоя. С ионом Са2+ вода связывается через атом кислорода (донор), а через водород (акцептор) с кислородом, содержащимся в ионах SО42-.
В условиях высокой температуры устойчивы менее гидратированные или безводные соединения, поэтому при получении вяжущих материалов образуются именно такие формы. При обычной температуре идет гидратация вяжущих материалов в результате взаимодействия как с жидкой водой или водными растворами, так и с водяным паром. Этот процесс способствует образованию пластичной массы вяжущих материалов. Со временем вяжущие материалы превращаются в камневидное тело, твердеют, так как образуются кристаллогидраты (гипс, портландцемент и др.).
При обычной температуре идет гидратация вяжущих материалов в результате взаимодействия как с жидкой водой или водными растворами, так и с водяным паром. Этот процесс способствует образованию пластичной массы вяжущих материалов. Со временем вяжущие материалы превращаются в камневидное тело, твердеют, так как образуются кристаллогидраты (гипс, портландцемент и др.).
3. Вода в гидрогелях. Твердение вяжущих строительных материалов проходит через стадию образования геля – студнеобразной массы. Это полужидкое – полутвердое состояние. Дегидратация геля (его обезвоживание) происходит по-разному: при обычной температуре или при нагревании вода испаряется или вступает в химическое взаимодействие с другими веществами. При этом давление водяного пара над гелем по мере его обезвоживания понижается непрерывно. При одинаковом количестве воды в геле давление водяного пара зависит от его структуры, которая может измениться со временем.
По мере обезвоживания геля изменяются его свойства, пористость. Постепенно гель переходит в твердое камневидное тело с высокой прочностью. Некоторые гели обладают способностью разжижаться при механических воздействиях – перемешивании, вибрировании и т.п. Неоднократное обратимое разжижение геля называют тиксотропией. Процесс тиксотропии используют при твердении бетона.
Постепенно гель переходит в твердое камневидное тело с высокой прочностью. Некоторые гели обладают способностью разжижаться при механических воздействиях – перемешивании, вибрировании и т.п. Неоднократное обратимое разжижение геля называют тиксотропией. Процесс тиксотропии используют при твердении бетона.
4. Адсорбированная вода. Многие строительные материалы поглощают своей поверхностью влагу из окружающей среды, в первую очередь из воздуха. Это явление называют адсорбцией. Адсорбция зависит от химического состава, состояния поверхности и от внешних условий (температуры, влажности и т.д.).
Если молекулы воды вступают в химическое взаимодействие с веществами поверхности, то это способствует образованию прочных соединений – хемосорбция. Однако в таком процессе участвует лишь часть воды, так как он ограничен доступной частью поверхности. С помощью специальной обработки состояние поверхности твердого вещества можно изменить таким образом, что оно будет отличаться от внутренних слоев.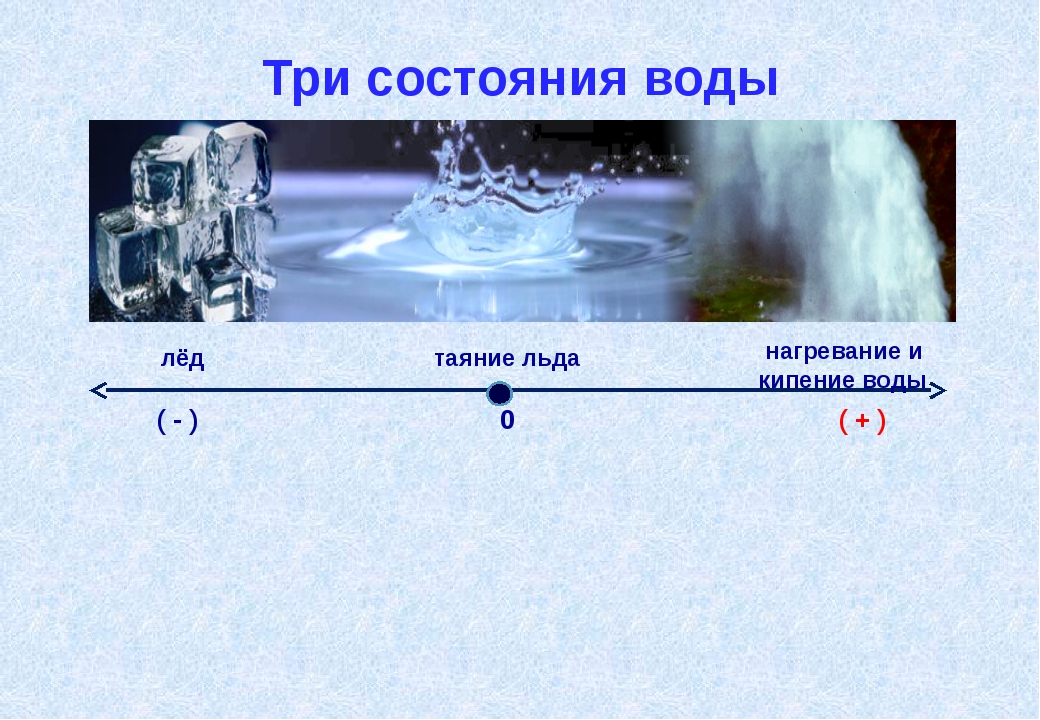 Это изменение называют химическим модифицированием. Вещества разделяют по отношению к воде на гидрофильные (хорошо смачиваются водой) и гидрофобные (не смачиваются водой) вещества. Соответствующая обработка строительных материалов изменяет их свойства по отношению к воде. С помощью химически модифицированных поверхностей уменьшают или увеличивают гидрофильность или гидрофобность поверхности строительной конструкции, что широко используется в строительной промышленности.
Это изменение называют химическим модифицированием. Вещества разделяют по отношению к воде на гидрофильные (хорошо смачиваются водой) и гидрофобные (не смачиваются водой) вещества. Соответствующая обработка строительных материалов изменяет их свойства по отношению к воде. С помощью химически модифицированных поверхностей уменьшают или увеличивают гидрофильность или гидрофобность поверхности строительной конструкции, что широко используется в строительной промышленности.
Под влиянием физических факторов вода непрочно адсорбируется поверхностью твердого вещества (физическая адсорбция). Поверхностные частицы твердого вещества (атомы, ионы, молекулы) притягивают подобные им частицы из окружающей среды, создавая силовое поле. Выход частиц из этого поля требует затраты энергии, т.е. «испарение» частиц с поверхности не является свободным. Так как поверхность твердого вещества неоднородна и имеет более или менее активные участки, по отношению к водяным парам, то при небольшой концентрации паров именно они участвуют в поглощении. Однако при повышении концентрации водяных паров оказываются задействованными и другие участки. Следовательно, повышение концентрации водяных паров в окружающей среде способствует увеличению количества адсорбированной воды, которое сильно различается для разных веществ.
Однако при повышении концентрации водяных паров оказываются задействованными и другие участки. Следовательно, повышение концентрации водяных паров в окружающей среде способствует увеличению количества адсорбированной воды, которое сильно различается для разных веществ.
Адсорбция – экзотермический процесс, поэтому с повышением температуры количество адсорбированной воды уменьшается. При хемосорбции влияние температуры может быть незначительным. Увеличение поверхности (внутренние поры, капилляры, повышение степени дисперсности) способствует увеличению количества адсорбированной воды, что следует учитывать при использовании строительных материалов.
5. Капиллярная вода. Жидкость, находящаяся в трубке, взаимодействует с ее поверхностью. В стеклянной трубке, опущенной одним концом в воду, столбик воды поднимается выше уровня воды в сосуде, образуя вогнутый мениск (рис. 11).
Рис.11. Стеклянная трубка, опущенная в воду (а) и ртуть(б)
Ртуть в таких же условиях опускается ниже своего уровня в сосуде, образуя выпуклый мениск. Это означает, что поверхность стекла смачивается водой и не смачивается ртутью. Чем меньше диаметр трубки, тем значительнее вышеописанный эффект. Различие уровней воды в трубке и сосуде означает, что давление ее насыщенного пара над этими поверхностями неодинаково. Давление пара над вогнутым мениском в капилляре, стенки которого смачиваются водой, меньше, чем над плоской поверхностью воды во внешнем сосуде. Это приводит к тому, что пар не конденсируется в жидкость на ее плоской поверхности, но конденсируется в капилляре, являясь насыщенным или пересыщенным по отношению к вогнутой поверхности мениска. Это явление называют капиллярной конденсацией, и оно возможно для любой жидкости. На практике роль капилляров могут выполнять поры разного размера и формы. Способность поверхности смачиваться той или иной жидкостью играет решающую роль в капиллярной конденсации.
Это означает, что поверхность стекла смачивается водой и не смачивается ртутью. Чем меньше диаметр трубки, тем значительнее вышеописанный эффект. Различие уровней воды в трубке и сосуде означает, что давление ее насыщенного пара над этими поверхностями неодинаково. Давление пара над вогнутым мениском в капилляре, стенки которого смачиваются водой, меньше, чем над плоской поверхностью воды во внешнем сосуде. Это приводит к тому, что пар не конденсируется в жидкость на ее плоской поверхности, но конденсируется в капилляре, являясь насыщенным или пересыщенным по отношению к вогнутой поверхности мениска. Это явление называют капиллярной конденсацией, и оно возможно для любой жидкости. На практике роль капилляров могут выполнять поры разного размера и формы. Способность поверхности смачиваться той или иной жидкостью играет решающую роль в капиллярной конденсации.
Перемещение влаги (миграция) в пористых и сыпучих материалах, грунте возможно за счет капиллярной конденсации. При этом в результате миграции система в естественных условиях переходит в более равновесное состояние. Внутри системы достигается одинаковое парциальное давление водяного пара. Если подвергнуть нагреванию часть системы, то происходит перенос конденсированной влаги в более холодные части системы.
Внутри системы достигается одинаковое парциальное давление водяного пара. Если подвергнуть нагреванию часть системы, то происходит перенос конденсированной влаги в более холодные части системы.
1.8. Замерзание воды и водных растворов в различных условиях
В строительстве необходимо учитывать климатические условия и зависимость от них процессов замерзания воды или таяния льда. Замерзание воды в порах строительных материалов при бетонировании, кирпичной кладке и т.п. влияет на их морозостойкость. Природная вода, содержащая различные примеси, при низких температурах ведет себя иначе, чем чистая вода, представляя собой растворы разбавленных электролитов. Следует учитывать и то, что большая часть воды в твердеющих вяжущих материалах находится в связанном состоянии и условия ее замерзания также отличаются от обычной воды.
В результате исследований было доказано, что часть воды в мерзлых грунтах при температуре более низкой, чем 0оС, находится в жидком состоянии, и при нагревании в области низких температур количество такой воды обратимо возрастает. Это свидетельствует о том, что в процессе участвует как свободная, так и связанная вода. В отличие от чистой воды кристаллизация природной воды происходит в некотором интервале низких температур, который может достигать несколько десятков градусов. Между различными формами состояния воды возможно достижение равновесия. Связанная вода обладает давлением равновесного пара (Р), но более низким давлением, чем давление насыщенного пара свободной воды (Р нас. ) при той же температуре. Поэтому температура, при которой связанная вода может находиться в равновесии со льдом, всегда ниже 0 о С (рис.12). Чем сильнее связана вода и, чем ниже поэтому давление равновесного с ней пара, тем ниже температура ее замерзания.
Это свидетельствует о том, что в процессе участвует как свободная, так и связанная вода. В отличие от чистой воды кристаллизация природной воды происходит в некотором интервале низких температур, который может достигать несколько десятков градусов. Между различными формами состояния воды возможно достижение равновесия. Связанная вода обладает давлением равновесного пара (Р), но более низким давлением, чем давление насыщенного пара свободной воды (Р нас. ) при той же температуре. Поэтому температура, при которой связанная вода может находиться в равновесии со льдом, всегда ниже 0 о С (рис.12). Чем сильнее связана вода и, чем ниже поэтому давление равновесного с ней пара, тем ниже температура ее замерзания.
Капиллярная вода обладает давлением пара Р, близким к Р нас. и замерзает почти при 0 о С в относительно широких капиллярах. В более узких капиллярах этот эффект еще заметнее. Можно утверждать, что чем больше отношение Р/Р нас. отличается от единицы, тем больше понижается температура замерзания воды. То же происходит и с адсорбированной водой. При этом следует учесть, что и капиллярная, и адсорбированная вода, находясь в жидком состоянии при температуре ниже 0 о С, является устойчивой равновесной системой и никакие «затравки» в виде льда не способствуют ее кристаллизации. Количество жидкой воды зависит от температуры, а также и от химического состава и структуры грунта. Вода находясь на расстоянии полмикрона от поверхности грунтовых частиц, является свободной и может замерзать и оттаивать почти при 0оС. Исследования показали, что образующаяся при твердении цемента вода в гидрогелях увеличивается в объеме при охлаждении в интервалах 5 – 8оС и –20 –50оС.
То же происходит и с адсорбированной водой. При этом следует учесть, что и капиллярная, и адсорбированная вода, находясь в жидком состоянии при температуре ниже 0 о С, является устойчивой равновесной системой и никакие «затравки» в виде льда не способствуют ее кристаллизации. Количество жидкой воды зависит от температуры, а также и от химического состава и структуры грунта. Вода находясь на расстоянии полмикрона от поверхности грунтовых частиц, является свободной и может замерзать и оттаивать почти при 0оС. Исследования показали, что образующаяся при твердении цемента вода в гидрогелях увеличивается в объеме при охлаждении в интервалах 5 – 8оС и –20 –50оС.
1.9. Показатели качества воды
Основными показателями качества воды различных источников являются: физические, химические, биологические и бактериологические. Физические показатели характеризуются как общесанитарные. К ним относятся:
- содержание взвешенных веществ (частиц песка, ила, планктона), которые определяются взвешиванием осадка после его выпаривания, мг/л;
- цветность (окраска) оценивается в условных единицах;
- вкус и запах (обуславливаются растворенными солями, газами, органическими соединениями) оцениваются в баллах (органолептически), либо по порогу разбавления.

Химические показатели условно делятся на пять групп:
1) Основные ионы. Наиболее распространены в природных водах анионы HCO – 3 , SO 4 2- , Cl – , CO 3 2- , HSiO – 3 и катионы Na + ,K + ,Ca 2+ , Mg 2+ , Fe 2+ , они составляют 90-95% от общего содержания ионов в воде. Содержание в воде растворимых солей кальция и магния характеризуют жесткость воды. Различают жесткость карбонатную (Са(НСО 3 )2, Mg(НСО3)2) и некарбонатную (СаSO 4 , MgSO 4 , CaCl2, MgCl2, Ca(NO3)2, Mg(NO 3 )2).
2) Растворенные газы : O2, CO2, h3S и др. Содержание кислорода в воде определяется поступлением его из воздуха и образованием в результате фотосинтеза. Растворимость кислорода зависит от температуры воды, и его концентрация в воде зимой меньше. СО2находится как в растворенном виде, так и в виде углекислоты. Основными источниками СО2являются процессы распада биохимических веществ. h3S бывает органического (продукт распада) и неорганического (растворение минеральных солей) происхождения.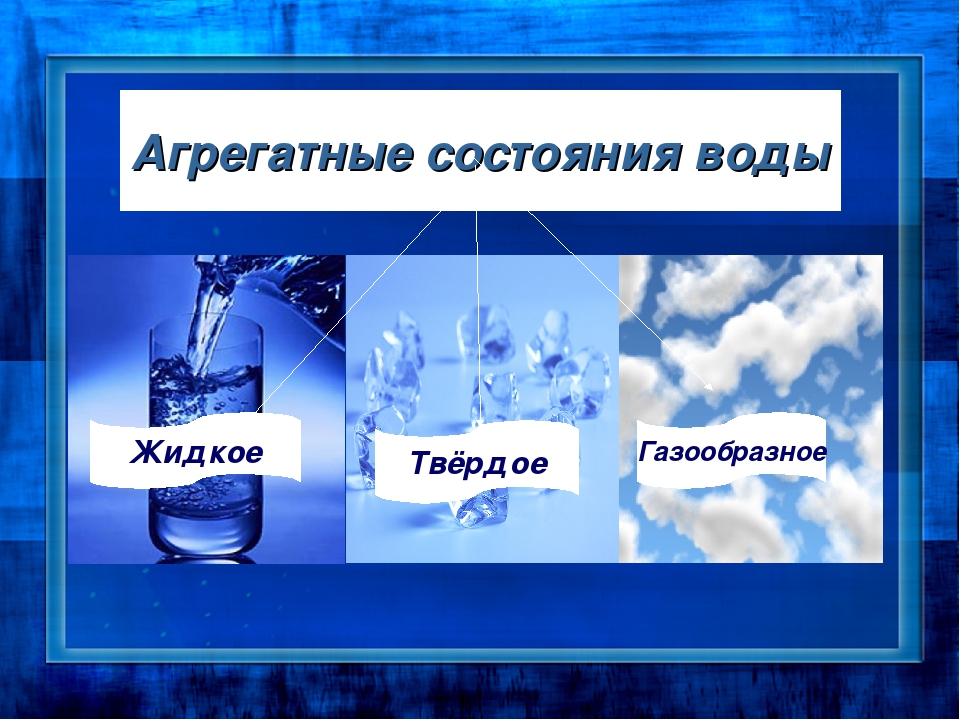 h3S придает воде неприятный запах и вызывает коррозию металла.
h3S придает воде неприятный запах и вызывает коррозию металла.
3) Биогенные вещества. К этой группе относятся необходимые для жизнедеятельности водных организмов и образующиеся в процессе обмена веществ соединения азота и фосфора.
4) Микроэлементы – элементы, содержание которых в воде менее 1 мг/л. Наиболее важные из них йод и фтор.
5) Органические вещества присутствуют в виде гуминовых соединений образующихся при разложении растительных остатков и органических соединений, поступающих со стоком. Их определяют показателями: ХПК (химическое потребление кислорода) и БПК (биологическое потребление кислорода). ХПК – это количество кислорода, которое идет на окисление органики химическим путем в присутствии катализатора (сульфата серебра или дихромата калия), мг/л. БПК – это количество кислорода, которое идет на окисление органики естественным путем (биологическое окисление веществ), мг/л.
К химическим показателям воды относится водородный показатель – рН.
Биологическими показателями качества воды являются гидробионты и гидрофлора. Гидробионты – обитатели от дна до поверхности. Гидрофлора – растительность макро- и микрофиты. Макрофиты – высшая форма растительности. Микрофиты – водоросли. При отмирании макрофитов вода обогащается органическими веществами, ухудшающими органолептические показатели. Микрофиты – продуцируют кислород.
Гидробионты – обитатели от дна до поверхности. Гидрофлора – растительность макро- и микрофиты. Макрофиты – высшая форма растительности. Микрофиты – водоросли. При отмирании макрофитов вода обогащается органическими веществами, ухудшающими органолептические показатели. Микрофиты – продуцируют кислород.
Бактериологические показатели – присутствие болезнетворных микроорганизмов (кишечной палочки). Содержание бактерий группы кишечной палочки в 1 литре воды определяет ее коли-индекс. наименьший объем воды (мл), приходящийся на 1 кишечную палочку называется коли-титром.
Природная вода, как правило, содержит различные примеси: грубодисперсные (песок, глина и т.д.) и коллоидные частицы, органического и минерального происхождения, растворимые и нерастворимые соединения, в том числе и соли. Для получения питьевой и технической воды, используемой в различных отраслях народного хозяйства, необходимо провести ее обработку. Процесс обработки воды обусловлен ее целевым назначением. Так питьевая вода должна соответствовать стандартным требованиям: полная безвредность, приятные органолептические свойства, бактериальная безопасность, жесткость не более 7 ммоль/л. К воде, применяемой для промышленных целей предъявляются менее жесткие требования.
Так питьевая вода должна соответствовать стандартным требованиям: полная безвредность, приятные органолептические свойства, бактериальная безопасность, жесткость не более 7 ммоль/л. К воде, применяемой для промышленных целей предъявляются менее жесткие требования.
Требования к качеству воды зависят от цели ее использования. В табл. 3 приведены требования к качеству питьевых вод.
Таблица 3 Требования, предъявляемые к качеству воды
Вещества и их свойства. Вода – методическая разработка для учителей, Апрелова Оксана Александровна
Работа с текстом в учебнике. Почему без воды не могут жить ни звери, ни птицы? Вода содержится во всех частях растений. Расскажите в группе своим одноклассникам, почему необходимо выпивать в день не менее 2 л воды.
– Чем отличается вода от куска дерева или камня? Вода жидкая, ее нельзя взять в руки и бросить на пол.
– Что нужно сделать, чтобы изменить форму твердого предмета? Можно расколоть его на части молотком, разрезать ножом или ударить обо что-нибудь.
– Что произойдет, если вы возьмете воду в руки? Она будет вытекать.
– Имеет ли какую-нибудь форму вода? Вода не имеет формы.
– Можно ли ее положить на стол? Что произойдет? Опыт в паре.
– Давайте нальем воду в стакан. Какую форму она приняла? Форму стакана.
– Нальем воду в баночку. Какую форму она приняла? Форму баночки.
– Что же такое вода? Жидкость.
Жидкости не имеют своей формы, а принимают форму сосуда, в котором находятся. Жидкости легко изменяют свою форму, растекаются. Поэтому их держат в сосудах: в бочках, ведрах, банках, бутылках, стаканах и других сосудах.
Назовите несколько известных вам жидкостей. Вода, молоко, сок.
Чем жидкость отличается от твердых тел? не имеет своей формы, растекается.
Давайте узнаем удивительные свойства воды.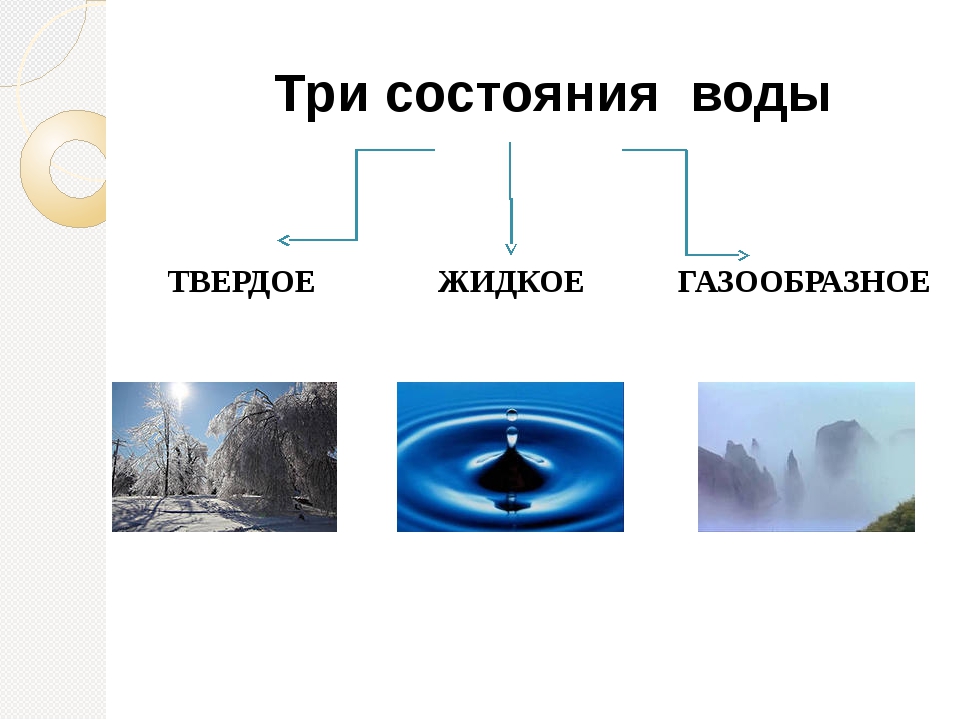
Посмотрите на аквариум с рыбками. Что можно сказать о воде? Что вы там видите?
– Как доказать, что вода прозрачная?
– Давайте проделаем опыт. У вас 2 пробирки. В одну мы наливаем воду, в другую молоко. В оба стакана опускаем ложки.
Что вы видите? Что можете сказать о воде и о молоке?
Молоко – белое, а вода – прозрачная.
– Как определить запах жидкости? Понюхать.
– Как правильно определить запах? Инструктаж учителя: На расстоянии 20–30 см от лица держать сосуд с жидкостью. Затем движениями руки направлять поток воздуха в свою сторону.
Почему необходимо так делать, а не совать нос во все емкости? Можно резким запахом обжечь носовую полость.
Имеет ли вода запах?
Как определить запах жидкости? Понюхать.
Как правильно определить запах? ответы детей: На расстоянии 20–30 см от лица держать сосуд с жидкостью.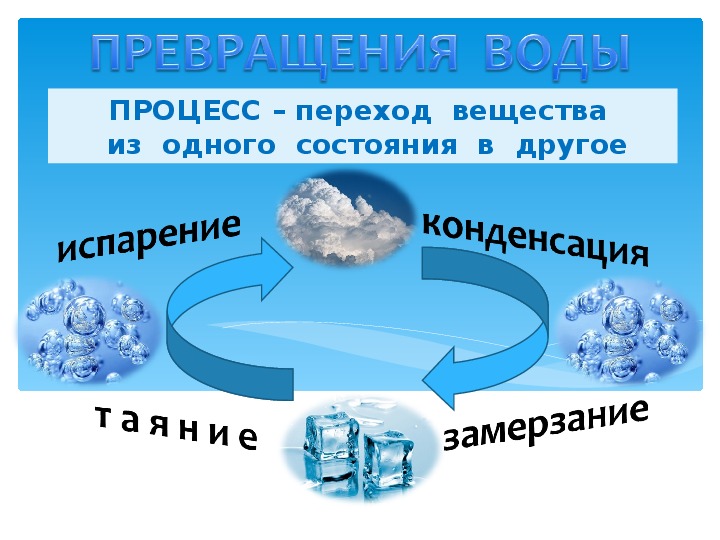 Затем движениями руки направлять поток воздуха в свою сторону. Почему необходимо так делать, а не совать нос во все емкости? Можно резким запахом обжечь носовую полость. Имеет ли вода запах? Она без запаха. Какой вкус у воды? Вода без вкуса.
Затем движениями руки направлять поток воздуха в свою сторону. Почему необходимо так делать, а не совать нос во все емкости? Можно резким запахом обжечь носовую полость. Имеет ли вода запах? Она без запаха. Какой вкус у воды? Вода без вкуса.
Энергетическое образование
1. Состояния вещества
Почти вся материя состоит из атомов, которые группируются в молекулы. Молекулы находятся в постоянном движении, и именно энергия их движения (кинетическая энергия) определяет состояние вещества — твердое, жидкое или газообразное. В твердом теле у молекул мало кинетической энергии, они колеблются вокруг фиксированных точек. Поэтому твердое тело сохраняет свою форму. Молекулы жидкости обладают достаточной энергией, чтобы преодолеть силу взаимного притяжения. Они могут перемещаться и, таким образом, изменять форму жидкости. Молекулы газа обладают большой кинетической энергией и практически свободны в своем движении.
Самыми распространенными являются следующие агрегатные состояния: твёрдое тело, жидкость, газ.
Плазма. Часто причисляемая к агрегатным состояниям вещества, плазма отличается от газа большой степенью ионизации атомов. Фазовым состоянием большей части барионного вещества (по массе ок. 99,9 %) во Вселенной является плазма.
Вода
Вода (оксид водорода) — прозрачная жидкость, не имеющая цвета (в малом объёме) и запаха. Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, лёд на полюсах).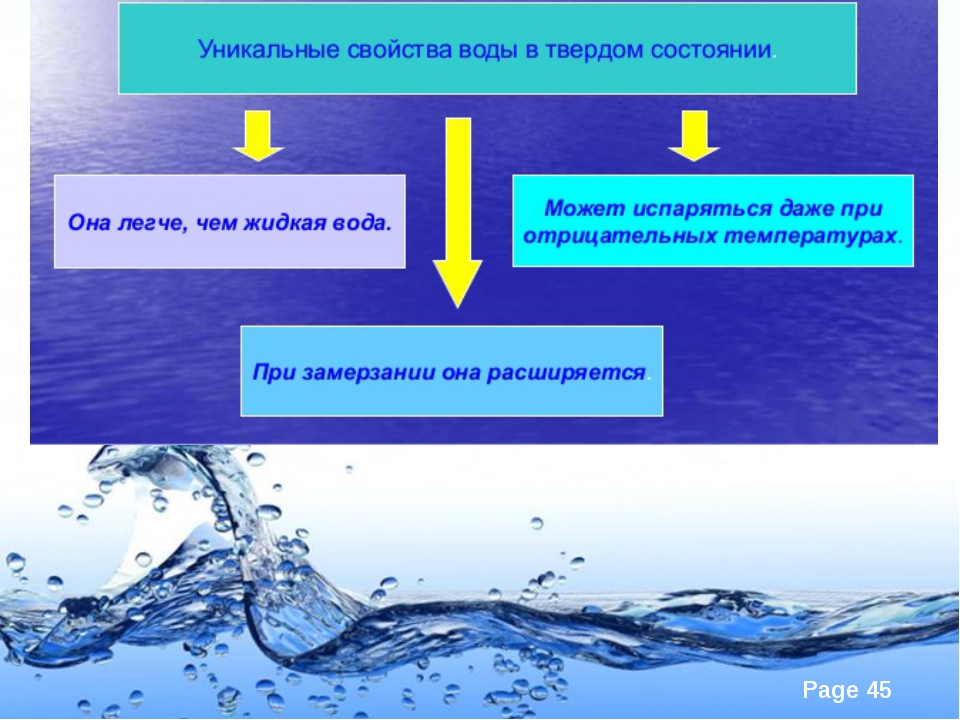
По состоянию различают: твёрдое — лёд, жидкое — вода, газообразное — водяной пар.
Около 71 % поверхности Земли покрыто водой.При атмосферном давлении вода замерзает (превращается в лёд) при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C. При снижении давления температура плавления воды медленно растёт, а температура кипения — падает. При давлении в 611.73 Па (около 0.006 атм) температура кипения и плавления совпадает и становится равной 0.01 °C. Такое давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар.
youtube.com/embed/j2KZmRIKea8″ allowfullscreen=»»/>
Вода — это древний универсальный символ чистоты, плодородия и источник самой жизни.
Источник жизни.70. Физические свойства воды. . Общая химия
Чистая вода представляет собой бесцветную прозрачную жидкость. Плотность воды при переходе ее из твердого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает. При нагревании воды от 0 до 4°C плотность ее также увеличивается.
— 198 —
При 4°C вода имеет максимальную плотность, и лишь при дальнейшем нагревании ее плотность уменьшается.
Если бы при понижении температуры и при переходе из жидкого состояния в твердое плотность воды изменялась так же, как это происходит у подавляющего большинства веществ, то при приближении зимы поверхностные слои природных вод охлаждались бы до 0°C и опускались на дно, освобождая место более теплым слоям, и так продолжалось бы до тех пор, пока вся масса водоема не приобрела бы температуру 0°C.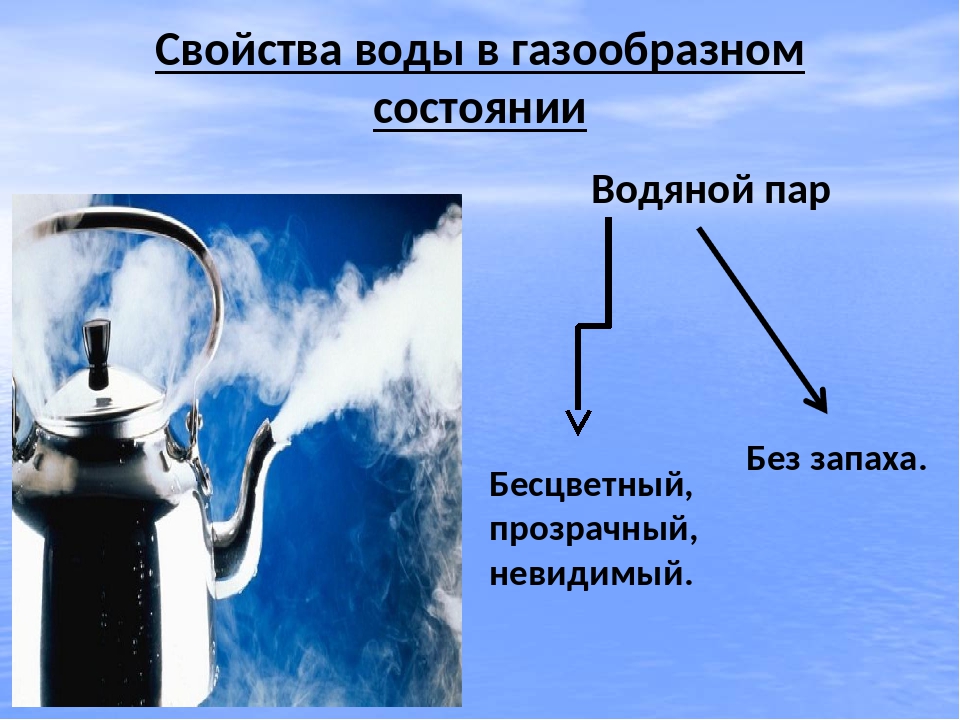 Далее вода начинала бы замерзать, образующиеся льдины погружались бы на дно и водоем промерзал бы на всю его глубину. При этом многие формы жизни в воде были бы невозможны. Но так как наибольшей плотности вода достигает при 4°C, то перемещение ее слоев, вызываемое охлаждением, заканчивается при достижении этой температуры, При дальнейшем понижении температуры охлажденный слой, обладающий меньшей плотностью, остается на поверхности, замерзает и тем самым защищает лежащие ниже слои от дальнейшего охлаждения и замерзания.
Далее вода начинала бы замерзать, образующиеся льдины погружались бы на дно и водоем промерзал бы на всю его глубину. При этом многие формы жизни в воде были бы невозможны. Но так как наибольшей плотности вода достигает при 4°C, то перемещение ее слоев, вызываемое охлаждением, заканчивается при достижении этой температуры, При дальнейшем понижении температуры охлажденный слой, обладающий меньшей плотностью, остается на поверхности, замерзает и тем самым защищает лежащие ниже слои от дальнейшего охлаждения и замерзания.
Большое значение в жизни природы имеет и тот факт, что вода обладает аномально высокой теплоемкостью [4.18 Дж/(г К)]*. Поэтому в ночное время, а также при переходе от лета к эиме вода остывает медленно, а днем или при переходе от зимы к лету так же медленно нагревается, являясь таким образом, регулятором температуры на земном шаре.
* Укажем для сравнения значения удельной теплоемкости некоторых веществ [ Дж/(г К)]: песок 0,79, известняк 0,88, хлорид натрия 0,88, глицерин 2,43, этиловый спирт 2,85
В связи с тем, что при плавлении льда объем, занимаемый водой, уменьшается, давление понижает температуру плавления льда. Это вытекает из принципа Ле Шателье. Действительно, пусть лед и жидкая вода находятся в равновесии при 0°C. При увеличении давления равновесие, согласно принципу Ле Шателье, сместится в сторону образования той фазы, которая при той же температуре занимает меньший объем. Этой фазой является в данном случае жидкость. Таким образом, возрастание давления при 0°C вызывает превращение льда в жидкость, а это и означает, что температура плавления льда снижается.
Это вытекает из принципа Ле Шателье. Действительно, пусть лед и жидкая вода находятся в равновесии при 0°C. При увеличении давления равновесие, согласно принципу Ле Шателье, сместится в сторону образования той фазы, которая при той же температуре занимает меньший объем. Этой фазой является в данном случае жидкость. Таким образом, возрастание давления при 0°C вызывает превращение льда в жидкость, а это и означает, что температура плавления льда снижается.
Молекула воды имеет угловое строение; входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине —ядро атома кислорода. Межъядерные расстояния O-H близки к 0,1 нм , расстояние между ядрами атомов водорода равно примерно 0,15 нм. Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды
Рис. 71. Схема строения молекулы воды.
— 199 —
Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды две электронные пары образуют ковалентные связи O-H, а остальные четыре электрона представляют собой две неподеленных электронных пары.
Как уже указывалось на стр. 132, атом кислорода в молекуле воды находится в состоянии sp3-гибридизации. Поэтому валентный угол НОН (104.3°) близок к тетраэдрическому (109.5°). Электроны, образующие связи O-H, смещены к более электроотрицательному атому кислорода. В результате атомы водорода приобретают эффективные положительные заряды, так что на этих атомах создаются два положительных полюса. Центры отрицательных зарядов неподеленных электронных пар атома кислорода, находящиеся на гибридных sp3-орбиталях, смещены относительно ядра атома и создают два отрицательных полюса (рис. 71).
Молекулярная масса парообразной воды равна 18 и отвечает ее простейшей формуле. Однако молекулярная масса жидкой воды, определяемая путем изучения ее растворов в других растворителях (см. § 80), оказывается более высокой. Это свидетельствует о том, что в жидкой воде происходит ассоциация молекул, т. е., соединение их в более сложные агрегаты. Такой вывод подтверждается и аномально высокими значениями температур плавления и кипения воды (см.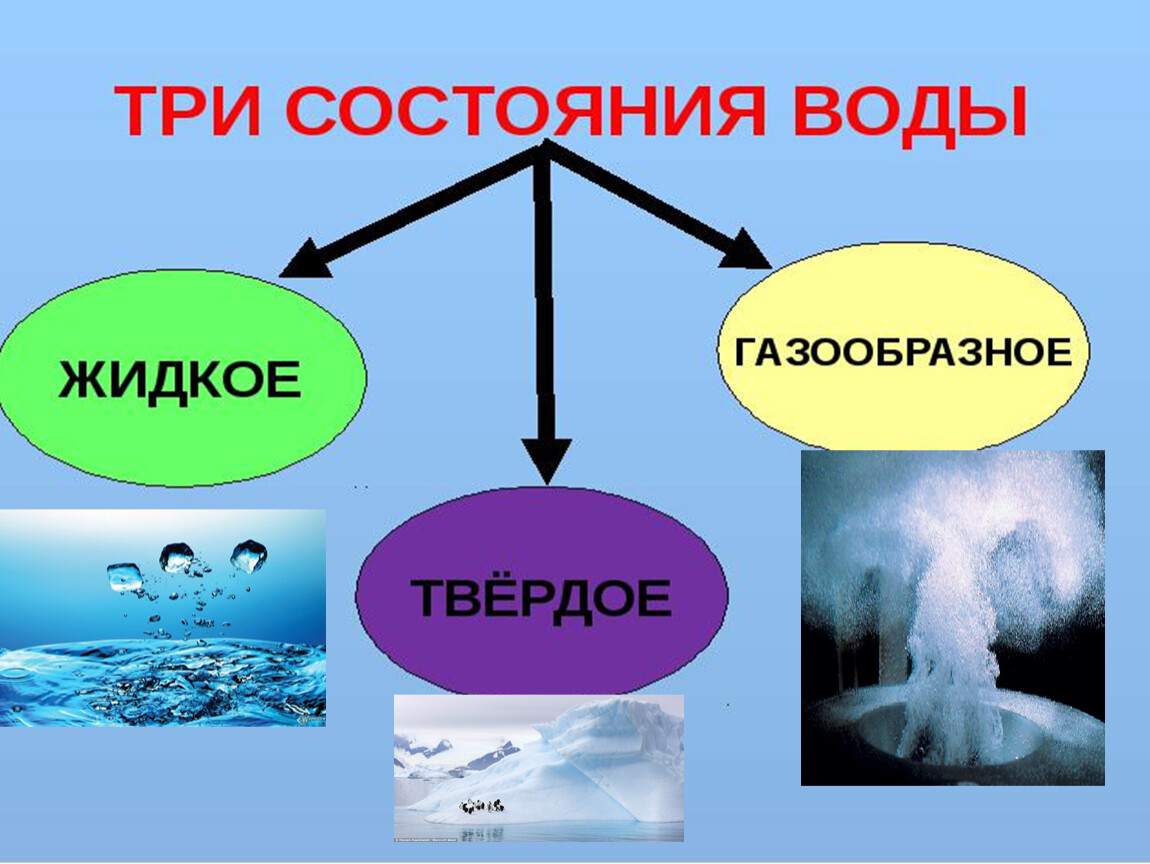 рис. 57 на стр. 148). Как уже говорилось в § 47, ассоциация молекул воды вызвана образованием между ними водородных связей.
рис. 57 на стр. 148). Как уже говорилось в § 47, ассоциация молекул воды вызвана образованием между ними водородных связей.
В твердой воде (лед) атом кислорода каждой молекулы участвует в образовании двух водородных связей с соседними молекулами воды согласно схеме
в которой водородные связи показаны пунктиром. Схема объемной структуры льда изображена на рис. 72. Образование водородных связей приводит к такому расположению молекул воды, при котором они соприкасаются друг с другом своими разноименными полюсами. Молекулы образуют слои, причем каждая из них связана с тремя молекулами, принадлежащими к тому же слою, и с одной — из соседнего слоя.
— 200 —
Структура льда принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры которых несколько превышают размеры молекулы H2O.
При плавлении льда его структура разрушается. Но и в жидкой воде сохраняются водородные связи между молекулами: образуются ассоциаты — как бы обломки структуры льда, — состоящие из большего или меньшего числа молекул воды. Однако в отличие от льда каждый ассоциат существует очень короткое время: постоянно происходит разрушение одних и образование других агрегатов. В пустотах таких «ледяных» агрегатов могут размещаться одиночные молекулы воды; при этом упаковка молекул воды становится более плотной. Именно поэтому при плавлении льда объем, занимаемый водой, уменьшается, а ее плотность возрастает.
Однако в отличие от льда каждый ассоциат существует очень короткое время: постоянно происходит разрушение одних и образование других агрегатов. В пустотах таких «ледяных» агрегатов могут размещаться одиночные молекулы воды; при этом упаковка молекул воды становится более плотной. Именно поэтому при плавлении льда объем, занимаемый водой, уменьшается, а ее плотность возрастает.
По мере нагревания воды обломков структуры льда в ней становится все меньше, что приводит к дальнейшему повышению плотности воды. В интервале температур от 0 до 4°C этот эффект преобладает над тепловым расширением, так что плотность воды продолжает возрастать. Однако при нагревании выше 4°C преобладает влияние усиления теплового движения молекул и плотность воды уменьшается. Поэтому при 4°C вода обладает максимальной плотностью.
При нагревании воды часть теплоты затрачивается на разрыв водородных связей (энергия разрыва водородной связи в воде составляет примерно 25 кДж/моль). Этим объясняется высокая теплоемкость воды.
Водородные связи между молекулами воды полностью разрываются только при переходе воды в пар.
(PDF) Физические, химические и биологические характеристики воды (модуль электронного содержания)
7
Водные ресурсы и управление
Физические, химические и биологические характеристики воды
2. Химические характеристики: pH, проводимость, соленость, жесткость , BOD,
3. Биологические характеристики: количество конкретных организмов и групп организмов
3.1 Физические характеристики:
Физические характеристики воды (температура, цвет, вкус, запах и т. Д.) определяются чувствами
осязания, зрения, запаха и вкуса. Например, температура на ощупь, цвет, плавающие частицы, мутность
и взвешенные твердые частицы на вид, а также вкус и запах по запаху.
3.1.2 Температура: Температура — это мера средней энергии (кинетической) молекул воды. Его
измеряется по линейной шкале в градусах Цельсия или Фаренгейта. Температура — это основная переменная качества воды
. Он определяет пригодность воды для различных форм водной флоры и фауны.В зависимости от географического местоположения
средняя годовая температура колеблется в диапазоне от 10 до 21 ° C, в среднем
— 16 ° C. Температура влияет на ряд параметров качества воды, таких как растворенный кислород, химическая характеристика которого составляет
. Растворимость кислорода в теплой воде меньше, чем в холодной. Температура также влияет на водную жизнь
, например, форель и лосось нуждаются в прохладной температуре для выживания и воспроизводства
, тогда как окунь и солнечная рыба лучше себя чувствуют при более высоких температурах.Температура в водоемах
в основном соответствует среднесуточной температуре воздуха. Он влияет на: количество кислорода, которое может быть растворено в воде
, скорость фотосинтеза водорослями и другими водными растениями, скорость метаболизма организмов, чувствительность
организмов к токсичным отходам, паразитам и болезням, а также время размножения, миграции,
и заселение водных организмов.
3.1.3 Цвет: Цвет воды в первую очередь влияет на качество воды по эстетическим причинам.Цветная вода
выглядит непригодной для питья, хотя она может быть совершенно безопасной для общественного пользования
. Цвет водоема может указывать на присутствие органических веществ, таких как водоросли или
гуминовых соединений. В последнее время цвет используется для количественной оценки присутствия
потенциально опасных или токсичных органических материалов в воде. Цвет имеет жизненно важное значение, поскольку большинство водопользователей, будь то
бытовых или промышленных, обычно предпочитают бесцветную воду.Определение цвета может помочь в оценке затрат
, связанных с обесцвечиванием воды. Цветность уменьшается или удаляется из воды за счет использования методов коагуляции, осаждения и фильтрации
Глава 5 Условия качества воды | Мониторинг и оценка
Обеспечение качества, контроль качества и меры оценки качества
Мониторинг качества воды определяется здесь как отбор проб и анализ компонентов и условий воды.Сюда могут входить:
- Внесенные загрязнители, такие как пестициды, металлы и нефть
- Природные компоненты воды, на которые, тем не менее, могут влиять человеческие источники, такие как растворенный кислород, бактерии и питательные вещества
На величину их воздействия могут влиять такие свойства, как pH и температура. Например, температура влияет на количество растворенного кислорода, которое может содержать вода, а pH влияет на токсичность аммиака.
Волонтеры, а также специалисты по качеству воды в штате и на местном уровне в течение многих лет следят за состоянием качества воды. Фактически, до последнего десятилетия или около того (когда протоколы биологического мониторинга были разработаны и начали применяться) мониторинг качества воды обычно считался основным способом выявления проблем загрязнения воды. Сегодня профессиональные специалисты по качеству воды и координаторы волонтерских программ в одинаковой мере движутся к подходам, сочетающим химические, физические и биологические методы мониторинга для получения наилучшей картины состояния качества воды.
Мониторинг качества воды можно использовать для многих целей:
- Для определения соответствия вод определенным видам использования. Все штаты установили особые критерии (ограничения на загрязняющие вещества), определяющие допустимые концентрации химических загрязнителей в их водах. Когда химические загрязнители превышают максимальные или минимально допустимые концентрации, воды могут больше не поддерживать полезные виды использования, такие как рыбная ловля, плавание и питье, для которых они предназначены.Назначенные виды использования и конкретные критерии, которые их защищают (наряду с заявлениями о предотвращении разложения, говорится, что вода не должна ухудшаться до уровня ниже существующего или ожидаемого) вместе образуют стандарты качества воды. Специалисты штата по качеству воды оценивают качество воды, сравнивая концентрации химических загрязнителей, обнаруженных в ручьях, с критериями, установленными в государственных стандартах, и таким образом оценивают, соответствуют ли водотоки установленным видам использования. Однако мониторинг качества воды может быть недостаточным для определения того, используются ли в ручье виды использования водной флоры и фауны.В то время как некоторые составляющие (например, растворенный кислород и температура) важны для поддержания здоровья популяций рыб и водных насекомых, другие факторы, такие как физическая структура ручья и состояние среды обитания, играют равную или большую роль. Методы биологического мониторинга (см. Главу 4), как правило, лучше подходят для определения того, поддерживается ли водная жизнь.
- Для определения конкретных загрязнителей и источников загрязнения. Мониторинг качества воды помогает связать источники загрязнения с проблемой качества водотока, поскольку он определяет конкретные проблемные загрязнители.Поскольку определенные виды деятельности имеют тенденцию генерировать определенные загрязнители (например, бактерии и питательные вещества, скорее всего, поступят с откормочной площадки для животных, чем с авторемонтной мастерской), может быть установлена предварительная связь, которая потребует дальнейшего исследования или мониторинга.
- Для определения тенденций. Химические составляющие, которые контролируются должным образом (т. Е. В постоянное время суток и на регулярной основе с использованием согласованных методов), могут быть проанализированы на предмет тенденций во времени.
- Для проверки на обесценение. Обнаружение чрезмерных уровней одного или нескольких химических компонентов может служить «экраном» раннего предупреждения о потенциальных проблемах загрязнения.
Первым шагом в разработке программы мониторинга качества воды является определение цели мониторинга. Это поможет вам выбрать, какие параметры отслеживать. Руководящий комитет программы должен принять это решение на основании таких факторов, как:
- Типы проблем с качеством воды и источников загрязнения, которые могут возникнуть (Таблица 5.1)
- Стоимость имеющегося оборудования для мониторинга
- Точность и достоверность имеющегося оборудования для мониторинга
- Возможности волонтеров
| Источник | Общие ассоциированные химические загрязнители | Таблица 5.1 Источники и сопутствующие загрязнители Программа добровольного мониторинга качества воды должна быть ориентирована на наиболее часто встречающиеся типы использования земель водосбора. |
| Пашня | Мутность, фосфор, нитраты, температура, общее содержание твердых веществ | |
| Лесозаготовка | Мутность, температура, общее содержание твердых веществ | |
| Пастбищные угодья | Фекальные бактерии, мутность, фосфор, нитраты, температура | |
| Промышленный сброс | Температура, проводимость, общее содержание твердых веществ, токсичные вещества, pH | |
| Горное дело | pH, щелочность, общее количество растворенных твердых веществ | |
| Септические системы | Фекальные бактерии (т.e., Escherichia coli, enterococcis), нитраты, фосфор, растворенный кислород / биохимическая потребность в кислороде, проводимость, температура | |
| Очистные сооружения | Растворенный кислород и биохимическая потребность в кислороде, мутность, проводимость, фосфор, нитраты, фекальные бактерии, температура, общее содержание твердых веществ, pH | |
| Строительство | Мутность, температура, растворенный кислород и биохимическая потребность в кислороде, общее содержание твердых и токсичных веществ | |
| Городской сток | Мутность, фосфор, нитраты, температура, проводимость, растворенный кислород и биохимическая потребность в кислороде |
Из-за затрат и трудностей добровольцы обычно не контролируют токсичные вещества, такие как тяжелые металлы и органические химические вещества (например,g., пестициды, гербициды, растворители и ПХД). Однако они могут собирать пробы воды для анализа в аккредитованных лабораториях.
Параметры, которые добровольцы чаще всего контролируют в потоках, подробно обсуждаются в этой главе. Они включают поток потока, растворенный кислород и биохимическую потребность в кислороде, температуру, pH, мутность, фосфор, нитраты, общее содержание твердых веществ, проводимость, общую щелочность и фекальные бактерии. Из них первые пять являются самыми основными и должны лечь в основу практически любой добровольной программы мониторинга качества воды.
Относительно недорогие и простые в использовании наборы для мониторинга этих загрязняющих веществ доступны в научных центрах снабжения. Многие волонтерские программы эффективно используют эти комплекты. Счетчики и сложное лабораторное оборудование могут быть более точными, но они также более дорогие, менее гибкие (например, счетчики обычно необходимо снимать в полевых условиях) и требуют периодической калибровки. В этой главе обсуждается конкретное оборудование и особенности отбора проб для каждого параметра, а также обычно описываются несколько подходов к их мониторингу.В таблице 5.2 перечислены методы, доступные для мониторинга ключевых параметров, включая предпочтительный участок тестирования (лаборатория или поле).
Общие правила подготовки и отбора пробВ следующих разделах подробно описаны особенности отбора проб и оборудования, а также аналитические процедуры для каждого из наиболее распространенных параметров качества воды. Однако есть две общие задачи, которые решаются каждый раз при отборе проб воды. Это обсуждается ниже.
Задача 1 Подготовка контейнеров для отбора проб
Повторно используемые контейнеры для проб и стеклянную посуду необходимо очистить и ополоснуть перед первым запуском отбора проб и после каждого цикла, следуя либо методу A, либо методу B, описанному ниже.Наиболее подходящий метод зависит от измеряемого параметра.
Метод A: Общая подготовка контейнеров для отбора проб
При подготовке всех контейнеров для проб и стеклянной посуды для контроля проводимости, общего содержания твердых веществ, мутности, pH и общей щелочности следует использовать следующий метод. Надевайте латексные перчатки!
- Вымойте каждую бутылку с образцом или стеклянную посуду с помощью щетки и моющего средства, не содержащего фосфатов.
- Трижды промыть холодной водой из-под крана.
- Трижды промыть дистиллированной или деионизированной водой.
Метод B: Процедура промывки кислотой для подготовки контейнеров для отбора проб
Этот метод следует использовать при подготовке всех контейнеров для проб и стеклянной посуды для контроля содержания нитратов и фосфора. Надевайте латексные перчатки!
- Вымойте каждую бутылку с образцом или стеклянную посуду с помощью щетки и моющего средства, не содержащего фосфатов.
- Трижды промыть холодной водой из-под крана.
- Промыть 10-процентной соляной кислотой.
- Трижды промыть деионизированной водой.
Задача 2 Сбор образцов
В общем, пробы вдали от стримбанка в основном течении. Никогда не отбирайте застоявшуюся воду. Внешний изгиб потока часто является хорошим местом для отбора проб, поскольку основное течение имеет тенденцию обнимать этот берег. На неглубоких участках осторожно пробирайтесь в центр потока, чтобы собрать образец.
Для глубоких участков потребуется лодка. Попробуйте направить лодку в центр основного течения, чтобы собрать пробу воды.
При отборе пробы воды для анализа в поле или в лаборатории выполните следующие действия.
Для мешков Whirl-pak®
- Наклейте на сумку номер, дату и время.
| Рисунок 5.1 Эскиз мешка Whirl-pak® Добровольцев можно легко обучить использованию этих одноразовых мешков для сбора проб воды с заводской запечаткой. |
- Оторвите верхнюю часть пакета по перфорации над проволочным ушком непосредственно перед взятием пробы (рис.5.1). Не прикасайтесь к внутренней части сумки. Если вы случайно дотронулись до внутренней части сумки, используйте другую.
- Брод. Постарайтесь как можно меньше взбалтывать донные отложения. В любом случае будьте осторожны, чтобы не собрать воду, содержащую донные отложения. Встаньте лицом вверх по течению. Возьмите образец воды перед собой.
Лодка. Осторожно потянитесь за борт и возьмите пробу воды с верхней стороны лодки. - Возьмитесь за два белых язычка в каждой руке и опустите сумку в воду со стороны входа вверх по течению так, чтобы отверстие было направлено вверх.Откройте сумку на полпути между поверхностью и дном, потянув за белые язычки. Мешок должен начать наполняться водой. Возможно, вам придется «зачерпнуть» воду в мешок, протягивая ее вверх по течению и от себя. Наполняйте мешок не более чем на 3/4!
- Выньте сумку из воды. Вылейте лишнюю воду. Потяните за проволочные петли, чтобы закрыть сумку. Продолжайте удерживать проволочные язычки и быстро переверните пакет как минимум 4-5 раз, чтобы запечатать его. Не пытайтесь выжать воздух из верхней части пакета.Сложите концы проволочных петель вместе в верхней части пакета, стараясь не проколоть пакет. Скрутите их вместе, образуя петлю.
- Впишите номер мешка и / или номер места в соответствующий полевой лист данных. Это важно! Это единственный способ узнать, какая сумка к какому участку подходит для координатора лаборатории.
- Если образцы должны быть проанализированы в лаборатории, поместите образец в холодильник со льдом или холодными пакетами. Отнесите все образцы в лабораторию.
Для бутылок с завинчивающейся крышкой
Для отбора проб воды из бутылей с завинчивающейся крышкой используйте следующие процедуры (Рис.5.2 и 5.3):
| Рисунок 5.2 Принятие позиции для взятия пробы воды Добровольцы должны брать пробы в почтовом течении, лицом вверх по течению. |
| 1. | 2. |
| 3. | 4. |
| Рисунок 5.3 Взятие пробы воды Включите бутылку в ток и черпайте вверх по потоку. | |
- Наклейте на бутылку номер места, дату и время.
- Снимите крышку с бутылки непосредственно перед взятием пробы. Не прикасайтесь к внутренней части бутылки или крышке. Если вы случайно дотронулись до внутренней части бутылки, воспользуйтесь другой.
- Брод. Постарайтесь как можно меньше взбалтывать донные отложения.В любом случае, будьте осторожны, чтобы не собрать воду с отложениями из-за волнения дна. Встаньте лицом вверх по течению. Соберите пробу воды перед собой на стороне выше по течению. Вы также можете прикрепить бутылку лентой к удлинителю для взятия пробы из более глубокой воды.
Лодка. Осторожно потянитесь за борт и возьмите пробу воды с верхней стороны лодки. - Держите бутылку возле дна и погрузите ее (открытием вниз) ниже поверхности воды. Если вы используете удлинитель, снимите крышку, переверните бутылку вверх дном и погрузите ее в воду лицевой стороной вверх.Соберите образец воды на глубине 8–12 дюймов ниже поверхности или на полпути между поверхностью и дном, если поток воды неглубокий.
- Поверните подводную бутылку против течения и от себя. В медленно движущихся ручьях протолкните бутылку под поверхностью и от себя в направлении вверх.
- Оставьте 1-дюймовый воздушный зазор (кроме образцов DO и BOD). Не наполняйте бутылку полностью (чтобы образец можно было встряхнуть непосредственно перед анализом). Тщательно закройте бутылку, не касаясь ее внутренней части.
- Впишите номер бутылки и / или номер участка в соответствующий полевой лист данных. Это важно, потому что это говорит координатору лаборатории, какая бутылка подходит к какому месту.
- Если образцы должны быть проанализированы в лаборатории, поместите их в холодильник для транспортировки в лабораторию.
Что такое качество воды?
Качество воды измеряется несколькими факторами, такими как концентрация растворенного кислорода, уровни бактерий, количество соли (или соленость) или количество взвешенного в воде материала (мутность).В некоторых водоемах для определения качества воды также может измеряться концентрация микроскопических водорослей и количество пестицидов, гербицидов, тяжелых металлов и других загрязнителей.
Несмотря на то, что для определения качества воды используются научные измерения, непросто сказать «вода хороша» или «вода плохая». Итак, определение обычно делается в зависимости от назначения воды — для питья, для мытья машины или для какой-то другой цели?
Плохое качество воды может представлять опасность для здоровья людей.Плохое качество воды также может представлять опасность для здоровья экосистем.
В Флорида-Кис хорошее качество воды имеет важное значение для здоровой морской экосистемы. Сообщества морских водорослей и коралловых рифов процветают в чистой воде с относительно низким содержанием питательных веществ. Слишком много питательных веществ в воде может вызвать чрезмерный рост водорослей, которые могут задушить кораллы и водоросли. Загрязняющие вещества, такие как металлы, масла, пестициды и удобрения, стекают с суши в воду, вызывая избыточный рост водорослей и другие вредные воздействия.
В Национальном морском заповеднике Флорида-Кис рекомендации по действиям по восстановлению и поддержанию условий качества воды, необходимых для поддержания здоровья популяций растений и животных, разрабатываются в рамках Программы защиты качества воды.
Есть вещи, которые вы можете сделать, чтобы предотвратить деградацию заповедных вод, например, поддержать и участвовать в передовых программах очистки сточных вод, которые удаляют нежелательные питательные вещества и вредные бактерии, используя «откачивающие» станции для санитарных устройств вашего судна, используя как можно больше «зеленых» продукты, насколько это возможно, в домашних условиях, а также сокращение или отказ от использования удобрений, гербицидов и пестицидов.
Дополнительные факты об океане и морском дне
Выбор площадки для аквакультуры: физические характеристики воды
Выбор площадки для аквакультуры: физические характеристики водыГЛАВА 8
ФИЗИЧЕСКИЕ ХАРАКТЕРИСТИКИ ВОДЫ
Информация о физических и химических характеристиках вода, в которой будет проводиться аквакультура, имеет первостепенное значение. важность при принятии решения о пригодности водного объекта для успешная культура.Эти характеристики будут сильно различаться в зависимости от типа водоема, например пруд, резервуар, озеро, выбран искусственный водохранилище, проточная вода или прибрежный водоем для культуры. Становится очевидным, что когда информация на доступны экологические характеристики водных объектов. правильно выбрать сайт можно было только имея информацию о допуске и оптимальных диапазонах этих характеристик для культивируемые виды.
Для каждого рассматриваемого экологического фактора организмы культурный имеет диапазон или зону, в пределах которых он может жить бесконечно, называется зоной допуска.Область за пределами этой зоны смертельная зона или зона сопротивления, в которой организм умрет в фиксированный период времени (время выживания или сопротивления), информация имеет большую ценность для аквакультуры, так как довольно часто во время резкие колебания такого фактора, как кислород или температура в летний день организм подвергается действию смертельного фактора на только на короткое время и емкость (продолжительность), в которой он может противостоять суровым условиям, решит его выживание.
Зона допуска дополнительно ограничена диапазонами факторы для оптимальной биологической активности, роста и воспроизводства наиболее важными, но, возможно, более важными являются диапазон для поведенческих действий, таких как кормление и плавание, (см. рис. 8.1)
Физические свойства воды кажутся идеальными для жизни, как в действительности они должны быть, поскольку именно среда формирует жизнь. Ранние ссылки на это обсуждение можно найти в Хатчинсона (1957), наиболее важной из которых является «Пригодность Окружающая среда »Л.Дж. Хендерсон (1913). Лед с меньшей плотностью плавает в воде с более высокой температурой. В водах, которые замерзают зимой, таким образом, плавучий лед обеспечивает защитное покрытие, позволяя нижняя вода должна быть теплее и живые существа выживают.
Рис. 1. Зоны и диапазоны толерантности (выживаемости) и других биологических функций, контролируемых фактор окружающей среды, такой как температура или pH. Горизонтальные двуглавые стрелки укажите диапазоны, а вертикальными стрелками — оптимальные диапазоны экологического фактора для конкретные биологические функции, такие как активность (например,Купание в рыбе), рост и размножение.
В природе существует лишь несколько неорганических жидкостей. Они есть вода, элементарная ртуть и жидкий CO 2 , очевидно, присутствуют при высоких давление в полостях кварцевого стекла. Другие природные жидкости: смеси углеводородов и нефтей. Особенность воды имеющий гораздо более высокие температуры плавления и кипения, при 0 и 100 ° C, как известно от того факта, что другие дигидриды, такие как сера, селен и теллур имеют АД ниже 0 ° C (как очевидно, для изучения и измерения тепла, вода служила в качестве основного объекта — шкала Цельсия устанавливается по температурам замерзания и кипения воды; мера тепла, Калорийность (большая или килограммовая) как необходимое тепло или энергия повысить температуру одного литра воды на 1 ° С; удельная теплоемкость воды единица).
В этой дискуссии о «Физических характеристиках воды» мы займитесь следующими аспектами в указанной последовательности, указав их важность и оптимальный диапазон для аквакультуры, насколько это возможно: Температура
Температурные изменения в малых водоемах
Температура рыбного пруда
Температурные соотношения крупных водоемов
Температурные соотношения культивируемых организмов
Контроль температуры в рыбоводных прудах
Состояние воды и глубина
Давление
Плотность
Вязкость
Свет, цвет и мутность
Движение воды
Волны
Токи
Приливы
Недвижимость на озере — окружающая среда и местное самоуправление
Как упоминалось ранее, озеро представляет собой сложную систему.Фактически, это экологическая система; сообщество животных, растений и микроорганизмов, которые взаимодействуют и зависят друг от друга и от окружающей среды, в которой они живут. Биологические свойства озера влияют на его здоровье и использование воды, а также на физические и химические характеристики.
Водоросли
Водоросли — это фотосинтезирующие организмы, обитающие в воде в виде отдельных микроскопических клеток или видимых колоний, и могут быть либо взвешены в воде, либо прикреплены к твердым поверхностям, таким как камни и бревна.Водоросли — важный живой компонент озер, и их присутствие обычно хорошо. Фотосинтезирующие водоросли и растения являются основными производителями или первыми преобразователями световой энергии и химической энергии питательных веществ в биологическую пищевую энергию в пищевой сети озера. В качестве основного продуцента водоросли составляют основу пищевой сети, и большая часть другой жизни в озере зависит от них в плане питания, производства кислорода и круговорота питательных веществ.
Водорослям для роста и размножения требуется свет, источник питательных веществ и определенный температурный диапазон.Из этих факторов, как правило, именно поступление питательных веществ, особенно фосфора, определяет количество роста водорослей в озере.
Водные растения
Как водоросли, водные растения играют жизненно важную роль в экологии озера. Они бывают разных форм и размеров и обеспечивают укрытие, среду обитания и пищу для водных организмов в озере. Водные растения имеют организованную структуру, такую как корни, стебли и листья, и их можно сгруппировать в четыре категории растений:
- Эмерджентные: Эти растения, примерно до колена, возвышаются над поверхностью воды, например, рогоз.
- Укорененные плавающие листья: До пояса или глубже это растения с листьями, которые лежат на поверхности воды или немного выше нее, например, водяные лилии.
- Под водой: от самых мелких озерных зон до нескольких метров глубиной, это растения, у которых все или большая часть их листьев и стеблей находится ниже поверхности воды, например, водоросли или тысячелистник.
- Свободно плавающие: это растения, которые можно найти на поверхности озера, плавающих в толще воды или лежащих на дне.У некоторых видов есть корни, свободно плавающие в воде, например, у ряски или водяного гиацинта.
Деструкторы
Разлагатели, включая бактерии, грибки и другие микроорганизмы, питаются остатками органических веществ, таких как мертвые водоросли, растения, насекомые и животные, которые спускаются из вод выше. При этом они разрушают или разлагают органическое вещество, возвращая его в неорганическое состояние и высвобождая обратно в воду некоторые из основных веществ, из которых состоит живой материал, например, питательные вещества фосфор и азот, которые затем становятся доступными для рост новых растений.
Когда уровень органического материала в озере чрезмерен, доступный растворенный кислород может потребляться и истощаться, поскольку разлагатели разрушают органический растительный и животный материал. Этот процесс может оказать негативное влияние на другие кислородзависимые водные организмы, такие как зоопланктон, рыбы и насекомые. Если уровень кислорода станет слишком низким, только несколько видов, устойчивых к условиям с низким содержанием кислорода, смогут разлагать органические вещества. Разложители, которым не нужен кислород, являются анаэробными бактериями, и хотя они полезны, они производят ядовитые газы в качестве побочного продукта своего метаболизма.
Как видите, озеро — это гораздо больше, чем кажется на первый взгляд. Физические, биологические и химические факторы, влияющие на работу озера, обеспечивают основу, необходимую для понимания озера, того, что может пойти не так и что мы можем с этим поделать.
Поскольку озеро подвергается этим химическим, физическим и биологическим процессам от сезона к сезону и из года в год, изменения за многие годы приводят к видимым признакам старения, которые можно увидеть во внешнем виде озера в целом. Это старение озерных систем более подробно описано на странице «Сукцессия озер и эвтрофикация».
Физические параметры качества воды / Физические характеристики воды
22 июля 2018 Гаураб Карки микробиология воды 0
- Это некоторые физические аспекты качества воды, которые помогают определить, загрязнена ли вода.
1. Цвет:
- Чистая вода бесцветна. Следовательно, появление любого цвета в воде указывает на ее загрязнение.
- Природная водная система часто окрашена посторонними веществами.Если цвет обусловлен взвешенным материалом, он называется видимым цветом. Цвет растворенного материала, который остается даже после удаления взвешенного материала, называется истинным цветом или настоящим цветом.
- Ориентировочное значение (максимально допустимый уровень) цветности питьевой воды составляет 15 TCU (единица истинного цвета).
2. Мутность:
- Чистая вода прозрачная и не поглощает свет. Следовательно, если в воде появляется помутнение, это свидетельствует о загрязнении воды.
- Мутность воды вызывается различными веществами, такими как взвешенные твердые вещества, растворенные материалы и микробиологические нагрузки.Обычно мутность увеличивается с увеличением количества этих материалов в воде. Однако разные материалы различаются по своей светопоглощающей способности.
- Некоторые материалы, которые придают мутность, могут быть токсичными для потребителей. Поэтому мутная вода не подходит для питья. Кроме того, помутнение снижает эффективность процесса дезинфекции.
- Материалы, которые придают мутность, обеспечивают место прикрепления токсичных химикатов.
- Мутность препятствует проникновению света в более глубокие слои естественной водной системы, что напрямую влияет на фотосинтезирующие организмы на дне.
- Питьевая вода должна иметь мутность менее 5 NTU (нафталометрическая единица мутности)
3. Вкус и запах:
- Чистая вода всегда без вкуса и запаха. Следовательно, если присутствуют какие-либо типы вкуса и запаха, это указывает на загрязнение воды.
- Вкус и запах воды могут появиться из-за природных или искусственных участков.
- Искусственная область вкуса и запаха в воде — результат процесса дезинфекции (хлорирования). Некоторые природные примеси, растворенные в воде, также могут придавать вкус и запах.
- Неорганические соли, такие как NaCl, KCl и т. Д., Растворяются в воде, придают вкус, тогда как такие соединения, как h3S, могут давать как вкус, так и запах.
- Соединения, придающие воде вкус и запах, могут быть токсичными для потребителя, поэтому питьевая вода должна быть без вкуса и запаха.
4. Температура:
- Температура не используется напрямую для оценки пригодности воды для питья.
- В естественной водной системе, такой как озеро и река, температура является очень важным физическим фактором, определяющим качество воды.При повышении температуры растворимость кислорода в воде снижается.
- Более того, повышение температуры увеличивает скорость роста водных микроорганизмов, поэтому они быстрее потребляют растворенный O2 и уровень растворенного O2 снижается.
- Точно так же температура влияет на процесс дезинфекции, потому что эффективность дезинфекции ниже при более низкой температуре.
5. Пена:
- Пена в воде из-за растворения в воде пенообразующих веществ, таких как моющие средства, мыло и т. Д.Пена считается опасной в естественной водной системе, поскольку она создает анаэробные условия.
- Некоторое пенообразующее вещество токсично для потребителей. Поэтому вода с пеной для питья не годится.
6. Электропроводность:
- Электропроводность воды в основном обусловлена наличием ионизируемых неорганических соединений.
- Чистая вода имеет очень низкую проводимость. Например, 1 мкм для дистиллированной воды. Следовательно, измерение проводимости показывает количество ионизируемых неорганических соединений в воде.
7. Всего растворенного твердого вещества:
- Если воду фильтруют для удаления взвешенного твердого вещества, оставшееся твердое вещество в воде указывает на общее количество растворенного твердого вещества.
- Растворенные твердые вещества могут быть органическими (отходы животных или растений) или неорганическими соединениями (карбонаты, сульфаты, бикарбонаты и т. Д.). Эти соединения дают различные эффекты, такие как твердость, вкус, запах и т. Д., В зависимости от природы растворенного твердого вещества.
- Если содержание растворенного в воде твердого вещества превышает 300 мг / л, это отрицательно влияет на живые организмы, а также на промышленные продукты.
Физические параметры качества воды / Физические характеристики воды
Качество воды | Международное десятилетие действий «Вода для жизни» 2005-2015 гг.
Качество воды
Качество любого массива поверхностных или грунтовых вод зависит как от природных, так и от антропогенных воздействий.Без человеческого влияния качество воды определялось бы выветриванием минералов коренных пород, атмосферными процессами эвапотранспирации и осаждением пыли и солей ветром, естественным вымыванием органических веществ и питательных веществ из почвы, гидрологическими факторами, которые приводят к сток и биологические процессы в водной среде, которые могут изменить физический и химический состав воды.
Обычно качество воды определяется путем сравнения физических и химических характеристик пробы воды с указаниями или стандартами качества воды. Руководящие принципы и стандарты качества питьевой воды предназначены для обеспечения чистой и безопасной воды для потребления людьми, тем самым защищая здоровье человека. Обычно они основаны на научно оцененных приемлемых уровнях токсичности для человека или водных организмов.
Снижение качества воды стало глобальной проблемой, вызывающей озабоченность, поскольку население растет, промышленная и сельскохозяйственная деятельность расширяется, а изменение климата угрожает вызвать серьезные изменения в гидрологическом цикле.
В глобальном масштабе наиболее распространенной проблемой качества воды является эвтрофикация в результате высокого содержания питательных веществ (в основном, фосфора и азота), что существенно ухудшает полезное использование воды. К основным источникам питательных веществ относятся стоки сельскохозяйственных культур, бытовые сточные воды (также являющиеся источником микробного загрязнения), промышленные сточные воды и атмосферные выбросы в результате сжигания ископаемого топлива и лесных пожаров. Озера и водохранилища особенно чувствительны к негативным воздействиям эвтрофикации из-за их сложной динамики, относительно более длительного времени пребывания в воде и их роли в качестве интегрирующего стока для загрязнителей из их водосборных бассейнов.Концентрации азота, превышающие 5 миллиграммов на литр воды, часто указывают на загрязнение от отходов жизнедеятельности людей и животных или стока удобрений с сельскохозяйственных угодий.
Возникающая проблема качества воды связана с воздействием средств личной гигиены и фармацевтических препаратов, таких как противозачаточные таблетки, обезболивающие и антибиотики, на водные экосистемы. Мало что известно об их долгосрочном воздействии на человека или экосистему, хотя считается, что некоторые из них имитируют естественные гормоны у людей и других видов.
Плохое качество воды напрямую влияет на количество воды по разным причинам. Загрязненная вода, которую нельзя использовать для питья, купания, промышленности или сельского хозяйства, эффективно снижает количество пригодной для использования воды в пределах данной территории.
Источники:
- Аналитическая записка по качеству воды. ООН-Вода, март 2011 г.
- Качество воды для экосистем и здоровья человека. 2-е издание. ЮНЕП, ERCE, ЮНЕСКО. 2008
- Отчет о развитии водных ресурсов в мире 3 «Вода в меняющемся мире».ПОВРМ, 2009 г.
- Vital Water Graphics. UNEP
Качество воды и ЦРТ
Управление качеством воды прямо и косвенно способствует достижению целей, поставленных во всех восьми Целях развития тысячелетия (ЦРТ), хотя оно наиболее тесно связано с конкретными задачами цели 7 по обеспечению экологической устойчивости. Индикаторы качества воды можно использовать для демонстрации прогресса в достижении целей путем построения графиков тенденций качества воды во времени и в пространстве.
Источник: Качество воды для экосистем и здоровье человека. 2-е издание. ЮНЕП, ERCE, ЮНЕСКО, 2008 г.
Что такое «загрязнение»?
Загрязнение обычно относится к химическим веществам или другим веществам в концентрациях, превышающих их концентрации в естественных условиях. Основные загрязнители воды включают микробы, питательные вещества, тяжелые металлы, органические химические вещества, нефть и отложения; тепло, повышающее температуру принимающей воды, также может быть загрязнителем.Загрязняющие вещества обычно являются причиной серьезного ухудшения качества воды во всем мире.
Источник: Отчет о мировом развитии водных ресурсов 3 «Вода в меняющемся мире»
Знаете ли вы?
- Ежедневно 2 миллиона тонн сточных вод и других стоков стекают в мировые воды.
- Ежегодно от небезопасной воды умирает больше людей, чем от всех форм насилия, включая войну
- Наиболее значительными источниками загрязнения воды являются недостаточная обработка отходов жизнедеятельности жизнедеятельности человека и ненадлежащее управление и обработка промышленных и сельскохозяйственных отходов
- Качество воды, необходимое для каждого использования человеком, различается, как и критерии, используемые для оценки качества воды.Например, для питьевой воды требуются самые высокие стандарты чистоты, тогда как допустимо, чтобы вода, используемая в некоторых промышленных процессах, была более низкого качества.
Инициативы ООН, которые помогают поднять этот вопрос …
- 2010: Всемирный день водных ресурсов «Чистая вода для здорового мира»
Всемирный день водных ресурсов проводится ежегодно 22 марта года как средство привлечения внимания к важности пресной воды и пропаганды устойчивого управления ресурсами пресной воды.Каждый год Всемирный день воды подчеркивает определенный аспект пресной воды. В 2010 году Всемирный день воды был посвящен теме качества воды. - Тематическая приоритетная область ООН-Вода по качеству воды
Тематическая приоритетная область ООН-Вода по качеству воды была создана в сентябре 2010 года для усиления межучрежденческого сотрудничества и координации по вопросам качества воды и поддержки правительств и других заинтересованных сторон в решении проблем качества воды. - Целевая группа ООН-Водные ресурсы по управлению сточными водами
Созданная в 2009 году Целевая группа ООН-Водные ресурсы по управлению сточными водами была создана для освещения вопросов, связанных с управлением сточными водами, повышения осведомленности правительств и укрепления сотрудничества системы ООН по деятельности, связанной с управлением сточными водами.
Дополнительная информация
Учет природного капитала и качества воды: обязательства, выгоды, потребности и прогресс
Экономика экосистем и биоразнообразия (TEEB). Декабрь 2013 г.
В этой информационной записке излагаются существующие руководства и примеры по учету качества воды. Вдохновленный растущим глобальным вниманием к учету естественного капитала, он определяет текущие проблемы, связанные с развитием учета природного капитала и учета качества воды, чтобы стимулировать обсуждение и приверженность эффективной политике в области водных ресурсов и биоразнообразия.
Стратегия качества воды и здоровья на 2013-2020 годы
Всемирная организация здравоохранения (ВОЗ). Январь 2013 г.
В этом документе изложена стратегия, принятая Всемирной организацией здравоохранения (ВОЗ) на период 2013-2020 гг. По управлению качеством воды с целью защиты и укрепления здоровья человека. Стратегия сосредоточена на первичной профилактике заболеваний, передаваемых через воду и воду. В документе представлена справочная информация о бремени болезней, связях с глобальными изменениями, подходе экономического риска и выгоды; основы политики ВОЗ, международные соглашения и стратегии; и руководящие принципы по продвижению эффективной политики и практики.
Меркурий. Время действовать
Программа Организации Объединенных Наций по окружающей среде (ЮНЕП). Январь 2013 г.
Этот отчет предназначен непосредственно для правительств, участвующих в разработке глобального договора по ртути. В нем представлены обновленные данные Глобальной оценки ртути ЮНЕП за 2013 год в виде фактов и цифр, подкрепленных графиками, которые дают правительствам и гражданскому обществу обоснование и необходимость действовать в отношении этого печально известного загрязнителя.
Глобальная оценка ртути, 2013 г.Источники, выбросы, выбросы и перенос в окружающей среде
Программа Организации Объединенных Наций по окружающей среде (ЮНЕП). Январь 2013 г.
В этом отчете представлена самая последняя доступная информация о мировых выбросах ртути в атмосферу, выбросах в водную среду, а также о переносе и судьбе ртути в глобальной окружающей среде. В отчете подчеркиваются выбросы в атмосферу в результате деятельности человека (антропогенной), но также включены выбросы в воду, поскольку водная среда является основным путем воздействия на людей и диких животных.Именно в водных системах неорганическая ртуть превращается в более токсичную форму, метилртуть, которая может накапливаться в рыбе и морских млекопитающих, потребляемых людьми.
Отходы животных, качество воды и здоровье человека
Всемирная организация здравоохранения (ВОЗ). Октябрь 2012 г.
В этой книге собрана соответствующая информация, связанная с пятью различными патогенами, о количестве фекалий домашних животных и птиц, сбрасываемых в окружающую среду, о судьбе и переносе фекальных отходов (и патогенов, которые они могут содержать), которые были сбрасываются в окружающую среду, воздействие фекальных отходов на человека, потенциальные последствия для здоровья, связанные с этими воздействиями, и вмешательства, которые ограничат воздействие на человека отходов животноводства.Он также касается мониторинга, обнаружения и управления этими явлениями.
Экспресс-оценка качества питьевой воды. Справочник по внедрению
Детский фонд Организации Объединенных Наций (ЮНИСЕФ), Всемирная организация здравоохранения (ВОЗ). Октябрь 2012 г.
Эта оценка исследует качество питьевой воды из «улучшенных» источников и была задумана для выяснения вопроса, в какой степени качество питьевой воды из «улучшенных» источников отклоняется от предположения о ее безопасности.Результаты в пяти пилотных странах показывают широкий диапазон условий, от полного соответствия Руководству ВОЗ по качеству питьевой воды до конкретных источников в данной стране, отвечающих стандартам только в 34% проб. В справочнике описаны методы и процедуры, применяемые ВОЗ и ЮНИСЕФ в пяти странах, для принятия любым органом или учреждением, которое хочет подготовить снимок качества «улучшенных» источников питьевой воды в качестве первого шага к укреплению питьевой воды. -регулирование качества воды.
Планирование безопасности воды для малых коммунальных систем водоснабжения. Пошаговое руководство по управлению рисками для источников питьевой воды в небольших общинах
Всемирная организация здравоохранения (ВОЗ). Июль 2012 г.
Это руководство предназначено для вовлечения, расширения возможностей и руководства сообществами в разработке и реализации планов обеспечения безопасности воды (ПОБВ) для их систем питьевого водоснабжения. Он предоставляет руководство о том, как применять эффективные и достижимые меры управления для повышения безопасности и качества подаваемой воды.Применительно ко всем системам, управляемым сообществом, он применим к схемам трубопроводов, точечным источникам, таким как ручные насосы, защищенным источникам или домашним системам сбора дождевой воды и другим источникам. Представленное руководство действительно как для новых, так и для существующих схем.
Фармацевтические препараты в питьевой воде
Всемирная организация здравоохранения (ВОЗ). Июнь 2012 г.
Данный технический отчет представляет собой практическое руководство и рекомендации в
решение проблем, связанных с фармацевтическими препаратами в питьевой воде, принимая во внимание
имеющиеся научные знания и доказательства.Он подчеркивает важность приоритета этого
возникающая проблема в общем контексте управления безопасностью воды, включая микробиологические
и другие химические риски, которые могут угрожать безопасности питьевой воды.
Руководство по качеству питьевой воды. 4-е издание
Всемирная организация здравоохранения (ВОЗ). Июль 2011 г.
Это 4-е издание Руководства Всемирной организации здравоохранения по качеству питьевой воды основано на более чем 50-летнем руководстве ВОЗ по качеству питьевой воды, которое сформировало авторитетную основу для установления национальных правил и стандартов безопасности воды. в поддержку общественного здоровья.Руководство адресовано в первую очередь регулирующим органам в области водоснабжения и здравоохранения, политикам и их советникам, чтобы помочь в разработке национальных стандартов. Это издание Руководства развивает концепции, подходы и информацию, представленную в предыдущих изданиях. Он рассматривает: безопасность питьевой воды, включая минимальные процедуры и конкретные нормативные значения, а также способы их использования; подходы, использованные при разработке Руководящих принципов, включая ориентировочные значения; микробные опасности, которые по-прежнему вызывают наибольшую озабоченность как в развивающихся, так и в развитых странах; изменение климата, которое приводит к изменению температуры воды и режима выпадения осадков, серьезной и продолжительной засухе или усилению наводнений, и его последствия для качества воды и нехватки воды, признавая важность управления этими воздействиями в рамках стратегий управления водными ресурсами; химические загрязнители в питьевой воде, включая информацию о химических веществах, которые ранее не рассматривались, таких как пестициды, используемые для борьбы с переносчиками болезней в питьевой воде; пересмотр существующих химических информационных бюллетеней с учетом новой научной информации; те ключевые химические вещества, которые вызывают крупномасштабные последствия для здоровья в результате воздействия питьевой воды, включая мышьяк, фторид, свинец, нитраты, селен и уран, обеспечивая руководство по определению местных приоритетов и управлению; важная роль множества различных заинтересованных сторон в обеспечении безопасности питьевой воды; руководство в ситуациях, отличных от традиционных коммунальных ресурсов или управляемых коммунальных услуг, таких как сбор дождевой воды и другие нетрубопроводные системы или системы с двумя трубами.
Аналитическая записка по качеству воды
ООН-Вода. Март 2011 г.
Эта аналитическая записка является совместным продуктом членов и партнеров системы «ООН-Водные ресурсы» и предназначена для практиков, политиков и лиц, принимающих решения в области управления водными ресурсами и других соответствующих секторов. В аналитической записке излагаются проблемы и тенденции, движущие силы и воздействия, связанные с качеством воды. В нем также представлены четыре стратегии, которые составляют основу политических решений.В заключение приводится ряд конкретных рекомендаций, с помощью которых могут быть достигнуты эти решения.
Читатель по качеству воды [- 244 КБ]
Программа ООН-Водные Десятилетия информационно-пропагандистской деятельности и коммуникации (UNW-DPAC). 2010
Этот ридер предназначен для всех, кто интересуется вопросами качества воды. Читатель предоставляет основные ссылки для удобства чтения и некоторые из последних и наиболее актуальных публикаций ООН по качеству воды.Он также содержит ссылки для конкретных аудиторий, таких как поставщики воды, преподаватели, фермеры или политики.
Больная вода. Центральная роль управления сточными водами в устойчивом развитии. Оценка быстрого реагирования
[- 5,93 МБ]
Программа Организации Объединенных Наций по окружающей среде (ЮНЕП), Программа Организации Объединенных Наций по населенным пунктам (ООН-Хабитат). 2010
В этом отчете определены основные угрозы для здоровья человека и окружающей среды, а также последствия неэффективного управления сточными водами и деградации канализационных систем.Он также предоставляет возможности, когда соответствующие политические и управленческие меры в краткосрочной и долгосрочной перспективе могут стимулировать занятость, поддерживать средства к существованию, улучшать здоровье населения и экосистем и способствовать более разумному управлению водными ресурсами.
Очистка вод: в центре внимания решения для повышения качества воды
[- 5,24 МБ]
Программа Организации Объединенных Наций по окружающей среде (ЮНЕП). 2010
Эта публикация обращается к срочности контроля загрязнения и сохранения качества воды во всем мире.Качество воды влияет на здоровье человека, количество воды, средства к существованию, экономическую деятельность и изменение климата. Новые загрязнители, рост населения и урбанизация создают дополнительные проблемы для качества воды. Эта публикация дает количественную оценку этих проблем, связанных с качеством воды, и использует тематические исследования, чтобы проиллюстрировать как проблемы, так и решения.
Руководящие принципы ВОЗ по качеству питьевой воды
Всемирная организация здравоохранения (ВОЗ)
Всемирная организация здравоохранения разрабатывает международные нормы качества воды и здоровья человека в форме руководящих принципов, которые используются в качестве основы для регулирования и установления стандартов в развивающиеся и развитые страны мира.
Руководство по плану обеспечения безопасности воды: пошаговое управление рисками для поставщиков питьевой воды
Всемирная организация здравоохранения (ВОЗ). 2009
В 2004 г. Руководство ВОЗ по качеству питьевой воды рекомендовало поставщикам воды разработать и внедрить «Планы безопасности воды» (ПОБВ) для систематической оценки рисков и управления ими. С этого времени правительства и регулирующие органы, поставщики воды и специалисты-практики все чаще используют этот подход, но они также запросили дополнительные указания.Настоящее учебное пособие отвечает на этот призыв, описывая, как разработать и внедрить ПОБВ в ясных и практических терминах. Пошаговые советы представлены в 11 обучающих модулях, каждый из которых представляет собой ключевой шаг в процессе разработки и внедрения ПОБВ.
Качество воды для экосистем и здоровья человека. 2-е издание
[- 3,12 МБ]
Программа Организации Объединенных Наций по окружающей среде (ЮНЕП), ERCE, Организация Объединенных Наций по вопросам образования, науки и культуры (ЮНЕСКО).2008
На основе примеров со всего мира в данной публикации представлены оценки текущего состояния и тенденций качества воды. Он также представляет собой введение в широкий спектр глобальных проблем качества воды, включая подходы к их выявлению, анализу и разрешению.
Более безопасная вода, лучшее здоровье — Стоимость, преимущества и устойчивость мероприятий по защите и укреплению здоровья [- 2,62 МБ]
Всемирная организация здравоохранения (ВОЗ).2008
В этом документе обобщены данные и информация, относящиеся к воде и здоровью в широком смысле, включая питьевое водоснабжение, санитарию, гигиену, а также развитие и управление водными ресурсами. В отчете собраны компоненты, поддерживающие политические решения, а именно: бремя болезней, которое стоит на кону, эффективность вмешательств, их стоимость и влияние, а также последствия для финансирования. В нем представлен обзор текущих знаний о воздействии на здоровье по странам и болезням, а также о том, что помогло снизить это бремя.
Справочник ЮНИСЕФ по качеству воды [- 1 МБ]
Детский фонд Организации Объединенных Наций (ЮНИСЕФ). 2008
Это руководство представляет собой введение во все аспекты качества воды с особым акцентом на областях, наиболее актуальных для специалистов, работающих в развивающихся странах. Он охватывает последствия плохого качества воды, мониторинг качества, защиту водоснабжения, методы улучшения качества воды, а также повышение осведомленности и потенциала, связанных с качеством воды.Наконец, в справочнике есть обширный набор ссылок на основные справочные материалы и ресурсы по качеству воды.
Меры по обеспечению качества воды для предотвращения диареи: стоимость и рентабельность
[- 406 KB]
Всемирная организация здравоохранения (ВОЗ). 2008
В этом документе проводится обзор эффективности мероприятий по обеспечению качества воды для предотвращения диареи. Анализ основан на информации о затратах из 28 страновых программ и рассчитывает рентабельность обычных улучшений качества воды в источнике (колодец, скважина, коммунальные стояки) и четырех мероприятий по улучшению качества воды на уровне домохозяйств (хлорирование, фильтрация). , солнечная дезинфекция и комбинированная флокуляция / дезинфекция).Затем он использует методологию обобщенного анализа экономической эффективности (CEA), разработанную ВОЗ в рамках ее проекта CHOICE, чтобы оценить экономическую эффективность этих мероприятий в 10 эпидемиологических субрегионах ВОЗ с более низкими уровнями улучшенного охвата услугами водоснабжения и санитарии.
Прогноз качества воды [- 1,40 МБ]
Программа ООН по окружающей среде (ЮНЕП), GEMS / Water, Программа ООН по оценке водных ресурсов мира (WWAP). 2007
В этом отчете представлен обзор глобальных проблем качества воды, связанных с достижением согласованных на международном уровне целей в области воды, санитарии и биоразнообразия.Факты свидетельствуют о том, что в некоторых частях мира произошло улучшение качества воды. Однако существуют серьезные проблемы, которые необходимо решать для всеобщего достижения здоровья и процветания.
Отчет о развитии глобального индекса качества питьевой воды и анализе чувствительности [- 2,46 МБ]
Программа ООН по окружающей среде (ЮНЕП), GEMS / Water. 2007
В этом документе описывается подход, принятый для разработки глобального индекса качества воды, а также предварительный анализ чувствительности и проверка индекса по сравнению с реальными данными о качестве воды.Обсуждаются ограничения индекса и дальнейшие шаги.
Защита подземных вод для здоровья. Управление качеством источников питьевой воды
Всемирная организация здравоохранения (ВОЗ). 2006
В этой публикации представлен структурированный подход к анализу опасностей для качества подземных вод, оценке рисков, которые они могут вызвать при конкретном водоснабжении, установлению приоритетов в их устранении и разработке стратегий управления для их контроля.Таким образом, для специалистов здравоохранения это инструмент доступа к экологической информации, необходимой для такого процесса, а для специалистов из других секторов — это отправная точка для понимания аспектов управления подземными водами, связанных со здоровьем.
Планы обеспечения безопасности воды: управление качеством питьевой воды от водосбора до потребителя
[- 1,22 MB]
Всемирная организация здравоохранения (ВОЗ). 2005
В этом документе описывается подход, основанный на плане обеспечения безопасности воды, и дальнейшее обоснование приводится в ряде сопутствующих томов, касающихся защиты источников, процессов очистки (на уровне водоснабжения и домашних хозяйств), распределения питьевой воды и выбора параметров и аналитических методов.Он предназначен для практиков всех уровней. Это особенно актуально для менеджеров по качеству воды, регулирующих органов (включая тех, кто отвечает за составление инструкций по интерпретации), аудиторов, консультантов и международных организаций.
Инвентаризация загрязнения подземных вод. Методическое руководство [- 7,66 МБ]
Организация Объединенных Наций по вопросам образования, науки и культуры (ЮНЕСКО). 2002
Общая цель этого документа — представить методологию инвентаризации загрязнения подземных вод и предоставить руководство для планирования, проведения, оценки и представления инвентаризации.Руководство предназначено для профессионалов — как руководство или справочный материал для гидрогеологов или других специалистов, ответственных за организацию и проведение инвентаризации загрязнения подземных вод, особенно в развивающихся странах.
Качество воды — Руководящие принципы, стандарты и здоровье: Оценка рисков и управление рисками инфекционных заболеваний, связанных с водой
Всемирная организация здравоохранения (ВОЗ). 2001
На сегодняшний день различные руководства ВОЗ, касающиеся воды, разработаны изолированно друг от друга.Потенциал повышения согласованности подходов к оценке и регулированию микробных опасностей, связанных с водой, обсуждался международной группой экспертов в период с 1999 по 2001 год. Эти обсуждения привели к разработке согласованной структуры, которая должна была информировать процесс разработки руководящие принципы и стандарты. Впоследствии последовательно разрабатывалась и уточнялась серия обзоров, в которых рассматривались основные вызывающие озабоченность вопросы, связанные с увязкой воды и здоровья с созданием и внедрением эффективных, доступных и действенных руководств и стандартов.Эта книга основана на этих обзорах, а также на обсуждениях согласованной структуры и связанных с ней проблем.
Контроль загрязнения воды [- 3,99 МБ]
Программа Организации Объединенных Наций по окружающей среде (ЮНЕП), Всемирная организация здравоохранения (ВОЗ), Совет по сотрудничеству в области водоснабжения и санитарии (WSSCC). 1997
В этом справочнике рассматриваются конкретные аспекты управления водными ресурсами и борьбы с загрязнением воды.Также включен ряд тематических исследований из различных регионов, освещающих успешные модели управления сточными водами и контроля загрязнения из разных частей мира. Это руководство для политиков и менеджеров по охране окружающей среды в органах водоснабжения и инженерных компаниях, участвующих в программах по обеспечению качества воды, особенно в развивающихся странах. Он также подходит для использования в качестве учебника или учебного материала для курса управления качеством воды.
>> Получите доступ к последним публикациям по качеству воды в Документационном центре ООН по воде и санитарии
Качество воды во всем мире
Африка
Экологическая оценка Огониленда
Резюме
Программа Организации Объединенных Наций по окружающей среде (ЮНЕП).Август 2011 г.
Огониленд является местом деятельности нефтяной промышленности с конца 1950-х годов. Огониленд имеет трагическую историю загрязнения в результате разливов нефти и пожаров на нефтяных скважинах, хотя систематической научной информации о последующем загрязнении не было. Экологическая оценка Огониленда охватывает загрязненные земли, грунтовые воды, поверхностные воды, отложения, растительность, загрязнение воздуха, общественное здравоохранение, отраслевую практику и институциональные вопросы. Этот отчет представляет собой лучшее доступное понимание того, что произошло с окружающей средой Огониленда — и соответствующих последствий для затронутого населения — и предоставляет четкие оперативные рекомендации относительно того, как можно решить эту проблему.
Оценка городского загрязнения поверхностных и подземных водоносных горизонтов в Африке [- 314 KB]
Программа Организации Объединенных Наций по окружающей среде (ЮНЕП), Организация Объединенных Наций по вопросам образования, науки и культуры Организация Объединенных Наций по вопросам образования, науки и культуры (ЮНЕСКО). 2002
Городское загрязнение поверхностных и подземных водоносных горизонтов в Африке — это совместный проект ЮНЕП и ЮНЕСКО, направленный на решение проблемы уязвимости водоносных горизонтов и необходимости защиты качества ресурсов подземных вод континента.В этом отчете представлены результаты оценки этого проекта.
Азия
Оценка улучшения качества воды в Китае. Пример озера Пужехэй в провинции Юньнань
Всемирный банк. Август 2011 г.
В этом документе сообщается об исследовании экономической оценки, проведенном в провинции Юньнань, Китай, целью которого является оценка общей стоимости реального инвестиционного проекта по улучшению качества воды в озере Пужхэй.В озере, расположенном в уезде Цюбэй, далеко от крупных городов, в последние годы наблюдается быстрое ухудшение качества воды. Это исследование также демонстрирует, что предыдущие знания об изменениях качества воды и проекте могут оказать значительное положительное влияние на оценку людей.
Европа
Рекомендации правительствам стран ЕЭК по критериям и целям качества воды
[- 86.

