чем можно ей помочь – Наука
Кости составляют основу опорно-двигательного аппарата. Под прочной защитой костей находятся ценные структуры организма — костный мозг, в котором в течение всей жизни идет образование всех клеток крови и иммунитета, а также головной и спинной мозг, осуществляющие регуляцию всех функций организма.
Фото: flickr.com / Yussef
Фото: flickr.com / Yussef
Долгая эволюция создала совершенный механизм образования костной ткани в нашем организме — механизм остеогенеза. Он обеспечивает как ее постоянное обновление (физиологическую регенерацию или так называемое ремоделирование), так и восстановление после травм (репаративную регенерацию).
Кость формально можно назвать композиционным материалом, в состав которого входят органические вещества (основной белок-коллаген) и неорганические вещества (основные соли — кальция и фосфора). Два главных вида клеток — разрушающие кость (остеокласты) и формирующие кость (остеобласты) — трудятся в течение всей нашей жизни, обеспечивая обновление костной ткани и ее восстановление после травм.
Биоминерализацию белков могли осуществлять организмы уже более 600 млн лет назад. Раковины моллюсков, иглы морского ежа, наружный скелет членистоногих — результат этого процесса. Процесс биоминерализации коллагена при образовании костной ткани (то есть инкрустация его солями кальция, фосфора и некоторыми микроэлементами) эволюционно древний, с одной стороны, а с другой — находящийся под контролем нервной и гуморальной (через кровь с помощью биологически активных веществ и гормонов) систем. Кроме того, в костной ткани и костном мозге находится глубокий резерв организма — центральное депо стволовых клеток, замещающих в течение жизни состарившиеся или погибшие клетки во многих органах и тканях.
Изучение механизмов и процессов остеогенеза постепенно привело к пониманию того, какие материалы и конструкты на их основе нужно разрабатывать, чтобы осуществлять органотипическое (то есть с формированием типичного для этого органа структур) замещение костных дефектов. Этот подход называется биомиметическим.
Когда же может понадобиться помощь регенерационным процессам в костной ткани, если они такие совершенные, эволюционно древние? Есть такие ситуации. Во-первых, это так называемые костные дефекты, превосходящие по размерам критические, костные дефекты у пожилых людей с нарушениями кальциевого обмена и, наконец, костные дефекты у онкологических больных после химио- или лучевой терапии, когда регенерация затруднена.
То есть такие материалы востребованы при реконструктивно-пластических операциях в травматологии, челюстно-лицевой хирургии, стоматологии и, конечно, в онкологии.
Сегодня опухоли костей и метастазы в костную ткань не приговор. Их удаляют, замещая дефекты остеопластическими материалами. Полнота реабилитации у этой категории больных напрямую зависит от успехов в медицинском материаловедении.
История создания остеопластических биоматериалов насчитывает более 60 лет. Первое поколение таких материалов составляли биоинертные материалы, второе — биоактивные, биодеградируемые, третье — материалы для стимулирования специфических клеточных ответов на молекулярном уровне.
Золотым стандартом, тем не менее, остается использование аутологичной (собственной) костной ткани. Однако необходимость дополнительного оперативного вмешательства и недостаточное количество материала для закрытия крупных дефектов привели к идее использовать аллогенную (другого организма) костную ткань. Но при этом появилась опасность переноса от донора неидентифицированных инфекционных, а также аллергизирующих агентов. Материаловеды предложили использовать для этих целей синтетические кальций-фосфатные материалы, близкие по составу к неорганической составляющей костной ткани. Они широко применяются и сегодня, так как биосовместимы, обладают остеоиндуктивными (стимулирующими остеогенез) свойствами и используются клетками для построения новой кости. Однако оказалось, что они растворяются медленнее, чем образуется кость.
Неожиданный толчок в развитии биоматериалов дало изучение скелета кораллов. Он состоит из карбоната кальция, имеет особо прочную кристаллическую решетку-арагонит, сквозную пористость (что обеспечивает поток питательных веществ, газов, прорастание сосудов) и скорость биорезорбции сходную со скоростью остеогенеза. Он оказался блестящим материалом природного происхождения для замещения костных дефектов. Однако добыча кораллов ограниченна, и трудно стандартизировать их микроэлементный состав. Это привело к идее трехмерной печати для создания конструктов с целью замещения костных дефектов заданной формы, пористости и архитектоники поверхности, используя в качестве «чернил» кальций-фосфатные материалы.
Он оказался блестящим материалом природного происхождения для замещения костных дефектов. Однако добыча кораллов ограниченна, и трудно стандартизировать их микроэлементный состав. Это привело к идее трехмерной печати для создания конструктов с целью замещения костных дефектов заданной формы, пористости и архитектоники поверхности, используя в качестве «чернил» кальций-фосфатные материалы.
Следующим этапом развития этого направления стала 3D-печать композиционных конструктов, содержащих как натуральную кость, так и органическую составляющую. В качестве таковой используют полимеры как природного (коллаген, альгинат, хитозан), так и синтетического происхождения. Еще более стимулировать остеогенез удалось при насыщении таких конструктов собственными стволовыми клетками из костного мозга, что открыло возможности изготовления персонализированных имплантатов заданной геометрии, пористости и архитектоники.
И, наконец, современные исследования в этой области посвящены разработке технологий функционализации таких 3D-конструктов биологически активными веществами (например, для пожилых людей или при крупных дефектах), антибиотиками (при открытых костных травмах, опасности инфицирования и развития воспалительных процессов) или противоопухолевыми препаратами.
Наталья Сергеева, доктор биологических наук, профессор, завлабораторией МНИОИ им. П. А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России
Гормоны и остеопороз | Ширалиев
Остеопороз и его осложнения — переломы костей — представляют значительную медико-социальную проблему. Ежегодно вследствие остеопороза возникают переломы костей у 1,3 млн американцев и у 40 тыс. канадцев [12, 37]. Во Франции каждая вторая, а в Австралии каждая пятая женщина в возрасте около 70 лет страдает от переломов, вызванных остеопорозом [2, 35]. Возникновение остеопороза в пожилом возрасте у женщин обусловлено’ ■уменьшением ‘ выработки эстрогенов [6]. Однако снижение минеральной плотности кости происходит не только с возрастом, но еще в большей степени при всех состояниях, приводящих к изменению баланса гормонов гипоталамо-гипофизарной системы, щитовидной и паращитовидных желез, надпочечников.
В связи с изложенным целью настоящей работы явилось обобщение данных литературы о влиянии гормонов на возникновение и развитие остеопороза.
Костная ткань — это динамичная метаболически активная система. В зависимости от выполняемой функции различают кортикальную и трабекулярную кость. Первая составляет три четверти всей скелетной массы, формирует диафизы трубчатых костей, имеет малую порозность, выполняет функцию опоры для мягких тканей и передачи мышечного сокращения из одной части тела в другую. Трабекулярная костная ткань составляет одну четвертую часть массы скелета, формирует кости аксиального скелета и эпифизы трубчатых костей, имеет высокую порозность и обеспечивает нормальную жизнедеятельность костного мозга. Для этого в трабекулярных костях имеются полости размером от 500 до 1000 мкм, расположенные между костными пластинками толщиной 100—150 мкм [42].
Основу жизнедеятельности костной ткани составляет функционирование двух видов клеток: остеокластов, резорбирующих кость, и остеобластов, ответственных за ее образование. Родоначальники этих клеток до конца не выяснены, хотя наиболее вероятными для остеокластов считаются гемопоэтические клетки моноциты-макрофаги, а для остеобластов — клетки стромы, из которых возникают преостеобласты [40].
Родоначальники этих клеток до конца не выяснены, хотя наиболее вероятными для остеокластов считаются гемопоэтические клетки моноциты-макрофаги, а для остеобластов — клетки стромы, из которых возникают преостеобласты [40].
В течение жизни происходит постоянное обновление костей, проявляющееся в рассасывании отдельных, очень маленьких участков ткани, с почти одновременным формированием новой кости. Этот процесс имеет огромное эволюционное значение, так как позволяет удалять возникающие в процессе жизнедеятельности микротравмы и микротрещины костей. Ежегодно 25 % массы трабекулярных костей и лишь 2—3 % кортикальных — обновляются [49].
Процесс ремоделирования кости делится на пять фаз [42]. В здоровом взрослом организме в состоянии покоя находится до 80 % трабекулярной и 95 % кортикальной костной ткани. Фаза активации, возникающая в каждом участке кости с интервалом 2—3 года, включает в себя пролиферацию и активацию предшественников остеокластов в гемопоэтической ткани, поступление и прикрепление мультиядерных остеокластов к поверхности резорбируемого участка. Следующая фаза — резорбция кости — продолжается приблизительно 1—3 нед. На клеточном уровне этот процесс заключается в расплавлении неорганического матрикса кости с последующей деградацией органического, что происходит с обязательным поступлением в участки резорбции ионов водорода и лизосомальных энзимов остеокластов [3, 56]. Переходная фаза длится 1 — 2 нед. В это время в резорбированной полости появляются остеобласты в результате как деления клеток, так и поступления из других участков. Новообразование кости начинается с откладывания остеобластами костного матрикса со скоростью 2—3 мкм в день, который через 5—10 дней минерализуется. Процесс костеобразования длится около 3 мес, а полный цикл обновления кости в каждом участке занимает 4—8 мес [22]. Следует отметить, что интимные механизмы этого процесса и его контроля остаются неизвестными.
Следующая фаза — резорбция кости — продолжается приблизительно 1—3 нед. На клеточном уровне этот процесс заключается в расплавлении неорганического матрикса кости с последующей деградацией органического, что происходит с обязательным поступлением в участки резорбции ионов водорода и лизосомальных энзимов остеокластов [3, 56]. Переходная фаза длится 1 — 2 нед. В это время в резорбированной полости появляются остеобласты в результате как деления клеток, так и поступления из других участков. Новообразование кости начинается с откладывания остеобластами костного матрикса со скоростью 2—3 мкм в день, который через 5—10 дней минерализуется. Процесс костеобразования длится около 3 мес, а полный цикл обновления кости в каждом участке занимает 4—8 мес [22]. Следует отметить, что интимные механизмы этого процесса и его контроля остаются неизвестными.
На основании физиологических процессов костного ремоделирования было предложено несколько возможных вариантов возникновения остеопороза [13]. Во-первых, во всех обновляющихся точках кости резорбирующая активность остеокластов больше костеобразующих возможностей остеобластов; во-вторых, резкое увеличение количества обновляющихся участков по всему скелету приводит к общей резорбции кости, так как длительность фазы резорбции короче фазы формирования новой кости.
Во-первых, во всех обновляющихся точках кости резорбирующая активность остеокластов больше костеобразующих возможностей остеобластов; во-вторых, резкое увеличение количества обновляющихся участков по всему скелету приводит к общей резорбции кости, так как длительность фазы резорбции короче фазы формирования новой кости.
В патогенезе развития остеопороза оба этих механизма имеют место. Так, при остеопорозе, возникающем сначала в метаболически более активной трабекулярной ткани, уменьшаются количество и толщина пластинок, полости, находящиеся между пластинами, увеличиваются за счет перфораций последних. Эти изменения обусловлены нарушением баланса между глубиной резорбированных полостей и толщиной вновь возникающих пластинок [43].
Одним из наиболее активных гормонов, влияющих на процессы обновления кости, является паратиреоидный гормон (ПТГ). Основная его функция заключается в поддержании в организме гомеостаза кальция. Уменьшение концентрации кальция в плазме приводит к выбросу паращитовидными железами гормона, который, воздействуя на почки, увеличивает реабсорбцию кальция в канальцах и экскрецию фосфатов, а на уровне костной ткани вызывает ее резорбцию и выход кальция во внеклеточную жидкость [10].
Уже через 30 мин после введения ПТГ количество и активность остеокластов увеличиваются. Однако эта реакция не наблюдается при воздействии ПТГ на изолированные остеокласты, а происходит лишь при добавлении к ним остеобластов. Дальнейшие исследования показали, что остеобласты и их предшественники имеют на своей поверхностной мембране рецепторы к ПТГ [53], в то время как на остеокластах таких рецепторов не обнаружено. На основании полученных результатов было предположено [47] существование связи между ПТГ-активными остеобластами и ПТГ-нечувствитель- ными остеокластами. Оказалось, что остеобласты являются основным звеном, запускающим и контролирующим резорбцию кости. Под воздействием ПТГ наблюдается пролиферация остеобластов, морфологически они из округлой формы приобретают звездообразную, происходит деполяризация мембраны и изменяется ферментативная активность, ингибируется синтез коллагена, остеокальцина и щелочной фосфатазы, увеличивается синтез коллагеназы. С целью стимуляции остеокластов к резорбции остеобласты выделяют водорастворимый фактор размером 0,5—2,0 кД, который блокируется ингибиторами липоксигеназы [31]. Внутриклеточные механизмы влияния ПТГ на остеобласты заключаются в резком увеличении концентрации кальция внутри клеток, что в свою очередь приводит к увеличению фосфорилирования белков стимуляцией протеинкиназы С. Выявлена положительная корреляция между способностью ПТГ увеличивать концентрацию кальция в остеобластах и возможностью последних вызывать резорбцию кости [22].
Внутриклеточные механизмы влияния ПТГ на остеобласты заключаются в резком увеличении концентрации кальция внутри клеток, что в свою очередь приводит к увеличению фосфорилирования белков стимуляцией протеинкиназы С. Выявлена положительная корреляция между способностью ПТГ увеличивать концентрацию кальция в остеобластах и возможностью последних вызывать резорбцию кости [22].
Указанные изменения возникают при повышении концентрации ПТГ в плазме. В то же время практически невозможно объяснить стимулирующее действие малых доз ПТГ на костеобразование [21].
У женщин в период постменопаузы отмечается отрицательный баланс кальция, хотя его концентрация в плазме повышается и снижается до нормального уровня при заместительной гормональной терапии [41]. Противоречивые результаты получены при исследовании ПТГ в постменопаузе. В раннем периоде концентрация ПТГ несколько снижается, через 3 года после наступления не меняется или незначительно повышается, а при проведении эстрогенотерапии уровень ПТГ возвращается к исходным показателям [34]. У больных с переломами позвонков, вызванных остеопорозом, выявлено снижение концентрации ПТГ, однако при переломах шейки бедра каких-либо его изменений не обнаружено.
У больных с переломами позвонков, вызванных остеопорозом, выявлено снижение концентрации ПТГ, однако при переломах шейки бедра каких-либо его изменений не обнаружено.
Антагонистом ПТГ является кальцитонин (КТ). Уже через несколько минут после добавления КТ к культуре остеокластов отмечается уменьшение количества ядер в них, а затем и общего количества, значительно снижается подвижность и их резорбционная способность, они покидают поверхность кости. Такая быстрая реакция остеокластов обусловлена тем, что они имеют на своей мембране рецепторы к КТ [38]. Молекулярные механизмы воздействия КТ на остеокласты связаны с увеличением образования циклического аденозинмонофосфата в них [39]. Кроме этого, остеокласты под воздействием КТ начинают вырабатывать пептид, называемый кальцитонин- генсвязанный пептид, который, действуя на остеобласты, заставляет их синтезировать циклический аденозинмонофосфат [32].
У здоровых людей имеется разница в концентрации КТ в плазме в зависимости от пола и возраста: у женщин эти значения ниже, чем у мужчин [54], с возрастом наблюдается уменьшение концентрации КТ в плазме. Снижение выработки половых гормонов как у мужчин, так и у женщин приводит к уменьшению секреции КТ, также обнаружена выраженная положительная корреляция между уровнем эстрогенов и КТ [46]. У женщин с остеопорозом концентрация КТ гораздо ниже, чем у женщин того же возраста, но без остеопороза. Введение КТ больным с остеопорозом способствует некоторому повышению минеральной плотности кости [33], хотя этот эффект наблюдается в течение 1 года [7]. В то же время проведение эстрогенотерапии при менопаузе приводит к повышению секреции КТ [14]. Это подтверждается и в исследованиях in vitro, в которых было показано прямое стимулирующее действие экстрогенов на выработку КТ клетками щитовидной железы [15]. Однако следует отметить, что разницы в минеральной плотности кости у больных с субтотальной тиреоидэктомией и здоровыми людьми не наблюдалось [23].
Снижение выработки половых гормонов как у мужчин, так и у женщин приводит к уменьшению секреции КТ, также обнаружена выраженная положительная корреляция между уровнем эстрогенов и КТ [46]. У женщин с остеопорозом концентрация КТ гораздо ниже, чем у женщин того же возраста, но без остеопороза. Введение КТ больным с остеопорозом способствует некоторому повышению минеральной плотности кости [33], хотя этот эффект наблюдается в течение 1 года [7]. В то же время проведение эстрогенотерапии при менопаузе приводит к повышению секреции КТ [14]. Это подтверждается и в исследованиях in vitro, в которых было показано прямое стимулирующее действие экстрогенов на выработку КТ клетками щитовидной железы [15]. Однако следует отметить, что разницы в минеральной плотности кости у больных с субтотальной тиреоидэктомией и здоровыми людьми не наблюдалось [23].
Наиболее часто остеопороз поражает женщин со сниженной гормональной функцией яичников, вне зависимости от причин, вызывающих это состояние. Позднее менархе, менопауза, аменорея у спортсменок и балетных танцоров, оперативное удаление яичников, пролактинсекретирующие опухоли, синдром Тернера приводят к деминерализации кости [28]. Чаще всего эти изменения возникают уже через год после наступления уменьшения концентрации эстрогенов в плазме. Заместительная эстрогенотерапии снижает потерю массы кости и даже приводит к ее увеличению [29].
Чаще всего эти изменения возникают уже через год после наступления уменьшения концентрации эстрогенов в плазме. Заместительная эстрогенотерапии снижает потерю массы кости и даже приводит к ее увеличению [29].
Механизм действия эстрогенов на процессы обновления кости остается спорной проблемой. В условиях дефицита эстрогенов наблюдаются как замедление формирования новой кости, так и ускоренная костная резорбция. В последнее время
опубликованы работы, в которых показано наличие рецепторов к эстрогенам на мембране остеобластов [9, 26]. Однако до этих исследований считалось, что эстрогены дают защитный эффект от воздействия ПТГ на костную ткань, а также увеличивают продукцию эндогенного КТ [34, 51].
Уменьшение выработки андрогенов как первичного генеза, так и вторичного (вследствие гипогонадотропного гипогонадизма) приводит к остеопорозу [24]. Отмечается положительная корреляционная зависимость между уровнем тестостерона в плазме и массой кости при различных формах гипогонадизма [II]. У таких больных терапия тестостероном и его метаболитами увеличивает минерализацию кости и ее массу [17]. Несмотря на четкую связь между уровнем выработки андрогенов и состоянием костной системы, механизмы их влияния на процессы образования и обновления кости остаются мало изученными.
У таких больных терапия тестостероном и его метаболитами увеличивает минерализацию кости и ее массу [17]. Несмотря на четкую связь между уровнем выработки андрогенов и состоянием костной системы, механизмы их влияния на процессы образования и обновления кости остаются мало изученными.
Роль других половых гормонов в процессах ремоделирования кости остается неизвестной, хотя имеются отдельные клинические наблюдения. Гиперпролактинемия сопровождается значительным снижением минеральной плотности кости, а терапия этого состояния способствует увеличению показателя |25]. У мужчин с гиперпролактинемией также отмечается уменьшение массы кости, а нормализация уровня тестостерона и пролактина вызывает ее увеличение (16].
Глюкокортикоиды (ГК) оказывают значительное влияние на процессы обновления кости. Считается, что 50 % больных с болезнью Иценко — Кушинга и 30—50 % больных, хронически принимающих ГК, страдают остеопорозом. Оперативное лечение детей с болезнью Иценко — Кушинга повышает минеральную плотность кости [45].
Воздействие ГК на кости обусловлено множеством факторов, среди которых основное значение имеет нарушение обмена кальция, связанное с уменьшением его абсорбции в кишечнике и увеличением экскреции с мочой, снижение выработки половых гормонов на всех уровнях и непосредственное влияние на клетки костной ткани (50].
Наиболее противоречивые данный получены при изучении прямого действия ГК на костную ткань. В физиологических дозах в первые сутки ГК усиливают функцию остеобластов и их способность синтезировать коллаген, а в последующем эта активность резко снижается [5]. ГК ингибируют превращения предшественников остеобластов, уменьшают время их активности, т. е. угнетают костеобразование. Воздействие ГК на остеокласты осуществляется, по-видимому, опосредованно через остеобласты. Несмотря на то что ГК увеличивают мобилизацию минералов кости усилением резорбции, они ингибируют созревание предшественников остеокластов и количество их снижается [52].
Одним из множества эффектов тиреоидных гормонов является их способность оказывать влияние на процессы обновления кости. В условиях гипертиреоза наблюдается повышение количества обновляющихся участков, уменьшаются как фаза резорбции, так и костеобразования, т. е. усиливается костный метаболизм [2]. Эти изменения приводят к отрицательному балансу кальция и уменьшению минеральной плотности кости, умеренной гиперкальциемии, снижению концентрации ПТГ и увеличению потери кальция и фосфора с мочой. Отрицательное действие повышения выработки тиреоидных гормонов на кости обусловлено непосредственным увеличением количества остеокластов и их активности, а также стимуляцией остеобластов [36].
В условиях гипертиреоза наблюдается повышение количества обновляющихся участков, уменьшаются как фаза резорбции, так и костеобразования, т. е. усиливается костный метаболизм [2]. Эти изменения приводят к отрицательному балансу кальция и уменьшению минеральной плотности кости, умеренной гиперкальциемии, снижению концентрации ПТГ и увеличению потери кальция и фосфора с мочой. Отрицательное действие повышения выработки тиреоидных гормонов на кости обусловлено непосредственным увеличением количества остеокластов и их активности, а также стимуляцией остеобластов [36].
В условиях гипотиреоза наблюдается уменьшение количества обновляющихся участков, резко увеличивается продолжительность всех фаз цикла ремоделирования, снижается резорбционная активность остеокластов, уменьшается способность остеобластов к формированию кости и ее минерализации [55].
Интересная особенность выявлена при лечении гипотиреоза тиреоидными препаратами. Все они вызывают остеопороз, хотя сроки его возникновения, по данным разных авторов, колеблются от 6 мес до 10 лет [12, 44]. По нашему мнению, такие разноречивые данные могут быть обусловлены различной дозировкой используемых препаратов.
По нашему мнению, такие разноречивые данные могут быть обусловлены различной дозировкой используемых препаратов.
Сахарный диабет (СД) наряду с метаболическими нарушениями различных органов и систем организма сопровождается изменениями в костной системе. У больных СД I типа длительностью более 5 лет отмечается уменьшение минеральной плотности кости по сравнению со здоровыми людьми того же возраста и пола [30, 57]. Особенно значительные изменения отмечаются у больных, заболевших в детском и юношеском возрасте, с большими дозами инсулина и плохим контролем. Отмечается изменение обмена кальция, проявляющееся увеличением экскреции кальция и фосфора, что приводит к уменьшению их концентраций в плазме. На этом фоне наблюдается парадоксальное уменьшение концентрации ПТГ в плазме у больных как без нарушения функции почек, так и со снижением их функционального состояния (19]. При этом уровень КТ не изменяется [48]. В патогенезе развития остеопороза у больных СД основное значение придается метаболическим и гормональным изменениям, диабетической ангиопатии [20]. Следует также отметить, что выявлены рецепторы к инсулину в остеобластах [27], в то же время механизмы его влияния на процессы обновления кости остаются неизвестными.
Следует также отметить, что выявлены рецепторы к инсулину в остеобластах [27], в то же время механизмы его влияния на процессы обновления кости остаются неизвестными.
Гормон роста — один из важнейших гормонов при росте костей, особенно их эпифизов. Он оказывает активирующее влияние на остеобласты локальным выделением соматомеди- на С, известного как инсулиноподобный фактор роста I. Этот пептид вызывает пролиферацию остеобластов, стимулирует синтез ДНК и протеинов. С возрастом продукция гормона роста снижается, однако это уменьшение не коррелирует с возрастными изменениями костной ткани. Использование гормона роста при остеопорозе оказалось неэффективным [1].
Анализ литературных публикаций показывает, что в течение жизни происходит постоянное обновление костной ткани. Наиболее активно на этот процесс оказывают влияние ПТГ и КТ через активацию или ингибирование клеточных элементов кости. Дефицит эстрогенов одна из самых широко распространенных причин остеопороза приводит к снижению костеобразования и ускорению резорбции кости. Выявлена четкая связь между состоянием костной системы и недостатком андрогенов и инсулина, избытком глюкокортикоидов, пролактина и гормонов щитовидной железы, хотя большинство вопросов этой проблемы далеки от разрешения. Характер и интенсивность процессов ремоделирования кости в значительной степени зависят от состояния гормонального баланса организма, но многие механизмы этого взаимодействия требуют дальнейшего изучения.
Выявлена четкая связь между состоянием костной системы и недостатком андрогенов и инсулина, избытком глюкокортикоидов, пролактина и гормонов щитовидной железы, хотя большинство вопросов этой проблемы далеки от разрешения. Характер и интенсивность процессов ремоделирования кости в значительной степени зависят от состояния гормонального баланса организма, но многие механизмы этого взаимодействия требуют дальнейшего изучения.
1. Aloia J. F., Vaswani A., Kapoor A. et al. // Metabolism.—1985—Vol. 34,—P. 124—129.
2. Auwera J., Bouillon R. // Quart. J. Med.— 1986.— Vol. 60,— P. 737—752.
3. Baron R. 11 Anat. Rec.— 1989,—Vol. 224,— P. 317—324.
4. Burckhardt P. // Hormone Res.— 1984.— Vol. 20.— P. 59— 64.
5. Canalis E. M. // Endocrinology.— 1983.— Vol. 112.— P. 931—939.
6. Compston J. E. // Clin. Endocr.— 1990.— Vol. 3.— P. 653—682.
7. Eastell R., Riggs B. L. // Clin. Obstet. Gynec.—1987— Vol. 30,— P. 860—870.
8. Eisman J. E. // Aust. Prescriber.— 1984. — Vol. 7.—
— Vol. 7.—
9. P. 34—36.
10. Eriksen E. F., Colvard D. S., Berg N. J. 11 Science.—1987—Vol. 241,— P. 84—86.
11. Evans R. A., Hills E. // Aust. N. Z. J. Ophthal.—1987— Vol. 17.— P. 121 — 124.
12. Foresta C., Ruzza G., Mioni R. et al. // Hormone Res.— 1984,-Vol. 19,—P. 18—22.
13. Franklyn J. A., Sheppard M. C. // Brit. med. J.—1987— Vol. 300,— P. 693—694.
14. Frost H. M. // Clin. Orthopaed. Relat. Res.— 1985.— Vol. 200,— P. 198-225.
15. Gennari C., Motagnani M., Nardi P., Civitelli R. // International Conference on Osteoporosis: Social and Clinical Aspects, 2-d.— Milan, 1986.— P. 240—254.
16. Greenberg С. P., Kukreja S. C., Bowser E. N. et al. // Endocrinology.— 1986,—Vol. 118,— P. 2594—2598.
17. Greenspan S. L., Neer R. M., Ridgway E. C., Klibanski A. 11 Ann. intern. Med.— 1986.— Vol. 104.— P. 777—782.
18. Greenspan S. L., Oppenheim D. S., Klibanski A. // Ibid.— 1989,—Vol. ПО,— P. 526—531.
19. Guimond J., Picard D., Chartrand R. et al. // Un. med. Can.—1986,—Vol. 115,—P. 529—532.
et al. // Un. med. Can.—1986,—Vol. 115,—P. 529—532.
20. Heidbreder E., Gotz R., Schafferhans K-, Heidland A. 11 Nephron.— 1986.— Vol. 42.— P. 285—289.
21. Hough F. S. 11 S. Afr. med. J.— 1987,— Vol. 72 — P. 116—119.
22. Howard G. A., Bottemiller B. L., Turner R. I. 11 Proc. nat. Acad. Sci. USA.— 1981.— Vol. 78.— P. 3204— 3208.
23. Huffer W. F. // Lab. Invest.— 1988,—Vol. 59.—P. 418— 442.
24. Hurley D. L, Tiegs R. D„ Wahner H. W., Heath H. Ill // New Engl. J. Med.— 1987.— Vol. 317— P. 537—541.
25. Jackson J. A., Kleerekoper M. // Medicine (Baltimore).— 1990,— Vol. 69.- P. 137-152.
26. Klibanski A., Greenspan S. L. // New Engl. J. Med.—1985— Vol. 315.— P. 542—546.
27. Komm B. S., Terpening C. A., Benz D. J. // Science.—1988— Vol. 241. P. 8 1-—.
28. Lefy J. R., Murry E., Manolagas S. // Endocrinology.— 1986.— Vol. 119. — P. 1786—1702.
29. Lindsay R. // Clin. Obstet. Gynec.— 1987.— Vol. 30.— P. 847—850.
30. Lindsay R. // Schweiz, med. Wschr.— 1980.— Bd 1D.— S..L806—1810.
Wschr.— 1980.— Bd 1D.— S..L806—1810.
31. McNair P. // Dan. med. Bull.— 1988.— Vol. 35,— P. 100— 121.
32. McSheehy P. M. J., Chambers T. J. // Endocrinology.— 1986.— Vol. 119.—P. 1654—1650.
33. Martin T. J., Kong Wah Ng, Suda T. // Endocr. Metab.—1989— Wo 1 8,— — . 838—W8.
34. Mazzuoli G. F., Passeri M., Gennari C. et al. Il Calcif. Tiss. int.— 1986,— Vol. 38,— P. 3—8.
35. Mazzuoli G. F., D’erasmo D, Minisola S. et al. // Clin. Rheum.— 1988.— Vol. 8.— Suppl. 2.— P. 22—20.
36. Milhaud G. // J. med. nucl. Biophys.— 1988.— Vol. 12.— P. 71—72.
37. Mosekilde L., Eriksen E. F., Chartes P. Il Endocr. Metab. Clin. N. Amer.— 1990.— Vol. 19,— P. 35.
38. National Institutes of Health: Consensus Conference. Osteoporosis // J. A. M. A.— 1984.— Vol. 252,— P. 700—802.
39. Nicholson G. C., Moseley J. Al., Sexton P. M, et al. // J. clin. Invest.— 1986,— Vol. 78. — P. 355—360.
40. Nicholson G. C., Livesey S. A., Moseley J. Л4., Martim T. J. // J. Cell Biochem.— 1986,— Vol. 31,— P. 220—236.
Cell Biochem.— 1986,— Vol. 31,— P. 220—236.
41. Nijweide P. J., Burger E. H, Feyen J. H. M. // Physiol. Rev.— 1986.— Vol. 66,— P. 855—886.
42. Nordin B. Е. Ch., Morris H. A. Il Nutr. Rev.— 1989.— Vol. 47.— P. 65—72.
43. Parfitt A. M. // Clin. Obstet. Gynec.— 1987.— Vol. 30.— P. 780—811.
44. Parfitt A. M. // Amer. J. Med.— 1987.— Vol. 82, Suppl. IB.— P. 68—72.
45. Paul T. L., Kerrigan J., Kelly A. A4 et al. Il J. A. M. A.— 1988,— Vol. 250,— P. 3137—3141.
46. Pocock N. A., Eisman J. A., Dunstan C. R. et al. // Ann. intern. Med.— 1987,— Vol. 107.— P. 3D—323.
47. Reginsier I. J., Deroisy R., Denis D. et al. Il Acta belg. med. phys.— 1989.— Vol. 12.— P. 41—46.
48. Rodan G. A., Martin T. J. Il Calcif. Tiss. int.— 1981.— Vol. 33,— P. 340—351.
49. Schmitz 0., Christensen C. K-, Christensen S. Е, Emmertsen K. Il Horm. Metab. Res.— 1984.— Vol. 16.— P. 100—101.
50. Silverberg S. J., Lindsay R. // Med. Clin. N. Amer.— 1987— Wo 7 1,—. 41-7.
51. Smith R. // Thorax.— 1990,— Vol. 45.— P. 573—578.
52. Stevenson J. C. // Bailliere’s Clin. Endocr. Metab.—1988—. 87—101.
53. Suda T, Testa. N. G., Allen T. D. // Calcif. Tiss. int.— 1983.- Vol. 35.— P. 82—86.
54. Teitelbaum A. P, Silve C. M., Nyiredy K. O., Arnaud C. D. Il Endocrinology.— 1986,—Vol. 118,— P. 505—602.
55. Tiegs R. D., Body J. J., Barta J. M., Heath H. Ill II J. Bone Mineral Res.— 1986,— Vol. 1,— P. 330—340.
56. Tremollieres F, Pouilles J. A4, Louvet J. P., Ribot C. // Clin. Rheum.— 1989,— Vol. 8,—Suppl. 2,—P. 116—118.
57. Vaananen H. K., Hentunen T, Lakkakorpi P. et al. // Ann. Chir. Gynaec.— 1988,— Vol. 77,—P. 193—196.
58. Weber G, Beccaria L., de’Angelis M, et al. Il Bone and Mineral Res.— 1990,— Vol. 8,— P. 20—23.
Кости стопы: анатомия, состояние и многое другое
Стопа представляет собой сложную часть тела, состоящую из 26 костей, 33 суставов, 107 связок и 19 мышц.
Кости и суставы стопы изнашиваются, поэтому состояния, вызывающие повреждение стопы, могут напрямую влиять на ее здоровье.
В этой статье описывается основная анатомия костей стопы, а также некоторые из наиболее распространенных состояний, поражающих эти кости.
Стопа человека состоит из 26 костей. Эти кости делятся на три группы: кости предплюсны, плюсневые кости и фаланги.
Изображение предоставлено Стивеном Келли, 2019 г.Кости предплюсны
Кости предплюсны представляют собой группу из семи костей, составляющих заднюю часть стопы.
Кости предплюсны включают:
- Таранная кость или лодыжка : Таранная кость представляет собой кость в верхней части стопы. Он соединяется с большеберцовой и малоберцовой костями голени.
- Пяточная кость, или пяточная кость : Пяточная кость является самой крупной из костей предплюсны. Он расположен ниже таранной кости и играет важную роль в поддержании веса тела.
- Предплюсны : Эти пять костей образуют свод средней части стопы. Это медиальная, промежуточная и латеральная клиновидные, кубовидная и ладьевидная кости.

Плюсневые кости
Плюсневые кости представляют собой группу из пяти трубчатых костей в середине стопы. Они соединяются с костями предплюсны и фалангами.
Плюсневые кости располагаются в ряд, и врачи нумеруют их от одного до пяти. Первый расположен ближе всего к своду стопы, а номер пять — к внешнему краю стопы.
Фаланги
Фаланги пальцев ног. Каждый из пальцев со второго по пятый содержит по три фаланги.
От задней части стопы к передней, врачи называют их проксимальной, средней и дистальной фалангами.
Большой палец ноги или большой палец стопы содержит только две фаланги, проксимальную и дистальную.
Плюснефаланговые суставы представляют собой суставы между плюсневыми костями и проксимальными фалангами каждого пальца стопы. Эти суставы образуют подушечку стопы.
Первый плюснефаланговый сустав располагается на одной линии с большим пальцем стопы. Это обычная область для болей в ногах и других проблем.
Общие состояния, поражающие кости стопы, включают:
Артрит большого пальца ноги
Артрит может поражать многие кости стопы, но чаще всего вызывает проблемы с суставами у основания большого пальца ноги.
Этот тип артрита известен как артрит большого пальца ноги. Врачи могут называть его Hallux limitus или Hallux Rigidus.
Артрит большого пальца стопы возникает, когда хрящ в суставе большого пальца ноги начинает изнашиваться. Это может произойти в результате многолетнего повторяющегося восходящего движения сустава.
Некоторые виды деятельности, такие как длительный бег и ходьба, могут увеличить риск развития артрита в этой области.
Симптомы артрита большого пальца стопы включают:
- боль, скованность и отек большого пальца стопы
- костную шпору
- метатарзалгию или боль и воспаление подушечки стопы
Бурсит большого пальца стопы
Поделиться на Pinterest Бурсит большого пальца стопы — распространенное осложнение, поражающее кости стопы.
Бурсит — это видная шишка на внутренней стороне стопы, у основания большого пальца ноги.
Бурсит развивается, когда кость у основания пальца стопы — первая плюсневая кость — начинает отделяться от кости у основания второго пальца стопы — второй плюсневой кости.
Когда первая плюсневая кость смещается наружу, большой палец смещается к остальным пальцам. Эти процессы приводят к тому, что бурсит становится более заметным.
Человек с бурситом может испытывать боль и дискомфорт в месте косточки или под подушечкой стопы. Эти симптомы могут усиливаться при ходьбе или стоянии.
Люди, у которых развивается бурсит, как правило, компенсируют это увеличением веса на втором пальце ноги, что может привести к образованию мозолей.
Подагра
Подагра — это тип воспалительного артрита. Хотя он может поражать практически любой сустав в организме, чаще всего он поражает сустав у основания большого пальца ноги.
Подагра обычно возникает из-за высокой концентрации мочевой кислоты в крови.
Мочевая кислота — это химическое вещество, которое обычно растворяется в крови и выводится из организма с мочой. У людей с подагрой избыток мочевой кислоты начинает накапливаться и образовывать кристаллы в суставах.
Отложения кристаллов мочевой кислоты могут вызвать сильную воспалительную реакцию, которая вызывает боль и отек в пораженной области.
Молоткообразные пальцы ног
Молоткообразные пальцы стопы — это состояние, которое обычно поражает пальцы ног, кроме большого. Вместо того, чтобы указывать прямо вперед, эти пальцы направлены вниз, образуя форму когтя.
В большинстве случаев заболевание развивается с возрастом. Обычно это результат мышечного дисбаланса, когда длинные мышцы голени подавляют более мелкие мышцы стопы. Этот дисбаланс заставляет пальцы ног сгибаться внутрь.
Молоткообразный палец может вызывать следующие симптомы:
- боль и мозоли на кончиках пальцев ног из-за трения об обувь
- боль в кончиках пальцев ног из-за давления пальцев на подошву обуви
- метатарзалгия или боль в суставах у основания пальцев ног
- ощущение, как при ходьбе по мрамору
Пяточные шпоры и подошвенный фасциит
Пяточные шпоры — это костные разрастания, развивающиеся на пяточной кости или пяточной кости. Хотя они могут вызывать некоторый дискомфорт, они редко бывают болезненными.
Однако пяточные шпоры часто развиваются в результате состояния, называемого подошвенным фасциитом, которое может вызывать боль.
Подошвенный фасциит относится к воспалению и утолщению подошвенной фасции, которая представляет собой связку, поддерживающую свод стопы.
Следующие факторы могут увеличить риск развития подошвенного фасциита:
- напряженные икроножные мышцы, которые снижают способность стопы сгибаться вверх
- очень высокий свод стопы
- повторяющиеся нагрузки при некоторых видах спорта
- ожирение
Подошвенный фасциит может вызывать боль в пятке или нижней части стопы при стоянии или ходьбе.
Люди, у которых развилась пяточная шпора без подошвенного фасцита, вряд ли будут испытывать болезненные симптомы.
Пяточная шпора поражает до 1 из 10 человек. Из них только половина будет испытывать какую-либо боль.
Сесамоидит
Сесамоидит — воспаление одной или обеих сесамовидных костей у основания большого пальца ноги. Состояние может вызвать сильную боль в этой области.
Состояние может вызвать сильную боль в этой области.
Чрезмерная и повторяющаяся нагрузка на большой палец ноги является основной причиной сесамоидита. Факторы, повышающие риск сесамоидита, включают внезапное повышение уровня активности или смену обуви.
Люди с сесамоидитом могут испытывать следующие симптомы:
- острая и часто сильная боль в основании большого пальца ноги
- боль и дискомфорт при ходьбе босиком или по твердой поверхности
- хромота при ходьбе
Стрессовый перелом 2 Стрессовые переломы случаются, когда область кости подвергается чрезмерной и повторяющейся нагрузке.
Некоторые повторяющиеся действия, такие как ходьба и бег, могут вызвать образование микроскопических трещин или микропереломов в костях. Обычно организм может восстанавливать эти микропереломы.
Однако иногда организм не в состоянии поддерживать скорость восстановления, необходимую для того, чтобы справиться с нагрузкой на стопу. Когда это происходит, микротрещины могут перерасти в усталостные переломы.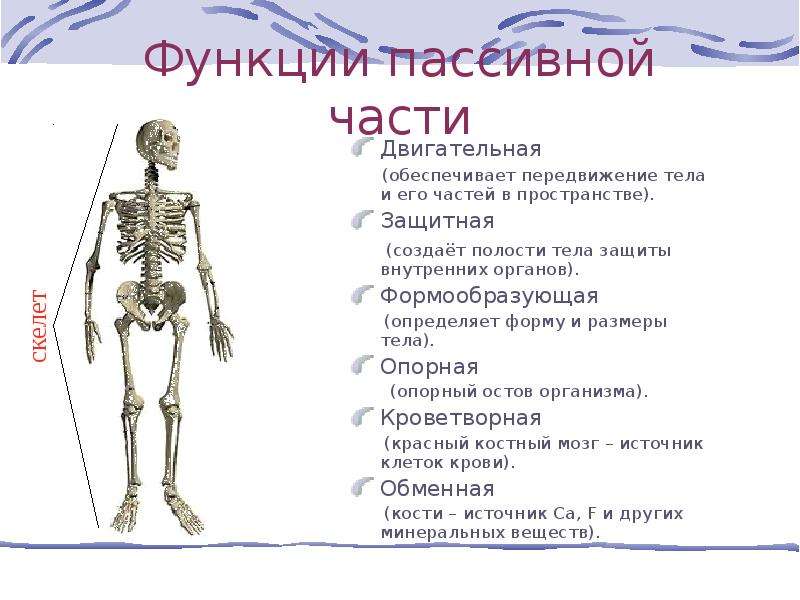
Определенные состояния, такие как недостаток гормонов щитовидной железы или дефицит кальция или витамина D, также могут подорвать способность организма к заживлению микропереломов.
Стрессовые переломы обычно поражают следующие кости:
- основание пятой плюсневой кости
- сесамовидные кости большого пальца стопы
- ладьевидная кость
Основным симптомом стрессового перелома является ноющая боль в пораженной области стопы.
Поделиться на PinterestЧеловеку, испытывающему постоянную боль или дискомфорт, следует обратиться к врачу.
По данным Американского колледжа хирургов стопы и голеностопного сустава, человек может захотеть обратиться к врачу, если у него возникнут следующие симптомы:
- травма стопы, такая как растяжение связок или перелом пальца ноги
- изменения внешнего вида стопа или лодыжка
- боль в стопе, лодыжке или голени
- боль или дискомфорт после стояния
- боль в пятке по утрам
- нарушение способности выполнять определенные действия
- аномальный рост на стопе
- заболевание, которое может стопы, такие как диабет или артрит
Анатомия стопы очень сложная, состоит из множества костей, суставов и связок.
Некоторые состояния здоровья, травмы и общий износ могут вызывать или способствовать заболеваниям костей стопы.
Люди, которые испытывают постоянную боль в стопах или замечают изменения во внешнем виде своих стоп, могут захотеть обратиться к врачу.
Вальгусная деформация коленного сустава (genu valgum): лечение, причины и упражнения
Вальгусная деформация коленного сустава или деформация коленного сустава — это состояние, при котором колени соприкасаются, а лодыжки — нет. Это чаще всего появляется у маленьких детей и может беспокоить родителей, которые могут мало знать об этом заболевании.
Genu valgum чаще называют вальгусной деформацией коленного сустава. Когда человек с вальгусной деформацией колена стоит, согнув колени, расстояние между лодыжками составляет около 8 сантиметров (3,1 дюйма) или более. Колени будут прижиматься друг к другу.
Наиболее часто встречается у детей, обычно в возрасте от 3 до 6 лет. У большинства маленьких детей это состояние естественным образом исправляется к 7 годам. В редких случаях вальгусная деформация коленного сустава может сохраняться в подростковом возрасте. В других случаях у детей старшего возраста или взрослых он может развиться в результате основного заболевания или состояния.
В редких случаях вальгусная деформация коленного сустава может сохраняться в подростковом возрасте. В других случаях у детей старшего возраста или взрослых он может развиться в результате основного заболевания или состояния.
В случаях, когда вальгусная деформация коленного сустава не проходит сама по себе, или когда вальгусная деформация колена развивается в более позднем возрасте, человеку может потребоваться официальное лечение.
В большинстве случаев предотвратить вальгусную деформацию колена невозможно. Однако доступны различные варианты лечения, которые могут помочь облегчить некоторые симптомы.
Можно предотвратить деформацию коленного сустава, которая развивается из-за основного заболевания, если врач сможет определить и вылечить причину.
Лечение вальгусной деформации коленного сустава во многом зависит от причины и тяжести состояния.
Типичные варианты лечения могут включать некоторые из следующих:
Лекарства и добавки
Если вальгусную деформацию коленного сустава вызывает основное заболевание, врач должен сначала вылечить болезнь, чтобы исправить положение ног. Они могут использовать лекарства и добавки как часть плана лечения.
Они могут использовать лекарства и добавки как часть плана лечения.
Регулярные физические упражнения
Несколько исследований показывают, что физические упражнения могут помочь укрепить мышцы ног и улучшить осанку и равновесие у людей с деформацией колена. Исследования также показывают, что это может относиться к молодым людям с деформацией колена, но недостаточно исследований, чтобы показать, что упражнения корректируют состояние у детей.
Человек должен всегда консультироваться с врачом перед началом любых упражнений. Врач или физиотерапевт сможет сказать, могут ли упражнения быть полезными и какие типы упражнений следует выполнять, исходя из походки человека и конкретных симптомов.
Примеры силовых и силовых упражнений, которые может выполнять человек, включают:
Боковые выпады
- Встаньте, расставив ноги на ширине плеч, и положите руки перед грудью.
- Сделайте широкий шаг влево.
- Согните колено, когда ступня коснется земли, и отведите бедро назад.

- Встаньте и вернитесь в нейтральное положение.
- Повторите 10–12 раз, а затем поменяйте ноги.
Похищение лежа
- Лягте на левый бок, положив ноги одну на другую.
- Поднимите правую ногу под углом 45 градусов и удерживайте в течение 1 секунды. Затем опустите ногу.
- Повторите 10–12 раз и сделайте то же самое с другой ногой.
Приседания у стены
- Встаньте прямо у стены, слегка отодвинув корпус от стены и поставив ноги на ширине плеч.
- Присядьте под углом не более 90 градусов и задержитесь на 5–10 секунд, удерживая мышцы живота в напряжении.
- При большей практике человек может начать удерживать позу дольше.
- Также может помочь добавление эластичной ленты вокруг коленей во время выполнения этого упражнения.
Потеря веса
Если человек имеет избыточную массу тела, это может способствовать вальгусной деформации коленного сустава. Дополнительный вес создает дополнительную нагрузку на ноги и колени, что может привести к усугублению дисфункции колена.
Врач, скорее всего, порекомендует человеку с избыточным весом похудеть с помощью сочетания диеты и физических упражнений.
Ортопедические стельки
Ортопедические стельки — это вставки, которые вставляются в обувь, чтобы помочь исправить походку человека или то, как его стопа касается земли при ходьбе или беге. Это может быть особенно полезно для людей с вальгусной деформацией коленного сустава, у которых одна нога длиннее другой.
Некоторым детям врачи могут порекомендовать ортезы или шины в дополнение к ортопедическим стелькам или вместо них. Брекеты предназначены для того, чтобы помочь костям расти в правильном положении.
Хирургия
Хирургия обычно не является первым методом лечения человека с вальгусной деформацией колена. Хирургическое вмешательство обычно проводят при сильном вывихе колена и в случаях, когда упражнения, растяжка и потеря веса не облегчают боль.
Для детей врачи используют процедуру, называемую управляемой хирургией роста. Хирург вставляет в колено небольшой кусочек металла. Эта металлическая пластина помогает кости расти в правильном направлении. После того, как кость выровнена правильно, проводится дальнейшая операция по удалению металлической пластины.
Хирург вставляет в колено небольшой кусочек металла. Эта металлическая пластина помогает кости расти в правильном направлении. После того, как кость выровнена правильно, проводится дальнейшая операция по удалению металлической пластины.
Взрослым и подросткам старшего возраста также может быть выполнена остеотомия. Подобно хирургии направленного роста, при остеотомии хирург вставляет в колено небольшую металлическую пластину. Пластина используется в качестве постоянного фиксатора для правильного выравнивания колена.
В редких случаях врач может порекомендовать замену коленного сустава. В этом случае правильно установленный искусственный коленный сустав решит вальгусную деформацию колена.
В зависимости от типа операции, наличия у пациента медицинской страховки и типа страховки, стоимость любой хирургической процедуры может значительно различаться. Это также может зависеть от тяжести симптомов пациента.
Хирургические расходы
Люди, имеющие страховку Medicare, могут заплатить от 344 до 644 долларов из своего кармана за остеотомию, в зависимости от того, где проводится процедура.
Стоимость остеотомии или хирургии направленного роста, если у человека есть другие виды страхования, неясна и может зависеть от конкретного плана страхования. В 2018 году средняя стоимость замены коленного сустава составляла 35 000 долларов США, но это общая стоимость без учета страхового покрытия.
Не всегда существует очевидная причина вальгусной деформации коленного сустава, но есть несколько потенциальных причин, включая метаболические нарушения костей и генетические нарушения. Однако в большинстве случаев genu valgum безвредны.
Факторы риска вальгусной деформации коленного сустава включают:
- травма или заболевание голени или колена
- скелетная дисплазия
- лизосомные болезни накопления, такие как синдром Моркио
- рахит, который является дефицитом витамина D колено
- дефицит кальция
Симптомы вальгусной деформации коленного сустава включают четкое визуальное разделение лодыжек, когда колени вместе.
Это проявляется в виде хромоты и проблем с равновесием при ходьбе. Обычно человек не испытывает никаких симптомов, но может иногда испытывать боль в коленях, ступнях, бедре или лодыжке.
Поделиться на PinterestGenu valgum, также известная как деформация коленей, у молодой девушки.
Sarnia/Shutterstock
Поделиться на PinterestСерьезная деформация голеней, которая выглядит как «вывернутое колено».
BioMed Central, CC BY 2.0, через Wikimedia Commons
Поделиться на PinterestВальгумная деформация колена нижних конечностей. B. Рентгенограмма, показывающая вальгусную деформацию коленного сустава.
Шарма С., Кумар С. Двусторонняя вальгумация коленного сустава: необычное проявление ювенильного первичного гиперпаратиреоза. Отчеты о клинических случаях Oxf Med. 2016;2016(7):141-143. Опубликовано 27 июля 2016 г. doi:10.1093/omcr/omw023
Диагностика обычно начинается с медицинского осмотра, при котором врач осматривает человека и подробно изучает историю болезни. Если человек с симптомами — ребенок, врач проверит траекторию роста его ног.
Если человек с симптомами — ребенок, врач проверит траекторию роста его ног.
При наличии боли врач, скорее всего, попросит человека описать ее локализацию, тяжесть и частоту.
Врач также проверит:
- положение коленей при стоянии
- походку человека
- разную длину ног . В некоторых случаях врач может назначить МРТ или рентген для изучения структуры кости.
Врач также должен определить, есть ли основная причина. Если его нет, врач обычно рекомендует подождать, чтобы увидеть, пройдет ли состояние само по себе.
Кривоногость похожа на вывих колена, и ее латинское название — genu varum. Они оба наиболее распространены в раннем детстве.
Кривые ноги — это изогнутые колени, которые уменьшают пространство между лодыжками. Кривые ноги — это противоположность изогнутым коленям, которые изгибаются внутрь и увеличивают пространство между лодыжками.
В то время как деформация коленного сустава чаще всего поражает детей в возрасте 3–6 лет, искривление ног редко сохраняется после 2 лет.
 Оба состояния могут иметь естественные и обусловленные болезнью причины.
Оба состояния могут иметь естественные и обусловленные болезнью причины.Поделиться на PinterestМужчина с genu varum нижней конечности, что означает искривление ноги. Эта деформация может быть типичным вариантом, а может быть результатом дефицита питания или заболеваний.
Кумар Р., Балачандран К., Камаланатан С., Саху Дж.П. Уникальная причина кальцификации межкостной мембраны. BMJ Case Rep. 2015; 2015:bcr2014208116. Опубликовано 23 января 2015 г. doi:10.1136/bcr-2014-208116Почти во всех случаях вальгусной деформации коленного сустава заболевание проходит до достижения ребенком подросткового возраста.
Для детей старшего возраста и взрослых наиболее вероятная форма терапии включает растяжку и упражнения для выпрямления коленей и облегчения боли. Некоторым людям могут помочь ортопедические стельки или брекеты.
В некоторых тяжелых случаях может потребоваться хирургическое вмешательство, но обычно это крайняя мера, поскольку другие методы лечения, как правило, эффективны при лечении вальгусной деформации коленного сустава.



 Оба состояния могут иметь естественные и обусловленные болезнью причины.
Оба состояния могут иметь естественные и обусловленные болезнью причины.