Пять стихий: вода
О необычных, а порой и «волшебных», свойствах воды нам рассказывают в школе, в институте, в электричках и на сайтах, где продают флаконы «живой воды». Кроме шуток, у самой распространенной жидкости на Земле действительно хватает необычных характеристик, чтобы их изучению посвящались тысячи научных работ. В рамках проекта «Пять стихий», который N+1 осуществляет совместно с НИТУ «МИСиС», мы расскажем о том, насколько жидкая стихия поддается укрощению, то есть можно ли с помощью современной физики вывернуть все необычные свойства воды наизнанку, как это сделать, а главное — зачем.
О главном
Принципиальный вопрос: откуда у вещества с такой простой формулой (H2O, как все помнят) берется такой набор необычных, местами парадоксальных свойств. Оказывается, что из этой самой формулы и берется. Молекулы воды устроены просто, но очень хитро: в них атом кислорода находится в середине воображаемого тетраэдра, а две неподеленных электронных пары и два атома водорода размещены в его вершинах.
Из наличия водородных связей вытекает, пожалуй, самая главная характеристика воды — огромная энергия когезии молекул, которая удерживает их вместе и отвечает за то, что вода остается жидкой при комнатной температуре. У ближайших соседей — сероводорода (H 2S), аммиака (NH3), галогеноводородов (HF, HCl и пр.
 ) — водородные связи тоже могут образоваться, но все эти вещества при комнатной температуре — газы, что еще раз подтверждает необычный статус воды. Но это еще далеко не все. Мы выбрали пять характерных явлений, связанных с водой, которые и предлагаем рассмотреть по порядку.
) — водородные связи тоже могут образоваться, но все эти вещества при комнатной температуре — газы, что еще раз подтверждает необычный статус воды. Но это еще далеко не все. Мы выбрали пять характерных явлений, связанных с водой, которые и предлагаем рассмотреть по порядку.Когезия: теплоемкость
Давайте вспомним, как на молекулярном уровне определяется агрегатное состояние вещества: если энергия теплового движения совсем мала, атомы будут выстраиваться в наиболее выгодное пространственное положение, как правило — очень симметричное. Такое состояние мы называем «твердым». Если температуру (а вместе с ней и тепловую энергию) системы повысить, атомы и молекулы смогут вырваться из кристаллической решетки, но им все еще не будет хватать прыти, чтобы разлететься далеко друг от друга — в этом случае вещество будет жидким. Когда тепловой энергии окажется достаточно, чтобы пересилить все межмолекулярные взаимодействия, молекулы разлетятся подальше друг от друга, а вещество превратится в газ.
Как видно из нашей простой картинки, именно межмолекулярные взаимодействия определяют то, как много энергии готова впитать жидкость прежде, чем испариться. Этот параметр называется теплоемкостью и для воды он действительно велик: чтобы нагреть килограмм воды на один градус, требуется 4200 джоулей — в четыре раза выше, чем для материалов вроде дерева, камня и стекла, и в 10 раз выше, чем теплоемкость металлов.
Как «победить» столь высокую теплоемкость воды? Значительных успехов здесь добиться не удалось, однако метод предельно ясен: раз во всем виноваты упорядоченные водородные связи, надо их устранить. Для этого достаточно заставить молекулы воды структурироваться как-то по-другому, например, тянуться атомами кислорода к какому-то заряженному объекту. С этой ролью неплохо справляются белки: в достаточно концентрированных растворах они облепляются молекулами воды, которые больше не могут образовывать водородные связи. Теплоемкость в таком случае снижается почти в два раза и становится такой же, как у льда.
 Кстати, о льде.
Кстати, о льде.Когезия: кристаллизация
Как мы уже знаем, молекулы воды любят упорядочиваться, однако за счет теплового движения их структура оказывается несколько разупорядоченной. Охлаждение способно внести порядок. «Если температуру понизить, водородные связи заставят молекулы воды практически замереть в наиболее удачном положении. Необычным фактом является то, что это для этого положения характерно сравнительно большое количество пустот между молекулами, поэтому лед занимает на 9 процентов больший объем, чем та же масса жидкой воды», — поясняет природу этого процесса профессор Юрий Николаевич Уткин, доктор химических наук, ведущий эксперт Центра энергоэффективности НИТУ «МИСиС». С одной стороны, такое свойство положительно сказывается на экосистеме: более легкий лед плавает на поверхности, а водоемы не промерзают до дна. С другой стороны, образование льда ставит под угрозу жизнь многих биологических систем, так как увеличившаяся в объеме вода может необратимо повредить клетки, которые уже не смогут восстановиться после разморозки.
Пагубное влияние льда, к счастью, оказалось несложно победить. Причем на этой почве преуспели и природные системы, и синтетические. Первые научились создавать специальные структуры, чаще всего белковые, которые называют «антифризами». Эти крупные молекулы хитро связываются с зародышами кристаллов льда, препятствуя их дальнейшему росту. Таким образом вместо крупных кристаллов с большим объемом в системе образуется кашица из мелких кристалликов льда, которая практически не повреждает клетку. Живые организмы, использующие белковые антифризы, выживают при температурах до −30 градусов Цельсия, а жуки Upis Ceramboides и вовсе выдерживают морозы до −60 градусов благодаря небелковым антифризам.
В промышленности же с замерзанием воды борются проще — добавляя в систему так называемые криопротекторы, образующие водородные связи с водой и препятствующие ее замерзанию.
 К этим веществам относятся глицерин, этанол, полиэтиленгликоль и другие. Эти же агенты используют и при исследовании биологических препаратов, которые требуется заморозить, но сохранить при этом в максимально близком к «живому» состоянию виде. Недавно оказалось, что и красители могут служить в качестве криопротекторов. Например, хорошо известный сафранин О по своим свойствам схож с белковыми антифризами, хотя и имеет значительно меньший размер молекул.
К этим веществам относятся глицерин, этанол, полиэтиленгликоль и другие. Эти же агенты используют и при исследовании биологических препаратов, которые требуется заморозить, но сохранить при этом в максимально близком к «живому» состоянию виде. Недавно оказалось, что и красители могут служить в качестве криопротекторов. Например, хорошо известный сафранин О по своим свойствам схож с белковыми антифризами, хотя и имеет значительно меньший размер молекул.Когезия: вязкость
Продолжая наблюдать за необычными свойствами, следующими из сильной когезии молекул воды, надо упомянуть и вязкость. Этот параметр, свойственный любым жидкостям и газам, отвечает за то, насколько сильно слои одного и того же вещества «трутся» друг о друга. Если точнее, вязкость определяет интенсивность обмена импульсом между молекулами. Сильно вязкие системы — мед, или кетчуп, например — текут медленно и неохотно, тогда как вещества с малой вязкостью — бензин или ацетон — растекаются быстро и при меньшем внешнем воздействии.
Значительная вязкость воды является главным виновником того, что под водой практически невозможно серьезно разогнаться, а для прокачки жидкости по трубам требуются мощные насосы. Самое обидное, что бороться с вязкостью путем устранения водородных связей не получается: когда молекулы воды упорядочиваются, их вязкость становится еще больше за счет тех же сил, что вызывают это упорядочение. Однако проблему вязкого сопротивления удалось вполне успешно атаковать не со стороны самой воды, а со стороны тела, движущегося сквозь нее. Для этого вспомним об адгезии и взаимодействии воды с другими телами.
Адгезия: прилипание
Если когезия — это притяжение молекул воды друг к другу, то адгезия — это их притяжение к сторонним телам, например, стенкам сосудов. Тут важно вспомнить, что вода ко всему прочему является полярной жидкостью, то есть каждая ее молекула представляет собой диполь — частицу, у которой один конец заряжен чуть более положительно, а другой — чуть более отрицательно.
Адгезия молекул воды к стенкам влечет за собой много последствий, одно из которых известно под названием «гидродинамическое условие прилипания». Оно выражается в том, что при течении воды вдоль большинства поверхностей ближайший к стенке слой «прилипает», поэтому скорость в нем нулевая. За счет вязкости этот слой сильно тормозит следующий и так далее. В итоге максимальная скорость будет наблюдаться в центре трубы или канала. Казалось бы, ничего страшного в этом нет, и это правда, пока речь идет о крупных трубах — водопроводных, например. Если же собрать устройство с каналами толщиной в несколько микрон, то в них вязкое сопротивление окажется настолько велико, что обычные насосы уже не смогут прокачать воду через тонкие трубки.
 Такая проблема существует в микрофлюидике — разделе науки о миниатюрных устройствах для управления жидкостями, пузырьками и каплями на микромасштабах. Специальные микрофлюидные приборы чем-то похожи на электронные чипы, только в них вместо проводов для электричества проложено множество каналов для жидкости. Такая «лаборатория-на-чипе» позволяет производить десяток биологических анализов в устройстве размером с наручные часы.
Такая проблема существует в микрофлюидике — разделе науки о миниатюрных устройствах для управления жидкостями, пузырьками и каплями на микромасштабах. Специальные микрофлюидные приборы чем-то похожи на электронные чипы, только в них вместо проводов для электричества проложено множество каналов для жидкости. Такая «лаборатория-на-чипе» позволяет производить десяток биологических анализов в устройстве размером с наручные часы. Очевидно, что миниатюризация в рамках микрофлюидики не предполагает наличие огромного насоса для прокачки жидкости, поэтому с вязким сопротивлением воды приходиться справляться. На данный момент существует два основных способа, как это сделать: во-первых, можно устранить прилипание воды на стенке, что существенно увеличит скорость течения. Для этого используют поверхность, которая слабо взаимодействует с молекулами воды, то есть гидрофобный материал. Однако первые же эксперименты показали, что обычная химическая гидрофобность дает лишь очень слабый эффект в снижение вязкого сопротивления.

Вторым способом устранения вязкого сопротивление является отказ от традиционных насосов для прокачки жидкости за счет перепада давления. Вместо этого можно заставить воду течь под действием электрического поля, правда, для этого необходимо добавить в систему электролит (например соль), а стенки — зарядить. Такое течение называется электроосмотическим и характеризуется тем, что профиль скорости жидкости оказывает плоским, без максимума в центре канала. Это очень удобно, если в системе есть требование к равномерной прокачке жидкости по микроканалу.

Адгезия: поверхностное натяжение
Раз мы вспомнили об адгезии воды и гидрофобных поверхностях, нельзя не упомянуть о смачивании и капиллярности. Эти свойства определяют, как ведет себя поверхность жидкости, а также ее капли и пленки на твердых телах, внутри капилляров, пор и так далее. Вода и здесь продолжает держать марку в качестве «самой-самой»: благодаря огромной энергии когезии велико и поверхностное натяжение, которое, например, отвечает за форму дождевых капель и позволяет водомеркам бегать по воде как по твердому основанию. Само натяжение возникает из-за того, что каждой молекуле воды выгоднее находиться в объеме, в окружении соседей, поэтому все молекулы одинаково стремятся покинуть поверхность, то есть максимально сократить ее площадь. Поэтому мы не видим капель в форме кубика: шар всегда имеет меньшую площадь при том же объеме.
Если добавить к поверхностному натяжению взаимодействие с твердыми телами, мы окунемся в богатый мир смачивания: здесь и идеально круглые капли на листке лотоса, и поднятие воды по тонким капиллярам, и пропитка пористых тел (мочалки, например). А еще интереснее посмотреть, как всеми этими эффектами можно управлять, так как поверхностное натяжение оказалось одним из самых «податливых» свойств воды. Самый известный бытовой пример — добавить к воде поверхностно-активное вещество, например мыло. В этом случае поверхность жидкости окажется стабилизирована, а натяжение значительно снизится. Попробуйте выдуть пузырь из чистой воды — не тут-то было, а из мыльной — пожалуйста: большая площадь поверхности уже не помеха. Можно провести другой эксперимент: посыпать воду молотым перцем и кинуть в нее кубик льда. За счет разницы температур возникнет перепад поверхностного натяжения, и перчинки поплывут в сторону кубика.
А еще интереснее посмотреть, как всеми этими эффектами можно управлять, так как поверхностное натяжение оказалось одним из самых «податливых» свойств воды. Самый известный бытовой пример — добавить к воде поверхностно-активное вещество, например мыло. В этом случае поверхность жидкости окажется стабилизирована, а натяжение значительно снизится. Попробуйте выдуть пузырь из чистой воды — не тут-то было, а из мыльной — пожалуйста: большая площадь поверхности уже не помеха. Можно провести другой эксперимент: посыпать воду молотым перцем и кинуть в нее кубик льда. За счет разницы температур возникнет перепад поверхностного натяжения, и перчинки поплывут в сторону кубика.
Снова вернемся к гидрофобным и супергидрофобным поверхностям: поскольку вода их очень не любит, она стремится максимально сократить площадь контакта с ними. Если каплю воды посадить на такую поверхность, мы увидим почти идеальный шар, который едва касается поверхности. Такие шарики очень легко заставить кататься, поэтому супергидрофобными поверхностями в основном интересуются для создания водоотталкивающих и антиобледенительных покрытий. Природа тоже давно их использует: лист лотоса, ножка водомерки, кожа акулы — вот лишь некоторые примеры. Гидрофобные поверхности оказались удачным решением и старых бытовых проблем: протекающего носика заварочного чайника, например. Если его снаружи покрыть гидрофобным материалом, заварка всегда будет литься только в чашку.
Природа тоже давно их использует: лист лотоса, ножка водомерки, кожа акулы — вот лишь некоторые примеры. Гидрофобные поверхности оказались удачным решением и старых бытовых проблем: протекающего носика заварочного чайника, например. Если его снаружи покрыть гидрофобным материалом, заварка всегда будет литься только в чашку.
Встречаются и совсем необычные эффекты управления поверхностным натяжением и смачиванием, например капли Ляйденфроста. Они образуются, если воду накапать на очень сильно нагретую поверхность: в этом случае между каплей воды и твердым телом возникает прослойка пара, поэтому капля свободно летает над поверхностью. Кстати, аналогичный эффект очень вредит промышленным водонагревателям: если их мощность слишком велика, на поверхности нагревателя образуется прослойка пара, которая блокирует теплообмен и приводит к перегреву устройства. В качестве других примеров необычных капиллярных явлений можно назвать эффекты, возникающие в отсутствие гравитации (например на орбите). Именно ими объясняются огромные капли воды, которые нам показывают в видеорепортажах про жизнь космонавтов: без силы тяжести поверхностное натяжение остается единственным фактором, определяющим форму капли, поэтому независимо от объема жидкость стремится стать шариком. На Земле же максимальный размер идеально круглых капель — несколько миллиметров. Если размер больше, гравитация придаст капле форму лужи.
Именно ими объясняются огромные капли воды, которые нам показывают в видеорепортажах про жизнь космонавтов: без силы тяжести поверхностное натяжение остается единственным фактором, определяющим форму капли, поэтому независимо от объема жидкость стремится стать шариком. На Земле же максимальный размер идеально круглых капель — несколько миллиметров. Если размер больше, гравитация придаст капле форму лужи.
Мы вспомнили лишь некоторые из свойств воды, с которыми мы сталкиваемся в повседневной и научной жизни. Существуют и многие другие особенности и эффекты — сольватация, диэлектрическая проницаемость, осмотическое давление — которые остались за кадром. Вода была и остается одним из самых популярных объектов для изучение в современной физической химии и материаловедении и чуть ли не главным залогом существования живых организмов, и каждый из названных эффектов играет в этом свою роль.
Тарас Молотилин
Аномальные свойства воды
- Авторы
- Руководители
- Файлы работы
- Наградные документы
Масалимова К.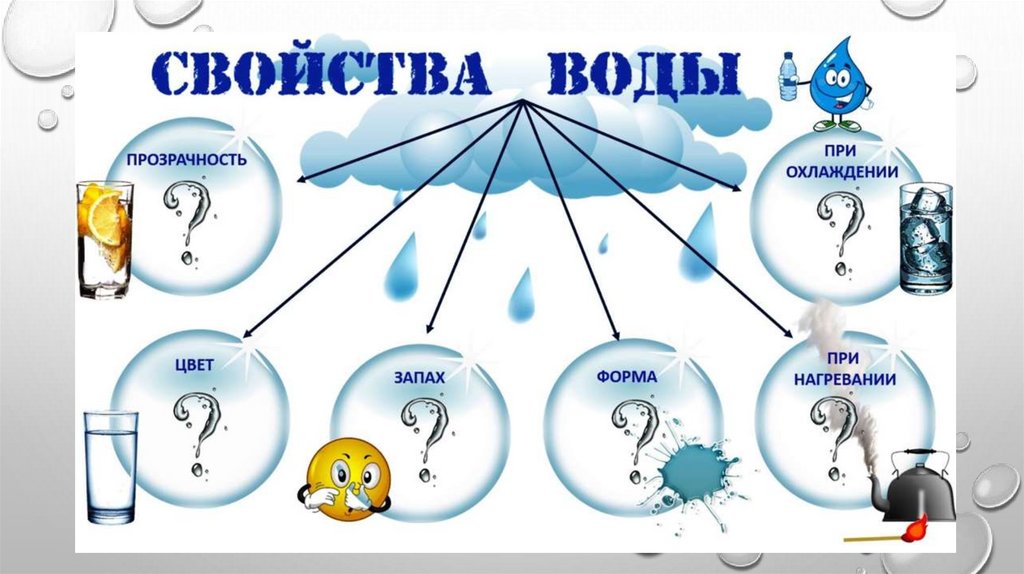 С. 1
С. 1
1МОУ СОШ № 1 г. Копейска Челябинской области
Лаврентьева В.Л. 1
1МОУ СОШ № 1 г. Копейска
Автор работы награжден дипломом победителя III степени
Диплом школьникаСвидетельство руководителя
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
ВВЕДЕНИЕ
Во 2 классе, на одном из занятий кружка «Необычное в обычном», учитель продемонстрировал нам как иголка не тонет на поверхности воды, налитой в небольшую емкость. Меня это удивило и заинтересовало. Как это может быть, ведь металлическая игла тяжелее? Я захотела подробнее узнать об этом удивительном свойстве воды, и выяснила, что она имеет еще и другие свойства. Я бы их назвала «волшебными», но ученые называют их «аномальными» свойствами воды.
Люди привыкли к воде, и считают ее обычным веществом.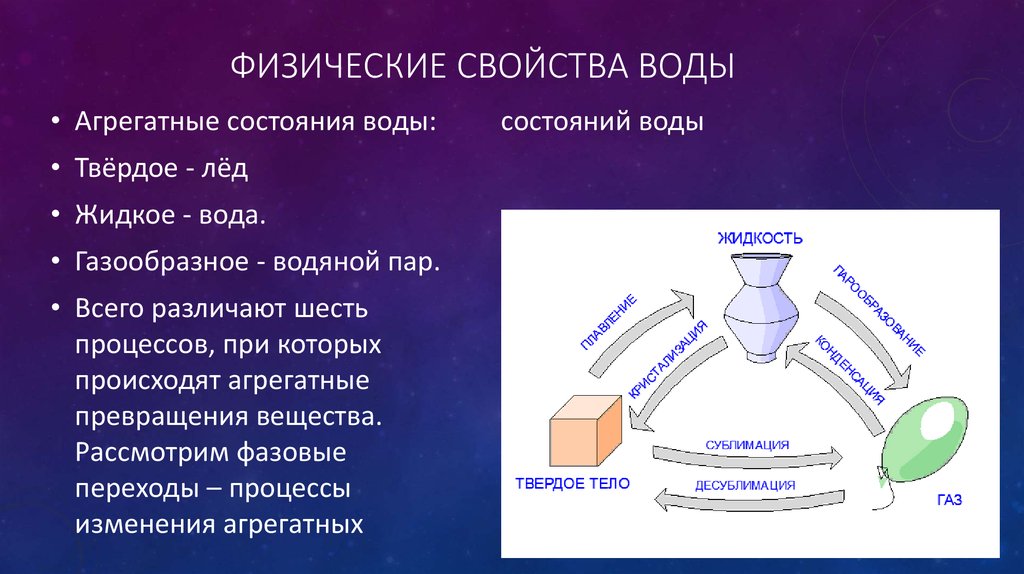 Многие не осознают, что структура воды и ее аномальные свойства обеспечивают существование жизни на Земле.
Многие не осознают, что структура воды и ее аномальные свойства обеспечивают существование жизни на Земле.
Наука до сих пор не смогла дать объяснение всем аномальным свойствам воды. Целый ряд свойств воды выпадает из общих закономерностей и правил, таких наук как физика и химия. Эти свойства не соответствуют законам «периодической системы», разработанной ученым-химиком Дмитрием Ивановичем Менделеевым. При этом, считается, что вся жизнь на Земле своим существованием во многом обязана аномальным свойствам воды, в частности — поверхностному натяжению. Так ли это на самом деле?
Обоснование выбора темы: с водой мы сталкиваемся ежедневно, и она занимает важнейшее место в нашей жизни. С одной стороны — нет ничего более простого и доступного на планете, как вода, с другой – более загадочного и уникального.
Цель исследования: выяснить причины уникальности воды; при проведении физико-химических опытов, доказать, что вода необычное вещество.
Задачи:
~ изучить и проанализировать литературу и информацию в Интернете по данной теме;
~ провести наблюдения за основными состояниями воды, её физическими свойствами;
~ определить и выделить удивительные свойства воды;
~ провести эксперименты и опыты, доказывающие уникальность воды;
~ понаблюдать, как человек использует необычные свойства воды;
~ сделать выводы.
Объект исследования: вода.
Предмет исследования: свойства воды, присущие только ей и неочевидные в природе.
Гипотеза: мы предположили, что аномальные свойства воды можно доказать в домашних условиях.
Методы исследования:
~ анализ литературы и других источников;
~ экспериментальная работа;
~ наблюдение.
Актуальность заключается в практической значимости уникальности воды на современном этапе развития науки и техники. Проект реализуется в рамках химии и физики и может быть квалифицирован как экспериментально-информационный.
Вода является неотъемлемым компонентом существования всего живого. Это объясняет интерес к обнаружению воды в других частях Вселенной. Все известные биохимические процессы происходят в водной среде. Она обладает свойствами, известными с древних времен. Именно благодаря этим особенностям ее и называют «основой жизни». Так в чем же «чудесность» этих свойств? Давайте разбираться.
Глава № 1. ВОДА В ПРИРОДЕ
Вода – самое значимое вещество для нашей планеты. Без нее на Земле жизнь невозможна, без нее не проходит ни один геологический процесс. Земная вода и поглощает, и возвращает очень много тепла и тем самым «выравнивает» климат. А от космического холода предохраняют Землю те молекулы воды, которые рассеяны в атмосфере – в облаках и в виде паров.
А от космического холода предохраняют Землю те молекулы воды, которые рассеяны в атмосфере – в облаках и в виде паров.
Вода входит в состав всех живых и растительных организмов. Вода присутствует не только в организме всех живых существ нашей планеты, но и во всех веществах на Земле – в минералах и горных породах.
Вода находится в постоянном и активном круговороте. Его движущей силой является Солнце, а основным источником воды — Мировой океан. Увлажняющая почву вода всасывается корнями растений. Вместе с водой растения получают растворенные питательные вещества. В растениях она поднимается по стеблям и возвращается в виде пара, в атмосферу через листья.
Вода в естественных природных условиях может существовать в трех агрегатных состояниях: твёрдое – лёд; жидкое – вода; газообразное — водяной пар. Один из ранних греческих философов, Фалес Милетский (640-546 гг. до нашей эры), исследовал универсальный характер воды. Он считал ее основным элементом, из которого рождается все. Обилие воды было очевидным, но Фалес заметил, что она является единственным веществом, естественным образом, присутствующим на Земле одновременно в трех разных состояниях: твердом, жидком и газообразном. В холодный зимний день снег и лед покрывают поля, рядом течет река, а над головой плывут облака.
Он считал ее основным элементом, из которого рождается все. Обилие воды было очевидным, но Фалес заметил, что она является единственным веществом, естественным образом, присутствующим на Земле одновременно в трех разных состояниях: твердом, жидком и газообразном. В холодный зимний день снег и лед покрывают поля, рядом течет река, а над головой плывут облака.
Глава № 2. УДИВИТЕЛЬНЫЕ СВОЙСТВА ВОДЫ
§ 1. Химическая формула воды. Физические свойства воды
Вода — это простейшее химическое соединение двух атомов водорода и одного атома кислорода: h3O. Из химических свойств воды особенно важна способность воды растворять вещества разной химической природы. Она удивительно легко растворяет большое количество самых разнообразных веществ и газов и, что тоже весьма важно, так же легко их отдает.
Физические свойства воды – это свойства, которые проявляются вне химических реакций. Основными физическими свойствами воды являются – запах, цвет, прозрачность, вкус, плотность, температура, жесткость, вязкость, структура.
Основными физическими свойствами воды являются – запах, цвет, прозрачность, вкус, плотность, температура, жесткость, вязкость, структура.
§ 2. АНОМАЛЬНЫЕ СВОЙСТВА ВОДЫ
Многие физические и химические свойства воды удивляют и выпадают из общих правил и закономерностей и являются аномальными. Отдельные свойства воды не соответствуют многим принципам физики и химии. Рассмотрим некоторые уникальные свойства воды.
Горячая вода застывает быстрее холодной
Удивительно, но факт – горячая вода замерзает быстрее холодной, что противоречит логике и общему восприятию вещей. Еще в древности Аристотель обращал внимание на это. В средние века ученые пытались объяснить данный феномен. Затем об этом неудобном факте забыли. И только в 1968 году «вспомнили» благодаря школьнику Эрасто Мпембе из далекой от всякой науки Танзании, который случайно заметил этот факт. Так его и назвали — эффект Мпембы – эффект горячей воды.
Высокая теплоемкость
Еще одним аномальным свойством воды является ее чрезвычайно высокая способность поглощать тепло без значительного повышения температуры. Пустой железный котелок, висящий над огнем, быстро раскалится докрасна, но если он заполнен водой, то его нагрев происходит постепенно. Теплоемкость воды в 10 раз превышает теплоемкость железа. Это значит, что для ее нагревания необходимо большое количество энергии, однако и при остывании энергии выделяется столько же. Это дает возможность в летнее время года накапливать тепло океанам и морям, а высвобождение тепла происходит в зимний период, Теплая вода легче холодной и всегда поднимается вверх. Благодаря этому явлению, называемому «конвекцией», большинство обитателей земных водоемов живут ближе к поверхности.
При замерзании вода увеличивается в объеме
В большинстве случаев при замерзании молекулы веществ располагаются ближе друг к другу, структура их становится компактнее и плотнее. Но с водой эта схема не работает. Плотность воды, при переходе ее из твердого состояния в жидкое, не уменьшается, как почти у всех других веществ, а возрастает. При замораживании объем воды увеличивается на 1%, но при этом становится не такой плотной, поэтому лед всегда легче воды, и находится на ее поверхности. Если бы озера замерзали снизу вверх, то водная жизнь вообще перестала бы существовать, а климатические и погодные условия резко изменились.
Но с водой эта схема не работает. Плотность воды, при переходе ее из твердого состояния в жидкое, не уменьшается, как почти у всех других веществ, а возрастает. При замораживании объем воды увеличивается на 1%, но при этом становится не такой плотной, поэтому лед всегда легче воды, и находится на ее поверхности. Если бы озера замерзали снизу вверх, то водная жизнь вообще перестала бы существовать, а климатические и погодные условия резко изменились.
Температура закипания
Температура замерзания и кипения воды не соответствуют общим закономерностям и законам химии. Так, мы знаем, что вода в реальной жизни замерзает при 0°C, а кипит при 100°C, в то время как в соответствии с общими правилами химии эти процессы должны проходить при -90°C (минус девяносто) и -70°C (минус 70) соответственно. При -120 ° С с водой начинают происходить странные вещи: она становится тягучей, как патока, а при температуре ниже -135 ° С превращается в «стеклянную» воду — твердое вещество, в котором отсутствует кристаллическая структура.
Вода – уникальный растворитель
Еще одним аномальным свойством воды является ее способность растворять другие полярные соединения – соли, спирты, карбоксильные соединения. В ней можно найти более половины известных химических элементов, одни в высоких концентрациях, а другие – только в следовых количествах. Между ее подвижных молекул могут «затесаться» практически любые вещества – от жидкостей до металлов. Неполярные соединения, в том числе большинство углеводородов, растворяются в низких или следовых количествах. Например, масла, как правило, плавают на поверхности воды.
Поверхностное натяжение
К аномальным свойствам воды относят и ее самое высокое (после ртути) поверхностное натяжение по сравнению с любой другой жидкостью. Молекулы воды активно притягиваются друг к другу, в результате ее поверхность, стремится к минимуму. Именно поэтому естественной формой любой жидкости является шар. Объекты, более тяжелые, чем вода, могут удерживаться на ее поверхности. Насекомые способны ходить по ней, а лезвие бритвы или игла – плавать.
Объекты, более тяжелые, чем вода, могут удерживаться на ее поверхности. Насекомые способны ходить по ней, а лезвие бритвы или игла – плавать.
§ 3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Те аномальные свойства воды, которые мы описали выше, попробуем проверить в домашних условиях.
Опыт № 1. Проведем эксперимент и понаблюдаем за горячей и холодной водой в морозильной камере.
Условия: В ячейки для льда я налила теплую воду 35 ° С и поставила в морозильную камеру, засекла время превращения воды в лёд. Тоже самое проделала с холодной водой – 0,5 ° С.
Результат: тёплая вода превратилась в лед через 20 минут; холодная вода превратилась в лед через 25 минут. Для опыта необходима вода определенной температуры.
Вывод: горячая вода замерзает быстрее, чем холодная при определенных условиях.
Опыт № 2. В ходе работы над проектом я обратила внимание, что вода может перемещаться самостоятельно.
Условия: Я взяла 3 стакана, в два из них налила воду. Третий оставила пустым и к нему перекинула «мостики» из бумажных салфеток.
Результат: вода по «мостикам» «перешла» в пустой стакан, уровень воды в 3-х стаканах стал почти одинаковый.
Вывод: вода может подниматься вверх без посторонней помощи (приложение № 2) Это удивительное свойство помогает растениям получать влагу из почвы и перемещать от корней по стеблям к листьям.
Опыт № 3. Я задумалась, а какая вода быстрее будет подниматься вверх?
Условия: Я взяла 2 стакана: № 1 — с теплой водой и № 2 — с холодной водой; две полоски картона, один конец которых окрашен в разные цвета маркерами; опустила концы полосок картона в стаканы.
Результат: Краски маркера на полоске в тёплой воде поднялись вверх быстрее и выше, чем в холодной.
Вывод: теплая вода поднимается вверх быстрее холодной (приложение № 3). Теперь мне понятно, почему растения нужно поливать теплой водой, она доставит необходимые питательные вещества из почвы и живительную влагу быстрее.
Опыт № 4. Горку можно соорудить практически из чего угодно — и песка, соли, сахара. А можно ли сделать неподвижную горку из воды?
Условия: Я взяла хорошо вымытый сухой стакан, наполнила его водой до отказа, после чего аккуратно опускала в него по одной монете.
Результат: По мере опускания монет в стакан, вода из него не выливалась, а начала понемногу приподниматься, образуя горку. Это хорошо заметно, если посмотреть на стакан сбоку. По мере увеличения в стакане количества монет, горка становилась всё выше — поверхность воды надулась, словно воздушный шарик. Однако, в какой-то момент этот шарик лопнул, и вода струйками потекла по стенкам стакана. В этом опыте горка на поверхности воды образуется за счёт поверхностного натяжения.
Однако, в какой-то момент этот шарик лопнул, и вода струйками потекла по стенкам стакана. В этом опыте горка на поверхности воды образуется за счёт поверхностного натяжения.
Вывод: Взаимодействуя с твёрдой поверхностью, вода плохо к ней прилипает и плохо растекается. Именно поэтому она не стекает сразу же через край стакана при образовании горки (приложение № 4).
Опыт № 5. А можно ли управлять плавающими на поверхности предметами, при этом ничем их не касаясь.
Условия: В миску, наполненную водой, аккуратно положила 10-12 спичек. Расположила их в форме лучей звезды, по возможности равномерно. Взяла жидкое мыло и капнула в воду в центре спичечной звезды.
Результат: Спички тут же начали плыть от него к краям блюдца.
В другой миске вместо мыла опустила в центр спичечной звезды кончик кусочка сахара-рафинада.
Результат: Спички, наоборот, поплыли в обратном направлении и собрались возле погружённого в воду сахара.
Вывод: Такое поведение спичек обусловлено следующим: погружая в воду разные вещества (мыло и сахар), мы тем самым изменяем силу поверхностного натяжения. Когда капаешь мыло на поверхность жидкости, оно растворяется и смешивается с ней. Молекулы мыла проходят между молекулами воды и снижают их взаимное притяжение. Сахар действует противоположно мылу — он увеличивает поверхностное натяжение. (приложение № 5).
Опыт № 6. Следующий опыт показал, что поверхность воды может растягиваться. Как вы думаете, сколько капелек воды поместится на обычной монетке?
Условия: Я положила монетку на блюдце, а блюдце — на очень ровную поверхность. В пипетку набрала воды, капнула воду в центр монетки с очень близкого расстояния.
Результат: Опытным путем мной установлено, что на 2-х рублевой монетке помещается 20 капель воды, а на 5-ти рублевой — 28 капель. Вода на монете располагается не ровным тонким слоем, как это может показаться перед экспериментом, а образует горку. Поверхность воды растягивается и становится все более выпуклой с каждой новой каплей до тех пор, пока тонкая пленка, которую образует поверхность воды, не порвется. И тогда почти вся вода с монетки вытечет в блюдце
Вода на монете располагается не ровным тонким слоем, как это может показаться перед экспериментом, а образует горку. Поверхность воды растягивается и становится все более выпуклой с каждой новой каплей до тех пор, пока тонкая пленка, которую образует поверхность воды, не порвется. И тогда почти вся вода с монетки вытечет в блюдце
Вывод: Поверхность воды растягивается за счет поверхностного натяжения (приложение № 6).
Опыт № 7. В предыдущем опыте мы убедились, что поверхность воды похожа на тонкую пленку, которая может растягиваться. Теперь мы сможем рассмотреть эту пленку, и увидеть, что она может не только удерживать воду внутри, но и не дает утонуть относительно тяжелым предметам и прогибаться под их весом.
Условия: Я налила воду в стакан, взяла иголку и, держа ее горизонтально, поднесла максимально близко к поверхности воды и опустила.
Результат: Иголка плавает и можно будет рассмотреть, как поверхность воды прогибается под ее весом.
Вывод: Поверхностное натяжение воды позволяет удерживать на поверхности достаточно тяжелые предметы (приложение № 7).
Опыт № 8. В холодное время года наши квартиры теплые благодаря паровому отоплению. А почему в батареях именно вода?
Условия: Я поставила металлический ковш на плиту. Через 10 секунд его нельзя взять в руки — он раскален, так как металл нагрелся. В этот же ковш нальем стакан воды и поставим на плиту. Доводим до кипения, на это нужно уже больше времени. Переливаем горячую воду из ковша в стакан с ложкой.
Результат: Через десять минут металлический ковш остыл, а стакан стал очень горячим. Вода нагрела ложку и стенки стакана.
Вывод: У воды есть свойство долго удерживать тепло. Поэтому в батареях именно вода, ну и, конечно, вода самое доступное текучее вещество (приложение № 9).
Опыт № 9. Вода имеет свойство менять плотность при переходе в твердое состояние. Так ли это на самом деле?
Условия: Я взяла стеклянную бутылку, налила воду и поместила её в морозильную камеру холодильника.
Результат: вода замерзла и расширилась, её объём увеличился и бутылка растрескалась.
Вывод: Вода при низких температурах превращается в лед и при этом расширяется (приложение № 10).
Опыт № 10. Логично было бы предположить, что замерзая, вода, как и любое другое вещество становится тяжелее.
Условия: Кусочек льда я опустила в стакан с водой.
Результат: Лед плавает на поверхности и не тонет.
Вывод: Замерзая, вода увеличивается в объеме, но структура становится более рыхлой. Поэтому лед, легче самой воды, он плавает на поверхности и не тонет.
Поэтому лед, легче самой воды, он плавает на поверхности и не тонет.
Опыт № 11. Приведем еще один интересный опыт, который продемонстрирует теплопроводность воды.
Условия: В воздушный шарик я налила холодную воду и немного надула. Поднесла шарик к горящей свече.
Результат: Воздушный шар не лопнул, так как в нем вода. Надуваем другой воздушный шарик и подносим к огню, он лопнул.
Вывод: Теплопроводность воды в 24 раза выше, чем у воздуха. Пока вода не испарится в шарике, он не лопнет (приложение № 12).
Опыт № 12. Жидкости, имеющие разную плотность – не смешиваются.
Условия: В стакан я поочерёдно налила жидкости разной плотности и цвета (растительное масло и воду).
Результат: они не смешиваются.
Вывод: Водородная связь определяет аномальное свойство воды смачивать большинство поверхностей. Такие вещества считаются гидрофильными. Другие вещества, такие как масла, жиры, воск и синтетика не намокают. Они являются гидрофобными. Разная плотность не дает смешиваться молекулам воды и масла (приложение № 13) .
Такие вещества считаются гидрофильными. Другие вещества, такие как масла, жиры, воск и синтетика не намокают. Они являются гидрофобными. Разная плотность не дает смешиваться молекулам воды и масла (приложение № 13) .
4. ЗАКЛЮЧЕНИЕ
Объект моего исследования – вода — кажется будничным и естественным, только на первый взгляд. Исследование позволило мне сделать вывод, что многие свойства воды, присущи только ей, они обязательно встречаются в природе, но они совсем не так очевидно представляются глазам наблюдателя, как в наших опытах. На основе опытов, мы доказали уникальность воды, как химического вещества, а физические свойства воды действительно обусловлены особенностями ее строения. Гипотеза, что аномальные свойства воды можно доказать в домашних условиях – подтвердилась.
В данной работе были рассмотрены такие уникальные свойства воды, как высокая теплоёмкость, плотность, теплопроводность, конвекция или перемешивание, поверхностное натяжение.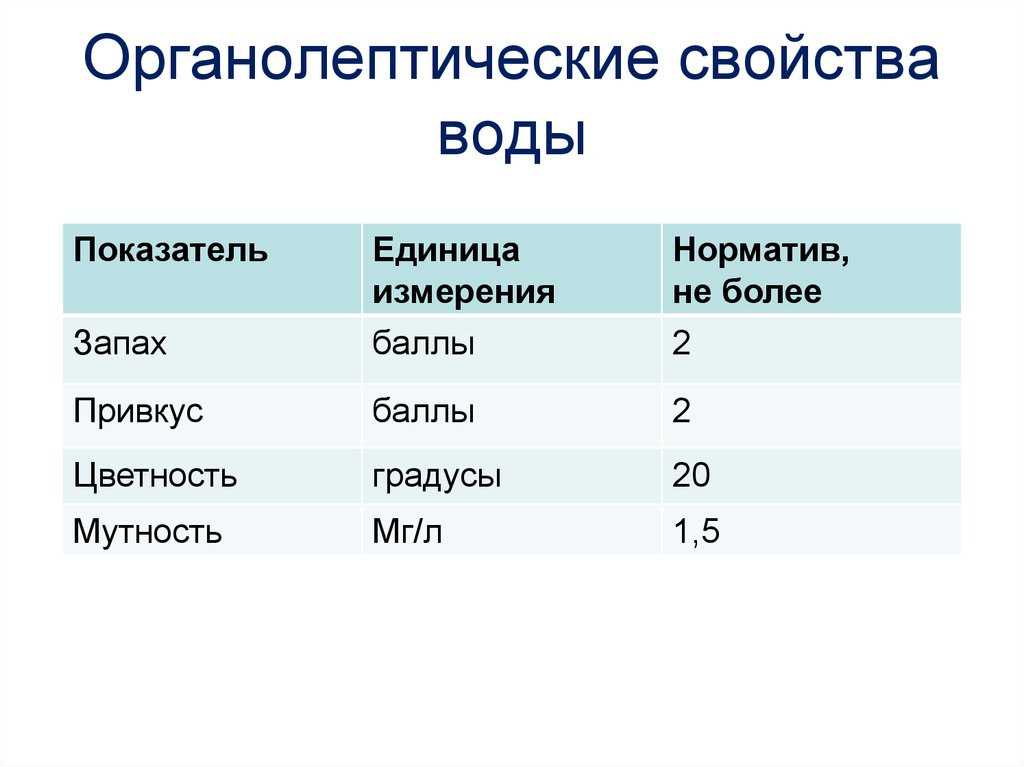
Научная новизна:
~ опытным путём рассмотрены различные свойства воды, являющиеся уникальными, как физико-химического вещества;
~ экспериментально установлено, что физические свойства воды действительно обусловлены особенностями ее строения. На основе это, было доказана уникальность воды, как химического вещества.
Материалы исследования можно применять и использовать на уроках физики в 7-8 классах при изучении темы «Состав и физические свойства воды», а также на факультативных занятиях, внеклассных мероприятиях.
В ходе работы над проектом я научилась самостоятельности, у меня появился интерес к предметам физика и химия, которые мне еще только предстоит изучать, развились исследовательские умения и навыки, например, умение пользоваться дополнительной литературой, думать, рассуждать, делать выводы.
Список использованной литературы
1. Вода для жизни. Сбережем воду – сохраним жизнь. / авт.-сост. А. Н. Пахоменко и др. – Могилев: Могилев. обл. укруп. тип,
Вода для жизни. Сбережем воду – сохраним жизнь. / авт.-сост. А. Н. Пахоменко и др. – Могилев: Могилев. обл. укруп. тип,
2. Врублевский А. И. Основы химии. Школьный курс. – 2-е изд. – Мн.: Юнипресс, 2010г. – 960 с.
3. Глинка Н. Л. Общая химия: учеб. пособие для вузов. – 23-е изд., испр. /Под ред. В. А. Рабиновича. – Л.: Химия, 1983г. – 704 с.
4. Энциклопедический словарь юного физика — М.: Педагогика, 1981
5. https://www.syl.ru/article/368647/anomalnyie-svoystva-vodyi-prichinyi znachenie
6. http://poznayka.org/s63232t1.html
7. https://vodamama.com/anomalnye-svojstva.html
9. http://sekretzdorovja.com/voda/maloizvestnoe-o-vode.html
Приложение № 1
Справа – стакан с водой +35 °C, слева – стакан с водой — 0, 5 °C
Горячая вода начала превращаться в лед через 20 минут, холодная через 25 минут
Приложение № 2
средний стакан пустой, в двух крайних стаканах – вода
вода по бумажным мостикам перешла в средний стакан
Приложение № 3
картонную полоску с отметкой черного цвета опускаем в стакан с холодной водой, с отметкой коричневого цвета – в стакан с теплой водой
теплая вода поднимается вверх быстрее, чем холодная
Приложение № 4
«горка» из воды
Приложение № 5
мыло уменьшает, а сахар увеличивает, а поверхностное натяжение воды
Приложение № 6
на двухрублевой монете помещается 20 капель воды
на пятирублевой монете помещается 28 капель воды
Приложение № 7
на поверхности воды спокойно плавают металлические игла, скрепка, лезвие
Приложение № 8
горячий металлический ковш остыл очень быстро, а стакан с водой – нет
Приложение № 9
при замерзании вода увеличилась в объеме
Приложение № 10
кусочек льда не тонет в воде
Приложение № 11
воздушный шар, наполненный водой, не лопается
воздушный шар, без воды лопнул сразу
Приложение № 12
растительное масло и вода не смешиваются
Просмотров работы: 12117
Видео-урок: Свойства воды
Стенограмма видео
В этом видео мы узнаем о
многие уникальные свойства воды, и мы рассмотрим, почему молекулы воды
полярный. Мы узнаем, как это полярно
природа приводит к некоторым из его очень важных физических и химических свойств.
Мы узнаем, как это полярно
природа приводит к некоторым из его очень важных физических и химических свойств.
Вода является важной молекулой для жизнь на нашей планете. Поверхность Земли покрыта около 71 процента воды. Биологическим системам нужна вода, чтобы поддерживать жизнь. Вода выполняет функции клеток и возможны живые организмы, от крошечных бактерий до растений и животных. Но что делает воду такой критический?
Вероятно, вы хорошо знакомы с
вода в виде Н3О. Это химическая формула воды,
что говорит нам о том, что каждая его молекула имеет два атома водорода и один атом кислорода.
атом. Атомы в молекуле воды
ковалентно связаны друг с другом. Это означает, что каждый атом водорода
делит пару электронов с атомом кислорода. Атомы кислорода содержат восемь протонов
и восемь электронов, тогда как атомы водорода содержат только один протон и один
электрон.
Мы знаем, что противоположные заряды привлекать. И поэтому отрицательно заряженные электроны притягиваются к положительно заряженным протонам. По количеству положительных зарядов увеличивается, притяжение усиливается. Это упрощенный способ обсуждения термин «электроотрицательность».
Электроотрицательность является свойством который измеряет, насколько сильно атом притягивает электронную пару или пары из химическая связь. Кислород, имеющий большее количество положительно заряженные протоны, имеет большую электроотрицательность, чем водород. Он тянет электроны, которые они разделяют сильнее.
В ковалентных связях чем больше
положительно заряженное ядро кислорода сильнее притягивает общие электроны
чем атомы водорода. Это приводит к концу молекулы
содержащие кислород, чтобы быть более отрицательным. И наоборот, это приводит к окончанию
молекула с атомами водорода более положительна, так как электроны
оттягивается от них.
И наоборот, это приводит к окончанию
молекула с атомами водорода более положительна, так как электроны
оттягивается от них.
В то время как первая диаграмма эффективно показывает электроны в воде, мы часто будем видеть молекулу воды, представленную эта шаровидная модель. Мы видим, что молекула воды имеет трехмерная изогнутая форма с углом 104,5 градуса между водородом атомы. Для представления противоположных зарядов сторон молекулы мы можем использовать символы 𝛿− и 𝛿+. 𝛿− представляет собой частичное отрицательный заряд, а 𝛿+ представляет частичный положительный заряд. Мы должны отметить, что в то время как молекула имеет противоположно заряженные концы, электроны в связях все еще общий. Итак, концы молекул только частично заряжены, а не полностью заряжены, как ионы.
Один из самых важных
Особенности заключается в том, что молекула воды является полярной молекулой. Полярная молекула представляет собой ковалентно
связанная молекула, где разница в электроотрицательности между элементами в
молекула относительно велика. Как мы видели, это приводит к
один конец молекулы постоянно и слегка положителен, а другой
конец постоянный и слегка отрицательный. Давайте рассмотрим, как полярность
молекула воды делает ее одной из самых важных молекул на Земле.
Полярная молекула представляет собой ковалентно
связанная молекула, где разница в электроотрицательности между элементами в
молекула относительно велика. Как мы видели, это приводит к
один конец молекулы постоянно и слегка положителен, а другой
конец постоянный и слегка отрицательный. Давайте рассмотрим, как полярность
молекула воды делает ее одной из самых важных молекул на Земле.
Полярность воды приводит к
увлекательное поведение между молекулами. До сих пор мы обсуждали воду и
его структура в одной молекуле. Однако на самом деле даже всего за
крошечная капля воды, всегда есть миллионы и миллионы молекул воды
присутствуют и взаимодействуют вместе. Они испытывают то, что
называются межмолекулярными силами, которые представляют собой силы притяжения и отталкивания между
отдельные молекулы. Молекулы воды могут образовывать особые
вид межмолекулярных сил, называемый водородной связью. Водородная связь — это притяжение
между водородом и отрицательным концом соседней молекулы. Зеленые пунктирные линии в
на диаграмме показано, где будут образовываться водородные связи.
Водородная связь — это притяжение
между водородом и отрицательным концом соседней молекулы. Зеленые пунктирные линии в
на диаграмме показано, где будут образовываться водородные связи.
Хотя мы используем термин «связь» для описывают эти взаимодействия, они не являются химическими связями. Химическая связь – это сила, которая удерживает атомы или ионы вместе, образуя молекулу или соединение. Химические связи очень прочны. Водородные связи держатся раздельно молекулы вместе. Хотя водородные связи прочны и требуют много энергии для преодоления, они слабее химических связей. Эта способность образовывать водородные связи уникальна для небольшой группы соединений. И эти взаимодействия приводят к важные свойства.
Один из первых физических
свойства, которые мы обсудим, — это растворимость в воде из-за ее очень полярной природы. Это позволяет быть очень
эффективный полярный растворитель. Это означает, что это вещество,
растворяет полярные растворы. Растворенное вещество – это вещество, которое
растворяясь в другом веществе. Есть много полярных растворов, которые
можно растворить водой. Пример водорастворимого
вещество является ионным соединением. Полярные соединения также могут быть
растворяется в воде. Посмотрим на раствор
поваренная соль, представляющая собой ионное соединение.
Это позволяет быть очень
эффективный полярный растворитель. Это означает, что это вещество,
растворяет полярные растворы. Растворенное вещество – это вещество, которое
растворяясь в другом веществе. Есть много полярных растворов, которые
можно растворить водой. Пример водорастворимого
вещество является ионным соединением. Полярные соединения также могут быть
растворяется в воде. Посмотрим на раствор
поваренная соль, представляющая собой ионное соединение.
Поваренная соль легко растворяется в
вода, поскольку ее противоположно заряженные ионы отделяются и смешиваются с частичными зарядами
молекулы воды. Молекулы воды способны разрушаться
ионные соединения из-за их полярности. Полярные ковалентные соединения также
вода. Такое соединение, как сахар, является полярным. Зерна сахара состоят из
множество отдельных молекул сахара. Молекулы сахара могут разделяться и
растворяются из зерен при добавлении в воду. Их частично, но навсегда
заряженные концы могут взаимодействовать с концами воды, растворяя более крупные части.
Молекулы сахара могут разделяться и
растворяются из зерен при добавлении в воду. Их частично, но навсегда
заряженные концы могут взаимодействовать с концами воды, растворяя более крупные части.
Растворенные вещества, не растворяющиеся в вода неполярные соединения. Пример неполярного соединения масло. Когда масло смешивается с водой, оно не растворяется. А вместо этого неполярные молекулы отдельно от полярных молекул воды. Мы, вероятно, увидим нефть и вода в совершенно разных слоях, так как нефть не растворялась бы в воде.
Прочие важные физические свойства
воды – это ее уникальные температуры кипения и плавления. Температура кипения вещества равна
температура, при которой он переходит из жидкого состояния в газообразное. Температура плавления – это
температура, при которой твердое состояние переходит в жидкое. При температуре кипения и плавления
вещества высока, это означает, что для
изменить состояние вещества. Другими словами, межмолекулярное
силы, удерживающие молекулы рядом друг с другом, велики. А для этого требуется много энергии.
преодолеть их и переставить частицы.
При температуре кипения и плавления
вещества высока, это означает, что для
изменить состояние вещества. Другими словами, межмолекулярное
силы, удерживающие молекулы рядом друг с другом, велики. А для этого требуется много энергии.
преодолеть их и переставить частицы.
Мы можем сравнить молекулу, подобную
к воде, чтобы понять значение ее температур кипения и плавления. Сероводород содержит один
атом серы и два атома водорода и имеет такой же размер и форму, как вода. Однако их температура плавления
крайне разные, с водой, плавящейся при нуле градусов по Цельсию, и сероводородом
плавится при минус 82 градусах Цельсия. Мы видим аналогичную картину с их
температуры кипения, при температуре кипения воды 100 градусов Цельсия и сероводорода
кипячение при минус 60 градусах Цельсия. При более низких температурах, при которых
происходят фазовые переходы, молекулы сероводорода требуют меньше энергии для разделения
друг от друга. Это связано с тем, что межмолекулярное
силы слабее, так как сероводород не может образовывать водородные связи. По отношению к другим молекулам
Подобная структура, вода имеет высокие температуры кипения и плавления.
Это связано с тем, что межмолекулярное
силы слабее, так как сероводород не может образовывать водородные связи. По отношению к другим молекулам
Подобная структура, вода имеет высокие температуры кипения и плавления.
Давайте посмотрим на различные агрегатные состояния воды. Мы видели относительно высокий температуры плавления и кипения воды. Мы подробнее рассмотрим твердое состояние вещества воды, называемое льдом, которое замерзает при нуле градусов Цельсия. Пока в жидком виде, как у нас Как уже было замечено, молекулы воды образуют прочные водородные связи друг с другом. Это расположение неравномерно и с небольшим пространством между отдельными молекулами.
Когда температура падает до
около нуля градусов по Цельсию и ниже начинает формироваться твердое тело. Молекулы воды образуют упорядоченное и
уникальный узор. В отличие от большинства веществ, при
замерзая, вода образует шестиугольный узор, который более расплывается, чем ее жидкая
форма. При образовании льда масса
вода остается прежней. Однако объем увеличивается. Таким образом, лед имеет меньшую плотность.
В отличие от большинства веществ, при
замерзая, вода образует шестиугольный узор, который более расплывается, чем ее жидкая
форма. При образовании льда масса
вода остается прежней. Однако объем увеличивается. Таким образом, лед имеет меньшую плотность.
Плотность вещества – это
мера его массы в единице объема пространства. Твердая вода имеет меньшую плотность
чем жидкая вода. Мы можем видеть это во многих повседневных
Примеры. Кубики льда в стакане воды плавают
к поверхности жидкости. Вода в прудах и озерах
поддерживает жизнь даже при очень низких температурах. Только самая верхняя часть
вода замерзает и всплывает, оставляя жизнь под ней нетронутой твердым телом. Пока есть другие сложные
причины, позволяющие водным обитателям выживать даже при температуре воздуха ниже
точки замерзания воды плотность льда вносит свой вклад. Если бы твердая вода была более плотной, она
утонет при замерзании.
Если бы твердая вода была более плотной, она
утонет при замерзании.
Другой пример, демонстрирующий Плотность льда – это расширение воды при замерзании. Когда скала или цемент смачиваются, вода просачивается в материал. Если вода останется в скале, когда температура падает примерно до точки замерзания, вода при замерзании расширяется, что приводит к растрескиванию и разрушению материала. Это можно было наблюдать и из положить напиток в морозилку.
Теперь мы рассмотрим некоторые химические
свойства воды. Одним из химических свойств воды является
его отсутствие кислотности или щелочности. Вода нейтральна, что может быть
проверяется с помощью простого лабораторного теста. Мы можем провести лакмусовую бумажку. Красная и синяя лакмусовая бумага может проверить
кислотность и основность вещества. И красные, и синие бумаги будут
кажутся красными, если вещество кислое.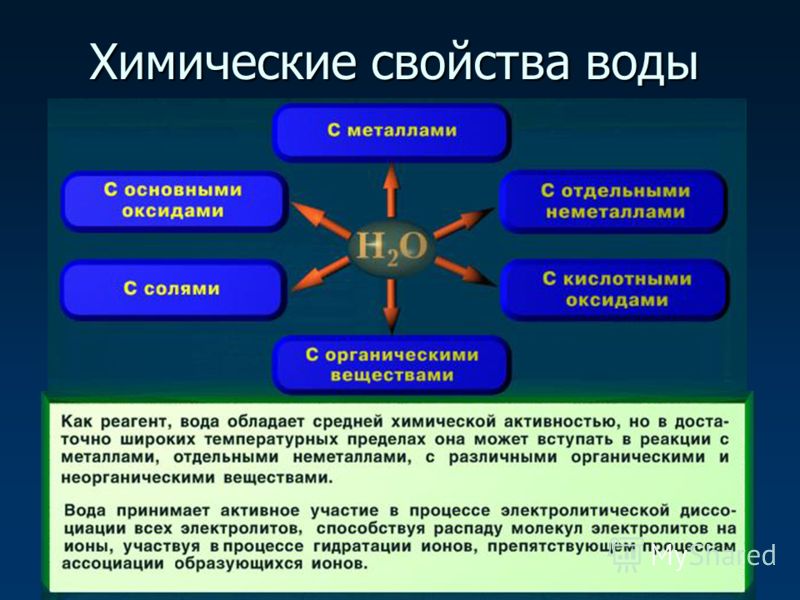 Если вещество является основным, то оба
бумаги будут синими. Как и в случае с водой, оба
бумаги остаются теми же, если вещество нейтрально. Нейтральное химическое свойство воды
позволяет ему быть важным и безопасным соединением в регуляции многих биологических
системы.
Если вещество является основным, то оба
бумаги будут синими. Как и в случае с водой, оба
бумаги остаются теми же, если вещество нейтрально. Нейтральное химическое свойство воды
позволяет ему быть важным и безопасным соединением в регуляции многих биологических
системы.
Другим химическим свойством является
реакционная вода подвергается образованию водорода и кислорода во время электролиза. При правильных условиях вода
может распадаться с образованием газообразного водорода и газообразного кислорода. Электролиз может быть использован для
эта реакция. Электролиз – это процесс, при котором
электрический ток пропускают через жидкость или раствор, что вызывает
вещества внутри разлагаются. Когда вещество разлагается, оно
разрушается путем разрыва химических связей его частиц. В этом случае жидкость,
ток проходит через воду.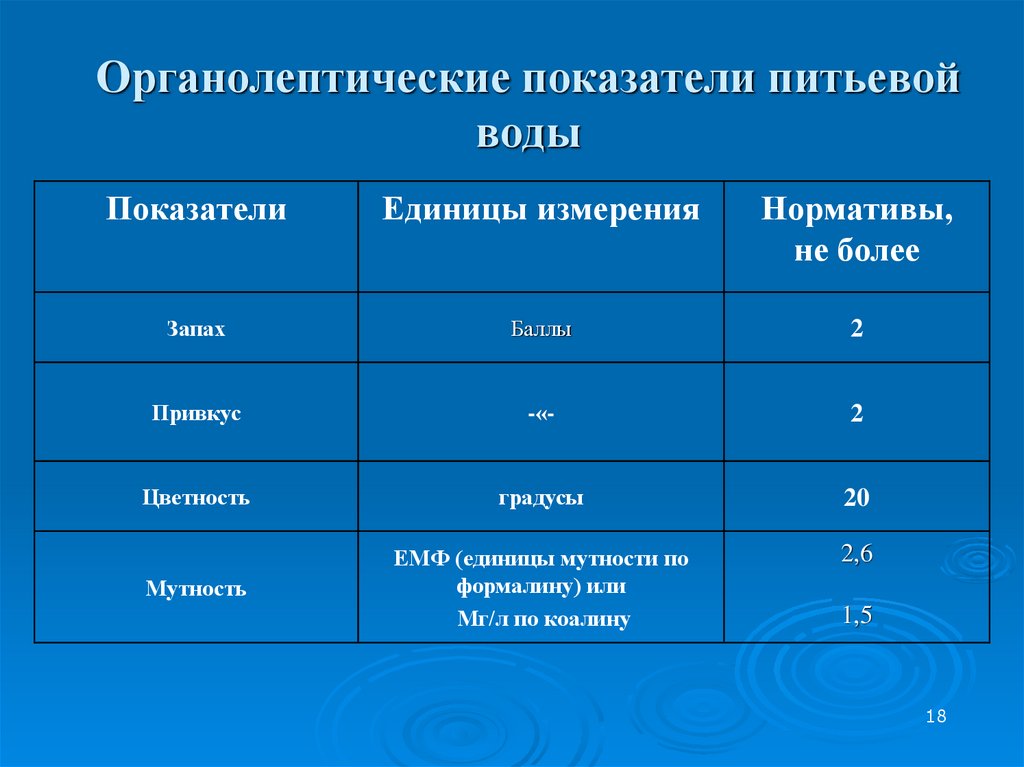 Химические связи, удерживающие воду
молекулы вместе разрушаются. И новые связи формируются для производства
газообразные водород и кислород.
Химические связи, удерживающие воду
молекулы вместе разрушаются. И новые связи формируются для производства
газообразные водород и кислород.
Аппарат Хофмана Для этого можно использовать вольтметр. Вода в вольтаметре Хоффмана подкисляется, то есть добавляется небольшое количество кислоты для улучшения способности проводить электрический ток. При подключении к электросети ток, подкисленная вода расщепляется на два газа. Двойное количество газообразного водорода производится в этой реакции по сравнению с газообразным кислородом. Это пример одного из вода может подвергаться многим химическим реакциям.
Давайте попрактикуемся.
Кислород более электроотрицательный, чем
водорода и притягивает связывающие электроны в молекуле воды ближе к
сам. 𝛿+ и 𝛿− используются, чтобы показать
Частичные заряды в химии. На какой схеме правильно показано
частичные заряды молекулы воды?
На какой схеме правильно показано
частичные заряды молекулы воды?
Символ 𝛿+ означает, что часть молекулы частично положительна из-за отрыва электронов. Символ 𝛿− означает, что часть молекулы частично отрицательна из-за сближения электронов. Мы знаем, что атом кислорода в вода является более электроотрицательным атомом и, таким образом, вытягивает электроны из связи ближе к себе.
Красный круг обозначает
атом кислорода, а белые кружки — атомы водорода. Электроны в связях
притягивается ближе к атому кислорода. Это вызывает неравномерное распределение
заряда, причем конец молекул, содержащих кислород, частично
отрицательный. Это означает, что символ 𝛿−
подходит на этом конце молекулы. Тогда атомы водорода будут
частично положительные и должны быть отмечены 𝛿+. Это соответствует схеме (А).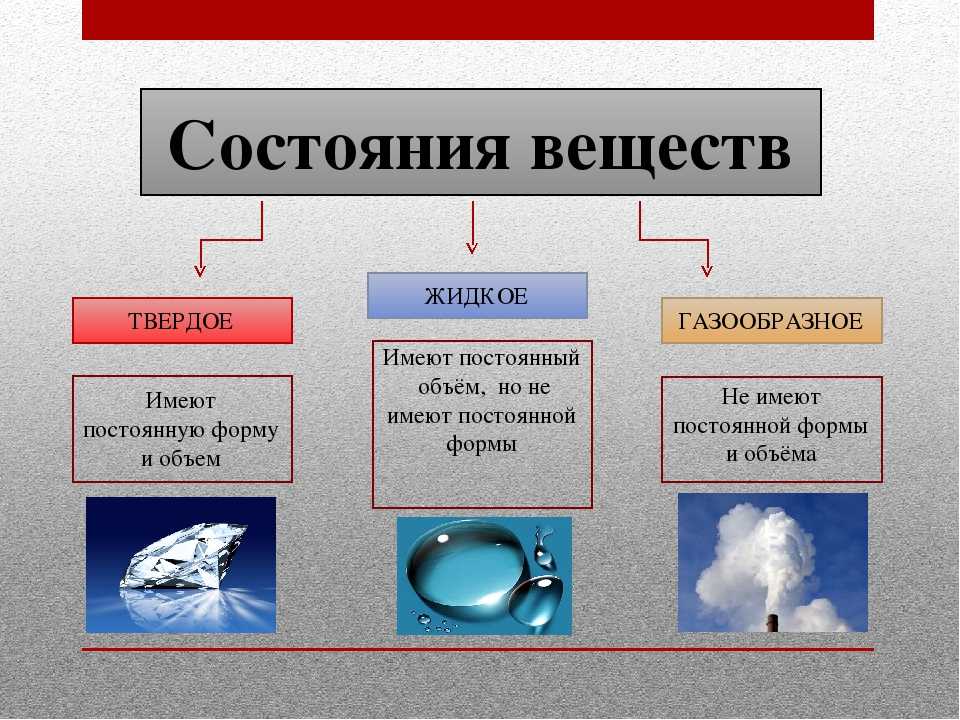 Поэтому схема, которая
правильно показаны частичные заряды молекулы воды – это вариант ответа (А).
Поэтому схема, которая
правильно показаны частичные заряды молекулы воды – это вариант ответа (А).
Какое название дано растворителю как вода, способная растворять ионные вещества, такие как соль? (А) полярный растворитель, (Б) неполярный растворитель, (C) электростатический растворитель, (D) ионизированный растворитель или (E) водород растворитель.
Нас спрашивают, как обратиться к
растворитель, такой как вода. Термин «растворитель» используется для
описывают вещества, которые эффективно растворяют другие вещества. Существуют различные типы
растворители. Мы ищем имя
растворитель, обладающий свойствами воды и способный растворять ионные вещества, такие как
соль. Соль – это ионное соединение, состоящее из
противоположно заряженных ионов, которые притягиваются друг к другу. Для растворения ионов
вещества, притяжение между ионами должно быть преодолено. Молекулы воды способны
преодолеть это притяжение и растянуть ионы в ионных соединениях друг от друга. Это связано с тем, что вода состоит из
полярные молекулы.
Молекулы воды способны
преодолеть это притяжение и растянуть ионы в ионных соединениях друг от друга. Это связано с тем, что вода состоит из
полярные молекулы.
Полярные молекулы ковалентно связаны и имеют частично положительные и частично отрицательные концы. Частично положительные концы молекулы воды притягивают отрицательные ионы. И частично отрицательные концы притягивают положительные ионы. Это растворяет ионные вещество. Этот тип растворителя состоит из полярные молекулы, способные растворять ионные вещества, называют полярными растворителями. Поэтому название, данное А. растворитель, такой как вода, который способен растворять ионные вещества, такие как соль, представляет собой (А), полярный растворитель.
Теперь давайте посмотрим, что у нас есть
узнали о воде и ее свойствах. Вода является критически важным
молекула. Вода получает много своих уникальных
свойства от его полярности. Многие его физические свойства
в результате сильных межмолекулярных сил, называемых водородными связями. Некоторые из этих свойств включают
является полярным растворителем, имеет высокие температуры плавления и кипения и образует твердый лед.
с низкой плотностью. Некоторые его химические свойства
включают нейтральность и выделение водорода и кислорода во время электролиза.
Вода получает много своих уникальных
свойства от его полярности. Многие его физические свойства
в результате сильных межмолекулярных сил, называемых водородными связями. Некоторые из этих свойств включают
является полярным растворителем, имеет высокие температуры плавления и кипения и образует твердый лед.
с низкой плотностью. Некоторые его химические свойства
включают нейтральность и выделение водорода и кислорода во время электролиза.
5 способов сделать свойства воды интересной темой для учащихся
Жизнь невозможна без воды. Многие жизненные процессы зависят от воды, но почему? Ответ в его химии; уникальные качества и свойства воды делают ее незаменимой и фундаментальной для жизни.
Вода — отличный растворитель, способный растворять питательные вещества в нашей крови. Он хорошо держит температуру за счет своей теплоемкости, поэтому жизнь в озерах и прудах не умирает, когда температура воздуха ночью падает. Он также поддерживает клеточную структуру, благодаря чему клетки сохраняют свою форму.
Он также поддерживает клеточную структуру, благодаря чему клетки сохраняют свою форму.
Вода существует в трех состояниях: вода, твердое тело и газ. Каждое состояние обладает уникальными свойствами, но химические структуры (два атома водорода и один кислород) остаются одинаковыми во всех формах. Изучение воды и ее тонкостей жизненно важно для старшеклассников, поскольку это помогает прикоснуться к основе и проложить маршрут для дополнительных сложных предметов в науке.
В этой статье мы расскажем вам о препятствиях, которые делают эту сложную тему, а затем предложим практические решения для преодоления этих проблем.
Почему свойства воды могут быть сложной темой?
Изучение свойств воды на молекулярном уровне продолжает усложняться по мере того, как мы продолжаем раскрывать концепции межмолекулярных и внутримолекулярных сил, полярности, поверхностного натяжения, теплоемкости и т. д. Давайте рассмотрим некоторые из наиболее распространенных причин, по которым вода является такой сложной тема для преподавателей и студентов.
1. Полярность воды
Заряд молекул воды распределяется неравномерно из-за способности кислорода сильно притягивать или притягивать электроны по сравнению с водородом. Эта склонность атома притягивать к себе электроны называется электроотрицательностью. Следовательно, кислород более электроотрицательный, чем водород; таким образом, атом кислорода в воде имеет более отрицательный заряд, а водород — положительный. Примером такого неравномерного распределения заряда может служить аналогия с перетягиванием каната.
Специфическая геометрия (из-за электроотрицательности и водородных связей) делает воду полярной молекулой. Вода легко смешивается с любой другой полярной молекулой, отсюда и название универсального растворителя. Большинству студентов сложно понять сложные детали концепции электроотрицательности и полярной природы воды.
Полярность воды (Источник изображения)
2. Содержание тяжелое
Вода реагирует с несколькими соединениями и является амфотерной, что означает, что она имеет смесь кислотных и основных свойств. Вода вступает в реакцию восстановления с электроположительными элементами; следовательно, это важный источник водорода и электронов. Точно так же вода может окисляться и выделять атомы кислорода, явление, наблюдаемое при фотосинтезе. Таким образом, вода играет заметную роль в значительных окислительно-восстановительных реакциях. Гидролиз воды является еще одним важным свойством, поскольку она быстро распадается на свои компоненты для растворения ионных или ковалентных соединений. Эти содержательные аспекты свойств воды делают студентов апатичными по отношению к этой теме.
Вода вступает в реакцию восстановления с электроположительными элементами; следовательно, это важный источник водорода и электронов. Точно так же вода может окисляться и выделять атомы кислорода, явление, наблюдаемое при фотосинтезе. Таким образом, вода играет заметную роль в значительных окислительно-восстановительных реакциях. Гидролиз воды является еще одним важным свойством, поскольку она быстро распадается на свои компоненты для растворения ионных или ковалентных соединений. Эти содержательные аспекты свойств воды делают студентов апатичными по отношению к этой теме.
3. Одни предметы плавают в воде, другие тонут.
Общеизвестно, что некоторые вещества, такие как лед, плавают на поверхности воды, но здесь возникает вопрос; Почему и как? Ответ на этот вопрос кажется простым: «любой объект менее плотный, чем вода, будет плавать», но учителям довольно сложно объяснить это на уровне средней школы. Вода при замерзании расширяется примерно на 9 %, но плотность льда (0,931 г-см-3) меньше плотности воды (1,0 г-см-3). Лед, по сути, представляет собой воду в твердом состоянии, но химические связи и клеточная структура снижают плотность замерзшей воды. Поскольку вода плотнее льда, последний способен плавать.
Лед, по сути, представляет собой воду в твердом состоянии, но химические связи и клеточная структура снижают плотность замерзшей воды. Поскольку вода плотнее льда, последний способен плавать.
Здесь применяется принцип Архимеда, который предполагает, что объект плавает на воде, когда нисходящий вес объекта уравновешивает восходящий толчок воды.
Чтобы понять эти детали и сравнения, учащиеся должны понимать дополнительные термины, такие как плотность, поверхностное натяжение и т. д., что усложняет изучение предмета. Более того, это вызывает любопытство и переполняет студентов, поскольку они продолжают открывать передовые свойства воды.
5 способов сделать свойства воды доступной для учащихся
Свойства воды не должны быть утомительной темой для учащихся. Вот пять надежных и проверенных стратегий, которые сделают изучение воды захватывающим занятием.
1. Поделитесь забавными фактами о воде
Ниже приведены некоторые интересные факты о воде, чтобы заинтересовать студентов во время лекции:
Количество воды на Земле такое же, как и при ее создании.
 Ваша водопроводная вода может содержать вещества, которые пили динозавры.
Ваша водопроводная вода может содержать вещества, которые пили динозавры.Пресная вода содержится в наших озерах, реках и ручьях, но не забывайте о подземных водах и ледниках. Более 68 процентов мировых запасов пресной воды заключены во льду и ледниках.
Вода в океанах исключительно соленая из-за присутствия хлорида натрия. Однако количество соли варьируется; например, Атлантический океан — самый соленый океан в мире.
Если слой льда в океанах и озерах опустится, весь водоем замерзнет. Следовательно, лед, плавающий на воде, является важным явлением, поддерживающим жизнь в равновесии.
Вода достаточно сильна, чтобы противостоять гравитации растений. Это связано с транспирацией растений и уникальными свойствами воды (когезия и адгезия).
Медузы и огурцы на 95% состоят из воды.
Некоторые организмы, например пауки, могут ходить по воде благодаря поверхностному натяжению.
Питьевая вода регулирует температуру тела при лихорадке, что объясняет термические свойства воды.
 По этой же причине многие водные организмы могут пережить колебания в жарком и холодном климате.
По этой же причине многие водные организмы могут пережить колебания в жарком и холодном климате.
2. Разработать основные концепции
Многие термины и явления в водной химии сложны для изучения и понимания. Поэтому, прежде чем углубляться в запутанные детали свойств воды, уделите некоторое время обсуждению основных терминов. Соотнесите определения с примерами, чтобы помочь учащимся в процессе обучения. Вот несколько терминов, которые помогут вам начать с:
Когезия: Молекулы воды удерживаются друг с другом за счет водородных связей. Он создает поверхностное натяжение, которое препятствует погружению некоторых организмов или веществ.
Адгезия: Молекулы воды прилипают или прилипают к другим молекулам/веществам. Например, вода в растениях движется вверх снизу вверх, прилипая к стенкам клетки.
Теплоемкость: Количество тепла, необходимое для изменения внутренней температуры вещества. Вода обладает высокой теплоемкостью, поэтому для повышения ее температуры требуется много тепла/энергии. Вот почему водная жизнь процветает, так как колебания температуры минимальны.
Вот почему водная жизнь процветает, так как колебания температуры минимальны.
Испарительное охлаждение: Испарение воды с поверхности снижает температуру; например, потоотделение или одышка являются примером охлаждения испарением.
Настало время повысить уровень вовлеченности, попросив учащихся мыслить нестандартно и придумать соответствующие примеры для каждого термина.
3. Мозговой штурм. Автобиография воды
Учащиеся заинтересуются изучением воды, включив в них веселые занятия, такие как автобиография воды. Это задание можно дать в качестве домашнего задания. Попросите их изобразить воду и придумать историю, объясняющую характеристики воды в повествовательной форме. Такие рассказы, составленные учениками и их сверстниками, повысят уровень вовлеченности в вашем классе. Учащиеся легко усвоили бы сложные понятия, творчески вяжу или слушая рассказы о свойствах воды.
4. Связь с игрой слов
Учащиеся должны запомнить науку о воде, чтобы хорошо сдать экзамены. Упомянутые выше идеи помогут сделать процесс обучения увлекательным и доступным для учащихся, но учителя также должны придумать забавные способы улучшения памяти. Одной из таких эффективных стратегий является мнемоника (набор букв или слов, который помогает что-то запомнить). Вот некоторые из игр слов, которые педагоги могут использовать для обучения свойствам воды:
Упомянутые выше идеи помогут сделать процесс обучения увлекательным и доступным для учащихся, но учителя также должны придумать забавные способы улучшения памяти. Одной из таких эффективных стратегий является мнемоника (набор букв или слов, который помогает что-то запомнить). Вот некоторые из игр слов, которые педагоги могут использовать для обучения свойствам воды:
Самый легкий способ запомнить шесть основных свойств воды – «CAHELU» — c плотность, a плотность, h высокая удельная теплоемкость, e паровое охлаждение, l плотность твердый , u растворитель универсальный.
Следите за трендом электроотрицательности, используя мнемонику «Пылающий кислород Хороший чистый яркий Я подозреваю консервированный водород», которая указывает на тренд F фтор > O кислород > N итроген > C хлор > B ромин > I один > S сера > C арбон > H 90 148 водород ≥ P фосфор.
 Это помогает понять водородные связи в воде, поскольку кислород является вторым наиболее электроотрицательным элементом и способен образовывать водородные связи.
Это помогает понять водородные связи в воде, поскольку кислород является вторым наиболее электроотрицательным элементом и способен образовывать водородные связи.Слово «терм» означает «тепло», что указывает на то, что теплоемкость — это способность вещества удерживать тепло.
Когезия относится к «сплоченности», что означает сохранение их вместе/союз, а адгезия относится к «липкости», что означает «свойство прилипания или соединения различных поверхностей».
5. Использование виртуальных лабораторных симуляций
Виртуальная лабораторная симуляция — отличный способ узнать о свойствах воды. В Labster мы стремимся создавать полностью интерактивные продвинутые лабораторные симуляторы, в которых используются элементов геймификации, таких как рассказывает истории и системы подсчета очков в захватывающей и увлекательной трехмерной вселенной.
Проверить Labster’s Свойства виртуальной лаборатории воды .
 Ваша водопроводная вода может содержать вещества, которые пили динозавры.
Ваша водопроводная вода может содержать вещества, которые пили динозавры. По этой же причине многие водные организмы могут пережить колебания в жарком и холодном климате.
По этой же причине многие водные организмы могут пережить колебания в жарком и холодном климате. Это помогает понять водородные связи в воде, поскольку кислород является вторым наиболее электроотрицательным элементом и способен образовывать водородные связи.
Это помогает понять водородные связи в воде, поскольку кислород является вторым наиболее электроотрицательным элементом и способен образовывать водородные связи.