На этот раз по-настоящему: открыто новое свойство воды
- Технологии
- Алексей Алексенко Автор
Физики обнаружили ранее неизвестное свойство воды, связанное с транспортом ионов. Открытие может найти применение в биомедицине и энергетике
Злополучные штудии на тему «молекулярной памяти воды» и других шарлатанских материй приучили просвещенную публику игнорировать научные новости, где сообщается об открытии у воды еще каких-то неизвестных науке свойств.
Одно из уникальных свойств воды — способность ее молекул распадаться на ионы водорода и гидроксила. Это качество делает воду уникальным ресурсом для получения энергии. На нем основана технология топливных ячеек, и это же свойство лежит в основе энергетики живой клетки. Ионы водорода и гидроксила не существуют в воде изолированно, на самом деле их окружает паутина целых молекул, которые взаимодействуют друг с другом и с ионами посредством водородных связей. На протяжении последнего столетия считалось установленным, что водородные связи взаимодействуют с протоном и гидроксилом абсолютно симметричным образом («с точностью до наоборот»). Однако последние теоретические модели предсказывали, что это, возможно, не так. Но если водород и гидроксил действительно переносятся водой по-разному, эта асимметрия открывает широкие возможности для разработки процессов, где один из ионов будет иметь преимущество перед другим.
Профессор Алексей Ершов из Нью-Йоркского университета и его коллеги поставили перед собой задачу экспериментально доказать существование такой асимметрии. Разработанная ими установка помогла достичь этой цели, о чем они и сообщают в своей статье.
Теоретически ожидалось, что свойство будет ярче всего проявляться в условиях «максимальной плотности» — при плюс четырех градусах по Цельсию, когда вода даже плотнее, чем лед. Благодаря этому качеству земные водоемы зимой покрываются льдом сверху, а не со дна, в противном случае жизнь в них не смогла бы развиться. При этой температуре с помощью метода ядерного магнитного резонанса исследователи измерили время существования ионов водорода и гидроксила. Разница в этом времени определяет различие в скорости транспорта двух ионов.
Наглядное описание процесса таково. Молекула воды Н2О состоит из атома кислорода и двух атомов водорода. Атом водорода способен прыгать с одной молекулы на другую. Эти прыжки и составляют основу движения «иона водорода» Н+ или, что то же самое, «иона гидроксония» H3O+. Так же движется и ион гидроксила ОН– (молекула воды с оторванным от нее водородом), хотя направление его движения противоположно направлению прыжка. Прыжки атомов зависят от рисунка водородных связей вокруг молекулы, и именно при одной конкретной конфигурации водородных связей ион гидроксила движется заметно медленнее, чем водород. Эта конфигурация наиболее вероятна при температуре максимальной плотности. Исследователи действительно отмечали, что наблюдаемый ими эффект скачкообразно меняется при +4 оС.
Молекула воды Н2О состоит из атома кислорода и двух атомов водорода. Атом водорода способен прыгать с одной молекулы на другую. Эти прыжки и составляют основу движения «иона водорода» Н+ или, что то же самое, «иона гидроксония» H3O+. Так же движется и ион гидроксила ОН– (молекула воды с оторванным от нее водородом), хотя направление его движения противоположно направлению прыжка. Прыжки атомов зависят от рисунка водородных связей вокруг молекулы, и именно при одной конкретной конфигурации водородных связей ион гидроксила движется заметно медленнее, чем водород. Эта конфигурация наиболее вероятна при температуре максимальной плотности. Исследователи действительно отмечали, что наблюдаемый ими эффект скачкообразно меняется при +4 оС.
Марк Такерман, соавтор работы и тот самый теоретик, который ранее предсказал асимметрию в поведении ионов, считает, что открытый эффект открывает дорогу для создания новых материалов, которые будут применяться в альтернативной «чистой» энергетике. Открытие может заинтересовать и биохимиков, занимающихся проблемами клеточной электрохимии и механизмами действия ферментов.
Открытие может заинтересовать и биохимиков, занимающихся проблемами клеточной электрохимии и механизмами действия ферментов.
Удивительные свойства воды
- Авторы
- Руководители
- Файлы работы
- Наградные документы
1МАОУ ДО «ДЮЦ «Радость»
Мохова В.Н. 1
1МАОУ ДО «ДЮЦ «Радость»
Автор работы награжден дипломом победителя III степени
Диплом школьникаСвидетельство руководителя
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
Введение.
Вода – при нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов. Физические свойства воды аномальны, вода является единственным веществом на Земле, существующим в жидком, твердом и газообразном состояниях.
Вода также может существовать в виде жидких кристаллов. Физические свойства воды аномальны, вода является единственным веществом на Земле, существующим в жидком, твердом и газообразном состояниях.
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды). На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % — ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды). Бо́льшая часть земной воды — солёная, непригодная для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах.
Вода является хорошим растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
В природных условиях всегда содержит растворённые вещества (соли, газы).
При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая — криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
Мировой океан содержит более 97,54 % земной воды, подземные воды — около 0,63 %, ледники — 1,81 %, реки и озера — 0,009 %, материковые солёные воды — 0,007 %, атмосфера — 0,001 %
Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов.
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоёмах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоёма, это позволяет его обитателям выжить.
Живое человеческое тело содержит от 50 % до 75 % воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
Цель: экспериментальным путем убедиться в уникальных свойствах воды.
Задачи:
1. Обзор литературных источников.
2. Провести эксперименты.
3. Познакомиться с ролью воды в природе и в жизни человека.
4. Сделать выводы.
2. Свойства воды
2.1.Поверхностное натяжение — это сила притяжения, с которой каждый участок поверхностной пленки (свободной поверхности жидкости или же любой поверхности раздела двух фаз) действует на смежные части поверхности.
-молекулы, которые находятся на поверхности какой либо жидкости, в том числе и воды, притягиваются остальными молекулами внутрь жидкости, вследствие чего и возникает поверхностное натяжение.
На поверхности любой жидкости образуется тонкая плёнка из её частиц (молекул). Эта плёнка прочнее, чем жидкость внутри объёма. Чтобы её разорвать, необходимо приложить силу.
Опыт 1. Горка на монете.
Ход эксперимента. Наберем пипеткой воду и с очень близкого расстояния капаем её на монету.
Суть эксперимента: Вода на монете будет расположена не ровным тонким слоем, как это может показаться перед экспериментом. Поверхность воды будет растягиваться и становиться все более выпуклой с каждой новой каплей до тех пор, пока тонкая пленочка, которую образует поверхность воды, не порвется. И тогда почти вся вода с монетки вытечет (приложение фото1)
Опыт 2. Горка в стакане.
Горка в стакане.
Ход эксперимента. Необходимо взять хорошо вымытый сухой стакан, немного смазать края растительным маслом и наполнить водой до отказа. А теперь очень аккуратно опускать в него по одной монете (гайке, шайбе).
Результат. По мере опускания монет в стакан вода из него не будет выливаться, а начнёт понемногу приподниматься, образуя горку. Это хорошо заметно, если посмотреть на стакан сбоку.
Суть эксперимента: В этом опыте горка на поверхности воды образуется в основном за счёт физического свойства воды, называемого поверхностным натяжением. Именно благодаря плёнке и образуется горка. Однако, если давление воды под плёнкой окажется очень большим (горка поднимется слишком высоко), она разорвётся.
Вторая причина образования горки — вода плохо смачивает поверхность стакана (холодная хуже, чем горячая). Что это значит? Взаимодействуя с твёрдой поверхностью, вода плохо к ней прилипает и плохо растекается. Именно поэтому она не стекает сразу же через край стакана при образовании горки. Кроме того, для уменьшения смачивания края стакана в опыте смазаны растительным маслом. Если бы, например, вместо воды использовали бензин, который очень хорошо смачивает стекло, никакой горки бы не получилось (приложение фото2)
Что это значит? Взаимодействуя с твёрдой поверхностью, вода плохо к ней прилипает и плохо растекается. Именно поэтому она не стекает сразу же через край стакана при образовании горки. Кроме того, для уменьшения смачивания края стакана в опыте смазаны растительным маслом. Если бы, например, вместо воды использовали бензин, который очень хорошо смачивает стекло, никакой горки бы не получилось (приложение фото2)
Опыт 3. Скрепка на воде.
Ход эксперимента. Необходимо налить воду в стакан. Взять скрепку и, держа ее горизонтально, поднести максимально близко к поверхности воды, отпустить. Если скрепка утонет, повторить эксперимент, только скрепку положить на маленький кусочек бумажной салфетки, а затем вместе с салфеткой опустить на поверхность воды. Через некоторое время салфетка намокнет и пойдет ко дну.
Суть эксперимента. Поверхностное натяжение — из-за этого натяжения поверхность жидкости ведет себя как упругое покрытие. Под поверхностью воды каждая молекула притягивается со всех сторон своими соседками. Молекулы стиснуты со всех сторон так плотно, что теснее прижаться друг к другу уже не могут. Однако на поверхности молекулы воды притягиваются только к боковым и нижним молекулам. В результате этого возникает суммарная сила, направленная вниз, что вызывает легкое продавливание верхнего слоя воды. Поверхностное натяжение оказывается вполне достаточным для удерживания легких тел, таких как скрепка в данном опыте. Говорят, что тело плавает (слегка погружено либо лежит на поверхности жидкости), если его плотность равна или меньше плотности жидкости. Однако плотность скрепки выше плотности воды; следовательно, она плавает только благодаря пленке поверхностного натяжения (приложение фото3)
Поверхностное натяжение — из-за этого натяжения поверхность жидкости ведет себя как упругое покрытие. Под поверхностью воды каждая молекула притягивается со всех сторон своими соседками. Молекулы стиснуты со всех сторон так плотно, что теснее прижаться друг к другу уже не могут. Однако на поверхности молекулы воды притягиваются только к боковым и нижним молекулам. В результате этого возникает суммарная сила, направленная вниз, что вызывает легкое продавливание верхнего слоя воды. Поверхностное натяжение оказывается вполне достаточным для удерживания легких тел, таких как скрепка в данном опыте. Говорят, что тело плавает (слегка погружено либо лежит на поверхности жидкости), если его плотность равна или меньше плотности жидкости. Однако плотность скрепки выше плотности воды; следовательно, она плавает только благодаря пленке поверхностного натяжения (приложение фото3)
Опыт 4. Непроницаемая ткань.
Ход эксперимента. Необходимо накрыть стакан марлей, закрепить марлю на месте резинкой. Края марли прижать к стенкам стакана. Налить через марлю полный стакан воды. Одной рукой взять стакан вместе с марлей, а другой рукой накрой его сверху. Перевернуть стакан вверх дном над миской или формой.
Необходимо накрыть стакан марлей, закрепить марлю на месте резинкой. Края марли прижать к стенкам стакана. Налить через марлю полный стакан воды. Одной рукой взять стакан вместе с марлей, а другой рукой накрой его сверху. Перевернуть стакан вверх дном над миской или формой.
Результат.Когда переворачиваешь стакан, из него вначале просачивается небольшое количество воды, но затем она перестает течь совсем. Марля не дает воде вылиться из стакана.
Суть эксперимента: В перевернутом стакане между его дном (находящимся теперь вверху) и поверхностью воды образуется пространство, наполненное воздухом и парами воды. На воду действует сила тяжести, которая тянет ее вниз. При этом пространство между дном стакана и поверхностью воды увеличивается. В условиях постоянной температуры давление в нем уменьшается и становится меньше атмосферного. Общее давление воздуха и воды на марлю изнутри получается немного меньше, чем давление воздуха снаружи. Поэтому вода и не выливается из стакана. Однако через некоторое время стакан потеряет свои волшебный свойства, и вода все же выльется. Это обусловлено испарением воды, увеличивающей давление внутри стакана.
Поэтому вода и не выливается из стакана. Однако через некоторое время стакан потеряет свои волшебный свойства, и вода все же выльется. Это обусловлено испарением воды, увеличивающей давление внутри стакана.
На поверхности воды образуется тоненькая пленочка, которую мы не видим. Именно благодаря ей по поверхности воды могут скользить такие насекомые, как водомерки (приложение фото 4)
2.2. Капиллярность – это поднятие жидкости по тонким трубочкам (капиллярам).
В основе капиллярности лежат смачиваемость и поверхностное натяжение.
Опыт 1.Гуляющая вода.
Ход эксперимента:
1) берем два цвета, смешиваем с водой и наполняем полученными растворами 2 стакана;
2) бумажные полотенца складываем вдоль и вставляем (по одному) в каждый из заполненных стаканов;
3) противоположные концы полотенец опускаем в пустой стакан. Наблюдаем. Для проведения этого эксперимента понадобится некоторое время.
Наблюдаем. Для проведения этого эксперимента понадобится некоторое время.
Суть эксперимента: Бумага отлично впитывает воду. Полотенца постепенно промокают, и окрашенная жидкость «путешествует» в пустой стакан. Он заполняется до одного уровня с прочими двумя, и вода внутри от смешения цветов приобретает совершенно новый оттенок (приложение фото 5)
Опыт 2. Распускание бумажных цветов.
Ход эксперимента: нам потребуется: бумага; ножницы; миска с водой.
Необходимо налить в тарелку немного воды и опустить в нее цветок. На глазах он начнет распускаться.
Суть эксперимента: Вода проникает в самые маленькие пустые пространства между волокнами бумаги и заполняет их. Бумага набухает, сгибы на ней распрямляются и цветок распускается.
Бумага набухает, сгибы на ней распрямляются и цветок распускается.
Но как вода преодолевает силы гравитации?
Собственно, так же, как и в растениях. Вода поднимается вверх по капиллярным сосудам растения и доставляет ее от корней к листьям и плодам.
Происходит это за счет разницы давлений и сил поверхностного натяжения воды. Поверхность воды, попадающей в узкий капилляр, принимает вогнутую форму (мениск). При таком положении давление жидкости под этим мениском становится меньше атмосферного, и вода стремится вверх. И чем тоньше капилляр, тем выше поднимается вода, стремясь уравновесить отрицательное давление. Если жидкость не смачивает поверхность, то мениск будет выпуклый, и она не станет подниматься вверх по капилляру (приложение фото 6)
2. 3. Плотность воды — какое количество, а, если точнее, какая масса содержится в определенном объеме вещества.
3. Плотность воды — какое количество, а, если точнее, какая масса содержится в определенном объеме вещества.
Опыт 1 Мандарин в кожуре и без кожуры.
Ход эксперимента. Один мандарин очищаем от кожуры, а второй нет. Опускаем в емкость с водой. Неочищенный мандарин — плавает. Попробуем его утопить — не получается. Кладем в воду очищенный от кожуры мандарин — сразу пошел ко дну.
Суть эксперимента. Всё дело в том, что в кожуре цитрусовых много пузырьков воздуха. Они выталкивают фрукт из воды. А без кожуры у цитрусовых нет пузырьков, поэтому очищенные апельсины и мандарины тонут (приложение фото 7, 8)
Опыт 2 Яйцо в пресной воде и в соленой
Ход эксперимента. Берем 2 банка. Заполняем одну пресной водой, другую – соленой. Осторожно опускаем яйца в воду и наблюдаем за происходящим.
Берем 2 банка. Заполняем одну пресной водой, другую – соленой. Осторожно опускаем яйца в воду и наблюдаем за происходящим.
Суть эксперимента. Соленая вода имеет большую плотность, чем обычная водопроводная. Именно соль поднимает яйцо на поверхность. А если добавлять в уже имеющуюся соленую воду пресную, то яйцо будет постепенно опускаться на дно (приложение фото9,10)
Опыт 3. Холодная и горячая вода.
Ход эксперимента. Берем 2 банки. Наливаем в одну – холодную воду, в другую – горячую. Добавляем в каждую – красители.
Результат. При объединении двух банок, если снизу находится банка с холодной водой, смешения не происходит, горячей воде не нужно подниматься – она и так сверху.
При объединении двух банок, когда банка с горячей водой находится снизу, горячая вода поднимается вверх, при этом она смешивается с холодной.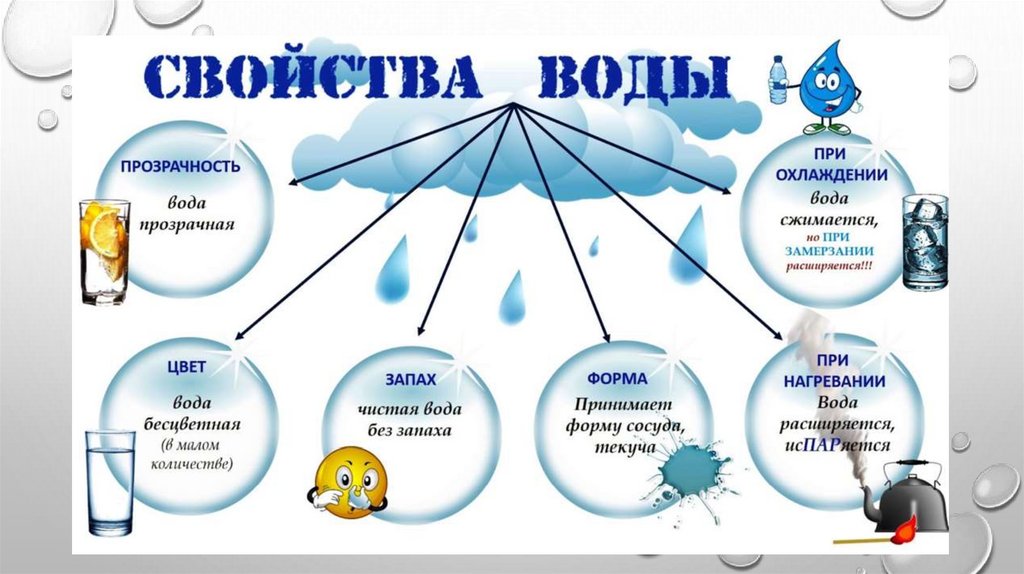
Суть эксперимента. Холодная вода тяжелее горячей, холодная вода опускается на дно, выталкивая горячую наверх тонкой струйкой, при нагревании воды, её молекулы начинают двигаться быстрее и быстрее, горячая воды менее плотная, чем холодная (приложение фото11,12)
Опыт 4. «Радуга» в стакане.
Ход эксперимента. Берем 3 стакана. В каждый из них добавляем разное количество сахара: в 1-й – 1 ст. л. сахара, во 2-й – 2 ст. л. В три стакана, выставленные в ряд, наливаем по 3 ст. ложки воды, лучше теплой, и перемешиваем. Четвертый стакан остается пустым. Затем при помощи чайной ложки в каждый стакан добавляем несколько капель пищевой краски и перемешиваем. В чистый стакан при помощи шприца без иглы начинаем добавлять содержимое стаканов, начиная с 4-го, и по порядку – в обратном отсчете. Стараемся лить по краю стенки стакана. В стакане образуется 4 разноцветных слоя. Они не перемешиваются.
Стараемся лить по краю стенки стакана. В стакане образуется 4 разноцветных слоя. Они не перемешиваются.
Суть эксперимента. Концентрация сахара в каждой окрашенной жидкости была разной. Чем больше сахара, тем выше плотность воды, тем она «тяжелее» и тем ниже этот слой будет в стакане (приложение фото 13)
Опыт 5. Домашняя лава
Ход эксперимента. В баночку наливаем обычной воды примерно на треть объема. Затем добавляем краситель и перемешиваем деревянной палочкой. Наливаем растительное масло. В баночку бросаем любую шипучую таблетку.
Суть эксперимента. Масло и вода имеют разную плотность. Масло -легче и всегда будет наверху. В состав шипучей таблетки входит лимонная кислота и сода. Эти вещества вступают в химическую реакцию с водой, в результате которой выделяется углекислый газ, который, подхватывая частицы красителя, стремится наверх и благополучно покидает емкость, а частицы подкрашенной воды возвращаются обратно вниз. И так снова и снова. Именно из-за этого постоянного круговорота жидкости и получается интересный и очень красивый эффект лавы (приложение фото 14)
И так снова и снова. Именно из-за этого постоянного круговорота жидкости и получается интересный и очень красивый эффект лавы (приложение фото 14)
Значение плотности.
1.Почему корабли не тонут? Внутри конструкции существуют полости больших размеров, которые заполнены воздухом. Благодаря этому, плотность всего корабля значительно меньше плотности воды. В результате этого выталкивающая сила держит конструкцию на плаву.
2.Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоемах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоема, это позволяет его обитателям выжить.
3.Выводы.
1. Провели обзор литературных источников.
2. Экспериментальным путем убедились в некоторых уникальных свойствах воды, а именно: поверхностном натяжении, капиллярности, плотности.
3. Познакомились со значением свойств воды в природе и в жизни человека.
4. Возможность использования данной работы на уроках окружающего мира.
4. Список используемой литературы:
1. Моргунова Г.С. Вода, которую мы пьём // Химия и жизнь. — 1965. — № 3. —
2. П. И. Воскресенский Техника лабораторных работ. 9-е изд. Л.: «Химия», 1970. С. 696—697
Интернет-источники:
http://simplescience. ru
ru
http://naukaveselo.ru
http://www.lmagic.info/nepronicaemaya_tkan.html
«Класс!ная физика» http://class-fizika.ru/op31-13.html
http://izbenka.org/igrovaya/shkola-opytov-i-eksperimentov/eksperiment-dva-mandarina/
http://rastishka.by/articles/citrusovye-fokusy-dlya-detej/
https://www.2mm.ru/malysh/razvitie-rebenka/2027/
http://tsvetyzhizni.ru
https://wassergroup.ru/index.php?route=record/record&record_id=22
http://fb. ru/article/229237/pochemu-korabl-ne-tonet-fizika-v-dele
ru/article/229237/pochemu-korabl-ne-tonet-fizika-v-dele
Приложение
Фото 1 Горка на монете фото 2 горка в стакане фото 3скрепка на воде
Фото 4 «непроницаемая ткань» фото 5 «гуляющая» вода
Фото 6 распускание бумажных цветов
Фото 7 мандарин в кожуре фото 8 мандарин без кожуры
Фото 9 яйцо в пресной воде фото10 яйцо в соленой воде
Фото 11 Сверху – горячая вода фото 12 Сверху – холодная вода
Снизу – холодная вода Снизу – горячая вода
Фото 13«Радуга» в стакане фото 14 «Лавовая лампа»
Просмотров работы: 356
5 Быстрых упражнений для проверки свойств воды
Проверка свойств воды свойства воды.
 Основные из них, которые мы здесь обсуждаем, это: полярность, поверхностное натяжение, адгезия и когезия.
Основные из них, которые мы здесь обсуждаем, это: полярность, поверхностное натяжение, адгезия и когезия.Обратите внимание, этот пост может содержать партнерские ссылки. Благодарим вас за поддержку The Homeschool Scientist.
ПолярностьМолекула воды состоит из двух атомов водорода и одного атома кислорода. Молекула воды имеет два конца. Два положительно заряженных атома водорода на одном конце и отрицательно заряженный атом кислорода на другом конце дают молекулам воды два полюса.
Эта комбинация атомов делает воду полярной молекулой. Полярные молекулы имеют отрицательную сторону и положительную сторону
На изображении выше две молекулы воды. Попросите вашего ученика определить два атома водорода и один атом кислорода в каждой из двух молекул.
Вода также нейтрально заряжена. Это означает, что он имеет равное количество протонов и электронов.
Однако, несмотря на то, что молекула воды имеет одинаковое количество протонов и электронов, существует неравномерное распределение электронов внутри каждой молекулы воды, что делает ее полярной.
Итак, полярность относится к распределению электрических зарядов вокруг молекулы. В полярной связи один атом имеет частичный положительный электрический заряд, а другой атом имеет частичный отрицательный электрический заряд.
Эта полярность воды придает ей некоторые особые свойства, такие как когезия и адгезия , которые можно легко продемонстрировать и наблюдать в приведенных ниже упражнениях.
Некоторыми примерами других полярных молекул являются озон, монооксид углерода, соляная кислота, аммиак и другие в таблице ниже. (Это не исчерпывающий список полярных молекул.)
Неполярность
Прежде чем двигаться дальше, давайте поговорим о неполярных молекулах. Неполярные молекулы имеют более равномерное распределение заряда. (В отличие от воды, которая на одном конце заряжена положительно, а на другом — отрицательно.)
В неполярной связи атомы делят электроны поровну, поэтому между атомами нет частичного положительного или отрицательного заряда.
Полярные и неполярные молекулы не притягиваются друг к другу. Другими словами, полярные и неполярные молекулы отталкиваются друг от друга.
Полярные молекулы притягиваются к другим полярным молекулам.
Неполярные молекулы имеют тенденцию притягиваться к другим неполярным молекулам.
В активности нефти и воды ниже мы сможем увидеть отталкивание и притяжение полярных и неполярных молекул.
Когезионные и адгезионные свойства водыПолярные молекулы будут смешиваться друг с другом. Это называется сплоченностью . Это происходит в воде, потому что отрицательный заряд атома кислорода в молекуле воды притягивается к положительному заряду атомов водорода в другой молекуле воды.
Когезия просто означает, что молекулы воды любят прилипать друг к другу. Это вызвано тем, что слегка отрицательный заряд атома кислорода одной молекулы воды притягивается к слегка положительному заряду атомов водорода другой молекулы воды.
Водородные связи между молекулами воды показаны ниже.
Если у вас есть под рукой два магнита, отличный способ продемонстрировать концепцию притяжения отрицательного конца молекулы воды к положительному концу другой молекулы воды — приложить северный полюс магнита к южному полюсу магнита. Они притягиваются друг к другу и «липнут» друг к другу.
Связанная запись: Свойства жидкостей Рабочий лист
Поверхностное натяжение
Молоко состоит в основном из молекул воды, а молекулы воды любят слипаться. На поверхности, где вода встречается с воздухом, молекулы воды еще крепче цепляются друг за друга. Это приводит к образованию «кожи» на поверхности воды. Эта кожа настолько прочна, что может выдержать вес, который обычно тонет в воде. Это называется поверхностным натяжением .
Когда поверхностное натяжение нарушается, тяжелый предмет, плавающий на коже, тонет. Легкий предмет на поверхности будет притягиваться молекулами воды, если поверхностное натяжение нарушено. Этот простой эксперимент продемонстрирует это явление.
Легкий предмет на поверхности будет притягиваться молекулами воды, если поверхностное натяжение нарушено. Этот простой эксперимент продемонстрирует это явление.
Сцепление
Поверхностное натяжение воды обусловлено сцеплением . Когезия означает, что молекулы воды любят прилипать друг к другу. Это вызвано тем, что слегка отрицательный заряд атома кислорода одной молекулы воды притягивается к слегка положительному заряду атомов водорода другой молекулы воды. Вы также можете проверить когезионные свойства воды, используя пипетку, воду и монету.
Действия по проверке свойств воды
Проверка свойств воды Деятельность 1: поверхностное натяжение с мылом и перцем
Проверка свойств воды Действие 3: сплоченность обойдется вам в копейки!
Поверхностное натяжение воды обусловлено сцеплением . Когезия означает, что молекулы воды любят прилипать друг к другу. Это вызвано тем, что слегка отрицательный заряд атома кислорода одной молекулы воды притягивается к слегка положительному заряду атомов водорода другой молекулы воды. Вы можете проверить когезионные свойства воды, используя пипетку, воду и монету.
Вы можете проверить когезионные свойства воды, используя пипетку, воду и монету.
Вам нужно собрать:
- Монету (пенни подойдет)
- Капельница
- Вода
Медленно капните воду на монету. Наблюдайте, как капли воды слипаются, образуя большую каплю.
Объяснение того, что произошло:
Молекулы воды слипнутся и образуют купол над монетой. Продолжайте добавлять капли, пока капля не сломается и не выльется из монеты. Это вызвано тем, что гравитация преодолевает силу сцепления. Сколько капель воды может поместиться на монете?
Проверка свойств воды Действие 4: когезия в стакане
Что вам потребуется:
- Стакан воды, наполненный доверху
- Пипетка
- Маленькая чаша с водой
Вы также можете наблюдать сплоченность, наполняя стакан водой доверху. Затем используйте пипетку, чтобы очень осторожно добавить больше воды, пока вода не образует водяную дугу, слегка выступающую над верхней частью стакана. Когезионные свойства воды удерживают молекулы вместе, чтобы они не проливались через верхнюю часть стакана. Наступит момент, когда слабые водородные связи перестанут удерживаться, и вода выльется наружу.
Затем используйте пипетку, чтобы очень осторожно добавить больше воды, пока вода не образует водяную дугу, слегка выступающую над верхней частью стакана. Когезионные свойства воды удерживают молекулы вместе, чтобы они не проливались через верхнюю часть стакана. Наступит момент, когда слабые водородные связи перестанут удерживаться, и вода выльется наружу.
Проверка свойств воды Упражнение 5: Полярность —
В этом упражнении ваш ученик сможет продемонстрировать и наблюдать взаимодействие полярных и неполярных молекул. Мы будем использовать воду (полярную) и растительное масло (неполярную).
Что нужно собрать:
- Тарелка
- Немного воды в мерном стакане (достаточно 1/4 стакана)
- Немного растительного масла (достаточно 1/4 стакана)
- Пищевой краситель
- Средство для мытья посуды Dawn
- Смешайте пищевой краситель с водой и перемешайте.
- Налейте 3 столовые ложки масла на середину тарелки.

- Попросите своего ученика понаблюдать за тем, что произошло? Капли масла притягивались друг к другу? Как вы думаете, почему это произошло?
- Затем налейте воду на другую часть тарелки, но рядом с маслом.
- Немного приподнимите каждую сторону пластины с поверхности и переместите воду по периметру масла. Что случилось? Они смешиваются?
- Зная, что мы узнали о полярных и неполярных молекулах, объясните, что вы наблюдаете.
- Поставьте тарелку на стол и сбрызните средство для мытья посуды «Рассвет» водой с маслом.
- Аккуратно возьмите тарелку с каждой стороны и переместите ее так, чтобы мыло, вода и масло смешались. Что начинает происходить? Как вы думаете, почему это происходит?
Объяснение того, что произошло
Неполярные молекулы масла притягиваются друг к другу, поэтому капли масла собираются вместе, образуя одну большую «лужу».
Полярные молекулы воды притягиваются друг к другу. Но когда вода сталкивается с маслом, полярные молекулы воды не притягиваются к неполярным молекулам масла.
Но когда вода сталкивается с маслом, полярные молекулы воды не притягиваются к неполярным молекулам масла.
Молекулы мыла немного отличаются. Имеют удлиненную форму. Один конец полярный, а другой неполярный. При добавлении мыла полярный конец молекулы мыла притягивался к воде, а неполярный — к маслу.
Теперь вы понимаете, почему мыло и вода используются для мытья посуды и как мыло воздействует на жир.
Другие ресурсы, связанные со свойствами водыСоставьте список словарного запаса, связанного с изучением воды, используя этот список терминов и определений из Геологической службы США.
Дополнительные эксперименты с водой
Эксперимент с качеством воды
Эксперимент по очистке воды с помощью древесного угля
Узнайте о круговороте воды (и эксперименте) 9001 9
- Пинтерест
- Фейсбук
- Электронная почтаhttps://thehomeschoolscientist.
 com/wp-admin/admin.php?page=socialsnap-settings#
com/wp-admin/admin.php?page=socialsnap-settings# - Копировать ссылку
- SMS
- Более
AP Biology Help
У многих простое упоминание предмета AP Biology вызывает в воображении образы сложных идей и концепций, для понимания которых могут потребоваться часы изучения. Даже тем, кто преуспевает в науках, все равно придется потратить много времени на учебу, чтобы выучить все, что вы увидите на экзаменах в конце года. Высокие стандарты теста AP означают, что даже самые подготовленные испытуемые могут по понятным причинам найти это время года напряженным. К счастью, инструменты обучения для преподавателей университетов всегда готовы помочь. Нужны ли вам лучшие репетиторы биологии в Олбани, репетиторы биологии в Кливленде или лучшие репетиторы биологии в Хьюстоне, работа с профессионалом может вывести ваше обучение на новый уровень.
Учебные пособия университетских преподавателей тщательно разработаны и доступны по различным предметам. Все средства обучения разработаны с учетом ваших пожеланий и направлены на то, чтобы сделать подготовку к экзамену AP по биологии проще, чем вы ожидаете. Вы найдете практические тесты AP по биологии, карточки для запоминания, вопрос дня и «Учись по концепции» — интерактивную программу с примерами вопросов и пояснений. В дополнение к справочному разделу AP Biology и репетиторству AP Biology вы также можете рассмотреть возможность прохождения некоторых из наших диагностических тестов AP Biology.
Все средства обучения разработаны с учетом ваших пожеланий и направлены на то, чтобы сделать подготовку к экзамену AP по биологии проще, чем вы ожидаете. Вы найдете практические тесты AP по биологии, карточки для запоминания, вопрос дня и «Учись по концепции» — интерактивную программу с примерами вопросов и пояснений. В дополнение к справочному разделу AP Biology и репетиторству AP Biology вы также можете рассмотреть возможность прохождения некоторых из наших диагностических тестов AP Biology.
Хороший способ начать подготовку к экзамену AP по биологии — это Learn by Concept, инструмент обучения, который включает всю информацию, которая вам понадобится для подготовки к экзамену в конце года. Учебный план полностью интерактивен и позволяет вам просмотреть многие типы вопросов и концепций, по которым вы в конечном итоге будете тестироваться.
Однако преимущества AP Biology Learn by Concept на этом не заканчиваются. Помимо чрезвычайно полезного агрегатора всей информации, по которой вы в конечном итоге будете тестироваться, Learn by Concept также синтезирует важные идеи в вопросы, что дает вам более четкое представление о том, как на самом деле будет выглядеть тест. Вы можете просмотреть каждую категорию и ответить на вопросы для себя. Это может дать вам ценную информацию о том, насколько хорошо вы знаете определенные темы. Кроме того, к каждому ответу прилагается пояснение, поэтому, если вы ошибетесь в вопросе или если вам просто интересно увидеть логику ответа, у вас будет объяснение для каждой категории.
Вы можете просмотреть каждую категорию и ответить на вопросы для себя. Это может дать вам ценную информацию о том, насколько хорошо вы знаете определенные темы. Кроме того, к каждому ответу прилагается пояснение, поэтому, если вы ошибетесь в вопросе или если вам просто интересно увидеть логику ответа, у вас будет объяснение для каждой категории.
Являетесь ли вы студентом, который не знает, с чего именно начать свой обзор, или просто пытаетесь освежить свои знания по определенной концепции AP Biology, скорее всего, вы найдете нужную информацию в этом AP Learn by Concept. Учебный материал по биологии. Некоторые из наиболее популярных категорий включают:
— Биохимические концепции
— Клеточная биология
— ДНК, РНК и белки
— Эволюция и генетика
— Биология растений
— Системная физиология
— И многие другие.
Этот обзор теста AP Biology будет бесценен для тех из вас, кто хочет видеть всю необходимую информацию в одном месте, но также хочет видеть, какие вопросы могут быть заданы по темам на руку, а затем, как вы должны ответить на указанные вопросы.

 com/wp-admin/admin.php?page=socialsnap-settings#
com/wp-admin/admin.php?page=socialsnap-settings#