Биологическая роль калия — это… Что такое Биологическая роль калия?
Калий (K) | |
|---|---|
| Атомный номер | 19 |
| Внешний вид простого вещества | Серебристо-белый мягкий металл |
| Свойства атома | |
| Атомная масса (молярная масса) | 39,0983 а. е. м. (г/моль) |
| Радиус атома | 235 пм |
| Энергия ионизации (первый электрон) | 418,5 (4,34) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 4s1 |
| Химические свойства | |
| Ковалентный радиус | 203 пм |
| Радиус иона | 133 пм |
| Электроотрицательность | 0,82 |
| Электродный потенциал | -2,92В |
| Степени окисления | 1 |
| Термодинамические свойства простого вещества | |
| Плотность | 0,856 г/см³ |
| Удельная теплоёмкость | 0,753 Дж/(K·моль) |
| Теплопроводность | 79,0 Вт/(м·K) |
| Температура плавления | 336,8 K |
| Теплота плавления | 102,5 кДж/моль |
| Температура кипения | 1047 K |
| Теплота испарения | 2,33 кДж/моль |
| Молярный объём | 45,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированая |
| Период решётки | 5,230 Å |
| Отношение c/a | n/a |
| Температура Дебая | 100,00 K |
| K | 19 |
| 39,0983 | |
| 4s1 | |
| Калий | |
Ка́лий — химический элемент с атомным номером 19 в периодической системе, обозначается символом K (лат. Kalium), мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щелочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются.
История и происхождение названия
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щелок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 г. английский химик Дэви электролизом твёрдого едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Присутствие в природе
В свободном состоянии не встречается. Калий входит в состав сильвинита KCl•NaCl, карналлита KCl•MgCl2•6H2O, каинита KCl•MgSO4•6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав почти всех растений.Получение
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650°C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
K+ + e— → K
2Cl— — 2e— → Cl2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
4OH— — 4e— → 2H2O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов)
Физические свойства
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства
Калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, легко отдаёт электроны.
Является сильным восстановителем. Он настолько активно соединяется с кислородом, что образуется не оксид, а супероксид калия KO2 (или K2O4). При нагревании в атмосфере водорода образуется гидрид калия KH. Хорошо взаимодействует со всеми неметаллами, образуя галогениды, сульфиды, нитриды, фосфиды и т. д., а также со сложными веществами, такими, как вода (реакция проходит со взрывом), различные оксиды и соли. В этом случае они восстанавливают другие металлы до свободного состояния.
Калий хранят под слоем керосина.
Оксиды и пероксиды
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
- 2K + 2O2 → K2O4
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
- K2O4 + 6K → 4K2O
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
- 2K2O4 + 2CO2 → 2K2CO3 + 3O2
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2
выделяется четыре объёма O2).Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Гидроксиды
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого калия при 20 °C в 100 г. воды составляет 112 г.
Применение
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения

Фиолетовый цвет пламени ионов калия в пламени горелки
- Бромид калия — применяется в медицине и как успокаивающее средство для нервной системы.
- Гидроксид калия (едкое кали) — применяется в щелочных аккумуляторах и при сушке газов.
- Карбонат калия (поташ) — используется как удобрение, при варке стекла.
- Хлорид калия (сильвин, «калийная соль») — используется как удобрение.
- Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.
- Перхлорат и хлорат (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике.
- Бихромат (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина.
- Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода.
- Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика.
- Дигидрофосфат и дидейтерофосфат в виде монокристаллов в лазерной технике.
- Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).
- Фтороборат калия — важный флюс для пайки сталей и цветных металлов.
- Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали.
- Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса. Калий и натрий между собой функционально связаны и выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений
- Поддержание осмотической концентрации крови
- Поддержание кислотно-щелочного баланса
- Нормализация водного баланса
- Обеспечение мембранного транспорта
- Активация многих энзимов
- Нормализация ритма сердца
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграмм, для взрослых от 1800 до 5000 миллиграмм. Необходимость в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин В6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
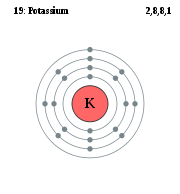
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251×109 лет. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
См. также
Ссылки
Литература
- Пилипенко А.Т. Натрий и калий // Справочник по элементарной химии. — 2-е изд. — Киев: Наукова думка, 1978. — С. 316—319.
- Дроздов А. Яростные металлы // Энциклопедия для детей. Химия. — М.: Аванта +, 2002. — С. 184—187. — ISBN 5-8483-0027-5
| Электрохимический ряд активности металлов | |
|---|---|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na | Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tс, Mn, Te, Rh, Po, Tl, Hg, Ag, Pb, Pd, Os, Ir, Pt, Au | |
| → активность металлов → |
Wikimedia Foundation. 2010.
Калий
Увеличение уровня калия в организме может быть следствием случайных отравлений соединениями калия. Токсичность солей калия определяется, как правило, токсичностью их анионов, таких как арсенит, хромат, фторид.
Точные данные о токсичности KCl для человека отсутствуют. Механизм токсического действия КCl в местах введения обусловлен в первую очередь высоким осмотическим давлением. В результате имеет место интенсивное поступление воды из окружающих тканей, приводящее к их обезвоживанию и нарушению физиологических функций клеток.
Избыточное поступление ионов К+ вызывает перегрузку соответствующих систем гомеостаза и нарушение метаболических процессов. В эпителии желудочно-кишечного тракта и почечных канальцев развивается воспаление, нередко приводящее к некрозу ткани.
Постоянный избыток калия и натрия вызывает некоторое повышение уровня инсулина в крови. Отмечаются и другие гормональные сдвиги.
Люди с избытком калия обычно легко возбудимы, впечатлительны, гиперактивны, страдают от повышенной потливости, учащенных мочеиспусканий.
Накопление калия в крови, гиперкалиемия (при концентрации свыше 0,06%) приводит к тяжелым отравлениям, сопровождающимся параличом скелетных мышц; при концентрации калия в крови, превышающей 0,1%, наступает смерть. Длительное постоянное употребление калийных лечебных препаратов может вызывать ослабление сократительной деятельности сердечной мышцы, поэтому в таких случаях в место калийных назначают натриевые препараты. Развитию гиперкалиемии способствует ацидоз.
Основные причины избытка калия:
- Избыточное поступление (в т.ч., длительный и избыточный прием препаратов калия, потребление «горьких» минеральных вод, постоянная картофельная диета и пр.).
- Нарушение регуляции обмена калия.
- Перераспределение калия между тканями организма.
- Массированный выход калия из клеток (цитолиз, гемолиз, синдром раздавливания тканей).
- Дисфункция симпатоадреналовой системы.
- Инсулин-дефицитные состояния.
- Нарушение функции почек, почечная недостаточность.
Основные проявления избытка калия:
- Повышенная возбудимость, раздражительность, беспокойство, потливость.
- Слабость и парезы мышц, дегенеративные нервно-мышечные расстройства.
- Нейроциркуляторная дистония.
- Аритмии, ослабление сократительной способности мышцы сердца.
- Параличи скелетных мышц.
- Кишечные колики.
- Учащенное мочеиспускание.
- Склонность к развитию сахарного диабета.
щелочной минерал для сердца и защиты клеток
Хотите быть здоровым — думайте о своих клетках
Клетки — кирпичики нашего организма.
Все ткани состоят из клеток, из тканей состоят органы, из органов — системы (их всего 12). Это и есть наш организм.
Здоровые клетки формируют здоровые ткани и органы, а это гарантирует слаженную работу всех систем, а значит — здоровый организм.
КАЛИЕВО-НАТРИЕВЫЙ НАСОС.
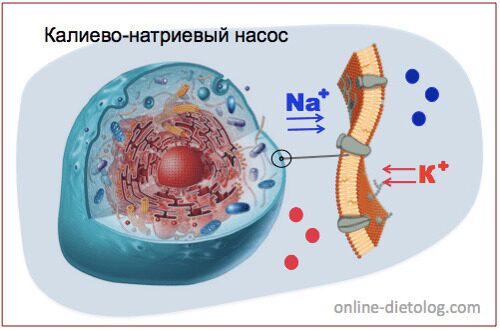
Чтобы в клетках происходили обменные процесы, необходимо постоянное поступление питательных веществ и кислорода, а также своевременное удаление отходов жизнидеятельности.
Калий есть внутри каждой клеточки. Вместе с ионами натрия он обеспечивает движение питательных веществ внутрь клетки, а отходы выводя наружу подобно насосу.
Эти микроэлементы выполняют противоположные функции. Ионы калия ускоряют химические реакции, а ионы натрия — замедляют.
Ионы калия клетки активно накапливают, а ионы натрия выводят наружу. Таким образом создается разность коцентраций — внутри больше калия, снаружи натрия. И это является необходимым условием для проведения нервных импульсов, стабильного сердечного ритма, поддержания водно-солевого баланса и нормального осмотического давлениея крови, а также баланса кислот и щелочей в организме. При этом калия и натрия в организме должно быть примерно одинаковое количество.
Также натрий способен удерживать воду, в то время как калий — наоборот способствует ее выведению из организма, «отталкивает» воду. Таким образом, превышение необходимого количества натрия провоцирует отечность.
НАТРИЯ МНОГО, А КАЛИЯ — КАТАСТРОФИЧЕСКИ НЕ ХВАТАЕТ
Изначально в рационе человека не было чрезмерного количества натрия, пока не началась добыча соли в промышленных масштабах. Сейчас мы солим практически все блюда, натрия в рационе современного человека стало слишком много.
Проблема в том, что в организме есть механизм запасания натрия. А вот с калием беда, калий постоянно выводится с мочой. Говорят его много в бананах. Ну может в тех, что сорвешь с дерева в Эквадоре и много. А нам-то на рынок завозят зеленые, которые дозревают в коробках, нет там никакого калия. Зелени едим мало. Вот калия в организме в организме часто и не хватает, это ведет к нарушению баланса.
Чрезмерное потребления натрия перегружает почки и сердце, а также становится причиной образования отеков. Именно поэтому при заболеваниях почек и сердца, при гипертонической болезни рекомендовано резкое ограничение количества повареной соли в рационе.
К ДЕФИЦИТУ КАЛИЯ ВЕДУТ:
- недостаточное поступление с пищей
- «мертвая» вода вымывает калий
- нарушения в работе ЖКТ (например понос, рвота)
- заболевания почек
- употребление диуретиков, антибиотиков
- гормональные нарушения
- диеты для похудения, голодание
Когда человек пьет мертвую очищенную воду (не говоря уже о прочих напитках), организму нужно сначала своими силами «снабдить» ее минералами. Иначе вода не сможет попасть в клетку. Так постепенно расходуются щелочные минералы — калий, кальций, магний, натрий. Но если натрий в организме большинства людей в избытке, то калия, кальция и магния — наоборот, не хватает.
Хронический недостаток калия провоцирует мышечные судороги и мышечную слабость, нарушение сердечного ритма (аритмия), редкое мочеиспускание, запоры, отечность, часто становится причиной сухости кожи и слабости волос.
КАК ВОССТАНОВИТЬ БАЛАНС
Необходимо уменьшить поступления натрия и увеличить поступление калия. При этом важно понимать — наш организм может усваивать только минералы органического происхождения, то есть из растений. Вот почему бесполезно пить синтетические витаминно-минеральные комплексы, которые в аптеке продаются, или, например, жевать мел в надежде на кальций.
Калий содержится в таких продктах, как молоко и молочные продукты, масо, зелень петрушки, помидоры, картофель, абрикосы, виноград (изюм), чернослив, какао. Проблема в том, что современные продукты содержат калия почти в половину меньше, чем еще 50 лет назад. А получить минералы наш организм может только с едой и водой, сам он их не синтезирует.
Для полноценного функционирования необходимо порядка 3500 мг калия в сутки. И важно обеспечить ежедневное его поступление в организм, так как, мы помним, что калий не запасается впрок.
ПЕНТОКАН — ОРГАНИЧЕСКИЙ КАЛИЙ В ЧИСТОМ ВИДЕ

СОСТАВ:
Гидрокарбонат калия (420 мг), витамин С и рибоза.
Это быстрорастворимые шипучие таблетки, которые насыщают воду органическим биодоступным калием.
Благодаря такой форме достигается уровень усваиваемости калия 97,5%
ПРИМЕНЕНИЕ:
Принимать во время еды. Растворите шипучую таблетку в 60 мл воды (можно больше, но выпить сразу).
Нажимая кнопку «УЗНАТЬ ЦЕНУ», вы переходите на официальный сайт компании-производителя, где указаны розничные цены на продукцию (смотреть правый верхний угол).
Заполните простую заявку и через 2 минуты на Ваш e-mail придет информация о том, как купить продукцию напрямую у компании со скидкой 20%
ЗАЧЕМ В СОСТАВЕ РИБОЗА

Дело в том, что для работы калия необходима энергия, поставляют ее молекулы АТФ (аденозинтрифосфат)
А для выработки АТФ в свою очередь необходима рибоза. В данном случае, когда мы используем рибозу в виде добавки, производство аденозинтрифосфата возрастает в 3-4 раза. А витамин С способствует доставке калия внутрь клетки.
ВИТАМИН «С» — АНТИОКСИДАНТ
Витамин C обладает высокими антиоксидативными свойствами. Это защита от преждевременного старения. Он особенно необходим тем людям, кто живет активной жизнью или напряженно работает, кто испытывает стрессы или живет в неблагоприятных условиях.
Витамин С способствует лучшему уваиванию белков, доставке кислорода в мышцы и ткани, благодаря ему организм легче и быстрее восстанавливается после нагрузок и стрессов.

Калий в жизни растений ⋆ Агрохимия
Накопление калия в хлоропластах и митохондриях способствует стабилизации их структуру и образованию АТФ. Он увеличивает гидрофильность коллоидов протоплазмы, при этом уменьшается транспирация, что способствует растениям лучше переносить кратковременные засухи.
Калий участвует в синтезе и обмене белков. При его недостатке синтез снижается с одновременным распадом старых молекул белков. В растениях накапливаются аминокислоты. Оптимизированное калийное питание приводит к повышению доли белка в растениях пшеницы. Усиливается синтез аспарагина и глютамина. Положительное действие калия на синтез белков связано с его влиянием на накопление и трансформацию углеводов (углеводы в процессе дыхания образуют кетокислоты, из которых синтезируются аминокислоты), а также с усилением ферментативной активности синтеза белка.
Калий катализирует синтез витаминов тиамина и рибофлавина, регулирует функционирование замыкающих клеток устьиц листьев.
Калий поглощается растениями в виде катиона и в этой форме остается в клетках и является основным противоионом отрицательно заряженных анионов клетки. Калий создает разность электрических потенциалов между клеткой и средой.
Участвуя в важнейших биохимических процессах, калий повышает устойчивость к различным заболеваниям в течение вегетации и в послеуборочный период, улучшает лежкость плодов и овощей.
Критический период в потреблении калия растениями приходится на первые 15 дней после появления всходов. Период максимального потребления, чаще всего, совпадает с периодом интенсивного прироста биологической массы. У некоторых культур, например, льна, поступление калия останавливается к фазе полного цветения или к цветению — началу молочной спелости, как у зерновых и зернобобовых. У других культур поступление более растянуто и происходит в течение всего вегетационного периода, как у картофеля, сахарной свеклы, капусты.
В районах, в которых действие калийных удобрений наиболее эффективно, их применение обеспечивает на каждый килограмм внесенного калия удобрений прибавку урожая: 2-3 кг зерна, 20-33 кг картофеля, 35-40 кг сахарной свеклы, 1-1,5 кг льноволокна, 20-33 кг сена сеяных трав и 8-18 кг сена луговых трав.
Зачем клетка обменивает натрий на калий?. Рассказы о биоэнергетике
Зачем клетка обменивает натрий на калий?
Мысль о двух формах конвертируемой энергии я высказал в 1975 году. Спустя два года эта точка зрения была поддержана Митчелом. А в группе А. Глаголева тем временем начались опыты по проверке одного из предсказаний этой новой концепции.
Я рассуждал следующим образом. Если протонный потенциал — разменная монета, то клетка должна располагать достаточным количеством, таких «денежных знаков».
Зачем клетка обменивает натрий на калий?
Это требование выполнялось, если речь шла об АТФ. Клетка всегда содержит довольно большие количества АТФ, причем приняты меры для стабилизации этого количества в условиях меняющейся конъюнктуры — непрерывно варьирующих скоростей образования и использования АТФ. Есть особое вещество — креатин-фосфат, участвующее только в одной реакции — фосфорилировании АДФ:
АДФ + креатинфосфат ? АТФ + креатин.
Когда АТФ в избытке, а АДФ в дефиците, реакция идет справа налево и накапливается креатинфосфат, которого в этих условиях становится много больше, чем АТФ. Но стоит повыситься уровню АДФ и уменьшиться АТФ, как реакция меняет направление, и креатинфосфат оказывается поставщиком АТФ. Тем самым креатинфосфат выполняет свою функцию стабилизатора, буфера уровня АТФ.
А как обстоят дела с протонным потенциалом?
Несложный расчет позволяет перевести одну энергетическую «валюту» в другую. Этот расчет показывает, что количество энергии, накопленное, к примеру, бактериальной клеткой в виде протонного потенциала, оказывается почти в тысячу раз меньшим, чем количество АТФ, если протонный потенциал находится в электрической форме. Это количество одного порядка с числом генераторов и потребителей потенциала в бактериальной мембране.
Такая ситуация создает особую необходимость в буферной системе, стабилизирующей уровень протонного потенциала. В противном случае даже кратковременное превышение общей скорости потребляющих потенциал процессов над скоростью его генерации приведет к исчезновению потенциала и остановке всех систем, питаемых потенциалом.
Итак, должен быть буфер для протонного потенциала наподобие креатинфосфата для АТФ. Но что за компонент подобрала природа на такую роль?
Обдумывая эту проблему, я попытался найти какую-нибудь связанную с потенциалом биологическую систему, функция которой была бы неизвестна.
Одна из старых загадок биологии: зачем клетка поглощает ионы калия и выбрасывает ионы натрия, создавая дорогостоящую асимметрию в распределении этих близких по своим свойствам ионов между цитоплазмой и окружающей средой? Практически в любой живой клетке ионов калия намного больше, чем ионов натрия, в то время как в среде натрий находится в огромном избытке над калием. Может быть, Na+ — яд для клетки?
Нет, это не так. Хоть некоторые ферментные системы действительно лучше работают в КСl, чем в NaCl, это выглядит вторичным приспособлением к «многокалиевой» и «малонатриевой» внутренней среде клетки. За огромный срок биологической эволюции клетка могла бы приспособиться к естественному соотношению ионов щелочных металлов во внешней среде. Живут же галофильные бактерии в насыщенном растворе NaCl, причем концентрация Na+ в их цитоплазме иногда доходит до моля на литр, что почти в тысячу раз больше концентрации Na+ в обычных клетках. Итак, Na+ не яд.
Заметим, что те же галофильные бактерии поддерживают внутриклеточную концентрацию К+ около 4 молей на литр, тратя на создание натрий-калиевого градиента колоссальные по масштабам клетки количества энергетических ресурсов.
Известно, что возбудимые клетки животных, такие, как нейроны, используют натрий-калиевый градиент для проведения нервного импульса. Но как быть с другими типами клеток, например, с бактериями?
Давайте обратимся к механизму транспорта К+ и Na+ через бактериальную мембрану. Известно, что между цитоплазмой бактерии и внешней средой существует разность электрических потенциалов, поддерживаемая работой белков-генераторов в бактериальной мембране. Откачивая протоны изнутри клетки наружу, белки-генераторы тем самым заряжают внутренность бактерии отрицательно. В этих условиях накопление ионов К+ внутри клетки могло бы происходить просто за счет электрофореза — движения положительно заряженного иона калия в отрицательно заряженную цитоплазму бактерии.
При этом поток калия должен разряжать мембрану, предварительно заряженную протонными генераторами.
В свою очередь, разрядка мембраны должна немедленно активировать работу генераторов.
Это означает, что энергетические ресурсы, затрачиваемые на генерацию разности электрических потенциалов между клеткой и средой, будут использованы для концентрирования ионов К+ внутри клетки. Конечным балансом такого процесса окажется обмен внутриклеточных ионов Н+ на внеклеточные ионы К+ (ионы Н+ откачиваются белками-генераторами наружу, ионы К+ поступают внутрь, двигаясь в электрическом поле, созданном движением ионов Н+).
Стало быть, внутри клетки будет создаваться не только избыток ионов К+, но и дефицит ионов Н+.
Этот дефицит можно использовать для откачки ионов Na+. Сделать это можно следующим образом. Известно, что бактерии располагают особым переносчиком ионов натрия, обменивающим Na+ на Н+ (этот переносчик носит название Nа+/Н+-антипортера). В условиях нехватки Н+ в цитоплазме антипорт может компенсировать протонный дефицит, перенося Н+ из внешней среды внутрь клетки. Произвести такой антипорт переносчик может только одним способом: обменяв внешний на внутренний Na+. Значит, движение ионов Н+ внутрь клетки может быть использовано для откачки из той же клетки ионов Na+.
Вот мы и создали калий-натриевый градиент: внутри клетки накопили К+ и откачали оттуда Na+. Движущей силой этих процессов был создаваемый белками-генераторами протонный потенциал. (Направление потенциала было таково, что внутренность клетки заряжалась отрицательно и там возникала нехватка ионов водорода.)
Допустим теперь, что протонные генераторы по какой-то причине выключились. Что произойдет в этих новых условиях с калий-натриевым градиентом?
Конечно же, он рассеется: ионы К+ вытекут из клетки в окружающую среду, где их мало, ионы Na+ войдут внутрь, где эти ионы в дефиците.
Но вот что интересно. Рассеиваясь, калий-натриевый градиент сам окажется генератором протонного потенциала того же направления, что образовывался при работе белков-генераторов.
Действительно, выход иона К+ как положительно заряженной частицы создает диффузионную разность потенциалов на клеточной мембране со знаком «минус» внутри клетки. Вход Na+ при участии Nа+/Н+ — антипортера будет сопровождаться выходом Н+, то есть созданием дефицита Н+ внутри клетки.
Так что же получается? Когда белки-генераторы работают, создаваемый ими протонный потенциал расходуется на образование калий-натриевого градиента. Зато когда они выключены (или их мощности недостает, чтобы удовлетворить многочисленных потребителей потенциала), калий-натриевый градиент, рассеиваясь, сам начинает генерировать протонный потенциал.
Так ведь это и есть буфер протонного потенциала, тот самый буфер, который так необходим для работы мембранных энергетических систем!
Схематично эту концепцию можно изобразить так:
калий-натриевый градиент
??
внешние энергетические ресурсы ? протонный потенциал ? работа.
Но если такая схема верна, то калий-натриевый градиент должен продлить работоспособность клетки в условиях, когда исчерпаны энергетические ресурсы.
А. Глаголев и И. Броун проверили справедливость этого вывода. Был взят мутант кишечной палочки, лишенный протонной АТФ-синтетазы. Для такого мутанта окисление субстратов кислородом служит единственным энергетическим ресурсом, пригодным, чтобы образовать протонный потенциал. Как было показано в свое время Дж. Адлером и его сотрудниками, мутант подвижен, пока в среде есть кислород.
Глаголев и Броун повторили опыт Адлера и убедились, что исчерпание запаса кислорода в растворе действительно останавливает бактерии, если они находятся в среде с КСl. В этих условиях калий-натриевый градиент отсутствует: калия много и в клетках и в среде, а натрия нет ни там, ни здесь.
А теперь давайте возьмем среду с NaCl. В таких условиях должны быть оба интересующих нас градиента: калиевый (калия много внутри и мало снаружи) и натриевый (натрия много снаружи и мало внутри). Гипотеза предсказывала, что в такой ситуации подвижность сохранится какое-то время и в бескислородных условиях, поскольку возможно превращение энергии:
калий-натриевый градиент ? протонный потенциал ? вращение флагеллы.
И в самом деле, бактерии двигались еще 15—20 минут после того, как измерительное устройство зарегистрировало нулевой уровень СЬ в среде.
Но особенно наглядным, как и следовало ожидать, оказался опыт с солелюбивыми бактериями, которые транспортируют очень большие количества ионов К+ и Na+ , чтобы создать калий-натриевый градиент. Такие бактерии быстро останавливались в темноте в бескислородных условиях, если в среде был КСl, и все еще двигались спустя девять (!) часов, если КСl был заменен на NaCl.
Эта величина — девять часов — интересна прежде всего как иллюстрация объема того резервуара энергии, который представляет собой калий-натриевый градиент у солелюбивых бактерий. Кроме того, она приобретает особый смысл, если вспомнить о том, что солелюбивые бактерии располагают бактериородопсином и, стало быть, способны к превращению энергии света в протонный потенциал. Ясно, что такое превращение возможно лишь в светлый период суток. А как быть ночью? Так вот оказывается, что энергии, запасенной днем в виде калий-натриевого градиента, хватает на всю ночь.
Утверждение, что калий-натриевый градиент играет роль буфера протонного потенциала, позволяет понять не только биологическую функцию этого градиента, но и причину, которая в течение многих лет препятствовала выяснению его значения для жизнедеятельности клетки. Мысль о буферной роли калий-натриевого градиента не могла родиться, прежде чем был открыт протонный потенциал и было доказано, что он служит конвертируемой формой энергии. Все эти годы проблема калия и натрия просто ждала своего часа.
Поделитесь на страничкеСледующая глава >
Биологическая роль натрия, калия, кальция и магния
Вследствие очень легкой окисляемости щелочные металлы встречаются в природе исключительно в виде соединений.
По содержанию в организме человека натрий (0,08%) и калий (0,23%) относятся к макроэлементам, литий, рубидий и цезий – к микроэлементам.
Натрий и калий относятся к жизненно необходимым элементам, постоянно содержатся в организме, участвуют в обмене веществ.
Натрий
Содержание натрия в организме человека массой 70 кг – около 60 г: 44% — во внеклеточной жидкости, 9% — во внутриклеточной. Остальное количество натрия находится в костной ткани – место депонирования иона Na+ в организме.
В организме человека натрий находится в виде его растворимых солей: хлорида, фосфата, гидрокарбоната.
Распределен по всему организму:
в сыворотке крови,
в спинномозговой жидкости,
в глазной жидкости,
9
в пищеварительных соках,
в желчи,
в почках,
в коже,
в костной ткани,
в легких,
в мозге.
Натрий является основным внеклеточным ионом. Концентрация ионов Na+ внутри клетки примерно в 15 раз меньше, чем во внеклеточной жидкости.
Ионы натрия играют важную роль в обеспечении постоянства внутренней среды человеческого организма, участвуют в поддержании постоянного осмотического давления биожидкости (осмотического гомеостаза).
В виде противоионов в соединениях с фосфорной кислотой (Na2HPO4 + Nah3PO4) органическими кислотами натрий обеспечивает кислотно-основное равновесие организма.
Ионы натрия участвуют в регуляции водного обмена и влияют на работу ферментов.
Вместе с ионами калия, магния, кальция, хлора ионы натрия участвуют в передаче нервных импульсов. При изменении содержания натрия в организме происходят нарушения функций нервной, сердечно-сосудистой систем, гладких и скелетных мышц.
Натрия хлорид NaCl – основной источник соляной кислоты для желудочного сока.
10
Ионы натрия принимают участие в формировании разности потенциалов на мембране.
Препараты натрия, применяемые в медицине
Изотонический раствор – NaCl (0,9%) – для инъекций вводят подкожно, внутривенно и в клизмах при обезвоживании организма и при интоксикацях. Также применяют для промывания ран, глаз, слизистой оболочки глаза, также для растворения различных ЛП.
Гипертонические растворы — NaCl (3-5-10%) – применяют наружно в виде компрессов и примочек при лечении гнойных ран. По закону осмоса применение таких компрессов способствует отделению гноя из ран и плазмолизу бактерий (антимикробное действие).
2-5% р-рNaCl назначают внутрь для промывания желудка при отравлении AgNO3.
Ag(р) + Cl(р) → AgCl(т)
Натрия гидрокарбонат NaHCO3 используют при заболеваниях, сопровождающихся ацидозом.
Механизм
NaHCO3 + RCOOH → h3O + CO2 + RCOONa
RCOONa натриевые соли органических кислот в значительной мере выводятся с мочой, CO2 – покидает организм с выдыхаемым воздухом.
NaHCO3 также используют при повышенной кислотности желудочного сока, язвенной болезни желудка и двенадцатиперстной кишки.
NaHCO3 + HCl → h3O + NaCl + CO2
11
Имеет ряд побочных эффектов :
NaHCO3 применяют в виде полосканий, промывания при воспалительных заболеваниях глаз, слизистых оболочек верхних дыхательных путей. В результате гидролиза NaHCO3 водный раствор имеет слабощелочные свойства. При воздействии щелочи на микробные клетки происходит их гибель.
NaHCO3 + h3O → NaOH + CO2 + h3O
Натрия сульфат Na2SO4*10h3O – применяют в качестве слабительного средства. Соль медленно всасывается из кишечника, что приводит к поддержанию повышенного осмотического давления в полости кишечника. В результате осмоса происходит накопление воды в кишечнике, содержимое его разжижается, сокращения кишечника усиливаются и каловые массы быстрее выводятся.
Натрия тетраборат Na2B4O7*10h3O – применяется наружно как антисептическое средство для полосканий, спринцеваний, смазываний. Антисептическое действие аналогично NaHCO3, связано со щелочной реакцией среды в результате гидролиза.
Na2B4O7 + 7h3O → 2NaOH + 4h4BO3
Радиоактивный изотоп 24Na в качестве метки применяют для определения скорости кровотока, используют для лечения некоторых форм лейкемии.
Калий
Содержание калия в организме человека массой 70 кг – около 160 г.: 2% — во внеклеточной жидкости, 98% — во внутриклеточной.
В организме человека калий находится:
12
Калий является основным внутриклеточным ионом. Концентрация ионов К+ внутри клетки примерно в 35 раз больше, чем во внеклеточной жидкости.Ионы калия играют важную роль в физиологических процессах – сокращении мышц, нормальном функционировании сердца, проведении нервных импульсов, обменных реакциях. Являются важными активаторами внутриклеточных ферментов.
Действие Na+, К+-АТФазы и возникновение разности потенциалов на клеточных мембранах
Многие важные биологические процессы осуществляются только при условии различного ионного и молекулярного состава внутри клеток и во внеклеточной жидкости. Концентрация ионов К+ внутри клетки примерно в 35 раз больше, чем во внеклеточной жидкости, концентрация ионов Na+ внутри клетки примерно в 15 раз меньше, чем во внеклеточной жидкости. Чтобы поддерживать такое распределение ионы калия должны перемещаться из внешней среды внутрь клетки, а ионы натрия – наоборот, поступать из клетки во внеклеточное пространство. Т.е. должен осуществляться перенос ионов из области с более низкой концентрацией в область с более высокой концентрацией. Самопроизвольно такой процесс протекать не может. Нормальное распределение ионов натрия и калия обеспечивается работой натрий-калиевых насосов. Работа этих насосов по переносу ионов против градиента концентрации и по поддержанию этого градиента требует большой
13
затраты энергии, следовательно, сопровождается макроэргической реакцией гидролиза АТФ.
За счет энергии гидролиза одной молекулы АТФ три иона Na+ выводятся из клетки, а два иона К+ — поступают в клетку. В итоге на мембране клетки возникает разность потенциалов: наружная поверхность мембраны заряжается положительно, а внутренняя – отрицательно.
Магний
Формально относится к макроэлементам. Общее содержание в организме 0,027% (около 20 г). В наибольшей степени магний концентрируется в дентине и эмали зубов, костной ткани. Накапливается в
поджелудочной железе,
скелетных мышцах,
почках,
мозге,
печени и сердце.
Является внутриклеточным катионом. Концентрация ионов Mg2+ внутри клеток примерно в 2,5-3 раза выше, чем во внеклеточной жидкости.
Во внутриклеточной жидкости АТФ и АДФ присутствуют, в основном, в виде комплексов MgАТФ 2- и MgАДФ 2-.
Во многих ферментативных реакциях активной формой АТФ является комплекс MgАТФ 2-.
14
Препараты магния, применяемые в медицине
MgO магния оксид – применяют в качестве антацидного средства при повышенной кислотности желудочного сока.
MgO + HCl → h3O + MgCl2
MgCl2 – обладает легким послябляющим эффектом.
MgO магния оксид (85%) и магния пероксид MgO2 (15%) «магний перекись». Применяют при кишечных расстройствах.
MgSO4*7h3O магния сульфат (горькая соль) – в зависимости от дозы может обладать седативным, снотворным или наркотическим эффектом. Применяют и как слабительное.
В качестве адсорбирующего и обволакивающего средства применяют тальк силикатное производное Mg2+ — 2 MgSiO3* Mg(HSiO3)2.
Здоровый баланс натрий-калий в продуктах питания
Строго говоря, безопасное количество натрия зависит от поступления калия, для здоровья важно правильное соотношение натрия и калия в продуктах питания, это соотношение определяет очень многие показатели: от общего тонуса до здоровья костей и артериального давления. Давайте разбираться.

Эволюционное несоответствие.
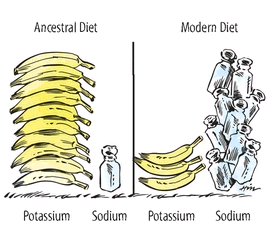
Откуда возникла проблема соотношения калия и натрия? Ответ на это дает теория несоответствия и исследования образа жизни наших далеких предков – охотников-собирателей.
Калий (К+, Potassium), Натрий (Na+, Sodium) – это два самых распространенных в клетках нашего организма минерала. Вещество, которое было редкостью во времена палеолита, а теперь имеется практически в избытке, — поваренная (натриевая) соль. Натрий абсолютно необходим для неврологического и мышечного функционирования; без него невозможно поддержание жизни. То же самое можно сказать о калии, но из этих двух питательных веществ организм активно сохраняет только натрий.
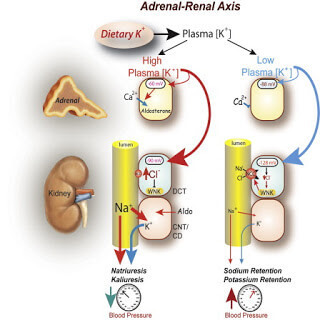
Когда уровень натрия в организме понижается, кора надпочечников выделяет гормон, называемый альдостероном, который заставляет почки снова поглощать циркулирующий натрий. Организм бережлив в отношении натрия и расточителен к калию. Он обладает мощными механизмами задержания натрия (ренин-ангиотензин-альдостероновая система), но лишен механизмов активного сохранения калия и выведения избытков натрия, поэтому недостаток натрия переносится легче, чем его избыток.
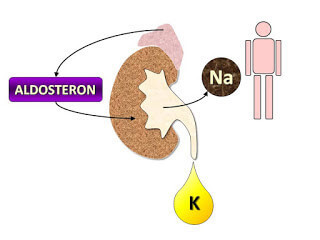
Хотя калий столь же необходим для жизни, в организме нет сложных физиологических механизмов для удержания калия. Он постоянно выводится с мочой, особенно при стрессе. Эти различия являются продуктом нашей эволюционной истории. За исключением морских побережий, древняя среда обитания была по большей части лишена поваренной соли.
Соответственно, нашему организму требуется натрий, и в нем имеются механизмы для ее удержания. Вдали от моря натрий содержится только в животной пищи, поэтому охотники могли обходится без соли. Но как только люди перешли к земледелию, то соль стала настоящим сокровищам, так как земледельцы стали потреблять значительно больше растительной пищи и меньше животной и у них возник серьезный дефицит соли (соляной голод).
С другой стороны, калий обычно содержится в растительной пище, в частности во фруктах. Охотник собиратель ел растительную пищу ежедневно, поэтому природа не предусмотрела механизм накопления и сохранения калия в нашем организме. Калий всегда был настолько распространенной частью окружающей среды, что у нас отсутствуют специальные физиологические приспособления для его сохранения. Мы никогда не испытывали настоятельной потребности в таком механизме за весь период своего эволюционного прошлого.
В современном мире натрий повсюду, и мы, как правило, употребляем натрий в намного большем количестве, чем необходимо. Современный человек не употребляет многие растительные продукты, а если употребляет, то или очень мало или в переработанном виде с добавлением натрия (тот же хлеб и др.). В итоге уровень калия в организме минимален, а соотношение калий-натрий перевернуто.
Что же сейчас? Баланс калий-натрий.
Сейчас у нас абсолютно противоположная ситуация: натрий находится в избытке, огромное количество натрия находится как в виде соли, так и в виде многочисленных добавок (натрия сорбат, натрия бензоат, натрия глутамат, натрия аскорбинат, натрия бикарбонат и др.). А растительной пищи мы едим намного меньше или сильно переработанную.
Например, томатный сок с солью, который обычно продается в магазинах, несмотря на то, что содержит большое количество калия, из-за того, что натрия там обычно в 2 раза больше, в итоге, мы не получаем калий, так как он нейтрализуется натрием.
Усугубляет ситуацию и стресс. При стрессе наш организм начинает еще сильнее выводить калий и накапливать натрий, ухудшая и без того неблагоприятную ситуацию. В итоге мы имеем «перевернутое» соотношение натрия и калия в современной диете, что приводит ко множеству проблем.
Существует тесная связь между обменом веществ, воды и электролитов. Ввиду того, что калий легко выводится из организма, а натрий легко задерживается в нем, можно говорить об известном антагонизме между калием и натрием в отношении водного обмена.
Калий и натрий оказывают противоположное действие на обмен воды в организме: калий обладает мочегонным эффектом, а натрий задерживает воду (ионы натрия вызывают набухание коллоидов тканей). Богатая калием пища вызывает повышенное выделение натрия из организма вместе с водой, при этом растворяются вредные солевые излишки, образующиеся при обмене веществ. В то же время потребление натриевой пищи в большом количестве приводит к потере калия и консервации в организме продуктов метаболизма.
Нормальное потребление калия в цельных растительных продуктах приводит к тому, что у них достаточно низкая частота заболеваний сердечно-сосудистой системы. Также у народов, в питании которых мало натрия и преобладают овощи и фрукты, гипертония встречается лишь у 1% населения.
В то время как среди городских жителей артериальная гипертония – одна из важнейших проблем со здоровьем, которой страдают около трети всех жителей городов. Это объясняется тем, что городские жители в пищу принимают в основном специально обработанные продукты, содержащие много соли (натрия). К примеру, у среднего американца суточное потребление натрия в 2 раза превышает норму, а калия – наоборот, в 2 раза меньше нормы.
Исследования показали, что большое количество натрия в пище было связано с повышением риска смерти от любого заболевания. «Люди в группе с повышенным содержанием натрия в пище имели увеличения риска смерти от любой болезни на 73% по сравнению с группой меньшего потребления натрия», говорит Куклина.
В группу повышенного потребления натрия входили люди, чей рацион содержал 5000 мг натрия в день. Те, кто потреблял 4069 мг калия в день, имели снижение риска смерти от любой болезни на 49% по сравнению с людьми, употреблявшими 1793 мг калия в день. Большое количество калия в пище снижало риск смертельного исхода при заболеваниях сердца.
При оценке соотношения натрия и калия в пище ученые обнаружили, что люди с самым неблагоприятным соотношением (много натрия и мало калия) имели вдвое больший риск смерти от заболеваний сердца и на 50% больший риск смерти от других заболеваний на протяжении наблюдения. Нормальное потребление калия предотвращает образование камней в почках, печени, желчных протоках. Калий предотвращает образования известковых отложений в суставах, сосудах. Избыток натрия, наоборот, вызывает задержку жидкости.
Необходимо помнить о калий-натриевом балансе. Дело в том, что пища, богатая калием, вызывает повышенное выведение натрия, и наоборот. Если человек потребляет продукты преимущественно растительного происхождения, богатые калием, не надо забывать о соли. Веган, который занимается спортом и не солит пищу, может заработать серьезный дефицит натрия за одну-две недели.
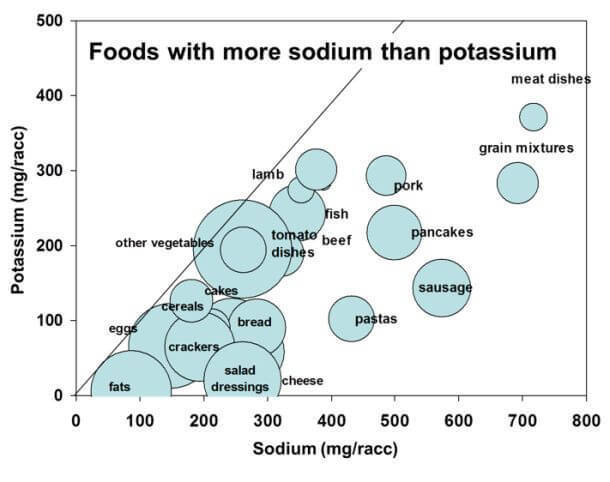
Проявления дефицита калия.
Слабость и утомление могут быть наиболее часто встречающимся показателем недостатка калия в организме. Судороги ног, особенно такие, что будят вас посреди ночи, тоже могут быть связаны с низким уровнем этого минерала ( а также магния и кальция).
Сторонники низкокалорийных диет и любители напряженных физических упражнений особенно подвержены связанной с недостатком калия потере энергии. То же можно сказать и о пожилых людях. Недостаточное количество калия и магния может способствовать развитию синдрома хронической усталости. Нередко одного лишь восполнения запасов минералов в организме с помощью равных количеств (250—500 мг) органических солей калия и магния оказывается достаточно, чтобы восстановить тонус мышц, повысить уровень энергии и увеличить выносливость.
Результаты зачастую могут стать заметными уже через неделю. Если этот дуэт сам по себе не помогает, он все равно может оказаться полезным дополнением при лечении других видов усталости.
Достаточное количество калия важно для образования гликогена и белкового обмена. Так, внутриклеточное связывание калия происходит при образовании гликогена и белка: на 1 г гликогена в клетки поступает 0,3 ммоль ионов К+, 1 г азота белка связывает 3 ммоль К+.
Это объясняет, почему изменения баланса калия и азота в организме однонаправленны. При усилении катаболических процессов калий и азот освобождаются из клеток, анаболических — задерживаются в них. Обмен калия в организме регулируют альдостерон и глюкокортикоиды: они уменьшают реабсорбцию калия в дистальных отделах канальцев, способствуют его освобождению из связи с белками и углеводами.
Где взять калий?
Цельная растительная пища — это универсальный источник калия. Например, калий во фруктах отлично усваивается, так как очень эффективно сочетание глюкозы с инсулином, что способствует переходу калия в клетки. Суточная потребность в калии для взрослого человека составляет 2-5 г в день, в натрии – 1-2 г.
При больших физических и умственных нагрузках, беременности и питании с большим количеством соли потребность в калии увеличивается. Детям рассчитывают необходимое количество калия, исходя из их веса: 16-30 мг на каждый килограмм. Официальные цифры из Руководства по питанию (США): потребление натрия не более 1500 мг в день и калия 4700 мг в день.
В большинстве физиологических процессов калий выступает как антагонист натрия (Na), поэтому, для сохранения хорошего здоровья необходимо чтобы соотношение натрия к калию в рационе питания было 1:2 – 1:4. Вредное для здоровья избыточное содержание натрия в организме можно нейтрализовать введением дополнительных количеств калия. На этом основана терапия отечных состояний диетой, обогащенной калием.
Овощи и фрукты содержат много калия и мало натрия. Например, один фрукт авокадо содержит целый грамм калия! Продукты-чемпионы по содержанию калия: горох, соя, фасоль, чечевица, орехи, сухофрукты, грибы белые сушеные, баклажаны, капуста брюссельская, краснокочанная, кольраби, картофель, петрушка, пастернак, ревень, редис, редька, репа, салат, сельдерей, свекла, томаты и томатная паста, укроп, чеснок, хрен, шпинат, щавель
Заключение.
Калий в организме человека – антипод натрия. Эти два элемента участвуют в одних и тех же биохимических процессах, но с разным вектором. Недостаток одного из этих элементов приводит к избытку другого и, как следствие, к сбою в определённых системах организма. Баланс натрия и калия в организме играет важную роль в процессе формирования нашего здоровья, и что пища способна быть основным источником поддержания этого баланса.
Соблюдая питание, основанное на сбалансированности натрия и калия, мы укрепите и поможете правильно функционировать собственным мышцам и нервным тканям (те мышцы, на которые приходится особенная нагрузка, нуждаются в обильном снабжении обоими минералами). Также тело будет лучше сохранять кислотно-основной баланс и водно-минеральный.
Баланс натрия и калия намного важнее, чем соблюдение конкретного количества.
Научная литература демонстрирует, что калий в цельной растительной пище может быть гораздо более важным как для лечения, так и для профилактики ряда заболеваний.опубликовано econet.ru
