Нестероидные противовоспалительные средства при желчной колике
Актуальность
Нестероидные противовоспалительные средства (НПВС), такие как диклофенак, кеторолак, теноксикам, флурбипрофен и т.д., как правило, используются для облегчения боли при желчной колике.
Характеристика исследований
Мы провели поиск рандомизированных клинических исследований, в которых участвовали люди, испытывающие желчные колики, и сравнили НПВС с отсутствием вмешательства, плацебо или другими лекарствами.
Основные результаты
Мы включили в обзор 12 рандомизированных клинических испытаний с 828 участниками, из которых 416 получали НПВС и 412 получали плацебо, или спазмолитические препараты, или опиоиды. Учитывая широкую распространенность возникновения желчных колик, эти числа испытаний и участников являются недостаточными. В этих испытаниях были слабо представленыпожилые участники и участники с сопутствующими заболеваниями. Двадцать четыре процента участников были мужчины.
Ни в одном из исследований не сообщалось о серьезных неблагоприятных событиях. В семи из 12 испытаний сообщили о незначительных неблагоприятных явлениях; в двух из восьми исследований нежелательных явлений не наблюдалось, и незначительные события были зарегистрированы в оставшихся пяти исследованиях.
Мы нашли одно продолжающееся рандомизированное клиническое испытание, направленное на оценку обезболивающего эффекта внутривенного введения ибупрофена при желчной колики.
Финансирование
Испытания оказались свободными от спонсорства фармацевтической промышленности или иного вида поддержки коммерческими организациями, которые могут манипулировать дизайном клинического испытания, его проведением, результатами или выводами.
Качество доказательств
Качество доказательств в соответствии с критериями GRADE (система, разработанная для классификации / ранжирования доказательств и рекомендаций в здравоохранении) была средним для сравнения НПВС с плацебо по исходу — отсутствие облегчения боли; и качество было низким или очень низким для других исходов и сравнений.
Только одно из 12 испытаний имело низкий риск смещения, в соответствии с предопределенными разделами (доменами) оценки «Риска смещения».
Результаты настоящего систематического обзора с мета-анализом позволяют предположить, что НПВС могут быть использованы для облегчения боли, но дальнейшие рандомизированные клинические испытания являются оправданными, и НПВС следует использовать с осторожностью в некоторых группах пациентов, таких как пожилые люди и люди с сопутствующими заболеваниями.
Лекарства для лечения Желчекаменной болезни
A.NATTERMANN and Cie., GmbH [А.Наттерманн энд Сие. ГмбХ]
Abdi Ibrahim Ilac Sanayi ve Ticaret [Абди Ибрахим Иляч Санайи ве Тидж]
Adamed Consumer Healthcare [Адамед Консьюмер Хелскеа]
Avexima [Авексима]
BalkanpharmaBiologische Heilmittel Heel [Биологише Хайльмиттель Хеель]
Cadila [Кадила]
Chinoin [Хиноин]
Dr. Falk Pharma [Доктор Фальк Фарма]
Falk Pharma [Доктор Фальк Фарма]
Dr. Reddy’s Laboratories [Доктор Реддис Лабораторис]
EGIS Pharmaceuticals [ЭГИС Фармасьютикалс]
Grindex [Гриндекс]
Krewel Meuselbach [Кревель Мойзельбах]
KRKA [КРКА]
Losan Pharma [Лозан Фарма]
Micro Labs [Микро Лабс]
Mipharm [Мифарм]
Novartis Pharma [Новартис Фарма]
Omega Bittner [Омега Биттнер]
Pharmproject [Фармпроект]
Pro. Med. [Про Мед]
Med. [Про Мед]
Renewal [Обновление]
Shreya Life Sciences [Шрея Лайф Саенсиз]
Sopharma [Софарма]
Stada Arzneimittel AG [Штада Арцнаймиттель]
Sun Pharmaceutical [Сан Фармасьютикалс]
Torrent Pharmaceuticals [Торрент Фармасьтикалс]
Unichem Laboratories [Юникем Лабораториз]
Valenta [Валента Фарм]
Zentiva [Зентива Прайвет Лимитед]
АВВА-РУС
Адифарм ЕАД
Альтфарм
Армавирская биофабрика
Биосинтез
Борисовский завод медицинских препаратов
Вертекс
ВетПром АД
Вифитех
Вокхардт Лимитед
Гиппократ ООО
Гротекс ООО
Дальхимфарм
Дальхимфарм ОАО
ЗиО-Здоровье
Канонфарма продакшн ЗАО
Медисорб АО
Московская фармацевтическая фабрика
Московский эндокринный завод
Муромский ПЗ
Нижфарм
Оболенское ФП
Озон ООО
Органика
Санофи-Авентис/Sanofi-Aventis
Северная Звезда ЗАО
Татхимфармпрепараты
Тева/Teva
Фармстандарт-Лексредства
ЮжФарм ООО
что это такое, причины, признаки, симптомы, лечение – МЕДСИ
Оглавление
Холецистит является воспалительным процессом, который возникает в желчном пузыре. От этой патологии сегодня страдает около 20% жителей всего мира. Причем наиболее подвержены заболеванию женщины старше 50 лет. Воспаление выявляют у людей и другого возраста. Причем для детей и подростков характерна бескаменная форма. Зачастую болезнь диагностируется в развитых странах. Обусловлено это особым образом жизни и пищевым поведением.
От этой патологии сегодня страдает около 20% жителей всего мира. Причем наиболее подвержены заболеванию женщины старше 50 лет. Воспаление выявляют у людей и другого возраста. Причем для детей и подростков характерна бескаменная форма. Зачастую болезнь диагностируется в развитых странах. Обусловлено это особым образом жизни и пищевым поведением.
Причины
Большое значение для развития патологии имеет застой желчи и инфекционный процесс в желчном пузыре. Опасные микроорганизмы проникают в орган из других очагов при отите, пародонтозе и иных заболеваниях или из кишечника контактным путем. Патогенная микрофлора преимущественно представлена бактериями, вирусами, реже паразитами и простейшими.
К основным причинам развития холецистита относят:
- Желчнокаменную болезнь. На ее фоне патология развивается в большинстве случаев. Объясняется это тем, что к застою желчи приводят именно конкременты. Они закупоривают просвет, травмируют слизистые и вызывают появление спаек.
 При этом камни поддерживают воспалительный процесс
При этом камни поддерживают воспалительный процесс - Дискинезию желчевыводящих путей. Данная патология приводит к недостаточному опорожнению органа, возникновению воспаления, образованию камней
- Врожденные анатомические аномалии. Рубцы, искривления, перетяжки пузыря, сужения протоков провоцируют застой желчи
Также спровоцировать холецистит могут и другие заболевания и новообразования (в том числе кисты и опухоли).
Патогенез
Основой механизма развития заболевания является застой желчи. В результате сокращается барьерная (защитная) функция эпителия слизистой и его устойчивость к патогенной флоре. При этом сама желчь становится местом активного размножения микробов. Во время своей жизнедеятельности они образуют токсины. В результате прогрессирования патологии воспаление распространяется. При этом сократительная способность желчного пузыря уменьшается. В желчи появляются слизь и гной.
Если воспаление переходит в соседние ткани, формируется абсцесс. Нарушения кровообращения становятся причиной кровоизлияний в стенках пузыря. Появляются отдельные участки некроза (отмирания тканей).
Нарушения кровообращения становятся причиной кровоизлияний в стенках пузыря. Появляются отдельные участки некроза (отмирания тканей).
Безусловно, все это негативно сказывается на состоянии здоровья человека. Очень важно вовремя обратить внимание на симптомы холецистита и начать его лечение. Только в этом случае можно предотвратить хронизацию процесса и избежать длительной многолетней и постоянной терапии.
Факторы риска
Холецистит возникает на фоне целого ряда провоцирующих факторов, к которым относят:
- Изменения нормального состава и консистенции желчи
- Гормональные перестройки, которые происходят в организме во время менопаузы, беременности и др.
- Неправильное питание
- Заброс ферментов поджелудочной железы
- Курение
- Злоупотребление алкоголем
- Сидячую работу и отсутствие необходимых нагрузок
- Наследственность
Классификация заболевания
От этой патологии сегодня страдает около 20% жителей всего мира.
Выделяют несколько форм патологии.
С учетом происхождения заболевание делится на 2 основных типа:
- Калькулезный холецистит. При таком типе патологии в желчном пузыре обнаруживают камни. Это является самым распространенным вариантом. Для подобного заболевания характерны выраженные клинические проявления с приступами колики. Одновременно с этим патология может протекать и совсем без симптомов
- Некалькулезный холецистит. При такой патологии камни не обнаруживаются. Заболевание отличается более благоприятным течением. Для него характерны редкие обострения
В зависимости от воспалительно-деструктивных изменений и степени выраженности признаков холецистит может быть:
- Острым. Для заболевания в этой форме характерны выраженные признаки воспаления. Обычно оно протекает с яркими клиническими проявлениями и явной интоксикацией. Боль при остром холецистите интенсивная, волнообразного характера
- Хроническим.
 Для заболевания характерно медленное течение без явных симптомов. Боль либо отсутствует полностью, либо является слабовыраженной и ноющей
Для заболевания характерно медленное течение без явных симптомов. Боль либо отсутствует полностью, либо является слабовыраженной и ноющей
В зависимости от степени проявлений выделяют следующие формы холецистита:
- Легкая. Для нее характерен слабовыраженный болевой синдром. Обычно приступы длятся не более 10–20 минут и проходят самостоятельно. Обострения возникают 1–2 раза в год. Их длительность обычно не превышает 14 дней. Функции остальных органов при этом не изменяются. Нарушения пищеварения выявляют редко
- Средняя. Для этой формы патологии характерны стойкие боли. Обострения длятся по 3–4 недели и возникают 3 раза в год и чаще. Обычно при диагностике выявляют изменения в работе печени, проявляющиеся повышенными показателями билирубина, АСТ и АЛТ
- Тяжелая. Для этой формы холецистита характерны нарушения функции и соседних органов, развиваются панкреатит и гепатит. Боль при патологии является резко выраженной. Обострения длятся более месяца и возникают часто.
 Самочувствие не улучшается даже при корректной терапии
Самочувствие не улучшается даже при корректной терапии
В зависимости от характера воспалительно-деструктивного процесса выделяют следующие виды течения холецистита:
- Рецидивирующее. Для него характерны приступы обострения, которые переходят в полную ремиссию
- Монотонное. При таком течении заболевания ремиссии отсутствуют. Пациенты постоянно жалуются на те или иные симптомы холецистита
- Перемежающееся. Обострения холецистита возникают на фоне его слабовыраженных постоянных признаков
Симптомы заболевания
Острый холецистит
При бескаменной форме заболевания пациенты жалуются на тянущие боли в результате переедания и употребления алкоголя. Данная форма протекает без осложнений. При калькулезной патологии пациенты жалуются на боль, горький привкус во рту, зуд кожи и ее желтушность.
Хронический холецистит
Во многом признаки патологии определяются характером воспаления, а также отсутствием или наличием камней. В периоды обострений пациенты жалуются на боль в виде приступов, которая отдает в лопатку, плечо и ключицу. Обычно неприятные ощущения возникают при погрешностях в питании, стрессах и после физических нагрузок. Нередко боль сопровождается слабостью, бессонницей, потливостью. В некоторых случаях к основным симптомам холецистита добавляются: рвота и тошнота, вздутия живота, нарушения стула, повышение температуры, тахикардия, сниженное артериальное давление. В фазе ремиссии симптомы отсутствуют или являются слабовыраженными.
В периоды обострений пациенты жалуются на боль в виде приступов, которая отдает в лопатку, плечо и ключицу. Обычно неприятные ощущения возникают при погрешностях в питании, стрессах и после физических нагрузок. Нередко боль сопровождается слабостью, бессонницей, потливостью. В некоторых случаях к основным симптомам холецистита добавляются: рвота и тошнота, вздутия живота, нарушения стула, повышение температуры, тахикардия, сниженное артериальное давление. В фазе ремиссии симптомы отсутствуют или являются слабовыраженными.
Во многом признаки патологии определяются характером воспаления, а также отсутствием или наличием камней.
Диагностика
В рамках обследования врачу предстоит определить характер и тип заболевания. Сначала проводится консультация. Гастроэнтеролог на основании жалоб и проведенного осмотра ставит предварительный диагноз. После этого выявляются вид и степень холецистита.
Для этого гастроэнтеролог назначает:
- УЗИ желчного пузыря.
 Диагностика позволяет определить форму и размер органа, толщину его стенок, наличие камней и сократительную функцию
Диагностика позволяет определить форму и размер органа, толщину его стенок, наличие камней и сократительную функцию - Фракционное дуоденальное зондирование. В рамках такой диагностики осуществляется забор 3 порций желчи с целью их дальнейшего микроскопического исследования. Методика позволяет оценить цвет и консистенцию биологической жидкости, а также моторику пузыря. Дополнительно выявляют чувствительность микрофлоры к антибиотикам
- Холецистохолангиографию. Метод помогает выявить нарушения двигательной функции всей системы выведения желчи, обнаружить конкременты и возможные деформации пузыря
Дополнительно могут проводиться следующие обследования:
- ФГДС
- Лапароскопия
- МСКТ
Важным является и лабораторное исследование крови. При обострениях холецистита в общем анализе обнаруживаются высокие показатели лейкоцитов и СОЭ, а в биохимическом – повышение билирубина, холестерина, АСТ и АЛТ.
Методы лечения холецистита
Консервативная терапия
Основой лечения как острого, так и хронического заболевания без камней являются прием препаратов и специальная диета.
Пациентам назначают обезболивающие средства и спазмолитики. Также могут быть рекомендованы антибактериальные препараты. Они назначаются при выявлении патогенных бактерий и подбираются в зависимости от возбудителя. На этапе ремиссии дополнительно рекомендуют средства, которые стимулируют образование желчи и ее отток.
Диета при холецистите рекомендована при всех формах заболевания и на любых его стадиях. О ее особенностях мы поговорим позже. К общим принципам относят дробное питание не менее 5–6 раз в день и употребление продуктов в тушеном, вареном и запеченном виде.
На всех этапах заболевания рекомендуют и физиотерапию. Она позволяет решить сразу несколько задач, в числе которых как снятие болевого синдрома, так и сокращение воспаления, а также восстановление тонуса органа.
Хирургические методы
Если патология с желчнокаменной болезнью протекает с частыми рецидивами или рисками осложнений, прибегают к оперативному вмешательству.
При запущенных формах заболевания выполняют полное удаление желчного пузыря. Особое внимание в настоящее время уделяют лапароскопической методике. Открытое вмешательство проводят только при ожирении у пациента, осложненных формах патологии и механической желтухе.
Особое внимание в настоящее время уделяют лапароскопической методике. Открытое вмешательство проводят только при ожирении у пациента, осложненных формах патологии и механической желтухе.
Если имеются камни, проводится их дробление с применением методики ударно-волновой литотрипсии.
Возможные осложнения
Если не проводить своевременное лечение холецистита, могут возникнуть следующие серьезные проблемы:
- Водянка желчного пузыря с дальнейшим его разрывом и перитонитом. Развитие патологии провоцируется воспалительным процессом и чрезмерным растяжением органа
- Сепсис. К этому осложнению приводит застой желчи с ее инфицированием и проникновением болезнетворных микроорганизмов в кровь
- Гангрена желчного пузыря. Это осложнение возникает из-за нарушения микроциркуляции крови с дальнейшим омертвением тканей
Неотложная хирургическая помощь требуется при скоплении гноя в полости органа, воспалении за пределами желчного пузыря и перфорации.
Диета при холецистите
Специальное питание позволяет как предотвратить развитие заболевания, так и сократить риски развития его осложнений. Пациентам рекомендована низкокалорийная пища растительного происхождения.
Следует насытить рацион такими веществами, как:
Специальное питание позволяет как предотвратить развитие заболевания, так и сократить риски развития его осложнений.
- Жирные полиненасыщенные кислоты
- Витамин E
- Фосфолипиды
Это обусловлено тем, что они разжижают желчь и повышают сократительную функцию органа. Для отхождения желчи рекомендованы отруби, фрукты и овощи. Также можно питаться молочными супами, макаронами и крупами, употреблять хлеб, несладкое печенье и сухари. Допустимо употребление неострых соусов, сухофруктов, некислого варенья, зелени, ванили и корицы, мармелада.
Под запретом такие продукты, как грибы и бобовые, яичные желтки, острые приправы, жирные молочные продукты, кислые овощи, шоколадные конфеты. Нельзя пить кофе и какао, газированные напитки и алкоголь.
Нельзя пить кофе и какао, газированные напитки и алкоголь.
Преимущества обращения в МЕДСИ
- Современное оборудование экспертного класса. Оно используется для диагностики и раннего выявления патологии, определения ее типа и иных важных особенностей
- Мультидисциплинарный подход. Благодаря ему обеспечиваются качественная диагностика и наблюдение за пациентами
- Лечение по последним рекомендациям (в т. ч. международным). Терапия, благодаря этому, является максимально эффективной и безопасной. Она позволяет достичь длительной ремиссии
- Малоинвазивные методики. Благодаря им обеспечивается снижение рисков осложнений и сокращение периода реабилитации
Клиники МЕДСИ располагают современным оборудованием экспертного класса для проведения точной и быстрой диагностики.
Чтобы уточнить условия лечения холецистита или записаться на прием, достаточно позвонить по номеру +7 (495) 7-800-500. Наш специалист ответит на все вопросы. Также запись возможна через приложение SmartMed.
Наш специалист ответит на все вопросы. Также запись возможна через приложение SmartMed.
Репейничек обыкновенный (Репешок)
Состав
Цветки, листья и стебель богаты дубильными, горькими и слизистыми веществами, содержат душистое эфирное масло, катехины, стероиды, азотосодержащие соединения, флавоноиды, глюкозу, фруктозу, сахарозу, полисахариды, следы витамина К.
Свойства
Препараты репешка обладают противомикробным, противовоспалительным, тонизирующим, мочегонным, желчегонным, обезболивающим, кровоостанавливающим, вяжущим, противоглистным, противоопухолевым свойствами.
Применение
Репешок регулирует функции печени, желчного пузыря; стимулирует секреторную и моторную функции печени и желчного пузыря, что помогает лечению желчнокаменной болезни и хронического холецистита. Кроме того, растение обладает закрепляющим и диуретическим действием.
Репешок применяют в виде чая против поносов, застоя желчи, потери аппетита и при желчных коликах.
В народной медицине pепешок используют при:
-
желудочно-кишечных заболеваниях,
-
болезнях селезенки,
-
болезнях печени и желчного пузыря,
-
камнях в почках и печени,
-
почечных кровотечениях,
-
заболеваниях печени,
-
заболеваниях желчного пузыря: гепатите, цирроез, желтухе, камнях желчного пузыря, v как мочегонное средство,
-
при нарушениях обмена веществ,
-
ревматизме, радикулите,
-
болях в суставах,
-
невралгии,
-
гинекологических нарушениях: опухолях, обильных менструациях, эрозии матки, болях при менструациях,
-
носовых кровотечениях, недержании мочи,
-
застарелых ранах,
-
кровохаркании,
-
колотье в боку,
-
болях в ногах,
-
астме,
-
гриппе,
-
нагноениях,
-
фурункулезе,
-
кашле,
-
полипозах,
-
как глистогонное.

Экспериментально установлено, что растение не токсично и препараты его обладают успокаивающим действием на центральную нервную систему, замедляют ритм сердца, увеличивают силу сердечных сокращений и понижают артериальное давление; обладают гипотензивным, седативным свойствами.
В отечественной народной медицине репешок применялся как горечь при заболеваниях желудка и кишечника, особенно при поносе, при заболеваниях печени, желтухе, при ревматизме, заболеваниях легких, при кровотечениях, геморрое, как вяжущее и мочегонное средство.
Отвар корней принимают при запущенном ревматизме, геморрое и опухолях (доброкачественных и злокачественных), а настой цветков — при различных кожных сыпях и геморрое.
Отвар листьев употребляют при лихорадке, поносах и как мочегонное при водянке.
Наружно водный настой репешка используют для полосканий при воспалительных процессах полости рта и глотки, миндалевидных желез, а также для орошения полости носа при насморке. Настой репешка употребляют также для компрессов, обмываний и примочек при ссадинах, ушибах, язвах, сыпях и других болезнях кожи и для ножных ванн при чувстве усталости после больших переходов пешком. Свежие измельченные листья прикладывают к воспаленным участкам кожи.
Настой репешка употребляют также для компрессов, обмываний и примочек при ссадинах, ушибах, язвах, сыпях и других болезнях кожи и для ножных ванн при чувстве усталости после больших переходов пешком. Свежие измельченные листья прикладывают к воспаленным участкам кожи.
Настой травы рекомендуется также в качестве спазмолитического средства при нейроциркуляторной дистонии, сопровождающейся головной болью и симпатико-адреналовыми кризами.
Избыточная масса тела и желчнокаменная болезнь — FullText — Visceral Medicine 2021, Vol. 37, № 4
Аннотация
Справочная информация: Приблизительно у одной пятой взрослых людей во всем мире диагностированы желчные камни. Из них около 25% заболевают желчнокаменной болезнью (на что указывает наличие симптомов) и подвергаются холецистэктомии. Резюме: Риск образования камней в желчном пузыре зависит от сочетания генетических факторов и факторов образа жизни, таких как избыточная масса тела. Фактически было продемонстрировано, что масса тела является основным фактором риска появления симптоматических камней в желчном пузыре. Быстрая потеря веса может также вызвать пролитогенное состояние и еще больше увеличить вероятность образования желчных камней или появления симптомов уже существующих желчных камней; однако разумные стратегии похудания могут снизить этот риск. В этом обзоре обсуждается роль избыточной массы тела и риск желчнокаменной болезни, а также возможные варианты профилактики симптоматических камней в желчном пузыре. Ключевые сообщения: Здоровые диеты для похудания в сочетании с регулярной физической активностью могут способствовать успешному снижению веса и поддержанию веса, а также снизить риск образования камней в желчном пузыре.Если по состоянию здоровья требуется или ожидается быстрая потеря веса, например, после бариатрической хирургии, профилактическое применение урсодезоксихолевой кислоты в период снижения веса снижает частоту образования камней в желчном пузыре или симптоматического появления камней в желчном пузыре.
Фактически было продемонстрировано, что масса тела является основным фактором риска появления симптоматических камней в желчном пузыре. Быстрая потеря веса может также вызвать пролитогенное состояние и еще больше увеличить вероятность образования желчных камней или появления симптомов уже существующих желчных камней; однако разумные стратегии похудания могут снизить этот риск. В этом обзоре обсуждается роль избыточной массы тела и риск желчнокаменной болезни, а также возможные варианты профилактики симптоматических камней в желчном пузыре. Ключевые сообщения: Здоровые диеты для похудания в сочетании с регулярной физической активностью могут способствовать успешному снижению веса и поддержанию веса, а также снизить риск образования камней в желчном пузыре.Если по состоянию здоровья требуется или ожидается быстрая потеря веса, например, после бариатрической хирургии, профилактическое применение урсодезоксихолевой кислоты в период снижения веса снижает частоту образования камней в желчном пузыре или симптоматического появления камней в желчном пузыре. Недавние немецкие руководства по желчным камням рекомендуют одновременную холецистэктомию во время бариатрической хирургии, но только для пациентов с уже существующими симптоматическими камнями.
Недавние немецкие руководства по желчным камням рекомендуют одновременную холецистэктомию во время бариатрической хирургии, но только для пациентов с уже существующими симптоматическими камнями.
© 2021 Автор (ы) Опубликовал С.Karger AG, Базель
Введение
Сообщается, что глобальная распространенность камней в желчном пузыре достигает 20% среди взрослых [1]. Выявление камней в желчном пузыре само по себе не требует лечения, поскольку у большинства людей с камнями симптомы отсутствуют. Однако примерно у 25% развиваются симптомы и / или осложнения [2, 3], и поэтому диагностируется желчнокаменная болезнь, для которой (лапароскопическая) холецистэктомия (удаление желчного пузыря) является золотым стандартом лечения [1].
Желчные камни классифицируются на основе их локализации (желчный пузырь или желчные пути) и состава, который определяется физико-химическими изменениями в желчи и дифференцируется по повышенным концентрациям холестерина или билирубина. Примерно 90% желчных камней представляют собой холестериновые камни и в основном состоят из холестерина [4]. Остальные 10% составляют черные и коричневые пигментные камни, которые в основном состоят из билирубината кальция, комплексов кальция и гликопротеинов муцина или неконъюгированного билирубина соответственно [4].
Примерно 90% желчных камней представляют собой холестериновые камни и в основном состоят из холестерина [4]. Остальные 10% составляют черные и коричневые пигментные камни, которые в основном состоят из билирубината кальция, комплексов кальция и гликопротеинов муцина или неконъюгированного билирубина соответственно [4].
Риск образования камней в желчном пузыре связан с сочетанием немодифицируемых (генетических) и изменяемых (окружающая среда / образ жизни) факторов. Было установлено, что генетические варианты составляют примерно четверть общего риска образования желчных камней [5]. Наиболее часто сообщаемый генетический фактор риска у людей, идентифицированный в исследованиях полногеномных ассоциаций, — это вариант гепатоканаликерного переносчика холестерина ABCG8 p.D19H, гетеродимер переносчиков АТФ-связывающих кассет [6].Изменяемые риски включают в себя сочетание таких факторов, как масса тела, паритет, метаболические аберрации, включая ожирение, гиперинсулинемию, инсулинорезистентность и диабет, или отсутствие физической активности и высококалорийное питание, включая повышенное потребление рафинированных углеводов и насыщенных жиров и ограниченное потребление волокно. Кроме того, некоторые лекарства, такие как эстрогены и прогестерон, могут предрасполагать к литогенным состояниям [7]. Этот обзор посвящен модифицируемым вариантам риска и вариантам профилактики желчных камней, связанных с ожирением у взрослых.
Кроме того, некоторые лекарства, такие как эстрогены и прогестерон, могут предрасполагать к литогенным состояниям [7]. Этот обзор посвящен модифицируемым вариантам риска и вариантам профилактики желчных камней, связанных с ожирением у взрослых.
Масса тела и камни в желчном пузыре
Повышенная масса тела является установленным фактором риска образования камней в желчном пузыре, и действительно, было продемонстрировано, что повышенный ИМТ причинно связан с риском появления симптоматических камней, как показано в рандомизированном исследовании Менделя с участием 77 679 человек [ 8]. Этот отчет показал наличие желчных камней с симптомами в 5,2% (4 106 человек) случаев за период до 34 лет наблюдения, причем результаты были более отчетливыми у женщин. Распределение жировых отложений также влияет на риск образования камней в желчном пузыре, при этом проспективные когортные исследования показывают связь между образованием камней в желчном пузыре и центральным ожирением по сравнению с ожирением конечностей или нижних конечностей [9]. Повышенный риск, связанный с абдоминальным ожирением, может возникать независимо от ИМТ, как показано в двух когортах из США [10, 11]. Как ожирение, так и абдоминальное ожирение увеличивают риск не только образования камней, но и необходимости хирургического лечения (холецистэктомии) из-за более высокой вероятности появления симптоматических камней [10, 12, 13]. Абдоминальное ожирение связано с инсулинорезистентностью, которая, учитывая его стимулирующее действие на секрецию холестерина в печени, считается ключевым фактором образования камней в желчном пузыре [14].
Повышенный риск, связанный с абдоминальным ожирением, может возникать независимо от ИМТ, как показано в двух когортах из США [10, 11]. Как ожирение, так и абдоминальное ожирение увеличивают риск не только образования камней, но и необходимости хирургического лечения (холецистэктомии) из-за более высокой вероятности появления симптоматических камней [10, 12, 13]. Абдоминальное ожирение связано с инсулинорезистентностью, которая, учитывая его стимулирующее действие на секрецию холестерина в печени, считается ключевым фактором образования камней в желчном пузыре [14].
Недавно было высказано предположение, что влияние веса тела на камни в желчном пузыре происходит независимо от возраста. Например, ретроспективное кросс-секционное азиатское исследование [15] показало, что участники моложе 50 лет имеют более высокий риск образования камней в желчном пузыре (OR = 5,4; 95% ДИ 2,3–12,7), если они страдали ожирением и проявляли признаки метаболического синдрома. Здесь ожирение было определено как ИМТ> 25 для азиатов [16]. Особенности метаболического синдрома определялись в соответствии с набором общепринятых единых критериев [подробнее см. В 17].Более того, распространенность камней в желчном пузыре у лиц моложе 50 лет с ожирением и метаболическим синдромом была идентична распространенности камней в желчном пузыре у пожилых людей, которые были метаболически здоровыми и не страдали ожирением.
Особенности метаболического синдрома определялись в соответствии с набором общепринятых единых критериев [подробнее см. В 17].Более того, распространенность камней в желчном пузыре у лиц моложе 50 лет с ожирением и метаболическим синдромом была идентична распространенности камней в желчном пузыре у пожилых людей, которые были метаболически здоровыми и не страдали ожирением.
Патофизиологические механизмы, повышающие риск образования желчных камней с избытком жира в организме, многофакторны. Первичный риск — возникновение холестериновых камней в желчном пузыре, которые возникают в результате накопления кристаллов моногидрата холестерина, осаждающихся в желчном пузыре, содержащем избыток холестерина по сравнению с солями желчных кислот и фосфолипидами [18].Этот избыток холестерина секретируется гепатоцитами в результате увеличения массы тела. Таким образом, увеличение жировых отложений является литогенным [19], и чем выше масса тела, тем выше риск образования холестериновых камней в желчном пузыре [12]. Было подсчитано, что каждый лишний килограмм жира в организме производит около 20 мг дополнительного холестерина. Этот избыток холестерина способствует насыщению желчи холестерином и, соответственно, перенасыщение холестерином желчи желчного пузыря было зарегистрировано у пациентов с ожирением, но не у пациентов без ожирения [20].Увеличение массы тела дополнительно связано со снижением подвижности желчного пузыря, еще одним фактором, который способствует образованию камней [21].
Было подсчитано, что каждый лишний килограмм жира в организме производит около 20 мг дополнительного холестерина. Этот избыток холестерина способствует насыщению желчи холестерином и, соответственно, перенасыщение холестерином желчи желчного пузыря было зарегистрировано у пациентов с ожирением, но не у пациентов без ожирения [20].Увеличение массы тела дополнительно связано со снижением подвижности желчного пузыря, еще одним фактором, который способствует образованию камней [21].
Совсем недавно в китайском исследовании было обнаружено, что более высокие концентрации (высокочувствительного) С-реактивного белка (СРБ) являются независимым фактором риска возникновения холестериновых желчных камней [22]. В частности, концентрация высокочувствительного CRP> 3 мг / л была связана с повышением риска образования камней на 12%. В настоящее время остается неизвестным, как повышенный уровень СРБ увеличивает риск образования желчных камней; однако было высказано предположение, что это связано с ожирением, когда секреция провоспалительного цитокина интерлейкина-6 (вышестоящий стимулятор выработки CRP в печени) стимулируется жировой тканью и способствует системному воспалению при ожирении [23, 24].
Rapid Weight Loss and Weight Cycling
В целом, потеря веса снижает риск образования желчных камней, за исключением двух конкретных настроек: очень быстрая потеря веса (т.е.> 1,5 кг / неделю) и чрезмерное снижение веса (т.е. ,> 25% массы тела) [25-27]. В обоих случаях повышается риск образования камней в желчном пузыре [28, 29]. Быстрая потеря веса может предрасполагать к литогенному состоянию и, как следствие, образованию желчных камней [27]. Кроме того, сообщалось, что потеря веса, вызванная бариатрической операцией, инициирует отстой желчных путей (состоящий из осажденных липидных частиц, таких как агрегированные кристаллы или микролиты) и желчных камней в 30% случаев в течение 6-месячного периода после проведения обходного желудочного анастомоза или билиопанкреатического отвода. [30, 31].В проспективном исследовании сообщалось о сопоставимой частоте (30%) желчных камней после рукавной гастрэктомии через 6–12 месяцев после операции [32]. Однако об этих рисках при лапароскопическом бандажировании желудка не сообщалось [33].
Циклическое изменение веса (т.е. вес, который теряется и восстанавливается) является независимым фактором риска желчных камней [34–36]. Колебания веса также увеличивают риск необходимости холецистэктомии [35]. Syngal et al. [35] наблюдали как умеренные (4,5–8,5 кг), так и серьезные (≥9 кг) колебания в одном цикле веса, что увеличивало риск холецистэктомии на 31 и 68% соответственно.Изменения соотношения холестерина и желчных солей в желчном пузыре наблюдались при колебаниях веса и при быстрой потере веса [37], что отражает повышенную секрецию и синтез холестерина в печени, а также снижение секреции солей желчных кислот [18]. Также происходит нарушение моторики желчного пузыря, что вызывает образование желчного ила [37, 38].
Профилактика и лечение камней в желчном пузыре
Роль холецистэктомии
Холецистэктомия — золотой стандарт лечения симптоматических камней в желчном пузыре, и ее часто, но не всегда, проводят во время бариатрических операций у пациентов с ожирением. В последние годы произошло снижение частоты одновременных холецистэктомий из-за заболеваемости и смертности, связанных с этой процедурой, а также из-за высокого риска повторного вмешательства [39]. Исследования показали, что сопутствующая холецистэктомия приводит к увеличению продолжительности операции, более длительному пребыванию в больнице и более высокому уровню осложнений [39, 40]. Риск вторичной холецистэктомии после лапароскопической реконструкции Roux-en-Y составил 6,8% (5,3% этих случаев проявлялись симптомами), как сообщалось в метаанализе 13 исследований, 12 из которых были ретроспективными [41]. .Другие исследования показали, что частота холецистэктомии составляет от 3,3 до 14,7% в течение 6–24 месяцев после бариатрической операции [42, 43]. Как правило, заболеваемость и смертность от холецистэктомии у пациентов с ожирением, не подвергавшихся бариатрической хирургии, не выше, чем в общей популяции [44]. Ранее были сообщения об увеличении времени процедуры и послеоперационных осложнений при ожирении; однако они не сильно различались по сравнению с контрольной группой, не страдающей ожирением [45].
В последние годы произошло снижение частоты одновременных холецистэктомий из-за заболеваемости и смертности, связанных с этой процедурой, а также из-за высокого риска повторного вмешательства [39]. Исследования показали, что сопутствующая холецистэктомия приводит к увеличению продолжительности операции, более длительному пребыванию в больнице и более высокому уровню осложнений [39, 40]. Риск вторичной холецистэктомии после лапароскопической реконструкции Roux-en-Y составил 6,8% (5,3% этих случаев проявлялись симптомами), как сообщалось в метаанализе 13 исследований, 12 из которых были ретроспективными [41]. .Другие исследования показали, что частота холецистэктомии составляет от 3,3 до 14,7% в течение 6–24 месяцев после бариатрической операции [42, 43]. Как правило, заболеваемость и смертность от холецистэктомии у пациентов с ожирением, не подвергавшихся бариатрической хирургии, не выше, чем в общей популяции [44]. Ранее были сообщения об увеличении времени процедуры и послеоперационных осложнений при ожирении; однако они не сильно различались по сравнению с контрольной группой, не страдающей ожирением [45]. Недавно Ривз и др. [44] сообщили о небольшом повышении вероятности госпитализации пациентов с тяжелым патологическим ожирением (ИМТ> 50) по сравнению с пациентами с ИМТ от 30 до 40, но этот повышенный риск был лишь умеренным (OR = 1,10; 95% ДИ 1,02– 1,19; р <0,001).
Недавно Ривз и др. [44] сообщили о небольшом повышении вероятности госпитализации пациентов с тяжелым патологическим ожирением (ИМТ> 50) по сравнению с пациентами с ИМТ от 30 до 40, но этот повышенный риск был лишь умеренным (OR = 1,10; 95% ДИ 1,02– 1,19; р <0,001).
Таким образом, недавние согласованные рекомендации Германии по желчнокаменной болезни рекомендуют одновременную холецистэктомию только у тучных пациентов с симптоматическими камнями в желчном пузыре [39, 46], как и европейские рекомендации [47].Однако эти риски различаются в зависимости от типа бариатрической хирургии: лапароскопическая операция Roux-en-Y демонстрирует более высокий риск, чем бандажирование желудка или резекция рукава [48]. Два недавних исследования подтвердили рекомендации руководства; Делла Пенна и др. [49] наблюдали 61 пациента с бессимптомными камнями в желчном пузыре, получавшего урсодезоксихолевую кислоту (УДХК) в течение 6 месяцев после бариатрической операции (либо лапароскопическое шунтирование желудка по Ру, либо рукавная гастрэктомия).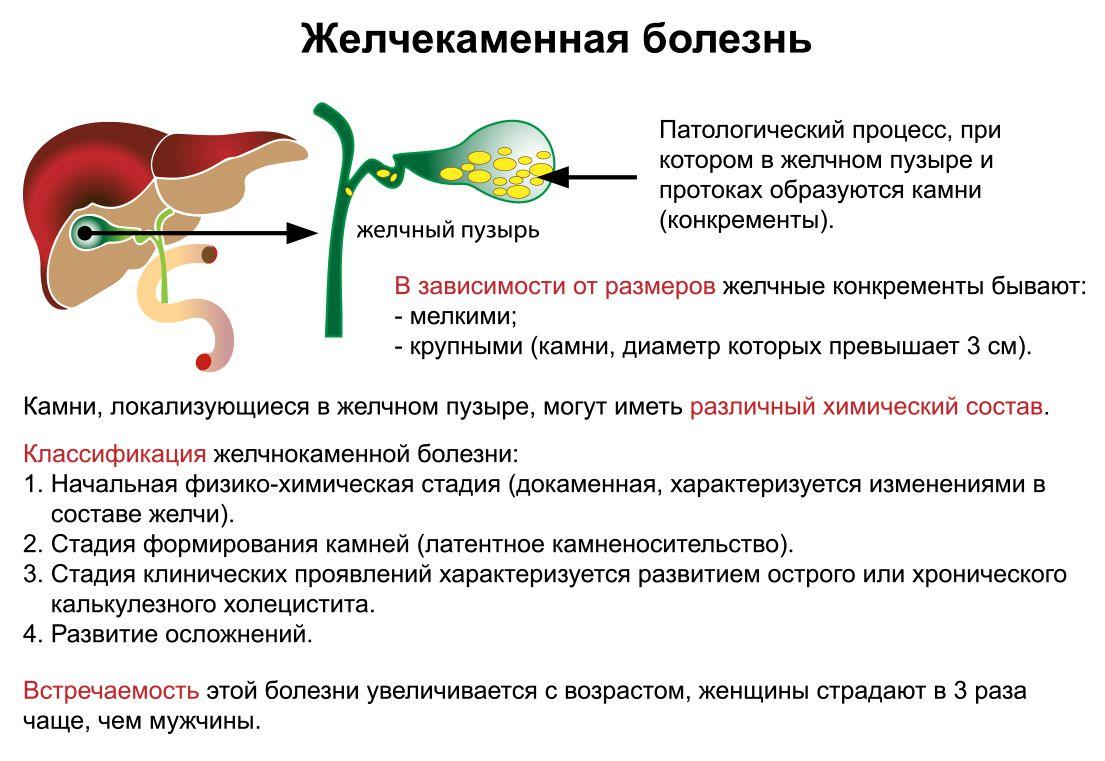 Холецистэктомия потребовалась только 1 пациенту, перенесшему рукавную гастрэктомию.Другой пациент сообщил о симптомах в течение 6 месяцев наблюдения после рукавной гастрэктомии, но холецистэктомии не потребовалось. Остальные 59 пациентов остались бессимптомными при профилактике УДХК.
Холецистэктомия потребовалась только 1 пациенту, перенесшему рукавную гастрэктомию.Другой пациент сообщил о симптомах в течение 6 месяцев наблюдения после рукавной гастрэктомии, но холецистэктомии не потребовалось. Остальные 59 пациентов остались бессимптомными при профилактике УДХК.
Шведское исследование тучных субъектов [50] также поддерживает недавние рекомендации, сообщая об общей низкой совокупной заболеваемости холецистэктомией после бариатрической хирургии. В этом нерандомизированном контролируемом исследовании стандарт лечения сравнивался с последствиями бариатрической хирургии [50]. Всего было проанализировано 3597 участников, которые не подвергались предыдущей или сопутствующей холецистэктомии на момент включения.Когорта была разделена на 2 группы: 1755 пациентов прошли бариатрическую операцию (обходной желудочный анастомоз, n = 236; гастропластика с вертикальными полосами, n = 1202; бандажирование желудка, n = 317). Контрольная группа ( n = 1842) получала обычное лечение ожирения, включая рекомендации по образу жизни. УДХК не была предоставлена ни одной из групп. В течение 26 лет наблюдения в контрольной группе наблюдались умеренные изменения веса (колебания 3%), в отличие от хирургической группы, где потеря веса составляла в среднем 25% через 2 года и 16% как через 10, так и через 15 лет.Заболеваемость симптоматическими камнями в желчном пузыре значительно различалась ( p <0,001), при этом хирургическая группа сообщила о 307 первичных событиях по сравнению с 252 в контрольной группе. Аналогичная тенденция наблюдалась для осложненных камней в желчном пузыре и частоты холецистэктомий: 172 случая против 144 впервые ( p <0,006) и 230 против 170 случаев ( p <0,001), соответственно. Вышеуказанные риски были более выражены в течение первых 5 лет после операции.
УДХК не была предоставлена ни одной из групп. В течение 26 лет наблюдения в контрольной группе наблюдались умеренные изменения веса (колебания 3%), в отличие от хирургической группы, где потеря веса составляла в среднем 25% через 2 года и 16% как через 10, так и через 15 лет.Заболеваемость симптоматическими камнями в желчном пузыре значительно различалась ( p <0,001), при этом хирургическая группа сообщила о 307 первичных событиях по сравнению с 252 в контрольной группе. Аналогичная тенденция наблюдалась для осложненных камней в желчном пузыре и частоты холецистэктомий: 172 случая против 144 впервые ( p <0,006) и 230 против 170 случаев ( p <0,001), соответственно. Вышеуказанные риски были более выражены в течение первых 5 лет после операции.
Учитывая инвазивность стандартного лечения желчнокаменной болезни, необходимо уделять больше внимания профилактике желчных камней, и это обсуждается в следующих разделах в контексте избыточной массы тела.
Диета и физическая активность
Устойчивое снижение веса (т. Е. <1,5 кг в неделю) рекомендуется при риске ожирения и желчных камней (как описано в разделе «Быстрая потеря веса и циклическое изменение веса»). Повышенный риск образования камней в желчном пузыре был проиллюстрирован двумя популярными методами снижения веса, а именно бариатрической хирургией и очень низкокалорийной диетой [26–28, 51], с приблизительными рисками 30 и 25% соответственно [26, 28]. Рандомизированные контролируемые испытания с участием пациентов с ожирением продемонстрировали, что эти риски в определенной степени уменьшаются, если диеты для похудания имеют более высокое содержание жира [37, 52, 53].Общие рекомендации, связанные с питанием, включают снижение энергетической плотности рациона (особенно отказ от насыщенных жиров и сахара) и вместо этого употребление продуктов, богатых клетчаткой, таких как цельнозерновые, фрукты или овощи [54-59]. Сокращение потребления высококалорийной пищи, особенно с высоким содержанием сахара, показало благотворное влияние как на вес, так и на риск образования желчных камней [60].
Е. <1,5 кг в неделю) рекомендуется при риске ожирения и желчных камней (как описано в разделе «Быстрая потеря веса и циклическое изменение веса»). Повышенный риск образования камней в желчном пузыре был проиллюстрирован двумя популярными методами снижения веса, а именно бариатрической хирургией и очень низкокалорийной диетой [26–28, 51], с приблизительными рисками 30 и 25% соответственно [26, 28]. Рандомизированные контролируемые испытания с участием пациентов с ожирением продемонстрировали, что эти риски в определенной степени уменьшаются, если диеты для похудания имеют более высокое содержание жира [37, 52, 53].Общие рекомендации, связанные с питанием, включают снижение энергетической плотности рациона (особенно отказ от насыщенных жиров и сахара) и вместо этого употребление продуктов, богатых клетчаткой, таких как цельнозерновые, фрукты или овощи [54-59]. Сокращение потребления высококалорийной пищи, особенно с высоким содержанием сахара, показало благотворное влияние как на вес, так и на риск образования желчных камней [60]. Высокая гликемическая нагрузка в рационе увеличивает риск образования камней в желчном пузыре [61–63]. Напротив, продукты, богатые клетчаткой, снижают риск холецистэктомии у женщин [64, 65].Кроме того, снижение литогенности гидрофобных солей желчных кислот было продемонстрировано при потреблении продуктов с высоким содержанием клетчатки и кальция [66]. Однако в рандомизированном исследовании с участием участников с ожирением прием пищевых волокон во время похудания не привел к значительным преимуществам с точки зрения развития желчных камней [67]. Другие продукты, снижающие риск холецистэктомии, включают бобовые, оливковое масло [68] и орехи [69].
Высокая гликемическая нагрузка в рационе увеличивает риск образования камней в желчном пузыре [61–63]. Напротив, продукты, богатые клетчаткой, снижают риск холецистэктомии у женщин [64, 65].Кроме того, снижение литогенности гидрофобных солей желчных кислот было продемонстрировано при потреблении продуктов с высоким содержанием клетчатки и кальция [66]. Однако в рандомизированном исследовании с участием участников с ожирением прием пищевых волокон во время похудания не привел к значительным преимуществам с точки зрения развития желчных камней [67]. Другие продукты, снижающие риск холецистэктомии, включают бобовые, оливковое масло [68] и орехи [69].
Пищевые липиды являются медиаторами риска образования желчных камней, при этом ненасыщенные жирные кислоты демонстрируют свойства снижения риска, а насыщенные и трансжиры повышают риск [70-72].У пациентов с желчными камнями добавление омега-3 жирных кислот снижает индекс насыщения холестерина в желчи [73]. В другом исследовании с участием женщин с ожирением без желчных камней, которые были рандомизированы для приема омега-3 жирных кислот, УДХК или плацебо в течение 6 недель, не наблюдалось снижения насыщения билиарного холестерина, несмотря на тот факт, что ни у кого из участников не развились камни в желчном пузыре в течение этого периода вмешательства [74 ]. Тем не менее, в группе омега-3 наблюдалось улучшение моторики желчного пузыря у пациентов с гипертриглицеридемией [75].Кроме того, гипомотичность желчного пузыря можно уменьшить, сократив время ночного голодания до менее 12 часов, как предполагают данные наблюдений [76].
Тем не менее, в группе омега-3 наблюдалось улучшение моторики желчного пузыря у пациентов с гипертриглицеридемией [75].Кроме того, гипомотичность желчного пузыря можно уменьшить, сократив время ночного голодания до менее 12 часов, как предполагают данные наблюдений [76].
Физическая активность имеет множество преимуществ в отношении похудания и поддержания веса, а также было изучено ее прямое влияние на риск образования желчнокаменной болезни. Фактически, в нескольких исследованиях сообщалось, что физическая активность оказывает защитное действие на образование желчных камней [34, 63, 77-79]. Однако интервенционные исследования показывают лишь умеренные эффекты: улучшения моторики желчного пузыря наблюдались в рандомизированном исследовании, в котором вмешательство включало умеренную тренировку, но результаты были аналогичными в контрольной группе [80].Об отсутствии значительного воздействия на камни в желчном пузыре также сообщалось у беременных женщин, принимавших участие в рандомизированном исследовании [81].
Профилактическая урсодезоксихолевая кислота
Во время фазы снижения веса профилактическая урсодезоксихолевая кислота показала большие перспективы в снижении образования камней в желчном пузыре независимо от метода потери веса, то есть низкокалорийной диеты или бариатрической хирургии, с сокращением до 58 % сообщили в рандомизированных контролируемых исследованиях [25, 29, 31, 53, 82-85]. Рекомендуется минимальная доза 500 мг / день, как показано в клинических испытаниях и метаанализе таких испытаний, при этом эта доза более эффективна, чем 300 мг / день для снижения риска образования камней в желчном пузыре в течение 6-недельного периода, но также через 3–4 месяца [53].Более высокая доза также не показала большей пользы, как показано в рандомизированном исследовании у пациентов, получавших обходное желудочное анастомозирование [31]. В этом исследовании сравнивали 3 дозы УДХК: 300, 600 и 1200 мг / день в течение 6 месяцев. Доза 600 мг оказалась наиболее эффективной для предотвращения образования камней в желчном пузыре с частотой 2% против 13 и 6% у тех, кто получал 300 и 1200 мг, соответственно. Эти данные были подтверждены [29].
Эти данные были подтверждены [29].
После последующей холецистэктомии, например после бариатрической хирургии может быть выполнено, если желчные камни становятся симптоматическими, многие пациенты не получают профилактический UCDA во время фазы снижения веса в клинической практике [86, 87].Учитывая описанные выше преимущества, недавние руководства по желчным камням настоятельно рекомендовали назначать УДХК в качестве профилактики в случае высокого риска образования осадка или камней при похудании с помощью низкокалорийной диеты или бариатрической хирургии [46, 47]. Исследования показывают, что первые 6 месяцев после операции являются наиболее критическими, поскольку они связаны с наибольшим снижением массы тела, при этом УДХК демонстрирует умеренные преимущества после первых 6 месяцев, что не оправдывает длительную профилактику [88].В недавнем рандомизированном исследовании оценивалось влияние профилактической УДХК на частоту образования камней в желчном пузыре у 190 пациентов, перенесших 1 анастомозный обходной желудочный анастомоз [89]. Эти пациенты были рандомизированы в группу приема УДХК 600 мг / день ( n = 95) или в контрольную группу ( n = 95) в течение 6 месяцев. Частота образования камней в желчном пузыре через 3 месяца составила 0 против 4 (4,2%) в группе УДХК и контрольной группы, соответственно, и 3 (3,1%) против 21 (22,1%) через 6 месяцев. Через 12 месяцев наблюдения 4 (4,2%) против 24 (25.2%) у пациентов из группы УДХК и контрольной группы развились камни в желчном пузыре соответственно ( p <0,05). Большинство из них протекало бессимптомно, и только у 28,6% участников наблюдались симптомы. Многофакторный анализ показал, что УДХК является единственным значимым предиктором образования желчных камней (HR = 0,17; 95% ДИ 0,06–0,48; p <0,001).
Эти пациенты были рандомизированы в группу приема УДХК 600 мг / день ( n = 95) или в контрольную группу ( n = 95) в течение 6 месяцев. Частота образования камней в желчном пузыре через 3 месяца составила 0 против 4 (4,2%) в группе УДХК и контрольной группы, соответственно, и 3 (3,1%) против 21 (22,1%) через 6 месяцев. Через 12 месяцев наблюдения 4 (4,2%) против 24 (25.2%) у пациентов из группы УДХК и контрольной группы развились камни в желчном пузыре соответственно ( p <0,05). Большинство из них протекало бессимптомно, и только у 28,6% участников наблюдались симптомы. Многофакторный анализ показал, что УДХК является единственным значимым предиктором образования желчных камней (HR = 0,17; 95% ДИ 0,06–0,48; p <0,001).
Выводы
Избыточная масса тела связана с повышенным риском образования холестериновых камней в желчном пузыре. Как показано на Рисунке 1, разумные стратегии похудания могут снизить этот риск, но быстрая потеря веса или циклическое изменение веса могут вызвать литогенный каскад и еще больше увеличить вероятность образования камней в желчном пузыре или появления симптомов. Здоровое питание с упором на растительную пищу и ненасыщенные жиры в сочетании с регулярной физической активностью может способствовать успешной потере веса и поддержанию веса. В случае быстрой потери веса, например, при бариатрической хирургии, профилактическое применение УДХК в течение первых 6 месяцев снижает частоту возникновения камней в желчном пузыре и желчных протоков. Такая стратегия должна принести пользу пациентам, которые являются кандидатами на бариатрическую операцию или которым по другим причинам со здоровьем необходимо быстро похудеть, поскольку недавние руководства не рекомендуют одновременную холецистэктомию во время операции, если у пациента нет предшествующего диагноза симптоматических камней в желчном пузыре.
Здоровое питание с упором на растительную пищу и ненасыщенные жиры в сочетании с регулярной физической активностью может способствовать успешной потере веса и поддержанию веса. В случае быстрой потери веса, например, при бариатрической хирургии, профилактическое применение УДХК в течение первых 6 месяцев снижает частоту возникновения камней в желчном пузыре и желчных протоков. Такая стратегия должна принести пользу пациентам, которые являются кандидатами на бариатрическую операцию или которым по другим причинам со здоровьем необходимо быстро похудеть, поскольку недавние руководства не рекомендуют одновременную холецистэктомию во время операции, если у пациента нет предшествующего диагноза симптоматических камней в желчном пузыре.
Рис. 1.
Предлагаемый подход, основанный на клинических данных и руководящих рекомендациях по снижению риска желчнокаменной болезни у пациентов с избыточной массой тела / ожирением, подвергающихся снижению веса.
Заявление о конфликте интересов
Авторам настоящего обзора нечего заявлять..jpg)
Источники финансирования
Финансирование для подготовки этого обзора получено не было.
Вклад авторов
Оба автора подготовили и отредактировали этот документ.
Список литературы
- Эверхарт JE, Ruhl CE. Бремя болезней органов пищеварения в Соединенных Штатах. Часть III: Печень, желчевыводящие пути и поджелудочная железа. Гастроэнтерология. 2009 Апрель; 136 (4): 1134–44.
- Portincasa P, Ciaula AD, Bonfrate L, Wang DQ.Терапия желчнокаменной болезни: что это было, что это такое, что будет.
 Мир J Gastrointest Pharmacol Ther. 2012 Апрель; 3 (2): 7–20.
Мир J Gastrointest Pharmacol Ther. 2012 Апрель; 3 (2): 7–20. - Аттили А.Ф., Де Сантис А., Капри Р., Репис А.М., Маселли С., Группа G; Группа GREPCO. Естественная история желчных камней: опыт GREPCO. Гепатология.1995 Март; 21 (3): 655–60.
- Шафмайер С., Хартлеб Дж., Тепель Дж., Альберс С., Фрайтаг С., Фельцке Х. и др. Предикторы состава желчных камней в 1025 симптоматических камнях в желчном пузыре из Северной Германии. BMC Gastroenterol. 2006 Ноябрь; 6 (1): 36.
- Кацика Д.
 , Гржибовски А., Эйнарссон С., Ламмерт Ф., Лихтенштейн П., Маршалл Х.Влияние генетики и окружающей среды на симптоматику желчнокаменной болезни: шведское исследование 43 141 пары близнецов. Гепатология. 2005 Май; 41 (5): 1138–43.
, Гржибовски А., Эйнарссон С., Ламмерт Ф., Лихтенштейн П., Маршалл Х.Влияние генетики и окружающей среды на симптоматику желчнокаменной болезни: шведское исследование 43 141 пары близнецов. Гепатология. 2005 Май; 41 (5): 1138–43. - Ламмерт Ф., Зауэрбрух Т. Механизмы заболевания: генетическая эпидемиология камней желчного пузыря. Нат Клин Практ Гастроэнтерол Гепатол.2005 Сен; 2 (9): 423–33.
- Ламмерт Ф., Гурусами К., Ко Ч.В., Микель Дж. Ф., Мендес-Санчес Н., Портинкаса П. и др. Камни в желчном пузыре. Nat Rev Dis Primers. 2016 Апрель; 2 (1): 16024.
- Stender S, Nordestgaard BG, Tybjaerg-Hansen A.
 Повышенный индекс массы тела как причинный фактор риска развития симптоматической желчнокаменной болезни: исследование методом менделевской рандомизации. Гепатология. 2013 декабрь; 58 (6): 2133–41.
Повышенный индекс массы тела как причинный фактор риска развития симптоматической желчнокаменной болезни: исследование методом менделевской рандомизации. Гепатология. 2013 декабрь; 58 (6): 2133–41. - Хаффнер С.М., Диль А.К., Штерн М.П., Хазуда Х.П. Центральное ожирение и заболевание желчного пузыря у американцев мексиканского происхождения. Am J Epidemiol.Март 1989 г., 129 (3): 587–95.
- Цай CJ, Leitzmann MF, Willett WC, Giovannucci EL. Центральное ожирение, региональное распределение жира и риск холецистэктомии у женщин. Кишечник. 2006 Май; 55 (5): 708–14.
- Цай CJ, Leitzmann MF, Willett WC, Giovannucci EL.
 Проспективное исследование абдоминального ожирения и желчнокаменной болезни у мужчин в США. Am J Clin Nutr. Июль 2004 г.; 80 (1): 38–44.
Проспективное исследование абдоминального ожирения и желчнокаменной болезни у мужчин в США. Am J Clin Nutr. Июль 2004 г.; 80 (1): 38–44. - Maclure KM, Hayes KC, Colditz GA, Stampfer MJ, Speizer FE, Willett WC. Вес, диета и риск появления симптоматических камней в желчном пузыре у женщин среднего возраста. N Engl J Med.1989 август; 321 (9): 563–9.
- Völzke H, Baumeister SE, Alte D, Hoffmann W, Schwahn C, Simon P и др. Независимые факторы риска образования камней в желчном пузыре в регионе с высокой распространенностью холелитиаза. Пищеварение. 2005. 71 (2): 97–105.
- Накиб А.
 , Комузи А.Г., Аль-Аззави Х., Зонненберг Г.Е., Киссебах А.Х., Питт Х.А.Инсулинорезистентность вызывает нарушение моторики желчного пузыря у человека. J Gastrointest Surg. Июль-август 2006 г.; 10 (7): 940–8.
, Комузи А.Г., Аль-Аззави Х., Зонненберг Г.Е., Киссебах А.Х., Питт Х.А.Инсулинорезистентность вызывает нарушение моторики желчного пузыря у человека. J Gastrointest Surg. Июль-август 2006 г.; 10 (7): 940–8. - Су ПЙ, Сюй Ю.С., Ченг Ю.Ф., Кор, Т.Т., Су, WW. Сильная связь между метаболически аномальным ожирением и желчнокаменной болезнью у взрослых в возрасте до 50 лет. BMC Gastroenterol. 2019 Июль; 19 (1): 117.
- ВОЗ / IASO / IOTF. Перспектива Азиатско-Тихоокеанского региона: новое определение ожирения и его лечения. Мельбурн: Здравоохранение Австралии; 2000 г.
- Альберти К.
 Г., Экель Р.Х., Гранди С.М., Зиммет П.З., Климан Дж.И., Донато К.А. и др.; Целевая группа Международной федерации диабета по эпидемиологии и профилактике; Национальный институт сердца, легких и крови; Американская Ассоциация Сердца; Всемирная федерация сердца; Международное общество атеросклероза; Международная ассоциация по изучению ожирения. Гармонизация метаболического синдрома: совместное промежуточное заявление Целевой группы Международной федерации диабета по эпидемиологии и профилактике; Национальный институт сердца, легких и крови; Американская Ассоциация Сердца; Всемирная федерация сердца; Международное общество атеросклероза; и Международная ассоциация изучения ожирения.Тираж. Октябрь 2009 г., 120 (16): 1640–5.
Г., Экель Р.Х., Гранди С.М., Зиммет П.З., Климан Дж.И., Донато К.А. и др.; Целевая группа Международной федерации диабета по эпидемиологии и профилактике; Национальный институт сердца, легких и крови; Американская Ассоциация Сердца; Всемирная федерация сердца; Международное общество атеросклероза; Международная ассоциация по изучению ожирения. Гармонизация метаболического синдрома: совместное промежуточное заявление Целевой группы Международной федерации диабета по эпидемиологии и профилактике; Национальный институт сердца, легких и крови; Американская Ассоциация Сердца; Всемирная федерация сердца; Международное общество атеросклероза; и Международная ассоциация изучения ожирения.Тираж. Октябрь 2009 г., 120 (16): 1640–5. - Portincasa P, Moschetta A, Palasciano G. Холестериновая желчнокаменная болезнь.
 Ланцет. Июль 2006 г.; 368 (9531): 230–9.
Ланцет. Июль 2006 г.; 368 (9531): 230–9. - Сахи Т., Паффенбаргер Р.С., Се СС, Ли И.М.Индекс массы тела, курение сигарет и другие характеристики как предикторы диагностированного врачом заболевания желчного пузыря у мужчин-выпускников колледжа. Am J Epidemiol. 1998 апр; 147 (7): 644–51.
- Freeman JB, Meyer PD, Printen KJ, Mason EE, DenBesten L. Анализ желчи желчного пузыря при патологическом ожирении.Am J Surg. 1975 Февраль; 129 (2): 163–6.
- Di Ciaula A, Wang DQ, Portincasa P.
 Желчный пузырь и моторика желудка у новорожденных с ожирением, до подростков и взрослых. J Gastroenterol Hepatol. 2012 августа; 27 (8): 1298–305.
Желчный пузырь и моторика желудка у новорожденных с ожирением, до подростков и взрослых. J Gastroenterol Hepatol. 2012 августа; 27 (8): 1298–305. - Лю Т., Сиинь С.Т., Яо Н., Дуань Н., Сюй Г., Ли В. и др.Связь между высокочувствительным С-реактивным белком и риском желчнокаменной болезни: результаты когортного исследования Кайлуан. BMJ Open. 2020 Сен; 10 (9): e035880.
- Квайфа И.К., Бахари Х., Йонг Ю.К., Нур С.М. Эндотелиальная дисфункция при воспалении, вызванном ожирением: молекулярные механизмы и клинические последствия.Биомолекулы. 2020 Февраль; 10 (2): 291.
- Cozma A, Orăşan O, Sâmpelean D, Fodor A, Vlad C, Negrean V и др.
 Эндотелиальная дисфункция при метаболическом синдроме. Rom J Intern Med. 2009. 47 (2): 133–40.
Эндотелиальная дисфункция при метаболическом синдроме. Rom J Intern Med. 2009. 47 (2): 133–40. - Брумфилд PH, Чопра Р., Шейнбаум Р.К., Боноррис Г.Г., Сильверман А., Шонфилд Л.Дж. и др.Влияние урсодезоксихолевой кислоты и аспирина на образование литогенной желчи и желчных камней при похудании. N Engl J Med. 1988 декабрь; 319 (24): 1567–72.
- Лиддл Р.А., Гольдштейн Р.Б., Сакстон Дж. Образование желчных камней во время диеты для снижения веса. Arch Intern Med. 1989 август; 149 (8): 1750–3.
- Weinsier RL, Wilson LJ, Lee J.
 Безопасная с медицинской точки зрения скорость потери веса для лечения ожирения: руководство, основанное на риске образования камней в желчном пузыре. Am J Med. 1995 Февраль; 98 (2): 115–7.
Безопасная с медицинской точки зрения скорость потери веса для лечения ожирения: руководство, основанное на риске образования камней в желчном пузыре. Am J Med. 1995 Февраль; 98 (2): 115–7. - Ли В.К., Пулидо Н., Файнвакс П., Сомштейн С., Розенталь Р., Мартинес-Дуартез П.Предикторы образования камней в желчном пузыре после бариатрической хирургии: многофакторный анализ факторов риска, сравнивающий обходной желудочный анастомоз, бандажирование желудка и рукавную резекцию желудка. Surg Endosc. Июль 2009 г., 23 (7): 1640–4.
- Шиффман М.Л., Каплан Г.Д., Бринкман-Каплан В., Викерс Ф.Ф. Профилактика образования камней в желчном пузыре с помощью урсодезоксихолевой кислоты у пациентов, соблюдающих низкокалорийную диету.
 Ann Intern Med. 1995 июнь; 122 (12): 899–905.
Ann Intern Med. 1995 июнь; 122 (12): 899–905. - Шиффман М.Л., Сугерман Х.Дж., Келлум Дж.Х., Брюэр У.Х., Мур Е.В. Желчные камни у больных с патологическим ожирением. Связь с массой тела, потерей веса и растворимостью холестерина в желчном пузыре. Int J Obes Relat Metab Disord. Март 1993 г., 17 (3): 153–8.
- Sugerman HJ, Brewer WH, Shiffman ML, Brolin RE, Fobi MA, Linner JH и др. Многоцентровое плацебо-контролируемое рандомизированное двойное слепое проспективное исследование профилактического применения урсодиола для предотвращения образования желчных камней после быстрой потери веса, вызванной обходным желудочным анастомозом.Am J Surg. 1995, январь, 169 (1): 91–6.

- Adams LB, Chang C, Pope J, Kim Y, Liu P, Yates A. Рандомизированное, проспективное сравнение урсодезоксихолевой кислоты для профилактики желчных камней после рукавной гастрэктомии. Obes Surg. 2016 Май; 26 (5): 990–4.
- О’Брайен ЧП, Диксон Дж. Б.Рациональный подход к лечению холелитиаза в бариатрической хирургии: его наложение на регулируемый желудочный бандаж, устанавливаемый лапароскопически. Arch Surg. 2003 август; 138 (8): 908–12.
- Ортега Р.
 М., Фернандес-Асуэла М., Энсинас-Сотильос А., Андрес П., Лопес-Собалер А. М.. Различия в диете и пищевых привычках между пациентами с желчными камнями и контрольной группой.J Am Coll Nutr. 1997 Февраль; 16 (1): 88–95.
М., Фернандес-Асуэла М., Энсинас-Сотильос А., Андрес П., Лопес-Собалер А. М.. Различия в диете и пищевых привычках между пациентами с желчными камнями и контрольной группой.J Am Coll Nutr. 1997 Февраль; 16 (1): 88–95. - Syngal S, Coakley EH, Willett WC, Byers T, Williamson DF, Colditz GA. Долгосрочные изменения веса и риск холецистэктомии у женщин. Ann Intern Med. Март 1999 г., 130 (6): 471–7.
- Цай CJ, Leitzmann MF, Willett WC, Giovannucci EL.Циклическое изменение веса и риск желчнокаменной болезни у мужчин. Arch Intern Med. 2006 ноябрь; 166 (21): 2369–74.
- Гебхард Р.
 Л., Пригге В.Ф., Ансель Х.Дж., Шласнер Л., Кетовер С.Р., Санде Д. и др. Роль опорожнения желчного пузыря в образовании желчных камней во время быстрой потери веса, вызванной диетой. Гепатология.1996 Сентябрь; 24 (3): 544–8.
Л., Пригге В.Ф., Ансель Х.Дж., Шласнер Л., Кетовер С.Р., Санде Д. и др. Роль опорожнения желчного пузыря в образовании желчных камней во время быстрой потери веса, вызванной диетой. Гепатология.1996 Сентябрь; 24 (3): 544–8. - Шиффман М. Л., Сугерман Х. Дж., Келлум Дж. М., Мур Е. В.. Изменения в составе желчного пузыря после образования желчных камней и снижения веса. Гастроэнтерология. Июль 1992 г., 103 (1): 214–21.
- Уорни М., Гуллер У., Шах А., Ганди М., Шах Дж., Раджгор Д. и др.Холецистэктомия в сочетании с лапароскопическим обходным желудочным анастомозом: анализ тенденций общенациональной стационарной выборки с 2001 по 2008 годы.
 Obes Surg. 2012 Февраль; 22 (2): 220–9.
Obes Surg. 2012 Февраль; 22 (2): 220–9. - Хамад Г.Г., Икрамуддин С., Гураш В.Ф., Шауэр ПР. Плановая холецистэктомия во время лапароскопического обходного желудочного анастомоза по Ру: стоит ли ждать? Obes Surg.2003 Февраль; 13 (1): 76–81.
- Warschkow R, Tarantino I, Ukegjini K, Beutner U, Güller U, Schmied BM и др. Сопутствующая холецистэктомия во время лапароскопического обходного желудочного анастомоза по Ру у пациентов с ожирением не оправдана: метаанализ. Obes Surg. 2013 Март; 23 (3): 397–407.
- Ким Дж.
 Дж., Ширмер Б.Безопасность и эффективность одновременной холецистэктомии при обходном желудочном анастомозе по Ру. Surg Obes Relat Dis. 2009, январь-февраль; 5 (1): 48–53.
Дж., Ширмер Б.Безопасность и эффективность одновременной холецистэктомии при обходном желудочном анастомозе по Ру. Surg Obes Relat Dis. 2009, январь-февраль; 5 (1): 48–53. - Swartz DE, Felix EL. Избирательная холецистэктомия после обходного желудочного анастомоза по Ру: почему бессимптомные камни в желчном пузыре следует лечить по-другому у пациентов с патологическим ожирением? Surg Obes Relat Dis.Ноябрь-декабрь 2005 г .; 1 (6): 555–60.
- Ривз Дж. Дж., Бертон Б. Н., Бродерик Р. К. и др. Ожирение и непредвиденная госпитализация после амбулаторной лапароскопической холецистэктомии. Surg Endosc.
 2021 Март; 35 (3): 1348–54.
2021 Март; 35 (3): 1348–54. - Аммори Б.Дж., Везакис А., Давидес Д., Мартин И.Г., Ларвин М., МакМахон М.Дж.Лапароскопическая холецистэктомия у пациентов с патологическим ожирением. Surg Endosc. 2001 ноя; 15 (11): 1336–9.
- Gutt C, Jenssen C, Barreiros AP, Götze TO, Stokes CS, Jansen PL, et al. Aktualisierte S3-Leitlinie der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) und der Deutschen Gesellschaft für Allgemein- und Viszeralchirurgie (DGAV) zur.З. Гастроэнтерол. 2018 август; 56 (8): 912–66.
- Ламмерт Ф.
 , Акаловски М., Эрколани Дж., Ван Эрпекум К., Гурусами К.С., ван Лаарховен С.Дж. и др. EASL Clinical Practice Guidelines по профилактике, диагностике и лечению камней в желчном пузыре. J Hepatol. Июль 2016; 65 (1): 146–81.
, Акаловски М., Эрколани Дж., Ван Эрпекум К., Гурусами К.С., ван Лаарховен С.Дж. и др. EASL Clinical Practice Guidelines по профилактике, диагностике и лечению камней в желчном пузыре. J Hepatol. Июль 2016; 65 (1): 146–81. - Цирлайн В.Б., Кейлани З.М., Эль Джузи С., Филлипс Р.С., Кувада Т.С., Герсин К. и др.Как часто и когда пациенты проходят холецистэктомию после бариатрической операции? Surg Obes Relat Dis. 2014 март-апрель; 10 (2): 313–21.
- Делла Пенна А., Ланге Дж., Гильберт Дж., Арчид Р., Кенигсрайнер А., Кванте М. Урсодезоксихолевая кислота в течение 6 месяцев после бариатрической хирургии влияет на заболеваемость, связанную с желчнокаменной болезнью, у пациентов с предоперационными бессимптомными желчными камнями.
 Obes Surg. 2019 Апрель; 29 (4): 1216–21.
Obes Surg. 2019 Апрель; 29 (4): 1216–21. - Анведен Å, Пелтонен М., Нэслунд И., Торгерсон Дж., Карлссон Л.М. Долгосрочная заболеваемость желчнокаменной болезнью после бариатрической хирургии: результаты нерандомизированного контролируемого исследования шведских пациентов с ожирением. Surg Obes Relat Dis. 2020 Октябрь; 16 (10): 1474–82.
- Камрат Р.О., Пламмер Л.Дж., Садур К.Н., Адлер М.А., Стрейдер В.Дж., Янг Р.Л. и др. Желчекаменная болезнь у пациентов, получающих очень низкокалорийную диету. Am J Clin Nutr. 1992 июл; 56 (1 доп.): 255S – 7S.
- Фести Д.
 , Колеккиа А., Орсини М., Сангермано А., Соттили С., Симони П. и др.Подвижность желчного пузыря и образование желчных камней у пациентов с ожирением, соблюдающих очень низкокалорийную диету. Используйте его (жир), чтобы его потерять (хорошо). Int J Obes Relat Metab Disord. 1998 июн; 22 (6): 592–600.
, Колеккиа А., Орсини М., Сангермано А., Соттили С., Симони П. и др.Подвижность желчного пузыря и образование желчных камней у пациентов с ожирением, соблюдающих очень низкокалорийную диету. Используйте его (жир), чтобы его потерять (хорошо). Int J Obes Relat Metab Disord. 1998 июн; 22 (6): 592–600. - Stokes CS, Gluud LL, Casper M, Lammert F. Урсодезоксихолевая кислота и диеты с более высоким содержанием жира предотвращают образование камней в желчном пузыре во время потери веса: метаанализ рандомизированных контролируемых исследований.Clin Gastroenterol Hepatol. 2014 июл; 12 (7): 1090–1100.e2.
- Малик В.
 С., Шульце МБ, Ху ФБ. Потребление сахаросодержащих напитков и увеличение веса: систематический обзор. Am J Clin Nutr. 2006 август; 84 (2): 274–88.
С., Шульце МБ, Ху ФБ. Потребление сахаросодержащих напитков и увеличение веса: систематический обзор. Am J Clin Nutr. 2006 август; 84 (2): 274–88. - Вартанян Л.Р., Шварц М.Б., Браунелл К.Д.Влияние потребления безалкогольных напитков на питание и здоровье: систематический обзор и метаанализ. Am J Public Health. 2007 Апрель; 97 (4): 667–75.
- Harland JI, Garton LE. Потребление цельного зерна как маркер здоровой массы тела и ожирения. Public Health Nutr. 2008 июн; 11 (6): 554–63.
- Savage JS, Marini M, Birch LL.
 Энергетическая ценность питания позволяет прогнозировать изменение веса женщины в течение 6 лет. Am J Clin Nutr. 2008 сентябрь; 88 (3): 677–84.
Энергетическая ценность питания позволяет прогнозировать изменение веса женщины в течение 6 лет. Am J Clin Nutr. 2008 сентябрь; 88 (3): 677–84. - Бес-Растролло М., Ван Дам Р.М., Мартинес-Гонсалес М.А., Ли Т.Ю., Сэмпсон Л.Л., Ху Ф.Б.Проспективное исследование диетической плотности энергии и увеличения веса у женщин. Am J Clin Nutr. 2008 сентябрь; 88 (3): 769–77.
- Хупер Л., Абдельхамид А., Мур Х. Дж., Даутвейт В., Скефф К. М., Саммербелл, компакт-диск. Влияние снижения общего потребления жиров на массу тела: систематический обзор и метаанализ рандомизированных контролируемых исследований и когортных исследований.
 BMJ. 2012 декабрь; 345: e7666.
BMJ. 2012 декабрь; 345: e7666. - Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Interdisziplinäre Leitlinie der Qualität S3 zur Prävention und Therapie der Adipositas. Deutsche Adipositas-Gesellschaft, Martinsried 2014.
- Цай CJ, Leitzmann MF, Willett WC, Giovannucci EL.Гликемическая нагрузка, гликемический индекс и потребление углеводов в зависимости от риска холецистэктомии у женщин. Гастроэнтерология. Июль 2005 г .; 129 (1): 105–12.
- Цай CJ, Leitzmann MF, Willett WC, Giovannucci EL.
 Углеводы в рационе, гликемическая нагрузка и частота симптоматической желчнокаменной болезни у мужчин.Кишечник. 2005 июн; 54 (6): 823–8.
Углеводы в рационе, гликемическая нагрузка и частота симптоматической желчнокаменной болезни у мужчин.Кишечник. 2005 июн; 54 (6): 823–8. - Misciagna G, Centonze S, Leoci C, Guerra V, Cisternino AM, Ceo R и др. Диета, физическая активность и камни в желчном пузыре — популяционное исследование случай-контроль в южной Италии. Am J Clin Nutr. 1999, январь, 69 (1): 120–6.
- Цай CJ, Leitzmann MF, Willett WC, Giovannucci EL.Употребление фруктов и овощей и риск холецистэктомии у женщин. Am J Med. 2006 сентябрь; 119 (9): 760–7.
- Nordenvall C, Oskarsson V, Wolk A.
 Потребление фруктов и овощей и риск холецистэктомии: проспективное когортное исследование женщин и мужчин. Eur J Nutr. 2018 Февраль; 57 (1): 75–81.
Потребление фруктов и овощей и риск холецистэктомии: проспективное когортное исследование женщин и мужчин. Eur J Nutr. 2018 Февраль; 57 (1): 75–81. - Цай CJ, Leitzmann MF, Willett WC, Giovannucci EL. Длительное потребление пищевых волокон и снижение риска холецистэктомии у женщин. Am J Gastroenterol. Июль 2004 г .; 99 (7): 1364–70.
- Моран С., Милке П., Родригес-Леал Дж., Урибе М.Образование желчных камней у лиц с ожирением, соблюдающих диету для снижения веса. Int J Obes Relat Metab Disord. 1998 Март, 22 (3): 282–4.
- Barré A, Gusto G, Cadeau C, Carbonnel F, Boutron-Ruault MC.
 Диета и риск холецистэктомии: проспективное исследование, основанное на французской когорте E3N.Am J Gastroenterol. 2017 сентябрь; 112 (9): 1448–56.
Диета и риск холецистэктомии: проспективное исследование, основанное на французской когорте E3N.Am J Gastroenterol. 2017 сентябрь; 112 (9): 1448–56. - Цай CJ, Leitzmann MF, Ху FB, Виллетт WC, Джованнуччи EL. Частое употребление орехов и снижение риска холецистэктомии у женщин. Am J Clin Nutr. Июль 2004 г.; 80 (1): 76–81.
- Цай CJ, Leitzmann MF, Willett WC, Giovannucci EL.Влияние длительного приема цис-ненасыщенных жиров на риск желчнокаменной болезни у мужчин: проспективное когортное исследование. Ann Intern Med. 2004 Октябрь; 141 (7): 514–22.
- Цай CJ, Leitzmann MF, Willett WC, Giovannucci EL.
 Длительное потребление трансжирных кислот и риск желчнокаменной болезни у мужчин.Arch Intern Med. 2005 Май; 165 (9): 1011–5.
Длительное потребление трансжирных кислот и риск желчнокаменной болезни у мужчин.Arch Intern Med. 2005 Май; 165 (9): 1011–5. - Цай CJ, Leitzmann MF, Willett WC, Giovannucci EL. Потребление длинноцепочечных насыщенных жирных кислот и риск желчнокаменной болезни у мужчин. Ann Surg. 2008 Янв; 247 (1): 95–103.
- Берр Ф., Холл Дж., Юнгст Д., Фишер С., Рихтер В. О., Зайфферт Б. и др.Пищевые полиненасыщенные жирные кислоты N-3 снижают насыщение билиарного холестерина при желчнокаменной болезни. Гепатология. 1992 Октябрь; 16 (4): 960–7.
- Мендес-Санчес Н.
 , Гонсалес В., Агуайо П., Санчес Дж. М., Танимото М. А., Элизондо Дж. И др. Полиненасыщенные жирные кислоты рыбьего жира (n-3) благотворно влияют на время зародышеобразования холестерина в желчных путях у женщин с ожирением, худеющих.J Nutr. 2001 сентябрь; 131 (9): 2300–3.
, Гонсалес В., Агуайо П., Санчес Дж. М., Танимото М. А., Элизондо Дж. И др. Полиненасыщенные жирные кислоты рыбьего жира (n-3) благотворно влияют на время зародышеобразования холестерина в желчных путях у женщин с ожирением, худеющих.J Nutr. 2001 сентябрь; 131 (9): 2300–3. - Jonkers IJ, Smelt AH, Ledeboer M, Hollum ME, Biemond I., Kuipers F, et al. Нарушение моторики желчного пузыря: фактор риска образования камней в желчном пузыре при гипертриглицеридемии и отмены терапии по снижению триглицеридов безафибратом и рыбьим жиром.Кишечник. 2003, январь; 52 (1): 109–15.
- Аттили А.Ф., Скафато Э.
 , Маркиоли Р., Марфизи Р.М., Фести Д. Диета и камни в желчном пузыре в Италии: результаты поперечного сечения MICOL. Гепатология. 1998 июн; 27 (6): 1492–8.
, Маркиоли Р., Марфизи Р.М., Фести Д. Диета и камни в желчном пузыре в Италии: результаты поперечного сечения MICOL. Гепатология. 1998 июн; 27 (6): 1492–8. - Leitzmann MF, Giovannucci EL, Rimm EB, Stampfer MJ, Spiegelman D, Wing AL, et al.Связь физической активности с риском развития симптоматической желчнокаменной болезни у мужчин. Ann Intern Med. 1998 Март, 128 (6): 417–25.
- Leitzmann MF, Rimm EB, Willett WC, Spiegelman D, Grodstein F, Stampfer MJ и др. Рекреационная физическая активность и риск холецистэктомии у женщин.N Engl J Med. 1999 сентябрь; 341 (11): 777–84.
- Сторти К.
 Л., Брач Дж. С., Фицджеральд С. Дж., Змуда Дж. М., Каули Дж. А., Криска А. М.. Физическая активность и снижение риска клинической желчнокаменной болезни у женщин в постменопаузе. Предыдущая Мед. 2005 сентябрь-октябрь; 41 (3-4): 772-7.
Л., Брач Дж. С., Фицджеральд С. Дж., Змуда Дж. М., Каули Дж. А., Криска А. М.. Физическая активность и снижение риска клинической желчнокаменной болезни у женщин в постменопаузе. Предыдущая Мед. 2005 сентябрь-октябрь; 41 (3-4): 772-7. - Utter AC, Whitcomb DC, Nieman DC, Butterworth DE, Vermillion SS.Влияние физических упражнений на функцию желчного пузыря у женщин с ожирением. Медико-спортивные упражнения. 2000 Янв, 32 (1): 41–5.
- Ко Ч.В., Наполитано П.Г., Ли С.П., Шульте С.Д., Чиол М.А., Бересфорд С.А. Физическая активность, показатели метаболизма матери и частота образования отложений или камней в желчном пузыре во время беременности: рандомизированное исследование.
 Am J Perinatol. 2014 Янв; 31 (1): 39–48.
Am J Perinatol. 2014 Янв; 31 (1): 39–48. - Уильямс К., Гоуэн Р., Перей Б.Дж. Двойное слепое плацебо-контролируемое испытание урсодезоксихолевой кислоты в профилактике образования желчных камней во время потери веса после гастропластики с вертикальной полосой. Obes Surg. 1993 август; 3 (3): 257–9.
- Воробец Л.Дж., Инглис Ф.Г., Шаффер Е.А.Влияние терапии урсодезоксихолевой кислотой на образование камней в желчном пузыре у пациентов с болезненным ожирением во время быстрой потери веса. Am J Gastroenterol. 1993 Октябрь; 88 (10): 1705–10.
- Wudel LJ Jr, Райт JK, Debelak JP, Allos TM, Shyr Y, Chapman WC.
 Профилактика образования камней в желчном пузыре у пациентов с болезненным ожирением, подвергающихся быстрой потере веса: результаты рандомизированного контролируемого пилотного исследования.J Surg Res. 2002, январь, 102 (1): 50–6.
Профилактика образования камней в желчном пузыре у пациентов с болезненным ожирением, подвергающихся быстрой потере веса: результаты рандомизированного контролируемого пилотного исследования.J Surg Res. 2002, январь, 102 (1): 50–6. - Миллер К., Хелл Э., Ланг Б., Ленгауэр Э. Профилактика образования желчных камней после желудочных рестриктивных процедур для похудания: рандомизированное двойное слепое плацебо-контролируемое исследование. Ann Surg. 2003 ноя; 238 (5): 697–702.
- Виллегас Л., Шнайдер Б., Провост Д., Чанг С., Скотт Д., Симс Т. и др.Требуется ли плановая холецистэктомия во время лапароскопического обходного желудочного анастомоза? Obes Surg.
 2004 Февраль; 14 (2): 206–11.
2004 Февраль; 14 (2): 206–11. - Ellner SJ, Myers TT, Piorkowski JR, Mavanur AA, Barba CA. Рутинная холецистэктомия не является обязательной во время операции по поводу патологического ожирения. Surg Obes Relat Dis. Июль-август 2007 г.; 3 (4): 456–60.
- Coupaye M, Calabrese D, Sami O, Msika S, Ledoux S. Оценка частоты холелитиаза после бариатрической хирургии у субъектов, получавших или не получавших урсодезоксихолевую кислоту. Surg Obes Relat Dis. 2017 Апрель; 13 (4): 681–5.
- Pizza F, D’Antonio D, Lucido FS, Tolone S, Del Genio G, Dell’Isola C и др.
 Роль урсодезоксихолевой кислоты (УДХК) в лечении холелитиаза после одного анастомозного обходного желудочного анастомоза (OAGB) при патологическом ожирении: результаты моноцентрического рандомизированного контролируемого исследования. Obes Surg. 2020 Ноябрь; 30 (11): 4315–24.
Роль урсодезоксихолевой кислоты (УДХК) в лечении холелитиаза после одного анастомозного обходного желудочного анастомоза (OAGB) при патологическом ожирении: результаты моноцентрического рандомизированного контролируемого исследования. Obes Surg. 2020 Ноябрь; 30 (11): 4315–24.
Автор Контакты
Фрэнк Ламмерт, откровенно[email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Поступила в редакцию: 20 января 2021 г.
Дата принятия: 22 марта 2021 г.
Опубликована в Интернете: 15 июня 2021 г.
Дата выпуска: август 2021 г.
Количество страниц для печати: 7
Количество рисунков: 1
Количество столов: 0
ISSN: 2297-4725 (печатный)
eISSN: 2297-475X (онлайн)
Для дополнительной информации: https: // www.karger.com/VIS
Лицензия открытого доступа / Дозировка лекарства / Заявление об ограничении ответственности
Эта статья находится под международной лицензией Creative Commons Attribution-NonCommercial 4.0 (CC BY-NC). Для использования и распространения в коммерческих целях требуется письменное разрешение. Дозировка лекарственного средства: авторы и издатель приложили все усилия для обеспечения того, чтобы выбор и дозировка лекарств, указанные в этом тексте, соответствовали текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат. Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат. Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Gallstone — обзор | Темы ScienceDirect
Холестерин и смешанные камни
Необходимым этапом образования холестерина и смешанных камней является перенасыщение холестерином желчи в желчном пузыре.Растворимость желчи, а также перенасыщение желчи основаны на относительных молярных концентрациях холестерина, желчных кислот, фосфатидилхолина (лецитина) и воды. Поскольку свободный холестерин нерастворим в воде, он должен быть включен в мицеллу лецитина и желчной соли (рис. 171.2). Используя треугольные координаты, можно продемонстрировать растворимость холестерина в желчи (рис. 171.3).
Поскольку свободный холестерин нерастворим в воде, он должен быть включен в мицеллу лецитина и желчной соли (рис. 171.2). Используя треугольные координаты, можно продемонстрировать растворимость холестерина в желчи (рис. 171.3).
Как показано на рисунках, увеличение секреции холестерина или уменьшение секреции желчной кислоты или лецитина приведет к перенасыщению желчи.После перенасыщения желчи камнеобразование инициируется такими факторами, как застой желчных протоков, инфекция и повышенная секреция муцина эпителием желчного пузыря. Как только камень начинает формироваться, его радиус увеличивается в среднем на 2,6 мм / год, в конечном итоге достигая размера от нескольких миллиметров до более чем сантиметра. Симптомы обычно возникают в среднем через 8 лет после начала формирования. Холелитиаз присутствует у 95% больных холециститом. 8
Факторы риска холестерина и смешанных камней
Основные факторы риска развития холестерина и смешанных желчных камней включают следующие 2–4 :
- •
Диета
- • Пол
- •
Раса
- •
Ожирение
- •
Высокая калорийность
- •
Эстрогены
Эстрогены
- 9 фиброз)
- •
Лекарства
- •
Возраст
Роль диеты с низким содержанием клетчатки и высоким содержанием жиров в развитии камней в желчном пузыре, а также других диетических факторах будет обсуждаться позже. .Остальные факторы кратко обсуждаются здесь.
.Остальные факторы кратко обсуждаются здесь.
Пол
Частота образования камней в желчном пузыре у женщин в два-четыре раза выше, чем у мужчин. Считается, что женщины предрасположены к образованию камней в желчном пузыре либо из-за повышенного синтеза холестерина, либо из-за подавления эстрогенами желчных кислот. Беременность, использование оральных контрацептивов или другие причины повышенного уровня эстрогена и тамоксифена значительно увеличивают частоту образования камней в желчном пузыре.
Генетические и этнические
Распространенность желчных камней, по-видимому, имеет некоторые генетические аспекты.Камни в желчном пузыре чаще всего встречаются у индейских женщин старше 30 лет. Почти у 70% этой группы есть камни в желчном пузыре. Напротив, только 10% чернокожих женщин старше 30 лет имеют камни в желчном пузыре. Разница в уровне распространенности между этническими и генетическими группами отражает степень насыщения желчи холестерином. Степень, в которой диетические факторы влияют на это значение, вероятно, перевешивает генетические факторы. 9
9
Ожирение
Люди с ожирением подвержены риску развития желчных камней из-за избыточного веса и при первоначальной потере веса. 10 Ожирение вызывает повышенную активность 3-гидрокси-3-метил-глутарил-КоА (HMG-CoA) редуктазы с повышенной секрецией холестерина с желчью в результате повышенного синтеза холестерина. Следовательно, ожирение связано со значительным увеличением числа желчных камней из-за насыщения билиарного холестерина.
Важно отметить, что во время активного снижения веса изменение жировых отложений и диеты может способствовать проблемам с желчными камнями. На первых этапах похудания изначально увеличивается сатурация холестерина желчных путей. 4 Во время похудания снижается секреция всех липидов желчных путей, но секреция желчных кислот уменьшается больше, чем секреция холестерина. Как только вес стабилизируется, выход желчной кислоты возвращается к нормальному уровню, тогда как выход холестерина остается низким. Чистый эффект — значительное снижение насыщения холестерином. При назначении диетотерапии пациентам с ожирением и высоким риском образования камней в желчном пузыре следует учитывать, что длительное снижение количества жиров, получаемых с пищей, также может способствовать застою желчных путей, 1 , таким образом, способствуя насыщению холестерина.Исследования показывают, что для правильного опорожнения желчного пузыря необходимо не менее 10 г жира в день. 11
Чистый эффект — значительное снижение насыщения холестерином. При назначении диетотерапии пациентам с ожирением и высоким риском образования камней в желчном пузыре следует учитывать, что длительное снижение количества жиров, получаемых с пищей, также может способствовать застою желчных путей, 1 , таким образом, способствуя насыщению холестерина.Исследования показывают, что для правильного опорожнения желчного пузыря необходимо не менее 10 г жира в день. 11
Заболевания желудочно-кишечного тракта
Мальабсорбция желчных кислот из терминального отдела подвздошной кишки нарушает энтерогепатическое кровообращение, тем самым уменьшая пул желчных кислот и скорость секреции желчи. Заболевания, связанные с этим явлением, включают болезнь Крона и муковисцидоз.
Лекарственные препараты
Лечение тамоксифеном у пациенток в постменопаузе с раком груди значительно увеличивает образование желчных камней.Одно ретроспективное когортное исследование с участием 703 женщин показало, что через 5 лет частота камнеобразования у пациентов, получавших тамоксифен, составила 37,4%, тогда как у пациентов, не получавших тамоксифен, она составляла 2%. 12 Большинство камней в желчном пузыре выявлялись через 3 года.
12 Большинство камней в желчном пузыре выявлялись через 3 года.
В дополнение к оральным контрацептивам и другим эстрогенам, другие препараты, повышающие риск образования камней в желчном пузыре, включают цефалоспорин цефтриаксон, октреотид, ингибиторы HMG-CoA редуктазы, 1 и, возможно, другие гиполипидемические препараты.
Возраст
Желчные камни были зарегистрированы от эмбрионального возраста до глубокой старости, но средний возраст пациента составляет от 40 до 50 лет. Снижение активности холестерин-7-α-гидроксилазы с возрастом 1 приводит к увеличению гиперсекреции билиарного холестерина 13 и, следовательно, к насыщению холестерина с ускоренным образованием желчных камней.
Гипотиреоз
Пациенты с гипотиреозом более склонны к высокому уровню холестерина в сыворотке крови. Механизмы воздействия гормонов щитовидной железы на холестерин многофакторны, включая влияние на синтез, абсорбцию и использование холестерина. Нарушения липидного обмена, возникающие при гипотиреозе, особенно в пути холестерина, изменяют скорость выведения желчи и приводят к образованию камней в желчном пузыре. В ходе многомерного регрессионного анализа был сделан вывод, что уровень тиреотропного гормона (ТТГ) в сыворотке крови является независимым фактором, который можно рассматривать как фактор риска образования камней в общем желчном протоке (отношение шансов [OR] = 3,07; 95 % доверительный интервал [CI], 1,51–6,3). 14
Нарушения липидного обмена, возникающие при гипотиреозе, особенно в пути холестерина, изменяют скорость выведения желчи и приводят к образованию камней в желчном пузыре. В ходе многомерного регрессионного анализа был сделан вывод, что уровень тиреотропного гормона (ТТГ) в сыворотке крови является независимым фактором, который можно рассматривать как фактор риска образования камней в общем желчном протоке (отношение шансов [OR] = 3,07; 95 % доверительный интервал [CI], 1,51–6,3). 14
Загрязнители окружающей среды
Загрязнение металлов как естественного, так и антропогенного происхождения отрицательно сказывается на здоровье человека.В исследовании изучалось влияние загрязнения металлами на образование камней в желчном пузыре путем сравнения двух контрастирующих с экологической точки зрения популяций в провинции Уэльва на юго-западе Испании. 15 Исследуемая популяция проживала в районе с высоким содержанием металлов, происходящим из естественно обогащенных металлами коренных пород и исторических горных работ в регионе Иберийского пиритового пояса, тогда как контрольная популяция проживала в Национальном парке Сьерра-де-Арасена и Пикос.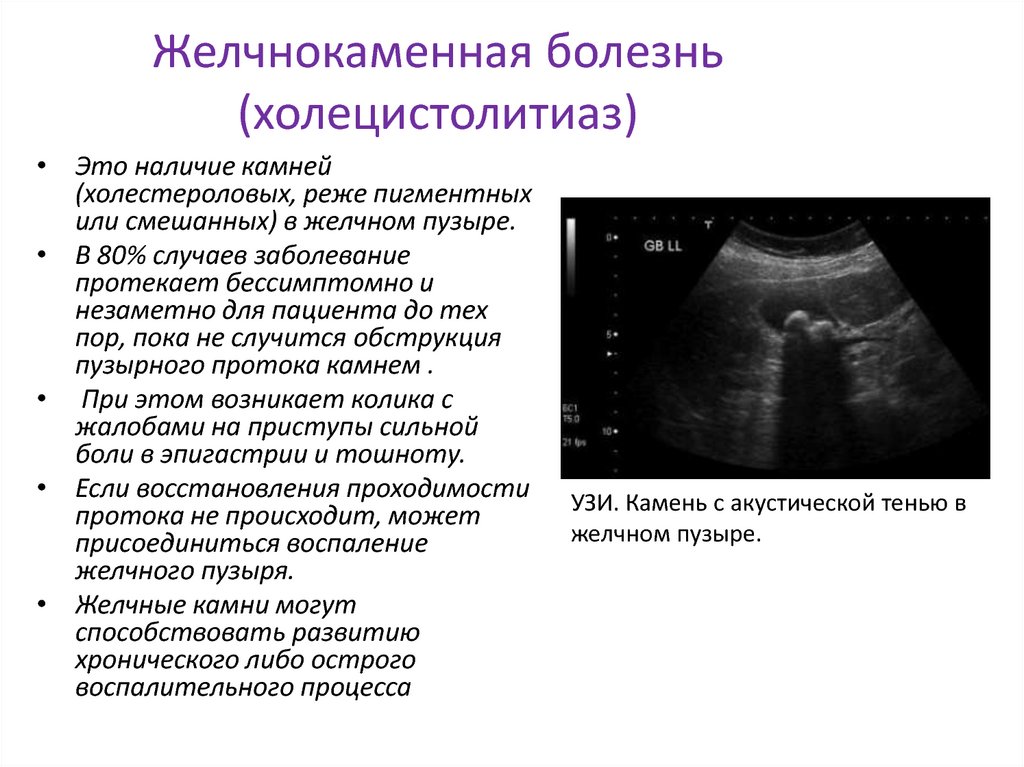 де Ароче. Пациенты из исследуемой группы имели более высокий риск воздействия металлов через загрязненную почву, частицы в воздухе и потребление местной воды и пищевых продуктов.Результаты показали, что воздействие металлов было связано с более высокой тенденцией к образованию желчных камней с черным пигментом в исследуемой группе по сравнению с контрольной группой, а желчные камни из исследуемой группы содержали более обильные металлические компоненты, такие как медь, железо, никель и цинк. . Кроме того, исследование, проведенное в Индии, выявило положительную корреляцию между содержанием никеля, кадмия и хрома в воде и высокую распространенность заболеваний желчного пузыря в соседних деревнях района Вайшали, Бихар. 16
де Ароче. Пациенты из исследуемой группы имели более высокий риск воздействия металлов через загрязненную почву, частицы в воздухе и потребление местной воды и пищевых продуктов.Результаты показали, что воздействие металлов было связано с более высокой тенденцией к образованию желчных камней с черным пигментом в исследуемой группе по сравнению с контрольной группой, а желчные камни из исследуемой группы содержали более обильные металлические компоненты, такие как медь, железо, никель и цинк. . Кроме того, исследование, проведенное в Индии, выявило положительную корреляцию между содержанием никеля, кадмия и хрома в воде и высокую распространенность заболеваний желчного пузыря в соседних деревнях района Вайшали, Бихар. 16
Хлорорганические пестициды (ХОП) — стойкие органические загрязнители (СОЗ), исторически использовавшиеся для борьбы с вредителями в сельском хозяйстве.Исследование методом случай-контроль, проведенное в Китае, показало, что высокие уровни остатков п, п’-ДДЭ и п, п’-ДДТ являются факторами риска образования камней в желчном пузыре. 17 Благодаря своим липофильным свойствам ХОП могут накапливаться в жировой ткани и других органах. Было обнаружено, что уровни β-HCH и p ‘, p’-DDE в жировой ткани выше у пациентов с желчнокаменной болезнью и сильно связаны с желчнокаменной болезнью. 18
17 Благодаря своим липофильным свойствам ХОП могут накапливаться в жировой ткани и других органах. Было обнаружено, что уровни β-HCH и p ‘, p’-DDE в жировой ткани выше у пациентов с желчнокаменной болезнью и сильно связаны с желчнокаменной болезнью. 18
Эффективность и безопасность нового местного средства для растворения желчных камней: 2-метокси-6-метилпиридин | Журнал трансляционной медицины
Определение основных характеристик ММП
В таблице 1 приведены структурные и функциональные сравнения МТБЭ и ММП.MMP имеет структуру, в которой трет-бутильная группа в MTBE заменена объемной ароматической функциональной группой, что приводит к повышению температуры кипения с 55 (MTBE) до 156 ° C (MMP). Значительная часть токсичности МТБЭ связана с более высоким испарением, вызванным относительно низкой температурой кипения; поэтому ожидается, что ММП будет иметь относительно меньшую токсичность из-за его более высокой точки кипения. Кроме того, в отличие от МТБЭ, который имеет только один гетероатом кислорода, ММП имеет два гетероатома (азот и кислород) в форме пинцета, что увеличивает возможность стабильного захвата катионов желчными камнями за счет хелатного эффекта, что означает повышенное сродство к атому металла соединением, которое присоединено к атому металла в циклической или кольцевой структуре. Хелатный эффект ускоряет растворение камней в желчном пузыре, что демонстрирует ЭДТА, которая усиливает растворение кальциевых камней за счет хелатирования кальциевого компонента камней в желчном пузыре [21]. В данном документе мы попытались определить силу хелатного эффекта каждого растворителя (МТВЕ и ММП) с использованием протонного ЯМР, поскольку ожидается, что химический сдвиг собственного протона будет изменяться в соответствии с хелатным эффектом между электронами неподеленной пары гетероатома и катиона ( Рис. 1а, б). Чтобы проверить эту концепцию, мы использовали Co (ClO 4 ) 2 · 6H 2 O в качестве поставщика Co 2+ , поскольку Co (ClO 4 ) 2 · 6H 2 O вероятно иметь независимые катионы за счет объемного аниона ClO 4 2-.Когда к растворителям (МТВЕ и ММП) добавляли 0,5 эквивалента Со (ClO 4 ) 2 · 6H 2 O, химические сдвиги были незначительными (0,19 и 0,18 частей на миллион соответственно).
Хелатный эффект ускоряет растворение камней в желчном пузыре, что демонстрирует ЭДТА, которая усиливает растворение кальциевых камней за счет хелатирования кальциевого компонента камней в желчном пузыре [21]. В данном документе мы попытались определить силу хелатного эффекта каждого растворителя (МТВЕ и ММП) с использованием протонного ЯМР, поскольку ожидается, что химический сдвиг собственного протона будет изменяться в соответствии с хелатным эффектом между электронами неподеленной пары гетероатома и катиона ( Рис. 1а, б). Чтобы проверить эту концепцию, мы использовали Co (ClO 4 ) 2 · 6H 2 O в качестве поставщика Co 2+ , поскольку Co (ClO 4 ) 2 · 6H 2 O вероятно иметь независимые катионы за счет объемного аниона ClO 4 2-.Когда к растворителям (МТВЕ и ММП) добавляли 0,5 эквивалента Со (ClO 4 ) 2 · 6H 2 O, химические сдвиги были незначительными (0,19 и 0,18 частей на миллион соответственно). Однако, когда эквивалент Co (ClO 4 ) 2 · 6H 2 O был увеличен до 1,0–2,0 относительно растворителей, ММП показал значительно более высокий химический сдвиг, чем МТБЭ (0,33–0,65 м.д. по сравнению с 0,50 –1.03 ppm) (рис. 1a, b), что свидетельствует о повышенном сродстве за счет хелатного эффекта между MMP и Co 2+ .Другие данные, подтверждающие усиление хелатного эффекта ММП, были представлены в дополнительном файле 3: рис. S1, дополнительном файле 4: рис. S2, дополнительном файле 5: рис. S3, дополнительном файле 6: рис. S4, дополнительном файле 7: рис. S5 , и Дополнительный файл 8: Рис. S6.
Однако, когда эквивалент Co (ClO 4 ) 2 · 6H 2 O был увеличен до 1,0–2,0 относительно растворителей, ММП показал значительно более высокий химический сдвиг, чем МТБЭ (0,33–0,65 м.д. по сравнению с 0,50 –1.03 ppm) (рис. 1a, b), что свидетельствует о повышенном сродстве за счет хелатного эффекта между MMP и Co 2+ .Другие данные, подтверждающие усиление хелатного эффекта ММП, были представлены в дополнительном файле 3: рис. S1, дополнительном файле 4: рис. S2, дополнительном файле 5: рис. S3, дополнительном файле 6: рис. S4, дополнительном файле 7: рис. S5 , и Дополнительный файл 8: Рис. S6.
Подтверждение хелатного эффекта и термогравиметрический анализ каждого растворителя. a Определение собственных протонных химических сдвигов МТБЭ в присутствии катиона Co 2+ с использованием протонного ядерного магнитного резонанса (ЯМР). Чистые значения химического сдвига (Δδ) МТБЭ с увеличением концентрации катиона Co 2+ составляли 0,19 (0–0,5 экв. Co 2+ ), 0,10 (0,5–1,0 экв. Co 2+ ) и 0,21 ( 1,0–2,0 экв. Co 2+ ). b Определение собственных протонных химических сдвигов ММП в присутствии катиона Co 2+ с использованием протонного ядерного магнитного резонанса (ЯМР). Чистые значения химического сдвига (Δδ) ММП с увеличением концентрации катиона Co 2+ составили 0,18 (0–0,5 экв.Co 2+ ), 0,14 (0,5–1,0 экв. Co 2+ ) и 0,32 (1,0–2,0 экв. Co 2+ ). Не было различий в химических сдвигах между МТБЭ и ММП в присутствии 0,5 эквивалента Со 2+ . Однако химический сдвиг ММП был более заметным, возможно, из-за хелатной силы между ММП и Со 2+ . c Термогравиметрический анализ МТБЭ. ТГА можно использовать для оценки термостабильности соединения. Термогравиметрический анализатор непрерывно измеряет массу вещества (МТБЭ или ММП), при этом температура изменяется с течением времени.
Чистые значения химического сдвига (Δδ) МТБЭ с увеличением концентрации катиона Co 2+ составляли 0,19 (0–0,5 экв. Co 2+ ), 0,10 (0,5–1,0 экв. Co 2+ ) и 0,21 ( 1,0–2,0 экв. Co 2+ ). b Определение собственных протонных химических сдвигов ММП в присутствии катиона Co 2+ с использованием протонного ядерного магнитного резонанса (ЯМР). Чистые значения химического сдвига (Δδ) ММП с увеличением концентрации катиона Co 2+ составили 0,18 (0–0,5 экв.Co 2+ ), 0,14 (0,5–1,0 экв. Co 2+ ) и 0,32 (1,0–2,0 экв. Co 2+ ). Не было различий в химических сдвигах между МТБЭ и ММП в присутствии 0,5 эквивалента Со 2+ . Однако химический сдвиг ММП был более заметным, возможно, из-за хелатной силы между ММП и Со 2+ . c Термогравиметрический анализ МТБЭ. ТГА можно использовать для оценки термостабильности соединения. Термогравиметрический анализатор непрерывно измеряет массу вещества (МТБЭ или ММП), при этом температура изменяется с течением времени. В случае МТБЭ анализ ТГА был невозможен, поскольку он быстро испарялся в камере из-за низкой температуры кипения. д Термогравиметрический анализ ММП. В случае MMP, он не испарялся до подачи начального тепла из-за его более высокой точки кипения, составляющей 156 ° C, и медленно испарялся при повышении температуры. ММП, 2-метокси-6-метилпиридин; MTBE, метил-трет-бутиловый эфир; ЯМР, ядерный магнитный резонанс; ТГА, термогравиметрический анализ
В случае МТБЭ анализ ТГА был невозможен, поскольку он быстро испарялся в камере из-за низкой температуры кипения. д Термогравиметрический анализ ММП. В случае MMP, он не испарялся до подачи начального тепла из-за его более высокой точки кипения, составляющей 156 ° C, и медленно испарялся при повышении температуры. ММП, 2-метокси-6-метилпиридин; MTBE, метил-трет-бутиловый эфир; ЯМР, ядерный магнитный резонанс; ТГА, термогравиметрический анализ
Затем с помощью ТГА определяли стабильность каждого растворителя при повышении температуры (рис.1в, г). В отношении МТБЭ мы не смогли получить данные ТГА, потому что МТБЭ уже был летучим при 25 ° C и не оставлял аналитических остатков. Однако ММП постепенно испарялся при повышении температуры от 20 до 70 ° C и демонстрировал наиболее резкое изменение при 57 ° C.
Классификация камней в желчном пузыре по компонентам
На основании литературы мы классифицировали камни в желчном пузыре по содержанию холестерина (≥ 70%, 70–30% и <30%) на холестериновые, смешанные и пигментированные камни в желчном пузыре соответственно [ 22]. На рис. 2а показаны типичные макросы и поперечные сечения каждого типа камней в желчном пузыре. Ферментативный анализ холестерина показал, что содержание холестерина составляло 84,3 ± 5,7% для холестериновых камней, 62,0 ± 3,9% для смешанных камней и 17,7 ± 0,2% для пигментированных камней (рис. 2b, c). В дополнение к содержанию холестерина, желчные камни каждого типа демонстрировали совершенно отличный состав от других типов желчных камней; например, пигментированные камни содержат значительно более высокие концентрации фосфатов и кальция, чем холестериновые камни.
На рис. 2а показаны типичные макросы и поперечные сечения каждого типа камней в желчном пузыре. Ферментативный анализ холестерина показал, что содержание холестерина составляло 84,3 ± 5,7% для холестериновых камней, 62,0 ± 3,9% для смешанных камней и 17,7 ± 0,2% для пигментированных камней (рис. 2b, c). В дополнение к содержанию холестерина, желчные камни каждого типа демонстрировали совершенно отличный состав от других типов желчных камней; например, пигментированные камни содержат значительно более высокие концентрации фосфатов и кальция, чем холестериновые камни.
Составы желчных камней по содержанию холестерина. a Типичный общий вид и поперечный вид холестериновых, смешанных и пигментированных желчных камней. b Сравнение компонентов желчных камней по их подтипам (холестериновые, смешанные и пигментированные желчные камни). c Процент (%) холестерина по отношению к сумме других компонентов каждого типа
Влияние каждого растворителя на эпителиальные клетки желчного пузыря человека
Мы исследовали прямую токсичность каждого растворителя на hGBEC. Тесты на жизнеспособность клеток показали, что жизнеспособность hGBEC существенно не снижалась при повышении концентраций MTBE и MMP до 1,0 M, что свидетельствует о незначительном влиянии обоих растворителей на жизнеспособность GBEC (рис. 3a). Затем мы выполнили вестерн-блот-анализ, чтобы определить экспрессию маркеров, которые отражают пролиферацию клеток (PCNA), антиапоптоз (Mcl-1) и апоптоз (BAX) при увеличении концентрации каждого растворителя (рис. 3b). С увеличением концентрации MTBE наблюдалось резкое повышение экспрессии PCNA и BAX и падение экспрессии Mcl-1.ММП индуцировал такие же изменения в этих маркерах, что и МТБЭ; однако изменения были не такими заметными, как у MTBE, и даже наблюдалось снижение экспрессии BAX при более высокой концентрации (1 мМ).
Тесты на жизнеспособность клеток показали, что жизнеспособность hGBEC существенно не снижалась при повышении концентраций MTBE и MMP до 1,0 M, что свидетельствует о незначительном влиянии обоих растворителей на жизнеспособность GBEC (рис. 3a). Затем мы выполнили вестерн-блот-анализ, чтобы определить экспрессию маркеров, которые отражают пролиферацию клеток (PCNA), антиапоптоз (Mcl-1) и апоптоз (BAX) при увеличении концентрации каждого растворителя (рис. 3b). С увеличением концентрации MTBE наблюдалось резкое повышение экспрессии PCNA и BAX и падение экспрессии Mcl-1.ММП индуцировал такие же изменения в этих маркерах, что и МТБЭ; однако изменения были не такими заметными, как у MTBE, и даже наблюдалось снижение экспрессии BAX при более высокой концентрации (1 мМ).
Определение токсичности и растворимости желчных камней каждого растворителя in vitro. a Анализ жизнеспособности клеток, показывающий влияние каждого растворителя на жизнеспособность эпителиальных клеток желчного пузыря человека (hGBEC). Жизнеспособность GBEC существенно не изменилась в зависимости от концентрации MTBE или MMP (0.0–1,0 мМ) в течение 24 часов. b Вестерн-блот-анализ, показывающий эффекты MTBE и MMP на экспрессию PCNA (маркер пролиферации), Mcl-1 (маркер антиапоптоза) и BAX (маркер апоптоза). [Вверх] С повышением концентрации MTBE произошло резкое повышение экспрессии PCNA и BAX и падение экспрессии Mcl-1. [Внизу] При повышении концентрации MPP экспрессия PCNA была менее выраженной, чем экспрессия MTBE. Кроме того, в отличие от MTBE, экспрессия BAX снижалась при более высокой концентрации (1 мМ), а экспрессия Mcl-1 повышалась. c Растворимость холестериновых камней в желчном пузыре. [Слева] График зависимости холестериновых камней в желчном пузыре от времени. ММП растворяет холестериновые камни в желчном пузыре значительно лучше, чем МТВЕ, через 8 и 24 часа ( P <0,05). [В центре] Репрезентативные фотографии остаточных камней в желчном пузыре через 24 часа. [Справа] Сравнение растворимости каждого растворителя через 8 и 24 часа в холестериновых камнях желчного пузыря.
Жизнеспособность GBEC существенно не изменилась в зависимости от концентрации MTBE или MMP (0.0–1,0 мМ) в течение 24 часов. b Вестерн-блот-анализ, показывающий эффекты MTBE и MMP на экспрессию PCNA (маркер пролиферации), Mcl-1 (маркер антиапоптоза) и BAX (маркер апоптоза). [Вверх] С повышением концентрации MTBE произошло резкое повышение экспрессии PCNA и BAX и падение экспрессии Mcl-1. [Внизу] При повышении концентрации MPP экспрессия PCNA была менее выраженной, чем экспрессия MTBE. Кроме того, в отличие от MTBE, экспрессия BAX снижалась при более высокой концентрации (1 мМ), а экспрессия Mcl-1 повышалась. c Растворимость холестериновых камней в желчном пузыре. [Слева] График зависимости холестериновых камней в желчном пузыре от времени. ММП растворяет холестериновые камни в желчном пузыре значительно лучше, чем МТВЕ, через 8 и 24 часа ( P <0,05). [В центре] Репрезентативные фотографии остаточных камней в желчном пузыре через 24 часа. [Справа] Сравнение растворимости каждого растворителя через 8 и 24 часа в холестериновых камнях желчного пузыря. d Растворимость смешанных желчных камней. [Слева] График реакции смешанных камней в желчном пузыре. Два растворителя продемонстрировали сходное растворение в смешанных камнях в желчном пузыре, за исключением более быстрого временного растворения ММП через 4 часа.[В центре] Репрезентативные фотографии остаточных камней в желчном пузыре через 24 часа. [Справа] Сравнение растворимости каждого растворителя через 8 и 24 часа в смешанных желчных камнях. e Растворимость пигментированных желчных камней. [Слева] График зависимости пигментированных желчных камней от времени. ММП растворял пигментированные желчные камни значительно лучше, чем МТБЭ, через 4, 8 и 24 часа ( P <0,05). [В центре] Репрезентативные фотографии остаточных камней в желчном пузыре через 24 часа. [Справа] Сравнение растворимости каждого растворителя через 8 и 24 часа в пигментированных камнях в желчном пузыре.Значения представлены как среднее ± стандартное отклонение трех независимых экспериментов. Растворимость желчных камней in vitro (%) каждого растворителя определялась как (средний вес необработанных желчных камней - средний вес желчных камней после обработки растворителем в определенный интервал времени) / средний вес необработанных желчных камней.
d Растворимость смешанных желчных камней. [Слева] График реакции смешанных камней в желчном пузыре. Два растворителя продемонстрировали сходное растворение в смешанных камнях в желчном пузыре, за исключением более быстрого временного растворения ММП через 4 часа.[В центре] Репрезентативные фотографии остаточных камней в желчном пузыре через 24 часа. [Справа] Сравнение растворимости каждого растворителя через 8 и 24 часа в смешанных желчных камнях. e Растворимость пигментированных желчных камней. [Слева] График зависимости пигментированных желчных камней от времени. ММП растворял пигментированные желчные камни значительно лучше, чем МТБЭ, через 4, 8 и 24 часа ( P <0,05). [В центре] Репрезентативные фотографии остаточных камней в желчном пузыре через 24 часа. [Справа] Сравнение растворимости каждого растворителя через 8 и 24 часа в пигментированных камнях в желчном пузыре.Значения представлены как среднее ± стандартное отклонение трех независимых экспериментов. Растворимость желчных камней in vitro (%) каждого растворителя определялась как (средний вес необработанных желчных камней - средний вес желчных камней после обработки растворителем в определенный интервал времени) / средний вес необработанных желчных камней. * P <0,05. BAX, Bcl-2-подобный белок 4; Mcl-1, лейкоз миелоидных клеток 1; ММП, 2-метокси-6-метилпиридин; MTBE, метил-трет-бутиловый эфир; PCNA, ядерный антиген клеток пролиферации
* P <0,05. BAX, Bcl-2-подобный белок 4; Mcl-1, лейкоз миелоидных клеток 1; ММП, 2-метокси-6-метилпиридин; MTBE, метил-трет-бутиловый эфир; PCNA, ядерный антиген клеток пролиферации
Определение растворимости желчных камней in vitro в каждом растворителе
Чтобы определить растворимость каждого растворителя в зависимости от типа желчного камня, мы сравнили сухую массу желчных камней человека в трех разных временных точках (4, 8 и 24 ч) после они напрямую вступали в реакцию с каждым растворителем.Растворимость желчных камней рассчитывалась как разница в весах желчных камней между предварительной обработкой и определенными временными интервалами. В холестериновых желчных камнях растворимость ММП была значительно лучше, чем растворимость МТБЭ через 8 и 24 часа ( P <0,05) (рис. 3c). В смешанных камнях желчного пузыря два растворителя продемонстрировали сходную растворимость, за исключением временной более высокой растворимости ММП через 4 часа (рис. 3d). В пигментированных желчных камнях растворимость ММП была значительно лучше, чем растворимость МТБЭ через 4 часа, 8 часов и 24 часа ( P <0. 05) (рис. 3д). Через 8 часов, в то время как МТБЭ продемонстрировал растворимость 58,5%, 44,5% и 22,2%, ММП продемонстрировал растворимость 73,5%, 47,5% и 37,2% для холестериновых, смешанных и пигментированных желчных камней, соответственно. Кроме того, через 24 часа, в то время как MTBE показал растворимость 65,7%, 54,2% и 29,0%, MMP показал растворимость 88,2%, 61,0% и 50,8% для холестерина, смешанных и пигментированных желчных камней, соответственно.
05) (рис. 3д). Через 8 часов, в то время как МТБЭ продемонстрировал растворимость 58,5%, 44,5% и 22,2%, ММП продемонстрировал растворимость 73,5%, 47,5% и 37,2% для холестериновых, смешанных и пигментированных желчных камней, соответственно. Кроме того, через 24 часа, в то время как MTBE показал растворимость 65,7%, 54,2% и 29,0%, MMP показал растворимость 88,2%, 61,0% и 50,8% для холестерина, смешанных и пигментированных желчных камней, соответственно.
Определение системных эффектов и растворимости желчных камней in vivo каждым растворителем
Мы создали модели хомяков с холестериновыми желчными камнями (группа CG) и пигментированными камнями в желчном пузыре (группа PG) с индивидуальными трехмесячными диетическими протоколами, как описано ранее [23].Во время кормления хомяки каждой группы демонстрировали постоянное увеличение массы тела (дополнительный файл 9: рис. S7), а в конце периода кормления желчные камни были обнаружены у 88% (44/50) группы CG. , и 82% (41/50) группы PG. После обнаружения камней в желчном пузыре с помощью УЗИ брюшной полости мы случайным образом распределили хомяков с холестериновыми камнями в желчном пузыре (N = 40) и пигментированными камнями в желчном пузыре (N = 40) на ДМСО (контроль; n = 10), МТБЭ (n = 15) и ММП (n = 15) группы соответственно. Впоследствии мы непосредственно вводили каждый материал в желчный пузырь хомяков с каждым типом желчных камней, соответственно, после лапаротомии под общим наркозом.
После обнаружения камней в желчном пузыре с помощью УЗИ брюшной полости мы случайным образом распределили хомяков с холестериновыми камнями в желчном пузыре (N = 40) и пигментированными камнями в желчном пузыре (N = 40) на ДМСО (контроль; n = 10), МТБЭ (n = 15) и ММП (n = 15) группы соответственно. Впоследствии мы непосредственно вводили каждый материал в желчный пузырь хомяков с каждым типом желчных камней, соответственно, после лапаротомии под общим наркозом.
Во-первых, чтобы определить, вызывает ли инфузия растворителя системную воспалительную реакцию, мы измерили сывороточные концентрации провоспалительных медиаторов (IL-6 и TNF-α) с помощью ELISA через 24 часа внутрикистозной инфузии. В то время как МТБЭ значительно увеличивал сывороточные уровни ИЛ-6, ММП не повышал как холестерин, так и пигментированные желчные камни на хомяках (рис. 4а). Кроме того, в то время как MTBE увеличивал уровни TNF-α в сыворотке, MMP снижал уровни TNF-α в обеих моделях (фиг. 4b). Впоследствии мы определили растворимость каждого растворителя, сравнив массу остаточных желчных камней через 24 часа после инфузии (рис. 4в). ДМСО использовали в качестве контрольного материала. В группе CG МТВЕ продемонстрировал растворимость 50,0%, в то время как ММП продемонстрировал растворимость 59,0%, и разница была статистически значимой ( P <0,05) (рис. 4d, слева). Более того, было обнаружено, что группа PG имеет гораздо более значимые различия; тогда как MTBE показал растворимость 32,0%, MMP показал растворимость 54,3% ( P <0,05) (рис. 4d, справа). Таким образом, мы могли сделать вывод, что ММП демонстрирует значительно более высокую растворимость, чем МТБЭ на моделях хомяков с желчными камнями, особенно пигментированными желчными камнями.
4в). ДМСО использовали в качестве контрольного материала. В группе CG МТВЕ продемонстрировал растворимость 50,0%, в то время как ММП продемонстрировал растворимость 59,0%, и разница была статистически значимой ( P <0,05) (рис. 4d, слева). Более того, было обнаружено, что группа PG имеет гораздо более значимые различия; тогда как MTBE показал растворимость 32,0%, MMP показал растворимость 54,3% ( P <0,05) (рис. 4d, справа). Таким образом, мы могли сделать вывод, что ММП демонстрирует значительно более высокую растворимость, чем МТБЭ на моделях хомяков с желчными камнями, особенно пигментированными желчными камнями.
Подтверждение эффектов каждого соединения, растворяющего желчные камни, на модели желчных камней на хомяке. a Влияние внутрикистозной инфузии каждого растворителя на высвобождение провоспалительных медиаторов у хомяков с камнями в желчном пузыре. ELISA показывает, что, хотя МТВЕ значительно увеличивал уровни ИЛ-6, ММП не увеличивал уровни холестерина на хомяках (слева) и пигментированных желчных камней [справа]. b Влияние внутрикистозной инъекции каждого растворителя на высвобождение TNF-α у хомяков с камнями в желчном пузыре.В отличие от MTBE, MMP снижал сывороточные уровни TNF-α в обеих моделях холестерина у хомяков [слева] и пигментированных желчных камнях [справа]. c Типичные изображения, демонстрирующие развитие холестерина [слева] и пигментированных [справа] желчных камней у экспериментальных хомяков, соблюдающих соответствующие протоколы диет. Желтые круги указывают на желчный пузырь и желчные камни в желчном пузыре. d Демонстрация растворимости желчных камней in vivo для каждого растворителя. После вливания каждого растворителя в желчный пузырь хомяков с желчными камнями в течение 24 часов определяли растворимость желчных камней путем сравнения веса остаточных желчных камней.Растворимость in vivo желчных камней (%) каждого растворителя определяли как (средний вес обработанных ДМСО камней в желчном пузыре — средний вес желчных камней после обработки растворителем) / средний вес обработанных ДМСО камней в желчном пузыре.
b Влияние внутрикистозной инъекции каждого растворителя на высвобождение TNF-α у хомяков с камнями в желчном пузыре.В отличие от MTBE, MMP снижал сывороточные уровни TNF-α в обеих моделях холестерина у хомяков [слева] и пигментированных желчных камнях [справа]. c Типичные изображения, демонстрирующие развитие холестерина [слева] и пигментированных [справа] желчных камней у экспериментальных хомяков, соблюдающих соответствующие протоколы диет. Желтые круги указывают на желчный пузырь и желчные камни в желчном пузыре. d Демонстрация растворимости желчных камней in vivo для каждого растворителя. После вливания каждого растворителя в желчный пузырь хомяков с желчными камнями в течение 24 часов определяли растворимость желчных камней путем сравнения веса остаточных желчных камней.Растворимость in vivo желчных камней (%) каждого растворителя определяли как (средний вес обработанных ДМСО камней в желчном пузыре — средний вес желчных камней после обработки растворителем) / средний вес обработанных ДМСО камней в желчном пузыре. MMP продемонстрировал значительно более высокую растворимость, чем MTBE, в обеих моделях холестерина [слева] и особенно пигментированных [справа] желчных камней у хомяков. Растворимость каждого растворителя (МТВЕ и ММП) для пигментированных желчных камней составляла 32,0% и 54,3% соответственно (P <0,05).* P <0,05. ДМСО, диметилсульфоксид; ММП, 2-метокси-6-метилпиридин; МТБЭ, метил-трет-бутиловый эфир
MMP продемонстрировал значительно более высокую растворимость, чем MTBE, в обеих моделях холестерина [слева] и особенно пигментированных [справа] желчных камней у хомяков. Растворимость каждого растворителя (МТВЕ и ММП) для пигментированных желчных камней составляла 32,0% и 54,3% соответственно (P <0,05).* P <0,05. ДМСО, диметилсульфоксид; ММП, 2-метокси-6-метилпиридин; МТБЭ, метил-трет-бутиловый эфир
Определение токсичности каждого растворителя in vivo
Чтобы определить токсическое действие каждого растворителя на печень и почки, мы провели гистологические исследования с использованием тканей, полученных от хомяков через 24 часа после внутрикистозной инфузии каждого растворителя. При микроскопическом исследовании с окрашиванием гематоксилином и эозином ткани печени и почек обоих хомяков, обработанных растворителем, были хорошо сохранены и не имели видимых признаков повреждения (рис.5а). Затем, чтобы определить прямую тканевую токсичность каждого растворителя, мы провели иммуногистохимический (ИГХ) анализ образцов желчного пузыря, полученных от обработанных растворителем хомяков. Панель IHC включала окрашивание репрезентативных маркеров проапоптоза (расщепленная каспаза-3) и пролиферации (PCNA). Экспрессия расщепленной каспазы 3 была намного более выраженной после инфузии MTBE, чем после инфузии MMP в группах CG и PG ( P <0,05) (рис. 5b, слева). Кроме того, инфузия МТБЭ значительно более значительно снижала экспрессию PCNA, чем инфузия ММП ( P <0.05), что свидетельствует о более высокой токсичности МТБЭ по сравнению с ММП, особенно в группе CG (рис. 5b, справа).
Панель IHC включала окрашивание репрезентативных маркеров проапоптоза (расщепленная каспаза-3) и пролиферации (PCNA). Экспрессия расщепленной каспазы 3 была намного более выраженной после инфузии MTBE, чем после инфузии MMP в группах CG и PG ( P <0,05) (рис. 5b, слева). Кроме того, инфузия МТБЭ значительно более значительно снижала экспрессию PCNA, чем инфузия ММП ( P <0.05), что свидетельствует о более высокой токсичности МТБЭ по сравнению с ММП, особенно в группе CG (рис. 5b, справа).
Подтверждение тканевой токсичности каждого соединения, растворяющего желчные камни, на моделях желчных камней у хомяков. a Окрашивание гематоксилином-эозином (H&E) тканей печени и почек, полученных от хомяков, содержащих желчный камень, через 24 часа после внутрикистозной инъекции каждого растворителя. При окрашивании HE ткани печени и почек в каждой группе оказались хорошо сохранившимися и не демонстрировали никаких признаков повреждения. b [Слева] Расщепленные иммуногистохимические пятна каспазы-3 тканей желчного пузыря, полученные от хомяков с желчными камнями, через 24 часа после внутрикистозной инъекции каждого растворителя. В то время как MTBE значительно увеличивал экспрессию расщепленной каспазы-9 ( P <0,05), MMP не увеличивал экспрессию холестерина и пигментированных желчных камней у хомяков. [Справа] PCNA-иммуногистохимические окрашивания тканей желчного пузыря, полученные от хомяков с желчными камнями, через 24 часа после внутрикистозной инъекции каждого растворителя.Хотя оба растворителя значительно снижали экспрессию PCNA, снижение экспрессии PCNA было намного значительным после MTBE, чем после MMP в обеих моделях желчных камней ( P <0,05). * P <0,05. ДМСО, диметилсульфоксид; ММП, 2-метокси-6-метилпиридин; МТБЭ, метил-трет-бутиловый эфир
b [Слева] Расщепленные иммуногистохимические пятна каспазы-3 тканей желчного пузыря, полученные от хомяков с желчными камнями, через 24 часа после внутрикистозной инъекции каждого растворителя. В то время как MTBE значительно увеличивал экспрессию расщепленной каспазы-9 ( P <0,05), MMP не увеличивал экспрессию холестерина и пигментированных желчных камней у хомяков. [Справа] PCNA-иммуногистохимические окрашивания тканей желчного пузыря, полученные от хомяков с желчными камнями, через 24 часа после внутрикистозной инъекции каждого растворителя.Хотя оба растворителя значительно снижали экспрессию PCNA, снижение экспрессии PCNA было намного значительным после MTBE, чем после MMP в обеих моделях желчных камней ( P <0,05). * P <0,05. ДМСО, диметилсульфоксид; ММП, 2-метокси-6-метилпиридин; МТБЭ, метил-трет-бутиловый эфир
Комплексное тестирование in vitro и in vivo токсичности каждого растворителя на различных моделях
Для дальнейшего определения токсичности каждого растворителя in vitro мы провели анализ жизнеспособности различных клеточных линий, включая клетки Vero. , Клетки L929 и клетки CHO-K1 (рис.6а). Мы обнаружили, что оба растворителя не снижали жизнеспособность клеток этих клеточных линий, по крайней мере, до концентрации 1,0 М каждого растворителя.
, Клетки L929 и клетки CHO-K1 (рис.6а). Мы обнаружили, что оба растворителя не снижали жизнеспособность клеток этих клеточных линий, по крайней мере, до концентрации 1,0 М каждого растворителя.
Подтверждение токсичности каждого соединения, растворяющего желчные камни, на различных моделях in vitro и in vivo. a Цитотоксичность каждого растворителя in vitro для клеток Vero, L929 и CHO-K1. Для сравнения токсичности МТВЕ и ММП in vitro проводили анализ жизнеспособности клеток с использованием набора для анализа жизнеспособности клеток Cyto X. Жизнеспособность клеток Vero, L929 и CHO-K1 существенно не изменилась в зависимости от концентрации MTBE или MMP (0–1000 мкМ) в течение 24 часов. b [Справа] Влияние каждого растворителя на двигательную активность личинок рыбок данио. Для определения токсичности каждого растворителя для ЦНС мы отслеживали перемещение личинок рыбок данио после обработки 1 мМ МТВЕ и 1 мМ ММП соответственно в течение 60 мин. Двигательная активность была нормализована относительно контроля ДМСО и представлена в процентах. В то время как МТБЭ увеличивал двигательную активность в течение первых 6 минут после лечения, ММП снижал ее в течение первых 6 минут после лечения. Однако в целом каждая группа не показала какой-либо значимой разницы в общей двигательной активности по сравнению с контролем ДМСО.[Слева] Общая двигательная активность в течение 60 минут, что не демонстрирует существенной разницы между группами МТВЕ и ММП. c Изменения выживаемости и массы тела после перорального введения МТБЭ и ММП у мышей. [Слева] По сравнению с контрольной группой, группы МТБЭ и ММП продемонстрировали схожую выживаемость. [Справа] Группа ММП продемонстрировала небольшое снижение массы тела в течение 7 дней, которое восстановилось через 14 дней после лечения. d Определение тканевой токсичности каждого растворителя через 14 дней после перорального приема.[Вверх] Иммуногистохимические окрашивания PCNA. Мыши, получавшие MMP, показали более высокую экспрессию PCNA (маркера пролиферации), чем мыши, получавшие MTBE ( P <0,05).
Двигательная активность была нормализована относительно контроля ДМСО и представлена в процентах. В то время как МТБЭ увеличивал двигательную активность в течение первых 6 минут после лечения, ММП снижал ее в течение первых 6 минут после лечения. Однако в целом каждая группа не показала какой-либо значимой разницы в общей двигательной активности по сравнению с контролем ДМСО.[Слева] Общая двигательная активность в течение 60 минут, что не демонстрирует существенной разницы между группами МТВЕ и ММП. c Изменения выживаемости и массы тела после перорального введения МТБЭ и ММП у мышей. [Слева] По сравнению с контрольной группой, группы МТБЭ и ММП продемонстрировали схожую выживаемость. [Справа] Группа ММП продемонстрировала небольшое снижение массы тела в течение 7 дней, которое восстановилось через 14 дней после лечения. d Определение тканевой токсичности каждого растворителя через 14 дней после перорального приема.[Вверх] Иммуногистохимические окрашивания PCNA. Мыши, получавшие MMP, показали более высокую экспрессию PCNA (маркера пролиферации), чем мыши, получавшие MTBE ( P <0,05). [Внизу] Иммуногистохимические пятна BAX. Мыши, получавшие MMP, показали меньшую экспрессию BAX (апоптотический маркер), чем мыши, получавшие MTBE ( P <0,05). * Р <0,05. BAX, bcl-2-подобный белок 4; ММП, 2-метокси-6-метилпиридин; MTBE, метил-трет-бутиловый эфир; PCNA, ядерный антиген клеток пролиферации
[Внизу] Иммуногистохимические пятна BAX. Мыши, получавшие MMP, показали меньшую экспрессию BAX (апоптотический маркер), чем мыши, получавшие MTBE ( P <0,05). * Р <0,05. BAX, bcl-2-подобный белок 4; ММП, 2-метокси-6-метилпиридин; MTBE, метил-трет-бутиловый эфир; PCNA, ядерный антиген клеток пролиферации
Затем, для определения токсичности каждого растворителя для центральной нервной системы (ЦНС), мы отслеживали перемещение личинок рыбок данио в 1 мМ MTBE и MMP соответственно в течение 60 мин (рис.6б). Двигательную активность нормализовали по ДМСО в качестве контроля и выражали в процентах. Было обнаружено, что МТБЭ увеличивал двигательную активность в течение первых 6 мин; однако MMP снизила его за тот же период. Следовательно, такие различия были компенсированы, когда общая сумма двигательной активности была подсчитана за период наблюдения.
Наконец, для определения острой токсичности in vivo, возникающей в результате однократного воздействия, смертность, изменения массы тела и общее поведение мышей отслеживали в течение 14 дней после перорального введения каждого растворителя в дозе 2000 мг / кг ( Инжир. 6в). На второй день эксперимента было обнаружено, что одинаковое количество мышей (3/7, 42,9%) умерло в обеих группах, которым вводили либо МТВЕ, либо ММП, соответственно. Эти животные проявляли ненормальное поведение, включая хрипы, тремор и атаксию до самой смерти, без заметных различий между каждой группой. Сходное, но не выраженное поведение также наблюдалось у выживших животных той же группы, и модели поведения были схожими в обеих группах. Кроме того, у мышей, которым вводили ММП, в течение первых 7 дней был обнаружен незначительный недостаток веса, и впоследствии они выздоровели.Впоследствии, после умерщвления мышей через 1 день и 14 дней после перорального введения, соответственно, мы получили образцы печени, почек, сердца и легких для определения гистологических эффектов каждого растворителя. Иммуногистохимия была проведена для маркеров пролиферации (PCNA), апоптоза (каспаза 3 и Bax) и антиапоптоза (сурвивин). На 1 день (дополнительный файл 10: рис. S8), а также на 14 день мыши, получавшие MMP, показали более высокую экспрессию PCNA, меньшую экспрессию каспазы 3 и Bas и более высокую экспрессию сурвивина, чем мыши с MTBE (все P с <0.
6в). На второй день эксперимента было обнаружено, что одинаковое количество мышей (3/7, 42,9%) умерло в обеих группах, которым вводили либо МТВЕ, либо ММП, соответственно. Эти животные проявляли ненормальное поведение, включая хрипы, тремор и атаксию до самой смерти, без заметных различий между каждой группой. Сходное, но не выраженное поведение также наблюдалось у выживших животных той же группы, и модели поведения были схожими в обеих группах. Кроме того, у мышей, которым вводили ММП, в течение первых 7 дней был обнаружен незначительный недостаток веса, и впоследствии они выздоровели.Впоследствии, после умерщвления мышей через 1 день и 14 дней после перорального введения, соответственно, мы получили образцы печени, почек, сердца и легких для определения гистологических эффектов каждого растворителя. Иммуногистохимия была проведена для маркеров пролиферации (PCNA), апоптоза (каспаза 3 и Bax) и антиапоптоза (сурвивин). На 1 день (дополнительный файл 10: рис. S8), а также на 14 день мыши, получавшие MMP, показали более высокую экспрессию PCNA, меньшую экспрессию каспазы 3 и Bas и более высокую экспрессию сурвивина, чем мыши с MTBE (все P с <0. 05) (рис. 6d и дополнительный файл 11: рис. S9), предполагая меньшую тканевую токсичность ММП.
05) (рис. 6d и дополнительный файл 11: рис. S9), предполагая меньшую тканевую токсичность ММП.
Симптомы и лечение желчных камней у вашей собаки
Желчные камни у собак
Камни в желчном пузыре, заболевание, также известное как холелитиаз, могут поражать собак и кошек, а также людей. Эта статья, однако, касается холелитиаза у собак. И у собак, и у людей желчные камни образуются из секретируемых в желчном пузыре веществ, таких как кальций и другие минералы.
Желчь собак насыщена холестерином ниже, чем у людей. Это полезно для наших собак-компаньонов, поскольку это означает, что у них меньше шансов, чем у людей, образовывать более крупные камни в желчном пузыре. Камни в желчном пузыре могут встречаться у собак любой породы, но более вероятно, что они станут серьезной проблемой у шетландских овчарок, пуделей и миниатюрных шнауцеров.
Симптомы и причины образования камней в желчном пузыре у собак
Образование камней в желчном пузыре у собак почти не имеет заметных симптомов. Однако камни в желчном пузыре могут присутствовать в сочетании с другой инфекцией. Эта сопутствующая инфекция может вызывать у собак следующие симптомы:
Однако камни в желчном пузыре могут присутствовать в сочетании с другой инфекцией. Эта сопутствующая инфекция может вызывать у собак следующие симптомы:
- Желтуха (пожелтение глаз и кожи)
- Рвота
- Лихорадка
- Боль в животе
Желчные камни могут образовываться в желчном пузыре собаки по разным причинам. Желчный пузырь может не функционировать, нарушая отток желчи и концентрируя холестерин, пигмент или кальций в желчи.Камни также могут образовываться в ответ на воспаление, инфекцию, клеточное разрушение желчного пузыря или опухоль.
Сами камни в желчном пузыре, если они есть, способствуют воспалению и могут усугубить проблему у здоровых собак.
Диагностика камней в желчном пузыре у собак
Чтобы диагностировать камни в желчном пузыре у собаки, ветеринар обычно проводит полное медицинское обследование и назначает рентген, анализ мочи и анализ крови. Камни в желчном пузыре могут быть идентифицированы на рентгеновском снимке, а могут и не быть идентифицированы, поэтому ваш ветеринар порекомендует дополнительные методы визуализации, такие как УЗИ, для диагностики состояния, исключая панкреатит, воспаление желчного протока, вздутие или воспаление желчного пузыря или различные заболевания печени. .
.
Лечение и прогноз желчных камней у собак
Если ваша собака не испытывает серьезных или опасных для жизни симптомов, операция по удалению камней в желчном пузыре обычно не оправдана. Существуют внутривенные лекарственные препараты, доступные для этого состояния, но среди ветеринаров есть некоторые разногласия по поводу того, оправданы ли эти методы лечения, если животному не угрожает опасность из-за камней в желчном пузыре. Хирургия или внутривенная терапия обычно требуют госпитализации животного.
Как правило, собак, страдающих желчными камнями легкой степени, на всю оставшуюся жизнь сажают на диету с высоким содержанием белка и низким содержанием жиров.
Камни в желчном пузыре могут быть серьезным заболеванием, но обычно требуют изменения диеты и мягкой терапии
Хотя камни в желчном пузыре являются серьезным заболеванием у некоторых собак, они обычно не требуют хирургического вмешательства или инвазивной терапии. Большинство собак, даже если они страдают вторичными инфекциями в результате образования камней в желчном пузыре, можно лечить с помощью лекарств и соблюдать строгую диету.
Об авторе
Доктор Эван Уэр, практикующий ветеринар из Феникса, Аризона.Он получил степень бакалавра микробиологии и степень доктора ветеринарной медицины в Университете штата Огайо.
Доктор Вэр в настоящее время является медицинским директором Университетской клиники для животных (VCA), а также владельцем двух других больниц, включая Ветеринарный центр Лавин и Ветеринарный центр Феникса. Его области знаний включают ортопедическую медицину и хирургию, ветеринарную онкологию и химиотерапию, а также общую и расширенную хирургию мягких тканей.
Уровни боли при желчном камне: от 0 до
ER Сентябрь9, 2015
У женщин в возрасте от 20 до 60 лет вероятность развития желчных камней в три раза выше, чем у мужчин. Шансы увеличиваются для женщин, которые перенесли многоплодную беременность, в семейном анамнезе имеют камни в желчном пузыре, имеют латиноамериканское или индейское происхождение, страдают ожирением или испытали быструю потерю веса.
Уровни боли при желчнокаменной болезни: от 0 до ER
Большинство людей с камнями в желчном пузыре испытывают некоторую боль, но другие не испытывают никаких симптомов.
Маленькие камни в желчном пузыре покидают желчный пузырь и его дренажные протоки, а затем выходят из организма через кишечник.После приема пищи с высоким содержанием жиров тонкие мышцы в стенке желчного пузыря сжимаются, чтобы помочь вывести желчь в кишечник во время процесса пищеварения. Если желчный пузырь прижимается к желчному камню или желчный камень препятствует легкому оттоку жидкости, желчный пузырь может болеть с сильной устойчивой болью.
Эти симптомы желчнокаменной болезни не всегда проявляются там, где вы могли подумать:
- Тошнота и рвота
- Расстройство желудка, вздутие живота и изжога
- Боль в правом верхнем углу живота
- Внезапная и быстрая боль в центре живота
- Боль между лопатками
- Боль в правом плече
Согласно
ДокторЭрик Орр, сертифицированный хирург, связанный с
В больнице Шарп-Гроссмонт многие женщины живут своей жизнью, не зная, что у них камни в желчном пузыре.
Когда происходит приступ желчного пузыря, вы можете попасть в отделение неотложной помощи. Поскольку лекарств для лечения камней в желчном пузыре нет, хирургическое удаление желчного пузыря может быть единственным вариантом лечения.
Лапароскопическая операция — это наиболее распространенная операция по удалению желчного пузыря. Хирург удаляет желчный пузырь и желчные камни через несколько небольших разрезов в брюшной полости.
Роботизированная хирургия Single-Site ™: новое решение для лечения
В отличие от традиционных лапароскопических операций, для которых требуется от трех до пяти небольших разрезов, теперь доступна новая технология, позволяющая сделать один дюйм через пупок, называемая роботизированной хирургией Single-Site ™.
«Во время операции в одном месте хирург сидит за консолью, просматривает трехмерное изображение анатомии пациента в высоком разрешении и использует элементы управления для перемещения роботизированных рук и камеры для выполнения операции», — объясняет д-р. Орр.
Орр.
«Поскольку в данной технологии используется один небольшой разрез через пупок, одно из основных преимуществ операции на желчном пузыре в одном месте — это косметическое преимущество, заключающееся в практически полном отсутствии рубцов».
К другим преимуществам односайтовой роботизированной хирургии относятся следующие:
- Минимальная боль
- Низкая кровопотеря
- Можно выполнить примерно за час
- Кратковременное пребывание в больнице менее 24 часов
- Быстрое выздоровление — пациенты обычно возвращаются к нормальной жизни в течение семи дней
Вы можете жить здоровой жизнью без желчного пузыря.Желчь, вырабатываемая вашей печенью, попадает непосредственно в тонкий кишечник, а не накапливается сначала в желчном пузыре.
Хотя камни в желчном пузыре предотвратить нельзя, доктор Орр советует, что есть способы снизить риск как для женщин, так и для мужчин: поддерживать здоровый вес; ешьте регулярное сбалансированное питание; и упражняйтесь ежедневно.
Комбинированное лечение полиненасыщенными жирными кислотами n-3 и урсодезоксихолевой кислотой растворяет холестериновые камни в желчном пузыре у мышей
Образование камней в желчном пузыре
Не было значительных различий между группами по массе тела или печени до или после лечения (рис.1A, B), и никаких системных побочных эффектов не наблюдалось. Вес желчных камней был значительно ниже в группе комбинированной терапии, чем в контрольной группе после лечения (рис. 1C). Кроме того, желчных камней было значительно меньше в группах УДХК и комбинированной терапии, чем в контрольной группе (рис. 1D). Уменьшение количества и размера желчных камней наблюдалось макроскопически во всех группах лечения (рис. 2A – E).
Рис. 1Масса тела, масса печени, масса и размер камней в желчном пузыре до и после лечения.Вес тела, вес печени, вес и размер камней в желчном пузыре проверяли на этапах до лечения (после кормления литогенной диетой в течение 8 недель) и после лечения (после введения терапевтического агента с обычной диетой в течение 12 недель). в четырех группах (контроль, урсодезоксихолевая кислота [УДХК], полиненасыщенные жирные кислоты [ПНЖК] и комбинированная группа). Переменные оценивали у 15 мышей в каждой группе на этапе до лечения и у 25 мышей в каждой группе на этапе после лечения.Не наблюдалось значительных различий между группами по массе тела ( A ) или массе печени ( B ), а также не было отмечено никаких системных побочных эффектов. ( C ) Вес желчных камней значительно снизился в группе комбинированной терапии. ( D ) Размер желчных камней, измеренный с использованием 6-балльной системы оценки, значительно уменьшился в группе УДХК и комбинированной группе. * P <0,05 по сравнению с контрольной группой.
Рисунок 2Общий вид печени, желчного пузыря и желчных камней.На фотографиях показаны общие результаты исследования печени, желчного пузыря и желчных камней. ( A ) На стадии предварительной обработки (после кормления литогенной диетой в течение 8 недель) образование желчных камней было подтверждено, и количество и размер желчных камней были измерены у 15 мышей в каждой из четырех групп ( B — E ). Количество и размер желчных камней сравнивали между контрольной группой ( B ) и тремя группами лечения (( C ) группой UDCA; ( D ) группой PUFA; ( E ) группой комбинированной терапии) на этапе после лечения. (после приема лечебного средства при соблюдении обычной диеты в течение 12 недель).Количество и размер желчных камней значительно уменьшились во всех трех группах лечения (УДХК, ПНЖК и комбинированная группа) по сравнению с группой до лечения.
Гистология желчного пузыря и экспрессия гена муцина
Толщина стенки желчного пузыря была значительно уменьшена в группах ПНЖК и комбинированной группе по сравнению с контрольной группой (рис. 3A – F) и была связана с истончением эпителия слизистой оболочки и уменьшением на высоте стенки желчного пузыря. Группы УДХК, ПНЖК и комбинированные группы показали значительно сниженную экспрессию Muc2 , Muc5ac , Muc5b и Muc6 в ткани желчного пузыря по сравнению с контрольной группой (рис.3G – I).
Рисунок 3Гистологические изменения слизистой оболочки, толщина стенки желчного пузыря и уровни экспрессии генов MUC в желчном пузыре. Фотографии демонстрируют микроскопические особенности желчного пузыря. ( A ) Литогенная диета (LD) вызвала гипертрофию слизистой желчного пузыря на стадии до лечения (после кормления литогенной диетой в течение 8 недель). ( B — E ) Утолщение стенки желчного пузыря сравнивали между контрольной группой и тремя группами лечения (( B ) контрольная группа; ( C ) группа UDCA; ( D ) группа PUFA и () E ) комбинированная группа) на этапе после лечения (после введения терапевтического средства с обычной диетой в течение 12 недель).В результате лечения уменьшилась толщина гипертрофированной стенки желчного пузыря. ( F ) Толщина стенки желчного пузыря значительно уменьшилась в группах с ПНЖК и комбинированной терапией. Уровни экспрессии ( G ) Muc2, ( H ) Muc5ac, ( I ) Muc5b и ( J ) Muc6 в желчном пузыре значительно снизились в группах UDCA, PUFA и комбинированных групп. * P <0,05 по сравнению с контрольной группой.
Общие фосфолипиды, холестерин и желчная кислота
По сравнению с контрольной группой, группа ПНЖК показала значительное повышение уровня общего холестерина в желчи (рис.4A), а ПНЖК и комбинированные группы показали значительное повышение уровней желчных кислот и фосфолипидов в желчи (рис. 4B, C). Соответственно, индекс насыщения холестерина (CSI) был значительно ниже в группах с ПНЖК и комбинацией, чем в контрольной группе (рис. 4D). Не было различий в уровне общего холестерина в сыворотке между группами (фиг. 4E), тогда как комбинированная группа показала значительно более высокий уровень фосфолипидов в сыворотке, чем другие группы (фиг. 4F).
Рисунок 4CSI и уровни общего холестерина, фосфолипидов и желчных кислот.( A ) Уровень общего холестерина в желчи значительно увеличился в группе, получавшей ПНЖК. ( B , C ) И ПНЖК, и комбинированные группы имели значительно повышенные уровни желчной кислоты ( B ) и общий уровень фосфолипидов в желчи ( C ). ( D ) В результате CSI значительно снизился в группах PUFA и комбинированных. ( E ) Общие уровни холестерина в сыворотке крови были одинаковыми во всех группах. ( F ) Уровни фосфолипидов в сыворотке значительно увеличились в группе, получавшей комбинацию.* P <0,05 по сравнению с контрольной группой.
Классы фосфолипидов, холестерина и желчной кислоты
Мы идентифицировали 12 холестериловых эфиров, 1 холестерин, 23 церамида, 9 сфингомиелинов, 3 церамид-1-фосфата, 50 фосфатидилхолинов, 17 лизофосфатидилхолинов, 1 лизофосфатидилхолин, 33 лизофосфид желчные кислоты и 157 липидов в желчи с использованием LC / QqQ-MS / MS. Чтобы сравнить уровни липидов в группах, мы создали тепловые карты для данных ЖХ-МС. Уровни большинства классов фосфолипидов были выше в группе ПНЖК, чем в контрольной группе (рис.5А). Кроме того, в группе с УДХК и комбинированной группой были выявлены более высокие уровни лизофосфатидной кислоты и церамид-1-фосфата, чем в контрольной группе. Уровень холестерина был выше в группах ПНЖК и УДХК, чем в контрольной группе (рис. 5В), но был сходным между группами комбинированной и контрольной групп.
Рисунок 5Тепловые карты классов желчных фосфолипидов, холестерина и желчных кислот. Анализ тепловой карты классов ( A ) фосфолипидов (например, фосфатидилхолин, лизофосфатидилхолин, липопротеин ( a ), PS, сфингомиелин, дигидроцерамид-1-фосфат, церамид-1-фосфат), ( B сложного эфира холестерина) и ( C ) различные желчные кислоты.Профили подклассов липидов по четырем типам. Каждый из четырех цветных типов на карте зависит от значения концентрации. Данные на тепловой карте измерены евклидовым расстоянием с использованием алгоритма кластеризации Уорда.
Анализ желчной кислоты показал более высокие уровни DHA и EPA в группе PUFA и более высокий уровень UDCA в группе UDCA, чем в контрольной группе (рис. 5C), что указывает на то, что экзогенное дозирование PUFA или UDCA привело к увеличению уровней этих веществ. По сравнению с контрольной группой, группа PUFA показала более высокие уровни гиодезоксихолевой кислоты (HDCA), мурохолевой кислоты (MuroCA), UDCA, гликурсодезоксихолевой кислоты, глико-гидезоксихолевой кислоты, таурохолата, тауро-ω-мышиной холевой кислоты, холевой кислоты, гиохолевой кислоты, таурохолевой кислоты. -β-мюрихолевая кислота, α-мюрихолевая кислота, β-MuroCA, таурохенодезоксихолевая кислота, тауродезоксихолевая кислота, таурогидезоксихолевая кислота, EPA и DHA.В группе УДХК были выявлены более высокие уровни HDCA, MuroCA, УДХК, гликурсодезоксихолевой кислоты, гликогидезоксихолевой кислоты, таурохенодезоксихолевой кислоты, тауродезоксихолевой кислоты, таурогиодезоксихолевой кислоты, EPA и DHA по сравнению с контрольной группой. Комбинированные группы и группы ПНЖК показали аналогичное увеличение уровней подклассов желчных кислот по сравнению с контрольной группой.
Затем мы оценили уровни липидов в группах PUFA, UDCA и комбинированных. Уровень PS (36: 0) был в 1,5 раза выше в группах PUFA и UDCA, чем в контрольной группе (дополнительная таблица 1), но был ниже в группе комбинации, чем в контрольной группе.Кроме того, уровни UDCA, HDCA и MuroCA были в 1,5 раза выше в группах с PUFA, UDCA и комбинированными группами, чем в контрольной группе.
Уровни экспрессии генов, связанных с выработкой, транспортом и метаболизмом холестерина и желчных кислот
Чтобы понять молекулярные механизмы, с помощью которых комбинированное лечение влияет на образование желчных камней, мы проанализировали экспрессию генов, участвующих в производстве холестерина. Холестерин секретируется канальцевыми транспортерами ABCG5 и ABCG8.Группа PUFA и комбинированная группа имели более низкую экспрессию Abcg5 и Abcg8 , чем в контрольной группе (фиг. 6A). Соответственно, экспрессия Abcb4 , необходимого для эффективной секреции холестерина из печени в желчь, также снижалась в группе, получавшей комбинацию (дополнительный рисунок S2). Кроме того, в группе UDCA и комбинированной группы была более низкая экспрессия гена, кодирующего HMG-CoA редуктазу ( Hmgcr ), фермента, ограничивающего скорость продукции холестерина (рис.6Б). Хотя уровень экспрессии гена рецептора скавенджера класса B типа I ( Sr-b1 ) варьировался между группами, уровень экспрессии гена, кодирующего рецептор липопротеинов низкой плотности ( Ldlr ), был снижен в группах с УДХК и комбинацией. В совокупности эти результаты предполагают, что комбинированное лечение модулирует образование камней в желчном пузыре за счет уменьшения канальцевого оттока и выработки холестерина.
Рисунок 6Производство и транспорт холестерина и желчных кислот, а также уровни экспрессии связанных генов.Уровни экспрессии в печени генов, связанных с ( A ) канальцевым оттоком, ( B ) синтезом холестерина, ( C ) синтезом желчных кислот и транспортеров желчных кислот, ( D ) липогенезом и ( E ) жировой транспортеры кислоты. Уровни экспрессии были нормализованы до уровня β-актина. ( F ) Уровни печеночных триглицеридов. ( G ) Микроскопические особенности печени. * P <0,05 и ** P <0,01 по сравнению с контрольной группой. Данные представляют собой среднее значение ± стандартная ошибка среднего (SEM).
Затем мы проанализировали уровни экспрессии генов, связанных с метаболизмом холестерина, которые также участвуют в синтезе и транспорте желчных кислот в печени. Экспрессия гена, кодирующего холестерин 7a-гидроксилазу ( Cyp7a1 ), фермента, ограничивающего скорость синтеза желчных кислот, была снижена в группе UDCA и комбинированной группе по сравнению с контрольной группой (фиг. 6C). Экспрессия генов 25-гидроксилхолестерин 7a-гидроксилазы ( Cyp7b1 ) и стерол 12a-гидроксилазы ( Cyp8b1 ) не была затронута лечением, но все три группы лечения показали пониженную экспрессию гена стерол-27-гидроксилазы ( Cyp27a1). ).
Гомеостаз желчных кислот регулируется системной передачей сигналов желчной кислоты через переносчики желчных кислот. Комбинированная группа продемонстрировала значительное снижение экспрессии генов, кодирующих насос, экспортирующий соли желчных кислот ( Bsep ), белок множественной лекарственной устойчивости 2 ( Mrp2 ), Mrp3 , Mrp4 и органический анион-транспортный полипептид 1 ( Oatp1 ) (рис. 6C), что свидетельствует о подавлении поглощения и синусоидального экспорта желчных кислот в печени.В соответствии с экспрессией гена Bsep , мы также заметили, что небольшой гетеродимерный партнер гена-мишени FXR хорошо известного ядерного рецептора желчных кислот ( Nr0b2 ) был заметно снижен в группе комбинированной терапии, что позволяет предположить, что комбинированное лечение может снизить FXR- опосредованный транскрипционный сигнальный путь в печени (дополнительный рис. S3).
Уровни экспрессии генов, связанных с липогенезом и стеатозом, и уровни триглицеридов
Учитывая наши наблюдения снижения продукции холестерина после комбинированного лечения, мы исследовали экспрессию генов, связанных с липогенезом в печени.Все три группы лечения показали сниженную экспрессию генов стеароил-КоА-десатуразы 1 ( Scd1 ), синтазы жирных кислот ( Fas ), ацетил-КоА-карбоксилазы ( Acc ), белка 1a, связывающего регуляторный элемент стерола ( Srebp1a). ) и Srebp1c (рис. 6D). Затем мы исследовали экспрессию генов, кодирующих транспортные белки жирных кислот. В комбинированной группе экспрессия генов 1 транспортного белка длинноцепочечных жирных кислот ( Fatp1 ), Fatp3 , Fatp4 и Fatp5 была снижена (рис.6E). Эти результаты предполагают, что комбинированное лечение снижает как липогенез de novo , так и поглощение жирных кислот в печени.
Чтобы проверить эти профили экспрессии генов, мы исследовали уровни триглицеридов в печени. В соответствии с профилями экспрессии генов, группы ПНЖК и комбинированные группы показали более низкие уровни триглицеридов в печени, чем контрольная группа (фиг. 6F). Кроме того, на основании гистологического анализа ткани печени комбинированная группа значительно снизила стеатоз печени по сравнению со всеми другими группами (рис.6G). Следовательно, комбинированное лечение снижает липогенез de novo и поглощение жирных кислот гепатоцитами, тем самым снижая уровень триглицеридов в печени. Помимо липидного метаболизма, мы также заметили, что провоспалительные цитокины в значительной степени подавлялись в группе комбинированной терапии, подразумевая, что комбинированное лечение будет иметь положительное влияние на уменьшение воспаления печени (дополнительный рисунок S4).
Транскриптомный анализ профилей экспрессии генов печени
Чтобы понять, как лечение влияет на профили экспрессии генов печени, мы выполнили транскриптомный анализ ткани печени с помощью RNA-seq.Экспрессия генов 389, 523 и 396 была изменена PUFA, UDCA и комбинированной обработкой соответственно (фиг. 7A). Кроме того, 129 генов были общими мишенями во всех группах лечения (фиг. 7B) и демонстрировали сходные паттерны экспрессии во всех группах (фиг. 7B). Анализ обогащения ГО показал, что несколько метаболических процессов, включая метаболизм липидов и гомеостаз холестерина, модулировались лечением (рис. 7C). Соответственно, все виды лечения вызывали изменения в метаболических путях, таких как передача сигналов PPARγ, передача сигналов инсулина, глюконеогенез и регуляция липолиза (дополнительные рисунки 2–4).Чтобы оценить молекулярные ассоциации высокого уровня между этими 129 генами, мы использовали EnrichNet (т.е. сетевой анализ обогащения набора генов) для характеристики сетей белок-белкового взаимодействия (рис. 7D). Адипонектин ( Adipo ), липопротеиновая липаза ( Lpl ), Fas и белок, связывающий жирные кислоты 4 ( Fabp4 ), были основными генами-концентраторами (рис. 7E), что позволяет предположить, что метаболизм липидов в печени является основной мишенью. лечения.
Рис. 7Анализ транскриптомов и сети белок-белкового взаимодействия.( A ) DEG в группах лечения; 129 DEG были общими для всех видов лечения. ( B ) Тепловая карта журнала 2 -кратных изменений в DEG. ( C ) анализ обогащения с помощью GO 129 общих генов-мишеней; столбцы представляют собой оценки обогащения (-log P-значение ). ( D ) Физические и функциональные взаимодействия между 129 общими генами-мишенями. ( E ) Количество степеней для основных генов концентратора в ( A ).
Камни в желчном пузыре у женщин — Американский колледж гастроэнтерологии
Поскольку у 80% людей с камнями в желчном пузыре симптомы отсутствуют, важно понимать, что тесты на камни в желчном пузыре необходимы только при наличии симптомов.Ваш врач будет знать, какой из следующих тестов подойдет вам лучше всего.
УЗИ брюшной полости: это самый безопасный, простой и доступный тест для диагностики желчных камней. Сонарные волны от зонда проходят через брюшную полость, чтобы визуализировать желчный пузырь и обнаружить наличие камней. Этот тест не является рентгеновским, и его можно безопасно выполнять во время беременности.
OCG (Oral Cholecystogram): это рентгеновский тест. Даются таблетки йода и на следующий день делают рентген.Этот тест нельзя проводить во время беременности.
Компьютерная томография (компьютерная томография): В этом тесте используются рентгеновские лучи, которые небезопасны во время беременности. Этот тест не очень точен для диагностики желчных камней.
Ядерное сканирование (HIDA, DISIDA): Этот тест включает введение в кровь небольшого количества радиоактивного индикатора, который быстро накапливается в печени и желчном пузыре и может быть замечен с помощью специальной камеры. Это очень точный и безопасный тест во время острого приступа, но обычно не рекомендуется во время беременности.
ЭРХПГ (эндоскопическая ретроградная холангиопанкреатограмма): Это очень важный рентгеновский тест, который используется только в особых случаях. Обычно этого не делают во время беременности. Иногда тест ERCP — единственный способ диагностировать камни в желчном пузыре или камни, которые мигрировали в желчный проток. Эта процедура может использоваться для удаления камней из желчного пузыря, которые переместились в желчный проток, и иногда позволяет избежать хирургического вмешательства.
Инфекция желчных протоков называется холангитом.Это очень серьезное заболевание, характеризующееся болью в животе, лихорадкой, пожелтением глаз и кожи (желтуха) и даже инфекцией кровотока.
 При этом камни поддерживают воспалительный процесс
При этом камни поддерживают воспалительный процесс Для заболевания характерно медленное течение без явных симптомов. Боль либо отсутствует полностью, либо является слабовыраженной и ноющей
Для заболевания характерно медленное течение без явных симптомов. Боль либо отсутствует полностью, либо является слабовыраженной и ноющей Самочувствие не улучшается даже при корректной терапии
Самочувствие не улучшается даже при корректной терапии Диагностика позволяет определить форму и размер органа, толщину его стенок, наличие камней и сократительную функцию
Диагностика позволяет определить форму и размер органа, толщину его стенок, наличие камней и сократительную функцию
 Мир J Gastrointest Pharmacol Ther. 2012 Апрель; 3 (2): 7–20.
Мир J Gastrointest Pharmacol Ther. 2012 Апрель; 3 (2): 7–20. , Гржибовски А., Эйнарссон С., Ламмерт Ф., Лихтенштейн П., Маршалл Х.Влияние генетики и окружающей среды на симптоматику желчнокаменной болезни: шведское исследование 43 141 пары близнецов. Гепатология. 2005 Май; 41 (5): 1138–43.
, Гржибовски А., Эйнарссон С., Ламмерт Ф., Лихтенштейн П., Маршалл Х.Влияние генетики и окружающей среды на симптоматику желчнокаменной болезни: шведское исследование 43 141 пары близнецов. Гепатология. 2005 Май; 41 (5): 1138–43. Повышенный индекс массы тела как причинный фактор риска развития симптоматической желчнокаменной болезни: исследование методом менделевской рандомизации. Гепатология. 2013 декабрь; 58 (6): 2133–41.
Повышенный индекс массы тела как причинный фактор риска развития симптоматической желчнокаменной болезни: исследование методом менделевской рандомизации. Гепатология. 2013 декабрь; 58 (6): 2133–41. Проспективное исследование абдоминального ожирения и желчнокаменной болезни у мужчин в США. Am J Clin Nutr. Июль 2004 г.; 80 (1): 38–44.
Проспективное исследование абдоминального ожирения и желчнокаменной болезни у мужчин в США. Am J Clin Nutr. Июль 2004 г.; 80 (1): 38–44. , Комузи А.Г., Аль-Аззави Х., Зонненберг Г.Е., Киссебах А.Х., Питт Х.А.Инсулинорезистентность вызывает нарушение моторики желчного пузыря у человека. J Gastrointest Surg. Июль-август 2006 г.; 10 (7): 940–8.
, Комузи А.Г., Аль-Аззави Х., Зонненберг Г.Е., Киссебах А.Х., Питт Х.А.Инсулинорезистентность вызывает нарушение моторики желчного пузыря у человека. J Gastrointest Surg. Июль-август 2006 г.; 10 (7): 940–8. Г., Экель Р.Х., Гранди С.М., Зиммет П.З., Климан Дж.И., Донато К.А. и др.; Целевая группа Международной федерации диабета по эпидемиологии и профилактике; Национальный институт сердца, легких и крови; Американская Ассоциация Сердца; Всемирная федерация сердца; Международное общество атеросклероза; Международная ассоциация по изучению ожирения. Гармонизация метаболического синдрома: совместное промежуточное заявление Целевой группы Международной федерации диабета по эпидемиологии и профилактике; Национальный институт сердца, легких и крови; Американская Ассоциация Сердца; Всемирная федерация сердца; Международное общество атеросклероза; и Международная ассоциация изучения ожирения.Тираж. Октябрь 2009 г., 120 (16): 1640–5.
Г., Экель Р.Х., Гранди С.М., Зиммет П.З., Климан Дж.И., Донато К.А. и др.; Целевая группа Международной федерации диабета по эпидемиологии и профилактике; Национальный институт сердца, легких и крови; Американская Ассоциация Сердца; Всемирная федерация сердца; Международное общество атеросклероза; Международная ассоциация по изучению ожирения. Гармонизация метаболического синдрома: совместное промежуточное заявление Целевой группы Международной федерации диабета по эпидемиологии и профилактике; Национальный институт сердца, легких и крови; Американская Ассоциация Сердца; Всемирная федерация сердца; Международное общество атеросклероза; и Международная ассоциация изучения ожирения.Тираж. Октябрь 2009 г., 120 (16): 1640–5. Ланцет. Июль 2006 г.; 368 (9531): 230–9.
Ланцет. Июль 2006 г.; 368 (9531): 230–9. Желчный пузырь и моторика желудка у новорожденных с ожирением, до подростков и взрослых. J Gastroenterol Hepatol. 2012 августа; 27 (8): 1298–305.
Желчный пузырь и моторика желудка у новорожденных с ожирением, до подростков и взрослых. J Gastroenterol Hepatol. 2012 августа; 27 (8): 1298–305. Эндотелиальная дисфункция при метаболическом синдроме. Rom J Intern Med. 2009. 47 (2): 133–40.
Эндотелиальная дисфункция при метаболическом синдроме. Rom J Intern Med. 2009. 47 (2): 133–40. Безопасная с медицинской точки зрения скорость потери веса для лечения ожирения: руководство, основанное на риске образования камней в желчном пузыре. Am J Med. 1995 Февраль; 98 (2): 115–7.
Безопасная с медицинской точки зрения скорость потери веса для лечения ожирения: руководство, основанное на риске образования камней в желчном пузыре. Am J Med. 1995 Февраль; 98 (2): 115–7. Ann Intern Med. 1995 июнь; 122 (12): 899–905.
Ann Intern Med. 1995 июнь; 122 (12): 899–905.
.gif) М., Фернандес-Асуэла М., Энсинас-Сотильос А., Андрес П., Лопес-Собалер А. М.. Различия в диете и пищевых привычках между пациентами с желчными камнями и контрольной группой.J Am Coll Nutr. 1997 Февраль; 16 (1): 88–95.
М., Фернандес-Асуэла М., Энсинас-Сотильос А., Андрес П., Лопес-Собалер А. М.. Различия в диете и пищевых привычках между пациентами с желчными камнями и контрольной группой.J Am Coll Nutr. 1997 Февраль; 16 (1): 88–95. Л., Пригге В.Ф., Ансель Х.Дж., Шласнер Л., Кетовер С.Р., Санде Д. и др. Роль опорожнения желчного пузыря в образовании желчных камней во время быстрой потери веса, вызванной диетой. Гепатология.1996 Сентябрь; 24 (3): 544–8.
Л., Пригге В.Ф., Ансель Х.Дж., Шласнер Л., Кетовер С.Р., Санде Д. и др. Роль опорожнения желчного пузыря в образовании желчных камней во время быстрой потери веса, вызванной диетой. Гепатология.1996 Сентябрь; 24 (3): 544–8. Obes Surg. 2012 Февраль; 22 (2): 220–9.
Obes Surg. 2012 Февраль; 22 (2): 220–9. Дж., Ширмер Б.Безопасность и эффективность одновременной холецистэктомии при обходном желудочном анастомозе по Ру. Surg Obes Relat Dis. 2009, январь-февраль; 5 (1): 48–53.
Дж., Ширмер Б.Безопасность и эффективность одновременной холецистэктомии при обходном желудочном анастомозе по Ру. Surg Obes Relat Dis. 2009, январь-февраль; 5 (1): 48–53. 2021 Март; 35 (3): 1348–54.
2021 Март; 35 (3): 1348–54.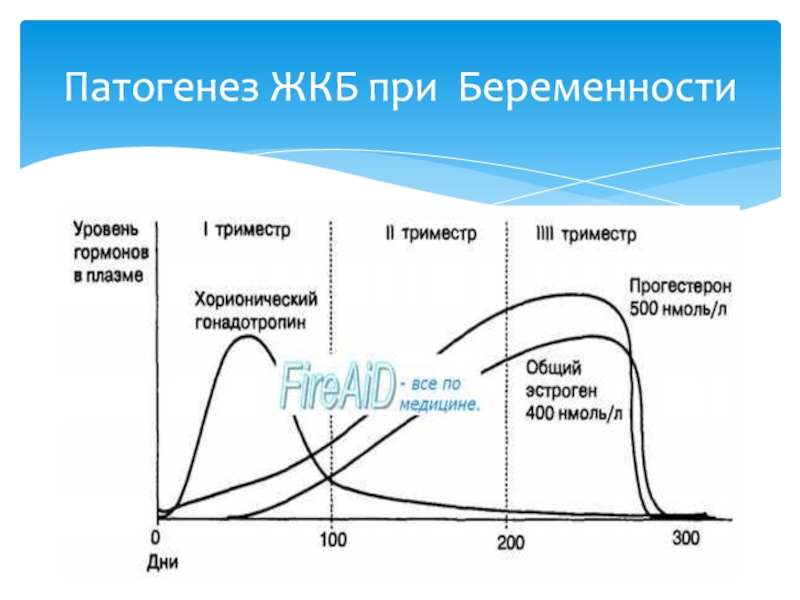 , Акаловски М., Эрколани Дж., Ван Эрпекум К., Гурусами К.С., ван Лаарховен С.Дж. и др. EASL Clinical Practice Guidelines по профилактике, диагностике и лечению камней в желчном пузыре. J Hepatol. Июль 2016; 65 (1): 146–81.
, Акаловски М., Эрколани Дж., Ван Эрпекум К., Гурусами К.С., ван Лаарховен С.Дж. и др. EASL Clinical Practice Guidelines по профилактике, диагностике и лечению камней в желчном пузыре. J Hepatol. Июль 2016; 65 (1): 146–81. Obes Surg. 2019 Апрель; 29 (4): 1216–21.
Obes Surg. 2019 Апрель; 29 (4): 1216–21. , Колеккиа А., Орсини М., Сангермано А., Соттили С., Симони П. и др.Подвижность желчного пузыря и образование желчных камней у пациентов с ожирением, соблюдающих очень низкокалорийную диету. Используйте его (жир), чтобы его потерять (хорошо). Int J Obes Relat Metab Disord. 1998 июн; 22 (6): 592–600.
, Колеккиа А., Орсини М., Сангермано А., Соттили С., Симони П. и др.Подвижность желчного пузыря и образование желчных камней у пациентов с ожирением, соблюдающих очень низкокалорийную диету. Используйте его (жир), чтобы его потерять (хорошо). Int J Obes Relat Metab Disord. 1998 июн; 22 (6): 592–600. С., Шульце МБ, Ху ФБ. Потребление сахаросодержащих напитков и увеличение веса: систематический обзор. Am J Clin Nutr. 2006 август; 84 (2): 274–88.
С., Шульце МБ, Ху ФБ. Потребление сахаросодержащих напитков и увеличение веса: систематический обзор. Am J Clin Nutr. 2006 август; 84 (2): 274–88. Энергетическая ценность питания позволяет прогнозировать изменение веса женщины в течение 6 лет. Am J Clin Nutr. 2008 сентябрь; 88 (3): 677–84.
Энергетическая ценность питания позволяет прогнозировать изменение веса женщины в течение 6 лет. Am J Clin Nutr. 2008 сентябрь; 88 (3): 677–84. BMJ. 2012 декабрь; 345: e7666.
BMJ. 2012 декабрь; 345: e7666. Углеводы в рационе, гликемическая нагрузка и частота симптоматической желчнокаменной болезни у мужчин.Кишечник. 2005 июн; 54 (6): 823–8.
Углеводы в рационе, гликемическая нагрузка и частота симптоматической желчнокаменной болезни у мужчин.Кишечник. 2005 июн; 54 (6): 823–8. Потребление фруктов и овощей и риск холецистэктомии: проспективное когортное исследование женщин и мужчин. Eur J Nutr. 2018 Февраль; 57 (1): 75–81.
Потребление фруктов и овощей и риск холецистэктомии: проспективное когортное исследование женщин и мужчин. Eur J Nutr. 2018 Февраль; 57 (1): 75–81. Диета и риск холецистэктомии: проспективное исследование, основанное на французской когорте E3N.Am J Gastroenterol. 2017 сентябрь; 112 (9): 1448–56.
Диета и риск холецистэктомии: проспективное исследование, основанное на французской когорте E3N.Am J Gastroenterol. 2017 сентябрь; 112 (9): 1448–56. , Гонсалес В., Агуайо П., Санчес Дж. М., Танимото М. А., Элизондо Дж. И др. Полиненасыщенные жирные кислоты рыбьего жира (n-3) благотворно влияют на время зародышеобразования холестерина в желчных путях у женщин с ожирением, худеющих.J Nutr. 2001 сентябрь; 131 (9): 2300–3.
, Гонсалес В., Агуайо П., Санчес Дж. М., Танимото М. А., Элизондо Дж. И др. Полиненасыщенные жирные кислоты рыбьего жира (n-3) благотворно влияют на время зародышеобразования холестерина в желчных путях у женщин с ожирением, худеющих.J Nutr. 2001 сентябрь; 131 (9): 2300–3. , Маркиоли Р., Марфизи Р.М., Фести Д. Диета и камни в желчном пузыре в Италии: результаты поперечного сечения MICOL. Гепатология. 1998 июн; 27 (6): 1492–8.
, Маркиоли Р., Марфизи Р.М., Фести Д. Диета и камни в желчном пузыре в Италии: результаты поперечного сечения MICOL. Гепатология. 1998 июн; 27 (6): 1492–8. Л., Брач Дж. С., Фицджеральд С. Дж., Змуда Дж. М., Каули Дж. А., Криска А. М.. Физическая активность и снижение риска клинической желчнокаменной болезни у женщин в постменопаузе. Предыдущая Мед. 2005 сентябрь-октябрь; 41 (3-4): 772-7.
Л., Брач Дж. С., Фицджеральд С. Дж., Змуда Дж. М., Каули Дж. А., Криска А. М.. Физическая активность и снижение риска клинической желчнокаменной болезни у женщин в постменопаузе. Предыдущая Мед. 2005 сентябрь-октябрь; 41 (3-4): 772-7. Am J Perinatol. 2014 Янв; 31 (1): 39–48.
Am J Perinatol. 2014 Янв; 31 (1): 39–48. Профилактика образования камней в желчном пузыре у пациентов с болезненным ожирением, подвергающихся быстрой потере веса: результаты рандомизированного контролируемого пилотного исследования.J Surg Res. 2002, январь, 102 (1): 50–6.
Профилактика образования камней в желчном пузыре у пациентов с болезненным ожирением, подвергающихся быстрой потере веса: результаты рандомизированного контролируемого пилотного исследования.J Surg Res. 2002, январь, 102 (1): 50–6. 2004 Февраль; 14 (2): 206–11.
2004 Февраль; 14 (2): 206–11.