👆 Никотиновая кислота для тренировок
У витамина РР много полезных свойства. Часть из них актуальна для людей, занимающихся спортом, профессионально и любительски. Никотинка снижает холестерин, расширяет мелкие сосуды – капилляры, сосуды головного мозга. Разжижает кровь, препятствует тромбам, отекам. Оказывает положительное влияние на память, координацию движений, которая так важна для спортсменов.
Никотиновая кислота для спорта
Если в организм вводить никотинку в больших дозах, окислительно-восстановительные реакции улучшаются. Повышается уровень кислотности желудочного сока, следовательно, еда усваивается лучше. А питание для спортсменов крайне важно, все витамины, белки, углеводы должны без остатка попадать в кровь, разноситься по телу. Улучшается скорость перистальтики в желудочно-кишечном тракте. Таким образом, витамин РР улучшает питание организма всеми силами – кровь двигается быстрее, кислорода больше, белки и витамины попадают в кровь быстрее, скорость обмена вещества улучшается.
Видео
Никотиновая кислота для мышц
Читайте также
Никотинка, она же витамин РР, повышает уровень производительности мышц, расширяет микрососуды, улучшает питание. В бодибилдинге никотиновая кислота полезна еще и тем, что улучшает пампинг и венозную прорисованность. Пампинг – чисто субъективное ощущение распирания мышц, раскачки, увеличения их объема, это происходит за счет улучшенного притока крови, усиления наполнения мышц кровью.
Никотинка с ее свойством улучшать кровоснабжение тканей является отличным натуральным средством для косметического пампинга перед фотосессией. Венозная прорисованность – термин из бодибилдинга, означает наличие некоторой степени прорисовки вен. Вены начинают проявляться при низких процентах содержания жировой массы в организме.
Никотиновая кислота для бодибилдинга – хорошее средство повысить работу мышц, ударная доза никотинки перед соревнованиями эффективно улучшит пампинг, венозную прорисованность. Но с препаратом следует быть аккуратнее тем, у кого есть проблемы с сердцем.
Более 50-100 мг витамина РР принимать не рекомендуется. В более огромных дозах он снижает скорость горения жиров в организме.
Никотиновая кислота для спорта – незаменимая добавка. У спортсменов зачастую повышается давление, причиной — большая концентрация липопротеинов в крови. Витамин РР расщепляет эти вещества, которые вдобавок могут вызывать тромбоз.Как использовать Никотиновую кислоту в бодибилдинге
Никотиновая кислота – витамин, который относиться к группе В.
В общем количестве, ниацин участвует в 60 обменных реакциях в организме, которые влияют на производство энергии. По этой причине нельзя пренебрегать приемом данного витамина. В принципе, дополнительный прием никотиновой кислоты неспортивному и здоровому человеку не нужен, так как она самостоятельно синтезируется в организме с аминокислоты триптофан. Данная аминокислота попадает в человеческий организм только при достаточном белковом питании и производит половину суточной нормы никотинамида. Остальная половина употребляется вместе с суточным рационом.
Подробная информация о Никотиновой кислоте находится здесь.
Польза никотиновой кислоты в бодибилдинге
Для начала следует назвать самые основные полезные эффекты вещества: снижение уровня вредного холестерина, расширение периферических сосудов и сосудов в головном мозге, разжижение крови, препятствие образования тромбов и отеков. Полезна никотиновая кислота для спортсменов тем, что в первую очередь улучшаются реакции окисления и восстановления организма. Увеличивается при употреблении никотинамида выделение желудочного сока, кислотность резко повышается, что способствует лучшему усвоению пищи и как следствие – перистальтики кишечника.
Для спортсмена это важный пункт, так как качество усвоения пищи напрямую влияет на будущие объемы мышц. Никотинамид в общем оказывает благотворное влияние на организм, так как кровь начинает быстрее циркулировать по телу, кислорода больше попадает, а также раскручивается метаболизм. Чем лучше усвоение ниутриентов и чем быстрее скорость метаболизма – тем лучше мышцы будут реагировать на силовую нагрузку! Без этих двух факторов, которые обеспечивает никотиновая кислота, прогресса в спортзале не будет! Так что рекомендуется ее периодически пропивать для ускорения достижения прогресса. Параллельно с приемом витамина нужно хорошо питаться, ведь без достаточного количества еды мышцы тоже не вырастут.
Чем лучше усвоение ниутриентов и чем быстрее скорость метаболизма – тем лучше мышцы будут реагировать на силовую нагрузку! Без этих двух факторов, которые обеспечивает никотиновая кислота, прогресса в спортзале не будет! Так что рекомендуется ее периодически пропивать для ускорения достижения прогресса. Параллельно с приемом витамина нужно хорошо питаться, ведь без достаточного количества еды мышцы тоже не вырастут.
Еще один немаловажный эффект для бодибилдинга – периферическая вазодилатация. Никотиновая кислота относится к группе вазодилататов – веществ, способствующих расширению сосудов. Благодаря этому эффекту, в мышцы поступает больше крови, они накачиваются ею, получают больше полезных веществ и соответственно, лучше начинают расти. Бодибилдеры любят использовать связки вазодилататоров для лучшего эффекта. Классическая связка – пентоксифиллин + оксид азота и папаверин. Неклассические связки включают в себя использование различных веществ, начиная с никотиновой кислоты, заканчивая нитроглицерином и адреналином.
Полезной окажется никотиновая кислота и для выступающих спортсменов. Перед выходом на сцену опытные бодибилдеры едят никотинамид в ударных дозах (не менее 150 мг) и закачивают мышцу гантелями, чтобы они стали визуально больше, а прорисовка вен улучшилась. Такие способы повышения качества мышц не являются запрещенными в соревновательном культуризме. Существует также один негативный момент для бодибилдеров при приеме ниацина: его не используют в период сушки тела от подкожного жира, так как он замедляет скорость расщепления жировых запасов. Прием никотинамида практикуется только в межсезонье и массонаборные периоды.
Побочные явления
Помимо всех своих положительных эффектов ниацин имеет некоторые негативные особенности: на большие дозы, свыше 50 мг принятого перорально и от 10 мг внутримышечно или внутривенного введения организм может реагировать гиперемией и гипертермией кожных покровов в области рук, ног, коленей, головы, шеи и грудной клетки. Связанно данное явление с выделением гистамина. Чтобы приглушить эту реакцию, необходимо принять антигистаминный препарат быстрого действия. Как правило, нет нужды их принимать, так как гипертермия с момента ее развития, сама проходит полностью за полчаса, максимум час времени.
Чтобы приглушить эту реакцию, необходимо принять антигистаминный препарат быстрого действия. Как правило, нет нужды их принимать, так как гипертермия с момента ее развития, сама проходит полностью за полчаса, максимум час времени.
Перед применением ниацина рекомендуется проконсультироваться со специалистом, так как гипотоникам или при пониженной вязкости крови он может быть противопоказан.
Ешь и люби витамины. Как развивать правильные пищевые привычки
В кулинарном училище учат правильно варить заправочные супы. Важно, когда суп закипает, сразу убавлять огонь: чтобы продукты не долго варились, а с учетом сезонного фактора, размера и формы нарезки овощей.
На эту тему
Все это нужно, чтобы максимально сохранить витамин С. Так мне говорил мой преподаватель по кулинарии. О правильном питании и пользе витаминов мы и поговорим сегодня.
Для начала давайте вспомним, сколько всего витаминов существует. В настоящее время известны 13.
Интересно, что жирорастворимые витамины могут накапливаться в тканях организма, а водорастворимые витамины такой способностью практически не обладают (за исключением витамина В12). Поэтому в водорастворимых витаминах, чтобы избежать риска дефицита, мы нуждаемся чаще.
Думать, что полноценного питания достаточно, чтобы поддерживать витаминный баланс в организме, конечно, не совсем верно. Но руководствуясь принципами здорового образа жизни при выборе продуктов и приготовлении блюд, все же можно уберечь и оградить себя от большого количества проблем.
Например, в крупах твердых сортов содержится большое количество пиридоксина — витамина В6, который нам нужен для обмена белков, аминокислот и жиров, образования никотиновой кислоты (витамина РР).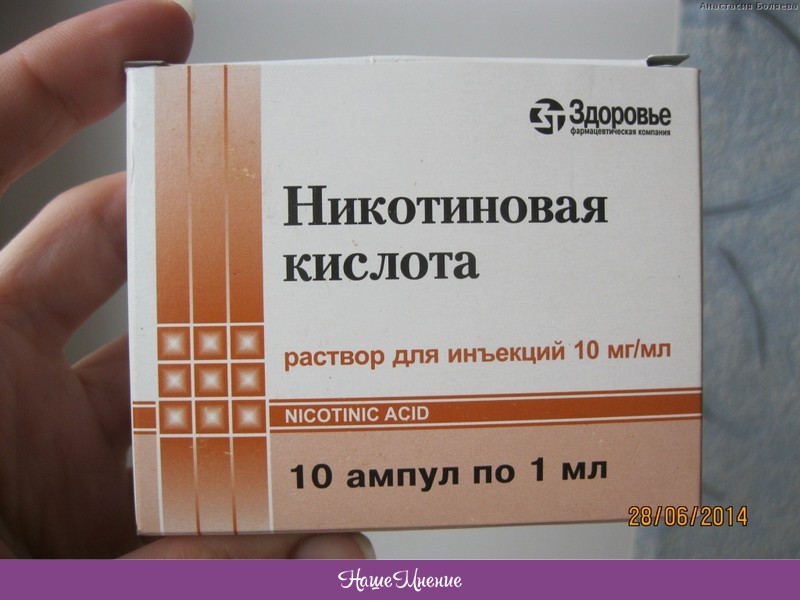
Цианокобаламин (витамин В12) тоже регулирует процессы кроветворения и очень нужен для центральной нервной системы.
На эту тему
Основным источником цианокобаламина являются продукты животного происхождения. Его много в говяжьей печени, сырах, твороге, сметане, сливках, кефире. Как включить В12 в ежедневную еду? Можно, например, заменить куриную котлету в чизбургере на печеночные оладьи.
Фолиевая кислота (фолацин) участвует в кроветворении, стимулирует синтез белков, процессы роста и развития. Чтобы поддерживать минимальный уровень фолацина в организме, можно устраивать себе завтраки с творогом, сметаной и медом.
Никотиновая кислота, или витамин РР, участвует в клеточном дыхании, активирует углеводный обмен, нормализует уровень холестерина в крови, водно-солевой обмен. Его очень много в орехах и крупах.
Биотин (витамин Н), который принимает участие в обмене углеводов, аминокислот, полиненасыщенных жирных кислот, содержится в мясе, яичных желтках и злаковых. По сути, достаточно съедать несколько яиц в неделю, чтобы не испытывать недостатка этого витамина.
По сути, достаточно съедать несколько яиц в неделю, чтобы не испытывать недостатка этого витамина.
Тиамин и кедровые орешки
Витамин В1 (тиамин) нужен нам, чтобы регулировать белковый, жировой, углеводный и минеральный обмены, деятельность органов кровообращения и пищеварения, функцию нервной системы.
© Дмитрий Феоктистов/ТАССВот вам самый простой и доступный рецепт, насыщенный тиамином, — спагетти с соусом песто и кедровыми орехами.
Что нужно:
- Спагетти (обязательно твердых сортов) — 300 г
- Соль гималайская или морская — 4 щепотки
- Соус песто — 8 ст. л.
- Орехи кедровые очищенные — 1 горсть
- Помидоры черри желтые — 2 горсти
Что делать:
- Спагетти взять двумя руками за верхнюю и нижнюю части, слегка скрутить и отправить в центр глубокой кастрюли с кипящей подсоленной водой на 10−12 минут. Паста должна распределиться веером в кастрюле.

- Через 5 минут слегка перемешать пасту.
- В отдельной сковороде прогреть кедровые орехи, пока не появится приятный аромат, добавить разрезанные пополам помидоры черри, обжарить на быстром огне вместе с орешками.
- Пасту слить на дуршлаг, отправить обратно в кастрюлю, добавить соус песто и хорошо перемешать.
- Выложить пасту на тарелки, сверху посыпать орехами с помидорами и сразу подавать к столу.
Ирга, авокадо и витамин роста (B2)
Витамин В2 принимает участие во всех обменных процессах белков, жиров и углеводов. Улучшает зрение, нужен пищеварительной системе, регулирует деятельность центральной нервной системы.
© REUTERS/Daniel BecerrilЭтого витамина много в авокадо, молочной продукции, в кедровых орехах, в невероятно полезной ягоде ирге, которая при хорошем маркетинге способна на российских прилавках заслонить годжи и многие суперфуды. Им также богаты брокколи, шпинат, спаржа, мясная и рыбная печень.
Всем, кому кажется, что готовить из правильных продуктов, а тем более есть — скучно, предлагаю попробовать мороженое из авокадо с кедровыми орехами и протертой иргой.
Что нужно:
- Авокадо очень спелое — 3−4 шт.
- Лайм — 1−2 шт.
- Сгущенное молоко — 6 ст. л.
- Сливки взбитые — 200 мл
- Орехи кедровые — 1 горсть
Для соуса:
- Ирга замороженная — 2 горсти
- Сахарный песок (нерафинированный) — 1 горсть
Что делать:
- У ½ лайма ножом срезать цедру (только зеленую часть), нарезать именно при помощи ножа мелкими кубиками (крошкой), из лайма выдавить весь сок.
- Авокадо очистить от кожи, удалить косточку и отправить в погружной блендер, добавить сок лайма, взбить до максимально однородного состояния, добавить сгущенное молоко, кедровые орехи и продолжать взбивать 1−2 минуты.
- Переложить в объемную стеклянную или керамическую форму, добавить взбитые сливки, цедру лайма и аккуратно перемешать силиконовой лопаткой.
- Равномерно распределить по всей поверхности формы, отправить в морозильный шкаф на 30−40 минут.

- Далее аккуратно перемешать и вновь отправить в морозилку. И так 5−7 раз, постоянно помешивая, чтобы получилась максимально однородная масса, без кристалликов льда.
- Накатать ложкой для мороженого несколько шариков, выложить в креманку. Иргу разморозить, перетереть с сахаром, полить мороженое и сразу подавать.
Непростая аскорбинка
Витамина С очень много в свежих фруктах, овощах и зелени. Особенно много — в шиповнике, облепихе, черной смородине и красном перце. Но практически нет в продуктах животного происхождения.
© Александр Алпаткин/ТАССВообще, содержание всех витаминов, и особенно витамина С, в растениях зависит от сорта, района выращивания, характеристики почвы, освещения и многих других факторов.
Кроме того, содержание этого витамина снижается при хранении в связи с наличием в овощах и фруктах фермента аскорбиназы, разрушающего аскорбиновую кислоту. Именно поэтому следует отдавать предпочтение фермерской продукции.
Аскорбиновая кислота (витамин С) нормализует обмен белков, жиров, углеводов, предупреждает кровоточивость, регулирует обмен холестерина, способствует сохранению целостности опорных тканей (хрящей и костей). Она повышает сопротивляемость организма неблагоприятным внешним воздействиям и инфекциям.
Она повышает сопротивляемость организма неблагоприятным внешним воздействиям и инфекциям.
Около 25 мг аскорбиновой кислоты теряется при выкуривании одной сигареты, то есть курильщики особенно нуждаются в этом витамине.
На эту тему
Недостаточность витамина С развивается, как правило, на фоне малого поступления с пищей, однако его дефицит может возникнуть и при нарушениях всасывания, обусловленных заболеванием желудка, кишечника, печени и поджелудочной железы. Также дефицит в пище белков, витамина А и витаминов группы В ускоряет развитие С-гиповитаминоза. Имеет значение и сезонный фактор: в зимне-весенний период меньше овощей и фруктов, а содержание в них витамина С снижено.
Неправильная кулинарная обработка фруктов и особенно овощей (длительная термическая обработка, чрезмерно долгая варка, варка в открытой посуде или в присутствии солей железа и меди, которые могут выделяться из посуды, долгое хранение в воде) ускоряет окисление аскорбиновой кислоты.
«Противопоказаны» вода, обработка пищевых продуктов, тепло, свет, курение. Основной враг витамина С — кислород, так как он необратимо окисляет аскорбиновую кислоту до неактивных веществ.
Основной враг витамина С — кислород, так как он необратимо окисляет аскорбиновую кислоту до неактивных веществ.
Предлагаю всем, кому сейчас нужен витамин С, приготовить напиток из шиповника с медом и листьями малины.
Что нужно:
- Шиповник сухой — 2 горсти
- Вода фильтрованная — 2 л
- Имбирь корень — 1 см
- Листья малины — 1 горсть
- Мед — 2 ст. л.
Что делать:
- Ягоды шиповника слегка раздавить, залить горячей водой.
- Добавить несколько лепестков имбиря, листья малины и убрать в теплое место на 2 часа.
- Перед подачей добавить мед и тщательно размешать.
Витамин А
Ретинол (витамин А) частично поступает в организм в готовом виде. Он содержится в продуктах животного происхождения: говяжьей печени, сливочном масле, куриных яйцах, сметане.
Многие растительные продукты содержат каротин, из которого синтезируется ретинол: морковь, помидоры, сладкий перец, зеленый лук, шпинат, петрушка, плоды шиповника и облепихи, абрикосы, салат, тыква.
Приготовьте насыщенный витамином А овощной омлет со сметаной и куркумой.
Что нужно:
- Тыква очищенная — 200 г
- Помидоры средние — 200 г
- Шпинат свежий — 5 горстей
- Лук зеленый — небольшой пучок
- Масло оливковое — 100 мл
- Соль гималайская или морская — 4−5 щепоток
- Яйца куриные — 6−8 шт.
Для соуса: Сметана
Что делать:
- Все овощи подготовить: тыкву нарезать мелкими кубиками, помидоры средними, лук зеленый измельчить, шпинат нарвать руками.
- Взбить с солью и оливковым маслом яйца.
- Добавить в них нарезанные овощи и залить в форму для запекания.
- Отправить в духовку, заранее разогретую до 180 градусов, на 15−20 минут.
- Сметану смешать с куркумой, посолить, подавать к овощному омлету.
Витамин D
Кальциферолы (витамин D). Этот витамин необходим для усвоения кальция, который укрепляет кости. Встречается только в животных организмах, и то в очень малых количествах.
Встречается только в животных организмах, и то в очень малых количествах.
Соответственно, богатые им продукты стоит искать среди пищи животного происхождения. В большей степени им насыщены печень трески, сельдь и внутренности рыб и морских млекопитающих. Также хорошим источником следует считать молочные продукты, рыбий жир, яйца (желток).
Витамин Е
Токоферолы (витамин Е) влияют на укрепление клеток и сосудов. Основные источники — нерафинированные растительные масла.
© Антон Новодережкин/ТАССТокоферолы содержатся в яйцах, хлебе из муки грубого помола, крупах, бобовых, молоке, рыбе, овощах и фруктах.
Добавляйте в свой рацион 1−2 чайные ложки нерафинированного масла: оливкового, льняного, тыквенного, кунжутного, рыжикового, горчичного.
Витамин К
Филлохиноны (витамин К) ускоряют свертываемость крови, восстанавливают поврежденные ткани, способствуют заживлению ран.
© AP Photo/J. Scott ApplewhiteОни содержатся в большом количестве в таких продуктах, как белокочанная и цветная капуста, томаты, тыква, шпинат, печень, мясо, яйца.
У меня, кстати, есть рецепт цветной капусты, жаренной со шпинатом и чесноком.
Что нужно:
- Цветная капуста — ½ вилка
- Соль гималайская или каменная — 4 щепотки
- Чеснок — 3−4 зубчика
- Кунжутные семечки — 4 щепотки
- Шпинат свежий — 3 большие горсти
Что делать:
- Цветную капусту разобрать на соцветия, отварить в подсоленной воде, выложить на сито.
- На отдельной сковороде на растительном масле обжарить лепестки чеснока, добавить соцветия капусты и обжаривать, постоянно помешивая, до золотистого цвета.
- За 1−2 минуты добавить шпинат и обжаривать, постоянно помешивая, пока шпинат не осядет.
- Посыпать кунжутными семечками.
Враги витаминов
- Алкоголь — разрушает витамины А, группы В.
- Никотин — губителен для витаминов А, С, Е.
- Кофеин — убивает витамины В, РР.
- Аспирин — уменьшает содержание витаминов группы В, С, А.

- Антибиотики — разрушают витамины группы В.
- Снотворные средства — затрудняют усвоение витаминов А, D, Е, В12.
Витамин С (аскорбиновая кислота) выполняет в организме множество важных функций: участвует в окислительно-восстановительных процессах в тканях, повышает эластичность и прочность кровеносных сосудов, защищает организм от инфекций, блокирует токсичные вещества в крови, влияет на процессы заживления тканей организма, поврежденных в результате травм или болезней. Витамин С необходим также для укрепления зубов и десен. Даже при нормальном состоянии здоровья в различные дни содержание витамина С значительно варьируется. Присутствие
бактерий в организме, инфекционные заболевания, воспалительные и многие другие процессы снижают количество витамина С. Следует
учитывать, что организм не накапливает витамин С, поэтому его надо принимать регулярно. Витамином С богаты: шиповник сухой и свежий, перец сладкий красный и зеленый, петрушка, укроп, капуста цветная и белокочанная, щавель, шпинат, брюква, лук зеленый, горошек зеленый, помидоры, редис, картофель молодой, салат, капуста квашеная, кабачки, печень, апельсины, клубника, лимоны, смородина, рябина, дыня, мандарины, крыжовник, морошка, кизил, малина, вишня, айва, брусника, черешня, клюква. | Витамин А (ретинол) оказывает многостороннее действие на организм человека. Недостаточность витамина А ведет к нарушениям во многих
органах и системах, в основе которых лежит поражение кожи и слизистых оболочек — сухость, ороговение, предрасположенность
к гнойничковым процессам, фурункулезу, склонность к насморку, воспалительным процессам в гортани и трахее,
бронхитам, пневмонии, расстройства пищеварения, нарушение желудочной секреции, склонность к гастритам, колитам, к воспалению
почек, мочевого пузыря. Снижается устойчивость к инфекциям. Витамином А богаты: печень говяжья, свиная и тресковая, масло сливочное, яйца, икра кетовая, сметана и сливки 20%-й жирности, сыр, творог жирный, почки, палтус, шпроты (консервы), икра осетровых рыб. | Витамин В1 (тиамин) имеет важноe значение для процессов энергетического обмена и нервной регуляции Витамином В1 богаты: горох, фасоль, крупы овсяная, гречневая, ячневая, кукурузная, перловая, манная, пшено, горошек зеленый, хлеб из муки 2-го сорта, свинина мясная, печень говяжья и свиная, сардельки свиные, телятина, мясо кролика, ставрида, карп, хек, макароны, картофель, капуста цветная. Витамин В2 (рибофлавин) — обеспечивает
регенерацию (обновления) тканевых структур организма. Витамином В2 богаты: яйца, сыр, творог, кефир, говядина, свинина, мясо кролика, печень говяжья, мясо кур, колбасы вареные, крупы гречневая, горошек зеленый, шпинат, капуста цветная, лук зеленый, перец сладкий, укроп, молоко, сметана, крупа овсяная, хлеб из муки 2-го сорта, сельдь, треска, скумбрия хек, камбала. Витамин В6 (пиридоксин) очень важен для белкового и жирового обмена. Пиридоксин необходим также мышцам, так как вместе с кальцием способствует их нормальному функционированию и эффективному расслаблению. Витамином В6 богаты: печень, скумбрия,
фасоль, сухие пивные дрожжи, говядина, мясо кур, почки, телятина, свинина, баранина, яйца, икра, сельдь, палтус, кета, молоко,
сыр, хлеб из муки 2-го сорта, рис цельный, крупы гречневая, ячневая, перловая, пшено, кукуруза, соя, горох, картофель, лук
сухой, морковь, шпинат, салат, свекла, персики, груша, виноград. Витамин В12 (цианкобаламин) участвует в кроветворении, регулируют углеродный и жировой обмен в организме. Эти два витамина группы В обеспечивают высокую скорость развития, созревания и функциональную активность эритроцитарных клеток костного мозга. Поэтому гипо- и авитаминозы В12 и фолиевой кислоты характеризуются нарушением кроветворения (анемии), поражением нервной системы и пищеварительных органов. Витамином В12 богаты: печень говяжья, почки, сердце, говядина, сельдь, яйца. | Никотиновая кислота (витамин РР)
обеспечивает энергетический обмен в организме. При недостаточности никотиновой кислоты развивается пеллагра —
тяжелое заболевание, связанное с поражением центральной нервной системы, желудочно-кишечного тракта и кожи. Со стороны
центральной нервной системы отмечаются раздражительность, нарушение чувствительности кожных покровов, снижение двигательной
активности (адинамия), потеря устойчивости при ходьбе (атаксия), психозы и психическая депрессия. Никотиновой кислотой богаты: говяжья печень, почки, язык, мясо кур и кроликов, телятина, говядина, баранина, крупа рис, пшено, крупы гречневая, овсяная, кукурузная, манная, рис, пшено, макароны, кофе, сельдь, ставрида, хек, судак, морковь, хлеб пшеничный из муки высшего сорта. |
Как быстро и недорого победить весенний авитаминоз
Сайт cherinfo запускает проект «0−5−30» — серию программ о комплексном подходе к здоровому образу жизни. Формула здоровья проста: ноль вредных привычек, пять порций овощей и фруктов и 30 минут физкультуры в день. Еще одна составляющая формулы — низкое потребление соли, не больше пяти граммов в сутки.
Соблюдение этих простых правил, по утверждению экспертов Минздрава, сделает человека здоровее и вполовину снизит риск смерти от болезней.
В программах мы расскажем, стоит ли, например, есть мясо, что для здоровья полезнее — фитнес, спорт или танцы, узнаем, что о модных здоровых практиках думают врачи и диетологи.
В первом выпуске «0−5−30» поговорим об укреплении ослабевшего за зиму иммунитета. Ежегодная причина весеннего авитаминоза — недостаток витаминов в пище. Чтобы поддержать организм, достаточно скорректировать свой рацион.
«Весна — это всегда снижение витаминов, при чем более всего витаминов группы B, резко уменьшается аскорбиновая кислота, витамины PP, никотиновая кислота. Поэтому очень важно, особенно весной, использовать как можно более разнообразные продукты питания, включая разноцветные овощи, фрукты, обязательно зелень в свежем или замороженном виде, — рекомендует диетолог Татьяна Бебякина. — Не стоит пренебрегать продуктами, которые являются источниками очень редких микроэлементов. Они есть в куркуме, кориандре, корице, горчице, любом перце, хрене. Все эти продукты пополняют организм очень нужными веществами. Витамины содержатся не только в овощах и фруктах, но и в продуктах животного происхождения: мясо обязательно, раз-два в неделю можно использовать рыбные блюда, молочные продукты обязательно. В последнее время вновь стали популярны разные семечки: кунжутовые, льняные, подсолнечные, тыквенные. Они очень богаты микроэлементами: цинком, магнием».
Они есть в куркуме, кориандре, корице, горчице, любом перце, хрене. Все эти продукты пополняют организм очень нужными веществами. Витамины содержатся не только в овощах и фруктах, но и в продуктах животного происхождения: мясо обязательно, раз-два в неделю можно использовать рыбные блюда, молочные продукты обязательно. В последнее время вновь стали популярны разные семечки: кунжутовые, льняные, подсолнечные, тыквенные. Они очень богаты микроэлементами: цинком, магнием».
Актуальные весенние блюда зрителей научит готовить шеф-повар Олег Бородулин, а фитнес-инструктор Алёна Адигезалова покажет небольшой комплекс упражнений, которые помогут быстрее проснуться и зарядиться энергией на весь день.
«0−5−30» — городской проект по пропаганде здорового образа жизни. В Череповце программа стартовала в 2016 году, ее концепция разработана по рекомендациям ВОЗ. Программа «0−5−30» выходит при поддержке правительства Вологодской области и регионального департамента здравоохранения.
Марина Жабо
Орнитин (L-ornithine) — описание, инструкция, свойства вещества
Общее описание
Общеизвестно, что в ряду жизненно важных для человека химических соединений аминокислоты занимают одно из центральных мест. Эти органические кислоты, содержащие аминогруппу – атом азота и 2 атома водорода, – уникальный строительный материал для нескольких миллионов белков. Они задействованы в огромном количестве обменных процессов, и нехватка хотя бы одной из них нарушает слаженную работу всего организма. Их деление на заменимые и незаменимые подразумевает, что первые образуются в организме человека, а вторые могут поступать в него только извне. Понятие «заменимые» может вызвать иллюзию, что потребление этой разновидности веществ необязательно. Однако это не так: дефицит заменимых аминокислот также возможен и опасен развитием патологических состояний.
Эти органические кислоты, содержащие аминогруппу – атом азота и 2 атома водорода, – уникальный строительный материал для нескольких миллионов белков. Они задействованы в огромном количестве обменных процессов, и нехватка хотя бы одной из них нарушает слаженную работу всего организма. Их деление на заменимые и незаменимые подразумевает, что первые образуются в организме человека, а вторые могут поступать в него только извне. Понятие «заменимые» может вызвать иллюзию, что потребление этой разновидности веществ необязательно. Однако это не так: дефицит заменимых аминокислот также возможен и опасен развитием патологических состояний.
Орнитин это заменимая, но необходимая для организма человека кислота выполняет очень ответственные функции. Именно поэтому она нашла широкое применение в медицине и спорте. Орнитин был открыт в 1937 году Д. Аккерманом, который синтезировал его из тканей акульей печени. Это водорастворимое бесцветное вещество кристаллической формы. Орнитин в оптимальной природной форме и дозировке содержится в продуктах пчеловодства — таких как цветочная пыльца, маточное молочко. Как и многие другие аминокислоты, орнитин представлен двумя формами – L и D, отражающими строение их молекул. Формы L, в отличии от D, обладают высокой биологической активностью. Поэтому, когда мы говорим о роли орнитина в метаболизме, мы подразумеваем форму орнитина L. При оральном употреблении именно L-формы без переваривания оперативно попадают в кровоток и вступают в обменные процессы.
Орнитин в оптимальной природной форме и дозировке содержится в продуктах пчеловодства — таких как цветочная пыльца, маточное молочко. Как и многие другие аминокислоты, орнитин представлен двумя формами – L и D, отражающими строение их молекул. Формы L, в отличии от D, обладают высокой биологической активностью. Поэтому, когда мы говорим о роли орнитина в метаболизме, мы подразумеваем форму орнитина L. При оральном употреблении именно L-формы без переваривания оперативно попадают в кровоток и вступают в обменные процессы.
Роль орнитина в организме человека
Его синтезирование и функции в нашем организме напрямую связаны с другой заменимой аминокислотой – аргинином, из которого он производится и в которое сам преобразуется. Однако, в отличие от своего близкого родственника, орнитин не входит в состав белковых соединений.
Вместе с аргинином орнитин причастен к продуцированию соматотропного гормона, ответственного как за рост в высоту (детей и подростков), так и за анаболические процессы – то есть синтез протеинов, а следовательно, увеличение мышечной массы. Гормон роста способствует переработке липидов в протеины, то есть трансформации жировых излишков в мышцы. Более того, соматропин ещё и антикатаболик, то есть вещество, препятствующее разрушению протеинов. Отмечается также влияние орнитина на увеличение секреции инсулина, также улучшающего анаболизм.
Гормон роста способствует переработке липидов в протеины, то есть трансформации жировых излишков в мышцы. Более того, соматропин ещё и антикатаболик, то есть вещество, препятствующее разрушению протеинов. Отмечается также влияние орнитина на увеличение секреции инсулина, также улучшающего анаболизм.
Крайне важна роль орнитина в выводе аммиака, возникающего в организме в результате метаболизма азота. Не случайно путь образования мочевины из продуктов распада называется орнитиновым циклом. Выведение токсичных азотосодержащих веществ из организма предупреждает эндогенное (обусловленное внутренними факторами) отравление и к тому же благотворно влияет на нервную систему, делая человека менее возбудимым и раздражительным. А вот нарушение этого процесса чревато гипотрофией, развитием умственной отсталости, нервно-психическими отклонениями, помутнением сознания вплоть до впадения в кому или смерти.
Орнитин участвует в производстве ряда веществ: полиаминов спермидина и спермина, путресцина, присутствующих в клеточных ядрах самых разных человеческих органов и участвующих в молекулярных взаимодействиях с ДНК и РНК.
Также диаминовалериановая кислота причастна к синтезу цитруллина, пролина, глютаминовой кислоты, а также ниацина, или никотиновой кислоты, активирующей обменные процессы и дыхание тканей, кроветворение и кровообращение, вывод токсинов. Влияет орнитин и на выработку глюкозы, нормализуя количество её содержания в крови.
Применение орнитина
Применение орнитина в спорте связано в первую очередь с его свойством активизировать посредством синтеза соматропина и увеличения выработки инсулина анаболические процессы, ведущие к росту мышечной массы. Особенно рекомендуется приём этого вещества в силовых видах спорта, таких как бодибилдинг, культуризм, пауэрлифтинг и другие. Орнитин также помогает обрести красивые формы за счёт своей способности ускорять сжигание жиров, что ценно при сушке тела.
Усиленные физические нагрузки и избыток белковой пищи ведут к высокой концентрации конечных метаболитов, то есть продуктов распада, отравляющих организм спортсмена. И здесь диаминовалериановая кислота приходит на помощь, помогая выводить вредные вещества, тем самым облегчая работу печени. Хотя орнитин и вырабатывается организмом, однако при интенсивных занятиях потребность в нём возрастает и собственного производства оказывается недостаточно.
Кроме того, отмечаются антиболевые, иммунокорректирующие, ранозаживляющие и энергетические свойства орнитина, восстанавливающее и укрепляющее воздействие на сухожилия и связки.
Приём орнитина способствует нормализации кислотно-основного состояния, что очень ценно при больших мышечных нагрузках, чреватых накоплением молочной кислоты и ацидозом. Его успокаивающее влияние на нервную систему также может быть полезным для спортсменов, подверженных частым стрессам и высоким психоэмоциональным нагрузкам.
Литература:
https://leveton.su/ornitin/
Входит в состав следующих препаратов:
Псориаз
Что такое псориаз?
Псориаз — хроническое неинфекционное заболевание, дерматоз, поражающий в основном кожу. В настоящее время предполагается аутоиммунная природа этого заболевания. Обычно псориаз вызывает образование чрезмерно сухих, красных, приподнятых над поверхностью кожи пятен. Однако некоторые больные псориазом не имеют никаких видимых поражений кожи. Вызванные псориазом пятна называются псориатическими бляшками. Эти пятна являются по своей природе участками хронического воспаления и избыточной пролиферации лимфоцитов, макрофагов и кератиноцитов кожи, а также избыточного образования новых мелких капилляров в подлежащем слое кожи.
От чего же возникает псориаз?
Причины псориаза в настоящее время окончательно ещё не выяснены. На данный момент существуют две основные гипотезы относительно характера процесса, который приводит к развитию этого заболевания.
Согласно первой гипотезе, псориаз является первичным заболеванием кожи, при котором нарушается нормальный процесс созревания и дифференцировки клеток кожи, и наблюдается избыточный рост и размножение этих клеток. При этом проблема псориаза видится сторонниками этой гипотезы как нарушение функции эпидермиса и его кератиноцитов.
Аутоиммунная агрессия Т-лимфоцитов и макрофагов против клеток кожи, их инвазия в толщу кожи и избыточная пролиферация в коже при этом видятся как вторичные, как реакция организма на избыточное размножение «неправильных», незрелых, патологически изменённых кератиноцитов. В пользу этой гипотезы говорит наличие положительного эффекта при лечении псориаза препаратами, тормозящими размножение кератиноцитов и/или вызывающими их ускоренное созревание и дифференцировку и при этом не обладающими или обладающими незначительными системными иммуномодулирующими свойствами — ретиноидами (синтетическими аналогами витамина A), витамином D и в особенности его активной формой, эфирами фумаровой кислоты.
Вторая гипотеза предполагает, что псориаз является иммунно-опосредованным, иммунопатологическим или аутоиммунным заболеванием, при котором избыточный рост и размножение клеток кожи и прежде всего кератиноцитов вторичны по отношению к различным факторам воспаления, продуцируемым клетками иммунной системы и/или по отношению, а аутоиммунному повреждению клеток кожи, вызывающему вторичную регенеративную реакцию.
Что происходит с кожей и как обеспечить ее уход?
Нарушенная барьерная функция кожи (в частности, механическое травмирование или раздражение, трение и давление на кожу, злоупотребление мылом и моющими веществами, контакт с растворителями, бытовой химией, спиртосодержащими растворами, наличие инфицированных очагов на коже или кожной аллергии, дефицит иммуноглобулинов, чрезмерная сухость кожи) также играют роль в развитии псориаза.
Проникшая в сухую кожу инфекция вызывает сухое (неэкссудативное) хроническое воспаление, которое, в свою очередь, вызывает симптомы, характерные для псориаза, такие, как зуд и повышенную пролиферацию клеток кожи. Это в свою очередь приводит к дальнейшему усилению сухости кожи, как вследствие воспаления и усиленной пролиферации клеток кожи, так и вследствие того, что инфицирующий организм потребляет влагу, которая в противном случае служила бы для увлажнения кожи. Чтобы избежать чрезмерной сухости кожи и уменьшить симптомы псориаза, больным псориазом не рекомендуется пользоваться мочалками и скрабами, особенно жёсткими, так как они не только повреждают кожу, оставляя микроскопические царапины, но и соскабливают с кожи верхний защитный роговой слой и кожное сало, в норме защищающие кожу от высыхания и от проникновения микробов. Также рекомендуется пользоваться тальком или детской присыпкой после мытья или купания, чтобы абсорбировать излишнюю влагу с кожи, которая в противном случае «достанется» инфицирующему агенту. Дополнительно рекомендуется использование средств, увлажняющих и питающих кожу, и лосьонов, улучшающих функцию сальных желез. Не рекомендуется злоупотреблять мылом, моющими средствами. Следует стараться избегать контакта кожи с растворителями, средствами бытовой химии.
Передается ли псориаз по наследству?
В развитии псориаза велика роль наследственного компонента, и уже известны многие из генов, ассоциированных с развитием псориаза или прямо участвующих в его развитии, но пока остаётся невыясненным, как эти гены взаимодействуют в процессе развития заболевания. Большинство известных на сегодня генов, ассоциированных с псориазом, так или иначе, влияют на работу иммунной системы.
Полагают, что если у здоровых родителей ребенок болен псориазом, то вероятность заболевания следующего ребенка составляет 17%, а при наличии псориаза у одного из родителей возможность заболевания у детей возрастает до 25% (при заболевании обоих родителей — до 60-70%).
В связи с тем, что у большинства больных псориазом не удается установить наследственную передачу дерматоза, высказывается мнение, что наследуется не сам псориаз, а предрасположение к нему, которые в части случаев реализуется в результате сложного взаимодействия наследственных факторов и неблагоприятных влияний внешней среды.
Как выглядит псориаз?
Избыточная пролиферация кератиноцитов (клеток кожи) в псориатических бляшках и инфильтрация кожи лимфоцитами и макрофагами быстро приводит к утолщению кожи в местах поражения, её приподнятию над поверхностью здоровой кожи и к формированию характерных бледных, серых или серебристых пятен, напоминающих застывший воск или парафин («парафиновые озёрца»). Псориатические бляшки чаще всего впервые появляются на подвергающихся трению и давлению местах — поверхностях локтевых и коленных сгибов, на ягодицах. Однако псориатические бляшки могут возникать и располагаться в любом месте кожи, включая кожу волосистой части головы (скальпа), ладонную поверхность кистей, подошвенную поверхность стоп, наружные половые органы. В противоположность высыпаниям при экземе, чаще поражающим внутреннюю сгибательную поверхность коленного и локтевого суставов, псориатические бляшки чаще располагаются на внешней, разгибательной поверхности суставов.
Что нужно, для того чтобы поставить диагноз псориаз?
Обычно у детей сделать это намного сложнее, чем у взрослых: у детей псориаз часто принимает атипичную форму, что может приводить к диагностическим трудностям. А чем раньше поставлен диагноз, тем больше возможностей бороться с недугом.
Не существует каких-либо специфичных для псориаза диагностических процедур или анализов крови. Тем не менее, при активном, прогрессирующем псориазе или тяжёлом его течении могут быть обнаружены отклонения в анализах крови, подтверждающие наличие активного воспалительного, аутоиммунного, ревматического процесса (повышение титров ревматоидного фактора, белков острой фазы, лейкоцитоз, повышенная СОЭ и т. п.), а также эндокринные и биохимические нарушения. Иногда бывает необходима биопсия кожи для исключения других заболеваний кожи и гистологического подтверждения диагноза псориаза.
Как лечить псориаз?
Лечить детский псориаз стоит начинать как можно раньше и контролировать ребенка, чтобы он соблюдал все советы врача. Иммунная система у малыша очень чуткая. При правильном подходе она может справиться с псориазом, а если пустить болезнь на самотек, то кожа будет поражаться все больше.
Если у ребенка появились симптомы заболевания — бляшки на коже, зуд, покраснение, шелушение, нужно немедленно начинать лечение, строго выполнять все рекомендации врача, а посоветует он наносить на кожу специальный крем.
В прогрессирующей стадии и при распространенных формах болезни лучше всего ребенка госпитализировать. Назначают десенсибилизирующие и седативные средства, внутрь 5 % раствор кальция глюконата или 10 % раствор кальция хлорида чайными, десертными или столовыми ложками 3 раза в день. Применяют 10 % раствор кальция глюконата внутримышечно по 3-5-8 мл (в зависимости от возраста) через день, 10-15 инъекций на курс. При выраженном зуде необходимы антигистаминные препараты внутрь короткими курсами, по 7-10 дней. У детей старшего возраста в прогрессирующей стадии при возбужденном состоянии, плохом сне иногда хороший эффект дают небольшие дозы снотворных и малых транквилизаторов (тазепам, седуксен, мепротан).
Применяют витамины: аскорбиновую кислоту по 0,05-0,1 г 3 раза в день; пиридоксин — 2,5-5 % раствор по 1 мл через день, 15-20 инъекций на курс лечения. Витамин В12 особенно показан при распространенных экссудативных формах псориаза — по 30- 100 мкг 2 раза в неделю внутримышечно в сочетании с фолиевой и аскорбиновой кислотами в течение 172-2 мес. Витамин А дают по 10 000 — 30 000 ME 1 раз в день в течение 1-2 мес. Больным с летней формой псориаза, особенно при сильном зуде, показана никотиновая кислота внутрь. При псориатической эритродермии целесообразны: рибофлавин-мононуклеотид внутримышечно, витамин B15 внутрь либо в свечах (в двойной дозировке), калия оротат. С некоторой осторожностью при всех формах псориаза следует назначать витамин D2.
С целью стимуляции защитно-приспособительных механизмов назначают пирогенные препараты, нормализующие сосудистую проницаемость и угнетающие митотическую активность эпидермиса. Пирогенал, Продигиозан. Хороший терапевтический эффект дают трансфузии крови, плазмы, альбумина, еженедельно, несколько раз, в зависимости от получаемого результата. У детей с упорными (экссудативной и эритродермической) формами псориаза получить от указанных средств положительный эффект иногда не удается. Тогда назначают глюкокортикоиды внутрь по 0,5-1 мг на 1 кг массы тела в день (в расчете на преднизолон) в течение 2-3 нед с последующим постепенным снижением дозы препарата до отмены его. Цитостатические препараты (метотрексат) из-за их токсичности детям всех возрастов не рекомендуются. В стационарной и регрессивной стадиях болезни назначают более активную терапию — УФО, общие ванны температуры 35- 37°С в течение 10 — 15 мин, через 1 день.
Наружное лечение псориаза.
Салициловая (1-2 %), серно-дегтярная (2-3 %) мази; глюкокортикоидные мази (0,5% преднизолоновая, локакортен, флуцинар, фторокорт, лоринден и др.). Эти мази довольно быстро дают непосредственный эффект в виде окклюзионных повязок при локализации псориатических бляшек на ладонях и подошвах. Детям с преимущественным поражением волосистой части головы можно рекомендовать применяемые в последнее время ингибиторы фосфодиэстеразы в виде смазываний или окклюзионных повязок с 5 % теофиллиновой или 1 % папавериновой мазями.
Необходимо подчеркнуть важность санации фокальной инфекции (заболевания дыхательных путей, ЛОР-органов, глистные инвазии и др.). Тонзилэктомию и аденотомию детям, больным псориазом, можно проводить в возрасте после 3 лет. В 90% случаев эти оперативные вмешательства благоприятно влияют на течение процесса, а у 10% больных, особенно с распространенным экссудативным псориазом, обострения продолжаются. Катамнестическое обследование через 7-10 лет показало, что у 2/3 больных после тонзиллэктомии не было рецидивов болезни, но даже у остальных 1/3 детей при обострениях высыпания были скудные и удлинялись ремиссии; у не оперированных же детей с псориазом и хроническим тонзиллитом обострения дерматоза отмечены чаще.
Наши многолетние наблюдения за детьми указывают на то, что в большинстве случаев рецидивы псориаза с возрастом наступают реже, менее выражены и отчетливо заметна тенденция к переходу распространенных форм дерматоза в ограниченные. Однако у отдельных больных процесс остается генерализованным, с тяжелым течением.
Псориаз — диагноз на всю жизнь?
Если начать своевременное и правильное лечение, то нет. Развитие псориаза у ребенка вовсе не означает, что, став взрослым, он также будет страдать от этого недуга. Конечно, псориаз — хроническое заболевание, излечиться от него на 100% практически невозможно. Но можно свести к максимуму период затишья. Детский псориаз лечат, как и взрослый, каждые три месяца меняя один вид лечения на другой.
Ребенка стоит заранее психологически подготовить к тому, что на его теле есть изъяны. В отличие от взрослых у детей довольно часто псориаз поражает не тело, а именно лицо (30% случаев). Высыпания могут появиться на лбу, на щеках, на веках. Психологически перенести это довольно тяжело. Также у трети детей, страдающих детским псориазом, поражаются ногти. Поэтому скрыть болезнь довольно сложно.
Помимо физически неприятных ощущений псориаз может стать суровым испытанием для душевного состояния ребенка. Родителям нельзя оставлять его один на один с проблемой. Нужно поощрять любую активность: занятие спортом, игры. Правда, стоит помнить о мерах предосторожности. Например, кожа на определенных участках тела может подвергаться растяжению (например, при долгой езде на велосипеде). А это может спровоцировать псориаз. Несмотря на внешне неприглядное состояние кожи ребенку можно заниматься плаванием! А если в воде есть химикаты, снять
Почему до сих пор нет лекарства, полностью излечивающего псориаз?
Эту болезнь недаром называют таинственной. До сих пор не ясна суть этого заболевания. У одних псориаз поражает лицо, у других конечности, у кого-то суставы! Отчего у клеток нашего организма происходит брак — непонятно. Как онкология, псориаз не поддается лечению таблетками. Сейчас в России ведутся интересные разработки. Детей пробуют лечить мазями из натурального сырья. Прогнозы благоприятные, но в производство мазь еще не поступила. А пока мой совет родителям — не доверять шарлатанам и псевдоцелителям, и при признаках псориаза у ребенка обращайтесь к профессионалу — детскому врачу-дерматологу.
Никотиновая кислотаповышает выносливость мышей, подвергшихся упражнениям на беговой дорожке
Метаболиты. 2020 Apr; 10 (4): 138.
Карстен Крюгер
2 Отделение физиологии упражнений и спортивной терапии, Институт спортивных наук, Юстус-Либихский университет Гиссена, Кугельберг 62, 35394 Гиссен, Германия; [email protected]
Поступила в редакцию 17 марта 2020 г .; Принято 31 марта 2020 г.
Лицензиат MDPI, Базель, Швейцария. Эта статья представляет собой статью в открытом доступе, распространяемую в соответствии с условиями лицензии Creative Commons Attribution (CC BY) (http: // creativecommons.org / licenses / by / 4.0 /). Эту статью цитировали в других статьях в PMC.Abstract
Недавно было обнаружено, что введение никотиновой кислоты (NA) в фармакологической дозе вызывает подобное изменение сократительного и метаболического фенотипа мышц, наблюдаемое в ответ на упражнения на выносливость. Таким образом, была проверена гипотеза о том, что комбинированное введение НА и упражнения на выносливость способствует адаптации мышц к регулярным упражнениям и улучшает показатели выносливости в большей степени, чем одни упражнения.Таким образом, 30 взрослых мышей случайным образом были разделены на три группы по 10 мышей в группе. Контрольная группа и группа упражнений (EX) получали адекватную диету NA, в то время как группа EX + NA получала диету с высоким содержанием NA. Мышей из групп EX и EX + NA выполняли программу упражнений на выносливость на беговой дорожке пять раз в неделю в течение 42-дневного экспериментального периода. На 41 день показатели выносливости были выше в группе EX + NA, чем в контрольной группе и группе EX ( p <0,05). Мыши из группы EX + NA имели более высокий процент волокон типа IIA (+ 60%) и более низкий тип IIB (-55%) в икроножной мышце (GN), чем контрольные мыши ( p <0.05), тогда как процентное содержание волокон типа I в мышцах GN имеет тенденцию к увеличению (+ 100%) в группе EX + NA по сравнению с контрольной группой ( p = 0,051). В группе EX + NA концентрация гликогена (+ 15%) и уровни мРНК двух гликолитических (+ 70–80%) и двух гликогенолитических ферментов (+ 80–120%) в мышцах GN были увеличены по сравнению с контрольной группой ( p <0,05). В заключение, кормление диетой с высоким содержанием NA вызывает изменения в составе волокон скелетных мышц и улучшает показатели выносливости мышей, которым регулярно выполняются упражнения на выносливость.
Ключевые слова: адаптация, выносливость, упражнения, никотиновая кислота, скелетные мышцы, развернутый белковый ответ
Никотиновая кислота (NA) принадлежит к комплексу витаминов группы B, которые имеют общую характеристику действовать как предшественники определенных коферментов ( NAD + и NADP + ) по существу необходимы для промежуточного метаболизма во всех тканях. Помимо этой физиологической функции NA, NA, как хорошо известно, проявляет выраженную липид-модулирующую активность в крови, такую как снижение уровня триацилглицеринов (TAG) в высоких дозах (у людей 2-6 г / день) [1].Эта фармакологическая активность NA долгое время в основном приписывалась опосредованному рецептором NA ингибированию липолиза в белой жировой ткани, тем самым уменьшая доступность субстрата (свободных жирных кислот (FFA)) для синтеза ТАГ в печени — основного источника плазменных ТАГ [1]. Однако этот механизм может лишь недостаточно объяснить ТАГ-модулирующий эффект НА, поскольку уровни СЖК в плазме при длительном введении НА обычно превышают уровни до лечения из-за явного эффекта отскока и даже превышения, но эффект снижения ТАГ сохраняется [ 2].На этом фоне недавние исследования липид-модулирующих эффектов NA также были сосредоточены на скелетных мышцах, которые не экспрессируют рецептор NA, рецептор гидроксикарбоновой кислоты 2, но из-за его большой массы и широкого использования жирных кислот в качестве источника энергии влияет на ТАГ плазмы. концентрация. В этом контексте примечательным является наблюдение из недавнего исследования, согласно которому кормление NA на фармакологических уровнях инсулинорезистентным тучным крысам влияет на сократительный и метаболический фенотип скелетных мышц [3].Как правило, фенотип мышц демонстрирует высокую пластичность в ответ на различные факторы. Например, ожирение снижает процент окислительных волокон типа I, увеличивая при этом процент менее окислительных волокон и гликолитических волокон. Напротив, потеря веса обращает вспять эти вызванные ожирением изменения состава мышечных волокон у людей и грызунов [4,5]. В исследовании на крысах с ожирением было обнаружено, что вызванное ожирением снижение процента волокон типа I и увеличение количества волокон типа II в мышцах крыс с ожирением предотвращается путем введения фармакологической дозы NA [3].Волокна типа I богаты митохондриями, обладают высокой активностью окислительных ферментов и способны эффективно использовать жирные кислоты для производства АТФ [6]. Таким образом, вызванное НА изменение фенотипа сократительной способности мышц у крыс с ожирением привело к более окислительному метаболическому фенотипу, о чем свидетельствует более высокая экспрессия в мышцах генов, участвующих в утилизации жирных кислот и окислительном фосфорилировании [3]. Эти данные свидетельствуют о том, что повышенное использование жирных кислот мышцами может способствовать снижению ТАГ-эффекта НА.
Подобные изменения в распределении мышечных волокон, наблюдаемые с NA, также происходят в ответ на регулярные аэробные упражнения на выносливость, а именно трансформацию мышечных волокон из гликолитических, чувствительных к усталости типа IIB в окислительные, устойчивые к усталости типа IIA и типа I волокна [7]. Эта адаптация мышц в значительной степени объясняет, помимо улучшения сердечно-легочной функции, улучшение способности выполнять упражнения на выносливость, определяемое максимальным потреблением кислорода (VO 2 max) у людей, регулярно выполняющих тренировки на выносливость.В свете схожих эффектов введения НА и регулярных упражнений на выносливость мы предположили, что их комбинация способствует адаптации мышц к регулярным упражнениям и улучшает показатели упражнений на выносливость в большей степени, чем одни упражнения. Чтобы проверить эту гипотезу, мышей подвергали шестинедельной программе упражнений на выносливость и кормили либо диетой, адекватной NA, достаточной для покрытия их потребности в витаминах, либо диетой с высоким содержанием NA, обеспечивающей фармакологическую дозу NA, сравнимую с дозой, используемой для снижения липидов в организме. люди.
Недавние исследования продемонстрировали, что активация сигнальных путей стресса, таких как развернутый белковый ответ (UPR), играет регулирующую роль в адаптации фенотипа мышц к упражнениям [8]. UPR — это механизм контроля качества белка, включающий программу транскрипции, которая направлена на снижение глобальной трансляции белка при одновременном увеличении продукции выбранных шаперонов и протеаз, участвующих в укладке белка и восстановлении протеостаза. UPR активируется, когда развернутые и неправильно свернутые белки накапливаются в эндоплазматическом ретикулуме (UPR ER ), но похожий, но независимый UPR, специфичный для компартментов, митохондриальный UPR (UPR MT ), возникает из-за нарушенного протеостаза в митохондриях. матрица и межмембранное пространство [9].Благодаря регулирующей роли UPR в адаптации мышц к нагрузке, мы также исследовали влияние лечения NA на пути UPR ER и UPR MT .
Главный вывод настоящего исследования состоит в том, что введение диеты с высоким содержанием NA мышам, подвергнутым шестинедельной программе упражнений на выносливость, улучшает их результаты. Доза NA, полученная из диеты с высоким содержанием NA, вызвала 7-10-кратное повышение концентрации NAM в плазме у мышей группы EX + NA по сравнению с мышами других групп.Доза NA, вводимая мышам (приблизительно 95 мг / кг массы тела), сравнима с дозой, применяемой для людей, в которой дозы NA 2–6 г / день эквивалентны 30–90 мг / кг массы тела для человека с массой тела 70 лет. кг применяются для того, чтобы вызвать гиполипидемический эффект в сыворотке. В соответствии с другими исследованиями, NA и NUA не могли быть обнаружены даже в плазме мышей, получавших диету с высоким содержанием NA [3,10]. Это связано с тем, что диетическая NA быстро превращается в NAD + в кишечнике и печени, а затем NAD + превращается в NAM посредством «пути амидирования» и впоследствии попадает в кровоток [11].
Еще одним ключевым выводом настоящего исследования является то, что состав волокон GN-мышцы — фазовой мышцы, активно участвующей в движении задней ноги во время бега на беговой дорожке — у мышей группы EX + NA демонстрирует повышенный процент окислительных волокон ( быстро сокращающийся тип IIA), которые в основном используют окислительный метаболизм для выработки АТФ и, таким образом, устойчивы к утомлению по сравнению с контрольной группой и группой EX. Кроме того, у мышей из группы EX + NA был пониженный процент быстросокращающихся волокон типа IIB, которые в основном зависят от гликолитического метаболизма для выработки АТФ и подвержены истощению, а также тенденция к более высокому соотношению между типами I и II по сравнению с в контрольную группу.Этот вид трансформации из типа IIB в тип IIA и волокна типа I, наблюдаемый в группе EX + NA, обычно происходит как адаптация к регулярным тренировкам [12] и провоцируется в основном преобразованием из типа IIB в тип IIA и в меньшее количество. степень до типа I [13]. В соответствии с этим, беговые упражнения на беговой дорожке, как сообщалось, увеличивают процентное содержание волокон типа IIA, уменьшают процентное содержание волокон типа IIB и численно увеличивают процентное содержание волокон типа I в мышце подошвенной мышцы крысы [13], которая имеет такой же состав волокон, как и GN-мышца.Об аналогичных адаптациях состава волокон длинного разгибателя пальцев, которые также преимущественно содержат волокна типа II, к беговым упражнениям сообщили Xu et al. [14]. Напротив, не было обнаружено адаптации состава мышечных волокон к регулярным тренировкам в мышцах, содержащих преимущественно волокна типа I, таких как камбаловидная мышца [13,14]. В настоящем исследовании мыши из группы EX продемонстрировали аналогичную трансформацию типов мышечных волокон, что и мыши из группы EX + NA, но трансформация была менее сильной и, таким образом, изменение состава типов волокон не было статистически значимым.Учитывая, что адаптация состава мышечных волокон к тренировкам с физической нагрузкой является долгосрочным эффектом, вполне возможно, что 6-недельный тренировочный протокол был недостаточно продолжительным, чтобы вызвать значительную трансформацию волокон, как это было видно после 12 недель тренировок [14]. . Однако наблюдение, что трансформация типа волокна была более выраженной у мышей группы EX + NA, чем у мышей группы EX, может быть объяснено ускоренной адаптацией мышц к регулярным тренировкам с помощью NA. Возможно, недавно наблюдаемый стимулирующий эффект NA на молекулярные регуляторы трансформации типа волокна, такой как PGC-1α [3,15], может быть причиной ускоренной трансформации типа волокна у мышей группы EX + NA.Повышение регуляции PGC-1α в мышцах и преобразование волокон типа II в тип I в ответ на введение NA также наблюдалось у свиней [16], что указывает на то, что активация PGC-1α является последовательным эффектом NA. В настоящем исследовании уровень мРНК Ppargc1a (кодирующий PGC-1α) был, по крайней мере, численно повышен в мышцах GN в группе EX + NA по сравнению с контрольной группой, но это повышение не было статистически значимым. Однако, поскольку уровень мРНК Ppargc1a в мышцах GN в группе EX был так же повышен, как и в группе EX + NA, маловероятно, что индукция Ppargc1a является причиной ускоренной трансформации типа волокна в EX + NA. группа.Тем не менее, наши наблюдения в отношении мРНК Ppargc1a не следует преувеличивать, поскольку уровень мРНК этого фактора транскрипции не является показателем его функции.
Чтобы выяснить, сопровождалась ли трансформация типа волокна в GN-мышце изменениями метаболического фенотипа, мы проанализировали экспрессию ключевых генов, участвующих в важных путях генерации энергии. Важно отметить, что эффекты, наблюдаемые на уровне мРНК, в значительной степени отражают адаптацию мышц к шестинедельному периоду вмешательства, а не острую реакцию на тест с напряженным бегом, потому что мышей умерщвляли через два дня после последней тренировки. .Хотя экспрессия генов, участвующих в утилизации жирных кислот в мышцах GN, не различалась в трех группах мышей, было очевидно, что гены, участвующие в гликолизе ( Gapdh , Pfkm ) и гликогенолизе ( Pygm ), были увеличены у GN-мышца группы EX + NA. В соответствии с неизменной экспрессией генов, участвующих в окислении жирных кислот в мышцах GN, плазменные концентрации метаболитов, связанных с метаболизмом жирных кислот, не различались между группами.Напротив, концентрация гликогена в мышцах GN была повышена в группе EX + NA по сравнению с контрольной группой, но не в группе EX. Повышенная концентрация гликогена и повышенный уровень мРНК Pygm в мышцах GN в состоянии покоя также были зарегистрированы у крыс, которые имели доступ к произвольному бегу на колесе в течение восьми недель [17], что свидетельствует об хорошо известном тренировочном эффекте (« загрузка гликогена ») от беговой деятельности. Было обнаружено, что даже в «окислительной» мышце, содержащей в основном медленно сокращающиеся волокна типа I, такие как камбаловидная мышца, произвольный бег в течение 12 недель увеличивает внутримышечную концентрацию гликогена [14].Поскольку внутримышечная концентрация гликогена позволяет мышцам вырабатывать АТФ из глюкозы в анаэробных условиях, вероятно, что повышенные уровни гликогена в мышцах GN в группе EX + NA способствовали более высокой сопротивляемости истощению во время бегового теста с прогрессивной беговой дорожкой, потому что шаги с более высокой скоростью мыши должны были бежать в анаэробном диапазоне. Помимо своего влияния на анаэробный потенциал, мышечный гликоген считается общепризнанным, что он играет решающую роль в регулировании способности выдерживать упражнения при заданной рабочей нагрузке [18].В соответствии с этим, истощение гликогена в мышцах было идентифицировано как основная причина утомляемости во время упражнений на выносливость с умеренной или высокой интенсивностью [19], а постепенное снижение концентрации гликогена в мышцах перед тренировкой, как недавно сообщалось, ухудшает способность к физической нагрузке у людей [19]. 20]. Помимо увеличения мышечного гликогена, индукция как ключевых гликогенолитических, так и гликолитических генов в мышцах GN в группе EX + NA по сравнению с контрольной группой, вероятно, указывает на улучшенную способность мобилизовать и использовать внутримышечную глюкозу, что предположительно также способствовало более высокая производительность мышей во время интенсивного прогрессивного бегового теста.У мышей группы EX уровни мРНК Gapdh и Pfkm имели тенденцию к увеличению, а уровень мРНК Pygm в мышцах GN был значительно повышен по сравнению с мышами контрольной группы — эффекты, которые также указывают на адаптацию. регулярным упражнениям на выносливость в этой группе. Что касается отсутствия повышения внутримышечной концентрации гликогена в этой группе, возможно, что один только шестинедельный тренировочный период был слишком коротким, чтобы вызвать увеличение внутримышечных запасов гликогена, тогда как дополнительное питание диеты с высоким содержанием NA ускорило адаптацию к регулярные упражнения на выносливость.Интересно, что, несмотря на повышенную секрецию липолитических гормонов, введение NA вызывает сильные антилиполитические эффекты в белой жировой ткани [2], что объясняет, что однократное введение фармакологической дозы NA у людей и грызунов вызывает быстрое снижение уровней FFA в плазме. Однако это быстрое снижение уровней FFA в плазме в ответ на острое введение NA сопровождается заметным возвратом и даже превышением уровней FFA в плазме выше уровней до лечения [2]. Соответственно, хроническое введение НА приводит к повышению базального уровня и уровня СЖК натощак в плазме [21].Таким образом, возможно, что добавление мышам высокой дозы NA увеличивало внутримышечную доступность FFA из-за повышенного потока FFA в тренирующуюся мышцу. Наблюдение за тем, что уровни FFA в плазме были, по крайней мере, численно ниже в группе EX + NA, чем в группе EX, может указывать на повышенное использование FFA тренирующими мышцами у этих мышей. Таким образом, повышенная доступность как глюкозы из гликогена, так и свободных жирных кислот в тренирующих мышцах, могла способствовать более высокому сопротивлению истощению во время прогрессивного бегового теста на беговой дорожке.
Недавние исследования продемонстрировали, что UPR, сигнальный путь клеточного стресса, который может исходить из эндоплазматического ретикулума (UPR ER ) и из митохондрии (UPR MT ), активируется в мышцах в ответ на физический стимул и игру. играет важную регулирующую роль в адаптации мышц к регулярным упражнениям [8]. Фактически, генетическая блокада активации UPR, как было показано, ухудшает восстановление после изнурительного бега на беговой дорожке и вызывает непереносимость упражнений после повторяющихся бегов на беговой дорожке [8].Сообщалось, что активация UPR в ответ на упражнение связана со стимуляцией митохондриального биогенеза, опосредованного различными сигналами упражнений, такими как внутриклеточная концентрация Ca 2+ и уровни активных форм кислорода (ROS) или цАМФ [22,23]. В настоящем исследовании было обнаружено, что экспрессия нескольких генов-мишеней UPR ER и UPR MT была увеличена в мышцах GN мышей в группе EX и группе EX + NA по сравнению с группой CON, но экспрессия эти гены не различались между группой EX и группой EX + NA.Таким образом, эти данные предполагают, что метаболическая адаптация и улучшенная производительность мышей группы EX + NA по сравнению с группой EX не опосредуются ослаблением пути UPR в тренированных скелетных мышцах. Однако хорошо известно, что введение NA вызывает несколько гуморальных изменений, таких как повышение уровней липолитических гормонов, таких как адреналин и кортикостерон, в плазме крови и модулирует уровни циркулирующих гормонов роста и адипонектина [1,15,24,25], все из которых могут влияют на снабжение скелетных мышц энергетическими субстратами и, таким образом, на выполнение упражнений.Кроме того, также возможно, что введение NA улучшило функцию митохондрий за счет увеличения количества NAD + , который быстро образуется из NA в тканях после абсорбции NA в кишечнике. Как уже упоминалось выше, диетическая NA быстро превращается в NAD + в кишечнике и печени, прежде чем она превратится в NAM. Таким образом, очень вероятно, что уровни NAD + в тканях были увеличены, по крайней мере временно, у мышей, получавших диету с высоким содержанием NA.К сожалению, мы не смогли определить внутримышечные уровни NAD + , но критическая роль этого метаболита для функции митохондрий не подлежит сомнению. Помимо того, что NAD + действует как важный переносчик электронов во многих энергетических путях, включая гликолиз, β-окисление и цикл трикарбоновых кислот, он поддерживает функцию митохондрий, воздействуя на несколько NAD + -зависимых протеин-деацетилаз, поли (АДФ). -рибоза) полимеразы и факторы транскрипции [26].
Одним из ограничений этого исследования является отсутствие группы мышей, которые получали диету с высоким содержанием NA, но не подвергались физическим упражнениям. Это позволило бы нам изучить основной эффект введения NA и, таким образом, оценить, вызваны ли некоторые из изменений, наблюдаемых в группе EX + NA, главным образом введением NA. Как упоминалось выше, фармакологические уровни НА, вводимые с помощью диеты с высоким содержанием НА, оказывают сильное влияние на циркулирующие уровни различных гормонов, которые могли препятствовать выработке внутримышечных уровней сигналов упражнений, тем самым влияя на адаптацию мышц к регулярным упражнениям в группа EX + NA.Будущие исследования должны прояснить роль АН в этом сценарии. Кроме того, еще одним ограничением исследования является то, что три группы лечения не включали подгруппу мышей, которых умерщвляли сразу после заключительного бегового теста. Это позволило бы нам дополнительно исследовать метаболический ответ на схватку с острой интенсивной физической нагрузкой и его потенциальную модуляцию введением NA. Это могло бы обеспечить более глубокое понимание метаболических адаптаций, лежащих в основе улучшающего производительность эффекта лечения НА.
В заключение, настоящие результаты позволяют предположить, что введение НА на фармакологическом уровне увеличивает показатели выносливости тренированных мышей за счет улучшения адаптации мышц к регулярным упражнениям. Может ли влияние NA на повышение производительности упражнений также затрагивать другие ткани, помимо скелетных мышц, таких как сердце, что значительно влияет на способность выполнять упражнения на выносливость за счет регулирования ударного объема, а также другие факторы, определяющие способность выполнять упражнения на выносливость (например,g., объем эритроцитов, гематокрит) не могут быть даны ответы в этом исследовании. Поскольку VO 2 max, параметр золотого стандарта кардиореспираторной пригодности, сильно зависит от ударного объема и объема эритроцитов [27], мы не можем исключить, что улучшение функции сердца и / или увеличение объема эритроцитов могут также способствовали положительному эффекту введения NA на выполнение упражнений на выносливость. Это необходимо прояснить в будущих исследованиях.
Вклад авторов
Концептуализация, Р.R. and K.E .; формальный анализ, D.K.G., A.M.B., Y.A., G.W. и E.M .; письменная — подготовка оригинального черновика, Р.Р .; написание — просмотр и редактирование, K.E .; надзор, К.К .; администрация проекта, R.R. and K.E. Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование
Это исследование не получало внешнего финансирования.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Никотиновая кислота повышает выносливость мышей, которым выполнялись упражнения на беговой дорожке
Метаболиты.2020 Apr; 10 (4): 138.
Карстен Крюгер
2 Отделение физиологии упражнений и спортивной терапии, Институт спортивных наук, Юстус-Либихский университет Гиссена, Кугельберг 62, 35394 Гиссен, Германия; [email protected]
Поступила в редакцию 17 марта 2020 г .; Принято 31 марта 2020 г.
Лицензиат MDPI, Базель, Швейцария. Эта статья представляет собой статью в открытом доступе, распространяемую в соответствии с условиями лицензии Creative Commons Attribution (CC BY) (http: // creativecommons.org / licenses / by / 4.0 /). Эту статью цитировали в других статьях в PMC.Abstract
Недавно было обнаружено, что введение никотиновой кислоты (NA) в фармакологической дозе вызывает подобное изменение сократительного и метаболического фенотипа мышц, наблюдаемое в ответ на упражнения на выносливость. Таким образом, была проверена гипотеза о том, что комбинированное введение НА и упражнения на выносливость способствует адаптации мышц к регулярным упражнениям и улучшает показатели выносливости в большей степени, чем одни упражнения.Таким образом, 30 взрослых мышей случайным образом были разделены на три группы по 10 мышей в группе. Контрольная группа и группа упражнений (EX) получали адекватную диету NA, в то время как группа EX + NA получала диету с высоким содержанием NA. Мышей из групп EX и EX + NA выполняли программу упражнений на выносливость на беговой дорожке пять раз в неделю в течение 42-дневного экспериментального периода. На 41 день показатели выносливости были выше в группе EX + NA, чем в контрольной группе и группе EX ( p <0,05). Мыши из группы EX + NA имели более высокий процент волокон типа IIA (+ 60%) и более низкий тип IIB (-55%) в икроножной мышце (GN), чем контрольные мыши ( p <0.05), тогда как процентное содержание волокон типа I в мышцах GN имеет тенденцию к увеличению (+ 100%) в группе EX + NA по сравнению с контрольной группой ( p = 0,051). В группе EX + NA концентрация гликогена (+ 15%) и уровни мРНК двух гликолитических (+ 70–80%) и двух гликогенолитических ферментов (+ 80–120%) в мышцах GN были увеличены по сравнению с контрольной группой ( p <0,05). В заключение, кормление диетой с высоким содержанием NA вызывает изменения в составе волокон скелетных мышц и улучшает показатели выносливости мышей, которым регулярно выполняются упражнения на выносливость.
Ключевые слова: адаптация, выносливость, упражнения, никотиновая кислота, скелетные мышцы, развернутый белковый ответ
Никотиновая кислота (NA) принадлежит к комплексу витаминов группы B, которые имеют общую характеристику действовать как предшественники определенных коферментов ( NAD + и NADP + ) по существу необходимы для промежуточного метаболизма во всех тканях. Помимо этой физиологической функции NA, NA, как хорошо известно, проявляет выраженную липид-модулирующую активность в крови, такую как снижение уровня триацилглицеринов (TAG) в высоких дозах (у людей 2-6 г / день) [1].Эта фармакологическая активность NA долгое время в основном приписывалась опосредованному рецептором NA ингибированию липолиза в белой жировой ткани, тем самым уменьшая доступность субстрата (свободных жирных кислот (FFA)) для синтеза ТАГ в печени — основного источника плазменных ТАГ [1]. Однако этот механизм может лишь недостаточно объяснить ТАГ-модулирующий эффект НА, поскольку уровни СЖК в плазме при длительном введении НА обычно превышают уровни до лечения из-за явного эффекта отскока и даже превышения, но эффект снижения ТАГ сохраняется [ 2].На этом фоне недавние исследования липид-модулирующих эффектов NA также были сосредоточены на скелетных мышцах, которые не экспрессируют рецептор NA, рецептор гидроксикарбоновой кислоты 2, но из-за его большой массы и широкого использования жирных кислот в качестве источника энергии влияет на ТАГ плазмы. концентрация. В этом контексте примечательным является наблюдение из недавнего исследования, согласно которому кормление NA на фармакологических уровнях инсулинорезистентным тучным крысам влияет на сократительный и метаболический фенотип скелетных мышц [3].Как правило, фенотип мышц демонстрирует высокую пластичность в ответ на различные факторы. Например, ожирение снижает процент окислительных волокон типа I, увеличивая при этом процент менее окислительных волокон и гликолитических волокон. Напротив, потеря веса обращает вспять эти вызванные ожирением изменения состава мышечных волокон у людей и грызунов [4,5]. В исследовании на крысах с ожирением было обнаружено, что вызванное ожирением снижение процента волокон типа I и увеличение количества волокон типа II в мышцах крыс с ожирением предотвращается путем введения фармакологической дозы NA [3].Волокна типа I богаты митохондриями, обладают высокой активностью окислительных ферментов и способны эффективно использовать жирные кислоты для производства АТФ [6]. Таким образом, вызванное НА изменение фенотипа сократительной способности мышц у крыс с ожирением привело к более окислительному метаболическому фенотипу, о чем свидетельствует более высокая экспрессия в мышцах генов, участвующих в утилизации жирных кислот и окислительном фосфорилировании [3]. Эти данные свидетельствуют о том, что повышенное использование жирных кислот мышцами может способствовать снижению ТАГ-эффекта НА.
Подобные изменения в распределении мышечных волокон, наблюдаемые с NA, также происходят в ответ на регулярные аэробные упражнения на выносливость, а именно трансформацию мышечных волокон из гликолитических, чувствительных к усталости типа IIB в окислительные, устойчивые к усталости типа IIA и типа I волокна [7]. Эта адаптация мышц в значительной степени объясняет, помимо улучшения сердечно-легочной функции, улучшение способности выполнять упражнения на выносливость, определяемое максимальным потреблением кислорода (VO 2 max) у людей, регулярно выполняющих тренировки на выносливость.В свете схожих эффектов введения НА и регулярных упражнений на выносливость мы предположили, что их комбинация способствует адаптации мышц к регулярным упражнениям и улучшает показатели упражнений на выносливость в большей степени, чем одни упражнения. Чтобы проверить эту гипотезу, мышей подвергали шестинедельной программе упражнений на выносливость и кормили либо диетой, адекватной NA, достаточной для покрытия их потребности в витаминах, либо диетой с высоким содержанием NA, обеспечивающей фармакологическую дозу NA, сравнимую с дозой, используемой для снижения липидов в организме. люди.
Недавние исследования продемонстрировали, что активация сигнальных путей стресса, таких как развернутый белковый ответ (UPR), играет регулирующую роль в адаптации фенотипа мышц к упражнениям [8]. UPR — это механизм контроля качества белка, включающий программу транскрипции, которая направлена на снижение глобальной трансляции белка при одновременном увеличении продукции выбранных шаперонов и протеаз, участвующих в укладке белка и восстановлении протеостаза. UPR активируется, когда развернутые и неправильно свернутые белки накапливаются в эндоплазматическом ретикулуме (UPR ER ), но похожий, но независимый UPR, специфичный для компартментов, митохондриальный UPR (UPR MT ), возникает из-за нарушенного протеостаза в митохондриях. матрица и межмембранное пространство [9].Благодаря регулирующей роли UPR в адаптации мышц к нагрузке, мы также исследовали влияние лечения NA на пути UPR ER и UPR MT .
Главный вывод настоящего исследования состоит в том, что введение диеты с высоким содержанием NA мышам, подвергнутым шестинедельной программе упражнений на выносливость, улучшает их результаты. Доза NA, полученная из диеты с высоким содержанием NA, вызвала 7-10-кратное повышение концентрации NAM в плазме у мышей группы EX + NA по сравнению с мышами других групп.Доза NA, вводимая мышам (приблизительно 95 мг / кг массы тела), сравнима с дозой, применяемой для людей, в которой дозы NA 2–6 г / день эквивалентны 30–90 мг / кг массы тела для человека с массой тела 70 лет. кг применяются для того, чтобы вызвать гиполипидемический эффект в сыворотке. В соответствии с другими исследованиями, NA и NUA не могли быть обнаружены даже в плазме мышей, получавших диету с высоким содержанием NA [3,10]. Это связано с тем, что диетическая NA быстро превращается в NAD + в кишечнике и печени, а затем NAD + превращается в NAM посредством «пути амидирования» и впоследствии попадает в кровоток [11].
Еще одним ключевым выводом настоящего исследования является то, что состав волокон GN-мышцы — фазовой мышцы, активно участвующей в движении задней ноги во время бега на беговой дорожке — у мышей группы EX + NA демонстрирует повышенный процент окислительных волокон ( быстро сокращающийся тип IIA), которые в основном используют окислительный метаболизм для выработки АТФ и, таким образом, устойчивы к утомлению по сравнению с контрольной группой и группой EX. Кроме того, у мышей из группы EX + NA был пониженный процент быстросокращающихся волокон типа IIB, которые в основном зависят от гликолитического метаболизма для выработки АТФ и подвержены истощению, а также тенденция к более высокому соотношению между типами I и II по сравнению с в контрольную группу.Этот вид трансформации из типа IIB в тип IIA и волокна типа I, наблюдаемый в группе EX + NA, обычно происходит как адаптация к регулярным тренировкам [12] и провоцируется в основном преобразованием из типа IIB в тип IIA и в меньшее количество. степень до типа I [13]. В соответствии с этим, беговые упражнения на беговой дорожке, как сообщалось, увеличивают процентное содержание волокон типа IIA, уменьшают процентное содержание волокон типа IIB и численно увеличивают процентное содержание волокон типа I в мышце подошвенной мышцы крысы [13], которая имеет такой же состав волокон, как и GN-мышца.Об аналогичных адаптациях состава волокон длинного разгибателя пальцев, которые также преимущественно содержат волокна типа II, к беговым упражнениям сообщили Xu et al. [14]. Напротив, не было обнаружено адаптации состава мышечных волокон к регулярным тренировкам в мышцах, содержащих преимущественно волокна типа I, таких как камбаловидная мышца [13,14]. В настоящем исследовании мыши из группы EX продемонстрировали аналогичную трансформацию типов мышечных волокон, что и мыши из группы EX + NA, но трансформация была менее сильной и, таким образом, изменение состава типов волокон не было статистически значимым.Учитывая, что адаптация состава мышечных волокон к тренировкам с физической нагрузкой является долгосрочным эффектом, вполне возможно, что 6-недельный тренировочный протокол был недостаточно продолжительным, чтобы вызвать значительную трансформацию волокон, как это было видно после 12 недель тренировок [14]. . Однако наблюдение, что трансформация типа волокна была более выраженной у мышей группы EX + NA, чем у мышей группы EX, может быть объяснено ускоренной адаптацией мышц к регулярным тренировкам с помощью NA. Возможно, недавно наблюдаемый стимулирующий эффект NA на молекулярные регуляторы трансформации типа волокна, такой как PGC-1α [3,15], может быть причиной ускоренной трансформации типа волокна у мышей группы EX + NA.Повышение регуляции PGC-1α в мышцах и преобразование волокон типа II в тип I в ответ на введение NA также наблюдалось у свиней [16], что указывает на то, что активация PGC-1α является последовательным эффектом NA. В настоящем исследовании уровень мРНК Ppargc1a (кодирующий PGC-1α) был, по крайней мере, численно повышен в мышцах GN в группе EX + NA по сравнению с контрольной группой, но это повышение не было статистически значимым. Однако, поскольку уровень мРНК Ppargc1a в мышцах GN в группе EX был так же повышен, как и в группе EX + NA, маловероятно, что индукция Ppargc1a является причиной ускоренной трансформации типа волокна в EX + NA. группа.Тем не менее, наши наблюдения в отношении мРНК Ppargc1a не следует преувеличивать, поскольку уровень мРНК этого фактора транскрипции не является показателем его функции.
Чтобы выяснить, сопровождалась ли трансформация типа волокна в GN-мышце изменениями метаболического фенотипа, мы проанализировали экспрессию ключевых генов, участвующих в важных путях генерации энергии. Важно отметить, что эффекты, наблюдаемые на уровне мРНК, в значительной степени отражают адаптацию мышц к шестинедельному периоду вмешательства, а не острую реакцию на тест с напряженным бегом, потому что мышей умерщвляли через два дня после последней тренировки. .Хотя экспрессия генов, участвующих в утилизации жирных кислот в мышцах GN, не различалась в трех группах мышей, было очевидно, что гены, участвующие в гликолизе ( Gapdh , Pfkm ) и гликогенолизе ( Pygm ), были увеличены у GN-мышца группы EX + NA. В соответствии с неизменной экспрессией генов, участвующих в окислении жирных кислот в мышцах GN, плазменные концентрации метаболитов, связанных с метаболизмом жирных кислот, не различались между группами.Напротив, концентрация гликогена в мышцах GN была повышена в группе EX + NA по сравнению с контрольной группой, но не в группе EX. Повышенная концентрация гликогена и повышенный уровень мРНК Pygm в мышцах GN в состоянии покоя также были зарегистрированы у крыс, которые имели доступ к произвольному бегу на колесе в течение восьми недель [17], что свидетельствует об хорошо известном тренировочном эффекте (« загрузка гликогена ») от беговой деятельности. Было обнаружено, что даже в «окислительной» мышце, содержащей в основном медленно сокращающиеся волокна типа I, такие как камбаловидная мышца, произвольный бег в течение 12 недель увеличивает внутримышечную концентрацию гликогена [14].Поскольку внутримышечная концентрация гликогена позволяет мышцам вырабатывать АТФ из глюкозы в анаэробных условиях, вероятно, что повышенные уровни гликогена в мышцах GN в группе EX + NA способствовали более высокой сопротивляемости истощению во время бегового теста с прогрессивной беговой дорожкой, потому что шаги с более высокой скоростью мыши должны были бежать в анаэробном диапазоне. Помимо своего влияния на анаэробный потенциал, мышечный гликоген считается общепризнанным, что он играет решающую роль в регулировании способности выдерживать упражнения при заданной рабочей нагрузке [18].В соответствии с этим, истощение гликогена в мышцах было идентифицировано как основная причина утомляемости во время упражнений на выносливость с умеренной или высокой интенсивностью [19], а постепенное снижение концентрации гликогена в мышцах перед тренировкой, как недавно сообщалось, ухудшает способность к физической нагрузке у людей [19]. 20]. Помимо увеличения мышечного гликогена, индукция как ключевых гликогенолитических, так и гликолитических генов в мышцах GN в группе EX + NA по сравнению с контрольной группой, вероятно, указывает на улучшенную способность мобилизовать и использовать внутримышечную глюкозу, что предположительно также способствовало более высокая производительность мышей во время интенсивного прогрессивного бегового теста.У мышей группы EX уровни мРНК Gapdh и Pfkm имели тенденцию к увеличению, а уровень мРНК Pygm в мышцах GN был значительно повышен по сравнению с мышами контрольной группы — эффекты, которые также указывают на адаптацию. регулярным упражнениям на выносливость в этой группе. Что касается отсутствия повышения внутримышечной концентрации гликогена в этой группе, возможно, что один только шестинедельный тренировочный период был слишком коротким, чтобы вызвать увеличение внутримышечных запасов гликогена, тогда как дополнительное питание диеты с высоким содержанием NA ускорило адаптацию к регулярные упражнения на выносливость.Интересно, что, несмотря на повышенную секрецию липолитических гормонов, введение NA вызывает сильные антилиполитические эффекты в белой жировой ткани [2], что объясняет, что однократное введение фармакологической дозы NA у людей и грызунов вызывает быстрое снижение уровней FFA в плазме. Однако это быстрое снижение уровней FFA в плазме в ответ на острое введение NA сопровождается заметным возвратом и даже превышением уровней FFA в плазме выше уровней до лечения [2]. Соответственно, хроническое введение НА приводит к повышению базального уровня и уровня СЖК натощак в плазме [21].Таким образом, возможно, что добавление мышам высокой дозы NA увеличивало внутримышечную доступность FFA из-за повышенного потока FFA в тренирующуюся мышцу. Наблюдение за тем, что уровни FFA в плазме были, по крайней мере, численно ниже в группе EX + NA, чем в группе EX, может указывать на повышенное использование FFA тренирующими мышцами у этих мышей. Таким образом, повышенная доступность как глюкозы из гликогена, так и свободных жирных кислот в тренирующих мышцах, могла способствовать более высокому сопротивлению истощению во время прогрессивного бегового теста на беговой дорожке.
Недавние исследования продемонстрировали, что UPR, сигнальный путь клеточного стресса, который может исходить из эндоплазматического ретикулума (UPR ER ) и из митохондрии (UPR MT ), активируется в мышцах в ответ на физический стимул и игру. играет важную регулирующую роль в адаптации мышц к регулярным упражнениям [8]. Фактически, генетическая блокада активации UPR, как было показано, ухудшает восстановление после изнурительного бега на беговой дорожке и вызывает непереносимость упражнений после повторяющихся бегов на беговой дорожке [8].Сообщалось, что активация UPR в ответ на упражнение связана со стимуляцией митохондриального биогенеза, опосредованного различными сигналами упражнений, такими как внутриклеточная концентрация Ca 2+ и уровни активных форм кислорода (ROS) или цАМФ [22,23]. В настоящем исследовании было обнаружено, что экспрессия нескольких генов-мишеней UPR ER и UPR MT была увеличена в мышцах GN мышей в группе EX и группе EX + NA по сравнению с группой CON, но экспрессия эти гены не различались между группой EX и группой EX + NA.Таким образом, эти данные предполагают, что метаболическая адаптация и улучшенная производительность мышей группы EX + NA по сравнению с группой EX не опосредуются ослаблением пути UPR в тренированных скелетных мышцах. Однако хорошо известно, что введение NA вызывает несколько гуморальных изменений, таких как повышение уровней липолитических гормонов, таких как адреналин и кортикостерон, в плазме крови и модулирует уровни циркулирующих гормонов роста и адипонектина [1,15,24,25], все из которых могут влияют на снабжение скелетных мышц энергетическими субстратами и, таким образом, на выполнение упражнений.Кроме того, также возможно, что введение NA улучшило функцию митохондрий за счет увеличения количества NAD + , который быстро образуется из NA в тканях после абсорбции NA в кишечнике. Как уже упоминалось выше, диетическая NA быстро превращается в NAD + в кишечнике и печени, прежде чем она превратится в NAM. Таким образом, очень вероятно, что уровни NAD + в тканях были увеличены, по крайней мере временно, у мышей, получавших диету с высоким содержанием NA.К сожалению, мы не смогли определить внутримышечные уровни NAD + , но критическая роль этого метаболита для функции митохондрий не подлежит сомнению. Помимо того, что NAD + действует как важный переносчик электронов во многих энергетических путях, включая гликолиз, β-окисление и цикл трикарбоновых кислот, он поддерживает функцию митохондрий, воздействуя на несколько NAD + -зависимых протеин-деацетилаз, поли (АДФ). -рибоза) полимеразы и факторы транскрипции [26].
Одним из ограничений этого исследования является отсутствие группы мышей, которые получали диету с высоким содержанием NA, но не подвергались физическим упражнениям. Это позволило бы нам изучить основной эффект введения NA и, таким образом, оценить, вызваны ли некоторые из изменений, наблюдаемых в группе EX + NA, главным образом введением NA. Как упоминалось выше, фармакологические уровни НА, вводимые с помощью диеты с высоким содержанием НА, оказывают сильное влияние на циркулирующие уровни различных гормонов, которые могли препятствовать выработке внутримышечных уровней сигналов упражнений, тем самым влияя на адаптацию мышц к регулярным упражнениям в группа EX + NA.Будущие исследования должны прояснить роль АН в этом сценарии. Кроме того, еще одним ограничением исследования является то, что три группы лечения не включали подгруппу мышей, которых умерщвляли сразу после заключительного бегового теста. Это позволило бы нам дополнительно исследовать метаболический ответ на схватку с острой интенсивной физической нагрузкой и его потенциальную модуляцию введением NA. Это могло бы обеспечить более глубокое понимание метаболических адаптаций, лежащих в основе улучшающего производительность эффекта лечения НА.
В заключение, настоящие результаты позволяют предположить, что введение НА на фармакологическом уровне увеличивает показатели выносливости тренированных мышей за счет улучшения адаптации мышц к регулярным упражнениям. Может ли влияние NA на повышение производительности упражнений также затрагивать другие ткани, помимо скелетных мышц, таких как сердце, что значительно влияет на способность выполнять упражнения на выносливость за счет регулирования ударного объема, а также другие факторы, определяющие способность выполнять упражнения на выносливость (например,g., объем эритроцитов, гематокрит) не могут быть даны ответы в этом исследовании. Поскольку VO 2 max, параметр золотого стандарта кардиореспираторной пригодности, сильно зависит от ударного объема и объема эритроцитов [27], мы не можем исключить, что улучшение функции сердца и / или увеличение объема эритроцитов могут также способствовали положительному эффекту введения NA на выполнение упражнений на выносливость. Это необходимо прояснить в будущих исследованиях.
Вклад авторов
Концептуализация, Р.R. and K.E .; формальный анализ, D.K.G., A.M.B., Y.A., G.W. и E.M .; письменная — подготовка оригинального черновика, Р.Р .; написание — просмотр и редактирование, K.E .; надзор, К.К .; администрация проекта, R.R. and K.E. Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование
Это исследование не получало внешнего финансирования.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Никотиновая кислота повышает выносливость мышей, которым выполнялись упражнения на беговой дорожке
Метаболиты.2020 Apr; 10 (4): 138.
Карстен Крюгер
2 Отделение физиологии упражнений и спортивной терапии, Институт спортивных наук, Юстус-Либихский университет Гиссена, Кугельберг 62, 35394 Гиссен, Германия; [email protected]
Поступила в редакцию 17 марта 2020 г .; Принято 31 марта 2020 г.
Лицензиат MDPI, Базель, Швейцария. Эта статья представляет собой статью в открытом доступе, распространяемую в соответствии с условиями лицензии Creative Commons Attribution (CC BY) (http: // creativecommons.org / licenses / by / 4.0 /). Эту статью цитировали в других статьях в PMC.Abstract
Недавно было обнаружено, что введение никотиновой кислоты (NA) в фармакологической дозе вызывает подобное изменение сократительного и метаболического фенотипа мышц, наблюдаемое в ответ на упражнения на выносливость. Таким образом, была проверена гипотеза о том, что комбинированное введение НА и упражнения на выносливость способствует адаптации мышц к регулярным упражнениям и улучшает показатели выносливости в большей степени, чем одни упражнения.Таким образом, 30 взрослых мышей случайным образом были разделены на три группы по 10 мышей в группе. Контрольная группа и группа упражнений (EX) получали адекватную диету NA, в то время как группа EX + NA получала диету с высоким содержанием NA. Мышей из групп EX и EX + NA выполняли программу упражнений на выносливость на беговой дорожке пять раз в неделю в течение 42-дневного экспериментального периода. На 41 день показатели выносливости были выше в группе EX + NA, чем в контрольной группе и группе EX ( p <0,05). Мыши из группы EX + NA имели более высокий процент волокон типа IIA (+ 60%) и более низкий тип IIB (-55%) в икроножной мышце (GN), чем контрольные мыши ( p <0.05), тогда как процентное содержание волокон типа I в мышцах GN имеет тенденцию к увеличению (+ 100%) в группе EX + NA по сравнению с контрольной группой ( p = 0,051). В группе EX + NA концентрация гликогена (+ 15%) и уровни мРНК двух гликолитических (+ 70–80%) и двух гликогенолитических ферментов (+ 80–120%) в мышцах GN были увеличены по сравнению с контрольной группой ( p <0,05). В заключение, кормление диетой с высоким содержанием NA вызывает изменения в составе волокон скелетных мышц и улучшает показатели выносливости мышей, которым регулярно выполняются упражнения на выносливость.
Ключевые слова: адаптация, выносливость, упражнения, никотиновая кислота, скелетные мышцы, развернутый белковый ответ
Никотиновая кислота (NA) принадлежит к комплексу витаминов группы B, которые имеют общую характеристику действовать как предшественники определенных коферментов ( NAD + и NADP + ) по существу необходимы для промежуточного метаболизма во всех тканях. Помимо этой физиологической функции NA, NA, как хорошо известно, проявляет выраженную липид-модулирующую активность в крови, такую как снижение уровня триацилглицеринов (TAG) в высоких дозах (у людей 2-6 г / день) [1].Эта фармакологическая активность NA долгое время в основном приписывалась опосредованному рецептором NA ингибированию липолиза в белой жировой ткани, тем самым уменьшая доступность субстрата (свободных жирных кислот (FFA)) для синтеза ТАГ в печени — основного источника плазменных ТАГ [1]. Однако этот механизм может лишь недостаточно объяснить ТАГ-модулирующий эффект НА, поскольку уровни СЖК в плазме при длительном введении НА обычно превышают уровни до лечения из-за явного эффекта отскока и даже превышения, но эффект снижения ТАГ сохраняется [ 2].На этом фоне недавние исследования липид-модулирующих эффектов NA также были сосредоточены на скелетных мышцах, которые не экспрессируют рецептор NA, рецептор гидроксикарбоновой кислоты 2, но из-за его большой массы и широкого использования жирных кислот в качестве источника энергии влияет на ТАГ плазмы. концентрация. В этом контексте примечательным является наблюдение из недавнего исследования, согласно которому кормление NA на фармакологических уровнях инсулинорезистентным тучным крысам влияет на сократительный и метаболический фенотип скелетных мышц [3].Как правило, фенотип мышц демонстрирует высокую пластичность в ответ на различные факторы. Например, ожирение снижает процент окислительных волокон типа I, увеличивая при этом процент менее окислительных волокон и гликолитических волокон. Напротив, потеря веса обращает вспять эти вызванные ожирением изменения состава мышечных волокон у людей и грызунов [4,5]. В исследовании на крысах с ожирением было обнаружено, что вызванное ожирением снижение процента волокон типа I и увеличение количества волокон типа II в мышцах крыс с ожирением предотвращается путем введения фармакологической дозы NA [3].Волокна типа I богаты митохондриями, обладают высокой активностью окислительных ферментов и способны эффективно использовать жирные кислоты для производства АТФ [6]. Таким образом, вызванное НА изменение фенотипа сократительной способности мышц у крыс с ожирением привело к более окислительному метаболическому фенотипу, о чем свидетельствует более высокая экспрессия в мышцах генов, участвующих в утилизации жирных кислот и окислительном фосфорилировании [3]. Эти данные свидетельствуют о том, что повышенное использование жирных кислот мышцами может способствовать снижению ТАГ-эффекта НА.
Подобные изменения в распределении мышечных волокон, наблюдаемые с NA, также происходят в ответ на регулярные аэробные упражнения на выносливость, а именно трансформацию мышечных волокон из гликолитических, чувствительных к усталости типа IIB в окислительные, устойчивые к усталости типа IIA и типа I волокна [7]. Эта адаптация мышц в значительной степени объясняет, помимо улучшения сердечно-легочной функции, улучшение способности выполнять упражнения на выносливость, определяемое максимальным потреблением кислорода (VO 2 max) у людей, регулярно выполняющих тренировки на выносливость.В свете схожих эффектов введения НА и регулярных упражнений на выносливость мы предположили, что их комбинация способствует адаптации мышц к регулярным упражнениям и улучшает показатели упражнений на выносливость в большей степени, чем одни упражнения. Чтобы проверить эту гипотезу, мышей подвергали шестинедельной программе упражнений на выносливость и кормили либо диетой, адекватной NA, достаточной для покрытия их потребности в витаминах, либо диетой с высоким содержанием NA, обеспечивающей фармакологическую дозу NA, сравнимую с дозой, используемой для снижения липидов в организме. люди.
Недавние исследования продемонстрировали, что активация сигнальных путей стресса, таких как развернутый белковый ответ (UPR), играет регулирующую роль в адаптации фенотипа мышц к упражнениям [8]. UPR — это механизм контроля качества белка, включающий программу транскрипции, которая направлена на снижение глобальной трансляции белка при одновременном увеличении продукции выбранных шаперонов и протеаз, участвующих в укладке белка и восстановлении протеостаза. UPR активируется, когда развернутые и неправильно свернутые белки накапливаются в эндоплазматическом ретикулуме (UPR ER ), но похожий, но независимый UPR, специфичный для компартментов, митохондриальный UPR (UPR MT ), возникает из-за нарушенного протеостаза в митохондриях. матрица и межмембранное пространство [9].Благодаря регулирующей роли UPR в адаптации мышц к нагрузке, мы также исследовали влияние лечения NA на пути UPR ER и UPR MT .
Главный вывод настоящего исследования состоит в том, что введение диеты с высоким содержанием NA мышам, подвергнутым шестинедельной программе упражнений на выносливость, улучшает их результаты. Доза NA, полученная из диеты с высоким содержанием NA, вызвала 7-10-кратное повышение концентрации NAM в плазме у мышей группы EX + NA по сравнению с мышами других групп.Доза NA, вводимая мышам (приблизительно 95 мг / кг массы тела), сравнима с дозой, применяемой для людей, в которой дозы NA 2–6 г / день эквивалентны 30–90 мг / кг массы тела для человека с массой тела 70 лет. кг применяются для того, чтобы вызвать гиполипидемический эффект в сыворотке. В соответствии с другими исследованиями, NA и NUA не могли быть обнаружены даже в плазме мышей, получавших диету с высоким содержанием NA [3,10]. Это связано с тем, что диетическая NA быстро превращается в NAD + в кишечнике и печени, а затем NAD + превращается в NAM посредством «пути амидирования» и впоследствии попадает в кровоток [11].
Еще одним ключевым выводом настоящего исследования является то, что состав волокон GN-мышцы — фазовой мышцы, активно участвующей в движении задней ноги во время бега на беговой дорожке — у мышей группы EX + NA демонстрирует повышенный процент окислительных волокон ( быстро сокращающийся тип IIA), которые в основном используют окислительный метаболизм для выработки АТФ и, таким образом, устойчивы к утомлению по сравнению с контрольной группой и группой EX. Кроме того, у мышей из группы EX + NA был пониженный процент быстросокращающихся волокон типа IIB, которые в основном зависят от гликолитического метаболизма для выработки АТФ и подвержены истощению, а также тенденция к более высокому соотношению между типами I и II по сравнению с в контрольную группу.Этот вид трансформации из типа IIB в тип IIA и волокна типа I, наблюдаемый в группе EX + NA, обычно происходит как адаптация к регулярным тренировкам [12] и провоцируется в основном преобразованием из типа IIB в тип IIA и в меньшее количество. степень до типа I [13]. В соответствии с этим, беговые упражнения на беговой дорожке, как сообщалось, увеличивают процентное содержание волокон типа IIA, уменьшают процентное содержание волокон типа IIB и численно увеличивают процентное содержание волокон типа I в мышце подошвенной мышцы крысы [13], которая имеет такой же состав волокон, как и GN-мышца.Об аналогичных адаптациях состава волокон длинного разгибателя пальцев, которые также преимущественно содержат волокна типа II, к беговым упражнениям сообщили Xu et al. [14]. Напротив, не было обнаружено адаптации состава мышечных волокон к регулярным тренировкам в мышцах, содержащих преимущественно волокна типа I, таких как камбаловидная мышца [13,14]. В настоящем исследовании мыши из группы EX продемонстрировали аналогичную трансформацию типов мышечных волокон, что и мыши из группы EX + NA, но трансформация была менее сильной и, таким образом, изменение состава типов волокон не было статистически значимым.Учитывая, что адаптация состава мышечных волокон к тренировкам с физической нагрузкой является долгосрочным эффектом, вполне возможно, что 6-недельный тренировочный протокол был недостаточно продолжительным, чтобы вызвать значительную трансформацию волокон, как это было видно после 12 недель тренировок [14]. . Однако наблюдение, что трансформация типа волокна была более выраженной у мышей группы EX + NA, чем у мышей группы EX, может быть объяснено ускоренной адаптацией мышц к регулярным тренировкам с помощью NA. Возможно, недавно наблюдаемый стимулирующий эффект NA на молекулярные регуляторы трансформации типа волокна, такой как PGC-1α [3,15], может быть причиной ускоренной трансформации типа волокна у мышей группы EX + NA.Повышение регуляции PGC-1α в мышцах и преобразование волокон типа II в тип I в ответ на введение NA также наблюдалось у свиней [16], что указывает на то, что активация PGC-1α является последовательным эффектом NA. В настоящем исследовании уровень мРНК Ppargc1a (кодирующий PGC-1α) был, по крайней мере, численно повышен в мышцах GN в группе EX + NA по сравнению с контрольной группой, но это повышение не было статистически значимым. Однако, поскольку уровень мРНК Ppargc1a в мышцах GN в группе EX был так же повышен, как и в группе EX + NA, маловероятно, что индукция Ppargc1a является причиной ускоренной трансформации типа волокна в EX + NA. группа.Тем не менее, наши наблюдения в отношении мРНК Ppargc1a не следует преувеличивать, поскольку уровень мРНК этого фактора транскрипции не является показателем его функции.
Чтобы выяснить, сопровождалась ли трансформация типа волокна в GN-мышце изменениями метаболического фенотипа, мы проанализировали экспрессию ключевых генов, участвующих в важных путях генерации энергии. Важно отметить, что эффекты, наблюдаемые на уровне мРНК, в значительной степени отражают адаптацию мышц к шестинедельному периоду вмешательства, а не острую реакцию на тест с напряженным бегом, потому что мышей умерщвляли через два дня после последней тренировки. .Хотя экспрессия генов, участвующих в утилизации жирных кислот в мышцах GN, не различалась в трех группах мышей, было очевидно, что гены, участвующие в гликолизе ( Gapdh , Pfkm ) и гликогенолизе ( Pygm ), были увеличены у GN-мышца группы EX + NA. В соответствии с неизменной экспрессией генов, участвующих в окислении жирных кислот в мышцах GN, плазменные концентрации метаболитов, связанных с метаболизмом жирных кислот, не различались между группами.Напротив, концентрация гликогена в мышцах GN была повышена в группе EX + NA по сравнению с контрольной группой, но не в группе EX. Повышенная концентрация гликогена и повышенный уровень мРНК Pygm в мышцах GN в состоянии покоя также были зарегистрированы у крыс, которые имели доступ к произвольному бегу на колесе в течение восьми недель [17], что свидетельствует об хорошо известном тренировочном эффекте (« загрузка гликогена ») от беговой деятельности. Было обнаружено, что даже в «окислительной» мышце, содержащей в основном медленно сокращающиеся волокна типа I, такие как камбаловидная мышца, произвольный бег в течение 12 недель увеличивает внутримышечную концентрацию гликогена [14].Поскольку внутримышечная концентрация гликогена позволяет мышцам вырабатывать АТФ из глюкозы в анаэробных условиях, вероятно, что повышенные уровни гликогена в мышцах GN в группе EX + NA способствовали более высокой сопротивляемости истощению во время бегового теста с прогрессивной беговой дорожкой, потому что шаги с более высокой скоростью мыши должны были бежать в анаэробном диапазоне. Помимо своего влияния на анаэробный потенциал, мышечный гликоген считается общепризнанным, что он играет решающую роль в регулировании способности выдерживать упражнения при заданной рабочей нагрузке [18].В соответствии с этим, истощение гликогена в мышцах было идентифицировано как основная причина утомляемости во время упражнений на выносливость с умеренной или высокой интенсивностью [19], а постепенное снижение концентрации гликогена в мышцах перед тренировкой, как недавно сообщалось, ухудшает способность к физической нагрузке у людей [19]. 20]. Помимо увеличения мышечного гликогена, индукция как ключевых гликогенолитических, так и гликолитических генов в мышцах GN в группе EX + NA по сравнению с контрольной группой, вероятно, указывает на улучшенную способность мобилизовать и использовать внутримышечную глюкозу, что предположительно также способствовало более высокая производительность мышей во время интенсивного прогрессивного бегового теста.У мышей группы EX уровни мРНК Gapdh и Pfkm имели тенденцию к увеличению, а уровень мРНК Pygm в мышцах GN был значительно повышен по сравнению с мышами контрольной группы — эффекты, которые также указывают на адаптацию. регулярным упражнениям на выносливость в этой группе. Что касается отсутствия повышения внутримышечной концентрации гликогена в этой группе, возможно, что один только шестинедельный тренировочный период был слишком коротким, чтобы вызвать увеличение внутримышечных запасов гликогена, тогда как дополнительное питание диеты с высоким содержанием NA ускорило адаптацию к регулярные упражнения на выносливость.Интересно, что, несмотря на повышенную секрецию липолитических гормонов, введение NA вызывает сильные антилиполитические эффекты в белой жировой ткани [2], что объясняет, что однократное введение фармакологической дозы NA у людей и грызунов вызывает быстрое снижение уровней FFA в плазме. Однако это быстрое снижение уровней FFA в плазме в ответ на острое введение NA сопровождается заметным возвратом и даже превышением уровней FFA в плазме выше уровней до лечения [2]. Соответственно, хроническое введение НА приводит к повышению базального уровня и уровня СЖК натощак в плазме [21].Таким образом, возможно, что добавление мышам высокой дозы NA увеличивало внутримышечную доступность FFA из-за повышенного потока FFA в тренирующуюся мышцу. Наблюдение за тем, что уровни FFA в плазме были, по крайней мере, численно ниже в группе EX + NA, чем в группе EX, может указывать на повышенное использование FFA тренирующими мышцами у этих мышей. Таким образом, повышенная доступность как глюкозы из гликогена, так и свободных жирных кислот в тренирующих мышцах, могла способствовать более высокому сопротивлению истощению во время прогрессивного бегового теста на беговой дорожке.
Недавние исследования продемонстрировали, что UPR, сигнальный путь клеточного стресса, который может исходить из эндоплазматического ретикулума (UPR ER ) и из митохондрии (UPR MT ), активируется в мышцах в ответ на физический стимул и игру. играет важную регулирующую роль в адаптации мышц к регулярным упражнениям [8]. Фактически, генетическая блокада активации UPR, как было показано, ухудшает восстановление после изнурительного бега на беговой дорожке и вызывает непереносимость упражнений после повторяющихся бегов на беговой дорожке [8].Сообщалось, что активация UPR в ответ на упражнение связана со стимуляцией митохондриального биогенеза, опосредованного различными сигналами упражнений, такими как внутриклеточная концентрация Ca 2+ и уровни активных форм кислорода (ROS) или цАМФ [22,23]. В настоящем исследовании было обнаружено, что экспрессия нескольких генов-мишеней UPR ER и UPR MT была увеличена в мышцах GN мышей в группе EX и группе EX + NA по сравнению с группой CON, но экспрессия эти гены не различались между группой EX и группой EX + NA.Таким образом, эти данные предполагают, что метаболическая адаптация и улучшенная производительность мышей группы EX + NA по сравнению с группой EX не опосредуются ослаблением пути UPR в тренированных скелетных мышцах. Однако хорошо известно, что введение NA вызывает несколько гуморальных изменений, таких как повышение уровней липолитических гормонов, таких как адреналин и кортикостерон, в плазме крови и модулирует уровни циркулирующих гормонов роста и адипонектина [1,15,24,25], все из которых могут влияют на снабжение скелетных мышц энергетическими субстратами и, таким образом, на выполнение упражнений.Кроме того, также возможно, что введение NA улучшило функцию митохондрий за счет увеличения количества NAD + , который быстро образуется из NA в тканях после абсорбции NA в кишечнике. Как уже упоминалось выше, диетическая NA быстро превращается в NAD + в кишечнике и печени, прежде чем она превратится в NAM. Таким образом, очень вероятно, что уровни NAD + в тканях были увеличены, по крайней мере временно, у мышей, получавших диету с высоким содержанием NA.К сожалению, мы не смогли определить внутримышечные уровни NAD + , но критическая роль этого метаболита для функции митохондрий не подлежит сомнению. Помимо того, что NAD + действует как важный переносчик электронов во многих энергетических путях, включая гликолиз, β-окисление и цикл трикарбоновых кислот, он поддерживает функцию митохондрий, воздействуя на несколько NAD + -зависимых протеин-деацетилаз, поли (АДФ). -рибоза) полимеразы и факторы транскрипции [26].
Одним из ограничений этого исследования является отсутствие группы мышей, которые получали диету с высоким содержанием NA, но не подвергались физическим упражнениям. Это позволило бы нам изучить основной эффект введения NA и, таким образом, оценить, вызваны ли некоторые из изменений, наблюдаемых в группе EX + NA, главным образом введением NA. Как упоминалось выше, фармакологические уровни НА, вводимые с помощью диеты с высоким содержанием НА, оказывают сильное влияние на циркулирующие уровни различных гормонов, которые могли препятствовать выработке внутримышечных уровней сигналов упражнений, тем самым влияя на адаптацию мышц к регулярным упражнениям в группа EX + NA.Будущие исследования должны прояснить роль АН в этом сценарии. Кроме того, еще одним ограничением исследования является то, что три группы лечения не включали подгруппу мышей, которых умерщвляли сразу после заключительного бегового теста. Это позволило бы нам дополнительно исследовать метаболический ответ на схватку с острой интенсивной физической нагрузкой и его потенциальную модуляцию введением NA. Это могло бы обеспечить более глубокое понимание метаболических адаптаций, лежащих в основе улучшающего производительность эффекта лечения НА.
В заключение, настоящие результаты позволяют предположить, что введение НА на фармакологическом уровне увеличивает показатели выносливости тренированных мышей за счет улучшения адаптации мышц к регулярным упражнениям. Может ли влияние NA на повышение производительности упражнений также затрагивать другие ткани, помимо скелетных мышц, таких как сердце, что значительно влияет на способность выполнять упражнения на выносливость за счет регулирования ударного объема, а также другие факторы, определяющие способность выполнять упражнения на выносливость (например,g., объем эритроцитов, гематокрит) не могут быть даны ответы в этом исследовании. Поскольку VO 2 max, параметр золотого стандарта кардиореспираторной пригодности, сильно зависит от ударного объема и объема эритроцитов [27], мы не можем исключить, что улучшение функции сердца и / или увеличение объема эритроцитов могут также способствовали положительному эффекту введения NA на выполнение упражнений на выносливость. Это необходимо прояснить в будущих исследованиях.
Вклад авторов
Концептуализация, Р.R. and K.E .; формальный анализ, D.K.G., A.M.B., Y.A., G.W. и E.M .; письменная — подготовка оригинального черновика, Р.Р .; написание — просмотр и редактирование, K.E .; надзор, К.К .; администрация проекта, R.R. and K.E. Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование
Это исследование не получало внешнего финансирования.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Никотиновая кислота повышает выносливость мышей, которым выполнялись упражнения на беговой дорожке
Метаболиты.2020 Apr; 10 (4): 138.
Карстен Крюгер
2 Отделение физиологии упражнений и спортивной терапии, Институт спортивных наук, Юстус-Либихский университет Гиссена, Кугельберг 62, 35394 Гиссен, Германия; [email protected]
Поступила в редакцию 17 марта 2020 г .; Принято 31 марта 2020 г.
Лицензиат MDPI, Базель, Швейцария. Эта статья представляет собой статью в открытом доступе, распространяемую в соответствии с условиями лицензии Creative Commons Attribution (CC BY) (http: // creativecommons.org / licenses / by / 4.0 /). Эту статью цитировали в других статьях в PMC.Abstract
Недавно было обнаружено, что введение никотиновой кислоты (NA) в фармакологической дозе вызывает подобное изменение сократительного и метаболического фенотипа мышц, наблюдаемое в ответ на упражнения на выносливость. Таким образом, была проверена гипотеза о том, что комбинированное введение НА и упражнения на выносливость способствует адаптации мышц к регулярным упражнениям и улучшает показатели выносливости в большей степени, чем одни упражнения.Таким образом, 30 взрослых мышей случайным образом были разделены на три группы по 10 мышей в группе. Контрольная группа и группа упражнений (EX) получали адекватную диету NA, в то время как группа EX + NA получала диету с высоким содержанием NA. Мышей из групп EX и EX + NA выполняли программу упражнений на выносливость на беговой дорожке пять раз в неделю в течение 42-дневного экспериментального периода. На 41 день показатели выносливости были выше в группе EX + NA, чем в контрольной группе и группе EX ( p <0,05). Мыши из группы EX + NA имели более высокий процент волокон типа IIA (+ 60%) и более низкий тип IIB (-55%) в икроножной мышце (GN), чем контрольные мыши ( p <0.05), тогда как процентное содержание волокон типа I в мышцах GN имеет тенденцию к увеличению (+ 100%) в группе EX + NA по сравнению с контрольной группой ( p = 0,051). В группе EX + NA концентрация гликогена (+ 15%) и уровни мРНК двух гликолитических (+ 70–80%) и двух гликогенолитических ферментов (+ 80–120%) в мышцах GN были увеличены по сравнению с контрольной группой ( p <0,05). В заключение, кормление диетой с высоким содержанием NA вызывает изменения в составе волокон скелетных мышц и улучшает показатели выносливости мышей, которым регулярно выполняются упражнения на выносливость.
Ключевые слова: адаптация, выносливость, упражнения, никотиновая кислота, скелетные мышцы, развернутый белковый ответ
Никотиновая кислота (NA) принадлежит к комплексу витаминов группы B, которые имеют общую характеристику действовать как предшественники определенных коферментов ( NAD + и NADP + ) по существу необходимы для промежуточного метаболизма во всех тканях. Помимо этой физиологической функции NA, NA, как хорошо известно, проявляет выраженную липид-модулирующую активность в крови, такую как снижение уровня триацилглицеринов (TAG) в высоких дозах (у людей 2-6 г / день) [1].Эта фармакологическая активность NA долгое время в основном приписывалась опосредованному рецептором NA ингибированию липолиза в белой жировой ткани, тем самым уменьшая доступность субстрата (свободных жирных кислот (FFA)) для синтеза ТАГ в печени — основного источника плазменных ТАГ [1]. Однако этот механизм может лишь недостаточно объяснить ТАГ-модулирующий эффект НА, поскольку уровни СЖК в плазме при длительном введении НА обычно превышают уровни до лечения из-за явного эффекта отскока и даже превышения, но эффект снижения ТАГ сохраняется [ 2].На этом фоне недавние исследования липид-модулирующих эффектов NA также были сосредоточены на скелетных мышцах, которые не экспрессируют рецептор NA, рецептор гидроксикарбоновой кислоты 2, но из-за его большой массы и широкого использования жирных кислот в качестве источника энергии влияет на ТАГ плазмы. концентрация. В этом контексте примечательным является наблюдение из недавнего исследования, согласно которому кормление NA на фармакологических уровнях инсулинорезистентным тучным крысам влияет на сократительный и метаболический фенотип скелетных мышц [3].Как правило, фенотип мышц демонстрирует высокую пластичность в ответ на различные факторы. Например, ожирение снижает процент окислительных волокон типа I, увеличивая при этом процент менее окислительных волокон и гликолитических волокон. Напротив, потеря веса обращает вспять эти вызванные ожирением изменения состава мышечных волокон у людей и грызунов [4,5]. В исследовании на крысах с ожирением было обнаружено, что вызванное ожирением снижение процента волокон типа I и увеличение количества волокон типа II в мышцах крыс с ожирением предотвращается путем введения фармакологической дозы NA [3].Волокна типа I богаты митохондриями, обладают высокой активностью окислительных ферментов и способны эффективно использовать жирные кислоты для производства АТФ [6]. Таким образом, вызванное НА изменение фенотипа сократительной способности мышц у крыс с ожирением привело к более окислительному метаболическому фенотипу, о чем свидетельствует более высокая экспрессия в мышцах генов, участвующих в утилизации жирных кислот и окислительном фосфорилировании [3]. Эти данные свидетельствуют о том, что повышенное использование жирных кислот мышцами может способствовать снижению ТАГ-эффекта НА.
Подобные изменения в распределении мышечных волокон, наблюдаемые с NA, также происходят в ответ на регулярные аэробные упражнения на выносливость, а именно трансформацию мышечных волокон из гликолитических, чувствительных к усталости типа IIB в окислительные, устойчивые к усталости типа IIA и типа I волокна [7]. Эта адаптация мышц в значительной степени объясняет, помимо улучшения сердечно-легочной функции, улучшение способности выполнять упражнения на выносливость, определяемое максимальным потреблением кислорода (VO 2 max) у людей, регулярно выполняющих тренировки на выносливость.В свете схожих эффектов введения НА и регулярных упражнений на выносливость мы предположили, что их комбинация способствует адаптации мышц к регулярным упражнениям и улучшает показатели упражнений на выносливость в большей степени, чем одни упражнения. Чтобы проверить эту гипотезу, мышей подвергали шестинедельной программе упражнений на выносливость и кормили либо диетой, адекватной NA, достаточной для покрытия их потребности в витаминах, либо диетой с высоким содержанием NA, обеспечивающей фармакологическую дозу NA, сравнимую с дозой, используемой для снижения липидов в организме. люди.
Недавние исследования продемонстрировали, что активация сигнальных путей стресса, таких как развернутый белковый ответ (UPR), играет регулирующую роль в адаптации фенотипа мышц к упражнениям [8]. UPR — это механизм контроля качества белка, включающий программу транскрипции, которая направлена на снижение глобальной трансляции белка при одновременном увеличении продукции выбранных шаперонов и протеаз, участвующих в укладке белка и восстановлении протеостаза. UPR активируется, когда развернутые и неправильно свернутые белки накапливаются в эндоплазматическом ретикулуме (UPR ER ), но похожий, но независимый UPR, специфичный для компартментов, митохондриальный UPR (UPR MT ), возникает из-за нарушенного протеостаза в митохондриях. матрица и межмембранное пространство [9].Благодаря регулирующей роли UPR в адаптации мышц к нагрузке, мы также исследовали влияние лечения NA на пути UPR ER и UPR MT .
Главный вывод настоящего исследования состоит в том, что введение диеты с высоким содержанием NA мышам, подвергнутым шестинедельной программе упражнений на выносливость, улучшает их результаты. Доза NA, полученная из диеты с высоким содержанием NA, вызвала 7-10-кратное повышение концентрации NAM в плазме у мышей группы EX + NA по сравнению с мышами других групп.Доза NA, вводимая мышам (приблизительно 95 мг / кг массы тела), сравнима с дозой, применяемой для людей, в которой дозы NA 2–6 г / день эквивалентны 30–90 мг / кг массы тела для человека с массой тела 70 лет. кг применяются для того, чтобы вызвать гиполипидемический эффект в сыворотке. В соответствии с другими исследованиями, NA и NUA не могли быть обнаружены даже в плазме мышей, получавших диету с высоким содержанием NA [3,10]. Это связано с тем, что диетическая NA быстро превращается в NAD + в кишечнике и печени, а затем NAD + превращается в NAM посредством «пути амидирования» и впоследствии попадает в кровоток [11].
Еще одним ключевым выводом настоящего исследования является то, что состав волокон GN-мышцы — фазовой мышцы, активно участвующей в движении задней ноги во время бега на беговой дорожке — у мышей группы EX + NA демонстрирует повышенный процент окислительных волокон ( быстро сокращающийся тип IIA), которые в основном используют окислительный метаболизм для выработки АТФ и, таким образом, устойчивы к утомлению по сравнению с контрольной группой и группой EX. Кроме того, у мышей из группы EX + NA был пониженный процент быстросокращающихся волокон типа IIB, которые в основном зависят от гликолитического метаболизма для выработки АТФ и подвержены истощению, а также тенденция к более высокому соотношению между типами I и II по сравнению с в контрольную группу.Этот вид трансформации из типа IIB в тип IIA и волокна типа I, наблюдаемый в группе EX + NA, обычно происходит как адаптация к регулярным тренировкам [12] и провоцируется в основном преобразованием из типа IIB в тип IIA и в меньшее количество. степень до типа I [13]. В соответствии с этим, беговые упражнения на беговой дорожке, как сообщалось, увеличивают процентное содержание волокон типа IIA, уменьшают процентное содержание волокон типа IIB и численно увеличивают процентное содержание волокон типа I в мышце подошвенной мышцы крысы [13], которая имеет такой же состав волокон, как и GN-мышца.Об аналогичных адаптациях состава волокон длинного разгибателя пальцев, которые также преимущественно содержат волокна типа II, к беговым упражнениям сообщили Xu et al. [14]. Напротив, не было обнаружено адаптации состава мышечных волокон к регулярным тренировкам в мышцах, содержащих преимущественно волокна типа I, таких как камбаловидная мышца [13,14]. В настоящем исследовании мыши из группы EX продемонстрировали аналогичную трансформацию типов мышечных волокон, что и мыши из группы EX + NA, но трансформация была менее сильной и, таким образом, изменение состава типов волокон не было статистически значимым.Учитывая, что адаптация состава мышечных волокон к тренировкам с физической нагрузкой является долгосрочным эффектом, вполне возможно, что 6-недельный тренировочный протокол был недостаточно продолжительным, чтобы вызвать значительную трансформацию волокон, как это было видно после 12 недель тренировок [14]. . Однако наблюдение, что трансформация типа волокна была более выраженной у мышей группы EX + NA, чем у мышей группы EX, может быть объяснено ускоренной адаптацией мышц к регулярным тренировкам с помощью NA. Возможно, недавно наблюдаемый стимулирующий эффект NA на молекулярные регуляторы трансформации типа волокна, такой как PGC-1α [3,15], может быть причиной ускоренной трансформации типа волокна у мышей группы EX + NA.Повышение регуляции PGC-1α в мышцах и преобразование волокон типа II в тип I в ответ на введение NA также наблюдалось у свиней [16], что указывает на то, что активация PGC-1α является последовательным эффектом NA. В настоящем исследовании уровень мРНК Ppargc1a (кодирующий PGC-1α) был, по крайней мере, численно повышен в мышцах GN в группе EX + NA по сравнению с контрольной группой, но это повышение не было статистически значимым. Однако, поскольку уровень мРНК Ppargc1a в мышцах GN в группе EX был так же повышен, как и в группе EX + NA, маловероятно, что индукция Ppargc1a является причиной ускоренной трансформации типа волокна в EX + NA. группа.Тем не менее, наши наблюдения в отношении мРНК Ppargc1a не следует преувеличивать, поскольку уровень мРНК этого фактора транскрипции не является показателем его функции.
Чтобы выяснить, сопровождалась ли трансформация типа волокна в GN-мышце изменениями метаболического фенотипа, мы проанализировали экспрессию ключевых генов, участвующих в важных путях генерации энергии. Важно отметить, что эффекты, наблюдаемые на уровне мРНК, в значительной степени отражают адаптацию мышц к шестинедельному периоду вмешательства, а не острую реакцию на тест с напряженным бегом, потому что мышей умерщвляли через два дня после последней тренировки. .Хотя экспрессия генов, участвующих в утилизации жирных кислот в мышцах GN, не различалась в трех группах мышей, было очевидно, что гены, участвующие в гликолизе ( Gapdh , Pfkm ) и гликогенолизе ( Pygm ), были увеличены у GN-мышца группы EX + NA. В соответствии с неизменной экспрессией генов, участвующих в окислении жирных кислот в мышцах GN, плазменные концентрации метаболитов, связанных с метаболизмом жирных кислот, не различались между группами.Напротив, концентрация гликогена в мышцах GN была повышена в группе EX + NA по сравнению с контрольной группой, но не в группе EX. Повышенная концентрация гликогена и повышенный уровень мРНК Pygm в мышцах GN в состоянии покоя также были зарегистрированы у крыс, которые имели доступ к произвольному бегу на колесе в течение восьми недель [17], что свидетельствует об хорошо известном тренировочном эффекте (« загрузка гликогена ») от беговой деятельности. Было обнаружено, что даже в «окислительной» мышце, содержащей в основном медленно сокращающиеся волокна типа I, такие как камбаловидная мышца, произвольный бег в течение 12 недель увеличивает внутримышечную концентрацию гликогена [14].Поскольку внутримышечная концентрация гликогена позволяет мышцам вырабатывать АТФ из глюкозы в анаэробных условиях, вероятно, что повышенные уровни гликогена в мышцах GN в группе EX + NA способствовали более высокой сопротивляемости истощению во время бегового теста с прогрессивной беговой дорожкой, потому что шаги с более высокой скоростью мыши должны были бежать в анаэробном диапазоне. Помимо своего влияния на анаэробный потенциал, мышечный гликоген считается общепризнанным, что он играет решающую роль в регулировании способности выдерживать упражнения при заданной рабочей нагрузке [18].В соответствии с этим, истощение гликогена в мышцах было идентифицировано как основная причина утомляемости во время упражнений на выносливость с умеренной или высокой интенсивностью [19], а постепенное снижение концентрации гликогена в мышцах перед тренировкой, как недавно сообщалось, ухудшает способность к физической нагрузке у людей [19]. 20]. Помимо увеличения мышечного гликогена, индукция как ключевых гликогенолитических, так и гликолитических генов в мышцах GN в группе EX + NA по сравнению с контрольной группой, вероятно, указывает на улучшенную способность мобилизовать и использовать внутримышечную глюкозу, что предположительно также способствовало более высокая производительность мышей во время интенсивного прогрессивного бегового теста.У мышей группы EX уровни мРНК Gapdh и Pfkm имели тенденцию к увеличению, а уровень мРНК Pygm в мышцах GN был значительно повышен по сравнению с мышами контрольной группы — эффекты, которые также указывают на адаптацию. регулярным упражнениям на выносливость в этой группе. Что касается отсутствия повышения внутримышечной концентрации гликогена в этой группе, возможно, что один только шестинедельный тренировочный период был слишком коротким, чтобы вызвать увеличение внутримышечных запасов гликогена, тогда как дополнительное питание диеты с высоким содержанием NA ускорило адаптацию к регулярные упражнения на выносливость.Интересно, что, несмотря на повышенную секрецию липолитических гормонов, введение NA вызывает сильные антилиполитические эффекты в белой жировой ткани [2], что объясняет, что однократное введение фармакологической дозы NA у людей и грызунов вызывает быстрое снижение уровней FFA в плазме. Однако это быстрое снижение уровней FFA в плазме в ответ на острое введение NA сопровождается заметным возвратом и даже превышением уровней FFA в плазме выше уровней до лечения [2]. Соответственно, хроническое введение НА приводит к повышению базального уровня и уровня СЖК натощак в плазме [21].Таким образом, возможно, что добавление мышам высокой дозы NA увеличивало внутримышечную доступность FFA из-за повышенного потока FFA в тренирующуюся мышцу. Наблюдение за тем, что уровни FFA в плазме были, по крайней мере, численно ниже в группе EX + NA, чем в группе EX, может указывать на повышенное использование FFA тренирующими мышцами у этих мышей. Таким образом, повышенная доступность как глюкозы из гликогена, так и свободных жирных кислот в тренирующих мышцах, могла способствовать более высокому сопротивлению истощению во время прогрессивного бегового теста на беговой дорожке.
Недавние исследования продемонстрировали, что UPR, сигнальный путь клеточного стресса, который может исходить из эндоплазматического ретикулума (UPR ER ) и из митохондрии (UPR MT ), активируется в мышцах в ответ на физический стимул и игру. играет важную регулирующую роль в адаптации мышц к регулярным упражнениям [8]. Фактически, генетическая блокада активации UPR, как было показано, ухудшает восстановление после изнурительного бега на беговой дорожке и вызывает непереносимость упражнений после повторяющихся бегов на беговой дорожке [8].Сообщалось, что активация UPR в ответ на упражнение связана со стимуляцией митохондриального биогенеза, опосредованного различными сигналами упражнений, такими как внутриклеточная концентрация Ca 2+ и уровни активных форм кислорода (ROS) или цАМФ [22,23]. В настоящем исследовании было обнаружено, что экспрессия нескольких генов-мишеней UPR ER и UPR MT была увеличена в мышцах GN мышей в группе EX и группе EX + NA по сравнению с группой CON, но экспрессия эти гены не различались между группой EX и группой EX + NA.Таким образом, эти данные предполагают, что метаболическая адаптация и улучшенная производительность мышей группы EX + NA по сравнению с группой EX не опосредуются ослаблением пути UPR в тренированных скелетных мышцах. Однако хорошо известно, что введение NA вызывает несколько гуморальных изменений, таких как повышение уровней липолитических гормонов, таких как адреналин и кортикостерон, в плазме крови и модулирует уровни циркулирующих гормонов роста и адипонектина [1,15,24,25], все из которых могут влияют на снабжение скелетных мышц энергетическими субстратами и, таким образом, на выполнение упражнений.Кроме того, также возможно, что введение NA улучшило функцию митохондрий за счет увеличения количества NAD + , который быстро образуется из NA в тканях после абсорбции NA в кишечнике. Как уже упоминалось выше, диетическая NA быстро превращается в NAD + в кишечнике и печени, прежде чем она превратится в NAM. Таким образом, очень вероятно, что уровни NAD + в тканях были увеличены, по крайней мере временно, у мышей, получавших диету с высоким содержанием NA.К сожалению, мы не смогли определить внутримышечные уровни NAD + , но критическая роль этого метаболита для функции митохондрий не подлежит сомнению. Помимо того, что NAD + действует как важный переносчик электронов во многих энергетических путях, включая гликолиз, β-окисление и цикл трикарбоновых кислот, он поддерживает функцию митохондрий, воздействуя на несколько NAD + -зависимых протеин-деацетилаз, поли (АДФ). -рибоза) полимеразы и факторы транскрипции [26].
Одним из ограничений этого исследования является отсутствие группы мышей, которые получали диету с высоким содержанием NA, но не подвергались физическим упражнениям. Это позволило бы нам изучить основной эффект введения NA и, таким образом, оценить, вызваны ли некоторые из изменений, наблюдаемых в группе EX + NA, главным образом введением NA. Как упоминалось выше, фармакологические уровни НА, вводимые с помощью диеты с высоким содержанием НА, оказывают сильное влияние на циркулирующие уровни различных гормонов, которые могли препятствовать выработке внутримышечных уровней сигналов упражнений, тем самым влияя на адаптацию мышц к регулярным упражнениям в группа EX + NA.Будущие исследования должны прояснить роль АН в этом сценарии. Кроме того, еще одним ограничением исследования является то, что три группы лечения не включали подгруппу мышей, которых умерщвляли сразу после заключительного бегового теста. Это позволило бы нам дополнительно исследовать метаболический ответ на схватку с острой интенсивной физической нагрузкой и его потенциальную модуляцию введением NA. Это могло бы обеспечить более глубокое понимание метаболических адаптаций, лежащих в основе улучшающего производительность эффекта лечения НА.
В заключение, настоящие результаты позволяют предположить, что введение НА на фармакологическом уровне увеличивает показатели выносливости тренированных мышей за счет улучшения адаптации мышц к регулярным упражнениям. Может ли влияние NA на повышение производительности упражнений также затрагивать другие ткани, помимо скелетных мышц, таких как сердце, что значительно влияет на способность выполнять упражнения на выносливость за счет регулирования ударного объема, а также другие факторы, определяющие способность выполнять упражнения на выносливость (например,g., объем эритроцитов, гематокрит) не могут быть даны ответы в этом исследовании. Поскольку VO 2 max, параметр золотого стандарта кардиореспираторной пригодности, сильно зависит от ударного объема и объема эритроцитов [27], мы не можем исключить, что улучшение функции сердца и / или увеличение объема эритроцитов могут также способствовали положительному эффекту введения NA на выполнение упражнений на выносливость. Это необходимо прояснить в будущих исследованиях.
Вклад авторов
Концептуализация, Р.R. and K.E .; формальный анализ, D.K.G., A.M.B., Y.A., G.W. и E.M .; письменная — подготовка оригинального черновика, Р.Р .; написание — просмотр и редактирование, K.E .; надзор, К.К .; администрация проекта, R.R. and K.E. Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование
Это исследование не получало внешнего финансирования.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Преимущества витамина B3 | Добавка с витамином B3
Витамин B-3 или ниацин не может накапливаться в организме человека, но его необходимо постоянно пополнять из пищевых источников или добавок витамина B3.Продукты с высоким содержанием B-3 включают мясные субпродукты, курицу, финики, авокадо, орехи и грибы. Самый высокий источник — пивные дрожжи. Недостаток B-3 обычно проявляется в виде усталости, и многие энергетические напитки содержат витамин, способствующий бодрствованию.
Медицинское сообщество давно признало многие важные преимущества добавок ниацина, особенно в том, что касается многих аспектов здоровья сердца и кровообращения. Например, добавка витамина B3 использовалась для повышения уровня ЛПВП или «хорошего холестерина» в организме.[i] Было замечено, что он оказывает благоприятный эффект на снижение воспаления кровеносных сосудов, а также на стабилизацию бляшек в кровеносных сосудах. [ii]
Преимущества витамина B3 (ниацин) и спортивные результаты
Благодаря преимуществам ниацина в отношении здоровья сердца и кровеносных сосудов, а также его способности повышать энергию, преимущества добавок ниацина были тщательно изучены для улучшения спортивных результатов и спортивного питания. Что касается питания, журнал Международного общества спортивного питания в обзоре, озаглавленном «Диетические добавки и спортивные результаты: введение и витамины», утверждает:
«Добавка ниацина может влиять на метаболизм жиров, блокируя высвобождение свободных жирных кислот (СЖК) из жировой ткани и увеличивая зависимость от использования углеводов, что может привести к преждевременному истощению мышечного гликогена.”
Поддержание гликогена в мышцах важно для продления кардио-тренировок и тренировок с отягощениями. Мы, естественно, предполагаем, что из всех групп спортсмены едят наиболее питательную пищу и больше всего придерживаются диеты. Это не всегда так.
В исследовании Университета штата Орегон от 27 декабря 2006 г., озаглавленном: «Плохая спортивная результативность связана с дефицитом витаминов». Это важное исследование пришло к выводу:
«Активные люди, которым не хватает витамина B, в том числе спортсмены колледжей и другие элитные спортсмены, могут работать хуже во время высокоинтенсивных упражнений и иметь меньшую способность восстанавливать и наращивать мышцы, чем их коллеги с богатой питательными веществами диетой.”
Поскольку ниацин, среди других витаминов группы B, теряется с жидкостями организма, легко увидеть, как пот, мочеиспускание и гидратация в дополнение к недостаточному питанию могут привести к снижению спортивных результатов. С другой стороны, при разработке добавки витамина B3 для улучшения спортивных результатов, в то время как некоторые добавки ниацина очень положительны, чрезмерное использование добавки витамина B3 может иметь отрицательный эффект.
Веб-сайт Diagnose-me.com отражает вышесказанное, делая вывод:
«Потребность в ниацине увеличивается во время беременности, кормления грудью и в период роста, а также после физических упражнений.Спортсменам требуется больше B3, чем менее активным людям. Стресс, болезни и травмы тканей также увеличивают потребность организма в ниацине. Людям, которые едят много сахара или рафинированных, обработанных пищевых продуктов, также требуется больше ниацина ».
Даже у тех людей, которые вели малоподвижный образ жизни и начинают выполнять режим упражнений, добавки витамина B3 обладают преимуществами ниацина. В исследовании, опубликованном в журнале Journals of Gerontology (февраль 2010 г.) под названием «Реакция липидов и липопротеинов крови на ниацин с пролонгированным высвобождением, и физические упражнения у малоподвижных женщин в постменопаузе», было обнаружено, что с упражнениями или без них ниацин помогает снизить уровень жиров. в кровотоке.”
Дозировка
По общему мнению, добавку витамина B3 принимают в капсулах по 500 мг. Излюбленный способ приема ниацина — это замедленное высвобождение, поскольку ниацин вызывает покраснение кожи. Ниацин следует принимать во время еды.
[ii] Wu, BJ; Ян, Л; Чарльтон, Ф. Уиттинг, P; Бартер, PJ; Рожь, KA (2010). «Доказательства того, что ниацин подавляет острое сосудистое воспаление и улучшает эндотелиальную дисфункцию независимо от изменений липидов плазмы». Артериосклероз, тромбоз и сосудистая биология 30 (5): 968–75.
Витамин B3 (ниацин) — усилители гормона роста
Витамин B3, также называемый ниацином и никотиновой кислотой, является единственным витамином, который может выделять гормон роста. Этот водорастворимый витамин B играет жизненно важную роль в метаболизме клеток и помогает организму высвобождать энергию из белков, жиров и углеводов во время обмена веществ.
Активные формы витамина B3 включают никотинамидадениндинулеотид (НАД, кофермент I) и никотинамидадениндинуклеотидфосфат (НАДФ, кофермент II). Действуя как кофермент, ниацин способствует синтезу половых гормонов. Он также способствует хорошему пищеварению, стимулируя выработку соляной кислоты в желудке.
Дефицит витамина B3:
Дефицит ниацина приводит к состоянию под названием пеллагра , что в Италии означает толстая кожа.Это заболевание проявляется симптомами и признаками, связанными с кожей, пищеварительной системой и мозгом. Обычно он характеризуется триадой дерматита, диареи и деменции (DDD или 3D). Поражения кожи включают покраснение открытых участков, таких как руки, шея и лоб. Воспаление ротовой полости и кишечника, диарея, опухший и красный язык и повышенное слюноотделение — это симптомы пищеварения. Проблемы центральной нервной системы могут возникать в результате нехватки ниацина и проявляться в виде головных болей, бессонницы, нарушения памяти и агрессивного поведения, а в тяжелых случаях — бреда, делирия и слабоумия.Дефицит витамина B3 может возникать, когда кукуруза используется в качестве основной части рациона, а также в случаях дисбаланса аминокислот, диарейных заболеваний, алкоголизма, заболеваний печени, длительного лечения изониазидом (противотуберкулезный препарат), болезни Хартнупа (наследственная болезнь). нарушение обмена веществ) и некоторые виды рака.
Витамин B3, спорт и долголетие:
Витамин B3 обладает некоторыми полезными эффектами, которых нет у других витаминов. Он может улучшить спортивные результаты и оказать антивозрастное действие следующими четырьмя способами:
1.Научные исследования показали, что витамин B3 является высвобождающим гормоном роста. Самая мощная форма витамина B3, ксантинол никотинат, может повышать секрецию гормона роста. Дозировка витамина B3, высвобождающая GH, составляет от 200 до 1000 миллиграммов. Ниацин и аминокислоты, стимулирующие рост гормона роста, обладают синергетическим действием, то есть их использование может увеличить высвобождение гормона роста в большей степени, чем использование любой из них по отдельности. По этой причине неудивительно, что ниацин является частью стека аминокислот.
2.Ниацин может снизить уровень холестерина ЛПНП в крови, подавляя высвобождение свободных жирных кислот из жировых клеток. Витамин B3 способствует долголетию, снижая уровень холестерина и, следовательно, снижая уровень смертности от сердечно-сосудистых заболеваний, а также улучшая память и улучшая когнитивные способности.
3. НАДН , активная форма витамина B3, играет важную роль в производстве энергии на клеточном уровне. Чтобы производить больше энергии, клетке нужно больше НАДН. Также НАДН регулирует высвобождение гормона роста.Повышенная выработка энергии и секреция гормона роста могут повысить физическую работоспособность.
4. Возрастная бессонница может ускорить процесс старения. Витамин B3, наряду с витамином B6 , кальцием и триптофаном , останавливает процесс старения, влияя на уровень мелатонина — естественного гормона, также называемого «гормоном сна ».
Польза витамина B3 для неспортсменов:
Добавки витамина B3 можно использовать в случае дефицита из природных источников.Его также можно использовать для поддержки следующих условий:
- Алкогольная абстиненция.
- Высокий уровень холестерина.
- Высокий уровень триглицеридов.
- Остеоартроз.
- Перемежающаяся хромота.
- Болезнь Рейно.
- Беспокойство.
- Акне.
- Шизофрения.
- Менструация болезненная (дисменорея).
- Рассеянный склероз (МС).
- Катаракта.
- Гипогликемия.
- Низкая функция щитовидной железы.
- Поддержка ВИЧ.
- Поздняя дискинезия.
Пищевые источники витамина B3:
Основные пищевые источники ниацина включают мясо, печень, белое мясо, рыбу, пивные дрожжи, бобовые, арахис, бананы, цельнозерновые продукты, миндаль, авокадо, яйца и семена кунжута.
Источники растений: | Источники животных: |
Кукурузные хлопья Белый рис Картофель Авокадо Арахис Грибы | Куриная грудка Креветки Красное мясо Тунец Печень Голубая рыбка |
Дозировка и побочные эффекты:
Рекомендуемая суточная доза витамина B3 составляет от 13 до 15 мг.Рекомендуемая дозировка для спортсменов — от 20 до 100 мг. Как упоминалось ранее, доза высвобождения GH составляет от 200 до 1000 мг. При лечении высокого уровня холестерина и триглицеридов ниацин назначают в дозе 300 мг в день в разделенных дозах, которые следует принимать после еды. Но его можно постепенно увеличивать до 1,5-4,5 граммов в день.
Несмотря на то, что низкие дозы ниацина почти всегда безопасны, высокие дозы могут вызывать некоторые побочные эффекты, такие как покраснение, зуд, жжение или покалывание, головные боли и расстройство желудка.
Наиболее частым побочным эффектом ниацина является покраснение кожи, которое опосредуется высвобождением простагландинов D2 и E2. Приливы могут возникнуть при приеме всего от 50 до 100 мг натощак.
Покраснение кожи — безвредная, но неприятная реакция, которая обычно начинается в течение 10-20 минут после приема ниацина и часто длится до 30 минут. Прилив крови можно уменьшить одним из следующих способов: 1) начинать с более низких доз и постепенно увеличивать до более высоких доз, 2) принимать формы без промывания или пролонгированного действия, 3) принимать 300 мг аспирина примерно за 30 минут до приема ниацина, 4 ) прием 200-400 мг Адвила в день и 5) прием ниацина во время еды.Учитывая высокую дозу высвобождения GH, употребление ниацина с пищей снизит частоту покраснения.
Рекомендуемая суточная доза витамина B3: | ||
Категория / состояние | Возраст (лет) | Ниацин (мг) |
Младенец | 0.0–0,5 | 5 |
0,5 — 1,0 | 6 | |
Дети | 1–3 | 9 |
4–6 | 12 | |
7–10 | 13 | |
Самцы | 11–14 | 17 |
15–18 | 20 | |
19–24 | 19 | |
25–50 | 19 | |
> 50 | 15 | |
суки | 11–14 | 15 |
15–18 | 15 | |
19–24 | 15 | |
25–50 | 15 | |
> 50 | 13 | |
Беременность | 17 | |
Грудное вскармливание | 1-е 6 месяцев | 20 |
2-е 6 месяцев | 20 | |
Спортсмены | 20–100 | |
Высокие дозы витамина B3, от 500 до 1000 мг в день, могут вызвать воспаление желудка и повреждение глаз и печени.Он также может повысить уровень сахара и мочевой кислоты в крови. Поэтому высокие дозы ниацина не следует принимать людям с язвенной болезнью, активным заболеванием печени, диабетом и подагрой.
Ниацинамид, форма витамина B3, не обладает антихолестериновой активностью и не может вызывать покраснение, как ниацин.
Может ли ниацин B3 улучшить спортивные результаты?
Может ли простой водорастворимый витамин повысить умственную концентрацию, помочь в формировании нового и улучшенного телосложения и улучшить спортивные результаты? Это маловероятно, не так ли? Но когда витамином является ниацин, ответ должен быть «да».
Ниацин считается третьим открытым витамином группы B, и по этой причине он также известен как витамин B3. Он предлагает множество преимуществ, и его можно найти во многих различных типах пищевых добавок и даже в энергетическом напитке Red Bull.
Ниацин — одно из природных веществ, которое вы обязательно должны ввести в свой ежедневный рацион
Преимущества ниацина
- Повышает уровень энергии
- Обеспечивает мышцы кислородом и питательными веществами, которые им необходимы для роста
- Улучшает умственную концентрацию
- Увеличивает человеческий рост уровни гормонов более чем на 600%
Защитная сила ниацина
Когда люди тренируются, они создают нагрузку на организм во многих отношениях, и чем тяжелее тренировка, тем больше нагрузка.Наиболее очевидным примером является болезненность мышц, возникающая во время и / или после тренировки, но есть и другие эффекты, которые не так легко увидеть или почувствовать.
- Истощение эритроцитов: Физические упражнения также могут вызвать снижение количества эритроцитов. Эти клетки необходимы для транспортировки кислорода по телу. Если их количество становится чрезмерно истощенным, это вызывает состояние, называемое спортивной анемией. Использование качественной добавки ниацина может помочь поддерживать здоровый уровень эритроцитов.
- Окислительный стресс, вызванный физическими упражнениями: Связь между физическими упражнениями и повреждением тканей свободными радикалами доказана наукой. Исследования не смогли выявить источник производства оксидантов, но было показано, что добавки с ниацином «значительно снижают окислительный стресс».
Бодрящие силы ниацина
Создатели Red Bull решили добавить дозу ниацина не без уважительной причины. Это не стимулятор, но ниацин помогает организму получать энергию из углеводов, поступающих с пищей.Достаточный уровень сахара в крови может защитить от ранней усталости во время занятий спортом и тренировок.
Ниацин не является спорным соединением, и его можно свободно использовать в качестве добавок.
Способность ниацина помочь вам расти
Все вышеупомянутые качества ниацина могут помочь людям активизировать свои тренировки и пожинать плоды, которые неизбежно возникают в результате повышения уровня активности, но ниацин предлагает еще два преимущества, а именно: особенно примечательно.
- Ниацин вызывает расширение сосудов: Это состояние, при котором кровеносные сосуды слегка расширяются, улучшая кровоток и позволяя всем тканям тела получать пользу от улучшенного снабжения кислородом и питательными веществами. Фокусировка на металле и его функции улучшатся, потому что мозг полагается на кровь, которая снабжает его необходимыми питательными веществами. Уровень выносливости повысится, потому что в мышцах будет больше того, что им нужно, а улучшенный кровоток поможет избавиться от молочной кислоты, которая может ограничивать физические возможности.Способность ниацина вызывать расширение сосудов подтверждается исследованием, проведенным в Университете Западной Австралии, и он имеет такую хорошую репутацию в плане получения результатов, что является ключевым ингредиентом многих лучших предтренировочных добавок.
- Ниацин Boost Производство гормона роста человека: Организм вырабатывает замечательное соединение, называемое гормоном роста человека (HGH), которое укрепляет иммунную систему и помогает людям расти. Уровень гормона роста у детей очень высок, потому что им еще многое предстоит сделать, но в подростковом возрасте уровень гормона роста значительно снижается, и снижение продолжается с каждым годом.Многочисленные исследования показывают, что добавка ниацина заставляет организм увеличивать выработку гормона роста, и, когда добавка принимается за несколько часов до начала упражнений, уровень гормона роста может быть увеличен более чем на 600%. Это очень желательная ситуация, потому что гормон роста может повысить уровень тестостерона, улучшить рост мышц, повысить уровень энергии и стимулировать сжигание жира.
Прилив ниацина
Добавки ниацина часто вызывают ощущение, называемое приливом ниацина. Во многом это немного похоже на покраснение, потому что кожа краснеет и начинает немного «гореть».Это может сопровождаться незначительным кожным зудом. Эффект обычно проявляется вскоре после приема добавок и длится недолго. Некоторым людям этот опыт очень нравится, но он может стать большим сюрпризом для любого, кто впервые принимает добавку, содержащую ниацин, и не знает, чего ожидать.
Вкратце
Ниацин — это форма витамина B, которая защищает организм от многих негативных последствий физических упражнений (истощение эритроцитов, окислительный стресс, накопление молочной кислоты).Он также помогает людям тренироваться усерднее и получать лучшие результаты благодаря своей способности обеспечивать расширение сосудов и повышать уровень гормона роста.



 Но, тем не менее, следует избегать
передозировки витамина. Хотя аскорбиновая кислота нетоксична и ее избыток выводится из организма, все же потребление ее в
слишком больших количествах может вызвать аллергическую реакцию. При гиповитаминозе С отмечаются нарушения общего состояния
организма (снижение работоспособности, быстрая утомляемость, слабость, раздражительность), склонность к кровоточивости десен,
железодефицитная анемия.
Но, тем не менее, следует избегать
передозировки витамина. Хотя аскорбиновая кислота нетоксична и ее избыток выводится из организма, все же потребление ее в
слишком больших количествах может вызвать аллергическую реакцию. При гиповитаминозе С отмечаются нарушения общего состояния
организма (снижение работоспособности, быстрая утомляемость, слабость, раздражительность), склонность к кровоточивости десен,
железодефицитная анемия. Он необходим для роста, развития и обновления (регенерации) тканей, поддержания активности иммунной зашиты, предохранения
от поражений кожи и слизистых оболочек, для обеспечения зрения. От витамина А зависит защитная способность организма, его
покровных тканей — кожи, слизистых оболочек. Поэтому нередко этот витамин называют «первой линией обороны
против болезней».
Он необходим для роста, развития и обновления (регенерации) тканей, поддержания активности иммунной зашиты, предохранения
от поражений кожи и слизистых оболочек, для обеспечения зрения. От витамина А зависит защитная способность организма, его
покровных тканей — кожи, слизистых оболочек. Поэтому нередко этот витамин называют «первой линией обороны
против болезней». Страдают также органы зрения — теряется способность
видеть в сумерках, развиваются явления конъюнктивита и сухость роговицы.
Страдают также органы зрения — теряется способность
видеть в сумерках, развиваются явления конъюнктивита и сухость роговицы. 

 Возникает также глоссит
(воспаление языка), нарушается секреция желудочного сока, раз��иваются упорные поносы. Поражение кожи характеризуется симметричным
воспалением (дерматитом) лица и открытых частей тела.
Возникает также глоссит
(воспаление языка), нарушается секреция желудочного сока, раз��иваются упорные поносы. Поражение кожи характеризуется симметричным
воспалением (дерматитом) лица и открытых частей тела.