Дистанционный репетитор — онлайн-репетиторы России и зарубежья
КАК ПРОХОДЯТ
ОНЛАЙН-ЗАНЯТИЯ?
Ученик и учитель видят и слышат
друг друга, совместно пишут на
виртуальной доске, не выходя из
дома!
КАК ВЫБРАТЬ репетитора
Выбрать репетитора самостоятельно
ИЛИ
Позвонить и Вам поможет специалист
8 (800) 333 58 91
* Звонок является бесплатным на территории РФ
** Время приема звонков с 10 до 22 по МСК
ПОДАТЬ ЗАЯВКУ
Россия +7Украина +380Австралия +61Белоруссия +375Великобритания +44Израиль +972Канада, США +1Китай +86Швейцария +41
Выбранные репетиторы
Заполните форму, и мы быстро и бесплатно подберем Вам дистанционного репетитора по Вашим пожеланиям.
Менеджер свяжется с Вами в течение 15 минут и порекомендует специалиста.
Отправляя форму, Вы принимаете Условия использования и даёте Согласие на обработку персональных данных
Вы также можете воспользоваться
расширенной формой подачи заявки
Как оплачивать и СКОЛЬКО ЭТО СТОИТ
от
800 до 5000 ₽
за 60 мин.
и зависит
ОТ ОПЫТА и
квалификации
репетитора
ОТ ПОСТАВЛЕННЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
(например, подготовка к олимпиадам, ДВИ стоит дороже, чем подготовка к ЕГЭ)
ОТ ПРЕДМЕТА (например, услуги репетиторовиностранных языков дороже)
Оплата непосредственно репетитору, удобным для Вас способом
Почему я выбираю DisTTutor
БЫСТРЫЙ ПОДБОР
ИНДИВИДУАЛЬНЫЙ ПОДХОД
ОПТИМАЛЬНОЕ
СООТНОШЕНИЕ ЦЕНЫ И
КАЧЕСТВА
ПРОВЕРЕНЫ ДОКУМЕНТЫ ОБ ОБРАЗОВАНИИ У ВСЕХ РЕПЕТИТОРОВ
НАДЕЖНОСТЬ И ОПЫТ.
DisTTutor на рынке с 2008 года.
ПРОВЕДЕНИЕ БЕСПЛАТНОГО, ПРОБНОГО УРОКА
ЗАМЕНА РЕПЕТИТОРА, ЕСЛИ ЭТО НЕОБХОДИМО
376737 УЧЕНИКОВ ИЗ РАЗНЫХ СТРАН МИРА
уже сделали свой выбор
И вот, что УЧЕНИКИ ГОВОРЯТ
о наших репетиторах
Чулпан Равилевна Насырова
«
Я очень довольна репетитором по химии. Очень хороший подход к ученику,внятно объясняет. У меня появились сдвиги, стала получать хорошие оценки по химии. Очень хороший преподаватель. Всем , кто хочет изучать химию, советую только её !!!
«
Алина Крякина
Надежда Васильевна Токарева
«
Мы занимались с Надеждой Васильевной по математике 5 класса. Занятия проходили в удобное для обоих сторон время. Если необходимо было дополнительно позаниматься во внеурочное время, Надежда Васильевна всегда шла навстречу. Ей можно было позванить, чтобы просто задать вопрос по непонятной задачке из домашнего задания. Моя дочь существенно подняла свой уровень знаний по математике и начала демонстрировать хорошие оценки.
«
Эльмира Есеноманова
Ольга Александровна Мухаметзянова
«
Подготовку к ЕГЭ по русскому языку мой сын начал с 10 класса. Ольга Александровна грамотный педагог, пунктуальный, ответственный человек. Она всегда старается построить занятие так, чтобы оно прошло максимально плодотворно и интересно. Нас абсолютно все устраивает в работе педагога. Сотрудничество приносит отличные результаты, и мы его продолжаем. Спасибо.
«
Оксана Александровна
Наталья Борисовна Карасева
«
Мы восторге от репетитора. Наталья Борисовна грамотный педагог, она любит свою профессию, любит учеников. Занятия с сыном (2 класс), он находится на домашнем обучении, проходят по скайпу в комфортной обстановке. Репетитор умеет заинтересовать ребенка и выстраивает занятие с учетом его способностей, доступно объясняя предметы русский язык и математику. По результатам занятий можно сразу заметить повышение уровня успеваемости ученика. Наталья Борисовна хороший педагог, умеет быстро найти общий язык с ребенком, внимательная, легко передающая знания ученику. С большим удовольствием будем продолжать наши занятия, т.к. мы всем довольны.
По результатам занятий можно сразу заметить повышение уровня успеваемости ученика. Наталья Борисовна хороший педагог, умеет быстро найти общий язык с ребенком, внимательная, легко передающая знания ученику. С большим удовольствием будем продолжать наши занятия, т.к. мы всем довольны.
«
Елена Васильевна
Клиентам
- Репетиторы по русскому языку
- Репетиторы по химии
- Репетиторы по биологии
- Репетиторы английского языка
- Репетиторы немецкого языка
Репетиторам
- Регистрация
- Публичная оферта
- Библиотека
- Бан-лист репетиторов
Партнеры
- ChemSchool
-
PREPY.
 RU
RU
- Class
Вода / Энциклопедия / Pozhproekt.ru
Вода
Вода — основное огнетушащее средство, наиболее доступное и универсальное. Хорошее охлаждающее свойство воды обусловлено её высокой теплоёмкостью. При попадании на горящее вещество вода частично испаряется и превращается в пар. При испарении её объём увеличивается в 1700 раз, благодаря чему кислород воздуха вытесняется из зоны очага пожара водяным паром. Вода, имея высокую теплоту парообразования, отнимает от горящих материалов и продуктов горения большое количество теплоты, что делает её незаменимым средством охлаждения. Вода обладает высокой термической стойкостью, её пары только при температуре свыше 1700°С могут разлагаться на водород и кислород. В связи с этим тушение водой большинства твёрдых материалов (древесины, пластмасс, каучука и др. ) безопасно, т. к. температура горения их не превышает 1300°С. Однако взаимодействие воды с щелочными и щёлочноземельными металлами, которые при горении создают в зоне пожара температуру, превышающую термическую стойкость воды, может привести к тяжёлым последствиям (например, к
) безопасно, т. к. температура горения их не превышает 1300°С. Однако взаимодействие воды с щелочными и щёлочноземельными металлами, которые при горении создают в зоне пожара температуру, превышающую термическую стойкость воды, может привести к тяжёлым последствиям (например, к
Вода имеет низкую теплопроводность, что способствует созданию на поверхности горящего материала надежной тепловой изоляции. Это свойство в сочетании с предыдущими допускает использование ее не только для тушения, но и для защиты материалов от воспламенения. Малая вязкость и несжимаемость воды позволяет подавать её по пожарным рукавам на значительные расстояния и под большим давлением. Вода способна растворять некоторые газы и пары, поглощать аэрозоли, снижать температуру в помещениях. Воду применяют также для защиты от теплового излучения (водяная завеса), для охлаждения нагретых поверхностей строительных конструкций сооружений, установок, для осаждения продуктов горения на пожарах в зданиях.
Наряду с этим у воды имеются и отрицательные свойства. Основной ее недостаток как огнетушащего средства — высокое поверхностное натяжение. Поэтому она плохо смачивает твёрдые материалы и особенно волокнистые вещества. Для повышения огнетушащей эффективности к ней добавляют: ПАВ (смачиватели), снижающие поверхностное натяжение воды; загустители, повышающие вязкость воды; высокомолекулярные добавки, увеличивающие ламинарный слой в потоке («скользкая вода»), и пенообразователи. Известно применение водяного пара для тушения пожаров в замкнутых объёмах, а также перегретой воды с температурой свыше 100°С.
10 августа 2008, 11:55 Екатерина
0 5681 0
Структура и свойства воды
Вода является ценным природным ресурсом. Вода необходима для выживания всех живых существ. Мы не можем представить мир без воды. Вода требуется животным и растениям для завершения их повседневной метаболической деятельности. Вода необходима растениям для синтеза пищи в процессе фотосинтеза. Мы все можем прожить дни без еды, но не можем представить дни без воды; без воды даже растения засыхают и сбрасывают листья.
Вода — бесцветное и прозрачное химическое вещество, которое является основным компонентом рек, океанов и озер земной коры. Это важная жидкость, которая играет важную роль в выживании жизни на Земле.
H 2 O — химическая формула воды. Он состоит из двух атомов водорода и одного атома кислорода, соединенных ковалентными связями. Эта жидкость составляет 71% земной поверхности.
Состояние воды
- Вода в твердом состоянии называется льдом. Вода замерзает, образуя лед, при 0 градусов по Цельсию (точка замерзания воды).
- Вода в жидком состоянии покрывает большую часть земной поверхности. Он используется в самых разных приложениях.
- Водяной пар представляет собой газообразное состояние воды. Вода достигает точки кипения при 100 градусах Цельсия и превращается в водяной пар.
Физические свойства воды
- Химическая формула: H 2 O — это химическая формула воды, как мы все знаем. Ковалентные связи существуют между атомами водорода и кислорода в молекуле воды. Один атом кислорода образует соединение с двумя атомами водорода.

- Внешний вид: В естественном состоянии вода представляет собой бесцветную жидкость без запаха и вкуса.
- Температура кипения: Температура кипения воды 100 градусов по Цельсию, как мы все знаем. Однако сравнительно высокая температура кипения воды нарушает тенденцию таблицы Менделеева. Водород (следующий гидрид) имеет относительно высокую температуру кипения по сравнению с теллуридом водорода и сероводородом, оба из которых имеют низкие температуры кипения. Это связано с чрезвычайно сильными водородными связями в молекуле воды. Для того, чтобы они сломались и начали кипеть, требуется много энергии.
- Температура замерзания: То же самое относится к температуре замерзания воды. Вода имеет температуру замерзания 0 градусов по Цельсию. Тот факт, что воде требуется много времени, чтобы замерзнуть (или даже закипеть), имеет решающее значение для существования нашей экосистемы.
- Плотность: Одним из замечательных свойств воды является то, что она плотная в проданном состоянии.
 Плотность воды увеличивается по мере ее охлаждения до 4°С. Однако после этого вода становится менее плотной. Из-за этого лед плавает в воде.
Плотность воды увеличивается по мере ее охлаждения до 4°С. Однако после этого вода становится менее плотной. Из-за этого лед плавает в воде. - Вязкость: Из-за очень сильных межмолекулярных взаимодействий вода имеет высокую вязкость.
- Растворимость: Вода является высокоэффективным растворителем. Его даже называют универсальным растворителем.
Химические свойства воды
- Амфотерная природа: Вода амфотерна по своей природе, потому что она может действовать как кислота и как основание. Следующие две реакции показывают, что вода имеет амфотерную природу.
Н 2 O (ж) + HCl (водн.) ⇌ H 3 O + + Cl –
H 2 900 13 O (ж) + NH 3 (водн.) ⇌ NH 4 + + OH –
- Окислительно-восстановительные реакции: Вода восстанавливается до молекулы водорода с помощью электроположительных элементов.
 В результате вода является богатым источником водорода. Вода окисляется до O 2 в процессе фотосинтеза. Вода очень полезна в окислительно-восстановительных реакциях, потому что она может окисляться и восстанавливаться.
В результате вода является богатым источником водорода. Вода окисляется до O 2 в процессе фотосинтеза. Вода очень полезна в окислительно-восстановительных реакциях, потому что она может окисляться и восстанавливаться. - Реакция гидролиза: Из-за своей диэлектрической проницаемости вода имеет очень сильную склонность к гидратации. Он растворяет широкий спектр ионных соединений. Вода может гидролизовать некоторые ковалентные и ионные соединения.
Структура воды
Жидкая вода
Молекула воды состоит из двух атомов водорода, соединенных одной химической связью с атомом кислорода. Ядра большинства атомов водорода полностью состоят из протонов. Вода содержит две изотопные формы, дейтерий и тритий, в которых атомные ядра также содержат один и два нейтрона соответственно. Оксид дейтерия (D 2 O), также известная как тяжелая вода, используется в химических исследованиях и в качестве замедлителя нейтронов в некоторых ядерных реакторах.
Атомы водорода в молекулах воды притягиваются к областям с высокой электронной плотностью и могут образовывать слабые связи, известные как водородные связи, с этими областями. Это означает, что атомы водорода в одной молекуле воды притягиваются к несвязывающим электронным парам атома кислорода соседней молекулы воды. Считается, что структура жидкой воды состоит из агрегатов молекул воды, которые постоянно образуются и переформируются. Другие необычные свойства воды, такие как ее высокая вязкость и поверхностное натяжение, объясняются этим ближним порядком.
Структуры льда
Межмолекулярные взаимодействия в твердом состоянии (лед) приводят к высокоупорядоченной, но рыхлой структуре, в которой каждый атом кислорода окружен четырьмя атомами водорода, два из которых ковалентно связаны с атомом кислорода и два других (на больших расстояниях) связаны водородной связью с неподеленными электронными парами атома кислорода.
Из-за своей открытой структуры лед имеет меньшую плотность, чем жидкая вода, в которой упорядоченная структура частично нарушена, а молекулы воды (в среднем) расположены ближе друг к другу. В зависимости от условий вода может замерзнуть в различные структуры.
В зависимости от условий вода может замерзнуть в различные структуры.
Значение структуры жидкой воды
- Жидкое состояние воды имеет очень сложную структуру, которая, несомненно, включает значительную ассоциацию молекул. Из-за обширных водородных связей между молекулами в жидкой воде значения таких свойств, как вязкость, поверхностное натяжение и температура кипения, намного выше, чем можно было бы ожидать для типичной жидкости с небольшими молекулами. В отличие от конденсированных состояний воды (твердого и жидкого), которые имеют обширную связь между молекулами воды, газообразная (парообразная) фаза имеет относительно независимые молекулы воды, разделенные большими расстояниями.
- Полярность молекулы воды важна при растворении ионных соединений во время образования водного раствора. Океаны на Земле содержат огромное количество растворенных солей, которые являются ценными природными ресурсами. Кроме того, сотни химических реакций, которые происходят каждую секунду, чтобы поддерживать жизнь организмов, происходят в водных жидкостях.
 Кроме того, растворимость в воде таких веществ, как сахар и соль, позволяет придавать пищевым продуктам аромат во время их приготовления. Хотя растворимость растворенного вещества в воде является очень сложным процессом, решающее значение имеет взаимодействие между полярными молекулами воды и растворенным веществом.
Кроме того, растворимость в воде таких веществ, как сахар и соль, позволяет придавать пищевым продуктам аромат во время их приготовления. Хотя растворимость растворенного вещества в воде является очень сложным процессом, решающее значение имеет взаимодействие между полярными молекулами воды и растворенным веществом. - Когда ионное твердое вещество растворяется в воде, анионы притягивают положительные концы молекул воды, а катионы притягивают отрицательные концы. Это известно как гидратация. Гидратация ионов соли приводит к ее распаду (растворению) в воде. В процессе растворения сильные силы, существовавшие между положительными и отрицательными ионами твердого тела, заменяются сильными взаимодействиями ионов воды.
Значение воды
- Сельское хозяйство является наиболее важным видом использования воды. Орошение необходимо для сельского хозяйства, а вода является важнейшим компонентом в производстве продуктов питания.
- В зависимости от размера тела человеческое тело содержит от 50 до 78 % воды.
 Чтобы избежать обезвоживания, люди должны выпивать 7 литров воды в день.
Чтобы избежать обезвоживания, люди должны выпивать 7 литров воды в день. - Необходим для пищеварения, а также других биологических процессов, происходящих в живых организмах. Это необходимо для поддержания рН тела. Он также помогает в движении антител иммунной системы.
- Помогает регулировать температуру тела. Вода обеспечивает организму необходимый охлаждающий эффект.
- Через пот и мочеиспускание вода вымывает вредные токсины из организма. Он предотвращает накопление отходов в живых организмах.
- Применяется для создания эмульсий и растворов, используемых в процессе стирки.
- Бытовое потребление воды составляет 15% от общего водопотребления. Вода используется для питья, купания, приготовления пищи и мытья посуды, одежды, фруктов и овощей, а также для чистки зубов.
- Используется либо при создании продукта, либо для охлаждения оборудования, используемого при создании продукта. Промышленная вода используется для мытья, охлаждения, обработки, транспортировки, разбавления или изготовления продукта.
 Большая часть воды используется в производстве химикатов, бумаги и продуктов питания.
Большая часть воды используется в производстве химикатов, бумаги и продуктов питания. - Он используется в транспорте, производстве, гидроэнергетике, удалении отходов тела, туризме и отдыхе.
Образец
Вопрос sВопрос 1: Какое использование воды является наиболее важным?
Ответ:
Потребление воды в домашних условиях является наиболее значительным повседневным потреблением воды для большинства людей. Бытовое использование относится к воде, используемой в доме ежедневно, например, для питья, приготовления пищи, купания, мытья одежды и посуды, смыва туалетов и орошения газонов и садов.
Вопрос 2. Дает ли вода энергию?
Ответ:
Вода содержит два типа электричества, а также множество других веществ. Кинетическая энергия считается первым видом энергии. Это электричество, такое как действие, которое используется во время выполнения процесса.
Вода может течь в результате кинетической энергии, и могут образовываться волны.
Вопрос 3. Каков естественный источник воды?
Ответ:
Питьевую воду получают из природных источников, таких как подземные или морские воды. Подземные воды образуются, когда снег и дождь просачиваются сквозь землю. Вода собирается в открытых помещениях и порах, а также в песчано-гравийных отложениях, известных как водоносные горизонты.
Вопрос 4. Что такое водородная связь?
Ответ:
Водородная связь представляет собой электростатическую силу притяжения между атомом водорода, который ковалентно связан с более электроотрицательным атомом или группой, и другим электроотрицательным атомом с одной парой электронов — акцептором водородной связи.
Вопрос 5. Что такое внутримолекулярная водородная связь?
Ответ:
Внутримолекулярные водородные связи возникают в пределах одной молекулы.
Когда две функциональные группы молекулы могут образовывать водородные связи друг с другом, это происходит.
Химия воды
Вода Химия
Вы вероятно, знаю, что химическое описание воды H 2 O. Молекула воды состоит из одного атома кислорода, связанного с двумя атомами водорода. Водород атомы «прикрепляются» к одной стороне атома кислорода, в результате чего молекула воды, имеющая положительный заряд на той стороне, где атомы водорода и отрицательный заряд с другой стороны, где находится атом кислорода. С противоположные электрические заряды притягиваются, молекулы воды притягиваются друг к другу, делает воду «липкой». Сторона с атомами водорода (положительная заряд) притягивает кислородную сторону (отрицательный заряд) другой молекулы воды.
Все эти молекулы воды
притяжение друг к другу означает, что они склонны слипаться. Вот почему вода
капли и есть капли! Если бы не некоторые земные силы, такие как
гравитации, капля воды имела бы форму шара — идеальная сфера. Даже если
на Земле она не образует идеальной сферы, мы должны радоваться, что вода липкая.
Даже если
на Земле она не образует идеальной сферы, мы должны радоваться, что вода липкая.
Воду называют «универсальным растворитель», потому что он растворяет больше веществ, чем любая другая жидкость. Это означает, что куда бы вода ни текла, будь то через землю или через наши тела, он берет с собой ценные химические вещества, минералы и питательные вещества.
Чистая вода имеет нейтральный рН. Чистая вода имеет рН около 7, что не является ни кислой, ни щелочной.
Вода
Физические свойства:
Вода уникальна
в том, что это единственное природное вещество, которое находится во всех трех состояниях
— жидкие, твердые (лед) и газообразные (пар) — при обычных температурах
на земле. Земная вода постоянно взаимодействует, изменяется и находится в движении.
Вода
замерзает при 32 по Фаренгейту (F) и кипит при 212 F. На самом деле вода замерзает
а точки кипения являются базовой линией, с которой измеряется температура: 0
по шкале Цельсия — температура замерзания воды, а 100 — температура кипения воды.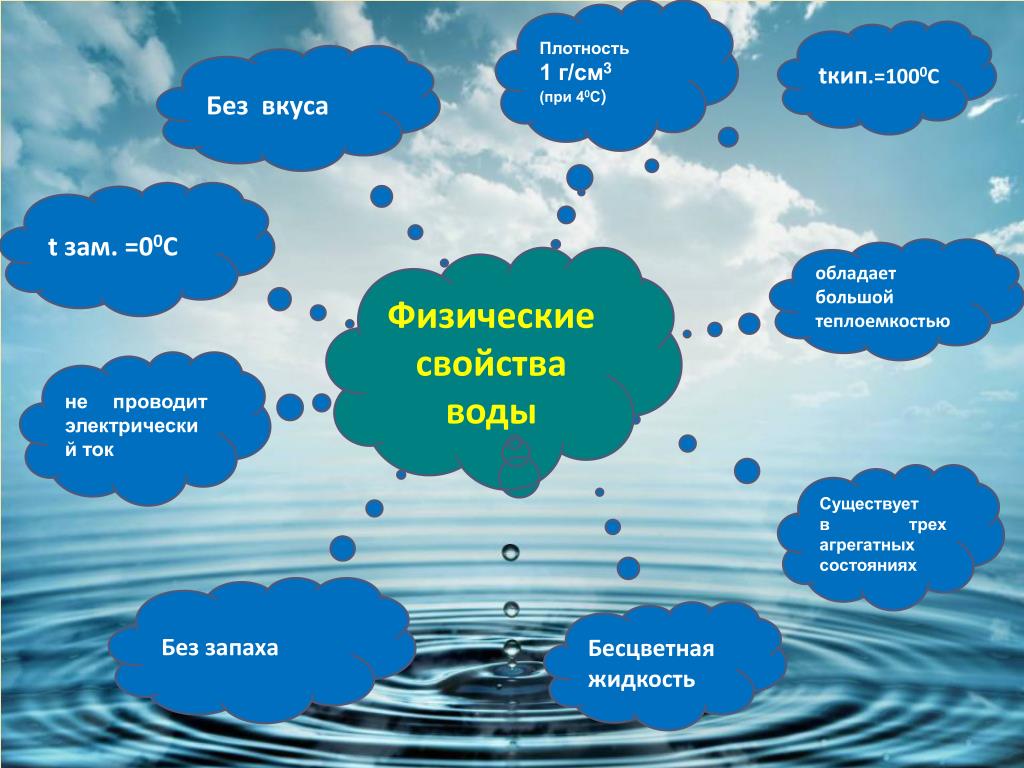 точка. Вода необычна тем, что ее твердая форма, лед, менее плотна, чем
жидкая форма, поэтому лед плавает.
точка. Вода необычна тем, что ее твердая форма, лед, менее плотна, чем
жидкая форма, поэтому лед плавает.
Вода имеет высокий удельный показатель теплоемкости. Это означает, что вода может поглощать много тепла. прежде чем он начнет нагреваться. Вот почему вода ценна для промышленности и в радиаторе вашего автомобиля в качестве охлаждающей жидкости. Высокая удельная теплоемкость воды также помогает регулировать скорость изменения температуры воздуха, поэтому изменение температуры между сезонами скорее постепенное, чем резкое, особенно возле океанов.
Вода имеет
очень высокое поверхностное натяжение. Другими словами, вода липкая и эластичная,
и имеет тенденцию слипаться в капли, а не растекаться тонкой пленкой.
Поверхностное натяжение отвечает за капиллярное действие, которое позволяет воде (и
его растворенных веществ) перемещаться по корням растений и через
крошечные кровеносные сосуды в наших телах.
Вода
температура:
Температура воды
важно не только для пловцов и рыбаков, но и для промышленности и
даже рыбы и водоросли. Много воды используется для охлаждения в энергетике.
установки, вырабатывающие электроэнергию. Для начала им нужна прохладная вода, и
они обычно выпускают более теплую воду обратно в окружающую среду. Температура
высвобожденной воды может повлиять на среду обитания ниже по течению. Температура также может
влияют на способность воды удерживать кислород, а также на способность организмов
сопротивляться некоторым загрязняющим веществам.
pH:
pH является мерой
насколько кислой/основной является вода. Диапазон варьируется от 0 до 14, где 7 означает нейтральное значение.
рН менее 7 указывает на кислотность, тогда как рН более 7 указывает на кислотность.
база. рН на самом деле является мерой относительного количества свободного водорода и
гидроксильных ионов в воде. Вода, в которой больше свободных ионов водорода, считается кислой.
тогда как вода, в которой больше свободных гидроксильных ионов, является щелочной. Так как pH может быть затронут
химическими веществами в воде, рН является важным показателем воды, который меняется
химически. pH сообщается в «логарифмических единицах», таких как шкала Рихтера.
шкала, которая измеряет землетрясения. Каждое число представляет 10-кратное изменение
в кислотности/основности воды. Вода с рН 5 в десять раз больше
кислее, чем вода, имеющая рН шесть.
Вода, в которой больше свободных ионов водорода, считается кислой.
тогда как вода, в которой больше свободных гидроксильных ионов, является щелочной. Так как pH может быть затронут
химическими веществами в воде, рН является важным показателем воды, который меняется
химически. pH сообщается в «логарифмических единицах», таких как шкала Рихтера.
шкала, которая измеряет землетрясения. Каждое число представляет 10-кратное изменение
в кислотности/основности воды. Вода с рН 5 в десять раз больше
кислее, чем вода, имеющая рН шесть.
Загрязнение
может изменить рН воды, что, в свою очередь, может нанести вред животным и растениям, живущим
в воде. Например, вода, вытекающая из заброшенной угольной шахты, может
иметь pH 2, что очень кисло и определенно повлияет на любую рыбу
достаточно сумасшедший, чтобы попытаться жить в нем! Используя логарифмическую шкалу, эта дренажная шахта
вода будет в 100 000 раз более кислой, чем нейтральная вода, так что держитесь подальше
заброшенных шахт.
Специфический
Проводимость:
Удельная проводимость
является мерой способности воды проводить электрический ток. Это
сильно зависит от количества растворенных твердых веществ (например, соли) в
вода. Чистая вода, например дистиллированная, имеет очень низкую удельную
проводимость, а морская вода будет иметь высокую удельную проводимость. Дождевая вода
часто растворяет переносимые по воздуху газы и переносимую по воздуху пыль, находясь в воздухе,
и поэтому часто имеет более высокую удельную проводимость, чем дистиллированная вода. Специфический
электропроводность является важным показателем качества воды, поскольку она дает хорошие
представления о количестве растворенного вещества в воде.
Возможно
в школе вы провели эксперимент, подключив батарейку к свету
лампочку и протяните два провода от аккумулятора в стакан с водой. Когда провода
помещают в стакан с дистиллированной водой, свет не загорится. Но
лампочка загорается, когда в стакане находится соленая вода (солевой раствор). В солевом растворе
воды соль растворилась, высвободив свободные электроны, и вода
проводить электрический ток.
Но
лампочка загорается, когда в стакане находится соленая вода (солевой раствор). В солевом растворе
воды соль растворилась, высвободив свободные электроны, и вода
проводить электрический ток.
Мутность:
Мутность
является мерой мутности воды. Измеряется при прохождении луча
света сквозь воду и видя, насколько сильно он отражается от частиц
в воде. Помутнение воды вызвано такими материалами, как грязь и остатки
из листьев, то есть подвешенных (плавающих) в воде. Кристально чистая вода,
таких как озеро Тахо (где упорно трудятся, чтобы не допустить смывания отложений в
озеро) имеет очень низкую мутность. Но посмотрите на реку после бури — она
скорее всего коричневый. Вы видите всю взвешенную почву в воде. Удачливый
для нас материалы, вызывающие мутность в нашей питьевой воде, либо оседают
или фильтруются до того, как вода попадает в наш стакан для питья дома.
Мутность измеряется в нефелометрических единицах мутности (NTU).
Распущен
Кислород:
Хотя вода
молекулы содержат атом кислорода, этот кислород не то, что нужно водным
организмы, живущие в наших природных водах. Небольшое количество кислорода, примерно
десять молекул кислорода на миллион воды фактически растворены в воде.
Этим растворенным кислородом дышат рыбы и зоопланктон, и он необходим им.
им выжить.
Быстро
движущаяся вода, например, в горном ручье или большой реке, как правило, содержит
много растворенного кислорода, а стоячая вода содержит мало. Процесс
где бактерии в воде помогают органическим веществам, таким как то, что происходит из
очистные сооружения, тление потребляет кислород. Таким образом, избыток органического материала
в наших озерах и реках может привести к кислородной недостаточности.
Водным обитателям может быть тяжело в стоячей воде, в которой много гниения,
органических веществ в нем, особенно летом, когда уровень растворенного кислорода
находятся на сезонном минимуме.
Твердость:
Количество
растворенных в воде кальция и магния определяет ее «жесткость».
Жесткость воды варьируется на всей территории Соединенных Штатов. Если вы живете в районе
где вода «мягкая», то вы, возможно, никогда даже не слышали о
жесткость воды. Но если вы живете во Флориде, Нью-Мексико, Аризоне, Юте, Вайоминге,
Небраска, Южная Дакота, Айова, Висконсин или Индиана, где вода относительно
жесткий, вы можете заметить, что при мытье трудно получить пену
свои руки или одежду. И предприятиям в вашем районе, возможно, придется потратить деньги
для смягчения воды, так как жесткая вода может повредить оборудование. Жесткая вода может
даже сократить срок службы тканей и одежды! Означает ли это, что студенты
которые живут в районах с жесткой водой, следят за модой с момента своего рождения.
одежда изнашивается быстрее?
Подвесной
Осадок:
Подвесной
осадок — это количество почвы, движущейся по течению. Это сильно зависит
от скорости течения воды, так как быстротекущая вода может подхватывать и приостанавливать
больше почвы, чем спокойной воды. Во время штормов почву смывает с берегов ручья.
в поток. Количество, которое смывается в поток, зависит от типа
земли в водосборном бассейне реки и растительности, окружающей реку.
Это сильно зависит
от скорости течения воды, так как быстротекущая вода может подхватывать и приостанавливать
больше почвы, чем спокойной воды. Во время штормов почву смывает с берегов ручья.
в поток. Количество, которое смывается в поток, зависит от типа
земли в водосборном бассейне реки и растительности, окружающей реку.
Если земля нарушается вдоль ручья и не принимаются меры по охране, то превышение осадок может нанести вред качеству воды в ручье. Вы, наверное, видели такие короткие пластиковые заборы, которые строители поставили по краям участка. развиваются. Эти заграждения от ила должны задерживать отложения во время ливня. и не позволяйте ему смываться в ручей, так как избыток наносов может повредить ручьям, реки, озера и водохранилища.
Осадок
заход в водоем всегда вызывает беспокойство; как только он входит, он не может получить
наружу — большая часть осядет на дно. Резервуары могут «заиливать»
если в них попадает слишком много осадка. Объем резервуара уменьшается,
что приводит к уменьшению площади для катания на лодках, рыбалки и отдыха, а также к сокращению
мощность электростанции на плотине.
Объем резервуара уменьшается,
что приводит к уменьшению площади для катания на лодках, рыбалки и отдыха, а также к сокращению
мощность электростанции на плотине.
Водный
Геохимия раствора:
Смотри
на схеме гидрогеохимического цикла.
- Кислота = вещество содержащий водород, который дает свободный водород (H + ) при растворении в воде
- Основание = вещество содержащий группу ОН, которая дает свободный (ОН —) при растворении в воде
Например:
- pH = обратный логарифм концентрации (активности) свободного H + , или pH = -log [Н + ]
- диапазоны pH при 25С от 0 до 14; pH < 7 = кислый раствор; pH > 7 = основной раствор.
Если добавить HCl или другую кислоту, pH уменьшится; если NaOH или другое основание
добавляется, тогда pH увеличивается.

- pH увеличивает как угольная кислота (слабая кислота) диссоциирует: Когда углекислый газ объединяется с водой, например, что происходит в атмосфере, когда ископаемое топливо сгорает, образуется угольная кислота: H 2 О + СО 2 ==> Н 2 СО 3 . Доступны бесплатные H + во время последовательных диссоциаций:
Н 2 CO 3 ==> H + + HCO 3- угольная кислота в бикарбонат, происходит при рН ~6,4
ХСО 3 ==> Н + + CO 3 2- бикарбонат до карбоната, происходит при рН ~10,3
Помните, бесплатно H + доступен только в кислой среде или при pH < ~ 7. Диссоциация бикарбоната
карбонатизация происходит, когда в системе слишком много OH — и
H + «освобождается», чтобы сбалансировать базу.
- Растворенные катионы
и анионы в воде
Катионы = доноры электронов, положительно заряженные: Na + , K + , Mg ++ , Ca ++ , Fe ++ или Fe +++ , Мн ++ , Ал +++
Анионы = электрон акцепторы, отр. заряжены: Cl — , F — , I — , 9 комн.0076 — , СО 4 — , СО 3 — , HCO 3 — , № 3 — , № 2 —
Металлы = акт в основном подобные катионы: Cu, Zn, Pb, Co, Ni, Cr, As, Se, Mo и др.
- Анализы воды — Необходимо наличие катионно-анионного баланса
миллиэквивалент (MEQ) = молярный эквивалентный заряд или анион или катион, мера общего заряда из-за
рассматриваемый ион растворяется в растворе.
 RU
RU


 Плотность воды увеличивается по мере ее охлаждения до 4°С. Однако после этого вода становится менее плотной. Из-за этого лед плавает в воде.
Плотность воды увеличивается по мере ее охлаждения до 4°С. Однако после этого вода становится менее плотной. Из-за этого лед плавает в воде. В результате вода является богатым источником водорода. Вода окисляется до O 2 в процессе фотосинтеза. Вода очень полезна в окислительно-восстановительных реакциях, потому что она может окисляться и восстанавливаться.
В результате вода является богатым источником водорода. Вода окисляется до O 2 в процессе фотосинтеза. Вода очень полезна в окислительно-восстановительных реакциях, потому что она может окисляться и восстанавливаться. Кроме того, растворимость в воде таких веществ, как сахар и соль, позволяет придавать пищевым продуктам аромат во время их приготовления. Хотя растворимость растворенного вещества в воде является очень сложным процессом, решающее значение имеет взаимодействие между полярными молекулами воды и растворенным веществом.
Кроме того, растворимость в воде таких веществ, как сахар и соль, позволяет придавать пищевым продуктам аромат во время их приготовления. Хотя растворимость растворенного вещества в воде является очень сложным процессом, решающее значение имеет взаимодействие между полярными молекулами воды и растворенным веществом. Чтобы избежать обезвоживания, люди должны выпивать 7 литров воды в день.
Чтобы избежать обезвоживания, люди должны выпивать 7 литров воды в день. Большая часть воды используется в производстве химикатов, бумаги и продуктов питания.
Большая часть воды используется в производстве химикатов, бумаги и продуктов питания. Вода может течь в результате кинетической энергии, и могут образовываться волны.
Вода может течь в результате кинетической энергии, и могут образовываться волны. Когда две функциональные группы молекулы могут образовывать водородные связи друг с другом, это происходит.
Когда две функциональные группы молекулы могут образовывать водородные связи друг с другом, это происходит.