Наша жизнь несправедлива. Один человек поправляется из-за кусочка шоколадки, а другой не прибавит и грамма после обильного ужина. Люди, у которых низкий уровень метаболизма, в рекордно короткие сроки набирают вес и с трудом его сбрасывают. А быстрый обмен веществ позволяет оставаться в форме несмотря ни на что. К тому же у мужчин уровень метаболизма в среднем выше, чем у женщин. Скорость метаболизма зависит от гормонов, в первую очередь тех, которые вырабатывает щитовидная железа. Болезни обмена веществ и нарушенного питания – бич нашего времени. Весьма ориентировочная статистика свидетельствует, что подавляющее число из известных к настоящему времени хронических заболеваний человека относится в значительной мере к наследственно и экологически обусловленным патологическим процессам. Острые же болезни возникают, как правило, в результате явного неблагополучия в окружающей среде и как следствие факторов, сформированных профессиональной, бытовой и иной деятельностью самого человека. Для диагностики различных большое значение придается определению гормонов (щитовидной железы, половых гормонов, надпочечников, гипофиза и др.) содержанию в крови продуктов обмена белков, жиров, углеводов, витаминов, минеральных веществ и др. Широко используются при обследовании пациентов функциональная ультразвуковая диагностика. Существует три степени эффективности обмена веществ: ускоренный, нормальный и экономный метаболизм. Людям с ускоренным метаболизмом остаются стройными вне зависимости от количества поглощаемой пищи. Жиры в организме “гиперметаболиков” намного быстрее сжигаются, чем накапливаются.
Ко всему вышесказанному можно добавить следующее. Неплохо способствуют ускорению обменных процессов в организме специи; морские водоросли, как источник йода; яблочный уксус; овощи, содержащие фолиевую кислоту; кофе и зеленый чай. Не забывая о каждом из этих элементов, мы поможем собственному организму, а он, в свою очередь, подарит нам красоту и долгие годы здоровой жизни. |
6. Регуляция обмена веществ. Нарушения обмена веществ
Регуляция обмена веществ
Обменные процессы в организме происходят под действием ферментов и регулируются нервно-гуморальным путём.
Почти все железы внутренней секреции принимают участие в регуляции обмена веществ:
- щитовидная железа регулирует окислительные процессы, влияя на рост и развитие организма;
- надпочечники регулируют углеводный, жировой и белковый обмен (способствуют превращению белков в углеводы), регулируют обмен воды и солей.
Нарушения регуляции обмена веществ вызывают различные заболевания.
Заболевания, связанные с нарушением обмена веществ
К нарушению обмена веществ может привести неправильное питание. Если нарушается баланс между энергией, поступающей в организм с пищей, и энергией, которую организм тратит, то может произойти изменение веса. Человек худеет или поправляется, в зависимости от количества энергии, поступающей в организм с пищей.
Наиболее распространённо такое нарушение обмена веществ как ожирение. В зависимости от количества жировой ткани ожирение делится на степени.
Ожирение повышает риск развития сахарного диабета (заболевания, связанного с нарушением углеводного обмена и дисфункцией поджелудочной железы), гипертонической болезни и других заболеваний (метаболический синдром), связанных с наличием избыточного веса.
Особенную опасность представляет собой ожирение, затрагивающее внутренние органы. Например, ожирение печени (признаки ожирения печени могут напоминать симптомы отравления).
Дистрофия — заболевание, связанное с недостаточным поступлением в организм питательных веществ (особенно белка). Когда использованы все запасы органических веществ, начинают разрушаться собственные белки организма.
Анорексия — это болезненное желание худеть, которое по некоторым данным может считаться проявлением шизофрении. Анорексия чаще встречается у девочек в возрасте от \(12\) до \(30\) лет. Больные худеют так сильно, что нарушается работа всех систем органов.
Анорексия чаще встречается у девочек в возрасте от \(12\) до \(30\) лет. Больные худеют так сильно, что нарушается работа всех систем органов.
Ещё одно заболевание — булимия — проявляется в обжорстве. Во время приступов булимии человек может съесть очень много пищи, а затем вызывает рвоту, чтобы воспрепятствовать набору лишнего веса. Булимия может привести к серьёзным осложнениям: от неврастении до острой сердечной недостаточности.
Нарушения обмена веществ в организме могут стать причиной отложения солей и образования камней в почках и мочевыводящих путях.
Источники:
http://med36.com/ill/1145
http://900igr.net/prezentatsii/biologija/Obmen-veschestv-v-organizme/012-Funktsii-belkov-zhirov-i-uglevodov.html
Возрастные особенности метаболизма
Обозначением «метаболизм» можно охарактеризовать явление обмена веществ между человеком и окружающей средой, что есть естественный процесс и фундамент жизнедеятельности любого живого организма. Он отвечает за клеточный рост, их размножение, позволяет сохранять организмам свою структуру.
Он отвечает за клеточный рост, их размножение, позволяет сохранять организмам свою структуру.
У метаболизма существует две стадии: катаболизм и анаболизм, работа которых согласовывается между собой в определённой последовательности. Катаболизм— простыми словами «энергетический обмен», либо распад сложных веществ на простые, а так же их окисление, из-за чего происходит выброс энергии. Так же его называют диссимиляцией.
Анаболизм— направлен на образование высокомолекулярных соединений, параллельно носит наименование «ассимиляция» или «пластический обмен».
Готовые органические вещества поступают в организм с пищей, но для их задействования требуется предварительное расщепление на элементарные частицы по причине необходимости использования организмом конкретно своих белков, жиров и углеводов. Таким образом, существование и необходимая перестройка организма без метаболизма становятся невозможными.
В периоде развития малыша наибольшие изменения связаны с анаболизмом, нежели с катаболизмом. Именно анаболизм заключает в себе следующие синтезные функции:
Именно анаболизм заключает в себе следующие синтезные функции:
1) Синтез роста — рост организма за счёт деления клеток и разрастания белковой массы, распределяющейся по всем органам;
2) Синтез функциональный и защитный — образование белков для других систем, связанных с ферментацией и гормональной средой;
3) Регенеративный синтез — связан с процессами восстановления повреждённых тканей вследствие травм любого рода или неправильного питания;
4) Синтез самообновления — срабатывает в связи с диссимиляцией, в ходе которой может происходить разрушение компонентов внутренней среды.
Ослабевание фаз метаболизма происходит на протяжении всего индивидуального развития. Выделяется наиболее ускоренным темпом развития внутриутробный период. В дальнейшем особенно важно для растущего организма получение незаменимых аминокислот, отсутствие которых может привести к задержке роста и развития. Нехватка заменимых аминокислот не столь критична, так как их преобразование возможно из незаменимых. Оба вида содержатся в полноценных белках.
Оба вида содержатся в полноценных белках.
В организме каждого человека генами заложена программа роста, после которой наступает постепенное увядание и старение, из-за чего замедляется и метаболизм. Заметить это уже можно после 30 лет, но сильнее всего данный процесс виден после 40. С возрастом обмен веществ замедлят скорость реакций во всех группах веществ — жиры, белки, углеводы. Более того, в тканях и клетках изменяется соотношение полезных веществ — минералов, витаминов, воды.
Знать, как улучшить обмен веществ в организме, никогда не поздно — будь вам 20 или 50. Но не менее важно уметь распознать, когда это необходимо. Организм, как правило, сам подсказывает с помощью следующих симптомов:
- расстройства пищеварения;
- нестабильный вес;
- ломкость волос и ногтей;
- боли в мышцах без физических нагрузок;
- высыпания на коже;
- отеки;
- участившиеся поводы для обращения к стоматологу.
Нарушения метаболизма и энергии в раннем возрасте можно смело отнести к учащённым случаям. Возникая у детей, они в большей степени закладывают основу состояния здоровья и качества всей последующей его жизни. Именно поэтому важно не откладывать поход к врачу, если у подрастающего организма замечены те или иные нарушения, свидетельствующие о плохом метаболизме. В период же естественного угасания гормональной функции в женском организме иногда первыми проявлениями и будут нарушения в метаболизме.Своевременная диагностика этого состония и коррекция изменений приводит к замедлению процессов старения, активации метаболизма и продлевает молодость
Возникая у детей, они в большей степени закладывают основу состояния здоровья и качества всей последующей его жизни. Именно поэтому важно не откладывать поход к врачу, если у подрастающего организма замечены те или иные нарушения, свидетельствующие о плохом метаболизме. В период же естественного угасания гормональной функции в женском организме иногда первыми проявлениями и будут нарушения в метаболизме.Своевременная диагностика этого состония и коррекция изменений приводит к замедлению процессов старения, активации метаболизма и продлевает молодость
Его величество метаболизм. Вся правда об обмене веществ от тяжелоатлета
От ленивца до колибри
Обмен веществ – процесс, который объединяет все живые существа на нашей планете. Например, ленивец не только самый медлительный из животных, но и лидер по медленному темпу метаболизма. А самый быстрый обмен веществ у малютки колибри.
Биологи делят процессы обмена веществ на два типа. Первый – базальный – обеспечивает организму получение энергии, необходимой для поддержания жизнедеятельности в состоянии покоя (переваривание пищи, кровоснабжение, дыхание и т. п.). Он происходит даже во сне и потребляет до 70 % всех калорий, поступающих в организм. Второй тип – дополнительный – связан с любой активностью, отличной от состояния покоя.
Первый – базальный – обеспечивает организму получение энергии, необходимой для поддержания жизнедеятельности в состоянии покоя (переваривание пищи, кровоснабжение, дыхание и т. п.). Он происходит даже во сне и потребляет до 70 % всех калорий, поступающих в организм. Второй тип – дополнительный – связан с любой активностью, отличной от состояния покоя.
Есть ли у человека инструменты, чтобы влиять на процесс обмена веществ? Ведь если метаболизм быстрый, то можно позволить себе есть больше, не беспокоясь о фигуре. Попробуем разобраться, от чего зависят эти процессы.
Во‑первых, возраст. Считается, что с годами метаболизм замедляется, поэтому всё сложнее оставаться в хорошей физической форме. Вроде бы и питание то же, что и раньше, а лишний вес будто прилипает к человеку. Обратимся к цифрам: по данным исследователя Эрика Полмана, начиная с 20 лет метаболизм снижается на 1–2 % каждые 10 лет. Если принимать за норму средний уровень базального метаболизма в 1200 ккал, то получим снижение на 12–24 ккал в день на каждое десятилетие. Выходит, что если даже повезёт дожить до 80 лет, то метаболизм снизится в среднем на 120 ккал в день.
Выходит, что если даже повезёт дожить до 80 лет, то метаболизм снизится в среднем на 120 ккал в день.
Тогда почему с возрастом нам всё сложнее сохранять хорошую внешнюю композицию тела? Всё просто: в 40 лет мы уже не так активны, как в 30. Мотивации меньше, хочется большего комфорта, становится лень лишний раз двигаться, куда‑то бежать и что‑то делать.
Во‑вторых, питание. Бытует мнение, что если питаться часто, но понемногу, можно разогнать метаболизм в организме. Правда ли это? Исследования учёных пока не подтверждают эту теорию. Для метаболизма нет никакой разницы, съедите вы ваш дневной рацион маленькими порциями либо проглотите всё одним махом.
В‑третьих, тренировки. «Нужно просто больше тренироваться! – считают некоторые эксперты из мира тяжёлой атлетики. – Чем больше у тебя мышц, тем быстрее метаболизм!» Отнюдь. Лишь самые экстремальные случаи набора мышц могут заметно ускорить метаболизм. Давайте снова обратимся к цифрам: набор каждых 2 кг мышц увеличивает обмен веществ в состоянии покоя всего на 30 ккал в день. А дополнительный расход на восстановление после силовой тренировки занимает примерно 100–150 ккал в сутки, что эквивалентно паре съеденных яблок.
А дополнительный расход на восстановление после силовой тренировки занимает примерно 100–150 ккал в сутки, что эквивалентно паре съеденных яблок.
Борис Ховрах / Фото: личный архив
Причины и симпмтомы нарушения обмена веществ
Нарушения метаболизма несут существенную угрозу для здоровья, поскольку от нормального протекания обменных процессов зависит жизнедеятельность органов и систем.
Признаки нарушения обмена веществ
Метаболические сбои проявляются:
- Быстрой утомляемостью (снижением работоспособности).
- Ухудшением памяти.

- Выпадением волос.
- Обострением кожных заболеваний, появлением акне, раздражений.
- Сбоями в функционировании желудочно-кишечного тракта (запором, диареей).
- Менструальными нарушениями у женщин.
- Необъяснимым (без существенных изменений рациона) набором или потерей веса.
- Перепадами давления, сердечного ритма.
- Повышением температуры тела.
- Непостоянством настроения, неврологическими нарушениями. Для их предотвращения употребляйте
Now Foods витамины для мужчин и женские витамины Ева.
Факторы, неблагоприятно влияющие на метаболизм
Нарушения обменных процессов обуславливаются:
- Генетической (наследственной) предрасположенностью.
- Возрастными патологиями.
- Ферментной недостаточностью.
- Наличием инфекционных возбудителей в организме (микробов, вирусов, паразитов).
- Злоупотреблением сильнодействующими медикаментами.

- Вредными привычками (табакокурением, употреблением спиртных напитков).
- Нерегулярным питанием (соблюдением диет, недостатком минералов, витаминов). Восполнить дефицит питательных веществ помогают витамины Eva now foods, купить их по невысокой цене можно здесь.
- Перенесенными инфекционными заболеваниями.
Профилактика метаболических нарушений
В профилактических целях рекомендуется, прежде всего, сбалансировать рацион питания: употреблять овощные, фруктовые блюда, кисломолочные, мясные, рыбные продукты, крупы и другую полезную пищу. Положительный эффект на обменные процессы оказывают биодобавки, к их числу относится биокомплекс Now Foods экстракт босвеллии – https://transferfaktory.ru/bosvelliya. Откажитесь от фаст-фуда, алкоголя и других вредных продуктов. Поддерживайте водный баланс в организме.
Повысьте двигательную активность, проводите больше времени на свежем воздухе. Дозированные, регулярные физические нагрузки – один из наиболее действенных способов нормализации метаболизма, избавления от лишних килограммов.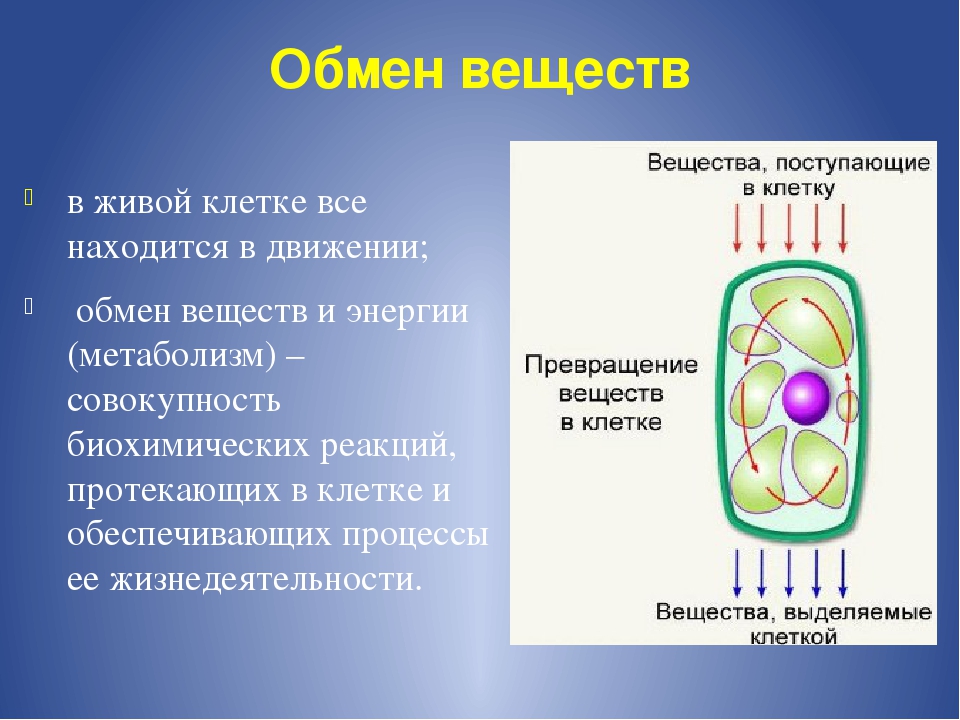
Если причиной дестабилизации обмена веществ стали заболевания желудочно-кишечного тракта или других систем организма, следует всенепременно провести их лечение.
Возврат к списку
Нарушение обмена веществ. Лечение в Москве, цены, запись на прием и консультацию
В организме человека, как, впрочем, и других живых существ, одновременно текут два взаимно уравновешенных процесса: всё в теле постоянно разрушается с образованием энергии и всё постоянно восстанавливается за счёт потребления пищи, так что по видимости никаких изменений вообще нет. Равновесие двух этих процессов — суть так называемого обмена веществ.
Обмен веществ в организме человека считается нормальным, когда процессы выработки энергии и ее восстановления вполне соответствуют друг другу. Но часто он идет с некоторым преобладанием одного из них.
Если в каком-то отношении преобладают процессы распада и выработки энергии, о таких людях говорят: «не в коня корм». .. Такие люди худеют.
.. Такие люди худеют.
Если же в каком-то отношении преобладают накопительные, строительные процессы, то имеет место обратное явление… Такие люди имеют лишний вес.
Обмен веществ, как и всё в организме, регулируется нервной системой; так что какова организация тонуса нервных регуляторных центров, таково и состояние организма. Поэтому, чтобы перевести организм в целом из одного устойчивого состояния в другое, надо устойчиво изменить тонус отдельных центров мозга.
Регуляцией обмена веществ в организме человека в основном занят отдел мозга, именуемый «гипоталамус». В нём обнаружено два отдела: эрготический(гpеч. ergon — работа) — он регулирует скорость выработки энергии, и трофический (греч. trophe — пища, питание) — он регулирует строительные, восстановительные, накопительные процессы.
Если по каким-либо причинам повышен тонус эрготического отдела гипоталамуса, то человек худеет. Если же по каким-то причинам повышен тонус трофического отдела — усилены процессы накопления, отложения. .. Так вот, упомянутый выше регуляторный сдвиг — это и есть, так называемое, нарушение обмена веществ.
.. Так вот, упомянутый выше регуляторный сдвиг — это и есть, так называемое, нарушение обмена веществ.
Итак, регуляция процессов обмена веществ осуществляется непосредственно центральной и вегетативной нервной системой или гормонально. Любое заболевание сопровождается нарушением обменных процессов в организме, что особенно отчетливо проявляется при расстройствах функций нервной системы и желез внутренней секреции. Основной обмен повышается при заболеваниях, связанных с усилением функций щитовидной железы, и понижается при заболеваниях, обусловленных недостаточной функцией этой железы, а также при снижении функции гипофиза, надпочечников, половых желез и при общем голодании. Обмен веществ и энергии нарушается при неправильном питании — избыточном, недостаточном или качественно неполноценном.
Нарушения обмена веществ и энергии проявляются в изменении взаимодействия и превращении различных соединений, избыточном накоплении промежуточных продуктов обмена, в неполном или чрезмерном их выделении и извращении течения различных процессов с образованием веществ, чуждых нормальному организму.
Генетически обусловленное расстройство обмена веществ также служит причиной многих болезней (подагра, ожирение и др.).
Восстановление нарушенного обмена веществ — непростой процесс, который потребует серьезного отношения, настойчивости и упорства. Первый шаг в этом направлении – консультация врача психотерапевта, эндокринолога, невролога.
Процессы обмена веществ | Параграф 37
«Биология. Человек. 9 класс». А.С. Батуев и др.
Вопрос 1.
Процесс образования органических веществ и кислорода из неорганических — углекислого газа и воды в хлоропластах на свету называется фотосинтезом.
Вопрос 2.
Процессы обмена веществ происходят в клетках: распад органических веществ, сопровождающийся выделением энергии, — в митохондриях; образование органических веществ, например, белков, — на рибосомах.
Вопрос 3.
Главное отличие живого организма от неживого — наличие у первого обмена веществ.
Вопрос 4.
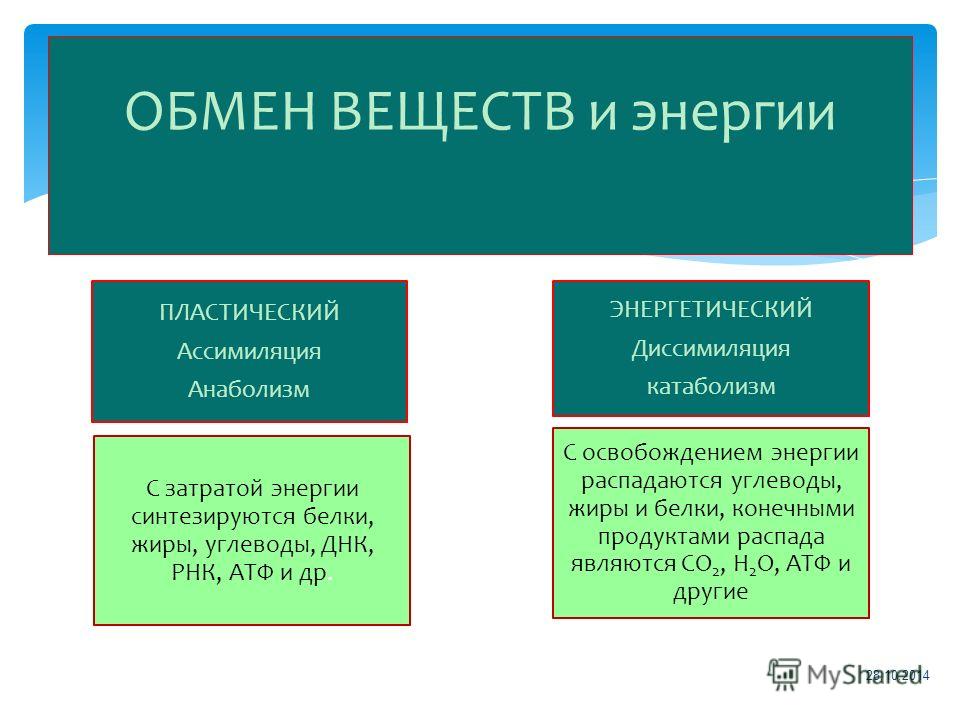
Пластический обмен (ассимиляция) — совокупность процессов биосинтеза, когда из простых веществ синтезируются более сложные и происходит накопление энергии химической связи.
Энергетический обмен (диссимиляция) — совокупность ферментативных процессов расщепления сложных органических веществ в организме, сопровождающихся выделением энергии.
Вопрос. 5.
Пластический обмен преобладает в период роста и развития организма.
Вопрос 6.
Уровень обмена веществ в организме зависит от:
а) состояния здоровья;
б)возраста;
в) эмоционального состояния;
г) степени усталости;
д) физической нагрузки.
Вопрос 7.
Обмен веществ. Регуляция. (см. схему 13.).
Рис. 13. Регуляция обмена веществ
Изменение концентрации гормона в крови —> возбуждение нейронов гипоталамуса —> регуляция функции гипофиза —> нормализация деятельности железы —> регуляция уровня обмена веществ.
1 (!)
где
E — рост и развитие, процессы жизнедеятельности (дыхание, сердцебиение), движения, теплообразование (поддержание постоянной температуры тела), обмен веществ.
2 (!). В состоянии покоя потребности организма в энергии незначительны. Расход энергии возрастает при работе. Это объясняется тем, что для мышечных сокращений или проведения нервных импульсов необходима энергия, которая образуется в клетках при окислении органических веществ. Чем больше физическая нагрузка, тем больше энергии необходимо мышцам, тем интенсивнее идут процессы обмена веществ в организме (учащаются сердцебиение и дыхание).
План § 37
Две стороны, единого процесса обмена веществ.
1. Единство живой и неживой природы.
а) Образование органических веществ из неорганических (растения — фотосинтез).
б) Использование органических веществ и их распад.
2. Обмен веществ — основная функция живого организма.
а) Определение понятия «обмен веществ».
б) Распад органических веществ с выделением энергии.
в) Расход энергии.
г) Пища — источник органических веществ.
д) Главное отличие живого от неживого.
3. Пластический обмен.
4. Энергетический обмен.
5. Единство двух противоположных процессов — пластического и энергетического обменов.
6. Регуляция обмена веществ.
а) Нервная (центры в промежуточном мозге).
б) Гуморальная (влияние гормонов).
7. Потребность организма в энергии.
Зависимость потребности от вида деятельности; возраста.
Общий обзор основных метаболических путей
Метаболизм — это набор химических реакций, которые происходят в клетке, которые позволяют ей продолжать жить, расти и делиться. Метаболические процессы обычно классифицируются как:
глюконеогенез — синтез глюкозы из более мелких перкурсоров, который будет использоваться мозгом.Щелкните изображение, чтобы получить информацию о каждом пути
Метаболические пути взаимодействуют сложным образом, чтобы обеспечить адекватную регуляцию.Это взаимодействие включает ферментативный контроль каждого пути, метаболического профиля каждого органа и гормонального контроля.
Ферментативный контроль метаболических путей
Регулирование гликолиза
Метаболический поток при гликолизе можно регулировать в трех ключевых точках:
- гексокиназа: ингибируется глюкозой-6-P (ингибирование продукта)
- фосфофруктокиназа : ингибируется АТФ и цитратом (что сигнализирует об изобилии промежуточных продуктов цикла лимонной кислоты).Он также ингибируется H + , что становится важным при анаэробиозе (молочная ферментация производит молочную кислоту, что приводит к снижению pH). Вероятно, этот механизм не позволяет клетке использовать весь свой запас АТФ в реакции фосфофрутокиназы, что предотвратит активацию глюкозы гексокиназой. Он стимулируется его субстратом (фруктозо-6-фосфат), АМФ и АДФ (которые сигнализируют об отсутствии доступной энергии) и т. Д.
- пируваткиназа : ингибируется АТФ, аланином, свободными жирными кислотами и ацетил-КоА.Активируется фруктозо-1,6-бисфосфатом и AMP
Регуляция глюконеогенеза
Поток регулируется специфическими для глюконеогенеза реакциями. Пируваткарбоксилаза активируется ацетил-КоА, что сигнализирует об изобилии промежуточных продуктов цикла лимонной кислоты, , то есть , о снижении потребности в глюкозе.
Регулирование цикла лимонной кислоты
Цикл лимонной кислоты регулируется в основном доступностью субстрата, ингибированием продукта и некоторыми промежуточными продуктами цикла.
- пируватдегидрогеназа: ингибируется ее продуктами, ацетил-КоА и НАДН
- цитратсинтаза : ингибируется ее продуктом, цитратом. Он также ингибируется НАДН и сукцинил-КоА (которые сигнализируют об изобилии промежуточных продуктов цикла лимонной кислоты).
- изоцитратдегидрогеназа и α-кетоглутарат дегидрогеназа : как и цитрат-синтаза, они ингибируются НАДН и сукцинил-КоА.Изоцитратдегидрогеназа также ингибируется АТФ и стимулируется АДФ. Все вышеупомянутые дегидрогеназы стимулируются Ca 2+ . Это имеет смысл в мышцах, поскольку высвобождение Ca 2+ из саркоплазматической сети вызывает сокращение мышц, что требует большого количества энергии. Таким образом, тот же «второй посланник» активирует энергозатратную задачу , а — средства для производства этой энергии.
Регулирование цикла карбамида
Карбамоилфосфатсинтетаза стимулируется N-ацетилглутамином, который сигнализирует о наличии большого количества азота в организме.
Регуляция обмена гликогена
Печень содержит гексокиназу ( гексокиназа D или глюкокиназа ) с низким сродством к глюкозе, которая (в отличие от «обычной» гексокиназы) не подлежит ингибированию продуктом. Следовательно, глюкоза фосфрилируется в печени только тогда, когда она присутствует в очень высоких концентрациях (, то есть после еды). Таким образом, печень не будет конкурировать с другими тканями за глюкозу, когда этого сахара недостаточно, а будет накапливать высокий уровень глюкозы для синтеза гликогена сразу после еды.
Регуляция обмена жирных кислот
Движение ацил-КоА в митохондрии является решающим фактором регуляции. Малонил-КоА (который присутствует в цитоплазме в больших количествах, когда метаболическое топливо в изобилии) ингибирует карнитин-ацилтрансферазу, тем самым предотвращая проникновение ацил-КоА в митохондрии. Кроме того, 3-гидроксиацил-КоА-дегидрогеназа ингибируется НАДН, а тиолаза ингибируется ацетил-КоА, так что жирные кислоты не будут окисляться, когда в клетке имеется много энергоемких субстратов.
Регуляция пентозофосфатного пути
Метаболический поток через пентозофосфатный путь контролируется активностью глюкозо-6-фосфатдегидрогеназы, которая контролируется доступностью NADP + .
Мозг
Обычно нейроны используют только глюкозу в качестве источника энергии. Поскольку мозг хранит лишь очень небольшое количество гликогена, ему необходимо постоянное поступление глюкозы. Во время длительного голодания он становится способен окислять кетоновые тела.
Печень
Поддержание достаточно постоянной концентрации глюкозы в крови — одна из основных функций печени. Это достигается за счет глюконеогенеза, синтеза и распада гликогена. Когда ацетил-КоА в избытке, он синтезирует кетоновые тела. Это также место синтеза мочевины.
Он синтезирует жирные кислоты и хранит их в виде триацилглицеринов. Глюкагон активирует гормоночувствительную липазу, которая гидролизует триацилглицерины с образованием глицерина и жирных кислот.Затем они попадают в кровоток в виде липопротеинов.
Мышцы используют глюкозу, жирные кислоты, кетоновые тела и аминокислоты в качестве источника энергии. Он также содержит запас креатинфосфата, соединения с высоким потенциалом переноса фосфата, которое способно фосфорилировать АДФ до АТФ, тем самым производя энергию без использования глюкозы. Количество креатина в мышцах достаточно, чтобы выдержать 3-4 с нагрузки. По истечении этого периода мышца использует гликолиз, сначала анаэробно (поскольку он намного быстрее, чем цикл лимонной кислоты), а позже (когда повышенная кислотность замедляет фосфофрутокиназу настолько, чтобы цикл лимонной кислоты стал неограничивающим) в аэробных условиях. .
Почки
Он может осуществлять глюконеогенез и выделять глюкозу в кровоток. Он также отвечает за выведение мочевины, электролитов и т. Д. Метаболический ацидоз может быть усилен действием цикла мочевины, поскольку синтез мочевины (который происходит в печени) использует HCO 3 —, таким образом дальнейшее снижение pH крови. В этих условиях азот может быть устранен совместным действием почек и печени: избыток азота сначала включается в глутамин с помощью глутаминсинтетазы.Затем глутаминаза почек расщепляет глутамин с образованием глутамата e NH 3 , который немедленно выводится почками. Этот процесс позволяет вывести азот, не влияя на уровень бикарбоната в крови.
| Биохимия,
Дональд Воет и Джудит Воет Отличный текст. В нем представлена биохимия с частыми ссылками на органическую химию и биохимическую логику. Рекомендуется для студентов, изучающих биохимию, химию и фармацевтику. | Биохимия,
Stryer Широко используемый классический текст, часто обновляемый и переизданный. | ||
| Учебник
биохимии с клиническими корреляциями, Томас Девлин Настоятельно рекомендуется студентам сестринского дела, медицины, стоматологии и т. д. Множество примеров применения биохимических знаний в клинических случаях. | Принципы
of Biochemistry, Lehninger Широко используемый классический текст, часто обновляемый и переизданный. |
Химическая логика, лежащая в основе … Разложение аминокислот и цикл мочевины
Помимо того, что являются наиболее важными строительными блоками белков аминокислоты также могут быть использованы в качестве предшественников азотсодержащих молекул : гемов, нуклеотидов, глутатион, физиологически активные амины и т. д.
Избыточные аминокислоты из рациона не хранятся и не выводятся как таковые: они превращаются в пируват, оксалоацетат, α-кетоглутарат и т. д.Следовательно, аминокислоты также являются предшественниками глюкозы, жирных кислот и кетоновых тел и могут использоваться для производство энергии .
Превращение аминокислот включает удаление аминогруппы (эаминирование), включение аммиака, образующегося в этой реакции, в мочевину для экскреции и превращение углеродных скелетов в промежуточные продукты метаболизма.
Дезаминирование большинства аминокислот включает в себя трансаминирование шаг, i.е. перенос их аминогрупп на α-кетокислоту с образованием аминокислотного эквивалента исходной α-кетокислоты и α-кетокислотный эквивалент исходной аминокислоты. Акцептор амина обычно представляет собой а-кетоглутарат, который превращается в глутамат:
Аминотрансферазы используют пиридоксаль-5′-фосфат, производное витамина B 6 . Пиридоксаль также участвует в реакциях декарбоксилирования аминокислот и удаления их боковых цепей. Это также кофактор, используемый гликогенфосфорилазой, хотя в этом случае механизм реакции другой.Аминотрансферазы специфичны для каждого типа аминокислот и продуцируют соответствующие α-кетокислоты. Однако большинство принимают только а-кетоглутарат. или (в меньшей степени) оксалоацетат в качестве акцептора амина с образованием глутамата или аспартата соответственно. Следовательно, большинство аминогрупп в конечном итоге заканчиваются глутаматом или аспартатом, которые могут взаимно превращаться глутамат-аспартатаминотрансферазой.
Набор мышечных аминотрансфераз использует пируват (который также является α-кетокислотой) в качестве акцептора амина, образуя соответствующую аминокислоту аланин .После попадания в кровоток аланин поглощается печенью, которая превращает его обратно в пируват, который используется в глюконеогенезе. Глюкоза, произведенная в этом процессе, будет окисляться мышцами до пирувата (и, в конечном итоге, до лактата или CO 2 , в зависимости от условий) мышцами, тем самым завершая цикл аланина . Освободившаяся аминогруппа будет использована в синтезе мочевины. Конечным результатом цикла аланина является перенос азота из мышц в печень.
Трансаминирование не приводит к высвобождению азота из аминокислот: оно просто переводит аминогруппы из большого количества аминокислот в две или три аминокислоты (глутамат, аспартат и аланин). Дезаминирование по большей части выполняется глутаматдегидрогеназой, митоходриальным ферментом, уникальным своей способностью использовать либо NAD + , либо NADP + .
Азот, выделяемый в результате этой реакции в виде аммиака, должен быть выведен из организма. Многие водные животные выделяют его без изменений. Другие животные с менее обильными запасами воды превращают аммиак в менее токсичные продукты, которым требуется меньше воды для выделения. Один из этих продуктов — карбамид .
Причины токсичности аммиака еще полностью не изучены, но известно, что в высоких концентрациях аммиак вступает в реакцию с глутаматом с образованием глутамина в реакции, катализируемой глутаминсинтетазой.
Чтобы восполнить запасы глутамата, другие аминокислоты реагируют с α-кетоглутаратом путем переаминирования. В результате обеих реакций a-кетоглутарат Глутамат постепенно истощается, что имеет очень вредные последствия для функции нейронов (поскольку глутамат является предшественником нейромедиаторов, а работа цикла лимонной кислоты зависит от постоянного уровня промежуточных продуктов, таких как а-кетоглутарат).
Мочевина синтезируется в печени, которая выделяет ее в кровоток, откуда она выводится почками. Общая реакция цикла мочевины:
Первый шаг — синтез карбамоилфосфат, активированная форма азота:
Карбамоил впоследствии превращается в орнитин, давая цитруллин. Эти молекулы представляют собой «особые» аминокислоты, то есть аминокислоты, которые не входят в ограниченный набор из 21 аминокислоты, используемый в синтезе белка.
После этих двух реакций (которые происходят внутри митохондрии) цитруллин переносится в цитоплазму, где и происходит оставшаяся часть цикла.
Второй атом азота в мочевине происходит от аспартата:
В этой реакции АТФ гидролизуется до АМФ вместо АДФ. (как обычно бывает). Поскольку АМФ может принимать фосфатную группу от АТФ, давая 2 АДФ, гидролиз АТФ до АМФ эквивалентен гидролизу 2 АТФ до 2 АДФ.
Аргининосукцинат может быть расщеплен на аргинин и фумарат:
При входе в митохондрию фумарат может реагировать в цикле лимонной кислоты с образованием НАДН и оксалоацетата, которые могут быть преобразованы в аспартат путем трансаминирования.
Гидролиз аргинина дает мочевину и орнитин, которые могут перезапустить цикл после попадания в митохондрии.
Цикл мочевины требует высоких затрат энергии, что эквивалентно гидролизу 4 АТФ до 4 АДФ.Однако эта стоимость может быть возмещена в цепи переноса электронов, поскольку НАДН, образующийся при дезаминировании глутамата и при окислении фумарата до оксалоацетата, эквивалентен примерно 6 АТФ.
Химическая логика … метаболизма жирных кислот
Химическая логика … метаболизма жирных кислотПроф. Дутор Педро Силва
Профессор Ауксильяр, Университет Фернандо Пессоа
| Другие метаболические пути: |
Большинство запасов энергии в организме хранится в виде триацилглицеридов, которые под действием липаз могут гидролизоваться до глицерина и жирных кислот:
Глицерин может метаболизироваться путем гликолиза при окислении (на внешней стороне внутренней митоходриальной мембраны) до дигидроксиацетонфосфата.Оба электрона захватываются убихиноном (Q) и направляются в цепь переноса электронов.
Жирные кислоты идут по другому пути: b-окисление , которое происходит в митохондрии. Прежде чем попасть в митохондрии, жирные кислоты должны быть активированы . Реакция активации происходит в цитоплазме и заключается в превращении жирной кислоты в ее производное ацил-Коа. Как мы видели в цикле лимонной кислоты, тиоэфирные связи очень активны.Следовательно, АТФ гидролизуется (до АМФ, что эквивалентно гидролизу 2 АТФ до 2 АДФ) в процессе.
Внутренняя мембрана митохондрий непроницаема для ацил-КоА. Чтобы попасть внутрь, они вступают в реакцию со «особой» аминокислотой, , карнитином, , высвобождая КоА. Карнитин стерилизованный транспортируется в матрикс митохондрий с помощью специфического мембраносвязанного транспортного комплекса. Внутри митохондрии карнитин передает ацильную группу другой молекуле КоА.Свободный карнитин возвращается в цитоплазму через тот же комплекс переносчиков. В этом процессе не происходит чистого транспорта КоА в митохондрии: сохраняется отдельных цитоплазматических и митохондриальных пулов КоА .
b-окисление жирных кислот — это цикл, состоящий из трех последовательных реакций, которые идентичны последней части цикла лимонной кислоты: дегидрирование, гидратация вновь образованной двойной связи C = C и окисление спирта до кетона:
Из продукта этих реакций фермент тиолаза высвобождает ацетил-КоА и ацил-КоА с двумя атомами углерода меньше, чем исходный ацил-КоА.
Ненасыщенные жирные кислоты проходят аналогичный путь, хотя для работы с двойными связями C = C необходимы новые ферменты. Если двойная связь лежит на нечетном атоме C, Δ 3 , Δ 2 -эноил-CoA изомераза необходима: этот фермент переносит двойную связь с C3 на C2, тем самым делая возможным β-окисление. В этом цикле β-окисления FADH 2 не образуется.
Когда двойная связь находится на углероде с четным номером, необходима 2,4-диеноил-КоА-редуктаза, поскольку наличие конъюгированных двойных связей делает гидратацию более благоприятной на углероде 4, чем на «правом» углероде (2).2,4-диеноил-КоА-редуктаза использует два электрона от НАДФН для восстановления системы Δ 4 , Δ 2 и образования одинарной двойной связи на углероде 3. Затем окисление следует той же процедуре, что и для жирных кислот, несущих двойную связь. связь на углероде с нечетным номером ..
Последовательные циклы цикла в конечном итоге приводят к полному разложению жирных кислот с четной цепью в ацетил-КоА, которые могут быть полностью окислены до CO 2 через цикл лимонной кислоты: жирные кислоты с четной цепью не могут быть используется для синтеза оксалоацетата и, следовательно, не является субстратом для глюконеогенеза.
В последнем раунде b-окисления жирных кислоты с нечетной цепью
дает ацетил-КоА и пропионил-КоА. Для того, чтобы пропионил-КоА использовался в цикле лимонной кислоты, он должен получить дополнительный атом углерода, и это достигается путем карбоксилирования . Метилмалонил-КоА, образующийся в этой реакции, затем перегруппировывается сукцинил-КоА в реакция с участием кобаламина (производное витамина B 12 ).Сукцинил-КоА является промежуточным звеном в цикле лимонной кислоты, а также предшественником биосинтеза гема.Таким образом, дефицит витамина B 12 снижает способность синтезировать гем и может в конечном итоге привести к развитию злокачественной анемии . Это заболевание обычно вызвано отсутствием способности извлекать кобаламин из питательных веществ в желудке и наблюдается у предрасположенных людей в пожилом возрасте. До современных методов производства кобаламина лечение этого заболевания заключалось в ежедневном потреблении большого количества сырой печени, которая является надежным резервуаром этого термолабильного витамина.Почти исключительное начало болезни у пожилых пациентов является следствием наличия в нашей собственной печени запаса B 12 , которого хватает примерно на 3-5 лет, так что последствия нарушения его абсорбции будут очень отсроченными.
Сукцинил-КоА может окисляться циклом лимонной кислоты до малат, который после попадания в цитоплазму может использоваться в глюконеогенезе. В цитоплазме малат также может декарбоксилироваться в пируват с помощью яблочного фермента , с некоммитивным образованием НАДФН:
Пируват, образующийся в этой реакции, может проникать в митохондрии и полностью окисляться до CO 2 за счет цикла лимонной кислоты.
Пероксисомное разложение жирных кислот
Пероксисомы — это маленькие органеллы, в которых происходят начальные стадии b-окисления жирных кислот с очень длинной цепью. Основные различия между митохондриальным и пероксисомальным b-окислением:
- Жирные кислоты свободно диффундируют в пероксисому: они не нуждаются в переносе карнитина. Продукт окисления перемещается в митохондрию после этерификации карнитина. При окислении ацил-КоА
- в качестве акцептора электронов использовался кислород вместо FAD, что давало перекись водорода.
- Пероксисомальная тиолаза практически неактивна с ацил-КоА с длиной углерода менее 8 атомов углерода, поэтому пероксисомальное окисление жирных кислот является неполным.
Большая часть ацетил-КоА, продуцируемого b-окислением жирных кислот в митоходриях печени, превращается в ацетоацетат и b -гидроксибутират (также известный как кетоновых тел ). Эти молекулы могут использоваться сердцем и скелетными мышцами для производства энергии.Мозг, который обычно зависит от глюкозы как единственного источника энергии, также может использовать кетоновые тела в течение длительного периода голодания (более двух или трех дней). Кетогенез (синтез кетоновых тел) начинается с конденсации двух молекул ацетил-КоА с образованием ацетоацетил-КоА:
Конденсация другой молекулы ацетил-КоА дает 3-гидрокси-3-метил-глутарил-КоА (HMG-CoA). Основной механизм этой реакции идентичен конденсации оксалоацетата с ацетил-КоА для получения цитрата, первой стадии цикла лимонной кислоты.
HMG-CoA впоследствии расщепляется ацетоацетатом и ацетил-КоА:
Ацетоацетат попадает в кровоток и распределяется по тканям. После абсорбции он реагирует (в митохондриях) с сукцинил-КоА, давая сукцинат и ацетоацетил-КоА, которые могут расщепляться тиолазой на две молекулы ацетил-КоА.
При большом количестве ацетил-КоА печень и жировая ткань синтезируют жирные кислоты.Путь синтеза очень похож на обратный путь b-окисления, но имеет несколько важных отличий:
- он находится в цитоплазме, а не в митохондрии.
- использует НАДФН в качестве донора электронов
- группа ацильного носителя представляет собой ACP ( A цил. C arrier P rotein) вместо кофермента A.
Синтез жирных кислот использует ацетил-КоА в качестве основного субстрата.Однако, поскольку процесс достаточно эндергонный, ацетил-КоА должен быть активирован , что происходит посредством карбоксилирования . Как и другие карбоксилазы (например, пирувата или пропионил-КоА), ацетил-КоА-карбоксилаза использует биотин в качестве простетической группы.
Малонил-КоА затем переносится на белок-носитель ацила (АСР), в результате чего образуется малонил-АСР, который конденсируется с ацетил-АСР (синтезированный также из ацетил-КоА).
У животных каждый этап синтеза пальмитиновой кислоты (16-углеродной насыщенной жирной кислоты) катализируется синтазой жирных кислот, очень большим ферментом с множественной ферментативной активностью.Бутирил-ACP, полученный в первой реакции, будет преобразован в бутил-ACP (4-углеродный ацил-ACP). Последовательность реакции обратна b-окислению, т. Е. Восстановлению, дегидратация и гидрирование:
Бутил-АСР может впоследствии конденсироваться с другой молекулой малонил-АСР. После семи циклов этого цикла образуется пальмитоил-АСР. Гидролиз пальмитоил-ACP дает пальмитиновую кислоту. Таким образом, стехиометрия синтеза пальмитиновой кислоты составляет:
Ацетил-КоА + 7 Малонил-КоА + 14 НАДФН + 7 Н + —> пальмитиновая кислота + 7 CO 2 + 14 НАДФ + + 8 CoA + 6 H 2 O
Более длинные (или ненасыщенные) жирные кислоты производятся из пальмитиновой кислоты элонгазами, и десатуразами.
Синтез жирных кислот происходит в цитоплазме, но ацетил-КоА вырабатывается в митохондриях. Следовательно, ацетил-КоА должен пересечь внутреннюю митохондриальную мембрану, прежде чем его можно будет использовать в синтезе жирных кислот. Это выполняется челноком цитрата : цитрат образуется в митохондрии путем конденсации ацетил-КоА с оксалоацетат и диффундирует через мембрану в цитоплазму, где он расщепляется цитрат-лиазой на ацетил-КоА и оксалоацетат, которые после восстановления до малата могут вернуться в матрикс митохондрий.Малат также может быть использован для производства части НАДФН, необходимого для синтеза жирных кислот, за счет действия яблочного фермента. Остальная часть НАДФН, необходимого для синтеза жирных кислот, должна производиться пентозофосфатным путем.
| Биохимия,
Дональд Воет и Джудит Воет Отличный текст. В нем представлена биохимия с частыми ссылками на органическую химию и биохимическую логику. Рекомендуется для студентов, изучающих биохимию, химию и фармацевтику. | Биохимия,
Stryer Широко используемый классический текст, часто обновляемый и переизданный. | ||
| Учебник
биохимии с клиническими корреляциями, Томас Девлин Настоятельно рекомендуется студентам сестринского дела, медицины, стоматологии и т. д. Множество примеров применения биохимических знаний в клинических случаях. | Принципы
of Biochemistry, Lehninger Широко используемый классический текст, часто обновляемый и переизданный. |
Химическая логика … Глюконеогенез
Химическая логика … ГлюконеогенезПроф. Дутор Педро Силва
Доцент Университета Фернандо Пессоа
| Другие метаболические пути: |
У человеческого тела есть два основных способа поддерживать постоянный уровень глюкозы в крови между приемами пищи: деградация гликогена и глюконеогенез. Глюконеогенез — это синтез глюкозы из других органических соединений (пирувата, сукцината, лактата, оксалоацетата и т. Д.). Большинство задействованных реакций очень похожи на обратную реакцию гликолиза. В самом деле, почти все реакции в гликолизе легко обратимы в физиологических условиях. Три исключения — реакции, катализируемые:
В глюконеогенезе каждая из этих стадий заменяется термодинамически благоприятными реакциями.Среди этих трех реакций синтез фосфоенолпирувата из пирувата является наиболее энергоемким, поскольку его DG довольно положительный. Чтобы преодолеть этот термодинамический барьер, реакция будет связана с декарбоксилированием , стратегия, часто используемая клеткой для смещения равновесия в сторону образования продуктов, что также будет наблюдаться в нескольких реакциях в цикле лимонной кислоты. . Поскольку и пируват, и фосфоенолпируват (PEP) являются трехуглеродными соединениями, пируват должен быть карбоксилирован до четырехуглеродного соединения, оксалоацетата (OAA), прежде чем может произойти такое декарбоксилирование.Фермент, ответственный за карбоксилирование пирувата (пируваткарбоксилаза), присутствует внутри митохондриального матрикса и содержит биотин, кофактор, активирующий CO 2 . Энергия, необходимая для карбоксилирования, возникает в результате гидролиза АТФ. Декарбоксилирование оксалоацетата высвобождает энергию, необходимую для фосфорилирования C2 с помощью GTP, с образованием фосфоенолпирувата (в реакции, катализируемой фосфоенолпируваткарбоксикиназой Numa — PEPCK).
Оксалоацетат, продуцируемый пруваткарбоксилазой, не может проникать через митоходриальную мембрану.Он может покинуть митохондрию только после преобразования в малат или аспартат. Выбор процесса зависит от наличия цитоплазматического НАДН (необходимого для глюконеогенеза). Если в цитоплазме достаточно НАДН (например, когда лактат используется в качестве глюконеогенного субстрата) оксалоацетат будет трансаминирован в аспартат. В противном случае ОАА будет восстановлена до малата в митохондриальном матриксе. Митохондриальная мембрана проницаема для малата, который перемещается в цитоплазму, где он может окисляться до оксалоацетата с сопутствующим образованием НАДН.Затем оксалоацетат можно декарбоксилировать до PEP цитоплазматическим PEPCK. Некоторые ткани также содержат митохондриальную PEPCK.
При глюконеогенезе реакции, катализируемые фосфофруктокиназой и гексокиназой, заменяются гидролитическими реакциями. Вместо фосфорилирования АДФ в АТФ (полная противоположность гликолиза, но термодинамически неблагоприятная в физиологических условиях) фосфат высвобождается путем гидролиза:
Фруктозо-1,6-бисфосфатаза присутствует почти во всех тканях, но глюкозо-6-фосфатаза присутствует только в печени и почках, что позволяет этим органам поставлять глюкозу в другие ткани:
Во время физических упражнений лактат, вырабатываемый в мышцах, направляется в кровоток и может использоваться печенью в качестве глюконеогенного субстрата.Хотя печень использует 6 АТФ для каждой новой синтезированной глюкозы и только 2 АТФ на глюкозу высвобождаются в мышцах в анаэробных условиях, этот «лактатный цикл» является полезным для организма, поскольку он позволяет поддерживать анаэробные упражнения в течение некоторого времени. немного дольше (и это может иметь решающее значение для выживания, например, позволяя жертве убегать от хищника или хищнику, чтобы продолжать преследовать свою добычу).| Биохимия,
Дональд Воет и Джудит Воет Отличный текст.В нем представлена биохимия с частыми ссылками на органическую химию и биохимическую логику. Рекомендуется для студентов, изучающих биохимию, химию и фармацевтику. | Биохимия,
Stryer Широко используемый классический текст, часто обновляемый и переизданный. | ||
| Учебник
биохимии с клиническими корреляциями, Томас Девлин Настоятельно рекомендуется студентам сестринского дела, медицины, стоматологии и т. д.Множество примеров применения биохимических знаний в клинических случаях. | Принципы
of Biochemistry, Lehninger Широко используемый классический текст, часто обновляемый и переизданный. |
Происхождение и эволюция метаболических путей: почему и как первичные клетки построили метаболические пути? | Эволюция: образование и пропаганда
Увлекательно.Захватывающе. Реконструкция истории жизни на Земле представляет собой один из самых интригующих вопросов науки. И еще более интригующим является попытка понять (самые) первые молекулярные шаги, ведущие к первичным клеткам и их ранней эволюции. Существующие клетки представляют собой довольно сложные образования, состоящие из множества различных молекул, которые, однако, должны действовать и взаимодействовать согласованным образом, чтобы обеспечить выживание и воспроизводство клеток (и многоклеточных организмов).В каждый момент клеточной жизни миллиарды молекул превращаются в разные посредством реакций, которые ускоряются (катализируются) так называемыми ферментами, большинство из которых представлены белками. Даже несмотря на то, что эти белки могут взаимодействовать с множеством различных молекул во время своего хаотического путешествия в клетке, они связываются только с конкретными молекулами, представляющими их субстрат , и трансформируют его в другую, отличную молекулу, называемую продуктом (реакции).В целом это верно не для всех ферментов; каждый фермент взаимодействует с одним субстратом, в результате чего образуется определенный продукт. Следовательно, в каждый момент жизни клетки миллиардов субстратов превращаются в миллиардов продуктов с помощью миллиардов молекул фермента. Эти реакции чрезвычайно быстры, и мы можем представить клетку как вязкую среду, в которой эти реакции протекают упорядоченным (и только кажущимся хаотическим) образом. Все эти реакции называются , метаболизм , круговая «сущность» в том смысле, что молекулы могут быть разрушены (катаболизм) для получения энергии и «кирпичиков», необходимых для создания других молекул (анаболизм) (рис.1). Таким образом, ясно, что внутри клетки существует «равновесие» между катаболическими и анаболическими реакциями. Таким образом, метаболизм сохранившихся клеток достаточно сложен, но мы также можем считать его чрезвычайно упорядоченным. На рисунке 2 показан пример катаболической (разложение глюкозы во время гликолиза) и анаболической (биосинтез аминокислоты гистидина) систем. Как видно из рис. 2, и гликолиз, и биосинтез гистидина протекают по своего рода «каскаду» реакций, в которых разрушение глюкозы и образование гистидина требует последовательного действия различных ферментов, каждый из которых способен катализировать один шаг этого каскада.Набор реакций, начинающихся с субстрата и ведущих к конечному продукту реакции, называется метаболическим путем . В большинстве случаев каждый этап метаболического пути катализируется одним ферментом, который (в трети случаев) представляет собой один белок, кодируемый одним геном (Holliday et al. 2011).
Рис. 1Схематическое изображение метаболических сетей, существующих в существующих клетках (из http://manet.illinois.edu/pathways.php)
Рис.2Схематическое изображение катаболического (гликолиза) (из http://www.genome.jp/dbget-bin/www_bget?pathway+hsa00010) ( a ) и анаболического пути (биосинтез гистидина) (из http: //www.genome.jp/kegg/pathway/map/map00340.html) ( b ) в гамма-протеобактерии Escherichia coli K12
Если предположить, что существующие и очень сложные клетки произошли от гораздо более простых предковых клеток, можно также предположить, что у последних был более простой метаболизм по сравнению с существующим.Это, в свою очередь, означает, что они должны обладать гораздо более простыми геномами, вероятно, состоящими из нескольких сотен генов. Если это так, то возникает вопрос: , почему и , как первичные клетки собрались и развили свои метаболические пути? Вопрос можно перефразировать следующим образом: почему и как ранние клетки увеличили количество своих генов и сложность своих геномов? Ответ (ы), которые мы можем попытаться дать на эти вопросы, явно зависит от условий примитивной Земли и того, как выглядели первобытные живые существа.Однако это одна из самых туманных проблем; фактически, хотя были предприняты значительные усилия, чтобы понять появление первых живых существ, мы до сих пор не знаем, когда и как возникла жизнь (Peretò et al. 1998). Тем не менее, обычно считается, что первые организмы возникли и заселили водную среду (океаны, реки, пруды и т. Д.), Богатую органическими соединениями, спонтанно образовавшимися в пребиотическом мире. Это гетеротрофное происхождение жизни принято считать и часто называют теорией Опарина – Холдейна (Oparin 1924; Lazcano and Miller 1996).Если эта идея верна, жизнь произошла из изначального супа, содержащего различные органические молекулы (многие из которых используются существующими формами жизни). Этот суп из питательных веществ был доступен для ранних гетеротрофных организмов, поэтому им приходилось проводить минимум биосинтеза. Экспериментальная поддержка этого предложения была получена в 1953 году, когда Миллер (1953) и Юри показали, что аминокислоты и другие органические молекулы образуются в атмосферных условиях, которые, как считается, являются типичными для тех, что существовали на ранней Земле.Первые живые системы, вероятно, действительно произошли непосредственно от изначального супа и относительно быстро эволюционировали до общего предка, обычно называемого Последним универсальным общим предком (LUCA), сущности, представляющей отправную точку дивергенции всех существующих на Земле форм жизни. (Рис. 3). Если мы предположим, что жизнь возникла в пребиотическом супе, содержащем большую часть, если не все, необходимых малых молекул, то можно предположить большую потенциальную доступность питательных веществ на примитивной Земле, обеспечивающую как рост, так и снабжение энергией большого количества предковые организмы.Мы можем представить себе существование «раннего плавающего живого мира», состоящего из первичных клеток, которые могли бы выглядеть как «мыльные пузыри», вмещающие одну или несколько информационных молекул и выполняющих ограниченное количество метаболических реакций. Эти пузыри были способны делиться, взаимодействовать друг с другом, сливаться и делиться своими геномами и метаболическими способностями, давая начало прогрессивно сложным живым существам. Если этот сценарий верен, то есть первобытные организмы были гетеротрофными и не нуждались в развитии новых и улучшенных метаболических способностей, поскольку большинство необходимых питательных веществ были доступны, мы можем вернуться к двум вопросам, на которые можно ответить, а именно: почему и , как первичные клетки расширили свои метаболические способности и геномы?
Фиг.3Ориентировочная эволюционная шкала времени от происхождения Земли до разнообразия жизни
Ответ на первый вопрос довольно интуитивно понятен. В самом деле, увеличение числа ранних клеток, процветающих на первичном бульоне, привело бы к истощению необходимых питательных веществ, создавая все более сильное селективное давление, которое, в свою очередь, благоприятствовало (в дарвиновском смысле) тем микроорганизмам, которые стали способны синтезировать эти молекулы. концентрация которого в исконном супе уменьшалась.Следовательно, происхождение и эволюция основных метаболических путей представляют собой решающий шаг в молекулярной и клеточной эволюции, поскольку это сделало первичные клетки менее зависимыми от экзогенных источников питательных веществ (рис. 4).
Рис. 4Схематическое изображение сообщества предковых клеток с давлением отбора, допускающим приобретение и распространение нового метаболического признака (изменено из Fondi et al. 2009a)
Но как произошло расширение геномов? В следующем разделе мы сосредоточимся на молекулярных механизмах, которые управляли этим переходом, т.е.е., расширение и уточнение древних метаболических путей, приводящее к структуре существующих метаболических путей.
Метаболические пути
В интерактивном режиме, показанном вверху страницы, мышечные клетки рассматриваются как один тип клеток. Но на самом деле у нас есть несколько типов мышц. Все мышцы похожи в том, что они сокращаются, и они могут выполнять большинство одинаковых метаболических реакций. И все же каждый тип индивидуален.
Сердце состоит из клеток сердечной мышцы.Эти клетки сжигают очень мало глюкозы. В качестве топлива они используют в основном жирные кислоты и не накапливают гликоген.
Листы гладкомышечных клеток обволакивают кровеносные сосуды, пищеварительный тракт и многие наши органы. Они работают вне нашего контроля и осознания, например, проталкивают пищу по мере ее переваривания и регулируют кровяное давление. Гладкомышечные клетки могут накапливать гликоген и сжигать как глюкозу, так и жирные кислоты, как описано выше.
Скелетные мышцы — самый распространенный тип.Эти мышцы прикрепляются к нашим костям и координируют все наши произвольные движения. Они хранят большую часть гликогена в организме и могут сжигать как глюкозу, так и жирные кислоты. Работающая мышечная клетка может проходить через АТФ примерно в 100 раз быстрее, чем мышца в состоянии покоя. По мере увеличения рабочей нагрузки скелетные мышцы начинают сжигать больше глюкозы.
Скелетные мышцы подразделяются на быстро и медленно сокращающиеся клетки. У всех нас есть оба типа, но у людей они есть в разных пропорциях. Медленно сокращающиеся клетки более многочисленны у марафонцев, и они постоянно сжигают топливо в течение продолжительных периодов времени.Эти клетки заполнены митохондриями, и во время физических упражнений они имеют тенденцию полностью расщеплять сахар на углекислый газ и воду.
Быстросокращающиеся клетки более многочисленны у спринтеров. В этих клетках меньше митохондрий, но они сокращаются сильнее, чем медленно сокращающиеся клетки. Быстро сокращающиеся клетки работают короткими импульсами и генерируют большую часть своего АТФ посредством гликолиза. Вместо того, чтобы полностью окислять глюкозу, они расщепляют ее до 3-углеродного пирувата, а затем до лактата (также называемого молочной кислотой).Лактат может поглощаться и сжигаться сердечными мышцами и медленно сокращающимися мышечными клетками, или он может поглощаться печенью и снова собираться вместе, чтобы произвести глюкозу.
Типы мышечных клеток
Метаболизм состоит из тесно взаимосвязанных путей — биохимия
Давайте теперь рассмотрим роли основных путей метаболизма и основных участков для их контроля:
Гликолиз. Эта последовательность реакций в цитозоле превращает одну молекулу глюкозы в две молекулы пирувата с одновременным образованием двух молекул АТФ и НАДН.NAD + , израсходованный в реакции, катализируемой глицеральдегид-3-фосфатдегидрогеназой, должен быть регенерирован для продолжения гликолиза. В анаэробных условиях, как и в высокоактивных скелетных мышцах, эта регенерация достигается за счет восстановления пирувата до лактата. Альтернативно, в аэробных условиях NAD + регенерируется путем переноса электронов от NADH к O 2 через цепь переноса электронов. Гликолиз служит двум основным целям: он разлагает глюкозу с образованием АТФ и обеспечивает углеродный скелет для биосинтеза.
Фосфофруктокиназа, которая катализирует обязательную стадию гликолиза, является наиболее важным контролирующим сайтом . АТФ является как субстратом в реакции переноса фосфорила, так и регуляторной молекулой. Высокий уровень АТФ ингибирует фосфофруктокиназу — регуляторные сайты отличаются от сайтов связывания субстрата и имеют более низкое сродство к нуклеотиду. Этот ингибирующий эффект усиливается цитратом и отменяется АМФ (). Таким образом, скорость гликолиза зависит от потребности в АТФ, о чем свидетельствует соотношение АТФ / АМФ, и от доступности строительных блоков, о чем свидетельствует уровень цитрата. В печени наиболее важным регулятором активности фосфофруктокиназы является 2,6-бисфосфат фруктозы (F-2,6-BP). Напомним, что уровень F-2,6-BP определяется активностью киназы, которая образует его из фруктозо-6-фосфата, и фосфатазы, гидролизующей 2-фосфорильную группу (Раздел 16.2.2). Когда уровень глюкозы в крови низкий, запускаемый глюкагоном каскад приводит к активации фосфатазы и ингибированию киназы в печени. Снижается уровень F-2,6-BP и, как следствие, активность фосфофруктокиназы.Следовательно, гликолиз замедляется, и оставшаяся глюкоза попадает в кровь для использования другими тканями.
Цикл лимонной кислоты и окислительное фосфорилирование. Реакции этого общего пути окисления молекул топлива — углеводов, аминокислот и жирных кислот — происходят внутри митохондрий. Большинство видов топлива входит в цикл как ацетил-КоА. Полное окисление ацетильной единицы циклом лимонной кислоты генерирует одну молекулу GTP и четыре пары электронов в виде трех молекул NADH и одной молекулы FADH 2 .Эти электроны передаются O 2 через цепь переноса электронов, что приводит к образованию протонного градиента, который стимулирует синтез девяти молекул АТФ. Доноры электронов окисляются и возвращаются обратно в цикл лимонной кислоты, только если АДФ одновременно фосфорилируется до АТФ. Эта тесная связь, называемая респираторным контролем, гарантирует, что скорость цикла лимонной кислоты соответствует потребности в АТФ. Изобилие АТФ также снижает активность двух ферментов в цикле — изоцитратдегидрогеназы, и α-кетоглутаратдегидрогеназы. Цикл лимонной кислоты также играет анаболическую роль. В сочетании с пируваткарбоксилазой , цикл лимонной кислоты обеспечивает промежуточные соединения для биосинтеза, такие как сукцинил-КоА для образования порфиринов и цитрат для образования жирных кислот.
Пентозофосфатный путь. Эта серия реакций, протекающая в цитозоле, состоит из двух стадий. Первый этап — окислительное декарбоксилирование глюкозо-6-фосфата.Его цель — производство НАДФН для восстановительного биосинтеза и образование рибозо-5-фосфата для синтеза нуклеотидов. Две молекулы НАДФН образуются при превращении глюкозо-6-фосфата в рибозо-5-фосфат. Дегидрирование глюкозо-6-фосфата является обязательным этапом на этом пути. Эта реакция контролируется уровнем акцептора электронов НАДФ + ().
Вторая стадия пентозофосфатного пути — это неокислительный обратимый метаболизм пятиуглеродных фосфосахаров в фосфорилированные трех- и шестиуглеродные гликолитические промежуточные соединения.Таким образом, неокислительная ветвь может либо вводить рибозы в гликолиз для катаболизма, либо генерировать рибозы из промежуточных продуктов гликолиза для биосинтеза.
Глюконеогенез. Глюкоза может синтезироваться печенью и почками из неуглеводных предшественников, таких как лактат, глицерин и аминокислоты. Основной точкой входа в этот путь является пируват, который карбоксилируется до оксалоацетата в митохондриях. Затем оксалоацетат метаболизируется в цитозоле с образованием фосфоенолпирувата.Другим отличительным средством глюконеогенеза являются две стадии гидролиза, которые обходят необратимые реакции гликолиза. Глюконеогенез и гликолиз обычно взаимно регулируются, так что один путь минимально активен, а другой — высокоактивен. Например, АМФ ингибирует, а цитрат активирует фруктозо-1,6-бисфосфатазу, важный фермент в глюконеогенезе, тогда как эти молекулы оказывают противоположное действие на фосфофруктокиназу, стимулятор гликолиза (). Фруктозо-2,6-бисфосфат также координирует эти процессы, ингибируя фруктозо-1,6-бисфосфатазу.Следовательно, когда глюкозы много, высокий уровень F-2,6-BP подавляет глюконеогенез и активирует гликолиз.
Синтез и разложение гликогена. Гликоген, легко мобилизуемый запас топлива, представляет собой разветвленный полимер из остатков глюкозы (). При деградации гликогена фосфорилаза катализирует расщепление гликогена ортофосфатом с образованием глюкозо-1-фосфата, который быстро превращается в глюкозо-6-фосфат для дальнейшего метаболизма. При синтезе гликогена активированным промежуточным продуктом является UDP-глюкоза, которая образуется из глюкозо-1-фосфата и UTP.Гликогенсинтаза катализирует перенос глюкозы от UDP-глюкозы к концевому остатку глюкозы растущей цепи. Распад и синтез гликогена скоординированно контролируются запускаемым гормонами каскадом амплификации, так что фосфорилаза активна, когда синтаза неактивна, и наоборот. Фосфорилирование и нековалентные аллостерические взаимодействия (Раздел 21.5) регулируют эти ферменты.
Синтез и разложение жирных кислот. Жирные кислоты синтезируются в цитозоле путем добавления двухуглеродных единиц к растущей цепи ацильного белка-носителя. Малонил-КоА, активированный промежуточный продукт, образуется при карбоксилировании ацетил-КоА. Ацетильные группы переносятся из митохондрий в цитозоль в виде цитрата посредством цитрат-малатного челнока. В цитозоле цитрат расщепляется с образованием ацетил-КоА. Помимо транспорта ацетил-КоА, цитрат в цитозоле стимулирует ацетил-КоА-карбоксилазу, фермент, катализирующий коммитируемую стадию.Когда много АТФ и ацетил-КоА, уровень цитрата увеличивается, что увеличивает скорость синтеза жирных кислот ().
Другой путь разложения жирных кислот в другом отделе. Карнитин переносит жирные кислоты в митохондрии, где они расщепляются до ацетил-КоА в матриксе митохондрий в результате β-окисления. Ацетил-КоА затем входит в цикл лимонной кислоты, если поступление оксалоацетата достаточно. Альтернативно, ацетил-КоА может давать кетоновые тела. FADH 2 и NADH, образующиеся на пути β-окисления, переносят свои электроны на O 2 через цепь переноса электронов.Как и цикл лимонной кислоты, β-окисление может продолжаться, только если NAD + и FAD регенерируются.
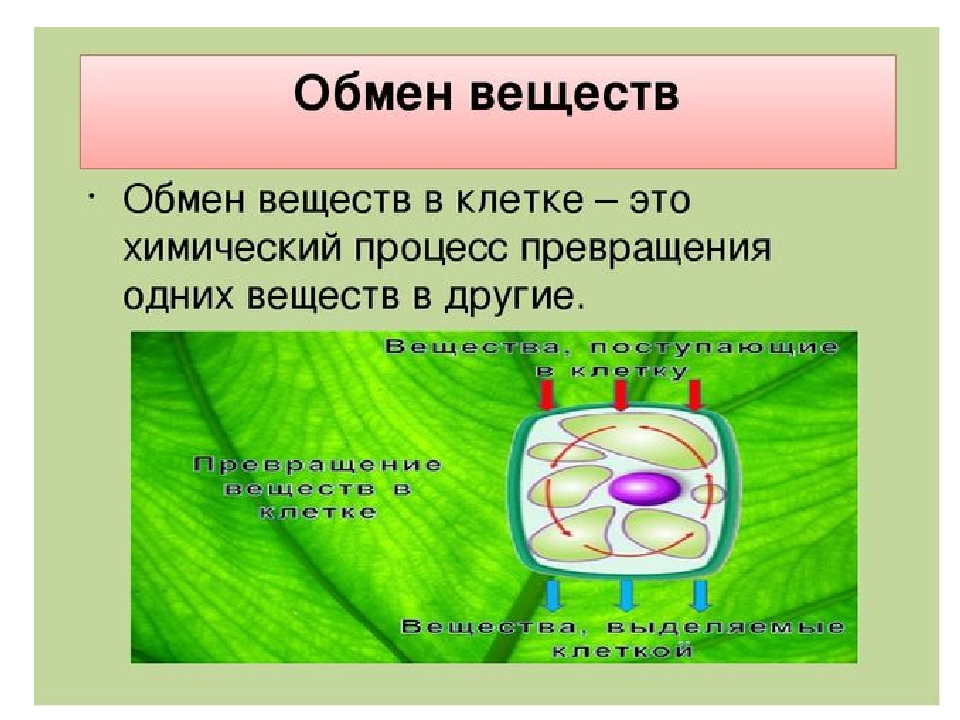

 Кислород активнее поступает во все органы, благодаря чему усиливается и клеточная активность. Посещая баню, сауну либо парную, хотя бы один раз в месяц, мы значительно ускорим обмен веществ.
Кислород активнее поступает во все органы, благодаря чему усиливается и клеточная активность. Посещая баню, сауну либо парную, хотя бы один раз в месяц, мы значительно ускорим обмен веществ.
 Одним словом – пляж и есть то место, где гармонично объединяются эти 3 компонента.
Одним словом – пляж и есть то место, где гармонично объединяются эти 3 компонента.
