Скелет. Строение, состав и соединение костей скелета человека
Если бы в теле человека не было костей, то оно напоминало бы бесформенный студенистый мешок, как у медузы.
Кости придают нашему телу форму. Они твёрдые и прочные. Все кости в теле человека образуют скелет. Слово «скелет» происходит от греческого слова «скелетос», что в переводе означает «высохший», вероятно, из-за того, что ткани скелета кажутся совсем безжизненными.
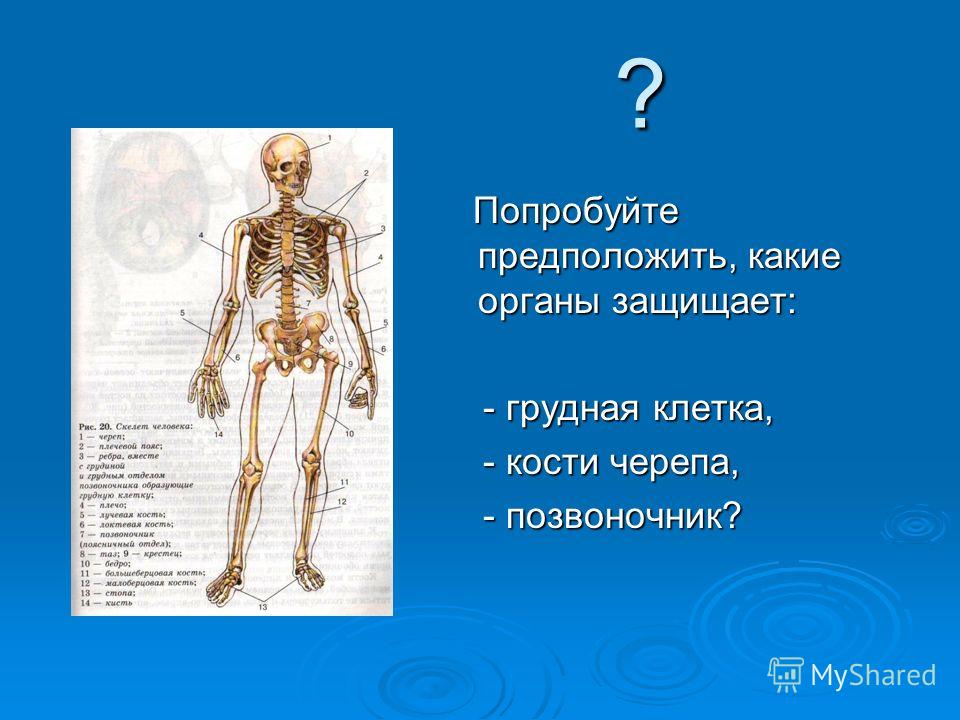
В скелете человека выделяют три отдела: скелет головы, скелет туловища и скелет конечностей. Масса скелета составляет около 11 килограммов. Он играет большую роль в жизни человека: является опорой тела и защищает внутренние органы от повреждений. Например, кости головы защищают головной мозг, а кости позвоночника – спинной мозг, который находится внутри него.
Мышцы
– это двигатели нашего тела, благодаря которым мы передвигаемся и
работаем.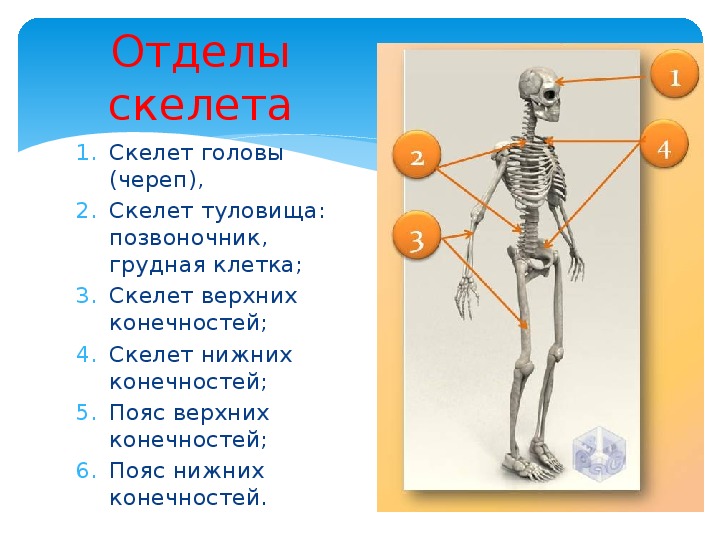
Строение и форма мышц зависят от той работы, которую им приходится чаще всего выполнять. Они, словно канаты, состоят из тонких волокон. Своими концами мышцы крепятся к костям. Они способны сокращаться и расслабляться. За счёт этого происходит движение костей, а значит, и нашего тела. Все этими процессами управляет головной мозг.
У человека выделяют мышцы головы, шеи, туловища, верхних и нижних конечностей. Всего в теле человека насчитывается более 600 мышц.
Например, 200 из них используются при ходьбе, 43 – для того, чтобы наморщить лоб, и 17 – для того, чтобы улыбнуться.
Скелет и мышцы образуют опорно-двигательную
систему. Её главная роль – обеспечение опоры и движения организма.
Так как кости не могут сами выполнять движения, они являются пассивной частью опорно-двигательной системы. Активной частью опорно-двигательной системы являются скелетные поперечно-полосатые мышцы. Именно они, сокращаясь, обеспечивают движение костей скелета, как рычагов.
Для человека характерно прямохождение и вертикальное положение тела, в связи с этим в опорно-двигательной системе имеется ряд особенностей. Например, изгибы позвоночника придают ему упругость во время совершения различных движений.
В скелете взрослого человека насчитывается от 204 до 208 костей. Они отличаются друг от друга по размерам, форме и выполняемым функциям. Различают
Трубчатые кости
входят в скелет верхних и нижних конечностей. Например, кости плеча,
предплечья, бедра и голени. Они являются прочными рычагами, с помощью которых
возможно передвижение организма или перемещение его частей.
Все трубчатые кости имеют вид полых цилиндров с утолщёнными концами – эпифизами. Средняя часть кости называется диафизом. Сверху кости покрыты соединительнотканной оболочкой – надкостницей. Она состоит из двух слоёв. В наружном слое много сосудов и нервных окончаний. К нему прикрепляются сухожилия и мышцы. Внутренний слой – тонкий и нежный, он состоит из живых клеток.
Надкостница прочно срастается с костной тканью. За ней располагается слой компактного вещества. В эпифизах компактное вещество переходит в губчатое. Оно заполняет всю головку.
Компактное и губчатое
вещество образованы костными пластинками и межклеточным веществом. В компактном
веществе костные пластинки образуют сложные системы ─ остеоны,
которые состоят из вставленных друг в друга цилиндров. В центре каждого остеона
расположен канал, по которому проходят кровеносные сосуды и нервы.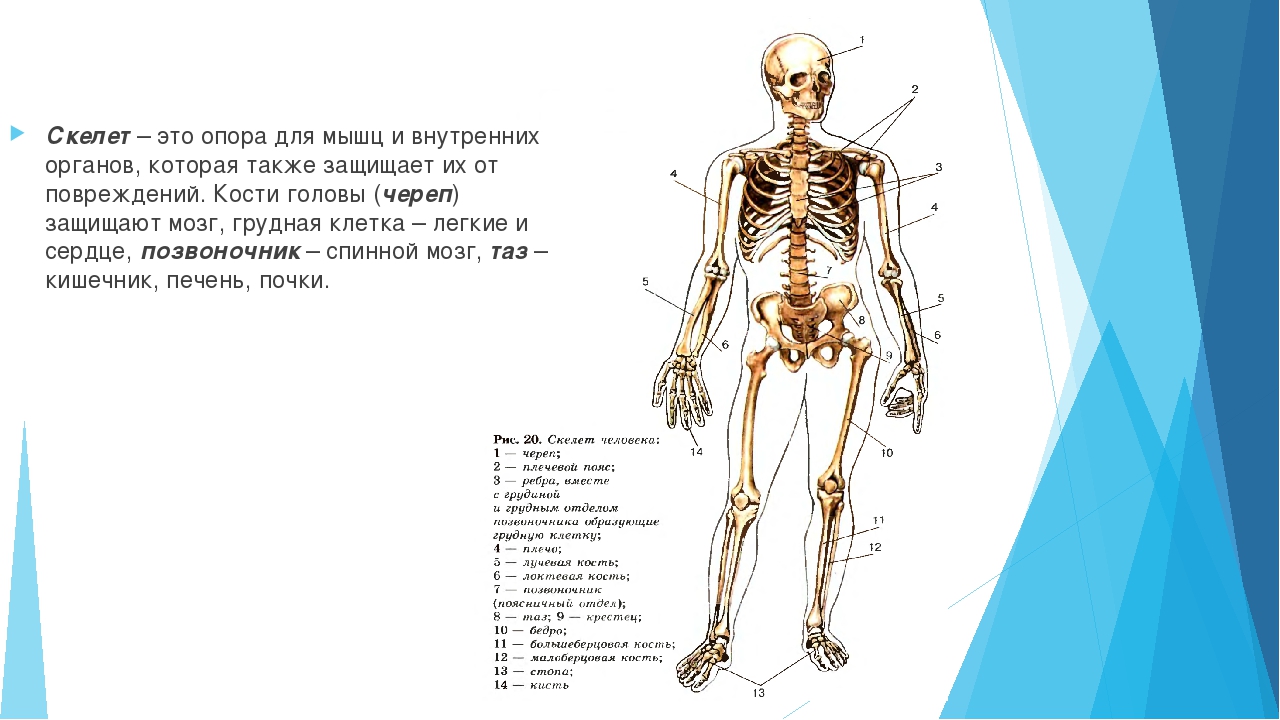
В губчатом веществе костные пластинки и перекладины перекрещиваются между собой и образуют множество ячеек.
Губчатые кости состоят из губчатого вещества, которое покрыто тонким слоем компактного. К губчатым костям относится надколенник и кости запястья. Кости такого типа расположены там, где необходимы одновременно большая прочность и подвижность.
К плоским
Смешанные кости состоят из нескольких частей, имеющих различное строение и форму. К этому типу костей относятся позвонки и кости основания черепа. Они выполняют функцию опоры и защиты.
Кость состоит из
нескольких тканей, важнейшей из которых является костная.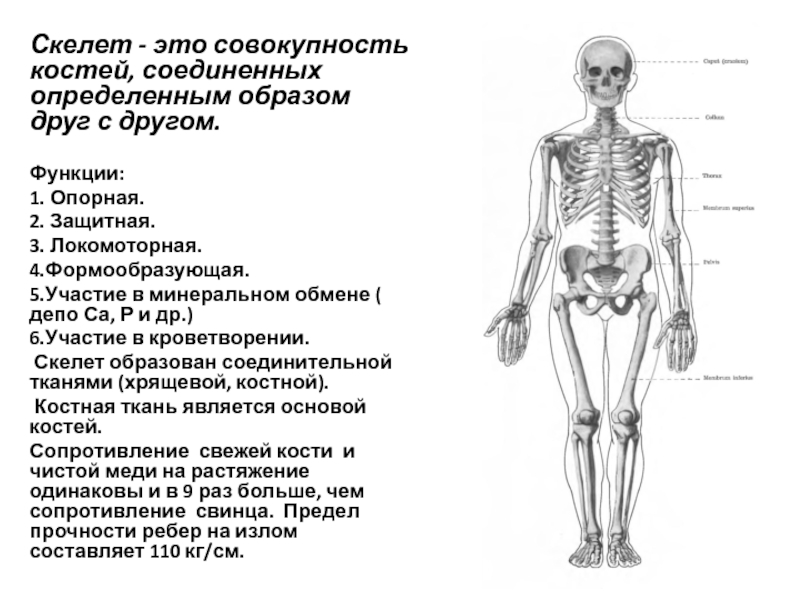 К какому бы
типу не относилась кость, она имеет сложный химический состав. Живая кость
содержит 50% воды, 12,5% белков, 15,7% жиров и углеводов и 21,8% неорганических
соединений. Это различные соединения, в состав которых входят кальций, фосфор,
магний и в незначительном количестве – алюминий, фтор, марганец, свинец,
молибден, железо и другие элементы.
К какому бы
типу не относилась кость, она имеет сложный химический состав. Живая кость
содержит 50% воды, 12,5% белков, 15,7% жиров и углеводов и 21,8% неорганических
соединений. Это различные соединения, в состав которых входят кальций, фосфор,
магний и в незначительном количестве – алюминий, фтор, марганец, свинец,
молибден, железо и другие элементы.
В костях содержится 99% всего кальция, имеющегося в теле человека. Кости – своеобразное депо этого элемента.
Органические вещества придают кости эластичность и упругость, а неорганические, или минеральные, вещества придают твёрдость. Сочетание этих веществ делает кость очень прочной. В детском возрасте в костях преобладают вода и органические вещества. С возрастом содержание органических веществ уменьшается и увеличивается содержание неорганических. Поэтому у пожилых людей кости более хрупкие и часто ломаются.
Кость представляет собой
живое образование, в котором происходят процессы роста и обмена веществ. В
детстве и юности кости людей растут в длину и утолщаются.
В
детстве и юности кости людей растут в длину и утолщаются.
Рост костей в длину происходит за счёт зон роста, которые расположены на границе диафиза и эпифизов.
В возрасте 22–25 лет формирование скелета заканчивается.
Между перекладинами губчатого вещества кости содержится особая ткань – красный костный мозг. В нём происходит образование клеток крови – кроветворение. До младшего школьного возраста (7–9 лет) красный костный мозг находится как в губчатом веществе, так и в полостях трубчатых костей. В дальнейшем в диафизах он заменяется жировой тканью, которую называют жёлтым костным мозгом. Он является накопителем жировой ткани и не участвует в кроветворении.
Кости соединяются между
собой по-разному.
Неподвижное соединение костей осуществляется хрящевой или соединительной тканью. У новорождённого ребёнка тазовая кость образована тремя костями (седалищной, лобковой и подвздошной). Они соединены хрящевыми прослойками. С возрастом хрящ постепенно заменяется костной тканью, и кости срастаются, образуя таз.
Неподвижное соединение костей может осуществляться с помощью швов. Так соединяются между собой кости черепа. В этом случае многочисленные выступы одной кости входят в соответствующие углубления другой кости. Непрерывные соединения обеспечивают надёжную защиту и опору для внутренних органов и мозга.
Большинство костей тела
человека не сращены между собой, так как если бы кости
нашего тела срастались, то движения были бы невозможны.
В полуподвижных соединениях кости связаны между собой хрящевыми дисками. Такие хрящевые диски расположены между телами позвонков. Они позволяют позвонкам менять своё положение в пространстве, и человек может совершать наклоны в разные стороны. С помощью таких хрящевых образований рёбра прикрепляются к грудине. Полупрерывные соединения смягчают толчки и удары. Они работают как биологические амортизаторы.
Подвижные (прерывные) соединения костей – суставы – облегчают скольжение костей относительно друг друга, одновременно плотно скрепляя их между собой. Скольжение достигается благодаря тому, что соединяющиеся концы костей имеют соответствующую форму.
Например, если на одной кости есть головка, то на другой – ямка.
Приведём несколько примеров суставов: это тазобедренный, коленный, локтевой суставы.
Строение коленного сустава.
В
его состав входят суставные поверхности сочленяющихся костей, капсула,
полость, суставная жидкость, а также вспомогательные элементы –
связки и мениски.
Сочленяющиеся концы костей покрыты гладким хрящом, который уменьшает трение между ними и облегчает движение. Прочность скрепления костей обеспечивается с помощью суставной капсулы, которая состоит из соединительной ткани, натянутой между концами костей по всей окружности сустава. Края капсулы прирастают к костям и прочно закрывают полость сустава. Полость сустава заполнена суставной, или синовиальной, жидкостью. Она постоянно выделяется внутренней поверхностью суставной капсулы. Синовиальная жидкость необходима для питания хряща и уменьшения трения костей. Наружный слой суставной капсулы переходит в надкостницу.
Капсула делает суставную полость герметичной. Герметичность способствует сближению костей и обеспечивает суставу достаточную прочность.
В создании герметичности принимают участие связки.
Связки – это пучки плотной волокнистой ткани, которые соединяют кости.
В состав
опорно-двигательной системы входят свыше 230 суставов и около 700 связок.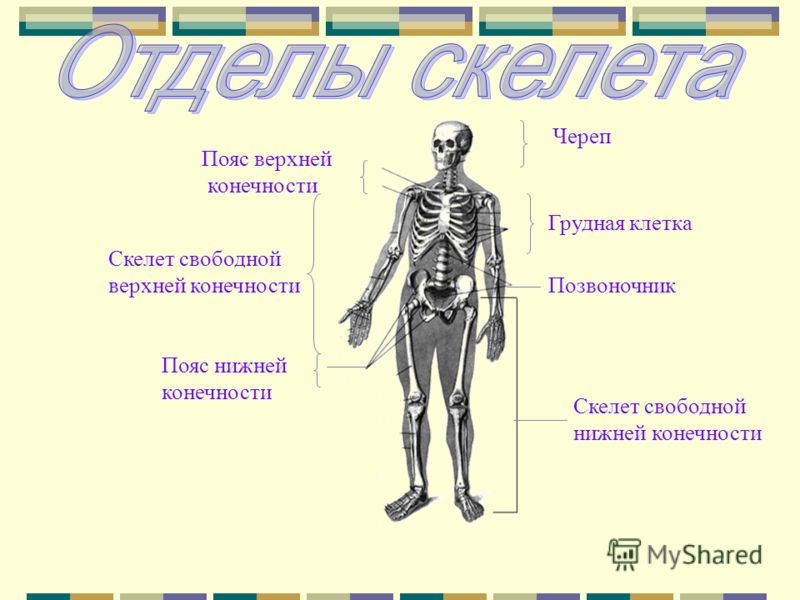
В состав опорно-двигательной системы входит свыше 230 суставов и около 700 связок.
Итог урока. Основу организма человека составляет скелет. В его состав входит более 200 костей. Различают трубчатые, плоские, губчатые и смешанные кости. Между собой они могут соединяться по-разному. Существует три типа соединения костей: неподвижное, полуподвижное и подвижное (сустав).
Скелет и мышцы человека образуют опорно-двигательную систему. Она обеспечивает опору и движение организма.
Химический состав костей скелета цесарок Текст научной статьи по специальности «Биологические науки»
бройлерных цыплят на фоне введения водной коллоидной дисперсии наночастиц серебра [9].
Таким образом, результаты наших исследований показали, что наночастицы серебра в организме крыс обладают анаболическим действием.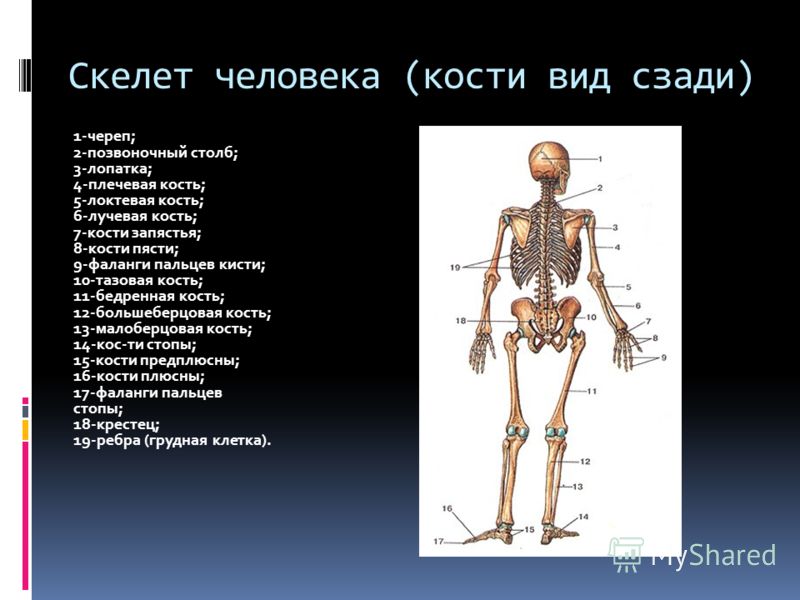 Анаболический эффект в максимальной степени выражен при поступлении металла в организм крыс в дозе 6,61 мг на 1 кг живой массы в сутки. При этой дозе сохраняется пропорциональность между приростом массы тела и увеличением массы органов, что свидетельствует о физиологичности изменений. Серебро преимущественно депонируется в печени. Уровень накопления металла определяется количеством серебра, поступившего в организм крыс парентерально.
Анаболический эффект в максимальной степени выражен при поступлении металла в организм крыс в дозе 6,61 мг на 1 кг живой массы в сутки. При этой дозе сохраняется пропорциональность между приростом массы тела и увеличением массы органов, что свидетельствует о физиологичности изменений. Серебро преимущественно депонируется в печени. Уровень накопления металла определяется количеством серебра, поступившего в организм крыс парентерально.
Литература
1. Кульский Л.А. Серебряная вода. Киев: Наукова думка, 1987. 152 с.
2. Нежинская Г.И., Копейкин В.В., Гмиро В.Е. Иммунотроп-ные свойства высокодисперсного металлического серебра // Серебро в медицине, биологии и технике. Препринт № 4. Новосибирск: СО РАМН, 1995. С. 151-153.
3. Зинина Е.Н. Местная защита слизистых оболочек и состояние резистентности у кур после применения серебросодержа-
щего препарата «Silvecoll»: автореф.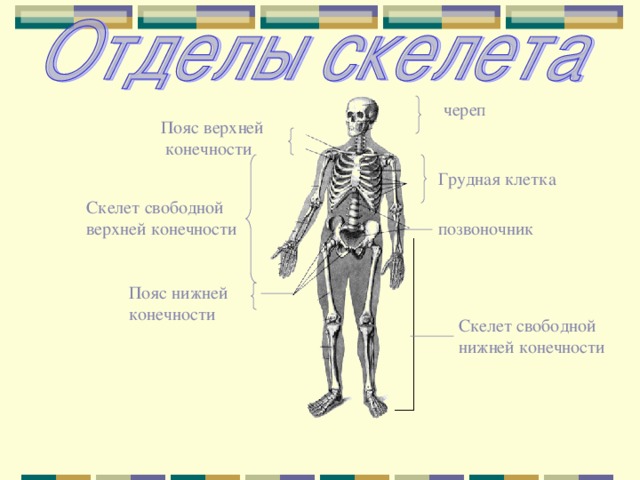 дисс. … канд. вет. наук. Саранск: Мордовский ГУ им. Н.П. Огарёва, 2013. 24 с.
дисс. … канд. вет. наук. Саранск: Мордовский ГУ им. Н.П. Огарёва, 2013. 24 с.
4. Ткаченко Е.А., Дерхо М.А. Влияние б-токоферола и наночастиц серебра на морфологический состав крови мышей при экспериментальной кадмиевой интоксикации // Известия Оренбургского государственного аграрного университета. 2015. № 1 (51). С. 84-87.
5. Юркова И.Н., Юркова А.В., Омельченко А.В. Влияние наночастиц серебра на ростовые процессы пшеницы // Вестник Восточно-Сибирского государственного университета технологий и управления. Научно-технический журнал. 2014. № 1 (46). С. 69-74.
6. Красочко П.А., Чижик С.А., Худолей А.Л. Оценка взаимодействия наночастиц серебра с перевариваемыми клетками МБДК. [Электронный ресурс]. URL: http: //86.57.180.90/ fulltext/ stat/ 418.pdf 2012 (дата обращения 26.03.2014).
7. Ткач О.Б., Трохимчук А.К., Левицкий А.П. Биохимические маркеры воспаления и антиоксидантной защиты в тканях полости рта крыс при воздействии липополисахарида и на-ночастиц золота и серебра. [Электронный ресурс]. URL: http: www.herald.com.ua /2013/03_13. (Дата обращения 25.03.2015).
Ткач О.Б., Трохимчук А.К., Левицкий А.П. Биохимические маркеры воспаления и антиоксидантной защиты в тканях полости рта крыс при воздействии липополисахарида и на-ночастиц золота и серебра. [Электронный ресурс]. URL: http: www.herald.com.ua /2013/03_13. (Дата обращения 25.03.2015).
8. Тарабанова Е.В. Физиологический статус сельскохозяйственной птицы в раннем онтогенезе при выращивании с использованием серебряного нанокомпозита: автореф. дисс. … канд. биол. наук. Новосибирск: НГАУ. 2013. 23 с.
9. Оценка уровня накопления серебра в тканях и органах цыплят-бройлеров при пероральном и аэрозольном применении коллоидного серебра / В.Ю. Коптев, М.А. Титова, Н.Ю. Балыбина [и др.] // Проблемы биологии продуктивных животных. 2014. № 3. С. 92-100.
Химический состав костей скелета цесарок
Е.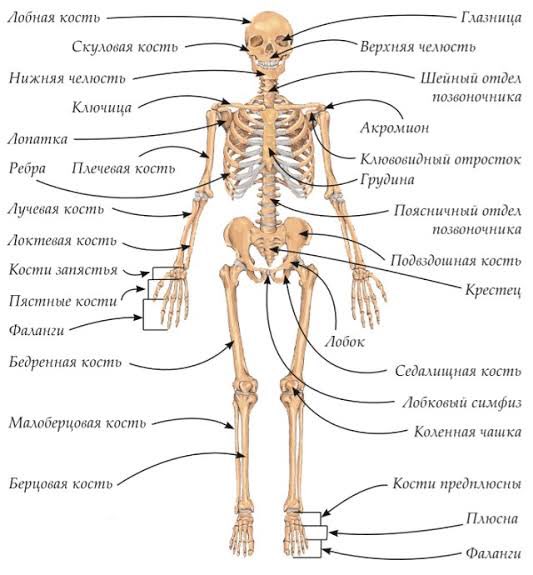 В.Куликов, к.б.н., Е.Д. Сотникова, к.б.н., Т.С. Кубатбеков,
В.Куликов, к.б.н., Е.Д. Сотникова, к.б.н., Т.С. Кубатбеков,
д.б.н, профессор, ФГАОУВО РУДН;В.И. Косилов, д.с.-х.н., профессор, ФГБОУ ВО Оренбургский ГАУ
Среди основных функций скелета особо выделяют метаболические — хранилище для кальция, фосфора и карбоната, карбонатный костный буфер, связывание токсинов и тяжёлых металлов. Всё это обусловливает крепость и твёрдость костей, а также своевременное выделение химических элементов в нужном количестве в кровь [1—4].
Установление характеристики химического состава костной ткани в породном, возрастном аспектах необходимо для оценки особенностей цесарок, для сравнительной и возрастной патологии птицы, для проведения различных экспериментов с целью определения адаптационных особенностей развития скелета [5].
Химический состав костей скелета цесарок белой волжской породы недостаточно изучен.
Цель исследования — изучение химического состава костей скелета цесарок белой волжской породы в постэмбриональный период онтогенеза.
Материал и методы исследования. Материалом для химического анализа служили грудная, тазовая кости, диафизы плечевой, бедренной, большебер-цовой костей и 7-й шейный позвонок. Кости брали у цесарок белой волжской породы в возрасте: 1, 60, 90, 180, 270 и 365 сут.
Для опытов отбирали птиц обоих полов, всего в экспериментах было задействовано 264 гол. цесарок. Все птицы были клинически здоровыми,
средней упитанности и находились на свободно-выгульном содержании.
Кальций и фосфор определяли в золе с помощью общепринятых методик. Содержание неорганических веществ в костях скелета определяли при помощи экспресс-метода, предложенного И. В. Хрусталевой [6].
В. Хрусталевой [6].
Результаты исследования. Данные по химическому составу костей скелета цесарок белой волжской породы, содержанию золы, кальция и фосфора представлены в таблицах 1—3. Они свидетельствуют о том, что содержание золы и кальция в костях цесарок больше, чем у цесарей. В то же время полученные данные показывают, что по содержанию фосфора в костях лидируют цесари.
Так, у суточных цесарок общее содержание золы и кальция в костях скелета было больше на 7,13 и 13,95%, а фосфора меньше на 4,7%, чем у цесарей. В возрасте 60 сут. содержание золы и кальция у цесарок было больше на 9,26 и 18,46% соответственно, а фосфора меньше на 11,94%, чем у цесарей. В 90-суточном возрасте эта разница составляла: золы — на 8,05%, кальция — на 10,93% больше, а фосфора — на 3,93% меньше. В 180-суточном возрасте по содержанию золы в костях скелета цесарки превосходили цесарей на 7,79%, кальция — на 12,83%, но уступали по содержанию фосфора 3,93%. Преимущество цесарок над цесарями по содержанию золы и кальция в костях сохранилось и в возрасте 270 сут. — больше на 7,87 и 11,88% соответственно, но по содержанию фосфора они уступали цесарям этой возрастной группы на 5,15%. В возрасте 365 сут. была уста-
Преимущество цесарок над цесарями по содержанию золы и кальция в костях сохранилось и в возрасте 270 сут. — больше на 7,87 и 11,88% соответственно, но по содержанию фосфора они уступали цесарям этой возрастной группы на 5,15%. В возрасте 365 сут. была уста-
1. Содержание золы в костях скелета, %
Возраст, сут. Кость Цесари Цесарки В среднем по всем образцам
1 грудная тазовая плечевая бедренная большеберцовая 7-й шейный позвонок 22,72 24,15 28,05 23,44 25,53 22,63 23,10 25,06 28,73 26,82 29,56 23,67 22,91 24,60 28,39 25,13 27,54 23,15
60 грудная тазовая плечевая бедренная большеберцовая 7-й шейный позвонок 29,48 32,85 35,81 29,41 32,64 32,15 31,51 34,83 38,12 36,03 37,49 32,19 30,49 33,84 36,96 32,72 35,07 32,17
90 грудная тазовая плечевая бедренная большеберцовая 7-й шейный позвонок 43,24 43,75 50,50 43,14 46,27 46,52 46,38 47,02 53.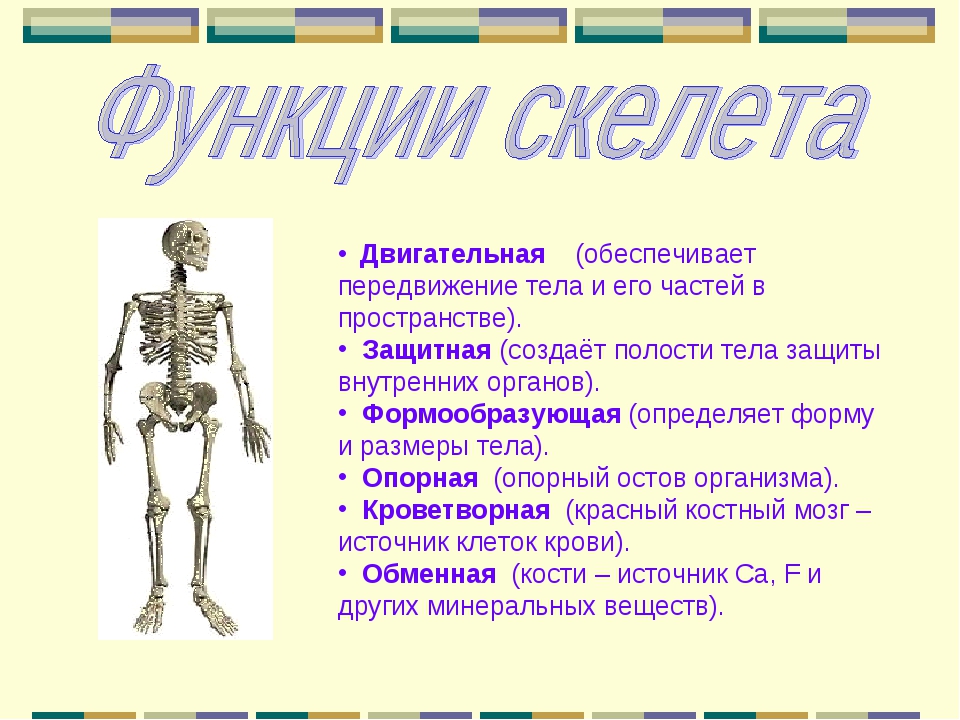 79 49,57 52.80 47,83 44,81 45,38 52,14 46,35 49,54 47,17
79 49,57 52.80 47,83 44,81 45,38 52,14 46,35 49,54 47,17
180 грудная тазовая плечевая бедренная большеберцовая 7-й шейный позвонок 47,62 49,30 52,34 48,52 49,92 48,95 53,26 52,98 57,64 54,09 53,89 49,87 50,44 51,14 54,99 51,30 51,90 49,41
270 грудная тазовая плечевая бедренная большеберцовая 7-й шейный позвонок 48,12 50,19 54,51 50,90 51,23 49,73 53,62 54,96 59,64 56,13 55,20 51,16 50,87 52,57 57,08 53,51 53,21 50,44
365 грудная тазовая плечевая бедренная большеберцовая 7-й шейный позвонок 52,92 55,09 56,80 54,35 53,82 52,13 54,70 56,30 60,11 60,52 57,28 54,73 53,81 55,69 58,46 57,43 55,55 53,43
2. Содержание кальция в костях, %
Возраст, сут. Кость Цесари Цесарки В среднем по всем образцам
1 2 3 4 5
1 грудная тазовая плечевая бедренная большеберцовая 7-й шейный позвонок 15,23 17,39 18,96 13,92 17,28 13,99 16,37 18,11 20,03 19,31 22,40 14,09 15,8 17,75 19,5 16,61 19,84 14,04
60 грудная тазовая плечевая бедренная большеберцовая 7-й шейный позвонок 20,14 23,91 25,19 19,59 23,13 19,30 22,98 25,64 29,01 27,56 28,52 21,80 21.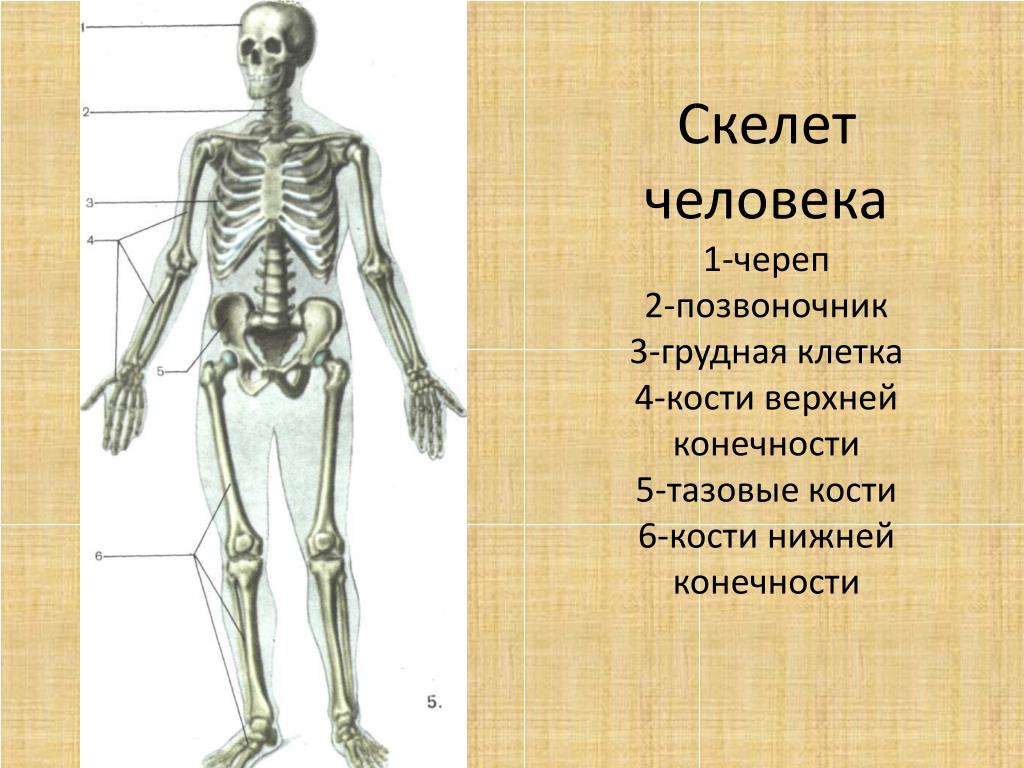 56 24,78 27,1 23.57 25,82 20,55
56 24,78 27,1 23.57 25,82 20,55
90 грудная тазовая плечевая бедренная большеберцовая 7-й шейный позвонок 30,19 34.14 35,01 27.15 31,74 33,37 33,60 35,23 38,91 34,95 37,90 34,52 31,89 34,69 36,96 31,05 34,82 33,94
Продолжение таблицы 2
1 2 3 4 5
грудная 34,01 39,25 36,63
тазовая 34,85 41,19 38,02
плечевая 36,28 41,90 39,09
бедренная 32,20 38,72 35,46
большеберцовая 33,56 39,03 36,29
7-й шейный позвонок 34,95 36,04 35,49
грудная 35,20 40,09 37,64
тазовая 36,17 42,89 39,53
плечевая 37,98 43,00 40,49
бедренная 34,63 39,92 37,27
большеберцовая 35,21 40,50 37,85
7-й шейный позвонок 35,75 37,52 36,63
грудная 38,69 41,90 40,29
тазовая 40,19 43,01 41,60
плечевая 39,79 44,11 41,95
бедренная 36,81 43,32 40,06
большеберцовая 35,93 42,03 38,98
7-й шейный позвонок 35,95 38,12 37,03
3. Содержание фосфора в костях скелета, %
Содержание фосфора в костях скелета, %
Возраст, сут. Кость Цесари Цесарки В среднем по всем образцам
1 грудная тазовая плечевая бедренная большеберцовая 7-й шейный позвонок 5,89 6,01 8,04 7,59 7,45 5,12 5,63 5,93 7,85 7,11 6,92 4,85 5,76 5.97 7,94 7,35 7,18 4.98
60 грудная тазовая плечевая бедренная большеберцовая 7-й шейный позвонок 8,52 8.44 9,57 8,76 8.45 6,88 7,83 7,96 8,01 7,83 7,90 5,72 8,17 8,00 8,79 8,29 8,17 6,3
90 грудная тазовая плечевая бедренная большеберцовая 7-й шейный позвонок 11,02 11,23 13,49 12,89 13,45 11,12 10,72 10,69 12,52 12,48 13,02 10,88 10,87 10,96 13,01 12,68 13,23 11,00
180 грудная тазовая плечевая бедренная большеберцовая 7-й шейный позвонок 11,52 11,62 14,50 14,19 14,02 11,93 11,12 10,76 14,01 13,89 13,11 11,82 11,32 11,19 14,25 14,04 13,56 11,87
270 грудная тазовая плечевая бедренная большеберцовая 7-й шейный позвонок 11,89 12,49 14,58 15,20 14,26 12,03 11,53 11. 14 14.15 14,37 13,17 11,95 11,71 11,81 14,36 14,78 13,71 11,99
14 14.15 14,37 13,17 11,95 11,71 11,81 14,36 14,78 13,71 11,99
365 грудная тазовая плечевая бедренная большеберцовая 7-й шейный позвонок 12,20 12,88 14,89 16,08 14,67 12,26 11,79 11,63 14,53 15,00 13,20 12,07 11,99 12,25 14,71 15,54 13,93 12,16
новлена следующая разница в содержании золы, кальция и фосфора в костях птиц: золы на 5,88, кальция — на 9,95% больше, чем у цесарей, фосфора, наоборот, меньше на 5,71%.
Необходимо отметить, что с возрастом содержание в костной ткани золы, кальция, фосфора повышается и у цесарок, и у цесарей. Так, содержание золы у цесарей в возрасте 1 сут. составляло 24,42%, в возрасте 365 сут. — 53,90%, т.е. увеличилось в 2,21 раза. Содержание кальция в костях цесарей увеличилось с 16,13% в возрасте 1 сут. до 37,89% в возрасте 365 сут., т.е. в 2,35 раза. Количество фосфора у цесарей в возрасте 1 сут. повысилось с 6,68 до 13,83%, или в 2,07 раза. Содержание в костях цесарок золы повысилось с 26,16 до 57,27%, т.е. в 2,19 раза, кальция — с 18,38 до 42,08%, или в 2,29 раза, фосфора — с 6,38 до 13,04%, или в 2,04 раза.
Содержание в костях цесарок золы повысилось с 26,16 до 57,27%, т.е. в 2,19 раза, кальция — с 18,38 до 42,08%, или в 2,29 раза, фосфора — с 6,38 до 13,04%, или в 2,04 раза.
Соотношение кальция к фосфору у исследуемых птиц находилось в пределах нормы. В кальциево-фосфорном отношении между цесарями и цесарками практической разницы не установлено (Р>0,05). Чётко прослеживается более широкий разброс в кальциево-фосфорном отношении у цесарок по сравнению с цесарями.
Наибольшее количество золы у птиц обоих полов отмечается в костях бедра, затем большеберцовой, плечевой, грудной и тазовой костях.
Количество кальция у птицы в разные периоды онтогенеза различно. В период от 1- до 60-суточного возраста наибольшее количество кальция содержится в плечевой, а в большеберцовой, тазовой, бедренной и грудной костях убывает. В период от 60- до 90-суточного возраста наибольшее количество кальция установлено в грудной кости, но снижается в бедренной, большеберцовой, плечевой и тазовой костях. В период от 90- до 180-суточного возраста выявлено увеличение количества кальция в плечевой и уменьшение в тазовой, грудной, большеберцовой и бедренной костях. В период от 180- до 365-суточного возраста очередность содержания максимального количества кальция вновь меняется: больше всего кальция в тазовой кости, а в плечевой, бедренной, тазовой, грудной и большеберцовой костях уменьшается.
В период от 90- до 180-суточного возраста выявлено увеличение количества кальция в плечевой и уменьшение в тазовой, грудной, большеберцовой и бедренной костях. В период от 180- до 365-суточного возраста очередность содержания максимального количества кальция вновь меняется: больше всего кальция в тазовой кости, а в плечевой, бедренной, тазовой, грудной и большеберцовой костях уменьшается.
Содержание фосфора у цесарей и цесарок в период от 1- до 90-суточного возраста наиболее высокое в бедренной, затем в плечевой, больше-берцовой, грудной и, наконец, в тазовой костях. У птиц остальных возрастных групп содержание фосфора за некоторыми исключениями практически не изменяется, как в рассмотренных выше возрастных группах.
Выводы. Подводя итоги по изучению химического состава скелета цесарок, мы пришли к
следующим выводам. Основными химическими элементами костей являются кальций и фосфор. Количество минеральных веществ в значительной степени изменяется в зависимости от возраста и пола. Отмечаются различия в степени минерализации костей скелета. Количество золы и кальция в костной ткани у цесарок больше, чем у цесарей. Обратная картина наблюдается по содержанию фосфора.
Количество минеральных веществ в значительной степени изменяется в зависимости от возраста и пола. Отмечаются различия в степени минерализации костей скелета. Количество золы и кальция в костной ткани у цесарок больше, чем у цесарей. Обратная картина наблюдается по содержанию фосфора.
Содержание кальция и фосфора в костях птицы обоих полов изменяется по той же закономерности, что и содержание золы, а именно: содержание кальция и фосфора в костях до 180-суточного возраста у цесарок заметно больше, чем у цесарей. Содержание кальция и фосфора в период от 180-до 365-суточного возраста не претерпевает резких изменений: по данному показателю цесари лишь немного уступают цесаркам. Такое изменение связано с началом интенсивной яйцекладки.
Повышение содержания золы, кальция и фосфора в костях птицы происходит неравномерно: здесь наблюдается явная зависимость от возраста. В период от 1 до 90 сут. повышение золы, кальция, фосфорф у цесарей составляет 21,15; 15,8 и 5,52% соответственно, от 90 до 365 сут. — лишь 8,33; 5,96 и 1,63% соответственно.
повышение золы, кальция, фосфорф у цесарей составляет 21,15; 15,8 и 5,52% соответственно, от 90 до 365 сут. — лишь 8,33; 5,96 и 1,63% соответственно.
У цесарок повышение по золе, кальцию и фосфору в период от суточного до 90-суточного возраста составляет 23,4; 17,47 и 5,34% соответственно, в возрасте от 90 до 365 сут. —7,71; 6,23 и 1,32%.
В кальциево-фосфорном отношении между цесарями и цесарками практической разницы не установлено (Р>0,05).
Литература
1. Косилов В.И., Востриков Н.И., Тихонов П.Т. и др. Влияние сезона вывода на параметры экстерьера и живой массы молодняка чёрного африканского страуса разных генотипов // Известия Оренбургского государственного аграрного университета. 2013. № 3 (41). С. 160-162.
2. Куликов Е.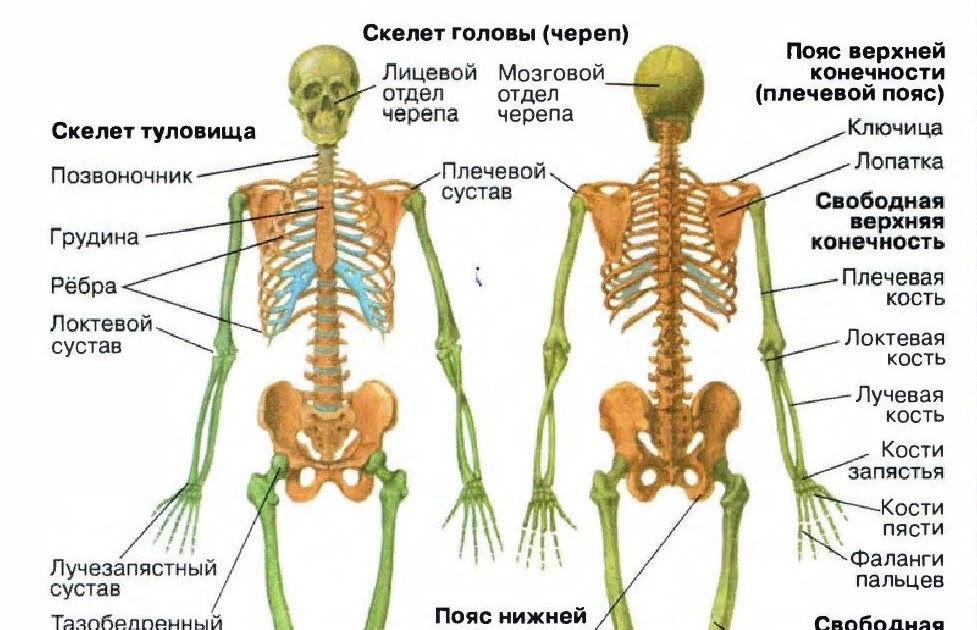 В. Морфохимическая характеристика скелета цесарок в постэмбриональном онтогенезе: автореф. дисс. … канд. биол. наук. Саранск, 2004. 18 с.
В. Морфохимическая характеристика скелета цесарок в постэмбриональном онтогенезе: автореф. дисс. … канд. биол. наук. Саранск, 2004. 18 с.
3. Куликов Е.В., Мыслович Н.А., Пиедра-Соболевская К. Особенности химического состава скелета цесарок белой волжской породы // Инновационные процессы в АПК: сб. статей VI Междунар. науч.-практич. конф. преподавателей, молодых учёных, аспирантов и студентов. М., 2014. С. 148-151.
4. Куликов Е.В., Ролдугина Н.П., Загайнова Е.И. Особенности гистологического строения костной ткани у цесарок белой волжской породы // Вестник Российского университета дружбы народов. Серия: Агрономия и животноводство. 2007. № 1-2. С. 100-106.
5. Куликов Е.В., Сотникова Е.Д. Особенности развития осевого и периферического скелета цесарок белой волжской породы в постэмбриональном онтогенезе // Вестник Российского университета дружбы народов. Серия: Агрономия и животноводство. 2015. № 2. С. 74-80.
Серия: Агрономия и животноводство. 2015. № 2. С. 74-80.
6. Хрусталева И.В. Морфофункциональный статус и тесты, его определяющие, у млекопитающих и птиц // Морфофункциональный статус млекопитающих и птиц. Симферополь, 1995. С. 3-4.
«Мечта скелета»
Гастрономическое соревнование проходило в рамках мероприятий, посвященных Международному дню борьбы с остеопорозом. «Обычно в эти дни мы проводим конкурс «Дары осени», — сказала в интервью «ЧН» заведующая поликлиникой, председатель профсоюзного комитета центра Ирина Черкасова. — Но в этот раз решили внести коррективы в ежегодную традицию и акцентировать внимание на здоровом питании. Главное условие конкурса — представленные блюда должны быть богаты кальцием и витамином Д».
Сотрудники центра встретили предложение на ура, даже реанимационное отделение, несмотря на большую занятость, приняло активное участие. Реаниматологи представили на суд жюри сырники, салат, тыкву, фаршированную молочной кашей, и десерт «Ирэн», в составе которого йогурт, фрукты и кунжут. Последний ингредиент имеет большие запасы кальция, потому очень полезен для костей и суставов. Так что кунжут присутствовал в составе многих конкурсных блюд.
Последний ингредиент имеет большие запасы кальция, потому очень полезен для костей и суставов. Так что кунжут присутствовал в составе многих конкурсных блюд.
Повара местной столовой отличились в нескольких номинациях: «Самое солнечное блюдо» — яйца, фаршированные сардинами, «Для здоровья костей» — творожный десерт «Снежок».
Вышеупомянутая клинико-диагностическая лаборатория взяла пальму первенства в номинации «Оригинальное название». Та самая «Мечта скелета» — это творожный кекс. А если вы попросите кого-либо из этого отделения приготовить «Кальций в шубе», то вас угостят блинами с творогом и лососем. Весьма заманчив и «Мистер Здоровье» — перец, фаршированный морепродуктами, сыром и кунжутом.
Награждение победителей и участников «здорового» кулинарного конкурса состоится сегодня в рамках Межрегиональной научно-практической конференции. Федеральный центр травматологии, ортопедии и эндопротезирования стал площадкой для обсуждения актуальных вопросов оказания медицинской помощи при болезнях костей и суставов. В программе, например, научный симпозиум «Старая» болезнь в «новом» 21 веке», посвященный остеохондрозу, и мастер-класс для ревматологов.
В программе, например, научный симпозиум «Старая» болезнь в «новом» 21 веке», посвященный остеохондрозу, и мастер-класс для ревматологов.
А завтра конференция выйдет за пределы центра, и в ней смогут принять участие не только медики и ученые. На набережной залива состоится прогулка с врачом под лозунгом «Шагай к здоровью и активному долголетию!». В 10.45 начнется мастер-класс, который проведет сертифицированный инструктор по скандинавской ходьбе Международной федерации скандинавской ходьбы Александр Мамонтов. В 11 часов стартует сама прогулка по-скандинавски — участникам предлагается пройти пять километров вокруг залива.
Подробности: http://www.chebnovosti.ru/News.aspx?group=a012945c-fc86-4563-83ee-7348f7f8bd0a&id=65caea24-ddcc-45d9-bd80-38d178410462
Признаки остеопороза – причины и симптомы заболевания скелета
Причины и факторы риска
Костная ткань обновляется постоянно на протяжении всей жизни человека. Интенсивность этих процессов закономерно снижается с возрастом. Общий механизм развития остеопороза представляет собой преобладание процессов разрушения костной ткани над процессами костеобразования.3
Общий механизм развития остеопороза представляет собой преобладание процессов разрушения костной ткани над процессами костеобразования.3
Основные причины возникновения остеопороза представлены рядом заболеваний, состояний и сопутствующих условий:
- предшествующие переломы и частые падения;
- возраст старше 65 лет;
- женский пол;
- европеоидная раса;
- избыточная масса тела;
- отягощенная наследственность по остеопорозу;
- курение;
- недостаточное потребление кальция и дефицит витамина D;
- эндокринные нарушения;
- длительный прием некоторых лекарственных средств (например, глюкокортикостероидов).1,2
Некоторые из перечисленных факторов являются немодифицируемыми (неконтролируемыми). Например, возраст, пол, раса и наследственность – это те причины остеопороза, которые неподвластны контролю. Другие же, наоборот, легко устранимы. К ним относятся курение, ожирение и нехватка кальция в организме.
Клиническая картина
Ранние симптомы развития остеопороза суставов и костей отсутствуют. Первым и единственным проявлением этого системного заболевания являются патологические переломы различной локализации. Это могут быть компрессионные переломы тел позвонков, переломы шейки бедра и костей предплечья, других трубчатых костей и ребер.
Переломы при остеопорозе могут возникать даже после минимального травмирующего воздействия. Например, кость может сломаться при падении с высоты собственного роста или ниже. В ряде случаев переломы появляются без предшествующей травматизации.
Диагностика
Диагноз остеопороза выставляется несколькими способами. Первый из них – наличие у пациентов старше 50 лет спонтанно возникшего типичного перелома, например, лучевой кости в нижней трети или шейки бедра. Второй способ – рентгенография костей скелета и определение минеральной плотности костной ткани методом рентгенологической денситометрии. К вспомогательным методам диагностики относятся лабораторные анализы с определением показателей обмена кальция, компьютерная и магнитно-резонансная томография.
Методы профилактики и лечения
Терапия остеопороза влияет на различные звенья механизма развития заболевания и направлена на:
- подавление разрушения кости;
- стимуляцию образования костной массы;
- снижение риска переломов.
Лечение включает в себя медикаментозные и немедикаментозные компоненты. Пациентам рекомендуется отказаться от вредных привычек, выполнять дозированные физические нагрузки и не допускать падений. При высоком риске переломов можно носить специальные протекторы.
Кальций | Tervisliku toitumise informatsioon
Общая масса кальция в организме человека составляет около 2% всей массы тела и 40% массы минеральных веществ. 99%, т.е. 1000–1500 г кальция находится в скелете человека в виде нерастворимых солей. Остальное – в зубах, мягких тканях и внеклеточной жидкости. В костях взрослого человека в год сменяется примерно 20% кальция.
Кальций необходим:
- для выполнения структурных функций, входя в состав скелета человека, его зубов и других тканей,
- для обеспечения обмена веществ в тканях, поддержания нормальной пропускной способности стенок кровеносных сосудов,
- для нормальной работы мышц,
- для процессов свертывания крови,
- для регулирования кровяного давления и уровня холестерина,
- для нормальной работы почек,
- для передачи нервных импульсов.

Распространенные симптомы дефицита кальция:
- мышечные судороги;
- размягчение костей (остеомаляция),
- остеопороз, или снижение плотности костной ткани.
Всасыванию кальция способствует в первую очередь витамин D, однако определенную роль играют также жиры, магний и другие питательные вещества. Всасывание кальция затрудняют оксалаты, которые встречаются, например, в шпинате и щавеле, а также фитаты, которые есть в зерновых, алкоголе, кофе, поваренной соли и сахаре.
При чрезмерном потреблении кальция может случиться следующее:
- Большие количества кальция могут вывести из равновесия рекомендуемое соотношение минеральных веществ в организме.
- При избыточных количествах кальция или неверных его пропорциях с фосфором и магнием, кальций откладывается в мышцах, миокарде и почках, могут возникнуть камни в почках.
- Очень высокие дозы кальция и витамина D приводят к гиперкальцемии, которая может стать причиной интенсивного кальцинирования костей, тканей и органов, в первую очередь – почек.

- Длительный избыток кальция нарушает функционирование нервной и мышечной ткани, свертываемость крови, нормальное усвоение цинка клетками скелета.
- При употреблении кальция в количествах, превышающих 2000 мг в день у мужчин возрастает риск возникновения рака предстательной железы.
Лучшими источниками кальция являются молоко и молочные продукты, рыба, темно-зеленые части растений. Люди, придерживающиеся смешанного питания и употребляющие молоко, около 75% кальция получают из молочных продуктов.
Рекомендуемые количества минеральных веществ по возрастным группам см. подробнее в таблице.
Рекомендуемое суточное потребление примерно 800 мг кальция обеспечивают следующие продукты:
- 660 г молока,
- 90 г сыра,
- 400 г рыбы с костями,
- 433 г миндаля,
- 600–800 г йогурта.
Если питаться разнообразно, в соответствии с количествами продуктов, которые рекомендованы в пирамиде питания, с получением достаточного количества кальция проблем не возникает.
Ученые исследуют скелет крупного древнего носорога, погибшего в болоте
Палеонтологи Университета Вроцлава Кшиштоф Стефаняк, Адам Котовский, Урсула Ратайчак и их коллега из ТГУ Андрей Шпанский исследуют остатки носорога Мерка, жившего более 100 тысяч лет назад. Предположительно носорог погиб в заболоченной местности, что помогло его скелету сохраниться почти полностью. Эта находка позволит ученым получить новые данные об исчезнувшем виде, который был одним из самых крупных двурогих носорогов.
– Внешне носорог Мерка, который экологически является лесным, очень похож на хорошо известного шерстистого носорога, – говорит доцент кафедры палеонтологии и исторической геологии ГГФ ТГУ Андрей Шпанский. – Можно сказать, что этот вид старше многих мамонтов, поскольку он был распространен 600-100 тысяч лет назад. Объект нашего изучения совершенно уникален – на сегодняшний день это единственный известный на планете сохранившийся скелет носорога Мерка.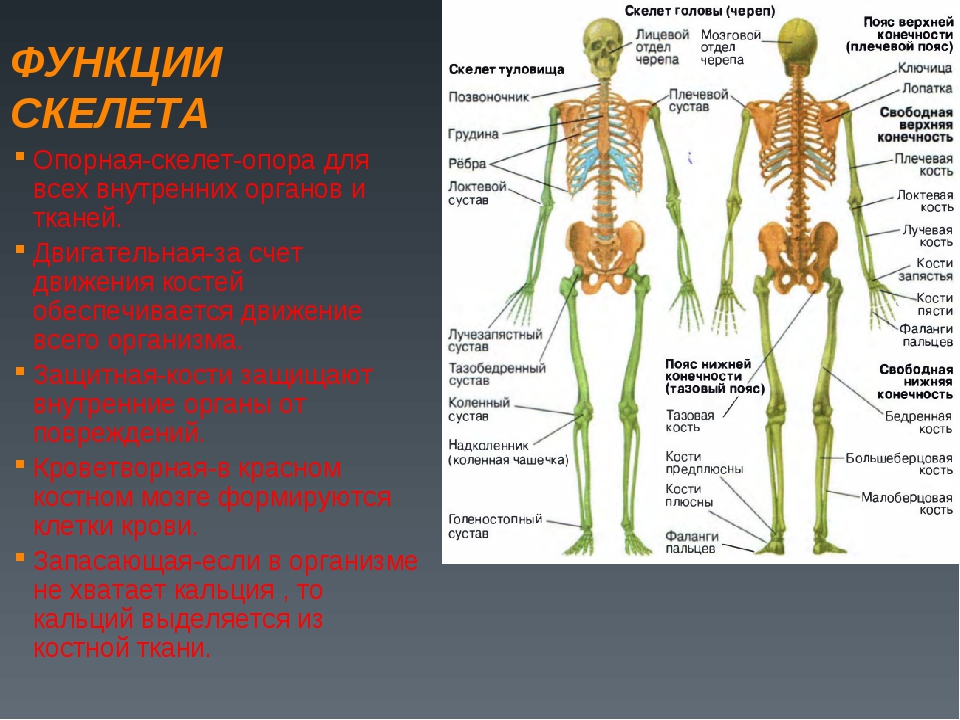
Остатки древнего животного были найдены случайно, во время строительства магистрали неподалеку от города Горжов Великопольский. Дорожникам пришлось приостановить масштабные работы, на извлечение древнего млекопитающего из окаменевшего грунта ученым дали всего три дня. Палеонтологи были вынуждены проводить раскопки в экстренном режиме.
По оценке ученых, лесной носорог был крупнее многих своих собратьев – шерстистого, черного и белого африканских и индийского носорогов. Расчет пропорций скелета свидетельствует о том, что приблизительный рост найденной особи составлял 182 сантиметра в холке, около 160 сантиметров в крестце. Ее возраст не менее 20 лет, поскольку коренные зубы животного заметно стерты.
– Нижняя челюсть носорога Мерка имела совершенно особое строение, – рассказывает Андрей Шпанский. – Ее передняя часть (симфиз) была очень длинной, узкой и при этом изогнутой подобно желобу. Это позволяло носорогу засовывать морду между ветками, очень удобно обхватывать их и обдирать листья с деревьев или кустарников.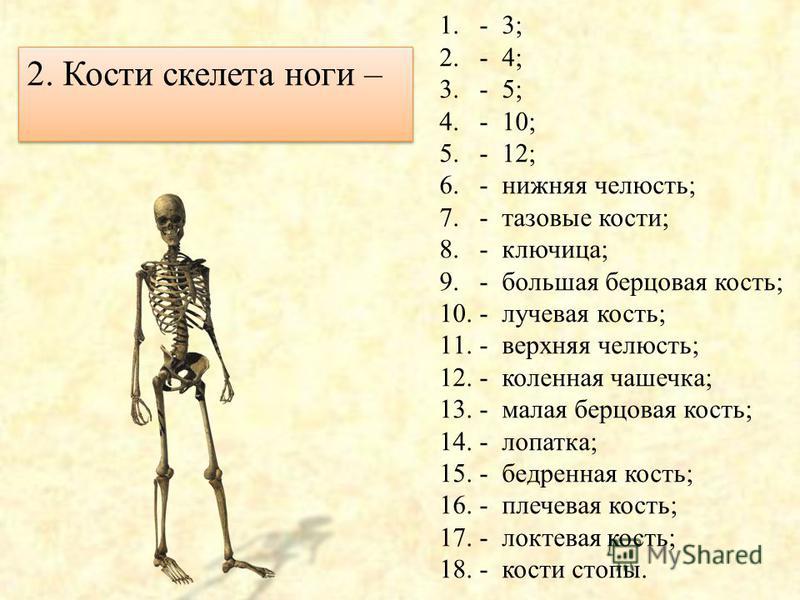
Наряду с этим установлено, что в отличие от приземистого шерстистого носорога, лесной был гораздо более стройным, с высокими ногами (длина свободной конечности – не менее 80 сантиметров) и широкими ступнями. Лапы животного прекрасно сохранились, поэтому палеонтологи смогли определить, что при ходьбе ступня хорошо раздвигалась, за счет этого площадь опоры у лесного носорога была приблизительно на 70 процентов больше, чем у шерстистого. Такое строение позволяло древнему млекопитающему без труда передвигаться по заболоченным участкам, заливавшимся поймам, где были распространены кустарники и деревья, листьями которых он питался.
Как ни странно, носорог погиб именно в болоте – в тех условиях, для которых он был хорошо приспособлен. Об этом свидетельствуют результаты исследования вмещающих отложений, окружавших кости и анализ, проведенный споро-пыльцевым методом.
Невыясненным пока остается вопрос относительно пола животного. Польские ученые склоняются к мнению, что это была самка, но данный факт требует уточнения. Помимо этого палеонтологов интересует, с кем соседствовал носорог Мерка? Пересекался ли он по времени и территориально с шерстистым носорогом? По завершении исследований статья с описанием редкой находки будет опубликована в одном из международных журналов.
Польские ученые склоняются к мнению, что это была самка, но данный факт требует уточнения. Помимо этого палеонтологов интересует, с кем соседствовал носорог Мерка? Пересекался ли он по времени и территориально с шерстистым носорогом? По завершении исследований статья с описанием редкой находки будет опубликована в одном из международных журналов.
Добавим, что это не первая совместная работа ученых ТГУ и Университета Вроцлава. Ранее палеонтологи проводили исследование и сравнительный анализ остатков древних сайгаков, живших на территории Северной Евразии, изучали древних бизонов и черепа овцебыков.
МИНЕРАЛЬНЫЙ СОСТАВ СКЕЛЕТОВ BRYOZOA И ЕГО ПРИМЕНЕНИЕ В ЭВОЛЮЦИОННЫХ ПОСТРОЕНИЯХ СИСТЕМЫ
23
полностью кальцитовыми. Среди Cheilostomata у крупных, сильно
обызвествленных колоний определялся арагонитовый или смешанный тип
скелета, а у гибких ветвистых колоний более часто кальцитовый тип, как и у
инкрустирующих колоний Anasca. У более эволюционно продвинутых
У более эволюционно продвинутых
Ascophora скелеты либо мономинерального типа, либо смешанного (Rucker,
Carver, 1969).
Изученный материал собран на грунтах различного типа с глубин от 2 до
500 м в северных и дальневосточных морях России-от Баренцева до Японского
морей, а также в антарктических и приантарктических водах. В систематическом
отношении мшанки принадлежат 9 видам из 7 семейств отряда Cyclostomata и 48
видам из 20 семейств отряда Cheilostomata (всего 57) (Таблица 1).
Представители 12 семейств биогеохимически были изучены впервые. Также
впервые в колониях определяли наличие Si, Ti, Ga, Zr, Ag, Sn, Hg, Pb и другие
элементы.
Минеральный состав скелетного вещества определялся
рентгенометрически, вещественный состав-спектрографически. Количество
органического вещества в скелетах мшанок можно примерно определить по
содержанию спектрографически определенного Ca и контролировать эти данные
по высоте главного пика рентгенограммы кальцита. Статистическая обработка
Статистическая обработка
спектрального анализа проводилась с помощью факторного анализа в модели
главных компонент.
Скелеты всех изученных колоний мшанок, за исключением одного вида,
состоят из магнезиального кальцита с содержанием магния 1-2%(1,7-5,5
MgCO3), что вдвое меньше, чем у мшанок из Средиземного моря (Poluzzi,
Sartori, 1971). Сходные результаты для мшанок Арктического океана получены
Kuklinski, Taylor (2009), которые изучили 76 видов, большинство из которых
имели кальцитовый скелет, и только 4 вида имели биминеральный тип скелета.
Семь изученных видов у этих авторов те же, что и у авторов данного
исследования, однако из различных и преимущественно не совпадающих
местообитаний. Эти авторы обсуждают наши данные и утверждают, что у
арктических мшанок кальцитовые скелеты, и также подтверждают наши
выводы, что антарктические мшанки имеют сходный тип минерализации и его
состав с арктическими видами.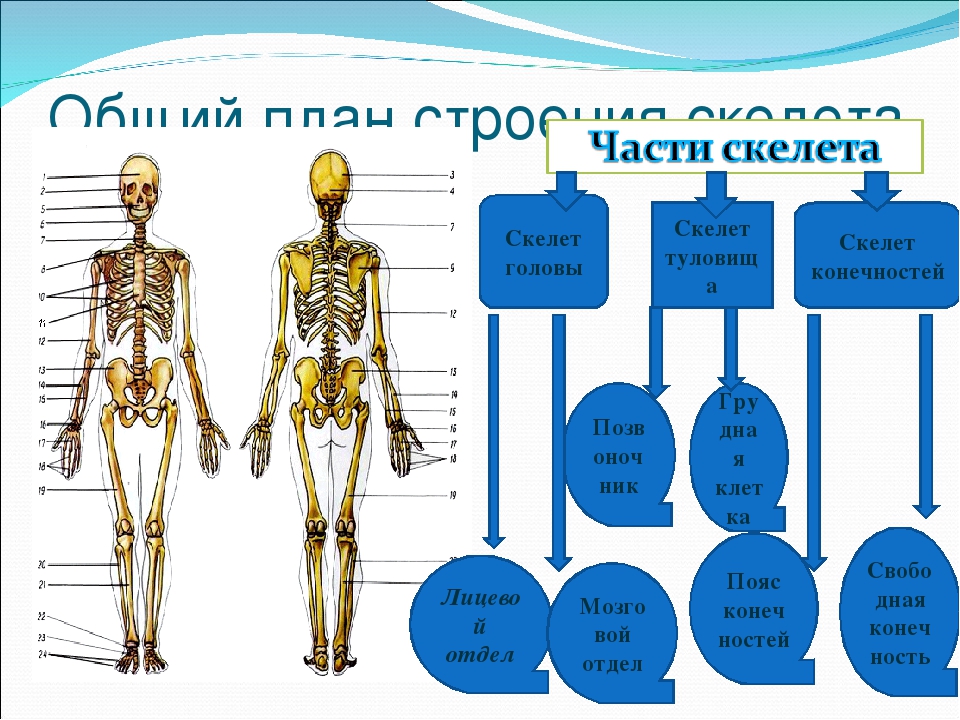 Нами лишь у Labioporella adeliensis из
Нами лишь у Labioporella adeliensis из
Антарктики был обнаружен арагонитовый тип минерализации скелета, что
подтверждается не только данными рентгеновского анализа, но и типичным для
биогенного арагонита повышенным в 3 раза содержанием Sr и во столько же раз
меньшим содержанием Mg против средних значений и кальцитовых скелетов.
Не обнаружен смешанный тип минерализации, на возможность появления
которого указывалось в предыдущих работах. Это объясняется, скорее всего,
тем, что арагонитовая минерализация может появляться совместно с
кальцитовой лишь в более тепловодных условиях. По-видимому, не все мшанки
способны становиться двуминеральными или даже полностью менять свой
минеральный состав. По крайней мере, часть из них никогда не меняла свой
кальцитовый или арагонитовый состав.
По своему минеральному составу скелетов мшанки должны различаться
хотя бы на уровне семейств. Между тем, например в сем. Phidoloporidae входят
Между тем, например в сем. Phidoloporidae входят
DoITPoMS — Библиотека TLP Структура костных материалов и материалов имплантатов
Длинные кости, такие как бедренная кость, содержат два разных морфологических типа костей:
- Кортикальная (компактная) кость
- Губчатая или губчатая кость
Они показаны на рисунке ниже.
Схема различных морфологических типов кости
Кортикальная кость образует плотный цилиндр вниз по стержню кости, окружающий центральную полость костного мозга.Хотя кортикальная кость составляет 80% массы кости в человеческом теле, она имеет гораздо меньшую площадь поверхности, чем губчатая кость, из-за ее меньшей пористости.
Губчатая (или губчатая) кость расположена на концах длинных костей, составляет примерно 20% от общей массы скелета и имеет открытую сотовую структуру. Его модуль Юнга намного ниже, чем у кортикальной кости, и этот градиентный модуль постепенно соответствует свойствам кортикальной кости и хряща, который формирует сочленяющуюся поверхность на головке бедренной кости.
Композиция
Сама кость состоит в основном из коллагеновых волокон и неорганического костного минерала в виде мелких кристаллов. In vivo кость (живая кость в организме) содержит от 10% до 20% воды. Примерно 60-70% его сухой массы составляет костный минерал. Большая часть остального — коллаген, но кость также содержит небольшое количество других веществ, таких как белки и неорганические соли.
Коллаген — это основной волокнистый белок в организме. Он имеет тройную спиральную структуру, а определенные точки вдоль волокон коллагена служат местами зарождения кристаллов костных минералов.Это показано на анимации ниже.
Состав минерального компонента можно приблизительно представить как гидроксиапатит (ГА) с химической формулой Ca 10 (PO 4 ) 6 (OH) 2 . Однако, в то время как соотношение Са: Р у HA as составляет 5: 3 (1,67), сам костный минерал имеет соотношение Са: Р в диапазоне 1,37–1,87. Это связано с тем, что состав костного минерала намного сложнее и содержит дополнительные ионы, такие как кремний, карбонат и цинк.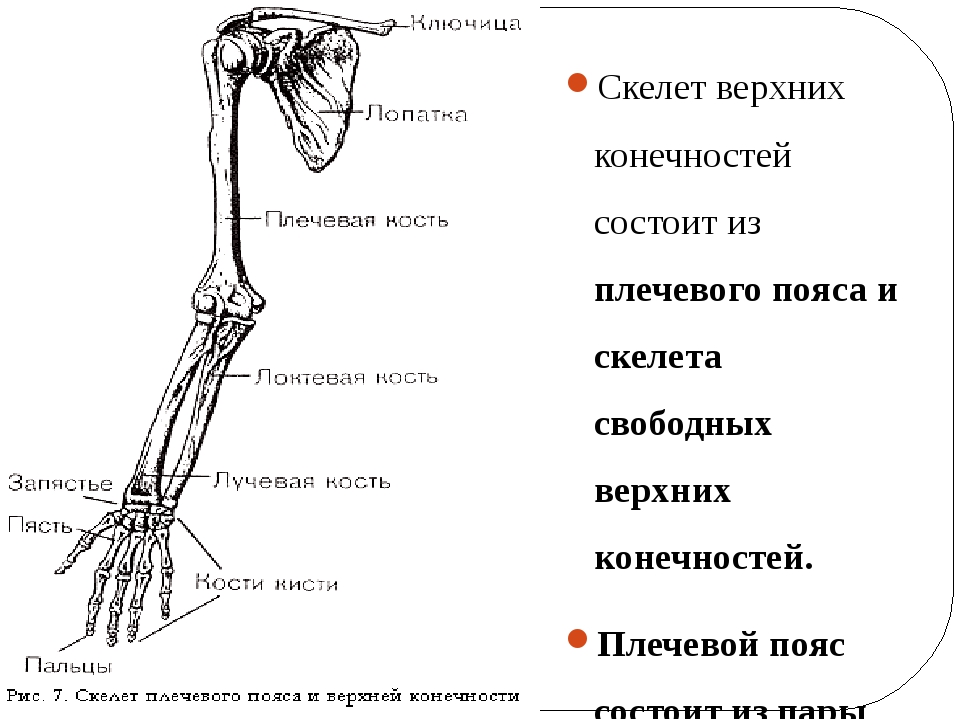
Хрящ — это ткань на основе коллагена, содержащая очень большие молекулы полисахарида белка, которые образуют гель, в котором запутаны волокна коллагена.Суставной, или гиалиновый, хрящ образует опорные поверхности подвижных суставов тела. С механической точки зрения суставной хрящ ведет себя как линейное вязкоупругое твердое тело. Он также имеет очень низкий коэффициент трения (<0,01), в значительной степени связанный с наличием синовиальной жидкости, которая может выдавливаться при сжимающей нагрузке.
Анимация ниже позволяет исследовать микроструктуру кортикальной кости.
Напряжения
Кости, такие как бедренная кость, подвергаются действию изгибающего момента, и напряжения (как растягивающие, так и сжимающие), создаваемые этим изгибающим моментом, определяют структуру и распределение губчатого вещества и кортикального слоя кости.
В верхнем отделе бедренной кости губчатая кость состоит из двух различных систем трабекул. Одна система следует изогнутым траекториям от внутренней стороны стержня и излучается наружу к противоположной стороне костей, следуя линиям максимального сжимающего напряжения. Вторая система образует изогнутые траектории с внешней стороны вала и пересекает первую систему под прямым углом. Эти трабекулы следуют по линиям максимального растягивающего напряжения и в целом имеют более легкую структуру, чем у сжимающей системы.
Вторая система образует изогнутые траектории с внешней стороны вала и пересекает первую систему под прямым углом. Эти трабекулы следуют по линиям максимального растягивающего напряжения и в целом имеют более легкую структуру, чем у сжимающей системы.
Толщина трабекул изменяется в зависимости от величины напряжений в любой точке, и, следуя траекториям основных напряжений сжатия и растяжения, они экономично переносят эти напряжения. Таким образом, максимальная прочность достигается при минимальном использовании материала.
Распределение компактной кости в диафизе также связано с необходимостью противостоять напряжениям изгибающего момента. Чтобы противостоять этим напряжениям, материал должен располагаться как можно дальше от нейтральной оси.Полый цилиндр — наиболее эффективная конструкция, обеспечивающая максимальную прочность при минимальном использовании материала.
Диаграмма, показывающая рассчитанные линии постоянного напряжения по результатам анализа различных поперечных сечений
предыдущая | следующий
Система скелета — (Структура + Состав + Факты)
Мы, люди, обладаем костями, которые помогают нам структурировать свое тело, не тратя впустую энергию.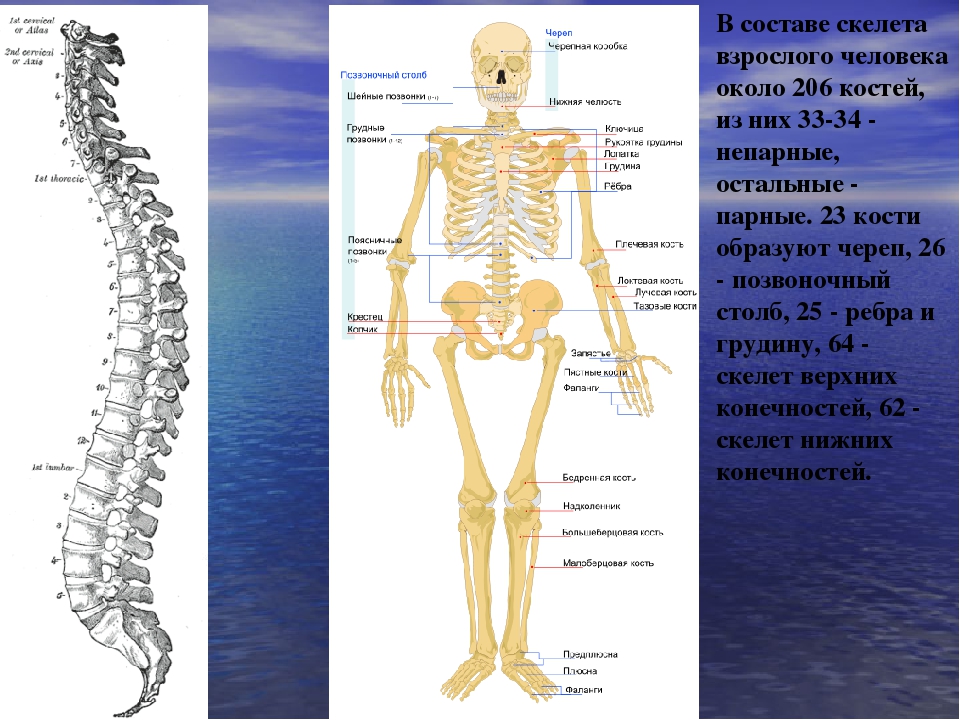 Потому что, когда мы стоим на месте или ходим, кости структурируются и придают нашему телу жесткость. Если в нашем теле нет костей, тогда тело должно структурировать себя с помощью мускулов — тратя много энергии. Давайте узнаем, как эти кости связаны вместе эфиром, образуя скелетную систему.
Потому что, когда мы стоим на месте или ходим, кости структурируются и придают нашему телу жесткость. Если в нашем теле нет костей, тогда тело должно структурировать себя с помощью мускулов — тратя много энергии. Давайте узнаем, как эти кости связаны вместе эфиром, образуя скелетную систему.
Что такое скелетная система?
Кости в теле человека соединены вместе, образуя систему костей, называемую скелетной системой. Основная задача скелетной системы — обеспечить жесткую структуру, на которой держится все наше тело.Кости не только обеспечивают жесткость, но и выполняют различные функции. Некоторые из этих функций обеспечивают защиту мягких и нежных органов, таких как сердце, легкие и мозг. Мозг защищен черепной коробкой, а сердце и легкие — грудной клеткой.
В скелете человеческого тела около 206 костей. Эти кости связаны между собой и с мышцами тела для выполнения движений. Кости связаны с другими костями тканями, называемыми связками.Мышцы соединены с костями с другой тканью, называемой сухожилием.
Состав костей
Кости человеческого тела в основном состоят из минералов кальция и воды. В среднем кости содержат 31% воды и в основном состоят из неживых тканевых материалов. Есть различные слои кости: внешний, внутренний и центральный. Внешний слой кости, называемый кортикальной костью, очень твердый и гладкий. Но внутренний слой пористый, что делает кости легкими, сохраняя при этом свою прочность на оптимальном уровне.Кроме того, центральная часть кости заполнена костным мозгом, который представляет собой мягкое вещество.
Наша кость содержит два вида кабачков; красный и желтый костный мозг. Красный костный мозг кости отвечает за производство эритроцитов и лейкоцитов. В то время как желтый костный мозг в основном состоит из жировых клеток.
Суставы
Когда кости соединяются вместе, они образуют сустав в месте их соединения — например, в коленях и локтях. Суставы позволяют костям двигаться относительно друг друга, сохраняя при этом жесткость.Наше тело содержит около 360 суставов, которые дают нам определенную степень свободы.
В человеческом теле есть 3 типа суставов в зависимости от степени движения; фиброзные суставы, хрящевые суставы и синовиальные суставы.
- Фиброзные суставы — Они неподвижны и позволяют костям соединяться друг с другом. Например, суставы между зубами и челюстью.
- Хрящевые суставы — Эти суставы соединяют кости с хрящами и не оставляют открытого пространства в суставах.Хрящевые суставы имеют частичную степень подвижности в детстве, но когда ребенок достигает взрослого возраста, у этих суставов очень мало свободы движения.
- Синовиальные суставы — Эти суставы очень распространены в человеческом теле, что дает большую свободу движений костям. Например, колени, локти и суставы пальцев являются синовиальными суставами.
Исцеление сломанных костей
Итак, как заживает кость, если она сломана из-за травмы? Поскольку кости в нашем теле более твердые, и они не заживают, как поврежденные мышцы или кожа.Процесс заживления костей занимает месяцы, в течение которых он не выдерживает давления, которое может выдержать нормальная кость.
Вот процесс заживления кости:
- Когда кость сломана, она сначала окружается кровью, которая образует своего рода шероховатый слой на сломанной части.
- После грубого слоя коллагены — своего рода ткань — начинают формироваться в сломанной части кости.
- Коллаген и хрящ — более гибкие, чем костная ткань — вместе заполняют пробелы в сломанной кости.
- Заполненная щель со временем медленно и постепенно превратится в затвердевшую кость.
Интересные факты
- В среднем костный мозг ежедневно производит 5 миллиардов эритроцитов в организме взрослого человека.
- Синовиальные суставы нашего тела содержат очень скользкую жидкость, называемую синовией, которая уменьшает трение в костях.
- Когда человеческому организму не хватает минералов кальция, он может забирать кальций непосредственно из костей, что ослабляет кости.
Анатомия и физиология нормальной кости
Clin J Am Soc Nephrol. 2008 ноя; 3 (Дополнение 3): S131 – S139.
Барт Кларк
Отделение эндокринологии, диабета, метаболизма и питания, Клиника Мейо, Рочестер, Миннесота
Отделение эндокринологии, диабета, метаболизма и питания, Клиника Майо, Рочестер, Миннесота
Адрес для корреспонденции: Барт Кларк, отдел эндокринологии, диабета, метаболизма и питания, клиника Мэйо, W18-A, 200 1st Street SW, Rochester, MN 55905; Телефон: 507-266-4322; Факс: 507-284-5745; Электронная почта удэ[email protected] Авторские права © 2008 Американского общества нефрологов Эта статья цитируется в других статьях в PMC.Abstract
В этом обзоре описываются анатомия и физиология нормальной кости в качестве введения к последующим статьям этого раздела, в которых обсуждаются клинические применения биопсии гребня подвздошной кости. Сначала рассматриваются нормальная анатомия и функции скелета, после чего дается общее описание процессов моделирования и ремоделирования костей. Процесс ремоделирования кости регулирует увеличение и уменьшение минеральной плотности костной ткани в скелете взрослого человека и напрямую влияет на прочность кости.Тщательное понимание процесса ремоделирования кости имеет решающее значение для оценки ценности и интерпретации результатов гистоморфометрии гребня подвздошной кости. Рекрутирование, активация и резорбция остеокластов обсуждается довольно подробно с последующим обзором рекрутирования остеобластов и процесса образования новой кости. Затем суммируются коллагеновые и неколлагеновые белковые компоненты и функция внеклеточного матрикса кости с последующим описанием процесса минерализации вновь образованного костного матрикса.Воздействие биомеханических сил на кость воспринимается синцитием остеоцитов в кости через канальцевую сеть и межклеточные щелевые соединения. Наконец, концепции, касающиеся ремоделирования кости, функции остеокластов и остеобластов, внеклеточного матрикса, минерализации матрикса и функции остеоцитов, синтезируются в кратком изложении понятных в настоящее время функциональных детерминант прочности кости. Эта информация закладывает основу для понимания полезности и клинического применения биопсии гребня подвздошной кости.
Скелет
Скелет взрослого человека состоит всего из 213 костей, не считая сесамовидных костей (1). Аппендикулярный скелет состоит из 126 костей, осевого скелета — 74, а слуховых косточек — 6 костей. Каждая кость постоянно подвергается моделированию в течение жизни, чтобы помочь ей адаптироваться к изменяющимся биомеханическим силам, а также ремоделированию для удаления старой, микроповрежденной кости и замены ее новой, механически более прочной костью, чтобы помочь сохранить прочность кости.
Четыре основные категории костей — длинные, короткие, плоские и неправильные кости.Длинные кости включают ключицы, плечевые кости, радиусы, локтевые кости, пястные кости, бедренные кости, голени, малоберцовые кости, плюсневые кости и фаланги. Короткие кости включают запястные и предплюсневые кости, надколенники и сесамовидные кости. Плоские кости включают череп, нижнюю челюсть, лопатки, грудину и ребра. Кости неправильной формы включают позвонки, крестец, копчик и подъязычную кость. Плоские кости образуются за счет образования перепончатой кости, тогда как длинные кости образуются путем сочетания эндохондрального и перепончатого образования кости.
Каркас выполняет множество функций.Кости скелета обеспечивают структурную поддержку для остального тела, позволяют движение и передвижение, обеспечивая рычаги для мышц, защищают жизненно важные внутренние органы и структуры, обеспечивают поддержание минерального гомеостаза и кислотно-щелочного баланса, служат резервуаром для роста. факторов и цитокинов, а также обеспечивают среду для кроветворения в костном мозге (2).
Длинные кости состоят из полого стержня или диафиза; расширяющиеся конусообразные метафизы под пластинками роста; и округлые эпифизы над пластинками роста.Диафиз состоит в основном из плотной кортикальной кости, тогда как метафиз и эпифиз состоят из кости трабекулярной сети, окруженной относительно тонкой оболочкой из плотной кортикальной кости.
Скелет взрослого человека состоит из 80% кортикальной кости и 20% губчатой кости в целом (3). Различные кости и участки скелета внутри костей имеют разное соотношение кортикальной и губчатой кости. Позвонок состоит из кортикальной и губчатой кости в соотношении 25:75. Это соотношение составляет 50:50 в головке бедренной кости и 95: 5 в лучевом диафизе.
Кортикальная кость плотная и твердая и окружает костный мозг, тогда как губчатая кость состоит из сотовой сети трабекулярных пластин и стержней, вкрапленных в компартменте костного мозга. И кортикальная, и губчатая кость состоят из остеонов.
Кортикальные остеоны называются гаверсовыми системами. Гаверсовы системы имеют цилиндрическую форму, примерно 400 мм в длину и 200 мм в ширину в основании и образуют разветвленную сеть внутри кортикальной кости (3). Стены гаверсовских систем образованы концентрическими пластинками.Кортикальная кость обычно менее метаболически активна, чем губчатая кость, но это зависит от вида. У здоровых взрослых людей имеется примерно 21 × 10 6 кортикальных остеонов с общей площадью гаверсовского ремоделирования примерно 3,5 м 2 . Пористость кортикальной кости обычно составляет <5%, но это зависит от соотношения активно ремоделирующих гаверсовских систем и неактивных кортикальных остеонов. Увеличение кортикального ремоделирования вызывает увеличение кортикальной пористости и уменьшение корковой костной массы.Здоровые стареющие взрослые обычно испытывают истончение коры и увеличение пористости коры.
Кортикальная кость имеет внешнюю периостальную поверхность и внутреннюю эндостальную поверхность. Поверхностная активность надкостницы важна для аппозиционного роста и заживления переломов. Костеобразование обычно превышает резорбцию кости на периостальной поверхности, поэтому кости обычно увеличиваются в диаметре с возрастом. Поверхность эндоста имеет общую площадь приблизительно 0,5 м 2 , с более высокой активностью ремоделирования, чем поверхность надкостницы, вероятно, в результате большего биомеханического напряжения или большего воздействия цитокинов из соседнего компартмента костного мозга.Резорбция костной ткани обычно превышает костное образование на эндостальной поверхности, поэтому костный мозг обычно расширяется с возрастом.
Трабекулярные остеоны называются пакетами. Трабекулярная кость состоит из пластин и стержней толщиной от 50 до 400 мм (3). Трабекулярные остеоны имеют полулунную форму, обычно примерно 35 мм толщиной, и состоят из концентрических пластинок. Подсчитано, что у здоровых взрослых людей имеется 14 × 10 6 трабекулярных остеонов с общей площадью трабекул примерно 7 м 2 .
Кортикальная кость и губчатая кость обычно имеют пластинчатый узор, в котором коллагеновые фибриллы располагаются в чередующейся ориентации (3). Пластинчатая кость лучше всего видна при микроскопическом исследовании в поляризованном свете, во время которого виден пластинчатый узор в результате двойного лучепреломления. Механизм, с помощью которого остеобласты откладывают коллагеновые фибриллы пластинчатым образом, не известен, но пластинчатая кость имеет значительную прочность в результате чередования ориентаций коллагеновых фибрилл, как у фанеры.В тканой кости отсутствует нормальный пластинчатый узор, в котором коллагеновые фибриллы располагаются неорганизованным образом. Плетеная кость слабее пластинчатой. Плетеная кость обычно образуется во время образования первичной кости, а также может наблюдаться при состояниях с высоким метаболизмом костной ткани, таких как кистозно-фиброзный остит, в результате гиперпаратиреоза и болезни Педжета или во время высокого костеобразования во время раннего лечения фтором.
Надкостница — это волокнистая соединительнотканная оболочка, которая окружает внешнюю кортикальную поверхность кости, за исключением суставов, где кость выстлана суставным хрящом, который содержит кровеносные сосуды, нервные волокна, остеобласты и остеокласты.Надкостница плотно прикреплена к внешней кортикальной поверхности кости толстыми коллагеновыми волокнами, называемыми волокнами Шарпейса, которые проникают в подлежащую костную ткань. Эндост представляет собой мембранную структуру, покрывающую внутреннюю поверхность кортикальной кости, губчатой кости и каналы кровеносных сосудов (каналы Фолькмана), присутствующие в кости. Эндост находится в контакте с пространством костного мозга, губчатой костью и каналами кровеносных сосудов и содержит кровеносные сосуды, остеобласты и остеокласты.
Рост, моделирование и ремоделирование костей
Кость подвергается продольному и радиальному росту, моделированию и ремоделированию в течение жизни.Продольный и радиальный рост во время роста и развития происходит в детском и подростковом возрасте. Продольный рост происходит на пластинах роста, где хрящ разрастается в эпифизарной и метафизарной областях длинных костей, прежде чем впоследствии подвергнется минерализации с образованием первичной новой кости.
Моделирование — это процесс, с помощью которого кости меняют свою общую форму в ответ на физиологические воздействия или механические силы, что приводит к постепенной адаптации скелета к силам, с которыми он сталкивается.Кости могут расширяться или изменять ось за счет удаления или добавления кости к соответствующим поверхностям за счет независимого действия остеобластов и остеокластов в ответ на биомеханические силы. Кости обычно расширяются с возрастом в ответ на надкостницу новой кости и эндостальную резорбцию старой кости. Закон Вольфа описывает наблюдение, что длинные кости меняют форму, чтобы приспособиться к нагрузкам на них. Во время моделирования кости формирование и резорбция кости не взаимосвязаны. Моделирование кости у взрослых встречается реже, чем ремоделирование (4).Моделирование может быть усилено при гипопаратиреозе (5), почечной остеодистрофии (6) или лечении анаболическими средствами (7).
Ремоделирование кости — это процесс обновления кости для поддержания прочности кости и минерального гомеостаза. Ремоделирование включает в себя непрерывное удаление отдельных пакетов старой кости, замену этих пакетов вновь синтезированным белковым матриксом и последующую минерализацию матрицы с образованием новой кости. Процесс ремоделирования резорбирует старую кость и формирует новую кость, чтобы предотвратить накопление микроповреждений кости.Ремоделирование начинается до рождения и продолжается до смерти. Блок ремоделирования кости состоит из тесно связанной группы остеокластов и остеобластов, которые последовательно выполняют резорбцию старой кости и образование новой кости. Ремоделирование костей увеличивается у женщин в перименопаузе и в раннем постменопаузе, а затем замедляется с дальнейшим старением, но продолжается более быстрыми темпами, чем у женщин в пременопаузе. Считается, что ремоделирование костей у стареющих мужчин происходит умеренно.
Цикл ремоделирования состоит из четырех последовательных фаз.Активация предшествует резорбции, предшествующей обращению, предшествующей формированию. Сайты ремоделирования могут развиваться случайным образом, но также нацелены на участки, требующие ремонта (8,9). Считается, что сайты ремоделирования развиваются в основном случайным образом.
Активация включает привлечение и активацию мононуклеарных моноцитов-макрофагов-предшественников остеокластов из кровотока (10), подъем эндоста, который содержит выстилающие клетки, с поверхности кости и слияние нескольких мононуклеарных клеток с образованием многоядерных преостеокластов.Преостеокласты связываются с костным матриксом посредством взаимодействий между рецепторами интегрина в их клеточных мембранах и RGD (аргинин, глицин и аспарагин) -содержащими пептидами в матричных белках с образованием кольцевых герметизирующих зон вокруг резорбируемых костью компартментов под многоядерными остеокластами.
Опосредованная остеокластами резорбция кости занимает примерно 2–4 недели в течение каждого цикла ремоделирования. Образование, активация и резорбция остеокластов регулируются соотношением активатора рецептора лиганда NF-κB (RANKL) к остеопротегерину (OPG;), IL-1 и IL-6, колониестимулирующему фактору (CSF), паратиреоидному гормону, 1 , 25-дигидроксивитамин D и кальцитонин (11,12).Резорбирующиеся остеокласты секретируют ионы водорода через протонные насосы H + -АТФазы и хлоридные каналы в их клеточных мембранах в резорбирующий отсек, чтобы снизить pH внутри резорбирующего кость компартмента до 4,5, что помогает мобилизовать костные минералы (13 ). Резорбирующиеся остеокласты выделяют устойчивую к тартрату кислую фосфатазу, катепсин К, матриксную металлопротеиназу 9 и желатиназу из цитоплазматических лизосом (14) для переваривания органического матрикса, в результате чего образуются блюдцеобразные лакуны Ховшипа на поверхности трабекулярной кости () и гаверсовских каналов. в кортикальном слое кости.Фаза резорбции завершается мононуклеарными клетками после того, как многоядерные остеокласты подвергаются апоптозу (15,16).
Регулирование остеокластогенеза с помощью активатора рецептора лиганда NF-κB (RANKL) и остеопротегерина (OPG): колониестимулирующий фактор 1 (CSF-1) обычно стимулирует рекрутирование остеокластов. Две формы RANKL продуцируются остеобластами и предшественниками остеобластов, чтобы стимулировать рекрутирование и активацию остеокластов. Мембраносвязанная форма напрямую взаимодействует с мембраносвязанными молекулами RANK на соседних предшественниках остеокластов.Растворимая форма высвобождается из остеобластов или предшественников остеобластов, чтобы диффундировать через межклеточное пространство и взаимодействовать с мембраносвязанными молекулами RANK на соседних предшественниках остеокластов. OPG действует как ловушка-рецептор, предотвращая взаимодействие RANKL или sRANKL с RANK. Соотношение между RANKL и OPG, продуцируемыми остеобластами и предшественниками остеобластов, контролирует RANKL-стимулированный остеокластогенез.
Многоядерные остеокласты резорбируют кость, образуя резорбционные ямы, известные как лакуны Ховшипа.
Во время фазы обращения резорбция кости переходит в формирование кости. По завершении резорбции кости резорбционные полости содержат множество мононуклеарных клеток, включая моноциты, остеоциты, высвобождаемые из костного матрикса, и преостеобласты, привлекаемые для начала образования новой кости. Связанные сигналы, связывающие конец резорбции кости с началом образования кости, пока неизвестны. Предполагаемые кандидаты для связывающего сигнала включают факторы, производные от костного матрикса, такие как TGF-β, IGF-1, IGF-2, костные морфогенетические белки, PDGF или фактор роста фибробластов (17-19).Концентрация TGF-β в костном матриксе коррелирует с гистоморфометрическими показателями метаболизма костной ткани, а также с остеокальцином в сыворотке крови и костной специфической щелочной фосфатазой. TGF-β, высвобождаемый из костного матрикса, снижает резорбцию остеокластов за счет ингибирования продукции RANKL остеобластами. Было высказано предположение, что фаза обращения опосредуется градиентом деформации в лакунах (20,21). Поскольку остеокласты резорбируют кортикальный слой кости в режущем конусе, деформация уменьшается спереди и увеличивается сзади, а в лакунах Ховшипа деформация наиболее высока в основании и меньше — в окружающей кости по краям лакунов.Градиент штамма может привести к последовательной активации остеокластов и остеобластов, при этом остеокласты активируются уменьшенным напряжением, а остеобласты — повышенным напряжением. Было высказано предположение, что сам остеокласт играет роль во время обращения (22).
Формирование кости занимает от 4 до 6 месяцев. Остеобласты синтезируют новый коллагеновый органический матрикс () и регулируют минерализацию матрикса, высвобождая небольшие мембраносвязанные матричные везикулы, которые концентрируют кальций и фосфат и ферментативно разрушают ингибиторы минерализации, такие как пирофосфат или протеогликаны (23).Остеобласты, окруженные матриксом и погребенные в нем, становятся остеоцитами с обширной канальцевой сетью, соединяющей их с клетками выстилки поверхности кости, остеобластами и другими остеоцитами, поддерживаемыми щелевыми соединениями между цитоплазматическими процессами, отходящими от остеоцитов (24). Сеть остеоцитов в кости служит функциональным синцитием. По завершении формирования кости приблизительно от 50 до 70% остеобластов подвергаются апоптозу, а остальная часть становится остеоцитами или клетками, выстилающими костную ткань.Клетки, выстилающие костную ткань, могут регулировать приток и отток минеральных ионов в костную внеклеточную жидкость и из нее, тем самым выступая в качестве гемато-костного барьера, но сохраняя способность повторно дифференцироваться в остеобласты при воздействии паратиреоидного гормона или механических сил (25). Клетки, выстилающие костную ткань эндоста, отрываются от поверхности кости перед резорбцией кости, чтобы сформировать дискретные компартменты ремоделирования кости со специализированным микроокружением (26). У пациентов с множественной миеломой клетки выстилки могут быть индуцированы экспрессией устойчивой к тартрату кислой фосфатазы и других классических маркеров остеокластов.
Остеобласты синтезируют белковый матрикс, состоящий в основном из коллагена I типа, для заполнения ямок резорбции. Белковый матрикс постепенно минерализуется, образуя новую кость.
Конечным результатом каждого цикла ремоделирования кости является производство нового остеона. Процесс ремоделирования в кортикальной и губчатой кости практически одинаков, при этом единицы ремоделирования кости в губчатой кости эквивалентны единицам ремоделирования кортикальной кости, разделенным пополам в продольном направлении (27). Костный баланс — это разница между резорбированной старой костью и новой сформированной костью.Баланс надкостницы умеренно положительный, тогда как балансы эндостальной и губчатой кости умеренно отрицательны, что приводит к истончению кортикального и трабекулярного слоев с возрастом. Эти относительные изменения происходят при эндостальной резорбции, опережающей периостальное образование.
Основные признанные функции ремоделирования кости включают сохранение механической прочности кости путем замены старой, микроповрежденной кости на более новую, более здоровую кость, а также гомеостаз кальция и фосфата. Относительно низкая скорость обновления кортикального слоя кости у взрослых, составляющая 2–3% в год, достаточна для поддержания биомеханической прочности кости.Скорость обновления губчатой кости выше, чем требуется для поддержания механической прочности, что указывает на то, что обновление губчатой кости более важно для метаболизма минералов. Повышенная потребность в кальции или фосфоре может потребовать увеличения единиц ремоделирования кости, но во многих случаях эта потребность может быть удовлетворена за счет увеличения активности существующих остеокластов. Повышенная потребность в кальции и фосфоре скелета частично удовлетворяется за счет резорбции остеокластов и частично за счет притока и оттока неостеокластического кальция.Постоянная деятельность по ремоделированию кости обеспечивает непрерывное поступление вновь сформированной кости, которая имеет относительно низкое содержание минералов и способна легче обмениваться ионами с внеклеточной жидкостью. Единицы ремоделирования кости, по-видимому, в основном случайным образом распределены по скелету, но могут быть вызваны образованием микротрещин или апоптозом остеоцитов. Пространство ремоделирования кости представляет собой сумму всех активных единиц ремоделирования кости в скелете в данный момент времени.
Остеокласты
Остеокласты — единственные клетки, которые, как известно, способны резорбировать кость ().Активированные многоядерные остеокласты происходят из одноядерных клеток-предшественников моноцитарно-макрофагальной линии (11). Мононуклеарные клетки-предшественники моноцитов-макрофагов были идентифицированы в различных тканях, но считается, что клетки-предшественники моноцитов-макрофагов костного мозга дают начало большинству остеокластов.
RANKL и макрофагальный CSF (M-CSF) — два цитокина, которые имеют решающее значение для образования остеокластов. И RANKL, и M-CSF продуцируются в основном стромальными клетками костного мозга и остеобластами в мембраносвязанных и растворимых формах, а для остеокластогенеза необходимо присутствие стромальных клеток и остеобластов в костном мозге (28).RANKL принадлежит к суперсемейству TNF и имеет решающее значение для образования остеокластов. M-CSF необходим для пролиферации, выживания и дифференцировки предшественников остеокластов, а также для выживания остеокластов и перестройки цитоскелета, необходимых для резорбции кости. OPG представляет собой мембраносвязанный и секретируемый белок, который связывает RANKL с высоким сродством, чтобы ингибировать его действие на рецептор RANK (29).
Резорбция кости зависит от секреции остеокластами ионов водорода и фермента катепсина К. Ионы H + подкисляют отсек резорбции под остеокластами, растворяя минеральный компонент костного матрикса, тогда как катепсин K переваривает белковый матрикс, который в основном состоит из коллагена I типа (11).
Остеокласты связываются с костным матриксом через рецепторы интегрина в мембране остеокластов, связываясь с пептидами костного матрикса. Семейство β1 рецепторов интегрина в остеокластах связывается с коллагеном, фибронектином и ламинином, но основным рецептором интегрина, способствующим резорбции кости, является интегрин α v β 3 , который связывается с остеопонтином и костным сиалопротеином (30).
Связывание остеокластов с костным матриксом заставляет их поляризоваться, при этом на резорбирующей кость поверхности образуется взъерошенная граница, которая образуется, когда подкисленные везикулы, содержащие матриксные металлопротеиназы и катепсин K, транспортируются через микротрубочки для слияния с мембраной.Рифленая граница секретирует ионы H + через H + -АТФазные и хлоридные каналы и вызывает экзоцитоз катепсина К и других ферментов в подкисленных везикулах (31).
При контакте с костным матриксом фибриллярный актиновый цитоскелет остеокласта организуется в актиновое кольцо, которое способствует образованию зоны уплотнения по периферии прикрепления остеокласта к матрице. Зона уплотнения окружает и изолирует подкисленный отсек резорбции от окружающей поверхности кости (32).Нарушение взъерошенной границы или актинового кольца блокирует резорбцию кости. Активно резорбирующиеся остеокласты образуют подосомы, которые прикрепляются к костному матриксу, а не к фокальным спайкам, которые образуются большинством клеток. Подосомы состоят из актинового ядра, окруженного интегринами α v β 3 и ассоциированными белками цитоскелета.
Остеобласты
Остеопрогениторные клетки образуют и поддерживают остеобласты, которые синтезируют новый костный матрикс на костеобразующих поверхностях (), остеоциты внутри костного матрикса, поддерживающие структуру кости, и клетки защитной оболочки, покрывающие поверхность покоящейся кости.Внутри линии остеобластов субпопуляции клеток по-разному реагируют на различные гормональные, механические или цитокиновые сигналы. Было показано, что остеобласты осевой и аппендикулярной кости по-разному реагируют на эти сигналы.
Самообновляющиеся плюрипотентные стволовые клетки дают начало клеткам-остеопрогениторам в различных тканях при правильных условиях окружающей среды. Костный мозг содержит небольшую популяцию мезенхимальных стволовых клеток, которые способны давать начало костной, хрящевой, жировой или волокнистой соединительной ткани, отличной от популяции гемопоэтических стволовых клеток, дающей начало клонам клеток крови (33).Клетки со свойствами, характерными для мезенхимальных стволовых клеток костного мозга взрослых, были выделены из периферической крови, пульпы зуба и пуповинной крови плода, печени, крови и костного мозга. Также были идентифицированы мультипотенциальные миогенные клетки, которые способны дифференцироваться в кости, мышцы или адипоциты. Мезенхимные клетки, принадлежащие к одному фенотипу, могут дедифференцироваться во время пролиферации и развить другой фенотип, в зависимости от местной тканевой среды. Перициты кровеносных сосудов могут развить остеобластический фенотип во время дедифференцировки при определенных обстоятельствах (34).
Приверженность мезенхимальных стволовых клеток к клону остеобластов требует канонического пути Wnt / β-catenin и ассоциированных белков (35). Идентификация фенотипа с высокой костной массой, связанного с активирующими мутациями белка, связанного с рецепторами LDL 5, подчеркнула важность канонического пути Wnt / β-catenin в формировании паттерна эмбрионального скелета, развитии скелета плода и ремоделировании скелета взрослых (36,37). Система Wnt также важна для хондрогенеза и гематопоэза и может быть стимулирующей или ингибирующей на разных стадиях дифференцировки остеобластов.
Сглаженные клетки выстилки кости считаются покоящимися остеобластами, которые образуют эндост на трабекулярной и эндостальной поверхностях и лежат в основе надкостницы на минерализованной поверхности. Остеобласты и клетки выстилки находятся в непосредственной близости и соединяются сращениями. Кадгерины — это кальций-зависимые трансмембранные белки, которые являются неотъемлемой частью адгезивных соединений и вместе с плотными контактами и десмосомами соединяют клетки вместе, связывая их цитоскелеты (38).
Предшественники остеобластов изменяют форму от веретеновидных остеопрогениторов до больших кубовидных дифференцированных остеобластов на поверхности костного матрикса после того, как преостеобласты перестают пролиферировать.Преостеобласты, которые находятся рядом с функционирующими остеобластами в модуле ремоделирования кости, обычно распознаются из-за экспрессии в них щелочной фосфатазы. Активные зрелые остеобласты, которые синтезируют костный матрикс, имеют большие ядра, увеличенные структуры Гольджи и обширный эндоплазматический ретикулум. Эти остеобласты секретируют коллаген I типа и другие матричные белки векторно по направлению к поверхности образования кости.
Популяции остеобластов неоднородны, разные остеобласты экспрессируют разные репертуары генов, что может объяснять гетерогенность трабекулярной микроархитектуры в разных участках скелета, анатомические сайт-специфические различия в болезненных состояниях и региональные различия в способности остеобластов реагировать на используемые агенты для лечения заболеваний костей.
Костный внеклеточный матрикс
Костный белок на 85–90% состоит из коллагеновых белков (). Костный матрикс в основном состоит из коллагена I типа (39) со следовыми количествами коллагенов III и V типов и FACIT на определенных стадиях формирования кости, что может помочь определить диаметр коллагеновых фибрилл. Коллагены FACIT являются членами семейства ассоциированных с фибриллами коллагенов с прерывистой тройной спиралью, группы нефибриллярных коллагенов, которые служат в качестве молекулярных мостиков, которые важны для организации и стабильности внеклеточных матриксов.Члены этого семейства включают коллагены IX, XII, XIV, XIX, XX и XXI. Неколлагеновые белки составляют от 10 до 15% от общего костного белка. Примерно 25% неколлагенового белка происходит экзогенно, включая сывороточный альбумин и α2-HS-гликопротеин, которые связываются с гидроксиапатитом из-за своих кислотных свойств. Неколлагеновые белки сыворотки крови могут помочь регулировать минерализацию матрикса, а α2-HS-гликопротеин, который является человеческим аналогом фетуина, может регулировать пролиферацию костных клеток. Остальные неколлагеновые белки, полученные экзогенно, состоят из факторов роста и большого количества других молекул в следовых количествах, которые могут влиять на активность костных клеток.
Таблица 1.
Белки внеклеточного матрикса a
| Белок (расположение хромосомы) | Функция | Болезнь человека | ||||
|---|---|---|---|---|---|---|
| Белки, связанные с коллагеном | (17q21.23, 7q22.1) | Самый распространенный белок костного матрикса | Несовершенный остеогенез | |||
| тип X (6q21) | Обнаружен в гипертрофическом хряще | Неизвестно | ||||
| 9027 тип III (2q21) Следы в костях; может регулировать диаметр коллагеновых фибрилл | Синдром Элерса-Данлоса | |||||
| тип V (9q34.2-34,3; 2q24.3-31; 19q13.2) | Следы в кости; может регулировать диаметр коллагеновых фибрилл | |||||
| Белки сыворотки в костном матриксе | ||||||
| альбумин (4q11-13) | Уменьшает рост кристаллов гидроксиапатита | 5 2 900co (3q27) | Бычий аналог — фетуин | Нет | ||
| Гликоаминогликан-содержащие белки и белки с высоким содержанием лейцина | ||||||
| аггрекан (15q26.1) | Организация матрикса, удержание кальция / фосфора | Нет | ||||
| версикан (5q14.3) | Определяет пространство, предназначенное для превращения в кость | Нет | ||||
| Декорин (12q21.3) | Регулирует коллаген диаметр фибриллы; связывает TGF-β | Прогероидная форма синдрома Элерса-Данлоса с двойным нокаутом декорина / бигликана | ||||
| бигликан (Xq28) | Связывает коллаген; связывает TGF-β; генетическая детерминанта пика костной массы | |||||
| гиалуронан (мультигенный комплекс) | Может работать с версиканом для определения пространства, предназначенного для превращения в кость | Нет | ||||
| Гликопротеины | Гидролизует ингибиторы осаждения минералов | Гипофосфатазия | ||||
| остеонектин (5q31.3-32) | Регулирует диаметр коллагеновых фибрилл | Нет | ||||
| SIBLING 4q21) | Подавляет минерализацию и ремоделирование | Нет | ||||
| Костный сиалопротеин (4q21) | Инициирует минерализацию | Нет | ||||
| MEPE (4q21.1) | Регулятор фосфатного обмена | Опухоль-индуцированная остеомаляция | ||||
| RGD-содержащие гликопротеины | ||||||
тромбоспондины (15q15,.137, 9027.190, 9027.1q27.1q, прикрепление 9027.1q, 1q27. Нет | ||||||
| фибронектин (2q34) | Связывается с клетками | Нет | ||||
| витронектин (17q11) | Прикрепление клеток | Нет | ||||
| Регулирует образование эластичных волокон | Фибриллин 1: синдром Марфана | |||||
| белки, содержащие гамма-карбоксиглутаминовую кислоту | ||||||
| матричный белок Gla12 (12p13.1-p ) | Подавляет минерализацию | Нет | ||||
| остеокальцин (1q25-q31) | Регулирует остеокласты; подавляет минерализацию | Нет | ||||
| протеин S (3p11.2) | Печеночный продукт, может быть произведен остеобластами | Остеопения |
Остеобласты синтезируют и секретируют столько же неколлагенового молярного белка, сколько не коллаген.Неколлагеновые белки в целом делятся на несколько категорий, включая протеогликаны, гликозилированные белки, гликозилированные белки с потенциальной активностью прикрепления клеток и γ-карбоксилированные (gla) белки. Роли каждого из костных белков в настоящее время четко не определены, и многие из них, по-видимому, выполняют несколько функций, включая регуляцию отложения и обмена костных минералов, а также регуляцию активности костных клеток. Ранее считалось, что остеокальцин в сыворотке крови, синтезируемый остеобластами, действует как промотор или инициатор отложения кальция в очаге между концами коллагеновых фибрилл и, следовательно, рассматривается как маркер образования кости.Наблюдение, что мышь с нокаутом остеокальцина имеет фенотип с высокой костной массой, предполагает, что остеокальцин обычно ингибирует образование кости. Поскольку сывороточный остеокальцин образуется как в результате высвобождения матрикса за счет активности остеокластов, так и в результате синтеза остеобластов, в настоящее время он рассматривается как маркер обновления костной ткани, а не как специфический маркер образования кости.
Основным гликозилированным белком, присутствующим в кости, является щелочная фосфатаза. Щелочная фосфатаза в кости связана с поверхностями клеток остеобластов через фосфоинозитоловую связь, а также находится в свободном состоянии в минерализованном матриксе.Щелочная фосфатаза играет пока еще неопределенную роль в минерализации костей (40). Наиболее распространенным неколлагеновым белком в кости является остеонектин, составляющий примерно 2% от общего белка в развивающейся кости. Считается, что остеонектин влияет на рост и / или пролиферацию остеобластов и минерализацию матрикса.
Минерализация костного матрикса
Кость состоит из 50–70% минералов, 20–40% органического матрикса, 5–10% воды и <3% липидов. Минеральный состав кости состоит в основном из гидроксиапатита [Ca 10 (PO 4 ) 6 (OH) 2 ] с небольшими количествами карбоната, магния и кислого фосфата с отсутствующими гидроксильными группами, которые обычно присутствуют. .По сравнению с геологическими кристаллами гидроксиапатита, костные кристаллы гидроксиапатита очень малы, их наибольший размер составляет всего около 200 Å. Эти маленькие, малокристаллические, карбонат-замещенные кристаллы более растворимы, чем кристаллы геологического гидроксиапатита, что позволяет им поддерживать минеральный метаболизм.
Созревание матрикса связано с экспрессией щелочной фосфатазы и нескольких неколлагеновых белков, включая остеокальцин, остеопонтин и костный сиалопротеин.Считается, что эти связывающие кальций и фосфат белки помогают регулировать упорядоченное отложение минералов, регулируя количество и размер образующихся кристаллов гидроксиапатита.
Костный минерал обеспечивает механическую жесткость и прочность костей, а органический матрикс обеспечивает эластичность и гибкость. Костный минерал изначально откладывается в зонах «дырок» между концами коллагеновых фибрилл (41). Этому процессу могут способствовать везикулы внеклеточного матрикса в кости, такие как кальцификация хряща и минерализация сухожилий индейки (23).Внеклеточные везикулы матрикса синтезируются хондроцитами и остеобластами и служат защищенным микроокружением, в котором концентрации кальция и фосфата могут увеличиваться в достаточной степени, чтобы ускорить образование кристаллов. Внеклеточная жидкость обычно не перенасыщена гидроксиапатитом, поэтому гидроксиапатит не осаждается самопроизвольно. Внеклеточные везикулы матрицы содержат ядро ядра, которое состоит из белков и комплекса кислых фосфолипидов, кальция и неорганического фосфата, которого достаточно для осаждения кристаллов гидроксиапатита.Пока неясно, как внеклеточные везикулы матрикса вносят вклад в минерализацию в определенных местах на концах фибрилл коллагена, потому что везикулы, по-видимому, не нацелены непосредственно на концы фибрилл (23).
Нет никаких доказательств того, что кластеры некристаллического фосфата кальция (аморфный фосфат кальция) образуются в кости до того, как он превращается в гидроксиапатит (42). По мере созревания костей кристаллы гидроксиапатита увеличиваются в размерах и снижают уровень примесей. Увеличение кристаллов происходит как за счет роста кристаллов, так и за счет агрегации.Макромолекулы костного матрикса могут способствовать начальному зарождению кристаллов, секвестрировать ионы минералов для увеличения локальной концентрации кальция и / или фосфора или способствовать гетерогенному зарождению. Макромолекулы также связываются с поверхностями растущих кристаллов, чтобы определить размер, форму и количество образующихся кристаллов.
Подтвержденные промоторы минерализации (нуклеаторы) включают белок 1 матрикса дентина и сиалопротеин кости. Коллаген I типа не способствует минерализации костей. Фосфопротеинкиназы и щелочная фосфатаза регулируют процесс минерализации.Костная щелочная фосфатаза может увеличивать локальную концентрацию фосфора, удалять фосфатсодержащие ингибиторы роста кристаллов гидроксиапатита или изменять фосфопротеины, чтобы контролировать их способность действовать как нуклеаторы.
Витамин D играет косвенную роль в стимуляции минерализации неминерализованного костного матрикса. После абсорбции или выработки кожей витамина D печень синтезирует 25-гидроксивитамин D, а почки впоследствии производят биологически активный 1,25-дигидроксивитамин D [1,25- (OH) 2 D].Сыворотка 1,25- (OH) 2 D отвечает за поддержание сывороточного кальция и фосфора в адекватных концентрациях, позволяющих пассивную минерализацию неминерализованного костного матрикса. Сыворотка 1,25- (OH) 2 D делает это в первую очередь за счет стимуляции кишечного всасывания кальция и фосфора. Сыворотка 1,25- (OH) 2 D также способствует дифференцировке остеобластов и стимулирует экспрессию остеобластами специфической для кости щелочной фосфатазы, остеокальцина, остеонектина, OPG и ряда других цитокинов.Сыворотка 1,25- (OH) 2 D также влияет на пролиферацию и апоптоз других скелетных клеток, включая гипертрофические хондроциты.
Остеоциты
Остеоциты представляют собой терминально дифференцированные остеобласты и функционируют в синцитиальных сетях, поддерживая структуру кости и метаболизм. Остеоциты лежат в лакунах в минерализованной кости () и имеют обширные филиподиальные отростки, которые лежат внутри канальцев в минерализованной кости (43). Остеоциты обычно не экспрессируют щелочную фосфатазу, но экспрессируют остеокальцин, галектин 3 и CD44, рецептор клеточной адгезии для гиалуроната, а также несколько других белков костного матрикса.Остеоциты экспрессируют несколько матричных белков, которые поддерживают межклеточную адгезию и регулируют обмен минералов в костной жидкости в лакунах и канальцевой сети. Остеоциты активны во время остеолиза и могут функционировать как фагоцитарные клетки, поскольку содержат лизосомы.
Остеоциты поддерживают связь друг с другом и с поверхностью кости посредством своих множественных филиподиальных клеточных отростков. Коннексины — это интегральные клеточные белки, которые поддерживают щелевые контакты между клетками, чтобы обеспечить прямую связь через межклеточные каналы.Остеоциты метаболически и электрически связаны посредством щелевых контактов, состоящих в основном из коннексина 43 (44). Щелевые соединения необходимы для созревания, активности и выживания остеоцитов.
Основная функция синцития остеоцитов-остеобластов / выстилающих клеток — механочувствительность (45). Остеоциты преобразуют сигналы напряжения от изгиба или растяжения кости в биологическую активность. Поток канальцевой жидкости в ответ на внешние силы вызывает множество реакций внутри остеоцитов.Считается, что быстрые потоки костного кальция через щелевые соединения филиподий стимулируют передачу информации между остеобластами на поверхности кости и остеоцитами внутри кости (46). Сигнальные механизмы, участвующие в механотрансдукции, включают простагландин E2, циклооксигеназу 2, различные киназы, Runx2 и закись азота.
Остеоциты могут десятилетиями жить в человеческих костях, которые не перевернуты. Присутствие пустых лакун в стареющей кости указывает на то, что остеоциты могут подвергаться апоптозу, вероятно, вызванному нарушением их межклеточных щелевых контактов или взаимодействий клетка-матрица (47).Апоптоз остеоцитов в ответ на дефицит эстрогена или лечение глюкокортикоидами вредит структуре кости. Терапия эстрогенами и бисфосфонатами, а также физиологическая нагрузка на кость могут помочь предотвратить апоптоз остеобластов и остеоцитов (48).
Детерминанты прочности кости
Костная масса составляет от 50 до 70% прочности кости (49). Однако геометрия и состав костей важны, потому что более крупные кости прочнее, чем более мелкие кости, даже при эквивалентной минеральной плотности костей.По мере того как диаметр кости увеличивается в радиальном направлении, прочность кости увеличивается на радиус пораженной кости, увеличенный до четвертой степени. Количество и пропорция трабекулярной и кортикальной кости в данном участке скелета независимо влияет на прочность кости. Свойства костного материала важны для прочности кости. У некоторых пациентов с остеопорозом аномальный костный матрикс. Мутации в некоторых белках могут вызывать слабость костей (, например, , дефекты коллагена вызывают снижение прочности костей при несовершенном остеогенезе, нарушение γ-карбоксилирования белков Gla).На прочность костей могут влиять остеомаляция, терапия фтором или состояния гиперминерализации. Микроструктура костей также влияет на прочность костей. Низкий костный обмен приводит к накоплению микротрещин. Высокий метаболизм кости, при которой резорбция кости выше, чем образование кости, является основной причиной ухудшения микроархитектуры.
Выводы
Каркас выполняет несколько функций. Моделирование и ремоделирование костей сохраняют функцию скелета на протяжении всей жизни. Блок ремоделирования кости обычно сочетает резорбцию и формирование кости.Костный матрикс регулирует минерализацию костей. Прочность костей зависит от костной массы, геометрии и состава, свойств материала и микроструктуры.
Список литературы
1. Опорно-двигательный аппарат. В: Анатомия Грея, 39-е изд., Под редакцией Standring S, New York, Elsevier, 2004. , стр83 –135
2. Тайчман Р.С.: Кровь и кость: две ткани, судьбы которых переплетаются, чтобы создать нишу для гемопоэтических стволовых клеток. Кровь 105 : 2631 –2639,2005 [PubMed] [Google Scholar]3. Эриксен Э. Ф., Аксельрод Д. В., Мельсен Ф.Костная гистоморфометрия, Нью-Йорк, Raven Press, 1994. , pp1 –12
4. Кобаяси С., Такахаси Х. Э., Ито А., Сайто Н., Навата М., Хориучи Х., Охта Х, Ито А., Иорио Р., Ямамото Н., Такаока К.: Трабекулярное минимальное моделирование подвздошной кости человека. Кость 32 : 163 –169,2003 [PubMed] [Google Scholar] 5. Убара Ю., Тагами Т., Наканиси С., Сава Н., Хосино Дж., Сувабе Т., Кайтори Н., Такемото Ф., Хара С., Такаичи К.: Значение минимального моделирования у диализных пациентов с адинамической болезнью костей. Почки Инт 68 : 833 –839,2005 [PubMed] [Google Scholar] 6.Ubara Y, Fushimi T, Tagami T., Sawa N, Hoshino J, Yokota M, Kaitori H, Takemoto F, Hara S: гистоморфометрические особенности кости у пациентов с первичным и вторичным гиперпаратиреозом. Почки Инт 63 : 1809 –1816,2003 [PubMed] [Google Scholar] 7. Линдси Р., Косман Ф., Чжоу Х., Бостром М., Шен В., Круз Дж., Ньевес Дж. В., Демпстер Д. В.: Новый график маркировки тетрациклинов для продольной оценки краткосрочных эффектов анаболической терапии с помощью биопсии одного гребня подвздошной кости: Ранние действия терипаратида.J Bone Miner Res 21 : 366 –373,2006 [PubMed] [Google Scholar] 9. Parfitt AM: Целевое и нецелевое ремоделирование кости: связь с возникновением и развитием основных многоклеточных единиц. Кость 30 : 5 –7,2002 [PubMed] [Google Scholar] 10. Рудман Г.Д .: Клеточная биология остеокластов. Опыт Гематол 27 : 1229 –1241,1999 [PubMed] [Google Scholar] 11. Бойл В.Дж., Симонет В.С., Лейси Д.Л.: дифференциация и активация остеокластов. Природа 423 : 337 –342,2003 [PubMed] [Google Scholar] 12. Блэр ХК, Атанасу Н.А.: Последние достижения в биологии остеокластов и патологической резорбции кости.Гистол Гистопатол 19 : 189 –199,2004 [PubMed] [Google Scholar] 13. Silver IA, Murrills RJ, Etherington DJ: Микроэлектродные исследования кислотного микроокружения под прилипшими макрофагами и остеокластами. Ячейка опыта, Res 175 : 266 –276,1988 [PubMed] [Google Scholar] 14. Delaisse JM, Andersen TL, Engsig MT, Henriksen K, Troen T, Blavier L: Матричные металлопротеиназы (MMP) и катепсин K по-разному влияют на активность остеокластов. Microsc Res Tech 61 : 504 –513,2003 [PubMed] [Google Scholar] 15. Эриксен Э.Ф .: Нормальное и патологическое ремоделирование губчатой кости человека: Трехмерная реконструкция последовательности ремоделирования в норме и при метаболическом заболевании костей.Endocr Ред. 7 : 379 –408,1986 [PubMed] [Google Scholar] 16. Редди С.В.: Регуляторные механизмы, действующие в остеокластах. Crit Rev Eukaryot Gene Expr 14 : 255 –270,2004 [PubMed] [Google Scholar] 17. Боневальд Л., Манди Г.Р .: Роль трансформирующего фактора роста бета в ремоделировании костей. Clin Orthop Rel Res 2S : 35 –40,1990 [Google Scholar] 18. Hock JM, Centrella M, Canalis E: инсулиноподобный фактор роста I (IGF-I) оказывает независимое влияние на формирование костного матрикса и репликацию клеток. Эндокринология 122 : 254 –260,2004 [PubMed] [Google Scholar] 19.Locklin RM, Oreffo RO, Triffitt JT: Эффекты TGFbeta и bFGF на дифференцировку стромальных фибробластов костного мозга человека. Cell Biol Int 23 : 185 –194,1999 [PubMed] [Google Scholar] 20. Smit TH, Burger EH, Huyghe JM: Является ли BMU-сцепление явлением, регулируемым деформацией? Анализ методом конечных элементов. J Bone Miner Res 15 : 301 –307,2002 [PubMed] [Google Scholar] 21. Smit TH, Burger EH, Huyghe JM: случай, когда поток жидкости, индуцированный деформацией, используется в качестве регулятора BMU-сцепления и выравнивания костной ткани. J Bone Miner Res 17 : 2021 –2029,2002 [PubMed] [Google Scholar] 22.Мартин Т.Дж., Симс Н.А.: Активность остеокластов в сочетании образования кости с резорбцией. Тренды Мол Мед 11 : 76 –81,2005 [PubMed] [Google Scholar] 23. Андерсон ХК: Матричные везикулы и кальцификация. Curr Rheumatol Rep 5 : 222 –226,2003 [PubMed] [Google Scholar] 24. Burger EH, Klein-Nuland J, Smit TH: Поток канальцевой жидкости, полученный из деформации, регулирует активность остеокластов в ремоделирующем остеоне: предложение. Дж Биомех 36 : 1452 –1459,2003 [PubMed] [Google Scholar] 25. Добниг Х., Тернер Р.Т.: Доказательства того, что периодическое лечение паратиреоидным гормоном увеличивает образование костной ткани у взрослых крыс за счет активации клеток выстилки костей.Эндокринология 136 : 3632 –3638,1995 [PubMed] [Google Scholar] 26. Hauge EM, Qvesel D, Eriksen EF, Mosekilde L, Melsen F: Ремоделирование злокачественной кости происходит в специализированных отсеках, выстланных клетками, экспрессирующими маркеры остеобластов. J Bone Miner Res 16 : 1575 –1582,2001 [PubMed] [Google Scholar] 27. Парфитт AM: Остеональное и гемиостеональное ремоделирование: пространственные и временные рамки для передачи сигналов в кости взрослого человека. J Cell Biochem 55 : 273 –276,1994 [PubMed] [Google Scholar] 28. Тейтельбаум С.Л., Росс Ф.П.: Генетическая регуляция развития и функции остеокластов.Нат Рев Жене 4 : 638 –649,2003 [PubMed] [Google Scholar] 29. Коэн М.М.-младший: Новая биология костей: патологические, молекулярные, клинические корреляты. Am J Med Genet A 140 : 2646 –2706,2006 [PubMed] [Google Scholar] 30. Росс Ф.П., Тейтельбаум С.Л.: α v β 3 и фактор, стимулирующий колонию макрофагов: партнеры в биологии остеокластов. Иммунол Рев 208 : 88 –105,2005 [PubMed] [Google Scholar] 31. Teitelbaum SL, Abu-Amer Y, Ross FP: Молекулярные механизмы резорбции кости. J Cell Biochem 59 : 1 –10,1995 [PubMed] [Google Scholar] 32.Vaananen HK, Zhao H, Mulari M, Halleen JM: клеточная биология функции остеокластов. J Cell Sci 113 : 377 –381,2000 [PubMed] [Google Scholar] 33. Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simonetti DW, Craig S, Marshak DR: Многолинейный потенциал мезенхимальных стволовых клеток взрослого человека. Наука 284 : 143 –147,1990 [PubMed] [Google Scholar] 34. Доэрти MJ, Ashton BA, Walsh S, Beresford JN, Grant ME, Canfield AE: Сосудистые перициты выражают остеогенный потенциал in vitro и in vivo.J Bone Miner Res 13 : 828 –838,1998 [PubMed] [Google Scholar] 35. Логан CY, Nusse R: Путь передачи сигналов Wnt в развитии и болезни. Анну Rev Cell Dev Biol 20 : 781 –810,2004 [PubMed] [Google Scholar] 36. Boyden LM, Mao J, Belsky J, Mitzner L, Farhi A, Mitnick MA, Wu D, Insogna K, Lifton RP: Высокая плотность костей из-за мутации в связанном с рецептором ЛПНП протеине 5. N Engl J Med 346 : 1513 –1521,2002 [PubMed] [Google Scholar] 37. Литтл Р.Д., Реккер Р.Р., Джонсон М.Л.: Высокая плотность костей из-за мутации белка 5, связанного с рецептором ЛПНП.N Engl J Med 347 : 943 –944,2002 [PubMed] [Google Scholar] 38. Shin CS, Lecanda F, Sheikh S, Weitzmann L, Cheng SL, Civitelli R: Относительное количество различных кадгеринов определяет дифференциацию мезенхимальных предшественников в остеогенные, миогенные или адипогенные пути. J Cell Biochem 78 : 566 –577,2000 [PubMed] [Google Scholar] 39. Бродский Б., Персиков А.В.: Молекулярная структура тройной спирали коллагена. Adv Protein Chem 70 : 301 –339,2005 [PubMed] [Google Scholar] 40. Уайт М.П .: Гипофосфатазия и роль щелочной фосфатазы в минерализации скелета.Endocr Ред. 15 : 439 –461,1994 [PubMed] [Google Scholar] 41. Ландис У. Дж .: Прочность кальцинированной ткани частично зависит от молекулярной структуры и организации составляющих ее минеральных кристаллов в их органической матрице. Кость 16 : 533 –544,1995 [PubMed] [Google Scholar] 42. Вайнер С., Саги И., Аддади Л.: Структурная биология: выбор менее пройденного пути кристаллизации. Наука 309 : 1027 –1028 [PubMed] 43. Bonewald LF: Создание и характеристика остеоцитоподобной клеточной линии MLO-Y4. Джей Боун Майнер Метаб 17 : 61 –65,1999 [PubMed] [Google Scholar] 44.Плоткин Л.И., Manolagas SC, Bellido T: Трансдукция сигналов выживания клеток с помощью полуканалов коннексина-43. J Biol Chem 277 : 8648 –8657,2002 [PubMed] [Google Scholar] 45. Rubin CT, Lanyon LE: Остеорегуляторная природа механических стимулов: функция как детерминант адаптивного ремоделирования кости. J Orthop Res 5 : 300 –310,1987 [PubMed] [Google Scholar] 46. Jorgensen NR, Teilmann SC, Henriksen Z, Civitelli R, Sorensen OH, Steinberg TH: Активация кальциевых каналов L-типа необходима для опосредованной щелевыми соединениями межклеточной передачи сигналов кальция в остеобластных клетках.J Biol Chem 278 : 4082 –4086,2003 [PubMed] [Google Scholar] 47. Xing L, Boyce BF: Регулирование апоптоза в остеокластах и остеобластных клетках. Биохимия Биофиз Рес Коммуна 328 : 709 –720,2005 [PubMed] [Google Scholar] 48. Плоткин Л.И., Агирре Дж.И., Кустени С., Манолагас С.К., Беллидо Т. Бисфосфонаты и эстрогены ингибируют апоптоз остеоцитов через различные молекулярные механизмы, расположенные ниже по ходу активации регулируемой внеклеточными сигналами киназы. J Biol Chem 280 : 7317 –7325,2005 [PubMed] [Google Scholar] 49. Покок Н.А., Эйсман Дж. А., Хоппер Дж. Л., Йейтс М. Г., Сэмбрук PH, Эберл С.: Генетические детерминанты костной массы у взрослых: исследование близнецов.J Clin Invest 80 : 706 –710,1987 [Бесплатная статья PMC] [PubMed] [Google Scholar]14.2: Введение в скелетную систему
- Последнее обновление
- Сохранить как PDF
- Компоненты скелетной системы
- Осевой и аппендикулярный скелеты
- Функции скелетной системы
- Поддержка, форма и защита
- Движение
- Гематопоэз
- Обзор
Обзор Mineral Storage and Homeostasis - Атрибуции
Череп и скрещенные кости
Символ черепа и скрещенных костей очень долгое время использовался для обозначения смерти, возможно, потому, что после смерти и разложения кости — это все, что осталось.Многие люди считают кости мертвыми, сухими и хрупкими. Эти прилагательные могут правильно описывать кости сохранившегося скелета, но кости живого человека очень живы. Живые кости также крепкие и гибкие. Кости — основные органы скелетной системы.
Рисунок \ (\ PageIndex {1} \): флаг черепа и скрещенных костейСкелетная система — это система органов, которая обеспечивает внутреннюю основу человеческого тела. Зачем нужна костная система? Попробуйте представить, как бы вы выглядели без него.Вы были бы мягкой, шаткой грудой кожи, содержащей мышцы и внутренние органы, но без костей. Вы можете выглядеть как очень большая пуля. Не то чтобы вы могли видеть себя — складки кожи опускались на ваши глаза и блокировали обзор из-за отсутствия костей черепа. Вы могли бы отодвинуть кожу, если бы вы могли двигать только руками, но для этого вам также понадобятся кости!
Компоненты скелетной системы
У взрослых скелетная система включает 206 костей, многие из которых показаны на рисунке \ (\ PageIndex {2} \).Кости — это органы, состоящие из плотных соединительных тканей, в основном из прочного белкового коллагена. Кости содержат кровеносные сосуды, нервы и другие ткани. Кости твердые и жесткие из-за отложений кальция и других минеральных солей в их живых тканях. Места, где встречаются две или более кости, называются суставами. Многие суставы позволяют костям двигаться как рычаги. Например, локоть — это сустав, позволяющий сгибать и выпрямлять руку.
Рисунок \ (\ PageIndex {2} \): Некоторые из 206 костей помечены на скелете взрослого человека.Помимо костей, скелетная система включает хрящи и связки.
- Хрящ — это тип плотной соединительной ткани, состоящей из прочных белковых волокон. Он прочный, но гибкий и очень гладкий. Он покрывает концы костей в суставах, обеспечивая гладкую поверхность для движения костей.
- Связки представляют собой связки волокнистой соединительной ткани, которые скрепляют кости. Они удерживают кости скелета на месте.
Осевой и аппендикулярный скелеты
Скелет традиционно делится на две основные части: осевой скелет и аппендикулярный скелет, обе из которых изображены на рисунке \ (\ PageIndex {3} \).
- Осевой каркас образует ось тела. Он включает череп, позвоночник (позвоночник) и грудную клетку. Кости осевого скелета, а также связки и мышцы позволяют человеческому телу сохранять вертикальное положение. Осевой скелет также передает вес от головы, туловища и верхних конечностей вниз по спине к нижним конечностям. Кроме того, кости защищают мозг и органы грудной клетки.
- Аппендикулярный скелет образует придатки и их прикрепления к осевому скелету.Он включает кости рук и ног, кистей и стоп, а также плечевой и тазовый пояса. Кости аппендикулярного скелета обеспечивают возможность передвижения и других движений придатков. Они также защищают основные органы пищеварения, выделения и размножения.
Функции скелетной системы
Скелетная система выполняет множество различных функций, необходимых для выживания человека.Некоторые функции, например поддержка тела, относительно очевидны. Остальные функции менее очевидны, но не менее важны. Например, три крошечные кости (молоток, наковальня и стремени) внутри среднего уха передают звуковые волны во внутреннее ухо.
Опора, форма и защита
Каркас поддерживает тело и придает ему форму. Без жестких костей скелетной системы человеческое тело было бы просто мешком мягких тканей, как описано выше. Кости скелета очень твердые и обеспечивают защиту нежных тканей внутренних органов.Например, череп окружает и защищает мягкие ткани головного мозга, а позвоночный столб защищает нервные ткани спинного мозга. Позвоночный столб, ребра и грудина (грудина) защищают сердце, легкие и основные кровеносные сосуды. Обеспечение защиты этих последних внутренних органов требует, чтобы кости могли расширяться и сжиматься. Ребра и хрящ, соединяющий их с грудиной и позвонками, способны к небольшим сдвигам, которые позволяют дышать и другие движения внутренних органов.
Механизм
Кости скелета обеспечивают поверхности прикрепления скелетных мышц. Когда мышцы сокращаются, они тянут и двигают кости. На рисунке ниже, например, показаны мышцы, прикрепленные к костям колена. Они помогают стабилизировать сустав и позволяют ноге сгибаться в коленях. Кости в суставах действуют как рычаги, движущиеся в точке опоры, а прикрепленные к костям мышцы прикладывают силу, необходимую для движения.
Рисунок \ (\ PageIndex {4} \): Кости, которые встречаются в коленном суставе, включают большеберцовую и малоберцовую кости в голени, бедро в верхней части ноги и коленную чашечку в передней части колена.Эти кости обеспечивают поверхности прикрепления для мышц, которые перемещают кости в суставе. Мышцы прикрепляются к костям через сухожилия.Кроветворение
Гематопоэз — это процесс производства клеток крови. Этот процесс происходит в ткани, называемой красным костным мозгом, которая находится внутри некоторых костей, включая таз, ребра и позвонки. Красный костный мозг синтезирует эритроциты, лейкоциты и тромбоциты. Ежедневно в костях вырабатываются миллиарды этих клеток крови.
Хранение минералов и гомеостаз
Другая функция скелетной системы — запасание минералов, особенно кальция и фосфора. Эта функция хранения связана с ролью костей в поддержании минерального гомеостаза. Для нормального функционирования организма в крови необходим необходимый уровень кальция и других минералов. Когда уровень минералов в крови слишком высок, кости поглощают некоторые из них и сохраняют их в виде минеральных солей, поэтому кости такие твердые.Когда уровень минералов в крови слишком низкий, кости выделяют часть минералов обратно в кровь. Костные минералы являются щелочными (основными), поэтому их выброс в кровь защищает кровь от чрезмерной кислотности (низкий pH), тогда как их обратное всасывание в кости защищает кровь от чрезмерной щелочности (высокий pH). Таким образом, кости помогают поддерживать кислотно-щелочной гомеостаз в крови.
Другой способ, которым кости помогают поддерживать гомеостаз, — действовать как эндокринный орган. Один эндокринный гормон, секретируемый костными клетками, — это остеокальцин, , который помогает регулировать уровень глюкозы в крови и отложение жира.Это увеличивает секрецию инсулина, а также чувствительность клеток к инсулину. Кроме того, он увеличивает количество клеток, вырабатывающих инсулин, и уменьшает жировые отложения.
Обзор
- Что такое костная система? Сколько костей в скелете взрослого человека?
- Опишите состав костей.
- Какие еще органы входят в скелетную систему, кроме костей?
- Определите две основные части скелета.
- Перечислите несколько функций костной системы.
- Обсудить половой диморфизм скелета человека.
- Кости, хрящи и связки состоят из ____________ тканей.
- Верно или неверно. Кости содержат живую ткань и могут влиять на процессы в других частях тела.
- Верно или неверно. Костные клетки сокращаются, чтобы подтянуть мышцы, чтобы начать движение.
- Если у человека проблемы с производством клеток крови, какой тип костной ткани, скорее всего, поражен? Поясните свой ответ.
- Являются ли тазовые пояса частью осевого или аппендикулярного скелета?
- Какие три формы гомеостаза регулирует скелетная система? Кратко объясните, как каждый из них регулируется костной системой.
- Как вы думаете, что было бы с нами, если бы у нас не было связок? Поясните свой ответ.
- а. Определите сустав в скелетной системе.
г. Как хрящ связан с суставами?
г. Определите один сустав человеческого тела и опишите его функцию.
Костный минерал: новое понимание его химического состава
Резников, Н., Билтон, М., Лари, Л., Стивенс, М., Крегер, Р. Фрактальная иерархическая организация кости начинается на наномасштабе. Наука 360 , eaao2189 (2018).
Артикул Google Scholar
Грандфилд, К., Вуонг, В. и Шварц, Х. П. Ультраструктура кости: иерархические характеристики от нанометров до микрометровых масштабов, выявленные в сечениях сфокусированного ионного пучка на ПЭМ. Calcif. Tissue Int. 103 , 606–616 (2018).
CAS Статья Google Scholar
Глимчер, М. Дж. Боун: Природа кристаллов фосфата кальция и клеточные, структурные и физико-химические механизмы их образования. Ред. Минеральное. Геохим. 64 , 223–282 (2006).
CAS Статья Google Scholar
Дельмас, П. Д., Трейси, Р. П., Риггс, Б. Л. и Манн, К. Г. Идентификация неколлагеновых белков бычьей кости с помощью двумерного гель-электрофореза. Calcif. Tissue Int. 36 , 308–316 (1984).
CAS Статья Google Scholar
Боски, А. Л. Неколлагеновые матричные белки и их роль в минерализации. Костяной шахтер. 6 , 111–123 (1989).
ADS CAS Статья Google Scholar
Боски, А. Л. и Роби, П. Г. Состав костей. In Primer on the Metabolic Bone Diseases and Disorders of Mineral Metabolism (ed. Rosen, C.J.) 49–58 (John Wiley & Sons, Inc., 2013).
Вопенка Б. и Пастерис Дж. Д. Минералогический взгляд на апатит в кости. Mater. Sci. Англ. С 25 , 131–143 (2005).
Артикул Google Scholar
Wu, Y. и др. . Спин-спиновая релаксация кристаллов кости, зубной эмали и синтетических гидроксиапатитов с помощью ядерного магнитного резонанса. J. Bone Miner. Res. Выключенный. Варенье. Soc. Костяной шахтер. Res. 17 , 472–480 (2002).
CAS Статья Google Scholar
Хуан С.-Дж., Цай Ю.-Л., Ли Ю.-Л., Линь С.-П. И Чан, Дж. С. С. Повторение структурной модели дентина крысы. Chem. Матер. 21 , 2583–2585 (2009).
CAS Статья Google Scholar
Ван, Ю. и др. . Преобладающая роль коллагена в зарождении, росте, структуре и ориентации костного апатита. Нат. Матер. 11 , 724–733 (2012).
ADS CAS Статья Google Scholar
Фон Эйв, С. и др. .Аморфный поверхностный слой в сравнении с переходной аморфной фазой-предшественником в кости — тематическое исследование, исследованное методом твердотельной ЯМР-спектроскопии. Acta Biomater. 59 , 351–360 (2017).
Артикул Google Scholar
Рей К., Комбес К., Друэ К., Сфихи Х. и Барроуг А. Физико-химические свойства нанокристаллических апатитов: значение для биоминералов и биоматериалов. Mater. Sci. Англ. С 27 , 198–205 (2007).
CAS Статья Google Scholar
Jäger, C., Welzel, T., Meyer-Zaika, W. & Epple, M. Исследование структуры нанокристаллического гидроксиапатита методом ЯМР в твердом состоянии. Magn. Резон. Chem. MRC 44 , 573–580 (2006).
Артикул Google Scholar
Нассиф, Н. и др. . In vivo Условия для синтеза биомиметического гидроксиапатита. Chem. Матер. 22 , 3653–3663 (2010).
CAS Статья Google Scholar
Vandecandelaere, N., Rey, C. & Drouet, C. Биомиметические биоматериалы на основе апатита: критическое влияние параметров синтеза и пост-синтеза. J. Mater. Sci. Матер. Med. 23 , 2593–2606 (2012).
CAS Статья Google Scholar
Фон Эйв, С. и др. . Организация костного минерала: роль взаимодействия минерала и воды. Науки о Земле 8 , 466 (2018).
ADS Статья Google Scholar
Браун, У. Э. Рост кристаллов костного минерала. Clin. Ортоп. 44 , 205–220 (1966).
CAS Статья Google Scholar
Крейн, Н. Дж., Попеску, В., Моррис, М. Д., Стинхуис, П. и Игнелци, М. А. Рамановские спектроскопические данные о октакальцийфосфате и других временных минеральных формах, отложившихся во время внутримембранной минерализации. Кость 39 , 434–442 (2006).
CAS Статья Google Scholar
Вялих, А., Эльшнер, К., Шульц, М., Май, Р. и Шелер, У. Ранние стадии биоминерального образования — твердотельное ЯМР-исследование нижней челюсти мини-свиней. Магнитохимия 3 , 39 (2017).
Артикул Google Scholar
Саймон, П. и др. . Первое свидетельство нанокомплекса октакальцийфосфат @ остеокальцин в качестве компонента скелетной кости, управляющего тройной спиральной минерализацией нанофибрилл коллагена. Sci. Отчетность 8 , 13696 (2018).
ADS Статья Google Scholar
Синь Р., Ленг Ю. и Ван Н. Исследование минеральных фаз в кортикальной кости человека с помощью HRTEM. Adv. Англ. Матер. 12 , B552 – B557 (2010).
Артикул Google Scholar
Дэвис, Э. и др. . Цитратные мостики между минеральными тромбоцитами в кости. Proc. Natl. Акад. Sci. 111 , E1354 – E1363 (2014).
CAS Статья Google Scholar
Арендс, Дж. и др. . Гидроксиапатит кальция осаждается из водного раствора. J. Cryst. Рост 84 , 515–532 (1987).
ADS CAS Статья Google Scholar
Джи, А. и Дейтц, В. Р. Образование пирофосфата при воспламенении осажденных основных фосфатов кальция 1. J. Am. Chem. Soc. 77 , 2961–2965 (1955).
CAS Статья Google Scholar
Пеллегрино, Э. Д. и Билтц, Р. М. Минерализация куриного эмбриона. Calcif. Tissue Res. 10 , 128–135 (1972).
CAS Статья Google Scholar
Термин, Дж. Д., Эанес, Э. Д., Гринфилд, Д. Дж., Найлен, М. У. и Харпер, Р. А. Гидразин-депротеиновый минерал кости. Calcif. Tissue Res. 12 , 73–90 (1973).
CAS Статья Google Scholar
Легрос Р., Балмейн Н. и Бонель Г. Возрастные изменения минералов кортикальной кости крысы и крупного рогатого скота. Calcif. Tissue Int. 41 , 137–144 (1987).
CAS Статья Google Scholar
Rey, C., Shimizu, M., Collins, B. & Glimcher, MJ Инфракрасная спектроскопия с преобразованием Фурье с улучшенным разрешением, исследование окружающей среды фосфат-ионов в ранних отложениях твердой фазы фосфата кальция. в кости и эмали и их эволюции с возрастом.I: Исследования в области v 4 PO 4 . Calcif. Tissue Int. 46 , 384–394 (1990).
CAS Статья Google Scholar
Rey, C., Shimizu, M., Collins, B. & Glimcher, MJ Исследование инфракрасной спектроскопии с преобразованием Фурье с улучшенным разрешением для изучения окружающей среды фосфат-иона в ранних отложениях твердой фазы фосфата кальция в кость и эмаль и их эволюция с возрастом: 2.Исследования в области v 3 PO 4 . Calcif. Tissue Int. 49 , 383–388 (1991).
CAS Статья Google Scholar
Колодзейски, В. Исследования кости с помощью ЯМР твердого тела. Верх. Curr. Chem. 246 , 235–270 (2005).
CAS Статья Google Scholar
Сюй Дж. и др. .Твердотельная ЯМР-спектроскопия кости с естественным изобилием 43Ca. J. Am. Chem. Soc. 132 , 11504–11509 (2010).
CAS Статья Google Scholar
Wang, Y. et al. . Водно-опосредованное структурирование костного апатита. Нат. Матер. 12 , 1144–1153 (2013).
ADS CAS Статья Google Scholar
Jaeger, C. и др. . Исследование природы границы раздела белок-минерал в кости методом твердотельного ЯМР. Chem. Матер. 17 , 3059–3061 (2005).
CAS Статья Google Scholar
Hu, Y.-Y., Rawal, A. & Schmidt-Rohr, K. Прочно связанный цитрат стабилизирует нанокристаллы апатита в кости. Proc. Natl. Акад. Sci. 107 , 22425–22429 (2010).
ADS CAS Статья Google Scholar
Рай, Р. и Синха, Н. Структурные изменения, вызванные дегидратацией на границе раздела коллаген-гидроксиапатит в кости, с помощью твердотельной ЯМР-спектроскопии высокого разрешения. J. Phys. Chem. С 115 , 14219–14227 (2011).
CAS Статья Google Scholar
Никель, О. и др. . Твердотельное ЯМР-исследование качества интактной кости человека: вопросы баланса и понимание структуры на границе раздела органических и минеральных веществ. J. Phys. Chem. С 116 , 6320–6331 (2012).
CAS Статья Google Scholar
Chow, W. Y. и др. . ЯМР-спектроскопия природных и in vitro тканей влияет на биоминерализацию полиАДФ-рибозы. Наука 344 , 742–746 (2014).
ADS CAS Статья Google Scholar
Roufosse, A.H., Aue, W.P., Roberts, J.E., Glimcher, M.J. и Griffin, R.G. Исследование минеральных фаз кости с помощью твердотельного образца с фосфором-31 под магическим углом, вращающего ядерный магнитный резонанс. Биохимия 23 , 6115–6120 (1984).
CAS Статья Google Scholar
Ву, Ю., Глимчер, М. Дж., Рей, К. и Акерман, Дж. Л. Уникальная протонированная фосфатная группа в костном минерале, не присутствующая в синтетических фосфатах кальция: идентификация с помощью твердотельной ЯМР-спектроскопии фосфора-31. J. Mol. Биол. 244 , 423–435 (1994).
CAS Статья Google Scholar
Kaflak-Hachulska, A., Samoson, A. & Kolodziejski, W. 1 H MAS и 1 H-> 31P CP / MAS ЯМР-исследование минералов кости человека. Calcif. Tissue Int. 73 , 476–486 (2003).
CAS Статья Google Scholar
Сантос, Р. А., Винд, Р. А., Бронниманн, К. Э. Эксперименты с 1H CRAMPS и 1H-31P HetCor на костной, костной минеральной и модельной фазах фосфата кальция. J. Magn. Резон. B 105 , 183–187 (1994).
CAS Статья Google Scholar
Чо, Г., Ву, Ю. и Акерман, Дж. Л. Обнаружение гидроксильных ионов в костном минерале с помощью твердотельной ЯМР-спектроскопии. Наука 300 , 1123–1127 (2003).
ADS CAS Статья Google Scholar
Мальцев, С., Дуэр, М. Дж., Мюррей, Р. К. и Джегер, К. Сравнение твердотельной ЯМР минеральной структуры в костях больных суставов лошади. J. Mater. Sci. 42 , 8804–8810 (2007).
ADS CAS Статья Google Scholar
Yesinowski, J. P. & Eckert, H.Водородная среда в фосфатах кальция: протонный MAS ЯМР при высоких скоростях прядения. J. Am. Chem. Soc. 109 , 6274–6282 (1987).
CAS Статья Google Scholar
Рей, К., Комб, К., Друэ, К. и Глимчер, М. Дж. Костный минерал: обновленная информация о химическом составе и структуре. Остеопорос. Int. 20 , 1013–1021 (2009).
Google Scholar
Bigi, A. и др. . Морфологические и структурные модификации октакальцийфосфата, индуцированные поли-1-аспартатом. Кристалл. Рост Des. 4 , 141–146 (2004).
CAS Статья Google Scholar
Rhee, S.-H. И Танака, Дж. Образование гидроксиапатита на целлюлозной ткани под действием лимонной кислоты. J. Mater. Sci. Матер. Med. 11 , 449–452 (2000).
CAS Статья Google Scholar
Rey, C., Combes, C., Drouet, C. & Somrani, S. 15 — Керамика на основе трикальцийфосфата. В Биокерамика и их клиническое применение (изд. Кокубо, Т.) 326–366 (Woodhead Publishing 2008).
Grunenwald, A. et al. . Пересмотр количественного определения карбонатов в апатитовых (био) минералах: проверенная методология FTIR. J. Archaeol. Sci. 49 , 134–141 (2014).
CAS Статья Google Scholar
Nielsen, N.C., Bildso / e, H., Jakobsen, H.J. и Levitt, M.H. Двухквантовый гомоядерный вращательный резонанс: эффективное диполярное восстановление в ядерном магнитном резонансе с вращением под магическим углом. J. Chem. Phys. 101 , 1805–1812 (1994).
ADS CAS Статья Google Scholar
Яннони, С.С. ЯМР высокого разрешения в твердых телах: эксперимент CPMAS. В соотв. Chem. Res. 15 , 201–208 (1982).
CAS Статья Google Scholar
Hediger, S., Meier, B.H., Kurur, N.D., Bodenhausen, G. & Ernst, R.R. Кросс-поляризация ЯМР посредством адиабатического прохождения через условие Хартмана-Хана (APHH). Chem. Phys. Lett. 223 , 283–288 (1994).
ADS CAS Статья Google Scholar
Feike, M. et al. .Широкополосная многоквантовая ЯМР-спектроскопия. J. Magn. Резон. А 122 , 214–221 (1996).
ADS CAS Статья Google Scholar
Рей, К., Микель, Дж. Л., Факкини, Л., Легран, А. П. и Глимчер, М. Дж. Гидроксильные группы в костном минерале. Кость 16 , 583–586 (1995).
CAS Статья Google Scholar
Мюллер Л., Кумар А., Бауманн Т. и Эрнст Р. Р. Переходные колебания в экспериментах с перекрестной поляризацией ЯМР в твердых телах. Phys. Rev. Lett. 32 , 1402–1406 (1974).
ADS Статья Google Scholar
Хестер, Р. К., Акерман, Дж. Л., Кросс, В. Р. и Во, Дж. С. Разрешенные спектры диполярной связи разбавленных ядерных спинов в твердых телах. Phys. Rev. Lett. 34 , 993–995 (1975).
ADS CAS Статья Google Scholar
Колодзейски В. и Клиновски Дж. Кинетика кросс-поляризации в твердотельном ЯМР: Руководство для химиков. Chem. Ред. 102 , 613–628 (2002).
CAS Статья Google Scholar
Катти М., Феррарис Г. и Филхол А. Водородная связь в кристаллическом состоянии.CaHPO4 (монетит), P 1 или P1? Новое нейтронографическое исследование. Acta Crystallogr. B 33 , 1223–1229 (1977).
Артикул Google Scholar
Карри, Н. А. и Джонс, Д. У. Кристаллическая структура брушита, дигидрата ортофосфата водорода кальция: нейтронографические исследования. J. Chem. Soc. Неорг. Phys. Теор. 0 , 3725–3729 (1971).
CAS Статья Google Scholar
Дэвис, Э., Дуэр, М. Дж., Эшбрук, С. Э. и Гриффин, Дж. М. Применение ЯМР-кристаллографии для решения проблем биоминерализации: уточнение кристаллической структуры и 31 P Твердотельное ЯМР-спектральное распределение октакальцийфосфата. J. Am. Chem. Soc. 134 , 12508–12515 (2012).
CAS Статья Google Scholar
Эппелл, С. Дж., Тонг, В., Кац, Дж. Л., Кун, Л. и Глимчер, М.J. Форма и размер изолированных костных минералов, измеренные с помощью атомно-силовой микроскопии. J. Orthop. Res. 19 , 1027–1034 (2001).
CAS Статья Google Scholar
Ким, Х.-М., Рей, К. и Глимчер, М. Дж. Выделение кристаллов фосфата кальция из кости неводными методами при низкой температуре. J. Bone Miner. Res. 10 , 1589–1601 (1995).
CAS Статья Google Scholar
Bocciarelli, D. S. Морфология кристаллитов в кости. Calcif. Tissue Res. 5 , 261–269 (1970).
CAS Статья Google Scholar
Кей М.И., Янг Р.А. и Познер А.С. Кристаллическая структура гидроксиапатита. Nature 204 , 1050–1052 (1964).
ADS CAS Статья Google Scholar
Кун, Л. Т. и др. . Сравнение физических и химических различий между злокачественными и корковыми минералами бычьей кости в двух возрастах. Calcif. Tissue Int. 83 , 146–154 (2008).
CAS Статья Google Scholar
Вялих А. и др. . ЯМР-исследование биомиметических фторапатит-желатиновых мезокристаллов. Sci . Репутация . 5 , (2015).
Nakayama, M. et al. . Чувствительный к стимулам жидкий кристалл гидроксиапатита с макроскопически управляемым упорядочением и магнитооптическими функциями. Нат . Коммуна . 9 , (2018).
Bertinetti, L. et al. . Структура поверхности, гидратация и катионные участки наногидроксиапатита: UHR-TEM, ИК и микрогравиметрические исследования. J. Phys. Chem. С 111 , 4027–4035 (2007).
CAS Статья Google Scholar
Нунамакер Д. М. Экспериментальные модели восстановления трещин. Клин . Ортоп . S56–65 (1998).
Kaflak, A., Chmielewski, D. & Kolodziejski, W. Исследование методом твердотельного ЯМР дискретного окружения костных минеральных наночастиц с использованием релаксации фосфора-31. J. Appl. Биомед. 14 , 321–330 (2016).
Артикул Google Scholar
Shaw, W. J. Исследования твердотельного ЯМР белков, иммобилизованных на неорганических поверхностях. Solid State Nucl. Magn. Резон. 70 , 1–14 (2015).
ADS CAS Статья Google Scholar
Гилберт П. У. П. А., Абрехт М. и Фрейзер Б. Х. Органико-минеральный интерфейс в биоминералах. Ред. Минеральное. Геохим. 59 , 157–185 (2005).
CAS Статья Google Scholar
Фон Эйв, С. и др. . Биологический контроль образования арагонита в каменистых кораллах. Наука 356 , 933–938 (2017).
ADS Статья Google Scholar
Бен Шир, И., Кабабья, С., Кац, И., Покрой, Б. и Шмидт, А. Открытые и скрытые биоминеральные границы раздела в арагонитовой оболочке Perna canaliculus, выявленные с помощью твердотельного ЯМР. Chem. Матер. 25 , 4595–4602 (2013).
Артикул Google Scholar
Структура, функции и факторы, влияющие на костные клетки
Костная ткань постоянно реконструируется за счет согласованных действий костных клеток, которые включают резорбцию кости остеокластами и формирование кости остеобластами, тогда как остеоциты действуют как механосенсоры и оркестраторы кости процесс ремоделирования. Этот процесс находится под контролем местных (например, факторы роста и цитокины) и системных (например, факторов роста и цитокинов).g., кальцитонин и эстрогены) факторы, которые в совокупности вносят вклад в гомеостаз костей. Дисбаланс между резорбцией и формированием кости может привести к заболеваниям костей, включая остеопороз. Недавно было обнаружено, что во время ремоделирования кости между костными клетками существует сложная связь. Например, связь резорбции кости с образованием кости достигается за счет взаимодействия между остеокластами и остеобластами. Более того, остеоциты продуцируют факторы, которые влияют на активность остеобластов и остеокластов, тогда как апоптоз остеоцитов сопровождается резорбцией остеокластов кости.Растущие знания о структуре и функциях костных клеток способствовали лучшему пониманию биологии костей. Было высказано предположение, что существует сложная связь между костными клетками и другими органами, что указывает на динамический характер костной ткани. В этом обзоре мы обсуждаем текущие данные о структуре и функциях костных клеток и факторах, влияющих на ремоделирование кости.
1. Введение
Кость — это минерализованная соединительная ткань, в которой представлены четыре типа клеток: остеобласты, клетки выстилки кости, остеоциты и остеокласты [1, 2].Кость выполняет важные функции в организме, такие как движение, поддержка и защита мягких тканей, хранение кальция и фосфата и укрытие костного мозга [3, 4]. Несмотря на свой инертный вид, кость представляет собой очень динамичный орган, который постоянно резорбируется остеокластами и вновь формируется остеобластами. Есть данные, что остеоциты действуют как механосенсоры и организаторы этого процесса ремоделирования кости [5–8]. Функция клеток выстилки кости не совсем ясна, но эти клетки, по-видимому, играют важную роль в соединении резорбции кости с формированием кости [9].
Ремоделирование кости — это очень сложный процесс, при котором старая кость заменяется новой, в цикле, состоящем из трех фаз: (1) инициирование резорбции кости остеокластами, (2) переход (или период обращения) от резорбции к образование новой кости и (3) образование кости остеобластами [10, 11]. Этот процесс происходит из-за скоординированных действий остеокластов, остеобластов, остеоцитов и клеток выстилки кости, которые вместе образуют временную анатомическую структуру, называемую базовой многоклеточной единицей (BMU) [12–14].
Нормальное ремоделирование кости необходимо для заживления переломов и адаптации скелета к механическому использованию, а также для гомеостаза кальция [15]. С другой стороны, дисбаланс резорбции и образования кости приводит к нескольким заболеваниям костей. Например, чрезмерная резорбция остеокластами без соответствующего количества нервно-сформированной кости остеобластами способствует потере костной массы и остеопорозу [16], тогда как наоборот может привести к остеопетрозу [17]. Таким образом, равновесие между образованием и резорбцией кости необходимо и зависит от действия нескольких местных и системных факторов, включая гормоны, цитокины, хемокины и биомеханическую стимуляцию [18–20].
Недавние исследования показали, что кость влияет на деятельность других органов, а на кость также влияют другие органы и системы тела [21], что дает новые представления и свидетельствует о сложности и динамической природе костной ткани.
В этом обзоре мы обратимся к текущим данным о биологии костных клеток, костном матриксе и факторах, влияющих на процесс ремоделирования кости. Кроме того, мы кратко обсудим роль эстрогена в костной ткани при физиологических и патологических условиях.
2. Костные клетки
2.1. Остеобласты
Остеобласты — это клетки кубовидной формы, расположенные вдоль поверхности кости, составляющие 4–6% от общего количества резидентных костных клеток, и широко известны своей функцией формирования кости [22]. Эти клетки демонстрируют морфологические характеристики клеток, синтезирующих белок, включая обильный грубый эндоплазматический ретикулум и выдающийся аппарат Гольджи, а также различные секреторные везикулы [22, 23]. Как поляризованные клетки, остеобласты секретируют остеоид в направлении костного матрикса [24] (Рисунки 1 (a), 1 (b) и 2 (a)).
Остеобласты происходят из мезенхимальных стволовых клеток (МСК). Обязательство MSC по отношению к клону остеопрогениторов требует экспрессии специфических генов после своевременных запрограммированных шагов, включая синтез костных морфогенетических белков (BMPs) и членов путей Wingless (Wnt) [25]. Экспрессия связанных с Runt факторов транскрипции 2, Distal-less homeobox 5 (Dlx5) и osterix (Osx) является критическим для дифференцировки остеобластов [22, 26]. Кроме того, Runx2 является главным геном дифференцировки остеобластов, о чем свидетельствует тот факт, что Runx2-нулевые мыши лишены остеобластов [26, 27]. Runx2 продемонстрировал активацию генов, связанных с остеобластами, таких как ColIA1 , ALP , BSP , BGLAP и OCN [28].
Когда во время дифференцировки остеобластов образуется пул предшественников остеобластов, экспрессирующих Runx2 и ColIA1 , наступает фаза пролиферации. На этой фазе предшественники остеобластов проявляют активность щелочной фосфатазы (ЩФ) и считаются преостеобластами [22].Переход преостеобластов в зрелые остеобласты характеризуется увеличением экспрессии Osx и секреции белков костного матрикса, таких как остеокальцин (OCN), костный сиалопротеин (BSP) I / II и коллаген I типа. претерпевают морфологические изменения, становясь крупными и кубовидными клетками [26, 29–31].
Имеются доказательства, что др. Факторы, такие как фактор роста фибробластов (FGF), микроРНК и коннексин 43, играют важную роль в дифференцировке остеобластов [32–35].Мыши с нокаутом FGF-2 показали снижение костной массы, связанное с увеличением адипоцитов в костном мозге, что указывает на участие FGF в дифференцировке остеобластов [34]. Также было продемонстрировано, что FGF-18 активирует дифференцировку остеобластов по аутокринному механизму [36]. МикроРНК участвуют в регуляции экспрессии генов во многих типах клеток, включая остеобласты, в которых одни микроРНК стимулируют, а другие ингибируют дифференцировку остеобластов [37, 38]. Коннексин 43, как известно, является основным коннексином в кости [35].Мутация в гене, кодирующем коннексин 43, нарушает дифференцировку остеобластов и вызывает пороки развития скелета у мышей [39].
Синтез костного матрикса остеобластами происходит в два основных этапа: отложение органического матрикса и его последующая минерализация (Рисунки 1 (b) –1 (d)). На первом этапе остеобласты секретируют белки коллагена, в основном коллаген I типа, неколлагеновые белки (OCN, остеонектин, BSP II и остеопонтин) и протеогликан, включая декорин и бигликан, которые образуют органический матрикс.После этого минерализация костного матрикса проходит в две фазы: везикулярную и фибриллярную фазы [40, 41]. Везикулярная фаза возникает, когда части с переменным диаметром в диапазоне от 30 до 200 нм, называемые везикулами матрикса, высвобождаются из домена апикальной мембраны остеобластов во вновь образованный костный матрикс, в котором они связываются с протеогликанами и другими органическими компонентами. Из-за своего отрицательного заряда сульфатированные протеогликаны иммобилизуют ионы кальция, которые хранятся в везикулах матрикса [41, 42].Когда остеобласты секретируют ферменты, разрушающие протеогликаны, ионы кальция высвобождаются из протеогликанов и пересекают кальциевые каналы, представленные в мембране матричных везикул. Эти каналы образованы белками, называемыми аннексинами [40].
С другой стороны, фосфатсодержащие соединения расщепляются ALP, секретируемой остеобластами, высвобождая ионы фосфата внутри везикул матрикса. Затем ионы фосфата и кальция внутри пузырьков зарождаются, образуя кристаллы гидроксиапатита [43].Фибриллярная фаза возникает, когда перенасыщение ионов кальция и фосфата внутри матричных везикул приводит к разрыву этих структур и кристаллы гидроксиапатита распространяются на окружающую матрицу [44, 45].
Зрелые остеобласты выглядят как единственный слой кубовидных клеток, содержащих обильный грубый эндоплазматический ретикулум и большой комплекс Гольджи (Рисунки 2 (а) и 3 (а)). Некоторые из этих остеобластов демонстрируют цитоплазматические отростки в направлении костного матрикса и достигают отростков остеоцитов [46].На этой стадии зрелые остеобласты могут подвергнуться апоптозу или стать остеоцитами или клетками выстилки кости [47, 48]. Интересно, что внутри вакуолей остеобластов наблюдались круглые / яйцевидные структуры, содержащие плотные тела и TUNEL-положительные структуры. Эти данные предполагают, что помимо профессиональных фагоцитов, остеобласты также способны поглощать и разрушать апоптотические тела во время формирования альвеолярной кости [49].
2.2. Клетки выстилки костей
Клетки выстилки костей представляют собой покоящиеся остеобласты плоской формы, которые покрывают костные поверхности, где не происходит ни резорбции кости, ни образования кости [50].Эти клетки имеют тонкий и плоский профиль ядра; его цитоплазма простирается вдоль поверхности кости и отображает несколько цитоплазматических органелл, таких как профили шероховатого эндоплазматического ретикулума и аппарата Гольджи [50] (Рисунок 2 (b)). Некоторые из этих клеток обнаруживают отростки, простирающиеся в канальцы, а также наблюдаются щелевые соединения между соседними клетками выстилки кости и между этими клетками и остеоцитами [50, 51].
Секреторная активность клеток выстилки костей зависит от физиологического статуса костей, в результате чего эти клетки могут повторно приобретать свою секреторную активность, увеличивая свой размер и принимая кубовидную форму [52].Функции клеток выстилки костной ткани до конца не изучены, но было показано, что эти клетки предотвращают прямое взаимодействие между остеокластами и костным матриксом, когда резорбция кости не должна происходить, а также участвуют в дифференцировке остеокластов, продуцируя остеопротегерин (OPG) и активатор рецептора. лиганда ядерного фактора каппа-B (RANKL) [14, 53]. Более того, клетки выстилки кости вместе с другими костными клетками являются важным компонентом BMU, анатомической структуры, которая присутствует во время цикла ремоделирования кости [9].
2.3. Остеоциты
Остеоциты, которые составляют 90–95% всех костных клеток, являются наиболее многочисленными и долгоживущими клетками с продолжительностью жизни до 25 лет [54]. В отличие от остеобластов и остеокластов, которые были определены их соответствующими функциями во время образования кости и резорбции кости, остеоциты ранее определялись по их морфологии и расположению. В течение десятилетий из-за трудностей с выделением остеоцитов из костного матрикса приводилось ошибочное представление о том, что эти клетки будут пассивными клетками, а их функции неверно интерпретировались [55].Развитие новых технологий, таких как идентификация специфичных для остеоцитов маркеров, новые модели на животных, разработка методов выделения и культивирования костных клеток, а также создание фенотипически стабильных клеточных линий, привело к улучшению понимания биологии остеоцитов. Фактически, было признано, что эти клетки выполняют множество важных функций в кости [8].
Остеоциты расположены в лакунах, окруженных минерализованным костным матриксом, при этом они имеют дендритную морфологию [15, 55, 56] (Рисунки 3 (a) –3 (d)).Морфология внедренных остеоцитов различается в зависимости от типа кости. Например, остеоциты губчатой кости более округлые, чем остеоциты кортикальной кости, которые имеют удлиненную морфологию [57].
Остеоциты происходят от линии МСК посредством дифференцировки остеобластов. В этом процессе были предложены четыре распознаваемых стадии: остеоид-остеоцит, преостеоцит, молодой остеоцит и зрелый остеоцит [54]. В конце цикла формирования кости субпопуляция остеобластов становится остеоцитами, включенными в костный матрикс.Этот процесс сопровождается заметными морфологическими и ультраструктурными изменениями, включая уменьшение размеров круглых остеобластов. Количество органелл, таких как шероховатый эндоплазматический ретикулум и аппарат Гольджи, уменьшается, а соотношение ядра и цитоплазмы увеличивается, что соответствует снижению синтеза и секреции белка [58].
Во время перехода остеобласт / остеоцит цитоплазматический процесс начинает проявляться до того, как остеоциты будут заключены в костный матрикс [22].Механизмы, участвующие в развитии цитоплазматических процессов остеоцитов, до конца не изучены. Однако белок E11 / gp38, также называемый подопланином, может играть важную роль. E11 / gp38 высоко экспрессируется во встроенных или недавно встроенных остеоцитах, подобно другим типам клеток с дендритной морфологией, таким как подоциты, альвеолярные клетки легких типа II и клетки сосудистого сплетения [59]. Было высказано предположение, что E11 / gp38 использует энергию активности GTPase для взаимодействия с компонентами цитоскелета и молекулами, участвующими в подвижности клеток, посредством чего регулирует динамику актинового цитоскелета [60, 61].Соответственно, ингибирование экспрессии E11 / gp38 в остеоцитоподобных клетках MLO-Y4, как было показано, блокирует удлинение дендритов, подтверждая, что E11 / gp38 участвует в образовании дендритов в остеоцитах [59].
По завершении стадии зрелого остеоцита, полностью заключенного в минерализованный костный матрикс, происходит подавление экспрессии некоторых ранее экспрессированных маркеров остеобластов, таких как OCN, BSPII, коллаген типа I и ЩФ. С другой стороны, маркеры остеоцитов, включая белок 1 дентинового матрикса (DMP1) и склеростин, высоко экспрессируются [8, 62–64].
В то время как тело клетки остеоцита расположено внутри лакуны, его цитоплазматические отростки (до 50 на каждую клетку) пересекают крошечные туннели, берущие начало в пространстве лакуны, называемые canaliculi, образуя лакуноканаликулярную систему остеоцитов [65] (Рисунки 3 (b)) –3 (г)). Эти цитоплазматические процессы связаны с другими процессами соседних остеоцитов щелевыми соединениями, а также с цитоплазматическими процессами остеобластов и выстилающих кость клеток на поверхности кости, облегчая межклеточный транспорт малых сигнальных молекул, таких как простагландины и оксид азота, между этими клетками [66 ].Кроме того, лакуно-каналическая система остеоцитов находится в непосредственной близости от сосудов, через которые кислород и питательные вещества попадают в остеоциты [15].
Было подсчитано, что поверхность остеоцитов в 400 раз больше, чем у всех систем Гаверса и Фолькмана, и более чем в 100 раз больше, чем поверхность губчатой кости [67, 68]. Связь между клетками также обеспечивается интерстициальной жидкостью, которая течет между отростками остеоцитов и канальцами [68]. С помощью лакуно-канальцевой системы (Рис. 3 (b)) остеоциты действуют как механосенсоры, поскольку их взаимосвязанная сеть обладает способностью обнаруживать механическое давление и нагрузки, тем самым помогая адаптации кости к ежедневным механическим силам [55].Таким образом, остеоциты, по-видимому, действуют как организаторы ремоделирования кости, регулируя активность остеобластов и остеокластов [15, 69]. Более того, апоптоз остеоцитов был признан хемотаксическим сигналом к резорбции костной ткани остеокластами [70–73]. В соответствии с этим было показано, что во время резорбции кости апоптотические остеоциты поглощаются остеокластами [74–76].
Механическая чувствительность остеоцитов достигается благодаря стратегическому расположению этих клеток в костном матриксе.Таким образом, форма и пространственное расположение остеоцитов согласуются с их функциями восприятия и передачи сигналов, способствуя преобразованию механических стимулов в биохимические сигналы, явление, которое называется пьезоэлектрическим эффектом [77]. Механизмы и компоненты, с помощью которых остеоциты преобразуют механические стимулы в биохимические сигналы, не очень хорошо известны. Однако было предложено два механизма. Один из них заключается в том, что существует белковый комплекс, образованный ресничками и ассоциированными с ней белками PolyCystins 1 и 2, который, как полагают, является критическим для механочувствительности остеоцитов и для опосредованного остеобластами / остеоцитами образования кости [78].Второй механизм включает компоненты цитоскелета остеоцитов, включая белковый комплекс фокальной адгезии и его множественные актин-ассоциированные белки, такие как паксиллин, винкулин, талин и циксин [79]. При механической стимуляции остеоциты производят несколько вторичных мессенджеров, например, АТФ, оксид азота (NO), Ca 2+ и простагландины (PGE 2 и PGI 2 ), которые влияют на физиологию костей [8, 80] . Независимо от задействованного механизма, важно отметить, что механочувствительная функция остеоцитов возможна благодаря сложной канальцевой сети, которая обеспечивает связь между костными клетками.
2.4. Остеокласты
Остеокласты — это терминально дифференцированные многоядерные клетки (Рисунки 4 (a) –4 (d)), которые происходят из мононуклеарных клеток линии гемопоэтических стволовых клеток под влиянием нескольких факторов. В число этих факторов входят макрофагальный колониестимулирующий фактор (M-CSF), секретируемый мезенхимальными клетками и остеобластами остеопрогениторов [81], и лиганд RANK, секретируемый остеобластами, остеоцитами и стромальными клетками [20]. Вместе эти факторы способствуют активации факторов транскрипции [81, 82] и экспрессии генов в остеокластах [83, 84].
M-CSF связывается со своим рецептором (cFMS), присутствующим в предшественниках остеокластов, что стимулирует их пролиферацию и ингибирует их апоптоз [82, 85]. RANKL является решающим фактором остеокластогенеза и экспрессируется остеобластами, остеоцитами и стромальными клетками. Когда он связывается со своим рецептором RANK в предшественниках остеокластов, индуцируется образование остеокластов [86]. С другой стороны, другой фактор, называемый остеопротегерином (OPG), который продуцируется широким спектром клеток, включая остеобласты, стромальные клетки, фибробласты десен и пародонта [87–89], связывается с RANKL, предотвращая взаимодействие RANK / RANKL и , следовательно, ингибирование остеокластогенеза [87] (Рисунок 5).Таким образом, система RANKL / RANK / OPG является ключевым медиатором остеокластогенеза [19, 86, 89].
Взаимодействие RANKL / RANK также способствует экспрессии других остеокластогенных факторов, таких как NFATc1 и DC-STAMP. Взаимодействуя с факторами транскрипции PU.1, cFos и MITF, NFATc1 регулирует гены, специфичные для остеокластов, включая TRAP и катепсин K , которые имеют решающее значение для активности остеокластов [90]. Под влиянием взаимодействия RANKL / RANK, NFATc1 также индуцирует экспрессию DC-STAMP, которая имеет решающее значение для слияния предшественников остеокластов [91, 92].
Несмотря на то, что эти остеокластогенные факторы были хорошо определены, недавно было продемонстрировано, что остеокластогенный потенциал может различаться в зависимости от рассматриваемого участка кости. Сообщалось, что остеокласты из длинного костного мозга формируются быстрее, чем в челюсти. Эта другая динамика остеокластогенеза, возможно, может быть связана с клеточным составом костного мозга, специфичным для костной ткани [93].
Во время ремоделирования кости остеокласты поляризуются; затем можно наблюдать четыре типа мембранных доменов остеокластов: зону уплотнения и волнистую границу, которые находятся в контакте с костным матриксом (рисунки 4 (b) и 4 (d)), а также базолатеральные и функциональные секреторные домены, которые не контактируют с костным матриксом [94, 95].Поляризация остеокластов во время резорбции кости включает перестройку актинового цитоскелета, в которой образуется кольцо F-актина, которое включает плотную непрерывную зону высокодинамичных подосом, и, следовательно, область мембраны, которая развивается в взъерошенную границу, изолирована. Важно отметить, что эти домены образуются только тогда, когда остеокласты находятся в контакте с внеклеточным минерализованным матриксом, в процессе, в котором -интегрин, а также CD44, опосредуют прикрепление подосом остеокластов к поверхности кости [96–99] .Ультраструктурно волнистая граница представляет собой мембранный домен, образованный микроворсинками, который изолирован от окружающей ткани прозрачной зоной, также известной как зона уплотнения. Светлая зона — это область, лишенная органелл, расположенная на периферии остеокласта рядом с костным матриксом [98]. Эта зона запечатывания образована актиновым кольцом и несколькими другими белками, включая актин, талин, винкулин, паксиллин, тензин и связанные с актином белки, такие как α -актинин, фимбрин, гельсолин и динамин [95].-Интегрин связывается с неколлагеновым костным матриксом, содержащим последовательность -RGD, такую как костный сиалопротеин, остеопонтин и витронектин, создавая периферическое уплотнение, ограничивающее центральную область, где расположена взъерошенная граница [98] (Рисунки 4 (b) -4 ( г)).
Поддержание взъерошенной границы также важно для активности остеокластов; эта структура формируется за счет интенсивного движения лизосомальных и эндосомных компонентов. В волнистой кайме находится H + -АТФаза вакуолярного типа (V-АТФаза), которая помогает подкислять лакуну резорбции и, следовательно, способствует растворению кристаллов гидроксиапатита [20, 100, 101].В этой области протоны и ферменты, такие как тартрат-устойчивая кислая фосфатаза (TRAP), катепсин K и матриксная металлопротеиназа-9 (MMP-9), транспортируются в отсек, называемый лакуной Howship, что приводит к деградации кости [94, 101–104 ] (Рисунок 5). Продукты этой деградации затем подвергаются эндоцитозу через взъерошенную границу и трансцитируются в функциональный секреторный домен на плазматической мембране [7, 95].
Аномальное увеличение образования и активности остеокластов приводит к некоторым заболеваниям костей, таким как остеопороз, когда резорбция превышает образование, вызывая снижение плотности костей и увеличение числа переломов костей [105].При некоторых патологических состояниях, включая метастазы в кости и воспалительный артрит, аномальная активация остеокластов приводит к околосуставным эрозиям и болезненным остеолитическим повреждениям соответственно [83, 105, 106]. При пародонтите заболевание пародонта, вызванное размножением бактерий [107, 108], вызывает миграцию воспалительных клеток. Эти клетки продуцируют химические медиаторы, такие как IL-6 и RANKL, которые стимулируют миграцию остеокластов [89, 109, 110]. В результате в альвеолярной кости происходит аномальное усиление резорбции костной ткани, что способствует потере прикрепления зубов и прогрессированию пародонтита [89, 111].
С другой стороны, при остеопетрозе, который является редким заболеванием костей, генетические мутации, влияющие на функции образования и резорбции остеокластов, приводят к снижению резорбции кости, что приводит к непропорциональному накоплению костной массы [17]. Эти заболевания демонстрируют важность нормального процесса ремоделирования кости для поддержания гомеостаза кости.
Кроме того, есть свидетельства того, что остеокласты выполняют несколько других функций. Например, было показано, что остеокласты продуцируют факторы, называемые кластокинами, которые контролируют остеобласты во время цикла ремоделирования кости, который будет обсуждаться ниже.Другие недавние данные свидетельствуют о том, что остеокласты также могут напрямую регулировать нишу гемопоэтических стволовых клеток [112]. Эти данные указывают на то, что остеокласты являются не только клетками, резорбирующими кости, но также источником цитокинов, влияющих на активность других клеток.
2,5. Внеклеточный костный матрикс
Кость состоит из неорганических солей и органического матрикса [113]. Органический матрикс содержит коллагеновые белки (90%), преимущественно коллаген I типа и неколлагеновые белки, включая остеокальцин, остеонектин, остеопонтин, фибронектин и костный сиалопротеин II, костные морфогенетические белки (BMP) и факторы роста [114].Существуют также небольшие протеогликаны, богатые лейцином, включая декорин, бигликан, люмикан, остеоадерин и сериновые белки [114–116].
Неорганический костный материал состоит преимущественно из ионов фосфата и кальция; однако также присутствуют значительные количества бикарбоната, натрия, калия, цитрата, магния, карбоната, флюорита, цинка, бария и стронция [1, 2]. Ионы кальция и фосфата образуют зародыши с образованием кристаллов гидроксиапатита, которые представлены химической формулой Ca 10 (PO 4 ) 6 (OH) 2 .Вместе с коллагеном неколлагеновые матричные белки образуют каркас для отложения гидроксиапатита, и такая ассоциация отвечает за типичную жесткость и сопротивление костной ткани [4].
Костный матрикс представляет собой сложный и организованный каркас, который обеспечивает механическую поддержку и играет важную роль в гомеостазе кости. Костный матрикс может высвобождать несколько молекул, которые мешают активности костных клеток и, следовательно, участвует в ремоделировании кости [117].Поскольку одной только потери костной массы недостаточно, чтобы вызвать переломы костей [118], предполагается, что другие факторы, включая изменения белков костного матрикса и их модификации, имеют решающее значение для понимания и прогнозирования переломов костей [119]. Фактически, известно, что коллаген играет решающую роль в структуре и функции костной ткани [120].
Соответственно, было продемонстрировано, что существует вариация в концентрации белков костного матрикса с возрастом, питанием, заболеванием и лечением антиостеопоротическими средствами [119, 121, 122], что может способствовать деформации после растяжения и переломам кости [119] .Например, in vivo и in vitro исследования сообщили, что увеличение синтеза гиалуроновой кислоты после лечения паратироидным гормоном (ПТГ) было связано с последующей резорбцией кости [123–127], что указывает на возможную связь между синтезом гиалуроновой кислоты и повышение активности остеокластов.
2.6. Взаимодействие между костными клетками и костным матриксом
Как обсуждалось ранее, костный матрикс не только обеспечивает поддержку костных клеток, но также играет ключевую роль в регулировании активности костных клеток посредством нескольких молекул адгезии [117, 128].Интегрины являются наиболее распространенными молекулами адгезии, участвующими во взаимодействии между костными клетками и костным матриксом [129]. Остеобласты взаимодействуют с костным матриксом с помощью интегринов, которые распознают и связываются с RGD и другими последовательностями, присутствующими в белках костного матрикса, включая остеопонтин, фибронектин, коллаген, остеопонтин и костный сиалопротеин [130, 131]. Наиболее частыми интегринами, присутствующими в остеобластах, являются, и [132]. Эти белки также играют важную роль в организации остеобластов на поверхности кости во время синтеза остеоидов [129].
С другой стороны, взаимодействие между остеокластами и костным матриксом важно для функции остеокластов, поскольку, как упоминалось ранее, резорбция кости происходит только тогда, когда остеокласты связываются с минерализованной поверхностью кости [97]. Таким образом, во время резорбции кости остеокласты экспрессируют интегрины и взаимодействуют с внеклеточным матриксом, в котором первые связываются с обогащенными костями RGD-содержащими белками, такими как костный сиалопротеин и остеопонтин, тогда как интегрины связываются с фибриллами коллагена [133, 134].Несмотря на эти связывания, остеокласты обладают высокой подвижностью, даже при активной резорбции, и, как мигрирующие клетки, остеокласты не экспрессируют кадгерины. Однако было продемонстрировано, что кадгерины обеспечивают тесный контакт между предшественниками остеокластов и стромальными клетками, которые экспрессируют важные факторы роста для дифференцировки остеокластов [135].
Интегрины играют посредническую роль во взаимодействиях остеоцитов с костным матриксом. Эти взаимодействия важны для механочувствительной функции этих клеток, посредством чего сигналы, индуцированные деформацией ткани, генерируются и усиливаются [136].До сих пор не ясно, какие интегрины участвуют, но было высказано предположение, что интегрины и интегрины участвуют во взаимодействии остеоцитов с костным матриксом [137, 138]. Эти взаимодействия происходят между телом остеоцитов и костным матриксом стенки лакуны, а также между стенкой канальца с отростками остеоцитов [137].
Только узкое перицеллюлярное пространство, заполненное жидкостью, отделяет тело клетки остеоцита и отростки от минерализованного костного матрикса [58]. Расстояние между телом клетки остеоцита и лакунарной стенкой составляет примерно 0.5–1,0 мкм шириной м, тогда как расстояние между мембранами отростков остеоцитов и стенкой канальца колеблется от 50 до 100 нм [139]. Химический состав перицеллюлярной жидкости точно не определен. Однако присутствует разнообразный набор макромолекул, продуцируемых остеоцитами, таких как остеопонтин, остеокальцин, белок матрикса дентина, протеогликаны и гиалуроновая кислота [136, 140, 141].
Остеоциты и их отростки окружены неорганизованным перицеллюлярным матриксом; внутри канальцевой сети наблюдались тонкие фиброзные связи, названные «тросами» [139].Было высказано предположение, что одним из возможных соединений этих связок является перлекан [141]. Отростки остеоцитов также могут прикрепляться непосредственно к «бугоркам», которые представляют собой выступающие структуры, исходящие из стенок канальцев. Эти структуры образуют тесные контакты, возможно, посредством -интегринов, с мембраной отростков остеоцитов [137, 142]. Таким образом, эти структуры, по-видимому, играют ключевую роль в механочувствительной функции остеоцитов, воспринимая движения потока жидкости вместе с перицеллюлярным пространством, вызванные силами механической нагрузки [143].Кроме того, движение потока жидкости также важно для двунаправленного транспорта растворенных веществ в перицеллюлярном пространстве, который влияет на сигнальные пути остеоцитов и связь между костными клетками [144, 145].
2.7. Локальный и системный фактор, регулирующий гомеостаз кости
Ремоделирование кости — это очень сложный цикл, который достигается согласованными действиями остеобластов, остеоцитов, остеокластов и клеток выстилки кости [3]. Формирование, пролиферация, дифференцировка и активность этих клеток контролируются местными и системными факторами [18, 19].К местным факторам относятся аутокринные и паракринные молекулы, такие как факторы роста, цитокины и простагландины, продуцируемые костными клетками, помимо факторов костного матрикса, которые высвобождаются во время резорбции кости [46, 146]. Системные факторы, которые важны для поддержания гомеостаза костей, включают паратироидный гормон (ПТГ), кальцитонин, 1,25-дигидроксивитамин D 3 (кальцитриол), глюкокортикоиды, андрогены и эстрогены [16, 147–150]. Сообщается, что, как и PTH, родственный PTH белок (PTHrP), который также связывается с рецептором PTH, влияет на ремоделирование кости [147].
Эстроген играет решающую роль в гомеостазе костной ткани; снижение уровня эстрогенов в период менопаузы является основной причиной потери костной массы и остеопороза [16]. Механизмы действия эстрогена на костную ткань до конца не изучены. Тем не менее, несколько исследований показали, что эстроген поддерживает гомеостаз костей, ингибируя апоптоз остеобластов и остеоцитов [151–153] и предотвращая чрезмерную резорбцию кости. Эстроген подавляет образование и активность остеокластов, а также вызывает апоптоз остеокластов [16, 76, 104, 154].Было высказано предположение, что эстроген снижает образование остеокластов за счет ингибирования синтеза остеокластогенного цитокина RANKL остеобластами и остеоцитами. Более того, эстроген стимулирует эти костные клетки продуцировать остеопротегерин (OPG), рецептор-ловушку RANK в остеокласте, тем самым подавляя остеокластогенез [19, 155–159]. Кроме того, эстроген подавляет образование остеокластов за счет снижения уровней других остеокластогенных цитокинов, таких как IL-1, IL-6, IL-11, TNF- α , TNF- β и M-CSF [160, 161] .
Эстроген действует непосредственно на костные клетки посредством своих рецепторов эстрогена α и β , присутствующих на этих клетках [162]. Более того, было показано, что остеокласты являются прямой мишенью для эстрогена [163, 164]. Соответственно, иммуноэкспрессия рецептора эстрогена β была продемонстрирована в клетках альвеолярной кости самок крыс, получавших эстрадиол. Более того, усиленная иммуноэкспрессия, наблюдаемая в TUNEL-положительных остеокластах, указывает на то, что эстроген участвует в контроле продолжительности жизни остеокластов непосредственно с помощью рецепторов эстрогена [163].Эти данные демонстрируют важность эстрогена для поддержания гомеостаза костей.
2,8. Процесс ремоделирования кости
Цикл ремоделирования кости происходит в костных полостях, которые необходимо реконструировать [165]. В этих полостях образуются временные анатомические структуры, называемые базовыми многоклеточными единицами (BMU), которые состоят из группы остеокластов впереди, образующих режущий конус, и группы остеобластов позади, образующих замыкающий конус, связанных с кровеносными сосудами и кровеносными сосудами. периферическая иннервация [11, 166].Было высказано предположение, что BMU покрыт покровом клеток (возможно, выстилающими костями клетками), которые формируют компартмент ремоделирования кости (BRC) [13]. BRC, по-видимому, связан с клетками выстилки кости на поверхности кости, которые, в свою очередь, сообщаются с остеоцитами, заключенными в костном матриксе [13, 14].
Цикл ремоделирования кости начинается с фазы инициации, которая состоит из резорбции кости остеокластами, за которой следует фаза образования кости остеобластами, но между этими двумя фазами существует переходная (или обратная) фаза.Цикл завершается скоординированными действиями остеоцитов и клеток выстилки кости [10, 11]. В фазе инициации под действием остеокластогенных факторов, включая RANKL и M-CSF, гемопоэтические стволовые клетки рекрутируются в определенные участки поверхности кости и дифференцируются в зрелые остеокласты, которые инициируют резорбцию кости [167, 168].
Известно, что во время цикла ремоделирования кости существуют прямые и непрямые связи между костными клетками в процессе, называемом механизмом сцепления, который включает растворимые факторы сцепления, хранящиеся в костном матриксе, которые будут высвобождаться после резорбции кости остеокластами [169].Например, такие факторы, как инсулиноподобные факторы роста (IGF), трансформирующий фактор роста β (TGF- β ), BMP, FGF и фактор роста тромбоцитов (PDGF), по-видимому, действуют как факторы связывания, поскольку они хранятся в костном матриксе и высвобождаются во время резорбции кости [170]. Эта идея подтверждается генетическими исследованиями на людях и мышах, а также фармакологическими исследованиями [105, 171].
Недавно было высказано предположение, что другая категория молекул, называемых семафоринами, участвует в коммуникации костных клеток во время ремоделирования кости [146].На начальном этапе необходимо подавить дифференцировку и активность остеобластов, чтобы полностью удалить поврежденную или старую кость. Остеокласты экспрессируют фактор, называемый семафорин4D (Sema4D), который ингибирует образование кости во время резорбции кости [172]. Семафорины включают большое семейство гликопротеинов, которые не только связаны с мембраной, но также существуют в виде растворимых форм, которые обнаруживаются в широком диапазоне тканей и, как было показано, участвуют в различных биологических процессах, таких как иммунный ответ, органогенез, развитие сердечно-сосудистой системы и опухоли. прогрессия [172, 173].В костях было высказано предположение, что семафорины также участвуют в межклеточной коммуникации между остеокластами и остеобластами во время цикла ремоделирования кости [174–176].
Sema4D, экспрессируемый в остеокластах, связывается со своим рецептором (Plexin-B1), присутствующим в остеобластах, и ингибирует путь IGF-1, необходимый для дифференцировки остеобластов [172], что указывает на то, что остеокласты подавляют образование костей, экспрессируя Sema4D. Напротив, другой член семейства семафоринов (Sema3A) был обнаружен в остеобластах и считается ингибитором остеокластогенеза [177].Таким образом, во время цикла ремоделирования кости остеокласты ингибируют образование кости, экспрессируя Sema4D, чтобы инициировать резорбцию кости, тогда как остеобласты экспрессируют Sema3A, который подавляет резорбцию кости, до образования кости [146] (Рис. 5).
Недавние исследования также предполагают существование других факторов, участвующих в механизме сцепления во время цикла ремоделирования кости. Одним из этих факторов является эфринB2, мембраносвязанная молекула, экспрессирующаяся в зрелых остеокластах, которая связывается с эфриномB4, обнаруженным в плазматической мембране остеобластов.Связывание ephrinB2 / ephrinB4 передает двунаправленные сигналы, которые способствуют дифференцировке остеобластов, тогда как обратная передача сигналов (ephrinB4 / ephrinB2) ингибирует остеокластогенез [178] (Рисунок 5). Эти находки предполагают, что путь ephrinB2 / ephrinB4 может быть вовлечен в прекращение резорбции кости и индуцирует дифференцировку остеобластов в переходной фазе [178].
Кроме того, было показано, что эфринB2 также экспрессируется в остеобластах [179]. Более того, зрелые остеокласты секретируют ряд факторов, которые стимулируют дифференцировку остеобластов, таких как секретируемые сигнальные молекулы Wnt10b, BMP6 и сигнальный сфинголипид, сфингозин-1-фосфат [180].Эти находки указывают на очень сложный механизм эфринов и участие других факторов в коммуникации остеокластов / остеобластов во время цикла ремоделирования кости. С другой стороны, несмотря на исследования, в которых сообщается об участии семафоринов и эфринов в коммуникации остеокластов / остеобластов, прямой контакт между зрелыми остеобластами и остеокластами не был продемонстрирован in vivo и до сих пор остается спорным.
Помимо остеокластов и остеобластов, было продемонстрировано, что остеоциты играют ключевую роль во время цикла ремоделирования кости [8].Фактически, под влиянием нескольких факторов остеоциты действуют как организаторы процесса ремоделирования кости, производя факторы, которые влияют на активность остеобластов и остеокластов [55] (Рисунок 5). Например, механическая нагрузка стимулирует остеоциты производить факторы, которые оказывают анаболическое действие на кость, такие как PGE 2 , простациклин (PGI 2 ), NO и IGF-1 [181–184]. С другой стороны, механическая разгрузка подавляет анаболические факторы и стимулирует остеоциты продуцировать склеростин и DKK-1, которые являются ингибиторами активности остеобластов [185–188], а также специфических факторов, стимулирующих местный остеокластогенез [189].Склеростин является продуктом гена SOST и, как известно, является негативным регулятором образования кости, подавляя в остеобластах действие Lrp5, ключевого рецептора сигнального пути Wnt / β -катенин [63].
Апоптоз остеоцитов, как было показано, действует как хемотаксический сигнал для локального рекрутирования остеокластов [70, 150, 152, 190, 191]. Соответственно, сообщалось, что остеокласты поглощают апоптотические остеоциты [74, 75, 192], предполагая, что остеокласты способны удалять умирающие остеоциты и / или остеобласты из сайта ремоделирования (Рисунки 4 (c) и 4 (d)).Более того, сообщается, что остеокластогенные факторы также продуцируются жизнеспособными остеоцитами рядом с умирающими остеоцитами [193]. Имеются данные о том, что остеоциты действуют как основной источник RANKL, способствуя остеокластогенезу [167, 168], хотя было продемонстрировано, что этот фактор также продуцируется другими типами клеток, такими как стромальные клетки [194], остеобласты и фибробласты [88, 89].
Таким образом, все еще остается неясным, какие именно факторы, стимулирующие остеокластогенез, продуцируются остеоцитами.Недавние обзоры сосредоточены на некоторых молекулах, которые могут быть кандидатами на передачу сигналов между апоптозом остеоцитов и остеокластогенезом [72, 73]. Например, в костях, подвергнутых усталостной нагрузке, жизнеспособные остеоциты вблизи апоптотических, помимо высокого отношения RANKL / OPG, экспрессируют повышенные уровни фактора роста эндотелия сосудов (VEGF) и хемоаттрактантного протеина-1 моноцитов (CCL2), способствуя усилению местного остеокластогенеза. [194, 195]. Было высказано предположение, что остеоциты действуют как основной источник RANKL, способствуя остеокластогенезу [166, 167].Кроме того, увеличение отношения RANKL / OPG, экспрессируемого остеоцитами, также наблюдалось у крыс с дефицитом коннексина 43, что позволяет предположить, что нарушение межклеточной коммуникации между остеоцитами может индуцировать высвобождение местных проостеокластогенных цитокинов [33, 196, 197] . Белок-бокс группы с высокой подвижностью 1 (HMGB1) [198–200] и M-CSF [201], как предполагается, также продуцируются остеоцитами, которые стимулируют рекрутирование остеокластов во время ремоделирования кости [72, 73]. Таким образом, для решения этой проблемы необходимы дальнейшие исследования.
2.9. Эндокринные функции костной ткани
Классические функции костной ткани, помимо передвижения, включают поддержку и защиту мягких тканей, накопление кальция и фосфатов и укрытие костного мозга. Кроме того, недавние исследования были сосредоточены на эндокринных функциях костей, которые могут влиять на другие органы [202]. Например, было показано, что остеокальцин, продуцируемый остеобластами, действует на другие органы [203]. Остеокальцин можно найти в двух разных формах: карбоксилированном и недкарбоксилированном.Карбоксилированная форма имеет высокое сродство к кристаллам гидроксиапатита, оставаясь в костном матриксе во время его минерализации. Андеркарбоксилированная форма проявляет более низкое сродство к минералам из-за подкисления костного матрикса во время резорбции костной ткани остеокластами, а затем она транспортируется кровотоком, достигая других органов [204, 205]. Было показано, что недокарбоксилированный остеокальцин оказывает некоторое действие на поджелудочную железу, жировую ткань, яички и нервную систему. В поджелудочной железе остеокальцин действует как положительный регулятор секреции и чувствительности инсулина поджелудочной железы, а также пролиферации β -клеток поджелудочной железы [110].В жировой ткани остеокальцин стимулирует экспрессию гена адипонектина, что, в свою очередь, увеличивает чувствительность к инсулину [204]. В яичках остеокальцин может связываться со специфическим рецептором в клетках Лейдига и усиливать синтез тестостерона и, следовательно, увеличивать фертильность [206]. Остеокальцин также стимулирует синтез моноаминовых нейромедиаторов в гиппокампе и ингибирует синтез гамма-аминомасляной кислоты (ГАМК), улучшая обучаемость и навыки памяти [207].
Остеоциты обеспечивают еще одну эндокринную функцию костной ткани.Эти клетки способны регулировать метаболизм фосфатов за счет продукции FGF23, который действует на другие органы, включая паращитовидную железу и почки, снижая уровень циркулирующих фосфатов [208, 209]. Остеоциты также действуют на иммунную систему, изменяя микроокружение в первичных лимфоидных органах и тем самым влияя на лимфопоэз [210]. Известно, что активность не только остеоцитов, но также остеобластов и остеокластов влияет на иммунную систему, в основном при воспалительном разрушении костей.Действительно, открытие коммуникативного взаимодействия между скелетной и иммунной системами привело к появлению новой области исследований, называемой остеоиммунологией [211].
3. Выводы
Знание структурной, молекулярной и функциональной биологии кости имеет важное значение для лучшего понимания этой ткани как многоклеточной единицы и динамической структуры, которая также может действовать как эндокринная ткань, функция все еще плохо понял. In vitro и in vivo Исследования продемонстрировали, что костные клетки реагируют на различные факторы и молекулы, что способствует лучшему пониманию пластичности костных клеток.Кроме того, взаимодействия костных клеток, зависимые от интегринов матрикса, необходимы для образования и резорбции кости. Исследования обращали внимание на важность лакуноканаликулярной системы и перицеллюлярной жидкости, с помощью которой остеоциты действуют как механосенсоры, для адаптации кости к механическим силам. Гормоны, цитокины и факторы, регулирующие активность костных клеток, такие как склеростин, эфринB2 и семафоринг, играют значительную роль в гистофизиологии кости в нормальных и патологических условиях.Таким образом, такое более глубокое понимание динамической природы костной ткани, безусловно, поможет управлять новыми терапевтическими подходами к заболеваниям костей.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Благодарности
Это исследование было поддержано Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP-2010 / 10391-9; 2012 / 19428-8 и 2012 / 22666-8), Conselho Nacional de Desenvolvimento Cientnífico ecientnífico ecientnífico (CNPq) и Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), Бразилия.
значений, предсказанных разведением изотопов и наблюдаемых при расслоении трупа у взрослой женщины по JSTOR
АбстрактныйУникальная возможность оценить состав тела in vivo была предоставлена путем однократного прямого анализа трупа пациента, которая завещала свое тело в лабораторию авторов, перед смертью прошедшая исследование состава тела изотопным разведением. В частности, измерение общей массы скелета позволило авторам пересмотреть ранее опубликованную номограмму для прогнозирования сухой массы без жира костей на основе общего обменного калия и обезжиренных твердых веществ.Оба эти параметра аналогично определялись изотопным разбавлением перед смертью. Наблюдаемая масса скелета предсказывает, что у нормального человека масса сухой обезжиренной кости составляет 8,3-8,5% от массы тела без жира. Содержание воды в скелете составляет 12,2% от массы влажного скелета. Этого недостаточно для объяснения наблюдаемых концентраций калия и хлорида в скелетах в виде ионов в свободном растворе. Эти данные также позволили разделить массу клеток тела в зависимости от расхода энергии.
Информация о журналеВсемирный форум новейших идей, методов и техник в этой области. Human Biology фокусируется на генетике в самом широком смысле. В эту рубрику включены: генетика человеческой популяции, эволюционная и генетическая демография, количественная генетика, эволюционная биология, исследования древней ДНК, биологическое разнообразие, интерпретируемое с точки зрения адаптации (биометрия, физическая антропология), и междисциплинарные исследования, связывающие биологическое и культурное разнообразие (выведенные из языковая изменчивость, этнологическое разнообразие, археологические свидетельства и т. д.)
Информация об издателеWayne State University Press — выдающееся городское издательство, приверженное поддержке основных исследований, обучения и миссии своего головного учреждения путем создания высококачественных научных и общих работ, имеющих глобальное значение. Через свою издательскую программу Press распространяет результаты исследований, продвигает образование и служит местному сообществу, одновременно повышая международную репутацию Прессы и Университета.
.
