Свойства воды — сообщение доклад
Вода – это жизнь. Это утверждение знакомо каждому человеку. Мы знаем, что все живые организмы состоят из воды, что она является важной составляющей нашего существования. Но какими свойствами обладает вода? Что делает ее уникальной? Почему именно вода стала «материалом» возникновения жизни?
Одним из важных свойств воды является растворимость в ней других веществ. Это свойство также определяет и соленость воды: чем больше солей растворилось в ней, тем более соленной окажется вода. Следует отметить, что соленая вода тяжелее и, следовательно, она будет опускаться на глубины океана, что позволяет живым существам в воде жить в тех условиях, в которых они находятся.
Также существенную роль играет и нерастворимость веществ в воде. Благодаря нерастворимости жиров появилась клеточная стенка — мембрана, что стало основополагающим фактором возникновения жизни.
Следующее свойство воды заключается в том, что замерзая, она превращается в лед, который легче ее жидкого состояния. Такое свойство предотвращает промерзание водоемов, и создает условия для успешной зимовки его обитателей. Стоит также отметить, что у большинства веществ т напротив жидкое состояние легче твердого.
Многие вещества обладают свойством испарения, которое происходит при кипении. Это свойство также характерно для воды. Однако молекулы с ее поверхности могут испаряться в жидкой форме (при отсутствии кипении), и даже в твердой – с поверхности льдов. Почему это свойство является важным? Оно делает возможным круговорот воды в природе. Если бы молекулы воды не испарялись, то жизнь существовала только на отдельных оазисах, на остальных же территориях планеты были бы безжизненные пустыни. В относительно равномерном распределении воды важную роль играют океаны и ледники. Благодаря тому, что с их поверхности испаряется вода, жизнь возможна даже в таких засушливых местах, как пустыня Сахара.
Еще одно свойство воды, которое является важным не только для жизни обитателей планеты, но и для промышленности, заключается в том, что она медленно нагревает и также медленно отдает тепло — остывает. Это качество воды спасает живых существ от перегрева и переохлаждения организма, позволяет выживать при экстремально низких и высоких температурах.
Теплая вода легче холодной. Поэтому нагретые толщи воды находятся на поверхности океана, что делает возможным существование теплых течении, к примеру, Гольфстрим. Это течение обогревает европейскую часть материка, следовательно, если бы не оно, то климат Европы был бы более суровым.
В твердом, жидком и газообразном состоянии (виде).
Свойства воды
Интересные ответы
- Жизнь и творчество Василия Белова
Василий Белов, больше известный как писатель-деревенщик, родился в Вологодской области , в селе Тимонихе.
 У него выходило много увлекательных романов, различных рассказов
У него выходило много увлекательных романов, различных рассказов - Киноискусство — доклад сообщение
«Самым важнейшим из искусств для нас является кино» — некогда говорил вождь мирового пролетариата В.И. Ленин. И хоть в наши дни этот человек давно перестал иметь какой-либо вес, невозможно не согласиться с ним в том
- Акробатика — сообщение доклад (3, 5 класс физкультура)
Акробатика — это олимпийский вид спорта. Спортсмен соревнуется выполняя акробатические элементы гимнастики на равновесие тела в пространстве, балансирование на одной конечности, вращение тела с опорой на снаряде и в безопорном положении.
- Доклад сообщение на тему Гриб Лисичка Гриб является популярным грибом, широко известным как лисички, имя которое также может относиться к видам типа «cibarius». Это грибы, которые образуют симбиотические ассоциации с растениями, что делает их очень трудными для эволюционирования
- Дуб — сообщение доклад 2, 3, 4 класс Окружающий мир
Дуб – любимое многими лиственное дерево.
 Всё из-за его красоты, пользы и мощи. В России это довольно распространённое растение, встречается повсеместно, относится к семейству Буковые
Всё из-за его красоты, пользы и мощи. В России это довольно распространённое растение, встречается повсеместно, относится к семейству Буковые
Физики доказали, что вода может существовать в нескольких жидких состояниях — Наука
ТАСС, 19 ноября. Американские ученые впервые получили переохлажденную воду, которая не замерзает при температуре –68 °С. Ее изучение позволило доказать, что вода на самом деле состоит как минимум из двух разных типов жидкости, обладающих разными физическими свойствами. Статью с описанием исследования опубликовал научный журнал Science.
«Пытаясь объяснить некоторые аномальные свойства воды при помощи расчетов на суперкомпьютерах, теоретики еще 30 лет назад предположили, что жидкая вода может существовать в двух разных состояниях. Эта противоречивая гипотеза была одним из самых важных вопросов в химии и физике воды, который не удавалось долго решить», – рассказал один из авторов исследования, профессор Городского университета Нью-Йорка (США) Николас Джовамбаттиста.
Долгое время ученые считали, что у воды есть лишь одно жидкое состояние. Эти представления начали меняться на рубеже веков, когда ученые обнаружили, что пространственная структура и некоторые физические свойства молекул воды зависят от того, в какую стороны «повернуты спины атомов водорода», а также раскрыли различия в химических свойствах двух подобных пространственных форм молекул воды, параводы и ортводы.
Аналогичным образом ученые при проведении экспериментов с водой, охлажденной до сверхнизких температур, предположили, что вода может существовать в жидком виде в двух разных формах, фазовых состояниях, обладающих сравнительно низкой и высокой плотностью. Трудности с их отделением друг от друга породили массу споров о том, существуют ли эти состояния в реальности или только в теории.
Скрытое многообразие форм воды
Эти проблемы, как объясняет профессор Джовамбаттиста, связаны с тем, что теория предсказывает, что вода будет находиться в двух четко отделимых фазовых формах только при сверхнизких температурах (около –60 °С), при которых она находится в так называемом переохлажденном виде.
Как правило, воду можно удерживать в жидком состоянии при температурах, не превышающих –48 °С, если удалить из нее все примеси и охлаждать ее очень быстро. В теории вода может оставаться жидкостью и при более низких температурах, составляющих около минус 70 градусов Цельсия, однако добиться этого крайне сложно.
Американские физики решили эту проблему, не охлаждая воду, а особым образом нагревая аморфный лед высокой плотности при помощи инфракрасного лазера, способного вырабатывать очень мощные, но при этом сверхкороткие импульсы теплового излучения.
Данные вспышки света были настолько непродолжительными, что плотность образца воды не менялась при таянии льда, что впервые позволило ученым увидеть то, как формируется вода высокой плотности и проследить за ее превращением — фазовым переходом — в воду легкой плотности, подсвечивая растаявший лед при помощи рентгеновского лазера.
Эти наблюдения подтвердили, что оба типа жидкостей обладают разными свойствами, а также показали, что плотная вода была примерно на 20% тяжелее, чем ее легкая разновидность. При определенных условиях, как показывают расчеты Джовамбаттисты и его коллег, обе формы переохлажденной воды не будут смешиваться друг с другом. Иными словами они будут взаимодействовать примерно так же, как обычная вода и масло, формирующие два четких слоя, если их налить в один и тот же сосуд.
При определенных условиях, как показывают расчеты Джовамбаттисты и его коллег, обе формы переохлажденной воды не будут смешиваться друг с другом. Иными словами они будут взаимодействовать примерно так же, как обычная вода и масло, формирующие два четких слоя, если их налить в один и тот же сосуд.
«Пока не понятно, как присутствие двух типов воды будет влиять на поведение различных растворов и реакций между ними, в том числе и внутри живых организмов. Это толкает нас на проведение новых экспериментов с этими фазовыми состояниями жидкой воды», — подытожил профессор.
Глава 4.1. Свойства воды | BookOnLime
Описание свойств воды начинают, обычно, с характеристики аномалий, присущих воде – самому распространенному и, вместе с тем, самому загадочному и необычному веществу на земле. Причем практически каждое из этих аномальных свойств имеет важное значение для обеспечения жизнедеятельности на земле. Необычные свойства воды особенно ярко выделяются на фоне свойств ее гомологов: h3S, h3Se, h3Te. Молекула воды является самым первым и легким представителем этого гомологического ряда, однако гидриды серы, селена и теллура при комнатной температуре, в отличие от воды, находятся в газообразном состоянии (рис. 23).
Молекула воды является самым первым и легким представителем этого гомологического ряда, однако гидриды серы, селена и теллура при комнатной температуре, в отличие от воды, находятся в газообразном состоянии (рис. 23).
И вода, если бы она была обычным членом гомологического ряда, должна в соответствии со своей молекулярной массой закипать при температуре –70 оС и превращаться в лед при температуре –90 оС, а значит, не могла бы быть основой жизни на земле.
Рис. 23. Точки плавления и кипения гидридов VI группы Периодической системы элементов
Другая особенность воды – это аномальное изменение плотности в зависимости от температуры (рис. 24). В обычных жидкостях плотность всегда уменьшается с ростом температуры. Для воды характер изменения плотности в зависимости от температуры другой – после таяния льда плотность увеличивается, проходит через максимум при температуре 4 оС, а затем уменьшается с ростом температуры.
Рис. 24. Зависимость плотности воды от температуры
Жидкая вода имеет максимум плотности не в точке плавления, а при температуре 4 оС и ее плотность уменьшается, как при повышении температуры, так и при ее понижении до температуры возможного переохлаждения, равной – 40 оС (при 1 атмосфере). При этом плотность воды больше плотности льда на 10%, благодаря чему лед плавает на поверхности воды. При температуре 4 оС вода уменьшается в объеме до минимальных значений, а при дальнейшем понижении температуры от 4 оС до 0 оС расширяется (рис. 25).
При этом плотность воды больше плотности льда на 10%, благодаря чему лед плавает на поверхности воды. При температуре 4 оС вода уменьшается в объеме до минимальных значений, а при дальнейшем понижении температуры от 4 оС до 0 оС расширяется (рис. 25).
Рис. 25. Зависимость молярного объема воды и льда от температуры
Минимум объема воды при температуре 4 оС обусловлен, по мнению Зацепиной Г.Н., особенностью межмолекулярного взаимодействия системы Н2О, в которой число межмолекулярных переходов протонов равно числу внутримолекулярных переходов. Вода, превращаясь в лед, благодаря увеличению объема приобретает огромную силу, способность разрушать крепчайшие породы и, вместе с тем это спасает нашу планету от оледенения. Так как максимум плотности при 4 оС предотвращает конвективное перемешивание жидкости и опускание на дно поверхностных слоев воды, остывших до температуры ниже 4 оС, что замедляет дальнейшее охлаждение и промерзание водоемов.
Морская вода, в отличие от пресной ведет себя иначе. Наличие различных солей меняет ее физико-химические свойства. Она замерзает при – 1,9 оС (переохлажденная вода) и имеет максимальную плотность при – 3,5 оС, то есть она превращается в лед, не достигая наибольшей плотности. Переохлажденная вода, то есть остающаяся в жидком состоянии ниже точки замерзания 0 оС, ведет себя странно, с одной стороны плотность воды сильно уменьшается по мере переохлаждения, но, с другой стороны она приближается к плотности льда при понижении температуры.
Наличие различных солей меняет ее физико-химические свойства. Она замерзает при – 1,9 оС (переохлажденная вода) и имеет максимальную плотность при – 3,5 оС, то есть она превращается в лед, не достигая наибольшей плотности. Переохлажденная вода, то есть остающаяся в жидком состоянии ниже точки замерзания 0 оС, ведет себя странно, с одной стороны плотность воды сильно уменьшается по мере переохлаждения, но, с другой стороны она приближается к плотности льда при понижении температуры.
Другая аномалия воды – необычное поведение ее сжимаемости, то есть уменьшение объема при увеличении давления. Для обычных жидкостей сжимаемость растет с температурой – при высоких температурах жидкости более рыхлы, имеют меньшую плотность, их легче сжать. Вода так ведет себя при высоких температурах выше 50 оС. При низких температурах, от 0 оС до 45 оС сжимаемость воды меняется противоположным образом, в результате при температуре 45 оС появляется минимум. Изотермическая сжимаемость воды при температуре 0 оС в четыре раза больше, чем изотермическая сжимаемость льда (рис. 26).
26).
Рис. 26. Зависимость сжимаемости воды от температуры
Максимальное изменение сжимаемость испытывает при плавлении. Сжимаемость воды и льда мала по сравнению со сжимаемостью других веществ (табл.4.1.1).
Таблица 4.1.1. Сжимаемость ряда веществ в интервале температур от 5 оС до 30 оС
Температура, оС | βs ·1012, дин/см2 | ||
Вода | Метанол | Бензин | |
5 | 51,6 | – | 84,2 |
10 | 48,7 | 114,9 | 88,5 |
15 | – | 118,8 | 92,2 |
25 | 46,6 | 122,7 | 95,6 |
30 | 45,8 | 131,0 | 103,1 |
Указание особенности изменения сжимаемости воды и льда объясняют характером водородных связей в них. На этих примерах видно, что необычные свойства воды характеризуются появлением максимумов или минимумов на кривых зависимостей от температуры. Такие зависимости означают, что имеют место два противоположных процесса, которые и определяют эти свойства. Один процесс – это обычное тепловое движение, которое усиливается с ростом температуры и делает воду, как и любую другую жидкость, более разупорядоченной. Другой процесс необычный, присущий только воде, за счет него вода становится более упорядоченной при низких температурах. Разные свойства воды по-разному чувствительны к этим двум процессам, и поэтому положение экстремума наблюдается для каждого свойства при своей температуре.
На этих примерах видно, что необычные свойства воды характеризуются появлением максимумов или минимумов на кривых зависимостей от температуры. Такие зависимости означают, что имеют место два противоположных процесса, которые и определяют эти свойства. Один процесс – это обычное тепловое движение, которое усиливается с ростом температуры и делает воду, как и любую другую жидкость, более разупорядоченной. Другой процесс необычный, присущий только воде, за счет него вода становится более упорядоченной при низких температурах. Разные свойства воды по-разному чувствительны к этим двум процессам, и поэтому положение экстремума наблюдается для каждого свойства при своей температуре.
Самая сильная аномалия воды – это температурная зависимость ее теплоемкости. Величина теплоемкости показывает, сколько нужно затратить тепла, чтобы поднять температуру вещества на один градус. При нагревании вещества теплоемкость, как правило, возрастает для всех веществ, кроме воды. Изменение теплоемкости воды с повышением температуры аномально – от 0 оС до 37 оС она падает и от 37 оС до 100 оС начинает повышаться. Теплоемкость водяного пара приближается к теплоемкости льда. Минимальное значение теплоемкость воды имеет около 37 оС. Это нормальная температура тела человека (36,6–37 оС), именно при этой температуре происходят сложные биохимические процессы в организме человека, значит энергетически это наиболее выгодные условия. Для подавляющего числа веществ теплоемкость жидкости после плавления кристалла изменяется незначительно (табл. 4.1.2).
Теплоемкость водяного пара приближается к теплоемкости льда. Минимальное значение теплоемкость воды имеет около 37 оС. Это нормальная температура тела человека (36,6–37 оС), именно при этой температуре происходят сложные биохимические процессы в организме человека, значит энергетически это наиболее выгодные условия. Для подавляющего числа веществ теплоемкость жидкости после плавления кристалла изменяется незначительно (табл. 4.1.2).
Таблица 4.1.2. Теплоемкость веществ в трех агрегатных состояниях
Агрегатное состояние | Теплоемкость вещества (СоР, кал/моль) | ||||||
Н2О | Nh4 | Ch5 | HCl | h3 | Hg | Na | |
газообразное | 8,75 | 9,9 | – | 6,7 | 6,9 | – | 5,0 |
жидкое | 18,0 | 12,0 | 11,0 | 12,0 | 11,0 | 6,8 | 7,6 |
твердое | 9,0 | 9,0 | 14,0 | 15,0 | 13,0 | 6,7 | 8,0 |
Вода же при плавлении льда меняет теплоемкость в два раза, такого огромного скачка при плавлении не наблюдается ни у одного вещества. Теплоемкость льда имеет очень низкое значение, она близка к теплоемкости одноатомных кристаллов и равна теплоемкости твердого аммиака. В процессе плавления металлов теплоемкость практически не изменяется, для веществ из многоатомных молекул в процессе плавления она, как правило, уменьшается, что, вероятно, связано с тем, что молекулы могут свободно вращаться в жидкости, и не могут в твердом теле. Для таких соединений как Н2О и Nh4 теплоемкость в жидком состоянии много больше, чем в твердом состоянии. Это означает, что в воде открываются какие-то новые, энергоемкие процессы, на которые тратится подводимое тепло, что и обуславливает появление избыточной теплоемкости, причем это характерно для всего диапазона температур, при которых вода находится в жидком состоянии. Эта аномалия исчезает только в паре, то есть это свойство именно жидкой воды. Для переохлажденной воды теплоемкость еще больше возрастает при сильном переохлаждении, то есть переохлажденная вода еще более аномальна, чем обычная.
Теплоемкость льда имеет очень низкое значение, она близка к теплоемкости одноатомных кристаллов и равна теплоемкости твердого аммиака. В процессе плавления металлов теплоемкость практически не изменяется, для веществ из многоатомных молекул в процессе плавления она, как правило, уменьшается, что, вероятно, связано с тем, что молекулы могут свободно вращаться в жидкости, и не могут в твердом теле. Для таких соединений как Н2О и Nh4 теплоемкость в жидком состоянии много больше, чем в твердом состоянии. Это означает, что в воде открываются какие-то новые, энергоемкие процессы, на которые тратится подводимое тепло, что и обуславливает появление избыточной теплоемкости, причем это характерно для всего диапазона температур, при которых вода находится в жидком состоянии. Эта аномалия исчезает только в паре, то есть это свойство именно жидкой воды. Для переохлажденной воды теплоемкость еще больше возрастает при сильном переохлаждении, то есть переохлажденная вода еще более аномальна, чем обычная. Высокая теплоемкость воды и высокая удельная теплота плавления среди простых веществ (лед трудно растопить, а воду заморозить) способствуют смягчению климата на земле, не происходит резкого перепада температур зимой и летом, ночью и днем, поскольку существует гигантский регулятор, своеобразный термостат – воды Мирового океана.
Высокая теплоемкость воды и высокая удельная теплота плавления среди простых веществ (лед трудно растопить, а воду заморозить) способствуют смягчению климата на земле, не происходит резкого перепада температур зимой и летом, ночью и днем, поскольку существует гигантский регулятор, своеобразный термостат – воды Мирового океана.
Другой величиной, которая определяет характер теплового движения в жидкостях, является теплопроводность. Зависимость изменения теплопроводности воды от температуры приведена на рисунке 26. Для сравнения приведено изменение теплопроводности четыреххлористого углерода, который ведет себя, как обычная жидкость, то есть с ростом температуры уменьшается теплопроводность и растет теплоемкость. Как видно из рисунка 27, теплопроводность при плавлении льда уменьшается приблизительно в четыре раза. Переохлажденная вода имеет тот же характер изменения теплопроводности, что и обычная.
Рис. 27. Зависимость теплопроводности воды и четыреххлористого углерода от температуры
Все нормальные жидкости с ростом давления изменяют знак зависимости теплопроводности от температуры. Теплопроводность воды не изменяет характера температурной зависимости под давлением. Относительная величина увеличения теплопроводности воды при давлении 1200 кг/см2 составляет около 50%, в то время как для нормальных жидкостей это увеличение при том же давлении составляет приблизительно 270%. Теплопроводность воды слабо зависит от давления, что связано с малой сжимаемостью воды по сравнению с другими жидкостями.
Теплопроводность воды не изменяет характера температурной зависимости под давлением. Относительная величина увеличения теплопроводности воды при давлении 1200 кг/см2 составляет около 50%, в то время как для нормальных жидкостей это увеличение при том же давлении составляет приблизительно 270%. Теплопроводность воды слабо зависит от давления, что связано с малой сжимаемостью воды по сравнению с другими жидкостями.
И, наконец, еще одно удивительное свойство воды, связанное с особенностями ее поверхностного натяжения. Вода в свободном состоянии принимает шарообразную форму (капли дождя, росы). На границе двух сред (вода-воздух) силы межмолекулярного притяжения действуют с одной стороны, стягивая поверхность жидкости. На структуру поверхностного слоя воды влияет два фактора – полярность молекул воды и сетка водородных связей. Поверхностное натяжение воды 72 мн/м (миллиньютон/метр). Это поверхностное натяжение настолько велико, что смоченные водой две пластинки из стекла удается разъединить только с помощью огромных усилий.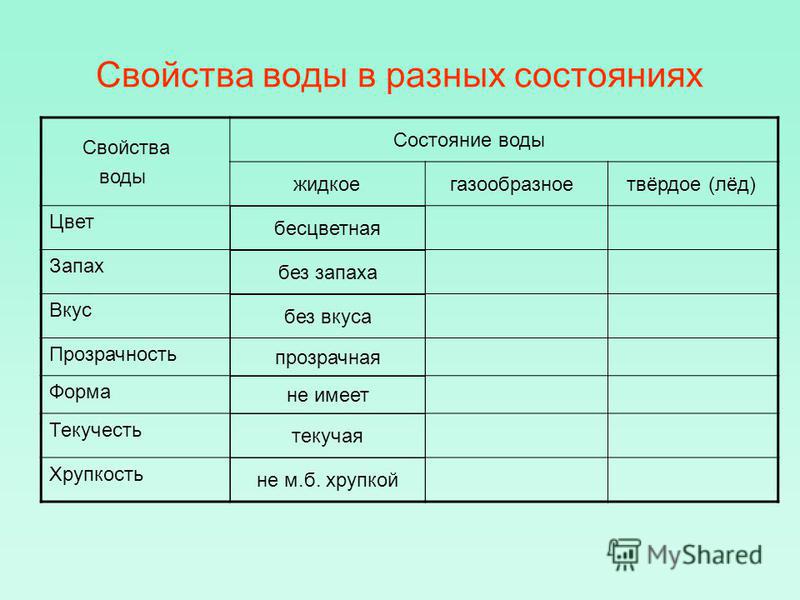 Из всех известных жидкостей силы поверхностного натяжения воды по своей величине уступают только ртути (около 500 мн/м).
Из всех известных жидкостей силы поверхностного натяжения воды по своей величине уступают только ртути (около 500 мн/м).
Рис. 28. Зависимость сдвиговой вязкости от температуры для воды и четыреххлористого углерода
Еще одно аномальное свойство воды – ее вязкость. Обычные жидкости с повышением давления увеличивают вязкость, а с ростом температуры уменьшают. Характер изменения вязкости у воды другой. На рисунке 28 представлена зависимость вязкости от температуры для воды и четыреххлористого углерода. Как видно из рисунка вязкость четыреххлористого углерода до температуры около 23 оС меньше, чем у воды, а для больших температур она больше, чем у воды.
Зависимость вязкости от давления для разных температур приведена на рисунке 29, из которой следует, что для низких температур с ростом давления вплоть до 2000 атм вязкость воды уменьшается, а затем начинает расти и при температуре 100 оС кривая близка по характеру зависимости для обычных жидкостей.
Рис. 29. Зависимость сдвиговой вязкости от давления для ряда температур
29. Зависимость сдвиговой вязкости от давления для ряда температур
Увеличение вязкости для них с ростом давления связано с уменьшением длины свободного пробега молекул, так как при большем давлении они плотнее упакованы. Как видно из приведенных характеристик, вода действительно является необычной, аномальной жидкостью и природа этих аномалий кроется в особенностях ее структуры.
У воды обнаружили неизвестные квантово-механические свойства: Наука и техника: Lenta.ru
На нанометровых расстояниях у воды появляются свойства, которые нельзя объяснить иначе, как с привлечением квантовой механики. Такой вывод был сделан учеными по итогам серии экспериментов. Статья исследователей пока не опубликована в рецензируемом научном журнале, но ее препринт доступен на сайте arXiv.org. Коротко о работе пишет портал Physics World.
Вода обладает рядом свойств, которые делают эту жидкость уникальной. В частности, H2O обладает максимальной плотностью при температуре плюс четыре градуса Цельсия. Благодаря этой особенности земные водоемы замерзают не снизу вверх, а сверху вниз, и в них в холодное время года могут обитать живые существа. Многие необычные характеристики воды объясняются тем, что ее молекулы связаны между собой особым типом нековалентных связей, получившем название водородной связи. Такие связи образуются между атомом водорода, который связан с так называемым электроотрицательным атомом (в случае воды — с кислородом), и другим электроотрицательным атомом, находящимся в той же или соседней молекуле.
Благодаря этой особенности земные водоемы замерзают не снизу вверх, а сверху вниз, и в них в холодное время года могут обитать живые существа. Многие необычные характеристики воды объясняются тем, что ее молекулы связаны между собой особым типом нековалентных связей, получившем название водородной связи. Такие связи образуются между атомом водорода, который связан с так называемым электроотрицательным атомом (в случае воды — с кислородом), и другим электроотрицательным атомом, находящимся в той же или соседней молекуле.
Авторы новой работы проверяли, насколько хорошо модель, описывающая свойства воды только с опорой на водородные связи (так называемая электростатическая модель), согласуется с данными экспериментов. Ученые отслеживали такой параметр как распределение протонов в молекулах воды по уровням кинетической энергии. Исследователи «загоняли» молекулы H2O в углеродные нанотрубки диаметром 1,6 нанометра, и подвергали систему воздействию высокоэнергетичных нейтронов, которые производил источник ISIS из лаборатории Резерфорда-Эпплтона в Оксфордшире, Великобритания.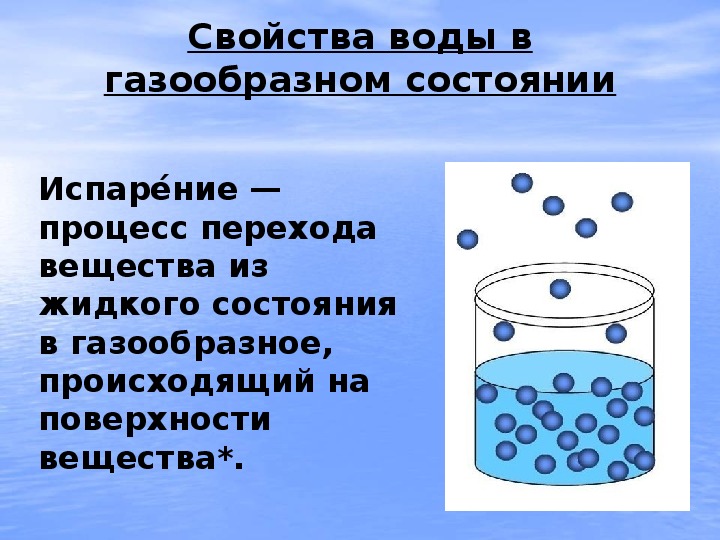
Из-за того, что нейтроны обладали очень высокой энергией, они успевали отразиться от встреченных на пути протонов до того, как последние успевали провзаимодействовать с окружающими их частицами. Таким образом, анализируя данные о рассеянии нейтронов после прохождения сквозь образец, ученые получали информацию о нативном распределении протонов по энергиям. Оказалось, что энергия сильно зависит от температуры: ее среднее значение было на 50 процентов больше предсказанного электростатической моделью при низких температурах, и на 20 процентов — при комнатной температуре. Внутри нанотрубок с диаметром 1,4 нанометра средняя энергия протонов оказалась на 30 процентов ниже, чем у воды, не помещенной в ограниченное пространство.
Также исследователи проверили, как будут распределяться по энергиям протоны в воде, помещенной в особый мембранный материал Nafion, который используется для производства топливных элементов. Ученые показали, что средняя энергия была на 30 процентов выше, чем у воды в «обычном» состоянии.
Авторы новой работы полагают, что, когда молекулы воды находятся на очень близком расстоянии друг от друга и «сдавлены» из-за маленького объема доступного пространства, протоны в них переходят в пока не описанное физиками квантовое состояние. Ученые отмечают, что квантово-механические свойства воды могут определять ее «поведение» в живых клетках, так как там расстояние между молекулами примерно соответствует тому расстоянию, на котором они находились в эксперименте.
Необычные свойства воды — Троицкий вариант — Наука
Вода – это основа жизни на планете Земля. Физико-химические свойства этого вещества уже который век поражают учёных по всему миру. Теоретические изыскания являются основой для дальнейшего практического применения этих особенностей. Аномальные свойства воды способны удивлять и простых людей, которые сталкиваются с ними в быту. Так что же это за необычные свойства?
Состояния воды
Ещё со школьной скамьи многие помнят, что вода имеет три агрегатных состояния – твёрдое (лёд), жидкое и газообразное (водяной пар). Учёные обнаружили до 19 состояний воды, среди которых пять различаются в жидком виде, а 14 – в твёрдом. Известно, что при -4 вода в природных водоёмах начинает замерзать так, что сверху накапливается толстый ледяной слой, а под ним она остаётся пребывать в жидком виде, обеспечивая нормальную жизнь различным существам. Но вот при -38 даже самая чистая вода внезапно превращается в лёд. При 120 градусах мороза это вещество приобретает качество сверхвязкости. Если понизить температуру ещё на 15 градусов, то вода в твёрдом виде потеряет свою кристаллическую структуру.
Учёные обнаружили до 19 состояний воды, среди которых пять различаются в жидком виде, а 14 – в твёрдом. Известно, что при -4 вода в природных водоёмах начинает замерзать так, что сверху накапливается толстый ледяной слой, а под ним она остаётся пребывать в жидком виде, обеспечивая нормальную жизнь различным существам. Но вот при -38 даже самая чистая вода внезапно превращается в лёд. При 120 градусах мороза это вещество приобретает качество сверхвязкости. Если понизить температуру ещё на 15 градусов, то вода в твёрдом виде потеряет свою кристаллическую структуру.
Что же происходит на молекулярном уровне? Здесь всё ещё более интересно. В 1995 году физики провели один эксперимент. Они рассеивали нейтроны в воде, рассчитывая на то, что эти частицы будут разбивать молекулы воды и захватывать с собой протоны водорода. Так вот, в ходе эксперимента было обнаружено, что 25 процентов протонов остаются незахваченными. Это приводит к изменению химической формулы воды.
Горячая вода замерзает быстрее
Какая вода замерзает быстрее? 99 процентов населения планеты, которые пребывают в добром здравии, ответят, что именно холодная. А вот оставшийся один процент наверняка знает об эксперименте танзанийского студента Эрасто Б. Мпембы, который в 1963 году заметил, что в морозильной камере приготовленная им горячая смесь для мороженого замёрзла быстрее холодной. Долгое время физики не верили этому, пока сами не провели подобный эксперимент. Учёные до сих пор не могут объяснить природу эффекта Мпемба. Хотя ещё за много веков до него подобные наблюдения проводили Аристотель, Рене Декарт и Френсис Бэкон.
А вот оставшийся один процент наверняка знает об эксперименте танзанийского студента Эрасто Б. Мпембы, который в 1963 году заметил, что в морозильной камере приготовленная им горячая смесь для мороженого замёрзла быстрее холодной. Долгое время физики не верили этому, пока сами не провели подобный эксперимент. Учёные до сих пор не могут объяснить природу эффекта Мпемба. Хотя ещё за много веков до него подобные наблюдения проводили Аристотель, Рене Декарт и Френсис Бэкон.
Сколько ещё загадок скрывает в себе вода? Как эти необычные свойства можно применить на практике? Эти и некоторые другие вопросы всё так же остаются неотвеченными, однако учёные, не покладая рук, работают над разгадкой этих аномалий.
Чудесные свойства и функции воды
Давайте разберемся, что же такое вода?
Это, прежде всего, простое химическое соединение, включающее в себя один атом водорода и два атома кислорода – это формула воды.
Но вода, которую мы используем, или для питья или для умывания, в общем, вся вода, что нас окружает, является носителем растворенных в ней различных микроэлементов, определяющие её минеральный состав.
От того где человек берет воду, это может быть вода из открытых источников (реки, озера, моря) или с гор Кавказа (ледниковая), или наконец из подземных природных кладовых (артезианская) будет меняться и её состав, который определяет физическую полноценность воды, и от которого напрямую зависит здоровье человека.
Физиологическая полноценность определяется ее оптимальным составом микро- и макроэлементов для организма.
И ещё одним из новых направлений в изучении свойств воды являются исследования: структуры воды, включающей в себя такие понятия, как энергоинформационная или кластерная память воды.
Если мы пьем физиологически полноценную воду (вода высшей категории), то клеткам не приходится приспосабливать эту воду к внутренней среде организма. Дело в том, что организму приходится затрачивать колоссальные усилия на биосовместимость, если вода не достаточно качественна (должно быть определенное поверхностное натяжение, окислительно-восстановительный потенциал, жесткость воды, структура, слабая минерализация, слабая щелочность и др. ). Например, известно, что у водопроводной воды поверхностное натяжение составляет 73 дин/см, а внутри клетки и во внеклеточной воде – 43дин/см. Поверхностное натяжение – это крепко сцепленные друг с другом молекулы. Проверить его можно так: положить на поверхность воды бритву или иголку. Их удельный вес в 8-10раз больше, чем у воды, но они в ней не тонут из-за поверхностного натяжения воды.
). Например, известно, что у водопроводной воды поверхностное натяжение составляет 73 дин/см, а внутри клетки и во внеклеточной воде – 43дин/см. Поверхностное натяжение – это крепко сцепленные друг с другом молекулы. Проверить его можно так: положить на поверхность воды бритву или иголку. Их удельный вес в 8-10раз больше, чем у воды, но они в ней не тонут из-за поверхностного натяжения воды.
У воды достаточно много уникальных свойств. Именно поэтому живые существа выбрали ее в качестве основного строительного материала для своего тела.
1) Транспортная функция воды и очистительная: Вода несет питательные вещества к клеткам, выводит токсины и шлаки, доставляет кислород. Водный раствор крови состоит из 80 процентов чистой воды. Вся очистительная и выделительная система организма — лимфа, пот, моча – тоже чистая вода, в которой растворены удаляемые из организма продукты. Мы потеем и с потом выходит до полутора литров воды в сутки даже в тени и в умеренном климате.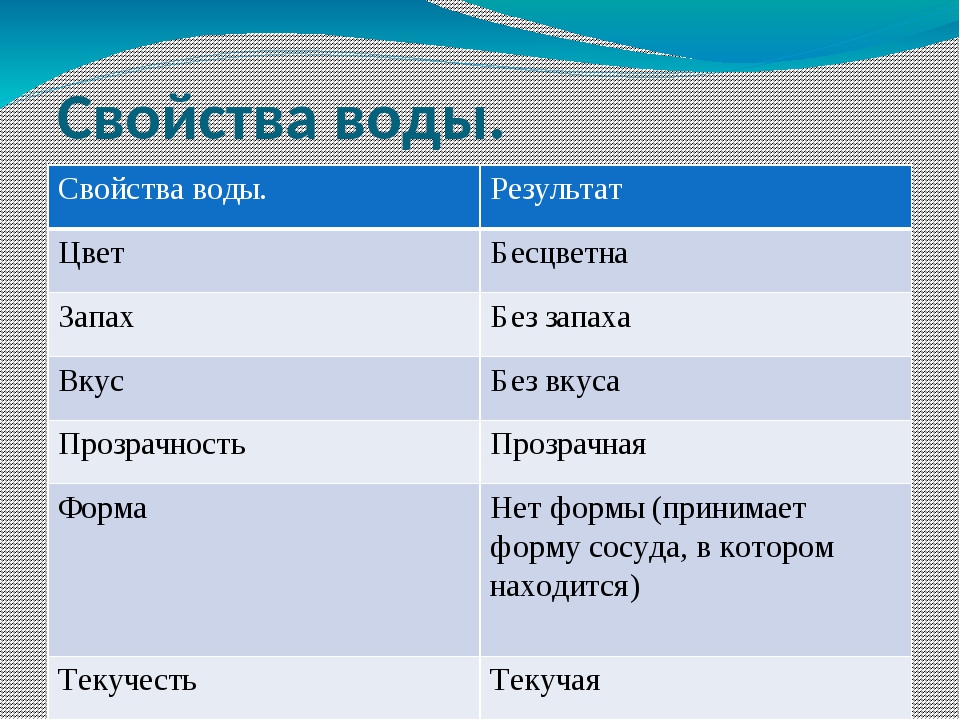 Канализационная система нашего тела, по которой выбрасывается из организма весь «шлак» обмена веществ, тоже для своего нормального функционирования требует немало воды. Кроме того, с возрастом наш организм вырабатывает все меньше гормонов. 80% гормонов, как известно, секретируется в тонком кишечнике. Чем более загрязняется тонкий кишечник слизью, водонерастворимыми веществами, тем меньше гормонов, — тем хуже работает пищеварительная система. А почистить его очень просто. Не надо покупать специальных лекарств или чего-то ждать. Нужно каждый день с утра натощак, а также перед каждой едой выпивать 1-2 стакана воды. Так вода сразу всасывается в кишечник и промывает его. Во время пищи ни в коем случае нельзя пить воду. Мы смываем ферменты, которые переваривают пищу. А вот после приема пищи через 2.5 часа нужно также выпить стакан воды.
Канализационная система нашего тела, по которой выбрасывается из организма весь «шлак» обмена веществ, тоже для своего нормального функционирования требует немало воды. Кроме того, с возрастом наш организм вырабатывает все меньше гормонов. 80% гормонов, как известно, секретируется в тонком кишечнике. Чем более загрязняется тонкий кишечник слизью, водонерастворимыми веществами, тем меньше гормонов, — тем хуже работает пищеварительная система. А почистить его очень просто. Не надо покупать специальных лекарств или чего-то ждать. Нужно каждый день с утра натощак, а также перед каждой едой выпивать 1-2 стакана воды. Так вода сразу всасывается в кишечник и промывает его. Во время пищи ни в коем случае нельзя пить воду. Мы смываем ферменты, которые переваривают пищу. А вот после приема пищи через 2.5 часа нужно также выпить стакан воды.
При отравлении человеку, в основном, дают только воду. Чтобы скорее вывести из организма отравляющие продукты и обновить всю воду в организме. Особенно это касается мам, кормящих грудью. Если такая женщина отравилась каким-то продуктом, то кормить ребенка грудью можно, главное пить воду!!! Из нее, в основном образуется молоко, и вода же выведет все яды.
Особенно это касается мам, кормящих грудью. Если такая женщина отравилась каким-то продуктом, то кормить ребенка грудью можно, главное пить воду!!! Из нее, в основном образуется молоко, и вода же выведет все яды.
Вода может избавить от запоров и геморроя, так как будет являться своеобразной смазкой для всех систем пищеварения и выведения.
О свойствах воды: Известно, что вода растворяет в себе все известные вещества, однако, она не вступает во взаимодействие с транспортируемыми ею веществами. Кроме того, вода обладает высокой текучестью в органах и клетках в любых его условиях. Ни одна другая жидкость в условиях Земли не обладает одновременным сочетанием таких свойств!
2) Вода доставляет кислород в клетки и помогает крови удалить углекислый газ. Когда мы дышим легкими, то изгоняем из себя каждые сутки 300—400 граммов воды. А кожа, когда дышит, расходует даже вдвое больше воды.
3) Вода-универсальный растворитель
Как мы уже сказали, вода растворяет в себе все известные вещества, но по отношению к организму она нейтральна! Вода расщепляет все питательные вещества на первичные компоненты (белки на аминокислоты, крахмалы на простые сахара, жиры на жирные кислоты). Именно этим объясняется то, что вода помогает семени взрасти и превратиться в цветок или дерево.
Именно этим объясняется то, что вода помогает семени взрасти и превратиться в цветок или дерево.
Основная масса воды в организме выполняет роль среды, в которой проходят различные реакции. Вода, поступающая в организм, должна быть нейтральной, а лучше слабощелочной, как и жидкости в организме.
4) Сохраняет температуру постоянной 36.6 градусов
Вода обладает большой теплоемкостью (4.19 кДж/(кг• К), что в 30 раз выше, чем у других веществ. А это значит, что она обеспечивает наилучшие условия для накопления и сохранения тепла, которое необходимо нашему организму, чтобы поддерживать стабильность всех процессов в организме. Так как для регуляции процессов в организме требуется сохранять температуру с точностью до десятых долей градуса. Свойство воды: одновременно обладает высокой теплоемкостью и довольно низкой теплопроводностью. Это свойство человек использовал не только для обогревания своего тела, но и для обогрева своего жилья с помощью батарей центрального отопления, где также циркулирует вода.
5) Вода поддерживает нормальные электрические свойства клеток и переносит электрические заряды, с помощью которых клетки общаются друг с другом. Вода является электролитом. Параметры нашего электролита специфичны и определяются растворенными в воде минералами, которые служат носителями электрических зарядов.
Важно! Поступающая вода должна иметь определенный окислительно-восстановительный потенциал воды (ОВП) у качественной воды должен соответствовать потенциалу межклеточной жидкости в организме. Когда водопроводная питьевая вода или искусственно созданная вода проникает в ткани человеческого (или иного) организма, она отнимает электроны от клеток и тканей, которые состоят из воды на 80 — 90%. В результате этого биологические структуры организма (клеточные мембраны, органоиды клеток, нуклеиновые кислоты и другие) подвергаются окислительному разрушению. Так организм изнашивается, стареет, жизненно-важные органы теряют свою функцию. Но эти негативные процессы могут быть замедлены, если в организм поступает вода, обладающая защитными восстановительными свойствами, то есть природная. Это подтверждается многочисленными исследованиями в специализированных научных центрах в России и за рубежом.
Но эти негативные процессы могут быть замедлены, если в организм поступает вода, обладающая защитными восстановительными свойствами, то есть природная. Это подтверждается многочисленными исследованиями в специализированных научных центрах в России и за рубежом.
6) Является строительным материалом Часть воды распадается на микро и макроэлементы, которые участвуют в ремонте клеток, тканей и органов. Таким образом, вода ускоряет процессы восстановления клеток, регенерации тканей.
7) Средство защиты органов
Благодаря своей «несжимаемости» вода создает гидроскелет внутри клеток и всего организма. Ведь основные жизненно важные внутренние органы, как известно, находятся в подвешенном состоянии (легкие, сердце, печень и др.) Каждый из этих органов имеет значительную массу. Когда мы бегаем, прыгаем, ходим, в силу законов инерции эти органы подвергаются нагрузкам. Но, поскольку организм наш состоит из 70% воды, то масса всех важных органов стала минимальной. Кроме того, вода стала выполнять и роль амортизирующей среды, и это позволило практически полностью защитить внутренние органы от перегрузок. Природа, как всегда, нашла самый простой способ! Таким образом, вода предохраняет от ударов кости и органы, скрепляет твердые структуры в самой клетке, а также служит смазкой для суставов.
Кроме того, вода стала выполнять и роль амортизирующей среды, и это позволило практически полностью защитить внутренние органы от перегрузок. Природа, как всегда, нашла самый простой способ! Таким образом, вода предохраняет от ударов кости и органы, скрепляет твердые структуры в самой клетке, а также служит смазкой для суставов.
8) Вода активизирует обменные процессы в организме. Правда, вода должна быть хорошего качества, физиологически полноценной. В связи с этим может устраняться даже похмельный синдром без специальных таблеток и рассолов. Может пройти изжога. Ведь в основе любой диеты лежит сбалансированное питание и потребление большого количества воды, так как вода помогает желудку усвоить продукты и съедать меньшее количество пищи. Вода также – хорошее средство для похудения, так как заполняет пространство желудка и хочется меньше есть. Ведь ни одна диета не обходится без воды.
9) Дополнительная энергия. Если вода физиологически полноценна, и обладает определенной структурой и памятью, необходимым окислительно-восстановительным потенциалом, то организм получает чистую дополнительную энергию. Современные ученые советуют детям давать больше воды во время экзаменов, так как вода способна устранить усталость. За счет чего вода дает энергию? В первую очередь, именно из воды организм берет все важные макро и микроэлементы. Именно из них появляется дополнительная энергия. При поступлении воды в клетку включаются насосы, при прохождении через которые вырабатывается чистая энергия в мембранах всех клеток. Без достаточного количества воды энергетика человека падает и на смену хорошему самочувствию приходит сильная усталость.
Если вода физиологически полноценна, и обладает определенной структурой и памятью, необходимым окислительно-восстановительным потенциалом, то организм получает чистую дополнительную энергию. Современные ученые советуют детям давать больше воды во время экзаменов, так как вода способна устранить усталость. За счет чего вода дает энергию? В первую очередь, именно из воды организм берет все важные макро и микроэлементы. Именно из них появляется дополнительная энергия. При поступлении воды в клетку включаются насосы, при прохождении через которые вырабатывается чистая энергия в мембранах всех клеток. Без достаточного количества воды энергетика человека падает и на смену хорошему самочувствию приходит сильная усталость.
Возможно, энергию организму также может давать информация «записанная» на молекулах воды, так как вода помнит информацию, с которой взаимодействовала. Если информация благоприятная (играет классическая музыка рядом с водой, наговариваются молитвы или просто добрые слова), то кристаллы у воды становятся правильной формы – структура будет гармоничной.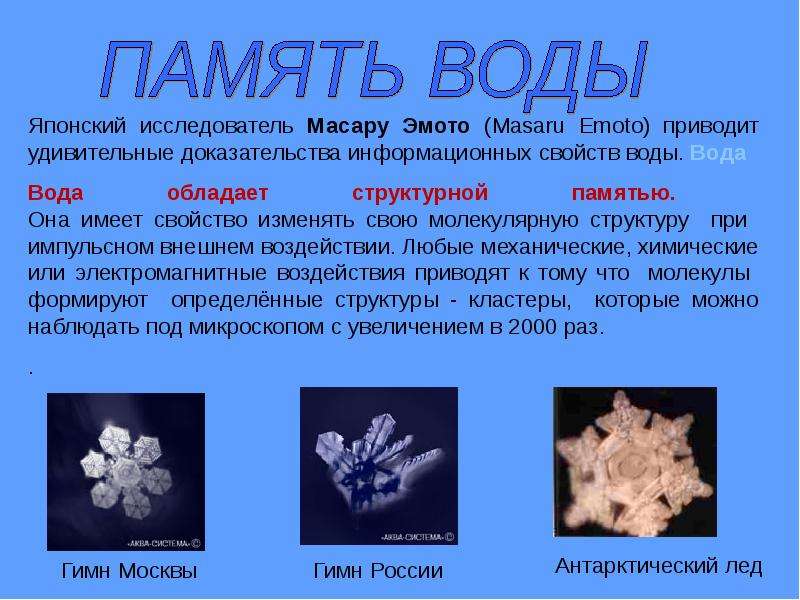 Два слова «ЛЮБОВЬ И БЛАГОДАРНОСТЬ» наиболее положительно влияют на структуру и память воды. А, если вода взаимодействовала с вирусами, бактериями, с ядами, тяжелыми металлами, то структура и память не будут гармоничными, так как любое вещество имеет свою частоту излучения и эти излучения вода запоминает и передает. К сожалению, водопроводная вода запоминает вещества, с которыми контактировала раннее, будучи еще не очищенной, а также, проходя по трубам, теряет свою структуру и часто вбирает в себя из них свинец, поливинилхлорид и другие вещества.
Два слова «ЛЮБОВЬ И БЛАГОДАРНОСТЬ» наиболее положительно влияют на структуру и память воды. А, если вода взаимодействовала с вирусами, бактериями, с ядами, тяжелыми металлами, то структура и память не будут гармоничными, так как любое вещество имеет свою частоту излучения и эти излучения вода запоминает и передает. К сожалению, водопроводная вода запоминает вещества, с которыми контактировала раннее, будучи еще не очищенной, а также, проходя по трубам, теряет свою структуру и часто вбирает в себя из них свинец, поливинилхлорид и другие вещества.
На этой способности воды запоминать информацию, основана и гомеопатия, имеющая уже двухсотлетний опыт. Всем нам также известно такое выражение как «порчу навели». Дело в том, что чужое плохое настроение, чья-то ругань в транспорте, ссоры в семье, все влияет на наши эмоции. А наш организм, как известно, состоит на 60-70% из воды, это отражается и на общем состоянии всех органов. Именно поэтому говорят про порчу. Меняя свою мысленную установку и употребляя природную воду, не потерявшую свою структуру и хорошую память, мы улучшаем свое здоровье. Японский исследователь Массару Эмото исследовал эти свойства воды. А также д-р Вольфганг Людвиг, Станислав Зенин. Разрушить структуру и стереть память можно, если воду заморозить в морозилке и держать ее там не менее трех часов. Затем можно записать другую полезную информацию. Возможно, что благодаря именно этому своему свойству вода может улучшать память.
Важно! После нагревания воды до 42С вода теряет свою структуру и превращается в обычную.
Японский исследователь Массару Эмото исследовал эти свойства воды. А также д-р Вольфганг Людвиг, Станислав Зенин. Разрушить структуру и стереть память можно, если воду заморозить в морозилке и держать ее там не менее трех часов. Затем можно записать другую полезную информацию. Возможно, что благодаря именно этому своему свойству вода может улучшать память.
Важно! После нагревания воды до 42С вода теряет свою структуру и превращается в обычную.
10) Тонизирует кожу, замедляет процессы старения
В юности клетки большие за счет воды и выделяют много энергии. Затем клетка уменьшается (ссыхается), а межклеточное пространство увеличивается. Если клетке постоянно не додавать воды, в следующий раз воды в организме создается чуть меньше. Так клетка постоянно уменьшается, а организм получает меньше энергии. Одной из главных причин преждевременного старения и многих заболеваний является повышенное содержание в организме свободных радикалов, которые являются побочными продуктами процессов окисления в организме. Они отнимают электроны у клеток, и те повреждаются. Вода связывает свободные радикалы между клетками. А это замедляет процессы старения, а также предупреждает болезни, онкологию.
Они отнимают электроны у клеток, и те повреждаются. Вода связывает свободные радикалы между клетками. А это замедляет процессы старения, а также предупреждает болезни, онкологию.
11) Устраняет стресс
При стрессе и тревоге выходит вода, чтобы снять напряжение с тела. Не случайно также, когда человек нервничает – ему дают выпить стакан воды, чтобы сохранить влагу в организме, немного успокоиться и добавить энергии. Все эти обычаи происходят от свойств воды, а также от механизмов распределения воды при стрессе. Древние знали об этих ее качествах.
Как известно, жизнь на Земле возникла в воде. Первые существа вышли на сушу, и им понадобилось создать в организме систему, отвечающую за сохранение и удержание воды в организме. Сегодня у людей, подвергающихся стрессу, приходит в действие такой же механизм кризисного распределения воды, как и миллионы лет назад – строгого ее контроля: воду получают самые важные органы, либо вообще ее не получают (исследования доктора Ф. Батмангхелиджа). Так как для выполнения любой функции в организме необходима вода, то организм управляет количеством воды для того, чтобы все необходимые питательные вещества попали к самым важным органам, которые снова будут иметь дело со стрессом. Обезвоживание вызывает стресс, а стресс приводит к дальнейшему обезвоживанию, так как при стрессе происходит мобилизация всех резервов.
Доктор в процессе исследований пришел к такому выводу: что при стрессе, а также больших физических и умственных нагрузках и болезни нужно пить в два раза больше воды!!!
Батмангхелиджа). Так как для выполнения любой функции в организме необходима вода, то организм управляет количеством воды для того, чтобы все необходимые питательные вещества попали к самым важным органам, которые снова будут иметь дело со стрессом. Обезвоживание вызывает стресс, а стресс приводит к дальнейшему обезвоживанию, так как при стрессе происходит мобилизация всех резервов.
Доктор в процессе исследований пришел к такому выводу: что при стрессе, а также больших физических и умственных нагрузках и болезни нужно пить в два раза больше воды!!!
В жизни мы можем проверить, как при небольшом стрессе вода успокаивает организм. Например, когда вы сильно понервничали на экзамене или на выступлении, перед ответственным делом, вы можете ощутить сухость во рту. Это уходит влага из организма, чтобы снять напряжение с тела. Если вы не выпьете воды в течение получаса-часа, то у вас заболит голова. Так как через кожу выходит вода, чтобы снять напряжение.
О других функциях воды: Также отмечались случаи, что при регулярном употреблении качественной воды рассасываются камни в почках, поджелудочной железе. Не зря ведь говорят, «вода камень точит».
Не зря ведь говорят, «вода камень точит».
Ученые нашего времени (Ф. Батмангхелиндж, Р. Моханти, Станислав Зенин) говорят, что многие болезни, такие как аллергии, ожирение, избыточное количество холестерина, снижение иммунитета, повышенное кровяное давление протекают и усугубляются на фоне нехватки воды в организме. Все зависит от того, какая область и в какой степени нуждается в воде.
Вот, например, как действует на организм нехватка воды при гипертонии. Когда в организме не хватает воды, клетки начинают втягивать в себя воду внеклеточную. И это является причиной отеков. Потому что мозг отдает команду увеличить концентрацию соли в организме, чтобы задержать воду. Дальше – больше – увеличивается осмотическое давление, чтобы увеличить поступление воды в клетки. Это вызывает гипертонию. Когда объем жидкости в организме уменьшается, сосудам также приходится сужать отверстия, чтобы заполнить всю кровеносную систему. Иначе от крови отделяются газы и заполняют пространство. Это ведет к повышению кровяного давления и учащенной работе сердца. Сердце пытается накачать больше крови к органам, чтобы сбалансировать количество крови в суженных сосудах. Хорошее здоровье зависит от поддержания в организме баланса между двумя океанами – внутриклеточном и внеклеточном. Баланс в организме можно достигнуть употреблением качественной воды, калия и соли (натрия).
Это ведет к повышению кровяного давления и учащенной работе сердца. Сердце пытается накачать больше крови к органам, чтобы сбалансировать количество крови в суженных сосудах. Хорошее здоровье зависит от поддержания в организме баланса между двумя океанами – внутриклеточном и внеклеточном. Баланс в организме можно достигнуть употреблением качественной воды, калия и соли (натрия).
Можно верить в эти исследования, можно не верить, во всяком случае, пить воду более полезно для организма и менее затратно, чем покупать дорогие лекарства от каждой болезни.
Вода – одно из самых необходимых для живых существ вещество. На Земле, кроме воды, больше нет ни одного вещества, находящегося в нормальных условиях в жидком, готовом для употребления виде, в большом количестве, в жидкой форме при нормальных условиях для человека и сравнительно простой доступности для организмов. Кроме того, ни одно другое жидкое вещество не может обеспечить все жизненно необходимые процессы в живом организме так, как это делает вода.
И в нашем организме воды более чем достаточно. 70% воды организма находится внутри клеток в составе клеточной протоплазмы. 30% воды во внеклеточной жидкости. Межклеточная жидкость составляет 20%, вода плазмы крови – 8%, вода лимфы — 2%. Если подсчитать, сколько у нас в организме жидкости, мы получим следующие цифры: крови – около 5л, лимфы -2,5л, слюны-1,5л, желчи-05-1,5л, желудочного сока-2,5л, кишечного сока-3л. Остальная вода находится в клетках и межклеточных интерстициальных пространствах. Кроме того, каждая ткань, кроме костной, как губка наполнена водой. Особенно мозговая. Наш организм это система сообщающихся сосудов, по которым непрерывно движутся потоки разнообразных жидкостей, взаимодействующих друг с другом. И нам не должно быть все равно, какого качества эта вода и жидкость в нашем организме! Заказать воду «Диво»
Правила употребления воды:
- выпить натощак утром 1,5 стакана воды, чтобы почистить кишечник и перед каждой едой выпивать стакан воды
- не пить непосредственно перед едой (только через час после воды можно есть)
- после еды также пить воду только через 2,5 часа, не говоря уже о чае
- в течение дня следует выпивать около 2-х литров воды, а точнее 30 мл на 1 кг веса
- на 1л воды ¼ ч.
 л. морской соли (соль задерживает воду в организме, а кофе, чай, таблетки, газировка, алкоголь – выводят воду из организма)
л. морской соли (соль задерживает воду в организме, а кофе, чай, таблетки, газировка, алкоголь – выводят воду из организма)
- Доктор Агапкин советует пить воду по 2-3 глотка через каждые 20 минут в течении дня, чтобы вода всасывалась в клетки, так как когда мы пьем воду целым стаканом сразу — жидкость в основном уходит в мочу. (телеканал Россия, программа «О самом главном»).
- если пьем кофе, чай, газированные напитки, алкоголь, таблетки – еще дополнительно стакан воды
- пить больше воды при физических и умственных нагрузках, при болезни!
- заменить воду не может ничто. Но, если у вас под рукой нет воды, то лучше всего пить свежевыжатые соки, плодово-ягодные и травяные чаи без кофеина, молоко. Только, самой собой, если вы уверены в качестве продукта.
Вода «Диво» – физиологически полноценная вода для организма высшей категории качества.
Отзывы наших покупателей о воде Диво
Автор: Мария Крупанова
Уникальные свойства воды
Содержание:
Особые свойства воды
Особые свойства воды. Известно, что понятие «вода» должно включать в себя не только молекулы h3016, но и вещества. С различными комбинациями изотопов водорода и кислорода существует 36 видов воды. В 99,7% природной воды молекулы HgO16, остальные виды воды составляют только 0,3%.Это не означает, что влияние других видов молекул на свойства воды пропорционально доле воды в общем объеме. Вода-это необыкновенное вещество. Во-первых, если температура и давление различны, то вода может находиться в одном из 3 агрегатных состояний: твердом (лед), жидком, газообразном (пар).
Известно, что понятие «вода» должно включать в себя не только молекулы h3016, но и вещества. С различными комбинациями изотопов водорода и кислорода существует 36 видов воды. В 99,7% природной воды молекулы HgO16, остальные виды воды составляют только 0,3%.Это не означает, что влияние других видов молекул на свойства воды пропорционально доле воды в общем объеме. Вода-это необыкновенное вещество. Во-первых, если температура и давление различны, то вода может находиться в одном из 3 агрегатных состояний: твердом (лед), жидком, газообразном (пар).
Благодаря наличию в воде растворенного насыщенного кислородом воздуха и наличию некоторых агрессивных компонентов, вода воздействует на материал, из которого собирается конструкция. Людмила Фирмаль
- Если температура падает с 4 ° С до 0 ° С, то количество воды не уменьшается(как и всех других веществ, кроме висмута), а увеличивается. Плотность воды с максимальным значением при 4°С уменьшается.
 При замерзании количество воды увеличивается примерно на 10%.Температура замерзания воды при повышении давления (до 19,6 МПа) снижается, а затем повышается. Известно, что конвекция водоема (пресной воды) прекращается при 4°C. At эта температура ниже 25. В слоях есть более плотная вода, чем в верхних слоях. Морская вода замерзает при температуре-1,9°С. Вода в капиллярах почвы может замерзнуть даже при температуре + 4,4°с. Вода обладает очень большой теплоемкостью.
При замерзании количество воды увеличивается примерно на 10%.Температура замерзания воды при повышении давления (до 19,6 МПа) снижается, а затем повышается. Известно, что конвекция водоема (пресной воды) прекращается при 4°C. At эта температура ниже 25. В слоях есть более плотная вода, чем в верхних слоях. Морская вода замерзает при температуре-1,9°С. Вода в капиллярах почвы может замерзнуть даже при температуре + 4,4°с. Вода обладает очень большой теплоемкостью.
Например, в 10 раз больше железа, в 33 раза больше ртути, в 3,3 раза больше алкоголя и glycerin. In в этом случае теплоемкость других жидкостей обычно увеличивается с повышением температуры. Вода характеризуется минимальной теплоемкостью при 35°С, при повышении температуры теплоемкость снова повышается. Возникновение этого минимума приблизительно объясняется разрушением связей (групп) молекул воды при данной температуре. В воде очень высокая теплота испарения, и скрытая теплота растворяется во мне. Например, теплота испарения воды в 8 раз выше, а скрытая теплота плавления в 27 раз больше, чем alcohol.
- Aтмосферное давление, в 6,75 раза больше тепла требуется для перемещения воды из окружающей среды в пар, чем при таянии льда при том же давлении. Во время конденсации (облачности) выделяется значительное количество тепла released. It используется в установке для создания искусственного тумана. Такие растения, помимо полива, можно использовать для защиты растений от заморозков. Электропроводность сухого льда и снега значительно ниже, чем у воды, а электропроводность воды в значительной степени зависит от наличия примесей, которые практически не влияют на электропроводность льда. Конечно, проводимость воды зависит от количества растворенной в ней соли.
Поэтому электропроводность морской воды на 2-3 порядка больше, чем у пресной речной воды, что примерно в 12 000 раз выше, чем у химически чистой воды при 18°С. Вода является сильным растворителем. Емкость этой воды характеризуется очень высокой диэлектрической проницаемостью, при 0 ° С она составляет около 87, а при 100°С она падает до 55,7 при повышении температуры rises. So, если сравнить ее с воздухом и водяным паром, диэлектрическая проницаемость которых равна 1, то свойства этой воды значительно больше(для льда-3,2).
So, если сравнить ее с воздухом и водяным паром, диэлектрическая проницаемость которых равна 1, то свойства этой воды значительно больше(для льда-3,2).
В результате эксперимента были получены данные, повышающие скорость фильтрации воды, обработанной магнитным полем, и ускоряющие время конденсации бетона, содержащего такую воду. Людмила Фирмаль
- Это вызовет corrosion. It не исключено, что соль растворится в воде, а взвешенные в ней твердые вещества»залечат» стенки трубопровода и т. д. в результате пропускная способность таких труб может значительно снизиться. Влияние магнитного поля на свойства воды. Магнитная обработка воды используется для предотвращения образования накипи, предотвращения коррозии котлов и опреснительных установок, а также способствует осаждению взвешенных веществ во время воды treatment. Однако механизм влияния магнитных полей на свойства воды до сих пор до конца не изучен
Смотрите также:
Задачи по гидравлике
Возможно эти страницы вам будут полезны:
- Силы, действующие в покоящейся или движущейся жидкости.

- Свойства жидкости.
- Напряженное состояние покоящейся жидкости. Гидростатическое давление.
- Дифференциальные уравнения равновесия жидкости.
Структура воды: свойства
Для инструктора
Эти студенческие материалы дополнить Наука о воде и общество Инструкторские материалы. Если вы хотите, чтобы у ваших учеников был доступ к учебным материалам, мы предлагаем вам либо укажите им на студенческую версию в котором отсутствуют обрамляющие страницы с информацией, предназначенной для факультет (и этот ящик). Или вы можете скачать эти страницы в нескольких форматах которые вы можете включить в свой веб-сайт курса или в местную систему управления обучением.Узнайте больше об использовании, изменение и совместное использование учебных материалов InTeGrate. Исследования показали, что кластеризация молекул воды происходит в растворах из-за так называемых водородных связей (слабое взаимодействие), которые составляют около 10% от силы ковалентной связи воды. Это немаловажно, и для разрыва связей требуется энергия или она достигается за счет образования водородных связей. Такие связи не являются постоянными, и происходит постоянное разрушение и реформирование облигаций, которые, по оценкам, длятся несколько триллионных долей секунды.Тем не менее, большая часть молекул воды связана в любой момент в растворе. Но эта структура приводит к другим важным свойствам воды.
Это немаловажно, и для разрыва связей требуется энергия или она достигается за счет образования водородных связей. Такие связи не являются постоянными, и происходит постоянное разрушение и реформирование облигаций, которые, по оценкам, длятся несколько триллионных долей секунды.Тем не менее, большая часть молекул воды связана в любой момент в растворе. Но эта структура приводит к другим важным свойствам воды.
В рамках этого курса мы рассмотрим только шесть из этих важных свойств:
- Тепловая мощность
- Скрытая теплота (плавления и испарения)
- Тепловое расширение и плотность
- Поверхностное натяжение
- Точки замерзания и кипения
- Свойства растворителя
Как упоминалось выше, эти свойства имеют значение для физических и биологических процессов на Земле.Фактически, большое количество воды буферизует изменения окружающей среды на поверхности Земли, а это означает, что, например, изменения температуры поверхности Земли относительно незначительны. Таким образом, высокая теплоемкость воды способствует непрерывности жизни на Земле, поскольку вода охлаждается / нагревается медленно по сравнению с землей, помогая удерживать и переносить тепло, сводя к минимуму экстремальные температуры и помогая поддерживать однородную температуру тела в организмах. Однако есть и другие эффекты свойств воды. Его низкая вязкость позволяет быстрому потоку выравнивать перепады давления.Его высокое поверхностное натяжение позволяет передавать энергию ветра к поверхности моря, способствуя нисходящему перемешиванию кислорода в крупных водоемах, таких как океан. Кроме того, это высокое поверхностное натяжение помогает отдельным клеткам организмов сохранять свою форму и контролировать поведение при падении (вы видели «Жизнь муравья»?). Кроме того, высокая скрытая теплота испарения очень важна для передачи тепла / воды в атмосфере и является важным компонентом передачи тепла из низких широт, где приток солнечной энергии более интенсивен, в высокие широты, где наблюдается дефицит солнечной энергии.
Таким образом, высокая теплоемкость воды способствует непрерывности жизни на Земле, поскольку вода охлаждается / нагревается медленно по сравнению с землей, помогая удерживать и переносить тепло, сводя к минимуму экстремальные температуры и помогая поддерживать однородную температуру тела в организмах. Однако есть и другие эффекты свойств воды. Его низкая вязкость позволяет быстрому потоку выравнивать перепады давления.Его высокое поверхностное натяжение позволяет передавать энергию ветра к поверхности моря, способствуя нисходящему перемешиванию кислорода в крупных водоемах, таких как океан. Кроме того, это высокое поверхностное натяжение помогает отдельным клеткам организмов сохранять свою форму и контролировать поведение при падении (вы видели «Жизнь муравья»?). Кроме того, высокая скрытая теплота испарения очень важна для передачи тепла / воды в атмосфере и является важным компонентом передачи тепла из низких широт, где приток солнечной энергии более интенсивен, в высокие широты, где наблюдается дефицит солнечной энергии.
Потратьте несколько минут, чтобы узнать, почему вода — самое интересное и важное вещество во Вселенной.
Структура воды: свойства
А, привет, здесь, в штаб-квартире ускоренного курса, нам нравится начинать каждый день с хорошей здоровой дозы воды во всех ее трех формах. Это единственное вещество на всей нашей планете Земля, которое естественным образом встречается в твердой, жидкой и газовой формах. и чтобы отпраздновать эту магическую связь между двумя атомами водорода и одним атомом кислорода, здесь сегодня мы будем праздновать чудесные поддерживающие жизнь свойства воды, но мы собираемся сделать это немного более одетыми.Намного лучше.
На этом мы закончили ускоренный курс биологии, мы говорим о жизни и довольно важном факте, что вся жизнь, как мы ее знаем, зависит от наличия воды вокруг Я просто астрономы всегда смотрят во Вселенную, пытаясь ее понять. выяснить, есть ли где-нибудь жизнь, потому что вы знаете, что это своего рода самый важный вопрос, который у нас есть прямо сейчас. Я был очень взволнован, когда они нашли воду где-нибудь, особенно жидкую воду, и это одна из причин, по которой я и многие другие люди были в восторге от Так сильно вышло в декабре прошлого года, когда на Марсе семилетний марсоход «Оппортьюнити» обнаружил 20-дюймовую жилу из гипса, которая почти наверняка была отложена жидкой водой на поверхности Марса, и это было, вероятно, миллиарды лет назад.И поэтому будет сложно сказать, привела ли вода, которая там была, к какой-то жизни, но, возможно, мы сможем это выяснить, и это будет действительно захватывающе. Но почему мы думаем, что вода необходима для жизни? Почему вода на других планетах так возбуждает нас?
выяснить, есть ли где-нибудь жизнь, потому что вы знаете, что это своего рода самый важный вопрос, который у нас есть прямо сейчас. Я был очень взволнован, когда они нашли воду где-нибудь, особенно жидкую воду, и это одна из причин, по которой я и многие другие люди были в восторге от Так сильно вышло в декабре прошлого года, когда на Марсе семилетний марсоход «Оппортьюнити» обнаружил 20-дюймовую жилу из гипса, которая почти наверняка была отложена жидкой водой на поверхности Марса, и это было, вероятно, миллиарды лет назад.И поэтому будет сложно сказать, привела ли вода, которая там была, к какой-то жизни, но, возможно, мы сможем это выяснить, и это будет действительно захватывающе. Но почему мы думаем, что вода необходима для жизни? Почему вода на других планетах так возбуждает нас?
Итак, давайте начнем с исследования некоторых удивительных свойств воды. Для этого нам нужно начать с этой самой популярной молекулы в мире или, по крайней мере, самой запоминающейся молекулы в мире, мы все знаем об этом, старый добрый h3o. Два атома водорода, один кислород, водород, каждый из которых делит электрон с кислородом в том, что мы называем ковалентной связью. Итак, как вы можете видеть, вы нарисовали мою молекулу воды определенным образом, и на самом деле она выглядит v-образной, потому что этот большой атом кислорода немного более жаден для электронов. Он имеет небольшой отрицательный заряд, тогда как эта область здесь с атомами водорода имеет небольшой положительный заряд, благодаря этой полярности все молекулы воды настолько притягиваются друг к другу, что фактически слипаются, и это называется водородными связями, и мы говорили о в прошлый раз, по сути, происходит то, что положительный полюс вокруг этих атомов водорода связывается с отрицательным полюсом вокруг атомов кислорода другой молекулы воды, и поэтому это слабая связь, но посмотрите, они связаны серьезно, я не могу переоценить важность этой водородной связи поэтому, когда ваш учитель спрашивает вас, что важно в воде, начните с водородных связей, и вы должны поместить ее во все промежутки и, возможно, вокруг нее будут блестки, одним из замечательных свойств, которые являются результатом этих водородных связей, является высокая когезия воды, что приводит к высокой когезия поверхностного натяжения — это притяжение между такими вещами, как притяжение между одной молекулой воды и другой молекулой воды.
Два атома водорода, один кислород, водород, каждый из которых делит электрон с кислородом в том, что мы называем ковалентной связью. Итак, как вы можете видеть, вы нарисовали мою молекулу воды определенным образом, и на самом деле она выглядит v-образной, потому что этот большой атом кислорода немного более жаден для электронов. Он имеет небольшой отрицательный заряд, тогда как эта область здесь с атомами водорода имеет небольшой положительный заряд, благодаря этой полярности все молекулы воды настолько притягиваются друг к другу, что фактически слипаются, и это называется водородными связями, и мы говорили о в прошлый раз, по сути, происходит то, что положительный полюс вокруг этих атомов водорода связывается с отрицательным полюсом вокруг атомов кислорода другой молекулы воды, и поэтому это слабая связь, но посмотрите, они связаны серьезно, я не могу переоценить важность этой водородной связи поэтому, когда ваш учитель спрашивает вас, что важно в воде, начните с водородных связей, и вы должны поместить ее во все промежутки и, возможно, вокруг нее будут блестки, одним из замечательных свойств, которые являются результатом этих водородных связей, является высокая когезия воды, что приводит к высокой когезия поверхностного натяжения — это притяжение между такими вещами, как притяжение между одной молекулой воды и другой молекулой воды.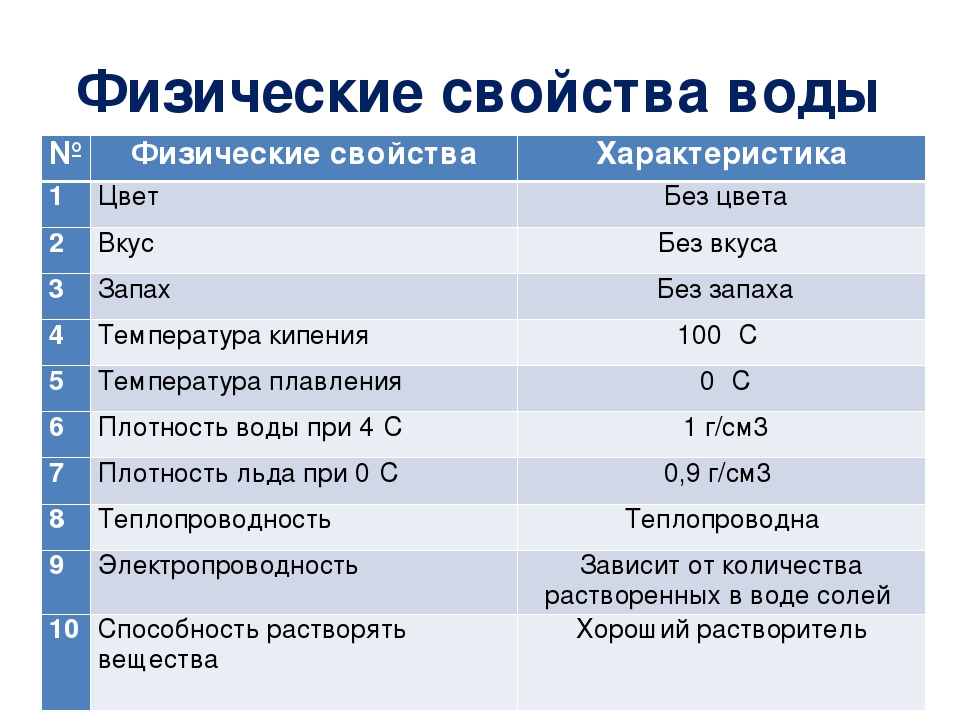 Наивысшая когезия любой неметаллической жидкости, и вы можете увидеть это, если налейте немного воды на вощеную бумагу или немного тефлона или что-то там, где вода поднимается, как некоторые листья растений справляются с этим очень хорошо.Это довольно круто, так как вода слабо прилипает к вощеной бумаге или к растению, но прочно молекулы воды удерживают эти капли вместе в конфигурации, которая создает наименьшую площадь поверхности. Именно такое высокое поверхностное натяжение допускает появление некоторых ошибок и даже думаю, одна ящерица, а также один Иисус, могут ходить по тому, что сила воды Цуй делает свои пределы.
Наивысшая когезия любой неметаллической жидкости, и вы можете увидеть это, если налейте немного воды на вощеную бумагу или немного тефлона или что-то там, где вода поднимается, как некоторые листья растений справляются с этим очень хорошо.Это довольно круто, так как вода слабо прилипает к вощеной бумаге или к растению, но прочно молекулы воды удерживают эти капли вместе в конфигурации, которая создает наименьшую площадь поверхности. Именно такое высокое поверхностное натяжение допускает появление некоторых ошибок и даже думаю, одна ящерица, а также один Иисус, могут ходить по тому, что сила воды Цуй делает свои пределы.
Конечно, есть и другие вещества, к которым вода очень любит прилипать. Возьмем, к примеру, стекло, это называется адгезией, и вода распространяется здесь, а не разбивается, потому что силы сцепления между водой и стеклом сильнее, чем силы сцепления отдельных молекул воды в капле воды. два разных вещества, поэтому в данном случае молекулы воды и молекулы стекла эти свойства приводят к тому, что одна из моих любимых вещей в воде — это то, что она может противостоять гравитации. Это действительно крутая вещь, которая только что произошла, называется капиллярным действием, и объяснить это можно с помощью того, что мы теперь знаем о когезии и адгезии: благодаря адгезии молекулы воды притягиваются к молекулам в соломке, но когда молекулы воды прилипают к соломинке. другие молекулы втягиваются за счет сцепления вслед за другими молекулами воды. Спасибо за сцепление. Создаваемое здесь поверхностное натяжение заставляет воду подниматься вверх по соломе, и она будет продолжать подниматься, пока в конечном итоге сила тяжести, тянущая вниз на вес воды, и солома не пересилит ее. поверхностное натяжение.Тот факт, что вода является полярной молекулой, также помогает ей растворять вещества.
Это действительно крутая вещь, которая только что произошла, называется капиллярным действием, и объяснить это можно с помощью того, что мы теперь знаем о когезии и адгезии: благодаря адгезии молекулы воды притягиваются к молекулам в соломке, но когда молекулы воды прилипают к соломинке. другие молекулы втягиваются за счет сцепления вслед за другими молекулами воды. Спасибо за сцепление. Создаваемое здесь поверхностное натяжение заставляет воду подниматься вверх по соломе, и она будет продолжать подниматься, пока в конечном итоге сила тяжести, тянущая вниз на вес воды, и солома не пересилит ее. поверхностное натяжение.Тот факт, что вода является полярной молекулой, также помогает ей растворять вещества.
Это хороший растворитель, заметьте, вода — не лучший растворитель, это потрясающий растворитель! В воде можно растворить больше веществ, чем в любой другой жидкости на Земле, и да, это включает в себя самую сильную кислоту, которую мы когда-либо создавали. Эти вещества, растворяющиеся в воде, — это сахар или соль, известные нам, называемые гидрофильными. и они гидрофильны, потому что они полярны, и их полярность сильнее, чем силы сцепления стены, поэтому, когда вы помещаете одно из этих полярных веществ в воду, оно достаточно сильное, чтобы разрушить все небольшие силы сцепления.Все эти маленькие водородные связи, и вместо водородных связей друг с другом вода будет водородной связью вокруг этих полярных веществ. Поваренная соль является ионной, и прямо сейчас она разделяется на ионы, поскольку полюса наших молекул воды взаимодействуют с ней, но что происходит, когда есть молекула, которая не может разрушить силы сцепления воды, в которую она не может проникнуть и войти в нее. Что происходит, когда это вещество не может преодолеть сильные силы сцепления воды и не может проникнуть внутрь воды? Это то, что мы называем гидрофобным веществом или чем-то, что боится воды.
и они гидрофильны, потому что они полярны, и их полярность сильнее, чем силы сцепления стены, поэтому, когда вы помещаете одно из этих полярных веществ в воду, оно достаточно сильное, чтобы разрушить все небольшие силы сцепления.Все эти маленькие водородные связи, и вместо водородных связей друг с другом вода будет водородной связью вокруг этих полярных веществ. Поваренная соль является ионной, и прямо сейчас она разделяется на ионы, поскольку полюса наших молекул воды взаимодействуют с ней, но что происходит, когда есть молекула, которая не может разрушить силы сцепления воды, в которую она не может проникнуть и войти в нее. Что происходит, когда это вещество не может преодолеть сильные силы сцепления воды и не может проникнуть внутрь воды? Это то, что мы называем гидрофобным веществом или чем-то, что боится воды.
У этих молекул не было заряженных полюсов, они неполярны и не растворяются в воде, потому что, по сути, они выталкиваются из воды силами сцепления воды. Воду, которую мы можем назвать универсальным растворителем, но это не означает, что он растворяет все, что было. на протяжении всей истории было много эксцентричных ученых, но все эти разговоры о воде заставили меня задуматься о, пожалуй, самом эксцентричном из эксцентриков, о человеке по имени Генри Кавендиш, который он общался со своими служанками только с помощью записок и добавил лестницу к задней части своего дома, чтобы избежать связаться со своей домработницей.Некоторые считают, что он, возможно, страдал от аутизма, но почти каждый признает, что он был гением науки. Его лучше всего помнят как первого человека, который распознал газообразный водород как отдельное вещество и определил состав воды в 1700-х годах. Большинство людей думали, что вода сама по себе является элементом, но Кавендиш заметил, что водород, который он называл легковоспламеняющимся воздухом, вступал в реакцию с кислородом. Ужасное название дефростер закрыл воздух, чтобы сформировать воду. Кавендиш не до конца понимал, что он здесь обнаружил, отчасти потому, что он не верил в химические соединения, он объяснил свои эксперименты с водородом с точки зрения огнеподобного элемента, называемого флогистоном, тем не менее, его эксперименты были новаторскими, как и его работа, и определение конкретных гравитация в основном сравнительная плотность водорода и других газов по отношению к обычному воздуху, это особенно впечатляет, если учесть грубые инструменты, с которыми он работал, например, это то, из чего он сделал свой водородный газ, он не только установил точный состав атмосферы, но также обнаружил плотность Земли неплохо для парня, который был настолько мучительно застенчивым, что единственный существующий его портрет был нарисован без его ведома, поэтому за все его десятилетия экспериментов было опубликовано только около 20 статей в годы после его смерти.
на протяжении всей истории было много эксцентричных ученых, но все эти разговоры о воде заставили меня задуматься о, пожалуй, самом эксцентричном из эксцентриков, о человеке по имени Генри Кавендиш, который он общался со своими служанками только с помощью записок и добавил лестницу к задней части своего дома, чтобы избежать связаться со своей домработницей.Некоторые считают, что он, возможно, страдал от аутизма, но почти каждый признает, что он был гением науки. Его лучше всего помнят как первого человека, который распознал газообразный водород как отдельное вещество и определил состав воды в 1700-х годах. Большинство людей думали, что вода сама по себе является элементом, но Кавендиш заметил, что водород, который он называл легковоспламеняющимся воздухом, вступал в реакцию с кислородом. Ужасное название дефростер закрыл воздух, чтобы сформировать воду. Кавендиш не до конца понимал, что он здесь обнаружил, отчасти потому, что он не верил в химические соединения, он объяснил свои эксперименты с водородом с точки зрения огнеподобного элемента, называемого флогистоном, тем не менее, его эксперименты были новаторскими, как и его работа, и определение конкретных гравитация в основном сравнительная плотность водорода и других газов по отношению к обычному воздуху, это особенно впечатляет, если учесть грубые инструменты, с которыми он работал, например, это то, из чего он сделал свой водородный газ, он не только установил точный состав атмосферы, но также обнаружил плотность Земли неплохо для парня, который был настолько мучительно застенчивым, что единственный существующий его портрет был нарисован без его ведома, поэтому за все его десятилетия экспериментов было опубликовано только около 20 статей в годы после его смерти. исследователи смерти выяснили, что Кавендиш на самом деле открыл закон Рихтера Закон Ома, закон Кулона и несколько других Законы — это множество чертовых законов, и если бы он получил признание за них, нам пришлось бы иметь дело со всеми, как с восьмым недостатком Кавендиша и четвертым законом Кавендиша.Так что я, например, рад, что на самом деле он не получил должного внимания.
исследователи смерти выяснили, что Кавендиш на самом деле открыл закон Рихтера Закон Ома, закон Кулона и несколько других Законы — это множество чертовых законов, и если бы он получил признание за них, нам пришлось бы иметь дело со всеми, как с восьмым недостатком Кавендиша и четвертым законом Кавендиша.Так что я, например, рад, что на самом деле он не получил должного внимания.
Мы собираемся заняться довольно удивительной наукой прямо сейчас, вы, ребята, не поверите, хорошо, что вы готовы, это плывет. Да, я знаю, что вы не удивлены этим, но вы должны быть удивлены, потому что все остальное, когда оно твердое, намного плотнее, чем когда оно жидкое, точно так же, как газы намного менее плотны, чем жидкости, но та простая характеристика воды, что она плавает в твердой форме, — это одна из причин, почему жизнь на этой планете, какой мы ее знаем, возможна, и почему твердая вода менее плотная, чем жидкая вода, в то время как все остальное прямо противоположно этому.Что ж, вы можете еще раз поблагодарить свои водородные связи, поэтому при температуре около 32 градусов по Фаренгейту или 0 градусов по Цельсию, если вы ученый или из той части мира, где все имеет смысл, молекулы воды начинают затвердевать, а водородные связи в этих молекулах воды образуются кристаллические структуры, которые разделяют молекулы более равномерно, что, в свою очередь, делает замороженную воду менее плотной, чем ее жидкая форма, поэтому почти при любых обстоятельствах плавающий водный лед — это действительно хорошо, если, клянусь, плотнее воды, он замерзнет, а затем тонет, а затем замерзнет, чем тонет чем замерзать, чем тонуть, так что просто поверьте мне в этом, вы не хотите жить в мире, где я тону, не только это полностью нанесет ущерб водным экосистемам, которые в основном являются тем, как жизнь сформировалась на земле, в первую очередь, это также Вы знаете, что весь лед и Северный полюс утонут, а затем вся вода повсюду поднимется, и у нас не будет земли, которая раздражала бы.
Есть еще одно удивительное свойство воды, о котором я забываю, так почему здесь так жарко? О, теплоемкость, да, вода имеет очень высокую теплоемкость, и, вероятно, это ничего не значит для вас, но в основном это означает, что вода действительно хорошо удерживает тепло, поэтому нам нравится ставить бутылки с горячей водой в нашу кровать и с ними, когда мы вы одиноки, но помимо искусственного обогрева вашей кровати, также очень важно, что океаны трудно нагреть и охладить, они становятся гигантскими радиаторами, которые регулируют температуру и климат нашей планеты, поэтому, например, это намного лучше в Лос-Анджелесе, где океан постоянно поддерживает такую же температуру, как есть, и скажем, Небраска, в меньшем масштабе, мы можем действительно легко и визуально увидеть воду с высокой теплоемкостью, поставив горшок без воды на плиту и увидев, насколько плохо это идет, но затем вы наливаете в него немного воды, и требуется вечность, чтобы чертовски закипеть, ох, и если вы еще не заметили этого, или когда вода испаряется с вашей кожи, она охлаждает вас, теперь это принцип за потоотделением, которое является чрезвычайно эффективной, хотя и несколько неловкой частью жизни, но это пример еще одной невероятно крутой вещи, связанной с водой, когда мое тело становится горячим, и оно потеет, это тепло возбуждает некоторые молекулы воды на моей коже до такой степени, что они ломаются эти водородные связи, и они испаряются, и когда они ускользают, они забирают эту тепловую энергию с собой, оставляя меня прохладнее, прекрасно хорошо, это не было упражнением, хотя я не знаю, почему так сильно потею, это может быть распылитель, которым я продолжаю опрыскивать себя возможно, это просто потому, что это предприятие с таким высоким уровнем стресса пытается научить вас тому, что я думаю, мне нужно немного воды, но пока я пью ах, есть обзор всех вещей, о которых мы говорили сегодня, если вы есть пара вещи, в которых вы не совсем уверены, просто вернитесь и посмотрите их, это не займет у вас много времени, и вы станете умнее. Я обещаю, что вы так хорошо сдадите тест, что у вас либо нет, либо вы подойдете, ладно, до свидания,
Я обещаю, что вы так хорошо сдадите тест, что у вас либо нет, либо вы подойдете, ладно, до свидания,
Свойства воды и урок науки о полярности воды
Свойства воды
Одна из особенностей нашей планеты — наличие жидкой воды. Вода необходима для всей жизни; без него все живое погибло бы.
Вода покрывает около 70% поверхности Земли и составляет 65-75% нашего тела (82% нашей крови — это вода).Хотя вода может показаться скучной — без цвета, вкуса или запаха — она обладает удивительными свойствами, которые делают ее необходимой для поддержания жизни.
(Наша потребность в воде и морских животных, которые живут в воде, — вот что делает разливы нефти настолько разрушительными).
Химический состав воды: H 2 O — два атома водорода и один атом кислорода. Свойства воды особенные из-за того, как ее атомы соединяются вместе, образуя молекулу воды, и из-за того, как молекулы взаимодействуют друг с другом.
Полярность воды
Когда два атома водорода связываются с кислородом, они прикрепляются к вершине молекулы, как уши Микки Мауса. Эта молекулярная структура придает молекуле воды полярность или однобокий электрический заряд, который притягивает другие атомы.
Конец молекулы с двумя атомами водорода заряжен положительно. Другой конец, с кислородом, заряжен отрицательно. Так же, как в магните, где северные полюса притягиваются к южным полюсам («притягиваются противоположности»), положительный конец молекулы воды будет соединяться с отрицательным концом других молекул.
Что это значит для нас? Полярность воды позволяет очень легко растворять другие полярные вещества . Когда полярное вещество помещается в воду, положительные концы его молекул притягиваются к отрицательным концам молекул воды, и наоборот. Притяжение заставляет молекулы нового вещества равномерно смешиваться с молекулами воды.
Вода растворяет больше веществ, чем любая другая жидкость, даже самая сильная кислота! Из-за этого его часто называют «универсальным растворителем». «Растворяющая способность воды очень важна для жизни на Земле. Куда бы вода ни попала, она несет растворенные химические вещества, минералы и питательные вещества, которые используются для поддержания жизни живых существ.
«Растворяющая способность воды очень важна для жизни на Земле. Куда бы вода ни попала, она несет растворенные химические вещества, минералы и питательные вещества, которые используются для поддержания жизни живых существ.
Из-за своей полярности молекулы воды сильно притягиваются друг к другу, что придает воде высокое поверхностное натяжение . Молекулы на поверхности воды «слипаются», образуя на воде своего рода «кожу», достаточно прочную, чтобы удерживать очень легкие предметы. Насекомые, которые ходят по воде, пользуются этим поверхностным натяжением.
Поверхностное натяжение заставляет воду скапливаться каплями, а не растекаться тонким слоем.
Он также позволяет воде проходить через корни и стебли растений, термометры и мельчайшие кровеносные сосуды в вашем теле. Когда одна молекула движется вверх, она «тянет» за собой другие.
Три состояния материи
Вода — один из четырех элементов и единственное природное вещество, которое может существовать во всех трех состояниях материи — твердом, жидком и газообразном — при температурах, обычно встречающихся на Земле.
Многие другие вещества должны быть перегреты или охлаждены для изменения состояния.
Вода в газообразном состоянии постоянно присутствует в нашей атмосфере в виде водяного пара. Жидкое состояние встречается повсюду в реках, озерах и океанах.
Твердое состояние воды, льда, уникально. Большинство жидкостей сжимаются при охлаждении, потому что молекулы движутся медленнее и имеют меньше энергии, чтобы сопротивляться притяжению друг к другу. Когда они превращаются в твердые частицы, они образуют плотно упакованные кристаллы, которые намного плотнее, чем была изначально жидкость.
Вода не действует. Когда он замерзает, он расширяется : молекулы выстраиваются в линию, образуя очень «открытую» кристаллическую структуру, менее плотную, чем жидкая вода.
Вот почему лед плавает. И это хорошо! Если бы вода действовала как большинство других жидкостей, озера и реки замерзли бы, и все живое в них погибло бы.
Три других свойства воды
Вода имеет высокую удельную теплоемкость. То есть, в отличие от воздуха, вода может поглощать много тепла без изменения температуры.Вот почему плавание так освежает в жаркий день.
То есть, в отличие от воздуха, вода может поглощать много тепла без изменения температуры.Вот почему плавание так освежает в жаркий день.
Вода также теряет тепло медленнее, чем воздух. В результате летом вода в озере и океане обычно самая холодная в начале сезона и самая теплая в конце сезона (после многих дней поглощения солнечной энергии).
Температура кипения воды (212 ° F или 100 ° C на уровне моря) зависит от высоты. Как правило, чем выше высота, тем ниже температура кипения воды. Например, в Денвере, штат CO (5280 футов), вода закипает при 202 градуса.4 ° F. На горе Эверест в Непале (29 012 футов) вода кипит при 156 ° F.
.Проекты в области науки о воде:
2.2 Вода — Концепции биологии — 1-е канадское издание
К концу этого раздела вы сможете:
- Опишите свойства воды, которые имеют решающее значение для поддержания жизни
Посмотрите видео о том, зачем нам кислород и как он вызывает проблемы для живых существ.
Вы когда-нибудь задумывались, почему ученые тратят время на поиски воды на других планетах? Это потому, что вода необходима для жизни; даже мельчайшие следы ее на другой планете могут указывать на то, что жизнь могла существовать или существовала на этой планете.Вода — одна из наиболее распространенных молекул в живых клетках и наиболее важная для жизни, какой мы ее знаем. Примерно 60–70 процентов вашего тела состоит из воды. Без него жизни просто не было бы.
Атомы водорода и кислорода в молекулах воды образуют полярные ковалентные связи. Общие электроны проводят больше времени, связанного с атомом кислорода, чем с атомами водорода. У молекулы воды нет общего заряда, но есть небольшой положительный заряд на каждом атоме водорода и небольшой отрицательный заряд на атоме кислорода.Из-за этих зарядов слегка положительные атомы водорода отталкиваются друг от друга и образуют уникальную форму. Каждая молекула воды притягивает другие молекулы воды из-за положительных и отрицательных зарядов в разных частях молекулы. Вода также притягивает другие полярные молекулы (например, сахара), образуя водородные связи. Когда вещество легко образует водородные связи с водой, оно может растворяться в воде и обозначается как гидрофильный («любящий воду»). Водородные связи не образуются легко с неполярными веществами, такими как масла и жиры.Эти неполярные соединения гидрофобны, («водобоязненные») и не растворяются в воде.
Вода также притягивает другие полярные молекулы (например, сахара), образуя водородные связи. Когда вещество легко образует водородные связи с водой, оно может растворяться в воде и обозначается как гидрофильный («любящий воду»). Водородные связи не образуются легко с неполярными веществами, такими как масла и жиры.Эти неполярные соединения гидрофобны, («водобоязненные») и не растворяются в воде.
Водородные связи в воде позволяют ей поглощать и отдавать тепловую энергию медленнее, чем многие другие вещества. Температура — это мера движения (кинетической энергии) молекул. По мере увеличения движения увеличивается энергия и, следовательно, выше температура.Вода поглощает много энергии, прежде чем ее температура повышается. Повышенная энергия разрушает водородные связи между молекулами воды. Поскольку эти связи могут создаваться и быстро разрушаться, вода поглощает увеличение энергии, а температура изменяется лишь минимально. Это означает, что вода смягчает изменения температуры внутри организмов и окружающей их среды. По мере того, как подвод энергии продолжается, баланс между образованием и разрушением водородных связей смещается в сторону разрушения. Связей разорвано больше, чем образовано.Этот процесс приводит к высвобождению отдельных молекул воды на поверхности жидкости (например, в водоеме, листьях растений или коже организма) в процессе, называемом испарением . Испарение пота, который на 90 процентов состоит из воды, позволяет охладить организм, поскольку разрыв водородных связей требует затрат энергии и отводит тепло от тела.
Поскольку эти связи могут создаваться и быстро разрушаться, вода поглощает увеличение энергии, а температура изменяется лишь минимально. Это означает, что вода смягчает изменения температуры внутри организмов и окружающей их среды. По мере того, как подвод энергии продолжается, баланс между образованием и разрушением водородных связей смещается в сторону разрушения. Связей разорвано больше, чем образовано.Этот процесс приводит к высвобождению отдельных молекул воды на поверхности жидкости (например, в водоеме, листьях растений или коже организма) в процессе, называемом испарением . Испарение пота, который на 90 процентов состоит из воды, позволяет охладить организм, поскольку разрыв водородных связей требует затрат энергии и отводит тепло от тела.
И наоборот, по мере того, как движение молекул уменьшается и температура падает, требуется меньше энергии для разрыва водородных связей между молекулами воды.Эти связи остаются неповрежденными и начинают образовывать жесткую решетчатую структуру (например, лед) (рис. 2.8 а ). В замороженном состоянии лед менее плотен, чем жидкая вода (молекулы находятся дальше друг от друга). Это означает, что лед плавает на поверхности водоема (рис. 2.8 b ). В озерах, прудах и океанах на поверхности воды образуется лед, создавая изолирующий барьер для защиты находящихся под ними животных и растений от замерзания в воде. Если бы этого не произошло, растения и животные, живущие в воде, замерзли бы в глыбе льда и не могли бы свободно передвигаться, что сделало бы жизнь при низких температурах трудной или невозможной.
2.8 а ). В замороженном состоянии лед менее плотен, чем жидкая вода (молекулы находятся дальше друг от друга). Это означает, что лед плавает на поверхности водоема (рис. 2.8 b ). В озерах, прудах и океанах на поверхности воды образуется лед, создавая изолирующий барьер для защиты находящихся под ними животных и растений от замерзания в воде. Если бы этого не произошло, растения и животные, живущие в воде, замерзли бы в глыбе льда и не могли бы свободно передвигаться, что сделало бы жизнь при низких температурах трудной или невозможной.
Поскольку вода полярная, с небольшими положительными и отрицательными зарядами, ионные соединения и полярные молекулы могут легко растворяться в ней. Таким образом, вода является так называемым растворителем — веществом, способным растворять другое вещество. Заряженные частицы образуют водородные связи с окружающим слоем молекул воды. Это называется сферой гидратации и служит для отделения или диспергирования частиц в воде. В случае поваренной соли (NaCl), смешанной с водой, ионы натрия и хлора разделяются или диссоциируют в воде, и вокруг ионов образуются сферы гидратации. Положительно заряженный ион натрия окружен частично отрицательными зарядами атомов кислорода в молекулах воды. Отрицательно заряженный хлорид-ион окружен частично положительными зарядами атомов водорода в молекулах воды.Эти сферы гидратации также называют гидратными оболочками. Полярность молекулы воды делает ее эффективным растворителем и играет важную роль в ее многочисленных функциях в живых системах.
Заряженные частицы образуют водородные связи с окружающим слоем молекул воды. Это называется сферой гидратации и служит для отделения или диспергирования частиц в воде. В случае поваренной соли (NaCl), смешанной с водой, ионы натрия и хлора разделяются или диссоциируют в воде, и вокруг ионов образуются сферы гидратации. Положительно заряженный ион натрия окружен частично отрицательными зарядами атомов кислорода в молекулах воды. Отрицательно заряженный хлорид-ион окружен частично положительными зарядами атомов водорода в молекулах воды.Эти сферы гидратации также называют гидратными оболочками. Полярность молекулы воды делает ее эффективным растворителем и играет важную роль в ее многочисленных функциях в живых системах.
Вы когда-нибудь наполняли стакан воды до самого верха, а затем медленно добавляли еще несколько капель? Прежде чем переливаться через край, вода фактически приобретает куполообразную форму над краем стакана. Эта вода может оставаться над стеклом благодаря свойству сцепления .В когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-воздух (газ), хотя в стекле больше нет места. Когезия приводит к поверхностному натяжению , способности вещества выдерживать разрыв при воздействии растяжения или напряжения. Когда вы роняете небольшой клочок бумаги на каплю воды, бумага плавает поверх капли, хотя объект плотнее (тяжелее), чем вода.Это происходит из-за поверхностного натяжения, создаваемого молекулами воды. Сплоченность и поверхностное натяжение сохраняют молекулы воды нетронутыми, а предмет — плавающим наверху. Можно даже «плавать» стальную иглу над стаканом с водой, если поместить ее осторожно, не нарушая поверхностного натяжения.
Эта вода может оставаться над стеклом благодаря свойству сцепления .В когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-воздух (газ), хотя в стекле больше нет места. Когезия приводит к поверхностному натяжению , способности вещества выдерживать разрыв при воздействии растяжения или напряжения. Когда вы роняете небольшой клочок бумаги на каплю воды, бумага плавает поверх капли, хотя объект плотнее (тяжелее), чем вода.Это происходит из-за поверхностного натяжения, создаваемого молекулами воды. Сплоченность и поверхностное натяжение сохраняют молекулы воды нетронутыми, а предмет — плавающим наверху. Можно даже «плавать» стальную иглу над стаканом с водой, если поместить ее осторожно, не нарушая поверхностного натяжения.
 Обратите внимание на углубление в воде вокруг иглы.
Обратите внимание на углубление в воде вокруг иглы.Эти силы сцепления также связаны со свойством воды адгезия или притяжением между молекулами воды и другими молекулами. Это наблюдается, когда вода «поднимается» по соломке, помещенной в стакан с водой. Вы заметите, что вода кажется выше по бокам соломинки, чем в середине. Это связано с тем, что молекулы воды притягиваются к соломке и, следовательно, прилипают к ней.
Силы сцепления и сцепления важны для поддержания жизни.Например, из-за этих сил вода может течь вверх от корней к верхушкам растений, чтобы прокормить растение.
Концепция в действии
Чтобы узнать больше о воде, посетите сайт Геологической службы США «Наука о воде для школ: все о воде!» Веб-сайт.
pH раствора является мерой его кислотности или щелочности. Вы, вероятно, использовали лакмусовую бумагу , бумагу, обработанную натуральным водорастворимым красителем, чтобы ее можно было использовать в качестве индикатора pH, чтобы проверить, сколько кислоты или основания (щелочности) существует в растворе. Возможно, вы даже использовали их, чтобы убедиться, что вода в открытом бассейне очищена должным образом. В обоих случаях этот тест pH измеряет количество ионов водорода, которые существуют в данном растворе. Высокие концентрации ионов водорода приводят к низкому pH, тогда как низкие уровни ионов водорода приводят к высокому pH. Общая концентрация ионов водорода обратно пропорциональна его pH и может быть измерена по шкале pH (рис. 2.11). Следовательно, чем больше присутствует ионов водорода, тем ниже pH; и наоборот, чем меньше ионов водорода, тем выше pH.
Возможно, вы даже использовали их, чтобы убедиться, что вода в открытом бассейне очищена должным образом. В обоих случаях этот тест pH измеряет количество ионов водорода, которые существуют в данном растворе. Высокие концентрации ионов водорода приводят к низкому pH, тогда как низкие уровни ионов водорода приводят к высокому pH. Общая концентрация ионов водорода обратно пропорциональна его pH и может быть измерена по шкале pH (рис. 2.11). Следовательно, чем больше присутствует ионов водорода, тем ниже pH; и наоборот, чем меньше ионов водорода, тем выше pH.
Шкала pH находится в диапазоне от 0 до 14. Изменение на одну единицу шкалы pH представляет собой изменение концентрации ионов водорода в 10 раз, изменение на две единицы представляет собой изменение концентрации ионов водорода на величину. коэффициент 100. Таким образом, небольшие изменения pH представляют собой большие изменения концентрации ионов водорода. Чистая вода нейтральна. Он не является ни кислым, ни основным, и его pH составляет 7,0. Все, что ниже 7,0 (от 0,0 до 6,9), является кислотным, а все, что выше 7.0 (от 7,1 до 14,0) — щелочной. Кровь в ваших венах слегка щелочная (pH = 7,4). Среда в желудке очень кислая (pH от 1 до 2). Апельсиновый сок имеет умеренную кислотность (pH = приблизительно 3,5), тогда как пищевая сода является щелочной (pH = 9,0).
Все, что ниже 7,0 (от 0,0 до 6,9), является кислотным, а все, что выше 7.0 (от 7,1 до 14,0) — щелочной. Кровь в ваших венах слегка щелочная (pH = 7,4). Среда в желудке очень кислая (pH от 1 до 2). Апельсиновый сок имеет умеренную кислотность (pH = приблизительно 3,5), тогда как пищевая сода является щелочной (pH = 9,0).
Кислоты — это вещества, которые обеспечивают ионы водорода (H + ) и понижают pH, тогда как оснований обеспечивают ионы гидроксида (OH — ) и повышают pH.Чем сильнее кислота, тем легче она отдает H + . Например, соляная кислота и лимонный сок очень кислые и легко выделяют H + при добавлении в воду. И наоборот, основания — это те вещества, которые легко отдают OH — . Ионы OH — соединяются с H + с образованием воды, которая повышает pH вещества. Гидроксид натрия и многие бытовые чистящие средства очень щелочные и быстро выделяют OH — при помещении в воду, тем самым повышая pH.
Большинство клеток нашего тела работают в очень узком диапазоне шкалы pH, обычно в пределах от 7,2 до 7,6. Если pH тела выходит за пределы этого диапазона, дыхательная система не работает, как и другие органы тела. Клетки больше не функционируют должным образом, и белки будут разрушаться. Отклонение от диапазона pH может вызвать кому или даже смерть.
Так как же мы можем проглотить или вдохнуть кислые или основные вещества и не умереть? Буферы — это ключ. Буферы легко абсорбируют избыток H + или OH — , тщательно поддерживая pH тела в вышеупомянутом узком диапазоне. Двуокись углерода является частью заметной буферной системы в организме человека; он поддерживает pH в нужном диапазоне. Эта буферная система включает анион угольной кислоты (H 2 CO 3 ) и бикарбонат (HCO 3 — ). Если слишком много H + попадает в организм, бикарбонат соединяется с H + , образуя угольную кислоту и ограничивая снижение pH. Аналогичным образом, если в систему вводится слишком много OH — , угольная кислота быстро диссоциирует на ионы бикарбоната и H + . Ионы H + могут объединяться с ионами OH — , ограничивая увеличение pH. Хотя угольная кислота является важным продуктом этой реакции, ее присутствие мимолетно, поскольку углекислота выделяется из организма в виде углекислого газа каждый раз, когда мы дышим. Без этой буферной системы pH в нашем организме будет слишком сильно колебаться, и мы не сможем выжить.
Аналогичным образом, если в систему вводится слишком много OH — , угольная кислота быстро диссоциирует на ионы бикарбоната и H + . Ионы H + могут объединяться с ионами OH — , ограничивая увеличение pH. Хотя угольная кислота является важным продуктом этой реакции, ее присутствие мимолетно, поскольку углекислота выделяется из организма в виде углекислого газа каждый раз, когда мы дышим. Без этой буферной системы pH в нашем организме будет слишком сильно колебаться, и мы не сможем выжить.
Вода обладает многими свойствами, которые имеют решающее значение для поддержания жизни. Он полярный, что позволяет образовывать водородные связи, которые позволяют ионам и другим полярным молекулам растворяться в воде. Поэтому вода — отличный растворитель. Водородные связи между молекулами воды дают воде способность удерживать тепло лучше, чем многие другие вещества. При повышении температуры водородные связи между водой постоянно разрываются и преобразуются, позволяя общей температуре оставаться стабильной, хотя в систему добавляется повышенная энергия. Силы сцепления воды учитывают свойство поверхностного натяжения. Все эти уникальные свойства воды важны для химии живых организмов.
Силы сцепления воды учитывают свойство поверхностного натяжения. Все эти уникальные свойства воды важны для химии живых организмов.
pH раствора является мерой концентрации ионов водорода в растворе. Раствор с большим количеством ионов водорода кислый и имеет низкое значение pH. Раствор с большим количеством гидроксид-ионов является основным и имеет высокое значение pH. Шкала pH находится в диапазоне от 0 до 14, при этом pH 7 является нейтральным. Буферы — это растворы, которые замедляют изменение pH при добавлении кислоты или основания в буферную систему.Буферы важны в биологических системах из-за их способности поддерживать постоянный уровень pH.
кислота: вещество, которое отдает ионы водорода и, следовательно, снижает pH
адгезия: притяжение между молекулами воды и молекулами другого вещества
основание: вещество, поглощающее ионы водорода и, следовательно, повышающее pH
буфер: раствор, который сопротивляется изменению pH за счет поглощения или высвобождения ионов водорода или гидроксида
когезия: межмолекулярные силы между молекулами воды, вызванные полярной природой воды; создает поверхностное натяжение
испарение: высвобождение молекул воды из жидкой воды с образованием водяного пара
гидрофильный: описывает вещество, растворяющееся в воде; водолюбивый
гидрофобный: описывает вещество, не растворяющееся в воде; водобоязненный
Лакмусовая бумага : фильтровальная бумага , обработанная натуральным водорастворимым красителем, поэтому ее можно использовать в качестве индикатора pH.
Шкала pH: шкала от 0 до 14, которая измеряет приблизительную концентрацию ионов водорода в веществе
растворитель: вещество, способное растворять другое вещество
поверхностное натяжение: сила сцепления на поверхности жидкого тела, которая препятствует разделению молекул
температура: мера молекулярного движения
Список литературы
Хамфри, W., Далке А. и Шультен К., «VMD — визуальная молекулярная динамика», J. Molec. Графика , 1996, т. 14. С. 33-38. http://www.ks.uiuc.edu/Research/vmd/
Атрибуция в СМИ
- Рисунок 2.7. Автор Gautam Dogra
- Рисунок 2.8
- ледяная решетка от Джейн Уитни
- (b) Карлос Понте
- Рисунок 2.10 Кори Занкер
- Рисунок 2.11 Эдварда Стивенса
Понимание свойств воды — Биология старшей школы
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает
или несколько ваших авторских прав, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее
в
информацию, описанную ниже, назначенному ниже агенту. Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как в качестве ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например нам требуется
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; а также
Ваше заявление: (а) вы добросовестно полагаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; а также
Ваше заявление: (а) вы добросовестно полагаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Каковы свойства воды? [Видео]
Мы ежедневно взаимодействуем с водой в ее различных формах. Это простая маленькая молекула — всего два атома водорода и один кислород, но каким-то образом она делает возможной жизнь, которую мы знаем. Сегодня мы собираемся взглянуть на физические свойства молекулы воды и узнать, что делает ее такой особенной.
Сегодня мы собираемся взглянуть на физические свойства молекулы воды и узнать, что делает ее такой особенной.Чтобы понять макроскопические свойства воды, нам нужно сначала понять молекулярные свойства. Итак, давайте начнем с рассмотрения структуры отдельной молекулы воды .
Мы знаем, что химическая формула воды — h3O — два атома водорода, ковалентно связанные с одним кислородом.
Это означает, что водород и кислород отдают электроны для образования каждой связи.Однако, хотя водород и кислород каждый вносят свой электрон в связь, электроны не распределяются между двумя атомами поровну. Кислород на электроотрицательнее на , чем водород, что означает, что кислород «хочет» электронов больше, чем водород.
Это приводит к тому, что электроны проводят больше времени вокруг кислорода, что приводит к возникновению частичного отрицательного заряда на кислороде, обозначаемого δ-.
Так как электроны проводят больше времени рядом с кислородом, они проводят меньше времени с водородом, что приводит к частичному положительному заряду на атомах водорода, который обозначается как δ +. Когда электроны неравномерно распределены в такой ковалентной связи, связь описывается как полярная. Это представлено стрелкой, указывающей на частичное отрицание связи со знаком плюс на частичном положительном конце.
Когда электроны неравномерно распределены в такой ковалентной связи, связь описывается как полярная. Это представлено стрелкой, указывающей на частичное отрицание связи со знаком плюс на частичном положительном конце.
Вы также услышите, что это называется диполем связи .
Итак, мы установили, что каждая связь O-H поляризована, но как насчет всей молекулы воды? Поскольку вода изгибается (в результате двух неподеленных пар на кислороде), атомы водорода находятся по одну сторону от кислорода, поэтому их диполи связей складываются вместе, образуя большой молекулярный диполь.
Другими словами, вода — это высокополярная молекула, в которой одна сторона частично положительна, а другая частично отрицательна.
Итак, что это означает, когда молекулы воды собираются вместе? Поскольку положительные заряды притягиваются к отрицательным зарядам (так называемые электростатические взаимодействия), молекулы воды ориентируются так, что частично положительные атомы водорода находятся рядом с частично отрицательными атомами кислорода различных молекул воды.
Это приводит к образованию водородных связей , взаимодействию между частично положительным водородом и неподеленной парой частично отрицательного акцептора (в данном случае кислорода).Поскольку кислород имеет две неподеленные пары, каждый кислород может образовывать водородные связи с двумя атомами водорода. Таким образом, каждая молекула воды может иметь до четырех водородных связей, что приводит к сильно взаимосвязанной паутине.
Электростатические взаимодействия и водородные связи — это типы межмолекулярных взаимодействий. Эти взаимодействия по отдельности слабые (намного слабее, чем ковалентные связи), но когда их много, они значительно влияют на физические свойства вещества. Давайте рассмотрим это для воды.
Вода очень липкая и липкая. Это из-за его межмолекулярного взаимодействия. В основном, поскольку вода полярна и легко образует водородные связи, она образует сильные взаимодействия с собой и другими полярными молекулами. Другими словами, он прилипает к вещам. Вот почему вода является жидкостью при стандартной температуре и давлении. Межмолекулярные взаимодействия удерживают молекулы вместе, не позволяя им улететь и превратиться в газ. Эти взаимодействия также делают воду хорошим растворителем, настолько, что ее часто называют «универсальным растворителем».Это означает, что многие вещества легко растворяются в воде из-за благоприятных межмолекулярных взаимодействий. Вы часто будете слышать, как эти вещества называют гидрофильными или водолюбивыми, что, опять же, просто означает, что они образуют сильные межмолекулярные взаимодействия с водой.
Мы можем использовать это рассуждение для объяснения других физических свойств воды. Например, почему нужно так долго кипятить кастрюлю с водой? Это связано с тем, что удельная теплоемкость воды является самой высокой среди обычных жидкостей, а это означает, что воде требуется больше тепла (энергии) для повышения своей температуры.Это потому, что для повышения температуры кинетическая энергия молекул воды должна увеличиваться. Но для этого необходимо разорвать водородные связи, что требует дополнительной энергии, в результате чего удельная теплоемкость составляет 1 калорию / грамм C. Сравните это с этанолом, у которого удельная теплоемкость составляет 0,6 калорий на грамм C. почти вдвое больше энергии для повышения температуры воды, чем этанола — все из-за межмолекулярных взаимодействий!
Подобные рассуждения помогают нам понять, почему для плавления и испарения воды требуется значительная энергия.
Во льду молекулы воды находятся в заданной сети водородных связей. Чтобы превратить лед в жидкую воду, эти водородные связи должны быть разорваны (хотя они реформируются в жидкой фазе). Это приводит к высокой скрытой теплоте плавления. Во время процесса испарения молекулы воды переходят в газовую фазу, что требует большого количества энергии, потому что водородные связи должны быть полностью разорваны, чтобы эта молекула высвободилась. Это приводит к большой теплоте испарения.
Обзор
Хорошо, давайте закончим с обзором.Мы исследовали структуру отдельной молекулы воды и установили, что она очень полярна. Это позволяет воде образовывать сильные межмолекулярные взаимодействия (например, водородные связи) между собой и другими полярными молекулами. Эти взаимодействия определяют большую часть физических свойств воды, таких как ее когезионная способность, адгезия и высокая удельная теплоемкость. В более общем плане мы также узнали, что для понимания объемных свойств любого вещества нам сначала нужно понять молекулярные свойства и типы межмолекулярных взаимодействий, которые могут образовывать молекулы.
Мы надеемся, что вы чувствуете себя готовыми и полными сил, спасибо за просмотр!
Свойства воды и их значение для жизни
1. Вода обладает высокой адгезией и адгезией:
Из-за водородных связей между молекулами воды возникает сильное межмолекулярное притяжение. Это называется сплоченностью.
Когда вода образует водородные связи с другим веществом, притяжение называется адгезией. Благодаря сплоченности и адгезии семена набухают и прорастают; происходит подъем сока и капиллярное движение воды.
2. Вода имеет высокое напряжение:
Это происходит из-за сцепления молекул воды. Благодаря этому свойству маленькие организмы плавают или ходят по водной поверхности.
3. Вода имеет высокую удельную теплоемкость и высокую теплоту испарения:
Оба эти свойства обусловлены потребностью большего количества энергии для разрыва водородных связей. Удельная теплоемкость означает количество тепла, поглощаемого или теряемого на 1 грамм. вещества, чтобы изменить его температуру на 1 ° C. У воды высокая удельная теплоемкость (1 калория / г / ° C).Это свойство обеспечивает медленный нагрев воды; поддерживать постоянную температуру живых организмов и окружающей среды.
Вода имеет высокую теплоту парообразования (540 кал. Г · м -1), т.е. около 540 кал. Тепла требуется для превращения 1 г жидкой воды в газ. Таким образом, испарение воды с поверхности снимает избыточную тепловую энергию. Это вызывает охлаждающий эффект листьев, выводит тепло тела через потоотделение и защищает организм от теплового шока.
4. Вода имеет высокую температуру кипения и теплопроводность:
Благодаря этим свойствам вода накапливает и распространяет тепло, а также предотвращает перегрев
5.Вода имеет высокую теплоту плавления:
Вода требует большого количества тепла, чтобы замерзнуть. Это предотвращает замерзание и образование льда в протоплазме даже при очень низкой температуре.
6. Вода имеет меньшую плотность при замерзании:
Вода имеет максимальную плотность при 4 ° C. Но при температуре ниже 4 ° C вода становится менее плотной, потому что из-за этого они расположены отдельно, поэтому лед менее плотен, чем жидкая вода, и плавает на поверхности воды. Лед изолирует подводную пленку от замерзания и защищает водную жизнь.
7. Вода прозрачная:
Это позволяет свету проникать на глубину 200 метров в море и озера. Таким образом, растения продолжают фотосинтез в условиях затопления.
8. Вода имеет высокую диэлектрическую проницаемость:
Противостоит притяжению ионов противоположных зарядов. Из-за этого вода действует как мощный растворитель для солей и многих неионизируемых органических молекул.
9. Вода несжимаемая:
Помогает организмам переносить давление и сжатие.Благодаря этому вода у дождевых червей выполняет роль гидроскелета. Потеря или приток воды вызывает различные движения растений, такие как движение устьиц, сейсмонастия листьев мимозы и т. Д.
10. Вода может ионизироваться:
Небольшое количество воды самопроизвольно диссоциирует на ион водорода (H + ) и гидроксил-ион (OH — ), что зависит от температуры. Это называется ионизацией.
H 2 O ⇋H + OH —
При 25 ° C из 550 миллионов молекул воды ионизируется только одна.В воде H + не существует стабильно и встречается в ассоциации с другой молекулой воды с образованием иона гидроксония (H 3 O + ).
 У него выходило много увлекательных романов, различных рассказов
У него выходило много увлекательных романов, различных рассказов Всё из-за его красоты, пользы и мощи. В России это довольно распространённое растение, встречается повсеместно, относится к семейству Буковые
Всё из-за его красоты, пользы и мощи. В России это довольно распространённое растение, встречается повсеместно, относится к семейству Буковые л. морской соли (соль задерживает воду в организме, а кофе, чай, таблетки, газировка, алкоголь – выводят воду из организма)
л. морской соли (соль задерживает воду в организме, а кофе, чай, таблетки, газировка, алкоголь – выводят воду из организма)
 При замерзании количество воды увеличивается примерно на 10%.Температура замерзания воды при повышении давления (до 19,6 МПа) снижается, а затем повышается. Известно, что конвекция водоема (пресной воды) прекращается при 4°C. At эта температура ниже 25. В слоях есть более плотная вода, чем в верхних слоях. Морская вода замерзает при температуре-1,9°С. Вода в капиллярах почвы может замерзнуть даже при температуре + 4,4°с. Вода обладает очень большой теплоемкостью.
При замерзании количество воды увеличивается примерно на 10%.Температура замерзания воды при повышении давления (до 19,6 МПа) снижается, а затем повышается. Известно, что конвекция водоема (пресной воды) прекращается при 4°C. At эта температура ниже 25. В слоях есть более плотная вода, чем в верхних слоях. Морская вода замерзает при температуре-1,9°С. Вода в капиллярах почвы может замерзнуть даже при температуре + 4,4°с. Вода обладает очень большой теплоемкостью.