Факты о воде
Чистая вода — прозрачная жидкость без вкуса, цвета и запаха. Молекулярная масса воды равна 18,016 а.е.м. Молекула воды нелинейна, угол между связями H-О-H составляет 104°27′. Связи H-О ковалентные полярные, электронная плотность смещена к атому кислорода. Поэтому атом кислорода способен притягивать атом водорода соседней молекулы воды, образуя водородную связь. Из-за высокой полярности молекул вода является уникальным растворителем других полярных соединений.
Таким образом, каждая молекула воды может образовать четыре водородных связи — с участием двух несвязанных электронных пар атома кислорода и двух поляризованных атомов водорода.
Многие свойства воды аномальны, что как раз и вызвано особенностями строения молекулы воды.. Так, вода имеет наибольшую теплоемкость среди жидкостей – 4,1868 кДж/кг, что почти вдвое превышает таковую растительных масел, ацетона, фенола, глицерина, спирта, парафина; и она в 10 раз больше, чем у железа. У воды от 0оС до 37оС градусов теплоемкость снижается, а с 37оС градусов и выше – растет.
Эта особенность пока не объяснена, как утверждает академик А. М. Черняев, однако совпадение с нормальной температурой здорового человека (36,6оС –37,0оС) невольно наводит на размышления. Предположим, если бы вода не обладала этим удивительным качеством, что бы произошло с человеком, состоящим в большем объеме из воды. Тогда бы просто столь высокоорганизованная система не была защищена от воздействия высоких температур. Вряд ли целебные свойства бани-сауны были бы здесь уместны. Уже при 42оС градусах белок необратимо разрушается. Остается только восхищаться, что вода снабдила человека наилучшим режимом теплового саморегулирования.
Аномально изменяется и плотность воды при нагревании-охлаждении. При понижении температуры от 100оС до 3,98оС вода непрерывно сокращается в объеме, и ее плотность составляет порядка 1 г/мл. Но после пересечения границы 3,98оС наступает обратное явление.
Вода обладает самым высоким поверхностным натяжением среди всех жидкостей (за исключением ртути).
Вода — слабый электролит и диссоциирует в очень малой степени. Поэтому дистиллированная вода не проводит электрического тока.
Относительная диэлектрическая постоянная воды равна 80 — это очень высокая величина, чем и объясняется ее способность быть универсальным растворителем.
Природная вода всегда представляет собой раствор различных химических соединений, большей частью солей. В воде, кроме различных солей, растворены также и газы. Современными методами анализа в морской воде найдено две трети химических элементов таблицы Менделеева и, надо полагать, с ростом технических возможностей остальная треть будет обнаружена.
Вода разлагает соли на отдельные ионы. При этом образующиеся ионы могут соединяться с водой в более сложные группы, находящиеся в состоянии диссоциации. Так как молекулы воды являются диполями, то они неизбежно присоединяются к другим частичкам, несущим электрический заряд, и образуют более сложные группы, изменяя структуру воды.
Жесткость воды определяется присутствием в воде солей кальция и магния. При нагревании такой воды на стенках сосуда выделяется осадок. Дождевая вода является наиболее мягкой. Жесткую воду смягчают кипячением или добавлением химических реагентов. Вода является одной из причин коррозии.
Все вышеперечисленные экстраординарные свойства воды наводят на мысль о том, что жидкая вода имеет упорядоченную структуру, благодаря чему воду может нести информацию.
Вода, обработанная магнитным полем, значительно меняет свою биологическую активность. Мало того, «магнитная» вода в некоторых случаях способствует лечению болезней, ран и т. д.
д.
Определенное изменение физических свойств воды происходит под воздействием внешних полей. Известны экспериментальные данные о странном влиянии электрического поля, которое увеличивает скорость испарения воды. Под действием ультразвука уменьшается ее вязкость. Свежесконденсированная вода обладает повышенной плотностью. Интересно и то, что после снятия действия внешних полей вода какое-то время сохраняет вызванные ими аномальные свойства. Эту способность некоторые ученые называют «структурной памятью» воды. Интереснейшее явление, еще до конца не изученное…
Особыми свойствами обладает вода в переходных состояниях, например, при таянии льда. Многим доводилось видеть, как ранней весной среди тающих сугробов появляются проталины, на которых в считанные сутки вырастают растения. Здесь таится немало удивительного, и самое главное – поражает необыкновенно быстрый рост этих растений благодаря талой воде, ускоряющей биологические процессы в растительных организмах.
А найденная в высокогорных озерах Гималаев вода, по предварительным исследованиям, способна лечить людей от диабета, ревматизма, полиартрита и даже от рака. Также в Гималаях был обнаружен феномен Сомати, механизм которого основан на переходе воды, находящейся в организме, в пока неизвестное науке четвертое агрегатное состояние.
Также в Гималаях был обнаружен феномен Сомати, механизм которого основан на переходе воды, находящейся в организме, в пока неизвестное науке четвертое агрегатное состояние.
Более того, как утверждают участники экспедиции, им удалось на основе опытов выяснить, что вода способна передавать информацию. Правда, о механизме накопления и передачи информации водой ученые пока предпочитают умолчать.
Однако все более распространенной становится идея о круговороте воды через информационные поля человечества: в любой момент времени 0,005% от общего запаса воды участвует в процессе круговорота воды. Капля воды примерно в течение 9 дней движется в воздухе и «считывает» информацию полей человечества. Когда она выпадает в виде осадков – может задержаться в леднике на 40 лет, в озере – на 100 лет, в земле – от 200 до 10 000 лет. Молекула воды может оставаться в океане 40 000 лет до того, как опять вступит в круговорот, но, в конце концов, каждая капля воды на Земле проходит полный цикл круговорота в природе, записывая и сохраняя в себе определенное количество информации.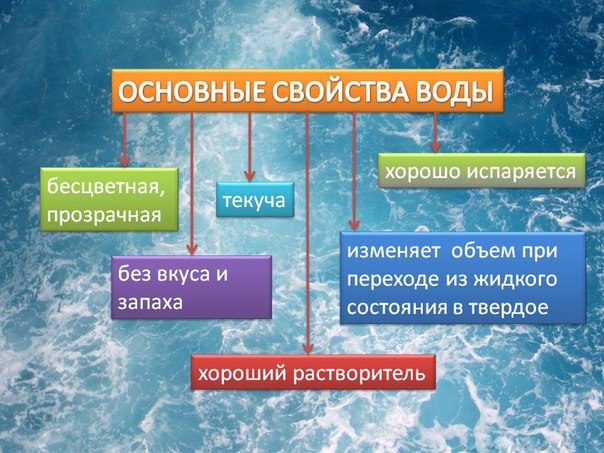
Ученые выяснили структуру воды и объяснили её аномальные свойства
Аномально высокое поверхностное натяжение жидкой воды не только позволяет некоторым насекомым спокойно ходить по её поверхности, но и благодаря капиллярным силам обеспечивает поступление питательных веществ к кронам гигантских деревьев, достигающих нескольких десятков метров в высоту.
Объяснить эти свойства на основании лишь строения и химических параметров молекул воды ученые до последнего времени не могли. Секрет крылся в структуре, в которую самоорганизуются молекулы жидкой воды. Он долгое время оставался неразгаданным, так как изучить эту структуру теми же методами, что применяются для изучения строения твердых тел, практически невозможно.
Команда Андерса Нильсона (Anders Nilsson), ведущего специалиста Стенфордского центра синхротронного излучения (Stanford Synchrotron Radiation Lightsource), сумела преодолеть эти трудности благодаря новейшим методам изучения строения жидкостей с использованием мощного рентгеновского излучения, получаемого с помощью больших ускорителей элементарных частиц, называемых синхротронами.
Ученые выяснили, что существовавшие до сих пор представления о молекулярной структуре воды были неверными — оказалось, что её молекулы формируют не одну структуру, а одновременно два типа структур, сосуществующих в жидкости вне зависимости от температуры. Один тип структуры формируется в виде сгустков примерно по 100 молекул, структура которых напоминает структуру льда. Второй тип структуры, окружающей сгустки, гораздо менее упорядочен.
Увеличение температуры вплоть до точки кипения воды приводит к некоторому искажению структуры сгустков и уменьшению их количества и доминированию разупорядоченной структуры.
«Этот процесс можно представить как танцевальный клуб, где часть людей сидит за столиками, отражая упорядоченную компоненту воды, а часть находясь в толпе, непрерывно перемещается в танце, отражая разупорядоченную. Увеличение температуры воды в этом случае можно сравнить с всеобщим поднятием настроения и ускорением музыки, когда люди начинают вставать из-за столов и присоединяться к танцующим, а часть пустующих столов и вовсе убирается для высвобождения места. Охлаждение — обратный процесс, когда танцпол заполняется столами, и за них присаживаются утомленные танцами гости клуба. При этом при одной и той же «температуре» танцующие и сидящие люди постоянно меняются местами — некоторые присаживаются отдохнуть а некоторые наоборот идут танцевать, тогда как общее соотношение танцующих и сидящих остается прежним» — пояснил результаты работы Нильсон, слова которого приводит пресс-служба Стенфордского центра линейных ускорителей в США.
Охлаждение — обратный процесс, когда танцпол заполняется столами, и за них присаживаются утомленные танцами гости клуба. При этом при одной и той же «температуре» танцующие и сидящие люди постоянно меняются местами — некоторые присаживаются отдохнуть а некоторые наоборот идут танцевать, тогда как общее соотношение танцующих и сидящих остается прежним» — пояснил результаты работы Нильсон, слова которого приводит пресс-служба Стенфордского центра линейных ускорителей в США.
Это, в частности, объясняет нелинейную зависимость плотности воды от температуры — упорядоченные скопления молекул имеют меньшую плотность, чем неупорядоченные, и она мало меняется с изменением температуры, которую можно сравнить с постоянным размером столов, не зависящим от настроения собравшихся или громкости музыки в ресторане.
Удивительные и странные свойства воды
«Вода, у тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобою наслаждаются, не ведая, что ты такое. Нельзя сказать, что ты необходима для жизни: ты сама жизнь. Ты восполняешь нас радостью, которую не объяснишь нашими чувствами. С тобою возвращаются к нам силы, с которыми мы уже простились. По твоей милости в нас вновь Нельзя сказать, что ты необходима для жизни: ты сама жизнь. Ты восполняешь нас радостью, которую не объяснишь нашими чувствами. С тобою возвращаются к нам силы, с которыми мы уже простились. По твоей милости в нас вновьначинают бурлить высохшие родники нашего сердца.» (Антуан де Сент Экзюпери). |
«Нет ничего мягче и слабее воды, и нет ничего, что бы превосходило ее в разрушительной атаке на все жесткое и сильное». Китайский мудрец Лао-Цзы именно так ее охарактеризовал в одном из своих древних текстов Также парадоксально, что вода хорошо знакома нам (из нее на две трети состоит наше тело и на три четверти наша планета) и в то же время чрезвычайно загадочна. Несмотря на то, что вы много о ней знаете, многие из ее свойств могут вас удивить. Другие же являются настолько странными, что до сих пор ускользают от научного понимания. Дефицит воды в человеческом и любом другом живом организме вызовет весьма скоротечное обезвоживание. В таком случае страдает прежде всего нервная система, больше всего состоящая из воды, а затем и другие системы жизнеобеспечения. Поэтому главное полезное свойство воды — это обеспечение жизнедеятельности всех живых существ.
Дефицит воды в человеческом и любом другом живом организме вызовет весьма скоротечное обезвоживание. В таком случае страдает прежде всего нервная система, больше всего состоящая из воды, а затем и другие системы жизнеобеспечения. Поэтому главное полезное свойство воды — это обеспечение жизнедеятельности всех живых существ.
Прежде всего главной составляющей крови является именно вода. Кровь разносит по всем системам органов полезные вещества, минералы и соли, поэтому чем больше в нее поступает чистой воды, тем лучше. Органом, наиболее подверженным заболеваниям из-за нехватки жидкости, являются почти. Из-за этого они сильно нагружаются, а затем перестают выводить токсины в достаточном объеме Высококвалифицированные специалисты утверждают, что талую воду применяют при лечении атеросклероза; холодную воду эффективно использовать при рвоте, головокружении, перегревании; токсическом и пищевом отравлении, обмороках и повышенной температуре тела; горячая вода снижает спазмы при менструальном цикле, обильно выводя кровь, а также помогает в улучшении пищеварения. Противореча школьным урокам физики, вода имеет вовсе не три агрегатных состояния — жидкое, твердое (лед и снег) и газообразное (пар). Сейчас известно, что вода как вещество способна существовать в пяти, а не трех, агрегатных состояниях, и это только в жидком виде. А в твердом — в целых четырнадцати! Ни одно вещество на Земле не может поглощать тепло так, как вода. Теплоемкость воды намного больше теплоемкости стали и даже ртути Вода обладает способностью отдавать и поглощать тепло, климат Земли в один миг стал бы совершенно непригодным для существования любых разумных форм жизни: высокие широты подверглись бы влиянию ужасного холода, а в низких широтах царствовало бы испепеляющее солнце.. Подземный океан обеспечивает нашу планету теплом благодаря внутренним источникам Земли. Ученые выделяют, как минимум, 5 различных состояний воды в жидком виде и 14 состояний в замерзшем виде. Физики обнаружили, что нейтроны, направленные на молекулы воды, «видят» на 25% меньше протонов водорода, чем ожидалось.
Противореча школьным урокам физики, вода имеет вовсе не три агрегатных состояния — жидкое, твердое (лед и снег) и газообразное (пар). Сейчас известно, что вода как вещество способна существовать в пяти, а не трех, агрегатных состояниях, и это только в жидком виде. А в твердом — в целых четырнадцати! Ни одно вещество на Земле не может поглощать тепло так, как вода. Теплоемкость воды намного больше теплоемкости стали и даже ртути Вода обладает способностью отдавать и поглощать тепло, климат Земли в один миг стал бы совершенно непригодным для существования любых разумных форм жизни: высокие широты подверглись бы влиянию ужасного холода, а в низких широтах царствовало бы испепеляющее солнце.. Подземный океан обеспечивает нашу планету теплом благодаря внутренним источникам Земли. Ученые выделяют, как минимум, 5 различных состояний воды в жидком виде и 14 состояний в замерзшем виде. Физики обнаружили, что нейтроны, направленные на молекулы воды, «видят» на 25% меньше протонов водорода, чем ожидалось. Вода хранит любую информацию.
Вода хранит любую информацию.
Альтернативная официальной медицине гомеопатия утверждает, что разбавленный раствор лекарственного препарата может оказывать лечебный эффект на организм, даже если коэффициент разбавления настолько велик, что в растворе уже не осталось ничего, кроме молекул воды. Японский ученый Масару Емото более двадцати лет изучает кристаллы воды. Оказалось, что кристаллы воды, к которой до начала кристаллизации «обратились» с такими словами, как «доброта», «любовь», «ангел», «благодарность», имели правильную структуру, симметричную форму и были украшены сложным, красивым орнаментом.
Но если воде были сообщены слова типа «зло», «ненависть», «злоба», «то кристаллы получались мелкими, деформированными, уродливыми на вид. Воде не важно, на каком языке с ней общаются, она понимает любую речь. Вода способна воспринимать и отображать такие человеческие эмоции, как страх, боль, страдание. «Прослушав» сочинения Бетховена, «Аве Марию» Шуберта или «Свадебный марш» Мендельсона, она образует кристаллы фантастической красоты. А когда воде сообщили названия пяти основных мировых религий — христианство, буддизм, индуизм, ислам, и иудаизм, из нее образовался пятиугольный кристалл, и в нем просматривались контуры человеческого лица! Вода в нашей жизни — самое обычное и самое распространенное вещество. Однако с научной точки зрения это самая необычная, самая загадочная жидкость. Нет предела человеческому разуму, нет предела его возможностям; и то, что мы теперь так много знаем о природе и свойствах поистине самого необыкновенного в мире вещества — о воде, открывает еще большие возможности. Кто может сказать, что еще будет узнано, что открыто нового, еще более необычайного? Надо только уметь видеть и удивляться. Вода, как и все в мире, неисчерпаема. Эти свойства- подарок всему живому на Земле.
А когда воде сообщили названия пяти основных мировых религий — христианство, буддизм, индуизм, ислам, и иудаизм, из нее образовался пятиугольный кристалл, и в нем просматривались контуры человеческого лица! Вода в нашей жизни — самое обычное и самое распространенное вещество. Однако с научной точки зрения это самая необычная, самая загадочная жидкость. Нет предела человеческому разуму, нет предела его возможностям; и то, что мы теперь так много знаем о природе и свойствах поистине самого необыкновенного в мире вещества — о воде, открывает еще большие возможности. Кто может сказать, что еще будет узнано, что открыто нового, еще более необычайного? Надо только уметь видеть и удивляться. Вода, как и все в мире, неисчерпаема. Эти свойства- подарок всему живому на Земле.
Материал подготовила врач ОМП ГУЗ «ЕГБ №2» И.С.Бурлакова
Исследование свойств воды при кристаллизации
- Участник:Ковалёв Павел Алексеевич
- Руководитель:Шик Галина Яковлевна

Вступление
Вода является не только одним из самых необходимых, но и самых удивительных явлений на нашей планете. Исключительно важна роль воды в возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле.
Введение
Большая часть поверхности Земли покрыта водой (океаны, моря, озёра, реки, льды). На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % – ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках, которые образуются из взвешенных в воздухе частиц льда и жидкой воды.
Вода при нормальных условиях находится в жидком состоянии, однако при температуре в 0 °C она переходит в твердое состояние – лед и кипит (превращается в водяной пар) при температуре 100 °C.
Значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию».
Лёд встречается в природе в виде собственно льда (материкового, плавающего, подземного), а также в виде снега, инея, изморози. Под действием собственного веса лёд приобретает пластические свойства и текучесть.
Природный лёд обычно значительно чище, чем вода, так как при кристаллизации воды в первую очередь в решётку встают молекулы воды.
Общие запасы льда на Земле около 30 млн. км³. Основные запасы льда сосредоточены в полярных шапках (главным образом, в Антарктиде, где толщина слоя льда достигает 4 км).
В мировом океане вода солёная и это препятствует образованию льда, поэтому лёд образуется только в полярных и субполярных широтах, где зима долгая и очень холодная. Замерзают некоторые неглубокие моря, расположенные в умеренном поясе.
Кроме того, имеются данные о наличии льда на планетах Солнечной системы (например, на Марсе), их спутниках, на карликовых планетах и в ядрах комет.
Исследование свойств воды необходимо для человечества.
При этом процесс кристаллизации воды можно изучать в домашних условиях, а также на уроках в средней школе.
Актуальность работы использование на уроках физики, для знакомства учащихся со свойствами воды при кристаллизации.
Объектом исследования является кристаллизация воды.
Предмет исследования – изучения свойств воды при кристаллизации.
Цель работы провести опыты по кристаллизации воды и подготовить предложения по их проведению.
Главной задачей является изучение свойств воды при кристаллизации.
Для решения главной задачи необходимо:
- Повести анализ основных свойств воды.
- Изучить значение кристаллизации воды для флоры и фауны Земли.
- Определить основные опыты для проведения исследования.
- Провести опыты и описать основные результаты.
- Подготовить предложения по проведению опытов на уроках в средней школе.

Теоретическая значимость работы заключается в систематизации основных свойств воды и значения кристаллизации воды для флоры и фауны Земли.
Практическая значимость работы – изучение процесса кристаллизации воды во время проведение опытов, а также подготовка предложений по проведению опытов на уроках в средней школе.
1. Подготовка к исследованию
1.1 Анализ основных свойств воды
Вода является одним из самых удивительных веществ на планете Земля. Встретить воду можно практически везде в естественных условиях как на поверхности планеты, так и в ее недрах в трех возможных физических состояниях для веществ: жидкое, твердое, газообразное (то есть вода, лед, водяной пар).
Конечно, существуют вещества, которые можно получить в виде жидкости, твердого тела или газа. Однако, не существует подобного химического вещества, которое именно в естественных условиях встречается в указанных выше трех физических состояниях.
Свойства воды:
- Вода является веществом, которое не имеет ни цвета, ни запаха, ни вкуса.
- Вода является единственным на планете Земля известным науке веществом, встречающимся в природных условиях в трех физических состояниях: твердое тело, жидкость, газ.
- Вода является универсальным растворителем, имея возможность растворять большее количество солей, а также других веществ, чем какие-либо другие вещества.
- Вода с большим трудом поддается окислению. Вода — достаточно химически устойчива, то есть разложить ее на составные части или сжечь достаточно проблематично.
- Окислению водой поддаются практически все естественные металлы, так же под ее воздействием разрушаются особо твердые горные породы.
- При замерзании вода обладает уникальными свойствами расширения. Благодаря таким свойствам лед на воде, которая находится в виде жидкости, плавает.
- Вода, как физическое вещество, характеризуется большим сродством сама с собой.
 Такое сродство у воды является самым большим среди всех жидкостей. Вследствие этого вода на поверхности размещается в виде капель сферической формы, поскольку сфера обладает наименьшей при заданном объеме поверхностью.
Такое сродство у воды является самым большим среди всех жидкостей. Вследствие этого вода на поверхности размещается в виде капель сферической формы, поскольку сфера обладает наименьшей при заданном объеме поверхностью. - Замерзание воды происходит не при температурных условиях ее наибольшей плотности (при 4 градусах Цельсия), а при нуле градусов Цельсия. Это свойства пресной воды. Однако, замерзание морской воды происходит при более низких температурах: минус 1,9 градусов Цельсия, при солености 35%.
- Вода обладает очень высокой теплоемкостью, относительно мало нагреваясь при этом. Также вода обладает достаточно высокой скрытой теплотой плавления (порядка 80 кал/г), а также испарения ( порядка 540 кал/г). Вода способна поглощать значительные объемы дополнительного тепла. Температура же в процессе замерзания или при кипении остается неизменной.
- Дистиллированная вода практически не проводит электрический ток, однако наличие в воде даже небольшого количества солей значительно увеличивает ее токопроводящие свойства.

Свойства снега:
- При смешивании соли со снегом наблюдается два процесса: разрушение кристаллической структуры соли, которое происходит с поглощением тепла, и гидрация ионов. Последний процесс происходит с выделением тепла в окружающую среду. Для поваренной соли и хлористого кальция первый процесс превалирует над вторым. Поэтому при смешивании снега с этими солями происходит активный отбор тепла из окружающей среды. Ещё одна особенность соляных растворов состоит в том, что их точка замерзания ниже 0 градусов. Чтобы снег на тротуарах таял при температуре ниже 0 градусов, его посыпают этими солями.
- Снег обладает удивительным свойством – памятью. Он сохраняет следы. По следам можно, например, изучать физику. Чем крупнее животное, тем глубже от него след, следовательно, тем большее давление оно оказывает на снег. Следы собаки более глубокие, чем следы её щенков. Мыши, ласки оставляет неглубокие чёрточки. Природа снабдила копытных животных способностью раздвигать копыта и увеличивать площадь опоры.
 Это помогает им зимой при передвижение по заснеженному лесу и полям не так глубоко погружаться в снег.
Это помогает им зимой при передвижение по заснеженному лесу и полям не так глубоко погружаться в снег.
1.2 Значение кристаллизации воды для флоры и фауны
Мы любим снег не только за то, что он дарит нам великолепные зимние пейзажи. У нашей любви к снегу немало рациональных причин. «Снег на полях — хлеб в закромах», «Зима без снега – лето без хлеба», – справедливо утверждают старинные русские пословицы. Снежный покров — это огромный запас влаги, столь необходимый полям, в то же время это своеобразное гигантское одеяло, защищающее поверхность земли от холодных ветров. Академик Б. И. Вернадский подчеркивал, что снежный покров — «не просто теплая покрышка озимых, это живительная покрышка», весной он дает талые воды, насыщенные кислородом. Известно, что количество азотистых соединений летом в почве пропорционально высоте сошедшего снежного покрова. Недаром снежная мелиорация рассматривается сегодня как одно из важнейших условий получения высоких и устойчивых урожаев.
Запасы снега существенно влияют на уровень воды в реках, определяют изменения климата на больших территориях.
Кроме того, снег является хорошим строительным материалом для различных построек на севере — от иглу (жилищ эскимосов) до больших складских помещений. Существует самая большая в мире гостиница, полностью сделанная изо льда и снега, находится она в шведской Лапландии в 200 километрах от Северного полярного круга.
Он служит основой зимних дорог и даже аэродромов.
Благодаря снегу мы каждый год любуемся сказочными зимними пейзажами, играем в снежки, строим снежные городки, крепости, катаемся на лыжах, санках, в снежном уборе приходит к нам прекрасный новогодний праздник.
Значение льда трудно недооценить. Лёд оказывает большое влияние на условия обитания и жизнедеятельности растений и животных, на разные виды хозяйственной деятельности человека. Покрывая воду сверху, лед играет в природе роль своего рода плавучего экрана, защищающего реки и водоемы от дальнейшего замерзания и сохраняющего жизнь подводному миру. Если бы плотность воды увеличивалась при замерзании, лед оказался бы тяжелее воды и начал тонуть, что привело бы к гибели всех живых существ в реках, озерах и океанах, которые замерзли бы целиком, превратившись в глыбы льда, а Земля стала ледяной пустыней, что неизбежно привело бы к гибели всего живого.
Если бы плотность воды увеличивалась при замерзании, лед оказался бы тяжелее воды и начал тонуть, что привело бы к гибели всех живых существ в реках, озерах и океанах, которые замерзли бы целиком, превратившись в глыбы льда, а Земля стала ледяной пустыней, что неизбежно привело бы к гибели всего живого.
Лёд может вызывать ряд стихийных бедствий с вредными и разрушительными последствиями – обледенение летательных аппаратов, судов, сооружений, дорожного полотна и почвы, град, метели и снежные заносы, речные заторы с наводнениями, ледяные обвалы и др. Природный лёд используется для хранения и охлаждения пищевых продуктов, биологических и медицинских препаратов, для чего он специально производится и заготавливается.
1.3 Выбор и обоснование опытов для проведения исследования
Для проведения опытов с водой необходимо выбрать те, которые наиболее полно характеризуют и подтверждают свойства воды.
Проведенный анализ показал, что лучше всего это будет реализовано при выполнении следующих опытов:
- Замерзание соленой воды.

- Расширение воды при замерзании.
- Замерзание жидкости при внешнем воздействии снега.
- Замерзание мыльных пузырей.
- Срастание сосульки.
- Скрип сухого снега.
- Примерзание к поверхности.
2. Проведение исследования
2.1 Подготовка материальной части
Для проведения опытов были взяты:
- предметы – кастрюля, стеклянная бутылка, пластиковая бутылка, одноразовые стаканы, тонкая медная проволока, трубочка;
- вещества – снег, сосулька, соль, вода, мыльный раствор, сок.
2.2 Проведение опытов с описанием основных результатов
1. Замерзание соленой воды.
Налейте в две формочки воду – чистую и очень солёную. Вынесите формочки на мороз или поставьте в морозильную камеру. Вы заметите, что чистая пресная вода превратилась в лёд, а солёная замёрзнет при очень сильном морозе.
Замерзание воды происходит не при температурных условиях ее наибольшей плотности (при 4 градусах Цельсия), а при нуле градусов Цельсия. Это свойства пресной воды.
Это свойства пресной воды.
При этом, морской лед отличается от пресноводного в ряде отношений. У соленой воды температура замерзания понижается по мере увеличения солености. В диапазоне солености от 30 до 35 промилле точка замерзания меняется от -1.6 до -1.9 град. Образование морского льда можно рассматривать как замерзание пресной воды с вытеснением солей в ячейки морской воды внутри толщи льда. Когда температура достигает точки замерзания, образуются ледяные кристаллы, которые «окружают» не замерзшую воду.
2. Расширение воды при замерзании.
Наполните водой пластиковый стакан, пластиковую бутылку и стеклянную бутылку. Выставьте их на мороз. Замерзая, вода увеличивается в объёме, «вылезает» из стакана, стеклянную бутылку разрывает даже в том случае, когда она заполнена наполовину. Пластиковая бутылка остаётся без видимых изменений.
При замерзании вода обладает уникальными свойствами расширения. Благодаря таким свойствам лед на воде, которая находится в виде жидкости, плавает.
Зимой из-за этого свойства воды происходят аварии на водопроводах. В сильные морозы основная причина таких аварий – замерзание текучей воды. Происходит ее расширение, так что образующийся лед легко разрывает трубы, так как плотность льда – 917 кг/м3, а плотность воды – 1000 кг/м3, то есть объем увеличивается в 1,1 раза, что довольно существенно.
3. Замерзание жидкости при внешнем воздействии снега.
Налейте в пластиковый стакан (пробирку) сок и поставьте его в кастрюлю с солёным снегом. Сок замёрзнет, и очень скоро вы будете лакомиться фруктовым льдом.
При смешивании соли со снегом наблюдается разрушение кристаллической структуры соли, которое происходит с поглощением тепла. Поэтому при смешивании снега с солью происходит активный отбор тепла из сока и сок превращается в лед.
4. Замерзание мыльных пузырей.
Приготовьте мыльный раствор. Раствор на морозе держите в рукавице, чтобы он не замёрз. Выдувайте пузыри трубочкой для сока. Из-за разности температур изнутри пузыря и снаружи возникает большая подъёмная сила, мгновенно уносящая пузыри вверх. Тонкая мыльная плёнка на морозе быстро замерзает, превращая пузыри в ледяные шарики.
Выдувайте пузыри трубочкой для сока. Из-за разности температур изнутри пузыря и снаружи возникает большая подъёмная сила, мгновенно уносящая пузыри вверх. Тонкая мыльная плёнка на морозе быстро замерзает, превращая пузыри в ледяные шарики.
Таким образом, тончайшая пленка мыльного пузыря замерзает за считанные секунды.
5. Срастание сосульки.
Возьмите сосульку. Перекиньте через неё тонкую проволоку, концы которой утяжелите грузиками. Наблюдайте, как проволока растапливает лёд, проникает всё глубже в сосульку. Вода над сосулькой вновь замерзает.
Это подтверждает свойство поглощения тепла большей массой льда.
Лед нарастает снизу, сразу над проволокой, так как стекающая вниз талая вода замерзает при соприкосновении с холодными стенками сосульки.
6. Скрип сухого снега.
Насыпьте в тарелку сахарный песок горкой и начните давить его ложкой. Вы услышите характерный скрип. Намочите песок и вновь разотрите. Скрип исчез. В морозные дни звук распространяется на большие расстояния.
Скрип исчез. В морозные дни звук распространяется на большие расстояния.
Снег скрипит только в мороз (ниже -5°C), и звук скрипа меняется в зависимости от температуры воздуха – чем крепче мороз, тем выше тон скрипа. При достаточном опыте можно оценивать температуру воздуха по звуку, который издает скрипящий снег. Скрип образуется из-за того, что при давлении разрушаются мельчайшие кристаллики снега. Причем каждый из них по отдельности очень мал, чтобы издавать звук, доступный уху человека, но вместе они ломаются довольно громко. Усиление морозов делает ледяные кристаллики более твердыми и хрупкими. При каждом шаге ледяные иглы ломаются. При температуре воздуха ниже -50°C скрип снега становится таким сильным, что его можно слышать через тройные стекла (этому способствует также большая плотность морозного воздуха).
7. Примерзание к поверхности.
Добавьте в кастрюлю со снегом поваренную соль в соотношении примерно 1 к 6. Тщательно размешайте смесь. Если теперь вы захотите переставить кастрюлю, то её придётся поднять вместе с табуретом.
Если теперь вы захотите переставить кастрюлю, то её придётся поднять вместе с табуретом.
Это также подтверждает поглощение тепла из окружающей среды.
При смешивании соли со снегом происходит образование раствора, сопровождающееся сильным охлаждением вследствие большого поглощения теплоты льдом при его плавлении и солью при ее растворении. Так, например, температура смеси из 29 грамм соли и 100 грамм льда понижается до – 21°С. А если взять 143 грамма соли и 100 грамм льда, то температура может быть понижена до – 55°С.
2.3 Предложения по проведению опытов
Опыты по изучению свойств воды целесообразно проводить на уроках в средней и начальной школе.
При этом для детей начальной школы рекомендуется проведение опытов № 1 и 2 в домашних условиях под присмотром родителей.
Для учеников средней школы возможно проведение опытов № 3, 6 и 7 на уроках под руководством учителя, а опыты № 4 и 5 – факультативно или самостоятельно в домашних условиях.
Заключение
Таким образом, исследование свойств воды необходимо для человечества.
Процесс кристаллизации воды можно изучать в домашних условиях, а также на уроках в средней и начальной школе.
В работе удалось решить следующие задачи:
- Повести анализ основных свойств воды.
- Изучить значение кристаллизации воды для флоры и фауны Земли.
- Определить основные опыты для проведения исследования.
- Провести опыты и описать основные результаты.
- Подготовить предложения по проведению опытов на уроках в средней школе.
Значимость работы по систематизации основных свойств воды и значения кристаллизации воды для флоры и фауны Земли подтвердилась.
Цель достигнута.
Оптические свойства воды и парадокс алмазов.
Какого цвета вода? На этот вопрос нельзя точно ответить. Она может быть прозрачной, голубой, синей. Оптические свойства Н2О зависят от ее освещенности, цвета, прозрачности. Чистая вода без примесей будет абсолютно прозрачной, тогда как в природных водоемах жидкость может иметь разнообразные оттенки.
Она может быть прозрачной, голубой, синей. Оптические свойства Н2О зависят от ее освещенности, цвета, прозрачности. Чистая вода без примесей будет абсолютно прозрачной, тогда как в природных водоемах жидкость может иметь разнообразные оттенки.Прозрачность оценивается длиной луча, проходящей через толщу воды. В жидком состоянии ультрафиолетовые лучи практически не задерживаются водой, тогда как лед отражает практически 98 % УФ-излучения. Инфракрасные лучи способны проникнуть только в верхние слои водных масс – именно поэтому на инфракрасных фото вода имеет черный цвет. Из-за поглощения оранжевых и красных компонентов света вода приобретает голубоватый оттенок.
Чистая вода океана имеет синий цвет, при этом при рассеянном освещении он приобретает серый оттенок. Если на воде рябь, интенсивной серого увеличивается, причем, с наветренной стороны менее, чем с подветренной.
Эталоном прозрачности воды в природных водоемах является Саргассово море. На глубине до 66 метров в нем виден белый диск.
 А снизу вверх видимость составляет 100 метров. Прозрачность вод рек, озер, океанов изменяется в зависимости от времени года. Весной во время паводков она снижается из-за поступления большого количества примесей.
А снизу вверх видимость составляет 100 метров. Прозрачность вод рек, озер, океанов изменяется в зависимости от времени года. Весной во время паводков она снижается из-за поступления большого количества примесей.Алмазы в воде
Из-за способности преломлять лучи вода может выполнять роль увеличительного стекла. Палочка, опущенная в воду, визуально будет толще, чем ее фрагмент над водой.
А вот если в воду положить бриллиант, он перестанет быть виден. Происходит это по причине полного преломления света на гранях камня. Но эта особенность характерна только для чистой воды, без примесей.
Парадокс воды и алмазов
Существует парадокс Смита. Заключается он в том, что второстепенные блага (драгоценные металлы, алмазы) в природе редки, их полезность для человека ниже и не удовлетворяет насущные потребности. При этом цена таких благ несравнимо выше первостепенных – воды, хлеба, одежды.
Объясняется это тем, что на цену товара/услуги влияет предельная полезность. Да, первый кувшин воды для человека, испытывающего жажду, будет ценным, второй – менее.
 После 6-7 полезность стремится к нулю, так как базовая потребность удовлетворена. При этом алмазов в мире чрезвычайно мало на фоне объемов воды, соответственно, предельная полезность с трудом может быть достигнута для подавляющего числа жителей планеты.
После 6-7 полезность стремится к нулю, так как базовая потребность удовлетворена. При этом алмазов в мире чрезвычайно мало на фоне объемов воды, соответственно, предельная полезность с трудом может быть достигнута для подавляющего числа жителей планеты.Парадокс стоимости воды и алмазов положил начало исследованию проблемы предельных величин. На ценность предмета, вещества влияет субъективная оценка человека. Поэтому наиболее ценными являются редкие товары/услуги.
Доступная чистая вода
Хоть вода и менее ценна, чем алмазы, тем не менее, она удовлетворяет одну из наших базовых потребностей – обеспечивает организм необходимой жидкостью, без нее он просто не сможет функционировать. Мы предлагаем вам покупать воду в 19 литровых бутылях. Такой объем удобен для установки в кулер или для использования с помпой. Обратите внимание, что доставка воды в офис в нашей компании стоит недорого. Мы также оказываем услуги аренды и санации кулеров. Чтобы заказать воду в офис, просто позвоните или оставьте заявку на сайте.
 Развозка проводится в рабочее время по территории Москвы и Московской области. Вода в 19 литровых бутылях доставляется в любом требуемом количестве.
Развозка проводится в рабочее время по территории Москвы и Московской области. Вода в 19 литровых бутылях доставляется в любом требуемом количестве.Удивительные свойства воды — Purewaterservice
Вы никогда не задумывались о необыкновенных свойствах такого, казалось бы, простого и распространенного вещества, как вода? Почему именно она стала колыбелью жизни на нашей планете и фактически является ее синонимом, ибо там, где нет воды, нет и ничего живого?
Ученые выяснили, что данный феномен содержит в себе множество загадок, большинство из которых пока не разгаданы.
Например, научно доказан факт того, что обычная питьевая вода имеет свою энергетику и обладает способностью к запоминанию информации. Поэтому некоторые экстрасенсы практикуют считывание информации именно по стакану с водой.
В традициях одной из основных мировых религий – христианстве – вода также имеет огромное значение: освящая ее при помощи креста, в нее погружают младенца при крещении, ею исцеляют физические и духовные недуги человека, а принятие святой воды после исповеди, согласно верованиям православных и католиков, освобождает душу от грехов.
 Кстати, после обряда освящения вода реально становится другой – будучи замороженной, она меняет свою кристаллическую решетку, что свидетельствует об изменении ее физических свойств. В некоторых случаях освященная в день Крещения Господня вода способна годами храниться в обычных условиях, не «зацветая». Порой приходится слышать, что этому якобы способствуют ионы серебра, растворяющиеся в воде, когда в нее опускают крест из этого металла. Но освящение воды возможно и деревянным крестом. Правда, сохраняется она в таком состоянии не всегда: священники утверждают, что, сталкиваясь с людской греховностью, святая вода может вновь стать самой обыкновенной.
Кстати, после обряда освящения вода реально становится другой – будучи замороженной, она меняет свою кристаллическую решетку, что свидетельствует об изменении ее физических свойств. В некоторых случаях освященная в день Крещения Господня вода способна годами храниться в обычных условиях, не «зацветая». Порой приходится слышать, что этому якобы способствуют ионы серебра, растворяющиеся в воде, когда в нее опускают крест из этого металла. Но освящение воды возможно и деревянным крестом. Правда, сохраняется она в таком состоянии не всегда: священники утверждают, что, сталкиваясь с людской греховностью, святая вода может вновь стать самой обыкновенной.Еще одна великая тайна воды – ее появление на нашей планете. Современные ученые считают, что первая вода появилась на Земле в ее «ранней юности» — почти четыре миллиарда лет тому назад. Именно тогда она подверглась мощнейшей бомбардировке астероидами, поверхность которых состояла изо льда. Растаяв, он превратился в воду, покрывшую собой земную поверхность.
 При этом часть ледяных астероидов, ударяясь о Землю, превратилась в облака пара, которые поднялись вверх, а затем вернулись обратно в виде осадков.
При этом часть ледяных астероидов, ударяясь о Землю, превратилась в облака пара, которые поднялись вверх, а затем вернулись обратно в виде осадков.Таким образом, вода – самый настоящий «пришелец из космоса»! Как тут не прислушаться к астрологам, уверяющим, что вода способна обмениваться информацией со Вселенной?
Морская вода – еще одна «ипостась» этой необыкновенной жидкости. Будучи в основной своей массе соленой и непригодной для питья, она, тем не менее, является настоящим целебным эликсиром, способным излечить человека от множества хворей. Недаром большинство курортов располагаются именно вдоль морских берегов. Полезные микроэлементы и минералы присутствуют в морской воде в форме ионов и потому легко усваиваются нашим организмом.
А ученые, опять-таки, утверждают, что по своему составу морская вода крайне схожа плазме нашей крови… случайность? Может быть… а может быть и нет.
Вода — это часть нашей жизни, а чистая вода — это неотъемлемая часть здоровья в нашей жизни.
 Мы заботится о чистой воде у вас дома, в квартире, на работе в офисе и предприятии, и предлагаем лучшие решения в области систем очистки воды: пурифайеры для коллективов на работе, бытовые фильтры для дома и квартиры, системы очистки воды для коттеджей и промышленных предприятий.
Мы заботится о чистой воде у вас дома, в квартире, на работе в офисе и предприятии, и предлагаем лучшие решения в области систем очистки воды: пурифайеры для коллективов на работе, бытовые фильтры для дома и квартиры, системы очистки воды для коттеджей и промышленных предприятий.Физические свойства воды, ПДК
Цветность
Показатель, выражающий интенсивность окрашивания воды и измеряемый в градусах платино-кобальтовой шкалы. Цветность воды определяется методом сравнения с эталонными образцами. Природные воды могут варьировать показатель цветности в широких пределах — от единиц до тысячи градусов. Высокая цветность — неблагоприятный показатель качества воды.
Визуальный показатель цветности для питьевой воды — не более 35 градусов по платино-кобальтовой шкале.
Качество воды в рекреационных зонах водоемов тоже нормируется по цветности — она не должна визуально обнаруживаться в столбике воды высотой 10 см.
Мутность
Характеристика мутности обусловлена присутствием в воде тонкодисперсных загрязнителей. Примеси могут быть в нерастворимой или в коллоидной форме, а по происхождению — органическими и неорганическими.
При лабораторных исследованиях качество воды мутность описывают, обращая внимание на следующие визуальные данные: слабая или заметная опалесценция; слабая, заметная или сильная муть.
Мутность питьевой воды не должна превышать 1,5 мг/дм³ по каолину, то есть должна быть не выше мутности стандартного образца с указанной концентрацией примеси.
Метод определения мутности — турбидиметрический, с использованием оптических свойств растворов. Мутность исследуемого образца сравнивают с мутностью стандартных растворов, результаты измерений выражают в мг/дм³ (для каолина).
Если в качестве стандартного образца используют суспензию формазина, мутность выражают в единицах мутности на кубический дециметр — ЕМ/дм³.
1,5 мг/дм³ по каолину соответствуют мутности 2,6 ЕМ/дм³ по формазину.
Запах
Запах воды обусловлен природой и концентрацией растворенных в ней веществ. На интенсивность запаха влияют факторы температуры, показатель pH, степень загрязнения источника водоснабжения, биологические и гидрологические факторы.
Запах воды — органолептический показатель. Интенсивность запаха измеряют и нормируют в баллах:
- 0 — отсутствие запаха (нет ощутимого запаха).
- 1 — очень слабый запах, не ощущаемый потребителем, но отмечаемый специалистом.
- 2 – потребитель обнаруживает слабый запах, если обратить на него внимание.
- 3 – запах заметен потребителем и вызывает у него неприятные ощущения при питье.
- 4 – отчетливый запах, заставляющие воздержаться от употребления воды.
- 5 – сильный запах, вода непригодна для питья.
Какие примеры свойств воды?
Основными свойствами воды являются ее полярность, когезия, адгезия, поверхностное натяжение, высокая удельная теплоемкость и испарительное охлаждение.
Полярность
Молекула воды слегка заряжена с обоих концов. Это потому, что кислород более электроотрицателен, чем водород.
Посмотрите видео сгибания струи воды — в демонстрации используется пластиковая линейка. Струя воды изгибается из-за полярности молекул воды.
Видео от: Ноэль Поллер
Сплоченность
Водородные связи удерживают молекулы воды вместе, как показано на рисунке выше. Сплоченность создает поверхностное натяжение , поэтому, если вы наполняете ложку водой, капля за каплей, объем воды будет больше, чем поверхность ложки, прежде чем вода упадет.
Вот видео, показывающее, как скрепка может «плавать» по воде — на самом деле она удерживается водородными связями, образованными между молекулами воды, которые придают воде ее поверхностное натяжение.
Видео от: Ноэль Поллер
Адгезия
Подобно когезии, но адгезия — это когда водородные связи в воде позволяют молекулам воды удерживаться на другой субстанции.
Высокая удельная теплоемкость
Удельная теплоемкость — это количество тепла, которое поглощается или теряется на 1 г при изменении температуры на 1 ° C, что в случае воды довольно велико. Это позволяет осуществлять испарительное охлаждение , то есть когда тепловая энергия передается молекулам воды, а испарение воды отводит много тепловой энергии от организма (например.когда мы потеем)
Другие важные характеристики воды заключаются в том, что она является универсальным растворителем , а также имеет необычную плотность . Вода, в отличие от любого другого твердо-жидкого, более плотная в жидкой форме, чем в твердом, поэтому лед плавает, и это позволяет целым средам обитания существовать под слоями льда, плавающими в океанах. Его нейтральный pH (7) также является важной характеристикой.
Его нейтральный pH (7) также является важной характеристикой.
Свойства воды
Свойства водыСвойства воды
Это вода — Дэвид Фостер Уоллес, 2005 г.Вода — одно из наиболее распространенных веществ, с которыми мы взаимодействуем, поэтому мы склонны не думать о ней и о том, насколько она особенная.Вода — важная молекула с некоторыми необычными свойствами. Без жидкой воды не могло бы быть жизни в том виде, в каком мы ее знаем. Жизнь возможна на Земле, потому что она существует в так называемой зоне Златовласки, где не слишком жарко и не слишком холодно, но как раз для существования жидкой воды. В нашей Солнечной системе единственные другие места, где жидкая вода может существовать в больших объемах, — это подо льдом спутников Юпитера и Сатурна, где гидротермальные источники могут позволить происходить хемосинтезу.
Планета Океан : Приблизительно 71% поверхности Земли покрыто водой, большая часть которой — океан (соленая вода). Взрослые люди тоже на 65% состоят из воды! Происхождение воды на Земле до конца не изучено, но большая часть воды, вероятно, поступила из внеземных источников. Ледяные шапки существуют на обоих полюсах, потому что они получают меньше солнечной радиации, чем экваториальные регионы, а ледяные шапки оказывают значительное влияние как на климат, так и на уровень моря. Появляется все больше свидетельств того, что ледяные шапки сокращаются в результате глобального изменения климата, вызванного деятельностью человека. Долгожданный Северо-Западный проход стал судоходным, по крайней мере, часть года, впервые в истории человечества.
Взрослые люди тоже на 65% состоят из воды! Происхождение воды на Земле до конца не изучено, но большая часть воды, вероятно, поступила из внеземных источников. Ледяные шапки существуют на обоих полюсах, потому что они получают меньше солнечной радиации, чем экваториальные регионы, а ледяные шапки оказывают значительное влияние как на климат, так и на уровень моря. Появляется все больше свидетельств того, что ледяные шапки сокращаются в результате глобального изменения климата, вызванного деятельностью человека. Долгожданный Северо-Западный проход стал судоходным, по крайней мере, часть года, впервые в истории человечества.
Приливы : Гравитационное взаимодействие между водой Земли и Луной приводит к ежедневным приливам и отливам. Приливные экстремумы были намного сильнее в раннюю историю Земли, когда Луна была вдвое дальше от нынешней, и есть предположения, что приливы могли инициировать или, по крайней мере, ускорить эволюцию жизни на Земле.
Молекулы воды притягиваются друг к другу из-за полярности.
Полярность : Хотя чистый заряд молекулы воды равен нулю, вода полярна из-за своей формы.Водородные концы молекулы положительны, а кислородные — отрицательны. Это заставляет молекулы воды притягивать друг друга и другие полярные молекулы. Это притяжение между молекулами воды можно увидеть на гладкой поверхности, например на стекле, где вода поднимается вверх. Связь молекул воды друг с другом является важной частью процесса транспирации в тканях ксилемы сосудистых растений. Вода также имеет высокое поверхностное натяжение из-за этого сцепления, и это причина, по которой водомерки могут кататься по воде.
Растворитель : Воду иногда называют универсальным растворителем, поскольку она может растворять самые разные химические вещества. Кислотно-основной химический состав зависит от воды. Кристаллические соли диссоциируют в воде с образованием положительных и отрицательных ионов.
Метрическая температура : Поскольку вода так важна для жизни, метрическая шкала температуры была разработана с 0 градусов как точка замерзания воды и 100 градусов как точка кипения воды (на уровне моря).
Плотность : Необычной характеристикой воды является то, что, в отличие от большинства твердых тел, лед менее плотен, чем жидкая вода.По этой причине кубики льда плавают в стакане с водой, а не опускаются на дно. Когда температура падает, вода в озере и океане замерзает сверху вниз, а слой льда плавает сверху, изолируя воду под ним от дальнейшего охлаждения. Если бы лед был более плотным, чем жидкая вода, озера замерзали бы снизу вверх, что было бы гораздо менее благоприятно для живых существ. Соленая вода более плотная, чем пресная, поэтому, если ее не перемешивать, пресная вода может образовать линзу поверх соленой воды.Это обычное явление, когда реки впадают в океан или когда пресная вода просачивается из источников на дне океана. Эти различия в плотности заставляют свет рассеиваться под разными углами, уменьшая видимость.
Удельная теплоемкость : Вода обладает очень высокой теплоемкостью. Это означает, что он долго сохраняет тепло относительно воздуха. Одним из важных результатов этого является то, что большие водоемы имеют умеренную температуру. Прибрежные районы имеют менее экстремальные летние и зимние температуры, чем внутренние части основных суши.Поскольку суша теряет тепло быстрее, чем вода, земля имеет тенденцию быть теплее днем и прохладнее ночью, чем океан, в результате чего дует прибрежный бриз утром и морской бриз вечером. Нагревание и охлаждение воды также может формировать конвекционные течения в океанах.
Одним из важных результатов этого является то, что большие водоемы имеют умеренную температуру. Прибрежные районы имеют менее экстремальные летние и зимние температуры, чем внутренние части основных суши.Поскольку суша теряет тепло быстрее, чем вода, земля имеет тенденцию быть теплее днем и прохладнее ночью, чем океан, в результате чего дует прибрежный бриз утром и морской бриз вечером. Нагревание и охлаждение воды также может формировать конвекционные течения в океанах.
Испарительное охлаждение : Когда вода испаряется с поверхности объекта, более быстро движущиеся молекулы с большей кинетической энергией улетучиваются в виде газа, в то время как молекулы с меньшей энергией и меньшей кинетической энергией остаются в жидком виде.Это снижает температуру на поверхности, с которой испаряется жидкость. Потоотделение — это форма испарительного охлаждения. Испарительное охлаждение лучше всего работает при низкой влажности, поэтому болотные охладители получают высокие оценки в Аризоне, но не во Флориде.
Отражающая способность : Снег отражает так много света, что длительное пребывание на нем может вызвать снежную слепоту и солнечный ожог. Снег имеет альбедо от 0,8 до 0,9. Поскольку большая часть света отражается от покрытой снегом поверхности, поглощается мало тепла и таяние замедляется.Этот процесс, который может продлить зимы и, возможно, даже способствовать возникновению ледниковых периодов, является противоположностью парникового эффекта и является причиной, по которой интерьер вашего автомобиля должен быть белым, если вы живете в Фениксе.
Эрозия : Лед занимает больше физического пространства, чем такое же количество жидкой воды. Вот почему, если вы наполните емкость водой до верха, а затем заморозите ее, емкость может лопнуть. Это свойство воды важно для процесса эрозии. Вода проникает в трещины в камнях, замерзает и расширяется.Трещины в породе расширяются, впуская больше воды во время следующей оттепели, и эрозия продолжается. Со временем горы могут исчезнуть из-за повторяющегося цикла замораживания-оттаивания.
Со временем горы могут исчезнуть из-за повторяющегося цикла замораживания-оттаивания.
Свойства воды и факты, о которых вы должны знать
Вода — самая распространенная молекула на поверхности Земли и одна из самых важных молекул для изучения в химии.Факты химии воды показывают, почему это такая невероятная молекула.
Что такое вода?
Вода — это химическое соединение. Каждая молекула воды, H 2 O или HOH, состоит из двух атомов водорода, связанных с одним атомом кислорода.
Свойства воды
Есть несколько важных свойств воды, которые отличают ее от других молекул и делают ее ключевым соединением для жизни:
- Сплоченность — ключевое свойство воды.Из-за полярности молекул молекулы воды притягиваются друг к другу. Между соседними молекулами образуются водородные связи.
 Из-за своей когезии вода при обычных температурах остается жидкостью, а не испаряется в газ. Связность также приводит к высокому поверхностному натяжению. Примером поверхностного натяжения является разбрызгивание воды на поверхности и способность насекомых ходить по жидкой воде, не тоня.
Из-за своей когезии вода при обычных температурах остается жидкостью, а не испаряется в газ. Связность также приводит к высокому поверхностному натяжению. Примером поверхностного натяжения является разбрызгивание воды на поверхности и способность насекомых ходить по жидкой воде, не тоня. - Адгезия — еще одно свойство воды. Адгезивность — это мера способности воды притягивать молекулы других типов.Вода прилипает к молекулам, способным образовывать с ней водородные связи. Адгезия и сцепление приводят к капиллярному действию, которое наблюдается, когда вода поднимается по узкой стеклянной трубке или внутри стеблей растений.
- Высокая удельная теплоемкость и высокая теплота испарения означают, что для разрыва водородных связей между молекулами воды требуется много энергии. Благодаря этому вода выдерживает резкие перепады температур. Это важно для погоды, а также для выживания видов. Высокая теплота испарения означает, что испаряющаяся вода имеет значительный охлаждающий эффект.
 Многие животные используют пот, чтобы охладиться, пользуясь этим эффектом.
Многие животные используют пот, чтобы охладиться, пользуясь этим эффектом. - Вода — полярная молекула. Каждая молекула изогнута, с отрицательно заряженным кислородом на одной стороне и парой положительно заряженных молекул водорода на другой стороне молекулы.
- Вода — единственное распространенное соединение, которое существует в твердой, жидкой и газовой фазах в обычных природных условиях.
- Вода амфотерная, что означает, что она может действовать как кислота и основание. Самоионизация воды производит ионы H + и OH — .
- Лед менее плотный, чем жидкая вода. Для большинства материалов твердая фаза более плотная, чем жидкая. Водородные связи между молекулами воды ответственны за более низкую плотность льда. Важным следствием этого является то, что озера и реки замерзают сверху вниз, а лед плавает по воде.
- Чистая жидкая вода при комнатной температуре не имеет запаха, вкуса и почти бесцветна. Вода имеет слабый синий цвет, который становится более заметным в больших объемах воды.

- Вода имеет второе место по удельной энтальпии плавления из всех веществ (после аммиака).Удельная энтальпия плавления воды составляет 333,55 кДж · кг − 1 при 0 ° C.
- Вода имеет второе место по удельной теплоемкости среди всех известных веществ. Аммиак имеет самую высокую удельную теплоемкость. Вода также имеет высокую теплоту парообразования (40,65 кДж · моль-1). Высокая удельная теплоемкость и теплота испарения являются результатом высокой степени водородной связи между молекулами воды. Одним из следствий этого является то, что вода не подвержена резким колебаниям температуры. На Земле это помогает предотвратить резкие изменения климата.
- Воду можно назвать универсальным растворителем, потому что она способна растворять множество различных веществ.
Интересные факты о воде
- Вода также называется монооксидом дигидрогена, оксиданом, гидроксильной кислотой и гидроксидом водорода.
- Молекулярная формула воды H 2 O
- Молярная масса: 18,01528 (33) г / моль
- Плотность: 1000 кг / м 3 , жидкость (4 ° C) или 917 кг / м 3 , твердая
- Температура плавления: 0 ° C, 32 ° F (273.
 15 K)
15 K) - Температура кипения: 100 ° C, 212 ° F (373,15 K)
- Кислотность (pKa): 15,74
- Основность (pKb): 15,74
- Показатель преломления: (nD) 1,3330
- Вязкость: 0,001 Па с при 20 ° C
- Кристаллическая структура: гексагональная
- Молекулярная форма: изогнутая
Прекрасная вода — Мир науки
Цели
Опишите свойства воды в различных состояниях.
Опишите когезионные и адгезионные свойства воды.
Опишите взаимосвязь между капиллярным действием, адгезией, когезией и поверхностным натяжением.
Материалы
Фон
Вода очень важна для жизни на Земле. Вода является основным компонентом клеток, обычно составляя от 70% до 95% массы клетки. Это означает, что мы на 80% состоят из воды по массе (весу), а некоторые мягкотелые существа, такие как медузы, состоят из воды на 96%. Вода также обеспечивает среду для жизни организмов, поскольку 75% земли покрыто водой. Вода циркулирует по земле так же, как и по человеческому телу, транспортируя, растворяя и пополняя питательные вещества и другие органические вещества, унося отходы.
Вода является основным компонентом клеток, обычно составляя от 70% до 95% массы клетки. Это означает, что мы на 80% состоят из воды по массе (весу), а некоторые мягкотелые существа, такие как медузы, состоят из воды на 96%. Вода также обеспечивает среду для жизни организмов, поскольку 75% земли покрыто водой. Вода циркулирует по земле так же, как и по человеческому телу, транспортируя, растворяя и пополняя питательные вещества и другие органические вещества, унося отходы.
Вода — единственное вещество, которое широко встречается в естественной среде и существует во всех трех состояниях материи (твердое (лед), жидкое (вода) и газ (пар)) в обычных температурных условиях Земли.
Химия воды
Каждая молекула воды состоит из двух атомов водорода и одного атома кислорода (H 2 0). Вода — это не линейная молекула, в которой все атомы расположены подряд. Два атома водорода образуют связь с кислородом под углом 104,5 градуса, делая молекулу V-образной.
Два атома водорода связаны с атомом кислорода ковалентными связями. Это означает, что атомы водорода делятся своими электронами с атомом кислорода.
Хотя каждая молекула воды нейтральна (с одинаковым количеством отрицательных электронов и положительных протонов), электроны остаются ближе к атому кислорода. В результате кончики V (атомы водорода) более положительны, а нижняя часть V (атом кислорода) более отрицательна. Таким образом, мы описываем молекулу воды как полярную, что означает, что у нее есть положительно заряженный «конец» и отрицательно заряженный «конец».Такая полярность помогает делать воду и необычной, и полезной!
Когда молекулы воды расположены близко друг к другу, положительно заряженные атомы водорода притягиваются к отрицательно заряженным атомам кислорода другой молекулы воды. Эти притяжения называются водородными связями. Они слабы по отдельности, но их огромное количество может сделать общую силу, удерживающую все молекулы вместе, весьма значительной.
Водородная связь между молекулами воды приводит ко многим интересным последствиям.Например, температура кипения воды, ее когезия и поверхностное натяжение, а также ее способность растворять соли связаны с водородными связями.
Температура кипения воды, 100 ° C, необычно высока для молекулы с такой низкой молекулярной массой. Высокая температура кипения обусловлена водородными связями. Кипячение воды означает разрыв всех водородных связей в жидкой воде, поэтому молекулы могут разойтись дальше друг от друга и превратиться в пар. Разрыв этих связей требует энергии; таким образом, более высокая точка кипения воды.
Водородные связи также придают жидкую воду молекулярную когезию и высокое поверхностное натяжение.
Сплоченность
Из-за протяженных водородных связей в воде молекулы имеют тенденцию прилипать друг к другу в регулярном порядке. Это явление, называемое когезией , легко наблюдается, если вы осторожно переполните стакан водой (совсем немного!) И наблюдаете, как молекулы воды удерживаются вместе над ободком; это называется мениском (однако в конце концов сила тяжести преодолевает водородные связи, и молекулы воды стекают по стенке стекла). Точно так же связующее свойство воды позволяет высоким деревьям доставлять воду к самым верхним листьям из подземных источников.
Точно так же связующее свойство воды позволяет высоким деревьям доставлять воду к самым верхним листьям из подземных источников.
Поверхностное натяжение
Особый тип сцепления — это поверхностное натяжение . Напряжение на поверхности воды возникает, когда молекулы воды на поверхности удерживаются вместе водородными связями. В результате вода ведет себя так, как будто у нее на поверхности тонкая пленка. Когда образуется капля воды, ее сферическая форма является результатом поверхностного натяжения.
Адгезия
Адгезия — это притяжение молекул воды к другим веществам. По этой причине вода «прилипает» к поверхности и делает вещи «мокрыми».
Словарь
адгезия : притяжение молекул воды к другим веществам.
когезия : притяжение молекул воды друг к другу.
ковалентная связь : форма химической связи, которая включает обмен электронными парами между атомами.
электронов : субатомная частица, несущая отрицательный электрический заряд.
force : толкать или тянуть.
гидравлика : Использование жидкости для выполнения работы.
водородная связь : притяжение между электроположительным атомом водорода одной молекулы и электроотрицательным атомом, например кислородом, соседней молекулы.
гидрофильный : «Любящий воду».
гидрофобный : «Водобоязнь».
гидростатическое равновесие : Давление во флюиде в состоянии покоя («гидро» + «статическое») обусловлено весом флюида над ним.
несжимаемая жидкость : жидкость, имеющая постоянную плотность или объем.
ионов : Атомы или молекулы, в которых общее количество электронов не равно общему количеству протонов, что придает им чистый положительный или отрицательный электрический заряд.
неполярный : описывает молекулу с равномерным зарядом.
ядро : очень плотная область в центре атома.
поршень : Диск или короткий цилиндр, плотно прилегающий к трубе, в которой он движется вверх и вниз против жидкости или газа.
полярность (полярность) : Полярная молекула имеет как положительно, так и отрицательно заряженный «конец».
протон : субатомная частица с положительным электрическим зарядом. Один или несколько протонов присутствуют в ядре каждого атома вместе с нейтронами.
растворитель : жидкость, твердое вещество или газ, который может растворять другое твердое вещество, жидкость или газ.
вещество : любое физическое вещество или материал.
поверхностное натяжение : «кожа» на поверхности воды из-за сцепления между ее молекулами.
вязкий : Густой или «сиропообразный», характеризует жидкость.
Другие ресурсы
HowEverythingWorks | Добавки | Раздел 15. 1: Вода, пар и лед
1: Вода, пар и лед
Kentchemistry | Водородная связь — капли воды на пенни
TedEd | Видео | Почему нельзя смешивать масло и воду
Государственный университет Сан-Диего | Кафедра астрономии | Статья | Гидростатическое равновесие
YouTube | Образовательные инновации | Полиакрилат натрия — «полимер для подгузников»
Университет Реджайны | Центр математического, естественнонаучного и технологического образования | QuickStarts | Лодка с мылом
Для приобретения полиакрилата натрия («полимер для пеленок»): Educational Innovations
Свойства воды
УЗНАЙТЕ СВОЙСТВА ВОДЫ
Структура молекулы воды создает слабое притяжение между кислородным концом.
одной молекулы и водородные концы других молекул воды.Хотя эти
«Полярные» связи относительно слабы и постоянно рвутся и реформируются, их
существование приводит к многим особенным свойствам воды по сравнению с другими веществами
на земле. Эти свойства воды во многом определяют жизнь на Земле.
Эти свойства воды во многом определяют жизнь на Земле.
Ниже приведены природные свойства воды, на которые может существенно повлиять человек. деятельность: химическая, физическая и биологическая.
ХИМИЧЕСКИЕ СВОЙСТВА
Природные воды всегда содержат растворенные соли, микроэлементы, некоторые металлы и газы. На самом деле в воде растворяется так много веществ, что это иногда (ошибочно) называют как «Универсальный растворитель». Хотя большинство этих веществ важны для здоровья водные экосистемы, по мере увеличения концентраций, они могут иметь негативные последствия и мы думаем о них как о загрязнителях.
ФИЗИЧЕСКИЕ СВОЙСТВА
БИОЛОГИЧЕСКИЕ СВОЙСТВА
Растения
Водные растения — фотосинтезирующие организмы, приспособленные к жизни в воде. Наземные растения
в основном «сосудистые» растения, имеющие корни, которые впитывают и переносят воду и питательные вещества.
к листьям, где происходит фотосинтез. Многие водные растения имеют более простую структуру.
Этим «макрофитам» не нужно транспортировать воду, поскольку они живут в воде, и
они обычно могут получать питательные вещества прямо из воды. Тип и форма, которые
водные растения принимают в зависимости от глубины воды и от того, течет ли вода
(реки и ручей) или неподвижные (озера, пруды или водно-болотные угодья).)
Наземные растения
в основном «сосудистые» растения, имеющие корни, которые впитывают и переносят воду и питательные вещества.
к листьям, где происходит фотосинтез. Многие водные растения имеют более простую структуру.
Этим «макрофитам» не нужно транспортировать воду, поскольку они живут в воде, и
они обычно могут получать питательные вещества прямо из воды. Тип и форма, которые
водные растения принимают в зависимости от глубины воды и от того, течет ли вода
(реки и ручей) или неподвижные (озера, пруды или водно-болотные угодья).)
Бактерии
С точки зрения качества воды нас больше всего беспокоит роль бактерий в развитии болезней.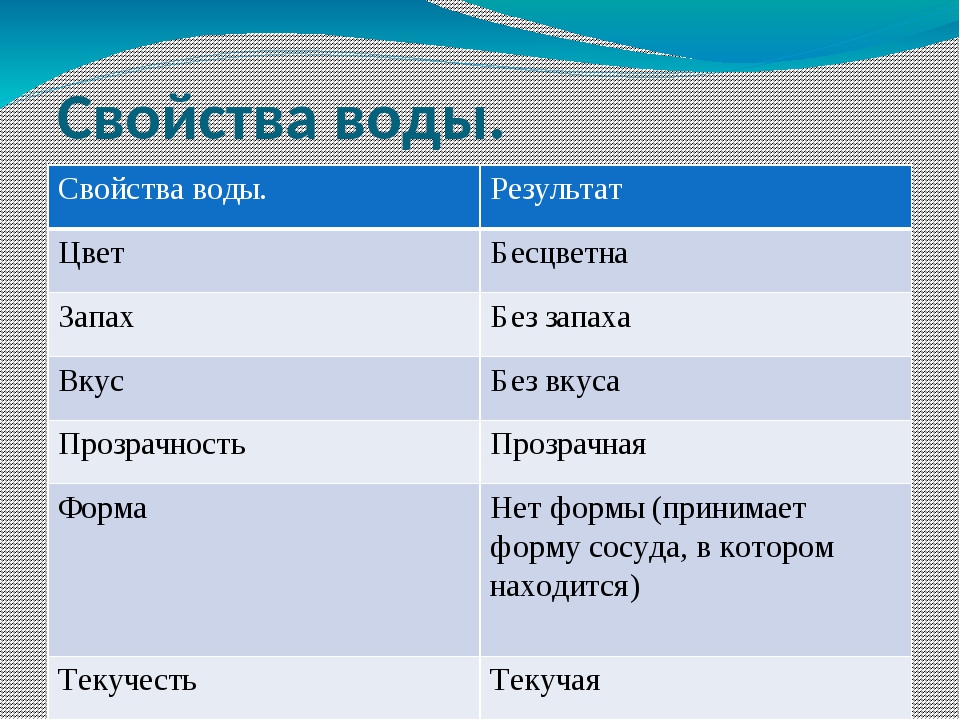 Бактерии и родственные одноклеточные организмы
все больше признается за их важность в разложении органических материалов, переработке
минералы и питательные вещества, а в некоторых случаях преобразование углекислого газа в новый растительный материал.
Бактерии и родственные одноклеточные организмы
все больше признается за их важность в разложении органических материалов, переработке
минералы и питательные вещества, а в некоторых случаях преобразование углекислого газа в новый растительный материал.
ДРУГИЕ УДАРЫ
Свойства воды и урок науки о полярности воды
Свойства воды
Одна из особенностей нашей планеты — наличие жидкой воды. Вода необходима для всей жизни; без него все живое погибло бы.
Вода необходима для всей жизни; без него все живое погибло бы.
Вода покрывает около 70% поверхности Земли и составляет 65-75% нашего тела (82% нашей крови — это вода). Хотя вода может показаться скучной — без цвета, вкуса или запаха — она обладает удивительными свойствами, которые делают ее необходимой для поддержания жизни.
(Наша потребность в воде и морских животных, которые живут в воде, — вот что делает разливы нефти настолько разрушительными).
Химический состав воды: H 2 O — два атома водорода и один атом кислорода.Свойства воды особенные из-за того, как ее атомы соединяются вместе, образуя молекулу воды, и из-за того, как молекулы взаимодействуют друг с другом.
Полярность воды
Когда два атома водорода связываются с кислородом, они прикрепляются к вершине молекулы, как уши Микки Мауса. Эта молекулярная структура придает молекуле воды полярность или однобокий электрический заряд, который притягивает другие атомы.
Конец молекулы с двумя атомами водорода заряжен положительно.Другой конец, с кислородом, заряжен отрицательно. Так же, как в магните, где северные полюса притягиваются к южным полюсам («притягиваются противоположности»), положительный конец молекулы воды будет соединяться с отрицательным концом других молекул.
Что это значит для нас? Полярность воды позволяет ей очень легко растворять другие полярные вещества . Когда полярное вещество помещается в воду, положительные концы его молекул притягиваются к отрицательным концам молекул воды, и наоборот.Притяжение заставляет молекулы нового вещества равномерно смешиваться с молекулами воды.
Вода растворяет больше веществ, чем любая другая жидкость — даже самая сильная кислота! Из-за этого его часто называют «универсальным растворителем». Растворяющая способность воды очень важна для жизни на Земле. Куда бы вода ни попала, она несет растворенные химические вещества, минералы и питательные вещества, которые используются для поддержания жизни живых существ.
Из-за своей полярности молекулы воды сильно притягиваются друг к другу, что придает воде высокое поверхностное натяжение .Молекулы на поверхности воды «слипаются», образуя на воде своего рода «кожу», достаточно прочную, чтобы удерживать очень легкие предметы. Насекомые, которые ходят по воде, пользуются этим поверхностным натяжением.
Поверхностное натяжение заставляет воду скапливаться каплями, а не растекаться тонким слоем.
Он также позволяет воде проходить через корни и стебли растений, термометры и мельчайшие кровеносные сосуды в вашем теле. Когда одна молекула движется вверх, она «тянет» за собой другие.
Три состояния материи
Вода — один из четырех элементов и единственное природное вещество, которое может существовать во всех трех состояниях материи — твердом, жидком и газообразном — при температурах, обычно встречающихся на Земле.
Многие другие вещества должны быть перегреты или охлаждены для изменения состояния.
Вода в газообразном состоянии постоянно присутствует в нашей атмосфере в виде водяного пара. Жидкое состояние встречается повсюду в реках, озерах и океанах.
Твердое состояние воды, льда, уникально.Большинство жидкостей сжимаются при охлаждении, потому что молекулы движутся медленнее и имеют меньше энергии, чтобы противостоять притяжению друг к другу. Когда они превращаются в твердые частицы, они образуют плотно упакованные кристаллы, которые намного плотнее, чем была изначально жидкость.
Вода не действует. Когда он замерзает, он расширяется : молекулы выстраиваются в линию, образуя очень «открытую» кристаллическую структуру, менее плотную, чем жидкая вода.
Вот почему лед плавает. И это хорошо! Если бы вода действовала как большинство других жидкостей, озера и реки замерзли бы, и все живое в них погибло бы.
Три других свойства воды
Вода имеет высокую удельную теплоемкость. То есть, в отличие от воздуха, вода может поглощать много тепла без изменения температуры. Вот почему плавание так освежает в жаркий день.
Вот почему плавание так освежает в жаркий день.
Вода также теряет тепло медленнее, чем воздух. В результате летом вода в озере и океане обычно самая холодная в начале сезона и самая теплая в конце сезона (после многих дней поглощения солнечной энергии).
Температура кипения воды (212 ° F или 100 ° C на уровне моря) зависит от высоты.Как правило, чем выше высота, тем ниже температура кипения воды. Например, в Денвере, штат Колорадо (5280 футов), вода кипит при 202,4 ° F. На горе Эверест в Непале (29 012 футов) вода кипит при 156 ° F.
.Проекты в области науки о воде:
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.
 Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie. - Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
.

 Такое сродство у воды является самым большим среди всех жидкостей. Вследствие этого вода на поверхности размещается в виде капель сферической формы, поскольку сфера обладает наименьшей при заданном объеме поверхностью.
Такое сродство у воды является самым большим среди всех жидкостей. Вследствие этого вода на поверхности размещается в виде капель сферической формы, поскольку сфера обладает наименьшей при заданном объеме поверхностью.
 Это помогает им зимой при передвижение по заснеженному лесу и полям не так глубоко погружаться в снег.
Это помогает им зимой при передвижение по заснеженному лесу и полям не так глубоко погружаться в снег.
 Из-за своей когезии вода при обычных температурах остается жидкостью, а не испаряется в газ. Связность также приводит к высокому поверхностному натяжению. Примером поверхностного натяжения является разбрызгивание воды на поверхности и способность насекомых ходить по жидкой воде, не тоня.
Из-за своей когезии вода при обычных температурах остается жидкостью, а не испаряется в газ. Связность также приводит к высокому поверхностному натяжению. Примером поверхностного натяжения является разбрызгивание воды на поверхности и способность насекомых ходить по жидкой воде, не тоня.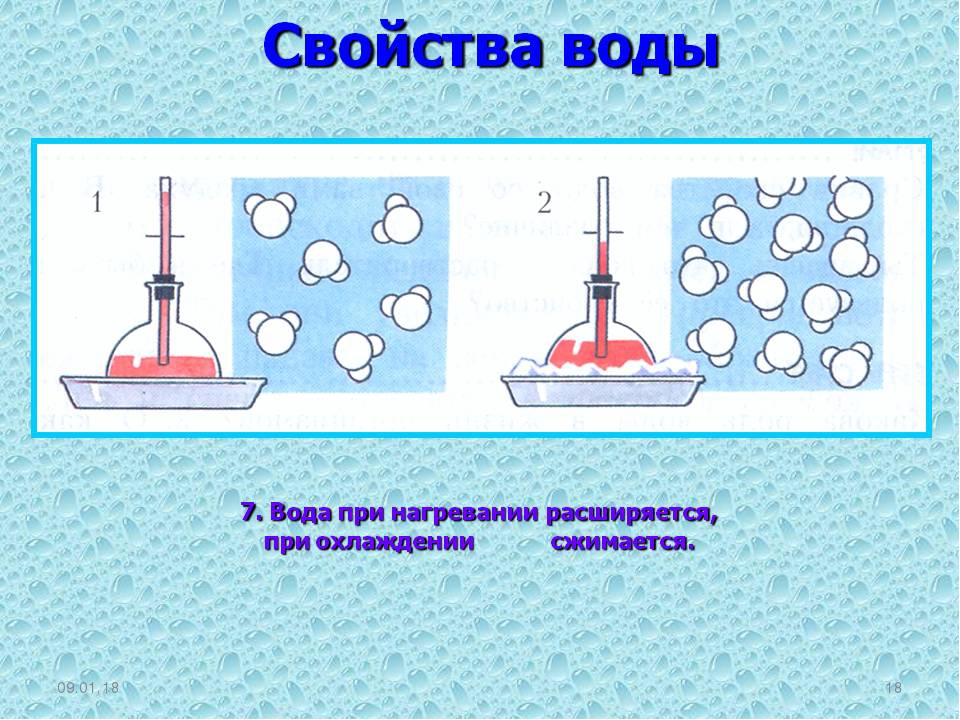 Многие животные используют пот, чтобы охладиться, пользуясь этим эффектом.
Многие животные используют пот, чтобы охладиться, пользуясь этим эффектом.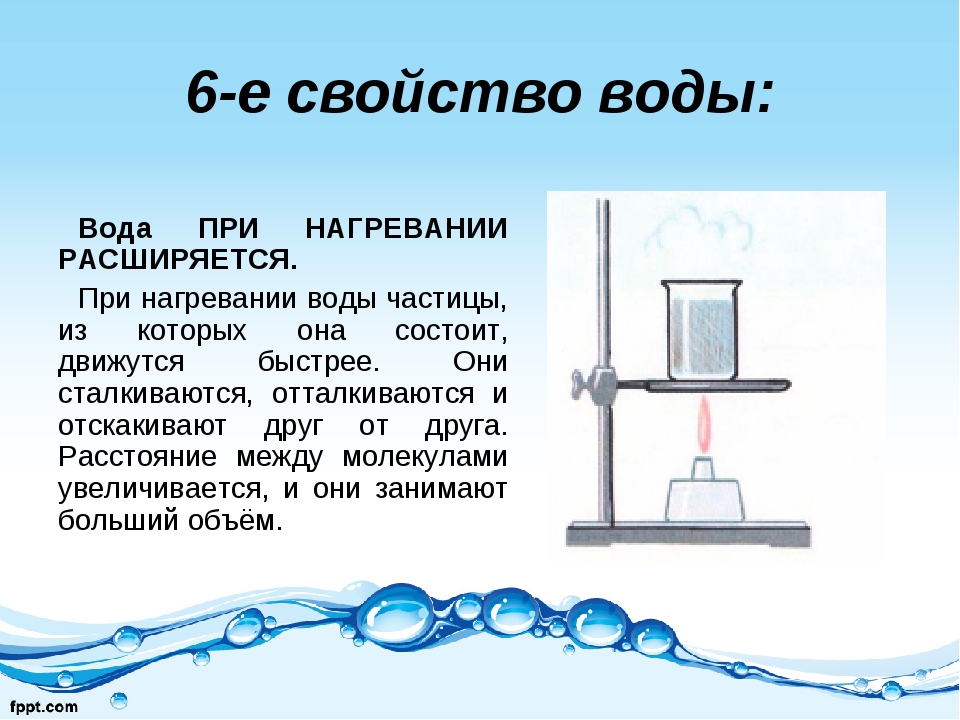
 15 K)
15 K) Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.