Урок 27. Состав и физические свойства воды – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 27 «Состав и физические свойства воды» из курса «Химия для чайников» узнаем, что из себя представляет вода, выясним её состав, а также физические свойства.
Наиболее распространенным оксидом на Земле является оксид водорода H2O, или вода. Без воды, как и без кислорода, невозможна жизнь человека, животных и растений.
Вода — единственное вещество, существующее на Земле одновременно в трех агрегатных состояниях: жидком, твердом и газообразном. Она является основным компонентом морей и океанов, ледников и айсбергов, облаков и тумана.
Около 70 % поверхности Земли покрыто океанами, морями, реками и озерами — природными хранилищами воды. Из космоса толстый слой воды имеет голубой цвет (рис. 104), вот почему нашу планету называют голубой. Вода входит в состав всех живых организмов, а также очень многих минералов.
Содержание
- Состав и строение воды
- Физические свойства воды
- Вода как растворитель
Состав и строение воды
Как вы уже знаете, молекула воды состоит из трех атомов — двух атомов водорода и одного атома кислорода (рис. 105). Относительная молекулярная масса воды равна:
105). Относительная молекулярная масса воды равна:
Следовательно, молярная масса воды равна:
Вода — это вещество с молекулярным строением. В твердом (рис. 106) и жидком агрегатных состояниях молекулы воды прочно связаны друг с другом. Этим во многом объясняется целый ряд удивительных физических свойств воды.
Физические свойства воды
При комнатных условиях вода представляет собой жидкость без вкуса и запаха. В тонком слое вода не имеет цвета. Однако при толщине более 2 м она имеет голубой цвет. Совершенно чистая вода очень плохо проводит электрический ток.
На заметку: По тому, как проводит электрический ток вода, можно судить о ее чистоте — чем ниже электропроводность, тем чище вода.
У большинства веществ в твердом состоянии плотность выше, чем в жидком. В отличие от них вода в твердом агрегатном состоянии (лед) имеет более низкую плотность, чем в жидком. При 0 °С плотность льда равна примерно 0,92 г/см3, а плотность жидкой воды — примерно 1,00 г/см3. Это означает, что лед легче воды, поэтому он не тонет в ней (рис. 107). Такая особенность воды объясняет, почему водоемы начинают замерзать не со дна, а с поверхности и очень редко промерзают до самого дна. Это защищает живые организмы, обитающие в реках и морях, от гибели.
Это означает, что лед легче воды, поэтому он не тонет в ней (рис. 107). Такая особенность воды объясняет, почему водоемы начинают замерзать не со дна, а с поверхности и очень редко промерзают до самого дна. Это защищает живые организмы, обитающие в реках и морях, от гибели.
У воды высокая теплоемкость, поэтому она медленно нагревается, но и медленно остывает. Это позволяет морям и океанам накапливать тепло летом (и днем) и высвобождать его зимой (и ночью), что предотвращает резкие колебания температуры воздуха на нашей планете в течение года (и суток). Моря и океаны служат своеобразными аккумуляторами тепла на нашей планете.
При нормальном давлении (101,3 кПа) температура кипения воды равна 100 °С. При понижении давления температура кипения воды понижается. Например, в горах на высоте около 5000 м давление существенно ниже нормального (примерно в два раза), поэтому вода закипает в этих условиях при температуре около 84 °С. Понятно, что варить продукты до готовности в горах необходимо более длительное время.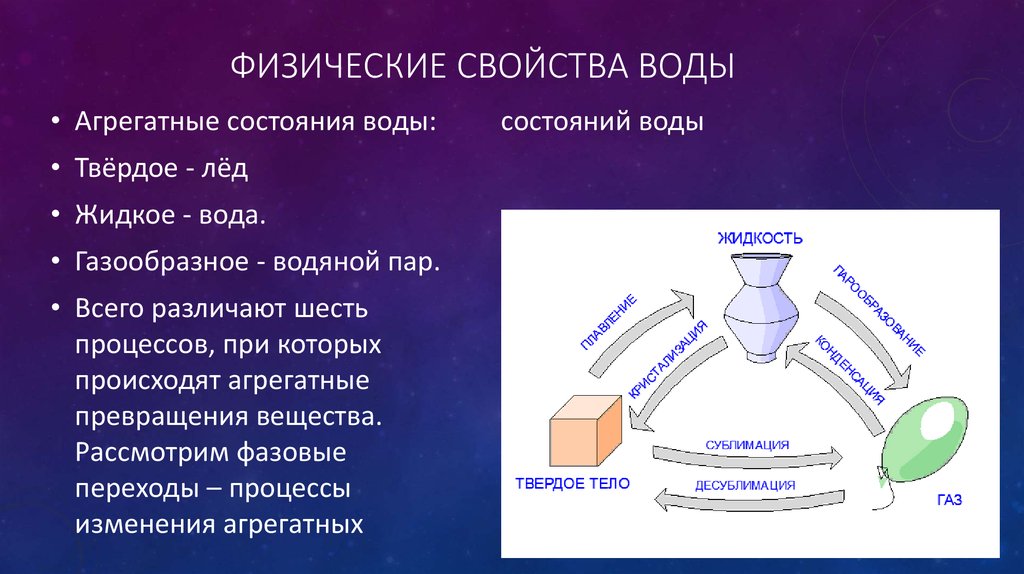 И наоборот, в скороварке, где создается высокое давление, вода закипает при температуре выше 100 °С, что позволяет быстрее приготавливать пищу.
И наоборот, в скороварке, где создается высокое давление, вода закипает при температуре выше 100 °С, что позволяет быстрее приготавливать пищу.
Вода как растворитель
С совершенно чистой водой, не содержащей никаких других веществ, большинство людей никогда не встречается. Такая вода используется только в специальных целях.
Почти все жидкости, с которыми мы сталкиваемся в повседневной жизни и деятельности, представляют собой растворы различных веществ.
Раствор — это однородная смесь двух и более веществ.
Одно из веществ, входящих в состав раствора, называется растворителем, а остальные — растворенными веществами. Очень часто растворителем является вода. Вода может растворять твердые, жидкие и газообразные вещества.
Все природные воды содержат растворенные соли. Их легко обнаружить экспериментально, выпарив воду на часовом стекле. Кроме солей, вода может растворять различные газы. Их присутствие (правда, не всегда) можно обнаружить экспериментально. Например, поместив пробирку с холодной водой из-под крана в теплое место, через некоторое время можно заметить у стенок пробирки пузырьки. Это растворенные газы (преимущественно кислород) выделяются из раствора при его нагревании до комнатной температуры (рис. 108).
Например, поместив пробирку с холодной водой из-под крана в теплое место, через некоторое время можно заметить у стенок пробирки пузырьки. Это растворенные газы (преимущественно кислород) выделяются из раствора при его нагревании до комнатной температуры (рис. 108).
Многие жидкости также хорошо растворимы в воде. Например, серная кислота и спирт неограниченно растворяются в воде. В таком случае говорят, что вещество смешивается с водой в любых соотношениях. Из-за хорошей растворимости многих веществ в воде ее иногда называют универсальным растворителем.
Краткие выводы урока:
- Вода не имеет вкуса, цвета (в тонком слое) и запаха, кипит при 100 °С, а переходит в твердое состояние при 0 °С.
- Плотность твердой воды меньше, чем жидкой.
- Раствор — это однородная смесь двух и более веществ.
- Вода является универсальным растворителем — она хорошо растворяет многие твердые, жидкие и газообразные вещества.
Надеюсь урок 27 «Состав и физические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Если у вас возникли вопросы, пишите их в комментарии.
Урок 28. Химические свойства воды →
← Урок 26. Получение водорода и его применение
Физические и термические свойства воды
Уникальные свойства воды интересуют людей с древнейших времен. Это единственное вещество на Земле, которое при нормальных для человека условиях может находится сразу в трех агрегатных состояниях — жидком, твердом и газообразном.
Физические свойства
| Состояние | Плотность | Динамическая вязкость | Кинематическая вязкость | Удельная электрическая проводимость | Поверхностное натяжение |
| жидкость | 0,9982 г/куб.см | 0,00101 Па*с | 0,01012 кв.см/с | 4,2·10-6 см/м | 3·10-3 Н/м |
Термические свойства
| Температура плавления | Температура кипения | Тройная точка 1 | Критическая точка 2 | Молярная теплоемкость | Теплопроводность |
| 0 С | 100 С | 0,01 °C, 611,73 Па | 374°C, 22,064 MПа | 75,37 Дж/(моль•К) | 0,56 Вт/(м•K) |
1 При указанном давлении температура плавления и кипения воды совпадают.
2 При указанных условиях плотность и остальные свойства воды и водяного пара совпадают.
Реальные свойства воды резко отличаются от свойств других гидритов (соединений с водородом). Проще говоря, в отличие от других веществ, свойства воды нельзя вычислить на основании ее положения в периодической таблице химических элементов Менделеева. Теоретически, исходя из своего положения в таблице, вода — то есть Н2О, гидрид кислорода — должна переходить в твердую фазу, превращаться в лед при -100С.
Температура. Для такой низкомолекулярной (то есть, простой по структуре) жидкости как вода стоградусный диапазон между точкой плавления и точкой кипения является чрезвычайно большим.
Лед, плотность, кристаллизация. При замерзании плотность воды уменьшается, поэтому лед всплывает. Благодаря этому уникальному свойству воды озера и реки не промерзают до дна, и водные обитатели могут пережить зиму.
Уменьшение плотности льда происходит вследствие увеличения объема. Именно поэтому замерзающая вода рвет водопроводные трубы.
Вода может быть переохлаждена до отрицательных температур без перехода в твердое состояние. Однако при малейшем сотрясении или попадании каких-либо частиц переохлажденная вода быстро превращается в лед. Посторонние частицы, пузырьки воздуха в этом случае становятся центрами кристаллизации.
Теплоемкость. Аномально высокая теплоемкость воды сглаживает суточные и сезонные колебания температур. Именно поэтому в прибрежных странах более мягкие зимы.
Высокая скрытая теплота испарения воды спасает водоемы от быстрого высыхания жарким летом. А высокая скрытая теплота плавления защищает нас весной от слишком быстрого таяния огромного количества снега, скопившегося за зиму.
Растворитель. Вода является универсальным растворителем. Это качество объясняется особым строением молекулы воды. Молекулы сильно поляризованы, благодаря чему легко входят во взаимодействие с молекулами других веществ. Именно свойство сильного растворителя затрудняет получение абсолютно химически чистой воды.
Диэлектрик. Как ни удивительно, но химически чистая вода является диэлектриком, то есть не проводит электрический ток, что расходится с нашим повседневным опытом. Проводником воду делают растворенные в ней соли, то есть положительные и отрицательные ионы.
Высокое поверхностное натяжение воды наблюдал каждый из нас. Вспомните, как по поверхности пруда бегают водомерки. Даже не очень тяжелый предмет из несмачиваемого материала может оставаться на поверхности воды. В отсутствии гравитации капля воды стремится принять идеальную форму шара. Из всех жидкостей по силе поверхностного натяжения вода уступает только ртути.
Кстати, еще одно полезное свойство воды — способность поглощать микроволновое излучение — позволяет нам разогревать продукты в микроволновой печи.
Все вышеперечисленные и многие другие необычные свойства воды существуют благодаря наличию в молекуле воды связей водорода и особому расположению атомом водорода и кислорода относительно друг друга.
Вода участвует в большинстве химических реакций, протекающих в организме человека, животных и растений. Вся биосфера Земли существует лишь благодаря наличию воды с ее уникальными свойствами.
Вся биосфера Земли существует лишь благодаря наличию воды с ее уникальными свойствами.
Похожие статьи
15 ноября 2021
Анализ воды в Измайлово: когда надо проводить
5 мая 2021
Методы и способы очистки воды от бактерий
4 мая 2021
Показатели бактериологических исследований воды: особенности анализа
Свойства воды – физические и химические свойства
Что такое вода?
Вода представляет собой химическое вещество с химической формулой H 2 O , в одной молекуле воды два атома водорода ковалентно связаны с одним атомом кислорода. Познакомимся с физическими и химическими свойствами воды.
Содержание
- Свойства воды
- Физические свойства воды
- Химические свойства воды
- Часто задаваемые вопросы – Часто задаваемые вопросы
Если посмотреть на Землю из космоса, она будет синей.
Физические свойства воды
Вода – бесцветная жидкость без вкуса. Молекулы воды имеют обширные водородные связи, что приводит к необычным свойствам в конденсированной форме. Это также приводит к высоким температурам плавления и кипения. По сравнению с другими жидкостями вода обладает более высокими удельной теплоемкостью, теплопроводностью, поверхностным натяжением, дипольным моментом и др. Эти свойства обуславливают ее значение в биосфере. Вода является отличным растворителем и поэтому помогает транспортировать ионы и молекулы, необходимые для метаболизма.
Электроположительные элементы восстанавливают воду до молекулы водорода. Таким образом, вода является отличным источником водорода. Давайте посмотрим на пример в этом случае:
\(\begin{array}{l}2H_2O(l) + 2Na(s) \rightarrow 2NaOH(aq) + H_2(g) \end{array} \)
В процессе фотосинтеза вода окисляется до O 2 . Поскольку вода может окисляться и восстанавливаться, она очень полезна в окислительно-восстановительных реакциях.
3. Реакция гидролизаВода имеет очень сильную склонность к гидратации из-за своей диэлектрической проницаемости. Он растворяет многие ионные соединения. Некоторые ковалентные и ионные соединения могут гидролизоваться в воде.
| Недвижимость | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Химическая формула | Н 2 О | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная масса | 18. 01528(33) г/моль 01528(33) г/моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Запах | Нет | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность | Твердый: 0,9167 г/мл при 0 °C Жидкость : 0,961893 г/мл при 95 °C 0,9970474 г/мл при 25 °C 0,9998396 г/мл при 0 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 99,98 ° С (211,96 ° F, 373,13 К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 0,00 °С (32,00 °F; 273,15 К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Растворимость | Плохо растворим в алифатических и ароматических углеводородах и эфирах.  Частично смешивается с бромом, этилацетатом, диэтиловым эфиром, дихлорметаном. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кислотность (p K a)
| 13,995 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Давление пара | 3,1690 кПа или 0,031276 атм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основность (p K б) | 13,995 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Показатель преломления ( n D) | 1.3330 (20°С) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 0,6065 Вт/м·К | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Вязкость | 0,890 сП | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Структура | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | Шестигранник | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молекулярная форма | Изогнутый | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа точек | С 2v | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дипольный момент | 1. 8546 Д 8546 Д | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Термохимия | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельная Теплоемкость ( C ) | 75,375 ± 0,05 Дж/моль·К | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартная энтальпия пласта (Δ f H o 298 ) | -285,83 ± 0,040 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартная молярная энтропия ( | 69,95 ± 0,03 Дж/моль·К | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Свободная энергия Гиббса (Δ f G ˚) | -237,24 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Часто задаваемые вопросы – Часто задаваемые вопросы
Какова температура плавления?
Температура, при которой твердое тело становится жидким из-за достаточного количества тепла. Для данного вещества точка плавления его твердой формы такая же, как и точка замерзания его жидкой формы, и зависит от таких факторов, как чистота вещества и окружающее давление.
Как работает точка кипения?
Температура кипения жидкости – это температура, при которой давление ее пара равно атмосферному давлению. Нормальная температура кипения жидкости – это температура, при которой одна атмосфера (760 торр) равна давлению пара. Нормальная температура кипения воды составляет 100 градусов по Цельсию.
Что влияет на температуру кипения воды?
Окружающее давление является самым большим фактором, определяющим точку кипения жидкости. Давление воздуха в открытой системе, безусловно, равно земной атмосфере. Например, вода достигает стандартного атмосферного давления при 100 градусах по Цельсию. Вода может кипеть при более низкой температуре по мере увеличения высоты.
Что такое удельная теплоемкость в химии?
Количество энергии, необходимое для повышения температуры 1 грамма материала на 1 °C, называется удельной теплоемкостью.
Почему удельная теплоемкость важна?
Высокая удельная теплоемкость воды делает ее подходящей для систем центрального отопления, поскольку она может передавать большое количество энергии путем нагревания при незначительных изменениях температуры.
Мы увидели физические и химические свойства воды и поняли их важность. Есть еще много вещей, которые можно исследовать и узнать о воде. Если вам интересно узнать больше, пожалуйста, установите BYJU’S — The Learning App.
Физические и химические свойства воды
Важнейшим ресурсом, также необходимым для основного устойчивого развития человека, является вода. Прежде чем мы обсудим воду, давайте познакомимся с некоторыми ключевыми статистическими данными о воде. Вот некоторые из них:
В среднем человек использует 101 галлон воды в день, т. е. 380 литров воды в день.
68% запасов пресной воды Земли находится в ледниках
85% человеческого мозга состоит из воды
Что такое вода?
Вода, также известная как \[H_{2}O\], представляет собой вещество, состоящее из химических элементов водорода (\[H_{2}\]) и кислорода (\[O_{2} \]). Как полярное неорганическое соединение вода представляет собой бесцветную жидкость без вкуса и запаха. Вода, как наиболее изученное химическое соединение, известна как универсальный растворитель. Это единственное вещество, которое существует во всех трех агрегатных состояниях – твердом, жидком и газообразном. Считалось, что жизнь на Земле зародилась в водоемах мира, таких как океаны, реки, озера.
Как полярное неорганическое соединение вода представляет собой бесцветную жидкость без вкуса и запаха. Вода, как наиболее изученное химическое соединение, известна как универсальный растворитель. Это единственное вещество, которое существует во всех трех агрегатных состояниях – твердом, жидком и газообразном. Считалось, что жизнь на Земле зародилась в водоемах мира, таких как океаны, реки, озера.
Как образуется молекула воды?
Молекула воды образуется при химической связи водорода и кислорода. Вода — лучший пример полярной ковалентной связи. Это означает химическую связь, при которой электроны неравномерно делят атомы. Каждая молекула воды ковалентно связана с двумя атомами водорода и одним атомом кислорода, реакция может быть записана следующим образом:
\[H_{2} + O_{2} \rightarrow H_{2}O \]
Какие состояния воды?
Как уже говорилось, вода — единственное вещество, которое существует во всех трех агрегатных состояниях — твердом, жидком и газообразном. Первое состояние воды в твердом состоянии — это лед. Как твердое вещество, вода доступна в виде твердого амальгамированного кристалла, называемого льдом, и рыхлого амальгамированного кристалла, называемого снегом. Наиболее часто видимым состоянием воды, которое является вторым состоянием, в атмосфере Земли является жидкость, известная как «вода». Третье состояние воды в газообразном состоянии называется водяным паром или паром. Это состояние воды, когда образуются облака — из мельчайших капелек воды, взвешенных в воздухе.
Первое состояние воды в твердом состоянии — это лед. Как твердое вещество, вода доступна в виде твердого амальгамированного кристалла, называемого льдом, и рыхлого амальгамированного кристалла, называемого снегом. Наиболее часто видимым состоянием воды, которое является вторым состоянием, в атмосфере Земли является жидкость, известная как «вода». Третье состояние воды в газообразном состоянии называется водяным паром или паром. Это состояние воды, когда образуются облака — из мельчайших капелек воды, взвешенных в воздухе.
Какая связь между гидрологическим циклом и состоянием воды?
Гидрологический цикл – это общий круговорот в природе, при котором водный поток регулируется в различных состояниях воды, что делает его переносимым для всех форм жизни на Земле. Это усиливается за счет наличия воды во всех штатах. Кроме того, процесс испарения, осаждения и конденсации облегчает транспортировку воды по разным формам рельефа.
Жидкое состояние воды из водоемов – океанов, рек, озер и т. д. переходит в газообразное состояние, называемое водяным паром, в результате процесса испарения. Далее вода конденсируется вместе, образуя крошечные капельки водяного пара, называемые облаками. Кроме того, облака осаждаются в виде воды в жидком состоянии, известной как дождь. Эта вода в жидком состоянии используется формами жизни для различных целей, а оставшаяся вода собирается обратно в водоемы.
д. переходит в газообразное состояние, называемое водяным паром, в результате процесса испарения. Далее вода конденсируется вместе, образуя крошечные капельки водяного пара, называемые облаками. Кроме того, облака осаждаются в виде воды в жидком состоянии, известной как дождь. Эта вода в жидком состоянии используется формами жизни для различных целей, а оставшаяся вода собирается обратно в водоемы.
Каковы свойства воды?
Свойства соединения – вода можно разделить на:
Давайте продолжим и сосредоточимся на физических и химических свойствах воды:
Физические свойства воды
Внешний вид: Как вы теперь знаете, бесцветная жидкость без запаха и вкуса в естественном состоянии. Кристаллическая структура воды шестиугольная.
Температура кипения воды: Температура кипения определяется как температура, при которой давление паров жидкости равно давлению, окружающему жидкость, и, таким образом, жидкость превращается в пар.
 Нам известно, что температура кипения воды равна 100°С.
Нам известно, что температура кипения воды равна 100°С.Температура замерзания воды: Температура замерзания – это температура, при которой вещество переходит из жидкого состояния в твердое. Итак, для воды точка, в которой вода из жидкого состояния превращается в лед в твердом состоянии, является точкой замерзания воды, которая составляет 0°C или 32°F.
Удельная теплоемкость: Вода имеет высокую удельную теплоемкость 4,2 Дж на грамм при 25°C. Это связано с обширными водородными связями между молекулами воды.
Плотность воды: Плотность воды составляет около 1 г/куб. см и изменяется в зависимости от температуры необычным образом. Плотность воды в разных состояниях – твердом и жидком. В твердом состоянии плотность составляет 0,9 г/см3.
Вязкость воды: Вязкость определяется сопротивлением деформации при заданной скорости.
 Другими словами, густота жидкости — например, сиропа и воды. Вязкость воды составляет 0,89 сП (сантипуаз).
Другими словами, густота жидкости — например, сиропа и воды. Вязкость воды составляет 0,89 сП (сантипуаз).Поверхностное натяжение воды: Поверхностное натяжение – это тенденция жидкости сжиматься на минимальной площади поверхности. Вода имеет высокое поверхностное натяжение 72 мН/м при 25°C. Из-за высокого поверхностного натяжения воды насекомые могут ходить по поверхности воды без какого-либо дискомфорта.
Показатель преломления воды. Проще говоря, показатель преломления — это число, которое описывает, как быстро свет достигает материала. Показатель преломления воды составляет 1,333 при 20°С.
Сжимаемость воды: Сжимаемость определяется как функция температуры и давления и их влияние на вещество. Для воды сжимаемость при 0°C составляет \[5,1 \times 10 — 10 Pa — 1\], а до 45°C она снижается до \[ 4,4 \times 10 — 10 Pa — 1\].
 По мере увеличения давления сжимаемость еще больше снижается.
По мере увеличения давления сжимаемость еще больше снижается.Диэлектрическая проницаемость воды: Диэлектрическая проницаемость является мерой того, насколько легко материал поляризуется электрическим полем. Диэлектрическая проницаемость воды очень высока и составляет 78,6. Эта константа играет очень важную роль в воде, являющейся универсальным растворителем.
Химические свойства воды
Химическая формула: Химическая формула воды \[H_{2}O\]. Как было описано ранее, молекула воды образована ковалентной связью атомов водорода и кислорода.
Амфотерность воды: Амфотерность воды — одно из важнейших свойств воды. Амфотерность означает способность вещества действовать как кислота или основание. Вода в естественном состоянии не является ни кислой, ни щелочной. Основная причина заключается в его способности отдавать и принимать протоны. Однако дождевая вода слабокислая, с pH от 5,2 до 5,8.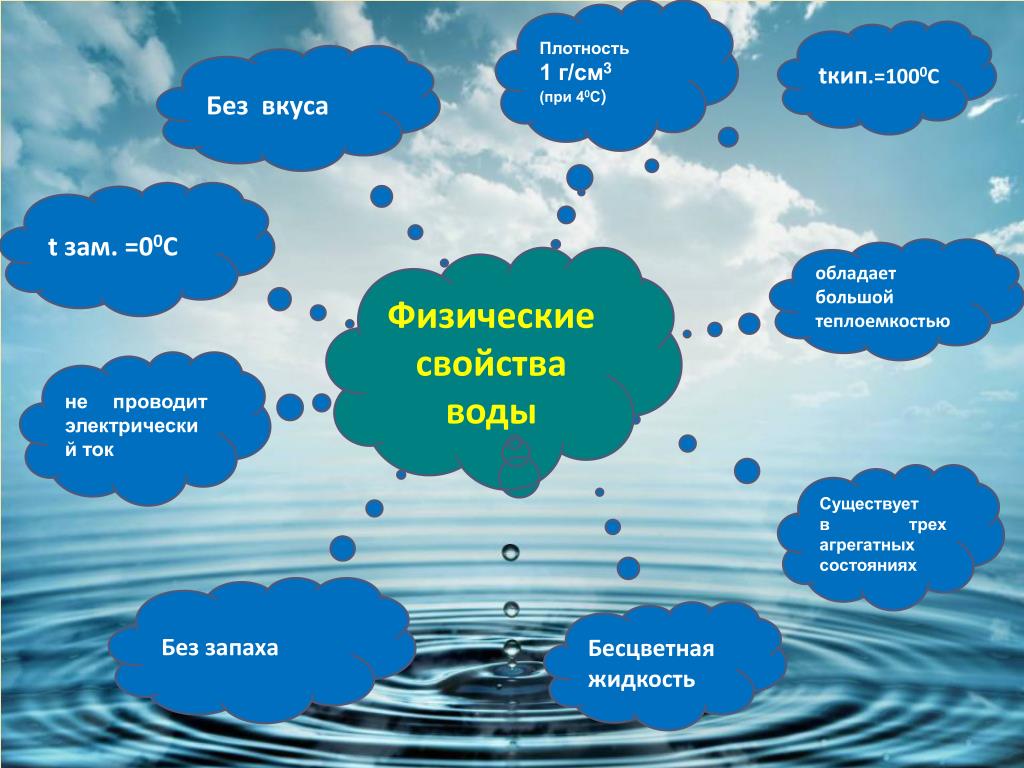
Растворимость воды: Вода считается универсальным растворителем. Это связано с химическим составом и физическими свойствами, а также с его высокой диэлектрической проницаемостью, что делает его наиболее растворимым веществом. Наличие положительных и отрицательных зарядов у водорода и кислорода соответственно позволяет ему притягиваться к другим молекулам соединений, нарушая их молекулярные силы и позволяя им распадаться и растворяться.
Химическое соединение, состоящее из двух атомов водорода и одного атома кислорода, известно как вода. Воду обычно называют жидким состоянием этого соединения, твердую фазу называют льдом, а газ называют паром. Сверхкритический флюид также образуется водой при особых условиях. В химии формула воды — \[H_{2}O\].
Формула воды
\[H_{2}O\] — это химическая формула воды, состоящей из двух элементов: водорода и кислорода. Чтобы образовалась вода, две молекулы водорода соединяются с одной молекулой кислорода. Вода также известна как универсальный растворитель, что указывает на то, что она обладает свойством растворять многие вещества.
Вода также известна как универсальный растворитель, что указывает на то, что она обладает свойством растворять многие вещества.
Физические свойства воды
Некоторые из физических свойств воды:
Молекулы воды имеют водородные связи между собой.
Температура кипения и плавления воды составляет 100° и 0°C соответственно.
Вода может иметь три состояния: твердое, жидкое и газообразное.
Вода имеет полярную природу, из-за которой она может растворять почти все вещества, поэтому ее называют универсальным растворителем.
В твердом состоянии вода имеет кристаллическую структуру, которая представляет собой клетку, имеющую трехмерную форму.
 Кристаллическая структура воды имеет много пустот, из-за которых плотность льда меньше, чем у воды, и, следовательно, он может плавать на воде.
Кристаллическая структура воды имеет много пустот, из-за которых плотность льда меньше, чем у воды, и, следовательно, он может плавать на воде.Известно, что плотность воды составляет 0,99 г/мл при 4°C.
Физические свойства воды{-}\]
Гидролиз. Диэлектрическая проницаемость воды очень высока, что означает сильную тенденцию к гидратации. При наличии вокруг себя гидратных оболочек вода вступает в сильные реакции с ионами солей.
\[SiCl_{4} + 2H{2}O \rightarrow SiO_{2} 4HCl \]
Окислительно-восстановительные реакции — Диводород можно получить с помощью воды, так как он является отличным источником и может быть восстановлен при реагирует с высоко электроположительным металлом, таким как натрий.

 Нам известно, что температура кипения воды равна 100°С.
Нам известно, что температура кипения воды равна 100°С. Другими словами, густота жидкости — например, сиропа и воды. Вязкость воды составляет 0,89 сП (сантипуаз).
Другими словами, густота жидкости — например, сиропа и воды. Вязкость воды составляет 0,89 сП (сантипуаз). По мере увеличения давления сжимаемость еще больше снижается.
По мере увеличения давления сжимаемость еще больше снижается. Кристаллическая структура воды имеет много пустот, из-за которых плотность льда меньше, чем у воды, и, следовательно, он может плавать на воде.
Кристаллическая структура воды имеет много пустот, из-за которых плотность льда меньше, чем у воды, и, следовательно, он может плавать на воде.