Витамины–антиоксиданты в профилактике и лечении сердечно–сосудистых заболеваний | Полосьянц О.Б., Алексанян Л.А.
Почему стареет человек, в чем причина его смертельных болезней? Эти вопросы всегда волновали ученых различных специальностей во всем мире, и лишь настоящее время завеса тайны над некоторыми из них стала приоткрываться.
Установлено, что один из важных процессов, протекающих в организме, связанном с функционированием и повреждением клеток, определяют так называемые свободные радикалы. Многие годы их существование отрицалось, и лишь с разработкой более тонких и совершенным методов исследования была показана их роль в организме, оказавшаяся порой достаточно драматичной. В начале 70–х годов прошлого века было опубликовано несколько работ, посвященных свободным радикалам, механизму их образования, проблеме старения и значения при этом свободнорадикального окисления, которые положили начало изучению как роли свободных радикалов, так и веществ, блокирующих их активность, названных антиоксидантами.
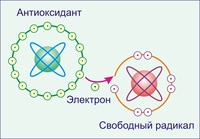
Свободный радикал представляет собой частицу, атом или молекулу, имеющую в своей внешней оболочке один или несколько неспаренных электронов. Это делает радикалы химически активными, поскольку радикал стремится либо вернуть себе недостающий электрон, отняв его от окружающих молекул, либо избавиться от «лишнего» электрона, отдавая его другим молекулам [8].
Чаще всего источником свободных радикалов в организме служит кислород, широко используемый организмом при дыхании, в обычном состоянии, ядро которого окружено 8 спаренными электронами. Также в качестве источников свободных радикалов могут выступать молекулы хлора, азота. Свободные радикалы образуются в организме в результате множества окислительно–восстановительных реакций. Физиологическая роль свободных радикалов заключается в переносе электронов флавинами, необходимых для обновления фосфолипидного слоя, клеточных мембран, они являются неотъемлемыми компонентами реакции окислительного фосфорилирования в митохондриях, митогенезе, они необходимы для передачи сигнала в процессах межклеточного взаимодействия и в процессах перекисного окисления липидов, арахидоновой и докозогексаеновой кислот, необходимых для реализации естественных цитотоксических реакций.
 Некоторые из них, в частности, супероксид, гипохлорная кислота и монооксид азота обладают бактерицидным и противоопухолевым действием, а оксид азота, кроме того, является специфическим фактором расслабления сосудов. Регулирующие функции свободных радикалов у здорового человека могут трансформироваться в их повреждающее влияние, прежде всего при изменении их количества [10].
Некоторые из них, в частности, супероксид, гипохлорная кислота и монооксид азота обладают бактерицидным и противоопухолевым действием, а оксид азота, кроме того, является специфическим фактором расслабления сосудов. Регулирующие функции свободных радикалов у здорового человека могут трансформироваться в их повреждающее влияние, прежде всего при изменении их количества [10].Число «лишних», не задействованных в физиологических процессах, свободных радикалов в организме прогрессивно увеличивается с возрастом, при физической нагрузке, при резких изменениях температуры, различных видах облучения, при инфекциях и интоксикациях (например, алкогольной), во время таких физиологических и патологических процессов, как апоптоз, воспаление, иммунный ответ.
Пытаясь возместить потерю электрона, свободный радикал отбирает его, например, у молекулы, входящей в состав бислоя клеточной мембраны, превращая ее в новый свободный радикал, так называемый вторичный. В дальнейшем возникает патологическая цепная реакция, которая нарушает целостность клеток и вызывает их гибель, названная свободнорадикальным каскадом и определяющая так называемый окислительный или оксидативный стресс. Разрушительное действие свободных радикалов проявляется в ускорении процессов старения организма, провоцировании воспалительных процессов в различных тканях и системах организма, включая клетки мозга, сердца, кроветворной, иммунной системы и многих других. В настоящее время доказана роль свободнорадикального окисления в патогенезе таких заболеваний, как атеросклероз, болезнь Альцгеймера, ангиопатии при сахарном диабете, дегенеративные заболевания суставов и позвоночника, катаракты, некоторые виды злокачественных опухолей, системных заболеваний. Постоянное образование свободных радикалов в процессе старения человека приводит к снижению функциональной активности его органов [10,11].

Механизм повреждающего действия свободными радикалами может различаться при разных патологиях. Так, при атеросклерозе большее значение приобретает перекисное окисление липидов (ПОЛ), при дегенеративных заболеваниях – повреждение белков, а в канцерогенезе ведущим является структурное нарушение нуклеиновых кислот ДНК и РНК. Естественно, во всех случаях процессы перекисного окисления не идут изолированно, и резкая активация одного из направлений затрагивает и другие – по типу цепной реакции. Тем не менее, можно говорить, что при различных заболеваниях ведущее значение в развитии патологических изменений будут иметь различные звенья процесса свободнорадикального окисления и будут более эффективны определенные вещества, мишенью которых являются именно те звенья, к которым у них имеется большее сродство [11].
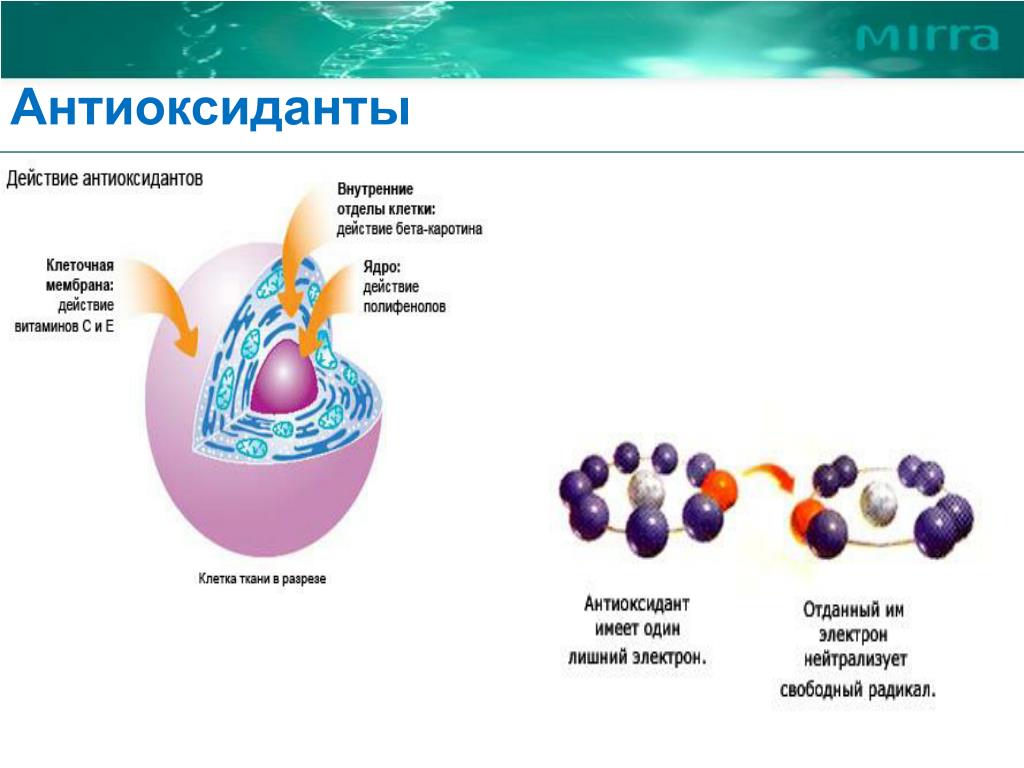
 Взаимодействуя со свободными радикалами, антиоксиданты сами становятся окисленными, так называемыми третичными радикалами, и уже не могут в дальнейшем выполнять свои функции, поэтому запас антиоксидантов необходимо пополнять постоянно.
Взаимодействуя со свободными радикалами, антиоксиданты сами становятся окисленными, так называемыми третичными радикалами, и уже не могут в дальнейшем выполнять свои функции, поэтому запас антиоксидантов необходимо пополнять постоянно.В организме существует естественная антиоксидантая система, состоящая из антиоксидантных ферментов: супероксиддисмутазы, связывающей активные формы кислорода с образованием перекиси водорода; каталазы, деструктирующей перекиси в липидные гидропероксиды, глутатионпероксидазы, редуцирующей липидные гидропероксиды за счет окисления глутатиона, глутатионредуктазы, восстанавливающей глутатион путем окисления НАДФН (последний восстанавливается через цитохромную цепь). Эндогенная антиоксидантная система организма, контролируя повреждающее действие свободных радикалов, играет огромную роль в нормализации метаболических процессов, поддерживая естественный метаболический баланс. В дополнение к ней существует система природных антиоксидантов, представленная прежде всего витаминами (токоферолом, витамином А и каротиноидами, аскорбиновой кислотой), флавоноидами – естественными пигментами растений, убихиноном и др.

Одной из самых обсуждаемых тем, посвященной оксидативному стрессу и защитной роль антиоксидантов, является перекисное окисление липидов при развитии атеросклероза.
В крупных эпидемиологических исследованиях была установлена связь между низким содержанием естественных антиоксидантов в организме и достоверным увеличением риска сердечно–сосудистых заболеваний. Экспериментальное изучение процесса атерогенеза установило роль свободнорадикального окисления в процессе формирования атеросклеротической бляшки. В литературе представлено множество исследований – от изучения химии и энзимологии процесса окисления липопротеинов низкой плотности (ЛПНП) in vitro, биологических эффектов окисленного ЛПНП на культуре клеток и у лабораторных животных до определения роли антиоксидантов при атеросклерозе у человека в крупных многоцентровых исследованиях [2].

Известно, что в процессе ПОЛ образуются так называемые модифицированные (окисленные) ЛПНП, которые плохо распознаются рецепторами гепатоцитов и не участвуют в нормальном физиологическом пути катаболизма ЛПНП. Окисленные липопротеиды захватываются макрофагами, которые при этом трансформируются в пенистые клетки, которые, разрушаясь, выделяют липидные кристаллы, входящие в состав атеросклеротических бляшек. Кроме того, модифицированные ЛПНП вызывают повреждение сосудистого эндотелия, запуская целый каскад патологических реакций со стороны сосудистой стенки. Кроме того, в атерогенезе могут играть роль такие факторы, связанные с антиоксидантной системой, как повреждение свободными радикалами эндотелия сосудов, нарушение гемостаза, смещение его в сторону гиперкоагуляции, изменение подвижности тромбоцитов, иммунные нарушения. Немаловажным является также усиленное развитие такого фактора риска, как артериальная гипертензия. Возникающее при оксидативном стрессе снижение синтеза эндогенного оксида азота за счет его связывания вторичными липидными радикалами уменьшает эндотелий–зависимую вазодилатацию, при этом происходит не только повышение АД, но и снижается активность многих гипотензивных и антиангинальных препаратов [5,7,9,12].

На опытных моделях было показано, что простое добавление антиоксидантов к плазме крови повышает устойчивость ЛПВП, а в культуре клеток происходит уменьшение накопление липидов, миграции макрофагов и снижение активности пролиферации клеток интимы. Эксперименты на животных показали способность антиоксидантов предотвращать развитие экспериментального атеросклероза, стабилизировать уже имеющиеся атеросклеротические изменения в сосудах. Эти данные подготовили почву для изучения действия антиоксидантов у человека. В настоящее время имеется множество различных исследований использования различных природных и синтетических антиоксидантов, результаты которых оказались далеко не однозначными.
В таблице 1 приведено несколько исследований, доказывающих положительное действие антиоксидантов. Видно, что несмотря на, казалось бы, позитивные результаты, предполагаемый и реальный эффект разнятся значительно. Так, практически ни в одном исследовании нет снижения частоты фатального инфаркта миокарда и других смертельных конечных точек, нет эффекта у женщин.

С чем это может быть связано? Среди причин можно рассматривать несколько. Во–первых, в основном эффект антиоксидантов при атеросклерозе преимущественно профилактический. А так как процесс образования атеросклеротической бляшки начинается в молодости, при ее формировании и манифестации ишемической болезни вряд ли можно добиться значительных успехов, используя средства, влияющие преимущественно на ранние патологические этапы. Во–вторых, как уже доказано, существует целая антиоксидантная система со своим легко нарушаемым балансом. Использование же какого–либо одного или нескольких экзогенных антиоксидантов может нарушить равновесие, причем, скорее, в худшую сторону. В качестве третьей причины не исключаются генетические дефекты, приводящие к ферментопатиям в антиоксидантной системе организма. В этом случае имеющиеся нарушения просто не могут быть устранены теми препаратами, которые мы используем, вследствие специфичности этих нарушений.

Так применять или не применять антиоксиданты? Несмотря ни на что большинство ученых все–таки рекомендуют использовать их, как профилактические средства с раннего возраста, в дополнение к другим лекарствам при развитии болезней, как один их компонентов здорового образа жизни.
Среди множества антиоксидантов, различающихся по механизму действия, происхождению, точкам приложения, химической структуре и др., с практической точки зрения большой интерес представляют естественные экзогенные антиоксиданты–витамины – вследствие своей доступности, распространенности в природе, лучшей изученности и близости по своей сути к организму человека.
От момента открытия витаминов до исследования механизма их действия, их роли в гомеостазе и понимания их значения в оксидативной защите организма прошло почти 450 лет. И сейчас не до конца ясными является их роль в развитии атеросклероза, канцерогенеза, различия их действия в эксперименте и клинических исследованиях.
В настоящее время доказанной антиоксидантной активностью среди витаминов обладают витамины А, Е и аскорбиновая кислота.

Витамин А представляет собой жирорастворимый витамин, совместно с другими каротиноидами представляет собой мощную естественную антиоксидантную защиту организма. Существуют разновидности витамина А, наибольшее физиологическое значение из них имеет витамин А1, имеющий несколько предшественников – a, b и g–каротиноидов, среди которых наибольшей витаминной и антиоксидантной активностью обладает b–каротин (кстати, не дающий симптомов гипервитаминоза).
Механизм действия витамина А и b–каротина как антиоксидантов заключается в участии в обмене тиоловых соединений, торможении превращения сульфгидрильных групп в дисульфидные, нормализации функционально–структурных свойств мембран. Согласно мембранной теории действия витамина А, ретинол способен проникать в гидрофобную зону биомембран и взаимодействовать с лецитино–холестериновыми монослоями на границе раздела фаз, вызывая перестройку мембран клетки, лизосом и митохондрий. b–каротин выполняет антиоксидантные функции за счет наличия изопреноидных участков в своей формуле.
Витамин А широко распространен. Им особенно богаты печень крупного рогатого скота и свиней, яичный желток, цельное молоко, масло, сметана, печень морского окуня, трески, палтуса. Каротиноидами богаты овощи и фрукты, окрашенные в красный и оранжевые цвета (морковь, помидоры, перец и др.).
Рекомендованная антиоксидантная доза витамина А составляет от 3300 до 5000 МЕ, большие же дозы могут приводить к явлениям гипервитаминоза, потребление b–каротина целесообразно в дозах, соответствующих верхнему уровню физиологических норм (6–10 мг/сут.).
Витамин Е – существует несколько химически различающихся соединений, относящихся к токоферолам, наибольшей биологической активностью из которых обладает a–токоферол. Он содержится в мембранах живых клеток. Его естественным источником могут выступать злаковые, растительные масла, полученные с помощью холодного отжима, зеленые части растений, икра.
Витамин Е активирует синтез гема и гемоглобина, миоглобина, каталаз, пероксидаз, ферментов тканевого дыхания – коэнзима Q и цитохромов, в том числе и цитохрома Р–450.
 Он контролирует не только энергетические (образование энергии в митохондриях), но и синтетические процессы в тканях.
Он контролирует не только энергетические (образование энергии в митохондриях), но и синтетические процессы в тканях.Вследствие липофильности молекула токоферола способна встраиваться в липидный слой мембран клеток и оказывать тем самым мембранопротективное и мембраностабилизирующее действие, поддерживая функциональную устойчивость внешней плазматической мембраны клетки, в том числе эритроцитарной, мембран лизосом, способствует нормализации тканевого дыхания в митохондриях, стабилизации ферментных систем клетки, препятствующих активности ПОЛ. При взаимодействии с пероксидными радикалами липидов витамин Е восстанавливает их в гидропероксиды, превращаясь при этом в комплекс токоферол–хинон, экскретируемый почками. Витамин Е является самым сильнодействующим природным антиоксидантом, играющим не до конца еще изученную роль в метаболизме селена. Связываясь в биологических мембранах с полиненасыщенными жирными кислотами (прежде всего арахидоновой) витамин Е препятствует образованию простагландинов, уменьшая реакции воспаления.
 Восстановителем антиоксидантных свойств токоферола является аскорбиновая кислота.
Восстановителем антиоксидантных свойств токоферола является аскорбиновая кислота. Экспериментально и клинически отмечено потенцирование антиоксидантного эффекта a–токоферола при сочетании с аскорбиновой кислотой, ретинолом, флавоноидами и препаратами селена.
При дефиците витамина Е отмечено выраженное развитие атеросклероза, преждевременное старение. Так, отмечена обратная корреляционная связь количества токоферола в рационе и частоты ИБС, жирового гепатоза. Исследования у больных различными формами ИБС выявило наиболее отчетливую тенденцию к снижению содержания в плазме витаминов Е и А у больных с острым коронарным синдромом и менее выраженную – у больных со стабильной стенокардией. Эти данные демонстрируют интенсивный процесс окисления и более низкую антиоксидантную активность при данных состояниях.
Дозировка витамина Е как антиоксиданта составляет 400–800 МЕ и при необходимости может быть безопасно увеличена.
Витамин С (аскорбиновая кислота) – водорастворимый витамин, широко представленный в природе.
 Витамин С участвует практически во всех видах обмена веществ, его биосинтез осуществляется растениями и большинством животных, за исключением человека и других приматов.
Витамин С участвует практически во всех видах обмена веществ, его биосинтез осуществляется растениями и большинством животных, за исключением человека и других приматов. Аскорбиновая кислота содержится в значительных количествах в продуктах растительного происхождения: цитрусовых и другие фруктах и ягодах, плодах шиповника, капусте, хвое и др.; однако в процессе кулинарной обработки и хранении она легко разрушается, что может обусловливать ее дефицит. Для медицинских целей витамин С получают синтетическим путем.
Аскорбиновая кислота является и уникальным витамином, и уникальным антиоксидантом, так как будучи водорастворимой легко проникает во все ткани, многие реакции, происходящие с ее участием, являются обратимыми, она активно взаимодействует с другими антиоксидантами и витаминами в метаболизме.
Витамин C вместе со своим метаболитом – дегидроаскорбиновой кислотой образует окислительно–восстановительную систему, транспортирующую ионы водорода. Аскорбиновая кислота участвует в синтезе коллагена, гиалуроновой кислоты, стероидных гормонов, норадреналина, карнитина, абсорбции железа из кишечника и включении его в гем, активации металлоферментов, образовании активных метаболитов витамина D, являясь его синергистом. Витамин С способен увеличивать количество оксида азота в эндотелии, препятствуя его разрушению и увеличивая его синтез [6].
Витамин С, взаимодействуя с токоферолом и глутатионом, является одним из ведущих компонентов биологической антиоксидантной системы. Доказано стимулирующее влияние витамина С на активность цитохрома Р–450 – ключевого фермента гидроксилирования и перекисного окисления. Витамин С в форме аскорбата–иона – наиболее важный эндогенный антиоксидант плазмы крови, он защищает липиды от окисления пероксидными радикалами. Витамин С относится к антиоксидантам немедленного действия, который называют «ловушкой радикалов». Кроме того, аскорбиновая кислота препятствует окислению и разрушению других важных антиоксидантов–витаминов Е и А. Высокие концентрации аскорбиновой кислоты определяются в метаболически активных органах и тканях: надпочечниках, хрусталике, роговице, почках, головном мозге, поджелудочной железе, а также в тромбоцитах и лейкоцитах [1].
Относительно используемых доз аскорбиновой кислоты нет однозначного мнения. Известно, что один из пропагандистов ее применения как средства продления жизни Л. Поллинг рекомендовал дозы до 10 г в сутки. Академик АМН СССР А.Л. Мясников также советовал принимать аскорбиновую кислоту в больших дозах (по 2–3 г) в день для профилактики и лечения атеросклероза. Однако эти дозы, как известно, могут оказывать токсичное действие на поджелудочную железу, способствуют образованию камней в мочевыводящих путях, проявляют эффект гиперкоагуляции. Поэтому Комитет экспертов ВОЗ ввел понятие о безусловно допустимой суточной дозе витамина С, которая не превышает 2,5 мг/кг веса тела, что при среднем весе в 80 кг составляет 200 мг. Данная доза многими врачами и представляется оптимальной для профилактических и антиоксидантных целей.
На рынке в настоящее время представлен препарат, содержащий 200 мг аскорбиновой кислоты – Асвитол (Фармстандарт, Россия) в виде таблеток для разжевывания (включен в новый Перечень лекарственный средств льготного отпуска). Асвитол показан к применению как в профилактических целях, так и в составе комплексной терапии заболеваний желудочно–кишечного тракта, сердечно–сосудистой системы, патологий респираторной системы, длительных инфекционных заболеваний. Взрослым пациентам с целью профилактики назначают по 1 таблетке 1 раз в сутки; в лечебных целях – по 1–2 таблетке 1–2 раза в сутки. Длительность приема зависит от характера заболевания.
Литература
1. Carr, A. C, Frei, B. Toward a new recommended dietary allowance for vitamin C based on antioxidant and health effects in humans. //Am. J. Clin. Nutr.– 1999.– Vol. 69.– P. 1086–1107.
2. Chisolm GM, Steinberg D. The oxidative modification hypothesis of atherogenesis: an overview. //Free Radic Biol Med.– 2000.– Vol. 28(12).– P.1815–1826.
3. Halliwell B., Gutteridge J.M. The antioxidants of human extracellular fuids. //Arch. Biochem. Biophys.– 1990.– Vol. 280.– P. 1–8.
4. Kris–Etherton P.M., Lichtenstein A.H., Howard B.V., et al. Antioxidant Vitamin Supplements and Cardiovascular Disease. //Circulation.– 2004.– Vol. 110.– P. 637–641.
5. Levy A.P., Friedenberg P., Lotan R., et at. The Effect of Vitamin Therapy on the Progression of Coronary Artery Atherosclerosis Varies by Haptoglobin Type in Postmenopausal Women //Diabetes Care.– 2004.– Vol. 27.– P. 925–930.
6. Padayatty, S. J., Katz, A., Wang, Y., Eck, P., Kwon, O., Lee, J.–H., Chen, S., Corpe, C., Dutta, A., Dutta, S. K, Levine, M. Vitamin C as an Antioxidant: Evaluation of Its Role in Disease Prevention. //J. Am. Coll. Nutr.– 2003.– Vol. 22.– P. 18–35.
7. Steinberg D., Witztum J.L. Is the Oxidative Modification Hypothesis Relevant to Human Atherosclerosis? Do the Antioxidant Trials Conducted to Date Refute the Hypothesis? //Circulation.– 2002.– Vol. 105.– P. 2107–2111.
8. Владимиров Ю.А. Свободные радикалы и антиоксиданты. Вестник Российской Академии Медицинских Наук.– 1998.– № 7.– С. 43–51.
9. Голиков А. П., Бойцов С. А., Михин В. П., Полумисков В. Ю. Свободнорадикальное окисление и сердечно–сосудистая патология: коррекция антиоксидантами. //Лечащий Врач.– 2003.– № 04.
10. Зайцев В.Г., Островский О.В., Закревский В.И. Связь между химическим строением и мишенью действия как основа классификации антиоксидантов прямого действия. //Эксперим. клин. фармакол.– 2003.– Т.66.– № 4.– С.66–70.
11. Оковитый С.В. Клиническая фармакология антиоксидантов. //Фарминдекс: практик.– 2001.– выпуск 5.
12. Свободно–радикальное окисление и антиоксидантная защита при сахарном диабете. Пособие для врачей. Под редакцией директора ЭНЦ РАМН Академика РАМН профессора И. И. Дедова, Москва, 2001.
.
Оценка антиоксидантной активности организма в диагностическом центре «МедиСкан» в Домодедово
В последние 10–15 лет ученым удалось раскрыть механизмы многих патологических процессов в организме. В основе этих механизмов, приводящих к различным заболеваниям, и, в конечном итоге, к старению организма, лежит одно и то же явление — повреждение клеточных структур. Основным фактором повреждения клеток оказался кислород — тот самый кислород, из-за недостатка которого возникает гибель клеток.
В последние 10–15 лет ученым удалось раскрыть механизмы многих патологических процессов в организме. В основе этих механизмов, приводящих к различным заболеваниям, и, в конечном итоге, к старению организма, лежит одно и то же явление — повреждение клеточных структур. Основным фактором повреждения клеток оказался кислород — тот самый кислород, из-за недостатка которого возникает гибель клеток.
Однако когда свободных радикалов становится много, чаша весов «окисление — восстановление» перевешивает в сторону окисления. В результате свободные радикалы начинают взаимодействовать не с теми молекулами, с которыми это необходимо для нормальной жизнедеятельности клетки, а со всеми подряд, например, с липидами клеточных мембран. Они окисляют липиды и происходит образование опасной формы липидного пероксида. В результате перекисного окисления липидов, клеточные мембраны изменяются, они становятся плохо проницаемыми и не справляются со своей главной функцией: избирательно пропускать в клетку одни ионы и молекулы и задерживать другие. В результате клетки начинают хуже работать. Если это клетки, из которых состоят кровеносные сосуды, может развиться атеросклероз, если зрительные клетки сетчатки глаза — катаракта. При повреждении нейронов головного мозга — слабеют память и внимание. А если свободные радикалы «добираются» до наследственного вещества клетки, молекул ДНК, то последствия еще серьезнее. Поскольку ДНК контролирует буквально все процессы в организме, то следствием ее повреждения могут быть и дефект в выработке гормонов, и нарушение процессов пищеварения, и потеря контроля над ростом и делением клеток, что ведет к их злокачественному перерождению.
Таким образом, в настоящее время с формированием липидной пероксидации ученые связывают процесс ускоренного старения, болезни сердца, иммунодефициты, онкологические другие заболевания.
Откуда же берутся свободные радикалы? Кроме нормального «воспроизводства» свободных радикалов в процессе жизнедеятельности организма мы «добавляем» их в свой рацион, когда едим консервированное мясо, некачественное масло или ветчину, употребляем некоторые лекарства, спиртные напитки, овощи, прошедшие обработку пестицидами. Они попадают в легкие вместе с воздухом, насыщенным выхлопными газами, табачным дымом, мельчайшими частицами асбестовой пыли. Усиленному образованию их в организме способствуют рентгеновское излучение и инфракрасные лучи. И, наконец, свободные радикалы в ненужном избытке сами образуются в клетках при эмоциональных потрясениях, травмах, больших физических нагрузках.
Однако организм обладает немалыми возможностями для борьбы со свободными радикалами. Специальная система защиты, называемая антиоксидантной (противоокислительная система защиты), устраняет нарушения клеточных структур, являясь «ловушкой» для свободных радикалов. Она сдерживает излишнее образование свободных радикалов и направляет их по тем путям клеточного метаболизма, где они приносят пользу.
Сейчас известен целый ряд соединений, обладающих антиоксидантными свойствами. Они представлены ферментами и низкомолекулярными соединениями. Среди ферментов, в первую очередь, следует выделить супероксиддисмутазу (СОД) — антиоксидант, представляющий первое звено защиты. Этот фермент находится во всех клетках, потребляющих кислород. В организме имеется три формы СОД, содержащие медь, цинк и магний. Роль супероксиддисмутазы заключается в ускорении реакции превращения токсичного для организма кислородного радикала (супероксид ОО-), продукта окислительных энергетических процессов, в перекись водорода и молекулярный кислород. При ишемической болезни сердца СОД защищает сердечную мышцу от действия свободных радикалов. Уровень СОД в сыворотке при ишемической болезни высокий.
Особое место в антиоксидантной системе организма, антиоксидантном статусе принадлежит глутатион-ферментному автономному объединению: глутатион, глутатионпероксидаза, глутатион-S-трансфераза, глутатион-редуктаза. Известно, что мощнейшим «поставщиком» свободных радикалов является перекись водорода. Для расщепления большого количества перекиси водорода требуется малое количество фермента. Фермент, глутатионпероксидаза, заставляет перекисные радикалы вступать в реакцию друг с другом, после чего образуются вода и кислород. Глутатионпероксидаза содержит селен и играет основную роль в инактивации липидных гидроперекисных соединений. Недостаток селена ведет к снижению активности антиоксидантных ферментов и превращению глутатионпероксидазы в глутатион-S-трансферазу. Для сохранения активности глутатионпероксидазы, помимо селена, необходимы витамины А, С, Е, S- содержащие аминокислоты и, естественно, глутатион. Весь этот глутатионферментный комплекс предотвращает нарушение клеточных мембран вследствие разрушения пероксидов.
Фермент церулоплазмин является универсальным внеклеточным «гасителем» свободных радикалов. Он является белком плазмы крови, выполняющим в организме ряд важных биологических функций: повышает стабильность клеточных мембран, участвует в иммунологических реакциях (в формировании защитных сил организма), ионном обмене, оказывает антиоксидантное (препятствующее перекисному окислению липидов клеточных мембран) действие, тормозит перекисное окисление липидов (жиров), стимулирует гемопоэз (кроветворение). Церулоплазмин имеет супероксиддисмутазную активность: восстанавливает в крови супероксидные радикалы до кислорода и воды и этим защищает от повреждения липидные структуры мембран. Одной из основных функций церулоплазмина является нейтрализация свободных радикалов, которые освобождаются вовне макрофагами и нейтрофилами во время фагоцитоза, а также при интенсификации свободнорадикального окисления в очагах воспаления. Он окисляет разные субстраты: серотонин, катехоламины, полиамины, полифенолы, превращает двухвалентное железо в трехвалентное. Церулоплазмин переносит медь из печени к органам и тканям, где она функционирует в виде цитохром-С-редуктазы и супероксиддисмутазы. Фермент является фактором естественной защиты организма при воспалительных, аллергических процессах, стрессовых состояниях, повреждениях тканей, в частности, при инфаркте миокарда, ишемии.
Поддерживать организм в здоровом состоянии — значит сохранять необходимый баланс между свободными радикалами и антиокислительными силами, роль которых выполняют антиоксиданты. Большинство антиоксидантов поступает в организм с пищей. Антиоксиданты являются питательными веществами, в которых постоянно нуждается организм человека. К ним относятся витамины (А, С, Е), селен, цинк, глутатион и др. Наиболее эффективным по своим антиоксидантным свойствам издавна считается витамин Е, улучшающий иммунный статус у пожилых людей и снижающий риск атеросклероза. Витамин С известен, как важный клеточный антиоксидант во многих тканях. Он имеет определенный защитный эффект против возникновения инсульта. Предшественники витамина А— каротиноиды эффективно уничтожают свободные радикалы, в т.ч. синглетный кислород, который может привести к развитию неоплазий.
Исследования показали, что антиоксиданты помогают организму снижать уровень повреждения тканей, ускорять процесс выздоровления, противостоять инфекциям, а следовательно, увеличить продолжительность жизни.
Антиоксиданты все более широко применяются для профилактики последствий простудных заболеваний, при большинстве острых заболеваний и состояний, при обострении хронических заболеваний, интоксикациях, ожогах, травмах, операциях, для устранения синдрома «весенней слабости», обусловленного, как полагают, интенсификацией перекисного окисления липидов (ПОЛ). Перекиси липидов необходимы для биосинтеза эйкозаноидов (простагландинов, простациклинов, тромбоксанов, лейкотриенов), прогестерона. Они участвуют в гидроксилировании холестерина (в частности, при образовании кортикостероидов), что создает благоприятные условия для функционирования ферментных систем в мембранах. Для диагностики липоперекисной патологии и оценки эффективности проводимого лечения содержание первичных, вторичных и конечных продуктов ПОЛ принято определять в плазме и эритроцитах крови.
В лаборатории «Диалаб» проводится комплекс исследований по оценке уровня отдельных ферментов-антиоксидантов (СОД, церулоплазмин, глутатионпероксидаза), витаминов-антиоксидантов, микроэлементов, определению перекисного окисления липидов (ПОЛ) и оценке общего антиоксидантного статуса (TAS) — как показателя многоуровневой системы антиоксидантной защиты организма. Такая комплексная диагностика позволит врачу-специалисту скорректировать антиоксидативный статус пациента до появления симптомов заболевания и использовать показатели TAS и ПОЛ как индикацию для назначения пациенту антиоксидативной терапии.
Клинико-диагностическая программа «Остеопороз» в лаборатории «Диалаб»
В лаборатории «Диалаб» проводится весь спектр исследований, необходимых для диагностики остеопороза. Программа включает следующий перечень анализов:
- антиоксидантный статус;
- анализ волос на содержание микроэлементов;
- общеклинические анализы крови, мочи;
- анализ мочи на микроальбуминурию;
- стандартный набор биохимических тестов + Na\K\Cl\Mg\;
- паратгормон, кальцитонин;
- деоксипиридининолин, пиридинолин;
- тестостерон, эстрогены, гестагены, ИФР, ТТГ;
- beta-cross laps (С-концевые телопептиды коллагена I типа).
Выявление маркера костной резорбции b-CrossLaps в сыворотке крови
Маркер костной резорбции — b-CrossLaps сыворотки крови — продукт деградации коллагена 1 типа, который составляет более 90% органического матрикса кости. В норме малые фрагменты коллагена, образующиеся при его деградации, поступают в кровь и выводятся почками с мочой. Их концентрация носит циркадный ритм: максимальные значения наблюдаются в полночь. При физиологически или патологически увеличенной костной резорбции (например, в пожилом возрасте или в результате остеопороза) скорость деградации коллагена 1 типа возрастает, соответственно, увеличивается содержание его фрагментов в сыворотке. Входящая в состав С-терминальных телопептидов альфа-аспарагиновая кислота конвертируется в бета-форму (b-CrossLaps). Изомеризованные телопептиды являются специфичными продуктами деградации коллагена 1 типа, уровень которых возрастает у пациентов с повышенной костной резорбцией. Они специфичны только для костной ткани. Их определение в крови имеет важное преимущество, так как они не подвергаются дальнейшему катаболизму.
Определение этого телопептида используют при диагностике и контроле за эффективностью терапии остеопороза, ревматоидного артрита, болезни Педжета, обменных остеопатиях, множественной миеломе и гиперпаратиреоидизме. На фоне терапии, направленной на ингибирование костной резорбции, уровень b-CrossLaps в сыворотке крови постепенно возвращается к норме (не ранее, чем через несколько недель). Следует учитывать, что различные клинические ситуации, затрагивающие уровень костной резорбции (состояние гиперпаратиреоидизма, гипертиреоидизма), могут влиять на результаты исследования. У пациентов со сниженной функцией почек содержание b-CrossLaps в сыворотке крови возрастает вследствие снижения экскреции.
Анализ на маркер костной резорбции b-CrossLaps в сыворотке крови Вы можете сделать в лаборатории «Диалаб».
Показания к назначению анализа:
- Диагностика остеопороза.
- Мониторинг и оценка эффективности терапии остеопороза.
- Решение о проведении и контроле заместительной гормональной терапии у женщин в менопаузе.
- Хроническая почечная недостаточность.
Глутатион: формула молодости и здоровья
Кажется, о пользе антиоксидантов сказано всё! Они продлевают молодость, активно борются со свободными радикалами, предотвращая опасные заболевания. Но какой из антиоксидантов можно назвать альфой и омегой для здорового функционирования нашего организма? Именно глутатион является одним из самых мощных антиоксидантов, который отвечает за нашу молодость, красоту, активность и хорошее самочувствие. Почему глутатион считается «королём» антиоксидантов? И насколько важно восполнять его запасы в организме? Давайте разбираться!
Глутатион как антиоксидант
Это один из самых мощных антиоксидантов, который активно борется со свободными радикалами в организме, предотвращая различные заболевания, включая рак. Глутатион выполняет очень важную антиоксидантную функцию в организме, защищая наш иммунитет. Роль глутатиона в антиоксидантных процессах в организме огромная! Дефицит этого вещества в организме может вызвать серьёзные проблемы со здоровьем: сердечно-сосудистые заболевания, рак, болезнь Альцегеймера и болезнь Паркинсона.
Также могут возникать нарушения иммунной системы – хронические инфекции, синдром хронической усталости, астма, сахарный диабет, артрит. Хоть в нашем организме и есть механизмы выработки этого жизненно важного антиоксиданта, но с возрастом его становится всё меньше и меньше. На процесс выработки глутатиона также влияют частые стрессы, неблагоприятная экология, вредные привычки, неправильное питание. Поэтому очень важно восполнять его запасы с помощью питания и диетических добавок.
Молекула здоровья: основные функции
Если разобрать химическую формулу глутатиона, то окажется, что это простая молекула, которая состоит из трех аминокислот – цистеина, глицина и глутамина. Но главный секрет этого сильнейшего антиоксиданта в том, что он содержит серу – клейкое вещество, к молекулам которой прилипают свободные радикалы, токсины и тяжелые металлы. Глутатион в первую очередь защищает иммунную систему, контролируя все антиоксидантные процессы в организме.
Глутатион также стимулирует работу других антиоксидантов – витаминов С, Е, бета каротина. Антиоксидант влияет на все системы организма: иммунную, нервную, желудочно-кишечную системы и легкие. Он незаменим для протекания всех обменных и биохимических процессов в организме. Глутатион обладает омолаживающими свойствами: поддерживает тургор и здоровый цвет кожи, уменьшает пигментацию, уменьшает поры и осветляет кожу. Антиоксидант также нормализует сон и успокаивает нервную систему.
Как восполнить запасы глутатиона?
Учёные давно доказали, что основная причина преждевременного старения организма – недостаток глутатиона в клетках. После 20 лет этого вещества в нашем организме с каждым годом становится на 1% меньше. А если учесть крайне неблагоприятную экологию и низкое качество продуктов питания, то у современного человека рано или поздно возникает дефицит глутатиона в организме. Хоть современные производители и предлагают множество диетических добавок в форме капсул, но загвоздка в том, что глутатион, попадая в кислотную среду желудка, почти не усваивается.
А поскольку глутатион вырабатывается организмом самостоятельно, мы можем лишь стимулировать его естественный синтез. Естественный способ повысить уровень самого мощного антиоксиданта – это правильное питание и занятие спортом. Ещё один эффективный способ доставки глутатиона в клетки – его внутривенное введение. Попадая в кровеносную систему, антиоксидант моментально начинает функционировать в организме, восстанавливая и омолаживая его. После капельницы сразу улучшается цвет кожи, появляется чувство легкости и бодрости, а голова начинает мыслить более ясно.
Как видим, глутатион можно смело назвать эликсиром молодости и здоровья. Активное вещество, которое вырабатывается нашим организмом, борется с процессами старения в организме, участвует во всех окислительных и антиоксидантных функциях. Правильное питание, физическая активность, а также внутривенные капельницы, помогают стимулировать выработку глутатиона, восстанавливая все жизненно важные функции в организме.
08.08.2019
Витамин А. Его функции и источники
Витамин А. Его функции и источники
Все мы, конечно же, слышали про витамин А – что он содержится в морковке и чрезвычайно важен для зрения. А употребляя морковный фреш, стоит запивать его свежими сливками. Но так ли прост этот витамин А?
На самом витамин А не похож на другие известные нам витамины. Это не какое-то отдельное химическое вещество, а обобщающее название различных соединений, обладающих общим биологическим действием. Одна группа, которая включает в себя ретинол, ретиналь и ретиноевую кислоту, образует А-витаминный комплекс и называется ретиноиды. Другая группа – про-витамины каротиноиды (в первую очередь β-каротин) способны в организме человека трансформироваться в ретинол (однако всего 10%). Несмотря на то, что обе группы веществ оказывают однонаправленное действие, организм получает их из разных источников. Общим у них является также и то, что они всасываются при участии жиров (поэтому витамин А – жирорастворимый витамин).
Источником ретиноидов являются животные продукты. Особенно богаты ретинолом рыбий жир, яйца, сливочное масло, молоко, говяжья печень. Количество ретиноидов в продуктах может значительно снижаться при неправильном хранении, при порче (прогоркании) жиров. К этому же результату приводит перегревание (длительное кипение) жира в процессе приготовления пищи. Кулинарные потери ретинола при тепловой обработке продуктов могут достигать 40 %.
Ретинол играет важнейшую роль в процессе развития клеток кожи и костной ткани, а также обеспечивает работу зрительного анализатора, включаясь в состав зрительного пигмента радопсина, обеспечивающего фоторецепцию на сетчатке глаза. Синтез радопсина особенно повышается в условиях низкой освещенности, обеспечивая темновую адаптацию. Ретиноевая кислота — необходимый компонент биохимических реакций с участием тиреоидных гормонов и витамина D. Эти процессы обеспечивают правильное внутриутробное развитие, стимулируют рост, влияют на развитие клеток крови, способствуют мобилизации депонированного железа для синтеза гемоглобина. Дефицит витамина А в питании ускоряет развитие железодефицитной анемии и препятствует дополнительному поступлению железа с пищей. Кроме того важнейшей функцией ретинола является его антиоксидантная активность.
Как уже говорилось, основными источниками ретинола являются животные продукты. При этом, чем больше продукт содержит жира, тем больше в нем витамина А. С гигиенических позиций это означает, что не следует увеличивать поступление ретинола за счет пищевых источников. Но не все так плохо – про-витамины А, каротиноиды, способны превращаться в организме в ретиноиды, таким образом, недостаток витамина А можно восполнить через растительную пищу.
В связи с этим скажем о каротиноидах. Название их происходит от латинского carota — наименования семейства моркови, из которой они впервые были выделены. К каротиноидам относятся как вещества с различной А-витаминной активностью: каротин, криптосантин, а так же соединения, не относящиеся к провитаминам: лютеин, зеаксантин и ликопин. Наиболее высокой витаминной активностью среди других каротиноидов обладает β-каротин. Каротиноиды выполняют в организме несколько важных функций: А-витаминную, антиоксидантную и регуляторную (на клеточном уровне). Несмотря на то, что у β-каротина низкая активность (по сравнению с ретинолом), каротиноиды вносят большой вклад в поддержание витаминного статуса. Лютеин и зеоксантин обеспечивают защиту сетчатки глаза, избирательно поглощая синий интервал светового излучения в видимом спектре.
Основным источником каротиноидов являются растительные продукты, как правило, красные и желтые овощи и фрукты. Однако в некоторых листовых растениях, в частности, шпинате, обилие хлорофилла маскирует желто-оранжевый пигмент и придает им зеленый цвет. Главными пищевыми источниками β-каротина признаны морковь, тыква, абрикосы, курага, шпинат. Ликопин поступает в организм с томатами. Лютеином и зеоксантином особенно богаты брокколи, тыква, кабачки, шпинат. Для обеспечения реальной потребности в каротиноидах недостаточно постоянно употреблять любую растительную продукцию — необходимо следить за регулярным включением в рацион именно перечисленных продуктов. Кулинарные потери каротиноидов при тепловой обработке продуктов также могут достигать 40 %. Особенно нестойки каротиноиды на свету.
Сочетание продуктов, содержащих каротиноиды, с пищевыми жирами увеличивает доступность этих витаминов, поэтому целесообразно использовать в питании, например, следующие блюда: тертая морковь или овощной салат с 10%-ной сметаной, молочная тыквенная каша со сливочным маслом. Правильным также будет включение в виде третьего сезонного блюда на обед абрикосов, апельсинов, арбуза, персиков.
Учитывая тот факт, что ретиноиды и каротиноиды поступают в организм с совершенно разными источниками, в настоящее время они классифицируются отдельно. Делаются попытки установить их самостоятельные нормативы поступления в организм, хотя обычно пользуются общим суммарным физиологическим уровнем их суточной потребности, который выражается в ретиноловом эквиваленте. Это показатель имеет половую дифференцировку и для мужчин составляет 1 мг/сут, а для женщин — 0,8 мг/сут. Потребность собственно в самом ретиноле устанавливается в количестве 40% от ретинолового эквивалента, что соответствует 0,4 мг для мужчин и 0,32 мг для женщин. А потребность в β-каротине установлена на уровне 5 мг/сут.
Глубокий дефицит витамина А в питании (авитаминоз) развивается при отсутствии животной и разнообразной растительной пищи, т.е. в условиях голода. В развивающихся бедных странах, на фоне общей белково-энергетической недостаточности очень часто у детей поражается орган зрения — ксерофтальмия с развитием слепоты. При этом имеет место также вторичный иммунодефицит, сопровождающийся чаще всего инфекциями дыхательных путей и мочеполовой системы.
При длительном недостаточном поступлении витамина А (гиповитаминоз) первыми признаками дефицита ретинола являются фолликулярный гиперкератоз и общая сухость кожи, слизистых (например, конъюнктивы), снижение времени темновой адаптации глаза к сумеречным условиям (куриная слепота).
Чрезвычайный пищевой избыток ретинола (гипервитаминоз) может возникнуть в результате употребления с пищей таких продуктов, как печень белого медведя и некоторых морских млекопитающих — крайне редкий случай для современного человека. Описано также отравление ретинолом, избыток которого накопился в традиционном пищевом продукте — печени цыплят по причине технологических нарушений использования витамина в качестве кормовой добавки при выращивании птицы. Однако, гипервитаминоз А чаще всего встречается из-за дополнительного приема лекарственных препаратов в большой дозировке. При длительном поступлении многократно (более чем в 10-20 раз) превышающих физиологическую норму количеств ретинола отмечаются головная боль, диспепсические расстройства (тошнота, рвота), поражение кожи лица и волосистой части головы (зуд, шелушение, выпадение волос), боли в костях и суставах.
Несмотря на то что каротиноиды способны трансформироваться в ретинол, их избыток с пищей не превращается в витамин А при насыщении печеночного депо. При высоком поступлении β-каротина за счет лекарственных препаратов или в результате употребления большого количества богатых им продуктов (например, морковного сока) может развиваться каротинодермия — желтое окрашивание кожных покровов.
При изучении влияния больших доз (20-30 мг/сут) каротиноидов при многолетнем употреблении были получены данные об увеличении смертности от рака легких среди курильщиков со стажем, принимавших этот витамин. Данный результат подтверждает необходимость осторожного отношения к использованию БАД, в том числе витаминов, у лиц с риском развития онкологических заболеваний — практически любой стаж курения сопровождается такой опасностью.
По материалам с сайта «ЗДОРОВОЕ ПИТАНИЕ» (https://здоровое-питание.рф)
Природные антиоксиданты
Если перевести с латинского, «anti» – это «против», «оxys» – это «кислый», то есть антиоксидант, если буквально, – это «противоокислитель». Но причем тут окисление, если речь идет о здоровье?
На Земле естественное разрушение любого вещества идет путем окисления этого вещества кислородом. Ржавеет машина во дворе – это окисление, гниет в парке опавшая листва – это тоже окисление. Человек болеет и старится – это также результат окислительных процессов в его организме. Практически все окислительные реакции вызваны свободными радикалами, другими словами, частичками со свободными электронами. Они опасны тем, что их электроны пытаются дополнить себя парою, позаимствовав её из структуры других атомов, а это прямая причина разрушения клеток. Далее, электроны атакованных клеток также пытаются восстановить свою структуру и уже за счёт других клеток. Увы, это бесконечный процесс, который невозможно остановить.
Антиоксиданты – это специфическая группа химических веществ, которые обладают одним замечательным свойством: они способны связывать упомянутые свободные радикалы, а значит, замедлять окислительные процессы. Следовательно, человек реже болеет и медленнее стареет. Это особенно актуально сейчас, когда эти окислительные процессы бешено ускоряются сумасшедшим темпом нашей жизни, постоянными стрессами, социальными проблемами и плохой экологией.
Какие бывают антиоксиданты?
Антиоксиданты бывают природные и синтетические. Природные содержатся в овощах, фруктах, ягодах, орехах, травах и других продуктах питания. Синтетические – в лекарственных препаратах и БАДах (хотя БАДы тоже бывают натуральными, нужно просто в этом разбираться), а также в пищевых добавках Е (нумерация от 300 до 399), которые добавляются в продукты для того, чтобы они могли дольше храниться.
Сразу заметим, что синтетические антиоксиданты нужны лишь для того, чтобы замедлять процессы окисления в продуктах, и не полезны для здоровья человека (за исключением тех, что содержатся в выверенных дозах в лекарственных препаратах и применяются в ограниченных случаях по рекомендации врача). Впрочем, происходит это лишь с теми, кто постоянно питается полуфабрикатами, консервами и прочим продуктовым ширпотребом из магазина. Но это уже вопрос культуры питания – она или есть, или ее нет.
Виды антиоксидантов
На сегодняшний день учёным известно порядка 3 000 антиоксидантов. И их число растёт с каждым днём, но все они неизменно попадают в три группы:
Витамины, что бывают жиро- и водорастворимыми. Первые, как и следует из названия, участвуют в липидных процессах и защищают жировые ткани, а вторые – заботятся о сосудах, мышцах и связках. Витамины А и Е, а также бета-кератин – это природные и самые мощные антиоксиданты среди жирорастворимых, а витамин С и витамины группы В – среди водорастворимых.
Биофлавоноиды. Эти натуральные вещества оказывают на свободные радикалы связывающее действие, подобное ловушке, тем самым подавляя их формирование и способствуя выводу токсических веществ. К подобным веществам относят катехин (составляющая красного вина) и кверцетин, которого в изобилии во всех цитрусовых и в зелёном чае.
Минеральные вещества и ферменты. Если говорить о минеральных элементах, то, увы, их можно получить лишь извне, так как в организме они не продуцируются. Среди самых важных – цинк, селен, кальций и марганец. Что же касается ферментов, то они зачастую выполняют роль катализаторов. Эти вещества производятся самим организмом и существенно ускоряют обезвреживание свободных радикалов.
Где искать антиоксиданты?
Природа предусмотрела, чтобы в организме человека были все необходимые виды антиоксидантов, но со временем их количество начинает катастрофически снижаться и, тогда радикалы продолжают свою разрушительную работу, не встречая никаких препятствий на пути. Чтобы предотвратить развитие такого неблагоприятного сценария для нашего здоровья, необходимо не забывать о правильном и сбалансированном питании продуктами, в составе которых есть антиоксиданты. Особенно это становится актуальным с увеличением возраста.
К основным антиоксидантам относится витамин Е, благодаря которому происходит регенерация клеток кожи, восстановление её эластичности, благодаря чему он заслуженно получил название витамина молодости. В больших количествах он содержится в растительном масле холодного отжима, злаках, пророщенных зёрнах. Провитамин А, каротин относятся к антиоксидантам жирорастворимым, которые помогают кожи бороться с морщинами. Они есть в моркови, шиповнике, пальмовом масле и облепихе. Биофлавоноиды являются антиоксидантами растительного происхождения, входят в состав растений, имеющих зелёную и синюю окраску. Очень много голубых биофлавоноидов содержится в чернике. Они помогают восстанавливать разрушенные клетки и питать кожу. Коэнзим Q, один из элементов, входящих в омолаживающую косметику, принадлежит к виду антиоксидантов, защищающих кожу лица от старения и повышающих её эластичность, а вот антиоксидант селен помогает усилить противораковую защиту всего организма.
Наиболее мощным и знаменитым из всех антиоксидантов является витамин С. Он относится к антиоксидантам водорастворимым. Его роль защищать от разрушительного воздействия свободных радикалов биологически активные вещества, отвечающие за омоложение организма. Если организм получает витамин С в достаточном количестве, он защищает кожу от ультрафиолета, ускоряет заживление ран, усиливает выработку коллагена, борется с болезнями сердца, замедляет процесс старения. Он необходим нашему организму для здоровья костей, сосудов, снижение риска развития заболеваний сердца и рака, здоровья зубов. Не менее важную роль он играет и в сохранении женской красоты. Если вы курите, потребность в антиоксидантах у вас возрастает в 2 раза, поэтому вам особенно важно есть лайм и лимоны.
Ученые давно определили, что наиболее сильными антиоксидантными свойствами обладают вещества, которые определяют окраску растений. Поэтому больше всего антиоксидантов в овощах и фруктах красного, оранжевого, синего и черного цветов, причем особенно в кисло-сладких и кислых. В желтых, ярко-зеленых и темно-зеленых растениях антиоксидантов тоже много, но не настолько.
фасоль (пестрая, черная и красная, но особенно ценится мелкая)
Список ягод и фруктов выглядит так: – клюква, ежевика и черника (это три самых сильных, по мнению учёных), дикая и садовая смородина, черная и красная малина, калина, облепиха и рябину, земляника, клюква, клубника, сливы, черешня, яблоки, сухофрукты (прежде всего чернослив) черноплодная рябина, вишня, виноград и изюм, ежевика, гранаты и цитрусовые. Среди овощей особенно ценится красная мелкая фасоль, артишок (причем в вареных артишоках антиоксидантов больше), картофель и баклажан, далее капуста, редис, репа, редька, морковь, свекла, чеснок, лук, брокколи, шпинат, петрушка, сельдерей. Три первых места среди орехов заняли: пекан, грецкий орех и фундук, затем миндаль, фисташки. Специи и масла: душица, куркума, корица, кориандр, сушеная петрушка и гвоздика, тертое какао и нерафинированные растительные масла холодного первого отжима (масло косточек винограда), натуральный кофе, красное вино. Среди трав богатым антиоксидантным составом отличаются шалфей и розмарин, ромашка и боярышник, шиповник, трава тысячелистника и полыни горькой, листовой зелёный чай.
Когда бесполезны антиоксиданты?
Ответ на этот вопрос прост – при наличии вредных привычек. Антиоксиданты легко разрушаются, если:
- вы курите;
- злоупотребляете спиртным;
- часто загораете на солнце или в солярии;
- постоянно живете в крупном загазованном городе и редко находитесь на свежем воздухе, а также когда болеете, и если вам уже больше 50 лет.
Тут выход только один. Расставаться с вредными привычками, регулярно выезжать за город на природу и в любом возрасте вести здоровый образ жизни.
Мифы об антиоксидантах
- В нашем питании мало антиоксидантов. Это далеко не так, если вы не злоупотребляете продуктами быстрого приготовления, не соблюдаете всё время диету, едите в достаточно большом количестве овощи и фрукты.
- Антиоксиданты подвержены быстрому разрушению. Это так, если вы курите, всё время загораете в солярии или под прямыми солнечными лучами, если вам более 50 лет, вы часто болеете, редко выходите гулять и живёте в большом городе.
- Нет никакой разницы между искусственными и природными антиоксидантами. Это неправда, природные антиоксиданты более сильны и полезны для нашего организма, поэтому лучше ешьте больше свежих овощей и фруктов, чем специальные таблетки. Сочетание натуральных антиоксидантов защищает организм от свободных радикалов лучше, чем самый разрекламированный синтетический состав.
- Косметика с антиоксидантами способна усилить её положительный эффект. Это не так, чтобы остановить процесс старения, необходимо антиоксиданты принимать внутрь, находясь в косметике, они ничем не смогут помочь. Осторожно, миф навязан рекламой! Поговорка «кашу маслом не испортишь» здесь не проходит. Когда антиоксидантов слишком много, они превращаются в прооксиданты и только вредят.
- Антиоксиданты лучше есть каждый по отдельности. Это неправильно. Антиоксиданты работают только парами, восстанавливая друг друга в процессе борьбы со свободными радикалами. Следует знать, что наилучшего эффекта антиоксиданты достигают лишь тогда, когда действуют парами или даже группами. Так что разнообразьте свой рацион.
Именно знание и употребление продуктов, богатых такими важными элементами, помогут естественным путём сохранить здоровье, молодость и красоту. Получая с питанием необходимое количество антиоксидантов, вы сможете без особого труда сохранить отличное здоровье и замедлить процесс старения.
Берегите себя, питайтесь правильно и будьте здоровы!
Старший преподаватель кафедры функциональной диагностики Жарихина М.П.
Антиоксидант в зеленом чае борется с опухолями и восстанавливает ДНК
Антиоксидант, содержащийся в зеленом чае, может повышать уровень p53, белка, который способен восстанавливать повреждения ДНК или разрушать раковые клетки. Теперь ученые выяснили, как это работает на молекулярном уровне.
Антиоксидант, содержащийся в зеленом чае, может повышать уровень p53, белка, который способен восстанавливать повреждения ДНК или разрушать раковые клетки. Теперь ученые выяснили, как это работает на молекулярном уровне, и описали процесс в журнале Nature Communications. Открытие позволяет в будущем разработать новое лекарство от рака. Новость появилась на сайте Ренсселерского политехнического института (США).
Противоопухолевые свойства антиоксиданта EGCG были обнаружены ранее, однако сейчас ученые рассмотрели на молекулярном уровне, как эти свойства проявляются.
Белок P53 выполняет несколько хорошо известных противораковых функций: останавливает рост клеток для восстановления ДНК, активирует «ремонт» ДНК и запуск запрограммированной гибели клеток – апоптоз, – если повреждение ДНК не может быть восстановлено. Один конец белка – N-концевой домен – имеет гибкую форму и, следовательно, потенциально может выполнять несколько функций в зависимости от его взаимодействия с несколькими молекулами.
Галлат эпигаллокатехина EGCG – природный антиоксидант, который в изобилии содержится в зеленом чае. Также EGCG также упакован в виде травяных добавок.
Команда обнаружила, что взаимодействие между EGCG и p53 не дает белку разрушаться. Обычно после образования в организме р53 быстро разлагается, когда N-концевой домен взаимодействует с белком MDM2. Этот регулярный цикл производства и деградации удерживает уровни p53 на низком уровне.
«И EGCG, и MDM2 связываются в одном и том же месте на p53, N-концевом домене, поэтому EGCG конкурирует с MDM2. Когда EGCG связывается с p53, белок не разлагается через MDM2, поэтому уровень p53 будет увеличиваться при прямом взаимодействии с EGCG, а это означает, что p53 используется для противораковой функции. Это очень важное взаимодействие», – отмечают авторы работы.
[Фото: RENSSELAER POLYTECHNIC INSTITUTE]
Универсальные антиоксиданты
В среднесрочной перспективе система реагирует подавлением биосинтеза протеинов, в долгосрочной перспективе система запускает запрограммированную гибель клетки. Причиной избытка радикалов может быть повышенная метаболическая нагрузка, например, вследствие отрицательного энергетического баланса в огранизме или из-за субклинических воспалительных процессов. Также поступление с кормом реактивных соединений кислорода является причиной оксидативного стресса. В качестве особенно эффективных кормовых добавок рекомендуются вторичные растительные субстанции, так называемые фитонутриенты, в частности, из группы полифенолов и каротиноидов, которые наряду с антиокислительными свойствами обладают также положительным эффектом при воспалительных процессах. Так, различные исследования показывают, что при добавлении фитонутриентов в полностью смешанный рацион дойных коров отмечается значительное улучшение молочной продуктивности [i],[ii] и различных параметров, типичных для состояния стресса эндоплазматического ретикулума. Правда, необходимая для этого концентрация варьируется (0,02% против 4,3%), кроме того, термостабильность может быть также важным фактором. Если необходимо целенаправленно, положительно поддержать метаболизм с помощью антиоксидантов в корме, следует точно подобрать подходящие вещества.
Квинтэссенция – с наименьшими затратами добиться оптимального улучшения
Антиоксиданты служат для консервации корма, но они так же полезны для обмена веществ животных. Посредством подходящей комбинации антиоксидантов, оптимизированной к составу корма, можно снизить дозировку и расходы, в то время как защитный эффект повысится. С помощью подобранных растительных антиоксидантов можно положительно воздействовать на продуктивность и клеточный стресс, а также сохранить физиологический баланс в организме животного или птицы.
Антиоксиданты продолжают оставаться очень актуальной темой.
[i] Winkler и другие; Arch Anim Nutr. 2015;69(6):425-41.
[ii] Gessner и другие; J Dairy Sci. 2015 Dec;98(12):8856-68.
Защитная роль антиоксидантов в защите от загрязнения окружающей среды, опосредованного ROS / RNS
Избыточное производство активных форм кислорода и азота может быть результатом воздействия загрязнителей окружающей среды, таких как ионизирующее и неионизирующее излучение, ультрафиолетовое излучение, повышенные концентрации озона, азота оксиды, диоксид серы, сигаретный дым, асбест, твердые частицы, пестициды, диоксины и фураны, полициклические ароматические углеводороды и многие другие соединения, присутствующие в окружающей среде.Похоже, что усиление окислительного / нитрозативного стресса часто игнорируется механизмом, с помощью которого загрязнители окружающей среды влияют на здоровье человека. Было высказано предположение, что окисление и окислительное повреждение клеточных компонентов и биомолекул вовлечены в этиологию нескольких хронических заболеваний, включая рак, сердечно-сосудистые заболевания, катаракту, возрастную дегенерацию желтого пятна и старение. Несколько исследований показали, что человеческий организм может снимать окислительный стресс с помощью экзогенных антиоксидантов.Однако не все пищевые антиоксидантные добавки проявляют защитное действие, например, -каротин для профилактики рака легких у курильщиков или токоферолы при фотоокислительном стрессе. В этом обзоре мы исследуем усиление окислительного стресса, вызванное воздействием загрязнителей окружающей среды, и защитные эффекты антиоксидантов.
1. Введение
Многие загрязнители окружающей среды являются источниками нескольких химически активных веществ (RS). RS — это собирательный термин, который включает как кислородные радикалы, так и другие активные формы кислорода и азота (ROS / RNS).Свободные радикалы, важные для живых организмов, включают гидроксил (), супероксид (), оксид азота (), тил и пероксильный радикал. Пероксинитрит (), хлорноватистая кислота (HOCl), перекись водорода (), синглетный кислород () и озон () не являются свободными радикалами, но могут легко привести к свободнорадикальным реакциям в живых организмах. Термин активные формы кислорода (АФК) часто используется для обозначения не только свободных радикалов, но и нерадикалов (например,,,) [1].
Имеются убедительные доказательства того, что RS участвует в окислительном / нитрозативном стрессе (O / NS) в качестве общего механизма, посредством которого несколько загрязнителей окружающей среды вызывают повреждение.Окислительный стресс можно определить как чрезмерное количество RS, которое является чистым результатом дисбаланса между производством и разрушением RS (последнее регулируется антиоксидантной защитой). Окислительный стресс является следствием повышенной генерации RS и / или снижения физиологической активности антиоксидантной защиты против RS. Загрязнители окружающей среды стимулируют различные механизмы токсичности на молекулярном уровне, и окислительный стресс, по-видимому, является общим знаменателем, приводящим к повреждению липидов, ДНК и белков клеточных мембран [2], а также к модуляции антиоксидантных ферментов.RS из-за их высокой реакционной способности (например, образования гидроксильных радикалов) склонны вызывать повреждение любого типа молекулы в клетке, например полиненасыщенных жирных кислот, глутатиона, некоторых аминокислот и так далее.
Когда антиоксидантная защита в организме человека становится подавленной, часто возникает окислительный стресс клеточных компонентов, вызывающий воспалительные, адаптивные, повреждающие и репаративные процессы [3]. С другой стороны, образ жизни и питание могут сыграть важную роль в борьбе с воздействием окислителей и повреждением окружающей среды.Защита от O / NS-опосредованных загрязнителей окружающей среды обычно может осуществляться на двух уровнях: (i) физико-химическая защита для снижения дозы воздействия, которая обычно не может быть достигнута людьми, живущими в загрязненных районах, или (ii) физиологическая защита для повышения антиоксидантной активности. защита организма. Появляется все больше научных доказательств того, что низкомолекулярные антиоксиданты участвуют в предотвращении или уменьшении ущерба, наносимого определенными загрязнителями окружающей среды.Поскольку мы мало влияем на повышение уровня эндогенных антиоксидантов, было бы разумно увеличить количество экзогенных антиоксидантов (в основном через прием пищи), чтобы усилить защитные свойства организмов против окислительного стресса окружающей среды. Текущие данные свидетельствуют о том, что повышенное потребление фруктов и овощей или определенных пищевых добавок может значительно усилить защиту от многих распространенных типов O / NS, вызываемых окружающей средой.
2.Цель
Этот обзор направлен на определение того, могут ли антиоксиданты модулировать токсичность загрязнителей окружающей среды, тем самым влияя на здоровье и исход заболеваний, связанных с поражениями, вызванными окислительным стрессом. Будут представлены доказательства того, что загрязнение окружающей среды увеличивает окислительный стресс и что диетические добавки с антиоксидантами могут играть роль в нейтрализации или буферизации воздействия загрязнителей с окислительными свойствами. Будут обсуждены рекомендации по использованию диетических антиоксидантов в районах с повышенным загрязнением окружающей среды.
В этом обзоре обобщены наиболее распространенные и важные для здоровья источники окислительного стресса, такие как загрязнение воздуха, радиация, пестициды, шум и бытовая химия. Из-за нехватки места и большого количества научных данных не все исследования можно было охватить в этом обзоре. Таким образом, читателю предлагается выполнить поиск по предоставленным ссылкам (и ссылкам в них) для получения дополнительных сведений о выбранном загрязнителе окружающей среды или выбранном антиоксиданте.
2.1. Окислительный стресс, вызванный загрязнением воздуха, и защита от него
Воздействие загрязнения воздуха на здоровье возникает в результате незначительного раздражения глаз и верхних дыхательных путей, хронических респираторных заболеваний, болезней сердца и сосудов, рака легких и смерти.Различные исследования, представленные в таблице 1, демонстрируют повышенный окислительный стресс / повреждение из-за воздействия загрязнителей воздуха и что антиоксиданты могут обеспечивать определенный уровень защиты [4–7].
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Кислород можно представить как ведущий загрязнитель воздуха в отношении образования окислительного стресса.Сам по себе молекула квалифицируется как свободный радикал, потому что у нее есть два неспаренных электрона с параллельными спинами на разных α-антисвязывающих орбиталях. Это ограничение спина объясняет его относительную стабильность и парамагнитные свойства. способен принимать электроны на свои разрыхляющие орбитали, становиться «восстановленными» в процессе и, следовательно, действовать как сильный окислитель [76]. Двухатомная молекула кислорода содержит два несвязанных электрона и поэтому может подвергаться восстановлению, давая несколько различных метаболитов кислорода, которые вместе называются АФК.Митохондрии являются основным местом потребления кислорода внутри клетки и основным источником образования АФК [8, 10, 13, 77]. После образования АФК они удаляются клеточной защитой, которая включает ферменты супероксиддисмутазу (Mn-SOD, Cu / Zn-SOD и внеклеточный (EC) -SOD), каталазу, глутатионпероксидазу, пероксиредоксины и неферментативные антиоксиданты, такие как глутатион (GSH), тиоредоксин, аскорбат, -токоферол и мочевая кислота [9, 78]. Поскольку окислительное повреждение клеток увеличивается с возрастом, повышенное потребление экзогенных антиоксидантов может поддерживать эндогенную антиоксидантную защиту.Клинические исследования показывают, что диета, богатая фруктами, овощами, цельнозерновыми, бобовыми и жирными кислотами омега-3, может помочь людям снизить окислительный стресс и отсрочить возникновение дегенеративных заболеваний [79].
Озон образуется из двуокиси кислорода под действием ультрафиолетового света и атмосферных электрических разрядов. Озон — очень реактивный газ, поглощение которого зависит от наличия антиоксидантов в жидкости футеровки [17, 18, 52]. Поверхность легких покрыта тонким слоем жидкости, содержащей ряд антиоксидантов, которые, по-видимому, обеспечивают первую линию защиты от загрязнителей воздуха.Mudway et al. [17] изучали взаимодействие озона с антиоксидантами и обнаружили, что иерархия озона в жидкости эпителиальной выстилки человека представляет собой аскорбиновую кислоту, затем мочевую кислоту и затем глутатион. Ву и Мэн [34] проанализировали влияние масла семян облепихи на защиту от вдыхания диоксида серы. Они обнаружили, что масло семян крушины оказывает антиоксидантное действие. Кроме того, исследование Zhao et al. [33] выявили защитное действие салициловой кислоты и витамина С на индуцированное диоксидом серы перекисное окисление липидов у мышей.
Табачный дым является одним из наиболее распространенных загрязнителей воздуха и генерирует большое количество различных ROS / RNS. Было обнаружено, что на оксидативный стресс, вызванный сигаретами, влияют защитные эффекты витамина С, глутатиона и других антиоксидантов, в основном как тушители ROS / RNS (Таблица 1) [36–41].
Kienast et al. [54] продемонстрировали, что альвеолярные макрофаги и мононуклеарные клетки периферической крови активируются после воздействия диоксида азота. Несколько исследований показали, что некоторые антиоксиданты могут играть полезную роль в индуцированной токсичности.Guth и Mavis [55] и Sevanian et al. [56, 80] исследовали влияние содержания витамина Е на легкие. Кроме того, исследование Böhm et al. [62] показали, что потребление ликопина томатов с пищей защищает клетки человека от повреждений, вызванных диоксидом азота. Возможное влияние диетических антиоксидантов, особенно витамина С, на рост распространенности астмы было исследовано Хэтчем [81].
Твердые частицы также могут вызывать окислительный стресс путем прямого образования АФК на поверхности растворимых соединений, изменяя функцию митохондрий или снижая активность никотинамидадениндинуклеотидфосфатоксидазы, вызывая активацию воспалительных клеток с образованием АФК и РНС и опосредует окислительное повреждение ДНК [63, 82].Антиоксиданты также могут обеспечивать защиту от токсичности твердых частиц. Действительно, антиоксиданты жидкости, выстилающей легкие (ураты, глутатион и аскорбат), продемонстрировали свою эффективность в исследовании Greenwell et al. [83]. Луо и др. [70] обнаружили ингибирующее действие экстракта зеленого чая на канцерогенез, вызванное комбинацией асбеста и бензо (а) пирена у крыс, употребляющих 2% экстракт зеленого чая на протяжении всей своей жизни.
Поскольку диета является основным источником антиоксидантных микронутриентов, в настоящее время существует правдоподобная связь между воздействием загрязнения воздуха и качеством потребляемой пищи.
2.2. Радиационно-индуцированный окислительный стресс и защита от него
Ионизирующее излучение состоит из высокоэнергетических частиц, которые могут генерировать АФК. Эти АФК могут образовываться в первую очередь за счет радиолиза воды или за счет вторичных реакций. Было показано, что большие дозы ионизирующего излучения обладают мутирующим эффектом; например, Sperati et al. [84] пришли к выводу, что радиоактивность в помещении, по-видимому, влияет на экскрецию 8-OHdG с мочой у женщин, которые, по оценкам, более заняты в жилищах, чем мужчины (Таблица 2).Было продемонстрировано, что многие соединения защищают клетки от повреждения, вызванного радиационно-индуцированным образованием ROS. Одним из таких соединений является эбселен, сеноорганическое соединение [85]. Другое соединение — N-ацетилцистеин, который снижает нитрозативное повреждение во время лучевой терапии [86], а также окислительное повреждение [87]. Также были обнаружены радиозащитные эффекты кверцетина и этанольного экстракта прополиса у мышей, облученных гамма-излучением [88]. Радиозащитная и радиосенсибилизирующая активность куркумина была продемонстрирована в исследовании Jagetia [89].
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Помимо ионизирующего излучения, неионизирующее излучение также вызывает окислительный стресс. Магнитные поля могут влиять на биологические системы, увеличивая высвобождение свободных радикалов. Есть несколько исследований, которые указывают на взаимосвязь между электромагнитными полями, уровнями АФК и ОС, оказывающими токсическое воздействие на живые организмы [90]. Поскольку маловероятно, что электромагнитные поля могут вызывать повреждение ДНК непосредственно из-за их низкого уровня энергии, в большинстве исследований изучали их влияние на клеточную мембрану, общие и специфические уровни экспрессии генов и пути передачи сигналов [91].Мусаев и др. [92] указали, что дециметровые микроволны оказывают окислительное действие при высокой интенсивности облучения (удельная скорость поглощения 15 мВт / кг) и антиоксидантное действие при низкой интенсивности (удельная скорость поглощения 5 мВт / кг) (Таблица 2). Сообщалось о защитных эффектах мелатонина и фенэтилового эфира кофейной кислоты против окислительного стресса сетчатки при длительном использовании мобильных телефонов [93]. Jajte et al. [94] пришли к выводу, что мелатонин обеспечивает защиту лимфоцитов крыс от повреждения ДНК.Другое исследование показало, что Ginkgo biloba предотвращает окислительный стресс, вызванный мобильным телефоном [95]. Guney et al. [96] обнаружили, что витамины E и C уменьшают повреждение эндометрия, вызванное телефоном.
Видимого и ультрафиолетового света недостаточно для ионизации большинства биомолекул. Тем не менее, воздействие ультрафиолетового излучения на человека имеет важные последствия для общественного здравоохранения. Хотя кожа обладает чрезвычайно эффективной антиоксидантной активностью, при старении уровни ROS повышаются, а антиоксидантная активность снижается.Кроме того, воздействие ультрафиолета на кожу приводит к генерации АФК [118], таких как синглетный кислород, пероксирадикалы, супероксид-анион и гидроксильные радикалы, которые повреждают ДНК и не-ДНК клеточные мишени [113–116] и ускоряют процесс старения кожи. УФ-излучение изменяет эндогенную антиоксидантную защиту; например, в исследовании Shindo et al. [127], после УФ-облучения активность эпидермальной и дермальной каталазы и супероксиддисмутазы значительно снизилась. Что касается защитной роли антиоксидантов, во многих исследованиях (таблица 2) изучалось влияние витамина С на повреждение, вызванное ультрафиолетовым излучением (УФР).Пероральные добавки витамина С привели к значительному увеличению содержания витамина С в плазме и коже [118]. В исследовании Aust et al. [134], фотозащитные эффекты синтетического ликопина были изучены после 12 недель приема добавок, и было обнаружено значительное повышение уровня ликопина в сыворотке и общих каротиноидов кожи. Исследования на животных и людях показали, что полифенолы зеленого чая обладают фотозащитными свойствами и могут применяться для предотвращения кожных заболеваний, вызванных солнечным УФ-В светом [137].Обзор исследования показывает, что полифенолы или другие фитохимические вещества, такие как полифенолы зеленого чая, проантоцианидины виноградных косточек, ресвератрол, силимарин, генистеин и другие, оказывают существенное фотозащитное действие против вызванного ультрафиолетом воспаления кожи, окислительного стресса, повреждения ДНК и т. Д. вперед.
В настоящее время мы подвергаемся воздействию различных источников излучения, как ионизирующего, так и неионизирующего. Результаты многих исследований показывают, что человеческий организм может в определенной степени справиться с радиационно-индуцированным окислительным стрессом, соблюдая соответствующую антиоксидантную диету.
2.3. Окислительный стресс, вызванный пестицидами, и защита от него
Пестициды стали неотъемлемой частью экосистемы из-за их широкого использования, распространения и стабильности некоторых пестицидов в окружающей среде. Воздействие пестицидов может играть важную роль в повышении окислительного стресса организмов и может привести к изменению восприимчивости к болезням. Багчи и др. [145] продемонстрировали, что пестициды вызывают производство АФК и окислительное повреждение тканей.де Лиз Оливейра Кавалли [146] обнаружил, что воздействие глифосата вызывает окислительный стресс и активирует множественные пути реакции на стресс, ведущие к гибели клеток Сертоли в яичках препубертатных крыс. Роль окислительного стресса в токсичности иммунных клеток, вызванной пестицидами линданом, малатионом и перметрином, была исследована Olgun и Misra [147]. Hassoun et al. [148] сообщили, что хлордан вызывает окислительное повреждение тканей на основе уровней перекисного окисления липидов в печени и повреждения ДНК (Таблица 3). Bus et al.[149] сообщили, что легочная токсичность параквата является результатом циклического восстановления и окисления параквата. Результаты исследования, проведенного Pérez-Maldonado et al. [150] продемонстрировали индукцию апоптоза ДДТ. Hassoun et al. [148] сообщили, что воздействие линдана, ДДТ, хлордана и эндрина привело к значительному увеличению перекисного окисления липидов в печени и повреждению ДНК. Другое исследование Senft et al. [151] обнаружили, что диоксин увеличивает продукцию АФК, зависящую от дыхания митохондрий.С другой стороны, Ciftci et al. [152] сообщили о защитном эффекте куркумина на иммунную систему крыс, отравленных 2,3,7,8-тетрахлордибензо-п-диоксином. Кроме того, Hung et al. [153] предположили, что чайный меланин может быть потенциальным агентом против развития оксидативного стресса, вызванного тетрахлордибензодиоксином. Гультекин и др. [154] исследовали влияние мелатонина и витаминов E и C на восстановление хлорпирифосэтила.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Другой группой пестицидов являются полихлорированные бифенилы (ПХБ), которые также вызывают повышенное внутриклеточное производство АФК.Zhu et al. [155] указали, что различные соединения ПХБ (Aroclor 1254, PCB153 и 2- (4-хлорфенил) -1,4-бензохиноновый метаболит PCB3) повышают стационарные уровни внутриклеточного и H 2 O 2 в эпителиальных клетках груди и простаты. Многие антиоксиданты также показали защиту от окислительного стресса и повреждений, вызванных ПХБ. Рамадасс и др. [156] проверили гипотезу о том, что флавоноиды модифицируют цитотоксичность, опосредованную ПХБ, и обнаружили, что флавоноиды ингибируют окислительный стресс, вызванный ПХБ.Zhu et al. [155] продемонстрировали, что обработка N-ацетилцистеином значительно защищает клетки от токсичности, опосредованной ПХБ. Было обнаружено, что красный женьшень, обладающий разнообразной биологической и фармакологической активностью, включая антиоксидантное, противовоспалительное, антимутагенное и антиканцерогенное действие, защищает организм от окислительного стресса / повреждений, вызванных воздействием ПХБ [157]. Шридеви и др. [158] также сообщили, что действие альфа-токоферола на нейротоксичность, вызванную ПХБ, приводит к снижению окислительного стресса.В другом исследовании сообщалось о синергических эффектах витаминов C и E против вызванного PCB- (Aroclor 1254) окислительного повреждения [159].
Диоксины и фураны являются побочными продуктами химического производства. Диоксины могут попадать в окружающую среду в результате производства пестицидов и других хлорированных веществ. И диоксины, и фураны связаны с различными реакциями сжигания и использованием различных химических продуктов. Ciftci и соавторы сообщили, что диоксин (2,3,7,8-тетрахлордибензо-п-диоксин; TCDD) вызывает реакцию на окислительный стресс в печени крыс.Однако субклеточные источники и механизмы, лежащие в основе индуцированных диоксинами активных форм кислорода, не совсем понятны. TCDD увеличивает образование веществ, реагирующих с тиобарбитуровой кислотой. Это также вызывает значительное снижение уровней глутатиона, каталазы, GSH-Px и супероксиддисмутазы Cu-Zn у крыс [160]. Влияние 2-фуран-2-ил-1H-бензимидазола на уровни витаминов A, E, C и Se, малонового диальдегида и глутатионпероксидазы у крыс было проанализировано в исследовании Karatas et al.[161]. Результаты показали, что уровни витаминов A, E, C и Se были ниже, чем в контрольных группах, в то время как уровень MDA в сыворотке и активность GSH-Px гибко увеличивались в зависимости от дней инъекции. Наблюдаемое снижение уровней витаминов A, E, C и Se в крови может быть причинно связано с повышенным количеством ROS. Потенциальный защитный эффект кверцетина на индуцированное TCDD повреждение яичек у крыс изучали Ciftci et al. [160]. Результаты показали, что воздействие TCDD вызывает повреждение яичек, а кверцетин предотвращает индуцированное TCDD повреждение яичек у крыс.Антиоксидантные эффекты ресвератрола также исследовались в исследовании Ishida et al. [162]. Результаты показали, что пероральный ресвератрол является привлекательным кандидатом для борьбы с токсичностью диоксинов. Türkez et al. [163] проанализировали влияние прополиса на гепатотоксичность, вызванную TCDD, у крыс и обнаружили, что прополис смягчает патологические эффекты и предотвращает подавление антиоксидантных ферментов в печени.
Можно сделать вывод, что стимуляция выработки АФК, индукция перекисного окисления липидов и окислительного повреждения ДНК и белков, а также нарушение общей антиоксидантной способности организма являются механизмами токсичности, вызываемой большинством пестицидов, включая органофосфаты, бипиридил гербициды и хлорорганические соединения.Питательные антиоксиданты и родственные им биоактивные соединения, часто встречающиеся в фруктах и овощах, а также в пищевых добавках, могут защитить от воздействия окружающей среды на окислительный стресс / повреждение, вызванное пестицидами (Таблица 3).
2.4. Окислительный стресс, вызванный бытовыми химикатами, и защита от него
Промышленные смолы, такие как мочевино-формальдегидные, фенолформальдегидные, полиацетальные и меламино-формальдегидные смолы, в основном используются в бытовых условиях в клеях и связующих для изделий из дерева. , целлюлозные изделия, бумажные изделия, пластмассы, синтетические волокна, а также в отделке текстиля.Было продемонстрировано, что формальдегид вызывает повышенное образование окислительного стресса (Таблица 4), в первую очередь в виде перекисного окисления липидов, как было обнаружено в исследовании, проведенном Чангом и Сюй [193]. Некоторые антиоксиданты также проявляют защиту от окислительного стресса, вызванного бытовыми химикатами. В недавнем исследовании Köse et al. [194] сообщили, что вдыхание розового масла защищает от вызванного формальдегидом повреждения яичек у крыс. Zararsiz et al. [195] продемонстрировали, что воздействие формальдегида увеличивает уровень свободных радикалов у крыс и что омега-3 жирные кислоты предотвращают окислительный стресс.Сообщалось также о защитном эффекте мелатонина против вызванного формальдегидом окислительного повреждения почек у крыс [196].
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Много исследований было выполнено с четыреххлористым углеродом, потому что это хорошо известная модель индукции химического поражения печени у мышей. Также воздействие четыреххлористого углерода увеличивает окислительный стресс / повреждение у протестированных модельных организмов, а повреждение, вызванное четыреххлористым углеродом, было обращено многими исследованными антиоксидантами. Так, сообщалось об антиоксидантном и гепатопротекторном эффектах многих антиоксидантов и растительных экстрактов против окислительного стресса, вызванного четыреххлористым углеродом [198].Например, опосредованная хлореллой защита от окислительного повреждения, вызванного тетрахлорметаном, у крыс была продемонстрирована в исследовании Peng et al. [224]. Озтюрк и др. [201] обнаружили, что кормление абрикосом ( Prunus armeniaca L ) оказывает положительное влияние. Способность витамина Е усиливать восстановление после окислительного повреждения почек, вызванного тетрахлорметаном, у мышей была выявлена в исследовании Adaramoye [202]. О защитных эффектах Curcuma longa Linn сообщили Lee et al.[205]. О защитном эффекте экстракта ежевики против окислительного стресса у крыс, получавших четыреххлористый углерод, сообщили Cho et al. [207].
Химические вещества, содержащиеся в обычных бытовых товарах и предметах личной гигиены, являются основными источниками воздействия окислителей, которые могут привести к окислительному стрессу. Сообщалось, что многие антиоксиданты, такие как мелатонин, витамин Е, аскорбат и экстракты различных растений, например розы, зеленого чая и ежевики, уменьшают окислительный стресс и / или повреждения in vivo и in vitro.
2.5. Побочные продукты дезинфекции (DBP) и другие загрязнители, переносимые водой
Полезная роль проглатывания воды может быть сведена к минимуму за счет образования побочных продуктов дезинфекции. Считается, что хлорирование и озонирование в процессе очистки воды приводит к образованию различных активных форм кислорода, которые, по-видимому, участвуют в реакции с фуминовой кислотой, загрязнителями и бактериями (таблица 4). Хлорноватистая кислота (HOCl) образуется при добавлении Cl 2 в воду для дезинфекции.Эта кислота обладает высокой реакционной способностью и способна окислять многие биологические молекулы. HOCl реагирует с образованием и с H 2 O 2 с образованием синглета O 2 . HOCl влияет на эндогенные ферментные антиоксиданты и увеличивает окислительный стресс. Например, Hassoun и Ray [212] продемонстрировали индукцию окислительного стресса и гибель клеток побочных продуктов дезинфекции питьевой воды. Об аналогичных наблюдениях сообщили Leustik et al. [214]. Исследования показывают, что вдыхание Cl 2 повреждает как дыхательные пути, так и альвеолярные эпителиальные ткани, и что эти повреждающие эффекты смягчаются профилактическим введением низкомолекулярных антиоксидантов.Сообщалось, что тролокс защищает от окислительного повреждения, вызванного HOCl на Са-АТФазу в саркоплазматическом ретикулуме скелетных мышц [220]. Аскорбиновая кислота также может играть защитную роль (Таблица 4), особенно у людей, принимающих добавки, содержащие этот витамин. Также сообщалось, что тиоаллил и S-аллилцистеин (оба являются соединениями, производными от чеснока), мелатонин, глутатион, дисульфид глутатиона, S-метилглутатион, липоевая кислота и дигидролипоевая кислота защищают от повреждений, вызванных хлорноватистой кислотой и пероксинитритом [217–219, 222 ]).
Кроме того, следующие экстракты растений проявляют защитный эффект против индуцированного HOCl окислительного повреждения: Agaricus campestris , Cynara cardunculus , Thymus pulegioides и Vicia faba [223]. При решении проблемы ДАД в первую очередь следует оценить причину их образования с помощью различных инженерных подходов ДАД, например, путем перемещения точки хлорирования ниже по потоку в технологической цепочке, уменьшения концентрации прекурсора природного органического вещества, замены прехлорирования пероксидом, и так далее.
Использование антиоксидантов в качестве соединений, снижающих токсичность, вызванную ДАД, должно быть лишь последней альтернативой, когда все другие подходы к образованию ДАД в питьевой воде не работают.
Исследования последних двух десятилетий показали, что металлы с окислительно-восстановительной активностью, такие как железо (Fe), медь (Cu), хром (Cr), кобальт (Co) и другие металлы, присутствующие в воде, обладают способностью производить АФК, такие как супероксид-анион-радикал и оксид азота. Нарушение гомеостаза ионов металлов может привести к окислительному стрессу, состоянию, при котором повышенное образование активных форм кислорода подавляет антиоксидантную защиту организма и впоследствии вызывает повреждение ДНК, перекисное окисление липидов, модификацию белков и другие эффекты [225].Загрязняющие вещества в воде, такие как тяжелые металлы, такие как As, Cd, Cu, Fe, Pb и Zn, могут вызывать окислительный стресс у рыб [226]. С другой стороны, Ян и соавторы [227] сообщают, что водяной шпинат, содержащий хлорофилл и ликопин, может снизить цитотоксичность и окислительный стресс в печени, вызванный тяжелыми металлами. Помимо тяжелых металлов, также источником окислительного стресса могут быть пестициды в воде. Атразин и хлорпирифос — самые распространенные пестициды, обнаруженные в пресноводных экосистемах по всему миру.Xing et al. [228] исследовали реакцию на окислительный стресс в печени карпа после воздействия атразина и хлорпирифоса и обнаружили, что воздействие или их смесь может вызывать снижение активности антиоксидантных ферментов и увеличение содержания МДА в зависимости от дозы. Eroğlu et al. [229] сообщили, что фосфорорганические пестициды вызывают окислительный стресс из-за образования свободных радикалов, которые изменяют систему антиоксидантной защиты в эритроцитах, и что витамины C и E могут играть защитную роль.
2.6. Роль окислительного стресса в повреждении слуха, вызванном шумом
Шум — это беспокоящий и нежелательный звук. Воздействие шума вызывает множество проблем со здоровьем, таких как потеря слуха, нарушение сна, а также снижает работоспособность, а также влияет на когнитивные способности. Он также увеличивает агрессию и снижает обработку социальных сигналов, которые считаются не имеющими отношения к выполнению задания, а также приводят к ишемической болезни сердца, гипертонии, повышению артериального давления, повышенному риску смертности, серьезным психологическим последствиям, головной боли, тревоге и тошноте ([230 ] и ссылки внутри).Продолжительное воздействие шума также может вызвать окислительный стресс в улитке, что приводит к потере (через апоптотические пути) внешних волосковых клеток кортиева органа. Повышенное шумовое воздействие приводит к повышенному уровню образования активных форм кислорода, которые играют значительную роль в вызванной шумом гибели волосковых клеток [231]. Острое, а также длительное воздействие шума может вызывать чрезмерное количество свободных радикалов, изменяя эндогенные антиоксидантные ферменты, такие как супероксиддисмутаза, каталаза и глутатионпероксидаза [232, 233].
В исследовании Demirel et al. [230] влияние шума на параметры окислительного стресса у крыс было проанализировано путем измерения уровня малонового диальдегида, оксида азота и активности глутатионпероксидазы. Результаты показали повышение уровня MDA, индикатора перекисного окисления липидов, а также уровня NO и активности GSH-Px из-за воздействия шума, предполагая, что присутствие окислительного стресса могло привести к разной степени повреждений клеток. Кроме того, увеличение параметров окислительного стресса, таких как уровень MDA, и снижение активности CAT и SOD у текстильных рабочих, подвергающихся повышенному уровню шума, подтверждает гипотезу о том, что шум вызывает окислительный стресс [234].Кажется, что шум может вызвать повреждение не только ушей, но и всего тела, что приведет к окислительному стрессу [230]. В исследовании van Campen et al. [235] оценивалась динамика повреждения АФК после воздействия. Основываясь на окислительном повреждении ДНК, присутствующем в улитке после интенсивного шума, исследователи предполагают, что первые 8 часов после воздействия могут быть критическим периодом для лечения антиоксидантами. Таким образом, свойства антиоксидантов и лекарственных растений подавлять АФК привлекают все больше и больше исследований для противодействия окислительному стрессу, вызванному шумом.Manikandan и Devi [232] исследовали антиоксидантные свойства альфа-азарона в отношении вызванных шумовым стрессом изменений в различных областях мозга крыс, и их данные доказали, что антиоксидантные свойства альфа-азарона действуют против повреждений, вызванных шумовым стрессом. Цель исследования, проведенного Manikandan et al. [233] должен был оценить защитный эффект этилацетата и метанольного экстракта Acorus calamus против вызванных шумовым стрессом изменений в головном мозге крыс. И этилацетат, и метанольный экстракт Acorus calamus защищали большинство изменений в мозге крыс, вызванных шумовым стрессом.N-ацетилцистеин также обеспечивает защиту от вызванной шумом потери слуха у крыс Sprague Dawley [236]. Исследование Ewert et al. [237] определили, может ли введение комбинации антиоксидантов 2,4-дисульфонил-фенил-трет-бутилнитрона (HPN-07) и N-ацетилцистеина уменьшить как временную, так и постоянную потерю слуха. Результаты показали, что комбинация антиоксидантов HPN-07 и NAC может как улучшить восстановление временного сдвига порога, так и предотвратить постоянное изменение порога за счет уменьшения повреждения механических и нервных компонентов слуховой системы при введении вскоре после воздействия взрывной волны.Кроме того, было показано, что арбоксиалкиловые сложные эфиры (сложные эфиры хинной кислоты, содержащиеся во фруктах и овощах) улучшают способность к репарации ДНК нейронов спиральных ганглиев в ответ на шумовой стресс [238].
Проблема окислительного стресса, приводящего к потере слуха, усугубляется, когда имеет место синергетический эффект, поскольку широкий спектр загрязняющих веществ окружающей среды и профессиональных факторов может взаимодействовать с шумом, усиливая вызванную шумом потерю слуха, например, из-за оксида углерода и акрилонитрилом [239].
2.7. Неблагоприятные или незначительные эффекты лечения антиоксидантами после воздействия загрязнителей окружающей среды
Введение антиоксидантов в случаях окислительного стресса, вызванного окружающей средой, не всегда демонстрирует защиту (Таблица 5). Hackney et al. [240] проанализировали, защищает ли добавка витамина E от воздействия O 3 , и не обнаружили существенных различий между группами, получавшими витамин E и плацебо. Другое исследование показало, что в группе высокого риска, такой как курильщики, высокие дозы бета-каротина увеличивают риск рака легких [241].Кроме того, результаты крупных контролируемых испытаний применения добавок бета-каротина не подтверждают выявленные полезные ассоциации или роль добавок бета-каротина в профилактике рака легких; вместо этого они предоставили убедительные доказательства его неблагоприятного воздействия на курильщиков [242]. McArdle et al. [118] исследовали влияние перорального приема витамина Е и бета-каротина на окислительный стресс кожи человека, вызванный ультрафиолетовым излучением. Результаты показали, что добавление витамина Е или бета-каротина не влияет на чувствительность кожи к УФИ.Исследование Stahl et al. [122], в котором исследовали антиоксидантный эффект каротиноидов и токоферолов на основании их способности улавливать АФК, образующиеся во время фотоокислительного стресса. Антиоксиданты, использованные в этом исследовании, обеспечивали защиту от эритемы у людей и могут быть полезны для снижения чувствительности к ультрафиолетовому свету (таблица 5).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Сообщалось, что железо и медь усиливают токсичность параквата в E. coli . Лечение двухвалентным железом в исследовании Korbashi et al. [248] привело к усилению уничтожения бактерий паракватом, тогда как лечение хелатирующими агентами, такими как нитрилотриацетат и десфериоксамин, заметно снижало, вплоть до полной отмены, токсические эффекты.Некоторые соединения способствуют антиоксидантной защите, хелатируя переходные металлы и не позволяя им катализировать производство свободных радикалов в клетке. Хелатирующие металлы антиоксиданты, такие как трансферрин, альбумин и церулоплазмин, улучшают образование радикалов, ингибируя реакцию Фентона, которая катализируется медью или железом. Latchoumycandane и Mathur [250] исследовали, защищает ли лечение витамином E семенники крысы от окислительного стресса, вызванного тетрахлордибензодиоксином, и обнаружили, что активность антиоксидантных ферментов и уровни перекиси водорода и перекисного окисления липидов не изменялись у животных, которым одновременно вводили тетрахлордибензодиоксин и витамин E. .Хотя несколько исследований продемонстрировали защитный эффект приема антиоксидантов от окислительного стресса, важно отметить, что не все антиоксиданты оказывают положительное влияние на здоровье.
2.8. Что может быть причиной?
Неправильное употребление пищевых добавок может привести к «антиоксидантному стрессу». Подробное описание негативных эффектов антиоксидантов можно найти в публикациях Poljsak et al., [253], Poljsak and Milisav [254] и ссылках в них. Вкратце, прием только одного антиоксиданта может изменить сложную систему эндогенной антиоксидантной защиты клеток или изменить пути апоптоза клеток [255].Полезное физиологическое использование ROS в клетках демонстрируется в различных областях, включая внутриклеточную передачу сигналов и регуляцию окислительно-восстановительного потенциала, а синтетические антиоксиданты не могут отличить радикалы, которые играют полезную роль, от радикалов, вызывающих окислительное повреждение биомолекул. Если введение антиоксидантных добавок снижает общее образование ROS / RNS, это также может мешать иммунной системе бороться с бактериями и важными защитными механизмами для удаления поврежденных клеток, в том числе предраковых и злокачественных [256].Когда принимается большое количество антиоксидантных питательных веществ, они также могут действовать как прооксиданты, увеличивая окислительный стресс [257, 258]. Ни одно из крупных клинических исследований, использующих смертность или заболеваемость в качестве конечной точки, не выявило положительных эффектов добавок антиоксидантов, таких как витамин C, витамин E или -каротин. Некоторые недавние исследования показали, что антиоксидантная терапия не оказывает никакого эффекта и может даже увеличить смертность (The Alpha-Tocopherol, Beta-Carotene Cancer Prevention Study Group, 1994; [259–261], Heart Protection Study Collaborative Group, 2002; Возрастные заболевания глаз Study Research Group, 2001).С другой стороны, антиоксидантные добавки, по-видимому, действительно эффективны в снижении окислительного стресса человека, если его / ее исходный оксидативный стресс выше нормы или превышает установленную для него точку регуляции [262, 263]. Таким образом, антиоксидантные добавки могут помочь организму скорректировать повышенный уровень окислительного стресса, когда он не может контролироваться эндогенными антиоксидантами.
3. Выводы
Имеются веские доказательства того, что загрязнение окружающей среды увеличивает окислительный стресс [264] и что пищевые добавки с антиоксидантами и / или повышенное потребление фруктов и овощей могут играть роль в нейтрализации или буферизации воздействия загрязнителей, проявляющих окислительные свойства. .Исследования in vitro и in vivo показывают, что питательные антиоксиданты и родственные им биоактивные соединения, часто встречающиеся во фруктах и овощах, могут защитить от токсического воздействия окружающей среды. Важно подчеркнуть, что антиоксиданты в качестве пищевых добавок могут обеспечивать защиту от повреждений, вызванных АФК, в условиях повышенного окислительного стресса организма. Можно предположить, что антиоксиданты будут терапевтически эффективны в условиях повышенного окислительного стресса или у пожилых млекопитающих, подвергшихся воздействию стрессора, вызывающего обострение окислительного повреждения.Представлены данные, демонстрирующие, что синтетические антиоксидантные добавки не могут обеспечить надлежащую или полную защиту от окислительного стресса и повреждений в «нормальных» условиях и что введение антиоксидантов для предотвращения болезней или процесса старения является спорным в условиях «нормального» окислительного стресса. Многие клинические испытания, в которых люди получали один или несколько синтетических антиоксидантов, не выявили положительных эффектов (см. Обзор [253]). Таким образом, результаты клинических испытаний приема экзогенных антиоксидантов противоречивы и противоречивы.Эти результаты показывают, что другие соединения во фруктах и овощах (возможно, флавоноиды) или сложная комбинация соединений могут способствовать улучшению здоровья сердечно-сосудистой системы и снижению заболеваемости раком, обнаруживаемым среди людей, потребляющих больше этих продуктов [265, 266].
Следует понимать, что использование синтетических витаминных добавок не является альтернативой регулярному употреблению фруктов и овощей. Катлер объясняет, что большинство людей поддерживают стабильный уровень окислительного стресса, и независимо от того, сколько дополнительных антиоксидантов люди потребляют в своем рационе, дальнейшего снижения окислительного стресса не происходит.Однако антиоксидантные добавки действительно эффективны в снижении окислительного стресса человека, если его / ее исходный уровень окислительного стресса выше нормы или выше его / ее стабильно регулируемого уровня [262, 263]. Таким образом, антиоксидантные добавки могут принести пользу организму только в том случае, если необходимо скорректировать высокий уровень окислительного стресса, который не может контролироваться эндогенными антиоксидантами. Все эти данные указывают на необходимость определения уровня окислительного стресса у человека до начала терапии антиоксидантными добавками.Как образование ROS / RNS, так и потенциал антиоксидантной защиты должны быть измерены у человека, чтобы определить его / ее статус окислительного стресса. Сегодня доступно множество методов измерения окислительного стресса, каждый из которых имеет свои преимущества и недостатки (см. Обзор [253]).
В заключение следует подчеркнуть, что необходимо провести дополнительные исследования, чтобы укрепить доказательства того, что пищевые добавки являются модуляторами неблагоприятных эффектов, вызванных повышенным воздействием загрязнения окружающей среды.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Ученые раскрывают скрытые природные процессы, с помощью которых тело исцеляется само и учится имитировать и оптимизировать этот процесс. Эти знания становятся основой для радикально новых лекарства или композиции, которые предотвращают или лечат различные заболевания, создание основы для бизнеса, обладающего огромным потенциалом за человеческую ценность и существенную прибыль.Одно из таких веществ, L-глутатион, давно признан исследователями главным защитником организма, но на сегодняшний день не получил широкого коммерческого распространения. Тион Интернешнл, Inc. извлекает выгоду из этого пробела на рынке и быстро становясь ведущим специалистом в этой области. Тем не мение, глутатион не работает сам по себе. Чтобы обеспечить максимальный положительный эффект против свободных радикалов, глутатион должен работать СИНЕРГИЧЕСКИ другие клеточные ферменты и антиоксиданты, такие как глутатионпероксидаза, селен и витамины C и E.Эта комбинация привела к развитию комплекса Thione Complex ™. Медицинские работники, диетологи и широкая общественность все больше узнают о преимуществах антиоксидантов и важную роль, которую они играют в избавлении организма от токсичных химикатов известные как «свободные радикалы». Свободные радикалы создаются во время клеточного нормальные метаболические функции, но бесчисленное множество других производятся организм в ответ на обиды от воспалительных реакций, инфекционных условия, табак (включая вторичный дым и жевательный табак), загрязнители окружающей среды, солнечный свет, радиационное воздействие, алкоголь потребление, употребление жирной пищи и даже чрезмерно агрессивное упражнения или физическая активность. Антиоксиданты улавливают и нейтрализуют свободные радикалы, делая их менее токсичными. или нетоксичное соединение. В то время как человеческое тело имеет сложную, встроенную система антиоксидантной защиты для подавления свободных радикалов, эти защитные механизмы часто не могут обеспечить достаточную защиту тела из-за чрезмерного производства свободных радикалов или истощения критических соединений, используемых антиоксидантной защитой организма.Либо или оба условия приводят к состоянию, известному как «окислительный стресс», состояние, которое вызывает изменения в структуре и функции клеток и даже гибель клеток. Следовательно, свободные радикалы считаются быть виновниками более пятидесяти распространенных и хронических заболеваний, включая сердечно-сосудистые заболевания, иммунные нарушения, нейродегенеративные болезни и преждевременное старение. Окислительный стресс также повреждает ДНК, приводящие к мутациям, которые приводят к различным видам рака. В организме много антиоксидантов. Хотя каждый из они играют роль в избавлении организма от лишних свободных радикалов, это это антиоксидант, известный как глутатион, который действует как «командир» главный ». Синтезируется в печени из трех составляющих его аминокислот. кислоты, глутатион содержится в жидкостях организма и в каждой клетке тело. Работая внутри и вне клетки в редуцированной форме, глутатион можно сочетать с другими важными ингредиентами ( Thione Complex ™), чтобы действовать как основной антиоксидант организма, детоксицирующий и защитный.Это привратник в дыхательных путях. тракт и слизистая оболочка кишечника и выполняет множество функций при заболеваниях профилактика и детоксикация от химических веществ и лекарств. Тело использует компоненты Thione Complex ™ для сохранения целостность клеточной структуры от разрушения и свести к нулю действие токсичных свободных радикалов, действующих на клеточном уровне и во внеклеточных жидкостях. Работает вот так.Одна молекула антиоксиданта атакует и нейтрализует одна молекула свободного радикала, но в процессе нейтрализации Сама молекула антиоксиданта окисляется. Затем он должен пройти реакция восстановления с целью регенерации в качестве антиоксиданта в противном случае он остается инертной молекулой, неспособной выполнять свои антиоксидантная функция. В некоторых случаях окисленный побочный продукт сам по себе является токсичным свободным радикалом и остается таковым до тех пор, пока не будет нейтрализован или снова регенерировали в антиоксидант. Это момент, когда синергия становится критически важной. Уникальный антиоксидант не может регенерировать. Чтобы продолжать действовать как антиоксидант функции, каждый окисленный «антиоксидант» должен регенерироваться определенным синергетический антиоксидант, клеточный фермент или кофактор. Глутатион и селен играют ключевую роль в этом процессе. В частности, в синергических целях, селен, антиоксидант. и антиканцерогенный, действует как кофактор фермента глутатиона пероксидаза.Поскольку фермент не может работать должным образом без кофактора, селен играет решающую роль в синергетическом процессе, поскольку он позволяет глутатиону и пероксидазе глутатиона работать вместе, синергетически, чтобы стереть окислительный стресс. Однако во время В этом процессе глутатион окисляется и, следовательно, должен действовать в комбинация с другими ферментными системами для восстановления в его полезную форму, чтобы он мог возобновить свою роль свободного радикала мусорщик.Фермент «глутатионредуктаза» выполняет важнейшие функции задача преобразования окисленного глутатиона обратно в его антиоксидант государственный. Поскольку фермент участвует в определенной реакции, но никогда не употребляется, глутатионредуктаза всегда доступна для восстановления окисленный глутатион в организме. Витамины C и E играют аналогичную роль. Хотя оба витамина действуют как защитные антиоксиданты в организме, они тоже окисляются в процесс нейтрализации свободных радикалов и должен быть сокращен и регенерированы до своего антиоксидантного состояния.В частности, витамин С, известная как аскорбиновая кислота, становится аскорбатом (прооксидантом) во время процесс нейтрализации свободных радикалов и требует глутатиона чтобы восстановить его до его антиоксидантной составляющей, аскорбиновой кислоты. Витамин Е, известный как токоферол, превращается в токоферил (еще один прооксидант). во время процесса нейтрализации и требует глутатиона и витамина C работая вместе, чтобы восстановить его до полезного антиоксиданта статус.Различные исследования, в том числе фотозащита кожи, показали ценность использования синергетически действующих антиоксидантов по сравнению с использованием отдельных антиоксидантов. Действительно, такие исследования показали увеличение маркеров повреждения свободными радикалами, в том числе ДНК, когда избыток или дисбаланс витамина С накапливается в виде свободный радикал «аскорбат». Глутатион играет ключевую роль в регенерации витамин С и другие его клеточные антиоксиданты. Глутатион присутствует в большинстве тканей растений и животных, из которых основная часть рациона человека является производным. Он доступен в диета, потому что клетки желудочно-кишечного тракта способны транспорт глутатиона нетронутым, хотя глутатион также может быть синтезирован большинством клеток из составляющих его аминокислот. Диетический глутатион поставляется в основном из фруктов, овощей, печени, мяса, птицы и рыбу.Курица очень богата глутатионом, и это может воистину объясняют легендарные лечебные свойства «куриного супа»! Однако, хотя глутатион легко доступен из многих диетических источников, средний человек не потребляет достаточное количество продуктов, богатых глутатионом, чтобы полностью пополнить запасы организма глутатиона или для поддержания достаточного количества глутатиона в организме для регенерации своих клеточных антиоксидантных партнеров, позволяя им поддерживают свою антиоксидантную функцию. Сводка Глутатион играет ключевую роль как главный антиоксидант организма, защитное средство, детоксифицирующий и антивозрастной фактор. Мало того, что он участвует как антиоксидант, действующий синергетически с селеном и глутатионом пероксидаза в каждой клетке, но она также служит для регенерации «потраченных» диетические антиоксиданты, витамины C и E. Глутатион и другие клеточные антиоксиданты уменьшаются в крови и тканях с возрастом, а также низкий уровень многих хронических заболеваний, таких как диабет, гепатит С, ВИЧ / СПИД и общие гериатрические заболевания.Окислительный стресс — частая причина при многих из этих заболеваний, но исследования показали, что восполнение глутатиона и его антиоксидантных партнеров могут уменьшить окислительные стресс. Хотя диета с высоким содержанием фруктов и овощей, безусловно, помогают пополнить организм этими важными компонентами для тех, кто не потребляйте достаточное количество диетических антиоксидантов или тем, кто подвергаются избыточному воздействию свободных радикалов в алкоголе, дыме, жирной пище, УФ и т. Д. Или для тех, кто страдает «заболеванием, связанным со свободными радикалами», пищевые добавки или препараты для местного применения на основе глутатиона синергетический цикл (Thione Complex ™ предлагает значительные дополнительные защита. См. Также:
|
Антиоксиданты для здоровья и болезней
Антиоксидант можно определить как: «любое вещество, которое, когда оно присутствует в низких концентрациях по сравнению с концентрацией окисляемого субстрата, значительно задерживает или ингибирует окисление этого субстрата». 1 Согласно этому определению, физиологическая роль антиоксидантов заключается в предотвращении повреждения клеточных компонентов, возникающего в результате химических реакций с участием свободных радикалов. В последние годы появилось множество доказательств, подтверждающих ключевую роль свободных радикалов во многих фундаментальных клеточных реакциях и предполагающих, что окислительный стресс может играть важную роль в патофизиологии распространенных заболеваний, включая атеросклероз, хроническую почечную недостаточность и сахарный диабет.Целью этого обзора является рассмотрение механизмов образования свободных радикалов в организме, последствий повреждения тканей, вызванного свободными радикалами, и функции систем антиоксидантной защиты при здоровье и болезнях.
Свободные радикалы и их химические реакции
Свободный радикал можно определить как любую молекулу, способную к независимому существованию, которая содержит неспаренный электрон на атомной орбитали. 2 Присутствие неспаренного электрона приводит к определенным общим свойствам, которые присущи большинству радикалов.Радикалы слабо притягиваются к магнитному полю и считаются парамагнитными. Многие радикалы обладают высокой реакционной способностью и могут либо отдавать электрон, либо извлекать электрон из других молекул, поэтому ведут себя как окислители или восстановители. В результате такой высокой реакционной способности большинство радикалов имеют очень короткий период полураспада (10 −6 секунд или меньше) в биологических системах, хотя некоторые виды могут выжить гораздо дольше. 2 Наиболее важными свободными радикалами при многих болезненных состояниях являются производные кислорода, особенно супероксид и гидроксильный радикал.Радикальное образование в организме происходит по нескольким механизмам с участием как эндогенных факторов, так и факторов окружающей среды (рис. 1).
Рисунок 1Основные источники свободных радикалов в организме и последствия повреждения свободными радикалами.
Супероксид (O 2 -. ) образуется путем добавления одного электрона к кислороду, и существует несколько механизмов, с помощью которых супероксид может образовываться in vivo. 3 Некоторые молекулы, включая адреналин, флавинуклеотиды, тиоловые соединения и глюкозу, могут окисляться в присутствии кислорода с образованием супероксида, и эти реакции значительно ускоряются в присутствии переходных металлов, таких как железо или медь. Цепь переноса электронов во внутренней митохондриальной мембране выполняет восстановление кислорода до воды. Во время этого процесса образуются свободнорадикальные промежуточные соединения, которые обычно прочно связаны с компонентами транспортной цепи.Однако происходит постоянная утечка нескольких электронов в матрицу митохондрий, что приводит к образованию супероксида. 4 Активность некоторых других ферментов, таких как оксидаза цитохрома p450 в печени и ферментов, участвующих в синтезе гормонов надпочечников, также приводит к утечке нескольких электронов в окружающую цитоплазму и, следовательно, к образованию супероксида. Также может быть непрерывное производство супероксида эндотелием сосудов для нейтрализации оксида азота, 5 , 6 производство супероксида другими клетками для регулирования роста и дифференцировки клеток, 7 и производство супероксида фагоцитарными клетками во время респираторный взрыв. 8
Любая биологическая система, генерирующая супероксид, также будет производить перекись водорода в результате спонтанной реакции дисмутации. Кроме того, несколько ферментативных реакций, в том числе катализируемых гликолатоксидазой и оксидазой D-аминокислот, могут напрямую производить перекись водорода. 9 Перекись водорода сама по себе не является свободным радикалом, но обычно включается в общую рубрику активных форм кислорода (АФК). Это слабый окислитель, который может напрямую повредить белки и ферменты, содержащие реактивные тиоловые группы.Однако его наиболее важным свойством является способность свободно пересекать клеточные мембраны, чего супероксид обычно не может. 10 Следовательно, перекись водорода, образующаяся в одном месте, может диффундировать на значительное расстояние перед тем, как разложиться с образованием высокореактивного гидроксильного радикала, который, вероятно, опосредует большинство токсических эффектов, приписываемых перекиси водорода. Следовательно, перекись водорода действует как канал для передачи вызванных свободными радикалами повреждений через клеточные компартменты и между клетками.В присутствии перекиси водорода миелопероксидаза будет генерировать хлорноватистую кислоту и синглетный кислород, реакция, которая играет важную роль в уничтожении бактерий фагоцитами. 11
Гидроксильный радикал (OH . ) или близкородственные ему виды, вероятно, являются последним медиатором большинства повреждений тканей, вызванных свободными радикалами. 12 Все химически активные формы кислорода, описанные выше, проявляют большую часть своих патологических эффектов, вызывая образование гидроксильных радикалов.Причина этого в том, что гидроксильный радикал реагирует с чрезвычайно высокими константами скорости почти со всеми типами молекул, обнаруживаемыми в живых клетках, включая сахара, аминокислоты, липиды и нуклеотиды. Хотя образование гидроксильных радикалов может происходить несколькими путями, наиболее важным механизмом in vivo, вероятно, является катализируемое переходными металлами разложение супероксида и пероксида водорода. 13
Все элементы в первой строке d-блока периодической таблицы классифицируются как переходные металлы.Как правило, они содержат один или несколько неспаренных электронов и поэтому сами являются радикалами в элементарном состоянии. Однако их ключевым свойством с точки зрения свободнорадикальной биологии является их переменная валентность, которая позволяет им вступать в реакции с переносом одного электрона. Наиболее важными переходными металлами при заболеваниях человека являются железо и медь. Эти элементы играют ключевую роль в производстве гидроксильных радикалов in vivo. 13 Перекись водорода может реагировать с железом II (или медью I) с образованием гидроксильного радикала, реакция, впервые описанная Фентоном в 1894:
Эта реакция может происходить in vivo, но ситуация осложняется тем фактом, что обычно также присутствует супероксид (основной источник перекиси водорода in vivo).Супероксид и пероксид водорода могут взаимодействовать вместе напрямую с образованием гидроксильного радикала, но константа скорости этой реакции в водном растворе практически равна нулю. Однако, если присутствуют ионы переходных металлов, устанавливается последовательность реакций, которые могут протекать с большой скоростью: чистый результат:
Общий результат проиллюстрированной выше последовательности реакций известен как реакция Габера-Вейсса. Хотя большая часть железа и меди в организме изолирована в формах, которые недоступны для катализа этой последовательности реакций, они по-прежнему важны как механизм образования гидроксильного радикала in vivo.Однако фактические реакции могут быть несколько более сложными, чем описанные выше, и возможно также образование других реакционноспособных промежуточных продуктов, таких как феррильный и перферрильный радикалы. 12
У среднего взрослого человека содержится примерно 4,5 г железа, большая часть которого содержится в молекуле гемоглобина и других гемсодержащих белках. Пищевое железо абсорбируется преимущественно из проксимальной части тонкой кишки в двухвалентной форме и передается в кровоток, по которому оно переносится трансферрином. 14 В большинстве случаев железо остается прочно связанным с одним из нескольких белков, включая трансферрин, лактоферрин, белки гема, ферритин или гемосидерин. Кроме того, однако, кажется вероятным, что небольшой пул железа будет поддерживаться в виде комплексов с множеством небольших молекул, таких как нуклеотиды и цитрат, в цитоплазме и субклеточных органеллах. 14 Этот пул, вероятно, способен катализировать реакцию Фентона, управляемую железом, in vivo. Конечно, эти комплексы могут способствовать образованию гидроксильных радикалов in vitro. 15 Редокс-реактивное железо может быть измерено с помощью анализа железа с блеомицином, 16 , хотя остается неясным, в какой степени железо, обнаруженное с помощью этого анализа, коррелирует с каким-либо дискретным анатомическим или физиологическим пулом. В нормальных условиях в плазме здоровых субъектов не обнаруживается реактивное с блеомицином железо, что означает, что трансферрин или железо, связанное с ферритином, недоступно для управления производством гидроксильных радикалов. 17 Однако трансферрин высвобождает свое железо при кислом pH, особенно в присутствии хелатирующих агентов с малой молекулярной массой, таких как АДФ, АТФ и цитрат. 15 Такие состояния обнаруживаются в областях активного воспаления и во время ишемического реперфузионного повреждения, 18 , и поэтому вполне вероятно, что гидроксильные радикалы способствуют повреждению тканей в этих условиях. Железо высвобождается из ферритина восстановителями, включая аскорбат и сам супероксид, 19 , 20 , а перекись водорода может выделять железо из ряда белков гема. 21 Следовательно, хотя железосвязывающие белки эффективно хелатируют железо и предотвращают любые заметные окислительно-восстановительные эффекты в нормальных физиологических условиях, эта защита может нарушиться при болезненных состояниях.Роль меди аналогична описанной выше для железа. 22 , 23
Хотя образование свободных радикалов происходит в результате эндогенных реакций, описанных выше, и играет важную роль в нормальном функционировании клеток, важно помнить, что экзогенные факторы окружающей среды также могут способствовать образованию радикалов. Ультрафиолетовый свет приводит к образованию синглетного кислорода и других активных форм кислорода в коже. 24 Загрязняющие атмосферу вещества, такие как озон и диоксид азота, приводят к образованию радикалов и истощению антиоксидантов в жидкости бронхоальвеолярной выстилки, что может усугубить респираторное заболевание. 25 — 27 Сигаретный дым содержит миллимолярные количества свободных радикалов наряду с другими токсинами. 28
Различные ксенобиотики также вызывают повреждение тканей в результате образования свободных радикалов, включая паракват, 29 парацетамол, 30 блеомицин, 31 и антрациклины. 32
Антиоксидантные защитные системы
Поскольку радикалы обладают способностью реагировать неизбирательным образом, приводя к повреждению практически любого клеточного компонента, присутствует широкий спектр антиоксидантной защиты, как эндогенной, так и экзогенной, для защиты клеточных компонентов от повреждений, вызванных свободными радикалами. Их можно разделить на три основные группы: антиоксидантные ферменты, антиоксиданты, разрушающие цепь, и белки, связывающие переходные металлы 2 (рис. 2).
Рисунок 2Антиоксидантная защита от атаки свободных радикалов. Антиоксидантные ферменты катализируют распад свободных радикалов, обычно во внутриклеточной среде. Белки, связывающие переходные металлы, предотвращают взаимодействие переходных металлов, таких как железо и медь, с перекисью водорода и супероксидом с образованием высокореакционных гидроксильных радикалов. Антиоксиданты, разрывающие цепь, являются мощными донорами электронов и реагируют преимущественно со свободными радикалами до того, как будут повреждены важные молекулы-мишени.При этом антиоксидант окисляется, и его необходимо регенерировать или заменить. По определению, антиоксидантный радикал относительно инертен и не способен атаковать другие молекулы.
АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ
Каталаза
Каталаза была первым антиоксидантным ферментом, который был охарактеризован и катализирует двухстадийное превращение перекиси водорода в воду и кислород:
Каталаза состоит из четырех белковых субъединиц, каждая из которых содержит группу гема и молекулу НАДФН. 33 Константа скорости описанных выше реакций чрезвычайно высока (∼10 7 М / сек), что означает, что практически невозможно насытить фермент in vivo. Каталаза в основном находится внутри клеток в пероксисомах, которые также содержат большинство ферментов, способных генерировать перекись водорода. Количество каталазы в цитоплазме и других субклеточных компартментах остается неясным, поскольку пероксисомы легко разрушаются во время манипуляции с клетками. Наибольшая активность проявляется в печени и эритроцитах, но некоторое количество каталазы обнаружено во всех тканях.
Глутатионпероксидазы и глутатионредуктаза
Глутатионпероксидазы катализируют окисление глутатиона за счет гидропероксида, которым может быть перекись водорода или другие соединения, такие как гидропероксид липидов 34 :
Другие пероксиды, включая гидропероксиды липидов, также могут действовать как субстраты для этих ферментов, которые, следовательно, могут играть роль в восстановлении повреждений, вызванных перекисным окислением липидов.Глутатионпероксидазам необходим селен в активном центре, и дефицит может возникать при наличии серьезного дефицита селена. 35 Некоторые ферменты глутатионпероксидазы кодируются отдельными генами. 36 Считается, что плазменная форма глутатионпероксидазы синтезируется в основном в почках. 37 Внутри клеток самые высокие концентрации обнаруживаются в печени, хотя глутатионпероксидаза широко распространена почти во всех тканях. Преобладающее субклеточное распределение находится в цитозоле и митохондриях, что позволяет предположить, что глутатионпероксидаза является основным поглотителем перекиси водорода в этих субклеточных компартментах.Активность фермента зависит от постоянной доступности восстановленного глутатиона. 38 Соотношение восстановленного и окисленного глутатиона обычно поддерживается очень высоким в результате активности фермента глутатионредуктазы:
НАДФН, необходимый этому ферменту для пополнения запасов восстановленного глутатиона, обеспечивается пентозофосфатным путем. Любой конкурирующий путь, в котором используется НАДФН (например, путь альдозоредуктазы), может привести к дефициту восстановленного глутатиона и, следовательно, нарушить действие глутатионпероксидазы.Глутатионредуктаза представляет собой фермент, зависимый от флавинуклеотидов, и имеет такое же распределение в тканях, что и глутатионпероксидаза. 39
Супероксиддисмутаза
Супероксиддисмутазы катализируют дисмутацию супероксида в пероксид водорода:
Затем перекись водорода должна быть удалена каталазой или глутатионпероксидазой, как описано выше. В тканях млекопитающих существует три формы супероксиддисмутазы, каждая из которых имеет определенное субклеточное расположение и различное тканевое распределение.
Супероксиддисмутаза цинка и меди (CuZnSOD): CuZnSOD обнаружен в цитоплазме и органеллах практически всех клеток млекопитающих. 40 Он имеет молекулярную массу приблизительно 32 000 кДа и имеет две белковые субъединицы, каждая из которых содержит каталитически активный атом меди и цинка.
Супероксиддисмутаза марганца (MnSOD): MnSOD обнаружен в митохондриях почти всех клеток и имеет молекулярную массу 40 000 кДа. 41 Он состоит из четырех белковых субъединиц, каждая из которых, вероятно, содержит один атом марганца. Аминокислотная последовательность MnSOD полностью отличается от CuZnSOD и не ингибируется цианидом, что позволяет отличать активность MnSOD от активности CuZnSOD в смесях двух ферментов.
Внеклеточная супероксиддисмутаза (EC-SOD): EC-SOD была описана Marklund в 1982 г. 42 и представляет собой секреторную SOD, содержащую медь и цинк, отличную от CuZnSOD, описанного выше.EC-SOD синтезируется только несколькими типами клеток, включая фибробласты и эндотелиальные клетки, и экспрессируется на поверхности клетки, где он связан с гепарансульфатами. EC-SOD является основной SOD, обнаруживаемой во внеклеточных жидкостях, и высвобождается в кровоток с поверхности эндотелия сосудов после инъекции гепарина. 43 EC-SOD может играть роль в регуляции сосудистого тонуса, потому что эндотелиальный релаксирующий фактор (оксид азота или близкородственное соединение) нейтрализуется в плазме супероксидом. 44
АНТИОКСИДАНТЫ, РАЗРЫВАЮЩИЕ ЦЕПЬ
Всякий раз, когда свободный радикал взаимодействует с другой молекулой, могут образовываться вторичные радикалы, которые затем могут реагировать с другими мишенями с образованием еще более радикальных частиц. Классическим примером такой цепной реакции является перекисное окисление липидов, и реакция будет продолжаться до тех пор, пока два радикала не объединятся с образованием стабильного продукта или радикалы не будут нейтрализованы антиоксидантом, разрывающим цепь. 45 Антиоксиданты, разрывающие цепь, представляют собой небольшие молекулы, которые могут получать электрон от радикала или отдавать электрон радикалу с образованием стабильных побочных продуктов. 46 Как правило, заряд, связанный с присутствием неспаренного электрона, диссоциирует на поглотитель, и полученный продукт с трудом принимает электрон от другой молекулы или передает электрон другой молекуле, предотвращая дальнейшее распространение цепной реакции. Такие антиоксиданты можно удобно разделить на антиоксиданты в водной фазе и липидной фазе.
Антиоксиданты, разрушающие липидную фазу
Эти антиоксиданты удаляют радикалы в мембранах и липопротеиновых частицах и имеют решающее значение для предотвращения перекисного окисления липидов. Наиболее важным антиоксидантом липидной фазы, вероятно, является витамин Е. 47 Витамин Е встречается в природе в восьми различных формах, которые сильно различаются по степени биологической активности. Токоферолы (α, β, γ и δ) имеют хроманольное кольцо и фитильный хвост и различаются числом и положением метильных групп в кольце.Токотриенолы (α, β, γ и δ) структурно похожи, но имеют ненасыщенные хвосты. Оба класса соединений растворимы в жирах и обладают ярко выраженными антиоксидантными свойствами. 48 Они реагируют с пероксильными радикалами быстрее, чем полиненасыщенные жирные кислоты, и, следовательно, нарушают цепную реакцию перекисного окисления липидов. Помимо своей антиоксидантной роли, витамин E может также играть структурную роль в стабилизации мембран. 49 Франк Дефицит витамина Е редко встречается у людей, хотя он может вызывать гемолиз 50 и может способствовать периферической невропатии, которая возникает при абеталипопротеинемии. 51
Абсорбция, транспорт и регуляция плазменных концентраций витамина E у людей были рассмотрены Kayden and Traber, 52 , хотя в целом метаболизм витамина E не очень хорошо описан. В клеточных мембранах и липопротеинах основная антиоксидантная функция витамина Е заключается в улавливании пероксильных радикалов и прерывании цепной реакции перекисного окисления липидов. 53 Витамин Е не препятствует начальному образованию углеродных центрированных радикалов в среде, богатой липидами, но сводит к минимуму образование вторичных радикалов.α-Токоферол является самым мощным антиоксидантом из токоферолов, а также наиболее распространен в организме человека. Он быстро реагирует с пероксильным радикалом с образованием относительно стабильного токофероксильного радикала, причем избыточный заряд, связанный с дополнительным электроном, рассеивается по хроманольному кольцу. Этот стабилизированный резонансом радикал может впоследствии реагировать одним из нескольких способов. α-Токоферол может быть регенерирован реакцией на водной границе раздела с аскорбатом 54 или другим антиоксидантом, разрывающим цепь в водной фазе, таким как восстановленный глутатион или урат. 55 Альтернативно, два α-токофероксильных радикала могут объединяться с образованием стабильного димера, или радикал может быть полностью окислен с образованием токоферолхинона.
Каротиноиды представляют собой группу жирорастворимых антиоксидантов, основанную на изопреноидном углеродном скелете. 56 Самым важным из них является β-каротин, хотя по крайней мере 20 других могут присутствовать в мембранах и липопротеинах. Они являются особенно эффективными поглотителями синглетного кислорода, 57 , но также могут улавливать пероксильные радикалы при низком давлении кислорода с эффективностью, по крайней мере, такой же, как у α-токоферола.Поскольку эти условия преобладают во многих биологических тканях, каротиноиды могут играть роль в предотвращении перекисного окисления липидов in vivo. 58 Другая важная роль некоторых каротиноидов — это предшественники витамина А (ретинол). Витамин А также обладает антиоксидантными свойствами, 59 , которые, однако, не показывают никакой зависимости от концентрации кислорода.
Флавоноиды — это большая группа полифенольных антиоксидантов, содержащихся во многих фруктах, овощах и напитках, таких как чай и вино. 60 — 62 Было идентифицировано более 4000 флавоноидов, и они разделены на несколько групп в соответствии с их химической структурой, включая флавонолы (кверцетин и кемферол), флавонолы (катехины), флавоны (апигенин) и изофлавоны ( геништейн). Эпидемиологические исследования предполагают обратную связь между потреблением флавоноидов и заболеваемостью хроническими заболеваниями, такими как ишемическая болезнь сердца (ИБС). 63 — 65 Однако в настоящее время мало что известно об абсорбции и метаболизме флавоноидов, и эпидемиологические ассоциации могут быть следствием влияния других факторов.Имеющиеся данные свидетельствуют о том, что биодоступность многих флавоноидов низкая, 66 — 68 и очень низкие значения в плазме, хотя есть некоторые свидетельства того, что увеличение потребления флавоноидов может улучшить биохимические показатели окислительного повреждения. 68 , 69 Помимо флавоноидов, другие диетические фенольные соединения также могут вносить небольшой вклад в общую антиоксидантную способность. 70
Убихинол-10, восстановленная форма кофермента Q10, также является эффективным липидорастворимым антиоксидантом, разрушающим цепь. 71 Хотя он присутствует в более низких концентрациях, чем альфа-токоферол, он может улавливать липидные пероксильные радикалы с большей эффективностью, чем альфа-токоферол или каротиноиды, а также может регенерировать связанный с мембраной альфа-токоферол из токоферильного радикала. 72 Действительно, всякий раз, когда плазма или изолированный холестерин липопротеинов низкой плотности (ЛПНП) подвергаются воздействию радикалов, образующихся в липидной фазе, убихинол-10 является первым антиоксидантом, который необходимо потреблять, что позволяет предположить, что он может иметь особое значение для предотвращения распространения инфекции. перекисное окисление липидов. 73 Однако работа по дальнейшему уточнению его роли затрудняется из-за легкости, с которой убинхинол-10 окисляется во время работы с пробами или анализа.
Антиоксиданты, разрывающие цепь в водной фазе
Эти антиоксиданты будут непосредственно улавливать радикалы, присутствующие в водной среде. Качественно важнейшим антиоксидантом этого типа является витамин С (аскорбат). 74 У человека аскорбат действует как важный кофактор для нескольких ферментов, катализирующих реакции гидроксилирования.В большинстве случаев он обеспечивает электроны для ферментов, которым для достижения полной ферментативной активности требуются ионы простетических металлов в восстановленной форме. Его наиболее известная роль — кофактор пролил- и лизилоксидаз в синтезе коллагена. Однако, в дополнение к этим четко определенным действиям, несколько других биохимических путей зависят от присутствия аскорбата. 75 В дополнение к его роли кофактора фермента, другая важная функция аскорбата — это антиоксидант, разрушающий ключевую цепь в водной фазе. 76 Было показано, что аскорбат поглощает супероксид, перекись водорода, гидроксильный радикал, хлорноватистую кислоту, водные пероксильные радикалы и синглетный кислород. Во время своего антиоксидантного действия аскорбат подвергается двухэлектронному восстановлению, сначала до полудегидроаскорбильного радикала, а затем до дегидроаскорбат. Полудегидроаскорбильный радикал относительно стабилен из-за дисперсии заряда, связанного с присутствием одного электрона по трем атомам кислорода, и его можно легко обнаружить с помощью электронного спинового резонанса в жидкостях организма в присутствии повышенного образования свободных радикалов. 77 Дегидроаскорбат относительно нестабилен и легко гидролизуется до дикетогулоновой кислоты, которая впоследствии расщепляется до щавелевой кислоты. Описаны два механизма, с помощью которых дегидроаскорбат может восстанавливаться до аскорбата; один опосредуется селеноферментной тиоредоксинредуктазой 78 , а другой является неферментной реакцией, в которой используется восстановленный глутатион. 79 Дегидроаскорбат в плазме, вероятно, быстро поглощается эритроцитами до рециркуляции, поэтому в плазме присутствует очень мало дегидроаскорбат, если он вообще присутствует. 80
Помимо аскорбата, в плазме в высоких концентрациях присутствуют другие антиоксиданты. Мочевая кислота эффективно улавливает радикалы, превращаясь в процессе в аллантоин. 81 Ураты могут быть особенно важны для защиты от некоторых окислителей, таких как озон. 82 Действительно, было высказано предположение, что увеличение продолжительности жизни, которое произошло в ходе эволюции человека, можно частично объяснить защитным действием мочевой кислоты в плазме крови человека. 83 Частично антиоксидантный эффект урата может быть связан с образованием стабильных нереактивных комплексов с железом, но он также является прямым акцептором свободных радикалов. Связанный с альбумином билирубин также является эффективным поглотителем радикалов, 84 , и было высказано предположение, что он может играть особенно важную роль в защите новорожденных от окислительного повреждения, 85 , потому что у новорожденных часто встречается дефицит других антиоксидантов, разрывающих цепь.
Другими основными антиоксидантами, разрушающими цепь, в плазме крови являются тиоловые группы, связанные с белками.Сульфгидрильные группы, присутствующие в белках плазмы, могут действовать как антиоксиданты, разрушающие цепь, отдавая электрон для нейтрализации свободных радикалов, что приводит к образованию тиильного радикала белка. Альбумин является преобладающим белком плазмы и вносит основной вклад в сульфгидрильные группы плазмы, хотя он также обладает рядом других антиоксидантных свойств. 86 Альбумин содержит 17 дисульфидных мостиков и имеет единственный оставшийся цистеиновый остаток, и именно этот остаток отвечает за способность альбумина реагировать с пероксильными радикалами и нейтрализовать их. 87 Это свойство важно с учетом роли, которую альбумин играет в транспортировке свободных жирных кислот в крови. Кроме того, альбумин обладает способностью связывать ионы меди и ингибирует медьзависимое перекисное окисление липидов и образование гидроксильных радикалов. Он также является мощным поглотителем хлорноватистой кислоты фагоцитарного продукта и обеспечивает основную защиту плазмы от этого окислителя. 88
Поскольку сам альбумин повреждается, когда он действует как антиоксидант, его рассматривают как жертвенную молекулу, которая предотвращает повреждение более жизненно важных видов. 86 Высокая концентрация альбумина в плазме и относительно короткий период полураспада означают, что любое нанесенное повреждение вряд ли будет иметь биологическое значение. Однако работа in vitro показала, что тиильные радикалы белка могут сами действовать как потенциальный источник реактивных окислителей. Тиильный радикал может отщеплять электрон от полиненасыщенной жирной кислоты, чтобы инициировать процесс перекисного окисления липидов, 89 , реакцию, которая может быть ингибирована аскорбатом и ретинолом. Было показано, что антиоксидантные эффекты альбумина и других белков снижаются при высоких концентрациях, и было высказано предположение, что это связано с тем, что тиильные радикалы могут окислительно повредить другие молекулы.Важность этих открытий для антиоксидантной роли альбумина in vivo остается неясной.
Восстановленный глутатион (GSH) является основным источником тиоловых групп во внутриклеточном компартменте, но не имеет большого значения во внеклеточном пространстве. 90 GSH может действовать непосредственно как антиоксидант, улавливая множество радикалов, а также действовать как важный фактор для глутатионпероксидазы (обсуждалось выше). Тиоредоксин также может действовать как ключевой внутриклеточный антиоксидант, особенно при окислительно-восстановительной активации факторов транскрипции. 91
ВЗАИМОДЕЙСТВИЕ МЕЖДУ АНТИОКСИДАНТАМИ, РАЗРЫВАЮЩИМИ ЦЕПЬ
Хотя действие антиоксидантов, разрушающих цепь, было рассмотрено отдельно выше, важно помнить, что in vivo комплексные взаимодействия между антиоксидантами могут иметь место. Например, вероятно, что аскорбат будет рециркулировать токоферильный радикал на границе раздела вода-липид, таким образом регенерируя токоферол. 54 Это может иметь решающее значение для поддержания концентрации токоферола в липопротеинах и мембранах.Подобным образом глутатион может регенерировать аскорбат из дегидроаскорбат. Следовательно, между антиоксидантами, вероятно, будет существовать сложное взаимодействие, что затрудняет прогнозирование того, как антиоксиданты будут действовать in vivo. Поэтому становится бессмысленным спрашивать, какой антиоксидант наиболее важен: ответ будет зависеть от обстоятельств, существующих в конкретном микросреде в определенное время, и от природы происходящего окислительного повреждения.
Вторым важным свойством антиоксидантов, разрывающих цепь, является их способность действовать как прооксиданты.В определенных обстоятельствах присутствие антиоксиданта может парадоксальным образом привести к усилению окислительного повреждения. Например, сообщалось, что прием витамина С может иногда приводить к усилению окислительного повреждения, особенно если также вводится железо. 92 Точно так же in vitro было ясно показано, что токоферол может способствовать окислению ЛПНП в отсутствие антиоксиданта водной фазы, такого как аскорбат. 93 Важны ли эти реакции in vivo, пока неясно.Однако возможность того, что антиоксиданты могут оказывать прооксидантное действие in vivo, необходимо учитывать при разработке и интерпретации результатов клинических испытаний добавок антиоксидантов.
БЕЛКИ, СВЯЗЫВАЮЩИЕ ПЕРЕХОДНЫЕ МЕТАЛЛЫ
Как обсуждалось выше, белки, связывающие переходные металлы (ферритин, трансферрин, лактоферрин и церулоплазмин), действуют как решающий компонент системы антиоксидантной защиты, связывая железо и медь, так что они не могут управлять образованием гидроксильного радикала.Основной белок, связывающий медь, церулоплазмин, также может действовать как антиоксидантный фермент, который может катализировать окисление двухвалентного железа. 94
Fe 2+ представляет собой форму железа, которая запускает реакцию Фентона, и поэтому быстрое окисление Fe 2+ до менее реакционной формы Fe 3+ является антиоксидантным эффектом.
Последствия окислительного повреждения
Окислительный стресс, возникающий в результате дисбаланса между производством свободных радикалов и антиоксидантной защитой, связан с повреждением широкого спектра молекулярных видов, включая липиды, белки и нуклеиновые кислоты.Липопротеиновые частицы или мембраны обычно подвергаются процессу перекисного окисления липидов, что приводит к образованию множества продуктов, включая альдегиды с короткой цепью, такие как малоновый диальдегид или 4-гидроксиноненаль, алканы и алкены, конъюгированные диены, а также различные гидроксиды и гидропероксиды. 45 Многие из этих продуктов можно определить как маркеры перекисного окисления липидов. Подробное обсуждение этого сложного вопроса выходит за рамки этого обзора, но измерение изопростанов методом газовой хроматографии, масс-спектроскопии, вероятно, является наиболее специфическим маркером повреждения липидов свободными радикалами. 95 Окислительное повреждение белков и нуклеиновых кислот аналогичным образом приводит к появлению множества специфических продуктов повреждения в результате модификаций аминокислот или нуклеотидов. 45 Такое окислительное повреждение также может приводить к клеточной дисфункции, и именно это может вносить вклад в патофизиологию широкого спектра заболеваний.
Окислительный стресс и болезни
Роль окислительного стресса постулируется во многих состояниях, включая атеросклероз, воспалительные состояния, 96 определенные виды рака, 97 и процесс старения. 98 Во многих случаях это следует за наблюдением повышенного количества продуктов повреждения свободными радикалами, особенно маркеров перекисного окисления липидов, в жидкостях организма. Однако важно помнить, что перекисное окисление липидов — неизбежное сопровождение гибели клеток по любой причине. В большинстве случаев перекисное окисление является вторичным явлением, и поэтому это напрямую не указывает на важную роль окислительного стресса в данном заболевании. Если основная роль окислительного стресса в определенных условиях должна поддерживаться, должен существовать правдоподобный механизм, с помощью которого может происходить увеличение выработки свободных радикалов или снижение антиоксидантной защиты.Кроме того, признаки окислительного стресса должны быть обнаружены до начала повреждения тканей, а повышение антиоксидантного статуса на ранней стадии должно либо предотвратить, либо значительно уменьшить повреждение тканей.
Атеросклероз можно рассматривать как пример процесса, для которого есть существенные доказательства роли окислительного стресса. Гиперхолестеринемия повсеместно считается основным фактором риска атеросклероза. Однако при любой данной концентрации холестерина в плазме по-прежнему существует большая вариабельность возникновения сердечно-сосудистых событий.Одним из главных достижений в исследованиях атерогенеза стало осознание того, что окислительная модификация ЛПНП может быть критически важным шагом в развитии атеросклеротической бляшки. 99 , 100 Образование пенистых клеток из макрофагов, происходящих из моноцитов, при ранних атеросклеротических поражениях не вызывается нативными ЛПНП, а только после модификации ЛПНП различными химическими реакциями, такими как окисление. Окисление ЛПНП — это процесс, инициируемый и распространяемый свободными радикалами или одним из нескольких ферментов, 101 , и считается, что он происходит в основном в стенке артерии в микросреде, где антиоксиданты могут истощаться.Все клетки стенки сосуда — эндотелиальные клетки, клетки гладких мышц, макрофаги и лимфоциты — могут изменять ЛПНП in vitro. 102 — 104 Вероятно задействовано несколько механизмов, включая опосредованное ионами переходного металла образование гидроксильных радикалов, производство активных форм кислорода такими ферментами, как миелопероксидаза и липоксигеназа, и прямая модификация реактивными формами азота. Поскольку окисление ЛПНП является в первую очередь процессом, опосредованным свободными радикалами, который ингибируется антиоксидантами, истощение запасов антиоксидантов может быть фактором риска сердечно-сосудистых заболеваний (ССЗ).
Доказательства окисления ЛПНП in vivo в настоящее время хорошо установлены. В иммуноцитохимических исследованиях антитела против окисленных ЛПНП окрашивают атеросклеротические поражения, но не нормальную артериальную ткань. 105 Было показано, что ЛПНП, экстрагированные из поражений животных и человека, окисляются и быстро поглощаются рецепторами скавенджеров макрофагов. 106 У молодых людей, переживших инфаркт миокарда (ИМ), была продемонстрирована связь между повышенной восприимчивостью ЛПНП к окислению и степенью коронарного атеросклероза, 107 , тогда как было показано присутствие цероида, продукта перекисного окисления липидов. в запущенных атеросклеротических бляшках. 108
Окисленный ЛПНП обладает рядом свойств, способствующих атерогенезу, помимо быстрого поглощения макрофагами через рецептор скавенджера. Окисленные формы ЛПНП являются хемотаксисом для циркулирующих макрофагов и гладкомышечных клеток и способствуют адгезии моноцитов к эндотелию и проникновению в субэндотелиальное пространство. 109 Окисленные ЛПНП также цитотоксичны по отношению к артериальным эндотелиальным клеткам 110 и ингибируют высвобождение оксида азота и, как следствие, зависимое от эндотелия расширение сосудов. 111 Следовательно, существует потенциальная роль окисленных ЛПНП в изменении вазомоторных реакций, возможно, способствуя вазоспазму в пораженных сосудах. Кроме того, окисленные ЛПНП иммуногенны; аутоантитела против различных эпитопов окисленных ЛПНП были обнаружены в сыворотке крови человека. 112 , 113 и иммуноглобулин (IgG), специфичный для эпитопов окисленных ЛПНП, могут быть обнаружены в очагах поражения. 114 Окисленный ЛПНП может побуждать клетки стенки артерии продуцировать хемотаксические факторы, молекулы адгезии, цитокины и факторы роста, которые играют роль в развитии бляшки. 115 , 116
Помимо атерогенных последствий окисления ЛПНП, все более широко признается, что активные формы кислорода и азота напрямую взаимодействуют с сигнальными механизмами в стенке артерий, регулируя функцию сосудов. 117 Активность ферментов, генерирующих оксидант, в стенке артерии регулируется как активацией рецепторов, так и путями, не опосредованными рецепторами. Эффекты антиоксидантов на эти процессы сложны, но обеспечивают альтернативные механизмы, с помощью которых добавление антиоксидантов может улучшить патологию сосудов, например, за счет улучшения функции эндотелия.
Доказательства того, что антиоксидантные микронутриенты потенциально снижают риск ИБС, получены из четырех основных источников. Во-первых, исследования приема антиоксидантных добавок на животных моделях атеросклероза в целом показали снижение заболеваемости. 118 , 119 Во-вторых, многие исследования показали, что прием антиоксидантных добавок у здоровых субъектов или пациентов с ИБС может снизить уровни продуктов повреждения свободными радикалами и защитить ЛПНП от окисления. 120 , 121 Витамин Е оказался наиболее эффективным антиоксидантом; и β-каротин, и витамин C увеличили время задержки окисления только в нескольких исследованиях, хотя остается возможность, что они могут иметь положительный эффект у людей с плохим исходным статусом.В-третьих, крупномасштабные эпидемиологические исследования обычно показывают, что низкое потребление антиоксидантов связано с повышенным риском сердечно-сосудистых заболеваний после корректировки других факторов риска. 122 — 125 Эпидемиологические данные наиболее убедительны в случае витамина Е. В частности, в двух крупных продольных исследованиях в США изучалась связь между приемом антиоксидантов и риском ИБС. В группе из 39 910 медицинских работников-мужчин мужчины, которые принимали добавки витамина E в дозах не менее 100 МЕ / день в течение более двух лет, имели относительный риск ИБС на 37% ниже, чем те, кто не принимал добавки витамина E, после корректировки. относительно возраста, факторов риска коронарных заболеваний и потребления витамина С и β-каротина. 126 В исследовании здоровья медсестер с участием 87 245 медсестер выяснилось, что у женщин, которые принимали добавки витамина Е более двух лет, относительный риск серьезной коронарной болезни был на 41% ниже. 127 Этот эффект сохранялся после корректировки с учетом возраста, курения, ожирения, физических упражнений, артериального давления, холестерина и использования заместительной терапии эстрогенами в постменопаузе, аспирина, витамина С и β-каротина. Высокое потребление витамина Е из пищевых источников не было связано со значительным снижением риска, хотя даже самые высокие уровни потребления витамина Е с пищей были намного ниже, чем его потребление среди пользователей добавок.
Доказательства связи водорастворимого витамина С с сердечно-сосудистыми заболеваниями менее убедительны, чем для витамина Е. В последующем исследовании врачей высокое потребление витамина С не было связано с более низким риском ИБС у мужчин, в то время как у женщин из По данным обследования состояния здоровья медсестер, первоначальный эффект был ослаблен после корректировки на использование поливитаминов. Только одно проспективное исследование с участием 11 348 взрослых продемонстрировало обратную зависимость между потреблением витамина С и общей смертностью от сердечно-сосудистых заболеваний. 128 Этот эффект в значительной степени является результатом использования витамина С в добавках и мог быть вызван другими витаминами-антиоксидантами в поливитаминных препаратах.Проспективное популяционное исследование 1605 здоровых мужчин в возрасте 42, 48, 54 или 60 лет в Финляндии недавно показало, что мужчины с дефицитом витамина С имели относительный риск ИМ 2,5 по сравнению с мужчинами с более высокими концентрациями витамина С в плазме после корректировки. для других факторов риска. 129 Имеются также некоторые указания на то, что повышенное потребление β-каротина с пищей связано со снижением риска ИБС, хотя опять же доказательства менее убедительны, чем для витамина Е. В ходе обследования состояния здоровья будущих медсестер потребление витаминов А и β-каротин в пище и добавках слабо предсказывает заболеваемость ИБС; Газиано и Хеннекенс подсчитали снижение риска на 22% для женщин с самым высоким квинтилем β-каротина по сравнению с женщинами с самым низким. 130
Таким образом, существует правдоподобный случай, подтвержденный экспериментальными исследованиями, экспериментами на животных и эпидемиологией, связывающими окислительный стресс и атеросклероз. Ключевой тест такой гипотезы заключается в том, можно ли показать, что повышенное потребление антиоксидантов предотвращает клинические проявления атеросклероза у людей. В нескольких опубликованных рандомизированных исследованиях этот вопрос был рассмотрен, другие в настоящее время продолжаются. Первые результаты не обнадеживают.
Исследование α-токоферола и β-каротина по профилактике рака (ATBC), проведенное среди 29 133 мужчин, заядлых курильщиков в Финляндии, не выявило снижения заболеваемости или смертности от ИБС в течение пяти-восьми лет лечения витамином E (50 мг в день) или β-каротин (20 мг в день). 131 У тех, кому назначен витамин Е, не было значительного снижения смертности от ишемической болезни сердца (ИБС), но на 50% больше случаев смерти от кровоизлияния в мозг, тогда как у тех, кому назначен бета-каротин, было зарегистрировано 11% увеличение смертности от ИБС. В дальнейшем анализе рассматривалась подгруппа исходных субъектов, перенесших ранее перенесенный ИМ. 132 Конечной точкой этого субисследования было первое серьезное коронарное событие после рандомизации. Доля серьезных коронарных событий не уменьшалась ни при приеме добавок альфа-токоферола, ни бета-каротина.Фактически, β-каротин приводил к увеличению риска ИБС со смертельным исходом (повышение риска на 75%). Было отмечено положительное влияние витамина Е на нелетальный ИМ со снижением риска на 38%. В отличие от этого, в китайском исследовании профилактики рака, проведенном среди 29 584 плохо питающихся жителей Линьсяня, Китай, рандомизированных на 5,25 лет для комбинированной схемы приема 15 мг / день β-каротина, 30 мг / день витамина E и 50 мкг / день. day selenium привел к значительному снижению общей смертности на 9%, к значительному снижению смертности от рака желудка на 21% и к незначительному снижению смертности от цереброваскулярных заболеваний на 10%. 133 Однако разумность обобщения этих результатов на хорошо питаемое население остается сомнительной.
Исследование эффективности β-каротина и ретинола (CARET), предназначенное для проверки эффектов комбинированной добавки, содержащей 30 мг β-каротина и 25000 МЕ ретинола в день среди 18 314 курильщиков сигарет и лиц с профессиональным воздействием асбеста, было завершено досрочно, когда исследователи признали повышенный риск смерти от рака легких у тех, кто получал β-каротин, и, опять же, не было обнаружено положительного влияния на сердечно-сосудистые заболевания. 134 Что касается смертности от сердечно-сосудистых заболеваний, то в обработанной группе наблюдалось незначительное увеличение на 26% (p = 0,06).
В медицинском исследовании приняли участие более 22 000 американских врачей-мужчин, получавших 50 мг β-каротина или плацебо через день в среднем в течение 12 лет. Судя по всему, исследование было проведено тщательно, и его результаты серьезно ставят под сомнение какое-либо положительное влияние таких добавок на сердечно-сосудистые заболевания в хорошо питающихся группах населения. Не наблюдалось значительного влияния на индивидуальные исходы или комбинированную конечную точку нефатального ИМ, нефатального инсульта и сердечно-сосудистой смерти, для которых относительный риск составлял 1.0 (95% доверительный интервал от 0,91 до 1,09). 135 Не было также доказательств вреда (или пользы) среди 11% участников, которые курили в настоящее время на исходном уровне, хотя нельзя было исключать небольшие эффекты.
Greenberg и др. изучали влияние добавок β-каротина (50 мг / день) у 1720 мужчин и женщин в течение медианного периода 4,3 года со средним периодом наблюдения 8,2 года. 136 Субъекты, у которых уровень β-каротина в плазме крови находился в наивысшем квартиле в начале исследования, имели самый низкий риск смерти от всех причин по сравнению с лицами, находящимися в самом низком квартиле.Однако добавки не повлияли ни на все причины, ни на смертность от сердечно-сосудистых заболеваний. Таким образом, добавление β-каротина, по-видимому, не дает общих преимуществ для тех людей с хорошим питанием, которые имеют низкий или средний риск развития ИБС. Однако ситуация может быть иной для тех, у кого в анамнезе уже было такое заболевание.
Hodis и др. показали снижение прогрессирования ИБС (измеренное ангиографически) у мужчин, получавших 100 МЕ витамина Е ежедневно, хотя не было обнаружено никаких преимуществ для витамина С. 137 Singh и др. обнаружили, что комбинация витаминов A, C, E и β-каротина, вводимая в течение нескольких часов после острого инфаркта миокарда и продолжавшаяся в течение 28 дней, приводила к значительно меньшему количеству сердечных событий и снижению частоты стенокардии в дополненной группе. 138 Кембриджское исследование сердечных антиоксидантов (CHAOS), испытание добавок витамина E на 2002 пациентах с ангиографическими признаками ишемической болезни сердца, было проведено со средней продолжительностью лечения 1.4 года. 139 Было обнаружено, что это краткосрочное добавление альфа-токоферола (268 или 537 мг / день) снижает заболеваемость ИБС у пациентов, поскольку у пациентов значительно (77%) снижается риск последующего нефатального ИМ. Однако не было обнаружено никаких преимуществ с точки зрения смертности от сердечно-сосудистых заболеваний, с незначительным превышением среди участников, получавших витамин Е.
В исследовании GISSI-P рандомизировано 11 324 мужчин, переживших инфаркт миокарда, которые получали 300 мг витамина E, 1 г n-3 полиненасыщенных жирных кислот (ПНЖК), оба или ни одного в рандомизированном плацебо-контролируемом исследовании. 140 Результаты показали положительный эффект n-3 ПНЖК, но не положительный эффект витамина Е (p = 0,07). Однако дальнейший анализ вторичных конечных точек показал некоторые положительные эффекты витамина Е. Кроме того, действие витамина Е могло быть улучшено средиземноморской диетой испытуемых. Ни одна из этих квалификаций не верна для исследования HOPE, 141 , в котором было задействовано более 9000 субъектов, которые, вероятно, придерживались типичной североевропейской диеты, которые имели высокий риск сердечно-сосудистых событий, потому что у них были сердечно-сосудистые заболевания или диабет в дополнение к еще одному фактору риска. .Субъекты были случайным образом распределены по факторному плану два на два для получения либо 400 МЕ витамина Е ежедневно из природных источников, либо соответствующего плацебо, а также либо ингибитора ангиотензинпревращающего фермента (рамиприл), либо соответствующего плацебо в течение в среднем 4,5 года. Добавки витамина Е не влияли на первичные или вторичные сердечно-сосудистые конечные точки.
Таким образом, в отношении витамина Е в западных популяциях единственные доступные данные испытаний первичной профилактики получены из исследования ATBC, которое не показало никакого эффекта.При вторичной профилактике накапливающиеся данные испытаний витамина Е менее последовательны, хотя и не особенно обнадеживают. Исследование CHAOS было положительным, хотя и страдает ограничениями дизайна. Исследование GISSI-P дало пограничный результат, тогда как исследование HOPE было однозначно отрицательным.
Как мы должны интерпретировать несоответствие между данными когортных исследований и результатами клинических испытаний? В общем, может случиться так, что продолжительность клинических испытаний слишком коротка, чтобы показать пользу, и что для предотвращения атеросклероза требуется прием антиоксидантов в течение многих лет.Необходимо продумать дизайн исследования с учетом дозы, продолжительности лечения и периода наблюдения, начальных значений антиоксидантов и рациона, а также степени и распределения существующего атеросклероза. На животных моделях почти всегда проверяли влияние антиоксидантов на ранние атеросклеротические поражения. Еще предстоит выяснить, оказывают ли антиоксиданты ингибирующее действие на более поздних стадиях. Кроме того, сложная смесь антиоксидантных микронутриентов, содержащихся в диете с высоким содержанием фруктов и овощей, может быть более эффективной, чем большие дозы небольшого количества витаминов-антиоксидантов.Возможно, некоторые из этих соединений работают вместе, но не действуют по отдельности, или что другие диетические компоненты (например, микроэлементы) могут быть эффекторами антиоксидантного действия. Доказательства испытаний, доступные до сих пор, относятся только к α-токоферолу и β-каротину. Хотя эти антиоксиданты эффективны для защиты от перекисного окисления липидов, они мало влияют на функцию эндотелия артерий. Аскорбат, напротив, кажется более эффективным в улучшении функции эндотелия, хотя существует меньше эпидемиологических подтверждений защитного действия аскорбата.
С другой стороны, значимые результаты, связывающие потребление антиоксидантов с риском ИБС, наблюдаемые в когортных исследованиях, могут быть результатом смешения с другим образом жизни. Слэттери и др. изучили пищевые антиоксиданты и липиды плазмы в исследовании развития риска коронарных артерий у молодых людей (CARDIA) и обнаружили, что более высокое потребление антиоксидантов было связано с другими факторами образа жизни, такими как физическая активность и отказ от курения. 142 Концентрации антиоксидантов в плазме связаны с социальным классом, они выше в более обеспеченных группах.Хотя эти переменные можно индивидуально контролировать в анализах, возможно, потребуется изучить сложную модель поведения на протяжении всей жизни, прежде чем делать выводы относительно антиоксидантов и ИБС. Например, недавно было показано, что пассивное курение оказывает атерогенное влияние на ЛПНП, 143 , однако курение является сложной переменной образа жизни, которую трудно контролировать в когортном анализе.
Выводы
Имеются неопровержимые доказательства того, что окислительный стресс возникает в клетках как следствие нормальных физиологических процессов и взаимодействий с окружающей средой, и что сложная сеть систем антиоксидантной защиты играет ключевую роль в защите от окислительного повреждения.Эти процессы, по-видимому, нарушаются во многих условиях, и может быть построена правдоподобная гипотеза, предполагающая, что окислительный стресс является причиной повреждения тканей. Однако, как показано на примере ИБС, попытки терапевтического вмешательства с использованием антиоксидантных добавок до сих пор в значительной степени не увенчались успехом. Более полное понимание биохимических событий, происходящих на клеточном уровне и влияющих на окислительное повреждение, необходимо для руководства будущими терапевтическими достижениями.
Список литературы
- ↵
Halliwell B, Gutteridge JC.Определение и измерение антиоксидантов в биологических системах. Free Radic Biol Med 1995; 18: 125–6.
- ↵
Halliwell B; Gutteridge JM. Свободные радикалы в биологии и медицине , 2-е изд. Оксфорд: Clarendon Press, 1989.
- ↵
Halliwell B, Gutteridge JC. Биологически релевантное образование гидроксильных радикалов, зависимое от ионов металлов, — обновленная информация. FEBS Lett 1992; 307: 108–12.
- ↵
Беккер Л. Б., Ванден Хук Т. Л., Шао Ч., и др. .Генерация супероксида в кардиомиоцитах при ишемии перед реперфузией. Am J Physiol 1999; 277: h3240–6.
- ↵
Barbacanne MA, Margeat E, Arnal JF, и др. . Высвобождение супероксида сливающимися эндотелиальными клетками, исследование электронно-спинового резонанса (ЭПР). Дж. Хим. Физ. Физ. Хим. Биол., 1999; 96: 85–92.
- ↵
Tsao PS, Heidary S, Wang A, и др. . Протеинкиназа C-эпсилон опосредует индуцированное глюкозой продукцию супероксида и экспрессию MCP-1 в эндотелиальных клетках.FASEB J 1998; 12: 512.
- ↵
Мастерс CJ. Клеточная передача сигналов: роль пероксисомы. Cell Signal 1996; 8: 197–208.
- ↵
Curnutte JT, Babior BM. Хроническая гранулематозная болезнь. Adv Hum Genet 1987; 16: 229–45.
- ↵
Chance B, Sies H, Boveris A. Метаболизм гидропероксида в органах млекопитающих. Physiol Rev 1979; 59: 527–605.
- ↵
Halliwell B, Gutteridge JMC.Роль свободных радикалов и каталитических ионов металлов в заболеваниях человека: обзор. Методы Enzymol 1990; 186: 1–85.
- ↵
Тацузава Х., Маруяма Т., Хори К., и др. . Синглетный кислород как основной окислитель в опосредованном миелопероксидазой уничтожении бактерий в фагосомах нейтрофилов. Biochim Biophys Res Commun 1999; 262: 647–50.
- ↵
Ллойд Р.В., Ханна П.М., Мейсон Р.П. Происхождение гидроксильного радикала кислорода в реакции Фентона.Free Radic Biol Med 1997; 22: 885–8.
- ↵
Stohs SJ, Bagchi D. Окислительные механизмы токсичности ионов металлов. Free Radic Biol Med 1995; 18: 321–36.
- ↵
Goldenberg HA. Регуляция метаболизма железа у млекопитающих: текущее состояние и потребность в дополнительных знаниях. Crit Rev Clin Lab Sci 1997; 34: 529–72.
- ↵
Аруома О.И., Холливелл Б.Супероксид-зависимое и аскорбат-зависимое образование гидроксильных радикалов из пероксида водорода в присутствии железа. Biochem J, 1987; 241: 273–8.
- ↵
Гаттеридж Дж. М., Роули Д. А., Холливелл Б. Супероксид-зависимое образование гидроксильных радикалов в присутствии солей железа. Biochem J 1981; 199: 263–5.
- ↵
Gutteridge JC, Quinlan GJ, Evans TW. Транзиторная перегрузка железом блеомицином, обнаруживаемое железом в плазме пациентов с респираторным дистресс-синдромом у взрослых.Thorax 1994; 49: 707–10.
- ↵
Пеппер Дж. Р., Мамби С., Гаттеридж Дж. С.. Последовательное окислительное повреждение и изменения связывания железа и окисляющих железо антиоксидантов плазмы во время операции искусственного кровообращения. Free Radic Res 1994; 21: 377–85.
- ↵
Gutteridge JMC, Quinlan GJ. Образование малонового диальдегида из гидропероксидов липидов в тесте с тиобарбитуровой кислотой: роль липидных радикалов, солей железа и хелаторов металлов.J Appl Biochem 1983; 5: 293–9.
- ↵
О’Коннелл М., Холливелл Б., Мурхаус С., и др. . Образование гидроксильных радикалов в присутствии ферритина и гемосидерина. Является ли образование гемосидерина биологическим защитным механизмом? Biochem J 1986; 234: 727–31.
- ↵
Бенатти Ю., Морелли А., Гуида Л., и др. . Производство активированных форм кислорода за счет взаимодействия метгемоглобина с аскорбатом.Biochem Biophys Res Commun. 1983; 111: 980–7.
- ↵
Свейн Дж., Гаттеридж Дж. М.. Прооксидантное железо и медь с ферроксидазной и ксантиноксидазной активностями в атеросклеротическом материале человека. FEBS Lett 1995; 368: 513–15.
- ↵
Коидзуми М., Фуджи Дж., Сузуки К., и др. . Заметное увеличение уровней свободной меди в плазме и печени крыс LEC: животная модель болезни Вильсона и рака печени.Free Radic Res 1998; 28: 441–50.
- ↵
McCaughan JS. Фотодинамическая терапия — обзор. Наркотики старения 1999; 15: 49–68.
- ↵
Cross CE, Ван дер Вильт А., О’Нил С., и др. . Окислители, антиоксиданты и жидкости, выстилающие дыхательные пути. Environ Health Perspect 1994; 102: 185–91.
Келли Ф.Дж., Мадуэй I, Кришна М.Т., и др. .Свободные радикалы в основе загрязнения воздуха сосредоточены на озоне. Респир Мед 1995; 89: 647–56.
- ↵
Келли Ф.Дж., Тетли ТД. Двуокись азота истощает мочевую кислоту и аскорбиновую кислоту, но не глутатион из жидкости слизистой оболочки легких. Biochem J 1997; 325: 95–9.
- ↵
Pourcelot S, Faure H, Firoozi F, и др. . Моча 8-оксо-7,8-дигидро-2′-дезоксигуанозина и 5- (гидроксиметил) урацила у курильщиков.Free Radic Res 1999; 30: 173–80.
- ↵
Вильгельм Дж., Фридрихова М., Визек М. Перекись водорода в дыхании крыс: эффекты гипоксии и параквата. Physiol Res 1999; 48: 445–9.
- ↵
Kapiotis S, Sengoelge G, Hermann M, и др. . Парацетамол катализирует инициируемое миелопероксидазой окисление липидов в ЛПНП. Артериосклер Thromb Vasc Biol 1997; 17: 2855–60.
- ↵
Weijl NI, Cleton FJ, Osanto S.Свободные радикалы и антиоксиданты при токсичности, вызванной химиотерапией. Cancer Treat Rev 1997; 23: 209–40.
- ↵
Гевиртц Д.А. Критическая оценка предложенных механизмов действия противоопухолевых эффектов антрациклиновых антибиотиков адриамицина и даунорубицина. Biochem Pharmacol 1999; 57: 727–41.
- ↵
Киркман Х.Н., Галиано С., Гаэтани Г.Ф. Функция NADPH, связанного с каталазой. J Biol Chem 1987; 262: 660–5.
- ↵
Takahashi K, Cohen HJ. Селен-зависимый белок и активность глутатионпероксидазы: иммунологические исследования клеточных ферментов и ферментов плазмы. Кровь 1986; 68: 640–6.
- ↵
Накане Т., Асаяма К., Кодера К., и др. . Влияние дефицита селена на клеточные и внеклеточные глутатионпероксидазы: иммунохимическое обнаружение и анализ мРНК в почках и сыворотке крыс.Free Radic Biol Med 1998; 25: 504–11.
- ↵
Бригелиус-Флоэ Р. Тканеспецифичные функции отдельных глутатионпероксидаз. Free Radic Biol Med 1999; 27: 951–65.
- ↵
Roxborough HE, Mercer C, McMaster D, и др. . Активность глутатионпероксидазы в плазме снижается у пациентов, находящихся на гемодиализе. Нефрон 1999; 81: 278–83.
- ↵
Холбен Д.Х., Смит AM.Разнообразная роль селена в селенопротеинах: обзор. J Am Diet Assoc 1999; 99: 836–43.
- ↵
Гибсон Д.Г., Гаврилко Дж., Маккей ПБ. GSH-зависимое ингибирование перекисного окисления липидов: свойства мощной цитозольной системы, которая защищает клеточные мембраны. Липиды 1985; 20: 704–10.
- ↵
Лиу В., Чанг Л-И, Гёзе Х.Дж., и др. . Распределение супероксиддисмутазы CuZn в печени крыс.Free Rad Biol Med 1993; 14: 201–7.
- ↵
Вайзигер Р.А., Фридович И. Митохондриальная супероксиддисмутаза: сайт синтеза и внутримитохондриальная локализация. J Biol Chem 1973; 248: 4793–6.
- ↵
Марклунд С. Человеческая медьсодержащая супероксиддисмутаза с высокой молекулярной массой. Proc Natl Acad Sci U S. A 1982; 79: 7634–8.
- ↵
Карлссон К., Сандстром Дж., Эдлунд А., и др. .Фармакокинетика внеклеточной супероксиддисмутазы в сосудистой системе. Free Radic Biol Med 1993; 14: 185–90.
- ↵
McIntyre M, Bohr DF, Dominiczak AF. Гипертония функции эндотелия — роль супероксид-аниона. Гипертония 1999; 34: 539–45.
- ↵
Де Цварт Л.Л., Меерман Дж. Н., Командор Дж. М., и др. . Биомаркеры воздействия свободных радикалов у экспериментальных животных и людей.Free Radic Biol Med 1999; 26: 202–26.
- ↵
Холливелл Б. Как охарактеризовать антиоксидант: обновленная информация. Biochem Soc Symp 1995; 61: 73–101.
- ↵
Esterbauer H, Dieber-Rotheneder M, Striegl G, et al . Роль витамина Е в предотвращении окисления липопротеинов низкой плотности. Am J Clin Nutr 1991; 53: 314s – 21s.
- ↵
Хорвитт MH.Данные, подтверждающие добавление витамина E к людям. J Nutr 1991; 121: 424–9.
- ↵
Урано С., Иномори Й., Сугавара Т., и др. . Витамин-E — ингибирование ретинол-индуцированного гемолиза и мембраностабилизирующего поведения. J Biol Chem 1992; 267: 18365–70.
- ↵
Суонн, Иллинойс, Кендра-младший. Анемия, дефицит витамина Е и нарушение нормального развития у младенца. Clin Lab Haematol 1998; 20: 61–3.
- ↵
Сокол РЖ. Дефицит витамина Е и неврологические заболевания. Анну Рев Нутр 1988; 8: 351–73.
- ↵
Кайден Х.Дж., Трабер МГ. Абсорбция, транспорт липопротеинов и регуляция плазменных концентраций витамина Е у человека. J. Lipid Res 1993; 34: 343–58.
- ↵
Burton GW, Ingold KU. Витамин Е: применение принципов физической органической химии к исследованию его структуры и функций.Acc Chem Res 1986; 19: 194–201.
- ↵
May JM, Qu ZC, Mendiratta S. Защита и рециркуляция альфа-токоферола в эритроцитах человека с помощью внутриклеточной аскорбиновой кислоты. Arch Biochem Biophys 1998; 349: 281–9.
- ↵
Каган В.Е., Тюрина Ю.Ю. Рециклинг и окислительно-восстановительный цикл фенольных антиоксидантов. К продлению здоровой жизни. Энн Н. Ю. Акад. Наук 1998; 854: 425–34.
- ↵
Купер Д.А., Элдридж А.Л., Петерс Дж.С.Диетические каротиноиды и некоторые виды рака, болезни сердца и возрастная дегенерация желтого пятна: обзор недавних исследований. Nutr Rev 1999; 57: 201–14.
- ↵
Fukuzawa K, Inokami Y, Tokumura A, et al . Константы скорости тушения синглетного кислорода и активности по ингибированию перекисного окисления липидов каротиноидов и альфа-токоферола в липосомах. Липиды 1998; 33: 751–6.
- ↵
Chaudiere J, Ferrari-Iliou R.Внутриклеточные антиоксиданты: от химических механизмов к биохимическим. Food Chem Toxicol 1999; 37: 949–62.
- ↵
Ключи SA, Циммерман ВФ. Антиоксидантная активность ретинола, глутатиона и таурина в мембранах фоторецепторных клеток крупного рогатого скота. Exp Eye Res 1999; 68: 693–702.
- ↵
Rice-Evans CA, Miller NJ, Paganga G. Взаимосвязь между структурой и антиоксидантной активностью флавоноидов и фенольных кислот.Free Radic Biol Med 1996; 20: 933–56.
Hertog MGL, Hollman PCH, Katan MB. Содержание потенциально антиканцерогенных флавоноидов в 28 овощах и 9 фруктах, обычно потребляемых в Нидерландах. J Agric Food Chem 1992; 40: 2379–83.
- ↵
Hertog MGL, Hollman PCH, Putte B. Содержание потенциально антиканцерогенных флавоноидов в чайных настоях, винах и фруктовых соках. J. Agric Food Chem 1993; 41: 1242–6.
- ↵
Hertog MGL, Feskens EJM, Hollman PCH, и др. . Диетические антиоксидантные флавоноиды и риск ишемической болезни сердца: исследование пожилых людей Zutphen. Ланцет 1993; 342: 1007–11.
Hertog MGL, Кромхаут Д., Араванис С., и др. . Потребление флавоноидов и долгосрочный риск ишемической болезни сердца и рака в исследовании 7 стран. Arch Intern Med 1995; 155: 381–6.
- ↵
Rimm EB, Katan MB, Ascerio A, и др. .Связь между приемом флавоноидов и риском ишемической болезни сердца у мужчин-медиков. Энн Интерн Мед 1996; 125: 384–9.
- ↵
Hollman PCH, Vries JHM, Leeuwen SD, и др. . Поглощение пищевых гликозидов кверцетина и квецетина у здоровых добровольцев после илеостомии. Am J Clin Nutr 1995; 62: 1276–82.
McAnlis GT, McEneny J, Pearce J, и др. . Всасывание и антиоксидантные эффекты кверцетина из лука у человека.Eur J Clin Nutr 1999; 53: 92–6.
- ↵
Серафини М., Гизелли А., Ферро-Луцци А. Антиоксидантный эффект зеленого и черного чая у человека in vivo. Eur J Clin Nutr 1996; 50: 28–32.
- ↵
Штейн Дж. Х., Кивил Дж. Г., Вибе Д. А., и др. . Фиолетовый виноградный сок улучшает функцию эндотелия и снижает восприимчивость холестерина ЛПНП к окислению у пациентов с ишемической болезнью сердца. Тираж 1999 г. 100: 1050–5.
- ↵
Day AP, Кемп Х.Дж., Болтон С., и др. . Влияние употребления концентрированного сока красного винограда на антиоксидантную способность сыворотки крови и окисление липопротеинов низкой плотности. Энн Нутр Метаб 1997; 41: 353–7.
- ↵
Shi HL, Noguchi N, Niki E. Сравнительное исследование динамики антиоксидантного действия альфа-токоферилгидрохинона, убихинола и альфа-токоферола против перекисного окисления липидов.Free Radic Biol Med 1999; 27: 334–46.
- ↵
Lass A, Sohal RS. Связанный с электронным транспортом убихинон-зависимый рециклинг альфа-токоферола ингибирует автоокисление митохондриальных мембран. Arch Biochem Biophys 1998; 352: 229–36.
- ↵
Thomas SR, Neuzil J, Stocker R. Добавление кофермента Q предотвращает прооксидантный эффект альфа-токоферола и увеличивает устойчивость ЛПНП к инициированию окисления, зависимого от переходных металлов.Артериосклер Thromb Vasc Biol 1996; 16: 687–96.
- ↵
Левин М., Рамси С.К., Дарувала Р., и др. . Критерии и рекомендации по приему витамина С. JAMA 1999; 281: 1415–23.
- ↵
Левин М. Новые концепции в биологии и биохимии аскорбиновой кислоты. N Engl J Med 1986; 314: 892–902.
- ↵
Джиалал I, Вега ГЛ, Гранди С.М.Физиологические уровни аскорбата подавляют окислительную модификацию липопротеинов низкой плотности. Атеросклероз 1990; 82: 185–91.
- ↵
Пьетри С., Сегин Дж. Р., Дарбиньи П., и др. . Свободный радикал аскорбила — неинвазивный маркер окислительного стресса в хирургии открытого сердца человека. Free Radic Biol Med 1994; 16: 523–8.
- ↵
May JM, Cobb CE, Mendiratta S, et al . Восстановление свободных радикалов аскорбила до аскорбата с помощью тиоредоксинредуктазы.J Biol Chem 1998; 273: 23039–45.
- ↵
May JM, Qu ZC, Whitesell RR, et al . Рециркуляция аскорбата в эритроцитах человека: роль GSH в снижении дегидроаскорбат. Free Radic Biol Med 1996; 20: 543–51.
- ↵
Koshiishi I, Mamura Y, Liu J, и др. . Оценка кислотной депротеинизации для измерения аскорбата и дегидроаскорбат в образцах плазмы.Clin Chem 1998; 44: 863-8.
- ↵
Grootveld M, Halliwell B. Измерение аллантоина и мочевой кислоты в жидкостях человеческого тела. Потенциальный показатель свободнорадикальных реакций in vivo? Biochem J. 1987; 243: 803-8.
- ↵
Cross CE, Reznick AZ, Packer L, и др. . Окислительное повреждение белков плазмы человека озоном. Free Radic Res Commun 1992; 15: 347–52.
- ↵
Эймс Б.Н., Кэткарт Р., Швиерс Э., и др. .Мочевая кислота обеспечивает антиоксидантную защиту человека от старения и рака, вызванного окислителями и радикалами. Proc Natl Acad Sci U S. A, 1981; 78: 6858–62.
- ↵
Frei B, Stocker R, Ames BN. Антиоксидантная защита и перекисное окисление липидов в плазме крови человека. Proc Natl Acad Sci U S A 1988; 85: 9748–52
- ↵
Gopinathan V, Miller NJ, Milner AD, и др. . Антиоксидантная активность билирубина и аскорбата в плазме новорожденных.FEBS Lett 1994; 349: 97–200.
- ↵
Halliwell B. Альбумин — важный внеклеточный антиоксидант? Biochem Pharmacol 1988; 37: 569–71.
- ↵
Stocker R, Frei B. Эндогенная антиоксидантная защита в плазме крови человека. В: Rice-Evans C, ed. Окислительный стресс: оксиданты и антиоксиданты . Лондон: Academic Press, 1991: 213–43.
- ↵
Ху М.Л., Луи С., Кросс CE, и др. .Антиоксидантная защита от хлорноватистой кислоты в плазме крови человека. J Lab Clin Med 1993; 121: 257–62.
- ↵
Ридл А., Шамси З., Андертон М. Различные свойства белков в мембранах могут приводить к антиоксидантному или прооксидантному действию: противоположные эффекты на перекисное окисление липидов алкогольдегидрогеназы и альбумина в липосомальных системах. Редокс Реп 1996; 2: 35-40.
- ↵
Састре Дж., Паллардо Ф.В., Вина Дж.Глутатион, окислительный стресс и старение. Возраст 1996; 19: 129–39.
- ↵
Арриго AP. Экспрессия генов и окислительно-восстановительное состояние тиолов. Free Radic Biol Med 1999; 27: 936–44.
- ↵
Suh J, Zhu BZ, Frei B. Анти- и прооксидантные эффекты аскорбата на железо-опосредованное окислительное повреждение бычьего сывороточного альбумина. Free Radic Biol Med 1999; 27: 305s1.
- ↵
Neuzil J, Thomas SR, Stocker R.Требование, стимулирование или ингибирование альфа-токоферолом радикально-индуцированного инициирования перекисного окисления липопротеинов плазмы. Free Radic Biol Med 1997; 22: 57–71.
- ↵
Атанасиу Р.Л., Стеа Д., Матееску М.А., и др. . Прямое свидетельство антиоксидантных свойств церулоплазмина. Mol Cell Biochem 1998; 189: 127–35.
- ↵
Лю Т., Стерн А., Робертс Л.Дж., и др. . Изопростаны: новые простагландиноподобные продукты перекисного окисления арахидоновой кислоты, катализируемого свободными радикалами.J Biomed Sci 1999; 6: 226–35.
- ↵
Розенфельд, ME. Воспаление, липиды и свободные радикалы: уроки атерогенного процесса. Семин Репрод Эндокринол 1998; 16: 249–61.
- ↵
Hecht SS. Канцерогены табачного дыма и рак легких. J Natl Cancer Inst 1999; 91: 1194–210.
- ↵
Ашок Б.Т., Али Р. Парадокс старения: свободнорадикальная теория старения.Exp Gerontol 1999; 34: 293–303.
- ↵
Witztum JL, Steinberg D. Роль окисленных ЛПНП в атерогенезе. Дж. Клин Инвест, 1991; 88: 1785–92.
- ↵
Witztum JL, Horkko S. Роль окисленных ЛПНП в атерогенезе: иммунологический ответ и антифосфолипидные антитела. Энн Н. Ю. Акад. Наук 1997; 811: 88–99.
- ↵
Heinecke JW. Механизмы окислительного повреждения липопротеидов низкой плотности при атеросклерозе человека.Curr Opin Lipidol 1997; 8: 268–74.
- ↵
Morel DW, DiCorleto PE, Chisholm GM. Эндотелиальные и гладкомышечные клетки изменяют липопротеины низкой плотности in vitro путем свободнорадикального окисления. Артериосклероз 1984; 4: 357–64.
Хенриксен Т., Махони Е.М., Стейнберг Д. Усиленная деградация макрофагами липопротеинов низкой плотности, ранее инкубированных с культивированными эндотелиальными клетками: распознавание рецептором ацетилированных липопротеинов низкой плотности.Proc Natl Acad Sci U S. A. 1981; 78: 6499–503.
- ↵
Фольчик В.А., Нивар-Аристы Р.А., Краевский Л.П., и др. Липоксигеназа способствует окислению липидов в атеросклеротических бляшках человека. J Clin Invest 1995; 96: 504–10.
- ↵
Итабэ Х., Ямамото Х., Иманака Т., и др. . Чувствительное обнаружение окислительно модифицированного липопротеина низкой плотности с использованием моноклональных антител.J. Lipid Res 1996; 37: 45–53.
- ↵
Yla-Herttuala S, Palinski W, Rosenfeld ME, и др. . Доказательства присутствия окислительно модифицированного липопротеина низкой плотности в атеросклеротических поражениях кролика и человека. Дж. Клин Инвест 1989; 84: 1086–95.
- ↵
Регнстром Дж., Нильссон Дж., Торнвалл П., и др. . Восприимчивость к окислению липопротеинов низкой плотности и атеросклерозу коронарных артерий у человека.Lancet 1992; 339: 1183–6.
- ↵
Болл Р.Й., Карпентер К.Л., Митчинсон М.Дж. Какое значение имеет цероид при атеросклерозе человека? Arch Pathol Lab Med 1987; 111: 1134–40.
- ↵
Navab M, Imes S, Hama S, и др. . Трансмиграция моноцитов, индуцированная модификациями ЛПНП в сокультурах клеток стенки аорты человека, происходит из-за индукции синтеза хемотаксического белка I моноцитов и отменяется ЛПВП.Дж. Клин Инвест, 1991; 88: 2039–46.
- ↵
Hessler JR, Робертсон А.Л., Чисолм GM. Цитотоксичность ЛПНП и ее ингибирование ЛПВП в гладких мышцах сосудов человека и культуре эндотелиальных клеток. Атеросклероз 1979; 32: 213.
- ↵
Kugiyama K, Kerns SA, Morrisett JD, и др. . Нарушение эндотелиально-зависимой артериальной релаксации лизолецитином в модифицированных липопротеинах низкой плотности.Nature 1990; 344: 160–2.
- ↵
Salonen JT, Yla-Herttuala S, Yamamoto R, и др. . Аутоантитела против окисленных ЛПНП и прогрессирования атеросклероза сонных артерий. Lancet 1992; 339: 883–7.
- ↵
Bergmark C, Wu R, de Faire U, и др. . У пациентов с ранним началом заболевания периферических сосудов повышен уровень аутоантител к окисленным ЛПНП. Артериосклер Thromb Vasc Biol 1995; 15: 441–5.
- ↵
Либби П., Ханссон Г.К. Участие иммунной системы в атерогенезе человека: современные знания и вопросы, на которые нет ответов. Lab Invest 1991; 64: 5–15.
- ↵
Кита Т., Куме Н., Исии К., и др. . Окисленный ЛПНП и экспрессия молекул адгезии моноцитов. Клиническая практика по лечению диабета, 1999; 45: 123–6.
- ↵
Хуанг Й.Х., Шафер-Элиндер Л., Ву Р., и др. .Лизофосфатидилхолин (LPC) индуцирует провоспалительные цитокины посредством механизма, зависимого от рецептора фактора активации тромбоцитов (PAF). Clin Exp Immunol 1999; 116: 326–31.
- ↵
Волин MS. Взаимодействие оксидантов с сигнальными системами сосудов. Артериосклер Thromb Vasc Biol 2000; 20: 1430–42.
- ↵
Bjorkhem I, Henrikssonfreyschuss A, Breuer O, et al . Антиоксидант бутилированный гидрокситолуол защищает от атеросклероза.Артериосклер Тромб 1991; 11: 15–22.
- ↵
Verlangieri AJ, Буш MJ. Влияние добавок d-альфа-токоферола на экспериментально индуцированный атеросклероз приматов. J Am Coll Nutr 1992; 11: 131–8.
- ↵
Stocker R, Bowry VW, Frei B. Убихинол-10 защищает липопротеины низкой плотности человека более эффективно от перекисного окисления липидов, чем альфа-токоферол. Proc Natl Acad Sci U S A, 1991; 88: 1646–50.
- ↵
Esterbauer H, Puhl H, Dieber-Rotheneder M, и др. . Влияние антиоксидантов на окислительную модификацию ЛПНП. Энн Мед 1991; 23: 573–81.
- ↵
Reaven PD, Khouw A, Beltz WF, и др. . Влияние диетических комбинаций антиоксидантов на человека. Защита ЛПНП витамином Е, но не бета-каротином. Артериосклер Тромб 1993; 13: 590–600.
Гей К.Г., Пуска П., Иордания П., и др. .Обратная корреляция между витамином Е и смертностью от ишемической болезни сердца в кросс-культурной эпидемиологии. Am J Clin Nutr 1991; 53: S326–34.
Riemersma RA, Wood DA, MacIntyre CCA, и др. . Риск стенокардии и концентрации в плазме витаминов A, C и E и каротина. Ланцет 1991; 337: 1–5.
- ↵
Salonen JT, Salonen R, Seppanen K, et al .Связь сывороточного селена и антиоксидантов с липопротеинами плазмы, агрегация тромбоцитов и распространенная ишемическая болезнь сердца у мужчин восточной Финляндии. Атеросклероз 1988; 70: 155–60.
- ↵
Rimm EB, Stampfer MJ, Ascherio A, и др. . Потребление витамина Е и риск ишемической болезни сердца у мужчин. N Engl J Med 1993; 328: 1450–6.
- ↵
Stampfer MJ, Hennekens CH, Manson JE, et al .Потребление витамина Е и риск ишемической болезни сердца у женщин. N Engl J Med 1993; 328: 1444–9.
- ↵
Enstrom JE, Kanim LE, Klein MA. Потребление витамина С и смертность среди выборки населения США. Эпидемиология 1992; 3: 194–202.
- ↵
Нюссонен К., Парвиайнен М.Т., Салонен Р., и др. . Дефицит витамина С и риск инфаркта миокарда: проспективное популяционное исследование мужчин из восточной Финляндии.BMJ 1997; 314: 634–8.
- ↵
Gaziano JM, Hennekens CH. Роль бета-каротина в профилактике сердечно-сосудистых заболеваний. Энн Н. Ю. Акад. Наук 1993; 691: 148–55.
- ↵
Альфа-токоферол, Исследовательская группа по профилактике рака бета-каротина. Влияние витамина Е и бета-каротина на заболеваемость раком легких и другими видами рака у курящих мужчин. N Engl J Med 1994; 330: 1029–35.
- ↵
Rapola JM, Virtamo J, Ripatti S, и др. .Рандомизированное испытание добавок альфа-токоферола и бета-каротина по частоте серьезных коронарных событий у мужчин с перенесенным инфарктом миокарда. Ланцет 1997; 349: 1715–20.
- ↵
Blot WJ, Li JY, Taylor PR, и др. . Испытания диетических вмешательств в Линьсяне, Китай: добавление определенных комбинаций витаминов / минералов, заболеваемость раком и смертность от конкретных болезней среди населения в целом. J Natl Cancer Inst 1993; 85: 1483–92.
- ↵
Omenn GS, Goodman GE, Thornquist MD, и др. . Влияние комбинации бета-каротина и витамина А на рак легких и сердечно-сосудистые заболевания. N Engl J Med 1996; 334: 1150–5.
- ↵
Hennekens CH, Buring JE, Manson JE, et al . Отсутствие эффекта длительного приема бета-каротина на частоту злокачественных новообразований и сердечно-сосудистых заболеваний.N Engl J Med 1996; 334: 1145–9.
- ↵
Гринберг Э. Р., Барон Дж. А., Карагас М. Р., и др. . Смертность связана с низкой концентрацией бета-каротина в плазме и действием пероральных добавок. JAMA 1996; 275: 699–703.
- ↵
Hodis HN, Mack WJ, LaBrec L, и др. . Серийные коронарные ангиографические доказательства того, что прием витаминов-антиоксидантов снижает прогрессирование атеросклероза коронарных артерий.JAMA 1995; 273: 1849–54.
- ↵
Сингх Р. Б., Ниаз М. А., Растоги С. С., и др. . Полезность витаминов-антиоксидантов при подозрении на острый инфаркт миокарда. Am J Cardiol 1996; 77: 232–6.
- ↵
Стивенс Н.Г., Парсонс А., Скофилд П.М., и др. . Рандомизированное контролируемое исследование витамина Е у пациентов с ишемической болезнью сердца: Кембриджское исследование сердечных антиоксидантов (CHAOS). Lancet 1996; 347: 781–6.
- ↵
Valagussa F, Franzosi MG, Geraci E, et al . Пищевые добавки с n-3 полиненасыщенными жирными кислотами и витамином E после инфаркта миокарда: результаты исследования GISSI-Prevenzione. Ланцет 1999; 354: 447–55.
- ↵
Юсуф С., Фил Д., Дагенаис Г., и др. . Добавки витамина Е и сердечно-сосудистые события у пациентов из группы высокого риска. N Engl J Med 2000; 342: 154–60.
- ↵
Слэттери М.Л., Джейкобс Д.Р., Дайер А., и др. . Диетические антиоксиданты и липиды плазмы: исследование CARDIA. J Am Coll Nutr 1995; 14: 635–42.
- ↵
Валконен М., Кууси Т. Пассивное курение вызывает атерогенные изменения липопротеинов низкой плотности. Тираж 1998; 97: 2012–16.
Глава 9. Витамин E
Глава 9. Витамин EРезюме роли витамина Е в метаболические процессы человека
Определение групп риска дефицит витамина E
Определение источников питания и возможные ограничения его доступности во всем мире
Резюме доказательств для определения рекомендуемое потребление питательных веществ
Будущие исследования
Ссылки
Резюме роли витамина Е в метаболические процессы человека
Большое количество научных данных указывает на то, что реактивная свободные радикалы участвуют во многих заболеваниях, включая болезни сердца и рак ( 1 ).Клетки содержат множество потенциально окисляемых субстратов, таких как полиненасыщенные жирные кислоты (ПНЖК), белки и ДНК. Следовательно, сложный система антиоксидантной защиты обычно защищает клетки от повреждающего воздействия эндогенно продуцируемые свободные радикалы, а также из видов экзогенного происхождения такие как сигаретный дым и загрязняющие вещества. Если наше воздействие свободных радикалов превышают защитную способность системы антиоксидантной защиты, явление часто называют окислительным стрессом ( 2 ), затем повреждение биологического молекулы могут встречаться.Существует множество доказательств того, что болезнь вызывает усиление окислительного стресса; поэтому потребление продуктов, богатых антиоксиданты, которые потенциально способны погасить или нейтрализовать избыток радикалы, могут играть важную роль в изменении развития таких болезни.
Витамин Е является основным жирорастворимым антиоксидантом в клетке. система антиоксидантной защиты и получается исключительно с пищей. Термин «Витамин Е» относится к семейству из восьми встречающихся в природе гомологов. которые синтезируются растениями из гомогентизиновой кислоты.Все являются производными от 6-хроманол и различаются количеством и положением метильных групп на кольце. состав. Четыре гомолога токоферола ( d- a-, d- b-, d- g- и d- d-) имеют насыщенную 16-углеродную фитильную боковую цепь, тогда как гомологи токотриенолов ( d- a-, d- b-, d- g- и d- d-) имеют три двойные связи на боковой цепи. Существует также широко доступный синтетический форма, дл -a-токоферол, полученная сочетанием триметилгидрохинон с изофитолом.Он состоит из смеси восьми стереоизомеры в примерно равных количествах; эти изомеры дифференцированы вращениями фитильной цепи в разных направлениях, которые не происходят естественно. В диетических целях активность витамина Е выражается в виде альфа-токоферола. эквиваленты (a-TE). Один a-TE — это активность 1 мг RRR -a-токоферол ( d -a-токоферол). Чтобы оценить a-TE смешанной диеты содержащих натуральные формы витамина Е, количество миллиграммов b-токоферола следует умножить на 0.5, g-токоферол на 0,1 и a-токотриенол на 0,3. Любой из синтетический all- rac -a-токоферол ( дл -a-токоферол) следует умножить на 0,74. Один миллиграмм последнего соединения в ацетатной форме эквивалентен 1 МЕ витамина E.
Витамин E является примером фенольного антиоксиданта. Такой молекулы легко отдают водород из гидроксильной (-ОН) группы кольца структура к свободным радикалам, которые затем становятся инертными. О пожертвовании водорода, само фенольное соединение становится относительно инертным, свободным радикал, потому что неспаренный электрон на атоме кислорода обычно делокализован в ароматическую кольцевую структуру, тем самым повышая ее стабильность ( 3 ).
Основная биологическая роль витамина Е заключается в защите ПНЖК и другие компоненты клеточных мембран и липопротеиды низкой плотности (ЛПНП) из окисление свободными радикалами. Витамин Е находится в основном в фосфолипидный бислой клеточных мембран. Он особенно эффективен при предотвращение перекисного окисления липидов, ряда химических реакций с участием окислительное разрушение ПНЖК. Повышенный уровень продуктов перекисного окисления липидов связаны с многочисленными заболеваниями и клиническими состояниями ( 4 ).Хотя витамин Е в основном находится в мембранах клеток и органелл, где он может оказывать максимальное защитное действие, его концентрация может быть только одной молекула на каждые 2000 молекул фосфолипидов. Это говорит о том, что после его реакция со свободными радикалами быстро регенерируется, возможно, другими антиоксиданты (5).
Всасывание витамина Е из кишечника зависит от адекватного функция поджелудочной железы, секреция желчевыводящих путей и образование мицелл. Условия для абсорбция аналогична таковой для пищевых липидов, то есть эффективное эмульгирование, солюбилизация в смешанных мицеллах желчных солей, поглощение энтероцитами и секреция в кровоток через лимфатическую систему ( 6 ).Эмульгирование происходит сначала в желудке, а затем в мелких кишечник при наличии секреции поджелудочной железы и желчных путей. Результирующий смешанная мицелла агрегирует молекулы витамина Е, растворяет витамин Е и затем переносит его к мембране щеточной каймы энтероцита, вероятно, за счет пассивная диффузия. Внутри энтероцита токоферол включается в хиломикроны и секретируются во внутриклеточное пространство и лимфатическую систему и впоследствии в кровоток.Эфиры токоферола, присутствующие в переработанных продукты и витаминные добавки должны быть гидролизованы в тонком кишечнике перед абсорбция.
Витамин Е транспортируется в крови плазмой липопротеины и эритроциты. Хиломикроны переносят токоферол из энтероцита в печень, где они включаются в паренхимные клетки как хиломикрон остатки. Катаболизм хиломикронов происходит в большом круге кровообращения. за счет действия клеточной липопротеидной липазы.Во время этого процесса токоферол может переходить в липопротеины высокой плотности (ЛПВП). В токоферол в ЛПВП может передаваться другим циркулирующим липопротеинам, таким как ЛПНП. и липопротеины очень низкой плотности (ЛПОНП) ( 7 ). Во время преобразования ЛПОНП в ЛПНП в кровотоке, некоторое количество альфа-токоферола остается в основных липидах и, таким образом, включается в состав ЛПНП. Затем большая часть альфа-токоферола попадает в клетки периферические ткани в интактном липопротеине через рецептор ЛПНП пути, хотя некоторые из них могут быть захвачены сайтами связывания с мембраной, распознающими аполипопротеины A-I и A-II присутствуют на ЛПВП ( 8 ).
Хотя процесс абсорбции всего токоферола гомологи в нашем питании аналогичны, форма α преобладает в крови и тканях. Это связано с действием связывающих белков, которые предпочтительно выбирают форма над другими. В первом случае связывающий белок массой 30 кДа, уникальный для цитоплазма печени преимущественно включает альфа-токоферол в формирующиеся ЛПОНП ( 9 ). Эта форма также накапливается в непеченочных тканях, особенно в мест, где производство свободных радикалов наиболее велико, например, в мембранах митохондрии и эндоплазматический ретикулум в сердце и легких ( 10 ).
Печеночный внутриклеточный транспорт может быть ускорен на 14,2 кДа связывающий белок, который связывает альфа-токоферол в большей степени, чем другие гомологи ( 11 ). Другие белковые участки с очевидным связыванием токоферола способности были обнаружены на эритроцитах, мембранах надпочечников и гладких мышцах ячеек ( 12 ). Они могут служить рецепторами витамина Е, которые ориентируют молекула внутри мембраны для оптимальной антиоксидантной функции.
Эти селективные механизмы объясняют, почему гомологи витамина Е обладают заметно различающимися антиоксидантными способностями в биологических системах и иллюстрирует важное различие между антиоксидантом in vitro и эффективность вещества в стабилизации, например, пищи продукт и его активность in vivo как антиоксидант.Из пищевого В перспективе наиболее важной формой витамина Е является альфа-токоферол; это подтверждено тестами биопотентности на животных моделях, которые оценивают способность различные гомологи для предотвращения абсорбции плода и мышечных дистрофий ( Таблица 22 ).
Концентрации витамина Е в плазме мало различаются в широком диапазоне диетических приемов. Даже ежедневные добавки порядка 1600 МЕ / день на 3 человека. недель только повышение уровня в плазме в 2-3 раза и при прекращении лечения уровни в плазме вернулись к уровням до лечения через 5 дней ( 13 ).Так же, концентрация в тканях увеличивается только на аналогичную величину, когда пациенты перенесшие операцию на сердце получали 300 мг / день природного стереоизомера в течение 2 недель до операции ( 14 ). Кинетические исследования с дейтерированным токоферолом ( 15 ) предполагают быстрое уравновешивание нового токоферола в эритроциты, печень и селезенка, но этот оборот в других тканях, таких как сердце, мышцы и жировая ткань работают намного медленнее. Мозг заметно устойчив к истощению и восполнению витамином Е ( 16 ).Это предположительно отражает адаптивный механизм, позволяющий избежать вредных окислительных реакций в этом ключевой орган.
Первичным продуктом окисления альфа-токоферола является токоферилхинон, который может быть конъюгированы с получением глюкуроната после предварительного восстановления до гидрохинона. Он выводится с желчью или далее разлагается в почках до альфа-токофероновой кислоты и, следовательно, выводится с желчью. Те гомологи витамина E, которые не выбираются предпочтительно печеночными связывающими белками выводятся в процессе зарождающейся секреции ЛПОНП в печени и вероятно выводится с желчью ( 17 ).Некоторое количество витамина Е также может выводиться из организма. через кожные сальные железы ( 18 ).
Таблица 22
Приблизительная биологическая активность встречающихся в природе токоферолы и токотриенолы по сравнению с d- α-токоферол
Общее название | Биологическая активность по сравнению с d-a-токоферолом,% |
d -a-токоферол | 100 |
d -b-токоферол | 50 |
d -g-токоферол | 10 |
d -d-токоферол | 3 |
d -a-токотриенол | 30 |
d -b-токотриенол | 5 |
d -г-токотриенол | неизвестно |
d -d-токотриенол | неизвестно |
Определение групп риска дефицит витамина E
Есть много признаков дефицита витамина E у животных, в основном из которых связаны с повреждением клеточных мембран и утечкой содержимого клеток в внешние жидкости.Нарушения, вызванные, например, следами перекисных ПНЖК. в рационах животных с низким статусом витамина Е присутствуют сердечные или скелетные миопатии, невропатии и некроз печени ( 19 ) ( Таблица 23 ). Мышечные и неврологические проблемы также являются следствием человеческого дефицит витамина Е ( 20 ). Ранние диагностические признаки дефицита включают: утечка мышечных ферментов, таких как креатинкиназа и пируваткиназа, в в плазме, повышенный уровень продуктов перекисного окисления липидов в плазме и повышенный гемолиз эритроцитов.
Оценка потребности человека в витамине Е осложняется нечастым появлением клинических признаков дефицита, потому что они обычно развиваются только у взрослых с синдромами мальабсорбции жира или печени. болезнь у людей с генетическими аномалиями в транспортных или связывающих белках, и, возможно, у недоношенных детей ( 19, 21 ). Это говорит о том, что диеты содержат достаточно витамина Е для удовлетворения потребностей в питании.
Несколько моделей животных ( 22 ) предполагают, что увеличение прием витамина Е подавляет прогрессирование сосудистых заболеваний, предотвращая окисление ЛПНП.Данные свидетельствуют о том, что окисленный липопротеин является ключевым событием. в развитии атероматозной бляшки, которая в конечном итоге может закупорить кровеносный сосуд ( 23 ).
Таблица 23
Заболевания и синдромы у животных, связанные с витамином Е дефицит и избыточное потребление полиненасыщенных жирных кислот
Синдром | Пораженный орган или ткань | Виды |
Энцефаломаляция | Мозжечок | Цыпленок |
Экссудативный диатез | Сосудистые | Турция |
Микроцитарная анемия | Кровь, костный мозг | Цыпленок |
Макроцитарная анемия | Кровь, костный мозг | Обезьяна |
Фиброз поджелудочной железы | Поджелудочная железа | Цыпленок, мышь |
Некроз печени | Печень | Свинья, крыса |
Мышечная дегенерация | Скелетная мышца | Свинья, крыса, мышь |
Микроангиопатия | Сердечная мышца | Свинья, баранина, теленок |
Дегенерация почек | Канальцы почек | Обезьяна, крыса |
Стеатит | Жировая ткань | Свинья, цыпленок |
Дегенерация яичка | Тесты | Свинья, теленок, цыпленок |
Злокачественная гипертермия | Скелетная мышца | Свинья |
Исследования на людях, однако, были менее последовательными в обеспечении доказательства роли витамина Е в предотвращении сердечных заболеваний.Витамин Е добавки снижают ex vivo окисляемость ЛПНП плазмы, но нет корреляция между ex vivo липопротеинов окисляемостью и эндогенными Уровни витамина Е в популяции без добавок ( 24 ). Точно так же немногие рандомизированные двойные слепые плацебо-контролируемые интервенционные исследования с участием людей добровольцев, которые сосредоточили внимание на взаимосвязи между витамином Е и сердечно-сосудистые заболевания дали противоречивые результаты. Был отмечен снижение нефатального инфаркта миокарда у пациентов с коронарной артерией заболевание (как определено ангиограммой), которым случайным образом назначали фармакологические дозы витамина Е (400 и 800 мг / день) или плацебо в Кембриджское исследование сердечных антиоксидантов с участием 2000 мужчин и женщин ( 25 ).Однако частота серьезных коронарных событий у курящих мужчин, получивших 20 мг / день витамина Е в течение примерно 6 лет не снижалось в Альфа-токоферол, исследование бета-каротина ( 26 ).
Эпидемиологические исследования показывают, что диетический витамин Е влияет на риск сердечно-сосудистых заболеваний. Гей и др. . ( 27 ) сообщили, что стандартизованные по липидам концентрации витамина Е в плазме у людей среднего возраста мужчин из 16 европейских стран предсказали 62 процента дисперсии смертность от ишемической болезни сердца.В Соединенных Штатах медсестры Исследование здоровья ( 28 ) с участием 87000 женщин за 8-летний период наблюдения и Последующее исследование медицинских работников с участием 40000 мужчин ( 29 ) пришло к выводу, что лица, принимающие добавки витамина Е в дозе 100 мг / день или более в течение как минимум 2-х лет было примерно на 40 процентов ниже заболеваемости инфарктом миокарда и смертность от сердечно-сосудистых заболеваний, чем у тех, кто не принимал добавки. Однако в исследованиях, проведенных в США, не было влияния одного витамина Е в рационе частота сердечно-сосудистых заболеваний после отмены приема добавок из анализов.Возможное объяснение значимых отношений между диетическим витамином Е и сердечно-сосудистыми заболеваниями в европейских странах, но не в Соединенных Штатах могут быть найдены в самых разных источниках витамина E в европейских странах. Сообщается, что подсолнечное масло, богатое в a-токофероле, как правило, более широко потребляется в южноевропейских страны с более низким риском сердечно-сосудистых заболеваний, чем в североевропейских страны, в которых соевое масло, содержащее больше g-формы, является предпочтительным ( 30 ) ( Таблица 24 ).Однако проведенное исследование, которое сравнивали концентрации a- и g-токоферола в плазме у мужчин и женщин среднего возраста в Тулузе (юг Франции) с Белфастом (Северная Ирландия) обнаружили, что концентрации g-токоферола в Белфасте были вдвое выше, чем в Тулуза; Концентрации альфа-токоферола были идентичны у мужчин в обеих странах. но выше у женщин в Белфасте, чем в Тулузе ( P <0,001) ( 31 ).
Таблица 24
Межстрановые корреляции между ишемической болезнью сердца смертность среди мужчин и снабжение гомологами витамина Е в 24 европейских странах. страны
Гомолог | Коэффициент корреляции, r |
Всего витамина Е | -0.386 |
d -a-токоферол | -0,753 |
d -b-токоферол | -0,345 |
d -g-токоферол | -0,001 |
d -d-токоферол | 0.098 |
d -a-токотриенол | -0,072 |
d -b-токотриенол | -0,329 |
d -г-токотриенол | -0,210 |
Корреляция с d -a-токоферолом очень значима ( P <0.001) тогда как все другие корреляции не достигают статистических значимость.
Источник: на основании ссылки 30 .
Также предлагались добавки витамина Е (200-400 мг / день) может быть подходящим терапевтическим средством для смягчения некоторых аспектов дегенеративные заболевания, такие как болезнь Паркинсона, уменьшают тяжесть неврологические расстройства, такие как поздняя дискинезия, предотвращают перивентрикулярную кровотечения у недоношенных детей, уменьшают повреждение тканей, вызванное ишемией, и реперфузия во время операции, задержка развития катаракты и улучшение подвижности в больные артритом ( 32 ).Однако очень высокие дозы также могут вызывать неблагоприятные прооксидантные эффекты ( 33 ) и долгосрочные преимущества таких лечение не было доказано.
Определение источников питания и возможные ограничения его доступности во всем мире
Поскольку витамин Е естественным образом присутствует в растительных диетах и продукты животного происхождения и часто добавляются производителями в растительные масла и обработанных пищевых продуктов, потребление, вероятно, будет достаточным, чтобы избежать явного дефицита большинства ситуации.Исключения могут быть при экологических катастрофах и культурных конфликтах. что привело к нехватке пищи и голоду.
Анализ Продовольственной и сельскохозяйственной организации Продовольственные балансы стран Организации Объединенных Наций показывают, что около половины альфа-токоферол в типичной диете североевропейских стран, например, в Соединенном Королевстве производится из растительных масел ( 30 ). Животные жиры, овощи и мясо каждая из них составляет около 10 процентов от общего предложения на душу населения и фрукты, орехи, злаки и молочные продукты составляют около 4 процентов.Меньше более 2 процентов получают из яиц, рыбы и бобовых.
Существуют заметные различия в содержании альфа-токоферола на душу населения поставки в разные страны от 8-10 мг на душу населения в день. (например, Исландия, Финляндия, Новая Зеландия и Япония) до 20-25 мг / голову / день (например, Франция, Греция и Испания) ( 30 ). Этот вариант можно отнести в основном к тип и количество диетических масел, используемых в разных странах и соотношение различных гомологов в маслах ( Таблица 25 ).Для Например, подсолнечное масло содержит примерно 55 мг альфа-токоферола / 100 г в отличие от соевого масла, которое содержит всего 8 мг / 100 мл ( 34 ). Расход этих масел заметно различается. между странами. Соя, богатый источник менее биологически активной формы g, чаще всего используется в северной Европе. страны, в то время как подсолнечное масло, которое в основном содержит форму a, обычно используется в южной Европе ( 30 ).
Таблица 25
Содержание витамина Е (мг токоферола / 100 г) в овощах масла
Масло | альфа-токоферол | г-токоферол | d-токоферол | атокотриенол |
Кокосовый орех | 0.5 | 0 | 0,6 | 0,5 |
Кукуруза (Кукуруза) | 11,2 | 60,2 | 1,8 | 0 |
Пальма | 25.6 | 31,6 | 7,0 | 14,3 |
оливковое | 5,1 | След | 0 | 0 |
Арахис | 13.0 | 21,4 | 2,1 | 0 |
Соя | 10,1 | 59,3 | 26,4 | 0 |
Ростки пшеницы | 133.0 | 26,0 | 27,1 | 2,6 |
Подсолнечник | 48,7 | 5,1 | 0,8 | 0 |
Источник: Slover HT, 1971. (34)
Резюме доказательств для определения рекомендуемое потребление питательных веществ
В главе об антиоксидантах было решено, что недостаточно доказательств, позволяющих обосновать рекомендуемое потребление питательных веществ (RNI) о дополнительных преимуществах для здоровья, получаемых от потребления питательных веществ сверх обычно содержится в диете.Даже для витамина Е с его важным биологическим антиоксидантными свойствами, не было убедительных доказательств защиты от хроническое заболевание от БАД. Тем не менее, основная функция витамин Е, по-видимому, предотвращает окисление ПНЖК, и это было используются органами, предлагающими РНИ для витамина Е, потому что существует значительный доказательства того, что низкий уровень витамина Е и избыток ПНЖК у разных видов животных появляются самые разные клинические признаки.
Имеется очень мало клинических данных о дефиците у людей, за исключением некоторых наследственных состояний, когда метаболизм витамина E обеспокоен. Даже биохимические доказательства плохого статуса витамина Е в обоих взрослые и дети минимальны. Мета-анализ данных, собранных в Европе стран указывает, что оптимальное потребление может подразумеваться при концентрации витамина Е превышают 25-30 ммоль / л стандартизованного по липидам а-токоферол ( 35 ).Однако к такому подходу следует относиться осторожно, поскольку концентрации витамина Е в плазме не обязательно отражают потребление или ткани резервы, потому что только 1 процент токоферола в организме может находиться в крови ( 36 ), а количество в обращении сильно зависит от циркулирующий липид ( 37 ). Тем не менее, стандартизованный по липидам витамин Е концентрация (например, отношение токоферол-холестерин) больше 2,25 (рассчитано как ммоль / ммоль) считается, что это соответствует удовлетворительному статусу витамина Е ( 36, 37 ).В эритроциты субъектов со значениями ниже этой концентрации витамина E могут демонстрируют возрастающую тенденцию к гемолизу при воздействии окислительного агентов, и, следовательно, такие значения следует рассматривать как показатель биохимического дефицит ( 38 ). Однако развитие клинических данных о витамине Дефицит E (например, повреждение мышц или неврологические поражения) может занять несколько лет. воздействия чрезвычайно низкого уровня витамина Е ( 39 ).
Основной фактор, используемый для оценки достаточности витамина Е консультативными органами США и Великобритании было потребление ПНЖК с пищей. ПНЖК очень восприимчивы к окислению, и их повышенное потребление без сопутствующее повышение уровня витамина E может привести к снижению уровня витамина E в плазме концентрации ( 40 ) и повышения некоторых индексов окислительного повреждения у людей-добровольцев ( 41 ). Однако в целом диеты с высоким содержанием ПНЖК также с высоким содержанием витамина E, и установить диетические рекомендации, основанные на крайних значениях Потребление ПНЖК будет значительно отклоняться от среднего потребления витамина Е в большинстве Западное население.Отсюда «безопасные» надбавки для Соединенного Королевства (мужчины 10 и женщины 7 мг / день) ( 42 ) и «произвольные» надбавки на Соединенные Штаты (мужчины 10 и женщины 8 мг / день) ( 43 ) для приема витамина Е приблизить средний уровень потребления в этих странах. Стоит отметить, что там были только 11 (0,7 процента) субъектов из 1629 взрослых в британском периоде 1986-1987 гг. Исследование питания, у кого был альфа-токоферол — холестерин коэффициенты <2,25. Кроме того, хотя высокое потребление соевого масла с его высокое содержание заменителей g-токоферола для потребление a-токоферола в британской диете, a сравнение найденных соотношений альфа-токоферол-холестерин почти идентичные результаты в двух случайно выбранных группах взрослых среднего возраста в Белфасте (Северная Ирландия) и Тулузе (Франция), двух странах с очень различное потребление a-токоферола ( 34 ) и сердечно-сосудистый риск ( 31 ).
Предполагается, что когда основными ПНЖК в рационе являются линолевая кислота, соотношение α-токоферол-ПНЖК d 0,4 (выражается в мг токоферола на г ПНЖК) достаточно для взрослых людей. ( 44, 45 ), и это соотношение рекомендовано в Соединенном Королевстве для детские смеси ( 46 ). Использование этого соотношения для расчета витамина Е потребности мужчин и женщин при потреблении энергии 2550 и 1940 ккал / день содержат ПНЖК на уровне 6 процентов от потребляемой энергии (примерно 17 и 13 г, соответственно) ( 42 ) давали значения a-TE, равные 7 и 5 мг / день, соответственно.И в Соединенных Штатах, и в Соединенное Королевство, среднее потребление a-TE составляет превышение этих количеств и соотношение α-токоферол-ПНЖК составляет примерно 0,6 ( 47 ), что значительно превышает коэффициент 0,4, который считается адекватный. Рабочая группа по питанию Международной ассоциации наук о жизни Институт Европы ( 48 ) предложил потребление 12 мг альфа-токоферола для ежедневного приема 14 г ПНЖК для компенсировать высокое потребление соевого масла в некоторых странах, где 50 процентов потребления витамина Е приходится на менее биологически активные г форма.Однако, как указано выше, концентрации в плазме крови во Франции и Северная Ирландия предполагает, что повышенное количество диетического витамина Е не необходимо для поддержания удовлетворительной концентрации в плазме ( 31 ).
В настоящее время данных недостаточно для формулировки рекомендации по приему витамина Е для разных возрастных групп, кроме младенчество. Есть некоторые признаки того, что новорожденные, особенно если они родились преждевременно, подвержены окислительному стрессу из-за нехватки запасов в организме витамин Е, нарушение всасывания и снижение транспортной способности в результате низкие концентрации циркулирующих липопротеидов низкой плотности при рождении ( 49 ).Однако доношенные дети почти достигают концентрации витамина Е в плазме взрослого человека в первая неделя ( 50 ) и хотя концентрация витамина Е в начале грудное молоко может быть различным, через 12 дней оно остается довольно постоянным и составляет 0,32 мг. TE / 100 мл молока (51). Таким образом, ребенок, вскармливаемый грудным молоком, потребляющий 850 мл, будет иметь прием 2,7 мг. Кажется разумным, что молочная смесь не должна содержать меньше менее 0,3 мг ТЕ / 100 мл восстановленного корма и не менее 0.4 мг TE / г ПНЖК.
Нет особых рекомендаций относительно витамина Е требования в отношении беременности и кормления грудью были сделаны другими консультативными органами ( 42, 43 ) в основном потому, что нет доказательств потребности в витамине Е отличается от таковых у других взрослых и, предположительно, также как повышенная энергия потребление компенсирует повышенные потребности в росте младенца и молоке синтез.
Витамин Е обладает очень низкой токсичностью, и количество 100-200 мг синтетического all- rac -a-токоферола широко потребляются в виде приложения ( 28, 29 ).Доказательства прооксидантного повреждения были связаны при кормлении добавками, но обычно только в очень высоких дозах (например, > 1000 мг / день) ( 33 ).
Будущие исследования
Необходимы дополнительные исследования роли витамина Е в биологические процессы, которые не обязательно связаны с его антиоксидантной функцией. Эти процессы включают:
- структурные роли в поддержании целостности клеточной мембраны;
- противовоспалительные эффекты за счет прямого и регулирующего взаимодействия с простагландинсинтетазный комплекс ферментов, участвующих в метаболизме арахидоновой кислоты;
- синтез ДНК;
- стимуляция иммунного ответа; и
- регуляция межклеточной передачи сигналов и пролиферации клеток посредством модуляции протеинкиназы-C.
Точно так же требуется дополнительное расследование в связи с растущими доказательствами того, что Статус витамина Е может повысить восприимчивость к инфекции, особенно если геномы некоторых относительно доброкачественных вирусов для преобразования в более вирулентные штаммы ( 52 ).
Существует важная потребность в определении оптимального уровня витамина Е поступления. Интервенционные испытания с конечными точками заболеваемости и смертности могут занять лет на завершение.Один из способов обойти эту задержку может заключаться в оценке влияние различных приемов витамина Е на биомаркеры окислительного повреждения липиды, белки и ДНК, потому что их наличие in vivo причастно при многих заболеваниях, включая сосудистые заболевания и некоторые виды рака.
Каталожные номера
1. Diplock, A.T. 1994. Антиоксиданты и болезни. профилактика. Моль. Аспект Мед., 15: 293-376.
2. Сис, Х. 1993. Окислительный стресс: введение. В кн .: Окислительный стресс; Окислители и антиоксиданты. Sies, H., ed. п. 15-22. Лондон, Академическая пресса.
3. Скотт, G. 1997. Антиоксиданты в науке, технике, медицина и питание. Чичестер, издательство «Альбион».
4. Duthie, G.G. 1993. Перекисное окисление липидов. евро. Дж. Clin. Nutr., 47: 759-764.
5. Каган В.Е. 1998 г. Переработка и окислительно-восстановительный цикл фенольные антиоксиданты. Ann. NY Acad. Sci., 854: 425-434.
6. Галло-Торрес, H.E. 1970. Обязательная роль желчи для кишечное всасывание витамина Е. Lipids, 5: 379-384.
7. Трабер, М.Г., Бертон, Г.В., Ингольд, К.У. И Кайден, H.J. 1990. RRR- и SRR-a-токоферолы секретируются без дискриминации в Хиломикроны человека, но RRR-a-токоферол предпочтительно секретируется в очень низких липопротеиды плотности. J. Lip.Res., 31: 675-685.
8. Трабер, М., Г. 1996. Регулирование плазмы человека витамин Е. В: Антиоксиданты в механизмах болезни и терапевтических стратегиях. Sies, H., ed. с.49-63. Сан-Диего, Academic Press.
9. Трабер, М.Г. & Kayden, H.J. 1989. Льготный включение альфа-токоферола по сравнению с гамма-токоферолом в липопротеины человека. Am. Дж. Clin. Nutr., , 49: 517-526.
10. Kornbrust, D.J. И Мавис, Р.D. 1979. Родственник. восприимчивость микросом из легких, сердца, печени, почек, головного мозга и яичек к перекисному окислению липидов: корреляция с содержанием витамина Е. Липиды , 15: 315-322.
11. Датта-Рой, А.К., Гордон, М.Дж., Лейшман, Д.Дж., Патерсон, Б.Дж., Дати, Г.Г. И Джеймс, W.P.T. 1993. Очищение и частичное характеристика альфа-токоферол-связывающего белка из цитозоля сердца кролика. Мол. Cell., 123: 139-144.
12. Датта-Рой, А.К., Гордон, М.Дж., Кэмпбелл, Ф.М., Дати, Г.Г. И Джеймс, W.P.T. 1994. Потребности в витамине Е, транспортировка и метаболизм: роль альфа-токоферол-связывающих белков. J. Nutr. Biochem. , 5: 562-570.
13. Esterbauer, H., Gebicki, J., Puhl, H. & Jurgens, G. 1992. Роль перекисного окисления липидов и антиоксидантов в окислительной модификация ЛПНП. Free Radic. Биол. Med., 13: 341-390.
14. Mickle, D.A.G., Weisel, R.D., Burton, G.W. & Ингольд, К.У. 1991. Дефект перорального введения a-токоферола ацетата на Уровни альфа-токоферола в миокарде человека. Cardiovas Drugs Ther. , 5: 309-312.
15. Трабер, М.Г., Рамакришнан, Р. и Кайден, Х.Дж. 1994. Кинетика витамина Е в плазме человека демонстрирует быструю переработку плазмы. RRR-a-токоферол. Proc. Natl. Акад. Sci. США, 91: 10005-10008.
16.Bourne, J. & Clement, M. 1991. Кинетика крысы. Истощение содержания альфа-токоферола в периферических нервах, переднем мозге и мозжечке: сравнение с разными органами. J. Nutr. 121: 1204-1207.
17. Drevon, C.A. 1991. Поглощение, транспортировка и метаболизм витамина Е. Free Radic. Res. Commun., 14: 229-246.
18. Shiratori, T. 1974. Поглощение, хранение и выведение 3H-альфа-токоферола, связанного с хиломикром, через кожу крысы. Жизнь Sci., 14: 929-935.
19. Макларен, Д.С., Ловеридж, Н., Дати, Г.Г. & Bolton-Smith, C. 1993. Жирорастворимые витамины В: Питание человека и диетология, Гарроу, Дж. С., Джеймс, В. П. Т., ред. п. 208-238. Лондон, Черчилль Ливингстон Пресс.
20. Сокол, Р.Дж. 1988. Дефицит витамина Е и неврологическое заболевание. Ann. Rev. Nutr., 8: 351-373.
21. Трабер М.Г., Сокол Р.Дж., Бертон Г.W., Ingold, K.U., Papas, A.M., Huffaker, J.E. & Kayden, H.J. 1990. Нарушение способности пациенты с семейным изолированным дефицитом витамина E для включения альфа-токоферола в липопротеины, секретируемые печенью. J. Clin. Инвест., 85: 397-407.
22. Williams, R.J., Motteram, J.M. & Sharp, C.H. 1992. Диетический витамин Е и замедление раннего развития поражений в модифицированные кролики Ваттанабе. Атеросклероз, 94: 153-159.
23. Steinberg, D., Parthasarthy, S., Carew, T.E., Khoo, J.C. & Witztum, J.L. 1989. Помимо холестерина. Модификации липопротеиды низкой плотности, повышающие его атерогенность. N. Engl. J. Med., 320: 915-924.
24. Dieber-Rotheneder, M., Puhl, H., Waeg, G., Striegl, G. & Esterbauer, H. 1991. Эффект перорального приема D-a-токоферол на содержание витамина E в липопротеинах низкой плотности человека и стойкость к окислению. J. Lip. Res ., 32: 1325-1332.
25. Стивенс, Н.Г., Парсонс, А., Скофилд, П.М., Келли, F., Cheeseman, K. & Michinson, M.J. 1996. Рандомизированное контрольное испытание витамин Е у пациентов с ишемической болезнью сердца: Кембриджское исследование сердечных антиоксидантов (ХАОС). Ланцет , 347: 781-786.
26. Рапола, Дж., Виртамо, Дж., Рипатти, С. Хуттунен, Дж. К., Албейнс Д., Тейлор П.Р. и Хейнонен О.Л. 1997. Рандомизированное исследование добавки с альфа-токоферолом и бета-каротином на частоту сердечных приступов события у мужчин, перенесших инфаркт миокарда. Ланцет , 349: 1715-1720 гг.
27. Гей, К.Ф., Пуска, П., Джордан, П. и Мозер, Великобритания 1991. Обратная корреляция между витамином Е в плазме и смертностью от ишемическая болезнь сердца в кросс-культурной эпидемиологии. Am. J. Clin. Нутр., 53: 326С-334С.
28. Stampler, M.J., Hennekens, M.D., Marson, J.E., Colditz, Г.А., Рознер Б. и Уиллетт В.С. 1993. Потребление витамина Е и риск ишемической болезни сердца у женщин. N. Engl. J. Med., 328: 1444–1449.
29. Римм, Э.Б., Стэмплер, М.Дж., Аскерио, А. Джовануччи, Э., Кольдиц, Г.А. И Уиллетт, W.C. 1993. Потребление витамина Е и риск ишемической болезни сердца у мужчин. N. Engl. J. Med., 328: 1450–1456.
30. Беллицци, М.С., Франклин, М.Ф., Дати, Г.Г. & Джеймс, W.P.T. 1994. Витамин Е и ишемическая болезнь сердца: европейский парадокс. евро.J. Clin. Nutr., 48: 822-831.
31. Ховард А.Н., Уильямс Н.Р., Палмер К.Р. и др. 1996. Предотвращают ли гидроксикаротиноиды ишемическую болезнь сердца? Сравнение между Белфастом и Тулузой. Внутр. J. Vit. Nutr. Res., 66: 113-118.
32. P acker, L. 1993. Витамин E: Биологическая активность и польза для здоровья: обзор. В: Витамин Е в здоровье и болезнь. с. 977-982. Нью-Йорк, Пакер, Л., Фукс, Дж., ред. Марсель Деккер, Inc.
33. Brown, K.M., Morrice, P.C. И Дати, Г. 1997. Концентрация витамина Е и аскорбата в плазме в эритроцитах по отношению к перекисное окисление эритроцитов у курильщиков и некурящих: дозозависимость витамина Е добавка. Am. J. Clin. Nutr., 65: 496-502.
34. Slover, H.T. 1971 Токоферолы в пищевых продуктах и жирах, Lipids, 6: 291-296.
35. Гей, К.Ф. .1993. Витамин Е и другие незаменимые вещества. антиоксиданты в отношении ишемической болезни сердца: исследования по оценке риска. В: Витамин Е в здоровье и болезнях. с.589-634. Нью-Йорк. Пакер, Л, Фукс, J., eds.Marcel Dekker, Inc.
36. Хорвитт, М.К., Харви, К.С., Дам, К.Х. & Searcy, M.T. 1972. Связь между уровнем токоферола и сывороточными липидами для определение полноценности питания. Ann. NY Acad. Sci. , 203: 223-236
37.Турнем Д.И., Дэвис Д.А., Крамп Б.Дж., Ситунаяке, Р. Д. и Дэвис, М. , 1986. Использование разных липидов для экспрессии сыворотки токоферол: липидные соотношения для измерения статуса витамина Е. Ann. Clin. Biochem. , 23: 514-520
38. Леонард П.Дж. и Лозовски М.С. 1971. Эффект Введение альфа-токоферола на выживаемость эритроцитов при дефиците витамина Е Люди. Am. J. Clin. Nutr., 24: 388-393.
39.Хорвитт, М. 1980 г. Интерпретация человека потребности в витамине Е. Витамин Е, комплексный трактат, стр. 621-636 [Л. Редактор Махлина]. Нью-Йорк: Марсель Деккер.
40. Баннелл Р. Х., де Риттер Э. и Рубин С. Х. . 1975. Влияние кормления полиненасыщенными жирными кислотами диеты с низким содержанием витамина Е на уровень токоферола в крови мужчин, выполняющих тяжелый физический труд. Am. Дж. Clin. Nutr., 28: 706-711
41.Jenkinson, A. McE., Franklin, M.F., Wahle, K. & Дати, Г. 1999. Потребление с пищей полиненасыщенных жирных кислот и показатели окислительного стресса у людей-добровольцев. евро. J. Clin. Нутр., 53: 523-528.
42. Департамент здравоохранения. 1991. Диетические ссылки Значения пищевой энергии и питательных веществ для Соединенного Королевства. Отчет по Здравоохранение и социальные темы, № 41. Анонимный Лондон: HMSO.
43. Национальный исследовательский совет. 1989. Рекомендуется Диетические добавки. Анонимный Вашингтон, округ Колумбия: Национальная академия прессы.
44. Bieri, J.G. И Эвартс, Р. П. , 1973. Токоферолы. и жирные кислоты в американских диетах: рекомендуемая норма витамина Е. J. Am. Диета. Доц. , 62: 147-151
45. Witting, L.A. & Lee, L. 1975. Уровни содержания в рационе витамин Е и полиненасыщенные жирные кислоты и витамин Е в плазме крови Am. J. Clin. Nutr., 28: 571-576
46.Департамент здравоохранения и социального обеспечения. 1980 г. Искусственные корма для грудных детей. Отчеты о здоровье и социальной предметы; 18. Анонимный Лондон: HMSO.
47. Грегори, Дж. Р., Фостер, К., Тайлер, Х. и Уайзман, M . 1990. Диетическое обследование взрослых британцев. Анонимный Лондон: HMSO.
48. Рабочая группа по питанию международной жизни Научный институт Европы. 1990. Рекомендуемая суточная доза витаминов и полезные ископаемые в Европе. Nutr. Abstracts Revs., (Серия A). 60: 827-842.
49. Lloyd, J.K. 1990. Важность витамина Е в питание. Acta Pediatr. Сканд., 79: 6-11.
50. Kelly, F.J., Rodgers, W., Handel, J., Smith, S. & Холл, M.A. 1990. Динамика восполнения запасов витамина Е у недоношенных детей. руб. J. Nutr., 63, 631-638
51. Янссон, Л., Акессон, Б. и Холмберг, Л. , 1981.Витамин Е и жирнокислотный состав грудного молока. Am. J. Clin. Нутр., 34: 8-13
52. Beck, M.A. 1998. Влияние антиоксиданта. питательные вещества на вирусную инфекцию. Nutr. Обм., 56: S140-S146.
границ | Роль АФК и пищевых антиоксидантов в заболеваниях человека
Введение
Недоедание является плохим прогностическим признаком различных заболеваний и считается серьезной проблемой для здоровья в развивающихся странах (Muller and Krawinkel, 2005).Активные формы кислорода (АФК) участвуют во многих важных клеточных действиях, включая транскрипцию генов, передачу сигналов и иммунный ответ. Обычные АФК включают гидроксильный радикал (• OH), супероксид (O 2 • — ) и пероксид водорода (H 2 O 2 ) (Rogers et al., 2014; Zuo et al., 2015b). Избыточное производство АФК может привести к окислительному повреждению биомолекул, таких как липиды, белки и ДНК, что связано с развитием старения, а также с различными заболеваниями, включая рак, респираторные, сердечно-сосудистые, нейродегенеративные и пищеварительные заболевания.Сообщается, что вредные эффекты избытка АФК или окислительного стресса (ОС) в конечном итоге приводят к гибели клеток [71]. Организм снабжен несколькими механизмами для противодействия пагубному воздействию ОС. Антиоксиданты, генерируемые либо эндогенно, либо поставляемые извне, способны поглощать АФК и уменьшать окисление клеточных молекул, таким образом уменьшая ОС (Gilgun-Sherki et al., 2001). Антиоксиданты, полученные с пищей, необходимы для обеспечения эндогенными антиоксидантами для нейтрализации ОС.Действительно, недоедание и дефицит определенных антиоксидантов коррелируют с такими заболеваниями, как хроническая обструктивная болезнь легких (ХОБЛ) и болезнь Крона (БК) (King et al., 2008; Alzoghaibi, 2013). У этих пациентов часто наблюдается нарушение пищевого и окислительно-восстановительного баланса. Дефицит антиоксидантов, вызванный неправильным питанием, может способствовать увеличению риска возникновения заболеваний и плохим результатам лечения (Ames and Wakimoto, 2002; Evatt et al., 2008; Schols et al., 2014). В настоящее время клиническая осведомленность о питательном балансе при возникновении, прогрессировании и исходах заболевания ограничена.Необходима обновленная информация об обзоре литературы, в котором основное внимание уделяется взаимосвязи между статусом питания пациентов и развитием болезни. В этом обзоре мы опишем роль АФК в распространенных заболеваниях, связанных с ОС, и старении, а также обсудим эффекты пищевых антиоксидантов в качестве лечебных или адъювантов.
Окислительный стресс и состояние питания при респираторных заболеваниях
Респираторные заболевания, такие как ХОБЛ и астма, были определены как серьезные проблемы со здоровьем из-за повышенной распространенности и смертности во всем мире (Masoli et al., 2004; Пауэлс и Рабе, 2004). Воздействие на окружающую среду загрязнителей воздуха и сигаретного дыма в значительной степени способствует увеличению ОВ при ХОБЛ (Рисунок 1). Токсичность оксидантов напрямую повреждает альвеолы и соединительные ткани легких, усугубляя развитие ХОБЛ (van Eeden and Sin, 2013). Избыточное образование АФК также может активировать воспалительные клетки, которые, в свою очередь, производят больше АФК в легких. Этот процесс запускает порочный круг хронического воспаления и ОС, как это видно при ХОБЛ (van Eeden and Sin, 2013).ОС также участвует в патофизиологии астмы (Comhair and Erzurum, 2010). Хотя остается неясным, является ли повышенная ОС при астме причинным фактором заболевания или следствием воспаления, предполагается, что ОС играет ключевую роль в прогрессировании астмы (Cho and Moon, 2010). При бронхиальной астме OS усугубляет воспаление дыхательных путей путем активации факторов транскрипции, таких как ядерный фактор-каппа B (NF-κB), митоген-активируемая протеинкиназа (MAPK), протеин-активатор-1 (AP-1), а также провоспалительные посредники (рисунок 1).Более того, он усиливает гиперчувствительность дыхательных путей и стимулирует секрецию муцина, оба из которых связаны с тяжелой астмой (Fitzpatrick et al., 2009; Cho and Moon, 2010; Zuo et al., 2016). OS-индуцированные повреждения дыхательной системы и снижение антиоксидантной защиты дополнительно приводят к увеличению образования эндогенных АФК (Jiang et al., 2014).
РИСУНОК 1. Схема, иллюстрирующая роль ОС и питательных антиоксидантов при ХОБЛ. AP-1, белок-активатор-1; ХОБЛ, хронические обструктивные заболевания легких; MAPK, митоген-активированная протеинкиназа; ОС, оксидативный стресс.
Предполагается, что помимо OS, низкий индекс массы тела (ИМТ) и недостаточность питания коррелируют с тяжестью ХОБЛ (King et al., 2008). Пациенты с ХОБЛ с пониженной массой тела, как правило, чаще страдают от повреждений легких, непереносимости физических упражнений и повышенного уровня смертности по сравнению с людьми с нормальным весом (King et al., 2008; Ferreira et al., 2012). Недоедание может привести к снижению массы дыхательных мышц, что снижает силу и выносливость этих мышц (Ferreira et al., 2012). Кроме того, снижение потребления или доступности пищевых антиоксидантов, таких как витамины C и E, каротиноиды и полифенолы, может ослабить антиоксидантную систему и усугубить прогрессирование заболевания (Рисунок 1 и Таблица 1) (Sies et al., 2005; King et al. , 2008). Диета, богатая овощами, фруктами, рыбой и цельнозерновыми продуктами, связана с улучшением функции легких и снижением риска развития ХОБЛ (Varraso et al., 2015). Предполагается, что пищевые добавки улучшают функцию дыхательных мышц у истощенных пациентов с ХОБЛ, тем самым улучшая их качество жизни (Ferreira et al., 1998). Например, Hornikx et al. (2012) сообщили, что высокие дозы витамина D усиливают функцию дыхательных мышц и повышают физическую работоспособность у людей с ХОБЛ. Как наиболее известный пищевой антиоксидант, витамин С способен уменьшать окислительные повреждения и воспаление в легочной системе, убирая избыток АФК и активируя путь NF-κB, соответственно (Tecklenburg et al., 2007). Кроме того, мелатонин, мощный антиоксидант и регулятор цикла сна-бодрствования, также может ослаблять связанное с ОС ухудшение легких (Рисунок 1 и Таблица 1) (Gumral et al., 2009). Эти данные подтверждают потенциальное использование пищевых антиоксидантов в качестве вспомогательного средства при лечении ХОБЛ. Точно так же несколько наблюдательных исследований показывают, что пищевые антиоксиданты из диет или добавок могут улучшить контроль астмы и функцию легких у пациентов с астмой (Moreno-Macias and Romieu, 2014). Систематический обзор показал, что существует обратная связь между потреблением витаминов А и С с пищей и заболеваемостью астмой (таблица 1) (Allen et al., 2009). Витамин C вместе с витамином E стимулирует регенерацию связанного с мембраной α-токоферола из его окисленного состояния (Moreno-Macias and Romieu, 2014).Кроме того, было показано, что диетические каротиноиды коррелируют с улучшением исходов астмы и улучшением функции легких (Wood et al., 2012).
ТАБЛИЦА 1. Роль пищевых антиоксидантов в заболеваниях человека и старении.
Связь между ОС и развитием респираторных заболеваний предполагает ключевую роль пищевых антиоксидантов (Romieu, 2005). Уязвимые группы населения включают людей с дефицитом пищевых антиоксидантов, повышенным воздействием источников окислителей из окружающей среды и ограниченным доступом к антиоксидантам в питании (Moreno-Macias and Romieu, 2014).Важно отметить, что, хотя антиоксиданты могут помочь смягчить прогрессирование респираторных заболеваний, антиоксидантные добавки могут действовать как прооксиданты или индукторы ОС, если их употреблять в количествах, значительно превышающих рекомендованное диетическое потребление (Pham-Huy et al., 2008). . Потенциальные преимущества и риски испытаний пищевых добавок с антиоксидантами при респираторных заболеваниях следует рассматривать в индивидуальном порядке. Кроме того, остается неизвестным, является ли ОС следствием или причинным фактором некоторых заболеваний легких.Следовательно, лечение антиоксидантами может быть неэффективным подходом к изменению прогрессирования заболевания, хотя оно может облегчить симптомы, связанные с ОС (Margaritelis, 2016).
Окислительный стресс и состояние питания при сердечно-сосудистых заболеваниях
Сердечно-сосудистые заболевания (ССЗ) являются основной причиной смертности в Соединенных Штатах, приводя к почти одному миллиону смертей ежегодно (Madamanchi et al., 2005; Heidenreich et al., 2011). Большинство ССЗ коррелируют с развитием атеросклероза, в котором ОС играет причинную роль (Madamanchi et al., 2005). Избыточные АФК могут генерироваться в сосудистых клетках из-за разобщения NAD (P) H-оксидазы (Nox), синтаз оксида азота (NOS) и митохондрий, которые вызывают окислительные модификации липопротеинов низкой плотности (ЛПНП) (Azumi et al., 2002; Ambrose и Barua, 2004; Madamanchi et al., 2005). Окисленные ЛПНП (ox-LDL), транспортируемые через артериальные просветы, вызывают апоптоз эндотелиальных клеток и гладкомышечных клеток (SMC). Поглощая бычий ЛПНП, макрофаги могут превращаться в пенистые клетки, которые секретируют медиаторы роста для привлечения SMC в интиму.SMCs могут секретировать внеклеточный матрикс, который формирует тонкую фиброзную крышку, окружающую жировую полоску (Madamanchi et al., 2005; Cachofeiro et al., 2008). При непрерывном размножении SMC, моноцитов и макрофагов жировые полосы в конечном итоге превращаются в более развитые фиброзные бляшки (Madamanchi et al., 2005), потенциально приводя к окклюзии сосудов (Cachofeiro et al., 2008). Кроме того, ОС также вовлечена в развитие сердечной гипертрофии, ишемически-реперфузионного повреждения и апоптоза миоцитов, которые могут способствовать сердечной недостаточности (Madamanchi et al., 2005; Чжоу и др., 2018).
Учитывая влияние ROS на развитие сердечно-сосудистых заболеваний, было проведено множество исследований для оценки эффектов пищевых антиоксидантов у пациентов с сердечно-сосудистыми заболеваниями. Установлено, что потребление фруктов и овощей увеличивает уровень антиоксидантов, таких как каротин и витамин С, в крови, а также снижает окисление холестерина (Zino et al., 1997; Asplund, 2002). Таким образом, потенциальные преимущества фруктов и овощей при сердечно-сосудистых заболеваниях широко изучены.В метаанализе, состоящем из 16 проспективных когортных исследований и 833 234 участников, было обнаружено, что смертность от сердечно-сосудистых заболеваний обратно коррелирует с потреблением фруктов и овощей (Wang et al., 2014a). Другое исследование, в котором участвовали 2002 г. пациенты с коронарным атеросклерозом, показало, что добавление природного альфа-токоферола (RRR-AT) может значительно снизить частоту смерти от сердечно-сосудистых заболеваний и нефатального инфаркта миокарда (таблица 1) (Stephens et al., 1996). Однако представлены разные результаты, свидетельствующие об отсутствии положительного влияния витаминных добавок на смертность или заболеваемость сердечно-сосудистыми заболеваниями (Kris-Etherton et al., 2004). Например, в метааналитическом исследовании, в котором участвовали 81 788 участников, сообщалось, что ежедневный прием витамина Е в дозе 50-800 МЕ или β-каротина в дозе 15-80 мг не снижает смертность, связанную с сердечно-сосудистыми заболеваниями ( Вивеканантан и др., 2003). Следовательно, витамин Е и β-каротин могут быть не единственными активными компонентами фруктов и овощей, которые оказывают защитное действие на сердечно-сосудистую систему. Вместо этого другие антиоксидантные соединения, такие как ликопин и полифенолы, могут играть более важную роль в защите от сердечно-сосудистых заболеваний, как будет обсуждаться ниже (Ignarro et al., 2007). Кроме того, несоответствие результатов лечения, вероятно, связано с составом антиоксиданта. В большинстве исследований, сообщающих о неэффективности витамина Е, использовался цельнорацемический альфа-токоферол, который является основным компонентом синтетического витамина Е (Hoppe and Krennrich, 2000; Madamanchi et al., 2005). Напротив, RRR-AT, естественная форма витамина E, была связана с лучшими лечебными эффектами (Hoppe and Krennrich, 2000; Madamanchi et al., 2005). Таким образом, необходимы дальнейшие исследования для устранения разницы между RRR-AT и полностью рацемическим альфа-токоферолом с точки зрения их терапевтической эффективности.Кроме того, сложные окислительно-восстановительные механизмы антиоксидантов в настоящее время далеко не ясны. Некоторые антиоксиданты, такие как витамин С, могут проявлять прооксидантные свойства при введении в высоких дозах (Madamanchi et al., 2005). Это может частично объяснить, почему некоторые испытания с использованием добавок антиоксидантов не показали какого-либо защитного эффекта.
Ликопин — это натуральный диетический антиоксидант, которого больше всего в томатах. Была обнаружена обратная связь между заболеваемостью сердечно-сосудистыми заболеваниями и потреблением томатов или ликопина (Kohlmeier and Hastings, 1995; Arab and Steck, 2000; Rao and Agarwal, 2000).Это может быть связано с защитным действием ликопина против окисления ЛПНП за счет ингибирования синтеза холестерина и улучшения деградации ЛПНП (таблица 1) (Ignarro et al., 2007). Раннее популяционное исследование было проведено для оценки взаимосвязи между риском инфаркта миокарда и состоянием трех типов каротиноидов, включая ликопин, α-каротин и β-каротин, соответственно. Было обнаружено, что только ликопин обладает значительными защитными эффектами (Kohlmeier et al., 1997).Следовательно, ликопин может быть одним из основных факторов, лежащих в основе защитных механизмов потребления овощей от сердечно-сосудистых заболеваний (Kohlmeier et al., 1997). Кроме того, полифенолы являются наиболее распространенными антиоксидантами в рационе человека (~ 1 г / день), широко распространены во фруктах, овощах, кофе, чае и злаках (Ignarro et al., 2007). Эпидемиологические исследования выявили значительное снижение риска сердечно-сосудистых заболеваний при повышенном потреблении полифенолов (таблица 1) (Vita, 2005). Напитки, богатые флавоноидами, такие как чай, могут заметно улучшить функцию эндотелия.Однако потребление чая не уменьшило окислительные маркеры в крови. Таким образом, остается неясным, вызван ли этот положительный эффект чая его антиоксидантным действием (Vita, 2005). Действительно, все больше данных свидетельствует о том, что защитные эффекты полифенолов обусловлены не только их антиоксидантной способностью, но, скорее всего, коррелируют с их противовоспалительным действием, а также с регуляцией вазодилатации и апоптоза эндотелиальных клеток (Quinones et al., 2013) .
Окислительный стресс и статус питания при нейродегенеративных заболеваниях
Нейроны особенно уязвимы к повреждениям, вызванным ОС, из-за их ослабленной системы антиоксидантной защиты, высокой потребности в кислороде и обильного содержания полиненасыщенных жирных кислот в их клеточных мембранах (Rego and Oliveira, 2003).Растущее число исследований показывает, что АФК могут генерироваться с помощью различных механизмов и играть сложные роли в развитии нейродегенеративных заболеваний, таких как болезнь Альцгеймера (AD), болезнь Хантингтона (HD), боковой амиотрофический склероз (ALS), болезнь Паркинсона (PD). и спиноцеребеллярная атаксия (SCA) (Davila, Torres-Aleman, 2008; Hakonen et al., 2008; Patten et al., 2010; Blesa et al., 2015; Covarrubias-Pinto et al., 2015; Zuo et al. , 2015b). БА является основной причиной деменции у пожилых людей (Harman, 2006).Хотя точный патогенез AD остается неясным, связанное со старением прогрессирующее увеличение OS считается основным фактором формирования поражений AD (Harman, 2006; Pimplikar et al., 2010). Данные свидетельствуют о том, что окислительные процессы происходят до начала патологии бляшек и накопления амилоида-β (Aβ), что дополнительно подтверждает критическую роль ОС на начальной стадии БА (Lin and Beal, 2006; Wang et al., 2014b). ). При БА OS модулирует пути JNK / p38 MAPK, что приводит к накоплению Aβ и гиперфосфорилированию тау-белков (Patten et al., 2010). HD — это аутосомно-доминантное наследственное заболевание, которое вызывается мутировавшей экспансией CAG-повтора в экзоне 1 гена HD и полученным в результате мутантным белковым продуктом «хантингтин» (mHtt) (Browne and Beal, 2006). ОС не является фактором инициации HD. Однако тяжелая ОС является типичной особенностью HD и может способствовать усилению окисления ДНК в головном мозге HD (Browne and Beal, 2006). OS-индуцированная митохондриальная дисфункция обычно наблюдается при HD, а нарушение дыхательной цепи может усугубить образование ROS (Browne and Beal, 2006).Кроме того, митохондриальная аконитаза, важный фермент цикла трикарбоновой кислоты (ТСА), значительно нарушается при HD. Считается, что снижение активности аконитазы вызвано индуцированным ROS окислением Fe-S кластера внутри аконитазы (Browne and Beal, 2006). В результате ОС ответственна за метаболические дефекты, наблюдаемые при HD (Browne and Beal, 2006). При HD OS также связана со сниженной экспрессией транспортера глюкозы (GLUT) -3, что приводит к ингибированию поглощения глюкозы и чрезмерному накоплению лактата (Covarrubias-Pinto et al., 2015). Остается неясным, является ли ОС инициатором или следствием нейродегенерации при БП. Однако чрезмерная продукция ROS является критическим компонентом механизмов, лежащих в основе прогрессирования PD (Jenner, 2003). Утрата антиоксидантной защиты, особенно содержания глутатиона (GSH), обнаруживается на ранних стадиях БП, хотя причина остается неизвестной (Jenner, 2003). При БП наблюдается высокий уровень окисления белков, ДНК и липидов. Токсичные продукты окислительного повреждения могут привести к гибели нервных клеток (Jenner, 2003).В компактной части черной субстанции (SNc) пациентов с БП сниженная активность Комплекса I в дыхательной цепи митохондрий способствует избыточной генерации АФК и, следовательно, вызывает апоптоз дофаминергических нейронов (Blesa et al., 2015). При БАС мутация супероксиддисмутазы (SOD) 1 и митохондриальная дегенерация представляют собой один из основных механизмов, лежащих в основе патологии БАС (Rotunno and Bosco, 2013). В частности, значительная вакуолярная дегенерация митохондрий наблюдалась непосредственно перед гибелью нейрона у мутантных мышей SOD1 и , указывая тем самым, что дисфункция митохондрий инициирует начало ALS (Lin and Beal, 2006).Было показано, что мутантный SOD1 аномально взаимодействует с митохондриями, что приводит к высвобождению цитохрома c и активации апоптоза (Lin and Beal, 2006). Снижение антиоксидантной способности из-за мутации SOD1 потенциально связано с дегенерацией двигательных нейронов (Zuo et al., 2015b). Кроме того, повышенная ОС может ингибировать нейрозащитные пути IGF-I / AKT, что приводит к дисфункции нейронных клеток (Davila and Torres-Aleman, 2008). Кроме того, предполагается, что заметные митохондриальные изменения, вызванные ОС, участвуют в развитии SCA (Stucki et al., 2016).
Учитывая сложную роль OS в нейродегенеративных расстройствах, регуляция клеточных уровней ROS может представлять собой потенциальное лечение, препятствующее нейродегенерации и облегчение связанных с ней симптомов (Uttara et al., 2009). Клинические данные показывают, что нейродегенерация может быть уменьшена при правильном приеме природных или дополнительных антиоксидантов (Zandi et al., 2004). С другой стороны, нехватка основных антиоксидантов из-за недоедания, которое вызывает различные нейродегенеративные заболевания, может ухудшить развитие неврологических состояний (Brambilla et al., 2008; Цагалиоти и др., 2016). Например, недавно возник дефицит витамина D как один из факторов, способствующих аберрантному неврологическому развитию. Витамин D является важным антиоксидантом, регулирующим опосредованную кальцием эксайтотоксичность нейронов и индукцию нейротрансмиттеров и синаптических структурных белков (Mpandzou et al., 2016; Wang et al., 2016). Wang et al. (2016) предположили, что недостаток витамина D в сыворотке тесно связан с потерей дофаминергических нейронов в мозге БП и повышенным риском БП.Неврологические нарушения также проявляются у людей с дефицитом витамина B. Множественный дефицит витамина B (например, B1, B3 и фолиевой кислоты) вовлечен в патофизиологию множества нейродегенеративных заболеваний, таких как БП и БА (Sechi et al., 2016).
Рутин, ресвератрол и витамин E, которые нацелены на каскады, опосредованные ROS, такие как JNK и NF-κB, дали некоторые положительные результаты в улучшении нейродегенерации как in vitro, , так и in vivo (Zuo et al., 2015а). Было обнаружено, что в мозге крысы витамин Е более эффективен в модуляции ОС, чем витамины А и С (Zaidi and Banu, 2004). Соответственно, было показано, что двухлетний прием витамина Е в дозе 2000 МЕ в день снижает функциональное снижение, связанное с БА (Sano et al., 1997). Комбинация витамина E и коэнзима Q10 улучшает выработку энергии в некоторых случаях атаксии Фридрейха за счет ослабления ОС и восстановления функции митохондрий (Lodi et al., 2001). Помимо витаминов, фитохимические вещества, еще один тип биоактивных соединений, которые можно найти во фруктах и овощах, обладают высокой антиоксидантной способностью с потенциальным нейрозащитным действием против БП (Mazo et al., 2017). Антоцианин, полученный из клубники, обладает антиоксидантными, противовоспалительными и антиапоптотическими свойствами. Сообщалось, что он облегчает астроглиоз и сохраняет нервно-мышечные соединения и функцию мышц, выступая в качестве возможного терапевтического агента при БАС и других нейродегенеративных заболеваниях (Winter et al., 2017). Во время прогрессирования БА способность ресвератрола защищать нейроны от токсичности, вызванной Aβ и OS, имеет многообещающие терапевтические возможности (Anekonda, 2006; Bellaver et al., 2014). Показано, что липоевая кислота (LA) усиливает выработку GSH и истощает перекись липидов, защищая нейроны от митохондриальной дисфункции, вызванной OS (таблица 1) (Moreira et al., 2010; Zuo and Motherwell, 2013). Длительное введение MitoQ, антиоксиданта-мишени для митохондрий, также значительно восстанавливает митохондриальные функции в клетках Пуркинье и облегчает симптомы, связанные с SCA1, такие как нарушение координации движений (Stucki et al., 2016).
Были проведены многочисленные исследования терапевтического воздействия природных антиоксидантов на нейродегенеративные расстройства; однако были получены смешанные результаты (Dias et al., 2013; Ян и др., 2013). Например, несмотря на кажущуюся эффективность витамина E, исследование показало, что потребление витамина E в течение 5 месяцев не привело к повышению уровня витамина E в желудочковой спинномозговой жидкости пациентов с БП (Pappert et al., 1996). Образование АФК тонко регулируется системами антиоксидантной защиты в организме человека (Zuo et al., 2015b). Следовательно, однократного приема антиоксидантов не может быть достаточно для противодействия ОС в патофизиологических условиях, и это может привести к повреждению клеток (Murphy, 2014).В связи с этим следует рассмотреть возможность комбинированного использования различных пищевых антиоксидантов. Важно отметить, что простая дихотомия в окислительно-восстановительной биологии, состоящая из хороших антиоксидантов и плохих ROS, считается несостоятельной. В настоящее время общепризнано, что небольшое количество АФК необходимо для активации сигнальных путей, чувствительных к окислительно-восстановлению, в то время как чрезмерное количество АФК может привести к пагубным последствиям (Margaritelis et al., 2016). Различные характеристики и источники АФК могут определять их конкретную роль в регуляции клеточной активности (Winterbourn and Hampton, 2008; Margaritelis et al., 2016). Многочисленные исследования подчеркнули необходимость более точного описания метаболизма АФК с точки зрения количества, реактивности, местоположения и кинетики реакции (Winterbourn and Hampton, 2008; Forman et al., 2014; Margaritelis et al., 2016). Однако большинство экзогенно вводимых антиоксидантов неселективны и равномерно распределяются по различным частям клеток или тканей (Margaritelis et al., 2016). Отсутствие специфичности антиоксидантов может объяснить их неэффективность при лечении заболеваний, связанных с ОС.Таким образом, в будущих исследованиях необходимо, чтобы исследователи сосредоточились на разработке новых и целевых антиоксидантов, таких как ингибиторы mitoQ и Nox, для улучшения точных терапевтических эффектов антиоксидантов (Altenhofer et al., 2015; Margaritelis et al., 2016).
Окислительный стресс и состояние питания при раке
АФК участвуют во всех трех стадиях развития рака, а именно в инициации, стимулировании и прогрессировании (Khandrika et al., 2009; Wells et al., 2009; Katakwar et al., 2016).На стадии инициации мутации ДНК, индуцированные АФК, могут накапливаться, если они не восстанавливаются в раковых тканях (Poulsen et al., 1998). Чрезмерное производство АФК может привести к онкогенной мутации ДНК, потенциально способствуя возникновению рака (Valko et al., 2006). Кроме того, раковые клетки характеризуются большим производством АФК, чем нормальные клетки, из-за измененного метаболизма и увеличения потребности в энергии (Sosa et al., 2013). АФК-индуцированная ОС в клетках карциномы может способствовать росту рака за счет запуска передачи сигналов роста клеток, повышения устойчивости опухоли к терапии, увеличения кровоснабжения опухолей и содействия метастазированию (Brown and Bicknell, 2001).АФК способствуют размножению раковых клеток путем модификации генов, связанных с факторами апоптоза, пролиферации клеток и транскрипции (Trueba et al., 2004). АФК также активируют антиапоптотические гены и подавляют проапоптотические белки посредством путей PI3K / AKT и ERK / MEK (McCubrey et al., 2007). На стадии прогрессирования рака АФК способствуют усилению регуляции матриксных металлопротеиназ, ингибируя действие антипротеаз и ангиогенез, что в конечном итоге приводит к метастазированию (Maulik, 2002; Mori et al., 2004; Шинохара и др., 2010).
Истощение запасов эндогенных антиоксидантов или нарушение окислительно-восстановительного равновесия может привести к развитию рака. Исследования показали, что 35% случаев рака можно предотвратить путем изменения диеты (Doll and Peto, 1981; Rayman, 2005). Фрукты и овощи, богатые антиоксидантами, обладают защитным действием против нескольких различных типов рака (Soerjomataram et al., 2010; Turati et al., 2015). Растительные продукты, содержащие полифенолы, оказались эффективными антиоксидантными агентами для организма (Barrajon-Catalan et al., 2010; Паредес-Лопес и др., 2010; Sreelatha et al., 2012; Cordero-Herrera et al., 2013). Было показано, что они обладают противораковой активностью, которая эффективна против рака легких, груди, языка, желудка, гортани, толстой кишки и простаты (таблица 1) (Manikandan et al., 2012; Sak, 2014). Фрукты с более высоким содержанием фенола обладают более сильными антиоксидантными свойствами, поскольку они могут вызывать замещение гидроксильных групп в ароматических кольцах фенольных соединений (Sun et al., 2002; Rokayya et al., 2014). Полифенолы вызывают апоптоз раковых клеток, подавляют пролиферацию мутировавших клеток, снижают продукцию циклооксигеназы-2 (ЦОГ-2) и подавляют экспрессию раковых генов (Gloria et al., 2014; Ли и др., 2014; Xie et al., 2014; Zhang et al., 2015). Более того, питательные вещества, такие как витамины и минералы, могут снизить риск рака, проявляя антиоксидантное действие, подавляя пролиферацию раковых клеток, поддерживая метилирование ДНК и способствуя остановке клеточного цикла (Pathak et al., 2003; Rayman, 2005). У людей, ранее лечившихся от рака, здоровая диета, богатая фруктами и овощами, может изменять биологические маркеры прогрессирования рака (Jones and Demark-Wahnefried, 2006). Было доказано, что здоровая растительная пища снижает риск смерти после постановки диагноза груди (Vrieling et al., 2013; George et al., 2014), головы и шеи (Arthur et al., 2013) и рака прямой кишки (Pelser et al., 2014). Было показано, что диета с высоким содержанием овощей эффективна в снижении рецидивов рака груди у пациентов, принимающих тамоксифен (Gold et al., 2009; Thomson et al., 2011).
Витамины, такие как витамины A и E, обладают профилактическим действием против рака полости рта (Garewal, 1995). Было показано, что отдельные питательные микроэлементы (витамин D, карнитин и селен) улучшают комплаентность и прогноз, улучшают качество жизни пациентов и снижают побочные эффекты лечения рака (Block et al., 2008; Grober et al., 2015). Однако ограниченные данные подтверждают эффективность витаминов и минералов в профилактике рака (Fortmann et al., 2013), и такие режимы питания в настоящее время не рекомендуются для практики у здоровых людей (World Cancer Research Fund / American Institute for Cancer Research, 2007). . Кроме того, не хватает рандомизированных контрольных испытаний, посвященных диетам и раку, из-за сложности вмешательства в полноценное питание, а также из-за этических проблем в предлагаемом исследовании (Norat et al., 2015). Следовательно, текущие рекомендации основаны на эффективности здорового питания (богатого фруктами, овощами и зерновыми и с низким содержанием красного мяса и алкоголя) и образа жизни в снижении риска рака (Norat et al., 2015).
Окислительный стресс и состояние питания при болезнях органов пищеварения
Хорошо известно, что ОС, ассоциированная с воспалением кишечника, играет важную роль в патофизиологии различных заболеваний желудочно-кишечного тракта (ЖКТ), таких как воспалительные заболевания кишечника (ВЗК) (Balmus et al., 2016). Хотя точная этиология ВЗК остается неясной, лежащие в основе патологии могут частично объясняться избыточным образованием АФК (Zhu and Li, 2012; Bhattacharyya et al., 2014). Из-за наличия частиц пищи, патогенов или дисбаланса микробиоты желудочно-кишечный тракт может раздражаться, генерируя избыток АФК и ставя под угрозу эндогенную антиоксидантную защиту (Moura et al., 2015). OS разрушает эпителиальный барьер кишечника и увеличивает проницаемость кишечника, что еще больше усугубляет воспаление (Рисунок 2) (Balmus et al., 2016). ВЗК, включающая БК и язвенный колит (ЯК), характеризуется хроническим и выраженным воспалением, связанным с ОС в желудочно-кишечном тракте (Balmus et al., 2016). Повышенные уровни провоспалительных медиаторов, таких как фактор активации тромбоцитов (PAF) и лейкотриен B 4 (LTB 4 ), наблюдаемые в образцах слизистой оболочки у активных пациентов с ВЗК, вызывают высвобождение цитотоксических реактивных метаболитов кислорода за счет чрезмерной стимуляции. фагоциты (Ingraham et al., 1982; Шэрон и Стенсон, 1984; Уоллес и Чин, 1997). Более того, миелопероксидазы высвобождаются во время массивной инфильтрации полиморфно-ядерных нейтрофилов и макрофагов в воспаленную слизистую, производя хлорноватистую кислоту, мощный окислитель, посредством метаболизма H 2 O 2 . Другие источники ROS включают ферменты, такие как циклооксигеназа, ксантиноксидаза и 5-липоксигеназа, которые находятся в слизистой оболочке кишечника (Alzoghaibi, 2013).
РИСУНОК 2. Схема, иллюстрирующая роль ОС и питательных антиоксидантов при ВЗК. ВЗК, воспалительные заболевания кишечника; ОС, оксидативный стресс; Se, селен; Zn, цинк.
Несмотря на перепроизводство АФК, дефицит пищевых и ферментативных антиоксидантов также способствует развитию ОС (Alzoghaibi, 2013). Например, у пациентов с БК наблюдаются низкие уровни ферментативных антиоксидантов и витаминов, что частично связано с недоеданием (Buffinton and Doe, 1995; Alzoghaibi, 2013).У истощенных пациентов с ВЗК снижение потребления фруктов и овощей с пищей сильно влияет на концентрацию каротиноидов (витамина А) (Balmus et al., 2016). Витамин C, который помогает восстанавливать и защищать слизистую оболочку от вредных воздействий, истощается при язвенной болезни и гастрите (Aditi and Graham, 2012). Примечательно, что повышенная частота дефицита витамина D у пациентов с БК тесно связана с заболеваниями скелета и ухудшением качества жизни (рисунок 2) (van Hogezand and Hamdy, 2006; Alastair et al., 2011). Стойкая ОС может повредить кишечный барьер и увеличить проницаемость эпителия ЖКТ за счет перекисного окисления липидов и разрушения плотных контактов. Это изменяет состав комменсальной микробиоты в желудочно-кишечном тракте и препятствует их способности устанавливать устойчивость к колонизации, тем самым способствуя инвазии патогенных бактерий (Buffie and Pamer, 2013; Moura et al., 2015). Такие инфекции еще больше усугубляют выработку АФК и воспаление и потенциально повышают риск воспалительного синдрома кишечника (Zhu and Li, 2012).
Учитывая явное указание на повышение уровня АФК при ВЗК и других заболеваниях ЖКТ, адъювантный или лечебный потенциал антиоксидантов в значительной степени исследуется. Было показано, что применение антиоксидантов восстанавливает окислительно-восстановительный баланс, тем самым уменьшая повреждения кишечника и поддерживая здоровье желудочно-кишечного тракта (Bhattacharyya et al., 2014). Например, исследования показали, что CuZn-SOD и 5-аминосалициловая кислота эффективно облегчают повреждения слизистой оболочки при БК, удаляя или вызывая быстрое разложение ROS (Emerit et al., 1989; Couto et al., 2010; Альзогайби, 2013). В рандомизированном плацебо-контролируемом исследовании 3 месяца перорального приема антиоксидантных добавок заметно улучшили антиоксидантный статус сыворотки у пациентов с CD в стадии ремиссии. Комбинация антиоксидантов с n -3 жирными кислотами дополнительно ослабляла провоспалительную активность, таким образом, служа потенциальным средством лечения CD (Geerling et al., 2000). По сравнению с добавками, диетическое потребление антиоксидантов из натуральных фруктов и овощей может быть более безопасным способом избежать чрезмерного потребления.Неправильное применение антиоксидантов может быть вредным из-за улавливания физиологических АФК (Bjelakovic et al., 2004; Poljsak et al., 2013). Сообщается, что продукты, богатые питательными микроэлементами, такими как альфа-токоферол (витамин Е) и минералы, облегчают повреждение АФК. Например, селен и цинк взаимодействуют с GPx и SOD соответственно для борьбы с ОС. Комбинация селена и витамина E продемонстрировала защитное действие против окислительного повреждения толстой кишки крыс UC (рис.2 и таблица 1) (Bitiren et al., 2010). Некоторые функциональные продукты могут быть полезны при ВЗК без побочных эффектов.
Окислительный стресс и состояние питания при старении
Теория свободных радикалов, которая была впервые предложена Харманом в 1956 году, предполагает, что старение — это процесс, связанный с прогрессирующим и необратимым накоплением окислительных повреждений в клетках (Harman, 1956; Mariani et al., 2005). Сдвиг окислительно-восстановительного баланса в сторону более окисленного состояния отмечается в стареющих клетках, на что указывает снижение соотношения GSH / GSSG.Это изменение окислительно-восстановительного профиля может снизить способность клеток буферизовать АФК, производимые как в физиологических условиях, так и в ответ на внешний стресс (Kregel and Zhang, 2007). Чрезмерное накопление АФК может напрямую повредить ДНК, белок и липиды, что нарушает нормальную клеточную функцию (Zuo et al., 2015b). Митохондриальная ДНК (мтДНК) особенно чувствительна к ОС, а мутации мтДНК тесно связаны с процессом старения (Trifunovic et al., 2004). Сообщалось, что у мышей с соматической мутацией мтДНК проявлялись более ранние проявления связанных со старением признаков, таких как выпадение волос, остеопороз и уменьшение подкожного жира, а также более короткая продолжительность жизни (Trifunovic et al., 2004). Воздействие высоких уровней ROS может также ускорить укорочение теломер, что в конечном итоге запускает клеточное старение (Kregel and Zhang, 2007). Например, клетки фибробластов, культивируемые при высокой ОС, показали повышенную скорость укорачивания теломер и сокращение продолжительности жизни (Vonzglinicki et al., 1995). Кроме того, связанный со старением OS может быть ответственным за хроническое систематическое воспаление, которое обычно наблюдается у пожилых людей, через активацию NF-κB (Chung et al., 2009). NF-κB является ключевым регулятором воспалительных факторов, таких как фактор некроза опухоли-альфа (TNF-α), интерлейкин (IL) -1β и IL-6 (Chung et al., 2009). OS-индуцированная передача сигналов NF-κB недолговечна в нормальных условиях в отличие от хронической активации во время старения (Chung et al., 2009). Устойчивое воспаление низкого уровня может быть причиной развития возрастных заболеваний, таких как атеросклероз, рак и деменция (Chung et al., 2009).
Стареющее население подвержено более высокому риску недоедания из-за общего снижения функций организма, включая снижение скорости метаболизма, пищеварительной и абсорбционной способности (Brownie, 2006).Следовательно, пожилые люди чаще страдают заболеваниями, связанными с недостаточностью питания. Например, было показано, что связанный со старением дефицит витамина D приводит к потере костной массы, предрасположенности к переломам и гиперпаратиреозу (Lips, 2001). Следовательно, соответствующие добавки с витамином D могут снизить риск переломов бедра и других переломов у пожилых людей, не привязанных к дому (таблица 1) (Lips, 2001). В последние годы внимание к диете возросло, поскольку она является важным источником экзогенно полученных антиоксидантов.Похоже, что диетические антиоксиданты обладают антивозрастной активностью благодаря своей способности подавлять образование свободных радикалов (Kandola et al., 2015). Снижение когнитивных функций представляет собой серьезную проблему для здоровья стареющего населения (Kang et al., 2005). Ключевое исследование Канга и др. (2005) наблюдали за более чем десятью тысячами женщин в 1984–2003 гг., Чтобы исследовать взаимосвязь между их режимом питания и когнитивными функциями. Было обнаружено, что женщины, которые потребляли больше зеленолистных или крестоцветных овощей, демонстрировали наименьшее снижение когнитивных функций; в то время как потребление фруктов не повлияло на их когнитивные функции (Kang et al., 2005). Интересно, что более высокое потребление зеленых и желтых овощей также коррелировало с более медленным старением кожи у японских женщин после корректировки на возраст, ИМТ, статус курения и пребывание на солнце (Nagata et al., 2010).
Ограничение энергии (ER) недавно было предложено как потенциальный способ увеличения продолжительности жизни. Частично это было связано с благоприятным влиянием ER на окислительно-восстановительный контроль. У плодовых мушек ER диета значительно увеличивала экспрессию SOD1 и SOD2, а также увеличивала продолжительность жизни на 16% (Peng et al., 2014). Различные природные антиоксиданты, нутрицевтики и функциональные продукты питания были определены как охотники за свободными радикалами или прогрессивным кислородом. Следовательно, функциональные продукты питания и нутрицевтики, контролирующие антиоксидантную активность, могут играть важную роль в замедлении процесса старения (Peng et al., 2014). Было показано, что диета, богатая антиоксидантами, увеличивает продолжительность жизни на животных моделях (Miquel, 2002; Peng et al., 2014). Например, было обнаружено, что экстракт черники с добавками к диете заметно увеличивает продолжительность жизни плодовых мух и Caenorhabditis elegans (Wilson et al., 2006; Peng et al., 2014). Это сопровождалось повышенной экспрессией СОД и каталазы. Продолжительность жизни, индуцированная экстрактом черники, не наблюдалась у плодовых мух с мутацией SOD или каталазой. Эти результаты предполагают, что положительное влияние черники на увеличение продолжительности жизни потенциально связано с усилением эндогенной антиоксидантной системы (Peng et al., 2014). Другие пищевые антиоксиданты, включая полифенолы яблока, экстракт антоцианов черного риса и теафлавины черного чая, продемонстрировали заметные эффекты в отношении долголетия за счет повышения уровня эндогенных антиоксидантов на животных моделях (таблица 1) (Peng et al., 2014). Необходимы дальнейшие исследования, чтобы оценить потенциальное влияние природных антиоксидантов на продолжительность жизни человека.
Резюме и перспективы
Влияние ОС на этиологию нескольких хронических и воспалительных заболеваний указывает на то, что терапия на основе антиоксидантов может быть многообещающей при этих расстройствах. Терапевтическая стратегия, которая увеличивает антиоксидантную способность человека, может быть полезна для длительного лечения. Однако многие проблемы, связанные с добавками антиоксидантов для профилактики заболеваний, остаются нерешенными.Остается выяснить точную роль ROS в патогенезе различных заболеваний. Текущие рекомендации основаны на соблюдении здоровой диеты (богатой фруктами, овощами и зерновыми и с низким содержанием красного мяса и алкоголя) и здорового образа жизни, который продемонстрировал способность снижать риск заболеваний. Перед использованием антиоксидантных добавок в качестве адъювантной терапии необходимы дальнейшие исследования. Между тем, при приеме диетических антиоксидантов необходимо избегать источников окислителей, таких как сигаретный дым и алкоголь.
Авторские взносы
LZ разработал концепцию и дизайн обзора. ZL, ZR и JZ обобщили литературу и написали рукопись. LZ, EK, C-CC и TZ критически отредактировали рукопись. Т.З. подготовила рисунки и аннотации. Все авторы согласились нести ответственность за содержание этой работы.
Финансирование
Это исследование было поддержано премией Рюдзи Уэно, Фонд S&R Американского физиологического общества, 2016 г.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим Пейдж Генри, Алисию Симпсон и Денети Виджегунавардана за их помощь во время подготовки рукописи.
Список литературы
Аллен С., Бриттон Дж. Р. и Леонарди-Би Дж. А. (2009). Связь между витаминами-антиоксидантами и показателями результатов астмы: систематический обзор и метаанализ. Грудь 64, 610–619. DOI: 10.1136 / thx.2008.101469
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Альтенхофер, С., Радермахер К. А., Клейкерс П. В., Винглер К. и Шмидт Х. Х. (2015). Эволюция ингибиторов НАДФН-оксидазы: селективность и механизмы взаимодействия с мишенью. Антиоксид. Редокс-сигнал. 23, 406–427. DOI: 10.1089 / ars.2013.5814
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Амвросий, Дж. А., и Баруа, Р. С. (2004). Патофизиология курения сигарет и сердечно-сосудистых заболеваний: обновленная информация. J. Am. Coll. Кардиол. 43, 1731–1737.DOI: 10.1016 / j.jacc.2003.12.047
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Артур А. Э., Петерсон К. Э., Розек Л. С., Тейлор Дж. М., Лайт Э., Чепеха Д. Б. и др. (2013). Диета перед лечением, статус веса и прогноз плоскоклеточного рака головы и шеи. Am. J. Clin. Nutr. 97, 360–368. DOI: 10.3945 / ajcn.112.044859
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Асплунд, К. (2002). Витамины-антиоксиданты в профилактике сердечно-сосудистых заболеваний: систематический обзор. J. Intern. Med. 251, 372–392. DOI: 10.1046 / j.1365-2796.2002.00973.x
CrossRef Полный текст | Google Scholar
Азуми, Х., Иноуэ, Н., Охаши, Ю., Терашима, М., Мори, Т., Фудзита, Х., и др. (2002). Образование супероксида в образцах направленной коронарной атерэктомии у пациентов со стенокардией — Важная роль NAD (P) H оксидазы. Артериосклер. Тромб. Васк. Биол. 22, 1838–1844. DOI: 10.1161 / 01.Atv.0000037101.40667.62
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бальмус, И.М., Чобица А., Трифан А. и Станчу К. (2016). Последствия окислительного стресса и антиоксидантной терапии при воспалительном заболевании кишечника: клинические аспекты и модели на животных. Саудовская Дж. Гастроэнтерол. 22, 3–17. DOI: 10.4103 / 1319-3767.173753
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Barrajon-Catalan, E., Fernandez-Arroyo, S., Saura, D., Guillen, E., Fernandez-Gutierrez, A., Segura-Carretero, A., et al. (2010). Водные экстракты цистовых, содержащие эллагитаннины, обладают антиоксидантной и антимикробной способностью, а также цитотоксической активностью в отношении раковых клеток человека. Food Chem. Toxicol. 48, 2273–2282. DOI: 10.1016 / j.fct.2010.05.060
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Беллавер Б., Соуза Д. Г., Соуза Д. О. и Кинкозес-Сантос А. (2014). Ресвератрол повышает антиоксидантную защиту и снижает провоспалительные цитокины в культурах астроцитов гиппокампа новорожденных, взрослых и старых крыс линии Вистар. Toxicol. In Vitro 28, 479–484. DOI: 10.1016 / j.tiv.2014.01.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бхаттачарья, А., Chattopadhyay, R., Mitra, S., and Crowe, S.E. (2014). Окислительный стресс: важный фактор в патогенезе заболеваний слизистой оболочки желудочно-кишечного тракта. Physiol. Ред. 94, 329–354. DOI: 10.1152 / Physrev.00040.2012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Битирен М., Каракилджик А.З., Зерин М., Озардали И., Селек С., Назлыгуль Ю. и др. (2010). Защитные эффекты комбинации селена и витамина Е при экспериментальном колите в плазме крови и толстой кишке крыс. Biol. Trace Elem. Res. 136, 87–95. DOI: 10.1007 / s12011-009-8518-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Белакович Г., Николова Д., Симонетти Р. Г. и Глууд К. (2004). Антиоксидантные добавки для профилактики рака желудочно-кишечного тракта: систематический обзор и метаанализ. Ланцет 364, 1219–1228. DOI: 10.1016 / S0140-6736 (04) 17138-9
CrossRef Полный текст | Google Scholar
Блеса, Дж., Триго-Дамас, И., Кирога-Варела А. и Джексон-Льюис В. Р. (2015). Окислительный стресс и болезнь Паркинсона. Фронт. Нейроанат. 9:91. DOI: 10.3389 / fnana.2015.00091
CrossRef Полный текст | Google Scholar
Блок, К. И., Кох, А. С., Мид, М. Н., Тоти, П. К., Ньюман, Р. А., и Джилленхол, К. (2008). Влияние добавок антиоксидантов на химиотерапевтическую токсичность: систематический обзор данных рандомизированных контролируемых исследований. Внутр. J. Cancer 123, 1227–1239.DOI: 10.1002 / ijc.23754
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Боннефон-Руссело, Д., и Коллин, Ф. (2010). Мелатонин: действие как антиоксидант и потенциальное применение при заболеваниях и старении человека. Токсикология 278, 55–67. DOI: 10.1016 / j.tox.2010.04.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брамбилла Д., Манкузо К., Скудери М. Р., Боско П., Кантарелла Г., Лемпереур Л. и др. (2008). Роль антиоксидантных добавок в иммунной системе, неопластических и нейродегенеративных расстройствах: точка зрения для оценки профиля риск / польза. Nutr. J. 7:29. DOI: 10.1186 / 1475-2891-7-29
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Браун, Н. С., Бикнелл, Р. (2001). Гипоксия и окислительный стресс при раке груди — Окислительный стресс: его влияние на рост, метастатический потенциал и ответ на терапию рака груди. Breast Cancer Res. 3, 323–327. DOI: 10.1186 / Bcr315
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баффинтон, Г.Д. и Доу У. Ф. (1995). Измененный статус аскорбиновой кислоты в слизистой оболочке у пациентов с воспалительным заболеванием кишечника. Free Radic. Res. 22, 131–143. DOI: 10.3109 / 1071576950
35
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Качофейро В., Гойкочеа М., Де Винуеса С. Г., Обина П., Лахера В. и Луно Дж. (2008). Окислительный стресс и воспаление, связь между хроническим заболеванием почек и сердечно-сосудистыми заболеваниями. Kidney Int. 74, S4 – S9.DOI: 10.1038 / ki.2008.516
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chung, H.Y., Cesari, M., Anton, S., Marzetti, E., Giovannini, S., Seo, A.Y., et al. (2009). Молекулярное воспаление: основы старения и возрастных заболеваний. Aging Res. Ред. 8, 18–30. DOI: 10.1016 / j.arr.2008.07.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Комхейр, С.А., и Эрзурум, С.С. (2010). Редокс-контроль астмы: молекулярные механизмы и терапевтические возможности. Антиоксид. Редокс-сигнал. 12, 93–124. DOI: 10.1089 / ARS.2008.2425
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кордеро-Эррера И., Мартин М. А., Браво Л., Гойя Л. и Рамос С. (2013). Галлат эпикатехина вызывает гибель клеток через активацию p53 и стимуляцию p38 и JNK в клетках рака толстой кишки человека SW480. Nutr. Рак 65, 718–728. DOI: 10.1080 / 01635581.2013.795981
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коуту, Д., Рибейро, Д., Фрейтас, М., Гомес, А., Лима, Дж. Л., и Фернандес, Э. (2010). Поглощение активных форм кислорода и азота пролекарством сульфасалазином и его метаболитами 5-аминосалициловой кислотой и сульфапиридином. Redox Rep. 15, 259–267. DOI: 10.1179 / 135100010X128264467
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коваррубиас-Пинто А., Молл П., Солис-Мальдонадо М., Акуна А. И., Риверос А., Миро М. П. и др. (2015). Помимо окислительно-восстановительного дисбаланса: окислительный стресс способствует нарушению модуляции GLUT3 при болезни Хантингтона. Free Radic. Биол. Med. 89, 1085–1096. DOI: 10.1016 / j.freeradbiomed.2015.09.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Давила, Д., и Торрес-Алеман, И. (2008). Смерть нейронов из-за окислительного стресса включает активацию FOXO3 через двунаправленный путь, который активирует стресс-киназы и ослабляет передачу сигналов инсулиноподобного фактора роста I. Мол. Биол. Cell 19, 2014–2025. DOI: 10.1091 / mbc.E07-08-0811
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Долл, Р.и Пето Р. (1981). Причины рака: количественные оценки предотвратимых рисков рака в Соединенных Штатах сегодня. J. Natl. Cancer Inst. 66, 1191–1308. DOI: 10.1093 / jnci / 66.6.1192
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Emerit, J., Pelletier, S., Tosoni-Verlignue, D., and Mollet, M. (1989). Фаза II испытания супероксиддисмутазы меди и цинка (CuZnSOD) в лечении болезни Крона. Free Radic. Биол. Med. 7, 145–149.DOI: 10.1016 / 0891-5849 (89)-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эватт, М. Л., Делонг, М. Р., Хазай, Н., Розен, А., Триче, С., и Тангприча, В. (2008). Распространенность недостаточности витамина D у пациентов с болезнью Паркинсона и Альцгеймера. Arch. Neurol. 65, 1348–1352. DOI: 10.1001 / archneur.65.10.1348
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Феррейра И. М., Брукс Д., Уайт Дж., и Р. Гольдштейн (2012). Пищевая добавка при стабильной хронической обструктивной болезни легких. Кокрановская база данных Syst. Ред. 12: CD000998. DOI: 10.1002 / 14651858.CD000998.pub3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Феррейра И. М., Веррески И. Т., Нери Л. Е., Гольдштейн Р. С., Замел Н., Брукс Д. и др. (1998). Влияние пероральных анаболических стероидов в течение 6 месяцев на массу тела и респираторные мышцы у пациентов с ХОБЛ с недостаточным питанием. Сундук 114, 19–28. DOI: 10.1378 / сундук.114.1.19
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фитцпатрик А. М., Тиг, В. Г., Ольгин, Ф., Йе, М., Браун, Л. А., и Программа исследований тяжелой астмы (2009). Гомеостаз глутатиона в дыхательных путях нарушен у детей с тяжелой астмой: свидетельства оксидантного стресса. J. Allergy Clin. Иммунол. 123, 146.e8–152.e8. DOI: 10.1016 / j.jaci.2008.10.047
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фортманн, С.П., Бурда, Б. У., Сенгер, К. А., Лин, Дж. С., и Уитлок, Э. П. (2013). Витаминные и минеральные добавки в первичной профилактике сердечно-сосудистых заболеваний и рака: обновленный систематический обзор данных для Целевой группы профилактических служб США. Ann. Междунар. Med. 159, 824–834. DOI: 10.7326 / 0003-4819-159-12-201312170-00729
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Герлинг, Б. Дж., Бадарт-Смук, А., Ван Дерсен, К., Ван Хаувелинген, А.К., Рассел М. Г., Стокбруггер Р. В. и др. (2000). Пищевые добавки с жирными кислотами N-3 и антиоксидантами у пациентов с болезнью Крона в стадии ремиссии: влияние на антиоксидантный статус и профиль жирных кислот. Inflamm. Кишечник. 6, 77–84. DOI: 10.1097 / 00054725-200005000-00002
CrossRef Полный текст | Google Scholar
Джордж С. М., Баллард-Барбаш Р., Шикани Дж. М., Каан, Б. Дж., Фройденхайм, Дж. Л., Кроенке, К. Х. и др. (2014). Лучшее качество диеты после диагностики связано со снижением риска смерти среди женщин в постменопаузе с инвазивным раком груди в рамках инициативы по охране здоровья женщин. Cancer Epidemiol. Биомаркеры Пред. 23, 575–583. DOI: 10.1158 / 1055-9965.EPI-13-1162
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гилгун-Шерки Ю., Меламед Э. и Оффен Д. (2001). Нейродегенеративные заболевания, вызванные окислительным стрессом: потребность в антиоксидантах, проникающих через гематоэнцефалический барьер. Нейрофармакология 40, 959–975. DOI: 10.1016 / S0028-3908 (01) 00019-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Глория, Н.Ф., Соареш, Н., Бранд, К., Оливейра, Ф. Л., Бороевич, Р., Теодоро, А. Дж. (2014). Ликопин и бета-каротин вызывают остановку клеточного цикла и апоптоз в клеточных линиях рака груди человека. Anticancer Res. 34, 1377–1386.
PubMed Аннотация | Google Scholar
Голд, Э. Б., Пирс, Дж. П., Натараджан, Л., Стефаник, М. Л., Лафлин, Г. А., Каан, Б. Дж. И др. (2009). Режим питания влияет на прогноз рака груди у женщин без приливов: исследование здорового питания и образа жизни женщин. J. Clin. Онкол. 27, 352–359. DOI: 10.1200 / JCO.2008.16.1067
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гудман М., Бостик Р. М., Кучук О. и Джонс Д. П. (2011). Клинические испытания антиоксидантов как средств профилактики рака: прошлое, настоящее и будущее. Free Radic. Биол. Med. 51, 1068–1084. DOI: 10.1016 / j.freeradbiomed.2011.05.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гробер У., Кистерс К., и Адамец, И. А. (2015). Витамин D в онкологии: обновление 2015 г. Med. Monatsschr. Pharm. 38, 512–516.
Google Scholar
Гумрал, Н., Назироглу, М., Онгель, К., Бейдилли, Э. Д., Озгунер, Ф., Сутчу, Р. и др. (2009). Уровни антиоксидантных ферментов и мелатонина у пациентов с бронхиальной астмой и хронической обструктивной болезнью легких в стабильный период и период обострения. Cell Biochem. Функц. 27, 276–283. DOI: 10.1002 / cbf.1569
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хаконен, А.Х., Гоффарт, С., Марджаваара, С., Паэтау, А., Купер, Х., Маттила, К. и др. (2008). Инфантильная спиноцеребеллярная атаксия и синдром митохондриальной рецессивной атаксии связаны с дефектом нейронального комплекса I и истощением мтДНК. Хум. Мол. Genet. 17, 3822–3835. DOI: 10.1093 / hmg / ddn280
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Heidenreich, P.A., Trogdon, J.G., Khavjou, O.A., Butler, J., Dracup, K., Ezekowitz, M.D., et al. (2011). Прогнозирование будущего сердечно-сосудистых заболеваний в Соединенных Штатах — политическое заявление Американской кардиологической ассоциации. Тираж 123, 933–944. DOI: 10.1161 / CIR.0b013e31820a55f5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Холик, М. Ф., Бинкли, Н. К., Бишофф-Феррари, Х. А., Гордон, К. М., Хэнли, Д. А., Хини, Р. П. и др. (2011). Оценка, лечение и профилактика дефицита витамина D: руководство по клинической практике эндокринного общества. J. Clin. Эндокринол. Метаб. 96, 1911–1930. DOI: 10.1210 / jc.2011-0385
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хоппе, П.П., и Креннрих Г. (2000). Биодоступность и эффективность природного и полностью рацемического альфа-токоферола у человека: спор. евро. J. Nutr. 39, 183–193. DOI: 10.1007 / s003
0010PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хорниккс, М., Ван Ремоортель, Х., Лехук, А., Матье, К., Маес, К., Гаян-Рамирес, Г., и др. (2012). Добавки витамина D во время реабилитации при ХОБЛ: вторичный анализ рандомизированного исследования. Респир.Res. 13:84. DOI: 10.1186 / 1465-9921-13-84
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Игнарро, Л. Дж., Балестриери, М. Л., и Наполи, К. (2007). Питание, физическая активность и сердечно-сосудистые заболевания: обновленная информация. Cardiovasc. Res. 73, 326–340. DOI: 10.1016 / j.cardiores.2006.06.030
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ингрэм, Л. М., Коутс, Т. Д., Аллен, Дж. М., Хиггинс, К. П., Баенер, Р. Л.и Боксер Л.А. (1982). Метаболические, мембранные и функциональные ответы полиморфно-ядерных лейкоцитов человека на фактор активации тромбоцитов. Кровь 59, 1259–1266.
PubMed Аннотация | Google Scholar
Цзян Л., Диаз П. Т., Бест Т. М., Стимпфл Дж. Н., Хе Ф. и Цзо Л. (2014). Молекулярная характеристика окислительно-восстановительных механизмов при аллергической астме. Ann. Allergy Asthma Immunol. 113, 137–142. DOI: 10.1016 / j.anai.2014.05.030
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонс, Л.W., и Demark-Wahnefried, W. (2006). Диета, физические упражнения и дополнительная терапия после первичного лечения рака. Ланцет Онкол. 7, 1017–1026. DOI: 10.1016 / S1470-2045 (06) 70976-7
CrossRef Полный текст | Google Scholar
Кандола, К., Боуман, А., и Берч-Машин, М.А. (2015). Окислительный стресс — ключевой возникающий фактор воздействия на здоровье, старение, образ жизни и эстетику. Внутр. J. Cosmet Sci. 37 (Дополнение 2), 1–8. DOI: 10.1111 / ics.12287
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хандрика, Л., Кумар, Б., Коул, С., Марони, П., и Коул, Х. К. (2009). Окислительный стресс при раке простаты. Cancer Lett. 282, 125–136. DOI: 10.1016 / j.canlet.2008.12.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кинг Д. А., Кордова Ф. и Шарф С. М. (2008). Аспекты питания хронической обструктивной болезни легких. Proc. Являюсь. Грудной. Soc. 5, 519–523. DOI: 10.1513 / pats.200707-092ET
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кольмайер, Л., и Гастингс, С. Б. (1995). Эпидемиологические данные о роли каротиноидов в профилактике сердечно-сосудистых заболеваний. Am. J. Clin. Nutr. 62, 1370–1376. DOI: 10.1093 / ajcn / 62.6.1370S
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кольмайер, Л., Карк, Дж. Д., Гомесграция, Э., Мартин, Б. К., Штек, С. Е., Кардинаал, А. Ф. и др. (1997). Ликопин и риск инфаркта миокарда в исследовании EURAMIC. Am. J. Epidemiol. 146, 618–626. DOI: 10.1093 / oxfordjournals.aje.a009327
CrossRef Полный текст | Google Scholar
Крегель, К. К., и Чжан, Х. Дж. (2007). Комплексный взгляд на окислительный стресс при старении: основные механизмы, функциональные эффекты и патологические соображения. Am. J. Physiol. Regul. Интегр. Комп. Physiol. 292, R18 – R36. DOI: 10.1152 / ajpregu.00327.2006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Крис-Этертон, П. М., Лихтенштейн, А. Х., Ховард, Б. В., Стейнберг, Д., Витцтум, Дж.L., et al. (2004). Антиоксидантные витаминные добавки и сердечно-сосудистые заболевания. Тираж 110, 637–641. DOI: 10.1161 / 01.Cir.0000137822.39831.F1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли Ю., Ма, К., Цянь, М., Вэнь, З., Цзин, Х., и Цянь, Д. (2014). Бутеин вызывает апоптоз клеток и ингибирование экспрессии циклооксигеназы 2 в клетках рака легкого A549. Мол. Med. Rep. 9, 763–767. DOI: 10.3892 / mmr.2013.1850
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Губы, П.(2001). Дефицит витамина D и вторичный гиперпаратиреоз у пожилых людей: последствия потери костной массы и переломов и терапевтические последствия. Endocr. Ред. 22, 477–501. DOI: 10.1210 / edrv.22.4.0437
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лоди, Р., Харт, П. Э., Раджагопалан, Б., Тейлор, Д. Дж., Крилли, Дж. Дж., Брэдли, Дж. Л. и др. (2001). Лечение антиоксидантами улучшает биоэнергетику сердца и скелетных мышц in vivo у пациентов с атаксией Фридрейха. Ann. Neurol. 49, 590–596. DOI: 10.1002 / ana.1001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мадаманчи, Н. Р., Вендров, А., Рунге, М. С. (2005). Окислительный стресс и сосудистые заболевания. Артериосклер. Тромб. Васк. Биол. 25, 29–38. DOI: 10.1161 / 01.ATV.0000150649.39934.13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маникандан, Р., Беуладжа, М., Арулвасу, К., Селламуту, С., Динеш, Д., Прабху, Д., и другие. (2012). Синергетическая противораковая активность куркумина и катехина: исследование in vitro с использованием линий раковых клеток человека. Microsc. Res. Tech. 75, 112–116. DOI: 10.1002 / jemt.21032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маргарителис, Н. В., Кобли, Дж. Н., Пасхалис, В., Вескукис, А. С., Теодору, А. А., Кипарос, А. и др. (2016). Принципы интеграции реактивных видов в биологические процессы in vivo: примеры из физиологии упражнений. Ячейка. Сигнал. 28, 256–271. DOI: 10.1016 / j.cellsig.2015.12.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мариани Э., Полидори М. К., Керубини А. и Мекоччи П. (2005). Окислительный стресс при старении мозга, нейродегенеративных и сосудистых заболеваниях: обзор. J. Chromatogr. B Анал. Technol. Биомед. Life Sci. 827, 65–75. DOI: 10.1016 / j.jchromb.2005.04.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Масоли, М., Фабиан, Д., Холт, С., Бизли, Р., и Программа Глобальной инициативы по астме (GINA) (2004). Глобальное бремя астмы: резюме отчета Комитета по распространению GINA. Аллергия 59, 469–478. DOI: 10.1111 / j.1398-9995.2004.00526.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мазо, Н. А., Эчеверриа, В., Кабесас, Р., Авила-Родригес, М., Алиев, Г., Лешек, Дж. И др. (2017). Лекарственные растения как защитные стратегии против болезни Паркинсона. Curr. Pharm. Des. 23, 4180–4188 DOI: 10.2174 / 1381612823666170316142803
PubMed Аннотация | CrossRef Полный текст | Google Scholar
МакКубри, Дж. А., Стилман, Л. С., Чаппелл, У. Х., Абрамс, С. Л., Вонг, Э. У., Чанг, Ф. и др. (2007). Роль пути Raf / MEK / ERK в росте клеток, злокачественной трансформации и лекарственной устойчивости. Biochim. Биофиз. Acta 1773, 1263–1284. DOI: 10.1016 / j.bbamcr.2006.10.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Микель, Дж.(2002). Может ли антиоксидантная диета защитить от возрастного повреждения митохондрий? Ann. Акад. Sci. 959, 508–516. DOI: 10.1111 / j.1749-6632.2002.tb02120.x
CrossRef Полный текст | Google Scholar
Морейра П. И., Чжу X., Ван Х., Ли Х. Г., Нуномура А., Петерсен Р. Б. и др. (2010). Митохондрии: терапевтическая мишень при нейродегенерации. Biochim. Биофиз. Acta 1802, 212–220. DOI: 10.1016 / j.bbadis.2009.10.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Морено-Масиас, Х., и Ромье, I. (2014). Влияние антиоксидантных добавок и питательных веществ на пациентов с астмой и аллергией. J. Allergy Clin. Иммунол. 133, 1237–1244; викторина 1245. DOI: 10.1016 / j.jaci.2014.03.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мори К., Шибанума М. и Нос К. (2004). Инвазивный потенциал, индуцированный длительным окислительным стрессом в эпителиальных клетках молочной железы. Cancer Res. 64, 7464–7472. DOI: 10.1158 / 0008-5472.CAN-04-1725
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моура, Ф.А., Де Андраде, К. К., Дос Сантос, Дж. К., Араужо, О. Р., и Гуларт, М. О. (2015). Антиоксидантная терапия при воспалительном заболевании кишечника: работает ли она? Редокс Биол. 6, 617–639. DOI: 10.1016 / j.redox.2015.10.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мпандзу, Г., Айт Бен Хадду, Э., Реграги, В., Беномар, А., Яхьяуи, М. (2016). Дефицит витамина D и его роль в неврологических состояниях: обзор. Rev. Neurol. 172, 109–122.DOI: 10.1016 / j.neurol.2015.11.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нагата К., Накамура К., Вада К., Оба С., Хаяши М., Такеда Н. и др. (2010). Связь пищевых жиров, овощей и антиоксидантных микронутриентов со старением кожи у японских женщин. руб. J. Nutr. 103, 1493–1498. DOI: 10.1017 / S00071145099
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Норат, Т., Скоччанти, К., Бутрон-Руо, М.К., Андерсон, А., Беррино, Ф., Чеккини, М. и др. (2015). Европейский кодекс против рака, 4-е издание: диета и рак. Cancer Epidemiol. 39 (Приложение 1), S56 – S66. DOI: 10.1016 / j.canep.2014.12.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Папперт, Э. Дж., Тангни, К. К., Гетц, К. Г., Линг, З. Д., Липтон, Дж. У., Стеббинс, Г. Т. и др. (1996). Альфа-токоферол в желудочковой спинномозговой жидкости пациентов с болезнью Паркинсона: исследование зависимости зависимости от дозы и корреляции с уровнями в плазме. Неврология 47, 1037–1042. DOI: 10.1212 / WNL.47.4.1037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паредес-Лопес, О., Сервантес-Сеха, М. Л., Винья-Перес, М., и Эрнандес-Перес, Т. (2010). Ягоды: улучшение здоровья человека и здоровое старение, а также повышение качества жизни — обзор. Растительная пища Hum. Nutr. 65, 299–308. DOI: 10.1007 / s11130-010-0177-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Патхак, С.К., Шарма Р. А. и Меллон Дж. К. (2003). Химиопрофилактика рака простаты с помощью диетических антиоксидантных средств и гормональных манипуляций (обзор). Внутр. J. Oncol. 22, 5–13. DOI: 10.3892 / ijo.22.1.5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паттен Д. А., Жермен М., Келли М. А. и Слэк Р. С. (2010). Активные формы кислорода: застряли в середине нейродегенерации. J. Alzheimers Dis. 20 (Приложение 2), S357 – S367. DOI: 10.3233 / JAD-2010-100498
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пауэлс, Р.А., и Рабе К. Ф. (2004). Бремя и клинические особенности хронической обструктивной болезни легких (ХОБЛ). Ланцет 364, 613–620. DOI: 10.1016 / S0140-6736 (04) 16855-4
CrossRef Полный текст | Google Scholar
Пелсер, К., Арем, Х., Пфайфер, Р. М., Елена, Дж. У., Альфано, К. М., Холленбек, А. Р. и др. (2014). Предиагностические факторы образа жизни и выживаемость после диагностики рака прямой и толстой кишки в Национальном институте здоровья (NIH) -AARP Diet and Health Study. Рак 120, 1540–1547.DOI: 10.1002 / cncr.28573
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Peng, C., Wang, X., Chen, J., Jiao, R., Wang, L., Li, Y.M, et al. (2014). Биология старения и роль диетических антиоксидантов. Biomed Res. Int. 2014: 831841. DOI: 10.1155 / 2014/831841
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фам-Хай, Л. А., Хе, Х. и Фам-Хай, К. (2008). Свободные радикалы, антиоксиданты в болезнях и здоровье. Внутр.J. Biomed. Sci. 4, 89–96.
Google Scholar
Пимпликар, С. В., Никсон, Р. А., Робакис, Н. К., Шен, Дж., И Цай, Л. Х. (2010). Амилоид-независимые механизмы в патогенезе болезни Альцгеймера. J. Neurosci. 30, 14946–14954. DOI: 10.1523 / Jneurosci.4305-10.2010
CrossRef Полный текст | Google Scholar
Полжак Б., Супут Д. и Милисав И. (2013). Достижение баланса между АФК и антиоксидантами: когда использовать синтетические антиоксиданты. Оксид. Med. Клетка. Longev. 2013:
2. DOI: 10.1155 / 2013/2PubMed Аннотация | CrossRef Полный текст | Google Scholar
Поульсен Х. Э., Прием Х. и Лофт С. (1998). Роль окислительного повреждения ДНК в инициации и развитии рака. евро. J. Cancer Prev. 7, 9–16.
Google Scholar
Proteggente, A. R., Pannala, A. S., Paganga, G., Van Buren, L., Wagner, E., Wiseman, S., et al. (2002). Антиоксидантная активность регулярно потребляемых фруктов и овощей отражает их фенольный и витаминный состав. Free Radic. Res. 36, 217–233. DOI: 10.1080 / 107157602
484
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рао, А. В., и Агарвал, С. (2000). Роль антиоксиданта ликопина при раке и сердечных заболеваниях. J. Am. Coll. Nutr. 19, 563–569. DOI: 10.1080 / 07315724.2000.1071895
CrossRef Полный текст | Google Scholar
Рэйман, М. П. (2005). Селен в профилактике рака: обзор доказательств и механизма действия. Proc. Nutr. Soc. 64, 527–542. DOI: 10.1079 / Pns2005467
CrossRef Полный текст | Google Scholar
Ребул, Э., Ришель, М., Перро, Э., Десмулен-Малезе, К., Пириси, В., и Борель, П. (2006). Биодоступность каротиноидов и витамина Е из их основных пищевых источников. J. Agric. Food Chem. 54, 8749–8755. DOI: 10.1021 / jf061818s
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Rego, A.C., и Oliveira, C.R. (2003).Дисфункция митохондрий и активные формы кислорода при эксайтотоксичности и апоптозе: значение для патогенеза нейродегенеративных заболеваний. Neurochem. Res. 28, 1563–1574. DOI: 10.1023 / A: 1025682611389
CrossRef Полный текст | Google Scholar
Роджерс, Н. М., Сигер, Ф., Гарсин, Э. Д., Робертс, Д. Д., и Изенберг, Дж. С. (2014). Регулирование растворимой гуанилатциклазы матричными тромбоспондинами: последствия для кровотока. Фронт. Physiol. 5: 134. DOI: 10.3389 / fphys.2014.00134
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рокайя, С., Ли, К. Дж., Чжао, Ю., Ли, Ю., и Сун, К. Х. (2014). Капуста ( Brassica oleracea L. var. Capitata) — фитохимические вещества с антиоксидантным и противовоспалительным потенциалом. Asian Pac. J. Cancer Prev. 14, 6657–6662. DOI: 10.7314 / APJCP.2013.14.11.6657
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Romieu, I.(2005). Питание и здоровье легких. Внутр. J. Tuberc. Lung Dis. 9, 362–374.
Google Scholar
Сано М., Эрнесто К., Томас Р. Г., Клаубер М. Р., Шафер К., Грундман М. и др. (1997). Контролируемое испытание селегилина, альфа-токоферола или обоих препаратов для лечения болезни Альцгеймера. N. Engl. J. Med. 336, 1216–1222. DOI: 10.1056 / NEJM199704243361704
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шолс, А.М., Феррейра, И. М., Франссен, Ф. М., Госкер, Х. Р., Янссенс, В., Мускаритоли, М. и др. (2014). Оценка питания и терапия при ХОБЛ: заявление Европейского респираторного общества. евро. Респир. J. 44, 1504–1520. DOI: 10.1183 / 036.00070914
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сечи, Г., Сечи, Э., Фойс, К., Кумар, Н. (2016). Достижения в клинических детерминантах и неврологических проявлениях дефицита витамина B у взрослых. Nutr.Ред. 74, 281–300. DOI: 10,1093 / Nutrit / nuv107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сессо, Х. Д., Бьюринг, Дж. Э., Чжан, С. М., Норкус, Э. П., и Газиано, Дж. М. (2005). Пищевой и плазменный ликопин и риск рака груди. Cancer Epidemiol. Биомаркеры Пред. 14, 1074–1081. DOI: 10.1158 / 1055-9965.EPI-04-0683
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шэрон П. и Стенсон У. Ф. (1984).Повышенный синтез лейкотриена B4 слизистой оболочкой толстой кишки при воспалительном заболевании кишечника. Гастроэнтерология 86, 453–460.
Google Scholar
Шей К. П., Моро Р. Ф., Смит Э. Дж., Смит А. Р. и Хаген Т. М. (2009). Альфа-липоевая кислота как пищевая добавка: молекулярные механизмы и терапевтический потенциал. Biochim. Биофиз. Acta 1790, 1149–1160. DOI: 10.1016 / j.bbagen.2009.07.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шинохара, М., Адачи, Ю., Мицусита, Дж., Кувабара, М., Нагасава, А., Харада, С., и др. (2010). Реактивный кислород, вырабатываемый НАДФН-оксидазой 1 (Nox1), способствует клеточной инвазии, регулируя продукцию матриксной металлопротеиназы-9 и миграцию клеток. J. Biol. Chem. 285, 4481–4488. DOI: 10.1074 / jbc.M109.071779
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Soerjomataram, I., Oomen, D., Lemmens, V., Oenema, A., Benetou, V., Trichopoulou, A., et al. (2010). Повышенное потребление фруктов и овощей и будущая заболеваемость раком в отдельных европейских странах. евро. J. Cancer 46, 2563–2580. DOI: 10.1016 / j.ejca.2010.07.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Соса, В., Молин, Т., Сомоса, Р., Пачуччи, Р., Кондо, Х., и Ме, Л. Л. (2013). Окислительный стресс и рак: обзор. Aging Res. Ред. 12, 376–390. DOI: 10.1016 / j.arr.2012.10.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Срилата С., Динеш Э. и Ума К. (2012). Антиоксидантные свойства листьев Rajgira ( Amaranthus paniculatus ) и потенциальный синергизм в химиопрофилактике. Asian Pac. J. Cancer Prev. 13, 2775–2780. DOI: 10.7314 / APJCP.2012.13.6.2775
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стивенс, Н. Г., Парсонс, А., Скофилд, П. М., Келли, Ф., Чизман, К., и Митчинсон, М. Дж. (1996). Рандомизированное контролируемое исследование витамина Е у пациентов с ишемической болезнью сердца: Кембриджское исследование сердечных антиоксидантов (CHAOS). Ланцет 347, 781–786. DOI: 10.1016 / S0140-6736 (96)
CrossRef Полный текст | Google Scholar
Штуки, Д.M., Ruegsegger, C., Steiner, S., Radecke, J., Murphy, M. P., Zuber, B., et al. (2016). Нарушения митохондрий вносят вклад в прогрессирование спиноцеребеллярной атаксии 1 типа и могут быть уменьшены с помощью нацеленного на митохондрии антиоксиданта MitoQ. Free Radic. Биол. Med. 97, 427–440. DOI: 10.1016 / j.freeradbiomed.2016.07.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сунь Дж., Чу Ю. Ф., Ву X. и Лю Р. Х. (2002). Антиоксидантная и антипролиферативная активность плодов обыкновенных. J. Agric. Food Chem. 50, 7449–7454. DOI: 10.1021 / jf0207530
CrossRef Полный текст | Google Scholar
Текленбург, С. Л., Миклборо, Т. Д., Флай, А. Д., Бай, Ю., и Стагер, Дж. М. (2007). Добавка аскорбиновой кислоты ослабляет вызванный физической нагрузкой бронхоспазм у пациентов с астмой. Респир. Med. 101, 1770–1778. DOI: 10.1016 / j.rmed.2007.02.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Томсон, К.А., Рок, К. Л., Томпсон, П. А., Каан, Б. Дж., Касслер, Э., Флатт, С. В. и др. (2011). Потребление овощей связано с уменьшением частоты рецидивов рака молочной железы у пользователей тамоксифена: вторичный анализ, проведенный в исследовании «Здоровое питание и жизнь женщин». Breast Cancer Res. Удовольствие. 125, 519–527. DOI: 10.1007 / s10549-010-1014-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Трифунович, А., Вреденберг, А., Фалькенберг, М., Спелбринк, Дж. Н., Ровио, А. Т., Брудер, К.E., et al. (2004). Преждевременное старение мышей, экспрессирующих дефектную митохондриальную ДНК-полимеразу. Природа 429, 417–423. DOI: 10.1038 / nature02517
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Труба, Г. П., Санчес, Г. М., и Джулиани, А. (2004). Свободные радикалы кислорода и механизм антиоксидантной защиты при раке. Фронт. Biosci. 9, 2029–2044. DOI: 10.2741 / 1335
CrossRef Полный текст | Google Scholar
Цагалиоти, Э., Трифонос, К., Морари, А., Вадиколиас, К., и Джиагинис, К. (2016). Клиническое значение статуса питания при нейродегенеративных заболеваниях: каково его влияние и как это влияет на прогрессирование заболевания и лечение? Nutr. Neurosci. 21, 162–175. DOI: 10.1080 / 1028415X.2016.1261529
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Турати, Ф., Росси, М., Пелукки, К., Леви, Ф., и Ла Веккья, К. (2015). Фрукты и овощи и риск рака: обзор южноевропейских исследований. руб. J. Nutr. 113 (Приложение 2), S102 – S110. DOI: 10.1017 / S0007114515000148
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уттара Б., Сингх А. В., Замбони П. и Махаджан Р. Т. (2009). Окислительный стресс и нейродегенеративные заболевания: обзор антиоксидантных терапевтических вариантов выше и ниже по течению. Curr. Neuropharmacol. 7, 65–74. DOI: 10.2174 / 157015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Валко, М., Родс, К. Дж., Монкол, Дж., Изакович, М., и Мазур, М. (2006). Свободные радикалы, металлы и антиоксиданты при раке, вызванном окислительным стрессом. Chem. Биол. Взаимодействовать. 160, 1–40. DOI: 10.1016 / j.cbi.2005.12.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ван Иден, С. Ф., и Син, Д. Д. (2013). Окислительный стресс при хронической обструктивной болезни легких: легкое и системный процесс. Кан. Респир. J. 20, 27–29. DOI: 10.1155 / 2013/509130
CrossRef Полный текст | Google Scholar
Варрасо, Р., Chiuve, S. E., Fung, T. T., Barr, R. G., Hu, F. B., Willett, W. C., et al. (2015). Альтернативный индекс здорового питания 2010 г. и риск хронической обструктивной болезни легких среди женщин и мужчин в США: проспективное исследование. BMJ 350: h386. DOI: 10.1136 / bmj.h386
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вивеканантан, Д. П., Пенн, М. С., Сапп, С. К., Хсу, А., и Тополь, Э. Дж. (2003). Использование витаминов-антиоксидантов для профилактики сердечно-сосудистых заболеваний: метаанализ рандомизированных исследований. Ланцет 362, 922–922. DOI: 10.1016 / S0140-6736 (03) 13637-9
CrossRef Полный текст | Google Scholar
Vonzglinicki, T., Saretzki, G., Docke, W., and Lotze, C. (1995). Легкая гипероксия укорачивает теломеры и подавляет пролиферацию фибробластов — модель старения. Exp. Cell Res. 220, 186–193. DOI: 10.1006 / excr.1995.1305
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Врилинг, А., Бак, К., Зайболд, П., Хайнц, Дж., Оби, Н., Флеш-Янис, Д. и др. (2013). Образцы питания и выживаемость у выживших после постменопаузального рака груди в Германии. руб. J. Cancer 108, 188–192. DOI: 10.1038 / bjc.2012.521
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уоллес, Дж. Л., и Чин, Б. С. (1997). Медиаторы воспаления при защите и травмах желудочно-кишечного тракта. Proc. Soc. Exp. Биол. Med. 214, 192–203. DOI: 10.3181 / 00379727-214-44087
CrossRef Полный текст | Google Scholar
Ван, X., Ouyang, Y. Y., Liu, J., Zhu, M. M., Zhao, G., Bao, W., et al. (2014a). Потребление фруктов и овощей и смертность от всех причин, сердечно-сосудистых заболеваний и рака: систематический обзор и метаанализ доза-реакция проспективных когортных исследований. BMJ 349: g4490. DOI: 10.1136 / bmj.g4490
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, X., Ван, В., Ли, Л., Перри, Г., Ли, Х. Г., и Чжу, X. W. (2014b). Окислительный стресс и дисфункция митохондрий при болезни Альцгеймера. Biochim. Биофиз. Acta 1842, 1240–1247. DOI: 10.1016 / j.bbadis.2013.10.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wells, P. G., Mccallum, G. P., Chen, C. S., Henderson, J. T., Lee, C. J., Perstin, J., et al. (2009). Окислительный стресс в причинах развития болезни: тератогенез, нарушения развития нервной системы и рак. Toxicol. Sci. 108, 4–18. DOI: 10.1093 / toxsci / kfn263
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уилсон, М.А., Шукитт-Хейл, Б., Калт, В., Ингрэм, Д. К., Джозеф, Дж. А., и Волков, К. А. (2006). Полифенолы черники увеличивают продолжительность жизни и термотолерантность у растений Caenorhabditis elegans . Ячейка старения 5, 59–68. DOI: 10.1111 / j.1474-9726.2006.00192.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Винтер, А. Н., Росс, Э. К., Уилкинс, Х. М., Станкевич, Т. Р., Уоллес, Т., Миллер, К. и др. (2017). Обогащенный антоцианом экстракт клубники задерживает начало заболевания и увеличивает выживаемость на мышиной модели бокового амиотрофического склероза hSOD1G93A. Nutr. Neurosci. DOI: 10.1080 / 1028415X.2017.1297023 [Epub перед печатью].
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вуд, Л. Г., Гарг, М. Л., Смарт, Дж. М., Скотт, Х. А., Баркер, Д., и Гибсон, П. Г. (2012). Управление потреблением антиоксидантов при астме: рандомизированное контролируемое исследование. Am. J. Clin. Nutr. 96, 534–543. DOI: 10.3945 / ajcn.111.032623
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Всемирный фонд исследований рака / Американский институт исследований рака (2007 г.). Продовольствие, питание, физическая активность и профилактика рака: глобальная перспектива. Вашингтон, округ Колумбия: AICR.
Google Scholar
Xie, Q., Bai, Q., Zou, L.Y., Zhang, Q.Y., Zhou, Y., Chang, H., et al. (2014). Генистеин подавляет метилирование ДНК и увеличивает экспрессию генов-супрессоров опухолей в клетках рака груди человека. Гены Хромосомы Рак 53, 422–431. DOI: 10.1002 / gcc.22154
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ян, М.Х., Ван, X., Чжу, X. (2013). Дефекты митохондрий и окислительный стресс при болезни Альцгеймера и Паркинсона. Free Radic. Биол. Med. 62, 90–101. DOI: 10.1016 / j.freeradbiomed.2012.11.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Заиди, С. М., и Бану, Н. (2004). Антиоксидантный потенциал витаминов А, Е и С в модуляции окислительного стресса в мозге крыс. Clin. Чим. Acta 340, 229–233. DOI: 10.1016 / j.cccn.2003.11.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Занди, П.П., Энтони, Дж. К., Хачатурян, А. С., Стоун, С. В., Густафсон, Д., Чанц, Дж. Т. и др. (2004). Снижение риска болезни Альцгеймера у пользователей антиоксидантных витаминных добавок: исследование округа Кэш. Arch. Neurol. 61, 82–88. DOI: 10.1001 / archneur.61.1.82
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, Y.J., Gan, R.Y., Li, S., Zhou, Y., Li, A.N., Xu, D.P., et al. (2015). Фитохимические антиоксиданты для профилактики и лечения хронических заболеваний. Molecules 20, 21138–21156. DOI: 10,3390 / молекулы201219753
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжоу Т., Пратер Э. Р., Гаррисон Д. Э. и Цзо Л. (2018). Взаимодействие между АФК и антиоксидантами при ишемии-реперфузии сердечных и скелетных мышц. Внутр. J. Mol. Sci. 19: E417. DOI: 10.3390 / ijms1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжу Х. и Ли Ю. Р.(2012). Окислительный стресс и окислительно-восстановительные сигнальные механизмы воспалительного заболевания кишечника: обновленные экспериментальные и клинические данные. Exp. Биол. Med. 237, 474–480. DOI: 10.1258 / EBM.2011.011358
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зино С., Скефф М., Уильямс С. и Манн Дж. (1997). Рандомизированное контролируемое исследование влияния потребления фруктов и овощей на плазменные концентрации липидов и антиоксидантов. BMJ 314, 1787–1791.DOI: 10.1136 / bmj.314.7097.1787
CrossRef Полный текст | Google Scholar
Цзо, Л., Хеммельгарн, Б. Т., Чуанг, К. К., Бест, Т. М. (2015a). Роль эпигенетических изменений, вызванных окислительным стрессом, в продукции бета-амилоида при болезни Альцгеймера. Оксид. Med. Клетка. Longev. 2015: 604658. DOI: 10.1155 / 2015/604658
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цзо, Л., Мазервелл, М. С. (2013). Влияние активных форм кислорода и генетических мутаций митохондрий на болезнь Паркинсона. Gene 532, 18–23. DOI: 10.1016 / j.gene.2013.07.085
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цзо, Л., Чжоу, Т., Паннелл, Б. К., Зиглер, А. К., и Бест, Т. М. (2015b). Биологическая и физиологическая роль активных форм кислорода — хорошего, плохого и уродливого. Acta Physiol. 214, 329–348. DOI: 10.1111 / apha.12515
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Роль антиоксидантной системы при интенсивных упражнениях на выносливость: уроки перелетных птиц | Журнал экспериментальной биологии
На сложных этапах жизненного цикла многие животные могут использовать антиоксиданты из своего рациона, чтобы защитить себя или своих детенышей от сильного окислительного повреждения.Например, у млекопитающих витамин Е важен для кормящих свиноматок, чтобы иметь здоровых поросят (Lauridsen et al., 2002). У птиц гульдовы зяблики ( Erythrura gouldiae ), которые подвергались холодовому стрессу и получали семена, богатые полифенолами, имели на 25% меньшее окислительное повреждение без изменения их антиоксидантной способности по сравнению с семенами, получавшими корм с более низким содержанием полифенолов (Beaulieu et al., 2014). Соответственно, зяблики значительно увеличили потребление семян с высоким содержанием полифенолов в холодных условиях, но не потребление семян с низким содержанием полифенолов (Beaulieu et al., 2014). В эксперименте по выбору дикие черные шапки во время сезона размножения выбирали пищу, содержащую флавоноиды, вместо диеты без флавоноидов (Catoni et al., 2008a). Весной после миграционных перелетов золотистый ржанок ( Pluvialis apricaria ) потребляет большое количество вороники ( Empetrum spp.) С высокими концентрациями антоцианов (Ogawa et al., 2008; Piersma and Jukema, 2002), что указывает на что антиоксиданты, содержащиеся в ягодах, можно использовать в терапевтических целях, чтобы помочь птицам справиться с окислительным повреждением, нанесенным им во время перелетов.Во время осенней миграции многие виды певчих птиц полагаются на сезонно обильные фрукты для пополнения запасов во время остановок, и присутствие плодоносящих видов может быть более важным, чем структура среды обитания при определении использования среды обитания птицами во время миграции (Eggers, 2000; Parrish, 1997; Sapir et al. al., 2004; Smith, McWilliams, 2014; Smith et al., 2007; Suthers et al., 2000). Птицы потребляют фрукты во время миграции как важный источник жира (Smith and McWilliams, 2010; Smith et al., 2007; Thompson and Willson, 1979), но также есть свидетельства того, что птицы выбирают фрукты на основе содержания антиоксидантов в рационе (рис.3; Алан и др., 2013; Bolser et al., 2013; Schaefer et al., 2008; Скрип и др., 2015). Черношапочные и садовые певчие птицы на остановках выбирали фрукты с высоким содержанием липидов и более темного цвета, что указывает на то, что они содержат больше полифенолов (Schaefer et al., 2014). Птицы на месте остановки во время осенней миграции употребляли плоды стрелы ( Viburnum spp.) С большей готовностью, чем другие плоды, причем количество общих антиоксидантов, общих антоцианов и фенольных соединений было выше, чем в других обильных плодах на месте остановки (Bolser et al., 2013). Плоды Arrowwood также имели высокое содержание жира (41,3 ± 5,8%), общих липофильных антиоксидантов и общих токоферолов (Alan et al., 2013; Bolser et al., 2013; Smith et al., 2007). Однако птицы не всегда выбирают фрукты с высоким содержанием антиоксидантов. Например, ягоды лианы Вирджинии богаты жирами, но относительно бедны антиоксидантами и преимущественно потребляются птицами (рис. 3). Взятые вместе, эти исследования показывают, что мигрирующие птицы могут иметь возможность визуально оценивать и выбирать фрукты с высоким содержанием антиоксидантов, возможно, для профилактического накопления запасов антиоксидантов перед последующими миграционными полетами (Skrip et al., 2015) или для терапевтического восстановления повреждений после миграционных перелетов (Piersma and Jukema, 2002). Однако относительная роль содержания жира и антиоксидантов в выборе пищи птицами во время миграции явно требует дальнейшего изучения.
добавок антиоксидантов в смазочные материалы | Смазочные материалы Най
Антиоксиданты — это присадки, предназначенные для продления срока службы смазочного материала за счет повышения стойкости базового масла к окислению. Антиоксиданты позволяют смазочным материалам работать при более высоких температурах, чем это было бы возможно без них.Многие синтетические смазочные материалы, особенно смазочные масла на углеводородной основе, подвержены разложению под действием кислорода. Этот процесс окисления, который инициируется образованием активных свободных радикалов и пероксидов, является основной причиной загустения масла и образования шлама и нагара во многих областях применения.
Что происходит во время цикла окисления?
Деструктивное окисление масла можно описать как циклический процесс, включающий начало, распространение, разветвление и завершение.Если цикл не прерван или не прерван, окисление будет продолжаться до тех пор, пока масло или смазка не станут непригодными для использования.
Цикл окисления
Первичные АО реагируют здесь с очень реактивными радикалами, замедляя разложение, разрывая самораспространяющиеся радикальные цепи. Вторичные АО реагируют здесь с присутствующими реакционноспособными пероксидами, нарушая цикл окисления.
Есть два типа антиоксидантов: первичные и вторичные антиоксиданты.Первичные антиоксиданты обычно состоят из ароматических аминов и затрудненных фенолов. Вторичные антиоксиданты обычно состоят из фосфитов и определенных серосодержащих соединений, таких как тиоэфиры и тиоэфиры. Каждый тип антиоксиданта выполняет свою функцию по подавлению окисления.
Процесс окисления начинается с фазы инициации, когда образуются свободные радикалы. Первичные антиоксиданты — это «поглотители радикалов», которые быстро реагируют со свободными радикалами во время фазы распространения, замедляя процесс разложения за счет образования новых радикалов, которые являются более стабильными.Вторичные антиоксиданты реагируют с пероксидами, которые часто присутствуют, поскольку смазочное масло реагирует с кислородом. Эти антиоксиданты несут ответственность за разрыв цикла и предотвращают разветвление и дальнейшее размножение. Чаще всего составители консистентных смазок используют комбинацию первичных и вторичных антиоксидантов для максимальной защиты масла от окислительной деградации.
Как мы измеряем стойкость к окислению?
Чаще всего для измерения эффективности пакета антиоксидантных присадок используется сканирующий калориметр перепада давления (PDSC).Этот тест измеряет способность масла или консистентной смазки противостоять окислению в очень требовательной среде с высоким давлением, богатой кислородом, при повышенных температурах в соответствии с методом ASTM D-6186. Обычно указывается в «минутах», и чем больше времени требуется для возникновения экзотермической реакции, тем лучше окислительная стабильность.
Правильная комбинация антиоксидантов имеет решающее значение для характеристик смазки в условиях вашего применения.