Почему нашему организму необходимы антиоксиданты и как их получить
Зачем нужны антиоксиданты
Антиоксиданты защищают организм от действия свободных радикалов — реактивных форм кислорода. Свободный радикал — это молекула с неспаренным электроном, из-за которого она забирает электрон у других молекул. Отобрав его, свободный радикал нейтрализует себя, но при этом образуются другие свободные радикалы, причём очень быстро, до 1 000 реакций за секунду.
Свободные радикалы постоянно возникают в организме в процессе утилизации кислорода, образуются при борьбе с инфекциями, вирусами, антигенами и токсинами. Их количество может повысить интенсивная физическая активность, хроническое воспаление, инфекция, аллергия и вредные вещества: сигаретный дым, пестициды, инсектициды и прочие.
Свободные радикалы разрушают клетки организма, вызывая старение, сердечно-сосудистые заболевания, катаракту, дисфункцию мозга и рак. К счастью, наше тело защищается с помощью антиоксидантов.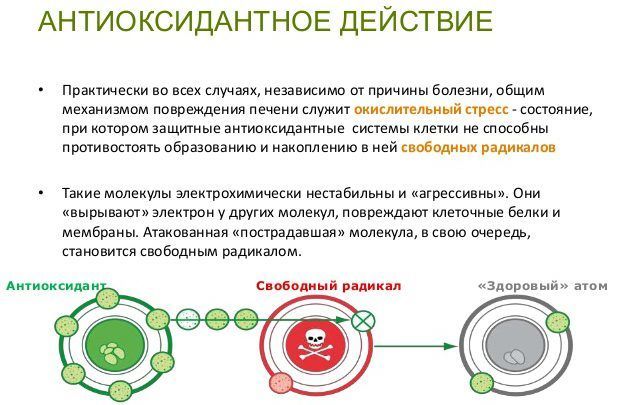 Эти вещества обезвреживают свободные радикалы, прежде чем они атакуют клетки.
Эти вещества обезвреживают свободные радикалы, прежде чем они атакуют клетки.
Сколько антиоксидантов нужно организму
Поскольку реактивные формы кислорода образуются, помимо прочего, и в процессе усвоения пищи, сразу после еды ваша антиоксидантная защита падает. Поэтому питательные вещества необходимо добавлять в каждый приём пищи, их количество зависит от общего потребления калорий.
Ниже приведён график из исследования профессора Роналда Приора (Ronald Prior) из Арканзасского центра детского питания.
Ориентируйтесь по своей норме калорий. Мужчины в среднем потребляют около 2 500 ккал в день, а женщины — 1 800–2 000 ккал. Получается, что мужчинам необходимо добавить 11 ммоль антиоксидантов в день, а женщинам — 8 ммоль.
Человеку необходимо потреблять 8–11 ммоль антиоксидантов в день.
И хотя вредные привычки, изматывающие тренировки и плохая экология повышают потребность организма в антиоксидантах, потреблять их стоит с осторожностью, особенно в виде добавок. Большое содержание бета-каротина увеличивает риск рака лёгких у курильщиков, а высокие дозы витамина Е могут спровоцировать рак простаты и инсульт.
Большое содержание бета-каротина увеличивает риск рака лёгких у курильщиков, а высокие дозы витамина Е могут спровоцировать рак простаты и инсульт.
Чтобы сохранить здоровье и избежать негативных последствий, нельзя концентрироваться только на одном виде антиоксидантов, надо получать их в комплексе. Эти вещества работают как команда, и чем больше в ней игроков, тем лучше они действуют.
Продукты с высоким содержанием антиоксидантов
Для удобства мы распределили все продукты по категориям. Значения взяты из исследования норвежских учёных 2009 года.
Ягоды
| Название | Количество антиоксидантов, ммоль на 100 граммов |
| Шиповник свежий | 12–34 |
| Чёрная смородина | 5,5–9 |
| Черника | 7–8,5 |
| Ежевика | 3,8–6 |
| Брусника | 5 |
| Клюква | 3 |
| Малина | 2–3 |
| Голубика | 1–3 |
| Клубника | 1,85–2 |
Напитки
| Название | Количество антиоксидантов, ммоль на 100 граммов |
| Кофе | 2–3 |
| Красное вино | 2–3 |
| Зелёный чай | 1–2 |
| Виноградный сок | 0,69–1,74 |
Сладости
| Название | Количество антиоксидантов, ммоль на 100 граммов |
| Тёмный шоколад с содержанием какао 68–70% | 7–14 |
| Батончики гранола | 0,4–0,8 |
Фрукты
| Название | Количество антиоксидантов, ммоль на 100 граммов |
| Гранат | 1,76–9,05 (вместе с мембранами) |
| Оливки с косточкой | 2–3 |
| Виноград чёрный | 0,79–2,42 |
| Слива | 0,8–1,42 |
| Ананас | 1–1,36 |
| Апельсин | 1,08 |
| Киви | 1,02 |
| Лимон | 1,02 |
Сухофрукты
| Название | Количество антиоксидантов, ммоль на 100 граммов |
| Сушёные яблоки | 1,86–6,07 |
| Сушёная вишня | 4,05 |
| Курага | 1,32–4,67 |
| Чернослив | 1,95–3,70 |
| Сушёный инжир | 0,75–1,83 |
| Изюм | 0,91–1,14 |
Травы и специи
| Название | Количество антиоксидантов, ммоль на 100 граммов |
| Гвоздика | 125–465 |
| Корица | 17–139 (мексиканская) |
| Перечная мята, сушёные листья | 160 |
| Сушёная душица | 40–96 |
| Сушёный розмарин | 35–66 |
| Сушёный тимьян (чабрец) | 42–63 |
| Шафран | 27–61 |
| Шалфей | 34–58 |
| Эстрагон | 44 |
| Мускатный орех | 20–43 |
| Базилик сушёный | 9–30 |
| Сушёный имбирь | 11–24 |
| Карри | 4–14 |
| Чили | 2–12 |
| Сушёный чеснок | 2,5–11 |
| Зира | 2–11 |
| Чёрный перец | 4–8 |
| Кайенский перец | 4–5 |
| Тмин | 3–4 |
Овощи
| Название | Количество антиоксидантов, ммоль на 100 граммов |
| Артишок, варёный или приготовленный в микроволновке | 3–4 |
| Красная капуста | 2,15 |
| Шпинат, замороженный и приготовленный в микроволновке | 1,10–1,35 |
| Брюссельская капуста | 0,74–1,33 |
| Красный перец | 0,91–1,24 |
| Брокколи | 0,25–1 |
| Красный лук | 0,71 |
Орехи и семена
| Название | Количество антиоксидантов, ммоль на 100 граммов |
| Грецкий орех вместе с плёнками | 13–33,3 |
| Орех пекан | 7,31–10,62 |
| Семечки подсолнуха | 5,3–7,5 |
| Фисташки | 1–4,28 |
| Арахис, жаренный со шкуркой | 1,97 |
Замените выпечку и сладости на сухофрукты и ягоды, добавьте в рацион больше свежих овощей, специй и орехов, пейте кофе и зелёный чай.
В таком случае свободные радикалы, возникающие от усвоения углеводов, будут устраняться антиоксидантами, и вы сможете избежать окислительного стресса, а вместе с ним и многих опасных заболеваний.
Читайте также
Антиоксидантное действие | Адаптогены
Окислительное повреждение является одним из основных механизмов старения . Окисление и спонтанное разрушение химических связей должны всегда защищать все живые организмы. Это делается либо заменой или восстановлением поврежденных молекул, либо предотвращением повреждения при поглощении окислителей и свободных радикалов. Вещества, способные нейтрализовать окислители, свободные радикалы и частично восстанавливающие окисленные молекулы, называются антиоксидантами . Теория окисления и антиоксидантов известна очень долго (19 век), но большая мода антиоксидантной пищи дошла до конца 20-го века. Эта волна моды сегодня находится на спаде, потому что обнаруживается, что антиоксиданты очень многочисленны в природе — они встречаются в организме всех растений и животных. Наше тело знало о антиоксидантах задолго до того, как наши химики и очень сильные антиоксиданты являются естественной частью нашей внеклеточной и внутриклеточной жидкости. Тем не менее, антиоксиданты остаются важными, поскольку, например, при приготовлении пищи антиоксиданты, содержащиеся в овощах и специях, защищают продукты от окислительного ухудшения.
Наше тело знало о антиоксидантах задолго до того, как наши химики и очень сильные антиоксиданты являются естественной частью нашей внеклеточной и внутриклеточной жидкости. Тем не менее, антиоксиданты остаются важными, поскольку, например, при приготовлении пищи антиоксиданты, содержащиеся в овощах и специях, защищают продукты от окислительного ухудшения.
Модные антиоксидантные диеты отступают
Читатель из множества статей о здоровых культурах может легко создать впечатление, что крупнейшим в мире антиоксидантным победителем является как-то слишком много растений (и грибов!). За последние несколько месяцев я видел, как этот маникюр маринует (« Lycium Plus — самый сильный антиоксидант, который в настоящее время присутствует на рынке ». ), наклон («у Чаги самый высокий показатель ORAC, когда-либо записанный для натуральной пищи! » ), Чай (Полифенолы!), Гренадер Фрукты (« Гранат — самый мощный антиоксидант всех фруктов »). ), ресвератрол красного вина (« Согласно последним исследованиям, ActiVin является самым сильным антиоксидантом ». ) кто хочет. Когда я прочитал некоторые индексы индекса антиоксидантной силы, я был удивлен, что в этом конкретном столе была «специя» — куркума — и еще около 5 других специй в районе вокруг Марианы (я ее не помню , черного перца не было).
) кто хочет. Когда я прочитал некоторые индексы индекса антиоксидантной силы, я был удивлен, что в этом конкретном столе была «специя» — куркума — и еще около 5 других специй в районе вокруг Марианы (я ее не помню , черного перца не было).
Как заметил Давыдов ( Davydov2000es , стр. 378), « будущее антиоксидантов в настоящее время не выглядит слишком розовым ». Было показано, что переедание антиоксидантными витаминами или бета-каротином не приносит пользы (например, Rautalahti1997bdn , Teixeira2009adn ), возможно, за исключением витамина С. Уже давно известно, что антиоксидант витамина А является ядовитым при передозировке, позже признан канцерогенным. В настоящее время подозревается даже бета-каротин ( Rautalahti1997bdn ), в то время как родственные каротиноиды ликопен и лютеин по-прежнему полезны. Тот факт, что химическое вещество является антиоксидантом, не обязательно означает, что он нам полезен. И поскольку эта статья является беспредметной статьей, я бы добавил, что, несмотря на вышеизложенное, у меня есть хороший субъективный опыт с высокими дозами витаминов С и Е.
Антиоксиданты, напротив, очень полезны в пищевой промышленности
Давайте вспомним, сколько источников побуждает нас варить на короткое время, потому что во время длительной кулинарии говорят, что витамин С полностью разлагается. Эти источники не говорят, что это из-за витамина С, который мы даем супу! Листовые овощи, в том числе кислые капусты, защищают суп от окисления витамином С, который потребляется во время приготовления пищи и работает главным образом в водной фазе. Специи (майоран, куркума и другие, такие как морковь) также содержат другие антиоксиданты, которые защищают жиры. Это одна из основных причин добавления специй в супы и другие блюда. Вторая важная причина — содержание активных ингредиентов в овощах и специях. До третьего места — вкус.
Гойя чампуру — традиционная японская кухня
Это правда, что вы привыкли к разнообразным вкусам специй, только если это здорово и полезно. Во многих местах земного шара интенсивное использование горькой Момордики , которая содержит витамин С в форме провитамина, растительного аналога инсулина и других лекарственных веществ, является горьким, как дьявол. Суп Момордика не ел при первой дегустации, потому что я подозревал, что кухня случайно вылила пыль насекомого на кухню (колбаса Йозефа Линека, а не майоран в последней главе романа Гашека). Сначала мне нужно было убедиться, что интенсивный горький вкус супа не был результатом ошибки кухни. После того, как я убедился, что такой горький овощной суп существует и даже очень заживает, я начал привыкать к нему. Что, если пиво и Фернет, почему бы не горький суп. Вскоре я даже не знал массового бульона без momordica. Точно так же шоколад (точнее какау), сильный антиоксидант, вкус которого мы когда-то считали отвратительным. Так что только этот горький коричневый порошок в шоколаде не для вкуса, а для исцеления. Вот почему они продают плохой шоколад с 70%, 80% и 90% какао.
Суп Момордика не ел при первой дегустации, потому что я подозревал, что кухня случайно вылила пыль насекомого на кухню (колбаса Йозефа Линека, а не майоран в последней главе романа Гашека). Сначала мне нужно было убедиться, что интенсивный горький вкус супа не был результатом ошибки кухни. После того, как я убедился, что такой горький овощной суп существует и даже очень заживает, я начал привыкать к нему. Что, если пиво и Фернет, почему бы не горький суп. Вскоре я даже не знал массового бульона без momordica. Точно так же шоколад (точнее какау), сильный антиоксидант, вкус которого мы когда-то считали отвратительным. Так что только этот горький коричневый порошок в шоколаде не для вкуса, а для исцеления. Вот почему они продают плохой шоколад с 70%, 80% и 90% какао.
Основными пищевыми антиоксидантами являются жирорастворимый витамин Е, витамин А и каротиноиды (провитамины витамина А), главным образом ликопин, лютеин и зеаксантин. Но в супах и консервах мы можем добавить приобретенный витамин С в кристаллической форме — не хуже натуральной.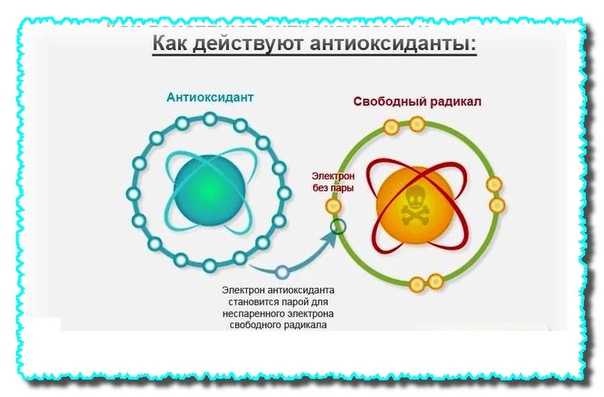 С добавлением витаминов C и E мы также встречаем косметику. Что касается специй (овощи, закуски …), я не чувствую себя призванным давать авторитетные списки. Но не забывайте, что куркума , майоран, розмарин и все средиземноморские травы, momordica , какао, красные и черные ягоды (черника, ежевика, черная смородина), помидоры, макароны и другие чудесные баклажаны с их каротиноидами, не говоря уже о обычных овощах супа. Также стоит упомянуть каротиноиды морских водорослей — фукоксантин, фукоидан и астаксантин. Сушеные водоросли, пригодные для супа, легко доступны в нашей стране. Высокий антиоксидантный индекс также включает в себя некоторые губки (специи и т. Д.) И лекарственные продукты, упомянутые в предыдущем абзаце (оливки, чайная ложка, гранат, красное вино и т. Д.). Стоит отметить, что красное вино — это не просто роскошный манекен, а это также имеет важное значение для здоровья.
С добавлением витаминов C и E мы также встречаем косметику. Что касается специй (овощи, закуски …), я не чувствую себя призванным давать авторитетные списки. Но не забывайте, что куркума , майоран, розмарин и все средиземноморские травы, momordica , какао, красные и черные ягоды (черника, ежевика, черная смородина), помидоры, макароны и другие чудесные баклажаны с их каротиноидами, не говоря уже о обычных овощах супа. Также стоит упомянуть каротиноиды морских водорослей — фукоксантин, фукоидан и астаксантин. Сушеные водоросли, пригодные для супа, легко доступны в нашей стране. Высокий антиоксидантный индекс также включает в себя некоторые губки (специи и т. Д.) И лекарственные продукты, упомянутые в предыдущем абзаце (оливки, чайная ложка, гранат, красное вино и т. Д.). Стоит отметить, что красное вино — это не просто роскошный манекен, а это также имеет важное значение для здоровья.
Адаптогены — это больше, чем просто антиоксиданты
Когда вы изучаете литературу отдельно от эффектов различных адаптогенов, вы часто сталкиваетесь с большим количеством публикаций, посвященных антиоксидантному эффекту. Здесь я хотел бы сказать вам, что вам нужно взять несколько резервов этой публикации. Исследователи Adaptogen также являются просто людьми и имеют привычные привычки, одним из которых является то, что они уделяют слишком много внимания антиоксидантным эффектам и часто смешивают адаптогенные и антиоксидантные эффекты. Почему это так? Это связано как с антиоксидантным способом, так и с простотой измерения антиоксидантного эффекта. Это, с одной стороны, эксперименты, ориентированные на прямой антиоксидантный индекс травы, а вторая попытка измерения цитопротекторного эффекта. Например, культура ткани in vitro подвергается окислительному стрессу, добавляется растительный экстракт и его эффект сравнивается с известными антиоксидантами. И если будет обнаружено, что трава защищает клетки от смерти, они говорят об антиоксидантном эффекте. Эта неточность молчит в научных травяных журналах, но профессиональные защитники должны понимать, что адаптогены в основном защищают клетки от различного, чем непосредственное поглощение реактивного кислорода и радикалов .
Здесь я хотел бы сказать вам, что вам нужно взять несколько резервов этой публикации. Исследователи Adaptogen также являются просто людьми и имеют привычные привычки, одним из которых является то, что они уделяют слишком много внимания антиоксидантным эффектам и часто смешивают адаптогенные и антиоксидантные эффекты. Почему это так? Это связано как с антиоксидантным способом, так и с простотой измерения антиоксидантного эффекта. Это, с одной стороны, эксперименты, ориентированные на прямой антиоксидантный индекс травы, а вторая попытка измерения цитопротекторного эффекта. Например, культура ткани in vitro подвергается окислительному стрессу, добавляется растительный экстракт и его эффект сравнивается с известными антиоксидантами. И если будет обнаружено, что трава защищает клетки от смерти, они говорят об антиоксидантном эффекте. Эта неточность молчит в научных травяных журналах, но профессиональные защитники должны понимать, что адаптогены в основном защищают клетки от различного, чем непосредственное поглощение реактивного кислорода и радикалов .
Например, женьшень , чей непосредственный антиоксидантный эффект ниже среднего, по-прежнему содержит сотни публикаций ( Medline более 300), которые говорят о «антиоксидантных свойствах женьшеня» (см. Huong1998vaa , Xie2006aeg , Xiang2008cau , Liao2002neg и др.). Что они означают? Это означает, вероятно, его косвенные эффекты, которые имитируют антиоксидантный эффект:
- Согласно Ramesh3012pgr, женьшень защищает от окисления липидов и старения путем косвенного увеличения активности природных антиоксидантных систем (супероксиддисмутаза, каталаза, глутатион и его обслуживающие ферменты, витамин С и Е).
- Сотни публикаций документируют способность женьшеня защищать окисленное повреждение клеток от контролируемой гибели клеток (апоптоз), которая имитирует антиоксидантный эффект. По этой причине женьшень является эффективным средством против старения и высокоэффективным антирадиационным средством, о котором уже сообщалось в 1980-х годах рентгенологом Морио Йонезава ( Yonezawa1976rri , Yonezawa1981rri , Yonezawa1985rri ).

- Женьшень (и другие адаптогены) действуют против воспаления, поэтому нет окислительной среды в пораженном органе (например, сердце или инсульт после инсульта), которые иначе возникли бы из-за тревожного ответа иммунной клетки. Таким образом, женьшень защищает сердце и нервные клетки без прямого действия антиоксиданта.
- Кроме того, после нежного потребления алкоголя женьшень успокаивает иммунные клетки в головном мозге (называется микроглия ), лечит похмелье и предотвращает потерю клеток мозга. Другими словами, женьшень оказывает нейропротективное действие на химическую нагрузку головного мозга без прямого действия антиоксиданта.
- Женьшень часто говорит о защите сосудистого эндотелия от окислительного повреждения (см., Например, Kwok2010gpp ), что можно подумать, что женьшень является антиоксидантом. Однако это также косвенный эффект. (Примечание: эндотелий сосудов является внутренним вестибулярным сосудом, окислительный ущерб которого приводит к атеросклерозу .
 )
)
Прямой антиоксидантный эффект — как я уже сказал, — женьшень не выделяется. Например, гинсенозид сапонин гинсенозид Rb1 непосредственно поглощает гидроксильные радикалы ( Lu2012grd ), но этот эффект далек от достижения прочности обычных антиоксидантных витаминов C и E.
Китайская белка — типичный антиоксидантный адаптоген
Антиоксидантные эффекты LBP ( Li2007elb ) и флавоноидов ( Le2007iqa ), извлеченные из фруктов goji , были продемонстрированы in vitro и в модельных организмах. Механизм действия аналогичен для обеих групп — редуктивные функции, хелатирование ионов металлов и свободных радикалов. Бетаин может также способствовать общему антиоксидантному эффекту ( Ren1995pal ). Однако больше внимания уделяется LBP. Показано, что экстракт LBP оказывает защитное действие на поврежденные кровью крысиные семенники in vivo и Т-клетки мышей in vitro, поврежденных H 2 O 2 . ( Luo2006lbp ) Кролики с продуктами с высоким содержанием холестерина снизили содержание триацилглицерина в крови после введения LBP, улучшили показатели HDL до общего уровня холестерина и окислительного стресса ( Ma2005elb ). Исследование с аналогичными результатами было также проведено на мышах, получавших высокоуглеводную муку ( Ming2009elb ). Диабетические мыши значительно снижали уровень холестерина в плазме, уровень инсулина и глюкозы после введения LBP, в то время как изменение окислительного повреждения и штамма, индуцированного стрептозотоцином, было меньше, чем когда LBP не вводили мышам ( W2006elb ) ( Li2007pel ) ( Zhao2005elb ).
Исследование с аналогичными результатами было также проведено на мышах, получавших высокоуглеводную муку ( Ming2009elb ). Диабетические мыши значительно снижали уровень холестерина в плазме, уровень инсулина и глюкозы после введения LBP, в то время как изменение окислительного повреждения и штамма, индуцированного стрептозотоцином, было меньше, чем когда LBP не вводили мышам ( W2006elb ) ( Li2007pel ) ( Zhao2005elb ).
Антиоксидантные эффекты распространены в адаптогенах
Составление полного списка адаптогенов с антиоксидантными эффектами было бы нелегко или желательно, потому что они распространены в растительных (грибковых, животных …) сферах. В качестве еще одного примера я упомянул высокоэффективный антиоксидантный куркумин ( Ak2008ars ) с длинным ушастым куркумом , салидрозид из розовой розетки ( Yang2016sao ) и антиоксидантный полифенол байкальского шихака ( Shang2010gse , Waisundara2008sbe ), не говоря уже о чайном дереве. Сильные чудесные антиоксидантные эффекты — это вся чудесная семья Solanaceae с гребешком, витанией, мочи, паприкой и помидорами, чудотворной семьей Lamiaceae с шагами, орегано, шалфеем и другими родами и бесчисленными другими чудесными таксонами растений и грибов, включая чудесные глянцевые глянцевые грибы ( Mohsin2011daa ) .
Полный гид по полифенолам
Научные исследования XX века показали, что одна из причин, по которым растительная пища полезна для организма человека — присутствие в ней полифенолов.
Сегодня мы расскажем, что это, в каких продуктах встречаются полифенолы, и в чем их польза.
Полифенолы — класс органических соединений, которые обладают антиоксидантными свойствами и входят в состав большинства растений.
Из-за большого разнообразия полифенолов и растений, в которых они содержатся, эти соединения разделяют в зависимости от источника происхождения, функции полифенолов и их химической структуры. Основные из них — флавоноиды, фенольные кислоты, стильбены и лигнаны.
Насчитывается более 8000 разновидностей полифенолов.
Полифенолы — вторичные метаболиты растений или органические соединения, синтезируемые ими. Вторичными их называют, потому что они не участвуют в росте, развитии или репродукции растения. Их роль — защита от ультрафиолетового излучения и влияния патогенов. Полифенолы также отвечают за цвет, вкус, запах и степень окисления продуктов растительного происхождения.
Полифенолы также отвечают за цвет, вкус, запах и степень окисления продуктов растительного происхождения.
Окисление — естественный процесс взаимодействия клеток с кислородом. Когда организм человека использует кислород для выработки энергии, образуются свободные радикалы. Это активные формы кислорода, которые участвуют в клеточных реакциях и работе иммунитета, но при высокой концентрации токсичны.
Для нейтрализации свободных радикалов организму нужны антиоксиданты, которые мы в основном получаем из еды. Вы можете помочь организму лучше справляться с этой задачей путем добавления в рацион полифенолов, которые обладают антиоксидантными свойствами.
Влияние полифенолов на здоровье
Благодаря антиоксидантным свойствам полифенолы могут ограничивать окислительное повреждение, связанное со старением и дегенеративными заболеваниями. Это означает, что риск развития заболеваний, которые чаще встречаются с возрастом — рака, сердечно-сосудистых заболеваний и диабета 2 типа, можно снизить с помощью богатого полифенолами питания.
Сердечно-сосудистые заболевания
Одна из причин сердечно-сосудистых заболеваний — повышенный уровень липопротеинов низкой плотности (ЛПНП), или «плохого» холестерина. Большое количество ЛПНП, циркулирующего в крови, может привести к атеросклерозу — появлению жировых отложений (бляшек) на внутренних стенках артерий и сужению их просвета с повышением риска возникновения тромбов.
Когда активность свободных радикалов выходит из-под контроля, они влияют на уровень ЛПНП. Это вызывает каскад воспалительных реакций, приводящих к атеросклерозу. Полифенолы с их антиоксидантным действием могут помочь замедлить прогрессирование атеросклероза.
Некоторые ученые предполагают, что регулярное употребление растительных продуктов с высоким содержанием полифенолов, особенно флавоноидов, может снижать риск образования тромбов и бляшек, уменьшать воспаление, снижать кровяное давление и риск сердечных приступов.
Продукты, богатые полифенолами, которые помогают управлять рисками развития сердечно-сосудистых заболеваний:
| Черный и зеленый чай | Черника |
| Виноград | Кунжутное масло |
| Какао/темный шоколад | Грецкий орех |
| Оливковое масло | Кофе |
| Грейпфрут/апельсин | Каперсы |
Сахарный диабет 2 типа
При снижении чувствительности к инсулину глюкоза не может попасть в клетки и циркулирует в крови, а организм не получает достаточно энергии.
Исследования показывают, что полифенолы помогают в профилактике и борьбе с сахарным диабетом 2 типа. Например, ресвератрол, кверцетин, катехины и антоцианы улучшают метаболизм глюкозы и липидов (жиров). Также эти полифенолы могут влиять на уровень глюкозы в крови, например, стимулируя ее поглощение тканями, повышая при этом чувствительность к инсулину.
Photo by Ismael Trevino / UnsplashМета-анализ восьми научных исследований показал, что увеличение в рационе количества продуктов с большим содержанием полифенолов на 300 миллиграмм в день снижает риски развития сахарного диабета 2 типа.
Особое внимание в борьбе с сахарным диабетом 2 типа ученые уделяют какао, кофе, чернике, оливковому маслу, прополису, красному вину, горькому шоколаду.
Злокачественные опухоли
Злокачественная опухоль характеризуется появлением клеток, которые бесконтрольно делятся и обладают способностью проникать в здоровые ткани организма и разрушать их.
Ученые связывают начало и прогрессирование рака с окислительным стрессом. Этот процесс может увеличивать количество повреждений ДНК и приводить к потере контроля над делением клеток. Исследования показали, что окислительный стресс, не контролируемый антиоксидантами, увеличивает риск развития саркомы, меланомы и рака груди, легких, печени и предстательной железы.
Photo by Arseniy Kapran / UnsplashБлагодаря противовоспалительному и антиоксидантному действию полифенолы участвуют в регулировании биологических процессов, связанных с развитием рака. Они могут остановить рост опухолевых клеток или даже заставить их уничтожать себя — этот процесс называется апоптоз.
Регулярное употребление овощей и фруктов ассоциируется со снижением рисков развития раковых заболеваний.
К полифенолам, которые оказывают положительное влияние на управление рисками развития раковых заболеваний, относятся полифенолы в кофе, флавоноиды в зеленом чае, цитрусовых, зеленых листовых овощах, продуктах из сои, а также фенольные кислоты в моркови и цельнозерновых продуктах.
Ожирение
Ожирение — хроническое многофакторное заболевание, на которое влияют питание, образ жизни и генетические факторы. Одна из причин ожирения — энергетический дисбаланс, при котором количество употребляемых калорий превышает количество расходуемой энергии. Это приводит к избыточному росту адипоцитов — основных клеток жировой ткани.
Адипоциты выделяют гормоны жировой ткани адипокины, которые бывают про- и противовоспалительными. При энергетическом дисбалансе увеличивается количество провоспалительных адипокинов, которые вызывают системное воспаление. Это может стать причиной развития сахарного диабета 2 типа.
Photo by Louis Hansel @shotsoflouis / UnsplashИсследования на животных показывают, что употребление продуктов, содержащих полифенолы, помогает в профилактике и борьбе с ожирением. Ученые предполагают, что полифенолы подавляют активность клеток жировой ткани, отвечающих за воспаление.
Среди полифенолов, которые могут помогать в борьбе с ожирением, — катехины в зеленом чае, ресвератрол в красном вине и винограде, куркумин в куркуме, антоцианы в голубике.
Здоровье микробиоты
Основной источник питания микробиоты кишечника — пища растительного происхождения. Полифенолы в ее составе — одно из любимых лакомств для полезных бактерий, благодаря которому они размножаются.
До 95% полифенолов, которые вы едите, попадают в непереваренном виде в толстую кишку, где их расщепляют бактерии кишечника.
Полифенолы — пребиотики, которые увеличивают рост полезных Bifidobacterium и Lactobacillus, которые в свою очередь предотвращают размножение «плохих» бактерий.
Результаты некоторых исследований позволяют предположить, что благодаря антиоксидантным свойствам, полифенолы могут быть использованы при лечении некоторых заболеваний ЖКТ, например, синдрома раздраженного кишечника.
Еще один вид бактерий, на которые влияют полифенолы — Akkermansia muciniphila. Этот микроорганизм населяет внутреннюю поверхность стенок кишечника и помогает производить защитный слизистый слой. Полифенолы стимулируют размножение этих бактерий. А чем выше их представленность, тем выше защита от развития язвенного колита, болезни Крона и сахарного диабета 2 типа.
Полифенолы стимулируют размножение этих бактерий. А чем выше их представленность, тем выше защита от развития язвенного колита, болезни Крона и сахарного диабета 2 типа.
С помощью Теста микробиоты Атлас можно узнать уровень разнообразия бактерий, и насколько хорошо они справляются с защитными функциями. Используйте промокод blog10, чтобы получить скидку 10% при заказе.
Сложно представить, как микробиота кишечника может быть связана с работой мозга и психическим здоровьем. Однако между желудочно-кишечным трактом и центральной нервной системой существует прямая связь.
Мозг и эмоции влияют на микробиоту и состав бактерий. Например, сильный стресс может привести к дисбиозу — нарушению бактериального баланса в кишечнике. А микробиота кишечника может воздействовать на нервную, гормональную и иммунную системы.
Несмотря на все преимущества полифенолов, необходимо помнить, что на здоровье влияет не только питание, но и образ жизни. Даже если рацион богат полифенолами, но при этом вы курите, злоупотребляете алкоголем и ведете малоподвижный образ жизни, то одно лишь правильное питание не сможет защитить вас от рисков развития хронических и многофакторных заболеваний.
В каких продуктах содержатся полифенолы
Эти соединения присутствуют во многих продуктах и некоторых напитках растительного происхождения. Антоцианы, например, отвечают за яркие цвета фруктов, ягод и овощей, а также за их вкус и аромат.
Цветовой спектр антоцианов — оранжевый, красный, синий и фиолетовый, чему обязаны своими оттенками сладкий картофель, клубника, черника и вишня. А флавоноиды и флавонолы придают терпкий вкус и аромат красному вину, кофе, орехам и темному шоколаду.
Содержание полифенолов в продуктах зависит не только от вида растения, но и от того, где и в каких условиях его выращивали, как хранили, обрабатывали и готовили. Основные источники полифенолов: фрукты, овощи, цельнозерновые продукты, орехи, семена и бобовые, масла, специи, а также некоторые напитки.
| Тип полифенола | Продукты и напитки |
|---|---|
| Флавоноиды | Репчатый лук, капуста кудрявая, лук-порей, брокколи, черника, яблоки, цитрусовые, какао, красное вино |
| Фенольные кислоты | Голубика, манго, черная и красная смородина, вишня, киви, баклажан, чай, кофе |
| Стильбены | Красное вино, виноград, арахис, голубика, клюква, клубника |
| Лигнаны | Льняное семя, кешью, арахис, семена подсолнечника, бразильский орех, соя, фасоль |
Всемирная Организация Здравоохранения рекомендует есть не менее 400 грамм или пять порций овощей и фруктов в день. Однако важно не только количество растительных продуктов, но и их разнообразие. Чем больше разных овощей, фруктов, злаков и бобов мы едим, тем выше вероятность, что мы получаем все необходимые витамины, минералы, типы клетчатки и полифенолы.
Однако важно не только количество растительных продуктов, но и их разнообразие. Чем больше разных овощей, фруктов, злаков и бобов мы едим, тем выше вероятность, что мы получаем все необходимые витамины, минералы, типы клетчатки и полифенолы.
Один из наиболее надежных способов разнообразить свой рацион растительными продуктами — готовить самостоятельно. Как правило, в ресторанах, кафе и магазинах больше заботятся о вкусе еды, чем о ее пищевой ценности и пользе. Даже простые блюда на скорую руку, но приготовленные из разноцветных овощей и фруктов, которые вам нравятся, добавят в ваш рацион полезные вещества, в том числе полифенолы.
В таблице ниже мы собрали продукты в зависимости от их цвета, каждый из которых имеет разную пользу для здоровья. Это поможет добавить каждый цвет в ежедневный рацион, чтобы организм получал полифенолы, необходимые для снижения риска хронических заболеваний и для поддержания здоровья кишечника.
Это поможет добавить каждый цвет в ежедневный рацион, чтобы организм получал полифенолы, необходимые для снижения риска хронических заболеваний и для поддержания здоровья кишечника.
| Цвет | Продукт | Польза |
|---|---|---|
| Красный | Яблоки вишня, красная смородина, малина, клубника, помидоры, красный лук | Защита от воспаления, антиоксидантное действие |
| Желтый | Лимоны, золотые вкусные яблоки, бананы, желтый лук, желтый болгарский перец | Защита от язвы желудка, регуляция уровня сахара в крови |
| Оранжевый | Абрикосы, апельсины, персики, морковь, красные апельсины, нектарины, куркума | Защита от воспаления, антиоксидантное действие, защита сердечно-сосудистой системы |
| Зеленый | Шпинат, швейцарский мангольд, зеленый чай, оливки, сельдерей, спаржа, зеленые яблоки | Защита от воспаления, антиоксидантное действие, защита сердечно-сосудистой системы |
| Синий | Черника, виноград, ежевика, чернослив, изюм, сливы | Антиоксидантная активность, профилактика рака, снижает уровень холестерина, улучшает настроение и когнитивные функции |
Вопреки распространенному мнению о том, что термическая обработка негативно влияет на пользу продуктов питания, некоторые исследования говорят об обратном. Варка, приготовление на пару или обжарка некоторых овощей и фруктов увеличивают их антиоксидантные свойства. Например, приготовление на пару капусты кейл увеличивает количество фенольных соединений, в то время как краснокочанная капуста при таком методе приготовления теряет антиоксиданты.
Варка, приготовление на пару или обжарка некоторых овощей и фруктов увеличивают их антиоксидантные свойства. Например, приготовление на пару капусты кейл увеличивает количество фенольных соединений, в то время как краснокочанная капуста при таком методе приготовления теряет антиоксиданты.
Но разбираться в методе приготовления каждого продукта может показаться слишком сложным. Начните с того, чтобы в вашем рационе присутствовала разнообразная еда, и сочетайте свежие продукты с приготовленными — так вы увеличите количество разнообразных нутриентов.
- Kanti Bhooshan Pandey, Syed Ibrahim Rizvi, Plant Polyphenols as Dietary Antioxidants in Human Health and Disease, 2009
- Claudine Manach et al., Polyphenols: food sources and bioavailability, 2004
- Sonja K Nicholson et al., Effects of dietary polyphenols on gene expression in human vascular endothelial cells, 2008
- Mark G. Shrime et al., Flavonoid-Rich Cocoa Consumption Affects Multiple Cardiovascular Risk Factors in a Meta-Analysis of Short-Term Studies, 2011
- David Vauzour et al.
 , Polyphenols and Human Health: Prevention of Disease and Mechanisms of Action, 2010
, Polyphenols and Human Health: Prevention of Disease and Mechanisms of Action, 2010 - Simone Reuter et al., Oxidative stress, inflammation, and cancer: How are they linked?, 2010
- Yue Zhou et al., Natural Polyphenols for Prevention and Treatment of Cancer, 2016
- Igor Otavio Minatel et al., Phenolic Compounds: Functional Properties, Impact of Processing and Bioavailability, 2016
- Daniella Carisa Murador et al., Cooking techniques improve the levels of bioactive compounds and antioxidant activity in kale and red cabbage, 2016
- Cardona, F et al., Benefits of Polyphenols on Gut Microbiota and Implications in Human Health, 2013
- Duda-Chodak, A., The Inhibitory Effect of Polyphenols on Human Gut Microbiota, 2012
- Filosa, S et al., Polyphenols-Gut Microbiota Interplay and Brain Neuromodulation, 2018
- Gwiazdowska, D et al., The Impact of Polyphenols on Bifidobacterium Growth, 2015
- Manach, C et al., Polyphenols and Prevention of Cardiovascular Diseases, 2015
- Minich, D, M.
 , A Review of the Science of Colourful, Plant-Based Food and Practical Strategies for “Eating the Rainbow”, 2019
, A Review of the Science of Colourful, Plant-Based Food and Practical Strategies for “Eating the Rainbow”, 2019 - Naito, Y et al., A Next-Generation Beneficial Microbe: Akkermansia muciniphila, 2018
- Ozdal, T et al., The Reciprocal Interactions Between Polyphenols and Gut Microbiota and Effects on Bioaccessibility, 2016
- Scalbert, A et al., Dietary Polyphenols and the Prevention of Diseases, 2005
- Scalbert, A et al., Polyphenols: Antioxidants and Beyond, 2005
- Trebatická, J et al., Psychiatric Disorders and Polyphenols: Can They Be Helpful in Therapy? 2015
- Tsao, R., Chemistry and Biochemistry of Dietary Polyphenols, 2010
- World Health Organisation, Cardiovascular Diseases, 2019
- Xu, H et al., Flavonoids Intake and Risk of Type 2 Diabetes Mellitus. A Meta-Analysis of Prospective Cohort Studies, 2018
- Carolina Simioni et al., Oxidative stress: role of physical exercise and antioxidant nutraceuticals in adulthood and aging, 2018
- Lien Ai Pham-Huy et al.
 , Free Radicals, Antioxidants in Disease and Health, 2008
, Free Radicals, Antioxidants in Disease and Health, 2008
*Deepti Dabas, Polyphenols as colorans, 2018
Мексиприм инструкция по применению: показания, противопоказания, побочное действие – описание Mexiprim таб., покр. пленочной оболочкой, 125 мг: 10, 20, 30, 40 или 60 шт. (24918)
Мексиприм® является производным 3-оксипиридина; оказывает антиоксидантное, антигипоксическое, противоишемическое, мембранопротекторное, ноотропное, стресс-протекторное, противосудорожное, анксиолитическое, гиполипидемическое действие.
Механизм действия препарата обусловлен антиоксидантным, антигипоксантным и мембранопротекторным действием. Мексиприм® уменьшает проявления окислительного стресса, ингибирует перекисное окисление липидов, повышает активность супероксиддисмутазы, повышает соотношение липид-белок, улучшает структуру и функцию мембраны клеток. Препарат модулирует активность мембраносвязанных ферментов (кальцийнезависимой фосфодиэстеразы, аденилатциклазы, ацетилхолинэстеразы), рецепторных комплексов (бензодиазепинового, GABA, ацетилхолинового), что усиливает их способность связывания с лигандами, способствует сохранению структурно-функциональной организации биомембран, транспорта нейромедиаторов и улучшению синаптической передачи.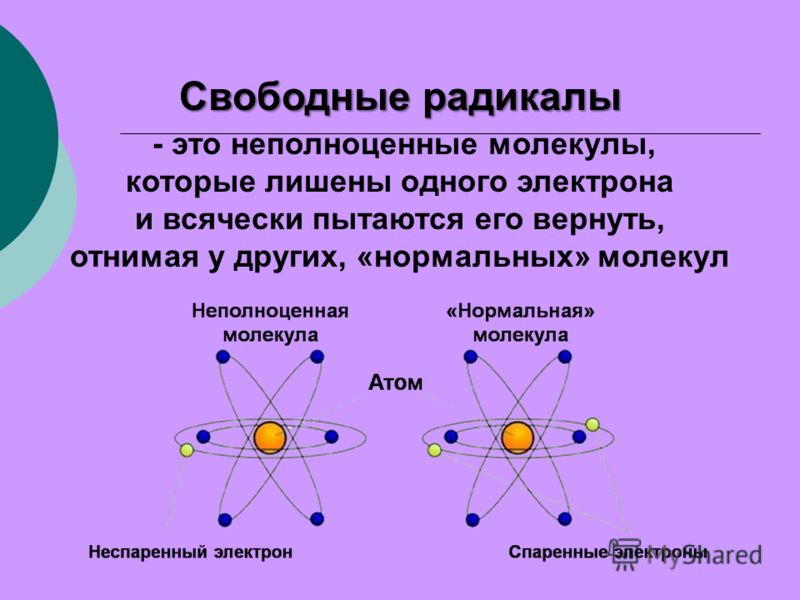
Мексиприм® повышает содержание допамина в головном мозге. Вызывает усиление компенсаторной активации аэробного гликолиза и снижение степени угнетения окислительных процессов в цикле Кребса в условиях гипоксии с увеличением содержания АТФ и креатинфосфата, активацию энергосинтезирующих функций митохондрий, стабилизацию клеточных мембран.
Препарат имеет широкий спектр фармакологической активности; повышает резистентность организма к стрессу и воздействию различных повреждающих факторов при патологических состояниях (гипоксии и ишемии, нарушении мозгового кровообращения, интоксикации этанолом и антипсихотическими средствами).
В условиях критического снижения коронарного кровотока способствует сохранению структурно-функциональной организации мембран кардиомиоцитов, стимулирует активность мембранных ферментов (фосфодиэстеразы, аденилатциклазы, ацетилхолинэстеразы). Поддерживает развивающуюся при острой ишемии активацию аэробного гликолиза и способствует в условиях гипоксии восстановлению митохондриальных окислительно-восстановительных процессов, увеличивает синтез АТФ и креатинфосфата. Обеспечивает целостность морфологических структур и физиологических функций ишемизированного миокарда. Улучшает клиническое течение инфаркта миокарда, повышает эффективность проводимой терапии, снижает частоту возникновения аритмий и нарушений внутрисердечной проводимости. Нормализует метаболические процессы в ишемизированном миокарде, повышает антиангинальную активность нитратов, улучшает реологические свойства крови, уменьшает последствия реперфузионного синдрома при острой коронарной недостаточности.
Обеспечивает целостность морфологических структур и физиологических функций ишемизированного миокарда. Улучшает клиническое течение инфаркта миокарда, повышает эффективность проводимой терапии, снижает частоту возникновения аритмий и нарушений внутрисердечной проводимости. Нормализует метаболические процессы в ишемизированном миокарде, повышает антиангинальную активность нитратов, улучшает реологические свойства крови, уменьшает последствия реперфузионного синдрома при острой коронарной недостаточности.
Улучшает функциональное состояние ишемизированного миокарда. В условиях коронарной недостаточности увеличивает коллатеральное кровоснабжение ишемизированного миокарда, способствует сохранению целостности кардиомиоцитов и поддержанию их функциональной активности. Эффективно восстанавливает сократимость миокарда при обратимой сердечной дисфункции.
Улучшает метаболизм тканей мозга и их кровоснабжение, улучшает микроциркуляцию и реологические свойства крови, уменьшает агрегацию тромбоцитов. Стабилизирует мембранные структуры клеток крови (эритроцитов и тромбоцитов). Обладает гиполипидемическим действием, уменьшает содержание общего холестерина и ЛПНП.
Проявляет анксиолитическое действие, не сопровождающееся миорелаксантным эффектом; обладает ноотропными свойствами, предупреждает и уменьшает нарушения обучения и памяти, возникающие при старении и воздействии различных патогенных факторов; оказывает противосудорожное действие; повышает концентрацию внимания и работоспособность.
Антистрессорное действие проявляется в нормализации постстрессового поведения, соматовегетативных нарушений, восстановлении циклов сон-бодрствование, нарушенных процессов обучения и памяти, снижении дистрофических и морфологических изменений в различных структурах головного мозга.
Уменьшает ферментативную токсемию и эндогенную интоксикацию при остром панкреатите.
Обладает выраженным антитоксическим действием при абстинентном синдроме. Устраняет неврологические и нейротоксические проявления острой алкогольной интоксикации, восстанавливает нарушения поведения, вегетативные функции, способствует уменьшению выраженности когнитивных нарушений, вызванных длительным приемом этанола. Под влиянием препарата усиливается действие транквилизирующих, нейролептических, антидепрессивных, снотворных и противосудорожных средств, что позволяет снизить их дозы и уменьшить побочные эффекты.
Продукты, содержащие антиоксиданты | Passion.ru
Или всем известный витамин С — самый знаменитый среди антиоксидантов и самый мощный. Благодаря действию аскорбиновой кислоты замедляется старение, снижается риск рака и болезней сердца, ее необходимо принимать для здоровья зубов, костей и стенок сосудов.
А еще этот витамин важен для сохранения красоты тела, он участвует в образовании коллагена — основного белка упругой и гладкой кожи. Кроме того, он не позволяет вредным воздействиям организма разрушать другие антиоксиданты — бета-каротины и токоферол. Особенно рекомендованы антиоксиданты курящим людям, так как у них концентрация радикалов в теле повышается в 2-3 раза.
Чтобы получить необходимое количество витамина С и испытать на себе его антиоксидантные эффекты, необходимо есть много цитрусов, полюбить лайм и лимоны, на втором месте стоят клубника и огородная зелень.
Картофель тоже богат витамином С, но обычные методы приготовления картофеля разрушают большую часть витамина. Лучше готовьте картофель на пару, так витамина С в нем останется больше. Полезны свежие овощи — болгарский перец, помидор, черемша и брокколи, шпинат. Достаточно много витамина С и в киви, смородине, облепихе и калине.
Токоферол, или витамин Е
Это второй по активности после витамина С антиоксидант, он хорошо работает в коже и репродуктивной системе, помогает при атеросклерозе. Это жирорастворимое соединение, поэтому им наиболее богаты масло- и жиросодержащие продукты.
Много токоферола содержится в злаках, растительных маслах первого отжима, проращенных зернах пшеницы, орехах и овощах зеленого цвета. Богаты им миндаль и кешью, фундук и арахис, печень трески, судак и угорь. Много витамина Е в кальмарах, кураге, черносливе, а также лососе.
Каротины
Это прародители витамина А и еще некоторых соединений, которые имеют достаточно высокую антиоксидантную силу. Они выступают защитниками клеток от свободных радикалов, особенно в зрительной системе, коже и системе иммунитета.
Эти вещества в большом количестве находят в желтых и оранжевых овощах и фруктах, таких как морковь и абрикосы, дыня и тыква. Не сильно от них отстают зеленые овощи — брокколи и шпинат, черемша и морская капуста. Богаты каротинами печень и брынза, сливочное масло, творог, угорь и другая жирная рыба, яйцо, сметана, плавленые сыры и устрицы.
Флавоноиды
Это еще одна группа веществ, обладающих защитным эффектом, останавливающим агрессию свободных радикалов.
Флавоноиды — это целая группа веществ, самое известное из которых — это витамин РР, или рутин. В природе флавоноидов много в чернике и других ягодах темного цвета, в зеленом чае и какао, в яблоках и айве, в кожице винограда, вишне и черешне, землянике, малине и баклажанах. Флавоноидов много в цедре цитрусов и гранатах, в том числе и в корках.
Доппельгерц® актив Витамины для глаз с хромом, цинком и селеном
Комплекс разработан для восполнения дефицита витаминов и минеральных веществ. Черника, лютеин и зеаксантин улучшают зрительную функцию, оказывают положительное влияние на сетчатку, уменьшают усталость глаз.
Плоды черники оказывают благотворное воздействие на сетчатку глаз. Это положительное влияние черники на глаза обусловлено антиоксидантным эффектом, которым обладают флавоноиды, содержащиеся в ее листьях и плодах.
Лютеин – это каротиноид, который является одним из основных пигментов, защищающих глаза от фотоповреждения. Находящийся в хрусталике и сетчатке лютеин, обеспечивает защиту фоторецепторных клеток от кислородных радикалов, избирательно поглощая УФ — часть спектра светового потока, обеспечивает весь спектр цветоощущений, оказывает антиоксидантное действие, а также предохраняет от развития некоторых заболеваний глаз.
Зеаксантин является каротиноидом, который также обеспечивает защиту глаз от опасности фотоповреждения. Зеаксантин вместе с лютеином являются наиболее активными соединениями антиоксидантной защиты глаз. Показана положительная роль зеаксантина для снижения риска ряда офтальмологических заболеваний.
Хром участвует в процессе регулирования внутриглазного давления и, в сочетании с витамином С, стимулирует транспортировку глюкозы к кристаллику глаза.
Цинк — важный микроэлемент для здоровья сетчатки. В структуре глаза он является преобладающим минеральным веществом, может способствовать обострению зрения. Селен — является одним из компонентов, участвующих в превращении светового сигнала, воспринимаемого глазом, в нервный импульс. Это антиоксидант, дефицит которого, может вызывать помутнение хрусталика глаза.
Антиоксидантное действие эфирных масел
Сейчас практически каждый человек слышал о таком понятии, как антиоксиданты, но далеко не все понимают, что же это такое. Чтобы разобраться в этом вопросе, обратимся сначала к другому термину – свободные радикалы. Это активные нестабильные молекулы, имеющие возможность для присоединения еще одного электрона, после чего молекула становится активной и стабильной. Однако подобные реакции, происходящие в нашем организме, в ряде случаев наносят ему непоправимый вредНебольшое количество свободных радикалов должно присутствовать в теле человека, но рост их концентрации может привести к таким последствиям, как преждевременное старение, снижение остроты зрения и слуха, ослабление мышц, болезнь Альцгеймера и даже рак . Способом нейтрализовать результаты свободнорадикальных реакций является использование антиоксидантов. Таким образом, употребление продуктов, богатых антиоксидантами, крайне полезно для каждого человека. В ходе исследований, проведенных по всему миру, было доказано, что некоторые эфирные масла также обладают антиоксидантным действием.
Так, например, в ходе исследования 2011 года была доказана антиоксидантная активность трех масел: коры корицы, розмарина и гвоздики. Эти масла в концентрации 0.5% и 0.25% были добавлены в масла мака и фундука, после чего масла хранились в течение 14 дней при 50°С в темноте. В таких же условиях находились и образцы из контрольной группы, и масла с добавлением синтетического антиоксиданта (БГА – бутилгидроксианизол, 0,02%). По завершении двухнедельного периода с помощью измерения пероксидного числа*1 был сделан вывод о том, что все масла проявили антиоксидантные свойства и могут быть использованы для замены синтетических веществ. Наилучший результат был зафиксирован у масел корицы и гвоздики. (Özcan, Arslan, Selcuk University, Turkey, 2011).
В российской работе 2012 года внимание исследователя было сконцентрировано в первую очередь на действующих компонентах эфирных масел. Их антиоксидантные свойства оценивались по скорости окисления цитраля*2 в присутствии исследуемых веществ на свету. Было выявлено, что эвгенол, ключевой компонент эфирного масла гвоздики, обладает наибольшей антиоксидантной активностью. Ещё более интересно – показатели масла гвоздики превосходили показатели эвгенола, что может объясняться наличием в маслах веществ, стабилизирующих всю систему (Самусенко, Институт биохимической физики им. Н. М. Эмануэля РАН, Россия, 2012).
В следующем исследовании был проведен анализ 11 различных масел с помощью 3 методов: DPPH анализ*3, PCL анализ*4 и β-carotene bleaching тест*5. Все они выделили 3 масла, обладающих наибольшим антиоксидантными свойствами: эфирное масло куркумы, масло иланг-иланга и уже отмеченное ранее масло розмарина. Показатели этих масел оказались сравнимы с искусственными антиоксидантами, а, значит, могут в дальнейшем использоваться вместо них. (Sacchetti, Maietti, Muzzoli , Scaglianti, Manfredini, Radic, Bruni, University of Ferrara, Italy, 2005).
В завершение хочется отметить американское исследование 2007 года, в котором ряд тестов был проведен с 13 эфирными маслами. С помощью уже упоминавшегося DPPH теста был сделан вывод о том, что масло жасмина обладает антиоксидантными свойствами. При облучении сквалена*6 ультрафиолетовым излучением было замечено, что масла семян петрушки и розы наилучшим образом сдерживают формирование малондеальдегидов, вредных для организма (Wei, Shibamoto, University of California, USA, 2007).
Итак, антиоксидантное действие эфирных масел было доказано во многих исследованиях, и возможно в будущем они смогут полностью заменить синтетические антиоксиданты.
*1 Пероксидное число используется для измерения реакций окисления в маслах и жирах.
*2 Цитраль — быстро окисляющийся альдегид.
*3 DPPH тест — способ определения антиоксидантных свойств вещества, основанный на их способности восстанавливать атомы азота.
*4 PCL тест — анализ изменения хемилюминесценции (свечения) при определенной реакции (в данном случае окисления) в присутствии исследуемых веществ.
*5 β-carotene bleaching тест — тест на наличие антиоксидантных свойств, во время которого эмульсия бета-каротина смешивается с веществом и измеряется, как быстро она будет обесцвечена.
*6 Сквален — природный ненасыщенный углеводород, для стабильного состояния которого необходимы атомы водорода.
Рекомендованные рецепты
3132
Дата публикации: 2018-01-08 12:16:04
О доставке и оплате, накопительные скидки, пункты самовывоза
Минимальная сумма заказа:
- Доставка заказов от 1000 р.
- Самовывоз:
— Офисы аромашки — любая сумма.
— Пункты самовывоза от 1000 р.
Стоимость доставки:
- Курьер (Москва):
- Почта:
- Курьер и более 3000 пунктов самовывоза (CDEK, Boxberry) по России, Белоруссии и Казахстану!
Заказ от 3000 р. — бесплатно.
Заказ до 3000 р. — 300 р.
— Заказ от 3000 р. + 100% предоплата = бесплатно.
— Заказ до 3000 р. — от 300 р.
Хотите компенсацию за доставку до 300 р.?
Читайте правила:
Антиоксидантная активность — обзор
32.4.2 Липофильная антиоксидантная активность
Что касается липофильной антиоксидантной активности (LAA), Tlili et al. (2011b), изучая антиоксидантную активность различных сортов арбуза на разных стадиях созревания, с помощью анализа TEAC сообщили, что в красных спелых плодах LAA варьировала от 218,0 до 467,9 мкмоль тролокса / 100 г сырой массы. Для большинства сортов полученные значения совпадают с ранее сообщенными: от 206,0 до 258.9 мкмоль тролокса / 100 г сырой массы (Tlili et al., 2011a). Эти значения также были сопоставимы с ранее сообщенными значениями в диапазоне от 195,23 до 283,97 мкмоль тролокса / 100 г сырой массы (Tlili et al., 2010). Wu et al. (2004) сообщили о гораздо более низких значениях от 16 до 22 мкмоль тролокса / 100 г живой массы за два периода отбора проб (в сезон и вне сезона). Используя анализ восстанавливающей антиоксидантной способности железа (FRAP), Tlili et al. (2011a) получили значения в диапазоне от 22,0 до 40,3 мМ FRAP / 100 г сырой массы.
LAA в основном объясняется присутствием каротиноидов, особенно ликопина, в плодах томатов (Ilahy et al., 2011). Точно так же липофильная антиоксидантная активность в основном приписывается присутствию в плодах арбуза каротиноидов, особенно ликопина. После рассмотрения данных по всем сортам арбуза, хорошая и значимая корреляция между значениями TEAC и содержанием ликопина ( R = 0,649; P <0,01) и β-каротина ( R = 0,403; P <0,01) были получены (Tlili et al., 2011b). Сильная положительная корреляция между содержанием ликопина и антиоксидантной активностью также была отмечена в обоих анализах DPPH ( r = 0.89, P <0,05) и анализ FRAP ( r = 0,92, P <0,05), как сообщили Arriola et al. (2014).
Хотя ряд исследований показал, что ликопин, по-видимому, является основным липофильным соединением, способствующим липофильной антиоксидантной активности арбуза, другие сообщили, что помимо ликопина, другие биоактивные соединения способствуют антиоксидантной активности арбуза за счет синергического и / или антагонистического действия ( Тлили и др., 2011а; Чу, Син, 2012).Аналогичное обнаружение было зарегистрировано и для HAA. Антиоксидантная активность (HAA и LAA), измеренная с помощью методов TEAC и FRAP, была сходной в большинстве проанализированных cvs (Tlili et al., 2011a, b), и это согласуется с данными, представленными Djuric и Powell (2001). Однако разные результаты были получены Arriola et al. (2014), исследуя потенциал нанофильтрации для концентрации биоактивных соединений арбузного сока, они обнаружили, что значения гидрофильной антиоксидантной активности в обоих анализах (FRAP и DPPH) были выше, чем значения липофильной антиоксидантной активности.Вероятно, это связано с различными системами растворителей, используемых в качестве липофильных экстракторов (например, гексаном). Ранее Wu et al. (2004) сообщили, что у арбуза HAA выше, чем LAA.
Следует отметить, что некоторые авторы также сообщили о более низких значениях общей антиоксидантной активности (ТАА). Чоудхари и др. (2015) сообщили о более низких значениях общей антиоксидантной активности, варьирующихся от 40,13 до 84,05 мкмоль TE / 100 г веса тела в 10 генотипах арбуза с красной мякотью. Ранее Pellegrini et al. (2003) также нашли значение TAA, равное 69.0 мкмоль тролокса / 100 г сырого веса и 1,13 ммоль Fe 2+ / кг сырого веса (что соответствует 31,5 мМ FRAP / 100 г сырого веса) с анализами TEAC и FRAP, соответственно, для плодов арбуза. Расхождения в значениях антиоксидантной активности обычно связаны с сортом, условиями окружающей среды и аналитической методологией.
Важность антиоксидантов, которые играют роль в клеточном ответе на окислительный / нитрозативный стресс: текущее состояние | Журнал питания
Курутас Е.Б., Чирагил П., Гуль М., Килинч М.Последствия окислительного стресса при инфекции мочевыводящих путей. Медиаторы Inflamm. 2005; 2005: 242–4.
PubMed Статья CAS Google ученый
Валко М., Лейбфриц Д., Монкол Дж., Кронин М.Т., Мазур М., Телсер Дж. Свободные радикалы и антиоксиданты в нормальных физиологических функциях и заболеваниях человека. Int J Biochem Cell Biol. 2007; 39: 44–84.
CAS PubMed Статья Google ученый
Barbacanne MA, Souchard JP, Darblade B, Iliou JP, Nepveu F, Pipy B, Bayard F, Arnal JF. Обнаружение супероксид-аниона, высвобождаемого внеклеточно эндотелиальными клетками, с использованием методов восстановления цитохрома с, СОЭ, флуоресценции и усиленной люцигенином хемилюминесценции. Free Radic Biol Med. 2000. 29: 388–96.
CAS PubMed Статья Google ученый
Видрио Э., Юнг Х., Анастасио С. Генерация гидроксильных радикалов из растворенных переходных металлов в растворах суррогатной жидкости легких.Atmos Environ. 2008; 42: 4369–79.
CAS PubMed Central Статья Google ученый
Мерфи Э., Стинберген С. Механизмы, лежащие в основе острой защиты от сердечной ишемии-реперфузионного повреждения. Physiol Rev.2008; 88: 581–609.
CAS PubMed PubMed Central Статья Google ученый
Bortoletto P, Lyman K, Camacho A, Fricchione M, Khanolkar A, Katz BZ.Хроническая гранулематозная болезнь. Pediatr Infect Dis J. 2015; 34: 1110–4.
PubMed PubMed Central Статья Google ученый
Цао П.С., Хейдари С., Ван А., Чан Дж. Р., Ривен Г.М., Кук Дж. Протеинкиназа C-эпсилон опосредует индуцированное глюкозой продукцию супероксида и экспрессию MCP-1 в эндотелиальных клетках. FASEB J. 1998; 12: 512.
Google ученый
Мастерс CJ.Клеточная передача сигналов: роль пероксисомы. Сотовый сигнал. 1996. 8: 197–208.
CAS PubMed Статья Google ученый
Седербаум А.И. Молекулярные механизмы микросомальных оксидаз смешанной функции и биологические и патологические последствия. Редокс Биол. 2015; 4: 60–73.
CAS PubMed Статья Google ученый
Dröge W. Свободные радикалы в физиологическом контроле функции клеток.Physiol Rev.2002; 82: 47–95.
PubMed Статья Google ученый
Валко М., Родс С.Дж., Монкол Дж., Изакович М.М., Мазура М. Свободные радикалы, металлы и антиоксиданты при раке, вызванном окислительным стрессом. Chem Biol Interact. 2006; 160: 1–40.
CAS PubMed Статья Google ученый
Тацузава Х., Маруяма Т., Хори К., Сано И., Накано М. Синглетный кислород ((1) Дельта (г) O (2)) как главный окислитель в опосредованном миелопероксидазой уничтожении бактерий в фагосомах нейтрофилов.Biochim Biophys Res Commun. 1999; 262: 647–50.
CAS Статья Google ученый
Ллойд Р.В., Ханна П.М., Мейсон Р.П. Происхождение гидроксильного радикала кислорода в реакции Фентона. Free Radic Biol Med. 1997. 22: 885–8.
CAS PubMed Статья Google ученый
Stohs SJ, Bagchi D. Окислительные механизмы в токсичности ионов металлов. Free Radic Biol Med.1995; 18: 321–36.
CAS PubMed Статья Google ученый
Пеппер Дж. Р., Мамби С., Гаттеридж Дж. С.. Последовательное окислительное повреждение и изменения связывания железа и окисляющих железо антиоксидантов плазмы во время операции искусственного кровообращения. Free Radic Res. 1994; 21: 377–85.
CAS PubMed Статья Google ученый
Джомова К., Валко М. Важность хелатирования железа при окислительном стрессе, вызванном свободными радикалами, и заболеваниях человека.Curr Pharm Des. 2011; 17: 3460–73.
CAS PubMed Статья Google ученый
Сайто Х., Хаяси Х. Скорость трансформации между ферритином и гемосидерином, определенная по кинетике сывороточного ферритина у пациентов с нормальными запасами железа и перегрузкой железом. Nagoya J Med Sci. 2015; 77: 571–83.
PubMed PubMed Central Google ученый
Гафурифар П., Каденас Э.Митохондриальная синтаза оксида азота. Trends Pharmacol Sci. 2005; 26: 190–5.
CAS PubMed Статья Google ученый
Бергенди Л., Бенеш Л., Дурацкова З., Ференчик М. Химия, физиология и патология свободных радикалов. Life Sci. 1999; 65: 1865–74.
CAS PubMed Статья Google ученый
Chiueh CC. Нейропротекторные свойства оксида азота.Ann NY Acad Sci. 1999; 890: 301–11.
CAS PubMed Статья Google ученый
Beckman JS, Koppenol WH. Оксид азота, супероксид и пероксинитрит: хорошее, плохое и уродливое. Am J Physiol. 1996; 271: C1424–37.
CAS PubMed Google ученый
Pacher P, Beckman JS, Liaudet L. Оксид азота и пероксинитрит в здоровье и болезнях.Physiol Rev.2007; 87: 315–424.
CAS PubMed PubMed Central Статья Google ученый
Янг И.С., Вудсайд СП. Антиоксиданты в здоровье и болезнях. J Clin Pathol. 2001; 54: 176–86.
CAS PubMed PubMed Central Статья Google ученый
Flora SJ. Структурные, химические и биологические аспекты антиоксидантов для стратегий против воздействия металлов и металлоидов.Oxid Med Cell Longev. 2009; 2: 191–206.
PubMed PubMed Central Статья Google ученый
Финкель Т., Холбрук, штат Нью-Джерси. Окислители, окислительный стресс и биология старения. Природа. 2000. 408: 239–47.
CAS PubMed Статья Google ученый
Учида К. 4-гидрокси-2-ноненал: продукт и медиатор окислительного стресса. Prog Lipid Res.2003. 42: 318–43.
CAS PubMed Статья Google ученый
Carini M, Aldini G, Facino RM. Масс-спектрометрия для обнаружения аддуктов 4-гидрокси- транс -2-оненаля (HNE) с пептидами и белками. Масс-спектром. Ред. 2004; 23: 281–305.
CAS PubMed Статья Google ученый
Cracowski JL, Durand T, Bessard G. Изопростаны как биомаркер перекисного окисления липидов у человека: физиология, фармакология и клинические последствия.Trends Pharmacol Sci. 2002; 23: 360–6.
CAS PubMed Статья Google ученый
Montuschi P, Barnes PJ, Roberts LJ. Изопростаны: маркеры и медиаторы окислительного стресса. FASEB J. 2004; 18: 1791–800.
CAS PubMed Статья Google ученый
Учида К. Гистидин и лизин как мишени окислительной модификации. Аминокислоты.2003. 25: 249–57.
CAS PubMed Статья Google ученый
Draper HH, Csallany AS, Hadley M. Альдегиды в моче как индикаторы перекисного окисления липидов in vivo. Free Radic Biol Med. 2000; 29: 1071–7.
CAS PubMed Статья Google ученый
Wilson R, Lyall K, Smyth L, Fernie CE, Riemersma RA. Пищевые гидроксижирные кислоты всасываются в организме человека: значение для измерения «окислительного стресса» in vivo.Free Radic Biol Med. 2002. 32: 162–8.
CAS PubMed Статья Google ученый
Басу С. Изопростаны: новые биоактивные продукты перекисного окисления липидов. Free Radic Res. 2004; 38: 105–22.
CAS PubMed Статья Google ученый
Miraloglu M, Kurutas EB, Ozturk P, Arican O. Оценка местного статуса микроэлементов и концентраций 8-изо-простагландина F2α у пациентов с Tinea pedis.Биол Процедура Онлайн. 2016; 18: 1.
PubMed PubMed Central Статья Google ученый
Morrow JD. Количественная оценка изопростанов как показателей оксидантного стресса и риска атеросклероза у людей. Артериосклер Thromb Vasc Biol. 2005. 25: 279–86.
CAS PubMed Статья Google ученый
Moret-Tatay I, Iborra M, Cerrillo E, Tortosa L, Nos P, Beltrán B.Возможные биомаркеры в крови для болезни Крона: окислительный стресс и микроРНК — текущие доказательства и дальнейшие аспекты, которые необходимо разгадать. Oxid Med Cell Longev. 2016; 2016: 2325162.
PubMed Статья Google ученый
Поли Г., Леонардуцци Г., Биази Ф., Кьярпотто Э. Окислительный стресс и клеточная передача сигналов. Curr Med Chem. 2004; 11: 1163–82.
CAS PubMed Статья Google ученый
Эйзирик Д.Л., Мандруп-Поулсен Т. Жезл смерти — передача сигнала иммуномедиированного апоптоза бета-клеток. Диабетология. 2001; 44: 2115–33.
CAS PubMed Статья Google ученый
Buttke TM, Sandstrom PA. Окислительный стресс как медиатор апоптоза. Иммунол сегодня. 1994; 15: 1–4.
Артикул Google ученый
Ники Э. Свободные радикалы в 1900-х годах: от in vitro к in vivo.Free Radic Res. 2001; 33: 693–704.
Артикул Google ученый
Клауниг Ю.Е., Камендулис Л.М., Хочевар Б.А. Окислительный стресс и окислительное повреждение в канцерогенезе. Toxicol Pathol. 2010; 38: 96–109.
CAS PubMed Статья Google ученый
Павлович Д., Кочич Р., Кочич Г., Евтович Т., Раденкович С., Микич Д., Стоянович М., Джорджевич ПБ. Эффект четырехнедельного лечения метформином на ферменты антиоксидантной защиты плазмы и эритроцитов у пациентов с впервые диагностированным ожирением NIDDM.Диабет ожирения Metab. 2000; 2: 251–6.
CAS PubMed Статья Google ученый
Диас М.Н., Фрей Б., Вита Дж. А., Кини Дж. Ф. Антиоксиданты и атеросклеротическая болезнь сердца. N Engl J Med. 1997; 337: 408–16.
CAS PubMed Статья Google ученый
Marinho HS, Real C, Cyrne L, Soares H, Antunes F. Чувствительность к перекиси водорода, передача сигналов и регуляция факторов транскрипции.Редокс Биол. 2014; 2: 535–62.
CAS PubMed PubMed Central Статья Google ученый
Nabavi SF, Barber AJ, Spagnuolo C, Russo GL, Daglia M, Nabavi SM, Sobarzo-Sánchez E. Nrf2 как молекулярная мишень для полифенолов: новая терапевтическая стратегия при диабетической ретинопатии. Критик Rev Clin Lab Sci. 2016; 29: 1–20.
Google ученый
Pang C, Sheng Y, Jiang P, Wei H, Ji L.Хлорогеновая кислота предотвращает повреждение печени, вызванное ацетаминофеном: участие метаболических ферментов CYP450 и некоторых антиоксидантных сигналов. J Zhejiang Univ Sci B. 2015; 16: 602–10.
CAS PubMed PubMed Central Статья Google ученый
Prasad KN. Одновременная активация Nrf2 и повышение диетических и эндогенных антиоксидантных химических веществ для профилактики рака у людей. J Am Coll Nutr. 2016; 35: 175–84.
CAS PubMed Статья Google ученый
Чан К., Хан XD, Кан YW. Важная функция Nrf2 в борьбе с окислительным стрессом: детоксикация ацетаминофена. Proc Natl Acad Sci U S. A. 2001; 98: 4611–6.
CAS PubMed PubMed Central Статья Google ученый
Эномото А, Ито К., Нагайоши Э., Харута Дж., Кимура Т., О’Коннор Т., Харада Т., Ямамото М. Высокая чувствительность мышей с нокаутом Nrf2 к ацетаминофену. Гепатотоксичность, связанная со снижением экспрессии регулируемого ARE препарата. метаболизирующие ферменты и гены-антиоксиданты.Toxicol Sci. 2001; 59: 169–77.
CAS PubMed Статья Google ученый
Чан К., Кан Ю.В. Nrf2 необходим для защиты от острого легочного повреждения у мышей. Proc Natl Acad Sci U S. A. 1999; 96: 12731–6.
CAS PubMed PubMed Central Статья Google ученый
Fahey JW, Haristoy X, Dolan PM, Kensler TW, Scholtus I, Stephenson KK, Talalay P, Lozniewski A.Сульфорафан подавляет внеклеточные, внутриклеточные и устойчивые к антибиотикам штаммы Helicobacter pylori и предотвращает индуцированные бензо [a] пиреном опухоли желудка. Proc Natl Acad Sci U S. A. 2002; 99: 7610–5.
CAS PubMed PubMed Central Статья Google ученый
Ramos-Gomez M, Kwak MK, Dolan PM, Itoh K, Yamamoto M, Talalay P, Kensler TW. У мышей с дефицитом фактора транскрипции nrf2 повышается чувствительность к канцерогенезу и теряется химиопротекторная эффективность индукторов ферментов.Proc Natl Acad Sci U S. A. 2001; 98: 3410–5.
CAS PubMed PubMed Central Статья Google ученый
Braun S, Hanselmann C, Gassmann MG, Auf Dem Keller U, Born-Berclaz C, Chan K, Kan YW, Werner S. Фактор транскрипции Nrf2, новая мишень действия фактора роста кератиноцитов, который регулирует экспрессию генов и воспаление в заживающей кожной ране. Mol Cell Biol. 2002; 22: 5492–505.
CAS PubMed PubMed Central Статья Google ученый
Dhakshinamoorthy S, Лонг DJ, Джайсвал AK. Антиоксидантная регуляция генов, кодирующих ферменты, детоксифицирующие ксенобиотики и канцерогены. Curr Top Cell Regul. 2000; 36: 201–16.
CAS PubMed Статья Google ученый
Lee JM, Moehlenkamp JD, Hanson JM, Johnson JA. Nrf2-зависимая активация антиоксидантного чувствительного элемента трет-бутилгидрохиноном не зависит от окислительного стресса в клетках нейробластомы человека IMR-32.Biochem Biophys Res Commun. 2001; 280: 286–92.
CAS PubMed Статья Google ученый
Lee JM, Hanson JM, Chu WA, Johnson JA. Фосфатидилинозитол-3-киназа, а не киназа, регулируемая внеклеточными сигналами, регулирует активацию антиоксидантно-чувствительного элемента в клетках нейробластомы человека IMR-32. J Biol Chem. 2001; 276: 20011–6.
CAS PubMed Статья Google ученый
Алам Дж., Викс С., Стюарт Д., Гонг П., Тушар С., Оттербейн С., Чой А. М., Буров М. Е., Тоу Дж. Механизм активации гена гемоксигеназы-1 кадмием в эпителиальных клетках молочной железы MCF-7. Роль киназы p38 и фактора транскрипции Nrf2. J Biol Chem. 2000; 275: 27694–702.
CAS PubMed Google ученый
Ким Ю.С., Масутани Х., Ямагути Ю., Ито К., Ямамото М., Йодой Дж. Хемин-индуцированная активация гена тиоредоксина с помощью Nrf2.Дифференциальная регуляция антиоксидантного ответного элемента путем переключения его связывающих факторов. J Biol Chem. 2001; 276: 18399–406.
CAS PubMed Статья Google ученый
Орино К., Леман Л., Цудзи И, Аяки Х, Торти С.В., Торти FM. Ферритин и реакция на окислительный стресс. Биохим Дж. 2001; 357: 241–7.
CAS PubMed PubMed Central Статья Google ученый
Мотохаши Х., О’Коннор Т., Кацуока Ф., Энгель Д.Д., Ямамото М. Интеграция и разнообразие регуляторной сети, состоящей из семейств транскрипционных факторов Maf и CNC. Ген. 2002; 294: 1–12.
CAS PubMed Статья Google ученый
Чанас С.А., Цзян К., МакМахон М., Маквалтер Г.К., Маклеллан Л.И., Элкомб С.Р., Хендерсон С.Дж., Вольф С.Р., Моффат Г.Дж., Ито К., Ямамото М., Хейс Дж.Д. Потеря фактора транскрипции Nrf2 вызывает заметное снижение конститутивной и индуцибельной экспрессии глутатион-S-трансферазы Gsta1, Gsta2, Gstm1, Gstm2, Gstm3 и Gstm4 в печени самцов и самок мышей.Биохим Дж. 2002; 365: 405–16.
CAS PubMed PubMed Central Статья Google ученый
Hayes JD, Chanas SA, Henderson CJ, McMahon M, Sun C, Moffat GJ, Wolf CR, Yamamoto M. Фактор транскрипции Nrf2 вносит вклад как в базальную экспрессию S-трансфераз глутатиона в печени мышей, так и в их индукция химиопрофилактическими синтетическими антиоксидантами, бутилированным гидроксианизолом и этоксихином. Biochem Soc Trans.2000; 28: 33–41.
CAS PubMed Статья Google ученый
Ishii T, Itoh K, Takahashi S, Sato H, Yanagawa T., Katoh Y, Bannai S, Yamamoto M. Транскрипционный фактор Nrf2 координирует группу генов, индуцируемых окислительным стрессом в макрофагах. J Biol Chem. 2000; 275: 16023–9.
CAS PubMed Статья Google ученый
Nguyen T, Huang HC, Pickett CB.Транскрипционная регуляция элемента антиоксидантного ответа. Активация Nrf2 и репрессия MafK. J Biol Chem. 2000; 275: 15466–73.
CAS PubMed Статья Google ученый
Wild AC, Moinova HR, Mulcahy RT. Регуляция экспрессии гена субъединицы гамма-глутамилцистеинсинтетазы с помощью фактора транскрипции Nrf2. J Biol Chem. 1999; 274: 33627–36.
CAS PubMed Статья Google ученый
Алам Дж., Стюарт Д., Тушар С., Бойнапалли С., Чой А. М., Кук Дж. Л.. Nrf2, фактор транскрипции Cap’n’Collar, регулирует индукцию гена гемоксигеназы-1. J Biol Chem. 1999; 274: 26071–8.
CAS PubMed Статья Google ученый
Yu R, Lei W., Mandlekar S, Weber MJ, Der CJ, Wu J, Kong AN. Роль митоген-активируемого пути протеинкиназы в индукции детоксицирующих ферментов фазы II химическими веществами. J Biol Chem.1999; 274: 27545–52.
CAS PubMed Статья Google ученый
Huang HC, Nguyen T, Pickett CB. Регулирование элемента антиоксидантного ответа с помощью протеинкиназы С-опосредованного фосфорилирования фактора 2, связанного с NF-E2. Proc Natl Acad Sci U S. A. 2000; 97: 12475–8031.
CAS PubMed PubMed Central Статья Google ученый
Ли Дж., Ли Дж. М., Джонсон Дж. А.Анализ микроматрицы выявляет набор генов, управляемых антиоксидантными элементами, участвующих в обеспечении защиты от апоптоза, вызванного окислительным стрессом, в клетках IMR-32. J Biol Chem. 2002; 277: 388–94.
CAS PubMed Статья Google ученый
Li J, Johnson JA. Зависящие от времени изменения в экспрессии генов, управляемых ARE, за счет использования процесса фильтрации шума для данных микрочипов. Physiol Genomics. 2002; 9: 137–44.
PubMed Статья Google ученый
Джонсон Д.А., Эндрюс Г.К., Сюй В., Джонсон Д.А. Активация элемента антиоксидантного ответа в культурах первичных корковых нейронов, полученных от трансгенных репортерных мышей. J Neurochem. 2002; 81: 1233–41.
CAS PubMed Статья Google ученый
Кан К.В., Чо МК, Ли СН, Ким С.Г. Активация фосфатидилинозитол-3-киназы и Akt трет-бутилгидрохиноном отвечает за индукцию rGSTA2, опосредованную элементом антиоксидантного ответа, в клетках h5IIE.Mol Pharmacol. 2001; 59: 1147–56.
CAS PubMed Google ученый
Ли Дж. М., Джонсон Дж. А. Важная роль пути Nrf2-ARE в механизме клеточной защиты. J Biochem Mol Biol. 2004. 37: 139–43.
CAS PubMed Google ученый
Сузуки Т., Ямамото М. Молекулярные основы системы Keap1-Nrf2. Free Radic Biol Med. 2015; 88: 93–100.
CAS PubMed Статья Google ученый
Нитур СК, Хатри Р., Джайсвал АК. Регламент Nrf2 — обновление. Free Radic Biol Med. 2014; 66: 34–6.
Артикул CAS Google ученый
Forman HJ, Davies KJA, Ursini F. Как на самом деле работают пищевые антиоксиданты: нейтрализация нуклеофильного тонуса и свободных радикалов парагормезиса in vivo. Free Radic Biol Med. 2014; 66: 24–35.
CAS PubMed Статья Google ученый
Внуков В.В., Гуценко О.И., Милютина Н.П., Ананян А.А., Даниленко А.О., Панина С.Б., Корниенко И.В. Влияние SkQ1 на экспрессию гена фактора транскрипции Nrf2, ARE-контролируемых генов антиоксидантных ферментов и их активность в лейкоцитах крови крыс. Биохимия (Москва). 2015; 80: 586–91.
CAS Статья Google ученый
Ито К., Мимура Дж., Ямамото М. Открытие отрицательного регулятора Nrf2, Кеап1: исторический обзор.Антиоксидный окислительно-восстановительный сигнал. 2010; 13: 1665–78.
CAS PubMed Статья Google ученый
Кенслер Т.В., Вакабаяши Н. Nrf2: друг или враг для химиопрофилактики? Канцерогенез. 2010; 31: 90–9.
CAS PubMed Статья Google ученый
Солис Л.М., Беренс С., Донг В., Сураокар М., Озберн, Северная Каролина, Моран, Калифорния, Корвалан А.Х., Бисвал С., Свишер С.Г., Бекеле Б.Н., Минна Д.Д., Стюарт Д.Д., Вистуба II.Аномалии Nrf2 и Keap1 при немелкоклеточной карциноме легкого и их связь с клинико-патологическими особенностями. Clin Cancer Res. 2010; 16: 3743–53.
CAS PubMed PubMed Central Статья Google ученый
Сингх А., Мисра В., Тиммулаппа Р.К., Ли Х., Эймс С., Хок М.О., Герман Дж. Г., Бейлин С.Б., Сидрански Д., Габриельсон Э., Брок М.В., Бисвал С. Дисфункциональное взаимодействие KEAP1-NRF2 в не- мелкоклеточный рак легкого. PLoS Med.2006; 3: e420.
PubMed PubMed Central Статья CAS Google ученый
Шибата Т., Кокубу А., Гото М., Одзима Х, Охта Т., Ямамото М., Хирохаши С. Генетическое изменение Keap1 придает конститутивную активацию Nrf2 и устойчивость к химиотерапии при раке желчного пузыря. Гастроэнтерол. 2008. 135: 1358–68. 1368.e1–4.
CAS Статья Google ученый
Li K, Zhong C, Wang B, He J, Bi J. Экспрессия Nrf2 участвует в росте и дифференцировке клеток карциномы эндометрия in vitro и in vivo. J Mol Histol. 2014; 45: 161–7.
PubMed Статья CAS Google ученый
Zhang P, Singh A, Yegnasubramanian S, Esopi D, Kombairaju P, Bodas M, Wu H, Bova SG, Biswal S. Потеря Kelch-подобной функции ECH-ассоциированного белка 1 в клетках рака простаты вызывает химиорезистентность и радиорезистентность и способствует росту опухоли.Mol Cancer Ther. 2010; 9: 336–46.
CAS PubMed PubMed Central Статья Google ученый
Ji XJ, Chen SH, Zhu L, Pan H, Zhou Y, Li W, You WC, Gao CC, Zhu JH, Jiang K, Wang HD. Нокдаун фактора 2, связанного с NF-E2, подавляет пролиферацию и рост клеток глиомы человека U251MG в модели ксенотрансплантата мыши. Онкол Реп. 2013; 30: 157–64.
CAS PubMed Google ученый
Soini Y, Eskelinen M, Juvonen P, Kärjä V, Haapasaari KM, Saarela A, Karihtala P. Ядерная экспрессия Nrf2 связана с плохой выживаемостью при аденокарциноме поджелудочной железы. Pathol Res Pract. 2014; 210: 35–9.
CAS PubMed Статья Google ученый
Кансанен Э., Куосманен С.М., Лейнонен Х., Левонен А.Л. Путь Keap1-Nrf2: механизмы активации и нарушения регуляции при раке. Редокс Биол. 2013; 1: 45–9.
CAS PubMed PubMed Central Статья Google ученый
Мицуиси Ю., Тагучи К., Каватани И., Шибата Т., Нукива Т., Абуратани Х., Ямамото М., Мотохаши Х. Nrf2 перенаправляет глюкозу и глутамин в анаболические пути при метаболическом перепрограммировании. Раковая клетка. 2012; 22: 66–79.
CAS PubMed Статья Google ученый
Lennicke C, Rahn J, Lichtenfels R, Wessjohann LA, Seliger B. Редокс-протеомика: методы идентификации и обогащения окислительно-восстановительных белков и их применения.Сигнал сотовой связи. 2015; 13:39.
PubMed PubMed Central Статья CAS Google ученый
Li L, Fath MA, Scarbrough PM, Watson WH, Spitz DR. Комбинированное ингибирование гликолиза, пентозного цикла и метаболизма тиоредоксина избирательно увеличивает цитотоксичность и окислительный стресс при раке груди и простаты человека. Редокс Биол. 2014; 4С: 127–35.
Google ученый
Ji X, Wang H, Zhu J, Zhu L, Pan H, Li W, Zhou Y, Cong Z, Yan F, Chen S. Нокдаун Nrf2 подавляет ангиогенез глиобластомы путем ингибирования индуцированной гипоксией активации HIF-1α. Int J Cancer. 2014; 135: 574–84.
CAS PubMed Статья Google ученый
Карки Р., Игве О.Дж. Активация каппа-B ядерного фактора, опосредованная толл-подобным рецептором 4, необходима для восприятия экзогенных оксидантов с целью распространения и поддержания окислительного / нитрозативного клеточного стресса.PLoS One. 2013; 8: e73840.
CAS PubMed PubMed Central Статья Google ученый
Gasparini C, Celeghini C, Monasta L, Zauli G. Пути NF-kB при гематологических злокачественных новообразованиях. Cell Mol Life Sci. 2014; 71: 2083–102.
CAS PubMed Статья Google ученый
Ямамото Ю., Гейнор РБ. Роль пути NF-kB в патогенезе болезненных состояний человека.Curr Mol Med. 2001; 1: 287–96.
CAS PubMed Статья Google ученый
Ghosh S, May MJ, Kopp EB. NF-каппа B и белки Rel: эволюционно консервативные медиаторы иммунных ответов. Анну Рев Иммунол. 1998. 16: 225–60.
CAS PubMed Статья Google ученый
Oliveira-Marques V, Marinho HS, Cyrne L, Antunes F. Роль перекиси водорода в активации NF-kappaB: от индуктора до модулятора.Антиоксидный окислительно-восстановительный сигнал. 2009; 11: 2223–43.
CAS PubMed Статья Google ученый
Jung Y, Kim H, Min SH, Rhee SG, Jeong W. Легкая цепь динеина LC8 отрицательно регулирует NF-kappaB посредством окислительно-восстановительного взаимодействия с IkappaBalpha. J Biol Chem. 2008; 283: 23863–71.
CAS PubMed PubMed Central Статья Google ученый
Lee DF, Kuo HP, Liu M, Chou CK, Xia W, Du Y, Shen J, Chen CT, Huo L, Hsu MC, Li CW, Ding Q, Liao TL, Lai CC, Lin AC, Chang YH, Tsai SF, Li LY, Hung MC. Опосредованное лигазой KEAP1 E3 подавление передачи сигналов NF-kappaB путем нацеливания на IKKbeta. Mol Cell. 2009; 36: 131–40.
CAS PubMed PubMed Central Статья Google ученый
Pham CG, Bubici C, Zazzeroni F, Papa S, Jones J, Alvarez K, Jayawardena S, De Smaele E, Cong R, Beaumont C, Torti FM, Torti SV, Franzoso G.Повышение активности тяжелой цепи ферритина с помощью NF-kappaB ингибирует апоптоз, индуцированный TNF-альфа, путем подавления активных форм кислорода. Клетка. 2004; 119: 529–42.
CAS PubMed Статья Google ученый
Камата Х., Хонда С., Маеда С., Чанг Л., Хирата Х., Карин М. Активные формы кислорода способствуют гибели TNF-альфа и устойчивой активации JNK путем ингибирования фосфатаз киназы МАР. Клетка. 2005; 120: 649–61.
CAS PubMed Статья Google ученый
Риус Дж., Гума М., Шахтруп С., Акассоглу К., Зинкернагель А.С., Низет В., Джонсон Р.С., Хаддад Г.Г., Карин М. NF-kappaB связывает врожденный иммунитет с гипоксическим ответом посредством регуляции транскрипции HIF-1альфа. Природа. 2008; 453: 807–11.
CAS PubMed PubMed Central Статья Google ученый
Ма К., Киннир К., Йе Дж., Чен Б.Дж. Ингибирование ядерного фактора kappaB фенольными антиоксидантами: взаимодействие между передачей сигналов антиоксиданта и экспрессией воспалительных цитокинов.Mol Pharmacol. 2003; 64: 211–9.
CAS PubMed Статья Google ученый
Feng X, Tan W, Cheng S, Wang H, Ye S, Yu C, He Y, Zeng J, Cen J, Hu J, Zheng R, Zhou Y. Повышение регуляции микроРНК-126 в звездчатой печени клетки могут влиять на патогенез фиброза печени через путь NF-B. ДНК Cell Biol. 2015; 34: 470–80.
CAS PubMed Статья Google ученый
Коллинз Т., Цибульский М.И. NF-kB: главный посредник или невиновный наблюдатель атерогенеза? J Clin Invest. 2001; 107: 255–64.
CAS PubMed PubMed Central Статья Google ученый
Ghashghaeinia M, Toulany M, Saki M, Rodemann HP, Mrowietz U, Lang F, Wieder T. Возможные роли путей NFkB и глутатиона в зрелых эритроцитах человека. Cell Mol Biol Lett. 2012; 17: 11–20.
CAS Статья Google ученый
Никола Дж. П., Пейрет В., Назар М., Ромеро Дж. М., Лусеро А. М., Монтесинос Мдел М., Бокко Дж. Л., Пеллисас К. Г.. Masini-Repiso AM S-нитрозилирование NF-kB p65 ингибирует индуцированную ТТГ экспрессию Na (+) / I (-) -симпортера. Эндокринология. 2015; 156: 4741–54.
CAS PubMed Статья Google ученый
Shi X, Dong Z, Huang C, Ma W, Liu K, Ye J, Chen F, Leonard SS, Ding M, Castranova V, Vallyathan V. Роль гидроксильного радикала как посредника в активации фактора ядерной транскрипции NF-kappaB.Mol Cell Biochem. 1999; 194: 63–70.
CAS PubMed Статья Google ученый
Рахман И., Марвик Дж., Киркхэм П. Редокс-модуляция ремоделирования хроматина: влияние на ацетилирование и деацетилирование гистонов, NF-kappaB и экспрессию провоспалительных генов. Biochem Pharmacol. 2004. 68: 1255–67.
CAS PubMed Статья Google ученый
Ямамото Ю., Гейнор РБ.Терапевтический потенциал ингибирования пути NF-kB при лечении воспаления и рака. J Clin Invest. 2001; 107: 135–42.
CAS PubMed PubMed Central Статья Google ученый
Карин М., Такахаши Т., Капахи П., Делхас М., Чен Ю., Макрис С., Ротварф Д., Бауд В., Натоли Г., Гвидо Ф., Ли Н. Окислительный стресс и экспрессия генов: AP-1 и Соединения NF-kB. Биофакторы. 2001; 15: 87–9.
CAS PubMed Статья Google ученый
Уитмарш AJ, Дэвис RJ. Регулирование фактора транскрипции AP-1 путями передачи сигнала митоген-активируемой протеинкиназы. Ж. Мол Мед (Берл). 1996. 74 (10): 589–607.
CAS Статья Google ученый
Пинкус Р., Вайнер Л. М., Дэниел В. Роль окислителей и антиоксидантов в индукции экспрессии генов AP-1, NF-kB и глутатион-S-трансферазы. J Biol Chem. 1996; 271: 13422–9.
CAS PubMed Статья Google ученый
Павлович Д., Джорджевич В., Коцич Г. «Перекрестный разговор» между окислительным стрессом и передачей сигналов редокс-клеток. Серия Facta Unıv: Med Biol. 2002; 9: 131–7.
Google ученый
Go YM, Patel RP, Maland MC, Park H, Beckman JS, Darley-Usmar VM, Jo H. Доказательства пероксинитрита как сигнальной молекулы в зависимой от потока активации c-Jun NH (2) — терминальная киназа. Am J Physiol. 1999; 277: h2647–1653.
CAS PubMed Google ученый
Lander HM, Ogiste JS, Teng KK, Novogrodsky A. p21 ras как общая сигнальная мишень реактивных свободных радикалов и клеточного окислительно-восстановительного стресса. J Biol Chem. 1995; 270: 21195–8.
CAS PubMed Статья Google ученый
Накамура Х, Накамура К., Йодой Дж. Редокс-регуляция клеточной активации. Энн Рев Иммунол. 1997; 15: 351–69.
CAS Статья Google ученый
Circu ML, Aw TY. Активные формы кислорода, клеточные окислительно-восстановительные системы и апоптоз. Free Radic Biol Med. 2010. 48: 749–62.
CAS PubMed PubMed Central Статья Google ученый
Trachootham D, Lu W, Ogasawara MA, Valle NR, Huang P. Редокс-регуляция выживаемости клеток. Антиоксидный окислительно-восстановительный сигнал. 2008; 10: 1343–74.
CAS PubMed PubMed Central Статья Google ученый
Coskun M, Bjerrum JT, Seidelin JB, Nielsen OH. МикроРНК при воспалительном заболевании кишечника — патогенез, диагностика и терапия. Мир Дж. Гастроэнтерол. 2012; 18: 4629–34.
CAS PubMed PubMed Central Статья Google ученый
Леунг AKL, Sharp PA. Функции микроРНК при стресс-ответах. Mol Cell. 2010; 40: 205–15.
CAS PubMed PubMed Central Статья Google ученый
Линь И, Лю Х, Ченг И, Ян Дж, Хо И, Чжан С. Участие микроРНК в опосредованной перекисью водорода регуляции генов и ответе на клеточное повреждение в гладкомышечных клетках сосудов. J Biol Chem. 2009; 284: 7903–13.
CAS PubMed PubMed Central Статья Google ученый
Wang L, Huang H, Fan Y, Kong B, Hu H, Hu K, Guo J, Mei Y и Liu W. Эффекты подавления микроРНК-181a на h3O2-индуцированный апоптоз клеток H9c2 через митохондриальный апоптотический путь.Oxid Med Cell Longev. 2014; 2014: 1–16.
Google ученый
Кристиан П., Су К. Регуляция микроРНК митохондриальных и сигнальных путей стресса ER: последствия для метаболизма липопротеинов при метаболическом синдроме. Am J Physiol — Endocrinol Metab. 2014; 307: E729–37.
CAS PubMed Статья Google ученый
Magenta A, Greco S, Gaetano C, Martelli F.Окислительный стресс и микроРНК при сосудистых заболеваниях. Int J Mol Sci. 2013; 14: 17319–46.
PubMed PubMed Central Статья CAS Google ученый
Сис Х. Окислительный стресс: концепция в окислительно-восстановительной биологии и медицине. Редокс Биол. 2015; 4: 180–3.
CAS PubMed PubMed Central Статья Google ученый
Lopez-Bernardo E, Anedda A, Sánchez-Pérez P, Acosta-Iborra B, Cadenas S.4-Гидроксиноненал индуцирует опосредованную Nrf2 активацию UCP3 в кардиомиоцитах мышей. Free Radic Biol Med. 2015; 88: 427–38.
CAS PubMed Статья Google ученый
Джонс Д.П., Сис Х. Редокс-код. Антиоксидный окислительно-восстановительный сигнал. 2015; 23: 734–46.
CAS PubMed PubMed Central Статья Google ученый
den Hertog J, Groen A, van der Wijk T.Редокс-регуляция протеин-тирозинфосфатаз. Arch Biochem Biophys. 2005; 434: 11–5.
Артикул CAS Google ученый
Гопалакришна Р., Джейкен С. Передача сигналов протеинкиназы С и окислительный стресс. Free Radic Biol Med. 2000; 28: 1349–61.
CAS PubMed Статья Google ученый
Зарубин Т., Хан Дж. Активация и передача сигналов пути киназы p38 MAP.Cell Res. 2005; 15: 11–8.
CAS PubMed Статья Google ученый
Catarzi S, Romagnoli C, Marcucci G, Favilli F, Iantomasi T., Vincenzini MT. Редокс-регуляция активации ERK1 / 2, индуцированной сфингозин-1-фосфатом в фибробластах: участие НАДФН-оксидазы и рецептора тромбоцитарного фактора роста. Biochim Biophys Acta. 1810; 2011: 446–56.
Google ученый
Meng D, Shi X, Jiang BH, Fang J. Инсулиноподобный фактор роста-I (IGF-I) индуцирует трансактивацию рецептора эпидермального фактора роста и пролиферацию клеток посредством активных форм кислорода. Free Radic Biol Med. 2007; 42: 1651–60.
CAS PubMed Статья Google ученый
Nagai H, Noguchi T, Takeda K, Ichijo H. Патофизиологические роли сигнальных путей киназы ASK1-MAP. J Biochem Mol Biol. 2007; 40: 1–6.
CAS PubMed Google ученый
Son Y, Cheong Y, Kim N, Chung H, Kang DG, Pae H. Mitogen-Activated Protein Kinases и реактивные формы кислорода: как ROS могут активировать пути MAPK? J Signal Transduct. 2011; 2011: 1–6.
Артикул CAS Google ученый
Zhou JY, Liu Y, Wu GS. Роль митоген-активированной протеинкиназы фосфатазы-1 в гибели клеток, вызванной окислительным повреждением. Cancer Res. 2006; 66: 4888–94.
CAS PubMed Статья Google ученый
Nithianandarajah-Jones GN, Wilm B, Goldring CEP, Müller J, Cross MJ. ERK5: Структура, регулирование и функции. Сотовый сигнал. 2012; 24: 2187–96.
CAS PubMed Статья Google ученый
Беруэлл Л.С., Надточий С.М., Томпкинс А.Дж., Янг С., Брукс П.С. Прямые доказательства S-нитрозирования митохондриального комплекса I. Biochem J. 2006; 394: 627–34.
CAS PubMed PubMed Central Статья Google ученый
Колесник Б., Палтен К., Шраммель А., Стессель Н., Шмидт К., Майер Б., Горрен ACF. Эффективное нитрозирование глутатиона оксидом азота. Free Radic Biol Med. 2013; 63: 51–64.
CAS PubMed PubMed Central Статья Google ученый
Espinosa-Diez C, Miguel V, Mennerich D, Kietzmann T, Sánchez-Pérez P, Cadenas S, Lamas S. Антиоксидантные реакции и клеточная адаптация к окислительному стрессу. Редокс Биол. 2015; 6: 183–97.
CAS PubMed PubMed Central Статья Google ученый
Abello N, Kerstjens HA, Postma DS, Bischoff R. Нитрование тирозина белков: селективность, физико-химические и биологические последствия, денитрация и методы протеомики для идентификации тирозин-нитрированных белков. J Proteome Res. 2009. 8: 3222–38.
CAS PubMed Статья Google ученый
Dröse S, Brandt U, Wittig I. Комплексы митохондриальной дыхательной цепи как источники и мишени окислительно-восстановительной регуляции на основе тиолов. Biochim Biophys Acta. 1844; 2014: 1344–54.
Google ученый
Zarse K, Schmeisser S, Groth M, Priebe S, Beuster G, Kuhlow D, Guthke R, Platzer M, Kahn CR, Ristow M. Нарушение передачи сигналов инсулина / IGF1 увеличивает продолжительность жизни за счет стимулирования митохондриального пролина катаболизм, чтобы вызвать временный сигнал АФК.Cell Metab. 2012; 15: 451–65.
CAS PubMed PubMed Central Статья Google ученый
Glasauer A, Chandel NS. РОС. Curr Biol. 2013; 23: R100–2.
CAS PubMed Статья Google ученый
Сена Л.А., Чандель Н.С. Физиологическая роль митохондриальных активных форм кислорода. Mol Cell. 2012; 48: 158–67.
CAS PubMed PubMed Central Статья Google ученый
Финкель Т. Трансдукция сигналов митохондриальными оксидантами. J Biol Chem. 2012; 287: 4434–40.
CAS PubMed Статья Google ученый
Юн Дж., Финкель Т. Mitohormesis. Cell Metab. 2014; 19: 757–66.
CAS PubMed PubMed Central Статья Google ученый
Рахман К. Исследования свободных радикалов, антиоксидантов и кофакторов.Clin Interv Aging. 2007; 2: 219–36.
CAS PubMed PubMed Central Google ученый
Молавиан Х., Тонекабони А.М., Кохандель М., Сивалоганатан С. Синергетическое взаимодействие между клеточными антиоксидантами глутатионпероксидаза / пероксиредоксин и другими антиоксидантами и его влияние на концентрацию H 2 O 2 O 2. Научный доклад 2015; 5: 1–8.
Артикул Google ученый
Sheng Y, Abreu IA, Cabelli DE, Maroney MJ, Miller A, Teixeira M, Valentine JS. Супероксиддисмутазы и супероксидредуктазы. Chem Rev.2014; 114: 3854–918.
CAS PubMed PubMed Central Статья Google ученый
Schmölz L, Birringer M, Lorkowski S, Wallert M. Сложность метаболизма витамина E. Мир J Biol Chem. 2016; 7: 14–43.
PubMed PubMed Central Статья Google ученый
Сингх У, Деварадж С., Джиалал И. Витамин Э, окислительный стресс и воспаление. Энн Рев Нутр. 2005; 25: 151–74.
CAS Статья Google ученый
Ван Х, Куинн П.Дж. Расположение и функция витамина Е в мембранах (обзор). Mol Membr Biol. 2000; 17: 143–56.
PubMed Статья Google ученый
Коджо С. Витамин C: основной метаболизм и его функция как показатель окислительного стресса.Curr Med Chem. 2004; 11: 1041–64.
CAS PubMed Статья Google ученый
Бирк Дж., Мейер М., Аллер I, Хансен Х. Г., Одерматт А., Дик Т. П., Мейер А. Дж., Аппенцеллер-Херцог С. Эндоплазматический ретикулум: восстановленный и окисленный глутатион. J Cell Sci. 2013; 126: 1604–17.
CAS PubMed Статья Google ученый
Bharath S, Hsu M, Kaur D, Rajagopalan S, Andersen JK.Глутатион, железо и болезнь Паркинсона. Biochem Pharmacol. 2002; 64: 1037–48.
CAS PubMed Статья Google ученый
Уорнер Д.С., Шенг Х., Батиник’-Хаберле И. Окислители, антиоксиданты и ишемический мозг. J Exp Biol. 2004. 207: 3221–31.
CAS PubMed Статья Google ученый
Pastore A, Federici G, Bertini E, Piemonte F.Анализ глутатиона: влияние на окислительно-восстановительный потенциал и детоксикацию. Clin Chim Acta. 2003; 333: 19–39.
CAS PubMed Статья Google ученый
Миллс Б.Дж., Вайс М.М., Ланг К.А., Лю М.К., Циглер С. Изменения глутатиона и цистеина в крови при сердечно-сосудистых заболеваниях. J Lab Clin Med. 2000; 135: 396–402.
CAS PubMed Статья Google ученый
Navarro J, Obrador E, Carretero J, Petschen I, Aviñó J, Perez P, Estrela JM. Изменения статуса глутатиона и антиоксидантной системы в крови и раковых клетках связаны с ростом опухоли in vivo. Free Radic Biol Med. 1999; 26: 410–8.
CAS PubMed Статья Google ученый
Rubartelli A, Bonifaci N, Sitia R. Высокие скорости секреции тиоредоксина коррелируют с остановкой роста клеток гепатомы. Cancer Res.1995; 55: 675–80.
CAS PubMed Google ученый
Тониссен К.Ф., Ди Трапани Г. Ингибиторы тиоредоксиновой системы как медиаторы апоптоза для лечения рака. Mol Nutr Food Res. 2009; 53: 87–103.
CAS PubMed Статья Google ученый
Йошида С., Като Т., Тецука Т., Уно К., Мацуи Н., Окамото Т. Участие тиоредоксина в ревматоидном артрите: его костимулирующая роль в индуцированной TNF-альфа продукции IL-6 и IL-8 из культивированных синовиальных фибробластов.J Immunol. 1999; 163: 351–8.
CAS PubMed Google ученый
Накамура Х., Де Роса С., Рёдерер М., Андерсон М. Т., Дабс Дж. Г., Йодой Дж., Холмгрен А., Герценберг Л. А., Герценберг Л. А.. Повышение уровня тиоредоксина в плазме у ВИЧ-инфицированных. Int Immunol. 1996; 8: 603–11.
CAS PubMed Статья Google ученый
Пакер Л, Рой С., Сен СК.Альфа-липоевая кислота: метаболический антиоксидант и потенциальный редокс-модулятор транскрипции. Adv Pharmacol. 1997; 38: 79–101.
CAS PubMed Статья Google ученый
Senoglu M, Nacitarhan V, Kurutas EB, Senoglu N, Altun I, Atli Y, Ozbag D. Интраперитонеальная альфа-липоевая кислота для предотвращения повреждения нервной системы после травмы седалищного нерва крысы. J Повреждение периферического нерва плечевого сплетения. 2009; 4: 22–7.
PubMed PubMed Central Google ученый
Бельге Курутас Э., Инанк Гюлер Ф., Килинч М. Свободные радикалы. Arch Med Rev J. 2004; 13: 120–32.
Google ученый
Knight TR, Fariss MW, Farhood A, Jaeschke H. Роль перекисного окисления липидов как механизма повреждения печени после передозировки ацетаминофена у мышей. Toxicol Sci. 2003. 6: 229–36.
Артикул CAS Google ученый
Байт М.Л., Найт Т.Р., Лемастерс Дж. Дж., Яешке Х.Ацетаминофен-индуцированный оксидантный стресс и повреждение клеток в культивируемых гепатоцитах мышей: защита N-ацетилцистеином. Toxicol Sci. 2004; 80: 343–9.
CAS PubMed Статья Google ученый
Brener PH, Ballardo M, Mariani G, Cernadas JMC. Ошибка лечения новорожденного с крайне низкой массой тела при рождении: передозировка парацетамолом. Arch Argent Pediatr. 2013; 111: 53–5.
PubMed Google ученый
Cetinkaya A, Bulbuloglu E, Belge Kurutas E, Ciralik H, Kantarceken B, Buyukbese MA. Благоприятные эффекты n-ацетилцистеина при колите, вызванном уксусной кислотой, у крыс. Tohoku J Exp Med. 2005; 206: 131–9.
CAS PubMed Статья Google ученый
Reiter RJ, Acuña-Castroviejo D, Tan DX, Burkhardt S. Опосредованное свободными радикалами молекулярное повреждение. Механизмы защитного действия мелатонина в центральной нервной системе.Ann N Y Acad Sci. 2001; 939: 200–15.
CAS PubMed Статья Google ученый
Федор Дж., Бурда К. Потенциальная роль каротиноидов как антиоксидантов в здоровье и болезнях человека. Питательные вещества. 2014; 6: 466–88.
PubMed PubMed Central Статья CAS Google ученый
Райс-Эванс К.А., Миллер Н.Дж., Паганга Г. Взаимосвязь между структурой и антиоксидантной активностью флавоноидов и фенольных кислот.Free Radic Biol Med. 1996; 20: 933–56.
CAS PubMed Статья Google ученый
Махима Р.А., Деб Р., Латиф С.К., Абдул Самад Х., Тивари Р., Верма А.К., Кумар А., Дхама К. Иммуномодулирующие и терапевтические возможности травяных, традиционных / неагрессивных и этноветеринарных лекарств. Pak J Biol Sci. 2012; 15: 754–74.
CAS PubMed Статья Google ученый
Джошипура KJ, Ascherio A, Manson JE, Stampfer MJ, Rimm EB, Speizer FE, Hennekens CH, Spiegelman D, Willett WC. Потребление фруктов и овощей в связи с риском ишемического инсульта. ДЖАМА. 1999; 282: 12331–1239.
Артикул Google ученый
Cox BD, Whichelow MJ, Prevost AT. Сезонное потребление салатов из овощей и свежих фруктов в связи с развитием сердечно-сосудистых заболеваний и рака. Public Health Nutr.2000; 3: 19–29.
CAS PubMed Статья Google ученый
Eastwood MA. Взаимодействие пищевых антиоксидантов in vivo: как фрукты и овощи предотвращают болезни? QJM. 1999; 92: 527–30.
CAS PubMed Статья Google ученый
Гилгун-Шерки Ю., Розенбаум З., Меламед Э., Оффен Д. Антиоксидантная терапия при остром повреждении центральной нервной системы: современное состояние.Pharmacol Rev.2002; 54: 271–84.
CAS PubMed Статья Google ученый
Гилгун-Шерки Ю., Меламед Э., Оффен Д. Антиоксидантная терапия при болезни Альцгеймера: текущее состояние. J Mol Neurosci. 2003; 21: 1–11.
CAS PubMed Статья Google ученый
Алтун И., Курутас Е.Б. Уровни рецепторов эстрогенов, связанных с G-белками, после повреждения периферического нерва на экспериментальной модели крыс.World Neurosurg. 2015; 84: 1903–6.
PubMed Статья Google ученый
Вивеканантан Д.П., Пенн М.С., Сапп С.К., Хсу А, Тополь Э.Дж. Использование витаминов-антиоксидантов для профилактики сердечно-сосудистых заболеваний: метаанализ рандомизированных исследований. Ланцет. 2003; 361: 2017–23.
CAS PubMed Статья Google ученый
Belge Kurutas E, Senoglu M, Yuksel KZ, Unsal V, Altun I.Окислительный / нитрозативный стресс у пациентов с модическими изменениями: предварительное контролируемое исследование. Позвоночник (Phila Pa 1976). 2015; 40: 1101–7.
Артикул Google ученый
Block KI, Koch AC, Mead MN, Tothy PK, Newman RA, Gyllenhaal C. Влияние добавок антиоксидантов на химиотерапевтическую эффективность: систематический обзор данных рандомизированных контролируемых исследований. Лечение рака Ред. 2007; 33: 407–18.
CAS PubMed Статья Google ученый
Конклин К.А. Окислительный стресс, связанный с химиотерапией: влияние на химиотерапевтическую эффективность. Integr Cancer Ther. 2004; 3: 294–300.
CAS PubMed Статья Google ученый
Lawenda BD, Kelly KM, Ladas EJ, Sagar SM, Vickers A, Blumberg JB. Следует ли избегать дополнительного приема антиоксидантов во время химиотерапии и лучевой терапии? J Natl Cancer Inst. 2008; 100: 773–83.
CAS PubMed Статья Google ученый
Hrelia S, Bordoni A, Angeloni C, Leoncini E, Biagi P. Питательные вмешательства для противодействия окислительному стрессу в сердечных клетках. Ital J Biochem. 2004. 53: 157–63.
CAS PubMed Google ученый
Ники Э. Антиоксиданты: основные принципы, новые концепции и проблемы. Биомед Дж. 2014; 37: 106–11.
PubMed Google ученый
Ники Э.Нарушают ли антиоксиданты передачу сигналов реактивными формами кислорода и продуктами окисления липидов? FEBS Lett. 2012; 586: 3767–70.
CAS PubMed Статья Google ученый
Рахал А., Кумар А., Сингх В., Ядав Б., Тивари Р., Чакраборти С., Дхама К. Окислительный стресс, прооксиданты и антиоксиданты: взаимодействие. BioMed Res Int. 2014; 2014: 1–19.
Артикул CAS Google ученый
Seo MY, Lee SM. Защитный эффект низких доз аскорбиновой кислоты на гепатобилиарную функцию при ишемии / реперфузии печени у крыс. J Hepatol. 2002; 36: 72–7.
CAS PubMed Статья Google ученый
Бюттнер Г.Р., Юркевич Б.А. Каталитические металлы, аскорбат и свободные радикалы: комбинации, которых следует избегать. Rad Res. 1996; 145: 532–41.
CAS Статья Google ученый
Buettner GR. Порядок иерархии свободных радикалов и антиоксидантов: перекисное окисление липидов, α-токоферол и аскорбат. Arch Biochem Biophys. 1993; 300: 535–43.
CAS PubMed Статья Google ученый
Яо ХТ, Луо Миннесота, Хунг Л.Б., Чианг М.Т., Линь Дж. Х., Лии К.К., Хуанг Си. Влияние олигосахаридов хитозана на ферменты, метаболизирующие лекарственные средства, в печени и почках крыс. Food Chem Toxicol. 2012; 50: 1171–7.
CAS PubMed Статья Google ученый
Hebbar V, Shen G, Hu R, Kim BR, Chen C, Korytko PJ, Crowell JA, Levine BS, Kong AN. Токсикогеномика ресвератрола в печени крыс. Life Sci. 2005. 76: 2299–314.
CAS PubMed Статья Google ученый
Янг А.Дж., Лоу GM. Антиоксидантные и прооксидантные свойства каротиноидов. Arch Biochem Biophys. 2001; 385: 20–7.
CAS PubMed Статья Google ученый
Kontush A, Finckh B, Karten B, Kohlsch¨utter A, Beisiegel U. Антиоксидантная и прооксидантная активность α-токоферола в плазме крови человека и липопротеинов низкой плотности. J Lipid Res. 1996; 37: 1436–48.
CAS PubMed Google ученый
Холливелл Б. Являются ли полифенолы антиоксидантами или прооксидантами? Что мы узнаем из исследований на культуре клеток и in vivo? Arch Biochem Biophys. 2008; 476: 107–12.
CAS PubMed Статья Google ученый
Эффекты антиоксидантов на здоровье — 1-е издание
Описание
Эффекты антиоксидантов на здоровье: светлая и темная сторона исследует роль, которую антиоксиданты играют в различных ситуациях, связанных со здоровьем и болезнями.В книге обсуждается историческая эволюция антиоксидантов, их окислительный стресс и содержится подробный подход к 1) эндогенным антиоксидантам, включая эндогенные источники, механизмы действия, положительное и вредное воздействие на здоровье, доказательства in vitro, исследования на животных и клинические исследования; 2) синтетические антиоксиданты, включая источники, химию, биодоступность, правовой статус, механизмы действия, положительное и вредное воздействие на здоровье, доказательства in vitro, исследования на животных и клинические исследования; и 3) природные антиоксиданты, включая источники, химию, биодоступность, механизмы действия, возможную прооксидантную активность; положительное и вредное воздействие на здоровье, данные in vitro, исследования на животных и клинические исследования.На протяжении всей беседы исследуется взаимосвязь антиоксидантов с различными полезными и вредными эффектами, а также рассматриваются и исследуются текущие противоречия и перспективы на будущее. Влияние антиоксидантов на здоровье: яркая и темная сторона оценивает текущие научные данные по антиоксидантным темам, уделяя особое внимание эндогенным антиоксидантам, природным антиоксидантам и синтетическим антиоксидантам. Это будет полезный ресурс для ученых-фармацевтов, специалистов в области здравоохранения, тех, кто изучает естественную химию, фитохимию, фармакогнозию, синтез натуральных продуктов, а также экспертов по составлению лекарственных трав и натуральных фармацевтических препаратов.
О редакторах
Сейед Мохаммад Набави
Сейед Мохаммад Набави — биотехнолог и старший научный сотрудник Исследовательского центра прикладной биотехнологии Медицинского университета Бакияталла и член Фонда национальных элит Ирана. Его исследования были сосредоточены на укреплении здоровья натуральных продуктов. Он является автором / соавтором 200 публикаций в международном журнале, 51 сообщения на национальных и международных конгрессах и восьми глав в книжных сериях.Он является рецензентом нескольких международных журналов.
Связи и экспертиза
Университет медицинских наук Бакияталла, Иран
Ана Силва
Ана Санчес Силва — научный сотрудник Национального института аграрных и ветеринарных исследований (INIAV, IP). Она получила степень в области фармации в Университете Коимбры, Португалия, и защитила докторскую диссертацию по Европе. Имеет степень бакалавра фармацевтики Университета Сантьяго-де-Компостела, Испания, с отличием. Кроме того, она была удостоена премии за лучшую докторантуру.Ана Санчес-Силва имеет замечательный послужной список (более 100 научных статей в рецензируемых журналах или главах книг). Имеет более 300 сообщений на национальных и международных конференциях. Ее исследовательские интересы сосредоточены на оценке безопасности и состава пищевых продуктов и упаковки пищевых продуктов. Кроме того, ее особый интерес представляет изучение пищевых биологически активных соединений и пищевых добавок, а также разработка аналитических методологий для анализа биологически активных соединений в пищевых продуктах.
Связи и экспертиза
Национальный институт аграрных и ветеринарных исследований (INIAV, I.P.) и Центр исследований в области зоотехники (CECA), Порту, Португалия
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Являются ли взаимные взаимодействия между антиоксидантами единственными факторами, ответственными за антагонистический антиоксидантный эффект их смесей? Аддитивные и антагонистические антиоксидантные эффекты в смесях галловой, феруловой и кофейной кислот
На рисунках 1, 2 и 3 показано влияние количества галловой, феруловой или кофейной кислоты в однокомпонентных растворах и их бинарных смесях (см. Таблицу 1), все различающиеся типом растворителя:
вода — рис.1а, 2а и 3а;
смесь этанол / вода, содержащая 15% этанола — рис. 1b, 2b и 3b;
смесь этанол / вода, содержащая 40% этанола Рис. 1c, 2c и 3c или
этанол — фиг. 1d, 2d и 3d, от антиоксидантной активности измерительной системы.
Пунктирная линия с треугольниками на рис.1 и 2 представляют собой галловую кислоту; штрихпунктирная линия с кружками на рис. 2 и 3 соответствует феруловой кислоте, а пунктирная линия со звездами на рис. 1 и 3 — кофейная кислота. На рисунках 1, 2 и 3 также представлены ожидаемые кривые (пунктирные линии с ромбами), построенные путем определения экспериментальной индивидуальной антиоксидантной активности исследуемых антиоксидантов. Внизу каждого рисунка расположены три оси, которые помогают связать отдельные экспериментальные точки на рисунках с номерами образцов, указанными в таблице 1.Концентрация каждого антиоксиданта выражалась объемом его раствора в 100 мкл образца, введенного в измерительную систему. Для лучшего понимания результатов на рис. 1a: a – d отмечены четыре точки.
Точка «а» соответствует проценту ингибирования измерительной системы, содержащей 80 мкл водного раствора галловой кислоты и 20 мкл воды в 100 мкл образца (образец номер 4 в таблице 1).
Точка «b» соответствует проценту ингибирования измерительной системы, содержащей 20 мкл водного раствора кофейной кислоты и 80 мкл воды в 100 мкл образца (номер образца 11 в таблице 1).
Точка «c» соответствует проценту ингибирования измерительной системы, содержащей 20 мкл кофейной кислоты и 80 мкл галловой кислоты (оба в виде водных растворов) в 100 мкл образца (номер образца 24 в таблице 1).
Точка «d» — это так называемая «теоретическая» точка, представляющая процент ингибирования, ожидаемый для смеси, содержащей 80 мкл галловой кислоты и 20 мкл кофейной кислоты, при условии аддитивности антиоксидантного эффекта. Значение было рассчитано путем определения процента ингибирования, показанного образцом, состоящим из 80 мкл галловой кислоты и 20 мкл растворителя (см. Пункт «а»), и образцом, состоящим из 20 мкл кофейной кислоты и 80 мкл растворителя ( см. пункт «б»).
Как следует из представленных рисунков, кривые, соответствующие отдельным компонентам, отражают очевидную взаимосвязь для антиоксидантов: увеличение их концентрации (выраженное в виде объема) вызывает рост процента ингибирования данного антиоксиданта. Однако наиболее важным для настоящих данных является сравнение экспериментально оцененной антиоксидантной активности бинарных смесей с их ожидаемой антиоксидантной активностью, рассчитанной на основе данных для отдельных антиоксидантов (сплошная и пунктирная линии, соответственно).Как видно из рисунка, ход экспериментальной и ожидаемой кривых практически одинаков. Во всех случаях наблюдаемые различия статистически незначимы ( p > 0,05), что указывает на то, что антиоксидантные свойства бинарных смесей антиоксидантов являются суммой антиоксидантных свойств их антиоксидантных компонентов. Этот результат согласуется со всеми использованными растворителями (см. Части a – d на рис. 1, 2, 3), т. Е. Аддитивный антиоксидантный эффект смесей галловая / феруловая или галловая / кофейная или феруловая / кофейная кислоты на процесс поглощения Катион-радикалы ABTS присутствуют во всех из них.
Более подробное рассмотрение результатов, представленных на рис. 1, 2 и 3 показывает, что антиоксидантная активность исследуемых кислот и их бинарных смесей зависит также от состава реакционной среды. Для всех кислот и кислотных пар наибольшая антиоксидантная активность наблюдается в смеси этанол / вода, содержащей 40% спирта (см. Часть c на рис. 1, 2, 3). Этот факт может быть связан с вязкостью смеси этанол / вода, которая является максимальной для 40% -ного раствора этанола.Не исключено, что наиболее вязкая структура этанол / вода проявляет наибольшее пропускание протонов и электронов и, следовательно, отвечает за самые высокие антиоксидантные свойства исследованных фенольных кислот. Важность типа растворителя для оценки антиоксидантной активности известна из литературы [13, 14]. Более того, Dawidowicz и Olszowy [15] показали, что содержание воды в антиоксидантном растворителе также оказывает явное влияние на процент ингибирования, который является мерой антиоксидантной активности.Таким образом, очевидны некоторые видимые различия в антиоксидантной активности исследуемых кислот и их бинарных смесей в воде, этаноле и растворителях вода / этанол.
Хотя аддитивный антиоксидантный эффект в бинарных смесях был объяснен для ситуации, когда оба антиоксиданта имеют одинаковую антиоксидантную эффективность [16], эти ответы бесполезны, когда три исследованные кислоты проявляют разную антиоксидантную способность, галловая кислота является самым мощным антиоксидантом. . В свете данных рис.1, 2 и 3, наблюдение Ауна и Макриса применимо не ко всем экспериментальным системам.
Последующие экспериментальные стадии включали тройные смеси. На рисунке 4 представлена антиоксидантная активность, выраженная в процентах ингибирования катион-радикалов ABTS, для кофейной кислоты (столбцы с точками), галловой кислоты (столбцы с клетчатым рисунком), растворов феруловой кислоты (белые столбцы) и их тройных смесей (столбцы с диагональными столбиками). полосы), различающиеся по количеству отдельных компонентов и оцениваемые как разные по типу растворителя:
вода — рис.4а;
смесь этанол / вода, содержащая 15% этанола — рис. 4b;
смесь этанола и воды, содержащая 40% этанола Рис. 4c или
этанол — рис. 4д
Количество каждой полосы в данном наборе полос соответствует количеству исследованных образцов, перечисленных в таблице 2, e.г .:
столбик номер 1 отражает антиоксидантную активность образца 1 из таблицы 2, состоящего из 15 мкл раствора кофейной кислоты и 75 мкл данного растворителя;
столбик номер 4 отражает антиоксидантную активность образца 4 из таблицы 2, состоящего из 30 мкл раствора галловой кислоты и 60 мкл данного растворителя;
столбик номер 7 отражает антиоксидантную активность образца 7 из таблицы 2, состоящего из 45 мкл раствора феруловой кислоты и 45 мкл данного растворителя;
столбик номер 10 отражает антиоксидантную активность образца 10 из таблицы 2, состоящего из 15 мкл раствора кофейной кислоты, 30 мкл раствора галловой кислоты и 45 мкл раствора феруловой кислоты, все в одном растворителе;
В этих экспериментах все образцы, введенные в измерительные системы, были 90 мкл.
Набор столбцов на рис. 4 также содержит ожидаемые антиоксидантные активности, построенные путем сложения экспериментальных данных об активности для каждого исследованного антиоксиданта (черные столбцы, обозначенные «Σ») — например, столбцы, обозначенные как Σ a , представляют ожидаемый процент ингибирования. смеси, содержащей 15 мкл кофейной кислоты, 30 мкл галловой кислоты и 45 мкл феруловой кислоты, предполагая аддитивный антиоксидантный эффект. Значение было рассчитано путем определения процента ингибирования, показанного для образцов 1, 4 и 7.
Анализ результатов показывает, что ожидаемые антиоксидантные свойства тройной смеси выше, чем экспериментально определенные. Значимость разницы между экспериментальной и ожидаемой антиоксидантной активностью тройных смесей была оценена по значениям T и p , приведенным в таблице 3. Чем выше значение T , тем более значимой будет разница. Как следует из анализа данных таблицы 3, наблюдаемая разница незначительна ( p > 0.05) только для образца № 13 (см. Столбцы 2 6 7 Σ d 13 в этаноле на рис. 4d). Таким образом, полученные экспериментальные данные в целом указывают на антагонистическое антиоксидантное действие тройных смесей исследуемых кислот на процесс улавливания свободных радикалов. Величина этого эффекта зависит от взаимных концентрационных соотношений между отдельными компонентами (выраженными объемами растворов антиоксидантов) и типами растворителей (см. Рис. 4; табл. 3).
Таблица 3 Значимость (значения T и p ) разницы между экспериментальной и ожидаемой антиоксидантной активностью для тройной смеси исследуемых антиоксидантовОчень трудно объяснить наблюдаемое явление, поскольку антагонизм и синергизм антиоксидантов еще не были подробно описаны.В литературе было высказано предположение, что антагонизм между антиоксидантами может быть результатом:
регенерация менее эффективного антиоксиданта более эффективным антиоксидантом [17, 18];
окисление более эффективного антиоксиданта радикалами менее эффективного антиоксиданта [17, 18];
конкурентное образование антиоксидантных аддуктов [19,20,21,22] и
изменение микросреды одного антиоксиданта другим антиоксидантом [17, 23].
Чтобы ответить на вопрос, какая из этих причин наиболее вероятно ответственна за наблюдаемый антиоксидантный антагонизм в исследуемых тройных смесях, был проведен анализ измерительных систем, содержащих отдельные антиоксиданты и их бинарные и тройные смеси, с использованием ВЭЖХ с масс-спектрометрией и детектированием флуоресценции. Эти эксперименты исключили образование аддуктов, димеров и / или продуктов окисления антиоксидантов и не показали повышенного потребления более сильного антиоксиданта в присутствии более слабого (что указывало бы на процесс регенерации более слабого антиоксиданта более сильным).Единственным очевидным наблюдением в этих экспериментах было явное снижение потребления феруловой кислоты (самого слабого используемого антиоксиданта) в тройных смесях по сравнению с ее потреблением в измерительных системах, содержащих только этот антиоксидант и его смесь с галловой или кофейной кислотой. Это наблюдение подтверждается экспериментальными данными из таблиц 4 и 5, показывающих истощение феруловой кислоты в измерительных системах, содержащих только этот антиоксидант и его бинарный (таблица 4), и его тройные (таблица 5) смеси с галловой и / или кофейной кислотой.Более подробный анализ результатов из таблицы 5 дополнительно показывает двусмысленную связь между истощением феруловой кислоты (самый слабый используемый антиоксидант) и концентрацией галловой кислоты (самый сильный используемый антиоксидант) в измерительной системе: чем больше концентрация галловой кислоты в тройной смеси антиоксиданта, тем меньше обеднение феруловой кислоты. Это соотношение может подтвердить справедливость гипотезы, предполагающей регенерацию менее эффективного антиоксиданта более эффективным [17, 18].По данным Rúa et al. [18], антиоксидантный антагонизм в бинарных смесях антиоксидантов возникает из-за разницы в восстановительном потенциале отдельных компонентов. Однако в свете литературных данных, касающихся восстановительного потенциала исследованных фенольных кислот, справедливость этого объяснения трудно принять. По данным Rúa et al. [18] и Chen et al. [24], потенциалы восстановления этих соединений близки. Следовательно, отсутствие антиоксидантного антагонизма в бинарных смесях исследуемых антиоксидантов (рис.1, 2, 3) кажется правдоподобным. С другой стороны, применимость этой теории для объяснения наблюдаемых антагонизмов в тройных смесях является спорной. Есть несколько работ [25, 26], в которых сообщается о различных потенциалах восстановления исследуемых антиоксидантов — ниже для галловой и кофейной кислоты и выше для феруловой кислоты. В таком случае теория регенерации была бы полезна для объяснения антагонистического антиоксидантного эффекта, наблюдаемого в тройных смесях, но ее было бы недостаточно для бинарных смесей, содержащих феруловую кислоту, для которых наблюдается аддитивность антиоксидантных свойств отдельных компонентов — см. Рис.2 и 3.
Таблица 4 Истощение запасов феруловой кислоты в измерительных системах, содержащих один антиоксидант и его бинарную смесь Таблица 5 Истощение запасов феруловой кислоты в измерительных системах, содержащих один антиоксидант и его тройную смесьТаблицы 6 и 7 показывают истощение галловой кислоты в измерительных системах, содержащих только этот антиоксидант и его бинарные и тройные смеси с феруловой и / или кофейной кислотой. Как следует из этих данных, наблюдается полное истощение галловой кислоты независимо от исследуемой системы.Эти данные и данные из таблиц 4 и 5 предлагают другое возможное объяснение антагонистического эффекта в трехкомпонентных смесях антиоксидантов: различия в кинетике реакции между данным антиоксидантом и катион-радикалом ABTS. Самый сильный антиоксидант быстро снижает концентрацию катион-радикала ABTS, тем самым уменьшая скорость реакции между более слабым антиоксидантом и радикалами из-за быстрого снижения концентрации последнего. Если это так, то величина наблюдаемого антагонистического эффекта в смесях исследуемых антиоксидантов должна зависеть не только от концентрации антиоксиданта и типа растворителя (подтверждается данными на рис.4), но и от концентрации катион-радикалов.
Таблица 6 Истощение галловой кислоты в измерительных системах, содержащих один антиоксидант и его бинарную смесь Таблица 7 Истощение галловой кислоты в измерительных системах, содержащих один антиоксидант и его тройную смесьНа рисунке 5 представлена антиоксидантная активность, оцененная в 40% этанола и выраженная как процент ингибирования катионных радикалов ABTS, для кофейной кислоты (столбцы с точками), галловой кислоты (столбцы с клетчатым рисунком), растворов феруловой кислоты (белые столбцы) и для их бинарных смесей (столбики с диагональными полосами), состоящих из равных объемов индивидуальных компонентов растворов.В этих экспериментах применяли две концентрации ABTS: Abs = 0,4 и Abs = 0,5 — рис. 5а, б соответственно. В измерительные системы вводили 100 мкл образцов. На рисунке 5 также представлены ожидаемые антиоксидантные активности, полученные путем сложения экспериментальных данных об активности для каждого исследованного антиоксиданта (черные столбцы, обозначенные как «Σ») — например, столбик, обозначенный как Σ 1 , представляет процент ингибирования, который должен проявляться смесью, содержащей 50 мкл кофейной кислоты и 50 мкл феруловой кислоты, предполагая аддитивный антиоксидантный эффект.Как следует из представленных данных, ожидаемые антиоксидантные свойства бинарных смесей выше, чем экспериментально определенные. Наблюдаемые антагонистические антиоксидантные эффекты более очевидны при более низкой концентрации ABTS (сравнение индивидуальных данных с рис. 5a, b). Наибольший антагонистический эффект имеет бинарная смесь галловой и феруловой кислот. Значимость разницы между экспериментальной и ожидаемой антиоксидантной активностью бинарных смесей была оценена по значениям T и p , приведенным в таблице 8.
Таблица 8 Значимость (значения T и p ) разницы между экспериментальной и ожидаемой антиоксидантной активностью для бинарной смеси исследуемых антиоксидантовНа рисунках 6 и 7 показаны результаты дополнительных экспериментов, проведенных для установления взаимосвязи между процентом ингибирования катион-радикала ABTS и концентрацией феруловой (A и D), кофейной (B и E) и галловой кислоты (C и F) при две разные концентрации ABTS • + (Abs = 0.5 — см. A, B и C; Abs = 1.0 — см. D, E и F) и при двух различных концентрациях этанола (15% — Рис. 6; 40% — Рис. 7). Наклон графика зависимости (см. Линейные уравнения на отдельных графиках) является мерой скорости реакции между радикалом и антиоксидантом. Представленные данные подтверждают литературные данные о кинетике реакции, в частности ее зависимости от концентрации реагента и типа растворителя, а также доказывают, что скорость реакции между катион-радикалом ABTS и галловой кислотой является самой быстрой.Следовательно, данные рис. 6 и 7 подтверждают справедливость гипотезы о том, что различия в кинетике реакций между данным антиоксидантом и катион-радикалом ABTS ответственны за наблюдаемый антагонистический эффект в тройных смесях: степень обеднения катион-радикалов ABTS за единицу времени галловой кислотой ( самый быстрый антиоксидант) самый лучший. Как следствие, доступность катион-радикалов ABTS для более слабых молекул антиоксидантов (кофейной и феруловой кислоты) снижается. При более высокой концентрации катион-радикалов ABTS ( A = 0.8) антагонистический антиоксидантный эффект в бинарных смесях не наблюдается (см. Рис. 1, 2, 3). Несмотря на быструю нейтрализацию радикалов сильнейшим антиоксидантом, их концентрация достаточно высока, чтобы поддерживать стабильность кинетики реакции с более слабым антиоксидантом. Добавление к радикалам другого конкурента при A = 0,8 вызывает их более быстрое расходование и замедляет кинетику их реакции с более слабыми антиоксидантами. Следовательно, в тройных смесях наблюдается антагонистический антиоксидантный эффект (см. Рис.4).
Настоящее исследование, как и другие многочисленные опубликованные научные работы и исследования, пытается объяснить причины антагонистического антиоксидантного эффекта, наблюдаемого в различных смесях фенольных веществ. Полученные данные доказывают, что экспериментально наблюдаемый антиоксидантный антагонизм в смесях антиоксидантов не является результатом взаимного взаимодействия отдельных антиоксидантов, вызывающего изменение их способности к нейтрализации радикалов, а является результатом различия кинетики реакции между данным антиоксидантом и катион-радикалом ABTS. .Величина наблюдаемого экспериментально антагонистического действия антиоксидантной смеси зависит как от типа отдельных компонентов смеси, так и от их взаимных количественных соотношений. Эти выводы были сделаны на основе экспериментов с бинарными и тройными смесями растворов галловой, феруловой и кофейной кислот концентраций, аналогичных тем, которые обнаруживаются в вине. Для их подтверждения необходимы дальнейшие эксперименты с другими антиоксидантными системами, различающимися по качественному и количественному составу.Тем более, что результаты из литературы [27, 28] показывают, что на антиоксидантное взаимодействие влияет соотношение фитохимических веществ. Подробные сведения об антагонистическом действии различных смесей антиоксидантов могут быть полезны при разработке функциональных пищевых продуктов и добавок.
Антиоксидантная активность и механизм ингибирующего действия гентизиновой и α-резорциловой кислот
Материалы
GA и α-RA были приобретены у Sigma-Aldrich (Сент-Луис, Миссури). Все остальные химические вещества и растворители, использованные в этом исследовании, были чистыми для аналитических реагентов и были предоставлены Sigma-Aldrich (St.Луис, Миссури) и Мерк (Дармштадт, Германия). Рафинированные соевые и оливковые масла без добавления антиоксидантов поставлялись Roghan Nahan Gol (Шахре Корд, провинция Чахармахал и Бахтиари) и Etka (Мешхед, провинция Хорасан Разави), соответственно, и хранили при -18 ° C до анализа. Состав жирных кислот масел показан в таблице 1.
Таблица 1 Состав жирных кислот растительных масел.DPPH
· Анализ активности по улавливаниюСпособность антиоксидантов улавливать радикалы 2,2-дифенил-1-пикрилгидразил (DPPH) измеряли согласно Lima et al. 9 . Образцы реагировали со стабильным DPPH · в метаноле. Оптическую плотность образцов измеряли по контрольному образцу при 517 нм через 30 мин при комнатной температуре в темноте. Ингибирование свободного DPPH · в процентах (I%) рассчитывали следующим образом:
$$ {\ text {I \% =}} \ frac {{{\ text {A}} _ {{{\ text { Пусто}}}} — {\ text {A}} _ {{{\ text {Sample}}}}}} {{{\ text {A}} _ {{{\ text {Blank}}}}}} \ times {100} $$
(1)
где A Sample представляет собой абсорбцию тестируемого соединения, а A Blank представляет собой абсорбцию контрольной реакции (содержащей все реагенты, кроме тестируемого соединения).Концентрация образца, необходимая для 50% -ного ингибирования DPPH · (значение IC 50 ), была рассчитана с помощью линейного регрессионного анализа кривой доза-ответ, построенной между I% и концентрациями. Снижающая способность антиоксидантов (ARP) была рассчитана на основе значения IC 50 следующим образом:
$$ {\ text {ARP =}} \ frac {1} {{{\ text {IC}} _ {{{50} }}}} \ times {100} $$
(2)
где чем больше значение ARP, тем эффективнее антиоксидант.
Коэффициент распределения (log P)
Растворы (0,3 мМ) каждого соединения в 1-октаноле выдерживали при 60 ° C в течение 1 часа. Максимальное поглощение считывали по УФ-спектру (A 0 ). Равные объемы этого раствора и ацетатного буфера (0,1 М, pH 3,5 и 5,5) встряхивали в течение 1 мин. УФ-спектр слоя 1-октанола определяли через 30 мин (A x ). Коэффициент распределения (log P) антиоксиданта был рассчитан по следующему уравнению: 10 :
$$ {\ text {P =}} \ frac {{{\ text {A}} _ {{\ text {x }}}}} {{{\ text {A}} _ {{0}} — {\ text {A}} _ {{\ text {x}}}}} $$
(3)
Удаление масел
Очищенные триацилглицерины соевого и оливкового масел получали путем удаления коренных антиоксидантов адсорбционной хроматографией 11 : 130 г масел очищали дважды, пропуская через стеклянную колонку (25 × 2.5 см в.д.), заполненный 70 г оксида алюминия 60, активированного при 200 ° C в течение 3 часов в нижнем слое, и 15 г силикагеля, активированного при 160 ° C в течение 3 часов в верхнем слое. Триацилглицерины отсасывали через колонку в темноте без растворителя. Образцы хранили при -20 ° C в инертной атмосфере. Очищенные масла содержат незначительные количества гидропероксидов (пероксидное число <1 мэкв. Кг -1 ) 12 , фенольные соединения 13 и токоферолы (<1 мг кг -1 ) 14 .
Приготовление и окисление масел и эмульсий масло-в-воде
Соевые и оливковые масла, содержащие различные концентрации антиоксидантов (0,02, 0,04, 0,08, 0,16 и 0,32% GA и α-RA), получали путем добавления аликвоты их растворов в ацетоне. Растворитель удаляли в атмосфере азота. Окисление проводили в темноте при 60 ° C. Полученные масла (4 г) толщиной 1 мм окисляли в чашке Петри диаметром 9 см. В этих условиях процесс протекал в кинетическом режиме, т.е.е., при достаточно высокой концентрации кислорода, при которой скорость диффузии не влияет на скорость окисления 15 . Были сохранены три реплики образцов.
Водную фазу эмульсии готовили диспергированием Tween 20 в дистиллированной воде с последующим перемешиванием при комнатной температуре в течение ночи для обеспечения полного диспергирования и гидратации. Эмульсию масла в воде готовили путем добавления 10 мас.% Очищенных масел, содержащих 0,02% антиоксидантов, к 90 мас.% Водной фазы при температуре окружающей среды и гомогенизировали в течение 2 мин в высокоскоростном смесителе (Waring Commercial, СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ).Для получения стабильной эмульсии смесь встряхивали на ультра-Turrax (3 мин, ~ 12000 об / мин). Во время каждого прохода эмульсии собирали в химическом стакане на ледяной бане. Образцы эмульсии хранили в печи при 60 ° C. Экстракцию масла из эмульсий для анализа проводили встряхиванием смеси системы растворителей метанол / хлороформ (1: 1 по объему) и эмульсии в течение 1 мин, а затем центрифугированием в течение 1 мин при 700 × g . Нижний липидный слой собирали, и его растворитель выпаривали, используя поток азота.После процесса окисления через определенные промежутки времени отбирали образцы и подвергали их спектрофотометрическому определению пероксидного числа (PV) как первичных продуктов окисления. Построены кинетические кривые накопления пероксида. Координата x точки пересечения двух прямых линий, соответствующих стадиям инициирования и распространения окисления масла, была рассчитана как период индукции (IP) 16 .
Измерение PV
Образцы растительного масла (≤ 0.01–0,30 г) добавляли в стеклянную пробирку, содержащую 9,8 мл хлороформ – метанол (7: 3 об. / Об.), И перемешивали в течение 2–4 с. Добавляли 50 мл раствора тиоцианата аммония (30% мас. / Об.), Образец перемешивали на вихревой мешалке в течение 2–4 с. Затем раствор хлорида железа (II) [50 мл, (0,4 г дегидрата хлорида бария, растворенного в 50 мл H 2 O) + (0,5 г FeSO 4 · 7 H 2 O, растворенных в 50 мл H 2 O) + 2 мл 10 M HCl] с осадком, сульфатом бария, отфильтрованным до получения прозрачного раствора]), и образец встряхивали в течение 2–4 с.После 5 мин инкубации при комнатной температуре оптическую плотность образца считывали с холостым образцом (содержащим все реагенты, кроме образца) при 500 нм (УФ-видимый спектрофотометр, модель 160A Shimadzu, Киото, Япония). Результаты были представлены в миллиэквивалентах кислорода на килограмм нефти 12 .
Кинетические параметры и механизм действия
Ингибирующее действие антиоксидантов (AH) в образцах масла описывалось коэффициентом стабилизации F , степенью окисления ORR, активностью A и средней скоростью потребление антиоксидантов \ (\ overline {r} _ {{{\ text {AH}}}} \) 17 .Параметр F — это мера эффективности, представляющая возможность блокирования цепного радикального процесса путем удаления пероксидных радикалов:
$$ F = \ frac {{{\ text {IP}} _ {{{\ text {AH }}}}}} {{{\ text {IP}} _ {{0}}}} $$
(4)
где IP AH — период индукции в присутствии антиоксиданта, а IP 0 — период индукции в отсутствие антиоксиданта. ЧОО — обратная мера силы антиоксиданта (чем ниже ЧОО, тем сильнее ингибитор).
$$ {\ text {ORR =}} \ frac {{W _ {{{\ text {AH}}}}}} {{W _ {{0}}}} $$
(5)
где W AH и W 0 — скорость окисления в присутствии и в отсутствие антиоксиданта соответственно. Параметр A — это общий параметр, объединяющий параметры F и ORR:
$$ A = \ frac {F} {{{\ text {ORR}}}} $$
(6)
Параметр \ (\ overline {r} _ {{{\ text {AH}}}} \) рассчитывался по следующей формуле:
$$ \ overline {r} _ {{{\ text {AH} }}} = \ frac {{{\ text {[AH]}} _ {{0}}}} {{{\ text {IP}} _ {{{\ text {AH}}}}}} $$
(7)
где [AH] 0 — начальная концентрация антиоксиданта.
Механизм ингибирующего действия GA и α-RA был определен на основании участия их антиоксидантных молекул (AH) и радикалов (A · ) в серии реакций (Схема 1) 18 . Возможность блокирования цепного радикального процесса за счет взаимодействия с пероксидными радикалами (основная реакция обрыва цепи 7) представлена параметром F . Линейная зависимость фактора F от концентрации антиоксиданта иллюстрирует участие молекулы антиоксиданта в основном в реакции 7.{n} + \ frac {{W_ {i}}} {f} $$
(8)
где K eff — константа скорости расхода антиоксиданта в побочной реакции (ах) инициирования цепи и зависит от характера липидного субстрата, W i (M s −1 ) — средняя скорость инициации во время IP, а f — стехиометрический коэффициент ингибирования, определяющий количество перекисных радикалов, улавливаемых молекулой антиоксиданта.Если молекула антиоксиданта не принимает участие в какой-либо побочной реакции (ах), скорость побочной реакции будет равна нулю ( n = 0). Линейная зависимость при n = 1 означает, что молекула антиоксиданта участвует только в одной побочной реакции инициирования цепи (реакции 11 или 12). {n} $$
(9)
Предыдущие исследования ингибирующего действия антиоксидантов показали, что линейная зависимость при n = — 1 означает, что антиоксидантный радикал не принимает участие в реакциях распространения цепи, тогда как, если A · участвует в одной реакции распространения цепи, линейная зависимость при п = — 0.5 наблюдается 19 . Было продемонстрировано, что реакция 10 должна быть этой реакцией 20 . Нелинейная зависимость как при n = — 1, так и при n = — 0,5 указывает на то, что антиоксидантные радикалы участвовали более чем в одной реакции роста цепи. Отсутствие зависимости ( n = 0) означает, что молекула антиоксиданта настолько активна, что пероксидные радикалы (LOO · ) быстрее реагируют с антиоксидантом, чем с липидным субстратом (LH) 19 .
Статистический анализ
Все определения проводили в трех экземплярах, а данные подвергали дисперсионному анализу (ANOVA). ANOVA и регрессионный анализ проводили в соответствии с программами SPSS и Excel. Значительные различия между средними значениями были определены с помощью множественных тестов Дункана. Значения p менее 0,05 считались статистически значимыми.
Антиоксидантная активность капсаицина в отношении радиационно-индуцированного окисления мю
Рамачандран Гангабхагиратхи, 1 Рави Джоши, 2
1 Подразделение биоорганических веществ, 2 Отделение радиации и фотохимии, Центр атомных исследований Бхаббэя Мумбаи, Индия
Резюме: Капсаицин является основным капсаициноидом в перце чили и широко используется в качестве приправы.Он также используется для местного применения при периферической невропатии. Настоящее исследование посвящено его роли в модуляции вызванных гамма-излучением повреждений биохимических компонентов препарата митохондриальной мембраны печени крысы (RLM). Степень образования гидропероксида липидов, истощения протеиновых тиолов и образования протеиновых карбонилов оценивалась биохимически в присутствии различных концентраций капсаицина в RLM. Также изучалось снижение активности важного антиоксидантного фермента супероксиддисмутазы, который участвует в улавливании свободных радикалов, и маркерного фермента митохондрий сукцинатдегидрогеназы.Было обнаружено, что капсаицин эффективно ингибирует биохимические изменения, вызванные радиацией, а именно перекисное окисление липидов и окисление белков. Это также значительно предотвратило вызванную радиацией потерю активности антиоксидантного фермента и важного эндогенного антиоксиданта глутатиона. Исследование предполагает, что капсаицин может действовать как антиоксидант и радиопротектор в физиологических системах.
Ключевые слова: капсаицин, гамма-излучение, радиозащита, перекисное окисление липидов, окисление белков, активность ферментов
Введение
Фенольные соединения представляют собой важную группу вторичных метаболитов, которые синтезируются растениями в процессе адаптации растений к условиям биотического и абиотического стресса. 1,2 Исходя из природы, те же фенольные соединения, которые присутствуют в продуктах питания и лекарствах, также считаются мощными антиоксидантами. Эти соединения могут защищать различные биохимические компоненты человеческого тела от условий окислительного стресса, производя высокоактивные свободные радикалы, поглощая их и ингибируя цепные окислительные реакции. Естественный метаболизм аэробных клеток связан с контролируемым образованием свободных радикалов, которые быстро и систематически удаляются системой антиоксидантной защиты (ферментами и антиоксидантами).Однако неконтролируемое образование под воздействием ионизирующего излучения, химических веществ и болезненных состояний (воспаление, рак и т. Д.) Может вызвать окислительный стресс, ведущий к повреждению и, в конечном итоге, к гибели клеток. 3,4 Известно, что многие синтетические химические вещества в различной степени подавляют окислительное повреждение, но они также связаны с неблагоприятными побочными эффектами. Таким образом, исследование аспектов улавливания свободных радикалов антиоксидантных препаратов, изготовленных из натуральных компонентов пищи, стало не только очень важным, но и важным из-за их нетоксичной природы, ежедневного приема с пищей и благоприятного взаимодействия с различными свободными радикалами в живых клетках, генерирующих как из экзогенных источников и в эндогенных метаболических реакциях. 5–7
В этом контексте капсаицин ( транс -8-метил- N -ваниллил-6-ноненамид), присутствующий в плодах чили и придающий пикантный вкус, является важным фенольным компонентом пищи. Капсаицин (рис. 1) присутствует в нескольких разновидностях порошка перца чили с концентрацией от ~ 0,3% до ~ 2% по весу. 8 Помимо того, что он является пищевым компонентом, он растворим как в водной (~ 40 мкМ), так и в липидной фазе (log P = 3,04), имеет низкую токсичность (LD 50 [средняя летальная доза] ≥40 мг. / кг), высокая стабильность ( p K a = 9.75) и высокая биодоступность в различных тканях, которая достигает пиков в разное время после перорального приема (от ~ 3 мкМ до 36 мкМ). 9–11
Рисунок 1 Структура капсаицина. |
Сообщается, что капсаицин проявляет широкий спектр фармакологических свойств, включая антимутагенные, антиканцерогенные, 12–15 и антиоксидантные свойства; 16–22 Защита ДНК от разрывов цепей и ингибирование хромосомных аберраций; 23 защита тканей от опосредованного свободными радикалами повреждения, вызванного экзогенными химическими веществами; 24 ингибирование образования активных форм кислорода; 25 и индукция апоптоза. 26,27
Существует множество исследований с использованием химических, in vitro и животных моделей, указывающих на его сильную антирадикальную активность. 12–38 Сообщается, что способность капсаицина улавливать пероксильные радикалы выше, чем у мелатонина и кофеина. 16,21 Было также показано, что он обладает антиоксидантной активностью, аналогичной активности флавоноидов и альфа-токоферола. 18,28 Кроме того, предполагается, что капсаицин взаимодействует с ферментами, метаболизирующими ксенобиотики, например, микросомальными P450-зависимыми монооксигеназами.Предполагается, что капсаицин превращается в промежуточный феноксильный радикал посредством катализа печеночным цитохромом P450 2E1. Этот феноксильный радикал капсаицина является высокореактивным веществом и может химически связываться не только с активным центром фермента ковалентным образом, но и с другими биологически активными макромолекулами в клетках. Предполагается, что суицидальное ингибирование микросомального цитохрома P450 может предотвратить последующую активацию химических канцерогенов, мутагенов и других токсичных ксенобиотиков.Некоторые исследования указывают на такую химиопрофилактическую роль капсаицина против некоторых химических канцерогенов и мутагенов. 12,39,40
Известно, что свободные радикалы, образующиеся в процессе естественного метаболизма аэробных клеток и окислительного стресса, вызванного стимулами (химические вещества, ионизирующее излучение и т. Д.), Также могут вырабатываться с помощью гамма-излучения. Эти свободные радикалы неселективно реагируют с белками, липидами и другими находящимися поблизости молекулами из-за их высокой реакционной способности и окисляют их до нефункциональных / вредных продуктов.В этом контексте сообщаемая антирадикальная и антиоксидантная активность капсаицина побудила нас исследовать его защитные эффекты против вызванных гамма-излучением окислительных повреждений в различных компонентах митохондриального препарата, а именно в липидах, белках и ферментах. Митохондриальный препарат использовался в качестве модели, потому что он является источником энергии клетки, участвует в важных событиях переноса электронов, а также в генерации и распаде высокореактивных форм кислорода.
Материалы и методы
Chemicals
Капсаицин ( транс -8-метил- N -ваниллил-6-ноненамид) был закуплен у Sigma Chemicals (Перт, Австралия).Все остальные химические вещества были аналитической чистоты. Растворы готовили в воде Nanopure из картриджной системы фильтрации Barnstead.
Использованные животные
Самки крыс линии Вистар (возраст примерно 3–4 месяца) содержались в помещении с контролируемой температурой и влажностью (24 ° C ± 2 ° C) с 12-часовым циклом свет / темнота и получали стандартную лабораторную диету. и воду использовали ad libitum. Строго соблюдались руководящие принципы, изданные Комитетом по этике институциональных животных Центра атомных исследований им. Бхабхи (Мумбаи, Индия) в отношении содержания и вскрытия мелких животных.
Выделение митохондрий из печени крысы и облучение
Самки крыс линии Вистар (возраст ~ 14 недель) весом около 250–300 г были использованы для приготовления митохондриальной мембраны печени. Крыс умерщвляли смещением шейных позвонков (без анестезии) с должного и надлежащего разрешения и рекомендаций комитета по этике животных. Печень вырезали и гомогенизировали в 0,25 М холодной сахарозе, содержащей 1 мМ ЭДТА, затем центрифугировали при 3000 × g в течение 10 минут и супернатант центрифугировали при 10000 × g в течение 10 минут для осаждения митохондрий.Этот осадок, содержащий разорванные митохондрии, трижды промывали 5 мМ калий-фосфатным буфером, pH 7,4, для удаления сахарозы, и все образцы выдерживали при 4 ° C. 41 Метод Лоури 42 использовали для оценки белка в образцах (10 мг / мл), которые затем хранили для последующего использования.
Образцы митохондриальной мембраны печени крысы (RLM) в присутствии и в отсутствие капсаицина подвергались воздействию гамма (γ) -излучения от источника 60 Co, чтобы вызвать радиационно-индуцированное окислительное повреждение.Известно, что воздействие гамма-излучения вызывает повреждение липидов и белков с образованием окисленных продуктов, таких как гидропероксиды липидов, альдегиды, карбонилы белков и окисленный тиол. Продукты липидов и белков, индуцированные излучением, измеряли с использованием различных стандартных анализов, чтобы понять влияние капсаицина на степень повреждения, и сравнивали с контрольным набором.
TBARS assay
Анализ реактивных веществ с тиобарбитуровой кислотой (TBARS) был проведен стандартным методом для измерения малонового диальдегида и других альдегидов, которые являются продуктами перекисного окисления липидов (LP).Одна молекула альдегида конденсируется с двумя молекулами тиобарбитуровой кислоты (ТВА) с образованием частиц розового цвета, которые поглощаются при 532 нм. RLM нагревали с реагентом TBA (TBA – TCA – HCl – EDTA) в течение 20 мин на кипящей водяной бане. Раствор охлаждали, а затем центрифугировали, и оптическую плотность супернатанта регистрировали при 532 нм. 43,44
Гидропероксид липидов
Гидропероксиды липидов оценивали модифицированным методом FOX (окисление двухвалентного железа в ксиленоловом оранжевом). 45 Гидропероксиды окисляют Fe 2+ до Fe 3+ в кислых условиях и комплексы ксиленолового оранжевого (красителя) с равной молярной концентрацией Fe 3+ с образованием комплекса сине-пурпурного цвета с очевидным исчезновением коэффициент 1,5 × 10 4 M −1 см −1 при 560 нм. Реагент FOX состоит из двух растворов, раствор A состоит из 98 мг сульфата железа и аммония, 100 мл 250 мМ H 2 SO 4 и 79 мг ксиленола оранжевого, а раствор B содержит 969 мг бутилированного гидрокситолуола в 900 мл метанола, смешать в соотношении 1: 9 (хранить в темноте).Около 875 мкл реагента FOX добавляли к 125 мкл реакционной смеси и инкубировали при 37 ° C в течение 30 минут. Его центрифугировали при 10000 × g в течение 15 минут при 20 ° C, и оптическую плотность измеряли при 560 нм.
Белок тиол
В этом анализе RLM суспендировали в 14% хлорной кислоте, центрифугировали при 4500 × g в течение 5 минут, осадок суспендировали в 7% хлорной кислоте и снова центрифугировали при 4500 × g для 5 мин. К осадку добавляли 10% Triton X-100,0.2 М калий-фосфатный буфер (pH 7,4). Затем за добавлением 2 мМ 5,5′-дитиобис- (2-нитробензойной кислоты) или DTNB в буфер следовало измерение оптической плотности при 412 нм после инкубации в течение 5 минут в темноте. 46,47
Анализ карбонила белка
Этот анализ включает реакцию карбонильных групп с 2,4-динитрофенилгидразином (DNPH) с образованием 2,4-динитрофенилгидразона, который был определен спектрофотометрически при длине волны 366 нм. Экспериментальные пробирки и соответствующий набор пустых пробирок обрабатывали 20% TCA, встряхивали, охлаждали на льду и затем центрифугировали при 2000 об / мин в течение 20 минут.Осадки в пустом наборе пробирок обрабатывали 2 мл 2 н. HCl, тогда как осадки в экспериментальных пробирках обрабатывали 2 мл 10 мМ ДНФГ в 2 н. HCl. Все пробирки инкубировали при комнатной температуре в течение 1 ч с последующим добавлением в пробирки 20% TCA. Содержимое пробирок осаждали в виде гранул, трижды промывали смесью этанола и этилацетата (1: 1) для удаления избытка ДНФГ, а затем гранулы сушили и растворяли в 6 M гидрохлориде гуанидина при 37 ° C в течение 20 мин. .Оптическую плотность считывали при 366 нм. Количество образовавшихся карбонилов рассчитывали по разнице в оптической плотности холостого образца и соответствующей экспериментальной пробирки. 48
Супероксиддисмутаза
Для измерения супероксиддисмутазы (СОД) использовался адреналиновый метод. Один мл реакционной смеси содержал 50 мМ буфера карбоната натрия (pH 10,0), 25 мкл 20 мМ адреналина в 0,1 N HCl и около 20 мкг белка в образце фермента. В пустую кювету было взято такое же количество фермента и буфера, за исключением адреналина.Поглощение регистрировали при 320 нм в течение 6 мин. Активность рассчитывали с использованием разницы между поглощением стандарта и поглощением фермента и выражали в единицах / мг белка. 49
Сукцинатдегидрогеназа
Сукцинатдегидрогеназа (SDH) обладает свойствами редуктазы красителя и является единственным мембраносвязанным ферментом в цикле лимонной кислоты. Метосульфат феназина и 2,6-дихлорфенолиндофенол являются электронно-акцепторными красителями в анализе. 50 В этом анализе реакционная смесь, содержащая RLM, смешивается с 0.1 M калий-фосфатный буфер (pH 7,4) и 0,1 M цианид натрия и инкубируют при 37 ° C в течение 10 мин. Цианид натрия полностью подавляет потребление кислорода дышащими клетками и, таким образом, предотвращает потерю сукцината в результате окисления. Содержимое разделяли на две кюветы с последующим добавлением 2 мМ феназинметосульфата и 50 мкМ 2,6-дихлорфенолиндофенола. Добавление 50 мкл 0,4 М сукцината в экспериментальную кювету знаменует начало реакции, в то время как 50 мкл деионизованной воды было добавлено в кювету для холостого опыта.Поглощение регистрировали при 600 нм в течение 6 мин. Концентрация SOD выражается в «единицах», где одна единица SOD вызывает 50% ингибирование автоокисления адреналина.
Анализ общего восстановленного глутатиона (GSH)
Примерно 60 мкл O -фосфорной кислоты добавляли к RLM и центрифугировали. Затем супернатант смешивали с 0,1 M натрий-фосфатным буфером, 0,05 M EDTA (pH 8,0) и 100 мкл O -фтальдегида (1 мг / мл) и инкубировали при комнатной температуре в течение 15 минут для измерения уровней GSH.Затем регистрировали флуоресценцию, используя длину волны возбуждения 350 нм и длину волны излучения 420 нм. 51,52
Статистический анализ
Проверяли статистическую значимость разницы в параметрах между образцами, содержащими капсаицин, и соответствующими контролями. Значения, измеренные в различных анализах из шести серий экспериментов, представлены как среднее ± стандартная ошибка среднего. Дисперсионный анализ проводился с использованием программного обеспечения Origin6.1-Scientific для построения графиков и анализа данных.Уровень статистической значимости P <0,05 обозначен * на рисунках 2–5.
Рис. 2 Радиационно-индуцированное увеличение (A) TBARS и (B) гидропероксида липидов и его восстановление капсаицином в RLM (C) липидных пероксильных радикалах, улавливающих капсаицин. |
Рис. 3 Радиационно-индуцированное истощение (A) тиолов белка и (B) увеличение карбонилов белка и их восстановление капсаицином в RLM. |
Рис. 4. Радиационно-индуцированное снижение активности (A) фермента SOD (супероксиддисмутазы) и (B) фермента SDH (сукцинатдегидрогеназа) и их восстановление капсаицином. |
Рис. 5 Радиационно-индуцированное истощение GSH и его восстановление капсаицином. |
Импульсный радиолиз
Облучение электронным пучком импульсами 7 МэВ длительностью 100 нс было использовано в настоящей работе для генерации in situ и исследования переходных частиц, что было описано ранее. 53 Кинетику реакций изучали, наблюдая образование или спад поглощения рассматриваемого переходного процесса со временем при различных концентрациях образца. 54 Механизм реакции и кинетика переходных процессов были изучены путем наблюдения поглощения на разных длинах волн в разные моменты времени после облучения.
Результаты и обсуждение
Гамма-излучение высокой энергии неселективно отлагает энергию в среде, вызывая окисляющие и восстанавливающие свободные радикалы.Свободные радикалы, полученные из воды, образуются в физиологической системе под воздействием ионизирующего излучения, поскольку вода является основным компонентом. По мере увеличения дозы облучения степень наносимого ущерба также увеличивается и затем выходит на плато. Поэтому доза облучения до достижения плато была выбрана для изучения влияния капсаицина на радиационно-индуцированное окислительное повреждение. Эффект капсаицина был исследован с точки зрения его способности защищать изолированный препарат RLM от вызванных гамма-излучением повреждений липидов, белков, антиоксидантного фермента (SOD) и SDH.
В настоящей работе RLM использовался как модель биологической системы in vitro, а не как модель живого организма. Доза, выбранная для настоящего исследования (450 Гр), дает ~ 270 мкМ (рассчитано) первичных свободных радикалов, которые могут нанести значительный ущерб RLM, чтобы его можно было легко и точно измерить. Цель настоящего исследования — получить радиационное повреждение в модельной системе, а не имитировать условия лечения рака. Кроме того, концентрации капсаицина до 50 мкМ были использованы для изучения защитного действия капсаицина против окислительного повреждения, вызванного ~ 270 мкМ первичными свободными радикалами.Влияние капсаицина на исследуемые параметры (без гамма-облучения) также показано на рисунках.
Повреждение компонентов RLM, вызванное гамма-излучением, было измерено с помощью стандартных анализов. LP определяется как окислительное разрушение полиненасыщенных жирных кислот с участием цепной реакции, опосредованной свободными радикалами. Конъюгированные диены, гидропероксиды липидов, альдегиды и кетоны являются продуктами окисления ЛП. Это достаточно стабильные молекулы при физиологических температурах, и их можно оценить с помощью различных стандартизированных анализов.Капсаицин в диапазоне 5–25 мкМ придавал RLM защиту в плане уменьшения образования радиационно-индуцированного TBARS и гидропероксидов липидов. Капсаицин показал значительную защиту липидов даже при концентрации 5 мкМ, и эта защита линейно возрастала с увеличением концентрации. Известно, что липиды (LH) реагируют с окисляющим гидроксильным радикалом (· OH) с образованием углерод-центрированного радикала за счет: 1) отрыва атома водорода и 2) присоединения к ненасыщенности. Эти липидные радикалы (L ·) реагируют с кислородом с образованием липидного пероксильного радикала (LO 2 ·), который инициирует цепную реакцию, вызывающую повреждение липидов.Присутствие капсаицина во время облучения значительно ингибировало образование этих продуктов окисления липидов в RLM (рис. 2A и B) в зависимости от концентрации. Было обнаружено, что значение IC 50 составляет около 11,3 и 16,7 мкМ для тестов TBARS и LOOH (гидропероксид линолевой кислоты) соответственно. Мы также изучили прямую очистку LO 2 · с капсаицином, используя метод импульсного радиолиза. Известно, что капсаицин реагирует с окислительными радикалами с образованием переходного процесса с полосой поглощения при 380 нм. 55 Высокая концентрация липида (линолевая кислота, 11,5 мМ) прореагировала с гидроксильным радикалом (8,4 мкМ), образовавшимся in situ в присутствии воздуха (0,25 мМ кислорода) и низких концентраций капсаицина при pH 11. Обнаружен капсаицин. улавливать липидный пероксильный радикал с высокой бимолекулярной константой скорости 3,3 × 10 9 M -1 с -1 (рис. 2C). Это предельное значение, полученное с 0,11 мМ капсаицина из-за 1) низкого сигнала поглощения радикала капсаицина при 380 нм при более низких концентрациях и 2) насыщения при более высоких концентрациях капсаицина.Измеренная константа скорости улавливания липидных пероксильных радикалов (3,3 × 10 9 M −1 с −1 ) при pH 11 выше, чем указанная для CCl 3 O 2 · (2,0 × 10 9 M -1 с -1 ) и CHCl 2 O 2 · (1,2 × 10 9 M -1 с -1 ) при pH 9,4. 55 Это хорошо согласуется с тем фактом, что скорость окисления любого химического вещества значительно превышает его значение p K a (капсаицин p K a = 9.75).
Вызванное гамма-излучением истощение тиолов белка в RLM также было восстановлено до базального уровня (рис. 3A) за счет присутствия 40 мкМ капсаицина во время воздействия. Капсаицин защищает тиол белка в диапазоне концентраций 5–30 мкМ, но эффект более значительный в диапазоне концентраций 30–40 мкМ. Точно так же присутствие капсаицина уменьшало радиационно-индуцированное образование карбонила белка в RLM, и этот эффект был значительным в диапазоне концентраций 20-40 мкМ (рис. 3B).
Капсаицин также придавал защиту антиоксидантному ферменту СОД от радиационно-индуцированного окислительного повреждения, что измерялось с точки зрения активности фермента. Радиозащитное действие капсаицина по отношению к СОД оказалось значительным даже при 5 мкМ и линейно увеличивалось от 5 до 25 мкМ (рис. 4А). Присутствие капсаицина также ингибировало вызванную гамма-излучением потерю активности митохондриального маркерного фермента SDH, но оно значимо только при концентрации выше 30 мкМ (рис. 4B).Защита, оказываемая капсаицином против вызванной гамма-излучением потери эндогенного антиоксиданта GSH, была обнаружена даже при концентрации 5 мкМ и почти линейно возрастала в диапазоне концентраций 5–25 мкМ (рис. 5).
В настоящем исследовании капсаицин показал защиту от окислительного повреждения в диапазоне концентраций 5–50 мкМ. Однако конкретная концентрация не оказывает одинакового уровня защиты от окислительного повреждения различных субклеточных компонентов. Таким образом, наблюдалась разница в уровне капсаицина, чтобы обратить действие гамма-излучения на разные компоненты RLM.Это может быть связано с коэффициентом распределения капсаицина октанол-вода (log P = 3,04), что свидетельствует о его высоком распределении в липидной фазе, что отражается в зависимости от концентрации защиты липидов от 5 до 25 мкМ. Кроме того, капсаицин полностью ингибировал процесс LP при концентрации ~ 40 мкМ. Следует отметить, что капсаицин ингибировал повреждение тиолового белка и образование карбонила белка выше 20 мкМ и почти полностью при концентрации ~ 40 мкМ, что может быть связано с его сольватацией в некоторых гидрофобных карманах белков / ферментов при более низких концентрациях.Более того, радиозащита GSH и SOD капсаицином наблюдалась даже при 5 мкМ и является линейной при более высоких концентрациях.
Радиационно-индуцированное повреждение белков (включая ферменты) можно изучать напрямую, наблюдая за переходными процессами аминокислот, образующихся в этом процессе. Тирозильный радикал (TyrO ·, максимум поглощения: 410 нм) является одним из маркеров переходных процессов, образующихся при окислительном повреждении белков в дополнение к другим переходным процессам. Таким образом, удаление TyrO · с увеличением концентрации капсаицина было использовано в качестве модели для изучения защиты белков, оказываемой капсаицином.Приблизительное значение улавливания радикалов TyrO · капсаицином может быть измерено из-за перекрытия временных полос поглощения капсаицина и тирозина. Было обнаружено, что капсаицин (28–115 мкМ) улавливает радикал TyrO · с бимолекулярной константой скорости 1,2 × 10 7 M −1 с −1 .
Защита, обеспечиваемая белку тиолу и GSH, хорошо согласуется с нашим предыдущим сообщением о том, что капсаицин улавливает глутатиловый радикал с бимолекулярной константой скорости 3,4 × 10 9 M -1 с -1 . 55 Полученное нами значение потенциала восстановления радикала капсаицина (0,467 В по сравнению с NHE при pH 10,3) предполагает, что он может улавливать радикалы биомолекул, что хорошо согласуется с радиозащитной активностью капсаицина. 55 Редокс-свойства переходных процессов капсаицина, продуцируемых гидроксильным радикалом, могут быть изучены с помощью метода импульсного радиолиза и окислительно-восстановительных стандартов, метилвиологендикатора (MV 2+ ) и дианиона ABTS (ABTS 2-). 56,57 Метилвиологен — хорошо известный поглотитель электронов с известным окислительно-восстановительным потенциалом ( E 0 (MV 2+ / MV · + ) = -0.45 В) и максимум поглощения (605 нм). С другой стороны, анион ABTS 2- окисляется при +0,68 В (ABTS · — / ABTS 2-) с образованием анион-радикала ABTS · — (максимум поглощения при 650 нм). Перенос электрона от транзиента / ов, полученный в реакции капсаицина с радикалом · ОН, на метилвиологен предполагает, что только ~ 9% из них могут снижать метилвиологендикат. Кроме того, не было обнаружено, что переходные процессы капсаицина с радикалом · ОН окисляют дианион ABTS.Более того, переходные процессы капсаицина с радикалом · ОН оказываются довольно инертными по отношению к реакции с кислородом.
Как упоминалось ранее, образование феноксильного радикала капсаицина при улавливании окисляющих свободных радикалов, а также печеночного цитохрома P450 2E1 предполагает важную роль как капсаицина, так и его феноксильного радикала в физиологических системах. Механизм радиозащиты капсаицином в настоящем исследовании, по-видимому, в первую очередь связан с улавливанием свободных радикалов, образующихся при воздействии гамма-излучения in vitro.В более раннем исследовании инкубация ДНК со смесью FeSO 4 и H 2 O 2 вызывала разрыв цепи ДНК, в то время как добавление капсаицина в инкубационную смесь уменьшало разрыв цепи в зависимости от концентрации. 58 Исследования кинетической конкуренции с использованием N-оксида 5,5-диметил-1-пирролина показали, что уменьшение окислительного повреждения ДНК в первую очередь связано с поглощением гидроксильного радикала капсаицином. 58 Было показано, что капсаицин улавливает пероксильные радикалы, полученные из 2,2′-азобис (2,4-диметилвалеронитрила), как показала спектроскопия электронного парамагнитного резонанса. 58 Более ранние исследования молекулярного механизма антиоксидантной активности капсаицина противоречивы по своей природе. Эти исследования связывают фенольный или С7-бензиловый водород в капсаицине с его антиоксидантной активностью, основанной на продуктах окисления капсаицина. 16,17 Однако, используя метод импульсного радиолиза, мы явно показали, что капсаицин улавливает окисляющие свободные радикалы, а именно гидроксильные, азидильные, глутатиловые и трихлорметилпероксильные радикалы, с образованием как феноксильных, так и углерод-центрированных радикалов. 55 Феноксильный радикал, как известно, димеризуется через орто- -атомов углерода с образованием бифенольных димеров, как также сообщалось для тирозина. Более того, бензильный радикал с углеродным центром может димеризоваться с образованием бифенольного соединения, как сообщалось ранее, с использованием масс-спектроскопии, связанной с химической ионизацией при атмосферном давлении. 16
Настоящее исследование и литература предполагают, что активность капсаицина по улавливанию радикалов играет важную роль в защите липидов (LH), белков (PH) и ферментов от окислительного повреждения, вызванного гамма-излучением.Поскольку гидроксильный радикал является наиболее окисляющим радикалом, образующимся при нормальном метаболизме и воздействии ионизирующего излучения, реакции, происходящие при окислительном повреждении исследуемых биомолекул и защите, обеспечиваемой капсаицином, могут быть объяснены, используя его в качестве реактивного радикала [Уравнения (1) — (7 )].
Заключение
Настоящее исследование показывает, что капсаицин является эффективным антиоксидантом в модели RLM даже при 5 мкМ. Он способен защищать основные биохимические компоненты клеток (липиды и белки) от окислительного повреждения, вызванного стрессом (радиацией), а при 40 мкМ наблюдается почти полная защита липидов и белков.Его другие особенности, такие как естественное происхождение и диетический компонент, делают его привлекательным и подходящим кандидатом в качестве антиоксиданта как in vitro, так и in vivo. Кроме того, продолжающиеся исследования клеточной системы могут выявить степень защиты, оказываемой капсаицином в системах in vivo.
Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов в этой работе.
Ссылки

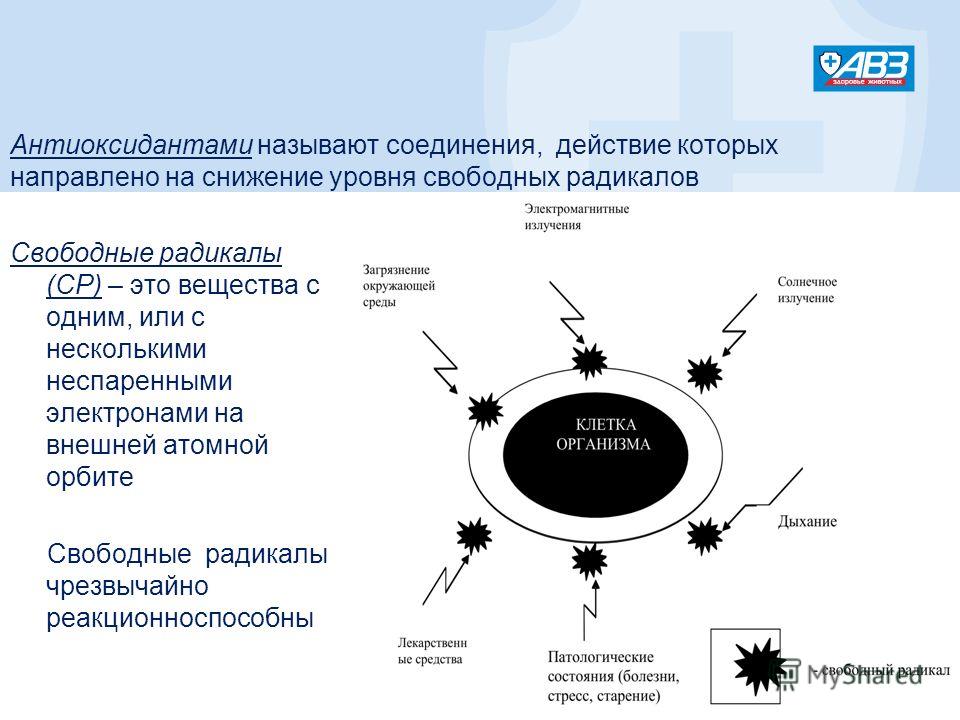 )
)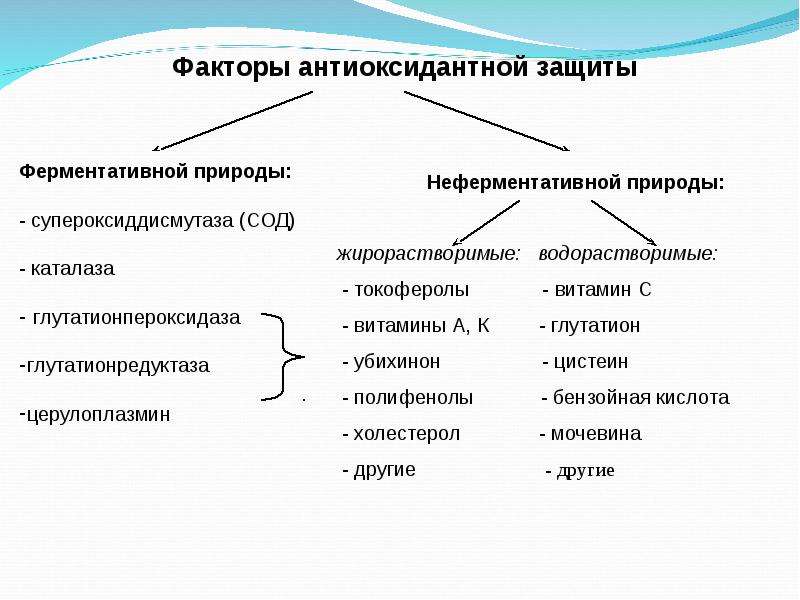 , Polyphenols and Human Health: Prevention of Disease and Mechanisms of Action, 2010
, Polyphenols and Human Health: Prevention of Disease and Mechanisms of Action, 2010 , A Review of the Science of Colourful, Plant-Based Food and Practical Strategies for “Eating the Rainbow”, 2019
, A Review of the Science of Colourful, Plant-Based Food and Practical Strategies for “Eating the Rainbow”, 2019 , Free Radicals, Antioxidants in Disease and Health, 2008
, Free Radicals, Antioxidants in Disease and Health, 2008