Самое удивительное на свете вещество
Самое удивительное на свете вещество
Наша Земля из космоса выглядит как голубая планета. И это не случайно. Ведь бóльшая часть ее поверхности покрыта водой, благодаря которой на Земле возможно существование жизни. Распространяется ли на воду тот разумный замысел, который мы обнаруживаем в физических константах и в удивительном сочетании планетарных характеристик нашей планеты?
В самом начале первой главы Библии мы находим указание на особое Божественное попечение о воде: «И Дух Божий носился над водою» (Быт.: 1, 2).
По толкованию св. Василия Великого «Дух носился, то есть приуготовлял водное естество к рождению живых тварей». Согласно этим представлениям воде при сотворении мира было уделено особое внимание. Если это так, то особое Божественное попечение о воде придало этому веществу и какие-то особые, уникальные свойства, которые больше нигде, кроме воды, не встречаются. Что может сказать по этому поводу наука?
Ученые удивляются
Еще в первой половине XIX века натуралисты обнаружили, что некоторые из характеристик воды нарушают общепринятые законы природы, что в этих несоответствиях присутствует Божественный замысел, и что они являются доказательством того, что вода была сотворена ради существования жизни. Позже известным русским ученым Дмитрием Менделеевым была составлена периодическая таблица, на основании которой он предсказал существование еще не известных науке элементов, а также свойства этих элементов и их соединений. Так вот оказалось, что вода не признает никаких закономерностей этой периодической системы. Согласно логике этой системы, вода должна была бы замерзать при –90 ОС, а она замерзает при ООС, кипеть при –70 ОС, а она кипит при 100 ОС. И это далеко не все, что делает воду уникальным веществом.
Академик И.В. Петрянов по поводу загадочных свойств воды утверждает следующее: «Почти все физико-химические свойства воды – исключение в природе. Она действительно самое удивительное вещество на свете. Ученые уже немало узнали о воде, разгадали многие ее тайны. Но чем больше они изучают воду, тем больше убеждаются в неисчерпаемости ее свойств, некоторые из которых настолько любопытны, что порой все еще не поддаются объяснению».
Несмотря на то, что вода принята за эталон меры плотности, объема и т.д. для других веществ, сама она, как это не странно, является самым аномальным среди всех веществ.
Аномальное поведение воды при замерзании
Одним из таких неповторимых свойств воды является ее способность расширяться при замерзании. Ведь все вещества при замерзании, то есть при переходе из жидкого состояния в твердое, сжимаются, а вода наоборот – расширяется. Ее объем при этом увеличивается на 9%.
Попробуем представить на мгновение, что бы случилось зимой в природе, если бы лед в тонул. Реки, озера, приполярные моря и океаны промерзли бы до самого дна, и все живые организмы в них погибли бы. Но когда на поверхности воды образуется лед, то он, находясь между холодным воздухом и водой, препятствует дальнейшему охлаждению и промерзанию водоемов.
Это необычное свойство воды, кстати, имеет важно и для образования почвы в горах. Попадая в маленькие трещины, которые всегда найдутся в камнях, дождевая вода при замерзании расширяется и разрушает камень. Так, постепенно каменная поверхность становится способной приютить растения, которые своими корнями довершают этот процесс разрушения камней и приводят к образованию на склонах гор почвы.
Четыре градуса выше нуля
Еще одно удивительное свойство воды связано с ее особым состоянием при температуре +4оС. При этой температуре она обладает максимально возможной для себя плотностью, а значит – и тяжестью. Вода при этой температуре тяжелее, чем при какой-либо другой, и поэтому всегда будет опускаться в водоеме на дно.
Аномальные тепловые свойства воды
Как известно, вода, испаряясь с поверхности тела человека, животных и растений, предохраняет их от перегрева. Способность отдавать тепло в окружающую среду при испарении присуща любой жидкости. Однако когда ученые сравнили эти способности у разных жидкостей, то оказалось, что вода является здесь своего рода чемпионкой. По сравнению с любой другой жидкостью она отдает при своем испарении в окружающую среду самое большое количество тепла, что, безусловно, делает ее самым лучшим регулятором температуры нашего тела.
Другое свойство воды, помогающее нам справляться как с перегревом нашего тела, так, впрочем, и с его переохлаждением – это ее аномально высокая теплоемкость. Вода при нагревании на один градус поглощает в 5 – 30 раз больше тепла, чем какое-либо другое вещество. Поэтому и те процессы, которые происходят в нашем организме при интенсивной мышечной работе, вызывают не столь высокое поднятие температуры, как это было бы в случае других жидкостей. У соли, к примеру, такое же количество выделенного тепла вызвало бы поднятие температуры в 5 раз большее, чем у воды, у железа – в 10 раз, а у свинца – в 30 раз.
Еще одно свойство воды, помогающее бороться организму с перегревом – высокая теплопроводность. Если бы эта физическая константа имела бы меньшее значение, то выделяемое в процессе интенсивной физической работы тепло не передавалось бы так хорошо из глубины тела на его поверхность и, соответственно, не удалялось бы из организма вместе с потом.
Такие удивительные свойства воды, помогающие нашему организму сохранять стабильную температуру, имеют значение и для жизни всей нашей планеты. Так, благодаря аномально высокой теплоемкости воды, на континентах не происходит резкого перепада температур зимой и летом, ночью и днем, поскольку они окружены своеобразным термостатом – водами Мирового океана. Летом он не дает Земле перегреваться, а зимой постоянно снабжает континенты теплом. Страны, расположенные вблизи океана, обладают мягким морским климатом. Напротив, безводные пустыни, находящиеся в глубине континентов, характеризуются резкими перепадами температуры, наблюдающимися даже в течение одних суток.
Еще одно аномальное свойство воды, имеющее значение для жизни всей планеты, связано с тем, что она обладает не только аномально высокой теплотой испарения предохраняющей наш организм от перегрева, но и аномально высокой скрытой теплотой плавления. У стали эта величина почти вдвое ниже, у свинца – ниже почти в 15 раз. Это свойство воды спасает нас от катастрофических весенних наводнений. Из-за медленного таяния льда и снега почва вбирает в себя достаточное количество влаги и тем самым предотвращает в некоторых случаях гибель растений во время засухи.
Удивительное сочетание
Подобное же сочетание полезных свойств, имеющих значение как для внутренних процессов организма, так и для жизни всей планеты, мы можем обнаружить и в других аномальных свойствах воды. Возьмем, к примеру, вязкость. Эта величина у воды имеет идеальное значение для обеспечения жизненных процессов в организме. Будь вязкость воды несколько ниже, вода бы неслась по тончайшим сосудам нашего тела с такой скоростью и силой, что разрушала бы эти сосуды. А если бы вязкость была несколько большей – течение воды в этих сосудах затормозилось, и все жизненные процессы в тканях нашего организма прекратились. Однако вязкость воды оказалась идеальной как для нашей жизни, так и для жизни любых других организмов.
Однако значение вязкость воды идеально не только для внутренних процессов нашего тела, связанных с движением крови в кровеносных сосудах, но и для процессов, протекающих во внешней среде. И здесь мы опять сталкиваемся с чем-то аномальным: в отличие от вязкости других жидкостей она снижается при повышении давления. Повышение температуры также понижает вязкость воды. Этот факт дает объяснение тому, почему подземные воды даже на больших глубинах при высоких давлениях и температурах довольно подвижны – они могут перемещаться, в том числе по направлению к поверхности земли и могут быть, в конце концов, использованы растениями или человеком.
И здесь мы опять сталкиваемся с чем-то аномальным: в отличие от вязкости других жидкостей она снижается при повышении давления. Повышение температуры также понижает вязкость воды. Этот факт дает объяснение тому, почему подземные воды даже на больших глубинах при высоких давлениях и температурах довольно подвижны – они могут перемещаться, в том числе по направлению к поверхности земли и могут быть, в конце концов, использованы растениями или человеком.
Возможность подобных перемещений обусловлена также необычными свойствами воды – сочетанием в ней высокого значения поверхностного натяжения и смачивания. Эта способность создает в почве и верхних слоях подпочвенного грунта так называемую подвешенную воду, которая, удерживаясь поверхностным натяжением, не стекает в более глубокие горизонты, обеспечивая растения влагой. Благодаря этому же явлению, вода внутри деревьев поднимается с уровня почвы на высоту их кроны. Можно сказать, что одни и те же уникальные свойства воды в очередной раз оказываются необходимыми как для внутренней жизни организмов, так и для создания благоприятных условий их обитания.
Подобное же сочетание внешнего и внутреннего эффектов относится и к замечательной способности воды растворять в себе различные вещества, что определяется особенности ее внутренней структуры. Без этого свойства процессы жизнедеятельности не могли бы протекать в живых организмах. Но это же свойство воды необходимо не только здесь, но и для жизни водоемов, где растворенные вещества играют исключительную роль.
«Память» воды
Еще в 1945 году бельгийский инженер запатентовал способ предохранения паровых котлов от пагубного воздействия накипи. Суть его изобретения заключалась в том, что воду, предназначенную для питания котлов, предварительно подвергали магнитной обработке, в результате чего накипь резко уменьшалась. Последующие исследования показали, что после обработки природной воды в магнитном поле, изменяются многие ее физико-химические свойства. И аналогичные изменения в свойствах воды происходят не только при воздействии на нее магнитного поля, но и под влиянием ряда других физических факторов – звуковых сигналов, электрических полей, температурных изменений, радиации, турбулентности и т.д. Каков же может быть механизм подобных воздействий?
И аналогичные изменения в свойствах воды происходят не только при воздействии на нее магнитного поля, но и под влиянием ряда других физических факторов – звуковых сигналов, электрических полей, температурных изменений, радиации, турбулентности и т.д. Каков же может быть механизм подобных воздействий?
Как известно, каждая молекула воды, состоя из одного атома кислорода и двух атомов водорода, имеет очень сложную пространственную организацию. В случае воды с ее простой формулой Н2О, мы, на самом деле, сталкиваемся с необычно высоко организованной системой. Обычно жидкости, как, впрочем, и газы, характеризуются хаотичным расположением в них молекул. Но не такова природа «самой удивительной жидкости». Рентгеновский анализ структуры воды показал, что жидкая вода ближе по своей структуре к твердым телам, а не к газам, поскольку в размещении молекул воды явно прослеживалась некоторая регулярность – ближний порядок, характерный для твердых тел. Этот ближний порядок, принято описывать таким понятием как микрокластеры, которыми называют небольшие устойчивые совокупности молекул воды. При этом ученые выяснили, что у воды, полученной, к примеру, в результате таяния льда и у воды, полученной путем конденсации пара, структура ближнего порядка будет различная – их микрокластеры будут иметь разное строение. Опыт показывает, что на живые организмы благотворное влияние оказывает именно талая вода.
Структурные различия воды сохраняются в течение определенного времени, что позволило ученым говорить о загадочном механизме «памяти» этой удивительной жидкости. Не вызывает сомнение тот факт, что вода некоторое время «помнит» осуществленное на нее физическое воздействие, и эта «записанная» в воде информация оказывает влияние на живые организмы, в том числе на человека. Ведь, как уже говорилось, в состав тела любого организма вода входит в весьма значительных количествах. И, как показали исследования, внутри организма вода находится в особом состоянии, еще более сходном с состоянием твердого тела, по сравнению с обычной водой.
В этом плане вовсе не удивительно, что человеку, как и любому другому организму, вовсе небезразлично то, какие внешние воздействия были запечатлены в «памяти» той воды, которую он пьет. Это, впрочем, относится и к любым другим живым существам. Существует также старинное поверье: хорошо поить скот грозовой водой. Да и для посевов летний дождик с грозой поистине живителен. Отличается такая вода от обычной, прежде всего, большим количеством ионизированных, положительных и отрицательных частиц. В то же время можно считать установленным научным фактом, что степень электризации поглощаемой животными влаги имеет огромное значение для осуществления самых различных биологических процессов.
Итак, вода способна сохранять в своей «памяти» разнообразные физические воздействия – это можно считать уже научно доказанным фактом. Но это удивительное свойство воды очень близко к тому, чем наука уже не занимается, но что известно из опыта духовной жизни человечества: вода может быть «хранительницей» и духовных воздействий. Вспомним о тех водосвятных молебнах, которые совершаются в православных храмах, а иногда и под открытым небом.
© Все права защищены http://www.portal-slovo.ru
Удивительные свойства воды реферат 2011 по химии
Введение До некоторых пор казалось, что проще и изученной воды ничего быть не может. Зазубренная всеми формула, температурные метаморфозы ото льда до пара, способность растворять некоторые вещества и участвовать в процессе конвекции — вот практически и все. На самом же деле, с «простой» водой оказалось не так уж все и просто… Вода наделялась душой во многих культурах мира. Открытие современными учеными четвертого, информационного, состояния воды, стало доказательством ее памяти. Вода способна воспринимать, сохранять и передавать информацию, даже такую тонкую, как человеческая мысль, эмоция, слово. Сейчас человечество находится на пороге совершенно иного понимания законов мироздания, открывающего новые перспективы: возможность программирования воды, лечение водой сложнейших заболеваний, управление погодой. Что же такого необычного с обычной водой?.. Цель проекта: изучить удивительные свойства воды. Я выбрал эту тему потому что – это самая актуальная тема, так как вода это самое важное вещество на Земле без которого не может существовать ни один живой организм и не могут протекать ни какие биологические, химические реакции, и технологические процессы. Так что особенного в этом веществе. Молекула воды является наиболее распространённым веществом на планете и, встречающимся на ней в жидком, газообразном и твёрдом состоянии. Вода – жидкость без вкуса, запаха и цвета, плотность 1,0 г/ см3. Гидросфера занимает 71% поверхности земного шара. Рождается из элементов, занимающих первое и третье место по распространенности во вселенной, в объёмном соотношении 2:1. Это одна из самых маленьких молекул нам известных. Уже много веков учёные изучают воду. Времени было достаточно, казалось о воде должно было быть всё известно, но не тут то было. Молекула воды состоит из двух атомов водорода (Н) и одного атома кислорода (О). Все многообразие свойств воды и необычность их проявления, в конечном счете, определяются физической природой этих атомов и способом их объединения в молекулу. В отдельной молекуле воды ядра водорода и кислорода расположены так относительно друг друга, что образуют как бы равнобедренный треугольник со сравнительно крупным ядром кислорода на вершине и двумя мелкими ядрами водорода у основания. В молекуле воды имеются четыре полюса зарядов: два отрицательных за счет избытка электронной плотности у кислородных пар электронов и два положительных — вследствие недостатка электронной плотности у ядер водорода — протонов. Такая ассиметричность распределения электрических зарядов воды обладает ярко выраженными полярными свойствами; она является диполем с высоким дипольным моментом -1,87 Дебай. Изо льда состоят огромные горные ледники, им покрыты и некоторые материки. Лёд хранит в себе огромные запасы пресной воды. Лёд твёрдый, а течёт как жидкость. Образуя огромные реки, медленно стекающие с гор.
Что же такого необычного с обычной водой?.. Цель проекта: изучить удивительные свойства воды. Я выбрал эту тему потому что – это самая актуальная тема, так как вода это самое важное вещество на Земле без которого не может существовать ни один живой организм и не могут протекать ни какие биологические, химические реакции, и технологические процессы. Так что особенного в этом веществе. Молекула воды является наиболее распространённым веществом на планете и, встречающимся на ней в жидком, газообразном и твёрдом состоянии. Вода – жидкость без вкуса, запаха и цвета, плотность 1,0 г/ см3. Гидросфера занимает 71% поверхности земного шара. Рождается из элементов, занимающих первое и третье место по распространенности во вселенной, в объёмном соотношении 2:1. Это одна из самых маленьких молекул нам известных. Уже много веков учёные изучают воду. Времени было достаточно, казалось о воде должно было быть всё известно, но не тут то было. Молекула воды состоит из двух атомов водорода (Н) и одного атома кислорода (О). Все многообразие свойств воды и необычность их проявления, в конечном счете, определяются физической природой этих атомов и способом их объединения в молекулу. В отдельной молекуле воды ядра водорода и кислорода расположены так относительно друг друга, что образуют как бы равнобедренный треугольник со сравнительно крупным ядром кислорода на вершине и двумя мелкими ядрами водорода у основания. В молекуле воды имеются четыре полюса зарядов: два отрицательных за счет избытка электронной плотности у кислородных пар электронов и два положительных — вследствие недостатка электронной плотности у ядер водорода — протонов. Такая ассиметричность распределения электрических зарядов воды обладает ярко выраженными полярными свойствами; она является диполем с высоким дипольным моментом -1,87 Дебай. Изо льда состоят огромные горные ледники, им покрыты и некоторые материки. Лёд хранит в себе огромные запасы пресной воды. Лёд твёрдый, а течёт как жидкость. Образуя огромные реки, медленно стекающие с гор.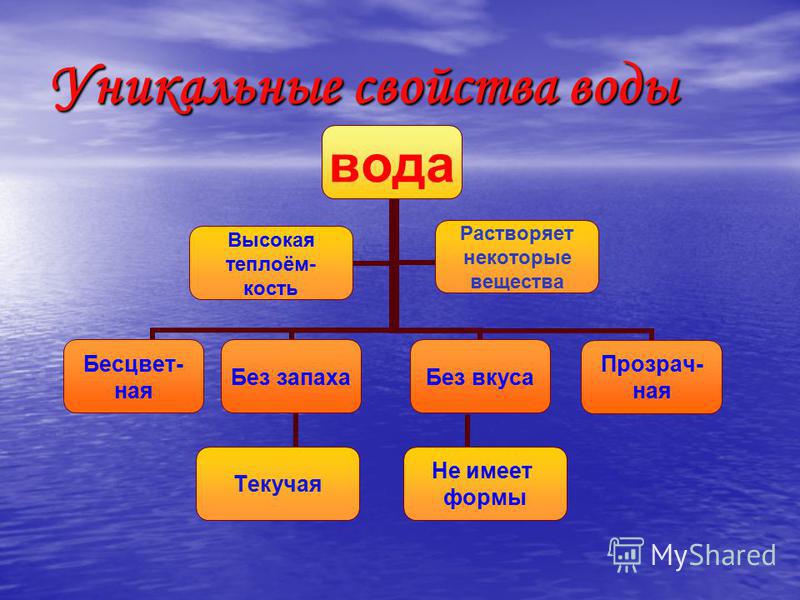 Лёд необычайно прочен и долговечен. Он может десятки тысяч лет хранить в себе скелеты животных, погибших в ледниках. Улавливая солнечное излучение, вода помогает поддерживать температуру на земле в комфортном диапазоне. Мощные морские течения разносят огромные объёмы воды по всей планете, в частности не дают мерзнуть европейцам омывая Европу Гольфстримом. И, наконец, вода обеспечивает жизнедеятельность всех организмов: она переносит питательные вещества, собирает и выводит отходы. провели нидерландские ученые в 1922 году В. Кеез и Дж. де Смедт. Ими было показано, что для жидкой воды характерна упорядоченное размещение молекул воды, т.е. вода имеет определённую регулярную структуру. Действительно, структура воды в живом организме во многом напоминает структуру кристаллической решетки льда. И именно этим объясняются сейчас уникальные свойства талой воды, долгое время сохраняющей структуру льда. Талая вода гораздо легче обычной вступает в реакцию с различными веществами, и организму не надо тратить добавочную энергию на перестройку ее структуры. Каждая молекула воды в кристаллической структуре льда участвует в 4 водородных связях, направленных к вершинам тетраэдра. В центре этого тетраэдра находится атом кислорода, в двух вершинах — по атому водорода, электроны которых задействованы в образовании ковалентной связи с кислородом. Две оставшиеся вершины занимают пары валентных электронов кислорода, которые не участвуют в образовании внутримолекулярных связей. При взаимодействии протона одной молекулы с парой неподеленных электронов кислорода другой молекулы возникает водородная связь, менее сильная, чем связь внутримолекулярная, но достаточно могущественная, чтобы удерживать рядом соседние молекулы воды. Каждая молекула может одновременно образовывать четыре водородные связи с другими молекулами под строго определенными углами, равными 109°28′, направленных к вершинам тетраэдра, которые не позволяют при замерзании создавать плотную структуру (при этом в структурах льда I, Ic, VII и VIII этот тетраэдр правильный).
Лёд необычайно прочен и долговечен. Он может десятки тысяч лет хранить в себе скелеты животных, погибших в ледниках. Улавливая солнечное излучение, вода помогает поддерживать температуру на земле в комфортном диапазоне. Мощные морские течения разносят огромные объёмы воды по всей планете, в частности не дают мерзнуть европейцам омывая Европу Гольфстримом. И, наконец, вода обеспечивает жизнедеятельность всех организмов: она переносит питательные вещества, собирает и выводит отходы. провели нидерландские ученые в 1922 году В. Кеез и Дж. де Смедт. Ими было показано, что для жидкой воды характерна упорядоченное размещение молекул воды, т.е. вода имеет определённую регулярную структуру. Действительно, структура воды в живом организме во многом напоминает структуру кристаллической решетки льда. И именно этим объясняются сейчас уникальные свойства талой воды, долгое время сохраняющей структуру льда. Талая вода гораздо легче обычной вступает в реакцию с различными веществами, и организму не надо тратить добавочную энергию на перестройку ее структуры. Каждая молекула воды в кристаллической структуре льда участвует в 4 водородных связях, направленных к вершинам тетраэдра. В центре этого тетраэдра находится атом кислорода, в двух вершинах — по атому водорода, электроны которых задействованы в образовании ковалентной связи с кислородом. Две оставшиеся вершины занимают пары валентных электронов кислорода, которые не участвуют в образовании внутримолекулярных связей. При взаимодействии протона одной молекулы с парой неподеленных электронов кислорода другой молекулы возникает водородная связь, менее сильная, чем связь внутримолекулярная, но достаточно могущественная, чтобы удерживать рядом соседние молекулы воды. Каждая молекула может одновременно образовывать четыре водородные связи с другими молекулами под строго определенными углами, равными 109°28′, направленных к вершинам тетраэдра, которые не позволяют при замерзании создавать плотную структуру (при этом в структурах льда I, Ic, VII и VIII этот тетраэдр правильный). Известно, что биологические ткани на 70-90% состоят из воды. Это позволяет предполагать, что многие физиологические явления могут отображать молекулярные особенности не только растворенного вещества, но в равной степени и растворителя — воды Первую теорию о структуре воды выдвинули английские исследователи Дж.Бернал и Фаулер. Они создали концепцию о тетраэдрической структуре воды. В августовском номере 1933 г. только что созданного международного журнала по химической физике «Journal of Chemical Physics” была опубликована их классическая работа о структуре молекулы воды и ее взаимодействии с себе подобными молекулами и ионами разных сортов. В своей научной интуиции Дж. Бернал и Р. Фаулер опирались на обширный материал накопленных экспериментальных и теоретических данных в области изучения строения молекулы воды, структуры льда, строения простых жидкостей, на данные ренгеноструктурного анализа воды и водных растворов. Прежде всего они определили роль водородных связей в воде. Было известно, что в воде есть ковалентные и водородные связи. Ковалентные связи не рвутся при фазовых переходах воды: вода-пар-лед. Лишь электролиз, нагревание воды на железе и т.п. разрывает ковалентные связи воды. Водородные связи в 24 раза слабее ковалентных. При таянии льда, снега, водородные связи в образующейся воде частично сохраняются, в паре воды они все разорваны. Попытки представить воду как ассоциированную жидкость с плотной упаковкой молекул воды, подобно шарикам какой-либо емкости, не соответствовали элементарным фактическим данным. В этом случае удельная плотность воды должна была бы быть не 1 г/см3, а более 1,8 г/см3. Второе важное доказательство в пользу особой структуры молекулы воды состояла в том, что в отличие от других жидкостей вода — это было уже известно — обладает сильным электрическим моментом, составляюющим ее дипольную структуру. Поэтому нельзя было представить наличие весьма сильного электрического момента молекулы воды в симметрической конструкции двух атомов водорода относительно атома кислорода, расположив все входящие в нее атомы по прямой линии, т.
Известно, что биологические ткани на 70-90% состоят из воды. Это позволяет предполагать, что многие физиологические явления могут отображать молекулярные особенности не только растворенного вещества, но в равной степени и растворителя — воды Первую теорию о структуре воды выдвинули английские исследователи Дж.Бернал и Фаулер. Они создали концепцию о тетраэдрической структуре воды. В августовском номере 1933 г. только что созданного международного журнала по химической физике «Journal of Chemical Physics” была опубликована их классическая работа о структуре молекулы воды и ее взаимодействии с себе подобными молекулами и ионами разных сортов. В своей научной интуиции Дж. Бернал и Р. Фаулер опирались на обширный материал накопленных экспериментальных и теоретических данных в области изучения строения молекулы воды, структуры льда, строения простых жидкостей, на данные ренгеноструктурного анализа воды и водных растворов. Прежде всего они определили роль водородных связей в воде. Было известно, что в воде есть ковалентные и водородные связи. Ковалентные связи не рвутся при фазовых переходах воды: вода-пар-лед. Лишь электролиз, нагревание воды на железе и т.п. разрывает ковалентные связи воды. Водородные связи в 24 раза слабее ковалентных. При таянии льда, снега, водородные связи в образующейся воде частично сохраняются, в паре воды они все разорваны. Попытки представить воду как ассоциированную жидкость с плотной упаковкой молекул воды, подобно шарикам какой-либо емкости, не соответствовали элементарным фактическим данным. В этом случае удельная плотность воды должна была бы быть не 1 г/см3, а более 1,8 г/см3. Второе важное доказательство в пользу особой структуры молекулы воды состояла в том, что в отличие от других жидкостей вода — это было уже известно — обладает сильным электрическим моментом, составляюющим ее дипольную структуру. Поэтому нельзя было представить наличие весьма сильного электрического момента молекулы воды в симметрической конструкции двух атомов водорода относительно атома кислорода, расположив все входящие в нее атомы по прямой линии, т.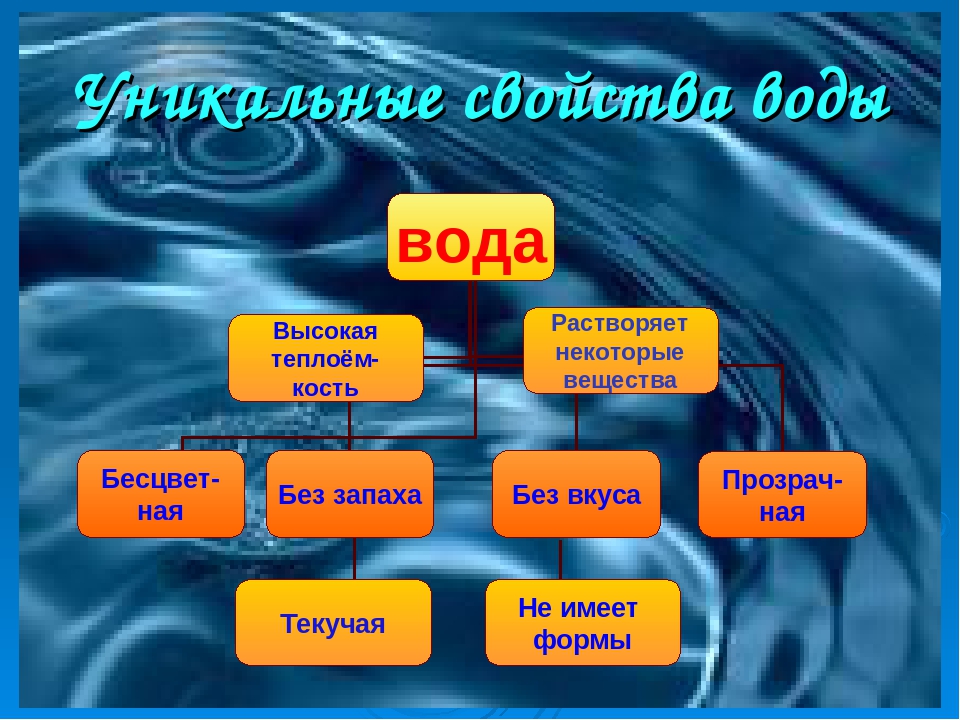 е. Н-О-Н. Экспериментальные данные, а также математические расчеты окончательно убедили английских ученых в том, что молекула воды «однобока» и имеет «угловую» конструкцию, а оба атома водорода должны быть смещены в одну сторону относительно атома кислорода на угол 104,50: Именно поэтому модель воды Бернала-Фаулера — трехструктурная, с наличием нескольких раздельных типов структур. Согласно этой модели, структура воды определяется структурой ее отдельных молекул. В дальнейшем была развита идея считать жидкую воду псевдокристаллом, согласно которой вода в жидком состоянии представляет собой как бы смесь трех компонент с различными структурами (структура льда, кристаллического кварца и плотно упакованная структура обычной воды). Вода — это ажурный псевдокристалл, в котором отдельные тетраэдрические молекулы h3О связаны друг с другом направленными водородными связями, образуя гексагональные структуры как в структуре льда. В дальнейшем модель воды Бернала-Фаулера была уточнена и пересмотрена. На ее основе возникли более 20 моделей структуры воды, которые можно разделить на 5 групп; 1) непрерывные, 2) смешанные модели структуры воды (двух- и трехструктурные), 3) модели с заполнением пустот, 4) кластерные и 5) модели ассоциатов. Непрерывные модели структуры воды постулируют, что вода — это единая тетраэдрическая сеть водородных связей между отдельными молекулами воды, которые искривляются при плавлении льда. Смешанные модели: вода — это смесь двух или трех структур, например, одиночных молекул, их ассоциатов различной сложности – кластеров. Дальнейшее усовершенствование этой модели привело к созданию модели с заполнением пустот (включая клатратные модели) и к кластерным структуры и на некоторое время задерживаются там, так как пустотам соответствуют относительные минимумы потенциальной энергии. Это ведет к увеличению координационного числа и к образованию дефектов решетки, наличие которых обусловливает аномальные свойства воды. Координационное число молекул (число ближайших соседей) меняется от 4,4 при 1,5 °С до 4,9 при 83 °С.
е. Н-О-Н. Экспериментальные данные, а также математические расчеты окончательно убедили английских ученых в том, что молекула воды «однобока» и имеет «угловую» конструкцию, а оба атома водорода должны быть смещены в одну сторону относительно атома кислорода на угол 104,50: Именно поэтому модель воды Бернала-Фаулера — трехструктурная, с наличием нескольких раздельных типов структур. Согласно этой модели, структура воды определяется структурой ее отдельных молекул. В дальнейшем была развита идея считать жидкую воду псевдокристаллом, согласно которой вода в жидком состоянии представляет собой как бы смесь трех компонент с различными структурами (структура льда, кристаллического кварца и плотно упакованная структура обычной воды). Вода — это ажурный псевдокристалл, в котором отдельные тетраэдрические молекулы h3О связаны друг с другом направленными водородными связями, образуя гексагональные структуры как в структуре льда. В дальнейшем модель воды Бернала-Фаулера была уточнена и пересмотрена. На ее основе возникли более 20 моделей структуры воды, которые можно разделить на 5 групп; 1) непрерывные, 2) смешанные модели структуры воды (двух- и трехструктурные), 3) модели с заполнением пустот, 4) кластерные и 5) модели ассоциатов. Непрерывные модели структуры воды постулируют, что вода — это единая тетраэдрическая сеть водородных связей между отдельными молекулами воды, которые искривляются при плавлении льда. Смешанные модели: вода — это смесь двух или трех структур, например, одиночных молекул, их ассоциатов различной сложности – кластеров. Дальнейшее усовершенствование этой модели привело к созданию модели с заполнением пустот (включая клатратные модели) и к кластерным структуры и на некоторое время задерживаются там, так как пустотам соответствуют относительные минимумы потенциальной энергии. Это ведет к увеличению координационного числа и к образованию дефектов решетки, наличие которых обусловливает аномальные свойства воды. Координационное число молекул (число ближайших соседей) меняется от 4,4 при 1,5 °С до 4,9 при 83 °С. Согласно гипотезе нашего учёного соотечественника С.В. Зенина вода представляет собой иерархию правильных объемных структур «ассоциатов» (clathrates), в основе которых лежит кристаллоподобный «квант воды», состоящий из 57 ее молекул, которые взаимодействуют друг с другом за счет свободных водородных связей. При этом 57 молекул воды (квантов), образуют структуру, напоминающую тетраэдр. Тетраэдр в свою очередь состоит из 4 додекаэдров (правильных 12-гранников). 16 квантов образуют структурный элемент, состоящий из 912 молекул воды. Вода на 80% состоит из таких элементов, 15% — кванты-тетраэдры и 3% — классические молекулы Н2О. Таким образом, структура воды связана с так называемыми платоновыми телами (тетраэдр, додекаэдр), форма которых связана с золотой пропорцией. Ядро кислорода также имеет форму платонова тела (тетраэдра). Элементарной ячейкой воды являются тетраэдры, содержащие связанные между собой водородными связями четыре (простой тетраэдр) или пять молекул Н2О (объемно-центрированный тетраэдр). При этом у каждой из молекул воды в простых тетраэдрах сохраняется способность образовывать водородные связи. За счет их простые тетраэдры могут объединяться между собой вершинами, ребрами или гранями, образуя различные кластеры со сложной структурой, например, в форме додекаэдра. Объединяясь друг с другом, кластеры могут образовывать более сложные структуры: Кластеры, содержащие в своём составе 20 молекулу оказались более стабильными. Профессор Мартин Чаплин рассчитал и предположил иную модель воды, в основе которой лежит икосаэдр. Согласно этой модели вода состоит из 1820 молекул воды — это в два раза больше, чем в модели Зенина. Гигантский икосаэдр в свою очередь состоит из 13 более мелких структурных элементов. Причем, так же как и у Зенина, структура гигантского ассоциата базируется на более мелких образованиях. Таким образом, сейчас это является очевидным фактом, что в воде возникают ассоциаты воды, которые несут в себе очень большую энергию и информацию крайне высокой плотности.
Согласно гипотезе нашего учёного соотечественника С.В. Зенина вода представляет собой иерархию правильных объемных структур «ассоциатов» (clathrates), в основе которых лежит кристаллоподобный «квант воды», состоящий из 57 ее молекул, которые взаимодействуют друг с другом за счет свободных водородных связей. При этом 57 молекул воды (квантов), образуют структуру, напоминающую тетраэдр. Тетраэдр в свою очередь состоит из 4 додекаэдров (правильных 12-гранников). 16 квантов образуют структурный элемент, состоящий из 912 молекул воды. Вода на 80% состоит из таких элементов, 15% — кванты-тетраэдры и 3% — классические молекулы Н2О. Таким образом, структура воды связана с так называемыми платоновыми телами (тетраэдр, додекаэдр), форма которых связана с золотой пропорцией. Ядро кислорода также имеет форму платонова тела (тетраэдра). Элементарной ячейкой воды являются тетраэдры, содержащие связанные между собой водородными связями четыре (простой тетраэдр) или пять молекул Н2О (объемно-центрированный тетраэдр). При этом у каждой из молекул воды в простых тетраэдрах сохраняется способность образовывать водородные связи. За счет их простые тетраэдры могут объединяться между собой вершинами, ребрами или гранями, образуя различные кластеры со сложной структурой, например, в форме додекаэдра. Объединяясь друг с другом, кластеры могут образовывать более сложные структуры: Кластеры, содержащие в своём составе 20 молекулу оказались более стабильными. Профессор Мартин Чаплин рассчитал и предположил иную модель воды, в основе которой лежит икосаэдр. Согласно этой модели вода состоит из 1820 молекул воды — это в два раза больше, чем в модели Зенина. Гигантский икосаэдр в свою очередь состоит из 13 более мелких структурных элементов. Причем, так же как и у Зенина, структура гигантского ассоциата базируется на более мелких образованиях. Таким образом, сейчас это является очевидным фактом, что в воде возникают ассоциаты воды, которые несут в себе очень большую энергию и информацию крайне высокой плотности. Порядковое число таких структур воды так же высоко, как и порядковое число кристаллов (структура с максимально высоким упорядочением, которую мы только знаем), потому их также называют «жидкими кристаллами» или «кристаллической водой». Такая структура энергетически выгодна и разрушается с освобождением свободных молекул воды лишь при высоких концентрациях спиртов и подобных им растворителей [Зенин, 1994]. Кванты воды» могут взаимодействовать друг с другом за счет свободных водородных связей, торчащих наружу из вершин “кванта” своими гранями. При этом возможно образование уже двух типов структур второго порядка. Их взаимодействие друг с другом приводит к появлению структур высшего порядка. Последние состоят из 912 молекул воды, которые по модели Зенина практически не способны к взаимодействию за счет образования водородных связей. Этим и объясняется, например, высокая текучесть жидкости, состоящей из громадных полимеров. Таким образом, водная среда представляет собой как бы иерархически организованный жидкий кристалл. Изменение положения одного структурного элемента в этом кристалле под действием любого внешнего фактора или изменение ориентации окружающих элементов под влиянием добавляемых веществ обеспечивает, согласно гипотезе Зенина, высокую чувствительность информационной системы воды. Если степень возмущения структурных элементов недостаточна для перестройки всей структуры воды в данном объеме, то после снятия возмущения система через 30-40 мин возвращается в исходное состояние. Если же перекодирование, т. е. переход к другому взаимному расположению структурных элементов воды оказывается энергетически выгодным, то в новом состоянии отражается кодирующее действие вызвавшего эту перестройку вещества [Зенин, 1994]. Такая модель позволяет Зенину объясненить «память воды» и ее информационные свойства [Зенин, 1997]. Кроме того, структурированное состояние воды оказалось чувствительным датчиком различных полей. С. Зенин считает, что мозг, сам состоящий на 90% из воды, может, тем не менее, изменять её структуру.
Порядковое число таких структур воды так же высоко, как и порядковое число кристаллов (структура с максимально высоким упорядочением, которую мы только знаем), потому их также называют «жидкими кристаллами» или «кристаллической водой». Такая структура энергетически выгодна и разрушается с освобождением свободных молекул воды лишь при высоких концентрациях спиртов и подобных им растворителей [Зенин, 1994]. Кванты воды» могут взаимодействовать друг с другом за счет свободных водородных связей, торчащих наружу из вершин “кванта” своими гранями. При этом возможно образование уже двух типов структур второго порядка. Их взаимодействие друг с другом приводит к появлению структур высшего порядка. Последние состоят из 912 молекул воды, которые по модели Зенина практически не способны к взаимодействию за счет образования водородных связей. Этим и объясняется, например, высокая текучесть жидкости, состоящей из громадных полимеров. Таким образом, водная среда представляет собой как бы иерархически организованный жидкий кристалл. Изменение положения одного структурного элемента в этом кристалле под действием любого внешнего фактора или изменение ориентации окружающих элементов под влиянием добавляемых веществ обеспечивает, согласно гипотезе Зенина, высокую чувствительность информационной системы воды. Если степень возмущения структурных элементов недостаточна для перестройки всей структуры воды в данном объеме, то после снятия возмущения система через 30-40 мин возвращается в исходное состояние. Если же перекодирование, т. е. переход к другому взаимному расположению структурных элементов воды оказывается энергетически выгодным, то в новом состоянии отражается кодирующее действие вызвавшего эту перестройку вещества [Зенин, 1994]. Такая модель позволяет Зенину объясненить «память воды» и ее информационные свойства [Зенин, 1997]. Кроме того, структурированное состояние воды оказалось чувствительным датчиком различных полей. С. Зенин считает, что мозг, сам состоящий на 90% из воды, может, тем не менее, изменять её структуру. Кластерная модель воды объясняет её многие аномальные свойства. Первое аномальное свойство воды – аномалия точек кипения и замерзания: Если бы вода — гидрид кислорода – Н2О была бы нормальным мономолекулярным соединением, таким, например, как ее аналоги по шестой группе Периодической системы элементов Д.И. Менделеева гидрид серы Н2S, гидрид селена Н2Se, гидрид теллура Н2Те, то в жидком состоянии вода существовала бы в диапазоне от минус 900С до минус 700С. При таких свойствах воды жизни на Земле не существовало бы. Но к счастью для нас, и для всего живого на свете, вода аномальна. Она не признает периодических закономерностей, характерных для бесчисленного множества соединений на Земле и в космосе, а следует своим, еще не вполне понятным для науки законам, подарившим нам удивительный мир жизни. «Ненормальные» температуры плавления и кипения воды далеко не единственная аномальность воды. Для всей биосферы исключительно важной особенностью воды является ее способность при замерзании увеличивать, а не уменьшать свой объем, т.е. уменьшать плотность. Это вторая аномалия большой степени похожую на ту, которую совершали римляне, пользуясь тарелками и утварью из свинца. Итак, это первое указание на различие между водой «структурированной» и «неструктурированной». Когда это было обнаружено, многие начали искать способ, которым можно структурировать «неструктурированную» воду. Для этого по всему миру начали использовать магниты, странной формы стеклянные сосуды, металлические насадки и тому подобное. Наши исследования показали, что вода, которая была структурирована искусственным путём, когда её подвергали энергетическому анализу, не всегда выглядела как природная структурированная вода. Магнит, например, структурирует воду практически мгновенно, но, по данным Университета Джорджии, пить её небезопасно. «Кластерная вода» Около пятнадцати лет назад была обнаружена абсолютно новая вода. Она называется «кластерная вода». Под микроскопом, при увеличении в 20 тысяч раз, замороженная «кластерная вода» выглядела подобно крошечным снежинкам.
Кластерная модель воды объясняет её многие аномальные свойства. Первое аномальное свойство воды – аномалия точек кипения и замерзания: Если бы вода — гидрид кислорода – Н2О была бы нормальным мономолекулярным соединением, таким, например, как ее аналоги по шестой группе Периодической системы элементов Д.И. Менделеева гидрид серы Н2S, гидрид селена Н2Se, гидрид теллура Н2Те, то в жидком состоянии вода существовала бы в диапазоне от минус 900С до минус 700С. При таких свойствах воды жизни на Земле не существовало бы. Но к счастью для нас, и для всего живого на свете, вода аномальна. Она не признает периодических закономерностей, характерных для бесчисленного множества соединений на Земле и в космосе, а следует своим, еще не вполне понятным для науки законам, подарившим нам удивительный мир жизни. «Ненормальные» температуры плавления и кипения воды далеко не единственная аномальность воды. Для всей биосферы исключительно важной особенностью воды является ее способность при замерзании увеличивать, а не уменьшать свой объем, т.е. уменьшать плотность. Это вторая аномалия большой степени похожую на ту, которую совершали римляне, пользуясь тарелками и утварью из свинца. Итак, это первое указание на различие между водой «структурированной» и «неструктурированной». Когда это было обнаружено, многие начали искать способ, которым можно структурировать «неструктурированную» воду. Для этого по всему миру начали использовать магниты, странной формы стеклянные сосуды, металлические насадки и тому подобное. Наши исследования показали, что вода, которая была структурирована искусственным путём, когда её подвергали энергетическому анализу, не всегда выглядела как природная структурированная вода. Магнит, например, структурирует воду практически мгновенно, но, по данным Университета Джорджии, пить её небезопасно. «Кластерная вода» Около пятнадцати лет назад была обнаружена абсолютно новая вода. Она называется «кластерная вода». Под микроскопом, при увеличении в 20 тысяч раз, замороженная «кластерная вода» выглядела подобно крошечным снежинкам. «Кластерная вода» найдена у всех новорождённых, человеческих и других существ. Она обнаружена также во всех фруктах и овощах, выращенных без химических добавок. По мере того как мы становимся старше, «кластерная вода» в наших телах в какой-то момент вступает в соединения с протеинами. Поэтому нам следует употреблять «кластерную воду» ежедневно, чтобы обеспечить нормальный водообмен и функционирование клеток. Важно знать, что срок хранения концентрата кластерной воды два года, если её хранить при температуре 21 градус Цельсия. Если температура концентрата достигнет 46 градусов, то его можно заморозить на 45 минут, чтобы он восстановил свои кластерные свойства, после чего его нужно хранить в холодильнике. Если температура превышает 46 градусов, то свойства воды утрачиваются. «Сверхионизированная вода» Теперь, однако, миру стала доступной ещё одна новая вода, которая может изменить известный нам сейчас мир и вполне возможно спасти нас от невероятной экологической катастрофы в будущем. Эта вода называется «сверхионизированная вода». У её молекулы три дополнительных электрона на внешних орбитах, и она очень устойчива. Если сделать анализ этой новой воды, то вы не обнаружите ничего, кроме воды. Но если взять обычную лампу и просто опустить электрическую вилку в стакан с этой водой, то лампа включится, и свет от этой лампы будет ярче, чем, если бы вы просто включили её в розетку. Очевидно, что это необычная вода. Она насыщена электричеством. Неразгаданные свойства воды Вода всегда представляла собой большую загадку для человеческого ума. Много непостижимого нашему разуму остается еще в свойствах и действиях воды. Наблюдая за текущим или струящимся потоком воды, человек может снимать свое нервное и психическое напряжение. Чем это вызвано? Насколько известно, вода не содержит никаких веществ, способных дать такой эффект. Некоторые ученые утверждают, что вода обладает способностью принимать и передавать любую информацию, сохраняя ее в неприкосновенности. В воде растворено прошлое, настоящее, будущее.
«Кластерная вода» найдена у всех новорождённых, человеческих и других существ. Она обнаружена также во всех фруктах и овощах, выращенных без химических добавок. По мере того как мы становимся старше, «кластерная вода» в наших телах в какой-то момент вступает в соединения с протеинами. Поэтому нам следует употреблять «кластерную воду» ежедневно, чтобы обеспечить нормальный водообмен и функционирование клеток. Важно знать, что срок хранения концентрата кластерной воды два года, если её хранить при температуре 21 градус Цельсия. Если температура концентрата достигнет 46 градусов, то его можно заморозить на 45 минут, чтобы он восстановил свои кластерные свойства, после чего его нужно хранить в холодильнике. Если температура превышает 46 градусов, то свойства воды утрачиваются. «Сверхионизированная вода» Теперь, однако, миру стала доступной ещё одна новая вода, которая может изменить известный нам сейчас мир и вполне возможно спасти нас от невероятной экологической катастрофы в будущем. Эта вода называется «сверхионизированная вода». У её молекулы три дополнительных электрона на внешних орбитах, и она очень устойчива. Если сделать анализ этой новой воды, то вы не обнаружите ничего, кроме воды. Но если взять обычную лампу и просто опустить электрическую вилку в стакан с этой водой, то лампа включится, и свет от этой лампы будет ярче, чем, если бы вы просто включили её в розетку. Очевидно, что это необычная вода. Она насыщена электричеством. Неразгаданные свойства воды Вода всегда представляла собой большую загадку для человеческого ума. Много непостижимого нашему разуму остается еще в свойствах и действиях воды. Наблюдая за текущим или струящимся потоком воды, человек может снимать свое нервное и психическое напряжение. Чем это вызвано? Насколько известно, вода не содержит никаких веществ, способных дать такой эффект. Некоторые ученые утверждают, что вода обладает способностью принимать и передавать любую информацию, сохраняя ее в неприкосновенности. В воде растворено прошлое, настоящее, будущее. Эти свойства воды широко использовались и используются в магии и целительстве. До сих пор еще существуют народные целители и целительницы, «нашептывающие на воду», излечивающие этим болезни. Текущая вода постоянно забирает энергию Космоса и в чистом виде отдает ее в окружающее околоземное пространство, где она поглощается всеми живыми организмами, располагающимися в пределах досягаемости потока, поскольку образованное текущей водой биополе постоянно увеличивается за счет отдаваемой энергии. Чем быстрее движется водный поток, тем сильнее это поле. Под воздействием этой силы происходит выравнивание энергетической оболочки живых организмов, закрываются «пробои» в невидимой простому человеку оболочке тела (ауре), организм исцеляется. Очень хорошо смывают энергетическую грязь струи холодной воды, наполняя организм силой. Это свойство воды используют в своей практике врачи и народные целители, рекомендуя своим пациентам регулярно обливаться холодной водой. При этом необходимо обращать внимание на то, чтобы вода при этой процедуре уходила в землю. Если этого не будет происходить, то энергия станет переходить с головы на ноги, провоцируя тем самым заболевания ног, суставов и сосудов. В деревне или на даче это сделать проще. Достаточно выйти во двор, встать на землю и окатить себя водой из ведра или умыться из родника. Вся энергетическая грязь уйдет в почву. В городских квартирах можно пользоваться следующим способом, позволяющим отрицательной энергии уйти в землю. Для этого надо постелить на дно ванны для приема душа небольшой лист металла или обычной алюминиевой фольги и, протянув от него тонкую проволочку, вывести ее в слив. Это позволит стекающей с тела энергии по проволоке уйти в землю. Тем, кому некогда обливаться холодной водой или кто не желает этого делать, можно просто ополаскивать лицо после посещения общественных мест или прогулок по городу. Можно использовать целительную силу воды, не соприкасаясь с нею. Для этого необходимо открыть дома кран, сесть так, чтобы спина была прямая, а ноги не скрещивались.
Эти свойства воды широко использовались и используются в магии и целительстве. До сих пор еще существуют народные целители и целительницы, «нашептывающие на воду», излечивающие этим болезни. Текущая вода постоянно забирает энергию Космоса и в чистом виде отдает ее в окружающее околоземное пространство, где она поглощается всеми живыми организмами, располагающимися в пределах досягаемости потока, поскольку образованное текущей водой биополе постоянно увеличивается за счет отдаваемой энергии. Чем быстрее движется водный поток, тем сильнее это поле. Под воздействием этой силы происходит выравнивание энергетической оболочки живых организмов, закрываются «пробои» в невидимой простому человеку оболочке тела (ауре), организм исцеляется. Очень хорошо смывают энергетическую грязь струи холодной воды, наполняя организм силой. Это свойство воды используют в своей практике врачи и народные целители, рекомендуя своим пациентам регулярно обливаться холодной водой. При этом необходимо обращать внимание на то, чтобы вода при этой процедуре уходила в землю. Если этого не будет происходить, то энергия станет переходить с головы на ноги, провоцируя тем самым заболевания ног, суставов и сосудов. В деревне или на даче это сделать проще. Достаточно выйти во двор, встать на землю и окатить себя водой из ведра или умыться из родника. Вся энергетическая грязь уйдет в почву. В городских квартирах можно пользоваться следующим способом, позволяющим отрицательной энергии уйти в землю. Для этого надо постелить на дно ванны для приема душа небольшой лист металла или обычной алюминиевой фольги и, протянув от него тонкую проволочку, вывести ее в слив. Это позволит стекающей с тела энергии по проволоке уйти в землю. Тем, кому некогда обливаться холодной водой или кто не желает этого делать, можно просто ополаскивать лицо после посещения общественных мест или прогулок по городу. Можно использовать целительную силу воды, не соприкасаясь с нею. Для этого необходимо открыть дома кран, сесть так, чтобы спина была прямая, а ноги не скрещивались. Протянув руки к воде, чтобы ее струя или просто человек похвалил вашего ребенка и вы боитесь, чтобы он не сглазил его, выкупайте ребенка в теплой проточной воде. Этим вы защитите энергетическое поле ребенка от плохой чужой энергии. К магическим действиям, приносящим положительный результат, относится и умение очищать одежду от накопленной отрицательной энергии. Причем это непросто стирка, а полоскание белья в проточной воде. Полоскание в стиральной машине нужного эффекта не даст из-за отсутствия стока воды, уносящей не нужную информацию с одежды или белья, которые вы полощете. Специалисты также не советуют надевать без предварительной стирки купленную или подаренную вещь или одежду, так как нет никакой гарантии, что ее до вас никто не держал в руках, и не оставил на ней ненужную вам энергетическую информацию. Но вода может не только приносить пользу. Она может и вредить человеку. Это так называемая «мертвая» вода. Наиболее яркими представителями такой воды являются стоячие водоемы — пруды и озера, практически: сплошь заросшие растительностью. Такие водоемы забирают у живых организмов энергию для продления :коего существования. По этой же причине не советуют держать в доме картины, рисунки, фотографии с изображением заросших озер и болот, поскольку они также обладают подобным действием. Правда, это еще не доказано наукой, поэтому отнеситесь к этой информации обыкновенно, как к информации, пригодной для ее разгадки. Знания о применении чудесных свойств четырех стихий — Огня, Земли, Воды и Воздуха передавались из поколения в поколение, на основе этих знаний создавались традиции и приметы. Например, из далекого прошлого перешла к нам традиция после купании ребенка окатывать его водой и приговаривать: «Как с гуся вода, так с (называется имя мальчика или девочки) — худоба». Эта традиция несет в себе глубокий смысл: вода способна смывать с тела не только грязь, но и плохую энергию. Поэтому после душа человек становится бодрее, здоровее. Ведь слово «худоба» раньше означало более широкое понятие: оно объединяло собой все плохое, а не только отсутствие нормального физического веса человека.
Протянув руки к воде, чтобы ее струя или просто человек похвалил вашего ребенка и вы боитесь, чтобы он не сглазил его, выкупайте ребенка в теплой проточной воде. Этим вы защитите энергетическое поле ребенка от плохой чужой энергии. К магическим действиям, приносящим положительный результат, относится и умение очищать одежду от накопленной отрицательной энергии. Причем это непросто стирка, а полоскание белья в проточной воде. Полоскание в стиральной машине нужного эффекта не даст из-за отсутствия стока воды, уносящей не нужную информацию с одежды или белья, которые вы полощете. Специалисты также не советуют надевать без предварительной стирки купленную или подаренную вещь или одежду, так как нет никакой гарантии, что ее до вас никто не держал в руках, и не оставил на ней ненужную вам энергетическую информацию. Но вода может не только приносить пользу. Она может и вредить человеку. Это так называемая «мертвая» вода. Наиболее яркими представителями такой воды являются стоячие водоемы — пруды и озера, практически: сплошь заросшие растительностью. Такие водоемы забирают у живых организмов энергию для продления :коего существования. По этой же причине не советуют держать в доме картины, рисунки, фотографии с изображением заросших озер и болот, поскольку они также обладают подобным действием. Правда, это еще не доказано наукой, поэтому отнеситесь к этой информации обыкновенно, как к информации, пригодной для ее разгадки. Знания о применении чудесных свойств четырех стихий — Огня, Земли, Воды и Воздуха передавались из поколения в поколение, на основе этих знаний создавались традиции и приметы. Например, из далекого прошлого перешла к нам традиция после купании ребенка окатывать его водой и приговаривать: «Как с гуся вода, так с (называется имя мальчика или девочки) — худоба». Эта традиция несет в себе глубокий смысл: вода способна смывать с тела не только грязь, но и плохую энергию. Поэтому после душа человек становится бодрее, здоровее. Ведь слово «худоба» раньше означало более широкое понятие: оно объединяло собой все плохое, а не только отсутствие нормального физического веса человека. Проточная вода запоминает и уносит все: грязь, усталость, накопившуюся отрицательную энергию — и вашу и чужую. Она выравнивает течение энергии в энергетических каналах тела, помогает сбалансировать биополе. Таким же образом она очищает одежду при стирке и дом при уборке. Водолечение известно с древнейших времен. Пресная и минеральная вода широко использовалась в лечебных целях в Древнем Египте, древними ассирийцами, в Древней Греции, Риме и на Руси. Огромная роль принадлежит воде в лечении и профилактике заболеваний. Разделы водной медицины многообразны. Основные из них: Бальнеотерапия — ванны, души, бани, сауны и другие водные процедуры; Лечение минеральной водой Специальные термины: Акваэндоэкология — очищение ЖКТ, печени, крови, лимфы и других органов и систем организма. Талассотерапия — морелечение. Аквафитотерапия — лечение травяными ваннами. Акватерапия — лечение биологически активной водой. Аквагериатрия — борьба со старением и лечение болезней старости путем замены грязной воды в организме человека на легкую чистую воду. Тектоника — лечение различных заболеваний травяными чаями, приготовленными на ЦТВ. Акваонкология — лечение рака ЦТВ. Талица — лечение и профилактика заболеваний при помощи талой воды и др. Магические свойства воды Вода может быть в жидком, твердом и газообразном состоянии. Она принимает форму того сосуда, в который налита. Вода способна передавать информацию, «запоминать» слова и мысли, включать механизм исцеления в человеческом организме. Вода очищает не только от физической, материальной грязи, но и от грязи энергетической. Для очищения от энергетической грязи ведическая практика советует: — Для очищения какого-либо предмета подержать его трое суток в воде, меняя воду каждые сутки. Или достаточно подержать его в проточной воде около часа. — Знахари говорят, что вода слышит и понимает человеческую речь, поэтому нельзя посылать проклятия реке даже в период бедствия — можно навлечь на себя большие неприятности. — Если к воде относиться неуважительно, засорять ее, вода обязательно накажет человека болезнями.
Проточная вода запоминает и уносит все: грязь, усталость, накопившуюся отрицательную энергию — и вашу и чужую. Она выравнивает течение энергии в энергетических каналах тела, помогает сбалансировать биополе. Таким же образом она очищает одежду при стирке и дом при уборке. Водолечение известно с древнейших времен. Пресная и минеральная вода широко использовалась в лечебных целях в Древнем Египте, древними ассирийцами, в Древней Греции, Риме и на Руси. Огромная роль принадлежит воде в лечении и профилактике заболеваний. Разделы водной медицины многообразны. Основные из них: Бальнеотерапия — ванны, души, бани, сауны и другие водные процедуры; Лечение минеральной водой Специальные термины: Акваэндоэкология — очищение ЖКТ, печени, крови, лимфы и других органов и систем организма. Талассотерапия — морелечение. Аквафитотерапия — лечение травяными ваннами. Акватерапия — лечение биологически активной водой. Аквагериатрия — борьба со старением и лечение болезней старости путем замены грязной воды в организме человека на легкую чистую воду. Тектоника — лечение различных заболеваний травяными чаями, приготовленными на ЦТВ. Акваонкология — лечение рака ЦТВ. Талица — лечение и профилактика заболеваний при помощи талой воды и др. Магические свойства воды Вода может быть в жидком, твердом и газообразном состоянии. Она принимает форму того сосуда, в который налита. Вода способна передавать информацию, «запоминать» слова и мысли, включать механизм исцеления в человеческом организме. Вода очищает не только от физической, материальной грязи, но и от грязи энергетической. Для очищения от энергетической грязи ведическая практика советует: — Для очищения какого-либо предмета подержать его трое суток в воде, меняя воду каждые сутки. Или достаточно подержать его в проточной воде около часа. — Знахари говорят, что вода слышит и понимает человеческую речь, поэтому нельзя посылать проклятия реке даже в период бедствия — можно навлечь на себя большие неприятности. — Если к воде относиться неуважительно, засорять ее, вода обязательно накажет человека болезнями. — Если приснится плохой сон, нужно подержать руки под проточной водой (для этой цели сгодится вода из открытого крана) и рассказать этот сон льющейся воде. Желательно, чтобы никто при этом вас не слышал. А вода унесет как плохое содержание сна, так и его влияние на вас. Но поскольку вода имеет свойство уносить не только плохой сон, не рекомендуется петь в ванной. Когда вы поете, у вас не просто хорошее настроение, а состояние радости. Вода будет уносить абсолютно любые ваши ощущения и состояния, Заключение Таким образом, аномальные и специфические свойства воды играют ключевую роль в ее многообразном взаимодействии с живой и неживой природой. Все эти необычные особенности свойств воды настолько «удачны» для всего живого, что делает воду незаменимой основой существования жизни на Земле. Список литературы 1.Белая М.Л., Левадный В.Г. Молекулярная структура воды. М.: Знание 1987. – 46 с. 2.Бернал Дж. Д. Геометрия построек из молекул воды. Успехи химии, 1956, т. 25, с. 643-660. 3.Бульенков Н.А. О возможной роли гидратации как ведущего интеграционного фактора в организации биосистем на разных уровнях их иерархии. Биофизика, 1991, т.36, в.2, с.181-243. 4.Зацепина Т.Н. Свойства и структура воды. М.: изд-во МГУ, 1974, — 280 с. 5.Наберухин Ю.И. Структурные модели жидкости. М.: Наука. 1981 – 185 с.
— Если приснится плохой сон, нужно подержать руки под проточной водой (для этой цели сгодится вода из открытого крана) и рассказать этот сон льющейся воде. Желательно, чтобы никто при этом вас не слышал. А вода унесет как плохое содержание сна, так и его влияние на вас. Но поскольку вода имеет свойство уносить не только плохой сон, не рекомендуется петь в ванной. Когда вы поете, у вас не просто хорошее настроение, а состояние радости. Вода будет уносить абсолютно любые ваши ощущения и состояния, Заключение Таким образом, аномальные и специфические свойства воды играют ключевую роль в ее многообразном взаимодействии с живой и неживой природой. Все эти необычные особенности свойств воды настолько «удачны» для всего живого, что делает воду незаменимой основой существования жизни на Земле. Список литературы 1.Белая М.Л., Левадный В.Г. Молекулярная структура воды. М.: Знание 1987. – 46 с. 2.Бернал Дж. Д. Геометрия построек из молекул воды. Успехи химии, 1956, т. 25, с. 643-660. 3.Бульенков Н.А. О возможной роли гидратации как ведущего интеграционного фактора в организации биосистем на разных уровнях их иерархии. Биофизика, 1991, т.36, в.2, с.181-243. 4.Зацепина Т.Н. Свойства и структура воды. М.: изд-во МГУ, 1974, — 280 с. 5.Наберухин Ю.И. Структурные модели жидкости. М.: Наука. 1981 – 185 с.
Аномальные свойства воды и возможность их использования для получения энергии Текст научной статьи по специальности «Химические науки»
УДК 536.73 (0.0620)
Аномальные свойства воды и возможность их использования
для получения энергии
Д-р хим. наук Ю. А. МАКАШЕВ, д-р техн. наук В. В. КИРИЛЛОВ
Санкт-Петербургский национальный исследовательский университет ИТМО Институт холода и биотехнологий 191002, Санкт-Петербург, ул. Ломоносова, 9
The abnormal properties of water due to the peculiarities of its molecular structure and being very different from those of its molecular analogues, in particular, the negative enthalpy of freezing, the maximum density at 4 оС and others are offered to use for creation of power sources. Their work can be the most effective in the Northwest of Russia, where the temperature drops at 0 оС occur 6-7 months a year, i. e. are normal weather. Keywords: water, crystal lattice, thermal capacity, phase transition. Ключевые слова: вода, кристаллическая решетка, теплоемкость, фазовый переход.
Their work can be the most effective in the Northwest of Russia, where the temperature drops at 0 оС occur 6-7 months a year, i. e. are normal weather. Keywords: water, crystal lattice, thermal capacity, phase transition. Ключевые слова: вода, кристаллическая решетка, теплоемкость, фазовый переход.
Вода обладает целым рядом уникальных физико-химических свойств. Известно, что из всех жидкостей вода единственная, которая аномально изменяет свою плотность при фазовых переходах из жидкого состояния в твердое. Вместо уплотнения затвердевающая вода (лед) становится менее плотной. Причины такой трансформации объясняются молекулярной и электронной структурой воды, которые вызывают образование водородных связей и особые, свойственные только воде кристаллические и жидкофазные решетки. Энергия водородных связей относительно невелика (25-40 кДж/моль), но ее достаточно для изменения теплоемкости, плотности в сторону увеличения, сжимаемости в сторону уменьшения по сравнению с ее молекулярными аналогами: ИД И28е, Н2Те. [1, 2]. На рис. 1 показано изменение плотности воды с изменением температуры.
Из графика видно, что наибольшая плотность воды достигается при 4 °С.
На рис. 2-4 показаны электронная структура и модели молекулы воды, которые реализуются вследствие Бр3-гибридизации атомных орбиталей кислорода. Пространственная структура молекулы — тетраэдр (рис. 2) в вершинах которого располагаются два атома водорода и две неподеленные электронные пары. Все узлы «водного» тетраэдра сохраняют способность к образо-
ванию связи: электроположительные водороды с кислородом и электронные пары — с водородом.
Электронное строение связывающих орбиталей обуславливает наличие пространственной сетки водородных связей, которые в массе создают разнообразные формы как в кристаллическом состоянии (снежинки, лед), так и в жидкой воде [3].
На рис. 5 изображены структуры обыкновенного льда (а), обозначаемого по свойствам симметрии как 1И. Структура (а) образует тетраэдрические ячейки с четверной координацией у каждой молекулы воды и объемные гексагональные кольца в соединениях шести молекул воды.
На рис. 6 [3] показана проекция структуры льда на плоскости и протонные дефекты кристаллической решетки, в результате которых лед 1И приобретает одностороннюю проводимость. Лед Ш (б) образуется при повышенном давлении и содержит искаженные водородные связи. Его строение приближается к строению жидкой воды.
При замерзании льда вода из довольно хаотичной и относительно малоупорядоченной превращается в высокоорганизованную структуру Энтальпия замерзания воды (АН ) — величина отрицательная (происходит выделение тепла) и составляет величину -5,99 кДж/ моль. Изменение энтропии составляет -5,99×1000 /273 = -21,9 Дж/ моль-град.
р, г/см3 1
0,98 0,96 0,94 0,92
б
40 60 Т °с
-40 -20 0 20 Рис. 1. Зависимость плотности воды от температуры
Н
Н
Рис. 2. Модели молекулы воды: а — положение облаков положительного и отрицательного заряда; б — тетраэдрическая модель
а
+
+
ХОЛОД: ТЕХНИКА И ТЕХНОЛОГИИ
33
Рис. 3. Модели молекулы воды: а, б — плоские; в — пространственная
3. Модели молекулы воды: а, б — плоские; в — пространственная
Рис. 4. Димерное строение воды [3]
Рис. 5. Модели структуры льда: а — фрагмент структуры льда I , кружки — молекулы воды, соединенные водородными связями (по 4), тетраэдры и шес-тичленные кольца; б — лед Ш, также по 4 водородные связи, искаженные 5-, 7-, 8-членные кольца
б
а
а
в
б
Таким образом, процесс проходит вследствие уменьшения внутренней энергии и система становится более упорядоченной и приобретает совершенно новую водородносвязанную кристаллическую структуру.
Итак, плотность воды при 4 °С (см. рис. 1) максимальна. Ниже 0 °С кривая показывает плотность переохлажденной воды. Изменение плотности на 4% приводит к значительно большему изменению объема, примерно на 10 %. В результате, выделяется энергия увеличения объема, равная энергии вновь образовавшихся связей молекул в кристалле льда.
Подсчитаем энергию замерзания (плавления) воды. При постоянных температуре и давлении вся теплота замерзания воды (ЛП) равна изменению внутренней энергии и может быть превращена в работу [2, 4]: ЛП = АН = 79,4 кал/г или 79,4×4,18×1000 =
з з
= 332 Дж/кг, или 3,32105 кДж/т.
Устройство, в котором замерзает одна тонна воды в течение 15 мин обладает мощностью 3,32 • 105/900 = 3,7 кВт.
Дефект
Это вполне приемлемый источник энергии в районах Северо-Запада, где перепады температур через 0 °С — обычный режим погоды в течение 6-7 мес в году.
Рис. 6. Шестичленное строение водородносвязанных молекул воды в кристаллах льда; ионные (Ь) и ориентационные (О) дефекты Бьеррума
а
б
Р,
Рис. 7. Принципиальная схема работы источника на фазовом переходе
Техническое решение может быть разнообразным. Принципиальная схема состоит, например, из набора труб, заполненных водой и герметично закрытых поршнями (рис. 7). Давление, создаваемое в трубах (Р2) утилизируется передаточным механизмом (Р1). Для поддержания непрерывной работы устройство может иметь две группы цилиндров, одна из которых находится в воде подо льдом. По-видимому, будет необходимость в аккумуляции энергии.
Диапазон работы устройств по температуре может быть расширен до -(30-40) оС, если применить хорошо известные хладоносители на основе водных растворов солей и спиртов. В дальнейшем предстоит исследовать диаграммы «состав-свойство» растворов в точках замерзания и в близких к ним температурах, а также соотношения объемов в системах «вода-лед» при низких температурах. Стоимость энергетических устройств будет значительно ниже ветряков и более дешевых в обслуживании. Для создания опытной установки на первом этапе внедрения исследований в практику необходима финансовая поддержка.
Список литературы
1. Крестовников А. Н., Вигдорович В. Н. Химическая термодинамика. — М.: Металлургия, 1973.
2. Зацепина Г. Н. Свойства и структура воды. — М.: МГУ 1974.
3. Вода: структура, состояние, сольватация. Достижения последних лет. Отв. ред. академик РАН А. М. Ку -тепов. — М.: Наука, 2003.
Достижения последних лет. Отв. ред. академик РАН А. М. Ку -тепов. — М.: Наука, 2003.
4. Головин Ю. Н. Вода и лед — знаем ли мы о них достаточно? // Соровский обр. журнал. 2000. № 9.
5. Киреев В. А. Методы практических расчетов в термодинамике химических реакций. — М.: Изд-во «Химия», 1975.
С 20-летием Международной академии холода
Уважаемый Александр Владимирович!
Примите поздравления с 20-летием Международной академии холода от коллектива ОАО «Информационные спутниковые системы» имени академика М.Ф. Решетнёва»!
Сегодня МАХ — это организация, объединяющая единомышленников нескольких десятков государств ближнего и дальнего зарубежья. Достижения ученых, являющихся ее членами, используются в самых разных областях промышленности.
Решение фундаментальных и прикладных проблем холодильной и криогенной техники имеет большую актуальность для нас, создателей космических аппаратов. Оно играет существенную роль как в разработке и изготовлении жизнеобеспечивающих систем самих спутников, так и в производстве различных испытательных установок для их наземной экспериментальной отработки.
Желаю членам Международной академии холода творческих успехов, интересных проектов и нестандартных научных решений. Пусть все больше Ваших разработок применяется в составе перспективной техники, принося пользу человечеству!
С уважением, Генеральный конструктор и генеральный директор ОАО «ИСС», д-р техн. наук, профессор, член-корреспондент РАН
Н.А. Тестоедов
Свойства воды как растворителя — Справочник химика 21
А. Структурные свойства воды как растворителя [c.106]
Структурные свойства воды как растворителя [c.106]Вода растворяет большинство комплексных соединений, и понятно, что в большинстве кинетических исследований комплексов в качестве растворителя использовали воду. Однако интерпретация полученных при этом кинетических данных усложнена из-за особых свойств воды как растворителя. Эти свойства по своей природе могут быть или структурными, или кинетическими. [c.106]
Кислотные свойства в наибольшей степени выражены у оксидов хлора, так как разность электроотрицательностей хлора и кислорода наименьшая (разд. 35.2.1). В соответствии с общими закономерностями С /) дает наиболее сильную кислоту (табл. В.26). Следует учитывать также свойства воды как растворителя. В таблице В.26 указаны продукты, образующиеся при взаимодействии оксидов галогенов с водой. Свойство оксидов, а следовательно, и кислородных кислот образовывать соединения полимерного типа в соответствии с общими правилами (разд. 35.2.1) наиболее типично для иода. Перечень извест- [c.503]
СВОЙСТВА ВОДЫ КАК РАСТВОРИТЕЛЯ [c.11]
Если растворенные газы не вступают в химические реакции с содержащимися в воде солями, то последние влияют на растворимость газов чисто физически, изменяя свойства воды как растворители (эффект Сеченова). Этот эффект приводит в большинстве случаев к уменьшению растворимости (высаливание) и редко к увеличению растворимости (всаливание). [c.129]
Ниже приведены физико-химические свойства воды как растворителя [c.223]
Объясните, почему свойства воды как растворителя обычно ухудшаются при понижении температуры от 90 до 35°С. [c.74]
Все это многообразие влияния органических веществ на белковые молекулы определяется, в основном, тремя факторами концентрацией органических молекул, длиной цепи их неполярной части и природой гидрофильной группы, причем осуществляться это действие может как путем непосредственного связывания (взаимодействия) дифильных молекул с молекулами белка, так и в результате изменения свойств воды как растворителя в присутствии органических молекул. При низких концентрациях органического вещества, когда его влияние на структуру воды невелико, преобладает эффект связывания. Связывание в таких условиях не вызывает конформационных изменений белковых молекул (либо [c.28]
При низких концентрациях органического вещества, когда его влияние на структуру воды невелико, преобладает эффект связывания. Связывание в таких условиях не вызывает конформационных изменений белковых молекул (либо [c.28]
Вода — бесспорно, наиболее распространенный в косметике растворитель, причем сильный растворитель, который может растворять соли, кислоты, щелочи, а также большое количество органических веществ. Вода служит основным компонентом в лосьонах для лица, в косметическом молочке и легких кремах, а также во многих шампунях. Во всех этих косметических средствах в воде растворены всевозможные вещества. Если то или иное вещество не растворяется в ней в достаточной степени, то свойства воды как растворителя можно улучшить, добавив в нее небольшие количества обычного спирта или глицерина. [c.124]
В связи с особыми физико-химическими свойствами воды как растворителя было интересно исследовать кинетику окислительно-восстановительной реакции в замороженных водных растворах. Тетраметил-4-оксипиперидин-1-оксил хорошо растворим в воде, гидразобензол в воде не растворяется. Поэтому в качестве второго реагента была выбрана аскорбиновая кислота. [c.209]
Прежде чем обсуждать свойства воды как растворителя, следует коротко рассмотреть теорию кислот и оснований. В химии водных растворов кислотой можно назвать любое вещество, которое является донором ионов водорода, а основанием — вещество, которое служит донором ионов гидроксила. Процесс нейтрализации заключается в образовании молекул растворителя — воды [c.320]
Свойства водно-дисперсных систем и их поведение в тех или иных процессах обусловлено в первую очередь свойствами воды как растворителя. [c.31]
В этот раздел вошли задачи, связанные, помимо традиционно рассматриваемых химических свойств названных соединений, со свойствами воды как растворителя. Сюда относятся задачи на физико-химическую сущность процесса растворения, на реакции гидролиза сложных веществ в водном растворе, разложение некоторых веществ водой. [c.83]
[c.83]
Вода как растворитель. Уникальные свойства воды как растворителя определяются малыми размерами, полярностью ее молекул и наличием у них двух неподеленных электронных пар. Диполи молекул воды активно взаимодействуют с ионами, находящимися в кристаллических решетках ионных кристаллов и с полярными молекулами, образующими молекулярные кристаллы. В тех случаях, когда энергия гидратации ионов или полярных молекул превышает энергии кристаллических решеток, происходит растворение кристаллических веществ в воде (см. гл. 7). [c.256]
Образование некоторыми веществами гомогенных систем в природных водах определяется в основном специфическими свойствами воды как растворителя. Последние обусловлены структурой электронного облака ее молекулы. Особенность воды как полярного растворителя создает условия для возникновения однофазных систем молекулярных и ионных [c.50]
Особенности формирования покрытий из водных растворов пленкообразователей связаны со специфическими свойствами воды как растворителя ее низкой температурой кипения и одновременно низким давлением паров (2,38 кПа при 20 °С), большим поверхностным натяжением (72,7 мДж/м ) и высокой теплотой парообразования (2,47 МДж/кг). Водные краски характеризуются резким нарастанием вязкости по мере испарения воды. Это затрудняет ее диффузию из внутренних слоев и замедляет пленкообразование. Оптимальным является ступенчатый режим формирования таких покрытий удаление большей части воды при температурах до 100 °С и окончательное обезвоживание и отверждение при более высоких температурах. [c.44]
Свойства воды как растворителя [c.48]
Сравнительно полно обсуждены термодинамические свойства предельно разбавленных растворов для систем, в которых растворителем является вода. Для водных систем имеется специальный обзор [101, в котором содержатся сведения об энергиях Гиббса, энтальпиях, теплоемкостях, энтропиях, объемных эффектах растворения большого числа органических соединений в воде. В обзоре специальное внимание уделено специфическим свойствам воды как растворителя, подчеркнуто особенно значительное для водных систем влияние температуры на свойства разбавленных растворов. [c.31]
В обзоре специальное внимание уделено специфическим свойствам воды как растворителя, подчеркнуто особенно значительное для водных систем влияние температуры на свойства разбавленных растворов. [c.31]
Изменение свойств воды как растворителя в широком диапазоне параметров, в основном характерных для условий работы теплосиловых установок, связано с изменением ее плотности от 1000 до 0,6 кг/м и температуры от 20 до 600 °С. Это вызывает изменение диэлектрической постоянной воды от 84 до 1,1 Ф/м и изменение степени ассоциации молекул воды от значительной до практически нулевой. [c.116]
Для гидратации белка наибольшее значение имеют пептидные связи, за счет которых притягивается примерно /3 всей гидрата-ционной воды. В общем частицы гидрофильных коллоидов связывают значительные количества воды так, 1 г сухого крахмала при растворении связывает 0,18 г воды, 1 г яичного альбумина (белка) — 0,35 г воды, 1 г карбоксигемоглобина — 0,353 г воды. Связанная полярными группами вода приобретает новые качества, приближающие ее к твердому веществу ее молекулы имеют уплотненное расположение, свойства воды как растворителя понижены, она не замерзает при низких температурах и т. п. В свою очередь, гидратированное вещество также приобретает иные свойства повышается его устойчивость в растворе, уменьшается скорость диффузии и др. Вязкость и скорость образования внутренних структур в этих растворах значительно выше, чем в коллоидных. [c.174]
Уникальные свойства воды как растворителя объясняют сочетанием в ее молекуле трех свойств высокой полярность] водородными связями с растворимыми веществами и донорнь свойствами. Она часто является лигандом в комплексных соеди ниях и кристаллогидратах. [c.32]
Взаимодействие белков с неполярными молекулами обусловлено гидрофобными взаимодействиями, возникновение которых определяется особыми структурными свойствами воды как растворителя. Структура и свойства воды являются в настоящее время предметом многочисленных физико-химических исследований. Современные структурные лтодели воды в основном базируются на классических представлениях Франка и Эванса [25 и Франка и Вэна [26]. Результаты выполненных в последние годы исследований обобщены в ряде обзоров [27—32]. Состояние воды в биологических системах специально рассмотрено в ряде работ [15, 33-36]. [c.8]
Современные структурные лтодели воды в основном базируются на классических представлениях Франка и Эванса [25 и Франка и Вэна [26]. Результаты выполненных в последние годы исследований обобщены в ряде обзоров [27—32]. Состояние воды в биологических системах специально рассмотрено в ряде работ [15, 33-36]. [c.8]
Закономерности, подобные приведенным на рис. 1, следует рассматривать не более как вариации второго метода сравнительного расчета М.Х. Ка-рапетьянца применительно к растворимости [46]. Они могут быть с успехом использованы для пpибJшжeннoгo расчета растворимости газов в неполярных и малополярных жидкостях. Однако следует отметить, что даже в этом случае специфические свойства воды как растворителя находят свое отражение. Корреляционный график для НтО явно выпадает из группы прямых для других растворителей, отличаясь от них наклоном и местом, занимаемым на рисунке. [c.110]
Полученные результаты показьшают, что изотопные эффекты гадратации катионов являются не только количественным отражением большей структурированности тяжелой воды за счет упрочнения водородных связей при замене атомов протия на атомы дейтерия. Они свидетельствуют также о наличии у воды развитой трехмерной структуры, определяюшей специфичность свойств воды как растворителя. В качестве подтверждения этого тезиса можно привести данные Кришнана и Фридмана [86] по измерению энтальпийных характеристик изотопных эффектов сольватации ионов в протонированном и дейтерированном метаноле СНзОО. Найдено, что АЯ°н о в метаноле значительно меньше, чем в воде. Эю свидетельствует о качественно иной природе действия ионов на воду по сравнению со спиртами. В частности, делается вьшод, что эффекты разрушения присущи только водным растворам. К этому следует, по-видимому, добавить, что поскольку в метаноле не происходит дестабилизации структуры, то, следовательно, в этом (и, очевидно, подобных ему) растворителе не может иметь место явление отрицательной сольватации (по крайней мере при [c. 143]
143]
Укажем на то обстоятельство, что ряд набухания одновалентных анионов в точности повторяет такой же ряд адсорбируемости (стр. 105) и обращенный ряд коагуляции лиофобных золей (стр. 135). Внешне эта закономерность очевидно связана с размерами (радиусом) ионов, а внутренне—со степенью ионной сольватации (гидратации). Недавно автор настоящего руководства показал, что в подобном же закономерном порядке идет воздействие ионов (не только анионов, но и катионов) на объемные] теплоемкостные свойства воды как растворителя. На основании этого им было высказано соображение, по которому влияние лиотропных рядов ионов на все важнейшие свойства гидрофильных дисперсных систем лежит не в воздействии их на вещество дисперсной фазы, а в воздействии на структуру воды—растворителя (в разрыхлении ее одними ионами и в уплотнении другими). [c.185]
Кислотные свойства воды как растворителя [20, 21] обусловлены образованием гидроксониевого катиона Н3О+ (ситуацию упрощают и говорят об образовании иона водорода). Сольватация протонов в воде не завершается ионом Н3О+. Это более сложный процесс так, обнаружен достаточно устойчивый катион Н904 [c.56]
Особенности формирования покрытий из водных растворов определяются свойствами воды как растворителя и структурой водных растворов. Вода характеризуется высоким поверхностным натяжением, способностью гидратировать как низкомолекулярные, так и полимерные соединения, сильной гидролизующей способностью, достаточно выраженной амфотерностью и т. д. [7]. В зависимости от сродства воды к пленкообразо-вателю (т. е. в зависимости от гидрофильности пленкообразователя и его молекулярной массы) их взаимодействие приводит к образованию либо мицеллярных растворов, либо лио-фильных дисперсий. В зависимости от этого вода может быть термодинамически хорошим или плохим растворителем. Для снижения поверхностного натяжения и улучщения термодинамического качества растворителя в водную пленкообразующую систему вводят спирты — низкомолекулярные типа изопропилового и высококипящие, такие как целлозольвы. Введение высококипящего спирта обеспечивает неограниченное смещение в процессе пленкообразоваиия, особенно при термоотверждении, и создает такие условия испарения растворителя, при которых сводится к минимуму изменение конформации и взаимного расположения макромолекул пленкообразователя при прохождении раствором всего концентрационного интервала от исходного состояния до пленкообразователя, свободного от растворителя [7, 164]. [c.102]
Введение высококипящего спирта обеспечивает неограниченное смещение в процессе пленкообразоваиия, особенно при термоотверждении, и создает такие условия испарения растворителя, при которых сводится к минимуму изменение конформации и взаимного расположения макромолекул пленкообразователя при прохождении раствором всего концентрационного интервала от исходного состояния до пленкообразователя, свободного от растворителя [7, 164]. [c.102]
Специфические свойства воды как растворителя частично обусловлены влиянием растворенного вещества на структуру растворителя. Выше уже обсуждалась тенденция к образованию айсбергов при введении неполярных веществ в воду, что приводит не только к выделению тепла, но и к большому отрицательному изменению энтропии (раздел А-6). Эти эффекты нередко проявляются в уменьшении растворяющей способности воды с повышением температуры, например при растворении полиметакри-ловой кислоты [131]. Иногда водные растворы полимеров осаждаются при нагревании. Это наблюдалось для сополимеров винилового спирта и ацетатов [132], метилцеллюлозы [133, 134] и других водорастворимых полимеров. Однако растворяющая способность воды не всегда снижается при повып1ении температуры. Например, при исследовании полиакриламида Зильберберг и др. [131] обнаружили, что вода становится термодинамически лучшим растворителем по мере повышения температуры. Во всяком случае следует помнить, что взаимодействие молекул воды с макромолеку-лярным растворенным веществом сильно локализовано на отдельных участках, и поэтому следует ожидать, что параметр взаимодействия между растворителем и растворенным веществом может изменяться в широких пределах в зависимости от состава системы. Приведем наглядный пример найлон имеет чрезвычайно большое сродство к воде при очень малой ее концентрации [135]. Однако растворимость воды в этом полимере довольно ограничена, а растворимость найлона в воде слишком мала, чтобы ее можно было обнаружить. Очевидно, что в таких случаях следует рассматривать отдельно взаимодействие воды с сильно полярными амидными группами и с неполярными участками полимерного растворенного вещества. [c.70]
[c.70]
Вода является рабочим веществом в паровых машинах и турбинах она служит для поднятия давления в нефтеносных пластах, для передачи работы в гидравлических прессах, размыва грунтов и т. д. Особенно велико значение воды в химической, и родственных ей отраслях промышленности. Здесь нет почти ни одного процесса, который пе требовал бы регулирования температурного режима, подвода или отвода тепла. Достаточно вспомнить роль водяного охлаждения в производстве серной и азотной кислот, аммиака при выплавке чугуна, производстве каменноугольного кокса. В производстве широко используются свойства воды как растворителя, для промывания исходных и промежуточных материалов и продуктов. Например, при получении водорода из геиераторгюго или природного газа громадные количества двуокиси углерода удаляются из газовых смесей путем растворения ее в воде. Для разделения сильвинита его обрабатывают водой. [c.103]
Распределение гидрофильных и гидрофобных остатков на поверхности белковой молекулы является признаком, определяющим растворимость белка в различных растворителях. Хотя гидрофобные группы стремятся сконцентрироваться внутри белковой молекулы, значительная их часть располагается на поверхности и контактирует с растворителем (рис. 3.1). Гидрофобным группам на поверхности молекул наряду с заряженными и другими полярными группами принадлежит важная роль в определении поведения белков. Основным компонентом растворителей всегда является вода, хотя есть основания предполагать, что, например, интегральные мембранные белки можно было бы выделять, используя неводные растворители. Для изменения растворимости белка можно манипулировать свойствами воды как растворителя, изменяя ионную силу, pH, количество добавляемых, смешивающихся с 50Д0Й, органических растворителей и других инертных веществ или полимеров, а также комбинируя эти изменения с изменениями- температуры. Чаще всего для селективного осаждения белков используют нейтральные соли. Это и будет предметом обсуждения двух следующих разделов. [c.57]
Это и будет предметом обсуждения двух следующих разделов. [c.57]
Участие органического вещества в формировании химического состава подземных вод проявляется а) в образовании различных форм связей с химическими элементами (органокомплексы и элементорганические соединения) б) в микробиологических процессах в) в окис-лительно-восстановительных процессах, протекающих химическим путем г) в изменениях физико-химических свойств воды как растворителя. [c.230]
ЖИЗНЬ, МОЛЕКУЛА ВОДЫ И ЗОЛОТАЯ ПРОПОРЦИЯ
Соотношения золотой пропорции исследователи находят в морфологической структуре растений, птиц, животных, человека. Закономерности золотой пропорции обнаруживаются и в организации неживой природы. В данной статье на основании анализа молекулы воды в различных агрегатных состояниях высказана гипотеза, что ее структура в состоянии талой воды практически соответствует треугольнику золотой пропорции.Наука и жизнь // Иллюстрации
Теплоемкость воды достигает минимального значения при температуре около 37<SUP>о</SUP>С.
Наука и жизнь // Иллюстрации
Илл. 1. Плотность воды при понижении температуры сначала возрастает, достигает максимума при 4<SUP>о</SUP>С и начинает уменьшаться.
Наука и жизнь // Иллюстрации
В момент плавления объем свинца мгновенно увеличивается от 1 до 1,003, а объем воды скачком уменьшается от 1,1 до 1,0.
Наука и жизнь // Иллюстрации
Вода имеет аномально высокие температуры кипения и замерзания по сравнению с другими трехатомными соединениями водорода.
Наука и жизнь // Иллюстрации
В жидкой воде молекулы H<SUB>2</SUB>O могут объединяться в сложные образования — кластеры, по структуре напоминающие лед.
Наука и жизнь // Иллюстрации
Схематичное изображение молекулы воды на плоскости.
Деление отрезка в крайнем и среднем отношении, или золотая пропорция. Отрезок разделен на две части так, что CB:AC = AC:AB.
Отрезок разделен на две части так, что CB:AC = AC:AB.
«Золотой треугольник». Соотношение его сторон OA:AB = OB:AB ≈ 0,618,
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
‹
›
Воде была дана волшебная власть стать соком жизни на Земле.
Леонардо да Винчи
Вода — одно из самых уникальных и загадочных веществ на Земле. Природа этого вещества до конца еще не понята. Внешне вода кажется достаточно простой, в связи с чем долгое время считалась неделимым элементом. Лишь в 1766 году Г. Кавендиш (Англия) и затем в 1783 году А. Лавуазье (Франция) показали, что вода не простой химический элемент, а соединение водорода и кислорода в определенной пропорции. После этого открытия химический элемент, обозначаемый как Н, получил название «водород» (Hydrogen — от греч. hydro genes), которое можно истолковать как «порождающий воду».
Дальнейшие исследования показали, что за незатейливой химической формулой Н2О скрывается вещество, обладающее уникальной структурой и не менее уникальными свойствами. Исследователи, пытавшиеся на протяжении двух с лишним столетий раскрыть секреты воды, часто заходили в тупик. Да и сейчас ученые понимают, что вода остается трудным объектом для исследований, ее свойства до сих пор не всегда до конца прогнозируемы.
Загадочная магия воды. Почему жидкая вода имеет необычные свойства? Традиционный ответ может быть следующим: из-за свойств атомов кислорода и водорода, из-за их структурного расположения в молекуле, из-за определенного поведения электронов в молекуле и т.п.
Так в чем же заключаются загадочные, необычные свойства привычной всем жидкой воды? Прежде всего, в том, что практически все свойства воды аномальны, а многие из них не подчиняются логике тех законов физики, которые управляют другими веществами. Кратко упомянем те из них, которые обуславливают существование жизни на Земле.
Вначале о трех особенностях тепловых свойств воды.
Первая особенность: вода — единственное вещество на Земле (кроме ртути), для которого зависимость удельной теплоемкости от температуры имеет минимум.
Из-за того, что удельная теплоемкость воды имеет минимум около 37оС, нормальная температура человеческого тела, состоящего на две трети из воды, находится в диапазоне температур 36-38оС (внутренние органы имеют более высокую температуру, чем наружные).
Вторая особенность: теплоемкость воды аномально высока. Чтобы нагреть определенное ее количество на один градус, необходимо затратить больше энергии, чем при нагреве других жидкостей, — по крайней мере вдвое по отношению к простым веществам. Из этого вытекает уникальная способность воды сохранять тепло. Подавляющее большинство других веществ таким свойством не обладают. Эта исключительная особенность воды способствует тому, что у человека нормальная температура тела поддерживается на одном уровне и жарким днем, и прохладной ночью.
Таким образом, вода играет главенствующую роль в процессах регулирования теплообмена человека и позволяет ему поддерживать комфортное состояние при минимуме энергетических затрат. При нормальной температуре тела человек находится в наиболее выгодном энергетическом состоянии.
Температура других теплокровных млекопитающих (32-39оС) также хорошо соотносится с температурой минимума удельной теплоемкости воды.
Третья особенность: вода обладает высокой удельной теплотой плавления, то есть воду очень трудно заморозить, а лед — растопить. Благодаря этому климат на Земле в целом достаточно стабилен и мягок.
Все три особенности тепловых свойств воды позволяют человеку оптимальным образом существовать в условиях благоприятной среды.
Имеются особенности и в поведении объема воды. Плотность большинства веществ — жидкостей, кристаллов и газов — при нагревании уменьшается и при охлаждении увеличивается, вплоть до процесса кристаллизации или конденсации. Плотность воды при охлаждении от 100 до 4оС (точнее, до 3,98оС) возрастает, как и у подавляющего большинства жидкостей. Однако, достигнув максимального значения при температуре 4оС, плотность при дальнейшем охлаждении воды начинает уменьшаться. Другими словами, максимальная плотность воды наблюдается при температуре 4оС (одна из уникальных аномалий воды), а не при температуре замерзания 0оС.
Плотность воды при охлаждении от 100 до 4оС (точнее, до 3,98оС) возрастает, как и у подавляющего большинства жидкостей. Однако, достигнув максимального значения при температуре 4оС, плотность при дальнейшем охлаждении воды начинает уменьшаться. Другими словами, максимальная плотность воды наблюдается при температуре 4оС (одна из уникальных аномалий воды), а не при температуре замерзания 0оС.
Замерзание воды сопровождается скачкообразным(!) уменьшением плотности более чем на 8%, тогда как у большинства других веществ процесс кристаллизации сопровождается увеличением плотности. В связи с этим лед (твердая вода) занимает больший объем, чем жидкая вода, и держится на ее поверхности.
Столь необычное поведение плотности воды крайне важно для поддержания жизни на Земле.
Покрывая воду сверху, лед играет в природе роль своего рода плавучего одеяла, защищающего реки и водоемы от дальнейшего замерзания и сохраняющего жизнь подводному миру. Если бы плотность воды увеличивалась при замерзании, лед оказался бы тяжелее воды и начал тонуть, что привело бы к гибели всех живых существ в реках, озерах и океанах, которые замерзли бы целиком, превратившись в глыбы льда, а Земля стала ледяной пустыней, что неизбежно привело бы к гибели всего живого.
Отметим еще некоторые особенности воды.
Внешне вода подвижна и податлива, и ее можно заключить в любой сосуд. Однако, проникая в трещины горных пород и расширяясь при замерзании, вода раскалывает скальные породы любой твердости, которые постепенно распадаются на все более мелкие частицы. Так начинается возврат окаменевших пород в жизненный цикл: на полях промерзание поверхностных слоев земли с ее органическими компонентами помогает образованию плодородной почвы.
Процесс включения твердых веществ в большой круговорот живой природы ускоряется чудесным свойством воды их растворять. Вода с растворенными компонентами твердых веществ становится средой питания и поставщиком микроэлементов, необходимых для жизни растений, животных и человека.
Вода сильнее других жидкостей проявляет свойства универсального растворителя. Если ей дать достаточно времени, она может растворить практически любое твердое вещество. Именно из-за уникальной растворяющей способности воды никому до сих пор не удалось получить химически чистую воду — она всегда содержит растворенный материал сосуда. Вода абсолютно необходима для всех ключевых систем жизнеобеспечения человека. Она содержится в человеческой крови (79%) и способствует переносу по кровеносной системе в растворенном состоянии тысяч необходимых для жизни веществ. Вода содержится в лимфе (96%), которая разносит из кишечника питательные вещества по тканям живого организма (см. таблицу 1).
Перечисленные свойства и особая роль воды в обеспечении жизни на Земле не могут оставить равнодушным ни один пытливый ум, даже если он верит в счастливые случайности. «Начало всего есть вода», — справедливо отмечал Фалес из Милета в VI веке до н.э.
Жидкое чудо. Прекратим перечисление странных, но жизненно необходимых свойств воды, которых можно набрать еще с десяток, и переключим внимание на секреты необычного строения ее молекулы. Именно анализ строения молекулы воды позволяет понять ее исключительность в живой и неживой природе. Так что дорога к истине проходит через строение одиночной молекулы воды.
Прежде всего отметим, что молекула воды самая маленькая среди подобных трехатомных молекул (по отношению к гомологам, то есть водородным соединениям типа Н2S, Н2Se, Н2Те, со свойствами которых традиционно сравнивают свойства воды). Такие молекулы при нормальных условиях образуют газы, а молекулы воды — жидкость. Почему?
Хаотичное сообщество газообразных молекул воды при конденсации, то есть при образовании жидкой фазы, формирует жидкое вещество удивительной сложности. В первую очередь это связано с тем, что молекулы воды обладают уникальным свойством объединяться в кластеры (группы) (Н2О)x. Под кластером обычно понимают группу атомов или молекул, объединенных физическим взаимодействием в единый ансамбль, но сохраняющих внутри него индивидуальное поведение. Возможности прямого наблюдения кластеров ограничены, и поэтому экспериментаторы компенсируют аппаратурные недостатки интуицией и теоретическими построениями.
Под кластером обычно понимают группу атомов или молекул, объединенных физическим взаимодействием в единый ансамбль, но сохраняющих внутри него индивидуальное поведение. Возможности прямого наблюдения кластеров ограничены, и поэтому экспериментаторы компенсируют аппаратурные недостатки интуицией и теоретическими построениями.
При комнатной температуре степень ассоциации X для воды составляет, по современным данным, от 3 до 6. Это означает, что формула воды не просто Н2О, а среднее между Н6О3 и Н12О6. Другими словами, вода — сложная жидкость, «составленная» из повторяющихся групп, содержащих от трех до шести одиночных молекул. Вследствие этого вода имеет аномальные значения температуры замерзания и кипения по сравнению с гомологами. Если бы вода подчинялась общим правилам, она должна была замерзать при температуре порядка -100оС и закипать при температуре около +10оС.
Если бы вода при испарении оставалась в виде Н6О3, Н8О4 или Н12О6, то водяной пар был бы намного тяжелее воздуха, в котором доминируют молекулы азота и кислорода. В этом случае поверхность всей Земли была бы покрыта вечным слоем тумана. Представить себе жизнь на такой планете практически невозможно.
Людям крупно повезло: кластеры воды при испарении распадаются, и вода превращается практически в простой газ с химической формулой Н2О (обнаруженное в последнее время в паре незначительное количество димеров Н4О2 погоды не делает). Плотность газообразной воды меньше плотности воздуха, и поэтому вода способна насыщать своими молекулами земную атмосферу, создавая комфортные для человека погодные условия.
На Земле нет других веществ, наделенных способностью быть жидкостью при температурах существования человека и при этом образовывать газ не только легче воздуха, но и способный возвращаться к ее поверхности в виде осадков.
Восхитительная геометрия. Итак, какова же самая маленькая среди трехатомных молекул? Молекула воды имеет симметричную V-образную форму, так как два небольших атома водорода располагаются с одной стороны от сравнительно крупного атома кислорода. Это сильно отличает молекулу воды от линейных молекул, например Н2Ве, в которой все атомы располагаются цепочкой. Именно такое странное расположение атомов в молекуле воды и позволяет ей иметь множество необычных свойств.
Если внимательно рассмотреть геометрические параметры молекулы воды, то в ней обнаруживается определенная гармония. Чтобы увидеть ее, построим равнобедренный треугольник Н-О-Н с протонами в основании и кислородом в вершине. Такой треугольник схематично копирует структуру молекулы воды, проекция которой на плоскость условно изображена на рисунке.
Длины сторон этого треугольника и валентный угол между двумя связями О-Н изменяются при изменении агрегатного состояния воды. Приведем эти параметры (см. таблицу 2).
Прокомментируем данные, характеризующие различные состояния воды.
Параметры молекулы воды в парообразном состоянии получены на основе обработки спектров ее поглощения. Результаты неоднократно уточнялись, но по существу правильно оценивают длины связей и валентный угол в молекуле воды в состоянии пара.
Кристаллическая структура льда при нормальном давлении довольно рыхлая с причудливой паутиной связей между молекулами воды. Схематично кристаллическую решетку обычного льда можно построить из атомов кислорода, каждый из которых участвует с соседними атомами в четырех водородных связях, направленных приблизительно к вершинам правильного тетраэдра.
Напомним, что водородной называется связь между атомами в одной молекуле или между соседними молекулами, которая осуществляется через атом водорода. Водородная связь играет чрезвычайно важную роль в структуре не только воды, но и большинства биологических молекул — углеводов, белков, нуклеиновых кислот и т. п.
п.
Если кристаллический лед хорошо упорядочен по кислороду, то этого нельзя сказать про водород: в расположении ионов водорода (протонов) наблюдается сильный беспорядок. Их положение четко не определено, и поэтому лед можно считать разупорядоченным по водороду.
Лед обладает многими удивительными особенностями, из которых отметим две.
Во-первых, он всегда очень чист химически. В структуре льда практически не бывает примесей: при замерзании они вытесняются в жидкость. Именно поэтому снежинки всегда белые, а льдинки на поверхности грязной лужи практически прозрачные. Вообще говоря, любой растущий кристалл стремится создать идеальную кристаллическую решетку и вытесняет посторонние вещества. Но в планетарном масштабе именно замечательный феномен замерзания и таяния воды играет роль гигантского очистительного процесса — вода на Земле постоянно очищает сама себя.
Во-вторых, лед и особенно снег обладают очень высокой отражательной способностью. Благодаря этому солнечное излучение не вызывает заметного нагрева полярных областей, и, как следствие этого, наша планета избавлена от сезонных наводнений и повышений уровня Мирового океана.
Экспериментальное определение параметров одиночной молекулы воды в жидкой фазе до сих пор встречает непреодолимые трудности, поскольку жидкая вода — это смесь структурных элементов, то есть различных кластеров, находящихся в динамическом равновесии между собой. Полной ясности в отношении их взаимодействий до сих пор нет, а разделить такую смесь на отдельные компоненты невозможно: «простая» жидкость Н2О не торопится раскрывать свои внутренние секреты.
Вернемся к рисунку, на котором в общих чертах представлена структура молекулы воды. В ней есть симметрия, которая играет основную роль в попытках всестороннего объяснения физического мира, и асимметрия, наделяющая эту молекулу возможностью движения и связью с золотой пропорцией. Поэтому кратко напомним о том, что в математике называют золотой пропорцией.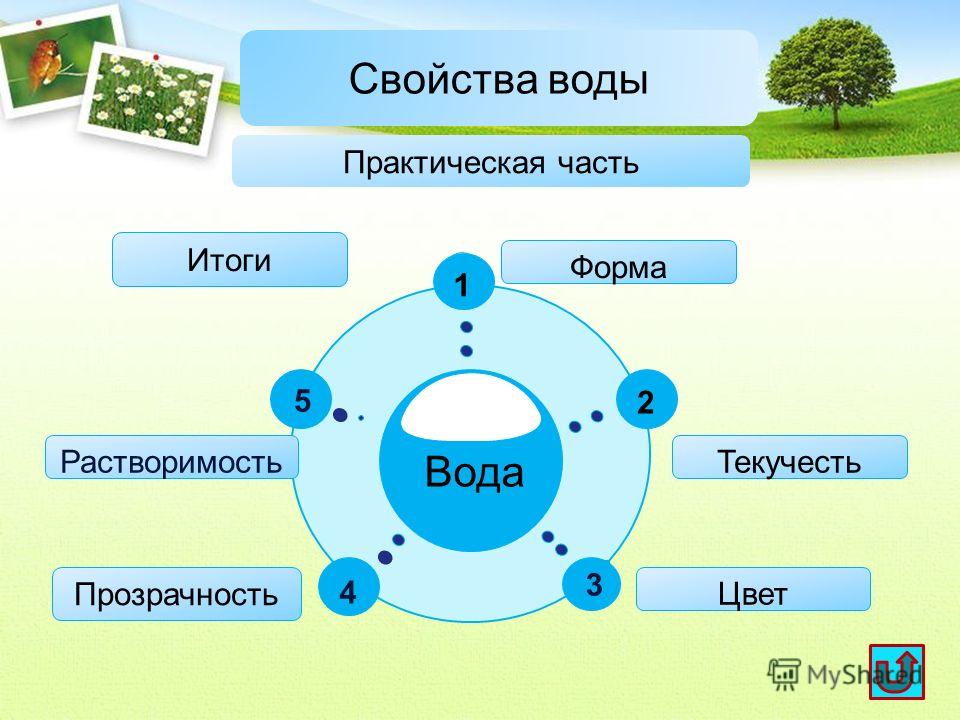
Золотая пропорция . Это понятие возникает при решении геометрической задачи о нахождении на отрезке АВ такой точки С, чтобы выполнялось соотношение СВ:АС = АС:АВ.
Решение этой задачи приводит к отношению СВ:АС = (-1+√5)/2, которое называют золотой пропорцией, а соответствующее геометрическое деление отрезка АВ точкой С называют золотым сечением. Если принять весь отрезок за единицу, то АС = 0,618033… и СВ = 0,381966….
Время показало, что золотая пропорция воплощает совершенные и гармоничные отношения двух величин. В геометрической интерпретации она приводит к соразмерному и привлекательному соотношению между двумя неравными отрезками.
Исследователи золотой пропорции с античных времен до наших дней всегда восхищались и продолжают восхищаться ее свойствами, которые проявляются в строении различных элементов физического и биологического мира. Золотая пропорция обнаруживается везде, где соблюдены принципы гармонии.
Что же объединяет золотую пропорцию с молекулой воды? Чтобы ответить на этот вопрос, рассмотрим двумерный образ золотой пропорции в виде треугольника.
В золотом треугольнике отношение ОА:АВ = ОВ:АВ приблизительно равно 0,618, угол α = 108,0о. Для льда отношение длин связей О-Н к Н-Н равно 0,100:0,163 = 0,613 и угол α = 109,5о, для пара — соответственно 0,631 и 104,5о. Не распознать в золотом треугольнике прообраз структуры молекулы воды просто невозможно! Удивительно, что до сих пор так мало внимания обращали на возможность подобной интерпретации ее строения.
И действительно, поместив в треугольнике АОВ в точки А и В атомы водорода, а в точку О — атом кислорода, получим в первом приближении молекулу жидкой воды, сконструированную на основе золотой пропорции. Подобная элегантность молекулы очаровывает и восхищает. Так что роль молекулы воды в природе и жизни не может быть правильно оценена без учета красоты ее формы.
Подобная элегантность молекулы очаровывает и восхищает. Так что роль молекулы воды в природе и жизни не может быть правильно оценена без учета красоты ее формы.
Исключительная гармония. Убедимся, что молекула жидкой воды — единственное трехатомное вещество, имеющее соразмерности, свойственные золотой пропорции.
В трехатомных молекулах-гомологах, близких по химическому составу к молекуле воды (Н2S, H2Se и Н2Те), валентный угол приблизительно равен 90о. Например, молекула Н2S имеет следующие геометрические параметры:
длина связи S-Н, нм ……………………. 0,1345
длина связи Н-Н, нм ……………………… 0,1938
валентный угол Н-S-Н, град ………….. 92,2
Отношение длин связей S-Н к Н-Н равно 0,694, что далеко от золотой пропорции. Квантово-химические расчеты показывают, что если бы вода была подобна родственным ей веществам, то валентный угол у ее молекулы должен был быть приблизительно таким же, как у Н2S, или больше максимум на 5о.
Но вода, как выясняется, не любит подобия, она всегда герой другого романа. Если бы валентный угол у воды был порядка 90-95о, о золотой пропорции пришлось бы забыть и вода оказалась бы в одном содружестве с другими водородными соединениями.
Но вода уникальна, ее молекула обладает практически выверенными эстетическими качествами, и поэтому ее свойства необходимо иногда интерпретировать, выходя за рамки традиционной научной парадигмы. И тогда некоторые загадки воды смогут быть объяснены таким «ненаучным» понятием, как гармония.
На приведенные рассуждения можно возразить: экспериментальные измерения геометрических параметров молекулы воды имеют определенную погрешность, и поэтому соотношение золотой пропорции может строго не выполняться. Но даже если в экспериментальные измерения внести еще большую погрешность, молекула воды все равно останется единственным из трехатомных веществ, имеющим практически «золотые» гармоничные пропорции.
В связи с этим обратим внимание на загадку талой воды, которая, по широко распространенному мнению, обладает отличным от обычной воды физиологическим воздействием.
Удивительная талая вода. Она рождается при таянии льда и сохраняет температуру 0оС, пока весь лед не растает. Специфика межмолекулярных взаимодействий, характерная для структуры льда, сохраняется и в талой воде, так как при плавлении кристалла разрушается только 15% всех водородных связей. Поэтому присущая льду связь каждой молекулы воды с четырьмя соседними («ближний порядок») в значительной степени не нарушается, хотя и наблюдается бoльшая размытость кислородной каркасной решетки.
Таким образом, талая вода отличается от обычной изобилием многомолекулярных кластеров, в которых в течение некоторого времени сохраняются рыхлые льдоподобные структуры. После таяния всего льда температура воды повышается и водородные связи внутри кластеров перестают противостоять возрастающим тепловым колебаниям атомов. Размеры кластеров изменяются, и поэтому начинают меняться свойства талой воды: диэлектрическая проницаемость приходит к своему равновесному состоянию через 15-20 минут, вязкость — через 3-6 суток. Биологическая активность талой воды спадает, по одним данным, приблизительно за 12-16 часов, по другим — за сутки.
Итак, физико-химические свойства талой воды самопроизвольно меняются во времени, приближаясь к свойствам обычной воды: она постепенно как бы «забывает» о том, что еще недавно была льдом.
Лед и пар — различные агрегатные состояния воды, и поэтому логично предположить, что в жидкой промежуточной фазе валентный угол отдельной молекулы воды лежит в диапазоне между значениями в твердой фазе и в паре. В кристалле льда валентный угол молекулы воды близок к 109,5о. При таянии льда межмолекулярные водородные связи ослабевают, расстояние Н-Н несколько сокращается, валентный угол уменьшается. При нагревании жидкой воды происходит разупорядочение кластерной структуры, и этот угол продолжает уменьшаться. В парообразном состоянии валентный угол молекулы воды составляет уже 104,5о.
В парообразном состоянии валентный угол молекулы воды составляет уже 104,5о.
Значит, для обычной жидкой воды валентный угол вполне может иметь некоторое среднее значение между 109,5и 104,5о, то есть примерно 107,0о. Но так как талая вода по своей внутренней структуре близка ко льду, то и валентный угол ее молекулы должен быть ближе к 109,5о, скорее всего, около 108,0о.
Сказанное выше можно сформулировать в виде гипотезы: в силу того, что талая вода значительно более структурирована, чем обычная вода, ее молекула с большой долей вероятности имеет структуру, максимально приближенную к гармоничному треугольнику золотой пропорции с валентным углом, близким к 108о, и с отношением длин связей примерно 0,618-0,619.
Экспериментального подтверждения этой гипотезы у авторов нет, как нет и какой-либо теории ее обоснования. Есть только догадка, высказанная на этих страницах, которая может, естественно, оспариваться.
Таинственная сила талой воды. Человеку с незапамятных времен известны удивительные свойства талой воды. Давно замечено, что вблизи тающих родников растительность альпийских лугов всегда пышнее, а у кромки тающего льда в арктических морях бурно цветет жизнь. Полив талой водой повышает урожайность сельскохозяйственных культур, ускоряет прорастание семян. При употреблении талой воды устойчиво повышаются привесы в животноводстве, ускоряется развитие цыплят. Известно, с какой жадностью животные пьют весной талую воду, а птицы буквально купаются в первых лужицах подтаявшего снега.
Талая вода, в отличие от обычной, по своей структуре очень похожа на жидкость, содержащуюся в клетках растительных и живых организмов. Именно поэтому для человека более подходит «ледяная» структура талой воды, в которой молекулы объединены в ажурные кластеры. Это уникальное свойство талой воды способствует ее легкому усвоению организмом, она биологически активна. Вот почему так полезны овощи и фрукты — они доставляют в организм воду, имеющую аналогичную структуру.
Вот почему так полезны овощи и фрукты — они доставляют в организм воду, имеющую аналогичную структуру.
При питье талой воды происходит подпитка организма самым гармоничным из всех веществ на Земле. Она улучшает обмен веществ и усиливает кровообращение, снижает количество холестерина в крови и успокаивает боли в сердце, повышает адаптационные возможности организма и способствует продлению жизни. Глоток чистейшей талой воды тонизирует лучше пастеризованного сока, в ней есть заряд энергии, бодрости и легкости.
Один из авторов этой работы постоянно пьет талую с плавающими льдинками воду и считает, что именно поэтому за три года ни разу не простудился. Талая вода освежает и молодит кожу, которая перестает нуждаться в кремах и лосьонах.
Теоретическое изучение свойств талой воды находится пока на уровне гипотез. Нет общепринятого мнения о причинах, вызывающих необычные эффекты при ее применении. Есть определенные проблемы и с доказательной стороной биологической активности талой воды. Исследования в этом направлении вызывают порой жаркие дискуссии. Сложность проблемы, отсутствие ясности — все это должно не отпугивать, а притягивать и способствовать появлению новых идей, гипотез, теорий. Таков зачастую тернистый путь развития науки.
Подчеркнем: приведенная гипотеза не претендует на расшифровку загадки талой воды. Она лишь позволяет выйти за рамки традиционного мышления и посмотреть на взаимную любовь жизни и воды с необычной стороны — со стороны гармонии и красоты, со стороны особых свойств талой воды, добавляющих ее изящной молекуле черты, которыми не обладают другие молекулы.
ЛИТЕРАТУРА
Ауэрбах Ф. Семь аномалий воды. — СПб., 1919.
Габуда С. П. Связанная вода. Факты и гипотезы. — Новосибирск: Наука, 1982.
Зацепина Г. Н. Физические свойства и структура воды. — М.: МГУ, 1998.
Синюков В. В. Вода известная и неизвестная. — М.: Знание, 1987.
Белянин В. С., Романова Е. Золотая пропорция. Новый взгляд // Наука и жизнь, 2003, № 6.
С., Романова Е. Золотая пропорция. Новый взгляд // Наука и жизнь, 2003, № 6.
Вода: структура, состояние, сольватизация. Достижения последних лет. — М.: Наука, 2003.
Подписи к иллюстрациям
Илл. 1. Плотность льда почти на 10% меньше, чем у воды, а удельный объем на столько же больше. Поэтому лед плавает, а вода, замерзая в трещинах горных пород, раскалывает их.
вещество привычное и необычное – конспект урока – Корпорация Российский учебник (издательство Дрофа – Вентана)
Цель урока: показать проявление общих закономерностей природы с точки зрения физики на примере воды.
Задачи: систематизировать знания о свойствах воды.
Оборудование: компьютер, презентация по теме урока, лабораторное оборудование.
Форма организации и взаимодействия на занятии: фронтальная, групповая.
|
Деятельность учителя |
Деятельность обучающегося |
Универсальные учебные действия (УУД) |
||
|
познавательные |
регулятивные |
коммуникативные |
||
|
Организует фронтальную беседу с обучающимися с использованием презентации; формирует у обучающихся реализовывать новые знания; организует работу в группах. |
Участвуют во фронтальной беседе, работают в группах, демонстрируют уровень знаний о веществах, работают с раздаточным материалом. |
Строят осознанные речевые высказывания в устной форме, логическую цепь рассуждений; выделяют количественные характеристики объектов; дополняют и расширяют имеющиеся знания. |
Предлагают разные способы решения практических задач; адекватно оценивают уровень своих знаний и умений. |
С достаточной полнотой и точностью выражают свои мысли в соответствии с задачами и условиями коммуникации. Добывают знания и приобретают умения при взаимодействии со сверстниками. |
Ход занятия
1) Организационный момент.
Вступительное слово учителя о роли воды, её физических свойствах.
2) Основные понятия, рассматриваемые на внеурочном занятии.
- Три агрегатных состояния воды. Переход из одного агрегатного состояния в другое
- Удельная теплоемкость. Сравнение по таблице теплоемкости разных веществ.
- Большая удельная теплоемкость определяет климат планеты. Вода нагревается значительно медленнее суши, забирая значительно больше количество солнечного тепла. Полученное тепло она сохраняет дольше, чем воздух и земля, выполняя терморегулирующую функцию.
- Плотность твердой и жидкой воды. Вода способна расширяться при замерзании. Поэтому лед занимает верхнюю часть водоема, укрывая его нижние слои и защищая водоем от промерзания. Не обладай вода таким свойством, все водоемы и даже Мировой океан за определенный геологический период промерзли бы до дна и жизнь на Земле не только бы не получила бы своего эволюционного развития она просто бы не возникла на ней.

- Петр I. Первый закон об охране вод был написан Петром I.
Элементы внеурочного занятия.
Агрегатные состояния воды
1) Ребята, назовите три агрегатных состояния вещество (воды). В чем их отличие?
Возможный ответ ученика.Существуют три различных агрегатных состояний воды: твердое (лед), жидкое (вода) и газообразное (например, невидимый водяной пар находится в окружающем нас воздухе).
Различные агрегатные состояния существуют у каждого вещества. Отличаются эти состояния друг от друга не молекулами, а тем как эти молекулы расположены и как движутся.
Вода испарилась и превратилась в пар. Изменились ли состав молекул, расстояние между молекулами, скорость молекул?
2) Перечислите все возможные процессы, при которых вещество переходит из одного агрегатного состояния в другое, дайте определения.
Ученик. Всего различают шесть процессов, при которых происходят агрегатные превращения вещества. Переход вещества из твердого (кристаллического) состояния в жидкое называется плавлением, обратный процесс называется кристаллизацией или отвердеванием. Пример плавления – таяние льда, обратный процесс происходит при замерзании воды.
Переход вещества из жидкого состояния в газообразное называется парообразованием, обратный процесс называется конденсацией. Пример парообразования – испарение воды, конденсацию можно наблюдать при образовании росы.
|
Пример |
Процесс |
|
Замерзание воды |
Кристаллизация (отвердевание) |
|
Образование росы |
Конденсация |
|
Таяние льда |
Плавление |
|
Образование на окнах зимних узоров |
Десублимация |
Учитель. Приведите примеры возгонки и десублимации.
Приведите примеры возгонки и десублимации.
Предполагаемый ответ ученика.Переход вещества из твердого состояния в газообразное (минуя жидкое) называется сублимацией или возгонкой, обратный процесс называется десублимацией. Примером десублимации может служить образование на окнах зимой узоров из кристалликов льда. Эти красивые узоры являются результатом десублимации водяного пара, находящегося в воздухе.
3) Как известно, при плавлении вещество получает энергию. При кристаллизации оно, наоборот, отдает её в окружающую среду. Получая количество теплоты, выделяющееся при кристаллизации, среда нагревается.
Ребята, как вы думаете, почему зимой птицы садятся на лёд, покрывающий реки и озера?
Кипение
1) Ребята, давайте вспомним один из видов парообразования – кипение.
Кипение возможно лишь при совершенно определенной (при данном давлении) температуре – температуре кипения.
Кто может рассказать про температуру кипения воды?
Предполагаемый ответ ученика. Известно, что вода кипит при 100°С. Но не следует забывать, что это справедливо лишь при нормальном атмосферном давлении (примерно 101 кПа). При увеличении давления температура кипения воды возрастает. Так, например, в кастрюлях-скороварках пищу варят под давлением около 200 кПа. Температура кипения воды при этом достигает 120°С. В воде такой температуры процесс «варения» происходит значительно быстрее, чем в обычном кипятке. Эти и объясняется название «скороварка».
И наоборот, при понижении давления температура кипения воды становится меньше 100°С. Например, в горных районах (на высоте 3 км, где давление атмосферы составляет 70 кПа) вода кипит при 90°С. Поэтому жителям этих районов, использующим такой кипяток, требуется значительно больше времени для приготовления пищи, чем жителям равнин.
2) Ребята, давайте проделаем опыт (учитель показывает опыт).
Нальём в пробирку немного воды, затем плотно закроем её пробкой и нагреем воду до кипения. Под давлением образовавшегося пара пробка выскочит и поднимется вверх. Сначала в этом опыте энергия топлива перешла во внутреннюю энергию пара. Затем пар, расширяясь, совершил работу – поднял пробку.
Что получиться, если мы заменим пробирку прочным металлическим цилиндром, а пробку – плотно пригнанным поршнем, способным двигаться внутри цилиндра?
Докладчик (ученик).Если мы заменим пробирку прочным металлическим цилиндром, а пробку – плотно пригнанным поршнем, способным двигаться внутри цилиндра, то получим простейший тепловой двигатель.
В России первый паровоз был построен в 1834 году крепостными мастерами-самоучками отцом и сыном Е.А. и М.А. Черепановыми.
На протяжении более ста лет паровозы были главными транспортным средством как у нас в стране, так и за рубежом. Выпуск паровозов в нашей стране был прекращен лишь в 1956 году, когда они стали заменяться электровозами и тепловозами.
Работа с таблицей «Удельная теплоемкость некоторых веществ»
Учебник «Физика. 8 класс» А.В.Перышкин – стр. 25.
|
Вещество |
Удельная теплоёмкость, Дж/кг·°С |
|
Подсолнечное масло |
2094 |
|
Лёд |
2100 |
|
Ацетон |
2187 |
|
Этиловый спирт |
2850 |
|
Вода |
4200 |
Учитель. Ребята, рассмотрите таблицу. Удельная теплоёмкость воды равна 4200Дж/кг·°С. Что это означает?
Ребята, рассмотрите таблицу. Удельная теплоёмкость воды равна 4200Дж/кг·°С. Что это означает?
Ответ ученика. Чтобы увеличить на 1°С температуру воды массой 1 кг, требуется количество теплоты, равное 4200 Дж.
Учитель. Меняется ли в различных агрегатных состояниях удельная теплоемкость вещества?
Ответ ученика. Удельная теплоемкость одного и того же вещества в разных агрегатных состояниях (твердом, жидком и газообразном) различна. Например, удельная теплоемкость воды 4200 Дж/кг·°С, а удельная теплоемкость льда 2100 Дж/кг·°С.
Учитель. Какое вещество имеет наибольшую теплоемкость?
Предполагаемый ответ ученика. Вода имеет очень большую удельную теплоемкость. Поэтому вода в морях и океанах, нагреваясь летом, поглощает из воздуха большое количество теплоты. Благодаря этому в тех местах, которые расположены близко от больших водоемов, лето не бывает таким жарким, как в местах, удаленных от воды.
Опыт 1 «Несгораемый платок»
Оборудование: штатив с муфтой и лапкой, спирт, носовой платок, спички
Проведение: Зажать в лапке штатива носовой платок (предварительно смоченный водой и отжатый), облить его спиртом и поджечь. Несмотря на пламя, охватывающее платок, он не сгорит. Почему?
Объяснение: Выделившаяся при горении спирта теплота полностью пошла на испарение воды, поэтому она не может зажечь ткань.
Опыт 2 «Вода кипит в бумажной кастрюле»
Оборудование: штатив с муфтой и лапкой, бумажная кастрюля на нитках, спиртовка, спички.
Проведение: Подвесим бумажную кастрюлю на штативе.
Можно ли вскипятить воду в этой кастрюле?
Объяснение:Вся теплота, выделяющаяся при горении, идет на нагревание воды. Кроме того, температура бумажной кастрюли не достигает температуры воспламенения.
Кроме того, температура бумажной кастрюли не достигает температуры воспламенения.
Задача
Оцените, на какой этаж можно было бы подняться легковой автомобиль массой 933 кг, совершив работу, численно равную количеству теплоты, которое отдает 1 литр воды, остывая от 100°С до комнатной температуры (20°С)? Высоту одного этажа примите равной 3 м.
Удельная теплоемкость воды 4200 Дж/кг·°С.
Работа с таблицей «Плотность»
1) Ребята, используя таблицу плотностей, сравните плотности веществ в различных агрегатных состояниях. Сделайте вывод.
Учебник «Физика. 7 класс» А.В.Перышкин – стр. 63-64.
|
Вещество |
Плотность жидкостей |
Плотность твердых тел |
|
Вода (лед) |
1000 кг/м3 |
917 кг/м3 |
|
Алюминий |
2380 кг/м3 |
2600 кг/м3 |
|
Золото |
17000 кг/м3 |
19500 кг/м3 |
|
Железо |
6900 кг/м3 |
7874 кг/м3 |
|
Парафин |
870 кг/м3 |
960 кг/м3 |
Предполагаемый ответ ученика. Лёд имеет гораздо меньшую плотность и плавает в воде. Это является аномалией. Большинство других веществ, например, металлы или парафин, имеют в твёрдом виде большую плотность, чем в расплавленном, и тонут в своём расплаве.
Лёд имеет гораздо меньшую плотность и плавает в воде. Это является аномалией. Большинство других веществ, например, металлы или парафин, имеют в твёрдом виде большую плотность, чем в расплавленном, и тонут в своём расплаве.
2) Когда вода имеет максимальную плотность? Какое это имеет значение в природе?
Докладчик № 4. Вода же имеет максимальную плотность при +4 °С. Это имеет огромное значение для существовании жизни на Земле. В водоёмах перед наступлением зимы постепенно охлаждающаяся вода, делаясь плотнее, опускается вниз до тех пор, пока температура всего водоёма не достигнет +4 °С. При дальнейшем охлаждении более холодная вода остаётся сверху, а теплопроводность воды, как мы знаем, очень низкая. В результате создаётся необычное положение: тонкий слой холодной воды становится «одеялом» для всех обитателей подводного мира, предохраняя их от сильного мороза. (Разумеется, низкая теплопроводность льда, и тем более снега, также защищает от низких температур воздуха). При +4 °С они чувствуют себя очень неплохо. Рыбы продолжают вести активный образ жизни – вспомним прелести зимней рыбалки. Попробуем вообразить, как выглядел бы мир, если бы вода обладала нормальными свойствами, а лёд был бы, как и полагается любому нормальному веществу, плотнее своей жидкой фазы (воды): зимой намерзающий сверху более плотный лёд тонул бы в воде, непрерывно опускаясь на дно. Летом лёд, закрытый толстым слоем холодной воды, не смог бы за лето растаять. Постепенно все озера, пруды, реки промёрзли бы целиком, превратившись в гигантские ледяные заторы. Потом промёрзли бы все моря и океаны. Весь мир превратился бы в ледяную пустыню, кое-где покрытую талой водой.
Итак, плотность воды достигает максимального значения при 4°С и больше плотности льда. Поэтому лёд плавает на поверхности воды.
Интересный опыт. Тело плавает в холодной воде и тонет в горячей. Почему?
Ответ: Плотность холодной воды больше, сила Архимеда больше.
Из истории
Докладчик (ученик). Петр I. Первый закон об охране вод был написан Петром I. 8 февраля 1724 года Указом правительствующего сената по распоряжению Петра I была основана Академия наук. 7 июня 1999 г. Указом президента РФ был установлен День Российской науки за выдающуюся роль отечественной науки в развитии государства и общества и в ознаменовании 275-летия со дня основания Академии наук с датой празднования 8 февраля.
Рефлексия
Ребята, вспомните и расскажите, что нового и интересного вы узнали сегодня на занятии?
Что было для Вас самым ценным?
Карточка-задание для ученика
«Исследование физических свойств воды»
Вода имеет следующие уникальные свойства:
- Лёд имеет ____________(большую, меньшую) плотность, чем вода и плавает в воде.
Однако, большинство веществ, в отличие от воды, металлы или парафин, имеют в твёрдом виде ______________плотность, чем в расплавленном, и тонут в своём расплаве.
Слова для работы: большую, меньшую.
- Составьте из слогов слова:
|
ция – стал – лиза –кри |
|
кон — ция – са – ден |
|
ли — суб — ция — ма |
|
ние – вле – пла |
|
обра- па — зова – ние — ро |
|
ма — де — ли – суб — ция |
Вода одновременно существует в ______агрегатных состояниях вещества: ____________, ________________ и ______________.
Всего различают ________(сколько?) процессов, при которых происходят агрегатные превращения вещества:
|
1._____________ |
|
3._____________ |
|
5.______________ |
|
2._____________ |
|
4._____________ |
|
6.______________ |
- Вода имеет __________ ( высокую, низкую) удельную теплоемкость, равную ________ Дж/кг·°С. Эта величина показывает, сколько теплоты надо затратить для нагревания ___ кг воды на ___ °С.
- Аномально высокие значения температуры плавления ___°С и температуры ___________ 100°С.
- Выберите правильный ответ на вопросы и получите имя человека, который издал в России первый «Закон об охране воды» (Ответ: Пётр I).
|
Агрегатные состояния вещества |
Твердое |
Жидкое |
Газ |
|
В каком агрегатном состоянии вещество занимает максимальное пространство? |
М |
Н |
П |
|
Тела не сохраняют форму, но сохраняют объем |
А |
Е |
Ю |
|
Тело не имеет форму |
К |
Д |
Т |
|
Иней-это одно из состояний воды. Какое? |
Р |
Л |
Д |
Задания.
1. Переход вещества из твердого состояния в газообразное (минуя жидкое)
2. Пример десублимации, наблюдаемый зимой на окнах
3. Переход вещества из газообразного состояния в жидкое
|
|
|
н |
|
|
|
|
|
|
|
|
4. Где кипящая вода горячее?
А. на уровне моря
Б. на вершине горы
В. в глубокой шахте
5. Что потребует большего количества теплоты для нагревания на 1°С: стакан воды или ведро воды?
А. стакан воды
Б. ведро воды
В. одинаковое количество
6. В каком агрегатном состоянии вещество занимает максимальное пространство?
А. твердом
Б.жидком
В. газообразном
7. Назовите физическую величину, показывающую, какое количество теплоты необходимо для нагревания вещества массой 1 кг на 1°С.
А. удельная теплоемкость
Б. удельная теплота плавления
В. плотность
Задача. Оцените, на какой этаж можно было бы подняться легковой автомобиль массой 933кг, совершив работу, численно равную количеству теплоты, которое отдает 1 литр воды, остывая от 100°С до комнатной температуры (20°С)?
Высоту одного этажа примите равной 3 м.
Анализ внеурочного занятия
Класс: 8.
Предмет: физика.
Тема: «Вода – вещество привычное и необычное».
Раздел: «Тепловые явления»
Данное занятие является уроком обобщения знаний по теме «Тепловые явления».
Цели данного урока спланированы как ожидаемые результаты, которые предполагается получить в процессе совместной деятельности с обучающимися при их обучении, воспитании и развитии. Они соответствуют стандартным требованиям программы и связаны с предыдущими учебными занятиями:
образовательная:
- познакомить обучающихся со свойствами такого вещества, как вода;
- применить и расширить умения и навыки решения практических задач;
- совершенствовать вычислительные навыки.
развивающая:
- способствовать выработке у школьников умения обобщать изучаемые факты, формулировать выводы;
- развивать исследовательские навыки; и самостоятельность путем составления умозаключений;
- развитие логического мышления для сознательного восприятия учебного материала.
воспитательная:
- формировать качества личности, как трудолюбие, внимательность, активность, самостоятельность, дисциплинированность;
- воспитывать познавательную активность;
- прививать интерес к предмету.
Оборудование: доска, цветные мелки, компьютер, проектор, лабораторное оборудование, карточки.
Дидактическое обеспечение: набор индивидуальных карточек, презентация Power Point.
На занятии я старалась создать условия для реализации поставленных целей. Этому способствовала форма проведённого урока, при изучения нового материала я использовала проблемно-исследовательский метод: организовала исследовательскую деятельность, результатом которой были «открыты» свойства и характеристики воды. Обобщая результаты проделанной работы и дома и в классе, восьмиклассники высказали предположение при сравнении удельной теплоёмкости различных веществ, гипотезу о зависимости плотности от агрегатного состояния вещества. Я немного помогала сформулировать грамотно, корректно, как с точки зрения физики, так и с точки зрения русского языка. Затем высказанное предположение доказали, организуя поисково-эвристическую деятельность учащихся. В завершение все применили знания при решении заданий, используя объяснительно-иллюстративный метод, различные виды деятельности, фронтальную и индивидуальную формы организации учебной деятельности.
Были использованы фронтальная, индивидуальная формы познавательной деятельности.
Время, отведенное на все этапы урока, было рационально распределено. Поддерживался высокий темп работы учащихся.
Завершающим этапом была рефлексия: оценка учащимися и учителем результатов урока, подведение итогов, комментирование деятельности учащихся. Между всеми этапами четко прослеживается логическая связь и завершенность каждого этапа. Учащиеся учились анализировать, делать выводы, рассуждать, правильно излагать свои мысли.
На каждом этапе урока учитывала индивидуальные особенности и интересы учащихся, уровень их подготовленности, осуществлялась индивидуализация обучения и дифференцированный подход.
Использовала различные виды контроля на уроке: ученик- ученик, ученик – учитель (вопросы-ответы).
Приветствовалась активность детей, поощрялась самостоятельность, гибкость ума. Перегрузки учащихся на уроке не было, так как чередовались письменные и устные задания. Постепенно увеличивалась степень сложности заданий и самостоятельности учащихся при их выполнении. Дифференцируемая самостоятельная работа проведена с целью закрепления и углубления знаний учащихся по теме внеурочного занятия, способствовала развитию логического мышления.
План внеурочного занятия выполнен полностью.
Выбранные мною формы и методы обучения способствовали созданию на уроке положительной психологической атмосферы. Применение проблемно-диалогического обучения на уроке позволило сделать его интересным, насыщенным, плотным по структуре.
7.6. Структура и уникальные свойства воды
Одно из самых распространенных веществ на Земле — вода. Вода покрывает большую часть поверхности нашей планеты, из нее в основном состоят почти все живые существа. Свойства воды настолько важны для живых организмов, что известная нам форма жизни без нее вообще невозможна (рис. 7.9). Уникальные свойства воды объясняются структурой ее молекул: атом кислорода связан ковалентно с двумя атомами водорода, молекула изогнута под углом, в вершине которого и находится кислород. Из-за того, что кислород притягивает электроны сильнее, чем водород, молекула воды всегда полярна: кислород частично заряжен отрицательно, водород — положительно, поэтому молекула воды удерживается водородными связями. Когда вода находится в жидкой фазе, эти слабые связи легко рвутся и разрушаются при столкно-
275
вениях молекул, тем не менее водородные связи играют большую роль, обеспечивая особое значение воды для жизни (рис. 7.10).
Тепловые свойства воды уникальны для обеспечения жизни. Испарение требует значительной траты энергии, так как температура кипения воды достаточно высока. Скрытая теплота испарения (количество теплоты, необходимой для превращения воды в пар или преодоления сил молекулярного сцепления в воде, обусловленных водородными связями) необычайно велика относительно других веществ. Ее приходится брать из среды, и испарение воды сопровождается охлаждением.
Пример — потоотделение у животных или тепловая одышка у млекопитающих или рептилий (сидят на солнцепеке с разинутым ртом). Относительно большая энергия требуется воде и при плавлении (таянии льда). И наоборот, при замерзании вода должна отдать большое количество тепловой энергии. Это уменьшает вероятность замерзания и клеток, и их окружения. Кристаллизация воды в клетках губительна для жизни, и большая теплота плавления обеспечивает стабильность внешних условий, т.е. жизнедеятельности.
Плотность воды в жидком состоянии больше, чем в твердом, и лед не тонет в ней. Кроме воды таким свойством обладают лишь висмут и чугун. Так как плотность воды при температуре от 4 до 0 °С понижается, лед образуется сначала у поверхности воды и
только под конец — около дна. Это обеспечивает сохранение жизни в водоемах: лед покрывает толщу воды, как одеяло, и тает быстрее, находясь на поверхности. Слои воды при температуре, меньшей 4°С, поднимаются вверх, перемешиваются и переносят питательные вещества по всей толще, что позволяет распространяться живому на больших диапазонах глубин. Высокая теплопроводность воды, достаточно высокие температуры кипения и замерзания, понижение температуры тел при испа-
276
рении воды с их поверхности — все это важно для стабильности условий жизни. Даже тот факт, что плотность воды максимальна при температуре 4 °С, что несколько выше точки ее замерзания (т.е. при охлаждении от 4 до О °С вода расширяется), и лед легче жидкой воды, играет важную роль — предотвращает образование кристаллов в клетках и не повреждает ткани. Низкая плотность льда спасает водных животных — лед плавает на поверхности и не допускает холодный воздух вглубь, где находятся живые организмы. Поэтому вода является вместе с растворенными в ней солями необходимой средой для химических процессов, составляющих жизнь.
Из-за большой теплоемкости воды требуется большое количество энергии даже для небольшого повышения ее температуры. Объясняется это тем, что энергия расходуется на разрыв водородных связей, обеспечивающих ее «клейкость». Поэтому биохимические процессы протекают в меньшем интервале температур, с более постоянной скоростью. Вода служит стабильной средой обитания для многих клеток и организмов, обеспечивая значительное постоянство внешних условий.
Она обладает большим поверхностным натяжением, поскольку ее молекулы слипаются друг с другом (когезия) посредством водородных связей. Полярные молекулы притягиваются любой поверхностью, несущей электрический заряд, отсюда ее способность подниматься по тонкой трубке или порам, называемая капиллярностью (адгезия). Кроме того, у воды самое большое поверхностное натяжение по сравнению с другими жидкостями — сильное сцепление между молекулами. Многие мелкие организмы поэтому могут скользить по водяной поверхности. Это уникальное свойство играет важную роль в живых клетках и при движении воды по сосудам ксилемы у растений.
Вода — активный участник процессов метаболизма. При фотосинтезе она — источник водорода, участвует в реакциях гидролиза. Вода — наиболее важный по объему компонент тканей животных и растений: она является средой, в которой происходят все биохимические реакции, и одновременно их участником. Было установлено, что фазовые переходы в воде могут управлять скоростью протекания биохимических реакций. После открытия По-лингом (1961) взаимосвязи между явлением наркоза и кристаллизацией гидратов наркотических веществ прояснилась роль перестроек связанной воды в явлениях наркоза, а в последнее время — и в возникновении важнейших свойств гидратированных веществ: глины, гипса, цемента, некоторых типов сегнетоэлектриков.
Вода имеет огромное значение при естественном отборе и видообразовании в живой природе. Все наземные организмы приспособились к добыванию и сбереганию воды, даже в пустынях. Не вызывает сомнения тот факт, что жизнь зародилась на Земле в водной среде.
277
Свойства воды: Обзор ускоренного курса AP® по биологии
Внимание: Этот пост был написан несколько лет назад и может не отражать последние изменения в программе AP®. Мы постепенно обновляем эти сообщения и удалим этот отказ от ответственности после обновления этого сообщения. Спасибо за ваше терпение!
Свойства воды ВведениеНа экзамене AP® по биологии многие студенты борются с вопросами, касающимися свойств воды.Эта тема обычно обсуждается в начале года, и когда дело доходит до всей информации, которую студенты несут в AP® Bio, о ней забывают. Свойства воды необходимы для поддержания гомеостаза, стабильного равновесия в организмах и в мире.
В этом обзоре ускоренного курса биологии AP® мы рассмотрим информацию, которая необходима вам для понимания свойств воды. Мы начнем с разговора о полярности воды и о том, как ее полярность делает воду одним из самых важных химических веществ на Земле.Затем мы поговорим о нескольких важных свойствах воды, которые позволяют организмам выживать. Наконец, мы рассмотрим бесплатный вопрос о свойствах воды, который студенты получили на экзамене AP® по биологии в 2009 году.
Важность полярности и водородных связейНа этом этапе вашей научной карьеры вы, вероятно, узнали о полярности. Полярная молекула — это молекула, которая не делит свои электроны поровну между своими атомами.Этот электронный дисбаланс заставляет молекулу иметь положительные и отрицательные диполи; поскольку электроны проводят больше времени на одном конце (из-за неравного распределения), эта часть молекулы будет иметь частичный отрицательный заряд. Конец, который притягивает электрон к себе, будет отрицательным диполем, а конец, отталкивающий электрон от него, будет положительным диполем.
Величина силы, которую оказывает отрицательный атом, называется электроотрицательностью. Важно понимать, что кислород имеет одно из самых высоких значений электроотрицательности, что означает, что он отталкивает электроны от атома, к которому он подключен, что делает его отрицательным диполем.В случае воды кислород оттянет электрон от водорода. Имейте в виду, что молекулы воды по-прежнему делятся своими электронами, но электроны проводят с кислородом больше времени, чем с водородом.
Почему все это так важно? Диполи в конечном итоге делают атом кислорода отрицательно заряженным, а атомы водорода — положительно заряженным. Вода состоит из миллионов этих молекул, которые заставляют их определенным образом ориентироваться. Отрицательная часть одной молекулы воды должна быть рядом с положительной частью другой.Эта сетчатая связь называется водородной связью.
Водородная связь — одна из самых важных вещей, которые вы должны знать о воде. Водородные связи — это причина свойств воды, которые вы должны знать для экзамена AP® Bio. Для каждого свойства, которое мы обсуждаем, мы рассмотрим, как оно возникает из-за водородных связей и как это влияет на жизнь на Земле.
Источник изображения: Wikimedia Commons. АдгезияПервые два свойства, которые мы обсудим в нашем обзоре ускоренного курса биологии AP®, связаны друг с другом: адгезия и сплоченность. Адгезия — это свойство воды, которое относится к молекулам воды, прилипающим к другой поверхности. Сплоченность — это свойство воды, при котором молекулы воды прилипают друг к другу. Оба эти свойства обусловлены водородными связями и тем, как водородные связи ориентируют молекулы воды.
Адгезия — важное свойство. Чтобы продемонстрировать адгезию, наполните пробирку водой. Вы увидите, как вода создает U. Эта U называется мениском .Мениск образуется из-за прилипания воды к стеклу пробирки. Если у вас есть еще более тонкая пробирка, вы увидите, что мениск станет глубже (вода будет подниматься выше). Если у вас нет пробирки, обратите внимание на иллюстрацию.
Адгезия также происходит естественным путем и является причиной того, что деревья могут быть высокими. Деревья получают воду из корней. Корни находятся далеко от листьев, которым нужна вода. Ксилема — это часть дерева, по которой вода движется вверх против силы тяжести, чтобы добраться до листьев.Ксилема состоит из маленьких капилляров. Когда вода попадает в ксилему, она прилипает к стенкам капилляра и позволяет ей перемещаться к листьям. Этот процесс называется капиллярным действием и жизненно важен для выживания растений.
СплоченностьСплоченность, как мы уже представляли, — это способность воды связываться с собой. Сплоченность отвечает за поверхностное натяжение, а это означает, что капли воды будут сопротивляться разрыву при добавлении в систему напряжения и давления.
Сплоченность возникает, когда вода окружена воздухом. Молекулы, которые существуют на концах капель, имеют меньше возможностей для водородной связи. Это заставляет их водородные связи укрепляться; поверхность способна выдерживать натяжение.
Сплоченность — важное свойство воды для многих видов насекомых. Пример можно найти в семействе насекомых Gerridae. Этих насекомых обычно называют водомерками. Они могут использовать поверхностное натяжение воды, чтобы стоять на воде.Среда обитания водомеров — гладь спокойных вод. Именно здесь они охотятся и размножаются. Без связующих свойств воды эти насекомые не выжили бы так, как сейчас.
Источник изображения: Wikimedia Commons. Удельная теплоемкостьБлагодаря прочности водородных связей вода имеет чрезвычайно высокую удельную теплоемкость. Удельная теплоемкость означает количество тепла, необходимое для перемещения вещества на один градус Цельсия. Высокая удельная теплоемкость означает, что вода способна выдерживать большое количество энергии до того, как ее температура изменится; это связано с водородными связями воды.Чтобы вода нагрелась, необходимо разорвать водородные связи. Эта дополнительная энергия, необходимая для разрыва связей, дает воде способность противостоять перепадам температуры.
Есть две важные температуры, которые часто изучаются в соединениях: теплота испарения и теплота плавления. Теплота испарения относится к теплу, необходимому для перехода соединения из жидкого состояния в газообразное. Теплота плавления относится к теплу, необходимому для перехода соединения из твердого состояния в жидкое.Благодаря водородным связям вода имеет высокую теплоту испарения и высокую теплоту плавления.
Высокая удельная теплоемкость чрезвычайно важна для выживания организмов на Земле. Земля на 70% состоит из воды. Вода на планете препятствует радикальному изменению температуры. Когда температура изменяется в атмосфере, вода поглощает изменение температуры, предотвращая выживание организмов в динамических средах. Кроме того, у людей (как и у большинства организмов) есть тела с очень высоким содержанием воды.По той же причине такое содержание воды предотвращает колебания температуры тела.
Плотность льдаЭто может показаться наиболее очевидным свойством воды; вода в твердой форме плавает в жидкой форме. Большинство веществ, обнаруженных на Земле, имеют гораздо более плотную твердую версию, чем жидкую, что должно иметь интуитивный смысл. Когда вещество становится твердым, оно конденсируется, делая связи более тесными и прочными. Почему же тогда вода не подчиняется этому правилу и плавает? Вы, наверное, догадались, водородные связи.
Водородные связи в воде заставляют твердую воду образовывать трехмерную матрицу. Водородные связи не позволяют воде конденсироваться, а заставляют ее распространяться. Когда вода находится в жидком состоянии, водородные связи намного более гибкие и могут перемещаться. Когда вода становится твердой, связи становятся менее гибкими, что приводит к расширению воды. Расширение связей вызывает уменьшение плотности льда; менее плотные соединения будут плавать в более плотных соединениях.
Помимо того, что это интересно, это чрезвычайно важно для нашего выживания на Земле. Если бы вода затонула, когда была в твердой форме, из-за меньшей плотности льда наша планета замерзла бы. Если вода опускается под воздействием низких температур, следующий слой воды также тонет, пока весь океан не замерзнет. Не только морские животные умрут, но и наземные организмы, скорее всего, тоже не выживут.
Универсальный растворительВы, наверное, слышали, что вода — универсальный растворитель.Вода считается универсальным растворителем, поскольку способна очень быстро растворять соединения. Это свойство уникально для воды из-за диполей, которыми обладают молекулы воды.
Когда соединение вводится в воду, молекулы воды окружают его, образуя клетку вокруг молекул соединения. Например, когда NaCl (поваренная соль) помещается в воду, Na отделяется от Cl. Молекулы воды разрывают соединение, потому что положительно заряженные молекулы водорода хотят связываться с отрицательно заряженным ионом хлора.Кроме того, отрицательно заряженный диполь кислорода хочет соединиться с положительно заряженным ионом натрия. Это притяжение разделяет молекулы и заставляет воду быстро растворять соль.
Есть класс соединений, которые не растворяются в воде. Эти соединения являются неполярными соединениями. Неполярные соединения делят свои электроны поровну и не имеют зарядов или диполей. Из-за этой характеристики вода не сможет разделить различные молекулы. По этой причине масло (неполярное) и вода (полярное) не смешиваются.
Растворители невероятно необходимы по многим причинам. Мы постоянно принимаем пищу, которую необходимо быстро и эффективно расщеплять. Присутствие воды в организме помогает пищеварению. Растворители важны почти во всех химических реакциях.
СводкаВ этом обзоре ускоренного курса биологии AP® мы говорили о многих различных свойствах воды, которые позволяют жизнь на Земле. Мы говорили о сплоченности, которая позволяет насекомым, таким как водомерки, стоять на воде.Мы также рассмотрели адгезию, которая позволяет воде подниматься до листьев дерева. Затем мы узнали о высокой удельной теплоемкости воды и о том, как это позволяет температуре на Земле и в организмах, таких как люди, оставаться на уровне гомеостаза. Затем мы поговорили о том, как вода в твердой форме, лед, плавает и как это позволяет нашим океанам оставаться таявшими. Наконец, мы узнали, что вода — универсальный растворитель, способный растворять любое полярное вещество.
В этой статье «Свойства воды: обзор ускоренного курса биологии AP®» содержится много информации.Чтобы вы чувствовали себя комфортно, мы рассмотрим вопрос AP® Bio о свойствах воды, который был замечен на экзамене AP® в 2009 году.
Вопрос к экзамену по биологии AP®Вода необходима всем живым существам.
(a) Обсудите ТРИ свойства воды.
(б) Объясните каждое из перечисленных ниже свойств воды. Вы не ограничены тремя свойствами, описанными в части (а):
- роль воды как среды для метаболических процессов клеток
- способность воды к умерению температуры внутри живых организмов и в окружающей среде организмов
- движение воды от корней к листьям заводы
Для части A у вас есть выбор.Вот несколько ответов, которые на экзамене AP® по биологии можно получить за полные баллы:
| Свойство | Описание |
| Сплоченность | Притяжение к другим молекулам воды, поверхностное натяжение |
| Адгезия | Притяжение к другим поверхностям |
| Состояния вещества | Лед менее плотен, чем вода, расширяется и становится менее плотным |
| Высокая теплота испарения | Молекулы воды поглощают энергию |
Для части B вы должны объяснить следующее: три важных части жизни на Земле и то, как вода необходима для их существования.Первый пример касается способности воды быть универсальным растворителем. Мы рассмотрели важность способности воды растворять вещества, а в клетке это особенно важно. Присутствие воды также способствует протеканию многих химических реакций.
Второй пример, который мы рассмотрели ранее в этой статье. Вода снижает температуру, поглощая тепло, но не меняя температуру. Это позволяет климату оставаться более стабильным. Высокая удельная теплоемкость воды также обеспечивает постоянную внутреннюю среду внутри организмов.
Наконец, в третьем примере мы можем использовать капиллярное действие воды. Вода движется вверх по ксилеме дерева, чтобы достичь листьев. Вода движется за счет адгезии и капиллярного действия.
Спасибо, что прочитали нашу статью! Дайте нам знать, если у вас есть какие-либо вопросы или вы хотите рассказать, как вы готовитесь к экзамену AP® Bio, ниже. Если вы хотите продолжить обучение, ознакомьтесь с нашей статьей Гомеостаз: Обзор ускоренного курса биологии AP® прямо сейчас!
Нужна помощь в подготовке к экзамену AP® по биологии?У Альберта есть сотни практических вопросов AP® по биологии, бесплатные ответы и полные практические тесты, которые можно опробовать.
Вы преподаватель или администратор, заинтересованный в улучшении успеваемости студентов AP® Biology?
Узнайте больше о наших школьных лицензиях здесь .
Каковы уникальные свойства воды?
Вода — одно из важнейших веществ на Земле, поэтому неудивительно, что дети начинают изучать воду и ее уникальные свойства на уроках естествознания в раннем возрасте. Если вам интересно: «Каковы свойства воды?», Начните с поиска простых объяснений основных химических и физических свойств воды.
Основные химические свойства воды
Изучение уникальных свойств воды начинается с понимания ее основных химических свойств.
Полярность
Вода состоит из полярных молекул, поэтому полярность является одним из ее уникальных свойств. Каждая молекула воды имеет два атома водорода и один атом кислорода (h3O). Эти молекулы образуют полярные ковалентные связи. Атомы водорода заряжены положительно, а молекулы кислорода — отрицательно.Это свойство заставляет молекулы воды притягиваться друг к другу.
Сплоченность
Полярность воды ведет к ее сплоченности. Сплоченность относится к силам, которые заставляют или позволяют схожим молекулам оставаться вместе. Тот факт, что молекулы воды естественным образом хотят сцепиться друг с другом, означает, что вода обладает связностью. Вот почему могут образовываться капли воды. Сплоченность также объясняет, почему емкость может быть наполнена водой до уровня чуть выше точки перелива, прежде чем она действительно разольется.
Поверхностное натяжение
Вода имеет второе место по величине поверхностного натяжения из всех жидких веществ (ртуть выше). Поскольку молекулы воды хотят держаться вместе, молекулы на поверхности образуют более сильные связи, чем молекулы под поверхностью. Это приводит к поверхностному натяжению, которое становится барьером между водой и воздухом над ней (атмосферой). Поверхностное натяжение объясняет, почему маленькие объекты будут плавать на поверхности воды, а не опускаться ниже ее поверхности.
Вязкость
Чем выше вязкость и жидкость, тем сильнее она сопротивляется течению.И наоборот, чем менее вязкая жидкость, тем более свободно она течет. Мед — пример очень вязкой жидкости. Вода, конечно, не такая вязкая, как мед, но вязкость у нее есть. Степень вязкости воды зависит от температуры. Существует обратная зависимость, означающая, что с повышением температуры воды ее вязкость уменьшается.
Точки кипения и замерзания
Вода имеет высокую температуру кипения и низкую точку замерзания , что означает, что она не закипает и не замерзает быстро.Тот факт, что вода не реагирует быстро на колебания температуры, является причиной того, что она может поддерживать водную жизнь. Температура кипения воды составляет 212 градусов по Фаренгейту, что преобразуется в 100 градусов по Цельсию. Температура замерзания воды составляет 32 градуса по Фаренгейту, что составляет ноль градусов по Цельсию.
Жидкое состояние
Вода находится в жидком состоянии всякий раз, когда она не заморожена до твердого состояния и не кипячена до газообразного. На самом деле это необычное свойство для веществ, не содержащих углерода (вода состоит из водорода и кислорода).Большинство веществ, не содержащих углерода, не являются жидкими при комнатной температуре. Вода наименее плотная, когда находится в жидком состоянии.
Твердотельный
Лед — вода в твердом состоянии. По мере охлаждения вода становится более плотной, пока не приблизится к точке замерзания. По мере того, как вода охлаждается и приближается к замерзанию, она начинает становиться слякотной. Когда вода достигает точки замерзания, она становится льдом. Непосредственно перед точкой образования льда плотность воды начинает уменьшаться, а не продолжает увеличиваться.Вот почему кубики льда плавают в стакане воды.
Газообразное состояние
Пар — газообразное состояние воды. Когда вода нагревается до точки кипения, она превращается в пар. Когда вода закипает, водородные связи в ней разрываются. Когда он достигает точки водяного пара, водородные связи не могут образовываться. Это объясняет, почему ожоги паром на самом деле даже хуже ожогов кипячением. Когда пар соприкасается с кожей человека, этот человек ощущает энергию, которую пар поглотил в результате разрыва водородных связей, а также тепло кипящей воды.
Основные физические свойства воды
Физические свойства воды — это ее характеристики, которые могут быть восприняты органами чувств. То, что вы можете увидеть, потрогать, попробовать или почувствовать в воде, отражает ее физические свойства. Основные физические свойства воды включают температуру, вкус, запах и цвет.
Температура
Температура воды — это физическое свойство. Температура воды влияет на многие характеристики, такие как уровень поверхностного натяжения, насколько она растворима и сколько весит.По мере повышения температуры скорость, с которой происходят биологические или химические реакции, также увеличивается.
Вкус
Вкус воды зависит от того, какие соединения в ней присутствуют. Например, соленая вода имеет соленый вкус из-за наличия хлорида натрия. Это верно для соленой воды природного происхождения, такой как вода в океанах, заливах и других водоемах, а также для искусственной соленой воды. Если добавить в воду сахар (сахарозу), она будет сладкой на вкус.
Запах
Чувства вкуса и запаха тесно связаны.Те же типы соединений, которые могут изменить вкус воды, также могут влиять на ее запах. Например, вода с высоким содержанием серы (газообразный сероводород) также описывается как пахнущая тухлыми яйцами и имеющая кислый привкус.
Цвет
Цвет воды может меняться в зависимости от множества факторов. Например, вода в океане кажется голубой, но чистая вода из крана прозрачна. Вода в океане поглощает красный цвет из светового спектра, оставляя синий цвет, который обычно ассоциируется с океанской водой.Когда вода в океане имеет другой цвет, это может быть связано с другими веществами в изделии, такими как водоросли или различные частицы.
Расширьте свои знания о воде
Теперь, когда вы знаете о некоторых уникальных свойствах воды, попробуйте практическое обучение, чтобы развить более глубокое понимание. Эти эксперименты в области науки о воде — отличное место для начала. Оттуда вы можете начать изучать примеры океанов и морей. О воде можно многое узнать.
Учебник по химииХимия водыПолярность воды
Многие другие уникальные свойства воды связаны с водородными связями. Например, ледяные поплавки потому что водородные связи удерживают молекулы воды в твердом теле больше, чем в жидкости, где на молекулу приходится на одну водородную связь. Уникальные физические свойства, включая высокую теплоту испарения, сильное поверхностное натяжение, высокую удельную теплоемкость и почти универсальные растворяющие свойства воды. также связаны с водородными связями.Гидрофобный эффект или исключение соединений, содержащих углерод и водород (неполярные соединения) — еще одно уникальное свойство воды, обусловленное водородными связями. Гидрофобный эффект особенно важен в формировании клеточных мембран. Лучшее описание — сказать, что вода «сжимает» неполярные молекулы вместе. Кислоты и основания, ионизация воды
Мы определяем pH раствора как отрицательный логарифм концентрации ионов водорода.
Биологический проект Кафедра биохимии и молекулярной биофизики Университет Аризоны Исправлено: 28 января 2003 г. Связаться с командой разработчиков http: // www.biology.arizona.edu | |
Странность воды | Feature
Вода, самая обычная из жидкостей, также самая странная. Он имеет по крайней мере 66 свойств, которые отличаются от большинства жидкостей — высокое поверхностное натяжение, высокая теплоемкость, высокие температуры плавления и кипения и низкая сжимаемость. Согласно одной из школ, вода — это не сложная жидкость, а «две простые жидкости со сложными отношениями».Для некоторых это утверждение противоречит основным принципам физической химии; для других это объясняет, почему вода ведет себя таким аномальным образом.
За последнее десятилетие научные аргументы достигли точки кипения. «[Это] вызывает очень сильные, почти религиозные мнения среди различных ученых», — говорит Андерс Нильссон, физик-химик, работавший в Стокгольмском университете в Швеции и Стэнфордском университете в США. Химики приписывают странные свойства воды тетраэдрическим сетям водородных связей, которые она формирует, но то, что именно происходит, особенно когда вода находится в переохлажденном состоянии, все еще вызывает споры.
Как и многие другие химики, Нильссон в начале своей карьеры предполагал, что структура воды хорошо изучена, но начал понимать, что это не так. За последние 10 лет он сконцентрировал на экстраординарного поведения ПОНИМАНИЕ воды и его последняя работа добавляет вес к теории, что вода не одна жидкость, но две различные отдельные жидкие структуры, которые могут сосуществовать — идея, которая до сих пор спорным.
Для такой маленькой молекулы много водородных связей
«Если вы посмотрите на простые термодинамические и кинетические свойства жидкостей, когда вы измените давление и температуру, все они будут вести себя одинаково», — объясняет Нильссон.По мере охлаждения жидкости ее плотность увеличивается, а теплоемкость и сжимаемость уменьшаются. «Почти все жидкости на планете ведут себя так. За исключением воды ». Эта странность становится очевидной, когда вода охлаждается до 4 ° C, где ее плотность достигает максимума, ниже которого она снова начинает уменьшаться.
Химики объясняют, что, хотя большинство жидкостей неупорядочены, а их молекулы постоянно перестраиваются, вода отличается из-за своей сети водородных связей. Водородные связи имеют силу между более прочными ковалентными связями и более слабыми дипольными взаимодействиями.В отличие от последнего, они являются направленными: каждый атом водорода указывает на электронную пару на атоме кислорода.
«Для такой маленькой молекулы много водородных связей», — говорит Мартин Чаплин, химик и исследователь воды из Лондонского университета Саут-Бэнк в Великобритании. Хотя вода ведет себя как большинство жидкостей при более высоких температурах, при охлаждении водородные связи начинают играть более важную роль. «Они фактически навязывают структурированное упорядоченное состояние», — говорит Чаплин. При понижении температуры дополнительные связывающие взаимодействия компенсируют потерю энтропии, вызванную упорядоченным расположением.
Две жидкости
Теории, объясняющие свойства воды, постоянно возникают с течением времени. В 1960-х годах теория русских химиков даже предполагала, что молекулы воды в капиллярных трубках могут образовывать полимерные цепи, известные как поливода. К этому относились серьезно, пока не стало ясно, что их результаты были связаны с экспериментальными загрязнителями.
Идея о том, что в жидкой воде могут быть два разных и разных расположения молекул, возникла более 100 лет назад.Немецкий физик Вильгельм Рентген, который первым открыл рентгеновские лучи, предположил в 1892 году, что вода состоит из двух различных фаз, сосуществующих в смеси.
В 1990-х годах модель жидкой воды с двумя состояниями вернулась, основанная на компьютерном моделировании, в котором была предпринята попытка воспроизвести реальное поведение воды. Две формы представляют собой расположение молекул воды с низкой и высокой плотностью. Версия с низкой плотностью представляет собой менее упорядоченную структуру, похожую на лед, где большинство молекул окружено четырьмя другими, чтобы создать открытую тетраэдрическую структуру с низкой плотностью.Жидкость с более высокой плотностью имеет более высокую упаковку молекул, и присутствие этих дополнительных молекул искажает водородные связи, вызывая менее направленные и более слабые молекулярные взаимодействия.
Согласно этой гипотезе, пропорция каждого компонента изменяется с температурой, и при понижении температуры образуется больше воды с низкой плотностью. В результате возникает конкуренция между ожидаемым увеличением плотности при понижении температуры и образованием воды с более низкой плотностью. Это приводит к максимуму плотности при 4 ° C, а также объясняет многие другие аномальные свойства воды.
Расстройка воды
Мощным подходом к пониманию воды стало компьютерное моделирование. «Это означает создание атомистической модели, в которой вы пытаетесь настроить заряды и электронное распределение, чтобы максимально точно воспроизвести поведение воды», — говорит математик и модельер Джон Руссо из Римского университета Ла Сапиенца в Италии. Руссо вместе с сотрудниками из Токийского университета в Японии создал модель, которая может «настраивать» молекулярные взаимодействия молекул воды, чтобы понять происхождение ее аномальных свойств.«Я пытался сделать воду менее« водянистой »и стараюсь постоянно переходить от поведения воды к поведению простой жидкости», — объясняет он.
Ключ к этому процессу — изменение силы водородной связи, которая приводит к тетраэдрической координации. 1 «Сила этого взаимодействия действительно может быть настроена. Вы можете искусственно сделать его более или менее четырехгранным ». Делая это, вы можете настроить структуру, чтобы изменить макроскопическое поведение воды, и, по словам Руссо,« многие аномалии по существу исчезнут — вы, по сути, можете заставить воду вести себя как простая жидкость.Например, при увеличении «тетраэдрическости» — пропорции молекул воды с четырьмя ближайшими соседями — лед становится плотнее воды и тонет, а не плавает, что обычно происходит с обычными жидкостями.
Ученые создали компьютерную модель, чтобы сделать воду менее «водянистой»
Руссо использует модель двух состояний, которая рассматривает воду как смесь форм с высокой и низкой плотностью, но если эти формы действительно существуют, можно ли выделить их как отдельные жидкости? В 1992 году моделирование, проведенное Юджином Стэнли из Бостонского университета в США, показало, что это может происходить в переохлажденной воде при очень низких температурах. 2 Хотя вода замерзает при 0 ° C при атмосферном давлении, без примесей, способствующих зарождению кристаллов, процесс настолько медленный, что жидкую воду можно охладить примерно до 232K (–41 ° C). Ниже этой точки вода будет быстро замерзать, что сделает измерение жидкости невозможным. Вода также существует в стекловидном состоянии ниже 150K, но быстро замерзает выше этой точки. «Между 235K и 150K находится то, что называется нейтральной зоной», — объясняет Нильссон, где невозможно измерить жидкую фазу вообще.
Модель Стэнли предполагает, что переохлажденная вода на самом деле разделится на две отдельные фазы в этой нейтральной зоне, и что при таких низких температурах существует ранее неизвестная критическая точка. Критическая точка — это температура и давление, при которых исчезает граница между двумя фазами; например, вода имеет критическую точку между жидким и парообразным состояниями при 647 К и 22,064 МПа, и свойства двух фаз становятся неразличимыми. Предлагаемая вторая критическая точка на нейтральной полосе будет означать исчезновение разделения фаз между двумя отдельными жидкими фазами.
Но найти доказательства существования этих двух жидких фаз непросто. «Мы не можем наполнить стакан водой двух типов, но было проведено несколько экспериментов, в которых косвенно наблюдались такие переходы», — говорит Руссо.
Один из подходов заключается в рассмотрении низкотемпературной воды в ее аморфном стекловидном состоянии. Ниже 136 К существует два типа стекловидной воды — одна с низкой плотностью, а другая с высокой плотностью. Одно из предположений состоит в том, что они, возможно, эквивалентны предложенным водным фазам с низкой и высокой плотностью, и при правильных экспериментальных условиях можно обнаружить отдельные жидкие фазы и переход между ними.«Люди пробуют этот путь, чтобы найти доказательства этого перехода жидкость-жидкость», — объясняет Руссо. «Они начинают со стекла, немного нагревают его и пытаются увидеть, есть ли переход в другую жидкость, прежде чем она кристаллизуется [при 150 К]»,
Нильссон пытался обнаружить две жидкости, используя рассеяние рентгеновских лучей на каплях ультрахолодной воды. «Мы разработали методы, позволяющие делать все очень быстро», — объясняет он. «Если вы можете проводить [эксперименты] на уровне микросекунд, вы можете раздвинуть границы нейтральной зоны до все более и более низких температур.Его команда охлаждала капли воды размером 10–20 мкм, впрыскивая их в вакуум, где они испаряются и очень быстро охлаждаются. Используя 50–100 фемтосекундных лазерных импульсов рентгеновского излучения с, они смогли измерить свойства, связанные со структурой любой жидкой воды, присутствующей в капле. «Нам удалось спуститься до 227 тысяч, поэтому мы видели, что происходило в этой нейтральной зоне», — говорит Нильссон. 3
Линия Widom
В 2017 году команда Нильссона опубликовала новаторский результат, который, как они утверждают, дает больше доказательств в пользу модели воды с двумя состояниями и помогает объяснить странное поведение воды при ее охлаждении.Они нашли доказательства существования линии Уидома, названной в честь Бенджамина Уидома, почетного профессора химии Корнельского университета в США. Эта линия проходит из критической точки на фазовой диаграмме и, в случае воды, представляет разделение жидкой фазы на две области, в одной из которых жидкая вода ведет себя больше как фаза с высокой плотностью (при высоких температурах и высоких температурах). -высокого давления), а другой больше похож на низкоплотный (на низкотемпературной стороне низкого давления).
Вблизи этой линии Widom жидкость испытывает наибольшую скорость изменения между двумя формами жидкости, и одна фаза может образовываться внутри другой.Существование линии Видома и связанной с ней критической точки может объяснить, почему вода колеблется между жидкостью с низкой и высокой плотностью выше критической точки. Гипотеза Нильссона предполагает, что даже в рамках одной фазы при понижении температуры около линии Уидома образуются очень маленькие карманы жидкости с более низкой плотностью, что объясняет, почему плотность воды уменьшается с 4 ° C до точки замерзания.
На основе экспериментов по рассеянию рентгеновских лучей капель воды Нильссон смог произвести расчеты флуктуаций электронной плотности и определить максимальное значение сжимаемости воды при 229 К и давлении 0 бар, которое согласуется с поведением, ожидаемым вблизи линии Уидома.На этой линии структура жидкости претерпевает самые быстрые структурные преобразования и, следовательно, является наиболее сжимаемой. 4 Нильссон продолжает искать точное положение критической точки. «Мы думаем, что это, вероятно, в температурном режиме около 1 кбар [100 МПа] при 210 К», — говорит он.
Скептики
Но не всех устраивает эта гипотеза. «Многие люди крайне скептически относятся к идее о том, что вода представляет собой смесь двух жидкостей», — говорит Алан Сопер из лаборатории Резерфорда Эпплтона в Оксфордшире, Великобритания.«Лично мне трудно представить себе, как могут быть молекулы воды двух разных типов».
Сопер говорит, что не оспаривает, что может быть вторая критическая точка в нейтральной зоне, но он говорит, что идея о том, что вода может содержать участки воды двух типов вплоть до окружающих условий, подразумевает разделение фаз выше критической точки. «Я хочу сказать, что у вас не может быть разделения фаз, если вы находитесь выше второй критической точки — это не имеет никакого смысла, иначе это не критическая точка.Ты не можешь съесть свой торт и съесть его ».
Сопер утверждает, что если бы там были пятна двух типов воды, это можно было бы обнаружить в экспериментах по рассеянию рентгеновских лучей. «У вас должно быть гораздо большее рассеяние, а рассеяния не будет». Например, по его словам, из рентгеновского рассеяния хорошо известно, что смеси, такие как структуры мицелл масла и воды, демонстрируют огромные контрасты между область воды и область нефти, с огромным количеством рассеяния, вызванного колебаниями плотности между каждой отдельной областью, и этого не наблюдается с водой.
У вас не может быть разделения фаз, если вы находитесь выше второй критической точки
Но Нильссон говорит, что он не предлагает, чтобы его исправления составляли две фазы выше критической точки. «В жидкости нет двух фаз, это колеблющиеся области — это нечто отличное от фаз». Он говорит, что они могут иметь размер 50 или 100 молекул и постоянно взаимозаменяемы с окружающими молекулами. Он описывает эту аранжировку, как гости на свадьбе или ужине-танце — в одном месте люди движутся и танцуют; в другом они сидят за столами — области различны, но люди (или молекулы) постоянно переходят от одного к другому.Нильссон говорит, что простая жидкая модель не объясняет аномальных свойств воды.
С другой стороны, исследование рассеяния рентгеновских лучей 2019 года, проведенное группой под руководством Александра Фёлиша из Helmholtz-Zentrum Berlin и Потсдамского университета, показало, что результаты согласуются с моделью непрерывного распределения жидкой воды в условиях окружающей среды с уровнем порядка это будет означать, что каждая молекула воды вносит в среднем около 1,75 водородных связей, отданных и принятых на молекулу. 5 Таким образом, они пришли к выводу, что даже если флуктуации могут происходить вблизи границы раздела фаз, при окружающих условиях модель с двумя состояниями маловероятна.
Что интересно, мы вглядываемся в регион, где есть жизнь
Сопер считает, что, а не идея дискретных участков двух жидкостей, то, что придает воде ее уникальные свойства при охлаждении, — это постепенное «вмораживание» ориентационного порядка молекул воды в тетраэдрическом расположении, даже когда они все еще находятся в движении, поскольку можно было бы ожидать от жидкости.«Именно это изменение порядка ориентации воды, кажется, упускается из виду во всех обсуждениях», — говорит он, и это может объяснить замечательное поведение воды без необходимости в двух различных состояниях выше критической точки.
Среди физиков-химиков до сих пор нет единого мнения о том, как ведет себя вода. Это может показаться чисто эзотерическим спором, но необычные свойства воды, особенно при очень низких температурах, действительно имеют значение для других областей науки. «Это влияет на модели климата [при] высоком давлении [и] внеземную воду, [которую] мы могли бы найти на других планетах, или [воду в] наноконтактных условиях», — говорит Руссо.Например, недавнее исследование показало, что вода на поверхности капель намного более упорядочена, чем объемная вода, и находится в состоянии, сопоставимом с переохлажденной водой с сильной водородной связью, даже при комнатной температуре. 6
Является ли вода смесью двух жидкостей или одной, свойства воды также имеют фундаментальное значение для биологии. «Вода — это то, что придает [нуклеиновым кислотам] их интересную структуру и свойства, то же самое и с белками», — говорит Чаплин. Сама жизнь процветала, потому что лед менее плотен, чем вода, что позволяет организмам выжить под плавающими слоями льда.«Что интересно, мы вглядываемся в регион, где существует жизнь, когда всплывает [аномальное поведение воды]», — говорит Нильссон. Согласно его модели двух состояний, только при температурах ниже 50 ° C вода становится смесью жидкости с низкой и высокой плотностью, и это также область температур, в которой существует жизнь. «Это совпадение или в этом есть что-то примечательное?» — спрашивает Нильссон. «Мы [еще] не знаем».
Рэйчел Бразилия, научный писатель из Лондона, Великобритания
Климатические исследования Южная Флорида
Уникальным свойством воды является ее высокая теплоемкость — самая высокая из всех жидкостей, кроме жидкого аммиака.Это свойство связано с водородной связью между молекулами воды. Следующее объяснение молекул воды поможет вам понять, почему в прибрежных районах обычно более умеренные температуры.
Молекула воды состоит из одного атома кислорода (O), связанного с двумя атомами водорода (H).«8+» относится к атомному номеру кислорода, который также является числом протонов в ядре и числом электронов на энергетических уровнях вне ядра. Для атома кислорода 2 электрона находятся на первом энергетическом уровне, а оставшиеся 6 электронов — на следующем или втором энергетическом уровне. Водород имеет атомный номер 1, что означает, что водород имеет один протон в ядре и один электрон на самом низком энергетическом уровне за пределами ядра. Второй энергетический уровень может содержать 8 электронов, поэтому каждый атом водорода делит свой 1 электрон с атомом кислорода, завершая второй энергетический уровень и создавая молекулу воды.
Связь между атомом кислорода и каждым атомом водорода известна как ковалентная связь, потому что они разделяют электроны, образуя очень стабильную молекулу воды. Два атома водорода связаны с атомом кислорода под углом 105 °. Такая геометрия молекулы воды приводит к тому, что ее концы меняются положительно и отрицательно, что называется полярностью. Вода относится к полярным или диполярным молекулам. Большое ядро атома кислорода притягивает общие электроны, заставляя эту сторону молекулы воды заряжаться отрицательно, а сторона водорода — положительно.Эта полярность позволяет воде легко связываться с соседними молекулами воды. Водородная связь — это связь между двумя молекулами воды.
Вода — это жидкость, а не газ (или водяной пар) при комнатной температуре из-за сильной водородной связи между молекулами воды.(Эта прочная связь заставляет воду сопротивляться молекулярному движению и оставаться жидкостью при комнатной температуре.) Это означает, что для повышения температуры воды требуется больше энергии или тепла, чем для большинства других веществ. Удельная теплоемкость — это количество тепловой энергии, необходимое для повышения или понижения температуры 1 грамма вещества на 1 ° Цельсия. Удельная теплоемкость жидкой воды составляет 1 калорию на грамм на 1 градус C (кал / г / ° C). Удельная теплоемкость воды выше, чем у сухой почвы, поэтому вода поглощает и отдает тепло медленнее, чем земля.
Вода также текучая, что позволяет теплу проникать на большую глубину, чем на суше. Теплоемкость — это произведение удельной теплоемкости и массы (в г) материала. Океаны обладают большей теплоемкостью, чем суша, потому что удельная теплоемкость воды выше, чем у сухой почвы, и потому, что смешивание верхних слоев океана приводит к нагреванию гораздо большей массы воды, чем суша. Это вызывает более быстрое нагревание участков суши и повышение температуры, а также более быстрое охлаждение и более низкие температуры по сравнению с океанами.
Высокая теплоемкость воды также объясняет, почему температура земли возле водоема более умеренная. Высокая теплоемкость воды позволяет удерживать ее температуру в относительно узком диапазоне, в результате чего близлежащие прибрежные районы также имеют узкий дневной и сезонный температурный диапазон. Напротив, районы с аналогичными погодными условиями, которые находятся дальше от побережья, как правило, имеют гораздо более широкий диапазон сезонных и дневных температур.Подводя итог, можно сказать, что большие водоемы имеют тенденцию смягчать температуру близлежащих земель из-за высокой теплоемкости воды. Эта высокая теплоемкость является результатом как более высокой удельной теплоемкости воды, так и смешивания тепла на большей глубине над океанами.
Структура воды: свойства
А, привет, здесь, в штаб-квартире ускоренного курса, нам нравится начинать каждый день с хорошей здоровой дозы воды во всех ее трех формах. Это единственное вещество на всей нашей планете Земля, которое естественным образом встречается в твердой, жидкой и газовой формах. и чтобы отпраздновать эту магическую связь между двумя атомами водорода и одним атомом кислорода, здесь сегодня мы будем праздновать чудесные поддерживающие жизнь свойства воды, но мы собираемся сделать это немного более одетыми.Намного лучше.
На этом мы закончили ускоренный курс биологии, мы говорим о жизни и довольно важном факте, что вся жизнь, как мы ее знаем, зависит от наличия воды вокруг Я просто астрономы всегда смотрят во Вселенную, пытаясь ее понять. выяснить, есть ли жизнь где-то еще, потому что вы знаете, что это своего рода самый важный вопрос, который у нас сейчас есть. Я был очень взволнован, когда они нашли воду где-нибудь, особенно жидкую воду, и это одна из причин, по которой я и многие другие люди были в восторге от Так сильно вышло в декабре прошлого года, когда на Марсе семилетний марсоход «Оппортьюнити» обнаружил 20-дюймовую жилу из гипса, которая почти наверняка была отложена жидкой водой на поверхности Марса, и это было, вероятно, миллиарды лет назад.И поэтому будет сложно сказать, привела ли вода, которая там была, к какой-то жизни, но, возможно, мы сможем это выяснить, и это будет действительно захватывающе. Но почему мы думаем, что вода необходима для жизни? Почему вода на других планетах так возбуждает нас?
Итак, давайте начнем с исследования некоторых удивительных свойств воды. Для этого нам нужно начать с этой самой популярной в мире молекулы или, по крайней мере, самой запоминающейся молекулы в мире, мы все знаем об этом, старый добрый h3o.Два атома водорода, один кислород, водород, каждый из которых разделяет электрон с кислородом в том, что мы называем ковалентной связью. Итак, как вы можете видеть, вы нарисовали мою молекулу воды определенным образом, и на самом деле она выглядит v-образной, потому что этот большой атом кислорода немного более жаден для электронов. Он имеет небольшой отрицательный заряд, тогда как эта область здесь с атомами водорода имеет небольшой положительный заряд, благодаря этой полярности все молекулы воды настолько притягиваются друг к другу, что фактически слипаются, и это называется водородными связями, и мы говорили о в прошлый раз, по сути, происходит то, что положительный полюс вокруг этих атомов водорода связывается с отрицательным полюсом вокруг атомов кислорода другой молекулы воды, и поэтому это слабая связь, но посмотрите, они связаны серьезно, я не могу переоценить важность этой водородной связи поэтому, когда ваш учитель спрашивает вас, что важно в воде, начните с водородных связей, и вы должны поместить ее во все зазоры и, возможно, вокруг нее будут блестки, одним из замечательных свойств, которые являются результатом этих водородных связей, является высокая когезия воды, что приводит к высокой когезия поверхностного натяжения — это притяжение между такими вещами, как притяжение между одной молекулой воды и другой молекулой воды. Наивысшая когезия любой неметаллической жидкости, и вы можете увидеть это, если налейте немного воды на вощеную бумагу или немного тефлона или что-то там, где вода поднимается, как некоторые листья растений справляются с этим очень хорошо.Это довольно круто, так как вода слабо прилипает к вощеной бумаге или к растению, но прочно молекулы воды удерживают эти капли вместе в конфигурации, которая создает наименьшую площадь поверхности. Именно такое высокое поверхностное натяжение допускает появление некоторых насекомых и даже я. думаю, одна ящерица, а также один Иисус, могут ходить по тому, что сила воды Цуй делает свои пределы.
Конечно, есть и другие вещества, к которым вода очень любит прилипать. Возьмем, к примеру, стекло, это называется адгезией, и вода распространяется здесь, а не разбивается, потому что силы сцепления между водой и стеклом сильнее, чем силы сцепления отдельных молекул воды в капле воды. два разных вещества, поэтому в данном случае молекулы воды и молекулы стекла, эти свойства приводят к тому, что одна из моих любимых вещей в воде — это то, что она может противостоять гравитации.Это действительно крутая вещь, которая только что произошла, называется капиллярным действием, и объяснить это можно с помощью того, что мы теперь знаем о когезии и адгезии: благодаря адгезии молекулы воды притягиваются к молекулам в соломке, но когда молекулы воды прилипают к соломинке. другие молекулы втягиваются за счет сцепления вслед за другими молекулами воды. Спасибо за сцепление. Создаваемое здесь поверхностное натяжение заставляет воду подниматься вверх по соломе, и она будет продолжать подниматься, пока в конечном итоге сила тяжести, тянущая вниз на вес воды, и солома не пересилит поверхностное натяжение.Тот факт, что вода является полярной молекулой, также помогает ей растворять вещества.
Это хороший растворитель, заметьте, вода — не лучший растворитель, это потрясающий растворитель! В воде можно растворить больше веществ, чем в любой другой жидкости на Земле, и да, это включает в себя самую сильную кислоту, которую мы когда-либо создавали. Эти вещества, растворяющиеся в воде, — это сахар или соль, известные нам, называемые гидрофильными. и они гидрофильны, потому что они полярны, и их полярность сильнее, чем силы сцепления стены, поэтому, когда вы помещаете одно из этих полярных веществ в воду, оно достаточно сильное, чтобы разрушить все небольшие силы сцепления.Все эти маленькие водородные связи, и вместо водородных связей друг с другом вода будет водородной связью вокруг этих полярных веществ. Поваренная соль является ионной, и прямо сейчас она разделяется на ионы, поскольку полюса наших молекул воды взаимодействуют с ней, но что происходит, когда есть молекула, которая не может разрушить силы сцепления воды, через которую она не может проникнуть и войти в нее. Что происходит, когда это вещество не может преодолеть сильные силы сцепления воды и не может проникнуть внутрь воды? Это то, что мы называем гидрофобным веществом или чем-то, что боится воды.
У этих молекул не было заряженных полюсов, они неполярны и не растворяются в воде, потому что, по сути, они выталкиваются из воды силами сцепления воды. Воду, которую мы можем назвать универсальным растворителем, но это не означает, что он растворяет все, что было. на протяжении всей истории было много эксцентричных ученых, но все эти разговоры о воде заставили меня задуматься о, пожалуй, самом эксцентричном из эксцентриков, о человеке по имени Генри Кавендиш, который он общался со своими служанками только с помощью записок и добавил лестницу к задней части своего дома, чтобы избежать связаться со своей домработницей.Некоторые считают, что он, возможно, страдал от аутизма, но почти каждый признает, что он был гением науки. Его лучше всего помнят как первого человека, который распознал газообразный водород как отдельное вещество и определил состав воды в 1700-х годах. Большинство людей думали, что вода сама по себе является элементом, но Кавендиш заметил, что водород, который он называл легковоспламеняющимся воздухом, вступал в реакцию с кислородом. Ужасное название дефростер закрыл воздух, чтобы сформировать воду. Кавендиш не совсем понимал, что он здесь обнаружил, отчасти потому, что он не верил в химические соединения, он объяснил свои эксперименты с водородом с точки зрения огнеподобного элемента, называемого флогистоном, тем не менее его эксперименты были новаторскими, как и его работа, и определения конкретных гравитация в основном сравнительная плотность водорода и других газов по отношению к обычному воздуху, это особенно впечатляет, если учесть грубые инструменты, с которыми он работал, например, это то, из чего он сделал свой водородный газ, он не только установил точный состав атмосферы, но также обнаружил плотность Земли неплохо для парня, который был настолько мучительно застенчивым, что единственный существующий его портрет был нарисован без его ведома, поэтому за все его десятилетия экспериментов было опубликовано только около 20 статей в годы после его смерти. исследователи смерти выяснили, что Кавендиш на самом деле открыл закон Рихтера Закон Ома, закон Кулона и несколько других Законы — это множество чертовых законов, и если бы он получил признание за них, нам пришлось бы иметь дело со всеми, как с восьмым недостатком Кавендиша и четвертым законом Кавендиша.Так что я, например, рад, что на самом деле он не получил должного внимания.
Мы собираемся заняться довольно удивительной наукой прямо сейчас, вы, ребята, не поверите, хорошо, что вы готовы, это плывет. Да, я знаю, что вы не удивлены этим, но вы должны быть удивлены, потому что все остальное, когда оно твердое, намного плотнее, чем когда оно жидкое, точно так же, как газы намного менее плотны, чем жидкости, но та простая характеристика воды, что она плавает в твердой форме, — это одна из причин, почему жизнь на этой планете, какой мы ее знаем, возможна, и почему твердая вода менее плотная, чем жидкая вода, в то время как все остальное прямо противоположно этому.Что ж, вы можете еще раз поблагодарить свои водородные связи, поэтому при температуре около 32 градусов по Фаренгейту или 0 градусов по Цельсию, если вы ученый или из той части мира, где все имеет смысл, молекулы воды начинают затвердевать, а водородные связи в этих молекулах воды образуются кристаллические структуры, которые разделяют молекулы более равномерно, что, в свою очередь, делает замороженную воду менее плотной, чем ее жидкая форма, поэтому почти при любых обстоятельствах плавающий водный лед — это действительно хорошо, если я клянусь, что плотнее воды, он замерзнет, а затем тонет, а затем замерзнет чем замерзать, чем тонуть, так что просто поверьте мне в этом, вы не хотите жить в мире, где я тону, не только это полностью нанесет ущерб водным экосистемам, которые в основном являются тем, как жизнь сформировалась на земле, в первую очередь, это также Вы знаете, что весь лед и Северный полюс утонут, а затем вся вода повсюду поднимется, и у нас не будет земли, которая раздражала бы.
Есть еще одно удивительное свойство воды, о котором я забываю, так почему здесь так жарко? О, теплоемкость, да, вода имеет очень высокую теплоемкость, и, вероятно, это ничего не значит для вас, но в основном это означает, что вода действительно хорошо удерживает тепло, поэтому нам нравится ставить бутылки с горячей водой в нашу кровать и с ними, когда мы вы одиноки, но помимо искусственного обогрева вашей кровати, также очень важно, что океаны трудно нагреть и охладить, они становятся гигантскими радиаторами, которые регулируют температуру и климат нашей планеты, поэтому, например, это намного лучше в Лос-Анджелесе, где океан постоянно поддерживает такую же температуру, как есть, и скажем, Небраска, в меньшем масштабе, мы можем действительно легко и визуально увидеть воду с высокой теплоемкостью, поставив горшок без воды на плиту и увидев, насколько плохо это идет, но затем вы наливаете в него немного воды, и требуется вечность, чтобы чертовски закипеть, ох, и если вы еще не заметили этого, или когда вода испаряется с вашей кожи, она охлаждает вас, теперь это принцип за потоотделением, которое является чрезвычайно эффективной, хотя и несколько неловкой частью жизни, но это пример еще одной невероятно крутой вещи, связанной с водой, когда мое тело становится горячим, и оно потеет, это тепло возбуждает некоторые молекулы воды на моей коже до точки, где они ломаются эти водородные связи, и они испаряются, и когда они ускользают, они забирают эту тепловую энергию с собой, оставляя меня прохладнее, прекрасно хорошо, это не было упражнением, хотя я не знаю, почему так сильно потею, это может быть распылитель, которым я продолжаю опрыскивать себя возможно, это просто потому, что это предприятие с таким высоким уровнем стресса, которое пытается научить вас тому, что я думаю, мне нужно немного воды, но пока я пью ах, есть обзор всех вещей, о которых мы говорили сегодня, если вы есть пара вещи, в которых вы не совсем уверены, просто вернитесь и посмотрите их, это не займет у вас много времени, и вы станете умнее.Я обещаю, что вы так хорошо сдадите тест, что у вас либо нет, либо вы подойдете, ладно, пока

