2. Вода и её роль в жизнедеятельности клетки
Вода (h3O) — важнейшее неорганическое вещество клетки. В клетке в количественном отношении вода занимает первое место среди других химических соединений. Вода входит в состав цитоплазмы, она придаёт клетке объём и упругость, участвует во всех химических реакциях. Все биохимические реакции происходят в водных растворах. Чем интенсивнее протекает в клетке обмен веществ, тем выше в ней содержание воды.
Вода заполняет пространства между клетками, она составляет основу клеточного сока в вакуолях. Транспорт веществ в живых организмах осуществляется в виде водных растворов.
У воды имеется ряд свойств, которые обуславливают её значение для живых организмов.
Структура молекулы воды
Особые свойства воды связаны со строением её молекулы.
Связи между атомами водорода и кислорода в молекуле воды полярные. Из-за большей электроотрицательности атома кислорода электроны общих электронных пар сдвинуты к нему. Поэтому на атоме кислорода имеется частичный отрицательный заряд, а на атомах водорода — частичные положительные заряды. Так как молекула воды имеет угловое строение, разные заряды в ней находятся у разных полюсов. Молекула полярная, она является диполем.
Поэтому на атоме кислорода имеется частичный отрицательный заряд, а на атомах водорода — частичные положительные заряды. Так как молекула воды имеет угловое строение, разные заряды в ней находятся у разных полюсов. Молекула полярная, она является диполем.
Рис. \(1\). Молекула воды
Полярные молекулы воды взаимодействуют между собой с образованием водородных связей, обуславливающих многие особенности физических и химических свойств вещества.
Рис. \(2\). Водородные связи
Свойства воды
Вода — полярный растворитель, в ней растворяются другие полярные вещества. Такие вещества называют гидрофильными. К этой группе относятся многие соли, моно- и дисахариды, аминокислоты, минеральные кислоты. В растворённом состоянии молекулы или ионы веществ могут свободно двигаться, и они легче вступают в химические реакции.
Вещества, нерастворимые в воде, называются гидрофобными. К ним относятся жиры, многие белки и нуклеиновые кислоты. Гидрофобность некоторых веществ имеет важное значение для живых организмов (например, из таких веществ формируются клеточные мембраны)
К ним относятся жиры, многие белки и нуклеиновые кислоты. Гидрофобность некоторых веществ имеет важное значение для живых организмов (например, из таких веществ формируются клеточные мембраны)
Важное свойство воды — способность растворять газообразные вещества (O2, CO2 и др.).
У воды высокая теплоёмкость, т. е. способностью поглощать много тепла при незначительном возрастании собственной температуры. Высокая теплоёмкость сглаживает температурные колебания и защищает организмы от быстрого и сильного охлаждения или нагревания.
Вода имеет высокую теплоту парообразования, для её испарения необходима довольно большая энергия. Использование значительного количества энергии на разрыв водородных связей при испарении воды способствует её охлаждению. Это свойство воды предохраняет организмы от перегрева. Примеры: испарение воды листьями растений и выделение пота у животных.
У воды также высокая теплопроводность, которая обеспечивает быстрое распределение тепла по всему организму.
Вода не сжимается. Она создаёт тургорное давление и поддерживается упругость тканей и органов. У некоторых беспозвоночных (например, у круглых червей) полостная жидкость выполняет функцию гидростатического скелета.
У воды высокое поверхностное натяжение. Поэтому кровь движется по капиллярам у животных и поднимается по сосудам в растениях.
Функции воды
1. Вода является универсальным растворителем. Благодаря разной растворимости веществ в воде формируются плазматические мембраны.
2. Вода выполняет в живых организмах транспортную функцию. Вещества поступают в клетки и организмы, а также переносятся внутри них в виде водных растворов.
3. Вода участвует в биохимических реакциях, протекающих в клетке (гидролиз веществ), является источником кислорода и водорода при фотолизе в световую фазу фотосинтеза.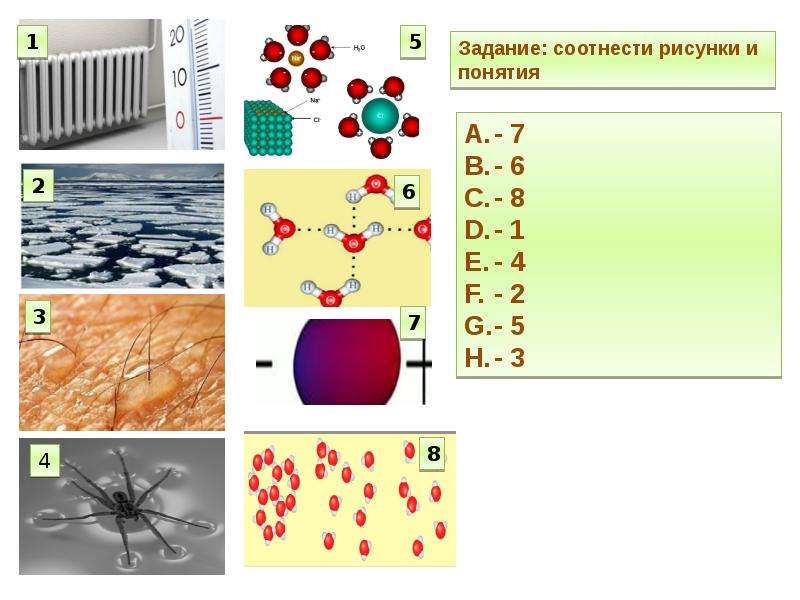
4. Вода играет важную роль в осуществлении теплорегуляции.
5. Вода является составной частью слизей, образующихся в органах дыхания и пищеварения, а также секретов некоторых желез и органов: пищеварительных соков, желчи, слюны, пота, слёз и т. д.
Источники:
Рис. 1. Молекула воды © ЯКласс.
Рис. 2. Водородные связи. Автор: chris 論 (vectorisation), Raimund Apfelbach — File:Wasserstoffbrückenbindungen Wasser.png, Общественное достояние, https://commons.wikimedia.org/w/index.php?curid=8973461. 07.09.2021.
Строение, свойства и функции воды
Цель урока: сформировать представление о целостной картине мира на примере вещества воды, осуществив интеграцию знаний учащихся, полученных в курсах физики, химии и биологии.
Задачи урока:
- Образовательные: усвоение всеми учащимися стандартного минимума фактических сведений о строении и функциях воды на всех уровнях организации живого.

- Развивающие: совершенствование надпредметных умений сравнивать и анализировать, устанавливать причинно-следственные связи; переводить информацию в графический вид (таблицу), постановки и решения проблем; оперировать понятиями и связывать с ранее полученными знаниями в курсах ботаники, зоологии, анатомии; рассуждать по аналогии, развивать память, произвольное внимание.
- Воспитательные: развивать интерес к окружающим явлениям, умение работать в парах и в коллективе, вести диалог, слушать товарищей, оценивать себя и других, формировать культуру речи.
Планируемые результаты: умение характеризовать функции вещества на основе строения и свойств; обобщение полученных знаний о функциях воды на разных уровнях организации живого в форме таблицы.
Тип урока: изучение нового материала и первичное закрепление знаний.
Методы обучения: беседа, рассказ учителя, показ иллюстраций, презентации, индивидуальная работа с текстом, контроль знаний.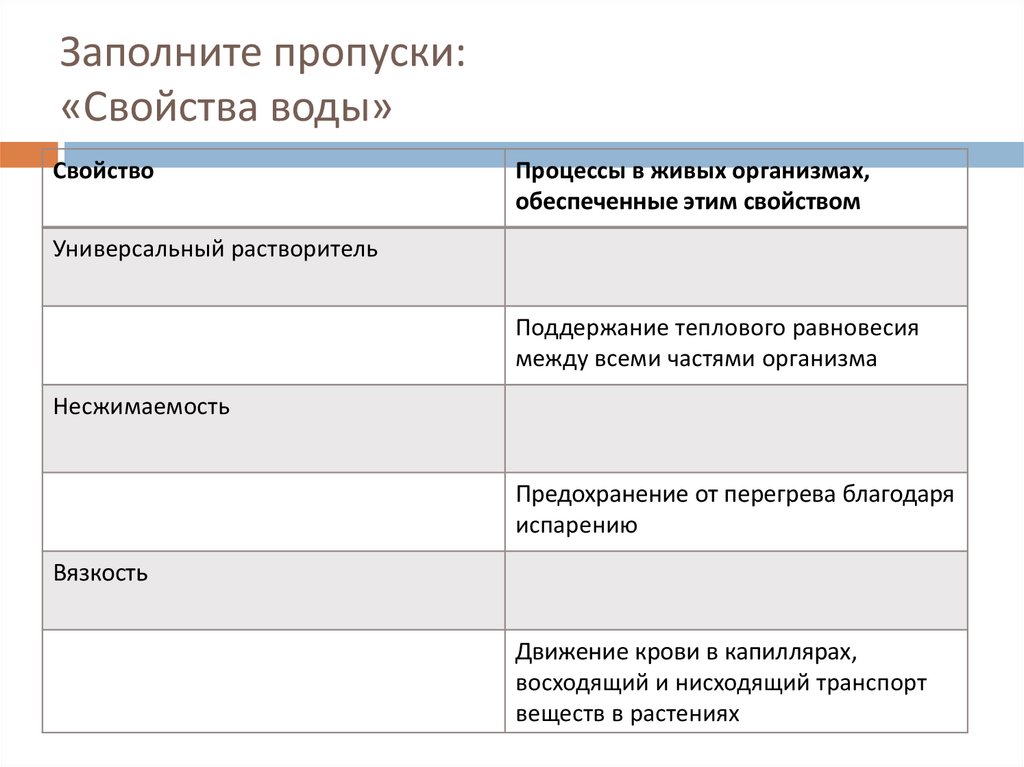
Формы организации учебной деятельности: работа в парах (составление обобщающей таблицы), индивидуальная, фронтальная, эксперимент.
Оборудование: фотографии, компьютер, мультимедийный проектор, на столах учащихся раздаточный материал для урока, демонстрационные опыты.
Ход урока
Организационный момент (2 мин.): поздороваться, представиться детям.
Введение (5 мин.):
Вода – самое распространенное и удивительное на Земле вещество (например, расширяется при охлаждении, замерзает уже при 0 0С, кипит при 100 0С, выполняет множество функций и даже может хранить информацию). Ею заполнены океаны, моря, озера и реки; пары воды входят и в состав воздуха. Вода содержится в клетках всех живых организмов (животных, растений, грибов, бактерий) в значительных количествах: организме млекопитающих массовая доля воды составляет примерно 70%, а в огурцах и арбузах ее около 90%, в костях человека – 45 %, а в мозге до 90 %.
Цели урока: почему воды больше всего в составе живых организмов? Почему вода покрывает большую часть суши? Как вода сохраняет информацию? На эти вопросы нам с вами предстоит ответить в конце урока.
Как будем работать: беседуем, я рассказываю, показываю иллюстрации и схемы (Презентация), в процессе объяснения заполняем пропущенные слова в распечатках (Приложение 1). В конце урока я проконтролирую, как вы меня поняли. Мы заполним обобщающую таблицу, а я оценю ваши старания.
Демонстрационные опыты:
Опыт № 1:
Цель опыта: доказать растворимость веществ в воде.
Ход опыта: насыпать в колбу с водой соль или сахар. Размешать.
Результат: соль (сахар) полностью растворились.
Вывод: вода – хороший растворитель.
Опыт № 2
Цель опыта: доказать способность воды передвигаться по сосудам стебля за счет корневого давления и присасывающей силы испарения.
Ход опыта: поставить на сутки укоренившийся побег бальзамина в раствор чернил.
Результат: стебель и некоторые листья бальзамина окрасились в синий цвет.
Вывод: вода передвигается по сосудам стебля за счет сил сцепления между молекулами при помощи корневого давления и присасывающей силы испарения..
Опыт № 3:
Цель опыта: доказать способность воды двигаться в область меньшей концентрации растворителя.
Ход опыта: в две чашки Петри поместить одинаковые кусочки картофеля. В одну чашку налить воду, в другую – концентрированный раствор соли.
Результат: картофель в простой воде набух, а в концентрированном растворе соли сморщился.
Вывод: молекулы воды двигаются в область меньшей концентрации растворителя.
Объяснение нового материала (20 мин.):
Проводится в форме беседы. Изучаем вещества по определенному плану (пишу на доске): строение – свойства – функции на системных уровнях организации живого.
Строение молекулы и межмолекулярные связи | Свойства |
|---|---|
Молекула воды имеет угловую форму: атомы водорода по отношению к кислороду образуют угол, равный примерно 105 0. Поэтому молекула воды – диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород – отрицательно. |
Вода – хороший растворитель. Растворы образуются путем взаимодействия растворенного вещества с частицами растворителя. Процесс растворения твердых веществ в жидкостях можно представить так: под влиянием растворителя от поверхности твердого вещества постепенно отрываются отдельные ионы или молекулы и равномерно распределяются по всему объему растворителя. |
|
Вода – реагент в реакциях гидролиза (разрушение сложных химических веществ под действием воды до более простых с новыми свойствами) и ряде других реакций |
Водородные связи между молекулами воды |
Растворы ряда веществ образуются за счет водородных связей между веществом и молекулами растворителя (сахара, газы) |
Водородных связей много, поэтому необходимо много энергии для их разрыва.
|
Вода обладает хорошей теплопроводностью и большой теплоемкостью. Вода медленно нагревается и медленно остывает. |
Водородные связи слабые |
Молекулы воды подвижны относительно друг друга |
Силы межмолекулярного сцепления образуют пространства между молекулами |
Вода практически не сжимается |
Образование водородных связей между молекулами воды и других веществ |
Вода характеризуется оптимальным для биологических систем значением силы поверхностного натяжения, текучесть воды Опыт № 2 |
Вода замерзает при 0 0С, при замерзании образуется много водородных связей, возникают пространства между молекулами между молекулами |
Максимальная плотность воды при 4 С° равна 1 г/см3, лед имеет меньшую плотность, и всплывает на ее поверхность. |
| Функции на системных уровнях организации живого |
|---|
Вода обеспечивает диффузию — пассивный транспорт веществ в клетку и из нее в область меньшей концентрации (осмос) и пиноцитоз, а также транспорт веществ из клетки. |
|
Гидрофильные вещества проникают внутрь клетки. |
Вода – терморегулятор. 4) Водные бассейны регулируют температуру на нашей планете. Большая теплоемкость определяет климатическую роль океанов. Поэтому морской климат мягче континентального, погода подвержена меньшим колебаниям температуры |
«Смазочный материал» в суставах, плевральной полости и околосердечной сумке. |
|
Капиллярный кровоток, движение веществ в капиллярах почвы, восходящий и нисходящий ток растворов в растениях. |
Лед защищает водоемы от промерзания. |
Вода может хранить информацию (Приложение 2).
Закрепление (13 мин.):
Биологические задачи:
- Показать синюю или зеленую хризантему. Как создают такие растения? Являются ли они результатом селекционной работы?
- Почему кожа на пальцах при длительном купании сморщивается?
- Почему сморщивается яблоко, лежащее в тепле?
Разделить класс на три группы (по рядам). Первая группа выписывает в тетрадь функции воды на уровне живой клетки. Вторая группа – на уровне живого организма. Третья группа – на уровне экосистем и биосферы. В конце работы оценить себя по количеству найденных функций. Работа ведется по парам.
Первая группа выписывает в тетрадь функции воды на уровне живой клетки. Вторая группа – на уровне живого организма. Третья группа – на уровне экосистем и биосферы. В конце работы оценить себя по количеству найденных функций. Работа ведется по парам.
Функции воды
| В живой клетке | В живом организме | В экосистемах и биосфере |
|---|---|---|
1. Транспорт веществ в клетке. |
1. Охлаждение организмов. |
1. Дыхание и фотосинтез водных организмов. |
2. Основная среда всех биохимических процессов. |
2. «Смазочный материал» в суставе, плевральной полости, околосердечной сумке, глазном яблоке. |
2. Регуляция температуры на планете. |
3. |
3. Гидростатический скелет. |
3. Благоприятная среда обитания для живых организмов. |
4. Сохранение структуры клетки. |
4. Защита плода млекопитающих. |
4. Защита водоемов от промерзания. |
5. Тургорное давление. |
5. Капиллярный кровоток, нисходящий и восходящий ток в растениях. |
5. Часть среды обитания животных. |
|
|
6. Подъем почвенных растворов по капиллярам почвы. |
Подведение итогов урока, оценка работы (2 мин.)
Словарик (Приложение 2)
Свойства питьевой воды | Доставка питьевой воды Аквалайн
Физиологически полноценная питьевая вода (47;78) с уровнем минерализации 150-350 мг/л по праву может считаться эталоном качества питьевой воды для Санкт-Петербурга и Ленинградской области. Именно такую воду добывает и доставляет потребителям наша компания.
Именно такую воду добывает и доставляет потребителям наша компания.
Немного истории
В конце 90-х годов прошлого столетия в Санкт Петербурге начинал формироваться рынок бутилированной питьевой воды, переработанной из водопровода по западной технологии – очистка воды обратным осмосом. Этот метод вызывал большие сомнения в целесообразности его применения, так как вода при очистке делается близкой к дистиллированной, которая не содержит солей и при длительном использовании способна разбалансировать работу организма человека.
Годин В.Ю. выбрал направление на исследование, поиск и использование подземных физиологически полноценных питьевых вод, отвечающих в полной мере потребностям интересам населения региона. В результате продолжительных исследований в 2008 году им была открыта природная физиологически полноценная артезианская питьевая вода – ФППВ (47;78). На это ушло более 10 лет непрерывной, напряженной научно-исследовательской и практической работы. В ходе этой работы был проведён анализ отечественной и зарубежной литературы в области оценки влияния водного фактора на здоровье человека, изучены свойства невской воды и дан её сравнительный анализ с подземными питьевыми водами г.Санкт-Петербурга и Ленинградской области. По результатам исследований химического состава и удельных дебитов основных водоносных гидрогеологических подразделений на территории Ленинградской области в границах административных районов в соответствии с нормативами физиологически полноценных питьевых вод (ФППВ) издана монография Годин В.Ю., Воронюк Г.Ю. «Гидрогеологичес
В ходе этой работы был проведён анализ отечественной и зарубежной литературы в области оценки влияния водного фактора на здоровье человека, изучены свойства невской воды и дан её сравнительный анализ с подземными питьевыми водами г.Санкт-Петербурга и Ленинградской области. По результатам исследований химического состава и удельных дебитов основных водоносных гидрогеологических подразделений на территории Ленинградской области в границах административных районов в соответствии с нормативами физиологически полноценных питьевых вод (ФППВ) издана монография Годин В.Ю., Воронюк Г.Ю. «Гидрогеологичесдля регионов № 47 (Ленинградская область) и 78 (Санкт-Петербург).

ФППВ(47; 78;) по своим химическим, микробиологическим и физическим параметрам полностью соответствует основным научным критериям действительно полезной питьевой воды. Именно такая вода может нести полноценную, здоровую жизнь, в том случае, если она местная, энергетически и информационно чиста, биологически активна и с оптимальным для организма составом.
Несмотря на то, что в регионе воды много, по-настоящему полезной питьевой воды мало. Это подтверждается продолжительными исследованиями и многочисленными комплексными анализами подземных вод. Только в четырёх районах Ленинградской области есть физиологически полноценные подземные питьевые воды и их дебит позволяет производить розлив для питьевых целей. Это уникальные подземные воды — химический состав и энергоинформацио Комплекс хорошо защищен от поверхностных загрязнений толстым слоем глины (от 70 до 100 м).
Комплекс хорошо защищен от поверхностных загрязнений толстым слоем глины (от 70 до 100 м).
В естественной природной среде подземные воды структурируются путем длительной фильтрации с поверхности земли до места коптажа в подземной толще водоносного горизонта, пронизываясь энергетическими потоками земли и космическими излучениями, что обеспечивает природную чистоту и первозданность воды.
Места расположения водоисточников отличаются особыми природными свойствами – это районы чистых озер, родников и больших лесных массивов.
Информационное насыщение питьевой воды происходит под воздействием уникального ландшафта местности – это озерная гладь, капелька росы на веточке сосны, листочках, журчанье ручья, свежесть и умиротворение. В таких водах сохранена энергия жизни. Энерго-информаци
Русский врач-терапевт М. Мудров в XVIII веке писал: «Зная взаимные действия друг на друга души и тела, долгом считаю заметить, что есть и душевные лекарства, кои врачуют тело». Таким лекарством обладает слово (энергоинформаци
В настоящее время факт существования энергоинформацио
По минеральному составу и микро и макроэлементам ФППВ ( 47: 87) идеально подходит для организма человека. Питьевая вода мягкая. Очень жесткая или очень мягкая вода одинаково не подходят для нормального функционирования клеток организма. Диаметр молекул воды ФППВ (47;78) позволяет легко проходить сквозь мембрану клеток организма, поэтому химические реакции в организме протекают быстрее и обмен веществ активизируется.
ФППВ (47; 78) биологически доступна, легкоусваиваема, имеет максимальную проникающую способность через мембраны клеток организма, основные физические и физиологические характеристики сравнимые с внутриклеточной средой.
Содержание основных жизненно важных биогенных элементов ФППВ (47; 78): кальций — 15 мг/л, магний — 10 мг/л, калий — 5 мг/л, бикарбонаты — 100-300 мг/л, фторид-ионы — 0,5-1,0 мг/л, йодид-ионы — 5-100 мкг/л, Ph — 7,4–8,3, общая жесткость — 1,5-2,5 мг-экв/л. Вода мягкая, в ней хорошо заваривается чай, кофе. Жёсткой считается вода, в которой содержатся в больших концентрациях соли кальция и магния. Мягкая вода – это вода, которая содержит мало солей. Жесткую воду не рекомендуется использовать в питьевых целях, т.к. содержащиеся в них в избыточном количестве минеральные соли плохо усваиваются организмом и они откладываются в суставах, хрящах, на стенках сосудов. В отличие от жесткой, мягкая вода, в основном выступает в роли оздоровительного фактора.
Вода мягкая, в ней хорошо заваривается чай, кофе. Жёсткой считается вода, в которой содержатся в больших концентрациях соли кальция и магния. Мягкая вода – это вода, которая содержит мало солей. Жесткую воду не рекомендуется использовать в питьевых целях, т.к. содержащиеся в них в избыточном количестве минеральные соли плохо усваиваются организмом и они откладываются в суставах, хрящах, на стенках сосудов. В отличие от жесткой, мягкая вода, в основном выступает в роли оздоровительного фактора.
ФППВ (47; 78) благодаря стерильности, свежести, естественной минерализации, биологической активности, обусловленными кругооборотом воды в природе, несёт жизненную энергию и является главным профилактическим средством заболеваний и средством немедикаментозного оздоровления населения. Вода имеет собственную биоэнергетику, задаваемую её природным свойством — это фрактальная, диссиметричная питьевая вода.
Употребление ФППВ(47; 78) снижает опасность возникновения артрита, атеросклероза. Эта вода полезна для людей, предрасположенны
Эта вода полезна для людей, предрасположенны
Утверждение о том, что энергию организму поставляет пища за счет образования аденозинтрифосфа Вода приводит в действие натриево-калиевы
Вода приводит в действие натриево-калиевы
ФППВ (47; 78) способствует поддержанию в организме условий, которые препятствуют развитию патологий в организме. Вода безопасна в бактериологическом отношении и отличается великолепными органолептическими свойствами.
Эталоном питьевой воды в Санкт-Петербурге по праву может считать физиологически полноценная питьевая вода Аквалайн Природная Премиум, которую можно заказать на нашем сайте!
По отношению к воде все практически вещества можно разделить на две группы:
1. Гидрофильные
(от греч. «филео» — любить,
имеющие положительное сродство к
воде). Эти вещества
имеют полярную молекулу, включающую
электроотрицательные атомы (кислород,
азот, фосфор и др.). В результате
отдельные атомы таких молекул также
обретают частичные заряды и образуют
водородные связи с молекулами воды.
Примеры: сахара, аминокислоты,
органические кислоты.
Кроме того, со свойством воды как растворителя прямо связана транспортная функция внутренних жидкостей как у многоклеточных животных (кровь, лимфа, гемолимфа, целомическая жидкость), так и у многоклеточных растений.
5. Вода как реагент. |
||||
Биологические свойства воды — презентация онлайн
1. ФГОУ ВПО «Нижегородская государственная сельскохозяйственная академия»
Кафедра «Частная зоотехния,разведение сельскохозяйственных
животных и акушерство»
2. Контрольная работа на тему: «Биологические свойства воды»
Выполнила студент 3 курса
заочного отделения
ветеринарного факультета
группы 67 «а»
шифр 146727
Мартиросова Е. Р.
Проверил(а): к. в. н., доцент Шкалова И. П.
Вода играет уникальную роль как вещество, определяющее
возможность существования и саму жизнь всех существ на
Земле. Она выполняет роль универсального растворителя, в
котором происходят основные биохимические процессы живых
организмов. Уникальность воды состоит в том, что она
достаточно хорошо растворяет как органические, так и
неорганические вещества, обеспечивая высокую скорость
протекания химических реакций и в то же время — достаточную
сложность образующихся комплексных соединений.
4. Биологические функции воды в природе:
1. Обеспечивает поддержание структуры организмов
2. Служит растворителем и средой для диффузии
3. Участвует в реакциях гидролиза
4. Среда для оплодотворения
5. Обеспечивает распространение семян, гамет, личиночных стадий водных
животных.
6. Главные биологические функции воды для растительных организмов:
• 1. Поддержание осмотического итургорного давления
• 2. Участвует в процессе фотосинтеза
• 3. Обеспечивает транспирацию
• 4. Обеспечивает прорастание семян.
8. Наиболее значимые биологические функции воды для животных и человека:
• 1. Обеспечивает транспорт веществ• 2. Способствует охлаждению тела
• 3. Обеспечивает осморегуляцию
• 4. Выполняет защитную функцию (слезы)
• 5. Способствует миграции (морские течения).
Таким образом, вода является основной биологической жидкостью.
Она не только инертная среда, она может также вступать в соединение с
другими компонентами живой материи. Необходимо особо подчеркнуть это ее
значение в биологическом круговороте.
Очевидно, что жизнедеятельность всех живых организмов прочно связана с
водой.
11. Спасибо за внимание!
Строение и функции воды. Вода. Строение, свойства. Роль воды в клетке и организме. Физические свойства воды
Ознакомившись с элементами, присутствующими в живых организмах, обратимся теперь к соединениям, в состав которых эти элементы входят. И здесь мы также обнаруживаем фундаментальное сходство между всеми живыми организмами. Больше всего в организмах содержится воды — от 60 до 95% общей массы организма. Во всех организмах мы находим также и некоторые простые органические соединения, играющие роль «строительных блоков», из которых строятся более крупные молекулы (табл. 5.2). О них речь пойдет ниже.
Таблица 5.2. Химические «строительные блоки» органических соединений
Таким образом, сравнительно небольшое число видов молекул дает начало всем более крупным молекулам и структурам живых клеток. По мнению биологов, эти немногие виды молекул могли синтезироваться в «первичном бульоне» (т. е. в концентрированном растворе химических веществ) в мировом океане на ранних этапах существования Земли, еще до появления жизни на нашей планете (разд. 24.1). Простые молекулы строятся в свою очередь из еще более простых неорганических молекул, а именно из диоксида углерода, из азота и воды.
Важная роль воды
Без воды жизнь на нашей планете не могла бы существовать. Вода важна для живых организмов вдвойне, ибо она не только необходимый компонент живых клеток, но для многих еще и среда обитания. Нам следует поэтому сказать здесь несколько слов о ее химических и физических свойствах.
Свойства эти довольно необычны и связаны главным образом с малыми размерами молекул воды, с полярностью ее молекул и с их способностью соединяться друг с другом водородными связями. Под полярностью подразумевают неравномерное распределение зарядов в молекуле. У воды один конец молекулы несет небольшой положительный заряд, а другой — отрицательный. Такую молекулу называют диполем . Более электроотрицательный атом кислорода притягивает электроны водородных атомов. В результате между молекулами воды возникает электростатическое взаимодействие, а, поскольку противоположные заряды притягиваются, молекулы как бы склонны «склеиваться» (рис. 5.4). Эти взаимодействия, более слабые, чем обычные ионные связи, называются водородными связями . Учитывая данную особенность воды, мы можем теперь перейти к рассмотрению тех ее свойств, которые важны с биологической точки зрения.
Рис. 5.4. Водородная связь между двумя полярными молекулами воды. δ + — очень маленький положительный заряд; δ — — очень маленький отрицательный заряд
Биологическое значение воды
Вода как растворитель. Вода — превосходный растворитель для полярных веществ. К ним относятся ионные соединения, такие, как соли, у которых заряженные частицы (ионы) диссоциируют (отделяются друг от друга) в воде, когда вещество растворяется (рис. 5.5), а также некоторые неионные соединения, например сахара и простые спирты, в молекуле которых присутствуют заряженные (полярные) группы (у Сахаров и спиртов это ОН-группы).
Когда вещество переходит в раствор, его молекулы или ионы получают возможность двигаться более свободно и соответственно его реакционная способность возрастает. По этой причине в клетке большая часть химических реакций протекает в водных растворах. Неполярные вещества, например липиды, не смешиваются с водой и потому могут разделять водные растворы на отдельные компартменты, подобно тому как их разделяют мембраны. Неполярные части молекул отталкиваются водой и в ее присутствии притягиваются друг к другу, как это бывает, например, когда капельки масла сливаются в более крупные капли; иначе говоря, неполярные молекулы гидрофобны . Подобные гидрофобные взаимодействия играют важную роль в обеспечении стабильности мембран, а также многих белковых молекул, нуклеиновых кислот и других субклеточных структур.
Присущие воде свойства растворителя означают также, что вода служит средой для транспорта различных веществ. Эту роль она выполняет в крови, в лимфатической и экскреторной системах, в пищеварительном тракте и во флоэме и ксилеме растений.
Большая теплоемкость. Удельной теплоемкостью воды называют количество теплоты в джоулях, которое необходимо, чтобы поднять температуру 1 кг воды на 1°С. Вода обладает большой теплоемкостью. Это значит, что существенное увеличение тепловой энергии вызывает лишь сравнительно небольшое повышение ее температуры. Объясняется такое явление тем, что значительная часть этой энергии расходуется на разрыв водородных связей, ограничивающих подвижность молекул воды, т. е. на преодоление ее упомянутой выше «клейкости».
Большая теплоемкость воды сводит к минимуму происходящие в ней температурные изменения. Благодаря этому биохимические процессы протекают в меньшем интервале температур, с более постоянной скоростью и опасность нарушения этих процессов от резких отклонений температуры грозит им не столь сильно. Вода служит для многих клеток и организмов средой обитания, для которой характерно довольно значительное постоянство условий.
Большая теплота испарения. Скрытая теплота испарения (или относительная скрытая теплота испарения) есть мера количества тепловой энергии, которую необходимо сообщить жидкости для ее перехода в пар, т. е. для преодоления сил молекулярного сцепления в жидкости. Испарение воды требует довольно значительных количеств энергии. Это объясняется существованием водородных связей между молекулами воды. Именно в силу этого температура кипения воды — вещества со столь малыми молекулами — необычно высока.
Энергия, необходимая молекулам воды для испарения, черпается из их окружения. Таким образом, испарение сопровождается охлаждением. Это явление используется у животных при потоотделении, при тепловой одышке у млекопитающих или у некоторых рептилий (например, у крокодилов), которые на солнцепеке сидят с открытым ртом; возможно, оно играет заметную роль и в охлаждении транспирирующих листьев.
Большая теплота плавления. Скрытая теплота плавления (или относительная скрытая теплота плавления) есть мера тепловой энергии, необходимой для расплавления твердого вещества (в нашем случае — льда). Воде для плавления (таяния) необходимо сравнительно большое количество энергии. Справедливо и обратное: при замерзании вода должна отдать большое количество тепловой энергии. Это уменьшает вероятность замерзания содержимого клеток и окружающей их жидкости. Кристаллы льда особенно губительны для живого, когда они образуются внутри клеток.
Плотность и поведение воды вблизи точки замерзания. Плотность воды от +4 до 0°С понижается, поэтому лед легче воды и в воде не тонет. Вода- единственное вещество, обладающее в жидком состоянии большей плотностью, чем в твердом.
Поскольку лед плавает в воде, он образуется при замерзании сначала на ее поверхности и лишь под конец в придонных слоях. Если бы замерзание прудов шло в обратном порядке, снизу вверх, то в областях с умеренным или холодным климатом жизнь в пресноводных водоемах вообще не могла бы существовать. Лед покрывает толщу воды, как одеялом, что повышает шансы на выживание у организмов, обитающих в воде. Это важно в условиях холодного климата и в холодное время года, но, несомненно, особенно важную роль это играло в ледниковый период. Находясь на поверхности, лед быстрее и тает. То обстоятельство, что слои воды, температура которых упала ниже 4°С, поднимаются вверх, обусловливает перемешивание воды в больших водоемах. Вместе с водой циркулируют и находящиеся в ней питательные вещества, благодаря чему водоемы заселяются живыми организмами на большую глубину.
Большое поверхностное натяжение и когезия. Когезия — это сцепление молекул физического тела друг с другом под действием сил притяжения. На поверхности жидкости существует поверхностное натяжение — результат действующих между молекулами сил когезии, направленных внутрь. Благодаря поверхностному натяжению жидкость стремится принять такую форму, чтобы площадь ее поверхности была минимальной (в идеале — форму шара). Из всех жидкостей самое большое поверхностное натяжение у воды. Значительная когезия, характерная для молекул воды, играет важную роль в живых клетках, а также при движении воды по сосудам ксилемы в растениях (разд. 14.4). Многие мелкие организмы извлекают для себя пользу из поверхностного натяжения: оно позволяет им удерживаться на воде или скользить по ее поверхности.
Вода как реагент. Биологическое значение воды определяется и тем, что она представляет собой один из необходимых метаболитов, т. е. участвует в метаболических реакциях. Вода используется, например, в качестве источника водорода в процессе фотосинтеза (разд. 9.4.2), а также участвует в реакциях гидролиза.
Вода и процесс эволюции. Роль воды для живых организмов находит свое отражение, в частности, в том факте, что одним из главных факторов естественного отбора, влияющих на видообразование, является недостаток воды. К этой теме мы уже обращались в гл. 3 и 4, когда обсуждали ограничения, с которыми связано распространение некоторых растений, имеющих подвижные гаметы. Все наземные организмы приспособлены к тому, чтобы добывать и сберегать воду; в крайних своих проявлениях — у ксерофитов, у обитающих в пустыне животных и т. п. — такого рода приспособления представляются подлинным чудом «изобретательности» природы. В табл. 5.3 перечислен ряд важных биологических функций воды.
| У всех организмов Обеспечивает поддержание структуры (высокое содержание воды в протоплазме) Служит растворителем и средой для диффузии Участвует в реакциях гидролиза Служит средой, в которой происходит оплодотворение Обеспечивает распространение семян, гамет и личиночных стадий водных организмов, а также семян некоторых наземных растений, например кокосовой пальмы |
| У растений Обусловливает осмос и тургесцентность (от которых зависит многое: рост (увеличение клеток), поддержание структуры, движения устьиц и т. д.) Участвует в фотосинтезе Обеспечивает транспирацию, а также транспорт неорганических ионов и органических молекул Обеспечивает прорастание семян — набухание, разрыв семенной кожуры и дальнейшее развитие |
| У животных Обеспечивает транспорт веществ Обусловливает осморегуляцию Способствует охлаждению тела (потоотделение, тепловая одышка) Служит одним из компонентов смазки, например в суставах Несет опорные функции (гидростатический скелет) Выполняет защитную функцию, например в слезной жидкости и в слизи Способствует миграции (морские течения) |
Вода играет важнейшую роль в жизни клеток и живых организмов в целом. Помимо того, что она входит в их состав, для многих организмов это еще и среда обитания. Роль воды в клетке определяется ее свойствами. Свойства эти довольно уникальны и связаны главным образом с малыми размерами молекул воды, с полярностью ее молекул и с их способностью, соединяться друг с другом водородными связями.
Молекулы воды имеют нелинейную пространственную структуру. Атомы в молекуле воды удерживаются посредством полярных ковалентных связей , которые связывают один атом кислорода с двумя атомами водорода. Полярность ковалентных связей (т.е. неравномерное распределение зарядов) объясняется в данном случае сильной электроотрицательностью атомов кислорода по отношению к атому водорода; атом кислорода оттягивает на себя электроны из общих электронных пар.
Вследствие этого на атоме кислорода возникает частично Отрицательный заряд, а на атомах водорода — частично положительный. Между атомами кислорода и водорода соседних молекул возникают водородные связи.
Благодаря образованию водородных связей молекулы воды им одна с другой, что и обусловливает ее исходное состояние при нормальных условиях.
Вода является превосходным растворителем для полярных веществ, например солей, сахаров, спиртов, кислот и др. Вещества хорошо растворимые в воде, называются гидрофильными .
Абсолютно неполярные вещества типа жиров или масел вода не растворяет и не смешивается с ними, поскольку она не может образовывать с ними водородные связи. Нерастворимые в воде вещества называются гидрофобными .
Вода обладает высокой удельной теплоемкостью . Для разрыва водородных связей, удерживающих молекулы воды, требуется поглотить большое количество энергии. Это свойство обеспечивает поддержание теплового баланса организма при значительных перепадах температуры в окружающей среде. Кроме того, вода обладает высокой теплопроводностью , что позволяет организму поддерживать одинаковую температуру во всем его объеме.
Вода обладает также высокой теплотой парообразования , т.е. способностью молекул уносить с собой значительное количество тепла, охлаждая организм. Это свойство воды используется при потоотделении у млекопитающих, тепловой одышке у крокодилов и транспирации у растений, предотвращая их перегрев.
Для воды характерно исключительно высокое поверхностное натяжение . Это свойство имеет очень важное значение для адсорбционных процессов, для передвижения растворов по тканям (кровообращение, восходящий и нисходящий токи в теле растений). Многие мелкие организмы извлекают для себя пользу из поверхностного натяжения: оно позволяет им удерживаться на воде или скользить по ее поверхности.
Биологические функции воды
Транспортная . Вода обеспечивает передвижение веществ в клетке и организме, поглощение веществ и выведение продуктов метаболизма.
Метаболическая . Вода является средой для всех биохимических реакций в клетке. Ее молекулы участвуют во многих химических реакциях, например при образовании или гидролизе полимеров. В процессе фотосинтеза вода является донором электронов и источником атомов водорода. Она же является источником свободного кислорода.
Структурная . Цитоплазма клеток содержит от 60 до 95 % воды. У растений вода определяет тургор клеток, а у некоторых животных выполняет опорные функции, являясь гидростатическим скелетом (круглые и кольчатые черви, иглокожие).
Вода участвует в образовании смазывающих жидкостей (синовиальная в суставах позвоночных; плевральная в плевральной полости, перикардиальная в околосердечной сумке) и слизей (которые облегчают передвижение веществ по кишечнику, создают влажную среду на слизистых оболочках дыхательных путей). Она входит в состав слюны, желчи, слез, спермы и др.
Минеральные соли
Молекулы солей в водном растворе диссоциируют на катионы и анионы. Наибольшее значение имеют катионы: К + , Na + , Ca 2+ , Mg 2+ и анионы: Cl — , H 2 PO 4 — , HPO 4 2- , HCO 3 — , NO 3 — , SO 4 2- . Существенным является не только содержание, но и соотношение ионов в клетке.
Разность между количеством катионов и анионов на поверхности и внутри клетки обеспечивает возникновение потенциала действия, что лежит в основе нервного и мышечного возбуждения. С разностью концентрации ионов по разные стороны мембраны связывают активный перенос веществ через мембрану, а также преобразование энергии.
Анионы фосфорной кислоты создают фосфатную буферную систему, поддерживающую pH внутриклеточной среды организма на уровне 6,9.
Угольная кислота и ее анионы создают бикарбонатную буферную систему, которая поддерживает рН внеклеточной среды (плазма крови) на уровне 7,4.
Некоторые ионы участвуют в активации ферментов, создании осмотического давления в клетке, в процессах мышечного сокращения, свертывании крови и др.
Некоторые катионы и анионы могут включаться в комплексы с различными веществами (например, анионы фосфорной кислоты входят в состав фосфолипидов, АТФ, нуклеотидов и др.; ион Fe 2+ входит в состав гемоглобина и т.д.).
Вода (H 2 O)
— важнейшее неорганическое вещество клетки. В клетке в количественном отношении вода занимает первое место среди других химических соединений. Вода выполняет различные функции: сохранение объема, упругости клетки, участие во всех химических реакциях. Все биохимические реакции происходят в водных растворах. Чем выше интенсивность обмена веществ в той или иной клетке, тем больше в ней содержится воды.
Обрати внимание!
Вода в клетке находится в двух формах: свободной и связанной.
Свободная вода находится в межклеточных пространствах, сосудах, вакуолях, полостях органов. Она служит для переноса веществ из окружающей среды в клетку и наоборот.
Связанная вода входит в состав некоторых клеточных структур, находясь между молекулами белка, мембранами, волокнами и соединена с некоторыми белками.
Вода обладает рядом свойств, имеющих исключительно важное значение для живых организмов.
Структура молекулы воды
Уникальные свойства воды определяются структурой ее молекулы.
Между отдельными молекулами воды образуются водородные связи, определяющие физические и химические свойства воды.
Характерное расположение электронов в молекуле воды придает ей электрическую асимметрию. Более электроотрицательный атом кислорода притягивает электроны атомов водорода сильнее, в результате молекула воды является диполем (обладает полярностью). Каждый из двух атомов водорода обладает частично положительным зарядом, а атом кислорода несет частично отрицательный заряд.
Частично отрицательный заряд атома кислорода одной молекулы воды притягивается частично положительными атомами водорода других молекул. Таким образом, каждая молекула воды стремится связаться водородной связью с четырьмя соседними молекулами воды.
Свойства воды
Так как молекулы воды полярны, то вода обладает свойством растворять полярные молекулы других веществ.
Вещества, растворимые в воде, называются гидрофильными (соли, сахара, простые спирты, аминокислоты, неорганические кислоты). Когда вещество переходит в раствор, его молекулы или ионы могут двигаться более свободно и, следовательно, реакционная способность вещества возрастает.
Вещества, нерастворимые в воде называются гидрофобными (жиры, нуклеиновые кислоты, некоторые белки). Такие вещества могут образовывать с водой поверхности раздела, на которых протекают многие химические реакции. Следовательно, тот факт, что вода не растворяет некоторые вещества, для живых организмов также очень важен.
Вода обладает высокой удельной теплоёмкостью , т.е. способностью поглощать тепловую энергию при минимальном повышении собственной температуры. Чтобы разорвать многочисленные водородные связи, имеющиеся между молекулами воды, требуется поглотить большое количество энергии. Это свойство воды обеспечивает поддержание теплового баланса в организме. Большая теплоёмкость воды защищает ткани организма от быстрого и сильного повышения температуры.
Для испарения воды необходима достаточно большая энергия. Использование значительного количества энергии на разрыв водородных связей при испарении способствует его охлаждению. Это свойство воды предохраняет организм от перегрева.
Пример:
Примерами этого могут являться транспирация у растений и потоотделение у животных.
Вода обладает также высокой теплопроводностью, обеспечивая равномерное распределение тепла по всему организму.
Обрати внимание!
Высокая удельная теплоемкость и высокая теплопроводность делает воду идеальной жидкостью для поддержания теплового равновесия клетки и организма.
Вода практически не сжимается , создавая тургорное давление, определяя объем и упругость клеток и тканей.
Пример:
Гидростатический скелет поддерживает форму у круглых червей, медуз и других организмов.
Благодаря силам сцепления молекул на поверхности воды создается плёнка, обладающая такой характеристикой, как поверхностное натяжение.
Пример:
Благодаря силе поверхностного натяжения происходит капиллярный кровоток, восходящий и нисходящий токи растворов в растениях.
К числу важных в физиологическом отношении свойств воды относится её способность растворять газы (O 2 , CO 2 и др.).
Вода является также источником кислорода и водорода, выделяемых при фотолизе в световую фазу фотосинтеза.
Биологические функции воды
- Вода обеспечивает передвижение веществ в клетке и организме, поглощение веществ и выведение продуктов метаболизма. В природе вода переносит продукты жизнедеятельности в почвы и к водоемам.
- Вода — активный участник реакций обмена веществ.
- Вода участвует в образовании смазывающих жидкостей и слизей, секретов и соков в организме (эти жидкости находятся в суставах позвоночных животных, в плевральной полости, в околосердечной сумке).
- Вода входит в состав слизей, которые облегчают передвижение веществ по кишечнику, создают влажную среду на слизистых оболочках дыхательных путей. Водную основу имеют и секреты, выделяемые некоторыми железами и органами: слюна, слёзы, желчь, сперма и т.д.
Вода является универсальным растворителем для полярных молекул — солей, Сахаров, простых спиртов. Вода обладает уникальным свойством разрывать все виды молекулярных и межмолекулярных связей и образовывать растворы.
Раствор — жидкая молекулярно-дисперсная система, в которой молекулы и ионы растворенных веществ взаимодействуют друг с другом. Различают растворы элекгролитов, неэлектролитов, полимеров.
Жидкие среды организма представляют собой сложные растворы -полиэлектролиты. При растворении в воде происходит гидратация, а образующиеся при этом вещества называют гидратами. При этом разрываются межмолекулярные связи.
Растворы электролитов характеризуются электролитической диссоциацией растворенного вещества с образованием ионов. В жидких средах организма, согласно природе и механизмам гидратации, нет собственно солей, кислот и оснований, а есть их ионы.
Растворы биополимеров — белков, нуклеиновых кислот — являются полиэлектролитами и не проходят через большинство биологических мембран.
Неполярные вещества, например липиды, не смешиваются с водой.
Вода является растворителем многих веществ и переносит их кровью, лимфатической и экскреторной системами.
Жидкие среды организма — кровь, лимфа, цереброспинальная, тканевая жидкость, омывающие клеточные элементы и принимающие участие в процессе метаболизма, в совокупности образуют внутреннюю среду организма. Термин «внутренняя среда» или «внутреннееморе» был предложен французским физиологом К. Бернаром.
Биологические функции воды
Около 60% массы тела взрослого человека (у мужчин — 61%, у женщин- 54%) приходится на долю воды. У новорожденного ребенка содержание воды достигает 77%, в старческом возрасте снижается до 50%.
Вода входит в состав всех тканей человеческого тела: в крови ее около 81%, в мышцах — 75%, в костях — 20%. Вода связана в организме в основном с соединительной тканью.
Вода — универсальный растворитель неорганических и органических соединений. В жидкой среде происходит переваривание пищи и всасывание в кровь питательных веществ.
Вода является важнейшим фактором, обеспечивающим относительное постоянство внутренней среды организма. Благодаря высокой теплоемкости и теплопроводности вода участвует в терморегуляции, способствуя теплоотдаче (потоотделение, испарение, тепловая одышка, мочеотделение).
Вода — участник множества метаболических реакций, в частности гидролиза. Она стабилизирует структуру многих высокомолекулярных соединений, внутриклеточных образований, клеток, тканей и органов, обеспечивает опорные функции тканей и органов, сохраняя их тургор, форлиз и
положение (гидростатический скелет). Вода является носителем метаболитов. гормонов, электролитов, участвует в транспорте веществ через клеточные мембраны и сосудистую стенку в целом. С помощью воды из организма выводятся токсичные продукты метаболизма.
Источники воды и пути выведения из организма
В сутки взрослый человек употребляет в среднем 2,5 л воды. Из них 1,2 в виде питьевой, напитков и пр.; 1 литр с поступающей пищей; 0,3 литра образуется в организме в результате метаболизма белков, жиров и углеводов, так называемая метаболическая или эндогенная вода. Столько же воды выводиться из организма.
В полость пищеварительного тракта в сутки выделяется 1,5 л слюны, 3,5 л желудочного сока, 0,7 л сока поджелудочной железы, 3 л кишечных соков и около 0,5 л желчи.
Около 1-1,5 л выводится почками в виде мочи, 0,2-0,5 л — с потом через кожу, около 1 л — через кишечник с калом. Совокупность процессов поступления воды и солей в организм, распределения их во внутренних средаx и выведения называется водно-солевым обменом.
Виды воды в организме
В организме человека и животных различают три вида воды — свободную, связанную и конституционную.
Свободная, или мобильная вода, составляет основу внеклеточной, внутриклеточной и трансцеллюлярной жидкостей.
Связанная вода удерживается ионами в виде гидратной оболочки и гидрофильными коллоидами (белками) крови и белками тканей в виде воды набухания.
конституционная (внутримолекулярная) вода входит в состав молекул, белков, жиров и углеводов и освобождается при их окислении. Вода перемещается между различными отделами жидких сред организма вследствии сил гидростатического и осмотического давления.
Внутриклеточная и внеклеточная жидкости электронейтральны и осмотически равновесны.
Транспортная . Вода обеспечивает передвижение веществ в клетке и организме, поглощение веществ и выведение продуктов метаболизма.
Метаболическая . Вода является средой для всех биохимических реакций в клетке. Ее молекулы участвуют во многих химических реакциях, например при образовании или гидролизе полимеров. В процессе фотосинтеза вода является донором электронов и источником атомов водорода. Она же является источником свободного кислорода.
Структурная . Цитоплазма клеток содержит от 60 до 95 % воды. У растений вода определяет тургор клеток, а у некоторых животных выполняет опорные функции, являясь гидростатическим скелетом (круглые и кольчатые черви, иглокожие).
Вода участвует в образовании смазывающих жидкостей (синовиальная в суставах позвоночных; плевральная в плевральной полости, перикардиальная в околосердечной сумке) и слизей (которые облегчают передвижение веществ по кишечнику, создают влажную среду на слизистых оболочках дыхательных путей). Она входит в состав слюны, желчи, слез, спермы и др.
Минеральные соли . Молекулы солей в водном растворе диссоциируют на катионы и анионы. Наибольшее значение имеют катионы: К + , Na + , Са 2+ , Mg 2+ и анионы: Cl — , H 2 PO 4 — , HPO 4 2- , HCO 3 — , NO 3 — , SO 4 2- . Существенным является не только содержание, но и соотношение ионов в клетке.
Разность между количеством катионов и анионов на поверхности и внутри клетки обеспечивает возникновение потенциала действия, что лежит в основе нервного и мышечного возбуждения. С разностью концентрации ионов по разные стороны мембраны связывают активный перенос веществ через мембрану, а также преобразование энергии.
Анионы фосфорной кислоты создают фосфатную буферную систему, поддерживающую pH внутриклеточной среды организма на уровне 6,9.
Угольная кислота и ее анионы создают бикарбонатную буферную систему, которая поддерживает рН внеклеточной среды (плазма крови) на уровне 7,4.
Некоторые ионы участвуют в активации ферментов, создании осмотического давления в клетке, в процессах мышечного сокращения, свертывании крови и др.
Некоторые катионы и анионы могут включаться в комплексы с различными веществами (например, анионы фосфорной кислоты входят в состав фосфолипидов, АТФ, нуклеотидов и др.; ион Fe 2+ входит в состав гемоглобина и т.д.).
Главные загрязнители воды
Установлено, что более 400 видов веществ могут вызвать загрязнение воды. В случае превышения допустимой нормы хотя бы по одному из трех показателей вредности: санитарно-токсикологическому, общесанитарному или органолептическому, вода считается загрязненной.
Различают химические, биологические и физические загрязнители. Среди химических загрязнителей к наиболее распространенным относят нефть и нефтепродукты, СПАВ (синтетические поверхностно-активные вещества), пестициды, тяжелые металлы, диоксины и др. Очень опасно загрязняют воду биологические загрязнители: вирусы и другие болезнетворные микроорганизмы; и физические — радиоактивные вещества, тепло и др.
Процессы загрязнения поверхностных вод обусловлены различными факторами. К основным из них относятся:
· Сброс в водоемы неочищенных сточных вод.
· Смыв ядохимикатов ливневыми осадками.
· Газодымовые выбросы.
· Утечки нефти и нефтепродуктов.
Приоритетные загрязнители водных экосистем по отраслям промышленности:
Нефтегазодобыча, нефтепереработка: Нефтепродукты, СПАВ, фенолы, аммонийные соли, сульфиды. Лесная промышленность: Сульфаты, органические вещества, лигнины, смолистые и жирные вещества, азот.
Машиностроение, металлообработка, металлургия: Тяжелые металлы, взвешенные вещества, фториды, цианиды, аммонийный азот, нефтепродукты, фенолы, смолы.
Химическая промышленность: Фенолы, нефтепродукты, СПАВ, ароматические углеводороды, неорганика.
Горнодобывающая, угольная промышленность: Флотореагенты, неорганика, фенолы, взвешенные вещества.
Легкая, текстильная, пищевая промышленности: СПАВ, нефтепродукты, органические красители и др.
Кроме поверхностных вод постоянно загрязняются и подземные воды, в первую очередь в районах крупных промышленных центров. Загрязняющие вещества могут проникать к подземным водам различными путями: при просачивании промышленных и хозяйственно-бытовых стоков из хранилищ, прудов-накопителей, отстойников и др., по затрубному пространству неисправных скважин, через поглощающие скважины, карстовые воронки и др.
К естественным источникам загрязнения относят сильно минерализованные подземные воды или морские воды, которые могут внедряться в пресные незагрязненные воды при эксплуатации водозаборных сооружений и откачке воды из скважин.
Важно подчеркнуть, что загрязнения подземных вод не ограничиваются площадью промпредприятий, хранилищ отходов и т.д., а распространяются вниз по течению потока на расстояния до 20-30 км и более от источника загрязнения. Это создает реальную угрозу для питьевого водоснабжения.
очистка вода показатель качество.
Среди водоохранных проблем одной из важнейших является разработка и внедрение эффективных методов обеззараживания и очистки поверхностных вод, используемых для питьевого водоснабжения.
Наиболее распространенные примеси, ухудшающие качество питьевой воды:
Взвешенные вещества — нерастворимые в воде суспензии, эмульсии. Наличие в воде взвешенных веществ свидетельствует о её загрязненности частичками глины, песка, ила, водорослей и т.п.
Органические вещества природного происхождения — частички почвенного гумуса, продукты жизнедеятельности и разложения растительных и животных организмов.
Органические вещества техногенного происхождения — органические кислоты, белки, жиры, углеводы, хлорорганические соединения, фенолы, нефтепродукты.
Микроорганизмы — планктон, бактерии, вирусы.
Соли жесткости — кальциевые и магниевые соли угольной, серной, соляной и азотной кислот.
Соединения железа и марганца — органические комплексные соединения, сульфаты, хлориды и гидрокарбонаты.
Соединения азота — нитраты, нитриты, аммиак.
Растворимые в воде газы — сероводород, метан.
Влияние примесей на качество воды:
Повышенная мутность воды указывает её значительную загрязненность взвешенными веществами и препятствует использованию в хозяйственно — питьевых целях.
Органические вещества вызывают различного рода запахи (землистый, гнилостный, болотный, рыбный, аптечный, нефтяной и т.п.), повышают цветность, вспениваемость, оказывают неблагоприятное воздействие на организм человека.
Микроорганизмы увеличивают количество органики, могут вызвать заболевания тифом, дизентерией, холерой, полиомиелитом и т.д. бесцветная.
Соли жесткости в большом количестве делают воду непригодной для хозяйственных нужд. В жесткой воде увеличивается расход моющих средств при стирке, медленно развариваются мясо и овощи, выходят из строя посуда и водонагреватели. Железо и марганец придают воде неприятную красновато-коричневую или черную окраску, ухудшают её вкус, вызывают развитие железобактерий. Избыток железа в организме увеличивает риск инфарктов, длительное употребление железосодержащей воды вызывает заболевание печени, снижает репродуктивную функцию организма. Марганецсодержащие воды отличаются вяжущим привкусом, окраской, оказывают токсическое действие на организм.
Соединения азота — при использовании питьевой воды с нитратами в количестве свыше 45 мг/л в организме человека синтезируются нитрозамины, способствующие образованию злокачественных опухолей.
Наличие в воде сероводорода резко ухудшает её качество, придает неприятный запах, провоцирует развитие серобактерий.
Хозяйственно — питьевая вода должна быть безвредна для здоровья человека, иметь хорошие физические, химические и санитарные показатели.
Метод или совокупность методов очистки выбирают на основе изучения свойств исходной воды, её запасов в источнике, требуемое количество продукта, а также воспринимающую способность канализации для приема выделенных из воды загрязнений.
Методы очистки воды
В реках и других водоемах происходит естественный процесс самоочищения воды. Однако он протекает медленно. Пока промышленно — бытовые сбросы были невелики, реки сами справлялись с ними. В наш индустриальный век в связи с резким увеличением отходов водоемы уже не справляются со столь значительным загрязнением. Возникла необходимость обезвреживать, очищать сточные воды и утилизировать их.
Очистка сточных вод — обработка сточных вод с целью разрушения или удаления из них вредных веществ. Освобождение сточных вод от загрязнения — сложное производство. В нем, как и в любом другом производстве имеется сырье (сточные воды) и готовая продукция (очищенная вода). Очистка сточных вод — вынужденное и дорогостоящее мероприятие, представляющее собой довольно сложную задачу, связанную с большим разнообразием загрязняющих веществ и появлением в их составе новых соединений.
Методы очистки вод можно разделить на 2 большие группы: деструктивные и регенеративные.
В основе деструктивных методов лежат процессы разрушения загрязняющих веществ. Образующиеся продукты распада удаляются из воды в виде газов, осадков или остаются в воде,. но уже в обезвреженном виде.
Регенеративные методы — это не только очистка сточных вод, но и утилизация ценных веществ, образующихся в отходах.
Методы очистки вод можно разделить на: механические, химические, гидрохимические, электрохимические, физико-химические и биологические. Когда же они применяются вместе, то метод очистки и обезвреживания сточных вод называется комбинированным. Применение того или иного метода в каждом конкретном случае определяется характером загрязнения и степенью вредности примеси.
Сущность механического метода состоит в том, что из сточных вод путем отстаивания и фильтрации удаляются механические примеси. Грубодисперсные частицы в зависимости от размеров улавливаются решетками, ситами, песколовками, септиками, навозоуловителями различных конструкций, а поверхностные загрязнения — нефтеловушками, бензомаслоуловителями, отстойниками. Механическая очистка позволяет выделять из бытовых сточных вод до 60-75% нерастворимых примесей, а из промышленных до 95%, многие из которых как ценные примеси, используются в производстве.
Химический метод заключается в том, что в сточные воды добавляют различные химические реагенты, которые вступают в реакцию с загрязнителями и осаждают их в виде нерастворимых осадков. Химической очисткой достигается уменьшение нерастворимых примесей до 95% и растворимых до 25%.
Гидромеханические методы применяют для извлечения из сточных вод нерастворимых грубодисперсных примесей органических и неорганических веществ путем отстаивания, процеживания, фильтрования, центрифугирования. С этой целью используют различные конструктивные модификации сит, решеток, песколовок, отстойников, центрифуг и гидроциклонов.
Электрохимические методы очистки сточных вод от различных растворимых и диспергированных примесей включают анодное окисление и катодное восстановление, электрокоагуляцию, электродиализ. Процессы, лежащие в основе этих методов, протекают при пропускании через сточную воду электрического тока. Под действием электрического поля положительно заряженные ионы мигрируют к катоду, а заряженные отрицательно — к аноду. В прикатодном пространстве происходят процессы восстановления, а в прианодном — процессы окисления.
Физико-химические методы очистки сточных вод многообразны. Это коагуляция, флотация, адсорбционная очистка, ионный обмен, экстракция, обратный осмос и ультрафикация. При физико-химическом методе обработки из сточных вод удаляются тонкодисперсные и растворенные неорганические примеси и разрушаются органические и плохо окисляемые вещества.
Биохимические методы очистки сточных вод. Применяются для очистки хозяйственно-бытовых и промышленных сточных вод от органических и некоторых неорганических (сероводорода, сульфидов, аммиака, нитратов и др.) веществ. Процесс очистки основан на способности микроорганизмов использовать эти вещества для питания, превращения их в воду, диоксид углерода, сульфат-фосфат-ион и др. и увеличивая свою биомассу.
Также к основным методам очистки воды относятся нижеперечисленные методы:
Осветление — удаление из воды взвешенных веществ. Реализуется фильтрацией воды через пористые фильтроэлементы (картриджи) или через слой фильтроматериала. Осветление воды путем осаждения взвешенных веществ. Эту функцию выполняют осветлители, отстойники и фильтры. В осветлителях и отстойниках вода движется с замедленной скоростью, вследствие чего происходит выпадение в осадок взвешенных частиц. В целях осаждения мельчайших коллоидных частиц, которые могут находиться во взвешенном состоянии неопределенно долгое время, к воде прибавляют раствор коагулянта (обычно сернокислый алюминий, железный купорос или хлорное железо). В результате реакции коагулянта с солями многовалентных металлов, содержащимися в воде, образуются хлопья, увлекающие при осаждении взвеси и коллоидные вещества.
Коагуляция — обработка воды специальными химическими реагентами для укрупнения частиц загрязнений. Делает возможными или интенсифицирует осветление, обесцвечивание, обезжелезивание. Коагуляцией примесей воды называют процесс укрупнения мельчайших коллоидных и взвешенных частиц, происходящий вследствие их взаимного слипания под действием сил молекулярного притяжения.
Окисление — обработка воды кислородом воздуха, гипохлоритом натрия, марганцевокислым калием или озоном. Обработка воды окислителем (или их комбинацией) делает возможными или интенсифицирует обесцвечивание, дезодорацию, обеззараживание, обезжелезивание, деманганацию.
Обесцвечивание — удаление или видоизменение веществ, придающих воде цвет. Реализуется различными методами, в зависимости от причины цветности. Обесцвечивание воды, т.е. устранение или обесцвечивание различных окрашенных коллоидов или полностью растворенных веществ может быть достигнуто коагулированием, применением различных окислителей (хлор и его производные, озон, перманганат калия) и сорбентов (активный уголь, искусственные смолы).
Обеззараживание — обработка воды окислителями и/или УФ-излучением для уничтожения микроорганизмов. Обеззараживание воды (удаление бактерий, спор, микробов и вирусов) является заключительным этапом подготовки воды питьевой кондиции. Использование для питья подземной и поверхностной воды в большинстве случаев невозможно без обеззараживания. Обычными методами при очистке воды являются:
- Хлорирование путем добавления хлора, диоксида хлора, гипохлорита натрия или кальция.
- Озонирование. При применении озона для подготовки питьевой воды используются окислительные и дезинфицирующие свойства озона.
- Ультрафиолетовое облучение. Используется энергия ультрафиолетового излучения для уничтожения микробиологических загрязнений. Кишечная палочка, бацилла дизентерии, возбудители холеры и тифа, вирусы гепатита и гриппа, сальмонелла погибают при дозе облучения менее 10 мДж/см2, а ультрафиолетовые стерилизаторы обеспечивают дозу облучения не менее 30 мДж/см2.
Обезжелезивание/деманганация — превращение растворённых соединений железа и марганца, как правило, через специальные фильтро-материалы. Решение проблемы очистки воды от железа представляется довольно сложной и комплексной задачей. К наиболее часто используемым методам можно отнести:
Аэрирование — окисление кислородом воздуха с последующим осаждением и фильтрацией. Расход воздуха для насыщения воды кислородом составляет около 30 л/м3. Это традиционный метод, применяемый уже много десятилетий. Реакция окисления железа требует довольно длительного времени и больших резервуаров, поэтому этот способ используется только на крупных муниципальных системах.
Каталитическое окисление с последующей фильтрацией. Наиболее распространенный на сегодняшний день метод удаления железа, применяемый в высокопроизводительных компактных системах. Суть метода заключается в том, что реакция окисления железа происходит на поверхности гранул специальной фильтрующей среды, обладающей свойствами катализатора (ускорителя химической реакции окисления). Наибольшее распространение в современной водоподготовке нашли фильтрующие среды на основе диоксида марганца (MnO2). Железо в присутствии диоксида марганца быстро окисляется и оседает на поверхности гранул фильтрующей среды. Впоследствии большая часть окисленного железа вымывается в дренаж при обратной промывке. Таким образом, слой гранулированного катализатора является одновременно и фильтрующей средой. Для улучшения процесса окисления в воду могут добавляться дополнительные химические окислители.
Умягчение — замена катионов кальция и магния в воде на эквивалентное количество катионов натрия или водорода. Реализуется фильтрованием воды через специальные ионообменные смолы. С жесткой водой сталкивался каждый, достаточно вспомнить о накипи в чайнике. Жесткая вода не годится при окрашивании тканей водорастворимыми красками, в пивоварении, производстве водки. В ней хуже пенится стиральный порошок и мыло. Высокая жесткость воды делает её непригодной и для питания газовых и электрических паровых котлов и бойлеров. Слой накипи в 1,5 мм снижает теплоотдачу на 15%, а слой толщиной 10 мм — уже на 50%. Снижение теплоотдачи ведет к увеличению расхода топлива или электроэнергии, что, в свою очередь, ведет к образованию прогаров, трещин на трубах и стенках котлов, выводя преждевременно из строя системы отопления и горячего водоснабжения. Наиболее эффективным способом борьбы с высокой жесткостью является применение автоматических фильтров — умягчителей. В основе их работы лежит ионообменный процесс, при котором растворенные в воде жесткие соли заменяются на мягкие, которые не образуют твердых отложений.
Обессоливание — удаление из воды растворённых солей на ионообменных смолах или фильтрование воды через специальные плёнки (мембраны), пропускающие только молекулы воды.
Все большее значение в охране поверхностных вод от загрязнения и засорения приобретают агро- лесо- мелиорация и гидротехнические мероприятия. С их помощью можно предотвращать заиление и зарастание озер, водохранилищ и малых рек. Выполнение этих работ позволит уменьшить загрязненный поверхностный сток и будет способствовать чистоте водоемов.
По данным Всемирной организации здравоохранения (ВОЗ) ежегодно в мире из-за низкого качества воды умирает около 5 млн. человек. Инфекционная заболеваемость населения, связанная с водоснабжением, достигает 500 млн. случаев в год. Это дало основание назвать проблему водоснабжения доброкачественной водой в достаточном количестве проблемой номер один .
В природе вода никогда не встречается в виде химически чистого соединения. Обладая свойствами универсального растворителя, она постоянно несет большое количество различных элементов и соединений, состав и соотношение которых определяется условиями формирования воды, составом водоносных пород. Из грунта атмосферная вода поглощает углекислоту и становиться способной растворять по пути своего движения минеральные соли
Проходя через породы, вода приобретает свойства, характерные для них. Так, при прохождении через известковые породы, вода становится известковой, через доломитовые породы — магниевой. Проходя через каменную соль и гипс, вода насыщается сернокислыми и хлористыми солями и становится минеральной.
После постройки колодца, да и любого другого источника водоснабжения, необходимо провести исследования качества и состава воды для определения пригодности ее к использованию и потреблению. Надо помнить, что хозяйственно-питьевая вода относится к пищевым продуктам и ее показатели должны отвечать согласно Закону РФ «О санитарно-эпидемическом благополучии населения» от 19.04.91года, санитарным правилам СанПиН 4630-88 и требованию ГОСТа 2874-82 «Вода питьевая».
ПДК ДЛЯ ОЗНАКОМЛЕНИЯ (ТАБЛИЦЫ НЕ ЗАУЧИВАТЬ О_о)
ПДК основных неорганических веществ в питьевой воде в различ. странах (мг/дм 3).
| Показатели | ВОЗ | USEPA США | ЕС | СанПиН Россия | СанПиН Украина | ГОСТ 2874-82 |
| Алюминий (Al) | 0,2 | 0,2 | 0,2 | 0,5 | 0,2 — 0,5 | 0,5 |
| Азот аммонийный (NH 3) | 1,5 | — | 0,5 | — | — | — |
| Асбест (млн. волокон/л) | — | 7,0 | — | — | — | — |
| Барий (Ва) | 0,7 | 2,0 | 0,1 | 0,1 | 0,1 | — |
| Берилий (Ве) | — | 0,004 | — | 0,0002 | — | 0,0002 |
| Бор (В) | 0,3 | — | 1,0 | 0,5 | — | — |
| Ванадий (V) | — | — | — | 0,1 | — | — |
| Висмут (Bi) | — | — | — | 0,1 | — | — |
| Вольфрам (W) | — | — | — | 0,05 | — | — |
| Европий (Eu) | — | — | — | 0,3 | — | — |
| Железо (Fe) | 0,3 | 0,3 | 0,2 | 0,3 | 0,3 | 0,3 |
| Кадмий (Cd) | 0,003 | 0,005 | 0,005 | 0,001 | отсут. | отсут. |
| Калий (К) | — | — | 12,0 | — | — | — |
| Кальций (Са) | — | — | 100,0 | — | — | — |
| Кобальт (Со) | — | — | — | 0,1 | — | — |
| Кремний (Si) | — | — | — | 0,1 | — | — |
| Литий (Li) | — | — | — | 10,0 | — | — |
| Магний (Mg) | — | — | 50,0 | 0,03 | — | — |
| Марганец (Mn) | 0,5 | 0,05 | 0,05 | — | 0,1 | 0,1 |
| Медь (Cu) | 1,0÷2,0 | 1,0÷1,3 | 2,0 | 0,1 | ||
| Молибден (Мо) | 0,07 | — | — | 0,25 | — | 0,5 |
| Мышьяк (As) | 0,01 | 0,05 | 0,01 | 0,05 | 0,001 | 0,05 |
| Натрий (Na) | — | — | — | |||
| Никель (Ni) | 0,02 | — | 0,02 | 0,1 | 0,1 | — |
| Ниобий (Nb) | — | — | — | 0,01 | — | — |
| Нитраты (NO 3) | ||||||
| Нитриты (NO 2) | 3,0 | 3,3 | 0,5 | 3,0 | отсут. | отсут. |
| Ртуть (Hg) | 0,001 | 0,002 | 0,001 | 0,0005 | отсут. | отсут. |
| Рубидий (Rb) | — | — | — | 0,1 | — | — |
| Самарий (Sm) | — | — | — | 0,024 | — | — |
| Свинец (Pb) | 0,01 | 0,015 | 0,01 | 0,03 | 0,01 | 0,01 |
| Селен (Se) | 0,01 | 0,05 | 0,01 | 0,01 | 0,01 | 0,001 |
| Серебро (Ag) | — | 0,1 | 0,01 | 0,05 | — | 0,05 |
| Сероводород (H 2 S) | 0,05 | — | — | 0,03 | — | — |
| Стронций (Sr) | — | — | — | 17,0 | — | |
| Сульфаты (SO 4 2-) | 250÷500 | |||||
| Cурьма (Sb) | 0,005 | 0,006 | 0,005 | 0,05 | — | — |
| Таллий (Ti) | — | 0,002 | — | 0,0001 | — | — |
| Теллур (Те) | — | — | — | 0,01 | — | — |
| Фосфор (Р), (РО 4) | — | — | — | 0,0001 | — | 3,5 |
| Фториды (F) | 1,5 | 2,0÷4,0 | 1,5 | 1,5 | 1,5 | 1,5 |
| Хлор/в т.ч. свободный | 0,5÷5,0 | — | — | 0,3÷0,5/0,8÷1,2 | 0,3÷0,5/0,8÷1,2 | — |
| Хлориды (Cl) | 250÷350 | — | ||||
| Хром (Cr 3+) | — | 0,1 | — | 0,5 | — | — |
| Хром (Cr 6+) | 0,05 | — | 0,05 | 0,05 | отсут. | — |
| Цианиды (СN) | 0,07 | 0,02 | 0,05 | 0,035 | отсут. | — |
| Цинк (Zn) | 3,01 | 5,0 | 5,0 | 5,0 | — |
* предел по органолептике и потребительским качествам воды.
** в пересчете на нитраты и нитриты соответственно.
Обязательные к соблюдению параметры, установленные основным стандартом США (National Primary Water Drinking Regulations).
Данный параметр установлен так называемым «вторичным стандартом» США (National Secondary Water Drinking Regulations), носящий рекомендательный характер.
питьевой воды …» 98/93/EC от 1998 г.
Индикаторный параметр, согласно «Директивы по качеству питьевой воды …» 98/93/EC. От 1998 г.
Обязательный для соблюдения параметр, согласно «Директивы по качеству питьевой воды …» 80/778/EC от 1980 г.
Рекомендованный уровень согласно EC Drinking Water Directive 80/778/EC от 1980 г. (приводятся только для элементов, для которых не установлена предельно допустимая концентрация — MAC (Maximum Admissible Conentration)). Указаны максимальные значения, допустимые в точке пользования.
UO (Undetectable Organoleptically) — не должен обнаруживаться органолептически (на вкус и запах), согласно «Директивы по качеству питьевой воды …» 80/778/EC от 1980 г.
ПДК обеззараживающих средств и продуктов обеззараживания (мкг/дм 3).
| Показатели | ВОЗ | USEPA США | ЕС | СанПиН Россия | СанПиН Украина | ГОСТ 2874-82 |
| ОБЕЗЗАРАЖИВАЮЩИЕ ВЕЩЕСТВА | ||||||
| Монохлорамин | — | — | — | — | — | |
| Ди- и трихлорамин | — | — | — | — | — | — |
| Хлор в том числе остаточный свободный и остаточный | — | — | 300-500 800-1200 | 300-500 800-1200 | — | |
| Диоксид хлора | — | — | — | — | — | — |
| Иод | — | — | — | — | — | — |
| Озон остаточный | — | — | — | — | ||
| ПОБОЧНЫЕ ПРОДУКТЫ ОБЕЗЗАРАЖИВАНИЯ | ||||||
| Броматы | — | — | — | — | — | |
| Хлорат | — | — | — | — | — | |
| Хлорит | — | — | — | — | ||
| Полиакриламид | — | — | — | — | ||
| Активированная кремниевая кислота (по Si) | — | — | — | — | — | |
| Полифосфаты | — | — | — | — | ||
| Хлорфенолы | — | — | — | — | — | — |
| 2-хлорфенол | — | — | — | — | — | |
| 1,2,4-хлорфенол | — | — | — | — | — | |
| 2,4,6-хлорфенол | — | * | — | — | ||
| Формальдегид | — | — | — | — | ||
| Монохлорамин | — | — | — | — | — | — |
| Тригалометаны | — | — | — | |||
| Бромформ | — | — | — | — | ||
| Дибромхлорметан | — | — | — | — | ||
| Бромдихлорметан | — | — | — | — | — | |
| Хлороформ | — | — | — | |||
| Хлорированные уксусные кислоты | — | — | — | — | — | — |
| Монохлоруксусная кислота | — | — | — | — | — | |
| Дихлоруксусная кислота | — | — | — | — | — | |
| Трихлоруксусная кислота | — | — | — | — | ||
| Трихлорацетальдегид (хлоргидраты) | — | — | — | — | ||
| Хлорацетон | — | — | — | — | — | — |
| Галогенированные ацетонитрилы | — | — | — | — | — | — |
| Дихлорацетонитрил | — | — | — | — | — | |
| Дибромацетонитрил | — | — | — | — | — | |
| Бромхлорацетонитрил | — | — | — | — | — | |
| Хлорциан | — | — | — | — | — | |
| Хлорпикрин | — | — | — | — | — | — |
Прочерк означает, что данный параметр не нормируется
ВОЗ — Всемирная Организация Здравохранения, USEPA (US Environment Protection Agency) — Агенство по охране окружающей среды США, ЕС — Европейское Сообщество, СанПиН — Россия — Госкомсанэпидемнадзор России, СанПиН Украина — Министерство Здравохранения Украины.
Вода свойства и биологические функции
Невозможно, конечно, учесть любые изменения степени взаимодействия между цепью и растворителями, например, когда цепь имеет тенденцию выдвигаться в окружающую среду, чтобы стать более сольватированной, или сокращаться для удаления элементов цепи из раствора. Поэтому результаты расчетов соответствуют таким условиям ( 0-точка ), при которых полимерная цепь является невозмущенной и тенденции выдвигаться или сокращаться строго сбалансированы. Условия в 6-точке обычно не отвечают условиям, наиболее способствующим проявлению биологических функций молекулы или ее свойств, представляющих технологический интерес. Следует отметить также, что математические методы для расчета энергий взаимодействия внутри цепи все еще весьма неточны, и поэтому их можно успешно применять для предсказания лишь общих тенденций. Однако в этом направлении достигнут некоторый успех [21]. Наиболее интересным общим свойством углеводных цепей в неупорядоченном состоянии является способность связывать воду и ионы, а также включать другие полимерные цепи в свой домен или исключать из него [1]. Связывание воды объясняется тем, что движущая сила этого процесса, конформационная энтропия, делает предпочтительной конформацию ста- [c.290]Книга начинается с глав, посвященных структуре клеток и важнейшим принципам органической химии, относящимся к биомолекулам материал, изложенный в этих главах, может оказаться полезным для тех, кто недостаточно подготовлен по биологии и органической химии. После рассмотрения свойств воды подробно описываются структура и биологические функции белков. На примере гемоглобина детально показано, как аминокислотная последовательность определяет его конформацию и как конформация белковых макромолекул может влиять на структуру и функцию клеток. Далее подробно рассматриваются ферменты и способы регуляции их активности, причем постоянно подчеркивается значение трехмерной структуры белка и для иллюстрации приводится целая галерея структур ферментов. [c.8]
Типичные биомолекулы, используемые в качестве строительных блоков, возникли самопроизвольно на ранних этапах истории Земли из атмосферных газов и воды под воздействием энергии. Эти процессы, в совокупности называемые химической эволюцией, можно воспроизвести в лабораторных условиях. Современные биомолекулы (строительные блоки), по-видимому, были отобраны на ранних этапах биологической эволюции благодаря тому, что они оказались лучше других приспособленными для выполнения биологических функций. Число таких биомолекул относительно невелико, однако они обладают весьма разнообразными свойствами и каждая из них может вьшолнять в клетках самые разные функции. [c.76]
Кодовый словарь далеко не случаен. Имеется определенная корреляция между строением кодонов и природой аминокислотных остатков. Генетически закодирована пространственная структура белковой молекулы, находящейся в водном окружении, и тем самым ее биологическая функция. Природа генов непосредственно связана со специфическими свойствами жидкой воды [c.296]
Липидами называют жиры и жироподобные вещества (липоиды) животного и растительного происхождения (от греч. Проз —> жир). Несмотря на разнообразие их химического состава, они обладают общими физико-химическими свойствами и биологическими функциями. Общим свойством всех липидов является их гидрофобность, т. е. они не растворяются в воде, но растворяются в органических растворителях (эфире, хлороформе, бензоле, бензине, спирте, ацетоне и др.). Характерная особенность липидов и их растворителей обусловливается наличием в их составе большого числа гидрофобных радикалов и группировок —СН2—, —СН- и СНз-групп. Липиды классифицируются по-разному. Их можно разделить на две основные группы жиры (нейтральные жиры) и липоиды — жироподобные соединения. [c.101]
Для жизнедеятельности организмов очень важна роль воды. Немецкий физиолог Э. Дюбуа-Реймон заметил, что человек — это одушевленная вода . И действительно, на две трети наш организм состоит из воды. Даже в головном мозге, этом командном пункте, управляющем всеми нашими помыслами и поступками, содержится около 80 % воды. По выражению А. А. Покровского, вода является основной средой, а во многих случаях — участником бесчисленных химических реакций, лежащих в основе жизни . В этой среде протекают все сложные процессы превращения веществ, все процессы обмена. Причины уникальной роли воды для жизни следует искать в ее особых физико-химических свойствах, которые как нельзя лучше соответствуют биологическим функциям клеток (см. главу 15). [c.29]
Сведения о белках, их составе, строении и биологических функциях начали формироваться еще в ХУП —XIX вв. На этом этапе в разнообразных природных объектах (семена и соки растений, мышцы, хрусталик глаза, кровь, молоко и др.) в достаточно больших количествах были обнаружены вещества, при сжигании которых ощущался запах паленой шерсти и аммиака. Эти вещества растворялись в воде с образованием вязких, клейких растворов при испарении воды из этих растворов получалась роговидная масса, свертывающаяся при нагревании. Именно из-за этих специфических свойств данные соединения получили название белки, поскольку аналогичными свойствами обладает яичный белок. [c.35]
ВОДА СВОЙСТВА И БИОЛОГИЧЕСКИЕ ФУНКЦИИ [c.448]
Обоснуйте взаимосвязь физико-химических свойств и биологических функций воды. [c.455]
Как указывалось, в настоящее время известны биологические функции некоторых гликопротеинов лишь в некоторых случаях выяснена взаимосвязь между их молекулярной структурой и биологической функцией в других случаях, например для гонадотропина, пока еще неясно, каким образом содержащиеся в его молекуле углеводы влияют на гормональные свойства. Функции большинства гликопротеинов, в том числе и многих гликопротеинов плазмы, пока не установлены. Некоторые из этих веществ, несомненно, выполняют определенные функции в клетке. Например, они могут быть связаны с переносом воды или других соединений через клеточные мембраны. Эту функцию могут выполнять, очевидно, и многие кислые гликопротеины. [c.296]
Следовательно, кроме традиционных методов оценки качества питьевых вод, подвергнувшихся внешним воздействиям, особое значение при ее биологическом функционировании имеет анализ структуры воды. Однако проблемы взаимосвязи строения и биологических свойств воды оказались наименее изученными в гигиеническом аспекте. В следующих разделах работы более детально рассмотрены вопросы взаимосвязи физикохимических свойств, структурных особенностей различных питьевых вод и их биологических функций. [c.212]
Попадающие в воду пестициды не только ухудшают ее вкусовые качества, воздействуя на органолептические свойства воды прямо или косвенно, нарушая биологическое равновесие водоемов, но и отрицательно влияют на ряд жизненно важных функций человеческого организма. [c.963]
Комплексообразователи широко используются в процессах, когда необходимо удалить или замедлить осаждение катиона металла из водного раствора. Эти соединения могут использоваться в следующих случаях поверхностно-активные и моющие составы в текстильной промышленности, очистка металла и удаление окалины, полировка металла, для производства пластиков и резины, при производстве бумаги при обработке нефтяных скважин, как хелатообразователи в биологических системах. Важным свойством этих соединений является их способность связывать Ре (II). При обводнении нефтяного пласта использованную воду, содержащую некоторое количество Ре II) и Н,5, часто смешивают со свежей водой. Если эти несовместимые воды смешивать, то образуется осадок Ре5,который может закупорить водопроницаемый слой в «нагнетательной» скважине. Другой функцией хелатообразующих соединений является способность предотвращать гелеобразование и выпадение осадков гидроксидов железа в скважине и в вытекающей отработанной воде. Следующие примеры показывают методь приготовления этих соединений. [c.80]
Превращение золя в гель связано с возникновением особой внутренней структуры в этой системе. Частицы коллоидных веществ, соприкасаясь друг с другом, как бы склеиваются и образуют своеобразный каркас, в ячейках которого оказывается включенным значительное количество воды. Наличие этой структуры придает гелю характерные механические (вязкоэластические) свойства. Образование тончайшей сети переплетающихся нитей во многих гелях можно наблюдать при помощи электронного микроскопа, дающего увеличение в 30 000—40 ООО раз. Такую сеть, состоящую из переплетающихся нитей гидрофильного коллоида, можно, в частности, видеть на электронных микрофотографиях мышечных белков. Интересную электронную микрофотографию (рис. 4) дает мышечный белок — актин, биологическое значение и биохимические функции которого рассматриваются в главе Мышечная ткань . [c.16]
Суставной хрящ представляет собой ткань, которая покрывает эпифизы костей, образующих сустав. Будучи полимерным материалом, ОН представляет интерес в качестве объекта для исследования особой роли воды в полимерах. В биологическом смысле его основная физиологическая функция состоит в том, чтобы воспринимать нагрузки, возникающие при работе сустава. Если не касаться патологических изменений, то хрящ способен противостоять разнообразным видам напряжений, прилагаемых к нему в течение жизни человека. Несмотря на то что он обладает относительно небольшой способностью к восстановлению [1], он почти не подвергается сколь-нибудь заметному износу. Можно полагать, что его способность выдерживать большие нагрузки и обеспечивать быструю релаксацию напряжения обусловливает такую высокую степень его износостойкости. Настоящее исследование было предпринято с целью выяснить механизм поведения хряща при нагружении, а также его свойства в отношении релаксации напряжения. В конечном счете автор надеялся связать эти механизмы с уникальным химическим составом и ультраструктурой этой ткани. [c.386]
Известно, что ароматическим углеводородам присущи черты неэлектролитного действия при попадании в организм. Это наркотики, вызывающие угнетение функций центральной нервной системы, оказывающие местное раздражающее действие на слизистые и кожу и обладающие гемолитическими свойствами. С ростом молекулярного веса в гомологическом ряду усиливаются наркотические свойства, а также местное раздражающее действие, но до определенного предела падение летучести и растворимости в воде ограничивает возможность создания наркотических концентраций в воздухе и крови, в результате чего пары высших алкилбензолов в нормальных условиях не оказывают сколько-нибудь заметного биологического действия. Этими физико-химическими свойствами объясняется малая токсичность интересующих нас соединений по данным, почерпнутым из литературных источников. Так, Джерард [1] сообщает о слабой токсичности додецилбензола и дурола при введении в желудок крысы (доза 5 мл и 5 г кг не была смертельной для животных), автор предполагает раздражающее действие паров и аэрозолей на органы дыхания и указывает на возможность местного раздражения кожи. Псевдокумол по данным, собранным тем же автором, токсичнее от дозы 5 лл//сг погибло [c.179]
Одно из самых значительных достижений рентгеноструктурного анализа белков последних лет, которое не может не повлиять на дальнейшее развитие биологии и становление ее новой области -молекулярной биологии клетки, состоит в начавшейся расшифровке трехмерных структур первых мембранных белков. Перед обсуждением полученных здесь результатов целесообразно кратко сообщить о том, что было известно об этих белках до исследования их с помощью рентгеновской дифракции. Если основные структурные особенности биологических мембран определяются молекулами липидного бислоя, то специфические функции мембран выполняются главным образом белками. Они ответственны за процессы превращения энергии, выступают в качестве рецепторов и ферментов, образуют каналы активного и пассивного транспорта молекул и ионов различных веществ через мембраны, охраняют организм от проникновения чужеродных антигенов и стимулируют иммунный ответ клеточного типа. В обычной плазматической мембране белок составляет около 50% ее массы. Однако в некоторых мембранах, например во внутренних мембранах митохондрий и хлоропластов, его содержание поднимается до 75%, а в других, например миелиновой мембране, снижается до 25%. Многие мембранные белки пронизывают липидный бислой насквозь и контактируют с водной средой по обеим сторонам мембраны. Молекулы этих белков, называемых трансмембранными, как и окружающие их молекулы липидов, обладают амфипатическими свойствами, поскольку содержат гидрофобные участки, взаимодействующие внутри бислоя с гидрофобными хвостами липидов, и гидрофильные участки, обращенные к воде с обеих сторон мембраны. Другая группа мембранных белков соприкасается с водой только с одной стороны бислоя [234, 235]. Одни из них погружены только во внешний или во внутренний слой мембраны, другие ассоциированы за счет невалентных взаимодействий с трансмембранными белками, третьи прикреплены к мембране с помощью ковалентно связанных с ними цепей жирных кислот, внедренных в липидный слой. [c.56]
Плоские липидные мембраны, наряду с липосомами, широко используются в качестве моделей для изучения электрических свойств мембраны, их проницаемости и других научных исследований. С помощью модельных мембран изучают ряд функций биологических мембран, а том числе, барьерную (например, селективность проницаемости — хорошую проницаемость для воды и плохую для ионов). Можно моделировать биологический транспорт, вводя в модельную мембрану молекулы-переносчики. [c.30]
Природная целлюлоза состоит из мономеров глюкозы, соединенных между собой посредством Р(1 4)-гликозидной связи. Благодаря Р-связям остатки глюкозы образуют вытянутую пйлимерную цепь (см. рис. 11-16). Между нисколькими параллельными цепями возникают межмолекулярные водородные связи, в результате чего формируются длинные жесткие нерастворимые волокна. Гликоген также состоит из остатков глюкозы, но они соединены друг с другом а(Г -> 4)-связями. Такая а-связь между остатками глюкозы вызывает изгиб цепи и препятствует образованию длинных нитей. Кроме того, гликоген сильно разветвлен (рис. 11-15). Эти структурные свойства обеспечивают высокую степень гидратации гликогена, поскольку многие гидроксильные группы обращены к воде. Поэтому гликоген можно экстрагировать в диспергированном виде горячей водой. Физические свойства этих двух полимеров хорошо подходят для выполнения ими их биологической функции. Целлюлоза служит структурным материалом в растениях, что согласуется с ее способностью агрегировать с образованием нерастворимых волокон. Гликоген играет роль запасного горючего в организме животных. Сильно гидратированные и незащищенные гранулы гликогена быстро гидролизуются гликогенфосфорилазой до глюкозо-1-фосфата. Этот фермент действует только на нередуцирующие концы, поэтому высокая степень разветвления полимера обеспечивает наличие в нем множества мест, доступных действию гликогенфосфорилазы. [c.358]
Специфическим свойством эволюционно отобранной аминокислотной последовательности является способность принимать в физиологических условиях вполне определенную, уникальную конформацию, которая определяет биологическую функцию белка. Такой способностью белки обладают, несмотря на значительную конформационную свободу аминокислотных остатков и малые значения барьеров вращения вокруг ординарных связей основной и боковых цепей. Плотная, глобулярная структура белковой молекулы непосредственно доказывается малой вязкостью белков в растворе и большей их плотностью по сравнению с синтетическими полипептидами. Молекулы последних образуют в тех же условиях рыхлые клубки с открытой структурой, в которых растворитель занимает до 99% всего объема. Отсюда сравнительно большие линейные размеры клубков и значительная вязкость белков в этом состоянии. Молекулы нативных белков содержат в несколько раз меньшее количество связанной воды (-30% по массе), они малы по линейным размерам и незначительно загущают раствор. На это указывает вся совокупность результатов исследования белка и синтетических полипептидов методами седиментации, диффузии, светорассеяния, рентгеноструктурного анализа, нейтронографии, рассеяния рентгеновских лучей под малыми углами, электронной микроскопии. [c.231]
К настоящему времени накоплено множество данных по проявлению золотого сечения в физических и биологических системах. Установлены ранее неизвестные связи золотого сечения со свойствами различных объектов, проявляющихся в физических свойствах воды, громкости, частоты звука, спектре видимого света, физико-механических свойствах твердых тел, физиологических функциях организма и т.п. Последние исследования фрактальных структур показали, что самоподобие фуллеренов, как геометрических, так и природных, контролируется золотой пропорцией или ее производными, связанными с обобщенной золотой пропорцией. Закон обобщенной золотой пропорции отвечает уравнению [c.164]
В процессе свободного окисления вследствие особенностей используемых цепей передачи электронов не происходит образования АТФ биологическая роль этих процессов заключается в метаболизме ряда природных и ксенобиотических субстратов. В последнем случае свободное окисление выполняет важную функцию модификации чужеродных соединений. К последним относятся лекарственные средства, гербициды, продукты загрязнения окружающей среды, в возрастающем количестве попадающие в организм с водой, пищей и атмосферным воздухом. Как правило, они имеют гидрофобные свойства. Многие из них являются канцерогенными. Их гидроксилирование в ходе свободного окисления облегчает последующую деструкцию и выведение из организма (см. главу 12 и 13). [c.314]
Мембранология как самостоятельная наука, изучающая строение, свойства, механизмы функционирования биологических мембран, сформировалась сравнительно недавно (1950—1970 гг.). Однако сам термин мембрана используется вот уже почти 150 лет для обозначения клеточной фаницы, служащей, с одной стороны, барьером между содержимым клетки и внешней средой, а с другой — полупроницаемой перегородкой, через которую могут проходить вода и растворенные в ней вещества. Однако мембраны представляют собой не только статически организованные поверхности раздела. Быстрое развитие биохимии мембран и прежде всего широкое исследование мембранных белков и липидов обусловили прогресс в понимании структуры и функций биологических мембран. [c.301]
Как модели, липосомы значительно ближе к биологическим мембранам, чем бислойные липидные пленки. Как и биологические мембраны, они предстввляют собой замкнутые системы, что делает их пригодными для изучения пассивного транспорта ионов и малых молекул через липидный бислой. В отличие от БЛМ, липосомы достаточно стабильны и не содержат органических растворителей. Состав липидов в липосомах можно произвольно варьировать и таким образом направленно изменять свойства мембраны. В настоящее время хорошо разработаны методы включения функционально-активных мембранных белков в липосомы. Такие искусственные белково-лнпидные структуры обычно называются протеолипо-сомами (рис. 310). Благодаря возможности реконструкции мембраны из ее основных компонентов удается моделировать ферментативные. транспортные и рецепторные функции клеточных мембран. В липосомы можно авести антигены, а также ковалентно присоединить антитела (рис. 311) и использовать их в иммунологических исследованиях. Они представляют собой удобную модель для изучения действия многих лекарственных веществ, витаминов, гормонов, антибиотиков и т. д. Как уже отмечалось, при образовании липосом водорастворимые вещества захватываются вместе с водой и попадают во внутреннее пространство липосом. Таким путем можно начинять липосомы различными веществами, включая [c.579]
Описание данных по качеству воды. Модуль качества воды WQ включает в себя четыре информационные компоненты. Первая группа данных получается в результате решения гидродинамической модели речной системы (модуль ПВ), поэтому модуль WQ всегда запускаются после модуля НВ. Для определения параметров несупдего потока используются полученные в НВ расходы и скорости как функции от времени для всех расчетных точек. Вторая группа данных содержит информацию о конвективной диффузии. Здесь перечисляются наименования компонент, единицы измерения концентрации для них, коэффициенты дисперсии (диффузия), начальные условия, коэффициенты распада (неконсервативности) несуш,его потока, открытые и закрытые граничные условия. Третья группа данных содержит информацию о граничных условиях для каждого загрязнителя (граничное условие и привязка к руслу речной системы). Четвертая группа описывает процессы взаимодействия биологически активных веш,еств (БПК, нитраты, аммоний) с кислородом. В этих данных указываются основные параметры этого взаимодействия с окружаюш,ей средой и свойства несуш,его потока реки (тепловая радиация, реаэрация, респирация, фотосинтез, температурные процессы и т.д.). Только наличие всех четырех типов данных позволяет произвести корректный расчет качества воды в речной системе. [c.316]
Токсическое действие. С. изменяет органолептические свойства воды, придавая ей выраженный землистый запах при концентрациях выше 1,0 мг/л. Пороговые концентрации С. по влиянию на органолептические свойства воды находятся в диапазоне 0,001-0,1 мг/л концентрация 2,5 мг/л — пороговая по влиянию на общесанитарный режим водоемов. В токсических дозах С. обладает политропным действием. Угнетает активность групп — 8Н ряда ферментов, нарушая ферментативные реакции, подавляет процессы биологического окисления и фосфорилирования, вызывает извращение фосфорно-кальциевого обмена, снижение интенсивности белкового обмена, нарушение функций печени и почек. С. и его соединения вызывают изменения иммунобиологической реактивности организма, нарушают условнорефлекторную деятельность, а также приводят к патоморфологическим изменениям некоторых внутренних органов. Помимо общетоксического действия, ингибирование групп — 8П ферментов позволяет относить С. к тиоловым ядам. Имеются указания на то, что С. обладает иммунотоксическим, эмбриотоксическим, тератогенным эффектами, угнетает митотическую активность и репродуктивную функцию. [c.490]
Вода играет важную роль в живых системах и в значительной степени определяет структуру и функции биологических полимеров, таких, как белки. Однако в этом сообщении мы сконцентрируем внимание в первую очередь не на том, как влияет вода на биополимеры, а на влиянии биополимеров на воду, которая с ними взаимодействует. Представляют интерес изменения структурных, энергетических и динамических свойств молекул воды. В результате изучения вращательной подвижности молекул воды на поверхности белков молекулы растворителя были поделены на три группы [1]. Первая группа включает быстро реориентируемые молекулы с временем вращательной релаксации (тг) не более 10 » с. В следующую группу входят частицы, имеющие время вращательной релаксации пример,но 10 с они предположительно идентифицируются как молекулы воды, связанные сильной связью с ионными остатками. Третья группа имеет Тг порядка 10- с эти молекулы растворителя считаются связанными с макромолекулами связями, запрещающими вращение примером могут служить четыре молекулы воды, распо- [c.31]
Равновесие 2К5Н- — /гОг = — ЗН + НгО сильно сдвинуто вправо, если раствор нейтрален или содержит неболь-щие количества щелочей в кислых растворах, наоборот, устойчивы сульфгидрильные группы 5Н. Связи — 5 —5 — могут быть внутримолекулярными или связывать мономерные единицы белка (например, сывороточный альбумин) в одну крупную частицу. В стабилизации формы молекулы играют роль и гидрофобные связи. Гидрофобные связи возникают за счет сил взаимодействия между углеводородными частями молекул белка. Углеводородные группы белковых частиц, находящихся в водной среде, ориентированы во внутренние зоны частицы, а гидрофильные группы (ОН, СООН) находятся на внещней стороне, которая обращена к воде. Вследствие этого внутри молекулы белка возникает углеводородное ядро, причем для того, чтобы его разрушить и перевести углеводородные группы в водную среду, надо затратить работу. Это и означает, что между углеводородными частями молекулы действуют силы притяжения. Кроме водородных, дисуль-фидных и гидрофобных связей, в поддержании формы молекулы белка принимают участие и другие факторы имеет значение возникновение солевых мостиков, действие сил Ван-дер-Ваальса особенно большое влияние оказывают молекулы воды. Сохранение определенной формы молекулы важно с биологической точки зрения. Оно обеспечивает, в частности, такое взаимное расположение групп атомов на поверхности молекулы, которое необходимо для проявления каталитической активности белка, его гормональных функций и т. д. Поэтому устойчивость глобул, так же как и многие особенности структур биологически активных молекул, не случайное свойство, а одно из средств стабилизации организма. [c.57]
Необратимое свертывание белка яиц при нагревании — явление хорошо известное. Подобное изменение в состоянии указанного белка может быть вызвано и действием ряда других физических и химических агентов сильным встряхиванием, облучением ультрафиолетовыми лучами, действием ультразвуковых волн, кислот, щелочей, органических растворителей, солей тяжелых металлов, мочевины, гуанидина, салицилатов и многих других веществ. При всех этих воздействиях белок теряет свою первоначальную растворимость и в большинстве случаев становится нерастворимым при изоэлектрической точке. В отличие от других белков коллаген при нагревании в воде растворяется. Измененные под влиянием всех указанных воздействий нативные белки получили название денатурированных белков. часто сопровождается потерей биологической активности белков. Так, например, ферменты теряют свою каталитическую активность, гормоны — физиологическую функцию, антитела — способность соединяться с антигеном. Эти изменения не всегда протекают параллельно изменениям физико-химических свойств белков. Денатурация, очевидно, представляет собой комплексное явление. Вряд ли можно думать, что действие столь различных соединений, как мочевина и серная кислота, а также влияние нагревания обусловливают одно и то же изменение белков. Нельзя поэтому просто говорить о денатурации белков, например яичного альбумина необходимо всегда указывать, какой именно агент вызвал денатурацию. [c.147]
Наряду с этим мы не обнаружили нарушений функции центральной нервной системы и симптомов поражения печени, характерных при воздействии других представителей этой группы. Очевидно, некоторыми различиями в физико-химических свойствах отдельных представителей галогенопроизводдых спиртов жирного ряда, в частности их способностью растворяться в жирах, обусловлены степень их токсичности и некоторые качественные различия в их токсикодинамических свойствах. Установлено, что этиленхлор — гидрин и эпихлор-гидрин, хорошо растворимые в жирах, обладают почти одинаковой токсичностью как нри нанесении на кожу, так и при введении их через рот. В то же время дихлоргидрин, нерастворимый в жирах, не проникает через неповрежденную кожу и не оказывает общетоксического действия. Можно предположить, что в силу незначительности липотропных свойств МХГ и ДХГ ограничивается их накопление в клетках центральной нервной системы, богатых липидами. Наряду с этим вследствие хорошей растворимости этих соединений в воде, а следовательно, и биологических жидкостях они способны быстро выводиться из организма. [c.138]
Изучение физико-химических свойств мембран удобно проводить на моделях монослоев, которые получаются при нанесении липидов на поверхность воды. Повышение давления и уплотнение монослоя приводят к тому, что подвижность углеводородных цепочек уменьшается, их взаимодействие друг с другом растет, а полярные головки фиксируются на поверхности раздела фаз. В пределе происходит такое уплотнение монослоя, где плошадь поперечного сечения молекулы липида не зависит от длины углеводородной цепи. Монослой представляет собой лишь половину липидного бислоя мембраны, и более удобной моделью служат различные искусственные бислойные липидные мембраны (БЛМ). Плоские ламеллярные структуры, могут сливаться, образуя замкнутые везикулярные частицы (липосомы), в которых липидные бислои отделяют внутреннюю водную фазу от наружного раствора. В везикулярные частицы можно встраивать белковые молекулы и другие компоненты биологических мембран для изучения механизмов их функционирования в биомембранах. Плоские БЛМ используются для изучения барьерных функций, электромеханических характеристик, а также межмолекулярных взаимодействий в мембранах. Электростатические взаимодействия осуществляются между заряженными группами либо в пределах одного полуслоя (латеральные), либо между разными слоями (трансмембранные). Дисперсионные вандерваальсовы взаимодействия между поверхностями мембран обнаруживаются на расстояниях до 1000 А. Это значительно превышает расстояния, где проявляется [c.131]
Почему же эти минералы и простое химическое соединение вода оказываются настолько близкими по своим свойствам к живым организмам, не обладая генами, которые обеспечивают постоянство строения и обусловливают изменчивость Ответ прост гены имеют к этим двум существенным качествам весьма отдаленное отношение. Такая констатация должна, казалось бы, уязвить мое самолюбие генетика во всяком случае она йгорчительна для тех, кто пытается решать все проблемы биологии, основываясь исключительно на функциях генов. У воды н кальцита генов нет, и однако в них уже заключены те механизмы, которые в настоящее время считаются главными атрибутами генов. В дальнейшем мы увидим, какова именно функция гена и насколько вторична его роль в биологических процессах. [c.103]
Одновременно с химическими методами, хотя и не так интенсивно, арсенал методов исследования биологических мембран пополнялся физическими методами. Так, измерение осмотических свойств клетки (Пфеффер, 1877), скорости процесса, вызывающего вторичное сокращение мышцы (Гельмгольц, 1850), некоторые опыты в исследованиях Э. Дюбуа-Реймона, В. Оствальда, X. де Фриза и Э. Рейда можно с уверенностью классифицировать как физические. А опыты Р. Чамберса по изучению проникновения веществ в клетку и их диффузии внутри клетки (1922), измерению электрической емкости и электрического сопротивления эритроцитов (Фрике, 1925 Хёбер, 1926), изменению поверхностного натяжения на границе липид — вода в зависимости от добавок различных веществ, которые провели Д. Даниэлли и X. Давсон в 1935 г., являются истинно физическими методами, одними из самых плодотворных в изучении структуры и функции мембран. Так, Даниэлли и Давсон, приняв во внимание, что уменьшение поверхностного натяжения на границе липид—протоплазма может быть следствием взаимодействия белковых и липидных молекул, а также используя данные и идеи преды- [c.5]
За более чем столетнюю историю витаминологии (науки о витаминах и их биологической роли) выделено и исследовано около 30 соединений, обладающих витаминной функцией. При изучении витаминов им сначала давали названия по имени того заболевания, которое вызывает недостаток или отсутствие данного витамина в пище. При этом к названию болезни добавляли приставку анти-. Позже их стали обозначать латинскими буквами. Таким образом, в настоящее время витамины имеют буквенные обозначения, химические названия и названия, характеризующие их физиологическое действие. Они также классифицируются по химической природе или физикохимическим свойствам. Последняя классификация наиболее известна. Так, по физико-химическим свойствам витамины делятся на водо- и жирорастворимые. К водорастворимым относятся аскорбиновая кислота, тиамин, рибофлавин, пантотеновая кислота, пиридоксин, фолиевая кислота, цианкоболамин, никотинамид, биотин к жирорастворимым — ретинол, кальциферолы, токоферолы, филлохиноны. К витаминоподобным соединениям принадлежат некоторые флавоноиды, липоевая, оротоновая, пагмановая кислоты, холин, инозит. [c.93]
Вопросу состояния воды и ее роли в биологических системах посвящено большое количество работ [ 10,11,38-42]. Основываясь на литературных данных, H.A. Аскоченская [36] указывает, что полифункциональность воды в живом субстрате базируется на выявленной структурной ассоциативной множественности ее в биологических системах. Авторы [43] отмечают, что в биологических объектах вода находится в двух состояниях свободная, обладающая всеми параметрами чистой воды, и связанная — с измененными свойствами, обусловливающая устойчивость организма к неблагоприятным условиям. Но свойства и той, и другой воды постоянно меняются. Обобщая результаты работ ряда исследователей, Ю.В. Новиков и соавторы [4] отмечают, что вода, связанная с клеточной протоплазмой, и вода, входящая в состав межклеточной жидкости и других образований организма, принимает структуру, напоминающую структуру льда. При этом структурированная вода более важна для сохранения функций и жизнеспособности тканей. А.К. Гуман [10] заключает, что конфигурация пустот ледяной решетки такова, что биомолекулы включаются в пустоты без всякого повреждения, с сохранением способности к проявлению жизненных функций, тогда как в плотноупакованной структуре они не могут войти в оптимальный контакт с водой. Используя метод рентгено-структурного анализа, авторы [44] приходят к выводу, что внутриклеточная вода эритроцита образует сложную пространственную сеть, в петлях которой расположены молекулы гемоглобина. И.М. Медведев и Т.П. Фисанович [45] считают, что структурированная вода является защитным фактором клетки, в частности эритроцита. По данным ряда авторов, вода с квазикристаллической структурой является катализатором ряда биохимических реакций [46-49]. [c.208]
Вода — определение, структура, характеристики, свойства, функции
Главная »Биохимия» Вода — определение, структура, характеристики, свойства, функции
Определение водыВода — это неорганическое жидкое химическое вещество, не имеющее цвета, запаха и вкуса, которое составляет большую часть гидросферы Земли и жидкостей в организме всех живых существ.
- Вода — чрезвычайно важный компонент для существования жизни, поскольку она жизненно важна для всех биологических процессов.Однако он не имеет калорийности или питательной ценности.
- Вода находится в жидком состоянии при стандартных атмосферных температуре и давлении.
- Он занимает 71% всей суши на Земле и около 70% от общей массы тела человека.
- Количество воды на Земле поддерживается за счет непрерывного движения воды от земли к атмосфере и обратно, называемого круговоротом воды.
- Вода также важна для различных химических процессов, поскольку является универсальным растворителем.
- Химическая формула воды — H 2 O, что указывает на то, что одна молекула воды состоит из двух атомов водорода и одного атома кислорода.
- Атомы в молекуле воды связаны друг с другом полярными ковалентными связями. Сама по себе молекула электрически нейтральна, но полярна с отрицательными и положительными зарядами, локализованными в разных областях.
- В молекуле воды s- и p-орбитали валентной оболочки sp 3 гибридизованы с образованием четырех гибридных sp 3 орбиталей, тетраэдрически ориентированных вокруг атома кислорода.
- Две гибридные орбитали заняты поодиночке, а неподеленные пары электронов занимают две другие.
- Каждая отдельная занятая sp 3 орбиталь перекрывается с наполовину заполненной орбиталью атома H.
- В результате атом кислорода связан с двумя атомами водорода двумя ковалентными связями O-H, и на атоме кислорода есть две неподеленные пары электронов.
- Самое стабильное расположение атомов — это то, где они находятся дальше всего.Угол между связями O-H составляет около 104 °, а не идеальный тетраэдр (109 °) из-за отталкивания между неподеленными парами.
- Таким образом, молекула воды имеет угловатую изогнутую структуру.
- Молекула воды полярна, потому что кислород более электроотрицателен, чем водород. Таким образом, атом кислорода притягивает к себе общие электроны.
- В результате на атоме кислорода развивается частичный отрицательный заряд, а у атома водорода — частичный положительный заряд.
- В жидкой фазе молекулы воды удерживаются вместе межмолекулярными водородными связями.
- Одна молекула воды способна образовывать четыре водородные связи, поскольку она может образовывать две связи с неподеленной парой кислорода и отдавать два электрона водороду.
- В воде образование четырех водородных связей приводит к межмолекулярной тетраэдрической структуре, образующей открытую структуру и трехмерную сетку связей.
- Твердая форма воды — лед, который может существовать в различных кристаллических формах в зависимости от условий замерзания воды.
- В обычном гексагональном льду каждый атом кислорода тетраэдрически окружен четырьмя другими атомами кислорода, тогда как один атом водорода находится между каждой парой кислорода.
- Таким образом, каждый атом водорода ковалентно связан с одним атомом кислорода и связан с другим атомом кислорода водородной связью.
- Это расположение вызывает упаковку атомов с большими открытыми пространствами, что приводит к уменьшению плотности льда по сравнению с жидкой водой.
- Когда лед тает, некоторые водородные связи разрываются, и молекулы воды становятся более плотными.
- Благодаря полярности молекул воды они способны притягивать друг друга. Эти взаимодействия представляют собой слабые притяжения, называемые водородными связями.
- Водородная связь в воде — это слабое взаимодействие между частично положительным атомом водорода и частично отрицательным атомом кислорода.
- Водородная связь в воде является межмолекулярной и происходит между двумя атомами двух разных молекул.
- Одна молекула воды способна образовывать четыре водородные связи, поскольку она может образовывать две связи с неподеленной парой кислорода и отдавать два электрона водороду.
- В воде образование четырех водородных связей приводит к межмолекулярной тетраэдрической структуре, образующей открытую структуру и трехмерную сетку связей.
- Структура, образованная после образования водородных связей, приводит к тому, что коллективное основное состояние жидкой воды имеет энергию ниже, чем основное состояние в отдельных газовых молекулах.
- Это создает стабильную структуру молекул воды в жидкой воде.
- Водородная связь, образованная в воде, является слабой, и ее прочность составляет одну двадцатую от силы ковалентной связи O-H.
- Срок службы этих облигаций также очень короткий, и они постоянно разрываются и образуются в течение коротких периодов времени.Таким образом, в жидкой воде поддерживается динамическое равновесие.
- Точно так же все молекулы воды в жидкой воде имеют по крайней мере одну водородную связь с соседней молекулой воды, в которой отсутствуют свободные молекулы воды.
- Водородная связь в воде удерживает молекулы воды примерно на 15% ближе, чем если бы существовали только ван-дер-ваальсовы взаимодействия.
- Однако водородная связь в воде является направленной, что ограничивает количество соседних молекул воды примерно четырьмя, чем большее количество в других жидкостях.
- Чистая вода — это прозрачная, бесцветная жидкость без запаха, которая легко улавливает запах любого растворенного в ней вещества.
- Точка замерзания, точка кипения, энтальпия плавления и энтальпия испарения воды выше по сравнению с гидридами других членов той же группы из-за межмолекулярных водородных связей между молекулами.
- Вода имеет высокий дипольный момент, что делает ее идеальной средой для растворения самых разных соединений.
- Высокая удельная теплоемкость воды позволяет ей поглощать тепло различных биохимических и физиологических реакций, происходящих внутри тела, с минимальным повышением температуры.
- Вода плохо проводит тепло и электричество, но добавление небольшого количества кислоты или щелочи делает ее электропроводящей.
- Воду также называют универсальным растворителем из-за ее способности растворять большее количество веществ.
- Эта способность обусловлена интенсивной водородной связью и полярностью молекул воды.
- Полярность воды заставляет воду вести себя по-разному с полярными и неполярными соединениями.
- Полярные молекулы воды могут образовывать слабые электростатические взаимодействия с другими полярными молекулами и ионами.
- Таким образом, полярные молекулы и ионы взаимодействуют с частично положительными и частично отрицательными концами воды, при этом положительные заряды притягивают отрицательные заряды.
- Когда количество молекул воды в растворе превышает количество молекул растворенного вещества, взаимодействия приводят к образованию трехмерной сферы воды, называемой гидратной оболочкой вокруг молекул растворенного вещества.
- Формирование гидратной оболочки обеспечивает равномерное диспергирование молекул растворенного вещества в растворе.
- Однако неполярные молекулы не взаимодействуют с водой и не образуют гидратных оболочек из-за отсутствия заряженных взаимодействий.
- Благодаря интенсивной водородной связи вода имеет очень высокую удельную теплоемкость и высокую теплоту испарения.
- Эти свойства позволяют воде смягчать климат и температуру Земли, смягчая большие колебания температуры.
- Аналогичный процесс происходит в организме, где вода предотвращает быстрое повышение температуры тела в результате различных биохимических реакций.
- Скрытая теплота плавления и испарения воды также высока, что предотвращает таяние ледников и дрейфующих льдов.
- Аномальное расширение воды — это ненормальное свойство воды, когда вода расширяется, а не сжимается, когда температура повышается с 4 ° C до 0 ° C.
- Таким образом, плотность воды максимальна при 4 ° C и уменьшается с понижением температуры.
- Это свойство воды является следствием того, что молекулы воды в состоянии замерзания удерживаются вместе притяжением H-O, а не притяжением O-O.
- Но поскольку взаимодействие H-O не такое сильное, как взаимодействие O-O, при замерзании наблюдается небольшое расширение воды.
Некоторые биологические функции воды перечислены ниже:
- Вода — это жизненно важная жидкость организма, которая необходима для регулирования таких процессов, как пищеварение, транспортировка питательных веществ и экскреция.Вода растворяет ионные и полярные органические соединения и позволяет транспортировать продукты пищеварения к нужным местам в организме.
- Вода регулирует температуру тела за счет потоотделения и испарения.
- Вода является средой для всех метаболических реакций в организме, поскольку все метаболические реакции в организме происходят в фазе растворения.
- Вода также обеспечивает среду обитания для различных животных в виде прудов, рек, морей и т. Д.
- Вода необходима для прорастания семян и процесса фотосинтеза, с помощью которого растения готовят себе пищу.
- Вода — это среда для переноса минералов из почвы в различные части растений.
- Вода помогает поддерживать структуру растений, обеспечивая соответствующее давление на ткани растений.
- Вода также способствует образованию различных биологических мембран, взаимодействуя с различными органическими соединениями.
- Вода также влияет на основные компоненты всех клеток, такие как ДНК и белки, где водородные связи регулируют сворачивание белков и нуклеиновых кислот.
- Структура двойной спирали ДНК также поддерживается молекулами воды, которые упорядоченно окружают ДНК.
- СК (2006). Концептуальная химия. С. Чанд и компания Ltd. Нью-Дели.
- 2% — https://sebiology.weebly.com/blog/water
- 1% — https://www.youtube.com/watch?v=I6LbFf__Z0Y
- 1% — https://www.usgs.gov/special-topic/water-science-school/science/heat-capacity-and-water
- 1% — https: // www.thinkco.com/definition-of-hydrogen-bond-605872
- 1% — https://www.slideshare.net/sureshss141/hydrogen-exercise-with-solutions
- 1% — https://www.reference.com/science/anomalous-expansion-water-7479a73146ba31d2
- 1% — https://www.entrancei.com/question-answer/all-metabolic-reactions-in-the-body-take-place-in-the-presence-of-27075
- 1% — https://quizlet.com/21532508/chap-3-water-and-life-flash-cards/
- 1% — https://pdfs.semanticscholar.org/9c1e/9c72b373726a426e4e3043f3f0a73a02cc16.pdf
- 1% — https://en.wikipedia.org/wiki/Water_(properties)
- 1% — http://www.esalq.usp.br/lepse/imgs/conteudo_thumb/Hydrogen-Bonding-in-Water.pdf
- <1% - https://yeahchemistry.com/questions/polar-vs-nonpolar-and-oil-vs-water
- <1% - https://www.usgs.gov/special-topic/water-science-school/science/ice-snow-and-glaciers-and-water-cycle
- <1% - https://www.oughttco.com/water-chemistry-facts-and-properties-609401
- <1% - https: // www.sciencedirect.com/topics/engineering/hydration-number
- <1% - https://www.khanacademy.org/science/ap-biology/chemistry-of-life/structure-of-water-and-hydrogen-bonding/a/hydrogen-bonding-in-water
- <1% - https://www.gkseries.com/general-science-questions-answers-on-physics/discussion-1
- <1% - https://www.dummies.com/education/science/chemistry/the-unusual-properties-of-water-molecules/
- <1% - https://www.chegg.com/homework-help/questions-and-answers/1-angle-tetrahed-bonds-diamond-angles-body-diagonals-cube-figure-10-use-vector -analysis-q18360262
- <1% - https: // www.britannica.com/science/vertical-mixing
- <1% - https://www.britannica.com/science/photosynthesis
- <1% - https://www.britannica.com/science/ice
- <1% - https://www.bartleby.com/essay/What-The-Boiling-Points-And-Enthalpy-Of-PKAUQJTW5G3D5
- <1% - https://ohtheme.com/water/
- <1% - https://en.wikipedia.org/wiki/Plant_nutrition
- <1% - https://en.wikipedia.org/wiki/DsDNA
- <1% - https: //chem.libretexts.org / Courses / Sacramento_City_College / SCC% 3A_CHEM_330 _-_ Adventures_in_Chemistry_ (Alviar-Agnew) /06%3A_Gases_Liquids_Solids_…_and_Intermolecular_Forces/6.03%3A_Forces_betles
- <1% - https://chem.libretexts.org/Courses/Oregon_Institute_of_Technology/OIT%3A_CHE_202_-_General_Chemistry_II/Unit_5%3A_The_Strength_and_Shape_of_Covalent_Bonds_Valence_Bonds_Valence_Bonds_5.3%3
- <1% - https://chem.libretexts.org/Courses/Eastern_Mennonite_University/EMU%3A_Chemistry_for_the_Life_Sciences_(Cessna)/4%3A_Covalent_Bonding_and_Simple_Molecular_Compounds/4.4% 3A_Полярная_и_Неполярная_Covalent_Bonds
- <1% - https://chem.libretexts.org/Bookshelves/Introductory_Chemistry/Book%3A_Introductory_Chemistry_(CK-12)/09%3A_Covalent_Bonding/9.16%3A_Hydrogen_Bonding
- <1% - https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_A_Molecular_Approach_(Tro)/10%3A_Chemical_Bonding_II-_Valance_Bond_Theory_and_Molecular_Orbital_Theory_Bond_Theory_and_Molecular_Orbital_Theory_SPA_One_V_Orbital_Theory/10
- <1% - https://brainly.in/question/3980650
- <1% - https: // brainly.в / вопрос / 318360
Вода в организме человека: взгляд анестезиолога на связь между физико-химическими свойствами воды и физиологическим значением
https://doi.org/10.1016/j.amsu.2017.12.007Получить права и контентОсновные моменты
- •
Вода — универсальный растворитель.
- •
Человеческие клетки зависят от нековалентных взаимодействий с участием водных связей.
- •
Вода — полярный растворитель, способный участвовать в растворах.
- •
Вода, помимо других процессов, участвует в сворачивании белков и модуляции поверхностного натяжения.
- •
Практика анестезиологии уходит корнями в знание структуры воды и ее взаимодействия.
Abstract
Уникальная структура и многогранные физико-химические свойства молекулы воды, в дополнение к ее универсальному присутствию в компартментах тела, делают воду ключевым игроком во многих биологических процессах в физиологии человека.Поскольку анестезиологи занимаются физиологическими процессами, в которых молекулы воды имеют решающее значение на разных уровнях, и вводят лекарства, фармакокинетика и фармакодинамика которых зависят от взаимодействия с молекулами воды, мы считаем, что изучение фундаментальных научных аспектов, связанных с водой и ее ролью в физиологии и фармакологии, актуально для практика анестезиологии. Цель этой статьи — очертить физико-химическую основу воды, которая имеет решающее значение для поддержки различных гомеостатических процессов.Проанализирована роль воды в образовании растворов, модуляции поверхностного натяжения и гомеостазе температуры тела, кислотно-основного статуса и осмолярности. Актуальность молекулярных взаимодействий воды для анестезиолога не ограничивается сферой физиологии и патофизиологии. Глубокие знания о важности воды в воздействии летучих анестетиков на нейроны открывают окно для нового всеобъемлющего понимания сложных клеточных механизмов, лежащих в основе практики анестезиологии.
Ключевые слова
Вода
Анестезия
Физико-химия
Осмолярность
Поверхностное натяжение
Рекомендуемые статьиЦитирующие статьи (0)
© 2017 Авторы. Опубликовано Elsevier Ltd от имени IJS Publishing Group Ltd.
Рекомендованные статьи
Цитирующие статьи
Вода, универсальный растворитель
• Школа наук о воде ГЛАВНАЯ • Темы о свойствах воды •
Знаете ли вы, что можно растворить M в M&M? Все, что вам нужно сделать, p , кроме нескольких M & M в воде стороной M вверх и наблюдайте, что происходит!
Кредит: кофейные чашки и мелки.com
Воду называют «универсальным растворителем», потому что она способна растворять больше веществ, чем любая другая жидкость. Это важно для каждого живого существа на земле. Это означает, что везде, где вода проходит через воздух, землю или через наши тела, она уносит с собой ценные химические вещества, минералы и питательные вещества.
Химический состав и физические свойства воды делают ее таким прекрасным растворителем. Молекулы воды имеют полярное расположение атомов кислорода и водорода: одна сторона (водород) имеет положительный электрический заряд, а другая сторона (кислород) — отрицательный.Это позволяет молекуле воды стать , притянутой ко многим другим типам молекул . Вода может настолько сильно притягиваться к другому соединению, как соль (NaCl), что может нарушить силы притяжения, которые удерживают натрий и хлорид в соединении соли вместе и, таким образом, растворяют его.
Наши почки и вода составляют отличную пару
Наши собственные почки и растворяющие свойства воды составляют отличную пару для сохранения жизни и здоровья.Почки отвечают за фильтрацию веществ, которые попадают в наш организм из продуктов и напитков, которые мы потребляем. Но почки должны избавляться от этих веществ после того, как они накапливают их. Вот тут-то и помогает вода; будучи таким прекрасным растворителем, вода, промывающая почки, растворяет эти вещества и выводит их из нашего тела.
На этой диаграмме показаны положительные и отрицательные части молекулы воды. Он также показывает, как заряд, например, на ионе (например, Na или Cl), может взаимодействовать с молекулой воды.
Кредит: Мариана Руис Вильярреал, Фонд CK-12
Почему соль растворяется в воде
На молекулярном уровне соль растворяется в воде из-за электрических зарядов и из-за того, что и вода, и солевые соединения полярны, с положительными и отрицательными зарядами на противоположных сторонах молекулы. Связи в солевых соединениях называются ионными, потому что они оба имеют электрический заряд — ион хлорида заряжен отрицательно, а ион натрия — положительно.Точно так же молекула воды имеет ионную природу, но связь называется ковалентной, когда два атома водорода располагаются с положительным зарядом на одной стороне атома кислорода, который имеет отрицательный заряд. Когда соль смешивается с водой, она растворяется, потому что ковалентные связи воды сильнее, чем ионные связи в молекулах соли.
Положительно заряженная сторона молекул воды притягивается к отрицательно заряженным ионам хлорида, а отрицательно заряженная сторона молекул воды притягивается к положительно заряженным ионам натрия.По сути, происходит перетягивание каната, когда молекулы воды выигрывают матч. Молекулы воды разъединяют ионы натрия и хлора, разрывая ионную связь, удерживающую их вместе. После разделения солевых соединений атомы натрия и хлора окружаются молекулами воды, как показано на этой диаграмме. Как только это происходит, соль растворяется, в результате чего получается гомогенный раствор.
Часто упоминалось ( e.грамм. [127]) что жизнь зависит от аномальных свойств воды. В в частности, большая теплоемкость, высокая теплопроводность и высокое содержание воды в организмах способствует термическому регулирование и предотвращение местных колебаний температуры. В высокая скрытая теплота испарения придает устойчивость к обезвоживанию и значительное испарительное охлаждение. Вода отличная растворитель из-за его полярности, высокой диэлектрической проницаемости и небольшой размер, особенно для полярных и ионных соединений и соли. 2 Имеет уникальный свойства гидратации в сторону биологических макромолекулы (особенно белки и нуклеиновые кислоты), которые определяют их трехмерную структуру и, следовательно, их функции в растворе. Эта гидратация образует гели, которые могут обратимо претерпевают фазовые переходы гель-золь, лежащие в основе многие клеточные механизмы [351]. Воды ионизирует и обеспечивает легкий обмен протонами между молекулами, так способствуя богатству ионных взаимодействий в биологии. При 4 ° C вода расширяется при нагревании или охлаждение. Этот максимум плотности вместе с низким Плотность льда приводит к (i) необходимости, чтобы все тело воды (а не только ее поверхности) близка к 0 ° C, прежде чем может произойти любое замерзание, (ii) замерзание рек, озер и океаны сверху вниз, поэтому изолируйте воду от дальнейшее замораживание, отражение солнечного света в космос и возможность быстрого оттаивания и (iii) тепловая конвекция, обусловленная плотностью вызывая сезонное перемешивание в более глубоких водах с умеренным климатом.Большой теплоемкость океанов и морей позволяет им действовать как резервуары тепла, так что температура моря колеблется только на треть столько же, сколько температура земли, и поэтому умеренный наш климат (, например, Гольфстрим несет тропическое тепло в северо-западную Европу). Сжимаемость воды снижает уровень моря примерно на 40 м дают нам на 5% больше земли. [65] Среди аномалий воды выделяются противоположные свойства горячей и холодной воды, с аномальным поведением более акцентируется при низких температурах.Как холодная жидкая вода нагревается он сжимается, становится труднее сжать, его преломляющий индекс увеличивается, скорость звука в нем увеличивается, газов становится меньше растворим и легче нагреть и лучше проводит тепло. Наоборот при нагревании горячей жидкой воды она расширяется, становится легче сжимать, его показатель преломления уменьшается, скорость звука внутри него уменьшается, газы становятся более растворимыми и труднее топить и беднее проводник тепла.С увеличением давление, движутся молекулы холодной воды быстрее, но молекулы горячей воды движутся помедленнее. Горячая вода замерзает быстрее чем тает холодная вода и лед, когда сжатый, кроме случаев высокого давления, когда жидкая вода замерзает при сжатии. Никакой другой материал обычно не бывает таким твердым, жидкость и газ. 3 Аномалии
1 Ли или Не кажутся аномальными свойства воды, зависит с какими материалами следует сравнивать воду и толкование «аномального». Например, можно утверждать, что вода обладает именно теми свойствами, которые можно было бы вывести из его структуры (см. e.грамм. [402]). Сравнение воды, жидкого натрия, аргона и бензола явиться Франксу [112] для обозначения некоторых из перечисленных выше свойств как не относящихся к аномальный. Однако эти материалы, пожалуй, не самые типично для жидкостей. В моем списке обычно приводятся необычные свойства. Понятно, что жидкая вода (и в одном случае лед) выдерживает вне «типичных» жидкостей (или, в одном случае, твердых тел).См. [242] за обзор, посвященный неаномальным свойствам воды; т.е. те, которые «такие же», как и для других жидкости. [Назад] 2 Следовательно, трудно получить действительно чистую воду ( например, < 5 частей на миллиард примесей). Для обзора прогноза растворимости в воде см. [744]. Примечание что лед, напротив, является очень плохим растворителем, и это может использоваться при очистке воды ( e.грамм. дегазация) с использованием последовательных циклов замораживания-оттаивания. [Назад] 3 Температура диапазон «горячей» и «холодной» воды в этих примерах различается; увидеть отдельные записи для подробностей. [Назад] |
(PDF) Вода: структура и свойства
Влияние растворенных веществ
Растворенные вещества нарушают структуру воды, в первую очередь в первой гидратной оболочке растворенного вещества
(слой воды, контактирующий
с растворителем), с меньшим влияние на более далекие
вод.
На рис. 2
показана rdf для жидкой воды вокруг гидрофобного (избегающего воды) растворенного тетраметиламмо-
ния
. Наблюдается небольшое усиление резкости распределения
, вызванное увеличением высоты первого пика и уменьшением
первого провала. Это указывает на повышенный порядок
воды в первой гидратной оболочке, но эффект невелик.
В расходе жидкой воды преобладают размер и упаковка
воды, т.е.е. за счет ван-дер-ваальсовых взаимодействий, и
они относительно нечувствительны к присутствию растворенного вещества.
Напротив, растворенные вещества оказывают большое влияние на угловую структуру воды
(
Рис. 3
). Аполярные растворенные вещества и группы
смещают бимодальное распределение водородной связи вода-вода
углов в сторону более ледяной, линейной формы, эффективно
увеличивая упорядоченность воды за счет уменьшения менее
упорядоченной совокупности водородных связей .Эти растворенные вещества не обладают способностью
к сильным электростатическим взаимодействиям с водой,
, и они взаимодействуют в основном через потенциал Ван-дер-Ваальса
. Их эффект по сути геометрический: они имеют тенденцию к
вытеснять более слабую водородно-связанную лицевую воду в координационной оболочке
(
, рис. 1d,
), тем самым уменьшая популяцию более изогнутых водородных связей на
. Ионы и полярные растворенные вещества и группы
имеют противоположный эффект.Они смещают распределение
водородных валентных углов в сторону более изогнутой формы.
Это следствие сильного электростатического взаимодействия, которое они могут производить с водой. Водные диполи имеют тенденцию выстраиваться
в направлении или от атомов с большими атомными частичными зарядами
, следовательно, искажая водородную связь вода-вода
(
Рисунок 1e
).
Гидрофобные и гидрофильные
Взаимодействия: вода как растворитель
Возможно, наиболее важная биологическая роль воды — это растворитель
.Он может растворять замечательное множество важных молекул
, от простых солей до
небольших молекул, таких как сахара и метаболиты, до очень больших молекул, таких как белки и нуклеиновые кислоты. Фактически воду
иногда называют универсальным растворителем. Практически все
молекулярных процессов, необходимых для жизни — химические реакции,
ассоциации и связывания молекул,
столкновений, обусловленные диффузией, ионная проводимость — будут иметь место только при значительных скоростях
в растворе, отсюда важность
растворяющие свойства воды.Не менее важным, чем способность воды
как хорошего растворителя, является ее отличное действие от растворителя
— тот факт, что она растворяет одни молекулы на
лучше, чем другие.
Рисунок 4
показывает относительную растворимость в воде
ряда растворенных веществ, которые имеют биологическое значение
или являются строительными блоками биологически важных макромолекул. Растворимость составляет более 50 порядков
величины! Верхний предел включает
ионов изаряженных аминокислот, таких как аргинин и аспарагиновая кислота.Эти
растворенных веществ являются гидрофильными (водолюбивыми). Эта категория также
включает некоторые другие нейтральные аминокислоты, такие как aspar-
агин, пептидный каркас белков, фосфат-
сахарный каркас нуклеиновых кислот, сахара и липидные группы
. На конце с низкой растворимостью находятся алифатические аминокислоты
, такие как лейцин, ароматические аминокислоты, такие как
фенилаланин, и углеводородные «хвосты» липидов. Эти
растворенных веществ являются гидрофобными.Другие растворенные вещества, такие как нуклеиновая кислота
,оснований и аминокислота триптофан, обладают промежуточной растворимостью
и не могут быть просто классифицированы как гидрофобные
или гидрофильные.
Физическая основа сольватации
Логарифм растворимости растворенного вещества пропорционален
термодинамической работе или свободной энергии гидратации
(DG
hyd
), необходимой для его переноса в воду из эталона
растворитель (здесь циклогексан).Высокая растворимость в воде соответствует
отрицательному (благоприятному) DG
hyd
, низкая растворимость
положительному DG
hyd
(необходимо провести работу по растворению растворенного вещества
). DG
hyd
напрямую связано со свойствами растворенного вещества
, воды и силой взаимодействия между водой
и растворителем. Именно здесь решающее значение имеют высокое поверхностное натяжение
и диэлектрическая проницаемость воды.Поверхностное натяжение
— это работа, необходимая для создания на единицу площади поверхности раздела воды —
вакуума (единицы силы на единицу длины равны
эквиваленту энергии на единицу площади). Необходимы работы
, так как взаимодействия должны быть нарушены, чтобы вывести воду изнутри
на поверхность.
можно разделить на два этапа гидратации растворенного вещества:
. создание в воде полости в форме растворенного вещества, которая требует работы
против поверхностного натяжения воды
;
.размещение растворенного вещества в полости, что включает в себя взаимодействие растворенного вещества с молекулами воды и реструктуризацию
воды.
Первый шаг всегда препятствует растворению любых растворенных веществ. Если
взаимодействия между растворенным веществом и водой слабые, как
для неполярных растворенных веществ и групп, член полости
преобладает и растворимость будет низкой. Термин полости
управляет агрегацией аполярных молекул для уменьшения площади поверхности
, контактирующей с растворителем.Это известно как гидрофобный эффект
. Напротив, когда полярное или ионное растворенное вещество
растворяется в воде, электрическое поле от парциальных атомных зарядов растворенного вещества
вызывает большую поляризацию
(переориентацию) диполей воды, приводящую к притягивающему электростатическому полю
(реакция поле) обратно на
растворенного вещества. Это приводит к высокой растворимости — результат
высокой диэлектрической проницаемости воды и причина того, что
может растворять широкий спектр ионных и полярных растворенных веществ.
Таким образом, растворимость определяется двумя основными факторами
:
Вода: структура и свойства
6
Взаимосвязь между гидратацией и молекулярными свойствами на границах раздела липидных мембран
Вода является распространенным товаром и выполняет различные важные функции . Он стабилизирует структуру биологических макромолекул, контролирует биохимическую активность и регулирует межфазные / межмолекулярные взаимодействия. Общие аспекты межфазной воды могут быть получены путем обзора основных функций и свойств в различных временных и пространственных масштабах.Важно понимать водородные связи и структурные свойства воды, а также оценивать отдельные молекулярные частицы, имеющие разные гидратные свойства. Молекулы воды образуют водородные связи с биомолекулами и способствуют регулированию их свойств, таких как поверхностный заряд, гидрофильность и структурная гибкость. В этом обзоре обобщены фундаментальные свойства молекул воды и методы, используемые для анализа динамики воды. В частности, на примере липидной мембраны обсуждается взаимосвязь между свойствами гидратации, определяемыми молекулами, и свойствами молекул, определяемыми их свойствами гидратации.Соответственно, представлены интересные функции воды, которые предоставляют полезную информацию в областях биохимии, медицины и пищевой химии.
1. Введение
Вода — это многочисленная и интересная молекула, которая выполняет различные функции в биологических системах. В этом контексте он вызвал большой интерес в различных областях исследований. Вода — единственный растворитель, который можно пить без серьезного риска для здоровья человека, и поэтому он незаменим в пищевой и медицинской областях.В частности, состояние гидратации пищи является одним из важных и определяющих факторов ее качества. Содержание воды (влаги) в пище определяет ее тонкий вкус и текстуру. Соответственно, контроль количества и состояния воды имеет решающее значение для сохранения качества пищи, поскольку устранение воды резко снижает рост живых видов (бактерий и грибов). Сушка и замораживание пищевых продуктов предотвращают рост микроорганизмов и, таким образом, представляют собой полезные методы сохранения пищевых продуктов.И наоборот, сушка и замораживание могут ухудшить вкус пищи, потому что характеристики воды (или льда) играют очень важную роль в организации составляющих структур материалов в продуктах питания. Соление и засахаривание также улучшают пищевую стабильность, в то время как более высокие концентрации соли приводят к денатурации белков. Коллоидные свойства раствора также зависят от количества воды. В системах, которые состоят только из масляных компонентов, поведение фазового разделения может зависеть от состава, температуры, pH, концентрации соли и присутствия поверхностно-активных веществ.В случае агаровых гидрогелей, часто используемых в качестве съедобных полимеров, их жесткость может вносить вклад в качестве определяющего фактора вкуса, при этом состояние гидратации является значительным фактором, определяющим губчатую структуру сформированного гидрогеля. Принимая во внимание вышесказанное, качество пищи зависит от состояния гидратации и структуры компонента.
Что касается стабильности и свежести пищевых продуктов, важное понятие относится к методу / подходу, необходимому для поддержания структуры клеток, белков (или ферментов) и самоорганизующихся соединений в пищевых материалах.Способность молекул воды функционализировать биологические молекулы и их сборки изучается в течение многих лет [1]. Молекулы воды необходимы для поддержания физиологической функции и структуры клеток. Следовательно, необходимо понимать, как он ведет себя как модулятор с различных точек зрения, включая химические, физические и биологические. Биологические интерфейсы, например, поверхности белков, нуклеиновых кислот и липидных мембран, обычно находятся в хорошо гидратированном состоянии, а свойства межфазной воды привлекают интерес исследователей в течение многих лет [2–5].Функции белков во многих случаях сильно связаны с их структурой, в том числе с гидратным водным слоем, где состояние гидратации поверхности белка влияет на конформацию белка [6]. Кроме того, молекулы воды, связанные с белками, могут работать, чтобы модулировать конформационные свойства белковых мотивов [7, 8]. В клеточных системах поведение воды на поверхности липидной мембраны напрямую связано с поддержанием клеточной структуры и их взаимодействием с биомолекулами [9].Информация о гидратационных свойствах липидной мембраны также полезна в медицинской и биологической областях. Кроме того, полярность липидной мембраны (гидрофильность) является важным индикатором доставки питательных веществ и лекарств в клетки, как с точки зрения оценки биосовместимости, так и модуляции биодоступности [10, 11]. Следовательно, требуется точное понимание основных свойств гидратации липидной мембраны.
Липидная двухслойная мембрана организована на основе гидрофобных взаимодействий между амфифильными молекулами, которые составляют гидрофобно-гидрофильную поверхность раздела в водной системе.Липидные бислои, обычно присутствующие в клеточных мембранах и часть внешних мембран внутриклеточных компартментов, действуют как физические барьеры, препятствующие свободному проникновению воды и водорастворимых соединений, таким образом играя важную роль в поддержании клеточного гомеостаза. В различных типах биологических поверхностей раздела (включая липидные мембраны) ключевые аспекты, касающиеся ролей молекул воды, следующие: (1) гидратные свойства, на которые может влиять образование водородных связей между гидратационными молекулами воды и веществом. представляющих интерес, и (2) классификация молекул воды в соответствии с их характеристиками гидратации, такими как свойства / характеристики сильной гидратации, проявляемые на границе раздела или в объеме.Хотя гидратационные свойства пищи сложны, водный слой гидратации каждого компонента (белков, нуклеиновых кислот, мембран и других малых молекул) по-прежнему актуален с точки зрения химии, биологии, медицинской химии и т. Д. (Рисунок 1) .
В таких системах, как белки, липидные мембраны и поверхности полимеров, межфазные молекулы воды существуют в виде гидратных водных слоев и проявляют свойства, отличные от свойств в объемной воде. В случае гидратной воды в фосфолипидной двухслойной мембранной системе состояние связывания гидратной воды варьируется в зависимости от положения связывания [12].Группа воды, которая связывается непосредственно на границе раздела, может рассматриваться как группа воды гидратации первого порядка. Кроме того, связывающие молекулы воды вокруг первой группы могут быть более гибкими, и эти группы можно рассматривать как гидратные группы воды второго порядка. Недавно было зарегистрировано повышенное внимание к классификации межфазной гидратационной воды по таким группам, поскольку каждая гидратная группа воды может играть важную роль в (а) модуляции структуры и функции белка и (б) регулировании адгезии между (био) материалами [13 ].Также важно оценить термодинамические свойства гидратации вместо наблюдения за связующими свойствами. Разделение межфазных молекул воды на несколько групп позволяет понять их вклад. Понимание свойств гидратации важно для пищевых материалов с точки зрения структурной стабильности и функции каждого компонента, включая липидные мембраны. В этом обзоре обобщены недавние подходы, принятые для исследования свойств воды, и фундаментальная взаимосвязь между гидратацией и молекулярными свойствами, с особым акцентом на свойствах липидных мембран.
2. Основные свойства молекул воды / Наблюдение за водой
Молекулы воды термически диффундируют в жидкости для выполнения определенных функций, принимая определенные структуры: Эйзенберг и Каузманн предположили, что структура молекул воды классифицируется в зависимости от времени наблюдения (Рисунок 2 ) [14]. (A) I, структура в каждый момент ( t < τ v ) (b) V, структура, усредненная по вибрации ( τ v < t < τ D ) (в) D, структура, усредненная с учетом ориентации и движения молекул ( τ D < t )
Порядки τ v и τ D равны 10 −13 с и 10 −12 с соответственно.Большинство свойств воды исследуются на предмет связи с D-структурой, в то время как существует несколько методов измерения, относящихся к V-образной структуре. Оценка поведения гидратационной воды может зависеть от метода измерения в соответствии с характеристиками целевой воды.
2.1. Экспериментальный подход: наблюдение за прямым движением молекул воды
Рентгеновская и нейтронная дифракционная спектроскопия являются типичными экспериментальными методами, которые использовались для оценки молекул воды на нуклеиновых кислотах, белках, липидных мембранах, обратных мицеллах и т. Д.Обсуждалась также ориентация молекул воды внутри гидратного слоя [15–19]. Свойства гидратного слоя непростые. Соответственно, соответствующие исследования гидратных слоев обсуждаются в разделе 3. Учитывая, что измерения дифракции рентгеновских лучей и нейтронов требуют кристаллизованных образцов, молекулярная структура и структуры могут отличаться от таковых в системах с водными растворами. В частности, эти подходы эффективны для определения потенциальных свойств, таких как стереоскопические характеристики на границе раздела (включая гидратную воду).Малоугловое рассеяние рентгеновских лучей (МУРР) и малоугловое рассеяние нейтронов (МУРН) были приняты для оценки молекулярных структур в нанометровом масштабе и часто используются для исследования гидратного слоя [20–23]. Анализ молекулярного распределения предполагает, что плотность воды в гидратном слое белка примерно на 15% выше, чем плотность воды в объеме [21, 23]. Кроме того, в липидных двухслойных системах избыточное количество молекул воды может быть распределено в области границы раздела мембрана-объем [24].Используя SAXS, можно оценить структурные свойства пищи. С научной точки зрения, самоорганизованную структуру майонеза можно разделить на эмульсионные гели (эмульсии масло-в-воде) или на бинепрерывные кубические фазы [25].
Инфракрасная (ИК) и рамановская спектроскопия могут использоваться для исследования поведения гидратной воды на границах раздела [26–29]. Многие исследователи сообщают о не связанных водородными связями молекулах воды на основе анализа спектроскопии комбинационного рассеяния света [29–31].Обычно H 2 O или D 2 O используются в качестве растворителей для биологических видов, и анализируется вклад мод колебаний колебаний O-H или O-D со стороны целевых молекул. Walrafen et al. наблюдали изобестическую точку в колебательных модах O-D, измеренных при различных температурах. При наложении этих спектров каждый спектр давал точку пересечения на определенной частоте. Изменяя температуру, частоты, полученные из чистого α 2 и чистого β 2 (при этом α и β соответствуют поляризуемости и анизотропии, соответственно) дали изобестическую точку.Это говорит о том, что вода с водородными связями и без водородных связей находится в термодинамически равновесном состоянии [32, 33]. Значение Δ H ° связи ОН – О было оценено как –2,6 ккал / моль [34]. В измерениях комбинационного рассеяния и ИК-излучения несколько типов колебательных пиков суммируются в одном спектре, и, таким образом, деконволюция пиков является эффективным инструментом для определения вклада каждой молекулы или связи [35–37]. Эти методы очень полезны для оценки динамического поведения молекул воды.
Гибкие молекулы, такие как растворенные вещества в водных системах или молекулы в системах самосборки, демонстрируют динамическое поведение в ответ на внешние раздражители. Это происходит из-за переориентации связанных молекул воды. Спиновую релаксацию изотопов водорода или кислорода можно измерить как функцию времени [38]. В общем, молекулярная динамика может быть оценена с точностью до наносекунд, чтобы исследовать поведение белков и нуклеиновых кислот [39–41]. Соответственно, время чистой вращательной корреляции молекул воды получается на основе дисперсии магнитной релаксации (MRD) для отслеживания медленной динамики, связанной с биомолекулами.В экспериментальных подходах трудно различить молекулярное поведение молекул воды, потому что различия физико-химических свойств между свободной водой (объемная вода) и гидратной водой чрезвычайно малы. Соответственно, широко используются подходы компьютерного моделирования (например, МД-моделирование и т. Д.) [42–44]. Кроме того, измерения ЯМР отражают информацию обо всех молекулах всей системы. Однако может быть трудно идентифицировать сигналы воды гидратации и воды растворителя при измерениях ЯМР раствора.Напротив, анализ MRD широко изучается для мониторинга динамического поведения молекул и, как было показано, дает результаты, которые сильно коррелируют с результатами моделирования [45–47].
Колебательная спектроскопия генерации суммарной частоты (SFG) позволяет наблюдать асимметричную молекулярную фракцию вблизи границы раздела [48]. Он в основном используется для анализа состояния гидратации липидной мембраны на границе раздела воздух-вода [43] и применяется для отслеживания направления, в котором молекулы воды ориентируются вокруг головной липидной группы (H-up, H- вниз) [49, 50].Хотя существуют ограничения, связанные с направленностью на границе раздела и условиями эксперимента, SFG является мощным инструментом, используемым для оценки ориентации молекул воды на молекулярной поверхности.
2.2. Экспериментальный подход: наблюдение молекул воды как группы
В спектроскопии диэлектрической релаксации можно наблюдать поведение дипольных моментов молекул воды [51–54]. Если система охвачена переменным электрическим полем, диполь молекулы воды демонстрирует дебаевскую релаксацию.Учитывая, что время релаксации воды имеет отношение к характеристикам гидратации, его значение зависит от времени переориентации отдельных молекул [55]. Точное определение масштаба каждой водной группы все еще обсуждается. Кроме того, объемные молекулы воды влияют на молекулы гидратированной воды в окрестности молекулы-мишени [41, 56, 57]. Следовательно, необходимо учитывать тот факт, что наблюдаемая динамика воды совместно ограничена по сравнению с ее исходными характеристиками.В качестве усовершенствования экспериментального метода количество молекул гидратной воды можно оценить на основе деконволюции множественных релаксационных пиков [44].
Динамическое рассеяние света (DLS) и оптический эффект Керра чувствительны к показателю преломления растворителя. Подобно анализу диэлектрической релаксации, релаксация полярного тензора может быть измерена с использованием этих методов. Учитывая, что молекулярный полярный тензор воды почти изотропен, эти методы существенно исследуют коллективные трансляционные перестройки молекул воды [56, 57].С помощью терагерцовой спектроскопии можно измерить физические свойства, соответствующие искажению сетки водородных связей в дальнем ИК-диапазоне. Сравнивая полосы около объема и молекулы, можно обнаружить водородную связь около молекулы. Используя этот метод, вокруг белков было обнаружено существование динамической гидратной оболочки толщиной 20 Å [58–61]. В этом определении есть некоторые допущения, относящиеся к ограничению этой оболочки, включая, например, ее равномерное распределение.Диэлектрические свойства относятся к активности воды ( a w ), которая представляет собой репрезентативный показатель сродства к воде с пищевым материалом. Имеются сообщения о применении упомянутого выше диэлектрического анализа для исследования и мониторинга качества пищевых продуктов [62, 63].
2.3. Экспериментальный подход: косвенное наблюдение за поведением воды
Высокочувствительная и конкретная информация о биологическом интерфейсе может быть получена с помощью методов молекулярного зонда.Чтобы оценить гидратационную среду на биологических границах раздела, были разработаны многочисленные флуоресцентные молекулы, в которых зонды чувствительны к их локальному окружению [64]. Были разработаны и оптимизированы различные молекулы зондов: здесь зонд предпочтительно связывается с молекулой-мишенью и вызывает сильные флуоресцентные сигналы, отражающие их микроскопическое окружение. Обычно внутренняя часть биомолекул (ядро белков, участки цепей нуклеиновых пар оснований) является гидрофобной по сравнению с водой, и вставленный флуоресцентный зонд может, таким образом, испускать более сильный сигнал флуоресценции.Например, обнаженный гидрофобный сайт в денатурированном белке или на поверхности самосборки, такой как липидная мембрана, можно обнаружить с помощью чувствительных к полярности зондов, таких как 8-анилино-1-нафталинсульфоновая кислота (ANS) и 6- (п-толуидино) нафталин-2-сульфонат (TNS) [65–69]. Чувствительные к растворителям флуоресцентные зонды, такие как 6-пропионил-2-диметиламинонафталин (продан), 6-додеканоил-2-диметиламинонафталин (лаурдан), ANS и TNS, широко используются для характеристики липидной мембраны [70– 73].Эти молекулы имеют дипольный момент после их возбуждения и вызывают релаксацию окружающих молекул воды. Следовательно, они обладают различными флуоресцентными характеристиками в зависимости от степени релаксации растворителя [74, 75]. Специфичность расположения флуоресцентного зонда в липидных мембранах имеет свои преимущества и недостатки. Преимущество заключается в том, что выбор конкретного зонда позволяет нам анализировать более локализованную информацию в отношении липидного бислоя, например, область поверхности мембраны, контролируемую 1- (4-триметиламмонийфенил) -6-фенил-1,3,5- гексатриен (ТМА-DPH), например.Внутреннюю область мембраны можно контролировать с помощью 1,6-дифенил-1,3,5-гексатриена (DPH) [76]. Недостатком является то, что свойство флуоресценции (квантовый выход) можно изменять в зависимости от полярности и вязкости растворителя. Таким образом, информация, полученная с помощью одного флуоресцентного зонда, может включать несколько факторов. Соответственно, изменение свойства мембраны может быть вызвано внешней молекулой (например, связыванием с белком) и наоборот. Эти проблемы можно решить с помощью нескольких флуоресцентных датчиков.Поэтому рекомендуется использовать несколько типов зондов, чтобы можно было систематически исследовать межфазную полярную среду [77–79].
Тип и количество молекул воды можно определить с помощью дифференциальной сканирующей калориметрии (ДСК) на основе теплового баланса процессов замораживания / оттаивания воды. В полимерных системах молекулы воды можно разделить на промежуточные и свободные типы воды, и их можно наблюдать при (а) температурах эндотермических пиков> 0 ° C и (b) <0 ° C, соответственно [80, 81].Поскольку вода в полимерах не замерзает при температуре ниже 0 ° C, ее можно отличить от свободной воды (объемной воды). Следовательно, количество незамерзающей воды можно оценить, определив разницу между количеством промежуточной воды и свободной воды, полученной из всей системы. Это очень эффективный метод, поскольку теплоемкость можно оценить по пику разбавления / плавления. Что касается оценки воды в биомолекулах, структура молекулы в значительной степени влияет на характеристики гидратации.Таким образом, дифференциация типа воды представляет собой серьезную проблему. Каждый экспериментальный подход имеет ограничения в отношении наблюдаемого времени, отводимого на динамику целевой молекулы. Согласно предыдущим отчетам, экспериментальные подходы, использованные для исследования динамики воды, обобщены на Рисунке 3.
2.4. Подход к моделированию поведения воды
Для компьютерного моделирования динамики воды важно задать силовые поля воды и сосуществующих молекул.До сих пор многие потенциальные функции были предложены для создания молекулярного поведения в подходах к моделированию [83]. Учитывая, что наиболее широко используемые подходы основаны на теоретических и экспериментальных результатах, были разработаны различные модели молекул воды, такие как TIP3P, TIP4P, SPC и др. [84–87]. Среднее число ближайших соседних молекул увеличилось почти до пяти в жидкой воде. Кроме того, среднее количество водородных связей на молекулу уменьшилось до трех по сравнению с состоянием льда.Недавние исследования выявили возможные структуры кластеров воды, состоящих из четырех или восьми молекул, а механизм, ответственный за флуктуации плотности, хорошо подтверждается результатами моделирования [88]. Некоторые типичные водные кластеры, такие как циклический пентамер, бициклооктамер и трицикло-декамер, относительно стабильны, а также изучалось динамическое поведение, обменивающееся непрерывным образованием сетей водородных связей [89].
Учитывая поведение воды как растворителя, необходимо провести имитационные расчеты в гидратном слое.Гидратную оболочку можно определить как группу молекул воды, в которой ориентация дипольного момента находится в хорошем расположении в первом слое (с толщиной, которая приблизительно равна 3,5 Å). Однако определение гидратной оболочки (или слоя) спорно, потому что молекулы воды в этих слоях проявляют разные свойства в зависимости от их состояний взаимодействия с другими молекулами [13, 42, 59, 60]. Расстояние до первого минимального значения в функции радиального распределения может быть определено как гидратная оболочка, включающая все вклады движущихся свойств молекул воды, таких как вращение, трансляция и водородные связи [82, 87, 90, 91].Наконец, можно исследовать механические свойства молекул воды, присутствующих в гидратированной оболочке [92].
3. Слой гидратации
Молекулы воды случайным образом распределяются в зависимости от их диполь-дипольных взаимодействий и образуют сеть водородных связей между молекулами воды посредством электростатических взаимодействий. В конечном итоге слой молекул воды образуется из гидрофобной границы раздела толщиной в несколько нанометров [93, 94]. Хотя определение гидратного слоя варьируется в зависимости от целевой поверхности раздела, аналогичную тенденцию можно наблюдать в пределах биологических поверхностей раздела.Uedaira et al. предложил концепцию структурированных гидратных слоев на основе исследований с использованием спин-решеточной релаксации ЯМР 17 O [95]. Авторы определили динамическое число гидратации n DHN , которое представляет динамические характеристики гидратации. Толщина структурированной воды составляет не менее нескольких нм независимо от типа материала, составляющего границу раздела, то есть гидратные слои, содержащие примерно 10 молекул воды, структурированы [95].
Израэлачвили и др.измерили межмолекулярные силы между пластинами слюды в разбавленных растворах KCl [96]. Взаимодействие двух интерфейсов было хорошо объяснено теорией DLVO с использованием расстояний 10 нм или меньше. При расстоянии до границ раздела менее 1,5 нм осцилляции возникали через каждые 0,25 ± 0,03 нм [97]. В этом случае между пластинами слюды находилось 6-7 ориентированных молекул воды. Краткодействующая сила гидратации между гладкими жесткими поверхностями всегда была колебательной, поскольку молекулы воды прикреплялись к группам гидратированной поверхности и образовывали упорядоченный слой [97].Эта сила отталкивания представляет собой синергетическое (поляризованное) взаимодействие водородных связей, которое ослабляется в зависимости от расстояния от поверхности [98, 99]. Интересно, что в гибких поверхностях, таких как липидные мембраны, эти колебания усредняются в монотонную силу отталкивания из-за шероховатости головной группы липидной молекулы и силы отталкивания тепловых флуктуаций, которая возникает из-за динамической природы поверхности липидной мембраны [100 –102].
Слой гидратации на твердой поверхности MgO состоит примерно из 10 молекул (с одномолекулярными слоями и слоями с толщиной, охватывающими две или три молекулы) [103].Первые молекулы воды ориентируются таким образом, что (а) один атом водорода обращен к атому кислорода MgO и (б) группы ОН ориентированы параллельно плоскости MgO. Толщина первого слоя находится в диапазоне 0,2-0,3 нм, в то время как второй слой представляет собой более распределенное выравнивание молекул воды со значениями толщины в диапазоне 0,4-0,6 нм. Толщины, равные трем и более слоям, эквивалентны объемной воде, и анизотропия ориентации исчезает. Согласно Zhang et al., Коэффициент самодиффузии воды в стенке капилляра ( ε = 5) находится в диапазоне от 4.От 5 до 4,9 × 10 −9 м 2 · с −1 , а объем воды в два раза меньше и равен 2,7 · 10 −9 м 2 · с −1 [104 ]. Группа молекул воды в виде слоя на такой границе раздела широко изучалась как функциональная вода [13, 61].
Предполагается, что в полимерной системе водный слой, обычно называемый промежуточным слоем, регулирует накопление белков [59, 82]. В системе разделения с использованием полимера, например, при искусственном диализе, учет активности молекул воды в этом промежуточном слое приводит к созданию высокоэффективной разделительной мембраны.Молекулы воды в этих промежуточных слоях измеряются с помощью ДСК, диэлектрической спектроскопии, ЯМР и так далее. В случае биополимеров утверждается, что слой, состоящий из одной молекулы, определяется как первый гидратный слой, в то время как второй гидратный слой имеет толщину, которая охватывает 2-10 молекул [13]. В биомолекулах на поверхности появляются полярные или заряженные участки, которые могут сильно взаимодействовать с первым слоем молекул воды через водородные связи или электростатические взаимодействия.Эти неоднородные состояния в гидратных свойствах могут приводить к генерации электрических полей. Однако эти свойства до конца не выяснены. Концепции, относящиеся к гидратному слою в соответствии с рассмотренными исследованиями, суммированы на рисунке 4. Пищевые материалы, полученные от животных или растений, можно рассматривать как собранную клеточную ткань, в которой передняя часть поверхности пищевого материала может состоять из клеточных мембран. В следующих разделах обсуждается корреляция между поведением гидратации и молекулярными свойствами, уделяя особое внимание липидным мембранам как представителям потенциальных функций биологических интерфейсов.
4. Свойства гидратации липидных мембран
Двухслойная липидная мембрана обеспечивает различную полярную среду, благодаря чему участки поверхности от головной липидной группы до глицериновой группы являются гидрофильными. Напротив, область внутренней мембраны является гидрофобной из-за накопленной углеводородной цепи [105]. Для экспериментального исследования липидных двухслойных мембран «липосома» может быть использована как искусственный самособирающийся объект с фосфолипидной мембраной (рис. 5).Слой гидратации образуется между объемными и гидрофобными областями ядра. Здесь слово «поверхность мембраны» указывает на гидрофильную область липидного бислоя, которая действует как граница раздела для взаимодействия с окружающей водой растворителя. «Интерфейс мембраны» указывает границу между гидрофильной и гидрофобной областями мембраны, то есть область вокруг карбонильной группы липидных молекул. Состояние гидратации липидной мембраны является сложным (не может быть просто определено) из-за различных факторов, таких как, например, химическая структура головной липидной группы, состояние упаковки ацильной цепи, латеральное взаимодействие между липидами и т. Д.Типичный цвиттерионный фосфолипид, например диацилглицерофосфохолин (PC), известный как лецитин, обладает как отрицательно заряженной фосфатной группой, так и положительно заряженной холиновой группой. Эти цвиттерионные головные группы сильно гидратированы за счет водородных связей с водой-растворителем. В фосфатной группе связанные молекулы воды сохраняются в тетраэдрической структуре вокруг атомов кислорода [106–108]. Молекулы воды, связанные с положительно заряженной холиновой группой, слабо связаны друг с другом в состоянии клатратной гидратации [106, 107].Как показано на мембране 1,2-дипальмитоил- sn -глицеро-3-фосфохолин (DPPC), молекулы воды вокруг фрагментов CH 2 в холиновой группе распределены в соответствии с распределением Гаусса, независимо от мембраны. фазовое состояние. Следовательно, их существование нельзя игнорировать [82].
В общем, гидратный слой, сформированный на поверхности ПК-мембраны, предотвращает доступ водорастворимых молекул, несмотря на существование тонкого гидратного слоя, который имеет толщину приблизительно 1 нм [24].Пока неясно, как такой гидратный слой может препятствовать доступу к внешним молекулам. Более толстый гидратный слой может стабилизировать самоорганизующуюся структуру мембраны, что является одной из важных тем, связанных с дизайном носителей лекарств [110]. Свойство гидратации мембраны можно варьировать в зависимости от головной липидной группы. Кроме того, липиды, модифицированные полиэтиленгликолем (ПЭГ) и гликолипидами, допускают существование большого количества молекул воды в форме гидратированной губки [111].Принимая во внимание другие факторы, которые влияют на поведение гидратации, исследование с помощью моделирования связанной динамики исследовало тот факт, что водородные связи между молекулами воды усиливаются на липидной мембране, состоящей из липидов фосфоэтаноламина (PE) [107]. PE имеет небольшую головную группу, которая создает плоскую поверхность мембраны, что приводит к заключению липидных молекул. С этой точки зрения считается, что однородность зарядовых характеристик поверхностного слоя также способствует стабильности связей между молекулами воды [112].
В исследованиях с использованием SFG были оценены направление и характеристики гидратации молекул воды на гидрофильной / гидрофобной границе. Одним из преимуществ измерений SFG является наблюдение ориентации молекул, локализованных на границе раздела объем-мембрана [48, 106]. В системе липидного монослоя, образованной на границе раздела воздух-вода, молекулы воды в анионных липидных мембранах, такие как 1,2-дипальмитоил- sn -глицеро-3-фосфо- (1′- rac -глицерин) ( DPPG) ориентированы так, чтобы направлять атомы водорода к липидной головке, в то время как молекулы воды, превышающие фосфатную группу, ориентированы так, что атомы водорода направлены в противоположном направлении [48].Для катионных липидных мембран, таких как 1,2-дипальмитоил-3-триметиламмоний-пропан (DPTAP), ориентация гидратного водного слоя противоположна таковой в случае DPPG, где вода на основной стороне и внутри мембраны направляет атомы кислорода к головной группе [48]. Такая ориентация воды очень важна для понимания сложной гидратационной среды на поверхности липидной мембраны.
Со структурной точки зрения было также высказано предположение, что молекулы воды, существующие среди ацильных цепей, вносят вклад в стабильность структуры молекулы на основе моделирования и исследований FTIR [113, 114].Аларкон и др. проанализировали состояние гидратации DPPC с помощью моделирования и подтвердили, что молекулы воды между ацильными цепями образуют цепочечную конфигурацию, которая стабилизируется в кармане ацильной цепи. Кроме того, эти результаты согласуются с экспериментальными результатами [19]. В случае липидных молекул, которые обладают донорными или акцепторными группами водородной связи, такими как сфингомиелин, молекулы воды могут выстраиваться относительно группы NH основной структуры, а также относительно фосфатных и холиновых групп из-за сильного водорода. связывают акцепторы атомов кислорода в воде.Сравнение PC и сфингомиелина с одинаковой длиной ацильной цепи показывает, что мембраны сфингомиелина имеют несколько гидратных слоев из-за водородной связи с водами растворителя, что подтверждается измерениями ЯМР [115]. Что касается ненасыщенного сфингомиелина, возможность взаимодействия межмолекулярных водородных связей может быть заменена водородными связями, образованными с молекулами воды, которые увеличивают молекулярную гибкость в соответствии с подходами квантовой химии [116]. Предполагается, что тонкие различия конфигурации, такие как насыщенная и ненасыщенная конфигурации, могут повлиять на поведение гидратации.
Как правило, липидные мембраны, состоящие из липидов с ненасыщенными ацильными цепями, проявляют гидрофильные свойства из-за их слабой ориентации липидов. Напротив, липидная мембрана, состоящая из насыщенных липидов, проявляет довольно гидрофобные свойства из-за высокой плотности упаковки липидов при температуре ниже температуры фазового перехода. Липидные рафты, в основном состоящие из сфингомиелина и холестерина, являются гидрофобными из-за их плотноупакованного состояния мембран [117].Конфигурация «зонтичной модели», при которой головная группа сфингомиелина покрывает холестерин и экранированную область внутренней мембраны, может вносить вклад в дегидратированную среду внутренней мембраны [118]. Считается, что эта зонтичная конструкция перемещает гидратные слои воды вокруг головной группы наружу. Наконец, изгнанные молекулы воды могут накапливаться в виде оболочки, которую можно наблюдать как слои молекул воды высокой плотности на поверхности мембраны.
Как показано в примерах выше, состояние гидратации в липидной мембране очень сложно, и механизмы стабилизации каждой гидратации могут варьироваться разными молекулами.Однако очень интересная задача — выяснить, определяют ли свойства мембраны характеристики гидратации или характеристики гидратации определяют свойства мембраны, и как это работает для взаимодействия с биомолекулами. В следующем разделе представлены характеристики мембраны, определяемые свойствами гидратации.
5. Свойства мембраны, определяемые гидратацией
Учитывая межфазное взаимодействие, электростатические взаимодействия действуют на больших расстояниях.Напротив, гидратные воды обеспечивают сильное отталкивание (называемое силой гидратации, как уже упоминалось в разделе 3), которое применяется на очень коротких расстояниях [119]. Основываясь на измерениях поверхностных сил, возникающих между двухслойными мембранами, было подтверждено, что существует дополнительная сила отталкивания, полученная из силы гидратации для толщины гидратации приблизительно 2 нм или меньше [120]. Дополнительная энергия требуется, чтобы вызвать обезвоживание области головной группы. Дополнительные подходы увеличивают силу отталкивания на расстояниях в пределах 0.2-0,3 нм [121]. Эта сила отталкивания предотвращает адгезию каждой липидной мембраны. Поэтому интересно знать, как липидные мембраны взаимодействуют с другими биомолекулами, такими как ферменты, за пределами этой гидратной стенки.
В цвиттерионном липидном бислое молекулы липидов имеют суммарный заряд, равный нулю. Свойства поверхностного заряда определяются гидратной оболочкой. Карбонильные и фосфатные группы обладают неподеленной парой электронов, и связанные с ними молекулы воды могут быть поляризованы.Зарядовые свойства фиксированного слоя (липида) экранируются анионами (ван-дер-ваальсовы взаимодействия, а не электроотрицательностью) и катионами [122]. Ширина этого слоя определяется плоскостью скольжения, определяющей потенциал ζ [123]. Учитывая, что группы ПК имеют ориентированные наружу фосфатные группы, можно предположить, что можно рассматривать плоскости скольжения от фосфатных групп. Однако следует обращать внимание на интерфейсы, где на поверхностных слоях возникают неровности, такие как отрицательно заряженные фрагменты фосфатидилсерина (PS) и донор водорода фосфатидилинозитола (PI).Таким образом, неоднородность латерального распределения липидов может быть важным фактором для создания потенциального поля для взаимодействия.
Степень водонасыщения также влияет на ориентацию дипольного момента головной липидной группы. В высокогидратированной межфазной области ориентация молекул гидратной воды вокруг карбонильных и фосфатных фрагментов может модулировать ориентацию головной группы [114, 124]. При низкой степени гидратации направление дипольного потенциала в головной группе меняется на противоположное, и потенциал поверхностного заряда мембраны, таким образом, проявляет отрицательно заряженные свойства [125, 126].Увеличение средней площади головы может быть вызвано гидратационным набуханием. Например, средняя площадь головной группы молекулы лецитина и расстояние между соседними молекулами липидов на ее мембранной поверхности составляют 0,7 нм 2 и 2,7 нм, тогда как 0,45–0,55 нм 2 и 1,3 нм для липидов PE соответственно. Таким образом, сила отталкивания между головными группами ПЭ довольно мала [122]. Молекулы воды в гидратной оболочке мембраны прочно связываются с полигидроксильными соединениями, такими как трегалоза, сахароза и арбутин, тем самым влияя на дипольный потенциал липида [127–132].Прямая корреляция между поляризованной водой среди полярной головной группы и дипольным потенциалом может быть объяснена вытеснением воды трегалозой и флоретином [127]. Гидратация может поддерживать выравнивание дипольного момента головной липидной группы и приводит к регулированию электрохимических свойств липидной мембраны.
Проницаемость молекул воды влияет на упаковку плоскости мембраны и образование доменов [125, 133–135]. Согласно предыдущему обзору, который суммировал структуру мембраны и ее отталкивание от проницаемости, количество молекул воды, которые стабилизируют внутреннюю плоскость мембраны, считается равным 10 на ПК [136].Молекулы воды, непосредственно гидратирующие карбонильные и фосфатные группы, непроницаемы, а молекулы воды, гидратированные косвенно, считаются проницаемыми. Когда популяция молекул воды превышает указанное число, на липидно-липидные взаимодействия может влиять наличие воды. По мере уменьшения плотности упаковки в гидрофильной части мембраны проникновение воды увеличивается. Это также относится к способности молекул воды обмениваться, потому что молекулы воды могут сильно взаимодействовать с полярными группами других молекул, которые могут препятствовать проникновению воды через водородные связи.Например, в присутствии декстрана или ПЭГ молекулы воды в гидратной оболочке липидной мембраны могут экструдироваться из-за сильного сродства с полярными молекулами [137, 138]. Обезвоживание, основанное на проникновении наружу, сжимает мембрану и уменьшает ее объем [139]. Структурные изменения могли бы происходить энергетически выгодным образом, регулируя некоторые параметры, такие как плотность упаковки мембраны или ориентация головной липидной группы. Такое поведение проявляется в мембранах и во взаимодействиях между отдельными молекулами.Следовательно, дефект конфигурации, вызванный экструзией воды, может быть целью замещения других молекул, таких как головная липидная группа или проникновение других молекул [107, 140].
Обмен водой между внутренней частью липидной мембраны и основной областью наблюдался в экспериментах ЯМР [141]. Ориентация гидрофильной группы может влиять на водный обмен. Количество гидратной воды будет либо уменьшаться по мере изменения ориентации, либо гидратный слой вокруг головных групп будет препятствовать обмену воды [142–144].Этот обмен может быть важной концепцией для рассмотрения активности гидратированной воды. Когда вода поступает в мембрану из объема, поперечное поверхностное натяжение увеличивается [107]. Увеличение поверхностного давления могло бы происходить при проникновении пептида. В частности, для анализа взаимодействия с пептидами в монослойной системе используется «отсеченное» поверхностное давление, при котором поверхностное давление становится нечувствительным к проникновению пептида [122, 145]. «Срезанное» поверхностное давление для ПК и полиэтилена составляет приблизительно 40 мН / м и 30 мН / м.6 мН / м соответственно. Принимая во внимание поверхностное давление насыщенного монослоя ПК, которое находится примерно в диапазоне 46,6–48,0 мН / м, поверхностное давление монослоя ПК, при котором он нечувствителен к проникновению пептида, относительно ниже. На основании этих результатов предполагается, что белок не проникает при давлениях, которые намного ниже, чем давления, при которых заполняется головная группа. Это указывает на то, что для адсорбции белка требуется дополнительная свободная энергия, что позволяет предположить, что термодинамически активная вода превышает таковую в гидратированной оболочке.Значительно более низкое «предельное» поверхностное давление монослоя полиэтилена указывает на существование меньшего количества термодинамически активной воды. В других экспериментах липидные мембраны, состоящие из PEs, взаимодействуют с протеазой с значительно меньшей скоростью по сравнению с PC [146]. Разница между ограниченными молекулами гидратированной воды вокруг карбонильных или фосфатных групп и молекулами воды, свободно диспергирующимися в области головной группы, может определять поверхностную активную энергию для взаимодействия с другими молекулами путем замены водородных связей [146].Высокая свободная энергия липидов означает, что эти свободные молекулы воды также могут влиять на поверхностное давление [107]. Согласно исследованиям, представленным в этом обзоре, корреляция свойств гидратации и липидных молекул суммирована на рисунке 6.
6. Выводы
Вода является одной из самых основных и фундаментальных молекул в природе. Он существует в различных материалах и изменяет их уникальные и интересные свойства, но его фактическая функция и роль по-прежнему неоднозначны.В этом обзоре мы представили характеристики молекул, гидратированных водой, рассматривая поведение гидратации на границе раздела липидной мембраны в качестве примера системы самосборки. Как упоминалось в разделе «Введение», становится важным понять науку о воде, чтобы прояснить свойства водородной связи воды (что такое и как она связана водородными связями) и классификацию (сколько воды каждого типа присутствует) вокруг биоматериал. В частности, в пищевой химии структурная стабильность клеточной мембраны и гомеостаз функции клетки или активности белка являются важными проблемами для сохранения свежести материала.Учитывая, что количество потребителей, заинтересованных в изысканной пище, растет в поисках здоровых, вкусных и антивозрастных продуктов, требуется разработка пищевых материалов с улучшенными характеристиками. Чтобы удовлетворить эти требования, было предпринято множество попыток использования химических подходов. Некоторым требуется повышенная проницаемость для питательных веществ, в то время как другим необходимо поддерживать активность ферментов. Следовательно, необходимо правильно понимать фундаментальное поведение клетки и ее активность, чтобы функционировать и поддерживать ее физиологические ценности.
Как показано в случае липидных мембран, свойство гидратации воды определяет ориентацию головной группы липидной мембраны, площадь липида, способность обмена с объемной водой и силы отталкивания. Кроме того, сами молекулы воды регулируют свою популяцию в зависимости от свойств кластеризации наиболее энергетически выгодными способами. Характеристики, определяемые гидратацией, могут привести к характеристикам поверхностного заряда всей системы, взаимодействию с другими молекулами и слиянию липидных мембран.Эта функциональная регулировка, вызванная водой, не ограничивается липидными мембранами, но вносит вклад в основную структуру других молекул, таких как белки, нуклеиновые кислоты и другие. С точки зрения синтетической химии, можно ожидать различных многообещающих перспектив в отношении здоровья или лекарственной эффективности. Однако безопасность всегда является сложной задачей. Вода — это многочисленная молекула, и для контроля ее функциональной активности используются методы с наименьшими энергетическими затратами и максимальной безопасностью. На основе использования имитационных расчетов и передовых экспериментальных методов было достигнуто устойчивое понимание функции молекулы воды.Будущие задачи будут включать классификацию, основанную на характеристиках гидратации, которые в дальнейшем потребуются для понимания различных систем, понимания тенденций и понимания исходных характеристик воды, которые в конечном итоге могут привести к проектированию функций воды.
Конфликт интересов
Авторы не заявляют о конфликте интересов.
Выражение признательности
Эта работа была в первую очередь поддержана Японским обществом содействия науке (JSPS), субсидия KAKENHI для научных исследований (A) (26249116), субсидия для молодых ученых (B) ( 16K18279), субсидии для сложных исследовательских исследований (T15K142040) и субсидии для научных сотрудников (JP18J11666).
Объясните, какое значение имеют свойства воды для живых организмов.
Вода — это среда жизни. Его четыре ключевых свойства — термические свойства, способность действовать как универсальный растворитель, когезия и адгезия — помогают поддерживать жизненные процессы и среду обитания практически всех организмов. Вода — полярная молекула, а это означает, что ее заряд неравномерно распределен с дельта-отрицательным кислородом и 2-мя дельта-положительными атомами водорода. В целом это приводит к небольшому положительному заряду и способствует многим другим свойствам.Способность воды действовать как универсальный растворитель во многом связана с ее полярностью. Полярные молекулы, как правило, притягиваются к полярным молекулам другого типа, нежели друг к другу, что означает, что молекулы воды заставляют другие полярные молекулы диссоциировать и растворяться. Это позволяет перемещать различные ионы и растворимые вещества в растворе, что особенно важно для функционирования цитоплазмы клетки, где происходит множество реакций. Точно так же этим свойством занимаются транспортные системы вроде кровеносной системы человека.Универсальная растворимость воды означает, что определенные аминокислоты, железо и хлорид натрия могут более эффективно переноситься с кровью. Кроме того, вода обладает тепловыми свойствами, известными как высокая удельная теплоемкость и высокая скрытая теплота испарения. Последнее означает, что вода требует значительного количества энергии для испарения, что позволяет ей действовать как хладагент, что важно для терморегуляции млекопитающих через потоотделение. С другой стороны, высокая удельная теплоемкость означает, что воде требуется много энергии для изменения состояния, что делает ее стабильной средой для водных видов.Сплоченность — это свойство воды, которое заставляет молекулы воды притягиваться друг к другу. Поскольку атомы водорода заряжены положительно, а атом кислорода — отрицательно, когда различные молекулы воды находятся в одном и том же месте, разноименные заряды будут притягиваться. Это образует водородные связи, которые каплями удерживают воду. Это свойство важно для создания поверхностного натяжения в водоемах, а это означает, что это благоприятная среда обитания для нескольких насекомых. Это также позволяет воде более эффективно вытягиваться ксилемой.Наконец, адгезия — это то, как молекулы воды притягиваются к другим полярным молекулам и прилипают к ним. Это также важно для транспорта ксилемы: вода притягивается к поверхности ксилемы, а это означает, что ее легче подтянуть вверх по листьям для фотосинтеза (поддерживая жизнь растения).
.





 Участвует в ряде химических реакций.
Участвует в ряде химических реакций.