Страница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
891011121314
15161718192021
22232425262728
2930
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Метки
Настройкидля слабовидящих
минералокортикоид, регулирующий водно-солевой обмен — 600 р.
 – ЦЭЛТ
– ЦЭЛТГормон коры надпочечников, который удерживает постоянство уровней натрия и калия и связанного с ними объема жидкости.
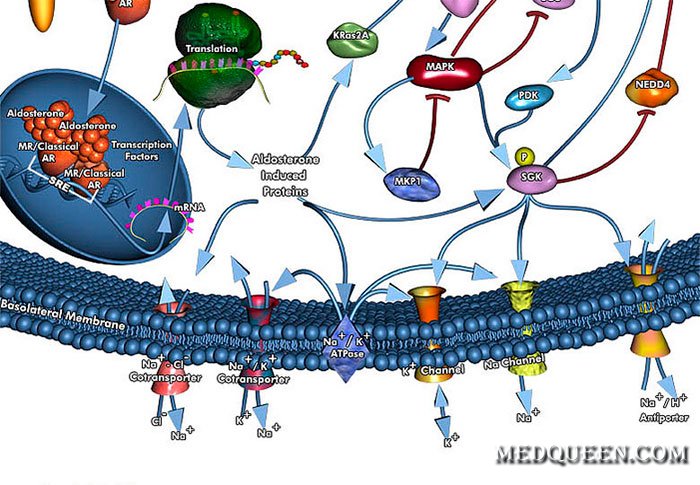
Место образования альдостерона – кора надпочечников, функция – удерживать натрий и выводить калий. Эти минералы «командуют» объемом крови в сосудистом русле. Альдостерон относится к группе минералокортикоидов.
Уровень гормона находится под управлением двух белков – ангиотензина и ренина. Если кровяное давление снижается, начинается синтез ренина. В это время содержание натрия уменьшается, а калия – растет. Образовавшийся ренин стимулирует несколько последовательных превращений ангиотензина, который сужает сосуды и запускает синтез альдостерона. Итог согласованных действий – нормализация артериального давления и минеральный гомеостаз.
Выработка ренина начинается не только при снижении артериального давления, но и в таких случаях:
Образование ренина и ангиотензина – сложнейший процесс, необходимые для этого вещества производятся в головном мозге, почках, яичниках, сердце и сосудах, жировой ткани. Три вещества – ренин, ангиотенизин и альдостерон – собраны в единую систему (РААС), которая регулирует сосудистый тонус и объем циркулирующей крови.
Три вещества – ренин, ангиотенизин и альдостерон – собраны в единую систему (РААС), которая регулирует сосудистый тонус и объем циркулирующей крови.
Действие альдостерона не ограничивается сосудистой стенкой. На его уровень откликаются клетки почек и головного мозга. В почках под его действием изменяется состав мочи – увеличивается натрий и снижается калий. В центральной нервной системе в ответ на повышение альдостерона увеличивается активность сосудодвигательного центра. В стенках сосудов увеличивается производство коллагена для усиления каркасных свойств. Коллаген также дополнительно вырабатывается при стимуляции альдостерона в тех местах, где есть повреждения, особенно в сердце и сосудах.
Болезни, при которых гормона вырабатывается либо слишком мало, либо слишком много, нарушают функции всех органов.
Наиболее частая причина увеличения выработки альдостерона – болезнь Конна, когда причиной гиперальдостеронизма становятся различные опухоли надпочечников. Производство гормона надпочечниками при этом резко повышено, что ведет к накоплению натрия и избыточному выведению калия. Натрий связывает много жидкости, что приводит к гипертонии, а калий мешает работе почек и мышц.
Натрий связывает много жидкости, что приводит к гипертонии, а калий мешает работе почек и мышц.
По механизму обратной биологической связи повышение уровня альдостерона происходит при опухолях и хроническом воспалении почек, при длительной существующей артериальной гипертензии.
Минеральный дисбаланс приводит к головным болям и слабости, ноющим болям в сердце, мышечной слабости и периферическим судорогам, нарушениям движений, снижению зрения, никтурии или усиленному ночному мочеиспусканию, сбоям ритма сердца.
Недостаточная выработка гормона происходит при аддисоновой или бронзовой болезни, когда поражаются оба надпочечника. Снизить уровень выработки могут генетические дефекты, когда нарушаются разные процессы синтеза гормона. Расстройства, связанные с диабетом, также ведут к снижению выработки.
Если альдостерона мало, резко снижается уровень натрия, а вслед за ним – количество жидкости. Проявляется это быстрой утомляемостью, головными болями, снижением артериального давления и ускоренным сердцебиением. Сниженный уровень калия ведет к сдвигу рH в кислую сторону, развивается ацидоз. Это проявляется разнообразными нарушениями ритма сердца, спазмами мышц, кислородным голоданием, помутнением сознания.
Сниженный уровень калия ведет к сдвигу рH в кислую сторону, развивается ацидоз. Это проявляется разнообразными нарушениями ритма сердца, спазмами мышц, кислородным голоданием, помутнением сознания.
У здорового человека уровень гормона зависит от количества натрия, поступающего с пищей и от положения тела. Минимальное содержание альдостерона отмечается утром в горизонтальном положении, максимальное – вечером в вертикальном.
Гормон выделяют из венозной крови методом иммуноферментного анализа, единицы измерения – пг/мл (пикограмм на миллилитр).
Показатель интерпретируется индивидуально в каждом конкретном случае врачом.
Уровень от 0 до 30 мг/дл считается нормальным, далее — высокий риск формирования атеросклероза.
Диуретики | Dopinglinkki
С поправками от 16.9.2019
Тело человека на 60 % состоит из воды [1]. В живых организмах вода находится в виде внеклеточной и внутриклеточной жидкости. Количество внеклеточной жидкости должно оставаться почти постоянным, чтобы клетки функционировали должным образом. Жидкости человека содержат различные соли, концентрация которых точно регулируется. Если концентрация солей становится слишком сильной или слишком слабой, возникают метаболические нарушения [2]. Наиболее важными солями крови человека являются натрий и калий. Внеклеточная жидкость содержит преимущественно натрий, а внутриклеточная жидкость — калий. Оба необходимы для нормального функционирования клетки. Солевой баланс в организме можно легко измерить по плазме. [3,4]. Количество натрия в плазме обычно составляет около 3,2 г/л, или около 140 миллимоль/л (ммоль/л) [4]. Уровень калия в плазме относительно низок (0,15 г/л), но имеет большое значение для обмена веществ. Эталонные значения калия составляют 3,3–4,9 ммоль/л [3].
Жидкости человека содержат различные соли, концентрация которых точно регулируется. Если концентрация солей становится слишком сильной или слишком слабой, возникают метаболические нарушения [2]. Наиболее важными солями крови человека являются натрий и калий. Внеклеточная жидкость содержит преимущественно натрий, а внутриклеточная жидкость — калий. Оба необходимы для нормального функционирования клетки. Солевой баланс в организме можно легко измерить по плазме. [3,4]. Количество натрия в плазме обычно составляет около 3,2 г/л, или около 140 миллимоль/л (ммоль/л) [4]. Уровень калия в плазме относительно низок (0,15 г/л), но имеет большое значение для обмена веществ. Эталонные значения калия составляют 3,3–4,9 ммоль/л [3].
Функция почек заключается в удалении посторонних веществ, отходов и поддержании стабильного баланса жидкости и электролитов в организме. Поэтому почки являются основным регулятором жидкостного и электролитного баланса организма: они производят до 180 литров сильно разбавленной первичной мочи (так называемой ранней мочи), состоящей из воды и электролитов.
К диуретикам относятся несколько различных лекарственных препаратов, которые отличаются друг от друга, помимо прочего, химической структурой и механизмом действия. Диуретики подразделяются на тиазидные диуретики и их производные, короткодействующие солевые диуретики, калийсодержащие и другие диуретики [5].
К диуретикам тиазидной группы относится гидрохлоротиазид. Фуросемид и буметанид являются короткодействующими солевыми (петлевыми) диуретиками. Спиронолактон, триамтерен и амилорид являются калийсберегающими диуретиками. К другим диуретикам относятся, например, ингибиторы карбангидразы (ацетазоламид и дорзоламид), а также осмотические диуретики, такие как маннитол, который вызывает водный диурез [5].
Диуретики применяются в лечении повышения артериального давления, сердечной недостаточности и отеков, а также других состояний [5, 6]. Для лекарственной терапии повышения артериального давления используются диуретики, которые повышают экскрецию натрия и хлорида с мочой [3]. Лечение сердечной недостаточности при помощи диуретиков направлено на снижение содержания воды и солей в организме человека, при этом также снижается объем циркулирующей крови.
Солевые диуретики применяются особенно в тех ситуациях, когда требуется быстрый и эффективный диурез. К этим ситуациям относится лечение отека легких, гипертензивных кризов и отравлений. [5] Солевые диуретики также применяются для лечения сердечной недостаточности [6].
Эффективность калийсберегающих диуретиков выражена меньше, по сравнению с другими диуретиками. Таким образом, при лечении повышения артериального давления они применяются в сочетании с тиазидными диуретиками.
Свойства различных диуретиков отличаются друг от друга [5]. Солевые диуретики обладают более высокой эффективностью, по сравнению с тиазидными диуретиками, тогда как калийсберегающие диуретики менее эффективны, чем другие диуретики [3]. Кроме того, различаются механизмы действия разных классов диуретиков [5].
Тем не менее, в целом можно отметить, что диуретики предотвращают реабсорбцию электролитов и воды в почках, в результате чего повышается экскреция мочи и электролитов.
Тиазидные диуретики повышают экскрецию натрия, калия, хлорида и воды. Кроме того, солевые диуретики также увеличивают экскрецию кальция с мочой. Среди калийсберегающих диуретиков спиронолактон повышает экскрецию натрия и воды с мочой и в то же время снижает экскрецию калия с мочой. Триамтерен и амилорид ингибируют реабсорбцию натрия в почках и снижают экскрецию калия с мочой.
Диуретики выводят воду и соли [5] из организма, поэтому они используются для снижения массы в тела в соревновательных видах спорта с весовыми категориями [7].
Диуретики также могут быть использованы при попытке скрыть присутствие допинговых препаратов в моче, поскольку они повышают количество выделяемой мочи, в связи с чем концентрация других веществ в моче снижается. Определенные диуретики могут изменять pH мочи, при этом допинговые препараты могут не выделяться с мочой.
Побочные эффектыПрименение диуретиков в больших дозах может вызвать тяжелое обезвоживание и гиповолемию в организме. Это означает, что объем крови уменьшается ниже нормы [5, 6]. Побочные эффекты, вызываемые тиазидными диуретиками, включают, помимо прочего, дисбаланс жидкости и электролитов [5].
Наиболее выраженным побочным эффектом тиазидных диуретиков является гипокалиемия, то есть уменьшения содержания калия в крови ниже нормы. Тиазидные диуретики в больших дозах могут привести к развитию обезвоживания и гипотонии, то есть чрезмерному снижению артериального давления.
Тиазидные диуретики в больших дозах могут привести к развитию обезвоживания и гипотонии, то есть чрезмерному снижению артериального давления.
Применение в больших дозах может привести к ухудшению течения сахарного диабета и повышению риска развития подагры [5], поскольку тиазиды могут ослаблять толерантность к глюкозе и увеличивать абсорбцию мочевого урата. [2, 3]. Таким образом, уровни глюкозы и урата в крови могут повышаться во время терапии тиазидными диуретиками [5]. Другие побочные эффекты включают различные симптомы нарушения работы нервной системы (головокружение, головную боль, повышенную утомляемость) и желудочно-кишечного тракта (рвоту, тошноту). Однако такие симптомы появляются редко [5].
Побочным эффектом короткодействующих солевых диуретиков, помимо обезвоживания, является дисбаланс жидкости и электролитов, в частности гипокалиемия [5]. Короткодействующие солевые диуретики, подобно тиазидным диуретикам, также могут ухудшить течение сахарного диабета и привести к повышению риска развития подагры.
Наиболее значимым побочным эффектом калийсберегающих диуретиков является гиперкалиемия, то есть состояние, при котором отмечается чрезмерное повышение уровня калия в крови [5]. Гиперкалиемия может привести к смертельному исходу.
Salla Ruuska (Салла Рууска)
Доктор наук, фармацевт
С поправками
Dopinglinkki
Анализы в KDL. Натрий, калий, хлор (Na/K/Cl)
Натрий, калий и хлор – это минеральные вещества, способные проводить электрический заряд. Они называются электролитами и делятся на катионы (носители положительного заряда) и анионы (носители отрицательного заряда). К катионам относятся калий и натрий, к анионам – хлор и его соединения. В организме электролиты содержатся в виде растворов солей в тканях и межклеточной жидкости. Некоторое их количество циркулирует в крови. Эти вещества способствуют обменным процессам организма, играют роль в поддержании водного баланса и уровня pH (кислотно-щелочной баланс).
Калий жизненно важен для клеточного метаболизма — он помогает транспортировать питательные вещества внутрь клетки и выводить из нее отходы, передает нервно-мышечные импульсы и участвует в работе сердечной мышцы. Он присутствует во всех жидкостях организма, но большая часть калия находится в клетках. Лишь небольшое его количество присутствует в крови.
Обычно калий поступает с пищей в достаточном количестве и выводится почками. Уровень калия жестко регулируется организмом при помощи гормона альдостерона, поскольку даже незначительные колебания содержания калия могут иметь значительные последствия для здоровья – такие, как шок, дыхательная и сердечная недостаточность, аритмия и остановка сердца. При электролитном дисбалансе возникает смещение pH организма в кислую (ацидоз) или щелочную (алкалоз) сторону, что приводит к угрожающим для жизни последствиям и требует незамедлительного лечения.
Натрий в основном содержится в жидкостях организма, и обеспечивает такие функции, как поддержание внеклеточного осмотического давления, проведение нервно-мышечных импульсов и участие в клеточном обмене.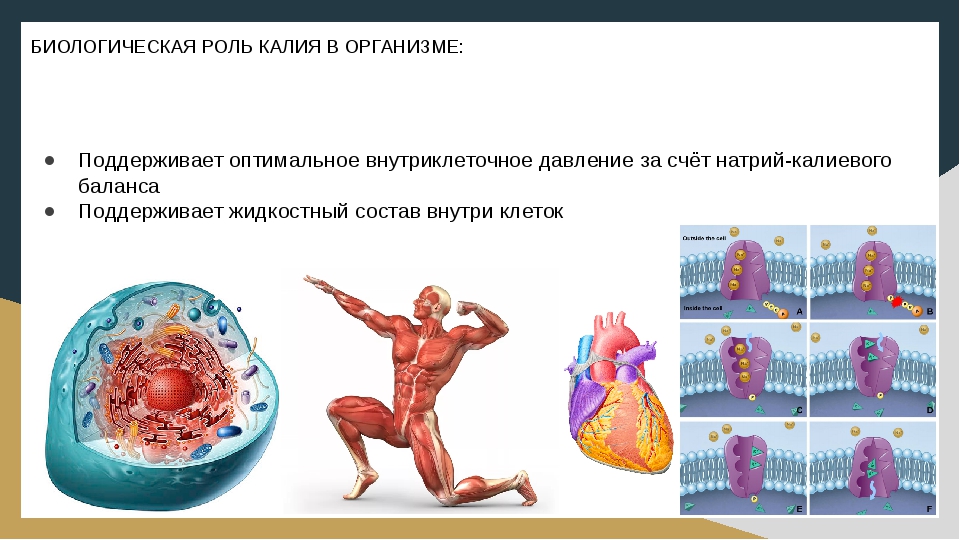 Значительное количество натрия циркулирует в крови. Как и калий, он поступает в организм с пищей из большинства продуктов, а также из поваренной соли. Организм регулирует уровень натрия в определенном диапазоне, а излишки выводит с помощью почек. Гормоны, такие как альдостерон и натрийуретический пептид, могут замедлить или ускорить выведение натрия с мочой.
Значительное количество натрия циркулирует в крови. Как и калий, он поступает в организм с пищей из большинства продуктов, а также из поваренной соли. Организм регулирует уровень натрия в определенном диапазоне, а излишки выводит с помощью почек. Гормоны, такие как альдостерон и натрийуретический пептид, могут замедлить или ускорить выведение натрия с мочой.
Избыток уровня натрия, в том числе в результате его чрезмерного потребления (злоупотребление солью и солеными продуктами) приводит к повышению артериального давления, обезвоживанию, повышенной нагрузке на почки, сухости глаз и кожных покровов. При недостатке натрия вода задерживается в организме за счет действия гормона вазопрессина, что приводит к отекам, в особенности нижних конечностей, застойным явлениям и сердечной недостаточности.
Хлор — отрицательно заряженный ион, который совместно с калием и натрием помогает регулировать количество жидкости в организме и поддерживать кислотно-щелочной баланс. Он присутствует во всех жидкостях организма, но больше всего хлора содержится в крови и внеклеточной жидкости. Обычно концентрация хлора отражает уровень натрия и изменяется прямо пропорционально его изменениям. Однако при нарушениях pH уровень хлоридов в крови может изменяться независимо от уровня натрия, поскольку хлор действует как буфер. Таким образом он помогает поддерживать нейтральный pH в клетках, перемещаясь внутрь клеток или наружу по необходимости. Хлор поступает в организм с пищей и поваренной солью, его избыток выводится с мочой.
Обычно концентрация хлора отражает уровень натрия и изменяется прямо пропорционально его изменениям. Однако при нарушениях pH уровень хлоридов в крови может изменяться независимо от уровня натрия, поскольку хлор действует как буфер. Таким образом он помогает поддерживать нейтральный pH в клетках, перемещаясь внутрь клеток или наружу по необходимости. Хлор поступает в организм с пищей и поваренной солью, его избыток выводится с мочой.
В каких случаях обычно назначают исследование?
- Как часть биохимического комплекса общего медицинского обследования;
- При диагностике дисбаланса pH (ацидоз, алкалоз) и для контроля эффективности его лечения;
- При таких жалобах, как аритмия, слабость, тошнота, отеки, помутнение сознания;
- Для контроля за эффективностью лечения заболеваний печени, почек, сердечной недостаточности;
- При обследовании пациентов с острыми и хроническими заболеваниями.
Что именно определяется в процессе анализа?
Происходит измерение концентрации электролитов в образце сыворотки крови пациента с помощью ионселективного метода.
Что означают результаты теста?
Концентрация электролитов в крови зависит от их поступления с пищей, содержания воды в организме и работы почек. Кроме того, влияние оказывают гормоны, такие как альдостерон (усиливает выведение калия и поддерживает уровень натрия) и натрийуретический пептид (ускоряет выведение натрия с мочой).
При нарушениях работы почек организм удерживает воду для разбавления натрия и хлора, что приводит к падению их концентрации ниже нормы. При обезвоживании концентрация электролитов наоборот может возрастать. Влияют на уровень калия, натрия и хлора сердечно-сосудистые и мышечные заболевания, сахарный диабет и патологии нервной системы.
Любые отклонения уровня электролитов от нормы, особенно калия, очень опасны для жизни и здоровья пациента, и могут быстро привести к серьезным нарушениям в работе сердца и даже к смерти. Поэтому в случае выявления отклонений необходимо как можно быстрее госпитализировать и обследовать пациента.
Сроки выполнения теста.

Обычно результат анализа можно получить на следующий день после взятия крови.
Как подготовиться к анализу?
Следует придерживаться общих правил подготовки к взятию крови из вены. С подробной информацией можно ознакомиться в соответствующем разделе статьи.
Ион калия — обзор
Физиологическая роль
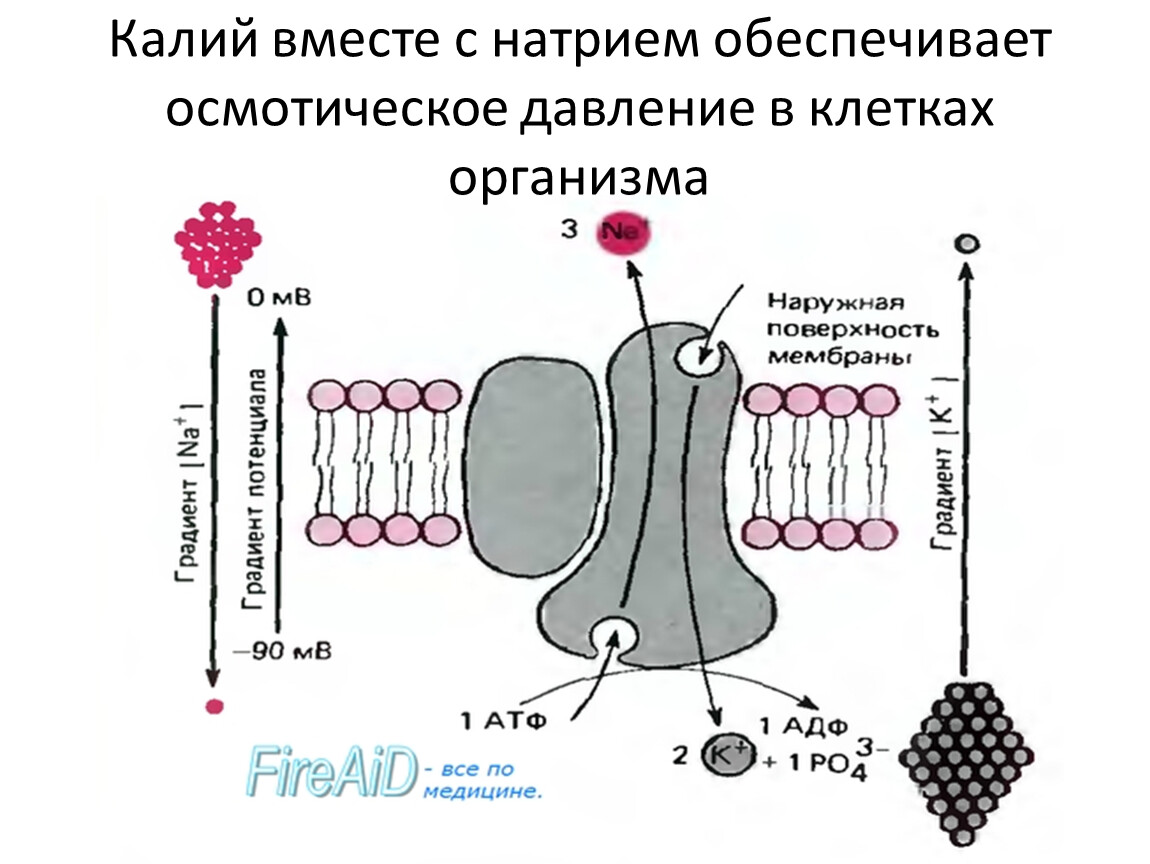
Ион калия (K + ), возможно, является наиболее часто добавляемым электролитом. 37 Калий играет важную роль в физиологии клеточных мембран, особенно в поддержании мембранного потенциала покоя и в создании потенциалов действия в нервной системе и сердце. Калий активно транспортируется в клетки аденозинтрифосфатазой натрия-калия (Na, K-АТФаза; Na + помпа), которая поддерживает внутриклеточный K + как минимум в 30 раз больше, чем внеклеточный K + .Внутриклеточная концентрация K + (K + ) обычно составляет 150 мМ, а внеклеточная концентрация составляет всего от 3,5 до 5,0 мМ. К + в сыворотке примерно на 0,5 мМ больше, чем в плазме К + из-за лизиса клеток во время свертывания. Общий K + в организме взрослого человека весом 70 кг составляет приблизительно 4256 мЭкв, из которых 4200 мЭкв является внутриклеточным; из 56 мг-экв в ECV, только 12 мг-экв в PV. Общие причины потерь K + показаны в Таблице 42.7. Соотношение внутриклеточного и внеклеточного K + способствует разнице потенциалов покоя через клеточные мембраны и, следовательно, целостности сердечной и нервно-мышечной передачи.
К + в сыворотке примерно на 0,5 мМ больше, чем в плазме К + из-за лизиса клеток во время свертывания. Общий K + в организме взрослого человека весом 70 кг составляет приблизительно 4256 мЭкв, из которых 4200 мЭкв является внутриклеточным; из 56 мг-экв в ECV, только 12 мг-экв в PV. Общие причины потерь K + показаны в Таблице 42.7. Соотношение внутриклеточного и внеклеточного K + способствует разнице потенциалов покоя через клеточные мембраны и, следовательно, целостности сердечной и нервно-мышечной передачи.
Внеклеточный K + определяется катехоламинами, ренин-ангиотензин-альдостероновой системой, глюкозой и инсулином, а также прямым высвобождением из работающих или поврежденных мышц. 37 Основным механизмом, поддерживающим K + внутри клеток, является перенос трех ионов Na + из клетки на каждые два иона K + , переносимых насосом Na, K-ATPase. 38 И инсулин, и агонисты β-адренорецепторов способствуют проникновению K + в клетки 38 (рис. 42,3). Напротив, агонисты α-адренорецепторов ухудшают клеточный захват K + . 39 Метаболический ацидоз имеет тенденцию вытеснять K + из клеток, тогда как метаболический алкалоз способствует перемещению в клетки.
42,3). Напротив, агонисты α-адренорецепторов ухудшают клеточный захват K + . 39 Метаболический ацидоз имеет тенденцию вытеснять K + из клеток, тогда как метаболический алкалоз способствует перемещению в клетки.
Обычное потребление K + составляет от 50 до 150 мг-экв / день. Свободно фильтруется в клубочках, большая часть экскреции K + приходится на мочу с некоторым выделением фекалий. Наиболее отфильтрованный K + реабсорбируется; экскреция обычно примерно равна поступлению. Пока СКФ превышает> 8 мл / кг, может выводиться диетическое потребление K + , если оно не превышает норму.Предполагая, что плазменный K + составляет 4,0 мМ и нормальная СКФ 180 л / день, 720 мэкв. K + фильтруется ежедневно, из которых от 85% до 90% реабсорбируется в проксимальных извитых канальцах и петле Генле. Оставшиеся от 10% до 15% достигают дистального извитого канальца, который является основным участком, в котором регулируется экскреция K + . Экскреция ионов K + является функцией открытых каналов K + и электрической движущей силы в кортикальном собирательном канале. 38
Экскреция ионов K + является функцией открытых каналов K + и электрической движущей силы в кортикальном собирательном канале. 38
Двумя наиболее важными регуляторами экскреции K + являются плазменный K + и альдостерон, хотя есть некоторые данные, позволяющие предположить участие ЦНС и кишечного рефлекса, опосредованного богатой калием пищей.Секреция калия в дистальные извитые канальцы и кортикальные собирательные каналы увеличивается из-за гиперкалиемии, альдостерона, алкалиемии, повышенной доставки Na + в дистальные канальцы и собирательный проток, высокой скорости потока мочи и присутствия в просвете жидкости не реабсорбируемых веществ. анионы, такие как карбенициллин, фосфаты и сульфаты. По мере увеличения реабсорбции Na + увеличивается электрическая движущая сила, препятствующая реабсорбции K + . Альдостерон увеличивает реабсорбцию Na + , вызывая открытие эпителиального канала Na + 40 ; Калийсберегающие диуретики (амилорид и триамтерен) и триметроприм блокируют эпителиальный канал Na + , тем самым увеличивая реабсорбцию K + . Истощение запасов магния способствует почечной недостаточности K + .
Истощение запасов магния способствует почечной недостаточности K + .
2.16: Натрий-калиевый насос — Biology LibreTexts
- Последнее обновление
- Сохранить как PDF
- Натрий-калиевый насос
- Электрохимический градиент
- Резюме
- Узнать больше
- Обзор
Что это за невероятный объект?
Вы удивитесь, узнав, что это человеческая клетка? Изображение представляет собой активную нервную клетку человека.Как функционируют нервные клетки, будет в центре внимания другой концепции. Однако активные транспортные процессы играют важную роль в функционировании этих клеток. В частности, в аксонах этих нервных клеток действует натрий-калиевый насос.
Натрий-калиевый насос
Активный транспорт — это энергозатратный процесс перекачки молекул и ионов через мембраны «в гору» против градиента концентрации. Чтобы переместить эти молекулы против градиента их концентрации, необходим белок-носитель.Белки-носители могут работать с градиентом концентрации (во время пассивного транспорта), но некоторые белки-носители могут перемещать растворенные вещества против градиента концентрации (от низкой концентрации к высокой) с подачей энергии. При активном транспорте, поскольку белки-носители используются для перемещения материалов против градиента их концентрации, эти белки известны как насосы. Как и в других видах клеточной активности, АТФ поставляет энергию для наиболее активного транспорта. Один из способов, которым АТФ обеспечивает активный транспорт, — это перенос фосфатной группы непосредственно на белок-носитель.Это может вызвать изменение формы белка-носителя, что приведет к перемещению молекулы или иона на другую сторону мембраны. Примером этого типа активной транспортной системы, как показано на Рис. ниже, является натрий-калиевый насос , , который обменивает ионы натрия на ионы калия через плазматическую мембрану клеток животных.
Примером этого типа активной транспортной системы, как показано на Рис. ниже, является натрий-калиевый насос , , который обменивает ионы натрия на ионы калия через плазматическую мембрану клеток животных.
Насосная система натрий-калий перемещает ионы натрия и калия против больших градиентов концентрации. Он перемещает два иона калия в клетку, где уровень калия высок, и выкачивает три иона натрия из клетки во внеклеточную жидкость.
Как показано на рисунке выше, три иона натрия связываются с протеиновым насосом внутри клетки. Затем белок-носитель получает энергию от АТФ и меняет форму. При этом он выкачивает из клетки три иона натрия. В этот момент два иона калия извне клетки связываются с протеиновым насосом. Затем ионы калия переносятся в клетку, и процесс повторяется. Натрий-калиевый насос находится в плазматической мембране почти каждой клетки человека и является общим для всей клеточной жизни.Он помогает поддерживать клеточный потенциал и регулирует клеточный объем.
Более подробный обзор натрий-калиевого насоса доступен на http://www.youtube.com/watch?v=C_H-ONQFjpQ (13:53) и http://www.youtube.com/watch? v = ye3rTjLCvAU (6:48).
Электрохимический градиент
Активный транспорт ионов через мембрану вызывает электрический градиент на плазматической мембране. Количество положительно заряженных ионов вне клетки больше, чем количество положительно заряженных ионов в цитозоле.Это приводит к относительно отрицательному заряду внутри мембраны и положительному заряду снаружи. Эта разница в зарядах вызывает напряжение на мембране. Напряжение — это электрическая потенциальная энергия, которая вызвана разделением противоположных зарядов, в данном случае через мембрану. Напряжение на мембране называется , мембранный потенциал . Мембранный потенциал очень важен для проведения электрических импульсов по нервным клеткам.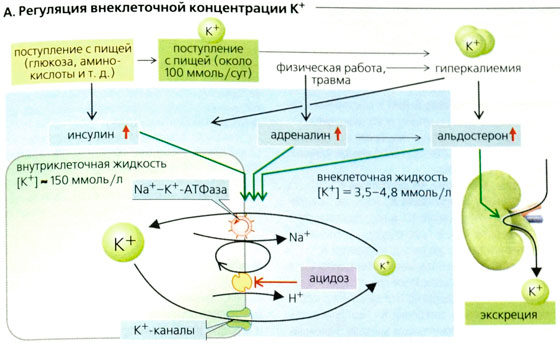
Поскольку внутренняя часть клетки отрицательна по сравнению с внешней, мембранный потенциал способствует перемещению положительно заряженных ионов (катионов) в клетку и перемещению отрицательных ионов (анионов) из клетки.Итак, есть две силы, которые управляют диффузией ионов через плазматическую мембрану: химическая сила (градиент концентрации ионов) и электрическая сила (влияние мембранного потенциала на движение ионов). Эти две силы, работающие вместе, называются электрохимическим градиентом и будут подробно обсуждаться в концепциях «Нервные клетки» и «Нервные импульсы».
Резюме
- Активный перенос — это энергозатратный процесс перекачки молекул и ионов через мембраны против градиента концентрации.
- Натрий-калиевый насос — это активный транспортный насос, который обменивает ионы натрия на ионы калия.
Узнать больше
Используйте этот ресурс, чтобы ответить на следующие вопросы.
- Есть ли больше ионов натрия снаружи клеток или внутри?
- Больше ионов калия снаружи или внутри клеток?
- Опишите роль АТФ в активном транспорте.

- Что происходит после фосфорилирования помпы?
- Что происходит после дефосфорилирования?
Обзор
- Что такое активный транспорт?
- Какой тип белка участвует в активном транспорте?
- Опишите, как работает натриево-калиевый насос.
- Что такое электрохимический градиент?
Важность ионов калия для структуры и функции рибосом, выявленная с помощью длинноволновой рентгеновской дифракции
Холм, Р. Х., Кеннепол, П., Соломон, Э. И. Структурные и функциональные аспекты сайтов металлов в биологии. Chem. Ред. 96 , 2239–2314 (1996).
CAS PubMed Статья Google ученый
Rotzschke, O., Lau, J. M., Hofstatter, M., Falk, K. & Strominger, J. L. pH-чувствительный остаток гистидина в качестве элемента управления высвобождением лиганда из молекул HLA-DR. Proc. Natl Acad. Sci. США 99 , 16946–16950 (2002).
ADS CAS PubMed Статья PubMed Central Google ученый
Сигель А., Сигель Х. и Сигель Р. К. Структурные и каталитические роли ионов металлов в РНК. Met. Ионы Жизни . 9 , vii – ix (2011).
Селандер, Д. В. и Чех, Т. Р. Визуализация фолдинга более высокого порядка каталитической молекулы РНК. Наука 251 , 401–407 (1991).
ADS CAS PubMed Статья Google ученый
Пайл А.М. Ионы металлов в структуре и функциях РНК. J. Biol. Неорг. Chem. 7 , 679–690 (2002).
CAS PubMed Статья Google ученый
Zot, H. G. & Potter, J. D. Структурная роль сайтов Ca 2+ -Mg 2 + на тропонине C в регуляции сокращения мышц. Получение и свойства миофибрилл, обедненных тропонином С. J.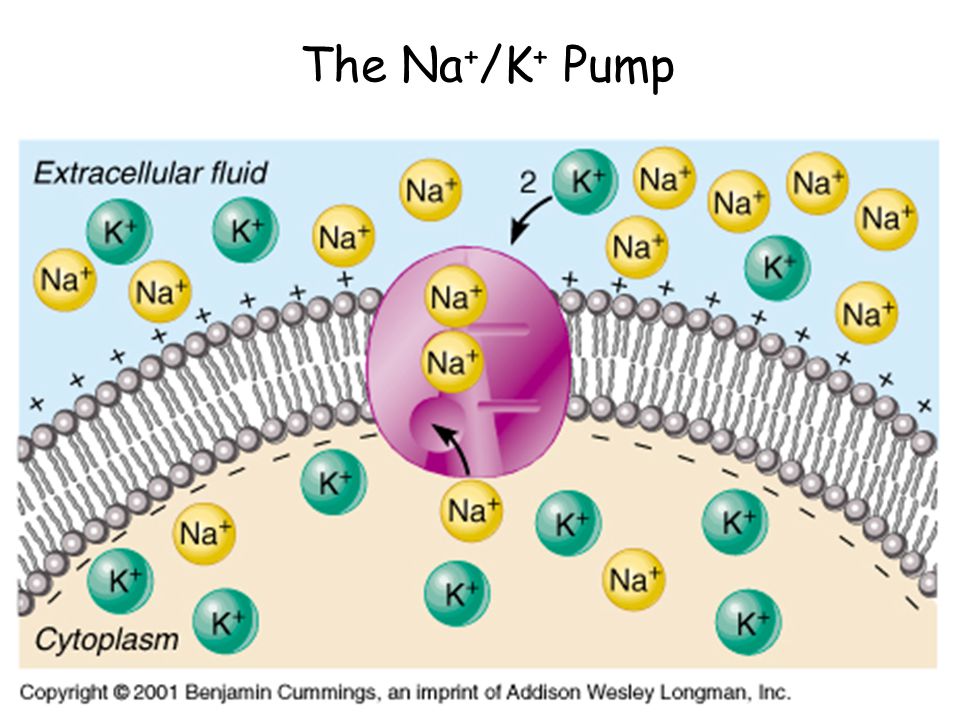 Biol. Chem. 257 , 7678–7683 (1982).
Biol. Chem. 257 , 7678–7683 (1982).
CAS PubMed Google ученый
Serra, M. J. et al. Влияние ионов магния на стабилизацию олигомеров РНК определенной структуры. РНК 8 , 307–323 (2002).
CAS PubMed PubMed Central Статья Google ученый
MacPherson, I. S. & Murphy, M. E. Медьсодержащие ферменты типа 2. Cell Mol. Life Sci. 64 , 2887–2899 (2007).
CAS PubMed Статья Google ученый
Solomon, E. I. et al. Активные центры меди в биологии. Chem. Ред. 114 , 3659–3853 (2014).
CAS PubMed PubMed Central Статья Google ученый
МакКолл, К. А., Хуанг, К. и Фиерке, К. А. Функция и механизм металлоферментов цинка. J. Nutr. 130 , 1437S – 1446S (2000).
CAS PubMed Статья Google ученый
Pace, N. J. & Weerapana, E. Цинк-связывающие цистеины: различные функции и структурные мотивы. Биомолекулы 4 , 419–434 (2014).
PubMed PubMed Central Статья CAS Google ученый
Аравин А. А., Хэннон Г. Дж. И Бреннеке Дж. Путь Piwi-piRNA обеспечивает адаптивную защиту в гонке вооружений транспозонов. Наука 318 , 761–764 (2007).
ADS CAS PubMed Статья Google ученый
Роллинз, М. Ф., Шуман, Дж. Т., Паулюс, К., Бухари, Х. С. и Виденхефт, Б. Механизм распознавания чужеродной ДНК комплексом надзора под управлением CRISPR РНК из Pseudomonas aeruginosa. Nucleic Acids Res 43 , 2216–2222 (2015).
CAS PubMed PubMed Central Статья Google ученый

Мисра В. К. и Дрейпер Д. Э. О роли ионов магния в стабильности РНК. Биополимеры 48 , 113–135 (1998).
CAS PubMed Статья Google ученый
Мисра В. К. и Дрейпер Д. Э. Связь между связыванием магния и сворачиванием РНК. J. Mol. Биол. 317 , 507–521 (2002).
CAS PubMed Статья Google ученый
Конн, Г. Л., Гиттис, А. Г., Латтман, Э. Э., Мисра, В. К. и Дрейпер, Д. Э. Компактная третичная структура РНК содержит скрытый каркас-комплекс K +. J. Mol. Биол. 318 , 963–973 (2002).
CAS PubMed Статья Google ученый
Leipply, D., Lambert, D. & Draper, D. E. Ион-РНК-взаимодействия термодинамический анализ влияния одно- и двухвалентных ионов на конформационное равновесие РНК. Methods Enzym. 469 , 433–463 (2009).
CAS Статья Google ученый
Аффингер П., Д’Аскенцо Л. и Эннифар Е. Взаимодействие натрия и калия с нуклеиновыми кислотами. Met. Ions Life Sci. 16 , 167–201 (2016).
CAS PubMed Статья Google ученый
Ламберт, Д., Лейппли, Д., Shiman, R. & Draper, D. E. Влияние размера одновалентных катионов на стабильность третичных структур РНК. J. Mol. Биол. 390 , 791–804 (2009).
CAS PubMed PubMed Central Статья Google ученый
Лиде, Д. Р. Справочник CRC по химии и физике: готовый справочник химических и физических данных. (CRC Press, 2001).
Мельников, С.и другие. Одно ядро, две оболочки: бактериальные и эукариотические рибосомы. Нат. Struct. Мол. Биол. 19 , 560–567 (2012).
CAS PubMed Статья Google ученый

Гордон Дж. И Липманн Ф. Роль двухвалентных ионов в поли-U-направленной полимеризации фенилаланина. J. Mol. Биол. 23 , 23–33 (1967).
CAS Статья Google ученый
Вайс, Р. Л., Каймс, Б. В. и Моррис, Д. Р. Катионы и структура рибосом. III. Влияние на 30S и 50S субъединицы замены связанного Mg 2+ . Неорг. катионы. Biochem. 12 , 450–456 (1973).
CAS Google ученый
Stahli, C. & Noll, H. Структурная динамика бактериальных рибосом. VI. Денатурация активных рибосом за счет Mg 2+ зависимых конформационных переходов. Мол. Genet 153 , 159–168 (1977).
CAS PubMed Статья Google ученый
Nierhaus, K. H. Mg 2+ , K + , и рибосома. J. Bacteriol. 196 , 3817–3819 (2014).
PubMed PubMed Central Статья CAS Google ученый
Маккарти, Б. Влияние магниевого голодания на содержание рибосом Escherichia coli . Biochim. et. Биофиз. Acta (BBA) -Spec. Разд. Нуклеиновые кислоты Relat. Subj. 55 , 880–889 (1962).
CAS Google ученый
Gesteland, R.F. Разворачивание рибосом Escherichia coli путем удаления магния. J. Mol. Биол. 18 , 356 – IN314 (1966).
CAS PubMed Статья Google ученый
Гаврилова Л., Иванов, Д., Спирин, А. Исследования структуры рибосом: III. Поэтапное разворачивание 50-секундных частиц без потери рибосомного белка. J. Mol. Биол. 16 , 473 – IN428 (1966).
CAS PubMed Статья Google ученый
Hershko, A., Amoz, S. & Mager, J. Влияние полиаминов и двухвалентных металлов на in vitro включение аминокислот в рибонуклеопротеиновые частицы. Biochem Biophys.Res Commun. 5 , 46–51 (1961).
CAS PubMed Статья Google ученый
Мартин Р. Г. и Эймс Б. Н. Влияние полиаминов и размера поли U на включение фенилаланина. Proc. Natl Acad. Sci. США 48 , 2171–2178 (1962).
ADS CAS PubMed Статья PubMed Central Google ученый
Натанс Д. и Липманн Ф. Перенос аминокислот от аминоацил-рибонуклеиновых кислот к белку на рибосомах Escherichia coli . Proc. Natl Acad. Sci. США 47 , 497–504 (1961).
ADS CAS PubMed Статья PubMed Central Google ученый
Такеда Ю. Полиамины и синтез белков. I. Влияние полиаминов на бесклеточный синтез полифенилаланина у Escherichia coli . J. Biochem 66 , 345–349 (1969).
CAS PubMed Статья PubMed Central Google ученый
Игараши К., Хиками К., Сугавара К. и Хиросе С. Влияние полиаминов на синтез полипептидов в бесклеточной системе печени крысы. Biochim. Биофиз. Acta. 299 , 325–330 (1973).
CAS PubMed Статья PubMed Central Google ученый
Игараси К., Сугавара К., Идзуми И., Нагаяма С. и Хиросе С. Влияние полиаминов на синтез полифенилаланина Escherichia coli и рибосомами печени крысы. евро. J. Biochem. 48 , 495–502 (1974).
CAS PubMed Статья PubMed Central Google ученый
Konecki, D., Kramer, G., Pinphanichakarn, P. & Hardesty, B. Полиамины необходимы для максимального синтеза пептидов глобина in vitro и играют роль в инициации цепи. Arch. Biochem Biophys. 169 , 192–198 (1975).
CAS PubMed Статья Google ученый
Jelenc, P.C. & Kurland, C.G. Регенерация нуклеозидтрифосфата снижает частоту ошибок трансляции. Proc. Natl Acad. Sci. США 76 , 3174–3178 (1979).
ADS CAS PubMed Статья Google ученый
Райнбергер, Х. Дж. И Нирхаус, К. Х. Рибосомный E-сайт при низком Mg 2 + : координирует инактивацию рибосомных функций при концентрациях Mg 2 + ниже 10 мМ и ее предотвращение полиаминами. J. Biomol. Struct. Дин. 5 , 435–446 (1987).
CAS PubMed Статья Google ученый
Bartetzko, A. & Nierhaus, K. H. Mg 2 + / NH 4 + / полиаминная система для полиуридин-зависимого синтеза полифенилаланина с характеристиками, близкими к in vivo. Methods Enzym. 164 , 650–658 (1988).
CAS Статья Google ученый
Таль М. Ионы металлов и конформация рибосом. Biochim Biophys. Acta 195 , 76–86 (1969).
CAS PubMed Статья Google ученый
Вайс, Р. Л. и Моррис, Д. Р. Катионы и структура рибосом. I. Влияние на 30S субъединицу замещения иона магния полиаминами. Биохимия 12 , 435–441 (1973).
CAS PubMed Статья Google ученый
Каймс, Б. В. и Моррис, Д. Р. Катионы и структура рибосом. II. Влияние на 50S субъединицу замещения иона магния полиаминами. Биохимия 12 , 442–449 (1973).
CAS PubMed Статья Google ученый
Коэн, С., Лихтенштейн, Дж. Полиамины и структура рибосом. J. Biol. Chem. 235 , 2112–2116 (1960).
CAS PubMed Google ученый
Leonarski, F., D’Ascenzo, L. & Auffinger, P. Ионы Mg 2 + : связываются ли они с азотом азотистых оснований? Nucleic Acids Res. 45 , 987–1004 (2017).
CAS PubMed Статья Google ученый
Девер Т. Э. и Иванов И. П. Роль полиаминов в переводе. J. Biol. Chem. 293 , 18719–18729 (2018).
CAS PubMed Статья Google ученый
Наслунд, П. Х. и Халтин, Т. Влияние дефицита калия на рибосомы млекопитающих. Biochim Biophys. Acta 204 , 237–247 (1970).
CAS PubMed Статья Google ученый
Зитомер, Р. С. и Флакс, Дж. Г. Зависимость от магния и равновесие ассоциации рибосомных субъединиц Escherichia coli . J. Mol. Биол. 71 , 263–279 (1972).
CAS PubMed Статья Google ученый
Спирин А.С., Сабо Б. и Коваленко В.А. Зависимость диссоциации-ассоциации незаряженных рибосом Escherichia coli от концентрации Mg 2 + , ионной силы, pH и температуры. FEBS Lett. 15 , 197–200 (1971).
CAS PubMed Статья Google ученый
Handing, K. B. et al. Характеристика сайтов связывания металлов в белках с помощью рентгеновской кристаллографии. Нат. Protoc. 13 , 1062–1090 (2018).
CAS PubMed PubMed Central Статья Google ученый
Вольбеда, А.in Metalloproteins: Methods and Protocols (ред. Juan C. Fontecilla-Camps и Yvain Nicolet) 189-206 (Humana Press, 2014).
Джинович Каруго, К., Хелливелл, Дж. Р., Штурманн, Х. и Вайсс, М. С. Более мягкое и мягкое рентгеновское излучение в кристаллографии макромолекул. J. Synchrotron Radiat. 12 , 410–419 (2005).
CAS PubMed Статья Google ученый
Вагнер, А., Думан, Р., Хендерсон, К., Михайлык, В. Длинноволновая кристаллография макромолекул в вакууме. Acta. Кристаллогр. Разд. D: Struct. Биол. 72 , 430–439 (2016).
CAS Статья Google ученый
Юсупова, Г., Дженнер, Л., Рис, Б., Морас, Д., Юсупов, М. Структурные основы движения матричной РНК по рибосоме. Nature 444 , 391–394 (2006).
ADS CAS PubMed Статья Google ученый
Дженнер, Л. Б., Демешкина, Н., Юсупова, Г., Юсупов, М. Структурные аспекты поддержания рамки считывания информационной РНК рибосомой. Нат. Struct. Мол. Биол. 17 , 555–560 (2010).
CAS PubMed Статья Google ученый
Поликанов, Ю.С., Стейтц, Т.А. и Иннис, С.А. Протонный провод для соединения аккомодации аминоацил-тРНК и образования пептидной связи на рибосоме. Нат.Struct. Мол. Биол. 21 , 787–793 (2014).
CAS PubMed PubMed Central Статья Google ученый
Ogle, J. M. et al. Распознавание родственной транспортной РНК 30S рибосомной субъединицей. Наука 292 , 897–902 (2001).
ADS CAS PubMed Статья Google ученый
Selmer, M.и другие. Структура рибосомы 70S в комплексе с мРНК и тРНК. Наука 313 , 1935–1942 (2006).
ADS CAS PubMed Статья Google ученый
Юсупова Г. З., Юсупов М. М., Кейт Дж. Х. и Ноллер Х. Ф. Путь информационной РНК через рибосому. Cell 106 , 233–241 (2001).
CAS PubMed Статья Google ученый
Демешкина Н., Дженнер Л., Вестхоф Э., Юсупов М. и Юсупова Г. Новое понимание принципа декодирования рибосомы. Природа 484 , 256–259 (2012).
ADS CAS PubMed Статья Google ученый
Розов А., Демешкина Н., Вестхоф Э., Юсупов М. и Юсупова Г. Структурные представления о механизме трансляционной неверности. Нат. Commun. 6 , 7251 (2015).
ADS CAS PubMed PubMed Central Статья Google ученый
Розов А., Вестхоф Э., Юсупов М. и Юсупова Г. Рибосома запрещает геометрию колебания G * U в первой позиции спирали кодон-антикодон. Nucleic Acids Res. 44 , 6434–6441 (2016).
CAS PubMed PubMed Central Google ученый
Розов А. и др. Новые взаимодействия пар оснований в положении колебания тРНК критически важны для точного считывания генетического кода. Нат. Commun. 7 , 10457 (2016).
ADS CAS PubMed PubMed Central Статья Google ученый
Розов А. и др. Таутомерные пары G * U в пределах молекулярного рибосомного захвата и точности декодирования у бактерий. Nucleic Acids Res . 46 , 7425–7435 (2018).
CAS PubMed PubMed Central Статья Google ученый
Frank, J. et al. Модель трансляционного аппарата на основе трехмерной реконструкции рибосомы Escherichia coli. Biochem. Cell Biol. 73 , 757–765 (1995).
CAS PubMed Статья Google ученый
Габашвили И.С.и другие. Структура раствора рибосомы E. coli 70S при разрешении 11,5 A. Cell 100 , 537–549 (2000).
CAS PubMed Статья Google ученый
Юсупов М.М. и др. Кристаллическая структура рибосомы при разрешении 5,5 А. Наука 292 , 883–896 (2001).
ADS CAS PubMed Статья Google ученый
Канг К., Чжан Х., Ратлифф Р., Мойзис Р. и Рич А. Кристаллическая структура четырехцепочечной теломерной ДНК Oxytricha. Nature 356 , 126–131 (1992).
ADS CAS PubMed Статья Google ученый
Хайдер С., Паркинсон Г. Н. и Нейдл С. Кристаллическая структура калиевой формы G-квадруплекса Oxytricha nova. J. Mol. Биол. 320 , 189–200 (2002).
CAS PubMed Статья Google ученый
Юсупова Г., Юсупов М. Биохимия рибосом в определении кристаллической структуры. РНК 21 , 771–773 (2015).
CAS PubMed PubMed Central Статья Google ученый
Браун А. и Шао С. Рибосомы и крио-ЭМ: дуэт. Curr. Opin. Struct.Биол. 52 , 1–7 (2018).
CAS PubMed Статья Google ученый
Auffinger, P., Bielecki, L. & Westhof, E. Сайты связывания Mg 2 + мотива E петли 5S рРНК, как исследовали с помощью моделирования молекулярной динамики. Chem. Биол. 10 , 551–561 (2003).
CAS PubMed Статья PubMed Central Google ученый
Ascone, I. & Strange, R. Биологическая рентгеновская абсорбционная спектроскопия и металлопротеомика. J. Synchrotron Radiat. 16 , 413–421 (2009).
CAS PubMed Статья PubMed Central Google ученый
Wu, G. & Zhu, J. ЯМР-исследования ионов щелочных металлов в органических и биологических твердых телах. Прог. Nucl. Magn. Reson Spectrosc. 61 , 1–70 (2012).
CAS PubMed Статья PubMed Central Google ученый
Элад, Н., Беллападрона, Г., Хубен, Л., Саги, И. и Эльбаум, М. Обнаружение изолированных ионов металлов, связанных с белками, с помощью одночастичного крио-STEM. Proc. Natl Acad. Sci. США 114 , 11139–11144 (2017).
CAS PubMed Статья PubMed Central Google ученый
Огл, Дж. М., Мерфи, Ф. В., Тарри, М. Дж. И Рамакришнан, В. Селекция тРНК рибосомой требует перехода от открытой формы к закрытой. Cell 111 , 721–732 (2002).
CAS PubMed Статья PubMed Central Google ученый
Дженнер, Л., Демешкина, Н., Юсупова, Г., Юсупов, М. Структурные перестройки рибосомы на этапе проверки тРНК. Нат. Struct. Мол. Биол. 17 , 1072–1078 (2010).
CAS PubMed Статья PubMed Central Google ученый
Розов А., Демешкина Н., Вестхоф Э., Юсупов М. и Юсупова Г. Новое структурное понимание трансляционного неправильного кодирования. Trends Biochem. Sci. 41 , 798–814 (2016).
CAS PubMed Статья PubMed Central Google ученый
Leonarski, F., D’Ascenzo, L. & Auffinger, P. Карбонильные группы азотистых оснований являются плохими связующими внутри сферы Mg 2+ , но прекрасными связующими одновалентными ионами — критический обзор PDB. РНК 25 , 173–192 (2019).
CAS PubMed PubMed Central Статья Google ученый
Дженнер, Л., Рис, Б., Юсупов, М., Юсупова, Г. Конформации матричной РНК в сайте E рибосомы, выявленные с помощью рентгеновской кристаллографии. EMBO Rep. 8 , 846–850 (2007).
CAS PubMed PubMed Central Статья Google ученый
Урбонавичус, Дж., Цянь, К., Дюран, Дж. М., Хагерваль, Т. Г. и Бьорк, Г. Р. Улучшение поддержания рамки считывания является общей функцией для нескольких модификаций тРНК. EMBO J. 20 , 4863–4873 (2001).
CAS PubMed PubMed Central Статья Google ученый
Urbonavicius, J. et al. Модификации РНК передачи, которые изменяют сдвиг кадра +1, в целом не влияют на сдвиг кадра -1. РНК 9 , 760–768 (2003).
CAS PubMed PubMed Central Статья Google ученый
Wilson, R.K. & Roe, B.A. Наличие гипермодифицированного нуклеотида N6- (дельта-2-изопентенил) -2-метилтиоаденозина предотвращает неправильное считывание кодонов РНК, переносящей фенилаланил Escherichia coli . Proc. Natl Acad. Sci. США 86 , 409–413 (1989).
ADS CAS PubMed Статья Google ученый
Кляйн Д. Дж., Мур П. Б. и Стейтц Т. А. Вклад ионов металлов в структурную стабильность большой субъединицы рибосомы. РНК 10 , 1366–1379 (2004).
CAS PubMed PubMed Central Статья Google ученый
Weixlbaumer, A. et al. Механизм расширения декодирующей способности транспортных РНК путем модификации уридинов. Нат. Struct. Мол. Биол. 14 , 498–502 (2007).
CAS PubMed PubMed Central Статья Google ученый
Belousoff, M. J. et al. Кристаллическая структура синергической пары антибиотиков, ланкамицина и ланкацидина, в комплексе с большой рибосомной субъединицей. Proc. Natl Acad. Sci. США 108 , 2717–2722 (2011).
ADS CAS PubMed Статья Google ученый
Demirci, H. et al. Модификация 16S рибосомной РНК с помощью KsgA-метилтрансферазы реструктурирует 30S-субъединицу для оптимизации функции рибосомы. РНК 16 , 2319–2324 (2010).
CAS PubMed PubMed Central Статья Google ученый
Choi, J. et al. N (6) -метиладенозин в мРНК нарушает отбор тРНК и динамику трансляции-элонгации. Нат. Struct. Мол. Биол. 23 , 110–115 (2016).
CAS PubMed PubMed Central Статья Google ученый
Choi, J. et al. 2’-O-метилирование мРНК нарушает декодирование тРНК во время элонгации трансляции. Нат. Struct. Мол. Биол. 25 , 208–216 (2018).
CAS PubMed PubMed Central Статья Google ученый
Kurata, S. et al. Модифицированные уридины с С5-метиленовыми заместителями в первом положении антикодона тРНК стабилизируют U.G спаривание колебаний во время декодирования. J. Biol. Chem. 283 , 18801–18811 (2008).
CAS PubMed Статья Google ученый
Sleator, R. D. & Hill, C. Бактериальная осмоадаптация: роль осмолитов в бактериальном стрессе и вирулентности. FEMS Microbiol Rev. 26 , 49–71 (2002).
CAS PubMed Статья Google ученый
Эпштейн, В. Роль и регулирование калия в бактериях. Прог. Nucleic Acid Res. Мол. Биол. 75 , 293–320 (2003).
CAS PubMed Статья Google ученый
Гогиа З. В., Юсупов М. М., Спирина Т. Н. Структура рибосом Thermus thermophilus. 1. Способ выделения и очистки рибосом. Мол. Биол. (Моск.) 20 , 519–526 (1986).
Google ученый
Kabsch, W. Xds. Acta. Кристаллогр. Разд. D Biol. Кристаллогр. 66 , 125–132 (2010).
CAS Статья Google ученый
Adams, P. D. et al. PHENIX: комплексная система на основе Python для решения макромолекулярных структур. Acta. Кристаллогр. D Biol .Crystallogr. 66 , 213–221 (2010).
CAS PubMed PubMed Central Статья Google ученый
Торн А. и Шелдрик Г. М. АНОД: расчет аномальной плотности и плотности тяжелых атомов. J. Appl. Кристаллогр. 44 , 1285–1287 (2011).
CAS PubMed PubMed Central Статья Google ученый
Эмсли П., Локамп Б., Скотт В. Г. и Коутан К. Особенности и развитие Coot. Acta. Кристаллогр. Разд. D Biol. Кристаллогр. 66 , 486–501 (2010).
CAS Статья Google ученый
Pettersen, E. F. et al. UCSF Chimera — система визуализации для поисковых исследований и анализа. J. Comput. Chem. 25 , 1605–1612 (2004).
CAS PubMed PubMed Central Статья Google ученый
Цай, Дж., Тейлор, Р., Чотиа, К. и Герштейн, М. Плотность упаковки в белках: стандартные радиусы и объемы. J. Mol. Биол. 290 , 253–266 (1999).
CAS PubMed Статья Google ученый
Cheatham, T. E. 3rd, Cieplak, P. & Kollman, P.A. Модифицированная версия Cornell et al. силовое поле с улучшенными фазами сахарной складки и спиральным повторением. J. Biomol. Struct. Дин. 16 , 845–862 (1999).
CAS PubMed Статья Google ученый
Натрий-калиевый насос имеет решающее значение для функционирования организма
23 сентября 2013 г.
История натрий-калиевого насоса тесно связана с Данией.В 1997 году датский ученый Йенс Чр. Скоу получил Нобелевскую премию по химии за свое открытие, и на протяжении многих лет исследования насоса оставались основным направлением деятельности Орхусского университета. В 2007 году совместные усилия различных исследовательских групп из Орхусского университета привели к описанию структуры состояния насоса, связанного с калием; теперь датские исследователи описали и другое состояние насоса; состояние, связанное с натрием. Результаты были недавно опубликованы в журнале Science .
Насос выполняет функцию тела
Натрий-калиевый насос — это жизненно важный фермент, содержащийся во всех клетках человека, который постоянно поддерживает оптимальный ионный баланс. На это расходуется много энергии — около четверти энергии тела, так называемый АТФ, используется для поддержания работы насоса; в головном мозге эта доля составляет почти 70%.
Натрий-калиевый насос закачивает два иона калия в клетку и откачивает три иона натрия, используя энергию молекулы АТФ.Это приводит к накоплению значительных различий в концентрации ионов снаружи и внутри ячейки. Различия, которые необходимы для передачи и транспортировки в клетку и из клетки питательных веществ и других соединений, а также для регулирования pH и объема клетки. Если помпа не работает должным образом в клетках мозга, результатом являются тяжелые неврологические состояния, такие как мигрень с аурой, мышечные спазмы или односторонний паралич (гемиплегия).
Поэтому знание насоса имеет решающее значение для нашего понимания баланса вещества и энергии, а также механизмов заболевания, которые вступают в действие, когда насос не функционирует должным образом.Эти знания также важны для разработки новых лекарств, направленных на помпу.
Молодые междисциплинарные исследователи генерируют знания
Путь к описанию связанного натрием состояния насоса пролегал через междисциплинарное исследовательское сотрудничество в Орхусском университете. Ионы натрия мелкие, и их трудно однозначно обнаружить одним методом. Но, объединив ряд различных методов, можно было составить полное описание состояния насоса, связанного с натрием.
«Описание — решающий шаг к пониманию функции насоса. Теперь мы знаем, где и как сосредоточить будущие исследования», — говорит профессор Пол Ниссен, один из исследователей, участвовавших в исследовании, который также возглавлял описание структуры связанного с калием штат. «Но это исследование также указывает путь вперед и в другом направлении: молодые исследователи сыграли ключевую роль в этой работе, разработав и предоставив новые знания и методы в фундаментальных биомедицинских исследованиях.«Открытие секретов насоса — это не только увлекательная исследовательская работа, но и мотивация для развития и привлечения новых исследовательских талантов на благо университетов и корпораций», — говорит Пол Ниссен.
Полный круг
Описав обе стороны натрий-калиевого насоса, исследователи сделали важный шаг в понимании насоса, открытого Йенсом Кристианом Скоу еще в 1957 году. Теперь мы понимаем, как насос работает как «молекулярная наномашина», и можем наблюдать, как на него влияют мутации, которые приводят к его неправильной работе.Теперь исследователи стремятся составить более подробное описание помпы и получить более глубокие знания о ее функциях и влиянии на здоровье и болезни.
PDB-101: Молекула месяца: натриево-калиевый насос
Натрий-калиевый насос с ионами калия (зеленый) в транспортных центрах и аналогом фосфата (желтый) в сайтах связывания АТФ. Клеточная мембрана схематически показана серым цветом.
Скачать изображение TIFF в высоком качествеНаш организм потребляет много энергии.АТФ (аденозинтрифосфат) является одним из основных источников энергии в наших клетках; он постоянно используется и восстанавливается в течение дня. Удивительно, но если вы сложите количество АТФ, которое вырабатывается каждый день, оно примерно равно весу всего вашего тела. Этот АТФ расходуется по-разному: для питания мышц, для обеспечения правильных реакций ферментов, для нагрева вашего тела. Однако львиная доля приходится на белок, изображенный здесь: примерно треть АТФ, производимого нашими клетками, расходуется на питание натрий-калиевого насоса.
Накачка ионов
Натрий-калиевый насос (записи PDB 2zxe и 3b8e ) находится в наших клеточных мембранах, где он отвечает за создание градиента ионов. Он непрерывно перекачивает ионы натрия из клетки, а ионы калия в клетку, питаясь от АТФ. Для каждого расщепленного АТФ он перемещает 3 иона натрия и 2 иона калия внутрь. По мере того, как клетка истощается, это создает электрический градиент и градиент концентрации, которые используются для многих задач.Amazing Gradients
Наиболее эффективное использование этого градиента — передача нервных сигналов. Наши нервные аксоны истощают себя ионами натрия, а затем используют специальные потенциалозависимые натриевые каналы, чтобы ионы возвращались обратно во время нервного импульса. Натрий-калиевый насос должен держать аксон готовым к следующему сигналу. Градиент также помогает контролировать осмотическое давление внутри клеток и приводит в действие множество других насосов, которые связывают поток ионов натрия с переносом других молекул, таких как ионы кальция или глюкозы.
Лекарство для сердца
Традиционное лекарство от сердечной недостаточности работает путем блокировки натрий-калиевого насоса. Токсины растений, такие как дигиталис и уабаин (запись PDB 3a3y ) и аналогичные токсины ядовитых жаб, известные под общим названием кардиотонические стероиды, можно использовать в малых дозах для замедления перекачки ионов. По мере того, как уровень ионов натрия увеличивается внутри клетки, это замедляет обменник натрия и кальция, что приводит к накоплению кальция, что в конечном итоге увеличивает силу сокращения сердечной мышцы.Недавние исследования показали, что наши собственные клетки производят молекулы, похожие на эти токсины, но только в низких концентрациях, чтобы регулировать действие наших натриево-калиевых насосов.Насосы P-типа
Натрий-калиевый насос (показан здесь из записи PDB 2zxe ) — один из большого класса насосов для АТФазы P-типа, названных так потому, что все они включают в свой механизм промежуточный продукт, связанный с фосфатом. Несколько других примеров в настоящее время доступны в PDB. Доступны многие конструкции кальциевого насоса (здесь изображена запись PDB 1su4 ), показывающая, как эти насосы претерпевают большие конформационные изменения в ходе цикла откачки.Другие примеры включают протонный насос, обнаруженный в мембранах растительных клеток (запись PDB 3b8c ), и протонно-калиевый насос, который подкисляет желудок (запись PDB 3ixz , здесь не показана). Протонный насос и кальциевый насос состоят из одной цепи, тогда как насосы, транспортирующие калий, обычно имеют вторую меньшую цепь, показанную здесь бирюзовым цветом. В структуре натрий-калиевого насоса также есть третья регулирующая цепь, показанная здесь фиолетовым цветом.Флуоресцентные индикаторы Na + и K + для визуализации функции клеток | Abcam
Обзор индикаторов Na +Существует большая разница в концентрации ионов натрия внутри и вне клетки (5-40 мМ внутриклеточно; 120-450 мМ внеклеточно, в зависимости от организма).Этот градиент концентрации необходим для поглощения питательных веществ, регулирования концентраций других внутриклеточных ионов и растворенных веществ, а также для генерации и передачи электрических импульсов в возбудимых клетках. Низкая внутриклеточная концентрация натрия требует использования чувствительных красителей, способных регистрировать любые небольшие отклонения. Поскольку внутриклеточная концентрация калия обычно выше, чем концентрация натрия (более 100 мМ), индикаторы Na + должны избирательно реагировать на Na +, а не на K +.
Индикатор | Возбуждение (нм) | Эмиссия (нм) | K d (мМ) |
| Ион NaTRIUM Зеленый — TMA6 Salt / AM | 17488309 | 20 |
Форма ацетоксиметилового (AM) сложного эфира, впервые представленная в 1981 г.Tsien1, 2 неинвазивен и является наиболее популярным методом
загрузки флуоресцентных ионных индикаторов в клетки. Функции фенольных и карбоновых кислот в молекуле дериватизируются в виде сложных эфиров AM
. Эти сложные эфиры делают молекулу достаточно гидрофобной, чтобы проникать через мембрану. Попав внутрь клетки, неспецифические эстеразы
, обнаруженные почти во всех типах клеток, гидролизуют сложные эфиры обратно до полианионной формы, необходимой для водорастворимости;
удержание в ячейке; и для обнаружения ионов.
Ion NaTRIUM Green — TMA + Salt
Ion NaTRIUM Green — это флуоресцентный индикатор с видимой длиной волны и полезным динамическим диапазоном для измерения цитозольных концентраций Na + . Краситель возбуждается видимым светом. Хотя Ion NaTRIUM Green максимально возбуждает на длине волны 517 нм, его исключительная яркость обеспечивает возбуждение при стандартных настройках 488 нм. Более того, он хорошо работает для двухфотонного возбуждения ближним инфракрасным светом. Ion NaTRIUM Green также отличается стойкостью к фотообесцвечиванию и утечкам.
Соль ТМА представляет собой водорастворимую солевую форму Ion NaTRIUM Green, доступную для целей калибровки или для инвазивной загрузки, такой как микроинъекция в клетки или загрузка через цельноклеточный патч-электрод, а также для калибровки красителя in vitro. .
Ion NaTRIUM Green — AM
Форма ацетоксиметилового (AM) эфира Ion NaTRIUM Green неинвазивна и является наиболее популярным методом загрузки флуоресцентных ионных индикаторов в клетки. Функции фенольных и карбоновых кислот в молекуле дериватизируются в виде сложных эфиров AM.Эти сложные эфиры делают молекулу достаточно гидрофобной, чтобы проникать через мембрану. Попав внутрь клетки, неспецифические эстеразы, обнаруженные почти во всех типах клеток, гидролизуют сложные эфиры до полианионной формы, необходимой для водорастворимости, удержания в клетке и восприятия ионов. Загрузка обычно выполняется в бессывороточной культуральной среде с эфиром AM в конечной концентрации в диапазоне от 1 до 10 мкМ.
K
+ индикаторов вкратце| Индикатор | Возбуждение (нм) | Эмиссия (нм) | K d (мМ) |
| Ион Калий 309 Зеленый 6309 5309 | 18 | ||
| PBFI | 340/390 | 500 | 5 |
Ион калиевый зеленый
Ион калиевый зеленый — это флуоресцентный индикатор с полезным K d 9136 для измерения цитозола концентрация.Он легко заряжается и возбуждается видимым светом. Несмотря на то, что он не является логометрическим, его большой динамический диапазон флуоресценции позволяет обнаруживать даже небольшие изменения в концентрации K + . Оптимальное возбуждение происходит на длине волны 517 нм, но индикатор также может возбуждаться на обычной длине волны 488 нм. Ионно-калиевый зеленый хорошо работает с двухфотонным возбуждением в ближнем инфракрасном диапазоне и, хотя и не полностью устойчив к фотообесцвечиванию, он более устойчив, чем другие красители. Как и его аналог Na + , он полезен для конфокальной микроскопии, проточной цитометрии и скрининга.
PBFI
K d PBFI для K + сильно зависит от присутствия Na + со значением 5,1 мМ в отсутствие Na + и 44 мМ в растворах с комбинированная концентрация Na + и K + 135 мМ (что приблизительно соответствует физиологической ионной силе). Хотя селективность PBFI для K + меньше, чем у индикаторов Ca 2+ , таких как Fura-2, ее достаточно для определения физиологических концентраций K + в присутствии других одновалентных катионов.Спектральный отклик PBFI при связывании ионов позволяет измерять коэффициент возбуждения, и этот индикатор можно использовать с теми же оптическими фильтрами и оборудованием, что и для Fura-2.
Na
+ ионофорыИонофоры способствуют транспортировке ионов Na + через липидные мембраны, в результате чего Na + может течь из отсека с более высокой концентрацией Na + через мембрану в отсек с более низкими концентрациями Na +. Эти ионофоры можно использовать для уравновешивания внутриклеточных и внеклеточных концентраций Na +.
Натриевая соль монензина — Na + -селективный карбоксильный ионофор
K
+ ионофорыВалиномицин
Валиномицин представляет собой природную липидорастворимую молекулу, которая связывает ионы калия (K + ) и облегчает их перенос. липидные бислои. Он демонстрирует 10 000-кратную селективность для K + по сравнению с Na + . Валиномицин — мощный антибиотик. Он обычно используется в качестве агента для индукции апоптоза, а также может использоваться для калибровки потенциометрических ответов в мембранных экспериментах с участием потенциально-чувствительных красителей.
Нигерицин
Нигерицин селективен как к K + , так и к ионам водорода (H + ). Поэтому он обычно используется при калибровке флуоресценции цитозольных индикаторов pH.
Nonactin
Моновалентный катион-ионофор, проявляющий селективность в отношении K + и NH 4 + (K + = NH 4 + > Na + > Mg Li 2+ > Mg Li 2+ > Mg Li 2+ + >> Ca 2+ ).Стимулирует перенос катионов через искусственные мембраны.
Как калий попадает в клетки?
Сбалансированное калийное домашнее хозяйство имеет решающее значение для выживания как людей, так и бактерий. Поскольку бактерии подвержены гораздо большим колебаниям условий окружающей среды, контролируемое потребление калия часто представляет собой особую проблему. Поскольку клеточная мембрана непроницаема для ионов калия, она должна перемещаться через определенные мембранные транспортные белки.
С одной стороны, калиевые каналы обеспечивают быстрый, но пассивный приток ионов калия. Это прекращается, как только достигается электрохимическое равновесие между клеткой и окружающей средой. Для достижения более высоких внутриклеточных концентраций калий активно транспортируется в клетку через калиевые насосы, при этом энергия расходуется в форме АТФ.
Поскольку оба семейства белков — каналы и насосы — выполняют очень разные функции, они всегда описывались как отдельные друг от друга.Этому, однако, противоречит наблюдение, что KdpFABC, высокоаффинная, активная система поглощения калия бактериями, не представляет собой простой насос, а состоит из четырех различных белков. Один из них является производным от обычного насоса, а другой похож на калиевый канал.
Инга Хенельт, доцент кафедры биохимии Университета Гете, и ее коллега Кристина Паулино из Университета Гронингена, Нидерланды, поэтому решили поближе взглянуть на мембранный белок KdpFABC через микроскоп, или, точнее, криоэлектрон. микроскоп.Результат их удивил: «Все предыдущие гипотезы были ошибочными», — утверждает Инга Хенельт. «Несмотря на то, что перед нами были все данные, нам потребовалось время, чтобы понять, каким образом калий проходит через комплекс в клетку».
Во-первых, канальный белок связывает калий и транспортирует его через первый туннель к насосу. По прибытии первый туннель, обращенный наружу, закрывается, а второй туннель, обращенный внутрь, открывается. Этот туннель также проходит между обоими белками и в конечном итоге заканчивается внутри клетки.«Этот комплекс, по сути, сочетает в себе лучшие качества обоих семейств белков», — объясняет Шарлотт Сток, докторант исследовательской группы Инге Хэнельт. «Каналоподобный белок связывает калий, сначала очень специфично и с высоким сродством, в то время как помпа обеспечивает активный транспорт, который может обогатить калий в клетке в 10 000 раз».
Данные, недавно опубликованные в Nature Communications , впечатлили ученых тем, насколько разнообразным может быть перенос через мембраны.«Мы узнали, что при исследовании различных белков мембранного транспорта мы не должны полагаться на кажущиеся неопровержимыми механизмы, но должны быть готовы к сюрпризам», — резюмирует Инга Хенельт.
###
Публикация: Charlott Stock, Lisa Hielkema, Igor Tascon, Dorith Wunnicke, Gert T. Oostergetel, Mikel Azkargorta, Cristina Paulino, Inga Hänelt, Крио-ЭМ структуры KdpFABC предполагают механизм транспорта K + через два межсубъединичных полуканала, в : Nature Communications , 10.1038 / s41467-018-07319-2
Изображение можно загрузить по адресу: http://www.uni-frankfurt.de/75137139
Надпись: Наружные и внутренние открывающиеся структуры KdpFABC в клеточной мембране. Предоставлено: исследовательская группа Инги Хенельт.
Дополнительная информация: д-р Инга Хенельт, Институт биохимии, факультет 14, кампус Ридберг, телефон: +49 69 798-29262, [email protected].
Текущие новости науки, образования и общества в GOETHE-UNI онлайн (http: // www.aktuelles.uni-frankfurt.de)
Университет Гете — исследовательский университет в европейском финансовом центре Франкфурта. Университет был основан в 1914 году за счет частного финансирования, в основном за счет еврейских спонсоров, и с тех пор добился новаторских достижений в области социальных наук, социологии и экономики. медицина, квантовая физика, исследования мозга и трудовое право. 1 января 2008 года он получил уникальный уровень автономии, вернувшись к своим историческим корням как «университет-основатель».Сегодня он входит в десятку лучших по внешнему финансированию и в тройку крупнейших университетов Германии с тремя кластерами передового опыта в области медицины, наук о жизни и гуманитарных наук. Вместе с Техническим университетом Дармштадта и Университетом Майнца он выступает в качестве партнера межгосударственного стратегического альянса Рейн-Майн университетов. Интернет: http://www.uni-frankfurt.de
Издатель: Президент Университета Гете Редактор: Доктор Энн Харди, референт отдела научных коммуникаций, PR и коммуникаций, Theodor-W.-Adorno-Platz 1, 60323 Франкфурт-на-Майне, тел .: (069) 798-13035, факс: (069) 798-763 12531
Журнал
Nature Communications
Заявление об ограничении ответственности: AAAS и EurekAlert! не несут ответственности за точность выпусков новостей, размещенных на EurekAlert! участвующими учреждениями или для использования любой информации через систему EurekAlert.
.