Уникальные свойства воды — Cyber Aqua на vc.ru
1. Вода полярная. Молекулы воды полярны, с частичным положительным зарядом на атомах водорода, частичным отрицательным зарядом на кислороде и изогнутой общей структурой. Это связано с тем, что кислород более электроотрицателен, а это означает, что он лучше, чем водород, притягивает электроны.
2. Вода отличный растворитель. Вода обладает уникальной способностью растворять многие полярные и ионные вещества. Это важно для всех живых существ, потому что, когда вода проходит через круговорот воды, она забирает с собой много ценных питательных веществ!
3. Вода обладает высокой теплоемкостью. Чтобы повысить температуру определенного количества воды на градус, требуется много энергии, поэтому вода помогает регулировать температуру в окружающей среде. Например, это свойство позволяет температуре воды в пруду оставаться относительно постоянной днем и ночью, независимо от изменения температуры воздуха.
4. Вода имеет высокую теплоту испарения.
5. Вода обладает когезионными и адгезионными свойствами. Молекулы воды обладают сильными силами сцепления из-за их способности образовывать водородные связи друг с другом. Силы сцепления ответственны за поверхностное натяжение тенденцию поверхности жидкости сопротивляться разрыву, когда она находится под напряжением или напряжением. Вода также обладает адгезионными свойствами, которые позволяют ей прилипать к другим веществам, кроме нее самой.
Эти когезионные и адгезионные свойства необходимы для переноса жидкости во многих формах жизни. Например, они позволяют транспортировать питательные вещества к верхушке дерева против силы тяжести.
6. Вода менее плотная в твердом виде, чем в жидкой.
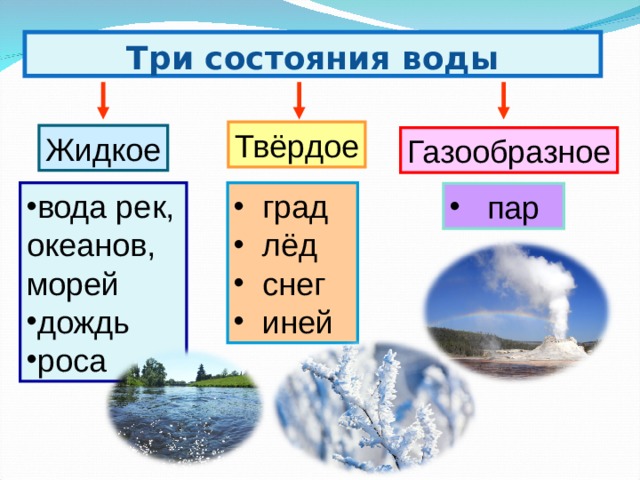 Когда вода замерзает, молекулы образуют кристаллическую структуру, которая разделяет молекулы дальше, чем в жидкой воде. Это означает, что лед менее плотный, чем жидкая вода, поэтому он плавает.
Когда вода замерзает, молекулы образуют кристаллическую структуру, которая разделяет молекулы дальше, чем в жидкой воде. Это означает, что лед менее плотный, чем жидкая вода, поэтому он плавает.Это свойство важно, поскольку оно защищает пруды, озера и океаны от замерзания и позволяет жизни продолжать процветать под ледяной поверхностью.
Распространенные ошибки и заблуждения
• Вода растворяет все, потому что это «универсальный растворитель». Вода обладает способностью растворять многие вещества, но термин «универсальный растворитель» вводит в заблуждение. Вода способна растворять другие полярные молекулы и ионы, такие как сахара и соли. Однако неполярные молекулы, такие как масла, не имеют частичных положительных или частичных отрицательных зарядов, поэтому они не притягиваются к молекулам воды. Вот почему неполярные вещества, такие как масло, остаются отдельными при добавлении в воду.
Источник:
https://cyberaqua.ru/
24 125 просмотров
Какие виды воды бывают.
 Разные виды и свойства воды
Разные виды и свойства водыОпубликовано:
Какие виды воды бывают. Разные виды и свойства воды. Признаки, по которым производится классификация всей существующей и производимой на планете воды. Особенности и состав каждой разновидности воды. Подвиды водной среды по различным физическим и химическим характеристикам. Хотите знать, какие виды воды бывают? Разные виды и свойства воды получаются в зависимости от определённых физических и химических характеристик водной среды.
Содержание
- По каким признакам классифицируется вода?
- Деление жидкости на разные виды в зависимости от водородных изотопов в молекуле водной среды
- Классификация воды по концентрации растворённых солевых частиц
- Деление водной среды, которая получается в процессе взаимодействия с иными компонентами
- Классификация воды по её местонахождению в природе
- Природные водные среды
- Жидкость, образующаяся в результате различных видов деятельности человека
- Другие воды водной среды
По каким признакам классифицируется вода?
Различные виды воды имеют разные свойства и состав. Существует несколько классификаций жидкостей:
Существует несколько классификаций жидкостей:
- Деление жидкости на разные виды в зависимости от водородных изотопов в молекуле водной среды.
- Классификация воды по концентрации растворённых солевых частиц.
- Деление водной среды, которая получается в процессе взаимодействия с иными компонентами.
- Классификация воды по её местонахождению в природе.
- Природные водные среды.
- Жидкость, образующаяся в результате различных видов деятельности человека.
- Другие воды водной среды.
Каждая разновидность воды имеет свою отдельную классификацию. Давайте рассмотрим деление по отдельным видам воды, их особенности и свойства.
Деление жидкости на разные виды в зависимости от водородных изотопов в молекуле водной среды
Различные виды воды в природе можно классифицировать по изотопам водорода на такие категории:
- Лёгкая водная среда – это такая разновидность водной среды, которая прошла процесс очистки от тяжёлых составляющих.
 Как правило, питьевая вода в большинстве своём именно лёгкая жидкость.
Как правило, питьевая вода в большинстве своём именно лёгкая жидкость. - Тяжёлая водная среда – это жидкость с такой же химической формулой, как и обычная вода, однако в её составе водородные молекулы замещены двумя тяжёлыми водородными изотопами.
- Полутяжёлая водная среда – это вода, которая в чистом виде нигде не обнаруживается. Обычно она есть в любой разновидности воды в небольшом количестве.
- Сверхтяжёлая водная среда характеризуется заменой водородных молекул двумя тритиевыми изотопами.
- Тяжёлокислородные виды водной среды с изотопами.
Классификация воды по концентрации растворённых солевых частиц
Различные виды питьевой воды и не питьевой жидкости могут классифицироваться по признаку солесодержания на такие подвиды:
- Жёсткая или мягкая водная среда обусловлена показателем жёсткости воды. Он зависит от концентрации в воде растворённых солей. Чаще всего выявляется присутствие кальциевых и магниевых солей. При этом все химически и физические свойства жидкости напрямую связаны с концентрацией солей щелочноземельных металлов.

- Пресная водная среда – это жидкость, в которой концентрация солей не выше 0,1 процента.
- Морская водная среда – это жидкость с большим содержанием солей. Их концентрация может быть в пределах 34,72 процентов.
- Минеральные природные воды – это жидкость из подземных источников, в которой концентрация микроэлементов и активных минералов очень высокая. Именно содержанием этих веществ и объясняются целебные свойства такой воды. В свою очередь она делится на разные виды воды: вода с малой степенью минерализации, вода со средним показателем концентрации минералов, жидкость с высоким уровнем минерализации, рассольная вода, крепкая рассольная вода.
- Солоноватые виды воды на земле – это промежуточное состояние воды, концентрация минералов в которой больше чем в пресной, но меньше чем в морской водной среде.
- Дистиллированная водная среда – это жидкость, которая прошла процесс испарения и конденсации, благодаря чему избавилась от любых солей и примесей, содержащихся в ней.

Деление водной среды, которая получается в процессе взаимодействия с иными компонентами
Различные виды воды получаются при её взаимодействии с другими компонентами. Так образуются такие типы водной среды:
- Шунгитовая среда получается при реакции с шунгитом.
- Кремниевая вода получается при взаимодействии с кремнием.
- Коралловая жидкость образуется при соседстве с кораллами.
- Кислородная среда обогащена кислородом.
- Фильтрованная водная среда проходит процесс очистки в фильтрах.
- Серебряная.
- Золотая.
- Медная.
Классификация воды по её местонахождению в природе
Хотите знать, какие виды воды существуют в гидросфере? Они делятся по местонахождению жидкости на такие подвиды:
- Подземная вода – это жидкость, которая залегает в водоносных пластах земной коры.
- Подводные воды (субмаринные) располагаются под океанами, большими водоёмами и морями.
- Артезианская вода залегает между водоупорными пластами и находится под большим давлением.

- Грунтовые воды – это ближе всего расположенные к поверхности земли водоносные пласты.
- Воды суши – это озёра, реки, болота, моря, океаны и другие поверхностные природные водные объекты.
- Атмосферные воды – это жидкость, скапливающаяся в атмосферных слоях.
Природные водные среды
Различные свойства имеют и природные виды воды:
- Вода из родников обычно самая чистая.
- Дождевая жидкость – это пресные воды, которые выпадают на землю в виде осадков.
- Питьевая водная среда обычно используется для питьевых нужд населения. Её состав и свойства не должны причинять никакого вреда человеческому здоровью.
Жидкость, образующаяся в результате различных видов деятельности человека
Хотите знать, сколько видов воды образуется в результате той или иной деятельности человека? Тогда рассмотрим их разновидности:
- Водопроводная жидкость подаётся в наши дома по системе централизованного водоснабжения.
- Канализационные стоки – это жидкость, отводящаяся из наших домов по канализационной системе.

- Сточная вода – это отходы различных производственных предприятий.
- Кипячёная вода.
Другие воды водной среды
Также существуют виды воды, отличающиеся по другим свойствам и характеристикам:
- Щелочная вода – это жидкость с показателем кислотно-щелочного баланса, превышающим значение 7,1.
- Магнитная водная среда обрабатывается магнитным полем.
- Деионизированная вода (без примесей).
- Апирогенная водная среда (вода для инъекций).
- Структурированная вода.
- Поливода.
- Талая вода.
У нас вы можете заказать анализ воды, чтобы выявить её качество, характеристики и свойства. Цена анализа зависит от проверяемых показателей и уточняется при звонке.
Рейтинг
( Пока оценок нет )
Физические и химические свойства воды
Биохимия
- Сообщение от Кеннеди Брем
02
августаОсновные понятия
В этом уроке о свойствах воды вы узнаете о физических и химических свойствах воды. Вы также узнаете о структуре молекулы воды.
Вы также узнаете о структуре молекулы воды.
Темы, освещенные в других статьях
Полярность воды
Электроотрицательность
Растворитель против растворителя. Растворенное вещество
Удельная теплоемкость
Плотность
Словарь
Плотность- Масса на единицу объема
Удельная теплоемкость- Количество энергии, необходимое для повышения температуры 1 кг материала 90 2 90 3 C 90 1 Теплота 1 0 of Vaporization- Количество энергии, необходимое для превращения некоторого количества жидкости в газ
Полярная молекула- Молекула с частично отрицательно заряженным концом и частично положительно заряженным концом
Электроотрицательность- Склонность атома притягивать общие электроны в химической связи h30) является «универсальным растворителем» и самой распространенной поверхностью на Земле. Это также единственное обычное вещество, существующее в твердом, жидком и газообразном состояниях. Молекулы воды образуют водородные связи и чрезвычайно полярны. Пять основных свойств воды — это ее высокая полярность, высокая удельная теплоемкость, высокая теплота парообразования, низкая плотность в твердом состоянии и притяжение к другим полярным молекулам.
Молекулы воды образуют водородные связи и чрезвычайно полярны. Пять основных свойств воды — это ее высокая полярность, высокая удельная теплоемкость, высокая теплота парообразования, низкая плотность в твердом состоянии и притяжение к другим полярным молекулам.
Полярность и структура
Один атом кислорода и два атома водорода составляют молекулу воды. Он имеет изогнутую молекулярную геометрию с кислородом, имеющим две неподеленные пары электронов. Разница в электроотрицательности между кислородом и водородом приводит к тому, что кислород имеет частичный отрицательный заряд, а водород — частичный положительный заряд. Эта разница в заряде вызывает полярность. Частичный положительный заряд водорода одной молекулы воды притягивает частичный отрицательный заряд кислорода другой молекулы воды. Это притяжение называется водородной связью.
Водородная связь слабее, чем ковалентная связь между кислородом и водородом одной и той же молекулы, но обуславливает многие уникальные свойства воды.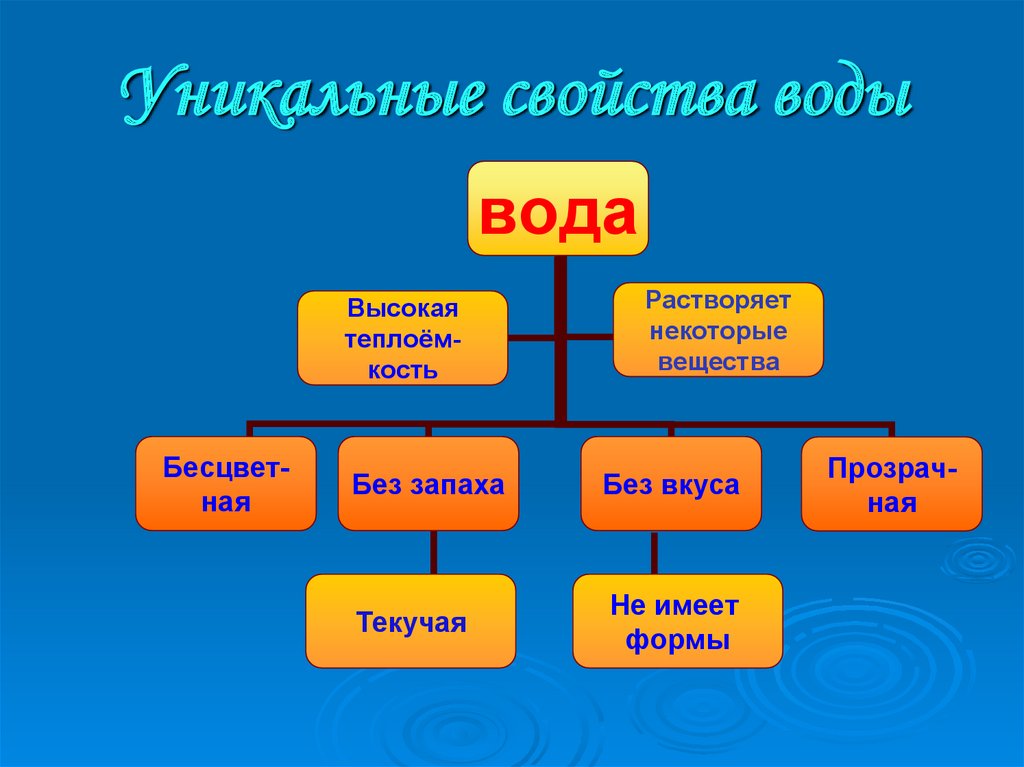 Например, для разрыва водородных связей требуется больше энергии, поэтому вода имеет более высокую температуру плавления и кипения.
Например, для разрыва водородных связей требуется больше энергии, поэтому вода имеет более высокую температуру плавления и кипения.
Универсальный растворитель
Вода — растворитель жизни. Гидрофильные вещества – это те, которые растворяются в воде, тогда как гидрофобные вещества плохо смешиваются с водой. Вещества могут растворяться в воде, если они могут соответствовать или преодолевать водородные связи между молекулами воды. Если они не могут, вещество образует осадок. Кислоты, спирты и соли хорошо растворимы в воде, а жиры и масла гидрофобны.
Растворенное в воде ионное вещество отделяется. Например, NaCl распадается на катионы Na+ и анионы Cl-, окруженные молекулами воды. Вода амфотерна, то есть может действовать как кислота или основание в зависимости от раствора. Он может образовывать ионы H+ и OH-.
Удельная теплоемкость
Вода имеет высокую удельную теплоемкость 4184 Дж/(кг x К) при 20°C и высокую теплоту парообразования из-за водородных связей. Это позволяет водоемам иметь минимальные колебания температуры для регулирования климата.
Это позволяет водоемам иметь минимальные колебания температуры для регулирования климата.
Высокая температура испарения воды позволяет людям использовать пот для охлаждения. Пот в основном состоит из воды. Он поглощает избыточное тепло тела, когда оно испаряется. Этот процесс известен как испарительное охлаждение.
Плотность
Плотность воды составляет 1 грамм на кубический сантиметр. Это используется для определения грамма. Вместо того, чтобы подвергаться тепловому расширению, плотность увеличивается с температурой до пика 3,98 ° C, а затем уменьшается. Отрицательное тепловое расширение — это увеличение плотности между 32 и 390,16 F. В результате лед менее плотный, чем вода, которая имеет уменьшение плотности примерно на 10%. Вот почему водоемы могут иметь слой льда на поверхности, но содержать жидкость под ним. Это позволяет рыбам и морским обитателям выживать подо льдом. Высокая удельная теплоемкость поддерживает относительно стабильную температуру воды в течение зимы, что позволяет морской флоре и фауне выжить.
Содержание соли снижает температуру замерзания океана почти на 2°C. Лед по-прежнему плавает в океане, но лед практически не содержит солей, а его плотность аналогична плотности льда в пресноводных водоемах. Соль увеличивает соленость и плотность оставшейся воды, которая опускается за счет конвекции. Этот процесс называется отказом от рассола.
Сжимаемость
Сжимаемость является результатом давления и температуры. Сжимаемость воды настолько мала, что ее часто считают несжимаемой. Низкая сжимаемость позволяет воде в глубоких океанах с высоким давлением уменьшаться в объеме всего на 1,8%.
Электропроводность
Чистая вода является хорошим изолятором, но деионизированная вода никогда не бывает полностью свободной от ионов. Вода в жидком состоянии подвергается процессу, называемому автоионизацией. Это означает, что две молекулы воды могут образовать один анион гидроксида (OH-) и один катион гидроксония (H 3 0+).
Когезия и адгезия
Водородные связи между молекулами воды постоянно разрываются и восстанавливаются с другими молекулами воды. Когезия – это способность молекул воды слипаться. Полярность воды также придает воде высокую адгезию: способность прилипать к другим поверхностям. Силы сцепления сильнее, чем силы сцепления.
Когезия – это способность молекул воды слипаться. Полярность воды также придает воде высокую адгезию: способность прилипать к другим поверхностям. Силы сцепления сильнее, чем силы сцепления.
Благодаря сильному когезии и адгезии вода проявляет капиллярное действие. Капиллярное действие — это процесс течения жидкости через узкое пространство без и часто против силы тяжести. Вода прилипает к стенкам корней растений и поднимается в растение. Пористые материалы, такие как вода, также проявляют капиллярное действие. Деревья могут переносить воду за счет капиллярного действия на расстояние более 100 метров.
Поверхностное натяжение
Водородная связь также приводит к тому, что вода имеет высокое поверхностное натяжение 71,99 мН/м при 25. Поверхностное натяжение достаточно велико, чтобы насекомые могли ходить по воде. Поверхностное натяжение является результатом когезионных свойств воды. Капли воды и вода, поднимающаяся над краем стакана, показывают высокое поверхностное натяжение воды. Подробнее о свойствах воды читайте здесь.
Подробнее о свойствах воды читайте здесь.
2.5: Свойства воды — биология LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 74484
- OpenStax
- OpenStax
Развитие навыков
- Описать свойства воды, имеющие решающее значение для поддержания жизни
- Объясните, почему вода является отличным растворителем
- Приведите примеры когезионных и адгезивных свойств воды
- Обсудите роль кислот, оснований и буферов в гомеостазе
Почему ученые тратят время на поиски воды на других планетах? Почему вода так важна? Это потому, что вода необходима для жизни, какой мы ее знаем. Вода — одна из самых распространенных молекул и наиболее важная для жизни на Земле. Примерно 60–70 процентов человеческого тела состоит из воды. Без него жизнь, какой мы ее знаем, просто не существовала бы.
Вода — одна из самых распространенных молекул и наиболее важная для жизни на Земле. Примерно 60–70 процентов человеческого тела состоит из воды. Без него жизнь, какой мы ее знаем, просто не существовала бы.
Полярность молекулы воды и возникающие в результате водородные связи делают воду уникальным веществом с особыми свойствами, которые тесно связаны с процессами жизни. Первоначально жизнь развивалась в водной среде, и большая часть клеточной химии и метаболизма организма происходит внутри водянистого содержимого цитоплазмы клетки. К особым свойствам воды относятся ее высокая теплоемкость и теплота парообразования, способность растворять полярные молекулы, ее когезионные и адгезивные свойства, а также ее диссоциация на ионы, что приводит к образованию рН. Понимание этих характеристик воды помогает понять ее важность для поддержания жизни.
Полярность воды
Одним из важных свойств воды является то, что она состоит из полярных молекул: водород и кислород внутри молекул воды (H 2 O) образуют полярные ковалентные связи.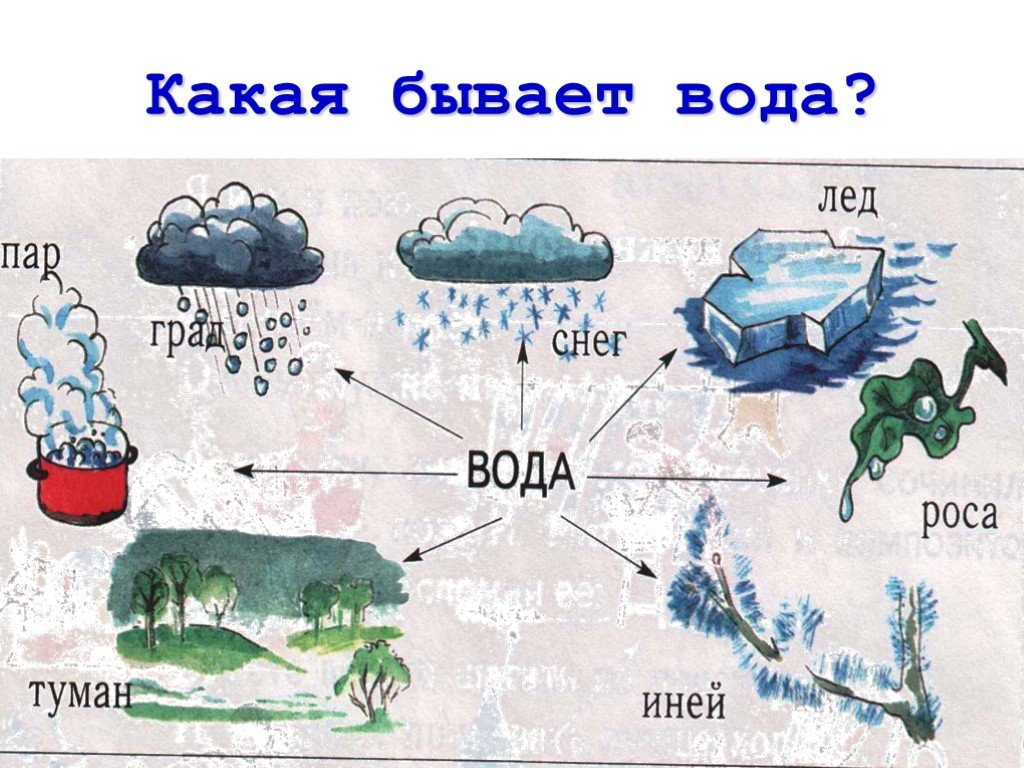 В то время как у молекулы воды нет чистого заряда, полярность воды создает слегка положительный заряд на водороде и слегка отрицательный заряд на кислороде, способствуя свойствам притяжения воды. Заряды воды образуются из-за того, что кислород более электроотрицательный, чем водород, что повышает вероятность того, что общий электрон будет находиться рядом с ядром кислорода, а не с ядром водорода, что приводит к частичному отрицательному заряду вблизи кислорода.
В то время как у молекулы воды нет чистого заряда, полярность воды создает слегка положительный заряд на водороде и слегка отрицательный заряд на кислороде, способствуя свойствам притяжения воды. Заряды воды образуются из-за того, что кислород более электроотрицательный, чем водород, что повышает вероятность того, что общий электрон будет находиться рядом с ядром кислорода, а не с ядром водорода, что приводит к частичному отрицательному заряду вблизи кислорода.
В результате полярности воды каждая молекула воды притягивает другие молекулы воды из-за противоположных зарядов между молекулами воды, образуя водородные связи. Вода также притягивает или притягивается к другим полярным молекулам и ионам. Полярное вещество, которое легко взаимодействует с водой или растворяется в ней, называется гидрофильным (гидро- = «вода»; -фильный = «любящий»). Напротив, неполярные молекулы, такие как масла и жиры, плохо взаимодействуют с водой, как показано на рисунке \(\PageIndex{1}\), и отделяются от нее, а не растворяются в ней, как мы видим в заправках для салатов, содержащих масло.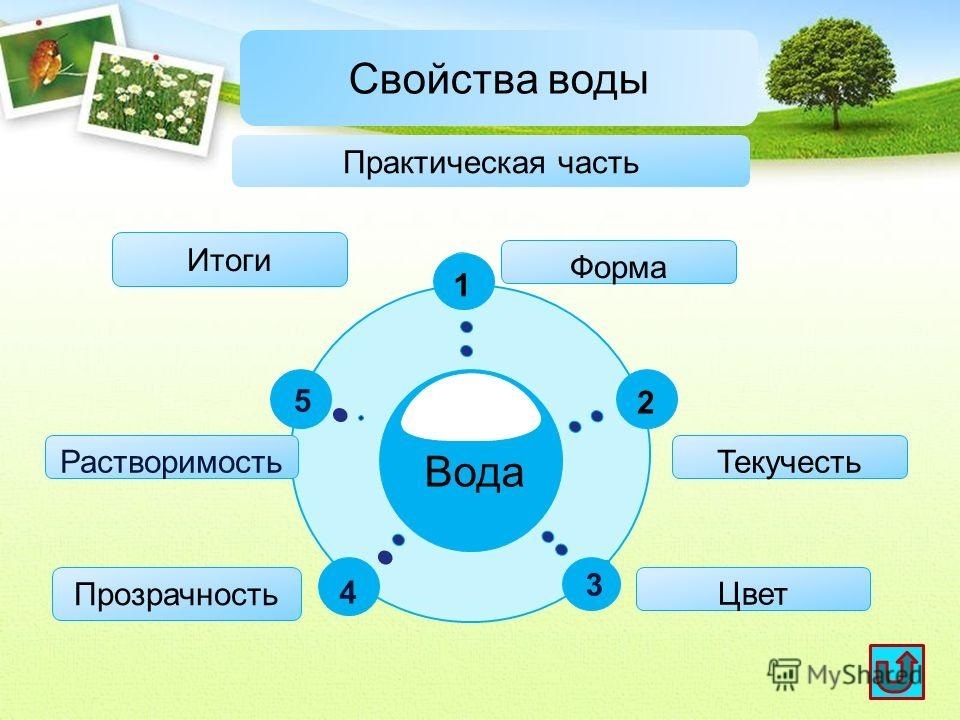 и уксус (кислый водный раствор). Эти неполярные соединения называются гидрофобными (гидро- = «вода»; -фоб = «боязнь»).
и уксус (кислый водный раствор). Эти неполярные соединения называются гидрофобными (гидро- = «вода»; -фоб = «боязнь»).
Образование водородных связей является важным качеством жидкой воды, которое имеет решающее значение для жизни, какой мы ее знаем. Поскольку молекулы воды образуют водородные связи друг с другом, вода приобретает некоторые уникальные химические характеристики по сравнению с другими жидкостями, и, поскольку живые существа имеют высокое содержание воды, понимание этих химических свойств является ключом к пониманию жизни. В жидкой воде водородные связи постоянно образуются и разрываются, когда молекулы воды скользят друг относительно друга. Разрыв этих связей вызывается движением (кинетической энергией) молекул воды за счет тепла, содержащегося в системе.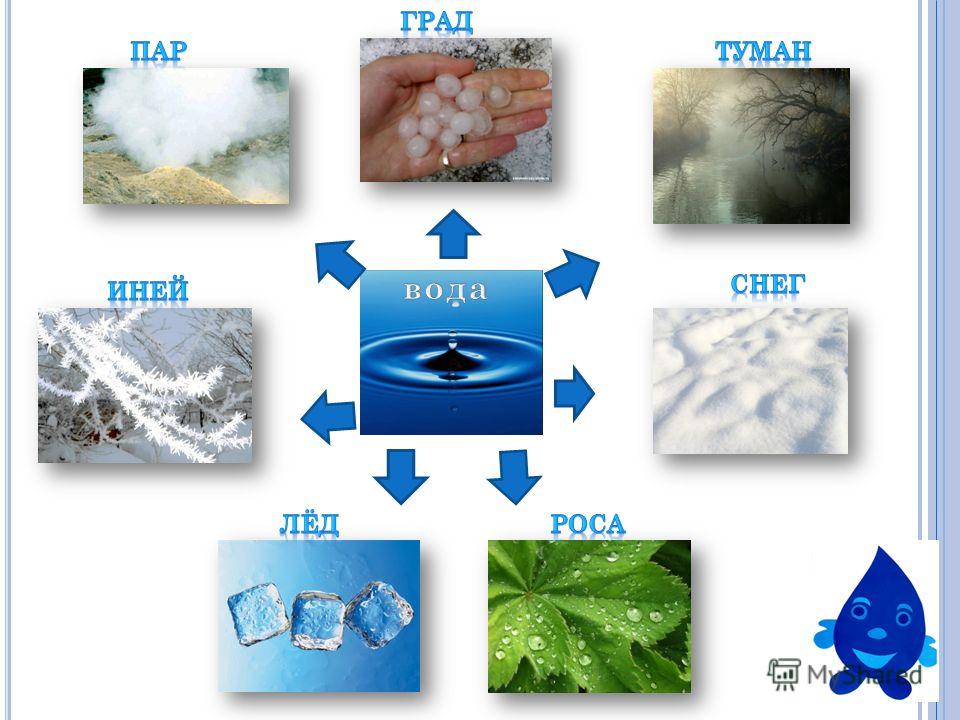 Когда тепло повышается при кипении воды, более высокая кинетическая энергия молекул воды приводит к полному разрыву водородных связей и позволяет молекулам воды выходить в воздух в виде газа (пара или водяного пара). С другой стороны, когда температура воды снижается и вода замерзает, молекулы воды образуют кристаллическую структуру, поддерживаемую водородными связями (энергии недостаточно для разрыва водородных связей), что делает лед менее плотным, чем жидкая вода, явление не наблюдается при затвердевании других жидкостей.
Когда тепло повышается при кипении воды, более высокая кинетическая энергия молекул воды приводит к полному разрыву водородных связей и позволяет молекулам воды выходить в воздух в виде газа (пара или водяного пара). С другой стороны, когда температура воды снижается и вода замерзает, молекулы воды образуют кристаллическую структуру, поддерживаемую водородными связями (энергии недостаточно для разрыва водородных связей), что делает лед менее плотным, чем жидкая вода, явление не наблюдается при затвердевании других жидкостей.
Более низкая плотность воды в ее твердом состоянии обусловлена тем, как ориентируются водородные связи при замерзании: молекулы воды раздвигаются дальше друг от друга по сравнению с жидкой водой. Для большинства других жидкостей затвердевание при понижении температуры включает снижение кинетической энергии между молекулами, что позволяет им упаковываться даже более плотно, чем в жидкой форме, и придает твердому телу большую плотность, чем жидкость.
Низкая плотность льда, показанная и изображенная на рисунке \(\PageIndex{2}\), представляет собой аномалию, заставляющую его плавать на поверхности жидкой воды, например, в айсберге или в кубиках льда в стакане.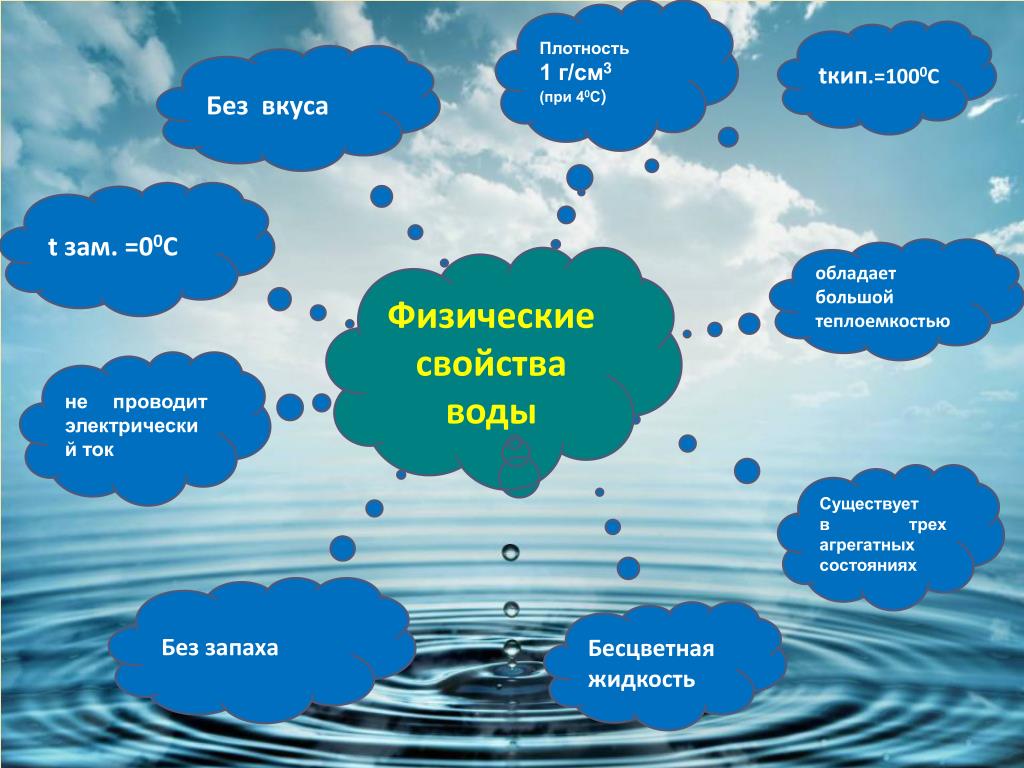 ледяной воды. В озерах и прудах лед образуется на поверхности воды, создавая изолирующий барьер, защищающий животных и растения в пруду от замерзания. Без этого слоя изолирующего льда растения и животные, живущие в пруду, замерзли бы в сплошной глыбе льда и не смогли бы выжить. Губительное действие замерзания на живые организмы обусловлено расширением льда относительно жидкой воды. Кристаллы льда, образующиеся при замораживании, разрывают тонкие мембраны, необходимые для функционирования живых клеток, необратимо повреждая их. Клетки могут пережить замораживание только в том случае, если вода в них временно заменена другой жидкостью, такой как глицерин.
ледяной воды. В озерах и прудах лед образуется на поверхности воды, создавая изолирующий барьер, защищающий животных и растения в пруду от замерзания. Без этого слоя изолирующего льда растения и животные, живущие в пруду, замерзли бы в сплошной глыбе льда и не смогли бы выжить. Губительное действие замерзания на живые организмы обусловлено расширением льда относительно жидкой воды. Кристаллы льда, образующиеся при замораживании, разрывают тонкие мембраны, необходимые для функционирования живых клеток, необратимо повреждая их. Клетки могут пережить замораживание только в том случае, если вода в них временно заменена другой жидкостью, такой как глицерин.
Ссылка на обучение
Видео: Нажмите здесь, чтобы увидеть трехмерную анимацию структуры ледяной решетки. (Изображение предоставлено Джейн Уитни. Изображение создано с помощью программного обеспечения Visual Molecular Dynamics VMD. 2 )
(Изображение предоставлено Джейн Уитни. Изображение создано с помощью программного обеспечения Visual Molecular Dynamics VMD. 2 )
Высокая теплоемкость воды
Высокая теплоемкость воды является свойством, обусловленным водородными связями между молекулами воды. Вода обладает наибольшей удельной теплоемкостью среди всех жидкостей. Удельная теплоемкость определяется как количество тепла, которое должен поглотить или отдать один грамм вещества, чтобы изменить его температуру на один градус Цельсия. Для воды это количество составляет одну калорию. Поэтому вода долго нагревается и долго охлаждается. На самом деле удельная теплоемкость воды примерно в пять раз больше, чем у песка. Это объясняет, почему суша остывает быстрее, чем море. Благодаря своей высокой теплоемкости вода используется теплокровными животными для более равномерного распределения тепла в их телах: она действует аналогично системе охлаждения автомобиля, перенося тепло из теплых мест в холодные, заставляя тело поддерживать более равномерная температура.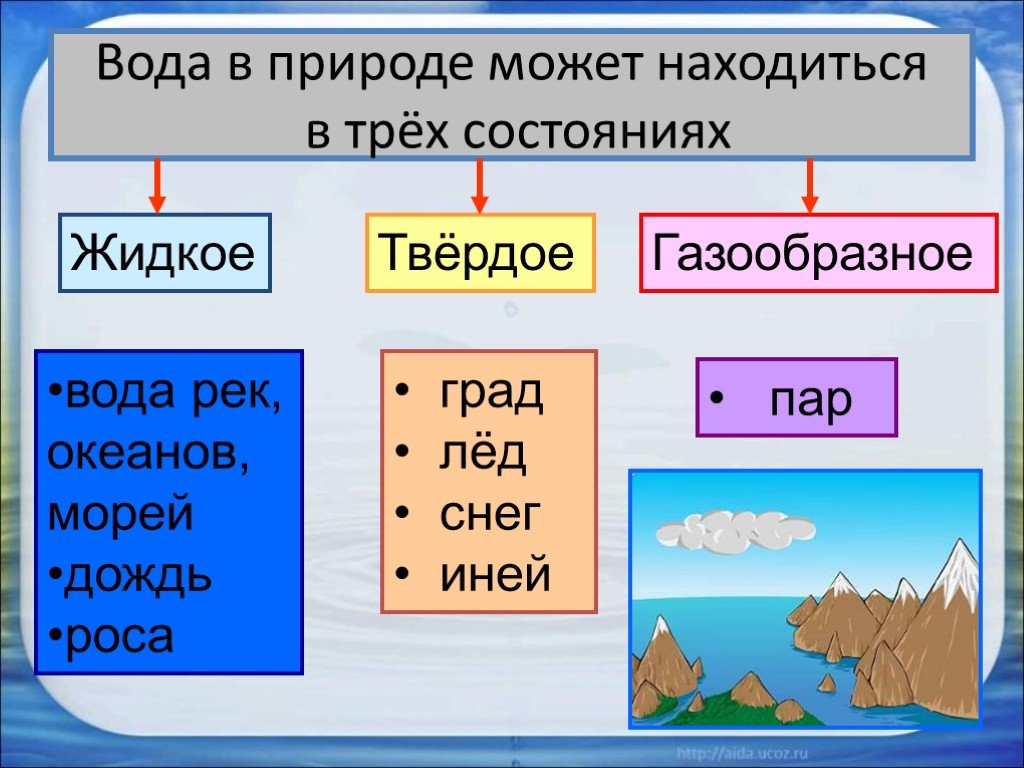
Теплота испарения воды
Вода также имеет высокую теплоту парообразования, количество энергии, необходимое для превращения одного грамма жидкого вещества в газ. Для осуществления этого превращения воды требуется значительное количество тепловой энергии (586 кал). Этот процесс происходит на поверхности воды. Когда жидкая вода нагревается, водородные связи затрудняют отделение молекул жидкой воды друг от друга, что необходимо для ее перехода в газообразную фазу (пар). В результате вода действует как поглотитель или резервуар тепла, и для ее кипения требуется гораздо больше тепла, чем для такой жидкости, как этанол (зерновой спирт), водородная связь которого с другими молекулами этанола слабее, чем водородная связь воды. В конце концов, когда вода достигает точки кипения 100 ° по Цельсию (212 ° по Фаренгейту), тепло может разорвать водородные связи между молекулами воды, а кинетическая энергия (движение) между молекулами воды позволяет им покинуть жидкость. как газ. Даже когда температура ниже точки кипения, отдельные молекулы воды получают достаточно энергии от других молекул воды, так что некоторые молекулы воды с поверхности могут ускользнуть и испариться: этот процесс известен как испарение.
Тот факт, что для испарения воды необходимо разорвать водородные связи, означает, что в процессе используется значительное количество энергии. Когда вода испаряется, процесс потребляет энергию, охлаждая окружающую среду, в которой происходит испарение. У многих живых организмов, в том числе и у человека, испарение пота, состоящего на 90 % из воды, позволяет организму охлаждаться для поддержания гомеостаза температуры тела.
Растворяющие свойства воды
Поскольку вода представляет собой полярную молекулу со слегка положительным и слегка отрицательным зарядом, ионы и полярные молекулы могут легко растворяться в ней. Поэтому воду называют растворителем, веществом, способным растворять другие полярные молекулы и ионные соединения. Заряды, связанные с этими молекулами, будут образовывать водородные связи с водой, окружая частицу молекулами воды. Это называется сферой гидратации или гидратной оболочкой, как показано на рисунке \(\PageIndex{3}\), и служит для разделения или диспергирования частиц в воде.
При добавлении к воде ионных соединений отдельные ионы реагируют с полярными областями молекул воды, и их ионные связи разрываются в процессе диссоциации. Диссоциация происходит, когда атомы или группы атомов отрываются от молекул и образуют ионы. Рассмотрим поваренную соль (NaCl или хлорид натрия): когда кристаллы NaCl добавляют в воду, молекулы NaCl диссоциируют на ионы Na + и Cl – , а вокруг ионов образуются сферы гидратации, как показано на рисунке \( \ИндексСтраницы{3}\). Положительно заряженный ион натрия окружен частично отрицательным зарядом кислорода молекулы воды. Отрицательно заряженный ион хлора окружен частично положительным зарядом водорода на молекуле воды.
Рисунок \(\PageIndex{3}\): Когда поваренная соль (NaCl) смешивается с водой, вокруг ионов образуются сферы гидратации.Когезионные и адгезивные свойства воды
Вы когда-нибудь наполняли стакан водой до самого верха, а затем медленно добавляли еще несколько капель? Прежде чем перелиться через край, вода образует куполообразную форму над краем стакана. Эта вода может оставаться над стеклом благодаря свойству когезии. При когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-газ (вода-воздух), хотя в стекле больше нет места.
Эта вода может оставаться над стеклом благодаря свойству когезии. При когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-газ (вода-воздух), хотя в стекле больше нет места.
Когезия допускает развитие поверхностного натяжения, способности вещества выдерживать разрыв при напряжении или напряжении. По этой же причине вода образует капли, когда ее кладут на сухую поверхность, а не расплющивают под действием силы тяжести. Когда небольшой клочок бумаги помещается на каплю воды, бумага плавает поверх капли воды, даже если бумага плотнее (тяжелее), чем вода. Когезия и поверхностное натяжение сохраняют водородные связи молекул воды неповрежденными и поддерживают плавание предмета на поверхности. Можно даже «поплавать» иглой над стаканом с водой, если положить ее осторожно, не нарушая поверхностного натяжения, как показано на рисунке \(\PageIndex{4}\).
Рисунок \(\PageIndex{4}\): Вес иглы тянет поверхность вниз; в то же время поверхностное натяжение тянет его вверх, удерживая на поверхности воды и удерживая от погружения. Обратите внимание на углубление в воде вокруг иглы. (Источник: Кори Занкер)
Обратите внимание на углубление в воде вокруг иглы. (Источник: Кори Занкер)Эти когезионные силы связаны со свойством воды прилипать или притяжением между молекулами воды и другими молекулами. Это притяжение иногда сильнее, чем силы сцепления воды, особенно когда вода подвергается воздействию заряженных поверхностей, таких как те, которые находятся внутри тонких стеклянных трубок, известных как капиллярные трубки. Адгезия наблюдается, когда вода «поднимается» вверх по трубке, помещенной в стакан с водой: обратите внимание, что вода кажется выше по бокам трубки, чем в середине. Это связано с тем, что молекулы воды притягиваются к заряженным стеклянным стенкам капилляра сильнее, чем друг к другу, и поэтому прилипают к нему. Этот тип адгезии называется капиллярным действием и показан на рисунке \(\PageIndex{5}\).
Рисунок \(\PageIndex{5}\): Капиллярное действие в стеклянной трубке вызвано силами сцепления, создаваемыми внутренней поверхностью стекла, превышающими силы сцепления между самими молекулами воды. (кредит: модификация работы Пирсона-Скотта Форесмана, переданная в дар Фонду Викимедиа)
(кредит: модификация работы Пирсона-Скотта Форесмана, переданная в дар Фонду Викимедиа)Почему когезионные и адгезионные силы важны для жизни? Когезионные и адгезионные силы важны для транспорта воды от корней к листьям растений. Эти силы создают «притяжение» к толще воды. Это притяжение возникает из-за тенденции молекул воды, испаряющихся на поверхности растения, оставаться связанными с молекулами воды под ними, и поэтому они притягиваются. Растения используют это природное явление, чтобы переносить воду от корней к листьям. Без этих свойств воды растения не смогли бы получать воду и растворенные минералы, которые им необходимы. В другом примере насекомые, такие как водомерка, показанная на рисунке \(\PageIndex{6}\), используют поверхностное натяжение воды, чтобы оставаться на плаву в поверхностном слое воды и даже спариваются там. 9- (aq)} \nonumber\]
лакмусовая или pH-бумага, фильтровальная бумага, обработанная натуральным водорастворимым красителем, чтобы ее можно было использовать в качестве индикатора pH для определения содержания кислоты (кислотности) или основания ( щелочность) существует в растворе.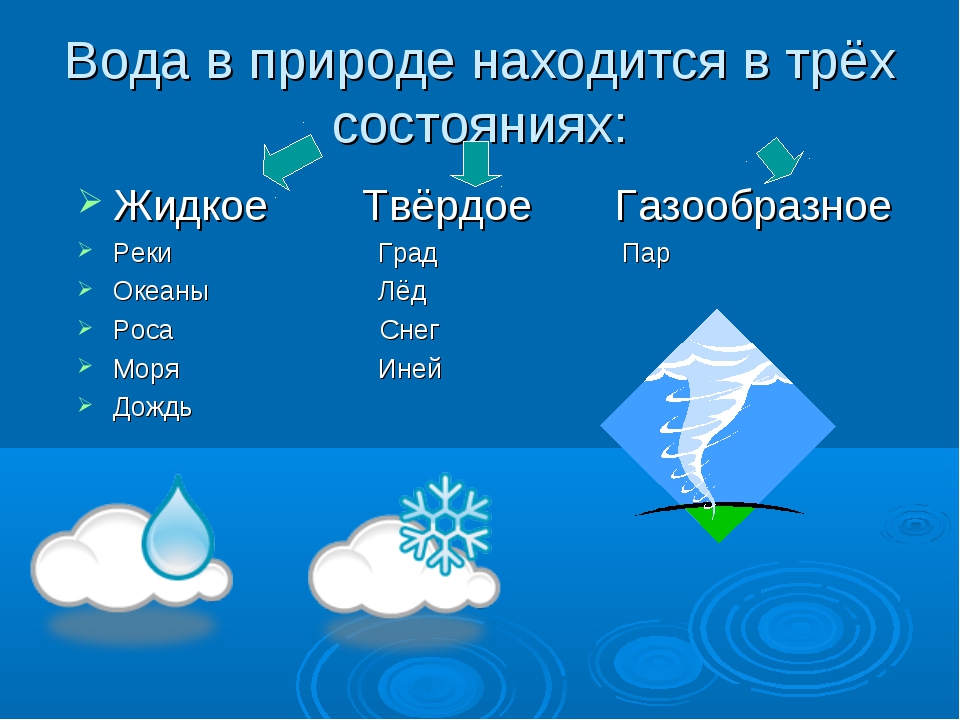 Возможно, вы даже использовали некоторые из них, чтобы проверить, правильно ли очищается вода в бассейне. В обоих случаях тест pH измеряет концентрацию ионов водорода в данном растворе.
Возможно, вы даже использовали некоторые из них, чтобы проверить, правильно ли очищается вода в бассейне. В обоих случаях тест pH измеряет концентрацию ионов водорода в данном растворе.
Ионы водорода спонтанно образуются в чистой воде путем диссоциации (ионизации) небольшого процента молекул воды на равное количество водорода (H + ) ионы и гидроксид (ОН — ) ионы. В то время как ионы гидроксида удерживаются в растворе за счет водородных связей с другими молекулами воды, ионы водорода, состоящие из голых протонов, немедленно притягиваются к неионизированным молекулам воды, образуя ионы гидроксония (H 3 0 + ). Тем не менее, условно ученые относятся к ионам водорода и их концентрации так, как если бы они находились в этом состоянии в жидкой воде в свободном состоянии.
Концентрация ионов водорода, диссоциирующих из чистой воды, составляет 1 × 10 -7 моль H + ионов на литр воды. Моли (mol) — это способ выражения количества вещества (которым могут быть атомы, молекулы, ионы и т. д.), при этом один моль равен 6,02 x 10 23 частиц вещества. Следовательно, 1 моль воды равен 6,02 х 10 23 молекул воды. pH рассчитывается как отрицательная величина логарифма по основанию 10 этой концентрации. Log10 1 × 10 -7 равен -7,0, и отрицательное значение этого числа (обозначаемое буквой «p» в «pH») дает значение pH 7,0, которое также известно как нейтральное значение pH. pH внутри человеческих клеток и крови являются примерами двух областей тела, где поддерживается почти нейтральный pH.
д.), при этом один моль равен 6,02 x 10 23 частиц вещества. Следовательно, 1 моль воды равен 6,02 х 10 23 молекул воды. pH рассчитывается как отрицательная величина логарифма по основанию 10 этой концентрации. Log10 1 × 10 -7 равен -7,0, и отрицательное значение этого числа (обозначаемое буквой «p» в «pH») дает значение pH 7,0, которое также известно как нейтральное значение pH. pH внутри человеческих клеток и крови являются примерами двух областей тела, где поддерживается почти нейтральный pH.
Ненейтральные показания рН возникают в результате растворения кислот или оснований в воде. Используя отрицательный логарифм для получения положительных целых чисел, высокие концентрации ионов водорода дают низкое число pH, тогда как низкие уровни ионов водорода приводят к высокому pH. Кислота — это вещество, которое увеличивает концентрацию ионов водорода (H + ) в растворе, обычно за счет диссоциации одного из его атомов водорода. Основание обеспечивает либо гидроксид-ионы (OH —), либо другие отрицательно заряженные ионы, которые соединяются с ионами водорода, уменьшая их концентрацию в растворе и тем самым повышая pH. В тех случаях, когда основание высвобождает ионы гидроксида, эти ионы связываются со свободными ионами водорода, образуя новые молекулы воды.
В тех случаях, когда основание высвобождает ионы гидроксида, эти ионы связываются со свободными ионами водорода, образуя новые молекулы воды.
Чем сильнее кислота, тем легче она отдает H + . Например, соляная кислота (HCl) полностью диссоциирует на ионы водорода и хлорида и является очень кислой, тогда как кислоты в томатном соке или уксусе полностью не диссоциируют и считаются слабыми кислотами. И наоборот, сильные основания — это вещества, которые легко отдают OH – или поглощают ионы водорода. Гидроксид натрия (NaOH) и многие бытовые чистящие средства сильно щелочные и выделяют OH – 9.0163 быстро помещается в воду, тем самым повышая рН. Примером слабощелочного раствора является морская вода с pH около 8,0, что достаточно близко к нейтральному pH, чтобы морские организмы, адаптированные к этой соленой среде, могли процветать в ней.
Шкала pH, как упоминалось ранее, является обратным логарифмом и находится в диапазоне от 0 до 14 (Рисунок \(\PageIndex{7}\)). Все, что ниже 7,0 (от 0,0 до 6,9), является кислотным, а все, что выше 7,0 (от 7,1 до 14,0), является щелочным. Экстремальные значения pH в любом направлении от 7,0 обычно считаются негостеприимными для жизни. pH внутри клеток (6,8) и pH крови (7,4) очень близки к нейтральному. Однако среда в желудке очень кислая, с рН от 1 до 2. Так как же клетки желудка выживают в такой кислой среде? Как они гомеостатически поддерживают внутри себя близкий к нейтральному рН? Ответ в том, что они не могут этого сделать и постоянно умирают. Новые клетки желудка постоянно производятся для замены мертвых клеток, которые перевариваются кислотами желудка. Подсчитано, что слизистая оболочка человеческого желудка полностью обновляется каждые семь-десять дней.
Все, что ниже 7,0 (от 0,0 до 6,9), является кислотным, а все, что выше 7,0 (от 7,1 до 14,0), является щелочным. Экстремальные значения pH в любом направлении от 7,0 обычно считаются негостеприимными для жизни. pH внутри клеток (6,8) и pH крови (7,4) очень близки к нейтральному. Однако среда в желудке очень кислая, с рН от 1 до 2. Так как же клетки желудка выживают в такой кислой среде? Как они гомеостатически поддерживают внутри себя близкий к нейтральному рН? Ответ в том, что они не могут этого сделать и постоянно умирают. Новые клетки желудка постоянно производятся для замены мертвых клеток, которые перевариваются кислотами желудка. Подсчитано, что слизистая оболочка человеческого желудка полностью обновляется каждые семь-десять дней.
Ссылка на обучение
Посмотрите это видео для простого объяснения рН и его логарифмической шкалы.
Так как же могут организмы, чьим телам требуется рН, близкий к нейтральному, поглощать кислые и щелочные вещества (например, человек, пьющий апельсиновый сок) и выживать? Буферы — это ключ. Буферы легко поглощают избыток H + или OH – , тщательно поддерживая pH тела в узком диапазоне, необходимом для выживания. Поддержание постоянного рН крови имеет решающее значение для благополучия человека. Буфер, поддерживающий pH крови человека, включает угольную кислоту (H 2 CO 3 ), ион бикарбоната (HCO 3 – ) и диоксид углерода (CO 2 ). Когда ионы бикарбоната объединяются со свободными ионами водорода и становятся угольной кислотой, ионы водорода удаляются, что замедляет изменения pH. Точно так же, как показано на рисунке \(\PageIndex{8}\), избыточная углекислота может быть преобразована в углекислый газ и выдыхаться через легкие. Это предотвращает накопление слишком большого количества свободных ионов водорода в крови и опасное снижение pH крови. Аналогично, если слишком много OH – введен в систему, угольная кислота соединится с ним с образованием бикарбоната, понизив рН. Без этой буферной системы рН тела колебался бы достаточно, чтобы поставить под угрозу выживание.
Аналогично, если слишком много OH – введен в систему, угольная кислота соединится с ним с образованием бикарбоната, понизив рН. Без этой буферной системы рН тела колебался бы достаточно, чтобы поставить под угрозу выживание.
Другими примерами буферов являются антациды, используемые для борьбы с избытком желудочной кислоты. Многие из этих безрецептурных лекарств действуют так же, как буферы крови, обычно с по крайней мере одним ионом, способным поглощать водород и снижать рН, принося облегчение тем, кто страдает от «изжоги» после еды. Уникальные свойства воды, которые способствуют этой способности уравновешивать pH, а также другие характеристики воды, необходимы для поддержания жизни на Земле.
Ссылка на обучение
Чтобы узнать больше о воде. Посетите Геологическую службу США. Наука о воде для школ. Все о воде! Веб-сайт.
Резюме
Вода обладает многими свойствами, которые необходимы для поддержания жизни. Это полярная молекула, допускающая образование водородных связей. Водородные связи позволяют ионам и другим полярным молекулам растворяться в воде. Таким образом, вода является отличным растворителем. Водородные связи между молекулами воды приводят к тому, что вода обладает высокой теплоемкостью, а это означает, что для повышения ее температуры требуется много дополнительного тепла. При повышении температуры водородные связи между водой постоянно разрываются и формируются заново. Это позволяет общей температуре оставаться стабильной, хотя в систему добавляется энергия. Вода также обладает высокой теплотой испарения, что является ключом к тому, как организмы охлаждаются за счет испарения пота. Силы сцепления воды учитывают свойство поверхностного натяжения, тогда как ее адгезионные свойства проявляются, когда вода поднимается внутри капиллярных трубок. Значение pH является мерой концентрации ионов водорода в растворе и является одной из многих химических характеристик, которые строго регулируются в живых организмах посредством гомеостаза. Кислоты и основания могут изменять значения pH, но буферы имеют тенденцию смягчать вызываемые ими изменения. Эти свойства воды тесно связаны с биохимическими и физическими процессами, происходящими в живых организмах, и жизнь была бы совсем другой, если бы эти свойства изменились, если бы она вообще могла существовать.
Значение pH является мерой концентрации ионов водорода в растворе и является одной из многих химических характеристик, которые строго регулируются в живых организмах посредством гомеостаза. Кислоты и основания могут изменять значения pH, но буферы имеют тенденцию смягчать вызываемые ими изменения. Эти свойства воды тесно связаны с биохимическими и физическими процессами, происходящими в живых организмах, и жизнь была бы совсем другой, если бы эти свойства изменились, если бы она вообще могла существовать.
Сноски
- 1 W. Humphrey W., A. Dalke, and K. Schulten, «VMD—Visual Molecular Dynamics», Journal of Molecular Graphics 14 (1996): 33-38.
- 2 W. Humphrey W., A. Dalke и K. Schulten, «VMD-Visual Molecular Dynamics», Journal of Molecular Graphics 14 (1996): 33-38.
Глоссарий
- кислота
- молекула, которая отдает ионы водорода и увеличивает концентрацию ионов водорода в растворе
- адгезия
- притяжение между молекулами воды и другими молекулами
- основание
- молекула, которая отдает ионы гидроксида или иным образом связывает избыток ионов водорода и снижает концентрацию ионов водорода в растворе
- буфер
- вещество, предотвращающее изменение pH за счет поглощения или выделения ионов водорода или гидроксида
- калорий
- количество теплоты, необходимое для изменения температуры одного грамма воды на один градус Цельсия
- капиллярное действие
- возникает из-за того, что молекулы воды притягиваются к зарядам на внутренних поверхностях узких трубчатых структур, таких как стеклянные трубки, притягивая молекулы воды к сторонам трубок
- сцепление
- межмолекулярных сил между молекулами воды, вызванных полярной природой воды; отвечает за поверхностное натяжение
- диссоциация
- высвобождение иона из молекулы таким образом, что исходная молекула теперь состоит из иона и заряженных остатков исходного вещества, например, когда вода диссоциирует на H + и ОХ —
- испарение
- выделение отдельных молекул с поверхности воды, листьев растений или кожи организма
- теплота парообразования воды
- требуется большое количество энергии для превращения жидкой воды в водяной пар
- гидрофильный
- описывает ионы или полярные молекулы, которые хорошо взаимодействуют с другими полярными молекулами, такими как вода
- гидрофобный
- описывает незаряженные неполярные молекулы, которые плохо взаимодействуют с полярными молекулами, такими как вода .

- лакмусовая бумага
- (также рН-бумага) фильтровальная бумага, обработанная натуральным водорастворимым красителем, который меняет свой цвет при изменении рН окружающей среды, поэтому ее можно использовать в качестве индикатора рН
- pH-бумага
- см. лакмусовую бумагу
- Шкала pH
- шкала от нуля до 14, что обратно пропорционально концентрации ионов водорода в растворе
- растворитель
- вещество, способное растворять другое вещество
- удельная теплоемкость
- Количество тепла, которое должен поглотить или отдать один грамм вещества, чтобы изменить его температуру на один градус Цельсия
- сфера гидратации
- , когда полярная молекула воды окружает заряженные или полярные молекулы, удерживая их в растворенном состоянии и в растворе
- поверхностное натяжение
- напряжение на поверхности жидкого тела, препятствующее разделению молекул; создаваемые силами притяжения и сцепления между молекулами жидкости
Эта страница под названием 2.
 Как правило, питьевая вода в большинстве своём именно лёгкая жидкость.
Как правило, питьевая вода в большинстве своём именно лёгкая жидкость.


