Физические и химические свойства воды
Из материалов урока вы узнаете, какими физическими и химическими свойствами обладает самое удивительное вещество на нашей планете!
I. Видео фильм: “Свойства воды”
II. Состав молекулы воды
Состав молекулы воды вам хорошо знаком: на два атома водорода в молекуле воды приходится один атом кислорода, е химическая формула – Н2О. Такой состав был установлен еще А.Л. Лавуазье и подтверждается результатами эксперимента по разложению воды, когда на 1 объем выделяющегося кислорода приходится два объема выделяющегося водорода.
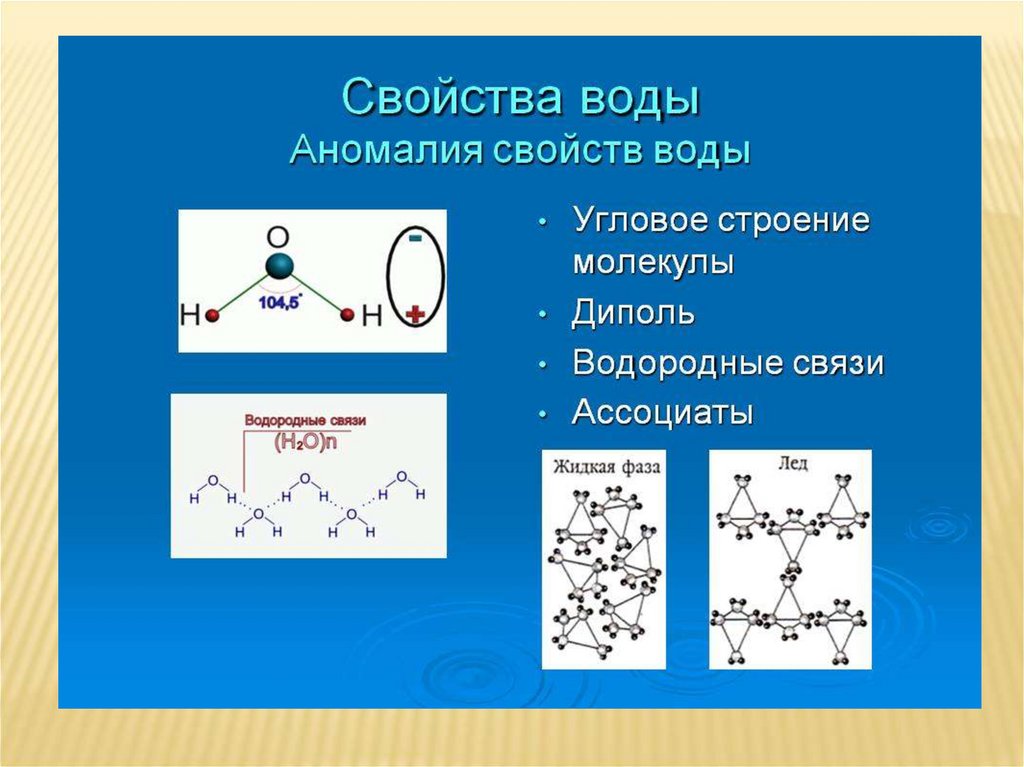
Угол 104,5° между связями в молекуле воды обусловливает рыхлость льда и жидкой воды и как следствие аномальную зависимость плотности от температуры.
III. Физические свойства воды
Чистая вода – бесцветная жидкость, без вкуса и запаха, при нормальном давлении кипит при температуре 100˚С, а замерзает при 0˚С. Ее максимальная плотность при 4˚С равна 1 г/см3.
Рис. 1. Вода
Необычным, или даже аномальным, свойством воды является ее способность расширяться при замерзании. Т.е. лед имеет меньшую плотность, чем жидкая вода. Поэтому он всплывает на поверхность, что очень важно для обитателей водоемов зимой.
Рис. 2. Лёд на поверхности воды
Водная среда была не только источником возникновения жизни, она способствовала ее сохранению и развитию. Чтобы заморозить воду, требуется большая энергия. Вот почему промерзание глубоких водоемов практически невозможно, что сохраняет в них жизнь.
Кроме того, вода обладает очень высокой теплоемкостью, что защищает наши континенты, благодаря океану, от резкого перепада температур зимой и летом, ночью и днем. Именно высокая теплоемкость воды способствует сохранению постоянной температуры тела человека и животных, поскольку и они, и мы на две трети состоим из воды.
Являясь уникальным растворителем, вода растворяет больше солей и других веществ, чем любая другая жидкость. В воде растворяются многие твердые вещества, жидкости и газы. Например, газированная вода – это раствор оксида углерода(IV) (углекислого газа) в воде, столовый уксус – это раствор уксусной кислоты в воде, сахарный сироп – раствор сахара в воде.
Но не все вещества одинаково хорошо растворяются в воде, есть и вовсе нерастворимые в воде вещества. Растворимость твердых веществ в воде с увеличением температуры, как правило, увеличивается.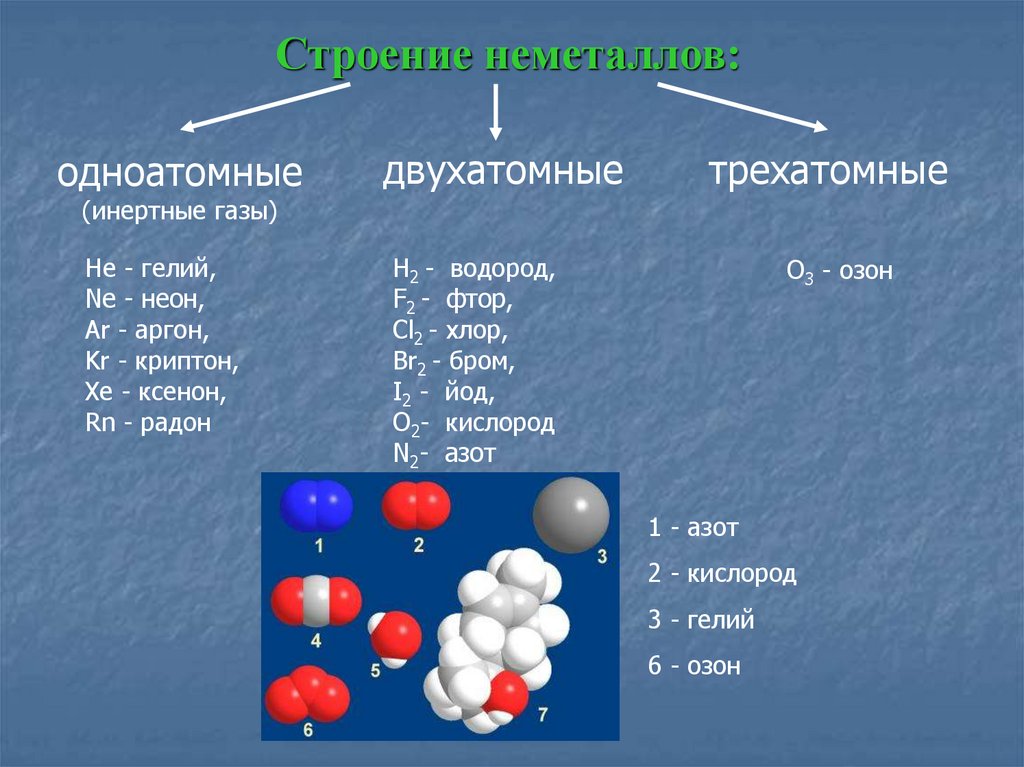
Благодаря сильному притяжению между молекулами у воды высокие температуры плавления (0С) и кипения (100С). Толстый слой воды имеет голубой цвет, что обусловливается не только ее физическими свойствами, но и присутствием взвешенных частиц примесей. Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Чистая вода – плохой проводник электричества. Плотность воды максимальна при 4С она равна 1 г/см3. Лёд имеет меньшую плотность, чем жидкая вода и всплывает на её поверхность, что очень важно для обитателей водоёмов зимой.
IV. Химические свойства воды
Вода — весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочно-земельными металлами. Вода образует многочисленные соединения — кристаллогидраты.
1. Взаимодействие воды металлами
Взаимодействие воды металлами
- Магний с горячей водой реагирует с образованием нерастворимого основания: Mg + 2H2O = Mg(OH)2 + H2
- Бериллий с водой образует амфотерный оксид: Be + H2O = BeO + H2
1). Активные металлы — это: Li, Na, K, Rb, Cs
2). Ряд активности металлов
3). Щёлочь – это растворимое в воде основание, сложное вещество в состав которого входит активный металл и гидроксильная группа ОН (I).
4). Металлы средней активности в ряду напряжений стоят от Mg до Pb (алюминий на особом положении)
Видео: «Взаимодействие натрия с водой»
Помните!!!
Алюминий реагирует с водой подобно активным металлам, образуя основание:
2Al + 6H2O = 2Al(OH)3 + 3H
2↑Взаимодействие с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
Реакция протекает только с парообразной водой, т.е. при нагревании. При этом образуются: оксид этого металла и водород.
II II
Fe + H2O = FeO + H2 (протекает реакция замещения)
оксид железа
Ni + H2O = NiO + H2
(валентность металла можно легко определить по ряду активности металлов, над их символом стоит значение, например +2, это означает, что валентность этого металла равна 2).
ВЫВОД – металлы средней активности, стоящие в ряду активности до (Н2) Be, Mg,Fe, Pb,
|
Me + Н2О = МехОу + Н2 (р. замещения) Оксид металла |
Металлы, стоящие в ряду активности после водорода, не реагируют с водой
Cu + H2O = нет реакции
2. Взаимодействие воды с оксидами неметаллов
С водой взаимодействуют только такие оксиды, которые при взаимодействии с водой дают растворимый в воде продукт (кислоту или щелочь).
Видео: «Взаимодействие кислотных оксидов с водой»
Задание:
Используя образец, запишите уравнения реакций взаимодействия:
СO2 + H 2O =
SO3 + H2O =
Cl2O7 + H2O =
P2O5 + H2O (горячая) =
N2O5 + H2O =
3. Взаимодействие воды с оксидами металлов
Взаимодействие воды с оксидами металлов
Помните!
С водой реагируют только оксиды активных металлов. Оксиды металлов средней активности и металлов, стоящих после водорода в ряду активности в воде не растворяются, например, CuO + H2O = реакция не возможна.
Видео: «Взаимодействие оксидов металлов с водой»
С водой взаимодействуют только основные оксиды активных металлов, которые расположены в в I А и I I А группах, кроме Ве и Mg (оксид алюминия не реагирует, т.к. он амфотерный). Реакция протекает при обычных условиях, при этом образуется только щелочь.
II I
Na2O + H2O = 2 NaOH BaO + H2O = Ba (OH)2 (протекает реакция соединения)
|
I H2O + ОСНОВНЫЙ ОКСИД = Ме(ОН)m (р. Щёлочь |
Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
4. Взаимодействие воды с неметаллами
5. Под действием электрического тока вода разлагается на водород и кислород:
2H2O электрический ток= 2H2↑+ O2↑
Видео: «Электролиз воды»
V. Задание для закрепления
Закончить уравнения практически осуществимых реакций, назвать продукты реакции
CaO + H2O =
SO2 + H2O =
Li + H2O =
Cu + H2O =
ZnO + H2O =
Al + H2O =
Ba + H2O =
K2O + H2O =
Mg + H2O =
N2O5 + H2O =
ЦОРы
Видео фильм: “Свойства воды”
Видео: «Электролиз воды»
Видео: «Взаимодействие кислотных оксидов с водой»
Видео: «Взаимодействие натрия с водой»
Видео: «Взаимодействие оксидов металлов с водой»
Урок по химии на тему «Физические и химические свойства воды.
 Применение воды». 8-й класс
Применение воды». 8-й классЦель урока: сформировать у учащихся понятие о химических свойствах воды.
Предметная:
- создать условия для исследования и выявления химических свойств воды;
- способствовать осмыслению новых понятий “основания, гидроксильная группа”;
- способствовать развитию умения пользоваться опорными знаниями, закрепить умения и навыки химического эксперимента, умение работать с таблицами, учебником.
Метапредметная:
- способствовать формированию умения планировать свою деятельность для изучения различных сторон окружающей действительности, умения делать логические выводы из наблюдений по опыту;
- искать пути и средства осуществления целей.
Личностная:
- создание условий для формирования навыков сотрудничества, умения принимать мнения других;
- формирование навыков оценки и самооценки;
- сформировать понимание практической важности воды в жизни человека.

Задачи:
- Образовательные: Обобщить и расширить знания учащихся о воде, ее роли в живой и неживой природе, в жизни человека, о необходимости бережного отношения к воде.
- Развивающие: Продолжить формировать логическое мышление, умения наблюдать, анализировать и сравнивать, находить причинно-следственные связи, делать выводы, наблюдать за ходом эксперимента, осуществлять самоконтроль и взаимоконтроль.
- Воспитательные: Формировать научное мировоззрение учащихся; научить слушать учителя и своих одноклассников, быть внимательным к себе и окружающим, вести беседу.
Планируемые результаты: По окончанию урока учащиеся смогут:
Метапредметные: использовать свои знания и умения для изучения различных сторон окружающей действительности.
Предметные: иметь понятие о химических свойствах воды, писать их уравнения реакций, иметь понятия о гидроксидах, основаниях, щелочах, оксидах, кислотах, опыт проведения химического эксперимента.
Личностные: научаться управлять своей познавательной деятельностью, будут продолжать развивать в себе целеустремленность.
Формируемые химические знания, умения, навыки учащихся: систематизация знаний учащихся о распространенности воды в природе, физических и химических свойствах, областях применения воды, расширение знаний учащихся об экологических проблемах, связанных с очисткой воды.
Формируемые компетенции:
- учебно-познавательная компетенция: развитие умений сравнивать, анализировать, доказывать, составлять схемы на основе работы с текстом, быть способными решать следующие жизненно-практические задачи: умение давать оценку состояния окружающей среды, выдвижение своих идей по охране водных ресурсов родного края;
- информационная компетенция: развитие умения анализировать и отбирать необходимую информацию, умения готовить и делать сообщения, умения пользоваться Интернатом для поиска учебной информации;
- коммуникативная компетенция: развитие умений вести беседу, диалог, задавать вопросы.

Формы организации работы детей: групповая (просмотр презентации, видеоролика, решение задач), индивидуальная (беседа, работа с рабочей тетрадью, работа с книгой), проблемное обучение (решение проблемных вопросов), опережающее обучение.
Формы организации работы учителя: организует эмоциональный настрой учащихся, вводит детей в тему урока, активизация и обобщает ранее полученные знания, организует беседу по слайдам и опытам, анализирует и дополняет ответы детей, создает проблемные ситуации.
Основные виды деятельности учащихся.
1. Составлять уравнения реакций, характеризующих химические свойства воды.
2. Работа с книгой.
3. Анализ видеоролика.
4. Дидактические игры.
Используемые технологии обучения: проблемного обучение (решение проблемных вопросов), опережающее обучение, личностно-ориентированного обучения, критического мышления, здоровьесберегающая.
Используемое оборудование ИКТ: компьютер, экран, мультимедийный проектор, презентация к уроку, выполненная в программе PowerPoint, опорный конспект.
Ход урока
1. Организационный момент 1-2 мин.2. Актуализация знаний (фронтальная беседа)Здравствуйте. Хотите узнать, о чем мы сегодня с вами будем говорить? Тогда отгадайте загадку: слайд № 1.
Я и туча, и туман,
И ручей, и океан,
И летаю, и бегу,
И стеклянной быть могу!
Правильно, это вода.
Посмотрите ребята на экран. На экране слова аквариум, акватория, акваланг, акварель. Слайд № 2
Что общего в этих словах.
Ответы учащихся: слайд №2 корень аква.
Что означает слово аква?
Ответы учащихся: вода.
Сейчас мы продолжим говорить о воде, вспомним физические воды.
Слайд №3
«Вода… Ты не имеешь ни вкуса, ни цвета, ни запаха, тебя невозможно описать – тобой наслаждаешься, не ведая, что ты такое.
Ты не просто необходима для жизни, ты и есть сама жизнь. Ты божество, ты совершенство, ты самое большое богатство на свете» (Проблемный вопрос)
Ты божество, ты совершенство, ты самое большое богатство на свете» (Проблемный вопрос)
Такие слова написал о воде французский писатель Антуан де Сент-Экзюпери.
Слайд №4
- Без крыльев летят.
Без ног бегут, без паруса плывут. (Облака) - Приходил – стучал по крыше,
Ууходил – никто не слышал. (Дождь) - Растёт она вниз головою.
Не летом растет а зимою.
Но солнце её припечёт –
Заплачет она и умрет. (Сосулька)
Отгадав эти загадки мы назвали три агрегатных состояния воды.
(Газ, жидкость, лед)
А какими еще физическими свойствами обладает вода при нормальных условиях? Используя предыдущие высказывания, и свои знания обобщим физические свойства воды, работая с индивидуальной картой. Ответы проверим по слайду №5. 1-2 мин. (самопроверка)
| Характеристика вещества | Физические свойства воды |
Агрегатное состояние | Жидкое |
Вкус | Без вкуса |
Цвет | Без цвета |
Запах | Без запаха |
Температура кипения | 100° С |
Температура замерзания | 0° С |
Плотность воды при t+4°С | 1г/см3 |
 Фронтальный и индивидуальный опрос
Фронтальный и индивидуальный опрос Слайд №6
Вычислите массовые доли водорода и кислорода в воде в индивидуальной карте.
- Каков состав воды?
- Какими методами можно определить состав воды?
- Что такое анализ и синтез?
1. Вода в природе? Дополнить предыдущие ответы. Содержание воды в разных организмах.
2. Назовите способы очистки воды – отстаивание, фильтрование, обеззараживание (хлорирование, озонирование, ультрафиолетом), аэрация.
3. Чтобы очистить воду от примесей ее пропускают через решетки, направляют в отстойник, фильтруют. (Схема в учебнике)
4. Фильтром для очистки служит слой песка и гравия. Для обеззараживания питьевой воды применяют хлорирование (0,7 г хлора на 1т воды)
5. Метод хлорирования применяется и в нашем районе, хотя он устарел и экологически небезопасен для здоровья.
6. Хлорированная вода влияет, прежде всего, на органы пищеварения, печень, почки.
7. Причины загрязнения водоемов сточные воды, сбросы предприятий, с/х. Основная причина утечка нефти.
8. В чем заключается охрана природных ресурсов?
Охрана водных ресурсов. Сообщения учащихсяСообщение. «Берегите воду!»В конце ΧΙΧ в. горожанину хватало полтора ведра воды в сутки – и на мытье, и даже на тушение пожаров. Нынешняя норма – свыше 18 ведер, т.е. 220 л. На деле мы и в эту ному не укладываемся, расходуя 30-40 ведер на человека.
«Эталонное» 12-литровое ведро несильная струя воды заполняет за минуту. Вы простояли под душем 5 мин – 60 л. воды убежали в канализацию. Этого с лихвой хватит, чтобы аккуратно вымыть слона.
Струйкой толщиной со спичку литровая банка наполняется за 3 мин. Этот эксперимент позволяет установить, что за сутки из неисправного крана утекает минимум 500 л.
Существует мнение, что промышленность тратит львиную долю воды. На самом деле на выпуск 1 т стали уходит 150 м3, хлопчатобумажной ткани – 1000 м3, искусственного волокна – 3000 м3 водопроводной воды. Из воды, поступающей в Москву ежесуточно, заводы и фабрики забирают лишь четверть. Столько же идет в столовые, детские сады, больницы. Остальное – в жилые дома.
Из воды, поступающей в Москву ежесуточно, заводы и фабрики забирают лишь четверть. Столько же идет в столовые, детские сады, больницы. Остальное – в жилые дома.
А ведь экономить воду без всякого гигиенического ущерба совсем не сложно. Скажем, зубы после чистки можно прополоскать из стакана, закрыв кран. Экономия – 5 л. воды за одну человеко — чистку. Во время бритья можно, вместо того чтобы открыть кран с горячей водой, налить, как в старину, воду из чайника в стакан, на бритье уйдет не 5-10 л., а всего 0,2, а бреющихся миллионы…
Хозяйки считают, что полоскать белье после стирки надо в проточной воде. Конечно, так белье выполаскивается быстрее, поскольку градиент концентрации стирального порошка на поверхности белья и омывающей его воде больше, чем в непроточной, а значит, и скорость диффузии больше. Но зато расход воды велик. Современные моющие средства вымываются из чистого белья и после того, как оно полежит в непроточной воде 10-15 мин. Сменив воду, белье можно выполоскать дочиста. Кстати, в стиральных машинах белье полощется также в двух-трех водах, а не в проточной воде. Мыть посуду лучше всего в раковине с двумя отделениями и пробками для сливных отверстий. Так же можно мыть овощи. Не забывайте, что вода — это богатство, красота и жизнь нашей планеты, и её надо беречь.
Кстати, в стиральных машинах белье полощется также в двух-трех водах, а не в проточной воде. Мыть посуду лучше всего в раковине с двумя отделениями и пробками для сливных отверстий. Так же можно мыть овощи. Не забывайте, что вода — это богатство, красота и жизнь нашей планеты, и её надо беречь.
Учитель. Известны случаи пожаров причиной, которых являлся дождь?
Мы можете это объяснить?
Объяснить это явление, можно только изучив химические свойства воды.
Слайд №7. Химические свойства воды:
Разложение воды в индивидуальной карте записать уравнение реакции.
Проверка – прочитать уравнение, используя химический язык.
(вопросы на внимательность)
Как называется прибор — эвдиометр
- Условия прохождения реакции — пост. ток, 2000 гр.С
- Объемные отношения -1:2,
- Массовые -1:8
Взаимодействие с активными металлами
Как определить активность металла, чтобы правильно написать уравнение реакции. Металлы по своей активности делятся на три группы: активные, средней активности и неактивные. Работа с рядом активности.
Металлы по своей активности делятся на три группы: активные, средней активности и неактивные. Работа с рядом активности.
Н2О +
- Взаимодействие с менее активными металлами
- Взаимодействие с неметаллами
- Взаимодействие с оксидами металлов
- Взаимодействие с оксидами неметаллов
Запишите уравнения реакций по слайду, определите тип химической реакции (в индивидуальной карте).
Самопроверка химических свойств по слайду
Давайте просмотрим видеоролики взаимодействия воды.
Смотрите внимательно. Обратите внимание на определения. Условия течения реакций.
Что такое щелочь? (Растворимые основания)
Основания – это сложные вещества, состоящие из металлов и одной или несколько гидроксильных групп ОН.
Что за вещество фенолфталеин? (Индикатор – вещества, изменяющие свою окраску в зависимости от среды)
1) С активными металлами IA группы и IIA групп.
2Na + 2HOH = 2 Na OH + H2↑ +Q
Ca + 2HOH = Ca (OH)2 + H2↑
2) с менее активными металлами при нагревании
Zn+HOH=ZnO+H2↑
3) С неактивными металлами
Взаимодействие меди с водой — не реагирует с водой никогда.
Ребята, как вы думаете, будут ли с водой взаимодействовать серебро и золото.
Минута для релаксации (под шум прибоя)
Проведём физминутку.
Очень всем нужна вода
Делай – раз, делай – два.
Звери у ручья напились
Вправо влево наклонились.
Вместе на носочки встали,
Тучку лапками достали.
Дружно хлопнули в ладоши
До чего же день хороший.
Дождик вдруг полил с утра.
За работу нам пора!
Второй видеоролик
4. Взаимодействие с неметалламиС + НОН=СО+Н2↑
5. Взаимодействие со сложными веществами1) Взаимодействие с оксидами неметаллов.
СаО+НОН=Са (ОН)2+Q
2) Взаимодействие с оксидами неметаллов.
Просмотр видеоролик взаимодействие с кислотными оксидами.
P2O5 + 3H2O —>2 H3PO4
Применение воды.
Ни умыться, не напиться,
Без воды
Листику не распуститься
Без воды
Без воды прожить не могут
Птица, зверь и человек
И поэтому всегда
Всем везде нужна вода.
Что может быть привычнее для нас, чем вода? Это самое распространенное вещество на поверхности земли в природе. Жизнь человека во все времена самым тесным образом была связана с водой.
Работа с книгойИспользуя рис.44 стр. 109. Дайте характеристику применению воды. Беседа.
Применение водыЗемледелие. Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды, доходящих до 90 % в некоторых странах.
Питьё и приготовление пищиЖивое человеческое тело содержит от 50 % до 75 % воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т.д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
В зависимости от температуры и влажности окружающей среды, физической активности и т.д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
Питьевая вода представляет собой воду из какого-либо источника, очищенную от микроорганизмов и вредных примесей. Пригодность воды для питья при её обеззараживании перед подачей в водопровод оценивается по количеству кишечных палочек на литр воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других микробов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья.
РастворительВода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
ТеплоносительСреди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Замедлитель. Во многих ядерных реакторах вода используется не только в качестве теплоносителя, но и замедлителя нейтронов для эффективного протекания цепной ядерной реакции. Также существуют тяжеловодные реакторы, в которых в качестве замедлителя используется тяжёлая вода.
Пожаротушение. В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе пены.
Спорт. Многими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой.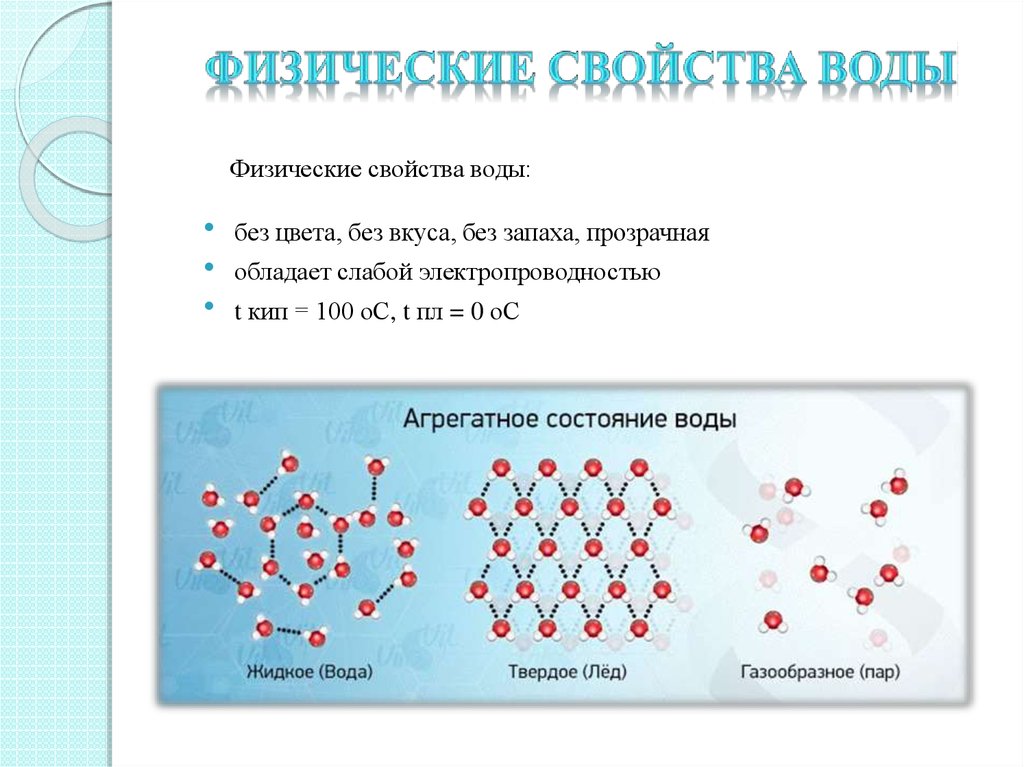 Это подводное плавание, хоккей, лодочные виды спорта, биатлон и др.
Это подводное плавание, хоккей, лодочные виды спорта, биатлон и др.
Гидроабразивная резка. Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Смазка. Вода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках.
Слайды по бережному использованию воды.
Берегите эти земли, эти воды,
Даже малую былиночку любя.
Берегите всех зверей внутри природы.
Убивайте лишь зверей внутри себя!
Евгения Евтушенко
Приведите в систему все те знания, которые вы получили на уроке.
Закрепления знаний проведем дидактические игры. Учащиеся выполняют данный вид работы в индивидуальных листах.
Первая игра «Вставь пропущенное слово» (фронтальная работа)
1. Щелочи – это _(растворимые) основания
2. Вода взаимодействует с __(активными)_ металлами
3. С неактивными металлами вода _(не взаимодействует)_
4. Фенолфталеин меняет свою окраску в щелочах на (малиновую)
5. При взаимодействии воды с оксидами неметаллов образуются (кислоты)
6. Без воды человек может прожить __(три дня)__
7. Основания – это сложные вещества состоящие из металла и (гидроксильной группы ОН)
8. Вода распадается на (водород) _и (кислород)
Правильность выполнения задания осуществляется методом взаимопроверка, затем самопроверка. (слайд № 25)
Вторая игра «Удивительная цифра». На парте у вас индивидуальный лист — задание. В поле игры правильные ответы необходимо обвести кружком.
На парте у вас индивидуальный лист — задание. В поле игры правильные ответы необходимо обвести кружком.
Карточка-задание:
1. Формула воды – Н2О.
2. Мr (Н2О) = 18 а.е.м.
3. Щелочи хорошо растворяются в воде.
4. Вода не имеет вкуса и запаха.
5. Вода – хороший растворитель.
6. В воде растворяется железный гвоздь.
7. Вода имеет вкус и запах.
8. Вода – летучая жидкость.
9. Вода может существовать в трех агрегатных состояниях.
10. медь не взаимодействует с водой.
11. основание можно определить фенолфталеином.
12. Вода при температуре +4°С 1г/см3.
Заполненные индивидуальные листы сдайте на проверку учителю.
Итог урокаПочему воду называют самым уникальным веществом на земле?
Ты не просто необходима для жизни, ты и есть сама жизнь. Ты божество, ты совершенство, ты самое большое богатство на свете » (Проблемный вопрос)
Леонардо да Винчи назвал воду “Соком жизни на Земле”.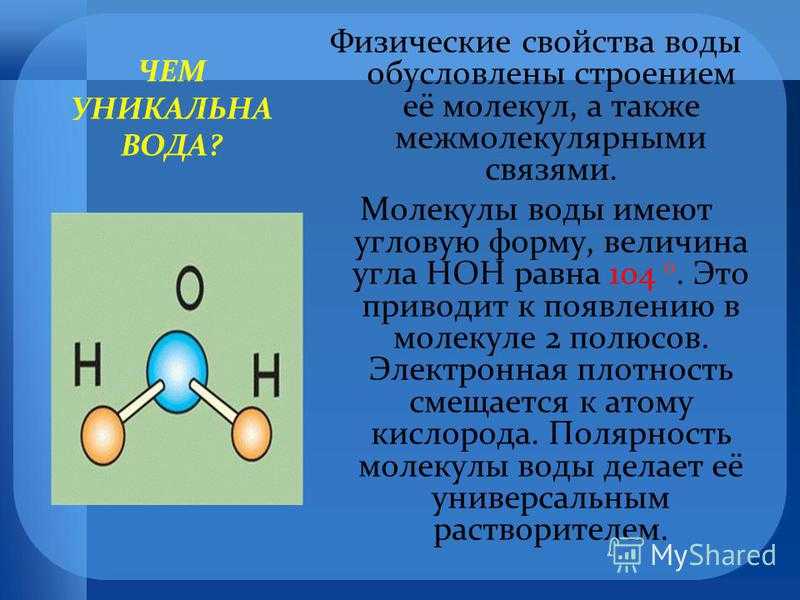 Действительно, все живое в среднем состоит из этого вещества: человек – 60%, медуза – 95%, клетки мозга – 85%, кровь – 80%, клетки костной ткани – 20%. Потеря воды в количестве 1% от веса тела вызывает жажду. Если потеря воды в 10 раз больше (т.е. составляет 10% от веса тела, это может привести к смерти). Почти все химические реакции идут в водной среде. Кроме того, испаряясь, вода охлаждает организм обитателей суши. Если бы человек не испарял пот, то после часа напряженной работы или игры в футбол его температура тела подскочила бы до 460. Писатель Антуан де Сент-Экзюпери так сформулировал мысль о соотношении воды и жизни: “Вода! Ты не просто необходима для жизни, ты и есть сама жизнь!”
Действительно, все живое в среднем состоит из этого вещества: человек – 60%, медуза – 95%, клетки мозга – 85%, кровь – 80%, клетки костной ткани – 20%. Потеря воды в количестве 1% от веса тела вызывает жажду. Если потеря воды в 10 раз больше (т.е. составляет 10% от веса тела, это может привести к смерти). Почти все химические реакции идут в водной среде. Кроме того, испаряясь, вода охлаждает организм обитателей суши. Если бы человек не испарял пот, то после часа напряженной работы или игры в футбол его температура тела подскочила бы до 460. Писатель Антуан де Сент-Экзюпери так сформулировал мысль о соотношении воды и жизни: “Вода! Ты не просто необходима для жизни, ты и есть сама жизнь!”
При ответе да на данные вопросы поднимите руку.
- Урок мне был полезен, интересен (да, нет)
- Я успешно справился с большинством заданий на уроке.
- На уроке я себя чувствовал комфортно.

Домашнее задание. §32 стр.109 тест.
Творческое задание: составить синквейн по теме «Вода».
Приложение 1.
Физические и химические свойства воды
Вода, используемая в качестве источника питьевой воды в любом частном секторе, имеет свои особые физические и химические свойства. Это может происходить из источника окружающей среды, такого как почва или геология, или из-за загрязнения, такого как стоки с полей. Крайне важно, чтобы вода была надлежащим образом изучена и обработана перед тем, как она будет использоваться для бытовых целей (как определено в Законе о водном хозяйстве 1991 года ). В этом разделе дается введение в то, как физические и химические свойства воды характеризуются и контролируются.
Значение pH
Значение pH воды является мерой ее кислотности или щелочности. Чистая вода очень слабо ионизирована на положительно заряженные ионы водорода (H+) и отрицательно заряженные ионы гидроксида (OH–). Вода нейтральна, когда количество ионов водорода и гидроксид-ионов одинаково. Когда концентрация ионов водорода превышает концентрацию ионов гидроксида, вода становится кислой и имеет значение pH менее 7. И наоборот, когда концентрация ионов гидроксида превышает концентрацию ионов водорода, вода становится щелочной и имеет значение pH выше 7. Шкала рН логарифмическая, поэтому изменение значения рН на одну единицу соответствует десятикратному изменению концентрации ионов водорода или гидроксида.
Вода нейтральна, когда количество ионов водорода и гидроксид-ионов одинаково. Когда концентрация ионов водорода превышает концентрацию ионов гидроксида, вода становится кислой и имеет значение pH менее 7. И наоборот, когда концентрация ионов гидроксида превышает концентрацию ионов водорода, вода становится щелочной и имеет значение pH выше 7. Шкала рН логарифмическая, поэтому изменение значения рН на одну единицу соответствует десятикратному изменению концентрации ионов водорода или гидроксида.
Кислотность сырой воды может быть результатом растворения двуокиси углерода с образованием слабой угольной кислоты. Подземные и поверхностные воды также могут содержать органические кислоты, образующиеся при разложении растительности. Поверхностная вода, полученная из водосбора торфяной вересковой пустоши, может иметь значение pH всего 4. Щелочные воды почти полностью образуются в результате растворения бикарбонатных, карбонатных и гидроксидных солей кальция, магния, натрия и калия, например, из известняковых водоносных горизонтов. Мягкая кислая вода может вызвать коррозию трубопроводов и растворение металлов, таких как медь, цинк и свинец. Жесткая щелочная вода может вызвать образование накипи, а некоторые жесткие воды также могут быть растворителями свинца.
Мягкая кислая вода может вызвать коррозию трубопроводов и растворение металлов, таких как медь, цинк и свинец. Жесткая щелочная вода может вызвать образование накипи, а некоторые жесткие воды также могут быть растворителями свинца.
Британские правила качества питьевой воды включают рН в качестве индикаторного параметра и определяют минимальное значение рН 6,5 и максимальное значение рН 9,0. При очистке воды значение pH можно изменить путем аэрации и дозирования щелочи или кислоты.
Жесткость
Жесткость воды обусловлена растворенными солями кальция и магния. Общая жесткость состоит из временной и постоянной жесткости. Временная жесткость почти полностью обусловлена карбонатами и бикарбонатами кальция и магния. Временная жесткость осаждается испарением и кипячением. Постоянная жесткость почти полностью обусловлена сульфатами и хлоридами кальция и магния. Постоянная жесткость не осаждается кипячением.
Жесткость воды, выраженная в мг/л CaCO3 (карбонат кальция), может быть классифицирована следующим образом:
| Вода Жесткость (мг/л CaCO3) | |
| до 50 | |
| Слегка твердый | 100 -150 |
| Умеренно твердый | 150 – 200 |
| 200 – 300 | |
| Очень твердый | Более 300 |
Директива по питьевой воде и правила качества питьевой воды Великобритании не определяют стандарты жесткости, кальция или магния. Умягчение может быть достигнуто известково-содовым умягчением, когда добавление в воду извести (Ca(OH) 2 ) и карбоната натрия (Na 2 CO 3 ) вызывает осаждение соединений жесткости. Альтернативным методом, распространенным в бытовых умягчителях воды, является ионный обмен (основной обмен), при котором ионы кальция и магния в воде заменяются ионами натрия. Там, где вода умягчается путем умягчения щелочным обменом, важно предусмотреть неумягченный выход для питьевых целей. Установка умягчителя непосредственно перед баком горячей воды или бойлером является более экономичным методом предотвращения осаждения солей жесткости (известкового налета), чем умягчение всей подачи.
Умягчение может быть достигнуто известково-содовым умягчением, когда добавление в воду извести (Ca(OH) 2 ) и карбоната натрия (Na 2 CO 3 ) вызывает осаждение соединений жесткости. Альтернативным методом, распространенным в бытовых умягчителях воды, является ионный обмен (основной обмен), при котором ионы кальция и магния в воде заменяются ионами натрия. Там, где вода умягчается путем умягчения щелочным обменом, важно предусмотреть неумягченный выход для питьевых целей. Установка умягчителя непосредственно перед баком горячей воды или бойлером является более экономичным методом предотвращения осаждения солей жесткости (известкового налета), чем умягчение всей подачи.
Цвет
Вода может быть окрашена гуминовыми и фульвокислотами, выщелачиваемыми из торфа или другой разлагающейся растительности, а также природными солями железа или марганца. Поверхностные воды, поступающие из водосборных бассейнов торфяных вересковых пустошей, могут быть сильно окрашены. Характерный коричневый цвет такой воды непостоянен и часто демонстрирует сильный сезонный эффект, при этом максимальная концентрация приходится на позднюю осень и зиму. Вода, поступающая из равнинных рек, также может демонстрировать сезонное усиление цвета после осеннего листопада.
Характерный коричневый цвет такой воды непостоянен и часто демонстрирует сильный сезонный эффект, при этом максимальная концентрация приходится на позднюю осень и зиму. Вода, поступающая из равнинных рек, также может демонстрировать сезонное усиление цвета после осеннего листопада.
Вода может казаться окрашенной из-за взвешенного вещества, и истинный цвет можно определить только после фильтрации. Цвет выражается в мг/л по платино-кобальтовой (Pt-Co) шкале, что эквивалентно измерениям, выраженным в единицах Хазена (°H). Удаление цвета из воды необходимо не только по эстетическим причинам, но и потому, что хлорирование сильно окрашенных вод может привести к высоким концентрациям тригалометанов. Сильный цвет также снижает эффективность дезинфекции УФ-облучением, хлорированием и озонированием, а также вызывает загрязнение мембран обратного осмоса.
Директива по питьевой воде включает цвет в качестве индикаторного параметра без числового стандарта, но с требованием «Приемлемо для потребителей и не имеет аномальных изменений». Правила качества воды Великобритании определяют стандарт 20 мг/л Pt-Co. Методы фильтрации могут применяться к небольшим расходным материалам, но эффективность удаления цвета обычно относительно низкая.
Правила качества воды Великобритании определяют стандарт 20 мг/л Pt-Co. Методы фильтрации могут применяться к небольшим расходным материалам, но эффективность удаления цвета обычно относительно низкая.
Мутность
Мутность вызывается в основном неорганическими веществами во взвешенном состоянии, включая минеральные отложения (например, из мела) и оксиды железа или марганца, но органические вещества, включая водоросли, также могут вызывать значительное помутнение. Большинство поверхностных вод имеют особенно высокую мутность после периодов сильных дождей, в то время как подземные воды обычно имеют мутность от низкой до очень низкой. Однако изменения после сильных дождей, например, могут указывать на быструю перезарядку, приносящую загрязняющие вещества с поверхности.
Измерение мутности дает количественную оценку прозрачности воды, и анализ выполняется с помощью нефелометра. Нефелометры измеряют интенсивность света, рассеянного в одном конкретном направлении, обычно перпендикулярном падающему свету, и на них относительно не влияет растворенный цвет. Нефелометры калибруют по стандартам мутности, приготовленным из суспензии формазина. Стандартной единицей мутности является нефелометрическая единица мутности или NTU.
Нефелометры калибруют по стандартам мутности, приготовленным из суспензии формазина. Стандартной единицей мутности является нефелометрическая единица мутности или NTU.
Мутность удаляется, поскольку высокая мутность может снизить эффективность дезинфекции и по эстетическим причинам. Правила качества воды Великобритании определяют стандарт 4NTU на водоразборных кранах потребителей при значении индикаторного параметра 1NTU в воде, выходящей из очистных сооружений. Различные методы фильтрации могут быть успешно применены к небольшим расходным материалам, и наиболее широко используются картриджные фильтры.
Вкус и запах
Источники вкуса и запаха исходной воды включают разлагающуюся растительность, водоросли, плесень и актиномицеты. Вкус и запах обычно связаны с присутствием определенных органических соединений, высвобождаемых исходным агентом, которые обуславливают «землистый» или «затхлый» вкус или запах. Хлор и побочные продукты хлорирования также могут вызывать жалобы на вкус или запах. Относительно высокие концентрации железа, марганца и некоторых других металлов могут придавать неприятный металлический привкус. Бытовые сантехнические материалы и приспособления, а в некоторых случаях водопровод также могут придавать заметный вкус или запах.
Относительно высокие концентрации железа, марганца и некоторых других металлов могут придавать неприятный металлический привкус. Бытовые сантехнические материалы и приспособления, а в некоторых случаях водопровод также могут придавать заметный вкус или запах.
Директива о питьевой воде включает вкус и запах в качестве индикаторных параметров без числовых стандартов, но с требованием «приемлемо для потребителей и не имеет аномальных изменений». Интенсивность запаха и вкуса выражается числом разбавления, которое представляет собой разбавление образца водой без запаха или вкуса, при котором запах или вкус не определяются.
Вкус и запах удаляются главным образом по эстетическим соображениям. Вкус и запах можно уменьшить или удалить путем аэрации, озонирования или адсорбции на активированном угле или, если хлорирование является источником вкуса или запаха, путем контроля процесса дезинфекции.
Радиоактивность
Вся вода окружающей среды содержит следовые количества встречающихся в природе радионуклидов, концентрация которых зависит от происхождения воды. Естественными радионуклидами, наиболее важными для питьевого водоснабжения, являются радон (Rn) и уран (U). Радон летуч, поэтому он может выделяться из воды в виде газа. Это вызывает беспокойство, если выброс происходит в замкнутом пространстве с недостаточной вентиляцией. Радон и уран обнаруживаются в значительных концентрациях в подземных водах только в определенных частях Великобритании, в зависимости от типа геологии, из которой происходят подземные воды. Дальнейшие консультации можно получить у местных властей, Британская геологическая служба и Службы радиационной защиты общественного здравоохранения Англии . Эти вещества не являются значительными для каких-либо поверхностных источников воды в Великобритании.
Естественными радионуклидами, наиболее важными для питьевого водоснабжения, являются радон (Rn) и уран (U). Радон летуч, поэтому он может выделяться из воды в виде газа. Это вызывает беспокойство, если выброс происходит в замкнутом пространстве с недостаточной вентиляцией. Радон и уран обнаруживаются в значительных концентрациях в подземных водах только в определенных частях Великобритании, в зависимости от типа геологии, из которой происходят подземные воды. Дальнейшие консультации можно получить у местных властей, Британская геологическая служба и Службы радиационной защиты общественного здравоохранения Англии . Эти вещества не являются значительными для каких-либо поверхностных источников воды в Великобритании.
Концентрация радиоактивных элементов в воде выражается через их активность в беккерелях на литр (Бк/л). Правила качества воды Великобритании определяют стандарт 0,1 Бк / л как валовую альфа-активность и 1 как валовую бета-активность.
Очистка от радона не может включать в себя системы, установленные на месте использования, потому что, будучи летучим, он выбрасывается в атмосферу всякий раз, когда используется вода. Обработка под раковиной с использованием фильтра с активированным углем также не рекомендуется, поскольку фильтр станет радиоактивным. Поэтому обработка для удаления радона должна быть проведена до поступления воды в здание, и аэрация является предпочтительным методом очистки, хотя возможны и другие методы. Удаление урана лучше всего достигается с помощью систем на месте использования.
Физические и химические свойства воды
Эксперты Element оценивают физические и химические свойства воды, чтобы помочь консультантам по охране окружающей среды убедиться, что вода соответствует нормативным требованиям и безопасна для людей и окружающей среды.
Физические характеристики воды – это температура, цвет, вкус и запах пробы воды. Химические свойства воды включают такие параметры, как рН и растворенный кислород. Мониторинг этих характеристик помогает определить, соответствует ли вода государственным нормам и безопасна ли она для потребления человеком и окружающей среды.
Мониторинг этих характеристик помогает определить, соответствует ли вода государственным нормам и безопасна ли она для потребления человеком и окружающей среды.
Физические характеристики качества воды
Необходимо контролировать физические аспекты качества воды, чтобы определить, загрязнена вода или нет. Физические характеристики можно определить по:
- Цвет – чистая вода бесцветна; окрашенная вода может указывать на загрязнение. Цвет также может показывать органические вещества. Максимально допустимый уровень цветности питьевой воды составляет 15 TCU (единица истинного цвета).
- Мутность – чистая вода прозрачна и не поглощает свет. Если в воде появилось помутнение, это может свидетельствовать о загрязнении воды.
- Вкус и запах – чистая вода всегда без вкуса и запаха. Если присутствует какой-либо вкус и запах, это может указывать на загрязнение воды.
- Температура – температура напрямую не используется для оценки пригодности воды для питья.
 Однако в естественных водных системах, таких как озера и реки, температура является важным физическим фактором, определяющим качество воды.
Однако в естественных водных системах, таких как озера и реки, температура является важным физическим фактором, определяющим качество воды. - Твердые вещества — если вода фильтруется для удаления взвешенных твердых частиц, оставшееся твердое вещество в воде указывает на общее количество растворенных твердых веществ. Если растворенные в воде твердые вещества превышают 300 мг/л, это оказывает неблагоприятное воздействие на живые организмы, а также на промышленные продукты.
Химические свойства воды
Химические свойства воды включают оценку таких параметров, как pH и растворенный кислород:
- pH – pH воды измеряется в диапазоне от 0 до 14, чтобы определить, насколько она кислая или щелочная. Измерение проводится с использованием логарифмической шкалы.
- Растворенный кислород – это уровень свободного несоставного кислорода, присутствующего в воде или других жидкостях. Это важный параметр при оценке качества воды из-за его влияния на организмы, живущие в водоеме.

 соединения)
соединения)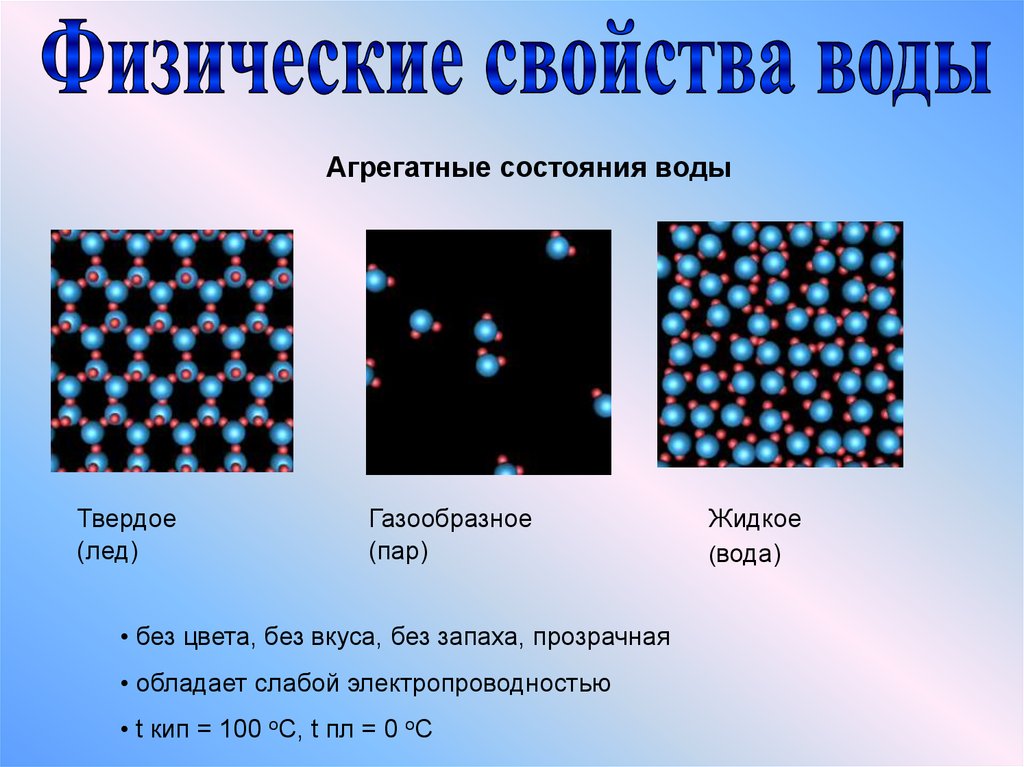

 Однако в естественных водных системах, таких как озера и реки, температура является важным физическим фактором, определяющим качество воды.
Однако в естественных водных системах, таких как озера и реки, температура является важным физическим фактором, определяющим качество воды.