Т-клеточный иммунитет при COVID-19
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Пандемия COVID-19 продолжается и усиливается. Все больше людей в мире встречается с данным вирусом. Уже давно стало понятно, что SARS-CoV-2 не исчезнет из человеческой популяции. Вероятность встречи с ним возрастает для каждого.Тем не менее, многие люди, неоднократно и длительно контактировавшие с заболевшими COVID-19 – сами не заболевают, никаких клинических симптомов не появляется. Почему так происходит – один из самых насущных вопросов на всех уровнях попыток понимания текущей пандемии, от бытового до научно-медицинского.
Наиболее вероятный ответ на него – особенности иммунного ответа части населения.
Т-клеточное звено состоит из различных пулов Т-лимфоцитов (обозначаемых общепринятой в иммунологии для указания их характерных маркеров аббревиатурой CD и цифрой/числом – CD-3, CD-4, CD-8, CD-16 и другие). Если ОЧЕНЬ упрощенно, то основные задачи Т-клеточного звена:
Опознать и изучить антиген – передать информацию о нем другим звеньям иммунной системы – уничтожить антиген – запомнить его.
У части людей, в силу особенностей иммунитета (а также, видимо, при инфицировании низкой дозой возбудителя), Т-клеточное звено элиминирует вирус из организма без значимой активации В-клеточного звена, то есть – с низким уровнем антителообразования, нередко не детектируемым (не определяемым) рутинными лабораторными методами. При этом, клинических симптомов часто не развивается. Иными словами, человек может перенести инфекционный процесс без развития болезни, уровень антител у него не определяется, но организм приобретает защиту от повторного заражения. Насколько стойкую и долгую – вопрос остается открытым.
Однако, недавние, достаточно объемные исследования группы ученых из нескольких стран выявили:
- Образование устойчивого Т-клеточного ответа на SARS-CoV-2 у большинства пациентов, встречавшихся с данным вирусом
- При этом у части пациентов, никогда не встречавшихся с SARS-CoV-2 – уже имеются Т-лимфоциты, реагирующие на данный вирус и элиминирующие его из организма.

Подробнее – здесь.
То есть: у части людей есть приобретенная невосприимчивость к SARS-CoV-2, обусловленная, вероятнее всего Т-клетками, которые ранее «активировались» другими коронавирусами и сохранили иммунологическую память.
Данное утверждение сложно проверить массовым лабораторным скринингом. Изучение Т-клеточного ответа к инфекциям – достаточно трудоемкий процесс и чаще удел специализированных научно-исследовательских лабораторий. Однако, уже опубликованные результаты и продолжающиеся работы по изучению Т-клеточного иммунитета при COVID-19 – дают определенную почву для осторожного оптимизма.
А.С. Поздняков, к.м.н.,
инфекционист, главный врач ООО «Инвитро-Сибирь»
Статистика INVITRO по пациентам с выявленными антителами к коронавирусу
Анализы для выявления антител в организме
Реконституция Т-клеточного звена иммунной системы у больных после трансплантации аллогенных гемопоэтических стволовых клеток | Попова
Введение
В настоящее время трансплантация аллогенных гемопоэтических стволовых клеток (алло-ТГСК) является единственным методом лечения, позволяющим достичь биологического излечения больных различными гемобластозами, аплазиями кроветворения, первичными иммунодефицитами.
С «неполной» реконституцией, то есть в первую очередь неполным восстановлением количества иммуно- компетентных клеток, связано развитие различных осложнений, и в первую очередь тяжелых инфекционных осложнений как в раннем посттрансплантационном периоде (до +100 дня после алло-ТГСК), так и в более позднем [2]. Кроме этого, функциональные особенности и взаимодействие различных иммунокомпетентных клеток обусловливают развитие иммунологических реакций — «трансплантат против опухоли» (РТПО) и «трансплантат против хозяина» (РТПХ) [3, 4].
Условно весь посттрансплантационный период можно разделить на несколько этапов. Первый — этап до приживления трансплантата (англ. pre-engraftment), который занимает 30 дней после инфузии аллогенных ГСК реципиенту.
Второй этап включает в себя непосредственно приживление трансплантата и последующий ранний посттрансплантационный период, который занимает от +30 до +100 дня (англ. post-engraftment). Это время характеризуется глубоким клеточным и гуморальным иммунодефицитом, что также сопровождается частыми инфекционными осложнениями, среди которых зачастую превалируют вирусные инфекции. Другой частой проблемой в этом периоде является развитие острой РТПХ. Именно на этом этапе начинается восстановление различных иммунокомпетентных клеток, таких как цитотоксические CD8+ Т-клетки, CD4+ Т-хелперы, NK-клетки, Т-регуляторные клетки (Treg) (табл. 1). Полное восстановление же этих субпопуляций и других иммунокомпетентных клеток происходит в позднем посттрансплантационном периоде, который занимает от 6 месяцев до нескольких лет [5, 6].
Таблица 1. Период восстановления различных субпопуляций клеток иммунной системы после алло-ТГСК [5, 6]
Table 1. Time of different immune cells recovery after allo-HSCT
Субпопуляция клеток | Время от алло-ТГСК до восстановления нормального уровня |
|---|---|
Subsets of immune cells | Time from allo-HSCT to full immune recovery |
Натуральные киллеры (NK-клетки) | От 1 мес до 6 мес |
Natural killers (NK) | From 1 to 6 months |
CD4+ Т-хелперы | Более 24 мес |
CD4+ Т cells | More than 24 months |
Цитотоксические CD8+ Т-клетки | От 1 до 18 мес |
Cytotoxic CD8+ Т cells | From 1 to 18 months |
Т-регуляторные клетки (Treg) | От 1 до 6 нед |
Regulatory T cells (Treg) | From 1 to 6 weeks |
Т-наивные клетки | От 8 до 9 мес |
Naive T cells | From 8 to 9 months |
T-клетки памяти | Более 24 мес |
Memory T cells | More than 24 months |
В-клетки (CD19+) | От 4 до 24 мес |
CD19+ В cells | From 4 to 24 months |
Целью данного обзора является описание основных этапов восстановления Т-клеточного звена иммунной системы у больных после трансплантации аллогенных гемопоэтических стволовых клеток.
Реконституция Т-клеточного звена иммунной системы после трансплантации аллогенных гемопоэтических стволовых клеток
Защита от инфекционных агентов и противоопухолевый контроль в первую очередь зависят от реконституции Т-клеточного звена иммунной системы. Сам процесс его восстановления условно разделяют на два самостоятельных пути: тимус-зависимый и тимус-независимый. В первый месяц после алло-ТГСК восстановление лимфоцитов происходит по тимус- независимому пути, то есть за счет зрелых донорских Т-клеток, которые содержались в самом трансплантате и были перелиты реципиенту вместе с ГСК, и в меньшей степени — за счет экспансии ранее существовавших хозяйских наивных Т-клеток и Т-клеток памяти, которые «выжили» после проведенного кондиционирования [7]. Экспансия как донорских, так и «хозяйских» Т-клеток происходит в ответ на высокую концентрацию интерлейкина (ИЛ)-7 и ИЛ-15, которые вырабатываются самими Т-клетками в условиях лимфопении. Этот процесс называют «гомеостатической пролиферацией», которая носит компенсаторный характер и позволяет на какое-то время «восполнить» Т-клеточный дефицит [8].
Образование Т-клеток de novo происходит по тимус- зависимому пути (рис. 1). Для дальнейшего созревания и пролиферации вновь образованные Т-клетки в костном мозге с током крови переносятся в тимус. Эти незрелые клетки являются предшественниками Т-лимфоцитов. Они не несут на своей поверхности никакого определяющего рецептора (CD3 CD4 CD8 ), в связи с чем их называют «трижды негативными» тимоцитами, или пре-Т-клетками. Дальнейшее созревание этих клеток условно можно разделить на два этапа. Первый этап происходит в кортикальном слое тимуса, где эти клетки активно делятся и пролиферируют под действием различных цитокинов, в первую очередь ИЛ-7, который вырабатывается кортикальными эпителиальными клетками [11]. Считается, что именно ИЛ-7 кортикальных эпителиальных клеток регулирует процесс дифференцировки тимоцитов, а именно формирование ТКР, который представляет собой поверхностный гетеродимерный белок, состоящий из двух субъединиц (α-, β- или γ-, δ-) , с помощью которого Т-клетка распознает и связывается с антигеном [12].
Эти незрелые клетки являются предшественниками Т-лимфоцитов. Они не несут на своей поверхности никакого определяющего рецептора (CD3 CD4 CD8 ), в связи с чем их называют «трижды негативными» тимоцитами, или пре-Т-клетками. Дальнейшее созревание этих клеток условно можно разделить на два этапа. Первый этап происходит в кортикальном слое тимуса, где эти клетки активно делятся и пролиферируют под действием различных цитокинов, в первую очередь ИЛ-7, который вырабатывается кортикальными эпителиальными клетками [11]. Считается, что именно ИЛ-7 кортикальных эпителиальных клеток регулирует процесс дифференцировки тимоцитов, а именно формирование ТКР, который представляет собой поверхностный гетеродимерный белок, состоящий из двух субъединиц (α-, β- или γ-, δ-) , с помощью которого Т-клетка распознает и связывается с антигеном [12].
Рисунок 1. Тимус-зависимый путь образования Т-клеток [11, 13-17 20, 21 ]
Figure 1. Thymus-dependent pathway for the formation of T cells [11, 13-17, 20, 21]
1. Образование предшественников Т-клеток в костном мозге.
Образование предшественников Т-клеток в костном мозге.
Development of T-cell precursors in the bone marrow.
2. Миграция предшественников Т-клеток в корковое вещество тимуса.
T-cell precursors migrate to the thymus cortex.
3. Реаранжировка ТКР
T-cell receptor gene rearrangement.
4. Позитивная тимическая селекция.
Positive selection of T cells in the thymus
5. Негативнаятимическаяселекция. Negative selection of T cells in the thymus.
6. Выход Т-клеток в периферическую кровь.
T cells moving to the peripheral blood.
В основе дифференцировки тимоцитов лежит процесс V(D) J-реаранжировки, результатом которого и является формирование ТКР. Гены ТКР состоят из сегментов, которые относятся к трем классам: V — отвечающий за «вариабельность», D — отвечающий за «разнообразие» и J — отвечающий за «связывание». В процессе перестройки гены из каждого сегмента связываются друг с другом и образуют один экзон, который кодирует вариабельный участок ТКР, отвечающий за распознавание и связывание антигена. У млекопитающих в результате V(D)J-реаранжировки образуется несколько основных комбинации генов, которые называются локусами антигенных рецепторов, — это TCRB (локус β-цепи), TCRG (локус γ-цепи), которые располагаются на 7- й хромосоме, и α/δ-локус ТКР, расположенный на 14-й хромосоме; α/δ-локус, в свою очередь, состоит из двух локусов: TCRA и TDRD. При этом гены TDRD располагаются внутри локуса TCRA [13]. Если при перестройке происходит формирование ло- куса TCRB, то в результате эта клетка будет экспрессировать ТКР, состоящий из β-цепи. Одномоментно с этим происходит подавление экспрессии генов других локусов TCRG и TDRD и запускается перестройка локуса TCRA, которая заключается в «вырезании» генов локуса TCRD, что приводит к формированию ТКР, состоящего из α- и β-цепей, и экспрессии CD4+ и CD8+ на поверхности Т-клетки [14]. Образовавшиеся CD4+CD8+ Т-клети называются «дважды позитивными» Т-клетками, а сам процесс — «позитивной тимической селекцией». Результатом этого процесса является формирование ТКР, с помощью которого «дважды позитивные» Т-клетки могут распознавать рецепторы гистосовместимости собственных клеток микроокружения, что нужно для последующего адекватного взаимодействия Т-клеток с антиген-презентирующими клетками уже в контексте распознавания антигенов.
У млекопитающих в результате V(D)J-реаранжировки образуется несколько основных комбинации генов, которые называются локусами антигенных рецепторов, — это TCRB (локус β-цепи), TCRG (локус γ-цепи), которые располагаются на 7- й хромосоме, и α/δ-локус ТКР, расположенный на 14-й хромосоме; α/δ-локус, в свою очередь, состоит из двух локусов: TCRA и TDRD. При этом гены TDRD располагаются внутри локуса TCRA [13]. Если при перестройке происходит формирование ло- куса TCRB, то в результате эта клетка будет экспрессировать ТКР, состоящий из β-цепи. Одномоментно с этим происходит подавление экспрессии генов других локусов TCRG и TDRD и запускается перестройка локуса TCRA, которая заключается в «вырезании» генов локуса TCRD, что приводит к формированию ТКР, состоящего из α- и β-цепей, и экспрессии CD4+ и CD8+ на поверхности Т-клетки [14]. Образовавшиеся CD4+CD8+ Т-клети называются «дважды позитивными» Т-клетками, а сам процесс — «позитивной тимической селекцией». Результатом этого процесса является формирование ТКР, с помощью которого «дважды позитивные» Т-клетки могут распознавать рецепторы гистосовместимости собственных клеток микроокружения, что нужно для последующего адекватного взаимодействия Т-клеток с антиген-презентирующими клетками уже в контексте распознавания антигенов. До 75 % клеток, которые вступают в процесс позитивной селекции, подвергаются апоптозу ввиду неадекватной реаранжировки ТКР [15]. После этого CD4+CD8+ T- клетки мигрируют в мозговой слой тимуса, где при взаимодействии с антигенами эпителиальных тимических клеток происходит второй этап дифференцировки этих клеток [16].
До 75 % клеток, которые вступают в процесс позитивной селекции, подвергаются апоптозу ввиду неадекватной реаранжировки ТКР [15]. После этого CD4+CD8+ T- клетки мигрируют в мозговой слой тимуса, где при взаимодействии с антигенами эпителиальных тимических клеток происходит второй этап дифференцировки этих клеток [16].
Второй этап созревания αβ Т-клеток заключается в формировании функциональной зрелости этих клеток, которая определяется способностью распознавать рецепторы главного комплекса гистосовместимости (ГКГ — MHC, major histocompatibility complex). Большая часть (около 90 %) αβ Т-клеток связывается с молекулами ГКГ, которые презентируются клетками микроокружения, — это эпителиальные кортикальные клетки, фибробласты, макрофаги и дендритные клетки [15]. В зависимости от того, с каким рецептором ГКГ связывается Т-клетка, она превращается или СD8+ (связываются с молекулами ГКГ I класса) или СD4+ (связываются с рецептором ГКГ II класса). Этот процесс называют «негативной тимической селекцией», который является ключевым механизмом формирования Т-клеточной центральной иммунологической толерантности, то есть невосприимчивости к собственным тканям [17].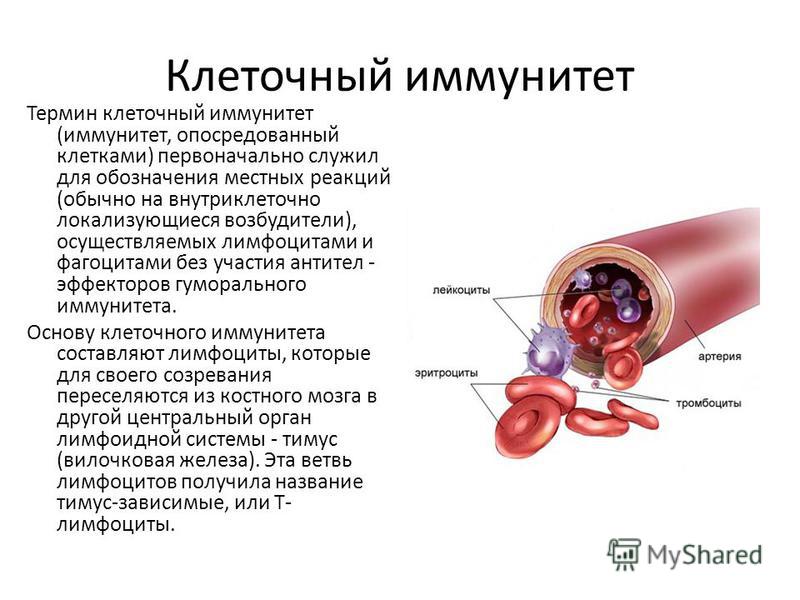 Часть CD4+CD8+ Т-клеток при взаимодействии с эпителиальными кортикальными клетками начинает экспрессировать транскрипционный фактор Foxp3, что в дальнейшем определяет формирование отдельной популяции им- мунокомпетентных клеток — популяции CD4+CD25high Т-регуляторных клеток (Treg), которая обеспечивает контроль толерантности к собственным антигенам путем подавления аутореактивных Т-клеток, по каким- то причинам избежавших селекции в тимусе и вышедших на периферию. Помимо этого, Treg регулируют активацию CD4+ и CD8+ Т-клеток, а также подавляют избыточную экспансию эффекторных Т-клеток после элиминации антигена [18, 19].
Часть CD4+CD8+ Т-клеток при взаимодействии с эпителиальными кортикальными клетками начинает экспрессировать транскрипционный фактор Foxp3, что в дальнейшем определяет формирование отдельной популяции им- мунокомпетентных клеток — популяции CD4+CD25high Т-регуляторных клеток (Treg), которая обеспечивает контроль толерантности к собственным антигенам путем подавления аутореактивных Т-клеток, по каким- то причинам избежавших селекции в тимусе и вышедших на периферию. Помимо этого, Treg регулируют активацию CD4+ и CD8+ Т-клеток, а также подавляют избыточную экспансию эффекторных Т-клеток после элиминации антигена [18, 19].
Таким образом, результатом селекции в тимусе является образование зрелых, экспрессирующих ТКР, СD4+ и CD8+ Т-клеток, которые далее выходят в периферическую кровь и разносятся по органам и тканям организма. Эти клетки называют недавними эмигрантами из тимуса (Recent Thymic Emigrant — RTE). Однако зрелые RTE-клетки в то же самое время являются функционально «незрелыми» или наивными Т-клетками, ввиду того что они еще не встречались с чужеродным антигеном [16, 17].
Продукция RTE-клеток зависит от возраста (рис. 2). Известно, что у детей первого года жизни продукция RTE является максимальной, что обеспечивает разнообразие ТКР и в дальнейшем позволяет реализовать иммунный ответ против широкого спектра различных антигенов. По мере взросления выработка RTE постепенно уменьшается, а постоянство периферического Т-клеточного пула происходит не за счет продукции RTE и разнообразия ТКР, а в большей степени за счет пролиферации Т-клеток на периферии [12].
Рисунок 2. Продукция RTE в зависимости от возраста [12]
Постоянство T-клеточного пула определяется двумя факторами: продукцией RTE и пролиферацией зрелых Т-клеток на периферии. С возрастом выработка наивных Т-клеток с различным репертуаром ТКР в тимусе уменьшается, а постоянство Т-клеточного пула осуществляется за счет зрелых Т-клеток, характеризующихся ограниченным репертуаром ТКР, на периферии.
Figure 2. Output of recent thymic emigrants depending on patients’ age [12]
T-cell homeostasis is determined by two main factors. These are the thymic output of RTE and the proliferation of peripheral T cells. The thymic output of na ve T cells with a diverse repertoire of T-cell receptors decreases with age, and peripheral T-cell homeostasis shifts to proliferation of peripheral mature T cells with a limited T-cell repertoire.
These are the thymic output of RTE and the proliferation of peripheral T cells. The thymic output of na ve T cells with a diverse repertoire of T-cell receptors decreases with age, and peripheral T-cell homeostasis shifts to proliferation of peripheral mature T cells with a limited T-cell repertoire.
Возможность реализации иммунного ответа определяется не только этапами дифференцировки образующихся Т-клеток в тимусе, но и является антиген-зависимой, так как для реализации своей эффекторной функции CD4+ и CD8+ Т-клетки в дальнейшем должны связаться с антигеном через молекулу ГКГ [17]. Таким образом, эта популяция Т-клеток в дальнейшем формирует адаптивный или вторичный иммунный ответ, то есть иммунный ответ против конкретного антигена.
Другая, существенно меньшая часть αβ Т-клеток взаимодействует не с молекулами ГКГ, а с подобными рецепторами MR1 (Т-клетки, ассоциированные со слизистыми, MAIT) или CD1d (Т-клетки — натуральные киллеры, ИКТ-клетки). МА!Т представляют собой субпопуляцию Т-клеток, которые преимущественно локализуются в слизистых желудочно-кишечного тракта, бронхолегочной системы, а циркулирующий пул составляет не более 10 % от общего числа циркулирующих Т-лимфоцитов. ИКТ-клетки — наименьшая субпопуляция иммунокомпетентных клеток, численность которой не превышает 0,1 % от общего количества циркулирующих Т-клеток. Активация и MAIT и ИКТ-клеток не требует распознавания ГКГ и является антиген-независимой, что обусловливает их способность взаимодействовать с любым антигеном. Эти клетки также отличаются способностью вырабатывать различные цитокины, такие как фактор некроза опухоли (ФНО), интерферон-γ, ИЛ-4, ИЛ-10, ИЛ-17, что позволяет им быстро реализовать цитоток- сическую функцию [20, 21].
ИКТ-клетки — наименьшая субпопуляция иммунокомпетентных клеток, численность которой не превышает 0,1 % от общего количества циркулирующих Т-клеток. Активация и MAIT и ИКТ-клеток не требует распознавания ГКГ и является антиген-независимой, что обусловливает их способность взаимодействовать с любым антигеном. Эти клетки также отличаются способностью вырабатывать различные цитокины, такие как фактор некроза опухоли (ФНО), интерферон-γ, ИЛ-4, ИЛ-10, ИЛ-17, что позволяет им быстро реализовать цитоток- сическую функцию [20, 21].
Если при V (DJ-реаранжировке «дважды негативных» тимоцитов происходит формирование TCRG и TDRD, то в результате Т-клетка экспрессирует ТКР, состоящий из γ- и δ-цепей. γδ Т-клетки не проходят процесс позитивной тимической селекции и выходят в периферическую кровь, не неся на своей поверхности ни CD8, ни CD4 [14]. Поскольку созревание γδ Т-клеток определяется фактически только процессом V (D)J-реаранжировки, их функциональная способность зависит от разнообразия их ТКР, что в результате дает возможность этим клеткам взаимодействовать с любым антигеном, что является ключевым в реализации первичного (врожденного) иммунного ответа [13, 14]. Эти клетки преимущественно локализуются в слизистых, а циркулирующий пул γδ Т-клеток составляет не более 10 % от общего числа Т-лимфоцитов [20].
Эти клетки преимущественно локализуются в слизистых, а циркулирующий пул γδ Т-клеток составляет не более 10 % от общего числа Т-лимфоцитов [20].
Таким образом, в результате тимус-зависимого пути образуются две большие группы Т-клеток, функция которых определяется способностью связывания с антигеном и, соответственно, участием в формировании первичного или вторичного иммунного ответа. Большинство Т-клеток взаимодействуют с антигеном с участием молекулы ГКГ (это CD4+ и CD8+ Т-лимфоциты) и участвуют в формировании адаптивного иммунного ответа. Эти клетки также называют конвенциональными Т-клетками. Другая часть Т-клеток, к которой относятся MAIT, NKT-клетки и γδ Т-клетки, являются неконвенциональными Т-клетками, так как для их активации не требуется связывание с антигеном с участием ГКГ, что дает им возможность взаимодействовать фактически с любым антигеном и формирует «первую линию» иммунной защиты, другими словами, первичный иммунный ответ [20, 21].
Эффект алло-ТГСК основан на развитии аллоим- мунной РТПО, которая, по сути, является реализацией иммуноопосредованной реакции против конкретного антигена, в данном случае — опухолевого. Другими словами, феномен биологического излечения больных различными опухолевыми заболеваниями системы крови после алло-ТГСК заключается в восстановлении именно адаптивного иммунитета. После того, как чужеродный антиген впервые попал в организм, происходит его связывание с наивными Т-клетками через ТКР. Связывание антигена с наивной Т-клеткой приводит к ее активации, структурной реорганизации ее мембраны и цитоскелета, ремоделированию хроматина и экспрессии новых генов, изменениям в адгезии и миграции клеток, а также индукции клеточного деления. В результате этих перестроек формируется пул эффекторных Т-клеток, которые и уничтожают этот антиген [22].
Другими словами, феномен биологического излечения больных различными опухолевыми заболеваниями системы крови после алло-ТГСК заключается в восстановлении именно адаптивного иммунитета. После того, как чужеродный антиген впервые попал в организм, происходит его связывание с наивными Т-клетками через ТКР. Связывание антигена с наивной Т-клеткой приводит к ее активации, структурной реорганизации ее мембраны и цитоскелета, ремоделированию хроматина и экспрессии новых генов, изменениям в адгезии и миграции клеток, а также индукции клеточного деления. В результате этих перестроек формируется пул эффекторных Т-клеток, которые и уничтожают этот антиген [22].
Известно, что весь процесс трансформации наивных клеток в эффекторный пул занимает около недели [22, 23]. В исследованиях на мышах было показано, что на 8-й день после инфицирования вирусом лимфоцитарного хориоменингита в периферической крови определяется максимальное количество эффекторных Т-клеток, которые экспрессируют на своей поверхности активационный маркер CD44, утрачивая при этом хоуминг-рецепторы и маркеры адгезии. Помимо этого, эти клетки секретируют различные цитокины, такие как интерферон-γ, посредством которых они реализуют свою цитотоксическую функцию. Нужно отметить, что наивные Т-клетки не экспрессирует CD44 и не секретируют провоспалительные цитокины, что говорит о том, что они не способны к реализации эффекторной функции. Отличительной особенностью наивных Т-клеток является экспрессия как раз хоуминг-рецепторов, например CCR-7 или L-селектина, что дает возможность этим клеткам мигрировать во вторичные лимфоидные органы, где и происходит их финальная трансформация в эффекторные Т-клетки [23, 24].
Помимо этого, эти клетки секретируют различные цитокины, такие как интерферон-γ, посредством которых они реализуют свою цитотоксическую функцию. Нужно отметить, что наивные Т-клетки не экспрессирует CD44 и не секретируют провоспалительные цитокины, что говорит о том, что они не способны к реализации эффекторной функции. Отличительной особенностью наивных Т-клеток является экспрессия как раз хоуминг-рецепторов, например CCR-7 или L-селектина, что дает возможность этим клеткам мигрировать во вторичные лимфоидные органы, где и происходит их финальная трансформация в эффекторные Т-клетки [23, 24].
После элиминации антигена часть эффекторных клеток погибает, а часть переходит в пул долгоживущих Т-клеток памяти. Формирование этого пула Т-клеток требует длительного времени. Показано, что Т-клетки памяти начинают определяться в периферической крови только к 40-му дню после первичного инфицирования [23]. Однако помимо классического пути формирования «иммунологической памяти» (наивные Т-клетки → эффекторные Т-клетки → Т-клетки памяти) есть неклассический путь, когда при первичном инфицировании часть наивных Т-клеток трансформируется в эффекторный пул, а другая часть сразу же переходит в пул Т-клеток памяти [25, 26]. Как при классическом, так и при неклассическом пути происходит формирование популяции иммунокомпетентных клеток (популяции Т-клеток памяти), которая реализует быстрый иммунный ответ при повторном попадании чужеродного антигена без участия наивных Т-клеток [24]. Пул Т-клеток памяти является гетерогенным, так как включает в себя иммунокомпетентные клетки, которые, имея различный иммунофенотип, отличаются своими функциональными свойствами, различной пролиферативной способностью и локализацией (табл. 2) [27, 28]. Условно Т-клетки памяти разделяют на две группы: истинные клетки памяти, к которым относят Т-стволовые клетки памяти (Tscm) и Т-клетки центральной памяти (Tcm), и эффекторный пул, состоящий из переходных Т-клеток (или Т-клетки транзиторной памяти, Ttm), Т-клеток эффекторной памяти (Tem), терминальных эффекторов (Тte) и Т-клеток резидуальной памяти (Trm) [29, 30].
Как при классическом, так и при неклассическом пути происходит формирование популяции иммунокомпетентных клеток (популяции Т-клеток памяти), которая реализует быстрый иммунный ответ при повторном попадании чужеродного антигена без участия наивных Т-клеток [24]. Пул Т-клеток памяти является гетерогенным, так как включает в себя иммунокомпетентные клетки, которые, имея различный иммунофенотип, отличаются своими функциональными свойствами, различной пролиферативной способностью и локализацией (табл. 2) [27, 28]. Условно Т-клетки памяти разделяют на две группы: истинные клетки памяти, к которым относят Т-стволовые клетки памяти (Tscm) и Т-клетки центральной памяти (Tcm), и эффекторный пул, состоящий из переходных Т-клеток (или Т-клетки транзиторной памяти, Ttm), Т-клеток эффекторной памяти (Tem), терминальных эффекторов (Тte) и Т-клеток резидуальной памяти (Trm) [29, 30].
В ходе многих исследований было выявлено, что Т-клетки памяти в первую очередь имеют различный иммунофенотип [27—30]. Показано, что основными маркерами этих клеток являются CD45RA, CD45R0, CD62L, CCR-7, CD27, CD28 [30].
Показано, что основными маркерами этих клеток являются CD45RA, CD45R0, CD62L, CCR-7, CD27, CD28 [30].
CD45 представляет собой трансмембранный гликопротеин, который экспрессируется на всех ядросодержащих клетках. Через этот рецептор происходит передача сигнала от ТКР. Вместе с тем выделяют несколько изоформ CD45, которые по-разному экспрессируются на Т-клетках. Иммунофенотип CD45RA+CD45R0— характеризует наивные Т-клетки. Есть исследования, которые показали, что при активации эти клетки начинают экспрессировать CD45R0 и утрачивают CD45RA [31, 32]. Таким образом, экспрессия CD45R0 отражает пролиферативную способность Т-клеток и характерна для популяции Т-клеток памяти (Tcm, Ttm, Tem) [31].
Экспрессия хоуминг-рецепторов и маркеров адгезии характеризует способность Т-клеток к миграции во вторичные лимфоидные органы. Экспрессия CD62L и CCR-7 характерна в большей степени для наивных Т-клеток и истинных Т-клеток памяти, что отражает их больший пролиферативный потенциал. Более дифференцированные Т-клетки эффекторного пула (Ttm, Tem, Tte) не экспрессируют эти маркеры, что свидетельствует о том, что эти клетки не способны к пролиферации во вторичных лимфоидных органах [33]. Как правило, вместе с экспрессией молекул адгезии Т-клетки экспрессируют и костимулирующие рецепторы CD27, CD28 [30].
Более дифференцированные Т-клетки эффекторного пула (Ttm, Tem, Tte) не экспрессируют эти маркеры, что свидетельствует о том, что эти клетки не способны к пролиферации во вторичных лимфоидных органах [33]. Как правило, вместе с экспрессией молекул адгезии Т-клетки экспрессируют и костимулирующие рецепторы CD27, CD28 [30].
Отличительной особенностью популяции истинных клеток памяти является их способность к длительной пролиферации даже в отсутствие антигена, что обеспечивает самоподдержание всей популяции. На этом основан феномен «иммунологической памяти», что позволяет хранить информацию о конкретном антигене и при его попадании в организм реализовать иммунный ответ против него [34—36]. Долгое время считалось, что субпопуляцией истинных клеток памяти является популяция Tcm [27, 28]. Однако в дальнейшем была выделена субпопуляция Tscm, которая функционально соответствовала популяции Tcm, однако иммунофенотипически в большей степени походила на наивные Т-клетки (CD45RA+CD45R0— CCR7+CD62L+CD27+CD28+) [37, 38]. В результате проведенных экспериментов по заражению макак вирусом иммунодефицита было выявлено, что эта субпопуляция способна к значимо более длительной пролиферации даже в условиях отсутствия вируса в сравнении с субпопуляцией Tcm [39, 40]. В дальнейшем было доказано, что Tscm являются предшественниками как Tcm, так и Т-клеток эффекторного пула [41, 42].
Исследования показали, что среди всей популяции Т-клеток памяти есть клетки, характеризующиеся продукцией интерферона-γ, ФНО, ИЛ-2, с помощью которых они быстро реализуют свою цитотоксиче- скую функцию. Истинные клетки памяти сами не могут реализовать быстрый иммунный ответ. Была выделена популяция эффекторных Т-клеток памяти [27, 43]. Однако в ряде случаев было замечено, что в периферической крови встречается субпопуляция Т-клеток с иммунофенотипом CCR7/CD62LCD28+, которая является более «зрелой» и более «активной», чем субпопуляция Tcm, но менее дифференцированной, чем субпопуляция Tem. Таким образом, эти клетки были названы переходными, или транзиторными,
Таблица 2. Основные субпопуляции Т-клеток памяти [30]
Table 2. Main subsets of memory T cells [30]
Субпопуляции Т-клеток памяти T-memory cell subsets | Иммунофенотип Immunophenotype | Свойства Characteristics | |
|---|---|---|---|
Истинные клетки памяти True memory cells | Т-стволовые клетки памяти (Tscm) T-memory stem cells (Tscm) | CD45RA+CD45R0— CD62L+CCR7+ CD27+CD28+ | Обеспечивают самообновление и самоподдержание популяции клеток памяти и хранение информации о конкретном антигене. Локализуются преимущественно в костном мозге и лимфатической ткани These cells provide self-renewal and self-maintenance of the whole population of memory T-cells and store the information about the specific antigen. They are localized in the bone marrow and lymphoid tissue |
Т-клетки центральной памяти (Tcm) T-central memory (Tcm) | CD45RA-CD45R0+ CD62L+CCR7+ CD27+CD28+ | Обеспечивают самоподдержание Т-клеток памяти, преимущественно локализуются в лимфатических узлах и костном мозге, способны быстро дифференцироваться в эффекторные клетки через Т-клетки транзиторной памяти These cells provide self-maintenance of T-memory cells and reside mostly in the bone marrow and lymphoid tissue. These cells are capable of differentiating promptly into transitional and effector T-cells | |
Эффекторный пул Effector pool of T-cells | Т-клетки транзиторной памяти (Ttm) T-transitional memory (Ttm) | CD45RA—CD45R0+ CD62L—CCR7— CD27+CD28+ | Способны к быстрой дифференцировке в эффекторные клетки при контакте с антигеном, после чего они переходят в Tcm These cells are interim and transitional between memory and effector T-cells. After interaction with the antigen, these cells differentiate into effector cells and subsequently to central memory T-cells |
Т-клетки эффекторной памяти (Tem) Т-effector memory (Tem) | CD45R0+CCR7—CD27+CD28— (оценка CD45RA и CD62L не производится) (CD45RA and CD62L are not investigated) | Преимущественно определяются в циркулирующей крови и тканях, быстро реагируют на встречу с антигеном и обеспечивают развитие иммунного ответа These cells circulate mostly in the peripheral blood and move into different tissues, where they respond promptly to the antigen encounter thus providing the respective immune reaction | |
Т-терминальные эффекторы (Tte) Т-terminal effectors (Tte) | CD45R0—CCR7—CD27—CD28— (оценка CD45RA и CD62L не производится) (CD45RA and CD62L are not investigated | Наиболее дифференцированные эффекторные клетки, обеспечивающие быстрый иммунный ответ против конкретного антигена The most mature, terminally differentiated effector T-cells that provide instant immunity against the antigen and subsequently undergo apoptosis | |
| Т-клетки резидуальной памяти (Trm) Т-residual memory cells (Trm) | CD69+CD103+CD62L— | Являются терминально-дифференцированными эффекторными клетками, реализующими иммунный ответ в месте своей локализации в различных органах и тканях (коже, бронхолегочной системы и желудочно-кишечного тракта) These cells are terminally differentiated effector cells providing local immunity in the periphery (in the skin, bronchopulmonary system and gastrointestinal tract) |
Т-клетками (Ttm) [44—46]. Помимо этого, в периферической крови также нередко определяются Т-клетки, которые не несут на своей поверхности ни CCR-7, CD62L, ни CD27, CD28. Отличительной чертой этой популяции является крайне низкая способность к пролиферации, что также свидетельствует о высокой диф- ференцировке этих клеток. Они были определены как терминальные эффекторные Т-клетки (Tte) [47].
Кроме циркулирующего пула Т-клеток памяти есть пул нециркулирующих Т-клеток резидуальной памяти (Trm), который характеризуется высокой экспрессией CD69 и провоспалительных цитокинов интерферона-γ, ФНО, ИЛ-2, ИЛ-17. Чаще всего эти клетки определяются на слизистых и функционально являются эффекторными клетками, реализующими иммунный ответ непосредственно в месте своей локализации [36, 48].
Таким образом, формирование адаптивного иммунитета основывается на формировании пула долгоживущих Т-клеток памяти (Tscm, Tcm), активация которых происходит в результате повторного контакта с антигеном, что в дальнейшем запускает формирование пула эффекторных Т-клеток, непосредственно реализующих сам иммунный ответ. Формирование адаптивного иммунитета невозможно без участия наивных Т-клеток, которые, по сути, являются предшественниками всей популяции Т-клеток памяти. Наиболее дифференцированные Т-клетки — терминальные эффекторы являются наиболее функционально активной субпопуляцией, но при этом не обладают пролиферативной способностью и погибают сразу же после реализации своей эффекторной функции.
Долгое время считалось, что аллореактивными Т-клетками, которые запускают развитие РТПХ, являются функционально активные, терминальнодифференцированные Т-клетки [49, 50]. Однако исследования показали, что через 12 часов после ин- фузии аллогенных ГСК и до +3 дня большинство донорских Т-клеток экспрессируют хемокиновый рецептор CCR-7 и хоуминг-рецепторы: CD4+ Т-клетки экспрессируют L-селектин (CD62L), CD8+ Т-клетки — CD62L и α4β7-интегрин. Именно это и обусловливает возможность мигрирации этих клеток в различные органы и ткани, где они и запускают РТПХ [51, 52]. В эксперименте на мышах была доказана принадлежность этой аллореактивной популяции CD62L+CCR-7+ Т-клеток к наивным Т-лимфоцитам, инфильтрация которыми была выявлена в ткани желудочно-кишечного тракта тех мышей, у которых впоследствии развилась тяжелая острая РТПХ [51]. Вместе с тем было показано, что зрелые функционально активные Т-клетки не индуцируют развитие РТПХ, так как они не способны к пролиферации во вторичных лимфоидных органах и дальнейшей миграции в органы-мишени ввиду отсутствия CD62L и CCR-7 [52]. Таким образом, было доказано, что аллореактивными Т-клетками, которые индуцируют развитие острой РТПХ, являются наивные Т-лимфоциты, а не эффекторные Т-клетки. На этих данных основано использование циклофос- фамида (ЦФ) на +3, +4 день после алло-ТГСК в качестве профилактики острой РТПХ, который удаляет сформировавшийся к этому времени клон аллореактивных Т-клеток и тем самым протектирует развитие острой РТПХ [53, 54]. Помимо этого, важно отметить, что ЦФ практически не оказывает влияния на истинные Т-клетки памяти (Tcm и Тscm). Это, в свою очередь, говорит о меньшем его воздействии на тимус, что обеспечивает возможность дальнейшей реконституции адаптивного иммунитета [55, 56].
Альтернативой ЦФ в режимах профилактики острой РТПХ является антитимоцитарный глобулин (АТГ). Однако его применение значительно удлиняет время восстановления практически всех субпопуляций иммунокомпетентных клеток ввиду того, что сам препарат является поликлональным антителом, которое получают из гипериммунной сыворотки лошадей (тимоглобулин — из кроличьей сыворотки), иммунизированных Т-лимфоцитами человека. Эта сыворотка содержит широкий спектр антител, которые комплементарно связываются со своими эпитопами на Т-клетках реципиента и тем самым обеспечивают массивную Т-клеточную деплецию как в периферической крови, так и в лимфоидных тканях. Помимо того, что АТГ деплетирует весь лимфоидный компартмент, он также оказывает воздействие на тимус, вызывая апоптоз кортикальных эпителиальных клеток тимуса, что приводит к отсроченной реконституции всего Т-клеточного пула в течение более чем 2 лет после алло-ТГСК [57, 58].
При сравнении режимов с АТГ и с ЦФ было показано, что после использования ЦФ в течение первого месяца после алло-ТГСК содержание αβ T- клеток значимо выше, чем после АТГ [59]. Содержание как CD4+, так CD8+ Т-клеток на +730 день алло-ТГСК после применения АТГ все еще не достигает нормальных значений [60]. Это объясняет и лучшие клинические результаты при использовании ЦФ по сравнению с АТГ в режимах профилактики острой РТПХ [61—63], которые показывают значимо меньшую частоту развития тяжелой острой РТПХ, лучшую общую и безрецидив- ную выживаемость.
Другим патогенетически обоснованным методом профилактики острой РТПХ является применение ведолизумаба — моноклонального антитела, которое, связываясь с α4β7- интегрином, блокирует миграцию Т-клеток в органы-мишени и предупреждает развитие РТПХ [64].
Восстановление Т-клеточного звена иммунной системы после алло-ТГСК является возможным в первую очередь благодаря способности Т-клеток к пролиферации и при необходимости генерации эффекторного пула Т-клеток in vivo. В экспериментах на мышах было показано, что трансплантация только лишь эффекторных Т-клеток, даже в больших дозах, не обеспечивает реконституцию Т-клеточного звена иммунной системы, ввиду того что эти клетки не обладают пролиферативной способностью [65—67]. Трансплантация же селектированных Т-клеток центральной памяти (Tcm) приводит к генерации пула эф- фекторных Т-клеток без развития РТПХ [68]. Однако при иммунофенотипировании и анализе репертуара Т-клеточного рецептора было доказано, что только лишь наивные Т-клетки и стволовые Т-клетки памяти (Tscm) могут обеспечить генерацию гетерогенного пула Т-клеток памяти, включая Tcm и эффекторный пул [42]. На основании всего вышесказанного можно заключить, что применение деплеции αβ Т-клеток ex vivo как метода профилактики острой РТПХ, с одной стороны, практически полностью исключает возможность развития этого осложнения, так как в его основе лежит механическое удаление из трансплантата, прежде всего, наивных Т-клеток [69]. Однако, с другой стороны, применение этого метода профилактики РТПХ, с биологической точки зрения, особенно у взрослых больных (старше 20 лет), не может обеспечить «полноценное» восстановление Т-клеточного звена иммунной системы. Это связано с тем, что в такой ситуации восстановление Т-клеточного звена осуществляется за счет гомеостатической пролиферации γδ Т-клеток, которые реализуют первичный иммунный ответ, но не обеспечивают развитие адаптивного иммунитета, в том числе и противоопухолевого [70, 71]. Помимо этого, у этих больных образование de novo наивных αβ Т-клеток ограничено повреждением тимуса в результате предшествующей химиотерапии и проведением предтрансплантационного кондиционирования, а также возрастными изменениями (инволюцией тимуса) [72—76].
Считается, что использование миелоаблативных режимов ассоциировано с отсроченной реконституцией Т-клеточного звена иммунной системы [77, 78]. Показано, что проведение тотального облучения тела или использование бусульфана в миелоаблативной дозе вызывает необратимую гибель эпителиальных кортикальных клеток тимуса, в результате чего образование лимфоидных популяций становится практически невозможным даже у детей [75, 76]. Использование режимов пониженной интенсивности значимо меньше повреждает эпителиальные клетки тимуса, что дает возможность для более быстрого восстановления Т-клеточного звена по сравнению с миелоаблативными режимами [79, 80]. Это доказывает выявление ИТЕ-клеток в периферической крови больных после режима пониженной интенсивности уже на сроках +3.. .+6.. .+12 месяцев после алло-ТГСК. При этом у больных после миелоаблативного кондиционирования ИТЕ на этих же сроках не определяются [81, 82]. Помимо этого, было показано, что восстановление количества наивных Т-клеток у детей после алло- ТГСК в режиме пониженной интенсивности достигает физиологической нормы не менее чем через 2 года. У взрослых (старше 20 лет) даже через 3 года после алло-ТГСК количество наивных Т-клеток остается значимо ниже возрастной нормы [83].
Таким образом, полноценное восстановление Т-клеточного звена иммунной системы после алло-ТГСК зависит от продукции наивных Т-клеток де novo, которая в дальнейшем приводит к формированию адаптивного, в том числе противоопухолевого, иммунитета. Возраст больных, а также выбор пред- трансплантационного кондиционирования и режима профилактики острой РТПХ влияют на скорость восстановления Т-клеточного звена иммунной системы у больных после алло-ТГСК.
1. Mehta R.S., Rezvani K. Immune reconstitution post allogeneic transplant and the impact of immune recovery on the risk of infection. Virulence. 2016; 7(8): 901–16. DOI: 10.1080/21505594.2016.1208866.
2. Kim B.E., Koh K.N., Im H.J., Seo J.J. Factors influencing lymphocyte reconstitution after allogeneic hematopoietic stem cell transplantation in children. Korean J Hematol. 2012; 47(1): 44–52. DOI: 10.5045/kjh.2012.47.1.44.
3. de Koning C., Plantinga M., Besseling P. et al. Immune Reconstitution after Allogeneic Hematopoietic Cell Transplantation in Children. Biol Blood Marrow Transplant. 2016; 22(2): 195–206. DOI: 10.1016/j.bbmt.2015.08.028.
4. Drokov M.Y., Davydova J.O., Kuzmina L.A. et al. Level of Granzyme B-positive T-regulatory cells is a strong predictor biomarker of acute Graft-versus-host disease after day +30 after allo-HSCT. Leuk Res. 2017; 54: 25–9. DOI: 10.1016/j.leukres.2017.01.014.
5. Williams K.M., Gress R.E. Immune reconstitution and implications for immunotherapy following haematopoietic stem cell transplantation. Best Pract Res Clin Haematol. 2008; 21(3): 579–96. DOI: 10.1016/j.beha.2008.06.003.
6. Ogonek J., Kralj Juric M., Ghimire S. et al. Immune Reconstitution after Allogeneic Hematopoietic Stem Cell Transplantation. Front Immunol. 2016; 7: 507. DOI: 10.3389/fimmu.2016.00507.
7. Krenger W., Blazar B. R., Holländer G.A. Thymic T-cell development in allogeneic stem cell transplantation. Blood. 2011; 117(25): 6768–76. DOI: 10.1182/blood-2011-02-334623.
8. Bourgeois C., Stockinger B. T cell homeostasis in steady state and lymphopenic conditions. Immunol Lett. 2006; 107(2): 89–92. DOI: 10.1016/j.imlet.2006.08.001.
9. Ge Q., Rao V.P., Cho B.K. et al. Dependence of lymphopenia-induced T cell proliferation on the abundance of peptide/ MHC epitopes and strength of their interaction with T cell receptors. Proc Natl Acad Sci USA. 2001; 98(4): 1728–33. DOI: 10.1073/pnas.98.4.1728.
10. Jameson S.C. T cell homeostasis: keeping useful T cells alive and live T cells useful. Semin Immunol. 2005; 17(3): 231–7. DOI: 10.1016/j.smim.2005.02.003.
11. Pénit C., Lucas B., Vasseur F. Cell expansion and growth arrest phases during the transition from precursor (CD4-8-) to immature (CD4+ 8+ ) thymocytes in normal and genetically modified mice. J Immunol. 1995; 15; 154(10): 5103–13.
12. Ye P., Kirschner D.E. Measuring emigration of human thymocytes by T-cell receptor excision circles. Crit Rev Immunol. 2002; 22(5–6): 483–97.
13. Onozawa M., Aplan P.D. llegitimate V(D)J recombination involving nonantigen receptor loci in lymphoid malignancy. Genes Chromosomes Cancer. 2012; 51(6): 525–35. DOI: 10.1002/gcc.21942.
14. Kreslavsky T., Gleimer M., Garbe A.I., von Boehmer H. αβ versus γδ fate choice: counting the T-cell lineages at the branch point. Immunol Rev. 2010; 238(1): 169–81. DOI: 10.1111/j.1600-065X.2010.00947.x.
15. Albano F., Vecchio E., Renna M. et al. Insights into Thymus Development and Viral Thymic Infections. Viruses. 2019; 11(9): 836. DOI: 10.3390/v11090836.
16. Godfrey D.I., Kennedy J., Suda T., Zlotnik A. A developmental pathway involving four phenotypically and functionally distinct subsets of CD3– CD4– CD8– triple-negative adult mouse thymocytes defined by CD44 and CD25 expression. J Immunol. 1993; 150(10): 4244–52.
17. Gardner J.M., Fletcher A.L., Anderson M.S., Turley S.J. AIRE in the thymus and beyond. Curr Opin Immunol. 2009; 21(6): 582–9. DOI: 10.1016/j.coi.2009.08.007.
18. Kondĕlková K., Vokurková D., Krejsek J. et al. Regulatory T cells (TREG) and their roles in immune system with respect to immunopathological disorders. Acta Medica (Hradec Kralove). 2010; 53(2): 73–7. DOI: 10.14712/18059694.2016.63.
19. Дроков М.Ю., Паровичникова Е.Н., Кузьмина Л.А. и др. Роль гранзима В в популяции Т-регуляторных клеток у больных после трансплантации аллогенного костного мозга. Гематол трансфузиол. 2016; 61(1): 32–7. DOI: 10.18821/0234-5730-2016-61-1-32-37.
20. Ivanov S., Paget C., Trottein F. Role of non-conventional T lymphocytes in respiratory infections: the case of the pneumococcus. PLoS Pathog. 2014; 10(10): e1004300. DOI: 10.1371/journal.ppat.1004300.
21. Yamamoto R., Xu Y., Ikeda S. et al. Thymic Development of a Unique Bone Marrow-Resident Innate-like T Cell Subset with a Potent Innate Immune Function. J Immunol. 2019; 203(1): 167–77. DOI: 10.4049/jimmunol.1900111.
22. Oehen S., Brduscha-Riem K. Differentiation of naive CTL to effector and memory CTL: correlation of effector function with phenotype and cell division. J Immunol. 1998; 161(10): 5338–46.
23. Kaech S.M., Hemby S., Kersh E., Ahmed R. Molecular and functional profiling of memory CD8 T cell differentiation. Cell. 2002; 111(6): 837–51. DOI: 10.1016/s0092-8674(02)01139-x.
24. Lau C.M., Sun J.C. The widening spectrum of immunological memory. Curr Opin Immunol. 2018; 54: 42–9. DOI: 10.1016/j.coi.2018.05.013.
25. Lauvau G., Vijh S., Kong P. et al. Priming of memory but not effector CD8 T cells by a killed bacterial vaccine. Science. 2001; 294(5547): 1735–9. DOI: 10.1126/science.1064571.
26. Manjunath N., Shankar P., Wan J. et al. Effector differentiation is not prerequisite for generation of memory cytotoxic T lymphocytes. J Clin Invest. 2001; 108(6): 871–8. DOI: 10.1172/JCI13296.
27. Sallusto F., Lenig D., Förster R. et al. Two subsets of memory T lymphocytes with distinct homing potentials and effector functions. Nature. 1999; 401(6754): 708–12. DOI: 10.1038/44385.
28. Hamann D., Baars P.A., Rep M.H. et al. Phenotypic and functional separation of memory and effector human CD8+ T cells. J Exp Med. 1997; 186(9): 1407–18.
29. Mahnke Y.D., Beddall M.H., Roederer M. OMIP-013: differentiation of human T-cells. Cytometry A. 2012; 81(11): 935–6. DOI: 10.1002/cyto.a.22201.
30. Mahnke Y.D., Brodie T.M., Sallusto F. et al. The who’s who of T-cell differentiation: human memory T-cell subsets. Eur J Immunol. 2013; 43(11): 2797–809. DOI: 10.1002/eji.201343751.
31. Johannisson A., Festin R. Phenotype transition of CD4+ T cells from CD45RA to CD45R0 is accompanied by cell activation and proliferation. Cytometry. 1995; 19(4): 343–52. DOI: 10.1002/cyto.990190409.
32. Akbar A.N., Terry L., Timms A. et al. Loss of CD45R and gain of UCHL1 reactivity is a feature of primed T cells. J Immunol. 1988; 140(7): 2171–8.
33. Picker L.J., Treer J.R., Ferguson-Darnell B. et al. Control of lymphocyte recirculation in man. II. Differential regulation of the cutaneous lymphocyte-associated antigen, a tissue-selective homing receptor for skin-homing T cells. J Immunol. 1993; 150(3): 1122–36.
34. Sallusto F., Geginat J., Lanzavecchia A. Central memory and effector memory T cell subsets: function, generation, and maintenance. Annu Rev Immunol. 2004; 22: 745–63. DOI: 10.1146/annurev.immunol.22.012703.104702.
35. Stemberger C., Neuenhahn M., Gebhardt F.E. et al. Stem cell-like plasticity of naïve and distinct memory CD8 + T cell subsets. Semin Immunol. 2009; 21(2): 62–8. DOI: 10.1016/j.smim.2009.02.004.
36. Mueller S.N., Gebhardt T., Carbone F.R., Heath W.R. Memory T cell subsets, migration patterns, and tissue residence. Annu Rev Immunol. 2013; 31: 137–61. DOI: 10.1146/annurev-immunol-032712-095954.
37. Fagnoni F.F., Vescovini R., Passeri G. et al. Shortage of circulating naive CD8(+) T cells provides new insights on immunodeficiency in aging. Blood. 2000; 95(9): 2860–8.
38. Lugli E., Pinti M., Nasi M. et al. Subject classification obtained by cluster analysis and principal component analysis applied to flow cytometric data. Cytometry A. 2007; 71(5): 334–44. DOI: 10.1002/cyto.a.20387.
39. Gattinoni L., Lugli E., Ji Y. et al. A human memory T cell subset with stem cell-like properties. Nat Med. 2011; 17(10): 1290–7. DOI: 10.1038/nm.2446.
40. Lugli E., Dominguez M.H., Gattinoni L. et al. Superior T memory stem cell persistence supports long-lived T cell memory. J Clin Invest. 2013; 123(2): 594–9. DOI: 10.1172/JCI66327.
41. Feuerer M., Beckhove P., Bai L. et al. Therapy of human tumors in NOD/ SCID mice with patient-derived reactivated memory T cells from bone marrow. Nat Med. 2001; 7(4): 452–8. DOI: 10.1038/86523.
42. Cieri N., Oliveira G., Greco R. et al. Generation of human memory stem T cells after haploidentical T-replete hematopoietic stem cell transplantation. Blood. 2015; 125(18): 2865–74. DOI: 10.1182/blood-2014-11-608539.
43. Gattinoni L., Speiser D.E., Lichterfeld M., Bonini C. T memory stem cells in health and disease. Nat Med. 2017; 23(1): 18–27. DOI: 10.1038/nm.4241.
44. Fritsch R.D., Shen X., Sims G.P. et al. Stepwise differentiation of CD4 memory T cells defined by expression of CCR7 and CD27. J Immunol. 2005; 175(10): 6489–97. DOI: 10.4049/jimmunol.175.10.6489.
45. Okada R., Kondo T., Matsuki F. et al. Phenotypic classification of human CD4 + T cell subsets and their differentiation. Int Immunol. 2008; 20(9):1189–99. DOI: 10.1093/intimm/dxn075.
46. Picker L.J., Reed-Inderbitzin E.F., Hagen S.I. et al. IL-15 induces CD4 effector memory T cell production and tissue emigration in nonhuman primates. J Clin Invest. 2006; 116(6): 1514–24. DOI: 10.1172/JCI27564.
47. Geginat J., Lanzavecchia A., Sallusto F. Proliferation and differentiation potential of human CD8 + memory T-cell subsets in response to antigen or homeostatic cytokines. Blood. 2003; 101(11): 4260–6. DOI: 10.1182/blood-2002-11-3577.
48. Schreiner D., King C.G. CD4 + Memory T Cells at Home in the Tissue: Mechanisms for Health and Disease. Front Immunol. 2018; 9: 2394. DOI: 10.3389/fimmu.2018.02394.
49. Billingham RE. The biology of graft-versus-host reactions. Harvey Lect. 1966; 62: 21–78.
50. Krenger W., Holländer G.A. The immunopathology of thymic GVHD. Semin Immunopathol. 2008; 30(4): 439–56. DOI: 10.1007/s00281-008-0131-6.
51. Beilhack A., Schulz S., Baker J. et al. In vivo analyses of early events in acute graft-versus-host disease reveal sequential infiltration of T-cell subsets. Blood. 2005; 106(3): 1113–22. DOI: 10.1182/blood-2005-02-0509.
52. Wysocki C.A., Panoskaltsis-Mortari A., Blazar B.R., Serody J.S. Leukocyte migration and graft-versus-host disease. Blood. 2005; 105(11): 4191–99. DOI: 10.1182/blood-2004-12-4726.
53. Дроков М.Ю., Паровичникова Е.Н., Кузьмина Л.А. и др. Трансплантация аллогенного костного мозга без проведения предтрансплантационного кондиционирования с использованием циклофосфамида и мезенхимальных стромальных клеток в качестве индукции толерантности. Гематол трансфузиол. 2014; 59(1): 42–6.
54. Luznik L., O‘Donnell P.V., Symons H.J. et al. HLA-haploidentical bone marrow transplantation for hematologic malignancies using nonmyeloablative conditioning and high-dose, posttransplantation cyclophosphamide. Biol Blood Marrow Transplant. 2008; 14(6): 641–50. DOI: 10.1016/j.bbmt.2008.03.005.
55. Cieri N., Peccatori J., Oliveiera G. et al. Tracking T cell dynamics in the first month after haploidentical HSCT with post-transplant cyclophosphamide reveals a predominant contribution of memory stem T cells to the early phase of immune reconstitution. Blood. 2013; 122(21): 4615. DOI: 10.1182/blood.V122.21.4615.4615.
56. Al-Homsi A.S., Roy T.S., Cole K. et al. Post-Transplant High-Dose Cyclophosphamide for the Prevention of Graft-versus-Host Disease. Biol Blood Marrow Transplant. 2015; 21(4): 604–11. DOI: 10.1016/j.bbmt.2014.08.014.
57. Servais S., Menten-Dedoyart C., Beguin Y. et al. Impact of Pre-Transplant Anti-T Cell Globulin (ATG) on Immune Recovery after Myeloablative Allogeneic Peripheral Blood Stem Cell Transplantation. PLoS One. 2015; 10(6): e0130026. DOI: 10.1371/journal.pone.0130026.
58. Storek J., Mohty M., Boelens J.J. Rabbit anti-T cell globulin in allogeneic hematopoietic cell transplantation. Biol Blood Marrow Transplant. 2015; 21(6): 959–70. DOI: 10.1016/j.bbmt.2014.11.676.
59. Retière C., Willem C., Guillaume T. et al. Impact on early outcomes and immune reconstitution of high-dose post-transplant cyclophosphamide vs anti-thymocyte globulin after reduced intensity conditioning peripheral blood stem cell allogeneic transplantation. Oncotarget. 2018; 9(14): 11451–64. DOI: 10.18632/oncotarget.24328.
60. Bosch M., Dhadda M., Hoegh-Petersen M. et al. Immune reconstitution after anti-thymocyte globulin-conditioned hematopoietic cell transplantation. Cytotherapy. 2012; 14(10): 1258–75. DOI: 10.3109/14653249.2012.715243.
61. Battipaglia G., Labopin M., Kröger N. et al. Posttransplant cyclophosphamide vs antithymocyte globulin in HLA-mismatched unrelated donor transplantation. Blood. 2019; 134(11): 892–9. DOI: 10.1182/blood.2019000487.
62. Nykolyszyn C., Granata A., Pagliardini T. et al. Posttransplantation cyclophosphamide vs antithymocyte globulin as GVHD prophylaxis for mismatched unrelated hematopoietic stem cell transplantation. Bone Marrow Transplant. 2019. DOI: 10.1038/s41409-019-0682-2.
63. Pagliardini T., Harbi S., Fürst S. et al. Post-transplantation cyclophosphamidebased haploidentical versus Atg-based unrelated donor allogeneic stem cell transplantation for patients younger than 60 years with hematological malignancies: a single-center experience of 209 patients. Bone Marrow Transplant. 2019; 54(7): 1067–76. DOI: 10.1038/s41409-018-0387-y.
64. Fløisand Y., Lundin K.E.A., Lazarevic V. et al. Targeting Integrin α4β7 in Steroid-Refractory Intestinal Graft-versus-Host Disease. Biol Blood Marrow Transplant. 2017; 23(1): 172–5. DOI: 10.1016/j.bbmt.2016.10.009.
65. Wherry E.J., Teichgräber V., Becker T.C. et al. Lineage relationship and protective immunity of memory CD8 T cell subsets. Nat Immunol. 2003; 4(3): 225–34. DOI: 10.1038/ni889.
66. Graef P., Buchholz V.R., Stemberger C. et al. Serial transfer of single-cellderived immunocompetence reveals stemness of CD8(+) central memory T cells. Immunity. 2014; 41(1): 116–26. DOI: 10.1016/j.immuni.2014.05.018.
67. Gattinoni L. Memory T cells officially join the stem cell club. Immunity. 2014; 41(1): 7–9. DOI: 10.1016/j.immuni.2014.07.003.
68. Huang W., Mo W., Jiang J. et al. Donor Allospecific CD44high Central Memory T Cells Have Decreased Ability to Mediate Graft-vs.-Host Disease. Front Immunol. 2019; 10: 624. DOI: 10.3389/fimmu.2019.00624.
69. Масчан М.А. Деплеция альфа/бета-Т-лимфоцитов — надежная платформа для развития трансплантации гемопоэтических стволовых клеток от гаплоидентичных доноров. Рос. журн. детской гематол. онкол. 2015; 2(3): 34–8.
70. Lamb L.S. Jr, Henslee-Downey P.J., Parrish R.S. et al. Increased frequency of TCR gamma delta + T cells in disease-free survivors following T cell-depleted, partially mismatched, related donor bone marrow transplantation for leukemia. J Hematother. 1996; 5(5): 503–9. DOI: 10.1089/scd.1.1996.5.503.
71. Saad A., Lamb L. Ex vivo T-cell depletion in allogeneic hematopoietic stem cell transplant: past, present and future. Bone marrow transplantation 2017; 52(9): 1241–8. DOI: 10.1038/bmt.2017.22.
72. Weinberg K., Blazar B.R., Wagner J.E. et al. Factors affecting thymic function after allogeneic hematopoietic stem cell transplantation. Blood. 2001; 97(5): 1458–66. DOI: 10.1182/blood.v97.5.1458.
73. Jiménez M., Martínez C., Ercilla G. et al. Clinical factors influencing T-cell receptor excision circle (TRECs) counts following allogeneic stem cell transplantation in adults. Transpl Immunol. 2006; 16(1): 52–9. DOI: 10.1016/j.trim.2006.02.006.
74. Castermans E., Hannon M., Dutrieux J. et al. Thymic recovery after allogeneic hematopoietic cell transplantation with non-myeloablative conditioning is limited to patients younger than 60 years of age. Haematologica. 2011; 96(2): 298–306. DOI: 10.3324/haematol.2010.029702.
75. Chung B., Barbara-Burnham L., Barsky L., Weinberg K. Radiosensitivity of thymic interleukin-7 production and thymopoiesis after bone marrow transplantation. Blood. 2001; 98(5): 1601–6. DOI: 10.1182/blood.v98.5.1601.
76. Fletcher A.L., Lowen T.E., Sakkal S. et al. Ablation and regeneration of tolerance-inducing medullary thymic epithelial cells after cyclosporine, cyclophosphamide, and dexamethasone treatment. J Immunol. 2009; 183(2): 823–31. DOI: 10.4049/jimmunol.0900225.
77. MacVittie T.J., Bennett A.W., Cohen M.V. et al. Immune cell reconstitution after exposure to potentially lethal doses of radiation in the nonhuman primate. Health Phys. 2014; 106(1): 84–96. DOI: 10.1097/HP.0b013e3182a2a9b2.
78. Mackall C.L., Fleisher T.A., Brown M.R. et al. Distinctions between CD8+ and CD4+ T-cell regenerative pathways result in prolonged T-cell subset imbalance after intensive chemotherapy. Blood. 1997; 89(10): 3700–7.
79. Turner B.E., Collin M., Rice A.M. Reduced intensity conditioning for hematopoietic stem cell transplantation: has it achieved all it set out to? Cytotherapy. 2010; 12(4): 440–54. DOI: 10.3109/14653241003709678.
80. Jiménez M., Ercilla G., Martínez C. Immune reconstitution after allogeneic stem cell transplantation with reduced-intensity conditioning regimens. Leukemia. 2007; 21(8): 1628–37. DOI: 10.1038/sj.leu.2404681.
81. Jiménez M., Martínez C., Ercilla G. et al. Reduced-intensity conditioning regimen preserves thymic function in the early period after hematopoietic stem cell transplantation. Exp Hematol. 2005; 33(10): 1240–8. DOI: 10.1016/j.exphem.2005.06.016.
82. Bahceci E., Epperson D., Douek D.C. et al. Early reconstitution of the T-cell repertoire after non-myeloablative peripheral blood stem cell transplantation is from post-thymic T-cell expansion and is unaffected by graft-versus-host disease or mixed chimaerism. Br J Haematol. 2003; 122(6): 934–43. DOI: 10.1046/j.13652141.2003.04522.x.
83. Small T.N., Papadopoulos E.B., Boulad F. et al. Comparison of immune reconstitution after unrelated and related T-cell-depleted bone marrow transplantation: effect of patient age and donor leukocyte infusions. Blood. 1999; 93(2): 467–80.
Комитет по здравоохранению Санкт-Петербурга | Новости
В Городской больнице №40 начали проводить исследование клеточного иммунитета при COVID-19
20 мая 2021
У большинства людей, столкнувшихся с коронавирусной инфекцией SARS-CoV-2, спустя 14 суток от момента контакта обнаруживаются специфические антитела к данному вирусу. Такой ответ на инфекцию ученые называют гуморальным иммунным ответом.
Однако известно, что не менее важную роль в защите от вирусных инфекций играет клеточный иммунитет, опосредуемый клетками иммунной системы, прежде всего Т-лимфоцитами. В ряде случаев эти клетки способны элиминировать вирус без помощи антител. Предполагается, что такая ситуация может возникнуть, например, при контакте человека с низкой дозой возбудителя: Т-клетки уничтожают вирус без значимой активации антителообразования. В этом случае уровень выработавшихся антител может не определяться обычными тест-системами.
Предполагается, что невосприимчивость некоторых людей к SARS-CoV-2 может быть обусловлена тем, что Т-лимфоциты данных пациентов перекрестно активированы предыдущими контактами с циркулирующими в популяции «простудными» коронавирусами, то есть у них имеется долговременная иммунная память.
Такая память Т-клеток при повторном воздействии вируса может остановить развитие тяжелого заболевания. По данным ряда исследований, у 93% людей, встречавшихся с вирусом SARS-CoV-2, формируется устойчивый Т-клеточный ответ. При этом антитела к коронарирусу были обнаружены только у 60% из них.
«Исследование только гуморального звена иммунитета не может дать полноценной картины иммунного статуса человека, — говорит Ольга Шнейдер, руководитель научно-исследовательского отдела инновационных и конверсионных программ Городской больницы №40. — С целью комплексной оценки иммунного ответа совместно с тестами на оценку уровня антител имеет смысл определять Т-клетки, специфично отвечающие на антигены вируса SARS-CoV-2. В нашем арсенале появилась тест-система, специально предназначенная для выявления в крови Т-лимфоцитов, которые реагируют на коронавирус. Она позволяет измерить силу иммунного ответа на инфекцию».
Внедрённая методика будет использована прежде всего в научных исследованиях. Первыми пациентами, сдавшими кровь для оценки Т-клеточного иммунитета, стали врачи Городской больницы №40, ранее переболевшие COVID-19.
Значимость клеточного звена иммунной системы в обеспечении эффективности заместительной терапии у больных общевариабельной иммунной недостаточностью | Сизякина
1. Хаитов Р.М., Пинегин Б.В., Ярилин А.А. Руководство по клинической иммунологии. Диагностика заболеваний иммунной системы: руководство для врачей. М.: ГЭОТАР-Медиа, 2009. 352 с.
2. Ameratunga R., Woon S.T., Gillis D., Koopmans W., Steele R. New diagnostic criteria for common variable immune deficiency (CVID), which may assist with decisions to treat with intravenous or subcutaneous immunoglobulin. Clin. Exp. Immunol., 2013, Vol. 174, no. 2, pp. 203-211.
3. Baumann U., Miescher S., Vonarburg C. Immunoglobulin replacement therapy in antibody deficiency syndromes: are we really doing enough? Clin. Exp. Immunol., 2014, no. 178, pp. 83-85.
4. Edwards E.S.J., Bosco J.J., Aui P.M., Stirling R.G., Cameron P.U., Chatelier J., Hore-Lacy F., O’Hehir R.E., van Zelm M.C. Predominantly antibody-deficient patients with non-infectious complications have reduced naive B, Treg, Th27, and Tfh27 сells. Front. Immunol., 2019, no. 10, 2593. doi: 10.3389/fimmu.2019.02593.
5. Gathmann B., Binder N., Ehl S., Kindle G. The European internet-based patient and research database for primary immunodeficiencies. ESID Registry Working Party. Clin. Exp. Immunol., 2012, Vol. 167, no. 3, pp. 479-491.
6. Li R., Zheng Y. Common variable immunodeficiency with genetic defects identified by whole exome sequencing. BioMed Res. Int., 2018, 3724630. doi: 10.1155/2018/3724630.
7. Quinti I., Soresina A., Guerra A., Rondelli R., Spadaro G., Agostini C., Milito C., Trombetta A.C., Visentini M., Martini H., Plebani A., Fiorilli M. Effectiveness of immunoglobulin replacement therapy on clinical outcome in patients with primary antibody deficiencies: results from a multicenter prospective cohort study. J. Clin. Immunol., 2011, Vol. 31, no. 3, pp. 315-322.
8. Tangye S.G., Al-Herz W., Bousfiha A., Chatila T., Cunningham-Rundles C., Etzioni A., Franco J.L., Holland S.M., Klein C., Morio T., Ochs H.D., Oksenhendler E., Picard C., Puck J., Torgerson T.R., Casanova J.L., Sullivan K.E. Human inborn errors of immunity: 2019 update on the classification from the International Union of Immunological Societies Expert Committee. J. Clin. Immunol., 2020, Vol. 40, pp. 24-64.
9. Shillitoe B., Gennery A. X-Linked agammaglobulinaemia: outcomes in the modern era. Clin. Immunol., 2017, Vol. 183, pp. 54-62.
10. Sizyakina L., Andreeva I., Antonova E., Kharitonova M. Effect of replacement therapy on the Т-cell function in patients with primary agammaglobulinemia. J. Clin. Immunol., 2014, Vol. 34, pp. 696-747.
Иммунологические показатели
Функционально активна только генетически стабильная клетка, то есть клетка с неповрежденной, способной к репарации ДНК, что нарушено при злокачественных опухолях, лучевой и химиотерапии. Накопление повреждений коррелирует с изменением лабораторных показателей. Состояние иммунитета оценивают комплексом показателей: неспецифическую резистентность определяют по содержанию в сыворотке крови комплемента, лизоцима, ИФН, фагоцитарной способности макрофагов и цитотоксической активности NK-клеток. Состояние иммунной системы определяют по уровню иммуноглобулинов (IgM, IgG, IgA) и цитокинов в сыворотке крови, содержанию субполяций Т-лимфоцитов (клеточное звено иммунитета) и В-лимфоцитов, их способности отвечать на антигены и митогены (гуморальное звено иммунитета).
Недостаточность гуморального иммунитета сопровождается снижением уровня сывороточных иммуноглобулинов. Сегодня нижняя граница нормы для Ig M – 0,4 г/л, IgG – 5 г/л, Ig A – 0,5 г/л [14]. При более низких показателях дополнительно производят оценку продукции антител к белковым и полисахаридным антигенам. Для подсчета Т- и В-лимфоцитов используют моноклональные антитела к мембранным маркерам лимфоцитов. В норме в 1 мкл содержится: лимфоцитов – 1250-2500, Т-лимфоцитов – 1000-2000 (55-75%), В-лимфоцитов – 100-300 (10-15%). Для оценки функций лимфоцитов применяют стимулирующие фитогемагглютинин, конкавалин А и митоген лаконоса. Способность к пролиферации оценивают с помощью меченного радиоактивными изотопами тимидина, включающегося в ДНК клетки. Продукция цитокинов также указывает на функциональные возможности Т-лимфоцитов. Клинические проявления снижения гуморального иммунитета и недостаточность комплимента похожи. Для исследования комплимента оценивают его гемолитическую активность и определяют количество его компонентов. Определяют бактериальную активность фагоцитов, их способность к хемотаксису и восстановлению.
Иммунологическое обследование показано при хронических, частых или оппортунистических инфекциях и, несомненно, при проведении химиотерапии [48]. Клиническая картина (постоянно рецидивирующая вирусная или грибковая инфекции) может свидетельствовать о вторичном иммунодефиците и явиться основанием для проведения иммунологического обследования [15]. Так как иммунная система работает по принципу весов, то есть под влиянием иммуномодулятора в той или иной степени изменяется функциональная активность всей системы в целом, весьма целесообразен иммунологический мониторинг во время всего курса лечения [16].
Кроме того, эффект иммунной терапии in vitro может абсолютно не соответствовать эффекту in vivo, а также клинический эффект может иметь место при сохраняющемся дефекте иммунитета. Поэтому ценность мониторинга для оптимальной терапии несомненно высока. А без предварительного иммунологического обследования, на основании клинической картины хронического воспалительного процесса можно назначать только иммунные препараты, действующие на фагоцитарное звено [17].
Тщательно собранный анамнез и физикальное обследование, общий анализ крови и определение сывороточной концентрации Ig M, IgG, Ig A, IgD и IgE позволяют достаточно быстро установить причину иммунодефицита у 95% пациентов [14]. Более сложные методы, используемые за рубежом только в специализированных центрах, в России включаются в рутинное обследование, например, индекс стимуляции митогенами (моноклональные антитела, фитогемагглютинин, конкавалин А).
Мещерякова Н.Г.
СОСТОЯНИЕ КЛЕТОЧНОГО И ГУМОРАЛЬНОГО ИММУНИТЕТА В ЗАВИСИМОСТИ ОТ ИСХОДА РАСПРОСТРАНЕННОГО ГНОЙНОГО ПЕРИТОНИТА | Савченко
1. Борисов А.Г. Клиническая характеристика нарушения функции иммунной системы // Медицинская иммунология. 2013. Т. 15, No 1. С. 45–50. [Borisov A.G. Clinical characteristics of dysfunction of the immune system. Meditsinskaya immunologiya = Medical Immunology (Russia), 2013, vol. 15, no. 1, pp. 45–50. (In Russ.)]
2. Земсков А.М., Земсков В.М. Дополнительные методы оценки иммунного статуса // Клиническая лабораторная диагностика. 1994. No 3. С. 34–35. [Zemskov A.M., Zemskov V.M. Additional methods for assessing of the immune status. Klinicheskaya laboratornaya diagnostika = Clinical Laboratory Diagnostics, 1994, no. 3, pp. 34–35. (In Russ.)]
3. Савельев В.С., Филимонов М.И., Гельфанд Б.Р., Подачин П.В., Бурневич С.З., Гиткович В.Е., Гайнулин Ш.М. Программируемый перитонеальный лаваж в лечении распространенного перитонита // Анналы хирургии. 1996. No 3. С. 25–29 [Savel’ev V.S., Filimonov M.I., Gel’fand B.R., Podachin P.V., Burnevich S.Z., Gitkovich V.E., Gajnulin S.M. Programmable peritoneal lavage in the treatment of widespread peritonitis. Annaly khirurgii = Annals of Surgery, 1996, no. 3, pp. 25–29. (In Russ.)]
4. Савченко А.А., Здзитовецкий Д.Э., Борисов А.Г., Лузан Н.А. Особенности состояния клеточного и гуморального иммунитета и уровни концентрации цитокинов у больных с распространенным гнойным перитонитом // Сибирское медицинское обозрение. 2013. No 1 (79). С. 24–28. [Savchenko A.A., Zdzitoveckij D.E., Borisov A.G., Luzan N.A. Features of the cellular and humoral immunity state and cytokine concentrations in patients with widespread purulent peritonitis. Sibirskoe meditsinskoe obozrenie = Siberian Medical Review, 2013, no. 1 (79), pp. 24–28. (In Russ.)]
5. Сарап П.В., Винник Ю.С., Останин А.А. Влияние иммунотропной терапии на структуру системообразующих показателей у пациентов с ургентной хирургической патологией // Вестник хирургии им. И.И. Грекова. 2012. Т. 171, No 4. С. 39–43. [Sarap P.V., Vinnik Ju.S., Ostanin A.A. Immunotropic influence on the structure of the backbone of therapy parameters in patients with urgent surgical pathology. Vestnik khirurgii im. I.I. Grekova = Herald of Surgery named after I.I. Grekov, 2012, vol. 171, no. 4, pp. 39–43. (In Russ.)]
6. Суковатых Б.С., Блинков Ю.Ю., Букреева А.Е., Ештокин С.А., Иванов П.А., Жуковский В.А. Применение иммобилизованных форм гипохлорита натрия в комплексном лечении распространенного гнойного перитонита // Вестник хирургии им. И.И. Грекова. 2011. Т. 170, No 6. С. 32–36. [Sukovatyh B.S., Blinkov Ju.Ju., Bukreeva A.E., Eshtokin S.A., Ivanov P.A., Zhukovskij V.A. The use of immobilized forms of sodium hypochlorite in the complex treatment of widespread purulent peritonitis. Vestnik khirurgii im. I.I. Grekova = Herald of Surgery named after I.I. Grekov, 2011, vol. 170, no. 6, pp. 32–36. (In Russ.)]
7. Хайдуков С.В., Байдун Л.А., Зурочка А.В., Тотолян Арег А. Стандартизованная технология «Исследование субпопуляционного состава лимфоцитов периферической крови с применением проточных цитофлюориметрованализаторов» (Проект) // Медицинская иммунология. 2012. Т. 14, No 3. С. 255–268. [Hajdukov S.V., Bajdun L.A., Zurochka A.V., Totoljan Areg A. Standardized technology «Research of lymphocytes subpopulation composition in peripheral blood using flow cytometry analyzers» (Draft). Meditsinskaya immunologiya = Medical Immunology (Russia), 2012, vol. 14, no. 3, pp. 255–268. (In Russ.)]
8. Ярилин А.А. Иммунология. М: ГЭОТАР-Медиа, 2010. 752 с. [Jarilin A.A. Immunologiya [Immunology]. Moscow: GEOTARMedia, 2010. 752 p.]
9. Amezcua Vesely M.C., Schwartz M., Bermejo D.A., Montes C.L., Cautivo K.M., Kalergis A.M., Rawlings D.J., AcostaRodríguez E.V., Gruppi A. FcγRIIb and BAFF differentially regulate peritoneal B1 cell survival. J. Immunol., 2012, vol. 188, no. 10, pp. 4792–4800.
10. Bone R.S., Balk R.A.B., Cerra F.B. American college of Chest Physicians. Society of Critical Care Medicine Consensus Conference: Definitions for sepsis and organ failure and guide lines for the use of innovative therapies in sepsis. Crit. Care Med., 1992, vol. 20, no. 6, pp. 864–874.
11. Carter C.R., Aravind G., Smalle N.L., Cole J.Y., Savic S., Wood P.M. CVID patients with autoimmunity have elevated T cell expression of granzyme B and HLA-DR and reduced levels of Treg cells. J. Clin. Pathol., 2013, vol. 66, no. 2, pp. 146–150.
12. Griffin D.O., Rothstein T.L. Human B1 cell frequency: isolation and analysis of human B1 cells. Front. Immunol., 2012, vol. 3, pp. 122–123.
13. Griveas I., Fleva A., Karanikas E., Gogos K., Sakellariou G. CD4/CD8 T-cell ratio in peritoneal dialysis effluents predicts the outcome of peritonitis in patients undergoing continuous ambulatory peritoneal dialysis. Artif. Organs., 2009, vol. 33, no. 12, pp. 1091–1095.
14. Harris N., Gause W.C. To B or not to B: B cells and the Th3-type immune response to helminthes. Trends Immunol., 2011, vol. 32, no. 2, pp. 80–88.
15. KiankC.,EntleutnerM.,FürllB.,WesterholtA.,HeideckeC.D.,SchüttC.Stress-inducedimmuneconditioningaffectsthecourse of experimental peritonitis. Shock, 2007, vol. 27, no. 3, pp. 305–311.
16. Kleinnijenhuis J., Quintin J., Preijers F., Joosten L.A., Jacobs C., Xavier R.J., Van Der Meer J.W., Van Crevel R., Netea M.G. BCG-induced trained immunity in NK cells: role for non-specific protection to infection. Clin. Immunol., 2014, vol. 155, no. 2, pp. 213–219.
17. Le Gall J.-R., Lemeshow S., Saulnier F. A new simplified acute physiology score (SAPS II) based on a European/North American multicenter study. JAMA, 1993, vol. 270, pp. 2957–2963.
18. Lertworapreecha M., Patumraj S., Niruthisard S., Hansasuta P., Bhattarakosol P. Cytotoxic function of gamma delta (gamma/ delta) T cells against pamidronate-treated cervical cancer cells. Indian J. Exp. Biol., 2013, vol. 51, no. 8, pp. 597–605.
19. Linder M.M., Wacha H., Feldmann U., Wesch G., Streifensand R.A., Gundlach E. Der Mannheimer Peritonitis-Index. Ein Instrument zur intraoperativen Prognose der Peritonitis. Chirurg, 1987, no. 58, pp. 84–91.
20. Luider J., Cyfra M., Johnson P., Auer I. Impact of the new Beckman Coulter Cytomics FC 500 5-color flow cytometer on a regional flow cytometry clinical laboratory service. Lab. Hematol., 2004, vol. 10, pp. 102–108.
21. Maecker H., McCoy P., Nussenblatt R. Standardizing immunophenotyping for the human immunology project. Nat. Rev. Immunol., 2012, vol. 12, pp. 191–200.
22. MarçaisA.,WalzerT.mTOR:agatetoNKcellmaturationandactivation.CellCycle,2014,vol.13,no.21,pp.3315–3316.
23. McKee S.J., Mattarollo S.R., Leggatt G.R. Immunosuppressive roles of natural killer T (NKT) cells in the skin. J. Leukoc. Biol., 2014, vol. 96, no. 1, pp. 49–54.
24. 24. PillaiM.R.,BixM.EvolutionofIL4andpathogenantagonism.GrowthFactors,2011,vol.29,no.4,pp.153–160.
25. SistaF.,SchietromaM.,SantisG.D.,MatteiA.,CeciliaE.M.,PiccioneF.,LeardiS.,CarleiF.,AmicucciG.Systemicinflammation and immune response after laparotomy vs laparoscopy in patients with acute cholecystitis, complicated by peritonitis. World J. Gastrointest. Surg., 2013, vol. 5, no. 4, pp. 73–82.
26. Terabe M., Berzofsky J.A. The immunoregulatory role of type I and type II NKT cells in cancer and other diseases. Cancer Immunol. Immunother., 2014, vol. 63, no. 3, pp. 199–213.
27. VasudevA.,YingC.T.,AyyadhuryS.,PuanK.J.,AndiappanA.K.,NyuntM.S.,ShadanN.B.,MustafaS.,LowI.,RotzschkeO., Fulop T., Ng T.P., Larbi A. γ/δ T cell subsets in human aging using the classical α/β T cell model. J. Leukoc. Biol., 2014, vol. 96, no. 4, pp. 647–655.
28. VincentJ.L.,MorenoR.,TakalaJ.,WillattsS.,DeMendonçaA.,BruiningH.,ReinhartC.K.,SuterP.M.,ThijsL.G.TheSOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the Working Group on SepsisRelated Problems of the European Society of Intensive Care Medicine. Intensive Care Med., 1996, vol. 22, no. 7, pp. 707–710.
29. WiestR.,KragA.,GerbesA.Spontaneousbacterialperitonitis:recentguidelinesandbeyond.Gut,2012,vol.61,no.2,pp.297–310.
Определение Т-клеток, специфически отвечающих на антигены вируса SARS-CoV-2. Оценка Т-клеточного иммунного ответа.
Т-клетки играют основную роль в обеспечении клеточного иммунитета. Их функцией является уничтожение вируса и формирование клеточной памяти. Память Т-клеток во время повторного воздействия может остановить развитие тяжелого заболевания. По данным исследований1 у 93% людей, которые встречались с вирусом SARS-CoV-2, формировался устойчивый Т-клеточный ответ, несмотря на то что антитела были обнаружены только у 60% из них. Исследование только гуморального звена иммунитета (определение у крови антител) не может дать полноценной картины иммунного статуса человека. С целью комплексной оценки иммунного ответа, совместно с тестами на оценку уровня антител, следует определять Т клетки, специфично отвечающие на антигены вируса SARS-CoV-2. Это можно сделать с помощью набора ТиграТест® SARS-CoV-2, разработанного компанией АО «ГЕНЕРИУМ».
Набор «ТиграТест® SARS-CoV-2» предназначен для лабораторной оценки Т-клеточного иммунного ответа в отношении вируса SARS-CoV-2.
В основе исследования лежит метод ELISPOT.
- ELISPOT — проверенная технология обнаружения активных Т-клеток для измерения силы иммунного ответа на инфекцию
- Платформа ELISPOT доказала свою эффективность для диагностики туберкулезной инфекции не зависимо от иммунного статуса человека
- ELISPOT широко используется исследователями разных стран при разработке вакцин от COVID-19
- ELISPOT является наиболее перспективной платформой среди методов оценки Т-клеточного иммунного ответа
Набор не является изделием медицинского назначения, получаемая информация предназначена строго
для исследовательских целей.
По вопросам проведения тестов организована «горячая линия».
тел.: 8 (495) 988-47-94
*7105 – по техническим характеристикам и методическим особенностям тест-системы
*7179 – по вопросам приобретения тест-системы
*7177 — по вопросам диагностической значимости тест-системы
E-mail: [email protected]
Где сделать тест:
1. Sekine T et al. Robust T Cell Immunity in Convalescent Individuals with Asymptomatic or Mild COVID-19. Cell. 2020 Oct 1;183(1):158-168.e14. doi: 10.1016/j.cell.2020.08.017.
Клеточный иммунитет — обзор
Клеточный иммунитет
Клеточный иммунитет (CMI), определяемый с помощью реакции гиперчувствительности замедленного типа (реакция DH), является одним из старейших объектов исследования в области иммунологии. При правильном использовании этот термин охватывает ряд явлений, которые имеют следующие общие характеристики. Антиген в форме чужеродных или измененных собственных клеток специфически распознается Т-лимфоцитами. Антиген может быть в форме привитых чужеродных клеток, химически модифицированных клеток-хозяев (например, при нанесении на кожу сенсибилизирующего химического вещества) или клеток-хозяев, инфицированных внутриклеточным вирусом, бактерией или простейшими.Чужеродные антигенные детерминанты в сочетании с аутоантигенами, кодируемыми в главном комплексе гистосовместимости (MHC), распознаются определенными Т-клетками, которые затем стимулируются к пролиферации. Одна подгруппа популяции Т-клеток, распознающая продукты HLA-A, B и C MHC, непосредственно вызывает необратимые литические изменения в антигенной клетке-мишени (цитотоксические T-клетки). Другая подгруппа, распознающая продукты HLA-DR MHC, отвечает на антиген высвобождением медиаторов, которые привлекают и активируют другие клетки (Т-клетки гиперчувствительности замедленного типа).Именно сигналы этих клеток приводят к накоплению макрофагов в месте реакции. Между Т-клетками и макрофагами существует двустороннее взаимодействие, оба из которых производят растворимые сигналы (интерлейкины), которые активируют друг друга. После этого активированные макрофаги могут убить клетки-мишени, которые спровоцировали реакцию. Накопление макрофагов, эозинофилов и базофилов и медиаторов воспаления, которые они впоследствии высвобождают, увеличивает проницаемость сосудов и вызывает локальное воспаление, характерное для реакции гиперчувствительности замедленного типа.
Экспериментальные реакции DH, которые можно визуализировать и количественно оценить, являются вторичными ответами на антигены, с которыми ранее сталкивался хозяин, и относительно легко выполнить такие тесты на онкологических больных. Используются антигены, воздействию которых большинство пациентов подвергается естественным образом (например, очищенное производное белка (PPD), эпидемический паротит, кандидоз), а также агенты, повышающие контактную чувствительность, такие как динитрохлорбензол (DNCB). В дополнение к кожным тестам DH, пролиферативная реакция лимфоцитов периферической крови на антиген и, чаще, поликлональные митогены, такие как фитогемагглютинин (PHA), стала рассматриваться как тест на CMI, хотя взаимосвязь между митогенными ответами и CMI, как описано выше, является строго не определено.На основе таких тестов большое количество исследований сообщало о дефектных CMI у онкологических больных (Catalona et al ., 1973; Dalbow et al ., 1977; Israel, 1976; Kopersztych et al ., 1976; Lichtenstein et al ., 1980; Adler et al ., 1980) и была отмечена корреляция между стадией заболевания, плохим прогнозом и дефектным CMI (Adler et al ., 1980; Barnes et al ., 1975; Дэлбоу и др. ., 1977; Хан и Такита, 1972; Болтон и др. ., 1976; Liberati и др. , 1982). Вопрос о том, имеют ли такие тесты значительную клиническую или прогностическую ценность, по сравнению с уже хорошо известными тестами клинического статуса и степени заболевания (Liberati et al ., 1982; Barg et al ., 1981).
Исследования такого рода, конечно, не позволяют измерить специфический противоопухолевый иммунитет. Многие лаборатории утверждают, что измеряют опухолеспецифический CMI у онкологических больных в ответ на различные экстракты опухолевой ткани (Hollinshead et al ., 1974; Стюарт и Оризага, 1971; Vose et al. ., 1977; Sega и др. ., 1980). Однако трудно поместить эти демонстрации специфических CMI в количественный контекст, и их ценность в настоящее время ограничена отсутствием четко определенных опухолеспецифических антигенов у человека.
У пациентов как с лимфопролиферативными, так и с солидными опухолями, безусловно, наблюдается общая депрессия клеточно-опосредованной иммунной реактивности, которая становится более очевидной по мере прогрессирования заболевания.Кажется маловероятным, что дефектный иммунитет такого типа предшествует (и, следовательно, предрасполагает) к неопластическим заболеваниям (за исключением особых случаев; например, саркома Капоши), а скорее то, что прогрессирующие опухоли оказывают подавляющее действие на иммунную систему. Механизмы, с помощью которых они могут это сделать, рассматриваются в разделе, начинающемся на стр. 303. Подробные обзоры дефектных CMI при раке см. Hersh et al. . (1974), Burdick и др. . (1975) и Натансон (1977).
Т-клетки и клеточный иммунитет
Цитотоксические Т-лимфоциты и поверхности слизистой оболочки
В лимфатической системе находятся большие популяции иммунных клеток, которые высвобождаются при обнаружении патогена.
Цели обучения
Опишите особенности лимфатической системы, связанные с иммунным ответом.
Ключевые выводы
Ключевые моменты
- Лимфатическая система содержит лимфу: жидкость, которая омывает ткани и органы и содержит лейкоциты (не эритроциты).
- После созревания В- и Т-клеток большинство из них попадает в лимфатическую систему, где они хранятся в лимфатических узлах до тех пор, пока они не понадобятся.
- Лимфатические узлы также хранят дендритные клетки и макрофаги; поскольку антигены фильтруются через лимфатическую систему, эти клетки собирают их, чтобы представить B- и T-клеткам.
- Селезенка, которая является кровью, чем лимфатические узлы для лимфы, фильтрует инородные вещества и патогенные микроорганизмы в комплексе с антителами из крови.
Ключевые термины
- лимфа : бесцветная водянистая жидкость организма, переносимая лимфатической системой, состоящая в основном из лейкоцитов
Лимфатическая система
Лимфа, водянистая жидкость, омывающая ткани и органы, содержит защитные лейкоциты, но не содержит эритроцитов (красных кровяных телец).Лимфа перемещается по телу через лимфатическую систему, которая состоит из сосудов, лимфатических протоков, лимфатических узлов и органов, таких как миндалины, аденоиды, тимус и селезенка. Хотя иммунная система характеризуется циркулирующими клетками по всему телу, регуляция, созревание и взаимодействие иммунных факторов происходят в определенных местах, известных как лимфатические узлы.
Кровь обеспечивает циркуляцию иммунных клеток, белков и других факторов в организме. Примерно 0,1 процента всех клеток крови составляют лейкоциты, в том числе моноциты (предшественники макрофагов) и лимфоциты.Большинство клеток крови — это эритроциты. Клетки иммунной системы могут перемещаться между отдельными лимфатической и кровеносной системами кровообращения, которые разделены интерстициальным пространством, посредством процесса, называемого экстравазацией (прохождение через окружающие ткани).
Напомним, что клетки иммунной системы происходят из стволовых клеток костного мозга. Созревание В-клеток происходит в костном мозге, тогда как клетки-предшественники мигрируют из костного мозга, развиваются и созревают в наивные Т-клетки в органе, называемом тимусом.По мере созревания Т- и В-лимфоциты циркулируют по разным направлениям. В лимфатических узлах, разбросанных по всему телу, находятся большие популяции Т- и В-клеток, дендритных клеток и макрофагов. Лимфа собирает антигены по мере оттока из тканей. Эти антигены фильтруются через лимфатические узлы, прежде чем лимфа возвращается в кровоток. Антигенпрезентирующие клетки (APC) в лимфатических узлах захватывают и обрабатывают антигены, информируя соседние лимфоциты о потенциальных патогенах.
Лимфатическая система : (a) Лимфатические сосуды переносят прозрачную жидкость, называемую лимфой, по всему телу.Жидкость проходит через (b) лимфатические узлы, которые фильтруют лимфу, которая входит в узел через афферентные сосуды, а выходит через эфферентные сосуды. Лимфатические узлы заполнены лимфоцитами, которые очищают инфицированные клетки.
В селезенке находятся В- и Т-клетки, макрофаги, дендритные клетки и NK-клетки. Селезенка также является местом, где APC, захватившие инородные частицы в крови, могут связываться с лимфоцитами. Антитела синтезируются и секретируются активированными плазматическими клетками в селезенке, которые фильтруют чужеродные вещества и патогенные микроорганизмы в комплексе с антителами из крови.Функционально селезенка относится к крови так же, как лимфатические узлы к лимфе.
Селезенка в лимфатической системе : Селезенка иммунологически фильтрует кровь и обеспечивает связь между клетками, соответствующими врожденным и адаптивным иммунным ответам.
Классы Т-клеток
Т-клетки играют центральную роль в клеточно-опосредованном иммунном ответе за счет использования поверхностного Т-клеточного рецептора для распознавания пептидных антигенов.
Цели обучения
Различают: наивные, эффекторные (хелперные и цитотоксические), Т-клетки памяти и регуляторные Т-клетки
Ключевые выводы
Ключевые моменты
- Предшественники Т-клеток происходят из костного мозга, но перемещаются в тимус, где созревают.
- Т-клетки можно разделить на три основных подтипа: эффекторные, клетки памяти и регуляторные клетки. Каждый тип выполняет определенную функцию во время иммунного ответа на чужеродные антигены. Подтипы
- Т-клеток дифференцируются по экспрессии уникальных маркеров клеточной поверхности, таких как CD4 для хелперных Т-клеток и CD8 для цитолитических или цитотоксических Т-клеток.
Ключевые термины
- цитотоксический : относящийся к цитотоксину, относящийся к нему или являющийся цитотоксином
- цитолитический : Относящийся к цитолизу или относящийся к нему
Клеточный иммунитет опосредуется Т лимфоцитами , также называемыми Т-клетками.Их название относится к органу, из которого они произведены: вилочковой железе. Этот тип иммунитета способствует уничтожению микробов, находящихся в фагоцитах, или уничтожению инфицированных клеток для устранения резервуаров инфекции. Т-клетки не производят молекулы антител. У них есть рецепторы антигенов, которые структурно родственны антителам. Эти структуры помогают распознавать антигены только в виде пептидов, отображаемых на поверхности антигенпрезентирующих клеток.
Т-клетки состоят из функционально различных популяций.К ним относятся наивные Т-клетки, которые распознают антигены и активируются в периферических лимфоидных органах. Эта активация приводит к увеличению пула антиген-специфических лимфоцитов и дифференцировке этих клеток в эффекторные клетки и клетки памяти. Эффекторные клетки включают хелперные Т-клетки и цитолитические или цитотоксические Т-клетки. В ответ на антигенную стимуляцию хелперные Т-клетки (характеризующиеся экспрессией маркера CD4 на своей поверхности) секретируют белки, называемые цитокинами, функция которых заключается в стимуляции пролиферации и дифференцировки самих Т-клеток, а также других клеток, включая В-клетки. , макрофаги и другие лейкоциты.Цитолитические или цитотоксические Т-клетки (характеризующиеся экспрессией маркера CD8 на их поверхности) убивают клетки, продуцирующие чужеродные антигены, такие как клетки, инфицированные вирусами и другими внутриклеточными микробами.
Клеточно-опосредованный иммунитет : Т-клетки способствуют уничтожению клеток, которые проглотили микроорганизмы и представляют чужеродные антигены на своей поверхности.
Т-клетки памяти представляют собой увеличенную популяцию Т-клеток, специфичных к антигенам, которые могут быстро реагировать на последующее столкновение с этим антигеном и дифференцироваться в эффекторные клетки для устранения антигена.Другой класс Т-клеток, называемый регуляторными Т-клетками, действует, чтобы подавлять иммунный ответ и устранять воспаление. Их основная роль — отключение опосредованного Т-клетками иммунитета к концу иммунной реакции.
Клеточный иммунитет
Клеточный иммунитет включает цитотоксические Т-клетки, распознающие инфицированные клетки и вызывающие их разрушение.
Цели обучения
Обобщить клеточно-опосредованный иммунный ответ
Ключевые выводы
Ключевые моменты
- Как только патоген попадает в клетку, он больше не может быть обнаружен гуморальным иммунным ответом; вместо этого клеточно-опосредованный иммунный ответ должен взять верх, чтобы убить инфицированную клетку, прежде чем он сможет позволить вирусу или бактериям размножаться и распространяться.
- Т-клетки распознают инфицированные клетки, взаимодействуя с антигеном, присутствующим на их молекулах MHC II; Прежде чем Т-клетка сможет это сделать, она должна быть активирована посредством взаимодействия с антигенпрезентирующей клеткой или APC.
- Как только цитотоксическая Т-клетка (T C ) активируется, она клонирует себя, производя множество клеток T C с правильными рецепторами; некоторые части клеток активны и помогают уничтожить инфицированные клетки, в то время как другие являются неактивными ячейками памяти, которые будут создавать более активные клетки T C , если инфекция вернется.
- Т-хелперы (клетки T H ) также способствуют клеточно-опосредованному иммунитету, высвобождая сигнальные молекулы, известные как цитокины, которые могут привлекать естественные клетки-киллеры и фагоциты для уничтожения инфицированных клеток и дальнейшей активации клеток T C ; они не уничтожают патогены напрямую.
Ключевые термины
- цитотоксические Т-клетки : подгруппа лимфоцитов (лейкоцитов), которые способны вызывать смерть инфицированных соматических или опухолевых клеток; часть клеточного иммунитета
- цитокин : любой из различных малых регуляторных белков, регулирующих клетки иммунной системы; они высвобождаются после привязки PRR к PAMPS
Т-клетки
Подобно тому, как гуморальный иммунный ответ имеет В-клетки, которые опосредуют его ответ, клеточный иммунный ответ имеет Т-клетки, которые распознают инфицированные клетки и уничтожают их до того, как патоген внутри сможет реплицироваться и распространиться, чтобы заразить другие клетки.В отличие от В-клеток, Т-лимфоциты (Т-клетки) не могут распознавать патогены без посторонней помощи. Во-первых, антигенпрезентирующая клетка (APC, такая как дендритная клетка или макрофаг) обнаруживает, поглощает (посредством фагоцитоза в случае макрофагов или путем проникновения патогена самостоятельно в случае дендритных клеток) и переваривает патогены на сотни или тысячи фрагментов антигенов. Эти фрагменты затем транспортируются на поверхность APC, где они представлены на белках, известных как главные комплексы гистосовместимости класса II (MHC II, см.).Т-клетки активируются по отношению к определенному антигену, как только они обнаруживают, что он отображается на MHC II. После того, как вирус или бактерия попадают в клетку, гуморальный иммунный ответ больше не может их обнаружить. Вместо этого должен преобладать клеточный иммунный ответ. Для этого Т-клетка активируется путем взаимодействия с антигеном инфицирующей клетки или вируса, представленного на MHC II APC.
APC, MHC и лимфоциты : антиген-представляющая клетка (APC), такая как макрофаг, поглощает чужеродный антиген, частично переваривает его в лизосоме, а затем встраивает в молекулу MHC класса II для представления в клетке поверхность.Лимфоциты адаптивного иммунного ответа должны взаимодействовать с встроенными в антиген молекулами MHC класса II, чтобы созреть в функциональные иммунные клетки.
Цитотоксические Т-клетки опосредуют одно из звеньев клеточного иммунного ответа
Существует два основных типа Т-клеток: хелперные Т-лимфоциты (Т H ) и цитотоксические Т-лимфоциты (Т C ). Лимфоциты T H действуют косвенно, сообщая другим иммунным клеткам о потенциальных патогенах, в то время как цитотоксические T-клетки (T C ) являются ключевым компонентом клеточно-опосредованной части адаптивной иммунной системы, которая атакует и уничтожает инфицированные клетки.Клетки T C особенно важны для защиты от вирусных инфекций, поскольку вирусы реплицируются внутри клеток, где они защищены от внеклеточного контакта с циркулирующими антителами. После активации T C создает большой клон клеток с одним специфическим набором рецепторов клеточной поверхности, подобно пролиферации активированных B-клеток. Как и B-клетки, клон включает активные клетки T C и неактивные клетки памяти T C . Полученные в результате активные клетки T C затем идентифицируют инфицированные клетки-хозяева.
T Клетки C пытаются идентифицировать и уничтожать инфицированные клетки, запуская апоптоз (запрограммированную гибель клеток) до того, как патоген сможет реплицироваться и ускользнуть, тем самым останавливая развитие внутриклеточных инфекций. Чтобы распознать, какие клетки преследовать, T C распознает антигены, представленные на комплексах MHC I, которые присутствуют на всех ядросодержащих клетках. Комплексы MHC I отображают текущее считывание внутриклеточных белков внутри клетки и представляют антигены патогена, если патоген присутствует в клетке.Клетки T C также поддерживают лимфоциты NK для уничтожения ранних стадий рака.
Цитокины, выделяемые клетками T
H , привлекают NK-клетки и фагоцитыЦитокины представляют собой сигнальные молекулы, секретируемые клеткой T H в ответ на инфицированную патогеном клетку; они стимулируют естественные клетки-киллеры и фагоциты, такие как макрофаги. Затем фагоциты поглощают инфицированные клетки и уничтожают их. Цитокины также участвуют в стимуляции клеток T C , повышая их способность выявлять и уничтожать инфицированные клетки и опухоли.Краткое описание того, как активируются гуморальные и клеточно-опосредованные иммунные ответы, появляется в плазматических клетках B и клетках T C , которые вместе называются эффекторными клетками, потому что они участвуют в «воздействии» (вызывая) иммунный ответ, убивающий патогены и инфицированные клетки-хозяева.
Т-хелперы в иммунном ответе : Т-хелперы активируются путем связывания с антигеном, представленным APC, через рецептор MHCII, заставляя его высвобождать цитокины.В зависимости от высвобождаемых цитокинов это активирует гуморальный или клеточно-опосредованный иммунный ответ.
Регуляторные Т-клетки
Регуляторные Т-клетки — это подмножество Т-клеток, которые модулируют иммунную систему и контролируют иммунные реакции.
Цели обучения
Опишите функцию и типы регуляторных Т-клеток
Ключевые выводы
Ключевые моменты
- Регуляторные Т-клетки (Treg) имеют решающее значение для поддержания гомеостаза иммунных клеток, что подтверждается последствиями генетического или физического уничтожения популяции Treg.
- Treg делятся на естественные и индуцированные Treg; Природные Treg — это CD4 + CD25 + Т-клетки, которые развиваются и мигрируют из тимуса, чтобы выполнять свою ключевую роль в иммунном гомеостазе.
- Адаптивные Treg — это нерегулирующие CD4 + Т-клетки, которые приобретают экспрессию CD25 (IL-2R альфа) вне тимуса и обычно индуцируются воспалением и болезненными процессами, такими как аутоиммунитет и рак.
Ключевые термины
- аутоиммунитет : Состояние, при котором иммунная система атакует собственные ткани, т.е.е., аутоиммунное заболевание.
Регуляторные Т-клетки — это компонент иммунной системы, подавляющий иммунные ответы других клеток. Это важная «самопроверка», встроенная в иммунную систему для предотвращения чрезмерных реакций и хронического воспаления. Регуляторные Т-клетки бывают разных форм, из которых наиболее хорошо изучены те, которые экспрессируют CD4, CD25 и Foxp3. Эти клетки также называются CD4 + CD25 + регуляторными Т-клетками или Treg. Эти клетки участвуют в отключении иммунных ответов после того, как они успешно уничтожили вторгшиеся организмы, а также в предотвращении аутоиммунитета.
CD25 является компонентом рецептора IL2. : рецептор интерлейкина 2 состоит из трех субъединиц (альфа, бета и гамма). CD25 составляет альфа-цепь рецептора IL2.
CD4 + Foxp3 + регуляторные Т-клетки были названы «естественными» регуляторными Т-клетками, чтобы отличить их от популяций «супрессорных» Т-клеток, которые генерируются in vitro . Дополнительные популяции супрессорных Т-клеток включают Tr1, Th4, CD8 + CD28 — и ограниченные Qa-1 Т-клетки.Вклад этих популяций в самотолерантность и иммунный гомеостаз определен менее четко. FOXP3 можно использовать в качестве хорошего маркера CD4 + CD25 + Т-клеток, а также недавние исследования, демонстрирующие доказательства наличия FOXP3 в CD4 + CD25-Т-клетках.
Дополнительная подгруппа регуляторных Т-клеток, индуцированные регуляторные Т-клетки, также необходимы для толерантности и подавления. Индуцированные регуляторные T (iTreg) клетки (CD4 + CD25 + Foxp3 + ) являются клетками-супрессорами, участвующими в толерантности.Было показано, что клетки iTreg подавляют пролиферацию Т-клеток и экспериментальные аутоиммунные заболевания. Клетки iTreg развиваются из зрелых CD4 + обычных Т-клеток вне тимуса: определяющее различие между естественными регуляторными Т-клетками (nTreg) и клетками iTreg. Хотя клетки iTreg и nTreg обладают схожей функцией, недавно было показано, что клетки iTreg являются важным неизбыточным регуляторным подмножеством, которое дополняет клетки nTreg, отчасти за счет увеличения разнообразия TCR в рамках регуляторных ответов.Острое истощение пула клеток iTreg на моделях мышей привело к воспалению и потере веса. Вклад клеток nTreg по сравнению с клетками iTreg в поддержании толерантности неизвестен, но оба важны. Эпигенетические различия наблюдались между клетками nTreg и iTreg, причем первые имели более стабильную экспрессию Foxp3 и более широкое деметилирование.
Т-клеточные рецепторы
Т-клеточный рецептор (TCR), обнаруженный на поверхности Т-клеток, отвечает за распознавание антигенов.
Цели обучения
Обсудить роль рецептора Т-клеток (TCR)
Ключевые выводы
Ключевые моменты
- Многие TCR распознают один и тот же антиген, и многие антигены распознаются одним и тем же TCR.
- TCR состоит из двух разных белковых цепей (то есть является гетеродимером). В 95% Т-клеток он состоит из альфа (α) и бета (β) цепей, тогда как в 5% Т-клеток он состоит из гамма- и дельта (γ / δ) цепей.
- Когда TCR взаимодействует с антигеном и MHC, Т-лимфоцит активируется посредством серии биохимических событий, опосредованных ассоциированными ферментами, корецепторами, специализированными вспомогательными молекулами и активированными или высвобождаемыми факторами транскрипции.
Ключевые термины
- полиморфный : относящийся к полиморфизму (в любом смысле), может иметь несколько форм или форм
- главный комплекс гистосовместимости : MHC представляет собой молекулу клеточной поверхности, которая опосредует взаимодействия иммунных клеток с другими лейкоцитами или клетками организма. MHC определяет совместимость доноров для трансплантации органов, а также предрасположенность к аутоиммунным заболеваниям. У людей MHC также называют человеческим лейкоцитарным антигеном (HLA).
Т-лимфоцитов обладают двойной специфичностью: они распознают полиморфные остатки молекул собственного главного комплекса гистосовместимости (MHC), что объясняет их ограничение MHC; они также распознают остатки пептидных антигенов, отображаемые этими молекулами MHC, что отвечает за их специфичность. Молекулы MHC и пептиды образуют комплексы на поверхности антигенпрезентирующих клеток (APC). Рецептор, который распознает эти комплексы пептид-MHC, называется рецептором Т-клеток (TCR).Клоны Т-клеток с разной специфичностью экспрессируют разные TCR.
Биохимические сигналы, которые запускаются в Т-клетках после распознавания антигена, передаются не самим TCR, а инвариантными белками (CD3 и дзета), которые нековалентно связаны с рецептором антигена с образованием комплекса TCR. Т-клетки также экспрессируют другие мембранные рецепторы, которые не распознают антигены, но участвуют в ответах на антигены; все вместе они называются «вспомогательными молекулами».Физиологическая роль некоторых вспомогательных молекул заключается в доставке сигналов Т-клеткам, которые функционируют совместно с сигналами от комплекса TCR, чтобы полностью активировать клетку.
Антигенный рецептор CD4-хелперных Т-лимфоцитов и цитолитических Т-лимфоцитов CD8 представляет собой гетеродимер, состоящий из двух трансмембранных полипептидных цепей, обозначенных альфа и бета, ковалентно связанных друг с другом дисульфидными связями. Каждая альфа- и бета-цепь состоит из одного вариабельного домена (V), одного константного домена (C), гидрофобной трансмембранной области и короткой цитоплазматической области.V-области TCR содержат короткие участки аминокислот, в которых сконцентрирована вариабельность между различными TCR, и они образуют гипервариабельные или определяющие комплементарность области (CDR). Распознавание комплексов пептид-MHC опосредуется CDR, образованными как альфа-, так и бета-цепями TCR.
Ткань, пораженная прионами : Эта микрофотография ткани мозга показывает цитоархитектурные гистопатологические изменения, обнаруженные при губчатой энцефалопатии крупного рогатого скота.Присутствие вакуолей, то есть микроскопических «дыр» в сером веществе, придает мозгу коров, пораженных BSE, губчатый вид, когда срезы тканей исследуются в лаборатории.
Т-клеточный рецептор : Т-клеточный рецептор состоит из альфа- и бета-цепей, трансмембранного домена и цитоплазматической области.
Адаптивный иммунитет и суперсемейство иммуноглобулинов
Адаптивный иммунитет стимулируется воздействием инфекционных агентов и привлекает элементы суперсемейства иммуноглобулинов.
Цели обучения
Опишите роль иммуноглобулинов в адаптивном иммунном ответе, в частности, в гуморальном иммунитете.
Ключевые выводы
Ключевые моменты
- Концепция адаптивного иммунитета предполагает создание de novo у каждого человека чрезвычайно большого репертуара разнообразных рецепторов и избирательную экспансию рецепторов, соответствующих антигену / патогену.
- Адаптивные иммунные рецепторы Т- и В-лимфоидных клеток принадлежат к суперсемейству иммуноглобулинов и создаются путем перестройки генных сегментов.
- Иммуноглобулины — это гликопротеины суперсемейства иммуноглобулинов, которые функционируют как антитела.
Ключевые термины
- цитокин : любой из различных небольших регуляторных белков, которые регулируют клетки иммунной системы.
Прецизионность иммуноглобулина
Адаптивный иммунитет стимулируется воздействием инфекционных агентов, и его сила и защитные способности возрастают с каждым последующим воздействием определенного микроба.Определяющими характеристиками адаптивного иммунитета являются специфичность к отдельным молекулам и способность «запоминать» и более энергично реагировать на повторяющиеся воздействия одного и того же микроба.
Составляющими адаптивного иммунитета являются лимфоциты и их продукты. Существует два типа адаптивных иммунных ответов: гуморальный иммунитет и клеточный иммунитет. Они управляются различными элементами иммунной системы и действуют по уничтожению различных типов микробов.Защитный иммунитет против микроба может быть вызван реакцией хозяина на микроб или переносом антител или лимфоцитов, специфичных для микроба. Антитела или иммуноглобулины связывают антигены в фазе узнавания и эффекторной фазе гуморального иммунитета.
Суперсемейство иммуноглобулинов
Иммуноглобулины производятся в мембраносвязанной форме B-лимфоцитами. Эти мембранные молекулы действуют как рецепторы B-клеток для антигенов. Взаимодействие антигенов с мембранными антителами на наивных В-клетках инициирует активацию В-клеток.Эти активированные В-клетки продуцируют растворимую форму иммуноглобулина, которая запускает эффекторные механизмы для устранения антигенов.
Активация В-клеток : Когда В-клетка встречает свой запускающий антиген, она дает начало многим крупным клеткам, известным как плазматические клетки. Каждая плазматическая ячейка — это, по сути, фабрика по производству антител. Каждая из плазматических клеток производит миллионы идентичных молекул антител и выбрасывает их в кровоток.
Эти антитела являются частью более крупного семейства, называемого суперсемейством ммуноглобулинов .Суперсемейство иммуноглобулинов (IgSF) представляет собой большую группу поверхностных и растворимых белков клетки, которые участвуют в процессах распознавания, связывания или адгезии клеток. Молекулы классифицируются как члены этого суперсемейства на основании структурных особенностей, общих с иммуноглобулинами, которые также известны как антитела. Все они обладают доменом, известным как домен иммуноглобулина или -кратный . Члены IgSF включают рецепторы антигена на поверхности клетки, корецепторы и костимуляторные молекулы иммунной системы, молекулы, участвующие в презентации антигена лимфоцитам, молекулы клеточной адгезии, рецепторы некоторых цитокинов и внутриклеточные мышечные белки.Они обычно связаны с ролями в иммунной системе.
Т-клеточный иммунитет — иммунобиология
После завершения своего развития в тимусе Т-клетки попадают в кровоток. и разносятся циркуляцией. Достигнув периферического лимфоидного органа, они покидают кровь снова мигрирует через лимфоидную ткань, возвращаясь в кровоток, чтобы рециркулируют между кровью и периферической лимфоидной тканью, пока они не столкнутся с их специфический антиген.Зрелые рециркулирующие Т-клетки, которые еще не столкнулись со своими антигены известны как наивные Т-клетки . Чтобы участвовать в адаптивном иммунном ответе, наивная Т-клетка должна сначала столкнуться с антигеном, а затем быть индуцированной размножаются и дифференцируются в клетки, способные способствовать удалению антиген. Мы будем называть такие клетки, вооруженные эффекторными Т-клетками, потому что они действуют очень быстро, когда сталкиваются со своими специфическими антиген на других клетках. Клетки, на которые действуют вооруженные эффекторные Т-клетки, будут называться в качестве своих клеток-мишеней.
В этой главе мы увидим, как наивные Т-клетки активируются для производства вооруженных эффекторных Т-клеток, когда они впервые сталкиваются со своим специфическим антигеном в форме пептида: MHC комплекс на поверхности активированной антигенпрезентирующей клетки ( APC ). Наиболее важными антигенпрезентирующими клетками являются высокоэффективные специализированные дендритные клетки, единственные известная функция заключается в проглатывании и презентации антигена. Тканевые дендритные клетки поглощают антиген в очагах инфекции и активируются как часть врожденного иммунного ответа.Этот вызывает их миграцию в локальную лимфоидную ткань и их созревание в клетки, которые очень эффективны при представлении антигена рециркулирующим Т-клеткам. Эти зрелые дендритные клетки отличаются поверхностными молекулами, известными как костимулятор . молекулы , которые действуют синергично с антигеном при активации наивных Т-клеток. Макрофаги, которые мы описали в Глава 2 как фагоцитарные клетки, которые обеспечивают первую линию защиты от инфекции, также могут быть активированы для экспрессии костимуляторные молекулы и молекулы MHC класса II.Это позволяет им действовать как антигенпрезентирующие клетки, хотя они менее мощны, чем дендритные клетки в активация наивных Т-клеток. В-клетки также могут служить антигенпрезентирующими клетками в некоторых обстоятельства. Как только был инициирован Т-клеточный ответ, макрофаги и В-клетки, которые поглотившие специфический антиген также становятся мишенями для вооруженных эффекторных Т-клеток. Дендритные клетки, макрофаги и В-клетки часто называют профессиональными антигенпредставителями. клетки.
эффекторных Т-клеток, как мы узнали в главе 5, делятся на три функциональных класса, которые обнаруживают пептидные антигены, полученные из разные виды возбудителя.Пептиды от внутриклеточных патогенов, размножающихся в цитоплазма переносится на поверхность клетки молекулами MHC класса I и представляется CD8 Т-клеткам. Они дифференцируются в цитотоксические Т-клетки, которые убивают инфицированные клетки-мишени. Пептидные антигены возбудителей болезней размножаются во внутриклеточных пузырьках и везикулах, полученных из внеклеточных бактерии и токсины, переносятся на поверхность клетки молекулами MHC класса II и представлены CD4 Т-клеткам. Они могут дифференцироваться на два типа эффекторных Т-клеток, звонили T H 1 и T H 2 .Патогены, которые накапливаются в большом количестве внутри макрофагов, а везикулы дендритных клеток имеют тенденцию к стимулируют дифференцировку клеток T H 1, тогда как внеклеточные антигены имеют тенденцию стимулировать продукцию клеток T H 2. T H 1 клетки активируются микробицидные свойства макрофагов и побуждение В-клеток к выработке антител IgG которые очень эффективны при опсонизации внеклеточных патогенов для поглощения их фагоцитами. клетки. Клетки T H 2 инициируют гуморальный иммунный ответ, активируя наивные антиген-специфические В-клетки для выработки антител IgM.Эти T H 2 ячейки могут впоследствии стимулируют выработку различных изотипов, включая IgA и IgE, поскольку а также нейтрализующие и / или слабоопсонизирующие подтипы IgG. показывает участие различных эффекторных Т-клеток в иммунных ответах на разные классы патогенов.
Рисунок 8.1
Роль эффекторных Т-клеток в клеточно-опосредованном и гуморальном иммунитете. ответы на репрезентативные патогены. Клеточно-опосредованные иммунные ответы включают разрушение инфицированных клеток цитотоксические Т-клетки или уничтожение внутриклеточных патогенов путем макрофаги (подробнее…)
Активация наивных Т-клеток в ответ на антиген и их последующая пролиферация и дифференциация составляет первичный иммунный ответ. Одновременно с предоставлением вооруженных эффекторных Т-клеток этот ответ генерирует иммунологическую память, которая дает защиту от последующее заражение тем же патогеном. Генерация Т-клеток памяти, долгоживущих клетки, которые дают ускоренный ответ на антиген, гораздо менее изучены, чем генерации эффекторных Т-клеток и будет рассмотрено в главе 10.Т-клетки памяти несколько отличаются от наивных Т-лимфоцитов. клетки, но, как наивные Т-клетки, они неподвижны и требуют активации антигенпрезентирующие клетки с костимулирующей активностью для регенерации эффектора Т клетки.
Вооруженные эффекторные Т-клетки во многом отличаются от своих наивных предшественников, и эти изменения дать им возможность быстро и эффективно реагировать при обнаружении специфического антигена на клетки-мишени. В последних двух разделах этой главы мы опишем специализированные механизмы опосредованной Т-клетками цитотоксичности и активации макрофагов вооруженными эффекторными Т-клетками, основными компонентами опосредованного клетками иммунитета.Оставим активацию В-клеток хелпером Т клетки до главы 9, где гуморальные, или опосредованный антителами иммунный ответ.
Содержание
- Производство вооруженных эффекторных Т-клеток
- Общие свойства вооруженных эффекторных Т-клеток
- Т-клеточная цитотоксичность
- Активация макрофагов вооруженными CD4 T H 1 клетки
- Резюме к главе 8
- Общие ссылки
- Ссылки на разделы
Гуморальный и клеточно-опосредованный иммунитет | Technology Networks
Гуморальный иммунитет и клеточный иммунитет — это два типа адаптивного иммунного ответа, которые позволяют человеческому организму целенаправленно защищаться от вредных агентов, таких как бактерии, вирусы и токсины.Несмотря на то, что между этими ветвями иммунного ответа есть некоторое совпадение — оба они зависят от функций лимфоидных клеток — есть также некоторые важные различия.
Можно приобрести гуморальный иммунитет к конкретной инфекции или заболеванию, если вводить антитела от кого-то, кто ранее был подвержен той же инфекции, в обход гуморального ответа. Однако иммунитет, опосредованный антителами, включает набор молекулярных компонентов и процессов, которые отличаются от иммунитета, опосредованного клетками.В этой статье мы определяем гуморальный иммунитет и клеточный иммунитет, обсуждая различные иммунные процессы, цели и важные типы клеток.
Гуморальный иммунитет — это опосредованный антителами ответ, который возникает, когда в организме обнаруживаются чужеродные вещества — антигены. Этот чужеродный материал обычно включает внеклеточных захватчиков, таких как бактерии. Этот механизм в первую очередь запускается лимфоцитами В-клеток, типом иммунных клеток, которые вырабатывают антитела после обнаружения специфического антигена.
Наивные В-клетки — это лимфоциты, которые циркулируют по всему телу в лимфатической системе. Эти лимфоциты экспрессируют множество антиген-специфических молекул, которые необходимы для обнаружения инфекционных агентов в организме человека. Когда наивные В-клетки сталкиваются с антигеном в лимфатической системе, они подвергаются процессу дифференцировки, который приводит к созданию В-клеток памяти и эффекторных В-клеток.
Во время этой дифференцировки В-клетки памяти и эффекторные В-клетки продуцируют те же антиген-специфические молекулы, что и их родительские наивные В-клетки.С помощью Т-клеточных лимфоцитов, в свою очередь активируемых рецепторами MHC класса II, которые распознают антигены, ассоциированные с микробами, активированные В-клетки памяти экспрессируют эти антиген-специфические молекулы на своей поверхности, в то время как эффекторные В-клетки секретируют эти молекулы в кровь для связывания интересующий антиген.
Что такое антитело?
Антитела — это тяжелые белки размером примерно 10 нанометров. Эти молекулы производятся В-клетками для выявления и нейтрализации вредных агентов, таких как инфекционные бактерии, грибы и вирусы.Эти Y-образные белки содержат антигенсвязывающие сайты, которые специфически связываются со своими антигенами-мишенями.
Как только антитела эффективно связываются со своим антигеном-мишенью, они могут либо нейтрализовать свой антиген-мишень напрямую, блокируя нормальное связывание антигена, либо они могут индуцировать рекрутирование других иммунных клеток или молекул, которые способствуют удалению или разрушению антигенов. У млекопитающих такие антитела имеют множество форм, обычно известных как изотипы.
Как вырабатываются антитела?Каждая В-клетка продуцирует собственный набор антител с уникальными антиген-специфическими сайтами связывания.Первоначально наивные В-клетки продуцируют антитела, которые остаются связанными с клеточной поверхностью, так что их открытые антигенсвязывающие сайты могут обнаруживать потенциальные патогены, токсины и чужеродные материалы. Эта поверхностно-связанная форма антитела известна как иммуноглобулин.
Когда антиген, соответствующий антигенсвязывающему сайту, связывается с наивной В-клеткой или В-клеткой памяти, он активирует В-клетку, чтобы производить и секретировать больше антиген-специфических антител. Когда В-клетка полностью созревает, она называется плазматической клеткой и будет продолжать вырабатывать и секретировать антиген-специфические антитела до конца своего жизненного цикла.
Когда антитела попадают в кровоток, эти свободно плавающие белки готовы действовать как защитные молекулы с прямыми и непрямыми иммунными функциями. К этим функциям относятся:
- нейтрализация инфекционных агентов — посредством блокирования или антителозависимой клеточной цитотоксичности
- активация системы комплемента — комплемент-зависимая цитотоксичность
- связывание чужеродных веществ, подлежащих разрушению — опсонизация и фагоцитоз
Антитела нейтрализуют антигены прежде всего через механизмы прикрепления и накопления.Например, агрегация нейтрализующих антител на вирусных частицах, соответствующих антигену, блокирует способность этого вируса инфицировать другие клетки.
Антитела могут также участвовать в процессах, которые приводят к лизису или уничтожению инфицированных или антигенпрезентирующих клеток посредством активации каскада комплемента или взаимодействия с эффекторными клетками и высвобождения цитокинов. Система комплемента — это часть врожденного иммунитета, которая увеличивает способность антител и лимфоцитов очищать организм от патогенов и инфицированных клеток.Наконец, антитела, которые покрывают патогены или инфицированные клетки, могут притягиваться (опсонизироваться) и интернализоваться макрофагами во время фагоцитоза.
Гуморальный иммунитет зависит от лимфоцитов, обеспечивающих защиту от инфекции посредством функций, опосредованных антителами, но это не единственная форма адаптивного иммунитета, в котором участвуют лимфоциты костного мозга.
В отличие от гуморального иммунитета , клеточный иммунитет не зависит от антител для его адаптивных иммунных функций.Клеточно-опосредованный иммунитет в первую очередь обеспечивается зрелыми Т-клетками, макрофагами и высвобождением цитокинов в ответ на антиген.
Т-клетки, участвующие в клеточно-опосредованном иммунитете, полагаются на антигенпрезентирующие клетки, которые содержат мембраносвязанные белки MHC класса I, чтобы распознавать внутриклеточные антигены-мишени. Специфичность связывания между белками MHC и чужеродными антигенами важна для созревания и дифференцировки наивных Т-клеток в Т-хелперы или Т-клетки-киллеры.
Клеточный иммунитет обычно проявляется в тех участках тела, где клетки инфицированы вирусом, бактериями или грибами (внутриклеточные захватчики).С помощью белков MHC класса I Т-клетки также могут распознавать раковые клетки.
Основные типы лимфоцитов, участвующих в клеточном иммунитете, включают хелперные Т-клетки, киллерные Т-клетки и макрофаги. Когда «вспомогательная» Т-клетка находит в организме антигенпрезентирующую клетку, она высвобождает набор сигнальных белков, называемых цитокинами. Эти цитокины активируют «киллерные» Т-клетки и макрофаги, чтобы перейти к интересующему участку, чтобы разрушить антигенпредставляющую клетку (а).
Гуморальный и клеточный иммунитет: таблица
| | Гуморальный | Клеточно-опосредованный | ||
| Тип | Опосредованный антителами ответ | |||
| Сайт активности | Внеклеточные жидкости | Местоположение антигенпрезентирующей ткани | ||
| Участвующие основные типы клеток | В-клетки | Т-клетки Скорость 905 | Быстрый ответ при обнаружении | Медленный ответ |
| Тип антигена | Внеклеточные патогены | Внутриклеточные патогены, раковые клетки | ||
| 9047 Метод удаления 9047 905 59 | Лизис клеток и запрограммированная смерть | |||
| Участвующие белки MHC | Белки MHC класса II | Белки MHC класса I |
Другие первичные клеточные иммунодефициты | Фонд иммунодефицита
Клеточные иммунодефициты (дефицит Т-клеток), обсуждавшиеся в предыдущих главах, включали тяжелый комбинированный иммунодефицит (SCID), атаксию-телеангиэктазию, синдром Вискотта-Олдрича и синдром Ди Джорджи.Некоторые пациенты с менее распространенными клеточными иммунодефицитами могут иметь тяжелый иммунодефицит с ранним началом и значительной заболеваемостью и смертностью, в то время как у других есть только легкие проблемы. Пациенты с этим типом дефицита имеют некоторый дефект их Т-клеточной (клеточной) иммунной системы, приводящий к другому спектру инфекционных проблем, чем у людей с типичным дефицитом антител. К ним относятся глубоко укоренившиеся бактериальные инфекции, вирусные и грибковые инфекции, туберкулез и другие микобактериальные инфекции.Клеточный иммунодефицит обычно труднее лечить и может потребовать клеточного восстановления с помощью трансплантации гемопоэтических стволовых клеток или, возможно, генной терапии.
Хронический кожно-слизистый кандидоз (CMC)
КМЦ характеризуется стойкими кандидозными (грибковыми) инфекциями слизистых оболочек, волосистой части головы, кожи и ногтей. В редких случаях инфекция может распространиться на кровоток или внутренние органы. CMC обычно передается по наследству и проявляется вскоре после рождения стойкими оральными инфекциями Candida (молочница).Позже ногти и кожа становятся хронически инфицированными. Эти инфекции поддаются лечению против Candida, но рецидивируют, когда лечение прекращается.
CMC связан с селективной недостаточностью Т-клеток для Candida и некоторых родственных грибов. За исключением этого дефицита Т-клеток, пациенты с КМЦ имеют нормально функционирующую иммунную систему. Наиболее частым отклонением от нормы в лабораторных условиях является отрицательный кожный тест на гиперчувствительность замедленного типа к антигену Candida, несмотря на широко распространенную инфекцию Candida.
Дополнительные ресурсы и дополнительные материалы
Одной из наследственных форм CMC является синдром APECED (аутоиммунная полиэндокринопатия-кандидоз-эктодермальная дисплазия), связанный с множественными эндокринными проблемами (например, гипотиреозом, диабетом или болезнью Аддисона) из-за дефекта гена AIRE на хромосоме 21.Однако CMC при этом заболевании также частично обусловлен аутоантителами, направленными против критических молекул, борющихся с Candida, вырабатываемых нарушенной иммунной системой. Некоторые другие формы CMC возникают из-за мутаций в преобразователе сигнала гена и активаторе транскрипции 1 (STAT1). Другие причины CMC связаны с аутоантителами к критически важным молекулам, борющимся с Candida, и с мутациями в очень необычных генах, таких как интерлейкин 17. Лечение требует пожизненных противогрибковых препаратов.
Гипоплазия волос хряща (CHH)
CHH — это аутосомно-рецессивный иммунодефицит, связанный с карликовостью и другими медицинскими проблемами.Это особенно распространено среди амишей из-за смешанных семейных браков. У большинства пациентов очень тонкие ломкие волосы и необычная восприимчивость к вирусным инфекциям. Степень иммунодефицита различна и обычно включает как антител, так и клеточный иммунитет. Некоторым пациентам была проведена трансплантация костного мозга, но это не исправит их наследственный низкий рост.
Х-сцепленные лимфопролиферативные (XLP) синдромы 1 и 2
XLP характеризуется пожизненной уязвимостью к инфекции вируса Эпштейна-Барра (ВЭБ), которая может привести к тяжелому и смертельному инфекционному мононуклеозу, раку лимфатических узлов (лимфомам), комбинированному иммунодефициту и, реже, апластической анемии (неспособность производить красный клетки крови) или васкулит (воспаление кровеносных сосудов).XLP связан с дефектом на Х-хромосоме, называемым Sh3DIA. Поскольку он связан с Х-хромосомой, этот дефект поражает только мужчин. (См. Главу «Наследование».) Большинство пациентов с XLP чувствуют себя хорошо, пока они не подвергаются воздействию EBV. Затем они серьезно заболевают лихорадкой, увеличением лимфатических узлов, увеличением печени и селезенки и гепатитом. Эта инфекция вызывает состояние, называемое «гемофагоцитарным синдромом», которое также возникает при других иммунодефицитах и может быть фатальным. Если пациенты выздоравливают, у них развивается одна из вышеназванных проблем.
Некоторым пациентам изначально неправильно ставят диагноз Common Variable Immune Deficiency (CVID). Раннее распознавание имеет решающее значение, поскольку болезнь можно вылечить с помощью трансплантации костного мозга или пуповинной крови. Ранний скрининг мальчиков-младенцев в семьях, в которых, как известно, были дети с ЛСС, также крайне важны, так как они могут быть трансплантированы до заражения ВЭБ-инфекцией. Есть две формы этого нарушения: XLP1 из-за дефектов в гене Sh3DIA и XLP2 из-за дефектов в гене XIAP.
Х-сцепленная иммунная дисрегуляция с синдромом полиэндокринопатии (IPEX)
IPEX характеризуется множественными аутоиммунными эндокринными заболеваниями (особенно диабетом и проблемами щитовидной железы), хронической диареей и сыпью, напоминающей экзему. Это заболевание, сцепленное с Х-хромосомой, поэтому поражаются только мальчики. (См. Главу «Наследование»). IPEX вызывается аномалиями гена на Х-хромосоме, называемого FOXP3. У этих мальчиков активированы Т-клетки, которые стимулируют аутоиммунные проблемы.В качестве лечения обычно используются иммунодепрессанты с последующей трансплантацией костного мозга.
Веноокклюзионная болезнь (VODI)
Веноокклюзионная болезнь печени — чрезвычайно редкая форма иммунодефицита, наследуемая по аутосомно-рецессивному типу с поражением как Т-клеток, так и В-клеток. Пациенты с VODI имеют предрасположенность к тому, что пациент становится подверженным грибковым инфекциям, таким как инфекция Pneumocystis jiroveci . У пациентов также может быть тромбоцитопения (низкое количество тромбоцитов) и увеличенная печень.Важное значение имеет внутривенный иммуноглобулин (ВВИГ) и Pneumocystis jiroveci , как только установлен диагноз VODI. Иногда рассматривается возможность трансплантации печени, но риск осложнений может быть высоким.
Синдром Хойераала-Хрейдарссона (конгенитадный дискератоз)
Этот синдром имеет Х-сцепленное наследование, и пациенты имеют плохой рост внутри матки, микроцефалию (маленькая голова), панцитопения (низкое количество всех клеток крови) и, в особенности, снижение количества естественных клеток-киллеров.Пациенты испытывают прогрессирующую потерю клеточного и гуморального иммунитета и, таким образом, подвержены инфекциям практически любым патогеном. Точная диагностика врожденного дискератоза имеет решающее значение для обеспечения надлежащего клинического ведения, поскольку пациенты с DC и недостаточностью костного мозга не отвечают на иммуносупрессивную терапию и могут иметь повышенную заболеваемость и смертность, связанные с трансплантацией гемопоэтических стволовых клеток.
Иммунодефицит с центромерной нестабильностью и лицевыми аномалиями (ICF)
СиндромICF — очень редкое заболевание, унаследованное от обоих родителей из-за дефектов в гене ДНК, переносимом метилом DNMT3B.Выражены аномальные черты лица, такие как макроглоссия (большие языки). Количество Т-клеток, В-клеток и сывороточных иммуноглобулинов низкое, и пациенты подвержены бактериальным и оппортунистическим инфекциям. Ранняя диагностика ICF важна, поскольку раннее введение добавок иммуноглобулинов может улучшить течение болезни. Трансплантацию аллогенных стволовых клеток следует рассматривать как терапевтический вариант у пациентов с тяжелыми инфекциями или с нарушением нормального развития.
Синдром Шимке
Синдром Шимке — это очень редкий первичный иммунодефицит с аутосомно-рецессивным наследованием, который приводит к снижению циркулирующих Т-клеток, но нормальному уровню В-клеток и сывороточных иммуноглобулинов.Признаками, связанными с этим синдромом, являются низкий рост, задержка внутриутробного развития, заболевание почек, недостаточность костного мозга и проблемы с борьбой со всеми типами инфекций. Это вызвано мутацией в гене, отвечающем за ремоделирование хроматина (SMARCAL1). Дополнительные признаки включают ишемические церебральные атаки, мигренеподобные головные боли, гематологические аномалии лейкопении, анемии и тромбоцитопении, энтеропатию, гиперпигментированные пятна на коже, необычные волосы и маленькие зубы. Течение болезни варьируется от тяжелого с внутриутробным или ранним детским началом и смертью в детстве до более легкого заболевания с дожитием до взрослого возраста.Как при тяжелом, так и при легком течении заболевания терапия в основном симптоматическая.
Синдром Комеля-Нетертона
Это очень редкое заболевание с аутосомно-рецессивным типом наследования. У пациентов нормальное количество Т-клеток, но пониженное количество В-клеток. Пациенты демонстрируют повышенные уровни IgE и IgA с функцией антител с переменной специфичностью. У новорожденных наблюдается ихтиоз (чешуйчатая кожа), волосы бамбукового типа (тонкие, трубчатые и ломкие), повышенная частота бактериальных инфекций и нарушение роста.Если дефицит антител может быть подтвержден провокационной вакциной, можно попробовать заменить иммуноглобулин.
В неонатальном периоде 20% младенцев страдают от обезвоживания, электролитного дисбаланса, нарушения терморегуляции, задержки развития и рецидивирующих инфекций, которые могут привести к преждевременной смерти. Отличительной чертой C-NS является инвагинированный трихорекс (бамбуковые волосы), но наблюдались и другие аномалии, в том числе пили торти (скрученные волосы) и узловатый трихорексис (волосы разного диаметра).Также характерны заметно повышенные уровни IgE, аллергические реакции на пищевые продукты и общие антигены, недоедание и повышенная восприимчивость к кожным, респираторным или системным инфекциям.
Выдержка из Справочника IDF для пациентов и семей по первичным иммунодефицитным заболеваниям ПЯТОЕ ИЗДАНИЕ . Авторское право 2013 г. Фондом иммунодефицита, США. Эта страница содержит общую медицинскую информацию, которую нельзя безопасно применить к любому отдельному случаю. Медицинские знания и практика могут быстро меняться.Таким образом, эту страницу не следует использовать как замену профессиональной медицинской консультации.
Антитела и клеточный иммунитет при тяжелой и легкой форме COVID-19
Пандемия COVID-19, вызванная тяжелым острым респираторным синдромом, коронавирусом 2 (SARS-CoV-2), является беспрецедентным глобальным кризисом, создающим огромную неопределенность — почти для всех сфер жизни. Правительства быстро разрабатывают и осуществляют меры реагирования на чрезвычайные ситуации, чтобы справиться с разворачивающимся кризисом. В то же время ученые со всего мира работают над разработкой вакцин от болезни COVID-19.В настоящее время некоторые исследования смещаются в сторону понимания причин возникновения болезни.
Новое исследование, опубликованное в журнале Signal Transduction and Targeted Therapy в августе 2020 года, показывает, что, хотя гуморальный и Т-клеточный иммунные ответы более устойчивы при тяжелой инфекции, болезнь активирует Т-клетки памяти как часть адаптивной иммунной системы. у пациентов с COVID-19 независимо от тяжести заболевания.
Адаптивный иммунитет при патогенной инфекции CoV
Более ранние исследования показали, что при MERS, SARS и гриппе адаптивные иммунные клетки, и особенно лимфоциты, играют жизненно важную роль в защите организма от вируса.Многие исследования подтвердили это на COVID-19, при этом в борьбе задействованы как антитела, так и клеточная защита. Таким образом, настоящее исследование направлено на изучение иммунной системы выздоравливающих пациентов с COVID-19, чтобы получить более четкое представление о том, как происходит выздоровление и как адаптивный иммунитет связан с тяжестью заболевания.
Исследование было сосредоточено на периферических Т-клетках и В-клетках пяти и четырех выздоравливающих, которые были тяжело и умеренно / легко больны COVID-19. Степень тяжести заболевания была классифицирована на основе Китайского клинического руководства по диагностике и лечению пневмонии COVID-19.
Активация Т-клеток и В-клеток в иммунной системе 3d иллюстрации. Кредит изображения: Sciencepics / Shutterstock
Схема распространения COVID-19
Затем исследователи изучили использование генов V (D) J среди субъектов, поскольку они определяют различные паттерны и предпочтения рецепторов В- и Т-клеток у этих пациентов. Они обнаружили, что здоровые люди, люди с легкой формой COVID-19 и люди с тяжелой формой COVID-19 имели разные клонотипы. Было много генов из семейства IGHV.Один из этих клонов B-клеток редко встречался в B-клетках памяти IgG от здоровых людей, но был чрезмерно представлен у одного пациента, который выздоровел после тяжелой болезни. Наиболее часто представленные сегменты VJ в этом семействе генов клонов рецепторов В-клеток также были специфичны для вируса.
Сравнивая тяжелое заболевание с легким, они обнаружили, что гены IGHV3-23, IGHV3-48, IGHV1-2 и IGHV4-34 были доминирующими в первом случае. Также было обнаружено, что некоторые гены сильно экспрессируются при других вирусных инфекциях, включая грипп и цитомегаловирус.
На основе общих генов в группах IGHV и IGHJ они обнаружили общедоступные кластеры последовательностей антител у пациентов, но не в контрольной группе, что они приписали присутствию COVID-19. Всего среди пациентов с COVID-19 было 19 общих антител IgG и 25 общих антител IgA. Дальнейшее исследование поддерживает идею о существовании гуморального и клеточного адаптивного иммунитета, специфичного для COVID-19 в легкой и тяжелой форме.
Изменения в составе и функциях клеток
Исследователи не обнаружили заметных изменений в составе Т-клеток у выздоровевших пациентов с COVID-19, но у всех пациентов была субпопуляция Т-эффекторных клеток памяти (ТЕМ) CD8 по сравнению с контрольной группой.Это может указывать на то, что эти клетки размножаются при этой инфекции. Подмножество CD8 + терминальных эффекторных (TTE) клеток обнаруживается на повышенных уровнях, особенно при тяжелой инфекции. По большей части это цитотоксические клетки. И CD4, и CD8 TTE, а также CD8 TEM, клонально увеличиваются у пациентов.
Комментарий исследователей: «Эти клонально увеличенные Т-клетки могут представлять собой Т-клетки CD8 + или CD4 +, специфичные для SARS-CoV-2. Однородность транскрипции у пациентов с COVID-19 [может дополнительно подтвердить эту] идею.”
Инвариантные T-клетки слизистой оболочки (MAIT) заметно снижены как у легких, так и у тяжелых пациентов, что, возможно, отражает неполное восстановление иммунной системы у этих пациентов на ранней стадии. Это наблюдалось и при других вирусных заболеваниях. Присутствие плазмобластов у выздоровевших в тяжелой форме пациентов дополнительно указывает на то, что эти пациенты отвечают более устойчивым антителным ответом по сравнению с легким заболеванием. Клональная экспансия BCR и активации B-клеток подтверждает этот вывод.
Дифференциальная экспрессия гена
Дифференциально экспрессируемые гены (DEG) показывает, что некоторые пути, связанные с иммунитетом и воспалением, экспрессируются на явно разном уровне в CD4 T-клетках, CD8 T-клетках и AEBC у всех пациентов по сравнению со здоровыми людьми из контрольной группы. К ним относятся пути продукции цитокинов и адгезии лейкоцитов к клеткам, в основном в Т-клетках CD4 или CD8. Путь активации Т-клеток также был активирован Т-лимфоцитами CD8 в трех из пяти тяжелых случаев. Тем не менее, противовирусные иммунные пути были чрезмерно экспрессированы в Т-клетках одного пациента с тяжелым и одного легкого поражения.
У тяжело больных пациентов также наблюдалась большая активация генов, касающихся опосредованного В-клетками гуморального иммунитета, активации комплемента, опосредованного Ig гуморального иммунного ответа и фагоцитоза. Это предполагает более широкий гуморальный иммунный ответ при тяжелом заболевании, включая системный провоспалительный процесс, опосредованный активацией комплемента.
Однако большинство адаптивных иммунных клеток не смогли экспрессировать провоспалительные цитокины, что может означать, что в большинстве случаев они возвращаются к норме после выздоровления пациента.Экспрессия пути митоген-активируемой протеинкиназы (MAPK) была значительно снижена у всех пациентов по сравнению с контрольной группой, и это согласуется с предыдущим исследованием, показывающим, что это признак выздоровления.
Специфические подмножества Т-клеток против SARS-CoV-2
Исследователи обнаружили, что все выздоровевшие пациенты показали активность IFN-γ-секретирующих или специфических Т-клеток памяти в ответ на воздействие одной или нескольких из десяти групп вирусных пептидов. Это экспериментальное подтверждение специфического Т-клеточного иммунитета, развиваемого у этих пациентов.
У каждого из пациентов доля таких клеток против S-пептидов была намного выше, чем у любого другого. Т-клетки у тяжелобольных пациентов в 12 раз превышали ответ на пять или более вирусных белков, но у пациентов с легкой степенью тяжести ответ был только в 3,5 раза по сравнению с исходными уровнями до стимуляции.
Это указывает на то, что S-специфические Т-клетки памяти, а также те, которые специфичны для других белков, продуцируются и поддерживаются выздоровевшими пациентами. Еще одним важным открытием является то, что у тяжелобольных пациентов иммунный ответ был более устойчивым, чем у умеренно больных.Это может означать, что первый имеет лучшую Т-клеточную память против этого вируса, чем второй.
Последствия
Исследователи резюмируют: « Взятые вместе, эти результаты означают, что SP и MP могут испытывать разные клеточные и гуморальные иммунные ответы, которые, вероятно, связаны с разной степенью тяжести заболевания ».
Исследователи обнаружили, что адаптивные иммунные ответы претерпели специфические изменения в репертуаре с периферическими лимфоцитами, показывающими другой паттерн функции и распределения.Оказалось, что тяжелые пациенты имели более сильный и устойчивый ответ Т- и В-клеток.
Результаты показали, что в адаптивной иммунной системе появились три значительных кластера Т-клеток памяти. Пептиды вирусного М-белка вызывают Т-клеточный ответ у большинства пациентов с COVID-19. Чем тяжелее фенотип заболевания, тем сильнее гуморальный и Т-клеточный ответ у выздоровевших пациентов.
Более высокий уровень экспрессии таких путей указывает на сохраняющийся активный иммунитет после исчезновения клинических симптомов, подтверждая, что это заболевание требует более длительного периода восстановления для восстановления здоровья.Как состав, так и функция лимфоцитов периферической крови нуждаются в дальнейшем детальном изучении, чтобы прояснить этот аспект выздоровления.
Присутствие клональной экспансии и сверхэкспрессии иммунных путей у одного пациента с легкой степенью тяжести, что характерно для тяжелых пациентов, может отражать эффект сосуществования гипертонии и диабета у этого пациента. Это, в свою очередь, может означать, что на адаптивный иммунитет при COVID-19 влияют определенные хронические заболевания.
ИндукцияIFN у этих пациентов неоднородна.Клон В-клеток IGHV4-34, который редко встречается в В-клетках памяти IgG в контроле, экспрессируется на повышенных уровнях у этих пациентов. Присутствие одного клона TCR, нацеленного на стромальный антиген в костном мозге человека, возможно, свидетельствует об аутоиммунном феномене, вызванном инфекцией, который способствует тяжелым симптомам.
Таким образом, многие вирусные пептиды вызывают специфические Т-клеточные ответы памяти у пациентов с COVID-19, включая S и M. Это предполагает больше целей для разработки вакцин.Более того, одновременное обнаружение трех основных кластеров Т-клеток памяти как у умеренно, так и у тяжелобольных, по-видимому, демонстрирует, что у всех пациентов развивается устойчивый адаптивный иммунитет против вируса.
Ссылка на журнал:
Zhang, F. et al. (2020). Адаптивные иммунные ответы на инфекцию SARS-Cov-2 у тяжелых и легких людей. Сигнальная трансдукция и таргетная терапия , том 5, номер статьи: 156. https://www.nature.com/articles/s41392-020-00263-y
Грааль иммунолога: вакцины, вызывающие клеточный иммунитет
Многие из прошлых попыток разработки вакцин сосредоточены на генерации ответов антител.В ряде текущие усилия по разработке обеих новых вакцин против многих инфекционных болезней и эффективных иммунотерапевтических методов лечения рака, цель была выработка ответов цитотоксических Т-лимфоцитов (CTL). В отличие от B клетки (и антитела), которые могут распознавать химически разные антигены (например, белки, полисахариды) в различных контекстах (клеточный или ассоциированные с патогенами или растворимые), Т-клетки обычно распознают только бимолекулярный комплекс, состоящий из антигенного пептида, связанного с определенными гликопротеины клеточной мембраны, главный комплекс гистосовместимости (MHC) молекулы класса I и класса II.Эти молекулы MHC обеспечивают генетический идентичность для каждого человека, поскольку каждый родительский гаплотип кодоминантно выражен.
Таким образом, Т-клетки обладают двойной специфичностью, за исключением случаи трансплантации органов, когда Т-клетки одного человека распознают «чужие» молекулы MHC, их рецепторы специфичны как для их собственных молекул MHC, так и для соответствующих антигенный пептид, связанный с этими молекулами MHC. Награждение Нобелевской премии по физиологии и медицине 1996 г. Питеру Доэрти и Рольф Цинкернагель отмечает их важный вклад в их демонстрация этой двойной специфичности, которую CTL должен распознавать две детерминанты на инфицированной вирусом клетке: одна специфична для вируса и один, специфичный для MHC хоста.
Одна подгруппа Т-клеток, которые экспрессируют гликопротеин CD8 клеточной поверхности, распознают пептидные антигены, связанные с молекулами MHC класса I. Эти CD8 + Т-клетки также могут секретировать цитокины в ответ на вовлечению их рецепторов Т-клеток, но их название отражает их способность лизировать клетки, представляющие антиген. Потому что в отличие от к белкам MHC класса II, экспрессия которых в основном ограничена профессиональные антигенпрезентирующие клетки (APC), молекулы MHC класса I присутствуют на поверхности большинства ядерных клеток, CD8 + T клетки могут убивать различные типы клеток, тем самым устраняя клетки, которые инфицированы вирусом (и, следовательно, производят больше вируса) или опухолевыми клетками, и т.п.Пептиды, связанные с молекулами MHC класса I, обычно являются производными из белков, присутствующих в цитоплазме клеток, обычное явление с вирусной инфекцией или для любого другого белка эндогенно синтезируется клеткой-хозяином, но не экзогенными белками (такими как введенный белок, который обычно попадает в эндосомы для деградация эндолизосомным путем). Вызов для индукция этих так называемых «цитотоксических T-лимфоцитов, ограниченных классом I MHC. клетки »или CTL, как искусственно вводить антигены в Путь MHC класса I через цитоплазму.
С выяснением механизмов процессинга антигена и прибыла презентация по созданию ЦТЛ, ограниченного классом I MHC усилия по созданию таких ответов либо с помощью вирусных векторов кодирующие гетерологичные антигены или невирусные системы. Четыре статьи недавно опубликованные в Proceedings (1–4) описывают различные подходы к созданию CTL, ограниченных MHC класса I. Это из Интересно описать эти статьи для стратегий и наблюдений которые они представляют, а также для сравнения подходов друг с другом и с другими методами иммунизации, которые в настоящее время изучаются в лабораторные и ранние клинические испытания.
Исследование Saron et al. (1) использует способность токсина (из Bordatella pertussis ) для перемещения токсиновый домен молекулы в цитоплазму клетки. Вставив пептидный эпитоп, ограниченный MHC класса I, из вируса в этот домен ферментного токсина, этот пептид, таким образом, был непосредственно перемещен в цитоплазму клеток в составе токсинового домена и эффективно иммунизированные мыши для защиты от смертельного заражения с вирусом.Исследование Bronte et al. (4) обеспечивает дополнительные сведения о стратегии, впервые разработанной в лаборатории Мосса, который вошел в клиническую оценку, а также широко использованный лабораторный инструмент: рекомбинантные вирусы вакцины, которые экспрессируют гетерологичные белковые антигены. Две статьи Buschle et al. al. (2) и Schmidt et al. (3) — новый взгляд на хорошо известный подход пептидной иммунизации путем доставки пептиды, смешанные с поликатионами, такими как полилизин и полиаргинин, Результатом является защита двух опухолевых систем.Каждое исследование важно для демонстрации не только потенциальной пользы для иммунной активация, способная опосредовать защиту in vivo против вирусная или опухолевая проба (или для иммунотерапии), но для дальнейшего разъяснение нашего понимания ключевых вопросов доставки антигена для оптимальная активация защитных / лечебных иммунитет.
В своих усилиях по доставке эпитопов в цитозоль APC для возможная ассоциация с возникающими молекулами MHC класса I, Saron et al. al. (1) сделал гибридный белок, вставив пептидный эпитоп интерес, полученный из нуклеопротеина лимфоцитарного хориоменингита (LCMV) в токсин аденилатциклазы B. pertussis . В токсин обладает способностью проникать в эукариотические клетки и доставлять N-концевой участок (каталитический домен) непосредственно через плазму мембрана в цитозоль. Пептиды можно вводить в определенные местоположения N-концевой каталитической области и, таким образом, транспортироваться непосредственно в цитоплазму, где они могут быть доступны для обработки и презентация о молекулах MHC класса I.В то время как другие, в том числе наши лаборатории, использовали другие гибридные белки для транспортировки пептидов или белков в цитоплазму клеток (5, 6), в этой статье демонстрация эффективности in vivo такого подход для генерации CTL-ответов. Более того, ответы CTL были достаточно для защиты мышей от смертельного внутримозгового заражение LCMV. В качестве дополнительной и важной демонстрации авторы также показали, что гибридный белок, созданный с тем же самым LCMV эпитоп, вставленный в генетически детоксифицированный токсин, также индуцированный MHC CTL, ограниченные классом I, и защитный иммунитет.
Использование токсина коклюша, который непосредственно переносит ферментативные домен в цитоплазму может иметь решающее значение для способности этого определенный токсин-гибридный белок, чтобы направить эпитоп в правильный внутриклеточный компартмент для in vivo примирования CTL. Для Например, Pseudomonas aeruginosa экзотоксин A (PE-токсин) очевидно, использует более сложный ретроградный путь от эндосом к комплекс Гольджи и эндоплазматический ретикулум для транслокации в цитоплазма (7, 8).И хотя слитные белки сделаны со связыванием и транслоцирующие домены токсина PE и пептидов гриппа A матричный белок и нуклеопротеин были способны сенсибилизировать клетки-мишени для лизиса CTL (5) никогда не было показано, что они способны индуцировать CTL при введении in vivo .
Различные молекулы MHC обычно связывают разные пептиды; таким образом вакцина, состоящая из одного эпитопа CTL, будет эффективна только для сегмент беспородного населения. Учитывая гаплотипическое разнообразие MHC человеческой популяции было бы предпочтительнее сделать синтез токсина белковая вакцина, которая обеспечила полный белковый антиген, а не гаплотип-специфические эпитопы, позволяющие детерминантному отбору обеспечить для увеличения охвата населения за счет предоставления количество различных пептидных эпитопов для любого данного антигена.Пастан и коллеги (9) продемонстрировали, что гибридный белок, состоящий из связывающие и перемещающие домены токсина PE и фермента барназы, смог доставить функциональный белок барназы в цитоплазму клетки. Их способность заменять токсин неповрежденным белком. фрагмента PE-токсина и демонстрация в статье Saron et al. al. (1) что каталазная активность токсина может быть инактивирована без нарушения способности токсина доставлять эпитопы, поднять вопрос о том, можно ли заставить токсин коклюша доставлять весь белок, а не только эпитоп, путем замены белок для или вставка белка в N-конец токсин.Для слитых белков PE правильная рефолдинг рекомбинантных белки представляли проблему; неизвестно, было ли включение весь белок, а не пептид, попадет в токсин коклюша. ввести трудности для рефолдинга такого гибридного белка в функциональная молекула доставки. Интересно, что авторы возможность многократно иммунизировать животных из-за одного потенциального недостатка этого подхода может быть формирование иммунного ответа против сам токсиновый белок (который в этой статье не оценивался).
В статье Bronte et al. (4) использовали поксвирус (коровьей оспы) векторной стратегии, которая использовалась как вакцина / иммунотерапевтическая стратегия и как инструмент для изучения CTL ответы и механизмы. Они еще больше добавили понимания факторов, которые важны для оптимизации эффективности этого подход (и, возможно, другие технологии рекомбинантных вирусных векторов) путем демонстрации дополнительного механизма, посредством которого выражение антиген рекомбинантного вируса осповакцины более эффективен из с иммунологической точки зрения, если экспрессия управляется ранним промотором (я.е. промотор, который активен сразу после заражения вирусом клетки до репликации вирусной ДНК), а не поздним промотор (активен после репликации вирусной ДНК), несмотря на то, что последний считается более сильным промоутером. Хотя ряд типов клеток экспрессируют наибольшее количество антигена, когда рекомбинантный вирус осповакцины использует поздний промотор, дендритные клетки экспрессировали модельный опухолевый антиген и активировал антиген-специфический CTL только тогда, когда экспрессия антигена была контролируется одним из первых промоутеров.В статье исследуется возможность что APC могут быть несколько непермиссивными по сравнению с другими ячейками для вирусная инфекция; следовательно, конструкция осповакцины, использующая поздний промотор приведет к меньшей экспрессии кодируемого антигена и, следовательно, низкая иммуногенность.
Однако, как указывают авторы, другие факторы могут объяснять различия в иммуногенности конструкций осповакцины с использованием ранних по сравнению с поздними промоутерами. Более ранние исследования Coupar et al. (10) продемонстрировали, что использование поздних промоторов для экспрессии коровьей оспы гемагглютинина (HA) гриппа приводит к ингибированию представление эпитопов НА для HA-специфических CTL.Townsend et al. al. (11) расширил эти наблюдения с использованием векторов осповакцины. кодирующие различные формы HA или нуклеопротеина гриппа (NP). Они продемонстрировали, что торможение также в меньшей степени происходит во время ранние стадии инфекции, и что подавление было эпитоп-зависимый и может быть преодолен, если антиген был сконструирован Быстрее деградировать. Они постулировали, что инфекция осповакцины продолжается, возникает дефект процессинга антигена, который может быть вызван производство ингибитора протеазы, кодируемой коровьей оспой; таким образом антиген который нацелен на более быструю деградацию, а не на более стабильный, эффективно спасет дефектный процессинг антигена в клетке, инфицированной коровьей оспой.Подавление клетки-хозяина синтез белка осповакциной может также снизить синтез MHC молекулы класса I, тем самым обеспечивая другую этиологию уменьшенного эффективность презентации антигена для конструкций с использованием позднего промоутер.
Тем не менее, результаты важны, потому что, если выражение белок APC по сравнению с экспрессией в других типах клеток определяет эффективность рекомбинантной вакцины как вакцины, векторы должны быть сконструирован специально для максимального увеличения экспрессии в этих клетках.Подчеркивая важность экспрессии белка (антигена, в случай вакцины), особенно в APC, демонстрирует необходимость оценить векторы экспрессии в интересующих клетках-мишенях. Тем не менее потребность в экспрессии белка профессиональными APC, что является предположение, лежащее в основе этого подхода, возможно, не следует принимать во внимание предоставляется. Например, в некоторых системах перенос антигена (12) или «Перекрестное праймирование» (13) считается ответственным за доставку антиген из клетки, синтезирующей антиген, к APC, который затем представляет это CTL.Таким образом, демонстрация того, что использование раннего промоторы были более эффективны для создания желаемого иммунного ответы из-за их большей активности (по сравнению с поздними промоторов) в APC перефокусирует усилия на конструирование вектора на по крайней мере, для поксвирусов, особенно при экспрессии в APC, а не общие уровни экспрессии в широком диапазоне типов клеток.
Некоторые группы избегают усилий по доставке белковых антигенов цитозоль для вступления в путь обработки MHC класса I в пользу пептиды, которые могут связываться с молекулами MHC в различных точки пути, в том числе внеклеточно.Группа Birnstiel (2) описывает способность поликатионов доставлять пептиды к APC. in vitro. Они показывают, что как отрицательно заряженные, так и нейтральные пептиды могут быть доставлены. Режим введения пептидов в клетки, по-видимому, различается для разных соединений, при этом полилизин, по-видимому, временно проницаемость клеточных мембран, тогда как полиаргинин действует через эндоцитарные механизмы. В их спутнике документ (3), процент мышей, иммунизированных пептидом, полученным из опухоль (мастоцитома P815), смешанная с полилизином, была защищена от опухоль.Используя систему меланомы, они показали, что подкожная иммунизация мышей комбинацией из четырех пептидов с некоторыми поликатионами обеспечивает определенную степень защиты при введении профилактически или терапевтически. В обеих системах защита обеспечивается облученными опухолевыми клетками (спроектированными для секреции цитокинов) обеспечивает эквивалентную или лучшую защиту. Хотя частичный защита, замеченная в этих ранних исследованиях, интересна, механизм защита непонятна. Нет демонстрации CTL или T ответы вспомогательных клеток (т.д., производство цитокинов) после только иммунизация. (Спленоциты животных, которые были первыми инокулировали опухолевыми клетками, затем терапевтически получали один из пептидно-катионные смеси секретируют γ-интерферон в ответ на сокультивирование с клетками меланомы, но инокуляция опухолью будет иметь праймировали животных.) Поскольку ни один из экспериментов не содержал контроля группы, иммунизированные только поликатионами и не антиген-специфичные ответы были продемонстрированы только для животных, получавших вакцину, это неясно, была ли наблюдаемая защита специфической для опухолевых антигенов или был неспецифический эффект.Хотя у некоторых видов поли-L-лизин (PLL) может действовать как классический T-зависимый антиген представлен в контексте молекул MHC класса II, и фактически был использован для первоначальной демонстрации контроля гена Ir антитела. ответы у морских свинок (14, 15), у большинства линий мышей гаптены конъюгированные с PLL ведут себя как Т-независимые антигены. Действительно, чтобы породить защитные MHC класса I-ограниченные Т-клетки с помощью CTL, введение Только пептиды, ограниченные MHC класса I, в отсутствие T сотовая помощь, вероятно, будет неоптимальным.Таким образом, пока защита увидела может указывать на полезность этого подхода, было бы важно выяснить механизм защиты, чтобы определить, насколько специфичен иммунитет и насколько широко применим такой подход для другие антигены и системы.
Подходы к вакцинам, описанные Leclerc и соавторами (1) и группа Birnstiel (2, 3) основаны на предоставлении конкретных пептиды, а не белки в качестве антигена. В то время как исследования оба продемонстрировать защитную и / или терапевтическую эффективность у мышей в отношении их соответствующие модели инфекционных заболеваний и рака, пептидный подход вызывает три проблемы: ( i ) пептиды обеспечивают ограниченный, скорее, чем широкая база эпитопов CTL (или хелперов) для популяции, которая имеет гаплотипическое разнообразие людей; ( ii ) нет B-клетки представлены эпитопы, если необходимы ответы антител для полного иммунный набор как антител, так и клеточных ответов; а также ( iii ) хелперные Т-клеточные эпитопы, которые важны для оптимальной генерации CTL-ответов не предусмотрено.Хотя Первая проблема может быть решена путем предоставления смеси пептидов эпитопы для покрытия большинства гаплотипов, обеспечение всего белок или несколько белков, как упоминалось выше, могут дать более широкий охват. Такое положение может быть важным, чтобы избежать генерация моноспецифических CTL-ответов, которые могут привести к антигенным варианты ускользания вируса или опухолевого антигена. Действительно, администрация большого количества аутологичных CTL, моноспецифичных для одного эпитоп из белка nef ВИЧ индивидууму привел к развитие вирусного штамма, у которого отсутствует этот эпитоп (16).Касательно генерация помощи Т-лимфоцитов в случае слияния токсина и антигена белка, токсин предположительно отвечает за обеспечение эпитопы хелперных Т-клеток для генерации первичного ответа, хотя очевидно, что ответы помощников будут основаны на белке впоследствии не присутствовал во время инфекционного заражения. Для пептидно-поликатионный подход, не ясно, являются ли специфические клеточные ответы хелперного или цитолитического фенотипа были вызваны сама иммунизация.
Таким образом, все эти три подхода представляют соблазнительную демонстрацию способность различных стратегий генерировать защитный иммунитет in vivo . Хотя поксвирус (4) и токсин-пептид слитый белок (1) оба ясно продемонстрировали способность генерировать CTL, механизм защиты пептидов-поликатионов (2, 3) менее ясен. Ряд других технологий, генерирующих CTL ответы (и в целом хорошие ответы антител) изучены доклинически и клинически, включая различные адъюванты, ДНК вакцины (17) и другие системы доставки векторов (например,г., другое рекомбинантные вирусы, ретровирусы и бактерии). Самый простой подход который позволяет избежать проблем с пептидами (ограничение эпитопов для популяции с различными гаплотипами MHC и необходимостью обеспечения разнообразных Помощь Т-лимфоцитов для генерации CTL) и потенциальное ограничение, вызванное иммунными реакциями, направленными против «носителя» доставки или вектор (например, фрагмент доставки токсина или вирусный вектор) представляет собой ДНК вакцинный подход (17), где бактериальная плазмида, кодирующая белок антиген под контролем вирусного промотора приводит к в situ поколения антигена с последующим развитием антитела и клеточные иммунные ответы.Этот подход был первым продемонстрировал свою эффективность для создания защитного класса MHC I-ограниченный CTL (18). Важно отметить, что защита была от перекрестной деформации. эффективный; то есть животные были защищены от смертельной опасности с другим штаммом вируса гриппа, чем тот, от которого ген, кодирующий антиген. Напротив, опосредованный антителами защита от вируса гриппа строго специфична для данного штамма вируса. Доказано, что эта технология обеспечивает защиту иммунитет против заражения рядом вирусных, бактериальных и других модели доклинических заболеваний (рак, аллергия и аутоиммунные заболевания) (17) путем генерации CTL и / или ответов антител.Это относительно универсальная технология, не способная вызывать инфекционные само заболевание (как это может происходить с вирусными или бактериальными переносчиками) и имеет способность предоставлять цельные белковые антигены или смеси антигенов (через их гены), тем самым обходя одно из основных ограничений подходы к вакцинам на основе пептидов (эпитопная рестрикция). Нет значительные иммунные ответы были замечены против самого вектора, тем самым позволяя повторно использовать вектор для бустерных доз или для разные вакцины; эта проблема может быть ограничением использования слитые белки или векторы осповакцины.Эти ДНК-вакцины можно легко манипулируют для нацеливания кодируемого белка на разные клеточные места, которые окажутся важными для улучшения конкретных стороны иммунного ответа (антитела, Т-клеточная помощь, CTL).
Эти различные технологии необходимо напрямую сравнивать для конкретных приложения для оценки соответствующих иммунных ответов в контексте специфической патофизиологии заболевания. Пока доклинические эффективность не может быть предиктором клинической полезности, каждый из подходы, описанные в этих статьях, расширили наш арсенал для разработки вакцин и иммунотерапевтических средств, и они обеспечивают дополнительные инструменты для дальнейшего изучения антигена обработка и механизмы защитного иммунитета.
Благодарности
Я хочу поблагодарить доктора.
