Т-клеточный иммунитет при COVID-19
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Пандемия COVID-19 продолжается и усиливается. Все больше людей в мире встречается с данным вирусом. Уже давно стало понятно, что SARS-CoV-2 не исчезнет из человеческой популяции. Вероятность встречи с ним возрастает для каждого.Тем не менее, многие люди, неоднократно и длительно контактировавшие с заболевшими COVID-19 – сами не заболевают, никаких клинических симптомов не появляется. Почему так происходит – один из самых насущных вопросов на всех уровнях попыток понимания текущей пандемии, от бытового до научно-медицинского.
Наиболее вероятный ответ на него – особенности иммунного ответа части населения.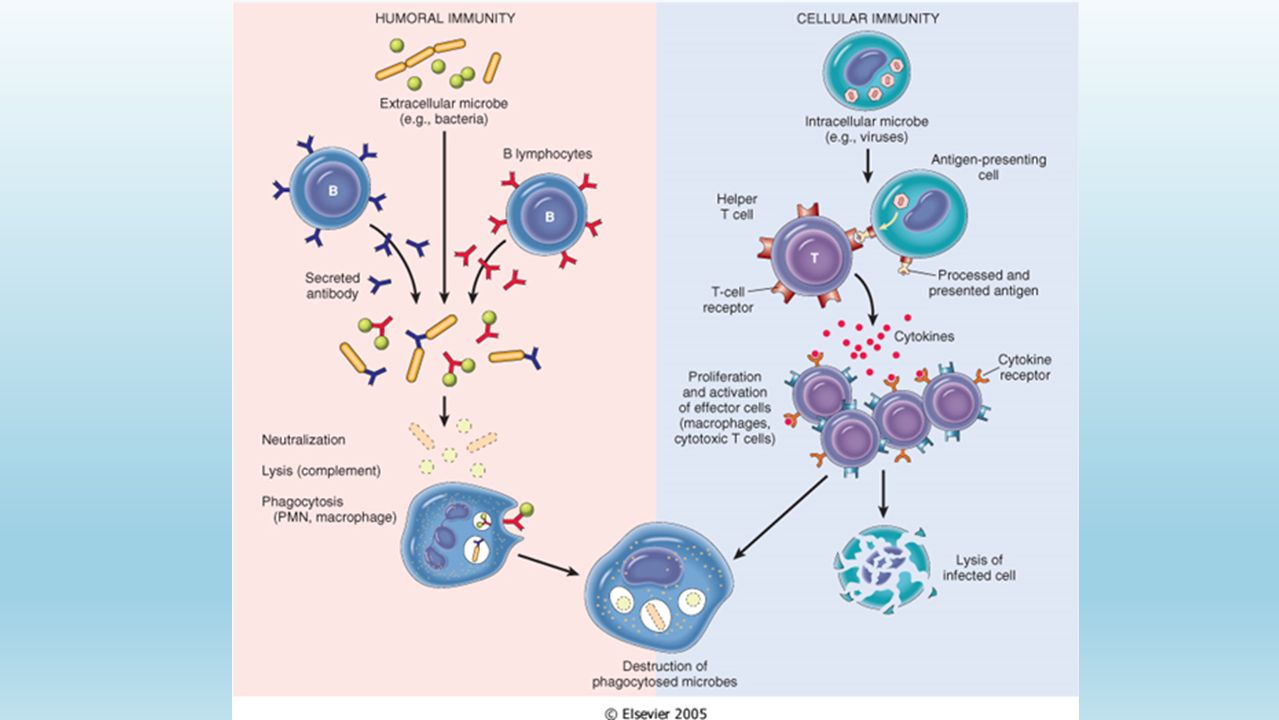
Т-клеточное звено состоит из различных пулов Т-лимфоцитов (обозначаемых общепринятой в иммунологии для указания их характерных маркеров аббревиатурой CD и цифрой/числом – CD-3, CD-4, CD-8, CD-16 и другие). Если ОЧЕНЬ упрощенно, то основные задачи Т-клеточного звена:
Опознать и изучить антиген – передать информацию о нем другим звеньям иммунной системы – уничтожить антиген – запомнить его.
У части людей, в силу особенностей иммунитета (а также, видимо, при инфицировании низкой дозой возбудителя), Т-клеточное звено элиминирует вирус из организма без значимой активации В-клеточного звена, то есть – с низким уровнем антителообразования, нередко не детектируемым (не определяемым) рутинными лабораторными методами. При этом, клинических симптомов часто не развивается. Иными словами, человек может перенести инфекционный процесс без развития болезни, уровень антител у него не определяется, но организм приобретает защиту от повторного заражения. Насколько стойкую и долгую – вопрос остается открытым.
Однако, недавние, достаточно объемные исследования группы ученых из нескольких стран выявили:
- Образование устойчивого Т-клеточного ответа на SARS-CoV-2 у большинства пациентов, встречавшихся с данным вирусом
- При этом у части пациентов, никогда не встречавшихся с SARS-CoV-2 – уже имеются Т-лимфоциты, реагирующие на данный вирус и элиминирующие его из организма.

Подробнее – здесь.
То есть: у части людей есть приобретенная невосприимчивость к SARS-CoV-2, обусловленная, вероятнее всего Т-клетками, которые ранее «активировались» другими коронавирусами и сохранили иммунологическую память.
Данное утверждение сложно проверить массовым лабораторным скринингом. Изучение Т-клеточного ответа к инфекциям – достаточно трудоемкий процесс и чаще удел специализированных научно-исследовательских лабораторий. Однако, уже опубликованные результаты и продолжающиеся работы по изучению Т-клеточного иммунитета при COVID-19 – дают определенную почву для осторожного оптимизма.
А.С. Поздняков, к.м.н.,
инфекционист, главный врач ООО «Инвитро-Сибирь»
Статистика INVITRO по пациентам с выявленными антителами к коронавирусу
Анализы для выявления антител в организме
Что значат результаты IgM, IgG к SARS-CoV-2? Как их понимать?
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
- Положительные IgM, отрицательные IgG
- Положительные М и G
- Отрицательные IgM, положительные IgG
- Отрицательные IgM и IgG
 Инфекционный процесс далеко не всегда «выливается» в болезнь. Понимание этого особенно актуально во время пандемии COVID-19 для объяснения широко используемого термина «бессимптомные носители». Такие пациенты клинически не больны, но эпидемиологически могут быть опасными для окружающих. Никогда ранее, ни при одном инфекционном заболевании, ни при одной эпидемии (пандемии) в мире – не выявляли такое количество клинически здоровых носителей.
Инфекционный процесс далеко не всегда «выливается» в болезнь. Понимание этого особенно актуально во время пандемии COVID-19 для объяснения широко используемого термина «бессимптомные носители». Такие пациенты клинически не больны, но эпидемиологически могут быть опасными для окружающих. Никогда ранее, ни при одном инфекционном заболевании, ни при одной эпидемии (пандемии) в мире – не выявляли такое количество клинически здоровых носителей. Для чего необходимо данное разъяснение? Чтобы было четкое понимание того, что человек с ЛЮБЫМИ положительными результатами Ig к SARS-CoV-2:
- Встречался с данными вирусом
- Но это далеко не всегда значит то, что он переболел COVID-19. Вполне возможно, что он был «бессимптомным носителем». Соответственно: термин «переболел» при интерпретации положительных результатов антител без знания анамнеза и клинической картины – неправилен.
Вариант 1: острый инфекционный процесс.
Вариант 2: инфекционный процесс давностью от 3 до 8-10 недель от момента заражения.
Вариант 3: примерная давность контакта с SARS-CoV-2 – более 10-12 недель.
Вариант 4: либо пациент, получивший данный результат не встречался с SARS-CoV-2, либо контакт был совсем недавно, до недели от момента обследования.
Это – наиболее частые и типичные сочетания результатов IgM и G. Возможно также получение «сомнительного» результата одного из тестов. Что такое «сомнительный результат»?
Это значение, полученное при конкретном анализе пациента, которое не позволяет трактовать данный результат, как «положительный» или «отрицательный». Чаще всего, такой результат возможен при низком уровне антител, который характерен, например, для ранних сроков заболевания. В таком случае необходимо пересдать данный анализ через 10-14 дней для оценки динамики. Возможны также медицинские состояния, при которых уровень ЛЮБЫХ антител может быть снижен (онкологические заболевания, иммуносупрессивная терапия, иммунодефициты и другие).
О том, как меняется уровень антител, о «клетках памяти» — в следующих публикациях.
А.С. Поздняков, к.м.н.,
инфекционист, главный врач ООО «Инвитро-Сибирь»
Статистика INVITRO по пациентам с выявленными антителами к коронавирусу
Анализы для выявления антител в организме
«Иммунитет к COVID-19 выработался шесть лет назад от других «простуд»
Такое предположение сделали американские ученые после исследования образцов крови 2015-2018 годов
Американские исследователи из Института иммунологии в Ла-Хойе опубликовали сенсационные данные. Исследование образцов донорской крови, забор которой проводился в 2015-2018 годах, выявило признаки специфического клеточного иммунитета, аналогичные тем, что появляются при новом коронавирусе. Из этого можно сделать осторожный вывод о том, что организм тех, кто когда-то болел другими разновидностями коронавируса, может оказаться устойчивыми к COVID-19.
Сегодня многие озабочены вопросом: дает ли факт наличия антител к новому коронавирусу гарантию иммунитета? Однако ситуация с иммунитетом гораздо сложнее. Его наличие зависит не только от присутствия в крови антител (иммуноглобулинов), но еще и от наличия важных клеток — Т-лимфоцитов, Т-киллеров (CD8-клеток) и Т-хэлперов (CD4-клеток). Т-киллеры способны по разным приметам опознавать в организме клетки, зараженные вирусами, и, в случае их обнаружения, убивать их самостоятельно или призывать другие клетки на помощь. А Т-хэлперы увеличивают количество и «убийственный» потенциал Т-киллеров, специфичных в отношении конкретного вируса.
Новое исследование американцев (пока это препринт) поставило целью выявить специфические антигены коронавируса, вызывающие наиболее сильный клеточный иммунный ответ — эта информация очень важна для создания будущей вакцины.
Однако параллельно случилось другое важное открытие. В каждом втором образце донорской крови людей, взятой в 2015-2018 годах, были найдены именно специфические СD4+ Т-лимфоцитов, которые сегодня обнаруживают у абсолютно всех переболевших новой коронавирусной инфекцией. То есть можно предположить, что 50% населения, которые еще не встретились с новой инфекцией, уже может иметь к ней иммунитет. Кроме того, сегодня в крови у 70% переболевших COVID-19 обнаруживаются еще и специфические CD8+ Т-лимфоциты. Их нашли в 20% образцов донорской крови.
То есть можно предположить, что 50% населения, которые еще не встретились с новой инфекцией, уже может иметь к ней иммунитет. Кроме того, сегодня в крови у 70% переболевших COVID-19 обнаруживаются еще и специфические CD8+ Т-лимфоциты. Их нашли в 20% образцов донорской крови.
Результаты исследования дают основания предполагать, что значительная часть населения может обладать перекрестным иммунитетом к вирусу SARS-CoV-2 благодаря ранее перенесенным «сезонным простудам», т.е. «обычным» коронавирусам. Те, кто когда-то болел другими «коронами», могли получить антитела, способные справиться с новым вирусом. Возможно, именно поэтому большинство переносят заболевание в легкой форме или вообще без клинической картины заболевания.
«Доноры, чьи образцы крови были подвергнуты анализу, определенно не могли болеть COVID-19 в 2015-2018 годах. Тем не менее, примерно в половине случаев у них обнаружилась специфическая реакция Т-клеток на антигены вируса.
Авторы исследования полагают, что дело в кросс-реактивном иммунитете. Они проверили образцы донорской крови, которые были использованы в эксперименте, на антитела к двум из четырех ранее известных коронавирусов, поражающих человека, HcoV-OC43 и HcoV-NL63, и получили положительный результат анализа. То есть эти люди ранее переболели другими коронавирусными инфекциями, отличными от COVID-19″, — отмечает старший научный сотрудник ЦКБ РАН Сергей Кацалап.
Они проверили образцы донорской крови, которые были использованы в эксперименте, на антитела к двум из четырех ранее известных коронавирусов, поражающих человека, HcoV-OC43 и HcoV-NL63, и получили положительный результат анализа. То есть эти люди ранее переболели другими коронавирусными инфекциями, отличными от COVID-19″, — отмечает старший научный сотрудник ЦКБ РАН Сергей Кацалап.
«Это исследование крайне важно для понимания механизмов адаптивного иммунитета, — рассказал «МК» завкафедрой клинической иммунологии и аллергологии Первого МГМУ им. И.М. Сеченова, академик РАН, заслуженный деятель науки РФ Александр Караулов. – Если этиологию заболевания COVID-19 мы изучили, это новый коронавирус SARS-CoV-2, то в отношении формирования иммунитета к нему идут постоянные дискуссии.
Иногда этот иммунитет патогенный (люди умирают от цитокинового шторма или от избыточного иммунного ответа), иногда протективный (что важно для создания вакцин).
В основе противовирусного иммунитета лежит не только и не столько антительный ответ, сколько Т-клеточный иммунитет, реакция Т-клеток: СД-4-хелперов и CD-8 киллеров, а также клеток памяти. Эти клетки вовлекаются в защиту организма в ответ на вирусную инфекцию, в т.ч. и SARS-CoV-2, и, благодаря им, при острой инфекции происходит элиминация вируса, то есть «очистка» от вируса и формирование иммунитета к последующему заражению. И в этом смысле все идет по классике.
Эти клетки вовлекаются в защиту организма в ответ на вирусную инфекцию, в т.ч. и SARS-CoV-2, и, благодаря им, при острой инфекции происходит элиминация вируса, то есть «очистка» от вируса и формирование иммунитета к последующему заражению. И в этом смысле все идет по классике.
Но вопрос еще и в том, от чего зависит тяжесть течения инфекции? Мы видим, что элиминации вируса не возникает у некоторых пожилых или у людей с тяжелыми заболеваниями типа сахарного диабета или онкологии. У них связь между врожденным и адаптивным иммунитетом нарушена; адаптивного у них недостаточно.
Сегодня основная гипотеза ответа на вопрос, почему одни болеют легко, а другие тяжело, заключается в том, что болеющие легко, по всей видимости, имеют перекрестный иммунитет к другим коронавирусам. Перекрестная реактивность встречается при некоторых инфекциях, например, при гриппе.
Установлен факт, что гриппом h2N1 легче болели те, у кого был перекрестный иммунитет к другим штаммам гриппа, то есть, у них есть Т-клетки-киллеры, активно работающие против вируса, что позволяет выздороветь быстрее.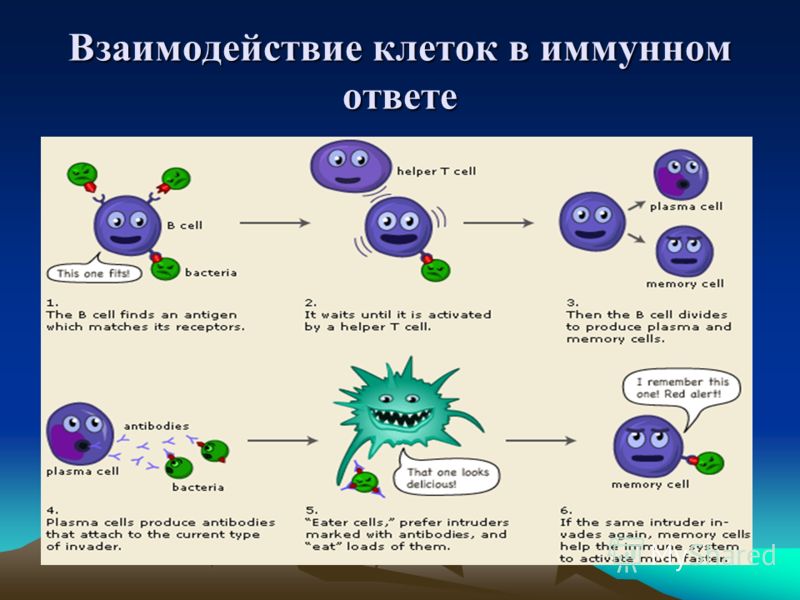 Конечно, работа американцев предварительная, нужно провести дополнительные исследования среди тяжелых пациентов в стационарах. И все же эти данные доказывают, что существование перекрестного иммунитета у здоровых людей в ответ на SARS-CoV-2 возможно. И это нужно учитывать при создании вакцин.
Конечно, работа американцев предварительная, нужно провести дополнительные исследования среди тяжелых пациентов в стационарах. И все же эти данные доказывают, что существование перекрестного иммунитета у здоровых людей в ответ на SARS-CoV-2 возможно. И это нужно учитывать при создании вакцин.
— Получается, что обладатели Т-лимфоцитов к старым коронавирусам при встрече с новым, скорее всего, переболеют легче?
— Да, за счет той самой кросс-реактивности между циркулирующими коронавирусами, которые вызывают обычную простуду. Это примерно 40-60% здоровых лиц, не имеющих контактов с COVID, которым Т-клетки памяти потенциально дадут иммунный ответ, то есть запустят активный и достаточный Т-клеточный цитотоксический (киллерный) ответ, помимо антительного ответа. Но этих киллеров очень сложно определять диагностически, нужно специальные исследования в лаборатории…
Тем временем, в журнале Nature опубликовано еще одно исследование биологов из Вашингтонского университета.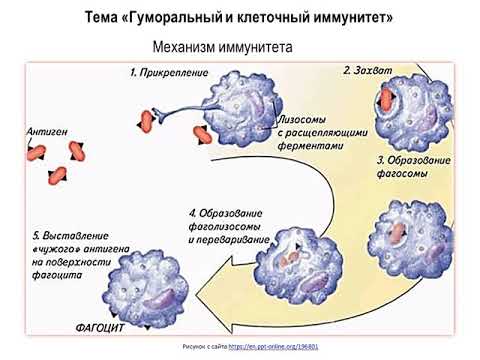 У пациента, который перенес тяжелый острый респираторный синдром (ТОРС, вызываемый SARS-CoV) в 2003 году, обнаружили антитела, способные блокировать работу и SARS-CoV-2.
У пациента, который перенес тяжелый острый респираторный синдром (ТОРС, вызываемый SARS-CoV) в 2003 году, обнаружили антитела, способные блокировать работу и SARS-CoV-2.
Возбудитель атипичной пневмонии SARS-CoV наиболее близок по своему строению и свойствам к новому SARS-CoV-2. Ученым удалось получить восемь разных антител, используя B-клетки памяти того пациента, которые в разной степени блокировали вирус. И одно из них продемонстрировало способность связываться с S-белком нового коронавируса SARS-CoV-2, который отвечает за проникновение вируса внутрь клетки человека, а значит является протективным, то есть защитным.
И это очень важно, так как именно понимание того, какие фрагменты вируса являются протективными, необходимо для разработки эффективной вакцины от коронавирусной инфекции, а также для новых методов лечения COVID-19, предполагают ученые. «Это также путь использования коктейля антител для профилактики и терапии тяжелого течения болезни», — считает академик Караулов.
Ссылка на публикацию: www.mk.ru
Оценка Т-клеточного ответа на коронавирусную инфекцию — Московская клиника
Антитела к коронавирусу могут быть обнаружены не у всех, даже если человек переболел коронавирусной инфекцией, либо антитела вырабатываются, но вскоре исчезают.
На самом деле иммунитет к вирусу, скорее всего, формируется. Для того, чтобы это выяснить, рекомендуется сдать анализ нового типа на Т-клеточный иммунитет.
С помощью оценки (анализа) Т-клеточного иммунитета можно получить точный ответ на вопрос, есть ли у вас защита от коронавируса. Данный вид иммунитета является долгосрочным, по сравнению с гуморальным (при котором выявляются антитела IgG). Антитела IgG могут исчезать спустя несколько месяцев после выздоровления, а Т-клетки живут в организме намного дольше и обеспечивают надежную защиту от заражения.
В Московской клинике вы можете пройти данный анализ и получить результат в течение 2-х суток.
Тест выявляет в крови Т-лимфоциты (Т-клетки), которые специфически отвечают на антигены вируса SARS-CoV-2.
Кому рекомендуется проверить Т-клеточный ответ:
- Люди, перенесшие COVID-19, в крови которых антитела (IgG) не определяются
- Люди с признаками коронавирусной инфекции, подтверждённой результатами КТ, с симптомами, но без антител
- Люди, контактировавшие с больными COVID-19 (на работе или дома)
- Пациенты после иммунопрофилактических мероприятий (вакцинации) для проверки выработки стойкого иммунитета
10 990 Р 17 500 Р*
* Предложение действует до 25 апреля
Готовность результата теста в течение 2-х суток.
При посещении клиники при себе нужно иметь паспорт для официального оформления необходимых документов на проведение исследования.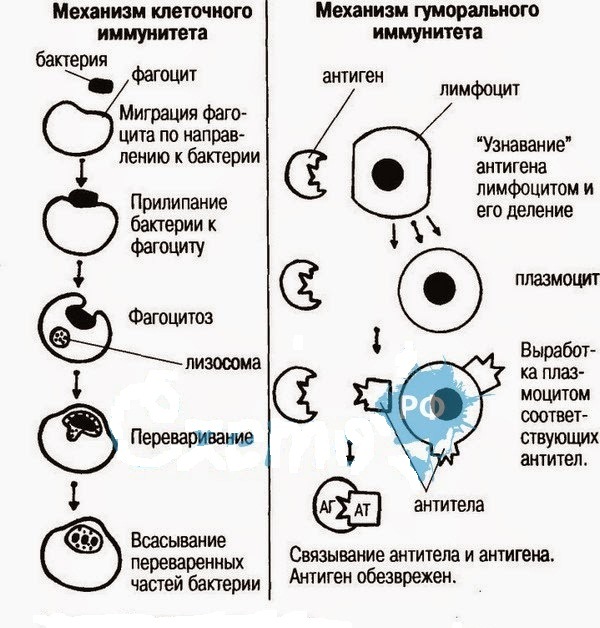
Также вы можете сдать анализ на дому, оформив предварительную заявку.
Стоимость выезда медсестры на дом зависит от территориального расположения пациента.
ПРИНИМАЕМ ЗАЯВКИ ОТ КОРПОРАТИВНЫХ КЛИЕНТОВ
Условия проведения исследования для юридических лиц уточняйте по телефону.
КРУГЛОСУТОЧНАЯ ЗАПИСЬ ПО ТЕЛЕФОНУ:
Тест проводится методом ELISPOT, который имеет ряд преимуществ:
- Проверенная технология обнаружения активных Т-клеток для измерения силы иммунного ответа на инфекцию
- Технология ELISPOT в настоящее время является уникальной в мире
- Платформа ELISPOT доказала свою эффективность для диагностики скрытой латентной туберкулезной инфекции не зависимо от иммунного статуса человека
- ELISPOT широко используется исследователями разных стран при разработке вакцин от COVID-19
- ELISPOT является наиболее перспективной платформой среди методов оценки Т-клеточного иммунного ответа
Коронавирусная инфекция, вызванная SARS-CoV-2, принимает критически разные формы течения: от почти бессимптомных и легких, до тяжелых, с развитием пневмонии и летальным исходом. Почему так происходит, пока остается неясным, но степень иммунной защиты является одним из основных объяснений.
Почему так происходит, пока остается неясным, но степень иммунной защиты является одним из основных объяснений.
Почему важно оценивать клеточный ответ
- Т-клетки отвечают на попадание вируса в организм раньше, чем антитела
- Клеточный ответ обеспечивает долговременную защиту от коронавирусной инфекции
- Одного только исследования на антитела недостаточно, для комплексной оценки защищенности от COVID-19
Как сдается анализ на Т-клеточный иммунитет
- Для теста берется кровь из вены, отделяются Т-лимфоциты, они могут и убить вирус и активировать выработку антител другими лимфоцитами.
- К определенным Т-лимфоцитами добавляют белки вируса
- Если Т-лимфоциты и вирусы раньше встречались, то они выделяют цитокины
- Если цитокинов больше 12 – это означает, что иммунитет есть
Подготовка к анализу
- Пациент не должен испытывать чувство голода, рекомендуется прием пищи и воды перед анализом.
КРУГЛОСУТОЧНАЯ ЗАПИСЬ ПО ТЕЛЕФОНУ:
Иммунитет: защита и нападение
Воспаление представляет собой реакцию ткани на инфекцию или повреждение и имеет следующие симптомы:
- покраснение вследствие усиления кровотока;
- отек вследствие накопления жидкости и клеток в тканях;
- боль вследствие повреждения ткани и раздражения нервных волокон;
- повышение температуры — местное (вследствие усиления кровотока) и/или системное (повышение температуры тела).

В процесс воспаления включаются белки плазмы крови — комплемент и цитокины. Комплементом называется ряд белков плазмы, вступающих в серию каскадных химических реакций в ответ на инфекцию. Это своего рода многоступенчатая сигнальная система, которая маркирует чужеродные микроорганизмы и привлекает в очаг инфекции специальные клетки — «убийцы» патогенов.
В ответ на сигнал тревоги начинается контратака защитной системы организма — запускается клеточный иммунный ответ. В неспецифическом иммунном ответе принимают участие два типа клеток крови — фагоциты и NK-клетки (или натуральные киллеры).
Фагоциты представляют собой крупные лейкоциты, поглощающие и буквально переваривающие внутри себя микроорганизмы и другие чужеродные частицы. Этот процесс называется фагоцитозом. Фагоциты наиболее чувствительны к микроорганизмам, помеченным белком-комплементом или антителами (эти частицы — уже часть адаптивного или специфического иммунного ответа). Кроме клеток, которые атакуют нарушителя по тревоге, в кровотоке также циркулирует регулярный «патруль» или особый вид лейкоцитов — натуральные киллеры. Их мишенью являются злокачественные клетки и клетки, инфицированные вирусами. Врожденный иммунитет быстро активируется на ранних стадиях инфекции. Его механизмы защиты могут ограничивать распространение патогенов в организме, но возможности для устранения чужеродных частиц ограничены и остаются прежними при повторном заражении тем же патогеном. Поэтому для борьбы с инфекцией обычно требуется участие третьей линии защиты — адаптивной иммунной системы (приобретённый иммунитет).
Кроме клеток, которые атакуют нарушителя по тревоге, в кровотоке также циркулирует регулярный «патруль» или особый вид лейкоцитов — натуральные киллеры. Их мишенью являются злокачественные клетки и клетки, инфицированные вирусами. Врожденный иммунитет быстро активируется на ранних стадиях инфекции. Его механизмы защиты могут ограничивать распространение патогенов в организме, но возможности для устранения чужеродных частиц ограничены и остаются прежними при повторном заражении тем же патогеном. Поэтому для борьбы с инфекцией обычно требуется участие третьей линии защиты — адаптивной иммунной системы (приобретённый иммунитет).
Адаптивный (приобретенный) иммунитет развивается после первой встречи с чужеродным агентом. Основными его качествами являются специфичность и иммунологическая память.
У специфического иммунитета в ответ на попадание в организм «чужака» в запасе имеется целая стратегия, которой позавидовали бы многие полководцы. «Основные войска» специфического иммунитета — лимфоциты. Это — специализированные лейкоциты, находящиеся в лимфатической системе. Лимфоциты характеризуются очень длительным периодом жизни — от нескольких лет до десятилетий! Известны три типа лимфоцитов: B-клетки, Т-клетки и натуральные киллеры (о них мы уже рассказывали).
Это — специализированные лейкоциты, находящиеся в лимфатической системе. Лимфоциты характеризуются очень длительным периодом жизни — от нескольких лет до десятилетий! Известны три типа лимфоцитов: B-клетки, Т-клетки и натуральные киллеры (о них мы уже рассказывали).
Для развития адаптивного иммунитета требуется специфическая мишень — антиген. Антиген представляет собой вещество (обычно крупную молекулу), которая активирует иммунный ответ. Один микроорганизм обычно имеет большое количество антигенов, например, поверхностные структуры, такие как компоненты клеточной стенки, полисахариды капсулы, жгутики и т. д., или внеклеточные белки, такие как токсины или ферменты, вырабатываемые микроорганизмом.
Сначала происходит выработка В-клетками оружия против нарушителей — белка, который прореагирует с антигеном и сделает его безвредным. Эти белки носят название антител, называемых также иммуноглобулинами (Ig). Антитела очень специфичны и способны связываться только с антигеном той же структуры, что изначально стимулировал их образование. Когда антитело находит соответствующий ему антиген, они соединяются наподобие ключа, вставляемого в замочную скважину.
Когда антитело находит соответствующий ему антиген, они соединяются наподобие ключа, вставляемого в замочную скважину.
Затем приобретенный иммунитет начинает действовать сразу на два фронта: гуморальный иммунный ответ направлен на антигены, присутствующие в плазме крови, а клеточный иммунный ответ — на патогены, присутствующие внутри клеток.
В процессе гуморального иммунного ответа В-клетки, активированные специфическими антигенами, начинают усиленно делиться с образованием большого количества идентичных клеток-клонов, каждая из которых способна бороться с данным антигеном. Антитела B-клеток также привлекают фагоциты, уничтожающие и переваривающие антиген-мишень.
Клеточный иммунитет использует «специализированные силы» — T-хелперы и цитотоксические T-клетки, непосредственно атакующие и уничтожающие «войска противника» — инфицированные клетки.
После того, как война с инфекцией выиграна, В- и Т-клетки, активированные антигенами, переходят в состояние покоя и становятся лимфоцитами памяти, специфичными по отношению к данному антигену или патогену. При повторном заражении аналогичным или очень похожим (антигенно-аналогичным) микроорганизмом, они обеспечивают быстрый и мощный иммунный ответ. Высокие концентрации нужных антител достигаются уже через 1 — 2 дня после инфицирования.
При повторном заражении аналогичным или очень похожим (антигенно-аналогичным) микроорганизмом, они обеспечивают быстрый и мощный иммунный ответ. Высокие концентрации нужных антител достигаются уже через 1 — 2 дня после инфицирования.
Итак, приобретенный иммунитет характеризуется тремя основными особенностями:
- Специфичность: каждое антитело или активированная Т-клетка реагирует только со специфичным антигеном, вызвавшим ее образование. При этом они не реагируют с другими антигенами и защищают организм только от заболеваний, характеризующихся присутствием данного антигена.
- Память: после того, как в процессе адаптивного иммунного ответа произошло образование специфичного антитела или Т-клетки, производство антител или активация Т-клеток происходит быстрее и в больших количествах. Данная особенность является основой эффекта многих вакцин.
-
Толерантность к собственным тканям: механизмы адаптивного иммунного ответа в норме способны отличать собственные структуры организма от чужеродных.

Анализ на клеточный иммунитет – сдать по цене 10350 руб. в Москве
Анализ на клеточный иммунитет проводится по следующим показателям:
- Т-лимфоциты и процент активных клеток,
- процент цитолитических Т-лимфоцитов,
- Т-хелперы,
- процент некомитированных Т-хелперов,
- Т-супрессорно/ цитотоксические лимфоциты,
- Соотношение CD4+ / CD8+,
- В-лимфоциты,
- Натуральные киллеры,
- количество активных натуральных киллеров.
Иммунная система человека разделена на 2 части: гуморальный и клеточный иммунитет. При активации гуморального иммунитета в защиту организма включаются молекулы, находящиеся в плазме крови. За клеточный иммунитет отвечают непосредственно клетки иммунной системы. Эта система борется с грибами, вирусами, опухолями. Именно благодаря клеточному иммунитету происходит отторжение тканей.
Ключевое значение в уничтожении клеток вируса имеет фагоцитоз. Это защитная реакция организма, в процессе которой особые клетки — фагоциты — захватывают и нейтрализуют опасные микроорганизмы.
Это защитная реакция организма, в процессе которой особые клетки — фагоциты — захватывают и нейтрализуют опасные микроорганизмы.
Анализы состояния клеточного и гормонального иммунитета играют важную роль в диагностике различных системных и аутоиммунных заболеваний.
Как проводится анализ на клеточный иммунитет?
Взятие биоматериала на анализ на клеточный иммунитет осуществляется в офисах нашей лаборатории. Анализ крови проводится с использованием современного оборудования, а также проверенных медицинских методик. Поэтому наши клиенты всегда получают достоверные результаты в короткие сроки.
Анализ крови на иммунный статус принимается в лаборатории «Литех» только пн-вт с 8:00-13:30.
Забор материала производится утром, натощак. Накануне процедуры рекомендуется исключить употребление жирной пищи, алкоголя, прекратить прием антибиотиков.
Для исследования клеточного иммунитета используется венозная кровь.
Участникам тестирования на Т-клеточный иммунитет к коронавирусу перестанут выдавать результаты
Бесплатное тестирование москвичей проводится в рамках исследования столичного департамента здравоохранения. Почему данные решили попридержать?
Почему данные решили попридержать?
В Москве сдать тест на Т-клеточный иммунитет к коронавирусу теперь можно только ради науки. Департамент здравоохранения распорядился больше не раскрывать результаты анализов.
В последние месяцы на фоне сообщений о быстром падении титров антител у части переболевших в российских и зарубежных СМИ стали чаще писать о так называемых Т- и B-лимфоцитах (или Т- и B-клетках). Это главные составляющие клеточного иммунитета. Предполагается, что клетки памяти, то есть знакомые с COVID-19 лимфоциты, будут сохраняться в организме дольше антител. Например, у некоторых переболевших SARS-CoV-1 в 2003 году их выявляюют до сих пор.
Где можно пройти такое тестирование и узнать о своей защищенности? Известно, что коммерческих тестов на клеточный иммунитет в России не существует, а в США первую подобную систему зарегистрировали в ноябре. Но оказалось, что сдать такой анализ в Москве не составляет труда, рассказал Business FM житель столицы Сергей.
Бесплатное тестирование москвичей проводится в рамках исследования столичного департамента здравоохранения под названием «Оценка напряженности клеточного и гуморального иммунитета к возбудителю COVID-19 у жителей города Москвы». Пройти его можно в филиалах четырех поликлиник: № 3, № 45, № 62 и № 68. В неофициальных телеграм-чатах участников испытаний «Спутника V» многие пишут о том, что уже получили результаты. Однако, как сообщили Business FM на горячей линии, правила исследования недавно изменились.
— Да, вы можете сделать тест. У нас работают четыре поликлиники на забор. Но хотела бы уточнить, что мы не предоставляем результаты в индивидуальном порядке. Мы присылали результаты, но у людей возникало очень много вопросов относительно того, что это значит. Люди стали делать неоднозначные выводы, которые пока делать нельзя на основе этих результатов. Поэтому появилось распоряжение результаты пока не выдавать. Научные центры анализируют только общий массив данных, не выделяя индивидуально.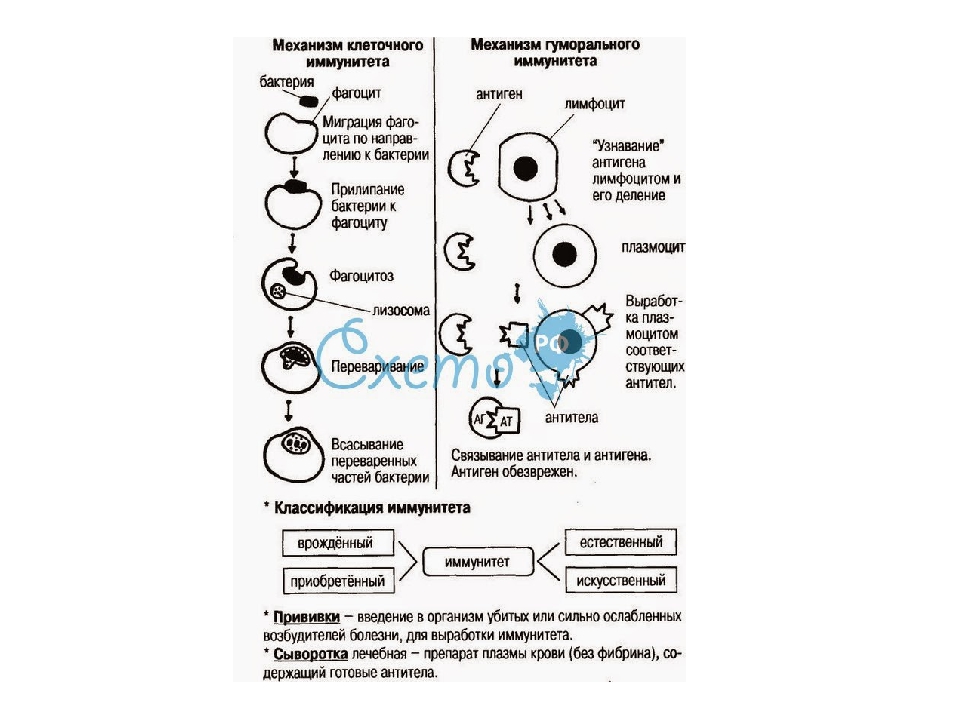 Это научная работа, это не клинический анализ.
Это научная работа, это не клинический анализ.
— А те, кто получил свои результаты, они им о чем говорят?
— Ни о чем не говорят. У них есть фактическое знание, выявлены ли признаки клеточного иммунитета либо нет. Но делать какие-то выводы на основе этого, к сожалению, пока еще рано. Многие люди интересуются этим для того, чтобы понимать: делать прививку или нет, защищаться или нет. На данный момент мы не можем сказать ничего точно. Пока мы только изучаем.
Мотивация департамента понятна. Наличие в организме неопределенного количества знакомых с коронавирусом лимфоцитов не гарантирует защиты от COVID-19, а положительный результат тестирования может снизить бдительность человека. Тем не менее некоторым участникам индивидуальные данные пока еще выдаются, говорит адвокат из Москвы Денис Скрябин.
Тем временем в России разрабатывается новая тест-система для оценки клеточного иммунитета, сообщил 8 декабря министр здравоохранения Михаил Мурашко.
Добавить BFM.ru в ваши источники новостей?
Гуморальный против клеточного иммунитета | Technology Networks
Гуморальный иммунитет и клеточный иммунитет — это два типа адаптивного иммунного ответа, которые позволяют человеческому организму целенаправленно защищаться от вредных агентов, таких как бактерии, вирусы и токсины. Несмотря на то, что между этими ветвями иммунного ответа есть некоторое совпадение — оба они зависят от функций лимфоидных клеток — есть также некоторые важные различия.
Можно приобрести гуморальный иммунитет к конкретной инфекции или заболеванию, если вводить антитела от кого-то, кто ранее был подвержен той же инфекции, в обход гуморального ответа.Однако иммунитет, опосредованный антителами, включает набор молекулярных компонентов и процессов, которые отличаются от иммунитета, опосредованного клетками. В этой статье мы определяем гуморальный иммунитет и клеточный иммунитет, обсуждая различные иммунные процессы, цели и важные типы клеток.
Гуморальный иммунитет — это опосредованная антителами реакция, которая возникает, когда в организме обнаруживаются чужеродные вещества — антигены. Этот чужеродный материал обычно включает внеклеточных захватчиков, таких как бактерии. Этот механизм в первую очередь запускается лимфоцитами В-клеток, типом иммунных клеток, которые вырабатывают антитела после обнаружения специфического антигена.
Наивные В-клетки — это лимфоциты, которые циркулируют по всему телу в лимфатической системе. Эти лимфоциты экспрессируют множество антиген-специфических молекул, которые необходимы для обнаружения инфекционных агентов в организме человека. Всякий раз, когда наивные В-клетки сталкиваются с антигеном в лимфатической системе, они подвергаются процессу дифференцировки, который приводит к созданию В-клеток памяти и эффекторных В-клеток.
Во время этой дифференцировки В-клетки памяти и эффекторные В-клетки продуцируют те же антиген-специфические молекулы, что и их родительские наивные В-клетки. С помощью Т-клеточных лимфоцитов, в свою очередь активируемых рецепторами МНС класса II, которые распознают антигены, ассоциированные с микробами, активированные В-клетки памяти экспрессируют эти антигенспецифические молекулы на своей поверхности, в то время как эффекторные В-клетки секретируют эти молекулы в кровь для связывания интересующий антиген.
С помощью Т-клеточных лимфоцитов, в свою очередь активируемых рецепторами МНС класса II, которые распознают антигены, ассоциированные с микробами, активированные В-клетки памяти экспрессируют эти антигенспецифические молекулы на своей поверхности, в то время как эффекторные В-клетки секретируют эти молекулы в кровь для связывания интересующий антиген.
Что такое антитело?
Антитела — это тяжелые белки размером примерно 10 нанометров. Эти молекулы производятся В-клетками для выявления и нейтрализации вредных агентов, таких как инфекционные бактерии, грибы и вирусы.Эти Y-образные белки содержат антигенсвязывающие сайты, которые специфически связываются со своими антигенами-мишенями.
Когда антитела эффективно связываются со своим антигеном-мишенью, они могут либо нейтрализовать свой антиген-мишень напрямую, блокируя нормальное связывание антигена, либо они могут вызвать рекрутирование других иммунных клеток или молекул, которые способствуют удалению или разрушению антигенов. У млекопитающих такие антитела имеют множество форм, обычно известных как изотипы.
У млекопитающих такие антитела имеют множество форм, обычно известных как изотипы.
Каждая В-клетка производит свой собственный набор антител с уникальными антиген-специфическими сайтами связывания.Первоначально наивные В-клетки продуцируют антитела, которые остаются связанными с клеточной поверхностью, так что их открытые антигенсвязывающие сайты могут обнаруживать потенциальные патогены, токсины и чужеродный материал. Эта поверхностно-связанная форма антитела известна как иммуноглобулин.
Когда антиген, соответствующий сайту связывания антигена, связывается с наивной В-клеткой или В-клеткой памяти, он активирует В-клетку, чтобы производить и секретировать больше антиген-специфических антител. Когда В-клетка полностью созревает, она называется плазматической клеткой и будет продолжать вырабатывать и секретировать антиген-специфические антитела до конца своего жизненного цикла.
Когда антитела попадают в кровоток, эти свободно плавающие белки готовы действовать как защитные молекулы с прямыми и косвенными иммунными функциями.
 К этим функциям относятся:
К этим функциям относятся:- нейтрализация инфекционных агентов — посредством блокирования или антителозависимой клеточной цитотоксичности
- активация системы комплемента — комплемент-зависимая цитотоксичность
- связывание чужеродных веществ, подлежащих разрушению — опсонизация и фагоцитоз
Антитела нейтрализуют антигены прежде всего через механизмы прикрепления и накопления.Например, агрегация нейтрализующих антител на вирусных частицах, соответствующих антигену, блокирует способность этого вируса инфицировать другие клетки.
Антитела также могут участвовать в процессах, которые приводят к лизису или уничтожению инфицированных или антигенпрезентирующих клеток за счет активации каскада комплемента или взаимодействия с эффекторными клетками и высвобождения цитокинов. Система комплемента — это часть врожденного иммунитета, которая увеличивает способность антител и лимфоцитов очищать организм от патогенов и инфицированных клеток.Наконец, антитела, которые покрывают патогены или инфицированные клетки, могут притягиваться (опсонизироваться) и интернализоваться макрофагами во время фагоцитоза.
Гуморальный иммунитет зависит от лимфоцитов, обеспечивающих защиту от инфекции посредством функций, опосредованных антителами, но это не единственная форма адаптивного иммунитета, в котором участвуют лимфоциты костного мозга.
В отличие от гуморального иммунитета , клеточный иммунитет не зависит от антител для его адаптивных иммунных функций.Клеточно-опосредованный иммунитет в первую очередь обеспечивается зрелыми Т-клетками, макрофагами и высвобождением цитокинов в ответ на антиген.
Т-клетки, участвующие в клеточно-опосредованном иммунитете, полагаются на антигенпрезентирующие клетки, которые содержат мембраносвязанные белки MHC класса I, чтобы распознавать внутриклеточные антигены-мишени. Специфичность связывания между белками MHC и чужеродными антигенами важна для созревания и дифференцировки наивных Т-клеток в Т-хелперы или Т-клетки-киллеры.
Клеточный иммунитет обычно проявляется в тех участках тела, где клетки инфицированы вирусом, бактериями или грибами (внутриклеточные захватчики).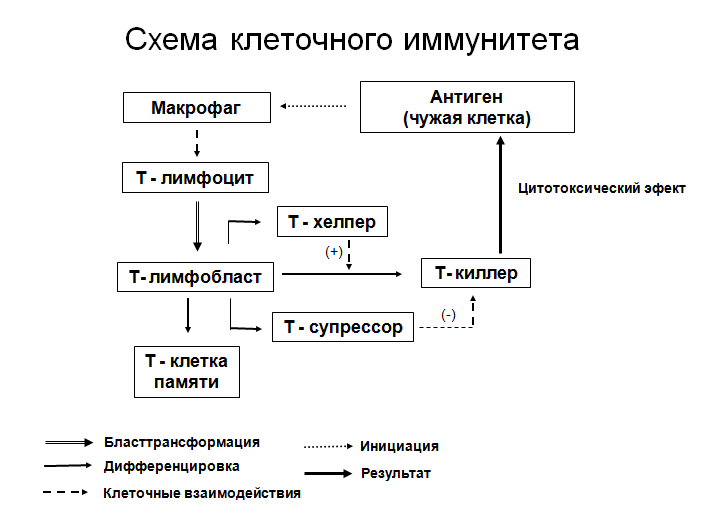 С помощью белков MHC класса I Т-клетки также могут распознавать раковые клетки.
С помощью белков MHC класса I Т-клетки также могут распознавать раковые клетки.
Основные типы лимфоцитов, участвующих в клеточно-опосредованном иммунитете, включают хелперные Т-клетки, Т-киллеры и макрофаги. Когда «вспомогательная» Т-клетка находит в организме антигенпрезентирующую клетку, она высвобождает набор сигнальных белков, называемых цитокинами. Эти цитокины активируют «киллерные» Т-клетки и макрофаги, чтобы перейти к интересующему участку, чтобы разрушить антигенпредставляющую клетку (ы).
Гуморальный и клеточно-опосредованный иммунитет: таблица
| | Гуморальный | Клеточно-опосредованный |
| Тип | Опосредованный антителами ответ | Опосредованный Т-клетками ответ |
| Участок активности | Внеклеточные жидкости | Расположение антигенпрезентирующей ткани |
| Участвующие основные типы клеток | В-клетки | Т-клетки |
| Скорость начала | Быстрый ответ при обнаружении | Медленный ответ |
| Тип антигена | Внеклеточные патогены | Внутриклеточные патогены, раковые клетки |
Метод удаления 093 | Опосредованная антителами деструкция 900 93 | Лизис клеток и запрограммированная смерть |
| Участвующие белки MHC | Белки MHC класса II | Белки MHC класса I |
Клеточный иммунный ответ на covid-19
- Херб Ф.
 Сьюэлл, заслуженный профессор иммунологии и консультант-иммунолог1,
Сьюэлл, заслуженный профессор иммунологии и консультант-иммунолог1, - Раймонд М. Агиус, заслуженный профессор медицины труда и окружающей среды2,
- Марсия Стюарт, рядовой член и заслуженный академик3,
- Дениз Кендрик, профессор исследований в области первичной медико-санитарной помощи и врач общей практики1
- 1 Ноттингемский университет, Ноттингем, Великобритания
- 2 Манчестерский университет, Манчестер, Великобритания
- 3 De Montfort University , Leicester, UK
- Соответствует: H Sewell herb.sewell {at} nottingham.ac.uk
Т-клетки могут быть ценными союзниками в борьбе с пандемией
Защитные и устойчивые иммунные ответы на вирусные инфекции или вакцины обычно возникают в результате комбинированного действия лимфоцитов: В-клеток (ответственных за иммунитет к гуморальным антителам). ) и Т-клетки (отвечающие за клеточный иммунитет и помогающие ответным В-клеткам).
В-клетки продуцируют определяемые антитела классов IgM, IgG и IgA, а также меньшие количества IgD и IgE. В отношении SARS-CoV-2, возбудителя covid-19, основное внимание уделяется антителам IgM, IgG и IgA, которые могут нейтрализовать вирус, связываясь со спайком и другими мембранными белками и тем самым предотвращая инфекцию.1 Понимание менее известных ролей Т-клеток и клеточного иммунитета углубит наше понимание патогенеза covid-19 и поможет получить информацию как при разработке вакцины, так и о стратегиях сдерживания пандемии.
Эффективный иммунный ответ на SARS-CoV-2 включает четыре типа или подмножества Т-клеток: Т-хелперные клетки (CD4) отвечают за клеточный иммунитет и помогают В-клеткам вырабатывать нейтрализующие антитела; цитотоксические или киллерные Т-клетки (CD8) напрямую убивают инфицированные клетки — с помощью хелперных Т-клеток2; другие Т-клетки (включая клетки Т-17 (Th27)) вызывают воспалительные реакции, которые помогают контролировать инфекции3; и регуляторные Т-клетки (T reg) помогают сдерживать иммунный ответ, предотвращая чрезмерную реакцию и повреждение тканей.
CD4 Т-клетки гарантируют, что все эти компоненты работают вместе, секретируя небольшие цитокины короткого действия, которые связываются с рецепторами на клетках-мишенях. Важно отметить, что все типы В- и Т-клеток обладают иммунологической памятью после первой встречи с патогеном. Это обеспечивает более быструю эффективную реакцию после второй встречи с тем же патогеном или с близкородственным микроорганизмом (перекрестная реакция).
Предварительные исследования, проведенные в США и Европе, недавно подтвердили наличие Т-лимфоцитов, специфичных для SARS-CoV-2, у людей с острым COVID-19 и выздоравливающих после инфекции.456 Они сообщают о хелперных и киллерных Т-клетках, специфичных для SARS-CoV-2, у людей с антителами и без них.6 Более неожиданно они обнаружили специфические Т-клетки у людей, не подвергавшихся воздействию SARS-CoV-2 в анамнезе, — людей, которые неоднократно брали мазки. отрицательный на вирус4. Эти клетки даже были обнаружены в хранящейся крови, взятой перед пандемией (2015–2018 гг.). Наконец, исследования выявили сильные Т-клеточные реакции памяти у людей, выздоравливающих от COVID-19. Клетки памяти имеют решающее значение для защитного и стойкого иммунитета.
Каковы последствия этих ранних результатов? В основном, эти исследования показывают, что хороший иммунный ответ Т-клеток и иммунологическая память сопровождают естественное воздействие или инфицирование SARS-CoV-2, что доказательства этих реакций присутствуют у некоторых людей, которые, по-видимому, никогда не сталкивались с этим вирусом, и что Т-клетки иммунные ответы могут существовать в отсутствие выявляемых антител.
В совокупности эти особенности предполагают, что вакцины-кандидаты7 должны быть нацелены на стимуляцию как В-клеточных (нейтрализующих) антител, так и противовирусных ответов Т-клеток.8 Ранние фазы клинических испытаний вакцин-кандидатов, разработанных в Оксфорде, Великобритания, и в Китае, действительно показывают наличие сопутствующих нейтрализующих В-клеток антител и противовирусных Т-клеток у вакцинированных здоровых добровольцев, 910 улучшающих перспективы защитного иммунитета. Такой комбинированный ответ является характерной чертой многих успешных вакцин, включая вакцины против ветряной оспы, гриппа, кори и гепатита B.
Иммунная память
То, что у некоторых «наивных вирусов» участников ранних исследований был уже существующий помощник памяти ( 50% участников) и Т-киллеры (20%) с потенциальной активностью против SARS-CoV-2 интригуют.Эти клетки могут возникать в результате перекрестных реакций на другие циркулирующие коронавирусы, такие как некоторые вирусы простуды, и могут быть долгожданным намеком на возможный фоновый иммунитет к covid-19 в группах риска — даже в отсутствие антител.
Любая клеточная иммунная память на SARS-CoV-2 в популяции может усилить реакцию на вакцины, а также может дать программе вакцинации фору на пути к коллективному иммунитету. Коллективный иммунитет — это устойчивость населения к распространению инфекции, достигаемая, когда достаточно высокая доля людей имеет иммунитет, обычно посредством вакцинации.1112
Существующие ранее Т-хелперы памяти, специфичные для SARS-CoV-2, могут повысить выработку нейтрализующих антител IgG в крови недавно подвергшихся воздействию людей, а также могут усилить защиту антител на слизистых оболочках за счет IgA в слюне, слезах или носу секреции.131415 Такие антитела IgA действуют как защитный барьер в общих точках проникновения вируса. В настоящее время необходимы исследования для дальнейшей характеристики этих возможных иммунных путей, включая В- и Т-клетки памяти в тканях слизистой оболочки.
Исследования должны также изучить роль регуляторных Т-лимфоцитов в тяжелой форме COVID-19, в частности, синдроме цитокинового шторма16, а также документально подтвержденную связь между высокими титрами антител IgG и худшими исходами заболевания, включая смерть.17 Оба могут отражать неэффективный контроль воспаления регуляторными Т-клетками.
Недавние открытия роли Т-клеток в covid-19 дают нам основания для осторожного оптимизма в отношении того, что клеточные иммунные ответы могут быть ценным союзником в глобальных усилиях по борьбе с этой и будущими пандемиями.
Сноски
Конкурирующие интересы: BMJ вынес решение об отсутствии дисквалифицирующих финансовых связей с коммерческими компаниями. Авторы заявляют о следующих других интересах: Нет
Происхождение и рецензирование: Заказано, не рецензировано
Эта статья предоставляется бесплатно для использования в соответствии с положениями и условиями веб-сайта BMJ в течение всего срока действия соглашения. 19 пандемии или до тех пор, пока BMJ не определит иное.Вы можете использовать, скачать и распечатать статью в любых законных некоммерческих целях (включая анализ текста и данных) при условии сохранения всех уведомлений об авторских правах и торговых марок.
https://bmj.com/coronavirus/usageАнтитела и клеточный иммунитет при тяжелой и легкой форме COVID-19
Пандемия COVID-19, вызванная тяжелым острым респираторным синдромом, коронавирусом 2 (SARS-CoV-2), является беспрецедентным глобальным кризисом, создающим огромную неопределенность — почти для всех сфер жизни.Правительства быстро разрабатывают и осуществляют меры реагирования на чрезвычайные ситуации, чтобы справиться с разворачивающимся кризисом. В то же время ученые со всего мира работают над разработкой вакцин против COVID-19. В настоящее время некоторые исследования смещаются в сторону понимания причин возникновения болезни.
Теперь новое исследование, опубликованное в журнале Signal Transduction and Targeted Therapy в августе 2020 года, показывает, что, хотя гуморальный и Т-клеточный иммунные ответы более устойчивы при тяжелой инфекции, болезнь активирует Т-клетки памяти как часть адаптивной иммунной системы. у пациентов с COVID-19 независимо от тяжести заболевания.
Адаптивный иммунитет при патогенной инфекции CoV
Более ранние исследования показали, что при MERS, SARS и гриппе адаптивные иммунные клетки и особенно лимфоциты играют жизненно важную роль в защите организма от вируса. Многие исследования подтвердили это на COVID-19, когда в борьбе задействованы как антитела, так и клеточная защита. Таким образом, настоящее исследование направлено на изучение иммунной системы выздоравливающих пациентов с COVID-19, чтобы получить более четкое представление о том, как происходит выздоровление и как адаптивный иммунитет связан с тяжестью заболевания.
Исследование было сосредоточено на периферических Т-клетках и В-клетках пяти и четырех выздоравливающих, которые были тяжело и умеренно / легко больны COVID-19. Степень тяжести заболевания была классифицирована на основе Китайского клинического руководства по диагностике и лечению пневмонии COVID-19.
Активация Т-клеток и В-клеток в иммунной системе 3d иллюстрации. Кредит изображения: Sciencepics / Shutterstock
Паттерн COVID-19
Затем исследователи изучили использование генов V (D) J среди субъектов, поскольку они определяют различные паттерны и предпочтения рецепторов В- и Т-клеток у этих пациентов.Они обнаружили, что здоровые люди, люди с легкой формой COVID-19 и люди с тяжелой формой COVID-19 имеют разные клонотипы. Было много генов из семейства IGHV. Один из этих клонов B-клеток редко встречался в B-клетках памяти IgG от здоровых людей, но был чрезмерно представлен у одного пациента, который выздоровел после тяжелой болезни. Наиболее часто представленные сегменты VJ в этом семействе генов клонов рецепторов В-клеток также были специфичны для вируса.
Сравнивая тяжелое заболевание с легким, они обнаружили, что гены IGHV3-23, IGHV3-48, IGHV1-2 и IGHV4-34 были доминирующими в первом случае.Также было обнаружено, что некоторые гены сильно экспрессируются при других вирусных инфекциях, включая грипп и цитомегаловирус.
На основе общих генов в группах IGHV и IGHJ они обнаружили общедоступные кластеры последовательностей антител у пациентов, но не в контрольной группе, что они приписали присутствию COVID-19. Всего среди пациентов с COVID-19 было 19 общих антител IgG и 25 общих антител IgA. Дальнейшее исследование поддерживает идею о существовании гуморального и клеточного адаптивного иммунитета, специфичного для COVID-19 в легкой и тяжелой форме.
Изменения в составе и функциях клеток
Исследователи не обнаружили заметных изменений в составе Т-клеток у выздоровевших пациентов с COVID-19, но у всех пациентов была подмножество Т-эффекторных клеток памяти (ТЕМ) CD8 по сравнению с контрольной группой. Это может указывать на то, что эти клетки размножаются при этой инфекции. Подмножество CD8 + терминальных эффекторных (TTE) клеток обнаруживается на повышенных уровнях, особенно при тяжелой инфекции. По большей части это цитотоксические клетки. И CD4, и CD8 TTE, а также CD8 TEM, клонально увеличиваются у пациентов.
Комментарий исследователей: «Эти клонально увеличенные Т-клетки могут представлять собой Т-клетки CD8 + или CD4 +, специфичные для SARS-CoV-2. Однородность транскрипции у пациентов с COVID-19 [может дополнительно подтвердить эту] идею ».
Инвариантные T-клетки слизистой оболочки (MAIT) заметно уменьшаются как у легких, так и у тяжелых пациентов, что, возможно, отражает неполное восстановление иммунной системы у этих пациентов на ранней стадии. Это наблюдалось и при других вирусных заболеваниях. Присутствие плазмобластов у выздоровевших в тяжелой форме пациентов дополнительно указывает на то, что эти пациенты отвечают более устойчивым антителным ответом по сравнению слегкое заболевание. Клональная экспансия BCR и активации B-клеток подтверждает этот вывод.
Дифференциальная экспрессия гена
Дифференциально экспрессируемые гены (DEG) показывают, что некоторые пути, связанные с иммунитетом и воспалением, экспрессируются на явно разном уровне в CD4 T-клетках, CD8 T-клетках и AEBC у всех пациентов по сравнению со здоровыми людьми из контрольной группы. К ним относятся пути продукции цитокинов и адгезии лейкоцитов к клеткам, в основном в Т-клетках CD4 или CD8. Путь активации Т-клеток также был активирован Т-лимфоцитами CD8 в трех из пяти тяжелых случаев.Тем не менее, противовирусные иммунные пути были чрезмерно экспрессированы в Т-клетках одного пациента с тяжелым и одного легкого поражения.
У тяжело больных пациентов также наблюдалась большая активация генов, касающихся опосредованного В-клетками гуморального иммунитета, активации комплемента, опосредованного Ig гуморального иммунного ответа и фагоцитоза. Это подразумевает более широкий гуморальный иммунный ответ при тяжелом заболевании, включая системный провоспалительный процесс, опосредованный активацией комплемента.
Однако большинство адаптивных иммунных клеток не смогли экспрессировать провоспалительные цитокины, что может означать, что в большинстве случаев они возвращаются к норме после выздоровления пациента.Экспрессия пути митоген-активируемой протеинкиназы (MAPK) была значительно снижена у всех пациентов по сравнению с контрольной группой, и это согласуется с предыдущим исследованием, показывающим, что это признак выздоровления.
Специфические подмножества Т-клеток против SARS-CoV-2
Исследователи обнаружили, что все выздоровевшие пациенты показали активность IFN-γ-секретирующих или специфических Т-клеток памяти в ответ на воздействие одной или нескольких из десяти групп вирусных пептидов. Это экспериментальное подтверждение специфического Т-клеточного иммунитета, развиваемого у этих пациентов.
У каждого из пациентов доля таких клеток против S-пептидов была намного выше, чем у любого другого. Т-клетки у тяжелобольных пациентов в 12 раз превышали ответ на пять или более вирусных белков, но у пациентов с легкой степенью тяжести ответ был только в 3,5 раза по сравнению с исходными уровнями до стимуляции.
Это указывает на то, что S-специфические Т-клетки памяти, а также те, которые специфичны для других белков, продуцируются и поддерживаются выздоровевшими пациентами. Еще одним важным открытием является то, что у тяжелобольных пациентов иммунный ответ был более устойчивым, чем у умеренно больных.Это может означать, что первый имеет лучшую Т-клеточную память против этого вируса, чем второй.
Последствия
Исследователи резюмируют: « Взятые вместе, эти результаты означают, что SP и MP могут испытывать разные клеточные и гуморальные иммунные ответы, которые, вероятно, связаны с разной степенью тяжести заболевания ».
Исследователи обнаружили, что адаптивные иммунные ответы претерпели специфические изменения в репертуаре с периферическими лимфоцитами, показывающими другой паттерн функции и распределения.Оказалось, что тяжелые пациенты имели более сильный и устойчивый ответ Т- и В-клеток.
Результаты показали, что в адаптивной иммунной системе появились три значительных кластера Т-клеток памяти. Пептиды вирусного М-белка вызывают Т-клеточный ответ у большинства пациентов с COVID-19. Чем тяжелее фенотип заболевания, тем сильнее гуморальный и Т-клеточный ответ у выздоровевших пациентов.
Более высокий уровень экспрессии таких путей указывает на сохранение активного иммунитета после исчезновения клинических симптомов, подтверждая, что это заболевание требует более длительного периода восстановления для восстановления здоровья.Как состав, так и функция лимфоцитов периферической крови нуждаются в дальнейшем детальном изучении, чтобы прояснить этот аспект выздоровления.
Наличие клональной экспансии и сверхэкспрессии иммунных путей у одного пациента с легкой степенью тяжести, что является обычным для тяжелых пациентов, может отражать эффект сосуществования гипертонии и диабета у этого пациента. Это, в свою очередь, может означать, что на адаптивный иммунитет при COVID-19 влияют определенные хронические заболевания.
ИндукцияIFN у этих пациентов не является равномерной.Клон В-клеток IGHV4-34, который редко встречается в В-клетках памяти IgG в контроле, экспрессируется на повышенных уровнях у этих пациентов. Присутствие одного клона TCR, нацеленного на стромальный антиген в костном мозге человека, возможно, свидетельствует об аутоиммунном феномене, вызванном инфекцией, который способствует тяжелым симптомам.
Таким образом, многие вирусные пептиды вызывают специфические Т-клеточные ответы памяти у пациентов с COVID-19, включая S и M. Это предполагает больше целей для разработки вакцин.Более того, одновременное обнаружение трех основных кластеров Т-клеток памяти как у умеренно, так и у тяжелобольных, по-видимому, демонстрирует, что у всех пациентов развивается устойчивый адаптивный иммунитет против вируса.
Ссылка на журнал:
Zhang, F. et al. (2020). Адаптивные иммунные ответы на инфекцию SARS-Cov-2 у тяжелых и легких людей. Передача сигналов и таргетная терапия , том 5, номер статьи: 156. https://www.nature.com/articles/s41392-020-00263-y
Иммунная система
Иммунная система
Иммунная система не включает только клетки, но также включает лимфоидные структуры, такие как лимфатические узлы, селезенка, миндалины.
Иммунные клетки
Эти ячейки состоят из двух основные типы: гранулоциты и Агранулоциты. Агранулоциты будут обсуждены в первую очередь, особенно лимфоциты. Лимфоциты производятся из стволовых клеток в костный мозг. Т-клеточные лимфоциты завершают свое созревание в тимусе. Считается, что В-клеточные лимфоциты созревают в костном мозге и являются способны превращаться в плазматические клетки. Там также небольшая группа — популяция нулевых клеток — ни B, ни T — но естественные клетки-киллеры.Эти клетки работают быстро, без предварительной сенсибилизации. Тем не мение, там активность может быть увеличена за счет определенных лимфокинов.
Хотя В- и Т-клетки морфологически идентичны, их поверхностные антигены и функция помогают различать, что есть что. В-клетки и Т-клетки запрограммированы на реакцию на определенные антигены. В-клетки к антителу рецепторные белки и Т-клетки к рецепторам клеточной поверхности. Оба могут действовать как эффекторные клетки, разрушая антигены. Они тоже клетки памяти, которые способны быстро реагировать на ранее встречавшиеся антигены.Функции макрофагов: необходим для функции В-клеток и Т-клеток.
Другой майор агранкулоциты обнаруживаются как часть системы моноцитов / макрофагов. Ранее это называлось ретикулоэндотелиальной системой . Система моноцитов / макрофагов включает оба подвижные и неподвижные фагоцитарные клетки. Примером неподвижной клетки могут быть купферовы клетки печени.
Мобильные соты, Моноциты и макрофаги захватывают антиген, обрабатывают его и представляют антиген лимфоциты.Антиген прикрепляется к внешней стороне клетки, и лимфоцит просто «захватывает ее». вверх »
Т-лимфоцитов — это отвечает за клеточно-опосредованный иммунный ответ. Они распознают антигены и высвобождают хемотаксические агенты, чтобы другие Т-клетки и В-клетки в эту область. Т-клетки делятся на две группы: регуляторные и эффекторные. Обе группы стимулируются антигенами к выпускают лимфокины. (Вещества, подобные как интерлейкин-1, который опосредует воспалительную реакцию, включая лихорадку, и интерферон, защищающий от внутриклеточных паразитов, например вирусов.Интерферон делает это, подавляя трансляция вирусной мРНК, предотвращающая производство вирусных белков, но не нормальные белки клетки-хозяина.)
Регуляторные Т-клетки являются вспомогательными и супрессорными клетками, которые включают и выключают другие Т-клетки и В-клетки. Эффекторные Т-клетки связываются к антигенам клеточной поверхности на клетке-мишени, высвобождая лимфокины, которые вызывают лизис клеточных мембран клетки-мишени.
В-клеток отвечает за гуморальный иммунитет.Т-хелперы способствуют превращению В-клеток в плазматические клетки. Именно плазматические клетки производят и секретируют иммуноглобулины или антитела.
Гранулоциты Нейтрофилы, базофилы и эозинофилы. Эти клетки могут дегранулировать, высвобождая свое содержимое как часть воспалительная реакция. Они также фагоцитарные клетки.
Иммунитет и иммунные механизмы
Иммунный ответ описывает взаимодействие между и антигеном и антителом или реактивным T клетка.
Антигены
Антиген-антитело реакция работает по теории «замка и ключа», по форме и его реактивные сайты. Это прежде всего очень специфическая реакция
Гуморальный иммунитет.
Это происходит при посредничестве Система комплемента, которая работает совместно с антителами. Это набор белков плазмы, которые необходимо активировать в правильной последовательности, чтобы дать возможность организму отреагировать на воспаление или инфекцию.Этот путь активируется, когда цель клетки вызывают ответ антиген-антитело. По сути, это ответы с участием специфических иммуноглобулинов, IgG. & IgM, которые инициируют фиксацию комплемента. Было показано, что система комплемента влияет на лизис клеток. мембраны и покрытие комплекса антиген-антитело, чтобы помочь его удалению путем лимфоидная ткань.
Гуморальный иммунитет зависит от В-клеток и плазматических клеток производство иммуноглобулинов.В первичный ответ возникает, когда антиген впервые попадает в организм. Есть скрытый период, который является результатом B-клетки распознают антиген и затем продуцируют плазматические клетки, которые будут производить необходимые антитела. Этот латентный период может длиться от 48 до 72 часов. После этого наблюдается заметный рост титров антител. Последующее воздействие вызывает более быстрое ответ с более высокими титрами антител. (анаместический ответ)
Есть два вида образуются плазматические клетки, одна производит антитела, другая становится воспоминанием клетка.Ячейка памяти распознает антиген на последующих инфекциях, вызывающих производство плазматических клеток, которые будут продуцируют специфическое антитело.
Опосредовано клетками Иммунитет
Клеточный иммунитет вовлекает действие Т-клеток и макрофагов. Воздействие Т-клеточных лимфокинов превращает макрофаги в очень агрессивные фагоциты. Активированные Т-клетки работают, секретируя лимфокины и фактор переноса. Фактор переноса может побуждать другие Т-клетки секретировать лимфокины.
Активная невосприимчивость
Антиген введен хозяину, который впоследствии активировали активность синтеза иммуноглобулинов. Память
Впрыск формованного иммуноглобулин в хозяина. Нет памяти для формирования будущих антител для борьбы с последующими инфекциями.
Эти ранее упомянутые концепции играют важную роль в поддержание адекватного иммунного ответа и содействие адекватному воспалительная реакция.
Воспалительная реакция
Воспаление — это местная реакция васкуляризированной ткани на травму. Это необходимо для того, чтобы раны зажили и оставались незначительными. инфекции становятся подавляющими. Воспалительная реакция тесно связана с заживлением ран и восстановление тканей.
Есть много причин от травмы к инфекции, однако, что бы ни спровоцировало ее, итоговая последовательность событий удивительно похожа.Воспалительная реакция включает последовательность определенных физиологических поведений, которые происходят в реакция на травму неспецифическим агентом. Однако тело будет использовать только те поведения в той последовательности, которая необходимо для минимизации повреждения тканей.
Воспаление может быть острый или хронический. Острое воспаление — это кратковременный ответ, связанный со всеми типами повреждения тканей. Он включает гемодинамические изменения, образование экссудата и наличие зернистых лейкоцитов.Хронический воспаление менее равномерное и более стойкое. Это связано с наличием негранулярных лейкоцитов и обычно приводит к при обширном образовании рубцов.
Острое воспаление
Рубор (покраснение), Опухоль (отек), Calor (тепло), Dolor (боль) и functio laesa (потеря функции)
Сосудистый ответ
Также гемодинамический отклик. Мгновенное сужение мелкие сосуды в области, за которыми сразу следует расширение сосудов.Район становится перегруженным и теплым. (Рубор & Калорийность) Происходит увеличение проницаемости капилляров, позволяя жидкости просачиваться в межклеточные промежутки. (Опухоль) Токсичные и раздражающие вещества: разбавленный. Плюс мобилизация защитные силы организма. Боль и потеря функции следуют по мере того, как высвобождаются химические медиаторы.
Сотовая связь
Путешествие WBC в области и покидают капилляры в составе экссудата.Лейкоциты, граничные по стенкам сосудов, расширение псевдоподий, чтобы помочь им пройти сквозь стены, чтобы добраться до источника воспаления. Их привлекают к источнику воспаления или клеточного дебриса путем хемотаксиса. Сродство к химическому веществу.
Первыми прибыли гранулоциты, в основном полиморфноядерные лейкоциты (полисы или нейтроны). Eos (красное пятно) (аллергия реакции), Basos (синее пятно), Bands, Stabs. Прибытие Басоса приводит к высвобождение важных химических медиаторов, гепарина и гистамина.Гистамин увеличивает проницаемость капилляров позволяя большему количеству белков плазмы и жидкостей просачиваться в интерстициальный пробелы. Медиаторы высвобождения нейтрофилов которые служат хемотаксическими агентами для моноцитов.
Следующими прибудут агранулоциты, моноциты и лимфоциты. Моноциты представляют собой фагоцитарные клетки, часто называемые макрофагами, которые удаляют клеточный мусор и столько же «захватчиков», сколько они может. Лимфоциты выделяют лимфокины. медиаторы, которые способствуют хемотаксису макрофагов, нейтрофилов и базофилов.Другие важные химические медиаторы: брадикинины, которые вызывают повышенную проницаемость капилляров и боль, и простагландины. Простагландины способствуют расширению сосудов, проницаемости капилляров, боли и лихорадке воспаление.
Система моноцитов / макрофагов.
Немобильный фагоцитарный клетки разбросаны по всему телу. Клетки печени, селезенки и лимфоидной ткани. Эти клетки поглощают остатки мертвых клеток, бактерий и т. Д.Увеличение лимфатических узлов и признаки инфекции в селезенке.
Воспалительный экссудат
Воспалительный экссудат являются важной частью процесса. Они позволяют доставить необходимые материалы на место проведения воспаление. Первоначально экссудаты состоят из белков плазмы или в случае аллергического ринита серозного дренажа, разбавленный водянистый экссудат с низким содержанием белков.
Как воспалительное реакция прогрессирует, экссудаты становятся волокнистыми, обеспечивая фибриноген и фибрин для создания основы для сгустка формирование или ограждение области, чтобы предотвратить распространение инфекции.
Гнойный экссудат состоит из остатков лейкоцитов, белков и остатков тканей. Они могут быть отгорожены фибрином и грануляционная ткань в абсцессы.
Разрешение острого воспаления
Острое воспаление может разрешиться одним из трех способов: 1) он может разрешиться с помощью травмированного область возвращается в норму, 2) может прогрессировать до гнойной (гнойная стадия) или 3) он может перейти в хроническую форму.
Хроническое воспаление
Хроническое воспаление является самовоспроизводящимся и может длиться неделю, несколько лет.Это может развиться в ходе повторного прогрессирующего острого воспалительного процесса. Обычно это происходит с стойкими раздражителями, такими как тальк и асбест. Эти раздражители устойчивы к фагоцитозу и другим воспалительным механизмам. В этом процессе обычно присутствуют лимфоциты, плазма крови. клетки и макрофаги.
Оппортунистические инфекции
С ослабленным иммунитетом пациенты подвержены риску различных инфекций, наиболее распространенными из которых являются ЦМВ, системные грибковые инфекции, герпес и Pneumocystis Carinii Pnuemonia (PCP).
PCP вызвано организмом, не вызывающим инфекции у здоровых людей. С тех пор выстилает альвеолы, образует барьер для газообмена. До развитие ВИЧ, ранее это наблюдалось только у пациентов, которые иммуносупрессия в результате химиотерапии. Выявление этой инфекции — одно из первых клинических критерии выявления заболевания СПИДом. Диагноз обычно ставится на основании промывания бронхов.Симптомы могут быть либо постепенный, либо острый. Терпение жалуется на боли в груди и выделение мокроты. Клинические данные включают лихорадку и учащенное дыхание. Рентген грудной клетки может показать интерстициальный инфильтраты. Примерно 80% из них у пациентов развивается дыхательная недостаточность. Это основная причина, по которой большинство пациентов со СПИДом попадают в отделения интенсивной терапии. Сильно нарушен газообмен. Пациенты сильно гипоксичны и часто требуют интубации и искусственной вентиляции легких.Результат разнообразен.
Воспаление и Иммунитет
Иммунитет и болезни
Роль медсестры
1) Оценка иммунологические данные.
2) Идентификация пациент «в группе риска».
3) Реверс / Изоляция процедуры и мытье рук.
4) Знайте, какие препараты связаны с иммунодефицитом — подавлением костного мозга.
6) Ранний Выявление оппортунистических инфекций.
JPFrizzell2000
Грааль иммунолога: вакцины, генерирующие клеточный иммунитет
Многие из прошлых попыток разработки вакцин сосредоточены на генерации ответов антител. В ряде текущие усилия по разработке обеих новых вакцин против многих инфекционных болезней и эффективных иммунотерапевтических методов лечения рака, цель была выработка ответов цитотоксических Т-лимфоцитов (CTL).В отличие от B клетки (и антитела), которые могут распознавать химически разные антигены (например, белки, полисахариды) в различных контекстах (клеточный или ассоциированные с патогенами или растворимые), Т-клетки обычно распознают только бимолекулярный комплекс, состоящий из антигенного пептида, связанного с определенными гликопротеины клеточной мембраны, главный комплекс гистосовместимости (MHC) молекулы класса I и класса II. Эти молекулы MHC обеспечивают генетический идентичность для каждого человека, поскольку каждый родительский гаплотип кодоминантно выражен.
Таким образом, Т-клетки обладают двойной специфичностью, за исключением случаи трансплантации органов, когда Т-клетки одного человека распознают «чужие» молекулы MHC, их рецепторы специфичны как для их собственных молекул MHC, так и для соответствующих антигенный пептид, связанный с этими молекулами MHC. Награждение Нобелевской премии по физиологии и медицине 1996 г. Питеру Доэрти и Рольф Цинкернагель отмечает их важный вклад в эту область их демонстрация этой двойной специфичности, которую CTL должен распознавать две детерминанты на инфицированной вирусом клетке: одна специфична для вируса и один, специфичный для MHC хоста.
Одна подгруппа Т-клеток, которые экспрессируют гликопротеин CD8 клеточной поверхности, распознают пептидные антигены, связанные с молекулами MHC класса I. Эти CD8 + Т-клетки также могут секретировать цитокины в ответ на задействованы их рецепторы Т-клеток, но их название отражает их способность лизировать клетки, представляющие антиген. Потому что в отличие от к белкам MHC класса II, экспрессия которых в основном ограничена профессиональные антигенпрезентирующие клетки (APC), молекулы MHC класса I присутствуют на поверхности большинства ядерных клеток, CD8 + T клетки могут убивать различные типы клеток, тем самым устраняя клетки, которые инфицированы вирусом (и, следовательно, производят больше вируса) или опухолевыми клетками, и т.п.Пептиды, связанные с молекулами MHC класса I, обычно получают из белков, присутствующих в цитоплазме клеток, обычное явление с вирусной инфекцией или для любого другого белка эндогенно синтезируется клеткой-хозяином, но не экзогенными белками (такими как введенный белок, который обычно попадает в эндосомы для деградация эндолизосомным путем). Вызов для индукция этих так называемых «цитотоксических T-лимфоцитов, ограниченных классом I MHC. клетки »или CTL, как искусственно вводить антигены в Путь MHC класса I через цитоплазму.
С выяснением механизмов процессинга антигена и прибыла презентация по созданию ЦТЛ, ограниченного классом I MHC усилия по созданию таких ответов либо с помощью вирусных векторов кодирующие гетерологичные антигены или невирусные системы. Четыре статьи недавно опубликованные в Proceedings (1–4) описывают различные подходы к созданию CTL, ограниченных MHC класса I. Это из Интересно описать эти статьи для стратегий и наблюдений которые они представляют, а также для сравнения подходов друг с другом и с другими методами иммунизации, которые в настоящее время изучаются в лабораторные и ранние клинические испытания.
Исследование Saron et al. (1) использует способность токсина (из Bordatella pertussis ) для перемещения токсиновый домен молекулы в цитоплазму клетки. Вставив пептидный эпитоп, ограниченный MHC класса I, из вируса в этот домен ферментного токсина, этот пептид, таким образом, был непосредственно перемещен в цитоплазму клеток в составе токсинового домена и эффективно иммунизированные мыши для защиты от смертельного заражения с вирусом.Исследование Bronte et al. (4) обеспечивает дополнительные сведения о стратегии, впервые разработанной в лаборатории Мосса, который вошел в клиническую оценку, а также широко использованный лабораторный инструмент: рекомбинантные вирусы вакцины, которые экспрессируют гетерологичные белковые антигены. Две статьи Buschle et al. al. (2) и Schmidt et al. (3) — новый взгляд на хорошо известный подход иммунизации пептидами путем доставки пептиды, смешанные с поликатионами, такими как полилизин и полиаргинин, в результате обеспечивается защита в двух опухолевых системах.Каждое исследование важно для демонстрации не только потенциальной пользы для иммунной активация, способная опосредовать защиту in vivo против вирусная или опухолевая проба (или для иммунотерапии), но для дальнейшего разъяснение нашего понимания ключевых вопросов доставки антигена для оптимальная активация защитных / лечебных иммунитет.
В своих усилиях по доставке эпитопов в цитозоль APC для возможная ассоциация с возникающими молекулами MHC класса I, Saron et al. al. (1) сделал гибридный белок, вставив пептидный эпитоп интерес, полученный из нуклеопротеина лимфоцитарного хориоменингита (LCMV) в токсин аденилатциклазы B. pertussis . В токсин обладает способностью проникать в эукариотические клетки и доставлять N-концевой участок (каталитический домен) непосредственно через плазму мембрана в цитозоль. Пептиды можно вводить в определенные местоположения N-концевой каталитической области и, таким образом, транспортироваться непосредственно в цитоплазму, где они могут быть доступны для обработки и презентация о молекулах MHC класса I.В то время как другие, в том числе наши лаборатории, использовали другие гибридные белки для транспортировки пептидов или белков в цитоплазму клеток (5, 6), в этой статье демонстрация эффективности in vivo такого подход для генерации CTL-ответов. Более того, ответы CTL были достаточно для защиты мышей от смертельного внутримозгового заражение LCMV. В качестве дополнительной и важной демонстрации авторы также показали, что гибридный белок, созданный с тем же самым LCMV эпитоп, вставленный в генетически детоксифицированный токсин, также индуцированный MHC CTL, ограниченные классом I, и защитный иммунитет.
Использование токсина коклюша, который непосредственно переносит ферментативные домен в цитоплазму может иметь решающее значение для способности этого определенный токсин-гибридный белок, чтобы направить эпитоп в правильный внутриклеточный компартмент для in vivo примирования CTL. Для Например, Pseudomonas aeruginosa экзотоксин A (PE-токсин) очевидно, использует более сложный ретроградный путь от эндосом к комплекс Гольджи и эндоплазматический ретикулум для транслокации в цитоплазма (7, 8).И хотя слитные белки сделаны со связыванием и транслоцирующие домены токсина PE и пептидов гриппа A матричный белок и нуклеопротеин были способны сенсибилизировать клетки-мишени для лизиса CTL (5) никогда не было показано, что они способны индуцировать CTL путем введения in vivo .
Различные молекулы MHC обычно связывают разные пептиды; таким образом вакцина, состоящая из одного эпитопа CTL, будет эффективна только для сегмент беспородного населения. Учитывая гаплотипическое разнообразие MHC человеческой популяции было бы предпочтительнее сделать синтез токсина белковая вакцина, которая обеспечила полный белковый антиген, а не гаплотип-специфические эпитопы, позволяющие детерминантному отбору обеспечить для увеличения охвата населения за счет предоставления количество различных пептидных эпитопов для любого данного антигена.Пастан и коллеги (9) продемонстрировали, что гибридный белок, состоящий из связывающие и перемещающие домены токсина PE и фермента барназы, смог доставить функциональный белок барназы в цитоплазму клетки. Их способность заменять токсин неповрежденным белком. фрагмента PE-токсина и демонстрация в статье Saron et al. al. (1) что каталазная активность токсина может быть инактивирована без нарушения способности токсина доставлять эпитопы, поднять вопрос о том, можно ли заставить токсин коклюша доставлять весь белок, а не только эпитоп, путем замены белок для или вставка белка в N-конец токсин.Для слитых белков PE правильная рефолдинг рекомбинантных белки представляли проблему; неизвестно, было ли включение весь белок, а не пептид, попадет в токсин коклюша. ввести трудности для рефолдинга такого гибридного белка в функциональная молекула доставки. Интересно, что авторы возможность многократно иммунизировать животных из-за одного потенциального недостатка этого подхода может быть формирование иммунного ответа против сам токсиновый белок (который в этой статье не оценивался).
В статье Bronte et al. (4) использовали поксвирус (осповакцины), которая использовалась как вакцина / иммунотерапевтическая стратегия и как инструмент для изучения CTL ответы и механизмы. Они еще больше добавили понимания факторов, которые важны для оптимизации эффективности этого подход (и, возможно, другие технологии рекомбинантных вирусных векторов) путем демонстрации дополнительного механизма, посредством которого выражение антиген рекомбинантного вируса осповакцины более эффективен из с иммунологической точки зрения, если экспрессия управляется ранним промотором (я.е. промотор, который активен сразу после заражения вирусом клетки до репликации вирусной ДНК), а не поздним промотор (активен после репликации вирусной ДНК), несмотря на то, что последний считается более сильным промоутером. Хотя ряд типов клеток экспрессируют наибольшее количество антигена, когда рекомбинантный вирус осповакцины использует поздний промотор, дендритные клетки экспрессировали модельный опухолевый антиген и активировал антиген-специфический CTL только тогда, когда экспрессия антигена была контролируется одним из первых промоутеров.В статье исследуется возможность что APC могут быть несколько непермиссивными по сравнению с другими ячейками для вирусная инфекция; следовательно, конструкция осповакцины, использующая поздний промотор приведет к меньшей экспрессии кодируемого антигена и, следовательно, низкая иммуногенность.
Однако, как указывают авторы, другие факторы могут различия в иммуногенности конструкций осповакцины с использованием ранних по сравнению с поздними промоутерами. Более ранние исследования Coupar et al. (10) продемонстрировали, что использование поздних промоторов для экспрессии коровьей оспы гемагглютинина (HA) гриппа приводит к ингибированию представление эпитопов НА для HA-специфических CTL.Townsend et al. al. (11) расширил эти наблюдения с использованием векторов осповакцины кодирующие различные формы HA или нуклеопротеина гриппа (NP). Они продемонстрировали, что торможение также в меньшей степени происходило во время ранние стадии инфекции, и что подавление было эпитоп-зависимый и может быть преодолен, если антиген был сконструирован Быстрее деградировать. Они постулировали, что инфекция коровьей оспы продолжается, возникает дефект процессинга антигена, который может быть вызван производство ингибитора протеазы, кодируемой коровьей оспой; таким образом антиген который нацелен на более быструю деградацию, а не на более стабильный, эффективно спасет дефектный процессинг антигена в клетке, инфицированной коровьей оспой.Подавление клетки-хозяина синтез белка осповакциной может также снизить синтез MHC молекулы класса I, тем самым обеспечивая другую этиологию сниженного эффективность презентации антигена для конструкций с использованием позднего промоутер.
Тем не менее, результаты важны, потому что, если выражение белок APC по сравнению с экспрессией в других типах клеток определяет эффективность рекомбинантной вакцины как вакцины, векторы должны быть сконструирован специально для максимального увеличения экспрессии в этих клетках.Подчеркивая важность экспрессии белка (антигена, в случай вакцины), особенно в APC, демонстрирует необходимость оценить векторы экспрессии в интересующих клетках-мишенях. Тем не менее потребность в экспрессии белка профессиональными APC, что является предположение, лежащее в основе этого подхода, возможно, не следует принимать предоставляется. Например, в некоторых системах перенос антигена (12) или «Перекрестное праймирование» (13) считается ответственным за доставку антиген из клетки, синтезирующей антиген, к APC, который затем представляет это CTL.Таким образом, демонстрация того, что использование раннего промоторы были более эффективны для создания желаемого иммунного ответы из-за их большей активности (по сравнению с поздними промоторов) в APC перефокусирует усилия на конструирование вектора на по крайней мере, для поксвирусов, особенно при экспрессии в APC, а не общие уровни экспрессии в широком диапазоне типов клеток.
Некоторые группы избегают усилий по доставке белковых антигенов цитозоль для входа в путь обработки MHC класса I в пользу пептиды, которые могут связываться с молекулами MHC в различных точки пути, в том числе внеклеточно.Группа Birnstiel (2) описывает способность поликатионов доставлять пептиды к APC. in vitro. Они показывают, что как отрицательно заряженные, так и нейтральные пептиды могут быть доставлены. Режим введения пептидов в клетки, по-видимому, отличается для разных соединений, причем полилизин, по-видимому, временно проницаемость клеточных мембран, тогда как полиаргинин действует через эндоцитарные механизмы. В их спутнике документ (3), процент мышей, иммунизированных пептидом, полученным из опухоль (мастоцитома P815), смешанная с полилизином, была защищена от опухоль.Используя систему меланомы, они показали, что подкожная иммунизация мышей комбинацией из четырех пептидов с определенными поликатионами обеспечивает определенную степень защиты при введении профилактически или терапевтически. В обеих системах защита обеспечивается облученными опухолевыми клетками (спроектированными для секреции цитокинов) обеспечивает эквивалентную или лучшую защиту. Хотя частичный защита, замеченная в этих ранних исследованиях, интересна, механизм защита непонятна. Нет демонстрации CTL или T ответы вспомогательных клеток (т.д., производство цитокинов) после только иммунизация. (Спленоциты животных, которые были первыми инокулировали опухолевыми клетками, затем терапевтически получали один из пептидно-катионные смеси секретируют γ-интерферон в ответ на сокультивирование с клетками меланомы, но инокуляция опухолью будет иметь праймировали животных.) Поскольку ни один из экспериментов не содержал контроля группы, иммунизированные только поликатионами, без антиген-специфической ответы были продемонстрированы только для животных, получавших вакцину, это неясно, была ли наблюдаемая защита специфической для опухолевых антигенов или был неспецифический эффект.Хотя у некоторых видов поли-L-лизин (PLL) может действовать как классический T-зависимый антиген представлен в контексте молекул MHC класса II, и фактически был использован для первоначальной демонстрации контроля гена Ir антитела. ответы у морских свинок (14, 15), у большинства линий мышей гаптены конъюгированные с PLL ведут себя как Т-независимые антигены. Действительно, чтобы породить защитные MHC класса I-ограниченные Т-клетки с помощью CTL, введение Только пептиды, ограниченные MHC класса I, в отсутствие T сотовая помощь, вероятно, будет неоптимальным.Таким образом, пока защита увидела может указывать на полезность этого подхода, было бы важно выяснить механизм защиты, чтобы определить, насколько специфичен иммунитет и насколько широко применим такой подход для другие антигены и системы.
Подходы к вакцинам, описанные Leclerc и соавторами (1) и группа Бирнстила (2, 3) основаны на предоставлении конкретных пептиды, а не белки в качестве антигена. В то время как исследования оба продемонстрировать защитную и / или терапевтическую эффективность у мышей в отношении их соответствующие модели инфекционных заболеваний и рака, пептидный подход вызывает три проблемы: ( i ) пептиды обеспечивают ограниченный, скорее, чем широкая база эпитопов CTL (или хелперов) для популяции, которая имеет гаплотипическое разнообразие людей; ( ii ) нет B-клетки представлены эпитопы, если необходимы ответы антител для полного иммунный набор как антител, так и клеточных ответов; а также ( iii ) хелперные Т-клеточные эпитопы, которые важны для оптимальной генерации CTL-ответов не предусмотрено.Хотя Первая проблема может быть решена путем предоставления смеси пептидов эпитопы для покрытия большинства гаплотипов, обеспечение всего белок или несколько белков, как упоминалось выше, могут дать более широкий охват. Такое положение может быть важным, чтобы избежать генерация моноспецифических CTL-ответов, которые могут привести к антигенным варианты ускользания вируса или опухолевого антигена. Действительно, администрация большого количества аутологичных CTL, моноспецифичных для одного эпитоп из белка nef ВИЧ индивидууму привел к развитие вирусного штамма, у которого отсутствует этот эпитоп (16).Касательно генерация помощи Т-клеток в случае слияния токсина и антигена белка, токсин предположительно отвечает за обеспечение эпитопы хелперных Т-клеток для генерации первичного ответа, хотя очевидно, что ответы помощников будут основаны на белке впоследствии не присутствовал во время инфекционного заражения. Для пептидно-поликатионный подход, неясно, являются ли специфические клеточные ответы хелперного или цитолитического фенотипа были вызваны сама иммунизация.
Таким образом, все эти три подхода представляют соблазнительную демонстрацию способность различных стратегий генерировать защитный иммунитет in vivo . Хотя поксвирус (4) и токсин-пептид слитый белок (1) оба ясно продемонстрировали способность генерировать CTL, механизм защиты пептид-поликатионов (2, 3) менее ясен. Ряд других технологий, генерирующих CTL ответы (и в целом хорошие ответы антител) изучены доклинически и клинически, включая различные адъюванты, ДНК вакцины (17) и другие системы доставки векторов (например,г., другое рекомбинантные вирусы, ретровирусы и бактерии). Самый простой подход который позволяет избежать проблем с пептидами (ограничение эпитопов для популяции с различными гаплотипами MHC и необходимостью обеспечения разнообразных Помощь Т-лимфоцитов для генерации CTL) и потенциальное ограничение, вызванное иммунными реакциями, направленными против «носителя» доставки или вектор (например, фрагмент доставки токсина или вирусный вектор) представляет собой ДНК вакцинный подход (17), где бактериальная плазмида, кодирующая белок антиген под контролем вирусного промотора приводит к в situ поколение антигена с последующим развитием антитела и клеточные иммунные ответы.Этот подход был первым продемонстрировал свою эффективность для создания защитного класса MHC I-ограниченный CTL (18). Важно отметить, что защита была от перекрестной деформации. эффективный; то есть животные были защищены от смертельной опасности с другим штаммом вируса гриппа, чем тот, от которого ген, кодирующий антиген. Напротив, опосредованный антителами защита от вируса гриппа строго специфична для данного штамма вируса. Доказано, что эта технология обеспечивает защиту иммунитет против заражения рядом вирусных, бактериальных и других модели доклинических заболеваний (рак, аллергия и аутоиммунные заболевания) (17) путем генерации CTL и / или ответов антител.Это относительно универсальная технология, не способная вызывать инфекционные само заболевание (как это может происходить с вирусными или бактериальными переносчиками) и имеет способность предоставлять цельные белковые антигены или смеси антигенов (через их гены), тем самым обходя одно из основных ограничений подходы к вакцинам на основе пептидов (эпитопная рестрикция). Нет значительные иммунные ответы были замечены против самого вектора, тем самым позволяя повторно использовать вектор для бустерных доз или для разные вакцины; эта проблема может быть ограничением использования слитые белки или векторы осповакцины.Эти ДНК-вакцины можно легко манипулируют для нацеливания кодируемого белка на разные клеточные места, которые окажутся важными для улучшения конкретных стороны иммунного ответа (антитела, Т-клеточная помощь, CTL).
Эти различные технологии необходимо напрямую сравнивать для конкретных приложения для оценки соответствующих иммунных ответов в контексте специфической патофизиологии заболевания. Пока доклинические эффективность не может быть предиктором клинической полезности, каждый из подходы, описанные в этих статьях, расширили наш арсенал для разработки вакцин и иммунотерапевтических средств, и они обеспечивают дополнительные инструменты для дальнейшего изучения антигена обработка и механизмы защитного иммунитета.
Благодарности
Я хочу поблагодарить доктора. Герман Эйзен, Джон Доннелли, Джефф Улмер, Тонг Фу и Джону Шиверу за критическое прочтение этой рукописи.
Сноски
↵ * Кому запросы на перепечатку следует направлять по адресу: WP16-101, Merck Исследовательские лаборатории, Самнейтаун-Пайк, Вест-Пойнт, Пенсильвания, 19486. Электронная почта: margaret_liu {at} merck.com.
- Copyright © 1997, Национальная академия наук США
23.2. Адаптивный иммунный ответ — Концепции биологии — 1-е канадское издание
Цели обучения
К концу этого раздела вы сможете:
- Объясните адаптивный иммунитет
- Сравните и сопоставьте адаптивный и врожденный иммунитет
- Описать клеточно-опосредованный иммунный ответ и гуморальный иммунный ответ
- Опишите иммунную толерантность
Для установления адаптивного или приобретенного иммунного ответа требуются дни или даже недели — намного дольше, чем врожденный ответ; однако адаптивный иммунитет более специфичен к патогенам и обладает памятью. Адаптивный иммунитет — это иммунитет, который возникает после воздействия антигена патогена или вакцинации. Эта часть иммунной системы активируется, когда врожденный иммунный ответ недостаточен для борьбы с инфекцией. Фактически, без информации от врожденной иммунной системы адаптивный ответ не может быть задействован. Существует два типа адаптивных ответов: опосредованный клетками иммунный ответ , который осуществляется Т-клетками, и гуморальный иммунный ответ , который контролируется активированными В-клетками и антителами.Активированные Т-клетки и В-клетки, специфичные для молекулярных структур патогена, пролиферируют и атакуют вторгшийся патоген. Их атака может убивать патогены напрямую или выделять антитела, которые усиливают фагоцитоз патогенов и разрушают инфекцию. Адаптивный иммунитет также включает в себя память, чтобы обеспечить хозяину долгосрочную защиту от повторного заражения тем же типом патогена; при повторном экспонировании это воспоминание будет способствовать эффективному и быстрому реагированию.
В отличие от NK-клеток врожденной иммунной системы, B-клетки (B-лимфоциты) представляют собой тип лейкоцитов, которые дают начало антителам, тогда как T-клетки (T-лимфоциты) представляют собой тип лейкоцитов, которые играют важную роль в иммунная реакция.Т-клетки являются ключевым компонентом клеточно-опосредованного ответа — специфического иммунного ответа, который использует Т-клетки для нейтрализации клеток, инфицированных вирусами и определенными бактериями. Существует три типа Т-клеток: цитотоксические, хелперные и супрессорные Т-клетки. Цитотоксические Т-клетки разрушают инфицированные вирусом клетки в клеточно-опосредованном иммунном ответе, а хелперные Т-клетки играют роль в активации как антител, так и клеточно-опосредованных иммунных ответов. Супрессорные Т-клетки дезактивируют Т-клетки и В-клетки, когда это необходимо, и, таким образом, предотвращают чрезмерную интенсивность иммунного ответа.
Антиген представляет собой чужеродную или «чужую» макромолекулу, которая реагирует с клетками иммунной системы. Не все антигены вызывают реакцию. Например, люди продуцируют бесчисленные «собственные» антигены и постоянно подвергаются воздействию безвредных чужеродных антигенов, таких как пищевые белки, пыльца или компоненты пыли. Подавление иммунных ответов на безвредные макромолекулы строго регулируется и обычно предотвращает процессы, которые могут повредить хозяину, известные как толерантность.
Врожденная иммунная система содержит клетки, которые обнаруживают потенциально опасные антигены, а затем информируют адаптивный иммунный ответ о присутствии этих антигенов. Антигенпредставляющая клетка (APC) — это иммунная клетка, которая обнаруживает, поглощает и сообщает адаптивному иммунному ответу об инфекции. При обнаружении патогена эти APC фагоцитируют патоген и переваривают его с образованием множества различных фрагментов антигена. Затем фрагменты антигена будут перенесены на поверхность APC, где они будут служить индикатором для других иммунных клеток. Дендритные клетки — это иммунные клетки, которые обрабатывают антигенный материал; они присутствуют в коже (клетки Лангерганса) и слизистой оболочке носа, легких, желудка и кишечника. Иногда дендритная клетка присутствует на поверхности других клеток, чтобы вызвать иммунный ответ, таким образом функционируя как антигенпрезентирующая клетка. Макрофаги также функционируют как APC. Перед активацией и дифференцировкой B-клетки также могут функционировать как APC.
После фагоцитоза APC фагоцитарная везикула сливается с внутриклеточной лизосомой, образуя фаголизосому.Внутри фаголизосомы компоненты разбиты на фрагменты; затем фрагменты загружаются в молекулы MHC класса I или MHC класса II и транспортируются на поверхность клетки для презентации антигена, как показано на рисунке 23.8. Обратите внимание, что Т-лимфоциты не могут должным образом реагировать на антиген, если он не обработан и не встроен в молекулу MHC II. APC экспрессируют MHC на своей поверхности, и в сочетании с чужеродным антигеном эти комплексы сигнализируют о «чужом» захватчике. Как только фрагмент антигена встроен в молекулу MHC II, иммунная клетка может ответить.Хелперные Т-клетки являются одними из основных лимфоцитов, которые реагируют на антигенпрезентирующие клетки. Напомним, что все другие ядерные клетки тела экспрессируют молекулы MHC I, которые сигнализируют о «здоровом» или «нормальном».
Рисунок 23.8. APC, такой как макрофаг, поглощает и переваривает чужеродные бактерии. Антиген бактерии представлен на поверхности клетки в сочетании с молекулой MHC II. Лимфоциты адаптивного иммунного ответа взаимодействуют с встроенными в антиген молекулами MHC II, созревая в функциональные иммунные клетки.Концепция в действии
Этот анимационный ролик из Университета Рокфеллера показывает, как дендритные клетки действуют как часовые в иммунной системе организма.
Лимфоциты в циркулирующей крови человека составляют примерно от 80 до 90 процентов Т-клеток, как показано на рисунке 23.9, и от 10 до 20 процентов В-клеток. Напомним, что Т-клетки участвуют в клеточно-опосредованном иммунном ответе, тогда как В-клетки являются частью гуморального иммунного ответа.
Т-клетки включают гетерогенную популяцию клеток с чрезвычайно разнообразными функциями.Некоторые Т-клетки отвечают на APC врожденной иммунной системы и косвенно индуцируют иммунные ответы, высвобождая цитокины. Другие Т-клетки стимулируют В-клетки к выработке собственного ответа. Другая популяция Т-клеток обнаруживает сигналы APC и напрямую убивает инфицированные клетки. Другие Т-клетки участвуют в подавлении несоответствующих иммунных реакций на безвредные или «собственные» антигены.
Рисунок 23.9. На этой сканирующей электронной микрофотографии показан Т-лимфоцит, ответственный за клеточно-опосредованный иммунный ответ.Т-клетки способны распознавать антигены. (кредит: модификация работы NCI; данные шкалы от Мэтта Рассела)Т- и В-клетки демонстрируют общую тему распознавания / связывания специфических антигенов через комплементарный рецептор с последующей активацией и самоамплификацией / созреванием для специфического связывания к конкретному антигену возбудителя инфекции. Т- и В-лимфоциты также похожи в том, что каждая клетка экспрессирует только один тип рецептора антигена. Любой человек может обладать популяцией Т- и В-клеток, которые вместе экспрессируют почти безграничное множество рецепторов антигена, способных распознавать практически любой инфекционный патоген.Т- и В-клетки активируются, когда они распознают небольшие компоненты антигенов, называемые эпитопами , , представленные APC, как показано на рисунке 23.10. Обратите внимание, что распознавание происходит на конкретном эпитопе, а не на всем антигене; по этой причине эпитопы известны как «антигенные детерминанты». В отсутствие информации от APC, Т- и В-клетки остаются неактивными или наивными и не могут подготовить иммунный ответ. Требование информации от APC врожденного иммунитета для запуска активации B-клеток или T-клеток иллюстрирует существенную природу врожденного иммунного ответа на функционирование всей иммунной системы.
Рисунок 23.10. Антиген — это макромолекула, которая реагирует с компонентами иммунной системы. Данный антиген может содержать несколько мотивов, распознаваемых иммунными клетками. Каждый мотив — это эпитоп. На этом рисунке вся структура представляет собой антиген, а выступающие из нее оранжевые, лососевые и зеленые компоненты представляют собой потенциальные эпитопы.Наивные Т-клетки могут экспрессировать на своей поверхности одну из двух разных молекул, CD4 или CD8, как показано на рисунке 23.11, и соответственно классифицируются как клетки CD4 + или CD8 + .Эти молекулы важны, потому что они регулируют то, как Т-клетка будет взаимодействовать с APC и отвечать на них. Наивные клетки CD4 + связывают APC через свои встроенные в антиген молекулы MHC II и стимулируются к превращению в хелперных T (T H ) лимфоцитов , клеток, которые продолжают стимулировать B-клетки (или цитотоксические T-клетки) напрямую или секретируют цитокины, чтобы сообщить большему количеству и различным клеткам-мишеням о патогенной угрозе. Напротив, клетки CD8 + взаимодействуют с встроенными в антиген молекулами MHC I на APC и стимулируются к превращению в цитотоксических Т-лимфоцитов (CTL) , которые непосредственно убивают инфицированные клетки путем апоптоза и выделяют цитокины для усиления иммунного ответа.Две популяции Т-клеток имеют разные механизмы иммунной защиты, но обе связывают молекулы MHC через свои антигенные рецепторы, называемые рецепторами Т-клеток (TCR). Поверхностные молекулы CD4 или CD8 различают, будет ли TCR взаимодействовать с молекулой MHC II или с молекулой MHC I. Поскольку они способствуют специфичности связывания, молекулы CD4 и CD8 описываются как корецепторы.
Какое из следующих утверждений о Т-клетках неверно?
- Хелперные Т-клетки выделяют цитокины, в то время как цитотоксические Т-клетки убивают инфицированную клетку.
- Т-хелперы — это CD4 + , а цитотоксические Т-клетки — это CD8 + .
- MHC II — это рецептор, обнаруженный в большинстве клеток организма, в то время как MHC I — это рецептор, обнаруженный только на иммунных клетках.
- Т-клеточный рецептор обнаружен как на Т-клетках CD4 + , так и на CD8 + .
Рассмотрите бесчисленное множество возможных антигенов, которым человек будет подвергаться в течение жизни. Адаптивная иммунная система млекопитающих способна адекватно реагировать на каждый антиген.Млекопитающие обладают огромным разнообразием популяций Т-клеток в результате разнообразия TCR. Каждый TCR состоит из двух полипептидных цепей, которые охватывают мембрану Т-клетки, как показано на рисунке 23.12; цепи связаны дисульфидным мостиком. Каждая полипептидная цепь состоит из константного домена и вариабельного домена: домен в этом смысле представляет собой специфическую область белка, которая может быть регуляторной или структурной. Внутриклеточный домен участвует во внутриклеточной передаче сигналов. Одна Т-клетка будет экспрессировать тысячи идентичных копий одного конкретного варианта TCR на своей клеточной поверхности.Специфичность адаптивной иммунной системы обусловлена тем, что она синтезирует миллионы различных популяций Т-клеток, каждая из которых экспрессирует TCR, который отличается своим вариабельным доменом. Такое разнообразие TCR достигается за счет мутации и рекомбинации генов, кодирующих эти рецепторы в стволовых клетках-предшественниках Т-клеток. Связывание антиген-отображающей молекулы MHC и комплементарного «совпадения» TCR указывает на то, что адаптивной иммунной системе необходимо активировать и продуцировать эту специфическую Т-клетку, потому что ее структура подходит для распознавания и уничтожения вторгающегося патогена.
Рисунок 23.12. Рецептор Т-клеток охватывает мембрану и проецирует вариабельные связывающие области во внеклеточное пространство, чтобы связывать процессированные антигены через молекулы MHC на APC.Лимфоциты T H опосредованно определяют потенциальные патогены для других клеток иммунной системы. Эти клетки важны для внеклеточных инфекций, например, вызванных некоторыми бактериями, гельминтами и простейшими. Лимфоциты T H распознают специфические антигены, представленные в комплексах MHC II APC.Существуют две основные популяции клеток T H : T H 1 и T H 2. Клетки T H 1 секретируют цитокины для усиления активности макрофагов и других Т-клеток. Клетки T H 1 активируют действие циотоксических Т-клеток, а также макрофагов. Клетки T H 2 стимулируют наивные В-клетки уничтожать чужеродных захватчиков посредством секреции антител. Будет ли развиваться иммунный ответ T H 1 или T H 2, зависит от конкретных типов цитокинов, секретируемых клетками врожденной иммунной системы, что, в свою очередь, зависит от природы вторгающегося патогена.
Ответ, опосредованный T H 1, включает макрофаги и связан с воспалением. Вспомните передовую защиту макрофагов, участвующих в врожденном иммунном ответе. Некоторые внутриклеточные бактерии, такие как Mycobacterium tuberculosis , эволюционировали, чтобы размножаться в макрофагах после того, как они были поглощены. Эти патогены уклоняются от попыток макрофагов уничтожить и переварить патоген. Когда происходит инфекция M. tuberculosis , макрофаги могут стимулировать наивные Т-клетки к превращению в клетки T H 1.Эти стимулированные Т-клетки секретируют специфические цитокины, которые отправляют обратную связь макрофагу, чтобы стимулировать его пищеварительные способности и позволить ему уничтожить колонизирующий M. tuberculosis . Таким же образом макрофаги, активированные T H 1, также лучше подходят для поглощения и уничтожения опухолевых клеток. В итоге; Ответы T H 1 направлены на внутриклеточных захватчиков, тогда как ответы T H 2 нацелены на внеклеточные.
При стимуляции с помощью пути T H 2 наивные В-клетки дифференцируются в плазматические клетки, секретирующие антитела.Плазматическая клетка — это иммунная клетка, которая секретирует антитела; эти клетки возникают из В-клеток, которые были стимулированы антигенами. Подобно Т-клеткам, наивные В-клетки изначально покрыты тысячами рецепторов В-клеток (BCR), которые представляют собой мембраносвязанные формы Ig (иммуноглобулин или антитело). Рецептор В-клетки имеет две тяжелые цепи и две легкие цепи, соединенные дисульфидными связями. Каждая цепочка имеет постоянную и вариабельную области; последний участвует в связывании антигена. Два других мембранных белка, Ig альфа и Ig бета, участвуют в передаче сигналов.Рецепторы любой конкретной B-клетки, как показано на рисунке 23.13, все одинаковы, но сотни миллионов различных B-клеток у человека имеют различные домены распознавания, которые вносят вклад в большое разнообразие типов молекулярных структур, с которыми они могут связываться. . В этом состоянии B-клетки функционируют как APC. Они связываются и поглощают чужеродные антигены через свои BCR, а затем отображают процессированные антигены в контексте молекул MHC II в клетках T H 2. Когда клетка T H 2 обнаруживает, что B-клетка связана с соответствующим антигеном, она секретирует специфические цитокины, которые вызывают быструю пролиферацию B-клетки, которая создает тысячи ее идентичных (клональных) копий, а затем синтезирует и секретирует антитела с тем же паттерном распознавания антигена, что и BCR.Активация В-клеток, соответствующих одному конкретному варианту BCR, и резкая пролиферация этого варианта известны как клональный отбор . Это явление резко, но кратко, изменяет пропорции вариантов BCR, экспрессируемых иммунной системой, и сдвигает баланс в сторону BCR, специфичных для инфекционного патогена.
Рисунок 23.13. Рецепторы В-клеток встроены в мембраны В-клеток и связывают различные антигены через свои вариабельные области. Область передачи сигнала передает сигнал в клетку.Т- и В-клетки различаются одним фундаментальным образом: тогда как Т-клетки связывают антигены, которые были переварены и встроены в молекулы MHC с помощью APC, B-клетки функционируют как APC, которые связывают интактные антигены, которые не были процессированы. Хотя Т- и В-клетки реагируют с молекулами, которые называются «антигенами», эти лимфоциты на самом деле реагируют на очень разные типы молекул. В-клетки должны быть способны связывать интактные антигены, потому что они секретируют антитела, которые должны распознавать патоген напрямую, а не переваренные остатки патогена.Бактериальные молекулы углеводов и липидов могут активировать В-клетки независимо от Т-клеток.
CTL, подкласс Т-клеток, непосредственно устраняют инфекцию. Клеточно-опосредованная часть адаптивной иммунной системы состоит из CTL, которые атакуют и разрушают инфицированные клетки. CTL особенно важны для защиты от вирусных инфекций; это потому, что вирусы размножаются внутри клеток, где они защищены от внеклеточного контакта с циркулирующими антителами. Когда APC фагоцитируют патогены и представляют встроенные в MHC I антигены наивным Т-клеткам CD8 + , которые экспрессируют комплементарные TCR, Т-клетки CD8 + активируются для пролиферации в соответствии с клональным отбором.Эти полученные CTL затем идентифицируют не-APC, отображающие те же самые встроенные антигены MHC I (например, вирусные белки) — например, CTL идентифицируют инфицированные клетки-хозяева.
Внутриклеточно инфицированные клетки обычно погибают после того, как инфекционный патоген реплицируется до достаточной концентрации и лизирует клетку, как это делают многие вирусы. CTL пытаются идентифицировать и уничтожать инфицированные клетки до того, как патоген сможет реплицироваться и ускользнуть, тем самым останавливая развитие внутриклеточных инфекций. CTL также поддерживают NK-лимфоциты для уничтожения ранних стадий рака.Цитокины, секретируемые ответом T H 1, который стимулирует макрофаги, также стимулируют CTL и повышают их способность идентифицировать и уничтожать инфицированные клетки и опухоли.
CTL воспринимают встроенные в MHC I антигены, напрямую взаимодействуя с инфицированными клетками через их TCR. Связывание TCR с антигенами активирует CTL с высвобождением перфорина и гранзима, ферментов деградации, которые вызывают апоптоз инфицированной клетки. Напомним, что это аналогичный механизм разрушения, используемый NK-клетками.В этом процессе CTL не заражаются и не страдают от секреции перфорина и гранзимов. Фактически, функции NK-клеток и CTL комплементарны и максимизируют удаление инфицированных клеток, как показано на рисунке 23.14. Если NK-клетка не может идентифицировать паттерн «отсутствующего я» подавляемых молекул MHC I, то CTL может идентифицировать его по комплексу MHC I с чужеродными антигенами, что сигнализирует об «измененном я». Точно так же, если CTL не может обнаружить встроенный в антиген MHC I, потому что рецепторы истощены с поверхности клетки, NK-клетки вместо этого разрушают клетку.CTL также выделяют цитокины, такие как интерфероны, которые изменяют экспрессию поверхностных белков в других инфицированных клетках, так что инфицированные клетки можно легко идентифицировать и уничтожать. Более того, эти интерфероны могут также предотвращать высвобождение вирусных частиц из инфицированных вирусом клеток.
На основании того, что вы знаете о рецепторах MHC, почему вы думаете, что орган, пересаженный от несовместимого донора реципиенту, будет отклонен?
Плазматические клетки и CTL вместе называются эффекторными клетками : они представляют собой дифференцированные версии своих наивных аналогов, и они участвуют в обеспечении иммунной защиты от уничтожения патогенов и инфицированных клеток-хозяев.
Поверхности слизистой оболочки и иммунная толерантность
Врожденный и адаптивный иммунные ответы, обсуждаемые до сих пор, включают системную иммунную систему (влияющую на все тело), которая отличается от иммунной системы слизистых оболочек. Иммунитет слизистой оболочки формируется связанной со слизистой оболочкой лимфоидной тканью, которая функционирует независимо от системной иммунной системы и имеет свои собственные врожденные и адаптивные компоненты. Лимфоидная ткань, связанная со слизистой оболочкой (MALT) , проиллюстрирована на Фигуре 23.15, представляет собой совокупность лимфатической ткани, которая сочетается с эпителиальной тканью, выстилающей слизистую оболочку по всему телу. Эта ткань действует как иммунный барьер и является ответной реакцией в областях тела, находящихся в прямом контакте с внешней средой. Системная иммунная система и иммунная система слизистых оболочек используют одни и те же типы клеток. Посторонние частицы, которые попадают в MALT, захватываются абсорбирующими эпителиальными клетками, называемыми М-клетками, и доставляются к APC, расположенным непосредственно под тканью слизистой оболочки. М-клетки функционируют в описанном транспорте и расположены в пейеровом участке, лимфоидном узелке.APC иммунной системы слизистой оболочки — это в первую очередь дендритные клетки, а B-клетки и макрофаги играют второстепенную роль. Обработанные антигены, отображаемые на APC, обнаруживаются Т-клетками в MALT и на различных участках индукции слизистой оболочки, таких как миндалины, аденоиды, аппендикс или мезентериальные лимфатические узлы кишечника. Затем активированные Т-клетки мигрируют через лимфатическую систему в систему кровообращения к участкам инфекции слизистой оболочки.
Рисунок 23.15. Показаны топология и функция кишечного MALT.Патогены захватываются М-клетками кишечного эпителия и выводятся в карман, образованный внутренней поверхностью клетки. Карман содержит антиген-презентирующие клетки, такие как дендритные клетки, которые поглощают антигены, а затем представляют их с молекулами MHC II на поверхности клетки. Дендритные клетки мигрируют в нижележащую ткань, называемую пейеровым пятном. Антигенпрезентирующие клетки, Т-клетки и В-клетки собираются внутри пейеровского пятна, образуя организованные лимфоидные фолликулы. Там активируются некоторые Т-клетки и В-клетки.Другие нагруженные антигеном дендритные клетки мигрируют через лимфатическую систему, где они активируют В-клетки, Т-клетки и плазматические клетки в лимфатических узлах. Затем активированные клетки возвращаются в эффекторные участки ткани MALT. IgA и другие антитела секретируются в просвет кишечника.MALT является важным компонентом функциональной иммунной системы, поскольку поверхности слизистых оболочек, такие как носовые ходы, являются первыми тканями, на которых оседают вдыхаемые или проглоченные патогены. Ткань слизистой оболочки включает рот, глотку и пищевод, а также желудочно-кишечный тракт, дыхательные пути и мочеполовые пути.
Иммунная система должна быть отрегулирована, чтобы предотвратить бесполезную и ненужную реакцию на безвредные вещества, и, что более важно, чтобы она не нападала на «себя». Приобретенная способность предотвращать ненужный или вредный иммунный ответ на обнаруженное чужеродное вещество, которое, как известно, не вызывает заболевания, описывается как иммунная толерантность . Иммунная толерантность имеет решающее значение для поддержания гомеостаза слизистой оболочки, учитывая огромное количество чужеродных веществ (таких как пищевые белки), с которыми сталкиваются APC полости рта, глотки и слизистой оболочки желудочно-кишечного тракта.Иммунная толерантность вызывается специализированными APC в печени, лимфатических узлах, тонком кишечнике и легких, которые представляют безвредные антигены исключительно разнообразной популяции из регуляторных T (T reg ) -клеток , специализированных лимфоцитов, которые подавляют локальное воспаление и подавляют секреция стимулирующих иммунных факторов. Комбинированный результат клеток T reg состоит в том, чтобы предотвратить иммунологическую активацию и воспаление в нежелательных тканевых компартментах и вместо этого позволить иммунной системе сосредоточиться на патогенах.Помимо стимулирования иммунной толерантности к безвредным антигенам, другие подмножества клеток T reg участвуют в предотвращении аутоиммунного ответа , который является несоответствующим иммунным ответом на клетки-хозяева или аутоантигены. Другой класс T reg подавляет иммунные ответы на вредные патогены после исчезновения инфекции, чтобы минимизировать повреждение клеток-хозяев, вызванное воспалением и лизисом клеток.
Адаптивная иммунная система обладает компонентом памяти, который позволяет эффективно и драматично реагировать на повторное проникновение того же патогена.Память обрабатывается адаптивной иммунной системой без особой зависимости от сигналов врожденной реакции. Во время адаптивного иммунного ответа на патоген, который ранее не встречался, называемого первичным ответом, плазматические клетки, секретирующие антитела и дифференцированные Т-клетки, увеличиваются, а затем с течением времени выходят на плато. По мере созревания В- и Т-клеток в эффекторные клетки подмножество наивных популяций дифференцируется в В- и Т-клетки памяти с той же антигенной специфичностью, как показано на рисунке 23.16.
Клетка памяти представляет собой антигенспецифический В- или Т-лимфоцит, который не дифференцируется в эффекторные клетки во время первичного иммунного ответа, но может сразу же стать эффекторными клетками при повторном воздействии того же патогена. Во время первичного иммунного ответа клетки памяти не реагируют на антигены и не участвуют в защите хозяина. Когда инфекция исчезает и патогенные раздражители утихают, эффекторы больше не нужны, и они подвергаются апоптозу. Напротив, клетки памяти сохраняются в кровообращении.
Rh-антиген обнаруживается на резус-положительных эритроцитах. Резус-отрицательная женщина обычно без труда выносит резус-положительный плод до срока. Однако, если у нее второй резус-положительный плод, ее организм может запустить иммунную атаку, которая вызовет гемолитическую болезнь новорожденного. Как вы думаете, почему гемолитическая болезнь — это проблема только во время второй или последующих беременностей?
Если патоген больше не встречается в течение жизни человека, В- и Т-клетки памяти будут циркулировать в течение нескольких лет или даже нескольких десятилетий и постепенно отмирать, никогда не функционируя как эффекторные клетки.Однако, если хозяин повторно подвергается действию патогена того же типа, циркулирующие клетки памяти немедленно дифференцируются в плазматические клетки и CTL без поступления от APC или клеток T H . Одна из причин задержки адаптивного иммунного ответа заключается в том, что для идентификации и активации наивных В- и Т-клеток с соответствующей антигенной специфичностью требуется время. При повторном заражении этот шаг пропускается, и в результате происходит более быстрое производство иммунной защиты. В-клетки памяти, которые дифференцируются в плазматические клетки, выделяют в десятки или сотни раз больше антител, чем секретировалось во время первичного ответа, как показано на графике на Фигуре 23.17 иллюстрирует. Этот быстрый и резкий ответ антител может остановить инфекцию еще до того, как она установится, и человек может не осознавать, что подвергся воздействию.
Рисунок 23.17. При первичном ответе на инфекцию антитела сначала секретируются из плазматических клеток. При повторном воздействии того же патогена клетки памяти дифференцируются в плазматические клетки, секретирующие антитела, которые выделяют большее количество антител в течение более длительного периода времени.Вакцинация основана на знании того, что воздействие неинфекционных антигенов, происходящих от известных патогенов, вызывает умеренный первичный иммунный ответ.Иммунный ответ на вакцинацию может не восприниматься хозяином как болезнь, но все же обеспечивает иммунную память. При воздействии соответствующего патогена, которому человек был вакцинирован, реакция аналогична вторичному воздействию. Поскольку каждая реинфекция генерирует больше клеток памяти и повышает устойчивость к патогену, а также потому, что некоторые клетки памяти умирают, определенные курсы вакцинации включают одну или несколько ревакцинаций, имитирующих повторяющиеся воздействия: например, ревакцинации от столбняка необходимы каждые десять лет, потому что только клетки памяти прожить так долго.
Подмножество Т- и В-клеток иммунной системы слизистой оболочки дифференцируется в клетки памяти, как и в системной иммунной системе. При повторном проникновении патогена того же типа на слизистую оболочку, где депонировался исходный патоген, возникает выраженный иммунный ответ, но коллективная защита также организуется внутри взаимосвязанной или смежной ткани слизистой оболочки. Например, иммунная память об инфекции в полости рта также вызовет реакцию в глотке, если полость рта подверглась воздействию того же патогена.
Вакцинолог
Вакцинация (или иммунизация) включает доставку, обычно путем инъекции, как показано на рисунке 23.18, неинфекционных антигенов, полученных от известных патогенов. Другие компоненты, называемые адъювантами, доставляются параллельно, чтобы стимулировать иммунный ответ. Иммунологическая память — это причина того, что вакцины работают. В идеале эффект вакцинации должен вызвать иммунологическую память и, таким образом, устойчивость к конкретным патогенам без необходимости заражения человека инфекцией.
Рисунок 23.18. Вакцины часто вводятся путем инъекции в руку. (Фото: помощник фотографа ВМС США, ученик Кристофера Д. Блачли)Вакцинологи участвуют в процессе разработки вакцины от первоначальной идеи до получения готовой вакцины. Этот процесс может занять десятилетия, может стоить миллионы долларов и может повлечь за собой множество препятствий. Например, инъецированные вакцины стимулируют системную иммунную систему, вызывая гуморальный и клеточно-опосредованный иммунитет, но мало влияют на ответ слизистой оболочки, что представляет собой проблему, поскольку многие патогены откладываются и реплицируются в компартментах слизистой оболочки, а инъекция не обеспечивает наиболее эффективная иммунная память для этих возбудителей болезней.По этой причине вакцинологи активно участвуют в разработке новых вакцин, которые применяются интраназальным, аэрозольным, пероральным или чрескожным (всасывающимся через кожу) способами доставки. Важно отметить, что вакцины, вводимые через слизистую оболочку, вызывают как слизистый, так и системный иммунитет и обеспечивают такой же уровень устойчивости к болезням, как вакцины, вводимые путем инъекции.
Рисунок 23.19. Вакцину против полиомиелита можно вводить перорально. (кредит: модификация работы UNICEF Sverige)В настоящее время доступна версия интраназальной вакцины против гриппа, а вакцины против полиомиелита и брюшного тифа можно вводить перорально, как показано на Рисунке 23.19. Аналогичным образом вакцины против кори и краснухи адаптируются для доставки аэрозолей с помощью ингаляционных устройств. В конце концов, трансгенные растения могут быть сконструированы для производства вакцинных антигенов, которые можно употреблять в пищу для придания устойчивости к болезням. Другие вакцины могут быть адаптированы для ректального или вагинального применения для индукции иммунных ответов в слизистой оболочке прямой кишки, мочеполовой системы или репродуктивной системы. Наконец, вакцинные антигены могут быть адаптированы для трансдермального применения, при котором кожа слегка соскабливается и используются микроиглы для прокалывания самого внешнего слоя.Помимо мобилизации иммунного ответа слизистых оболочек, это новое поколение вакцин может положить конец тревоге, связанной с инъекциями, и, в свою очередь, улучшить участие пациентов.
Первичные центры иммунной системы
Хотя иммунная система характеризуется циркулирующими клетками по всему телу, регуляция, созревание и взаимодействие иммунных факторов происходят в определенных местах. Кровь циркулирует по организму иммунных клеток, белков и других факторов.Примерно 0,1 процента всех клеток крови составляют лейкоциты, которые включают моноциты (предшественники макрофагов) и лимфоциты. Большинство клеток крови — это эритроциты (красные кровяные тельца). Лимфа — водянистая жидкость, которая омывает ткани и органы защитными лейкоцитами и не содержит эритроцитов. Клетки иммунной системы могут перемещаться между отдельными лимфатической и кровеносной системами кровообращения, которые разделены интерстициальным пространством, посредством процесса, называемого экстравазацией (прохождение через окружающие ткани).
Клетки иммунной системы происходят из гемопоэтических стволовых клеток костного мозга. Цитокины стимулируют эти стволовые клетки к дифференцировке в иммунные клетки. Созревание В-клеток происходит в костном мозге, тогда как наивные Т-клетки переходят из костного мозга в тимус для созревания. В тимусе незрелые Т-клетки, которые экспрессируют TCR, комплементарные аутоантигенам, разрушаются. Этот процесс помогает предотвратить аутоиммунные реакции.
По мере созревания Т- и В-лимфоциты циркулируют по разным направлениям.Лимфатические узлы, разбросанные по всему телу, как показано на рисунке 23.20, содержат большие популяции Т- и В-клеток, дендритных клеток и макрофагов. Лимфа собирает антигены по мере оттока из тканей. Затем эти антигены фильтруются через лимфатические узлы, прежде чем лимфа возвращается в кровоток. APC в лимфатических узлах захватывают и обрабатывают антигены и информируют близлежащие лимфоциты о потенциальных патогенах.
Рисунок 23.20. (а) Лимфатические сосуды переносят прозрачную жидкость, называемую лимфой, по всему телу.Жидкость попадает в (б) лимфатические узлы через афферентные сосуды. Лимфатические узлы заполнены лимфоцитами, которые очищают инфицированные клетки. Затем лимфа выходит через эфферентные сосуды. (кредит: модификация работы NIH, NCI)В селезенке находятся В- и Т-клетки, макрофаги, дендритные клетки и NK-клетки. Селезенка, показанная на рисунке 23.21, является местом, где APC, которые захватили инородные частицы в крови, могут связываться с лимфоцитами. Антитела синтезируются и секретируются активированными плазматическими клетками в селезенке, а селезенка фильтрует инородные вещества и патогенные микроорганизмы в комплексе с антителами из крови.Функционально селезенка относится к крови так же, как лимфатические узлы к лимфе.
Рисунок 23.21. Селезенка похожа на лимфатический узел, но намного больше и фильтрует кровь, а не лимфу. Кровь попадает в селезенку по артериям и выходит по венам. Селезенка состоит из двух типов ткани: красной пульпы и белой пульпы. Красная мякоть состоит из полостей, в которых хранится кровь. В красной пульпе поврежденные эритроциты удаляются и заменяются новыми. Белая пульпа богата лимфоцитами, которые удаляют из крови покрытые антигеном бактерии.(кредит: модификация работы NCI)Резюме
Адаптивный иммунный ответ — это медленный, продолжительный и более специфический ответ, чем врожденный. Однако для функционирования адаптивного ответа требуется информация от врожденной иммунной системы. APC отображают антигены через молекулы MHC комплементарным наивным Т-клеткам. В ответ Т-клетки дифференцируются и пролиферируют, превращаясь в клетки Т Н или CTL. Клетки T H стимулируют В-клетки, которые поглотили и представили патогенные антигены.В-клетки дифференцируются в плазматические клетки, которые секретируют антитела, тогда как ЦТЛ вызывают апоптоз внутриклеточно инфицированных или раковых клеток. Клетки памяти сохраняются после первичного воздействия патогена. Если происходит повторное воздействие, клетки памяти дифференцируются в эффекторные клетки без участия врожденной иммунной системы. Иммунная система слизистой оболочки в значительной степени независима от системной иммунной системы, но функционирует параллельно, защищая обширные поверхности слизистой оболочки тела.
Упражнения
- Какое из следующих утверждений о Т-клетках неверно?
- Хелперные Т-клетки выделяют цитокины, в то время как цитотоксические Т-клетки убивают инфицированную клетку.
- Т-хелперы — это CD4 +, а цитотоксические Т-клетки — это CD8 + .
- MHC II — это рецептор, обнаруженный в большинстве клеток организма, в то время как MHC I — это рецептор, обнаруженный только на иммунных клетках.
- Т-клеточный рецептор обнаружен как на Т-клетках CD4 + , так и на CD8 + .
- На основании того, что вы знаете о рецепторах MHC, почему вы думаете, что орган, пересаженный от несовместимого донора реципиенту, будет отклонен?
- Rh-антиген обнаружен на резус-положительных эритроцитах.Резус-отрицательная женщина обычно без труда выносит резус-положительный плод до срока. Однако, если у нее второй резус-положительный плод, ее организм может запустить иммунную атаку, которая вызовет гемолитическую болезнь новорожденного. Как вы думаете, почему гемолитическая болезнь — это проблема только во время второй или последующих беременностей?
- Что из следующего является фагоцитом и антигенпрезентирующей клеткой?
- Ячейка НК
- эозинофил
- нейтрофил
- макрофаг
- Какие иммунные клетки связывают молекулы MHC на APC через корецепторы CD8 на своей клеточной поверхности?
- T H ячейки
- CTL
- тучные клетки
- базофилы
- Какой образец «я» идентифицируют NK-клетки?
- измененная личность
- пропавшее без вести
- нормальный самобытный
- чужое
- Приобретенная способность предотвращать ненужную или деструктивную иммунную реакцию на безвредные инородные частицы, такие как пищевой белок, называется ________.
- Т H 2 ответа
- аллергия
- иммунная толерантность
- аутоиммунитет
- B-клетка памяти может дифференцироваться при повторном контакте с патогеном какого типа клетки?
- CTL
- наивная В-клетка
- Т-клетка памяти
- плазматическая ячейка
- Посторонние частицы, циркулирующие в крови, фильтруются ________.
- селезенка
- лимфатические узлы
- СОЛОД
- лимфа
- Объясните разницу между эпитопом и антигеном.
- Что такое наивная В- или Т-клетка?
- Чем ответ T H 1 отличается от ответа T H 2?
- В адаптивной иммунной системе млекопитающих рецепторы Т-клеток чрезвычайно разнообразны. Какая функция иммунной системы является результатом этого разнообразия и как это разнообразие достигается?
- Чем В- и Т-клетки различаются по антигенам, которые они связывают?
- Почему иммунный ответ после повторного заражения намного быстрее, чем адаптивный иммунный ответ после первоначального заражения?
Ответы
- С Рецепторы
- MHC различаются от человека к человеку.Таким образом, рецепторы MHC несовместимого донора считаются «чужими» и отвергаются иммунной системой.
- Если кровь матери и плода смешивается, клетки памяти, распознающие антиген Rh, могут образоваться на поздних сроках первой беременности. Во время последующих беременностей эти клетки памяти запускают иммунную атаку на клетки крови плода. Введение анти-резус-антитела во время первой беременности предотвращает возникновение иммунного ответа.
- D
- B
- B
- С
- D
- А
- Антиген — это молекула, которая реагирует с некоторым компонентом иммунного ответа (антитело, В-клеточный рецептор, Т-клеточный рецептор).Эпитоп — это участок антигена, через который на самом деле происходит связывание с иммунным компонентом.
- Наивная Т- или В-клетка — это клетка, которая не была активирована путем связывания с соответствующим эпитопом. Наивные Т- и В-клетки не могут вызывать реакции.
- Ответ T H 1 включает секрецию цитокинов для стимуляции макрофагов и CTL и улучшения их разрушения внутриклеточных патогенов и опухолевых клеток. Это связано с воспалением. Ответ T H 2 участвует в стимуляции B-клеток в плазматические клетки, которые синтезируют и секретируют антитела.
- Разнообразие TCR позволяет иммунной системе иметь миллионы различных Т-клеток и, таким образом, быть специфичным в различении антигенов. Это разнообразие возникает в результате мутации и рекомбинации генов, кодирующих вариабельные области TCR.
Т-клетки связывают антигены, которые были переварены и встроены в молекулы MHC с помощью APC. Напротив, B-клетки функционируют как APC, связывая интактные необработанные антигены.
- После повторного заражения клетки памяти немедленно дифференцируются в плазматические клетки и CTL без поступления от APC или клеток T H .Напротив, адаптивный иммунный ответ на первоначальную инфекцию требует времени для идентификации и активации наивных В- и Т-клеток с соответствующей антигенной специфичностью.
Глоссарий
- адаптивная невосприимчивость
- Иммунитет с памятью, возникающий после воздействия антигена патогена или вакцинации
- антигенпрезентирующая клетка (APC)
- Иммунная клетка, которая обнаруживает, поглощает и сообщает адаптивному иммунному ответу об инфекции, представляя процессированный антиген на поверхности клетки
- антиген
- чужеродный или «чужой» белок, запускающий иммунный ответ
- аутоиммунный ответ
- несоответствующий иммунный ответ на клетки-хозяева или аутоантигены
- клеточно-опосредованный иммунный ответ
- адаптивный иммунный ответ, который осуществляется Т-клетками
- клональный отбор
- Активация В-клеток, соответствующих одному конкретному варианту BCR, и резкая пролиферация этого варианта
- цитотоксический Т-лимфоцит (CTL)
- адаптивная иммунная клетка, которая напрямую убивает инфицированные клетки с помощью перфорина и гранзимов и высвобождает цитокины для усиления иммунного ответа
- дендритная клетка
- Иммунная клетка, которая обрабатывает антигенный материал и представляет его на поверхности других клеток, чтобы вызвать иммунный ответ
- эффекторная клетка
- дифференцировавшийся лимфоцит, такой как В-клетка, плазматическая клетка или цитотоксический Т-лимфоцит
- эпитоп
- небольшой компонент антигена, который специфически распознается антителами, В-клетками и Т-клетками; антигенная детерминанта
- Т-лимфоцит-помощник (T H )
- Клетка адаптивной иммунной системы, которая связывает APC через молекулы MHC II и стимулирует В-клетки или секретирует цитокины, чтобы инициировать иммунный ответ
- гуморальный иммунный ответ
- адаптивный иммунный ответ, который контролируется активированными В-клетками и антителами
- иммунная толерантность
- приобретенная способность предотвращать ненужный или вредный иммунный ответ на обнаруженное инородное тело, которое, как известно, не вызывает заболевания, или на аутоантигены
- лимфа
- водянистая жидкость, омывающая ткани и органы защитными лейкоцитами и не содержащая эритроцитов
- ячейка памяти
- антигенспецифический В- или Т-лимфоцит, который не дифференцируется в эффекторные клетки во время первичного иммунного ответа, но который может сразу же стать эффекторной клеткой при повторном воздействии того же патогена
- лимфоидная ткань, ассоциированная со слизистой оболочкой (MALT)
- скопление лимфатической ткани, которая сочетается с эпителиальной тканью, выстилающей слизистую оболочку по всему телу
- регулятор T (T reg ) ячейка
- специализированный лимфоцит, подавляющий местное воспаление и подавляющий секрецию цитокинов, антител и других стимулирующих иммунных факторов; участвует в иммунной толерантности
Плазматическая клетка — это иммунная клетка, секретирующая антитела; эти клетки возникают из В-клеток, которые были стимулированы антигенами.
T-CMI
T-CMIТ-клеточно-опосредованный Иммунитет
Это модуль вам поможет
- посмотрите, как устроены Т-клетки активируется антигеном, представленным на APC.
- понять свойства и функции эффекторных Т-клеток.
- проверьте свои знания и навыки решения проблем иммунологии.
Т-клетка
Активация
Свойства эффекторных Т-клеток
Цитотоксические Т-клетки
Активация макрофагов Th2 (воспалительные Т) -клетки
т Активация ячейки
Адаптивный Т клеточный иммунитет управляется активацией Т-клеток: цитотоксические Т-клетки, активируемые эндогенным антигеном для уничтожения инфицированных клетки и хелперные Т-клетки, активируемые экзогенным антигеном для стимуляции макрофаги убивают эндосомальные патогены.Обратите внимание, что возбудители нацелены на клеточный иммунитет, защищены от антител и связывание комплемента по их внутриклеточному расположению. Адаптивный гуморальный иммунитет также обычно включает активацию Т-клеток для производства цитокинов. которые стимулируют синтез антител к В-клеткам. Наивные Т-клетки в состоянии покоя стимулируются антигенным пептидом, представленным на MHC класса I, до цитотоксических CD8 T-клетки или MHC класса II для поддержки CD4 T-клеток вместе с костимулирующие сигналы от APC, чтобы пролиферировать и дифференцироваться в клоны полностью активированных эффекторных Т-клеток.Только профессиональный БТР (дендритные клетки, макрофаги и В-клетки) имеют как класс I, так и класс II MHC и может доставлять костимуляторные сигналы. Активированные Т-клетки выполняют свои эффекторные функции, когда сталкиваются с MHC-представленными пептид на их клетках-мишенях .
Эффектор Клетки адаптивного иммунитета | ||||
Эффектор | Возбудитель | Антиген | Цель
Ячейка | |
Сотовая связь | Тс
CD8 | Цитоплазма | Зараженный ячейка MHC I | Зараженный
ячейка |
Чт2
CD4 | Макрофаг | Макрофаги MHC II | Макрофаги активация для уничтожения патогена | |
Гуморальный | Чт3
CD4 | Внеклеточный | БТР MHC II | B продукция клеточных антител |
Наивные зрелые Т-клетки постоянно рециркулируют между вторичными лимфоидными органами и кровью и лимфатическое кровообращение.Торговля лимфоцитами зависит от распознавания адресинов сосудов на эндотелиальных клетках сосудов внутри вторичные лимфоидные органы. Большинство Т-клеток используют L-селектин для связывания CD34 на лимфатическом узле и селезенки HEV. Подмножество Т-клеток использует LPAM-1 для связывания MadCAM-1 на эндотелий слизистой оболочки. Только около одной Т-клетки из 10 4 -10 6 специфичен для данного антигена, и вероятность этих редких T клетки, встречающие правильно представленный антиген в кровообращении, очень низкий.Активация антигена Т-клеток происходит во вторичной лимфоидные органы: пейеровы бляшки или миндалины для заражения болезнетворными микроорганизмами ткани слизистой оболочки (дыхательные, пищеварительные и урогенитальные тракты), дренирование лимфатических узлов для патогенов в периферических тканях и селезенка на наличие патогенов в крови. Трафик через эти вторичные лимфоидные органы выводят Т-клетки за пределы APC, которые, вероятно, будут представляющий чужеродный антиген, если таковой присутствует, поскольку и антиген, и лейкоциты накапливаются во вторичных лимфоидных органах.Т-клеточная «выборка» собственный пептид : комплексов MHC на APC при отсутствии инфекции служит сигналом выживания для зрелых Т-клеток, когда они покидают вилочковая железа.
Передача сигналов между Т-клетками и APC также зависит от CAM. Даже если Т-клетка, специфичная для пептида, должна встретить APC с этим пептидом на правильном MHC, вероятность этих молекул достаточно близко на обеих клеточных поверхностях для связывания произойти было бы очень мало.Многочисленные CAM на обеих ячейках позволяют им придерживаться неспецифического характера в течение некоторого времени, так что если антигенспецифический взаимодействие может произойти, оно будет. При слипании Т-лимфоцитов и АПК движение комплексов TCR и пептида : MHC в плоскости клетки мембраны приближают их достаточно близко, чтобы связать друг друга. Как только TCR получит связанный пептид + MHC, T-клеточный LFA-1 изменяет свою конформацию, чтобы связывать даже более плотно к APC для длительного контакта, необходимого для Т-лимфоцитов активация.Этот контакт может длиться несколько дней, в течение которых T клетка делится, и ее потомство также присоединяется к APC и получает сигналы активации.
Ключ Молекулы адгезии в Т-клетках Активация | ||
Ig
Надсемейство | Ткань Распределение | Интегрин Лиганд |
CD2 (LFA-2) | т ячейки | LFA-3 на APC |
ICAM-1 (CD 54) | Активировано
эндотелий | LFA-1
на Т-клетках |
ICAM-2 (CD102) | Отдыхающий эндотелий | LFA-1 на Т-клетках |
ICAM-3 (CD50) | Наивный Т-клетки | DC-SIGN на дендритных клетках |
LFA-3 (CD58) | Лимфоциты | CD2 на Т-клетках |
VCAM-1 | Активировано эндотелий | VLA-4 на активированных Т-клетках |
Для активации Т-клеток, APC должен доставлять два разных сигнала: один к TCR через пептид на MHC, а один второй костимулирующий сигнал .Профессиональный APC, который может обеспечивают костимуляцию дендритных клеток (ДК), макрофагов и B клетки. Из этих типов клеток ДК обеспечивают лучшую совместную стимуляцию и являются вероятно, отвечает за активацию большинства наивных Т-клеток. Использование APC молекула мембраны B7 ( B7.1 = CD80 и B7.2 = CD86 — несколько разные формы этой молекулы) для доставки костимулирующий сигнал через Т-клеточную мембрану CD28 . Сигналы полученные через CD28, когда они получены с сигналами антигена, активируют T клетка.Некоторые антитела к CD28 могут давать костимуляторные сигналы, в то время как антитела к B7 блокируют способность APC активировать Т-клетки.
В общем, та же ячейка должен доставлять антигенный сигнал и костимуляторный сигнал одновременно с Т-клеткой для активации. Причина для это ограничение состоит в том, что не все самореактивные Т-клетки удаляются в вилочковой железы, поскольку некоторые аутоантигены секвестрируются в других тканях или внутри клеток. Если антиген и сигналы костимуляции могут быть доставляемые отдельно, Т-клетки могут стимулироваться собственными пептидами посредством не-APC, а затем полностью активируются, чтобы вызвать аутоиммунный ответ APC, представляющий другой пептид.Т-клетки, связывающие антиген без костимуляции становится анергическим и не может в будущем реагировать на антиген, даже если получена надлежащая совместная стимуляция. Почему клетки инактивируются, но не погибают (хотя некоторые из них подвергаются апоптоз) неизвестно. Одна из гипотез состоит в том, что анергические клетки могут конкурировать с наивными клетками за чужеродный пептид, который похож на себя и предотвратить аутоиммунитет.
Как только Т-клетка становится активированный, он экспрессирует другие рецепторы, которые усиливают совместную стимуляцию.А Ключевой молекулой Т-клетки, экспрессирующейся на ранней стадии активации, является лиганд CD40 ( CD40L ). CD40L связывает APC CD40 и передает активацию сигналы к Т-клетке; Т-клетки мышей, которые не могут экспрессировать CD40L, не могут выходят за рамки ранних стадий активации Т-клеток. Связывание CD40L с APC CD40 сигнализирует APC экспрессировать больше молекул B7, чтобы обеспечить еще больше костимуляция Т-клеток; передача сигналов В-клеткам и макрофагам через CD40 также способствует их активации.Связывание других индуцибельных сигнальные молекулы 4-1BB (CD137) и ICOS (Inducible CO-Stimulator) на Т-клетки к лиганду 4-1BB (4-1BBL) и LICOS (лиганд ICOS) на активированные DC, макрофаги и B-клетки также дополнительно активируют как T ячейка и БТР.
Когда Т-клетка становится активированный, он экспрессирует CTLA-4 молекулу, очень похожую на CD28 а также способен связывать B7 вместе с его молекулами CD28. CTLA-4 связывает B7 примерно в 20 раз более жадно, чем CD28, и связывание CTLA-4 с B7 посылает сигнал инактивации Т-клетке.Иммунный ответ, следовательно, зависит от «толчка» стимуляции антигеном, чтобы активировать T клетки в эффекторы и «притяжение» отрицательных сигналов, которые сокращают T клеточные ответы. Эти комбинации активации и инактивации сигнальные механизмы распространены в иммунной системе и служат для контролировать очень мощную реакцию, которая может повредить тело, если не ограниченный. Мыши, рожденные с дефектным геном CTLA-4, страдают: чрезмерное разрастание лимфоцитов.
Дендритные клетки мигрируют в периферические ткани из костного мозга, где они производятся.Они находятся в виде незрелых дендритных клеток под поверхностными эпителиальными клетками (кожа и слизистые оболочки) и в большинстве твердых органов. Когда незрелый, DC экспресса нет B7 и мало MHC. Однако они очень активны в связывании антиген путем распознавания образов и с рецептором DEC-205, а в фагоцитирующий антиген так же, как и макрофаги. Незрелый DC также может поглощать антиген, проглатывая внеклеточную жидкость, используя макропиноцитоз . DC заражены многими вирусами, и другими вирусами, которые проникают через макропиноцитоз может реплицироваться в цитоплазме ДК.Пептиды фагоцитированные вирусы также могут быть представлены на MHC класса I, хотя это неясно, как они попадают из эндосомы в цитоплазматическую путь презентации. Следовательно, DC могут активировать как Tc с пептидом на MHC класса I, а также Th с пептидами MHC класса II. Постоянный ток присутствует пептиды от самых разных патогенов (включая грибы и паразиты), аллергены и аллоантигены из пересаженных органов.
Как только незрелые DC имеют уловив антиген, они мигрируют в периферические лимфоидные органы.Там они попадают в области Т-клеток и теряют способность принимать антиген, но экспрессируют высокие уровни MHC класса I и класса II, B7 и CAM DC-SIGN, что делает их отличными БТР. Они также выделяют хемокин (DC-CK), привлекающий Т-клетки. Сигналы, которые посылают постоянный ток в лимфоидные органы и изменение их фенотипа неизвестны, хотя Передача сигналов LPS через Toll-подобный рецептор TLR-4 также происходит для DC. Клетки Лангерганса в коже являются примером незрелых дендритные клетки, которые становятся активными APC в лимфатических узлах.
Макрофаги очень активные фагоциты, особенно бактериальных возбудителей; они не берут растворимые антигены (белки) хорошо. Они встречаются по всему телу как резидентные макрофаги в тканях, а циркулирующие моноциты могут проникать ткани в ответ на инфекцию и становятся макрофагами. Отдыхает макрофаги мало экспрессируют MHC и B7 класса II, но увеличивают экспрессию этих молекул, как только они фагоцитируют бактерии из-за передача сигналов через рецепторы, такие как TLR-4.Патогены, которые фагоцитируются, наиболее эффективно связываются с рецепторами макрофагов распознавание паттернов общих бактериальных антигенов, таких как ЛПС и углеводы: CD14, рецептор маннозы, рецептор скавенджера и рецепторы комплемента. Бактериальные антигены часто служат эффективными адъюванты для субъединичных (белковых или пептидных) вакцин, поскольку они индуцируют экспрессия костимулирующих молекул на APC. Макрофаги мигрируют в вторичные лимфоидные органы из очагов инфекции для презентации антигена T клетки.
Макрофаги в красном пульпа селезенки и клетки Купфера в печени непрерывно фагоцитируют мертвые клетки-хозяева и, если они должны были представить эти клетки Т-клетки могут вызывать аутоиммунитет. Однако эти макрофаги экспрессируют мало B7 и MHC и не стимулируются связыванием и фагоцитирующие клетки-хозяева. Их также нет в местах, часто посещаемых Т-клетки.
B-клеток уникальны среди APC, потому что они используют свой мембранный Ig для специфического связывания и усваивают растворимые антигены.Сшивание антигенов BCR стимулирует эндоцитоз и презентация антигена В-клетками. В-клетки конститутивно имеют высокий уровень MHC класса II. Костимуляторная экспрессия молекулы увеличивается при контакте с некоторыми бактериальными углеводами и ЛПС, что делает маловероятным, что В-клетки активируют Т-клетки для ответа на самостоятельные пептиды при отсутствии инфекции. В-клетки попадают во вторичные лимфоидные органы, проходя через области Т-клеток, где они вероятно, контактирует с Т-клетками.В-клетки активируют Т-клетки при более низком уровне антигена концентрации, чем макрофаги. Они представлены преимущественно токсины и аллергены бактерий и насекомых. Важность В-клеток в активация наивных Т-клеток сомнительна. Потому что специфические В-клетки изначально не присутствуют на высоких частотах, постоянный ток, вероятно, ответственны за большую активацию Т-лимфоцитов на ранних стадиях первичный ответ.
После активации Т-лимфоцитов пептидом + MHC и получая костимуляцию, они начинают синтезировать цепь рецептора IL-2 (IL-2R , также называется Tac в честь ранних моноклональных антител, специфичных для он) и секретировать ИЛ-2.Tac увеличивает сродство к IL-2R, поэтому что более низкие концентрации ИЛ-2 могут сигнализировать активированным Т-клеткам о начать клональную пролиферацию и дифференцировку в вооруженный эффектор клетка. Покоящиеся Т-клетки экспрессируют только b и g цепей IL-2R и связывают гораздо менее плотно к Ил-2. Выражение все большего и большего сродства рецепторы цитокинов активированными клетками по сравнению с покоящимися клетками сохраняют антигенспецифический иммунный ответ, даже если те же цитокины производятся в ответ на множество различных антигенов.Ответ T клетки к цитокину, который они секретируют, называется аутокринным отклик.
Недвижимость вооруженных эффекторных Т-клеток
Через 4-5 дней быстрого клональная экспансия, Т-клетки дифференцируются в вооруженных эффекторных клеток которые больше не нуждаются в костимуляции для выполнения своих эффекторных функций: цитотоксичность или секреция цитокинов. Однако Т-клетки должны продолжать связывают пептид + MHC, чтобы убить или активировать свои клетки-мишени.Три класса вооруженных эффекторных клеток специализируются на три разных вида патогенов. CD8 CTL убивают инфицированные клетки отображение пептидов цитозольных патогенов на MHC I класса. CD4 Th2 клетки активируют макрофаги с устойчивыми везикулярными патогенами, чьи пептиды отображаются на MHC класса II. Они также активируют В-клетки, чтобы продуцируют опсонизирующие антитела. CD4 Th3 клеток активируют В-клетки которые использовали свой мембранный Ig для интернализации специфического антигена и отображать пептиды на MHC класса II.Активация В-клеток и эффектор функции описаны в гуморальном иммунитете.
Вооруженные эффекторные клетки имеют различные мембранные маркеры от наивных Т-клеток в состоянии покоя. В в частности, они потеряли L-селектин, но приобрели VLA-4, так что они теряют ориентацию на лимфатические узлы и с большей вероятностью попадут в инфицированные вирусом ткани или участки инфекции, содержащие макрофаги. Эффекторные Т-клетки также экспрессируют более высокие уровни LFA-1 и CD2 и экспрессируют CD45RO вместо CD45RA (CD45 — тирозинфосфатаза, которая усиливает передачу сигналов через комплексы TCR и BCR).
Два функционально разных подмножества эффекторных Th-клеток секретируют цитокины, которые способствуют различным виды деятельности. Воспалительный или Th2 CD4 T клеток клетки продуцируют IL-2, IFNg и TNFb, которые активируют Tc и макрофаги, чтобы стимулируют клеточный иммунитет и воспаление. Клетки Th2 также секретируют IL-3 и GM-CSF для стимуляции костного мозга для производства большего количества лейкоцитов и сигнальные В-клетки для выработки опсонизирующих антител (IgG 1 и IgG 3 у людей и IgG 2a и IgG 2b у мышей). Помощник или Th3 CD4 Т-клеток клеток активируют наивные В-клетки для деления и секретируют IgM; Клетки Th3 также секретируют ИЛ-4, ИЛ-5 и ИЛ-6, которые стимулировать выработку нейтрализующих антител В-клетками.
Т-лимфоцитов изначально активируются как клетки T0, которые продуцируют IL-2, IL-4 и IFNg. Факторы, влияющие на Th0-клетку стать Th2 или Th3 не очень хорошо изучены, но включают цитокины, вызванные патогеном, костимуляторные сигналы и природа пептида MHC : , представленного Th-клетке.Цитокины Th2 и Th3 имеют антагонистические эффекты на Th-клетки. Цитокин Th2 IFNg подавляет пролиферацию клеток Th3, в то время как цитокин Th3 IL-10 ингибирует секрецию Th2 IFNg и IL-2. Баланс между Th2 и Активность Th3 направляет иммунный ответ в направлении клеточный или гуморальный иммунитет.
В некоторых случаях иммунный ответ может стать настолько поляризованным, что патоген не может быть устранено. Примером может служить ответ на Mycobacterium leprae , вызывающая болезнь Хансена (проказа). M. leprae может выжить и реплицироваться в фаголизосомах макрофагов. Люди, инфицированные M. leprae , которые вызывают ответ Th2, вырабатывают минимальные антитела, но их клеточный ответ снижает количество патогенов и их болезни медленно прогрессирует (туберкулоидная проказа). Люди, инфицированные M. leprae , которые в основном вызывают ответ Th3, имеют высокие уровни M. leprae -специфические антитела, но бактерии размножаются бесконтрольно в их макрофагах и болезнь прогрессирует быстро (лепроматозный проказа).Активность клеток Th2 и Th3 была обнаружена, потому что некоторые мыши имеют очень разную восприимчивость к простейшим паразитам Leishmania майор , который, как было обнаружено, был связан с их изготовлением гуморальные (чувствительные) или клеточные (резистентные) ответы.
CD8 Tc-клетки распознают антиген класса I MHC. Им требуются более сильные костимулирующие сигналы. чем CD4 Т-клетки, чтобы стать эффекторными клетками. CD8 Т-клетки могут быть активированы к пептидам MHC класса I инфицированными дендритными клетками, которые доставляют сильный костимулирующий сигнал.Другие БТР не производят достаточно сильных костимулирующие сигналы, поэтому связывание IL-2 от близлежащих CD4 Th-клеток пептид + MHC класса II на том же APC требуется для полной активации CD8 Tc-клетки становятся цитотоксичными. Зараженные клетки, которые не профессиональные пептиды APC экспрессируют на MHC класса I, но не могут активировать Tc клетки, потому что они не могут обеспечить совместную стимуляцию.
Первоначальное взаимодействие между эффекторными Т-клетками и их мишенями происходит через САМ, например LFA-1 на Т-клетке и ICAM-1 на целевой клетке.Если конкретно Связывание TCR-пептид-MHC не происходит, эффекторные Т-клетки отсоединяются и связывает другую потенциальную цель. Если TCR связывает специфический пептид + MHC, кластеры взаимодействующих молекул на противоположном TCR и клетке-мишени мембраны. Многие индивидуальные комплексы TCR-пептид-MHC образуют центр область связывания, окруженная множеством взаимодействий CAM-CAM для удержания клетки плотно прилегают друг к другу. Т-клетка запускается для высвобождения эффектора молекул в тесное пространство между клетками: цитотоксинов для CTL и цитокинов для Th-клеток.Близость клетки мембраны увеличивают эффективную концентрацию секретируемых молекул и гарантирует, что никакие другие клетки не будут неспецифически стимулированы к смерти или стать активированным.
Цитотоксический Т-клетки
Цитотоксические Т-клетки (CTL) опосредуют антиген-специфическую цитотоксичность, ограниченную MHC, и являются важными для уничтожения внутрицитоплазматических паразитов, недоступных для секретируемое антитело или к фагоцитам.Примеры включают все вирусы, риккетсии (причины пятнистой лихорадки Скалистых гор и сыпного тифа), некоторые облигатные внутриклеточные бактерии ( Chlamydia ) и некоторые простейшие паразиты, которые экспортируют свои белки из везикул макрофагов в цитоплазма ( Toxoplasma gondii ). Единственный способ устранить эти патогены убивают их клетки-хозяева.
Effector CTL связывают свои сначала нацеливается через неспецифические молекулы адгезии, такие как LFA-1 (CD 11a / 18), затем с конкретным TCR.Реориенты связывания TCR-пептид-MHC-CD8 цитоскелет CTL, чтобы направить высвобождение эффекторных молекул на целевая ячейка. CTL индуцируют апоптоз в своих мишенях. Клетки подвергаясь апоптозу, подвергаются конденсации хроматина и мембраны выпадение пузырьков. ДНК разрезается на части, кратные 200 п.н., что выглядят как ступеньки на лестнице (и называется « DNA лестница ») при работе на геле, разделяющем ДНК по размеру. Фрагментированная ДНК может быть детектируется в отдельных клетках с помощью анализа TUNEL .
Программирование цели клетке, чтобы умереть, требуется всего около 5 минут контакта между CTL и target, хотя цели могут казаться жизнеспособными намного дольше. CTL затем диссоциировать, чтобы связать и убить другие клетки-мишени, представляющие такие же эпитоп. В процессе созревания в эффекторные CTL клетки CD8 синтезировать цитотоксические молекулы и хранить их в цитоплазматических гранулах для быстрого высвобождения при связывании клеток-мишеней. Perforin имеет гомология последовательности с комплементом C9 и полимеризуется с образованием пор в мембрана клетки-мишени, через которую могут проникать вода и соли.В высокие концентрации перфорина, этого может быть достаточно, чтобы уничтожить цель осмотическим лизисом, но считается, что физиологические уровни перфорина быть слишком низким, чтобы вызвать осмотический лизис. Вместо этого поры перфорина позволяют гранзимы для попадания в целевую клетку. Гранзимы являются сериновыми протеазы, которые запускают апоптотический каскад, ведущий к ДНК фрагментация и отхождение мембраносвязанных пузырьков. Апоптотические ферменты активируется гранзимами, может также разрушать вирусы или другие цитоплазматические патогены в клетках-мишенях, так что патогены не могут заразить соседние клетки.Мертвые клетки-мишени быстро поглощаются макрофагами без активации экспрессии макрофагами B7, предотвращая костимуляция любых самоспецифичных Т-клеток, которые связываются с самими собой пептиды на макрофагах MHC.
Полимеризация перфорина должен происходить преимущественно в плазматической мембране клетки-мишени, поскольку CTL не лизируются, и один CTL может последовательно убить множество инфицированных. цели. Непонятно, как CTL защищены от перфорина. полимеризация и проникновение гранзима, поскольку молекулы неспецифичны а в аллогенных системах CTL могут служить клетками-мишенями
Второй механизм для CTL убийство было обнаружено у мышей с нокаутом по перфорину.Связывание CTL мембранный лиганд Fas ( FasL ) к клетке-мишени Fas индуцирует апоптоз клеток-мишеней. Поскольку активированные клетки Th2 и Th3 также экспрессируют FasL, они также могут обладать цитотоксической активностью. Потому что мыши с дефектами в Fas или FasL чаще встречаются лимфопролиферативные заболевания. и аутоиммунитет этот цитотоксический механизм может быть важен для регулирование иммунных ответов.
CTL также регулируют иммунную ответы путем высвобождения IFNg, TNFa и TNFb.IFNg подавляет репликацию вируса, активирует экспрессию IL-1 и TAP инфицированными клетками, чтобы продвигать антиген презентация, рекрутирует и активирует макрофаги как APC и эффекторные клетки. TNFa и TNFb действуют вместе с IFNg, чтобы активировать макрофаги и непосредственно убить некоторые клетки-мишени. Макрофаги с выжившими везикулярными патогенами, такими как Toxoplasma gondii может также представлять пептид патогена на MHC класса I, потому что некоторые патогены белки экспортируются в цитоплазму.В этих случаях CTL может сыграть важная роль в уничтожении паразита путем уничтожения макрофагов хозяина а также активация других макрофагов, чтобы поглотить и убить паразит. IFNg также может умереть от голода резидентные внутриклеточные паразиты за счет снижения концентрации триптофана. Клетки Natural Killer опосредуют ранние врожденные цитотоксические реакции на вирусов и опухолевых клеток с перфорином и гранзимами, хотя распознавание целей совсем другое.
Макрофаги Активация Th2 (воспалительные Т) -клетки
Фагоцитоз макрофагов и убить множество патогенов с помощью лизосомальных ферментов.Некоторые патогены, однако фагоцитируются, но избегают убийства, предотвращая слияние лизосомы с фагоцитарным пузырьком или активацией лизосомального ферменты путем подкисления фаголизосомы. Некоторые патогены могут покидают фаголизосомы и живут в цитоплазме макрофагов. В целом В этих условиях патогены защищены от дополнения и антитела; там, где патогены остаются в пузырьках, их пептиды также недостаточно эффективно представлены CD8 Т-клеткам.
Активация макрофагов вооруженные эффекторные клетки Th2 необходимы для устранения везикулярных патогенов. Активация макрофагов требует связывания Т-клеток с антигенным пептидом на макрофаги класса II MHC, костимуляция макрофагов через CD40 и активация макрофага IFNg. CD40L мембраны Th2 связывается с CD40 макрофага и сигнализирует макрофагу о экспрессии рецепторов IFNg, который синтезируется de novo клеткой Th2. Синтез длится несколько часов, поэтому макрофаги активация происходит медленнее, чем цитотоксичность, опосредованная CTL.Секреция CD40L и IFNg направлена на антигенпредставляющий макрофаг за счет поляризации мембраны; активация обычно ограничивается инфицированными макрофагами. IFNg продуцируемые CTL могут активировать макрофаги, представляющие цитозольные пептиды по классу I MHC. Макрофаги могут быть сенсибилизированы к IFNg за счет низких уровней LPS и мембраносвязанного TNFa или TNFb. может заменять сигнал CD40L при активации макрофагов. Активирован Клетки Th3 экспрессируют CD40L, но вместо IFNg они секретируют цитокин IL-10, ингибирующий макрофаги.
IFNg активирует макрофаги для активации MHC класса II, Экспрессия рецепторов B7, CD40 и TNF для привлечения большего количества эффекторного Th2 клетки и стать более чувствительными к CD40L и TNFa. Активированные макрофаги также сливают свои фагосомы. и лизосомы более эффективно и увеличивают синтез азотных оксид, кислородные радикалы, антимикробные пептиды и IL-12, который выталкивает Th-клетки по направлению к пути Th2.
Когда патогены присутствуют, которые не могут быть фагоцитированы, например, крупные паразиты, активированные макрофаги выделяют кислородные радикалы, оксид азота и протеазы во внеклеточную жидкость, чтобы убить патоген.Выделение эти соединения также повреждают окружающие ткани хозяина. Хронически инфицированные макрофаги могут стать устойчивыми к активации. Гранулемы , гигантские клетки, состоящие из слитых макрофагов, окруженных активированным Т клетки, образующиеся, когда невозможно устранить внутриклеточные патогены. Как клетки в центре гранулемы умирают, омертвевшая ткань напоминает сыр и называется казеозный некроз . Местный воспалительный ответ в результате активации Th2-клеток и макрофагов называется отсроченным Тип или тип 4 гиперчувствительности (ГЗТ).Если макрофаги экспрессируют Fas, они может быть убит FasL-экспрессирующими Th2 клетками.
Помимо активации макрофаги, клетки Th2 секретируют различные цитокины, которые регулируют клеточный иммунитет. IL-2 стимулирует клональную пролиферацию Т-клеток. IL-3 и GM-CSF стимулируют дифференцировку макрофагов в кости костный мозг. Множественные цитокины, включая TNFa, TNFb и хемотаксис макрофагов Белок (MCP) привлекает макрофаги к месту заражения.
Практический тест
Выберите один ЛУЧШИЙ ответ нажав на букву правильного выбора.
1. Адаптивная клеточно-опосредованная иммунитет включает образование активированного антигенспецифического эффектора
а. антитела.
г. В-клетки.
г. цитокины.
г. макрофаги
e. Т-клетки.
2. Т-клетки активированы к вооруженным эффекторным клеткам, когда они сталкиваются с антигеном на
а. возникшие в крови болезнетворные бактерии.
г. стромальные клетки костного мозга.
г. профессиональный БТР.
г. инфицированные вирусом ткани.
e. все вышеперечисленное.
3. Т-клетки перемещаются из циркуляция в периферических лимфоидных тканях, когда они связываются
а. антиген.
г. APC.
г. B7.
г. самонаводящиеся молекулы.
e. сосудистые адресации.
4. LFA-1 — это
а. корецептор на Т-клетки.
г. костимулирующая молекула на APC.
г.рецептор цитокинов на APC.
г. интегрин на Т-клетках.
e. сосудистый адресин на HEV.
5. Антигенная специфичность активации Th макрофагами усиливается за счет
а. способность каждого макрофага представлять Т-клеткам только определенные эпитопы.
г. связывание молекул адгезии Т-клеток только с макрофагами, представляющими антиген, распознаваемый Т-клеткой.
г. специфичность связывания CD4 с MHC класса II на макрофаге.
г. повышение регуляции корецепторов CD4 или CD8 после связывания антигена.
e. активация костимуляторных молекул только на макрофагах, которые имеют контактировал чужой антиген
6. Мембранные события необходимые для активации Th включают все следующие, ЗА ИСКЛЮЧЕНИЕМ привязки Т-клеток
а. CD4 в APC Класс II MHC.
г. CTLA-4 — APC B7.
г. рецептор IL-2 с высоким сродством к IL-2.
г. LFA-1 в APC ICAM.
e. Преобразование TCR в пептид на MHC APC класса II.
7. Цитоплазматические сигналы. генерируется в ответ на связывание антигена и костимулирующие сигналы к Tc-клетки включают все следующие, ЗА ИСКЛЮЧЕНИЕМ
а. активация факторы транскрипции, которые активируют синтез IL-2.
г. агрегация TCR и CD8 в Т-клеточной мембране.
г. повышенный свободный внутриклеточный Ca ++ .
г. индукция синтеза РАГ.
e. связывание тирозинкиназы с цитоплазматическими доменами CD3 и CD8.
8. Клетки Th2 секретируют цитокины, которые
а. активировать макрофаги.
г. повышают склонность к аллергическим реакциям
c. подавляют секрецию воспалительных цитокинов макрофагами
d. стимулируют В-клетки секретировать нейтрализующие антитела
e. стимулировать пролиферацию клеток Th3
9. Т-клетка, связывающая антиген без костимулирующего сигнала от APC
а.становится неактивным.
г. может стать клеткой-помощником, но не клеткой-убийцей.
г. может получить костимулирующий сигнал от другого APC
d. умирает.
e. делит, но не образует эффекторные молекулы.
10. Дендритные клетки лучшие БТР для активации
а. CTL.
г. хелперные Т-клетки.
г. наивные Т-клетки.
г. Th2 клетки.
e. Th3 клетки.
11.Макрофаги в норме имеют низкие уровни B7 и MHC, но экспрессируют больше после фагоцитоза
а. бактериальные антигены.
г. пептидные антигены.
г. Цитокины Tc.
г. Цитокины Th.
e. вирусные антигены.
12. В-клетки отличаются от другой профессиональный APC, потому что B-клетки
а. активируют Т-клетки во вторичных лимфоидных органах.
г. представляют экзогенный антиген Т-клеткам на MHC класса II.
г. представляют только пептиды антигенов, которые они связывают с их мембранным Ig.
г. используют B7 в качестве костимулирующей молекулы.
e. Ничего из вышеперечисленного не соответствует действительности.
13. Как только Т-клетки получили антиген плюс костимулирующие сигналы, они делятся в ответ к ИЛ-2, секретируемому
а. В-клетки.
г. дендритные клетки.
г. макрофаги.
г. сами себя.
e. какой бы APC их ни активировал.
14. А-цепь рецептора IL-2
а. вызывает рецептор для связывания с TCR в Т-клеточной мембране.
г. изменяет специфичность рецептора к связыванию IFNg.
г. увеличивает сродство рецептора к ИЛ-2.
г. увеличивает передачу сигнала ITAM рецептора.
e. Все вышесказанное верно.
15. Требуется ___________________ после контакта с антигеном до включения Т-лимфоцитов эффекторные клетки.
а. 5 минут.
г. 30 минут.
г. 24 часа.
г. 4-5 дней.
e. 7-10 дней.
16. Вооруженные эффекторные Т-клетки отличаются от наивных Т-клеток тем, что эффекторные клетки
а. не антигенспецифичны.
г. не нужно связывать костимуляторные молекулы.
г. не нужно связывать пептид плюс MHC.
г. не используйте CAM для связывания других ячеек.
e. имеют CD28 вместо CTLA-4 для связывания B7.
17. Эффекторные молекулы. цитотоксических Т-клеток НЕ включают
18. Интерфероны.а. Фас.
г. гранзимы.
г. IFNg.
г. перфорин.
e. TNFb.
а. активировать B клетки для выработки вирус-специфических антител.
г. цитокины Th3.
г. представляют собой вирусные белки, которые препятствуют активации цитотоксических Т-клеток.
г. препятствуют проникновению вируса в клетки-хозяева.
e. подавляют репликацию вируса инфицированными клетками.
19. Способность цитокин для изменения экспрессии гена в клетке-мишени зависит от все нижеперечисленное, ЗА ИСКЛЮЧЕНИЕМ
21. CD40 на макрофагах связывание с CD40L на клетках Th2 сигнализирует макрофагам оа. наличие высокоаффинных рецепторов на клетке-мишени.
г. наличие растворимых рецепторов цитокинов.
г. близость продуцирующих и целевых клеток.
г. скорость транспорта цитокин-рецепторных комплексов в цитоплазму.
e. одновременное производство другого цитокина, рецептор которого использует та же субъединица, передающая сигнал.
23. Клеточный иммунитет. включает в себя все следующее, кромеа. умри.
г. убивают цитоплазматические вирусы.
г. фагоцитируют клетки Th2.
г. ответить на IFNg, выразив больше мембрана MHC.
e. секретируют ИЛ-2.
27. Гранзимы — этоа.активированные макрофаги убивают фагоцитированные бактерии.
г. CD8 Т-клетки, индуцирующие апоптоз, с использованием связывания Fas-FasL.
г. комплемент-опосредованный лизис бактериальных клеток.
г. Цитотоксические Т-клетки, ограниченные МНС, убивают инфицированные вирусом клетки.
e. NK-клетки, выполняющие естественное уничтожение опухолевых клеток.
29. IFNg выполняет все перечисленные ниже действия, ЗА ИСКЛЮЧЕНИЕМа. ферменты, которые разрезают ДНК на лестницы, чтобы вызвать апоптоз.
г. присутствует в неактивной форме в покоящихся клетках CD8.
г. секретируется в больших количествах CTL, чтобы убить множество клеток-мишеней одновременно.
г. структурно подобен цитокинам макрофагов, которые убивают везикулярные возбудители.
e. синтезируются CTL до того, как они свяжутся с клетками-мишенями.
а. активировать макрофаги.
г. резать ДНК в клетках-мишенях на фрагменты размером 200 п.н.
г. напрямую подавляют репликацию вируса в инфицированных клетках.
г. побуждают макрофаги экспрессировать более высокие уровни MHC на их мембранах.
e. голодать внутриклеточные паразиты триптофана.
30. Макрофаги. активация Th2-клетками является важным иммунным механизмом для исключая
а. бактерии, которые могут сопротивляться лизосомная деградация.
г. бактерии, капсула которых делает их устойчивыми к фагоцитозу.
г. обволакивающие вирусы.
г. паразиты, заражающие Т-клетки.
e. вирусы, поражающие макрофаги.
31. Т-клетки, которые активируют макрофаги выполняют все следующие функции, ЗА ИСКЛЮЧЕНИЕМ
а. активировать макрофаги на месте заражения.
г. активируют только макрофаги, представляющие специфический антиген на MHC.
г. становятся активированными эффекторными клетками в ответ на антиген плюс совместная стимуляция.
г. есть мембрана CD4.
e. обеспечивают гранзимы, которые макрофаги используют для уничтожения везикулярных патогенов.
32. Чт2 клетки способствуют клеточному иммунитету, секретируя в основном
а. ИЛ-1 и ИЛ-6.
г. Ил-2 и IFNg.
г. ИЛ-4 и ИЛ-5.
г. ИЛ-10 и ИЛ-12.
e. TNFa и FasL.
33. Макрофаги убивают патогены, использующие все следующие, ЗА ИСКЛЮЧЕНИЕМ
а. оксид азота.
г. кислородные радикалы.
г. перфорины.
г. перекиси.
e. протеолитические ферменты.
34. Клетки Th2 вырабатывают ИЛ-3. и GM-CSF, который
а. активировать макрофаги.
г. вызывают апоптоз в старых макрофагах.
г. стимулируют макрофаги к уничтожению везикулярных патогенов.
г. стимулируют выработку макрофагов в костном мозге.
e. Ничего из вышеперечисленного не является функцией IL-3 и GM-CSF.
Проблемы
1.Крупная лейшмания простейший паразит, поражающий макрофаги и моноциты, где он избегает разрушения лизосомальными ферментами и ускользает от репликации в везикулы. Различные линии мышей по-разному реагируют на L. major инфекция: мыши BALB / c продуцируют в основном активированные клетки Th3, тогда как Мыши C57Bl / 6 продуцируют в первую очередь активированные клетки Th2.



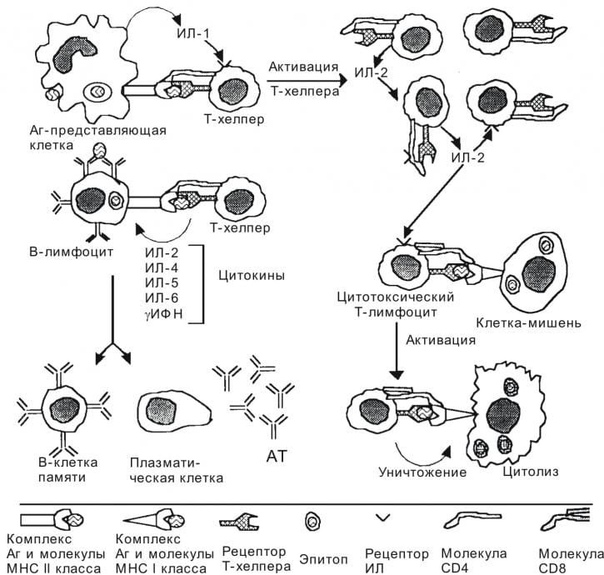 Сьюэлл, заслуженный профессор иммунологии и консультант-иммунолог1,
Сьюэлл, заслуженный профессор иммунологии и консультант-иммунолог1,