Обмен веществ
09 Сентября 2019
Гипертриглицеридемия
Гипертриглицеридемия – это заболевание, при котором в крови повышается уровень триглицеридов. Это приводит к нарушению работы внутренних органов, повышается риск развития ожирения и серьезных заболеваний. Именно поэтому рекомендуется регулярно определять уровень триглицеридов в крови и следить за тем, чтобы данный показатель был в пределах нормы.
Подробнее
05 Июля 2019
Сахарный диабет: причины, симптомы и лечение
Нарушения метаболизма (обмена веществ) широко распространены среди жителей развитых стран. Сахарный диабет — заболевание, при котором повышается уровень глюкозы в крови вследствие дисфункций поджелудочной железы либо нарушения чувствительности к инсулину со стороны рецепторов.
Подробнее
01 Июля 2019
Гипергомоцистеинемия
Гипергомоцистеинемия — патологическое состояние, которое сопровождается повышением уровня гомоцистеина в крови.
Подробнее
23 Мая 2019
Метаболизм
Обменом веществ называют набор химических реакций, которые происходят в ходе роста и жизнедеятельности клетки. В обменных процессах принимает участие множество веществ: белки, жиры, углеводы, витамины, минералы.
Подробнее
17 Марта 2019
Углеводный обмен
Совокупность процессов, протекающих в организме человека, включающих превращение моносахаридов и их производных, гомо-, гетерополисахаридов и различных углеводсодержащих биополимеров носит название углеводного обмена. Его результатом является снабжение организма энергией, осуществление межмолекулярных взаимодействий и процессов передачи биологической информации.
Подробнее
14 Марта 2019
Гомоцистеин
Эта непротеиногенная аминокислота является промежуточным продуктом в процессе метаболизма незаменимой аминокислоты метионина, который протекает в присутствии фолиевой кислоты, витаминов B12, B6, B2 и магния. В больших количествах метионин содержится в мясе, молоке, сыре, рыбе, белом хлебе, обработанных и консервированных пищевых продуктах.
Подробнее
24 Февраля 2019
Гиперхолестеринемия
Гиперхолестеринемия – это заболевание, при котором уровень холестерина в крови повышается до патологических значений. Данное соединение с точки зрения нормальной физиологии является важным и полезным. В норме большая его часть вырабатывается организмом (до 80 %). Холестерин обеспечивает стабильность мембран клеток, участвует в синтезе витаминов, желчных кислот, гормонов.
Подробнее
11 Февраля 2019
Нарушение липидного обмена
Нарушения липидного обмена (дислипидемии) влияют на процессы всасывания, трансформации и обмена жиров в организме. Помимо энергетической функции, жиры являются важным компонентом клеточных мембран, участвуют в синтезе гормонов, передаче нервных импульсов и выполняют массу других жизненно важных задач. Поэтому нарушение липидного обмена значительно сказывается на состоянии всего организма в целом и может приводить к развитию тяжелых последствий.
Помимо энергетической функции, жиры являются важным компонентом клеточных мембран, участвуют в синтезе гормонов, передаче нервных импульсов и выполняют массу других жизненно важных задач. Поэтому нарушение липидного обмена значительно сказывается на состоянии всего организма в целом и может приводить к развитию тяжелых последствий.
Подробнее
23 Января 2019
Жировой обмен
Жиры преимущественно располагаются в подкожной клетчатке и отвечают за теплоизоляцию и механическую защиту. Жировой обмен — это метаболизм липидов, включающий их расщепление, всасывание и ресинтез. Потребность в жирах у взрослого человека достигает 80–100 г в сутки. Это около 30 % энергии всего рациона питания.
Подробнее
симптомы и лечение в «ОН КЛИНИК Рязань»
Что такое «обмен веществ»? Это совокупность всех обменных процессов в организме, в результате которых он правильно развивается и нормально функционирует. Это важнейший процесс, отвечающий за жизнеобеспечение организма в целом. Любое заболевание в той или иной степени сопровождается нарушением обмена веществ, и чем тяжелее состояние пациента, тем сложнее будет привести обменные процессы в норму.
Это важнейший процесс, отвечающий за жизнеобеспечение организма в целом. Любое заболевание в той или иной степени сопровождается нарушением обмена веществ, и чем тяжелее состояние пациента, тем сложнее будет привести обменные процессы в норму.
Что может спровоцировать нарушение обмена веществ в организме? Прежде всего, это различные неврологические заболевания, а также болезни, связанные с нарушением работы щитовидной железы, надпочечников, гипофиза и репродуктивной системы. Кроме того, неправильное питание – как слишком скудный рацион, так и систематическое переедание – также может повлечь за собой сбои в обменных процессах.
Симптомы, которыми сопровождается нарушение обмена веществ
В зависимости от причин нарушений они могут проявляться по-разному. К наиболее важным симптомам можно отнести:
- стремительный набор массы тела – зачастую без каких-либо изменений в рационе пациента;
- ухудшение состояния зубов, их быстрое разрушение;
- бледность кожи и ее сильное пересушивание;
- сечение и выпадение волос;
- хрупкость и ломкость ногтей, на поверхности которых могут появиться характерные бороздки;
- у женщин нарушение обмена веществ может сопровождаться аменореей;
- нарушение работы кишечника – это может быть диарея или запор, а также их чередование.

При появлении подобных симптомов обязательно запишитесь на прием к терапевту или эндокринологу. Не откладывайте обращение к специалисту: чем раньше на основании результатов обследования будет поставлен диагноз, тем эффективнее будет лечение!
Кто находится в группе риска?
Развитие подобных нарушений – не редкость среди ведущих малоподвижный образ жизни, употребляющих алкоголь, курящих и неправильно питающихся людей. Кроме того, спровоцировать это заболевание также может и сильный стресс, нарушения сна и авитаминоз.
Другая категория пациентов, страдающих от нарушений обменных процессов в организме – это люди, в рационе которых повышенная концентрация жиров. Организм не может произвести их переработку в энергию и откладывает излишки «про запас», что приводит к оседанию на стенках сосудов холестериновых бляшек. Как следствие из этого – развитие у пациента ВСД и различных кардиологических заболеваний, а также преждевременное изнашивание и других органов и систем организма.
Лечение нарушений обмена веществ в «ОН КЛИНИК Рязань»
Лечение сбоев метаболизма – это непростой и зачастую длительный процесс. Если они обусловлены генетически, то на протяжении всей жизни пациента ему необходима поддерживающая терапия и наблюдение у эндокринолога. Что касается приобретенных заболеваний, то их лечение тем проще, чем раньше поставлен диагноз.
Прежде всего, пациенту следует нормализовать свой рацион. Специалисты нашей частной клиники в Рязани могут в индивидуальном порядке разработать программу сбалансированного питания или снижения веса, придерживаясь которой, пациент быстро приведет индекс массы тела к нормальным значениям. Правильное питание в дальнейшем поможет ему сохранять достигнутый результат, предотвращая рецидивы заболевания.
Важнейший для эффективного лечения нарушений обмена веществ фактор – это отсутствие стрессов в жизни пациента. Разумная физическая активность, нормализация режима сна и возможность регулярно уделять время любимому занятию поможет привести в норму и физическое, и психическое состояние пациента.
Физиология, метаболизм — StatPearls — NCBI Bookshelf
Введение
Метаболизм относится ко всей сумме реакций, происходящих в организме в каждой клетке и обеспечивающих тело энергией. Эта энергия используется для процессов жизнедеятельности и синтеза нового органического материала. Каждый живой организм использует окружающую среду, чтобы выжить, забирая питательные вещества и вещества, которые служат строительными блоками для движения, роста, развития и размножения. Все они опосредованы ферментами, которые представляют собой белки со специализированными функциями в анаболизме и катаболизме. Скорость производства энергии называется скоростью основного обмена и зависит от таких факторов, как пол, раса, физические упражнения, диета, возраст и такие заболевания, как сепсис или рак.
Вопросы, вызывающие озабоченность
Химические реакции, посредством которых происходит обмен веществ, почти одинаковы во всех живых организмах, включая животных, растения, бактерии и грибы. Все эти химические реакции опосредованы белками, которые действуют как катализаторы в определенных условиях окружающей среды, таких как рН и температура. Синтез многих катализаторов, обеспечивающих химические реакции в нашем организме, берет свое начало в ДНК. Дезоксирибонуклеиновая кислота представляет собой молекулу, находящуюся внутри ядра, состоящую из четырех оснований, называемых аденином, гуанином, цитозином и тимином. РНК — это молекула, используемая некоторыми живыми организмами вместо ДНК, и компоненты этой молекулы включают рибозу и урацил вместо тимина. Окружающая среда, в основном растения, использует солнечный свет для преобразования воды и углекислого газа для синтеза углеводов. Живые организмы поступают наоборот, потребляя углеводы и другие органические материалы для производства энергии.
Все эти химические реакции опосредованы белками, которые действуют как катализаторы в определенных условиях окружающей среды, таких как рН и температура. Синтез многих катализаторов, обеспечивающих химические реакции в нашем организме, берет свое начало в ДНК. Дезоксирибонуклеиновая кислота представляет собой молекулу, находящуюся внутри ядра, состоящую из четырех оснований, называемых аденином, гуанином, цитозином и тимином. РНК — это молекула, используемая некоторыми живыми организмами вместо ДНК, и компоненты этой молекулы включают рибозу и урацил вместо тимина. Окружающая среда, в основном растения, использует солнечный свет для преобразования воды и углекислого газа для синтеза углеводов. Живые организмы поступают наоборот, потребляя углеводы и другие органические материалы для производства энергии.
Термодинамика
Невозможно говорить об обмене веществ, не взглянув на законы термодинамики. Особого внимания заслуживают первые два закона. Первые два закона термодинамики гласят, что энергия не может быть ни создана, ни уничтожена и что результатом физических и химических изменений является увеличение энтропии во Вселенной. Энергия, которая действительно полезна, или свободная энергия, — это такая энергия, которая способна совершать работу при любой разнице температур. Менее полезные формы энергии высвобождаются в виде тепла.[1]
Энергия, которая действительно полезна, или свободная энергия, — это такая энергия, которая способна совершать работу при любой разнице температур. Менее полезные формы энергии высвобождаются в виде тепла.[1]
Сотовый уровень
Химический носитель энергии называется АТФ. Синтез АТФ происходит внутри внутриклеточной органеллы, ограниченной внешней и внутренней мембранами. Диссоциация воды на молекулу водорода и гидроксильную группу, происходящая во внутренней среде организма, необходима для синтеза АТФ. Катаболические реакции, которые будут обсуждаться в этой статье позже, высвобождают значительное количество протонов, большая часть которых транспортируется в митохондрии для производства АТФ. Эти протоны транспортируются через ряд комплексов во внутренней мембране митохондрий, чтобы активировать АТФазу, используя энергию, высвобождаемую механизмом транспорта электронов.
Организмы перерабатывают пищу, которую они едят, в три этапа. Первый этап включает в себя преобразование сложных молекул в простые молекулы; это включает расщепление сложных белков на олигопептиды и свободные аминокислоты для облегчения всасывания, расщепление сложных сахаров на дисахариды или моносахариды и расщепление липидов на глицерин и свободные жирные кислоты.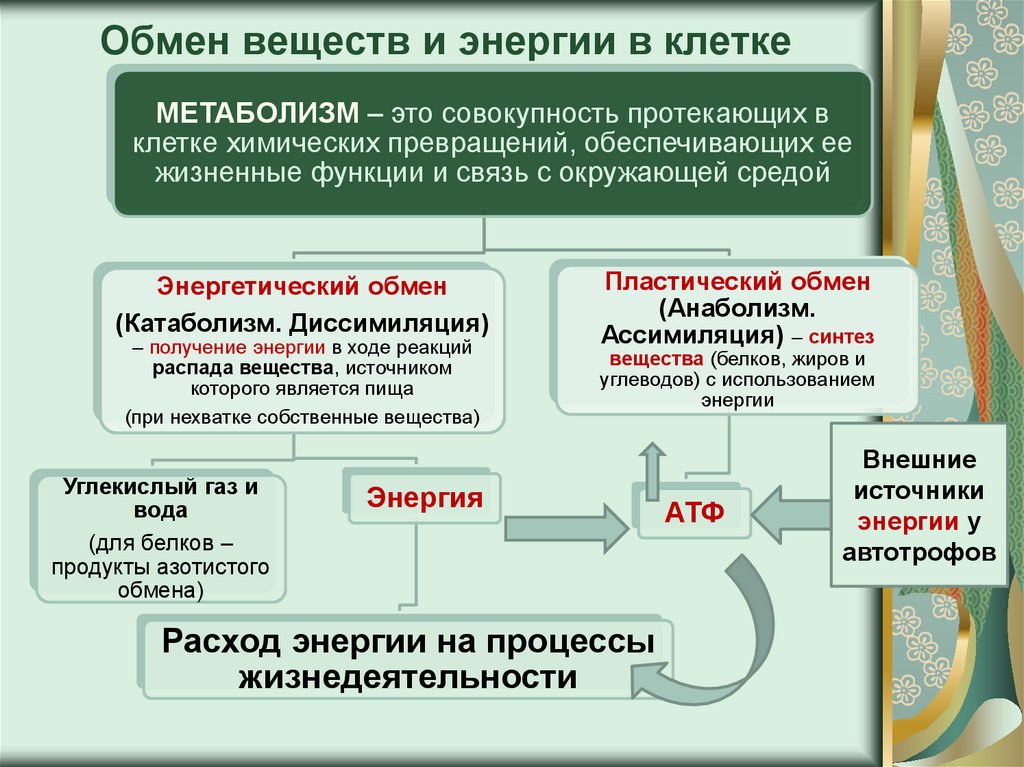
Дисбаланс между анаболизмом и катаболизмом может привести к ожирению и кахексии соответственно. Метаболическая энергия переносится высокоэнергетическими фосфатными группами, такими как АТФ, ГТФ и креатинфосфат; или переносчиками электронов, такими как НАДН, ФАДН и НАДФН.[2][3]
Метаболическая энергия переносится высокоэнергетическими фосфатными группами, такими как АТФ, ГТФ и креатинфосфат; или переносчиками электронов, такими как НАДН, ФАДН и НАДФН.[2][3]
Вовлеченные системы органов
Поджелудочная железа является ключевым метаболическим органом, который регулирует количество углеводов в крови либо путем высвобождения значительного количества инсулина для снижения уровня глюкозы в крови, либо путем высвобождения глюкагона для его повышения. Утилизация углеводов и липидов организмом называется циклом Рэндла, регулируется инсулином.
Печень является органом, отвечающим за переработку абсорбированных аминокислот и липидов из тонкого кишечника. Он также регулирует цикл мочевины и основные метаболические процессы, такие как глюконеогенез и отложение гликогена.[4]
Функция
Характеристики углеводов включают растворимость, относительно легкость транспортировки, нетоксичность молекул, которые служат источником энергии при снижении уровня кислорода.
Наиболее энергоемкими молекулами являются липиды, и они являются основной энергетической молекулой для млекопитающих и тканей. Поскольку они нерастворимы, они плохо переносятся кровью, не используются анаэробно и требуют большего количества кислорода для извлечения из них энергии (2,8 АТФ/молекула кислорода). Они не могут проникнуть через гематоэнцефалический барьер, и эритроциты или почечные клетки не могут их использовать. Аминокислоты действуют как субстраты для производства глюкозы только в условиях длительного голодания, демонстрируя истощение запасов гликогена.
Метаболизм этих трех основных субстратов сводится к одной молекуле, ацетил-КоА, в митохондриях. Метаболизм этой промежуточной молекулы генерирует 3 NADH, 1 FADH, 1 GTP и 2 CO2, все из которых участвуют в дыхательной цепи в митохондриях для синтеза АТФ.[5]
Механизм
Метаболизм углеводов
Основное внимание уделяется одному конкретному виду сахара — глюкозе. После поглощения клеткой молекулы глюкозы она немедленно метаболизируется в глюкозо-6-фосфат, который не может покинуть клетку.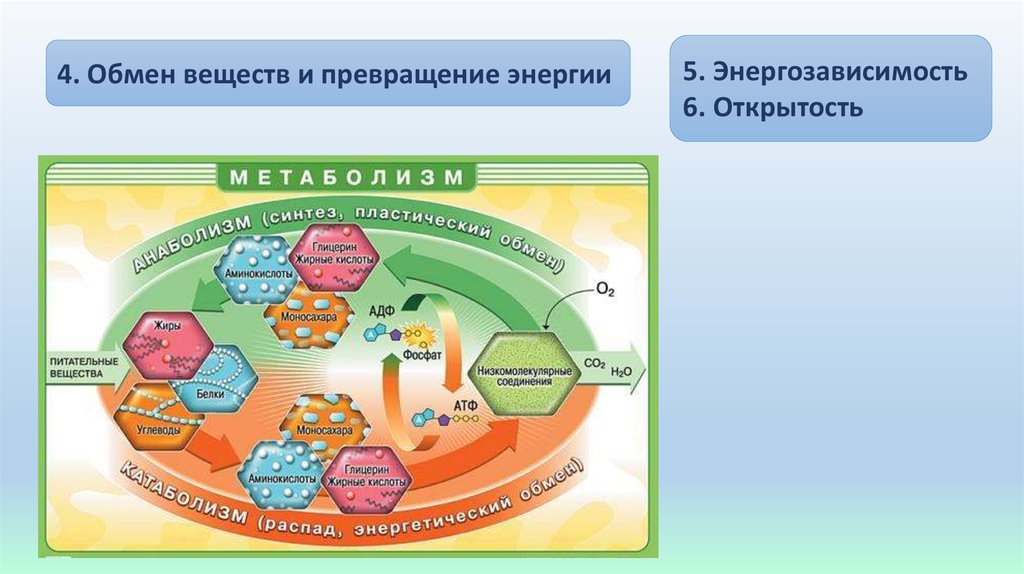 Фермент, катализирующий эту реакцию, называется гексокиназой (в печени и поджелудочной железе) или глюкокиназой во всех других тканях. Этот метаболит используется почти во всех метаболических процессах, включая гликолиз и гликогенез. Углеводы хранятся в виде гранул гликогена для быстрой мобилизации глюкозы при необходимости.
Фермент, катализирующий эту реакцию, называется гексокиназой (в печени и поджелудочной железе) или глюкокиназой во всех других тканях. Этот метаболит используется почти во всех метаболических процессах, включая гликолиз и гликогенез. Углеводы хранятся в виде гранул гликогена для быстрой мобилизации глюкозы при необходимости.
Гликоген представляет собой полимер глюкозы, собранный гликогенсинтазой, с точками ветвления через каждые десять молекул глюкозы, что придает гликогену древовидную структуру, что способствует мобилизации глюкозы. Некоторые ткани используют гликоген для собственного поддержания, например скелетные мышцы; некоторые другие ткани используют гликоген для поддержания стабильного уровня глюкозы в сыворотке, например, печень. Печень может хранить почти 100 г гликогена, который поставляет глюкозу в течение 24 часов; скелетные мышцы запасают 350 г, которых достаточно для 60-минутного сокращения мышц. Глюкоза метаболизируется путем гликолиза во всех клетках с образованием пирувата.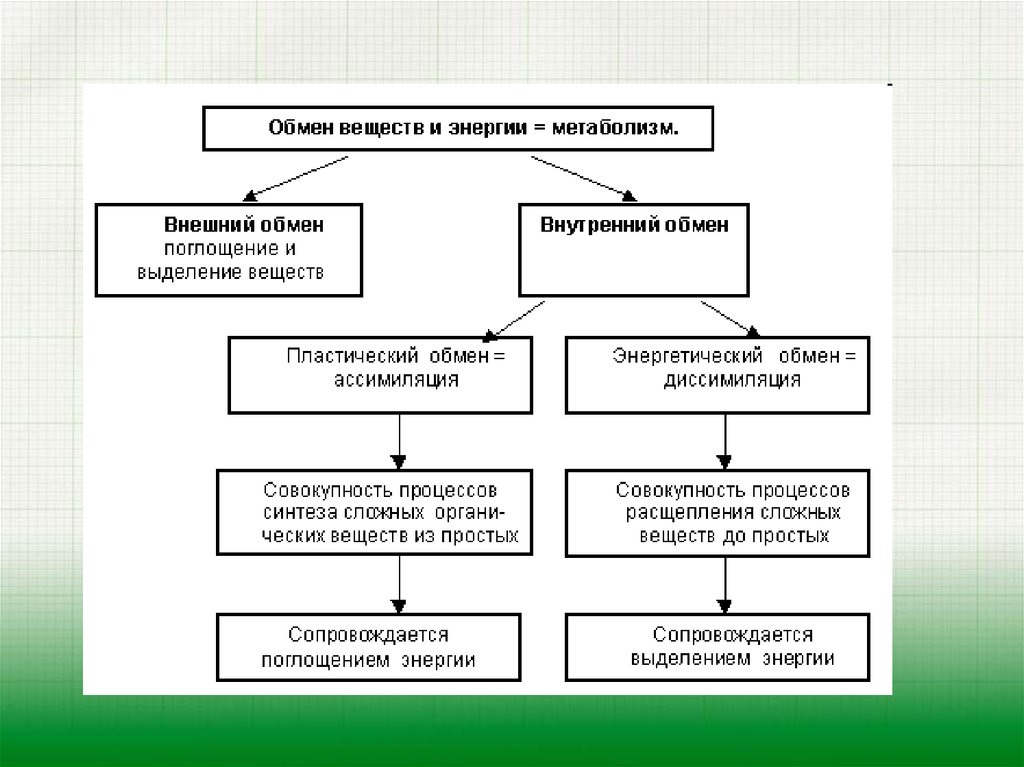 В этом процессе не используется кислород, и образуются две молекулы пирувата, 2 НАДН и 2 АТФ.
В этом процессе не используется кислород, и образуются две молекулы пирувата, 2 НАДН и 2 АТФ.
Пируват может иметь три судьбы внутри клетки: он может транспортироваться в митохондрии и генерировать ацетил-КоА, он может оставаться в цитозоле и генерировать лактат или может использоваться в гликонеогенезе ферментом аланинаминотрансферазой (АЛТ). Судьба пирувата в тканях будет зависеть от гормональной регуляции, доступности кислорода и конкретной ткани. Например, в печени избыток пирувата метаболизируется до ацетил-КоА, который затем используется для синтеза липидов, тогда как в мышцах он подвергается полному окислению до СО2.
Глюкозо-6-фосфат также можно использовать в пентозофосфатном пути. Этот путь синтезирует нуклеотиды, синтез специфических липидов и поддерживает глутатион в его активной форме. Этот процесс регулируется глюкозо-6-фосфатдегидрогеназой.
Углеводный обмен регулируется в основном инсулином, так как он стимулирует гликолиз и гликогенез. Катехоламины, глюкагон, кортизол и гормон роста стимулируют глюконеогенез и гликогенолиз. [6]
[6]
Метаболизм липидов
Жирные кислоты служат для производства энергии в окислительных тканях. Некоторые из них являются амфипатическими, потенциально токсичными и транспортируются в связанном виде с альбумином. Кишечник всасывает жирные кислоты в виде мицелл; они поглощаются энтероцитами в стенке кишечника. Оказавшись внутри, эти молекулы жира расщепляются на более мелкие молекулы, свободные жирные кислоты и глицерин, которые в задней части конъюгируются с образованием триглицеридов. Они связаны с белками, образуя хиломикроны вне энтероцита.
Эти хиломикроны очень богаты холестерином и триглицеридами, которые по системе воротной вены транспортируются в печень. Печень будет обрабатывать эти сложные молекулы, чтобы извлечь фракцию холестерина и триглицеридов. Печень секретирует новую форму сложной молекулы, называемой ЛПОНП, которая транспортирует эндогенные липиды и жир к периферическим тканям, экспрессирующим гормоночувствительную липазу и липопротеинлипазу.
Этот фермент превращает ЛПОНП в ЛПНП, который содержит больше холестерина, чем другие молекулы, и в конечном итоге поглощается тканями-мишенями. Весь этот процесс называется «прямой метаболизм холестерина». Когда в периферических тканях содержится слишком много жира или холестерина, они перемещаются в липопротеине, называемом ЛПВП, который попадает в билиарную систему для экскреции. Этот процесс называется «обратным метаболизмом холестерина». Оба регулируются инсулином, который стимулирует липазы в организме, но подавляет липолиз.][10]
Метаболизм аминокислот
Мы потребляем почти 100 г белка в день. В организме содержится почти 10 кг белка, который метаболизируется по 300 г в день. Структурными единицами, составляющими белки, являются аминокислоты. Некоторые из них являются незаменимыми (это означает, что организм не может их синтезировать и должен получать с пищей), а некоторые являются заменимыми аминокислотами (которые организм может синтезировать). Белки поглощаются энтероцитами в виде аминокислот. Аминокислоты содержат группу азота и двухуглеродный скелет, называемый 2-оксокислотой.
Белки поглощаются энтероцитами в виде аминокислот. Аминокислоты содержат группу азота и двухуглеродный скелет, называемый 2-оксокислотой.
Метаболизм аминокислот приводит к образованию аммония, который является токсичной молекулой, особенно для ЦНС. Аммоний может метаболизироваться в печени для экскреции в цикле орнитина (мочевины). Метаболизм аминокислот происходит в результате двух видов химических реакций. Первый называется трансаминированием, в котором участвуют аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (АСТ). Эти две реакции требуют трехуглеродного скелета для замены аминогруппы; скелетом этих двух ферментов является альфа-кетоглутарат. В реакции, регулируемой АЛТ, аланин переносит аминогруппу на альфа-кетоглутарат с образованием пирувата и глутамата. При регулируемой АСТ реакции происходит обратная ситуация. Он использует пожертвованную аминогруппу из глутамата для создания аспартата, чтобы пожертвовать второй атом амино в цикл мочевины. Второй реакцией является дезаминирование, при котором глутаматдегидрогеназа метаболизирует глутамат с образованием альфа-кетоглутарата и аммиака, который должен быть детоксицирован циклом мочевины.
После дезаминирования скелет подвергается промежуточному метаболизму. Метаболизм аминокислот может давать семь типов скелетов, а именно: альфа-кетоглутарат, оксалоацетат, сукцинил-КоА, фумарат, пируват, ацетил-КоА и ацетоацетил-КоА. Первые пять имеют три или более атомов углерода и полезны для гликонеогенеза, последние два имеют только два атома углерода и непригодны для гликонеогенеза. Вместо этого они используются для синтеза липидов.
Как и все другие метаболические пути, инсулин является основным регулятором. Напротив, регулятором метаболизма аминокислот является кортизол и гормон щитовидной железы, который опосредует разрушение мышц.
Клиническая значимость
Сахарный диабет
Поджелудочная железа определяет концентрацию глюкозы в крови и некоторых аминокислот, таких как аргинин и лейцин. Высокий уровень этих веществ указывает на питательное насыщение, и это сообщение посылается организму поджелудочной железой в виде инсулина. Инсулин является уникальным метаболическим гормоном, отвечающим за распределение питательных веществ в организме, а это означает, что дефицит инсулина вызывает плейотропные изменения в метаболизме человека. При дефиците инсулина торможение катаболических реакций меньше; это приводит к чистой мобилизации субстратов из тканей. Поджелудочная железа определяет статус метаболитов, периферические ткани определяют статус концентрации инсулина. Когда периферические ткани ощущают снижение уровня инсулина, они начинают катаболизироваться, и начинают мобилизоваться субстраты. Печень реагирует на низкий уровень инсулина увеличением синтеза глюкозы с помощью глюконеогенеза и гликогенолиза. Как видно из метаболизма аминокислот, основным субстратом глюконеогенеза является аланин, образующийся в результате мышечного распада и протеолиза. Жировая ткань также реагирует, усиливая липолиз, что приводит к накоплению жирных кислот и глицерина. Повышенная доставка неэтерифицированных жирных кислот (НЭЖК) в печень увеличивает кетогенез.[14]
При дефиците инсулина торможение катаболических реакций меньше; это приводит к чистой мобилизации субстратов из тканей. Поджелудочная железа определяет статус метаболитов, периферические ткани определяют статус концентрации инсулина. Когда периферические ткани ощущают снижение уровня инсулина, они начинают катаболизироваться, и начинают мобилизоваться субстраты. Печень реагирует на низкий уровень инсулина увеличением синтеза глюкозы с помощью глюконеогенеза и гликогенолиза. Как видно из метаболизма аминокислот, основным субстратом глюконеогенеза является аланин, образующийся в результате мышечного распада и протеолиза. Жировая ткань также реагирует, усиливая липолиз, что приводит к накоплению жирных кислот и глицерина. Повышенная доставка неэтерифицированных жирных кислот (НЭЖК) в печень увеличивает кетогенез.[14]
Сепсис, травма и ожоги
Катаболизм также может инициироваться чрезмерной воспалительной реакцией, характеризующейся активацией и экспрессией провоспалительных цитокинов, таких как TNF-альфа, IL-6 и IL-1. Этот процесс называется синдромом системной воспалительной реакции (SIRS). Он имеет три фазы метаболизма; фаза прилива или шока, катаболическая фаза и анаболическая фаза. В этих сценариях происходит значительная мобилизация субстрата по всему телу.[15]
Этот процесс называется синдромом системной воспалительной реакции (SIRS). Он имеет три фазы метаболизма; фаза прилива или шока, катаболическая фаза и анаболическая фаза. В этих сценариях происходит значительная мобилизация субстрата по всему телу.[15]
Дефицит G6PDH
Дефицит широко распространен в экваториальных регионах. Он связан с Х-хромосомой и снижает уровень НАДФН, следовательно, снижает уровень активной формы глутатиона и увеличивает окислительный стресс для эритроцитов; это приводит к гемолизу, представленному как кризис, в зависимости от инсульта. Он проявляется в виде телец Хайнца и пузырчатых клеток в мазке периферической крови.[16]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Прокомментируйте эту статью.
Ссылки
- 1.
Liu X, Chen T, Jain PK, Xu W. Выявление термодинамических свойств элементарных химических реакций на уровне одной молекулы.
 J Phys Chem B. 25 июля 2019 г.; 123 (29): 6253-6259. [PubMed: 31246466]
J Phys Chem B. 25 июля 2019 г.; 123 (29): 6253-6259. [PubMed: 31246466]- 2.
Ramnanan CJ, Edgerton DS, Kraft G, Cherrington AD. Физиологическое действие глюкагона на метаболизм глюкозы в печени. Сахарный диабет Ожирение Metab. 13 октября 2011 г. Приложение 1 (Приложение 1): 118–25. [Бесплатная статья PMC: PMC5371022] [PubMed: 21824265]
- 3.
Сабо И., Зоратти М. Митохондриальные каналы: потоки ионов и многое другое. Physiol Rev. 2014 Apr;94(2):519-608. [PubMed: 24692355]
- 4.
Hue L, Taegtmeyer H. Новый взгляд на цикл Рэндла: новая голова для старой шляпы. Am J Physiol Endocrinol Metab. 2009 г., сен; 297 (3): E578-91. [Бесплатная статья PMC: PMC2739696] [PubMed: 19531645]
- 5.
KREBS HA. Цикл трикарбоновых кислот. 1948–1949 Харви Лект. Серия 44: 165-99. [PubMed: 14849928]
- 6.
Дашти М. Краткий обзор биохимии: углеводный обмен. Клин Биохим. 2013 Октябрь;46(15):1339-52.
 [PubMed: 23680095]
[PubMed: 23680095]- 7.
Абумрад Н.А., Дэвидсон НЕТ. Роль кишечника в липидном гомеостазе. Physiol Rev. 2012 г., июль; 92 (3): 1061-85. [Бесплатная статья PMC: PMC3589762] [PubMed: 22811425]
- 8.
Goldstein JL, Brown MS. Рецептор ЛПНП. Артериосклеры Тромб Васк Биол. 2009 г.29 апреля (4): 431-8. [Бесплатная статья PMC: PMC2740366] [PubMed: 19299327]
- 9.
Яворски К., Саркади-Надь Э., Дункан Р.Э., Ахмадян М., Сул Х.С. Регуляция метаболизма триглицеридов. IV. Гормональная регуляция липолиза в жировой ткани. Am J Physiol Gastrointest Liver Physiol. 2007 июль; 293(1):G1-4. [Бесплатная статья PMC: PMC2887286] [PubMed: 17218471]
- 10.
Пирс В., Кароббио С., Видаль-Пуиг А. Различные оттенки жира. Природа. 2014 05 июня; 510 (7503): 76-83. [В паблике: 24899307]
- 11.
Deutz NE, Wolfe RR. Существует ли максимальный анаболический ответ на прием белка во время еды? Клин Нутр.
 2013 апр; 32 (2): 309-13. [Бесплатная статья PMC: PMC3595342] [PubMed: 23260197]
2013 апр; 32 (2): 309-13. [Бесплатная статья PMC: PMC3595342] [PubMed: 23260197]- 12.
Finn PF, Dice JF. Протеолитические и липолитические реакции на голодание. Питание. 2006 июль-август; 22 (7-8): 830-44. [PubMed: 16815497]
- 13.
Ванденберг Р.Дж., Райан Р.М. Механизмы транспорта глутамата. Physiol Rev. 9 октября 2013 г.3(4):1621-57. [PubMed: 24137018]
- 14.
Заккарди Ф., Уэбб Д.Р., Йейтс Т., Дэвис М.Дж. Патофизиология сахарного диабета 1 и 2 типа: взгляд на 90 лет. Postgrad Med J. 2016 Feb; 92 (1084): 63-9. [PubMed: 26621825]
- 15.
Чеккони М., Эванс Л., Леви М., Родс А. Сепсис и септический шок. Ланцет. 2018 07 июля; 392 (10141): 75-87. [PubMed: 29937192]
- 16.
Штайнер М., Людеманн Дж., Краммер-Штайнер Б. Фавизм и дефицит глюкозо-6-фосфатдегидрогеназы. N Engl J Med. 2018 15 марта; 378 (11): 1068. [В паблике: 29542311]
Физиология, метаболизм — StatPearls — NCBI Bookshelf
Введение
Метаболизм относится ко всей сумме реакций, происходящих в каждой клетке тела и обеспечивающих тело энергией. Эта энергия используется для процессов жизнедеятельности и синтеза нового органического материала. Каждый живой организм использует окружающую среду, чтобы выжить, забирая питательные вещества и вещества, которые служат строительными блоками для движения, роста, развития и размножения. Все они опосредованы ферментами, которые представляют собой белки со специализированными функциями в анаболизме и катаболизме. Скорость производства энергии называется скоростью основного обмена и зависит от таких факторов, как пол, раса, физические упражнения, диета, возраст и такие заболевания, как сепсис или рак.
Эта энергия используется для процессов жизнедеятельности и синтеза нового органического материала. Каждый живой организм использует окружающую среду, чтобы выжить, забирая питательные вещества и вещества, которые служат строительными блоками для движения, роста, развития и размножения. Все они опосредованы ферментами, которые представляют собой белки со специализированными функциями в анаболизме и катаболизме. Скорость производства энергии называется скоростью основного обмена и зависит от таких факторов, как пол, раса, физические упражнения, диета, возраст и такие заболевания, как сепсис или рак.
Вопросы, вызывающие озабоченность
Химические реакции, посредством которых происходит обмен веществ, почти одинаковы во всех живых организмах, включая животных, растения, бактерии и грибы. Все эти химические реакции опосредованы белками, которые действуют как катализаторы в определенных условиях окружающей среды, таких как рН и температура. Синтез многих катализаторов, обеспечивающих химические реакции в нашем организме, берет свое начало в ДНК. Дезоксирибонуклеиновая кислота представляет собой молекулу, находящуюся внутри ядра, состоящую из четырех оснований, называемых аденином, гуанином, цитозином и тимином. РНК — это молекула, используемая некоторыми живыми организмами вместо ДНК, и компоненты этой молекулы включают рибозу и урацил вместо тимина. Окружающая среда, в основном растения, использует солнечный свет для преобразования воды и углекислого газа для синтеза углеводов. Живые организмы поступают наоборот, потребляя углеводы и другие органические материалы для производства энергии.
Дезоксирибонуклеиновая кислота представляет собой молекулу, находящуюся внутри ядра, состоящую из четырех оснований, называемых аденином, гуанином, цитозином и тимином. РНК — это молекула, используемая некоторыми живыми организмами вместо ДНК, и компоненты этой молекулы включают рибозу и урацил вместо тимина. Окружающая среда, в основном растения, использует солнечный свет для преобразования воды и углекислого газа для синтеза углеводов. Живые организмы поступают наоборот, потребляя углеводы и другие органические материалы для производства энергии.
Термодинамика
Невозможно говорить об обмене веществ, не взглянув на законы термодинамики. Особого внимания заслуживают первые два закона. Первые два закона термодинамики гласят, что энергия не может быть ни создана, ни уничтожена и что результатом физических и химических изменений является увеличение энтропии во Вселенной. Энергия, которая действительно полезна, или свободная энергия, — это такая энергия, которая способна совершать работу при любой разнице температур. Менее полезные формы энергии высвобождаются в виде тепла.[1]
Менее полезные формы энергии высвобождаются в виде тепла.[1]
Сотовый уровень
Химический носитель энергии называется АТФ. Синтез АТФ происходит внутри внутриклеточной органеллы, ограниченной внешней и внутренней мембранами. Диссоциация воды на молекулу водорода и гидроксильную группу, происходящая во внутренней среде организма, необходима для синтеза АТФ. Катаболические реакции, которые будут обсуждаться в этой статье позже, высвобождают значительное количество протонов, большая часть которых транспортируется в митохондрии для производства АТФ. Эти протоны транспортируются через ряд комплексов во внутренней мембране митохондрий, чтобы активировать АТФазу, используя энергию, высвобождаемую механизмом транспорта электронов.
Организмы перерабатывают пищу, которую они едят, в три этапа. Первый этап включает в себя преобразование сложных молекул в простые молекулы; это включает расщепление сложных белков на олигопептиды и свободные аминокислоты для облегчения всасывания, расщепление сложных сахаров на дисахариды или моносахариды и расщепление липидов на глицерин и свободные жирные кислоты. Эти процессы называются пищеварением и составляют лишь около 0,1% производства энергии, которая не может быть использована клеткой. Во второй фазе все эти небольшие молекулы подвергаются неполному окислению. Окисление означает удаление электронов или атомов водорода. Конечным продуктом этих процессов являются вода и углекислый газ, а также три основных вещества, а именно: ацетилкофермент А, оксалоацетат и альфа-оксоглутарат. Из них наиболее распространенным соединением является ацетилкофермент А, который образует 2/3 углерода в углеводах и глицерине, весь углерод в жирных кислотах и половину углерода в аминокислотах. Третья и последняя фаза этого процесса происходит в цикле, называемом циклом Кребса, открытом сэром Гансом Кребсом. В этом цикле ацетилкоэнзим А и оксалоацетат объединяются и образуют цитрат. В этой ступенчатой реакции происходит высвобождение протонов, которые передаются в дыхательную цепь для синтеза АТФ.
Эти процессы называются пищеварением и составляют лишь около 0,1% производства энергии, которая не может быть использована клеткой. Во второй фазе все эти небольшие молекулы подвергаются неполному окислению. Окисление означает удаление электронов или атомов водорода. Конечным продуктом этих процессов являются вода и углекислый газ, а также три основных вещества, а именно: ацетилкофермент А, оксалоацетат и альфа-оксоглутарат. Из них наиболее распространенным соединением является ацетилкофермент А, который образует 2/3 углерода в углеводах и глицерине, весь углерод в жирных кислотах и половину углерода в аминокислотах. Третья и последняя фаза этого процесса происходит в цикле, называемом циклом Кребса, открытом сэром Гансом Кребсом. В этом цикле ацетилкоэнзим А и оксалоацетат объединяются и образуют цитрат. В этой ступенчатой реакции происходит высвобождение протонов, которые передаются в дыхательную цепь для синтеза АТФ.
Дисбаланс между анаболизмом и катаболизмом может привести к ожирению и кахексии соответственно. Метаболическая энергия переносится высокоэнергетическими фосфатными группами, такими как АТФ, ГТФ и креатинфосфат; или переносчиками электронов, такими как НАДН, ФАДН и НАДФН.[2][3]
Метаболическая энергия переносится высокоэнергетическими фосфатными группами, такими как АТФ, ГТФ и креатинфосфат; или переносчиками электронов, такими как НАДН, ФАДН и НАДФН.[2][3]
Вовлеченные системы органов
Поджелудочная железа является ключевым метаболическим органом, который регулирует количество углеводов в крови либо путем высвобождения значительного количества инсулина для снижения уровня глюкозы в крови, либо путем высвобождения глюкагона для его повышения. Утилизация углеводов и липидов организмом называется циклом Рэндла, регулируется инсулином.
Печень является органом, отвечающим за переработку абсорбированных аминокислот и липидов из тонкого кишечника. Он также регулирует цикл мочевины и основные метаболические процессы, такие как глюконеогенез и отложение гликогена.[4]
Функция
Характеристики углеводов включают растворимость, относительно легкость транспортировки, нетоксичность молекул, которые служат источником энергии при снижении уровня кислорода.
Наиболее энергоемкими молекулами являются липиды, и они являются основной энергетической молекулой для млекопитающих и тканей. Поскольку они нерастворимы, они плохо переносятся кровью, не используются анаэробно и требуют большего количества кислорода для извлечения из них энергии (2,8 АТФ/молекула кислорода). Они не могут проникнуть через гематоэнцефалический барьер, и эритроциты или почечные клетки не могут их использовать. Аминокислоты действуют как субстраты для производства глюкозы только в условиях длительного голодания, демонстрируя истощение запасов гликогена.
Метаболизм этих трех основных субстратов сводится к одной молекуле, ацетил-КоА, в митохондриях. Метаболизм этой промежуточной молекулы генерирует 3 NADH, 1 FADH, 1 GTP и 2 CO2, все из которых участвуют в дыхательной цепи в митохондриях для синтеза АТФ.[5]
Механизм
Метаболизм углеводов
Основное внимание уделяется одному конкретному виду сахара — глюкозе. После поглощения клеткой молекулы глюкозы она немедленно метаболизируется в глюкозо-6-фосфат, который не может покинуть клетку. Фермент, катализирующий эту реакцию, называется гексокиназой (в печени и поджелудочной железе) или глюкокиназой во всех других тканях. Этот метаболит используется почти во всех метаболических процессах, включая гликолиз и гликогенез. Углеводы хранятся в виде гранул гликогена для быстрой мобилизации глюкозы при необходимости.
Фермент, катализирующий эту реакцию, называется гексокиназой (в печени и поджелудочной железе) или глюкокиназой во всех других тканях. Этот метаболит используется почти во всех метаболических процессах, включая гликолиз и гликогенез. Углеводы хранятся в виде гранул гликогена для быстрой мобилизации глюкозы при необходимости.
Гликоген представляет собой полимер глюкозы, собранный гликогенсинтазой, с точками ветвления через каждые десять молекул глюкозы, что придает гликогену древовидную структуру, что способствует мобилизации глюкозы. Некоторые ткани используют гликоген для собственного поддержания, например скелетные мышцы; некоторые другие ткани используют гликоген для поддержания стабильного уровня глюкозы в сыворотке, например, печень. Печень может хранить почти 100 г гликогена, который поставляет глюкозу в течение 24 часов; скелетные мышцы запасают 350 г, которых достаточно для 60-минутного сокращения мышц. Глюкоза метаболизируется путем гликолиза во всех клетках с образованием пирувата. В этом процессе не используется кислород, и образуются две молекулы пирувата, 2 НАДН и 2 АТФ.
В этом процессе не используется кислород, и образуются две молекулы пирувата, 2 НАДН и 2 АТФ.
Пируват может иметь три судьбы внутри клетки: он может транспортироваться в митохондрии и генерировать ацетил-КоА, он может оставаться в цитозоле и генерировать лактат или может использоваться в гликонеогенезе ферментом аланинаминотрансферазой (АЛТ). Судьба пирувата в тканях будет зависеть от гормональной регуляции, доступности кислорода и конкретной ткани. Например, в печени избыток пирувата метаболизируется до ацетил-КоА, который затем используется для синтеза липидов, тогда как в мышцах он подвергается полному окислению до СО2.
Глюкозо-6-фосфат также можно использовать в пентозофосфатном пути. Этот путь синтезирует нуклеотиды, синтез специфических липидов и поддерживает глутатион в его активной форме. Этот процесс регулируется глюкозо-6-фосфатдегидрогеназой.
Углеводный обмен регулируется в основном инсулином, так как он стимулирует гликолиз и гликогенез. Катехоламины, глюкагон, кортизол и гормон роста стимулируют глюконеогенез и гликогенолиз. [6]
[6]
Метаболизм липидов
Жирные кислоты служат для производства энергии в окислительных тканях. Некоторые из них являются амфипатическими, потенциально токсичными и транспортируются в связанном виде с альбумином. Кишечник всасывает жирные кислоты в виде мицелл; они поглощаются энтероцитами в стенке кишечника. Оказавшись внутри, эти молекулы жира расщепляются на более мелкие молекулы, свободные жирные кислоты и глицерин, которые в задней части конъюгируются с образованием триглицеридов. Они связаны с белками, образуя хиломикроны вне энтероцита.
Эти хиломикроны очень богаты холестерином и триглицеридами, которые по системе воротной вены транспортируются в печень. Печень будет обрабатывать эти сложные молекулы, чтобы извлечь фракцию холестерина и триглицеридов. Печень секретирует новую форму сложной молекулы, называемой ЛПОНП, которая транспортирует эндогенные липиды и жир к периферическим тканям, экспрессирующим гормоночувствительную липазу и липопротеинлипазу.
Этот фермент превращает ЛПОНП в ЛПНП, который содержит больше холестерина, чем другие молекулы, и в конечном итоге поглощается тканями-мишенями. Весь этот процесс называется «прямой метаболизм холестерина». Когда в периферических тканях содержится слишком много жира или холестерина, они перемещаются в липопротеине, называемом ЛПВП, который попадает в билиарную систему для экскреции. Этот процесс называется «обратным метаболизмом холестерина». Оба регулируются инсулином, который стимулирует липазы в организме, но подавляет липолиз.][10]
Метаболизм аминокислот
Мы потребляем почти 100 г белка в день. В организме содержится почти 10 кг белка, который метаболизируется по 300 г в день. Структурными единицами, составляющими белки, являются аминокислоты. Некоторые из них являются незаменимыми (это означает, что организм не может их синтезировать и должен получать с пищей), а некоторые являются заменимыми аминокислотами (которые организм может синтезировать). Белки поглощаются энтероцитами в виде аминокислот. Аминокислоты содержат группу азота и двухуглеродный скелет, называемый 2-оксокислотой.
Белки поглощаются энтероцитами в виде аминокислот. Аминокислоты содержат группу азота и двухуглеродный скелет, называемый 2-оксокислотой.
Метаболизм аминокислот приводит к образованию аммония, который является токсичной молекулой, особенно для ЦНС. Аммоний может метаболизироваться в печени для экскреции в цикле орнитина (мочевины). Метаболизм аминокислот происходит в результате двух видов химических реакций. Первый называется трансаминированием, в котором участвуют аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (АСТ). Эти две реакции требуют трехуглеродного скелета для замены аминогруппы; скелетом этих двух ферментов является альфа-кетоглутарат. В реакции, регулируемой АЛТ, аланин переносит аминогруппу на альфа-кетоглутарат с образованием пирувата и глутамата. При регулируемой АСТ реакции происходит обратная ситуация. Он использует пожертвованную аминогруппу из глутамата для создания аспартата, чтобы пожертвовать второй атом амино в цикл мочевины. Второй реакцией является дезаминирование, при котором глутаматдегидрогеназа метаболизирует глутамат с образованием альфа-кетоглутарата и аммиака, который должен быть детоксицирован циклом мочевины.
После дезаминирования скелет подвергается промежуточному метаболизму. Метаболизм аминокислот может давать семь типов скелетов, а именно: альфа-кетоглутарат, оксалоацетат, сукцинил-КоА, фумарат, пируват, ацетил-КоА и ацетоацетил-КоА. Первые пять имеют три или более атомов углерода и полезны для гликонеогенеза, последние два имеют только два атома углерода и непригодны для гликонеогенеза. Вместо этого они используются для синтеза липидов.
Как и все другие метаболические пути, инсулин является основным регулятором. Напротив, регулятором метаболизма аминокислот является кортизол и гормон щитовидной железы, который опосредует разрушение мышц.
Клиническая значимость
Сахарный диабет
Поджелудочная железа определяет концентрацию глюкозы в крови и некоторых аминокислот, таких как аргинин и лейцин. Высокий уровень этих веществ указывает на питательное насыщение, и это сообщение посылается организму поджелудочной железой в виде инсулина. Инсулин является уникальным метаболическим гормоном, отвечающим за распределение питательных веществ в организме, а это означает, что дефицит инсулина вызывает плейотропные изменения в метаболизме человека. При дефиците инсулина торможение катаболических реакций меньше; это приводит к чистой мобилизации субстратов из тканей. Поджелудочная железа определяет статус метаболитов, периферические ткани определяют статус концентрации инсулина. Когда периферические ткани ощущают снижение уровня инсулина, они начинают катаболизироваться, и начинают мобилизоваться субстраты. Печень реагирует на низкий уровень инсулина увеличением синтеза глюкозы с помощью глюконеогенеза и гликогенолиза. Как видно из метаболизма аминокислот, основным субстратом глюконеогенеза является аланин, образующийся в результате мышечного распада и протеолиза. Жировая ткань также реагирует, усиливая липолиз, что приводит к накоплению жирных кислот и глицерина. Повышенная доставка неэтерифицированных жирных кислот (НЭЖК) в печень увеличивает кетогенез.[14]
При дефиците инсулина торможение катаболических реакций меньше; это приводит к чистой мобилизации субстратов из тканей. Поджелудочная железа определяет статус метаболитов, периферические ткани определяют статус концентрации инсулина. Когда периферические ткани ощущают снижение уровня инсулина, они начинают катаболизироваться, и начинают мобилизоваться субстраты. Печень реагирует на низкий уровень инсулина увеличением синтеза глюкозы с помощью глюконеогенеза и гликогенолиза. Как видно из метаболизма аминокислот, основным субстратом глюконеогенеза является аланин, образующийся в результате мышечного распада и протеолиза. Жировая ткань также реагирует, усиливая липолиз, что приводит к накоплению жирных кислот и глицерина. Повышенная доставка неэтерифицированных жирных кислот (НЭЖК) в печень увеличивает кетогенез.[14]
Сепсис, травма и ожоги
Катаболизм также может инициироваться чрезмерной воспалительной реакцией, характеризующейся активацией и экспрессией провоспалительных цитокинов, таких как TNF-альфа, IL-6 и IL-1. Этот процесс называется синдромом системной воспалительной реакции (SIRS). Он имеет три фазы метаболизма; фаза прилива или шока, катаболическая фаза и анаболическая фаза. В этих сценариях происходит значительная мобилизация субстрата по всему телу.[15]
Этот процесс называется синдромом системной воспалительной реакции (SIRS). Он имеет три фазы метаболизма; фаза прилива или шока, катаболическая фаза и анаболическая фаза. В этих сценариях происходит значительная мобилизация субстрата по всему телу.[15]
Дефицит G6PDH
Дефицит широко распространен в экваториальных регионах. Он связан с Х-хромосомой и снижает уровень НАДФН, следовательно, снижает уровень активной формы глутатиона и увеличивает окислительный стресс для эритроцитов; это приводит к гемолизу, представленному как кризис, в зависимости от инсульта. Он проявляется в виде телец Хайнца и пузырчатых клеток в мазке периферической крови.[16]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Прокомментируйте эту статью.
Ссылки
- 1.
Liu X, Chen T, Jain PK, Xu W. Выявление термодинамических свойств элементарных химических реакций на уровне одной молекулы.
 J Phys Chem B. 25 июля 2019 г.; 123 (29): 6253-6259. [PubMed: 31246466]
J Phys Chem B. 25 июля 2019 г.; 123 (29): 6253-6259. [PubMed: 31246466]- 2.
Ramnanan CJ, Edgerton DS, Kraft G, Cherrington AD. Физиологическое действие глюкагона на метаболизм глюкозы в печени. Сахарный диабет Ожирение Metab. 13 октября 2011 г. Приложение 1 (Приложение 1): 118–25. [Бесплатная статья PMC: PMC5371022] [PubMed: 21824265]
- 3.
Сабо И., Зоратти М. Митохондриальные каналы: потоки ионов и многое другое. Physiol Rev. 2014 Apr;94(2):519-608. [PubMed: 24692355]
- 4.
Hue L, Taegtmeyer H. Новый взгляд на цикл Рэндла: новая голова для старой шляпы. Am J Physiol Endocrinol Metab. 2009 г., сен; 297 (3): E578-91. [Бесплатная статья PMC: PMC2739696] [PubMed: 19531645]
- 5.
KREBS HA. Цикл трикарбоновых кислот. 1948–1949 Харви Лект. Серия 44: 165-99. [PubMed: 14849928]
- 6.
Дашти М. Краткий обзор биохимии: углеводный обмен. Клин Биохим. 2013 Октябрь;46(15):1339-52.
 [PubMed: 23680095]
[PubMed: 23680095]- 7.
Абумрад Н.А., Дэвидсон НЕТ. Роль кишечника в липидном гомеостазе. Physiol Rev. 2012 г., июль; 92 (3): 1061-85. [Бесплатная статья PMC: PMC3589762] [PubMed: 22811425]
- 8.
Goldstein JL, Brown MS. Рецептор ЛПНП. Артериосклеры Тромб Васк Биол. 2009 г.29 апреля (4): 431-8. [Бесплатная статья PMC: PMC2740366] [PubMed: 19299327]
- 9.
Яворски К., Саркади-Надь Э., Дункан Р.Э., Ахмадян М., Сул Х.С. Регуляция метаболизма триглицеридов. IV. Гормональная регуляция липолиза в жировой ткани. Am J Physiol Gastrointest Liver Physiol. 2007 июль; 293(1):G1-4. [Бесплатная статья PMC: PMC2887286] [PubMed: 17218471]
- 10.
Пирс В., Кароббио С., Видаль-Пуиг А. Различные оттенки жира. Природа. 2014 05 июня; 510 (7503): 76-83. [В паблике: 24899307]
- 11.
Deutz NE, Wolfe RR. Существует ли максимальный анаболический ответ на прием белка во время еды? Клин Нутр.

