Прогностическое значение состояния прооксидантной и антиоксидантной систем организма у больных со стерильным панкреонекрозом
Введение
Наиболее часто используемыми биохимическими методами оценки интенсивности свободнорадикальных процессов, изменяющих свою активность в ответ на эндогенную интоксикацию, являются методы определения состояния антиоксидантной системы организма (АОС). Этот комплекс методов включает определение активности супероксиддисмутазы (СОД), суммарного количества низкомолекулярных антиоксидантов (НМАО), а также уровня перекисного окисления липидов (ПОЛ) по накоплению малонового диальдегида (МДА) [3, 5, 7].
По мнению некоторых авторов, исходное нарушение равновесия между процессами ПОЛ и состоянием АОС следует рассматривать как один из факторов риска развития осложнений течения заболевания и неблагоприятного исхода в послеоперационном периоде. В свою очередь правильная оценка и своевременная коррекция этих нарушений позволяют снизить частоту такого рода осложнений [3, 7, 9].
Материал и методы
Представленная работа основана на анализе результатов консервативного и хирургического лечения 123 больных стерильным панкреонекрозом, находившихся на лечении в хирургическом отделении Республиканского центра экстренной медицинской помощи Республики Саха (Якутия) за период с 2004 по 2009 г.
Диагноз панкреонекроза и его осложнений верифицирован на основании комплексного обследования с использованием клинических, лабораторных и инструментальных методов диагностики: ультразвукового сканирования (УЗИ) брюшной полости (БП), забрюшинной клетчатки (ЗК), видеолапароскопии, чрескожных диагностических пункций жидкостных образований поджелудочной железы (ПЖ), БП и ЗК под контролем УЗИ с дальнейшим микробиологическим и цитологическим исследованием пунктата, а также интраоперационных и патологоанатомических исследований операционного материала.
При обследовании всех неоперированных по экстренным показаниям больных использовали компьютерную томографию (КТ) для уточнения состояния поджелудочной железы, желчного пузыря и внепеченочных желчных протоков.
Лабораторные методы исследования включали общеклинические анализы крови и мочи, биохимические анализы крови (определение уровня общего белка, мочевины, креатинина, остаточного азота, сахара, аспартатаминотрансферазы — АСТ и аланинаминотрансферазы — АЛТ, амилазы), определение кислотно-щелочного состояния и газов крови.
Наряду с использованием общеклинических методов исследования проводили оценку состояния антиоксидантной системы по уровню ПОЛ (по накоплению одного из конечных продуктов перекисного окисления липидов — МДА), активности СОД, суммарного количества НМАО.
Все больные разделены на 3 группы в зависимости от типа внутрибрюшного осложнения и тяжести состояния по интегральным системам-шкалам Ranson и APACHE II: 1-я группа — 28 (22,8%) пациентов с псевдокистами ПЖ различной степени «зрелости». Значение показателей тяжести общего состояния у них составило по шкалам Ranson ≥2 баллам и APACHE II≥10 баллам; 2-я группа — 56 (45,5%) пациентов с ферментативным асцит-перитонитом. Значения показателей по шкалам Ranson 4-6 баллов и АРАСНЕ II 11-30 баллов; 3-я группа — 39 (31,7%) пациентов с внутрибрюшными осложнениями, соответствующими парапанкреатическому инфильтрату. Значение показателей тяжести общего состояния у них составило по шкалам Ranson 4-6 баллов и APACHE II 11-30 баллов.
Результаты и обсуждение
У большинства больных с псевдокистами (1-я группа) они локализовались в головке ПЖ. 15 (53,6%) больным с острыми жидкостными скоплениями выполнили дренирование кист под контролем УЗИ. У всех больных отмечали спадение стенок и облитерацию полости кисты. В данной подгруппе наблюдалось одно осложнение, связанное с образованием свища, который закрылся самостоятельно в ходе консервативных мероприятий. При кистах, осложнением которых являлось сдавление внепеченочных желчных протоков и развитие механической желтухи, применялись малоинвазивные чрескожные пункционно-дренирующие вмешательства. У 8 (28,6%) таких больных при «незрелых» кистах, не сообщавшихся с главным панкреатическим протоком, вмешательства выполнялись также с целью уточнения диагноза. При сформированных кистах производили внутреннее дренирование (цистодигестивные анастомозы). В этой группе внутреннее дренирование было выполнено у 5 (17,8%) больных.
15 (53,6%) больным с острыми жидкостными скоплениями выполнили дренирование кист под контролем УЗИ. У всех больных отмечали спадение стенок и облитерацию полости кисты. В данной подгруппе наблюдалось одно осложнение, связанное с образованием свища, который закрылся самостоятельно в ходе консервативных мероприятий. При кистах, осложнением которых являлось сдавление внепеченочных желчных протоков и развитие механической желтухи, применялись малоинвазивные чрескожные пункционно-дренирующие вмешательства. У 8 (28,6%) таких больных при «незрелых» кистах, не сообщавшихся с главным панкреатическим протоком, вмешательства выполнялись также с целью уточнения диагноза. При сформированных кистах производили внутреннее дренирование (цистодигестивные анастомозы). В этой группе внутреннее дренирование было выполнено у 5 (17,8%) больных.
Такой тип внутрибрюшного осложнения, как асцит-перитонит (2-я группа), c явлениями аутоферментной агрессии отмечен у 56 (45,5%) больных. В этой группе консервативно удалось купировать процесс у 47 (83,9%) больных. В остальных 9 (16,1%) наблюдениях в связи с неэффективностью консервативной терапии потребовалось выполнение этапных эндоскопических санаций или лапаротомии с использованием в последующем «закрытых» или «полуоткрытых» методов дренирования брюшной полости. Осложнений и летальных исходов в этой группе не отмечено.
В остальных 9 (16,1%) наблюдениях в связи с неэффективностью консервативной терапии потребовалось выполнение этапных эндоскопических санаций или лапаротомии с использованием в последующем «закрытых» или «полуоткрытых» методов дренирования брюшной полости. Осложнений и летальных исходов в этой группе не отмечено.
Парапанкреатический инфильтрат выявлен нами в 39 (31,7%) наблюдениях (3-я группа). 12 (30,7%) больным успешно проведен комплекс интенсивной консервативной терапии, на фоне которой отмечена положительная динамика, выражавшаяся в рассасывании инфильтрата и купировании симптомов аутоферментной агрессии. У 27 (69,3%) пациентов проводимая интенсивная консервативная терапия не дала ожидаемых результатов, что привело к инфицированию очагов деструкции на 10-14-е сутки от момента госпитализации и потребовало выполнения полостных операций с использованием «закрытых» или «полуоткрытых» методов дренирования брюшной полости. При этом умерли 5 (18,5%) больных.
Динамика активности процессов ПОЛ и состояния АОС у неоперированных и оперированных больных в разных периодах исследования представлена на рис. 1-6.Рисунок 1. Динамика содержания МДА в крови неоперированных больных (n=59).Рисунок 2. Динамика содержания МДА в крови оперированных больных (n=64).Рисунок 3. Динамика содержания НМАО в крови неоперированных больных (n=59).Рисунок 4. Динамика содержания НМАО в крови оперированных больных (n=64).Рисунок 5. Динамика содержания СОД в крови неоперированных больных (n=59).Рисунок 6. Динамика содержания СОД в крови оперированных больных (n=64).
1-6.Рисунок 1. Динамика содержания МДА в крови неоперированных больных (n=59).Рисунок 2. Динамика содержания МДА в крови оперированных больных (n=64).Рисунок 3. Динамика содержания НМАО в крови неоперированных больных (n=59).Рисунок 4. Динамика содержания НМАО в крови оперированных больных (n=64).Рисунок 5. Динамика содержания СОД в крови неоперированных больных (n=59).Рисунок 6. Динамика содержания СОД в крови оперированных больных (n=64).
Как видно из данных диаграмм, выраженная активация процессов ПОЛ характерна для больных с асцит-перитонитом и парапанкреатическим инфильтратом. Так, отмечается повышение содержания МДА в эритроцитах крови у неоперированных больных 2-й и 3-й групп на протяжении всего контрольного периода наблюдений с наибольшим пиком в 1, 3, 7-е сутки (см. рис. 1). На этих этапах исследования значения МДА превышают почти в 3 раза контрольные значения и показатели МДА у пациентов с неосложненным течением. У больных 1-й группы обращает на себя внимание снижение количества МДА в эритроцитах крови в первые 3 сут от момента поступления.
У больных, которым проводилось оперативное лечение в связи с неэффективностью консервативной терапии (2-я и 3-я группы), наблюдалось значительное повышение уровня МДА на 3-и и 7-е сутки после операции с последующим его уменьшением к 10-м и 15-м суткам (рис. 2).
Интенсивность процессов ПОЛ зависит от состояния антиоксидантной защиты организма, которая оценивалась по содержанию НМАО и активности СОД в эритроцитах крови. Результаты, полученные при измерении активности НМАО и СОД, представлены на рис. 3-6.
Отмечается значительное снижение относительно контроля уровня НМАО у неоперированных больных в первые 7 сут от начала заболевания (2-я и 3-я группы) с последующим его увеличением к 15-м суткам консервативной терапии и на 3-и и 7-е сутки у оперированных больных, что характерно для всех пациентов с асцит-перитонитом и парапанкреатическим инфильтратом (рис. 3 и 4).
Выявленный в ходе исследования существенный дефицит суммарного содержания НМАО в крови пациентов 2-й 3-й групп потребовал включения в комплекс интенсивной терапии препаратов, оказывающих специфическое антиоксидантное действие, как советуют некоторые авторы [3, 4, 10].
При изучении активности СОД во всех периодах исследования у неоперированных пациентов 1-й группы отмечается повышение активности СОД по сравнению с показателями во 2-й и 3-й группах (рис. 5). Послеоперационная динамика активности СОД в крови пациентов 2-й и 3-й групп сравнима с динамикой активности НМАО. Так, у пациентов этих групп регистрируется отчетливое снижение активности СОД почти в 2 раза по сравнению с показателями в 1-й группе на протяжении первых 7 сут у неоперированных больных и в первые 3-7 сут послеоперационного периода у больных, которым производилось оперативное вмешательство (рис. 6).
Кроме показателей состояния прооксидантной и антиоксидантной систем (МДА, НМАО, СОД), о состоянии процессов ПОЛ, АОС и характере их взаимоотношений можно судить по соотношению нормированных показателей концентраций НМАО, МДА и коэффициенту антиоксидантной защиты (Rаоз) — (НМАО+СОД)/МДА. Расчетные показатели соотношения неоперированных и оперированных больных представлены в табл. 1 и 2.
1 и 2.
У неоперированных больных 1-й группы значения НМАО/МДА и (НМАО+СОД)/МДА отличаются от контрольных цифр и свидетельствуют об активации АОС в 1-е и 3-и сутки консервативного лечения. У больных 2-й и 3-й групп расчетные показатели состояния ПОЛ и АОС, их соотношения значительно отличаются от показателей в 1-й группе, в обеих группах эти сдвиги сводятся к активации процессов ПОЛ в основном за счет снижения активности НМАО и СОД. При этом снижение антиоксидантного резерва обусловлено в основном дефицитом СОД. По мере объективного улучшения состояния больного на 10-15-е сутки от начала интенсивного лечения наблюдается постепенное снижение активности ПОЛ и повышение показателей АОС. В то же время изменения имеют волнообразный характер с повышением активности АОС в 1, 10 и 15-е сутки.
Анализируя результаты, полученные при обследовании оперированных больных в представленных группах (см. табл. 2), можно отметить, что во всех группах значения НМАО/МДА и (НМАО+СОД)/МДА имеют выраженные изменения, которые сводятся в основном к более выраженной активации ПОЛ.
Как и у больных, лечившихся консервативно, у оперированных больных отмечается достоверное повышение активности АОС, имеющей волнообразный характер, о чем свидетельствует повышение соотношения (НМАО+СОД)/МДА по сравнению с контролем в 1, 3, 10, 15-е сутки.
Анализ представленных результатов показывает, что для больных с асцит-перитонитом и инфильтратом забрюшинной клетчатки характерно более выраженное нарушение процессов липопероксидации. Эти нарушения сводятся в основном к нарастанию скорости протекания процессов ПОЛ, о чем свидетельствует повышение в крови больных уровня МДА. Выявленная активация процессов ПОЛ сопровождалась различными изменениями состояния АОС. При анализе состояния АОС у пациентов со стерильным панкреонекрозом можно заметить, что активация процессов пероксидации почти всегда сопровождалась снижением уровня антиоксидантов (СОД и НМАО) в крови. Активация процессов ПОЛ встречалась у большинства неоперированных больных на 7-е сутки от начала интенсивного лечения. Повышение активности ПОЛ и снижение активности АОС наблюдались более чем у 53% больных, которым производилась операция при неэффективности консервативной терапии.
Повышение активности ПОЛ и снижение активности АОС наблюдались более чем у 53% больных, которым производилась операция при неэффективности консервативной терапии.
Активацию АОС в данной ситуации можно назвать компенсаторной, возникающей в ответ на инициацию свободнорадикальных процессов и направленной на саморегулирование системы. Подобные взаимоотношения процессов ПОЛ и состояния АОС свидетельствуют о способности антиоксидантного резерва поддерживать равновесие в системе ПОЛ-АОС [1-3]. Однако неизбежно продолжающаяся активация ПОЛ приводит зачастую к истощению ферментных и неферментных антиоксидантов, что ведет к неуправляемому процессу окисления липидов. Согласно большинству исследований в этой области, больные с дефицитом антиоксидантов на фоне активации процессов ПОЛ могут быть отнесены к группе риска в плане дальнейшего нарушения состояния ПОЛ и АОС и возникновения различных осложнений в период консервативного лечения и в послеоперационном периоде у оперированных больных [3, 8, 10]./128.jpg)
Полученные результаты показывают изменение процессов ПОЛ и АОС под влиянием стресса, вызванного панкреонекрозом. Большинство авторов указывают, что ферментативная агрессия вызывает метаболические сдвиги, которые заключаются в активации расстройств водно-электролитного, кислотно-щелочного балансов и в повышении уровня катаболизма. Все это оказывает значительное влияние на течение процессов ПОЛ в организме, непосредственно активизируя образование свободных радикалов [3-6].
Как правило, в ближайшие сроки после операции у всех больных панкреонекрозом отмечается активация процессов АОС, которая реализуется за счет повышения уровня антиоксидантов НМАО и СОД. При этом динамика процессов ПОЛ и АОС непосредственно оказывается зависимой от течения послеоперационного периода. Так, при благоприятном течении послеоперационного периода критический период активации процессов ПОЛ приходится в основном на 7-е сутки, а к 10-15-м послеоперационным суткам этот показатель возвращается к исходным значениям. В случае прогрессирования заболевания повышенная активность процессов ПОЛ отмечается на протяжении всего периода наблюдения. Данное явление свидетельствует об истощении антиоксидантного резерва в послеоперационном периоде и прогностически неблагоприятно [3, 5].
В случае прогрессирования заболевания повышенная активность процессов ПОЛ отмечается на протяжении всего периода наблюдения. Данное явление свидетельствует об истощении антиоксидантного резерва в послеоперационном периоде и прогностически неблагоприятно [3, 5].
Ряд авторов указывают на важность именно совместного анализа показателей ПОЛ и АОС в послеоперационном периоде [3, 7, 8]. Как правило, выявление определенных особенностей их взаиморегулирующего влияния может послужить прогностическим критерием благоприятного течения послеоперационного периода. В наших наблюдениях благоприятное течение послеоперационного периода сопровождалось умеренной активацией процессов ПОЛ, максимум которых приходится на 7-е послеоперационные сутки с последующей их стабилизацией к 10-15-м суткам. Постепенная активация АОС (повышение содержания НМАО и СОД в крови) начиналась с 1-3-х послеоперационных суток. Представленная динамика показателей реакции ПОЛ и АОС принималась для характеристики течения послеоперационного периода и оценивалась совместно, поскольку изолированная оценка по отдельным параметрам неинформативна и не позволяет судить об истинном состоянии процессов пероксидации [3, 8].
Таким образом, отмеченные изменения показателей ПОЛ и АОС, на наш взгляд, являются признаком адаптации организма к сложившимся условиям патологического процесса, что подтверждают многие исследователи [3, 5, 7]. Изменения клинического течения послеоперационного периода, проявившиеся некоторым увеличением тяжести состояния по интегральным шкалам Ranson и APACHE II, при описанном варианте взаимоотношений ПОЛ-АОС не свидетельствовали о каком-либо осложнении послеоперационного периода и купировались в течение 1-2 дней без существенных изменений проводимой лечебной тактики. В то же время резкое повышение активности ПОЛ на фоне продолжающегося снижения содержания антиоксидантов предполагало возможное неблагоприятное течение послеоперационного периода и требовало изменения лечебной тактики.
Презентация на тему: Наследственные дефекты
пероксисом
•При акаталазии наблюдается угнетение липидного обмена.
•Болезнь Цельвегера характеризуется отсутствием пероксисом, сопровождается резкой мышечной слабостью, нервными расстройствами, восприимчивостью к инфекциям. Новорожденные живут всего несколько месяцев.
Новорожденные живут всего несколько месяцев.
•Хронический грануломатоз — дефект ферментов, участвующих в в образовании АФК в лейкоцитах → бактериальные инфекции
РЕГУЛЯЦИЯ ПЕРЕКИСНОГО ОКИСЛЕНИЯ В КЛЕТКЕ
Состояние ПОЛ в клетке определяется
следующими факторами:
•Качественным составом ненасыщенных жирных кислот и фосфолипидов мембран
•Наличием достаточного количества кислорода, его активных форм
•Наличием катализаторов или прооксидантов
•Наличием антиоксидантов
•Факторами инициации
Не все фосфолипиды одинаково чувствительны к перекисному окислению
•При усилении ПОЛ мембраны обогащаются более устойчивыми к окислению фракциями фосфолипидов
-фосфатидилхолин
-сфингомиелин
•Уменьшение скорости ПОЛ приводит к повышению уровня легкоокисляемых фракций фосфолипидов
-фосфатидилсерин -фосфатидилинозитол -фосфатидилэтаноламин
ПРООКСИДАНТЫ
Прооксиданты (или катализаторы) – это вещества, стимулирующие процессы ПОЛ
Кним относятся:
•активные формы кислорода
•перекись водорода
•свободные радикалы
•ионы металлов с переменной валентностью
•витамин D
•ионы железа
Роль ионов железа
Метаболизм железа в организме
Содержание железа в белках:
• | Гемоглобин | 3,0 г |
• | Миоглобин | 0,15 г |
• | Ферритин | 0,7 г |
• | Трансферрин | 0,003 г |
• | Цитохром с | 0,003 г |
• | Др. | 0,003 г |
Усвоению железа в полости кишечника способствует аскорбиновая кислота,
восстанавливающая железо. В клетках слизистой кишечника железо соединяется с апоферритином с образованием ферритина, при этом ферритин окисляет Fe2+ в Fe3+. Поступление железа из энтероцитов в кровь сопровождается окислением железа ферментом сыворотки крови ферроксидазой (церулоплазмин) . В крови Fe3+ транспортирует белок трансферрин(транзитный пул). В ткани Fe2+ используется для синтеза железосодержащих белков или депонируется в ферритине (медленно обменивающийся пул)
Антиоксиданты
содержат подвижный атом водорода с ослабленной связью с углеродом, препятствуют образованию свободных радикалов
•Ловушки радикалов
•Вещества-синергисты
•Комплексоны
Ловушки радикалов
• Ингибиторы свободнорадикальных реакций, липидные антиоксиданты
• Резко тормозят свободнорадикальные реакции в низких концентрациях
• Витамин Е, бутилированный гидрокситолуол
•Менее радикальный путь торможения ПОЛ осуществляется за счет взаимодействия гидроперекисей НЖК с
глутатионпероксидазой и предот-
вращения процесса разветвления цепей
Витамин Е
Прооксиданты — это химические вещества, которые вызывают окислительный стресс либо за счет создания активных форм кислорода, либо за счет ингибирования антиоксидантных систем. Некоторые вещества могут действовать либо как антиоксиданты, либо как прооксиданты, в зависимости от конкретного набора условий. [4] Некоторые важные условия включают концентрацию химического вещества и наличие кислорода или переходных металлов. Хотя термодинамически это очень благоприятно, восстановление молекулярного кислорода или пероксида до супероксида или гидроксильного радикала, к счастью, запрещено по спину. Это значительно снижает скорость этих реакций, что позволяет существовать аэробной жизни. В результате восстановление кислорода обычно включает либо начальное образование синглетного кислорода, либо спин-орбитальную связь за счет восстановления металла переходного ряда, такого как марганец, железо или медь. Дополнительные рекомендуемые знания
Металлы Переходные металлы могут действовать как прооксиданты. Например, хронический манганизм является классическим «прооксидантным» заболеванием [1]. Другим заболеванием, связанным с хроническим присутствием прооксидантного металла переходного ряда, является гемохроматоз, связанный с повышенным уровнем железа. Точно так же болезнь Вильсона связана с повышенным уровнем меди в тканях. Такие синдромы, как правило, связаны с общей симптоматикой. Обычно это включает различные комбинации психоза, дискинезии (в том числе паркинсоноподобной симптоматики), пигментных аномалий, фиброза, глухоты, диабета и артрита. ФиброзФиброз или образование рубцов — еще один симптом, связанный с прооксидантами. Например, интерокулярная медь или халькоз стекловидного тела связаны с тяжелым фиброзом стекловидного тела, как и интерокулярная железа. Цирроз печени также является основным симптомом болезни Вильсона. Легочный фиброз, вызываемый паракватом и противоопухолевым средством блеомицином, также считается вызванным прооксидантными свойствами этих средств. Возможно, окислительный стресс, вызванный такими агентами, имитирует нормальный физиологический сигнал для преобразования фибробластов в миофибробласты. Витамины-прооксиданты Витамины, являющиеся восстановителями, могут быть прооксидантами.
Относительная важность антиоксидантной и прооксидантной активности витаминов-антиоксидантов является областью текущих исследований, но, например, витамин С, по-видимому, оказывает в организме в основном антиоксидантное действие. [8] [6] Однако по другим пищевым антиоксидантам, таким как полифенольные антиоксиданты, имеется меньше данных [9] цинк, [10] и витамин Е. [11] Мочевая кислота Прооксидантные свойства восстановителей также могут иметь клинические последствия. Однако, как и аскорбат, мочевая кислота также может способствовать выработке активных форм кислорода и, таким образом, действовать как прооксидант. Впервые было высказано предположение, что это играет роль в этиологии синдрома Леша-Нихана (связанного с хореоатетоидной дискинезией) и гиперурикемического синдрома у далматинских собак. Последний отвечает на лечение антиоксидантным препаратом орготеином, фармацевтической формой супероксиддисмутазы. Такие животные также обычно «бронзовые». Высокие уровни мочевой кислоты также встречаются при атеросклерозе, метаболическом синдроме и инсульте. Вопрос заключается в том, является ли гиперурикемия защитной реакцией на окислительный стресс при таких заболеваниях или является ее первичной причиной [4]. Так, некоторые исследователи считают, что вызванный уратами окислительный стресс является причиной инсульта [5], в то время как другие предполагают прямо противоположное, что урат обладает нейропротекторным действием благодаря своим антиоксидантным свойствам [6]. ГомоцистинурияУ людей повышенный уровень гомоцистеина связан с повышенной заболеваемостью атеросклерозом и может играть роль в болезни Альцгеймера. Гомоцистеин является мощным восстанавливающим агентом и, как и большинство подобных агентов, может вызывать окислительный стресс. Было высказано предположение, что это играет роль в этиологии таких заболеваний. [8] [9] [10] [11] Противораковые препараты Несколько важных противоопухолевых агентов связываются с ДНК и генерируют активные формы кислорода. К ним относятся адриамицин и другие антрациклины, блеомицин и цисплатин. Эти агенты могут проявлять специфическую токсичность по отношению к раковым клеткам из-за низкого уровня антиоксидантной защиты, обнаруженной в опухолях.
9 Шнайдер С (2005 г.). «Химия и биология витамина Е». Mol Nutr Food Res 49 (1): 7-30. | |
| Эта статья находится под лицензией GNU Free Documentation License. Он использует материал из статьи Википедии «Прооксидант». Список авторов есть в Википедии. |
Две стороны одного меча
«Существует несколько механизмов «антиоксидантной» активности, от хелатирования реактивных металлов до подавления свободнорадикальных реакций. По мере роста популярности антиоксидантов фенольные соединения заняли центральное место. Фенольные антиоксиданты обычно действуют посредством свободнорадикальных реакций, отдавая электроны или атомы водорода.
Многие факторы могут влиять на степень окисления этих фенолов в растворе, включая pH, хелатирование ионами металлов и свет среди прочего. В аналитической лаборатории подкисление и хелатирование ионов металлов имеют первостепенное значение для предотвращения окисления и «деградации» соединения во время анализа.
Для витамина С в растворитель для экстракции обычно добавляют химический восстановитель, чтобы гарантировать смещение окислительно-восстановительного равновесия в сторону восстановленной формы, подробнее об этом позже.
Также важно отметить, что реакции окисления и восстановления не протекают изолированно; должно быть окисление и восстановление. Восстановитель (антиоксидант) — это химическое вещество, которое само окисляется в ходе реакции, тем самым восстанавливая другое химическое вещество.
Итак, антиоксиданты склонны к окислению. Как только они окисляются, многие из них, лучшие из них, могут вступать в окислительно-восстановительный цикл. В случае фенолов, в частности катехинов, они могут многократно переходить из восстановленной формы в свободнорадикальную и хиноновую формы и обратно без деградации.
Известно, что ионы металлов катализируют окисление фенолов и поддерживают циклические окислительно-восстановительные реакции. Таким образом, окислительно-восстановительные фенолы являются как восстановителями, так и окислителями, в зависимости от окислительно-восстановительного состояния, в котором они находятся, и окружающей среды.
Для обсуждения я обычно делю мир редокс-медицины на две категории: окислители и восстановители или антиоксиданты и прооксиданты. В этом чрезмерно упрощенном мире антиоксиданты защищают, а прооксиданты убивают. Окислительно-восстановительные активные фенолы используются в качестве антиоксидантов в защитном режиме, в то время как активированные химиотерапевтические молекулы используются для лечения заболеваний.
В этом чрезмерно упрощенном мире антиоксиданты защищают, а прооксиданты убивают. Окислительно-восстановительные активные фенолы используются в качестве антиоксидантов в защитном режиме, в то время как активированные химиотерапевтические молекулы используются для лечения заболеваний.
Исследователи витамина С для иммунного ответа, с которыми я разговаривал, говорят, что витамин С необходимо «инкубировать» в физиологических условиях (рН 7,3, буферы со следовыми уровнями переходных металлов) в течение 8 часов перед началом эксперимента, чтобы увидеть какие-либо активность. Как химик-аналитик, я могу сказать вам, что не осталось восстановленного или витамина С-антиоксиданта, все было окислено.
Другим примером является использование фенолов в качестве антибиотиков. Они измеряются в лаборатории контроля качества в восстановленной форме в защитных кислых условиях. Но затем эти фенолы обычно вводят в виде «солей». Чтобы сделать соль, вы добавляете основание к фенолу, часто окисляя его в процессе.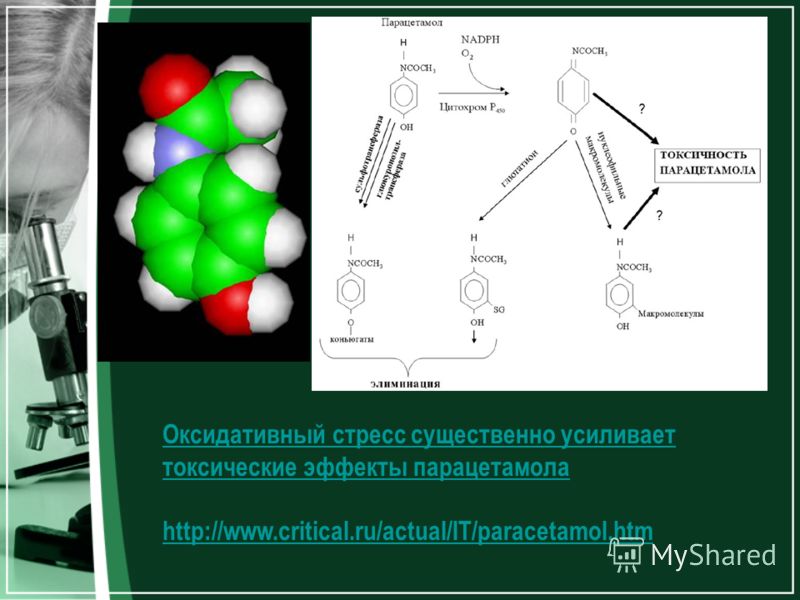
Это разъединение равнозначно тестированию в восстановленном «антиоксидантном» состоянии и последующему введению препарата в окисленной форме. Широко известно, что антибиотики и химиотерапия вызывают окислительный стресс, и я считаю, что они действуют посредством окислительного стресса, а не антиоксидантных механизмов.
Другим примером является давнее использование зверобоя в качестве местного антибиотика, а не антидепрессанта. Традиционные составы антибиотиков требовали экстракции и воздействия света на западе, в то время как на востоке китайцы добавляли металлы. Оба достигают одной и той же цели; окисление нафтодиантронов (гиперицинов) перед использованием. Имеются патенты на использование фотоактивированного гиперицина для противовирусного лечения и химиотерапии рака.
По моему мнению, продукты на основе зверобоя противопоказаны больным химиотерапией рака, потому что он также «активируется» во время лечения (химиотерапия рака обычно является прооксидантной), что увеличивает дозу и усложняет лечение.
Поскольку фенольные антиоксиданты могут быть либо антиоксидантами, либо прооксидантами, я ввел термины «оксидант с окислительно-восстановительным циклом» и «терминальный» антиоксидант. В свободнорадикальной полимеризации у вас есть инициация, распространение и прекращение.
Кверцетин представляет собой антиоксидант, содержащий катехол, окислительно-восстановительный цикл, который может отдавать электрон/атом водорода, а также потенциально участвовать в текущих реакциях окислительно-восстановительного цикла. Интересно, не следует ли нам давать катехин, содержащий антиоксиданты с окислительно-восстановительным циклом, людям, страдающим от хронического окислительного стресса или острого окислительного стресса (химиотерапия).
Подводя итог, думаю, важно вернуться к основам антиоксидантов, а именно к окислительно-восстановительной химии. Похоже, что многие биологические процессы основаны на окислительно-восстановительных процессах, включая иммунную систему и многие межклеточные сигнальные пути.
Тот факт, что молекула является окислительно-восстановительным активным фенолом, не означает, что она является антиоксидантом, вы должны учитывать реакцию другой половины клетки и то, будет ли фенол/радикал/хинон восстановителем или окислителем в этой ситуации.
Если мы изучим и используем оба лезвия окислительно-восстановительного меча, может появиться совершенно новая область прикладной окислительно-восстановительной медицины.
– Стивен Боуг (Steven Baugh) – директор по техническим вопросам компании ChromaDex Analytics Inc, Боулдер, Колорадо. Г-н Боуг имеет более чем 15-летний опыт работы в области анализа натуральных продуктов. Другие должности включают фармацевтического химика-исследователя, промышленного гигиениста, технического писателя, специалиста по обеспечению качества и менеджера аналитической лаборатории, аккредитованной по стандарту ISO17025. Мистер Боуг получил степень бакалавра наук. получил степень бакалавра химии со степенью бакалавра физики в Университете Восточного Кентукки в Ричмонде, штат Кентукки, и степень магистра химических наук в Колорадской горной школе в Голдене, штат Колорадо.
 белки
белки [1] Окислительный стресс, вызванный этими химическими веществами, может повредить клетки и ткани, например, передозировка анальгетика парацетамола (ацетаминофена) может привести к фатальному повреждению печени, частично из-за выработки ею активных форм кислорода. [2] [3]
[1] Окислительный стресс, вызванный этими химическими веществами, может повредить клетки и ткани, например, передозировка анальгетика парацетамола (ацетаминофена) может привести к фатальному повреждению печени, частично из-за выработки ею активных форм кислорода. [2] [3]  Затем этот восстановленный металл передает единственный электрон молекулярному кислороду или перекиси.
Затем этот восстановленный металл передает единственный электрон молекулярному кислороду или перекиси. [2]. Таким образом, все они являются случайными симптомами (например) гемохроматоза, другое название которого — «бронзовый диабет». Прооксидантный гербицид паракват, болезнь Вильсона и полосатое железо также были связаны с паркинсонизмом у человека. Паракват также вызывает симптомы паркинсонизма у грызунов.
[2]. Таким образом, все они являются случайными симптомами (например) гемохроматоза, другое название которого — «бронзовый диабет». Прооксидантный гербицид паракват, болезнь Вильсона и полосатое железо также были связаны с паркинсонизмом у человека. Паракват также вызывает симптомы паркинсонизма у грызунов. Витамин С обладает антиоксидантной активностью, когда он восстанавливает окисляющие вещества, такие как перекись водорода, [5] , однако он также может восстанавливать ионы металлов, что приводит к образованию свободных радикалов посредством реакции Фентона. [6] [7]
Витамин С обладает антиоксидантной активностью, когда он восстанавливает окисляющие вещества, такие как перекись водорода, [5] , однако он также может восстанавливать ионы металлов, что приводит к образованию свободных радикалов посредством реакции Фентона. [6] [7]  Например, у людей на мочевую кислоту приходится примерно половина антиоксидантной способности плазмы. Фактически, мочевая кислота могла заменить аскорбат в эволюции человека [3].
Например, у людей на мочевую кислоту приходится примерно половина антиоксидантной способности плазмы. Фактически, мочевая кислота могла заменить аскорбат в эволюции человека [3]. Точно так же данные связывают метаболический синдром с прооксидантными свойствами уратов, вторичными по отношению к гиперурикемии, вызванной фруктозой [7].
Точно так же данные связывают метаболический синдром с прооксидантными свойствами уратов, вторичными по отношению к гиперурикемии, вызванной фруктозой [7]. PMID 15580660.
PMID 15580660.