Исследование свойств воды при кристаллизации
Внимание! Администрация сайта rosuchebnik.ru не несет ответственности за содержание методических разработок, а также за соответствие разработки ФГОС.
- Участник:Ковалёв Павел Алексеевич
- Руководитель:Шик Галина Яковлевна
Цель работы: провести опыты по кристаллизации воды и подготовить предложения по их проведению.
Вступление
Вода является не только одним из самых необходимых, но и самых удивительных явлений на нашей планете. Исключительно важна роль воды в возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле.
Введение
Большая часть поверхности Земли покрыта водой (океаны, моря, озёра, реки, льды). На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % – ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках, которые образуются из взвешенных в воздухе частиц льда и жидкой воды.
Вода при нормальных условиях находится в жидком состоянии, однако при температуре в 0 °C она переходит в твердое состояние – лед и кипит (превращается в водяной пар) при температуре 100 °C.
Значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию».
Лёд встречается в природе в виде собственно льда (материкового, плавающего, подземного), а также в виде снега, инея, изморози. Под действием собственного веса лёд приобретает пластические свойства и текучесть.
Природный лёд обычно значительно чище, чем вода, так как при кристаллизации воды в первую очередь в решётку встают молекулы воды.
Общие запасы льда на Земле около 30 млн. км³. Основные запасы льда сосредоточены в полярных шапках (главным образом, в Антарктиде, где толщина слоя льда достигает 4 км).
В мировом океане вода солёная и это препятствует образованию льда, поэтому лёд образуется только в полярных и субполярных широтах, где зима долгая и очень холодная. Замерзают некоторые неглубокие моря, расположенные в умеренном поясе.
Замерзают некоторые неглубокие моря, расположенные в умеренном поясе.
Кроме того, имеются данные о наличии льда на планетах Солнечной системы (например, на Марсе), их спутниках, на карликовых планетах и в ядрах комет.
Исследование свойств воды необходимо для человечества.
При этом процесс кристаллизации воды можно изучать в домашних условиях, а также на уроках в средней школе.
Актуальность работы использование на уроках физики, для знакомства учащихся со свойствами воды при кристаллизации.
Объектом исследования является кристаллизация воды.
Предмет исследования – изучения свойств воды при кристаллизации.
Цель работы провести опыты по кристаллизации воды и подготовить предложения по их проведению.
Главной задачей является изучение свойств воды при кристаллизации.
Для решения главной задачи необходимо:
- Повести анализ основных свойств воды.

- Изучить значение кристаллизации воды для флоры и фауны Земли.
- Определить основные опыты для проведения исследования.
- Провести опыты и описать основные результаты.
- Подготовить предложения по проведению опытов на уроках в средней школе.
Теоретическая значимость работы заключается в систематизации основных свойств воды и значения кристаллизации воды для флоры и фауны Земли.
Практическая значимость работы – изучение процесса кристаллизации воды во время проведение опытов, а также подготовка предложений по проведению опытов на уроках в средней школе.
1. Подготовка к исследованию
1.1 Анализ основных свойств воды
Вода является одним из самых удивительных веществ на планете Земля. Встретить воду можно практически везде в естественных условиях как на поверхности планеты, так и в ее недрах в трех возможных физических состояниях для веществ: жидкое, твердое, газообразное (то есть вода, лед, водяной пар).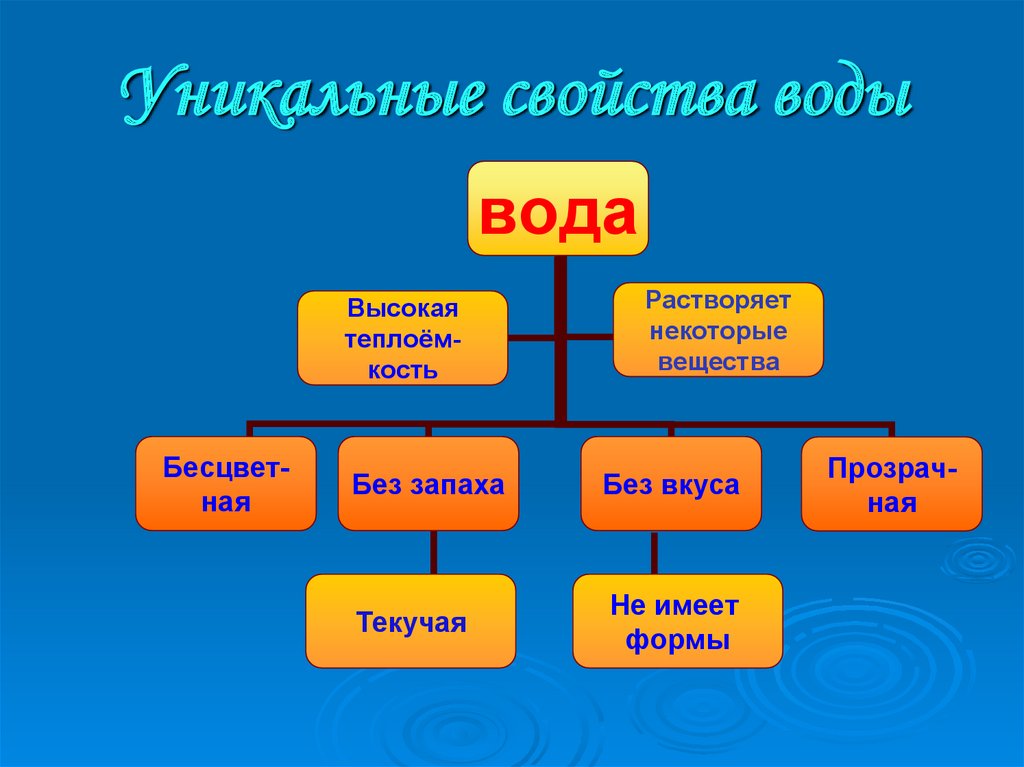
Конечно, существуют вещества, которые можно получить в виде жидкости, твердого тела или газа. Однако, не существует подобного химического вещества, которое именно в естественных условиях встречается в указанных выше трех физических состояниях.
Свойства воды:
- Вода является веществом, которое не имеет ни цвета, ни запаха, ни вкуса.
- Вода является единственным на планете Земля известным науке веществом, встречающимся в природных условиях в трех физических состояниях: твердое тело, жидкость, газ.
- Вода является универсальным растворителем, имея возможность растворять большее количество солей, а также других веществ, чем какие-либо другие вещества.
- Вода с большим трудом поддается окислению. Вода — достаточно химически устойчива, то есть разложить ее на составные части или сжечь достаточно проблематично.
- Окислению водой поддаются практически все естественные металлы, так же под ее воздействием разрушаются особо твердые горные породы.

- При замерзании вода обладает уникальными свойствами расширения. Благодаря таким свойствам лед на воде, которая находится в виде жидкости, плавает.
- Вода, как физическое вещество, характеризуется большим сродством сама с собой. Такое сродство у воды является самым большим среди всех жидкостей. Вследствие этого вода на поверхности размещается в виде капель сферической формы, поскольку сфера обладает наименьшей при заданном объеме поверхностью.
- Замерзание воды происходит не при температурных условиях ее наибольшей плотности (при 4 градусах Цельсия), а при нуле градусов Цельсия. Это свойства пресной воды. Однако, замерзание морской воды происходит при более низких температурах: минус 1,9 градусов Цельсия, при солености 35%.
- Вода обладает очень высокой теплоемкостью, относительно мало нагреваясь при этом. Также вода обладает достаточно высокой скрытой теплотой плавления (порядка 80 кал/г), а также испарения ( порядка 540 кал/г). Вода способна поглощать значительные объемы дополнительного тепла.
 Температура же в процессе замерзания или при кипении остается неизменной.
Температура же в процессе замерзания или при кипении остается неизменной. - Дистиллированная вода практически не проводит электрический ток, однако наличие в воде даже небольшого количества солей значительно увеличивает ее токопроводящие свойства.
Свойства снега:
- При смешивании соли со снегом наблюдается два процесса: разрушение кристаллической структуры соли, которое происходит с поглощением тепла, и гидрация ионов. Последний процесс происходит с выделением тепла в окружающую среду. Для поваренной соли и хлористого кальция первый процесс превалирует над вторым. Поэтому при смешивании снега с этими солями происходит активный отбор тепла из окружающей среды. Ещё одна особенность соляных растворов состоит в том, что их точка замерзания ниже 0 градусов. Чтобы снег на тротуарах таял при температуре ниже 0 градусов, его посыпают этими солями.
- Снег обладает удивительным свойством – памятью. Он сохраняет следы. По следам можно, например, изучать физику.
 Чем крупнее животное, тем глубже от него след, следовательно, тем большее давление оно оказывает на снег. Следы собаки более глубокие, чем следы её щенков. Мыши, ласки оставляет неглубокие чёрточки. Природа снабдила копытных животных способностью раздвигать копыта и увеличивать площадь опоры. Это помогает им зимой при передвижение по заснеженному лесу и полям не так глубоко погружаться в снег.
Чем крупнее животное, тем глубже от него след, следовательно, тем большее давление оно оказывает на снег. Следы собаки более глубокие, чем следы её щенков. Мыши, ласки оставляет неглубокие чёрточки. Природа снабдила копытных животных способностью раздвигать копыта и увеличивать площадь опоры. Это помогает им зимой при передвижение по заснеженному лесу и полям не так глубоко погружаться в снег.
1.2 Значение кристаллизации воды для флоры и фауны
Мы любим снег не только за то, что он дарит нам великолепные зимние пейзажи. У нашей любви к снегу немало рациональных причин. «Снег на полях — хлеб в закромах», «Зима без снега – лето без хлеба», – справедливо утверждают старинные русские пословицы. Снежный покров — это огромный запас влаги, столь необходимый полям, в то же время это своеобразное гигантское одеяло, защищающее поверхность земли от холодных ветров. Академик Б. И. Вернадский подчеркивал, что снежный покров — «не просто теплая покрышка озимых, это живительная покрышка», весной он дает талые воды, насыщенные кислородом.
Запасы снега существенно влияют на уровень воды в реках, определяют изменения климата на больших территориях.
Кроме того, снег является хорошим строительным материалом для различных построек на севере — от иглу (жилищ эскимосов) до больших складских помещений. Существует самая большая в мире гостиница, полностью сделанная изо льда и снега, находится она в шведской Лапландии в 200 километрах от Северного полярного круга.
Он служит основой зимних дорог и даже аэродромов.
Благодаря снегу мы каждый год любуемся сказочными зимними пейзажами, играем в снежки, строим снежные городки, крепости, катаемся на лыжах, санках, в снежном уборе приходит к нам прекрасный новогодний праздник.
Значение льда трудно недооценить. Лёд оказывает большое влияние на условия обитания и жизнедеятельности растений и животных, на разные виды хозяйственной деятельности человека. Покрывая воду сверху, лед играет в природе роль своего рода плавучего экрана, защищающего реки и водоемы от дальнейшего замерзания и сохраняющего жизнь подводному миру. Если бы плотность воды увеличивалась при замерзании, лед оказался бы тяжелее воды и начал тонуть, что привело бы к гибели всех живых существ в реках, озерах и океанах, которые замерзли бы целиком, превратившись в глыбы льда, а Земля стала ледяной пустыней, что неизбежно привело бы к гибели всего живого.
Лёд оказывает большое влияние на условия обитания и жизнедеятельности растений и животных, на разные виды хозяйственной деятельности человека. Покрывая воду сверху, лед играет в природе роль своего рода плавучего экрана, защищающего реки и водоемы от дальнейшего замерзания и сохраняющего жизнь подводному миру. Если бы плотность воды увеличивалась при замерзании, лед оказался бы тяжелее воды и начал тонуть, что привело бы к гибели всех живых существ в реках, озерах и океанах, которые замерзли бы целиком, превратившись в глыбы льда, а Земля стала ледяной пустыней, что неизбежно привело бы к гибели всего живого.
Лёд может вызывать ряд стихийных бедствий с вредными и разрушительными последствиями – обледенение летательных аппаратов, судов, сооружений, дорожного полотна и почвы, град, метели и снежные заносы, речные заторы с наводнениями, ледяные обвалы и др. Природный лёд используется для хранения и охлаждения пищевых продуктов, биологических и медицинских препаратов, для чего он специально производится и заготавливается.
1.3 Выбор и обоснование опытов для проведения исследования
Для проведения опытов с водой необходимо выбрать те, которые наиболее полно характеризуют и подтверждают свойства воды.
Проведенный анализ показал, что лучше всего это будет реализовано при выполнении следующих опытов:
- Замерзание соленой воды.
- Расширение воды при замерзании.
- Замерзание жидкости при внешнем воздействии снега.
- Замерзание мыльных пузырей.
- Срастание сосульки.
- Скрип сухого снега.
- Примерзание к поверхности.
2. Проведение исследования
2.1 Подготовка материальной части
Для проведения опытов были взяты:
- предметы – кастрюля, стеклянная бутылка, пластиковая бутылка, одноразовые стаканы, тонкая медная проволока, трубочка;
- вещества – снег, сосулька, соль, вода, мыльный раствор, сок.
2.
 2 Проведение опытов с описанием основных результатов
2 Проведение опытов с описанием основных результатов1. Замерзание соленой воды.
Налейте в две формочки воду – чистую и очень солёную. Вынесите формочки на мороз или поставьте в морозильную камеру. Вы заметите, что чистая пресная вода превратилась в лёд, а солёная замёрзнет при очень сильном морозе.
Замерзание воды происходит не при температурных условиях ее наибольшей плотности (при 4 градусах Цельсия), а при нуле градусов Цельсия. Это свойства пресной воды.
При этом, морской лед отличается от пресноводного в ряде отношений. У соленой воды температура замерзания понижается по мере увеличения солености. В диапазоне солености от 30 до 35 промилле точка замерзания меняется от -1.6 до -1.9 град. Образование морского льда можно рассматривать как замерзание пресной воды с вытеснением солей в ячейки морской воды внутри толщи льда. Когда температура достигает точки замерзания, образуются ледяные кристаллы, которые «окружают» не замерзшую воду.
2. Расширение воды при замерзании.
Наполните водой пластиковый стакан, пластиковую бутылку и стеклянную бутылку. Выставьте их на мороз. Замерзая, вода увеличивается в объёме, «вылезает» из стакана, стеклянную бутылку разрывает даже в том случае, когда она заполнена наполовину. Пластиковая бутылка остаётся без видимых изменений.
При замерзании вода обладает уникальными свойствами расширения. Благодаря таким свойствам лед на воде, которая находится в виде жидкости, плавает.
Зимой из-за этого свойства воды происходят аварии на водопроводах. В сильные морозы основная причина таких аварий – замерзание текучей воды. Происходит ее расширение, так что образующийся лед легко разрывает трубы, так как плотность льда – 917 кг/м3, а плотность воды – 1000 кг/м3, то есть объем увеличивается в 1,1 раза, что довольно существенно.
3. Замерзание жидкости при внешнем воздействии снега.
Налейте в пластиковый стакан (пробирку) сок и поставьте его в кастрюлю с солёным снегом. Сок замёрзнет, и очень скоро вы будете лакомиться фруктовым льдом.
Сок замёрзнет, и очень скоро вы будете лакомиться фруктовым льдом.
При смешивании соли со снегом наблюдается разрушение кристаллической структуры соли, которое происходит с поглощением тепла. Поэтому при смешивании снега с солью происходит активный отбор тепла из сока и сок превращается в лед.
4. Замерзание мыльных пузырей.
Приготовьте мыльный раствор. Раствор на морозе держите в рукавице, чтобы он не замёрз. Выдувайте пузыри трубочкой для сока. Из-за разности температур изнутри пузыря и снаружи возникает большая подъёмная сила, мгновенно уносящая пузыри вверх. Тонкая мыльная плёнка на морозе быстро замерзает, превращая пузыри в ледяные шарики.
Таким образом, тончайшая пленка мыльного пузыря замерзает за считанные секунды.
5. Срастание сосульки.
Возьмите сосульку. Перекиньте через неё тонкую проволоку, концы которой утяжелите грузиками. Наблюдайте, как проволока растапливает лёд, проникает всё глубже в сосульку. Вода над сосулькой вновь замерзает.
Вода над сосулькой вновь замерзает.
Это подтверждает свойство поглощения тепла большей массой льда.
Лед нарастает снизу, сразу над проволокой, так как стекающая вниз талая вода замерзает при соприкосновении с холодными стенками сосульки.
6. Скрип сухого снега.
Насыпьте в тарелку сахарный песок горкой и начните давить его ложкой. Вы услышите характерный скрип. Намочите песок и вновь разотрите. Скрип исчез. В морозные дни звук распространяется на большие расстояния.
Снег скрипит только в мороз (ниже -5°C), и звук скрипа меняется в зависимости от температуры воздуха – чем крепче мороз, тем выше тон скрипа. При достаточном опыте можно оценивать температуру воздуха по звуку, который издает скрипящий снег. Скрип образуется из-за того, что при давлении разрушаются мельчайшие кристаллики снега. Причем каждый из них по отдельности очень мал, чтобы издавать звук, доступный уху человека, но вместе они ломаются довольно громко. Усиление морозов делает ледяные кристаллики более твердыми и хрупкими. При каждом шаге ледяные иглы ломаются. При температуре воздуха ниже -50°C скрип снега становится таким сильным, что его можно слышать через тройные стекла (этому способствует также большая плотность морозного воздуха).
Усиление морозов делает ледяные кристаллики более твердыми и хрупкими. При каждом шаге ледяные иглы ломаются. При температуре воздуха ниже -50°C скрип снега становится таким сильным, что его можно слышать через тройные стекла (этому способствует также большая плотность морозного воздуха).
7. Примерзание к поверхности.
Добавьте в кастрюлю со снегом поваренную соль в соотношении примерно 1 к 6. Тщательно размешайте смесь. Если теперь вы захотите переставить кастрюлю, то её придётся поднять вместе с табуретом.
Это также подтверждает поглощение тепла из окружающей среды.
При смешивании соли со снегом происходит образование раствора, сопровождающееся сильным охлаждением вследствие большого поглощения теплоты льдом при его плавлении и солью при ее растворении. Так, например, температура смеси из 29 грамм соли и 100 грамм льда понижается до – 21°С. А если взять 143 грамма соли и 100 грамм льда, то температура может быть понижена до – 55°С.
2.3 Предложения по проведению опытов
Опыты по изучению свойств воды целесообразно проводить на уроках в средней и начальной школе.
При этом для детей начальной школы рекомендуется проведение опытов № 1 и 2 в домашних условиях под присмотром родителей.
Для учеников средней школы возможно проведение опытов № 3, 6 и 7 на уроках под руководством учителя, а опыты № 4 и 5 – факультативно или самостоятельно в домашних условиях.
Заключение
Таким образом, исследование свойств воды необходимо для человечества.
Процесс кристаллизации воды можно изучать в домашних условиях, а также на уроках в средней и начальной школе.
В работе удалось решить следующие задачи:
- Повести анализ основных свойств воды.
- Изучить значение кристаллизации воды для флоры и фауны Земли.
- Определить основные опыты для проведения исследования.

- Провести опыты и описать основные результаты.
- Подготовить предложения по проведению опытов на уроках в средней школе.
Значимость работы по систематизации основных свойств воды и значения кристаллизации воды для флоры и фауны Земли подтвердилась.
Цель достигнута.
Лекарство от самой природы: лечебные свойства воды
Лекарство от самой природы: лечебные свойства воды
Вода — основной жизнеопределяющий компонент организма человека. Однако процентное содержание ее в нашем организме меняется в зависимости от возраста. В период внутриутробного развития человек состоит из воды на 90-95%. Затем ее содержание сокращается: в организме ребенка — до 80%, а взрослого человека — до 50-70%. Уменьшение жидкости в организме — одна из причин старения кожи, волос и нарушений работы внутренних органов.
Вода — не просто жидкость, это жизнь
Употребление 6-8 стаканов воды в день — не только банальная рекомендация врачей. Это, действительно, способ оставаться здоровым и эмоционально стабильным даже на старости лет.
Это, действительно, способ оставаться здоровым и эмоционально стабильным даже на старости лет.
Уже давно доказано учеными, что большая часть заболеваний возникает из-за нехватки в организме человека жидкости. Ведь вода является универсальным растворителем и непосредственным участником многих биохимических реакций. Наш организм не может впитать в себя полезные вещества, получаемые «извне», если они не будут растворены жидкостью. Только после этого они проникают в кровь и передаются из клетки в клетку.
Однако, как известно, дело не только в количестве, но и в качестве. Важно употреблять воду, которая будет помогать, созидать, а не разрушать. Человек, который не заботится о качестве употребляемой воды, по статистике, за всю жизнь снабжает свой организм 420 стаканами откровенного мусора: солями металлов и загрязнителями. Итак, чтобы вода стала лекарством, она должна соответствовать питьевым или минеральным стандартам.
Что может питьевая и минеральная вода?
Во-первых, нужно заметить, что, если питьевая вода может употребляться ежедневно в соответствии с необходимостью, то минеральная вода должна рассматриваться как лекарственное средство. А употребление лекарства должен назначать врач. Минеральную воду, то есть воду, в которой сохранилось природное количество минеральных солей, можно употреблять всего несколько раз в день. Такая вода оказывает общеукрепляющее, иммуномодулирующее действие на организм человека, а также способна избавить человека от заболеваний моче-половой системы и желудочно-кишечного тракта.
А употребление лекарства должен назначать врач. Минеральную воду, то есть воду, в которой сохранилось природное количество минеральных солей, можно употреблять всего несколько раз в день. Такая вода оказывает общеукрепляющее, иммуномодулирующее действие на организм человека, а также способна избавить человека от заболеваний моче-половой системы и желудочно-кишечного тракта.
Однако даже обычная питьевая вода может стать эффективным средством в борьбе с различными болезнями.
1. Питьевая вода при внутреннем применении помогает расщеплять жиры, поэтому необходима страдающим ожирением и сахарным диабетом.
2. Она хорошо очищает от шлаков кишечник и печень.
3. При ингаляциях, когда человек вдыхает полезные частицы воды, разжижается мокрота и происходит быстрое восстановление после перенесенного заболевания дыхательных путей.
4. В замороженном состоянии, в виде примочек, вода устраняет отеки вокруг глаз и тонизирует кожу.
Что может быть проще и доступнее чистой воды? И богатства, сокрытые в ней, предлагает нам сегодня сама природа!
Вода — основной жизнеопределяющий компонент организма человека. Однако процентное содержание ее в нашем организме меняется в зависимости от возраста. В период внутриутробного развития человек состоит из воды на 90-95%. Затем ее содержание сокращается: в организме ребенка — до 80%, а взрослого человека — до 50-70%. Уменьшение жидкости в организме — одна из причин старения кожи, волос и нарушений работы внутренних органов.
Однако процентное содержание ее в нашем организме меняется в зависимости от возраста. В период внутриутробного развития человек состоит из воды на 90-95%. Затем ее содержание сокращается: в организме ребенка — до 80%, а взрослого человека — до 50-70%. Уменьшение жидкости в организме — одна из причин старения кожи, волос и нарушений работы внутренних органов.
Вода — не просто жидкость, это жизнь!
Употребление 6-8 стаканов воды в день — не только банальная рекомендация врачей. Это, действительно, способ оставаться здоровым и эмоционально стабильным даже на старости лет.
Уже давно доказано учеными, что большая часть заболеваний возникает из-за нехватки в организме человека жидкости. Ведь вода является универсальным растворителем и непосредственным участником многих биохимических реакций. Наш организм не может впитать в себя полезные вещества, получаемые «извне», если они не будут растворены жидкостью. Только после этого они проникают в кровь и передаются из клетки в клетку.
Однако, как известно, дело не только в количестве, но и в качестве. Важно употреблять воду, которая будет помогать, созидать, а не разрушать. Человек, который не заботится о качестве употребляемой воды, по статистике, за всю жизнь снабжает свой организм 420 стаканами откровенного мусора: солями металлов и загрязнителями. Итак, чтобы вода стала лекарством, она должна соответствовать питьевым или минеральным стандартам.
Что может питьевая вода Родниковый край?
Во-первых, нужно заметить, что, если питьевая вода нашего производства может употребляться ежедневно в соответствии с необходимостью, то минеральная вода должна рассматриваться как лекарственное средство. А употребление лекарства должен назначать врач. Минеральную воду, то есть воду, в которой сохранилось природное количество минеральных солей, можно употреблять всего несколько раз в день. Такая вода оказывает общеукрепляющее, иммуномодулирующее действие на организм человека, а также способна избавить человека от заболеваний моче-половой системы и желудочно-кишечного тракта, поэтому выбирая питьевую воду Родниковый Край Вы укрепляете здоровье без врачей и рецептов!
Однако даже обычная питьевая вода может стать эффективным средством в борьбе с различными болезнями.
- Питьевая вода при внутреннем применении помогает расщеплять жиры, поэтому необходима страдающим ожирением и сахарным диабетом.
- Она хорошо очищает от шлаков кишечник и печень.
- При ингаляциях, когда человек вдыхает полезные частицы воды, разжижается мокрота и происходит быстрое восстановление после перенесенного заболевания дыхательных путей.
- В замороженном состоянии, в виде примочек, вода устраняет отеки вокруг глаз и тонизирует кожу.
Что может быть проще и доступнее чистой воды, тем более если кулеры с питьевой водой Родниковый Край легко заказть вместе? И богатства, сокрытые в ней, предлагает нам сегодня сама природа!
Свойства воды: обзор ускоренного курса биологии AP®
Свойства воды Введение На экзамене по биологии AP® многие студенты задаются вопросами, касающимися свойств воды. Эта тема обычно раскрывается в начале года, а когда дело доходит до всей информации, за которую учащиеся отвечают в AP® Bio, о ней забывают. Свойства воды необходимы для поддержания гомеостаза, стабильного равновесия в организмах и в мире.
Свойства воды необходимы для поддержания гомеостаза, стабильного равновесия в организмах и в мире.
В этом обзоре ускоренного курса биологии AP® мы рассмотрим информацию, необходимую для понимания свойств воды. Мы начнем с разговора о полярности воды и о том, как ее полярность делает воду одним из самых важных химических веществ на Земле. Затем мы поговорим о нескольких важных свойствах воды, которые позволяют организмам выживать. Наконец, мы рассмотрим бесплатный вопрос о свойствах воды, заданный учащимся на экзамене 2009 г.Экзамен AP® по биологии.
Важность полярности и водородных связей К этому моменту вашей научной карьеры вы, вероятно, узнали о полярности. Полярная молекула — это молекула, которая не распределяет свои электроны поровну между своими атомами. Этот электронный дисбаланс заставляет молекулу иметь положительные и отрицательные диполи; поскольку электроны проводят больше времени на одном конце (из-за неравного распределения), эта часть молекулы будет иметь частичный отрицательный заряд. Конец, который притягивает электрон к себе, будет отрицательным диполем, а конец, оттягивающий электрон от себя, будет положительным диполем.
Конец, который притягивает электрон к себе, будет отрицательным диполем, а конец, оттягивающий электрон от себя, будет положительным диполем.
Величина силы, которую оказывает отрицательный атом, называется электроотрицательностью. Важно понимать, что кислород имеет одно из самых высоких значений электроотрицательности, а это означает, что он будет оттягивать электроны от атома, с которым он связан, превращая его в отрицательный диполь. В случае воды кислород вытянет электрон из водорода. Имейте в виду, что молекулы воды по-прежнему делятся своими электронами, но электроны проводят больше времени с кислородом, чем с водородом.
Почему все это так важно? Диполи в конечном итоге делают атом кислорода отрицательно заряженным, а атомы водорода — положительно заряженными. Вода состоит из миллионов этих молекул, которые заставляют их ориентироваться определенным образом. Отрицательная часть одной молекулы воды захочет оказаться рядом с положительной частью другой. Эта решетчатая связь называется водородной связью.
Водородные связи — одна из самых важных вещей, которые вы должны знать о воде. Водородная связь является причиной свойств воды, которые вы должны знать для экзамена AP® Bio. Для каждого свойства, которое мы обсуждаем, мы рассмотрим, как оно возникает из-за водородных связей и как это влияет на жизнь на Земле.
Источник изображения: Wikimedia Commons. АдгезияПервые два свойства, которые мы обсудим в обзоре ускоренного курса биологии AP®, связаны друг с другом: адгезия и адгезия. Адгезия — это свойство воды, которое относится к прилипанию молекул воды к другой поверхности. Когезия — это свойство воды, которое относится к тому, что молекулы воды прилипают друг к другу. Оба этих свойства обусловлены водородными связями и тем, как водородные связи ориентируют молекулы воды.
Адгезия является важным свойством. Для демонстрации адгезии наполните пробирку водой. Вы увидите, как вода образует букву U. Эта буква U называется мениском . Мениск образуется из-за прилипания воды к стеклу пробирки. Если у вас будет еще более тонкая пробирка, вы увидите, что мениск станет глубже (вода поползет выше). Если у вас нет пробирки, обратите внимание на рисунок.
Эта буква U называется мениском . Мениск образуется из-за прилипания воды к стеклу пробирки. Если у вас будет еще более тонкая пробирка, вы увидите, что мениск станет глубже (вода поползет выше). Если у вас нет пробирки, обратите внимание на рисунок.
Слипание также происходит естественным образом и является причиной того, что деревья могут быть высокими. Деревья получают воду из своих корней. Корни находятся далеко от листьев, которым нужна вода. Ксилема — это часть дерева, по которой вода движется вверх против силы тяжести, чтобы добраться до листьев. Ксилема состоит из мелких капилляров. Когда вода попадает в ксилему, вода прилипает к стенкам капилляра и позволяет ей двигаться к листьям. Этот процесс называется капиллярным действием и жизненно важен для выживания растений.
Сплоченность Связность, как мы уже говорили, — это способность воды связываться сама с собой. Когезия отвечает за поверхностное натяжение, а это означает, что капли воды будут сопротивляться разрыву, когда в систему добавляются напряжение и давление.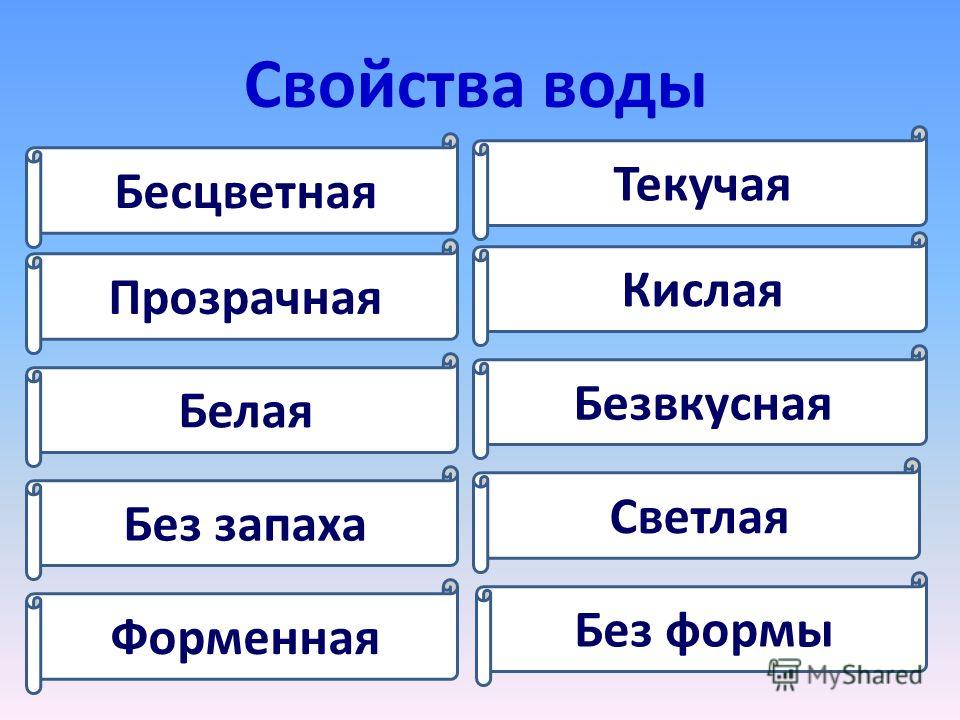
Сплоченность возникает, когда вода окружена воздухом. Молекулы, находящиеся на концах капель, имеют меньше возможностей для образования водородных связей. Это приводит к укреплению их водородных связей; поверхность способна выдерживать нагрузки.
Сплоченность – важное свойство воды для многих видов насекомых. Пример можно найти в семействе насекомых Gerridae. Этих насекомых принято называть водомерками. Они могут использовать поверхностное натяжение воды, чтобы стоять на воде. Ареал обитания водомерок – поверхность спокойных вод. Именно здесь они охотятся и размножаются. Без связующих свойств воды эти насекомые не выжили бы так, как сейчас.
Источник изображения: Wikimedia Commons. Удельная теплоемкость Благодаря прочности водородных связей вода обладает чрезвычайно высокой удельной теплоемкостью. Удельная теплоемкость относится к количеству тепла, необходимому для перемещения вещества на один градус Цельсия. Высокая удельная теплоемкость означает, что вода способна выдержать большое количество энергии, прежде чем ее температура изменится; это связано с водородными связями воды. Чтобы вода нагрелась, водородные связи должны быть разорваны. Эта дополнительная энергия, необходимая для разрыва связей, дает воде способность противостоять изменениям температуры.
Чтобы вода нагрелась, водородные связи должны быть разорваны. Эта дополнительная энергия, необходимая для разрыва связей, дает воде способность противостоять изменениям температуры.
Есть две важные температуры, которые часто изучаются в соединениях: теплота парообразования и теплота плавления. Теплота парообразования относится к теплу, необходимому для перехода соединения из жидкого состояния в газообразное. Теплота плавления относится к теплу, необходимому для перевода соединения из твердого состояния в жидкое. Благодаря водородным связям вода имеет как высокую теплоту парообразования, так и высокую теплоту плавления.
Высокая удельная теплоемкость чрезвычайно важна для выживания организмов на Земле. Земля на 70% состоит из воды. Вода на планете препятствует радикальному изменению температуры. Когда температура в атмосфере меняется, вода поглощает изменение температуры, не позволяя организмам выживать в динамичной среде. Кроме того, у людей (как и у большинства организмов) есть тела с очень высоким содержанием воды. По той же причине содержание воды предотвращает колебания температуры тела.
По той же причине содержание воды предотвращает колебания температуры тела.
Это может показаться наиболее очевидным свойством воды; вода в твердом состоянии плавает в жидком. Большинство веществ, обнаруженных на Земле, имеют гораздо более плотную твердую версию, чем жидкая версия, что интуитивно понятно. Когда вещество становится твердым, оно уплотняется, делая связи более тесными и прочными. Почему же тогда вода не подчиняется этому правилу и плавает? Вы, наверное, догадались, водородные связи.
Водородные связи в воде заставляют твердую воду образовывать трехмерную матрицу. Водородные связи удерживают связи растянутыми, не позволяя воде конденсироваться, а скорее заставляя ее растекаться. Когда вода находится в жидком состоянии, водородные связи гораздо более гибкие и способны перемещаться. Когда вода становится твердой, связи становятся менее гибкими, что приводит к расширению воды. Расширение связей приводит к уменьшению плотности льда; менее плотные соединения будут плавать в более плотных смесях.
Помимо того, что это интересно, это чрезвычайно важно для нашего выживания на Земле. Если бы вода утонула в твердом состоянии из-за меньшей плотности льда, наша планета была бы заморожена. Если вода тонет, когда она подвергается воздействию низких температур, то следующий слой воды тоже будет тонуть, пока весь океан не замерзнет. Умрут не только морские животные, но и наземные организмы, скорее всего, не выживут.
Универсальный растворительВозможно, вы слышали, что вода является универсальным растворителем. Вода считается универсальным растворителем, так как способна очень быстро растворять соединения. Это свойство уникально для воды из-за диполей, которые имеют молекулы воды.
Когда соединение попадает в воду, молекулы воды окружают его, образуя клетку вокруг молекул соединения. Например, когда NaCl (поваренная соль) помещается в воду, Na отделяется от Cl. Молекулы воды разрывают соединение, потому что положительно заряженные молекулы водорода хотят соединиться с отрицательно заряженным ионом хлора. Кроме того, отрицательно заряженный диполь кислорода хочет соединиться с положительно заряженным ионом натрия. Это притяжение раздвигает молекулы и заставляет воду быстро растворять соль.
Кроме того, отрицательно заряженный диполь кислорода хочет соединиться с положительно заряженным ионом натрия. Это притяжение раздвигает молекулы и заставляет воду быстро растворять соль.
Существует класс соединений, которые вода не может растворить. Эти соединения являются неполярными соединениями. Неполярные соединения делят свои электроны поровну и не имеют зарядов или диполей. Из-за этой характеристики вода не может разделять разные молекулы. По этой причине масло (неполярное) и вода (полярное) не смешиваются.
Растворители невероятно необходимы по многим причинам. Мы постоянно поглощаем пищу, которая должна быть быстро и эффективно расщеплена. Присутствие воды в нашем организме способствует пищеварению. Растворители играют важную роль почти во всех химических реакциях.
Резюме В этом обзоре ускоренного курса биологии AP® мы говорили о многих различных свойствах воды, которые позволяют жить на Земле. Мы говорили о сплоченности, которая позволяет таким насекомым, как водомерки, стоять на воде. Мы также рассмотрели адгезию, которая позволяет воде доходить до листьев дерева. Затем мы узнали о высокой удельной теплоемкости воды и о том, как она позволяет температуре на Земле и в организмах, таких как люди, оставаться на уровне гомеостаза. Далее мы говорили о том, как твердая форма воды, лед, плавает, и как это позволило нашим океанам оставаться талыми. Наконец-то мы узнали о том, что вода является универсальным растворителем, способным растворить любое полярное вещество.
Мы также рассмотрели адгезию, которая позволяет воде доходить до листьев дерева. Затем мы узнали о высокой удельной теплоемкости воды и о том, как она позволяет температуре на Земле и в организмах, таких как люди, оставаться на уровне гомеостаза. Далее мы говорили о том, как твердая форма воды, лед, плавает, и как это позволило нашим океанам оставаться талыми. Наконец-то мы узнали о том, что вода является универсальным растворителем, способным растворить любое полярное вещество.
В этой статье «Свойства воды: обзор ускоренного курса биологии AP®» содержится много информации для обзора. Чтобы убедиться, что вы чувствуете себя комфортно, мы сейчас рассмотрим вопрос AP® Bio о свойствах воды, который был замечен на экзамене AP® в 2009 году. .
а) Обсудите ТРИ свойства воды.
(b) Объясните каждое из следующего с точки зрения свойств воды. Вы не ограничены тремя свойствами, описанными в части (а):
- роль воды как среды для метаболических процессов клеток
- способность воды смягчать температуру в живых организмах и в окружающей их среде
- движение воды от корней к корням листья растений
Для части А у вас есть выбор. Вот несколько ответов, за которые Экзамен по биологии AP® принимает полные баллы:
Вот несколько ответов, за которые Экзамен по биологии AP® принимает полные баллы:
| Свойство | Описание | |
| Когезия | Притяжение к другим молекулам воды, поверхностное натяжение | |
| Адгезия | 5Притяжение к другим поверхностям 27 Высокая удельная теплоемкость | Поглощение тепла без изменения температуры |
| Состояние вещества | Лед менее плотный, чем вода, расширяется и становится менее плотным | |
| Высокая теплота парообразования | Молекулы воды поглощают энергию |
В части B вы должны объяснить три важные составляющие жизни на Земле и то, как вода необходима для их существования. Первый пример относится к способности воды быть универсальным растворителем. Мы рассмотрели, что важно, чтобы вода могла растворять вещества, а в клетке это особенно важно. Присутствие воды также позволяет протекать многим химическим реакциям.
Присутствие воды также позволяет протекать многим химическим реакциям.
Второй пример, который мы рассмотрели ранее в этой статье. Вода снижает температуру, поглощая тепло и не изменяя температуру. Это позволяет климату оставаться более стабильным. Высокая удельная теплоемкость воды также позволит поддерживать постоянную внутреннюю среду внутри организмов.
Наконец, в третьем примере мы можем использовать капиллярное действие воды. Вода движется вверх по ксилеме дерева, чтобы достичь листьев. Вода движется за счет адгезии и капиллярного действия.
Большое спасибо, что прочитали нашу статью! Дайте нам знать, если у вас есть какие-либо вопросы или вы хотите поделиться своей подготовкой к экзамену AP® Bio ниже. Если вы хотите продолжить обучение, ознакомьтесь с нашей статьей Гомеостаз: обзор ускоренного курса биологии AP® прямо сейчас!
Нужна помощь в подготовке к экзамену AP® по биологии? У Альберта есть сотни практических вопросов AP® Biology, бесплатные ответы и полные практические тесты, которые можно попробовать.
Начните подготовку к экзамену AP® Biology здесь
Вы учитель или администратор, заинтересованный в повышении успеваемости учащихся AP® Biology?
Узнайте больше о наших школьных лицензиях здесь .
Заинтересованы в школьной лицензии?
Пригласите Альберта в свою школу и предоставьте всем учителям лучший в мире банк вопросов для:
➜ SAT® и ACT®
➜ AP®
➜ ELA, математика, естествознание и социальные науки
➜ Оценка штата
Варианты для учителей, школ и школьных округов.
ИЗУЧИТЕ ВАРИАНТЫ
Вода: свойства, соленость и слои
Свойства воды
Связи
Вода представляет собой соединение. Он содержит водород и кислород в фиксированной пропорции, h3O. Водород и Кислород удерживаются вместе химическими связями; в частности, ковалентные связи, что означает, что электроны являются общими. Вода является полярной молекулой из-за небольшого отрицательного заряда кислорода и небольшого положительного заряда водорода, поэтому молекула имеет изогнутую форму. Именно эта полярность позволяет воде притягивать другие молекулы. Это свойство под названием
Вода является полярной молекулой из-за небольшого отрицательного заряда кислорода и небольшого положительного заряда водорода, поэтому молекула имеет изогнутую форму. Именно эта полярность позволяет воде притягивать другие молекулы. Это свойство под названием
, позволяет молекулам воды прилипать друг к другу. Вода также имеет тенденцию прилипать к другим материалам, это свойство называется адгезией
.
Удельная теплоемкость
Вода имеет высокую удельную теплоемкость: 4,186 Дж/г*C. Это означает, что для повышения температуры одного грамма воды на один градус Цельсия требуется 4,186 Дж тепловой энергии. Сравните это с медью (удельная теплоемкость = 0,386) или стеклом (удельная теплоемкость = 0,84). Эта высокая удельная теплоемкость означает, что вода сопротивляется изменению температуры (выше или ниже) и помогает регулировать климат во всем мире.
Термостатические эффекты
Термостатические свойства – это свойства, которые действуют для смягчения изменений температуры.
Различия в самых жарких и самых прохладных местах:
- На суше = 140 °C
- В воде = 34 °C
Лос-Анджелес
Колумбия
Широта: 34,3 с.ш. 34 с.ш. Температура 60–85 °F 70–90 °F
Среднее количество осадков 2–3 дюйма/месяц 47 дюймов
Почему разница?? Воздушные массы, определяющие климат Лос-Анджелеса, приходят с океана (более умеренный климат). Наш климат управляется воздушными массами , пересекающими сушу; следовательно, они, скорее всего, изменятся резко и не так мягко. (большие погодные диапазоны)
(большие погодные диапазоны)
Эти термостатические эффекты влияют на климат (иначе полюса замерзнут, а экваториальные океаны закипят!). По мере того, как вода движется вокруг океана, теплая тропическая вода уносится к полюсам, а прохладная полярная вода – к экватору.
Морская вода
«Морская вода состоит примерно на 96,5% из чистой воды и на 3,5% из растворенных твердых веществ и газов» [ Океанография , Гарнизон]. Эти твердые вещества («соли») поступают из двух мест: химического выветривания горных пород на суше, которые выносятся в океан реками, и из недр Земли — высвобождения через гидротермальные источники или вулканы. Существует 6 основных растворимых ионов: Cl, Mg, K, Ca, Na и SO4-. Чистая вода имеет плотность 1,00 при 3,9.8°С. Добавление твердых веществ вызывает увеличение плотности примерно до 1,02 или 1,03.
Соленость (количество присутствующих растворенных твердых веществ) .
Чистая вода составляет 0%, а океан — 3,5%. Эти растворенные твердые вещества действуют как антифриз. Он снижает точку замерзания. Температура замерзания морской воды составляет -1,91°С. Когда морская вода замерзает, лед представляет собой чистую воду —> соли остаются, делая окружающую воду более соленой и плотной. Эта более плотная вода тонет. Когда морская вода испаряется, испаряется только вода, оставляя после себя соли —> более соленая вода —> более плотная —> тонет.
Эти растворенные твердые вещества действуют как антифриз. Он снижает точку замерзания. Температура замерзания морской воды составляет -1,91°С. Когда морская вода замерзает, лед представляет собой чистую воду —> соли остаются, делая окружающую воду более соленой и плотной. Эта более плотная вода тонет. Когда морская вода испаряется, испаряется только вода, оставляя после себя соли —> более соленая вода —> более плотная —> тонет.
Существует обратная зависимость между температурой и соленостью. При понижении температуры увеличивается соленость и, следовательно, увеличивается плотность. Это означает, что холодная морская вода более плотная, чем теплая морская вода.
Вода уникальна тем, что расширяется при замерзании, в результате чего она становится легче/менее плотной как твердое тело. Вот почему лед плавает — если бы этого не произошло, водоемы замерзли бы снизу вверх, и в конце концов в океане не было бы жизни!
***Обратите внимание, что две пробы воды могут иметь одинаковую плотность при различных сочетаниях температуры и солености***
Интересно Соленость: (помните, большая часть морской воды составляет 3,5%)
Красное море = 4%
Балтийское море = 0,7%
Мертвое море = 15-30%
Соленость сильно влияет на то, какие типы организмов способны там жить.


 Температура же в процессе замерзания или при кипении остается неизменной.
Температура же в процессе замерзания или при кипении остается неизменной.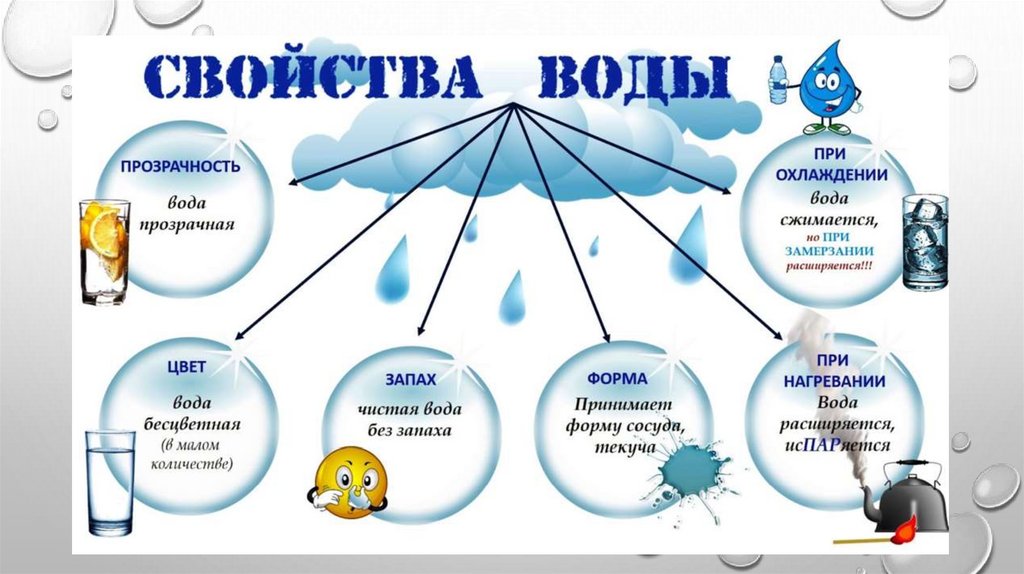 Чем крупнее животное, тем глубже от него след, следовательно, тем большее давление оно оказывает на снег. Следы собаки более глубокие, чем следы её щенков. Мыши, ласки оставляет неглубокие чёрточки. Природа снабдила копытных животных способностью раздвигать копыта и увеличивать площадь опоры. Это помогает им зимой при передвижение по заснеженному лесу и полям не так глубоко погружаться в снег.
Чем крупнее животное, тем глубже от него след, следовательно, тем большее давление оно оказывает на снег. Следы собаки более глубокие, чем следы её щенков. Мыши, ласки оставляет неглубокие чёрточки. Природа снабдила копытных животных способностью раздвигать копыта и увеличивать площадь опоры. Это помогает им зимой при передвижение по заснеженному лесу и полям не так глубоко погружаться в снег.