Удивительные свойства воды – краткое описание опыта (физика 7 класс)
4.2
Средняя оценка: 4.2
Всего получено оценок: 120.
Обновлено 10 Августа, 2021
4.2
Средняя оценка: 4.2
Всего получено оценок: 120.
Обновлено 10 Августа, 2021
Из курса физики 7 класса известно, что вода — это вещество, имеющее исключительно важное значение для Земли. Облик нашей планеты и сама жизнь на ней определяется наличием воды во всех трёх агрегатных состояниях. Поговорим об удивительных свойствах воды, позволивших ей стать настолько важной для нашего существования.
Молекула воды
Молекула воды — это соединение двух атомов водорода с одним атомом кислорода. В электронной оболочке атома водорода один электрон, а во внешней оболочке атома кислорода — шесть электронов. Двум атомам водорода «энергетически выгодно» объединить свои оболочки с атомом кислорода, в результате чего образуется общая восьмиэлектронная оболочка.
За счёт большой разницы зарядов ядер, электроны в этой оболочке распределены неравномерно.
Несимметричность распределения заряда (говорят «полярность» молекулы) обуславливает способность воды образовывать межмолекулярные связи (называемые водородными). В результате у воды появляется ряд интересных свойств.
Свойства воды
Важнейшее свойство воды — способность растворять многие вещества. Молекулы веществ, попадая в раствор, окружаются полярными молекулами воды, которые препятствуют возвращению молекул в исходное тело, вещество начинает растворяться. В растворе молекулы веществ получается более «свободными», в результате становятся возможными многие химические реакции, которые не происходят между твёрдыми веществами.
Лимонная кислота и пищевая сода не реагируют друг с другом в виде порошков. Однако стоит залить смесь порошков водой — начнётся бурная реакция.
Более странное свойство демонстрирует вода при затвердевании. Из опыта все знают, что лёд плавает на поверхности воды, хотя большинство веществ в твёрдом состоянии увеличивают плотность. Следовательно, плотность льда меньше. Почему?
Дело опять в образовании водородных связей. При образовании льда молекулы воды образуют водородные связи и выстраиваются в «ажурную» структуру. Плотность льда оказывается меньше плотности воды.
Рис. 2. Молекулы льда и воды.Не менее удивительны тепловые свойства воды. Они также определяются водородными связями. На их построение и разрыв требуется дополнительная энергия, поэтому вода обладает аномально высокой теплоёмкостью и теплотой парообразования.
Значение воды для жизни
Комплекс свойств воды делает её незаменимой для существования жизни на Земле. Фактически живые существа являются «растворами», содержащимися в клетках-«пробирках» из белковых оболочек. В каждой «пробирке» идёт множество биохимических реакций при непосредственном участии воды.
Растения в процессе фотосинтеза из углекислого газа и воды синтезируют глюкозу и выделяют кислород. Однако атомы кислорода, выделяемые растениями, изначально входят в молекулы воды. Атомы кислорода, входящие в поглощённую молекулу углекислого газа, переходят в молекулы глюкозы и усваиваются растениями.
Рис. 3. Фотосинтез.Что мы узнали?
Молекула воды состоит из атома кислорода и двух атомов водорода и способна к образованию связей, называемых водородными. Это в свою очередь определяет способность воды растворять другие вещества, иметь высокую теплоёмкость и малую плотность в твёрдом состоянии. Кроме того, без воды невозможна жизнь.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 120.
А какая ваша оценка?
XVI Международный конкурс научно-исследовательских и творческих работ учащихся Старт в науке.
 Летняя площадка 2022
Летняя площадка 2022- Авторы
- Руководители
- Файлы работы
- Наградные документы
1МБОУ «Средняя общеобразовательная школа № 15 г. Калуги»
Андреева Ю.В. 11МБОУ «Средняя общеобразовательная школа №15 г.Калуги»
Автор работы награжден дипломом победителя III степени
Диплом школьникаСвидетельство руководителя
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
Введение
Среди всего многообразия веществ есть одно, без которого невозможно обойтись: у него нет вкуса, нет цвета, нет запаха, но мы всегда остро ощущаем, когда этого вещества нет. Без него человек может прожить не более 10 дней, но 80 % болезней связано с качеством этого вещества. Это вещество –
Мне стало интересно узнать об этой жидкости, о её физических свойствах и я решил их изучить, проделав некоторые опыты, которые мне захотелось провести дома, зафиксировать их на видео, а затем показать их друзьям и тем самым удивить одноклассников.
Актуальность темы исследования: обусловлена обобщением накопленного опыта и продвижением знаний по основному вопросу между одноклассниками, а также проведением увлекательного и познавательного занятия в домашних условиях, которое поможет мне познакомиться с удивительными свойствами самой простой воды
Объект исследования: вода как физическое явление.Предмет исследования: физическиесвойства воды.
Цель: изучить особенности свойств воды и возможность их использования в жизни человека.
Задачи:
Изучить физические свойства воды
Провести опыты с водой
Сделать выводы на основе полученных данных
Защитить проект в классе
Показать одноклассникам видеоролик с практической частью
Гипотеза:
Жизнь без воды невозможна.
Ввода – уникальное вещество на планете, которое имеет множество физических и химических свойств и в котором нуждается всё живое. Проведение самых простых опытов в домашних условиях, позволит доказать, насколько удивительны свойства самой простой воды.
В своей работе я использовал следующие методы исследования:
Методы эмпирического уровня:
фотографирование и видеосъемкапроводимых в домашних условиях опытов. Необходимо зафиксировать опыты на фото и видео, чтобы в дальнейшем продемонстрировать собранный материал своим одноклассникам.
Методы экспериментально-теоретического уровня:
анализ – используется для описания выводов.
Методы теоретического уровня: изучение теоретических материалов и обобщение среди одноклассников.
Практическая значимость моей работы состоит в том, что она может быть использована школьниками для повышения образовательного уровня, а учителем физики для объяснения тем и проведения занимательного урока по данному материалу.
1. Теоретические сведения о воде.
1.1. Применение воды в жизни человека
Главный потребитель воды на Земле — это человек. Не случайно все мировые цивилизации формировались и развивались исключительно вблизи водоемов. Значение же воды в жизни человека просто огромное.
Тело человека тоже состоит из воды. В теле новорожденного — до 75% воды, в теле пожилого человека — более 50%. При этом известно, что без воды человек не выживет. Так, когда у нас исчезает хотя бы 2% воды из организма, начинается мучительная жажда. При потере более 12% воды человеку уже не восстановится без помощи врачей. А потеряв 20% воды из организма, человек умирает.
 Благодаря наличию воды наш организм может регулировать температуру тела. Вода также позволяет перерабатывать пищу в энергию, помогает клеткам усваивать питательные вещества. А еще вода выводит шлаки и отходы из нашего тела.
Благодаря наличию воды наш организм может регулировать температуру тела. Вода также позволяет перерабатывать пищу в энергию, помогает клеткам усваивать питательные вещества. А еще вода выводит шлаки и отходы из нашего тела.
Человек повсеместно использует воду для своих нужд: для питания, в сельском хозяйстве, для различного производства, для выработки электроэнергии. Неудивительно, что борьба за водные ресурсы идет нешуточная.
1.2. Физические свойства воды.
Вода — единственное вещество, существующее на Земле одновременно в трех агрегатных состояниях: жидком, твердом и газообразном. Она является основным компонентом морей и океанов, ледников и айсбергов, облаков и тумана.
Около 70 % поверхности Земли покрыто океанами, морями, реками и озерами — природными хранилищами воды. Из космоса толстый слой воды имеет голубой цвет, вот почему нашу планету называют голубой. Вода входит в состав всех живых организмов, а также очень многих минералов.
Вода входит в состав всех живых организмов, а также очень многих минералов.
Попробую определиться с тем, что же считается основными свойствами воды.
Получается, что когда нужно перечислить основные свойства воды, имеются в виду те свойства, которые важны для всех живых существ. Можно сказать, для жизни в целом.
Многие свойства воды аномальны, это вызвано особенностями строения молекулы воды. Формула воды — Н2О (предложена в 1805 г Гумбольдтом и Гей-Люсаком), т.е. состоит из 1 атома кислорода и 2-х атомов водорода. Молекула воды обладает угловым строением, ядра которого образуют равнобедренный треугольник. В основании этого треугольника находятся два протона — ядра атомов водорода, а вершиной является ядро атома кислорода. (Приложение 1)
1) Молекулы воды осуществляют переходы из одного состояния в другое. Переходы сопровождаются выделением или поглощением энергии.
2) При нормальном давлении температура плавления льда и замерзания воды равна 0°С. При повышении давления лед плавится при отрицательных температурах.
3) С увеличением солености понижается температура замерзания воды.
4) Плотность воды в твердом состоянии меньше, чем в жидком. Следовательно, лед образуется на поверхности водоемов и не опускается на дно.
5) В диапазоне температуры воды от 0 до 4°С плотность воды не уменьшается, а увеличивается. Это аномальное свойство воды, вследствие которого образуется лед и водоемы не промерзают, потому что при температуре воды менее 4°С пресная вода становится менее плотной.
6) Аномальное изменение плотности приводит к аномальному изменению объёма воды. С увеличением температуры от 0 до 4°С объём химически чистой воды уменьшается; лишь при дальнейшем увеличении температуры объём увеличивается. Объём льда всегда больше объема воды. Примеры в природе — морозное выветривание, образование наледей, бугров бучения и т.д.
Объём льда всегда больше объема воды. Примеры в природе — морозное выветривание, образование наледей, бугров бучения и т.д.
7) Высокая удельная теплоемкость воды, что ведет к регулированию тепловых процессов на всей планете.
8) Очень малая теплопроводность. При понижении температуры и давления понижается и теплопроводность. С понижением температуры и понижением плотности уменьшается теплопроводность. Поэтому происходит медленный нагрев и охлаждение водной массы. Проявляется это свойство в том, что снег предохраняет почву от промерзания, а лед — водоемы от промерзания.
9) Вязкость воды невелика, поэтому вода подвижна. При увеличении температуры вязкость уменьшается, поэтому в холодное время года вязкость воды больше, чем в теплое.
10) Очень высокое поверхностное натяжение.
11) Свет частично поглощается и преломляется, поэтому проникает лишь на небольшую глубину. Именно здесь протекает фотосинтез.
Именно здесь протекает фотосинтез.
12) Вода хорошо проводит звук (в 4-5 раз больше, чем в воздухе). Скорость звука увеличивается при повышении температуры воды, солености и давления.
13) Низкая электропроводность, которая увеличивается при повышении минерализации количества ионов хлора и калия.
14) Вода является универсальным растворителем.
1.3. Интересные факты о воде.
Вот всего лишь несколько фактов:
— Самая чистая вода по данным ЮНЕСКО находится в Финляндии. Всего в исследовании свежей природной воды принимало участие 122 страны. При этом 1 млрд. людей по всему миру вообще не имеет доступа к безопасной воде.
— С помощью воды можно бороться с лишним весом. Употребляя из напитков только воду, можно резко снизить общую калорийность рациона. Во-первых, потому, что человек прекращает пить калорийные сладкие газировки и соки, во-вторых, потому, что после воды меньше тянет взять сладостей, как в случае с чаем или кофе
— Вода помогает снизить вероятность сердечного приступа. Во время исследований ученые выяснили, что те люди, которые пьют около шести стаканов воды в день, меньше подвержены риску сердечного удара в отличие от тех, кто выпивает всего два стакана.
Во время исследований ученые выяснили, что те люди, которые пьют около шести стаканов воды в день, меньше подвержены риску сердечного удара в отличие от тех, кто выпивает всего два стакана.
— Без воды человек может прожить очень не долго. Без еды человек может прожить около шести недель, а без воды – пять-семь суток. За всю свою жизнь человек выпивает примерно 35 т воды.
— Самая дорогая в мире вода продается в Лос-Анджелесе. Производители упаковывают драгоценную жидкость со сбалансированным вкусом и значением ph в бутылки со стразами «Swarovski». Стоит такая вода 90 $ за 1 л.
— Существует и опасная вода. Так, например, в Азербайджане есть вода, в которой много метана, поэтому она может загореться, если поднести к ней спичку. А в Сицилии в одном из озер есть подводные источники кислоты, которые отравляют всю воду в этом водоеме.
— Морская вода – весьма питательная субстанция. В 1 куб. см такой воды содержится 1.5 г белка и других веществ.
В 1 куб. см такой воды содержится 1.5 г белка и других веществ.
2. Практическая часть.
2.1. Мои исследования, анализ результатов.
В практической части мной было проведено несколько опытов, наглядно показывающих физические свойства воды.
Исследования на основе свойства плотности воды:
«Плавающее яйцо»
Что потребуется?
Одно сырое яйцо, вода, соль, высокий стакан
Инструкция
Наливаю половину стакана воды. Опускаю яйцо в обычную пресную воду, и яйцо опускается на дно. Затем добавляю большое количестве соли (около 6 столовых ложек) и перемешиваю. Аккуратно опускаю яйцо в соленую воду и смотрю, что происходит.
Что происходит?
Когда я опускаю яйцо в жидкость, оно плавает на поверхности и не опускается на дно. Соленая вода более плотная, чем обычная водопроводная вода, чем плотнее жидкость, тем легче плавать телу, погруженному в неё. Таким образом, можно сделать простой вывод: тела тонут в жидкости, если их плотность выше, чем плотность жидкости
Соленая вода более плотная, чем обычная водопроводная вода, чем плотнее жидкость, тем легче плавать телу, погруженному в неё. Таким образом, можно сделать простой вывод: тела тонут в жидкости, если их плотность выше, чем плотность жидкости
«Утонувший лёд»
Что потребуется?
Стакан с водой, кубик льда, подсолнечное масло
Инструкция
Беру стакан с водой и опускаю в него кубик льда. Лёд оказался на поверхности воды. Затем я наливаю в этот стакан немного подсолнечного масла, и лёд оказался между слоем воды и слоем масла.
Что происходит?
Вещества с меньшей плотностью плавают на поверхности более плотных веществ. Растительное масло остается на поверхности воды, потому что плотность масла меньше плотности воды.
Исследование, основанное на свойстве теплопроводности воды:
«Свеча и шарик»
Что потребуется?
Шарик, свеча, вода.
Инструкция
Что произойдёт с надутым шариком, если его поднести к зажжённой свечке? Конечно, он лопнет! А теперь наливаю в шарик немного воды и подношу его к свечке – шарик выдерживает огонь.
Что происходит?
Вода в шарике забирает тепло свечки, не дает стенкам шарика расплавиться, и шарик останется целым. Но долго так держать не получится.
Исследования, основанные на свойствах натяжения воды и давления:
«Скрепка на воде»
Что потребуется?
Канцелярские скрепки, два стакана с водой, пинцет.
Инструкция
Сначала просто опускаю скрепку в стакан с водой, вижу, что она утонула. Затем, с помощью пинцета, кладу аккуратно скрепку на поверхность воды и скрепка осталась на поверхности.
Что происходит?
Благодаря молекулам воды, которые очень близко расположены друг к другу, вода образует пленку, которая может удерживать предметы.
«Шарик в банке»
Что потребуется?
Стеклянная банка, шарик, вода.
Инструкция
Беру банку, наливаю в неё горячую воду и жду 2-3 минуты, чтобы стенки банки хорошо прогрелись. Воду выливаю и на горлышко банки помещаю надутый шарик с небольшим количеством воды внутри, так, чтобы он был больше объёма горлышка банки.
Что происходит?
Стенки банки начинают отдавать тепло воздуху внутри банки, а перекрыв горлышко шариком, я создал разницу давления внутри и снаружи банки. За счет этого шарик и втягивается в банку.
Исследования, основанные на капиллярном свойстве и текучести воды:
«Цветы на воде»
Что потребуется?
Цветная бумага, ножницы, широкая емкость с водой
Инструкция
Вырезаю из бумаги квадраты примерно 10 см х 10 см. Складываю их пополам дважды и вырезаю лепестки, чтобы получились цветы. Помещаю цветки в посуду, наполненную водой.
Складываю их пополам дважды и вырезаю лепестки, чтобы получились цветы. Помещаю цветки в посуду, наполненную водой.
Что происходит?
Цветы раскрываются. Всё дело в волокнах, из которых состоит бумага. Бумажные волокна поглощают воду, они набухают и стремятся выпрямиться, при этом лепестки раскрываются.
«Перемещение воды»
Что потребуется?
3 стакана, вода, краситель, бумажные салфетки.
Инструкция
Беру 3 стакана, в два из них наливаю воду и добавляю цветной краситель. Из бумажной салфетки сделаем 2 жгута и поместим одним концом в цветную воду, а другим в пустой стакан.
Что происходит?
Через некоторое время по бумажному жгуту вода поднимается вверх и переливается в соседний стакан, цвета воды смешиваются. Между волокнами бумаги есть промежутки и по ним вода поднимается вверх. Чем тоньше капилляры, тем выше вода может по ним подняться.
Между волокнами бумаги есть промежутки и по ним вода поднимается вверх. Чем тоньше капилляры, тем выше вода может по ним подняться.
ЗАКЛЮЧЕНИЕ.
«Что такое вода?» – вопрос далеко не простой.
Вода – это важный источник энергоресурсов, это вещество, которое создало нашу планету, и наша жизнь без нее невозможна!
При выполнении своей исследовательской работы, я ещё раз убедился в том, что вода — одно из самых удивительных веществ в природе. Без воды не может жить человек, животные, растения.
На основании проведённых опытов, мною было выяснено, какими основными свойствами она обладает.
• Вода — прозрачная жидкость, не имеющая вкуса, цвета и запаха.
• Она принимает форму того сосуда, в который ее помещают.
• Вода – универсальный растворитель.
• Вода текуча и перемещается из одного сосуда в другой.
• Вода имеет поверхностное натяжение.
• Вода обладает хорошей теплопроводностью.
• Вода может замерзнуть за секунду
• Вода расширяется при замерзании.
Плотность воды может быть разной.
Цели и задачи, поставленные мной в начале исследовательской работы, были достигнуты.
Гипотеза была доказана. Проведение опытов – это очень увлекательное и познавательное занятие, которое помогло мне познакомиться с удивительными свойствами самой простой воды. Думаю, что знания, которые я приобрел, работая над проектом, пригодятся мне не только на уроках физики, но и в повседневной жизни.
СПИСОК ЛИТЕРАТУРЫ
1. Википедия (свободная энциклопедия) – [электронный ресурс]
https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B4%D0%B0
https://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B4%D0%B0#%D0%A4%D0%B8%D0%B7%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5_%D1%81%D0%B2%D0%BE%D0%B9%D1%81%D1%82%D0%B2%D0%B0
2. http://rnto.club/biblioteka/kollektiv-rnto/Stati/voda-samij-zagadochnij-jelement-na-zemle.html
http://rnto.club/biblioteka/kollektiv-rnto/Stati/voda-samij-zagadochnij-jelement-na-zemle.html
https://www.healthwaters.ru/articles/
3. Российская электронная школа (информационно-образовательная среда) – [электронный ресурс]
https://resh.edu.ru/subject/lesson/2062/main/
«Удивительная физика», Л. Г. Асламазов, А. А. Варламов, изд.: «Наука», Москва, 1988
ПРИЛОЖЕНИЯ
Приложение 1
Рис.1
Рис.2
Молекула воды
Приложение 2
«Плавающее яйцо»
«Утонувший лёд»
« Свеча и шарик»
« Скрепка на воде»
« Шарик в банке»
« Цветы на воде»
« Перемещение воды»
Просмотров работы: 723
Физика воды — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 37366
Физические свойства воды
Химические и физические свойства воды часто обсуждают вместе. Эти свойства лежат в основе многих дисциплин, таких как гидрология, экологические исследования, химическая инженерия, экологическая инженерия, гражданское строительство и т. д. Они, конечно, представляют интерес для химиков и физиков.
Эти свойства лежат в основе многих дисциплин, таких как гидрология, экологические исследования, химическая инженерия, экологическая инженерия, гражданское строительство и т. д. Они, конечно, представляют интерес для химиков и физиков.
Вот некоторые основные сведения о физических свойствах воды. Чистая жидкая вода имеет высокую теплоемкость 4,182 Дж К -1 г -1 ; это хороший проводник тепла, но плохой проводник электричества. Он является растворителем для растворения ионных и полярных веществ, но слабо взаимодействует с неполярными веществами. Поверхностное натяжение воды довольно велико, и небольшое количество воды скапливается в капли, а не растекается тонкими слоями.
Водородная связь влияет на многие физические и химические свойства, такие как необычная, но обычно известная температура замерзания 273,15 К и 373,15 К соответственно. Критические температура и давление составляют 647,3 К и 220,5 бар (22050 кПа), а критический объем = 0,056 м 9 . 0028 3 кмоль -1 .
0028 3 кмоль -1 .
Из-за множества применений воды желательны некоторые подробности о свойствах воды. Таким образом, отслеживание свойств воды представляет национальный интерес. Например, такой организацией является Американское общество инженеров-механиков (ASME). Международное сотрудничество в области исследований и обмена информацией более экономично, а для тепловых свойств создана Международная ассоциация свойств воды и пара (IAPWS). Канада является членом этой организации.
С точки зрения применения требуются изменения следующих свойств в зависимости от температуры и давления.
- Сжимаемость пара и воды в зависимости от давления при различных температурах
- Плотность воды как функция температуры
- Вязкость воды как функция температуры
- Энтальпия воды для различных термодинамических оценок
- Молярные объемы и коэффициенты расширения воды и пара в зависимости от давления и температуры
- Скорость звука в воде и паре и скорость звука в паровоздушной смеси в зависимости от температуры и давления
- Энтропия воды как функция температуры и давления
- Теплопроводность воды и пара
- Вязкость воды при любой температуре для труб и насосов
- Диэлектрическая проницаемость в зависимости от температуры и давления
- Поверхностное натяжение в зависимости от температуры и давления
- Энергия Гиббса при различной температуре и давлении
- Свойства, такие как диэлектрическая проницаемость и ионные продукты сверхкритической воды (жидкости)
- Применение сверхкритической воды: переработка пластиковых отходов, восстановление толуолдиамина, гидролиз ПЭТ (полиэтилентерефталата) и т.
 д.
д.
Мы обсудим некоторые из них, чтобы проиллюстрировать суть, но не все.
Плотность воды
| Плотность воды | ||
|---|---|---|
| Т/К | Плотность г/мл | Д 2 О |
| 273 | 0,999841 | 1.10469 |
| 274 | 0,999900 | |
| 275 | 0,999941 | |
| 276 | 0,999965 | |
| 277 | 0,999973 | 1. 1057 1057 |
| 278 | 0,999965 | 1.10562 |
| 279 | 0,999941 | |
| 280 | 0,999902 | |
| 281 | 0,999849 | |
| 282 | 0,999781 | |
| 281 | 0,999700 | |
Плотность — это масса на единицу объема. Плотность воды обычно принимается равной 1,0 г/мл или 1,000e3 кг м -3 при 277 К.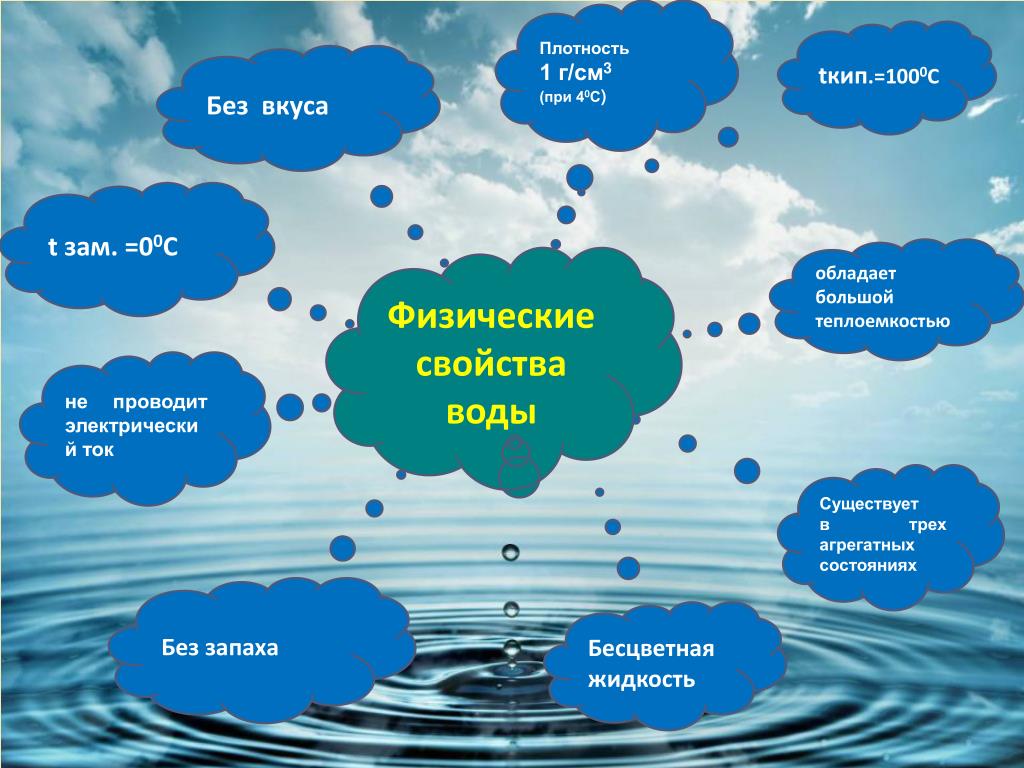 Это говорит о том, что плотность воды меняется в зависимости от температуры, а плотность воды самая высокая при 277 К, а плотность между 273 и 281 K из CRC Справочник по химии и физике приведены в таблице здесь. Эти данные рассчитаны на основе экспериментальных данных для чистой воды на основе эталона при 276,98 К. Тот же источник дает плотность обычной воды 1,000000 г/мл при 277 К.
Это говорит о том, что плотность воды меняется в зависимости от температуры, а плотность воды самая высокая при 277 К, а плотность между 273 и 281 K из CRC Справочник по химии и физике приведены в таблице здесь. Эти данные рассчитаны на основе экспериментальных данных для чистой воды на основе эталона при 276,98 К. Тот же источник дает плотность обычной воды 1,000000 г/мл при 277 К.
Объем, занимаемый одним молем вещества, называется молярным объемом . Молярный объем жидкой воды равен 18,016/, плотность . При 277 К молярный объем составляет 18,016 мл. Для жидкой воды молярные объемы жидкой воды увеличиваются до 18,03 мл как при 269 К, так и при 285 К.
Плотность льда составляет 0,917 при 273 К, а молярный объем составляет 19,65 мл, что на 9 % больше, чем молярный объем жидкости. . Таким образом, 9% кубика льда, не содержащего пузырьков воздуха, плавает над поверхностью, а 91% его находится ниже ватерлинии. Плотность делает поведение айсбергов интересным. Айсберги являются основными туристическими достопримечательностями в Ньюфаундленде и Лабрадоре, Канада.
Айсберги являются основными туристическими достопримечательностями в Ньюфаундленде и Лабрадоре, Канада.
Электрический дипольный момент и диэлектрическая проницаемость
Заряженные ионы взаимодействуют друг с другом за счет электростатического притяжения или отталкивания. Сила F между двумя заряженными частицами с зарядами q 1 и q 2 разделены расстоянием r is
q1 q2
F = ————
4 p eo r2
| 9017 0 кл д- | Na д+ |
Незаряженные молекулы все еще взаимодействуют друг с другом, но не за счет электростатического взаимодействия, а за счет электрического дипольного взаимодействия. Электрический дипольный момент представляет собой вектор из-за неравномерного распределения разноименных зарядов. В двухатомных системах величину электрического дипольного момента можно оценить как разность электроотрицательностей Полинга двух атомов. Для удобства предположим, что центры положительного и отрицательного полюсов Na-Cl разнесены на расстояние l, тогда электрический дипольный момент \(\mu\) равен
Для удобства предположим, что центры положительного и отрицательного полюсов Na-Cl разнесены на расстояние l, тогда электрический дипольный момент \(\mu\) равен
m = q l
Традиционно дипольные моменты молекул табулировались в электростатических единицах, и в этом случае заряд электрона равен 4,80e-10 esu (= (1,6e-19 Кл) (3e9 esu/C) ). В кристаллах NaCl расстояние между ионами Na и Cl составляет 240 пм. Если молекула NaCl (в газе) имеет такое же расстояние между идеализированными ионами, то дипольный момент рассчитывается ниже: 29 см. м.
или в единицах cgs-esu
м = 4,8e-10 esu * 2,40e-8 см
= 11,5e-18 esu см
В единицах cgs-esu 1e-18 esu см определяют дебаев (символ D). Таким образом, мы имеем
1 D = 1e-18 esu см
= 3,355e-30 C м (из расчета выше)
m = 11,5 D для идеализированной молекулы газа NaCl
, но
mobserved = 9 D в газе NaCl =3e -29 С м.
| Электрический дипольный момент некоторых молекул газа | |
|---|---|
| Молекула | м/Д |
| NaCl | 9,0 |
| KCl | 10,3 |
| СО | 0,1 |
| ВЧ | 1,8 |
| HCl | 1,1 |
| HBr | 0,8 |
| Н 2 О | 1,8 |
| СО 2 | 1,6 |
| Н 2 О | 0,2 |
| НХ 3 | 1,5 |
Однако экспериментальный дипольный момент = 9 D для газа NaCl. Таким образом, модель для расчета должна быть изменена для учета частичной делокализации зарядов или путем включения некоторого ковалентного характера в связь Na-Cl. В любом случае модель показывает физический метод (модель) для оценки дипольного момента. Дипольные моменты некоторых молекул газа приведены здесь в таблице.
Таким образом, модель для расчета должна быть изменена для учета частичной делокализации зарядов или путем включения некоторого ковалентного характера в связь Na-Cl. В любом случае модель показывает физический метод (модель) для оценки дипольного момента. Дипольные моменты некоторых молекул газа приведены здесь в таблице.
Дипольный момент представляет собой вектор от отрицательного заряда к положительному вдоль связи. Для трехатомных молекул, таких как молекулы воды, полный электрический дипольный момент представляет собой сумму аль-диполей для каждой связи. Экспериментальный дипольный момент для воды равен 1,8 D, что совпадает с моментом H-F. Вода — очень полярное соединение. Аммиак с тремя связями N-H имеет дипольный момент 1,5 D.
Одноатомные двухатомные молекулы, конечно, имеют нулевой дипольный момент. Так же и линейные CO 2 и CS 2 молекулы.
Высокий дипольный момент делает воду особым веществом. Вода имеет очень высокую диэлектрическую постоянную, 80. Благодаря взаимодействию дипольного заряда вода является универсальным растворителем ионных веществ, особенно одновалентных ионов. На приведенной ниже диаграмме показаны некоторые типичные ион-дипольные и диполь-дипольные взаимодействия в растворах. Растворение в воде называется гидратацией.
Благодаря взаимодействию дипольного заряда вода является универсальным растворителем ионных веществ, особенно одновалентных ионов. На приведенной ниже диаграмме показаны некоторые типичные ион-дипольные и диполь-дипольные взаимодействия в растворах. Растворение в воде называется гидратацией.
Дипольный момент как-то связан с его взаимодействием с микроволнами. «Применение георадара в гляциологии» — это веб-сайт, на котором излагается теория радиолокации и обсуждается взаимодействие радара с водой. Это также иллюстрирует применение в гляциологии.
Сверхкритическая вода, напротив, имеет низкую диэлектрическую проницаемость, что делает ее хорошим растворителем для неполярных веществ.
Пример 1
Предположим, что молекула H-F состоит из двух ионов, положительного и отрицательного. Какое расстояние разделяет эти два иона, чтобы дать дипольный момент 1,8 D?
Решение
Вспомните первую формулу из приведенного выше обсуждения дипольного момента и выполните вычисления, как показано:
м = q л
q л = 4,8е-10 е. е.с. * л
е.с. * л
= 1,8е-18 е.е.с. см.
1.8e-18 esu см
l = —————— = 0.375e-8 см (37,5 пм)
4.8e-10 esu
ОБСУЖДЕНИЕ
Каково нормальное расстояние связи HF-F? (Ответ 92 вечера).
Деление кажущейся длины связи 38 пм на наблюдаемую длину связи 92 пм дает ионный характер 38/92 = 41 % ионный характер.
Вопросы
- В пожарном или атомном электрогенераторе пар с температурой 600ºC под давлением часто используется для передачи тепла от котла к турбине. В какой фазе находится этот пар?
Решения
Авторы и авторство
Water Physics распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- хайтоп
- да
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Поверхностное натяжение и вода | Геологическая служба США
Школа водных наук 6 июня 2019 г.
Свойства воды Фотогалерея
Узнайте о свойствах воды по картинкам
Свойства воды Вопросы и ответы
Дом Школы водных наук
- Обзор
- Наука
- Мультимедиа
Поверхностное натяжение в воде может быть полезным для выполнения трюков, таких как возможность плавать на поверхности скрепки для бумаги, но поверхностное натяжение выполняет гораздо больше функций, жизненно важных для окружающей среды и людей. Узнайте все о поверхностном натяжении и воде здесь.
Узнайте все о поверхностном натяжении и воде здесь.
• Водная школа ГЛАВНАЯ • Темы свойств воды •
Поверхностное натяжение: «Свойство поверхности жидкости, которое позволяет ей сопротивляться внешней силе из-за когезивной природы ее молекул .»
Источники/использование: общественное достояние.
Кажется, что это противоречит законам физики, но стальная скрепка действительно может плавать на поверхности воды. Высокое поверхностное натяжение помогает скрепке с гораздо большей плотностью плавать на воде. Силы сцепления между молекулами жидкости ответственны за явление, известное как поверхностное натяжение. Молекулы на поверхности стакана с водой не имеют других молекул воды со всех сторон от себя и, следовательно, они сильнее связываются с теми, которые непосредственно с ними связаны (в данном случае рядом и под ними, но не над ними). Неправда, что на поверхности воды образуется «кожа»; более сильное сцепление между молекулами воды, в отличие от притяжения молекул воды к воздуху, затрудняет перемещение объекта по поверхности, чем перемещение его, когда он полностью погружен. (Источник: ГСУ).
(Источник: ГСУ).
Когезия и поверхностное натяжение
Силы сцепления между молекулами жидкости действуют совместно со всеми соседними молекулами. Те, что находятся на поверхности, не имеют соседних молекул сверху и, таким образом, проявляют более сильные силы притяжения к своим ближайшим соседям на поверхности и под ней. Поверхностное натяжение можно определить как свойство поверхности жидкости, которое позволяет ей сопротивляться внешней силе из-за когезионной природы молекул воды.
Поверхностное натяжение на молекулярном уровне
Источники/использование: общественное достояние.
Поверхностное натяжение в воде связано с тем, что молекулы воды притягиваются друг к другу, поскольку каждая молекула образует связь с соседними молекулами. Однако на поверхности, в самом внешнем слое молекул, меньше молекул, за которые можно цепляться, поэтому это компенсируется за счет установления более прочных связей со своими соседями, что приводит к образованию поверхностного натяжения.
Молекулы воды хотят цепляться друг за друга. Однако на поверхности меньше молекул воды, за которые можно цепляться, поскольку наверху находится воздух (таким образом, молекул воды нет). Это приводит к более прочной связи между теми молекулами, которые действительно соприкасаются друг с другом, и слоем прочно связанной воды (см. диаграмму). Этот поверхностный слой (удерживаемый поверхностным натяжением) создает значительный барьер между атмосферой и водой. На самом деле, кроме ртути, вода обладает самым большим поверхностным натяжением среди всех жидкостей. (Источник: Lakes of Missouri)
В теле жидкости на молекулу не действует результирующая сила, потому что все силы соседних молекул компенсируются (диаграмма). Однако для молекулы на поверхности жидкости будет действовать направленная внутрь сила, так как не будет силы притяжения, действующей сверху. Эта внутренняя результирующая сила заставляет молекулы на поверхности сжиматься и сопротивляться растяжению или разрыву. Таким образом, поверхность находится под напряжением, отсюда, вероятно, и название «поверхностное натяжение». (Источник: Фонд Вудро Вильсона).
Таким образом, поверхность находится под напряжением, отсюда, вероятно, и название «поверхностное натяжение». (Источник: Фонд Вудро Вильсона).
Из-за поверхностного натяжения мелкие объекты будут «плавать» на поверхности жидкости до тех пор, пока объект не сможет прорваться и отделить верхний слой молекул воды. Когда объект находится на поверхности жидкости, натянутая поверхность будет вести себя как эластичная мембрана.
Примеры поверхностного натяжения
Источники/Использование: Некоторое содержимое может иметь ограничения. Посетите СМИ, чтобы узнать подробности.
Водомерки могут ходить по поверхности воды благодаря сочетанию нескольких факторов. Водомерки используют высокое поверхностное натяжение воды и длинные гидрофобные ноги, чтобы оставаться над водой. Водомерки используют это поверхностное натяжение в своих интересах благодаря своим хорошо адаптированным ногам и распределенному весу. Ноги водомерки длинные и тонкие, что позволяет распределять вес тела водомерки по большой площади поверхности. Ноги сильные, но обладают гибкостью, что позволяет водомеркам равномерно распределять свой вес и двигаться вместе с движением воды. Гидрофьюжные волоски выстилают поверхность тела водомерки.
Ноги сильные, но обладают гибкостью, что позволяет водомеркам равномерно распределять свой вес и двигаться вместе с движением воды. Гидрофьюжные волоски выстилают поверхность тела водомерки.- Хождение по воде: Мелкие насекомые, такие как водомерка, могут ходить по воде, потому что их веса недостаточно, чтобы проникнуть на поверхность.
- Плавающая игла: Аккуратно расположенную маленькую иглу можно заставить плавать на поверхности воды, даже если она в несколько раз плотнее воды. Если поверхность взболтать, чтобы разрушить поверхностное натяжение, то игла быстро утонет.
- Не прикасайтесь к палатке!: Обычные материалы для палаток в какой-то степени непроницаемы для дождя, поскольку поверхностное натяжение воды закрывает поры в тонкотканом материале. Но если вы прикоснетесь к материалу палатки пальцем, вы нарушите поверхностное натяжение, и дождь будет капать.
- Клинический тест на желтуху: Нормальная моча имеет поверхностное натяжение около 66 дин/см, но если присутствует желчь (тест на желтуху), оно падает примерно до 55.
 В тесте Хея на мочу посыпают порошкообразную серу. поверхность. Он будет плавать в обычной моче, но утонет, если желчь понизит поверхностное натяжение.
В тесте Хея на мочу посыпают порошкообразную серу. поверхность. Он будет плавать в обычной моче, но утонет, если желчь понизит поверхностное натяжение. - Дезинфицирующие средства с поверхностным натяжением: Дезинфицирующие средства обычно представляют собой растворы с низким поверхностным натяжением. Это позволяет им распространяться на клеточных стенках бактерий и разрушать их.
- Мыло и моющие средства: Облегчают чистку одежды за счет снижения поверхностного натяжения воды, благодаря чему она легче впитывается в поры и загрязненные участки.
- Стирка холодной водой: Основная причина использования горячей воды для стирки заключается в том, что ее поверхностное натяжение ниже, и она является лучшим смачивающим средством. Но если моющее средство снижает поверхностное натяжение, нагрев может быть ненужным.
- Почему пузырьки круглые: Поверхностное натяжение воды обеспечивает необходимое натяжение стенки для образования пузырьков с водой.
 Стремление к минимизации напряжения стенки приводит к тому, что пузырьки принимают сферическую форму.
Стремление к минимизации напряжения стенки приводит к тому, что пузырьки принимают сферическую форму. - Поверхностное натяжение и капли: Поверхностное натяжение отвечает за форму жидких капель. Хотя капли воды легко деформируются, они стремятся принять сферическую форму за счет сил сцепления поверхностного слоя.
Источник: Университет штата Джорджия
Ниже приведены другие научные темы, связанные с поверхностным натяжением и свойствами воды.
Изображения и мультимедийные материалы , относящиеся к поверхностному натяжению и свойствам качества воды:
- Обзор
Поверхностное натяжение в воде может быть полезным для выполнения трюков, таких как возможность плавать на поверхности скрепки для бумаги, но поверхностное натяжение выполняет гораздо больше функций, которые жизненно важны для окружающей среды и людей. Узнайте все о поверхностном натяжении и воде здесь.
• Водная школа ГЛАВНАЯ • Темы свойств воды •
Поверхностное натяжение: «Свойство поверхности жидкости, которое позволяет ей сопротивляться внешней силе из-за когезивной природы ее молекул .
 »
» Источники/использование: общественное достояние.
Кажется, что это противоречит законам физики, но стальная скрепка действительно может плавать на поверхности воды. Высокое поверхностное натяжение помогает скрепке с гораздо большей плотностью плавать на воде.Силы сцепления между молекулами жидкости ответственны за явление, известное как поверхностное натяжение. Молекулы на поверхности стакана с водой не имеют других молекул воды со всех сторон от себя и, следовательно, они сильнее связываются с теми, которые непосредственно с ними связаны (в данном случае рядом и под ними, но не над ними). Неправда, что на поверхности воды образуется «кожа»; более сильное сцепление между молекулами воды, в отличие от притяжения молекул воды к воздуху, затрудняет перемещение объекта по поверхности, чем перемещение его, когда он полностью погружен. (Источник: ГСУ).
Когезия и поверхностное натяжение
Силы сцепления между молекулами жидкости действуют совместно со всеми соседними молекулами.
 Те, что находятся на поверхности, не имеют соседних молекул сверху и, таким образом, проявляют более сильные силы притяжения к своим ближайшим соседям на поверхности и под ней. Поверхностное натяжение можно определить как свойство поверхности жидкости, которое позволяет ей сопротивляться внешней силе из-за когезионной природы молекул воды.
Те, что находятся на поверхности, не имеют соседних молекул сверху и, таким образом, проявляют более сильные силы притяжения к своим ближайшим соседям на поверхности и под ней. Поверхностное натяжение можно определить как свойство поверхности жидкости, которое позволяет ей сопротивляться внешней силе из-за когезионной природы молекул воды.Поверхностное натяжение на молекулярном уровне
Источники/использование: общественное достояние.
Поверхностное натяжение в воде связано с тем, что молекулы воды притягиваются друг к другу, поскольку каждая молекула образует связь с соседними молекулами. Однако на поверхности, в самом внешнем слое молекул, меньше молекул, за которые можно цепляться, поэтому это компенсируется за счет установления более прочных связей со своими соседями, что приводит к образованию поверхностного натяжения.Молекулы воды хотят цепляться друг за друга. Однако на поверхности меньше молекул воды, за которые можно цепляться, поскольку наверху находится воздух (таким образом, молекул воды нет).
 Это приводит к более прочной связи между теми молекулами, которые действительно соприкасаются друг с другом, и слоем прочно связанной воды (см. диаграмму). Этот поверхностный слой (удерживаемый поверхностным натяжением) создает значительный барьер между атмосферой и водой. На самом деле, кроме ртути, вода обладает самым большим поверхностным натяжением среди всех жидкостей. (Источник: Lakes of Missouri)
Это приводит к более прочной связи между теми молекулами, которые действительно соприкасаются друг с другом, и слоем прочно связанной воды (см. диаграмму). Этот поверхностный слой (удерживаемый поверхностным натяжением) создает значительный барьер между атмосферой и водой. На самом деле, кроме ртути, вода обладает самым большим поверхностным натяжением среди всех жидкостей. (Источник: Lakes of Missouri) В теле жидкости на молекулу не действует результирующая сила, потому что все силы соседних молекул компенсируются (диаграмма). Однако для молекулы на поверхности жидкости будет действовать направленная внутрь сила, так как не будет силы притяжения, действующей сверху. Эта внутренняя результирующая сила заставляет молекулы на поверхности сжиматься и сопротивляться растяжению или разрыву. Таким образом, поверхность находится под напряжением, отсюда, вероятно, и название «поверхностное натяжение». (Источник: Фонд Вудро Вильсона).
Из-за поверхностного натяжения мелкие объекты будут «плавать» на поверхности жидкости до тех пор, пока объект не сможет прорваться и отделить верхний слой молекул воды.
 Когда объект находится на поверхности жидкости, натянутая поверхность будет вести себя как эластичная мембрана.
Когда объект находится на поверхности жидкости, натянутая поверхность будет вести себя как эластичная мембрана.Примеры поверхностного натяжения
Источники/Использование: Некоторое содержимое может иметь ограничения. Посетите СМИ, чтобы узнать подробности.
Водомерки могут ходить по поверхности воды благодаря сочетанию нескольких факторов. Водомерки используют высокое поверхностное натяжение воды и длинные гидрофобные ноги, чтобы оставаться над водой. Водомерки используют это поверхностное натяжение в своих интересах благодаря своим хорошо адаптированным ногам и распределенному весу. Ноги водомерки длинные и тонкие, что позволяет распределять вес тела водомерки по большой площади поверхности. Ноги сильные, но обладают гибкостью, что позволяет водомеркам равномерно распределять свой вес и двигаться вместе с движением воды. Гидрофьюжные волоски выстилают поверхность тела водомерки.- Хождение по воде: Мелкие насекомые, такие как водомерка, могут ходить по воде, потому что их веса недостаточно, чтобы проникнуть на поверхность.

- Плавающая игла: Аккуратно расположенную маленькую иглу можно заставить плавать на поверхности воды, даже если она в несколько раз плотнее воды. Если поверхность взболтать, чтобы разрушить поверхностное натяжение, то игла быстро утонет.
- Не прикасайтесь к палатке!: Обычные материалы для палаток в какой-то степени непроницаемы для дождя, поскольку поверхностное натяжение воды закрывает поры в тонкотканом материале. Но если вы прикоснетесь к материалу палатки пальцем, вы нарушите поверхностное натяжение, и дождь будет капать.
- Клинический тест на желтуху: Нормальная моча имеет поверхностное натяжение около 66 дин/см, но если присутствует желчь (тест на желтуху), оно падает примерно до 55. В тесте Хея на мочу посыпают порошкообразную серу. поверхность. Он будет плавать в обычной моче, но утонет, если желчь понизит поверхностное натяжение.
- Дезинфицирующие средства с поверхностным натяжением: Дезинфицирующие средства обычно представляют собой растворы с низким поверхностным натяжением.
 Это позволяет им распространяться на клеточных стенках бактерий и разрушать их.
Это позволяет им распространяться на клеточных стенках бактерий и разрушать их. - Мыло и моющие средства: Облегчают чистку одежды за счет снижения поверхностного натяжения воды, благодаря чему она легче впитывается в поры и загрязненные участки.
- Стирка холодной водой: Основная причина использования горячей воды для стирки заключается в том, что ее поверхностное натяжение ниже, и она является лучшим смачивающим средством. Но если моющее средство снижает поверхностное натяжение, нагрев может быть ненужным.
- Почему пузырьки круглые: Поверхностное натяжение воды обеспечивает необходимое натяжение стенки для образования пузырьков с водой. Стремление к минимизации напряжения стенки приводит к тому, что пузырьки принимают сферическую форму.
- Поверхностное натяжение и капли: Поверхностное натяжение отвечает за форму жидких капель. Хотя капли воды легко деформируются, они стремятся принять сферическую форму за счет сил сцепления поверхностного слоя.

- Хождение по воде: Мелкие насекомые, такие как водомерка, могут ходить по воде, потому что их веса недостаточно, чтобы проникнуть на поверхность.
 д.
д.
 В тесте Хея на мочу посыпают порошкообразную серу. поверхность. Он будет плавать в обычной моче, но утонет, если желчь понизит поверхностное натяжение.
В тесте Хея на мочу посыпают порошкообразную серу. поверхность. Он будет плавать в обычной моче, но утонет, если желчь понизит поверхностное натяжение. Стремление к минимизации напряжения стенки приводит к тому, что пузырьки принимают сферическую форму.
Стремление к минимизации напряжения стенки приводит к тому, что пузырьки принимают сферическую форму. »
»  Те, что находятся на поверхности, не имеют соседних молекул сверху и, таким образом, проявляют более сильные силы притяжения к своим ближайшим соседям на поверхности и под ней. Поверхностное натяжение можно определить как свойство поверхности жидкости, которое позволяет ей сопротивляться внешней силе из-за когезионной природы молекул воды.
Те, что находятся на поверхности, не имеют соседних молекул сверху и, таким образом, проявляют более сильные силы притяжения к своим ближайшим соседям на поверхности и под ней. Поверхностное натяжение можно определить как свойство поверхности жидкости, которое позволяет ей сопротивляться внешней силе из-за когезионной природы молекул воды. Это приводит к более прочной связи между теми молекулами, которые действительно соприкасаются друг с другом, и слоем прочно связанной воды (см. диаграмму). Этот поверхностный слой (удерживаемый поверхностным натяжением) создает значительный барьер между атмосферой и водой. На самом деле, кроме ртути, вода обладает самым большим поверхностным натяжением среди всех жидкостей. (Источник: Lakes of Missouri)
Это приводит к более прочной связи между теми молекулами, которые действительно соприкасаются друг с другом, и слоем прочно связанной воды (см. диаграмму). Этот поверхностный слой (удерживаемый поверхностным натяжением) создает значительный барьер между атмосферой и водой. На самом деле, кроме ртути, вода обладает самым большим поверхностным натяжением среди всех жидкостей. (Источник: Lakes of Missouri)  Когда объект находится на поверхности жидкости, натянутая поверхность будет вести себя как эластичная мембрана.
Когда объект находится на поверхности жидкости, натянутая поверхность будет вести себя как эластичная мембрана.
 Это позволяет им распространяться на клеточных стенках бактерий и разрушать их.
Это позволяет им распространяться на клеточных стенках бактерий и разрушать их.