T-клеточный иммунитет. |
Т-клеточный иммунитет – это реакция в иммунной системе организма, посредством которой иммунная система распознаёт чужеродного захватчика, называемого антигеном, и реагирует, разрушая его. Есть два типа белых кровяных клеток: B-клетки и T-клетки. Для разрушения антигенов Т-клеточный иммунитет использует лейкоциты или лимфоциты, называемые Т-клетками или Т-лимфоцитами. Этот конкретный иммунный ответ отличается от других иммунных ответов, таких как белковый ответ системы или использование организмом фагоцитов для поедания инородных тел, хотя эти элементы принимают участие в акте иммунитета Т-клеток.
В организме работают несколько типов Т-клеток: Т-клетки-помощники, Т-клетки-киллеры, Т-клетки-супрессоры и Т-клетки памяти. Хотя Т-клетки, как и другие лимфоциты, образуются в костном мозге в организме, Т-клетки перемещаются в тимус после их развития. Эта функция также даёт ей название «Т-клетка».
Т-клеточный иммунитет требует вызова других компонентов иммунной системы, начиная с процесса, называемого презентацией антигена. Во-первых, фагоцит, такой как макрофаги, захватывает и пожирает захватчика. Затем он перемещается к лимфатическому узлу, чтобы передать информацию о захватчике в Т-клетку-помощник, представив кусочки антигена на её поверхности. Рецепторы каждого хелпера Т-клетки распознают только один тип антигена, поэтому фагоцит должен найти подходящую Т-клетку-хелпер, чтобы распознать антиген и вызвать ответ. Когда Т-клетка, наконец, распознаёт антиген, она начинает делиться и создавать белки, называемые цитокинами, чтобы уведомить остальную часть иммунной системы – Т-клетки-киллеры и В-клетки – о продолжении иммунного ответа.
Т-клетки-убийцы также известны как цитотоксические Т-лимфоциты. Как следует из их названия, они реагируют, нападая и убивая зараженные клетки, которые остались бы незамеченными для других компонентов иммунной системы. Её рецепторы инспектируют каждую соседнюю клетку и, таким образом, атакуют любую клетку с признаками инфекции, используя фермент, который в конечном итоге убивает данную клетку. Типы инфекций, которые могут возникнуть в клетке, и, следовательно, реакция от Т-клетки-убийцы – включают вирусы, бактерии и даже рак.
Как только к антигену обращаются, другие Т-клетки начинают действовать. Т-клетки-супрессоры, например, работают для предотвращения ненужного образования дополнительных Т-клеток-киллеров. Кроме того, Т-клетки памяти помнят, что специфический антиген вызывает более быстрый ответ, если захватчик когда-либо возвращается в организм.
Т-клеточный иммунитет также известен как клеточный иммунитет и сам может быть нарушен такими вирусами, как вирус иммунодефицита человека (ВИЧ). Эти типы вирусов специфически нацеливаются и убивают вспомогательные Т-клетки, чтобы сильно ослабить даже базовый иммунный ответ. Например, это действие со стороны ВИЧ заставляет организм в конечном итоге поддаваться синдрому приобретенного иммунодефицита (СПИД).
И ученые, и все остальные горят желанием узнать один из главных секретов коронавируса SARS-CoV-2: почему и у кого болезнь протекает в легкой форме или вообще без симптомов. Очевидно, что одну из главных ролей в этом играет иммунная система. Но она очень сложна и еще многое в ее работе для человечества остается загадкой, признают врачи. Новые исследования приближают нас к раскрытию некоторых тайн.
Сразу несколько команд ученых — из США, Германии, Израиля исследовали определенные типы иммунных клеток у людей, которые в своей жизни еще точно не встречались с новым коронавирусом (это подтверждается, в том числе, периодом получения биоматериала — в одном из исследований, в частности, изучали образцы донорской крови, взятые с 2015 по 2018 годы). О каких именно «бойцах» иммунной армии идет речь, какую задачу они выполняют в нашем организме и о чем могут говорить результаты новых исследований — мы разобрали свежие научные работы с иммунологом, экспертом по международному здравоохранению, кандидатом медицинских наук Николаем Крючковым.
КТО ЖИВЕТ В ИММУННОМ МИРЕ
— У человека есть два вида иммунитета, — вводит в курс дела эксперт. — Первый тип — врожденный иммунитет, неспецифический. Ему неважно, какой именно чужеродный агент (бактерия, вирус и т.д.) попал в организм. Врожденный иммунитет оперативно реагирует на все вражеское, отличающееся некими общими признаками. В этом случае нет специального этапа распознавания антигенов (то есть белков и других элементов) конкретных «непрошеных гостей».
— Еще есть адаптивный, или приобретенный, иммунитет. К его «армии бойцов» относятся в том числе широко известные иммунные клетки-лимфоциты, — продолжает Николай Крючков. — Этот тип иммунитета заточен на то, чтобы, во-первых, детально распознавать чужеродный антиген (фрагмент), когда он новый для организма. Понимать, что этот антиген является «чужим» и потенциально вредным. Также стоит задача отреагировать на него — именно на данный антиген, а не на какие-то похожие. Эту задачу выполняют так называемые эффективные (активированные) клетки. И, наконец, важно запомнить его на будущее: чтобы в случае повторной встречи с этим антигеном (инфекцией) возникал быстрый и усиленный иммунный ответ.
То есть благодаря адаптивному иммунитету наш организм имеет определенные клетки памяти, которые запоминают те или иные антигены при первой встрече с ними. Именно с помощью эффективных клеток и клеток памяти, в том числе, в крови появляются широко обсуждаемые сейчас антитела классов M и G.
КИЛЛЕРЫ И ХЕЛПЕРЫ
— Клетки-лимфоциты, важнейшие бойцы приобретенного иммунитета, бывают двух основных типов, — рассказывает иммунолог. — Есть В-лимфоциты. Изначально это неактивированные (наивные) клетки. Когда они встречаются с антигеном, вражеским агентом, то возможны два варианта. Часть В-лимфоцитов становятся активированными (их называют плазмоциты), а другая часть «превращается» в те самые клетки иммунной памяти.
Плазмоциты же синтезируют известные сейчас практически каждому, уже упомянутые антитела — иммуноглобулины M и G.
— Второй тип — Т-лимфоциты. Они делятся на два вида: хелперы («помощники») и киллеры («убийцы»). Хелперы на своей поверхности несут белок под названием CD4, поэтому их называют еще CD4+. Киллеры называются CD8+, поскольку на их поверхности есть белок CD8.

Иммунолог, эксперт по общественному здоровью и международному здравоохранению, кандидат медицинских наук Николай Крючков.
ЗАЩИТА ОТ ИНФЕКЦИЙ: НЕ ТОЛЬКО АНТИТЕЛА
— Сейчас мы все зациклились на антителах. Потому что измерить, исследовать их гораздо проще. Все надеются и мечтают иметь у себя специфические антитела к новому коронавирусу, — говорит Николай Крючков. — Между тем помимо
— В новых исследованиях изучались как раз лимфоциты типов CD4+ и CD8+, — продолжает иммунолог. — Поясню: CD8+ клетки распознают чужеродные антигены на поверхности любых собственных клеток организма. И убивают любые (но не обязательно все) поврежденные клетки в организме: инфицированные, раковые и т. д. А хелперы CD4+ взаимодействуют только со специализированными (так называемыми антигенпрезентирующими) клетками. Такие лимфоциты не уничтожают опасные микроорганизмы непосредственно, а активируются при появлении конкретного чужеродного антигена. Также хелперы CD4+ очень нужны для синтеза защитных антител.
ЧТО ВЫЯСНИЛИ УЧЕНЫЕ
В американском исследовании ученые первым делом оценили наличие особых CD4+ и CD8+ лимфоцитов у тех, кто переболел новым коронавирусом. Оказалось, что у 100% перенесших COVID-19 образовались иммунные CD4+ клетки к тем или иным антигенам (фрагментам) нового коронавируса. А специфические CD8+ лимфоциты (то есть Т-лимфоциты-киллеры) удалось обнаружить у 70% выздоровевших. В целом, полученные результаты подтвердили исходную гипотезу: эти клетки появились в достаточном количестве в момент первой встречи организма с новой инфекцией SARS-CоV-2.
Затем исследователи проверили образцы крови людей, не заражавшихся нынешним коронавирусом. Оказалось, что примерно у половины из них (60%) также есть иммунные CD4+ клетки, реагирующие на разные участки (антигены) нового коронавируса!
Немецкие ученые уточнили: у 34% не болевших «ковидом» обнаруживаются CD4+ клетки, чувствительные к наиболее активному фрагменту нынешнего коронавируса — белку-шипику (так называемому S-протеину). Это те самые выступы в «короне», с помощью которых вирус проникает в клетки человека.
— Другими словами, получается, что в крови людей, никогда ранее не сталкивавшихся с новым коронавирусом, могут находиться лимфоциты, направленные против антигенов этого самого вируса SARS-CоV-2, — поясняет иммунолог.
Как такое может быть?
Об этом читайте во второй части нашего материала
КСТАТИ
Почему коронавирус оказался гуманным к астматикам и как повлияет на аллергиков
Врач-пульмонолог, профессор РАН Кирилл Зыков объяснил, почему во время эпидемии у пациентов с бронхиальной астмой не повышается риск обострений (подробности)
ЧИТАЙТЕ ТАКЖЕ
Как отразятся на организме ингаляции с антисептиками и походы в сауну при коронавирусе
На вопросы kp.ru ответил один из ведущих экспертов по COVID-19, врач-пульмонолог, доктор медицинских наук, профессор РАН Кирилл Зыков (подробности)
Регуляторные Т-клетки — миротворцы иммунной системы
Клетки T-reg как иммунные регуляторы
Fehervari, Zoltan & Sakaguchi, Shimon
Peacekeepers of the Immune System
Scientific American. 2006. — 295(4):56-63
Регуляторные Т-клетки, существование которых было доказано совсем недавно, удерживают защитные силы организма от нападения на него самого. Манипуляции с этими клетками могут предложить новые методы лечения различных заболеваний, начиная от диабета и заканчивая отторжением органов.
Регуляторные Т-клетки: регуляторные Т-лимфоциты, Т-супрессоры (англ. regulatory T cells, suppressor T cells, Treg) — центральные регуляторы иммунного ответа. Основная их функция — контролировать силу и продолжительность иммунного ответа через регуляцию функции Т-эффекторных клеток (Т-хелперов и Т-киллеров). Эти Т-лимфоциты экспрессируют FOXP3 — транскрипционный фактор, регулирующий транскрипцию генов, ответственных за дифференцировку Т-клеток и экспрессию цитокинов и других факторов, участвующих в супрессии иммунного ответа. Поэтому эти клетки часто называют регуляторными Т-клетками FOXP3+ (англ. FOXP3+ Treg cells).
Про клетки Тreg см. также:
«Тяжелейший аутотоксикоз» — такой термин был введен около ста лет назад известным немецким врачом-бактериологом Паулем Эрлихом для описания патологического состояния, при котором иммунная система человека «атакует» его же собственные органы и ткани. Эрлих полагал, что с биологической точки зрения в аутоиммунности (еще одно введенное им определение) нет ничего абсурдного, когда она находится под строжайшим контролем. Однако медицинское сообщество не приняло столь неоднозначной идеи. В самом деле, зачем природе встраивать в организм человека механизм, способный разрушать своего носителя?
Однако врачи время от времени сталкивались с заболеваниями, которые попадали под концепцию Эрлиха. Среди них рассеянный склероз, инсулинозависимый диабет, ревматоидные артриты. Выяснилось, что у подобных больных обычно нарушена функция особых лейкоцитов, известных как CD4+-T-лимфоциты (они названы так потому, что созревают в тимусе — железе, расположенной в грудной клетке чуть выше сердца, и несут на своей поверхности молекулы гликопротеина CD4). В норме они играют роль «старших офицеров», которые отдают команду другим клеткам иммунной системы к наступлению на вторгшихся в организм врагов — болезнетворных микроорганизмов, но иногда направляют оружие против органов и тканей собственного тела.
Эрлих оказался прав и в другом: недавно идентифицированы клетки, специализирующиеся на возвращении на путь истинный вышедшей из повиновения иммунной системы. Они получили название регуляторных Т-клеток. Будучи частью популяции CD4+-T-клеток, они поддерживают мир и согласие между иммунной системой и организмом. Кроме того, выяснилось, что им свойственна не только миротворческая функция: они также влияют на реакцию иммунной системы на проникшие в организм инфекционные агенты, опухолевые клетки, трансплантированные органы, клетки плода при наступлении беременности и т. д. Если удастся выяснить, как они выполняют свои обязанности, и почему их работа иногда дает сбой, исследователи получат возможность контролировать деятельность этих регуляторов и при необходимости подавлять иммунную активность.
Ненадежная система обороны
Многих людей сегодня пугает сознание того, что иммунная система в любой момент может выйти из-под контроля и спровоцировать аутоиммунное заболевание. Неприятнее всего то, что такой «иммунологический дамоклов меч» не так уж трудно привести в действие. Например, при введении мышам белков их собственной центральной нервной системы вместе с каким-нибудь адъювантом (неспецифическим стимулятором иммуногенеза) возникает деструктивная иммунная реакция, которая в основном проявляется как рассеянный склероз, вызывающий разрушение головного и спинного мозга.
Вводя животным их собственные белки разного происхождения, можно вызвать и другие аутоиммунные реакции. Такая же опасность подстерегает и человека. По крайней мере, из крови вполне здоровых людей выделены аутореактивные клетки иммунной системы, которые в пробирке ведут себя крайне агрессивно в отношении тканей своего родного организма.
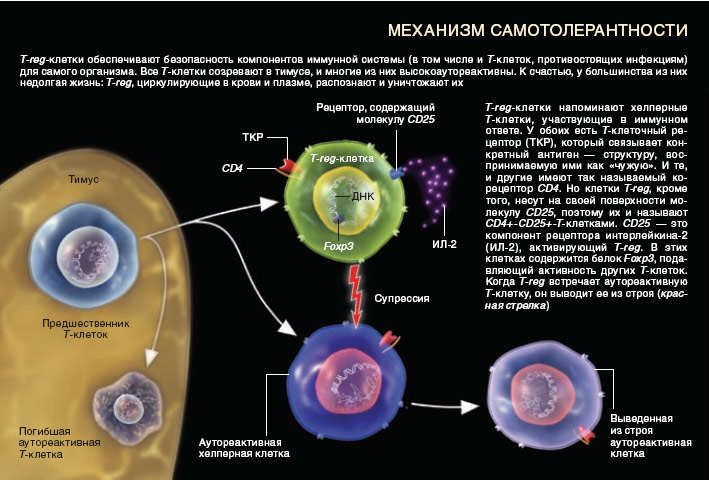
Почему же при наличии постоянной угрозы со стороны собственной иммунной системы большинство из нас не страдает аутоиммунными заболеваниями? Каким образом наша внутренняя защита отличает опасных микробов от нормальных клеток своего организма? Исследователи обнаружили, что для обеспечения самотолерантности (способности удерживать иммунную систему в рамках) принимается множество мер предосторожности. Первая линия обороны, во всяком случае, в том, что касается Т-клеток, располагается в тимусе. Здесь созревшие Т-клетки проходят серьезный «курс обучения» и настраиваются на крайне слабую реакцию на здоровые клетки организма-хозяина. Клетки, не поддающиеся «дрессировке», отбраковываются. Однако ни одна система не застрахована от ошибок, и некоторое количество аутоагресивных Т-клеток ускользает от контроля. Попадая в кровоток и лимфу, они создают угрозу запуска аутоиммунной реакции.
Кровь и лимфа представляют собой вторую линию обороны. Здесь используется несколько приемов. Некоторые ткани, в том числе головного и спинного мозга, ограждены от аутоагрессивных клеток иммунной системы тем, что к ним ведет небольшое число сосудов, уходящих вглубь этих органов. Однако такая самоизоляция не может быть полной. В силу определенных обстоятельств (например, при повреждении тканей) аутореактивные клетки все же могут проникнуть внутрь. Другие способы защиты носят упреждающий характер. Иммунные клетки, проявляющие подозрительный интерес к здоровым тканям и органам, атакуются другими компонентами иммунной системы и разрушаются или инактивируются ими.
По-видимому, среди «подразделений», участвующим в упреждающих действиях, ключевая роль принадлежит регуляторным Т-клеткам. Большинство из них (а возможно, и все) обучаются мастерству в тимусе, а затем распространяются по всему организму в виде специализированной субпопуляции Т-клеток.
История открытия регуляторных Т-клеток
В 1969 г. Ясуаки Нисидзука (Yasuaki Nishizuka) и Тэруе Сакакура (Teruyo Sakakura) из японского Центра по исследованию рака в г. Нагоя обнаружили, что удаление тимуса у новорожденных мышат женского пола приводит к серьезным последствиям — разрушению яичников. Вначале ученые предположили, что тимус секретирует гормоны, необходимые для развития и сохранения данных органов. Однако позже выяснилось, что ткани яичников у мышат, лишенных тимуса, буквально наводнены иммунными клетками, что свидетельствовало о наличии аутоиммунного заболевания, возникшего в результате выхода из строя какого-то регуляторного механизма. Стоило ввести грызунам нормальные Т-клетки, как болезнь отступала. Все указывало на то, что в популяции Т-клеток имеется система самоконтроля.
В начале 1970-х гг. аналогичные результаты в ходе опытов на взрослых крысах получил Джон Пенхейл (John Penhale) из Эдинбургского университета, а Ричард Гершон (Richard Gershon) из Йельского университета впервые предположил, что существует некая группа Т-клеток, способных подавлять иммунную реакцию, в том числе и направленную против тканей собственного организма. Гипотетические клетки были названы супрессорными, но в то время никто не мог найти объяснения их поведению (на рисунке слева изображена T-reg-клетка мыши).
Основные надежды возлагались на обнаружение особых структур на поверхности Т-клеток — маркеров, по которым супрессорные Т-клетки можно было бы отличить от других составляющих иммунной системы. Начиная с середины 1980-х гг. многие молекулы были испробованы на роль потенциального маркера. В конце концов в 1995 г. один из нас (Сакагути) обнаружил таковой — им оказалась молекула, названная CD25. Когда у мышей были удалены CD4+-T-клетки, несущие данный маркер, иммунной атаке подверглось сразу несколько органов: желудок, половые, слюнные, щитовидная и поджелудочная железы. К ним устремились лейкоциты и разрушили их.
Обзор: иммунные регуляторы
- Долгое время иммунологи не верили в существовании клеток, специализирующихся на подавлении излишней активности иммунной системы. Однако таковые действительно имеются — они получили название регуляторных Т-клеток (T-reg).
- T-reg-клетки не только подавляют аутоиммунную реакцию, но и помогают организму противостоять повторному заражению патогенными микробами, защищают от уничтожения полезные бактерии, населяющие кишечник, способствуют нормальному протеканию беременности. Однако у них есть и отрицательные свойства: они помогают раковым клеткам избежать атаки со стороны иммунной системы.
- Результаты последних исследований дают надежду на создание новых методов лечения аутоиммунных заболеваний и рака. Возможно также, что T-reg-клетки избавят пациентов, перенесших трансплантацию органов или тканей, от пожизненного приема иммуносупрессантов.
Важным подтверждением того, что мы находимся на правильном пути, стал следующий эксперимент. Мы выделили популяцию Т-клеток нормальной мыши, удалили из нее большую часть CD4+-CD25+-T-клеток, а затем оставшийся материал инъецировали грызунам с нефункционирующей иммунной системой, что привело к развитию у них аутоиммунного заболевания. Чем меньше CD4+-CD25+-T-клеток оставалось в Т-клеточной популяции, вводимой лабораторным животным, тем шире становился круг аутоиммунных расстройств, приводивших к гибели подопытных. При введении же CD4+-CD25+-T-клеток даже в небольших количествах иммунитет восстанавливался и защищал организм от саморазрушения. Иммунологи стали называть CD4+-CD25+—T-клетки регуляторными (или просто T-reg), по-видимому, желая устранить путаницу, которую вызывало определение «супрессорные».
Как работают T-reg-клетки?
Механизм подавления аутоиммунной активности клетками T-reg остается загадкой. По-видимому, они способны воздействовать на самые разные клети иммунной системы, блокируя их амплификацию и такие процессы, как секреция сигнальных молекул — цитокинов. Специалисты склонны думать также, что T-reg-клетки активируются прямым межклеточным взаимодействием. Во всем остальном картина остается неясной.
Рис.1. Механизм самотолерантности
Однако недавно сотрудники нашей лаборатории в Киотском университете, а также Александр Руденски (Alexander Rudensky) с коллегами из Вашингтонского университета и группа Фреда Рамсдела (Fred Ramsdell) из компании CellTech R&D в шт. Вашингтон независимо друг от друга получили результаты, приподнимающие завесу тайны над образованием и механизмом действия T-reg. Обнаружилось, что они содержат в необычайно большом количестве специфические молекулы под названием Foxp3, которые служат одним из факторов транскрипции, регулирующих работу определенных генов и тем самым — синтез кодируемых ими белков. Изменение экспрессии любого клеточного гена может повлиять на функционирование всей клетки. Что касается действия фактора Foxp3, то он, по-видимому, перенастраивает клеточные гены таким образом, что Т-клетки превращаются в T-reg. В действительности, введение Foxp3 в обычные Т-клетки приводит к тому, что они приобретают такую же способность к иммуносупрессии, как и исходно полноценные T-reg-клетки, образовавшиеся в тимусе. Недавно выяснилось, что мыши, относящиеся к широко используемой лабораторной линии Scurfy, синтезируют только неактивную, мутантную форму белка Foxp3, но в их организме нет и следа T-reg. Иммунная система у таких животных расшатана до предела, они страдают от множественных воспалений различных органов и рано погибают.
Имеются ли какие-либо данные о том, что человеку также необходимы T-reg-клетки? И есть ли они в нашем организме? Исследователи выяснили, что молекулярные особенности, характерные для T-reg-грызунов, присущи также некой субпопуляции Т-клеток человека. На поверхности данных клеток присутствуют молекулы CD25, а внутри содержится необычайно много белка Foxp3. Они обладают иммуносупрессивными свойствами — по крайней мере, таковы результаты опытов in vitro.
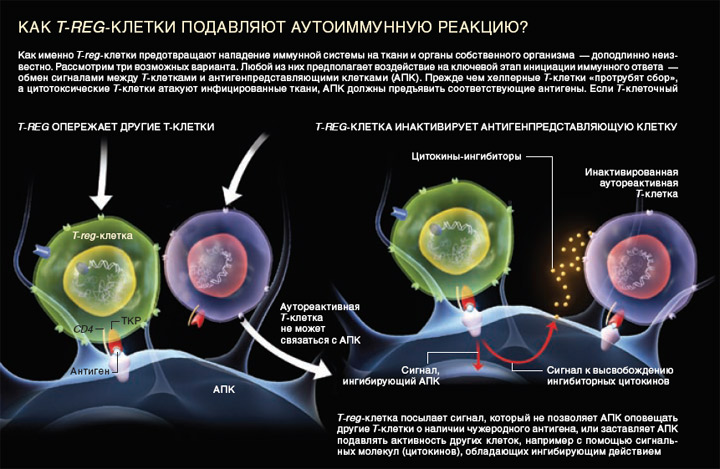
Рис. 2. Как T-reg-клетки подавляют аутоиммунную реакцию
Лучшим свидетельством того, что данные клетки жизненно важны и для нас, служит следующее наблюдение. Существует редкое генетическое заболевание под названием IPEX (Immune dysregulation, Polyendocrinopathy, Enteropathy, X-linked syndrome), которое связано с мутацией в одном из генов Х-хромосомы и поражает младенцев мужского пола (в отличие от девочек, они наследуют только одну Х-хромосому и потому не могут синтезировать вторую, нормальную копию соответствующего белка). Его следствием становится аутоиммунная реакция, влекущая за собой поражение многих органов и смерть в младенчестве. Как выяснилось недавно, данная мутация локализована в том самом гене, который кодирует белок Foxp3. Таким образом, IPEX — это аутоиммунное заболевание человека, аналогичное таковому у мышей линии Scurfy.
Не только самотолерантность
Итак, есть указания на то, что T-reg-клетки действительно предотвращают развитие аутоиммунных заболеваний у человека, однако их роль оказалась еще значительнее. Так, они принимают участие в реакции организма на проникновение микробов.
В 1990-х гг. Фиона Паури (Fiona Powrie) из DNAX, исследовательского института в Пало-Альто, шт. Калифорния, проводила эксперименты по введению популяции Т-клеток, обедненной T-reg, мышам с нефункционирующей иммунной системой. В одной из серий экспериментов у животных развилось острое воспаление кишечника. Но аберрантная иммунная реакция была направлена в первую очередь не на клетки самого органа.
В кишечнике как грызунов, так и человека присутствует множество микроорганизмов. Нередко их число превышает триллион на каждый грамм ткани. Большинство из них не только безвредны, но даже необходимы: они улучшают пищеварение и вытесняют патогенные бактерии (например, сальмонеллы), которые в противном случае заселили бы кишечник. В норме иммунная система никак не реагирует на присутствие полезных, хотя и чужеродных тел. Но у мышей, которые использовала в своих опытах Паури, все было не так. Введенные иммунные клетки атаковали не только микроорганизмы, но и стенки кишечника реципиента. Однако при инъекции клеток T-reg подобных проблем не возникало. И если бы последние вводились вместе с другими Т-клетками с самого начала, то никакого воспалительного процесса в кишечнике не возникло бы. Подводя итоги, можно сказать, что иммунная система представляет собой спусковой механизм, готовый в любую минуту атаковать микрофлору кишечника, и сдерживают ее только T-reg-клетки.
Ответ иммунной системы на болезнетворные чужеродные агенты может контролироваться аналогичным образом. С одной стороны, T-reg-клетки способны блокировать слишком сильную реакцию, с другой — предотвращать уничтожение какого-нибудь инородного тела, позволяя ему существовать в организме хозяина. Есть свидетельство того, например, что невозможность полностью уничтожить обитающую в желудке бактерию Helicobactor pilori, вызывающую язвенную болезнь, связана с «умиротворяющим» действием T-reg-клеток на иммунную систему.
Рис. 3. T-reg сама подавляет активность других T-клеток
Работы Дэвида Сакса (David Sacks) и его коллег из Национальных институтов здоровья проиллюстрировали всю сложность данной ситуации. Дело в том, что, по мнению авторов, неполное уничтожение в организме патогенов имеет положительную сторону. Был поставлен следующий опыт: мышей инфицировали безопасными для них паразитами. Даже если иммунная система животных была здорова, в их организме оставалось небольшое число микроорганизмов, и тогда повторная инфекция получала достойный отпор. Если же популяция Т-клеток была бедна клетками T-reg, то паразиты уничтожались все до одного, однако при повторном заражении иммунная реакция была столь слабой, будто организм грызунов никогда прежде с этими паразитами не встречался. T-reg-клетки, по-видимому, улучшают иммунологическую память, которая обеспечивает невосприимчивость организма к повторным заражениям и лежит в основе действия вакцин.
Есть указания и на то, что клетки T-reg способствуют нормальному (с иммунологической точки зрения) протеканию беременности, которая всегда оказывается вызовом иммунной системе. Поскольку плод наследует от матери только половину генов, а вторую получает от отца, он генетически не идентичен матери и по существу может считаться имплантированным органом. От отторжения плод защищает целый ряд механизмов, функционирующих в трофобласте (плацентарной ткани, соединяющей зародыш со стенкой матки). Трофобласт — не просто физиологический барьер для содержащихся в материнской крови веществ, вредных для плода: в нем продуцируются молекулы-иммуносупрессанты.
При беременности иммунная система будущей матери претерпевает изменения. Есть данные, что у женщин с таким аутоиммунным заболеванием, как рассеянный склероз, в период беременности T-reg-клетки проявляют большую активность. Недавно получены дополнительные данные: Александр Бетц (Alexander Betz) из Кембриджского университета обнаружил, что у беременных мышей повышено число материнских клеток T-reg. Причем у генетически модифицированных особей, не имеющих T-reg, при вынашивании потомства наблюдается массовое проникновение иммунных клеток через плацентарный барьер. Есть основания полагать, что причиной спонтанных абортов у некоторых женщин оказывается низкая активность T-reg-клеток.
Использование T-reg-клеток в медицине
Итак, T-reg-клетки являются мощным природным регулятором иммунной системы. Научившись влиять на его работу, мы сможем лечить различные заболевания. Ожидать немедленного практического внедрения подобного способа борьбы с недугами, конечно, не приходится, но имеющиеся данные позволяют надеяться, что введение в организм самих T-reg-клеток или препаратов, воздействующих на их активность, уже в скором времени сможет облегчить состояние некоторых больных.
Речь идет, прежде всего, об аутоиммунных заболеваниях. Возможно, с помощью T-reg-клеток удастся справиться также с разными видами аллергии. А легкость, с которой клетки T-reg «усмиряют» иммунную систему, предполагает, что они могут стать незаменимыми при операциях по пересадке органов.
Альтернативный метод мог бы состоять в избирательном устранении определенных компонентов из популяции T-reg-клеток для подавления нежелательной иммуносупресии и, следовательно, для усиления реакции, направленной на нужную мишень. Оптимальным было бы удаление только тех T-reg-клеток, которые блокируют специфическую иммунную реакцию. Такая стратегия может быть незаменима в борьбе с инфекционными заболеваниями, при которых иммунная система, предоставленная самой себе, часто действует не совсем адекватно, например, при туберкулезе и СПИДе.
Рис.4. Будущее трансплантологии
Уменьшение активности T-reg-клеток можно было бы использовать и при лечении онкологии. Компоненты иммунной системы, циркулируя в крови и лимфе, бдительно следят за появлением в организме клеток, превратившихся в раковые. Они распознают их по определенным морфологическим признакам и причисляют к чужеродным агентам. Мешая «патрульным» клеткам иммунной системы выполнять работу, T-reg поневоле способствуют образованию и росту опухоли. При некоторых онкологических заболеваниях пораженные клетки даже помогают в этом клеткам T-reg: они секретируют сигнальные молекулы, способные привлекать T-reg и инициировать превращение не-T-reg в T-reg. По наблюдениям некоторых врачей, у больных раком аномально высоко содержание активных T-reg-клеток как в крови, так и в самой опухоли.
Технические трудности
До сих пор не было никаких попыток создать препараты, увеличивающие или уменьшающие численность популяции T-reg-клеток непосредственно в организме человека. Любые средства, которые можно было бы использовать, должны обладать способностью влиять только на те субпопуляции T-reg-клеток, которые играют роль в развитии конкретного заболевания. Но как распознать такие клетки, специалисты пока не знают.
Таблица 1. Варианты T-reg-терапии | ||
Перечисленные здесь методы уже проходят клинические испытания или находятся на стадии подготовки. Большинство тестируемых веществ, действующих на T-reg-клетки, направлены на их уничтожение или подавление активности. Введение таких веществ в организм требует особой осторожности — при передозировке возможно развитие аутоиммунного заболевания | ||
Манипуляции с T-reg-клетками | Заболевание | Принцип действия |
Подавление активности или уничтожение (для усиления иммунной реакции) | Рак кожи (меланома), яичников, почек | Токсин присоединяют к интерлейкину-2, который обеспечивает его проникновение в T-reg-клетку. Вводят моноклональные антитела, способные уничтожать T-reg-клетки или блокировать их проникновение в опухоль |
Пролиферация в организме пациента (для подавления иммунной реакции) | Рассеянный склероз, псориаз, болезнь Крона, инсулинозависимый сахарный диабет | Готовят вакцину, содержащую компоненты Т-клеточного рецептора, с тем, чтобы стимулировать пролиферацию T-reg-клеток |
Пролиферация in vitro и введение в организм пациента | Реакция «трансплантат против хозяина» (иммунные клетки пересаженного костного мозга атакуют ткани реципиента) | Культивируют T-reg-клетки донора со специфическими антителами и факторами роста. Вводят образовавшуюся популяцию T-reg-клеток до пересадки костного мозга или во время нее (чтобы предотвратить отторжение) или при угрозе возникновения реакции «трансплантат против хозяина» |
Разработка методов, основанных на воздействии на T-reg in vitro, тоже представляет серьезную проблему. Самое трудное — получить достаточное число клеток. Несмотря на то, что некоторые T-reg-клетки могут полноценно работать, даже находясь в значительном меньшинстве относительно тех, на которые они оказывают супрессорное действие, для эффективного лечения аутоиммунного заболевания могут понадобиться десятки миллионов T-reg-клеток. Выделение такого числа этих редких элементов из крови пациента представляется невозможным. И, похоже, без разработки метода амплификации T-reg in vitro здесь не обойтись.
К счастью, проблему «больших чисел» можно решить другим способом. Различными исследовательскими группами установлено, что клетки с иммунносупрессивным действием можно создать в относительно больших количествах, обработав обычные T-клетки смесью определенных химических веществ. Идентичны ли такие клетки, названные Tr1, искомым T-reg-клеткам — пока неясно, но они несомненно обладают ярко выраженными иммуносупрессивными свойствами.
Теперь, когда специалистам известно, что Foxp3 служит ключевой молекулой, контролирующей развитие и функционирование T-reg, можно попробовать получить нужное число регуляторных клеток, используя стандартный лабораторный метод переноса гена Foxp3 в более многочисленные, а потому добываемые с меньшими трудностями Т-клетки другого типа. Сейчас над данным методом работают многие исследователи, в том числе и я. В первую очередь нас интересует, какие молекулярные процессы инициируют синтез белка Foxp3 во время развития T-reg. Может быть, разобравшись в данном вопросе, удастся создать лекарственные вещества, прием которых сделает ненужным выделение соответствующих клеток, их модификацию и введение в организм.
Что касается трансплантации органов, то здесь разрабатывается другой способ получения T-reg-клеток с нужными свойствами. Он предусматривает удаление T-regиз организма больного, которому предстоит трансплантация, и культивирование их вместе с клетками соответствующего органа донора. Цель подобной процедуры — получение T-reg-клеток с уникальными способностями подавлять отторжение. Один из нас (Сакагути) доказал, что однократного введения таких клеток во время пересадки кожи достаточно для того, чтобы трансплантированный лоскут полностью прижился. Следует также отметить, что описанная процедура оставляет в неприкосновенности иммунную систему реципиента, нисколько не снижая ее способности противостоять инфекционным и другим заболеваниям.
За последние десять лет представления о том, как работает защитная система организма, претерпели существенные изменения. В частности, стало ясно, что хотя она допускает циркуляцию в крови и лимфе потенциально аутодеструктивных Т-клеток, ею же предусмотрено образование Т-клеток, контролирующих последние. Выяснив, как появляются такие клетки-регуляторы и почему они обладают столь высокой иммуносупрессивной активностью, мы сможем использовать их для лечения многих смертельно опасных недугов. Позволяя разрушать «чужое» и строго охраняя «свое», T-reg-клетки служат настоящими миротворцами иммунной системы.
Источник: Fehervari, Zoltan & Sakaguchi, Shimon. Peacekeepers of the Immune System. Scientific American. 2006. — 295(4):56-63
По теме см. также: Развитие и поддержание регуляторных Т-клеток кишечника
Дополнительно см.:
К разделам:
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
- ПРОБИОТИКИ
- ДОМАШНИЕ ЗАКВАСКИ
- БИФИКАРДИО
- КОНЦЕНТРАТ БИФИДОБАКТЕРИЙ ЖИДКИЙ
- ПРОПИОНИКС
- ЙОДПРОПИОНИКС
- СЕЛЕНПРОПИОНИКС
- БИФИДОБАКТЕРИИ
- ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ
- ПРОБИОТИКИ И ПРЕБИОТИКИ
- СИНБИОТИКИ
- АНТИОКСИДАНТНЫЕ СВОЙСТВА
- АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ
- АНТИМУТАГЕННАЯ АКТИВНОСТЬ
- МИКРОФЛОРА КИШЕЧНОГО ТРАКТА
- МИКРОФЛОРА И ФУНКЦИИ МОЗГА
- ПРОБИОТИКИ И ХОЛЕСТЕРИН
- ПРОБИОТИКИ ПРОТИВ ОЖИРЕНИЯ
- МИКРОФЛОРА И САХАРНЫЙ ДИАБЕТ
- ПРОБИОТИКИ и ИММУНИТЕТ
- ПРОБИОТИКИ и ГРУДНЫЕ ДЕТИ
- ДИСБАКТЕРИОЗ
- МИКРОЭЛЕМЕНТНЫЙ СОСТАВ
- ПРОБИОТИКИ С ПНЖК
- ВИТАМИННЫЙ СИНТЕЗ
- АМИНОКИСЛОТНЫЙ СИНТЕЗ
- АНТИМИКРОБНЫЕ СВОЙСТВА
- СИНТЕЗ ЛЕТУЧИХ ЖИРНЫХ КИСЛОТ
- СИНТЕЗ БАКТЕРИОЦИНОВ
- ФУНКЦИОНАЛЬНОЕ ПИТАНИЕ
- АЛИМЕНТАРНЫЕ ЗАБОЛЕВАНИЯ
- ПРОБИОТИКИ ДЛЯ СПОРТСМЕНОВ
- ПРОИЗВОДСТВО ПРОБИОТИКОВ
- ЗАКВАСКИ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
- НОВОСТИ
Ниже продублирован мой предыдущий пост на эту важную тему. На днях появились новые, очень интересные данные. Об этом в следующем посте (скорее всего завтра). А пока рекомендую ознакомиться с результатами первого исследования Т-клеточного иммунитета при SARS-CoV-2 инфекции/COVID-19.
Иммунитет к любому инфекционному заболеванию есть следствие глубоко эшелонированной обороны, состоящей из множество элементов. В норме они действуют координировано, работая на единую цель – отбить «атаку агрессора». Если не вдаваться в детали, то в «иммунной обороне» есть несколько блоков.
Первый блок это, так-называемый, врождённый иммунитет (innate immunity). Особенности врождённого иммунитета – распознавание агрессоров «по-крупному», не вдаваясь в детали, быстрое реагирование и отсутствие «памяти» — это означает, что врождённый иммунитет, встретившись с агрессором, не «запоминает» его и если происходит повторная встреча, реагирует точно таким же образом как и при первой встрече. Хотя, нужно отметить, что в последнее время появились данные о существования аналога памяти и у врождённого иммунитета. Для обозначения этого феномена предложен термин «тренированный иммунитет» (trained immunity). Наши возможности избирательно влиять в нужном направлении на врождённый иммунитет пока очень ограничены.
Второй блок это, так называемый, адаптивный иммунитет (adaptive immunity). Эта линия обороны реагирует на агрессора медленнее, но зато она значительно лучше различает индивидуальность агрессоров и обладает «злопамятностью» — если агрессор попытается внедриться повторно, то «сдачи» он получит гораздо сильнее, чем при первом вторжении. По-научному, это называется иммунологической памятью . Ключевыми элементами индивидуального образа агрессора являются антигены. Именно антигены, а точнее их микроструктуры, находящиеся на поверхности, так-называемые, эпитопы, являются теми элементами, по которым адаптивная иммунная система отличает «своих» от «чужих». Когда агрессорами являются вирусы, то антигены это белки вирусов. В адаптивной иммунной системе есть две составные части. Первая, традиционно называется гуморальной («жидкостной»), в вторая – клеточной. Это исторически-укоренившиеся названия не совсем точны, поскольку первичными «игроками» и в гуморальном и в клеточном звене адаптивного иммунитета являются клетки, а «жидкостные факторы» играют роль не только в гуморальном, но и в клеточном звене иммунитета. Более точное название для гуморального иммунитета — «антительный или В-клеточный», так как ключевым «бойцом» здесь являются антитела (продукты В-клеток). А клеточный адаптивный иммунитет точнее называть «Т-клеточным», так как эффекторами этого звена являются Т-лимфоциты. В- и Т- клеточные звенья иммунитета работают не изолированно. Они взаимосвязаны. Но феномены, связанные с антительным иммунитетом, значительно проще исследовать и мы знаем о В-клеточном иммунитете значительно больше, чем о Т-клеточном. Большинство существующих вакцин работают, в основном или исключительно, стимулируя В-клеточный иммунитет. Единственный тип вакцин, который включает в иммунную защиту все типы иммунитета, это вакцины, состоящие из живых, но ослабленных (аттенуированных) возбудителей. Эти вакцины наиболее полно «имитируют» естественный инфекционный процесс. Но такие вакцины не полностью безопасны. Их пытаются заменить более безопасными «высокотехнологичными» вакцинами. Этот процесс идёт не очень быстро. Но это отдельная большая тема, в которую я сейчас углубляться не буду. Экскурс в иммунологию сделан для того, чтобы читатели-неспециалисты понимали, в самых общих чертах, что иммунная защита от инфекции, в частности, иммунная защита от SARS-CoV-2 не сводится только к антителам. Просто антительные иммунные ответы значительно легче изучать, чем Т-клеточные, а методы определения антител, в отличие от таковых для Т-клеточных иммунных ответов, относительно просты и легко коммерциализируются. Однако, без понимания роли каждого из этих двух звеньев адаптивного иммунитета попытки создание вакцины против SARS-CoV-2/COVID-19 это «блуждание в потемках». А ведь до сих пор не было ни одной научной публикации о Т-клеточном иммунитете при инфекции «новым коронавирусом»! Наконец она появилась.
В MedRxiv опубликован препринт статьи озаглавленной «Присутствие SARS-CoV-2-реактивных клеток у пациентов с COVID-19 и здоровых доноров» (оригинал здесь: https://doi.org/10.1101/2020.04.17.20061440). Не буду вдаваться в методические детали этой работы. Не специалисту с ходу в этом разобраться трудно. Остановлюсь на основных выводах:
1) Т-клетки, реагирующие на главный антиген SARS-CoV-2 (гликопротеин S), есть в крови 83% больных COVID-19. Частота обнаружения таких клеток коррелирует с тяжестью заболевания – у тяжелых больных COVID-19, таких клеток, как правило, было меньше или они отсутствовали (хотя размер выборки очень маленький). Существенной корреляции между антительным и Т-клеточным иммунными ответами у больных COVID-19 не обнаружено.
2) Т-клетки, реагирующие на гликопротеин S вируса SARS-CoV-2, обнаружены у здоровых людей, у которых нет никаких признаков инфицирования этим вирусом, ни в настоящем, ни в прошлом. Причём, реагирующие на вирус Т-клетки у больных COVID-19 и здоровых доноров «нацелены» на разные эпитопы гликопротеина S. Более того, эпитопы, с которыми реагируют Т-клетки от здоровых доноров, находятся в той части гликопротеина S, которая имеет наибольшее сходство с аналогичным белком «сезонных» коронавирусов.
Что это всё значит? Прежде всего, это только первая работа такого рода и количество исследованных случаев не слишком велико (больных исследовано – 18; здоровых доноров — 68). Работа выполнена в весьма авторитетной лаборатории, но независимо от авторитета, научные результаты должны пройти проверку на воспроизводимость. Если всё подтвердиться, то будут основания считать, что Т-клеточный иммунитет является важным, а возможно, и необходимым фактором для выздоровления. Остаётся открытым вопрос, насколько важен Т-клеточный иммунитет для поддержания пост-инфекционного иммунитета, если он конечно развивается (что пока не доказано). Методы, апробированные в данной работе, дают возможность этот вопрос изучить. Далее нужно разобраться, что означает неожиданно частая реактивность Т-клеток здоровых доноров с некоторыми эпитопами гликопротеина S. Действительно ли это связано с перекрёстной реакцией между «новым» и «старыми» сезонными коронавирусами? На уровне антительного ответа такой перекрёстной реактивности нет. Но может она есть на уровне Т-клеточных эпитопов. Если окажется, что это так, то можно будет, по крайней мере частично, объяснить индивидуальные различия в чувствительности к SARS-CoV-2, особенно, в зависимости от возраста. Ведь дети чаще взрослых болеют ОРВИ, вызванными обычными коронавирусами. Может в следствии этого они приобретают частичный иммунитет против SARS-CoV-2?
Т-лимфоциты: путешественники и домоседы
Статья на конкурс «био/мол/текст»: Клетки иммунной системы путешествуют по лимфе и кровотоку в поисках антигена, который можно распознать и начать защитную иммунную реакцию. Но значительная часть Т-лимфоцитов находится не в крови и не в лимфоузлах, а в органах, не относящихся к иммунной системе. Эта статья рассказывает, чем заняты резидентные Т-клетки тканей, как они туда попадают и какие преимущества для медицины может дать их изучение.
Обратите внимание!
Эта работа заняла первое место в номинации «Лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Адекватная защитная реакция при заражении патогенным вирусом — уничтожить зараженные клетки, не допустив распространения инфекции по организму и гибели большего числа клеток. Зараженная вирусом клетка может заметить в себе вирус и начать аутофагию либо апоптоз — или получить инструкцию для программируемой клеточной гибели от Т-киллера.
Цитотоксический Т-лимфоцит, или Т-киллер — вершина эволюции адаптивного иммунитета, ведь для распознавания фрагмента вируса (антигена) на зараженной клетке он использует Т-клеточный рецептор, случайно и независимо собирающийся на каждой Т-клетке в тимусе. Не имеющий аналогов вне адаптивной иммунной системы позвоночных механизм сборки Т-клеточного рецептора использует преимущества, полученные позвоночными при дупликациях генома в процессе эволюции и протекает с участием особых белков-рекомбиназ, когда-то заимствованных у ДНК-транспозонов (см. подробнее в статье Чудакова «Анализ индивидуальных репертуаров Т-клеточных рецепторов»).
Классическая иммунология человека построена на изучении иммунных клеток крови просто в силу того, что анализ крови можно взять у любого пациента, исследовать в норме и в патологии. Именно на клетках крови была выстроена классификация Т-лимфоцитов: деление на Т-киллеры и Т-хелперы, которые проверяют антигенную специфичность Т-киллеров, выдают им «лицензию на убийство» и способны управлять всем ходом иммунного ответа через сигнальные растворимые молекулы — цитокины. А также более позднее выделение из ветви Т-хелперов группы регуляторных Т-клеток, подавляющих избыточный адаптивный иммунитет.
Но как нам напоминает реклама йогурта, значительная часть клеток иммунной системы сосредоточена вокруг слизистой оболочки пищеварительного тракта и в других тканях. В то время как в 5–6 литрах крови взрослого человека находится около 6–15 миллиардов лимфоцитов, то число Т-клеток, находящихся в эпидермисе и коже, оценивают в 20 млрд [1], в печени взрослого мужчины — еще 4 млрд [2]. Достаточно ли изучения клеток крови для полного описания функций Т-клеток, если в периферических органах Т-клеток больше, чем в кровотоке? И достаточно ли классических субпопуляций, чтобы описать все типы Т-клеток, находящихся в организме человека?
Жизненный цикл Т-лимфоцита
Каждая Т-клетка после сборки Т-клеточного рецептора проходит тестирование на функциональность случайно собранного рецептора (положительная селекция) и отсутствие специфичности к собственным антигенам организма (отрицательная селекция), то есть на отсутствие очевидной аутоиммунной угрозы. Этапы селекции происходят в вилочковой железе, тимусе; при этом более 90% клеток-предшественников погибает, не сумев правильно собрать рецептор либо пройти селективный отбор. Выжившие Т-клетки пролиферируют и выходят из тимуса в кровоток — это наивные Т-лимфоциты, не встречавшиеся с антигеном. Наивная Т-клетка циркулирует по крови и периодически заходит в лимфоузлы, где в Т-клеточной зоне контактирует со специализированными антигенпрезентирующими клетками.
После встречи с антигеном в лимфоузле Т-клетка приобретает способность снова делиться — становится предшественницей Т-клеток памяти (TSCM, stem cell memory T cells). Cреди клона её потомков появляются клетки центральной памяти (TCM), короткоживущие эффекторные клетки, осуществляющие иммунную реакцию (SLEC или TEMRA-клетки), и эффекторные клетки-предшественники памяти TEM, в свою очередь при делении дающие TEMRA [3]. Все эти клетки выходят из лимфоузла и перемещаются по крови. Эффекторные клетки затем могут выйти из кровотока для осуществления иммунной реакции в периферической ткани органа, где находится патоген. Что потом — снова путешествие по крови и лимфоузлам?

Рисунок 1. Эмиграция эффекторной Т-клетки в ткань при вирусной инфекции. Сигналы воспаления от зараженных эпителиальных клеток при участии резидентных клеток передаются эндотелию сосудов, клетки эндотелия привлекают эффекторные Т-клетки хемокинами CXCL9, CXCL10. Роллинг: при движении по посткапиллярной венуле в ткани эффекторная клетка замедляется, образуя временные контакты между Е-селектинами и P-селектинами на клетках эндотелия. Остановка: эффекторная клетка плотно прикрепляется к эндотелию при взаимодействии LFA-1 и других альфа-интегринов с ICAM-1/VCAM-1/MAdCAM-1 (на эндотелии). Трансмиграция: эффекторная Т-клетка связывает эндотелиальный JAM-1 молекулами PECAM, CD99, LFA-1 и проникает через клетки эндотелия в подслизистую. Рисунок из [3].
Процесс трансмиграции лейкоцита.
Клетки стромы, то есть основы лимфоузла, выделяют сигнальные вещества для того, чтобы позвать Т-клетку в лимфоузел — хемокины. Распознают хемокины лимфоузлов рецепторы хоуминга CCR7 и CD62L. Но на эффекторных клетках отсутствуют оба этих рецептора. Из-за этого долгое время было загадкой, как эффекторные клетки могут попасть из периферической ткани обратно во вторичные лимфоидные органы — селезенку и лимфоузлы.
В то же время стали накапливаться данные о различиях в репертуарах мембранных маркеров и профилях транскрипции между Т-клетками памяти в крови (TEM) и Т-клетками памяти в других органах, которые никак не укладывались в концепцию постоянной миграции Т-клеток между тканями и кровью. Решено было выделить новую субпопуляцию: резидентные клетки памяти, которые населяют определенный орган и не рециркулируют — TRM-клетки [4].

Рисунок 2. Схема перехода потомков активированных Т-лимфоцитов между популяциями. Рисунок из [14].
Происхождение резидентных Т-клеток тканей
Откуда впервые появляются резидентные клетки ткани? Это потомки эффекторных клеток, которые потеряли способность рециркулировать. Некоторые периферические для иммунной системы ткани, например, слизистая тонкого кишечника, брюшная полость, — позволяют эффекторным Т-лимфоцитам проникать внутрь свободно; другие — очень ограниченно, большой поток эффекторных Т-клеток в эти ткани наблюдается только при реакции воспаления. К тканям второго типа относятся отделенные барьером от иммунной системы, к примеру, головной и спинной мозг, а также многие другие: периферические ганглии, слизистые половых органов, легкие, эпидермис, глаза. Разница между двумя типами тканей — в экспрессии дополнительных молекул хоуминга для эффекторных Т-клеток, например, молекулы адгезии для проникновения в эпителий MadCAM-1 [3].

Рисунок 3. «To home or not to home?» — сложный выбор эффекторной клетки. To home — процесс хоминга, или миграции Т-клеток, например, в наиболее привычное для наивных клеток место — лимфоузел. Альтернатива — не отправляться в путешествие по организму и превратиться в резидентную клетку ткани.
Резидентные Т-клетки в старении тканей человека
Карта соотношений присутствия отдельных субпопуляций Т-клеток в разных органах человека, как ни странно, была составлена только в 2014 году. Команда Донны Фарбер из медицинского центра Колумбийского Университета Нью-Йорка провела сравнение фенотипов Т-клеток, выделенных из крови и тканей доноров органов всех возрастных групп от 3 до 73 лет, всего по 56 донорам [5]. Анализ субпопуляций Т-клеток при помощи проточной цитофлуориметрии подтвердил многие данные, полученные методами с меньшим разрешением и меньшей статистикой, и некоторые черты описания иммунной системы, перенесенные с иммунологии мыши на человека, к примеру, снижение содержания наивных Т-лимфоцитов при старении во всех органах.
Уменьшение числа наивных Т-клеток с возрастом связано с быстрым старением тимуса (вилочковой железы), в котором будущие Т-клетки проходят этапы сборки Т-клеточного рецептора, проверку работоспособности рецептора и селекцию на отсутствие аутоиммунного потенциала. Важно не только снижение абсолютной численности наивных Т-клеток, но и уменьшение разнообразия репертуара Т-клеточных рецепторов, а значит, и возможности сформировать адаптивный иммунный ответ на ранее незнакомую инфекцию [6]. Для наивных Т-киллеров подтвердилось прогрессирующее падение численности в крови и лимфоузлах, хотя для наивных Т-хелперов отрицательная корреляция численности с возрастом в данном исследовании оказалась значительной только во вторичных лимфоидных органах, но не в крови.
Выделение Т-лимфоцитов памяти, эффекторных клеток памяти и короткоживущих эффекторных клеток из слизистых легких, тонкого и толстого кишечника, паховых и мезентериальных лимфоузлов доноров органов позволило впервые оценить динамику данных популяций в тканях человека при старении. Доля центральных клеток памяти ожидаемо растет с течением жизни, в соответствии с ростом числа инфекций, которые успели встретиться организму и попасть в библиотеку памяти иммунной системы. Растет и процент терминально дифференцированных эффекторных Т-киллеров (TEMRA), но только в лимфоузлах и в селезенке; в нелимфоидных тканях численность TEMRA падает. Эффекторные клетки памяти TEM стремительно заполняют нишу для Т-клеток в тканях ребенка, быстро, примерно к 12 годам вытесняя наивные Т-клетки. Короткоживущие терминально дифференцированные Т-киллеры чаще всего встречаются в крови, селезенке и слизистых легких в любом возрасте, а вот среди Т-хелперов эта субпопуляция представлена исчезающе малым числом клеток. Аналогично мало центральных клеток памяти среди Т-киллеров, преимущественно они находятся в слизистых двух барьерных тканей: легких и кишечника.
Широкими мазками карту распределения Т-лимфоцитов человека можно обрисовать так: наивные Т-клетки путешествуют по крови и периодически заходят во вторичные лимфоидные органы, киллеры-TEMRA находятся в крови, селезенке и легких. Для центральных клеток памяти, судя по всему, характерно более индивидуальное распределение по тканям, чем для других субпопуляций: во всяком случае, закономерностей динамики при старении разных тканей выявить не удалось. Эффекторные клетки памяти, включающие в себя и TRM субпопуляцию, доминируют среди Т-клеток слизистых барьерных тканей. В целом, при старении Т-клеточного иммунитета нелимфоидные ткани большую возрастную динамику типов Т-клеток [5]. Стабильность тканевых клеток проще объяснить, если разобраться, какие из эффекторных клеток TEM остаются в ткани, становятся резидентными TRM, и из каких событий состоит их жизнь после отказа от путешествий по организму.

Рисунок 4. Пути циркуляции Т-лимфоцитов различных субпопуляций. Tnaive — наивные Т-клетки, вместе с субпопуляцией TCM перемещаются по крови и заходят в Т-клеточную зону различных лимфоузлов, в капиллярах тканей встречаются, но в ткань не выходят (красная траектория). Эффекторные Т-клетки (голубой цвет) перемещаются по лимфе и кровотоку, при попадании в лимфоузел не заходят в Т-клеточные зоны (центр лимфоузла) — траектория лилового цвета. Резидентные Т-клетки тканей (показаны зеленым в коже и различными цветами в слизистых) перемещаются только внутри ткани — траектория зеленого цвета. Рисунок из [9], с изменениями.
Как отличить резидентные клетки тканей от примесей клеток крови?
Резидентные Т-клетки корректно, но неудобно каждый раз определять по способности индивидуальной клетки мигрировать в лимфоузлы, поэтому необходимо составить список характерных признаков, по которым можно определить принадлежность к этой субпопуляции. Резидентные Т-лимфоциты в тканях-естественных барьерах организма (например, в легких и слизистой тонкого кишечника) немного похожи на классические эффекторные клетки крови: экспрессируют маркер активированных клеток CD69, причем экспрессия стабильна в течении жизни при взрослении и старении и характерна для всех нелимфоидных тканей. Но вдобавок CD69 колокализуется с маркером CD103, который обозначает группу молекул адгезии — интегринов, способствующих прикреплению резидентной Т-клетки к эпителию и к фибробластам в подслизистой выбранного органа. Для эффекторных Т-клеток во вторичных лимфоидных органах экспрессия CD103-интегринов совершенно нехарактерна: TEM клетки постоянно сохраняют подвижный фенотип.
У карты, составленной коллективом Донны Фарбер, есть крупный недочет: неясно, насколько чисто удается выделить Т-лимфоциты из органа, какую долю анализируемых клеток на самом деле составляют Т-лимфоциты крови из капилляров внутри органа.
Особенно остро вопрос загрязнения клетками крови стоит для легких, не случайно субпопуляционный состав Т-клеток легких неожиданно похож на Т-клетки крови и лимфоузлов. Вопрос загрязнения клетками крови был изящно решен для Т-лимфоцитов мыши: подопытных мышей заражали вирусом лимфоцитарного хориоменингита после пересадки трансгенного клона Т-клеток P14, специфичного к данному вирусу. В результате при инфекции большая часть циркулирующих клеток была представлена вирус-специфичным клоном P14, и его присутствие в тканях можно было отследить иммунофлуоресценцией по P14-специфичному антителу. Перед тем, как мышей убивали, им в кровь вводили антитело к маркеру Т-киллерных клеток анти-CD8, оно быстро распространялось по кровотоку и связывалось со всеми Т-киллерами в крови (но не в тканях). При микроскопии срезов органов легко было отличить резидентные киллерные TRM от только недавно вышедших из крови в орган клеток, помеченных анти-CD8 антителом [7]. Численность резидентных клеток, подсчитанная этим методом, превышала в 70 раз определенные методом проточной цитометрии числа; разница меньше, чем в два раза, наблюдалась только для резидентных клеток лимфоузлов и селезенки: получается, стандартные методики выделения лимфоцитов из органов плохо подходят для анализа киллерных резидентных клеток и существенно занижают размеры популяции.
Работа резидентных Т-клеток: не стоит путать туризм с эмиграцией
Мышиные резидентные клетки тканей в нормальной ситуации почти не перемещаются внутри нелимфоидной ткани и достаточно прочно прикреплены молекулами адгезии к строме органа. Когда резидентные макрофаги той же ткани секрецией цитокинов инициируют реакцию воспаления, ТRM приобретают большую подвижность и патрулируют близлежащий эпителий в поисках зараженных клеток.
Если воспалительная реакция усиливается, то клетки понимают это как сигнал о подкреплении: к работе патрульных TRM подключаются вновь прибывающие из крови TCM и TEM -клетки. Эти клетки крови куда более подвижны и лучше перемещаются в эпителии: значит ли это, что именно в крови находятся готовые действовать Т-киллеры среди TEM , а CD8+ TRM выполняют в ткани хелперные и регуляторные функции?
C одной стороны, Т-хелперы по спектру Т-клеточных рецепторов более тканеспецифичны, то есть пересечений между репертуарами Т-клеточных рецепторов клеток, взятых из разных тканей, совсем мало, тогда как клетки одного клона Т-киллера встречаются в разных тканях среди TEM [5]. Спектр функций и репертуар антигенной специфичности TRM еще предстоит исследовать, но способности к уничтожению зараженных клеток тканей у TRM -киллеров точно есть. Более того, афинность вирус-специфичных Т-клеточных рецепторов (ТКР) резидентных киллерных клеток выше, чем у вирус-специфичных клеток центральной памяти в модели мышиной инфекции полиомавирусом, протекающей в ткани головного мозга [8].
Однако размер популяции Т-клеток зависит не только от специфичности Т-клеточных рецепторов к инфекциям, которые раньше протекали в данном органе, но и от гомеостатической пролиферации Т-клеток — размножения более удачливых клеток для заполнения емкости органа по числу Т-лимфоцитов. По маркерам CD28 и CD127 на поверхности клеток можно отличить недавно и давно активированные через Т-клеточный рецептор клетки от тех, которые получили только гомеостатический сигнал к пролиферации от фактора роста IL-7. При старении ткани гомеостатическое размножение клеток начинает преобладать над пролиферацией активированных через ТКР клеток.
Независимо от Т-клеточных рецепторов часто функционируют NKT-клетки, крупный тип резидентных клеток печени, встречающиеся и в других тканях. Они могут быть активированы NK-клеточными рецепторами через распознавание не индивидуальных антигенов, а общих молекулярных паттернов опасности и тканевого стресса. При активации CD8+ NKT-клетки выделяют цитотоксические гранулы и лизируют подозрительные клетки ткани, к примеру, единичные опухолевые клетки и зараженные вирусами клетки, экспрессирующие и выставляющие на внешней мембране MHC-подобные стрессорные молекулы. При старении тенденция TRM к активации без Т-клеточного рецептора через NK-клеточные рецепторы или цитокиновые сигналы может приводить к ошибочному лизису клеток ткани, недостаточному контролю над хронически зараженными или перерождающимися участками эпителия.
Патологические проявления, связанные с работой резидентных Т-клеток включают в себя органоспецифичные аутоиммунные синдромы и синдромы хронического воспаления в ткани. Примеры хронического воспаления, поддерживаемого резидентными Т-лимфоцитами — контактный дерматит и псориаз, а механизмом служит выделение воспалительных факторов IL-17 резидентными Т-киллерами и IL-22 резидентными Т-хелперами дермы. CD8+ эффекторные Т-киллеры, находящиеся в головном мозге, похожи по совокупности мембранных молекул-маркеров на TRM кожи, кишечника и легких и способны подталкивать развитие перемежающегося рассеянного склероза при периодических выбросах воспалительных цитокинов; неясно, однако, есть ли в норме в головном мозге TRM популяция или же это Т-лимфоциты, оставшиеся в ткани после нейротропной вирусной инфекции [9].
Функции резидентных клеток памяти в норме, при отсутствии инфекции или хронического воспаления, могут включать в себя cross-talk (взаимную регуляцию преимущественно через секрецию цитокинов и костимуляторные молекулы) с неклассическими малоизученными лимфоидными клетками, такими как ассоциированные со слизистыми гамма/дельта Т-клетки, несущие альтернативный вариант сборки Т-клеточного рецептора; или лимфоидные клетки врожденного иммунитета (innate lymphoid cells, ILC), которые делят с Т-и В-лимфоцитами общие черты эпигенетического ландштафта, но не имеют Т-/В- или NK-клеточных рецепторов [10, 11].
TRM клетки контактируют с антигенпрезентирующими клетками тканей — это дендритные клетки кожи и резидентные макрофаги тканей. Резидентные миелоидные клетки в разных тканях дифференцированы и слабо похожи друг на друга. К примеру, макрофаги маргинальной зоны селезенки, макрофаги печени и микроглия (макрофаги мозга) будут сильно отличаться и по морфологии, и по спектру функций. Кроме обнаружения антигенов в ткани, резидентные макрофаги заняты регуляцией процессов старения и самообновления тканей, в частности, выделяют факторы роста и цитокины, стимулирующие деление стволовых клеток тканей. В жировой ткани, к примеру, макрофаги стимулируют дифференцировку новых жировых клеток, но при переходе в активированное M1-состояние, запускают воспаление и вместо дифференцировки заставляют увеличиваться и набухать имеющиеся жировые клетки. Сопутствующие изменения метаболизма жировой ткани приводят к накоплению жировой массы и в последние годы связываются с механизмами развития ожирения и диабета II типа. В коже цитокины, выделяемые макрофагами и резидентными гамма/дельта Т-клетками стимулируют деление стволовых клеток при регенерации эпидермиса и стволовых клеток волосяных фолликулов [12, 13]. Можно предположить, что хелперные TRM клетки при патрулировании эпителия и образовании контактов с тканевыми макрофагами могут модулировать спектр и объем выделяемых последними факторов роста для стволовых клеток, воспалительных цитокинов и факторов ремоделирования эпителия, и тем самым участвовать в обновлении тканей.

Рисунок 5. Предполагаемые функции резидентных Т-лимфоцитов тканей. Часть функций может выполняться во взаимодействии с резидентными макрофагами (см. пояснения в тексте).
Что изучение Trm может дать медицине?
Понимание принципов работы резидентных Т-клеток абсолютно необходимо для борьбы с инфекциями, которые не поступают сразу в кровь, а проникают в организм через барьерные ткани — то есть, для подавляющего большинства инфекций. Рациональный дизайн вакцин для защиты от этой группы инфекций может быть направлен именно на усиление первого этапа защиты с помощью резидентных клеток: ситуация, при которой оптимально активированные специфичные к антигену клетки элиминируют патоген в барьерной ткани куда выгоднее, чем запуск острого воспаления для вызова Т-лимфоцитов из крови, поскольку меньше повреждается ткань.
Репертуар Т-клеточных рецепторов клеток, ассоциированных со слизистыми барьерных тканей, считается частично вырожденным и публичным, то есть идентичным для многих людей в популяции. Тем не менее, искажения при выделении Т-клеток из органов, перекос данных в результате отбора только определенных европеиодных доноров в когорты и общее небольшое количество накопленных данных секвенирования не дают уверенности в публичности репертуаров Т-клеточных рецепторов TRM-клеток. Хотя это было бы удобно, дизайн вакцин мог бы сводиться к поиску и модификации наиболее аффинных и иммуногенных пептидов из патогена, взаимодействующих с одним из публичных вариантов ТКР в барьерной для этого патогена ткани.
Конечно, представления о том, какие Т-клеточные рецепторы несут на своей поверхности TRM-клетки недостаточно для того, чтобы эффективно манипулировать иммунными реакциями в ткани. Предстоит детально изучить факторы, влияющие на заселение тканей определенными клонами Т-клеток и разобраться в механизмах активации местного тканевого иммунитета и индукции толерантности TRM. Как заселяются ниши Т-лимфоцитов в слизистых у ребенка до встречи с большим числом патогенов и, соответственно, до формирования значительного пула эффекторных Т-клеток памяти — предшественников резидентных клеток и клеток центральной памяти? Почему и как вместо классической активации лимфоцитов формируется игнорирование, реакция толерантности к микробам непатогенной флоры слизистых? Эти вопросы стоят на повестке дня в изучении резидентных клеток иммунной системы.
Определение закономерностей хоуминга Т-лимфоцитов в определенные ткани может дать преимущество в клеточной иммунотерапии опухолевых заболеваний. Теоретически, киллерные Т-клетки нужной специфичности к опухолевому антигену, активированные in vitro, должны убивать опухолевые клетки пациента. На практике подобная иммунотерапия осложняется тем, что опухолевые клетки способны подавлять иммунные реакции и приводить в неактивное состояние анергии приближающиеся к опухоли Т-киллеры. Зачастую в массе растущей опухоли и вокруг неё накапливаются анергичные Т-лимфоциты, в первую очередь, TRM данной ткани. Из множества инъецированных пациенту активных опухолеспецифичных Т-клеток до цели дойдут немногие, и даже они могут оказаться практически бесполезными в иммуносупрессивном микроокружении опухоли.
Расшифровка механизмов, которые обеспечивают попадание конкретных клонов Т-клеток в определенные ткани, может позволить более эффективно направлять к опухоли сконструированные в лаборатории Т-лимфоциты и приблизить эру доступной персонализированной иммунотерапии.
- Clark R.A. (2010). Skin resident T cells: the ups and downs of on site immunity. J. Invest. Dermatol. 130 (2), 362–370;
- Муж и жена — одна сатана?;
- Iijima N. and Iwasaki A. (2015). Tissue instruction for migration and retention of TRM cells. Trends Immunol. 36, 556–564;
- Schenkel J.M. and Masopust D. (2014). Tissue-resident memory T cells. Immunity. 41, 885–897;
- Thome J.J., Yudanin N., Ohmura Y., Kubota M., Grinshpun B., Sathaliyawala T. et al. (2014). Spatial map of human T cell compartmentalization and maintenance over decades of life. Cell. 159, 814–828;
- Откуда пошло зрение;
- Steinert E.M., Schenkel J.M., Fraser K.A., Beura L.K., Manlove L.S., Igyártó B.Z. et al. (2015). Quantifying memory CD8 T cells reveals regionalization of immunosurveillance. Cell. 161, 737–749;
- Frost E.L., Kersh A.E., Evavold B.D., Lukacher A.E. (2015). Cutting edge: resident memory CD8 T cells express high-affinity TCRs. J. Immunol. 195, 3520–3524;
- Park C.O. and Kupper T.S. (2015). The emerging role of resident memory T cells in protective immunity and inflammatory disease. Nat. Med. 21, 688–697;
- Schluns K.S. and Klonowski K. Diverse functions of mucosal resident memory T cells. E-book, 2015;
- Godfrey D.I., Uldrich A.P., McCluskey J., Rossjohn J., Moody D.B. (2015). The burgeoning family of unconventional T cells. Nat. Immunol. 16, 1114–1123;
- Castellana D., Paus R., Perez-Moreno M. (2014). Macrophages contribute to the cyclic activation of adult hair follicle stem cells. PLoS Biol. 12, e1002002;
- Rodero M.P. and Khosrotehrani K. (2010). Skin wound healing modulation by macrophages. Int. J. Clin. Exp. Pathol. 3 (7), 643–653;
- Farber D., Yudanin N., Restifo N.P. (2014). Human memory T cells: generation, compartmentalization and homeostasis. Nat. Rev. Immunol. 14, 24–35..
Стражи иммунной системы
Золтан Фегервари, Шимон Сакагучи
«В мире науки» №12, 2006
Регуляторные Т-клетки удерживают иммунную систему организма от нападения на собственные ткани. Их использование позволит лечить самые разные заболевания и, возможно, решить проблему отторжения трансплантированных органов.

«Тяжелейший аутотоксикоз» — такой термин был введен около ста лет назад известным немецким врачом-бактериологом Паулем Эрлихом для описания патологического состояния, при котором иммунная система человека «атакует» его же собственные органы и ткани. Эрлих полагал, что с биологической точки зрения в аутоиммунности (еще одно введенное им определение) нет ничего абсурдного, когда она находится под строжайшим контролем. Однако медицинское сообщество не приняло столь неоднозначной идеи. В самом деле, зачем природе встраивать в организм человека механизм, способный разрушать своего носителя?
Однако врачи время от времени сталкивались с заболеваниями, которые попадали под концепцию Эрлиха. Среди них рассеянный склероз, инсулинозависимый диабет, ревматоидные артриты. Выяснилось, что у подобных больных обычно нарушена функция особых лейкоцитов, известных как CD4+-T-лимфоциты (они названы так потому, что созревают в тимусе — железе, расположенной в грудной клетке чуть выше сердца, и несут на своей поверхности молекулы гликопротеина CD4). В норме они играют роль «старших офицеров», которые отдают команду другим клеткам иммунной системы к наступлению на вторгшихся в организм врагов — болезнетворных микроорганизмов, но иногда направляют оружие против органов и тканей собственного тела.
Эрлих оказался прав и в другом: недавно идентифицированы клетки, специализирующиеся на возвращении на путь истинный вышедшей из повиновения иммунной системы. Они получили название регуляторных Т-клеток. Будучи частью популяции CD4+-T-клеток, они поддерживают мир и согласие между иммунной системой и организмом. Кроме того, выяснилось, что им свойственна не только миротворческая функция: они также влияют на реакцию иммунной системы на проникшие в организм инфекционные агенты, опухолевые клетки, трансплантированные органы, клетки плода при наступлении беременности и т. д. Если удастся выяснить, как они выполняют свои обязанности, и почему их работа иногда дает сбой, исследователи получат возможность контролировать деятельность этих регуляторов и при необходимости подавлять иммунную активность.
Ненадежная система обороны
Многих людей сегодня пугает сознание того, что иммунная система в любой момент может выйти из-под контроля и спровоцировать аутоиммунное заболевание. Неприятнее всего то, что такой «иммунологический дамоклов меч» не так уж трудно привести в действие. Например, при введении мышам белков их собственной центральной нервной системы вместе с каким-нибудь адъювантом (неспецифическим стимулятором иммуногенеза) возникает деструктивная иммунная реакция, которая в основном проявляется как рассеянный склероз, вызывающий разрушение головного и спинного мозга.
Вводя животным их собственные белки разного происхождения, можно вызвать и другие аутоиммунные реакции. Такая же опасность подстерегает и человека. По крайней мере, из крови вполне здоровых людей выделены аутореактивные клетки иммунной системы, которые в пробирке ведут себя крайне агрессивно в отношении тканей своего родного организма.
Почему же при наличии постоянной угрозы со стороны собственной иммунной системы большинство из нас не страдает аутоиммунными заболеваниями? Каким образом наша внутренняя защита отличает опасных микробов от нормальных клеток своего организма? Исследователи обнаружили, что для обеспечения самотолерантности (способности удерживать иммунную систему в рамках) принимается множество мер предосторожности. Первая линия обороны, во всяком случае, в том, что касается Т-клеток, располагается в тимусе. Здесь созревшие Т-клетки проходят серьезный «курс обучения» и настраиваются на крайне слабую реакцию на здоровые клетки организма-хозяина. Клетки, не поддающиеся «дрессировке», отбраковываются. Однако ни одна система не застрахована от ошибок, и некоторое количество аутоагресивных Т-клеток ускользает от контроля. Попадая в кровоток и лимфу, они создают угрозу запуска аутоиммунной реакции.
Кровь и лимфа представляют собой вторую линию обороны. Здесь используется несколько приемов. Некоторые ткани, в том числе головного и спинного мозга, ограждены от аутоагрессивных клеток иммунной системы тем, что к ним ведет небольшое число сосудов, уходящих вглубь этих органов. Однако такая самоизоляция не может быть полной. В силу определенных обстоятельств (например, при повреждении тканей) аутореактивные клетки все же могут проникнуть внутрь. Другие способы защиты носят упреждающий характер. Иммунные клетки, проявляющие подозрительный интерес к здоровым тканям и органам, атакуются другими компонентами иммунной системы и разрушаются или инактивируются ими.
По-видимому, среди «подразделений», участвующим в упреждающих действиях, ключевая роль принадлежит регуляторным Т-клеткам. Большинство из них (а возможно, и все) обучаются мастерству в тимусе, а затем распространяются по всему организму в виде специализированной субпопуляции Т-клеток.
История открытия регуляторных Т-клеток
В 1969 г. Ясуаки Нисидзука (Yasuaki Nishizuka) и Тэруе Сакакура (Teruyo Sakakura) из японского Центра по исследованию рака в г. Нагоя обнаружили, что удаление тимуса у новорожденных мышат женского пола приводит к серьезным последствиям — разрушению яичников. Вначале ученые предположили, что тимус секретирует гормоны, необходимые для развития и сохранения данных органов. Однако позже выяснилось, что ткани яичников у мышат, лишенных тимуса, буквально наводнены иммунными клетками, что свидетельствовало о наличии аутоиммунного заболевания, возникшего в результате выхода из строя какого-то регуляторного механизма. Стоило ввести грызунам нормальные Т-клетки, как болезнь отступала. Все указывало на то, что в популяции Т-клеток имеется система самоконтроля.
В начале 1970-х гг. аналогичные результаты в ходе опытов на взрослых крысах получил Джон Пенхейл (John Penhale) из Эдинбургского университета, а Ричард Гершон (Richard Gershon) из Йельского университета впервые предположил, что существует некая группа Т-клеток, способных подавлять иммунную реакцию, в том числе и направленную против тканей собственного организма. Гипотетические клетки были названы супрессорными, но в то время никто не мог найти объяснения их поведению.
Основные надежды возлагались на обнаружение особых структур на поверхности Т-клеток — маркеров, по которым супрессорные Т-клетки можно было бы отличить от других составляющих иммунной системы. Начиная с середины 1980-х гг. многие молекулы были испробованы на роль потенциального маркера. В конце концов в 1995 г. один из нас (Сакагути) обнаружил таковой — им оказалась молекула, названная CD25. Когда у мышей были удалены CD4+-T-клетки, несущие данный маркер, иммунной атаке подверглось сразу несколько органов: желудок, половые, слюнные, щитовидная и поджелудочная железы. К ним устремились лейкоциты и разрушили их.
Важным подтверждением того, что мы находимся на правильном пути, стал следующий эксперимент. Мы выделили популяцию Т-клеток нормальной мыши, удалили из нее большую часть CD4+-CD25+-T-клеток, а затем оставшийся материал инъецировали грызунам с нефункционирующей иммунной системой, что привело к развитию у них аутоиммунного заболевания. Чем меньше CD4+-CD25+-T-клеток оставалось в Т-клеточной популяции, вводимой лабораторным животным, тем шире становился круг аутоиммунных расстройств, приводивших к гибели подопытных. При введении же CD4+-CD25+-T-клеток даже в небольших количествах иммунитет восстанавливался и защищал организм от саморазрушения. Иммунологи стали называть CD4+-CD25+—T-клетки регуляторными (или просто T-reg), по-видимому, желая устранить путаницу, которую вызывало определение «супрессорные».
Как работают T-reg-клетки?
Механизм подавления аутоиммунной активности клетками T-reg остается загадкой. По-видимому, они способны воздействовать на самые разные клети иммунной системы, блокируя их амплификацию и такие процессы, как секреция сигнальных молекул — цитокинов. Специалисты склонны думать также, что T-reg-клетки активируются прямым межклеточным взаимодействием. Во всем остальном картина остается неясной.
Однако недавно сотрудники нашей лаборатории в Киотском университете, а также Александр Руденски (Alexander Rudensky) с коллегами из Вашингтонского университета и группа Фреда Рамсдела (Fred Ramsdell) из компании CellTech R&D в шт. Вашингтон независимо друг от друга получили результаты, приподнимающие завесу тайны над образованием и механизмом действия T-reg. Обнаружилось, что они содержат в необычайно большом количестве специфические молекулы под названием Foxp3, которые служат одним из факторов транскрипции, регулирующих работу определенных генов и тем самым — синтез кодируемых ими белков. Изменение экспрессии любого клеточного гена может повлиять на функционирование всей клетки. Что касается действия фактора Foxp3, то он, по-видимому, перенастраивает клеточные гены таким образом, что Т-клетки превращаются в T-reg. В действительности, введение Foxp3 в обычные Т-клетки приводит к тому, что они приобретают такую же способность к иммуносупрессии, как и исходно полноценные T-reg-клетки, образовавшиеся в тимусе. Недавно выяснилось, что мыши, относящиеся к широко используемой лабораторной линии Scurfy, синтезируют только неактивную, мутантную форму белка Foxp3, но в их организме нет и следа T-reg. Иммунная система у таких животных расшатана до предела, они страдают от множественных воспалений различных органов и рано погибают.
Имеются ли какие-либо данные о том, что человеку также необходимы T-reg-клетки? И есть ли они в нашем организме? Исследователи выяснили, что молекулярные особенности, характерные для T-reg-грызунов, присущи также некой субпопуляции Т-клеток человека. На поверхности данных клеток присутствуют молекулы CD25, а внутри содержится необычайно много белка Foxp3. Они обладают иммуносупрессивными свойствами — по крайней мере, таковы результаты опытов in vitro.
Лучшим свидетельством того, что данные клетки жизненно важны и для нас, служит следующее наблюдение. Существует редкое генетическое заболевание под названием IPEX (Immune dysregulation, Polyendocrinopathy, Enteropathy, X-linked syndrome), которое связано с мутацией в одном из генов Х-хромосомы и поражает младенцев мужского пола (в отличие от девочек, они наследуют только одну Х-хромосому и потому не могут синтезировать вторую, нормальную копию соответствующего белка). Его следствием становится аутоиммунная реакция, влекущая за собой поражение многих органов и смерть в младенчестве. Как выяснилось недавно, данная мутация локализована в том самом гене, который кодирует белок Foxp3. Таким образом, IPEX — это аутоиммунное заболевание человека, аналогичное таковому у мышей линии Scurfy.
Не только самотолерантность
Итак, есть указания на то, что T-reg-клетки действительно предотвращают развитие аутоиммунных заболеваний у человека, однако их роль оказалась еще значительнее. Так, они принимают участие в реакции организма на проникновение микробов.
В 1990-х гг. Фиона Паури (Fiona Powrie) из DNAX, исследовательского института в Пало-Альто, шт. Калифорния, проводила эксперименты по введению популяции Т-клеток, обедненной T-reg, мышам с нефункционирующей иммунной системой. В одной из серий экспериментов у животных развилось острое воспаление кишечника. Но аберрантная иммунная реакция была направлена в первую очередь не на клетки самого органа.
В кишечнике как грызунов, так и человека присутствует множество микроорганизмов. Нередко их число превышает триллион на каждый грамм ткани. Большинство из них не только безвредны, но даже необходимы: они улучшают пищеварение и вытесняют патогенные бактерии (например, сальмонеллы), которые в противном случае заселили бы кишечник. В норме иммунная система никак не реагирует на присутствие полезных, хотя и чужеродных тел. Но у мышей, которые использовала в своих опытах Паури, все было не так. Введенные иммунные клетки атаковали не только микроорганизмы, но и стенки кишечника реципиента. Однако при инъекции клеток T-reg подобных проблем не возникало. И если бы последние вводились вместе с другими Т-клетками с самого начала, то никакого воспалительного процесса в кишечнике не возникло бы. Подводя итоги, можно сказать, что иммунная система представляет собой спусковой механизм, готовый в любую минуту атаковать микрофлору кишечника, и сдерживают ее только T-reg-клетки.
Ответ иммунной системы на болезнетворные чужеродные агенты может контролироваться аналогичным образом. С одной стороны, T-reg-клетки способны блокировать слишком сильную реакцию, с другой — предотвращать уничтожение какого-нибудь инородного тела, позволяя ему существовать в организме хозяина. Есть свидетельство того, например, что невозможность полностью уничтожить обитающую в желудке бактерию Helicobactor pilori, вызывающую язвенную болезнь, связана с «умиротворяющим» действием T-reg-клеток на иммунную систему.
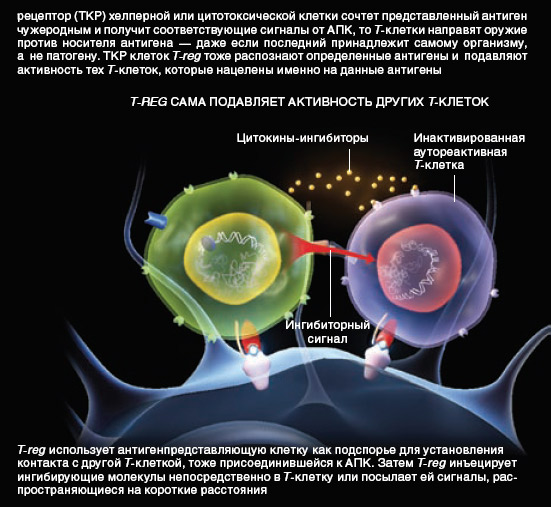
Работы Дэвида Сакса (David Sacks) и его коллег из Национальных институтов здоровья проиллюстрировали всю сложность данной ситуации. Дело в том, что, по мнению авторов, неполное уничтожение в организме патогенов имеет положительную сторону. Был поставлен следующий опыт: мышей инфицировали безопасными для них паразитами. Даже если иммунная система животных была здорова, в их организме оставалось небольшое число микроорганизмов, и тогда повторная инфекция получала достойный отпор. Если же популяция Т-клеток была бедна клетками T-reg, то паразиты уничтожались все до одного, однако при повторном заражении иммунная реакция была столь слабой, будто организм грызунов никогда прежде с этими паразитами не встречался. T-reg-клетки, по-видимому, улучшают иммунологическую память, которая обеспечивает невосприимчивость организма к повторным заражениям и лежит в основе действия вакцин.
Есть указания и на то, что клетки T-reg способствуют нормальному (с иммунологической точки зрения) протеканию беременности, которая всегда оказывается вызовом иммунной системе. Поскольку плод наследует от матери только половину генов, а вторую получает от отца, он генетически не идентичен матери и по существу может считаться имплантированным органом. От отторжения плод защищает целый ряд механизмов, функционирующих в трофобласте (плацентарной ткани, соединяющей зародыш со стенкой матки). Трофобласт — не просто физиологический барьер для содержащихся в материнской крови веществ, вредных для плода: в нем продуцируются молекулы-иммуносупрессанты.
При беременности иммунная система будущей матери претерпевает изменения. Есть данные, что у женщин с таким аутоиммунным заболеванием, как рассеянный склероз, в период беременности T-reg-клетки проявляют большую активность. Недавно получены дополнительные данные: Александр Бетц (Alexander Betz) из Кембриджского университета обнаружил, что у беременных мышей повышено число материнских клеток T-reg. Причем у генетически модифицированных особей, не имеющих T-reg, при вынашивании потомства наблюдается массовое проникновение иммунных клеток через плацентарный барьер. Есть основания полагать, что причиной спонтанных абортов у некоторых женщин оказывается низкая активность T-reg-клеток.
Использование T-reg-клеток в медицине
Итак, T-reg-клетки являются мощным природным регулятором иммунной системы. Научившись влиять на его работу, мы сможем лечить различные заболевания. Ожидать немедленного практического внедрения подобного способа борьбы с недугами, конечно, не приходится, но имеющиеся данные позволяют надеяться, что введение в организм самих T-reg-клеток или препаратов, воздействующих на их активность, уже в скором времени сможет облегчить состояние некоторых больных.
Речь идет, прежде всего, об аутоиммунных заболеваниях. Возможно, с помощью T-reg-клеток удастся справиться также с разными видами аллергии. А легкость, с которой клетки T-reg «усмиряют» иммунную систему, предполагает, что они могут стать незаменимыми при операциях по пересадке органов.
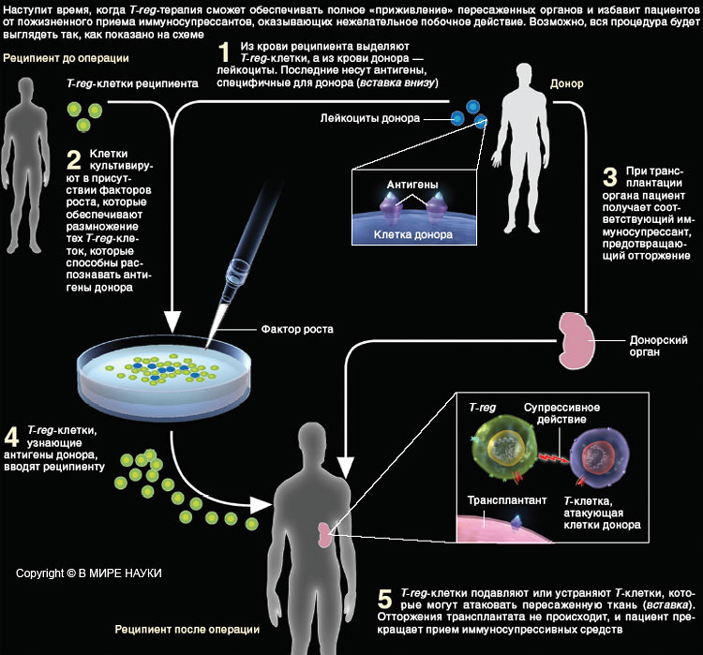

Альтернативный метод мог бы состоять в избирательном устранении определенных компонентов из популяции T-reg-клеток для подавления нежелательной иммуносупресии и, следовательно, для усиления реакции, направленной на нужную мишень. Оптимальным было бы удаление только тех T-reg-клеток, которые блокируют специфическую иммунную реакцию. Такая стратегия может быть незаменима в борьбе с инфекционными заболеваниями, при которых иммунная система, предоставленная самой себе, часто действует не совсем адекватно, например, при туберкулезе и СПИДе.
Уменьшение активности T-reg-клеток можно было бы использовать и при лечении онкологии. Компоненты иммунной системы, циркулируя в крови и лимфе, бдительно следят за появлением в организме клеток, превратившихся в раковые. Они распознают их по определенным морфологическим признакам и причисляют к чужеродным агентам. Мешая «патрульным» клеткам иммунной системы выполнять работу, T-reg поневоле способствуют образованию и росту опухоли. При некоторых онкологических заболеваниях пораженные клетки даже помогают в этом клеткам T-reg: они секретируют сигнальные молекулы, способные привлекать T-reg и инициировать превращение не-T-reg в T-reg. По наблюдениям некоторых врачей, у больных раком аномально высоко содержание активных T-reg-клеток как в крови, так и в самой опухоли.
Технические трудности
До сих пор не было никаких попыток создать препараты, увеличивающие или уменьшающие численность популяции T-reg-клеток непосредственно в организме человека. Любые средства, которые можно было бы использовать, должны обладать способностью влиять только на те субпопуляции T-reg-клеток, которые играют роль в развитии конкретного заболевания. Но как распознать такие клетки, специалисты пока не знают.
Варианты T-reg-терапии | ||
|---|---|---|
Перечисленные здесь методы уже проходят клинические испытания или находятся на стадии подготовки. Большинство тестируемых веществ, действующих на T-reg-клетки, направлены на их уничтожение или подавление активности. Введение таких веществ в организм требует особой осторожности — при передозировке возможно развитие аутоиммунного заболевания | ||
| Манипуляции с T-reg-клетками | Заболевание | Принцип действия |
| Подавление активности или уничтожение (для усиления иммунной реакции) | Рак кожи (меланома), яичников, почек | Токсин присоединяют к интерлейкину-2, который обеспечивает его проникновение в T-reg-клетку. Вводят моноклональные антитела, способные уничтожать T-reg-клетки или блокировать их проникновение в опухоль |
| Пролиферация в организме пациента (для подавления иммунной реакции) | Рассеянный склероз, псориаз, болезнь Крона, инсулинозависимый сахарный диабет | Готовят вакцину, содержащую компоненты Т-клеточного рецептора, с тем, чтобы стимулировать пролиферацию T-reg-клеток |
| Пролиферация in vitro и введение в организм пациента | Реакция «трансплантат против хозяина» (иммунные клетки пересаженного костного мозга атакуют ткани реципиента) | Культивируют T-reg-клетки донора со специфическими антителами и факторами роста. Вводят образовавшуюся популяцию T-reg-клеток до пересадки костного мозга или во время нее (чтобы предотвратить отторжение) или при угрозе возникновения реакции «трансплантат против хозяина» |
Разработка методов, основанных на воздействии на T-reg in vitro, тоже представляет серьезную проблему. Самое трудное — получить достаточное число клеток. Несмотря на то, что некоторые T-reg-клетки могут полноценно работать, даже находясь в значительном меньшинстве относительно тех, на которые они оказывают супрессорное действие, для эффективного лечения аутоиммунного заболевания могут понадобиться десятки миллионов T-reg-клеток. Выделение такого числа этих редких элементов из крови пациента представляется невозможным. И, похоже, без разработки метода амплификации T-reg in vitro здесь не обойтись.
К счастью, проблему «больших чисел» можно решить другим способом. Различными исследовательскими группами установлено, что клетки с иммунносупрессивным действием можно создать в относительно больших количествах, обработав обычные T-клетки смесью определенных химических веществ. Идентичны ли такие клетки, названные Tr1, искомым T-reg-клеткам — пока неясно, но они несомненно обладают ярко выраженными иммуносупрессивными свойствами.
Теперь, когда специалистам известно, что Foxp3 служит ключевой молекулой, контролирующей развитие и функционирование T-reg, можно попробовать получить нужное число регуляторных клеток, используя стандартный лабораторный метод переноса гена Foxp3 в более многочисленные, а потому добываемые с меньшими трудностями Т-клетки другого типа. Сейчас над данным методом работают многие исследователи, в том числе и я. В первую очередь нас интересует, какие молекулярные процессы инициируют синтез белка Foxp3 во время развития T-reg. Может быть, разобравшись в данном вопросе, удастся создать лекарственные вещества, прием которых сделает ненужным выделение соответствующих клеток, их модификацию и введение в организм.
Что касается трансплантации органов, то здесь разрабатывается другой способ получения T-reg-клеток с нужными свойствами. Он предусматривает удаление T-reg из организма больного, которому предстоит трансплантация, и культивирование их вместе с клетками соответствующего органа донора. Цель подобной процедуры — получение T-reg-клеток с уникальными способностями подавлять отторжение. Один из нас (Сакагути) доказал, что однократного введения таких клеток во время пересадки кожи достаточно для того, чтобы трансплантированный лоскут полностью прижился. Следует также отметить, что описанная процедура оставляет в неприкосновенности иммунную систему реципиента, нисколько не снижая ее способности противостоять инфекционным и другим заболеваниям.
За последние десять лет представления о том, как работает защитная система организма, претерпели существенные изменения. В частности, стало ясно, что хотя она допускает циркуляцию в крови и лимфе потенциально аутодеструктивных Т-клеток, ею же предусмотрено образование Т-клеток, контролирующих последние. Выяснив, как появляются такие клетки-регуляторы и почему они обладают столь высокой иммуносупрессивной активностью, мы сможем использовать их для лечения многих смертельно опасных недугов. Позволяя разрушать «чужое» и строго охраняя «свое», T-reg-клетки служат настоящими миротворцами иммунной системы.
Французские вирусологи из Страсбургского и Руанского университетов исследовали образцы крови членов семей, где есть заболевшие Ковидом. И получили поразительные результаты. Что именно выяснили ученые и как это правильно трактовать? Чтобы узнать все подробности, мы досконально изучили оригинал научной работы вместе с экспертом-иммунологом, кандидатом медицинских наук, гендиректором контрактно-исследовательской компании Николаем Крючковым.
БОЛЕЗНЬ ОБНАРУЖЕНА, ИММУНИТЕТ — НЕТ
— Французские исследователи решили проверить, как возникает иммунитет у членов семей, которые живут вместе с заболевшими COVID-19 в легкой форме (то есть у контактных лиц), — поясняет эксперт. — В наблюдении участвовало 7 семей, в которых были в общей сложности 9 заболевших и 8 контактных.
Ученые прицельно исследовали не знакомые уже многим антитела, а другой важный компонент иммунной системы — клеточный иммунитет. Его основные «бойцы» — иммунные клетки памяти, или Т-лимфоциты. У добровольцев брали анализ крови в период от 44 до 80 дней после появления симптомов болезни. И оценивали: есть ли в образцах крови соответствующие клетки памяти к новой инфекции, или нет.
Результаты оказались такие:
— У двоих контактных лиц не удалось обнаружить вообще никаких признаков иммунитета — ни Т-лимфоцитов (клеток памяти), ни антител.
— Еще у двоих не появилось никаких симптомов «ковида» (то есть из восьми контактных лиц шесть заболели с признаками болезни, начиная с температуры и заканчивая кашлем).
— У одного из двоих, не имевших симптомов, брали анализ на антитела тремя разными тестами и — анализ на специфические Т-клетки. Не нашли ничего.
— У второго человека без признаков болезни тоже не оказалось никаких антител. Но! Нашлись Т-лимфоциты, иммунные клетки памяти.
Однако это не все поразительные факты. Среди контактных лиц был еще один человек, который заболел, но анализы на антитела и на Т-клетки дали отрицательный результат. То есть организм этого больного как будто вообще не запомнил коронавирус! Во всяком случае, через 44 дня после появления симптомов уже не было никаких признаков иммунитета к «ковиду».
У шести человек из восьми со временем появились и антитела, и Т-лимфоциты.
ТРИ НОВЫЕ ЗАГАДКИ КОРОНАВИРУСА
— Это исследование поставило перед нами три новых вопроса, — говорит Николай Крючков.
1. Если человек заболевает, то у него, по идее, должны образоваться и антитела, и Т-лимфоциты, распознающие коронавирус. У одного из участников исследования не обнаружилось антител в положенный срок, однако нашелся другой элемент иммунитета — Т-лимфоциты, или клетки памяти.
2. Еще у одного заболевшего при всех признаках COVID-19 не обнаружилось никаких намеков на иммунитет — ни антител, ни Т-клеток.
3. Наконец, в ходе наблюдения нашелся человек, у которого анализ показал Т-лимфоциты, но при этом не было ни малейших признаков болезни.
НЕ ВСЕ ТАК ГЛАДКО: КАКИЕ ПРЕТЕНЗИИ ЕСТЬ К ИССЛЕДОВАНИЮ
— Во-первых, мы должны понимать, что изучение проведено на очень маленьком количестве участников. В таких случаях результаты исследования не признаются подтверждением гипотезы. Считается, что они позволяют сформулировать, выдвинуть гипотезу, которую еще предстоит проверять в дальнейшем, — говорит Николай Крючков.

Кандидат медицинских наук, гендиректор контрактно-исследовательской компании Николай Крючков. Фото: Личный архив.
Это значит: мы не можем сделать вывод, что вместо антител многие люди обзавелись Т-клеточным иммунитетом. Соответственно, нет никаких доказательств, что иммунная прослойка в обществе намного больше, чем показывают анализы на антитела, подчеркивает эксперт.
Второй важный момент. Отсутствие Т-клеток у одного из переболевших и, наоборот, их обнаружение у не болевшего человека, может быть не признаком «коварности» или новой загадкой коронавируса. Не исключено, что это объясняется неточностью теста. Поскольку, в отличие от тест-систем для обнаружения антител, наличие Т-лимфоцитов исследуется очень сложным методом для научных исследований, который не прошел достаточную валидацию для применения в рутинной клинической практике (упрощенно говоря, проверки точности. — Ред.).
ВЫВОДЫ: ХОРОШАЯ И ПЛОХАЯ НОВОСТЬ
— Подчеркну еще раз: в данном случае мы говорим именно о гипотезах, которые еще предстоит подтвердить в масштабных исследованиях, — отмечает Николай Крючков. Учитывая это, мы можем предполагать:
— Похоже, есть группа людей, которые столкнулись с вирусом, не наработали достаточного количества антител (анализ «не видит» их), но при этом получили Т-клеточный иммунитет. Судя по данному исследованию, таких людей относительно немного — максимум 20% от всех переболевших.
— У части людей, переболевших в легкой форме, организм, возможно, вообще «не замечает» новой инфекции. У них не возникает никаких элементов иммунитета, и есть все шансы заболеть повторно. Если только в этой части исследования не были получены ложные результаты из-за неточности теста на Т-лимфоциты к новому коронавирусу.
КСТАТИ
Можно ли по желанию протестироваться на Т-клетки?
Это сложный дорогостоящий метод, который применяется только в научно-исследовательских целях. То есть вы не сможете сделать его в обычной медицинской лаборатории.
В ТЕМУ
Что выяснили шведы
В Интернете сейчас широко обсуждается еще одно исследование, где упоминаются «ковид» и Т-клетки. Это шведская научная работа.
— Николай, говорят, в новом шведском исследовании доказано, что у большого количества людей есть иммунные Т-клетки к новому коронавирусу.
— На самом деле в этой научной работе речь о другом. Здесь ученые исследовали виды Т-клеток у разных групп людей. Изучались иммунные клетки, способные реагировать на разные фрагменты коронавирусов в целом. И основной вывод касается кросс-реактивности (перекрестного иммунитета). То есть подтверждается, что у людей, перенесших сезонные коронавирусы (традиционные простуды), появляются иммунные Т-клетки, реагирующие на сходные участки сезонных коронавирусов и SARS-CoV-2. При этом по-прежнему нет никаких доказательств, что такой перекрестный иммунитет защищает от нынешней инфекции. Возможно, он позволяет тем, кто простужался из-за сезонных коронавирусов, переносить новую инфекцию в более легкой форме. Но это пока лишь гипотеза.
ВОПРОС-РЕБРОМ
Сколько же людей на самом деле переболело коронавирусом?
— Некоторые эксперты говорят о том, что вывод по анализам на антитела — около 20% по статистике в Москве — занижен. На самом деле нужно увеличивать эту цифру едва ли не в 2-3 раза. В том числе потому, что у многих не появились антитела, зато есть Т-клеточный иммунитет. Вы согласны?
— Увы, как исследователь и иммунолог не могу поддержать таких оптимистичных выводов. Скорее, научные данные сейчас говорят о том, что объем иммунной прослойки на уровне 20% не занижен, а преувеличен. Причина в дизайне исследования. Если говорить упрощенно, то тестироваться на антитела в подавляющем большинстве случаев идут люди, у которых были какие-то симптомы, контакты, то есть те или иные основания подозревать болезнь. Естественно, среди таких процент антител будет ощутимо выше, чем если бы выборка была действительно репрезентативной, то есть сформированной объективно. При этом практика показывает, что среди людей, которые уверены, что не переболели, очень высокая частота отказа проходить тестирование на антитела.
Что касается большого вклада Т-клеточного иммунитета, то имеющиеся на сегодня исследования как раз говорят о том, что процент людей без антител, но с Т-клетками к SARS-COV-2 очень невелик, максимум 20% от всех переболевших. Точно оценить это значение пока еще сложно.
Словом, думаю, до высокой иммунной прослойки нам еще далеко. Впрочем, коронавирус преподносит немало сюрпризов. Осенью увидим, чьи предположения окажутся ближе к истине.
Поделиться видео </>Коронавирус: мифы и реальность.Чем коронавирус дальше, тем больше вокруг него правды и домыслов. Мы постарались разобраться с основными мифами о пандемии Covid-19
ЧИТАЙТЕ ТАКЖЕ
Доктор Мясников: «Из Китая могут прийти смертельные вирусы. Страшнее коронавируса и бубонной чумы»
Врач назвал настоящие болезни-убийцы, которые могут подкосить человечество (подробности)
Добровольцы, испытывающие вакцину от COVID-19, готовятся к следующему этапу тестов
Клетки, ткани, функции и болезни
Наша иммунная система необходима для нашего выживания. Без иммунной системы наши тела были бы открыты для нападения бактерий, вирусов, паразитов и многого другого. Это наша иммунная система, которая сохраняет нас здоровыми, когда мы дрейфуем сквозь море патогенов.
Эта обширная сеть клеток и тканей постоянно ищет захватчиков, и, как только враг обнаружен, происходит сложная атака.
Иммунная система распространяется по всему организму и включает в себя множество типов клеток, органов, белков и тканей.Важно то, что он может отличить нашу ткань от инородной ткани — себя и не-я. Мертвые и дефектные клетки также распознаются и очищаются иммунной системой.
Если иммунная система сталкивается с патогеном, например, бактерией, вирусом или паразитом, она вызывает так называемый иммунный ответ. Позже мы объясним, как это работает, но сначала мы представим некоторых главных персонажей в иммунной системе.
Поделиться на PinterestA лейкоциты (желтые), атакующие бактерии сибирской язвы (оранжевые).Белая линия внизу имеет длину 5 микрометров.Автор изображения: Volker Brinkmann
Белые кровяные клетки также называют лейкоцитами. Они циркулируют в организме в кровеносных сосудах и лимфатических сосудах, которые параллельны венам и артериям.
Белые кровяные клетки постоянно патрулируют и ищут патогенные микроорганизмы. Когда они находят цель, они начинают умножаться и посылать сигналы другим типам ячеек, чтобы сделать то же самое.
Наши лейкоциты хранятся в разных местах тела, которые называются лимфоидными органами.К ним относятся следующие:
- Тимус — железа между легкими и чуть ниже шеи.
- Селезенка — орган, который фильтрует кровь. Он сидит в верхнем левом углу живота.
- Костный мозг — находится в центре костей, он также производит эритроциты.
- Лимфатические узлы — небольшие железы, расположенные по всему телу, связанные лимфатическими сосудами.
Существует два основных типа лейкоцитов:
1.Фагоциты
Эти клетки окружают и поглощают патогенные микроорганизмы и разрушают их, эффективно поедая их. Существует несколько типов, в том числе:
- Нейтрофилы — это наиболее распространенный тип фагоцитов и, как правило, атакует бактерии.
- Моноциты — это самый крупный тип и выполняют несколько ролей.
- Макрофаги — это патрулирование на патогенные микроорганизмы, а также удаление мертвых и умирающих клеток.
- Мачтовые клетки — у них много заданий, в том числе помощь в залечивании ран и защите от патогенных микроорганизмов.
2. Лимфоциты
Лимфоциты помогают организму помнить предыдущих захватчиков и узнавать их, если они снова возвращаются для атаки.
Лимфоциты начинают свою жизнь в костном мозге. Некоторые остаются в костном мозге и развиваются в В-лимфоциты (В-клетки), другие направляются в тимус и превращаются в Т-лимфоциты (Т-клетки). Эти два типа клеток имеют разные роли:
- B-лимфоцитов — они продуцируют антитела и помогают предупреждать Т-лимфоциты.
- Т-лимфоциты — они разрушают поврежденные клетки в организме и помогают предупредить другие лейкоциты.
Иммунная система должна уметь отличать себя от не-я. Это делается путем обнаружения белков, которые находятся на поверхности всех клеток. Он учится игнорировать свои или собственные белки на ранней стадии.
Антиген — это любое вещество, которое может вызвать иммунный ответ.
Во многих случаях антиген — это бактерия, грибок, вирус, токсин или инородное тело. Но это также может быть одна из наших собственных ячеек, которая неисправна или мертва. Первоначально, ряд типов клеток работает вместе, чтобы распознать антиген как захватчик.
Роль B-лимфоцитов
Как только B-лимфоциты обнаруживают антиген, они начинают выделять антитела (антиген сокращен от «генераторов антител»). Антитела — это особые белки, которые связываются со специфическими антигенами.
Каждая В-клетка образует одно специфическое антитело. Например, один может создать антитело против бактерий, вызывающих пневмонию, а другой может распознать вирус простуды.
Антитела являются частью большого семейства химических веществ, называемых иммуноглобулинами, которые играют многие роли в иммунном ответе:
- Иммуноглобулин G (IgG) — маркирует микробы, чтобы другие клетки могли распознавать и обрабатывать их.
- IgM — эксперт по уничтожению бактерий.
- IgA — собирается во флюидах, таких как слезы и слюна, где защищает проходы в организм.
- IgE — защищает от паразитов, а также виноват в аллергии.
- IgD — остается связанным с B-лимфоцитами, помогая им запустить иммунный ответ.
Антитела запираются на антигене, но не убивают его, а лишь отмечают его смертью. Убийство — это работа других клеток, таких как фагоциты.
Роль Т-лимфоцитов
Существуют различные типы Т-лимфоцитов:
Хелперные Т-клетки (Th-клетки) — они координируют иммунный ответ. Некоторые общаются с другими клетками, а некоторые стимулируют В-клетки вырабатывать больше антител. Другие привлекают больше Т-клеток или фагоцитов, питающихся клетками.
Т-клетки-киллеры (цитотоксические Т-лимфоциты) — как следует из названия, эти Т-клетки атакуют другие клетки. Они особенно полезны для борьбы с вирусами.Они работают, распознавая небольшие части вируса снаружи зараженных клеток и уничтожают зараженные клетки.
Иммунная система каждого человека различна, но, как правило, она становится сильнее во взрослом возрасте, так как к этому времени мы столкнулись с большим количеством болезнетворных микроорганизмов и выработали больше иммунитета.
Вот почему подростки и взрослые заболевают реже, чем дети.
После того, как антитело было произведено, его копия остается в теле, так что, если тот же антиген появляется снова, с ним можно справиться быстрее.
Вот почему при некоторых заболеваниях, таких как ветряная оспа, вы получаете его только один раз, поскольку в организме хранится антитело против ветряной оспы, готовое и ожидающее его уничтожения при следующем поступлении. Это называется иммунитет.
Существует три типа иммунитета у людей, называемых врожденным, адаптивным и пассивным:
Врожденный иммунитет
Мы все рождены с определенным уровнем иммунитета к захватчикам. Человеческая иммунная система, как и у многих животных, будет атаковать иностранных захватчиков с первого дня.Этот врожденный иммунитет включает внешние барьеры нашего организма — первую линию защиты от патогенных микроорганизмов — таких как кожа и слизистые оболочки горла и кишечника.
Этот ответ является более общим и неспецифическим. Если патогену удается уклониться от врожденной иммунной системы, срабатывает адаптивный или приобретенный иммунитет.
Адаптивный (приобретенный) иммунитет
Эта защита от патогенов развивается по мере того, как мы идем по жизни. Поскольку мы подвержены болезням или вакцинированы, мы создаем библиотеку антител к различным патогенам.Это иногда называют иммунологической памятью, потому что наша иммунная система помнит предыдущих врагов.
Пассивный иммунитет
Этот тип иммунитета «заимствован» из другого источника, но он не длится бесконечно. Например, ребенок получает антитела от матери через плаценту до рождения и в грудное молоко после рождения. Этот пассивный иммунитет защищает ребенка от некоторых инфекций в первые годы его жизни.
Иммунизация
Иммунизация вводит человеку антигены или ослабленные патогены таким образом, что человек не заболевает, а все еще производит антитела.Поскольку тело сохраняет копии антител, оно защищено, если угроза появится позже в жизни.
Поскольку иммунная система настолько сложна, есть много потенциальных путей, которыми она может пойти не так. Типы иммунного расстройства делятся на три категории:
Иммунодефициты
Они возникают, когда одна или несколько частей иммунной системы не функционируют. Иммунодефициты могут быть вызваны разными способами, включая возраст, ожирение и алкоголизм. В развивающихся странах недоедание является распространенной причиной.СПИД является примером приобретенного иммунодефицита.
В некоторых случаях иммунодефициты могут передаваться по наследству, например, при хронической гранулематозной болезни, когда фагоциты не функционируют должным образом.
Аутоиммунитет
В аутоиммунных условиях иммунная система ошибочно нацеливается на здоровые клетки, а не на чужеродные патогены или дефектные клетки. В этом сценарии они не могут отличить себя от не-я.
Аутоиммунные заболевания включают целиакию, диабет 1 типа, ревматоидный артрит и болезнь Грейвса.
Гиперчувствительность
При гиперчувствительности иммунная система чрезмерно реагирует таким образом, что повреждает здоровые ткани. Примером является анафилактический шок, когда организм реагирует на аллерген настолько сильно, что он может быть опасным для жизни.
Иммунная система невероятно сложна и крайне важна для нашего выживания. Несколько различных систем и типов клеток работают в идеальной синхронности (большую часть времени) по всему телу, чтобы бороться с патогенами и очищать мертвые клетки.
Клетки иммунной системы
Последнее обновление: Сагар Ариал
Клетки, которые играют специализированные роли в врожденных и адаптивных иммунных реакциях, представляют собой фагоциты, дендритные клетки, антигенспецифические лимфоциты и различные другие лейкоциты, которые функционируют для удаления антигенов. Хотя большинство этих клеток находится в крови, их реакции на микробы обычно происходят в лимфоидных и других тканях.

Фагоциты
Фагоциты, включая нейтрофилы и макрофаги, являются клетками, основная функция которых состоит в том, чтобы поглощать и уничтожать микробы и избавляться от поврежденных тканей.Функциональные ответы фагоцитов в защите хозяина состоят из последовательных этапов: рекрутирование клеток в места заражения, распознавание и активация микробами, проглатывание микробов в процессе фагоцитоза и уничтожение проглоченных микробов.
Нейтрофилы
Нейтрофилы, также называемые полиморфноядерными лейкоцитами , являются наиболее многочисленной популяцией циркулирующих лейкоцитов и опосредуют самые ранние фазы воспалительных реакций.Нейтрофилы циркулируют в виде сферических клеток диаметром около 12-15 мкм с многочисленными мембранными выступами. Цитоплазма содержит гранулы двух типов. Конкретные гранулы , заполненные ферментами, такими как лизоцим, коллагеназа и эластаза. Эти гранулы не сильно окрашиваются основными или кислотными красителями (гематоксилин и эозин соответственно), что отличает нейтрофильные гранулы от гранул двух других циркулирующих гранулоцитов, называемых базофилами и эозинофилами. Остальные гранулы нейтрофилов, называемые азурофильными гранулами , представляют собой лизосомы, которые содержат ферменты и другие микробицидные вещества, включая дефензины и кателицидины.
Мононуклеарные фагоциты
Система мононуклеарных фагоцитов включает циркулирующие клетки, называемые моноцитами, и резидентные клетки тканей, называемые макрофагами , . Моноциты имеют диаметр от 10 до 15 мкм и имеют бобовидные ядра и мелкозернистую цитоплазму, содержащие лизосомы, фагоцитарные вакуоли и цитоскелетные филаменты. Моноциты, которые мигрируют в ткани в ответ на инфекцию, могут дифференцироваться в специфические макрофаги ткани.Некоторые макрофаги являются долгожителями в тканях и играют важную роль в регулировании их восстановления и регенерации.
Другие макрофаги участвуют в врожденном иммунном ответе и претерпевают ряд ключевых изменений, когда они стимулируются встречами с патогенами или повреждением тканей. Они упоминаются как воспалительные макрофаги и играют двойную роль в иммунной системе как эффективные фагоциты, которые могут способствовать выведению патогенов из ткани, а также антигенпрезентирующие клетки, которые могут активировать Т-лимфоциты.Остеокласты в кости, микроглиальные клетки в центральной нервной системе и альвеолярные макрофаги в легких являются тканеспецифическими примерами макрофагов с этими свойствами.
Мачтовые клетки
Тучные клетки — это клетки костного мозга, присутствующие в эпителии кожи и слизистой оболочки, которые содержат обильные цитоплазматические гранулы, заполненные гистамином и другими медиаторами. Тучные клетки экспрессируют высокоаффинных рецепторов плазматической мембраны для типа антител, называемых IgE , и обычно покрыты этими антителами.Когда антитела на поверхности тучных клеток связывают антиген, индуцируются сигнальные события, которые приводят к высвобождению содержимого цитоплазматических гранул во внеклеточное пространство. Высвобожденное содержимое гранул, включая гистамин, способствует изменениям в кровеносных сосудах, которые вызывают воспаление. Тучные клетки функционируют в качестве дозорных в тканях, где они распознают микробные продукты и отвечают, производя цитокины и другие медиаторы, которые вызывают воспаление.
Базофилы
Базофилы — это гранулоциты крови со многими структурными и функциональными сходствами с тучными клетками.Хотя они обычно не присутствуют в тканях, базофилы могут быть завербованы в некоторые места воспаления. Как и тучные клетки, базофилы экспрессируют рецепторы IgE, связывают IgE и могут быть вызваны связыванием антигена с IgE. Поскольку количество базофилов в тканях низкое, их значение в защите хозяина и аллергических реакциях остается неопределенным.
Эозинофилы
Эозинофилы — это гранулоциты крови, которые экспрессируют цитоплазматические гранулы, содержащие ферменты, которые вредны для клеточных стенок паразитов, но также могут повредить ткани хозяина.Некоторые эозинофилы обычно присутствуют в периферических тканях, особенно в слизистой оболочке дыхательных путей, желудочно-кишечного тракта и мочеполовой системы, и их количество может увеличиваться при наборе из крови при воспалении.
Антиген-презентирующие клетки
Антигенпрезентирующие клетки (АРС) — это клетки, которые захватывают микробные и другие антигены, выводят их на лимфоциты и обеспечивают сигналы, которые стимулируют пролиферацию и дифференцировку лимфоцитов.Основным типом APC, который участвует в инициировании ответов Т-клеток, является дендритная клетка . Макрофаги и В-клетки представляют антигены Т-лимфоцитам в клеточных и гуморальных иммунных реакциях.
дендритных клеток
Дендритные клетки являются наиболее важными АРС для активации наивных Т-клеток, и они играют главную роль в врожденных ответах на инфекции и в связывании врожденных и адаптивных иммунных ответов. Они имеют длинные мембранные выступы и фагоцитарные возможности и широко распространены в лимфоидных тканях, эпителии слизистой оболочки и паренхиме органов.Большинство дендритных клеток являются частью миелоидной линии кроветворных клеток и происходят из предшественника, который также может дифференцироваться в моноциты, но не в гранулоциты.
лимфоцитов
Лимфоциты являются основными клеточными игроками в адаптивном иммунном ответе. Они представляют от 20% до 40% циркулирующих лейкоцитов и 99% клеток лимфы. Лимфоциты можно широко подразделить на три основные популяции на основе функциональных и фенотипических различий:
- В-лимфоциты (В-клетки)
- Т-лимфоциты (Т-клетки)
- Натуральные киллеры (НК).
Каждая B или T-клетка также экспрессирует антиген-специфический рецептор (B-клеточный рецептор (BCR) или T-клеточный рецептор (TCR) соответственно) на своей поверхности.
B- лимфоциты
В-лимфоцит (В-клетка) получил свое буквенное обозначение по месту своего созревания в бурсе Фабрициуса у птиц; активированные В-клетки дифференцируются в эффекторные клетки, известные как плазматические клетки. Плазматические клетки теряют экспрессию поверхностного иммуноглобулина и становятся высокоспециализированными для секреции антител.
T- лимфоциты
Т-лимфоциты (Т-клетки) получают свое буквенное обозначение по месту их созревания в тимусе. Рецепторы Т-клеток распознают только обработанные фрагменты антигена (обычно пептидов), связанные с белками клеточной мембраны, называемыми молекулами главного комплекса гистосовместимости (МНС). Они становятся активированными, пролиферирующими и дифференцируются в эффекторную клетку, называемую цитотоксическим Т-лимфоцитом (ЦТЛ). ЦТЛ выполняет жизненно важную функцию, контролируя клетки организма и устраняя любые клетки, которые обнаруживают чужеродный антиген в комплексе с МНС класса I,
натуральных клеток-киллеров
Натуральные киллеры (NK) — это лимфоидные клетки, тесно связанные с В и Т клетками.Однако они не экспрессируют антигенспецифичные рецепторы. NK-клетки составляют от 5 до 10% лимфоцитов периферической крови человека. Они являются эффективными клеточными киллерами и атакуют различные аномальные клетки, включая некоторые опухолевые клетки и некоторые клетки, инфицированные вирусом.
Клетки иммунной системы
,
Роль иммунной системы — совокупности структур и процессов в организме — заключается в защите от болезней или других потенциально вредных инородных тел. При правильном функционировании иммунная система выявляет различные угрозы, включая вирусы, бактерии и паразиты, и отличает их от собственной здоровой ткани организма, согласно инструкциям Merck.
Врожденный против адаптивного иммунитета
Иммунную систему можно разделить на категории: врожденный иммунитет и адаптивный иммунитет.
Врожденный иммунитет — это иммунная система, с которой вы родились, и, по данным Национальной медицинской библиотеки (NLM), он в основном состоит из барьеров на теле и в теле, которые не допускают внешних угроз. Компоненты врожденного иммунитета включают кожу, желудочную кислоту, ферменты, обнаруженные в слезах и кожном масле, слизь и кашлевой рефлекс Есть также химические компоненты врожденного иммунитета, в том числе вещества, называемые интерфероном и интерлейкином-1.
Врожденный иммунитет не является специфическим, то есть он не защищает от каких-либо конкретных угроз.
Адаптивный, или приобретенный, иммунитет нацелен на конкретные угрозы для организма, согласно NLM. Адаптивный иммунитет является более сложным, чем врожденный иммунитет, согласно Проекту Биологии в Университете Аризоны. В адаптивном иммунитете угроза должна обрабатываться и распознаваться организмом, а затем иммунная система создает антитела, специально предназначенные для этой угрозы. После того, как угроза нейтрализована, адаптивная иммунная система «запоминает» ее, что делает будущие реакции на тот же микроб более эффективными.
Основные компоненты
Лимфатические узлы: Небольшие бобовидные структуры, которые производят и хранят клетки, которые борются с инфекцией и болезнями и являются частью лимфатической системы, которая состоит из костного мозга, селезенки, тимуса и лимфатических узлов, в соответствии с «Практическое руководство по клинической медицине» от Калифорнийского университета в Сан-Диего (UCSD). Лимфатические узлы также содержат лимфу, прозрачную жидкость, которая переносит эти клетки в разные части тела. Когда организм борется с инфекцией, лимфатические узлы могут увеличиться и почувствовать боль.
Селезенка: Самый большой лимфатический орган в организме, который находится на левой стороне, под ребрами и над животом, содержит лейкоциты, которые борются с инфекцией или болезнью. По данным Национального института здоровья (NIH), селезенка также помогает контролировать количество крови в организме и удаляет старые или поврежденные клетки крови.
Костный мозг: Желтая ткань в центре костей производит белые кровяные клетки. Эта губчатая ткань внутри некоторых костей, таких как бедра и бедра, содержит незрелые клетки, называемые стволовыми клетками, согласно NIH.Стволовые клетки, особенно эмбриональные стволовые клетки, которые получены из яиц, оплодотворенных in vitro (вне организма), ценятся за их гибкость в способности превращаться в любую клетку человека.
Лимфоциты: Эти маленькие белые кровяные клетки играют большую роль в защите организма от болезней, согласно Клинике Майо. Два типа лимфоцитов — это В-клетки, которые вырабатывают антитела, которые атакуют бактерии и токсины, и Т-клетки, которые помогают уничтожать инфицированные или раковые клетки.Т-клетки-убийцы представляют собой подгруппу Т-клеток, которые убивают клетки, инфицированные вирусами и другими патогенами или иным образом поврежденные. Т-клетки-помощники помогают определить, какой иммунный ответ организм реагирует на определенный патоген.
Тимус: В этом маленьком органе созревают Т-клетки. Эта часто пропускаемая часть иммунной системы, которая расположена под грудиной (и имеет форму листа тимьяна, отсюда и название), может запускать или поддерживать выработку антител, что может привести к мышечной слабости, сказала клиника Майо.Интересно, что тимус несколько большой у младенцев, растет до полового созревания, затем начинает медленно сжиматься и с возрастом замещаться жиром, согласно данным Национального института неврологических расстройств и инсульта.
Лейкоциты: Эти борющиеся с болезнями лейкоциты выявляют и уничтожают патогенные микроорганизмы и являются вторым звеном врожденной иммунной системы. По данным клиники Майо, высокий уровень лейкоцитов в крови называется лейкоцитозом. Врожденные лейкоциты включают фагоциты (макрофаги, нейтрофилы и дендритные клетки), тучные клетки, эозинофилы и базофилы.
Заболевания иммунной системы
Если заболевания, связанные с иммунной системой, определены очень широко, то аллергические заболевания, такие как аллергический ринит, астма и экзема, очень распространены. Однако, по словам доктора Мэтью Лау, начальника отдела аллергии и иммунологии в Kaiser Permanente Hawaii, они фактически представляют собой гиперреакцию на внешние аллергены. Астма и аллергия также затрагивают иммунную систему. Обычно безвредный материал, такой как пыльца травы, частицы пищи, плесень или перхоть домашних животных, принимается за серьезную угрозу и подвергается нападению.
Другие нарушения регуляции иммунной системы включают аутоиммунные заболевания, такие как волчанка и ревматоидный артрит.
«Наконец, некоторые менее распространенные заболевания, связанные с дефицитом иммунной системы, — это дефицит антител и клеточно-опосредованные состояния, которые могут проявляться врожденно», — сказал Лау в интервью Live Science.
Нарушения иммунной системы могут привести к аутоиммунным заболеваниям, воспалительным заболеваниям и раку, согласно NIH.
Иммунодефицит возникает, когда иммунная система не так сильна, как обычно, что приводит к повторяющимся и опасным для жизни инфекциям, согласно медицинскому центру Университета Рочестера.У людей иммунодефицит может быть результатом генетического заболевания, такого как тяжелый комбинированный иммунодефицит, приобретенные состояния, такие как ВИЧ / СПИД, или путем использования иммунодепрессантов.
На противоположном конце спектра, согласно данным Медицинского центра Университета Рочестера, аутоиммунитет является результатом гиперактивной иммунной системы, атакующей нормальные ткани, как если бы они были инородными телами. Общие аутоиммунные заболевания включают тиреоидит Хашимото, ревматоидный артрит, сахарный диабет 1 типа и системную красную волчанку.Другим заболеванием, которое считается аутоиммунным заболеванием, является миастения (произносится как my-us-THEE-nee-uh GREY-vis).
Диагностика и лечение заболеваний иммунной системы
Несмотря на то, что симптомы иммунных заболеваний различаются, лихорадка и усталость являются общими признаками того, что иммунная система не функционирует должным образом, отметила клиника Майо.
В большинстве случаев иммунодефициты диагностируются с помощью анализов крови, которые измеряют уровень иммунных элементов или их функциональную активность, сказал Лау.
Аллергические состояния могут быть оценены с помощью анализов крови или кожной аллергии, чтобы определить, какие аллергены вызывают симптомы.
При гиперактивности или аутоиммунных заболеваниях очень полезны лекарства, снижающие иммунный ответ, такие как кортикостероиды или другие иммуносупрессивные агенты.
«При некоторых состояниях иммунодефицита лечение может быть заменой отсутствующих или дефицитных элементов», — сказал Лау. «Это может быть инфузия антител для борьбы с инфекциями.«
Лечение также может включать в себя моноклональные антитела, — сказал Лау. Моноклональное антитело — это тип белка, получаемый в лаборатории, который может связываться с веществами в организме. Их можно использовать для регуляции частей иммунного ответа, вызывающих воспаление, По словам Лау, по данным Национального института рака, для лечения рака используются моноклональные антитела, которые могут переносить лекарства, токсины или радиоактивные вещества непосредственно к раковым клеткам.
Основные этапы в истории иммунологии
1718 : леди Мэри Уортли Монтегю, жена британского посла в Константинополе, наблюдала положительное влияние вариационной инфекции — преднамеренного заражения оспой — на местное население и проводила технику на своих собственных детях.
1796 : Эдвард Дженнер был первым, кто продемонстрировал вакцину против оспы.
1840 : Якоб Хенле выдвинул первое современное предложение о микробной теории болезни.
1857-1870 : роль микробов в ферментации была подтверждена Луи Пастером.
1880-1881 : Была разработана теория, что бактериальную вирулентность можно использовать в качестве вакцин. Пастер применил эту теорию на практике, экспериментируя с вакцинами против куриной холеры и сибирской язвы.5 мая 1881 года Пастер привил 24 овцам, одной козе и шести коровам пять капель живой аттенуированной сибирской язвы.
1885 : Джозефу Мейстеру, 9 лет, инъецировали ослабленную вакцину против бешенства Пастера после укуса бешеной собакой. Он первый известный человек, переживший бешенство.
1886 : американский микробиолог Теоболд Смит продемонстрировал, что убитые теплом культуры куриной палочки при холере были эффективными в защите от холеры.
1903 : Морис Артус описал локализующую аллергическую реакцию, которая теперь известна как реакция Артуса.
1949 : Джон Эндерс, Томас Уэллер и Фредерик Роббинс экспериментировали с ростом вируса полиомиелита в культуре тканей, нейтрализацией с помощью иммунных сывороток и демонстрацией ослабления нейровирулентности при повторяющемся прохождении.
1951 : разработана вакцина против желтой лихорадки.
1983 : ВИЧ (вирус иммунодефицита человека) был обнаружен французским вирусологом Люком Монтанье.
1986 : вакцина против гепатита В была получена с помощью генной инженерии.
2005 : Ян Фрейзер разработал вакцину против вируса папилломы человека.
Дополнительные ресурсы:
Эта статья носит исключительно информационный характер и не предназначена для предоставления медицинских консультаций. Эта статья была обновлена 17 октября 2018 года редактором журнала Live Science Health Сарой Миллер.
,иммунная система | Описание, функции и факты
Иммунная система , сложная группа защитных реакций у людей и других продвинутых позвоночных, которая помогает отталкивать болезнетворные организмы (патогены). Иммунитет от болезней фактически обеспечивается двумя системами совместной защиты, называемыми неспецифическим, врожденным иммунитетом и специфическим приобретенным иммунитетом. Неспецифические защитные механизмы одинаково отталкивают все микроорганизмы, в то время как специфические иммунные ответы приспособлены к определенным типам захватчиков.Обе системы работают вместе, чтобы препятствовать проникновению и размножению организмов в организме. Эти иммунные механизмы также помогают устранить аномальные клетки организма, которые могут развиться в рак.
Иммунная стимуляция активированными хелперными T-клетками Стимуляция иммунного ответа активированными хелперными T-клетками. Активированный в результате сложного взаимодействия с молекулами на поверхности макрофагов или некоторых других антиген-презентирующих клеток, хелперная Т-клетка пролиферирует в два общих подтипа, T H 1 и T H 2.Это, в свою очередь, стимулирует сложные пути клеточного иммунного ответа и гуморального иммунного ответа соответственно. Encyclopædia Britannica, Inc.Британика Викторина
Тело человека
Какая часть человеческого тела состоит из крови?
В следующих разделах подробно объясняется, как функционирует неспецифический и специфический иммунитет и как развивалась иммунная система.Для получения информации о том, как эти системы могут выйти из строя и привести к болезни, см. расстройство иммунной системы. Для получения дополнительной информации о лейкемиях, лимфомах и миеломах, см. рак.
Механизмы иммунной системы
Большинство микроорганизмов, встречающихся в повседневной жизни, отталкиваются до того, как они вызывают обнаруживаемые признаки и симптомы заболевания. Эти потенциальные патогены, которые включают вирусы, бактерии, грибы, простейшие и червей, весьма разнообразны, и поэтому неспецифическая защитная система, которая одинаково отклоняет все типы этой разнообразной микроскопической орды, весьма полезна для организма.Врожденная иммунная система обеспечивает этот вид неспецифической защиты с помощью ряда защитных механизмов, которые включают физические барьеры, такие как кожа, химические барьеры, такие как антимикробные белки, которые наносят вред или уничтожают захватчиков, и клетки, которые атакуют чужеродные клетки и клетки организма, в которых содержатся инфекционные агенты. , Детали того, как работают эти механизмы для защиты организма, описаны в следующих разделах.
Клональная селекция В-клетки Клональная селекция В-клетки.Активируемая связыванием антигена со специфическим соответствующим рецептором на своей поверхности, В-клетка пролиферирует в клон. Некоторые клональные клетки дифференцируются в плазматические клетки, которые являются короткоживущими клетками, которые секретируют антитело против антигена. Другие образуют клетки памяти, которые живут дольше и которые, быстро размножаясь, помогают обеспечить эффективную защиту при повторном воздействии антигена. Encyclopædia Britannica, Inc.Внешние барьеры для инфекции
Кожа и слизистые оболочки дыхательных путей, желудочно-кишечного тракта и мочеполовой системы обеспечивают первую линию защиты от вторжения микробов или паразитов.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской. Подпишитесь сегодняКожа человека имеет жесткий наружный слой клеток, которые вырабатывают кератин. Этот слой клеток, который постоянно обновляется снизу, служит механическим барьером для инфекции. Кроме того, железы в коже выделяют жирные вещества, которые включают жирные кислоты, такие как олеиновая кислота, которые могут убивать некоторые бактерии; Кожные железы также выделяют лизоцим, фермент (также присутствует в слезах и слюне), который может разрушать внешнюю стенку некоторых бактерий.Жертвы сильных ожогов часто становятся жертвами инфекций от обычно безвредных бактерий, что свидетельствует о важности неповрежденной, здоровой кожи для здоровой иммунной системы.
Подобно внешнему слою кожи, но гораздо более мягкому, слизистые оболочки дыхательных, желудочно-кишечных и мочеполовых путей создают механический барьер для клеток, которые постоянно обновляются. В слизистой оболочке дыхательных путей имеются клетки, которые выделяют слизь (мокроту), которая улавливает мелкие частицы. Другие клетки в стенке дыхательных путей имеют небольшие волосяные выступы, называемые ресничками, которые постоянно бьются широким движением, которое продвигает слизь и любые захваченные частицы вверх и наружу из горла и носа.Также в слизи присутствуют защитные антитела, которые являются продуктами специфического иммунитета. Клетки в слизистой оболочке желудочно-кишечного тракта выделяют слизь, которая, помимо содействия прохождению пищи, может задерживать потенциально вредные частицы или препятствовать их прикреплению к клеткам, которые составляют слизистую оболочку кишечника. Защитные антитела секретируются клетками, лежащими в основе желудочно-кишечного тракта. Кроме того, слизистая оболочка желудка выделяет соляную кислоту, которая достаточно сильна, чтобы убить много микробов.
Химические барьеры для инфекции
Некоторые микробы проникают через защитные барьеры организма и проникают во внутренние ткани. Там они сталкиваются с различными химическими веществами, которые могут препятствовать их росту. Эти вещества включают химические вещества, защитные эффекты которых связаны с их основной функцией в организме, химические вещества, основная функция которых заключается в нанесении вреда или уничтожении захватчиков, и химические вещества, производимые естественными бактериями.
Химикаты со случайными защитными эффектами
Некоторые из химических веществ, участвующих в нормальных процессах организма, напрямую не участвуют в защите организма от болезней.Тем не менее, они помогают отразить захватчиков. Например, химические вещества, которые ингибируют потенциально повреждающие пищеварительные ферменты, высвобождаемые из клеток организма, которые погибли в ходе естественного развития событий, также могут ингибировать аналогичные ферменты, продуцируемые бактериями, тем самым ограничивая рост бактерий. Другим веществом, обеспечивающим защиту от микробов в связи с его основной клеточной ролью, является трансферрин белка крови. Обычная функция трансферрина — связывать молекулы железа, которые всасываются в кровоток через кишечник, и доставлять железо в клетки, которым требуется минерал для роста.Защитное преимущество трансферрина дает результат того факта, что бактериям, подобно клеткам, для роста необходимо свободное железо. Однако при связывании с трансферрином железо недоступно для вторгающихся микробов, и их рост сдерживается.
Антимикробные белки
Ряд белков вносит непосредственный вклад в систему неспецифической защиты организма, помогая уничтожать вторгающиеся микроорганизмы. Одна группа таких белков называется комплементом, потому что она работает с другими защитными механизмами организма, дополняя их усилия по искоренению захватчиков.Многие микроорганизмы могут активировать комплемент способами, которые не включают специфический иммунитет. После активации белки комплемента работают вместе, чтобы лизировать или разрушать вредные инфекционные организмы, не имеющие защитных оболочек. Другие микроорганизмы могут избегать этих механизмов, но становятся жертвами клеток-падальщиков, которые поглощают и уничтожают инфекционные агенты, и механизмами специфического иммунного ответа. Дополнение взаимодействует как с неспецифическими, так и с конкретными системами защиты.
,