Знакомые с коронавирусом Т-клетки нашлись не только у переболевших
Shomuradova et al. / Immunity
Российские ученые сравнили иммунный ответ на коронавирус у болевших и не болевших COVID-19 людей и обнаружили, что Т-клетки последних тоже часто узнают вирус, но антител к нему у них нет. Это подтверждает идею о том, что организм вполне может справиться с вирусом при помощи одного Т-клеточного ответа, свежеприобретенного или полученного при знакомстве со старыми сезонными коронавирусами. Кроме этого, ученым удалось определить участки белков коронавируса, на которые Т-клетки реагируют чаще всего, и соответствующие им популярные варианты Т-клеточных рецепторов. Результаты этой работы, вышедшей в журнале
О том, что Т-клеточный ответ при COVID-19 играет важную роль, известно еще с весны. В пользу этого говорит отсутствие положительной корреляции между низким уровнем антител и тяжестью заболевания; кроме того, у некоторых переболевших антитела к SARS-CoV-2 вообще найти не удается. В этих случаях человек может справиться с вирусом за счет другой части иммунной системы — Т-клеток. В ходе болезни они учатся распознавать патогена, самостоятельно уничтожают больные клетки и руководят другими участниками иммунного ответа.
Если человек, иммунная система которого защищалась от вируса T-клетками, перенес инфекцию бессимптомно и не сдал вовремя ПЦР-тесты, то понять, переболел ли он в действительности, с помощью теста на антитела не удастся.
В лаборатории активность Т-клеток в ответ на узнавание патогена измеряют при помощи технологии ELISPOT. Активируясь, Т-клетки начинают выделять цитокины, и эти цитокины можно «поймать» при помощи стандартных лабораторных антител. Комплексы цитокин-антитело подсчитывают и по этому оценивают были ли в образце Т-клетки, узнающие ту или иную деталь вируса.
Чтобы подробнее разобраться в иммунном ответе, группа исследователей из НМИЦ Гематологии во главе с Григорием Ефимовым проверила антительный и Т-клеточный ответ на белки коронавируса на трех видах образцов. Первые образцы получили весной от 34 переболевших COVID-19, вторые были собраны тогда же у 7 не болевших, а третью группу образцов (10 образцов плазмы и 10 клеток крови) взяли из коллекций 2017 и 2019 годов.
Оказалось, что у большинства переболевших есть как антитела ко всем трем проверенным белкам коронавируса, так и специфичные к вирусу Т-киллеры и Т-хелперы — два вида Т-клеток. Но у части пациентов ответ оказался неполным: у пары человек не нашли нужных антител вообще, а у других пациентов не было какого-нибудь из видов Т-клеток.
Если сравнить результаты между болевшими и не болевшими, то можно заметить, что у вторых антитела можно обнаружить только в значительно меньших количествах — и, в основном, к самому консервативному N белку. При этом во многих образцах есть Т-клетки, способные «включаться» при взаимодействии с деталями SARS-CoV-2, и таких образцов в 2020 году заметно больше.
По словам первого автора статьи Алины Шомурадовой, природа такого ответа может быть разной: «Т-клеточный ответ может наблюдаться из-за того, что активируются клетки иммунологической памяти на другие коронавирусы, которые существовали вокруг нас и до 2019 года. Или, например, эти люди на самом деле перенесли COVID-19 бессимптомно и не выработали к вирусу антитела».
Уровни антител к трем белкам SARS-CoV-2 в трех группах образцов
Shomuradova et al. / Immunity
Уровни индикатора активации Т-киллеров(CD8+) и Т-хелперов(CD4+) интерферона гамма в трех группах образцов
Shomuradova et al. / Immunity
Препринт этой работы появился еще в мае, и за лето многие другие исследователи независимо пришли к выводу о том, что у значительной части людей с отрицательными ПЦР-тестами, тестами на антитела и без симптомов есть Т-клетки, способные активироваться при встрече с SARS-CoV-2. Для правильной диагностики таких людей необходимо понять, какие именно участки коронавируса Т-клетки узнают чаще всего, и уже на их основе создавать коммерческие тесты. Чтобы атаковать патоген, Т-клетка должна сперва увидеть его детали на HLA-рецепторах пораженной клетки, а потом еще и узнать его при помощи своего рецептора (TCR). Не все участки коронавирусных белков для этого подходят.Сравнительное количество клеток, узнающих каждый из 13 коронавирусных эпитопов у разных доноров
Shomuradova et al. / Immunity
/ Immunity
Вера Мухина
Иммунологический «ликбез»
Не последнюю роль в отказе от иммунных препаратов играет и то, что большинством врачей иммунология воспринимается как сложнейшая, не подлежащая восприятию «китайская грамота». Каждый из нас неоднократно изучал учебник иммунологии, и каждый раз – как первый, начиная с полнейшей «стерильности», отсеивал мелкие, потребные только специалистам детали, отбивающие охоту продолжать изучение у любого самого прилежного читателя, но занимающие десятки страниц текста. Поэтому позволим себе начать с азов и представить адаптированный вариант «учения об иммунитете»; он поможет в дальнейшем разобраться с механизмом действия иммунных препаратов без каких-либо ограничений.
Организм человека имеет несколько барьеров, препятствующих проникновению инфекционного агента, распознающих его и уничтожающих. Факторы защиты постоянно взаимодействуют и подразделяются на конституциональные, или врожденные, и индуцированные, или приобретенные.
Факторы защиты постоянно взаимодействуют и подразделяются на конституциональные, или врожденные, и индуцированные, или приобретенные.
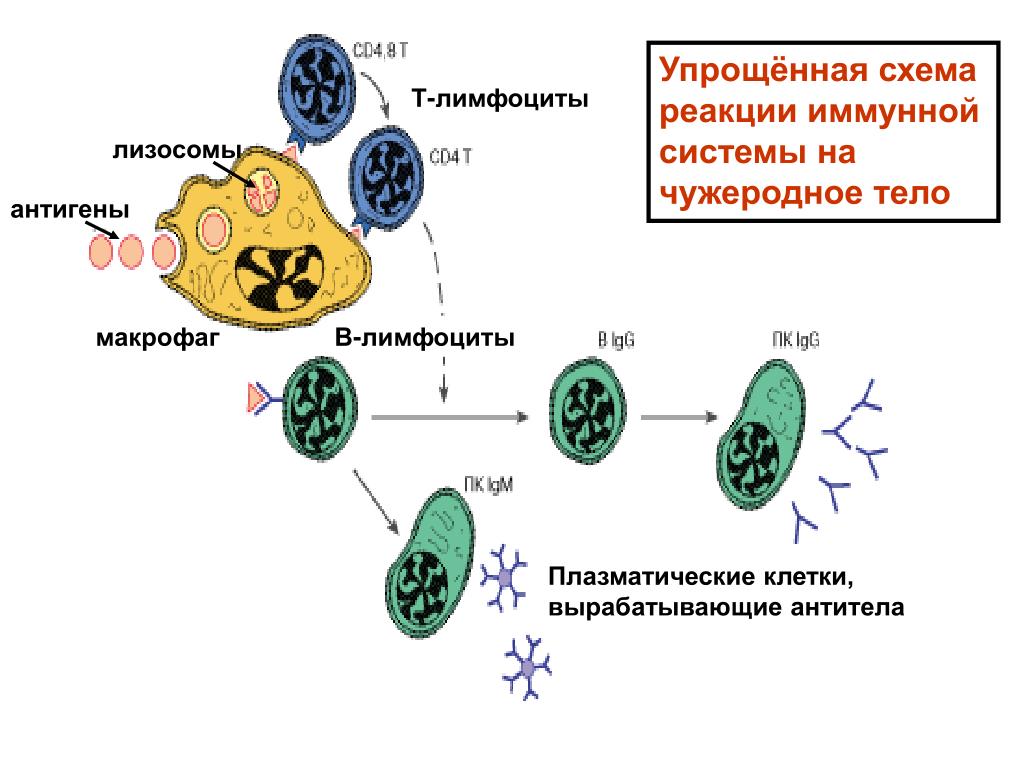
Конституциональные факторы объединяет неспецифичность действия, и, в свою очередь, они подразделяются на механические барьеры (кожа и слизистые), физико-химические (секреты желез кожи и слизистых) и иммунобиологические (гуморальные и клеточные). Реакции неспецифического иммунитета не обладают памятью, не направлены против определенного агента. Их основная роль – защита от любого агента. Это первая линия защиты, вторая – иммунная система, представляющая собой совокупность органов, тканей и клеток, обеспечивающих генетическое и структурное постоянство организма. Задача первой линии защиты – не допустить проникновение болезнетворного агента, а если он проник – вывести. Активацию факторов иммунобиологической резистентности организма вызывают бактериальные продукты, многие цитокины и антитела, компоненты комплимента. Главную роль играют фаготирующие клетки и система комплимента.
Фаготирующие клетки поглощают, разрушают чужеродный агент и выводят его из организма. Фагоциты представляют собой гранулоциты крови (нейтрофилы, эозинофилы и базофилы) и моноциты, которые циркулируют 1-2 дня в крови, затем мигрируют в ткани и становятся макрофагами.
Основные функции системы комплимента, состоящей из 26 сывороточных белков, – стимуляция фагоцитоза, нарушение целостности клеточных стенок микроорганизмов, воспроизводство медиаторов воспаления. Поочередно компоненты комплимента взаимодействуют с антигеном или комплексом антиген-антитело, образуя на мембране микроба повреждающий комплекс, разрушающий его.
Фагоцитоз – процесс поглощения и переваривания микроорганизмов, чужеродных частиц и клеток, состоит из четырех последовательных стадий: хемотаксис (процесс передвижения фагоцита к максимальной концентрации активирующих стимулов), адгезия (приклеивание к чужеродному агенту), поглощение и уничтожение.
К другим факторам неспецифической резистентности относятся интерфероны, естественные антитела и факторы, выделяющиеся при разрушении клеток, проявляющие бактерицидное действие (лейкины, плакины). Принципы структурного постоянства основаны на способности распознавания «свой – чужой», для чего на поверхности клеток имеются рецепторы, составляющие главный комплекс гистосовместимости – МНС. При изменении рецепторов иммунная система реагирует на клетку как на чужака. Оптимальное функционирование системы обеспечивают механизмы взаимодействия лимфоидных клеток и макрофагов, как непосредственно, так и с помощью посредников – медиаторов. Макрофаги, поглотившие и расщепившие чужеродный агент, представляют его лимфоцитам и выделяют цитокины, то есть передают информацию на вторую линию защиты [12].
Цитокины – это 18 белков межклеточного взаимодействия, вырабатываемые различными клетками. Многие цитокины оказывают сходное действие, в то же время каждый из них способен действовать на разные типы клеток. Каждый цитокин выполняет множество функций. Важно то, что цитокины осуществляют взаимодействие между клетками, они же регулируют пролиферацию, дифференцировку, активацию клеток иммунной системы и развитие иммунного ответа [13,55].
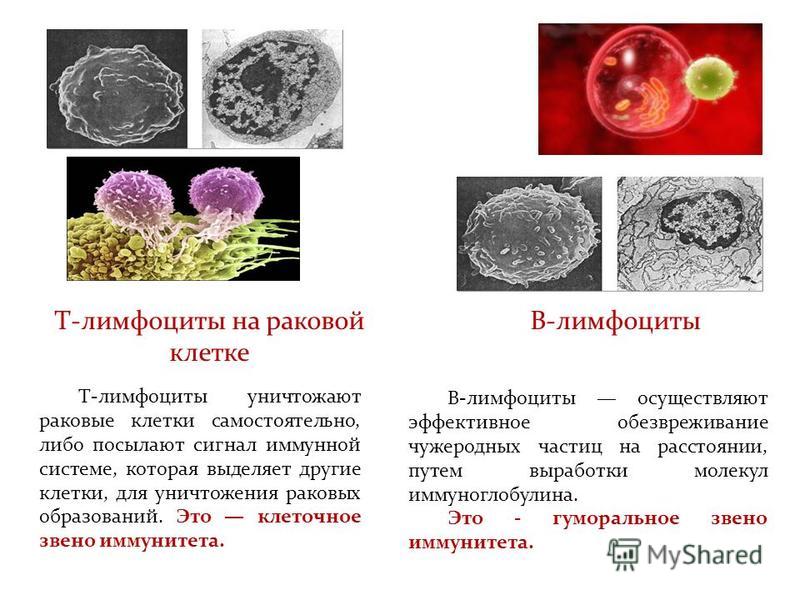
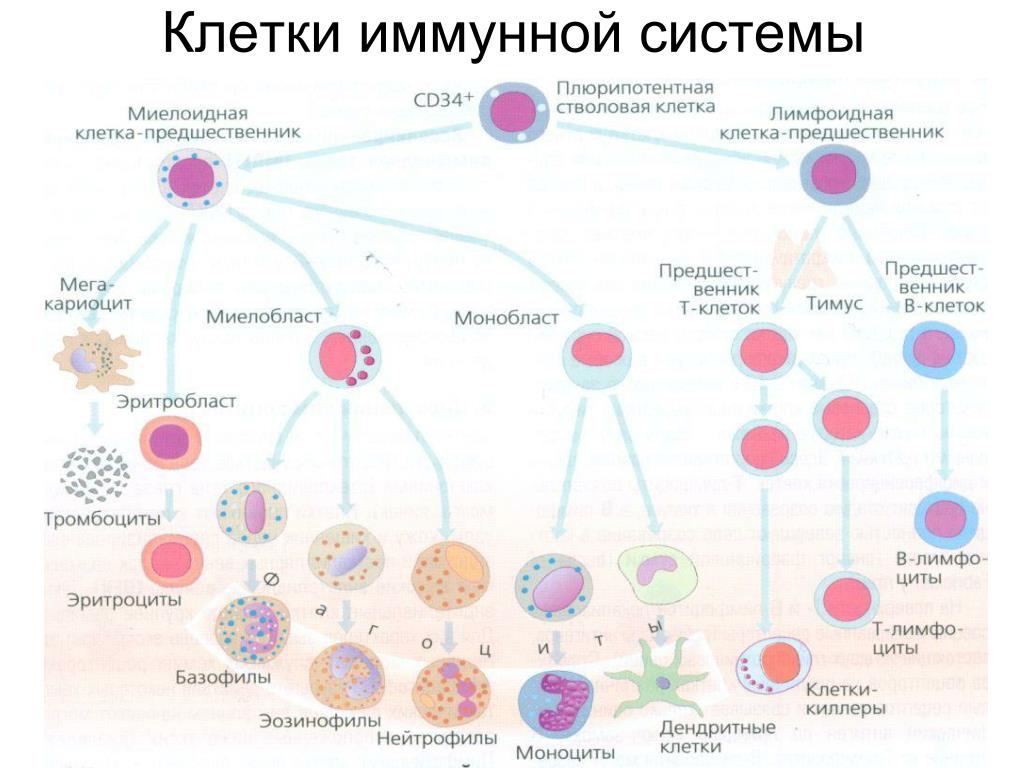
Ко второй линии защиты принадлежат органы иммунной системы и клетки, ими вырабатываемые, – лимфоциты. В центральных органах иммунной системы (костный мозг и тимус) осуществляется лимфопоэз, в периферических (селезенка, лимфоузлы, лимфоидная ткань) зрелые лимфоциты взаимодействуют между собой, антигенами и вспомогательными клетками. Лимфоциты, распознающие свои и чужеродные антигены, имеют одинаковую морфологию, но разные функции, поверхностно-клеточные маркеры, индивидуальное развитие (по клонам) и судьбу: Т-лимфоциты, В-лимфоциты и естественные киллеры (NK-клетки). Взаимодействие иммунокомпетентных клеток с другими регулируют медиаторы иммунного ответа – цитокины.
Т-лимфоцит происходит из предшественника, тот, в свою очередь, – из стволовой клетки. Созревание Т-лимфоцита завершается в детстве, далее популяция поддерживается только за счет пролиферации зрелых форм. В-лимфоциты, моноциты и гранулоциты созревают на протяжении всей жизни человека в костном мозге из стволовой клетки.
Т-лимфоциты выполняют различные функции, по этому признаку их подразделяют на субпопуляции, каждая из которых имеет свои специфические поверхностные белковые молекулы: Т-хелперы, Т-супрессоры, Т-киллеры (цитотоксические Т-лимфоциты – ЦТЛ), Т-клетки памяти. Т-хелперы распознают антигены, взаимодействуют с макрофагами и В-лимфоцитами. Т-супрессоры регулируют интенсивность иммунного ответа, предотвращая развитие аутоиммунных реакций. Т-киллеры, или ЦТЛ, лизируют клетки-мишени. Т-лимфоциты осуществляют свои функции, секретируя различные факторы (цитокины и хемокины). А представляют антиген лимфоцитам макрофаги и дендритные клетки.
В-лимфоциты имеют две субпопуляции: предшественники антителообразующих клеток, которые после антигенной стимуляции дифференцируются в плазматические клетки (синтезирующие антитела), и В-клетки памяти. На поверхности В-лимфоцита находятся рецепторы, распознающие антиген, – иммуноглобулины, состоящие из нескольких цепей и подразделяющиеся по виду цепей на пять классов.
Естественные киллеры, или NK-клетки, представляют собой большие зернистые лимфоциты, уничтожающие опухолевые клетки и клетки, поврежденные вирусами, бактериями и простейшими. Эти клетки неспособны к фагоцитозу, поэтому уничтожают инородный агент другим способом. NK-клетки выделяют встраивающиеся в поверхностную мембрану клетки-мишени порфирины, что выравнивает ионный состав цитоплазмы и внешней среды и приводит к гибели клетки. Активность NK-клеток регулируют цитокины. Активация лимфоцитов – многоступенчатый процесс, развивающийся в следующем направлении: получение сигнала, его внутриклеточная передача, пролиферация, дифференцировка и реализация функций лимфоцитов [14].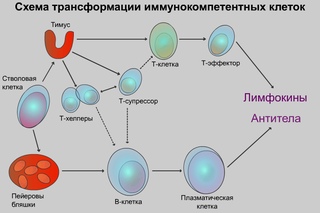
Иммунные реакции традиционно, хотя и весьма условно, разделяют на гуморальные (реализуются циркулирующими в средах организма антителами, произведенными плазматическими клетками) и клеточные (реализуются при непосредственном контакте иммунокомпетентных клеток путем выделения цитокинов и хемокинов) [13].
В норме реакция на чужеродный агент проходит четыре стадии:
- миграция лейкоцитов к месту внедрения;
- специфическое, посредством Т- и В-лимфоцитов, и неспецифическое, посредством макрофагов, связывание антигена и активация комплемента;
- накопление в месте внедрения антигена специфических и неспецифических клеток-эффекторов, их активация комплементом, цитокинами, кининами и метаболитами;
- фагоцитоз макрофагами и нейтрофилами или лизис Т-лимфоцитами и NK-клетками [14].
Мещерякова Н.Г.
Реконституция Т-клеточного звена иммунной системы у больных после трансплантации аллогенных гемопоэтических стволовых клеток | Попова
Введение
В настоящее время трансплантация аллогенных гемопоэтических стволовых клеток (алло-ТГСК) является единственным методом лечения, позволяющим достичь биологического излечения больных различными гемобластозами, аплазиями кроветворения, первичными иммунодефицитами. В ее основе лежит перенос не только кроветворной, но и донорской иммунной системы реципиенту. Если восстановление кроветворения у реципиентов аллогенных гемопоэтических стволовых клеток (ГСК) происходит в течение первого месяца после алло-ТГСК, то восстановление иммунной системы занимает несколько лет [1].
С «неполной» реконституцией, то есть в первую очередь неполным восстановлением количества иммуно- компетентных клеток, связано развитие различных осложнений, и в первую очередь тяжелых инфекционных осложнений как в раннем посттрансплантационном периоде (до +100 дня после алло-ТГСК), так и в более позднем [2]. Кроме этого, функциональные особенности и взаимодействие различных иммунокомпетентных клеток обусловливают развитие иммунологических реакций — «трансплантат против опухоли» (РТПО) и «трансплантат против хозяина» (РТПХ) [3, 4].
Условно весь посттрансплантационный период можно разделить на несколько этапов. Первый — этап до приживления трансплантата (англ. pre-engraftment), который занимает 30 дней после инфузии аллогенных ГСК реципиенту. Это время характеризуется полной аплазией кроветворения, что, как правило, сопровождается развитием различных инфекционных осложнений. Проведение адекватной противомикробной терапии в этот период и постепенное восстановление моноцитов и гранулоцитов позволяют успешно контролировать эти осложнения в самом раннем периоде после алло-ТГСК [2, 5].
Второй этап включает в себя непосредственно приживление трансплантата и последующий ранний посттрансплантационный период, который занимает от +30 до +100 дня (англ. post-engraftment). Это время характеризуется глубоким клеточным и гуморальным иммунодефицитом, что также сопровождается частыми инфекционными осложнениями, среди которых зачастую превалируют вирусные инфекции. Другой частой проблемой в этом периоде является развитие острой РТПХ. Именно на этом этапе начинается восстановление различных иммунокомпетентных клеток, таких как цитотоксические CD8+ Т-клетки, CD4+ Т-хелперы, NK-клетки, Т-регуляторные клетки (Treg) (табл. 1). Полное восстановление же этих субпопуляций и других иммунокомпетентных клеток происходит в позднем посттрансплантационном периоде, который занимает от 6 месяцев до нескольких лет [5, 6].
Таблица 1. Период восстановления различных субпопуляций клеток иммунной системы после алло-ТГСК [5, 6]
Table 1. Time of different immune cells recovery after allo-HSCT
Субпопуляция клеток | Время от алло-ТГСК до восстановления нормального уровня |
|---|---|
Subsets of immune cells | Time from allo-HSCT to full immune recovery |
Натуральные киллеры (NK-клетки) | От 1 мес до 6 мес |
Natural killers (NK) | From 1 to 6 months |
CD4+ Т-хелперы | Более 24 мес |
CD4+ Т cells | More than 24 months |
Цитотоксические CD8+ Т-клетки | От 1 до 18 мес |
Cytotoxic CD8+ Т cells | From 1 to 18 months |
Т-регуляторные клетки (Treg) | От 1 до 6 нед |
Regulatory T cells (Treg) | From 1 to 6 weeks |
Т-наивные клетки | От 8 до 9 мес |
Naive T cells | From 8 to 9 months |
T-клетки памяти | Более 24 мес |
Memory T cells | More than 24 months |
В-клетки (CD19+) | От 4 до 24 мес |
CD19+ В cells | From 4 to 24 months |
Целью данного обзора является описание основных этапов восстановления Т-клеточного звена иммунной системы у больных после трансплантации аллогенных гемопоэтических стволовых клеток.
Реконституция Т-клеточного звена иммунной системы после трансплантации аллогенных гемопоэтических стволовых клеток
Защита от инфекционных агентов и противоопухолевый контроль в первую очередь зависят от реконституции Т-клеточного звена иммунной системы. Сам процесс его восстановления условно разделяют на два самостоятельных пути: тимус-зависимый и тимус-независимый. В первый месяц после алло-ТГСК восстановление лимфоцитов происходит по тимус- независимому пути, то есть за счет зрелых донорских Т-клеток, которые содержались в самом трансплантате и были перелиты реципиенту вместе с ГСК, и в меньшей степени — за счет экспансии ранее существовавших хозяйских наивных Т-клеток и Т-клеток памяти, которые «выжили» после проведенного кондиционирования [7]. Экспансия как донорских, так и «хозяйских» Т-клеток происходит в ответ на высокую концентрацию интерлейкина (ИЛ)-7 и ИЛ-15, которые вырабатываются самими Т-клетками в условиях лимфопении. Этот процесс называют «гомеостатической пролиферацией», которая носит компенсаторный характер и позволяет на какое-то время «восполнить» Т-клеточный дефицит [8]. Однако при такой пролиферации не меняется репертуар Т-клеточного рецептора (ТКР), так как эти клетки уже являются функционально зрелыми. Кроме этого, такая пролиферация не заменяет периферический пул наивных Т-клеток у реципиента на донорский, так как в случае пролиферации в условиях лимфопении наивные Т-клетки трансформируются в клетки, подобные клеткам памяти (memory-like), утрачивая при этом фенотип наивных Т-клеток. Таким образом, иммунный ответ является ограниченным ввиду ограниченного репертуара ТКР [7, 9, 10]. Образование нового пула Т-клеток при таком пути реконституции не происходит, а в связи с тем что существование «хозяйских» Т-клеток и донорского Т-компартмента ограниченно по времени (3—6 месяцев), то в результате иммунный ответ, который реализуется этими клетками, носит преходящий характер [7].
Образование Т-клеток de novo происходит по тимус- зависимому пути (рис. 1). Для дальнейшего созревания и пролиферации вновь образованные Т-клетки в костном мозге с током крови переносятся в тимус. Эти незрелые клетки являются предшественниками Т-лимфоцитов. Они не несут на своей поверхности никакого определяющего рецептора (CD3 CD4 CD8 ), в связи с чем их называют «трижды негативными» тимоцитами, или пре-Т-клетками. Дальнейшее созревание этих клеток условно можно разделить на два этапа. Первый этап происходит в кортикальном слое тимуса, где эти клетки активно делятся и пролиферируют под действием различных цитокинов, в первую очередь ИЛ-7, который вырабатывается кортикальными эпителиальными клетками [11]. Считается, что именно ИЛ-7 кортикальных эпителиальных клеток регулирует процесс дифференцировки тимоцитов, а именно формирование ТКР, который представляет собой поверхностный гетеродимерный белок, состоящий из двух субъединиц (α-, β- или γ-, δ-) , с помощью которого Т-клетка распознает и связывается с антигеном [12].
1). Для дальнейшего созревания и пролиферации вновь образованные Т-клетки в костном мозге с током крови переносятся в тимус. Эти незрелые клетки являются предшественниками Т-лимфоцитов. Они не несут на своей поверхности никакого определяющего рецептора (CD3 CD4 CD8 ), в связи с чем их называют «трижды негативными» тимоцитами, или пре-Т-клетками. Дальнейшее созревание этих клеток условно можно разделить на два этапа. Первый этап происходит в кортикальном слое тимуса, где эти клетки активно делятся и пролиферируют под действием различных цитокинов, в первую очередь ИЛ-7, который вырабатывается кортикальными эпителиальными клетками [11]. Считается, что именно ИЛ-7 кортикальных эпителиальных клеток регулирует процесс дифференцировки тимоцитов, а именно формирование ТКР, который представляет собой поверхностный гетеродимерный белок, состоящий из двух субъединиц (α-, β- или γ-, δ-) , с помощью которого Т-клетка распознает и связывается с антигеном [12].
Рисунок 1. Тимус-зависимый путь образования Т-клеток [11, 13-17 20, 21 ]
Figure 1. Thymus-dependent pathway for the formation of T cells [11, 13-17, 20, 21]
1. Образование предшественников Т-клеток в костном мозге.
Development of T-cell precursors in the bone marrow.
2. Миграция предшественников Т-клеток в корковое вещество тимуса.
T-cell precursors migrate to the thymus cortex.
3. Реаранжировка ТКР
T-cell receptor gene rearrangement.
4. Позитивная тимическая селекция.
Positive selection of T cells in the thymus
5. Негативнаятимическаяселекция. Negative selection of T cells in the thymus.
6. Выход Т-клеток в периферическую кровь.
T cells moving to the peripheral blood.
В основе дифференцировки тимоцитов лежит процесс V(D) J-реаранжировки, результатом которого и является формирование ТКР. Гены ТКР состоят из сегментов, которые относятся к трем классам: V — отвечающий за «вариабельность», D — отвечающий за «разнообразие» и J — отвечающий за «связывание». В процессе перестройки гены из каждого сегмента связываются друг с другом и образуют один экзон, который кодирует вариабельный участок ТКР, отвечающий за распознавание и связывание антигена. У млекопитающих в результате V(D)J-реаранжировки образуется несколько основных комбинации генов, которые называются локусами антигенных рецепторов, — это TCRB (локус β-цепи), TCRG (локус γ-цепи), которые располагаются на 7- й хромосоме, и α/δ-локус ТКР, расположенный на 14-й хромосоме; α/δ-локус, в свою очередь, состоит из двух локусов: TCRA и TDRD. При этом гены TDRD располагаются внутри локуса TCRA [13]. Если при перестройке происходит формирование ло- куса TCRB, то в результате эта клетка будет экспрессировать ТКР, состоящий из β-цепи. Одномоментно с этим происходит подавление экспрессии генов других локусов TCRG и TDRD и запускается перестройка локуса TCRA, которая заключается в «вырезании» генов локуса TCRD, что приводит к формированию ТКР, состоящего из α- и β-цепей, и экспрессии CD4+ и CD8+ на поверхности Т-клетки [14]. Образовавшиеся CD4+CD8+ Т-клети называются «дважды позитивными» Т-клетками, а сам процесс — «позитивной тимической селекцией». Результатом этого процесса является формирование ТКР, с помощью которого «дважды позитивные» Т-клетки могут распознавать рецепторы гистосовместимости собственных клеток микроокружения, что нужно для последующего адекватного взаимодействия Т-клеток с антиген-презентирующими клетками уже в контексте распознавания антигенов. До 75 % клеток, которые вступают в процесс позитивной селекции, подвергаются апоптозу ввиду неадекватной реаранжировки ТКР [15]. После этого CD4+CD8+ T- клетки мигрируют в мозговой слой тимуса, где при взаимодействии с антигенами эпителиальных тимических клеток происходит второй этап дифференцировки этих клеток [16].
В процессе перестройки гены из каждого сегмента связываются друг с другом и образуют один экзон, который кодирует вариабельный участок ТКР, отвечающий за распознавание и связывание антигена. У млекопитающих в результате V(D)J-реаранжировки образуется несколько основных комбинации генов, которые называются локусами антигенных рецепторов, — это TCRB (локус β-цепи), TCRG (локус γ-цепи), которые располагаются на 7- й хромосоме, и α/δ-локус ТКР, расположенный на 14-й хромосоме; α/δ-локус, в свою очередь, состоит из двух локусов: TCRA и TDRD. При этом гены TDRD располагаются внутри локуса TCRA [13]. Если при перестройке происходит формирование ло- куса TCRB, то в результате эта клетка будет экспрессировать ТКР, состоящий из β-цепи. Одномоментно с этим происходит подавление экспрессии генов других локусов TCRG и TDRD и запускается перестройка локуса TCRA, которая заключается в «вырезании» генов локуса TCRD, что приводит к формированию ТКР, состоящего из α- и β-цепей, и экспрессии CD4+ и CD8+ на поверхности Т-клетки [14]. Образовавшиеся CD4+CD8+ Т-клети называются «дважды позитивными» Т-клетками, а сам процесс — «позитивной тимической селекцией». Результатом этого процесса является формирование ТКР, с помощью которого «дважды позитивные» Т-клетки могут распознавать рецепторы гистосовместимости собственных клеток микроокружения, что нужно для последующего адекватного взаимодействия Т-клеток с антиген-презентирующими клетками уже в контексте распознавания антигенов. До 75 % клеток, которые вступают в процесс позитивной селекции, подвергаются апоптозу ввиду неадекватной реаранжировки ТКР [15]. После этого CD4+CD8+ T- клетки мигрируют в мозговой слой тимуса, где при взаимодействии с антигенами эпителиальных тимических клеток происходит второй этап дифференцировки этих клеток [16].
Второй этап созревания αβ Т-клеток заключается в формировании функциональной зрелости этих клеток, которая определяется способностью распознавать рецепторы главного комплекса гистосовместимости (ГКГ — MHC, major histocompatibility complex). Большая часть (около 90 %) αβ Т-клеток связывается с молекулами ГКГ, которые презентируются клетками микроокружения, — это эпителиальные кортикальные клетки, фибробласты, макрофаги и дендритные клетки [15]. В зависимости от того, с каким рецептором ГКГ связывается Т-клетка, она превращается или СD8+ (связываются с молекулами ГКГ I класса) или СD4+ (связываются с рецептором ГКГ II класса). Этот процесс называют «негативной тимической селекцией», который является ключевым механизмом формирования Т-клеточной центральной иммунологической толерантности, то есть невосприимчивости к собственным тканям [17]. Часть CD4+CD8+ Т-клеток при взаимодействии с эпителиальными кортикальными клетками начинает экспрессировать транскрипционный фактор Foxp3, что в дальнейшем определяет формирование отдельной популяции им- мунокомпетентных клеток — популяции CD4+CD25high Т-регуляторных клеток (Treg), которая обеспечивает контроль толерантности к собственным антигенам путем подавления аутореактивных Т-клеток, по каким- то причинам избежавших селекции в тимусе и вышедших на периферию. Помимо этого, Treg регулируют активацию CD4+ и CD8+ Т-клеток, а также подавляют избыточную экспансию эффекторных Т-клеток после элиминации антигена [18, 19].
Большая часть (около 90 %) αβ Т-клеток связывается с молекулами ГКГ, которые презентируются клетками микроокружения, — это эпителиальные кортикальные клетки, фибробласты, макрофаги и дендритные клетки [15]. В зависимости от того, с каким рецептором ГКГ связывается Т-клетка, она превращается или СD8+ (связываются с молекулами ГКГ I класса) или СD4+ (связываются с рецептором ГКГ II класса). Этот процесс называют «негативной тимической селекцией», который является ключевым механизмом формирования Т-клеточной центральной иммунологической толерантности, то есть невосприимчивости к собственным тканям [17]. Часть CD4+CD8+ Т-клеток при взаимодействии с эпителиальными кортикальными клетками начинает экспрессировать транскрипционный фактор Foxp3, что в дальнейшем определяет формирование отдельной популяции им- мунокомпетентных клеток — популяции CD4+CD25high Т-регуляторных клеток (Treg), которая обеспечивает контроль толерантности к собственным антигенам путем подавления аутореактивных Т-клеток, по каким- то причинам избежавших селекции в тимусе и вышедших на периферию. Помимо этого, Treg регулируют активацию CD4+ и CD8+ Т-клеток, а также подавляют избыточную экспансию эффекторных Т-клеток после элиминации антигена [18, 19].
Таким образом, результатом селекции в тимусе является образование зрелых, экспрессирующих ТКР, СD4+ и CD8+ Т-клеток, которые далее выходят в периферическую кровь и разносятся по органам и тканям организма. Эти клетки называют недавними эмигрантами из тимуса (Recent Thymic Emigrant — RTE). Однако зрелые RTE-клетки в то же самое время являются функционально «незрелыми» или наивными Т-клетками, ввиду того что они еще не встречались с чужеродным антигеном [16, 17].
Продукция RTE-клеток зависит от возраста (рис. 2). Известно, что у детей первого года жизни продукция RTE является максимальной, что обеспечивает разнообразие ТКР и в дальнейшем позволяет реализовать иммунный ответ против широкого спектра различных антигенов. По мере взросления выработка RTE постепенно уменьшается, а постоянство периферического Т-клеточного пула происходит не за счет продукции RTE и разнообразия ТКР, а в большей степени за счет пролиферации Т-клеток на периферии [12].
По мере взросления выработка RTE постепенно уменьшается, а постоянство периферического Т-клеточного пула происходит не за счет продукции RTE и разнообразия ТКР, а в большей степени за счет пролиферации Т-клеток на периферии [12].
Рисунок 2. Продукция RTE в зависимости от возраста [12]
Постоянство T-клеточного пула определяется двумя факторами: продукцией RTE и пролиферацией зрелых Т-клеток на периферии. С возрастом выработка наивных Т-клеток с различным репертуаром ТКР в тимусе уменьшается, а постоянство Т-клеточного пула осуществляется за счет зрелых Т-клеток, характеризующихся ограниченным репертуаром ТКР, на периферии.
Figure 2. Output of recent thymic emigrants depending on patients’ age [12]
T-cell homeostasis is determined by two main factors. These are the thymic output of RTE and the proliferation of peripheral T cells. The thymic output of na ve T cells with a diverse repertoire of T-cell receptors decreases with age, and peripheral T-cell homeostasis shifts to proliferation of peripheral mature T cells with a limited T-cell repertoire.
Возможность реализации иммунного ответа определяется не только этапами дифференцировки образующихся Т-клеток в тимусе, но и является антиген-зависимой, так как для реализации своей эффекторной функции CD4+ и CD8+ Т-клетки в дальнейшем должны связаться с антигеном через молекулу ГКГ [17]. Таким образом, эта популяция Т-клеток в дальнейшем формирует адаптивный или вторичный иммунный ответ, то есть иммунный ответ против конкретного антигена.
Другая, существенно меньшая часть αβ Т-клеток взаимодействует не с молекулами ГКГ, а с подобными рецепторами MR1 (Т-клетки, ассоциированные со слизистыми, MAIT) или CD1d (Т-клетки — натуральные киллеры, ИКТ-клетки). МА!Т представляют собой субпопуляцию Т-клеток, которые преимущественно локализуются в слизистых желудочно-кишечного тракта, бронхолегочной системы, а циркулирующий пул составляет не более 10 % от общего числа циркулирующих Т-лимфоцитов. ИКТ-клетки — наименьшая субпопуляция иммунокомпетентных клеток, численность которой не превышает 0,1 % от общего количества циркулирующих Т-клеток. Активация и MAIT и ИКТ-клеток не требует распознавания ГКГ и является антиген-независимой, что обусловливает их способность взаимодействовать с любым антигеном. Эти клетки также отличаются способностью вырабатывать различные цитокины, такие как фактор некроза опухоли (ФНО), интерферон-γ, ИЛ-4, ИЛ-10, ИЛ-17, что позволяет им быстро реализовать цитоток- сическую функцию [20, 21].
ИКТ-клетки — наименьшая субпопуляция иммунокомпетентных клеток, численность которой не превышает 0,1 % от общего количества циркулирующих Т-клеток. Активация и MAIT и ИКТ-клеток не требует распознавания ГКГ и является антиген-независимой, что обусловливает их способность взаимодействовать с любым антигеном. Эти клетки также отличаются способностью вырабатывать различные цитокины, такие как фактор некроза опухоли (ФНО), интерферон-γ, ИЛ-4, ИЛ-10, ИЛ-17, что позволяет им быстро реализовать цитоток- сическую функцию [20, 21].
Если при V (DJ-реаранжировке «дважды негативных» тимоцитов происходит формирование TCRG и TDRD, то в результате Т-клетка экспрессирует ТКР, состоящий из γ- и δ-цепей. γδ Т-клетки не проходят процесс позитивной тимической селекции и выходят в периферическую кровь, не неся на своей поверхности ни CD8, ни CD4 [14]. Поскольку созревание γδ Т-клеток определяется фактически только процессом V (D)J-реаранжировки, их функциональная способность зависит от разнообразия их ТКР, что в результате дает возможность этим клеткам взаимодействовать с любым антигеном, что является ключевым в реализации первичного (врожденного) иммунного ответа [13, 14]. Эти клетки преимущественно локализуются в слизистых, а циркулирующий пул γδ Т-клеток составляет не более 10 % от общего числа Т-лимфоцитов [20].
Таким образом, в результате тимус-зависимого пути образуются две большие группы Т-клеток, функция которых определяется способностью связывания с антигеном и, соответственно, участием в формировании первичного или вторичного иммунного ответа. Большинство Т-клеток взаимодействуют с антигеном с участием молекулы ГКГ (это CD4+ и CD8+ Т-лимфоциты) и участвуют в формировании адаптивного иммунного ответа. Эти клетки также называют конвенциональными Т-клетками. Другая часть Т-клеток, к которой относятся MAIT, NKT-клетки и γδ Т-клетки, являются неконвенциональными Т-клетками, так как для их активации не требуется связывание с антигеном с участием ГКГ, что дает им возможность взаимодействовать фактически с любым антигеном и формирует «первую линию» иммунной защиты, другими словами, первичный иммунный ответ [20, 21].
Эффект алло-ТГСК основан на развитии аллоим- мунной РТПО, которая, по сути, является реализацией иммуноопосредованной реакции против конкретного антигена, в данном случае — опухолевого. Другими словами, феномен биологического излечения больных различными опухолевыми заболеваниями системы крови после алло-ТГСК заключается в восстановлении именно адаптивного иммунитета. После того, как чужеродный антиген впервые попал в организм, происходит его связывание с наивными Т-клетками через ТКР. Связывание антигена с наивной Т-клеткой приводит к ее активации, структурной реорганизации ее мембраны и цитоскелета, ремоделированию хроматина и экспрессии новых генов, изменениям в адгезии и миграции клеток, а также индукции клеточного деления. В результате этих перестроек формируется пул эффекторных Т-клеток, которые и уничтожают этот антиген [22].
Известно, что весь процесс трансформации наивных клеток в эффекторный пул занимает около недели [22, 23]. В исследованиях на мышах было показано, что на 8-й день после инфицирования вирусом лимфоцитарного хориоменингита в периферической крови определяется максимальное количество эффекторных Т-клеток, которые экспрессируют на своей поверхности активационный маркер CD44, утрачивая при этом хоуминг-рецепторы и маркеры адгезии. Помимо этого, эти клетки секретируют различные цитокины, такие как интерферон-γ, посредством которых они реализуют свою цитотоксическую функцию. Нужно отметить, что наивные Т-клетки не экспрессирует CD44 и не секретируют провоспалительные цитокины, что говорит о том, что они не способны к реализации эффекторной функции. Отличительной особенностью наивных Т-клеток является экспрессия как раз хоуминг-рецепторов, например CCR-7 или L-селектина, что дает возможность этим клеткам мигрировать во вторичные лимфоидные органы, где и происходит их финальная трансформация в эффекторные Т-клетки [23, 24].
После элиминации антигена часть эффекторных клеток погибает, а часть переходит в пул долгоживущих Т-клеток памяти.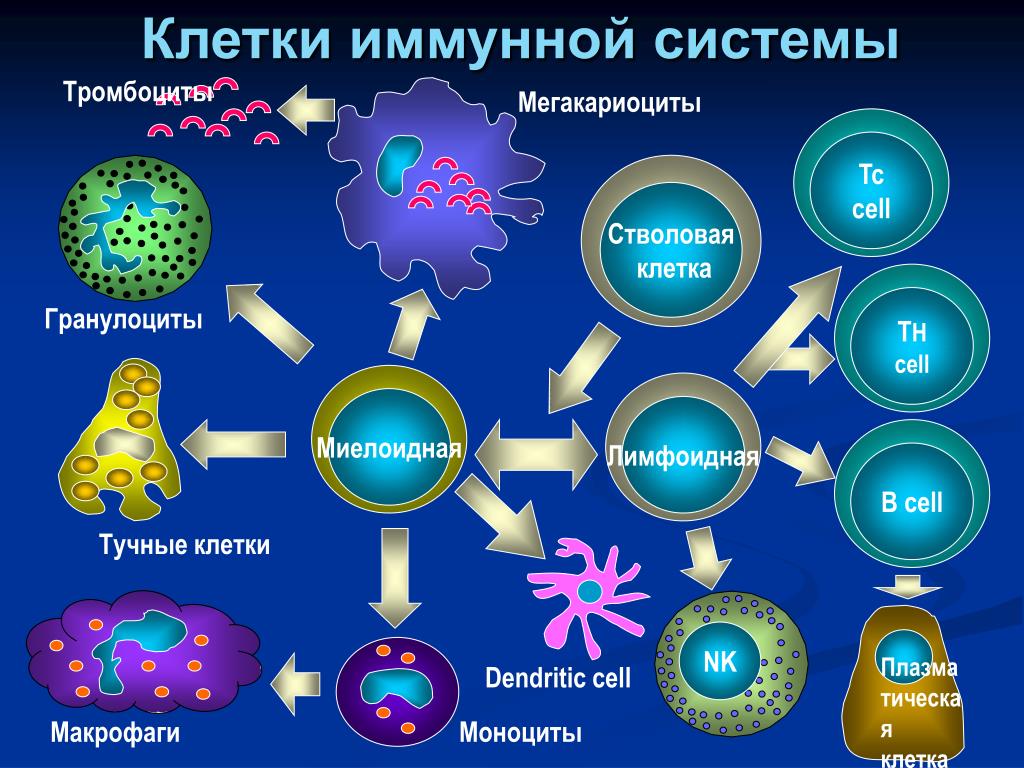 Формирование этого пула Т-клеток требует длительного времени. Показано, что Т-клетки памяти начинают определяться в периферической крови только к 40-му дню после первичного инфицирования [23]. Однако помимо классического пути формирования «иммунологической памяти» (наивные Т-клетки → эффекторные Т-клетки → Т-клетки памяти) есть неклассический путь, когда при первичном инфицировании часть наивных Т-клеток трансформируется в эффекторный пул, а другая часть сразу же переходит в пул Т-клеток памяти [25, 26]. Как при классическом, так и при неклассическом пути происходит формирование популяции иммунокомпетентных клеток (популяции Т-клеток памяти), которая реализует быстрый иммунный ответ при повторном попадании чужеродного антигена без участия наивных Т-клеток [24]. Пул Т-клеток памяти является гетерогенным, так как включает в себя иммунокомпетентные клетки, которые, имея различный иммунофенотип, отличаются своими функциональными свойствами, различной пролиферативной способностью и локализацией (табл. 2) [27, 28]. Условно Т-клетки памяти разделяют на две группы: истинные клетки памяти, к которым относят Т-стволовые клетки памяти (Tscm) и Т-клетки центральной памяти (Tcm), и эффекторный пул, состоящий из переходных Т-клеток (или Т-клетки транзиторной памяти, Ttm), Т-клеток эффекторной памяти (Tem), терминальных эффекторов (Тte) и Т-клеток резидуальной памяти (Trm) [29, 30].
Формирование этого пула Т-клеток требует длительного времени. Показано, что Т-клетки памяти начинают определяться в периферической крови только к 40-му дню после первичного инфицирования [23]. Однако помимо классического пути формирования «иммунологической памяти» (наивные Т-клетки → эффекторные Т-клетки → Т-клетки памяти) есть неклассический путь, когда при первичном инфицировании часть наивных Т-клеток трансформируется в эффекторный пул, а другая часть сразу же переходит в пул Т-клеток памяти [25, 26]. Как при классическом, так и при неклассическом пути происходит формирование популяции иммунокомпетентных клеток (популяции Т-клеток памяти), которая реализует быстрый иммунный ответ при повторном попадании чужеродного антигена без участия наивных Т-клеток [24]. Пул Т-клеток памяти является гетерогенным, так как включает в себя иммунокомпетентные клетки, которые, имея различный иммунофенотип, отличаются своими функциональными свойствами, различной пролиферативной способностью и локализацией (табл. 2) [27, 28]. Условно Т-клетки памяти разделяют на две группы: истинные клетки памяти, к которым относят Т-стволовые клетки памяти (Tscm) и Т-клетки центральной памяти (Tcm), и эффекторный пул, состоящий из переходных Т-клеток (или Т-клетки транзиторной памяти, Ttm), Т-клеток эффекторной памяти (Tem), терминальных эффекторов (Тte) и Т-клеток резидуальной памяти (Trm) [29, 30].
В ходе многих исследований было выявлено, что Т-клетки памяти в первую очередь имеют различный иммунофенотип [27—30]. Показано, что основными маркерами этих клеток являются CD45RA, CD45R0, CD62L, CCR-7, CD27, CD28 [30].
CD45 представляет собой трансмембранный гликопротеин, который экспрессируется на всех ядросодержащих клетках. Через этот рецептор происходит передача сигнала от ТКР. Вместе с тем выделяют несколько изоформ CD45, которые по-разному экспрессируются на Т-клетках. Иммунофенотип CD45RA+CD45R0— характеризует наивные Т-клетки. Есть исследования, которые показали, что при активации эти клетки начинают экспрессировать CD45R0 и утрачивают CD45RA [31, 32]. Таким образом, экспрессия CD45R0 отражает пролиферативную способность Т-клеток и характерна для популяции Т-клеток памяти (Tcm, Ttm, Tem) [31].
Таким образом, экспрессия CD45R0 отражает пролиферативную способность Т-клеток и характерна для популяции Т-клеток памяти (Tcm, Ttm, Tem) [31].
Экспрессия хоуминг-рецепторов и маркеров адгезии характеризует способность Т-клеток к миграции во вторичные лимфоидные органы. Экспрессия CD62L и CCR-7 характерна в большей степени для наивных Т-клеток и истинных Т-клеток памяти, что отражает их больший пролиферативный потенциал. Более дифференцированные Т-клетки эффекторного пула (Ttm, Tem, Tte) не экспрессируют эти маркеры, что свидетельствует о том, что эти клетки не способны к пролиферации во вторичных лимфоидных органах [33]. Как правило, вместе с экспрессией молекул адгезии Т-клетки экспрессируют и костимулирующие рецепторы CD27, CD28 [30].
Отличительной особенностью популяции истинных клеток памяти является их способность к длительной пролиферации даже в отсутствие антигена, что обеспечивает самоподдержание всей популяции. На этом основан феномен «иммунологической памяти», что позволяет хранить информацию о конкретном антигене и при его попадании в организм реализовать иммунный ответ против него [34—36]. Долгое время считалось, что субпопуляцией истинных клеток памяти является популяция Tcm [27, 28]. Однако в дальнейшем была выделена субпопуляция Tscm, которая функционально соответствовала популяции Tcm, однако иммунофенотипически в большей степени походила на наивные Т-клетки (CD45RA+CD45R0— CCR7+CD62L+CD27+CD28+) [37, 38]. В результате проведенных экспериментов по заражению макак вирусом иммунодефицита было выявлено, что эта субпопуляция способна к значимо более длительной пролиферации даже в условиях отсутствия вируса в сравнении с субпопуляцией Tcm [39, 40]. В дальнейшем было доказано, что Tscm являются предшественниками как Tcm, так и Т-клеток эффекторного пула [41, 42].
Исследования показали, что среди всей популяции Т-клеток памяти есть клетки, характеризующиеся продукцией интерферона-γ, ФНО, ИЛ-2, с помощью которых они быстро реализуют свою цитотоксиче- скую функцию. Истинные клетки памяти сами не могут реализовать быстрый иммунный ответ. Была выделена популяция эффекторных Т-клеток памяти [27, 43]. Однако в ряде случаев было замечено, что в периферической крови встречается субпопуляция Т-клеток с иммунофенотипом CCR7/CD62LCD28+, которая является более «зрелой» и более «активной», чем субпопуляция Tcm, но менее дифференцированной, чем субпопуляция Tem. Таким образом, эти клетки были названы переходными, или транзиторными,
Истинные клетки памяти сами не могут реализовать быстрый иммунный ответ. Была выделена популяция эффекторных Т-клеток памяти [27, 43]. Однако в ряде случаев было замечено, что в периферической крови встречается субпопуляция Т-клеток с иммунофенотипом CCR7/CD62LCD28+, которая является более «зрелой» и более «активной», чем субпопуляция Tcm, но менее дифференцированной, чем субпопуляция Tem. Таким образом, эти клетки были названы переходными, или транзиторными,
Таблица 2. Основные субпопуляции Т-клеток памяти [30]
Table 2. Main subsets of memory T cells [30]
Субпопуляции Т-клеток памяти T-memory cell subsets | Иммунофенотип Immunophenotype | Свойства Characteristics | |
|---|---|---|---|
Истинные клетки памяти True memory cells | Т-стволовые клетки памяти (Tscm) T-memory stem cells (Tscm) | CD45RA+CD45R0— CD62L+CCR7+ CD27+CD28+ | Обеспечивают самообновление и самоподдержание популяции клеток памяти и хранение информации о конкретном антигене. Локализуются преимущественно в костном мозге и лимфатической ткани These cells provide self-renewal and self-maintenance of the whole population of memory T-cells and store the information about the specific antigen. They are localized in the bone marrow and lymphoid tissue |
Т-клетки центральной памяти (Tcm) T-central memory (Tcm) | CD45RA-CD45R0+ CD62L+CCR7+ CD27+CD28+ | Обеспечивают самоподдержание Т-клеток памяти, преимущественно локализуются в лимфатических узлах и костном мозге, способны быстро дифференцироваться в эффекторные клетки через Т-клетки транзиторной памяти These cells provide self-maintenance of T-memory cells and reside mostly in the bone marrow and lymphoid tissue. These cells are capable of differentiating promptly into transitional and effector T-cells | |
Эффекторный пул Effector pool of T-cells | Т-клетки транзиторной памяти (Ttm) T-transitional memory (Ttm) | CD45RA—CD45R0+ CD62L—CCR7— CD27+CD28+ | Способны к быстрой дифференцировке в эффекторные клетки при контакте с антигеном, после чего они переходят в Tcm These cells are interim and transitional between memory and effector T-cells. |
Т-клетки эффекторной памяти (Tem) Т-effector memory (Tem) | CD45R0+CCR7—CD27+CD28— (оценка CD45RA и CD62L не производится) (CD45RA and CD62L are not investigated) | Преимущественно определяются в циркулирующей крови и тканях, быстро реагируют на встречу с антигеном и обеспечивают развитие иммунного ответа These cells circulate mostly in the peripheral blood and move into different tissues, where they respond promptly to the antigen encounter thus providing the respective immune reaction | |
Т-терминальные эффекторы (Tte) Т-terminal effectors (Tte) | CD45R0—CCR7—CD27—CD28— (оценка CD45RA и CD62L не производится) (CD45RA and CD62L are not investigated | Наиболее дифференцированные эффекторные клетки, обеспечивающие быстрый иммунный ответ против конкретного антигена The most mature, terminally differentiated effector T-cells that provide instant immunity against the antigen and subsequently undergo apoptosis | |
| Т-клетки резидуальной памяти (Trm) Т-residual memory cells (Trm) | CD69+CD103+CD62L— | Являются терминально-дифференцированными эффекторными клетками, реализующими иммунный ответ в месте своей локализации в различных органах и тканях (коже, бронхолегочной системы и желудочно-кишечного тракта) These cells are terminally differentiated effector cells providing local immunity in the periphery (in the skin, bronchopulmonary system and gastrointestinal tract) |
Т-клетками (Ttm) [44—46]. Помимо этого, в периферической крови также нередко определяются Т-клетки, которые не несут на своей поверхности ни CCR-7, CD62L, ни CD27, CD28. Отличительной чертой этой популяции является крайне низкая способность к пролиферации, что также свидетельствует о высокой диф- ференцировке этих клеток. Они были определены как терминальные эффекторные Т-клетки (Tte) [47].
Отличительной чертой этой популяции является крайне низкая способность к пролиферации, что также свидетельствует о высокой диф- ференцировке этих клеток. Они были определены как терминальные эффекторные Т-клетки (Tte) [47].
Кроме циркулирующего пула Т-клеток памяти есть пул нециркулирующих Т-клеток резидуальной памяти (Trm), который характеризуется высокой экспрессией CD69 и провоспалительных цитокинов интерферона-γ, ФНО, ИЛ-2, ИЛ-17. Чаще всего эти клетки определяются на слизистых и функционально являются эффекторными клетками, реализующими иммунный ответ непосредственно в месте своей локализации [36, 48].
Таким образом, формирование адаптивного иммунитета основывается на формировании пула долгоживущих Т-клеток памяти (Tscm, Tcm), активация которых происходит в результате повторного контакта с антигеном, что в дальнейшем запускает формирование пула эффекторных Т-клеток, непосредственно реализующих сам иммунный ответ. Формирование адаптивного иммунитета невозможно без участия наивных Т-клеток, которые, по сути, являются предшественниками всей популяции Т-клеток памяти. Наиболее дифференцированные Т-клетки — терминальные эффекторы являются наиболее функционально активной субпопуляцией, но при этом не обладают пролиферативной способностью и погибают сразу же после реализации своей эффекторной функции.
Долгое время считалось, что аллореактивными Т-клетками, которые запускают развитие РТПХ, являются функционально активные, терминальнодифференцированные Т-клетки [49, 50]. Однако исследования показали, что через 12 часов после ин- фузии аллогенных ГСК и до +3 дня большинство донорских Т-клеток экспрессируют хемокиновый рецептор CCR-7 и хоуминг-рецепторы: CD4+ Т-клетки экспрессируют L-селектин (CD62L), CD8+ Т-клетки — CD62L и α4β7-интегрин. Именно это и обусловливает возможность мигрирации этих клеток в различные органы и ткани, где они и запускают РТПХ [51, 52]. В эксперименте на мышах была доказана принадлежность этой аллореактивной популяции CD62L+CCR-7+ Т-клеток к наивным Т-лимфоцитам, инфильтрация которыми была выявлена в ткани желудочно-кишечного тракта тех мышей, у которых впоследствии развилась тяжелая острая РТПХ [51].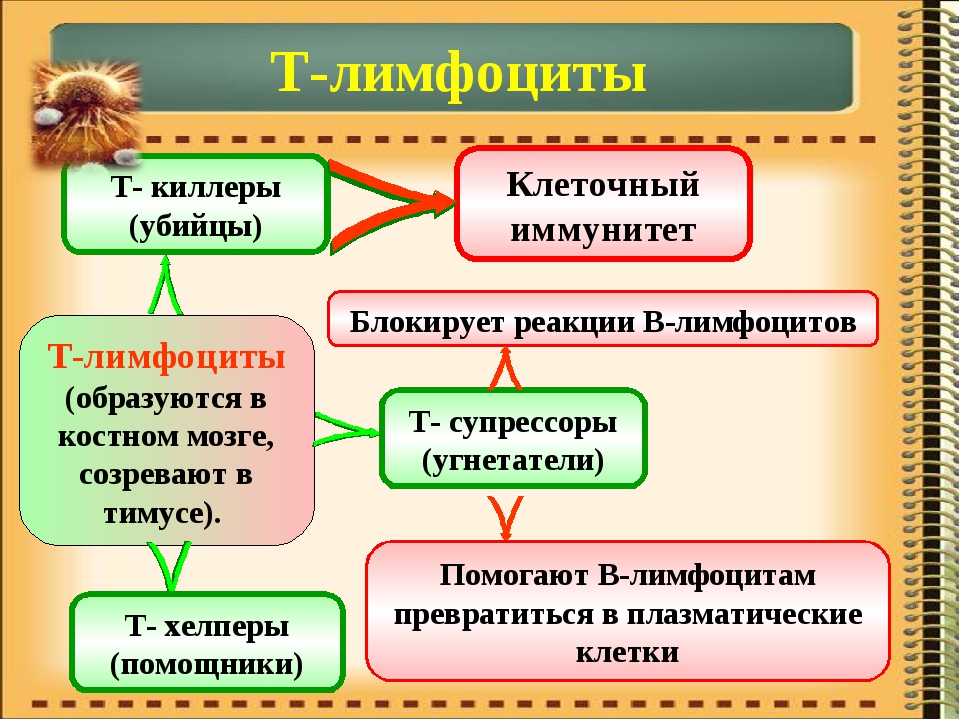 Вместе с тем было показано, что зрелые функционально активные Т-клетки не индуцируют развитие РТПХ, так как они не способны к пролиферации во вторичных лимфоидных органах и дальнейшей миграции в органы-мишени ввиду отсутствия CD62L и CCR-7 [52]. Таким образом, было доказано, что аллореактивными Т-клетками, которые индуцируют развитие острой РТПХ, являются наивные Т-лимфоциты, а не эффекторные Т-клетки. На этих данных основано использование циклофос- фамида (ЦФ) на +3, +4 день после алло-ТГСК в качестве профилактики острой РТПХ, который удаляет сформировавшийся к этому времени клон аллореактивных Т-клеток и тем самым протектирует развитие острой РТПХ [53, 54]. Помимо этого, важно отметить, что ЦФ практически не оказывает влияния на истинные Т-клетки памяти (Tcm и Тscm). Это, в свою очередь, говорит о меньшем его воздействии на тимус, что обеспечивает возможность дальнейшей реконституции адаптивного иммунитета [55, 56].
Вместе с тем было показано, что зрелые функционально активные Т-клетки не индуцируют развитие РТПХ, так как они не способны к пролиферации во вторичных лимфоидных органах и дальнейшей миграции в органы-мишени ввиду отсутствия CD62L и CCR-7 [52]. Таким образом, было доказано, что аллореактивными Т-клетками, которые индуцируют развитие острой РТПХ, являются наивные Т-лимфоциты, а не эффекторные Т-клетки. На этих данных основано использование циклофос- фамида (ЦФ) на +3, +4 день после алло-ТГСК в качестве профилактики острой РТПХ, который удаляет сформировавшийся к этому времени клон аллореактивных Т-клеток и тем самым протектирует развитие острой РТПХ [53, 54]. Помимо этого, важно отметить, что ЦФ практически не оказывает влияния на истинные Т-клетки памяти (Tcm и Тscm). Это, в свою очередь, говорит о меньшем его воздействии на тимус, что обеспечивает возможность дальнейшей реконституции адаптивного иммунитета [55, 56].
Альтернативой ЦФ в режимах профилактики острой РТПХ является антитимоцитарный глобулин (АТГ). Однако его применение значительно удлиняет время восстановления практически всех субпопуляций иммунокомпетентных клеток ввиду того, что сам препарат является поликлональным антителом, которое получают из гипериммунной сыворотки лошадей (тимоглобулин — из кроличьей сыворотки), иммунизированных Т-лимфоцитами человека. Эта сыворотка содержит широкий спектр антител, которые комплементарно связываются со своими эпитопами на Т-клетках реципиента и тем самым обеспечивают массивную Т-клеточную деплецию как в периферической крови, так и в лимфоидных тканях. Помимо того, что АТГ деплетирует весь лимфоидный компартмент, он также оказывает воздействие на тимус, вызывая апоптоз кортикальных эпителиальных клеток тимуса, что приводит к отсроченной реконституции всего Т-клеточного пула в течение более чем 2 лет после алло-ТГСК [57, 58].
При сравнении режимов с АТГ и с ЦФ было показано, что после использования ЦФ в течение первого месяца после алло-ТГСК содержание αβ T- клеток значимо выше, чем после АТГ [59]. Содержание как CD4+, так CD8+ Т-клеток на +730 день алло-ТГСК после применения АТГ все еще не достигает нормальных значений [60]. Это объясняет и лучшие клинические результаты при использовании ЦФ по сравнению с АТГ в режимах профилактики острой РТПХ [61—63], которые показывают значимо меньшую частоту развития тяжелой острой РТПХ, лучшую общую и безрецидив- ную выживаемость.
Содержание как CD4+, так CD8+ Т-клеток на +730 день алло-ТГСК после применения АТГ все еще не достигает нормальных значений [60]. Это объясняет и лучшие клинические результаты при использовании ЦФ по сравнению с АТГ в режимах профилактики острой РТПХ [61—63], которые показывают значимо меньшую частоту развития тяжелой острой РТПХ, лучшую общую и безрецидив- ную выживаемость.
Другим патогенетически обоснованным методом профилактики острой РТПХ является применение ведолизумаба — моноклонального антитела, которое, связываясь с α4β7- интегрином, блокирует миграцию Т-клеток в органы-мишени и предупреждает развитие РТПХ [64].
Восстановление Т-клеточного звена иммунной системы после алло-ТГСК является возможным в первую очередь благодаря способности Т-клеток к пролиферации и при необходимости генерации эффекторного пула Т-клеток in vivo. В экспериментах на мышах было показано, что трансплантация только лишь эффекторных Т-клеток, даже в больших дозах, не обеспечивает реконституцию Т-клеточного звена иммунной системы, ввиду того что эти клетки не обладают пролиферативной способностью [65—67]. Трансплантация же селектированных Т-клеток центральной памяти (Tcm) приводит к генерации пула эф- фекторных Т-клеток без развития РТПХ [68]. Однако при иммунофенотипировании и анализе репертуара Т-клеточного рецептора было доказано, что только лишь наивные Т-клетки и стволовые Т-клетки памяти (Tscm) могут обеспечить генерацию гетерогенного пула Т-клеток памяти, включая Tcm и эффекторный пул [42]. На основании всего вышесказанного можно заключить, что применение деплеции αβ Т-клеток ex vivo как метода профилактики острой РТПХ, с одной стороны, практически полностью исключает возможность развития этого осложнения, так как в его основе лежит механическое удаление из трансплантата, прежде всего, наивных Т-клеток [69]. Однако, с другой стороны, применение этого метода профилактики РТПХ, с биологической точки зрения, особенно у взрослых больных (старше 20 лет), не может обеспечить «полноценное» восстановление Т-клеточного звена иммунной системы. Это связано с тем, что в такой ситуации восстановление Т-клеточного звена осуществляется за счет гомеостатической пролиферации γδ Т-клеток, которые реализуют первичный иммунный ответ, но не обеспечивают развитие адаптивного иммунитета, в том числе и противоопухолевого [70, 71]. Помимо этого, у этих больных образование de novo наивных αβ Т-клеток ограничено повреждением тимуса в результате предшествующей химиотерапии и проведением предтрансплантационного кондиционирования, а также возрастными изменениями (инволюцией тимуса) [72—76].
Это связано с тем, что в такой ситуации восстановление Т-клеточного звена осуществляется за счет гомеостатической пролиферации γδ Т-клеток, которые реализуют первичный иммунный ответ, но не обеспечивают развитие адаптивного иммунитета, в том числе и противоопухолевого [70, 71]. Помимо этого, у этих больных образование de novo наивных αβ Т-клеток ограничено повреждением тимуса в результате предшествующей химиотерапии и проведением предтрансплантационного кондиционирования, а также возрастными изменениями (инволюцией тимуса) [72—76].
Считается, что использование миелоаблативных режимов ассоциировано с отсроченной реконституцией Т-клеточного звена иммунной системы [77, 78]. Показано, что проведение тотального облучения тела или использование бусульфана в миелоаблативной дозе вызывает необратимую гибель эпителиальных кортикальных клеток тимуса, в результате чего образование лимфоидных популяций становится практически невозможным даже у детей [75, 76]. Использование режимов пониженной интенсивности значимо меньше повреждает эпителиальные клетки тимуса, что дает возможность для более быстрого восстановления Т-клеточного звена по сравнению с миелоаблативными режимами [79, 80]. Это доказывает выявление ИТЕ-клеток в периферической крови больных после режима пониженной интенсивности уже на сроках +3.. .+6.. .+12 месяцев после алло-ТГСК. При этом у больных после миелоаблативного кондиционирования ИТЕ на этих же сроках не определяются [81, 82]. Помимо этого, было показано, что восстановление количества наивных Т-клеток у детей после алло- ТГСК в режиме пониженной интенсивности достигает физиологической нормы не менее чем через 2 года. У взрослых (старше 20 лет) даже через 3 года после алло-ТГСК количество наивных Т-клеток остается значимо ниже возрастной нормы [83].
Таким образом, полноценное восстановление Т-клеточного звена иммунной системы после алло-ТГСК зависит от продукции наивных Т-клеток де novo, которая в дальнейшем приводит к формированию адаптивного, в том числе противоопухолевого, иммунитета.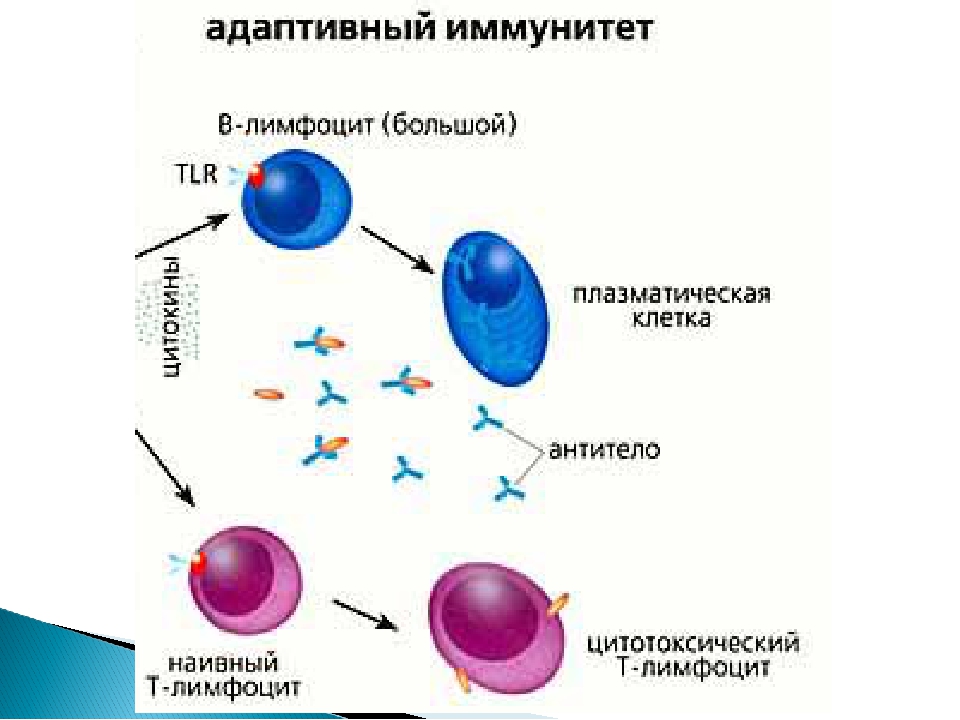 Возраст больных, а также выбор пред- трансплантационного кондиционирования и режима профилактики острой РТПХ влияют на скорость восстановления Т-клеточного звена иммунной системы у больных после алло-ТГСК.
Возраст больных, а также выбор пред- трансплантационного кондиционирования и режима профилактики острой РТПХ влияют на скорость восстановления Т-клеточного звена иммунной системы у больных после алло-ТГСК.
1. Mehta R.S., Rezvani K. Immune reconstitution post allogeneic transplant and the impact of immune recovery on the risk of infection. Virulence. 2016; 7(8): 901–16. DOI: 10.1080/21505594.2016.1208866.
2. Kim B.E., Koh K.N., Im H.J., Seo J.J. Factors influencing lymphocyte reconstitution after allogeneic hematopoietic stem cell transplantation in children. Korean J Hematol. 2012; 47(1): 44–52. DOI: 10.5045/kjh.2012.47.1.44.
3. de Koning C., Plantinga M., Besseling P. et al. Immune Reconstitution after Allogeneic Hematopoietic Cell Transplantation in Children. Biol Blood Marrow Transplant. 2016; 22(2): 195–206. DOI: 10.1016/j.bbmt.2015.08.028.
4. Drokov M.Y., Davydova J.O., Kuzmina L.A. et al. Level of Granzyme B-positive T-regulatory cells is a strong predictor biomarker of acute Graft-versus-host disease after day +30 after allo-HSCT. Leuk Res. 2017; 54: 25–9. DOI: 10.1016/j.leukres.2017.01.014.
5. Williams K.M., Gress R.E. Immune reconstitution and implications for immunotherapy following haematopoietic stem cell transplantation. Best Pract Res Clin Haematol. 2008; 21(3): 579–96. DOI: 10.1016/j.beha.2008.06.003.
6. Ogonek J., Kralj Juric M., Ghimire S. et al. Immune Reconstitution after Allogeneic Hematopoietic Stem Cell Transplantation. Front Immunol. 2016; 7: 507. DOI: 10.3389/fimmu.2016.00507.
Front Immunol. 2016; 7: 507. DOI: 10.3389/fimmu.2016.00507.
7. Krenger W., Blazar B. R., Holländer G.A. Thymic T-cell development in allogeneic stem cell transplantation. Blood. 2011; 117(25): 6768–76. DOI: 10.1182/blood-2011-02-334623.
8. Bourgeois C., Stockinger B. T cell homeostasis in steady state and lymphopenic conditions. Immunol Lett. 2006; 107(2): 89–92. DOI: 10.1016/j.imlet.2006.08.001.
9. Ge Q., Rao V.P., Cho B.K. et al. Dependence of lymphopenia-induced T cell proliferation on the abundance of peptide/ MHC epitopes and strength of their interaction with T cell receptors. Proc Natl Acad Sci USA. 2001; 98(4): 1728–33. DOI: 10.1073/pnas.98.4.1728.
10. Jameson S.C. T cell homeostasis: keeping useful T cells alive and live T cells useful. Semin Immunol. 2005; 17(3): 231–7. DOI: 10.1016/j.smim.2005.02.003.
11. Pénit C., Lucas B., Vasseur F. Cell expansion and growth arrest phases during the transition from precursor (CD4-8-) to immature (CD4+ 8+ ) thymocytes in normal and genetically modified mice. J Immunol. 1995; 15; 154(10): 5103–13.
12. Ye P., Kirschner D.E. Measuring emigration of human thymocytes by T-cell receptor excision circles. Crit Rev Immunol. 2002; 22(5–6): 483–97.
13. Onozawa M., Aplan P.D. llegitimate V(D)J recombination involving nonantigen receptor loci in lymphoid malignancy. Genes Chromosomes Cancer. 2012; 51(6): 525–35. DOI: 10. 1002/gcc.21942.
1002/gcc.21942.
14. Kreslavsky T., Gleimer M., Garbe A.I., von Boehmer H. αβ versus γδ fate choice: counting the T-cell lineages at the branch point. Immunol Rev. 2010; 238(1): 169–81. DOI: 10.1111/j.1600-065X.2010.00947.x.
15. Albano F., Vecchio E., Renna M. et al. Insights into Thymus Development and Viral Thymic Infections. Viruses. 2019; 11(9): 836. DOI: 10.3390/v11090836.
16. Godfrey D.I., Kennedy J., Suda T., Zlotnik A. A developmental pathway involving four phenotypically and functionally distinct subsets of CD3– CD4– CD8– triple-negative adult mouse thymocytes defined by CD44 and CD25 expression. J Immunol. 1993; 150(10): 4244–52.
17. Gardner J.M., Fletcher A.L., Anderson M.S., Turley S.J. AIRE in the thymus and beyond. Curr Opin Immunol. 2009; 21(6): 582–9. DOI: 10.1016/j.coi.2009.08.007.
18. Kondĕlková K., Vokurková D., Krejsek J. et al. Regulatory T cells (TREG) and their roles in immune system with respect to immunopathological disorders. Acta Medica (Hradec Kralove). 2010; 53(2): 73–7. DOI: 10.14712/18059694.2016.63.
19. Дроков М.Ю., Паровичникова Е.Н., Кузьмина Л.А. и др. Роль гранзима В в популяции Т-регуляторных клеток у больных после трансплантации аллогенного костного мозга. Гематол трансфузиол. 2016; 61(1): 32–7. DOI: 10.18821/0234-5730-2016-61-1-32-37.
20. Ivanov S., Paget C., Trottein F. Role of non-conventional T lymphocytes in respiratory infections: the case of the pneumococcus. PLoS Pathog. 2014; 10(10): e1004300. DOI: 10.1371/journal.ppat.1004300.
PLoS Pathog. 2014; 10(10): e1004300. DOI: 10.1371/journal.ppat.1004300.
21. Yamamoto R., Xu Y., Ikeda S. et al. Thymic Development of a Unique Bone Marrow-Resident Innate-like T Cell Subset with a Potent Innate Immune Function. J Immunol. 2019; 203(1): 167–77. DOI: 10.4049/jimmunol.1900111.
22. Oehen S., Brduscha-Riem K. Differentiation of naive CTL to effector and memory CTL: correlation of effector function with phenotype and cell division. J Immunol. 1998; 161(10): 5338–46.
23. Kaech S.M., Hemby S., Kersh E., Ahmed R. Molecular and functional profiling of memory CD8 T cell differentiation. Cell. 2002; 111(6): 837–51. DOI: 10.1016/s0092-8674(02)01139-x.
24. Lau C.M., Sun J.C. The widening spectrum of immunological memory. Curr Opin Immunol. 2018; 54: 42–9. DOI: 10.1016/j.coi.2018.05.013.
25. Lauvau G., Vijh S., Kong P. et al. Priming of memory but not effector CD8 T cells by a killed bacterial vaccine. Science. 2001; 294(5547): 1735–9. DOI: 10.1126/science.1064571.
26. Manjunath N., Shankar P., Wan J. et al. Effector differentiation is not prerequisite for generation of memory cytotoxic T lymphocytes. J Clin Invest. 2001; 108(6): 871–8. DOI: 10.1172/JCI13296.
27. Sallusto F., Lenig D., Förster R. et al. Two subsets of memory T lymphocytes with distinct homing potentials and effector functions. Nature. 1999; 401(6754): 708–12. DOI: 10.1038/44385.
28. Hamann D., Baars P.A., Rep M.H. et al. Phenotypic and functional separation of memory and effector human CD8+ T cells. J Exp Med. 1997; 186(9): 1407–18.
Hamann D., Baars P.A., Rep M.H. et al. Phenotypic and functional separation of memory and effector human CD8+ T cells. J Exp Med. 1997; 186(9): 1407–18.
29. Mahnke Y.D., Beddall M.H., Roederer M. OMIP-013: differentiation of human T-cells. Cytometry A. 2012; 81(11): 935–6. DOI: 10.1002/cyto.a.22201.
30. Mahnke Y.D., Brodie T.M., Sallusto F. et al. The who’s who of T-cell differentiation: human memory T-cell subsets. Eur J Immunol. 2013; 43(11): 2797–809. DOI: 10.1002/eji.201343751.
31. Johannisson A., Festin R. Phenotype transition of CD4+ T cells from CD45RA to CD45R0 is accompanied by cell activation and proliferation. Cytometry. 1995; 19(4): 343–52. DOI: 10.1002/cyto.990190409.
32. Akbar A.N., Terry L., Timms A. et al. Loss of CD45R and gain of UCHL1 reactivity is a feature of primed T cells. J Immunol. 1988; 140(7): 2171–8.
33. Picker L.J., Treer J.R., Ferguson-Darnell B. et al. Control of lymphocyte recirculation in man. II. Differential regulation of the cutaneous lymphocyte-associated antigen, a tissue-selective homing receptor for skin-homing T cells. J Immunol. 1993; 150(3): 1122–36.
34. Sallusto F., Geginat J., Lanzavecchia A. Central memory and effector memory T cell subsets: function, generation, and maintenance. Annu Rev Immunol. 2004; 22: 745–63. DOI: 10.1146/annurev.immunol.22.012703.104702.
35. Stemberger C., Neuenhahn M., Gebhardt F.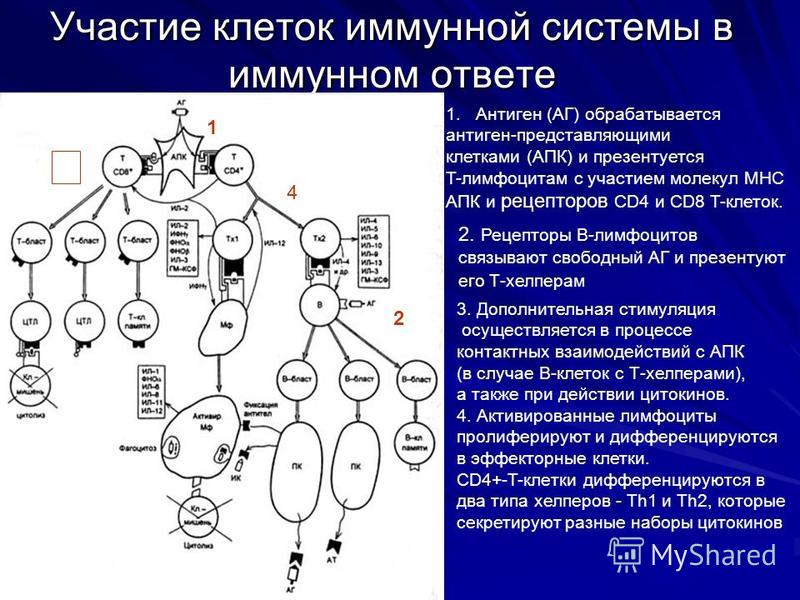 E. et al. Stem cell-like plasticity of naïve and distinct memory CD8 + T cell subsets. Semin Immunol. 2009; 21(2): 62–8. DOI: 10.1016/j.smim.2009.02.004.
E. et al. Stem cell-like plasticity of naïve and distinct memory CD8 + T cell subsets. Semin Immunol. 2009; 21(2): 62–8. DOI: 10.1016/j.smim.2009.02.004.
36. Mueller S.N., Gebhardt T., Carbone F.R., Heath W.R. Memory T cell subsets, migration patterns, and tissue residence. Annu Rev Immunol. 2013; 31: 137–61. DOI: 10.1146/annurev-immunol-032712-095954.
37. Fagnoni F.F., Vescovini R., Passeri G. et al. Shortage of circulating naive CD8(+) T cells provides new insights on immunodeficiency in aging. Blood. 2000; 95(9): 2860–8.
38. Lugli E., Pinti M., Nasi M. et al. Subject classification obtained by cluster analysis and principal component analysis applied to flow cytometric data. Cytometry A. 2007; 71(5): 334–44. DOI: 10.1002/cyto.a.20387.
39. Gattinoni L., Lugli E., Ji Y. et al. A human memory T cell subset with stem cell-like properties. Nat Med. 2011; 17(10): 1290–7. DOI: 10.1038/nm.2446.
40. Lugli E., Dominguez M.H., Gattinoni L. et al. Superior T memory stem cell persistence supports long-lived T cell memory. J Clin Invest. 2013; 123(2): 594–9. DOI: 10.1172/JCI66327.
41. Feuerer M., Beckhove P., Bai L. et al. Therapy of human tumors in NOD/ SCID mice with patient-derived reactivated memory T cells from bone marrow. Nat Med. 2001; 7(4): 452–8. DOI: 10.1038/86523.
42. Cieri N., Oliveira G., Greco R. et al. Generation of human memory stem T cells after haploidentical T-replete hematopoietic stem cell transplantation.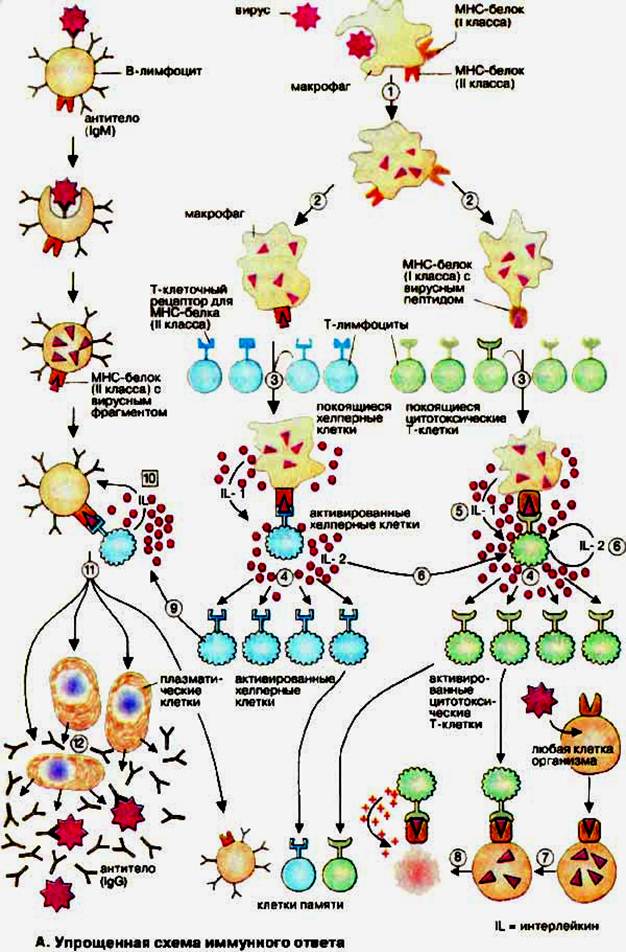 Blood. 2015; 125(18): 2865–74. DOI: 10.1182/blood-2014-11-608539.
Blood. 2015; 125(18): 2865–74. DOI: 10.1182/blood-2014-11-608539.
43. Gattinoni L., Speiser D.E., Lichterfeld M., Bonini C. T memory stem cells in health and disease. Nat Med. 2017; 23(1): 18–27. DOI: 10.1038/nm.4241.
44. Fritsch R.D., Shen X., Sims G.P. et al. Stepwise differentiation of CD4 memory T cells defined by expression of CCR7 and CD27. J Immunol. 2005; 175(10): 6489–97. DOI: 10.4049/jimmunol.175.10.6489.
45. Okada R., Kondo T., Matsuki F. et al. Phenotypic classification of human CD4 + T cell subsets and their differentiation. Int Immunol. 2008; 20(9):1189–99. DOI: 10.1093/intimm/dxn075.
46. Picker L.J., Reed-Inderbitzin E.F., Hagen S.I. et al. IL-15 induces CD4 effector memory T cell production and tissue emigration in nonhuman primates. J Clin Invest. 2006; 116(6): 1514–24. DOI: 10.1172/JCI27564.
47. Geginat J., Lanzavecchia A., Sallusto F. Proliferation and differentiation potential of human CD8 + memory T-cell subsets in response to antigen or homeostatic cytokines. Blood. 2003; 101(11): 4260–6. DOI: 10.1182/blood-2002-11-3577.
48. Schreiner D., King C.G. CD4 + Memory T Cells at Home in the Tissue: Mechanisms for Health and Disease. Front Immunol. 2018; 9: 2394. DOI: 10.3389/fimmu.2018.02394.
49. Billingham RE. The biology of graft-versus-host reactions. Harvey Lect. 1966; 62: 21–78.
50. Krenger W., Holländer G.A. The immunopathology of thymic GVHD. Semin Immunopathol. 2008; 30(4): 439–56. DOI: 10.1007/s00281-008-0131-6.
Krenger W., Holländer G.A. The immunopathology of thymic GVHD. Semin Immunopathol. 2008; 30(4): 439–56. DOI: 10.1007/s00281-008-0131-6.
51. Beilhack A., Schulz S., Baker J. et al. In vivo analyses of early events in acute graft-versus-host disease reveal sequential infiltration of T-cell subsets. Blood. 2005; 106(3): 1113–22. DOI: 10.1182/blood-2005-02-0509.
52. Wysocki C.A., Panoskaltsis-Mortari A., Blazar B.R., Serody J.S. Leukocyte migration and graft-versus-host disease. Blood. 2005; 105(11): 4191–99. DOI: 10.1182/blood-2004-12-4726.
53. Дроков М.Ю., Паровичникова Е.Н., Кузьмина Л.А. и др. Трансплантация аллогенного костного мозга без проведения предтрансплантационного кондиционирования с использованием циклофосфамида и мезенхимальных стромальных клеток в качестве индукции толерантности. Гематол трансфузиол. 2014; 59(1): 42–6.
54. Luznik L., O‘Donnell P.V., Symons H.J. et al. HLA-haploidentical bone marrow transplantation for hematologic malignancies using nonmyeloablative conditioning and high-dose, posttransplantation cyclophosphamide. Biol Blood Marrow Transplant. 2008; 14(6): 641–50. DOI: 10.1016/j.bbmt.2008.03.005.
55. Cieri N., Peccatori J., Oliveiera G. et al. Tracking T cell dynamics in the first month after haploidentical HSCT with post-transplant cyclophosphamide reveals a predominant contribution of memory stem T cells to the early phase of immune reconstitution. Blood. 2013; 122(21): 4615. DOI: 10.1182/blood.V122.21.4615.4615.
56. Al-Homsi A.S., Roy T.S., Cole K. et al. Post-Transplant High-Dose Cyclophosphamide for the Prevention of Graft-versus-Host Disease. Biol Blood Marrow Transplant. 2015; 21(4): 604–11. DOI: 10.1016/j.bbmt.2014.08.014.
Al-Homsi A.S., Roy T.S., Cole K. et al. Post-Transplant High-Dose Cyclophosphamide for the Prevention of Graft-versus-Host Disease. Biol Blood Marrow Transplant. 2015; 21(4): 604–11. DOI: 10.1016/j.bbmt.2014.08.014.
57. Servais S., Menten-Dedoyart C., Beguin Y. et al. Impact of Pre-Transplant Anti-T Cell Globulin (ATG) on Immune Recovery after Myeloablative Allogeneic Peripheral Blood Stem Cell Transplantation. PLoS One. 2015; 10(6): e0130026. DOI: 10.1371/journal.pone.0130026.
58. Storek J., Mohty M., Boelens J.J. Rabbit anti-T cell globulin in allogeneic hematopoietic cell transplantation. Biol Blood Marrow Transplant. 2015; 21(6): 959–70. DOI: 10.1016/j.bbmt.2014.11.676.
59. Retière C., Willem C., Guillaume T. et al. Impact on early outcomes and immune reconstitution of high-dose post-transplant cyclophosphamide vs anti-thymocyte globulin after reduced intensity conditioning peripheral blood stem cell allogeneic transplantation. Oncotarget. 2018; 9(14): 11451–64. DOI: 10.18632/oncotarget.24328.
60. Bosch M., Dhadda M., Hoegh-Petersen M. et al. Immune reconstitution after anti-thymocyte globulin-conditioned hematopoietic cell transplantation. Cytotherapy. 2012; 14(10): 1258–75. DOI: 10.3109/14653249.2012.715243.
61. Battipaglia G., Labopin M., Kröger N. et al. Posttransplant cyclophosphamide vs antithymocyte globulin in HLA-mismatched unrelated donor transplantation. Blood. 2019; 134(11): 892–9. DOI: 10.1182/blood.2019000487.
62. Nykolyszyn C. , Granata A., Pagliardini T. et al. Posttransplantation cyclophosphamide vs antithymocyte globulin as GVHD prophylaxis for mismatched unrelated hematopoietic stem cell transplantation. Bone Marrow Transplant. 2019. DOI: 10.1038/s41409-019-0682-2.
, Granata A., Pagliardini T. et al. Posttransplantation cyclophosphamide vs antithymocyte globulin as GVHD prophylaxis for mismatched unrelated hematopoietic stem cell transplantation. Bone Marrow Transplant. 2019. DOI: 10.1038/s41409-019-0682-2.
63. Pagliardini T., Harbi S., Fürst S. et al. Post-transplantation cyclophosphamidebased haploidentical versus Atg-based unrelated donor allogeneic stem cell transplantation for patients younger than 60 years with hematological malignancies: a single-center experience of 209 patients. Bone Marrow Transplant. 2019; 54(7): 1067–76. DOI: 10.1038/s41409-018-0387-y.
64. Fløisand Y., Lundin K.E.A., Lazarevic V. et al. Targeting Integrin α4β7 in Steroid-Refractory Intestinal Graft-versus-Host Disease. Biol Blood Marrow Transplant. 2017; 23(1): 172–5. DOI: 10.1016/j.bbmt.2016.10.009.
65. Wherry E.J., Teichgräber V., Becker T.C. et al. Lineage relationship and protective immunity of memory CD8 T cell subsets. Nat Immunol. 2003; 4(3): 225–34. DOI: 10.1038/ni889.
66. Graef P., Buchholz V.R., Stemberger C. et al. Serial transfer of single-cellderived immunocompetence reveals stemness of CD8(+) central memory T cells. Immunity. 2014; 41(1): 116–26. DOI: 10.1016/j.immuni.2014.05.018.
67. Gattinoni L. Memory T cells officially join the stem cell club. Immunity. 2014; 41(1): 7–9. DOI: 10.1016/j.immuni.2014.07.003.
68. Huang W., Mo W., Jiang J. et al. Donor Allospecific CD44high Central Memory T Cells Have Decreased Ability to Mediate Graft-vs.-Host Disease. Front Immunol. 2019; 10: 624. DOI: 10.3389/fimmu.2019.00624.
69. Масчан М.А. Деплеция альфа/бета-Т-лимфоцитов — надежная платформа для развития трансплантации гемопоэтических стволовых клеток от гаплоидентичных доноров. Рос. журн. детской гематол. онкол. 2015; 2(3): 34–8.
70. Lamb L.S. Jr, Henslee-Downey P.J., Parrish R.S. et al. Increased frequency of TCR gamma delta + T cells in disease-free survivors following T cell-depleted, partially mismatched, related donor bone marrow transplantation for leukemia. J Hematother. 1996; 5(5): 503–9. DOI: 10.1089/scd.1.1996.5.503.
71. Saad A., Lamb L. Ex vivo T-cell depletion in allogeneic hematopoietic stem cell transplant: past, present and future. Bone marrow transplantation 2017; 52(9): 1241–8. DOI: 10.1038/bmt.2017.22.
72. Weinberg K., Blazar B.R., Wagner J.E. et al. Factors affecting thymic function after allogeneic hematopoietic stem cell transplantation. Blood. 2001; 97(5): 1458–66. DOI: 10.1182/blood.v97.5.1458.
73. Jiménez M., Martínez C., Ercilla G. et al. Clinical factors influencing T-cell receptor excision circle (TRECs) counts following allogeneic stem cell transplantation in adults. Transpl Immunol. 2006; 16(1): 52–9. DOI: 10.1016/j.trim.2006.02.006.
74. Castermans E., Hannon M., Dutrieux J. et al. Thymic recovery after allogeneic hematopoietic cell transplantation with non-myeloablative conditioning is limited to patients younger than 60 years of age. Haematologica. 2011; 96(2): 298–306. DOI: 10.3324/haematol.2010.029702.
75. Chung B., Barbara-Burnham L., Barsky L., Weinberg K. Radiosensitivity of thymic interleukin-7 production and thymopoiesis after bone marrow transplantation. Blood. 2001; 98(5): 1601–6. DOI: 10.1182/blood.v98.5.1601.
76. Fletcher A.L., Lowen T.E., Sakkal S. et al. Ablation and regeneration of tolerance-inducing medullary thymic epithelial cells after cyclosporine, cyclophosphamide, and dexamethasone treatment. J Immunol. 2009; 183(2): 823–31. DOI: 10.4049/jimmunol.0900225.
77. MacVittie T.J., Bennett A.W., Cohen M.V. et al. Immune cell reconstitution after exposure to potentially lethal doses of radiation in the nonhuman primate. Health Phys. 2014; 106(1): 84–96. DOI: 10.1097/HP.0b013e3182a2a9b2.
78. Mackall C.L., Fleisher T.A., Brown M.R. et al. Distinctions between CD8+ and CD4+ T-cell regenerative pathways result in prolonged T-cell subset imbalance after intensive chemotherapy. Blood. 1997; 89(10): 3700–7.
79. Turner B.E., Collin M., Rice A.M. Reduced intensity conditioning for hematopoietic stem cell transplantation: has it achieved all it set out to? Cytotherapy. 2010; 12(4): 440–54. DOI: 10.3109/14653241003709678.
80. Jiménez M., Ercilla G., Martínez C. Immune reconstitution after allogeneic stem cell transplantation with reduced-intensity conditioning regimens. Leukemia. 2007; 21(8): 1628–37. DOI: 10.1038/sj.leu.2404681.
81. Jiménez M., Martínez C., Ercilla G. et al. Reduced-intensity conditioning regimen preserves thymic function in the early period after hematopoietic stem cell transplantation. Exp Hematol. 2005; 33(10): 1240–8. DOI: 10.1016/j.exphem.2005.06.016.
82. Bahceci E., Epperson D., Douek D.C. et al. Early reconstitution of the T-cell repertoire after non-myeloablative peripheral blood stem cell transplantation is from post-thymic T-cell expansion and is unaffected by graft-versus-host disease or mixed chimaerism. Br J Haematol. 2003; 122(6): 934–43. DOI: 10.1046/j.13652141.2003.04522.x.
83. Small T.N., Papadopoulos E.B., Boulad F. et al. Comparison of immune reconstitution after unrelated and related T-cell-depleted bone marrow transplantation: effect of patient age and donor leukocyte infusions. Blood. 1999; 93(2): 467–80.
Как Т-клетки сформировали новый иммунитет против COVID-19 и изменили статистику
Неодоцененный вирус
Число пострадавших от COVID-19, возможно, было сильно недооценено. Тесты на коронавирус делают, чтобы найти специфические антитела в крови, а не Т-клетки, которые борются с инфекцией, говорят эксперты.
Что такое Т-лимфоциты?
Т-лимфоциты, или T-клетки — это главное оружие организма. Они выделяются из лейкоцитов в костном мозге, чтобы убивать вирусы, когда иммунная система нуждается в дополнительной помощи. Они играют важную роль в приобретенном иммунном ответе. Обеспечивают распознавание и уничтожение клеток, несущих чужеродные антигены, усиливают действие моноцитов и многое другое.
Основной функцией Т-клеток является реакция на патогены, прежде неизвестные иммунной системе организма. После того, как Т-клетки распознают антиген, они становятся активированными. Активированные клетки начинают активно делиться, образуя клон вируса.
Что выяснили ученые?
Ученые заявили, что три четверти людей, которые проживают и постоянно контактируют с больным коронавирусом, могут выработать свою реакцию на вирус без необходимости в антителах.
После проведенного исследования эксперты обнаружили: шесть из восьми наблюдаемых, которые контактировали с зараженными COVID-19, показали отрицательные результаты при тестировании на антитела к коронавирусу в их крови.
Но когда ученые проверили образцы крови на иммунитет Т-клеток — часть глубокой защиты организма от инфекции, от лейкоцитов в костном мозге — они обнаружили, что на самом деле перенесли COVID-19 с легкими симптомами.
Как происходит появление нового иммунитета?
Иммунологическая система некоторых пациентов, по-видимому, «расщепляется» из-за их реакции на вирус. В итоге те, у кого нет антител в крови, реагируют на вирус Т-лимфоцитами, заявили иммунологи.
Новые проверки на коронавирус
Последнее исследование открывает перспективы новых проверок на коронавирус, которые будут нацелены именно на обнаружение Т-клеток. Такая система аналогична тестам на туберкулез — с возможностью для одной лаборатории обработать сотни пациентов и получить эффективные результаты в течение двух дней.
Воздействие коронавируса может индуцировать вирус-специфические Т-клеточные ответы без выработки антител. Т-клеточные ответы могут быть более чувствительными индикаторами воздействия SARS-Co-V-2, чем антитела. Это важно, ведь поможет медикам отслеживать случаи заражения более точно.
Как проводилось исследование?
На фоне нынешней пандемии COVID-19 используются серологические тесты для оценки перенесенной инфекции и иммунитета против SARS-CoV-2. Эти знания имеют первостепенное значение для определения динамики передачи коронавируса в постпандемический период. Несколько человек из «зон заражения» сообщили о симптомах COVID-19, но их результаты показали отсутствие антител в организме.
Последнее исследование, проведенное в больнице Страсбургского университета во Франции, изучило семь семей. Они были выбраны, потому что у их анализы крови на коронавирус показались экспертам необычными.
У шести из восьми контактов развился специфический для SARS-CoV-2 Т-клеточный ответ на структурные и/или вспомогательные белки, который длится до 80 дней после появления симптомов. Это свидетельствует о перенесенной инфекции COVID-19.
Исследование включает в себя небольшую выборку и еще не рецензировано, но тщательно изучается иммунологами. Ведущие ученые уже заявили: появляется все больше свидетельств того, что иммунитет к COVID-19 выглядит необычно, поскольку некоторые люди проявляют иммунитет только в виде Т-клеток, клеток «памяти».
Нормальным ответом на вирус было бы присутствие антител в крови.
Есть ли причина для беспокойства?
Проведенное исследование означает, что большое количество инфицированных и имеющих легкие симптомы могут по-разному реагировать на вирус, который делает их «тихими» носителями и невосприимчивыми к коронавирусу. В настоящий момент их нельзя диагностировать как подвергшиеся воздействию COVID-19 с помощью текущих тестов.
Ученые предупреждают — эпидемиологические данные, основанные только на обнаружении антител к SARS-CoV-2, могут привести к существенной недооценке предшествующего воздействия вируса.
Читать также
Комета NEOWISE видна в России. Где ее увидеть, куда смотреть и как сделать фото
Новые тонкие солнечные батареи можно прикрепить к любой поверхности
В Австралии начнут платить за использование электромобилей
Как кишечная микрофлора договаривается с иммунной системой
Незрелые Т-лимфоциты направляются на курсы повышения квалификации в кишечник, где учатся распозновать дружелюбную микрофлору и не атаковать ее без надобности.
Необходимое свойство иммунитета — его способность отличать своих от чужих. Между тем в нашем кишечнике живет великое множество бактерий, атаковать которые никак нельзя, хотя формально они относятся к классу врагов. Как именно клетки имунной системы обучаются распознавать кишечную микрофлору? К примеру, считается, что недуги вроде язвенного колита и болезни Крона возникают из-за того, что иммунитет вдруг начинает нападать на собственную кишечную микрофлору человека.
Загадкой в данном случае является то, что распознавать своих иммунные клетки учатся в тимусе. Незрелые Т-лимфоциты синтезируют великое множество мембранных рецепторов, которые позволяют им узнавать самые разные поверхностные белки-антигены. В тимусе Т-лимфоцитам предъявляются специфичные антигены, которые сидят на поверхности собственных клеток организма. Т-лимфоциты, узнающие своих, либо уничтожаются, либо становятся Т-регуляторами. Функция регуляторов в том, чтобы подавлять аутоиммунный ответ, не давая иммунитету «поедать» своего же хозяина. Но при этом никаких представителей кишечной микрофлоры в тимусе нет и в помине. Как же тогда иммунитет учится узнавать кишечные бактерии?
Исследователи из Вашингтонского университета в Сент-Луисе (США) опубликовали в журнале Nature статью, в которой утверждают, что открыли еще одну обучающую базу для имунных клеток. Уже появлялись предположения, что предшественники Т-лимфоцитов могут дозревать где-то еще, помимо тимуса, но сейчас впервые было получено строгое экспериментальное подтверждение. Ученые обнаружили, что рецепторы на поверхности Т-регуляторов, обитающих в желудочно-кишечном тракте мышей, отличаются от рецепторов их «коллег» из других тканей того же организма. Было решено проверить, не является ли это следствием контакта незрелых Т-лимфоцитов с микробными обитателями кишечника. Гены, которые кодировали эти рецепторы, были пересажены в клетки костного мозга (где берут начало иммунные клетки). Операция проводилась над мышами, которые были генетически лишены спсобности создавать какие-либо собственные Т-клетки.
Костный мозг таких животных с двумя пересаженными генами начинал производить предшественников Т-клеток, но созреть им не удавалось. Если же мышей, из клеток которых взяли эти гены, и тех, которым эти гены пересадили, держали вместе, то у мышей-доноров появлялись такие же Т-регуляторы. Это происходило из-за того, что у животных «обобществлялась» кишечная микрофлора, бактерии от первых попадали в организм вторых. Иными словами, бактерии обучали незрелые Т-клетки не атаковать их, и присходило это в кишечнике.
Как именно контактируют незрелые Т-клетки и кишечная микрофлора, пока неизвестно, но ученые не сомневаются, что причиной многих кишечных болезней может быть именно нарушение процесса натаскивания иммунных клеток в кишечнике. Если научиться искуственно «разъяснять» иммуным клеткам, что есть бактериальные антигены, то можно будет предотращать нежелательные иммунные атаки на кишечных симбионтов.
http://science.compulenta.ru
В России создают тест на определение Т-клеточного иммунитета к коронавирусу
27.11.2020
Т-клетки (Т-лимфоциты) хранят информацию о ранее выявленных иммунной системой в организме антигенах и формируют долговременный иммунитет к перенесенным инфекционным заболеваниям. Т-клетки, специфичные к SARS-Cov-2, есть даже у людей, которые перенесли инфекцию бессимптомно и не выработали антитела. Ученые НМИЦ гематологии выяснили, что Т-клетки, которые «узнают» коронавирус, обнаруживаются даже в образцах крови, взятых еще до пандемии. Этот феномен исследователи объясняют перекрестным иммунитетом, вызванным ранее перенесенными коронавирусными инфекциями.
«Мы получаем все больше сведений, что Т-клетки, как минимум, не менее важный защитный механизм против COVID-19, чем антитела. Это подтверждается тем, что у многих, особенно легко и бессимптомно переболевших, не вырабатываются антитела, а Т-клетки присутствуют. Исследования показывают, что уже через полгода у значительной части переболевших количество антител сильно снижается, а у некоторых они и вовсе исчезают. Т-клеточный ответ потенциально сохраняется гораздо дольше»,— сообщил МедПорталу сотрудник лаборатории трансплантационной иммунологии НМИЦ гематологии Алексей Титов.
Массово протестировать людей на Т-клеточный иммунитет пока технически невозможно: такие исследования проводятся только в специализированных лабораториях практически вручную. Специалисты НМИЦ-гематологии работают над созданием тестов на Т-клетки, которые позволят выявлять переболевших на более длительной временной дистанции, чем антитела.
«Технология основана на зарекомендовавшем себя методе выявления реагирующих на вирус Т-клеток, однако нашим ноу-хау является конкретный набор фрагментов коронавирусных белков, который мы тщательно отбираем, отсекая те, что могут дать ложно-позитивную реакцию Т-клеток»,— рассказал Алексей Титов,— «Эти тесты смогут в спорных случаях подтвердить факт прошлой коронавирусной инфекции, а также использоваться для оценки эффективности вакцинации».
«В перспективе мы сможем установить „границу“ Т-клеточного ответа, при пересечении которой человек, скорее всего, не заболеет. А для тех, кто ее не пересек, возможно, болезнь будет протекать легче. Но для того, чтобы провести такие исследования, требуется время»,— отметил Алексей Титов.
Ученые НМИЦ гематологии планируют завершить разработку теста уже зимой 2021 года. В ближайшее время он будет использоваться только в исследовательских целях. Однако на основе той же технологии работают некоторые тесты на латентный туберкулез (Т-спот), поэтому не исключено, что, как минимум, те же лаборатории, которые предоставляют такую услугу, смогут проводить тестирование.
Читать подробнее.
У здоровых людей найдены T-лимфоциты, реагирующие на SARS-CoV-2
Клинические проявления COVID-19 варьируются в широких пределах, от бессимптомной инфекции до острой дыхательной недостаточности и смерти. Очевидно, в значительной мере это связано с особенностями иммунного ответа у пациента. Сейчас много внимания уделяют гуморальному иммунитету — появлению в крови антител (иммуноглобулинов IgG и IgM) к вирусным белкам; антитела вырабатывают B-лимфоциты. Однако существует также клеточный иммунитет, за который отвечают Т-лимфоциты. Суть его в следующем: патоген поедают клетки-макрофаги, фрагменты белков патогена экспонируют на своей мембране в комплексе с белками главного комплекса гистосовместимости (MHC). Фрагменты-антигены распознают Т-клетки с помощью Т-клеточных рецепторов (TCR) — эти рецепторы, как и антитела, относятся к иммуноглобулинам и специфично связываются с антигенами. У Т-хелперов в этом взаимодействии участвует также корецептор CD4, у Т-киллеров CD8.
Основная задача Т-хелперов — усиление адаптивного иммунного ответа. Соответственно, присутствие в крови Т-лимфоцитов с рецептором CD4 (CD4+ клеток) и TCR, подходящим к антигену SARS-CoV-2, может способствовать развитию иммунного ответа при COVID-19. Для SARS-CoV 2002/03 (атипичной пневмонии) ответы CD4+ T-клеток на белок S коронавируса, как правило, связаны с положительными исходами. Однако клеточный иммунный ответ на SARS-CoV-2 детально еще не изучался. Это решила сделать группа ученых из Берлина.
Исследователи проверили встречаемость и характеристики CD4+ T-клеток, реагирующих на S-белок SARS-CoV-2, в крови у пациентов с COVID-19 и у здоровых людей, SARS-CoV-2-серонегативных (без антител к новому коронавирусу). У участников исследования брали кровь, изолированные лимфоциты стимулировали пептидами, соответствующими различным фрагментам S-белка. Участки, расположенные ближе к С-концу белка нового коронавируса, имеют больше гомологии с коронавирусами, вызывающими обычную простуду у людей (HCoV-229E, -NL63, -OC43, -HKU1), по сравнению с участками из N-конца белка. К сожалению, рецептор-связывающий домен S-белка (RBD), который особенно перспективен как мишень нейтрализующего вирус антитела, находится ближе к N-концу.
Из 18 пациентов с COVID-19 у 12 обнаружились Т-клетки, реагирующие на пептиды из N-конца S-белка, у 15 (83%) — на пептиды из С-конца. У пациентов, в крови которых такие Т-клетки отсутствовали, болезнь, как правило, протекала тяжелее.
Интересно, что S-реактивные CD4+ T-клетки обнаружились у 24 из 68 здоровых доноров; это 34%. К пептидам из N-конца белка — всего у 6 человек (8,8%). При этом, однако, у 10 здоровых серонегативных людей с Т-клетками, реагирующими на S-белок коронавируса, ПЦР-тест выявил РНК коронавируса в мазках из носоглотки — очевидно, они находились на ранней стадии инфекции.
Таким образом, Т-клетки здоровых людей, реагирующие на белок нового коронавируса, явно «предпочитают» его С-конец, более сходный с белками сезонных коронавирусов. Восемнадцать из 68 здоровых участников исследования протестировали на антитела к простудным коронавирусам и нашли антитела у всех, независимо от наличия S-реактивных T-клеток. Такая ситуация описана и для других вирусных заболеваний, например для желтой лихорадки.
S-реактивные CD4+ T-клетки от пациентов с COVID-19 отличались от клеток здоровых доноров еще и тем, что коэкспрессировали более высокие уровни белков CD38 и HLA-DR, что указывает на их недавнюю активацию in vivo.
Авторы отмечают, что, по их данным, это первое прямое исследование Т-клеточных ответов на SARS-CoV-2. Оно указывает на потенциальную возможность кросс-реактивного клеточного иммунитета к новой коронавирусной инфекции, то есть иммунного ответа у тех, кто ранее переболел сезонными коронавирусами. А это довольно большое число людей: коронавирусы ответственны примерно за каждую пятую простуду. «Инфекции HCoV распространены повсеместно, но демонстрируют зимнюю сезонность в умеренных регионах, — пишут авторы. — На основании эпидемиологических данных, указывающих в среднем на два эпизода “простуды” в год у взрослого населения, можно экстраполировать, что средний взрослый человек заражается HCoV-инфекцией в среднем каждые два-три года. Протективные антитела могут снизиться, но клеточный иммунитет может остаться».
Возможно, эта кросс-реактивность вносит вклад в более легкое протекание COVID-19 у детей и молодежи, предполагают авторы. Большее число социальных контактов, посещение детских учреждений и учебных заведений увеличивает шанс переболеть коронавирусной простудой.
Как долго сохраняются гуморальный и клеточный иммунитет к SARS-CoV-2, пока неизвестно. Нейтрализующие антитела к SARS-CoV могут выявляться и год спустя после болезни, для нового коронавируса этот аспект, естественно, не изучен. Антитела к другим коронавирусам могут исчезать спустя месяцы, однако повторная инфекция протекает легче. Какую роль в этом играет клеточный иммунитет, предстоит выяснить.
Авторы считают, что необходимо детальное изучение Т-клеточного ответа на SARS-CoV-2, в том числе у здоровых людей, возможно, с акцентом на региональную специфику, связанную с различными частотами коронавирусных простуд. «Присутствие SARS-CoV-2-реактивных Т-клеток у здоровых доноров представляет большой интерес, но необходимы более масштабные проспективные когортные исследования, чтобы оценить, является ли их наличие коррелятом защиты или патологии. Результаты таких исследований будут ключевыми для механистического понимания пандемии SARS-CoV-2, адаптации методов сдерживания инфекции и поддержки разработки вакцин», — пишут авторы.
Иммунная система и первичный иммунодефицит
Иммунная система состоит из множества различных типов клеток и белков. Каждый элемент выполняет определенную задачу, направленную на распознавание постороннего материала и / или реагирование на него.
Организация и развитие иммунной системы
Иммунная система — это прекрасное сотрудничество между клетками и белками, которые работают вместе, чтобы обеспечить защиту от инфекции. Эти клетки и белки не образуют единого органа, такого как сердце или печень.Вместо этого иммунная система рассредоточена по всему телу, чтобы обеспечить быстрый ответ на инфекцию (, рис. 1, ). Клетки проходят через кровоток или в специальные сосуды, называемые лимфатическими. Лимфатические узлы и селезенка обеспечивают структуры, которые способствуют межклеточной коммуникации.
Костный мозг и тимус представляют собой тренировочную площадку для двух клеток иммунной системы (B-клеток и T-клеток соответственно). Развитие всех клеток иммунной системы начинается в костном мозге с гемопоэтических (кроветворных) стволовых клеток ( Рисунок 2 ).Эта клетка называется «стволовой», потому что все другие специализированные клетки возникают из нее. Благодаря своей способности генерировать всю иммунную систему, эта клетка является наиболее важной при трансплантации костного мозга или гемопоэтических стволовых клеток. Он связан с эмбриональными стволовыми клетками, но представляет собой отдельный тип клеток. В большинстве случаев развитие одного типа клеток не зависит от других типов клеток.
Первичные иммунодефициты могут поражать только один компонент иммунной системы или несколько клеток и белков.Чтобы лучше понять описанные ниже иммунодефицитные состояния, в этом разделе будет описана организация и созревание иммунной системы.
Хотя все компоненты иммунной системы взаимодействуют друг с другом, обычно рассматриваются две широкие категории иммунных ответов: врожденная иммунная система и адаптивная иммунная система.
Врожденные иммунные реакции — это те реакции, которые зависят от клеток, которым не требуется дополнительная «тренировка» для выполнения своей работы. Эти клетки включают нейтрофилы, моноциты, естественные киллеры (NK) и набор белков, называемых белками комплемента.Врожденные реакции на инфекцию происходят быстро и надежно. Даже у младенцев есть отличные врожденные иммунные реакции.
Адаптивные иммунные ответы составляют вторую категорию. В этих ответах участвуют Т-клетки и В-клетки, два типа клеток, которым требуется «обучение» или образование, чтобы научиться не атаковать наши собственные клетки. Преимуществами адаптивных ответов являются их долговечная память и способность адаптироваться к новым микробам.
Центральным элементом обеих категорий иммунных ответов является способность отличать чужеродных захватчиков (то есть, что нужно атаковать) от наших собственных тканей, которые необходимо защищать.Из-за своей способности быстро реагировать врожденные реакции обычно первыми реагируют на «вторжение». Этот первоначальный ответ служит для предупреждения и запуска адаптивного ответа, для полной активации которого может потребоваться несколько дней.
В раннем возрасте врожденные реакции наиболее заметны. У новорожденных есть антитела от матери, но они не вырабатывают собственных антител в течение нескольких недель.
Адаптивная иммунная система функционирует при рождении, но она не приобрела опыта, необходимого для оптимальной реакции памяти.Хотя это формирование памяти происходит на протяжении всей жизни, наиболее быстрый иммунологический опыт происходит в период между рождением и трехлетним возрастом. Каждое инфекционное воздействие приводит к тренировке клеток, так что реакция на повторное воздействие той же инфекции происходит быстрее и сильнее.
В течение первых нескольких лет жизни большинство детей заражаются различными инфекциями и вырабатывают антитела, направленные против этих конкретных инфекций. Клетки, вырабатывающие антитело, «запоминают» инфекцию и обеспечивают длительный иммунитет к ней.Точно так же Т-клетки могут запоминать вирусы, с которыми столкнулся организм, и могут более энергично реагировать, когда снова сталкиваются с тем же вирусом. Такое быстрое созревание адаптивной иммунной системы в раннем детстве затрудняет тестирование маленьких детей, поскольку ожидания относительно того, что является нормальным, с возрастом меняются. В отличие от адаптивной иммунной системы, врожденная иммунная система в значительной степени не повреждена при рождении.
Основные органы иммунной системы
Нажмите, чтобы увеличить изображение
А.Тимус: Тимус — это орган, расположенный в верхней части грудной клетки. Незрелые лимфоциты покидают костный мозг и попадают в тимус, где они «обучаются», чтобы стать зрелыми Т-лимфоцитами.
B. Печень: Печень — главный орган, ответственный за синтез белков системы комплемента. Кроме того, он содержит большое количество фагоцитарных клеток, которые поглощают бактерии в крови, когда она проходит через печень.
C. Костный мозг: Костный мозг — это место, где все клетки иммунной системы начинают свое развитие из примитивных стволовых клеток.
D. Миндалины: Миндалины представляют собой скопление лимфоцитов в горле.
E. Лимфатические узлы: Лимфатические узлы представляют собой скопления В-лимфоцитов и Т-лимфоцитов по всему телу. Клетки собираются в лимфатических узлах, чтобы общаться друг с другом.
F. Селезенка: Селезенка представляет собой совокупность Т-лимфоцитов, В-лимфоцитов и моноцитов. Он служит для фильтрации крови и предоставляет место для взаимодействия организмов и клеток иммунной системы.
G. Кровь: Кровь — это система кровообращения, которая переносит клетки и белки иммунной системы из одной части тела в другую.
Клетки иммунной системы
Нажмите, чтобы увеличить изображение
A. Костный мозг: Участок в организме, где большая часть клеток иммунной системы вырабатывается в виде незрелых или стволовых клеток.
B. Стволовые клетки: Эти клетки обладают потенциалом дифференцироваться и созревать в различные клетки иммунной системы.
C. Тимус: Орган, расположенный в грудной клетке, который заставляет незрелые лимфоциты становиться зрелыми Т-лимфоцитами.
D. B-клетки: Эти лимфоциты возникают в костном мозге и дифференцируются в плазматические клетки, которые, в свою очередь, вырабатывают иммуноглобулины (антитела).
E. Цитотоксические Т-клетки: Эти лимфоциты созревают в тимусе и отвечают за уничтожение инфицированных клеток.
F. Т-хелперы: Эти специализированные лимфоциты «помогают» другим Т-клеткам и В-клеткам выполнять свои функции.
G. Клетки плазмы: Эти клетки развиваются из B-клеток и являются клетками, вырабатывающими иммуноглобулин для сыворотки и секретов.
H. Иммуноглобулины: Эти узкоспециализированные белковые молекулы, также известные как антитела, подходят чужеродным антигенам, таким как полиомиелит, как замок и ключ. Их разнообразие настолько велико, что их можно производить так, чтобы они соответствовали всем возможным микроорганизмам в нашей окружающей среде.
I. Нейтрофилы (полиморфноядерные клетки PMN): Тип клеток, обнаруженных в кровотоке, которые быстро поглощают микроорганизмы и убивают их.
J. Моноциты: Тип фагоцитарных клеток, обнаруженных в кровотоке, которые развиваются в макрофаги при миграции в ткани.
K. Красные кровяные тельца: Клетки в кровотоке, которые переносят кислород из легких в ткани.
L. Тромбоциты: Мелкие клетки в кровотоке, которые важны для свертывания крови.
M. Дендритные клетки: Важные клетки в представлении антигена клеткам иммунной системы.
Компоненты иммунной системы
Каждый основной компонент иммунной системы будет рассмотрен отдельно ниже. Иммунная недостаточность может влиять на один или несколько компонентов. Проявления иммунодефицита могут быть единичным типом инфекции или более глобальной восприимчивостью к инфекции. Из-за множества взаимодействий между клетками и белками иммунной системы некоторые иммунодефицитные состояния могут быть связаны с очень ограниченным кругом инфекций.Для этих иммунодефицитов существуют другие элементы, которые «компенсируют слабину» и могут хотя бы частично компенсировать недостающую часть. В других случаях способность защищаться от инфекции очень слаба, и у человека могут быть серьезные проблемы с инфекциями.
Клетки иммунной системы можно разделить на лимфоциты (Т-клетки, В-клетки и NK-клетки), нейтрофилы и моноциты / макрофаги. Это все типы лейкоцитов. Основные белки иммунной системы — это преимущественно сигнальные белки (часто называемые цитокинами), антитела и белки комплемента.
Лимфоциты иммунной системы
В-клетки
B-клетки (иногда называемые B-лимфоцитами и часто называемые в лабораторных отчетах клетками CD19 или CD20) — это специализированные клетки иммунной системы, основная функция которых заключается в выработке антител (также называемых иммуноглобулинами или гамма-глобулинами). В-клетки развиваются в костном мозге из гемопоэтических стволовых клеток. В процессе созревания в костном мозге В-клетки обучаются или обучаются таким образом, чтобы они не вырабатывали антитела к здоровым тканям.В зрелом состоянии B-клетки могут быть обнаружены в костном мозге, лимфатических узлах, селезенке, некоторых областях кишечника и кровотоке.
Когда B-клетки сталкиваются с чужеродным материалом (антигенами), они реагируют созреванием в другой тип клеток, называемый плазматическими клетками. B-клетки также могут созревать в клетки памяти, что позволяет быстро отреагировать, если та же инфекция встречается снова. Плазматические клетки — это зрелые клетки, которые действительно производят антитела. Антитела, основной продукт плазматических клеток, попадают в кровоток, ткани, дыхательные и кишечные секреты и даже в слезы.Антитела — это узкоспециализированные белковые молекулы сыворотки.
Для каждого чужеродного антигена существуют молекулы антител, специально разработанные для этого антигена, такие как замок и ключ. Например, есть молекулы антител, которые физически соответствуют полиовирусу, другие — дифтерии, а третьи — вирусу кори. Разнообразие различных молекул антител очень велико, поэтому В-клетки обладают способностью вырабатывать их против практически всех микробов в нашей среде.Однако каждая плазматическая клетка производит только один вид антител.
Когда молекулы антител распознают микроорганизм как чужеродный, они физически прикрепляются к нему и запускают сложную цепочку событий с участием других компонентов иммунной системы, которые работают, чтобы в конечном итоге уничтожить микроб. Антитела различаются в зависимости от их специализированных функций в организме. Эти вариации определяются химической структурой антитела, которая, в свою очередь, определяет класс антитела (или иммуноглобулина).
Существует пять основных классов антител (IgG, IgA, IgM, IgD и IgE). IgG имеет четыре различных подкласса (IgG1, IgG2, IgG3, IgG4). IgA имеет два подкласса (IgA1 и IgA2).
Каждый класс иммуноглобулинов имеет различные химические характеристики, которые наделяют его определенными функциями (рис. 3). Например, антитела IgG образуются в больших количествах, остаются в кровотоке в течение нескольких недель и легко перемещаются из кровотока в ткани. Только IgG проникает через плаценту и передает часть иммунитета от матери новорожденному.
Антитела класса IgA вырабатываются возле слизистых оболочек и попадают в выделения, такие как слезы, желчь, слюна и слизь, где они защищают от инфекций дыхательных путей и кишечника. Некоторое количество IgA также появляется в кровотоке.
Антитела класса IgM — первые антитела, образующиеся в ответ на инфекцию. Они важны для защиты в первые дни заражения.
Антитела класса IgE вызывают аллергические реакции.
Антитела защищают организм от инфекции различными способами. Например, некоторые микроорганизмы, такие как вирусы, должны прикрепиться к клеткам организма, прежде чем они смогут вызвать инфекцию, но антитела, связанные с поверхностью вируса, могут препятствовать способности вируса прикрепляться к клетке-хозяину. Кроме того, антитела, прикрепленные к поверхности некоторых микроорганизмов, могут вызывать активацию группы белков, называемой системой комплемента, которая может напрямую убивать некоторые бактерии или вирусы.
Бактерии, покрытые антителами, также намного легче поглощаются нейтрофилами и уничтожаются, чем бактерии, не покрытые антителами. Все эти действия антител препятствуют успешному проникновению микроорганизмов в ткани организма и возникновению серьезных инфекций.
Длительный срок жизни плазматических клеток позволяет нам сохранять иммунитет к вирусам и бактериям, заразившим нас много лет назад. Например, как только люди будут полностью иммунизированы живыми вакцинными штаммами вируса кори, они почти никогда не заразятся им, потому что они сохраняют плазматические клетки и антитела в течение многих лет, и эти антитела предотвращают инфекцию.
Т-клетки
Т-клетки (иногда называемые Т-лимфоцитами и часто называемые в лабораторных отчетах как CD3-клетки) — еще один тип иммунных клеток. Т-клетки напрямую атакуют клетки, инфицированные вирусами, а также действуют как регуляторы иммунной системы.
Т-клетки развиваются из гемопоэтических стволовых клеток в костном мозге, но завершают свое развитие в тимусе. Тимус — это специализированный орган иммунной системы грудной клетки. В тимусе незрелые лимфоциты развиваются в зрелые Т-клетки («Т» обозначает тимус), и Т-клетки, способные атаковать нормальные ткани, удаляются.Тимус необходим для этого процесса, и Т-клетки не могут развиваться, если у плода нет вилочковой железы. Зрелые Т-клетки покидают тимус и заселяют другие органы иммунной системы, такие как селезенка, лимфатические узлы, костный мозг и кровь.
Каждая Т-клетка реагирует со специфическим антигеном, точно так же, как каждая молекула антитела реагирует со специфическим антигеном. Фактически, на поверхности Т-клеток есть молекулы, похожие на антитела. Разнообразие различных Т-клеток настолько велико, что в организме есть Т-клетки, которые могут реагировать практически против любого антигена.
Т-клетки обладают разными способностями распознавать антиген и различаются по функциям. Существуют «киллерные» или цитотоксические Т-клетки (часто обозначаемые в лабораторных отчетах как Т-клетки CD8), хелперные Т-клетки (часто обозначаемые в лабораторных отчетах как Т-клетки CD4) и регуляторные Т-клетки. Каждый из них играет свою роль в иммунной системе.
Киллерные, или цитотоксические, Т-клетки фактически уничтожают инфицированные клетки. Т-киллеры защищают организм от определенных бактерий и вирусов, которые способны выживать и даже воспроизводиться в собственных клетках организма.Т-киллеры также реагируют на инородные ткани в организме, такие как пересаженная почка. Клетка-киллер должна мигрировать к месту заражения и напрямую связываться со своей мишенью, чтобы гарантировать ее разрушение.
Т-хелперы помогают В-клеткам вырабатывать антитела и помогают Т-клеткам-киллерам атаковать чужеродные вещества.
Регуляторные Т-клетки подавляют или выключают другие Т-лимфоциты. Без регулирующих клеток иммунная система продолжала бы работать даже после излечения инфекции.Без регуляторных Т-клеток организм может «чрезмерно отреагировать» на инфекцию. Регуляторные Т-клетки действуют как термостат системы лимфоцитов, чтобы держать ее включенной ровно достаточно — не слишком много и не слишком мало.
Структура иммуноглобулина
Нажмите, чтобы увеличить изображение
Каждый класс или тип иммуноглобулинов имеет общие свойства с другими. Все они имеют сайты связывания антигена, которые специфически сочетаются с чужеродным антигеном.
А.IgG: IgG является основным классом иммуноглобулинов в организме и обнаруживается в кровотоке, а также в тканях.
B. Секреторный IgA: Секреторный IgA состоит из двух молекул IgA, соединенных J-цепью и прикрепленных к секреторной части. Эти модификации позволяют секреторному IgA секретироваться в слизь, кишечные соки и слезы, где он защищает эти области от инфекции.
C. IgM: IgM состоит из пяти молекул иммуноглобулина, прикрепленных друг к другу.Он образуется на очень ранней стадии заражения и очень легко активирует комплемент.
NK Cells
Естественные клетки-киллеры (NK) названы так потому, что они легко убивают клетки, инфицированные вирусами. Их называют «естественными клетками-киллерами», поскольку они не требуют такого же образования тимуса, как Т-клетки. NK-клетки происходят из костного мозга и в относительно небольшом количестве присутствуют в кровотоке и тканях. Они важны для защиты от вирусов и, возможно, также для предотвращения рака.
NK-клеток убивают инфицированные вирусом клетки, вводя им смертоносное зелье химикатов. Они особенно важны для защиты от вирусов герпеса. Это семейство вирусов включает традиционную форму герпеса (простой герпес), а также вирус Эпштейна-Барра (причина инфекционного мононуклеоза) и вирус ветряной оспы (причина ветряной оспы).
Нейтрофилы
Нейтрофилы или полиморфноядерные лейкоциты (полисы или PMN) являются наиболее многочисленными из всех типов белых кровяных телец, составляя около половины или более от общего числа.Их также называют гранулоцитами, и они появляются в лабораторных отчетах как часть общего анализа крови (CBC с дифференциалом). Они обнаруживаются в кровотоке и могут мигрировать в места заражения в течение нескольких минут. Эти клетки, как и другие клетки иммунной системы, развиваются из гемопоэтических стволовых клеток костного мозга.
Нейтрофилы увеличиваются в количестве в кровотоке во время инфекции и в значительной степени ответственны за повышенное количество лейкоцитов, наблюдаемое при некоторых инфекциях.Это клетки, которые покидают кровоток и накапливаются в тканях в течение первых нескольких часов инфекции и отвечают за образование «гноя». Их основная роль — заглатывать бактерии или грибки и убивать их. Их стратегия убийства основана на поглощении инфицированных организмов в специальных пакетах клеточной мембраны, которые затем сливаются с другими частями нейтрофила, содержащими токсичные химические вещества, убивающие микроорганизмы. Они не играют особой роли в защите от вирусов.
Моноциты
Моноциты тесно связаны с нейтрофилами и циркулируют в кровотоке.Они составляют 5-10 процентов лейкоцитов. Они также выстилают стенки кровеносных сосудов в таких органах, как печень и селезенка. Здесь они улавливают микроорганизмы в крови, когда микроорганизмы проходят мимо. Когда моноциты покидают кровоток и попадают в ткани, они меняют форму и размер и становятся макрофагами. Макрофаги необходимы для уничтожения грибов и класса бактерий, к которому принадлежит туберкулез (микобактерии). Подобно нейтрофилам, макрофаги поглощают микробы и доставляют токсичные химические вещества непосредственно инородному захватчику, чтобы убить его.
Макрофаги живут дольше нейтрофилов и особенно важны при медленно растущих или хронических инфекциях. На макрофаги могут влиять Т-клетки, и они часто взаимодействуют с Т-клетками, убивая микроорганизмы.
Цитокины
Цитокины — очень важный набор белков в организме. Эти небольшие белки служат гормонами для иммунной системы. Они производятся в ответ на угрозу и представляют собой коммуникационную сеть для иммунной системы. В некоторых случаях клетки иммунной системы общаются, напрямую касаясь друг друга, но часто клетки общаются, секретируя цитокины, которые затем могут воздействовать на другие клетки либо локально, либо на расстоянии.
Эта умная система позволяет быстро доставить очень точную информацию, чтобы предупредить тело о статусе угрозы. Цитокины не часто измеряются клинически, но могут отображаться в лабораторных документах как IL-2, IL-4, IL-6 и т. Д. Некоторые цитокины были названы до того, как была введена нумерация интерлейкинов (IL), и имеют разные названия.
Дополнение
Система комплемента состоит из 30 белков крови, которые действуют упорядоченным образом для защиты от инфекции.Большинство белков в системе комплемента вырабатываются в печени. Некоторые белки системы комплемента покрывают зародыши, чтобы облегчить их усвоение нейтрофилами. Другие компоненты комплемента посылают химические сигналы для привлечения нейтрофилов к участкам инфекции. Белки комплемента также могут собираться на поверхности микроорганизмов, образуя комплекс. Этот комплекс может затем проколоть клеточную стенку микроорганизма и разрушить ее.
Примеры того, как иммунная система борется с инфекциями
Бактерии
Наши тела покрыты бактериями, и наша окружающая среда содержит бактерии на большинстве поверхностей.Наша кожа и внутренние слизистые оболочки действуют как физические барьеры, помогающие предотвратить инфекцию. Когда кожа или слизистые оболочки повреждены из-за болезни, воспаления или травмы, бактерии могут попасть в организм. Инфекционные бактерии обычно покрываются комплементом и антителами, когда попадают в ткани, и это позволяет нейтрофилам легко распознавать бактерии как что-то чужеродное. Затем нейтрофилы поглощают бактерии и уничтожают их (рис. 4).
Когда антитела, комплемент и нейтрофилы работают нормально, этот процесс эффективно убивает бактерии.Однако, когда количество бактерий слишком велико или есть дефекты в продукции антител, комплемента и / или нейтрофилов, могут возникать рецидивирующие бактериальные инфекции.
Вирусов
Большинство из нас часто подвергаются воздействию вирусов. То, как наш организм защищается от вирусов, отличается от того, как мы сражаемся с бактериями. Вирусы могут выживать и размножаться только внутри наших клеток. Это позволяет им «прятаться» от нашей иммунной системы. Когда вирус заражает клетку, клетка выделяет цитокины, чтобы предупредить другие клетки об инфекции.Это «предупреждение» обычно предотвращает заражение других клеток. К сожалению, многие вирусы могут перехитрить эту защитную стратегию и продолжают распространять инфекцию.
Циркулирующие Т-клетки и NK-клетки предупреждаются о вирусном вторжении и мигрируют в то место, где они убивают определенные клетки, в которых содержится вирус. Это очень разрушительный механизм уничтожения вируса, потому что многие из наших собственных клеток могут быть принесены в жертву в процессе. Тем не менее, это эффективный процесс искоренения вируса.
В то же время, когда Т-лимфоциты убивают вирус, они также инструктируют В-лимфоциты вырабатывать антитела. Когда мы подвергаемся воздействию того же вируса во второй раз, антитела помогают предотвратить инфекцию. Т-клетки памяти также продуцируются и быстро реагируют на вторую инфекцию, что также приводит к более легкому течению инфекции.
Нормальное антибактериальное действие
Нажмите, чтобы увеличить изображение
В большинстве случаев бактерии уничтожаются совместными усилиями фагоцитирующих клеток, антител и комплемента.
A. Нейтрофил (фагоцитарная клетка) взаимодействует с бактериями (микробом): Микроб покрыт специфическим антителом и комплементом. Затем фагоцитарная клетка начинает свою атаку на микроб, присоединяясь к молекулам антитела и комплемента.
B. Фагоцитоз микроба: После прикрепления к микробу фагоцитарная клетка начинает поглощать микроб, распространяясь вокруг микроба и поглощая его.
C. Уничтожение микроба: После проглатывания микроба пакеты с ферментами или химическими веществами сбрасываются в вакуоль, где они убивают микроб.
Иммунная система и первичные иммунодефицитные заболевания
Иммунная недостаточность классифицируется как первичная иммунная недостаточность или вторичная иммунная недостаточность. Первичный иммунный дефицит является «первичным», потому что иммунная система является основной причиной, и большинство из них являются генетическими дефектами, которые могут передаваться по наследству. Вторичные иммунодефицитные состояния называются так, потому что они вызваны другими состояниями.
Вторичный иммунный дефицит является обычным явлением и может возникать как часть другого заболевания или как следствие приема определенных лекарств.Наиболее распространенные вторичные иммунные недостаточности вызваны старением, недоеданием, приемом некоторых лекарств и некоторыми инфекциями, такими как ВИЧ.
Наиболее распространенными лекарствами, связанными с вторичным иммунодефицитом, являются химиотерапевтические препараты и препараты, подавляющие иммунитет, рак, отторжение трансплантированного органа или аутоиммунные заболевания. Другой вторичный иммунный дефицит включает потерю белка в кишечнике или почках. Когда белки теряются, теряются и антитела, что приводит к низким иммунным глобулинам или низким уровням антител.Эти состояния важно распознавать, потому что, если основная причина может быть устранена, функция иммунной системы может быть улучшена и / или восстановлена.
Независимо от первопричины может оказаться полезным распознавание вторичного иммунодефицита и оказание иммунологической поддержки. Предлагаемые виды поддержки сопоставимы с теми, которые используются при первичном иммунодефиците.
Заболевания, связанные с первичным иммунодефицитом, представляют собой группу заболеваний, вызываемых основными дефектами иммунной функции, которые являются внутренними или присущими клеткам и белкам иммунной системы.Существует более 400 первичных иммунодефицитов. Некоторые из них относительно распространены, а другие — довольно редко. Некоторые влияют на одну клетку или белок иммунной системы, а другие могут влиять на два или более компонентов иммунной системы.
Хотя болезни, связанные с первичным иммунодефицитом, могут во многом отличаться друг от друга, у них есть одна важная особенность. Все они являются результатом дефекта одного или нескольких элементов или функций нормальной иммунной системы, таких как Т-клетки, В-клетки, NK-клетки, нейтрофилы, моноциты, антитела, цитокины или система комплемента.Большинство из них являются наследственными заболеваниями и могут передаваться по наследству, например, Х-связанная агаммаглобулинемия (XLA) или тяжелый комбинированный иммунодефицит (SCID). Другие первичные иммунодефициты, такие как общий вариабельный иммунодефицит (CVID) и селективный дефицит IgA, не всегда наследуются четко или предсказуемо. Причина этих расстройств неизвестна, но считается, что взаимодействие генетических факторов и факторов окружающей среды может играть роль в их возникновении.
Поскольку наиболее важной функцией иммунной системы является защита от инфекции, люди с заболеваниями первичного иммунодефицита имеют повышенную восприимчивость к инфекции.Это может включать слишком много инфекций, трудноизлечимых инфекций, необычно тяжелых инфекций или инфекций, вызванных необычными организмами. Инфекции могут располагаться в любом месте тела. Обычно поражаются носовые пазухи (синусит), бронхи (бронхит), легкие (пневмония) или кишечник (инфекционная диарея).
Другая функция иммунной системы — различать здоровую ткань («я») и чужеродный материал («чужой»). Примерами инородного материала могут быть микроорганизмы, пыльца или даже трансплантированная почка другого человека.При некоторых заболеваниях, связанных с иммунодефицитом, иммунная система неспособна отличить «я» от «чужого». В этих случаях, помимо повышенной восприимчивости к инфекции, люди с первичным иммунодефицитом также могут иметь аутоиммунные заболевания, при которых иммунная система атакует их собственные клетки или ткани, как если бы эти клетки были чужеродными или чужеродными.
Существует также несколько типов первичных иммунодефицитов, при которых способность реагировать на инфекцию в основном не нарушена, но способность регулировать этот ответ является ненормальной.Примерами этого являются аутоиммунный лимфопролиферативный синдром (ALPS) и IPEX (X-связанный синдром иммунодефицита, полиэндокринопатии и энтеропатии).
Заболевания, связанные с первичным иммунодефицитом, могут возникать у людей любого возраста. Первоначальные описания этих болезней были у детей. Однако по мере роста медицинского опыта у многих подростков и взрослых были диагностированы заболевания первичного иммунодефицита. Частично это связано с тем, что некоторые расстройства, такие как CVID и селективный дефицит IgA, могут иметь свои первоначальные клинические проявления во взрослой жизни.Эффективная терапия существует для нескольких основных иммунодефицитов, и многие люди с этими расстройствами могут жить относительно нормальной жизнью.
Заболевания, связанные с первичным иммунодефицитом, первоначально считались очень редкими. Однако недавние исследования показали, что как группа они более распространены, чем предполагалось изначально. Подсчитано, что 1 из 1 200–2 000 человек может иметь ту или иную форму первичного иммунодефицита.
Выдержка из Справочника IDF для пациентов и семей по первичным иммунодефицитным заболеваниям ПЯТОЕ ИЗДАНИЕ Авторское право 2013 г. Фондом иммунодефицита, США.Эта страница содержит общую медицинскую информацию, которую нельзя безопасно применить к любому отдельному случаю. Медицинские знания и практика могут быстро меняться. Таким образом, эту страницу не следует использовать как замену профессиональной медицинской консультации.
Клетки, ткани, функции и болезни
Наша иммунная система необходима для нашего выживания. Без иммунной системы наши тела были бы открыты для атак бактерий, вирусов, паразитов и многого другого. Именно наша иммунная система поддерживает наше здоровье, пока мы дрейфуем сквозь море патогенов.
Эта обширная сеть клеток и тканей постоянно ищет захватчиков, и как только враг обнаружен, начинается комплексная атака.
Иммунная система распространяется по всему телу и включает в себя множество типов клеток, органов, белков и тканей. Что особенно важно, он может отличить нашу ткань от чужеродной — собственную от чужой. Мертвые и поврежденные клетки также распознаются и удаляются иммунной системой.
Если иммунная система сталкивается с патогеном, например, бактерией, вирусом или паразитом, у нее возникает так называемый иммунный ответ.Позже мы объясним, как это работает, но сначала мы познакомим вас с некоторыми из главных персонажей иммунной системы.
Поделиться на PinterestЛейкоцит (желтый), атакующий бактерии сибирской язвы (оранжевый). Белая линия внизу имеет длину 5 микрометров.Изображение предоставлено: Фолькер Бринкманн
Лейкоциты также называют лейкоцитами. Они циркулируют в организме в кровеносных и лимфатических сосудах, параллельных венам и артериям.
Лейкоциты постоянно патрулируют и ищут патогены.Когда они находят цель, они начинают размножаться и посылать сигналы другим типам клеток, чтобы сделать то же самое.
Наши лейкоциты хранятся в разных частях тела, которые называются лимфоидными органами. К ним относятся следующие:
- Тимус — железа между легкими и чуть ниже шеи.
- Селезенка — орган, фильтрующий кровь. Он находится в верхнем левом углу живота.
- Костный мозг — находится в центре костей, он также производит эритроциты.
- Лимфатические узлы — небольшие железы, расположенные по всему телу и связанные лимфатическими сосудами.
Существует два основных типа лейкоцитов:
1. Фагоциты
Эти клетки окружают и поглощают патогены и разрушают их, эффективно поедая их. Существует несколько типов, в том числе:
- Нейтрофилы — это наиболее распространенный тип фагоцитов, который имеет тенденцию атаковать бактерии.
- Моноциты — это самый крупный тип, выполняющий несколько функций.
- Макрофаги — патрулируют патогены, а также удаляют мертвые и умирающие клетки.
- Тучные клетки — они выполняют множество функций, в том числе помогают заживлять раны и защищаться от патогенов.
2. Лимфоциты
Лимфоциты помогают организму запоминать прошлых захватчиков и распознавать их, если они вернутся, чтобы атаковать снова.
Лимфоциты начинают свою жизнь в костном мозге. Некоторые остаются в костном мозге и развиваются в В-лимфоциты (В-клетки), другие направляются в тимус и становятся Т-лимфоцитами (Т-лимфоцитами).Эти два типа клеток имеют разные роли:
- В-лимфоцитов — они вырабатывают антитела и помогают предупреждать Т-лимфоциты.
- Т-лимфоциты — они разрушают поврежденные клетки в организме и помогают предупредить другие лейкоциты.
Иммунная система должна уметь отличать себя от чужого. Он делает это, обнаруживая белки, которые находятся на поверхности всех клеток. Он учится игнорировать свои собственные или собственные белки на ранней стадии.
Антиген — это любое вещество, которое может вызвать иммунный ответ.
Во многих случаях антигеном является бактерия, грибок, вирус, токсин или инородное тело. Но это также может быть одна из наших собственных ячеек, неисправная или мертвая. Первоначально ряд типов клеток работают вместе, чтобы распознавать антиген как захватчика.
Роль В-лимфоцитов
Как только В-лимфоциты обнаруживают антиген, они начинают секретировать антитела («антиген» — это сокращение от «генераторы антител»). Антитела — это особые белки, которые связываются со специфическими антигенами.
Каждая В-клетка вырабатывает одно специфическое антитело.Например, один может создать антитело против бактерий, вызывающих пневмонию, а другой может распознать вирус простуды.
Антитела являются частью большого семейства химических веществ, называемых иммуноглобулинами, которые играют множество ролей в иммунном ответе:
- Иммуноглобулин G (IgG) — маркирует микробы, чтобы другие клетки могли распознавать их и бороться с ними.
- IgM — специалист по уничтожению бактерий.
- IgA — накапливается в жидкостях, таких как слезы и слюна, где он защищает ворота в организм.
- IgE — защищает от паразитов, а также вызывает аллергию.
- IgD — остается связанным с В-лимфоцитами, помогая им запустить иммунный ответ.
Антитела фиксируют антиген, но не убивают его, а лишь отмечают смерть. Убийство — это работа других клеток, например фагоцитов.
Роль Т-лимфоцитов
Существуют различные типы Т-лимфоцитов:
Т-хелперные Т-клетки (Th-клетки) — они координируют иммунный ответ.Некоторые связываются с другими клетками, а некоторые стимулируют В-клетки производить больше антител. Другие привлекают больше Т-клеток или фагоцитов, поедающих клетки.
Т-киллеры (цитотоксические Т-лимфоциты) — как следует из названия, эти Т-клетки атакуют другие клетки. Они особенно полезны для борьбы с вирусами. Они работают, распознавая небольшие части вируса снаружи инфицированных клеток и уничтожая инфицированные клетки.
Иммунная система каждого человека разная, но, как правило, она становится сильнее в зрелом возрасте, поскольку к этому времени мы подвергаемся воздействию большего количества патогенов и развиваем больший иммунитет.
Именно поэтому подростки и взрослые болеют реже, чем дети.
После того, как антитело было произведено, его копия остается в организме, так что, если тот же антиген появится снова, с ним можно будет справиться быстрее.
Вот почему при некоторых заболеваниях, таких как ветряная оспа, вы получаете их только один раз, поскольку в организме есть антитела к ветряной оспе, готовые и ждущие, чтобы уничтожить их в следующий раз, когда они появятся. Это называется иммунитетом.
У людей есть три типа иммунитета, которые называются врожденным, адаптивным и пассивным:
Врожденный иммунитет
Все мы рождаемся с некоторым уровнем иммунитета к захватчикам.Иммунная система человека, как и иммунная система многих животных, с первого дня будет атаковать иноземных захватчиков. Этот врожденный иммунитет включает внешние барьеры нашего тела — первую линию защиты от патогенов, например кожу и слизистые оболочки горла и кишечника.
Этот ответ более общий и не конкретный. Если патогену удается увернуться от врожденной иммунной системы, срабатывает адаптивный или приобретенный иммунитет.
Адаптивный (приобретенный) иммунитет
Эта защита от патогенов развивается по мере того, как мы идем по жизни.По мере того, как мы подвергаемся болезням или вакцинируемся, мы накапливаем библиотеку антител к различным патогенам. Иногда это называют иммунологической памятью, потому что наша иммунная система помнит предыдущих врагов.
Пассивный иммунитет
Этот тип иммунитета «заимствован» из другого источника, но не действует бесконечно. Например, ребенок получает антитела от матери через плаценту до рождения и с грудным молоком после рождения. Этот пассивный иммунитет защищает ребенка от некоторых инфекций в первые годы его жизни.
Иммунизация
Иммунизация вводит человеку антигены или ослабленные патогены таким образом, что человек не заболевает, но при этом производит антитела. Поскольку организм сохраняет копии антител, он защищен, если угроза снова появится в более позднем возрасте.
Поскольку иммунная система очень сложна, существует множество потенциальных причин, по которым она может пойти не так. Типы иммунных расстройств делятся на три категории:
Иммунодефициты
Они возникают, когда одна или несколько частей иммунной системы не функционируют.Иммунодефицит может быть вызван множеством причин, включая возраст, ожирение и алкоголизм. В развивающихся странах недоедание — частая причина. СПИД — это пример приобретенного иммунодефицита.
В некоторых случаях иммунодефицит может передаваться по наследству, например, при хронической гранулематозной болезни, когда фагоциты не функционируют должным образом.
Аутоиммунитет
При аутоиммунных заболеваниях иммунная система ошибочно нацелена на здоровые клетки, а не на чужеродные патогены или дефектные клетки.В этом сценарии они не могут отличить себя от чужого.
Аутоиммунные заболевания включают целиакию, диабет 1 типа, ревматоидный артрит и болезнь Грейвса.
Гиперчувствительность
При гиперчувствительности иммунная система чрезмерно реагирует, повреждая здоровые ткани. Примером может служить анафилактический шок, когда организм реагирует на аллерген настолько сильно, что это может быть опасно для жизни.
Иммунная система невероятно сложна и чрезвычайно важна для нашего выживания.Несколько различных систем и типов клеток работают в идеальной синхронности (большую часть времени) по всему телу, чтобы бороться с болезнетворными микроорганизмами и удалять мертвые клетки.
Клетки, ткани, функции и болезни
Наша иммунная система необходима для нашего выживания. Без иммунной системы наши тела были бы открыты для атак бактерий, вирусов, паразитов и многого другого. Именно наша иммунная система поддерживает наше здоровье, пока мы дрейфуем сквозь море патогенов.
Эта обширная сеть клеток и тканей постоянно ищет захватчиков, и как только враг обнаружен, начинается комплексная атака.
Иммунная система распространяется по всему телу и включает в себя множество типов клеток, органов, белков и тканей. Что особенно важно, он может отличить нашу ткань от чужеродной — собственную от чужой. Мертвые и поврежденные клетки также распознаются и удаляются иммунной системой.
Если иммунная система сталкивается с патогеном, например, бактерией, вирусом или паразитом, у нее возникает так называемый иммунный ответ. Позже мы объясним, как это работает, но сначала мы познакомим вас с некоторыми из главных персонажей иммунной системы.
Поделиться на PinterestЛейкоцит (желтый), атакующий бактерии сибирской язвы (оранжевый). Белая линия внизу имеет длину 5 микрометров.Изображение предоставлено: Фолькер Бринкманн
Лейкоциты также называют лейкоцитами. Они циркулируют в организме в кровеносных и лимфатических сосудах, параллельных венам и артериям.
Лейкоциты постоянно патрулируют и ищут патогены. Когда они находят цель, они начинают размножаться и посылать сигналы другим типам клеток, чтобы сделать то же самое.
Наши лейкоциты хранятся в разных частях тела, которые называются лимфоидными органами. К ним относятся следующие:
- Тимус — железа между легкими и чуть ниже шеи.
- Селезенка — орган, фильтрующий кровь. Он находится в верхнем левом углу живота.
- Костный мозг — находится в центре костей, он также производит эритроциты.
- Лимфатические узлы — небольшие железы, расположенные по всему телу и связанные лимфатическими сосудами.
Существует два основных типа лейкоцитов:
1. Фагоциты
Эти клетки окружают и поглощают патогены и разрушают их, эффективно поедая их. Существует несколько типов, в том числе:
- Нейтрофилы — это наиболее распространенный тип фагоцитов, который имеет тенденцию атаковать бактерии.
- Моноциты — это самый крупный тип, выполняющий несколько функций.
- Макрофаги — патрулируют патогены, а также удаляют мертвые и умирающие клетки.
- Тучные клетки — они выполняют множество функций, в том числе помогают заживлять раны и защищаться от патогенов.
2. Лимфоциты
Лимфоциты помогают организму запоминать прошлых захватчиков и распознавать их, если они вернутся, чтобы атаковать снова.
Лимфоциты начинают свою жизнь в костном мозге. Некоторые остаются в костном мозге и развиваются в В-лимфоциты (В-клетки), другие направляются в тимус и становятся Т-лимфоцитами (Т-лимфоцитами). Эти два типа клеток имеют разные роли:
- В-лимфоцитов — они вырабатывают антитела и помогают предупреждать Т-лимфоциты.
- Т-лимфоциты — они разрушают поврежденные клетки в организме и помогают предупредить другие лейкоциты.
Иммунная система должна уметь отличать себя от чужого. Он делает это, обнаруживая белки, которые находятся на поверхности всех клеток. Он учится игнорировать свои собственные или собственные белки на ранней стадии.
Антиген — это любое вещество, которое может вызвать иммунный ответ.
Во многих случаях антигеном является бактерия, грибок, вирус, токсин или инородное тело.Но это также может быть одна из наших собственных ячеек, неисправная или мертвая. Первоначально ряд типов клеток работают вместе, чтобы распознавать антиген как захватчика.
Роль В-лимфоцитов
Как только В-лимфоциты обнаруживают антиген, они начинают секретировать антитела («антиген» — это сокращение от «генераторы антител»). Антитела — это особые белки, которые связываются со специфическими антигенами.
Каждая В-клетка вырабатывает одно специфическое антитело. Например, один может создать антитело против бактерий, вызывающих пневмонию, а другой может распознать вирус простуды.
Антитела являются частью большого семейства химических веществ, называемых иммуноглобулинами, которые играют множество ролей в иммунном ответе:
- Иммуноглобулин G (IgG) — маркирует микробы, чтобы другие клетки могли распознавать их и бороться с ними.
- IgM — специалист по уничтожению бактерий.
- IgA — накапливается в жидкостях, таких как слезы и слюна, где он защищает ворота в организм.
- IgE — защищает от паразитов, а также вызывает аллергию.
- IgD — остается связанным с В-лимфоцитами, помогая им запустить иммунный ответ.
Антитела фиксируют антиген, но не убивают его, а лишь отмечают смерть. Убийство — это работа других клеток, например фагоцитов.
Роль Т-лимфоцитов
Существуют различные типы Т-лимфоцитов:
Т-хелперные Т-клетки (Th-клетки) — они координируют иммунный ответ. Некоторые связываются с другими клетками, а некоторые стимулируют В-клетки производить больше антител.Другие привлекают больше Т-клеток или фагоцитов, поедающих клетки.
Т-киллеры (цитотоксические Т-лимфоциты) — как следует из названия, эти Т-клетки атакуют другие клетки. Они особенно полезны для борьбы с вирусами. Они работают, распознавая небольшие части вируса снаружи инфицированных клеток и уничтожая инфицированные клетки.
Иммунная система каждого человека разная, но, как правило, она становится сильнее в зрелом возрасте, поскольку к этому времени мы подвергаемся воздействию большего количества патогенов и развиваем больший иммунитет.
Именно поэтому подростки и взрослые болеют реже, чем дети.
После того, как антитело было произведено, его копия остается в организме, так что, если тот же антиген появится снова, с ним можно будет справиться быстрее.
Вот почему при некоторых заболеваниях, таких как ветряная оспа, вы получаете их только один раз, поскольку в организме есть антитела к ветряной оспе, готовые и ждущие, чтобы уничтожить их в следующий раз, когда они появятся. Это называется иммунитетом.
У людей есть три типа иммунитета, которые называются врожденным, адаптивным и пассивным:
Врожденный иммунитет
Все мы рождаемся с некоторым уровнем иммунитета к захватчикам.Иммунная система человека, как и иммунная система многих животных, с первого дня будет атаковать иноземных захватчиков. Этот врожденный иммунитет включает внешние барьеры нашего тела — первую линию защиты от патогенов, например кожу и слизистые оболочки горла и кишечника.
Этот ответ более общий и не конкретный. Если патогену удается увернуться от врожденной иммунной системы, срабатывает адаптивный или приобретенный иммунитет.
Адаптивный (приобретенный) иммунитет
Эта защита от патогенов развивается по мере того, как мы идем по жизни.По мере того, как мы подвергаемся болезням или вакцинируемся, мы накапливаем библиотеку антител к различным патогенам. Иногда это называют иммунологической памятью, потому что наша иммунная система помнит предыдущих врагов.
Пассивный иммунитет
Этот тип иммунитета «заимствован» из другого источника, но не действует бесконечно. Например, ребенок получает антитела от матери через плаценту до рождения и с грудным молоком после рождения. Этот пассивный иммунитет защищает ребенка от некоторых инфекций в первые годы его жизни.
Иммунизация
Иммунизация вводит человеку антигены или ослабленные патогены таким образом, что человек не заболевает, но при этом производит антитела. Поскольку организм сохраняет копии антител, он защищен, если угроза снова появится в более позднем возрасте.
Поскольку иммунная система очень сложна, существует множество потенциальных причин, по которым она может пойти не так. Типы иммунных расстройств делятся на три категории:
Иммунодефициты
Они возникают, когда одна или несколько частей иммунной системы не функционируют.Иммунодефицит может быть вызван множеством причин, включая возраст, ожирение и алкоголизм. В развивающихся странах недоедание — частая причина. СПИД — это пример приобретенного иммунодефицита.
В некоторых случаях иммунодефицит может передаваться по наследству, например, при хронической гранулематозной болезни, когда фагоциты не функционируют должным образом.
Аутоиммунитет
При аутоиммунных заболеваниях иммунная система ошибочно нацелена на здоровые клетки, а не на чужеродные патогены или дефектные клетки.В этом сценарии они не могут отличить себя от чужого.
Аутоиммунные заболевания включают целиакию, диабет 1 типа, ревматоидный артрит и болезнь Грейвса.
Гиперчувствительность
При гиперчувствительности иммунная система чрезмерно реагирует, повреждая здоровые ткани. Примером может служить анафилактический шок, когда организм реагирует на аллерген настолько сильно, что это может быть опасно для жизни.
Иммунная система невероятно сложна и чрезвычайно важна для нашего выживания.Несколько различных систем и типов клеток работают в идеальной синхронности (большую часть времени) по всему телу, чтобы бороться с болезнетворными микроорганизмами и удалять мертвые клетки.
Клетки иммунной системы
Иммунная система — это уникальное сочетание различных клеток, тканей и органов, работающих вместе для защиты от инфекций и болезней. Все элементы иммунной системы взаимосвязаны друг с другом. Иммунная система подразделяется на два типа:
- Врожденная иммунная система
- Адаптивная иммунная система
Все клетки иммунной системы развиваются из гемопоэтических стволовых клеток костного мозга, которые позже дифференцируются в миелоидные и лимфоидные предшественники.Каждый из них далее дифференцируется на различные типы клеток.
Врожденная иммунная система:
Врожденные иммунные ответы неспецифичны и быстро и стабильно реагируют на инфекцию. Хотя они являются общими и неспецифическими, они играют очень важную роль в защите организма от внешних инфекций. Их активность основана на рецепторах распознавания образов (PRR).
Врожденная иммунная система состоит в основном из клеток Myeloid Progenitor .
- Нейтрофилы — Нейтрофилы — это гранулоцитарные лейкоциты с многодольчатыми ядрами. Это первые клетки, которые действуют в месте повреждения тканей, уничтожая патогены, особенно бактерии, путем фагоцитоза. Тип клеток, находящихся в кровотоке, быстро поглощающих и уничтожающих микроорганизмы. Число нейтрофилов увеличивается в кровотоке из-за болезни, и они в первую очередь ответственны за повышенное количество лейкоцитов, связанное с некоторыми инфекциями.
- Эозинофилы — Эозинофилы также представляют собой гранулоцитарные лейкоциты с лопастным ядром в форме почки. Они выпускают содержимое своих гранул, чтобы убить болезнетворные микроорганизмы. Они производят множество факторов роста и цитокинов и помогают другим иммунным клеткам.
- Базофилы — Базофилы представляют собой самые крупные гранулоцитарные лейкоциты с двулопастным ядром. Они имеют богатые гистамином гранулы и участвуют в воспалительных реакциях. Они помогают в секреции цитокинов, участвующих в созревании Т-хелперных клеток.
- Моноциты — Тип фагоцитарных клеток, расположенных в кровотоке, которые при перемещении в ткани трансформируются в макрофаги. Моноциты — это самые большие белые кровяные тельца, которые производят макрофаги и дендритные клетки.
- Макрофаги поглощают и перерабатывают клеточный мусор, патогены и раковые клетки. Они участвуют в заживлении ран, регенерации тканей и провоспалительной деятельности.
- Дендритные клеток присутствуют в таких тканях, как кожа, легкие и кишечник.Они представляют антигены В- и Т-клеткам, а также секретируют цитокины. Чувствительные клетки вводят антиген в клетки иммунной системы.
- Тучные клетки — это гранулоциты, секретирующие гепарин, гистамин и другие факторы. Они помогают в заживлении ран, ангиогенезе и уничтожении паразитов.
- Естественные клетки-киллеры (NK) (могут развиваться как из миелоидных, так и из лимфоидных предшественников). NK-клетки производятся из костного мозга и обнаруживаются в кровотоке и тканях в относительно небольших количествах.Это цитотоксические клетки, которые имеют небольшие гранулы с перфоринами и гранзимами и быстро разрушают инфицированные клетки и раковые клетки.
Адаптивная иммунная система:
Адаптивная иммунная система развивает специфические иммунные реакции. Он включает клетки из лимфоидных предшественников .
- B-клеточный предшественник — Эти лимфоциты возникают по всему костному мозгу и делятся на плазматические клетки, которые, по сути, превращаются в иммуноглобулины (антитела).Дифференцируется в клетки памяти и плазматические клетки.
- Плазматические клетки растут из B-клеток и являются компонентами, которые образуют сыворотку и выделяют иммуноглобулин.
- Иммуноглобулины представляют собой чрезвычайно модифицированные белковые компоненты, также идентифицируемые как антитела, соответствующие чужеродным антигенам, таким как ключ и замок. Их разнообразие настолько велико, что они могут быть созданы для любого микроорганизма в экосистеме.
- Предшественник Т-клеток — дифференцируется на Т-хелперы и цитотоксические Т-клетки
- Цитотоксические Т-клетки: Такие лимфоциты прорастают в тимусе и убивают зараженные или инфицированные клетки.Регуляторные Т-клетки убивают другие Т-лимфоциты или выключают их. Иммунная система начнет работать, не регулируя клетки, даже если болезнь уже вылечена.
- Т-хелперы: Эти продвинутые лимфоциты «помогают» другим Т-клеткам и В-клеткам работать. Эта Т-клетка взаимодействует со специфическим антигеном так же, как молекула антитела взаимодействует с определенным антигеном. На самом деле, Т-клетки имеют на своей поверхности молекулы, подобные антителам. Это такой огромный набор специфических Т-клеток, что в организме есть Т-клетки, которые могут реагировать практически на любой антиген.
Как иммунная система борется с инфекциями:
- Бактерии: Наши тела наполнены микробами, и бактерии встречаются в некоторых регионах нашей окружающей среды. Кожа и слизистые оболочки внутри нас служат физической защитой, помогающей избежать инфекции. Если кожа или слизистые оболочки повреждены в результате болезни, заболевания или повреждения, бактерии затем поглощаются нейтрофилами и погибают. Если и белковые комплементы, и нейтрофилы функционируют правильно, этот метод навсегда уничтожает бактерии.Тем не менее, повторные бактериальные инфекции могут возникать, когда количество бактерий непропорционально или есть дефекты в развитии антител, комплементов или нейтрофилов.
- Вирусов: Многие из нас часто знакомятся с вирусами. То, как наш организм защищает себя от вирусов, отличается от того, как мы боремся с бактериями. Только внутри наших клеток вирусы могут жить и размножаться. Когда вирус заражает клетку, цитокины высвобождаются в клетку, чтобы уведомить другие клетки об инфекции.Это «предупреждение» обычно предотвращает вторжение в другие клетки. К сожалению, определенные патогены найдут способ победить эту защитную технику, и инфекция будет распространяться. Циркулирующие Т-клетки и NK-клетки предупреждаются о вторжении вируса и перемещаются в то место, где они вторгаются в различные клетки, в которых находится вирус. Это очень опасный метод уничтожения вируса, поскольку он может уничтожить несколько наших клеток в процессе. Во второй раз, если мы подвергаемся воздействию одного и того же штамма, антитела помогают избежать инфекции.Также образуются Т-клетки памяти, которые быстро реагируют на вторую инфекцию, что часто способствует более легкому пути заражения.
Каталожные номера:
- Кларк, Рэйчел и Томас Куппер. (2005) «Старое встречается с новым: взаимодействие между врожденным и адаптивным иммунитетом» Journal of Investigative Dermatology 4: 629-637.
- Паркер, Джордж «Клетки иммунной системы». В: Паркер Г. (ред.). (2017) Immunopathology in Toxicology and Drug Humana Press, Cham.95-201. https://doi.org/10.1007/978-3-319-47377-2_2
- Cichocki, F., Grzywacz, B., & Miller, J. S. (2019). Развитие NK-клеток человека: один путь или много ?. Границы иммунологии , 10 , 2078. https://doi.org/10.3389/fimmu.2019.02078
11.1A: Клетки и органы иммунной системы
Иммунная система включает первичные лимфоидные органы, вторичные лимфатические ткани и различные клетки врожденной и адаптивной иммунной систем.
Цели обучения
- Распознавать клетки и органы иммунной системы и их функции
Ключевые моменты
- Ключевыми первичными лимфоидными органами иммунной системы являются тимус и костный мозг, а также вторичные лимфатические ткани, такие как селезенка, миндалины, лимфатические сосуды, лимфатические узлы, аденоиды, кожа и печень.
- Лейкоциты (белые кровяные тельца) действуют как независимые одноклеточные организмы и являются вторым звеном врожденной иммунной системы.
- Врожденные лейкоциты включают фагоциты (макрофаги, нейтрофилы и дендритные клетки), тучные клетки, эозинофилы, базофилы и естественные клетки-киллеры. Эти клетки идентифицируют и устраняют патогены, а также являются важными медиаторами активации адаптивной иммунной системы.
- Клетки адаптивной иммунной системы представляют собой особые типы лейкоцитов, называемые лимфоцитами.В-клетки и Т-клетки являются основными типами лимфоцитов и происходят из гемопоэтических стволовых клеток костного мозга.
- Лимфатическая система — это часть системы кровообращения, состоящая из сети трубопроводов, называемых лимфатическими сосудами. Лимфатическая система выполняет несколько функций, таких как транспортировка лейкоцитов к лимфатическим узлам и от них к костям.
Ключевые термины
- лимфоцитов : лимфоцит — это тип лейкоцитов в иммунной системе позвоночных.Три основных типа лимфоцитов — это Т-клетки, В-клетки и естественные киллеры (NK). Т-клетки (клетки тимуса) и В-клетки (клетки, происходящие из сумки) являются основными клеточными компонентами адаптивного иммунного ответа.
- Лейкоциты : клетки иммунной системы, участвующие в защите организма как от инфекционных заболеваний, так и от инородных материалов. Существует пять различных и разнообразных типов лейкоцитов.
Органы иммунной системы
Ключевые первичные лимфоидные органы иммунной системы включают тимус и костный мозг, а также вторичные лимфатические ткани, включая селезенку, миндалины, лимфатические сосуды, лимфатические узлы, аденоиды, кожу и печень.
Тимус «обучает» Т-клетки и обеспечивает индуктивную среду для развития Т-клеток из гемопоэтических клеток-предшественников. Тимус является самым крупным и наиболее активным в неонатальный и предподростковый периоды развития. К раннему подростковому возрасту вилочковая железа начинает атрофироваться, и строма тимуса замещается жировой тканью. Тем не менее остаточный Т-лимфопоэз продолжается на протяжении всей взрослой жизни.
Костный мозг — это гибкая ткань внутри костей.У людей красные кровяные тельца образуются в головках длинных костей. Красный костный мозг является ключевым элементом лимфатической системы, являясь одним из основных лимфоидных органов, которые производят лимфоциты из незрелых гематопоэтических клеток-предшественников. Костный мозг и тимус представляют собой первичные лимфоидные ткани, участвующие в производстве и раннем отборе лимфоцитов.
Лимфатическая система — это часть системы кровообращения, состоящая из сети трубопроводов, называемых лимфатическими сосудами, которые переносят прозрачную жидкость, называемую лимфой, в одном направлении к сердцу.Лимфатическая система выполняет множество взаимосвязанных функций, включая транспортировку лейкоцитов к лимфатическим узлам и из них в кости, а также транспортировку антигенпредставляющих клеток (таких как дендритные клетки) к лимфатическим узлам, где стимулируется иммунный ответ. Лимфоидная ткань находится во многих органах, особенно в лимфатических узлах.
Рисунок: Лимфатические узлы и лимфатические сосуды у человека : Лимфатическая система — это часть системы кровообращения, состоящая из сети каналов, называемых лимфатическими сосудами, по которым проходит прозрачная жидкость, называемая лимфой.Селезенка похожа по структуре на большой лимфатический узел и действует, прежде всего, как фильтр крови. Он синтезирует антитела в своей белой пульпе и удаляет покрытые антителами бактерии вместе с покрытыми антителами кровяными клетками посредством циркуляции крови и лимфатических узлов.
Небные миндалины и носоглоточные миндалины представляют собой лимфоэпителиальные ткани, расположенные рядом с ротоглоткой и носоглоткой. Эти иммунокомпетентные ткани являются первой линией защиты иммунной системы от проглатываемых или вдыхаемых чужеродных патогенов.Основные иммунологические функции миндалин еще не изучены.
Лимфатические узлы широко распространены по всему телу, включая подмышку и живот, и связаны лимфатическими сосудами. Лимфатические узлы — это гарнизоны B, T и других иммунных клеток. Лимфатические узлы действуют как фильтры или ловушки для инородных частиц и важны для правильного функционирования иммунной системы. Они плотно упакованы лейкоцитами, называемыми лимфоцитами и макрофагами.
Кожа — одна из наиболее важных частей тела, поскольку она взаимодействует с окружающей средой и является первой линией защиты от внешних факторов, действуя как анатомический барьер от патогенов и повреждений между внутренней и внешней средой при защите организма.Клетки Лангерганса кожи являются частью адаптивной иммунной системы.
Печень выполняет широкий спектр функций, включая иммунологические эффекты — ретикулоэндотелиальная система печени содержит множество иммунологически активных клеток, действующих как «сито» для антигенов, переносимых к ней через портальную систему.
Клетки иммунной системы
Лейкоциты (белые кровяные тельца) — это клетки иммунной системы, участвующие в защите организма от инфекционных заболеваний и инородных материалов.Существует пять различных типов лейкоцитов, все они продуцируются и происходят из мультипотентных клеток костного мозга, известных как гемопоэтические стволовые клетки. Врожденные лейкоциты включают фагоциты, тучные клетки, эозинофилы, базофилы и естественные клетки-киллеры. Эти клетки идентифицируют и устраняют патогены и являются важными медиаторами активации адаптивной иммунной системы.
Нейтрофилы и макрофаги — это фагоциты, которые путешествуют по телу в поисках вторгающихся патогенов. Нейтрофилы обычно находятся в кровотоке и являются наиболее распространенным типом фагоцитов.Во время острой фазы воспаления нейтрофилы мигрируют к месту воспаления и обычно являются первыми клетками, попадающими на место инфекции. Макрофаги находятся в тканях и производят широкий спектр химических веществ. Они также действуют как мусорщики, очищая организм от изношенных клеток и другого мусора, и как антигенпрезентирующие клетки, активирующие адаптивную иммунную систему. Дендритные клетки — это фагоциты в тканях, которые контактируют с внешней средой и расположены в основном в коже, носу, легких, желудке и кишечнике.Эти клетки служат связующим звеном между тканями организма и врожденной и адаптивной иммунной системами, поскольку они представляют антиген Т-клеткам, одному из ключевых типов клеток адаптивной иммунной системы.
Рисунок: Фагоцит в действии : Нейтрофилы, поглощающие бактерии сибирской язвы. Снято на растровом электронном микроскопе Leo 1550. Шкала 5 мкм.Тучные клетки находятся в соединительных тканях и слизистых оболочках и регулируют воспалительный ответ. Чаще всего они связаны с аллергией и анафилаксией.
Базофилы и эозинофилы связаны с нейтрофилами. Они выделяют химические медиаторы, которые участвуют в защите от паразитов и играют роль в аллергических реакциях, таких как астма.
Естественные клетки-киллеры — это лейкоциты, которые атакуют и разрушают опухолевые клетки или клетки, инфицированные вирусами.
Клетки адаптивной иммунной системы представляют собой особые типы лейкоцитов, называемые лимфоцитами. В-клетки и Т-клетки являются основными типами лимфоцитов и происходят из гемопоэтических стволовых клеток костного мозга.
Рисунок: Клетки крови : Красные кровяные тельца, несколько белых кровяных телец, включая лимфоциты, моноцит, нейтрофил и множество небольших дискообразных тромбоцитов.Т-клетки распознают «чужую» мишень, такую как патоген, только после того, как антигены были обработаны и представлены в комбинации с «собственным» рецептором, называемым молекулой главного комплекса гистосовместимости (MHC). Существует два основных подтипа Т-клеток: Т-киллерные Т-клетки, которые убивают клетки, инфицированные вирусами (и другими патогенами) или иным образом поврежденные или дисфункциональные, и вспомогательные Т-клетки, которые регулируют как врожденные, так и адаптивные иммунные ответы и помогают определить, какие иммунные реакции организм вызывает на определенный патоген.Эти клетки не обладают цитотоксической активностью и не убивают инфицированные клетки и не уничтожают патогены напрямую. Третий, второстепенный подтип — это γ-Т-клетки, которые распознают интактные антигены, не связанные с рецепторами MHC.
Напротив, В-клеточный антиген-специфический рецептор представляет собой молекулу антитела на поверхности В-клетки, которая распознает целые патогены без какой-либо необходимости в процессинге антигена. Каждая линия B-клеток экспрессирует разные антитела, поэтому полный набор рецепторов B-клеточных антигенов представляет все антитела, которые может вырабатывать организм.
Иммунная система: информация о лимфоцитах, дендритных клетках, макрофагах и лейкоцитах — что такое химиотерапия?
Chemocare.com
Уход во время химиотерапии и после нее
Иммунная система
Иммунная система — это сложная сеть клеток (например, лимфоцитов) и органов. которые работают вместе, чтобы защитить организм от инородных веществ (антигенов), таких в виде бактерий, вирусов или опухолевых клеток.Когда организм обнаруживает такое вещество несколько видов клеток вступают в действие, вызывая так называемый иммунный ответ. Ниже приводится описание некоторых клеток, которые являются частью иммунной системы.
Лимфоциты
Лимфоциты — один из основных типов иммунных клеток. Лимфоциты делится в основном на В- и Т-клетки.
- B-лимфоциты продуцируют антитела — белки (гамма-глобулины), которые распознают чужеродные вещества (антиген) и прикрепляются к ним.В-лимфоциты (или В-клетки) запрограммированы на выработку одного специфического антитела. Когда В-клетка встречает свой запускающий антиген, она дает начало множеству крупных клеток. известные как плазматические клетки. Каждая плазменная ячейка — это, по сути, фабрика по производству антитело. Антитело соответствует антигену так же, как ключ соответствует замку. Всякий раз, когда антитело и антиген сцепляются, антитело маркирует антиген для разрушение.В-лимфоциты не могут проникнуть в клетку, поэтому работа атаковать эти клетки-мишени остается Т-лимфоцитам.
- Т-лимфоциты — это клетки, которые запрограммированы на распознавание, реагирование и запомните антигены. Т-лимфоциты (или Т-клетки) способствуют иммунной защите двумя основными способами. Некоторые направляют и регулируют иммунные ответы. При стимуляции с помощью антигенного материала, представленного макрофагами, Т-клетки вырабатывают лимфокины. которые сигнализируют другим клеткам.Другие Т-лимфоциты способны уничтожать целевые ячейки при прямом контакте.
Макрофаги
Макрофаги являются первой линией защиты организма и выполняют множество функций. Макрофаг является первой клеткой, которая распознает и поглощает чужеродные вещества (антигены). Макрофаги расщепляют эти вещества и представляют более мелкие белки Т-лимфоцитам. (Т-клетки запрограммированы на распознавание, реакцию и запоминание антигенов).Макрофаги также производят вещества, называемые цитокинами, которые помогают регулировать активность лимфоцитов.
Дендритные клетки
Дендритные клетки известны как наиболее эффективный тип антигенпрезентирующих клеток с способность взаимодействовать с Т-клетками и инициировать иммунный ответ. Дендритный клетки вызывают все больший научный и клинический интерес из-за их ключевых роль в иммунном ответе и потенциальное использование с противоопухолевыми вакцинами.
Белые кровяные тельца
Есть разные типы лейкоцитов, которые являются частью иммунного ответа. Нейтрофилы или гранулоциты — самые распространенные иммунные клетки в организме. При инфекции их количество быстро увеличивается. Это основные компоненты гноя и обнаруживаются вокруг наиболее распространенных воспалений. Их работа — есть и уничтожить посторонний материал. Базофилы и эозинофилы — это белые кровяные тельца. которые содержат внутри клетки большие гранулы.Они взаимодействуют с некоторыми иностранными материалы. Их повышенная активность может привести к аллергической реакции.
Иммунный ответ — это скоординированные усилия. Все иммунные клетки работают вместе, поэтому им нужно общаться друг с другом. Они делают это, секретируя увеличенное уровни особой белковой молекулы, называемой цитокинами, которая действует на другие клетки. Есть много разных цитокинов. Примерами являются интерлейкины, интерфероны, факторы некроза опухолей и колониестимулирующие факторы.Немного стратегии иммунотерапевтического лечения включают введение большего количества этих белки путем инъекции или инфузии. Это делается в надежде стимулировать клетки иммунной системы, чтобы действовать более эффективно или заставлять опухолевые клетки более узнаваемый для иммунной системы.
Внимание: Есть люди, которые продвигают недоказанные методы лечения. как ускорители иммунной системы.Будьте осторожны при оценке этих заявлений. Ниже приведены типы иммунотерапии, которые обычно и законно используются. в традиционной и научной медицинской практике.
Дополнительная информация о химиотерапии:
Условия химиотерапии Химиотерапия Протоколы — как работает химиотерапия Как проводится химиотерапия Как врачи решают, какие химиотерапевтические препараты назначать Как долго дается химиотерапия Как узнать, работает ли химиотерапия Раковые клетки и химиотерапия Типы химиотерапии Целевые Терапия Иммунный Система О Иммунотерапия Гормон Терапия Химиопоротективный Агенты Сопротивление химиотерапии Краткосрочные и долгосрочные побочные эффекты химиотерапии Надир Клинические испытания рака
Chemocare.com предназначен для предоставления самой последней информации о химиотерапии пациентам и их семьям, опекунам и друзьям. Для получения информации о программе наставничества «Четвертый ангел» посетите сайт www.4thangel.org
.Иммунный ответ: Медицинская энциклопедия MedlinePlus
Иммунная система защищает организм от потенциально вредных веществ, распознавая антигены и реагируя на них. Антигены — это вещества (обычно белки) на поверхности клеток, вирусов, грибов или бактерий.Неживые вещества, такие как токсины, химические вещества, лекарства и инородные частицы (например, заноза), также могут быть антигенами. Иммунная система распознает и уничтожает или пытается уничтожить вещества, содержащие антигены.
В клетках вашего тела есть белки, которые являются антигенами. К ним относится группа антигенов, называемых антигенами HLA. Ваша иммунная система учится воспринимать эти антигены как нормальные и обычно не реагирует на них.
ВНУТРЕННИЙ ИММУНИТЕТ
Врожденный или неспецифический иммунитет — это система защиты, с которой вы родились.Он защищает вас от всех антигенов. Врожденный иммунитет включает в себя барьеры, препятствующие проникновению вредных веществ в ваш организм. Эти барьеры образуют первую линию защиты иммунного ответа. Примеры врожденного иммунитета включают:
- Рефлекс кашля
- Ферменты в слезах и кожном масле
- Слизь, которая задерживает бактерии и мелкие частицы
- Кожа
- Желудочная кислота
Врожденный иммунитет также имеет химическую форму белка, называемую врожденный гуморальный иммунитет.Примеры включают систему комплемента организма и вещества, называемые интерфероном и интерлейкином-1 (вызывающим жар).
Если антиген преодолевает эти барьеры, он подвергается атаке и уничтожается другими частями иммунной системы.
ПРИОБРЕТЕННЫЙ ИММУНИТЕТ
Приобретенный иммунитет — это иммунитет, который развивается при воздействии различных антигенов. Ваша иммунная система выстраивает защиту от этого специфического антигена.
ПАССИВНЫЙ ИММУНИТЕТ
Пассивный иммунитет возникает из-за антител, которые вырабатываются в организме, отличном от вашего.Младенцы обладают пассивным иммунитетом, потому что они рождаются с антителами, которые передаются через плаценту от матери. Эти антитела исчезают в возрасте от 6 до 12 месяцев.
Пассивная иммунизация также может быть вызвана инъекцией антисыворотки, которая содержит антитела, вырабатываемые другим человеком или животным. Он обеспечивает немедленную защиту от антигена, но не обеспечивает длительной защиты. Глобулин иммунной сыворотки (назначается при заражении гепатитом) и антитоксин против столбняка являются примерами пассивной иммунизации.
КОМПОНЕНТЫ КРОВИ
Иммунная система включает определенные типы лейкоцитов. Он также включает химические вещества и белки в крови, такие как антитела, белки комплемента и интерферон. Некоторые из них напрямую атакуют чужеродные вещества в организме, а другие работают вместе, чтобы помочь клеткам иммунной системы.
Лимфоциты — это белые кровяные тельца. Есть лимфоциты B и T.
- В-лимфоциты становятся клетками, вырабатывающими антитела.Антитела прикрепляются к определенному антигену и помогают иммунным клеткам уничтожить антиген.
- Т-лимфоциты напрямую атакуют антигены и помогают контролировать иммунный ответ. Они также выделяют химические вещества, известные как цитокины, которые контролируют весь иммунный ответ.
По мере развития лимфоцитов они обычно учатся отличать ткани вашего тела от веществ, которые обычно не встречаются в вашем организме. Как только B-клетки и T-клетки образуются, некоторые из этих клеток будут размножаться и обеспечивать «память» для вашей иммунной системы.Это позволяет вашей иммунной системе реагировать быстрее и эффективнее в следующий раз, когда вы подвергнетесь воздействию того же антигена. Во многих случаях это предотвратит заболевание. Например, человек, который переболел ветряной оспой или был иммунизирован против ветряной оспы, имеет иммунитет от повторного заражения ветряной оспой.
ВОСПАЛЕНИЕ
Воспалительная реакция (воспаление) возникает, когда ткани повреждены бактериями, травмами, токсинами, теплом или по любой другой причине. Поврежденные клетки выделяют химические вещества, включая гистамин, брадикинин и простагландины.Эти химические вещества заставляют кровеносные сосуды пропускать жидкость в ткани, вызывая отек. Это помогает изолировать инородное вещество от дальнейшего контакта с тканями тела.
Эти химические вещества также привлекают белые кровяные тельца, называемые фагоцитами, которые «поедают» микробы и мертвые или поврежденные клетки. Этот процесс называется фагоцитозом. В конечном итоге фагоциты погибают. Гной образуется из скопления мертвых тканей, мертвых бактерий, а также живых и мертвых фагоцитов.
НАРУШЕНИЯ И АЛЛЕРГИИ ИММУННОЙ СИСТЕМЫ
Нарушения иммунной системы возникают, когда иммунный ответ направлен против тканей тела, является чрезмерным или отсутствует.Аллергия связана с иммунным ответом на вещество, которое большинство людей воспринимает как безвредное.
ИММУНИЗАЦИЯ
Вакцинация (иммунизация) — это способ вызвать иммунный ответ. Небольшие дозы антигена, например мертвых или ослабленных живых вирусов, вводятся для активации «памяти» иммунной системы (активированных В-клеток и сенсибилизированных Т-клеток). Память позволяет вашему телу быстро и эффективно реагировать на будущие воздействия.
ОСЛОЖНЕНИЯ, СВЯЗАННЫЕ С ИЗМЕНЕНИЕМ ИММУННОГО ОТВЕТА
Эффективный иммунный ответ защищает от многих болезней и расстройств.Неэффективный иммунный ответ позволяет болезням развиваться. Слишком много, слишком мало или неправильный иммунный ответ вызывает нарушения иммунной системы. Сверхактивный иммунный ответ может привести к развитию аутоиммунных заболеваний, при которых образуются антитела против собственных тканей организма.
 After interaction with the antigen, these cells differentiate into effector cells and subsequently to central memory T-cells
After interaction with the antigen, these cells differentiate into effector cells and subsequently to central memory T-cells