Статьи: Роль железа в организме и чем опасен железодефицит
Микроэлемента железа (Fe, феррум) в организме настолько мало, что его едва хватит, чтобы изготовить небольшой гвоздь весом около 5 г. Но…Роль даже такого небольшого количества железа настолько велика, что его нехватка сразу же отражается на нашем здоровье и самочувствии. Давайте же уделим отдельное внимание этому жизненно важному микроэлементу и определим его место в нашей повседневной жизни.
В главной роли – железо
Железо – один из наиболее распространенных микроэлементов на планете. Железо из воды и грунта впитывается корнями растений и по пищевой цепи попадает в организм живых организмов. При участи железа растениями осуществляется фотосинтез – процесс образования органических соединений из углекислого газа и воды при участии солнечного света. И, что важно, в процессе этой реакции происходит выделение кислорода – основы жизни на планете.
Какие главные функции железа в нашем организме?
При участии железа в организме человека происходят наиболее важны процессы: дыхательная деятельность, синтез ферментов, белков, ДНК, энергетический обмен, окислительно-восстановительные реакции и т.
Больше всего железа в организме человека содержится в красных клетках крови – эритроцитах, в соединении железа и белка – гемоглобине. Именно благодаря железу гемоглобин способен удерживать кислород и доставлять его от легких ко всем клеткам организма, а углекислый газ – в обратную сторону. Без железа процесс дыхания на клеточном уровне был бы просто невозможен.
Другое соединение белка и железа – миоглобин – содержится в мышцах и сердце. Главной функцией миоглобина является формирование запасов кислорода и расходование по мере необходимости организмом.
Кроме этого, железо в организме принимает участие в образовании многих ферментов и белков, превращении калорий в энергию, обмене холестерина, разрушении и утилизации токсинов, стимулирует рост и физическое развитие детей, укрепляет иммунитет, поддерживает работу щитовидной железы и печени, поддерживает красоту волос, кожи и ногтей.
Сколько надо железа, чтобы быть здоровыми?
На потребность организма в этом микроэлементе влияют пол, возраст и физиологическое состояние. Женщинам требуется больше железа, чем мужчинам. Это связано с ежемесячной потерей крови во время менструации и особенностями гормональной системы. Каждый день женщина должна получать не менее 15 мг железа с едой, а во время беременности и лактации – 20 мг и более. Суточная потребность в железе для мужчин составляет 10 мг, для детей и подростков до 18 лет – 5-15 мг: чем старше ребенок, тем выше потребность.
Женщинам требуется больше железа, чем мужчинам. Это связано с ежемесячной потерей крови во время менструации и особенностями гормональной системы. Каждый день женщина должна получать не менее 15 мг железа с едой, а во время беременности и лактации – 20 мг и более. Суточная потребность в железе для мужчин составляет 10 мг, для детей и подростков до 18 лет – 5-15 мг: чем старше ребенок, тем выше потребность.
Почему возникает дефицит железа в организме?
Нехватка железа может возникнуть по разным причинам. Его основной источник – продукты питания, поэтому чаще всего дефицит железа возникает из-за несбалансированного питания, недостаточного поступления с пищей этого микроэлемента и витаминов А, С, В9 и В12, которые способствуют его усвоению.
Очень часто железодефицитное состояние возникает при отказе от продуктов животного происхождения, ведь они являются источником легкоусвояемого гемового железа. Известно, что из мясных продуктов железо усваивается до 35%, а из растительной пищи только на 1-5%.
Другой основной причиной недостатка железа в организме является его активный расход в периоды роста, во время беременности и лактации.
Дефицит железа может наблюдаться при потере крови вследствие операции, ранении, родах, обильных менструациях. При различных заболеваниях желудка и кишечника, глистных инвазиях чаще всего нарушено всасывание этого микроэлемента, что также приводит к его недостатку в организме.
Нехватка железа в организме может возникать при чрезмерных физических нагрузках из-за сбоев транспортировки железа.
Какие признаки указывают на нехватку железа в организме?
При железодефиците человек постоянно испытывает слабость и быструю утомляемость, усталость беспокоит даже утром после пробуждения. Могут беспокоить ухудшение памяти, рассеянность, раздражительность, сонливость, головные боли, мелькание «мушек» перед глазами, головокружения и даже обмороки.
При недостатке этого микроэлемента кожа становится сухой и бледной, ногти – ломкие, волосы – сухие и тусклые. В уголках рта зачастую появляется шелушение и трещинки.
В уголках рта зачастую появляется шелушение и трещинки.
Если есть длительная нехватка железа в организме, типичны постоянные простудные заболевания и кишечные инфекции, так как железо принимает активное участие в формировании иммунной защиты человека.
Даже незначительные физические нагрузки вызывают учащение сердцебиения и одышку – сказывается нехватка кислорода в организме.
По мере усугубления выраженности железодефицита может нарушаться аппетит, искажаться вкусовые ощущения, возникать дискомфорт при глотании.
Самым надежным и достоверным методом определения нехватки железа в организме является анализ крови и определение уровня железа в сыворотке крови. Обращайтесь к доктору хотя бы 1 раз в год и проходите эти исследования, чтобы не допустить развитие железодефицита и не бороться потом с его последствиями.
Как же не допустить дефицит железа в организме и как с ним бороться?
Основным источником железа являются продукты питания, поэтому, в первую очередь, откорректируйте ваш рацион. Обратите внимание на продукты с большим содержанием железа и веществ, которые помогают ему лучше усваиваться.
Обратите внимание на продукты с большим содержанием железа и веществ, которые помогают ему лучше усваиваться.
Лидируют в списке железосодержащих продуктов красное мясо и субпродукты, особенно печень, яйца, устрицы, тунец, гречка, свекла, сельдерей, томатный сок, бобовые, печеный картофель в мундире, орехи, гранаты, яблоки, персики, абрикосы, инжир, чернослив, изюм, орехи, горький шоколад.
Также пополните свой рацион продуктами, содержащими витамин С – шиповник, цитрусовые, грецкие орехи, смородина, красный перец, облепиха, петрушка, укроп, брокколи, брюссельская и цветная капуста.
Для насыщения организма витаминами А и В12, которые помогут железу усвоиться, употребляйте больше рыбы, морепродуктов, субпродуктов, молочных продуктов, фруктов и овощей желтых, красных и оранжевых оттенков.
Употребление крепкого чая, кофе следует ограничить, а от алкоголя – и вовсе отказаться, ведь они препятствуют усвоению железа организмом.
Больше двигайтесь. Умеренная физическая нагрузка усиливает кровоснабжение всех органов, организм лучше насыщается кислородом и так легче избавиться от усталости и сонливости.
Если у железодефицита нет других, более серьезных проблем, то уже через месяц-другой сбалансированного питания и умеренной физической активности можно добиться улучшения. Если же, по-прежнему, состояние не улучшается, следует обратиться к вашему доктору для детального обследования и решения проблемы.
Дополнительный прием железосодержащих биодобавок – надежный способ профилактики и коррекции железодефицитных состояний. Но очень важно выбирать правильный продукт, который содержит железо в биологически доступной легкоусвояемой форме и те компоненты, которые способствуют наилучшему усвоению этого микроэлемента. Именно такими свойствами обладает новый натуральный витаминный комплекс от Amrita – «Феррум Баланс».
Учитывая пользу и незаменимость для нашего организма, железо по праву претендует на титул жизненно важного микроэлемента. Благодаря ему мы способны дышать, жить, хорошо выглядеть и ежедневно справляться с тысячей задач. Поэтому каждый день формируйте свой рацион и образ жизни с пользой для своего организма, не забывайте хотя бы раз в год посещать доктора для контроля уровня железа в крови. Будьте здоровы и активны!
Будьте здоровы и активны!
Роль железа в организме человека Текст научной статьи по специальности «Клиническая медицина»
Огляди
УДК: 612.392.45
РОЛЬ ЖЕЛЕЗА В ОРГАНИЗМЕ ЧЕЛОВЕКА
Н. Т. Ватутин, Н. В. Калинкина, А. С. Смирнова, О. К. Кашанская, И. А. Мильнер
Донецкий национальный медицинский университет имени М. Г орького, Украина
В обзоре представлены современные данные литературы о механизмах интестинальной абсорбции и регуляции обмена железа в организме человека. Отдельное внимание уделено факторам, приводящим как к дефициту этого микроэлемента, так и к его избытку. Описаны методы оптимальной фармакологической коррекции данных состояний.
КЛЮЧЕВЫЕ СЛОВА: обмен железа
М. Т. Ватутін, Н. В. Калінкіна, Г. С. Смирнова, О. К. Кашанська, І. А. Мільнер
Т. Ватутін, Н. В. Калінкіна, Г. С. Смирнова, О. К. Кашанська, І. А. Мільнер
Донецький національний медичний університет імені М. Г орького, Україна
В огляді представлені сучасні дані літератури стосовно механізмів інтестінальної абсорбції та регуляції обміну заліза в організмі людини. Окрему увагу надано чинникам, що приводять як до дефіциту цього мікроелементу, так і до його надлишку. Описано методи оптимальної фармакологічної корекції даних станів.
КЛЮЧОВІ СЛОВА: обмін заліза
THE ROLE OF IRON IN THE HUMAN ORGANISM
M. T. Vatutin, N. V. Kalinkina, G. S. Smyrnova, O. K. Kashanska, I. A. Milner Donetsk National Medical University named by M. Gorkiy, Ukraine
This review presents recent data of literature on the mechanisms of iron absorption in the human organism. Separately we marked factors that can lead to iron deficiency or overload. Th e methods of optimal pharmacological correction of these states were described.
Separately we marked factors that can lead to iron deficiency or overload. Th e methods of optimal pharmacological correction of these states were described.
KEY WORDS: iron metabolism
Железо является важнейшим микроэлементом, который входит в состав более 100 ферментов организма человека и принимает участие в дыхании, кроветворении, иммунобиологических процессах и окислительно-восстановительных реакциях. Концентрация его в плазме широко варьируется и у здорового человека составляет 10,8— 28,8 мкмоль/л [1]. Ежедневная потеря железа чрезвычайно мала (около 1 мг/сут.). В основном она осуществляется за счет десква-мация эпителиальных клеток кишечника и кожи, микрокровотечений, выведения с желчью и мочой. Компенсация этих потерь имеет фундаментальное значение и происходит путем абсорбции железа из пищи [2].
© Ватутт М. Т., Калтшна Н. В., Смирнова Г. С., Кашанська О. К., Мшьнер L А., 2012
В., Смирнова Г. С., Кашанська О. К., Мшьнер L А., 2012
Интестинальная абсорбция представляет главный этап этого процесса, который тщательно регулируется общим содержанием железа в организме, эритропоэтической активностью и выраженностью гипоксии. Однако механизмы интестинальной абсорбции и регуляции обмена железа в организме человека до сих пор изучены недостаточно.
Обмен железа
Как известно, в пищевых продуктах содержится 2 типа железа — гемовое (красное мясо) и негемовое или ионизированное (овощи, фрукты, зерновые культуры). При среднем поступлении с пищей 10-20 мг железа в сутки у здорового человека около 1-2 мг
абсорбируется в желудочно-кишечном тракте (ЖКТ) [3]. Наиболее интенсивно этот процесс происходит в двенадцатиперстной и начальных отделах тощей кишки. Желудок играет лишь незначительную роль в усвоении железа, т. к. в нем абсорбируется не более 1-2 % от общего количества поступающего микроэлемента. В процессе прохождения железа через апикальную и базолатеральную мембраны абсорбирующих эпителиальных клеток участвуют 2 вида транспортеров [4]. Негемовое железо переносится интестинальным дивалентным катионом DMT1 (divalent metal transporter 1). При этом атомы трехвалентного железа (Fe3+), поступившие с пищей, сначала редуцируются в атомы двухвалентного (Fe2) ферриредукта-зой, а затем захватываются DMT1 [5]. Вторым транспортером негемового железа внутрь энтероцита является комплекс мобильферрин-интегрин, механизм действия которого еще не совсем ясен. Считается [6], что внутриклеточная железосвязывающая молекула мобильферрина получает ионы железа от DMT1 и транспортирует микроэлемент в цитозоль. В базолатеральной мембране энтероцита присутствует другой транспортер — IREGi/ferroportin/MTPi (iron regulated proteini/ferroportin/metal transporter proteini), который окисляет Fe2+ до Fe3+ и транспортирует его в кровь.
к. в нем абсорбируется не более 1-2 % от общего количества поступающего микроэлемента. В процессе прохождения железа через апикальную и базолатеральную мембраны абсорбирующих эпителиальных клеток участвуют 2 вида транспортеров [4]. Негемовое железо переносится интестинальным дивалентным катионом DMT1 (divalent metal transporter 1). При этом атомы трехвалентного железа (Fe3+), поступившие с пищей, сначала редуцируются в атомы двухвалентного (Fe2) ферриредукта-зой, а затем захватываются DMT1 [5]. Вторым транспортером негемового железа внутрь энтероцита является комплекс мобильферрин-интегрин, механизм действия которого еще не совсем ясен. Считается [6], что внутриклеточная железосвязывающая молекула мобильферрина получает ионы железа от DMT1 и транспортирует микроэлемент в цитозоль. В базолатеральной мембране энтероцита присутствует другой транспортер — IREGi/ferroportin/MTPi (iron regulated proteini/ferroportin/metal transporter proteini), который окисляет Fe2+ до Fe3+ и транспортирует его в кровь.
Механизм транспортировки гемового железа внутрь энтероцита также остается мало изученным. Считается [7], что гемовое железо освобождается от белковых цепей в ЖКТ и в виде металлопорфирина всасывается энтероцитами кишечника. Внутри клетки происходит расщепление гема гем-оксиге-назой-1 с высвобождением Fe2+. Далее, с помощью белковой транспортной системы IREG1/ferroportin/MTP1, ионы окисляются до Fe3+, связываются с трансферрином и покидают энтероцит, выходя в ток крови [8].
Высвобождение абсорбированного железа в сторону общей циркуляции происходит с помощью трансмембранных белков ферропортина [9] и гефестина [10]. Последний является ферроксидазой и обеспечивает взаимопревращение Fe2+ и Fe3+. Интенсивность поступления микроэлемента в кровь зависит от соотношения содержания в плазме свободного, моножелезистого и дижеле-зистого (насыщенного) трансферрина. Комплекс трансферрин-железо поступает главным образом в костный мозг (КМ), где
используется для эритропоэза, небольшая часть — в депо (преимущественно в печень) и еще меньшее количество ассимилируется тканями для образования миоглобина, некоторых ферментов тканевого дыхания, нестойких комплексов железа с аминокислотами и белками [11, 12]. В транспорте железа принимает участие и лактоферрин [13, 14] — железосвязывающий гликопротеин, который является эволюционно самым молодым представителем семейства трансфер -ринов. Лактоферрин абсорбирует железо из интестинальных эпителиальных клеток, а затем также транспортирует его к печени и другим органам.
В транспорте железа принимает участие и лактоферрин [13, 14] — железосвязывающий гликопротеин, который является эволюционно самым молодым представителем семейства трансфер -ринов. Лактоферрин абсорбирует железо из интестинальных эпителиальных клеток, а затем также транспортирует его к печени и другим органам.
Депонирование железа осуществляется ферритином — белком, который преимущественно содержится в макрофагах КМ, печени и селезенке. В случае избытка железа в организме ферритин преобразуется в гемо-сидерин. Основную железодепонирующую функцию выполняет ферритин печени, тогда как в слизистой оболочке тонкого кишечника он отвечает за перенос железа, абсорбированного энтероцитами к трансферрину плазмы крови. Ферритин системы фагоцитирующих макрофагов абсорбирует железо, которое высвобождается после деструкции энтероцитов, для его реутилизации.
Регуляция гомеостаза железа
Существует множество механизмов, участвующих в поддержании гомеостаза железа. Так, белки, регулирующие обмен железа IRP1 и IRP2 (Iron Regulatory Protein), позволяют каждой клетке определять его количество [15]. В том случае, когда содержание железа в клетке достаточное, IRP перенаправляет его к ферритину. В условиях железодефицита происходит связывание IRP с IRE (iron-responsive element) ферритина, что приводит к снижению уровня последнего и увеличению концентрации трансферрина.
Так, белки, регулирующие обмен железа IRP1 и IRP2 (Iron Regulatory Protein), позволяют каждой клетке определять его количество [15]. В том случае, когда содержание железа в клетке достаточное, IRP перенаправляет его к ферритину. В условиях железодефицита происходит связывание IRP с IRE (iron-responsive element) ферритина, что приводит к снижению уровня последнего и увеличению концентрации трансферрина.
Интенсивность всасывания железа из ЖКТ регулируется количеством этого микроэлемента, поступающего с пищей (алиментарный регулятор), его общим содержанием в организме (депо-регулятор или регулятор запасов железа), а также активностью эритропоэза в костном мозге (эритроидный регулятор).
В последние годы установлено [16], что роль универсального гуморального регулятора метаболизма железа выполняет гепси-дин — 25-аминокислотный пептид, синтезирующийся в печени, моноцитах и нейтро-
филах, а также в альвеолярных макрофагах. Отмечено [17], что под действием провоспа-лительных цитокинов происходит гиперпродукция гепсидина, который блокирует рецепторы ферропортина — белка, транспортирующего железо как из энтероцитов, так и макрофагов в кровь. Таким образом, с одной стороны, это может нарушать абсорбцию железа из кишечника, а с другой — приводить к его избыточному скоплению в макрофагах, что затрудняет его использование для построения гемоглобина.
Отмечено [17], что под действием провоспа-лительных цитокинов происходит гиперпродукция гепсидина, который блокирует рецепторы ферропортина — белка, транспортирующего железо как из энтероцитов, так и макрофагов в кровь. Таким образом, с одной стороны, это может нарушать абсорбцию железа из кишечника, а с другой — приводить к его избыточному скоплению в макрофагах, что затрудняет его использование для построения гемоглобина.
Имеются данные [18], что в регуляции обмена железа также играет роль HFE (Human hemochromatosis protein) — протеин, который является своеобразным «информатором» потребности организма в железе. Кроме того, HFE, взаимодействуя с р2-мик-роглобулином, может конкурировать с железом за связывание с рецепторами транс-феррина 1-го типа (RTf1). Результаты ряда исследований [19] показали, что снижение уровня HFE приводит к уменьшению концентрации гепсидина и, соответственно, увеличению уровня сывороточного железа.
Еще одним регулирующим звеном гомеостаза железа является 2-й тип рецептора трансферрина (RTf2) [20]. Он также способен связывать трансферрин в зависимости от рН крови, но с аффиностью в 25 раз меньшей, чем у RTf1. Так, при рН крови 7,4 отмечается высокая способность связывания дижелезистого трансферрина с RTf2, которая существенно снижается с уменьшением рН. Предполагают [21], что RTf2 «информирует» гепатоциты о количестве сывороточного железа. Согласно этой гипотезе утрата функции RTf2 может привести к снижению захвата железа гепатоцитами и снижению выработки гепсидина, что вызовет увеличение интестинальной абсорбции железа и уменьшение его захвата макрофагами.
Он также способен связывать трансферрин в зависимости от рН крови, но с аффиностью в 25 раз меньшей, чем у RTf1. Так, при рН крови 7,4 отмечается высокая способность связывания дижелезистого трансферрина с RTf2, которая существенно снижается с уменьшением рН. Предполагают [21], что RTf2 «информирует» гепатоциты о количестве сывороточного железа. Согласно этой гипотезе утрата функции RTf2 может привести к снижению захвата железа гепатоцитами и снижению выработки гепсидина, что вызовет увеличение интестинальной абсорбции железа и уменьшение его захвата макрофагами.
В обмене железа важную роль играют витамины и некоторые микроэлементы: витамин С принимает участие в восстановлении Fe3+ в Fe2+ и процессе высвобождения железа из депо; дефицит рибофлавина сопровожда -ется увеличением экскреции железа с мочой; снижение уровня пиридоксина отражается на состоянии аминокислотного обмена (лизина, гистидина, метионина), участвующих в процессе всасывания железа в кишечнике; эргокальциферол участвует в переносе железа из депо в КМ. В настоящее время известно, что медь входит в состав множества фер-
В настоящее время известно, что медь входит в состав множества фер-
ментов и белков, которые участвуют в окислении Fe2+ и его связывании с трансферрином.
Изменение содержания железа в сыворотке крови
Дефицит железа может быть обусловлен следующими причинами [22, 23]: хронической кровопотерей (геморрой, обильные меноррагии и т. п.), недостаточным поступлением железа с пищей (вегетарианство), усиленным его расходом (периоды интенсивного роста и развития, беременность и лактация), нарушением всасывания при патологии ЖКТ или избыточном употреблении фосфатов, оксалатов, кальция или танина, его конкурентным потреблением (глистные инвазии), а также гиповитаминозом.
Недостаток железа в крови часто наблюдается при системных, эндокринных заболеваниях и патологии печени. Так, S. Agrawal et я1. [24] обследовали 214 пациентов, страдающих ревматоидным артритом (РА). Анемия была диагностирована в 71 % случаев, при этом железодефицитная анемия (ЖДА) развилась у 48 % больных. В другом исследовании [25] анемия была зарегистрирована у 85 % больных РА, 60 % из которых имели ЖДА.
[24] обследовали 214 пациентов, страдающих ревматоидным артритом (РА). Анемия была диагностирована в 71 % случаев, при этом железодефицитная анемия (ЖДА) развилась у 48 % больных. В другом исследовании [25] анемия была зарегистрирована у 85 % больных РА, 60 % из которых имели ЖДА.
Результаты нашего исследования [26] показали, что среди обследованных 65 больных РА анемия была диагностирована в 64,6 % случаев. При этом клиническими особенностями РА у пациентов со сниженным уровнем гемоглобина являлись его более тяжелое и длительное течение, высокая степень активности и низкое качество жизни по сравнению с больными без анемии.
Известно, что при системных заболеваниях соединительной ткани (СЗСТ) происходит активация различных провоспалитель-ных цитокинов (интерферон-у, интерлейкины, фактор некроза опухоли-а), действие которых может приводить к изменению метаболизма железа. При СЗСТ возникновение ЖДА также обусловлено снижением всасывания ионов железа в ЖКТ, прежде всего, в результате поражения его слизистой оболочки нестероидными [27] и стероидными про-тивоспалительными препаратами [28], метотрексатом [29], нарушением её трофики вследствие системного воспаления [30], развитием микронутриентной недостаточности [31]. Как известно, любой воспалительный процесс сопровождается интенсификацией свободно-радикального окисления. В ответ
Как известно, любой воспалительный процесс сопровождается интенсификацией свободно-радикального окисления. В ответ
на это происходит компенсаторная активация антиоксидантной системы, основными компонентами которой являются витамины (А, С и Е), микроэлементы (селен, медь, цинк и др.) и ферменты (супероксиддисму-таза, глутатионпероксидаза, каталаза и др.). Большинство из этих веществ принимает участие во всасывании, транспортировке и других процессах обмена железа в организме человека.
Эндокринные заболевания, такие как гипотиреоз и сахарный диабет (СД) также могут сопровождаться снижением уровня железа в сыворотке крови. ЖДА, развивающаяся у 30 % больных гипотиреозом, чаще обусловлена снижением всасывания железа в тонком кишечнике вследствие атрофии и отека его слизистой, отсутствием стимулирующего влияния тиреоидных гормонов на эритропоэз. Для гипотиреоза характерно также снижение агрегации тромбоцитов, что может усугубить кровоточивость и привести к развитию постгеморрагической ЖДА. Имеются данные [32], что заместительная терапия гипотиреоза может приводить к нормализации уровня железа в сыворотке крови и исчезновению симптомов ЖДА. Анемия со сниженным уровнем железа у больных СД наблюдается в 19-38 % случаев. Наиболее частыми причинами ее развития являются нарушение продукции эритро-поэтина, всасывания железа и витаминов [33, 34]. Интересно, что эффективное лечение ЖДА у больных СД приводит к достоверному снижению уровня гликозилирован-ного гемоглобина [35].
Имеются данные [32], что заместительная терапия гипотиреоза может приводить к нормализации уровня железа в сыворотке крови и исчезновению симптомов ЖДА. Анемия со сниженным уровнем железа у больных СД наблюдается в 19-38 % случаев. Наиболее частыми причинами ее развития являются нарушение продукции эритро-поэтина, всасывания железа и витаминов [33, 34]. Интересно, что эффективное лечение ЖДА у больных СД приводит к достоверному снижению уровня гликозилирован-ного гемоглобина [35].
ЖДА также часто сопровождает заболевания печени. Причинами её возникновения в этих случаях являются кровотечения из варикозно расширенных вен, а также нарушение гемостаза при возникновении тром-боцитопении или дефиците факторов свертываемости крови. Так, согласно данным Semba R. D. et а!. [36], ЖДА была зарегистрирована у 46,7 % пациентов, страдающих вирусным гепатитом С. Авторы отметили, что развитие анемии ассоциировалось с увеличением тяжести гепатита и смертности больных. В другом исследовании [37], ЖДА была диагностирована у 25,7 % больных таким гепатитом. При этом, согласно данным многофакторного регрессионного анализа, проведенного авторами, параметром, предсказывающим вероятность возникновения ЖДА, является уровень RTf.
В другом исследовании [37], ЖДА была диагностирована у 25,7 % больных таким гепатитом. При этом, согласно данным многофакторного регрессионного анализа, проведенного авторами, параметром, предсказывающим вероятность возникновения ЖДА, является уровень RTf.
Анемия при злокачественных новообразованиях встречается в 65 % случаев, из которых ЖДА составляет 27 % [38]. В развитии анемии в этом случае, прежде всего, играет роль хроническая кровопотеря, замещение нормальных клеток КМ малигнизиро-ванными, а также миелотоксическое действие противоопухолевых препаратов. Так, у 21 % больных колоректальным раком была диагностирована ЖДА [39], при этом у пациентов, получавших химиотерапию, ЖДА развивалась чаще, по сравнению с теми, кто ее не получал. Интересно, что дефицит железа и анемия активируют оксидативный стресс и вызывают повреждение ДНК, что в свою очередь может увеличить риск канцерогенеза [40].
Причинами увеличения уровня железа в сыворотке крови могут быть его избыточное потребление (например, при повышенном его содержании в питьевой воде), а также неконтролируемый прием препаратов железа и оральных контрацептивов. Так [41], у 46 женщин, получавших препараты, содержащие эстроген на протяжении 2-х лет, было зарегистрировано достоверное (р < 0,001) увеличение уровня сывороточного железа по сравнению с контрольной группой (132,7 ± ± 47,6 нг/дл; 104,0 ± 34,3 нг/дл, соответственно). Как уже было сказано ранее, при избытке железа в организме происходит накопление гемосидерина, патологически высокое содержание которого в ретикулоэндотелиа-льных клетках паренхиматозных органов приводит к гемосидерозу. Симптоматический гемосидероз встречается при наследственных и приобретенных гемолитических анемиях, некоторых инфекционных болезнях (возвратном тифе, бруцеллезе, малярии) и циррозе печени. Первичный гемосидероз, к примеру, эссенциальный легочный или наследственный гемохроматоз, характеризуется преимущественно локальным накоплением железа (легкие, кожа).
Так [41], у 46 женщин, получавших препараты, содержащие эстроген на протяжении 2-х лет, было зарегистрировано достоверное (р < 0,001) увеличение уровня сывороточного железа по сравнению с контрольной группой (132,7 ± ± 47,6 нг/дл; 104,0 ± 34,3 нг/дл, соответственно). Как уже было сказано ранее, при избытке железа в организме происходит накопление гемосидерина, патологически высокое содержание которого в ретикулоэндотелиа-льных клетках паренхиматозных органов приводит к гемосидерозу. Симптоматический гемосидероз встречается при наследственных и приобретенных гемолитических анемиях, некоторых инфекционных болезнях (возвратном тифе, бруцеллезе, малярии) и циррозе печени. Первичный гемосидероз, к примеру, эссенциальный легочный или наследственный гемохроматоз, характеризуется преимущественно локальным накоплением железа (легкие, кожа).
Коррекция уровня железа
Коррекция низкого уровня железа прежде всего заключается в устранении возможных его этиологических факторов. При наличии ЖДА больным назначают пероральные или парентеральные формы препаратов железа [42]. Последние применяют при плохой переносимости пероральных форм или ограниченной возможности их абсорбции в кишечнике (например, воспалительные изменения
При наличии ЖДА больным назначают пероральные или парентеральные формы препаратов железа [42]. Последние применяют при плохой переносимости пероральных форм или ограниченной возможности их абсорбции в кишечнике (например, воспалительные изменения
ЖКТ). Для профилактики развития ЖДА рекомендуют употреблять в пищу продукты, содержащие большое количество железа и витамины, улучшающие его всасывание.
В настоящее время актуальным остается вопрос выбора препарата железа, перораль-ные формы которого могут быть представ-
т»‘ 2+
лены ионными солевыми препаратами Fe или неионными — разработанными на основе гидроксид-полимальтозного комплекса (ГПК) Fe3+. В метаболизме этих препаратов имеется принципиальное различие. Так, благодаря своей низкой молекулярной массе
2+
всасывание солевых препаратов Fe являет -ся пассивным неконтролируемым процессом, что может привести к их передозировке. Одновременно с этим вследствие реакции окисления Fe происходит образование свободных радикалов, которые могут повреждать слизистую оболочку ЖКТ, что в последующем может блокировать процессы всасывания многих микроэлементов, в том числе и железа.
Одновременно с этим вследствие реакции окисления Fe происходит образование свободных радикалов, которые могут повреждать слизистую оболочку ЖКТ, что в последующем может блокировать процессы всасывания многих микроэлементов, в том числе и железа.
Особенностями ГПК Fe3+ являются его высокая молекулярная масса, наличие ядра гидроокиси железа, окруженного полималь-тозной оболочкой, что ограничивает его вса -сывание, в связи с чем их передозировка становится невозможной. При их применении отсутствует также и этап окисления с переходом Fe2+ в Fe3+, а соответственно и высвобождение свободных радикалов. Все это существенно снижает риск нежелательных реакций, характерных для солевых препаратов железа. Так, Jacobs P. et al. [43] сравнивали эффективность лечения ЖДА препаратами, содержащими сульфат железа (1-я группа) и ГПК (2-я группа). Результаты исследования показали, что достоверных различий в приросте уровня гемоглобина между группами не было (1-я группа — 121 ± ± 11 г/л, 2-я — 123 ± 15 г/л, р > 0,05). Вместе с тем концентрация ферритина оказалась существенно (р < 0,05) выше у пациентов 1-й группы (12,1 ± 11,3 нг/мл) по сравнению со 2-й (5,5 ± 4,9 нг/мл). Частота возникновения побочных эффектов со стороны ЖКТ также была достоверно (р < 0,05) больше в 1-й группе (44,7 %), чем во 2-й (17,5 %).
Вместе с тем концентрация ферритина оказалась существенно (р < 0,05) выше у пациентов 1-й группы (12,1 ± 11,3 нг/мл) по сравнению со 2-й (5,5 ± 4,9 нг/мл). Частота возникновения побочных эффектов со стороны ЖКТ также была достоверно (р < 0,05) больше в 1-й группе (44,7 %), чем во 2-й (17,5 %).
В тоже время в исследовании Bopche A. et al. [44] обнаружили, что после лечения сульфатом железа у пациентов наблюдался более
высокий уровень железа в крови и меньшее количество побочных явлений по сравнению с теми, кто принимал ГПК. В другом исследовании [45], у пациентов, принимающих ГПК, не наблюдалось достоверного увеличения уровня гемоглобина после 12 нед. лечения, тогда как через 6 нед. после замены ГПК сульфатом железа зарегистрировано существенное (на 8-32 г/л) возрастание концентрации гемоглобина. Liu T. et al. [46] также отметили, что лечение ЖДА препаратами, содержащими Fe2+, было более эффективно и безопасно, чем использование ГПК.
При повышенном содержании уровня железа в организме также следует исключить влияние факторов, которые могут привести к его избытку. Одним из методов уменьшения концентрации железа в сыворотке крови являются гемоэксфузии. При этом следует отметить, что с 500 мл крови выводится лишь 250 мг железа. Обычно кровопускания производят 1-2 раза в неделю до тех пор, пока уровни железа и ферритина в сыворотке, а также степень насыщения трансферрина железом не снизятся до нижней границы нормы. Согласно данным Bring P. et al. [47], средняя продолжительность жизни больных, которых лечили кровопусканиями, значительно больше (8,2 г), чем у больных, которым они не производились (4,9 г). У леченных также была меньше и летальность за 5 лет — 11 % и 67 %, соответственно.
Для лечения перегрузки железом можно использовать его хелаторы и эритроцитофе-рез. Так, при инфузии хелатора железа дефе-роксамина у 17 из 21 пациента (80,9 %) наблюдалось достоверное (р < 0,05) снижение уровня ферритина [48]. В другом исследовании [49] отмечено снижение уровня ферри-тина в сыворотке крови с 886,8 нг/мл до 485,9 нг/мл при приеме перорального хелатора деферазирокса в течение 5 нед.
В другом исследовании [49] отмечено снижение уровня ферри-тина в сыворотке крови с 886,8 нг/мл до 485,9 нг/мл при приеме перорального хелатора деферазирокса в течение 5 нед.
Таким образом, представленные данные показывают, что механизмы интестинальной абсорбции и регуляции железа в организме человека весьма сложны. При этом к ухудшению качества жизни больных может приводить как дефицит железа, так и избыток. Вместе с тем, своевременное выявление и оптимальная коррекция дефицита и избытка железа существенно улучшают качество жизни и прогноз пациентов.
ЛИТЕРАТУРА
1. Cadet E. Donnes recentes sur metabolisme du fer: un etat de transition I [E. Cadet, M. Gadenne,
D. Capront, J. Rochette] II La revue de medecine interne. — 2005. — Vol. 26. — Р. 315—324.
2. Anderson G. Control of iron absorption / G. Anderson II J Gastroenterol Hepatol. — 1996. — Vol. 11. — P. 1030—1032.
Anderson G. Control of iron absorption / G. Anderson II J Gastroenterol Hepatol. — 1996. — Vol. 11. — P. 1030—1032.
3. Zhang A. Iron Homeostasis: Recently identified proteins provide insight into novel control mechanisms I
A. Zhang, A. Caroline II J Biol Chem. — 2009. — Vol. 284. — P. 711—715.
4. Shayeghi M. Identification of an intestinal heme transporter I M. Shayeghi, G. Latunde-Dada, J. Oakhill II Cell. — 2005. — Vol. 122. — P. 789—801.
5. Conrad M. Umbreit J. Pathways of iron absorption I M. Conrad, J. Umbreit II Blood Cells Mol Dis. — 2002. — Vol. 29. — P. 336—55.
6. Umbreit J. The ferrireductase paraferritin contains divalent metal transporter as well as mobilferrin I
J. Umbreit, M. Conrad, L. Hainsworth II Am J Physiol Gastrointest Liver Physiol. — 2002. —
Umbreit, M. Conrad, L. Hainsworth II Am J Physiol Gastrointest Liver Physiol. — 2002. —
Vol. 282. — P. 534—539.
7. Anderson G. Mechanisms of haem and non-haem iron absorption: lessons from inherited disorders of iron metabolism I G. Anderson, D. Frazer, A. McKie II Biometals. — 2005. — Vol. 18. — P. 339—348.
8. Linder M. Vesicular transport of Fe and interaction with other metal ions in polarized Caco2 Cell monolayers I M. Linder, M. Moriya, A. Whon II Biol. Res. — 2006. — Vol. 39. — P. 143—156.
9. Donovan A. The iron exporter ferroportinISlc40a1 is essential for iron homeostasis I A. Donovan, C. Lima, J. Pinkus [et al.] II Cell Metab. — 2005. — Vol. 1 (3). — P. 191—200.
10. Yeh K. Iron feeding induces ferroportin 1 and hephaestin migration and interaction in rat duodenal
epithelium I K. Yeh, M. Yeh, L. Mims II Am J Physiol Gastrointest Liver Physiol. — 2009. —
Yeh, M. Yeh, L. Mims II Am J Physiol Gastrointest Liver Physiol. — 2009. —
Vol. 296. — P. 55—65.
11. Sipe D. Binding to cellular receptors results in increased iron release from transferrin at mildly acidic pH I D. Sipe, R. Murphy II J Biol Chem. — 1991. — Vol. 266. — P. 802—807.
12. Bali P. A new role for the transferrin receptor in the release of iron from transferring I P. Bali, O. Zak, P. Aisen II Biochemistry. — 1991. — Vol. 30. — P. 324—328.
13. Adlerova L. Lactoferrin: a review I L. Adlerova, A. Bartoskova, M. Faldyna II Veterinarni Medicina. —
2008. — Vol. 53. — P. 457—468.
14. Artym J. The role of lactoferrin in the iron metabolism. Part I. Effect of lactofferin on intake, transport and iron storage I J. Artym II Postepy Hig Med Dosw. — 2008. — Vol. 62. — P. 599—612.
Artym II Postepy Hig Med Dosw. — 2008. — Vol. 62. — P. 599—612.
15. Pantopoulos K. Iron metabolism and the IREIIRP regulatory system: an update I K. Pantopoulos II Ann N Y Acad Sci. — 2004. — Vol. 12. — P. 1—13.
16. Hudson D. Human hephaestin expression is not limited to enterocytes of the gastrointestinal tract but is also found in the antrum, the enteric nervous system, and pancreatic cells I D. Hudson, S. Curtis, V. Smith II Am J Physiol Gastrointest Liver Physiol. — 2010. — Vol. 298. — P. 425—432.
17. Yang F. Hepcidin expression and iron transport in alveolar macrophages I F. Yang II Am J Physiol Lung Cell Mol Physiol. — 2006. — Vol. 291. — P. 417—425.
18. Nemeth E. IL6 mediates hypoferremia inducing the synthesis of the iron regulatory hormone hepcidin I
E. Nemeth, S. Rivera, V. J. Gabajan II J. Clin. Inv. — 2004. — Vol. 113 (9). — Р. 1271—1276.
Nemeth, S. Rivera, V. J. Gabajan II J. Clin. Inv. — 2004. — Vol. 113 (9). — Р. 1271—1276.
19. Лубянова И. Современные представления о метаболизме железа с позиции профпатолога I И. Лубянова II Актуальные проблемы транспортной медицины. — 2010. — № 2. — C. 47—57.
20. Giannetti A. Mechanism for multiple ligand recognition by the human transferrin receptor I A. Giannetti, P. Snow, O. Zak // PLoS Biol. — 2003. — Vol. 3. — P. 51.
21. Fleming R. Transferrin receptor 2: Continued expression in mouse liver in the face of iron overload and in hereditary hemochromatosis I R. Fleming, M. Migas, C. Holden II PNAS. — 2000. — Vol. 97. — P. 2214—2219.
22. Clark S. Iron Deficiency Anemia I S. Clark II Nutr Clin Pract. — 2008. — Vol. 23. — P. 128—141.
23. Новик А. А., Богданов А. Н. Анемии (от А до Я) руководство для врачей I Под ред. акад. Ю. Л. Шевченко. — СПб : Нева, 2004. — 320 с., ил.
Новик А. А., Богданов А. Н. Анемии (от А до Я) руководство для врачей I Под ред. акад. Ю. Л. Шевченко. — СПб : Нева, 2004. — 320 с., ил.
24. Agrawal S. Anemia in rheumatoid arthritis: high prevalence of iron-deficiency anemia in Indian
patients I S. Agrawal, R. Misra, A. Agrawal II Rheumatol Int. — 2006. — Vol. 26 (12). — P. 1091—
1095.
25. Tandra M. Iron deficiency in rheumatoid arthritic patients especially with in the middle age I M. Tandra,
A. Srivastava II International Journal of Systems Biology. — 2010. — Vol. 2, Is. 1. — P. 1—5.
26. Калинкина Н. В. Особенности течения ревматоидного артрита у пациентов со сниженным
уровнем гемоглобина I Н. В. Калинкина, А. С. Смирнова, Н. Т. Ватутин II Український
В. Калинкина, А. С. Смирнова, Н. Т. Ватутин II Український
ревматологічний журнал. — 2010. — № 42. — С. 34—42.
27. Lai L. Н. Nonsteroid anti-inflammatory drug-induced gastroduodenal injury I L. Н. Lai, F. К. Chan II Curr Opin Gastroenterol. — 2009. — Vol. 25 (б). — P. 544—548.
28. Filaretova L. From gastroprotective to proulcerogenic action of glucocorticoids on the gastric mucosa I [L. Filaretova, O. Morozova, T. Bagaeva, T. Podvigina] II J Physiol Pharmacol. — 2009. — Suppl. 7. — P. 79—8б.
29. Fijlstra M. Lactose maldigestion during methotrexate-induced gastrointestinal mucositis in a rat model I M. Fijlstra, E. Rings, H. Verkade [et al.] II Am J Physiol Gastrointest Liver Physiol. — 2011. — Vol. 300 (2). — P. 283—291.
30. Parker B. A case of rheumatoid vasculitis involving the gastrointestinal tract inearly disease I B. Parker, C. Chattopadhyay II Rheumatology. — 2007. — Vol. 4б. — P. 1737—1738.
Parker B. A case of rheumatoid vasculitis involving the gastrointestinal tract inearly disease I B. Parker, C. Chattopadhyay II Rheumatology. — 2007. — Vol. 4б. — P. 1737—1738.
31. Huang H. Multivitamin’mineral supplements and prevention of chronic disease: executive II H. Huang,
B. Caballero, S. Chang II Am J Clin Nutr. — 2007. — Vol. 85. — P. 2б5—2б8.
32. Duntas L. Incidence of sideropenia and effects of iron repletion treatment in women with subclinical hypothyroidism I L. Duntas, L. Papanastasiou, E. Mantzou II Exp Clin Endocrinol Diabetes. — 1999. — Vol. 107. — P. 35б—3б0.
33. Маньковский Б. Необходимость коррекции анемии для управления сахарным диабетом I Б. Маньковский II Здоров’я України. — 2007. — № 10. — С. 29.
34. Thomas М. Functional erythropoietin deficiency in patients with Type 2 diabetes and anaemia I М. Thomas, С. Tsalamandris, R. Macisaac II Diabet Med. — 200б. — Vol. 23. — Р. 502—509.
Thomas М. Functional erythropoietin deficiency in patients with Type 2 diabetes and anaemia I М. Thomas, С. Tsalamandris, R. Macisaac II Diabet Med. — 200б. — Vol. 23. — Р. 502—509.
35. Tarim O. Effects of iron deficiency anemia on hemoglobin A1c in type 1 diabetes mellitus I O. Tarim,
A. KuQukerdogan, U. Gunay II Pediatr Int. — 1999. — Vol. 41. — P. 357—3б2.
36. Semba R. High prevalence of iron deficiency and anemia among female injection drug users with and without HIV infection I R. Semba, N. Shah, S. Strathdee, D. Vlahov II J Acquir Immune Defic Syndr. — 2002. — Vol. 29. — P. 142—144.
37. Salwa T. Role of Hepcidin in Anemia of Chronic Hepatitis C Patients I S. Toima, S. Abeya, M. Mona II Journal of American Science. — 2010. — Vol. 12. — P. 145—154.
38. Robertson K. Assessment of iron status and the role for iron-replacement therapy in anaemic cancer patients under the care of a specialist palliative care unit I K. Robertson, S. Hutchison II Palliat Med. —
Robertson K. Assessment of iron status and the role for iron-replacement therapy in anaemic cancer patients under the care of a specialist palliative care unit I K. Robertson, S. Hutchison II Palliat Med. —
2009. — Vol. 23. — P. 40б—409.
39. Park S. Estimation of iron deficiency anemia prevalence in colorectal cancer patients I S. Park, K. Hicks, R. Nisenbaum [et al.] II Gastrointestinal Cancers Symposium. General Poster Session. — 2010. — Abstract 514.
40. Pra D. A possible link between iron deficiency and gastrointestinal carcinogenesis I D. Pra II Nutr Cancer. — 2009. — Vol. б1. — P. 415—42б.
41. Frassineii-Gunderson E. Iron stores in users of oralcontraceptive agents I E. Frassineii-Gunderson II The American Journal of Clinical Nutrition. — 1985. — Vol. 41. — P. 703—712.
42. Goddard A. Guidelines for the management of iron deficiency anaemia I A. Goddard, A. McIntyre,
B. Scott II Gut. — 2000. — Vol. 4б. — P. 1—5.
43. Jacobs P. Erythrocytes: Better Tolerance of Iron Polymaltose Complex Compared with Ferrous Sulphate in the Treatment of Anaemia I P. Jacobs, L. Wood, A. R. Bird II Hematology. — 2000. — Vol. 5 (1). — Р. 77—83.
44. Bopche A. Ferrous sulfate versus iron polymaltose complex for treatment of iron deficiency anemia in children I A. Bopche, R. Dwivedi, R. Mishra II Indian Pediatr. — 2009. — Vol. 4б. — P. 883—885.
45. Mehta B. Iron hydroxide polymaltose-cause of persistent iron deficincy anemia at delivery I B. Mehta II Indian Journal of medical sciences. — 2001. — Vol. 55. — P. б1б—б20.
46. Liu T. Comparison of a combination ferrous fumarate product and a polysaccharide iron complex as oral treatments of iron deficiency anemia I T. Liu, S. Lin, C. Chang II Int J Hematol. — 2004. — Vol. 80. — P. 41б—420.
47. Bring P. Iron overload disorders: treatment options for patients refractory to or intolerant of phlebotomy I P. Bring, N. Partovi, J. Ford II Pharmacotherapy. — 2008. — Vol. 28. — P. 331—342.
48. Drakonaki E. Deferoxamine versus combined therapy for chelating liver, spleen and bone marrow iron in beta-thalassemic patients: a quantitative magnetic resonance imaging study I E. Drakonaki, T. Maris,
S. Maragaki II Hemoglobin. — 2010. — Vol. 34. — P. 95—10б.
49. Miura Y. Iron Chelation Therapy with Deferasirox Results in Improvement of Liver Enzyme Level in Patients with Iron Overload-Associated Liver Dysfunction I [Y. Miura, Y. Matsui, H. Kaneko, M. Watanabe] II Case Report Med. — 2010. — Vol. 1. — P. 1—3.
Miura, Y. Matsui, H. Kaneko, M. Watanabe] II Case Report Med. — 2010. — Vol. 1. — P. 1—3.
Железо | Tervisliku toitumise informatsioon
Железо в организме человека встречается только в связанной, растворимой и нетоксичной форме. Свободное железо для человеческого организма опасно, поскольку оно быстро окисляется до труднорастворимых вредных веществ.
Железо необходимо:
- для кроветворения, где оно используется в синтезе гемо- и миоглобина. Железо играет ключевую роль в связывании и транспорте в составе гемоглобина необходимого для жизни кислорода, в т.ч. оно участвует в доставке кислорода из легких в ткани,
- в составе таких биомолекул, которые участвуют в синтезе АТФ (аденозинтрифосфата, играющего роль оперативного переносчика энергии в клетках) и помогают обезвреживать попавшие в организм чужеродные соединения, повышая таким образом его сопротивляемость стрессу и заболеваниям,
- для уменьшения усталости и поддержания нормального цвета кожи.

Железо встречается как в растительной, так и в животной пище. Железо из животной пищи, например из мяса, усваивается организмом на 15–35 %, а из растительной, например из зерновых, – на 2–20 %, причем в последнем случае велика роль витамина С. Длительный дефицит доступного железа – наиболее распространенная причина анемии. Состав продукта оказывает влияние на то, как усваивается входящее в него железо. Степень усвояемости увеличивается, если в повседневном рационе присутствуют мясо и рыба, а также достаточно витамина С. Усвояемость падает, если человек ест такие продукты (например, шпинат или ревень), в которых наличествуют оксалаты, фитиновая кислота и некоторые другие органические кислоты.
Дефицит железа может возникнуть:
- при большой кровопотере,
- у беременных,
- у недоношенных детей или детей с низкой массой тела,
- у грудных детей и маленьких детей,
- у девочек-подростков,
- у вегетарианцев,
- при заболевании органов пищеварения.

Чрезмерное употребление железа в течение длительного времени, главным образом в виде биоактивных добавок, может быть вредно для организма. Избыток железа приводит к глубокому оксидативному стрессу, который является причиной многих заболеваний. Избыток железа угрожает прежде всего взрослым мужчинам и женщинам в постменопаузе, и им желательно не превышать в течение долгого времени количество употребляемого железа.
Лучшим источником железа являются продукты животного происхождения, такие как печень, кровяная колбаса, яйца, постная говядина и свинина, но также и семена, изюм, хлеб, цельнозерновые продукты, греча, клубника. Продукты, богатые жирами и сахаром, обычно бедны железом.
У женщин потери железа с менструальной кровью очень различаются. Это значит, что некоторым женщинам требуется больше железа, чем его можно получить из обычной пищи. Если железо усваивается на 15 %, то 90 % потребности в железе у женщин детородного возраста покроют 15 мг железа в день.
Для поддержания баланса железа в организме в начале беременности требуется накопить около 500 мг запасов железа.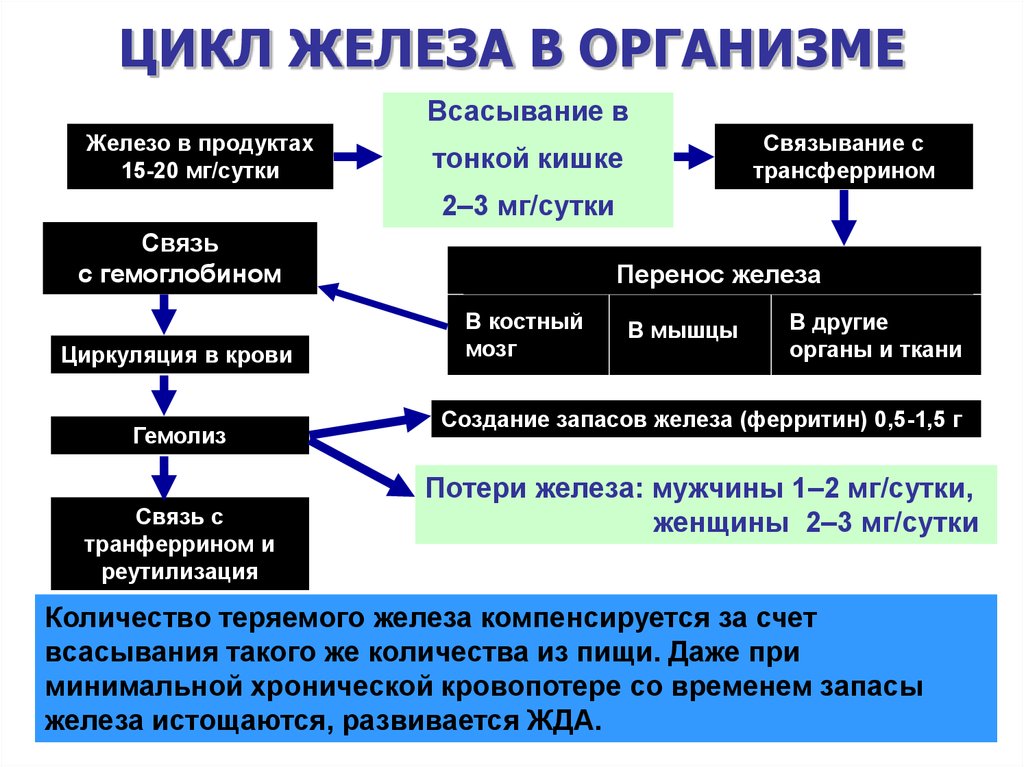 Некоторым женщинам для покрытия биологической потребности в железе в последние два триместра беременности недостаточно того железа, которое поступает с пищей, и требуются железосодержащие добавки.
Некоторым женщинам для покрытия биологической потребности в железе в последние два триместра беременности недостаточно того железа, которое поступает с пищей, и требуются железосодержащие добавки.
Рекомендуемые количества минеральных веществ по возрастным группам см. подробнее в таблице.
Рекомендуемая суточная доза железа составляет 10–15 мг. 10 мг железа содержат, например, следующие продукты:
- 50 г тушеной печени,
- 55 г пшеничных отрубей,
- 90 г чечевицы,
- 125 г кровяной колбасы,
- 400 г тушеной говядины.
Если питаться разнообразно, в соответствии с теми количествами продуктов, которые рекомендованы в пирамиде питания, с получением достаточного количества железа проблем не возникает.
Почему страшен для организма избыток «железа»? — Российская газета
В организме взрослого человека должно быть примерно 4-5 г железа.
Но сегодня все реже встречаются люди, у которых этот элемент содержится в норме. Особенно у горожан все чаще наблюдается повышенная концентрация железа. Хорошо это или плохо?
Хорошо это или плохо?
У нас не заржавеет
Все знают о том, что «низкий уровень железа — это плохо». И только в последнее время заговорили, что и в повышенном содержании этого элемента нет ничего хорошего. Ведь помимо переноса кислорода железо регулирует работу иммунной системы, принимает участие в работе щитовидной железы, способствует выведению токсинов из организма, участвует в процессах регенерации, улучшает состояние кожи, структуру волос и ногтей… Словом, большинство процессов в наших клетках протекает с участием железа. Но при его избытке происходят реакции, похожие на образование ржавчины: молекулы железа окисляются и повреждают живые ткани.
Откуда излишки?
Большая часть железа в нашем теле входит в состав гемоглобина, отвечающего за перенос кислорода в теле. Именно поэтому, когда человеку не хватает кислорода, организм пытается компенсировать это увеличением концентрации гемоглобина. Так происходит у альпинистов в горах. И у жителей городов, где воздух насыщен выхлопными газами. Но альпинисты спускаются с гор. А горожане постоянно испытывают кислородное голодание. Иногда излишки железа в крови — признак болезни печени. А еще есть люди (практически каждый седьмой житель планеты), которые являются носителями особого гена, вызывающего накопление железа. К счастью, ген этот большей частью дремлет, потому гемохроматозом (так называется избыточное содержание железа) страдают немногие. Этот «дефектный» ген еще называют «геном кельтов». Он чаще встречается у жителей Скандинавии. Избыток железа характерен больше для мужчин, из-за физиологических потерь крови женщин эта неприятность затрагивает реже, однако после менопаузы они начинают «догонять» мужчин.
Но альпинисты спускаются с гор. А горожане постоянно испытывают кислородное голодание. Иногда излишки железа в крови — признак болезни печени. А еще есть люди (практически каждый седьмой житель планеты), которые являются носителями особого гена, вызывающего накопление железа. К счастью, ген этот большей частью дремлет, потому гемохроматозом (так называется избыточное содержание железа) страдают немногие. Этот «дефектный» ген еще называют «геном кельтов». Он чаще встречается у жителей Скандинавии. Избыток железа характерен больше для мужчин, из-за физиологических потерь крови женщин эта неприятность затрагивает реже, однако после менопаузы они начинают «догонять» мужчин.
Симптомы
Симптомы избытка железа сходны с признаками гепатита — желтушное окрашивание кожи, склер, а также неба и языка, зуд, увеличение печени.
Кроме того, нарушается сердечный ритм, люди выглядят бледными, худеют. Возможна также пигментация в тех местах, где ее не должно быть по определению, например на ладонях, в области подмышек, в местах старых рубцов. Но для того, чтобы поставить точный диагноз, требуется биохимический анализ крови
Но для того, чтобы поставить точный диагноз, требуется биохимический анализ крови
Больше всего железа накапливается в печени, поджелудочной железе, сердечной мышце, что в конечном итоге становится причиной изменения и самого органа: развивается гепатит, цирроз печени, сахарный диабет, заболевания суставов, нервной системы, сердечные патологии, вплоть до внезапной остановки сердца.
Избыток железа осложняет ход болезней Паркинсона и Альцгеймера, может спровоцировать рак кишечника, печени, легких. Ревматоидный артрит также часто протекает на фоне избытка железа.
Что делать
К людям с сильно повышенным гемоглобином нужен особый подход. Им нельзя назначать даже, казалось бы, безобидную аскорбиновую кислоту, ведь этот витамин имеет свойство усиливать всасывание железа.
Избыток железа устранить даже сложнее, чем недостаток. Пожалуй только старый дедовский способ — кровопускание (флеботомия) — позволяет добиться нужных результатов и даже избежать иногда медикаментозных препаратов при лечении.
За рубежом, например, людям после 40-50 лет даже рекомендуют донорство — для профилактики ишемической болезни сердца. Так что человек, «переполненный» железом, может смело записываться в ряды доноров крови.
Ну и самый традиционный, но и самый верный способ регуляции уровня железа в крови — правильное питание.
важно знать
Считается, что железо, содержащееся в красном мясе, усваивается лучше, чем железо из растений. Это не всегда так. Например, регулярное употребление сельдерея способно восстановить баланс этого элемента в организме за несколько недель. Железо из растительных продуктов лучше усваивается, когда их сочетают с продуктами животного происхождения.
Лучшему усвоению железа способствуют витамин С и витамины группы В. Так что, например, яблоко в дополнение к мясу полезно съедать при анемии, а вот при повышенном гемоглобине лучше воздержаться. Если же в продуктах питания много кальция и сахара, железо усваивается плохо.Гречка, сваренная на воде (без молока), значительно полезнее при низком гемоглобине.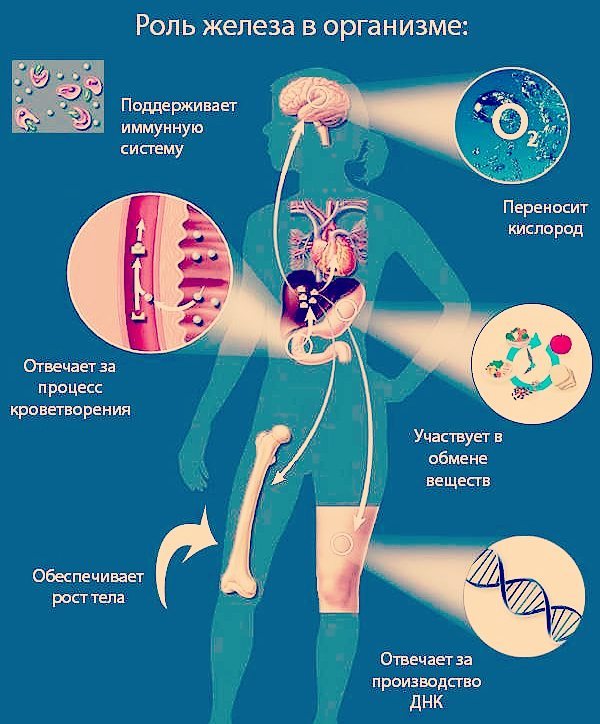
Лучше всего готовить пищу в русской печке, но ее может заменить аэрогриль, который готовит по тому же принципу. Блюдо равномерно прогревается со всех сторон, при этом — без лишней воды и масла, что позволяет лучше сохранить полезные свойства продуктов. Все это делает пищу вкусной и полезной, она хорошо усваивается организмом, поставляя максимум необходимых элементов. Не только овощи, но и мясо, приготовленное в аэрогриле, соответствует рекомендациям диетологов и помогает нормализации гемоглобина.
Выявлена взаимосвязь старения с уровнем железа в крови
Железо играет в организме человека очень важную роль. Оно входит в состав гемоглобина – белка, отвечающего за захват кислорода эритроцитами. Эти красные кровяные тельца раздают кислород тканям и забирают у них углекислый газ.
При нехватке железа возникает анемия (в народе именуемая малокровием). Человек из-за нехватки кислорода начинает чувствовать себя вялым, раздражительным, быстро утомляется и даже может терять сознание.
Но, как выяснилось, в случае с железом также актуально правило “Хорошего понемножку”. Об этом свидетельствуют результаты исследования, проведённого учёными Шотландии и Германии.
Изначально они ставили себе целью выяснить, какие гены могут быть связаны с более долгой и здоровой жизнью. Для этого ими были проанализированы три общедоступных набора геномных данных, охватывающих информацию о более чем миллионе человек.
В итоге учёные выявили 10 областей генома, связанных с увеличением продолжительности жизни. К слову, половина из них была обнаружена впервые. Но самое удивительное, что многие из них были связаны с метаболизмом железа. В итоге исследователи выдвинули гипотезу, что нарушения переработки организмом железа приводит к появлению многих возрастных заболеваний.
Этих нарушений недостаточно, чтобы вызвать какие-то серьёзные проблемы со здоровьем (например гемохроматоз). Поэтому люди их не замечают, а медики, соотвественно, никак не лечат. Однако мало по малу, оказывая накопительный эффект, ненормально большое содержание железа в те или иных органах может приводить к возникновению таких, казалось бы, типично старческих заболеваний, как артрит, диабет, атеросклероз, деменция и болезни сердца. .. Всё это вызывает постепенную дегенерацию организма.
.. Всё это вызывает постепенную дегенерацию организма.
«Мы очень взволнованы этими результатами, так как они убедительно свидетельствуют о том, что высокий уровень железа в крови сокращает здоровые годы жизни, а контроль над ним может предотвратить возрастные повреждения”, – отмечает в пресс-релизе Университета Эдинбурга соавтор исследования Пол Тиммерс (Paul Timmers).
Результаты данного исследования также могут объяснить, почему большое количество богатого железом красного мяса в рационе может быть связано с деструктивными возрастными изменениями.
Плохие новости для любителей стейков и сочных отбивных…
К слову, многие нейродегенеративные заболевания, например, болезнь Альцгеймера, связаны с аномально высоким уровнем железа в мозге. Медики уже ищут способы, как бы его оттуда вывести.
Результаты масштабного метаанализа опубликовал журнал Nature Communications.
А пока учёные ищут способы, как добавить не только годы жизни, но и жизни – годам, можно прочесть материал Вести. Ru о том, как учёные омолодили мозг старых и малоподвижных мышей при помощи всего одного белка. Также мы рассказывали об исследованиях, показавших, какие продукты лучше пореже включать в свой рацион, а какие, наоборот, почаще использовать в меню.
Ru о том, как учёные омолодили мозг старых и малоподвижных мышей при помощи всего одного белка. Также мы рассказывали об исследованиях, показавших, какие продукты лучше пореже включать в свой рацион, а какие, наоборот, почаще использовать в меню.
Влияние железа на здоровье человека
Железо – чрезвычайно важный металл в человеческом организме. Самое большое количество железа (примерно 60 %) содержится в крови человека. Остальная его часть находится в тканях, печени, костном мозге, селезёнке. Железо играет огромную роль в процессе вырабатывания гемоглобина в крови, а также миоглобина и других ферментов. Также этот элемент участвует в процессе окислительно-восстановительных реакций. Железо увеличивает сопротивляемость организма человека к различным заболеваниям.
Продукты, богатые железом, необходимо употреблять детям в период активного роста, беременным женщинам, а также женщинам во время менструаций. Вообще, железо необходимо употреблять при всех заболеваниях, сопровождающихся малокровием.
Нехватка железа в организме человека
Недостаток этого металла в организме человека может привести к неприятным последствиям. При дефиците железа у людей наблюдается быстрая утомляемость, снижение иммунитета. Особенно опасен дефицит железа у детей. Это приводит к задержке физического и умственного развития. Все органы начинают работать хуже. У мужчин недостаток железа может привести к ухудшению работы половых органов, что влечет за собой импотенцию. Беременным женщинам нужно особенно следить за поступлением железа в организм. Его нехватка может сильно навредить потомству (как в умственном, так и в физическом отношении).
Дефицит железа может возникнуть при недостаточном потреблении его с пищей, а также из-за некоторых патологических состояний: различные инфекции, хроническая диарея, после кровопотерь, послеоперационных кровотечений.
Для лучшего усвоения этого металла необходимо употреблять в пищу также марганец, медь, витамин С и кобальт.
Продукты, богатые железом:
1) Такие фрукты, как яблоки, абрикосы, персики, груши, айва;
2) Фасоль, горох, чечевица;
3) Некоторые овощи: репчатый лук, картофель, тыква, свекла;
4) Почки и печень скота;
5) Куриные яйца;
6) Зелень петрушки.
Для того, чтобы защитить организм от дефицита железа детям на 1 кг веса необходимо употреблять 0,6 мг в сутки, взрослым 0,2 мг, беременным женщинам 0,3 мг. Обычно, употребления продуктов, богатых железом, достаточно. Но в отдельных случаях (донорство крови, анемия) следует употреблять препараты или пищевые добавки с железом.
железо: значение для организма, где содержится и какова суточная норма для организма?
Железо — это важный микроэлемент, который участвует во многих процессах в организме человека. Дыхание, кроветворение, окислительно-восстановительные и метаболические реакции, иммунологические и многие другие процессы не обходятся без его участия[1]. Нехватка железа в организме может приводить к ухудшению общего состояния человека и развитию серьезных заболеваний. В статье расскажем, какие функции выполняет микроэлемент железо и как поддерживать его в норме.
Для чего нужен микроэлемент железо в организме
Железо отвечает за доставку кислорода к тканям, регулирование синтеза ДНК и обмена веществ в мышцах[2].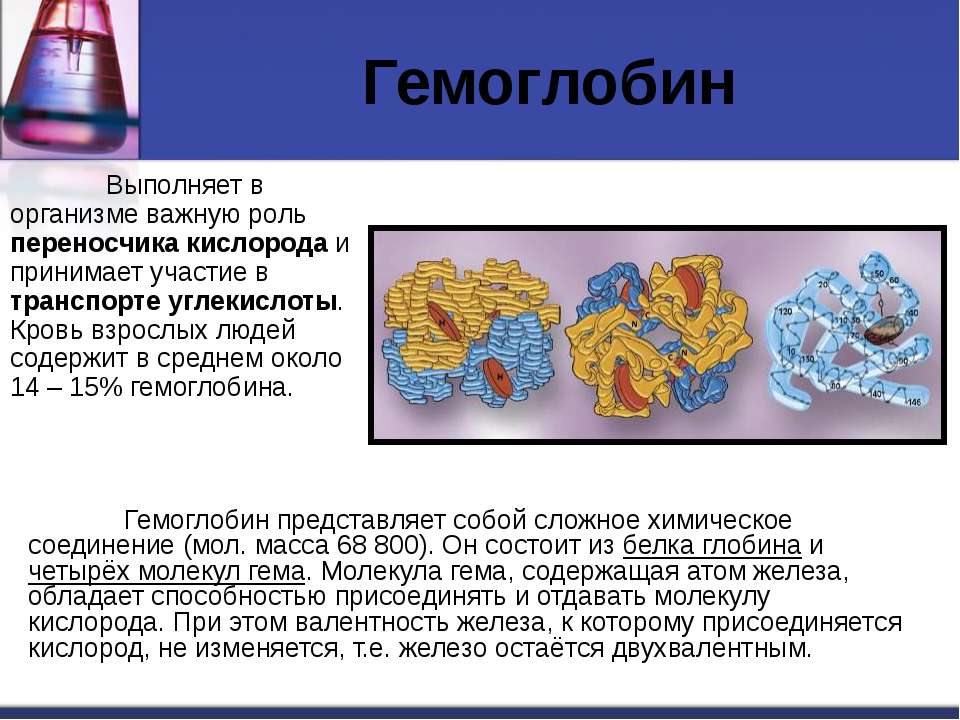 На этом «деятельность» микроэлемента не заканчивается. Рассмотрим подробнее, какое значение имеет железо для различных систем организма и в каких процессах принимает участие.
На этом «деятельность» микроэлемента не заканчивается. Рассмотрим подробнее, какое значение имеет железо для различных систем организма и в каких процессах принимает участие.
Процессы кроветворения.
Невозможно представить выработку и формирование клеточных элементов в костном мозге без участия железа. Этот элемент — важная составная часть молекулы гемоглобина[3], а значит, и «короля» крови — эритроцита.
Перенос кислорода.
В легких молекулы кислорода связываются с гемоглобином. Далее потоком крови эритроциты переносятся к органам и тканям, здесь связь O2 с гемоглобином разрывается. Так происходит транспорт кислорода от легких к тканям и органам[4].
Работа мышечной ткани.
Немалое значение микроэлемент железо имеет для нормальной работы скелетных мышц: Fe входит в состав красного пигмента мышц — миоглобина[5]. Это своеобразный аналог гемоглобина, который все свои силы обращает на снабжение кислородом мышечной ткани.
Энергетический обмен и деление клеток.
Помимо помощи в основных этапах клеточного метаболизма, железо также вносит свой вклад в синтез ДНК[6].
Деятельность щитовидной железы.
Элемент способствует усвоению йода и нормализует работу щитовидной железы[7,8].
Работа нервной системы.
Согласно современным исследованиям, железо участвует в генерации нервных импульсов, а также оказывает влияние на функции гипоталамуса[9].
Иммунный ответ.
Железо влияет на механизмы как врожденного, так и приобретенного иммунитета: для полноценного иммунного ответа требуется метаболическое обеспечение, реализуемое в том числе благодаря микроэлементу[10].
Где содержится железо и какова суточная норма потребления элемента
Важно поддерживать уровень железа в норме, обеспечивать достаточное поступление микроэлемента с продуктами питания. Основные пищевые источники железа — мясо, говяжья печень, кедровые и грецкие орехи, морская капуста, фисташки, семечки, кунжут, бобовые (нут, горох, чечевица, фасоль), финики, изюм, курага и другие сухофрукты. Также немалое количество железа содержится в некоторых овощах и фруктах: моркови, грибах, хурме и яблоках[11].
Основные пищевые источники железа — мясо, говяжья печень, кедровые и грецкие орехи, морская капуста, фисташки, семечки, кунжут, бобовые (нут, горох, чечевица, фасоль), финики, изюм, курага и другие сухофрукты. Также немалое количество железа содержится в некоторых овощах и фруктах: моркови, грибах, хурме и яблоках[11].
Суточная норма микроэлемента железа различается в зависимости от возраста, пола и степени физической активности человека. Согласно Нормам физиологических потребностей в энергии и пищевых веществах для различных групп населения[12], суточная норма железа для женщин составляет 15–20 мг, для мужчин — 8–10 мг. Детям с рождения и до трех месяцев необходимо всего 4 мг железа ежедневно, затем норма увеличивается: годовалому ребенку показано 10 мг микроэлемента, детям старше семи лет требуется 12 мг, а девушкам и юношам 14–18 лет необходимо по 18 и 15 мг соответственно. Потребность в микроэлементе возрастает во время беременности: в некоторых случаях суточная норма может быть увеличена на 15 мг.
Лабораторная диагностика
Определить изменение содержания железа в организме можно с помощью стандартного обследования — общего (клинического) анализа крови, в рамках которого оценивается уровень гемоглобина. Низкий уровень этого белка может быть обусловлен дефицитом железа. Дополнительно можно провести биохимические анализы на трансферрин (белок — переносчик железа), ферритин (молекулу, запасающую железо) и общую железосвязывающую способность сыворотки крови.
Чем опасен избыток железа в организме?
Повышенный уровень железа наблюдается при усиленном разрушении эритроцитов (при гемолитической анемии)[13], наследственном гемохроматозе, острых и хронических воспалительных заболеваниях (гепатите, нефрите)[14]. Зачастую профицит можно получить при бесконтрольном потреблении железосодержащих лекарственных препаратов или после многочисленных переливаний донорской крови.
Однако повышение уровня железа наблюдается относительно редко[15]. Более распространенное явление — снижение микроэлемента в организме.
Чем опасен дефицит железа?
Когда содержание микроэлемента железа в организме снижено, человек может ощущать усталость, апатичность, нередко отмечается потеря аппетита, снижение работоспособности[16]. Подобные симптомы могут быть первыми сигналами развития железодефицитной анемии. Это состояние характеризуется также головокружением, шумом в ушах, бледностью кожи, быстрой утомляемостью, ухудшением памяти и сонливостью, нарушениями в работе ЖКТ[17,18].
По данным Всемирной организации здравоохранения, дефицит железа — это самый распространенный вид нарушения питания. Более 30 % населения мира страдает от анемии, и основная причина развития этого состояния — нехватка микроэлемента[19]. Чаще всего железодефицитные состояния наблюдаются у женщин (во время беременности, при менопаузе), у детей, у людей с некоторыми заболеваниями. Также снижение уровня железа может наблюдаться при длительных и тяжелых физических нагрузках[20].
Что делать при недостатке железа?
В первую очередь нужно достоверно определить причину снижения уровня микроэлемента. Помимо недостатка железа в рационе питания, причинами могут быть нарушение его всасывания в кишечнике или транспортировки в плазме, хронические воспалительные заболевания, системные заболевания соединительной ткани, беременность, быстрый рост в пубертатный период[21,22,23]. У женщин дефицит железа может быть следствием нарушения менструального цикла — при гиперполименорее, когда наблюдается чрезмерная потеря крови, а вместе с ней и микроэлемента железа[24]. Снижение гемоглобина может наблюдаться у регулярно сдающих кровь доноров[25].
После выявления причины отклонений врач определяет тактику купирования недостатка микроэлемента. Лечебные мероприятия, как правило, включают увеличение железосодержащих продуктов в рационе питания, использование биологически активных добавок и специальных лекарственных средств. Терапевтические меры зависят от степени тяжести заболевания и индивидуальных особенностей человека.
ВОЗ отмечает, что профилактические мероприятия по предупреждению дефицитных состояний можно начинать с программы питательных добавок[26]. Эффективность приема БАД подтверждена некоторыми современными исследованиями[27]. Подобные добавки выпускаются в разных формах, так что каждый может найти наиболее оптимальный для себя вариант. Вот некоторые БАД, которые можно найти практически в любой аптеке:
- GENTLE IRON® от Solgar®. В одной капсуле содержится 25 мг железа в форме бисглицината железа. В профилактических целях взрослым рекомендуется принимать по одной капсуле ежедневно[28].
- Iron Double Strength от Now®. Средство также выпускается в форме капсул. В одной штуке 36 мг железа (также в форме железа бисглицината). Рекомендации по применению аналогичные[29].
- «Железо Хелат» от «Эвалар». В одной таблетке БАД содержится не менее 14 мг железа (в хелатной форме). Согласно инструкции, взрослым и детям старше 14 лет можно принимать по одной таблетке в день на протяжении минимум двух месяцев[30].
- «Феррогематоген пастилки жевательные детские» от «Фармстандарт». Гематоген помогает восполнять нехватку железа за счет альбумина черного пищевого и железа (в виде сульфата гептагидрата) в составе. Принимать пастилки следует на протяжении одного–двух месяцев[31].
- «Гематоген народный витаминизированный» от «Сибирское здоровье». Еще один гематоген с пищевым альбумином в составе, также БАД содержит железо сернокислое закисное. Взрослым рекомендуется принимать по 50 мг средства ежедневно[32].
Снижение уровня железа в организме — достаточно распространенное явление. Чтобы предупредить развитие дефицитных состояний, следует уделять должное внимание питанию, включать в рацион соответствующие продукты, при необходимости можно использовать специальные биологически активные добавки.
** Все указанные средства — БАД. Не являются лекарственными средствами. Имеются противопоказания, перед применением необходима консультация специалиста.
Вся информация, касающаяся здоровья и медицины, представлена исключительно в ознакомительных целях и не является поводом для самодиагностики или самолечения.
Обзор железа и его значения для здоровья человека
J Res Med Sci. 2014 фев; 19 (2): 164–174.
Назанин Аббаспур
Департамент наук о системах окружающей среды, Институт наземных экосистем, Швейцарский федеральный технологический институт, Цюрих, Швейцария
Ричард Харрелл
1 Департамент здравоохранения и технологий, Лаборатория питания человека, Институт пищевых продуктов , Питание и здоровье, Швейцарский федеральный технологический институт, Цюрих, Швейцария
Ройя Келишади
2 Исследовательский центр детского роста и развития, Исфаханский университет медицинских наук, Исфахан, Иран
Департамент науки о системах окружающей среды, Институт наземных исследований Экосистема, Швейцарский федеральный технологический институт, Цюрих, Швейцария
1 Департамент медицинских наук и технологий, Лаборатория питания человека, Институт питания, питания и здоровья Швейцарского федерального технологического института, Цюрих, Швейцария
2 Исследования роста и развития детей Ce nter, Исфаханский университет медицинских наук, Исфахан, Иран
Адрес для корреспонденции: Prof.Роя Келишади, Исследовательский центр детского роста и развития Исфаханский университет медицинских наук, Исфахан, Иран. Эл. Почта: ri.ca.ium.dem@idahsilekПоступила в редакцию 8 июня 2013 г .; Пересмотрено 3 ноября 2013 г .; Принято 27 ноября 2013 г.
Авторские права: © Journal of Research in Medical SciencesЭто статья в открытом доступе, распространяемая в соответствии с условиями Creative Commons Attribution-Noncommercial-Share Alike 3.0 Unported, что разрешает неограниченное использование, распространение и воспроизведение в на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.Abstract
Хорошо известно, что недостаток или чрезмерное воздействие различных элементов оказывает заметное влияние на здоровье человека. Действие элемента определяется несколькими характеристиками, включая абсорбцию, метаболизм и степень взаимодействия с физиологическими процессами. Железо является важным элементом почти для всех живых организмов, поскольку оно участвует в широком спектре метаболических процессов, включая транспорт кислорода, синтез дезоксирибонуклеиновой кислоты (ДНК) и транспорт электронов.Однако, поскольку железо может образовывать свободные радикалы, его концентрацию в тканях организма необходимо строго регулировать, поскольку в чрезмерных количествах оно может привести к повреждению тканей. Нарушения метаболизма железа являются одними из наиболее распространенных заболеваний человека и охватывают широкий спектр заболеваний с различными клиническими проявлениями, от анемии до перегрузки железом и, возможно, до нейродегенеративных заболеваний. В этом обзоре мы обсуждаем последние достижения в исследованиях метаболизма и биодоступности железа, а также наше текущее понимание потребности человека в железе, а также последствий и причин дефицита железа.Наконец, мы обсуждаем стратегии профилактики дефицита железа.
Ключевые слова: Анемия, потребность человека в железе, биодоступность железа, дефицит железа, метаболизм железа
ВВЕДЕНИЕ
С древних времен человек осознавал особую роль железа в здоровье и болезнях. [1] Железо вначале использовалось в медицине египтянами, индуистами, греками и римлянами. [2, 3] В 17 — веках железо использовалось для лечения хлороза (зеленой болезни), состояния, часто возникающего из-за дефицита железа.[4] Однако только в 1932 году важность железа была окончательно установлена убедительным доказательством того, что неорганическое железо необходимо для синтеза гемоглобина. [5] В течение многих лет пищевой интерес к железу был сосредоточен на его роли в образовании гемоглобина и транспорте кислорода. [6] В настоящее время, хотя низкое потребление железа и / или его биодоступность являются причиной большинства анемий в промышленно развитых странах, на них приходится только около половины анемии в развивающихся странах [7], где инфекционные и воспалительные заболевания (особенно малярия), кровопотеря от паразитарных инфекций. , и дефицит других питательных веществ (витамина А, рибофлавина, фолиевой кислоты и витамина B12) также являются важными причинами.[8]
Биохимия и физиология
В отличие от цинка, железо является распространенным элементом на Земле [2,9] и является биологически важным компонентом каждого живого организма. [10,11] Однако, несмотря на его геологическое изобилие, железо часто является фактором, ограничивающим рост в окружающей среде. [9] Этот кажущийся парадокс связан с тем фактом, что при контакте с кислородом железо образует оксиды, которые очень нерастворимы и, следовательно, не доступны для усвоения организмами [2]. В ответ возникли различные клеточные механизмы захвата железа из окружающей среды в биологически полезных формах.Примерами являются сидерофоры, секретируемые микробами для захвата железа в высокоспецифический комплекс [12], или механизмы восстановления железа из нерастворимого трехвалентного железа (Fe +3 ) до растворимой двухвалентной формы (Fe +2 ), как в дрожжах. [13] Многие механизмы, обнаруженные у низших организмов, имеют аналогичные аналоги у высших организмов, включая человека. В организме человека железо в основном существует в сложных формах, связанных с белком (гемопротеином), в виде гемовых соединений (гемоглобин или миоглобин), гемовых ферментов или негемовых соединений (ферменты флавин-железо, переносчики и ферритин).[3] Организму требуется железо для синтеза белков, переносящих кислород, в частности гемоглобина и миоглобина, а также для образования гемовых ферментов и других железосодержащих ферментов, участвующих в переносе электронов и окислении-восстановлении. [14,3] Почти Две трети железа в организме содержится в гемоглобине, присутствующем в циркулирующих эритроцитах, 25% содержится в легко мобилизуемых запасах железа, а оставшиеся 15% связаны с миоглобином в мышечной ткани и с различными ферментами, участвующими в окислительном процессе. метаболизм и многие другие функции клеток.[15]
Железо перерабатывается и, таким образом, сохраняется в организме. показана схематическая диаграмма цикла железа в организме. Железо доставляется к тканям с помощью циркулирующего трансферрина, переносчика, который захватывает железо, высвобождаемое в плазму, в основном из кишечных энтероцитов или ретикулоэндотелиальных макрофагов. Связывание нагруженного железом трансферрина с рецептором трансферрина на клеточной поверхности (TfR) 1 приводит к эндоцитозу и поглощению металлического груза. Интернализованное железо транспортируется в митохондрии для синтеза гема или кластеров железо-сера, которые являются неотъемлемой частью нескольких металлопротеинов, а избыток железа накапливается и детоксифицируется в цитозольном ферритине.
Железо связывается и транспортируется в организме через трансферрин и хранится в молекулах ферритина. После всасывания железа не существует физиологического механизма выведения избыточного железа из организма, кроме кровопотери, то есть беременности, менструации или другого кровотечения обычно низкий, но может колебаться от 5% до 35% в зависимости от обстоятельств и типа железа. [3]
Поглощение железа происходит энтероцитами с помощью переносчика двухвалентного металла 1, члена группы переносчиков растворенных веществ мембранных транспортных белков.Это происходит преимущественно в двенадцатиперстной кишке и верхних отделах тощей кишки [16]. Затем он переносится через слизистую двенадцатиперстной кишки в кровь, где транспортируется трансферрином к клеткам или костному мозгу для эритропоэза [производства красных кровяных телец (эритроцитов)]. [14,17,18] Существует механизм обратной связи, который усиливается. всасывание железа у людей с дефицитом железа. Напротив, люди с перегрузкой железом снижают абсорбцию железа через гепсидин. В настоящее время общепринято, что абсорбция железа контролируется ферропортином, который позволяет или не позволяет железу из клетки слизистой оболочки попадать в плазму.
Физическое состояние железа, поступающего в двенадцатиперстную кишку, сильно влияет на его всасывание. При физиологическом pH двухвалентное железо (Fe +2 ) быстро окисляется до нерастворимой трехвалентной формы (Fe +3 ). Желудочная кислота снижает pH в проксимальном отделе двенадцатиперстной кишки, снижая содержание Fe +3 в просвете кишечника за счет редуктазы железа, тем самым обеспечивая последующий транспорт Fe +2 через апикальную мембрану энтероцитов. Это увеличивает растворимость и поглощение трехвалентного железа.Когда продукция желудочного сока нарушена (например, ингибиторами кислотного насоса, такими как лекарство, прилосек), абсорбция железа существенно снижается.
Диетический гем также может транспортироваться через апикальную мембрану по еще неизвестному механизму и впоследствии метаболизироваться в энтероцитах гемоксигеназой 1 (HO-1) с высвобождением (Fe +2 ) [19]. Этот процесс более эффективен, чем абсорбция неорганического железа, и не зависит от рН двенадцатиперстной кишки. Таким образом, на него не влияют такие ингибиторы, как фитат и полифенолы.Следовательно, красное мясо с высоким содержанием гемоглобина является отличным источником железа. Непосредственно интернализованный Fe +2 обрабатывается энтероцитами и в конечном итоге (или нет) экспортируется через базолатеральную мембрану в кровоток через транспортер ферропортин Fe +2 . Ферропортин-опосредованный отток Fe +2 связан с его повторным окислением с Fe +2 , катализируемым мембраносвязанным ферроксидазой гефестином, который физически взаимодействует с ферропортином [20] и, возможно, также его гомологом в плазме церулоплазмином.Экспортируемое железо улавливается трансферрином, который поддерживает Fe +3 в окислительно-восстановительном инертном состоянии и доставляет его в ткани. Общее содержание железа в трансферрине (≈3 мг) соответствует менее 0,1% железа в организме, но оно очень динамично и подвергается более чем 10-кратному ежедневному обороту для поддержания эритропоэза. Пул трансферрина железа пополняется в основном за счет железа, рециркулируемого из неэффективных эритроцитов, и, в меньшей степени, за счет вновь абсорбированного пищевого железа. Старые эритроциты очищаются ретикулоэндотелиальными макрофагами, которые метаболизируют гемоглобин и гем и высвобождают железо в кровоток.По аналогии с кишечными энтероцитами, макрофаги экспортируют Fe +2 из своей плазматической мембраны через ферропортин в процессе, сопряженном с повторным окислением Fe +2 до Fe +3 церулоплазмином с последующей загрузкой Fe +3. на трансферрин. [21]
Theil et al ., [21] недавно сообщили, что существует также независимый механизм абсорбции растительных ферритинов, в основном присутствующих в бобовых. Однако актуальность переносчика ферритина неясна, поскольку большая часть ферритина, по-видимому, разлагается во время обработки и переваривания пищи, тем самым высвобождая неорганическое железо из оболочки ферритина для поглощения по нормальному механизму.[22] Поскольку одна молекула ферритина содержит 1000 или более атомов железа и на нее также не должны влиять ингибиторы абсорбции железа, такой механизм может стать важным источником железа в развивающихся странах, где обычно потребляются бобовые.
Регуляция гомеостаза железа
Поскольку железо требуется для ряда разнообразных клеточных функций, для поддержания гомеостаза железа требуется постоянный баланс между поглощением, транспортом, хранением и использованием железа. [11] Поскольку в организме отсутствует определенный механизм активного выведения железа, баланс железа в основном регулируется в точке абсорбции.[23,24]
Гепсидин — это циркулирующий пептидный гормон, секретируемый печенью, который играет центральную роль в регуляции гомеостаза железа. Это главный регулятор системного гомеостаза железа, координирующий использование и хранение железа с приобретением железа. [25] Этот гормон в основном вырабатывается гепатоцитами и является негативным регулятором поступления железа в плазму []. Гепсидин действует путем связывания с ферропортином, переносчиком железа, присутствующим на клетках двенадцатиперстной кишки, макрофагах и клетках плаценты.Связывание гепсидина вызывает интернализацию и деградацию ферропортина. [26] Потеря ферропортина с поверхности клетки предотвращает попадание железа в плазму []. Снижение поступления железа в плазму приводит к низкому насыщению трансферрина и меньшему количеству железа доставляется в развивающийся эритробласт. Напротив, снижение экспрессии гепсидина приводит к увеличению ферропортина на клеточной поверхности и увеличению абсорбции железа [27] []. У всех видов концентрация железа в биологических жидкостях строго регулируется, чтобы обеспечить необходимое железо и избежать токсичности, поскольку избыток железа может привести к образованию активных форм кислорода.[28] Гомеостаз железа у млекопитающих регулируется на уровне кишечной абсорбции, поскольку для железа не существует экскреторного пути.
Гепсидин-опосредованная регуляция гомеостаза железа. (а) Повышенная экспрессия гепсидина печенью является результатом воспалительных стимулов. Высокий уровень гепсидина в кровотоке приводит к интернализации и деградации ферропортина, экспортера железа. Потеря ферропортина на клеточной поверхности приводит к загрузке железа макрофагами, низким уровням железа в плазме и снижению эритропоэза из-за снижения количества железа, связанного с трансферрином.Снижение эритропоэза приводит к анемии хронического заболевания. (b) Нормальные уровни гепсидина в ответ на потребность в железе регулируют уровень импорта железа в плазму, нормальное насыщение трансферрина и нормальные уровни эритропоэза. (c) Гемохроматоз или перегрузка железом возникает из-за недостаточного уровня гепсидина, вызывая повышенный импорт железа в плазму, высокое насыщение трансферрина и избыточное отложение железа в печени. Источник: Де Доменико, и др. . [27]
Уровни гепсидина в плазме регулируются различными стимулами, включая цитокины, железо в плазме, анемию и гипоксию.Нарушение регуляции экспрессии гепсидина приводит к нарушениям железа. Избыточная экспрессия гепсидина приводит к анемии хронического заболевания, в то время как низкая выработка гепсидина приводит к наследственному гемохроматозу (HFE) с последующим накоплением железа в жизненно важных органах []. Большинство наследственных заболеваний, связанных с железом, возникают в результате недостаточного производства гепсидина по сравнению со степенью накопления железа в тканях. Было показано, что нарушение экспрессии гепсидина является результатом мутаций в любом из 4 различных генов: TfR2, HFE, гемохроматоз типа 2 (HFE2) и антимикробный пептид гепсидина (HAMP).Мутации в HAMP, гене, кодирующем гепсидин, приводят к болезни, связанной с перегрузкой железом, поскольку отсутствие гепсидина обеспечивает постоянное высокое всасывание железа. Роль других генов (TFR2, HFE и HFE2) в регуляции продукции гепсидина не ясна [27].
Хранение
Концентрация ферритина вместе с концентрацией гемосидерина отражает запасы железа в организме. Они хранят железо в нерастворимой форме и присутствуют в основном в печени, селезенке и костном мозге. [2] Большая часть железа связана с широко распространенным и высококонсервативным железосвязывающим белком ферритином.[18] Гемосидерин представляет собой комплекс хранения железа, который с меньшей готовностью выделяет железо для нужд организма. В условиях устойчивого состояния сывороточные концентрации ферритина хорошо коррелируют с общими запасами железа в организме. [29] Таким образом, сывороточный ферритин является наиболее удобным лабораторным тестом для оценки запасов железа.
Экскреция
Помимо потерь железа из-за менструации, другого кровотечения или беременности, железо очень консервативно и нелегко выводится из организма. [30] Существует некоторая обязательная потеря железа из организма в результате физиологического отшелушивания клеток с эпителиальных поверхностей [30], включая кожу, мочеполовые и желудочно-кишечные тракты.[3] Однако, по оценкам, эти потери очень ограничены (≈1 мг / день). [31] Потери железа из-за кровотечения могут быть значительными, а чрезмерная менструальная кровопотеря является наиболее частой причиной дефицита железа у женщин.
БИОЛОГИЧЕСКАЯ ДОСТУПНОСТЬ
Пищевое железо встречается в двух формах: гемовая и негемовая. [23] Основными источниками гемового железа являются гемоглобин и миоглобин из мяса, птицы и рыбы, тогда как негемовое железо получают из злаков, бобовых, бобовых, фруктов и овощей.[32] Гемовое железо обладает высокой биодоступностью (15–35%), и диетические факторы мало влияют на его абсорбцию, тогда как абсорбция негемового железа намного ниже (2–20%) и сильно зависит от присутствия других пищевых компонентов. [23] Напротив, количество негемового железа в рационе во много раз превышает количество гемового железа в большинстве приемов пищи. Таким образом, несмотря на более низкую биодоступность, негемовое железо обычно вносит больший вклад в питание железом, чем гемовое железо. [33] Основными ингибиторами абсорбции железа являются фитиновая кислота, полифенолы, кальций и пептиды из частично переваренных белков.[23] Усилители — это аскорбиновая кислота и мышечная ткань, которые могут восстанавливать трехвалентное железо до двухвалентного железа и связывать его в растворимые комплексы, доступные для абсорбции. [23]
Факторы, повышающие абсорбцию железа
На абсорбцию железа влияет ряд диетических факторов. Аскорбат и цитрат частично увеличивают усвоение железа, действуя как слабые хелаторы, помогая растворить металл в двенадцатиперстной кишке []. [34] Железо легко переносится из этих соединений в клетки слизистой оболочки. Исследователи продемонстрировали дозозависимый усиливающий эффект нативной или добавленной аскорбиновой кислоты на абсорбцию железа.[34] Усиливающий эффект в значительной степени связан с его способностью восстанавливать трехвалентное железо до двухвалентного железа, но также из-за его способности хелатировать железо. [35] Аскорбиновая кислота преодолеет негативное влияние на абсорбцию железа всех ингибиторов, включая фитат, [36] полифенолы, [37], кальций и белки, содержащиеся в молочных продуктах [38], и увеличит абсорбцию как нативного, так и обогащенного железа. Во фруктах и овощах усиливающий эффект аскорбиновой кислоты часто нивелируется ингибирующим действием полифенолов.[39] Аскорбиновая кислота является единственным усилителем всасывания в вегетарианских диетах, а всасывание железа из вегетарианских и веганских блюд можно оптимизировать путем включения овощей, содержащих аскорбиновую кислоту. [40] Варка, промышленная переработка и хранение разлагают аскорбиновую кислоту и устраняют ее усиливающий эффект на усвоение железа. [41]
Таблица 1
Факторы, которые могут влиять на всасывание железа
Было показано усиливающее действие мяса, рыбы или птицы на всасывание железа из вегетарианских блюд [42], и 30 г мышечной ткани считается эквивалентом 25 мг аскорбиновой кислоты. .[33] Бьорн-Расмуссен и Халлберг [43] сообщили, что добавление курицы, говядины или рыбы к кукурузной муке увеличивало всасывание негемового железа в 2-3 раза без влияния того же количества белка, что и яичного альбумина. Как и в случае с аскорбиновой кислотой, было несколько сложнее продемонстрировать усиливающий эффект мяса при многократном приёме пищи и в полных исследованиях диеты. Редди и др. ., [44] сообщили только о незначительном улучшении всасывания железа (35%) в самостоятельно выбранных диетах в течение 5 дней, когда ежедневное потребление мышечной ткани было увеличено до 300 г / день, хотя в аналогичных 5-дневных рационах. В ходе дневного исследования 60 г свинины, добавленные к вегетарианской диете, увеличили всасывание железа на 50%.[45]
Факторы, ингибирующие абсорбцию железа
В растительной диете фитат (мио-инозитол гексакисфосфат) является основным ингибитором абсорбции железа. [23] Было показано, что отрицательное влияние фитата на абсорбцию железа зависит от дозы и начинается с очень низких концентраций 2-10 мг / прием пищи. [37,46] Молярное отношение фитата к железу может быть использовано для оценки влияния на абсорбцию. . Соотношение должно составлять 1: 1 или предпочтительно 0,4: 1 для значительного улучшения всасывания железа в простых злаковых или бобовых блюдах, которые не содержат каких-либо усилителей усвоения железа, или 6: 1 в комбинированных блюдах с некоторыми овощами, содержащими аскорбиновую кислоту. кислота и мясо как усилители.[47]
Полифенолы содержатся в различных количествах в растительной пище и напитках, таких как овощи, фрукты, некоторые злаки и бобовые, чай, кофе и вино. Ингибирующее действие полифенолов на абсорбцию железа было показано с черным чаем и, в меньшей степени, с травяными чаями. [48,49] В зерновых и бобовых культурах полифенолы усиливают ингибирующий эффект фитата, как было показано в исследовании, сравнивающем сорго с высоким и низким содержанием полифенолов. [23]
Было показано, что кальций отрицательно влияет на абсорбцию негемового и гемового железа, что отличает его от других ингибиторов, влияющих только на абсорбцию негемового железа.[50] Дозозависимые ингибирующие эффекты были показаны при дозах 75-300 мг, когда кальций добавлялся в булочки, и при дозах 165 мг кальция из молочных продуктов. [51] Предполагается, что исследования однократного приема пищи показывают отрицательное влияние кальция на абсорбцию железа, тогда как исследования многократного приема пищи с большим разнообразием продуктов и различными концентрациями других ингибиторов и усилителей показывают, что кальций лишь ограниченно влияет на абсорбцию железа. [52]
Было показано, что животные белки, такие как молочные белки, яичные белки и альбумин, ингибируют абсорбцию железа.[53] Было показано, что две основные белковые фракции коровьего молока, казеин и сыворотка, а также яичный белок ингибируют абсорбцию железа у человека. [54] Белки сои также снижают всасывание железа. [55]
Конкуренция с железом
Исследования конкуренции показывают, что некоторые другие тяжелые металлы могут участвовать в пути всасывания железа в кишечнике. К ним относятся свинец, марганец, кобальт и цинк. Поскольку дефицит железа часто сочетается с интоксикацией свинцом, это взаимодействие может вызвать особенно серьезные медицинские осложнения у детей.[56]
Свинец является особенно опасным элементом для метаболизма железа. [57] Свинец поглощается механизмом поглощения железа (DTM1) и вторично блокирует железо за счет конкурентного торможения. Кроме того, свинец препятствует ряду важных железозависимых метаболических этапов, таких как биосинтез гема. Это многогранное влияние имеет особенно тяжелые последствия для детей, поскольку свинец не только вызывает анемию, но и может ухудшить когнитивное развитие. Свинец естественным образом присутствует в больших количествах в грунтовых водах и почве в некоторых регионах и может тайно нанести вред здоровью детей.По этой причине большинство педиатров в США обычно проверяют содержание свинца в раннем возрасте с помощью простого анализа крови.
ТРЕБОВАНИЯ К ЧЕЛОВЕКУ
В раннем детстве потребности в железе удовлетворяются за счет небольшого количества железа, содержащегося в грудном молоке. [58] Потребность в железе заметно возрастает через 4-6 месяцев после рождения и составляет около 0,7-0,9 мг / день в течение оставшейся части первого года [58]. В возрасте от 1 до 6 лет содержание железа в организме снова увеличивается вдвое. [58] Потребность в железе также очень высока у подростков, особенно в период скачка роста.У девочек обычно происходит скачок роста до менархе, но к этому времени рост не заканчивается. У мальчиков наблюдается заметное увеличение массы и концентрации гемоглобина в период полового созревания. На этой стадии потребности в железе повышаются до уровня, превышающего средние потребности в железе у менструирующих женщин [58] [см.].
Таблица 2
Потребность в железе 97,5% людей с точки зрения абсорбированного железа a , по возрастным группам и полу (Всемирная организация здравоохранения, 1989 г.) ее тело.Точный баланс между потреблением и потерей пищи поддерживает этот баланс. Около 1 мг железа теряется каждый день из-за отшелушивания клеток кожи и слизистых оболочек, включая слизистую оболочку желудочно-кишечного тракта. [59] Менструация увеличивает среднесуточную потерю железа примерно до 2 мг в день у взрослых женщин в пременопаузе. [60] Увеличение массы тела во время скачков роста в неонатальном и детском возрасте временно увеличивает потребность в железе. [61]
Потребление железа с пищей необходимо для восполнения потери железа с калом и мочой, а также через кожу.Эти базальные потери составляют примерно 0,9 мг железа для взрослого мужчины и 0,8 мг для взрослой женщины. [62] У женщин репродуктивного возраста необходимо учитывать потерю железа с менструальной кровью [].
ГРУППЫ ПОВЫШЕННОГО РИСКА
Наибольшая вероятность дефицита железа обнаруживается в тех частях населения, которые не имеют надлежащего доступа к пище, богатой усвояемым железом, во время стадий высокой потребности в железе. Эти группы соответствуют детям, подросткам и женщинам репродуктивного возраста, особенно во время беременности.[63,58]
У младенцев и подростков повышенная потребность в железе является результатом быстрого роста. Для женщин репродуктивного возраста основная причина — чрезмерная кровопотеря во время менструации. Во время беременности потребность в железе значительно возрастает из-за быстрого роста плаценты и плода, а также увеличения глобулярной массы. [63] Напротив, взрослые мужчины и женщины в постменопаузе имеют низкий риск дефицита железа, и количество железа в нормальном рационе обычно достаточно для удовлетворения их физиологических потребностей.[63]
ПОСЛЕДСТВИЯ И ПРИЧИНЫ ДЕФИЦИТА ЖЕЛЕЗА
Последствия дефицита железа
Дефицит железа определяется как состояние, при котором отсутствуют мобилизуемые запасы железа и при котором появляются признаки нарушения поступления железа в ткани, включая эритрон. , отмечены. [64] Дефицит железа может сопровождаться анемией или без нее. Некоторые функциональные изменения могут произойти и в отсутствие анемии, но наиболее функциональные нарушения, по-видимому, возникают при развитии анемии. [2] Даже легкие и умеренные формы железодефицитной анемии могут быть связаны с функциональными нарушениями, влияющими на когнитивное развитие [65], механизмы иммунитета [66] и работоспособность.[67] Дефицит железа во время беременности связан с множеством неблагоприятных исходов как для матери, так и для ребенка, включая повышенный риск сепсиса, материнской смертности, перинатальной смертности и низкой массы тела при рождении. [68] Дефицит железа и анемия также снижают способность к обучению и связаны с повышенным уровнем заболеваемости. [68]
Причины дефицита железа
Дефицит железа возникает в результате истощения запасов железа и возникает, когда абсорбция железа не может идти в ногу с метаболическими потребностями в железе для поддержания роста и восполнения потери железа, что в первую очередь связано с кровопотерей .[2] Основные причины дефицита железа включают низкое потребление биодоступного железа, повышенную потребность в железе в результате быстрого роста, беременности, менструации и избыточную кровопотерю, вызванную патологическими инфекциями, такими как анкилостомы и власоглавы, вызывающие потерю крови из желудочно-кишечного тракта [2] 69,70,71,72] и нарушение всасывания железа. [73] Частота дефицита железа увеличивается у девочек-подростков, потому что менструальные потери железа накладываются на потребность в быстром росте [74]. Другими факторами риска дефицита железа у молодых женщин являются высокий паритет, использование внутриматочной спирали и вегетарианская диета.[75]
Дефицит железа в питании возникает, когда физиологические потребности не могут быть удовлетворены за счет абсорбции железа из рациона. [72] Биодоступность пищевого железа низка в группах населения, потребляющих однообразные растительные диеты с небольшим количеством мяса. [72] Во многих развивающихся странах растительные продукты для отлучения от груди редко обогащаются железом, а частота анемии превышает 50% у детей младше 4 лет. [64]
Когда запасы железа истощаются и железа недостаточно для эритропоэза, синтез гемоглобина в предшественниках эритроцитов нарушается и появляются гематологические признаки железодефицитной анемии.
ОЦЕНКА СТАТУСА ЖЕЛЕЗА
Дефицит железа и, в конечном итоге, анемия развиваются поэтапно и могут быть оценены путем измерения различных биохимических показателей. Хотя некоторые ферменты железа чувствительны к дефициту железа [63], их активность не использовалась в качестве успешного рутинного измерения статуса железа [2].
Лабораторные измерения необходимы для правильной диагностики дефицита железа. Они наиболее информативны, когда несколько показателей уровня железа исследуются и оцениваются в контексте питания и истории болезни.
Пул железа в плазме или сыворотке — это фракция всего железа в организме, которая циркулирует в основном связанном с трансферрином. Три способа оценки уровня железа в плазме или сыворотке включают: 1) измерение общего содержания железа в единице объема в мкг / дл; 2) измерение общего количества сайтов связывания для атомов железа на трансферрине, известного как общая железосвязывающая способность в мкг / дл 2 ; и 3) оценка процента двух сайтов связывания на всех занятых молекулах трансферрина, называемого процентным насыщением трансферрина.[76] Однако заметные биологические вариации этих значений могут возникать в результате суточных колебаний, наличия инфекции или воспалительных состояний и недавнего потребления железа с пищей. [76]
Протопорфирин цинка отражает нехватку железа на последних стадиях синтеза гемоглобина, так что цинк вставляется в молекулу протопорфирина вместо железа. Протопорфирин цинка может быть обнаружен в эритроцитах с помощью флуориметрии и является мерой тяжести дефицита железа. [76]
Сывороточный ферритин является хорошим индикатором запасов железа в организме в большинстве случаев.Когда концентрация сывороточного ферритина ≥15 мкг / л, присутствуют запасы железа; более высокие концентрации отражают размер хранилища железа; при низкой концентрации (<12 мкг / л для детей младше 5 лет и <15 мкг / л для детей старше 5 лет) запасы железа истощаются. [76] Однако ферритин является белком-реагентом острой фазы, и его сывороточные концентрации могут быть повышены независимо от изменения запасов железа, инфекции или воспаления. [76,2] Это означает, что может быть трудно интерпретировать концентрацию ферритина там, где инфекция болезни распространены.
Еще одним индикатором статуса железа является концентрация TfR в сыворотке крови. Поскольку TfR в основном происходит из развивающихся эритроцитов, он отражает интенсивность эритропоэза и потребность в железе. Когда запасы железа истощаются, концентрация повышается при железодефицитной анемии, что указывает на серьезную недостаточность железа. Это при условии, что нет других причин аномального эритропоэза. [76] Клинические исследования показывают, что сывороточный TfR менее подвержен воспалению, чем сывороточный ферритин. [77] Основным преимуществом TfR как индикатора является возможность оценки величины функционального дефицита железа после истощения запасов железа.[78]
Отношение TfR к ферритину (TfR / ферритин) было разработано для оценки изменений как в хранящемся железе, так и в функциональном железе и считается более полезным, чем TfR или только ферритин. [79] TfR / ферритин использовался для оценки запасов железа в организме как у детей, так и у взрослых. [80] Однако высокая стоимость и отсутствие стандартизации анализа TfR до сих пор ограничивают применимость метода [81].
Низкая концентрация гемоглобина является показателем анемии, конечной стадии дефицита железа.[76,2]
АНЕМИЯ И ЕЕ ПРИЧИНЫ
Анемия описывает состояние, при котором количество эритроцитов в крови низкое или в клетках крови содержится меньше нормального гемоглобина. Человека, страдающего анемией, называют анемичным. Целью эритроцитов является доставка кислорода из легких в другие части тела. Молекула гемоглобина является функциональной единицей эритроцитов и представляет собой сложную белковую структуру, которая находится внутри эритроцитов. Несмотря на то, что эритроциты производятся в костном мозге, в их производство вовлечены многие другие факторы.Например, железо — очень важный компонент молекулы гемоглобина; эритропоэтин, молекула, секретируемая почками, способствует образованию эритроцитов в костном мозге.
Наличие правильного количества эритроцитов и профилактика анемии требует взаимодействия между почками, костным мозгом и питательными веществами в организме. Если почки или костный мозг не функционируют, или организм плохо питается, то нормальное количество и функции эритроцитов может быть трудно поддерживать.
Анемия на самом деле является признаком болезненного процесса, а не самой болезни.Обычно его классифицируют как хронический или острый. Хроническая анемия возникает в течение длительного периода времени. Острая анемия возникает быстро. Определение того, присутствует ли анемия в течение длительного времени или это что-то новое, помогает врачам найти причину. Это также помогает предсказать, насколько серьезными могут быть симптомы анемии. При хронической анемии симптомы обычно начинаются медленно и постепенно прогрессируют; тогда как при острой анемии симптомы могут быть резкими и более тревожными.
Эритроциты живут около 100 дней, поэтому организм постоянно пытается их заменить.У взрослых производство эритроцитов происходит в костном мозге. Врачи пытаются определить, вызвано ли низкое количество эритроцитов повышенной кровопотерей эритроцитов или их снижением в костном мозге. Знание того, изменилось ли количество лейкоцитов и / или тромбоцитов, также помогает определить причину анемии.
По оценкам Всемирной организации здравоохранения (ВОЗ), два миллиарда человек во всем мире страдают анемией и примерно 50% всех анемий объясняются дефицитом железа. [64] Это происходит на всех этапах жизненного цикла, но чаще встречается у беременных женщин и маленьких детей.[82] Анемия является результатом множества причин, которые можно изолировать, но чаще всего они сосуществуют. Некоторые из этих причин включают следующие:
Железодефицитная анемия
Наиболее важной и частой причиной анемии является дефицит железа. [82] Если потребление железа ограничено или неадекватно из-за плохого питания, в результате может возникнуть анемия. Это называется железодефицитной анемией. Железодефицитная анемия также может возникать при наличии язвы желудка или других источников медленного хронического кровотечения (рак толстой кишки, рак матки, полипы кишечника, геморрой и т. Д.).[83]
Анемия хронического заболевания
Любое длительное заболевание может привести к анемии. Этот тип анемии является вторым по распространенности после анемии, вызванной дефицитом железа, и развивается у пациентов с острым или хроническим системным заболеванием или воспалением. [84] Это состояние было названо «анемией воспаления» из-за повышенного содержания гепсидина, который блокирует как рециркуляцию железа из макрофагов, так и абсорбцию железа. [85]
Анемия из-за активного кровотечения
Потеря крови из-за обильного менструального кровотечения или ран может вызвать анемию.[82] Язвы желудочно-кишечного тракта или раковые заболевания, такие как рак толстой кишки, могут медленно терять кровь и также могут вызывать анемию. [86,87]
Анемия, связанная с заболеванием почек
Почки выделяют гормон эритропоэтин, который помогает костному мозгу сделать эритроциты. У людей с хроническим (длительным) заболеванием почек выработка этого гормона снижена, а это, в свою очередь, снижает выработку эритроцитов, вызывая анемию. [88] Хотя дефицит эритропоэтина является основной причиной анемии при хронической почечной недостаточности, это не единственная причина.Следовательно, необходимо минимальное обследование, чтобы исключить дефицит железа и другие аномалии клеточной линии. [89]
Анемия, связанная с беременностью
Увеличение объема плазмы во время беременности приводит к разбавлению эритроцитов и может проявляться как анемия. [90] Железодефицитная анемия составляет 75% всех анемий во время беременности. [90]
Анемия, связанная с плохим питанием
Витамины и минералы необходимы для образования эритроцитов. Помимо железа, для правильного производства гемоглобина необходимы витамин B12, виамин А, фолиевая кислота, рибофлавин и медь.[82] Дефицит любого из этих питательных микроэлементов может вызвать анемию из-за недостаточного производства эритроцитов. Плохое питание — важная причина низкого уровня витаминов и, как следствие, анемии.
Ожирение и анемия
Ожирение характеризуется хроническим слабым системным воспалением, повышенным уровнем гепсидина, что, в свою очередь, связано с анемией хронического заболевания. Ausk и Ioannou [91] предположили, что ожирение может быть связано с особенностями анемии хронического заболевания, включая низкую концентрацию гемоглобина, низкое содержание железа и трансферрина в сыворотке, а также повышенный уровень ферритина в сыворотке.Избыточный вес и ожирение были связаны с изменениями сывороточного железа, насыщения трансферрина и ферритина, которые, как ожидается, произойдут в условиях хронического системного воспаления. Воспаление, связанное с ожирением, может повышать концентрацию гепсидина и снижать доступность железа. Aeberli и др. , [92] сравнили уровень железа, потребление железа с пищей и его биодоступность, а также циркулирующие уровни гепсидина, лептина и интерлейкина-6 (ИЛ-6) у детей с избыточной массой тела и детей с нормальным весом.Они указали, что имеется пониженная доступность железа для эритропоэза у детей с избыточным весом и что это, вероятно, связано с опосредованным гепсидином сниженным всасыванием железа и / или повышенным секвестрацией железа, а не с низким содержанием железа с пищей.
Алкоголизм
Алкоголь оказывает многочисленные неблагоприятные эффекты на различные типы клеток крови и их функции. [93] У алкоголиков часто есть дефектные эритроциты, которые преждевременно разрушаются. [93,94] Сам по себе алкоголь также может быть токсичным для костного мозга и может замедлять производство эритроцитов.[93,94] Кроме того, с алкоголизмом связаны плохое питание и дефицит витаминов и минералов. [95] Сочетание этих факторов может привести к анемии у алкоголиков.
Серповидно-клеточная анемия
Серповидно-клеточная анемия — одно из наиболее распространенных наследственных заболеваний. [96] Это заболевание, связанное с кровью, которое влияет на молекулу гемоглобина и приводит к изменению формы всей клетки крови в стрессовых условиях [97]. В таком состоянии проблема с гемоглобином бывает качественной или функциональной.Аномальные молекулы гемоглобина могут вызвать проблемы в целостности структуры эритроцитов, и они могут стать серповидными (серповидные клетки). [97] Существуют разные типы серповидно-клеточной анемии разной степени тяжести. Это особенно распространено у африканцев, ближневосточных и средиземноморских предков. [97]
Талассемия
Это еще одна группа причин анемии, связанных с гемоглобином, которая связана с отсутствием или ошибками в генах, ответственных за выработку гемоглобина. [97] Молекула гемоглобина имеет субъединицы, обычно называемые альфа- и бета-цепями глобина.Отсутствие определенной субъединицы определяет тип альфа- или бета-талассемии. [97,98] Существует много типов талассемии, которые различаются по степени тяжести от легкой (малая талассемия) до тяжелой (большая талассемия). [98] Они также являются наследственными, но вызывают количественные аномалии гемоглобина, то есть вырабатывается недостаточное количество молекул правильного типа. Альфа- и бета-талассемии являются наиболее распространенными наследственными моногенными заболеваниями в мире с наибольшей распространенностью в регионах, где малярия была или все еще является эндемической.[97]
Апластическая анемия
Апластическая анемия — это заболевание, при котором разрушается костный мозг и снижается выработка клеток крови. [99] Это вызывает дефицит всех трех типов клеток крови (панцитопения), включая эритроциты (анемия), лейкоциты (лейкопения) и тромбоциты (тромбоцитопения). [100,101] Многие распространенные лекарства могут иногда вызывать этот тип анемии в качестве побочного эффекта. у некоторых людей. [99]
Гемолитическая анемия
Гемолитическая анемия — это тип анемии, при которой происходит разрыв эритроцитов, известный как гемолиз, который разрушается быстрее, чем костный мозг может их заменить.[102] Гемолитическая анемия может возникнуть по разным причинам и часто классифицируется как приобретенная или наследственная. Распространенными приобретенными причинами гемолитической анемии являются аутоиммунитет, микроангиопатия и инфекции. Нарушения ферментов эритроцитов, мембран и гемоглобина вызывают наследственную гемолитическую анемию. [102]
ПРЕДОТВРАЩЕНИЕ НЕДОСТАТОЧНОСТИ ЖЕЛЕЗА (СТРАТЕГИИ ВМЕШАТЕЛЬСТВА)
Четыре основных стратегии коррекции эффективности микронутриентов в популяциях могут использоваться для коррекции дефицита железа, как по отдельности, так и в комбинации.Это обучение в сочетании с модификацией диеты для улучшения потребления железа и его биодоступности; добавление железа (обеспечение железом, обычно в более высоких дозах, без еды), обогащение пищевых продуктов железом и новый подход к биофортификации. Однако есть некоторые трудности в применении некоторых из этих стратегий при рассмотрении железа.
Диверсификация продуктов питания
Модификации диеты для сокращения потребления Индийской стоматологической ассоциации включают увеличение потребления продуктов, богатых железом, особенно мясных продуктов, увеличение потребления фруктов и овощей, богатых аскорбиновой кислотой, для увеличения абсорбции негемового железа и снижение потребления чая и кофе, которые подавляют всасывание негемового железа.[103,58] Другая стратегия — снизить содержание антинутриентов, чтобы сделать железо, поступающее из их пищевых источников, более доступным. Биодоступность железа может быть увеличена такими методами, как проращивание и ферментация, которые способствуют ферментативному гидролизу фитиновой кислоты в цельнозерновых зерновых и бобовых культурах за счет повышения активности эндогенных или экзогенных ферментов фитазы. [104] Даже использование неферментативных методов, таких как термическая обработка, замачивание и измельчение, для снижения содержания фитиновой кислоты в основных продуктах растительного происхождения позволило улучшить биодоступность железа (и цинка).[105,106]
Добавка
Для перорального приема добавок железа предпочтительны соли двухвалентного железа (сульфат двухвалентного железа и глюконат двухвалентного железа) из-за их низкой стоимости и высокой биодоступности. [72] Хотя абсорбция железа выше при приеме добавок железа натощак, тошнота и боль в эпигастрии могут развиться из-за введенных более высоких доз железа (обычно 60 мг Fe / день). Если возникают такие побочные эффекты, следует попытаться снизить дозу между приемами пищи или давать железо во время еды, хотя пища снижает всасывание лекарственного железа примерно на две трети.[107] Добавки железа во время беременности рекомендуется в развивающихся странах, где женщины часто вступают в беременность с низкими запасами железа. [108] Хотя обычно считалось, что польза от приема добавок железа перевешивает предполагаемый риск, есть некоторые свидетельства того, что добавление в дозах, рекомендованных для здоровых детей, несет в себе риск увеличения тяжести инфекционного заболевания на фоне малярии. [109,110]
Обогащение
Обогащение пищевых продуктов железом сложнее, чем обогащение такими питательными веществами, как цинк в муке, йод в соли и витамин А в кулинарном масле.[72] Наиболее биодоступные соединения железа растворимы в воде или разбавленной кислоте, но часто вступают в реакцию с другими пищевыми компонентами, вызывая неприятный запах, изменение цвета или окисление жиров. [103] Таким образом, менее растворимые формы железа, хотя и хуже усваиваются, часто выбираются для обогащения, чтобы избежать нежелательных сенсорных изменений. [72] Обогащение обычно производится с гораздо меньшими дозами железа, чем с добавками. Это ближе к физиологической среде и может быть самым безопасным вмешательством в малярийных областях. [111] Нет никаких опасений по поводу безопасности добавок железа или обогащения железа в немалярийных эндемичных районах.[112]
Соединения железа, рекомендованные [7] для обогащения пищевых продуктов, включают сульфат железа, фумарат железа, пирофосфат железа и порошок электролитического железа. Пшеничная мука является наиболее распространенным пищевым продуктом, обогащенным железом, и обычно она обогащается порошками элементарного железа, которые не рекомендуются ВОЗ. [7,113] Харрелл и Эгли [23] сообщили, что из 78 национальных программ по пшеничной муке только восемь улучшатся. статус железа. В этих программах использовались рекомендуемые соединения железа на рекомендованных уровнях.В других странах использовались не рекомендуемые соединения или более низкие уровни железа по сравнению с потреблением муки. Коммерческое детское питание, такое как смеси и злаки, также обычно обогащено железом.
Биофортификация
Содержание железа колеблется от 25 до 56 мг / кг в различных сортах пшеницы и от 7 до 23 мг / кг в зернах риса. Однако большая часть этого железа удаляется в процессе измельчения. Поглощение железа зерновыми и бобовыми культурами, многие из которых имеют высокое содержание самородного железа, обычно низкое из-за высокого содержания в них фитата, а иногда и полифенолов.[48] Стратегии биофортификации включают селекцию растений и генную инженерию. Уровни железа в обычных бобах и просе были успешно увеличены за счет селекции растений, но использование других основных продуктов питания является более трудным или невозможным (рис) из-за недостаточной естественной генетической изменчивости. Lucca и др. ., [114] увеличили содержание железа в эндосперме риса, чтобы улучшить его всасывание в кишечнике человека с помощью генной инженерии. Они ввели ген ферритина из Phaseolus vulgaris в рисовые зерна, увеличив содержание железа в них вдвое.Для увеличения биодоступности железа они ввели в эндосперм риса термотолерантную фитазу из Aspergillus fumigatus . Они указали, что этот рис с более высоким содержанием железа и богатым фитазой имеет большой потенциал для существенного улучшения питания железом в тех популяциях, где дефицит железа так широко распространен. [114] К сожалению, фитаза не устояла перед приготовлением. Важность различных минералов, таких как цинк [115] и железо, требует большего внимания на индивидуальном уровне и уровне общественного здравоохранения.
Сноски
Источник поддержки: Нет
Конфликт интересов: Не объявлен.
СПИСОК ЛИТЕРАТУРЫ
1. Борода Дж. Л., Доусон HD. Железо. В: О’Делл Б.Л., Сунде Р.А., редакторы. Справочник по незаменимым в питании минеральным элементам. Нью-Йорк: CRC Press; 1997. С. 275–334. [Google Scholar] 2. Вуд Р.Дж., Ронненберг А. Железо. В: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, редакторы. Современное питание в здоровье и болезнях. 10-е изд. Балтимор: Липпинкотт Уильямс и Уилкинс; 2005 г.С. 248–70. [Google Scholar] 3. Макдауэлл LR. 2-е изд. Амстердам: Elsevier Science; 2003. Минералы в питании животных и человека; п. 660. [Google Scholar] 4. Гуггенхайм KY. Хлороз: возникновение и исчезновение болезни, связанной с питанием. J Nutr. 1995; 125: 1822–5. [PubMed] [Google Scholar] 5. Ип Р., Даллман PR. Железо. В: Ziegler EE, Filer LJ, редакторы. Присутствуют знания в области питания. 7-е изд. Вашингтон, округ Колумбия: ILSI Press; 1996. С. 278–92. [Google Scholar] 6. Андервуд Э.Дж., Саттл Н.Ф. 3-е изд. Уоллингфорд: Международное издательство CABI; 1999 г.Минеральное питание скота; п. 614. [Google Scholar] 7. Аллен Л., де Бенуа Б., Дари О., Харрелл Р., редакторы. Женева: ВОЗ и ФАО; 2006. ВОЗ. Рекомендации по обогащению пищевых продуктов микронутриентами; п. 236. [Google Scholar] 8. Брабин Б.Дж., Премжи З., Верхое ff Ф. Анализ анемии и детской смертности. J Nutr. 2001; 131: 636–45С. [PubMed] [Google Scholar] 9. Quintero-Gutiérrez AG, González-Rosendo G, Sánchez-Muñoz J, Polo-Pozo J, Rodríguez-Jerez JJ. Биодоступность гемового железа в начинке для печенья с использованием поросят в качестве модели животных для человека.Int J Biol Sci. 2008; 4: 58–62. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Айзен П., Эннс С., Весслинг-Резник М. Химия и биология метаболизма железа в эукариотах. Int J Biochem Cell Biol. 2001; 33: 940–59. [PubMed] [Google Scholar] 11. Лиу П. Т., Хейскала М., Петерсон П. А., Ян Ю. Роль железа в здоровье и болезнях. Мол Аспекты Мед. 2001; 2: 1–87. [PubMed] [Google Scholar] 12. Guerinot ML. Транспорт микробного железа. Annu Rev Microbiol. 1994; 48: 743–72. [PubMed] [Google Scholar] 13. Асквит К., Каплан Дж.Транспорт железа и меди в дрожжах и его значение для болезней человека. Trends Biochem Sci. 1998. 23: 135–8. [PubMed] [Google Scholar] 15. Вашингтон, округ Колумбия: Национальная академия прессы; 2001. МОМ. Институт медицины. железо. В: Диетические рекомендуемые дозы витамина А, витамина К, мышьяка, бора, хрома, меди, йода, железа, марганца, молибдена, никеля, кремния, ванадия и цинка; С. 290–393. [PubMed] [Google Scholar] 16. Muir A, Hopfer U. Региональная специфичность поглощения железа щеточно-граничными мембранами тонкого кишечника у нормальных мышей и мышей с дефицитом железа.Am J Physiol. 1985; 248: G376–9. [PubMed] [Google Scholar] 17. Фрейзер Д.М., Андерсон Г.Дж. Импорт железа. I. Абсорбция железа в кишечнике и ее регуляция. Am J Physiol Gastrointest Liver Physiol. 2005; 289: G631–5. [PubMed] [Google Scholar] 18. Наддур С.С., Шрирама К., Мудипалли А. Механизмы транспорта и гомеостаза железа: их роль в здоровье и болезнях. Индийский J Med Res. 2008; 128: 533–44. [PubMed] [Google Scholar] 20. Yeh KY, Yeh M, Mims L, Glass J. Кормление железом индуцирует миграцию и взаимодействие ферропортина 1 и гефестина в двенадцатиперстном эпителии крыс.Am J Physiol Gastrointest Liver Physiol. 2009. 296: 55–65. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Тейл Э.С., Чен Х., Миранда С., Янсер Х., Эльзенханс Б., Нуньес М.Т. и др. Абсорбция железа из ферритина не зависит от гемового железа и солей двухвалентного железа у женщин и сегментов кишечника крыс. J Nutr. 2012; 142: 478–83. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Hoppler M, Schoenbaechler A, Meile L, Hurrell RF, Walczyk T. Ферритин-железо высвобождается во время кипячения и in vitro при пищеварении в желудке .J Nutr. 2008. 138: 878–84. [PubMed] [Google Scholar] 23. Hurrell R, Egli I. Биодоступность железа и диетические контрольные значения. Am J Clin Nutr. 2010; 91: 1461–7S. [PubMed] [Google Scholar] 25. Немет Э., Ганц Т. Регулирование метаболизма железа гепсидином. Annu Rev Nutr. 2006; 26: 323–42. [PubMed] [Google Scholar] 26. Немет Э., Таттл М.С., Пауэлсон Дж., Вон М.Б., Донован А., Уорд Д.М. и др. Гепсидин регулирует отток клеточного железа, связываясь с ферропортином и индуцируя его интернализацию. Наука. 2004; 306: 2090–3.[PubMed] [Google Scholar] 28. Браун В., Киллманн Х. Бактериальные решения проблемы снабжения железом. Trends Biochem Sci. 1999; 24: 104–109. [PubMed] [Google Scholar] 29. Хант-младший. Насколько важна биодоступность железа с пищей? Am J Clin Nutr. 2001; 73: 3–4. [PubMed] [Google Scholar] 30. Хант-младший, Зито, Калифорния, Джонсон, Лос-Анджелес. Выведение железа из организма здоровыми мужчинами и женщинами. Am J Clin Nutr. 2009; 89: 1–7. [PubMed] [Google Scholar] 31. Фэрбенкс В.Ф. Железо в медицине и питании. В: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, редакторы.Современное питание в здоровье и болезнях. 10-е изд. Балтимор: Липпинкотт Уильямс и Уилкинс; 1999. С. 193–221. [Google Scholar] 32. потребности человека в витаминах и минералах. Рим: ФАО; 2001. ФАО / ВОЗ. Пищевые подходы к удовлетворению потребностей в витаминах и минералах; С. 7–25. [Google Scholar] 33. Monsen ER, Hallberg L, Layrisse M, Hegsted DM, Cook JD, Mertz W. и др. Оценка доступного пищевого железа. Am J Clin Nutr. 1978; 31: 134–41. [PubMed] [Google Scholar] 34. Конрад ME, Umbreit JN. Краткий обзор: абсорбция железа — путь муцин-мобилферрин-интегрин.Конкурентоспособный путь поглощения металлов. Am J Hematol. 1993; 42: 67–73. [PubMed] [Google Scholar] 35. Конрад М.Э., Шаде С.Г. Хелаты аскорбиновой кислоты в абсорбции железа: роль соляной кислоты и желчи. Гастроэнтерология. 1968; 55: 35–45. [PubMed] [Google Scholar] 36. Холлберг Л., Брюн М., Россандер Л. Поглощение железа у человека: аскорбиновая кислота и дозозависимое ингибирование фитатом. Am J Clin Nutr. 1989; 49: 140–4. [PubMed] [Google Scholar] 37. Зигенберг Д., Бейнс Р.Д., Ботвелл Т.Х., Макфарлейн Б.Дж., Лампарелли Р.Д., Car NG и др.Аскорбиновая кислота предотвращает дозозависимое ингибирующее действие полифенолов и фитатов на абсорбцию негемового железа. Am J Clin Nutr. 1991; 53: 537–41. [PubMed] [Google Scholar] 38. Стекель А., Оливарес М., Писарро Ф., Чадуд П., Лопес И., Амар М. Поглощение обогащающего железа из молочных смесей у младенцев. Am J Clin Nutr. 1986; 43: 917–22. [PubMed] [Google Scholar] 39. Бюллетень D, Бейнс Р.Д., Ботвелл Т.Х., Гиллули М., Макфарлейн Б.Дж., Макфейл А.П. и др. Влияние фруктовых соков и фруктов на усвоение железа из рисовой муки.Br J Nutr. 1987. 57: 331–43. [PubMed] [Google Scholar] 40. Линч SR, Кук JD. Взаимодействие витамина С и железа. Ann N Y Acad Sci. 1980; 355: 32–44. [PubMed] [Google Scholar] 41. Teucher B, Olivares M, Cori H. Усилители поглощения железа: аскорбиновая кислота и другие органические кислоты. Int J Vitam Nutr Res. 2004; 74: 403–19. [PubMed] [Google Scholar] 42. Линч С.Р., Харрелл Р.Ф., Дассенко С.А., Кук Дж.Д. Влияние пищевых белков на биодоступность железа у человека. Adv Exp Med Biol. 1989; 249: 117–32. [PubMed] [Google Scholar] 43.Бьорн-Расмуссен Э., Халльберг Л. Влияние животных белков на усвоение пищевого железа человеком. Нутр Метаб. 1979; 23: 192–202. [PubMed] [Google Scholar] 44. Редди МБ, Харрелл Р.Ф., Кук Дж.Д. Разнообразное питание незначительно влияет на всасывание негемового железа у нормальных людей. J Nutr. 2006; 136: 576–81. [PubMed] [Google Scholar] 45. Бах Кристенсен М., Хелс О, Морберг С., Марвинг Дж., Бугель С., Тетенс I. Свинина увеличивает усвоение железа при 5-дневной полностью контролируемой диете по сравнению с вегетарианской диетой с аналогичным содержанием витамина С и фитиновой кислоты.Br J Nutr. 2005. 94: 78–83. [PubMed] [Google Scholar] 46. Харрелл Р.Ф., Джуллерат М.А., Редди М.Б., Линч С.Р., Дассенко С.А., Кук Дж.Д. Соевый белок, фитат и абсорбция железа у человека. Am J Clin Nutr. 1992; 56: 573–8. [PubMed] [Google Scholar] 47. Hurrell RF. Разложение фитиновой кислоты как средство улучшения усвоения железа. Int J Vitam Nutr Res. 2004. 74: 445–52. [PubMed] [Google Scholar] 48. Харрелл Р.Ф., Редди М., Кук Дж. Д.. Подавление абсорбции негемного железа у человека напитками, содержащими полифенолы. Br J Nutr.1999. 81: 289–95. [PubMed] [Google Scholar] 49. Холлберг Л., Россандер Л. Влияние различных напитков на усвоение негемового железа из сложных блюд. Hum Nutr Appl Nutr. 1982; 36: 116–23. [PubMed] [Google Scholar] 50. Hallberg L, Rossander-Hulthen L, Brune M, Gleerup A. Ингибирование усвоения гемового железа у человека кальцием. Br J Nutr. 1993; 69: 533–40. [PubMed] [Google Scholar] 51. Hallberg L, Rossander-Hulthen L. Потребность в железе у менструирующих женщин. Am J Clin Nutr. 1991; 54: 1047–58. [PubMed] [Google Scholar] 52.Линч SR. Влияние кальция на усвоение железа. Nutr Res Rev.2000; 13: 141–58. [PubMed] [Google Scholar] 53. Повар JD, Monsen ER. Поглощение пищевого железа у людей. III. Сравнение влияния животных белков на всасывание негемового железа. Am J Clin Nutr. 1976; 29: 859–67. [PubMed] [Google Scholar] 54. Харрелл РФ, Линч С.Р., Тринидад Т.П., Дассенко С.А., Кук Дж.Д. Абсорбция железа у людей: бычий сывороточный альбумин по сравнению с говяжьими мышцами и яичным белком. Am J Clin Nutr. 1988; 47: 102–7. [PubMed] [Google Scholar] 55.Линч С.Р., Дассенко С.А., Кук Дж.Д., Джульерат М.А., Харрелл РФ. Ингибирующий эффект фрагмента, связанного с соевым белком, на абсорбцию железа у людей. Am J Clin Nutr. 1994; 60: 567–72. [PubMed] [Google Scholar] 56. Piomelli S, Seaman C, Kapoor S. Вызванные свинцом аномалии метаболизма порфирина, связь с дефицитом железа. Ann N Y Acad Sci. 1987; 514: 278–88. [PubMed] [Google Scholar] 58. 2-е изд. Бангкок: 2004 г. ФАО / ВОЗ. Консультации экспертов по потребностям человека в витаминах и минералах, потребностях в витаминах и минералах в питании человека: отчет совместного экспертного заключения ФАО / ВОЗ; п.341. [Google Scholar] 59. Cook JD, Skikne BS, Lynch SR, Reusser ME. Оценки достаточности железа у населения США. Кровь. 1986; 68: 726–31. [PubMed] [Google Scholar] 60. Ботвелл TH, Чарльтон RW. Общий подход к проблемам железодефицита и перегрузки железом у населения в целом. Semin Hematol. 1982; 19: 54–67. [PubMed] [Google Scholar] 61. Гибсон Р.С., Макдональд А.С., Смит-Вандеркой П.Д. Параметры сывороточного ферритина и пищевого железа в выборке канадских детей дошкольного возраста. J Can Dietetic Assoc.1988; 49: 23–8. [Google Scholar] 62. ДеМайер Э.М., Даллман П., Герни Дж. М., Холлберг Л., Суд С. К., Срикантия С. Г., редакторы. Женева: Всемирная организация здравоохранения; 1989. ВОЗ. Профилактика и контроль железодефицитной анемии с помощью первичной медико-санитарной помощи: руководство для администраторов здравоохранения и руководителей программ; п. 58. [Google Scholar] 63. Даллман П. Айрон. В: Браун М.Л., редактор. Настоящие знания в области питания. 6-е изд. Вашингтон, округ Колумбия: Фонд питания; 1990. С. 241–50. [Google Scholar] 64. Женева: Швейцария: Всемирная организация здравоохранения; 2001 г.ВОЗ / ЮНИСЕФ / УООН. Оценка, профилактика и контроль железодефицитной анемии; п. 114. [Google Scholar] 65. Борода Дж. Л., Коннор Дж. Р. Статус железа и нейронное функционирование. Annu Rev Nutr. 2003. 23: 41–58. [PubMed] [Google Scholar] 66. Failla ML. Микроэлементы и защита хозяина: последние достижения и сохраняющиеся проблемы. J Nutr. 2003; 133: S1443–7. [PubMed] [Google Scholar] 67. Витери Ф.Е., Торунь Б. Анемия и физическая работоспособность. В: Гарби Л., редактор. Клиники гематологии. Vol. 3. Лондон: У. Б. Сондерс; 1974. стр.609–26. [Google Scholar] 68. CDC. Табель успеваемости по грудному вскармливанию, США: показатели результатов (публикация из Центров по контролю и профилактике заболеваний, Национальное обследование иммунизации. 2010 г. [последний доступ 11 мая 2010 г.]. Http://www.cdc.gov/breastfeeding/data/index .htm .69. Купер Е.С., Банди Д.А. Трихоцефалопатия. Ballieres Clin Trop Med Commun Dis. 1987; 2: 629–43. [Google Scholar] 70. Всемирная организация здравоохранения, Женева; 1995. ВОЗ. Отчет неофициальной консультации ВОЗ. на анкилостомоз и анемию у девочек и женщин; с.46. [Google Scholar] 71. Crompton DW, Nesheim MC. Пищевая ценность кишечных гельминтозов в течение жизненного цикла человека. Annu Rev Nutr. 2002; 22: 35–99. [PubMed] [Google Scholar] 72. Ларок Р., Касапиа М., Готуццо Е., Дьеркос Т.В. Взаимосвязь между интенсивностью заражения гельминтами, передающимися через почву, и анемией во время беременности. Am J Trop Med Hyg. 2005; 73: 783–9. [PubMed] [Google Scholar] 73. Циммерманн МБ, Харрелл РФ. Недостаток пищевого железа. Ланцет. 2007; 370: 115–20. [Google Scholar] 74. Харви LJ, Armah CN, Dainty JR, Foxall RJ, John Lewis D, Langford NJ и др.Влияние менструальной кровопотери и диеты на дефицит железа у женщин в Великобритании. Br J Nutr. 2005. 94: 557–64. [PubMed] [Google Scholar] 75. Борода JL. Потребность в железе у девочек-подростков. Симпозиум: Повышение уровня железа у подростков до деторождения. J Nutr. 2000; 130: S440–2. [PubMed] [Google Scholar] 77. Бегин Ю. Растворимый рецептор трансферрина для оценки эритропоэза и статуса железа. Clinica Chimica Acta. 2003. 329: 9–22. [PubMed] [Google Scholar] 79. Повар JD, Flowers CH, Skikne BS. Количественная оценка bodyiron.Кровь. 2003. 101: 3359–64. [PubMed] [Google Scholar] 80. Кук JD, Boy E, Flowers C, Daroca Mdel C. Влияние высокогорной жизни на железо тела. Кровь. 2005; 106: 1441–6. [PubMed] [Google Scholar] 81. Ян З., Дьюи К.Г., Лоннердал Б., Хернелл О., Чапарро С., Аду-Афарвуа С. и др. Сравнение концентрации ферритина в плазме с соотношением рецептора трансферрина в плазме к ферритину для оценки запасов железа в организме: результаты 4 интервенционных испытаний. Am J Clin Nutr. 2008; 87: 1892–8. [PubMed] [Google Scholar] 82.Де Бенуа Б., Маклин Э., Эгли И., Когсуэлл М. — редакторы. Женева: Пресса ВОЗ, Всемирная организация здравоохранения; 2008. ВОЗ / CDC. Данные библиотечной каталогизации в публикации. Распространенность анемии в мире, 1993–2005 гг .: глобальная база данных ВОЗ по анемии; п. 40. [Google Scholar] 83. Джонсон-Уимбли Т.Д., Грэм Д.Ю. Диагностика и лечение железодефицитной анемии в 21 веке. Ther Adv Гастроэнтерол. 2011; 4: 177–84. [Бесплатная статья PMC] [PubMed] [Google Scholar] 84. Зарычанский Р., Хьюстон Д.С. Анемия хронического заболевания: вредное заболевание или адаптивная, полезная реакция? Can Med Assoc J.2008; 179: 333–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Weiss G, Goodnough LT. Анемия хронического заболевания. N Engl J Med. 2005; 352: 1011–23. [PubMed] [Google Scholar] 86. 2-е изд. Женева: 2004 г. ВОЗ / CDC. Отчет о совместной технической консультации Всемирной организации здравоохранения / Центров по контролю и профилактике заболеваний по оценке статуса железа на уровне населения; п. 108. [Google Scholar] 87. Knight K, Wade S, Balducci L. Распространенность и исходы анемии при раке: систематический обзор литературы.Am J Med. 2004; 116: 11–26С. [PubMed] [Google Scholar] 88. О’Мара NB. Больные анемией с хроническими заболеваниями почек. Спектр диабета. 2008; 21: 12–9. [Google Scholar] 89. Нурко С. Анемия при хронической болезни почек: причины, диагностика, лечение. Cleve Clin J Med. 2006. 73: 289–97. [PubMed] [Google Scholar] 90. Горовиц К.М., Ингардия С.Дж., Боргида А.Ф. 2013, Анемия при беременности. Clin Lab Med. 2013; 33: 281–91. [PubMed] [Google Scholar] 91. Ауск К.Дж., Иоанну Г.Н. Связано ли ожирение с анемией хронического заболевания? Популяционное исследование.Ожирение. 2008. 16: 2356–61. [PubMed] [Google Scholar] 92. Aeberli I, Hurrell RF, Zimmermann MB. Дети с избыточным весом имеют более высокие концентрации циркулирующего гепсидина и более низкий статус железа, но их потребление железа с пищей и биодоступность сопоставимы с детьми с нормальным весом. Int J Obes. 2009; 33: 1111–7. [PubMed] [Google Scholar] 94. Lewis G, Wise MP, Poynton C, Godkin A. Случай стойкой анемии и злоупотребления алкоголем. Нат Клин Практ Гастроэнтерол Гепатол. 2007; 4: 521–6. [PubMed] [Google Scholar] 95. Lindenbaum J, Роман MJ.Пищевая анемия при алкоголизме. Am J Clin Nutr. 1980; 33: 2727–35. [PubMed] [Google Scholar] 96. Cox SE, L’Esperance V, Makani J, Soka D, Prentice AM, Hill CM и др. Серповидно-клеточная анемия: доступность железа и ночная оксиметрия. J Clin Sleep Med. 2012; 8: 541–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 98. Манси Х.Л., младший, Кэмпбелл Дж. Альфа- и бета-талассемия. Я семейный врач. 2009; 80: 339–44. [PubMed] [Google Scholar] 99. Сегель ГБ, Лихтман М.А. Апластическая анемия: приобретенная и наследственная. В: Каушанский К., Вильямс В.Дж., редакторы.Гематология Вильямса. 8-е изд. Нью-Йорк: McGraw-Hill Medical; 2010. С. 569–90. [Google Scholar] 100. Янг Н.С., Каладо Р.Т., Шейнберг П. Современные концепции патофизиологии и лечения апластической анемии. Кровь. 2006; 108: 2509–19. [Бесплатная статья PMC] [PubMed] [Google Scholar] 101. Шейнберг П., Чен Дж. Апластическая анемия: что мы узнали на моделях на животных и в клинике. Semin Hematol. 2013; 50: 156–64. [PubMed] [Google Scholar] 102. Dhaliwal G, Cornett PA, Tierney LM., Jr Гемолитическая анемия.Я семейный врач. 2004. 69: 2599–606. [PubMed] [Google Scholar] 103. Hurrell RF. Как обеспечить адекватное усвоение железа из продуктов, обогащенных железом. Nutr Rev. 2002; 60: S7–15. [PubMed] [Google Scholar] 104. Повар JD. Диагностика и лечение железодефицитной анемии. Лучшая практика Res Clin Haematol. 2005; 18: 319–32. [PubMed] [Google Scholar] 105. Schlemmer U, Frølich W, Prieto RM, Grases F. Фитат в пищевых продуктах и значение для человека: источники пищи, потребление, обработка, биодоступность, защитная роль и анализ.Mol Nutr Food Res. 2009; 53: S330–75. [PubMed] [Google Scholar] 106. Лян Дж., Хан Б.З., Ноут М.Дж., Хамер Р.Дж. Влияние замачивания, прорастания и ферментации на общую фитиновую кислоту и растворимый цинк in vitro в коричневом рисе. Food Chem. 2008; 110: 821–8. [PubMed] [Google Scholar] 107. Кавалли-Сфорца Т., Бергер Дж., Смитасири С., Витери Ф. Еженедельный прием добавок железа и фолиевой кислоты для женщин репродуктивного возраста: обзор воздействия, извлеченные уроки, планы расширения и вклад в достижение целей развития тысячелетия.Nutr Rev.2005; 63: S152–8. [PubMed] [Google Scholar] 109. Oppenheimer SJ. Железо и его отношение к иммунитету и инфекционным заболеваниям. J Nutr. 2001; 131: S616–33. [PubMed] [Google Scholar] 110. Sazawal S, Black RE, Ramsan M, Chwaya HM, Stoltzfus RJ, Dutta A и др. Влияние рутинных профилактических добавок с железом и фолиевой кислотой на госпитализацию и смертность детей дошкольного возраста в условиях высокой передачи малярии: рандомизированное плацебо-контролируемое исследование на уровне общины. Ланцет. 2006; 367: 133–43.[PubMed] [Google Scholar] 112. Hurrell RF. Обогащение железом: его эффективность и безопасность в отношении инфекций. Еда Nutr Bull. 2007. 28: 585–94. [PubMed] [Google Scholar] 114. Лукка П., Харрелл Р., Потрикус И. Борьба с железодефицитной анемией с помощью риса, богатого железом. J Am Coll Nutr. 2002; 21: 184С – 90. [PubMed] [Google Scholar] 115. Рухани Н., Харрелл Р., Келишади Р., Шулин Р. Цинк и его значение для здоровья человека: комплексный обзор. J Res Med Sci. 2013; 18: 144–57. [Бесплатная статья PMC] [PubMed] [Google Scholar]Обзор железа и его значения для здоровья человека
J Res Med Sci.2014 фев; 19 (2): 164–174.
Назанин Аббаспур
Департамент наук о системах окружающей среды, Институт наземных экосистем, Швейцарский федеральный технологический институт, Цюрих, Швейцария
Ричард Харрелл
1 Департамент здравоохранения и технологий, Лаборатория питания человека, Институт пищевых продуктов , Питание и здоровье, Швейцарский федеральный технологический институт, Цюрих, Швейцария
Ройя Келишади
2 Исследовательский центр детского роста и развития, Исфаханский университет медицинских наук, Исфахан, Иран
Департамент науки о системах окружающей среды, Институт наземных исследований Экосистема, Швейцарский федеральный технологический институт, Цюрих, Швейцария
1 Департамент медицинских наук и технологий, Лаборатория питания человека, Институт питания, питания и здоровья Швейцарского федерального технологического института, Цюрих, Швейцария
2 Исследования роста и развития детей Ce nter, Исфаханский университет медицинских наук, Исфахан, Иран
Адрес для корреспонденции: Prof.Роя Келишади, Исследовательский центр детского роста и развития Исфаханский университет медицинских наук, Исфахан, Иран. Эл. Почта: ri.ca.ium.dem@idahsilekПоступила в редакцию 8 июня 2013 г .; Пересмотрено 3 ноября 2013 г .; Принято 27 ноября 2013 г.
Авторские права: © Journal of Research in Medical SciencesЭто статья в открытом доступе, распространяемая в соответствии с условиями Creative Commons Attribution-Noncommercial-Share Alike 3.0 Unported, что разрешает неограниченное использование, распространение и воспроизведение в на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.Abstract
Хорошо известно, что недостаток или чрезмерное воздействие различных элементов оказывает заметное влияние на здоровье человека. Действие элемента определяется несколькими характеристиками, включая абсорбцию, метаболизм и степень взаимодействия с физиологическими процессами. Железо является важным элементом почти для всех живых организмов, поскольку оно участвует в широком спектре метаболических процессов, включая транспорт кислорода, синтез дезоксирибонуклеиновой кислоты (ДНК) и транспорт электронов.Однако, поскольку железо может образовывать свободные радикалы, его концентрацию в тканях организма необходимо строго регулировать, поскольку в чрезмерных количествах оно может привести к повреждению тканей. Нарушения метаболизма железа являются одними из наиболее распространенных заболеваний человека и охватывают широкий спектр заболеваний с различными клиническими проявлениями, от анемии до перегрузки железом и, возможно, до нейродегенеративных заболеваний. В этом обзоре мы обсуждаем последние достижения в исследованиях метаболизма и биодоступности железа, а также наше текущее понимание потребности человека в железе, а также последствий и причин дефицита железа.Наконец, мы обсуждаем стратегии профилактики дефицита железа.
Ключевые слова: Анемия, потребность человека в железе, биодоступность железа, дефицит железа, метаболизм железа
ВВЕДЕНИЕ
С древних времен человек осознавал особую роль железа в здоровье и болезнях. [1] Железо вначале использовалось в медицине египтянами, индуистами, греками и римлянами. [2, 3] В 17 — веках железо использовалось для лечения хлороза (зеленой болезни), состояния, часто возникающего из-за дефицита железа.[4] Однако только в 1932 году важность железа была окончательно установлена убедительным доказательством того, что неорганическое железо необходимо для синтеза гемоглобина. [5] В течение многих лет пищевой интерес к железу был сосредоточен на его роли в образовании гемоглобина и транспорте кислорода. [6] В настоящее время, хотя низкое потребление железа и / или его биодоступность являются причиной большинства анемий в промышленно развитых странах, на них приходится только около половины анемии в развивающихся странах [7], где инфекционные и воспалительные заболевания (особенно малярия), кровопотеря от паразитарных инфекций. , и дефицит других питательных веществ (витамина А, рибофлавина, фолиевой кислоты и витамина B12) также являются важными причинами.[8]
Биохимия и физиология
В отличие от цинка, железо является распространенным элементом на Земле [2,9] и является биологически важным компонентом каждого живого организма. [10,11] Однако, несмотря на его геологическое изобилие, железо часто является фактором, ограничивающим рост в окружающей среде. [9] Этот кажущийся парадокс связан с тем фактом, что при контакте с кислородом железо образует оксиды, которые очень нерастворимы и, следовательно, не доступны для усвоения организмами [2]. В ответ возникли различные клеточные механизмы захвата железа из окружающей среды в биологически полезных формах.Примерами являются сидерофоры, секретируемые микробами для захвата железа в высокоспецифический комплекс [12], или механизмы восстановления железа из нерастворимого трехвалентного железа (Fe +3 ) до растворимой двухвалентной формы (Fe +2 ), как в дрожжах. [13] Многие механизмы, обнаруженные у низших организмов, имеют аналогичные аналоги у высших организмов, включая человека. В организме человека железо в основном существует в сложных формах, связанных с белком (гемопротеином), в виде гемовых соединений (гемоглобин или миоглобин), гемовых ферментов или негемовых соединений (ферменты флавин-железо, переносчики и ферритин).[3] Организму требуется железо для синтеза белков, переносящих кислород, в частности гемоглобина и миоглобина, а также для образования гемовых ферментов и других железосодержащих ферментов, участвующих в переносе электронов и окислении-восстановлении. [14,3] Почти Две трети железа в организме содержится в гемоглобине, присутствующем в циркулирующих эритроцитах, 25% содержится в легко мобилизуемых запасах железа, а оставшиеся 15% связаны с миоглобином в мышечной ткани и с различными ферментами, участвующими в окислительном процессе. метаболизм и многие другие функции клеток.[15]
Железо перерабатывается и, таким образом, сохраняется в организме. показана схематическая диаграмма цикла железа в организме. Железо доставляется к тканям с помощью циркулирующего трансферрина, переносчика, который захватывает железо, высвобождаемое в плазму, в основном из кишечных энтероцитов или ретикулоэндотелиальных макрофагов. Связывание нагруженного железом трансферрина с рецептором трансферрина на клеточной поверхности (TfR) 1 приводит к эндоцитозу и поглощению металлического груза. Интернализованное железо транспортируется в митохондрии для синтеза гема или кластеров железо-сера, которые являются неотъемлемой частью нескольких металлопротеинов, а избыток железа накапливается и детоксифицируется в цитозольном ферритине.
Железо связывается и транспортируется в организме через трансферрин и хранится в молекулах ферритина. После всасывания железа не существует физиологического механизма выведения избыточного железа из организма, кроме кровопотери, то есть беременности, менструации или другого кровотечения обычно низкий, но может колебаться от 5% до 35% в зависимости от обстоятельств и типа железа. [3]
Поглощение железа происходит энтероцитами с помощью переносчика двухвалентного металла 1, члена группы переносчиков растворенных веществ мембранных транспортных белков.Это происходит преимущественно в двенадцатиперстной кишке и верхних отделах тощей кишки [16]. Затем он переносится через слизистую двенадцатиперстной кишки в кровь, где транспортируется трансферрином к клеткам или костному мозгу для эритропоэза [производства красных кровяных телец (эритроцитов)]. [14,17,18] Существует механизм обратной связи, который усиливается. всасывание железа у людей с дефицитом железа. Напротив, люди с перегрузкой железом снижают абсорбцию железа через гепсидин. В настоящее время общепринято, что абсорбция железа контролируется ферропортином, который позволяет или не позволяет железу из клетки слизистой оболочки попадать в плазму.
Физическое состояние железа, поступающего в двенадцатиперстную кишку, сильно влияет на его всасывание. При физиологическом pH двухвалентное железо (Fe +2 ) быстро окисляется до нерастворимой трехвалентной формы (Fe +3 ). Желудочная кислота снижает pH в проксимальном отделе двенадцатиперстной кишки, снижая содержание Fe +3 в просвете кишечника за счет редуктазы железа, тем самым обеспечивая последующий транспорт Fe +2 через апикальную мембрану энтероцитов. Это увеличивает растворимость и поглощение трехвалентного железа.Когда продукция желудочного сока нарушена (например, ингибиторами кислотного насоса, такими как лекарство, прилосек), абсорбция железа существенно снижается.
Диетический гем также может транспортироваться через апикальную мембрану по еще неизвестному механизму и впоследствии метаболизироваться в энтероцитах гемоксигеназой 1 (HO-1) с высвобождением (Fe +2 ) [19]. Этот процесс более эффективен, чем абсорбция неорганического железа, и не зависит от рН двенадцатиперстной кишки. Таким образом, на него не влияют такие ингибиторы, как фитат и полифенолы.Следовательно, красное мясо с высоким содержанием гемоглобина является отличным источником железа. Непосредственно интернализованный Fe +2 обрабатывается энтероцитами и в конечном итоге (или нет) экспортируется через базолатеральную мембрану в кровоток через транспортер ферропортин Fe +2 . Ферропортин-опосредованный отток Fe +2 связан с его повторным окислением с Fe +2 , катализируемым мембраносвязанным ферроксидазой гефестином, который физически взаимодействует с ферропортином [20] и, возможно, также его гомологом в плазме церулоплазмином.Экспортируемое железо улавливается трансферрином, который поддерживает Fe +3 в окислительно-восстановительном инертном состоянии и доставляет его в ткани. Общее содержание железа в трансферрине (≈3 мг) соответствует менее 0,1% железа в организме, но оно очень динамично и подвергается более чем 10-кратному ежедневному обороту для поддержания эритропоэза. Пул трансферрина железа пополняется в основном за счет железа, рециркулируемого из неэффективных эритроцитов, и, в меньшей степени, за счет вновь абсорбированного пищевого железа. Старые эритроциты очищаются ретикулоэндотелиальными макрофагами, которые метаболизируют гемоглобин и гем и высвобождают железо в кровоток.По аналогии с кишечными энтероцитами, макрофаги экспортируют Fe +2 из своей плазматической мембраны через ферропортин в процессе, сопряженном с повторным окислением Fe +2 до Fe +3 церулоплазмином с последующей загрузкой Fe +3. на трансферрин. [21]
Theil et al ., [21] недавно сообщили, что существует также независимый механизм абсорбции растительных ферритинов, в основном присутствующих в бобовых. Однако актуальность переносчика ферритина неясна, поскольку большая часть ферритина, по-видимому, разлагается во время обработки и переваривания пищи, тем самым высвобождая неорганическое железо из оболочки ферритина для поглощения по нормальному механизму.[22] Поскольку одна молекула ферритина содержит 1000 или более атомов железа и на нее также не должны влиять ингибиторы абсорбции железа, такой механизм может стать важным источником железа в развивающихся странах, где обычно потребляются бобовые.
Регуляция гомеостаза железа
Поскольку железо требуется для ряда разнообразных клеточных функций, для поддержания гомеостаза железа требуется постоянный баланс между поглощением, транспортом, хранением и использованием железа. [11] Поскольку в организме отсутствует определенный механизм активного выведения железа, баланс железа в основном регулируется в точке абсорбции.[23,24]
Гепсидин — это циркулирующий пептидный гормон, секретируемый печенью, который играет центральную роль в регуляции гомеостаза железа. Это главный регулятор системного гомеостаза железа, координирующий использование и хранение железа с приобретением железа. [25] Этот гормон в основном вырабатывается гепатоцитами и является негативным регулятором поступления железа в плазму []. Гепсидин действует путем связывания с ферропортином, переносчиком железа, присутствующим на клетках двенадцатиперстной кишки, макрофагах и клетках плаценты.Связывание гепсидина вызывает интернализацию и деградацию ферропортина. [26] Потеря ферропортина с поверхности клетки предотвращает попадание железа в плазму []. Снижение поступления железа в плазму приводит к низкому насыщению трансферрина и меньшему количеству железа доставляется в развивающийся эритробласт. Напротив, снижение экспрессии гепсидина приводит к увеличению ферропортина на клеточной поверхности и увеличению абсорбции железа [27] []. У всех видов концентрация железа в биологических жидкостях строго регулируется, чтобы обеспечить необходимое железо и избежать токсичности, поскольку избыток железа может привести к образованию активных форм кислорода.[28] Гомеостаз железа у млекопитающих регулируется на уровне кишечной абсорбции, поскольку для железа не существует экскреторного пути.
Гепсидин-опосредованная регуляция гомеостаза железа. (а) Повышенная экспрессия гепсидина печенью является результатом воспалительных стимулов. Высокий уровень гепсидина в кровотоке приводит к интернализации и деградации ферропортина, экспортера железа. Потеря ферропортина на клеточной поверхности приводит к загрузке железа макрофагами, низким уровням железа в плазме и снижению эритропоэза из-за снижения количества железа, связанного с трансферрином.Снижение эритропоэза приводит к анемии хронического заболевания. (b) Нормальные уровни гепсидина в ответ на потребность в железе регулируют уровень импорта железа в плазму, нормальное насыщение трансферрина и нормальные уровни эритропоэза. (c) Гемохроматоз или перегрузка железом возникает из-за недостаточного уровня гепсидина, вызывая повышенный импорт железа в плазму, высокое насыщение трансферрина и избыточное отложение железа в печени. Источник: Де Доменико, и др. . [27]
Уровни гепсидина в плазме регулируются различными стимулами, включая цитокины, железо в плазме, анемию и гипоксию.Нарушение регуляции экспрессии гепсидина приводит к нарушениям железа. Избыточная экспрессия гепсидина приводит к анемии хронического заболевания, в то время как низкая выработка гепсидина приводит к наследственному гемохроматозу (HFE) с последующим накоплением железа в жизненно важных органах []. Большинство наследственных заболеваний, связанных с железом, возникают в результате недостаточного производства гепсидина по сравнению со степенью накопления железа в тканях. Было показано, что нарушение экспрессии гепсидина является результатом мутаций в любом из 4 различных генов: TfR2, HFE, гемохроматоз типа 2 (HFE2) и антимикробный пептид гепсидина (HAMP).Мутации в HAMP, гене, кодирующем гепсидин, приводят к болезни, связанной с перегрузкой железом, поскольку отсутствие гепсидина обеспечивает постоянное высокое всасывание железа. Роль других генов (TFR2, HFE и HFE2) в регуляции продукции гепсидина не ясна [27].
Хранение
Концентрация ферритина вместе с концентрацией гемосидерина отражает запасы железа в организме. Они хранят железо в нерастворимой форме и присутствуют в основном в печени, селезенке и костном мозге. [2] Большая часть железа связана с широко распространенным и высококонсервативным железосвязывающим белком ферритином.[18] Гемосидерин представляет собой комплекс хранения железа, который с меньшей готовностью выделяет железо для нужд организма. В условиях устойчивого состояния сывороточные концентрации ферритина хорошо коррелируют с общими запасами железа в организме. [29] Таким образом, сывороточный ферритин является наиболее удобным лабораторным тестом для оценки запасов железа.
Экскреция
Помимо потерь железа из-за менструации, другого кровотечения или беременности, железо очень консервативно и нелегко выводится из организма. [30] Существует некоторая обязательная потеря железа из организма в результате физиологического отшелушивания клеток с эпителиальных поверхностей [30], включая кожу, мочеполовые и желудочно-кишечные тракты.[3] Однако, по оценкам, эти потери очень ограничены (≈1 мг / день). [31] Потери железа из-за кровотечения могут быть значительными, а чрезмерная менструальная кровопотеря является наиболее частой причиной дефицита железа у женщин.
БИОЛОГИЧЕСКАЯ ДОСТУПНОСТЬ
Пищевое железо встречается в двух формах: гемовая и негемовая. [23] Основными источниками гемового железа являются гемоглобин и миоглобин из мяса, птицы и рыбы, тогда как негемовое железо получают из злаков, бобовых, бобовых, фруктов и овощей.[32] Гемовое железо обладает высокой биодоступностью (15–35%), и диетические факторы мало влияют на его абсорбцию, тогда как абсорбция негемового железа намного ниже (2–20%) и сильно зависит от присутствия других пищевых компонентов. [23] Напротив, количество негемового железа в рационе во много раз превышает количество гемового железа в большинстве приемов пищи. Таким образом, несмотря на более низкую биодоступность, негемовое железо обычно вносит больший вклад в питание железом, чем гемовое железо. [33] Основными ингибиторами абсорбции железа являются фитиновая кислота, полифенолы, кальций и пептиды из частично переваренных белков.[23] Усилители — это аскорбиновая кислота и мышечная ткань, которые могут восстанавливать трехвалентное железо до двухвалентного железа и связывать его в растворимые комплексы, доступные для абсорбции. [23]
Факторы, повышающие абсорбцию железа
На абсорбцию железа влияет ряд диетических факторов. Аскорбат и цитрат частично увеличивают усвоение железа, действуя как слабые хелаторы, помогая растворить металл в двенадцатиперстной кишке []. [34] Железо легко переносится из этих соединений в клетки слизистой оболочки. Исследователи продемонстрировали дозозависимый усиливающий эффект нативной или добавленной аскорбиновой кислоты на абсорбцию железа.[34] Усиливающий эффект в значительной степени связан с его способностью восстанавливать трехвалентное железо до двухвалентного железа, но также из-за его способности хелатировать железо. [35] Аскорбиновая кислота преодолеет негативное влияние на абсорбцию железа всех ингибиторов, включая фитат, [36] полифенолы, [37], кальций и белки, содержащиеся в молочных продуктах [38], и увеличит абсорбцию как нативного, так и обогащенного железа. Во фруктах и овощах усиливающий эффект аскорбиновой кислоты часто нивелируется ингибирующим действием полифенолов.[39] Аскорбиновая кислота является единственным усилителем всасывания в вегетарианских диетах, а всасывание железа из вегетарианских и веганских блюд можно оптимизировать путем включения овощей, содержащих аскорбиновую кислоту. [40] Варка, промышленная переработка и хранение разлагают аскорбиновую кислоту и устраняют ее усиливающий эффект на усвоение железа. [41]
Таблица 1
Факторы, которые могут влиять на всасывание железа
Было показано усиливающее действие мяса, рыбы или птицы на всасывание железа из вегетарианских блюд [42], и 30 г мышечной ткани считается эквивалентом 25 мг аскорбиновой кислоты. .[33] Бьорн-Расмуссен и Халлберг [43] сообщили, что добавление курицы, говядины или рыбы к кукурузной муке увеличивало всасывание негемового железа в 2-3 раза без влияния того же количества белка, что и яичного альбумина. Как и в случае с аскорбиновой кислотой, было несколько сложнее продемонстрировать усиливающий эффект мяса при многократном приёме пищи и в полных исследованиях диеты. Редди и др. ., [44] сообщили только о незначительном улучшении всасывания железа (35%) в самостоятельно выбранных диетах в течение 5 дней, когда ежедневное потребление мышечной ткани было увеличено до 300 г / день, хотя в аналогичных 5-дневных рационах. В ходе дневного исследования 60 г свинины, добавленные к вегетарианской диете, увеличили всасывание железа на 50%.[45]
Факторы, ингибирующие абсорбцию железа
В растительной диете фитат (мио-инозитол гексакисфосфат) является основным ингибитором абсорбции железа. [23] Было показано, что отрицательное влияние фитата на абсорбцию железа зависит от дозы и начинается с очень низких концентраций 2-10 мг / прием пищи. [37,46] Молярное отношение фитата к железу может быть использовано для оценки влияния на абсорбцию. . Соотношение должно составлять 1: 1 или предпочтительно 0,4: 1 для значительного улучшения всасывания железа в простых злаковых или бобовых блюдах, которые не содержат каких-либо усилителей усвоения железа, или 6: 1 в комбинированных блюдах с некоторыми овощами, содержащими аскорбиновую кислоту. кислота и мясо как усилители.[47]
Полифенолы содержатся в различных количествах в растительной пище и напитках, таких как овощи, фрукты, некоторые злаки и бобовые, чай, кофе и вино. Ингибирующее действие полифенолов на абсорбцию железа было показано с черным чаем и, в меньшей степени, с травяными чаями. [48,49] В зерновых и бобовых культурах полифенолы усиливают ингибирующий эффект фитата, как было показано в исследовании, сравнивающем сорго с высоким и низким содержанием полифенолов. [23]
Было показано, что кальций отрицательно влияет на абсорбцию негемового и гемового железа, что отличает его от других ингибиторов, влияющих только на абсорбцию негемового железа.[50] Дозозависимые ингибирующие эффекты были показаны при дозах 75-300 мг, когда кальций добавлялся в булочки, и при дозах 165 мг кальция из молочных продуктов. [51] Предполагается, что исследования однократного приема пищи показывают отрицательное влияние кальция на абсорбцию железа, тогда как исследования многократного приема пищи с большим разнообразием продуктов и различными концентрациями других ингибиторов и усилителей показывают, что кальций лишь ограниченно влияет на абсорбцию железа. [52]
Было показано, что животные белки, такие как молочные белки, яичные белки и альбумин, ингибируют абсорбцию железа.[53] Было показано, что две основные белковые фракции коровьего молока, казеин и сыворотка, а также яичный белок ингибируют абсорбцию железа у человека. [54] Белки сои также снижают всасывание железа. [55]
Конкуренция с железом
Исследования конкуренции показывают, что некоторые другие тяжелые металлы могут участвовать в пути всасывания железа в кишечнике. К ним относятся свинец, марганец, кобальт и цинк. Поскольку дефицит железа часто сочетается с интоксикацией свинцом, это взаимодействие может вызвать особенно серьезные медицинские осложнения у детей.[56]
Свинец является особенно опасным элементом для метаболизма железа. [57] Свинец поглощается механизмом поглощения железа (DTM1) и вторично блокирует железо за счет конкурентного торможения. Кроме того, свинец препятствует ряду важных железозависимых метаболических этапов, таких как биосинтез гема. Это многогранное влияние имеет особенно тяжелые последствия для детей, поскольку свинец не только вызывает анемию, но и может ухудшить когнитивное развитие. Свинец естественным образом присутствует в больших количествах в грунтовых водах и почве в некоторых регионах и может тайно нанести вред здоровью детей.По этой причине большинство педиатров в США обычно проверяют содержание свинца в раннем возрасте с помощью простого анализа крови.
ТРЕБОВАНИЯ К ЧЕЛОВЕКУ
В раннем детстве потребности в железе удовлетворяются за счет небольшого количества железа, содержащегося в грудном молоке. [58] Потребность в железе заметно возрастает через 4-6 месяцев после рождения и составляет около 0,7-0,9 мг / день в течение оставшейся части первого года [58]. В возрасте от 1 до 6 лет содержание железа в организме снова увеличивается вдвое. [58] Потребность в железе также очень высока у подростков, особенно в период скачка роста.У девочек обычно происходит скачок роста до менархе, но к этому времени рост не заканчивается. У мальчиков наблюдается заметное увеличение массы и концентрации гемоглобина в период полового созревания. На этой стадии потребности в железе повышаются до уровня, превышающего средние потребности в железе у менструирующих женщин [58] [см.].
Таблица 2
Потребность в железе 97,5% людей с точки зрения абсорбированного железа a , по возрастным группам и полу (Всемирная организация здравоохранения, 1989 г.) ее тело.Точный баланс между потреблением и потерей пищи поддерживает этот баланс. Около 1 мг железа теряется каждый день из-за отшелушивания клеток кожи и слизистых оболочек, включая слизистую оболочку желудочно-кишечного тракта. [59] Менструация увеличивает среднесуточную потерю железа примерно до 2 мг в день у взрослых женщин в пременопаузе. [60] Увеличение массы тела во время скачков роста в неонатальном и детском возрасте временно увеличивает потребность в железе. [61]
Потребление железа с пищей необходимо для восполнения потери железа с калом и мочой, а также через кожу.Эти базальные потери составляют примерно 0,9 мг железа для взрослого мужчины и 0,8 мг для взрослой женщины. [62] У женщин репродуктивного возраста необходимо учитывать потерю железа с менструальной кровью [].
ГРУППЫ ПОВЫШЕННОГО РИСКА
Наибольшая вероятность дефицита железа обнаруживается в тех частях населения, которые не имеют надлежащего доступа к пище, богатой усвояемым железом, во время стадий высокой потребности в железе. Эти группы соответствуют детям, подросткам и женщинам репродуктивного возраста, особенно во время беременности.[63,58]
У младенцев и подростков повышенная потребность в железе является результатом быстрого роста. Для женщин репродуктивного возраста основная причина — чрезмерная кровопотеря во время менструации. Во время беременности потребность в железе значительно возрастает из-за быстрого роста плаценты и плода, а также увеличения глобулярной массы. [63] Напротив, взрослые мужчины и женщины в постменопаузе имеют низкий риск дефицита железа, и количество железа в нормальном рационе обычно достаточно для удовлетворения их физиологических потребностей.[63]
ПОСЛЕДСТВИЯ И ПРИЧИНЫ ДЕФИЦИТА ЖЕЛЕЗА
Последствия дефицита железа
Дефицит железа определяется как состояние, при котором отсутствуют мобилизуемые запасы железа и при котором появляются признаки нарушения поступления железа в ткани, включая эритрон. , отмечены. [64] Дефицит железа может сопровождаться анемией или без нее. Некоторые функциональные изменения могут произойти и в отсутствие анемии, но наиболее функциональные нарушения, по-видимому, возникают при развитии анемии. [2] Даже легкие и умеренные формы железодефицитной анемии могут быть связаны с функциональными нарушениями, влияющими на когнитивное развитие [65], механизмы иммунитета [66] и работоспособность.[67] Дефицит железа во время беременности связан с множеством неблагоприятных исходов как для матери, так и для ребенка, включая повышенный риск сепсиса, материнской смертности, перинатальной смертности и низкой массы тела при рождении. [68] Дефицит железа и анемия также снижают способность к обучению и связаны с повышенным уровнем заболеваемости. [68]
Причины дефицита железа
Дефицит железа возникает в результате истощения запасов железа и возникает, когда абсорбция железа не может идти в ногу с метаболическими потребностями в железе для поддержания роста и восполнения потери железа, что в первую очередь связано с кровопотерей .[2] Основные причины дефицита железа включают низкое потребление биодоступного железа, повышенную потребность в железе в результате быстрого роста, беременности, менструации и избыточную кровопотерю, вызванную патологическими инфекциями, такими как анкилостомы и власоглавы, вызывающие потерю крови из желудочно-кишечного тракта [2] 69,70,71,72] и нарушение всасывания железа. [73] Частота дефицита железа увеличивается у девочек-подростков, потому что менструальные потери железа накладываются на потребность в быстром росте [74]. Другими факторами риска дефицита железа у молодых женщин являются высокий паритет, использование внутриматочной спирали и вегетарианская диета.[75]
Дефицит железа в питании возникает, когда физиологические потребности не могут быть удовлетворены за счет абсорбции железа из рациона. [72] Биодоступность пищевого железа низка в группах населения, потребляющих однообразные растительные диеты с небольшим количеством мяса. [72] Во многих развивающихся странах растительные продукты для отлучения от груди редко обогащаются железом, а частота анемии превышает 50% у детей младше 4 лет. [64]
Когда запасы железа истощаются и железа недостаточно для эритропоэза, синтез гемоглобина в предшественниках эритроцитов нарушается и появляются гематологические признаки железодефицитной анемии.
ОЦЕНКА СТАТУСА ЖЕЛЕЗА
Дефицит железа и, в конечном итоге, анемия развиваются поэтапно и могут быть оценены путем измерения различных биохимических показателей. Хотя некоторые ферменты железа чувствительны к дефициту железа [63], их активность не использовалась в качестве успешного рутинного измерения статуса железа [2].
Лабораторные измерения необходимы для правильной диагностики дефицита железа. Они наиболее информативны, когда несколько показателей уровня железа исследуются и оцениваются в контексте питания и истории болезни.
Пул железа в плазме или сыворотке — это фракция всего железа в организме, которая циркулирует в основном связанном с трансферрином. Три способа оценки уровня железа в плазме или сыворотке включают: 1) измерение общего содержания железа в единице объема в мкг / дл; 2) измерение общего количества сайтов связывания для атомов железа на трансферрине, известного как общая железосвязывающая способность в мкг / дл 2 ; и 3) оценка процента двух сайтов связывания на всех занятых молекулах трансферрина, называемого процентным насыщением трансферрина.[76] Однако заметные биологические вариации этих значений могут возникать в результате суточных колебаний, наличия инфекции или воспалительных состояний и недавнего потребления железа с пищей. [76]
Протопорфирин цинка отражает нехватку железа на последних стадиях синтеза гемоглобина, так что цинк вставляется в молекулу протопорфирина вместо железа. Протопорфирин цинка может быть обнаружен в эритроцитах с помощью флуориметрии и является мерой тяжести дефицита железа. [76]
Сывороточный ферритин является хорошим индикатором запасов железа в организме в большинстве случаев.Когда концентрация сывороточного ферритина ≥15 мкг / л, присутствуют запасы железа; более высокие концентрации отражают размер хранилища железа; при низкой концентрации (<12 мкг / л для детей младше 5 лет и <15 мкг / л для детей старше 5 лет) запасы железа истощаются. [76] Однако ферритин является белком-реагентом острой фазы, и его сывороточные концентрации могут быть повышены независимо от изменения запасов железа, инфекции или воспаления. [76,2] Это означает, что может быть трудно интерпретировать концентрацию ферритина там, где инфекция болезни распространены.
Еще одним индикатором статуса железа является концентрация TfR в сыворотке крови. Поскольку TfR в основном происходит из развивающихся эритроцитов, он отражает интенсивность эритропоэза и потребность в железе. Когда запасы железа истощаются, концентрация повышается при железодефицитной анемии, что указывает на серьезную недостаточность железа. Это при условии, что нет других причин аномального эритропоэза. [76] Клинические исследования показывают, что сывороточный TfR менее подвержен воспалению, чем сывороточный ферритин. [77] Основным преимуществом TfR как индикатора является возможность оценки величины функционального дефицита железа после истощения запасов железа.[78]
Отношение TfR к ферритину (TfR / ферритин) было разработано для оценки изменений как в хранящемся железе, так и в функциональном железе и считается более полезным, чем TfR или только ферритин. [79] TfR / ферритин использовался для оценки запасов железа в организме как у детей, так и у взрослых. [80] Однако высокая стоимость и отсутствие стандартизации анализа TfR до сих пор ограничивают применимость метода [81].
Низкая концентрация гемоглобина является показателем анемии, конечной стадии дефицита железа.[76,2]
АНЕМИЯ И ЕЕ ПРИЧИНЫ
Анемия описывает состояние, при котором количество эритроцитов в крови низкое или в клетках крови содержится меньше нормального гемоглобина. Человека, страдающего анемией, называют анемичным. Целью эритроцитов является доставка кислорода из легких в другие части тела. Молекула гемоглобина является функциональной единицей эритроцитов и представляет собой сложную белковую структуру, которая находится внутри эритроцитов. Несмотря на то, что эритроциты производятся в костном мозге, в их производство вовлечены многие другие факторы.Например, железо — очень важный компонент молекулы гемоглобина; эритропоэтин, молекула, секретируемая почками, способствует образованию эритроцитов в костном мозге.
Наличие правильного количества эритроцитов и профилактика анемии требует взаимодействия между почками, костным мозгом и питательными веществами в организме. Если почки или костный мозг не функционируют, или организм плохо питается, то нормальное количество и функции эритроцитов может быть трудно поддерживать.
Анемия на самом деле является признаком болезненного процесса, а не самой болезни.Обычно его классифицируют как хронический или острый. Хроническая анемия возникает в течение длительного периода времени. Острая анемия возникает быстро. Определение того, присутствует ли анемия в течение длительного времени или это что-то новое, помогает врачам найти причину. Это также помогает предсказать, насколько серьезными могут быть симптомы анемии. При хронической анемии симптомы обычно начинаются медленно и постепенно прогрессируют; тогда как при острой анемии симптомы могут быть резкими и более тревожными.
Эритроциты живут около 100 дней, поэтому организм постоянно пытается их заменить.У взрослых производство эритроцитов происходит в костном мозге. Врачи пытаются определить, вызвано ли низкое количество эритроцитов повышенной кровопотерей эритроцитов или их снижением в костном мозге. Знание того, изменилось ли количество лейкоцитов и / или тромбоцитов, также помогает определить причину анемии.
По оценкам Всемирной организации здравоохранения (ВОЗ), два миллиарда человек во всем мире страдают анемией и примерно 50% всех анемий объясняются дефицитом железа. [64] Это происходит на всех этапах жизненного цикла, но чаще встречается у беременных женщин и маленьких детей.[82] Анемия является результатом множества причин, которые можно изолировать, но чаще всего они сосуществуют. Некоторые из этих причин включают следующие:
Железодефицитная анемия
Наиболее важной и частой причиной анемии является дефицит железа. [82] Если потребление железа ограничено или неадекватно из-за плохого питания, в результате может возникнуть анемия. Это называется железодефицитной анемией. Железодефицитная анемия также может возникать при наличии язвы желудка или других источников медленного хронического кровотечения (рак толстой кишки, рак матки, полипы кишечника, геморрой и т. Д.).[83]
Анемия хронического заболевания
Любое длительное заболевание может привести к анемии. Этот тип анемии является вторым по распространенности после анемии, вызванной дефицитом железа, и развивается у пациентов с острым или хроническим системным заболеванием или воспалением. [84] Это состояние было названо «анемией воспаления» из-за повышенного содержания гепсидина, который блокирует как рециркуляцию железа из макрофагов, так и абсорбцию железа. [85]
Анемия из-за активного кровотечения
Потеря крови из-за обильного менструального кровотечения или ран может вызвать анемию.[82] Язвы желудочно-кишечного тракта или раковые заболевания, такие как рак толстой кишки, могут медленно терять кровь и также могут вызывать анемию. [86,87]
Анемия, связанная с заболеванием почек
Почки выделяют гормон эритропоэтин, который помогает костному мозгу сделать эритроциты. У людей с хроническим (длительным) заболеванием почек выработка этого гормона снижена, а это, в свою очередь, снижает выработку эритроцитов, вызывая анемию. [88] Хотя дефицит эритропоэтина является основной причиной анемии при хронической почечной недостаточности, это не единственная причина.Следовательно, необходимо минимальное обследование, чтобы исключить дефицит железа и другие аномалии клеточной линии. [89]
Анемия, связанная с беременностью
Увеличение объема плазмы во время беременности приводит к разбавлению эритроцитов и может проявляться как анемия. [90] Железодефицитная анемия составляет 75% всех анемий во время беременности. [90]
Анемия, связанная с плохим питанием
Витамины и минералы необходимы для образования эритроцитов. Помимо железа, для правильного производства гемоглобина необходимы витамин B12, виамин А, фолиевая кислота, рибофлавин и медь.[82] Дефицит любого из этих питательных микроэлементов может вызвать анемию из-за недостаточного производства эритроцитов. Плохое питание — важная причина низкого уровня витаминов и, как следствие, анемии.
Ожирение и анемия
Ожирение характеризуется хроническим слабым системным воспалением, повышенным уровнем гепсидина, что, в свою очередь, связано с анемией хронического заболевания. Ausk и Ioannou [91] предположили, что ожирение может быть связано с особенностями анемии хронического заболевания, включая низкую концентрацию гемоглобина, низкое содержание железа и трансферрина в сыворотке, а также повышенный уровень ферритина в сыворотке.Избыточный вес и ожирение были связаны с изменениями сывороточного железа, насыщения трансферрина и ферритина, которые, как ожидается, произойдут в условиях хронического системного воспаления. Воспаление, связанное с ожирением, может повышать концентрацию гепсидина и снижать доступность железа. Aeberli и др. , [92] сравнили уровень железа, потребление железа с пищей и его биодоступность, а также циркулирующие уровни гепсидина, лептина и интерлейкина-6 (ИЛ-6) у детей с избыточной массой тела и детей с нормальным весом.Они указали, что имеется пониженная доступность железа для эритропоэза у детей с избыточным весом и что это, вероятно, связано с опосредованным гепсидином сниженным всасыванием железа и / или повышенным секвестрацией железа, а не с низким содержанием железа с пищей.
Алкоголизм
Алкоголь оказывает многочисленные неблагоприятные эффекты на различные типы клеток крови и их функции. [93] У алкоголиков часто есть дефектные эритроциты, которые преждевременно разрушаются. [93,94] Сам по себе алкоголь также может быть токсичным для костного мозга и может замедлять производство эритроцитов.[93,94] Кроме того, с алкоголизмом связаны плохое питание и дефицит витаминов и минералов. [95] Сочетание этих факторов может привести к анемии у алкоголиков.
Серповидно-клеточная анемия
Серповидно-клеточная анемия — одно из наиболее распространенных наследственных заболеваний. [96] Это заболевание, связанное с кровью, которое влияет на молекулу гемоглобина и приводит к изменению формы всей клетки крови в стрессовых условиях [97]. В таком состоянии проблема с гемоглобином бывает качественной или функциональной.Аномальные молекулы гемоглобина могут вызвать проблемы в целостности структуры эритроцитов, и они могут стать серповидными (серповидные клетки). [97] Существуют разные типы серповидно-клеточной анемии разной степени тяжести. Это особенно распространено у африканцев, ближневосточных и средиземноморских предков. [97]
Талассемия
Это еще одна группа причин анемии, связанных с гемоглобином, которая связана с отсутствием или ошибками в генах, ответственных за выработку гемоглобина. [97] Молекула гемоглобина имеет субъединицы, обычно называемые альфа- и бета-цепями глобина.Отсутствие определенной субъединицы определяет тип альфа- или бета-талассемии. [97,98] Существует много типов талассемии, которые различаются по степени тяжести от легкой (малая талассемия) до тяжелой (большая талассемия). [98] Они также являются наследственными, но вызывают количественные аномалии гемоглобина, то есть вырабатывается недостаточное количество молекул правильного типа. Альфа- и бета-талассемии являются наиболее распространенными наследственными моногенными заболеваниями в мире с наибольшей распространенностью в регионах, где малярия была или все еще является эндемической.[97]
Апластическая анемия
Апластическая анемия — это заболевание, при котором разрушается костный мозг и снижается выработка клеток крови. [99] Это вызывает дефицит всех трех типов клеток крови (панцитопения), включая эритроциты (анемия), лейкоциты (лейкопения) и тромбоциты (тромбоцитопения). [100,101] Многие распространенные лекарства могут иногда вызывать этот тип анемии в качестве побочного эффекта. у некоторых людей. [99]
Гемолитическая анемия
Гемолитическая анемия — это тип анемии, при которой происходит разрыв эритроцитов, известный как гемолиз, который разрушается быстрее, чем костный мозг может их заменить.[102] Гемолитическая анемия может возникнуть по разным причинам и часто классифицируется как приобретенная или наследственная. Распространенными приобретенными причинами гемолитической анемии являются аутоиммунитет, микроангиопатия и инфекции. Нарушения ферментов эритроцитов, мембран и гемоглобина вызывают наследственную гемолитическую анемию. [102]
ПРЕДОТВРАЩЕНИЕ НЕДОСТАТОЧНОСТИ ЖЕЛЕЗА (СТРАТЕГИИ ВМЕШАТЕЛЬСТВА)
Четыре основных стратегии коррекции эффективности микронутриентов в популяциях могут использоваться для коррекции дефицита железа, как по отдельности, так и в комбинации.Это обучение в сочетании с модификацией диеты для улучшения потребления железа и его биодоступности; добавление железа (обеспечение железом, обычно в более высоких дозах, без еды), обогащение пищевых продуктов железом и новый подход к биофортификации. Однако есть некоторые трудности в применении некоторых из этих стратегий при рассмотрении железа.
Диверсификация продуктов питания
Модификации диеты для сокращения потребления Индийской стоматологической ассоциации включают увеличение потребления продуктов, богатых железом, особенно мясных продуктов, увеличение потребления фруктов и овощей, богатых аскорбиновой кислотой, для увеличения абсорбции негемового железа и снижение потребления чая и кофе, которые подавляют всасывание негемового железа.[103,58] Другая стратегия — снизить содержание антинутриентов, чтобы сделать железо, поступающее из их пищевых источников, более доступным. Биодоступность железа может быть увеличена такими методами, как проращивание и ферментация, которые способствуют ферментативному гидролизу фитиновой кислоты в цельнозерновых зерновых и бобовых культурах за счет повышения активности эндогенных или экзогенных ферментов фитазы. [104] Даже использование неферментативных методов, таких как термическая обработка, замачивание и измельчение, для снижения содержания фитиновой кислоты в основных продуктах растительного происхождения позволило улучшить биодоступность железа (и цинка).[105,106]
Добавка
Для перорального приема добавок железа предпочтительны соли двухвалентного железа (сульфат двухвалентного железа и глюконат двухвалентного железа) из-за их низкой стоимости и высокой биодоступности. [72] Хотя абсорбция железа выше при приеме добавок железа натощак, тошнота и боль в эпигастрии могут развиться из-за введенных более высоких доз железа (обычно 60 мг Fe / день). Если возникают такие побочные эффекты, следует попытаться снизить дозу между приемами пищи или давать железо во время еды, хотя пища снижает всасывание лекарственного железа примерно на две трети.[107] Добавки железа во время беременности рекомендуется в развивающихся странах, где женщины часто вступают в беременность с низкими запасами железа. [108] Хотя обычно считалось, что польза от приема добавок железа перевешивает предполагаемый риск, есть некоторые свидетельства того, что добавление в дозах, рекомендованных для здоровых детей, несет в себе риск увеличения тяжести инфекционного заболевания на фоне малярии. [109,110]
Обогащение
Обогащение пищевых продуктов железом сложнее, чем обогащение такими питательными веществами, как цинк в муке, йод в соли и витамин А в кулинарном масле.[72] Наиболее биодоступные соединения железа растворимы в воде или разбавленной кислоте, но часто вступают в реакцию с другими пищевыми компонентами, вызывая неприятный запах, изменение цвета или окисление жиров. [103] Таким образом, менее растворимые формы железа, хотя и хуже усваиваются, часто выбираются для обогащения, чтобы избежать нежелательных сенсорных изменений. [72] Обогащение обычно производится с гораздо меньшими дозами железа, чем с добавками. Это ближе к физиологической среде и может быть самым безопасным вмешательством в малярийных областях. [111] Нет никаких опасений по поводу безопасности добавок железа или обогащения железа в немалярийных эндемичных районах.[112]
Соединения железа, рекомендованные [7] для обогащения пищевых продуктов, включают сульфат железа, фумарат железа, пирофосфат железа и порошок электролитического железа. Пшеничная мука является наиболее распространенным пищевым продуктом, обогащенным железом, и обычно она обогащается порошками элементарного железа, которые не рекомендуются ВОЗ. [7,113] Харрелл и Эгли [23] сообщили, что из 78 национальных программ по пшеничной муке только восемь улучшатся. статус железа. В этих программах использовались рекомендуемые соединения железа на рекомендованных уровнях.В других странах использовались не рекомендуемые соединения или более низкие уровни железа по сравнению с потреблением муки. Коммерческое детское питание, такое как смеси и злаки, также обычно обогащено железом.
Биофортификация
Содержание железа колеблется от 25 до 56 мг / кг в различных сортах пшеницы и от 7 до 23 мг / кг в зернах риса. Однако большая часть этого железа удаляется в процессе измельчения. Поглощение железа зерновыми и бобовыми культурами, многие из которых имеют высокое содержание самородного железа, обычно низкое из-за высокого содержания в них фитата, а иногда и полифенолов.[48] Стратегии биофортификации включают селекцию растений и генную инженерию. Уровни железа в обычных бобах и просе были успешно увеличены за счет селекции растений, но использование других основных продуктов питания является более трудным или невозможным (рис) из-за недостаточной естественной генетической изменчивости. Lucca и др. ., [114] увеличили содержание железа в эндосперме риса, чтобы улучшить его всасывание в кишечнике человека с помощью генной инженерии. Они ввели ген ферритина из Phaseolus vulgaris в рисовые зерна, увеличив содержание железа в них вдвое.Для увеличения биодоступности железа они ввели в эндосперм риса термотолерантную фитазу из Aspergillus fumigatus . Они указали, что этот рис с более высоким содержанием железа и богатым фитазой имеет большой потенциал для существенного улучшения питания железом в тех популяциях, где дефицит железа так широко распространен. [114] К сожалению, фитаза не устояла перед приготовлением. Важность различных минералов, таких как цинк [115] и железо, требует большего внимания на индивидуальном уровне и уровне общественного здравоохранения.
Сноски
Источник поддержки: Нет
Конфликт интересов: Не объявлен.
СПИСОК ЛИТЕРАТУРЫ
1. Борода Дж. Л., Доусон HD. Железо. В: О’Делл Б.Л., Сунде Р.А., редакторы. Справочник по незаменимым в питании минеральным элементам. Нью-Йорк: CRC Press; 1997. С. 275–334. [Google Scholar] 2. Вуд Р.Дж., Ронненберг А. Железо. В: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, редакторы. Современное питание в здоровье и болезнях. 10-е изд. Балтимор: Липпинкотт Уильямс и Уилкинс; 2005 г.С. 248–70. [Google Scholar] 3. Макдауэлл LR. 2-е изд. Амстердам: Elsevier Science; 2003. Минералы в питании животных и человека; п. 660. [Google Scholar] 4. Гуггенхайм KY. Хлороз: возникновение и исчезновение болезни, связанной с питанием. J Nutr. 1995; 125: 1822–5. [PubMed] [Google Scholar] 5. Ип Р., Даллман PR. Железо. В: Ziegler EE, Filer LJ, редакторы. Присутствуют знания в области питания. 7-е изд. Вашингтон, округ Колумбия: ILSI Press; 1996. С. 278–92. [Google Scholar] 6. Андервуд Э.Дж., Саттл Н.Ф. 3-е изд. Уоллингфорд: Международное издательство CABI; 1999 г.Минеральное питание скота; п. 614. [Google Scholar] 7. Аллен Л., де Бенуа Б., Дари О., Харрелл Р., редакторы. Женева: ВОЗ и ФАО; 2006. ВОЗ. Рекомендации по обогащению пищевых продуктов микронутриентами; п. 236. [Google Scholar] 8. Брабин Б.Дж., Премжи З., Верхое ff Ф. Анализ анемии и детской смертности. J Nutr. 2001; 131: 636–45С. [PubMed] [Google Scholar] 9. Quintero-Gutiérrez AG, González-Rosendo G, Sánchez-Muñoz J, Polo-Pozo J, Rodríguez-Jerez JJ. Биодоступность гемового железа в начинке для печенья с использованием поросят в качестве модели животных для человека.Int J Biol Sci. 2008; 4: 58–62. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Айзен П., Эннс С., Весслинг-Резник М. Химия и биология метаболизма железа в эукариотах. Int J Biochem Cell Biol. 2001; 33: 940–59. [PubMed] [Google Scholar] 11. Лиу П. Т., Хейскала М., Петерсон П. А., Ян Ю. Роль железа в здоровье и болезнях. Мол Аспекты Мед. 2001; 2: 1–87. [PubMed] [Google Scholar] 12. Guerinot ML. Транспорт микробного железа. Annu Rev Microbiol. 1994; 48: 743–72. [PubMed] [Google Scholar] 13. Асквит К., Каплан Дж.Транспорт железа и меди в дрожжах и его значение для болезней человека. Trends Biochem Sci. 1998. 23: 135–8. [PubMed] [Google Scholar] 15. Вашингтон, округ Колумбия: Национальная академия прессы; 2001. МОМ. Институт медицины. железо. В: Диетические рекомендуемые дозы витамина А, витамина К, мышьяка, бора, хрома, меди, йода, железа, марганца, молибдена, никеля, кремния, ванадия и цинка; С. 290–393. [PubMed] [Google Scholar] 16. Muir A, Hopfer U. Региональная специфичность поглощения железа щеточно-граничными мембранами тонкого кишечника у нормальных мышей и мышей с дефицитом железа.Am J Physiol. 1985; 248: G376–9. [PubMed] [Google Scholar] 17. Фрейзер Д.М., Андерсон Г.Дж. Импорт железа. I. Абсорбция железа в кишечнике и ее регуляция. Am J Physiol Gastrointest Liver Physiol. 2005; 289: G631–5. [PubMed] [Google Scholar] 18. Наддур С.С., Шрирама К., Мудипалли А. Механизмы транспорта и гомеостаза железа: их роль в здоровье и болезнях. Индийский J Med Res. 2008; 128: 533–44. [PubMed] [Google Scholar] 20. Yeh KY, Yeh M, Mims L, Glass J. Кормление железом индуцирует миграцию и взаимодействие ферропортина 1 и гефестина в двенадцатиперстном эпителии крыс.Am J Physiol Gastrointest Liver Physiol. 2009. 296: 55–65. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Тейл Э.С., Чен Х., Миранда С., Янсер Х., Эльзенханс Б., Нуньес М.Т. и др. Абсорбция железа из ферритина не зависит от гемового железа и солей двухвалентного железа у женщин и сегментов кишечника крыс. J Nutr. 2012; 142: 478–83. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Hoppler M, Schoenbaechler A, Meile L, Hurrell RF, Walczyk T. Ферритин-железо высвобождается во время кипячения и in vitro при пищеварении в желудке .J Nutr. 2008. 138: 878–84. [PubMed] [Google Scholar] 23. Hurrell R, Egli I. Биодоступность железа и диетические контрольные значения. Am J Clin Nutr. 2010; 91: 1461–7S. [PubMed] [Google Scholar] 25. Немет Э., Ганц Т. Регулирование метаболизма железа гепсидином. Annu Rev Nutr. 2006; 26: 323–42. [PubMed] [Google Scholar] 26. Немет Э., Таттл М.С., Пауэлсон Дж., Вон М.Б., Донован А., Уорд Д.М. и др. Гепсидин регулирует отток клеточного железа, связываясь с ферропортином и индуцируя его интернализацию. Наука. 2004; 306: 2090–3.[PubMed] [Google Scholar] 28. Браун В., Киллманн Х. Бактериальные решения проблемы снабжения железом. Trends Biochem Sci. 1999; 24: 104–109. [PubMed] [Google Scholar] 29. Хант-младший. Насколько важна биодоступность железа с пищей? Am J Clin Nutr. 2001; 73: 3–4. [PubMed] [Google Scholar] 30. Хант-младший, Зито, Калифорния, Джонсон, Лос-Анджелес. Выведение железа из организма здоровыми мужчинами и женщинами. Am J Clin Nutr. 2009; 89: 1–7. [PubMed] [Google Scholar] 31. Фэрбенкс В.Ф. Железо в медицине и питании. В: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, редакторы.Современное питание в здоровье и болезнях. 10-е изд. Балтимор: Липпинкотт Уильямс и Уилкинс; 1999. С. 193–221. [Google Scholar] 32. потребности человека в витаминах и минералах. Рим: ФАО; 2001. ФАО / ВОЗ. Пищевые подходы к удовлетворению потребностей в витаминах и минералах; С. 7–25. [Google Scholar] 33. Monsen ER, Hallberg L, Layrisse M, Hegsted DM, Cook JD, Mertz W. и др. Оценка доступного пищевого железа. Am J Clin Nutr. 1978; 31: 134–41. [PubMed] [Google Scholar] 34. Конрад ME, Umbreit JN. Краткий обзор: абсорбция железа — путь муцин-мобилферрин-интегрин.Конкурентоспособный путь поглощения металлов. Am J Hematol. 1993; 42: 67–73. [PubMed] [Google Scholar] 35. Конрад М.Э., Шаде С.Г. Хелаты аскорбиновой кислоты в абсорбции железа: роль соляной кислоты и желчи. Гастроэнтерология. 1968; 55: 35–45. [PubMed] [Google Scholar] 36. Холлберг Л., Брюн М., Россандер Л. Поглощение железа у человека: аскорбиновая кислота и дозозависимое ингибирование фитатом. Am J Clin Nutr. 1989; 49: 140–4. [PubMed] [Google Scholar] 37. Зигенберг Д., Бейнс Р.Д., Ботвелл Т.Х., Макфарлейн Б.Дж., Лампарелли Р.Д., Car NG и др.Аскорбиновая кислота предотвращает дозозависимое ингибирующее действие полифенолов и фитатов на абсорбцию негемового железа. Am J Clin Nutr. 1991; 53: 537–41. [PubMed] [Google Scholar] 38. Стекель А., Оливарес М., Писарро Ф., Чадуд П., Лопес И., Амар М. Поглощение обогащающего железа из молочных смесей у младенцев. Am J Clin Nutr. 1986; 43: 917–22. [PubMed] [Google Scholar] 39. Бюллетень D, Бейнс Р.Д., Ботвелл Т.Х., Гиллули М., Макфарлейн Б.Дж., Макфейл А.П. и др. Влияние фруктовых соков и фруктов на усвоение железа из рисовой муки.Br J Nutr. 1987. 57: 331–43. [PubMed] [Google Scholar] 40. Линч SR, Кук JD. Взаимодействие витамина С и железа. Ann N Y Acad Sci. 1980; 355: 32–44. [PubMed] [Google Scholar] 41. Teucher B, Olivares M, Cori H. Усилители поглощения железа: аскорбиновая кислота и другие органические кислоты. Int J Vitam Nutr Res. 2004; 74: 403–19. [PubMed] [Google Scholar] 42. Линч С.Р., Харрелл Р.Ф., Дассенко С.А., Кук Дж.Д. Влияние пищевых белков на биодоступность железа у человека. Adv Exp Med Biol. 1989; 249: 117–32. [PubMed] [Google Scholar] 43.Бьорн-Расмуссен Э., Халльберг Л. Влияние животных белков на усвоение пищевого железа человеком. Нутр Метаб. 1979; 23: 192–202. [PubMed] [Google Scholar] 44. Редди МБ, Харрелл Р.Ф., Кук Дж.Д. Разнообразное питание незначительно влияет на всасывание негемового железа у нормальных людей. J Nutr. 2006; 136: 576–81. [PubMed] [Google Scholar] 45. Бах Кристенсен М., Хелс О, Морберг С., Марвинг Дж., Бугель С., Тетенс I. Свинина увеличивает усвоение железа при 5-дневной полностью контролируемой диете по сравнению с вегетарианской диетой с аналогичным содержанием витамина С и фитиновой кислоты.Br J Nutr. 2005. 94: 78–83. [PubMed] [Google Scholar] 46. Харрелл Р.Ф., Джуллерат М.А., Редди М.Б., Линч С.Р., Дассенко С.А., Кук Дж.Д. Соевый белок, фитат и абсорбция железа у человека. Am J Clin Nutr. 1992; 56: 573–8. [PubMed] [Google Scholar] 47. Hurrell RF. Разложение фитиновой кислоты как средство улучшения усвоения железа. Int J Vitam Nutr Res. 2004. 74: 445–52. [PubMed] [Google Scholar] 48. Харрелл Р.Ф., Редди М., Кук Дж. Д.. Подавление абсорбции негемного железа у человека напитками, содержащими полифенолы. Br J Nutr.1999. 81: 289–95. [PubMed] [Google Scholar] 49. Холлберг Л., Россандер Л. Влияние различных напитков на усвоение негемового железа из сложных блюд. Hum Nutr Appl Nutr. 1982; 36: 116–23. [PubMed] [Google Scholar] 50. Hallberg L, Rossander-Hulthen L, Brune M, Gleerup A. Ингибирование усвоения гемового железа у человека кальцием. Br J Nutr. 1993; 69: 533–40. [PubMed] [Google Scholar] 51. Hallberg L, Rossander-Hulthen L. Потребность в железе у менструирующих женщин. Am J Clin Nutr. 1991; 54: 1047–58. [PubMed] [Google Scholar] 52.Линч SR. Влияние кальция на усвоение железа. Nutr Res Rev.2000; 13: 141–58. [PubMed] [Google Scholar] 53. Повар JD, Monsen ER. Поглощение пищевого железа у людей. III. Сравнение влияния животных белков на всасывание негемового железа. Am J Clin Nutr. 1976; 29: 859–67. [PubMed] [Google Scholar] 54. Харрелл РФ, Линч С.Р., Тринидад Т.П., Дассенко С.А., Кук Дж.Д. Абсорбция железа у людей: бычий сывороточный альбумин по сравнению с говяжьими мышцами и яичным белком. Am J Clin Nutr. 1988; 47: 102–7. [PubMed] [Google Scholar] 55.Линч С.Р., Дассенко С.А., Кук Дж.Д., Джульерат М.А., Харрелл РФ. Ингибирующий эффект фрагмента, связанного с соевым белком, на абсорбцию железа у людей. Am J Clin Nutr. 1994; 60: 567–72. [PubMed] [Google Scholar] 56. Piomelli S, Seaman C, Kapoor S. Вызванные свинцом аномалии метаболизма порфирина, связь с дефицитом железа. Ann N Y Acad Sci. 1987; 514: 278–88. [PubMed] [Google Scholar] 58. 2-е изд. Бангкок: 2004 г. ФАО / ВОЗ. Консультации экспертов по потребностям человека в витаминах и минералах, потребностях в витаминах и минералах в питании человека: отчет совместного экспертного заключения ФАО / ВОЗ; п.341. [Google Scholar] 59. Cook JD, Skikne BS, Lynch SR, Reusser ME. Оценки достаточности железа у населения США. Кровь. 1986; 68: 726–31. [PubMed] [Google Scholar] 60. Ботвелл TH, Чарльтон RW. Общий подход к проблемам железодефицита и перегрузки железом у населения в целом. Semin Hematol. 1982; 19: 54–67. [PubMed] [Google Scholar] 61. Гибсон Р.С., Макдональд А.С., Смит-Вандеркой П.Д. Параметры сывороточного ферритина и пищевого железа в выборке канадских детей дошкольного возраста. J Can Dietetic Assoc.1988; 49: 23–8. [Google Scholar] 62. ДеМайер Э.М., Даллман П., Герни Дж. М., Холлберг Л., Суд С. К., Срикантия С. Г., редакторы. Женева: Всемирная организация здравоохранения; 1989. ВОЗ. Профилактика и контроль железодефицитной анемии с помощью первичной медико-санитарной помощи: руководство для администраторов здравоохранения и руководителей программ; п. 58. [Google Scholar] 63. Даллман П. Айрон. В: Браун М.Л., редактор. Настоящие знания в области питания. 6-е изд. Вашингтон, округ Колумбия: Фонд питания; 1990. С. 241–50. [Google Scholar] 64. Женева: Швейцария: Всемирная организация здравоохранения; 2001 г.ВОЗ / ЮНИСЕФ / УООН. Оценка, профилактика и контроль железодефицитной анемии; п. 114. [Google Scholar] 65. Борода Дж. Л., Коннор Дж. Р. Статус железа и нейронное функционирование. Annu Rev Nutr. 2003. 23: 41–58. [PubMed] [Google Scholar] 66. Failla ML. Микроэлементы и защита хозяина: последние достижения и сохраняющиеся проблемы. J Nutr. 2003; 133: S1443–7. [PubMed] [Google Scholar] 67. Витери Ф.Е., Торунь Б. Анемия и физическая работоспособность. В: Гарби Л., редактор. Клиники гематологии. Vol. 3. Лондон: У. Б. Сондерс; 1974. стр.609–26. [Google Scholar] 68. CDC. Табель успеваемости по грудному вскармливанию, США: показатели результатов (публикация из Центров по контролю и профилактике заболеваний, Национальное обследование иммунизации. 2010 г. [последний доступ 11 мая 2010 г.]. Http://www.cdc.gov/breastfeeding/data/index .htm .69. Купер Е.С., Банди Д.А. Трихоцефалопатия. Ballieres Clin Trop Med Commun Dis. 1987; 2: 629–43. [Google Scholar] 70. Всемирная организация здравоохранения, Женева; 1995. ВОЗ. Отчет неофициальной консультации ВОЗ. на анкилостомоз и анемию у девочек и женщин; с.46. [Google Scholar] 71. Crompton DW, Nesheim MC. Пищевая ценность кишечных гельминтозов в течение жизненного цикла человека. Annu Rev Nutr. 2002; 22: 35–99. [PubMed] [Google Scholar] 72. Ларок Р., Касапиа М., Готуццо Е., Дьеркос Т.В. Взаимосвязь между интенсивностью заражения гельминтами, передающимися через почву, и анемией во время беременности. Am J Trop Med Hyg. 2005; 73: 783–9. [PubMed] [Google Scholar] 73. Циммерманн МБ, Харрелл РФ. Недостаток пищевого железа. Ланцет. 2007; 370: 115–20. [Google Scholar] 74. Харви LJ, Armah CN, Dainty JR, Foxall RJ, John Lewis D, Langford NJ и др.Влияние менструальной кровопотери и диеты на дефицит железа у женщин в Великобритании. Br J Nutr. 2005. 94: 557–64. [PubMed] [Google Scholar] 75. Борода JL. Потребность в железе у девочек-подростков. Симпозиум: Повышение уровня железа у подростков до деторождения. J Nutr. 2000; 130: S440–2. [PubMed] [Google Scholar] 77. Бегин Ю. Растворимый рецептор трансферрина для оценки эритропоэза и статуса железа. Clinica Chimica Acta. 2003. 329: 9–22. [PubMed] [Google Scholar] 79. Повар JD, Flowers CH, Skikne BS. Количественная оценка bodyiron.Кровь. 2003. 101: 3359–64. [PubMed] [Google Scholar] 80. Кук JD, Boy E, Flowers C, Daroca Mdel C. Влияние высокогорной жизни на железо тела. Кровь. 2005; 106: 1441–6. [PubMed] [Google Scholar] 81. Ян З., Дьюи К.Г., Лоннердал Б., Хернелл О., Чапарро С., Аду-Афарвуа С. и др. Сравнение концентрации ферритина в плазме с соотношением рецептора трансферрина в плазме к ферритину для оценки запасов железа в организме: результаты 4 интервенционных испытаний. Am J Clin Nutr. 2008; 87: 1892–8. [PubMed] [Google Scholar] 82.Де Бенуа Б., Маклин Э., Эгли И., Когсуэлл М. — редакторы. Женева: Пресса ВОЗ, Всемирная организация здравоохранения; 2008. ВОЗ / CDC. Данные библиотечной каталогизации в публикации. Распространенность анемии в мире, 1993–2005 гг .: глобальная база данных ВОЗ по анемии; п. 40. [Google Scholar] 83. Джонсон-Уимбли Т.Д., Грэм Д.Ю. Диагностика и лечение железодефицитной анемии в 21 веке. Ther Adv Гастроэнтерол. 2011; 4: 177–84. [Бесплатная статья PMC] [PubMed] [Google Scholar] 84. Зарычанский Р., Хьюстон Д.С. Анемия хронического заболевания: вредное заболевание или адаптивная, полезная реакция? Can Med Assoc J.2008; 179: 333–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Weiss G, Goodnough LT. Анемия хронического заболевания. N Engl J Med. 2005; 352: 1011–23. [PubMed] [Google Scholar] 86. 2-е изд. Женева: 2004 г. ВОЗ / CDC. Отчет о совместной технической консультации Всемирной организации здравоохранения / Центров по контролю и профилактике заболеваний по оценке статуса железа на уровне населения; п. 108. [Google Scholar] 87. Knight K, Wade S, Balducci L. Распространенность и исходы анемии при раке: систематический обзор литературы.Am J Med. 2004; 116: 11–26С. [PubMed] [Google Scholar] 88. О’Мара NB. Больные анемией с хроническими заболеваниями почек. Спектр диабета. 2008; 21: 12–9. [Google Scholar] 89. Нурко С. Анемия при хронической болезни почек: причины, диагностика, лечение. Cleve Clin J Med. 2006. 73: 289–97. [PubMed] [Google Scholar] 90. Горовиц К.М., Ингардия С.Дж., Боргида А.Ф. 2013, Анемия при беременности. Clin Lab Med. 2013; 33: 281–91. [PubMed] [Google Scholar] 91. Ауск К.Дж., Иоанну Г.Н. Связано ли ожирение с анемией хронического заболевания? Популяционное исследование.Ожирение. 2008. 16: 2356–61. [PubMed] [Google Scholar] 92. Aeberli I, Hurrell RF, Zimmermann MB. Дети с избыточным весом имеют более высокие концентрации циркулирующего гепсидина и более низкий статус железа, но их потребление железа с пищей и биодоступность сопоставимы с детьми с нормальным весом. Int J Obes. 2009; 33: 1111–7. [PubMed] [Google Scholar] 94. Lewis G, Wise MP, Poynton C, Godkin A. Случай стойкой анемии и злоупотребления алкоголем. Нат Клин Практ Гастроэнтерол Гепатол. 2007; 4: 521–6. [PubMed] [Google Scholar] 95. Lindenbaum J, Роман MJ.Пищевая анемия при алкоголизме. Am J Clin Nutr. 1980; 33: 2727–35. [PubMed] [Google Scholar] 96. Cox SE, L’Esperance V, Makani J, Soka D, Prentice AM, Hill CM и др. Серповидно-клеточная анемия: доступность железа и ночная оксиметрия. J Clin Sleep Med. 2012; 8: 541–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 98. Манси Х.Л., младший, Кэмпбелл Дж. Альфа- и бета-талассемия. Я семейный врач. 2009; 80: 339–44. [PubMed] [Google Scholar] 99. Сегель ГБ, Лихтман М.А. Апластическая анемия: приобретенная и наследственная. В: Каушанский К., Вильямс В.Дж., редакторы.Гематология Вильямса. 8-е изд. Нью-Йорк: McGraw-Hill Medical; 2010. С. 569–90. [Google Scholar] 100. Янг Н.С., Каладо Р.Т., Шейнберг П. Современные концепции патофизиологии и лечения апластической анемии. Кровь. 2006; 108: 2509–19. [Бесплатная статья PMC] [PubMed] [Google Scholar] 101. Шейнберг П., Чен Дж. Апластическая анемия: что мы узнали на моделях на животных и в клинике. Semin Hematol. 2013; 50: 156–64. [PubMed] [Google Scholar] 102. Dhaliwal G, Cornett PA, Tierney LM., Jr Гемолитическая анемия.Я семейный врач. 2004. 69: 2599–606. [PubMed] [Google Scholar] 103. Hurrell RF. Как обеспечить адекватное усвоение железа из продуктов, обогащенных железом. Nutr Rev. 2002; 60: S7–15. [PubMed] [Google Scholar] 104. Повар JD. Диагностика и лечение железодефицитной анемии. Лучшая практика Res Clin Haematol. 2005; 18: 319–32. [PubMed] [Google Scholar] 105. Schlemmer U, Frølich W, Prieto RM, Grases F. Фитат в пищевых продуктах и значение для человека: источники пищи, потребление, обработка, биодоступность, защитная роль и анализ.Mol Nutr Food Res. 2009; 53: S330–75. [PubMed] [Google Scholar] 106. Лян Дж., Хан Б.З., Ноут М.Дж., Хамер Р.Дж. Влияние замачивания, прорастания и ферментации на общую фитиновую кислоту и растворимый цинк in vitro в коричневом рисе. Food Chem. 2008; 110: 821–8. [PubMed] [Google Scholar] 107. Кавалли-Сфорца Т., Бергер Дж., Смитасири С., Витери Ф. Еженедельный прием добавок железа и фолиевой кислоты для женщин репродуктивного возраста: обзор воздействия, извлеченные уроки, планы расширения и вклад в достижение целей развития тысячелетия.Nutr Rev.2005; 63: S152–8. [PubMed] [Google Scholar] 109. Oppenheimer SJ. Железо и его отношение к иммунитету и инфекционным заболеваниям. J Nutr. 2001; 131: S616–33. [PubMed] [Google Scholar] 110. Sazawal S, Black RE, Ramsan M, Chwaya HM, Stoltzfus RJ, Dutta A и др. Влияние рутинных профилактических добавок с железом и фолиевой кислотой на госпитализацию и смертность детей дошкольного возраста в условиях высокой передачи малярии: рандомизированное плацебо-контролируемое исследование на уровне общины. Ланцет. 2006; 367: 133–43.[PubMed] [Google Scholar] 112. Hurrell RF. Обогащение железом: его эффективность и безопасность в отношении инфекций. Еда Nutr Bull. 2007. 28: 585–94. [PubMed] [Google Scholar] 114. Лукка П., Харрелл Р., Потрикус И. Борьба с железодефицитной анемией с помощью риса, богатого железом. J Am Coll Nutr. 2002; 21: 184С – 90. [PubMed] [Google Scholar] 115. Рухани Н., Харрелл Р., Келишади Р., Шулин Р. Цинк и его значение для здоровья человека: комплексный обзор. J Res Med Sci. 2013; 18: 144–57. [Бесплатная статья PMC] [PubMed] [Google Scholar]Обзор железа и его значения для здоровья человека
J Res Med Sci.2014 фев; 19 (2): 164–174.
Назанин Аббаспур
Департамент наук о системах окружающей среды, Институт наземных экосистем, Швейцарский федеральный технологический институт, Цюрих, Швейцария
Ричард Харрелл
1 Департамент здравоохранения и технологий, Лаборатория питания человека, Институт пищевых продуктов , Питание и здоровье, Швейцарский федеральный технологический институт, Цюрих, Швейцария
Ройя Келишади
2 Исследовательский центр детского роста и развития, Исфаханский университет медицинских наук, Исфахан, Иран
Департамент науки о системах окружающей среды, Институт наземных исследований Экосистема, Швейцарский федеральный технологический институт, Цюрих, Швейцария
1 Департамент медицинских наук и технологий, Лаборатория питания человека, Институт питания, питания и здоровья Швейцарского федерального технологического института, Цюрих, Швейцария
2 Исследования роста и развития детей Ce nter, Исфаханский университет медицинских наук, Исфахан, Иран
Адрес для корреспонденции: Prof.Роя Келишади, Исследовательский центр детского роста и развития Исфаханский университет медицинских наук, Исфахан, Иран. Эл. Почта: ri.ca.ium.dem@idahsilekПоступила в редакцию 8 июня 2013 г .; Пересмотрено 3 ноября 2013 г .; Принято 27 ноября 2013 г.
Авторские права: © Journal of Research in Medical SciencesЭто статья в открытом доступе, распространяемая в соответствии с условиями Creative Commons Attribution-Noncommercial-Share Alike 3.0 Unported, что разрешает неограниченное использование, распространение и воспроизведение в на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.Abstract
Хорошо известно, что недостаток или чрезмерное воздействие различных элементов оказывает заметное влияние на здоровье человека. Действие элемента определяется несколькими характеристиками, включая абсорбцию, метаболизм и степень взаимодействия с физиологическими процессами. Железо является важным элементом почти для всех живых организмов, поскольку оно участвует в широком спектре метаболических процессов, включая транспорт кислорода, синтез дезоксирибонуклеиновой кислоты (ДНК) и транспорт электронов.Однако, поскольку железо может образовывать свободные радикалы, его концентрацию в тканях организма необходимо строго регулировать, поскольку в чрезмерных количествах оно может привести к повреждению тканей. Нарушения метаболизма железа являются одними из наиболее распространенных заболеваний человека и охватывают широкий спектр заболеваний с различными клиническими проявлениями, от анемии до перегрузки железом и, возможно, до нейродегенеративных заболеваний. В этом обзоре мы обсуждаем последние достижения в исследованиях метаболизма и биодоступности железа, а также наше текущее понимание потребности человека в железе, а также последствий и причин дефицита железа.Наконец, мы обсуждаем стратегии профилактики дефицита железа.
Ключевые слова: Анемия, потребность человека в железе, биодоступность железа, дефицит железа, метаболизм железа
ВВЕДЕНИЕ
С древних времен человек осознавал особую роль железа в здоровье и болезнях. [1] Железо вначале использовалось в медицине египтянами, индуистами, греками и римлянами. [2, 3] В 17 — веках железо использовалось для лечения хлороза (зеленой болезни), состояния, часто возникающего из-за дефицита железа.[4] Однако только в 1932 году важность железа была окончательно установлена убедительным доказательством того, что неорганическое железо необходимо для синтеза гемоглобина. [5] В течение многих лет пищевой интерес к железу был сосредоточен на его роли в образовании гемоглобина и транспорте кислорода. [6] В настоящее время, хотя низкое потребление железа и / или его биодоступность являются причиной большинства анемий в промышленно развитых странах, на них приходится только около половины анемии в развивающихся странах [7], где инфекционные и воспалительные заболевания (особенно малярия), кровопотеря от паразитарных инфекций. , и дефицит других питательных веществ (витамина А, рибофлавина, фолиевой кислоты и витамина B12) также являются важными причинами.[8]
Биохимия и физиология
В отличие от цинка, железо является распространенным элементом на Земле [2,9] и является биологически важным компонентом каждого живого организма. [10,11] Однако, несмотря на его геологическое изобилие, железо часто является фактором, ограничивающим рост в окружающей среде. [9] Этот кажущийся парадокс связан с тем фактом, что при контакте с кислородом железо образует оксиды, которые очень нерастворимы и, следовательно, не доступны для усвоения организмами [2]. В ответ возникли различные клеточные механизмы захвата железа из окружающей среды в биологически полезных формах.Примерами являются сидерофоры, секретируемые микробами для захвата железа в высокоспецифический комплекс [12], или механизмы восстановления железа из нерастворимого трехвалентного железа (Fe +3 ) до растворимой двухвалентной формы (Fe +2 ), как в дрожжах. [13] Многие механизмы, обнаруженные у низших организмов, имеют аналогичные аналоги у высших организмов, включая человека. В организме человека железо в основном существует в сложных формах, связанных с белком (гемопротеином), в виде гемовых соединений (гемоглобин или миоглобин), гемовых ферментов или негемовых соединений (ферменты флавин-железо, переносчики и ферритин).[3] Организму требуется железо для синтеза белков, переносящих кислород, в частности гемоглобина и миоглобина, а также для образования гемовых ферментов и других железосодержащих ферментов, участвующих в переносе электронов и окислении-восстановлении. [14,3] Почти Две трети железа в организме содержится в гемоглобине, присутствующем в циркулирующих эритроцитах, 25% содержится в легко мобилизуемых запасах железа, а оставшиеся 15% связаны с миоглобином в мышечной ткани и с различными ферментами, участвующими в окислительном процессе. метаболизм и многие другие функции клеток.[15]
Железо перерабатывается и, таким образом, сохраняется в организме. показана схематическая диаграмма цикла железа в организме. Железо доставляется к тканям с помощью циркулирующего трансферрина, переносчика, который захватывает железо, высвобождаемое в плазму, в основном из кишечных энтероцитов или ретикулоэндотелиальных макрофагов. Связывание нагруженного железом трансферрина с рецептором трансферрина на клеточной поверхности (TfR) 1 приводит к эндоцитозу и поглощению металлического груза. Интернализованное железо транспортируется в митохондрии для синтеза гема или кластеров железо-сера, которые являются неотъемлемой частью нескольких металлопротеинов, а избыток железа накапливается и детоксифицируется в цитозольном ферритине.
Железо связывается и транспортируется в организме через трансферрин и хранится в молекулах ферритина. После всасывания железа не существует физиологического механизма выведения избыточного железа из организма, кроме кровопотери, то есть беременности, менструации или другого кровотечения обычно низкий, но может колебаться от 5% до 35% в зависимости от обстоятельств и типа железа. [3]
Поглощение железа происходит энтероцитами с помощью переносчика двухвалентного металла 1, члена группы переносчиков растворенных веществ мембранных транспортных белков.Это происходит преимущественно в двенадцатиперстной кишке и верхних отделах тощей кишки [16]. Затем он переносится через слизистую двенадцатиперстной кишки в кровь, где транспортируется трансферрином к клеткам или костному мозгу для эритропоэза [производства красных кровяных телец (эритроцитов)]. [14,17,18] Существует механизм обратной связи, который усиливается. всасывание железа у людей с дефицитом железа. Напротив, люди с перегрузкой железом снижают абсорбцию железа через гепсидин. В настоящее время общепринято, что абсорбция железа контролируется ферропортином, который позволяет или не позволяет железу из клетки слизистой оболочки попадать в плазму.
Физическое состояние железа, поступающего в двенадцатиперстную кишку, сильно влияет на его всасывание. При физиологическом pH двухвалентное железо (Fe +2 ) быстро окисляется до нерастворимой трехвалентной формы (Fe +3 ). Желудочная кислота снижает pH в проксимальном отделе двенадцатиперстной кишки, снижая содержание Fe +3 в просвете кишечника за счет редуктазы железа, тем самым обеспечивая последующий транспорт Fe +2 через апикальную мембрану энтероцитов. Это увеличивает растворимость и поглощение трехвалентного железа.Когда продукция желудочного сока нарушена (например, ингибиторами кислотного насоса, такими как лекарство, прилосек), абсорбция железа существенно снижается.
Диетический гем также может транспортироваться через апикальную мембрану по еще неизвестному механизму и впоследствии метаболизироваться в энтероцитах гемоксигеназой 1 (HO-1) с высвобождением (Fe +2 ) [19]. Этот процесс более эффективен, чем абсорбция неорганического железа, и не зависит от рН двенадцатиперстной кишки. Таким образом, на него не влияют такие ингибиторы, как фитат и полифенолы.Следовательно, красное мясо с высоким содержанием гемоглобина является отличным источником железа. Непосредственно интернализованный Fe +2 обрабатывается энтероцитами и в конечном итоге (или нет) экспортируется через базолатеральную мембрану в кровоток через транспортер ферропортин Fe +2 . Ферропортин-опосредованный отток Fe +2 связан с его повторным окислением с Fe +2 , катализируемым мембраносвязанным ферроксидазой гефестином, который физически взаимодействует с ферропортином [20] и, возможно, также его гомологом в плазме церулоплазмином.Экспортируемое железо улавливается трансферрином, который поддерживает Fe +3 в окислительно-восстановительном инертном состоянии и доставляет его в ткани. Общее содержание железа в трансферрине (≈3 мг) соответствует менее 0,1% железа в организме, но оно очень динамично и подвергается более чем 10-кратному ежедневному обороту для поддержания эритропоэза. Пул трансферрина железа пополняется в основном за счет железа, рециркулируемого из неэффективных эритроцитов, и, в меньшей степени, за счет вновь абсорбированного пищевого железа. Старые эритроциты очищаются ретикулоэндотелиальными макрофагами, которые метаболизируют гемоглобин и гем и высвобождают железо в кровоток.По аналогии с кишечными энтероцитами, макрофаги экспортируют Fe +2 из своей плазматической мембраны через ферропортин в процессе, сопряженном с повторным окислением Fe +2 до Fe +3 церулоплазмином с последующей загрузкой Fe +3. на трансферрин. [21]
Theil et al ., [21] недавно сообщили, что существует также независимый механизм абсорбции растительных ферритинов, в основном присутствующих в бобовых. Однако актуальность переносчика ферритина неясна, поскольку большая часть ферритина, по-видимому, разлагается во время обработки и переваривания пищи, тем самым высвобождая неорганическое железо из оболочки ферритина для поглощения по нормальному механизму.[22] Поскольку одна молекула ферритина содержит 1000 или более атомов железа и на нее также не должны влиять ингибиторы абсорбции железа, такой механизм может стать важным источником железа в развивающихся странах, где обычно потребляются бобовые.
Регуляция гомеостаза железа
Поскольку железо требуется для ряда разнообразных клеточных функций, для поддержания гомеостаза железа требуется постоянный баланс между поглощением, транспортом, хранением и использованием железа. [11] Поскольку в организме отсутствует определенный механизм активного выведения железа, баланс железа в основном регулируется в точке абсорбции.[23,24]
Гепсидин — это циркулирующий пептидный гормон, секретируемый печенью, который играет центральную роль в регуляции гомеостаза железа. Это главный регулятор системного гомеостаза железа, координирующий использование и хранение железа с приобретением железа. [25] Этот гормон в основном вырабатывается гепатоцитами и является негативным регулятором поступления железа в плазму []. Гепсидин действует путем связывания с ферропортином, переносчиком железа, присутствующим на клетках двенадцатиперстной кишки, макрофагах и клетках плаценты.Связывание гепсидина вызывает интернализацию и деградацию ферропортина. [26] Потеря ферропортина с поверхности клетки предотвращает попадание железа в плазму []. Снижение поступления железа в плазму приводит к низкому насыщению трансферрина и меньшему количеству железа доставляется в развивающийся эритробласт. Напротив, снижение экспрессии гепсидина приводит к увеличению ферропортина на клеточной поверхности и увеличению абсорбции железа [27] []. У всех видов концентрация железа в биологических жидкостях строго регулируется, чтобы обеспечить необходимое железо и избежать токсичности, поскольку избыток железа может привести к образованию активных форм кислорода.[28] Гомеостаз железа у млекопитающих регулируется на уровне кишечной абсорбции, поскольку для железа не существует экскреторного пути.
Гепсидин-опосредованная регуляция гомеостаза железа. (а) Повышенная экспрессия гепсидина печенью является результатом воспалительных стимулов. Высокий уровень гепсидина в кровотоке приводит к интернализации и деградации ферропортина, экспортера железа. Потеря ферропортина на клеточной поверхности приводит к загрузке железа макрофагами, низким уровням железа в плазме и снижению эритропоэза из-за снижения количества железа, связанного с трансферрином.Снижение эритропоэза приводит к анемии хронического заболевания. (b) Нормальные уровни гепсидина в ответ на потребность в железе регулируют уровень импорта железа в плазму, нормальное насыщение трансферрина и нормальные уровни эритропоэза. (c) Гемохроматоз или перегрузка железом возникает из-за недостаточного уровня гепсидина, вызывая повышенный импорт железа в плазму, высокое насыщение трансферрина и избыточное отложение железа в печени. Источник: Де Доменико, и др. . [27]
Уровни гепсидина в плазме регулируются различными стимулами, включая цитокины, железо в плазме, анемию и гипоксию.Нарушение регуляции экспрессии гепсидина приводит к нарушениям железа. Избыточная экспрессия гепсидина приводит к анемии хронического заболевания, в то время как низкая выработка гепсидина приводит к наследственному гемохроматозу (HFE) с последующим накоплением железа в жизненно важных органах []. Большинство наследственных заболеваний, связанных с железом, возникают в результате недостаточного производства гепсидина по сравнению со степенью накопления железа в тканях. Было показано, что нарушение экспрессии гепсидина является результатом мутаций в любом из 4 различных генов: TfR2, HFE, гемохроматоз типа 2 (HFE2) и антимикробный пептид гепсидина (HAMP).Мутации в HAMP, гене, кодирующем гепсидин, приводят к болезни, связанной с перегрузкой железом, поскольку отсутствие гепсидина обеспечивает постоянное высокое всасывание железа. Роль других генов (TFR2, HFE и HFE2) в регуляции продукции гепсидина не ясна [27].
Хранение
Концентрация ферритина вместе с концентрацией гемосидерина отражает запасы железа в организме. Они хранят железо в нерастворимой форме и присутствуют в основном в печени, селезенке и костном мозге. [2] Большая часть железа связана с широко распространенным и высококонсервативным железосвязывающим белком ферритином.[18] Гемосидерин представляет собой комплекс хранения железа, который с меньшей готовностью выделяет железо для нужд организма. В условиях устойчивого состояния сывороточные концентрации ферритина хорошо коррелируют с общими запасами железа в организме. [29] Таким образом, сывороточный ферритин является наиболее удобным лабораторным тестом для оценки запасов железа.
Экскреция
Помимо потерь железа из-за менструации, другого кровотечения или беременности, железо очень консервативно и нелегко выводится из организма. [30] Существует некоторая обязательная потеря железа из организма в результате физиологического отшелушивания клеток с эпителиальных поверхностей [30], включая кожу, мочеполовые и желудочно-кишечные тракты.[3] Однако, по оценкам, эти потери очень ограничены (≈1 мг / день). [31] Потери железа из-за кровотечения могут быть значительными, а чрезмерная менструальная кровопотеря является наиболее частой причиной дефицита железа у женщин.
БИОЛОГИЧЕСКАЯ ДОСТУПНОСТЬ
Пищевое железо встречается в двух формах: гемовая и негемовая. [23] Основными источниками гемового железа являются гемоглобин и миоглобин из мяса, птицы и рыбы, тогда как негемовое железо получают из злаков, бобовых, бобовых, фруктов и овощей.[32] Гемовое железо обладает высокой биодоступностью (15–35%), и диетические факторы мало влияют на его абсорбцию, тогда как абсорбция негемового железа намного ниже (2–20%) и сильно зависит от присутствия других пищевых компонентов. [23] Напротив, количество негемового железа в рационе во много раз превышает количество гемового железа в большинстве приемов пищи. Таким образом, несмотря на более низкую биодоступность, негемовое железо обычно вносит больший вклад в питание железом, чем гемовое железо. [33] Основными ингибиторами абсорбции железа являются фитиновая кислота, полифенолы, кальций и пептиды из частично переваренных белков.[23] Усилители — это аскорбиновая кислота и мышечная ткань, которые могут восстанавливать трехвалентное железо до двухвалентного железа и связывать его в растворимые комплексы, доступные для абсорбции. [23]
Факторы, повышающие абсорбцию железа
На абсорбцию железа влияет ряд диетических факторов. Аскорбат и цитрат частично увеличивают усвоение железа, действуя как слабые хелаторы, помогая растворить металл в двенадцатиперстной кишке []. [34] Железо легко переносится из этих соединений в клетки слизистой оболочки. Исследователи продемонстрировали дозозависимый усиливающий эффект нативной или добавленной аскорбиновой кислоты на абсорбцию железа.[34] Усиливающий эффект в значительной степени связан с его способностью восстанавливать трехвалентное железо до двухвалентного железа, но также из-за его способности хелатировать железо. [35] Аскорбиновая кислота преодолеет негативное влияние на абсорбцию железа всех ингибиторов, включая фитат, [36] полифенолы, [37], кальций и белки, содержащиеся в молочных продуктах [38], и увеличит абсорбцию как нативного, так и обогащенного железа. Во фруктах и овощах усиливающий эффект аскорбиновой кислоты часто нивелируется ингибирующим действием полифенолов.[39] Аскорбиновая кислота является единственным усилителем всасывания в вегетарианских диетах, а всасывание железа из вегетарианских и веганских блюд можно оптимизировать путем включения овощей, содержащих аскорбиновую кислоту. [40] Варка, промышленная переработка и хранение разлагают аскорбиновую кислоту и устраняют ее усиливающий эффект на усвоение железа. [41]
Таблица 1
Факторы, которые могут влиять на всасывание железа
Было показано усиливающее действие мяса, рыбы или птицы на всасывание железа из вегетарианских блюд [42], и 30 г мышечной ткани считается эквивалентом 25 мг аскорбиновой кислоты. .[33] Бьорн-Расмуссен и Халлберг [43] сообщили, что добавление курицы, говядины или рыбы к кукурузной муке увеличивало всасывание негемового железа в 2-3 раза без влияния того же количества белка, что и яичного альбумина. Как и в случае с аскорбиновой кислотой, было несколько сложнее продемонстрировать усиливающий эффект мяса при многократном приёме пищи и в полных исследованиях диеты. Редди и др. ., [44] сообщили только о незначительном улучшении всасывания железа (35%) в самостоятельно выбранных диетах в течение 5 дней, когда ежедневное потребление мышечной ткани было увеличено до 300 г / день, хотя в аналогичных 5-дневных рационах. В ходе дневного исследования 60 г свинины, добавленные к вегетарианской диете, увеличили всасывание железа на 50%.[45]
Факторы, ингибирующие абсорбцию железа
В растительной диете фитат (мио-инозитол гексакисфосфат) является основным ингибитором абсорбции железа. [23] Было показано, что отрицательное влияние фитата на абсорбцию железа зависит от дозы и начинается с очень низких концентраций 2-10 мг / прием пищи. [37,46] Молярное отношение фитата к железу может быть использовано для оценки влияния на абсорбцию. . Соотношение должно составлять 1: 1 или предпочтительно 0,4: 1 для значительного улучшения всасывания железа в простых злаковых или бобовых блюдах, которые не содержат каких-либо усилителей усвоения железа, или 6: 1 в комбинированных блюдах с некоторыми овощами, содержащими аскорбиновую кислоту. кислота и мясо как усилители.[47]
Полифенолы содержатся в различных количествах в растительной пище и напитках, таких как овощи, фрукты, некоторые злаки и бобовые, чай, кофе и вино. Ингибирующее действие полифенолов на абсорбцию железа было показано с черным чаем и, в меньшей степени, с травяными чаями. [48,49] В зерновых и бобовых культурах полифенолы усиливают ингибирующий эффект фитата, как было показано в исследовании, сравнивающем сорго с высоким и низким содержанием полифенолов. [23]
Было показано, что кальций отрицательно влияет на абсорбцию негемового и гемового железа, что отличает его от других ингибиторов, влияющих только на абсорбцию негемового железа.[50] Дозозависимые ингибирующие эффекты были показаны при дозах 75-300 мг, когда кальций добавлялся в булочки, и при дозах 165 мг кальция из молочных продуктов. [51] Предполагается, что исследования однократного приема пищи показывают отрицательное влияние кальция на абсорбцию железа, тогда как исследования многократного приема пищи с большим разнообразием продуктов и различными концентрациями других ингибиторов и усилителей показывают, что кальций лишь ограниченно влияет на абсорбцию железа. [52]
Было показано, что животные белки, такие как молочные белки, яичные белки и альбумин, ингибируют абсорбцию железа.[53] Было показано, что две основные белковые фракции коровьего молока, казеин и сыворотка, а также яичный белок ингибируют абсорбцию железа у человека. [54] Белки сои также снижают всасывание железа. [55]
Конкуренция с железом
Исследования конкуренции показывают, что некоторые другие тяжелые металлы могут участвовать в пути всасывания железа в кишечнике. К ним относятся свинец, марганец, кобальт и цинк. Поскольку дефицит железа часто сочетается с интоксикацией свинцом, это взаимодействие может вызвать особенно серьезные медицинские осложнения у детей.[56]
Свинец является особенно опасным элементом для метаболизма железа. [57] Свинец поглощается механизмом поглощения железа (DTM1) и вторично блокирует железо за счет конкурентного торможения. Кроме того, свинец препятствует ряду важных железозависимых метаболических этапов, таких как биосинтез гема. Это многогранное влияние имеет особенно тяжелые последствия для детей, поскольку свинец не только вызывает анемию, но и может ухудшить когнитивное развитие. Свинец естественным образом присутствует в больших количествах в грунтовых водах и почве в некоторых регионах и может тайно нанести вред здоровью детей.По этой причине большинство педиатров в США обычно проверяют содержание свинца в раннем возрасте с помощью простого анализа крови.
ТРЕБОВАНИЯ К ЧЕЛОВЕКУ
В раннем детстве потребности в железе удовлетворяются за счет небольшого количества железа, содержащегося в грудном молоке. [58] Потребность в железе заметно возрастает через 4-6 месяцев после рождения и составляет около 0,7-0,9 мг / день в течение оставшейся части первого года [58]. В возрасте от 1 до 6 лет содержание железа в организме снова увеличивается вдвое. [58] Потребность в железе также очень высока у подростков, особенно в период скачка роста.У девочек обычно происходит скачок роста до менархе, но к этому времени рост не заканчивается. У мальчиков наблюдается заметное увеличение массы и концентрации гемоглобина в период полового созревания. На этой стадии потребности в железе повышаются до уровня, превышающего средние потребности в железе у менструирующих женщин [58] [см.].
Таблица 2
Потребность в железе 97,5% людей с точки зрения абсорбированного железа a , по возрастным группам и полу (Всемирная организация здравоохранения, 1989 г.) ее тело.Точный баланс между потреблением и потерей пищи поддерживает этот баланс. Около 1 мг железа теряется каждый день из-за отшелушивания клеток кожи и слизистых оболочек, включая слизистую оболочку желудочно-кишечного тракта. [59] Менструация увеличивает среднесуточную потерю железа примерно до 2 мг в день у взрослых женщин в пременопаузе. [60] Увеличение массы тела во время скачков роста в неонатальном и детском возрасте временно увеличивает потребность в железе. [61]
Потребление железа с пищей необходимо для восполнения потери железа с калом и мочой, а также через кожу.Эти базальные потери составляют примерно 0,9 мг железа для взрослого мужчины и 0,8 мг для взрослой женщины. [62] У женщин репродуктивного возраста необходимо учитывать потерю железа с менструальной кровью [].
ГРУППЫ ПОВЫШЕННОГО РИСКА
Наибольшая вероятность дефицита железа обнаруживается в тех частях населения, которые не имеют надлежащего доступа к пище, богатой усвояемым железом, во время стадий высокой потребности в железе. Эти группы соответствуют детям, подросткам и женщинам репродуктивного возраста, особенно во время беременности.[63,58]
У младенцев и подростков повышенная потребность в железе является результатом быстрого роста. Для женщин репродуктивного возраста основная причина — чрезмерная кровопотеря во время менструации. Во время беременности потребность в железе значительно возрастает из-за быстрого роста плаценты и плода, а также увеличения глобулярной массы. [63] Напротив, взрослые мужчины и женщины в постменопаузе имеют низкий риск дефицита железа, и количество железа в нормальном рационе обычно достаточно для удовлетворения их физиологических потребностей.[63]
ПОСЛЕДСТВИЯ И ПРИЧИНЫ ДЕФИЦИТА ЖЕЛЕЗА
Последствия дефицита железа
Дефицит железа определяется как состояние, при котором отсутствуют мобилизуемые запасы железа и при котором появляются признаки нарушения поступления железа в ткани, включая эритрон. , отмечены. [64] Дефицит железа может сопровождаться анемией или без нее. Некоторые функциональные изменения могут произойти и в отсутствие анемии, но наиболее функциональные нарушения, по-видимому, возникают при развитии анемии. [2] Даже легкие и умеренные формы железодефицитной анемии могут быть связаны с функциональными нарушениями, влияющими на когнитивное развитие [65], механизмы иммунитета [66] и работоспособность.[67] Дефицит железа во время беременности связан с множеством неблагоприятных исходов как для матери, так и для ребенка, включая повышенный риск сепсиса, материнской смертности, перинатальной смертности и низкой массы тела при рождении. [68] Дефицит железа и анемия также снижают способность к обучению и связаны с повышенным уровнем заболеваемости. [68]
Причины дефицита железа
Дефицит железа возникает в результате истощения запасов железа и возникает, когда абсорбция железа не может идти в ногу с метаболическими потребностями в железе для поддержания роста и восполнения потери железа, что в первую очередь связано с кровопотерей .[2] Основные причины дефицита железа включают низкое потребление биодоступного железа, повышенную потребность в железе в результате быстрого роста, беременности, менструации и избыточную кровопотерю, вызванную патологическими инфекциями, такими как анкилостомы и власоглавы, вызывающие потерю крови из желудочно-кишечного тракта [2] 69,70,71,72] и нарушение всасывания железа. [73] Частота дефицита железа увеличивается у девочек-подростков, потому что менструальные потери железа накладываются на потребность в быстром росте [74]. Другими факторами риска дефицита железа у молодых женщин являются высокий паритет, использование внутриматочной спирали и вегетарианская диета.[75]
Дефицит железа в питании возникает, когда физиологические потребности не могут быть удовлетворены за счет абсорбции железа из рациона. [72] Биодоступность пищевого железа низка в группах населения, потребляющих однообразные растительные диеты с небольшим количеством мяса. [72] Во многих развивающихся странах растительные продукты для отлучения от груди редко обогащаются железом, а частота анемии превышает 50% у детей младше 4 лет. [64]
Когда запасы железа истощаются и железа недостаточно для эритропоэза, синтез гемоглобина в предшественниках эритроцитов нарушается и появляются гематологические признаки железодефицитной анемии.
ОЦЕНКА СТАТУСА ЖЕЛЕЗА
Дефицит железа и, в конечном итоге, анемия развиваются поэтапно и могут быть оценены путем измерения различных биохимических показателей. Хотя некоторые ферменты железа чувствительны к дефициту железа [63], их активность не использовалась в качестве успешного рутинного измерения статуса железа [2].
Лабораторные измерения необходимы для правильной диагностики дефицита железа. Они наиболее информативны, когда несколько показателей уровня железа исследуются и оцениваются в контексте питания и истории болезни.
Пул железа в плазме или сыворотке — это фракция всего железа в организме, которая циркулирует в основном связанном с трансферрином. Три способа оценки уровня железа в плазме или сыворотке включают: 1) измерение общего содержания железа в единице объема в мкг / дл; 2) измерение общего количества сайтов связывания для атомов железа на трансферрине, известного как общая железосвязывающая способность в мкг / дл 2 ; и 3) оценка процента двух сайтов связывания на всех занятых молекулах трансферрина, называемого процентным насыщением трансферрина.[76] Однако заметные биологические вариации этих значений могут возникать в результате суточных колебаний, наличия инфекции или воспалительных состояний и недавнего потребления железа с пищей. [76]
Протопорфирин цинка отражает нехватку железа на последних стадиях синтеза гемоглобина, так что цинк вставляется в молекулу протопорфирина вместо железа. Протопорфирин цинка может быть обнаружен в эритроцитах с помощью флуориметрии и является мерой тяжести дефицита железа. [76]
Сывороточный ферритин является хорошим индикатором запасов железа в организме в большинстве случаев.Когда концентрация сывороточного ферритина ≥15 мкг / л, присутствуют запасы железа; более высокие концентрации отражают размер хранилища железа; при низкой концентрации (<12 мкг / л для детей младше 5 лет и <15 мкг / л для детей старше 5 лет) запасы железа истощаются. [76] Однако ферритин является белком-реагентом острой фазы, и его сывороточные концентрации могут быть повышены независимо от изменения запасов железа, инфекции или воспаления. [76,2] Это означает, что может быть трудно интерпретировать концентрацию ферритина там, где инфекция болезни распространены.
Еще одним индикатором статуса железа является концентрация TfR в сыворотке крови. Поскольку TfR в основном происходит из развивающихся эритроцитов, он отражает интенсивность эритропоэза и потребность в железе. Когда запасы железа истощаются, концентрация повышается при железодефицитной анемии, что указывает на серьезную недостаточность железа. Это при условии, что нет других причин аномального эритропоэза. [76] Клинические исследования показывают, что сывороточный TfR менее подвержен воспалению, чем сывороточный ферритин. [77] Основным преимуществом TfR как индикатора является возможность оценки величины функционального дефицита железа после истощения запасов железа.[78]
Отношение TfR к ферритину (TfR / ферритин) было разработано для оценки изменений как в хранящемся железе, так и в функциональном железе и считается более полезным, чем TfR или только ферритин. [79] TfR / ферритин использовался для оценки запасов железа в организме как у детей, так и у взрослых. [80] Однако высокая стоимость и отсутствие стандартизации анализа TfR до сих пор ограничивают применимость метода [81].
Низкая концентрация гемоглобина является показателем анемии, конечной стадии дефицита железа.[76,2]
АНЕМИЯ И ЕЕ ПРИЧИНЫ
Анемия описывает состояние, при котором количество эритроцитов в крови низкое или в клетках крови содержится меньше нормального гемоглобина. Человека, страдающего анемией, называют анемичным. Целью эритроцитов является доставка кислорода из легких в другие части тела. Молекула гемоглобина является функциональной единицей эритроцитов и представляет собой сложную белковую структуру, которая находится внутри эритроцитов. Несмотря на то, что эритроциты производятся в костном мозге, в их производство вовлечены многие другие факторы.Например, железо — очень важный компонент молекулы гемоглобина; эритропоэтин, молекула, секретируемая почками, способствует образованию эритроцитов в костном мозге.
Наличие правильного количества эритроцитов и профилактика анемии требует взаимодействия между почками, костным мозгом и питательными веществами в организме. Если почки или костный мозг не функционируют, или организм плохо питается, то нормальное количество и функции эритроцитов может быть трудно поддерживать.
Анемия на самом деле является признаком болезненного процесса, а не самой болезни.Обычно его классифицируют как хронический или острый. Хроническая анемия возникает в течение длительного периода времени. Острая анемия возникает быстро. Определение того, присутствует ли анемия в течение длительного времени или это что-то новое, помогает врачам найти причину. Это также помогает предсказать, насколько серьезными могут быть симптомы анемии. При хронической анемии симптомы обычно начинаются медленно и постепенно прогрессируют; тогда как при острой анемии симптомы могут быть резкими и более тревожными.
Эритроциты живут около 100 дней, поэтому организм постоянно пытается их заменить.У взрослых производство эритроцитов происходит в костном мозге. Врачи пытаются определить, вызвано ли низкое количество эритроцитов повышенной кровопотерей эритроцитов или их снижением в костном мозге. Знание того, изменилось ли количество лейкоцитов и / или тромбоцитов, также помогает определить причину анемии.
По оценкам Всемирной организации здравоохранения (ВОЗ), два миллиарда человек во всем мире страдают анемией и примерно 50% всех анемий объясняются дефицитом железа. [64] Это происходит на всех этапах жизненного цикла, но чаще встречается у беременных женщин и маленьких детей.[82] Анемия является результатом множества причин, которые можно изолировать, но чаще всего они сосуществуют. Некоторые из этих причин включают следующие:
Железодефицитная анемия
Наиболее важной и частой причиной анемии является дефицит железа. [82] Если потребление железа ограничено или неадекватно из-за плохого питания, в результате может возникнуть анемия. Это называется железодефицитной анемией. Железодефицитная анемия также может возникать при наличии язвы желудка или других источников медленного хронического кровотечения (рак толстой кишки, рак матки, полипы кишечника, геморрой и т. Д.).[83]
Анемия хронического заболевания
Любое длительное заболевание может привести к анемии. Этот тип анемии является вторым по распространенности после анемии, вызванной дефицитом железа, и развивается у пациентов с острым или хроническим системным заболеванием или воспалением. [84] Это состояние было названо «анемией воспаления» из-за повышенного содержания гепсидина, который блокирует как рециркуляцию железа из макрофагов, так и абсорбцию железа. [85]
Анемия из-за активного кровотечения
Потеря крови из-за обильного менструального кровотечения или ран может вызвать анемию.[82] Язвы желудочно-кишечного тракта или раковые заболевания, такие как рак толстой кишки, могут медленно терять кровь и также могут вызывать анемию. [86,87]
Анемия, связанная с заболеванием почек
Почки выделяют гормон эритропоэтин, который помогает костному мозгу сделать эритроциты. У людей с хроническим (длительным) заболеванием почек выработка этого гормона снижена, а это, в свою очередь, снижает выработку эритроцитов, вызывая анемию. [88] Хотя дефицит эритропоэтина является основной причиной анемии при хронической почечной недостаточности, это не единственная причина.Следовательно, необходимо минимальное обследование, чтобы исключить дефицит железа и другие аномалии клеточной линии. [89]
Анемия, связанная с беременностью
Увеличение объема плазмы во время беременности приводит к разбавлению эритроцитов и может проявляться как анемия. [90] Железодефицитная анемия составляет 75% всех анемий во время беременности. [90]
Анемия, связанная с плохим питанием
Витамины и минералы необходимы для образования эритроцитов. Помимо железа, для правильного производства гемоглобина необходимы витамин B12, виамин А, фолиевая кислота, рибофлавин и медь.[82] Дефицит любого из этих питательных микроэлементов может вызвать анемию из-за недостаточного производства эритроцитов. Плохое питание — важная причина низкого уровня витаминов и, как следствие, анемии.
Ожирение и анемия
Ожирение характеризуется хроническим слабым системным воспалением, повышенным уровнем гепсидина, что, в свою очередь, связано с анемией хронического заболевания. Ausk и Ioannou [91] предположили, что ожирение может быть связано с особенностями анемии хронического заболевания, включая низкую концентрацию гемоглобина, низкое содержание железа и трансферрина в сыворотке, а также повышенный уровень ферритина в сыворотке.Избыточный вес и ожирение были связаны с изменениями сывороточного железа, насыщения трансферрина и ферритина, которые, как ожидается, произойдут в условиях хронического системного воспаления. Воспаление, связанное с ожирением, может повышать концентрацию гепсидина и снижать доступность железа. Aeberli и др. , [92] сравнили уровень железа, потребление железа с пищей и его биодоступность, а также циркулирующие уровни гепсидина, лептина и интерлейкина-6 (ИЛ-6) у детей с избыточной массой тела и детей с нормальным весом.Они указали, что имеется пониженная доступность железа для эритропоэза у детей с избыточным весом и что это, вероятно, связано с опосредованным гепсидином сниженным всасыванием железа и / или повышенным секвестрацией железа, а не с низким содержанием железа с пищей.
Алкоголизм
Алкоголь оказывает многочисленные неблагоприятные эффекты на различные типы клеток крови и их функции. [93] У алкоголиков часто есть дефектные эритроциты, которые преждевременно разрушаются. [93,94] Сам по себе алкоголь также может быть токсичным для костного мозга и может замедлять производство эритроцитов.[93,94] Кроме того, с алкоголизмом связаны плохое питание и дефицит витаминов и минералов. [95] Сочетание этих факторов может привести к анемии у алкоголиков.
Серповидно-клеточная анемия
Серповидно-клеточная анемия — одно из наиболее распространенных наследственных заболеваний. [96] Это заболевание, связанное с кровью, которое влияет на молекулу гемоглобина и приводит к изменению формы всей клетки крови в стрессовых условиях [97]. В таком состоянии проблема с гемоглобином бывает качественной или функциональной.Аномальные молекулы гемоглобина могут вызвать проблемы в целостности структуры эритроцитов, и они могут стать серповидными (серповидные клетки). [97] Существуют разные типы серповидно-клеточной анемии разной степени тяжести. Это особенно распространено у африканцев, ближневосточных и средиземноморских предков. [97]
Талассемия
Это еще одна группа причин анемии, связанных с гемоглобином, которая связана с отсутствием или ошибками в генах, ответственных за выработку гемоглобина. [97] Молекула гемоглобина имеет субъединицы, обычно называемые альфа- и бета-цепями глобина.Отсутствие определенной субъединицы определяет тип альфа- или бета-талассемии. [97,98] Существует много типов талассемии, которые различаются по степени тяжести от легкой (малая талассемия) до тяжелой (большая талассемия). [98] Они также являются наследственными, но вызывают количественные аномалии гемоглобина, то есть вырабатывается недостаточное количество молекул правильного типа. Альфа- и бета-талассемии являются наиболее распространенными наследственными моногенными заболеваниями в мире с наибольшей распространенностью в регионах, где малярия была или все еще является эндемической.[97]
Апластическая анемия
Апластическая анемия — это заболевание, при котором разрушается костный мозг и снижается выработка клеток крови. [99] Это вызывает дефицит всех трех типов клеток крови (панцитопения), включая эритроциты (анемия), лейкоциты (лейкопения) и тромбоциты (тромбоцитопения). [100,101] Многие распространенные лекарства могут иногда вызывать этот тип анемии в качестве побочного эффекта. у некоторых людей. [99]
Гемолитическая анемия
Гемолитическая анемия — это тип анемии, при которой происходит разрыв эритроцитов, известный как гемолиз, который разрушается быстрее, чем костный мозг может их заменить.[102] Гемолитическая анемия может возникнуть по разным причинам и часто классифицируется как приобретенная или наследственная. Распространенными приобретенными причинами гемолитической анемии являются аутоиммунитет, микроангиопатия и инфекции. Нарушения ферментов эритроцитов, мембран и гемоглобина вызывают наследственную гемолитическую анемию. [102]
ПРЕДОТВРАЩЕНИЕ НЕДОСТАТОЧНОСТИ ЖЕЛЕЗА (СТРАТЕГИИ ВМЕШАТЕЛЬСТВА)
Четыре основных стратегии коррекции эффективности микронутриентов в популяциях могут использоваться для коррекции дефицита железа, как по отдельности, так и в комбинации.Это обучение в сочетании с модификацией диеты для улучшения потребления железа и его биодоступности; добавление железа (обеспечение железом, обычно в более высоких дозах, без еды), обогащение пищевых продуктов железом и новый подход к биофортификации. Однако есть некоторые трудности в применении некоторых из этих стратегий при рассмотрении железа.
Диверсификация продуктов питания
Модификации диеты для сокращения потребления Индийской стоматологической ассоциации включают увеличение потребления продуктов, богатых железом, особенно мясных продуктов, увеличение потребления фруктов и овощей, богатых аскорбиновой кислотой, для увеличения абсорбции негемового железа и снижение потребления чая и кофе, которые подавляют всасывание негемового железа.[103,58] Другая стратегия — снизить содержание антинутриентов, чтобы сделать железо, поступающее из их пищевых источников, более доступным. Биодоступность железа может быть увеличена такими методами, как проращивание и ферментация, которые способствуют ферментативному гидролизу фитиновой кислоты в цельнозерновых зерновых и бобовых культурах за счет повышения активности эндогенных или экзогенных ферментов фитазы. [104] Даже использование неферментативных методов, таких как термическая обработка, замачивание и измельчение, для снижения содержания фитиновой кислоты в основных продуктах растительного происхождения позволило улучшить биодоступность железа (и цинка).[105,106]
Добавка
Для перорального приема добавок железа предпочтительны соли двухвалентного железа (сульфат двухвалентного железа и глюконат двухвалентного железа) из-за их низкой стоимости и высокой биодоступности. [72] Хотя абсорбция железа выше при приеме добавок железа натощак, тошнота и боль в эпигастрии могут развиться из-за введенных более высоких доз железа (обычно 60 мг Fe / день). Если возникают такие побочные эффекты, следует попытаться снизить дозу между приемами пищи или давать железо во время еды, хотя пища снижает всасывание лекарственного железа примерно на две трети.[107] Добавки железа во время беременности рекомендуется в развивающихся странах, где женщины часто вступают в беременность с низкими запасами железа. [108] Хотя обычно считалось, что польза от приема добавок железа перевешивает предполагаемый риск, есть некоторые свидетельства того, что добавление в дозах, рекомендованных для здоровых детей, несет в себе риск увеличения тяжести инфекционного заболевания на фоне малярии. [109,110]
Обогащение
Обогащение пищевых продуктов железом сложнее, чем обогащение такими питательными веществами, как цинк в муке, йод в соли и витамин А в кулинарном масле.[72] Наиболее биодоступные соединения железа растворимы в воде или разбавленной кислоте, но часто вступают в реакцию с другими пищевыми компонентами, вызывая неприятный запах, изменение цвета или окисление жиров. [103] Таким образом, менее растворимые формы железа, хотя и хуже усваиваются, часто выбираются для обогащения, чтобы избежать нежелательных сенсорных изменений. [72] Обогащение обычно производится с гораздо меньшими дозами железа, чем с добавками. Это ближе к физиологической среде и может быть самым безопасным вмешательством в малярийных областях. [111] Нет никаких опасений по поводу безопасности добавок железа или обогащения железа в немалярийных эндемичных районах.[112]
Соединения железа, рекомендованные [7] для обогащения пищевых продуктов, включают сульфат железа, фумарат железа, пирофосфат железа и порошок электролитического железа. Пшеничная мука является наиболее распространенным пищевым продуктом, обогащенным железом, и обычно она обогащается порошками элементарного железа, которые не рекомендуются ВОЗ. [7,113] Харрелл и Эгли [23] сообщили, что из 78 национальных программ по пшеничной муке только восемь улучшатся. статус железа. В этих программах использовались рекомендуемые соединения железа на рекомендованных уровнях.В других странах использовались не рекомендуемые соединения или более низкие уровни железа по сравнению с потреблением муки. Коммерческое детское питание, такое как смеси и злаки, также обычно обогащено железом.
Биофортификация
Содержание железа колеблется от 25 до 56 мг / кг в различных сортах пшеницы и от 7 до 23 мг / кг в зернах риса. Однако большая часть этого железа удаляется в процессе измельчения. Поглощение железа зерновыми и бобовыми культурами, многие из которых имеют высокое содержание самородного железа, обычно низкое из-за высокого содержания в них фитата, а иногда и полифенолов.[48] Стратегии биофортификации включают селекцию растений и генную инженерию. Уровни железа в обычных бобах и просе были успешно увеличены за счет селекции растений, но использование других основных продуктов питания является более трудным или невозможным (рис) из-за недостаточной естественной генетической изменчивости. Lucca и др. ., [114] увеличили содержание железа в эндосперме риса, чтобы улучшить его всасывание в кишечнике человека с помощью генной инженерии. Они ввели ген ферритина из Phaseolus vulgaris в рисовые зерна, увеличив содержание железа в них вдвое.Для увеличения биодоступности железа они ввели в эндосперм риса термотолерантную фитазу из Aspergillus fumigatus . Они указали, что этот рис с более высоким содержанием железа и богатым фитазой имеет большой потенциал для существенного улучшения питания железом в тех популяциях, где дефицит железа так широко распространен. [114] К сожалению, фитаза не устояла перед приготовлением. Важность различных минералов, таких как цинк [115] и железо, требует большего внимания на индивидуальном уровне и уровне общественного здравоохранения.
Сноски
Источник поддержки: Нет
Конфликт интересов: Не объявлен.
СПИСОК ЛИТЕРАТУРЫ
1. Борода Дж. Л., Доусон HD. Железо. В: О’Делл Б.Л., Сунде Р.А., редакторы. Справочник по незаменимым в питании минеральным элементам. Нью-Йорк: CRC Press; 1997. С. 275–334. [Google Scholar] 2. Вуд Р.Дж., Ронненберг А. Железо. В: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, редакторы. Современное питание в здоровье и болезнях. 10-е изд. Балтимор: Липпинкотт Уильямс и Уилкинс; 2005 г.С. 248–70. [Google Scholar] 3. Макдауэлл LR. 2-е изд. Амстердам: Elsevier Science; 2003. Минералы в питании животных и человека; п. 660. [Google Scholar] 4. Гуггенхайм KY. Хлороз: возникновение и исчезновение болезни, связанной с питанием. J Nutr. 1995; 125: 1822–5. [PubMed] [Google Scholar] 5. Ип Р., Даллман PR. Железо. В: Ziegler EE, Filer LJ, редакторы. Присутствуют знания в области питания. 7-е изд. Вашингтон, округ Колумбия: ILSI Press; 1996. С. 278–92. [Google Scholar] 6. Андервуд Э.Дж., Саттл Н.Ф. 3-е изд. Уоллингфорд: Международное издательство CABI; 1999 г.Минеральное питание скота; п. 614. [Google Scholar] 7. Аллен Л., де Бенуа Б., Дари О., Харрелл Р., редакторы. Женева: ВОЗ и ФАО; 2006. ВОЗ. Рекомендации по обогащению пищевых продуктов микронутриентами; п. 236. [Google Scholar] 8. Брабин Б.Дж., Премжи З., Верхое ff Ф. Анализ анемии и детской смертности. J Nutr. 2001; 131: 636–45С. [PubMed] [Google Scholar] 9. Quintero-Gutiérrez AG, González-Rosendo G, Sánchez-Muñoz J, Polo-Pozo J, Rodríguez-Jerez JJ. Биодоступность гемового железа в начинке для печенья с использованием поросят в качестве модели животных для человека.Int J Biol Sci. 2008; 4: 58–62. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Айзен П., Эннс С., Весслинг-Резник М. Химия и биология метаболизма железа в эукариотах. Int J Biochem Cell Biol. 2001; 33: 940–59. [PubMed] [Google Scholar] 11. Лиу П. Т., Хейскала М., Петерсон П. А., Ян Ю. Роль железа в здоровье и болезнях. Мол Аспекты Мед. 2001; 2: 1–87. [PubMed] [Google Scholar] 12. Guerinot ML. Транспорт микробного железа. Annu Rev Microbiol. 1994; 48: 743–72. [PubMed] [Google Scholar] 13. Асквит К., Каплан Дж.Транспорт железа и меди в дрожжах и его значение для болезней человека. Trends Biochem Sci. 1998. 23: 135–8. [PubMed] [Google Scholar] 15. Вашингтон, округ Колумбия: Национальная академия прессы; 2001. МОМ. Институт медицины. железо. В: Диетические рекомендуемые дозы витамина А, витамина К, мышьяка, бора, хрома, меди, йода, железа, марганца, молибдена, никеля, кремния, ванадия и цинка; С. 290–393. [PubMed] [Google Scholar] 16. Muir A, Hopfer U. Региональная специфичность поглощения железа щеточно-граничными мембранами тонкого кишечника у нормальных мышей и мышей с дефицитом железа.Am J Physiol. 1985; 248: G376–9. [PubMed] [Google Scholar] 17. Фрейзер Д.М., Андерсон Г.Дж. Импорт железа. I. Абсорбция железа в кишечнике и ее регуляция. Am J Physiol Gastrointest Liver Physiol. 2005; 289: G631–5. [PubMed] [Google Scholar] 18. Наддур С.С., Шрирама К., Мудипалли А. Механизмы транспорта и гомеостаза железа: их роль в здоровье и болезнях. Индийский J Med Res. 2008; 128: 533–44. [PubMed] [Google Scholar] 20. Yeh KY, Yeh M, Mims L, Glass J. Кормление железом индуцирует миграцию и взаимодействие ферропортина 1 и гефестина в двенадцатиперстном эпителии крыс.Am J Physiol Gastrointest Liver Physiol. 2009. 296: 55–65. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Тейл Э.С., Чен Х., Миранда С., Янсер Х., Эльзенханс Б., Нуньес М.Т. и др. Абсорбция железа из ферритина не зависит от гемового железа и солей двухвалентного железа у женщин и сегментов кишечника крыс. J Nutr. 2012; 142: 478–83. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Hoppler M, Schoenbaechler A, Meile L, Hurrell RF, Walczyk T. Ферритин-железо высвобождается во время кипячения и in vitro при пищеварении в желудке .J Nutr. 2008. 138: 878–84. [PubMed] [Google Scholar] 23. Hurrell R, Egli I. Биодоступность железа и диетические контрольные значения. Am J Clin Nutr. 2010; 91: 1461–7S. [PubMed] [Google Scholar] 25. Немет Э., Ганц Т. Регулирование метаболизма железа гепсидином. Annu Rev Nutr. 2006; 26: 323–42. [PubMed] [Google Scholar] 26. Немет Э., Таттл М.С., Пауэлсон Дж., Вон М.Б., Донован А., Уорд Д.М. и др. Гепсидин регулирует отток клеточного железа, связываясь с ферропортином и индуцируя его интернализацию. Наука. 2004; 306: 2090–3.[PubMed] [Google Scholar] 28. Браун В., Киллманн Х. Бактериальные решения проблемы снабжения железом. Trends Biochem Sci. 1999; 24: 104–109. [PubMed] [Google Scholar] 29. Хант-младший. Насколько важна биодоступность железа с пищей? Am J Clin Nutr. 2001; 73: 3–4. [PubMed] [Google Scholar] 30. Хант-младший, Зито, Калифорния, Джонсон, Лос-Анджелес. Выведение железа из организма здоровыми мужчинами и женщинами. Am J Clin Nutr. 2009; 89: 1–7. [PubMed] [Google Scholar] 31. Фэрбенкс В.Ф. Железо в медицине и питании. В: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, редакторы.Современное питание в здоровье и болезнях. 10-е изд. Балтимор: Липпинкотт Уильямс и Уилкинс; 1999. С. 193–221. [Google Scholar] 32. потребности человека в витаминах и минералах. Рим: ФАО; 2001. ФАО / ВОЗ. Пищевые подходы к удовлетворению потребностей в витаминах и минералах; С. 7–25. [Google Scholar] 33. Monsen ER, Hallberg L, Layrisse M, Hegsted DM, Cook JD, Mertz W. и др. Оценка доступного пищевого железа. Am J Clin Nutr. 1978; 31: 134–41. [PubMed] [Google Scholar] 34. Конрад ME, Umbreit JN. Краткий обзор: абсорбция железа — путь муцин-мобилферрин-интегрин.Конкурентоспособный путь поглощения металлов. Am J Hematol. 1993; 42: 67–73. [PubMed] [Google Scholar] 35. Конрад М.Э., Шаде С.Г. Хелаты аскорбиновой кислоты в абсорбции железа: роль соляной кислоты и желчи. Гастроэнтерология. 1968; 55: 35–45. [PubMed] [Google Scholar] 36. Холлберг Л., Брюн М., Россандер Л. Поглощение железа у человека: аскорбиновая кислота и дозозависимое ингибирование фитатом. Am J Clin Nutr. 1989; 49: 140–4. [PubMed] [Google Scholar] 37. Зигенберг Д., Бейнс Р.Д., Ботвелл Т.Х., Макфарлейн Б.Дж., Лампарелли Р.Д., Car NG и др.Аскорбиновая кислота предотвращает дозозависимое ингибирующее действие полифенолов и фитатов на абсорбцию негемового железа. Am J Clin Nutr. 1991; 53: 537–41. [PubMed] [Google Scholar] 38. Стекель А., Оливарес М., Писарро Ф., Чадуд П., Лопес И., Амар М. Поглощение обогащающего железа из молочных смесей у младенцев. Am J Clin Nutr. 1986; 43: 917–22. [PubMed] [Google Scholar] 39. Бюллетень D, Бейнс Р.Д., Ботвелл Т.Х., Гиллули М., Макфарлейн Б.Дж., Макфейл А.П. и др. Влияние фруктовых соков и фруктов на усвоение железа из рисовой муки.Br J Nutr. 1987. 57: 331–43. [PubMed] [Google Scholar] 40. Линч SR, Кук JD. Взаимодействие витамина С и железа. Ann N Y Acad Sci. 1980; 355: 32–44. [PubMed] [Google Scholar] 41. Teucher B, Olivares M, Cori H. Усилители поглощения железа: аскорбиновая кислота и другие органические кислоты. Int J Vitam Nutr Res. 2004; 74: 403–19. [PubMed] [Google Scholar] 42. Линч С.Р., Харрелл Р.Ф., Дассенко С.А., Кук Дж.Д. Влияние пищевых белков на биодоступность железа у человека. Adv Exp Med Biol. 1989; 249: 117–32. [PubMed] [Google Scholar] 43.Бьорн-Расмуссен Э., Халльберг Л. Влияние животных белков на усвоение пищевого железа человеком. Нутр Метаб. 1979; 23: 192–202. [PubMed] [Google Scholar] 44. Редди МБ, Харрелл Р.Ф., Кук Дж.Д. Разнообразное питание незначительно влияет на всасывание негемового железа у нормальных людей. J Nutr. 2006; 136: 576–81. [PubMed] [Google Scholar] 45. Бах Кристенсен М., Хелс О, Морберг С., Марвинг Дж., Бугель С., Тетенс I. Свинина увеличивает усвоение железа при 5-дневной полностью контролируемой диете по сравнению с вегетарианской диетой с аналогичным содержанием витамина С и фитиновой кислоты.Br J Nutr. 2005. 94: 78–83. [PubMed] [Google Scholar] 46. Харрелл Р.Ф., Джуллерат М.А., Редди М.Б., Линч С.Р., Дассенко С.А., Кук Дж.Д. Соевый белок, фитат и абсорбция железа у человека. Am J Clin Nutr. 1992; 56: 573–8. [PubMed] [Google Scholar] 47. Hurrell RF. Разложение фитиновой кислоты как средство улучшения усвоения железа. Int J Vitam Nutr Res. 2004. 74: 445–52. [PubMed] [Google Scholar] 48. Харрелл Р.Ф., Редди М., Кук Дж. Д.. Подавление абсорбции негемного железа у человека напитками, содержащими полифенолы. Br J Nutr.1999. 81: 289–95. [PubMed] [Google Scholar] 49. Холлберг Л., Россандер Л. Влияние различных напитков на усвоение негемового железа из сложных блюд. Hum Nutr Appl Nutr. 1982; 36: 116–23. [PubMed] [Google Scholar] 50. Hallberg L, Rossander-Hulthen L, Brune M, Gleerup A. Ингибирование усвоения гемового железа у человека кальцием. Br J Nutr. 1993; 69: 533–40. [PubMed] [Google Scholar] 51. Hallberg L, Rossander-Hulthen L. Потребность в железе у менструирующих женщин. Am J Clin Nutr. 1991; 54: 1047–58. [PubMed] [Google Scholar] 52.Линч SR. Влияние кальция на усвоение железа. Nutr Res Rev.2000; 13: 141–58. [PubMed] [Google Scholar] 53. Повар JD, Monsen ER. Поглощение пищевого железа у людей. III. Сравнение влияния животных белков на всасывание негемового железа. Am J Clin Nutr. 1976; 29: 859–67. [PubMed] [Google Scholar] 54. Харрелл РФ, Линч С.Р., Тринидад Т.П., Дассенко С.А., Кук Дж.Д. Абсорбция железа у людей: бычий сывороточный альбумин по сравнению с говяжьими мышцами и яичным белком. Am J Clin Nutr. 1988; 47: 102–7. [PubMed] [Google Scholar] 55.Линч С.Р., Дассенко С.А., Кук Дж.Д., Джульерат М.А., Харрелл РФ. Ингибирующий эффект фрагмента, связанного с соевым белком, на абсорбцию железа у людей. Am J Clin Nutr. 1994; 60: 567–72. [PubMed] [Google Scholar] 56. Piomelli S, Seaman C, Kapoor S. Вызванные свинцом аномалии метаболизма порфирина, связь с дефицитом железа. Ann N Y Acad Sci. 1987; 514: 278–88. [PubMed] [Google Scholar] 58. 2-е изд. Бангкок: 2004 г. ФАО / ВОЗ. Консультации экспертов по потребностям человека в витаминах и минералах, потребностях в витаминах и минералах в питании человека: отчет совместного экспертного заключения ФАО / ВОЗ; п.341. [Google Scholar] 59. Cook JD, Skikne BS, Lynch SR, Reusser ME. Оценки достаточности железа у населения США. Кровь. 1986; 68: 726–31. [PubMed] [Google Scholar] 60. Ботвелл TH, Чарльтон RW. Общий подход к проблемам железодефицита и перегрузки железом у населения в целом. Semin Hematol. 1982; 19: 54–67. [PubMed] [Google Scholar] 61. Гибсон Р.С., Макдональд А.С., Смит-Вандеркой П.Д. Параметры сывороточного ферритина и пищевого железа в выборке канадских детей дошкольного возраста. J Can Dietetic Assoc.1988; 49: 23–8. [Google Scholar] 62. ДеМайер Э.М., Даллман П., Герни Дж. М., Холлберг Л., Суд С. К., Срикантия С. Г., редакторы. Женева: Всемирная организация здравоохранения; 1989. ВОЗ. Профилактика и контроль железодефицитной анемии с помощью первичной медико-санитарной помощи: руководство для администраторов здравоохранения и руководителей программ; п. 58. [Google Scholar] 63. Даллман П. Айрон. В: Браун М.Л., редактор. Настоящие знания в области питания. 6-е изд. Вашингтон, округ Колумбия: Фонд питания; 1990. С. 241–50. [Google Scholar] 64. Женева: Швейцария: Всемирная организация здравоохранения; 2001 г.ВОЗ / ЮНИСЕФ / УООН. Оценка, профилактика и контроль железодефицитной анемии; п. 114. [Google Scholar] 65. Борода Дж. Л., Коннор Дж. Р. Статус железа и нейронное функционирование. Annu Rev Nutr. 2003. 23: 41–58. [PubMed] [Google Scholar] 66. Failla ML. Микроэлементы и защита хозяина: последние достижения и сохраняющиеся проблемы. J Nutr. 2003; 133: S1443–7. [PubMed] [Google Scholar] 67. Витери Ф.Е., Торунь Б. Анемия и физическая работоспособность. В: Гарби Л., редактор. Клиники гематологии. Vol. 3. Лондон: У. Б. Сондерс; 1974. стр.609–26. [Google Scholar] 68. CDC. Табель успеваемости по грудному вскармливанию, США: показатели результатов (публикация из Центров по контролю и профилактике заболеваний, Национальное обследование иммунизации. 2010 г. [последний доступ 11 мая 2010 г.]. Http://www.cdc.gov/breastfeeding/data/index .htm .69. Купер Е.С., Банди Д.А. Трихоцефалопатия. Ballieres Clin Trop Med Commun Dis. 1987; 2: 629–43. [Google Scholar] 70. Всемирная организация здравоохранения, Женева; 1995. ВОЗ. Отчет неофициальной консультации ВОЗ. на анкилостомоз и анемию у девочек и женщин; с.46. [Google Scholar] 71. Crompton DW, Nesheim MC. Пищевая ценность кишечных гельминтозов в течение жизненного цикла человека. Annu Rev Nutr. 2002; 22: 35–99. [PubMed] [Google Scholar] 72. Ларок Р., Касапиа М., Готуццо Е., Дьеркос Т.В. Взаимосвязь между интенсивностью заражения гельминтами, передающимися через почву, и анемией во время беременности. Am J Trop Med Hyg. 2005; 73: 783–9. [PubMed] [Google Scholar] 73. Циммерманн МБ, Харрелл РФ. Недостаток пищевого железа. Ланцет. 2007; 370: 115–20. [Google Scholar] 74. Харви LJ, Armah CN, Dainty JR, Foxall RJ, John Lewis D, Langford NJ и др.Влияние менструальной кровопотери и диеты на дефицит железа у женщин в Великобритании. Br J Nutr. 2005. 94: 557–64. [PubMed] [Google Scholar] 75. Борода JL. Потребность в железе у девочек-подростков. Симпозиум: Повышение уровня железа у подростков до деторождения. J Nutr. 2000; 130: S440–2. [PubMed] [Google Scholar] 77. Бегин Ю. Растворимый рецептор трансферрина для оценки эритропоэза и статуса железа. Clinica Chimica Acta. 2003. 329: 9–22. [PubMed] [Google Scholar] 79. Повар JD, Flowers CH, Skikne BS. Количественная оценка bodyiron.Кровь. 2003. 101: 3359–64. [PubMed] [Google Scholar] 80. Кук JD, Boy E, Flowers C, Daroca Mdel C. Влияние высокогорной жизни на железо тела. Кровь. 2005; 106: 1441–6. [PubMed] [Google Scholar] 81. Ян З., Дьюи К.Г., Лоннердал Б., Хернелл О., Чапарро С., Аду-Афарвуа С. и др. Сравнение концентрации ферритина в плазме с соотношением рецептора трансферрина в плазме к ферритину для оценки запасов железа в организме: результаты 4 интервенционных испытаний. Am J Clin Nutr. 2008; 87: 1892–8. [PubMed] [Google Scholar] 82.Де Бенуа Б., Маклин Э., Эгли И., Когсуэлл М. — редакторы. Женева: Пресса ВОЗ, Всемирная организация здравоохранения; 2008. ВОЗ / CDC. Данные библиотечной каталогизации в публикации. Распространенность анемии в мире, 1993–2005 гг .: глобальная база данных ВОЗ по анемии; п. 40. [Google Scholar] 83. Джонсон-Уимбли Т.Д., Грэм Д.Ю. Диагностика и лечение железодефицитной анемии в 21 веке. Ther Adv Гастроэнтерол. 2011; 4: 177–84. [Бесплатная статья PMC] [PubMed] [Google Scholar] 84. Зарычанский Р., Хьюстон Д.С. Анемия хронического заболевания: вредное заболевание или адаптивная, полезная реакция? Can Med Assoc J.2008; 179: 333–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Weiss G, Goodnough LT. Анемия хронического заболевания. N Engl J Med. 2005; 352: 1011–23. [PubMed] [Google Scholar] 86. 2-е изд. Женева: 2004 г. ВОЗ / CDC. Отчет о совместной технической консультации Всемирной организации здравоохранения / Центров по контролю и профилактике заболеваний по оценке статуса железа на уровне населения; п. 108. [Google Scholar] 87. Knight K, Wade S, Balducci L. Распространенность и исходы анемии при раке: систематический обзор литературы.Am J Med. 2004; 116: 11–26С. [PubMed] [Google Scholar] 88. О’Мара NB. Больные анемией с хроническими заболеваниями почек. Спектр диабета. 2008; 21: 12–9. [Google Scholar] 89. Нурко С. Анемия при хронической болезни почек: причины, диагностика, лечение. Cleve Clin J Med. 2006. 73: 289–97. [PubMed] [Google Scholar] 90. Горовиц К.М., Ингардия С.Дж., Боргида А.Ф. 2013, Анемия при беременности. Clin Lab Med. 2013; 33: 281–91. [PubMed] [Google Scholar] 91. Ауск К.Дж., Иоанну Г.Н. Связано ли ожирение с анемией хронического заболевания? Популяционное исследование.Ожирение. 2008. 16: 2356–61. [PubMed] [Google Scholar] 92. Aeberli I, Hurrell RF, Zimmermann MB. Дети с избыточным весом имеют более высокие концентрации циркулирующего гепсидина и более низкий статус железа, но их потребление железа с пищей и биодоступность сопоставимы с детьми с нормальным весом. Int J Obes. 2009; 33: 1111–7. [PubMed] [Google Scholar] 94. Lewis G, Wise MP, Poynton C, Godkin A. Случай стойкой анемии и злоупотребления алкоголем. Нат Клин Практ Гастроэнтерол Гепатол. 2007; 4: 521–6. [PubMed] [Google Scholar] 95. Lindenbaum J, Роман MJ.Пищевая анемия при алкоголизме. Am J Clin Nutr. 1980; 33: 2727–35. [PubMed] [Google Scholar] 96. Cox SE, L’Esperance V, Makani J, Soka D, Prentice AM, Hill CM и др. Серповидно-клеточная анемия: доступность железа и ночная оксиметрия. J Clin Sleep Med. 2012; 8: 541–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 98. Манси Х.Л., младший, Кэмпбелл Дж. Альфа- и бета-талассемия. Я семейный врач. 2009; 80: 339–44. [PubMed] [Google Scholar] 99. Сегель ГБ, Лихтман М.А. Апластическая анемия: приобретенная и наследственная. В: Каушанский К., Вильямс В.Дж., редакторы.Гематология Вильямса. 8-е изд. Нью-Йорк: McGraw-Hill Medical; 2010. С. 569–90. [Google Scholar] 100. Янг Н.С., Каладо Р.Т., Шейнберг П. Современные концепции патофизиологии и лечения апластической анемии. Кровь. 2006; 108: 2509–19. [Бесплатная статья PMC] [PubMed] [Google Scholar] 101. Шейнберг П., Чен Дж. Апластическая анемия: что мы узнали на моделях на животных и в клинике. Semin Hematol. 2013; 50: 156–64. [PubMed] [Google Scholar] 102. Dhaliwal G, Cornett PA, Tierney LM., Jr Гемолитическая анемия.Я семейный врач. 2004. 69: 2599–606. [PubMed] [Google Scholar] 103. Hurrell RF. Как обеспечить адекватное усвоение железа из продуктов, обогащенных железом. Nutr Rev. 2002; 60: S7–15. [PubMed] [Google Scholar] 104. Повар JD. Диагностика и лечение железодефицитной анемии. Лучшая практика Res Clin Haematol. 2005; 18: 319–32. [PubMed] [Google Scholar] 105. Schlemmer U, Frølich W, Prieto RM, Grases F. Фитат в пищевых продуктах и значение для человека: источники пищи, потребление, обработка, биодоступность, защитная роль и анализ.Mol Nutr Food Res. 2009; 53: S330–75. [PubMed] [Google Scholar] 106. Лян Дж., Хан Б.З., Ноут М.Дж., Хамер Р.Дж. Влияние замачивания, прорастания и ферментации на общую фитиновую кислоту и растворимый цинк in vitro в коричневом рисе. Food Chem. 2008; 110: 821–8. [PubMed] [Google Scholar] 107. Кавалли-Сфорца Т., Бергер Дж., Смитасири С., Витери Ф. Еженедельный прием добавок железа и фолиевой кислоты для женщин репродуктивного возраста: обзор воздействия, извлеченные уроки, планы расширения и вклад в достижение целей развития тысячелетия.Nutr Rev.2005; 63: S152–8. [PubMed] [Google Scholar] 109. Oppenheimer SJ. Железо и его отношение к иммунитету и инфекционным заболеваниям. J Nutr. 2001; 131: S616–33. [PubMed] [Google Scholar] 110. Sazawal S, Black RE, Ramsan M, Chwaya HM, Stoltzfus RJ, Dutta A и др. Влияние рутинных профилактических добавок с железом и фолиевой кислотой на госпитализацию и смертность детей дошкольного возраста в условиях высокой передачи малярии: рандомизированное плацебо-контролируемое исследование на уровне общины. Ланцет. 2006; 367: 133–43.[PubMed] [Google Scholar] 112. Hurrell RF. Обогащение железом: его эффективность и безопасность в отношении инфекций. Еда Nutr Bull. 2007. 28: 585–94. [PubMed] [Google Scholar] 114. Лукка П., Харрелл Р., Потрикус И. Борьба с железодефицитной анемией с помощью риса, богатого железом. J Am Coll Nutr. 2002; 21: 184С – 90. [PubMed] [Google Scholar] 115. Рухани Н., Харрелл Р., Келишади Р., Шулин Р. Цинк и его значение для здоровья человека: комплексный обзор. J Res Med Sci. 2013; 18: 144–57. [Бесплатная статья PMC] [PubMed] [Google Scholar]Iron (Fe) | Мичиган Медицина
Обзор теста
Тест на содержание железа проверяет количество железа в крови, чтобы увидеть, насколько хорошо железо метаболизируется в организме.Железо (Fe) — это минерал, необходимый для гемоглобина, белка красных кровяных телец, переносящего кислород. Железо также необходимо для получения энергии, хорошей работы мышц и органов.
Около 70% железа в организме связано с гемоглобином в красных кровяных тельцах. Остальное связано с другими белками (трансферрин в крови или ферритин в костном мозге) или хранится в других тканях организма. Когда эритроциты умирают, их железо высвобождается и переносится трансферрином в костный мозг и в другие органы, такие как печень и селезенка.В костном мозге железо хранится и используется по мере необходимости для образования новых красных кровяных телец.
Источником всего железа в организме является пища, например печень и другое мясо, яйца, рыба и листовые зеленые овощи. Организму требуется больше железа в периоды роста (например, в подростковом возрасте), во время беременности, во время кормления грудью или в периоды, когда в организме низкий уровень железа (например, после кровотечения).
Здоровые взрослые мужчины получают достаточно железа из пищи, которую они едят. У мужчин в организме достаточно железа, чтобы хватить на несколько лет, даже если они не потребляют новое железо.У мужчин редко возникает дефицит железа из-за своего рациона. Но женщины могут терять большое количество железа из-за менструального кровотечения, во время беременности или кормления грудью. Таким образом, у женщин чаще, чем у мужчин, развивается дефицит железа, и им может потребоваться прием добавок железа. Дефицит железа у мужчин и женщин после менопаузы часто возникает из-за аномального кровотечения, часто в желудочно-кишечном тракте, например, из-за язвы желудка или рака толстой кишки.
Тест на содержание железа проверяет:
- Количество железа, связанного с трансферрином в крови (сыворотке).
- Количество железа, необходимое для связывания всего трансферрина. Эта величина называется общей железосвязывающей способностью (TIBC).
- Процент трансферрина со связанным с ним железом. Это значение называется насыщением трансферрина.
Зачем это нужно
Тест на железо проводится по:
Как подготовиться
Не принимайте добавки железа в течение 12 часов до теста на железо.
Уровень железа меняется в течение дня, поэтому лучше проводить тесты на железо утром, когда уровень железа самый высокий.
Как это делается
Медицинский работник возьмет кровь:
- Оберните эластичную ленту вокруг вашего плеча, чтобы остановить кровоток. Это увеличивает размер вены под лентой, что упрощает введение иглы в вену.
- Очистите место для иглы спиртом.
- Введите иглу в вену. Может потребоваться более одной иглы.
- Присоедините к игле трубку, чтобы наполнить ее кровью.
- Снимите повязку с руки, когда наберется достаточно крови.
- Поместите марлевую салфетку или ватный диск на место иглы, когда игла будет извлечена.
- Надавите на это место и наложите повязку.
Как это чувствуется
Образец крови берется из вены на руке. Плечо обернуто резинкой. Может ощущаться стеснение. Вы можете вообще ничего не чувствовать от иглы или можете почувствовать быстрое укусывание или защемление.
Риски
Очень мала вероятность возникновения проблемы из-за взятия пробы крови из вены.
- На этом участке может образоваться небольшой синяк. Вы можете снизить вероятность образования синяков, если надавите на это место в течение нескольких минут.
- В редких случаях после взятия пробы крови вена может опухнуть. Эта проблема называется флебитом. Для лечения этого состояния можно использовать теплый компресс несколько раз в день.
Результаты
Тест на содержание железа проверяет количество железа в крови, чтобы увидеть, насколько хорошо железо метаболизируется в организме.
Нормальный
Нормальные значения, перечисленные здесь, называемые эталонным диапазоном, являются лишь ориентировочными. Эти диапазоны варьируются от лаборатории к лаборатории, и ваша лаборатория может иметь другой диапазон от нормального. Отчет вашей лаборатории должен содержать диапазон, который использует ваша лаборатория. Кроме того, ваш врач оценит ваши результаты на основе вашего здоровья и других факторов. Это означает, что значение, выходящее за пределы нормальных значений, перечисленных здесь, может быть нормальным для вас или вашей лаборатории.
Мужчины и женщины: | 250–450 мкг / дл или 45–76 мкмоль / л |
Мужчины: | 10% –50% |
Женщины: | 15% –50% |
Высокие и низкие значения
Значения сывороточного железа, общей железосвязывающей способности (TIBC) и насыщения трансферрина используются, чтобы определить, вызвано ли низкое количество железа в организме железодефицитной анемией или другим заболеванием.Эти значения также используются для определения того, связано ли высокое количество железа с гемохроматозом или другим заболеванием. Другие состояния, которые влияют на уровни насыщения железом, TIBC и трансферрином, включают:
- Гемолитическая анемия. Это приводит к низкому содержанию гемоглобина, переносящего кислород, в красных кровяных тельцах. Уровень железа часто в норме.
- Талассемия. Это заболевание крови, передающееся по наследству. Это меняет то, как организм вырабатывает гемоглобин.Уровень железа часто в норме, но уровень ферритина может быть высоким, если человеку было много переливаний крови.
- Цирроз. Это состояние, которое возникает, когда воспаление и рубцевание повреждают печень.
- Отравление свинцом. Это происходит в результате месяцев или лет воздействия небольшого количества свинца в окружающей среде.
- Железодефицитная анемия. Это происходит, когда низкий уровень железа вызывает низкое количество переносящего кислород гемоглобина в красных кровяных тельцах.Уровни железа низкие, насыщение трансферрина высокое, а уровень ферритина низкий.
- Ревматоидный артрит. Эта форма артрита вызывает воспаление мембран или тканей, выстилающих суставы.
- Чрезмерное употребление добавок железа.
- Кровотечение.
- Почечная недостаточность.
- Тяжелая инфекция.
Что влияет на тест
Причины, по которым вы не сможете пройти тест или почему его результаты могут оказаться бесполезными, включают:
- Прием лекарств, таких как противозачаточные таблетки, кортикотропин, эстроген, аспирин и добавки железа.
- Использование некоторых лечебных трав, особенно зверобоя и пальметто.
- Прием добавок витамина B12 за 48 часов до теста на железо.
- Переливание крови за последние 4 месяца.
Что думать о
- Прием препаратов железа от усталости может замаскировать проблему с железом. Перед приемом добавок железа проконсультируйтесь с врачом.
- Уровень железа меняется в течение дня.Тесты на железо лучше всего проводить утром, когда уровень железа самый высокий.
- Результаты теста на железо также сверяются с результатами общего анализа крови (CBC), тестов на ферритин и трансферрин. Тест на ферритин часто лучше, чем тест на железо, чтобы увидеть, присутствует ли дефицит железа. Тест на железо и тест на ферритин часто проводят одновременно.
- Тест, называемый тестом на окрашивание сидероцитов, проверяет количество красных кровяных телец, содержащих частицы железа, не связанные с гемоглобином (сидероциты).Обычно в крови присутствует очень небольшое количество сидероцитов. Высокий уровень сидероцитов у взрослых может означать наличие анемии, перегрузки железом, отравления свинцом, гемохроматоза или тяжелой инфекции.
- При диагностировании железодефицитной анемии необходимо найти и лечить источник анемии. Дефицит железа может быть вызван длительной (хронической) кровопотерей из-за обильных менструальных кровотечений, беременности, недостаточного количества железа в рационе или кровотечений внутри кишечного тракта (из-за язв, полипов толстой кишки, рака толстой кишки, геморроя или других состояний) .В редких случаях слишком много железа может быть потеряно через кожу (из-за такого заболевания, как псориаз) или с мочой. Железодефицитную анемию можно легко вылечить с помощью добавок железа, но главное — определить ее и остановить потерю железа.
- Гемохроматоз можно лечить с помощью лекарств, которые помогают организму избавиться от лишнего железа. Процедура, называемая флеботомией, также может применяться для удаления железа из организма.
Список литературы
Цитаты
- Fischbach FT, Dunning MB III, ред.(2009). Руководство по лабораторным и диагностическим исследованиям , 8 изд. Филадельфия: Липпинкотт Уильямс и Уилкинс.
Кредиты
Текущий по состоянию на: 23 сентября 2020 г.
Автор: Healthwise Staff
Медицинский обзор:
Э. Грегори Томпсон, врач-терапевт
Адам Хусни, доктор медицины, семейная медицина
Мартин Дж.Габица MD — Семейная медицина
По состоянию на: 23 сентября 2020 г.
Автор: Здоровый персонал
Медицинское обозрение: E. Грегори Томпсон, врач внутренних болезней и Адам Хусни, доктор медицины, семейная медицина и Мартин Дж. Габика, доктор медицины, семейная медицина
Почему железо так важно для вашего тела
Почему железо важно для организма?
Человеческому организму требуется железо для выполнения многих жизненно важных физиологических функций.Например, железо является ключевым компонентом гемоглобина, который позволяет эритроцитам транспортировать кислород по всему телу, и играет ключевую роль в росте и дифференцировке клеток. По данным Всемирной организации здравоохранения, до 80% людей в мире могут иметь дефицит железа. Женщины в пременопаузе, особенно те, кто регулярно занимается спортом, сталкиваются с большим риском дефицита железа или даже анемии. Спортивные, активные мужчины также подвержены высокому риску дефицита железа. Низкий уровень железа может вызвать физическую усталость и слабость, нарушить умственную функцию и ослабить иммунную систему.С другой стороны, наличие слишком большого количества железа в организме может отравить определенные органы и даже привести к смерти. Поэтому поддержание оптимального баланса железа в организме имеет важное значение для здоровья.
Планы фитнеса и производительностиInsideTracker измеряют два маркера, связанных с железом, гемоглобин и ферритин. Наш новый Ultimate Plan добавляет еще четыре маркера, связанных с железом, чтобы дать пользователям системное представление об этом важном питательном веществе, позволяя лучше понять любой дисбаланс железа.
Как организм усваивает и изгоняет железо?
Тело не может производить железо; вы должны получить его через свой рацион. Пищевое железо перерабатывается и всасывается клетками слизистой оболочки тонкого кишечника. Однако только около 10% железа, которое мы потребляем каждый день, усваивается организмом. Процесс абсорбции железа жестко регулируется, поскольку в организме нет биохимических механизмов для удаления железа. Вместо этого железо теряется в результате таких процессов, как кровотечение, менструация и кормление грудью.Кроме того, железо в организме постоянно перерабатывается и повторно используется (например, в обмене эритроцитов).
Что происходит, когда железо попадает в организм?
После абсорбции клетками слизистой оболочки тонкого кишечника часть железа откладывается в белке ферритине. Каждая молекула ферритина способна связываться примерно с 4500 молекулами железа одновременно. Ферритин связывает и высвобождает железо в ответ на колебания количества железа в крови, тем самым поддерживая относительно постоянный уровень железа в сыворотке (крови).Ферритин содержится во всех клетках, но наиболее часто встречается в костном мозге, печени и селезенке. Печень, сердце и поджелудочная железа обычно имеют высокий уровень ферритина и поэтому подвержены заболеваниям или повреждению от перегрузки железом.
Железо, не содержащееся в ферритине, выводится из клеток кишечника и попадает в кровоток. Как только железо попадает в кровь, оно связывается с белком трансферрином. Белки, такие как трансферрин, предотвращают образование соединений железа, повреждающих клетки, таких как свободные радикалы, и помогают транспортировать железо к различным тканям по всему телу.
Некоторое количество железа также доставляется в костный мозг, где оно играет ключевую роль в образовании новых красных кровяных телец. Связанный с железом трансферрин связывается с рецептором трансферрина на поверхности вновь образующихся красных кровяных телец, а затем перемещается в клетку, где железо отделяется от трансферрина. Белок трансферрина возвращается в кровоток, а железо доступно в клетке для использования. Поскольку у эритроцитов такая короткая продолжительность жизни (около 120 дней), организму требуется постоянный запас железа для восстановления гемоглобина.В результате умирающие эритроциты перерабатываются лейкоцитами, известными как макрофаги. Старый гемоглобин расщепляется, чтобы восполнить запасы железа в крови.
Почему у меня низкий уровень железа?
Одна из причин, по которой у вас может быть мало железа, заключается в том, что потребность вашего организма в железе, возможно, увеличилась. Это часто происходит у быстро растущих детей раннего возраста, беременных женщин и людей, которые теряют кровь из-за сдачи крови, кишечных заболеваний, менструации или очень интенсивных физических нагрузок.Еще одна причина низкого уровня железа — снижение потребления или усвоения железа. Институт медицины Национальной академии наук рекомендует мужчинам в возрасте 19-50 лет потреблять 8 мг железа в день, а женщинам в пременопаузе — 18 мг железа в день. После менопаузы потребность женщин в железе упадет до того же уровня, что и у мужчин: 8 мг в день.
Как я могу повысить уровень железа в моем организме?
Пищевое железо имеет две формы: гем (мясо, птица и рыба) и негем (бобы, шпинат и обогащенные продукты).Хотя негемовое железо является более распространенной формой, организм легче усваивает гемовое железо. Следовательно, вы можете увеличить абсорбцию железа, потребляя больше гемового железа. Кроме того, витамин С помогает увеличить количество усваиваемого организмом железа; Употребление продуктов или напитков, богатых витамином С, в то же время, когда вы едите продукты с высоким содержанием железа, повысит усвоение железа. Другие соединения препятствуют усвоению железа, поэтому вам следует избегать употребления продуктов или напитков, содержащих эти вещества, в то же время, когда вы едите продукты, богатые железом.Например, для улучшения усвоения железа не пейте кофе или чай во время еды или в течение часа после еды. Точно так же бобовые и цельнозерновые содержат соединения, снижающие абсорбцию железа, поэтому избегайте употребления бобов или цельного зерна с богатой железом едой.
Основные параметры железа в InsideTracker
План фитнеса и производительности InsideTracker измеряет ферритин и гемоглобин, два важных маркера железа. Ферритин — это белок, который связывает железо для хранения.Основная функция ферритина — поддерживать относительно постоянный уровень активного железа в организме, высвобождая или связывая железо. Если в организме мало железа, он может получить доступ к железу, содержащемуся в ферритине. Если в организме много железа, он может накапливать потенциально опасный избыток железа в ферритине. Если у вас низкий уровень ферритина, вам следует внимательно следить за уровнем железа. Гемоглобин — железосодержащий переносчик кислорода в красных кровяных тельцах. Его основная функция — переносить кислород из легких в мышцы, мозг и пищеварительную систему, где он высвобождает кислород для использования клетками.Оптимальный уровень гемоглобина улучшает силу, увеличивает выносливость и улучшает общую аэробную производительность.
Новый план InsideTracker Ultimate
Четыре новых маркера, связанных с железом, включенные в панель Ultimate, дают подробную картину железа в вашем теле: Сывороточное железо — количество железа в крови. Общая железосвязывающая способность (TIBC) — измеряет максимальное количество железа, которое может быть в крови. переносят, и является косвенным показателем трансферрина, который транспортирует железо к различным тканям и предотвращает повреждение железа в организме.Ненасыщенная железосвязывающая способность (UIBC) — это TIBC минус сывороточная насыщенность трансферрина железом (также называемая насыщением железом) — это сывороточное железо, деленное на TIBC, а затем умноженное на 100. Это показывает, сколько железа в крови связывается трансферрином.
Зачем вам нужно больше знать об уровне железа?
InsideTracker добавил эти четыре маркера железа на панель Ultimate, потому что ферритин и гемоглобин сами по себе не могут дать вам исчерпывающего представления о состоянии вашего железа.Железо в сыворотке, насыщение трансферрина, TIBC и UIBC раскрывают информацию о содержании железа в крови. Изменения этих маркеров могут указывать на ранние признаки дефицита или избытка железа, даже если уровень ферритина оптимален. С шестью маркерами, связанными с железом, Ultimate Plan дает вам возможность глубоко погрузиться в ваш статус железа, что может помочь вам оптимизировать уровень железа и, таким образом, повысить вашу энергию и концентрацию, улучшить аэробную производительность и укрепить вашу иммунную систему. Чтобы узнать больше о статусе вашего железа, подпишитесь на Ultimate Plan сегодня.
Для получения дополнительной информации о ферритине посетите наш блог: https://www.insidetracker.com/blog/post/56962740603/got-fatigue-increase-your-ferritin
Дополнительную информацию о геме и негемовом железе можно найти в нашем блоге: https://www.insidetracker.com/blog/post/38863886706/pump-some-iron-do-you-know-the-difference-between- heme Попробуйте нашу бесплатную демонстрацию
Iron
Железо — это минерал, и его основная цель — переносить кислород в гемоглобине красных кровяных телец по всему телу, чтобы клетки могли производить энергию.Железо также помогает удалять углекислый газ. Когда запасы железа в организме становятся настолько низкими, что нормальных красных кровяных телец недостаточно для эффективного переноса кислорода, развивается состояние, известное как железодефицитная анемия.
Низкий уровень железа часто приводит к утомляемости, слабости и затруднению поддержания температуры тела. Другие симптомы могут включать:
- Бледная кожа и ногти
- Головокружение
- Головная боль
- Глоссит (воспаление языка)
Несмотря на то, что железо широко доступно в продуктах питания, некоторые люди, например девочки-подростки и женщины в возрасте от 19 до 50 лет, могут не получать необходимое количество ежедневно.Это также проблема для маленьких детей и беременных женщин или женщин, которые могут забеременеть. Если необходимо лечение дефицита железа, врач оценит уровень железа и определит точную форму лечения, которая может включать изменения в диете и / или прием добавок.
Детям железо необходимо для развития и роста мозга. Они хранят достаточно железа для первых четырех-шести месяцев жизни. Педиатр может порекомендовать добавку для недоношенного ребенка или ребенка с низким весом при рождении, находящегося на грудном вскармливании.По прошествии шести месяцев их потребность в железе увеличивается, поэтому введение твердой пищи, когда ребенок уже готов к развитию, может помочь обеспечить источники железа. Большинство смесей для младенцев обогащены железом.
Сколько железа вам нужно? Хотя ваше тело очень хорошо приспосабливается к более низким или более высоким уровням, поглощая больше или меньше железа по мере необходимости, рекомендуемые уровни установлены для удовлетворения потребностей большей части населения. Вот текущие Рекомендуемые нормы потребления железа (RDA):
| Пол / Возраст | Утюг RDA |
| Дети 1-3 | 7 мг |
| Дети 4-8 | 10 мг |
| Дети 9-13 | 8 мг |
| Мужчины / 14-18 | 11 мг |
| Женщины / 14-18 | 15 мг |
| Мужчины / 19 + | 8 мг |
| Женщины / 19-50 | 18 мг |
| Женщины / 51 + | 8 мг |
Железо в продуктах питания бывает двух типов: гемовое и негемовое.Продукты животного происхождения, такие как мясо, морепродукты и птица, содержат оба типа и лучше усваиваются организмом. Негемовое железо содержится в растительных продуктах, таких как шпинат и бобы, в обогащенных зернах, таких как рис и хлеб, и в некоторых обогащенных хлопьях для завтрака. Чтобы увеличить усвоение железа из растительных источников, рекомендуется употреблять его с мясом, морепродуктами или птицей или с хорошим источником витамина С, например с цитрусовыми, киви, клубникой или болгарским перцем. Хороший способ улучшить потребление железа — это сбалансированное и здоровое питание, включающее разнообразные продукты.
Количественная оценка железа в организме | Кровь
Текущие инициативы по снижению высокой распространенности дефицита пищевого железа подчеркнули необходимость в надежных эпидемиологических методах оценки статуса железа. В настоящем отчете описан метод оценки железа в организме на основе отношения рецептора трансферрина сыворотки к ферритину сыворотки. Анализ показал единственное нормальное распределение запасов железа в организме у мужчин в США в возрасте от 20 до 65 лет (среднее ± 1 стандартное отклонение, 9.82 ± 2,82 мг / кг). Единое нормальное распределение также наблюдалось у беременных ямайских женщин (среднее ± 1 стандартное отклонение, 0,09 ± 4,48 мг / кг). Анализ распределения среди женщин США в возрасте от 20 до 45 лет показал 2 группы населения; У 93% женщин запасы железа в организме составляли в среднем 5,5 ± 3,35 мг / кг (среднее ± 1 стандартное отклонение), тогда как у остальных 7% женщин средний дефицит железа в тканях составлял 3,87 ± 3,23 мг / кг. Расчеты железа в организме при испытаниях добавок железа на Ямайке и обогащения железа во Вьетнаме показали, что этот метод можно использовать для расчета абсорбции добавленного железа.Количественные оценки железа в организме значительно улучшают оценку статуса железа и чувствительность интервенционных испытаний железа в группах населения, в которых воспаление встречается редко или было исключено лабораторным скринингом. Этот метод полезен в клинической практике для мониторинга статуса железа у тех, кто очень чувствителен к дефициту железа.
Данные 3 опубликованных исследований были использованы для количественной оценки железа в организме.Самым большим набором данных была удобная выборка, собранная в третьем Национальном обследовании здоровья и питания (NHANES III) среди населения США с 1988 по 1994 год.4 Выборка отличалась от полной выборки NHANES III тем, что она не была отобрана для представления населения США. . Тем не менее, считалось, что это дает полезную информацию об использовании отношения R / F для оценки железа в организме. В общей сложности 2057 образцов, полученных у участников мужского и женского пола, были использованы для оценки влияния возраста на железо в организме.Две подгруппы образцов NHANES III, состоящие из 409 женщин (20-45 лет) и 649 мужчин (20-65 лет), были использованы для изучения частотного распределения железа в организме взрослых мужчин и женщин. Эти возрастные диапазоны были выбраны для представления сегментов населения с относительно однородным статусом железа.
Второе исследование проводилось на беременных женщинах, живущих в Кингстоне, Ямайка, Вест-Индия, которые участвовали в испытании добавок железа.5 Критериями отбора для участия в исследовании были возраст матери от 16 до 35 лет, гестационный возраст от 14 до 22 недель (в среднем 135 дней) и концентрация гемоглобина от 80 до 110 г / л. После получения исходных образцов женщины были случайным образом разделены на 1 из 3 групп: контрольная группа, не получавшая дополнительного железа (n = 86), группа FeSO 4 , получавшая таблетку FeSO 4 по 50 мг два раза в день (n = 86). = 79), и группа с желудочной системой доставки (GDS), получавшая одну капсулу GDS железа 50 мг в день (n = 83).Из 376 женщин, первоначально включенных в исследование, уровень железа в организме, рассчитанный по соотношению R / F, был исследован у 248, у которых образцы крови были доступны на исходном уровне и после 6 и 12 недель исследования. Исходные образцы использовались для оценки частотного распределения железа в организме во время беременности, а значения через 6 и 12 недель использовались для оценки абсорбции железа из добавок железа.
Окончательный набор данных был получен из образцов, собранных в ходе двойного слепого рандомизированного испытания обогащения железа у анемичных вьетнамских женщин.6,7 В течение 6 дней каждую неделю женщин кормили едой, содержащей лапшу или рис, и подавали 10 мл рыбного соуса, не содержащего железа (контроль), или 10 мг железа в виде NaFeEDTA (натрий-железо этилендиаминтетрауксусная кислота) (обогащенная). Образцы крови были взяты на исходном уровне и через 3 и 6 месяцев. Из 136 женщин, завершивших исследование, первые 15 образцов, полученных в нашей лаборатории из контрольной и обогащенной групп, были отобраны для оценки возможности использования уменьшенного размера образца для оценки абсорбции обогащенного железа.
Иммуноферментный анализ (ELISA) был использован для измерения уровней ферритина 8 и sTfR9 в сыворотке, как описано ранее. Моноклональные антитела были использованы в двухсайтовом анализе на ферритин и sTfR, чтобы гарантировать однородность иммунологических реагентов для всех данных, представленных здесь. Пероксидазу хрена использовали в качестве фермента, конъюгированного с индикаторным антителом в обоих анализах. Очищенный антиген для каждого анализа был тщательно стандартизирован, чтобы уменьшить вариабельность между исследованиями.Анализ сывороточного ферритина стандартизировали с перекристаллизованным ферритином печени человека, который разбавляли до 1000 мкг / л в забуференном бычьем сывороточном альбумине (BSA) и хранили в аликвотах при -70 ° C. Свежий стандартный материал размораживали в начале каждого исследования и калибровали по международному стандарту ВОЗ 80-578, полученному от Национального института биологических стандартов и контроля, Соединенное Королевство.
Анализ sTfR стандартизировали с рецептором, не содержащим трансферрина, очищенным из плаценты человека по методу Turkewitz et al.10 Дополнительную очистку свободного рецептора проводили путем пропускания рецептора, не содержащего трансферрина, через гель-фильтрационную колонку HR-300 100 × 2,5 см (Pharmacia, Упсала, Швеция). После того, как пробирки с пиком белка, измеренные с помощью A 280 нм , были объединены и сконцентрированы, чистота рецептора была установлена с помощью гель-электрофореза путем демонстрации одной полосы белка при 190 000 Да без восстановления и 95 000 Да после восстановления 2- меркаптоэтанол. Концентрацию белка измеряли с помощью анализа Лоури.11 Если в ELISA для sTfR наблюдалось расхождение более 5% между содержанием белка и иммунологической активностью, этап гель-фильтрации повторяли до получения расхождения менее 2%. Очищенный рецептор трансферрина хранили при 4 ° C, в условиях, при которых очищенный рецептор, как было показано в предыдущих исследованиях, был стабильным в течение минимум 18 месяцев. Свежий человеческий плацентарный рецептор готовили в начале каждого исследования и хранили не более 1 года. Эффективность всех представленных здесь анализов сывороточного ферритина и sTfR была дополнительно оценена путем включения минимум 3 сывороток контроля качества, которые хранились в аликвотах при -70 ° C.Анализы повторяли, если было расхождение более чем на 10% в более чем одной контрольной сыворотке со средним значением нескольких определений перед замораживанием.
В исследованиях на Ямайке и Вьетнаме проводилось внутреннее или полевое обучение для стандартизации методов сбора и транспортировки образцов венозной крови с контролируемой температурой в региональную лабораторию для обработки в день сбора. Кровь центрифугировали, 0.Аликвоты плазмы объемом 5 мл помещали в микроцентрифужные пробирки для хранения при -30 ° C до отправки на сухом льду в Медицинский центр Канзасского университета. Замороженные образцы, полученные в ходе исследования NHANES III, хранили при -30 ° C и анализировали в течение 2 месяцев с момента прибытия.
Взаимосвязь между возрастом и телесным железом была впервые исследована на удобной выборке мужчин и женщин, участвовавших в пилотном исследовании sTfR для NHANES III (Рисунок 2).Средние значения для обоих полов были схожими до позднего подросткового возраста, когда содержание железа в организме мужчин резко увеличилось и достигло плато в начале третьего десятилетия. За этим последовал медленный, продолжающийся рост до шестого десятилетия, когда уровень железа в организме немного снизился. Из-за потери железа, связанной с менструацией и деторождением, заметного увеличения содержания железа в организме у женщин не наблюдалось до третьего десятилетия. Затем телесное железо оставалось относительно стабильным до пятого десятилетия, когда оно постепенно увеличивалось, приближаясь к значениям у мужчин к седьмому десятилетию.Эти результаты в целом согласуются с нашими знаниями о влиянии секса, роста и менструации на железо в организме19.
Рис. 2.
Влияние возраста на железо в организме.
Все значения телесного железа положительны и указывают количество накопленного железа. Данные основаны на удобной выборке из 2057 экземпляров, собранных в NHANES III. Заштрихованные области представляют собой среднее значение ± 1 SEM для каждого 5-летнего интервала.
Рис. 2.
Влияние возраста на железо в организме.
Все значения телесного железа положительны и указывают количество накопленного железа. Данные основаны на удобной выборке из 2057 экземпляров, собранных в NHANES III. Заштрихованные области представляют собой среднее значение ± 1 SEM для каждого 5-летнего интервала.
Затем мы исследовали частотные распределения железа в организме по отдельности у мужчин и женщин. У 649 мужчин в возрасте от 20 до 65 лет средняя геометрическая концентрация ферритина составляла 109 мкг / л (± 1 стандартное отклонение; диапазон 66–285 мкг / л), средняя концентрация sTfR составляла 6.12 ± 2,73 мг / л, а среднее геометрическое соотношение R / F составило 42 (± 1 стандартное отклонение; диапазон 19-93). Запасы железа в организме составляли в среднем 9,89 ± 2,82 мг / кг и соответствовали единственному нормальному распределению (Рисунок 3). У 409 женщин в возрасте от 20 до 45 лет среднее геометрическое значение ферритина в сыворотке составляло 34 мкг / л (± 1 стандартное отклонение; диапазон 12-94 мкг / л), средняя концентрация sTfR составляла 6,3 ± 2,57 мг / л, а средняя концентрация sTfR составляла 6,3 ± 2,57 мг / л. Среднее геометрическое отношение R / F составило 172 (± 1 стандартное отклонение; диапазон 54-544). Запасы железа в организме в общей выборке составляли в среднем 4,87 ± 4,14 мг / кг. Однако, в отличие от распределения у мужчин, частотное распределение отклонялось от линейности в нижней части кривой, указывая на небольшую популяцию женщин с дефицитом железа.Анализ смешанного распределения показал 2 нормально распределенные популяции. Основная популяция, представляющая 92,7% женщин, имела средние запасы железа 5,5 ± 3,35 мг / кг (± 1 стандартное отклонение), тогда как вторая группа из 7,3% имела средний дефицит железа в тканях -3,87 ± 3,23 мг / кг. Статистика согласия χ 2 , равная 3,31, согласовывалась с двумя отдельными распределениями ( df = 3; P = 0,34). Распределение показателей железа в организме было относительно широким в обеих популяциях, что привело к значительному совпадению.В результате 5% женщин из основной популяции имели тканевой дефицит железа, а 12% женщин из второстепенной популяции имели запасы железа. Из 44 женщин в общей выборке с тканевым дефицитом железа 18 принадлежали к основной популяции с высоким содержанием железа, а 26 — к популяции с незначительным дефицитом железа.
Рис. 3.
Кумулятивные частотные распределения железа в организме, рассчитанные на основе отношения рецептора трансферрина сыворотки к ферритину сыворотки.
Чистая область и положительные значения указывают на запасенное железо, а заштрихованная область и отрицательные значения указывают на дефицит железа в тканях. Данные представлены для беременных ямайских женщин в возрасте 16-35 лет, женщин из США в возрасте 20-45 лет и мужчин из США в возрасте 20-65 лет.
Рис. 3.
Кумулятивные частотные распределения железа в организме, рассчитанные на основе отношения рецептора трансферрина сыворотки к ферритину сыворотки.
Чистая область и положительные значения указывают на запасенное железо, а заштрихованная область и отрицательные значения указывают на дефицит железа в тканях.Данные представлены для беременных ямайских женщин в возрасте 16-35 лет, женщин из США в возрасте 20-45 лет и мужчин из США в возрасте 20-65 лет.
Базовые оценки содержания железа в организме показаны для 246 беременных женщин в возрасте от 16 до 35 лет, проживающих в Кингстоне, Ямайка5 (Рисунок 3). Все женщины страдали анемией, что определялось концентрацией гемоглобина ниже 110 г / л. Среднее геометрическое значение сывороточного ферритина составляло 11 мкг / л (± 1 стандартное отклонение; диапазон 4-32 мкг / л), среднее значение sTfR составляло 7.87 ± 3,4 мг / л (± 1 стандартное отклонение), а среднее геометрическое отношение R / F составило 650 (± 1 стандартное отклонение; диапазон 187–2258). Железо в организме составляло в среднем всего 0,085 ± 4,48 мг / кг, что указывает на то, что половина женщин страдает дефицитом железа в тканях. Статистика согласия χ 2 для телесного железа составила 7,21 ( df = 17; P = 0,98), что указывает на единственное распределение Гаусса.
Преимущества использования измерения содержания железа в организме стали очевидны при повторном исследовании испытания добавок железа у беременных ямайских женщин.В оригинальной публикации обе группы женщин, получавших добавку железа, имели значительное увеличение концентрации гемоглобина и снижение sTfR по сравнению с контрольными субъектами.5 Однако не было очевидной разницы между группой FeSO 4 , получавшей 100 мг железа в день. и группа GDS получала 50 мг железа в день. Когда использовались оценки железа в организме, разница между группами железа была очевидна (Рисунок 4). Что еще более важно, измерения содержания железа в организме позволили измерить абсорбцию железа.В течение 3-месячного испытания среднее количество железа в организме в контрольной группе упало с 68 мг до -111 мг, или общее снижение на 179 мг. Среднесуточная потеря железа в 2 мг отражает потребность плода в железе. У женщин в группе FeSO 4 было увеличение запаса железа в среднем с 0 до 141 мг железа, тогда как у женщин в группе GDS было увеличение с -47 мг до 36 мг с приростом железа в организме на 83 мг. По сравнению с контрольной группой, женщины в группе FeSO 4 набрали 320 мг железа в организме, что соответствует абсорбции 3.5 мг в день или 3,5% от введенной добавки железа. Группа GDS ежедневно получала 262 мг железа, или 2,9 мг железа, что указывает на более высокую абсорбцию на 5,8%. Последнее демонстрирует физиологическое преимущество состава GDS, который был разработан для задержки высвобождения железа в желудке и, таким образом, снижения ингибирующего действия пищи на абсорбцию элементарного железа.
Рис. 4.
Изменения в содержании железа в организме при испытании добавок железа у беременных ямайских женщин.
Контрольная группа не получала дополнительного железа, группа FeSO 4 получала 100 мг железа в день, а группа GDS получала 50 мг железа в день. Железо в организме рассчитывали из отношения рецептора трансферрина сыворотки к ферритину сыворотки. Положительные значения и чистая область представляют запас железа, тогда как отрицательные значения и заштрихованная область указывают на дефицит железа в тканях. Вертикальные полосы представляют ± 1 SEM.
Рис. 4.
Изменения в содержании железа в организме при испытании добавок железа у беременных ямайских женщин.
Контрольная группа не получала дополнительного железа, группа FeSO 4 получала 100 мг железа в день, а группа GDS получала 50 мг железа в день. Железо в организме рассчитывали из отношения рецептора трансферрина сыворотки к ферритину сыворотки. Положительные значения и чистая область представляют запас железа, тогда как отрицательные значения и заштрихованная область указывают на дефицит железа в тканях. Вертикальные полосы представляют ± 1 SEM.
Затем полезность определения железа в организме была исследована в испытании по обогащению железом, в котором изменения в статусе железа менее выражены и происходят медленнее, чем при добавлении железа.Изменения уровня железа в организме у 15 вьетнамских женщин, страдающих анемией, которые не получали железа или ежедневно получали 10 мг обогащенного железа, показаны на Рисунке 5. В контрольной группе средний исходный дефицит железа в тканях -17 ± 79 мг (среднее ± 1 SEM) снизился до -27 ± 87 мг через 3 месяца и -43 ± 75 мг через 6 месяцев. В группе обогащенных препаратов железо в организме увеличилось с 5 ± 52 мг на исходном уровне до 156 ± 41 мг через 3 месяца и 209 ± 37 мг через 6 месяцев. После 3 месяцев обогащения парный тест t разницы в содержании железа в организме от исходных значений в усиленной группе был очень значимым ( t = 4.02; P <0,001). По сравнению с контрольными субъектами, женщины, получавшие обогащенный рыбный соус, получали 1,68 ± 0,37 мг железа в день (среднее ± 1 SEM), что указывает на абсорбцию 17% обогащенного железа в течение первых 3 месяцев. Скорость накопления железа снизилась во время второго трехмесячного интервала до 0,59 ± 0,21 мг в сутки или 6% от добавленного железа. У женщин, получавших обогащенный рыбный соус, наблюдалась значимая корреляция между исходным уровнем железа в организме и процентом абсорбции (n = 15; r = 0.70; P = 0,004), что согласуется с хорошо установленной обратной зависимостью между статусом железа и абсорбцией железа.
Рис. 5.
Влияние обогащения железом на содержание железа в организме у анемичных вьетнамских женщин.
Уровень железа в организме рассчитывали исходя из отношения рецептора трансферрина сыворотки к ферритину сыворотки. Положительные значения (чистая область) обозначают запасы железа, а отрицательные значения (заштрихованная область) указывают на дефицит железа в тканях.Данные показаны для 15 женщин, не получавших дополнительного железа (контроль), и для 15 женщин, получавших пищу, обогащенную 10 мг железа в виде NaFeEDTA, 6 дней в неделю (обогащенная). Вертикальные полосы представляют ± 1 SEM.
Рис. 5.
Влияние обогащения железом на содержание железа в организме у анемичных вьетнамских женщин.
Уровень железа в организме рассчитывали исходя из отношения рецептора трансферрина сыворотки к ферритину сыворотки. Положительные значения (чистая область) обозначают запасы железа, а отрицательные значения (заштрихованная область) указывают на дефицит железа в тканях.Данные показаны для 15 женщин, не получавших дополнительного железа (контроль), и для 15 женщин, получавших пищу, обогащенную 10 мг железа в виде NaFeEDTA, 6 дней в неделю (обогащенная). Вертикальные полосы представляют ± 1 SEM.
Несмотря на продолжающееся широкое использование скрининга на анемию для оценки статуса железа в популяциях, отдельные измерения концентрации гемоглобина или уровня гематокрита не подходят в качестве единственного индикатора статуса железа.Чувствительность измерений гемоглобина низкая, поскольку анемия, связанная с дефицитом железа в питании, относительно легкая, что приводит к значительному совпадению значений гемоглобина у здоровых людей и людей с дефицитом железа.13,15,20 Проблема усугубляется почти всеобщим признанием ВОЗ критериев анемии, несмотря на доказательства значительных расовых различий в нормальных значениях гемоглобина. 21-24 Низкая специфичность является еще большим ограничением скрининга гемоглобина на дефицит железа в развивающихся странах, где бедность, недоедание и инфекции связаны с высокой распространенностью анемии. хронического заболевания, которое часто превышает заболевание, вызванное железодефицитной анемией.В NHANES в США для более точного определения дефицита железа использовались многочисленные лабораторные измерения, 4 но на большинство этих дополнительных параметров аналогичным образом влияют железодефицитная анемия и анемия при хронических заболеваниях. Более того, стоимость и неудобства этого подхода недопустимы в странах, в которых распространенность анемии наиболее высока.
Оценки содержания железа в организме в настоящем исследовании с использованием отношения R / F аналогичны значениям, полученным с помощью более раннего, более сложного подхода с использованием нескольких лабораторных измерений и 3 отдельных алгоритмов.25 запасов железа в организме составляли в среднем 776 ± 313 мг (± 1 стандартное отклонение) у мужчин и 309 ± 346 мг у женщин в соответствии с исходным методом по сравнению с 752 мг и 297 мг, соответственно, после преобразования данных в настоящем отчете в абсолютные значения. для определения железа в организме с использованием средних весов мужчин и женщин в США26. Предыдущий метод был успешно использован при анализе двухлетнего испытания обогащения железа в Южной Африке27 и 36-месячного испытания обогащения сахара в полукруглой Гватемале28. Эти исследования показали, что изменения содержания железа в организме в результате обогащения согласуются с предварительными измерениями поглощения с использованием радиоизотопов железа.Следует отметить, что небольшая группа женщин с железом в нижней части тела не была обнаружена в первоначальном исследовании, но могла быть пропущена из-за эмпирических алгоритмов, используемых для оценки железа в организме. Эта небольшая популяция может представлять женщин с мутацией трансферрина Gly227Ser, которая, как сообщается, увеличивает риск дефицита железа.29
Оценка железа в организме с использованием отношения R / F имеет несколько преимуществ по сравнению с исходным методом, 25 для которого потребовалось 5 лабораторных измерений (гемоглобин, сывороточный ферритин, протопорфирин эритроцитов, уровни сывороточного железа и общая железосвязывающая способность) по сравнению с 2 с настоящий метод.Более того, устраняя необходимость в величине насыщения трансферрина, содержание железа в организме можно определить с помощью отношения R / F из небольшого образца капиллярной крови. Это важный шаг вперед в полевых исследованиях, особенно в развивающихся странах, в которых часто бывает трудно получить разрешение на взятие венозных проб. Другим преимуществом настоящего метода является определение содержания железа в организме на основе массы тела, а не абсолютных значений, используемых в исходном методе и в большей части опубликованной литературы по статусу железа.Помимо устранения влияния различий в массе тела, выражение железа в организме на килограмм позволяет экстраполировать его на более молодых людей. Степень, в которой алгоритм, использующий соотношение R / F, может быть применен к детям школьного и дошкольного возраста, неясна, но возрастные отношения, показанные на рисунке 2, правдоподобны. Будет сложно подтвердить взаимосвязь между соотношением R / F и телесным железом у детей и беременных женщин из-за ограничений при выполнении количественной флеботомии.
Измерения уровня железа в организме с использованием отношения R / F обеспечивают измерение статуса железа у каждого обследуемого человека, а не текущие эпидемиологические подходы, основанные на произвольных точках отсечения лабораторных показателей. Возможность изучить распределение статуса железа в различных слоях населения может дать важные сведения об оптимальной разработке стратегий общественного здравоохранения по сокращению дефицита железа. Существующие программы вмешательства часто предоставляют железо только тем, кто страдает анемией, и этот подход предполагает наличие двух отдельных групп: железодефицитных и здоровых людей.Единичное распределение железа в организме, наблюдаемое у беременных ямайских женщин с использованием соотношения R / F, указывает на то, что лучше охватить все население, используя обогащение продуктов питания. Еще одно преимущество индивидуального определения железа в организме заключается в том, что можно исследовать небольшие группы населения для оценки влияния различных детерминант питания железом, таких как расовая или этническая принадлежность, социально-экономический статус, режим питания, добавки железа и некоторые лекарства, такие как аспирин. . Ограниченные промежуточные обследования также могут использоваться для выявления временных изменений в статусе железа в сторону увеличения или уменьшения железа в организме.
Измерения уровня железа в организме не зависят от определения гемоглобина и, таким образом, смещают акцент в программах скрининга с анемии на дефицит железа, единственную причину анемии, которую можно легко устранить с помощью мер общественного здравоохранения. Капиллярные измерения гемоглобина могут быть получены при определении отношения R / F, но анемия также может быть определена по дефициту железа в тканях, измеренному с помощью отношения R / F.У человека с избытком железа развитие анемии соответствует снижению уровня гемоглобина на 20 г / л или дефициту железа в тканях примерно на -4 мг / кг железа.25 Ловушка в использовании только уровня гемоглобина для определения дефицита железа проиллюстрировано исследованием на Ямайке, в котором все женщины страдали анемией, определяемой концентрацией гемоглобина ниже 110 г / л. Однако, основываясь на измерениях содержания железа в организме, только 20% имели железодефицитную анемию, определяемую дефицитом железа в тканях более -4 мг / кг (рис. 2).Отчасти это несоответствие может быть связано с увеличением объема плазмы во время беременности, но главным фактором, скорее всего, является использование неподходящего критерия анемии из-за генетических различий в значениях гемоглобина22
Использование отношения R / F для оценки железа в организме имеет определенные ограничения. Наиболее важным из них является влияние воспаления или заболевания печени на уровень ферритина в сыворотке независимо от запасов железа в организме.Принимая во внимание большой и постоянно расширяющийся список лабораторных маркеров воспаления, можно предположить, что в будущем может быть разработан алгоритм, который корректирует влияние воспаления на уровень ферритина в сыворотке, что позволит использовать его для расчета железа в организме. В настоящее время единственным практическим подходом является использование скринингового теста, такого как С-реактивный белок, для исключения людей с воспалением из расчета содержания железа в организме. STfR все еще можно использовать для выявления сопутствующего дефицита железа у людей с воспалением.30,31
Еще одно существенное препятствие для более широкого использования отношения R / F в популяционных исследованиях — это переменный диапазон значений, сообщаемых для sTfR с различными коммерческими анализами. Большинство расхождений между анализами, вероятно, можно было бы устранить, используя общий справочный материал для стандартизации. В настоящее время производители различных коммерческих анализов не предоставляют подробностей об источнике и методе очистки рецептора трансферрина, использованного в их анализе.Хотя потребность в стандартизации sTfR часто упоминается 32,33, промышленность не предприняла никаких усилий для разработки справочного материала, предположительно из-за проблем, связанных с патентованием. Пока проблема стандартизации не будет решена, соотношение R / F должно быть откалибровано с помощью количественных измерений флеботомии, прежде чем оно будет использоваться для оценки железа в организме.
Клиническое применение измерения содержания железа в организме ограничено многочисленными нарушениями, которые влияют на уровни сывороточного ферритина и sTfR независимо от статуса железа, хотя наиболее важные из них можно обнаружить по повышенным уровням С-реактивного белка.Основное клиническое применение — мониторинг статуса железа у лиц с высокой предрасположенностью к дефициту железа, таких как младенцы, дети дошкольного возраста и беременные женщины. В настоящее время врачи полагаются на уровень ферритина в сыворотке, чтобы определить адекватность запасов железа, и на концентрацию гемоглобина, чтобы определить прогрессирующий дефицит железа на другом конце спектра железа. Однако в настоящее время не существует надежного лабораторного метода выявления дефицита железа в тканях до развития анемии.Дефицит железа без анемии может составлять до 30% уязвимого населения, например беременных ямайских женщин (рис. 2). Имеются убедительные доказательства пагубного влияния дефицита железа в младенчестве на последующую интеллектуальную деятельность и способность к обучению34,35, а также постоянную озабоченность по поводу неблагоприятных последствий дефицита железа во время беременности. Измерения уровня железа в организме позволяют исследователям более точно оценить значимость тканевого дефицита железа без анемии, а клиницистам — определить его.
Наиболее важным непосредственным применением измерения содержания железа в организме является оценка интервенционных испытаний для улучшения статуса железа. Учитывая удручающий долгосрочный успех программ приема добавок железа, основное внимание в программах по снижению дефицита железа в последние годы уделяется обогащению пищевым железом36,37. Большинство изучаемых в настоящее время стратегий обогащения основаны на изотопных измерениях абсорбции железа из пищи. скармливают голодающим в лабораторных условиях, но этот подход не оценивает многие другие факторы, которые определяют успех или неудачу данной стратегии при ее применении в популяции.Испытания по обогащению традиционно требовали сотен участников и лет для проведения27,28,34,35 В исследовании во Вьетнаме измерений у 30 субъектов в течение 3 месяцев было достаточно, чтобы определить эффективность стратегии обогащения (рис. 5). Измерение уровня железа в организме может значительно ускорить разработку и внедрение программ по снижению распространенности дефицита железа.
Мы благодарим доктора Фама Ван Туи за разрешение использовать предварительные данные испытания обогащения железа у вьетнамских женщин.Исследование проводилось при поддержке Nippon Foundation и Международного института наук о жизни, Центра укрепления здоровья (Атланта, Джорджия), и проводилось Национальным институтом питания (Ханой, Вьетнам), Институтом научно-исследовательских разработок (Монпелье, Франция). и Лаборатория питания человека Института пищевых наук Швейцарского федерального технологического института (Рушликон, Швейцария).

