Роль калия в жизни растений
Николай Вишенский
Калий наряду с азотом и фосфором относится к главным элементам питания растений. Он, безусловно, необходим всем растениям, животным и микроорганизмам. Попытки заменить калий близкими к нему элементами (натрием, литием, рубидием) оказались безрезультатными. Функция калия в растениях. как и других необходимых для них элементов, строго специфична.
Впервые предположение о необходимости калия растениям высказал Сосюр в 1804 г. на основании анализа золы растений, в которой всегда присутствовал калий. Затем Либих сделал заключение о необходимости применения калийных удобрений. Первые экспериментальные данные об абсолютной необходимости калия растениям были получены Сальм-Горстмаром в 1846 г.
В растениях калий находится в ионной форме. До сих пор неизвестно ни одно органическое соединение, в состав которого входил бы этот элемент. Калий содержится в основном в цитоплазме и вакуолях клеток; в ядрах и пластидах он отсутствует.
Около 80% калия находится в клеточном соке и может легко вымываться водой (например, дождями), особенно из старых листьев. В дневное время суток, когда в растениях активно протекают все биохимические процессы, калий, сохраняя легкую подвижность, все же удерживается в клетках освещенного растения. Ночью, когда процессы фотосинтеза прекращаются, часть калия может выделяться через корни, чтобы потом, с появлением первого солнечного луча, вновь поглощаться растением.
Примерно 20% калия удерживается в клетках растений в обменнопоглощенном состоянии коллоидами цитоплазмы и до 1% его необменно поглощается митохондриями.
Молодые органы растений содержат калия в 3-5 раз больше, чем старые: его больше в тех органах и тканях, где интенсивно идут процессы обмена веществ и деления клеток. Поэтому калий иногда называют элементом молодости. Много калия в пыльце растений. В золе пыльцы кукурузы содержится до 35,5% калия, а кальция, магния, серы и фосфора, вместе взятых — лишь 24,7%.
Физиологические функции калия весьма разнообразны. Установлено, что он стимулирует нормальное течение фотосинтеза, усиливает отток углеводов из пластинки листа в другие органы, а также синтез сахаров и высокомолекулярных углеводов — крахмала, целлюлозы, пектиновых веществ, ксиланов.
Калий усиливает накопление моносахаров в плодовых и овощных культурах, повышает содержание сахарозы в корнеплодах, крахмала в картофеле, утолщает стенки клеток соломины злаковых культур и повышает устойчивость хлебов к полеганию, а у льна и конопли улучшает качество волокна.
Способствуя накоплению углеводов в клетках растений, калий увеличивает осмотическое давление клеточного сока и тем самым повышает холодоустойчивость и морозостойкость растений.
Накапливаясь в хлоропластах и митохондриях, калий стабилизирует их структуру и способствует образованию АТФ. Калий увеличивает гидрофильность коллоидов протоплазмы; при этом снижается транспирация, что помогает растениям лучше переносить кратковременные засухи.
Калий играет важную роль в синтезе и обновлении белков в растениях. При его недостатке синтез белков резко снижается и одновременно происходит распад старых белковых молекул. В растениях накапливаются растворимые азотные соединения (свободные аминокислоты). Улучшение калийного питания сопровождается повышением удельного веса белкового азота в растениях пшеницы. Усиливается также синтез амидов (аспарагина и глютамина). Положительное влияние калия на синтез белков связано, по-видимому, во-первых, с его влиянием на накопление и трансформацию углеводов (а последние, как известно, в процессе дыхания дают кетокислоты — материал для построения аминокислот) и, во-вторых, с усилением под влиянием калия деятельности ферментов, участвующих в синтезе белка.
Калий поглощается растениями в виде катиона и, очевидно, в такой форме остается в клетке, образуя лишь слабые связи с ее веществами. В такой форме калий является основным противоионом для нейтрализации отрицательно заряженных компонентов клетки, а также создает разность электрических потенциалов между клеткой и средой. Возможно, именно в этом проявляется специфическая функция калия как незаменимого элемента питания.
Активизируя важнейшие биохимические процессы в клетках растений, калий повышает их устойчивость к различным заболеваниям как в течение вегетации, так и в послеуборочный период, значительно улучшает лежкость плодов и овощей.
Содержание калия в клетках растений существенно выше, чем других катионов. Внутриклеточная концентрация калия в растениях во много раз (в 100-1000) превышает его концентрацию в почвенном растворе.
Критический период в потреблении калия растениями приходится на первые 15 дней после всходов. Период максимального потребления, как правило, совпадает с периодом интенсивного прироста биологической массы. У одних растений поступление калия заканчивается уже к фазе полного цветения (лен) или к цветению — началу молочной спелости (зерновые и зернобобовые). У других растений оно более растянуто и происходит в течение всего вегетационного периода (картофель, сахарная свекла, капуста).
У одних растений поступление калия заканчивается уже к фазе полного цветения (лен) или к цветению — началу молочной спелости (зерновые и зернобобовые). У других растений оно более растянуто и происходит в течение всего вегетационного периода (картофель, сахарная свекла, капуста).
В отличие от азота и фосфора, калия больше в вегетативных органах растений, чем в репродуктивных. Например, в соломе большинства злаков калия больше почти в 2 раза, а в стеблях кукурузы — в 5 раз, чем в зерне. Поэтому вынос К2О с нетоварной частью урожая, как правило, выше, чем с товарной (за исключением зернобобовых).
Калиелюбивые культуры — сахарная и кормовая свекла, картофель, овощи — потребляют этот элемент гораздо больше, чем зерновые и зернобобовые культуры, лен и многолетние травы. Также много калия потребляет подсолнечник. В соотношении N : Р: К у калиефилов преобладает калий (2,5-4,5 : 1 : 3,5-6), а у зерновых культур — азот (2,5-3 : 1 : 1,5-2,2).
Недостаток калия вызывает множество нарушений обмена веществ у растений: ослабляется деятельность ряда ферментов, нарушается углеводный и белковый обмен, повышаются затраты углеводов на дыхание. В итоге продуктивность растений падает, качество продукции снижается. У зерновых образуется щуплое зерно, снижаются всхожесть и жизнеспособность семян. Нередко из-за ухудшения прочности соломины хлеба полегают. Уменьшается содержание крахмала в клубнях картофеля, сахарозы в корнеплодах сахарной свеклы, пектиновых веществ в плодах и ягодах. Урожайность зерновых, плодовых и овощных культур падает, снижается содержание витаминов в продукции. При дефиците калия возрастает поражаемость растений различными болезнями.
В итоге продуктивность растений падает, качество продукции снижается. У зерновых образуется щуплое зерно, снижаются всхожесть и жизнеспособность семян. Нередко из-за ухудшения прочности соломины хлеба полегают. Уменьшается содержание крахмала в клубнях картофеля, сахарозы в корнеплодах сахарной свеклы, пектиновых веществ в плодах и ягодах. Урожайность зерновых, плодовых и овощных культур падает, снижается содержание витаминов в продукции. При дефиците калия возрастает поражаемость растений различными болезнями.
Внешне калийное голодание растений проявляется в первую очередь на листьях нижнего яруса: они преждевременно желтеют, начиная с краев; в дальнейшем края буреют, а затем отмирают и разрушаются, вследствие чего они выглядят, как обожженные. Это явление получило название «краевой ожог». Дефицит калия сказывается и на снижении тургора, листья вянут и поникают. Чаще всего недостаток калия проявляется в период интенсивного роста растений (в середине вегетации), когда его содержание в клетках растений снижается в 3-5 раз в сравнении с нормой.
Сильнее от недостатка калия страдают калиелюбивые культуры.
Чрезмерное калийное питание растений также негативно отражается на их росте и развитии. Проявляется оно в возникновении между жилками листьев бледных мозаичных пятен, которые со временем буреют, а затем листья опадают.
Таким образом, регулируя уровень калийного питания растений, можно в значительной мере влиять на их продуктивность и качество получаемой продукции.
Круговорот и баланс калия в земледелии
Калий — один из основных биогенных элементов. Его круговорот в биоценозах весьма интенсивен. Содержание калия в биомассе различных биоценозов колеблется от 20 (пустыня) до 2000 кг/га (дубравы).
Замкнутый цикл круговорота питательных веществ в естественных биоценозах и аккумулирующая деятельность растений приводят к перераспределению калия в пределах корнеобитаемого слоя почвы и постепенному обогащению этим элементом ее верхних горизонтов.
В агроценозах круговорот и баланс калия зависят в основном от хозяйственной деятельности землепользователей: обеспеченности удобрениями, специализации хозяйств и др.
Валовые запасы калия в почвах во много раз (в 5-50) выше, чем азота и фосфора. Этого нельзя не учитывать.
Часть калия теряется из корнеобитаемого слоя почвы за счет инфильтрации: на легких почвах около 5 %, на тяжелых — около 2 % от внесенного количества удобрений. На интенсивность этого процесса оказывают влияние гранулометрический состав почвы и ее водный режим, дозы удобрений, особенности культур.
Часть калия почвы теряется в результате водной и ветровой эрозии. По усредненным данным, это составляет 4-8 кг/га. Обычно считается, что расходные статьи потерь калия от эрозии компенсируются поступлением его с семенами (около 2 кг/га) и осадками (2-6 кг/га).
Следует иметь в виду, что некоторая часть обменного калия может переходить в почве в фиксированное (необменно-поглощенное) состояние и тем самым изыматься из доступного для растений фонда калия. Установлено также, что в снабжении растений калием принимают участие не только пахотные, но и подпахотные горизонты почв.
Состав и свойства калийных удобрений
Промышленные калийные удобрения подразделяют на концентрированные (хлористый калий, сернокислый калий, хлористый калий — электролит, калийная соль, калимагнезия, калийно-магниевый концентрат) и сырые (сильвинит и каинит).
Сырые калийные соли.
Получают путем дробления и размола природных калийных солей. Обычно для этой цели используют более концентрированные пласты месторождений. Применять сырые калийные соли целесообразно лишь вблизи месторождений калийных руд, так как они имеют низкое содержание К2О и большое количество примесей. Они содержат много хлора, что также ограничивает их применение.
Из сырых калийных солей наиболее распространены сильвинит и каинит.
Сильвинит — пКС1 + mNaCl. Содержит 12-15% К2О и 35-40% ^2О. Выпускается в грубом помоле (размер кристаллов 1-5 мм и более). Розовато-бурый с включением синих кристаллов. При хранении во влажном помещении отсыревает, а при высыхании слеживается. Перевозят бестарным способом. Применяют под натриелюбивые культуры.
Выпускается в грубом помоле (размер кристаллов 1-5 мм и более). Розовато-бурый с включением синих кристаллов. При хранении во влажном помещении отсыревает, а при высыхании слеживается. Перевозят бестарным способом. Применяют под натриелюбивые культуры.
Каинит — КО . MgSO4.3h3O с примесью №0. Содержит 10% К2О, 6-7% MgO, 32-35% а, 22-25% №2О, 15-17% SО4. Это крупные кристаллы розовато-бурого цвета. Влажность не более 5%. Получают при размоле каинитовой или каинитово-лангбей-нитовой руды. Не слеживается, транспортируют навалом (насыпью).
Концентрированные калийные удобрения. Хлористый калий, хлорид калия — КО. Это основное калийное удобрение. Его производство составляет 80-90% от общего производства калийных удобрений. Получают хлорид калия в основном из сильвинита, который представляет собой смесь (агломерат) сильвина (КО) и галита (№0), содержащую 12-15% К2О. В химически чистом хлориде содержится 63,1% К2О. В зависимости от способа производства хлорид калия, поставляемый сельскому хозяйству, содержит от 57 до 60% К2О. Это мелкокристаллический порошок розового или белого цвета с сероватым оттенком.
Это мелкокристаллический порошок розового или белого цвета с сероватым оттенком.
Хлористый калий производят несколькими способами. Полученный белый мелкокристаллический хлорид калия при хранении сильно слеживается.
Отход производства содержит до 95% №0 и служит материалом для получения соды, технической поваренной соли.
Флотационный хлорид калия имеет более крупные естественные кристаллы розового цвета. Гидрофобные добавки (жирные амины), используемые в процессе флотации, существенно уменьшают гигроскопичность и слеживаемость удобрения.
Этот способ производства хлористого калия получил наибольшее распространение.
Сульфат калия — K2SО4. Это высококонцентрированное бесхлорное удобрение. Содержит 46-50% К2О. Мелкокристаллический порошок белого цвета с желтым оттенком, влажность 1,2%. Не слеживается, транспортируется в мешках или насыпью (без тары). Получают в процессе комплексной переработки полиминеральных калийных руд (лангбейнита, шенита) конверсией (обменным разложением) хлоридом калия, а также как побочный продукт ряда химических производств.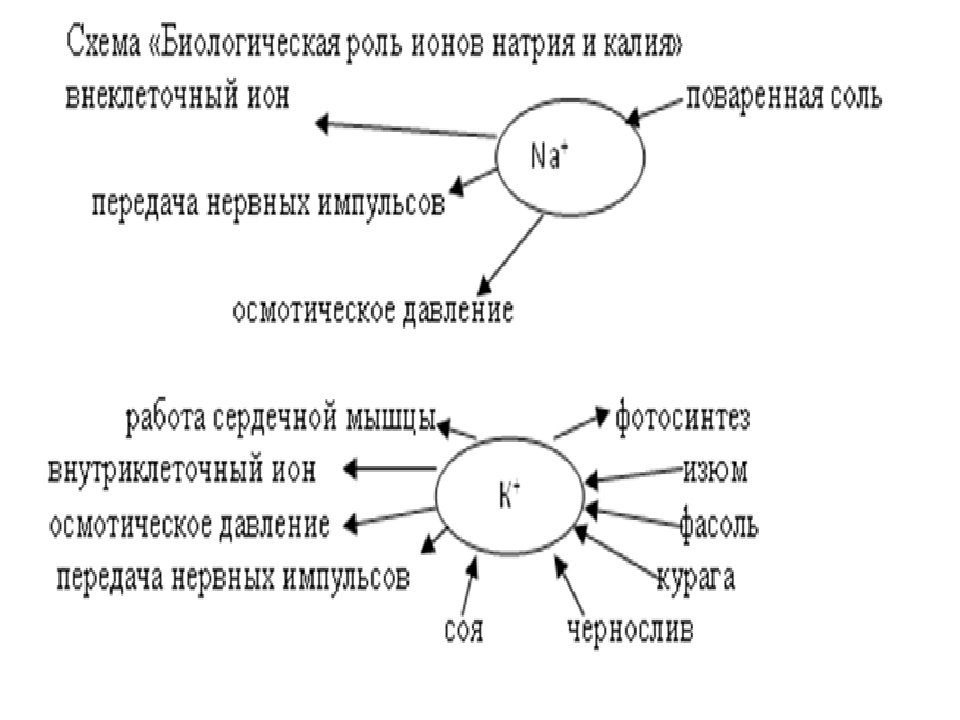
По сравнению с хлорсодержащими калийными удобрениями K2SО4 обеспечивает достоверные прибавки урожая винограда, гречихи, табака и других хлорофобных культур. Это удобрение широко используют в овощеводстве, особенно в защищенном грунте. Наличие серы в удобрении положительно влияет на продуктивность крестоцветных, бобовых и некоторых других культур.
Однако себестоимость сульфата калия гораздо выше, чем всех других калийных удобрений.
Калимагнезия, сульфат калия-магния — K2SО4 . MgSО4. Содержит 29% К2О и 9% MgO. Получают путем перекристаллизации из природных сульфатных солей, в основном из шенита. Поэтому это удобрение иногда называют шенитом. Белый сильнопылящий порошок с сероватым или розоватым оттенком либо серовато-розовые гранулы неправильной формы. Не слеживается, транспортируется в мешках или насыпью. Используется в первую очередь под культуры, чувствительные к хлору или на легких почвах.
Калимаг, калийно-магнезиальный концентрат — K2SО4 . 2MgSО4. Получают из сульфатных калий-маг-нийсодержащих минералов путем их обогащения.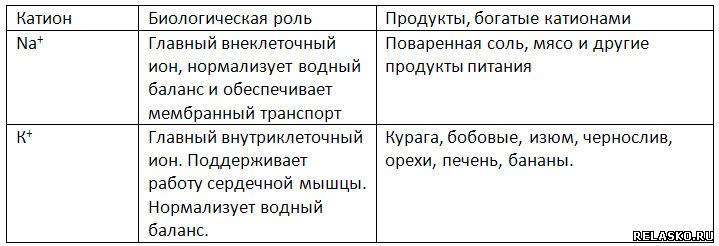 Содержит 18-20% К2О и 8-9% MgO. Выпускается в виде гранул серого цвета. Не слеживается, транспортируется насыпью. По эффективности приближается к калимагнезии.
Содержит 18-20% К2О и 8-9% MgO. Выпускается в виде гранул серого цвета. Не слеживается, транспортируется насыпью. По эффективности приближается к калимагнезии.
Хлоркалий электролит — КО с примесями №0 и MgCl2. Это побочный продукт при производстве магния из карналлита. Содержит 34-42% КА, по 5% MgO и №2О и до 50% а. Сильнопылящий мелкокристаллический порошок с желтым оттенком. Не слеживается, его перевозят в бумажных мешках или насыпью. По эффективности приближается к хлористому калию; на бедных магнием почвах более эффективен, чем КО.
Цементная пыль. Отход производства цемента, бесхлорное калийное удобрение. Содержит от 10-15 до 35% К2О. Калий содержится в виде карбонатов, бикарбонатов, сульфатов и в небольшом количестве силикатов. Имеются также гипс, оксид кальция, полуторные оксиды и некоторые микроэлементы. Калийные соли цементной пыли растворимы в воде и доступны растениям. Применяют в качестве основного удобрения, в первую очередь на кислых почвах и под хлорофобные культуры.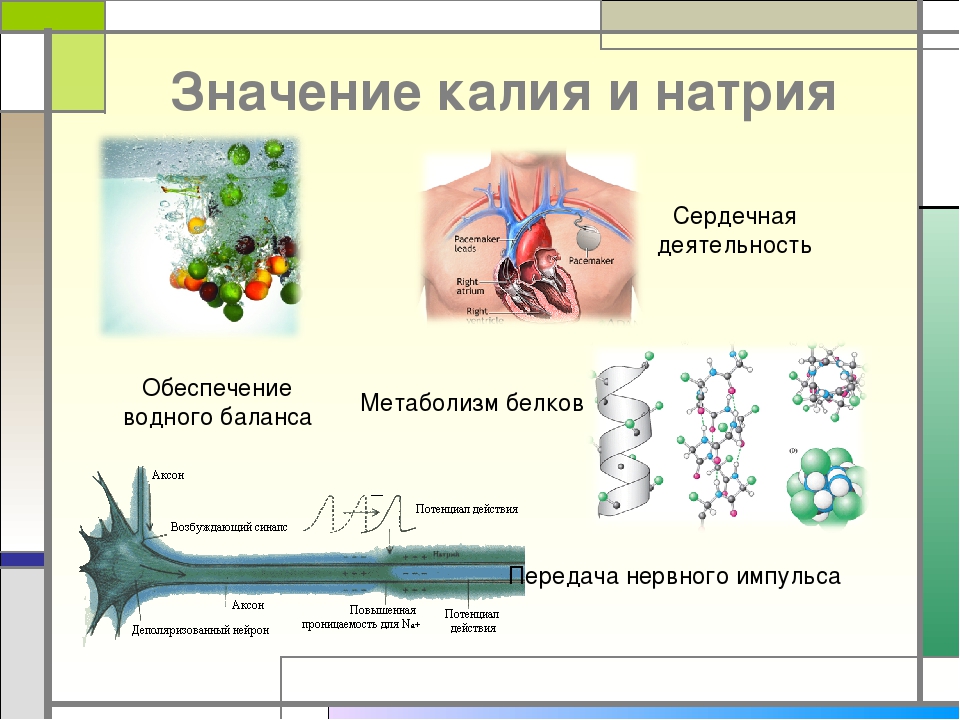
Печная зола. Местное калийно-фосфорно-известковое удобрение. Калий содержится в золе в виде поташа (К2СО3). Содержание К2О в золе существенно колеблется в зависимости от источника топлива. Например, зола лиственных пород содержит 1014% К2О, 7% Р2О5, 36% СаО, зола хвойных пород — 3-7% К2О, 2,0-2,5% Р2О5 и 25-30% СаО. Молодые деревья при сжигании дают больше золы, в которой и содержание питательных элементов выше. Печная зола — достаточно эффективное удобрение для всех культур (особенно для хлорофобных) и для всех почв (в первую очередь для кислых).
Взаимодействие калийных удобрений с почвой
Калийные удобрения хорошо растворимы в воде. При внесении в почву они растворяются в почвенном растворе, а затем вступают во взаимодействие с почвенным поглощающим комплексом по типу обменного (физико-химического), а частично и необменного поглощения.
Обменное поглощение катионов калия почвой составляет небольшую часть от всей емкости поглощения. Реакция обменного поглощения катионов калия почвой обратима.
В результате перехода калия в обменно-поглощенное состояние ограничивается его подвижность в почве и предотвращается вымывание за пределы пахотного слоя, за исключением легких почв с низкой емкостью поглощения. Обменно-поглощенный почвой калий удобрений хорошо доступен растениям.
Вторичные процессы взаимодействия почвенного раствора с почвенным поглощающим комплексом постепенно вытесняют из него катионы калия. Активное участие в таком обмене принимает и корневая система растений благодаря корневым выделениям.
На кислых и сильнокислых почвах (в особенности легкого гранулометрического состава), имеющих в составе ППК обменный водород и алюминий, при внесении калийных удобрений наблюдается заметное подкисление почвенного раствора. Поэтому на таких почвах эффективность калийных удобрений снижается.
Кроме того, дополнительное подкисление почвенного раствора происходит и за счет проявления физиологической кислотности калийных солей. Однако следует отметить, что физиологическая кислотность у калийных удобрений значительно меньше, чем у аммонийных, и проявляется она, как правило, только при длительном применении этих удобрений под калиелюбивые культуры, потребляющие большое количество калия.
Необменный (фиксированный) калий обладает значительно меньшей подвижностью, чем обменно-поглощенный. Переход его в раствор и доступность растениям значительно затруднены.
Фиксация калия удобрений разными почвами в зависимости от их минералогического состава и дозы удобрений может составлять от 14 до 82 % от внесенного количества.
При внесении крупнокристаллических или гранулированных удобрений фиксация калия почвой снижалась на 20-30% из-за меньшего контакта удобрения с почвой.
Размер необменного поглощения калия зависит и от дозы вносимого удобрения. Абсолютное количество фиксированного калия при увеличении дозы калийных удобрений резко возрастает, хотя в процентном отношении к внесенной дозе наблюдается понижение фиксации. Потенциальная способность почвы фиксировать калий очень велика.
При систематическом применении калийных удобрений и положительном балансе калия (т. е. при превышении внесенного калия удобрений над его выносом растениями) в почве повышается содержание как подвижных форм калия (водорастворимый и обменный), так и его фиксированных форм.
В условиях дефицита калийных удобрений (т. е. при отрицательном балансе калия) происходит обратный процесс. По мере расходования растениями доступных форм калия (водорастворимого и обменного) происходит постепенный переход фиксированного калия, а отчасти и калия кристаллической решетки в более подвижные формы. Например, в опыте на суглинистой почве (Англия) за 101 год растения вынесли с урожаями в 3-4 раза больше калия, чем его содержалось в почве в обменной форме.
Применение калийных удобрений на различных почвах
В районах эффективного действия калийных удобрений они обеспечивают на каждый килограмм внесенного калия удобрений прибавку урожая: зерна 2-3 кг, картофеля 2033, сахарной свеклы 35-40, льноволокна 1-1,5, сена сеяных трав 20-33 и сена луговых трав 8-18 кг.
Эффективность калийных удобрений зависит от почвенно-климатических условий и биологических особенностей возделываемых культур.
Что касается почвенных факторов, то здесь основным является обеспеченность почв доступным для растений калием (сумма водорастворимого и обменного калия).
Применение калийных удобрений наиболее эффективно на песчаных, супесчаных, дерново-подзолистых, торфяно-болотных и пойменных почвах, а также на красноземах. Положительное действие на урожай растений оказывают калийные удобрения и в зоне достаточного увлажнения на суглинистых дерново-подзолистых, серых лесных почвах, оподзоленных и выщелоченных черноземах (в случаях низкой и средней обеспеченности их калием).
На типичных, обыкновенных, южных черноземах, каштановых почвах и сероземах действие калийных удобрений в большинстве случаев слабое или совсем не проявляется. Применение калийных удобрений оправдано в этих условиях только под калиелюбивые культуры — сахарную свеклу, подсолнечник, овощные, а также на каштановых почвах и сероземах при орошении.
На солонцах, обычно богатых калием, калийные удобрения не применяют, так как они усиливают солонцеватость этих почв и не дают ожидаемого эффекта.
Калийные удобрения, как правило, оказывают положительное влияние на урожай растений при содержании в почве подвижного калия на уровне 1-3-го классов. При более высокой обеспеченности почв калием эффективность калийных удобрений снижается и определяется в основном составом культур севооборота, уровнем применяемых доз азотных и фосфорных удобрений и других агротехнических мероприятий.
При более высокой обеспеченности почв калием эффективность калийных удобрений снижается и определяется в основном составом культур севооборота, уровнем применяемых доз азотных и фосфорных удобрений и других агротехнических мероприятий.
Основные принципы оптимизации применения калийных удобрений следующие.
- Применение калийных удобрений с учетом обеспеченности почв калием, гранулометрического состава почв, биологических особенностей сельскохозяйственных растений и форм калийных удобрений.
- Повышение общего уровня культуры земледелия, окультуренности почв, соблюдение сбалансированного питания растений калием и другими питательными элементами (в первую очередь азотом и фосфором).
Эффективность калийных удобрений (как и фосфорных, и азотных) на слабокислых и нейтральных почвах заметно возрастает по сравнению с сильнокислыми почвами.
Поэтому известкование кислых почв — один из обязательных приемов повышения эффективности калийных удобрений. Однако из-за антагонизма ионов калия и кальция на произвесткованных почвах возникает потребность в повышении доз калийных удобрений.
Применение навоза, который сам является хорошим источником калия для растений, как правило, снижает действие минеральных калийных удобрений.
Наибольшая эффективность калийных удобрений достигается при оптимальном соотношении их с азотными и фосфорными. Одностороннее применение калийных удобрений возможно на осушенных торфяниках и торфяно-болотных почвах, обеспеченных другими элементами питания.
В ассортименте калийных удобрений преобладают хлорсодержащие формы. На почвах среднего и тяжелого гранулометрического состава такие удобрения в полной дозе (за исключением небольшой дозы в рядки под некоторые культуры) целесообразно вносить осенью. При этом удобрения размещают в более влажном слое почвы, где развивается основная масса корней, и они лучше усваиваются растениями, а хлор вымывается осенне-весенними осадками из пахотного слоя и не оказывает отрицательного действия на хлорофобные культуры. Только на легких, а также на торфяно-болотных и пойменных почвах калийные удобрения следует вносить весной. Под пропашные и овощные культуры в таких случаях часть общей дозы калия целесообразно давать в подкормку.
Под пропашные и овощные культуры в таких случаях часть общей дозы калия целесообразно давать в подкормку.
В севообороте калийные удобрения в первую очередь вносят под калиелюбивые культуры, которые дают при этом более заметные прибавки урожая.
Лен и конопля потребляют сравнительно немного калия, но их слабая корневая система не может в обычных условиях обеспечить эти растения достаточным количеством калия. Поэтому под эти культуры следует вносить повышенные дозы калийных удобрений.
Под хлорофобные культуры целесообразно применять удобрения с минимальным содержанием хлора. Опыты с картофелем показали, что применение хлорсодержащих калийных удобрений снижает количество крахмала на 7-15% по сравнению с удобрениями, не содержащими хлор.
3. Минеральные вещества и их роль в клетке
Для нормальной жизнедеятельности организмов требуются минеральные соли. В клетке они находятся в твёрдом или в растворённом виде. Растворённые соли диссоциированы на ионы. Наиболее важными являются катионы металлов: калия K+, натрия Na+, кальция Ca2+, магния Mg2+, и анионы: Cl−, h3PO4−, HPO42−, HCO3−, CO32−.
Роль минеральных солей в клетке разная. Так, ионы калия и натрия обеспечивают возбудимость клеток. Внутри клетки больше ионов K+ , а снаружи всегда больше содержание Na+, что приводит к возникновению разности потенциалов на клеточной мембране, обеспечивает раздражимость клеток и передачу возбуждения по нервам или мышцам. Перенос ионов через мембрану клетки осуществляется натрий-калиевым насосом и происходит с затратами АТФ (активный транспорт).
Рис. \(1\). Натриево-калиевый насос
Ионы кальция участвуют в регуляции мышечных сокращений, необходимы для процесса свёртывания крови. Твёрдые соли кальция входят в состав костной ткани, содержатся в раковинах моллюсков и панцирях ракообразных.
Ионы магния входят в состав хлорофилла, а ионы железа — в состав гемоглобина.
Катионы многих металлов (магния, кальция, железа, меди, кобальта, цинка, марганца и др. ) необходимы для синтеза некоторых ферментов, гормонов и витаминов.
) необходимы для синтеза некоторых ферментов, гормонов и витаминов.
Анионы фосфорной и угольной кислот образуют буферные системы, поддерживающие на постоянном уровне содержание ионов водорода в клетке (рН среды). Анионы HPO42− и h3PO4− (фосфатная буферная система) обеспечивают рН цитоплазмы клеток в пределах \(6,9\)–\(7,4\). Анионы HCO3− и CO32− (бикарбонатная буферная система) поддерживают значение рН плазмы крови \(7,4\).
Минеральные соли, содержащие азот и фосфор, нужны для образования белков, ДНК, РНК, АТФ и др.
Фосфаты входят в состав костной и зубной ткани. Хлорид-ионы необходимы для образования соляной кислоты, содержащейся в желудочном соке, а сульфат ионы — для синтеза некоторых аминокислот.
Недостаток минеральных солей приводит к нарушению процессов обмена веществ и негативно сказывается на жизнедеятельности клетки.
Источники:
Рис. 1. Натриево-калиевый насос © ЯКласс.
Дефициты питания овощных культур
Согласно медицинской статистике, на первом месте в ряду неблагоприятных факторов, вызывающих заболевания человека, находятся нарушения питания. То же самое мы наблюдаем в мире растений. Для овощных культур минеральное питание является ведущим фактором, определяющим их здоровье или болезнь. Полноценное, сбалансированное и достаточное питание – необходимое условие здоровья. Но если растения не получают полноценного питания, у них нарушается обмен веществ, что приводит к изменению их внешнего вида. Так возникают болезни обмена. Их чаще называют дефицитами питания, или неинфекционными болезнями. Неважно, недостает растениям одного или нескольких веществ, основные это элементы питания или микроэлементы, недостаточность и несбалансированность питания всегда проявляется как болезнь.
Чем опасны дефициты питания.
Неизбежным следствием любого дефицита питания является снижение урожая и пищевой ценности овощной продукции. Кроме того, неполноценное питание ослабляет растения, подрывает их иммунитет и способность противостоять грибным и бактериальным инфекциям. Поэтому за болезнями обмена обычно следуют инфекции и нашествие вредителей. Классическим примером связи между инфекцией и дефицитом питания является сухая гниль корнеплодов свеклы. Это заболевание способно обесценить практически весь урожай корнеплодов, а его истинной и легко устраняемой причиной является нехватка бора. Дефициты питания имеют слишком серьезные последствия, чтобы с ними можно было мириться. Их нужно вовремя распознавать и устранять.
Кроме того, неполноценное питание ослабляет растения, подрывает их иммунитет и способность противостоять грибным и бактериальным инфекциям. Поэтому за болезнями обмена обычно следуют инфекции и нашествие вредителей. Классическим примером связи между инфекцией и дефицитом питания является сухая гниль корнеплодов свеклы. Это заболевание способно обесценить практически весь урожай корнеплодов, а его истинной и легко устраняемой причиной является нехватка бора. Дефициты питания имеют слишком серьезные последствия, чтобы с ними можно было мириться. Их нужно вовремя распознавать и устранять.
Причины возникновения дефицитов питания.
Все элементы технологии узких гряд, с которыми мы познакомились в предыдущих публикациях — это рычаги воздействия на растения, посредством которых можно получить мощные, здоровые овощные культуры. Растениям предоставлено необходимое жизненное пространство и максимальная освещенность, и даже тепловой режим на узких грядах оптимизирован с помощью бортиков. Двухрядная посадка снимает конкуренцию между соседними растениями, а отсутствие на грядах сорняков освобождает овощи от более грозных, хорошо приспособленных к местным условиям конкурентов, которые с легкостью отнимают у культурных растений питательные элементы и угнетают их рост. Форма узких гряд и их строгая горизонтальность помогают обеспечить каждое растения влагой. Система питания на узких грядах призвана удовлетворить пищевые потребности культур и предохранить их от развития дефицитов. Она предусматривает сбалансированный состав питательных смесей, оптимальные сроки и кратность подкормок. В составе смесей 1 и 2 растения получают в общей сложности 7 важнейших элементов питания (азот, фосфор, калий, кальций, магний, серу, бор и молибден). Остальные элементы растения получают с помощью некорневого опрыскивания. Гарантирует ли соблюдение технологии от возникновения дефицитов питания овощных культур? Полной гарантии нет. Местные почвенные условия весьма разнообразны, а погодные условия сезона столь непредсказуемы, что иногда возникает необходимость корректировки стандартной схемы питания.
Двухрядная посадка снимает конкуренцию между соседними растениями, а отсутствие на грядах сорняков освобождает овощи от более грозных, хорошо приспособленных к местным условиям конкурентов, которые с легкостью отнимают у культурных растений питательные элементы и угнетают их рост. Форма узких гряд и их строгая горизонтальность помогают обеспечить каждое растения влагой. Система питания на узких грядах призвана удовлетворить пищевые потребности культур и предохранить их от развития дефицитов. Она предусматривает сбалансированный состав питательных смесей, оптимальные сроки и кратность подкормок. В составе смесей 1 и 2 растения получают в общей сложности 7 важнейших элементов питания (азот, фосфор, калий, кальций, магний, серу, бор и молибден). Остальные элементы растения получают с помощью некорневого опрыскивания. Гарантирует ли соблюдение технологии от возникновения дефицитов питания овощных культур? Полной гарантии нет. Местные почвенные условия весьма разнообразны, а погодные условия сезона столь непредсказуемы, что иногда возникает необходимость корректировки стандартной схемы питания. Приведу 2 примера.
Приведу 2 примера.
- Большое количество садовых участков в Подмосковье расположено на осушенных верховых торфяниках. Эта почва крайне бедна питательными элементами, поэтому богатые урожаи, получаемые на ней после перехода на технологию узких гряд, воспринимаются почти как чудо. Но у верхового торфяника есть одна особенность: это почва очень прочно связывает медь, поэтому у растущих на ней растений часто возникает дефицит меди. Чтобы кардинально и на долгие годы снять дефицит, перед тем, как разбивать огород, торфяник следует «прокупоросить»: внести на каждую сотку от 0,5 до 1,5 кг медного купороса.
- Вспомним лето 1995 г., его особенностью было чередование мощных «тропических» ливней и теплой солнечной погодой, которая наступала уже на следующее утро. Растения хорошо росли при таком режиме, но повсеместно, в том числе на узких грядах, отмечался дефицит калия. В отличие от азота, фосфора или магния, калий не входит с состав крупных молекул. Внутри растения он находится в низкомолекулярной форме, а потому легко вымывается при дожде из листьев.
 Из почвы калий не вымывается, и того количества калия, которое вносится с подкормочными смесями, хватает большинству огородных культур (только картофель «просит» добавки), но в данной ситуации корни просто не успевали вовремя восполнить образующийся дефицит и требовались дополнительное внесение калия.
Из почвы калий не вымывается, и того количества калия, которое вносится с подкормочными смесями, хватает большинству огородных культур (только картофель «просит» добавки), но в данной ситуации корни просто не успевали вовремя восполнить образующийся дефицит и требовались дополнительное внесение калия.
Оба приведенных примера описывают возникновение дефицита на фоне соблюдения рекомендованного режима подкормок. Но на практике бывает, что огородники экономят подкормочные смеси, или частично заменяют смесь 2 настоями крапивы, сброженными травными настоями, а иногда, принимая всю геометрию посадок узких гряд и связанные с ней преимущества, по экономическим или идейным соображениям пользуются альтернативными системами питания. Для таких случаев, когда, питая растения, огородники действуют наугад, особенно важно уметь распознавать дефициты питания и научиться своевременно их восполнять. Врез Как узнать, получают ли наши овощные культуры все необходимое для роста и плодоношения или страдают от нехватки питания? У растений есть свой язык, на котором они заявляют о своих потребностях, нужно только научиться его понимать. Язык растения – это его внешний вид – рост и габитус растения; размер и окраска листьев; количество, размер и форма цветков и плодов и многое другое, на что необходимо обращать внимание, если мы хотим, чтобы наши труды получили вознаграждение в виде обильного урожая.
Язык растения – это его внешний вид – рост и габитус растения; размер и окраска листьев; количество, размер и форма цветков и плодов и многое другое, на что необходимо обращать внимание, если мы хотим, чтобы наши труды получили вознаграждение в виде обильного урожая.
Признаки пищевого благополучия
Об этих растениях можно сказать, что они здоровы. Мы вправе рассчитывать, что они принесут высокий урожай полноценных овощей. Овощи, полученные от здоровых культур, обладают высокими вкусовыми качествами и большой питательной ценностью.
- Полноценно питающиеся растения быстро растут, они крупные, без задержки переходят к цветению и плодоношению
- Листья ярко-зеленые, крупные, правильной формы, эластичные, упругие, развернуты к солнцу. Они не имеют пятен, крапинок, сухих краев и кончиков, не желтеют и не опадают. • Стебли округлые и упругие, при сгибании не ломаются
- Цветки – их много и они крупные; бутоны, цветки и мелкие завязи не опадают
- Плоды – завязи не загнивают.
 Плоды имеют правильную форму, крупные, сочные, но не водянистые. Они ярко окрашены, с сильным специфическим запахом и сладкие
Плоды имеют правильную форму, крупные, сочные, но не водянистые. Они ярко окрашены, с сильным специфическим запахом и сладкие - Корнеплоды – ровные, без разветвления, интенсивно окрашенные, сочные и сладкие
- Кочаны – с хорошо развитой розеткой оберточных листьев, крупные, плотные, с эластичными листьями, сочные и сладкие
Острое голодание овощных культур
Острое голодание – это общая недостаточность питания, когда овощные культуры нуждаются как минимум в 6 или 7 питательных элементах: во всех макроэлементах (азоте, фосфоре, калии, магнии, кальции, сере), а также в наиглавнейшем микроэлементе – боре. Разве «молчат» эти страдальцы? Их вид «вопиет» к их хозяину о состоянии острого голодания, в котором они находятся. Это медленно растущие, чахлые растения с тонким жестким стеблем и бледноватой, пятнистой листвой. Эти овощи несъедобны – он пусты, безвкусны и могут быть токсичными, если участок расположен вблизи трассы или в зоне промышленных выбросов. Голодающие культуры отвечают усилением роста на любую подкормку основными элементами питания, будь то комплексное минеральное удобрение или травные настои, и, как правило, не отвечают на опрыскивание микроэлементами. Когда неопытный огородник видит, что состояние культур в ответ на подкормку улучшилось, у него создается впечатление, что дано достаточно питательных веществ. Потому и в дальнейшем он держат свои огородные культуры на грани выживания, подкармливая изредка. Голодающие растения приносят скудный урожай, практически лишенный питательной ценности. При «классической» технологии подкормки под перекопку вносится некоторое количество золы и пустого самодельного компоста, приготовленного из сорняков и пищевых отходов без всяких правил и хорошо промытого дождями. Кабачки и картофель удостоились дополнительно по ложке золы и компоста в лунку. Вид почвы и растений свидетельствует о крайнем истощении почвенного плодородия, об энергетической смерти почвы. Перед нами замкнутый круг – почве нечего дать растениям, а жалкие растения ничем не могут помочь умирающей почве.
Голодающие культуры отвечают усилением роста на любую подкормку основными элементами питания, будь то комплексное минеральное удобрение или травные настои, и, как правило, не отвечают на опрыскивание микроэлементами. Когда неопытный огородник видит, что состояние культур в ответ на подкормку улучшилось, у него создается впечатление, что дано достаточно питательных веществ. Потому и в дальнейшем он держат свои огородные культуры на грани выживания, подкармливая изредка. Голодающие растения приносят скудный урожай, практически лишенный питательной ценности. При «классической» технологии подкормки под перекопку вносится некоторое количество золы и пустого самодельного компоста, приготовленного из сорняков и пищевых отходов без всяких правил и хорошо промытого дождями. Кабачки и картофель удостоились дополнительно по ложке золы и компоста в лунку. Вид почвы и растений свидетельствует о крайнем истощении почвенного плодородия, об энергетической смерти почвы. Перед нами замкнутый круг – почве нечего дать растениям, а жалкие растения ничем не могут помочь умирающей почве. Специально перечислять признаки острого голодания едва ли целесообразно. Проще посмотреть на фотографии, и заменить все слова в приведенном выше описании пищевого благополучия на слова с противоположным значением. Но как разорвать этот замкнутый круг вырождения? Очень просто. Если на данной мертвой почве сделать узкие гряды и обеспечить овощным культурам минеральное питание,то в первый же год будет получен высокий урожай овощей, и одновременно здоровые растения начнут исцеление почвы. Органические вещества, выделяемые корнями мощных здоровых растений, привнесут в почву энергию солнца, что сделает возможным возрождение почвенной микрофлоры и увеличение численности дождевых червей. Это начало, а после уборки урожая богатые питательными элементами послеуборочные остатки можно переработать прямо на грядках с помощью препаратов ЭМ (эффективных агрономически полезных микроорганизмов).
Специально перечислять признаки острого голодания едва ли целесообразно. Проще посмотреть на фотографии, и заменить все слова в приведенном выше описании пищевого благополучия на слова с противоположным значением. Но как разорвать этот замкнутый круг вырождения? Очень просто. Если на данной мертвой почве сделать узкие гряды и обеспечить овощным культурам минеральное питание,то в первый же год будет получен высокий урожай овощей, и одновременно здоровые растения начнут исцеление почвы. Органические вещества, выделяемые корнями мощных здоровых растений, привнесут в почву энергию солнца, что сделает возможным возрождение почвенной микрофлоры и увеличение численности дождевых червей. Это начало, а после уборки урожая богатые питательными элементами послеуборочные остатки можно переработать прямо на грядках с помощью препаратов ЭМ (эффективных агрономически полезных микроорганизмов).
Скрытое голодание овощных культур
Если одни растения обгоняют в росте соседние растения того же сорта, это верный признак скрытого голодания. На одной грядке можно видеть и хорошо развитые, доминирующие растения и угнетенные растения. Другим характерным признаком скрытого голодания служит сильное разрастание корневой системы у доминирующих растений. Третий признак – слабая реакция на опрыскивание микроэлементами. Когда не хватает основных питательных веществ, дефицит микроэлементов маскирован (точно так, как невозможно голодающего человека накормить витаминными препаратами). При скрытом голодании растения на первый взгляд могут выглядеть нормально, и только в сравнении с культурами, получающими хорошее питание, видно, что стебли отстают в росте, листья мельче и бледнее, плодов меньше и они мельче. У томатов нехватка питания иногда ведет к растрескиванию зреющих плодов с цветочного конца, к появлению плодов с впалыми боками, что особенно заметно на сливовидных сортах. Скрытое голодание – это мягкая форма общей недостаточности питания, когда культуры нуждаются в тех же в 6 или 7 элементах, что и при остром голодании (азоте, фосфоре, калии, магнии, кальции, сере, боре).
На одной грядке можно видеть и хорошо развитые, доминирующие растения и угнетенные растения. Другим характерным признаком скрытого голодания служит сильное разрастание корневой системы у доминирующих растений. Третий признак – слабая реакция на опрыскивание микроэлементами. Когда не хватает основных питательных веществ, дефицит микроэлементов маскирован (точно так, как невозможно голодающего человека накормить витаминными препаратами). При скрытом голодании растения на первый взгляд могут выглядеть нормально, и только в сравнении с культурами, получающими хорошее питание, видно, что стебли отстают в росте, листья мельче и бледнее, плодов меньше и они мельче. У томатов нехватка питания иногда ведет к растрескиванию зреющих плодов с цветочного конца, к появлению плодов с впалыми боками, что особенно заметно на сливовидных сортах. Скрытое голодание – это мягкая форма общей недостаточности питания, когда культуры нуждаются в тех же в 6 или 7 элементах, что и при остром голодании (азоте, фосфоре, калии, магнии, кальции, сере, боре). Подкормка любым простым удобрением (азотным, фосфорным или калийным) не снимает проблему, более того, симптомы нехватки остальных элементов проявляются острее. Однако при внесении комплексного удобрения, содержащего только 3 основных элемента, состояние растений обычно меняется к лучшему. Врез Основными элементами питания называют знаменитую тройку «NPK» – азот (N), фосфор (P) и калий (K). Само название указывает на огромную роль азота, фосфора и калия в жизни растений и высокий уровень их потребления. Нехватка NPK – самая распространенная причина неурожая. Когда агрономы говорят о минеральных удобрениях, они имеют в виду именно NPK. Огородники, подкармливая растения, часто уделяют внимание исключительно азотным, фосфорным и калийным удобрениям. Но при всей значимости NPK длительное внесение только этой тройки элементов приводит к негативным последствиям. Со временем грунт закисляется и зафосфачивается; проявляются дефициты кальция, магния и микроэлементов; у растений нарушается обмен веществ, ухудшается качество плодов, в них накапливаются нитраты.
Подкормка любым простым удобрением (азотным, фосфорным или калийным) не снимает проблему, более того, симптомы нехватки остальных элементов проявляются острее. Однако при внесении комплексного удобрения, содержащего только 3 основных элемента, состояние растений обычно меняется к лучшему. Врез Основными элементами питания называют знаменитую тройку «NPK» – азот (N), фосфор (P) и калий (K). Само название указывает на огромную роль азота, фосфора и калия в жизни растений и высокий уровень их потребления. Нехватка NPK – самая распространенная причина неурожая. Когда агрономы говорят о минеральных удобрениях, они имеют в виду именно NPK. Огородники, подкармливая растения, часто уделяют внимание исключительно азотным, фосфорным и калийным удобрениям. Но при всей значимости NPK длительное внесение только этой тройки элементов приводит к негативным последствиям. Со временем грунт закисляется и зафосфачивается; проявляются дефициты кальция, магния и микроэлементов; у растений нарушается обмен веществ, ухудшается качество плодов, в них накапливаются нитраты. Практика овощеводства на узких грядах показала: чтобы не накапливалось негативных последствий, чтобы из года в год получать высокие урожаи полноценных по составу овощей, с низким содержанием нитратов, нужно кормить растения сбалансированными смесями, содержащими все макроэлементы, и снабжать их микроэлементами. Скрытое голодание коварно. Дело не только в недоборе урожая и невысоком качестве плодов. Растения, испытывающие скрытый голод, находятся в постоянном стрессе, они чувствительны к любым неблагоприятным воздействиям. В разгар плодоношения они обычно заболевают, причем на голодающих растениях защита от инфекций не эффективна. На фоне скрытого голодания болезни развиваются быстро и неотвратимо губят урожай.
Практика овощеводства на узких грядах показала: чтобы не накапливалось негативных последствий, чтобы из года в год получать высокие урожаи полноценных по составу овощей, с низким содержанием нитратов, нужно кормить растения сбалансированными смесями, содержащими все макроэлементы, и снабжать их микроэлементами. Скрытое голодание коварно. Дело не только в недоборе урожая и невысоком качестве плодов. Растения, испытывающие скрытый голод, находятся в постоянном стрессе, они чувствительны к любым неблагоприятным воздействиям. В разгар плодоношения они обычно заболевают, причем на голодающих растениях защита от инфекций не эффективна. На фоне скрытого голодания болезни развиваются быстро и неотвратимо губят урожай.
Дефицит отдельных элементов питания
Кроме тотального голодания, острого или скрытого, на практике возникают ситуации, когда торможение роста и плодоношения вызвано дефицитом 1–2 элементов питания. При этом извращается обмен, внешний вид растений меняется, возникают аномалии, специфичные для каждого отдельного элемента. Так как все элементы питания являются незаменимыми, нехватку одного элемента нельзя компенсировать избытком других. Нужно выявить лимитирующее вещество и устранить дефицит. Визуальную диагностику облегчает то обстоятельство, что все питательные вещества по их поведению в растении можно разделить на 2 группы.
Так как все элементы питания являются незаменимыми, нехватку одного элемента нельзя компенсировать избытком других. Нужно выявить лимитирующее вещество и устранить дефицит. Визуальную диагностику облегчает то обстоятельство, что все питательные вещества по их поведению в растении можно разделить на 2 группы.
- Легко реутилизируемые элементы питания. К ним относятся азот, фосфор, калий и магний. Когда их не хватает, они перетекают из старых (нижних) листьев к точке роста, в молодые листья, в цветочные кисти и плоды. Поэтому специфические признаки дефицита азота, фосфора, калия и магния ярче всего проявляются на старых листьях: на нижних ярусах огуречных и томатных плетей, на наружных листьях моркови, свеклы и других корнеплодов, на оберточных листьях капусты и т.д.
- Не реутилизируемые и слабо реутилизируемые элементы питания. К ним относятся кальций, бор и молибден, а также сера и большинство микроэлементов. Поскольку эти элементы практически не способны перераспределяться в растении, то по мере роста дефицит становится все более и более тяжелым, причем, чем моложе лист, тем больше он страдает.
 В ряде случаев сильнее всего поражаются верхушечные почки. Диагностика дефицитов питания Итак, диагностику дефицитов питания мы начинаем с того, что определяем, какие части растения выглядят более поврежденными, старые или молодые. Этим мы ограничим круг дальнейших изысканий. Если мы видим, что пострадали старые листья, нам предстоит определить по специфическим признакам, какой из 4 реутилизируемых элементов находится в дефиците: азот, фосфор, калий или магний. Хорошей подсказкой при визуальной диагностике являются индикаторные растения. Это овощные культуры, которые испытывают повышенную потребность в данном элементе, а потому у них раньше появляются и ярче выражены специфические признаки его недостаточности.
В ряде случаев сильнее всего поражаются верхушечные почки. Диагностика дефицитов питания Итак, диагностику дефицитов питания мы начинаем с того, что определяем, какие части растения выглядят более поврежденными, старые или молодые. Этим мы ограничим круг дальнейших изысканий. Если мы видим, что пострадали старые листья, нам предстоит определить по специфическим признакам, какой из 4 реутилизируемых элементов находится в дефиците: азот, фосфор, калий или магний. Хорошей подсказкой при визуальной диагностике являются индикаторные растения. Это овощные культуры, которые испытывают повышенную потребность в данном элементе, а потому у них раньше появляются и ярче выражены специфические признаки его недостаточности.
Дефицит и избыток азота
Азот – элемент жизни. Этот элемент – основа всех жизненных процессов. Он входит в состав многих органических веществ, в том числе в состав белков и хлорофилла, находится в хромосомах и во всех других важнейших структурах живой клетки. Из тройки NPK, азот по праву считается главным элементом. При нехватке азота растения низкорослые, у них тонкие и жесткие стебли, «сжатый» габитус. Листья постепенно желтеют, причем равномерно меняется окраска всего листа, как между жилками, так и самих жилок. На начальных стадиях листья светло-зеленые, при умеренном дефиците – желтовато-зеленые, при сильном – желтеет все растение. Чтобы расти, растения перекачивают азот к точке роста. Поэтому на старых (нижних) листьях изменение окраски выражено сильнее, чем вблизи верхушечной почки. При хронической азотной недостаточности листья мелкие, верхние листья отходят от стебля под острым углом. Переход к цветению ускорен, однако цветков мало и они мелкие. Растения часто сбрасывают цветки и завязи. Малочисленные вызревшие плоды мелкие и невкусные. Голодание растений, когда им недостает всех основных питательных веществ, визуально чаще всего проявляется как дефицит азота. Индикаторные растения Огурец: при нехватке азота плоды приобретают характерную форму «крючка» – возле плодоножки плод имеет нормальный размер, а к цветочному концу он сужается и загибается.
Из тройки NPK, азот по праву считается главным элементом. При нехватке азота растения низкорослые, у них тонкие и жесткие стебли, «сжатый» габитус. Листья постепенно желтеют, причем равномерно меняется окраска всего листа, как между жилками, так и самих жилок. На начальных стадиях листья светло-зеленые, при умеренном дефиците – желтовато-зеленые, при сильном – желтеет все растение. Чтобы расти, растения перекачивают азот к точке роста. Поэтому на старых (нижних) листьях изменение окраски выражено сильнее, чем вблизи верхушечной почки. При хронической азотной недостаточности листья мелкие, верхние листья отходят от стебля под острым углом. Переход к цветению ускорен, однако цветков мало и они мелкие. Растения часто сбрасывают цветки и завязи. Малочисленные вызревшие плоды мелкие и невкусные. Голодание растений, когда им недостает всех основных питательных веществ, визуально чаще всего проявляется как дефицит азота. Индикаторные растения Огурец: при нехватке азота плоды приобретают характерную форму «крючка» – возле плодоножки плод имеет нормальный размер, а к цветочному концу он сужается и загибается.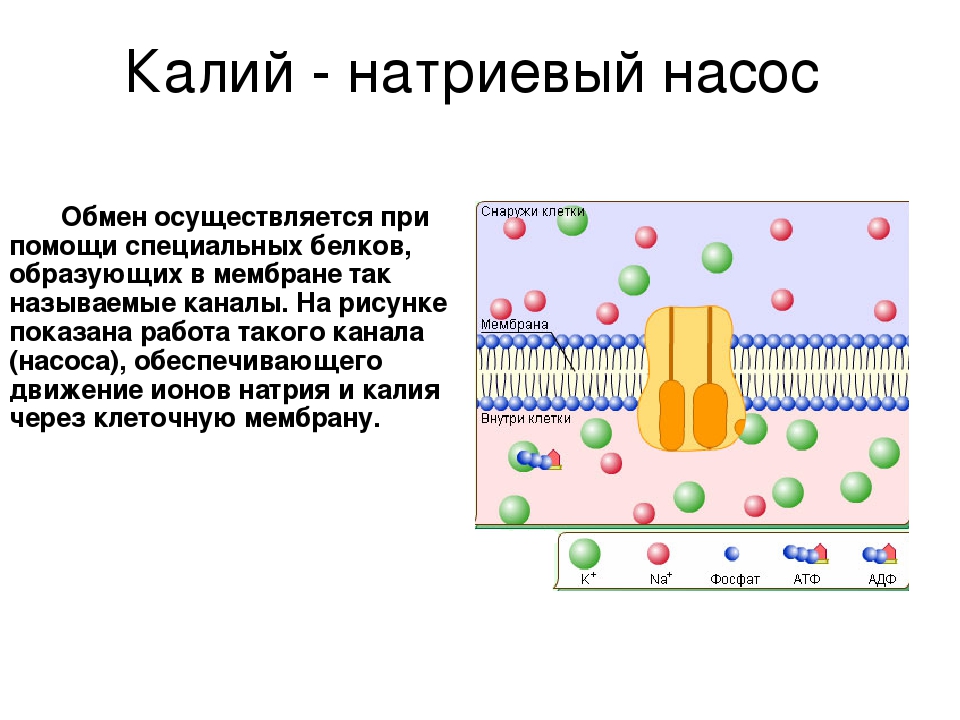 Кукуруза: голый, свободный от зерен дистальный конец початка. Кочанная капуста: «голенастые» кочаны (кочаны с длинной кочерыжкой). Причины дефицита азота На узких грядах при стандартной системе питания дефицит азота бывает крайне редко, но может проявиться при излишней загущенности посадок или при нарушении режима подкормок. При альтернативных системах питания азотное голодание возникает по разным причинам. При заправке грунта невызревшим компостом или другой неразложившейся органикой огородные культуры до середины лета испытывают хроническую нехватку азота. Азот неразложившейся органики недоступен для растений. Если июнь холодный, дефицит может принять тяжелую форму. Когда ночи становятся теплыми, начинается активная переработка органики микроорганизмами. Поскольку для этого процесса требуется свободный азот, растения и микроорганизмы вступают в период острой конкуренции за доступный азот почвы. Весной и в начале лета, чтобы обеспечить нормальный стартовый рост огородных культур, необходимо использовать минеральные азотные удобрения.
Кукуруза: голый, свободный от зерен дистальный конец початка. Кочанная капуста: «голенастые» кочаны (кочаны с длинной кочерыжкой). Причины дефицита азота На узких грядах при стандартной системе питания дефицит азота бывает крайне редко, но может проявиться при излишней загущенности посадок или при нарушении режима подкормок. При альтернативных системах питания азотное голодание возникает по разным причинам. При заправке грунта невызревшим компостом или другой неразложившейся органикой огородные культуры до середины лета испытывают хроническую нехватку азота. Азот неразложившейся органики недоступен для растений. Если июнь холодный, дефицит может принять тяжелую форму. Когда ночи становятся теплыми, начинается активная переработка органики микроорганизмами. Поскольку для этого процесса требуется свободный азот, растения и микроорганизмы вступают в период острой конкуренции за доступный азот почвы. Весной и в начале лета, чтобы обеспечить нормальный стартовый рост огородных культур, необходимо использовать минеральные азотные удобрения.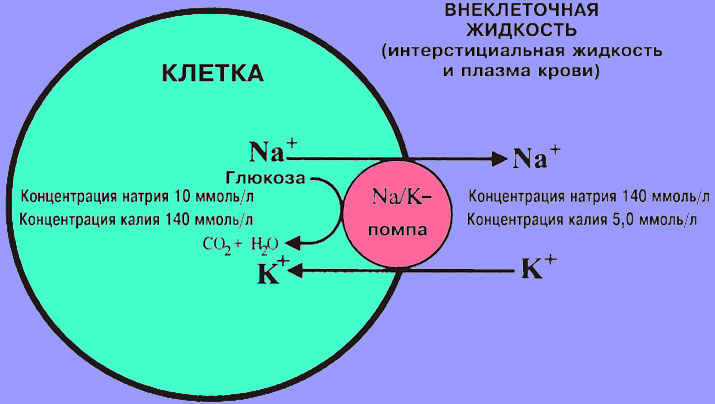 При низкой температуре грунта молодые огородные культуры, особенно теплолюбивые, плохо поглощают аммиачный азот и азот органических подкормок. Лучшая форма азота для весны и начала лета – нитратная. Спровоцировать азотное голодание можно подкормками древесной золой, суперфосфатом или калийными удобрениями. Устранение дефицита азота Если дефицит азота возник из-за общего скудного питания, нужно перейти на регулярные подкормки растений комплексным сбалансированным удобрением. В остальных случаях для коррекции дефицита вносят простые азотные удобрения: аммиачную селитру (40 г/м) или мочевину (30 г/м). Удобрение насыпают полосой вдоль рядков растений и растворяют при поливе. Избыток азота Вреден для огородных культур. Даже небольшой избыток вызывает усиленный вегетативный рост в ущерб плодоношению. Когда растения потребляют лишний азот, они более подвержены инфекциям. В продукции повышается содержание нитратов; увеличивается отход плодов и корнеплодов при хранении. Первым признаком избытка азота является пышная мягкая листва.
При низкой температуре грунта молодые огородные культуры, особенно теплолюбивые, плохо поглощают аммиачный азот и азот органических подкормок. Лучшая форма азота для весны и начала лета – нитратная. Спровоцировать азотное голодание можно подкормками древесной золой, суперфосфатом или калийными удобрениями. Устранение дефицита азота Если дефицит азота возник из-за общего скудного питания, нужно перейти на регулярные подкормки растений комплексным сбалансированным удобрением. В остальных случаях для коррекции дефицита вносят простые азотные удобрения: аммиачную селитру (40 г/м) или мочевину (30 г/м). Удобрение насыпают полосой вдоль рядков растений и растворяют при поливе. Избыток азота Вреден для огородных культур. Даже небольшой избыток вызывает усиленный вегетативный рост в ущерб плодоношению. Когда растения потребляют лишний азот, они более подвержены инфекциям. В продукции повышается содержание нитратов; увеличивается отход плодов и корнеплодов при хранении. Первым признаком избытка азота является пышная мягкая листва. При большом избытке возможен краевой ожог нижних листьев и повреждение корней. Использование сбалансированных смесей и соблюдение режима подкормок гарантируют от избытка азота и от накопления нитратов в овощах. Смеси содержат молибден и магний, с помощью опрыскивания растения получают медь и другие элементы, участвующие в азотном обмене, поэтому поступающие в растения нитраты быстро перерабатываются. Нитраты – отличная пища для растений. Нужно только, чтобы растения ее «переварили» до того, как овощи попадут на наш стол.
При большом избытке возможен краевой ожог нижних листьев и повреждение корней. Использование сбалансированных смесей и соблюдение режима подкормок гарантируют от избытка азота и от накопления нитратов в овощах. Смеси содержат молибден и магний, с помощью опрыскивания растения получают медь и другие элементы, участвующие в азотном обмене, поэтому поступающие в растения нитраты быстро перерабатываются. Нитраты – отличная пища для растений. Нужно только, чтобы растения ее «переварили» до того, как овощи попадут на наш стол.
| Дефицит азота на винограде | Дефицит азота на огурце | Дефицит азота на томате |
Избыток азота на огурце
Дефицит и избыток фосфора
Фосфор – элемент плодоношения и энергии Значение фосфора в жизни растений огромно. Хранение и передача генетической информации, деление клеток, образование углеводов при фотосинтезе – эти и многие другие процессы требуют фосфора. С фосфором связана энергетика живой клетки. В «силовых подстанциях» клеток – митохондриях – энергия запасается в форме соединений фосфора. Особенно много фосфора содержится в генеративных органах и семенах. Диагностика фосфорного голодания Как и при дефиците азота, при нехватке фосфора растения низкорослые, с тонким стеблем; симптомы голодания сильнее выражены на старых листьях, меньше – на молодых. Но на этом сходство кончается. Если универсальным признаком нехватки азота является желтизна, то при нехватке фосфора листья тускло-зеленые или остаются зелеными, но приобретают фиолетовый, красно-фиолетовый, лиловый или бронзовый оттенки, которые особенно заметны с нижней стороны листовых пластинок. Если при дефиците азота переход к цветению ускорен, то при нехватке фосфора он задерживается. Плоды завязываются плохо, период их созревания удлиняется; при хроническом дефиците помидоры, перец, фасоль не успевают созреть до конца вегетации.
С фосфором связана энергетика живой клетки. В «силовых подстанциях» клеток – митохондриях – энергия запасается в форме соединений фосфора. Особенно много фосфора содержится в генеративных органах и семенах. Диагностика фосфорного голодания Как и при дефиците азота, при нехватке фосфора растения низкорослые, с тонким стеблем; симптомы голодания сильнее выражены на старых листьях, меньше – на молодых. Но на этом сходство кончается. Если универсальным признаком нехватки азота является желтизна, то при нехватке фосфора листья тускло-зеленые или остаются зелеными, но приобретают фиолетовый, красно-фиолетовый, лиловый или бронзовый оттенки, которые особенно заметны с нижней стороны листовых пластинок. Если при дефиците азота переход к цветению ускорен, то при нехватке фосфора он задерживается. Плоды завязываются плохо, период их созревания удлиняется; при хроническом дефиците помидоры, перец, фасоль не успевают созреть до конца вегетации.
Индикаторные растения:
Томаты: пурпурные и фиолетовые оттенки, особенно с нижней стороны листьев, а иногда и на нижней части стебля.
Причины дефицита фосфора
При температуре грунта 12°С и ниже корни теплолюбивых культур плохо поглощают фосфор. При ранней высадке рассады дефицит возникает при нормальном содержании фосфора в почве. Иногда для подкормок огородники используют раствор коровяка. По сравнению с азотом, в этом удобрении непропорционально мало фосфора, оно не подходит для подкормок требовательных к фосфору культур, особенно томатов и перца. Причиной нехватки фосфора может быть его «фиксация», т.е. переход в нерастворимые, недоступные растениям соединения. Фиксации внесенного с удобрениями фосфора активно идет как в кислом, так и в переизвесткованном грунте. В первом случае фосфор фиксируется, взаимодействуя с железом и алюминием, во втором образуется нерастворимый трикальциевый фосфат. Устранение дефицита фосфора Нехватка фосфора, вызванная низкой температурой грунта, часто наблюдается у томатов вскоре после высадки рассады в грунт или теплицу. Для устранения дефицита достаточно повысить температуру грунта. Томаты поливают теплой водой и устанавливают полосные укрытия. Дефицит, вызванный несбалансированным питанием, устраняют внесением двойного суперфосфата в дозе 25 г/м рядка. Удобрение насыпают полосой и растворяют при поливе. Коррекцию проводят между плановыми подкормками, а не вместо них. Избежать фиксации фосфора помогает дробное внесение удобрений малыми дозами, использование смесей, содержащих азот, фосфор и калий в правильном соотношении, и поддержание слабокислой реакции почвенной среды. Избыток фосфора Фосфор, не востребованный растениями, переходит в нерастворимую форму и накапливается в грунте. Грунт «зафосфачивается». Избыток фосфора в почве вреден, так как мешает поглощению других элементов питания, в частности, железа, цинка, меди. Если огородные культуры несколько лет подкармливали фосфорными удобрениями или печной золой, велика вероятность, что грунт перегружен фосфором. Это можно проверить по биотесту. Врез Биотест на избыточное содержание фосфора в грунте Весной на тестируемом грунте выращивают редис.
Томаты поливают теплой водой и устанавливают полосные укрытия. Дефицит, вызванный несбалансированным питанием, устраняют внесением двойного суперфосфата в дозе 25 г/м рядка. Удобрение насыпают полосой и растворяют при поливе. Коррекцию проводят между плановыми подкормками, а не вместо них. Избежать фиксации фосфора помогает дробное внесение удобрений малыми дозами, использование смесей, содержащих азот, фосфор и калий в правильном соотношении, и поддержание слабокислой реакции почвенной среды. Избыток фосфора Фосфор, не востребованный растениями, переходит в нерастворимую форму и накапливается в грунте. Грунт «зафосфачивается». Избыток фосфора в почве вреден, так как мешает поглощению других элементов питания, в частности, железа, цинка, меди. Если огородные культуры несколько лет подкармливали фосфорными удобрениями или печной золой, велика вероятность, что грунт перегружен фосфором. Это можно проверить по биотесту. Врез Биотест на избыточное содержание фосфора в грунте Весной на тестируемом грунте выращивают редис. Если доля стрелкующихся растений превышает 5%, это свидетельствует о перегрузке грунта фосфором. В учебниках по агрохимии сообщается, что растения усваивают примерно 10% фосфора, вносимого с удобрениями, а остальной фосфор фиксируется в грунте. Это утверждение не является справедливым по отношению к системе питания, практикуемой на узких грядах, при которой сбалансированные смеси удобрений вносятся дробно (часто и небольшими дозами) на поверхность грунта. Обычно фосфор фиксируется, когда он мигрирует в почве. При поверхностном внесении подкормок густая сетка корней подходит к самой поверхности грунта, и корни поглощают фосфор до перехода в недоступную форму. Для данной технологии характерна исключительно высокая степень усвоения фосфора.
Если доля стрелкующихся растений превышает 5%, это свидетельствует о перегрузке грунта фосфором. В учебниках по агрохимии сообщается, что растения усваивают примерно 10% фосфора, вносимого с удобрениями, а остальной фосфор фиксируется в грунте. Это утверждение не является справедливым по отношению к системе питания, практикуемой на узких грядах, при которой сбалансированные смеси удобрений вносятся дробно (часто и небольшими дозами) на поверхность грунта. Обычно фосфор фиксируется, когда он мигрирует в почве. При поверхностном внесении подкормок густая сетка корней подходит к самой поверхности грунта, и корни поглощают фосфор до перехода в недоступную форму. Для данной технологии характерна исключительно высокая степень усвоения фосфора.
| Дефицит фосфора на винограде | Дефицит фосфора на томате | Дефицит фосфора на томате |
Дефицит и избыток калия
Калий – элемент здоровья. В отличие от азота и фосфора, он не входит в состав органических соединений и структур. Но его роль в жизнедеятельности клеток столь велика, а функции столь разнообразны, что калий поистине является элементом здоровья. Калий укрепляет ткани, определяет устойчивость растений к неблагоприятным условиям и инфекционным заболеваниям. Уже на начальных стадиях дефицита у огородных культур снижается иммунитет, и они становятся восприимчивыми к инфекциям. Калий обеспечивает корневые выделения углеводов и отвечает за микоризообразование. Диагностика калийного голодания. Начальные стадии дефицита калия визуально проявляются только в снижении темпов роста, и их трудно диагностировать. Но у таких растений повышена чувствительность к заморозкам. При умеренном дефиците самым характерным признаком является краевой ожог – побурение и засыхание кончиков и краев листьев. На листьях часто появляются белые точки. Симптомы выражены сильнее на старых листьях. В периоды бурного роста нехватка калия проявляется также на самых молодых листьях в виде морщинистости листьев вблизи точки роста.
В отличие от азота и фосфора, он не входит в состав органических соединений и структур. Но его роль в жизнедеятельности клеток столь велика, а функции столь разнообразны, что калий поистине является элементом здоровья. Калий укрепляет ткани, определяет устойчивость растений к неблагоприятным условиям и инфекционным заболеваниям. Уже на начальных стадиях дефицита у огородных культур снижается иммунитет, и они становятся восприимчивыми к инфекциям. Калий обеспечивает корневые выделения углеводов и отвечает за микоризообразование. Диагностика калийного голодания. Начальные стадии дефицита калия визуально проявляются только в снижении темпов роста, и их трудно диагностировать. Но у таких растений повышена чувствительность к заморозкам. При умеренном дефиците самым характерным признаком является краевой ожог – побурение и засыхание кончиков и краев листьев. На листьях часто появляются белые точки. Симптомы выражены сильнее на старых листьях. В периоды бурного роста нехватка калия проявляется также на самых молодых листьях в виде морщинистости листьев вблизи точки роста. Ее следует отличать от бугорчатости, или бородавчатости, которая является признаком дефицита кальция. При сильном дефиците калия листья грубые, с рваными краями и дырами на листовых пластинках. Нехватка калия сказывается на качестве плодов, они не ароматные и невкусные. Увеличивается доля плодов неправильной формы. Плоды склонны к загниванию. Индикаторные растения Огурец: плоды имеют грушевидную форму – узкие со стороны плодоножки, а на цветочном конце раздуты, как шар. Кукуруза: мелкие, недоразвитые зерна на дистальном конце початка, из-за чего початки имеют заостренные концы. Томаты: в созревших плодах середка остается белой, что хорошо видно на вертикальном разрезе. При тяжелом дефиците в белой ткани возникают жесткие тяжи. Горох: мелкие стручки, пустые со стороны прикрепления к стеблю. Причины дефицита калия Дефицит калия часто возникает после сильных ливней, так как калий легко вымывается из листьев. У картофеля, томатов и других пасленовых повышенная потребность в калии. Этим культурам иногда требуется дополнительное внесение калия.
Ее следует отличать от бугорчатости, или бородавчатости, которая является признаком дефицита кальция. При сильном дефиците калия листья грубые, с рваными краями и дырами на листовых пластинках. Нехватка калия сказывается на качестве плодов, они не ароматные и невкусные. Увеличивается доля плодов неправильной формы. Плоды склонны к загниванию. Индикаторные растения Огурец: плоды имеют грушевидную форму – узкие со стороны плодоножки, а на цветочном конце раздуты, как шар. Кукуруза: мелкие, недоразвитые зерна на дистальном конце початка, из-за чего початки имеют заостренные концы. Томаты: в созревших плодах середка остается белой, что хорошо видно на вертикальном разрезе. При тяжелом дефиците в белой ткани возникают жесткие тяжи. Горох: мелкие стручки, пустые со стороны прикрепления к стеблю. Причины дефицита калия Дефицит калия часто возникает после сильных ливней, так как калий легко вымывается из листьев. У картофеля, томатов и других пасленовых повышенная потребность в калии. Этим культурам иногда требуется дополнительное внесение калия. Избыток азота в аммонийной форме препятствует поглощению калия. Устранение дефицита калия Нехватка калия устраняется внеочередным внесением любого калийного удобрения. Сульфат калия, калийную селитру и калимагнезию вносят в дозе 50 г/м, хлористый калий – в дозе 40 г/м. Можно использовать золу соломы зерновых культур в дозе 40 г/м. Сухое удобрение насыпают полосой по середине гряды и растворяют при поливе. При коррекции дефицита на томатах предпочтительным удобрением является калимагнезия. Избыток калия Небольшой избыток не приносит вреда растениям. Более того, при избыточном потреблении калия плодоносящие культуры формируют плоды высокого качества. Однако вносить лишние калийные удобрения не рекомендуется, так как это удорожает продукцию, а главное, избыток калия в грунте мешает поглощению магния, кальция, аммонийного азота, марганца и некоторых других элементов.
Избыток азота в аммонийной форме препятствует поглощению калия. Устранение дефицита калия Нехватка калия устраняется внеочередным внесением любого калийного удобрения. Сульфат калия, калийную селитру и калимагнезию вносят в дозе 50 г/м, хлористый калий – в дозе 40 г/м. Можно использовать золу соломы зерновых культур в дозе 40 г/м. Сухое удобрение насыпают полосой по середине гряды и растворяют при поливе. При коррекции дефицита на томатах предпочтительным удобрением является калимагнезия. Избыток калия Небольшой избыток не приносит вреда растениям. Более того, при избыточном потреблении калия плодоносящие культуры формируют плоды высокого качества. Однако вносить лишние калийные удобрения не рекомендуется, так как это удорожает продукцию, а главное, избыток калия в грунте мешает поглощению магния, кальция, аммонийного азота, марганца и некоторых других элементов.
Недостаток калия на помидорах
Недостаток калия на винограде
Дефицит магния
Магний – элемент, дающий растениям зеленый цвет В центре каждой молекулы зеленого пигмента хлорофилла стоит магний. Хлорофилл осуществляет фотосинтез, а яркий зеленый цвет листьев свидетельствует о благополучии растения. Зелень листвы говорит о том, что все обменные процессы, обеспечивающие образование хлорофилла и фотосинтез, протекают нормально, а значит, полным ходом идет рост и формирование урожая. Диагностика магниевой недостаточности. Признаки дефицита нужно искать на старых листьях. На ранних стадиях наблюдается некоторое просветление тканей между зелеными жилками нижних листьев. При умеренном дефиците на нижних листьях появляется мозаика желтых или оранжевых пятен между жилками, но сами жилки остаются зелеными. Если не устранить дефицит, то начинается отмирание ткани листовых пластинок: в центре желтых пятен появляются бурые области некроза (погибшей ткани). Есть определенное сходство в проявлении дефицитов магния и азота: симптомы выражены сильнее на нижних листьях; разрушается хлорофилл и появляется желтизна; ткань листа отмирает. Но различить дефициты не сложно. При нехватке азота равномерно желтеет весь лист, при нехватке магния пятна желтизны появляются между зелеными жилками.
Хлорофилл осуществляет фотосинтез, а яркий зеленый цвет листьев свидетельствует о благополучии растения. Зелень листвы говорит о том, что все обменные процессы, обеспечивающие образование хлорофилла и фотосинтез, протекают нормально, а значит, полным ходом идет рост и формирование урожая. Диагностика магниевой недостаточности. Признаки дефицита нужно искать на старых листьях. На ранних стадиях наблюдается некоторое просветление тканей между зелеными жилками нижних листьев. При умеренном дефиците на нижних листьях появляется мозаика желтых или оранжевых пятен между жилками, но сами жилки остаются зелеными. Если не устранить дефицит, то начинается отмирание ткани листовых пластинок: в центре желтых пятен появляются бурые области некроза (погибшей ткани). Есть определенное сходство в проявлении дефицитов магния и азота: симптомы выражены сильнее на нижних листьях; разрушается хлорофилл и появляется желтизна; ткань листа отмирает. Но различить дефициты не сложно. При нехватке азота равномерно желтеет весь лист, при нехватке магния пятна желтизны появляются между зелеными жилками. Отмирание ткани тоже идет по-разному: при нехватке азота весь лист засыхает, при нехватке магния участки некроза появляются сначала в виде небольших бурых пятнышек в середине желтого пятна. Причины дефицита магния В технологии узких гряд в должной мере учитывается уникальная роль магния в формировании урожая. Магний введен в состав смеси 2, и растения получают его с каждой подкормкой («Настоящий хозяин», №4, 2006). Отсюда и яркий «праздничный» зеленый цвет растущих культур и уникальная урожайность узких гряд. Бывает ли дефицит магния, если кормить овощные культуры смесями 2? Да, он бывает у растений с повышенной потребностью в магнии, прежде всего у томатов и огурцов. Среди овощей нет другой культуры, со столь большой потребностью в магнии, как томаты. Магний требуется и листьям, и плодам: если разрезать незрелый помидор, видно, что вся толща плода имеет зеленый цвет (содержит хлорофилл). Поэтому в период плодоношения потребность в магнии резко возрастает, и чем больше плодов на кусте, тем выше потребность.
Отмирание ткани тоже идет по-разному: при нехватке азота весь лист засыхает, при нехватке магния участки некроза появляются сначала в виде небольших бурых пятнышек в середине желтого пятна. Причины дефицита магния В технологии узких гряд в должной мере учитывается уникальная роль магния в формировании урожая. Магний введен в состав смеси 2, и растения получают его с каждой подкормкой («Настоящий хозяин», №4, 2006). Отсюда и яркий «праздничный» зеленый цвет растущих культур и уникальная урожайность узких гряд. Бывает ли дефицит магния, если кормить овощные культуры смесями 2? Да, он бывает у растений с повышенной потребностью в магнии, прежде всего у томатов и огурцов. Среди овощей нет другой культуры, со столь большой потребностью в магнии, как томаты. Магний требуется и листьям, и плодам: если разрезать незрелый помидор, видно, что вся толща плода имеет зеленый цвет (содержит хлорофилл). Поэтому в период плодоношения потребность в магнии резко возрастает, и чем больше плодов на кусте, тем выше потребность. В период массового налива плодов томатам часто не хватает магния. Содержание магния в смесях находится на нижнем допустимом пределе, достаточном для большинства культур и для томатов на всех фазах развития, кроме фазы массового налива плодов. Магниевые удобрения дороги, и нижний предел магния допущен из соображений экономии. Дешевле 1–2 раза провести коррекцию дефицита, чем повышать содержание магния в смесях. Но можно увеличить в 1,5–2 раза содержание магния в смеси 2. Устранение дефицита магния При первых признаках магниевой недостаточности проводят подкормку культур сульфатом магния. Удобрение в дозе 30 г/м вносят полосой вдоль рядка растений и растворяют при поливе. Корректирующую подкормку проводят между очередными еженедельными подкормками. В редких случаях через 2–3 недели может потребоваться вторая подкормка сульфатом магния. Врез в конце Устраняя дефициты питания растений, мы заботимся не только о наших питомцах и о величине урожая, но и о собственном здоровье. Овощи и фрукты – основные поставщики минеральных элементов в питании человека, единственные продукты питания, поддерживающие кислотно-щелочное равновесие в жидких средах нашего организма.
В период массового налива плодов томатам часто не хватает магния. Содержание магния в смесях находится на нижнем допустимом пределе, достаточном для большинства культур и для томатов на всех фазах развития, кроме фазы массового налива плодов. Магниевые удобрения дороги, и нижний предел магния допущен из соображений экономии. Дешевле 1–2 раза провести коррекцию дефицита, чем повышать содержание магния в смесях. Но можно увеличить в 1,5–2 раза содержание магния в смеси 2. Устранение дефицита магния При первых признаках магниевой недостаточности проводят подкормку культур сульфатом магния. Удобрение в дозе 30 г/м вносят полосой вдоль рядка растений и растворяют при поливе. Корректирующую подкормку проводят между очередными еженедельными подкормками. В редких случаях через 2–3 недели может потребоваться вторая подкормка сульфатом магния. Врез в конце Устраняя дефициты питания растений, мы заботимся не только о наших питомцах и о величине урожая, но и о собственном здоровье. Овощи и фрукты – основные поставщики минеральных элементов в питании человека, единственные продукты питания, поддерживающие кислотно-щелочное равновесие в жидких средах нашего организма.
| Дефицит магния на винограде | Дефицит магния на томатах |
Дефицит магния на клубнике
Огородные культуры — индикаторы дефицитов питания
Среди огородных культур имеются особенно чувствительные к недостатку того или иного элемента питания. Они первыми просигналят о неблагополучии. Признаки дефицита проявляются на них явно и ярко, когда все остальные овощи еще чувствуют себя комфортно. Такие растения называют индикаторными культурами. Пока на ваших грядках с индикаторными культурами все в порядке, можно не думать ни о каких дефицитах. Познакомимся поближе с индикаторными культурами.
Кукуруза. Это растение очень требовательно к минеральному питанию и прежде других укажет вам на напряженную ситуацию с 5-ю элементами: азотом, фосфором, калием, цинком и медью. Помимо общих признаков, перечисленных в таблице, о недостаточной обеспеченности основными элементами свидетельствует внешний вид початка. В норме початок имеет совершенную форму, его верхушка закруглена и зерна на ней ничуть не мельче, чем у основания початка. При нехватке азота верх початка вообще не содержит зерен, там торчит голый стержень. Недостаток фосфора дает о себе знать кривыми рядами и пропуском зерен. При недостаточном снабжении калием верхушка початка заострена и зерна на ней недоразвиты.
В норме початок имеет совершенную форму, его верхушка закруглена и зерна на ней ничуть не мельче, чем у основания початка. При нехватке азота верх початка вообще не содержит зерен, там торчит голый стержень. Недостаток фосфора дает о себе знать кривыми рядами и пропуском зерен. При недостаточном снабжении калием верхушка початка заострена и зерна на ней недоразвиты.
Дефицит микроэлементов обычно выявляется только тогда, когда растения хорошо обеспечены азотом, фосфором и калием. На фоне достаточного снабжения растений кукурузы основными элементами питания при нехватке цинка на листьях среднего яруса появляются желтые полосы, иногда узкие, иногда более широкие, идущие от самого кончика до основания листа. При нехватке меди концы листьев увядают, повисают и потом засыхают.
Огурец. Плоды огурца красноречиво свидетельствуют о недостаточности трех элементов питания — азота, калия и бора. При дефиците азота у плодоножки огурец имеет нормальный вид, но резко сужается к цветочному концу. Такие плоды обычно называют «крючками». Противоположная картина наблюдается при нехватке калия: у плодоножки огурец тонкий, как палец, а на цветочном конце он раздут, как шар. Не сомневаюсь, что каждый огородник видел таких уродцев на своих грядках. При дефиците бора на кожице плода появляются бежевые, опробковевшие, слегка выпуклые рубцы в виде штрихов или линий, похожие на зажившие повреждения. Другая форма реакции на нехватку бора, обычно проявляющаяся на партенокарпических длинноплодных огурцах
Такие плоды обычно называют «крючками». Противоположная картина наблюдается при нехватке калия: у плодоножки огурец тонкий, как палец, а на цветочном конце он раздут, как шар. Не сомневаюсь, что каждый огородник видел таких уродцев на своих грядках. При дефиците бора на кожице плода появляются бежевые, опробковевшие, слегка выпуклые рубцы в виде штрихов или линий, похожие на зажившие повреждения. Другая форма реакции на нехватку бора, обычно проявляющаяся на партенокарпических длинноплодных огурцах
Калий биологическая функция — Справочник химика 21
Для нормального роста и вьшолнения биологических функций человеку и животным кроме витаминов необходим также целый ряд неорганических элементов. Эти элементы можно разделить на два класса макроэлементы и микроэлементы. Макроэлементы, к которым относятся кальций, магний, натрий, калий, фосфор, сера и хлор, требуются организму в относительно больших количествах (порядка нескольких граммов в сутки). Часто они выполняют более чем одну функцию. Например, кальций служит структурным компонентом неорганического вещества костей гидроксиапатита, состав которого можно приблизительно описать формулой [Саз (РО гЗз. Вместе [c.294]
Часто они выполняют более чем одну функцию. Например, кальций служит структурным компонентом неорганического вещества костей гидроксиапатита, состав которого можно приблизительно описать формулой [Саз (РО гЗз. Вместе [c.294]
Макроэлементами в живом веществе являются кислород, водород, углерод, азот, кальций, сера, фосфор, калий, магний, железо, кремний, натрий, хлор и алюминий. Их роль в живых организмах различна. Первые десять элементов (их названия выделены в перечне полужирным шрифтом) жизненно необходимы для животных и для растений. Натрий и хлор, безусловно, нужны всем животным и полезны для некоторых видов растений. Биологические функции кремния и алюминия изучены недостаточно. Все макроэлементы живого вещества располагаются в верхней части периодической системы. Большинство из них входит в состав второго и третьего периодов. [c.142]
Натрий и калий в живой клетке. Несмотря на большое сходство химических свойств натрия и калия, их биологические функции различны. В плазме клеток велико содержание катионов К+, но относительно мало катионов Ма+, и наоборот, во внеклеточном растворе много Ма+, но мало К+. Концентрация калия внутри клетки превышает концентрацию вне клеток в 10 раз и более. Катион калия связан с внутриклеточной активностью, а катион натрия участвует в процессах на внешней поверхности клетки и эти два катиона не могут заменить друг друга. Катион К+ является важным активатором более чем 60 ферментов внутри клетки. Катион Ма+ не действует на К+-зависимые ферменты. Катион Na+ также активирует несколько ферментов, а К+ не способен их активировать. [c.277]
В плазме клеток велико содержание катионов К+, но относительно мало катионов Ма+, и наоборот, во внеклеточном растворе много Ма+, но мало К+. Концентрация калия внутри клетки превышает концентрацию вне клеток в 10 раз и более. Катион калия связан с внутриклеточной активностью, а катион натрия участвует в процессах на внешней поверхности клетки и эти два катиона не могут заменить друг друга. Катион К+ является важным активатором более чем 60 ферментов внутри клетки. Катион Ма+ не действует на К+-зависимые ферменты. Катион Na+ также активирует несколько ферментов, а К+ не способен их активировать. [c.277]
Утверждение, что калий-натриевый градиент играет роль буфера протонного потенциала, позволяет понять не только биологическую функцию этого градиента, но и причину, которая в течение многих лет препятствовала выяснению его значения для жизнедеятельности клетки. Мысль о буферной роли калий-натриевого градиента не могла родиться, прежде чем был открыт протонный потенциал и было доказано, что он служит конвертируемой формой энергии. Все эти годы проблема калия и натрия просто ждала своего часа. [c.173]
Все эти годы проблема калия и натрия просто ждала своего часа. [c.173]
В животных организмах калий необходим для нормальной ра боты мышечных клеток и нервной системы. Нормальный ритм ра боты организма, в частности ритм сокращения сердца, поддержи вается при определенном соотношении концентраций ионов калия и натрия. Оценивая роль ионов калия и натрия в развивающихся системах — клетках и организмах, — приходится констатировать, что не химическое сходство, казалось бы такое очевидное, а довольно тонкие различия между ионами стали основой для того распределения биохимических функций, которое необходимо для действия биологических систем связи и регулирования. [c.153]
Различная адсорбируемость солей калия и натрия почвенным комплексом привела к разделению ионов ионы натрия оказались в водах морей и океанов, а ионы калия закрепились в почве и, естественно, вошли как важнейший компонент в метаболические процессы растений.
 Различная способность ионов калия и натрия проходить через биологические мембраны обусловила и специфические функции этих ионов в передаче нервного импульса. [c.153]
Различная способность ионов калия и натрия проходить через биологические мембраны обусловила и специфические функции этих ионов в передаче нервного импульса. [c.153] Аккумулятивная функция Сущность этой функции заключается в накоплении в форме ГВ важнейших элементов питания живых организмов, органических соединений, несущих энергетические запасы или непосредственно необходимых и усваиваемых микроорганизмами или растениями, а также элементов, не участвующих в биологических процессах Такое накопление происходит не только в почвах, но также в природных водах, донных отложениях, где ГВ служат источниками энергии и питания для биоты Именно в форме ГВ в почвах накапливается до 90% всего азота, половина и более фосфора, серы [451] В этой же форме аккумулируются и сохраняются длительное время калий, кальций, магний, железо и практически все необходимые микроорганизмам микроэлементы В составе ГВ идентифицируются такие элементы, как Н , РЬ, N1, 2п, Си и Аи, которые они очень эффективно сорбируют [c. 350]
350]
В природе с белками связано относительно небольшое число металлов. Если рассматривать также ферменты, активируемые металлами, то к этому списку элементов следует добавить лишь натрий, калий и магний. Биологическая роль иона металла в белке характеризуется высокой специфичностью. И тем не менее в зависимости от типа белка один и тот же ион металла осуществляет различные функции разнообразие выполняемых функций является, очевидно, следствием ограничений, накладываемых белковым окружением. В связи с этим биологическая специфичность функций металла имеет, по-видимому,- стереохимическую природу. Основная тема обзора — значение структурных и стереохимических данных и сведений о строении координационных центров металл —лиганд для выяснения функциональной роли металлов в ферментативных процессах — не требует, таким образом, дополнительного обоснования. [c.16]
Липиды играют важную биологическую роль они являются источником энергии для животного организма, при окислении в организме 1 г жира выделяется 9,3 кал. Они хорошие растворители биологически активных веществ (например, витаминов), необходимы для осуществления нормальных функций животного организма. Жировая ткань образует мягкую изолирующую прослойку, защищая внутренние органы и все тело от толчков, ударов и переохлаждения. [c.267]
Они хорошие растворители биологически активных веществ (например, витаминов), необходимы для осуществления нормальных функций животного организма. Жировая ткань образует мягкую изолирующую прослойку, защищая внутренние органы и все тело от толчков, ударов и переохлаждения. [c.267]
Важное биологическое значение имеют и некоторые щелочные и щелочноземельные элементы. По сравнению с переходными элементами они связываются менее прочно, и поэтому более легко и свободно перемещаются. Функция натрия и калия в клеточных мембранах связана с нервными импульсами. Магний и кальций участвуют в процессе превращения химической энергии в работу мышц. Определенную функцию в биохимических процессах выполняют и некоторые неметаллы [51]. [c.601]
Остальные из названных выше элементов металлы. Каковы же их функции Какая роль, например, магния, для чего нужны организму калий и натрий, каковы функции ионов кобальта, сделавшие его необходимым для нормальной работы организма Не всегда удается дать исчерпывающие ответы на подобные вопросы. В дальнейшем мы изложим те сведения о роли ионов металлов в ферментных системах, которые могут считаться надежно установленными. Природа экономно использует металлы — их содержание в организмах невелико и ион каждого вида выполняет различные функции. Чаще всего они связаны с усилением действия биологических катализаторов или образованием специфических активных групп катализаторов — металлосодержащих ферментов. Известно, что металлы, как правило, входят в состав организмов в виде комплексных соединений. Так, железо с азотсодержащими веществами образует сложный комплекс — гем. Гем вступает во взаимодействие с белками, и в зависимости от того, с каким белком он соединился, получающееся вещество приобретает различные свойства. В одном случае получается превосходный переносчик кислорода — гемоглобин, в другом — фермент, разлагающий перекись водорода,— каталаза, в третьем — фермент пероксидаза и т. д. [c.10]
В дальнейшем мы изложим те сведения о роли ионов металлов в ферментных системах, которые могут считаться надежно установленными. Природа экономно использует металлы — их содержание в организмах невелико и ион каждого вида выполняет различные функции. Чаще всего они связаны с усилением действия биологических катализаторов или образованием специфических активных групп катализаторов — металлосодержащих ферментов. Известно, что металлы, как правило, входят в состав организмов в виде комплексных соединений. Так, железо с азотсодержащими веществами образует сложный комплекс — гем. Гем вступает во взаимодействие с белками, и в зависимости от того, с каким белком он соединился, получающееся вещество приобретает различные свойства. В одном случае получается превосходный переносчик кислорода — гемоглобин, в другом — фермент, разлагающий перекись водорода,— каталаза, в третьем — фермент пероксидаза и т. д. [c.10]
Ионы кальция, магния, калия и натрия регулируют многие биологические процессы они влияют на функции ферментов и играют роль в передаче нервного возбуждения. Между ними наблюдается антагонизм эффект избыточного количества калия подавляется увеличением концентрации натрия. [c.19]
Между ними наблюдается антагонизм эффект избыточного количества калия подавляется увеличением концентрации натрия. [c.19]
Растворимые соединения бария токсичны. Это объясняется тем, что вследствие близости ионных радиусов Ва + и катион бария может замещать катион калия в биологически активных соединениях, не выполняя его функцию. [c.307]
Спинномозговая жидкость. Функции механическая защита мозга, удаление продуктов метаболизма из мозга, транспорт биологически активных веществ. Общий объем СМЖ — 150 мл, плотность — 1,006—1,008, pH — 7,31, содержание белков — 200—400 мг/л, глюкозы — 2,5-4,44 ммоль/л, натрия — 138-150, калия — 2,7—3,9 ммоль/л. Равновесие между глюкозой крови и глюкозой СМЖ устанавливается за 4 ч. При спинномозговой пункции требуется одновременная оценка уровня глюкозы в крови и СМЖ. Белки проникают в СМЖ из плазмы крови путем пиноцитоза через эндотелий капилляров.
 [c.457]
[c.457]В лейкопластах образуются крахмал и некоторые другие вещества клетки. В хромопластах, окрашенных в желтый, красный или оранжевый цвет, накапливаются биологически важные вещества— каротиноиды. Хлоропласты являются органами первичного синтеза углеводов — фотосинтеза. Они устроены очень сложно. Это округлые или овальные тельца, ярко-зеленого цвета, размером в несколько микрометров. Внутри них находятся очень мелкие зерна— граны, окрашенные в ярко-зеленый цвет. Хлоропласты состоят из хлорофилла, белков, липидов, каротиноидов и некоторого количества РНК- Из элементов, кроме магния, входящего в молекулу хлорофилла, в них обнаружены калий, кальций, марганец и др. Главная функция хлоропластов — биосинтез глюкозы, который идет при использовании солнечной энергии. [c.26]
В зависимости от химического состава ПАВ мицеллы могут быть неионными, катионными, анионными или амфотерными. Физические свойства ряда детергентов приведены в табл. 1. Наиболее широко применяемые неионные детергенты содержат полиоксиэти-леновую или полиоксипропиленовую цепь, связанную, как правило, со спиртами или фенолами имеющими длинную углеводородную цепь. К неионным ПАВ относятся также эфиры сахаров, жирные алканоламины, жирные окиси аминов. Все эти вещества довольно трудно получить в виде индивидуальных химических соединений, однако отсутствие ионов в мицеллах, которые они образуют, делает их особенно полезными в качестве детергентов и эмульгаторов и позволяет упростить теоретическое рассмотрение структуры таких мицелл. ККМ неионных ПАВ обычно в 100 раз меньше, чем ККМ ионогенных детергентов, содержащих сравнимые по величине гидрофобные группы. Поэтому масса мицелл неионных детергентов существенно больше, чем масса мицелл ионогенных ПАВ. Анионные детергенты обычно содержат длинную углеводородную цепь и карбоксилатную, сульфатную или сульфонатную группу. В качестве противоионов выступают натрий, калий, литий или водород. Длинноцепочечные четвертичные амины или пиридипы с бромид-, хлорид- или иодид-ионом в качестве противоиона образуют группу катионных ПАВ. Степень нейтрализации заряда противоионами в слое Штерна у катионных мицелл несколько меньше (это связано с некоторым экранированием заряда четвертичной аммониевой группы), поэтому их структура более компактна по сравнению с анионными мицеллами.
К неионным ПАВ относятся также эфиры сахаров, жирные алканоламины, жирные окиси аминов. Все эти вещества довольно трудно получить в виде индивидуальных химических соединений, однако отсутствие ионов в мицеллах, которые они образуют, делает их особенно полезными в качестве детергентов и эмульгаторов и позволяет упростить теоретическое рассмотрение структуры таких мицелл. ККМ неионных ПАВ обычно в 100 раз меньше, чем ККМ ионогенных детергентов, содержащих сравнимые по величине гидрофобные группы. Поэтому масса мицелл неионных детергентов существенно больше, чем масса мицелл ионогенных ПАВ. Анионные детергенты обычно содержат длинную углеводородную цепь и карбоксилатную, сульфатную или сульфонатную группу. В качестве противоионов выступают натрий, калий, литий или водород. Длинноцепочечные четвертичные амины или пиридипы с бромид-, хлорид- или иодид-ионом в качестве противоиона образуют группу катионных ПАВ. Степень нейтрализации заряда противоионами в слое Штерна у катионных мицелл несколько меньше (это связано с некоторым экранированием заряда четвертичной аммониевой группы), поэтому их структура более компактна по сравнению с анионными мицеллами. Катионные мицеллы обладают несколько большей солюбилизующей способностью в отношении неполярных субстратов, чем анионные мицеллы, образованные ПАВ того же молекулярного веса. Амфотерные мицеллы образованы цвиттер-ионными молекулами, у которых тип диссоциации определяется pH раствора [45, 46]. Природные фосфатиды и липиды, такие, как лецитин и соли желчных кислот, также образуют мицеллы и определяют многие важные биологические функции in vivo и in vitro [20, 47—51]. [c.228]
Катионные мицеллы обладают несколько большей солюбилизующей способностью в отношении неполярных субстратов, чем анионные мицеллы, образованные ПАВ того же молекулярного веса. Амфотерные мицеллы образованы цвиттер-ионными молекулами, у которых тип диссоциации определяется pH раствора [45, 46]. Природные фосфатиды и липиды, такие, как лецитин и соли желчных кислот, также образуют мицеллы и определяют многие важные биологические функции in vivo и in vitro [20, 47—51]. [c.228]
Хорошо известно, что ионы кальция поступают в цитоплазму в ответ на нервную стимуляцию и что именно они вызывают различные ответные реакции в организме, такие, например, как мышечное сокращение. Весьма вероятно, что в результате присоединения ионов Са- к специфическим центрам связывания (как это имеет место, например, в каль-ций-связывающем белке карпа) в молекуле происходят конформационные изменения, инициирующие биологические ответные реакции. Кальций-связывающий белок содержит интересную систему внутренних полярных групп, связанных между собой специфическим образом с помощью водородных связей (рис. 4-5, ). Присоединение ионов кальция может вызывать перестройку этих внутренних связей (гл. 2, разд. Б.7) и изменять тем самым характер взаимодействия этого белка (функция которого точно не известна) с другим белком (ср., например, с действием тропонина С, разд. Е.1). В других кальций-связывающих центрах в белках содержатся остатки у-карбоксиглутаминовой кислоты, способной образовывать хелатные комплексы (дополнение 10-Г). [c.270]
4-5, ). Присоединение ионов кальция может вызывать перестройку этих внутренних связей (гл. 2, разд. Б.7) и изменять тем самым характер взаимодействия этого белка (функция которого точно не известна) с другим белком (ср., например, с действием тропонина С, разд. Е.1). В других кальций-связывающих центрах в белках содержатся остатки у-карбоксиглутаминовой кислоты, способной образовывать хелатные комплексы (дополнение 10-Г). [c.270]
Каждая клетка состоит из огромного числа атомов и молекул. Попробуем разобраться, насколько они универсальны и какие функции выполняют в клетках Оказалось, что из периодической системы элементов всего лишь шесть биоэлементов используются для построения подавляющего числа биологически значимых молекул углерод С, ьшслород О, водород Н, сера 8, азот N и фосфор Р. Еще 16 микроэлементов присутствуют в клетках в различных количествах и соотношениях. К ним относятся железо Ре, медь Си, цинк Zn, марганец Мп, кобальт Со, иод I, молибден Мо, ванадий V, никель N1, хром Сг, фтор Р, селен 8е, кремний 81, олово 8п, бор В, мышьяк Аз и пять ионов натрий Na , калий К , магний Mg , кальций Са » , хлор С1 . Каков бы ни был принцип отбора атомов для процессов жизнедеятельности, он не связан с их распространенностью в природе. Например, из галогенов только хлор и иод выбраны природой, хотя фтор и бром обладают не меньшей доступностью. По-видимому, в основу отбора положен принцип пригодности и целесообразности. Например, шесть основных биоэлементов имеют набор свойств, достаточный для построения почти всех необходимых для клетки молекул. [c.6]
Каков бы ни был принцип отбора атомов для процессов жизнедеятельности, он не связан с их распространенностью в природе. Например, из галогенов только хлор и иод выбраны природой, хотя фтор и бром обладают не меньшей доступностью. По-видимому, в основу отбора положен принцип пригодности и целесообразности. Например, шесть основных биоэлементов имеют набор свойств, достаточный для построения почти всех необходимых для клетки молекул. [c.6]
Биология и медицина. Начало биологическим применениям стеклянных электродов с металлической функцией ( катион-чувствительных ) положили работы Эйзенмана с сотрудниками (1957 г.). Результаты работы, проведенной под руководством Эйзенмана, дали возможность биологам получать данные об активности ионов калия и натрия непосредственно с места их действия (in situ) в биологических процессах. В этих работах подчеркивается и другая сторона вопроса для ряда биологических явлений (возникновение биопотенциалов, клеточная проницаемость и связанные с ней процессы нервного возбуждения, кажущаяся специфичность многих клеток и тканей по отношению к ионам К ) физико-химические закономерности оказываются во многом сходными с теми, которые имеют важное значение в функционировании стеклянных и мембранных электродов. Это повышает интерес и значимость самой ионообменной теории стеклянного электрода. [c.331]
Это повышает интерес и значимость самой ионообменной теории стеклянного электрода. [c.331]
Если смешать соответствующие фосфолипиды и белки и нанести эту смесь на поверхность воды, то спонтанно образуются мембраноподобные структуры, сходные по толщине с биологическими мембранами. Исследование таких искусственных мембран, приготовленных из белков и липидов природных мембран, дает нам возможность лучше понять структуру и функцию биологических мембран. Искусственные мембраны обнаруживают разную проницаемость для разных ионов в зависимости от природы белков и липидов, входящих в их состав. Чрезвычайно-интересные эффекты можно наблюдать при добавлении к искусственным мембранам некоторых антибиотиков. Валиномицин, например, благодаря своей структуре (т. е. определенным размерам и заряду молекулы) оказывается способным притягивать и удерживать ионы калия, но не притягивает ионов натрия (рис. 2.5). Если добавить валиномицин к искусственной мембране, отделяющей растворы с ионами К+ и Ка+ от чистой воды. [c.28]
[c.28]
Этот последний член семейства ГР—ПРЛ— ХС не выполняет у человека строго определенной функции. При биологических испытаниях он проявляет лактогенную и лютеотропную активность, а его метаболические эффекты качественно сходны с действием гормона роста, включая торможение поглощения глюкозы, стимуляцию высвобождения свободных жирных кислот и глицерола, усиление задержки азота и кальция (несмотря на повыщение выделения кальция с мочой), а также снижение мочевой экскреции фосфора и калия. ХС может поддерживать рост развивающегося плода, однако и в тех случаях, когда ни у плода, ни в плаценте нет генов группы ГР—ХС (кроме генов ГР-Ы и ХС-Ь), внутриутробное развитие плода и рост младенца в неонатальном периоде протекают нормально. Поскольку [c.177]
Структурная и молекуля1рная организация биологических мембран. Эта проблема — одна из актуальнейших в современной биологии. Ее решение позволит не только адекватно представить структурную и функциональную организацию клетки, но и активно воздействовать на нее. Мембраны образуют большие площади и играют универсальную регуляторную роль. Функции биологических мембран многообразны активный транспорт веществ, общая н избирательная диффузия небольших молекул и рюнов, регулирование транспорта ионов и продуктов метаболизма внутри клеток, преобразование световой энергии в химическую энергию АТФ и энергии биологического окисления в химическую энергию макроэргических фосфорных связей. Мембраны поддерживают неравномерное распределение ионов (например, калия, натрия, хлора) между протопластом и окружающей средой и обусловливают появление разности биоэлектрических потенциалов. [c.65]
Мембраны образуют большие площади и играют универсальную регуляторную роль. Функции биологических мембран многообразны активный транспорт веществ, общая н избирательная диффузия небольших молекул и рюнов, регулирование транспорта ионов и продуктов метаболизма внутри клеток, преобразование световой энергии в химическую энергию АТФ и энергии биологического окисления в химическую энергию макроэргических фосфорных связей. Мембраны поддерживают неравномерное распределение ионов (например, калия, натрия, хлора) между протопластом и окружающей средой и обусловливают появление разности биоэлектрических потенциалов. [c.65]
Сдать анализ на магний в крови
Метод определения Колориметрия с ксилидилом синим.
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Синонимы: Анализ крови на магний; Общий магний; Ионы магния. Serum Magnesium Test; Magnesium test; Magnesium, blood; Serum magnesium.
Serum Magnesium Test; Magnesium test; Magnesium, blood; Serum magnesium.
Краткая характеристика определяемого аналита Магний
Магний, как и калий, содержится преимущественно внутри клеток. 1/3-1/2 всего магния организма содержится в костной ткани, приблизительно 27% – в мышечной ткани. Около 1% всего количества магния организма находится во внеклеточной жидкости и плазме (из них 60-70% в виде ионов или различных комплексов с низкомолекулярными анионами, остальная часть – в связанной с белками форме). Магний активирует более трехсот ферментов организма (среди них – Na+/K+-АТФаза), поэтому многие процессы жизнедеятельности клеток являются магнийзависимыми (гликолиз, окислительный метаболизм, процессы мембранного транспорта, нервной и мышечной возбудимости, синтез нуклеиновых кислот и др.). Часть эффектов магния связана с его способностью конкурировать с кальцием за участки связывания. Существует также взаимосвязь баланса магния и калия как основных внутриклеточных катионов. Поддержание магниевого гомеостаза осуществляется изменением его всасывания в желудочно-кишечном тракте и выведения в почках. Уровень магния в сыворотке крови может сохраняться в пределах референсных значений даже при значительном уменьшении общего количества магния в организме.
Поддержание магниевого гомеостаза осуществляется изменением его всасывания в желудочно-кишечном тракте и выведения в почках. Уровень магния в сыворотке крови может сохраняться в пределах референсных значений даже при значительном уменьшении общего количества магния в организме.
Скакой целью определяют уровень Магния в сыворотке крови
Исследование магния в сыворотке крови в комплексе с другими электролитами используют для выявления нарушений электролитного баланса. Гипомагниемия (снижение концентрации магния в сыворотке крови) обычно является признаком выраженного дефицита магния в организме. Уменьшение содержания магния нарушает функции нервных и мышечных клеток, его дефицит сочетается с сердечно-сосудистыми заболеваниями. Гипомагниемия достаточно часто отмечается среди госпитализированных пациентов, преимущественно на фоне патологии желудочно-кишечного тракта и почек. Причиной дефицита магния может быть сахарный диабет (осмотический диурез), применение петлевых диуретиков (фуросемид) и аминогликозидовых антибиотиков. Возможны такие клинические проявления, как повышенная возбудимость и судороги (дефицит магния является распространенной причиной гипокальциемии). Одно из наиболее серьезных осложнений дефицита магния – сердечная аритмия. Во время беременности дефицит магния может провоцировать спонтанные аборты и преждевременные роды.
Возможны такие клинические проявления, как повышенная возбудимость и судороги (дефицит магния является распространенной причиной гипокальциемии). Одно из наиболее серьезных осложнений дефицита магния – сердечная аритмия. Во время беременности дефицит магния может провоцировать спонтанные аборты и преждевременные роды.
Зачем клетка обменивает натрий на калий?. Рассказы о биоэнергетике
Зачем клетка обменивает натрий на калий?
Мысль о двух формах конвертируемой энергии я высказал в 1975 году. Спустя два года эта точка зрения была поддержана Митчелом. А в группе А. Глаголева тем временем начались опыты по проверке одного из предсказаний этой новой концепции.
Я рассуждал следующим образом. Если протонный потенциал — разменная монета, то клетка должна располагать достаточным количеством, таких «денежных знаков».
Зачем клетка обменивает натрий на калий?
Это требование выполнялось, если речь шла об АТФ. Клетка всегда содержит довольно большие количества АТФ, причем приняты меры для стабилизации этого количества в условиях меняющейся конъюнктуры — непрерывно варьирующих скоростей образования и использования АТФ. Есть особое вещество — креатин-фосфат, участвующее только в одной реакции — фосфорилировании АДФ:
Клетка всегда содержит довольно большие количества АТФ, причем приняты меры для стабилизации этого количества в условиях меняющейся конъюнктуры — непрерывно варьирующих скоростей образования и использования АТФ. Есть особое вещество — креатин-фосфат, участвующее только в одной реакции — фосфорилировании АДФ:
АДФ + креатинфосфат ? АТФ + креатин.
Когда АТФ в избытке, а АДФ в дефиците, реакция идет справа налево и накапливается креатинфосфат, которого в этих условиях становится много больше, чем АТФ. Но стоит повыситься уровню АДФ и уменьшиться АТФ, как реакция меняет направление, и креатинфосфат оказывается поставщиком АТФ. Тем самым креатинфосфат выполняет свою функцию стабилизатора, буфера уровня АТФ.
А как обстоят дела с протонным потенциалом?
Несложный расчет позволяет перевести одну энергетическую «валюту» в другую. Этот расчет показывает, что количество энергии, накопленное, к примеру, бактериальной клеткой в виде протонного потенциала, оказывается почти в тысячу раз меньшим, чем количество АТФ, если протонный потенциал находится в электрической форме. Это количество одного порядка с числом генераторов и потребителей потенциала в бактериальной мембране.
Это количество одного порядка с числом генераторов и потребителей потенциала в бактериальной мембране.
Такая ситуация создает особую необходимость в буферной системе, стабилизирующей уровень протонного потенциала. В противном случае даже кратковременное превышение общей скорости потребляющих потенциал процессов над скоростью его генерации приведет к исчезновению потенциала и остановке всех систем, питаемых потенциалом.
Итак, должен быть буфер для протонного потенциала наподобие креатинфосфата для АТФ. Но что за компонент подобрала природа на такую роль?
Обдумывая эту проблему, я попытался найти какую-нибудь связанную с потенциалом биологическую систему, функция которой была бы неизвестна.
Одна из старых загадок биологии: зачем клетка поглощает ионы калия и выбрасывает ионы натрия, создавая дорогостоящую асимметрию в распределении этих близких по своим свойствам ионов между цитоплазмой и окружающей средой? Практически в любой живой клетке ионов калия намного больше, чем ионов натрия, в то время как в среде натрий находится в огромном избытке над калием. Может быть, Na+ — яд для клетки?
Может быть, Na+ — яд для клетки?
Нет, это не так. Хоть некоторые ферментные системы действительно лучше работают в КСl, чем в NaCl, это выглядит вторичным приспособлением к «многокалиевой» и «малонатриевой» внутренней среде клетки. За огромный срок биологической эволюции клетка могла бы приспособиться к естественному соотношению ионов щелочных металлов во внешней среде. Живут же галофильные бактерии в насыщенном растворе NaCl, причем концентрация Na+ в их цитоплазме иногда доходит до моля на литр, что почти в тысячу раз больше концентрации Na+ в обычных клетках. Итак, Na+ не яд.
Заметим, что те же галофильные бактерии поддерживают внутриклеточную концентрацию К+ около 4 молей на литр, тратя на создание натрий-калиевого градиента колоссальные по масштабам клетки количества энергетических ресурсов.
Известно, что возбудимые клетки животных, такие, как нейроны, используют натрий-калиевый градиент для проведения нервного импульса. Но как быть с другими типами клеток, например, с бактериями?
Давайте обратимся к механизму транспорта К+ и Na+ через бактериальную мембрану. Известно, что между цитоплазмой бактерии и внешней средой существует разность электрических потенциалов, поддерживаемая работой белков-генераторов в бактериальной мембране. Откачивая протоны изнутри клетки наружу, белки-генераторы тем самым заряжают внутренность бактерии отрицательно. В этих условиях накопление ионов К+ внутри клетки могло бы происходить просто за счет электрофореза — движения положительно заряженного иона калия в отрицательно заряженную цитоплазму бактерии.
Известно, что между цитоплазмой бактерии и внешней средой существует разность электрических потенциалов, поддерживаемая работой белков-генераторов в бактериальной мембране. Откачивая протоны изнутри клетки наружу, белки-генераторы тем самым заряжают внутренность бактерии отрицательно. В этих условиях накопление ионов К+ внутри клетки могло бы происходить просто за счет электрофореза — движения положительно заряженного иона калия в отрицательно заряженную цитоплазму бактерии.
При этом поток калия должен разряжать мембрану, предварительно заряженную протонными генераторами.
В свою очередь, разрядка мембраны должна немедленно активировать работу генераторов.
Это означает, что энергетические ресурсы, затрачиваемые на генерацию разности электрических потенциалов между клеткой и средой, будут использованы для концентрирования ионов К+ внутри клетки. Конечным балансом такого процесса окажется обмен внутриклеточных ионов Н+ на внеклеточные ионы К+ (ионы Н+ откачиваются белками-генераторами наружу, ионы К+ поступают внутрь, двигаясь в электрическом поле, созданном движением ионов Н+).
Стало быть, внутри клетки будет создаваться не только избыток ионов К+, но и дефицит ионов Н+.
Этот дефицит можно использовать для откачки ионов Na+. Сделать это можно следующим образом. Известно, что бактерии располагают особым переносчиком ионов натрия, обменивающим Na+ на Н+ (этот переносчик носит название Nа+/Н+-антипортера). В условиях нехватки Н+ в цитоплазме антипорт может компенсировать протонный дефицит, перенося Н+ из внешней среды внутрь клетки. Произвести такой антипорт переносчик может только одним способом: обменяв внешний на внутренний Na+. Значит, движение ионов Н+ внутрь клетки может быть использовано для откачки из той же клетки ионов Na+.
Вот мы и создали калий-натриевый градиент: внутри клетки накопили К+ и откачали оттуда Na+. Движущей силой этих процессов был создаваемый белками-генераторами протонный потенциал. (Направление потенциала было таково, что внутренность клетки заряжалась отрицательно и там возникала нехватка ионов водорода.)
Допустим теперь, что протонные генераторы по какой-то причине выключились. Что произойдет в этих новых условиях с калий-натриевым градиентом?
Что произойдет в этих новых условиях с калий-натриевым градиентом?
Конечно же, он рассеется: ионы К+ вытекут из клетки в окружающую среду, где их мало, ионы Na+ войдут внутрь, где эти ионы в дефиците.
Но вот что интересно. Рассеиваясь, калий-натриевый градиент сам окажется генератором протонного потенциала того же направления, что образовывался при работе белков-генераторов.
Действительно, выход иона К+ как положительно заряженной частицы создает диффузионную разность потенциалов на клеточной мембране со знаком «минус» внутри клетки. Вход Na+ при участии Nа+/Н+ — антипортера будет сопровождаться выходом Н+, то есть созданием дефицита Н+ внутри клетки.
Так что же получается? Когда белки-генераторы работают, создаваемый ими протонный потенциал расходуется на образование калий-натриевого градиента. Зато когда они выключены (или их мощности недостает, чтобы удовлетворить многочисленных потребителей потенциала), калий-натриевый градиент, рассеиваясь, сам начинает генерировать протонный потенциал.
Так ведь это и есть буфер протонного потенциала, тот самый буфер, который так необходим для работы мембранных энергетических систем!
Схематично эту концепцию можно изобразить так:
калий-натриевый градиент
??
внешние энергетические ресурсы ? протонный потенциал ? работа.
Но если такая схема верна, то калий-натриевый градиент должен продлить работоспособность клетки в условиях, когда исчерпаны энергетические ресурсы.
А. Глаголев и И. Броун проверили справедливость этого вывода. Был взят мутант кишечной палочки, лишенный протонной АТФ-синтетазы. Для такого мутанта окисление субстратов кислородом служит единственным энергетическим ресурсом, пригодным, чтобы образовать протонный потенциал. Как было показано в свое время Дж. Адлером и его сотрудниками, мутант подвижен, пока в среде есть кислород.
Глаголев и Броун повторили опыт Адлера и убедились, что исчерпание запаса кислорода в растворе действительно останавливает бактерии, если они находятся в среде с КСl. В этих условиях калий-натриевый градиент отсутствует: калия много и в клетках и в среде, а натрия нет ни там, ни здесь.
В этих условиях калий-натриевый градиент отсутствует: калия много и в клетках и в среде, а натрия нет ни там, ни здесь.
А теперь давайте возьмем среду с NaCl. В таких условиях должны быть оба интересующих нас градиента: калиевый (калия много внутри и мало снаружи) и натриевый (натрия много снаружи и мало внутри). Гипотеза предсказывала, что в такой ситуации подвижность сохранится какое-то время и в бескислородных условиях, поскольку возможно превращение энергии:
калий-натриевый градиент ? протонный потенциал ? вращение флагеллы.
И в самом деле, бактерии двигались еще 15—20 минут после того, как измерительное устройство зарегистрировало нулевой уровень СЬ в среде.
Но особенно наглядным, как и следовало ожидать, оказался опыт с солелюбивыми бактериями, которые транспортируют очень большие количества ионов К+ и Na+ , чтобы создать калий-натриевый градиент. Такие бактерии быстро останавливались в темноте в бескислородных условиях, если в среде был КСl, и все еще двигались спустя девять (!) часов, если КСl был заменен на NaCl.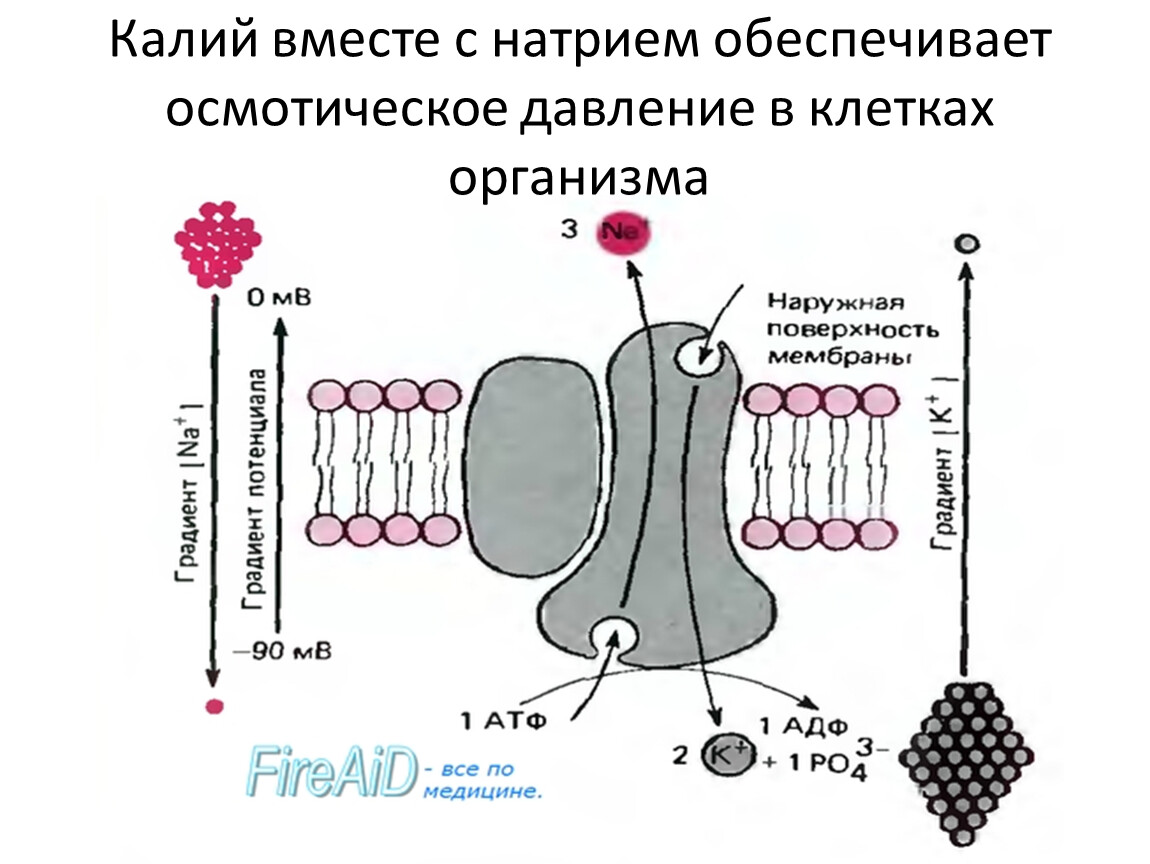
Эта величина — девять часов — интересна прежде всего как иллюстрация объема того резервуара энергии, который представляет собой калий-натриевый градиент у солелюбивых бактерий. Кроме того, она приобретает особый смысл, если вспомнить о том, что солелюбивые бактерии располагают бактериородопсином и, стало быть, способны к превращению энергии света в протонный потенциал. Ясно, что такое превращение возможно лишь в светлый период суток. А как быть ночью? Так вот оказывается, что энергии, запасенной днем в виде калий-натриевого градиента, хватает на всю ночь.
Утверждение, что калий-натриевый градиент играет роль буфера протонного потенциала, позволяет понять не только биологическую функцию этого градиента, но и причину, которая в течение многих лет препятствовала выяснению его значения для жизнедеятельности клетки. Мысль о буферной роли калий-натриевого градиента не могла родиться, прежде чем был открыт протонный потенциал и было доказано, что он служит конвертируемой формой энергии. Все эти годы проблема калия и натрия просто ждала своего часа.
Все эти годы проблема калия и натрия просто ждала своего часа.
Белорусская калийная компания. — Калий для растений
Роль калия в жизнедеятельности растений многогранна. Он необходим всем растениям, микроорганизмам, животным и человеку. Потребление растениями калия в значительной степени обусловлено запасами этого элемента в почве, степенью его подвижности и доступности растениям.
Физиологическая роль калия в жизни растений проявляется, прежде всего, в поддержании благоприятных (для жизни клетки) физико-химических свойств протоплазмы, что имеет большое значение для нормального обмена веществ. К тому же калий способствует более эффективному поглощению растениями азота, тем самым предотвращая загрязнение окружающей среды.
Он участвует в формировании клеточных стенок, что приводит к утолщению, благодаря чему повышается устойчивость растений к полеганию. В равной степени более плотные клеточные стенки растений служат хорошей защитой от проникновения внутрь вредителей и болезней сельскохозяйственных культур. Уменьшение содержания калия в растении создает благоприятные условия для развития патогенных грибов и бактерий в тканях растений. Поэтому, растения, хорошо обеспеченные калием, более устойчивы к воздействию патогенов.
Уменьшение содержания калия в растении создает благоприятные условия для развития патогенных грибов и бактерий в тканях растений. Поэтому, растения, хорошо обеспеченные калием, более устойчивы к воздействию патогенов.
Калий участвует в регулировании водного режима растения. Хорошее обеспечение растений калием позволяет более экономно использовать имеющиеся запасы почвенной влаги, что способствует повышению засухоустойчивости растений. Эффективность калийных удобрений резко возрастает при достаточном обеспечении растений влагой, поэтому в зоне интенсивного орошения при оптимальном уровне внесения калийных удобрений расход воды значительно снижается.
Растения, хорошо обеспеченные калием, входят в зимний период более подготовленными, с хорошо развитой корневой системой. Калий повышает зимостойкость растений и их устойчивость к весенним и осенним заморозкам. Недостаток калия тормозит развитие растений, происходит нарушение процессов обмена веществ, что приводит к значительному снижению продуктивности и ухудшению качества урожая сельскохозяйственных культур.
При достаточном уровне калия:
- Активизируются ферменты и увеличивается содержание белка (в зерне пшеницы, ячменя, риса, семенах зернобобовых культур).
- Стимулируется накопление вегетативной массы.
- Стимулирует накопление жира в семенах подсолнечника, рапса, плодах пальмового, оливкового деревьев и других масличных культур.
- Способствует увеличению содержания сахаров, витаминов, каротина, органических кислот.
- Улучшает вкусовые качества, цвет и консистентность мякоти плодов и ягод плодовых и ягодных культур.
- Под действием калийных удобрений увеличивается прочность и длина волокна хлопчатника, льна и других технических культур.
- На загрязненных радионуклидами почвах калийные удобрения снижают содержание 137Cs в продукции в 1,5–2,7 раза, и это далеко не все.
Калий для растениеводства | UMN Extension
На рис. 7 приведены примеры того, как сушка различных почв перед анализом влияет на количество извлеченного калия. Образцы почвы были взяты из илистого суглинка в Red Wing, суглинка в Рочестере и Ламбертоне и суглинистого песка в Беккере.
7 приведены примеры того, как сушка различных почв перед анализом влияет на количество извлеченного калия. Образцы почвы были взяты из илистого суглинка в Red Wing, суглинка в Рочестере и Ламбертоне и суглинистого песка в Беккере.
В Рочестере и Ред Уинге влажный тест К извлек больше калия, чем тест с воздушной сушкой. Влажный K-тест извлекал больше K при увеличении расхода K.
Эти два теста были аналогичными для песчаного грунта в Беккере и без применения К в Red Wing.В Ламбертоне влажный тест K извлекал меньше K, чем тест с воздушной сушкой, когда было нанесено 100 фунтов K 2 O или меньше.
Рисунок 7: Сравнение теста почвы K, полученного на образцах почвы, высушенных на воздухе и влажных в полевых условиях, в четырех полевых районах Миннесоты с различными типами почвы. Влияние высыхания на тест на почву К может затруднить оценку того, где может возникнуть дефицит. Не рекомендуется вносить удобрения, если значение К-теста для воздушной сушки составляет более 160 ppm. Неуверенность в том, произойдет ли высвобождение фиксации, может изменить то, как интерпретировать этот критический уровень.
Неуверенность в том, произойдет ли высвобождение фиксации, может изменить то, как интерпретировать этот критический уровень.
Количество извлеченного калия и результаты испытаний почвы
На рис. 8 показана взаимосвязь между количествами K, экстрагированного на влажных образцах, и разницей между K, экстрагированным ацетатом аммония во влажном тесте по сравнению с обычным тестом с воздушной сушкой.
Рисунок 8: Взаимосвязь между K в полевых влажных образцах почвы и K в полевых влажных и воздушно-высушенных тестах для суглинков (Ламбертон) и илистых суглинистых почв (Моррис).Данные показывают, что влажный тест будет извлекать меньше K, чем тест на воздушную сушку, когда тест влажной почвы составляет менее 200 ppm, и будет извлекать больше K, когда он превышает 200 ppm.
Если для вашей почвы вероятно завышение K, вы можете использовать критический уровень 200 ppm для целей строительства или обслуживания. Это помогает снизить риск снижения урожайности из-за завышенной оценки доступного K из-за воздушной сушки образцов почвы.
Во влажном К-тесте используется та же химическая экстракция, что и в обычном воздушно-сухом тесте, но его следует рассматривать как отдельный тест. Не используйте классы интерпретации теста почвы для теста с воздушной сушкой в Миннесоте для теста влажного К.
Взаимодействие растения и почвы: поглощение питательных веществ | Изучайте науку в Scitable
Бейер П. Золотой рис и «Золотые» культуры для питания человека. Новое Биотехнология 27 , 478-481 (2010).
Бритто, Д. Т. и Х. Дж. Кронзукер. Клеточные механизмы транспорта калия в растениях. Physiologia Plantarum 133 , 637-650 (2008).
Коннолли, Э. Л. и Э. Л. Уокер. Пора качать железо: механизмы сигнализации о дефиците железа у высших растений. Текущее мнение по биологии растений 11 , 530-535 (2008).
Фергюсон Б. Дж. и др. . Молекулярный анализ бобовых культур
Развитие узелков и ауторегуляция. Журнал
интегративной биологии растений 52 ,
61-76 (2010).
Грэм Л., Грэм Дж. И Л. Уилкокс. Биология растений. Река Аппер Сэдл, Нью-Джерси: Pearson Prentice Hall, 2006.
Guerinot M. L. & Y. Yi. Железо: питательно, ядовито и труднодоступно. Физиология растений 104 , 815-820 (1994).
Ад Р. и Х. Гиллебранд. Концепции заводов по добыче и распределению полезных ископаемых. Текущее мнение в области биотехнологии 12 , 161–168 (2001).
Джонс Б. и К. Люнг. Подземное освоение космоса: развитие архитектуры корневой системы. Текущее мнение по биологии растений 15 , 97-102 (2012).
Карандашов В. и М. Бухер. Симбиотический транспорт фосфата у арбускулярных микориз. Тенденции в растениеводстве 10 , 22-29 (2005).
Лопес-Бусио Дж. и др. . Роль доступности питательных веществ в регулировании корневой архитектуры. Текущий Заключение по биологии растений 6 , 280-287 (2003).
Лимпенс Э. и Т. Бисселинг.
Сигнализация в симбиозе.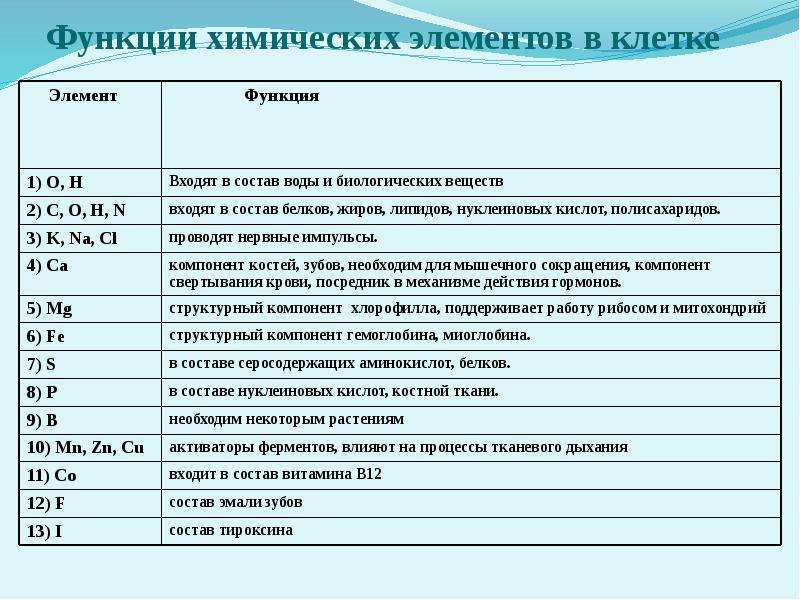 Текущее мнение
в области биологии растений 6 , 343-350
(2003).
Текущее мнение
в области биологии растений 6 , 343-350
(2003).
Nehls U. и др. . Сахар для меда: углеводы расщепление в эктомикоризном симбиозе. Фитохимия 68 , 82-91 (2007).
Nehls U. Мастеринг эктомикоризный симбиоз: влияние углеводов. Журнал экспериментальной ботаники 59 , 1097-1108 (2008).
Pyo Y. J. et al . Высокое сродство K + Транспортировка арабидопсиса: AtHAK5 и AKT1 имеют жизненно важное значение для создания рассады и рост после прорастания в условиях низкого содержания калия. Физиология растений 153 , 863-875 (2010).
Sprent J. 60 млн лет бобовых культур узловатость.Какие новости? Что меняется? Журнал Экспериментальной ботаники 59 , г. 1081-1084 (2008).
Вэнс К. Симбиотик Азотфиксация и поглощение фосфора. Питание растений в мире Снижение возобновляемых ресурсов. Завод Физиология 127 , 390-397 (2001).
Very, A. & H. Sentenac.
Молекулярные механизмы и регуляция транспорта K + в высших
Растения. Ежегодный обзор биологии растений 54 , 575-603 (2003).
& H. Sentenac.
Молекулярные механизмы и регуляция транспорта K + в высших
Растения. Ежегодный обзор биологии растений 54 , 575-603 (2003).
границ | Роль K + каналов в захвате и перераспределении калия у модельного растения Arabidopsis thaliana
Введение
Калий (K + ) необходим для роста и развития организма. Он участвует в различных важных клеточных процессах, таких как стабилизация синтеза белка, активация ферментов, нейтрализация отрицательных зарядов на белках и многое другое. В дополнение к вышеупомянутым задачам, у растений он играет ключевую роль в осмотических процессах, влияющих на клеточный тургор, удлинение клеток, транслокацию фотосинтатов, поддержание цитозольного гомеостаза pH и настройку мембранного потенциала наряду с протонной движущей силой ( Maathuis, 2009; Marschner, 2012).Все эти функции подтверждают, что это самый распространенный неорганический катион в растениях, составляющий до 10% их сухой массы (Leigh and Wyn Jones, 1984).
Калий является основным фактором устойчивости к засухе, засолению и грибковым заболеваниям (Amtmann et al., 2008). Это объясняет, почему это имеет решающее значение в сельском хозяйстве, влияющем на урожайность сельскохозяйственных культур. Для выполнения задач, описанных выше, растениям требуются концентрации калия в цитоплазме от 100 до 200 мМ (Wyn Jones and Pollard, 1983).Напротив, концентрация калия в почве (10–100 мкМ) на 3–4 порядка ниже (Schroeder et al., 1994). Следовательно, завод должен инвестировать энергию для поглощения K + и его распределения по всему предприятию.
Транспорт калия осуществляется различными белками-переносчиками. В модельном растительном организме Arabidopsis thaliana уже идентифицирован 71 канал и транспортеры K + (Mäser et al., 2001; Véry and Sentenac, 2003; Amtmann et al., 2004; Ван и Ву, 2010). Они были разделены на шесть различных семейств генов, состоящих из трех семейств каналов и трех семейств транспортеров (семейства KUP / HAK / KT, HKT и CPA; Gierth and Mäser, 2007; Chanroj et al. , 2012; Gomez-Porras et al. ., 2012).
, 2012; Gomez-Porras et al. ., 2012).
Три идентифицированных семейства каналов K + : Shaker , Tandem-Pore K + (TPK) и K ir -подобные каналы. Однако недавние филогенетические данные свидетельствуют о том, что каналы, подобные K ir , на самом деле принадлежат к семейству TPK и возникли в результате недавних эволюционных событий дупликации генов и частичных делеций (Marcel et al., 2010; Voelker et al., 2010; Gomez-Porras et al., 2012). Поэтому мы больше не рассматриваем каналы типа K и как отдельное семейство. Каналы K + активны как мультимерные белки, состоящие из двух или четырех α-субъединиц, которые характеризуются наличием либо одного, либо двух поровых (P) доменов. В функциональном мультимерном белке четыре P домена связаны, образуя часть пути проводимости, включая его фильтр селективности. Селективные каналы K + имеют отличительный мотив TXGYGD / E в своих P-доменах (Lebaudy et al. , 2007; Таблица 1, Рисунок 1).
, 2007; Таблица 1, Рисунок 1).
Таблица 1. Обзор расположения, функций и регулирования установки K + каналов .
Рисунок 1. Структура и функции семейств каналов K + в растениях . Два семейства каналов Plant K + различаются по структуре (A), и функции (B), . Шейкер Каналы составляют самое универсальное семейство среди каналов K + . Девять членов разделяются на внутренние, внешние и слабо выпрямляющие каналы.Функциональные каналы представляют собой тетрамеры и работают в зависимости от напряжения. Одна субъединица состоит из шести трансмембранных доменов (S1 – S6) и одного порового домена (P). Четвертая трансмембранная область S4 богата положительно заряженными аминокислотами и действует вместе с S1, S2 и S3 как датчик напряжения. Выявлено пять каналов ТПК. Одна субъединица содержит два поровых домена (P1 и P2), а двух субъединиц достаточно для формирования функционального канала. TPK действуют в значительной степени независимо от напряжения и проявляют токи утечки.KCO3 первоначально был классифицирован как канал, подобный K ir , с двумя трансмембранными областями и одним поровым доменом. Фактически, «растительные K ir -подобные каналы» происходят из TPK в результате частичной делеции одного фильтра селективности и двух трансмембранных доменов. В соответствии с этим представлением были обнаружены только стабильные димеры. Транспортная функция K + для этих усеченных каналов не показана. Сокращения: экстра, внеклеточная сторона; внутри-, внутриклеточная сторона; СУ, субъединица; +, положительно заряженные аминокислоты; cNBD, циклический нуклеотид-связывающий домен; анки, анкириновый повторяющийся домен; K (T) / HA , кислый домен; EF, EF ручной домен.
TPK действуют в значительной степени независимо от напряжения и проявляют токи утечки.KCO3 первоначально был классифицирован как канал, подобный K ir , с двумя трансмембранными областями и одним поровым доменом. Фактически, «растительные K ir -подобные каналы» происходят из TPK в результате частичной делеции одного фильтра селективности и двух трансмембранных доменов. В соответствии с этим представлением были обнаружены только стабильные димеры. Транспортная функция K + для этих усеченных каналов не показана. Сокращения: экстра, внеклеточная сторона; внутри-, внутриклеточная сторона; СУ, субъединица; +, положительно заряженные аминокислоты; cNBD, циклический нуклеотид-связывающий домен; анки, анкириновый повторяющийся домен; K (T) / HA , кислый домен; EF, EF ручной домен.
В 1992 г., AKT1 и KAT1, два внутренних выпрямляющих канала из Arabidopsis , были идентифицированы по функциональной комплементации штаммов дрожжей, дефектных по поглощению калия. Эти два члена семейства Shaker -подобных каналов были первыми клонированными растительными калиевыми каналами (Anderson et al., 1992; Schachtman et al., 1992; Sentenac et al., 1992).
Эти два члена семейства Shaker -подобных каналов были первыми клонированными растительными калиевыми каналами (Anderson et al., 1992; Schachtman et al., 1992; Sentenac et al., 1992).
В 1997 году первый член семейства каналов TPK был идентифицирован с помощью in silico подходов с использованием программы секвенирования гена Arabidopsis .Каналы TPK являются растительными аналогами каналов тандемных пор животных (TWIK-подобных) каналов (Chempinski et al., 1997). При поиске последовательностей, связанных с TPK1, в базе данных геномных последовательностей был идентифицирован KCO3, который, как полагали, был структурно подобен внутренним ректифицирующим каналам животного калия (Chempinski et al., 1999), что привело к его первоначальной классификации в отдельное семейство растений K ir. -подобных каналов.
Независимый от напряжения K
+ Каналы в ArabidopsisТандемные поровые калиевые каналы
Семейство каналов Tandem-Pore K + (TPK) состоит из шести членов (TPK1-TPK5 и KCO3, этот особый случай см. Также ниже) в модельном заводе Arabidopsis thaliana .Гомологи TPK были идентифицированы у высших растений и зеленых водорослей (Voelker et al., 2010; Gomez-Porras et al., 2012). Филогенетический анализ показал, что каналы ТПК растений делятся на два подсемейства: ТПК1 принадлежит одному, а ТПК2, ТПК3, ТПК4 и ТПК5 — второму подсемейству. Это подразделение на семейства указывает на общее наследственное происхождение каналов TPK2, TPK3, TPK4 и TPK5; гипотеза, которая была дополнительно подтверждена анализом дупликации хромосомных сегментов в геноме Arabidopsis (Marcel et al., 2010; Voelker et al., 2010; Gomez-Porras et al., 2012).
Также ниже) в модельном заводе Arabidopsis thaliana .Гомологи TPK были идентифицированы у высших растений и зеленых водорослей (Voelker et al., 2010; Gomez-Porras et al., 2012). Филогенетический анализ показал, что каналы ТПК растений делятся на два подсемейства: ТПК1 принадлежит одному, а ТПК2, ТПК3, ТПК4 и ТПК5 — второму подсемейству. Это подразделение на семейства указывает на общее наследственное происхождение каналов TPK2, TPK3, TPK4 и TPK5; гипотеза, которая была дополнительно подтверждена анализом дупликации хромосомных сегментов в геноме Arabidopsis (Marcel et al., 2010; Voelker et al., 2010; Gomez-Porras et al., 2012).
Первый канал TPK (AtTPK1) был клонирован посредством поиска в базе данных A. thaliana EST консервативного мотива порового домена канала K + TXGYGD (Chempinski et al., 1997). TPK демонстрируют структуру TM-P-TM-TM-P-TM с дублированным трансмембранно-поровым-трансмембранным модулем (рис. 1A). Как правило, эти каналы содержат одну или две связывающие Ca 2+ EF-руки в цитозольной С-концевой части и сайты связывания для белков 14-3-3 в цитозольной N-концевой части, а также предполагаемый N- сайт гликозилирования в люминальной петле между поровым доменом и вторым трансмембранным доменом.
Функциональные каналы TPK состоят из двух таких субъединиц и существуют в виде димеров (Maitrejean et al., 2011). Они обнаруживают высокую зависимость от Ca 2+ , что может быть важным для регуляции каналов (Latz et al., 2007a). Каналы TPK локализованы в вакуолярной мембране (Chempinski et al., 2002; Schönknecht et al., 2002). Единственным исключением является TPK4, который, как сообщается, локализуется в плазматической мембране (Becker et al., 2004; Dunkel et al., 2008). TPK4 имеет 85% сходства (53% идентичности) с TPK5, но не имеет регуляторных доменов и мотива взаимодействия с белками 14-3-3.Таким образом, можно предположить, что TPK4 произошел от TPK5 и впоследствии подвергся событиям усечения. Другим исключением из исключительно вакуолярной локализации может быть TPK3. При вестерн-блоттинге TPK3 был также идентифицирован в тилакоидных мембранах (Zanetti et al., 2010), в связи с чем возникает вопрос, могут ли TPKs иметь множественные субклеточные местоположения.
Анализ экспрессии TPK с помощью количественных экспериментов ПЦР в реальном времени показал их присутствие в различных тканях растений, таких как корни, листья и цветы (Deeken et al., 2003; Voelker et al., 2010). Среди всех TPK, TPK1 показал самые высокие уровни экспрессии во всех проанализированных тканях, за ним следовали TPK3 и TPK5 . Уровни экспрессии TPK2 и TPK4 были очень низкими. Повышенные уровни транскриптов TPK2 и были обнаружены в тычинках и пыльце. TPK3 Уровни транскрипта были более высокими в лепестках, тычинках, семенах и стареющих листьях.
Состояние сборки тандем-поры K
+ каналовИсследования гена промотор-репортер и эксперименты qRT-PCR выявили перекрывающиеся паттерны экспрессии для членов семейства каналов TPK / KCO3 (Chempinski et al., 2002; Дикен и др., 2003; Филиппар и др., 2003; Беккер и др., 2004; Voelker et al., 2006). Экспрессия TPK1 перекрывается с экспрессией TPK3 в кончиках корней и с экспрессией TPK5 и KCO3 в тканях сосудов. Кроме того, TPK1, TPK2, TPK3 и TPK4 экспрессируются в пыльце. Перекрывающиеся паттерны экспрессии и их общая локализация в тонопласте предполагают, что комбинация субъединиц гетеромерного канала может происходить на разных стадиях развития или физиологических условиях (Latz et al., 2007а).
Димеризация каналов TPK была продемонстрирована экспериментально с использованием центрифугирования в градиенте сахарозы гомогенатов листьев, экспрессирующих TPK1-GFP. Это подтверждает вклад четырех поровых доменов в фильтр селективности K + канала TPK1 (Maitrejean et al., 2011). Используя тот же метод, было обнаружено, что AtKCO3 и AtKCO3-GFP также существуют в виде димеров. Таким образом, эти каналы будут иметь только два поровых домена в димеризованном состоянии (рис. 1A), что не считается достаточным для активного, K + -селективного канала (Rocchetti et al., 2012).
С целью изучения состояния сборки членов семейства TPK / KCO были проведены различные эксперименты с использованием таких методов, как FRET и BiFC (split-YFP). Результаты этих подходов указывают на существование гомомерных каналов TPK / KCO3, как, например, в случае TPK1 или TPK5 (Voelker et al., 2006). Однако до сих пор не может быть предоставлено никаких доказательств образования гетеромерных каналов. Тем не менее убедительных данных, исключающих такую возможность, нет. Таким образом, нельзя исключить, что образование гетеромерных каналов in vivo и может происходить при различных онтогенетических и физиологических условиях.
Локализация тандем-поры K
+ каналовПри первом подходе к обнаружению субклеточной локализации канал TPK1 стабильно сверхэкспрессируется в клетках BY-2 табака. После фракционирования белка с градиентом сахарозы этот канал K + , как было обнаружено, совместно фракционирует с маркерами тонопласта, что дает первый ключ к его локализации на вакуолярной мембране (Chempinski et al., 2002). Дальнейшие исследования локализации были выполнены путем создания слитых конструкций GFP с последующей их временной экспрессией в A.thaliana протопластов. Такие эксперименты продемонстрировали вакуолярную локализацию TPK1, TPK2, TPK3 и TPK5 (Voelker et al., 2006). Напротив, когда слитая конструкция TPK4: GFP экспрессировалась в эпидермальных клетках лука, было обнаружено, что она частично локализуется в плазматической мембране. Однако основная фракция была обнаружена в ER (Becker et al., 2004; Dunkel et al., 2008). Это может быть связано либо с задержкой ER, либо может указывать на то, что помимо TPK3, обнаруженного в тонопласте и в тилакоидной мембране, также TPK4 может проявлять по крайней мере профиль двойной локализации.
К сожалению, до сих пор неизвестна общая последовательность нацеливания, которая «направляет» каналы TPK к соответствующей мембране (Vitale and Hinz, 2005; Dunkel et al., 2008). С целью идентификации сигнала сортировки вакуолярных каналов TPK были созданы различные химеры между TPK4 (белок плазматической мембраны) и TPK1 (белок тонопласта). Неизвестно, почему была выбрана именно эта пара, а не «близнецы» TPK5 и TPK4; TPK4 имеет 85% сходных аминокислот с TPK5.Тем не менее, химеры показали, что полная замена цитозольного С-конца TPK1 приводит к удержанию ER. Дальнейший подробный анализ показал, что концевые 25 аминокислот не важны для процесса доставки. Анализ аминокислот 292–308 на С-конце TPK1 может идентифицировать три двухосновных мотива. Из этих трех мотивов мутации в (D296G / E298G) привели к застрявшим в ER белкам TPK1, что позволяет предположить, что этот двухосновный мотив является решающим для экспорта TPK1 из ER (Dunkel et al., 2008; Voelker et al., 2010). Связанное с этим исследование TPK риса выявило аминокислоты в цитозольном C-концевом домене, которые определяют дифференциальное нацеливание TPK на эндомембраны большой центральной литической вакуоли или вакуолей для хранения белка (Isayenkov et al., 2011a), что указывает на общую роль определенных области цитозольного С-конца для нацеливания на каналы.
Удержание белка канала TPK1 в ER также происходило, когда листья растений обрабатывали брефельдином А, грибковым токсином, который вызывает перераспределение мембран Гольджи.Из этого наблюдения был сделан вывод, что транспорт белков канала ТПК к вакуолярной мембране осуществляется посредством Гольджи-зависимого пути и что аппарат Гольджи является первым компартментом, пересекаемым белком после того, как он покидает ER (Dunkel et al., 2008). . Эксперименты с рисом показали более сложную ситуацию с нацеливанием ТПК. TPKs, нацеленные на литическую вакуоль, действительно проходят через аппарат Гольджи. Однако TPK, нацеленные на вакуоли хранения белка, по-видимому, достигают эндомембраны независимым от Гольджи способом (Isayenkov et al., 2011а).
Регулировка и функция тандем-пор К
+ каналовВ настоящее время знания о функционировании и регулировании заводских ТПК ограничены. Исследования часто подкрепляются сравнением со связанными каналами из других королевств. Было показано, что активность двухпоровых каналов животных регулируется взаимодействием белков 14-3-3 (Rajan et al., 2002). Также было обнаружено, что у растений подавление активности канала K + в тонопласте вызвано взаимодействием с белками 14-3-3.В TPKs цитозольный N-конец содержит классический мотив связывания для белков 14-3-3 (RSXpS / pTXP). Фосфорилирование этих сериновых или треониновых остатков имеет решающее значение для взаимодействия с 14-3-3 белками (Latz et al., 2007a).
Предполагается, что каналыTPK участвуют в гомеостазе K + растительных клеток, обеспечивая контролируемый внутриклеточный транспорт K + из органелл и внутрь них. Недавние эксперименты с использованием техники патч-кламп продемонстрировали механочувствительную природу каналов TPK, что указывает на их роль в осморегуляции.Эта концепция была дополнительно подтверждена анализами разрушения протопластов (Maathuis, 2011) и тестами на прорастание проростков (Gobert et al., 2007).
AtTPK1 повсеместно экспрессируется в A. thaliana . Используя слияние промотор-репортерный ген (GUS), активность промотора TPK1 наблюдали в коре корня, сосудистой ткани, клетках мезофилла, замыкающих клетках и пыльцевых зернах (Chempinski et al., 2002). При экспрессии в дрожжах TPK1 обладает характеристиками селективных каналов K + из Vicia faba (каналы VK), ранее охарактеризованных in vivo с высокой селективностью в отношении K + по сравнению с Na + (Bihler et al., 2005; Gobert et al., 2007; Latz et al., 2007b). Активность TPK1 не зависит от мембранного напряжения, но было показано, что она зависит от цитозольного pH с максимальной вероятностью открытия при pH 6,7, снижаясь на 20-30% при физиологическом pH 7,5-7,8. Он активируется цитозольным Ca 2+ , демонстрируя наивысшее сродство к ионам кальция среди протестированных белков, включая кальмодулин. Взаимодействие TPK1 с 14-3-3 белком GRF6 (общий фактор высвобождения 6) увеличивает активность канала в зависимости от дозы.Это взаимодействие не играет никакой роли в нацеливании белка на тонопласт (Latz et al., 2007a). Все эти данные указывают на то, что TPK1 строго контролируется сотовыми сигналами. TPK1, как сообщается, участвует в высвобождении вакуолярного K + во время закрытия устьиц, а также во время прорастания семян и роста корешков (Gobert et al., 2007).
AtTPK4 представляет собой мгновенно активируемый селективный канал K + , который также обнаруживается в плазматической мембране при экспрессии в ооцитах Xenopus и дрожжах. In planta, TPK4 демонстрирует низкое количество транскриптов. Он преимущественно экспрессируется в пыльце, как показывает анализ слияния промотор-GUS. TPK4 блокируется внеклеточным Ca 2+ и нечувствителен к изменениям внеклеточного pH, но эффективно блокируется цитозольным подкислением. Сообщалось также об активации TPK4 теплом (Becker et al., 2004). Предполагается, что TPK4 вносит вклад в проводимость K + плазматической мембраны пыльцевой трубки, где он работает как так называемый «открытый выпрямитель» с током насыщения при деполяризующих потенциалах мембраны.
AtTPK5 нацелен на тонопласт. На уровне мРНК TPK5 обнаруживает более высокое содержание в стареющих листьях и лепестках (Voelker et al., 2010). Исследования промотора GUS TPK5 показали экспрессию в сосудистых тканях листьев, корней, гидатодах, тканях цветов и стеблях. TPK5 уровень транскрипта повышается или понижается в ответ на внешние факторы.
Недавно AtTPK1, AtTPK2 и AtTPK5 были функционально охарактеризованы в Escherichia coli .Эти три изоформы были способны дополнять дефицитный по поглощению K + мутант LB2003 E. coli на среде с низким содержанием K + (Isayenkov and Maathuis, 2013). Интересно, что в тех же экспериментах AtTPK3 не смог дополнить LB2003. Это может указывать на то, что этот канал может быть активен в другом мембранном окружении, например, в тилакоидной мембране (Zanetti et al., 2010).
Различные изоформы тандем-поры K
+ каналовТандемно-поровые каналы K + также были идентифицированы и охарактеризованы у других видов растений, кроме A.thaliana , например Hordeum vulgare, Nicotiana tabacum, Solanum tuberosum, Oryza sativa (Chempinski et al., 1999; Hamamoto et al., 2008a, b; Isayenkov et al., 2011a, b). Интересно видеть, что NtTPK1 из табака проявляет свойства, отличные от других каналов TPK растений, поскольку он активен даже в отсутствие Ca 2+ . Тем не менее, увеличение цитозольного Ca 2+ привело к двукратному увеличению амплитуды тока K + (Hamamoto et al., 2008а). Его текущий профиль показывает мгновенную и зависящую от времени составляющую (Hamamoto et al., 2008b). Наиболее интересной отличительной особенностью является то, что две из четырех идентифицированных изоформ в N. tabacum не содержат консервативного мотива TXGYGD во втором домене поры. Вместо этого NtTPKb и NtTPKc обладают VHG или GHG соответственно.
Plant K
ir -Подобные каналы Каналы, подобныеPlant K ir , изначально были классифицированы как отдельная группа, хотя они похожи на каналы ТПК.На сегодняшний день они обнаружены только в роде Arabidopsis (A. thaliana и A. lyrata ; Gomez-Porras et al., 2012). Таким образом, они, по-видимому, возникли совсем недавно в эволюции. Филогенетический анализ показал, что они произошли от дупликации гена канала TPK с последующим событием частичной делеции, которое привело к потере одного порового домена (Рисунок 1A; Marcel et al., 2010; Voelker et al., 2010). Как следствие, субъединица K ir -подобного канала растения содержит только две ТМ и одну Р-область.На основании этой структурной особенности было высказано предположение, что каналы, подобные растению K и , являются тетрамерами. Однако эта концепция весьма сомнительна. Геном A. thaliana содержит только один ген (называемый KCO3), кодирующий субъединицу, подобную K ir . В последнее время KCO3 может быть обнаружен только как стабильный димер на биохимическом уровне (Rocchetti et al., 2012), что указывает на его происхождение от каналов TPK. Очень низкая распространенность транскриптов наблюдалась для KCO3 .Конструкции слияния промотор-GUS для KCO3 демонстрируют экспрессию в сосудистой ткани листьев, корней, ткани цветка и стебля, а также в гидатодах, как это видно также для TPK5 . KCO3 может играть роль в осморегуляции, так как растение с нокаутом для гена KCO3 демонстрирует сниженный рост в условиях осмотического стресса. Однако это изменение фенотипа растения может быть дополнено экспрессией мутантного гена KCO3 с неактивной областью поры. Эти результаты показывают, что функция KCO3 в условиях осмотического стресса не зависит от его способности переносить ионы калия (Rocchetti et al., 2012). В заключение, на основании текущих знаний каналы, похожие на каналы K ir , должны быть повторно интегрированы в семейство TPK, а не рассматриваться как отдельное семейство каналов. Их присутствие только в Arabidopsis может указывать на то, что они просто «чудо природы», не имеющее фундаментального физиологического значения за пределами этого рода.
Зависимость от напряжения K
+ Каналы в ArabidopsisТак называемое семейство устройств Shaker представляет собой группу стробированных по напряжению каналов K + .В A. thaliana он состоит из девяти членов. Эту группу можно разделить на три подсемейства в зависимости от их реакции на мембранное напряжение (Lebaudy et al., 2007; Dreyer and Blatt, 2009). Шесть членов активируются при гиперполяризации мембраны и закрываются, когда движущая сила для калия направлена вовне. Как следствие, они вызывают только внутренние токи K + (K в ). Два члена активируются при деполяризации мембраны. Они закрываются, когда движущая сила калия направлена внутрь.Таким образом, они вызывают только внешние токи K + (K из ). И один член демонстрирует слабую зависимость от напряжения и может опосредовать как отток K + , так и приток K + (K слабый ; Рисунок 1B).
Функциональная установка Шейкер каналы состоят из четырех α-субъединиц. Каждая α-субъединица содержит шесть трансмембранных доменов и один поровый домен между пятым и шестым трансмембранным доменом. С-конец содержит различные регуляторные элементы, такие как домен связывания циклических нуклеотидов, домен анкириновых повторов, кислый домен K , HA и в K в каналах домен K T (Sentenac et al., 1992; Ehrhardt et al., 1997; Gaymard et al., 1998; Dreyer et al., 2004). Помимо того, что они функционируют как гомотетрамеры, образование гетеротетрамеров является обычным явлением и, как доказано, происходит у растений (Dreyer et al., 1997; Lebaudy et al., 2008a).
Разнообразные физиологические функции растений Shaker каналов были идентифицированы в ходе многочисленных экспериментов. Нокаутные и сверхэкспрессирующие мутантные растения, а также гетерологичные системы экспрессии, такие как ооциты Saccharomyces cerevisiae, Xenopus laevis , клетки HEK293, COS или Sf9, использовали для изучения функциональности каналов K + (Dreyer et al., 1999). В следующих разделах описаны физиологические роли и влияние каналов растения Shaker на растение.
K
+ Поглощение в корнях через AKT1Различные условия требуют разных систем поглощения
ЗахватK + из почвы осуществляется хорошо организованной системой транспортных белков, каждый из которых вносит свой вклад по-своему (Alemán et al., 2011). Все системы поглощения вместе работают в широком диапазоне концентраций K + и являются частью обширной регулирующей сети (рис. 2).В качестве основных систем захвата K + в корнях Arabidopsis были идентифицированы Shaker -подобный канал K + AKT1 и K + транспортер AtHAK5 (Hirsch et al., 1998; Gierth et al., 2005 ; Rubio et al., 2008). При внешних концентрациях K + ниже 0,01 мМ управляемый протонами H + / K + ко-переносчик AtHAK5 является единственной системой, ответственной за поглощение K + из почвы. При концентрациях K + между 0.01 мМ и 0,05 мМ AtHAK5 и AKT1 вместе вносят вклад в поглощение K + . При более высоких внешних концентрациях K + AKT1 вместе с другими неизвестными низкоаффинными системами поглощения K + ответственны за поглощение K + из почвы (Rubio et al., 2010; Pyo et al., 2010; Caballero et al. др., 2012).
Рисунок 2. Поглощение K + корнями Arabidopsis и его регулирование . В зависимости от фактической концентрации K + в почве действуют различные системы поглощения K + с низким или высоким сродством.При концентрациях K + ниже 0,01 мМ активен только высокоаффинный транспортер AtHAK5. Он блокируется внеклеточным NH + 4 и стимулируется внеклеточным Na + и H + . Shaker -подобный канал K + AKT1 участвует в захвате K + с высоким и низким сродством. Это мишень обширной регуляторной сети, которая включает сенсоры кальция (CBL), киназы (CIPK), фосфатазы (PP2C) и способность образовывать гетеротетрамеры с AtKC1.В присутствии CBL1 или CBL9 CIPK23 фосфорилирует и активирует AKT1. Взаимодействие CIPK 6, 16 и 23 каждый с CBL1, 2, 3 и 9 и его влияние на AKT1 было показано в дрожжевых двухгибридных анализах и ооцитах Xenopus laevis (Lee et al., 2007). AKT1 деактивируется прямым взаимодействием с CBL10, внешним Ba 2+ или дефосфорилированием через фосфатазы PP2C. Фосфатазы действуют непосредственно на AKT1 или на механизм CIPK-CBL, инактивируя AKT1 (Lan et al., 2011). Кроме того, AKT1 способен образовывать гетеротетрамеры с AtKC1.Гетеромерный канал проявляет измененные свойства стробирования и проникновения, которые эффективно блокируют потенциальное высвобождение K + при низких внешних концентрациях K + (Geiger et al., 2009). Кроме того, предполагалось взаимодействие CIPK23 с гетеромерным AKT1-AtKC1 и был описан вклад SYP121 в нативные характеристики AKT1-AtKC1 (Honsbein et al., 2009).
AKT1 и AtHAK5 подвержены влиянию различных условий окружающей среды. Оба транспортных белка работают в разных концентрационных спектрах K + и проявляют индивидуальную чувствительность к другим ионам.Например, AtHAK5 чувствителен к аммонию (NH + 4 ), тогда как AKT1 остается неизменным в присутствии NH + 4 . Напротив, Ba 2+ блокирует AKT1, в то время как AtHAK5 остается неизменным, а Na + и H + стимулируют активность AtHAK5 (Hirsch et al., 1998; Spalding et al., 1999; Rubio et al., 2008 г.). Следовательно, разные системы поглощения K + дополняют друг друга и даже допускают поглощение K + , когда одна система поглощения отключена.AKT1 обеспечивает, следовательно, альтернативную систему поглощения K + для NH + 4 чувствительного AtHAK5 в условиях низкого K + .
Постановление AKT1
AKT1 сам способствует захвату K + с высоким и низким сродством и является целью регулирующей сети. Xu et al. и Ли и др. показали в 2006 году, что CIPK23 и CBL1 или CBL9 необходимы для активации AKT1. Два кальциневрина B-подобных кальциевых сенсора CBL1 и CBL9 связываются с CBL-взаимодействующей протеинкиназой CIPK23, которая затем, в свою очередь, фосфорилирует AKT1.Все три компонента (AKT1-CIPK23-CBL1 / 9) необходимы для функциональной экспрессии AKT1 в ооцитах X. laevis .
Вскоре после этого были обнаружены другие компоненты этой очень сложной и гибкой регулирующей сети. Помимо нескольких киназ CIP, было показано, что протеинфосфатаза 2C-типа (PP2C), AIP1, связывает и инактивирует AKT1 (Lee et al., 2007). Последующие исследования выявили больше взаимосвязей между несколькими CBL и CIPK с AKT1 (Lee et al., 2007; Lan et al., 2011; Ren et al., 2013). Lan et al. предположили, что фосфатазы PP2C также взаимодействуют с комплексом CIPK-CBL, чтобы ингибировать активность фосфорилирования киназы и дефосфорилировать AKT1. И Рен и др. (2013) продемонстрировали, что CBL10 напрямую связывает AKT1 и снижает его активность зависимым от концентрации и CIPK-независимым образом.
Сообщалось о многих различных ассоциациях AKT1 с CBL, CIPK и PP2C. Грефен и Блатт (2012) утверждают, что метод, используемый для исследования взаимодействий между белками, расположение меток и способ анализа, имеют решающее влияние на обнаруживаемые взаимодействия.Тем не менее, CBL, CIPK и PP2C обеспечивают комплексную систему для регуляции захвата K + , опосредованного AKT1. В особенности, поскольку разные CBL участвуют в разных сигнальных путях, эта система фосфорилирования-дефосфорилирования обеспечивает мощную регуляторную сеть для растений, чтобы реагировать на широкий спектр изменений окружающей среды (для обзора см. Kudla et al., 2010).
Внутреннее регулирование посредством гетеромеризации
Помимо регуляции с помощью киназ и фосфатаз, другой член семейства Shaker -подобных изменяет функциональность AKT1: AtKC1.AtKC1 известен как регуляторная или молчащая α-субъединица K в Shaker -подобных каналах, поскольку он не показывает токи в ооцитах Xenopus , когда экспрессируется отдельно, и влияет только на K в каналах (Dreyer et al., 1997; Jeanguenin et al., 2011). Тем не менее, его участие в поглощении K + и его связь с AKT1 было признано давно (Reintanz et al., 2002; Pilot et al., 2003). Duby et al. (2008) продемонстрировали влияние AtKC1 на AKT1. Они описали, что AtKC1 сдвигает порог активации AKT1 в сторону более отрицательных значений.Это, в свою очередь, предотвратило бы отток K + через AKT1 в неблагоприятных условиях. Снижение потенциальных выходных токов предохраняет установку от потерь K + при низких концентрациях K + . Однако стоимость такого «клапана» заключается в снижении активности канала, что, в свою очередь, означает уменьшение притока K + при более благоприятных условиях. Гейгер и др. (2009) поддержали, расширили и уточнили эту гипотезу «клапана». Они показали в электрофизиологических экспериментах влияние AtKC1 на входящие и исходящие токи AKT1 при различных концентрациях K + .Помимо влияния на порог активации, в гетеромерах AKT1-AtKC1 также была изменена зависимая от K + стабильность поры. Когда внешняя концентрация K + падает, путь проникновения каналов K + становится нестабильным и разрушается (Zhou et al., 2001). Пороговая концентрация, ниже которой это происходит, оказывается характерной чертой каждого канала. Гейгер и др. (2009) обнаружили, что поры гетеромеров AKT1-AtKC1 схлопываются при более высоких концентрациях K + , чем у гомомеров AKT1.Таким образом, гетеромеры составляют более эффективный блок прохода K + в неблагоприятном направлении наружу.
Кроме того, ассоциация CIPK23 с гетеромерным каналом AKT1-AtKC1 была предположена на основе анализа взаимодействия в дрожжах (Grefen and Blatt, 2012) наряду с влиянием белка SNARE SYP121, переносящего мембранные везикулы (Honsbein et al., 2009 г.). В отличие от CIPK23, SYP121 связывается только с α-субъединицей AtKC1, но не с α-субъединицей AKT1. Белки SNARE участвуют в нацеливании и слиянии пузырьков.Таким образом, транспорт K + регулируется не только посредством активности канала, но также посредством процессов мембранного переноса. Интересно, что уровень транскрипта AKT1 постоянен в различных условиях окружающей среды (Lagarde et al., 1996; Pilot et al., 2003). Но уровни экспрессии его регуляторов изменяются в зависимости от стимулов окружающей среды (Pilot et al., 2003, обзор: Batistic and Kudla, 2004; Tripathi et al., 2009).
Выпрямители наружу в корнях
ГОРК в корневых волосках
Наряду с внутренним выпрямляющим каналом K + AKT1, направленный наружу выпрямляющий канал K + GORK экспрессируется в эпидермальных клетках корня (Ивашикина и др., 2001). GORK активируется при деполяризации мембраны, и его выход зависит от внеклеточной концентрации K + . Изменения окружающей среды в окружении корневых волосков могут проявляться быстро, и в ответ мембрана деполяризуется (Càrdenas et al., 2000). GORK активируется в этих условиях и считается инициатором реполяризации мембраны. Контролируя мембранный потенциал и тургор корневых волосков, растение может реагировать на изменения окружающей среды, такие как отсутствие или обилие воды, которые вызывают изменения концентрации растворенных веществ и влияют на механическую стабильность и состояние гидратации корня.Кроме того, способность GORK воспринимать внеклеточную концентрацию K + , как предполагается, позволяет корневым волоскам воспринимать и гибко реагировать на содержание K + в почве.
Корень для связи через SKOR
K + транспортируется от корней к верхним частям растения через ксилему. Выпрямляющий наружу канал Shaker SKOR экспрессируется в перицикле и паренхиме ксилемы в корнях. SKOR был идентифицирован как транспортный белок, ответственный за загрузку K + в ксилему на основании открытия, что его разрушение сильно снижает содержание K + в побегах, в то время как содержание K + в корнях остается неизменным (Gaymard et al., 1998).
Помимо мембранного напряжения, SKOR модулируется внешней концентрацией K + . При наличии достаточного количества внешнего K + каналу требуется более высокое мембранное напряжение для открытия и, таким образом, сводится к минимуму риск использования в качестве нежелательного пути K + -притока. Такое поведение достигается за счет сложного взаимодействия между областью поры и последним трансмембранным доменом канала, который отвечает за окончательное открытие и закрытие канала. Когда внешняя концентрация K + высока, область пор является довольно жесткой и сильно взаимодействует с последним трансмембранным доменом канала.Как следствие, канал стабилизируется в закрытом состоянии. В условиях низкого внешнего K + область пор менее занята ионами K + . Как следствие, пора становится более гибкой и больше не взаимодействует с окружающими трансмембранными доменами. Открытие канала возможно с меньшим подводом энергии, то есть при меньшем положительном мембранном напряжении. Если последние трансмембранные домены перестраивают и разжимают путь проводимости, внутриклеточные ионы K + могут повторно войти в пору, стабилизировать ее в проницаемой конформации и, таким образом, активировать выходящий ток K + (механизмы распознавания K + был анимирован в дополнительном материале Johansson et al., 2006).
На распределениеK + также влияют факторы, которые участвуют в передаче сигналов стресса. Экспрессия SKOR подавляется абсцизовой кислотой (ABA). Было высказано предположение, что снижение высвобождения K + в ксилему в ответ на АБК может быть возможностью регулировать осмотические условия корнями в стрессовых ситуациях (Gaymard et al., 1998). Кроме того, внутри- и внеклеточное закисление отрицательно влияет на токи SKOR. Поскольку регуляция посредством АБК проявляется на уровне транскрипции, чувствительность к pH может быть дополнительным процессом для предотвращения потери K + от корней к ткани побега (Lacombe et al., 2000а).
Перекись водорода (H 2 O 2 ) оказывает противоположное действие на токи SKOR. Активные формы кислорода действуют как сигнал и регулятор в развитии растений и в ответ на стрессовые ситуации окружающей среды (Torres and Dangl, 2005; Gapper and Dolan, 2006). Обработка H 2 O 2 приводит к увеличению выходных токов SKOR и уменьшению его половины времени активации (Garcia-Mata et al., 2010). Это открытие указывает на связь между активными формами кислорода и разделением K + во время процессов развития и стрессовых реакций.
Расположение и извлечение флоэмы
После загрузки в ксилему K + циркулирует по всему растению. Там другие каналы K + способствуют дальнейшему распространению. Shaker -подобный калиевый канал AKT2 в основном экспрессируется в сосудистой ткани надземных частей и в замыкающих клетках растений. Однако он не экспрессируется до тех пор, пока растение не станет в значительной степени независимым от углеводов, содержащихся в семенах (Marten et al., 1999; Deeken et al., 2000; Lacombe et al., 2000b; Широки и др., 2001; Ивашкина и др., 2005).
Зарядка и использование калиевой батареи
Являясь единственным членом Shaker, подобным каналам в установках, AKT2 обладает уникальными канальными свойствами и может опосредовать как входящие, так и внешние токи K + . AKT2 фактически является специализированным внутренним выпрямляющим каналом, который можно превратить в не выпрямляющий канал. Он демонстрирует два режима стробирования, зависящих от статуса фосфорилирования, которые взаимно превращаются (Dreyer et al., 2001; Черель и др., 2002; Michard et al., 2005a, b). Нефосфорилированный AKT2 (режим 1) лишен своего внешнего компонента и ведет себя как внутренний выпрямляющий канал. Напротив, фосфорилированный AKT2 (режим 2) постоянно открыт и способен проводить K + как внутрь, так и наружу. Два остатка серина, расположенные рядом с внутриклеточной стороной канала, идентифицированы как мишени для фосфорилирования (Michard et al., 2005a). Тем не менее, предполагается, что двух фосфо-сериновых остатков одних недостаточно для полного преобразования AKT2 между его режимами.Sandmann et al. (2011) предложили скорее переход через каскад посттрансляционных (пока неизвестных) модификаций. Эта гипотеза подтверждается экспериментальными наблюдениями. Лизин в датчике напряжения позволяет AKT2 определять его статус фосфорилирования и переключаться между двумя режимами. Замена лизина на серин или аргинин сохраняет AKT2 в режиме внутреннего исправления 1 (Michard et al., 2005b; Sandmann et al., 2011).
Подводя итог, AKT2 может модулировать мембранное напряжение, переключаясь между режимами внутреннего и не выпрямляющего канала соответственно, а фосфорилирование действует как инструмент для точной настройки (Deeken et al., 2002; Michard et al., 2005a, b). Gajdanowicz et al. (2011) включили AKT2 в качестве центрального игрока в модель «калиевой батареи», в которой K + служит мобильным источником энергии в тканях сосудов. В исходных тканях растение вкладывает энергию, чтобы загрузить K + в клеточные комплексы ситовых элементов флоэмы. Затем загруженный калий циркулирует с потоком флоэмы. В условиях ограничения энергии канал AKT2 может переключаться из режима внутреннего выпрямления в режим без выпрямления и, таким образом, обеспечивает прохождение потока K + .Это, в свою очередь, позволяет использовать градиент K + между флоэмой и апопластом для перезагрузки фотоассимилятов во флоэму. Эта концепция «калиевой батареи» проиллюстрирована в дополнительном материале Gajdanowicz et al. (2011). Ограничивающие условия возникают, например, при нехватке АТФ или когда H + -АТФаза подавляется клеточными сигналами. Затем обычно используемый градиент H + дополняется градиентом K + . Помимо прослушивания «батареи», канал AKT2 также предлагает заряжать ее в зависимости от его фактического режима стробирования (Michard et al., 2005b).
Дальнейшие эффекты на AKT2
Было продемонстрировано, что в дополнение к модуляции стробирующего режима AKT2 действует на различные сигналы, участвующие в стрессовых ответах. Уровень экспрессии AKT2 увеличивается в присутствии ABA, света и ассимилятов CO 2 (Deeken et al., 2000; Lacombe et al., 2000b). В первую очередь влияние последних двух факторов привело к мнению, что AKT2 играет роль в транспорте флоэмы.
Макроскопические токи K + , опосредованные AKT2, модулируются изменениями внутреннего и внешнего pH и внешнего Ca 2+ (Marten et al., 1999; Lacombe et al., 2000b). В то время как внешний Ca 2+ блокирует входящие токи при отрицательных напряжениях в зависимости от напряжения, закисление с обеих сторон мембраны уменьшает токи AKT2 во всем диапазоне напряжений. Изменения pH и Ca 2+ не влияют на режим стробирования канала, что указывает на то, что H + и Ca 2+ влияют только на путь проникновения AKT2. Чувствительность AKT2 к Ca 2+ исследовали на замыкающих клетках.Ивашкина и др. (2005) показали в экспериментах на протопластах замыкающих клеток, что чувствительность к Ca 2+ каналов захвата K + коррелирует с присутствием субъединиц AKT2.
Недавно Held et al. (2011) продемонстрировали ассоциацию AKT2 с CIPK6 и CBL4 и влияние этой сборки на макроскопические токи AKT2. В отличие от комплексов AKT1-CIPK-CBL, события фосфорилирования in vitro пока не могут быть обнаружены. Held et al. поэтому предложено для этих находок зависимое от Ca 2+ нацеливание AKT2 на плазматическую мембрану, которое зависит исключительно от физического взаимодействия AKT2 с CIPK6 / CBL4, а не от регуляции канала посредством фосфорилирования.
Сторожевые клетки и их популяция канала K
+Две трети членов семейства каналов Shaker экспрессируются в замыкающих клетках. Помимо AKT2, здесь обнаруживаются также KAT1, KAT2, AKT1, AtKC1 и GORK, которые оказывают важное влияние на открытие и закрытие устьиц (Szyroki et al., 2001; Ivashikina et al., 2005; Lebaudy et al., 2008b). Обширные пути передачи сигналов координируют движение устьиц. В случае открытия устьиц они приводят к активации K в каналах и поглощению K + и анионов, что в конечном итоге приводит к увеличению тургора замыкающих клеток.При закрытии устьиц активируются каналы K из , K + высвобождается вместе с анионами, вода пассивно вытекает и тургор замыкающих клеток снижается. Недавние всеобъемлющие обзоры путей передачи сигналов, которые влияют на открытие и закрытие устьиц, были опубликованы Pandey et al. (2007) или Kim et al. (2010). На рис. 3 представлен обзор регуляции каналов K + , участвующих в движениях устьиц.
Фигура 3. Каналы K + в замыкающих клетках Arabidopsis и их эффекторах .Изменения мембранного потенциала приводят к открытию или закрытию устьиц соответственно. Гиперполяризация мембраны в ответ на активность H + -АТФазы активирует выпрямляющие внутрь каналы K + . Транскрипты KAT1, KAT2, AKT1, AKT2 и AtKC1 обнаруживаются в замыкающих клетках (Szyroki et al., 2001). Все эти субъединицы канала K + образуют гетеротетрамерные каналы, такие как KAT1-KAT2, AKT2-KAT2 и AKT1-AtKC1. Воздействие AKT1 и K в -AtKC1 на движение устьиц подробно не исследовалось.Подкисление напрямую влияет на токи через каналы K + в замыкающих ячейках. K в каналах активируется при внеклеточном закислении, тогда как токи через K слабые каналы уменьшаются. Кроме того, K слабый канал AKT2 отрицательно зависит от внеклеточного Ca 2+ . К тому же токи KAT1 модулируются внутриклеточным pH, АТФ и цГМФ. АТФ и цГМФ обладают антагонистическим действием. Более того, устьичные каналы K + подвергаются воздействию сигналов через каскады передачи сигналов.Сообщалось об эффектах 14-3-3 белков, Ca 2+ и киназ. С другой стороны, деполяризация мембраны, вызванная инактивацией H + -АТФаз и активацией анионных каналов, активирует K из канала GORK. На токи GORK положительно влияет внеклеточное и внутриклеточное подщелачивание. Кроме того, исследуется текущий усиливающий эффект H 2 O 2 . И на открытие, и на закрытие устьиц влияют фитогормоны.В то время как ауксин вызывает открытие устьиц, АБК тормозит их открытие, но вызывает закрытие устьиц. Сокращения: pH ac , подкисление; pH ba , подщелачивание.
Вариабельность каналов в замыкающих ячейках
Хотя KAT1 представляет собой доминантный K в канале замыкающих клеток, он не важен для открытия устьиц (Ichida et al., 1997; Kwak et al., 2001; Szyroki et al., 2001). Совместно экспрессируемый K в субъединицах канала AKT1, AKT2 и KAT2 способен компенсировать потерю KAT1.Паттерн экспрессии всех замыкающих клеток K в субъединицах канала не совсем идентичен, как показано на примерах KAT1 и KAT2. Обе субъединицы экспрессируются в замыкающих клетках. Но KAT1 экспрессируется только в замыкающих клетках листьев и черешков, тогда как KAT2 дополнительно экспрессируется в замыкающих клетках ствола (Nakamura et al., 1995; Pilot et al., 2001). Это указывает на различные доступные наборы каналов K + в зависимости от местоположения защитной соты. Кроме того, субъединицы канала K + способны образовывать гетеромерные каналы у растений (Dreyer et al., 1997; Lebaudy et al., 2008a). Для гетеротетрамеров KAT1-KAT2 было показано, что их основные свойства сходны со свойствами, наблюдаемыми для гомотетрамерных каналов KAT1 и KAT2 (Pilot et al., 2001; Lebaudy et al., 2010). Напротив, гетеротетрамер AKT2-KAT2 сочетает разные свойства своих родительских каналов и формирует новый функциональный тип канала K + (Xicluna et al., 2007). Стробирующие свойства гетеротетрамера унаследованы от AKT2, канала K + со слабым выпрямлением, описанного выше.Чувствительность к Ca 2+ и H + унаследована от KAT2. Таким образом, гетеромеры каналов K + вносят заметный вклад в увеличение вариабельности каналов и повышают регуляторные возможности каналов K + .
K
в каналах способствует устьичному открытиюДля активации K в каналах мембранный потенциал должен быть гиперполяризован. Гиперполяризация достигается за счет активности H + -АТФаз, которые транспортируют протоны из клетки при потреблении АТФ.Напряжение на мембране определяется датчиком внутреннего напряжения, который образован трансмембранными областями S1 – S4. Важную роль играют положительные заряды в S4 (рис. 1A). Четыре датчика напряжения канала вызывают конформационные изменения в белке, которые затем приводят к открытию пути проникновения. Эта чувствительность к напряжению модулируется другими факторами, которые взаимодействуют с канальным белком. Действительно, многие эксперименты показывают чувствительность замыкающей клетки K в каналах к изменениям pH (Hedrich et al., 1995; Хоши, 1995; Marten et al., 1999; Pilot et al., 2001; Xicluna et al., 2007). KAT1, KAT2 и гетеромерный KAT1-KAT2 активируются внеклеточным и внутриклеточным закислением из-за сдвига зависимости каналов от напряжения в сторону более положительных значений. Было высказано предположение, что остаток гистидина, консервативный среди растений K в каналах, который расположен в поре, определяет изменения pH в K в каналах (Hoth et al., 1997; Hoth and Hedrich, 1999). Для KST1, K в канале из замыкающих клеток картофеля, было показано, что этот гистидин является частью датчика pH.Удивительно, но мутации этого гистидина в KAT1 не повлияли на его зависимость от pH. Дальнейшее исследование показало, что KAT1 воспринимает изменения pH через сенсорное облако, а не через один остаток (Gonzalez et al., 2012). Кроме того, KAT1 также модулируется АТФ и цГМФ. В то время как цГМФ снижает токи КАТ1, АТФ положительно влияет на КАТ1. Таким образом, АТФ и цГМФ проявляют антагонистические эффекты (Hoshi, 1995).
Другим регулятором замыкающей клетки K в токах может быть внеклеточный Ca 2+ .Здесь AKT2 является единственным каналом, на который непосредственно влияет внешний Ca 2+ (Marten et al., 1999; Latz et al., 2007b). В то время как AKT2 блокируется Ca 2+ , KAT1, KAT2 и AKT1 не проявляют никакого ответа (Szyroki et al., 2001; Ivashikina et al., 2005; Brüggemann et al., 1999). Поэтому предполагается, что экспериментально наблюдаемая чувствительность замыкающей клетки K в каналах к внеклеточному Ca 2+ обеспечивается субъединицами AKT2 (Ivashikina et al., 2005).
Кроме того, было показано влияние регуляторных белков на KAT1.Например, KAT1 фосфорилируется Ca 2+ -зависимым образом в присутствии CDPK-a Ca 2+ -зависимой протеинкиназы с кальмодулин-подобным доменом (Li et al., 1998). В этом исследовании использовалась рекомбинантная CDPK из фасоли Vicia faba и не было показано, фосфорилируется ли KAT1 непосредственно CDPK или, скорее, киназа влияет на другие белки. Берковиц и др. (2000) в электрофизиологических экспериментах показали, что рекомбинантная CDPK отрицательно влияет на токи KAT1.Ca 2+ -зависимое фосфорилирование KAT1 дополнительно подтверждается исследованием, которое манипулировало протеинкиназой C (PKC), присутствующей в ооцитах X. laevis (Sato et al., 2010). При активации PKC, которая имеет такие же сайты-мишени, что и Ca 2+ -зависимые киназы растений, токи KAT1 снижаются. Кроме того, рекомбинантные белки 14-3-3 кукурузы стимулировали токи KAT1 (Sottocornola et al., 2006, 2008). Эти исследования дают первое представление о широком диапазоне возможных эффекторов каналов K + в замыкающих клетках.
Кроме того, было обнаружено, что популяция каналов внутри мембраны также подвергается регуляции (Mikosch et al., 2006, 2009; Sutter et al., 2006, 2007; Sieben et al., 2008; Reuff et al., 2010). Было показано, что KAT1 взаимодействует с белками SNARE (см. Выше), а ABA запускает эндоцитоз KAT1 из плазматической мембраны. Более того, мотив экспорта ER субъединиц KAT1 важен для правильной передачи каналов. Было показано, что эффективный экспорт KAT1 в ER зависит от кислотного мотива на С-конце.Следовательно, эндо- и экзоцитоз, а также экспорт в ER каналов K + могут быть другим уровнем для регулирования плотности каналов и токов K + через мембрану.
K
выход каналов при закрытии устьицK из каналов активируются при деполяризации. Такое изменение мембранного напряжения достигается за счет ингибирования H + -АТФазы и активации анионных каналов. GORK — единственный канал K из , идентифицированный в замыкающих клетках и отвечающий за закрытие устьиц (Szyroki et al., 2001; Hosy et al., 2003). В отличие от внутренних выпрямляющих каналов, токи GORK уменьшаются с уменьшением внутреннего и внешнего pH (Blatt, 1992; Ache et al., 2000). GORK также воспринимает внешнюю концентрацию K + , так что при более высоком внешнем K + ему требуется более высокое положительное напряжение для его активации (Ache et al., 2000). Аналогичная аналогия со SKOR может также иметь место для прямого взаимодействия GORK с сигнальной молекулой стресса H 2 O 2 . GORK и SKOR имеют общий остаток цистеина, который, как было показано, отвечает за эффект активации в SKOR (Garcia-Mata et al., 2010). Тем не менее, влияние H 2 O 2 на GORK и роль этой предполагаемой регуляции в физиологии замыкающих клеток еще предстоит изучить. Более ранние сообщения показали, что H 2 O 2 является важным игроком в устьичной передаче сигналов (обзор Wang and Song, 2008).
Наряду с активацией K из каналов во время закрытия устьиц, K в каналах деактивируется (Blatt, 1990; Thiel et al., 1992). Было показано, что нокаут-мутант K в канале AKT1 более устойчив к водному стрессу, чем растения дикого типа (Nieves-Cordones et al., 2012). Транспирация была уменьшена, а закрытие устьиц было более эффективным у растений с нокаутом, обработанных АБК. Таким образом, инактивация K в каналах способствует закрытию устьиц, но не является существенной для самого процесса закрытия (MacRobbie, 1998). Кроме того, можно было наблюдать очень похожие фенотипы растений с нокаутом akt1 и cipk23 , что указывает на регуляцию AKT1 с помощью CIPK23 также в замыкающих клетках, как это уже было показано для AKT1 в корнях.
Влияние фитогормонов
Фитогормоны ауксин и АБК оказывают противоположное действие на устьица.Ауксин участвует в процессах развития растений и способствует открытию устьиц, тогда как АБК участвует в различных ответных реакциях на стресс. Он предотвращает открытие и способствует закрытию устьиц (Gehring et al., 1990). Прямое влияние ABA на токи замыкающих клеток K + было показано Блаттом и Армстронгом (1993). Обработка ABA приводит к инактивации K в и активации K из каналов в замыкающих клетках. Хотя фитогормон влияет на уровень транскрипции канала K из GORK в корнях и побегах, уровень транскрипции в замыкающих клетках остается неизменным (Becker et al., 2003). Кроме того, электрофизиологические анализы исключают прямое влияние АБК на исходящие токи в замыкающих клетках. Следовательно, ABA, по-видимому, косвенно влияет на защитную ячейку K из токов. Поскольку сигналы ABA от корней приходят вместе с подщелачиванием цитоплазмы замыкающих клеток (Blatt and Armstrong, 1993), чувствительный к pH GORK может быть активирован и затронут ABA этим сигнальным путем на большом расстоянии (Blatt, 1992; Ache et al., 2000). ; Becker et al., 2003).
С другой стороны, ауксинстимулирует транскрипцию KAT1 и KAT2 (Philippar et al., 2004). Однако неясно, является ли эта стимуляция тканеспецифичной, как в случае GORK, или это общая черта этих K в генах каналов в различных частях растения.
Влияние на развитие пыльцевых трубок
The Shaker channel SPIK является основным K в канале в пыльце и экспрессируется исключительно там (Mouline et al., 2002; Zhao et al., 2013). Нарушение его отрицательно сказывается на росте пыльцевых трубок. Активность SPIK усиливается за счет снижения внешнего pH и отрицательно влияет на Ca 2+ -зависимые протеинкиназы CDPK11 и CDPK24.Ca 2+ влияет на K в токах только в пыльцевой трубке, но не в протопластах пыльцевого зерна. Было показано, что эффект Ca 2+ зависит от присутствия обеих киназ. При отсутствии одной из киназ Ca 2+ не может блокировать пыльцу K в токах . Zhao и его коллеги предполагают, что Ca 2+ отрицательно действует на SPIK посредством каскада киназ, в котором CDPK11 фосфорилирует CDPK24.
Выводы
Каналы K + важны для поглощения K + из почвы, его распределения в растении и процессов для поддержания и поддержки роста растений.Последние два десятилетия выявили важную информацию, особенно для каналов, подобных растению Shaker , относительно структуры, физиологической роли и — в меньшей степени — относительно их регуляции. Напротив, наши знания о каналах ТПК гораздо более рудиментарны. Задача будущего исследования каналов растений K + будет заключаться в выявлении сложных регуляторных сетей, которые регулируют их деятельность, и в понимании динамики этих сетей.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Эта работа была поддержана грантами испанского Министерства экономики и конкуренции (BFU2011-28815), грантом для карьерной интеграции Марии-Кюри (FP7-PEOPLE-2011-CIG № 303674 — Regopoc) и грантами Deutsche Forschungsgemeinschaft Инго Драйеру (DFG предоставляет DR430 / 8-1 и DR430 / 9-1). Трипти Шарма и Джанин Ридельсбергер были стипендиатами Международной исследовательской школы Макса Планка «Первичный метаболизм и рост растений».Авторы благодарны рецензентам за полезные комментарии.
Сокращения
ABA, абсцизовая кислота; АТФ, аденозинтрифосфат; CBL, кальциневрин B-подобный сенсор кальция; CDPK, Ca 2+ -зависимая протеинкиназа; цГМФ, циклический гуанозинмонофосфат; CIPK, протеинкиназа, взаимодействующая с CBL; ER, эндоплазматический ретикулум; GFP, зеленый флуоресцентный белок; P — пора; PKC, протеинкиназа C; PP2C, протеинфосфатаза 2C-типа; SNARE, растворимый рецептор белка прикрепления белка, чувствительного к N-этилмалеимиду; ТМ, трансмембранный; YFP, желтый флуоресцентный белок.
Сноски
Список литературы
Аче, П., Беккер, Д., Ивашкина, Н., Дитрих, П., Роэльфсема, М., и Хедрих, Р. (2000). GORK, выпрямитель с задержкой наружу, экспрессируемый в замыкающих клетках Arabidopsis thaliana , представляет собой K + -селективный, K + -чувствительный ионный канал. FEBS Lett . 486, 93–98. DOI: 10.1016 / S0014-5793 (00) 02248-1
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Алеман, Ф., Ньевес-Кордонес, М., Мартинес, В., и Рубио, Ф. (2011). Получение корня K + в растениях: модель Arabidopsis thaliana . Физиология растительных клеток . 52, 1603–1612. DOI: 10.1093 / pcp / pcr096
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Амтманн А., Арменгауд П. и Волков В. (2004). «Калиевое питание и солевой стресс», в Membrane Transport in Plants , ed M. R. Blatt (Oxford: Blackwell), 316–348.
Amtmann, A., Troufflard, S.и Арменгауд П. (2008). Влияние калийного питания на устойчивость растений к вредителям и болезням. Physiol. Завод . 133, 682–691. DOI: 10.1111 / j.1399-3054.2008.01075.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Андерсон, Дж. А., Хуприкар, С. С., Кочиан, Л. В., Лукас, В. Дж., И Габер, Р. Ф. (1992). Функциональная экспрессия вероятного калиевого канала Arabidopsis thaliana в Saccharomyces cerevisiae . Proc.Natl. Акад. Sci. США . 89, 3736–3740.
Pubmed Реферат | Pubmed Полный текст
Basset, M., Conejero, G., Lepetit, M., Fourcroy, P., and Sentenac, H. (1995). Организация и экспрессия гена, кодирующего транспортную систему калия AKT1 Arabidopsis thaliana . Завод Мол. Биол . 29, 947–958.
Pubmed Реферат | Pubmed Полный текст
Батистик, О., и Кудла, Дж. (2004). Интеграция и передача сигналов кальция через сеть сенсоров кальция CBL / протеинкиназ CIPK. Planta 219, 915–924. DOI: 10.1007 / s00425-004-1333-3
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Беккер Д., Гейгер Д., Дункель М. и Роллер А. (2004). AtTPK4, канал Arabidopsis с тандемными порами K + , способный контролировать напряжение на мембране пыльцы в зависимости от pH и Ca 2+ . Proc. Natl. Акад. Sci. США . 101, 15621–15626.
Pubmed Реферат | Pubmed Полный текст
Беккер, Д., Hoth, S., Ache, P., Wenkel, S., Roelfsema, M. R. G., Meyerhoff, O., et al. (2003). Регуляция АБК-чувствительного гена калиевого канала Arabidopsis GORK в ответ на водный стресс. FEBS Lett . 554, 119–126. DOI: 10.1016 / S0014-5793 (03) 01118-9
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Берковиц, Г., Чжан, X., Мерсье, Р., Ленг, К., и Лоутон, М. (2000). Совместная экспрессия кальций-зависимой протеинкиназы с направленным внутрь выпрямленным каналом K + KAT1 изменяет текущие параметры в ооцитах Xenopus laevis . Физиология растительных клеток . 41, 785–790. DOI: 10.1093 / pcp / 41.6.785
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Билер, Х., Эйнг, К., Хебайзен, С., Роллер, А., Чемпински, К., и Бертл, А. (2005). TPK1 представляет собой вакуумный ионный канал, отличный от медленного вакуолярного катионного канала. Физиология растений . 139, 417–424. DOI: 10.1104 / стр.105.065599
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Блатт, М. Р. (1990).Токи калиевых каналов в интактных замыкающих клетках устьиц: быстрое усиление абсцизовой кислотой. Planta 180, 445–455. DOI: 10.1007 / BF01160403
CrossRef Полный текст
Блатт, М. Р. (1992). K + каналы замыкающих клеток устьиц. Характеристики внутреннего выпрямителя и его регулирование по pH. J. Gen. Physiol . 99, 615–644.
Pubmed Реферат | Pubmed Полный текст
Блатт, М. Р., и Армстронг, Ф. (1993). K + каналы замыкающих клеток устьиц: вызванный абсцизовой кислотой контроль выпрямителя наружу, опосредованный цитоплазматическим pH. Planta 191, 330–341. DOI: 10.1007 / BF00195690
CrossRef Полный текст
Брюггеманн, Л., Дитрих, П., Дрейер, И., и Хедрих, Р. (1999). Выраженные различия между нативными каналами K + и гомомерами альфа-субъединиц KAT1 и KST1 замыкающих клеток. Planta 207, 370–376. DOI: 10.1007 / s004250050494
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Кабальеро, Ф., Ботелла, М. А., Рубио, Л., Фернандес, Дж.А., Мартинес В. и Рубио Ф. (2012). Система, чувствительная к Ca 2+ , опосредует низкоаффинное поглощение K + в отсутствие AKT1 у растений Arabidopsis . Физиология растительных клеток . 53, 2047–2059. DOI: 10,1093 / pcp / шт140
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Карденас, Л., Холдэуэй-Кларк, Т. Л., Сайнчес, Ф., Куинто, К., Фейджой, Дж. А., Кункель, Дж. Г. и др. (2000). Ионные изменения корневых волосков бобовых растений в ответ на Nod-факторы. Физиология растений . 123, 443–452. DOI: 10.1104 / стр.123.2.443
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Шерель И., Мишар Э., Платет Н., Мулин К., Алкон К., Сентенак Х. и др. (2002). Физическое и функциональное взаимодействие канала AKT2 Arabidopsis K + и фосфатазы AtPP2CA. Растительная клетка 14, 1133–1146. DOI: 10.1105 / tpc.000943
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Чанрой, С., Ван Г., Венема К., Чжан М. В., Делвиче К. Ф. и Сзе Х. (2012). Консервативные и диверсифицированные генные семейства антипортеров одновалентных катионов / H + от водорослей к цветковым растениям. Фронт. Завод Sci . 3:25. DOI: 10.3389 / fpls.2012.00025
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Chempinski, K., Frachisse, J.-M., Maurel, C., Barbier-Brygoo, H., and Mueller-Roeber, B. (2002). Локализация в вакуолярной мембране «двухпорового» канала Arabidopsis K + KCO1. Завод J . 29, 809–820. DOI: 10.1046 / j.1365-313X.2002.01260.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Chempinski, K., Gaedeke, N., Zimmermann, S., and Muĺller-Roĺber, B. (1999). Молекулярные механизмы и регуляция ионных каналов растений. J. Exp. Бот . 50, 955–966.
Chempinski, K., Zimmermann, S., Ehrhardt, T., and Muĺller-Roĺber, B. (1997). Новая структура и функция в каналах установки K + : KCO1, выпрямитель наружу с крутой зависимостью от Ca 2+ . EMBO J . 16, 2565–2575. DOI: 10.1093 / emboj / 16.10.2565
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Дикен Р., Гейгер Д., Фромм Дж., Королева О., Аче П., Лангенфельд-Хейзер Р. и др. (2002). Потеря калиевого канала AKT2 / 3 влияет на загрузку сахара во флоэму Arabidopsis . Planta 216, 334–344. DOI: 10.1007 / s00425-002-0895-1
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Дикен, Р., Ивашкина, Н., Цирджак, Т., Филиппар, К., Беккер, Д., Аче, П. и др. (2003). В развитии опухоли Arabidopsis thaliana участвует Shaker -подобный K + каналы AKT1 и AKT2 / 3. Завод J . 34, 778–787. DOI: 10.1046 / j.1365-313X.2003.01766.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Deeken, R., Sanders, C., Ache, P., and Hedrich, R. (2000). Развитие и светозависимая регуляция локализованного во флоэме канала K + Arabidopsis thaliana . Завод J . 23, 285–290. DOI: 10.1046 / j.1365-313x.2000.00791.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Деннисон, К. Л., Робертсон, В. Р., Льюис, Б. Д., Хирш, Р. Е., Сассман, М. Р., и Сполдинг, Э. П. (2001). Функции калиевых каналов AKT1 и AKT2 определены исследованиями одиночных и двойных мутантов Arabidopsis . Физиология растений . 127, 1012–1019. DOI: 10.1104 / pp.010193
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Дрейер, И., Antunes, S., Hoshi, T., Muĺller-Roĺber, B., Palme, K., Pongs, O., et al. (1997). Растение K + -канальные альфа-субъединицы собираются без разбора. Biophys. J . 72, 2143–2150.
Pubmed Реферат | Pubmed Полный текст
Дрейер И., Хоро К., Лемайле Г., Циммерманн С., Буш Д. Р., Родригес-Наварро А. и др. (1999). Идентификация и характеристика переносчиков растений. J. Exp. Бот . 50, 1073–1087.
Дрейер, И., Михард, Э., Лакомб Б. и Тибо Дж. Б. (2001). В устройстве Shaker , подобном каналу K + , происходит переключение между двумя отдельными режимами стробирования, что приводит либо к выпрямлению внутрь, либо к току утечки. FEBS Lett . 505, 233–239. DOI: 10.1016 / S0014-5793 (01) 02832-0
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Дрейер И., Пори Ф., Шнайдер А., Миттельштадт Дж., Бертл А., Сентенак Х. и др. (2004). Сборка установки Shaker -подобного K из каналов требует двух различных участков альфа-субъединицы канала. Biophys. J . 87, 858–872.
Pubmed Реферат | Pubmed Полный текст
Duby, G., Hosy, E., Fizames, C., Alcon, C., Costa, A., Sentenac, H., et al. (2008). В KC1, условно нацеленная субъединица типа Shaker , регулирует активность каналов K + растения. Завод J . 53, 115–123. DOI: 10.1111 / j.1365-313X.2007.03324.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Дункель, М., Латц, А., Шумахер, К., Мюллер, Т., Беккер, Д., и Хедрих, Р. (2008). Нацеливание на членов семейства каналов TPK, локализованных в вакуолярной мембране. Мол. Завод 1, 938–949.
Pubmed Реферат | Pubmed Полный текст
Эрхардт Т., Циммерманн С. и Мюллер-Ребер Б. (1997). Ассоциация растения K + в каналах опосредуется консервативными С-концами и не влияет на сборку субъединиц. FEBS Lett . 409, 166–170. DOI: 10.1016 / S0014-5793 (97) 00502-4
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Гайданович, П.а, Л. Г. Г., Рамирез-Агилар, С. Дж. и др. (2011). Градиенты калия (K + ) служат мобильным источником энергии в тканях сосудов растений. Proc. Natl. Акад. Sci. США . 108, 864–869.
Pubmed Реферат | Pubmed Полный текст
Гарсия-Мата, К., Ван, Дж., Гайданович, П., Гонсалес, В., Хиллс, А., Дональд, Н., и др. (2010). Минимальный цистеиновый мотив, необходимый для активации канала SKOR K + в Arabidopsis с помощью активных форм кислорода H 2 O 2 . J. Biol. Chem . 285, 29286–29294.
Pubmed Реферат | Pubmed Полный текст
Gaymard, F., Pilot, G., Lacombe, B., Bouchez, D., Bruneau, D., Boucherez, J., et al. (1998). Идентификация и разрушение растительного Shaker -подобного внешнего канала, участвующего в высвобождении K + в ксилемный сок. Ячейка 94, 647–655. DOI: 10.1016 / S0092-8674 (00) 81606-2
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Геринг, К.А., Ирвинг Х. Р. и Пэриш Р. У. (1990). Влияние ауксина и абсцизовой кислоты на цитозольный кальций и pH в растительных клетках. Proc. Natl. Акад. Sci. США . 87, 9645–9649.
Pubmed Реферат | Pubmed Полный текст
Geiger, D., Becker, D., Vosloh, D., Gambale, F., Palme, K., Rehers, M., et al. (2009). Heteromeric At каналы KC1-AKT1 в корнях Arabidopsis способствуют росту в условиях, ограничивающих K + . J. Biol. Chem .284, 21288–21295.
Pubmed Реферат | Pubmed Полный текст
Gierth, M., Maser, P., and Schroeder, J. I. (2005). Переносчик калия At HAK5 функционирует в индуцированном депривацией K + высокоаффинном захвате K + и вкладе каналов AKT1 K + в кинетику поглощения K + в корнях Arabidopsis . Физиология растений . 137, 1105–1114. DOI: 10.1104 / стр.104.057216
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Гирт, М., и Мазер, П. (2007). Переносчики калия в растениях — участие в приобретении, перераспределении и гомеостазе K + . FEBS Lett . 581, 2348–2356. DOI: 10.1016 / j.febslet.2007.03.035
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Гоберт А., Исаенков С., Фелькер К., Чемпински К. и Маатуис Ф. Дж. М. (2007). Ген TPK1 канала с двумя порами кодирует вакуолярную проводимость K + и играет роль в гомеостазе K + . Proc. Natl. Акад. Sci. США . 104, 10726–10731.
Pubmed Реферат | Pubmed Полный текст
Gomez-Porras, J. L., Riaño-Pachón, D. M., Benito, B., Haro, R., Sklodowski, K., Rodriguez-Navarro, A., et al. (2012). Филогенетический анализ переносчиков K + у мохообразных, ликофитов и цветковых растений указывает на специализацию сосудистых растений. Фронт. Завод Sci . 3: 167. DOI: 10.3389 / fpls.2012.00167
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Гонсалес, В., Riedelsberger, J., Morales-Navarro, S.E., Caballero, J., Alzate-Morales, J.H., Gonzaìlez-Nilo, F. D., et al. (2012). Датчик pH растительного канала поглощения K + KAT1 построен из сенсорного облака, а не из отдельных ключевых аминокислот. Biochem. J . 442, 57–63.
Pubmed Реферат | Pubmed Полный текст
Грефен, К., Блатт, М. Р. (2012). Взаимодействуют ли кальциневрин B-подобные белки независимо от серин-треонинкиназы CIPK23 с K + каналом AKT1? Уроки, извлеченные из meìnage aÌ trois. Физиология растений . 159, 915–919. DOI: 10.1104 / стр.112.198051
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Грефен К., Чен З., Хонсбейн А., Дональд Н., Хиллс А. и Блатт М. Р. (2010). Новый мотив, необходимый для взаимодействия SNARE с каналом K + KC1 и стробирования канала в Arabidopsis . Растительная клетка 22, 3076–3092. DOI: 10.1105 / tpc.110.077768
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Хамамото, С., Маруи, Дж., Мацуока, К., Хигаси, К., Игараси, К., Накагава, Т. и др. (2008a). Характеристика канала K + табака TPK-типа как нового канала тонопласта K + с использованием дрожжевых тонопластов. J. Biol. Chem . 283, 1911–1920.
Pubmed Реферат | Pubmed Полный текст
Хамамото, С., Ябэ, И., и Уодзуми, Н. (2008b). Электрофизиологические свойства NtTPK1, экспрессируемого в тонопласте дрожжей. Biosci. Biotechnol. Биохим . 72, 2785–2787.
Pubmed Реферат | Pubmed Полный текст
Hedrich, R., Moran, O., Conti, F., Busch, H., Becker, D., Gambale, F., et al. (1995). Калиевые каналы внутреннего выпрямителя у растений отличаются от своих собратьев у животных реакцией на модуляторы напряжения и каналов. Eur. Биофиз. J . 24, 107–115.
Pubmed Реферат | Pubmed Полный текст
Held, K., Pascaud, F., Eckert, C., Gajdanowicz, P., Hashimoto, K., Corratgeì-Faillie, C., et al. (2011). Кальций-зависимая модуляция и нацеливание на плазматическую мембрану калиевого канала AKT2 с помощью комплекса сенсор кальция / протеинкиназы CBL4 / CIPK6. Ячейка Res . 21, 1116–1130. DOI: 10.1038 / cr.2011.50
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Honsbein, A., Sokolovski, S., Grefen, C., Campanoni, P., Pratelli, R., Paneque, M., Chen, Z., et al. (2009). Трехсторонний комплекс каналов SNARE-K + обеспечивает зависимое от каналов питание K + у Arabidopsis . Растительная клетка 21, 2859–2877. DOI: 10.1105 / tpc.109.066118
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Хоши, Т.(1995). Регулирование зависимости канала KAT1 от напряжения внутриклеточными факторами. J. Gen. Physiol . 105, 309–328.
Pubmed Реферат | Pubmed Полный текст
Hosy, E., Vavasseur, A., Mouline, K., Dreyer, I., Gaymard, F., Poree, F., et al. (2003). Arabidopsis наружу K + канал GORK участвует в регуляции движений устьиц и транспирации растений. Proc. Natl. Акад. Sci. США . 100, 5549–5554.
Pubmed Реферат | Pubmed Полный текст
Хот, С., Дрейер, И., Дитрих, П., Беккер, Д., Мюллер-Ребер, Б., и Хедрих, Р. (1997). Молекулярная основа растительной кислотной активации каналов поглощения K + . Proc. Natl. Акад. Sci. США . 94, 4806–4810.
Pubmed Реферат | Pubmed Полный текст
Хот, С., и Хедрих, Р. (1999). Определенные молекулярные основания для pH-чувствительности замыкающей клетки K + каналы KST1 и KAT1. J. Biol. Chem . 274, 11599–11603.
Pubmed Реферат | Pubmed Полный текст
Ичида, А.М., Пей, З. М., Байзабал-Агирре, В. М., Тернер, К. Дж., И Шредер, Дж. И. (1997). Экспрессия канала K + устойчивой к Cs + замыкающей клетки обеспечивает устойчивое к Cs + светоиндуцированное открытие устьиц у трансгенного Arabidopsis . Растительная клетка 9, 1843–1857.
Pubmed Реферат | Pubmed Полный текст
Исаенков, С., Иснер, Дж. К., Маатуис, Ф. Дж. (2011a). Рисовые двухпоровые каналы K + экспрессируются в различных типах вакуолей. Растительная клетка 23, 756–768.
Pubmed Реферат | Pubmed Полный текст
Исаенков, С., Иснер, Дж. К., и Маатуис, Ф. Дж. (2011b). Разнообразие мембранной локализации каналов ТПК и их физиологическая роль. Сигнальное поведение предприятия . 6, 1201–1204.
Pubmed Реферат | Pubmed Полный текст
Исаенков, С., Маатуис, Ф. Дж. (2013). Arabidopsis thaliana вакуолярных ТПК каналов образуют функциональные пути захвата K + в Escherichia coli . Завод Сигнал. Поведение . 8, e24665.
Pubmed Реферат | Pubmed Полный текст
Ивашкина Н., Беккер Д., Аче П., Мейерхофф О., Фелле Х. Х. и Хедрих Р. (2001). K + профиль канала и электрические свойства корневых волосков Arabidopsis . FEBS Lett . 508, 463–469. DOI: 10.1016 / S0014-5793 (01) 03114-3
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ивашкина, Н., Дикен, Р., Фишер, С., Аче, П., и Хедрих, Р. (2005). Субблоки AKT2 / 3 делают каналы защитной ячейки K + Ca 2+ чувствительными. J. Gen. Physiol . 125, 483–492.
Pubmed Реферат | Pubmed Полный текст
Jeanguenin, L., Alcon, C., Duby, G., Boeglin, M., Chèrel, I., Gaillard, I., et al. (2011). At KC1 является общим модулятором активности каналов Arabidopsis внутрь Shaker . Завод J . 67, 570–582. DOI: 10.1111 / j.1365-313X.2011.04617.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Johansson, I., Wulfetange, K., Poree, F., Michard, E., Gajdanowicz, P., Lacombe, B., et al. (2006). Внешний K + модулирует активность калиевого канала SKOR Arabidopsis посредством необычного механизма. Завод J . 46, 269–281. DOI: 10.1111 / j.1365-313X.2006.02690.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ким, Т. Х., Бёмер, М., Ху, Х., Нисимура, Н., Шредер, Дж. И. (2010). Сеть передачи сигналов охранных клеток: успехи в понимании передачи сигналов абсцизовой кислоты, CO 2 и Ca 2+ . Annu. Ред. Завод Биол . 61, 561–591. DOI: 10.1146 / annurev-arplant-042809-112226
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Квак, Дж. М., Мурата, Ю., Байзабал-Агирре, В. М., Меррилл, Дж., Ван, М., Кемпер, А. и др. (2001). Мутанты по каналу K + доминантных отрицательных замыкающих клеток снижают выпрямляющие внутрь токи K + и индуцированное светом открытие устьиц у Arabidopsis . Физиология растений . 127, 473–485. DOI: 10.1104 / pp.010428
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Lacombe, B., Pilot, G., Gaymard, F., Sentenac, H., and Thibaud, J. B. (2000a). Контроль PH растения внешне-выпрямляющим калиевым каналом СКОР. FEBS Lett . 466, 351–354.
Pubmed Реферат | Pubmed Полный текст
Lacombe, B., Pilot, G., Michard, E., Gaymard, F., Sentenac, H., and Thibaud, J. B. (2000b). Shaker -подобный канал K + со слабой ректификацией экспрессируется как в исходных, так и в тонких тканях флоэмы Arabidopsis . Растительная клетка 12, 837–851.
Pubmed Реферат | Pubmed Полный текст
Lagarde, D., Basset, M., Lepetit, M., Conejero, G., Gaymard, F., Astruc, S., et al. (1996). Тканеспецифическая экспрессия гена Arabidopsis AKT1 согласуется с ролью в питании K + . Завод J . 9, 195–203. DOI: 10.1046 / j.1365-313X.1996.095.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Lan, W.-Z., Lee, S.-C., Че, Ю.-Ф., Цзян, Ю.-К., и Луан, С. (2011). Механистический анализ регуляции AKT1 посредством взаимодействий CBL-CIPK-PP2CA. Мол. Завод 4, 527–536.
Pubmed Реферат | Pubmed Полный текст
Латц А., Беккер Д., Хекман М., Мюллер Т., Бейл Д., Мартен И. и др. (2007a). TPK1, Ca 2+ -регулируемый двухпоровый канал вакуоли Arabidopsis K + активируется 14–3–3 белками. Завод J . 52, 449–459.
Pubmed Реферат | Pubmed Полный текст
Латц, А., Ивашкина, Н., Фишер, С., Аче, П., Сано, Т., Беккер, Д. и др. (2007b). Субъединицы AKT2 планта образуют pH- и Ca 2+ -чувствительный внутренний выпрямляющий канал K + . Planta 225, 1179–1191.
Pubmed Реферат | Pubmed Полный текст
Lebaudy, A., Hosy, E., Simonneau, T., Sentenac, H., Thibaud, J., and Dreyer, I. (2008a). Гетеромерные каналы K + в растениях. Завод J . 54, 1076–1082.
Pubmed Реферат | Pubmed Полный текст
Лебауди, А., Vavasseur, A., Hosy, E., Dreyer, I., Leonhardt, N., Thibaud, J.-B., et al. (2008b). Адаптация растений к изменяющимся условиям окружающей среды и производство биомассы сильно зависят от калиевых каналов замыкающих клеток. Proc. Natl. Акад. Sci. США . 105, 5271–5276.
Pubmed Реферат | Pubmed Полный текст
Lebaudy, A., Pascaud, F., Veìry, A.-A., Alcon, C., Dreyer, I., Thibaud, J.-B., et al. (2010). Предпочтительная гетеромеризация KAT1-KAT2 определяет текущие свойства внутреннего K + в замыкающих клетках Arabidopsis . J. Biol. Chem . 285, 6265–6274.
Pubmed Реферат | Pubmed Полный текст
Ли, С. К., Лан, З.-З., Ким, Б.-Г., Ли, Л., Чеонг, Ю. Х., Панди, Г. К. и др. (2007). Сеть фосфорилирования / дефосфорилирования белков регулирует калиевый канал растений. Proc. Natl. Акад. Sci. США . 104, 15959–15964.
Pubmed Реферат | Pubmed Полный текст
Ли, Р. А., и Вин Джонс, Р. Г. (1984). Гипотеза, связывающая критические концентрации калия для роста с распределением и функциями этого иона в растительной клетке. Новый Фитол . 97, 1–13. DOI: 10.1111 / j.1469-8137.1984.tb04103.x
CrossRef Полный текст
Ли Дж., Ли Й. Дж. И Ассманн С. М. (1998). Защитные клетки обладают кальций-зависимой протеинкиназой, которая фосфорилирует калиевый канал KAT1. Физиология растений . 116, 785–795. DOI: 10.1104 / стр.116.2.785
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ли, Л., Ким, Б.-Г., Чеонг, Ю. Х., Пандей, Г. К., и Луан, С. (2006).Сигнальный путь Ca 2+ регулирует канал K + для ответа низкого K в Arabidopsis . Proc. Natl. Акад. Sci. США . 103, 12625–12630.
Pubmed Реферат | Pubmed Полный текст
MacRobbie, E.A.C. (1998). Передача сигналов и ионные каналы в замыкающих клетках. Philos. Пер. R. Soc. Лондон. В . 353, 1475–1488.
Pubmed Реферат | Pubmed Полный текст
Maitrejean, M., Wudick, M. M., Voelker, C., Prinsi, B., Mueller-Roeber, B., Chempinski, K., et al. (2011). Сборка и сортировка калиевого канала тонопласта At TPK1 и его оборот путем интернализации в вакуоль. Физиология растений . 156, 1783–1796. DOI: 10.1104 / стр.111.177816
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Марсель Д., Мюллер Т., Хедрих Р. и Гейгер Д. (2010). K + транспортные характеристики тандемно-порового канала плазматической мембраны TPK4 и поровых химер с их вакуолярными гомологами. письма ФВБ 584, 2433–2439. DOI: 10.1016 / j.febslet.2010.04.038
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Маршнер, Х. (2012). Минеральное питание высших растений . Лондон: Academic Press.
Мартен И., Хот С., Дикен Р., Аче П., Кетчум К. А., Хоши Т. и др. (1999). AKT3, локализованный во флоэме канал K + , блокируется протонами. Proc. Natl. Акад. Sci. США . 96, 7581–7586.
Pubmed Реферат | Pubmed Полный текст
Mäser, P., Thomine, S., Schroeder, J., Ward, J., Hirschi, K., Sze, H., et al. (2001). Филогенетические отношения внутри семейств переносчиков катионов Arabidopsis . Физиология растений . 126, 1646–1667. DOI: 10.1104 / стр.126.4.1646
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Мишар Э., Драйер И., Лакомб Б., Сентенак Х. и Тибо Ж.-Б. (2005a). Внутреннее выпрямление канала AKT2 отменяется зависимым от напряжения фосфорилированием. Завод J .44, 783–797.
Pubmed Реферат | Pubmed Полный текст
Michard, E., Lacombe, B., Poreìe, F., Mueller-Roeber, B., Sentenac, H., Thibaud, J.-B., et al. (2005b). Уникальный датчик напряжения сенсибилизирует калиевый канал AKT2 к фосфорегуляции. J. Gen. Physiol . 126, 605–617.
Pubmed Реферат | Pubmed Полный текст
Mikosch, M., Hurst, A.C., Hertel, B., and Homann, U. (2006). Диацидный мотив необходим для эффективного транспорта K + канала KAT1 к плазматической мембране. Физиология растений . 142, 923–930. DOI: 10.1104 / стр.106.087064
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Микош, М., Кеберих, К., и Хоманн, У. (2009). Экспорт KAT1 в ER коррелирует с количеством кислотных остатков в трехкислом мотиве. Трафик 10, 1481–1487. DOI: 10.1111 / j.1600-0854.2009.00962.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Мулин, К., Вейри, А.-А., Гаймар, Ф., Бушерез, Дж., Pilot, G., Devic, M., et al. (2002). Развитие пыльцевых трубок и конкурентоспособность ухудшаются из-за нарушения канала Shaker K + в Arabidopsis . Гены Дев . 16, 339–350. DOI: 10.1101 / gad.213902
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Накамура, Р. Л., МакКендри, В. Л., Хирш, Р. Э., Седбрук, Дж. К., Габер, Р. Ф. и Сассман, М. Р. (1995). Экспрессия гена калиевого канала Arabidopsis в замыкающих клетках. Физиология растений . 109, 371–374. DOI: 10.1104 / стр.109.2.371
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ньевес-Кордонес, М., Кабальеро, Ф., Мартинес, В., и Рубио, Ф. (2012). Нарушение канала AKT1 Arabidopsis thaliana , направленного внутрь выпрямителя, K + , улучшает реакцию растений на водный стресс. Физиология растительных клеток . 53, 423–432. DOI: 10.1093 / pcp / pcr194
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Филиппар, К., Büchsenschutz, K., Abshagen, M., Fuchs, I., Geiger, D., Lacombe, B., et al. (2003). Канал K + KZM1 опосредует захват калия флоэмой и замыкающими клетками травы C4 Zea mays . J. Biol. Chem . 278, 16973–16981.
Pubmed Реферат | Pubmed Полный текст
Филиппар, К., Ивашкина, Н., Аче, П., Кристиан, М., Лютен, Х., Пальме, К. и др. (2004). Ауксин активирует KAT1 и KAT2, два гена канала K + , экспрессируемые в проростках Arabidopsis thaliana . Завод J . 37, 815–827. DOI: 10.1111 / j.1365-313X.2003.02006.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Pilot, G., Gaymard, F., Mouline, K., Chèrel, I., and Sentenac, H. (2003). Регулируемая экспрессия генов каналов Arabidopsis Shaker K + , участвующих в захвате и распределении K + в растении. Завод Мол. Биол . 51, 773–787.
Pubmed Реферат | Pubmed Полный текст
Пилот, Г., Lacombe, B., Gaymard, F., Cherel, I., Boucherez, J., Thibaud, J. B., et al. (2001). Активность внутреннего канала K + защитной клетки в Arabidopsis включает экспрессию субъединиц двойного канала KAT1 и KAT2. J. Biol. Chem . 276, 3215–3221.
Pubmed Реферат | Pubmed Полный текст
Pyo, Y. J., Gierth, M., Schroeder, J. I., and Cho, M.H. (2010). Высокоаффинный транспорт K + в Arabidopsis : At HAK5 и AKT1 жизненно важны для укоренения проростков и роста после прорастания в условиях низкого содержания калия. Физиология растений . 153, 863–875. DOI: 10.1104 / стр.110.154369
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Rajan, S., Preisig-Muller, R., Wischmeyer, E., Nehring, R., Hanley, P.J., Renigunta, V., et al. (2002). Взаимодействие с белками 14-3-3 способствует функциональной экспрессии калиевых каналов TASK-1 и TASK-3. Дж. Физиол . 545, 13–26. DOI: 10.1113 / jphysiol.2002.027052
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Рейнтанц, Б., Szyroki, A., Ivashikina, N., Ache, P., Godde, M., Becker, D., et al. (2002). В KC1 молчащая альфа-субъединица калиевого канала Arabidopsis модулирует приток K + корневых волосков. Proc. Natl. Акад. Sci. США . 99, 4079–4084.
Pubmed Реферат | Pubmed Полный текст
Ren, X.-L., Qi, G.-N., Feng, H.-Q., Zhao, S., Zhao, S.-S., Wang, Y., et al. (2013). Кальциневрин B-подобный белок CBL10 напрямую взаимодействует с AKT1 и модулирует гомеостаз K + в Arabidopsis . Завод J . 74, 258–266. DOI: 10.1111 / tpj.12123
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Rocchetti, A., Sharma, T., Wulfetange, C., Scholz-Starke, J., Grippa, A., Carpaneto, A., et al. (2012). Предполагаемая субъединица канала K + At KCO3 образует стабильные димеры в Arabidopsis . Фронт. Завод Sci . 3: 251. DOI: 10.3389 / fpls.2012.00251.
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Рубио, Ф., Алеман, Ф., Ньевес-Кордонес, М., и Мартинез, В. (2010). Исследования ArabidopsisAt HAK5, At двойных мутантов AKT1 раскрывают диапазон концентраций, при котором At HAK5, At AKT1 и неизвестные системы опосредуют поглощение K. Physiol. Завод . 139, 220–228. DOI: 10.1111 / j.1399-3054.2010.01354.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Рубио, Ф., Ньевес-Кордонес, М., Алеман, Ф., и Мартинез, В. (2008).Относительный вклад At HAK5 и At AKT1 в поглощение K + в высокоаффинном диапазоне концентраций. Physiol. Завод 134, 598–608. DOI: 10.1111 / j.1399-3054.2008.01168.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Sandmann, M., Skłodowski, K., Gajdanowicz, P., Michard, E., Rocha, M., Gomez-Porras, J. L., et al. (2011). K + , регулирующий батарею, Arabidopsis K + канал AKT2 находится под контролем нескольких посттрансляционных этапов. Завод Сигнал. Поведение . 6, 558–562.
Pubmed Реферат | Pubmed Полный текст
Сато А., Гамбале Ф., Драйер И. и Уодзуми Н. (2010). Модуляция канала KAT1 Arabidopsis активатором протеинкиназы C в ооцитах Xenopus laevis . FEBS J . 277, 2318–2328. DOI: 10.1111 / j.1742-4658.2010.07647.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Шахтман, Д. П., Шредер, Дж. И., Лукас, У. Дж., Андерсон, Дж. А., и Габер, Р. Ф. (1992). Экспрессия внутреннего выпрямляющего калиевого канала кДНК Arabidopsis KAT1. Наука 258, 1654–1658. DOI: 10.1126 / science.8966547
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Schönknecht, G., Spoormaker, P., Steinmeyer, R., Brüggemann, L., Ache, P., Dutta, R., et al. (2002). KCO1 является компонентом ионного канала медленного вакуума (SV). FEBS Lett . 511, 28–32.DOI: 10.1016 / S0014-5793 (01) 03273-2
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Шредер, Дж. И., Уорд, Дж. М., и Гассманн, В. (1994). Перспективы физиологии и структуры внутренних выпрямляющих каналов K + у высших растений: биофизические последствия для захвата K + . Annu. Rev. Biophys. Biomol. Struc . 23, 441–471.
Pubmed Реферат | Pubmed Полный текст
Sentenac, H., Bonneaud, N., Minet, M., Lacroute, F., Salmon, J.M., Gaymard, F., et al. (1992). Клонирование и экспрессия в дрожжах системы транспорта ионов калия растений. Наука 256, 663–665. DOI: 10.1126 / science.1585180
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Зибен, К., Микош, М., Брандици, Ф., и Хоманн, У. (2008). Взаимодействие K + -канала KAT1 с покрывающим компонентом Sec24 комплекса белков оболочки II зависит от дикислотного мотива экспорта эндоплазматического ретикулума. Завод J . 56, 997–1006. DOI: 10.1111 / j.1365-313X.2008.03658.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Sottocornola, B., Gazzarrini, S., Olivari, C., Romani, G., Valbuzzi, P., Thiel, G., et al. (2008). Белки 14-3-3 регулируют калиевый канал KAT1 двойным образом. Завод Биол . 10, 231–236. DOI: 10.1111 / j.1438-8677.2007.00028.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Соттокорнола, Б., Visconti, S., Orsi, S., Gazzarrini, S., Giacometti, S., Olivari, C., et al. (2006). Калиевый канал KAT1 активируется белками 14-3-3 растений и животных. J. Biol. Chem . 281, 35735–35741.
Pubmed Реферат | Pubmed Полный текст
Сполдинг, Э. П., Хирш, Р. Э., Льюис, Д. Р., Ци, З., Сассман, М. Р., и Льюис, Б. Д. (1999). Поглощение калия, поддерживающее рост растений при отсутствии активности канала AKT1: ингибирование аммонием и стимуляция натрием. J. Gen. Physiol . 113, 909–918.
Pubmed Реферат | Pubmed Полный текст
Саттер, Дж. У., Кампанони, П., Тиррелл, М., и Блатт, М. Р. (2006). Избирательная подвижность и чувствительность к SNAREs демонстрирует канал Arabidopsis KAT1 K + на плазматической мембране. Растительная клетка 18, 935–954. DOI: 10.1105 / tpc.105.038950
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Саттер, Ж.-У., Зибен, К., Хартель, А., Эйзенах, К., Тиль, Г., и Блатт, М. Р. (2007). Абсцизовая кислота запускает эндоцитоз канала Arabidopsis KAT1 K + и его рециркуляцию в плазматическую мембрану. Curr. Биол . 17, 1396–1402.
Pubmed Реферат | Pubmed Полный текст
Широки А., Ивашкина Н., Дитрих П., Роэльфсема М. Р., Аче П., Рейнтанц Б. и др. (2001). KAT1 не важен для открытия устьиц. Proc. Natl. Акад. Sci. США .98, 2917–2921.
Pubmed Реферат | Pubmed Полный текст
Тиль, Г., МакРобби, Э.А.С., и Блатт, М.Б. (1992). Мембранный транспорт в замыкающих клетках устьиц: важность контроля напряжения. J. Membr. Биол . 126, 1–18.
Pubmed Реферат | Pubmed Полный текст
Торрес, М.А., и Дангл, Дж. Л. (2005). Функции оксидазы респираторного взрыва в биотических взаимодействиях, абиотическом стрессе и развитии. Curr. Opin. Завод Биол . 8, 397–403.
Pubmed Реферат | Pubmed Полный текст
Трипати В., Парасураман Б., Лакшми А. и Чаттопадхьяй Д. (2009). CIPK6, протеинкиназа, взаимодействующая с CBL, необходима для развития и солеустойчивости растений. Завод J . 58, 778–790. DOI: 10.1111 / j.1365-313X.2009.03812.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Вери А., Гаймар Ф., Боссе К., Сентенак Х. и Тибо Дж. (1995). Экспрессия клонированного канала K + растения в ооцитах Xenopus : анализ макроскопических токов. Завод J . 7, 321–332. DOI: 10.1046 / j.1365-313X.1995.7020321.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Вери А. и Сентенак Х. (2003). Молекулярные механизмы и регуляция транспорта K + у высших растений. Annu. Ред. Завод Биол . 54, 575–603. DOI: 10.1146 / annurev.arplant.54.031902.134831
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Витале А. и Хинц Г. (2005). Сортировка белков по запасным вакуолям: сколько механизмов? Завод Тенденции .10, 316–323.
Pubmed Реферат | Pubmed Полный текст
Фолькер, К., Гомес-Поррас, Дж. Л., Беккер, Д., Хамамото, С., Уодзуми, Н., Гамбале, Ф. и др. (2010). Роль тандем-поровых каналов K + в растениях — загадка, которую еще предстоит решить. Завод Биол . 12 (Прил. 1), 56–63. DOI: 10.1111 / j.1438-8677.2010.00353.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Фёлькер, К., Шмидт, Д., Мюллер-Робер, Б., и Чемпински, К.(2006). Члены семейства Arabidopsis AtTPK / KCO образуют гомомерные вакуолярные каналы в planta. Завод J . 48, 296–306. DOI: 10.1111 / j.1365-313X.2006.02868.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Вин Джонс, Р. Г., и Поллард, А. (1983). «Белки, ферменты и неорганические ионы», в Энциклопедия физиологии растений , ред. А. Лаухли и А. Пирсон (Берлин: Springer), 528–562.
Xicluna, J., Lacombe, B., Дрейер, И., Алкон, К., Жангуенин, Л., Сентенак, Х. и др. (2007). Повышенное функциональное разнообразие растительных каналов K + за счет предпочтительной гетеромеризации Shaker -подобных субъединиц AKT2 и KAT2. J. Biol. Chem . 282, 486–494.
Pubmed Реферат | Pubmed Полный текст
Xu, J., Li, H.-D., Chen, L.-Q., Wang, Y., Liu, L.-L., He, L., et al. (2006). Протеинкиназа, взаимодействуя с двумя белками, подобными кальциневрину B, регулирует K + транспортер AKT1 в Arabidopsis . Ячейка 125, 1347–1360. DOI: 10.1016 / j.cell.2006.06.011
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Занетти М., Тирдо Э., Ла Рокка Н., Зулкифли Л., Чеккетто В., Шиджуку Т. и др. (2010). Новый калиевый канал у фотосинтезирующих цианобактерий. PLoS ONE 5: e10118. DOI: 10.1371 / journal.pone.0010118
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Чжао, Л.-Н., Шэнь, Л.-К., Чжан, В.-З., Zhang, W., Wang, Y., and Wu, W.-H. (2013). Ca 2+ -зависимые протеинкиназы 11 и 24 модулируют активность внутренних выпрямляющих каналов K + в пробирках пыльцы Arabidopsis. Растительная клетка 25, 649–661. DOI: 10.1105 / tpc.112.103184
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Zhou, Y., Morais-Cabral, J.H., Kaufman, A., and MacKinnon, R. (2001). Химия ионной координации и гидратации, выявленная комплексом K + канал-Fab при 2.0 А разрешение. Природа 414, 43–48. DOI: 10.1038 / 35102009
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Новый подход к оптической внутриклеточной визуализации динамики калия в астроцитах
Abstract
Астроциты выполняют центральную роль в регуляции K + и глутамата, которые высвобождаются нейронами во внеклеточное пространство во время активности. Поглощение глиального глутамата — это вторичный активный процесс, который включает приток трех ионов Na + и одного протона и отток одного иона K + .Таким образом, на внутриклеточную концентрацию K + ([K + ] i ) потенциально влияют как внеклеточные колебания концентрации K + ([K + ] o ), так и транспорт глутамата в астроцитах. Мы оценили влияние этих движений ионов K + на [K + ] и в первичных астроцитах мыши с помощью микроспектрофлуориметрии. Мы разработали новый неинвазивный и надежный подход к мониторингу и количественной оценке [K + ] i с использованием недавно разработанного чувствительного флуоресцентного индикатора K + Asante Potassium Green-1 (APG-1).Процедура калибровки на месте позволила нам оценить состояние покоя [K + ] i на уровне 133 ± 1 мМ. Сначала мы исследовали зависимость уровней [K + ] и от [K + ] o . Мы обнаружили, что [K + ] i следует за изменениями [K + ] o почти пропорционально в диапазоне 3–10 мМ, что согласуется с ранее сообщенными микроэлектродными измерениями внутриклеточных изменений концентрации K + в астроциты.Затем мы обнаружили, что суперфузия глутамата вызвала обратимое падение [K + ] i , которое зависело от концентрации глутамата с очевидным EC 50 11,1 ± 1,4 мкМ, что соответствует аффинности переносчиков глутамата астроцитов. Амплитуда капли [K + ] i оказалась равной 2,3 ± 0,1 мМ для 200 мкМ глутамата. В целом, это исследование показывает, что флуоресцентный индикатор K + APG-1 является новым мощным инструментом для решения важных вопросов, касающихся точного регулирования [K + ] i с превосходным пространственным разрешением.
Образец цитирования: Риммеле Т.С., Чаттон Дж. Й. (2014) Новый подход к оптической внутриклеточной визуализации динамики калия в астроцитах. PLoS ONE 9 (10): e109243. https://doi.org/10.1371/journal.pone.0109243
Редактор: Александр А. Монгин, Медицинский колледж Олбани, Соединенные Штаты Америки
Поступила: 4 августа 2014 г .; Одобрена: 9 сентября 2014 г .; Опубликовано: 2 октября 2014 г.
Авторские права: © 2014 Rimmele, Chatton.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Авторы подтверждают, что все данные, лежащие в основе выводов, полностью доступны без ограничений. Все соответствующие данные находятся в документе и его файле вспомогательной информации.
Финансирование: Работа поддержана грантом № 31003A-135720 Швейцарского национального научного фонда Дж. Я. Чаттону.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
Введение
Градиент ионов калия через мембрану клеток млекопитающих, наряду с градиентом Na + , играет жизненно важную роль как в установлении постоянного электрического потенциала, так и в обеспечении питания многочисленных транспортных систем.В астроцитах эти градиенты имеют решающее значение не только для поддержания собственного внутреннего гомеостаза клетки, такого как регулирование внутреннего pH и ионного состава, но они также позволяют динамическое регулирование интерстициальной среды мозга. Особенно важно то, что астроциты играют доминирующую роль в клиренсе нейротрансмиттеров, высвобождаемых в синаптической щели нейронами во время синаптической активности [1]. Они также активно участвуют в поглощении внеклеточного K + ([K + ] o ), высвобождаемого нейронами во время активности, особенно во время фазы реполяризации потенциала действия [2].Без адекватной регуляции увеличение [K + ] o после потенциалов действия будет мешать нормальной электрической активности и быстро отменять сетевую активность [2], [3]. Астроциты экспрессируют как активные, так и пассивные механизмы захвата и высвобождения K + , такие как внутренний выпрямляющий калиевый канал 4.1 (K ir 4.1) [2], [4], Na + / K + / Котранспортер Cl — и АТФаза Na + / K + [5], [6], и вместе они обеспечивают высокоэффективный механизм быстрой регуляции K + астроцитами в головном мозге.Вследствие того, что астроциты широко связаны между собой щелевыми контактами, они способны перераспределять K + в отдаленные участки через астроцитарный синцитий [2].
Внутриклеточный Na + , как было показано, претерпевает значительные изменения во время активности [7]. Этот приток Na + вызван, в частности, Na + -зависимым поглощением глутамата, который, как было установлено, играет ключевую роль в метаболической коммуникации нейронов и глии [8]. Поглощение глиального глутамата осуществляется как вторичный активный процесс, который включает приток трех ионов Na + и одного протона и отток одного иона K + [9] — [11].Следовательно, можно ожидать, что внутриклеточный K + будет претерпевать изменения из-за активности транспорта глутамата.
Таким образом, на [K + ] i потенциально влияют как колебания [K + ] o , так и активность транспорта глутамата в астроцитах. Было показано, что K + накапливается в астроцитах в ответ на увеличение [K + ] o в срезах и в культивируемых астроцитах нескольких видов [12] — [16]. Однако мало что известно о том, влияет ли и как на внутриклеточную концентрацию K + трансмембранные потоки ионов, связанные с захватом глутамата астроцитами.
Ионоселективные электроды широко используются для внеклеточных измерений K + (см., Например, [17], [18]). Они также использовались для внутриклеточных измерений концентрации K + в исследованиях, упомянутых выше [12] — [16]. Однако эти подходы относительно инвазивны и не предоставляют прямой пространственной информации об изменениях K + . Обнаружение на основе флуоресценции [K + ] и предлагает преимущества как неинвазивности, так и способности оценивать пространственно-временную картину потока K + в ткани.Однако реализовать этот подход было непросто. Единственный доступный на сегодняшний день флуоресцентный краситель, ультрафиолетовый зонд. Калий-связывающий изофталат бензофурана ( PBFI) трудно загружать внутриклеточно, имеет слабую флуоресценцию и имеет K d для K + ∼8 мМ [19] это далеко от ожидаемого диапазона [K + ] i , который обычно составляет> 100 мМ. По этим причинам только несколько отчетов продемонстрировали успешное использование этого зонда (см. E.грамм. [17], [20], [21]).
Цели настоящего исследования заключались в том, чтобы (1) охарактеризовать новый чувствительный к K + индикатор под названием Asante Potassium Green-1 (www.teflabs.com) для его потенциального использования в качестве неинвазивного и надежного инструмента для мониторинга и количественной оценки [K + ] и во время глиальной активности; (2) использовать этот инструмент, чтобы исследовать, как [K + ] i изменяется в ответ на колебания [K + ] o и применение глутамата в первичных астроцитах мыши.Этот новый флуоресцентный индикатор позволил нам продемонстрировать, что первичные астроциты мыши демонстрируют значительные изменения [K + ] – порядка нескольких миллимолярных как в ответ на изменения уровня [K + ] –, так и на активацию транспортера глутамата. . Эти изменения, вероятно, играют важную роль в интегрированных функциях астроцитов, которые участвуют как в [K + ] o , так и в регуляции внеклеточного глутамата.
Материалы и методы
Культура клеток
Были приложены все усилия, чтобы свести к минимуму страдания и количество животных, используемых во всех экспериментах.Все экспериментальные процедуры проводились в строгом соответствии с рекомендациями Швейцарского постановления об экспериментах на животных и были специально одобрены для этого исследования Ветеринарным отделом кантона Во, Швейцария (номер разрешения 1288.5). Первичные культуры кортикальных астроцитов получали от мышей C57Bl6 в возрасте от 1 до 3 дней, как описано в другом месте [22]. Перед экспериментами астроциты культивировали в течение 3-4 недель в среде DME (Sigma) с добавлением 10% FCS и помещали на покровные стекла для визуализации.
Спектрофлуориметрия
Свободнокислотная форма соли ТМА красителя Asante Калий Зеленый-1 (APG-1) или соли ТМА APG-2 была использована для характеристики in vitro . Флуориметрический анализ проводили в кварцевых кюветах с использованием люминесцентного / флуоресцентного спектрометра Perkin Elmer, модель LS55. Внутриклеточно-подобные растворы использовали для титрования и содержали (мМ): 12 NaCl, 5 MgCl2, 0,5 CaCl 2 , 1 EGTA, 10 HEPES, pH доведен до 7,2 с помощью N-метил-D-глюконата.Титрование красителя K + получали последовательным добавлением известных количеств K + -глюконата. Селективность K + APG-1 по Na + анализировали с использованием растворов, содержащих (мМ): 135 K + глюконат, 5 MgCl 2 , 0,5 CaCl 2 , 1 EGTA, 10 HEPES, скорректировано до pH 7,2, используя N-метил-D-глюкамин, и добавляли возрастающие количества NaCl. Спектры испускания регистрировали для каждой концентрации K + или Na + .Спектры внутриклеточного возбуждения регистрировали в живых клетках с использованием монохроматора, соединенного с ксеноновой дуговой лампой (Polychrome II, Till Photonics, Planegg, Германия), присоединенного к инвертированному флуоресцентному микроскопу (, см. Ниже ). Спектры излучения после возбуждения при 488 нм получали с использованием конфокального микроскопа LSM710, оснащенного спектральным детектором (Carl Zeiss).
Флуоресцентная микроскопия
Клетки с красителем помещали в термостатированную камеру, предназначенную для быстрой замены перфузионных растворов и наблюдения с использованием масляных иммерсионных объективов [23].Клетки подвергали суперфузии при 35 ° C. Визуализацию флуоресценции при низком уровне света выполняли на инвертированном эпифлуоресцентном микроскопе (Axiovert 100 M, Carl Zeiss) с использованием масляно-иммерсионного объектива 40 × 1,3 N.A. Длины волн возбуждения флуоресценции были выбраны с использованием монохроматора (Till Photonics), а флуоресценция детектировалась с помощью 12-битной охлаждаемой камеры CCD (Princeton Instruments) или камеры EM-CCD (Andor). Получение изображений контролировалось компьютером с использованием программного обеспечения Metafluor (Universal Imaging, Reading, PA).Изображения были получены с частотой от 0,2 до 1 Гц.
Экспериментальные растворы содержали (мМ) NaCl, 137,4; KCl, 5,4; NaHCO 3 ,25; CaCl 2 , 1,3; MgSO 4 0,8; и NaH 2 PO 4 , 0,78, глюкоза, 5, барботированный 5% CO 2 /95% воздуха. При использовании различных концентраций K + NaCl регулировали для поддержания изотоничности. Растворы для загрузки красителя содержали (мМ) NaCl, 160; KCl, 5,4; ГЕПЕС, 20; CaCl 2 , 1,3; MgSO 4 , 0.8; NaH 2 PO 4 , 0,78; глюкоза, 20 и были дополнены 0,1% Pluronic F-127 (Molecular Probes, Юджин, Орегон). В экспериментах с более чем одним применением решения порядок чередовался, чтобы исключить эффекты, связанные с порядком. В этом исследовании был выбран стандартный эталон [K + ] o 5,4 мМ, чтобы обеспечить прямое сравнение с предыдущими исследованиями в нашей и других лабораториях в области исследования астроцитов [23] — [25].
[K + ] и контролировали путем загрузки астроцитов при 37 ° C в течение 40 минут с помощью проницающей для мембраны формы красителя APG-1 AM (12 мкМ) ацетоксиметилового эфира, как описано в [26].Флуоресценцию APG-1 возбуждали при 515 нм и детектировали при 535-585 нм (Chroma, Rockingham, VT). Аналогичная процедура калибровки in situ , описанная ранее для мезангиальных клеток и гранулярных клеток мозжечка, использовалась, как описано ранее [20], [27]. Вкратце, астроциты были пермеабилизированы с использованием 10 мкг / мл нигерицина и 10 мкМ валиномицина с одновременным ингибированием Na + / K + -АТФазы с использованием 1 мМ уабаина. Затем клетки последовательно перфузировали растворами, забуференными при pH 7.2 с 20 мМ HEPES и содержащими 160, 140, 120 и 100 мМ K + , соответственно, и 30 мМ Cl —, 135 мМ глюконата с постоянной общей концентрацией Li + и K + из 160 мМ, заменив K + на Li + в растворе и сохранив постоянные концентрации Na + и Cl —. Процедура калибровки in situ была выполнена для каждой ячейки в конце экспериментов, где концентрация K + отображается на оси ординат графика, как описано в предыдущих исследованиях внутриклеточного Na + или pH (см.грамм. [23], [28]).
Эксперименты с использованием изофталата бензофурана, связывающегося с натрием (SBFI-AM, 15 мкМ, возбуждение при 340 нм и 380 нм) или Fura-2 AM (8 мкМ, возбуждение при 360 нМ) вместе с APG-1 AM (возбуждение при 490 нм) были выполнены с использованием протокола, аналогичного описанному ранее [29]. Для этих экспериментов испускаемая флуоресценция детектировалась через интерференционный фильтр 535 нм (полосовой 35 нм) (Omega Optical, Brattleboro, VT).
Для экспериментов, требующих локальной доставки K + , нагруженные красителем клетки были помещены в специальную открытую камеру, обеспечивающую быструю замену перфузионных растворов.Стеклянную пипетку с диаметром кончика 1-2 мкм заполняли 500 мМ K + -глюконат, приближали с помощью микроманипулятора (Sutter Instruments) на расстоянии ~ 10 мкм от клеток. Импульсы давления 200–500 мс, 1–2 фунта на квадратный дюйм подавались на заднюю часть пипетки с помощью Picospritzer III (Sensortechnics, Пуххайм, Германия) для локальной доставки K + .
Анализ данных и статистика
Кривые интенсивности флуоресценциибыли нарисованы из областей интереса, выбранных в максимум 10 отдельных клетках из поля зрения с использованием программного пакета Metafluor.Дальнейшие расчеты проводились с помощью Excel (Microsoft). Графики и аппроксимация кривых были выполнены с помощью Kaleidagraph (Synergy Software, Reading, PA, USA). Если не указано иное, для каждой экспериментальной группы проводили парный t-критерий Стьюдента для оценки статистической значимости по сравнению с соответствующими контролями, *, ** и *** относятся к значениям p 0,05, 0,01 и 0,001 соответственно. Для оценки значений EC 50 была проведена аппроксимация нелинейной кривой с использованием алгоритма Левенберга-Марквардта, реализованного в программном пакете Kaleidagraph.Уравнение, используемое для подбора экспериментов по анализу доза-реакция, следующее: (1) были F obs — наблюдаемый ответ, F max , F min — максимальный, минимальный параметры ответа . [A] представляет собой концентрацию агониста, а K представляет собой концентрацию агониста, которая дает половинный максимальный ответ (, т.е. EC 50 ). Уравнение [1] соответствует односайтовой модели Михаэлиса-Ментен.
Красители и лекарственные препараты
Нигерицин был от Abcam (Кембридж, Великобритания), валиномицин от Fluka (Buchs, Швейцария).Все остальные химические вещества были от Sigma-Aldrich (Букс, Швейцария).
Результаты
Характеристика АПГ-1
На первом этапе чувствительность и селективность K + флуоресцентного индикатора APG-1 была охарактеризована in vitro с использованием спектрофлуориметрии. APG-1 основан на конструкции, аналогичной очень успешной натриевой версии Asante Natrium Green-1 [26]. Для этого APG-1 растворяли в растворах, соответствующих внутриклеточному ионному составу i.е. , содержащий 10 мМ Na + , наномолярную концентрацию Ca 2+ и миллимолярную концентрацию Mg 2+ при pH 7,2. Спектры возбуждения имели пик при ∼515 нм ( не показано, ), тогда как спектры излучения имели максимум при ∼540 нм ( Рис. 1A, ), таким образом проявляя спектральные свойства, очень похожие на родственный индикатор Na + Asante Natrium. Грин-1 [26]. Изменение концентрации K + от 0 до 150 мМ вызывало скачкообразное увеличение флуоресцентного излучения.Эмиссия флуоресценции APG-1 в зависимости от концентрации K + ( фиг. 1B ) демонстрировала монотонное увеличение до ожидаемого верхнего физиологического диапазона концентраций K + , составляющего 150 мМ. Ни в спектрах возбуждения, ни в спектрах излучения не наблюдалось смещения максимумов при увеличении концентрации K + . K + -чувствительность родственного индикатора APG-2 была проанализирована в параллельных экспериментах. Фиг. 1B показывает, что APG-2, как указано производителем, имеет более высокое сродство к K + в идентичных внутриклеточно-подобных растворах.Флуоресценция APG-2 достигала насыщения при концентрациях K + выше, чем ∼80 мМ. Этот результат указывает на то, что APG-2 вряд ли будет реагировать на изменения K + при физиологических внутриклеточных концентрациях. Наши тесты, проведенные с внутриклеточным APG-2 (нагруженным с использованием его проницаемой через мембрану формы), подтвердили это предсказание, так как во время клеточной стимуляции, такой как нанесение глутамата, не наблюдались никаких изменений или очень небольшие изменения флуоресценции ( не показано ).
Рисунок 1.Спектрофлуориметрическая характеристика индикатора АПГ-1 К + .
( A ) Спектры излучения, зарегистрированные в присутствии различных [K + ] во внутриклеточно-подобных растворах после возбуждения на длине волны 515 нм. Максимум излучения составлял ~ 540 нм. ( B ) Эмиссия флуоресценции, построенная как функция [K + ], показывающая монотонную взаимосвязь флуоресценции APG-1 с увеличением [K + ] (кружки). Такой же анализ был проведен на APG-2, родственном индикаторе с идентичными спектральными свойствами (ромбики), но более низким Kd для K + .Графики показывают, что флуоресценция APG-2 становится насыщенной при [K + ]> 80 мМ, что не относится к APG-1. ( C ) Na + -зависимость флуоресценции APG-1, измеренная во внутриклеточно-подобном растворе, содержащем 135 мМ K + (см. Также фиг. S1). ( D ) pH-зависимость флуоресценции APG-1, измеренная во внутриклеточно-подобном растворе, содержащем 135 мМ K + . PH каждого раствора регулировали с помощью NMDG. Этот pH-анализ повторяли три раза.Данные представлены как среднее ± стандартная ошибка среднего для трех измерений.
https://doi.org/10.1371/journal.pone.0109243.g001
Затем мы проверили возможное влияние Na + , который, как известно, претерпевает быстрые и существенные изменения амплитуды в астроцитах в диапазоне 10–30 мМ. [7], [23], [30], в частности, во время активности переносчика глутамата. Фиг. 1C показывает, что концентрации Na + до 50 мМ имели лишь незначительное влияние на флуоресценцию APG-1. Фиг. S1 расширяет этот анализ и показывает влияние Na + на APG-1 для различных концентраций K + в диапазоне от 0 до 150 мМ. Было обнаружено, что в отсутствие K + индикатор демонстрирует ожидаемую повышенную чувствительность к Na + . Однако для концентраций K + в диапазоне внутриклеточных уровней ([K + ]> 100 мМ) взаимодействие с Na + оказалось минимальным.
APG-1 является слабой кислотой, как и другие родственные флуоресцентные индикаторы катионов, и поэтому на нее потенциально влияет pH.Поэтому мы проверили, влияет ли pH на флуоресценцию APG-1. Фиг. 1D показывает, что флуоресценция APG-1 была стабильной в диапазоне pH 7-8, обнаруженном in vivo в клетках мозга при нормальных условиях. На рисунке также показано, что флуоресценция APG-1 имеет тенденцию к снижению ниже pH ~ 6,8, что следует принимать во внимание в экспериментах, связанных со значительным подкислением клеток.
Таким образом, APG-1 представляет собой флуоресцентный индикатор в спектре видимого света, который проявляет свойства кюветы, которые делают его очень многообещающим для измерения внутриклеточной концентрации K + .
В следующей серии экспериментов астроциты были загружены с использованием проницаемой через мембрану формы красителя, APG-1 AM. Культивированные астроциты имеют чрезвычайно плоскую морфологию (толщина клетки обычно составляет ~ 1-2 мкм), причем ядро является самой толстой частью клетки (обычно 5-8 мкм). При загрузке индикаторов с цитозольной локализацией, которые обладают способностью проникать через ядерные поры, широкоугольные изображения астроцитов показывают яркие флуоресцентные ядра, поскольку они соответствуют области клетки с наибольшей длиной оптического пути.Как видно на фиг. , фиг. 2А, , клеточная нагрузка APG-1 была сильной и демонстрировала типичное распределение цитозольного красителя. Это свойство APG-1 AM контрастирует с низкой эффективностью загрузки, обычно сообщаемой для другого K + -чувствительного красителя PBFI AM. Затем регистрировали спектры возбуждения и испускания внутриклеточного APG-1, которые показали максимумы при 522 нм и 547 нм, соответственно (, фиг. 2B, ). Таким образом, in situ краситель демонстрирует небольшое красное смещение своих спектров по сравнению с измерениями в кювете.Зонд показал замечательную внутриклеточную стабильность с незначительным фотообесцвечиванием или утечкой клеток, как наблюдалось ранее с родственным натриевым зондом ANG-1 [26]. Затем была разработана и оптимизирована процедура калибровки in situ с применением общих принципов, используемых для калибровки индикаторов Na + . После пермеабилизации клеточной мембраны с помощью ионофоров и блокады АТФазы Na + / K + последовательно наносили растворы с различной концентрацией K + и регистрировали результирующий сигнал флуоресценции ( рис.2С ). Удовлетворительную проницаемость оценивали по быстрому установлению значений флуоресценции на плато, которые затем наносили на график в зависимости от известной концентрации K + (, фиг. 2D, ), чтобы сделать возможным ретроспективный расчет изменений концентрации K + во время эксперимента. В наших экспериментальных условиях и с использованием этой процедуры было обнаружено, что [K + ] i в состоянии покоя в среднем составляет 133 ± 1 мМ, что согласуется с ожидаемыми значениями [K + ] i клеток млекопитающих [20], [21], [27].
Рис. 2. Внутриклеточная характеристика индикатора К + АПГ-1.
( A ) Флуоресцентное изображение первичных астроцитов, загруженных с использованием APG-1 AM. Масштабная линейка 50 мкм. ( B ) Спектры возбуждения и излучения на месте , измеренные с помощью флуоресцентной микроскопии. Внутриклеточные спектры были на ~ 10 нм смещены в красную область по сравнению с измерениями в кюветах. ( C ) Типичная экспериментальная кривая, изображающая процедуру калибровки in situ .Во время, указанное стрелкой, клеточная мембрана была проницаема для K + с использованием валиномицина и нигерицина, в то время как Na + / K + АТФаза ингибировалась уабаином. Затем последовательно применяли растворы различных [K + ] до получения стабильных плато флуоресценции. ( D ) Калибровочная кривая, полученная путем построения значений плато флуоресценции, измеренных для каждого известного [K + ].
https: // doi.org / 10.1371 / journal.pone.0109243.g002
Взятые вместе, можно сделать вывод из этого in vitro и внутриклеточных характеристик, что APG-1 можно безопасно использовать в качестве K + -чувствительного внутриклеточного индикатора.
[K
+ ] o Уровень влияет на цитозольный K + в астроцитахПоскольку астроциты являются основными участниками регуляции интерстициального K + в головном мозге [2], мы спросили, в какой степени [K + ] i зависит от [K + ] o .Поэтому мы загрузили первичные астроциты с APG-1 AM и применили различные растворы, содержащие K + в ожидаемом диапазоне концентраций, в котором эти клетки могут подвергаться воздействию в головном мозге. На рис. 3A и B показано, что изменение [K + ] o воспроизводимо вызвало изменение в [K + ] i уровней, которые следовали за [K + ] o , пропорционально изменяются в диапазоне 3– 10 мМ (наклон = 1,04 ± 0,06, n = 120 клеток, 12 exp). Дальнейшего увеличения [K + ] i не наблюдалось для 15 мМ [K + ] o .Кроме того, более низкий наклон и кинетика изменений с начальным переходным процессом согласуется с некоторой степенью регуляции объема клеток.
Рисунок 3. Внутриклеточный K + модулируется изменениями уровня [K + ] o .
( A ) Типичный одноклеточный [K + ] i след при нанесении в ванну растворов с различными концентрациями K + в диапазоне от 3 до 10 мМ, которые обнаруживаются во время физиологических и патологических состояний.( B ) Связь между установившимся [K + ] i (измерено на уровнях плато) и внешним [K + ] o (n = 120 ячеек из 12 опытных). График показывает устойчивое увеличение [K + ] i в диапазоне [K + ] o 3–10 мМ (простые кружки), что дает наклон 1,04 ± 0,06 (r = 0,82). . Более высокое значение [K + ] o , составляющее 15 мМ (незакрашенный кружок), не привело к дальнейшему увеличению [K + ] i .( C ) На внутриклеточный K + влияет локальное нанесение слоек K + -глюконата. Типичные следы [K + ] и (средние значения по 7 клеток каждая) во время нанесения затяжки (черные стрелки) глюконата K + в непосредственной близости от пипетки (верхний график) и на расстоянии> 90 мкм (нижний след). На вставках: увеличение следа после одноклеточного нанесения K + . Средняя амплитуда ( D ) и продолжительность подъема [K + ] i ( E ), вызванного затяжками K + (черная полоса) по сравнению с ответами, наблюдаемыми в присутствии 200 мкМ Ba 2+ (белая полоса) или 20 мкМ карбеноксолона (CBX, серая полоса) (n = 62 клетки, 5 эксп.).Не было обнаружено значительных изменений амплитуд, тогда как продолжительность ответа была значительно увеличена на CBX и уменьшена на Ba 2+ .
https://doi.org/10.1371/journal.pone.0109243.g003
Чтобы выяснить, можно ли использовать APG-1, измерьте реакцию на быстрые и пространственно ограниченные [K + ] o возвышения на [K + ] и , мы наносили одиночные короткие внеклеточные затяжки из пипетки, заполненной глюконатом K + ( Рис.3С ). [K + ] i быстро поднялся со средней амплитудой 2,2 ± 0,2 мМ ( Рис. 3D ) и восстановился до половины амплитуды в течение 26,8 ± 2,6 с ( Рис. 3E ) в непосредственной близости от пипетки. наконечник (верхний график), тогда как на расстояниях> 90 мкМ (нижний график) ответов не обнаружено. Применение 200 мкМ Ba 2+ не предотвратило начальный приток K + , но действительно уменьшило продолжительность ответа ( Рис. 3D и E ). Механизм, лежащий в основе сокращения продолжительности ответа, в настоящее время неясен.
Считается, что после принятия временного локального избытка [K + ] o , возникающего в непосредственной близости от активированных нейронов, астроциты перераспределяют его через щелевые соединения над синцитием в сторону более низких локальных [K + ] i , откуда он в конечном итоге возвращается во внеклеточное пространство [31] — [33]. Поэтому мы исследовали, участвуют ли щелевые контакты в формировании наблюдаемого ответа [K + ] i . В присутствии карбеноксолона (CBX, 20 мкМ), блокатора щелевых контактов [34], полупериод восстановления [K + ] i удваивается (46.7 ± 4,3 с), тогда как амплитуда существенно не изменилась (2,4 ± 0,3 мМ) ( Рис. 3C – E ). Этот результат согласуется с представлением о пространственном перераспределении K + по астроцитарному синцитию, как было предложено ранее [2], [35]. В ситуациях, когда связь между щелевыми соединениями нарушена, избыток K + дольше сохраняется в отдельных ячейках.
Активность переносчика глутамата динамически влияет на [K
+ ] iГлиальные высокоаффинные переносчики глутамата имеют сложную стехиометрию, в которой приток глутамата связан с тремя ионами Na + и одним протоном в обмен на один ион K + [10], [11].Активации этого переносчика достаточно, чтобы вызвать существенные изменения [Na + ] и в астроцитах как в культуре, так и in situ [7], [23]. Поэтому мы спросили, может ли отток K + , связанный с циклом транспорта глутамата, изменять уровни [K + ] i обнаруживаемым образом. На фиг. 4A показан след одной клетки во время нанесения глутамата, который вызвал обратимое уменьшение [K + ] i . Падение [K + ] i , индуцированное 200 мкМ глутамата, в среднем составило 2.3 ± 0,1 мМ (n = 89 клеток, 9 эксп.) Для нанесения 200 мкМ глутамата, выполняемого в 5,4 мМ внешних условиях K + .
Рисунок 4. Внутриклеточный K + модулируется применением глутамата.
( A ) Применение 200 мкМ глутамата вызывало быстрое и обратимое уменьшение [K + ] i с амплитудой 2,3 ± 0,1 мМ ( B ) [K + ] i реакция на нанесение глутамата в диапазоне от 0,1 мкМ до 10 мМ соответствовала кинетике Михаэлиса и Ментен с очевидным EC 50 из 11.1 ± 1,4 мкМ. ( C ) Одновременный мониторинг Na + и K + с использованием SBFI и APG-1 соответственно. SBFI последовательно возбуждали при 340 и 380 нм и вычисляли его коэффициент возбуждения флуоресценции, а APG-1 возбуждали при 490 нм. Нанесение глутамата (200 мкМ) показано на графике. Образец следа отдельной клетки из трех экспериментов. ( D ) Флуоресцентный краситель Fura-2, совместно загруженный с APG-1, возбуждали на длине волны 360 нм, его Ca 2+ -нечувствительная длина волны, тогда как APG-1 возбуждалась при 490 нм.В то время как нанесение 200 мкМ глутамата вызывало снижение флуоресцентного ответа APG-1, ответ Fura-2 при 360 нм оставался невозмущенным (примерный след из двух экспериментов).
https://doi.org/10.1371/journal.pone.0109243.g004
Чтобы проверить, зависел ли этот ответ [K + ] i от концентрации глутамата, мы применили глутамат в диапазоне концентраций 0,1 мкМ-10 мМ и измеряли флуоресцентный ответ APG-1. Амплитуда ответа K + была пропорциональна концентрации глутамата в ванне и соответствовала кинетике Михаэлиса и Ментен ( рис.4Б ). Аппроксимация нелинейной кривой с использованием уравнения [1] дала EC 50 11,1 ± 1,4 мкМ (n = 116 клеток, 12 exp). Таким образом, как кинетика, проявляемая ответом K + на глутамат, так и очевидное сродство эффекта согласуются с опосредованием эффекта переносчиками глутамата. В этом случае одновременные ответы Na + должны наблюдаться в клетках, подвергающихся ответу K + . Поэтому мы загрузили как УФ-индикатор Na + SBFI, так и APG-1, которые спектрально совместимы.Последовательное освещение при 340 нм, 380 нм и 490 нм позволило зарегистрировать соотношение флуоресценции SBFI и отклик флуоресценции APG-1, отражающие изменения Na + и K + , соответственно, в одной и той же ячейке. Фиг. 4C показывает, что астроциты проявляют противоположные ответы на глутамат, совместимые с активацией транспортеров глутамата, вызывая как увеличение Na + , так и снижение K + с аналогичной кинетикой. Для сравнения мы загрузили УФ-зонд Фура-2 и осветили его изобестическим — мк.е. Ca 2+ -нечувствительный — длина волны. В то время как APG-1 показал нисходящую флуоресцентную реакцию на глутамат, Fura-2 при 360 нм не показал изменения флуоресценции в ответ на глутамат, что указывает на отсутствие набухания клеток, которое могло участвовать в снижении флуоресценции APG-1.
Обсуждение
Нормальная мозговая деятельность включает существенные движения ионов, вторичные по отношению к генерации потенциалов действия. В частности, возбуждение нейронов приводит к повышению внеклеточных уровней K + , которые необходимо быстро нормализовать, чтобы обеспечить последующую активность [3].Не менее важно, чтобы сопутствующий возбуждающий нейротрансмиттер глутамат, высвобождаемый из активированных синапсов, должен быть удален из интерстициального пространства, чтобы справиться с высокочастотной синаптической передачей и предотвратить накопление эксайтотоксического глутамата. Астроциты играют центральную роль в обоих этих процессах, что делает их важными участниками регуляции активности нейронов. В настоящем исследовании мы использовали новый чувствительный к K + флуоресцентный индикатор, чтобы продемонстрировать, что [K + ] i значительно зависит как от внешнего K + , так и от активности транспорта глутамата.
Внутриклеточные измерения K + до сих пор затруднялись из-за отсутствия адекватного флуоресцентного зонда. Единственный доступный ранее, PBFI, страдает низким квантовым выходом, плохой селективностью в отношении K + по сравнению с Na + , ультрафиолетовым возбуждением, а также сродством к K + ∼8 мМ [19] что делает его малочувствительным к K + в его физиологическом внутриклеточном диапазоне> 100 мМ. Более того, проницаемая через мембрану форму этого красителя, как известно, трудно загружать в клетки млекопитающих.Для настоящего исследования мы использовали недавно синтезированный зонд K + APG-1 и охарактеризовали его основные свойства как в кювете, так и in situ . Мы обнаружили, что APG-1 генерирует важные изменения флуоресценции в ответ на изменения концентрации K + и не является насыщенным на физиологических внутриклеточных уровнях K + , , т.е. выше 100 мМ. В отличие от PBFI (см., Например, [27]), на флуоресценцию APG-1 лишь незначительно влияют Na + и pH на их соответствующих физиологически значимых внутриклеточных уровнях.Спектральные свойства APG-1 очень похожи на таковые из недавно описанного индикатора Na + ANG-1 [26]. Как и в случае с этим последним индикатором, проницаемая через мембрану форма APG-1 легко загружается в астроциты и дает яркую и равномерно распределенную флуоресценцию, указывающую на преобладающую цитозольную локализацию. Было обнаружено, что пики возбуждения и излучения, измеренные внутриклеточно, смещены в красную область на ~ 10 нм по сравнению с измерениями, выполненными в кюветах. Этот батохромный сдвиг часто наблюдается с флуоресцентными красителями, включая флуоресцеин, при исследовании внутри живых клеток и отражает взаимодействия с внутриклеточными макромолекулами [36].
Используя этот подход, мы могли измерить обнаруживаемые изменения [K + ] i в регистре с ванной K + изменения концентрации в диапазоне 3–10 мМ [K + ] o . Этот результат соответствует предыдущим измерениям [K + ] и , выполненным с использованием чувствительных микроэлектродов K + (см., Например, [12], [16]). Тот факт, что не наблюдалось дальнейшего увеличения [K + ] i при 15 мМ [K + ] o , свидетельствует о наличии насыщаемого пути для входа K + и / или регуляторного механизм.Чтобы определить, можно ли использовать APG-1 для исследования реакции [K + ] i на локальные переходные увеличения [K + ] o , мы нанесли затяжки K + из пипетки, расположенной близко нацеливать клетки в поле зрения. Действительно, такие локальные затяжки вызывали кратковременный, но заметный внутриклеточный ответ, состоящий в начальном резком подъеме [K + ] i с последующим более медленным восстановлением до исходного уровня. Клетки на расстоянии> 90 мкм от наконечника пипетки не показали изменения [K + ] i .В этих экспериментах применение Ba 2+ не подавляло быстрый ответ [K + ] i , что указывает на то, что каналы K ir вряд ли будут непосредственно задействованы. Точная роль и участие каналов K ir в буферизации K + остается предметом дискуссий [6], [37], [38], а репертуар проводимости K + , лежащих в основе пассивной проводимости K + в астроцитах остается неопределенным [4], [39]. Тот факт, что Ba 2+ не отменял ответ [K + ] i , вероятно, указывает на то, что другие механизмы, возможно, ко-переносчики Na / K / 2Cl (NKCC1) или Na + / K + АТФазы, как предполагалось ранее [6].Члены семейства каналов двухпорового домена K + , а именно TWIK-1 и TREK-1, как недавно было показано, экспрессируются и функционируют в астроцитах [39]. Поскольку эти каналы устойчивы к Ba 2+ , они могут представлять альтернативного кандидата, опосредующего наблюдаемый ответ. В этих экспериментах вклад астроцитарного синцития в быстрое диспергирование увеличенного [K + ] i был продемонстрирован путем блокирования щелевых контактов, что заметно увеличивало продолжительность подъема [K + ] i в стимулированная клетка.
Здесь мы также впервые демонстрируем, насколько нам известно, что уровни [K + ] i в астроцитах снижаются при применении глутамата. Наблюдаемое падение [K + ] i связано с активностью переносчиков глутамата, транспортный цикл которых включает обмен одного иона K + , транспортируемого из клетки, на три иона Na + и протон, который переносятся вместе с глутаматом в клетку [9], [11].Следует отметить, что вклад ионотропных рецепторов глутамата в ответ маловероятен, поскольку применение NMDA не вызывает ответов в модели первичных астроцитов, использованной в этом исследовании [28]. Ранее мы также показали, что десенсибилизация рецептора AMPA в первичных астроцитах предотвращает значительный приток катионов, влияющий на внутриклеточные концентрации [23]. Кинетика наблюдаемого ответа, одновременно измеренное повышение Na + и очевидное EC 50 ответа на глутамат в концентрации 11 мкМ — все они идентичны тем, которые были опубликованы ранее в аналогичных экспериментальных условиях при измерении транспорта глутамата, связанного с Na . + ответ в астроцитах [23].Стоит отметить, что уровень внеклеточного глутамата в покое поддерживается в низком микромолярном диапазоне. Было установлено, что во время активности нейронов глутамат достигает мембраны астроцита с концентрацией от 10 мкМ [40] до 160–190 мкМ [41]. Наши результаты, полученные с использованием первичных астроцитов, показывают, что APG-1 достаточно чувствителен, чтобы обнаруживать изменения K + , происходящие в пределах физиологического диапазона концентраций глутамата. То, так ли это также и в случае астроцитов срезов головного мозга, требует дальнейшего экспериментального подтверждения.Учитывая, что должно быть соотношение 3: 1 движения Na + к движению K + во время каждого транспортного цикла, можно предположить, что реакция K + должна быть в три раза ниже, чем реакция Na + . . Однако мы наблюдали амплитуду ответа [K + ] и на глутамат всего 2,3 мМ, то есть примерно в 5–10 раз ниже, чем у [Na + ] и в аналогичных экспериментальных условиях [см. например 23]. Следовательно, похоже, что одновременный приток K + во время применения глутамата может быть быстро активирован для компенсации цитозольного падения K + .Одним из кандидатов может быть АТФаза Na + / K + , которая подвергается быстрой активации во время поглощения глутамата астроцитами [23]. В то время как Na + / K + АТФаза закачивает два иона K + в клетку для 3 вытесняемых Na + , транспорт глутамата обменивает один K + на три Na + . Таким образом, если рассматривать Na + / K + АТФазы и транспорт глутамата как функционально связанный комплекс, как предполагалось [42] — [44], во время транспорта глутамата, в целом приток K + будет больше, чем его отток, что, возможно, объясняет меньшее, чем ожидалось, уменьшение [K + ] i во время транспорта глутамата.Другой альтернативой может быть возможное участие митохондрий, которые, как предполагается, секвестируют K + в астроцитах [21]. Было показано, что митохондрии активно участвуют в ответах астроцитов на глутамат, в частности, поглощая Na + [45] и протоны [28] в своем матриксе. Возможно, что в этих условиях митохондрии благодаря своей способности захватывать и высвобождать K + могут действовать как внутриклеточные буферы K + и, таким образом, уменьшать изменения [K + ] i .Эта идея может объяснить как падение K + во время транспорта глутамата, так и наклон изменения [K + ] i при внешних изменениях уровня K + , которые оказались ниже, чем ожидалось в настоящем исследовании.
В заключение, это исследование демонстрирует, что новый флуоресцентный индикатор K + APG-1 является мощным новым инструментом, который можно использовать для решения подробных и фундаментальных вопросов о регулировании [K + ] i .Особое значение имеет наше новое открытие, согласно которому поглощение глутамата астроцитами оказывает значительное влияние на [K + ] i , открытие, которое представляет собой важный вклад в комплексное понимание функций астроцитов в головном мозге.
Дополнительная информация
Рисунок S1.
Спектрофлуориметрическая характеристика влияния Na + на флуоресценцию АПГ-1. Флуоресцентное излучение в зависимости от концентрации Na + во внутриклеточно-подобном растворе, содержащем возрастающие концентрации K + (0–150 мМ).Общую концентрацию одновалентных катионов поддерживали постоянной с помощью соответствующих добавлений NMDG. Каждая кривая представляет собой трехкратные измерения.
https://doi.org/10.1371/journal.pone.0109243.s001
(TIF)
Благодарности
Мы благодарим доктора Акваси Минта (Teflabs) за постоянное плодотворное взаимодействие и советы относительно флуоресцентных зондов, Энеа Пианецци за его помощь со спектрофлуориметрическим анализом и Дженнифер Луэбке (Бостонский университет) за ее критическое прочтение рукописи.
Вклад авторов
Задумал и спроектировал эксперименты: TSR JYC. Проведены эксперименты: TSR JYC. Проанализированы данные: TSR JYC. Участвовал в написании меню: TSR JYC.
Список литературы
- 1. Андерсон CM, Swanson RA (2000) Транспорт глутамата астроцитов: обзор свойств, регуляции и физиологических функций. Глия 32: 1–14.
- 2. Кофуджи П., Ньюман Э.А. (2004) Буферизация калия в центральной нервной системе.Неврология 129: 1045–1056.
- 3. Амеди Т., Роберт А., Коулз Дж. А. (1997) Гомеостаз калия и метаболизм глиальной энергии. Глия 21: 46–55.
- 4. Olsen M (2012) Изучение функции калиевых каналов в астроцитах. Методы Мол Биол 814: 265–281.
- 5. Amzica F (2002) Электрофизиологические доказательства in vivo взаимодействий корковых нейронов с глией во время медленных (<1 Гц) и пароксизмальных колебаний сна. J Physiol Paris 96: 209–219.
- 6.Ларсен Б.Р., Ассентофт М., Котрина М.Л., Хуа С.З., Недергаард М. и др. (2014) Вклады Na (+) / K (+) — ATPase, NKCC1 и Kir4.1 в клиренс K (+) и объемные реакции гиппокампа. Glia 62: 608–622.
- 7. Langer J, Rose CR (2009) Синаптически индуцированные сигналы натрия в астроцитах гиппокампа in situ. J Physiol 587: 5859–5877.
- 8. Pellerin L, Bouzier-Sore AK, Aubert A, Serres S, Merle M и др. (2007) Активно-зависимая регуляция энергетического метаболизма астроцитами: обновление.Glia 55: 1251–1262.
- 9. Levy LM, Warr O, Attwell D (1998) Стехиометрия глиального транспортера глутамата GLT-1, индуцибельно экспрессируемого в линии клеток яичника китайского хомячка, отобранной для низкого эндогенного Na + -зависимого поглощения глутамата. Журнал неврологии 18: 9620–9628.
- 10. Danbolt NC (2001) Поглощение глутамата. Прогресс в нейробиологии 65: 1–105.
- 11. Zerangue N, Kavanaugh MP (1996) Сцепление потока в нейрональном транспортере глутамата.Nature 383: 634–637.
- 12. Ballanyi K, Grafe P, ten Bruggencate G (1987) Ионные активности и механизмы захвата калия глиальными клетками в срезах обонятельной коры морских свинок. J Physiol 382: 159–174.
- 13. Coles JA, Schneider-Picard G (1989) Увеличение глиального внутриклеточного K + в сетчатке дрона, вызванное фотостимуляцией, но не опосредованное увеличением внеклеточного K +. Глия 2: 213–222.
- 14. Kettenmann H, Sonnhof U, Schachner M (1983) Исключительная калиевая зависимость мембранного потенциала в культивируемых олигодендроцитах мыши.J Neurosci 3: 500–505.
- 15. Wuttke WA (1990) Механизм захвата калия глиальными клетками нейропиля в центральной нервной системе пиявки. J Neurophysiol 63: 1089–1097.
- 16. Coles JA, Orkand RK (1983) Модификация движения калия через сетчатку дрона (самец Apis mellifera) за счет поглощения глии. J Physiol 340: 157–174.
- 17. Dufour S, Dufour P, Chever O, Vallee R, Amzica F (2011) Одновременная регистрация внутри- и внеклеточного калия in vivo с использованием микрооптрода.J Neurosci Methods 194: 206–217.
- 18. Heinemann U, Lux HD (1975) Недостаточные выстрелы после индуцированного стимулом повышения концентрации внеклеточного калия в коре головного мозга кошек. Brain Res 93: 63–76.
- 19. Минта А., Цзянь Р. Я. (1989) Флуоресцентные индикаторы цитозольного натрия. Журнал биологической химии 264: 19449–19457.
- 20. Kasner SE, Ganz MB (1992) Регулирование внутриклеточного калия в мезангиальных клетках: флуоресцентный анализ с использованием красителя PBFI.Американский журнал физиологии 262: F462 – F467.
- 21. Козориз М.Г., Черч Дж., Озог М.А., Наус С.К., Кребс С. (2010) Временная секвестрация калия митохондриями в астроцитах. J Biol Chem.
- 22. Sorg O, Magistretti PJ (1992) Вазоактивный кишечный пептид и норадреналин оказывают долгосрочное регулирование уровней гликогена в астроцитах: блокада путем ингибирования синтеза белка. Журнал неврологии 12: 4923–4931.
- 23. Chatton J-Y, Marquet P, Magistretti PJ (2000) Количественный анализ регулируемой L-глутаматом динамики Na + в корковых астроцитах мышей: последствия для клеточной биоэнергетики.Европейский журнал нейробиологии 12: 3843–3853.
- 24. Hounsgaard J, Nicholson C (1983) Накопление калия вокруг отдельных клеток Пуркинье в срезах мозжечка морской свинки. J Physiol 340: 359–388.
- 25. Pellerin L, Magistretti PJ (1994) Поглощение глутамата астроцитами стимулирует аэробный гликолиз: механизм, связывающий активность нейронов с утилизацией глюкозы. Труды Национальной академии наук США 91: 10625–10629.
- 26.Lamy CM, Chatton JY (2011) Оптическое зондирование динамики натрия в нейронах и астроцитах. NeuroImage 58: 572–578.
- 27. Kiedrowski L (1999) Эксайтотоксичность N-метил-D-аспартата: взаимосвязь между потенциалом плазматической мембраны, обменом Na (+) / Ca (2+), митохондриальной перегрузкой Ca (2+) и цитоплазматическими концентрациями Ca (2+), Н (+) и К (+). Mol Pharmacol 56: 619–632.
- 28. Азариас Г., Перретен Х., Ленгахер С., Побурко Д., Деморекс Н. и др. (2011) Транспорт глутамата снижает рН митохондрий и модулирует окислительный метаболизм в астроцитах.Журнал неврологии 31: 3550–3559.
- 29. Bernardinelli Y, Magistretti PJ, Chatton J-Y (2004) Астроциты генерируют метаболические волны, опосредованные Na + . Труды Национальной академии наук США 101: 14937–14942.
- 30. Rose CR, Karus C (2013) Две стороны одной медали: гомеостаз натрия и передача сигналов в астроцитах в физиологических и патофизиологических условиях. Глия.
- 31. Leis JA, Bekar LK, Walz W (2005) Гомеостаз калия в ишемическом мозге.Glia 50: 407–416.
- 32. Walz W (2000) Роль астроцитов в очистке от избыточного внеклеточного калия. Neurochem Int 36: 291–300.
- 33. Somjen GG (2002) Ионная регуляция в головном мозге: значение для патофизиологии. Невролог 8: 254–267.
- 34. Langer J, Stephan J, Theis M, Rose CR (2012) Щелевые соединения опосредуют межклеточное распространение натрия между астроцитами гиппокампа in situ. Glia 60: 239–252.
- 35.Gardner-Medwin AR, Nicholson C (1983) Изменения внеклеточной активности калия, вызванные электрическим током через ткань мозга у крысы. J. Physiol 335: 375–392.
- 36. Meisingset KK, Steen HB (1981) Внутриклеточное связывание флуоресцеина в лимфоцитах. Цитометрия 1: 272–278.
- 37. Hertz L, Xu J, Song D, Yan E, Gu L и др. (2013) Накопление в астроцитах и нейронах повышенного внеклеточного K (+) с соотношением потоков 2/3 K (+) / Na (+) — последствия для энергетического метаболизма, осмолярности и более высокой функции мозга.Front Comput Neurosci 7: 114
- 38. D’Ambrosio R, Gordon DS, Winn HR (2002) Дифференциальная роль канала KIR и Na (+) / K (+) — насоса в регуляции внеклеточного K (+) в гиппокампе крысы. J Neurophysiol 87: 87–102.
- 39. Чжоу М., Сюй Г., Се М., Чжан Х, школьный врач общей практики и др. (2009) TWIK-1 и TREK-1 представляют собой калиевые каналы, вносящие значительный вклад в пассивную проводимость астроцитов в срезах гиппокампа крысы. J Neurosci 29: 8551–8564.
- 40. Lalo U, Pankratov Y, Kirchhoff F, North RA, Verkhratsky A (2006) NMDA-рецепторы опосредуют передачу сигналов от нейрона к глии в корковых астроцитах мышей.J Neurosci 26: 2673–2683.
- 41. Dzubay JA, Jahr CE (1999) Концентрация синаптически высвобождаемого глутамата за пределами синаптической щели поднимающихся волокон и клеток Пуркинье. Журнал неврологии 19: 5265–5274.
- 42. Cholet N, Pellerin L, Magistretti PJ, Hamel E (2002) Сходная перисинаптическая глиальная локализация для субъединицы Na +, K + -АТФазы альфа 2 и транспортеров глутамата GLAST и GLT-1 в соматосенсорной коре крыс. Cereb Cortex 12: 515–525.
- 43. Matos M, Augusto E, Agostinho P, Cunha RA, Chen JF (2013) Антагонистическое взаимодействие между аденозиновыми рецепторами A2A и Na + / K + -ATPase-alpha2, контролирующим поглощение глутамата в астроцитах. J Neurosci 33: 18492–18502.
- 44. Rose EM, Koo JC, Antflick JE, Ahmed SM, Angers S и др. (2009) Сочетание переносчика глутамата с Na, K-АТФазой. J Neurosci 29: 8143–8155.
- 45. Bernardinelli Y, Azarias G, Chatton J-Y (2006) Визуализация флуоресценции in situ вызванных глутаматом митохондриальных ответов Na + в астроцитах.Glia 54: 460–470.
Как человеческое тело использует электричество
Автор Amber Plante
Электричество есть везде, даже в человеческом теле. Наши ячейки предназначены для проведения электрических токов. Электричество требуется нервной системе, чтобы посылать сигналы по всему телу и в мозг, позволяя нам двигаться, думать и чувствовать.
Итак, как клетки управляют электрическими токами?
Элементы нашего тела, такие как натрий, калий, кальций и магний, обладают определенным электрическим зарядом.Почти все наши клетки могут использовать эти заряженные элементы, называемые ионами, для выработки электричества.
Содержимое клетки защищено от внешней среды клеточной мембраной. Эта клеточная мембрана состоит из липидов, которые создают барьер, через который только определенные вещества могут проникнуть внутрь клетки. Мало того, что клеточная мембрана действует как барьер для молекул, она также действует как способ для клетки генерировать электрические токи. Покоящиеся клетки заряжены отрицательно внутри, тогда как внешняя среда заряжена более положительно.Это происходит из-за небольшого дисбаланса между положительными и отрицательными ионами внутри и снаружи клетки. Клетки могут достичь разделения зарядов, позволяя заряженным ионам входить и выходить через мембрану. Поток зарядов через клеточную мембрану — это то, что генерирует электрические токи.
Клетки контролируют поток определенных заряженных элементов через мембрану с помощью белков, которые находятся на поверхности клетки и создают отверстие для прохождения определенных ионов. Эти белки называются ионными каналами.Когда клетка стимулируется, это позволяет положительным зарядам проникать в клетку через открытые ионные каналы. Затем внутренняя часть клетки становится более положительно заряженной, что вызывает дополнительные электрические токи, которые могут превращаться в электрические импульсы, называемые потенциалами действия. Наше тело использует определенные модели потенциалов действия, чтобы инициировать правильные движения, мысли и поведение.
Нарушение электрического тока может привести к болезни. Например, чтобы сердце могло перекачивать кровь, клетки должны генерировать электрические токи, которые позволяют сердечной мышце сокращаться в нужное время.Врачи могут даже наблюдать эти электрические импульсы в сердце с помощью аппарата, называемого электрокардиограммой или ЭКГ. Нерегулярные электрические токи могут помешать правильному сокращению сердечных мышц, что приведет к сердечному приступу. Это всего лишь один пример, показывающий важную роль электричества в здоровье и болезнях.
Список литературы
CrashCourse. «Нервная система, часть 2 — Действие! Потенциал! Ускоренный курс A&P №9 ». Видео на YouTube, 11:43. 2 марта 2015 г. https://www.youtube.com / watch? v = OZG8M_ldA1M.
Основы анатомии и физиологии. «Каналы с ограничением по напряжению и потенциал действия». McGraw-Hill Co., Видео. 2016. http://highered.mheducation.com/sites/0072943696/student_view0/chapter8/animation__voltage-gated_channels_and_the_action_potential__quiz_1_.html.
Нельсон, Дэвид Л. и Майкл М. Кокс. 2013. Принципы биохимии Ленингера, 6-е изд. Книга. 6-е изд. Нью-Йорк: W.H. Фриман и Ко. Doi: 10.1016 / j.jse.2011.03.016.
4.3B: Первичный активный транспорт — Biology LibreTexts
- Последнее обновление
- Сохранить как PDF
- Ключевые слова
- Ключевые слова
Цели обучения
Опишите, как клетка перемещает натрий и калий из клетки и внутрь клетки против своего электрохимического градиента.
Натрий-калиевый насос поддерживает электрохимический градиент живых клеток, перемещая натрий внутрь и калий из клетки.Первичный активный транспорт, который функционирует с активным транспортом натрия и калия, позволяет происходить вторичному активному транспорту. Вторичный метод транспортировки по-прежнему считается активным, поскольку он зависит от использования энергии, как и первичный транспорт.
Рисунок: Активный транспорт натрия и калия : Первичный активный транспорт перемещает ионы через мембрану, создавая электрохимический градиент (электрогенный транспорт).Одним из наиболее важных насосов в клетках животных является натриево-калиевый насос (Na + -K + АТФаза), который поддерживает электрохимический градиент (и правильные концентрации Na + и K + ). в живых клетках.Натрий-калиевый насос перемещает два K + в ячейку, одновременно перемещая три Na + из ячейки. Na + -K + АТФаза существует в двух формах, в зависимости от ее ориентации внутри или снаружи клетки и ее сродства к ионам натрия или калия. Процесс состоит из следующих шести шагов:
- Поскольку фермент ориентирован внутрь клетки, носитель имеет высокое сродство к ионам натрия. С белком связываются три иона натрия.
- АТФ гидролизуется белком-носителем, и к нему присоединяется низкоэнергетическая фосфатная группа.
- В результате носитель меняет форму и переориентируется по направлению к внешней стороне мембраны. Сродство белка к натрию снижается, и три иона натрия покидают носитель.
- Изменение формы увеличивает сродство носителя к ионам калия, и два таких иона присоединяются к белку. Впоследствии низкоэнергетическая фосфатная группа отделяется от носителя.
- После удаления фосфатной группы и присоединения ионов калия белок-носитель перемещается внутрь клетки.
- Белок-носитель в своей новой конфигурации имеет пониженное сродство к калию, и два иона высвобождаются в цитоплазму. Теперь белок имеет более высокое сродство к ионам натрия, и процесс начинается снова.
В результате этого процесса произошло несколько событий. В этот момент снаружи клетки больше ионов натрия, чем внутри, и больше ионов калия внутри, чем снаружи.На каждые три выходящих иона натрия входят два иона калия. Это приводит к тому, что внутреннее пространство становится немного более отрицательным по сравнению с внешним. Эта разница в загрузке важна для создания условий, необходимых для вторичного процесса. Таким образом, натрий-калиевый насос является электрогенным насосом (насос, который создает дисбаланс заряда), создающий электрический дисбаланс на мембране и способствующий мембранному потенциалу.
Ключевые моменты
- Натрий-калиевый насос перемещает K + в ячейку, перемещая Na + в соотношении три Na + на каждые два иона K +.
- Когда фермент натрий-калий-АТФаза направляется в клетку, он имеет высокое сродство к ионам натрия и связывает три из них, гидролизуя АТФ и меняя форму.
- По мере того как фермент меняет форму, он переориентируется по направлению к внешней стороне клетки, и высвобождаются три иона натрия.
- Новая форма фермента позволяет двум калиям связываться и фосфатной группе отделяться, а белок-носитель перемещается внутрь клетки.
- Фермент снова меняет форму, высвобождая ионы калия в клетку.
- После того, как калий попадает в клетку, фермент связывает три иона натрия, что снова запускает процесс.
Ключевые термины
- электрогенный насос : ионный насос, который генерирует чистый поток заряда в результате своей работы.
- Na + -K + АТФаза : фермент, расположенный в плазматической мембране всех клеток животных, который выкачивает натрий из клеток, перекачивая калий в клетки.
 Из почвы калий не вымывается, и того количества калия, которое вносится с подкормочными смесями, хватает большинству огородных культур (только картофель «просит» добавки), но в данной ситуации корни просто не успевали вовремя восполнить образующийся дефицит и требовались дополнительное внесение калия.
Из почвы калий не вымывается, и того количества калия, которое вносится с подкормочными смесями, хватает большинству огородных культур (только картофель «просит» добавки), но в данной ситуации корни просто не успевали вовремя восполнить образующийся дефицит и требовались дополнительное внесение калия. Плоды имеют правильную форму, крупные, сочные, но не водянистые. Они ярко окрашены, с сильным специфическим запахом и сладкие
Плоды имеют правильную форму, крупные, сочные, но не водянистые. Они ярко окрашены, с сильным специфическим запахом и сладкие В ряде случаев сильнее всего поражаются верхушечные почки. Диагностика дефицитов питания Итак, диагностику дефицитов питания мы начинаем с того, что определяем, какие части растения выглядят более поврежденными, старые или молодые. Этим мы ограничим круг дальнейших изысканий. Если мы видим, что пострадали старые листья, нам предстоит определить по специфическим признакам, какой из 4 реутилизируемых элементов находится в дефиците: азот, фосфор, калий или магний. Хорошей подсказкой при визуальной диагностике являются индикаторные растения. Это овощные культуры, которые испытывают повышенную потребность в данном элементе, а потому у них раньше появляются и ярче выражены специфические признаки его недостаточности.
В ряде случаев сильнее всего поражаются верхушечные почки. Диагностика дефицитов питания Итак, диагностику дефицитов питания мы начинаем с того, что определяем, какие части растения выглядят более поврежденными, старые или молодые. Этим мы ограничим круг дальнейших изысканий. Если мы видим, что пострадали старые листья, нам предстоит определить по специфическим признакам, какой из 4 реутилизируемых элементов находится в дефиците: азот, фосфор, калий или магний. Хорошей подсказкой при визуальной диагностике являются индикаторные растения. Это овощные культуры, которые испытывают повышенную потребность в данном элементе, а потому у них раньше появляются и ярче выражены специфические признаки его недостаточности.